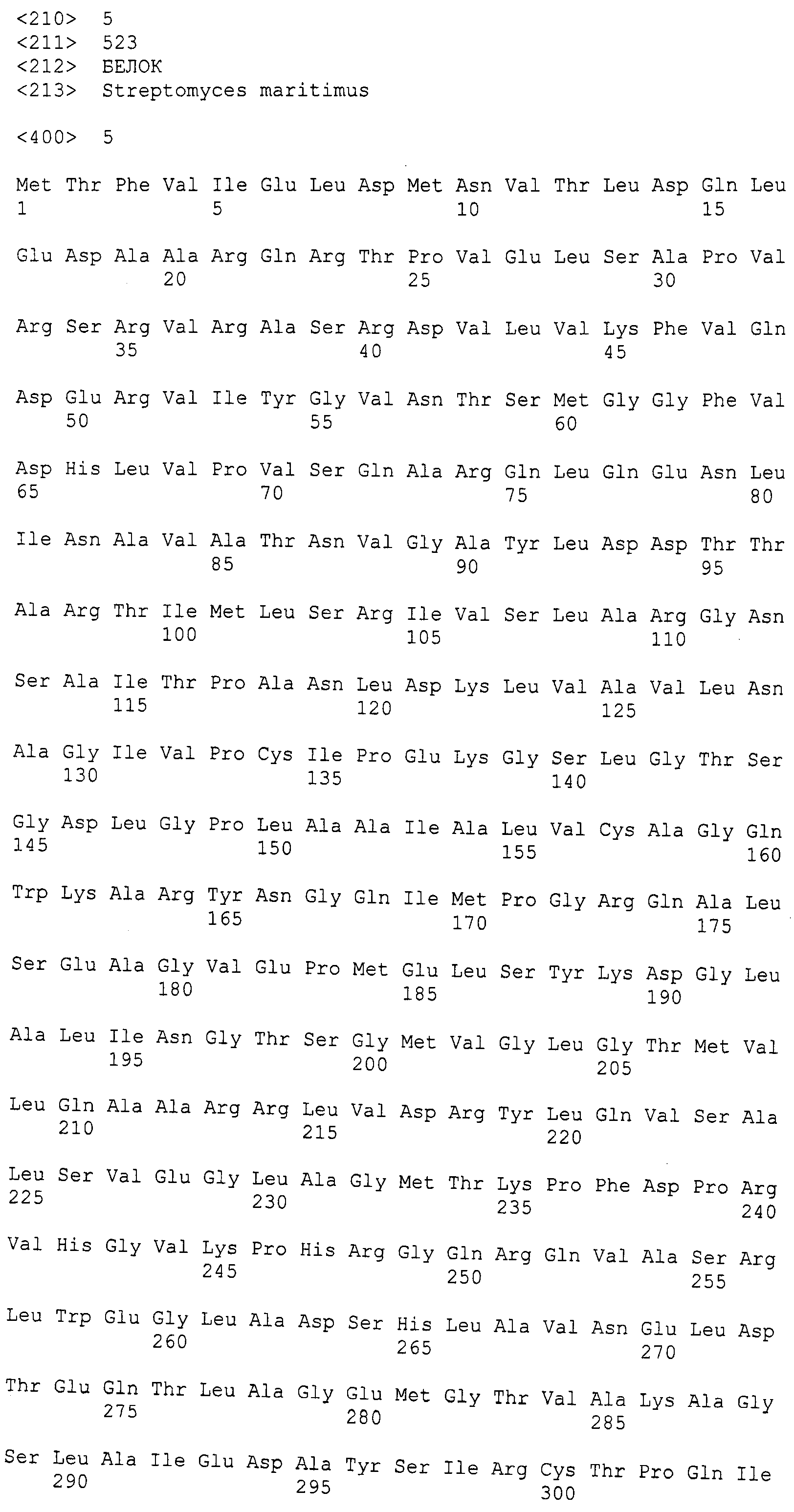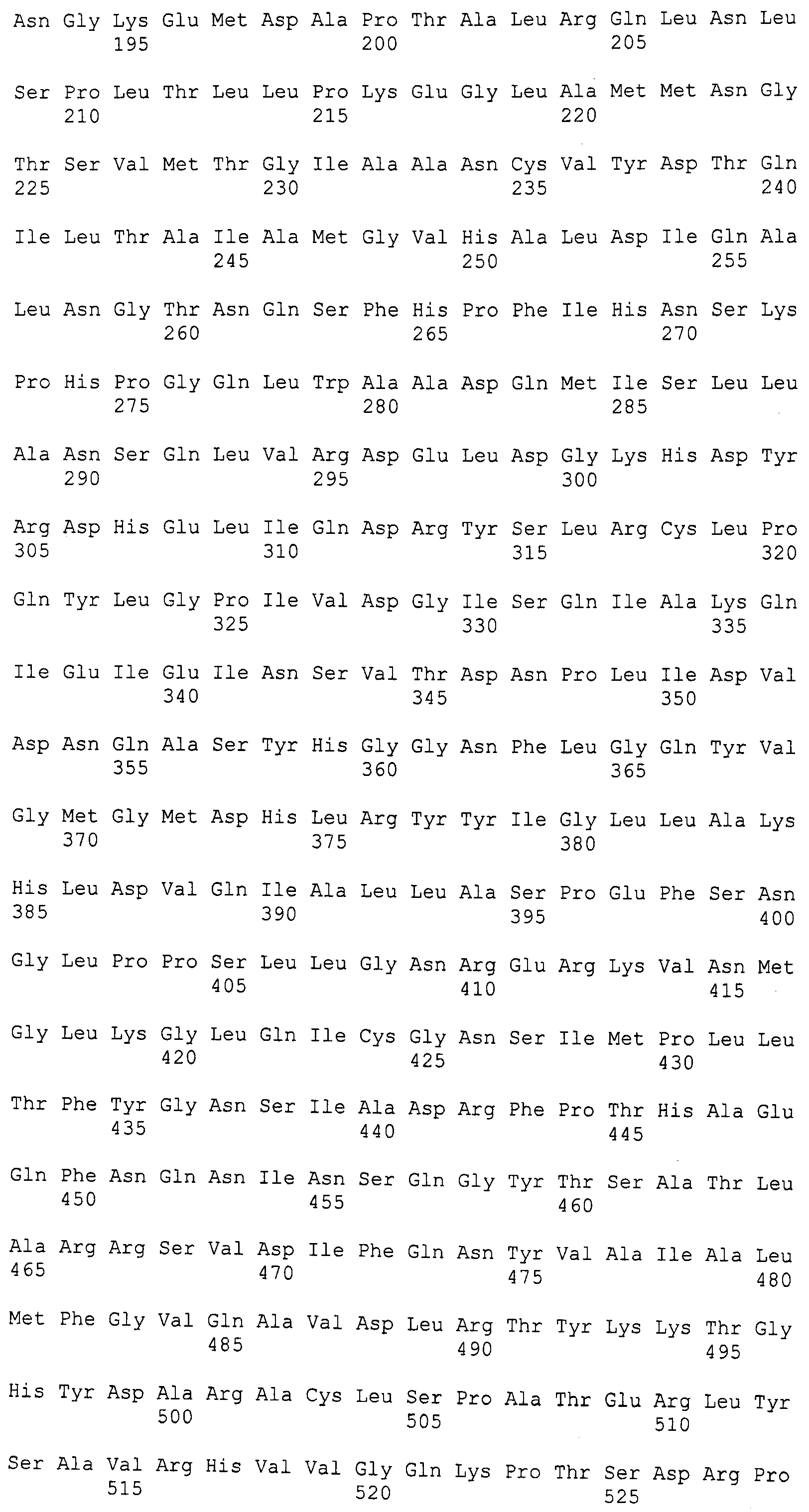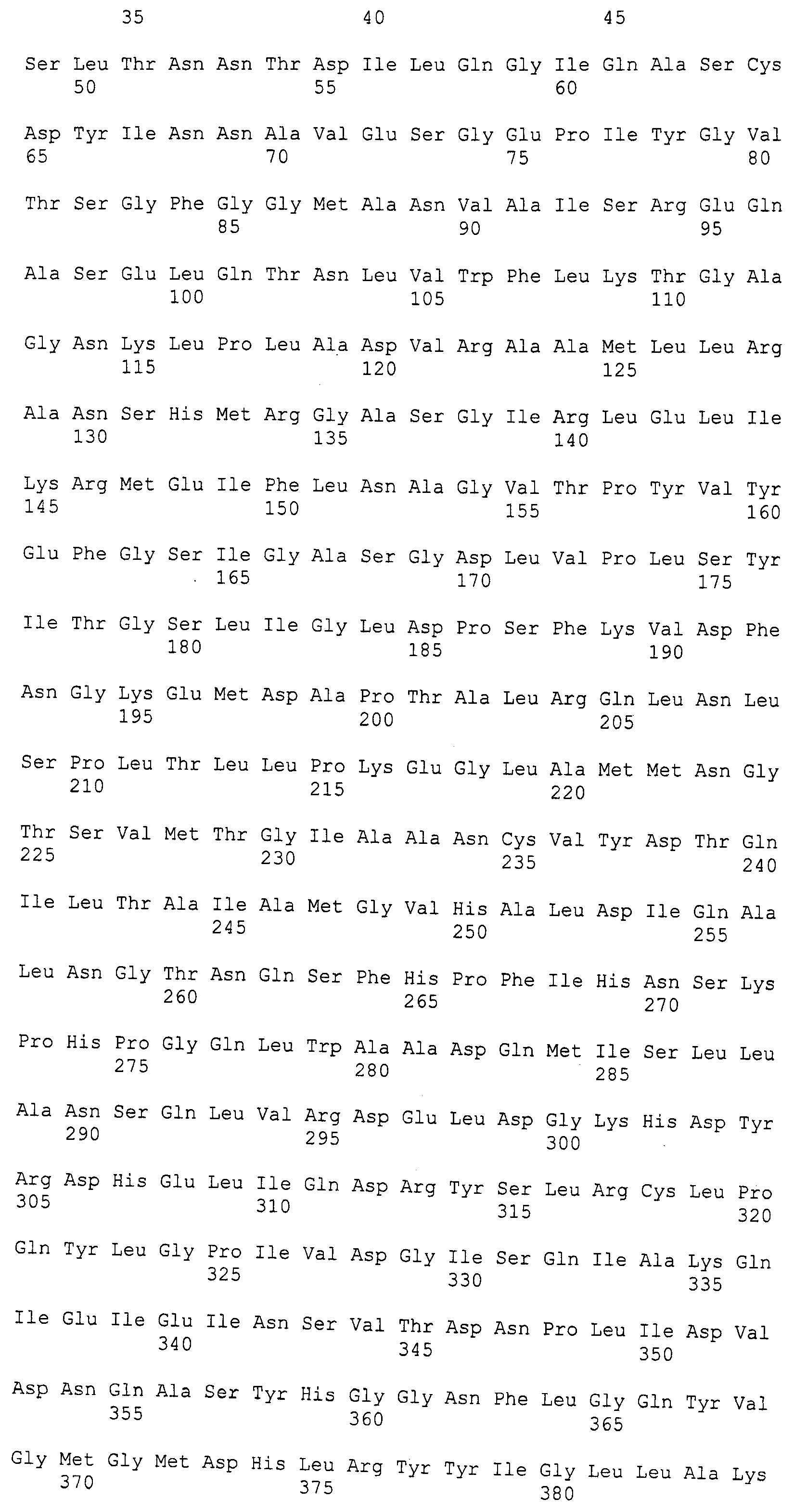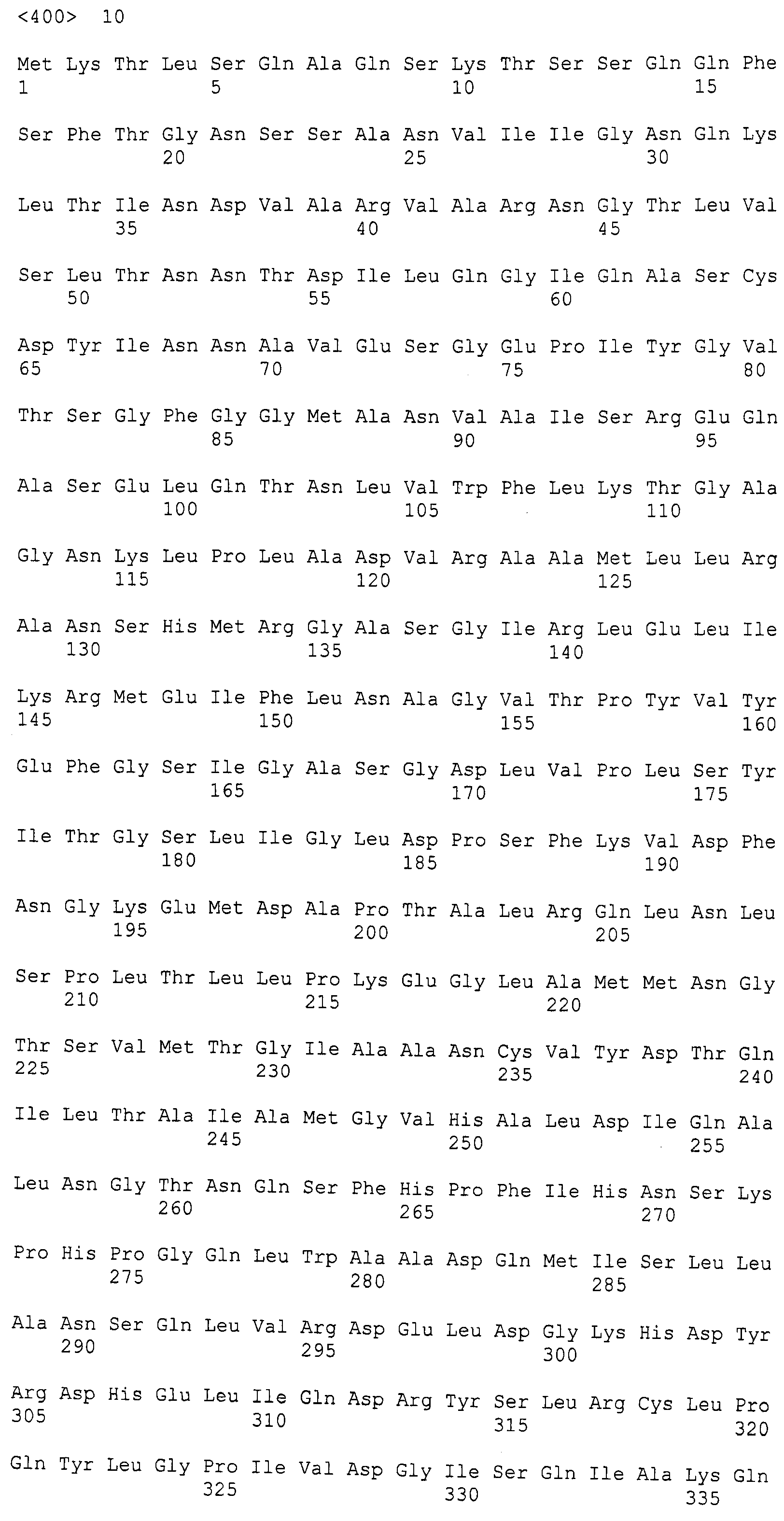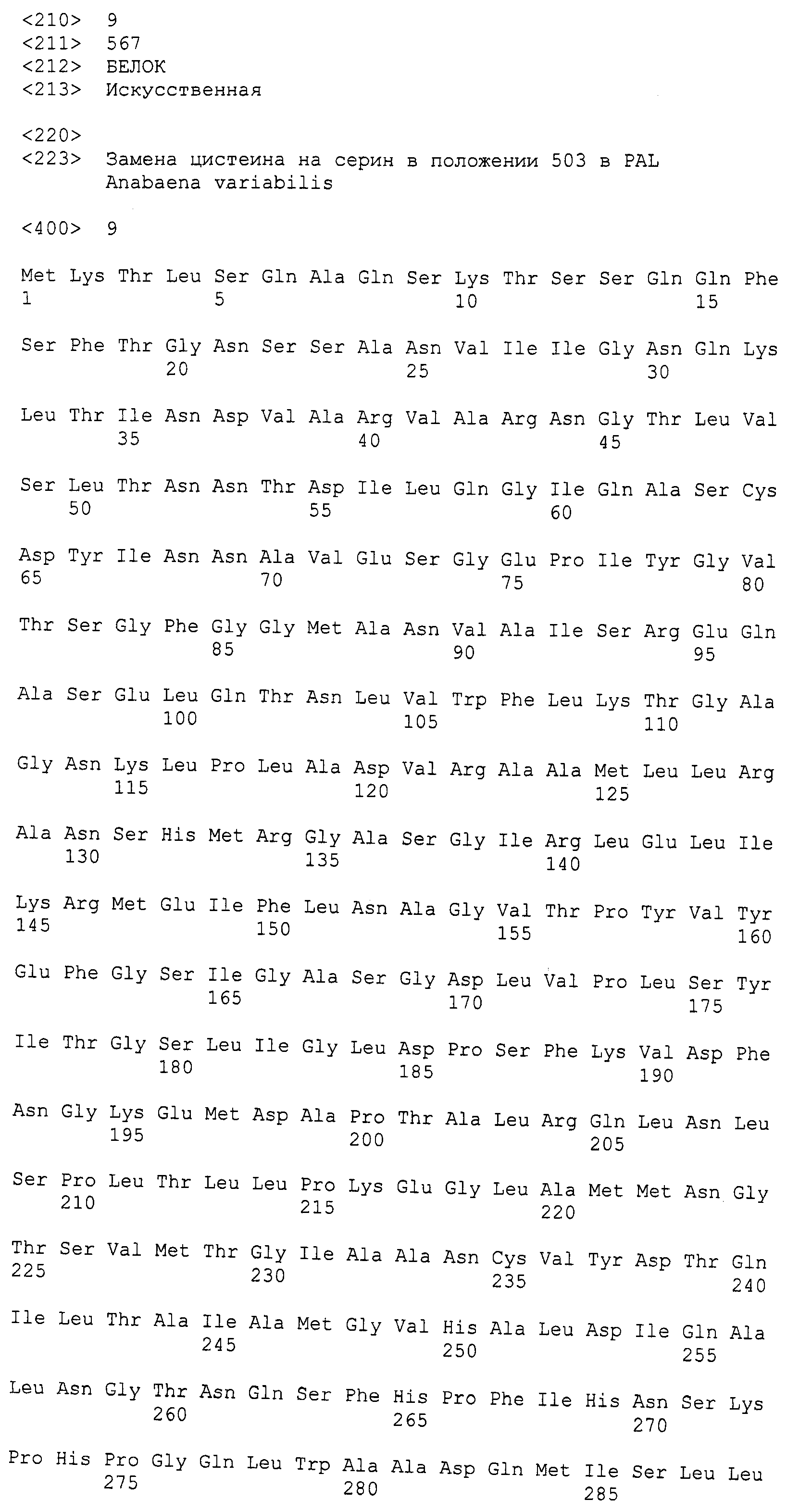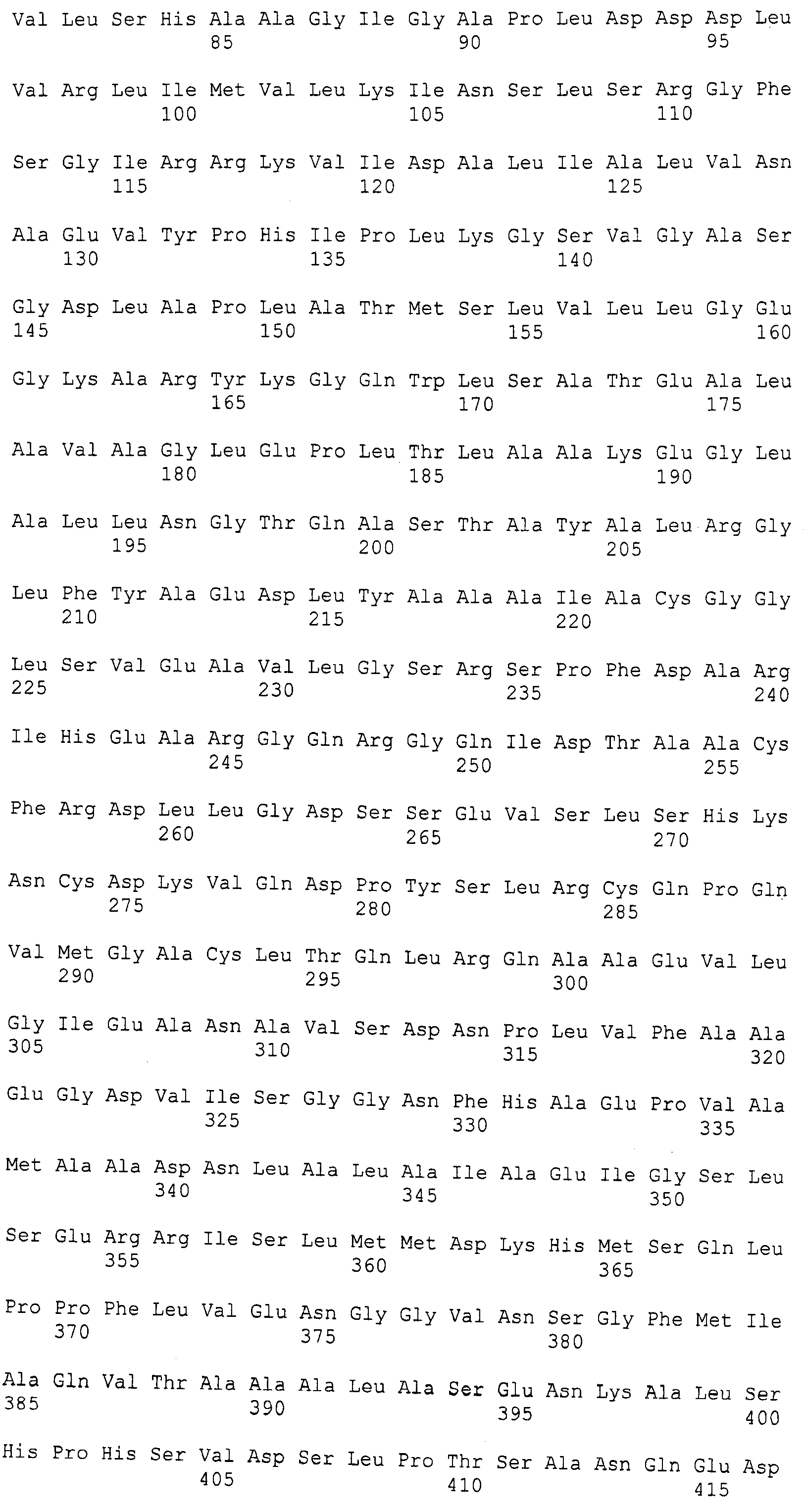Результат интеллектуальной деятельности: КОМПОЗИЦИИ ПРОКАРИОТИЧЕСКОЙ ФЕНИЛАЛАНИН-АММИАК-ЛИАЗЫ И СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ ТАКИХ КОМПОЗИЦИЙ
Вид РИД
Изобретение
Область, к которой относится изобретение
Настоящее изобретение относится к прокариотической фенилаланин-аммиак-лиазе (PAL) и к ее композициям, а также к оптимизации таких композиций для повышения каталитической активности и/или стабильности прокариотической PAL и, тем самым, снижения иммуногенности и/или протеолитической чувствительности прокариотической PAL. Настоящее изобретение также относится к применению указанных оптимальных композиций прокариотической PAL для лечения рака.
Предшествующий уровень техники
PAL представляет собой фермент, отсутствующий у млекопитающих и широко распространенный в растениях (Koukol, et al., J. Biol. Chem. 236:2692-2698 (1961); Hanson, et al., The Enzymes 7:75-166 (1972); Poppe, et al., Curr. Org. Chem. 7: 1297-1315 (2003)), в некоторых грибах (Rao, et al., Can. J. Biochem. 4512:1863-1872 (1967); Abell, et al., Methods Enzymol. 142:242-253 (1987)) и в бактериях (Bezanson, et al., Can. J. Microbiol. 16:147-151 (1970); Xiang, et al., J. Biol. Chem. 277:32505-32509 (2002); Hill, et al., Chem. Commun. 1358-1359 (2003)), и такой фермент может быть рекомбинантно продуцирован в Escherichia coli.
Репрезентативный список PAL включает следующие ферменты: Q9ATN7 Agastache rugosa; 093967 Amanita muscaria (мухомора); P35510, P45724, P45725, Q9SS45, Q8RWP4 Arabidopsis thaliana (резушки Таля); Q6ST23 Bambusa oldhamii (дендрокаламуса); Q42609 Bromheadia finlaysoniana (орхидеи); P45726 Camellia sinensis (чая); Q9MAX1 Catharanthus roseus (розового барвинка) (Мадагаскарского барвинка); Q9SMK9 Cicer arietinum (турецкого гороха); Q9XFX5, Q9XFX6 цитрусового гибрида Citrus Clementina x Citrus reticulate; Q42667 Citrus limon (лимона); Q8H6V9, Q8H6W0 Coffea canephora (кофе робуста); Q852S1 Daucus carota (моркови); О23924 Digitalis lanata (наперстянки); О23865 Daucus carota (моркови); P27991 Glycine max (сои); О04058 Helianthus annuus (подсолнечника однолетнего); P14166, Q42858 Ipomoea batatas (сладкого картофеля); Q8GZR8, Q8W2E4 Lactuca sativa (садового латука); О49835, О49836 Lithospermum erythrorhizon; P35511, P26600 Lycopersicon esculentum (томата); P35512 Malus domestica (яблони) (Malus sylvestris); Q94C45, Q94F89 Manihot esculenta (кассавы) (маниоки); P27990 Medicago sativa (люцерны); P25872, P35513, P45733 Nicotiana tabacum (табака настоящего); Q6T1C9 Quercus suber (пробкового дуба); P14717, P53443, Q7M1Q5, Q84VE0, Q84VE0 Oryza sativa (риса); P45727 Persea americana (авокадо); Q9AXI5 Pharbitis nil (фиалки) (японской ипомеи); P52777 Pinus taeda (сосны ладанной); Q01861, Q04593 Pisum sativum (садового гороха); P24481, P45728, P45729 Petroselinum crispum (петрушки огородной) (Petroselinum hortense); Q84LI2 гибридного сорта Phalaenopsis x Doritaenopsis; P07218, P19142, P19143 Phaseolus vulgaris (фасоли обыкновенной) (французских бобов); Q7XJC3, Q7XJC4 Pinus pinaster (приморской сосны); Q6UD65 гибридного бальзамического тополя подвида trichocarpa x Populus deltoides; P45731, Q43052, О24266 Populus kitakamiensis (осины); Q8H6V5, Q8H6V6 Populus tremuloides (тополя осинообразного); P45730 Populus trichocarpa (американского бальзамического тополя); О64963 Prunus avium (вишни); Q94EN0 Rehmannia glutinosa; Pl1544 Rhodosporidium toruloides (дрожжей) (Rhodotorula gracilis); P10248 Rhodotorula rubra (дрожжей) (Rhodotorula mucilaginosa); Q9M568, Q9M567 Rubus idaeus (малины); P31425, P31426 Solanum tuberosum (картофеля); Q6SPE8 Stellaria longipes (девясила высокого); P45732 Stylosanthes humilis (таунсвильской люцерны); P45734 Trifolium subterraneum (средиземноморского клевера); Q43210, Q43664 Triticum aestivum (пшеницы); Q96V77 Ustilago maydis (головневых грибов); P45735 Vitis vinifera (винограда); и Q8VXG7 Zea mays (кукурузы).
Многочисленные исследования были направлены на возможность применения фермента фенилаланин-аммиак-лиазы (PAL, EC 4.3.1.5) для ферментной заместительной терапии фенилкетонурии (PKU) (Hoskins, et al., Lancet l(8165):392-394 (1980); Gilbert, et al., Biochem. J. 199(3):715-723 (1981); Hoskins, J.A., et al., Res. Commun. Chem. Pathol. Pharmacol. 35(2):275-282 (1982); Sarkissian, et al., Proc. Natl. Acad. Sci. USA 96(5):2339-2344 (1999); Liu, et al., Artif. Cells Blood Substit. Immobil. Biotechnol. 30(4):243-257 (2002); Wieder, et al., J Biol. Chem. 254(24): 12579-12587 (1979); Gamez, et al., Mol. Ther. 11(6):986-989 (2005); Ambrus, et al., J. Pharmacol. Exp. Ther. 224(3):598-602 (1983); Ambrus, et al., Science 201(4358):837-839 (1978); Kalghatgi, Res. Commun. Chem. Pathol. Pharmacol. 27(3):551-561 (1980); Ambrus, Res. Commun. Chem. Pathol. Pharmacol. 37(l):105-111 (1982); Gilbert, et al., Biochem. Biophys. Res. Commun. 131(2):557-563 (1985); Pedersen, Res. Commun. Chem. Pathol. Pharmacol. 20(3):559-569 (1978); Marconi, et al., Biochimie 62(8-9):575-580 (1980); Larue, et al., Dev. Pharmacol. Ther. 9(2):73-81 (1986); Ambrus, et al., Ann. Intern. Med. 106(4):531-537 (1987); Bourget, et al., Appl. Biochem. Biotechnol. 10:57-59 (1984); Bourget, et al., FEBS Lett. 180(l):5-8 (1985); Bourget, et al., Biochim. Biophys. Acta 883(3):432-438 (1986); Chang, et al., Artif. Cells Blood Substit. Immobil. Biotechnol. 23(1):1-21 (1995); Chang, et al., Mol. Biotechnol. 17(3):249-260 (2001); патент США № 5753487).
Было высказано предположение, что исходя из способности фермента PAL ограничивать поступление питательного вещества, а именно, фенилаланина в раковые клетки и, тем самым, ингибировать рост опухоли, такой фермент может быть использован для лечения рака (Fritz, et al., J. Biol. Chem. 251(15):4646-4650 (1976); Roberts, et al., Cancer Treat. Rep. 60(3):261-263 (1976); Shen, et al., Cancer Res. 37(4):1051-1056 (1977); Shen, et al., Cancer Treat. Rep. 63(6):1063-1068 (1979); Wieder, et al., J. Biol. Chem. 254(24):12579-12587 (1979)). Кроме того, PAL-опосредуемое снижение уровня фенилаланина приводит к предупреждению пролиферации клеток мышиного лейкоза и метастатической меланомы. Однако, внутривенно инъецированный ПЭГилированный PAL быстро выводится из кровотока уже после 13-й инъекции (Abell, et al., Cancer Res. 33:2529-2532 (1973); Roberts, et al., (1976), там же; Shen, et al., (1977), там же; (Shen, et al., J. Reticuloendothelial Soc. 23:167-175 (1978)).
Некоторые опухолевые или раковые клетки имеют более высокую скорость метаболизма и большую потребность в незаменимых аминокислотах, таких как фенилаланин, чем нормальные клетки. В литературе имеются данные, которые позволяют предположить, что ограничение или снижение уровня конкретных аминокислот, например, фенилаланина, благодаря использованию ферментов, разлагающих аминокислоты, например, PAL, может приводить к снижению роста некоторых опухолевых клеток у человека, страдающего раком, и у животных с моделями рака. Так, например, в некоторых лейкозных клетках отсутствует фермент аспарагин-синтетаза, которая синтезирует заменимую аминокислоту аспарагин из глутамина, а поэтому выживаемость этих клеток зависит от аспарагина. Онкаспар (пегаспаргаза, Enzon Pharmaceuticals, Inc.), то есть, ПЭГилированная L-аспарагиназа, был с успехом использован для лечения острого лимфобластного лейкоза (ОЛЛ) (Graham, Adv. Drug Del. Rev. 55:1293-1302 (2003)). Другими примерами аминокислот, служащими в качестве потенциальных мишеней для ферментативного истощения фермента в противораковой терапии, являются глутамин (глутаминдезаминаза, Medical Enzymes AG), аргинин (аргининдезиминаза, Phoenix Pharmacologies, Inc.) и метионин (метиониназа, Anticancer, Inc.) (см., например, патенты США №№ 6312939, 6737259 и 5690929).
Было показано, что ограничение поступления фенилаланина с пищей приводит к ингибированию роста и метастазирования в высокой степени инвазивной метастатической меланомы и андроген-независимых клеток рака предстательной железы у животных-моделей, а также к стимуляции апоптоза опухолевых, но не здоровых клеток в культуре, к повышению выживаемости мышей с опухолью, к повышению чувствительности опухолевых клеток к химиотерапевтическим средствам и к повышению цитотоксичности под действием токсинов (Fu, et al., Nutr. Cancer 31:1-7 (1998); Fu, et al., Cancer Res. 59:758-765 (1999); Fu, et al., Nutr. Cancer 45:60-73 (2003); Fu, et al., J. Cell. Physiol. 209:522-534 (2006); Meadows, et al., Cancer Res. 42:3056-3063 (1982); Elstad, et al., Anticancer Res. 13:523-528 (1993); Elstad, et al., Nutr. Cancer 25:47-60 (1996); Nunez, et al., Cancer Lett. 236:133-141 (2006)).
Ферментативное истощение фенилаланина под действием фермента PAL, происходящего от дрожжей Rhodosporidium toruloides (также известных как Rhodotorula glutinis) (RtPAL), приводит к ингибированию роста лейкозных лимфоцитов в культуре in vitro (Abell, et al., Cancer Res. 32:285-290 (1972); Stith, et al., Cancer Res. 33:966-971 (1973)) и у мышей in vivo (Abell, et al., Cancer Res. 33:2529-2532 (1973)). Однако, после повторных инъекций RtPAL мышам, выведение этого фермента из плазмы значительно ускоряется, и скорость его клиренса у мышей с опухолью была выше, чем у мышей, не имеющих опухоли (Fritz, et al., J. Biol. Chem. 251:4646-4650 (1976); Shen, et al., Cancer Res. 37:1051-1056 (1977)). После множества введений, время полужизни RtPAL снижалось примерно до 1 часа в результате увеличения титра антител, что указывало на то, что для замедления клиренса и увеличения времени полужизни может потребоваться радиоактивное облучение всего организма (Shen, et al. , J. Reticuloendothelial Soc. 23:167-175 (1978).
В целях снижения иммуногенности фермента RtPAL и скорости его клиренса in vivo, этот фермент был ПЭГилирован. (Wieder, et al., J. Biol. Chem. 254:12579-12587 (1979)). После одной внутривенной инъекции или после множества внутривенных инъекций мышам, время полужизни ПЭГилированного RtPAL в крови превышало время полужизни не-ПЭГилированного RtPAL; но, тем не менее, ПЭГилированый RtPAL все же быстро выводился из кровотока после тринадцатой внутривенной инъекции.
Хотя PAL может быть использован в различных терапевтических целях, однако применение PAL может быть ограничено из-за его пониженной удельной активности и протеолитической нестабильности. Применение PAL, аналогично применению других терапевтических белков в ферментной терапии, связано с некоторыми проблемами, такими как иммуногенность этих ферментов и их чувствительность к протеолизу (см. Vellard, Curr. Opin. Biotechnol. 14:1-7 (2003)). До настоящего времени, совместные усилия, направленные на улучшение таких параметров, не дали желаемого результата, что обусловлено малым количеством информации о структуре и биохимических свойствах этого белка.
Таким образом, необходимость в получении молекул PAL с оптимальными кинетическими свойствами, включая высокую каталитическую активность, продолжительное время биологической полужизни, повышенную биохимическую стабильность и/или ослабленную иммуногенность, требуемыми для терапевтического применения, включая лечение рака, остается актуальной.
Описание сущности изобретения
Настоящее изобретение основано на обнаружении того факта, что прокариотический или бактериальный PAL может служить в качестве эффективного средства для лечения рака. В настоящем изобретении рассматриваются композиции прокариотического PAL и его биологически активных фрагментов, мутантов, вариантов или аналогов, обладающие улучшенными свойствами, такими как повышенная каталитическая активность и повышенная биохимическая стабильность, а также при применении таких композиций в терапии, ослабленная иммуногенность и/или увеличенное время биологической полужизни. Настоящее изобретение относится к фармацевтическим композициям и препаратам, содержащим прокариотический фермент PAL и его биологически активные фрагменты, мутанты, варианты или аналоги, и фармацевтически приемлемый носитель, включая стабилизаторы. Настоящее изобретение также относится к способам получения и очистки прокариотического PAL и его биологически активных фрагментов, мутантов, вариантов или аналогов, а также к способам применения таких композиций в терапевтических целях, включая лечение опухолевого заболевания и рака.
Используемые здесь термины «бактериальный PAL» и «прокариотический PAL» являются взаимозаменяемыми и означают: (1) PAL дикого типа, происходящий от организма-прокариота, включая, но не ограничиваясь ими, PAL от Streptomyces maritimus (также известного как EncP, SEQ ID NO:5, фигура 4), Nostoc punctiforme (SEQ ID NO:2, фигура 4), Anabaena variabilis (SEQ ID NO:4, фигура 4), Anacystis nidulans (Lofflehardt, Z. Naturforsch. 31(l1-12):693-9 (1976), Photorabdus luminescens TT0l (Williams, et al., Microbiology 151:2543-2550 (2005), и Streptomyces verticillatus (Bezanson, et al., Can. J. Microbiol. 16(3):147-51 (1970)); (2) фрагменты, мутанты, варианты или аналоги таких ферментов PAL дикого типа, которые сохраняют аналогичную (то есть, по меньшей мере 50%-ую) каталитическую активность по отношению к фенилаланину, и предпочтительно обладают повышенной каталитической активностью и повышенной биохимической стабильностью, а также имеют увеличенное время полужизни и/или обладают пониженной иммуногенностью, и (3) химически модифицированные варианты таких ферментов PAL дикого типа или их фрагментов, мутантов, вариантов или аналогов, которые связаны с другими химическими молекулами, сообщающими другие преимущественные свойства, такие как, например, но не ограничивающиеся ими, увеличенное время полужизни и/или пониженная иммуногенность. Так, например, все упоминаемые способы получения или использования прокариотического PAL и его фрагментов, мутантов, вариантов, аналогов или химически модифицированных вариантов, и композиций такого(их) фермента(ов) в терапевтических целях относятся к способам получения, использования или приготовления всех указанных прокариотических PAL дикого типа или их фрагментов, мутантов, вариантов, аналогов или химических модификаций.
В своем первом аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим бактериальный PAL или его биологически активные фрагменты, мутанты, варианты или аналоги, и фармацевтически приемлемый носитель. В своем предпочтительном варианте, настоящее изобретение относится к бактериальному PAL, происходящему от Nostoc punctiforme (SEQ ID NO:2), или к его биологически активному фрагменту, мутанту, варианту или аналогу. В другом своем предпочтительном варианте настоящее изобретение относится к бактериальному PAL, происходящему от Anabaena variabilis (SEQ ID NO:4), или к его биологически активному фрагменту, мутанту, варианту или аналогу. В настоящем изобретении рассматриваются прокариотические варианты PAL, которые обладают более высокой фенилаланин-конвертирующей активностью и/или более низкой иммуногенностью, по сравнению с ферментом PAL дикого типа.
Предпочтительно, варианты прокариотического PAL сохраняют остатки активного центра дикого типа в положениях, соответствующих положениям Ser210, триады Ala-Ser-Gly (211-213), Asp214, Leu215, Asn270, Val269, Leu266, Leul34, His 137, Lys468, Glu496, Gln500 в PAL, происходящем от Rhodosporidium toruloides (RtPAL), или консервативную(ые) замену(ы) остатка(ов) активного центра, из которых остатки триады Ala-Ser-Gly в положениях 211-213, очевидно, являются сайтом связывания с фенилаланином.
Желательные варианты прокариотического PAL могут включать белки, в которых один или несколько аминокислотных остатков были заменены другими аминокислотными остатками, способствующими снижению агрегации белка, которая может быть ассоциирована со снижением ферментативной активности, повышением иммуногенности и/или с другими нежелательными эффектами, такими как пониженная биологическая доступность in vivo. В настоящем изобретении рассматривается фармацевтическая композиция, в которой один или несколько аминокислотных остатков варианта прокариотичесого PAL были заменены другой аминокислотой, где указанная замена, по сравнению с PAL дикого типа, приводит к повышению фенилаланин-конвертирующей активности и/или к снижению иммуногенности.
В некоторых вариантах изобретения один или несколько аминокислотных остатков варианта прокариотического PAL были заменены другим аминокислотным остатком. В некоторых вариантах изобретения один или несколько цистеиновых остатков варианта прокариотического PAL были заменены сериновым остатком. В предпочтительных вариантах изобретения вариантом прокариотического PAL является PAL Anabaena variabilis (AvPAL). В более предпочтительных вариантах изобретения один или несколько цистеиновых остатков варианта AvPAL, выбранных из группы, состоящей из цистеиновых остатков в положениях 64, 318, 503 и 565, были заменены сериновым остатком. В более предпочтительном варианте изобретения цистеиновый остаток в положении 565 варианта AvPAL был заменен сериновым остатком. В наиболее предпочтительном варианте изобретения цистеиновые остатки в положениях 503 и 565 варианта AvPAL были заменены сериновыми остатками.
Желательными вариантами прокариотического PAL могут быть гибридные белки, в которых фермент PAL был присоединен к другому гетерологичному полипептиду, такому как нативная или модифицированная константная область иммуноглобулина или его фрагмента, сохраняющие эпитоп «спасения», который, как известно, увеличивает время полужизни или распознается белками, специфичными к конкретным формам рака.
В настоящем изобретении также рассматриваются химически модифицированные варианты таких полипептидов прокариотического PAL, которые были присоединены к химической молекуле, сообщающей другие преимущественные эффекты. Так, например, известно, что неспецифическое или сайт-специфическое (например, N-концевое) присоединение водорастворимых полимеров, например, полиэтиленгликоля, к полипептидам приводит к увеличению времени полужизни, а связывание химических молекул может также приводить к снижению иммуногенности и/или к повышению резистентности к протеазе.
В некоторых вариантах изобретения вариант прокариотического PAL включает водорастворимый полимер. В предпочтительных вариантах изобретения вариант прокариотического PAL включает полиэтиленгликоль. В более предпочтительном варианте изобретения вариант прокариотического PAL представляет собой PAL Anabaena variabilis (AvPAL), а отношение AvPAL к полиэтиленгликолю составляет примерно 1:3 (AvPAL:ПЭГ=1:3). В наиболее предпочтительном варианте изобретения вариантом прокариотического PAL является вариант AvPAL, отношение варианта AvPAL к полиэтиленгликолю составляет примерно 1:3 (AvPAL:ПЭГ=1:3), а цистеиновые остатки в положениях 503 и 565 варианта AvPAL были заменены сериновыми остатками.
В некоторых вариантах изобретения один или несколько аминокислотных остатков варианта прокариотического PAL были заменены лизиновым остатком. ПЭГилирование дополнительного(ых) лизинового(ых) остатка(ов) в варианте прокариотического PAL может приводить к образованию фермента, обладающего пониженной иммуногенностью, повышенной каталитической активностью и/или повышенной биохимической стабильностью. Не ограничиваясь какой-либо конкретной теорией можно лишь высказать предположение, что тирозиновый остаток, находящийся в активном центре прокариотического PAL (например, в положении 78 в AvPAL) или расположенный рядом с этим центром, может представлять собой сайт для ПЭГилирования, способствующий снижению ферментативной активности. В предпочтительном варианте изобретения одна или несколько аминокислот, расположенных в активном центре или рядом с активным центром варианта прокариотического PAL и не требующихся для ферментативной активности, заменены лизиновым остатком. Не ограничиваясь какой-либо конкретной теорией, можно лишь высказать предположение, что ПЭГилирование замененного лизинового остатка, расположенного в активном центре или рядом с активным центром, приводит к стерическому затруднению ПЭГилирования тирозинового остатка (например, в положении 78 в AvPAL).
Такие варианты прокариотического PAL выделяют и очищают способами согласно изобретению, и полученные таким образом варианты присутствуют в количествах, достаточных для применения прокариотического фермента PAL в терапевтических целях. В некоторых вариантах изобретения используется кДНК, кодирующая полноразмерный прокариотический PAL или прокариотический PAL дикого типа. Однако, в других вариантах изобретения может быть использована кДНК, кодирующая биологически активный фрагмент, мутант, вариант или аналог такого фермента. Кроме того, настоящее изобретение относится к композициям оптимизированного прокариотического PAL, полученным методами структурного молекулярного конструирования, и/или химически модифицированных (например, ПЭГилированных) форм PAL. В конкретных вариантах изобретения рассматриваются оптимальные композиции прокариотического PAL, которые обладают повышенной удельной активностью, повышенной стабильностью, пониженной иммуногенностью и/или пониженной чувствительностью к протеолизу, и которые могут быть использованы в терапевтических целях. Предпочтительным вариантом является ПЭГилированная форма PAL Nostoc punctiforme, обладающая повышенной удельной активностью, повышенной стабильностью, пониженной иммуногенностью и/или пониженной чувствительностью к протеолизу. Другим предпочтительным вариантом является ПЭГилированная форма PAL Anabaena variabilis, обладающая повышенной удельной активностью, повышенной стабильностью, пониженной иммуногенностью и/или пониженной чувствительностью к протеолизу.
В некоторых вариантах изобретения биологически активные центры прокариотического PAL дикого типа согласно изобретению могут быть модифицированы, если это необходимо, для оптимизации кинетических свойств PAL. В предпочтительном варианте изобретения модифицированный прокариотический PAL, после его введения индивидууму, обладает активностью, достаточной для снижения уровней фенилаланина в плазме и составляющей в пределах от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, примерно менее чем 20 мкМ, а еще более предпочтительно, примерно менее чем 10 мкМ, как было определено стандартными методами детектирования, хорошо известными специалистам. В других предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL имеет kcat по меньшей мере примерно 0,1 с-1, предпочтительно, более чем примерно 0,5 с-1, а еще более предпочтительно, более чем примерно 1,0 с-1. В более предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL имеет kcat по меньшей мере примерно 0,4 с-1, предпочтительно, более чем примерно 2,0 с-1, а еще более предпочтительно, более чем примерно 4,0 с-1. В других предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL имеет Km примерно от 10 мкМ до 2000 мкМ. В более предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL имеет Km примерно от 10 мкМ до 1000 мкМ. В еще более предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL имеет Km примерно от 10 мкМ до 500 мкМ. В других предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL обладает ферментативной активностью, которая составляет по меньшей мере примерно 50% от ферментативной активности PAL дикого типа, и примерно до величины, в 10 раз превышающей активность PAL дикого типа. В других предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL обладает ферментативной активностью, которая по меньшей мере примерно на 50%-100% превышает ферментативную активность PAL дикого типа. Такие биологически активные модифицированные прокариотические белки PAL могут быть получены методами, хорошо известными специалистам, такими как сайт-направленный мутагенез.
В других своих вариантах настоящее изобретение относится к использованию прокариотического PAL или его биологически активного фрагмента, мутанта, варианта или аналога, участвующих в метаболизме фенилаланина (то есть, превращают фенилаланин в другое вещество), в целях приготовления лекарственного препарата для предупреждения или лечения рака у индивидуума, а предпочтительно, у человека, а также для приготовления фармацевтической композиции, содержащей прокариотический PAL или его биологически активный фрагмент, мутант, вариант или аналог, для предупреждения или лечения рака у индивидуума, а предпочтительно, у человека. В некоторых вариантах изобретения указанный лекарственный препарат может быть использован для предупреждения рака у человека. В других вариантах изобретения указанный лекарственный препарат может быть использован для лечения рака у человека. В предпочтительном варианте изобретения фармацевтическая композиция содержит в высокой степени очищенный PAL, происходящий от бактерий, или его биологически активный фрагмент, мутант, вариант или аналог и фармацевтически приемлемый носитель. Предпочтительные препараты содержат прокариотический PAL или его биологически активный фрагмент, мутант, вариант или аналог с чистотой более чем 90%, 95%, 96%, 97%, 98%, 99%, 99,2%, 99,5%, 99,6%, 99,7%, 99,8% или 99,9%. Относительная удельная активность прокариотического PAL или его биологически активного фрагмента, мутанта, варианта или аналога согласно изобретению, предпочтительно, составляет по меньшей мере примерно 50%, а более предпочтительно, более чем примерно 110% от удельной активности прокариотического PAL дикого типа.
Во втором своем аспекте настоящее изобретение относится к новым способам применения композиций варианта прокариотического PAL в терапевтических целях. В настоящем изобретении рассматриваются способы лечения различных форм рака.
В одном из своих вариантов настоящее изобретение относится к способам лечения рака путем введения индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, содержащей вариант прокариотического PAL и фармацевтически приемлемый носитель, где указанный вариант прокариотического PAL обладает более высокой фенилаланин-конвертирующей активностью и/или более низкой иммуногенностью по сравнению с PAL дикого типа, и является эффективным для снижения концентрации фенилаланин в крови, сыворотке или в плазме, а предпочтительно, в плазме индивидуума до уровня, составляющего в пределах от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, примерно менее чем 20 мкМ, а еще более предпочтительно, примерно менее чем 10 мкМ. В некоторых вариантах изобретения один или несколько аминокислотных остатков варианта прокариотического PAL были заменены другим аминокислотным остатком, где указанная замена приводит к повышению фенилаланин-конвертирующей активности и/или к снижению иммуногенности по сравнению с PAL дикого типа. В некоторых вариантах изобретения один или несколько цистеиновых остатков варианта прокариотического PAL были заменены другим аминокислотным остатком. В некоторых вариантах изобретения один или несколько цистеиновых остатков варианта прокариотического PAL были заменены сериновым остатком. В предпочтительном варианте изобретения вариантом прокариотического PAL является вариант PAL Anabaena variabilis (AvPAL). В особенно предпочтительном варианте изобретения один или несколько цистеиновых остатков варианта AvPAL были заменены сериновым остатком, то есть, один из указанных цистеиновых остатков, выбранных из группы, состоящей из цистеиновых остатков в положениях 64, 318, 503 и 565, был заменен сериновым остатком в положении 565, или два из указанных цистеиновых остатков были заменены сериновыми остатками в положениях 503 и 565. В некоторых вариантах изобретения вариант прокариотического PAL содержит водорастворимый полимер. В некоторых вариантах изобретения указанным водорастворимым полимером является полиэтиленгликоль. В предпочтительном варианте изобретения указанным вариантом прокариотического PAL является вариант PAL Anabaena variabilis (AvPAL), а отношение варианта AvPAL к полиэтиленгликолю составляет примерно 1:3 (AvPAL:ПЭГ=1:3). В более предпочтительном варианте изобретения указанным вариантом прокариотического PAL является вариант PAL Anabaena variabilis (AvPAL), отношение варианта AvPAL к полиэтиленгликолю составляет примерно 1:3 (AvPAL:ПЭГ=1:3), а цистеиновые остатки в положениях 503 и 565 варианта AvPAL были заменены сериновыми остатками.
В более конкретном предпочтительном варианте настоящее изобретение относится к способу лечения рака, включающему введение индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, содержащей вариант AvPAL и фармацевтически приемлемый носитель, где указанные цистеиновые остатки в положениях 503 и 565 варианта AvPAL были заменены сериновыми остатками, вариант AvPAL также содержит водорастворимый полимер полиэтиленгликоля, где отношение варианта AvPAL к полиэтиленгликолю составляет примерно 1:3, а вариант AvPAL является эффективным для снижения концентрации фенилаланина в крови, сыворотке или плазме, а предпочтительно, в плазме индивидуума, до уровня, составляющего в пределах от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, примерно менее чем 20 мкМ, а еще более предпочтительно, примерно менее чем 10 мкМ.
В широком варианте изобретения раковым заболеванием является раковое заболевание, при котором пролиферация и/или выживание раковых клеток являются чувствительными к ограничению уровня или к дефициту фенилаланина. В предпочтительных вариантах изобретения указанным раковым заболеванием является рак легких, рак головного мозга или центральной нервной системы, рак толстой кишки, рак предстательной железы, рак почек или метастатическая меланома. В других предпочтительных вариантах изобретения указанным раковым заболеванием является рак головы и шеи, рак яичника, рак матки, лейкоз (например, острый миелоидный лейкоз или острый лимфобластный лейкоз) или миелома. В других предпочтительных вариантах изобретения указанным раковым заболеванием является рак у детей или резистентный рак (то есть, рак, который, как было обнаружено, является резистентным к противораковым терапевтическим средствам или к противораковым терапевтическим средствам направленного действия).
В настоящем изобретении описаны способы лечения рака у индивидуума, включающие введение индивидууму прокариотического PAL или его биологически активного фрагмента, мутанта, варианта или аналога, где указанное введение прокариотического PAL является эффективным для снижения концентрации фенилаланина (Phe) в крови, сыворотке или в плазме, а предпочтительно, в плазме индивидуума, по сравнению с концентрацией в отсутствие прокариотического PAL. Индивидуум, подвергаемый лечению способами согласно изобретению, может иметь любую концентрацию Phe в плазме, например, примерно от 40 мкМ до 2000 мкМ, или концентрацию Phe в плазме в нормальных пределах, например, такая концентрация может составлять в пределах примерно от 40 мкМ до 80 мкМ, а обычно, примерно от 50 мкМ до 70 мкМ, а у большинства людей такая концентрация составляет примерно от 55 мкМ до 65 мкМ. Концентрация Phe в плазме у индивидуума после лечения снижается до пределов от нижнего уровня детекции и примерно до 20 мкМ-60 мкМ, предпочтительно, до менее чем примерно 20 мкМ, а еще более предпочтительно, до менее чем примерно 10 мкМ, как было определено стандартными методами детектирования, хорошо известными специалистам.
В настоящем изобретении также рассматриваются способы лечения рака путем введения индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, содержащей вариант прокариотического PAL и фармацевтически приемлемый носитель в комбинации с пищей с ограниченным содержанием белка (то есть, не содержащей фенилаланина), где указанное лечение является эффективным для снижения концентрации Phe в плазме у указанного индивидуума в отличие от лечения, проводимого в отсутствие комбинированного введения. Концентрация Phe в плазме у индивидуума после лечения снижается в пределах от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, до менее чем примерно 20 мкМ, а еще более предпочтительно, до менее чем примерно 10 мкМ, как было определено стандартными методами детектирования, хорошо известными специалистам.
В другом варианте изобретения прокариотический PAL или его биологически активный фрагмент, мутант, вариант или аналог могут быть также введены в комбинации с пищей с ограниченным содержанием белка. Пищей с ограниченным содержанием белка, вводимой описанным здесь способами, является пища с ограниченным содержанием фенилаланина, где общее потребление Phe данным индивидуумом ограничено до менее чем 600 мг в день. В других вариантах изобретения пищей с ограниченным содержанием белка является пища с ограниченным содержанием фенилаланина, где общее потребление Phe ограничено до менее чем 300 мг в день. В других вариантах изобретения пищей с ограниченным содержанием белка является пища, в которую добавлены одна или несколько аминокислот, таких как, например, но не ограничивающихся ими, тирозин, валин, изолейцин и/или лейцин.
В настоящем изобретении также рассматривается фармацевтическая композиция, содержащая прокариотический PAL или его биологически активный фрагмент, мутант, вариант или аналог, и фармацевтически приемлемый носитель, разбавитель или наполнитель. Фармацевтическая композиция может также содержать белковую лечебную добавку. В других вариантах изобретения такой белковой добавкой является добавка, не содержащая фенилаланина. Указанная белковая добавка, предпочтительно, обогащена L-тирозином, L-глутамином, L-карнитином, содержащимися в концентрации 20 мг/100 г добавки, L-таурином, содержащимся в концентрации 40 мг/100 г добавки, и селеном. Такая добавка может также содержать рекомендованные суточные дозы минералов, например, кальция, фосфора и магния. Указанная добавка может также содержать рекомендованную суточную дозу одной или нескольких аминокислот, выбранных из группы, состоящей из L-лейцина, L-пролина, ацетата L-лизина, L-валина, L-изолейцина, L-аргинина, L-аланина, глицина, моногидрата L-аспарагина, L-триптофана, L-серина, L-треонина, L-гистидина, L-метионина, L-глутаминовой кислоты и L-аспарагиновой кислоты. Кроме того, такая добавка может содержать рекомендованную суточную дозу витаминов A, D и E. Указанная добавка, предпочтительно, имеет содержание жира, которое обеспечивает по меньшей мере 40% энергетической ценности данной добавки. Такая добавка может быть приготовлена в форме порошка или белкового брикета.
В настоящем изобретении также рассматриваются способы лечения рака путем введения индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, содержащей вариант прокариотического PAL и фармацевтически приемлемый носитель в комбинации с противораковым терапевтическим средством или с противораковым терапевтическим средством направленного действия, где указанное лечение является эффективным для снижения концентрации фенилаланина в плазме у указанного индивидуума в отличие от лечения, проводимого в отсутствие комбинированного введения. Концентрация Phe в плазме у индивидуума после лечения снижается в пределах от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, до менее чем примерно 20 мкМ, а еще более предпочтительно, до менее чем примерно 10 мкМ, как было определено стандартными методами детектирования, хорошо известными специалистам.
Предпочтительные варианты включают оптимизацию дозы, вводимой в организм, подвергаемый лечению, а предпочтительно, млекопитающему или человеку, до уровней, которые являются эффективными для предупреждения или ослабления симптомов заболевания. Прокариотический PAL может быть введен в виде одной суточной дозы, дробных суточных доз, одной еженедельной дозы, дробных еженедельных доз, одной ежемесячной дозы или дробных ежемесячных доз. В некоторых вариантах изобретения PAL-терапия не является непрерывной, но тем не менее, PAL может вводиться ежедневно до тех пор, пока концентрация PAL в плазме индивидуума не будет снижаться в пределах от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, до менее чем примерно 20 мкМ, а еще более предпочтительно, до менее чем примерно 10 мкМ, как было определено стандартными методами детектирования, хорошо известными специалистам. Мониторинг концентрации Phe в плазме индивидуума предпочтительно проводят ежедневно, а PAL вводят в том случае, если наблюдается 10%-20%-ое увеличение концентрации Phe в плазме. В других предпочтительных вариантах изобретения дозы вводят один раз в неделю. В настоящем изобретении рассматриваются дозы, составляющие по меньшей мере 0,001 мг/кг, 0,005 мг/кг, 0,01 мг/кг, 0,05 мг/кг, и такие дозы могут составлять до 0,1 мг/кг, 0,5 мг/кг, 1,0 мг/кг, 5,0 мг/кг, 12 мг/кг в неделю или выше. Предпочтительной дозой является доза 1 мг/кг/неделю, более предпочтительной дозой является доза 0,1 мг/кг/неделю, а еще более предпочтительной дозой является доза 0,01 мг/кг/неделю.
В настоящем изобретении рассматриваются парентеральные или непарентеральные способы введения, включая пероральное введение, чрескожное введение, введение через слизистую, внутрилегочное введение (включая введение с помощью аэрозоля), внутримышечное введение, подкожное введение или внутривенное введение, которые позволяют доставлять эквивалентные дозы. Также конкретно рассматривается инъекция или инфузия ударной дозы непосредственно в суставы или в цереброспинальную жидкость, такая как интратекальная, интрацеребральная, интравентрикулярная инъекция или инфузия, инъекция или инфузия, вводимая посредством люмбальной пункции или через мозжечково-мозговую цистерну. Предпочтительные дозы вводят подкожно или перорально.
Рассматриваются также и другие способы повышения активности прокариотического PAL у человека, включая генотерапию. Перенос гена прокариотического PAL может быть осуществлен различными методами, известными специалистам, включая перенос с использованием вирусных векторов, гомологичную рекомбинацию или прямую инъекцию ДНК. В объем данного аспекта изобретения входят варианты, отличающиеся тем, что они имеют последовательности нуклеиновой кислоты, кодирующие весь прокариотический PAL или его часть или его биологически активный фрагмент, мутант, вариант или аналог, которые могут быть введены in vivo в клетки, которыми являются, например, но не ограничиваются ими, клетки, пораженные раком; клетки, находящиеся поблизости от раковых клеток, или соседствующие с раковыми клетками; гемопоэтические клетки, циркулирующие в кровотоке и/или мигрирующие на участок ракового заболевания.
В своем третьем аспекте, настоящее изобретение относится к фармацевтическим композициям или препаратам вариантов прокариотического PAL, содержащим бактериальный PAL и его биологически активные фрагменты, мутанты, варианты или аналоги, и фармацевтически приемлемый носитель, где указанный фармацевтически приемлемый носитель содержит стабилизатор. В некоторых вариантах изобретения указанным стабилизатором является L-фенилаланин или его структурный аналог. В некоторых вариантах изобретения стабилизатор выбран из группы, состоящей из L-фенилаланина, транс-коричной кислоты и бензойной кислоты. В некоторых вариантах изобретения указанным стабилизатором является L-фенилаланин. В некоторых вариантах изобретения указанным стабилизатором является транс-коричная кислота. В своем предпочтительном варианте, настоящее изобретение относится к способам лечения рака с использованием указанных фармацевтических композиций или препаратов.
В особенно предпочтительном варианте изобретения фармацевтическая композиция или препарат содержит вариант прокариотического PAL и фармацевтически приемлемый носитель, где указанным вариантом прокариотического PAL является вариант AvPAL; отношение варианта AvPAL к полиэтиленгликолю составляет примерно 1:3 (AvPAL:ПЭГ=1:3), цистеиновые остатки в положениях 503 и 565 варианта AvPAL были заменены сериновыми остатками, а указанный фармацевтически приемлемый носитель содержит стабилизатор. В некоторых вариантах изобретения указанным стабилизатором является L-фенилаланин или его структурный аналог. В некоторых вариантах изобретения стабилизатор выбран из группы, состоящей из L-фенилаланина, транс-коричной кислоты и бензойной кислоты. В некоторых вариантах изобретения указанным стабилизатором является L-фенилаланин. В некоторых вариантах изобретения указанным стабилизатором является транс-коричная кислота. В некоторых вариантах изобретения указанным стабилизатолром является бензойная кислота. В своем особенно предпочтительном варианте настоящее изобретение относится к способам лечения рака с использованием указанных фармацевтических композиций или препаратов.
В своем четвертом аспекте настоящее изобретение относится к способу продуцирования рекомбинантного прокариотического PAL или его биологически активного фрагмента, мутанта, варианта или аналога в количествах, подходящих для использования данного фермента в терапевтических целях. В настоящем изобретении рассматривается PAL, происходящий от бактерий, включая, но не ограничиваясь ими, Streptomyces, Sorangium, Pseudomonas и цианобактерии, такие как Nostoc и Anabaena. В некоторых вариантах изобретения PAL происходит от бактерий вида Streptomyces maritimus, S. verticillatus, Soragium cellulosum, Nostoc punctiforme, Nostoc tobacum, Anabaena variabilis или Pseudomonas putida. В предпочтительных вариантах изобретения PAL происходит от цианобактерий вида Nostoc punctiforme или Anabaena variabilis. В особенно предпочтительном варианте изобретения PAL происходит от Anabaena variabilis. В другом варианте изобретения активность прокариотического фермента PAL продуцируется с использованием последовательностей кДНК или ДНК, происходящих от последовательностей, которые иногда определяются как последовательности, кодирующие HAL-активность или характеризующиеся присутствием мотива PAL-HAL, но имеющие ключевые остатки PAL, отличающиеся от остатков HAL.
В широком варианте изобретения указанный способ включает стадию переноса кДНК или ДНК, кодирующей весь прокариотический PAL или его биологически активный фрагмент, мутант, вариант или аналог или их части, в клетки, подходящие для их экспрессии. В предпочтительных вариантах изобретения для переноса ДНК в клетки или клеточные линии, подходящие для экспрессии данной ДНК, используют экспрессионный вектор. В одном из особенно предпочтительных вариантов изобретения кДНК или ДНК переносят в E.coli, в результате чего происходит сверхэкспрессия рекомбинантного бактериального PAL, необязательно в виде гибридного белка. В другом варианте изобретения способ продуцирования прокариотического PAL включает стадии: (a) культивирования клеток, трансформированных кДНК или ДНК, кодирующих весь прокариотический PAL или его биологически активный фрагмент, мутант, вариант или аналог, в подходящей культуральной среде до соответствующей плотности, достаточной для продуцирования посевной культуры, (b) введения трансформированных клеток в биореактор, (c) подачи подходящей культуральной среды в указанный биореактор, и (d) отделения трансфецированных клеток от среды, содержащей фермент.
В предпочтительном варианте изобретения рекомбинантный прокариотический PAL или его биологически активный фрагмент, мутант, вариант или аналог сверхэкспрессируются в присутствии или в отсутствие N-концевой метки (например, октагистидиловой метки) в векторе, предпочтительно, pIBXl (Su, et al., Appl. Environ. Microbiol. 62:2723-2734 (1996)) или pET28a (Invitrogen), содержащем индуцибельный промотор, такой как промотор IPTG (изопропил-бета-D-тиогалактопиранозида), в клетках E.coli BLR(DE3)/pLysS (Novagen) или в клетках E.coli BL21(DE3)/pLysS (Invitrogen). В особенно предпочтительном варианте изобретения способ продуцирования прокариотического PAL включает стадии: (1) выращивания посевной культуры для биореактора/ферментера из глицеринового маточного раствора в шейкерных колбах; (2) введения такой посевной культуры в управляемый биореактор в режиме с подпиткой; (3) выращивания указанной культуры в среде с добавленной глюкозой, pH 7,8, содержащей >20% растворенного кислорода и перемешиваемой со скоростью до 1200 об/мин, при 30°С до тех пор, пока клеточная плотность не достигнет OD600=70-100 (~22-25 часов); (4) индуцирования роста указанной культуры путем добавления 0,4 мМ IPTG; (5) выращивания указанной культуры при пониженной температуре 22-26°С до тех пор, пока величина активности не будет составлять <0,1 МЕ/мл (приблизительно 40-48 часов, а OD600 обычно составляет 200); и (5) сбора бактерий путем непрерывного центрифугирования. В предпочтительном варианте изобретения среда для культивирования клеток обычно состоит из белка дрожжевого экстракта, пептона-триптона, глюкозы, глицерина, казаминокислот, следовых количеств солей и забуферивающих фосфатных солей.
В своем пятом аспекте настоящее изобретение относится к способу очистки прокариотического PAL или его биологически активного фрагмента, мутанта, варианта или аналога. В соответствии с первым вариантом изобретения трансформированную клеточную массу культивируют и разрушают с выделением неочищенного рекомбинантного фермента. Экзогенные материалы обычно отделяют от неочищенной массы во избежание загрязнения колонок. Хроматографическую очистку проводят с использованием одной или нескольких хроматографических смол. Затем очищенный белок приготавливают в буфере в целях обеспечения стабильной активности в течение длительного периода времени. В другом предпочтительном варианте изобретения способ очистки прокариотического PAL включает стадии: (a) лизиса бактерий, содержащих рекомбинантный PAL; (b) термообработки лизата для инактивации вирусов; (c) осветления этого лизата путем проведения второй стадии непрерывного центрифугирования и/или глубокой фильтрации; (d) пропускания осветленного лизата через угольный фильтр; (e) пропускания фильтрата (d) через фильтр в последней стадии фильтрации (через 0,2 мкм-фильтр Sartorious Sartopore); (f) пропускания конечного фильтрата через гидрофобную хроматографическую смолу, такую как бутиловая смола для гидрофобной хроматографии; (g) пропускания элюата (f) через анионообменную хроматографическую смолу, такую как смола на ионообменной колонке Q; (h) выделения конечного продукта путем буферного обмена с фильтрацией в тангенциальном потоке; и (i) стерилизации конечного продукта. Для специалиста в данной области совершенно очевидно, что одна или несколько хроматографических стадий могут не проводиться, либо они могут быть заменены, либо порядок проведения хроматографических стадий может быть изменен, где такие изменения входят в объем настоящего изобретения. И наконец, при желании могут быть проведены соответствующие стадии стерилизации.
В шестом аспекте настоящего изобретения рассматриваются скрининг-анализы для идентификации прокариотического PAL или его биологически активного фрагмента, мутанта, варианта или аналога, которые могут способствовать предупреждению, ослаблению симптомов или лечению рака посредством контактирования опухолевых клеток в культуре с прокариотическим PAL, и определения способности прокариотического PAL снижать степень пролиферации и/или выживаемости опухолевых клеток. Такие скрининг-анализы могут также включать стадии создания вариантов, которые имеют консервативные или не-консервативные замены в активных сайтах, например, в положениях Gly142, триады Thr-Ser-Gly (143-145), Asp146, Leu147, Asn196, Ile195, Leu192, Leu76, Asn79, Met400, Thr428, Gln432 в EncP, происходящем от Streptomyces maritimus, или их эквивалентов в другом прокариотическом PAL, таком как PAL Nostoc punctiforme или Anabaena variabilis, которые эквивалентны остаткам Ser210, триады Ala-Ser-Gly (211-213), Asp214, Leu215, Asn270, Val269, Leu266, Leu134, His137, Lys468, Glu496, Gln500 в PAL от Rhodosporidium toruloides (RtPAL), в областях, смежных с активными центрами, или по всей полипептидной последовательности, с последующим тестированием вариантов на фенилаланин-конвертирующую активность in vitro. В некоторых вариантах изобретения такой способ представляет собой крупномасштабный анализ. В предпочтительном варианте изобретения полноразмерные геномы бактерий секвенируют и скринируют на присутствие гомологов прокариотического PAL биоинформативными методами. В еще одном предпочтительном варианте изобретения каталитическую PAL-активность белкового продукта таких гомологов подтверждают, например, путем анализа на способность к превращению фенилаланина в транс-циннамат in vitro.
В своем седьмом аспекте настоящее изобретение относится к способам применения композиций прокариотического PAL для диагностики заболеваний, включая, но не ограничиваясь ими, раковые заболевания. В одном из вариантов изобретения прокариотический PAL используют для измерения уровней Phe в пробах крови, плазмы или сыворотки. В другом своем варианте, настоящее изобретение относится к диагностическому набору, содержащему прокариотический PAL для его использования в целях мониторинга уровенй Phe в пробах крови, плазмы или сыворотки индивидуума.
Другие отличительные признаки и преимущества настоящего изобретения будут очевидны из нижеследующего подробного описания изобретения. Однако, следует отметить, что несмотря на то, что в таком подробном описании и конкретных примерах представлены предпочтительные варианты осуществления изобретения которые приводятся лишь в целях иллюстрации, в настоящее изобретение могут быть внесены различные изменения и модификации, не выходящие за рамки существа и объема изобретения и такие изменения и модификации будут очевидны для специалистов из подробного описания изобретения.
Подробное описание графического материала
Фигура 1. Фигура 1A: Генная последовательность PAL Nostoc punctiforme (SEQ ID NO:1); Фигура 1B: Последовательность белка PAL Nostoc punctiforme (SEQ ID NO:2).
Фигура 2. Фигура 2A: Генная последовательность PAL Anabaena variabilis (SEQ ID NO:3); Фигура 2B: Последовательность белка PAL Anabaena variabilis (SEQ ID NO:4).
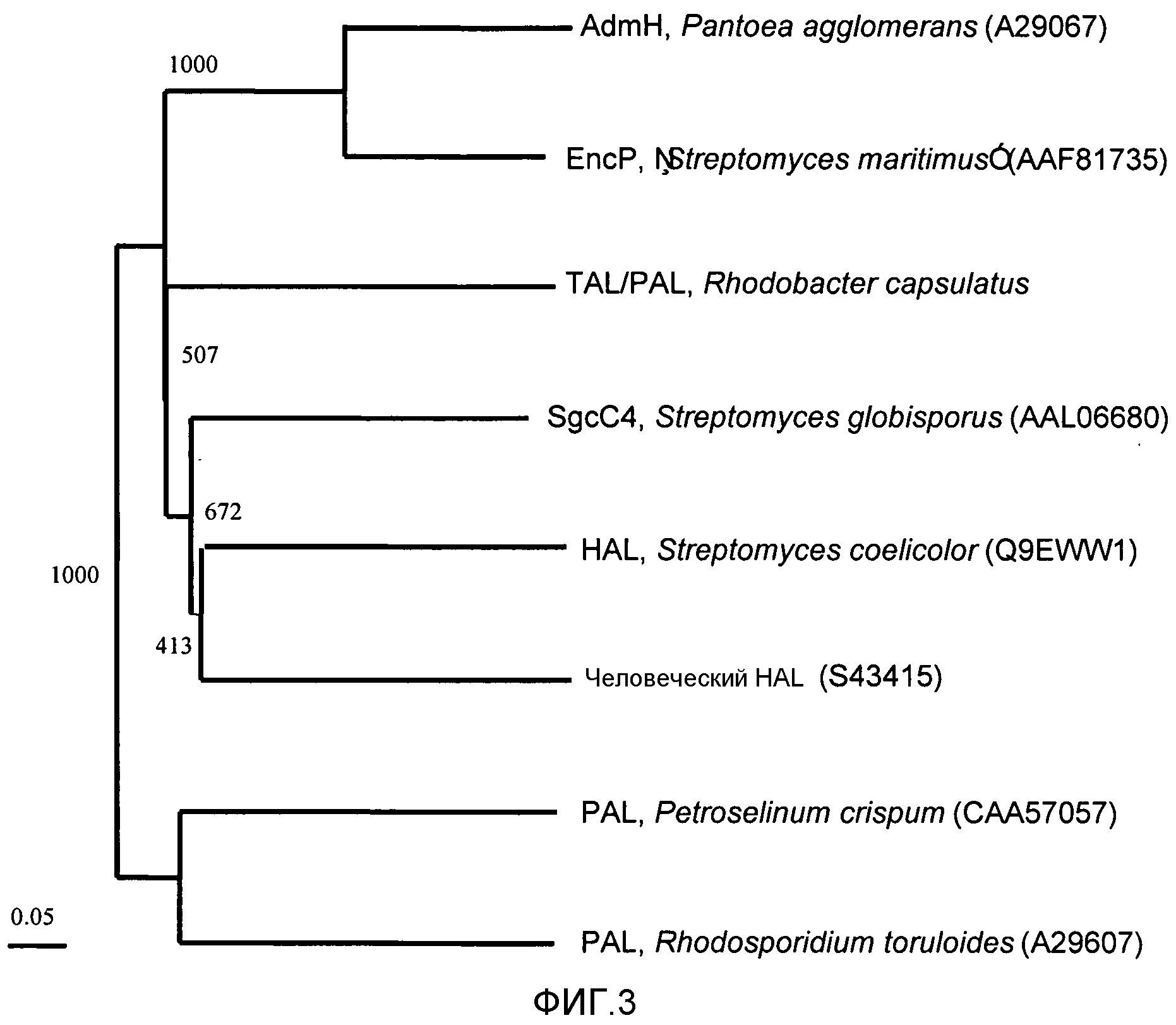
Фигура 3. Древовидная схема ферментов (ароматическая аминокислота)-аммиак-лиазы прокариотов и эукариотов. Последовательности брали из GenBank (регистрационные номера приводятся в скобках) и выравнивали с использованием программы ClustalX (1.83) методом присоединения соседних остатков.
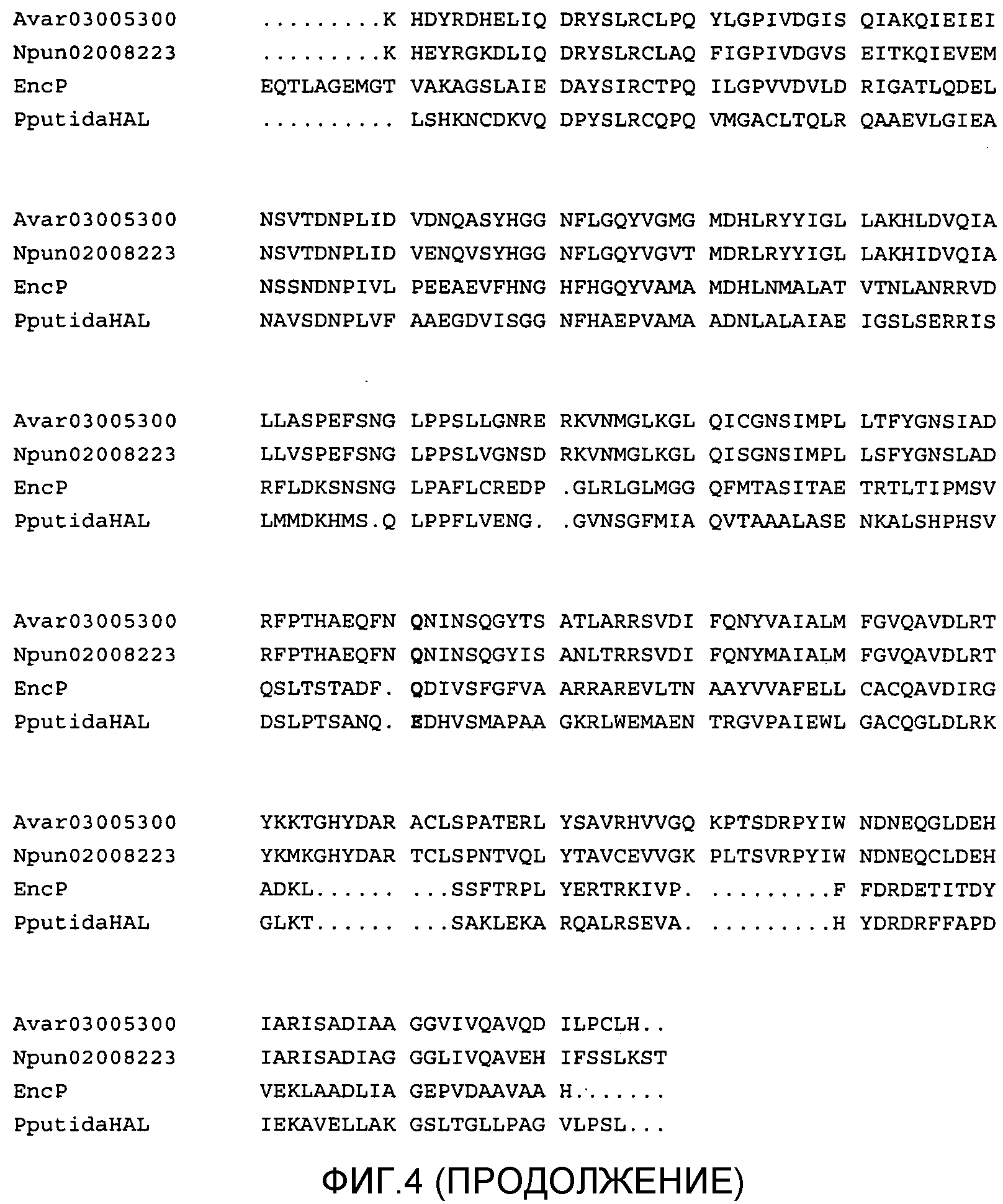
Фигура 4. Выравнивание последовательностей белка PAL цианобактерий N. punctiforme (SEQ ID NO:2) и A. variabilis (SEQ ID NO:4) с последовательностями PAL EncP (SEQ ID. NO:5) и HAL P. putida (SEQ ID NO:6). Остатки активных центров, соответствующие PAL- или HAL-активности, выделены.
Фигура 5. Фигура 5A: Последовательность белка фенилаланин-аммиак-лиазы (PAL) Anabaena variabilis с заменой цистеина на серин в положении 64 (AvPAL_C64S, SEQ ID NO:7); Фигура 5B: Последовательность белка PAL Anabaena variabilis с заменой цистеина на серин в положении 318 (AvPAL_C318S, SEQ ID NO:8); Фигура 5C: Последовательность белка PAL Anabaena variabilis с заменой цистеина на серин в положении 503 (AvPAL_C503S, SEQ ID NO:9); Фигура 5D: Последовательность белка PAL Anabaena variabilis с заменой цистеина на серин в положении 565 (AvPAL_C565S, SEQ ID NO: 10); Фигура 5E: Последовательность белка PAL Anabaena variabilis с заменой цистеина на серин в положениях 503 и 565 (AvPAL_C565SC503S, SEQ ID NO:11). Замены цистеина на серин подчеркнуты и выделены жирным шрифтом.
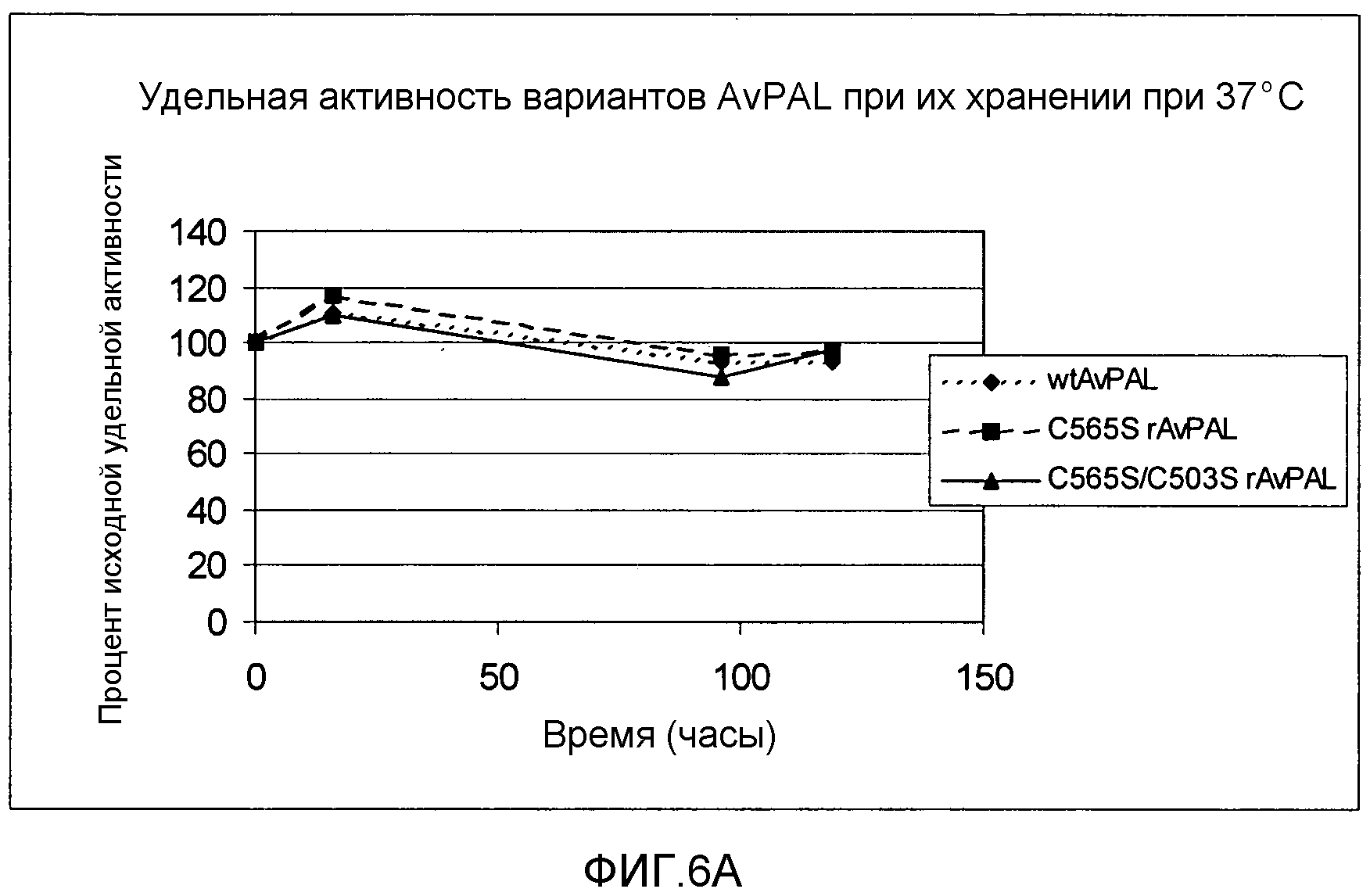
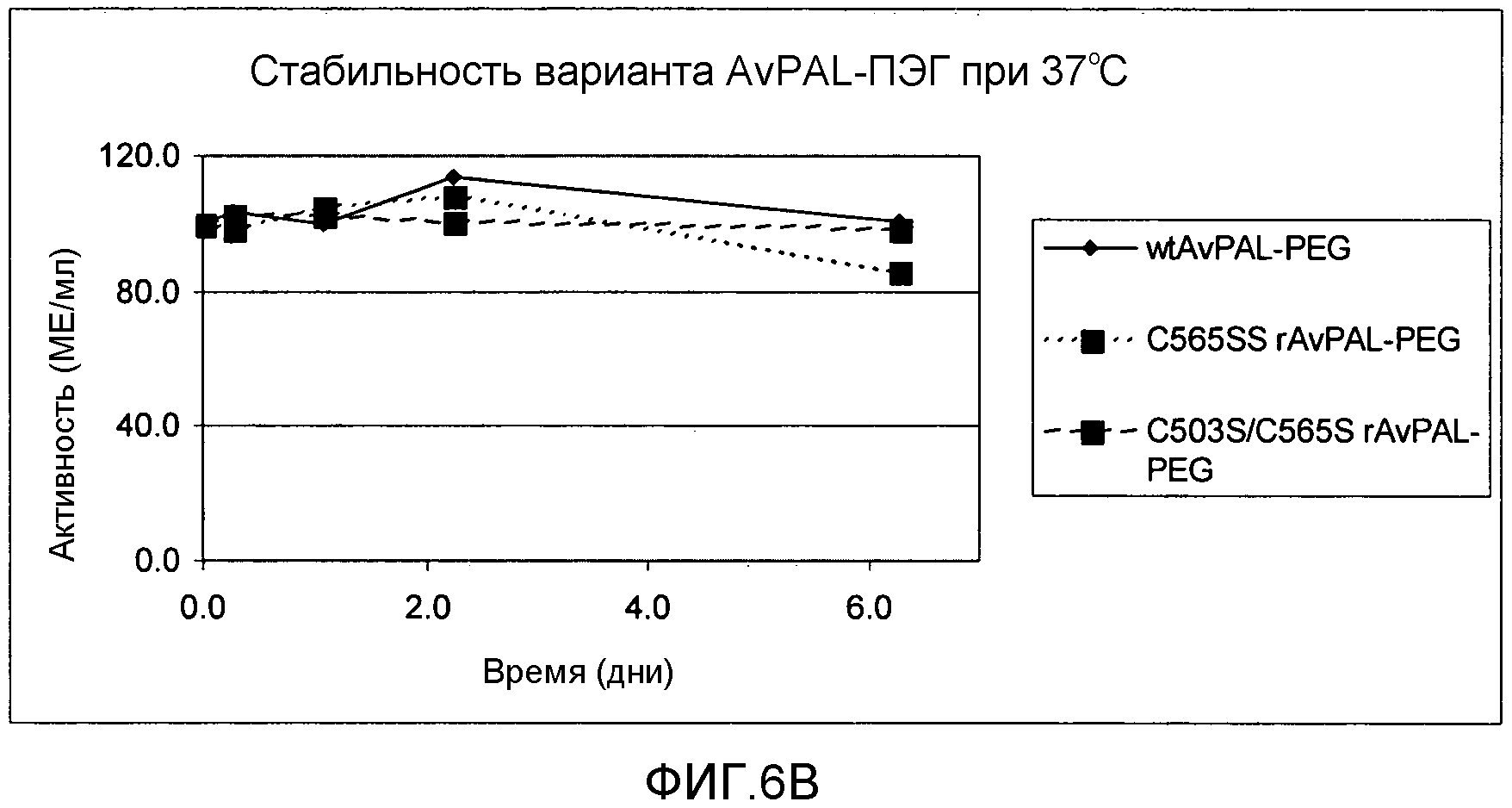
Фигура 6. Фигура 6A: Влияние замен цистеина на серин в положении 565 или положениях 565 и 503 не-ПЭГилированного AvPAL на удельную активность фермента PAL in vitro после инкубирования в различные периоды времени при 37°С. Фигура 6B: Влияние замен цистеина серином в положении 565 или положениях 565 и 503 ПЭГилированного AvPAL на удельную активность фермента PAL in vitro после инкубирования в различные периоды времени при 37°С.
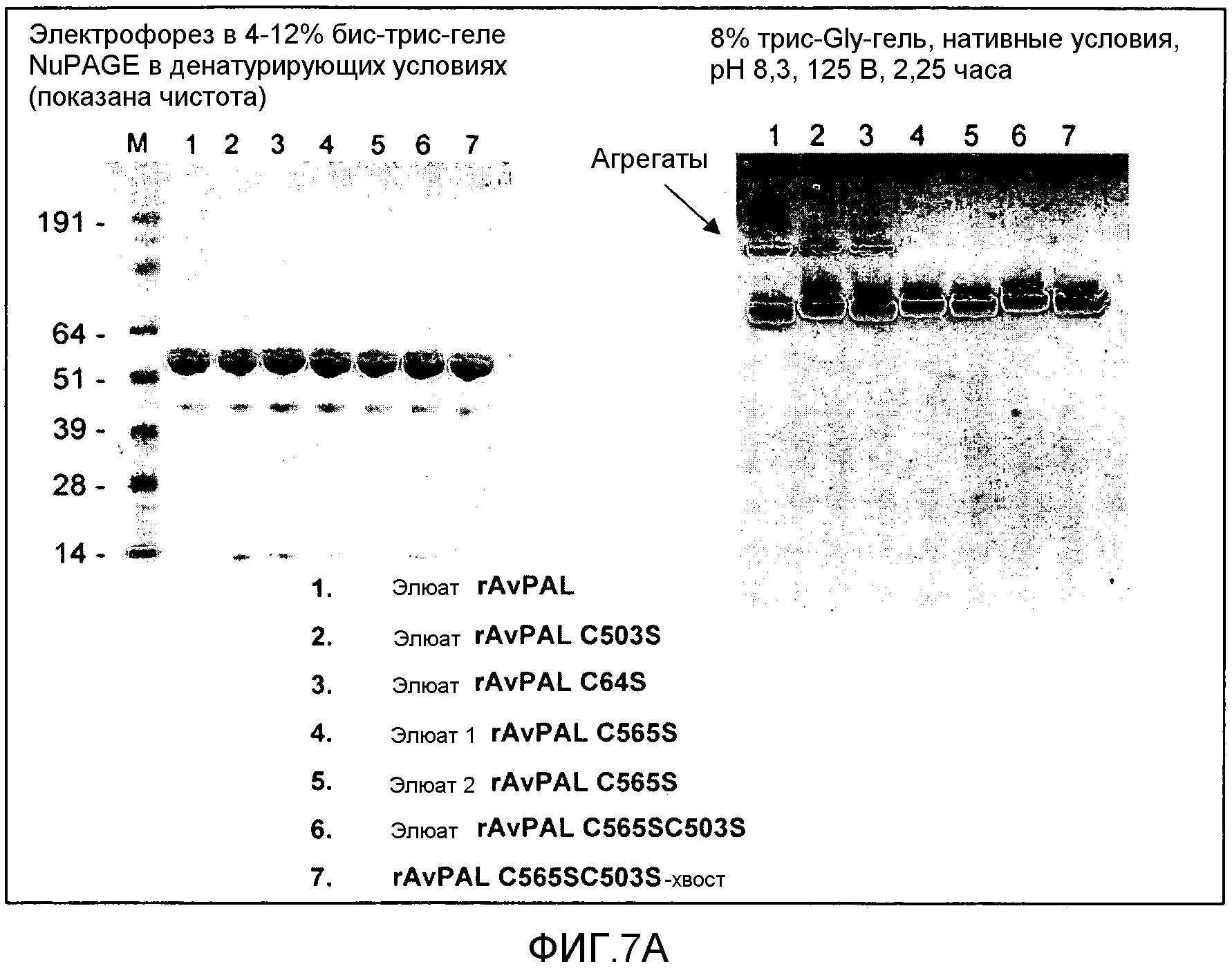
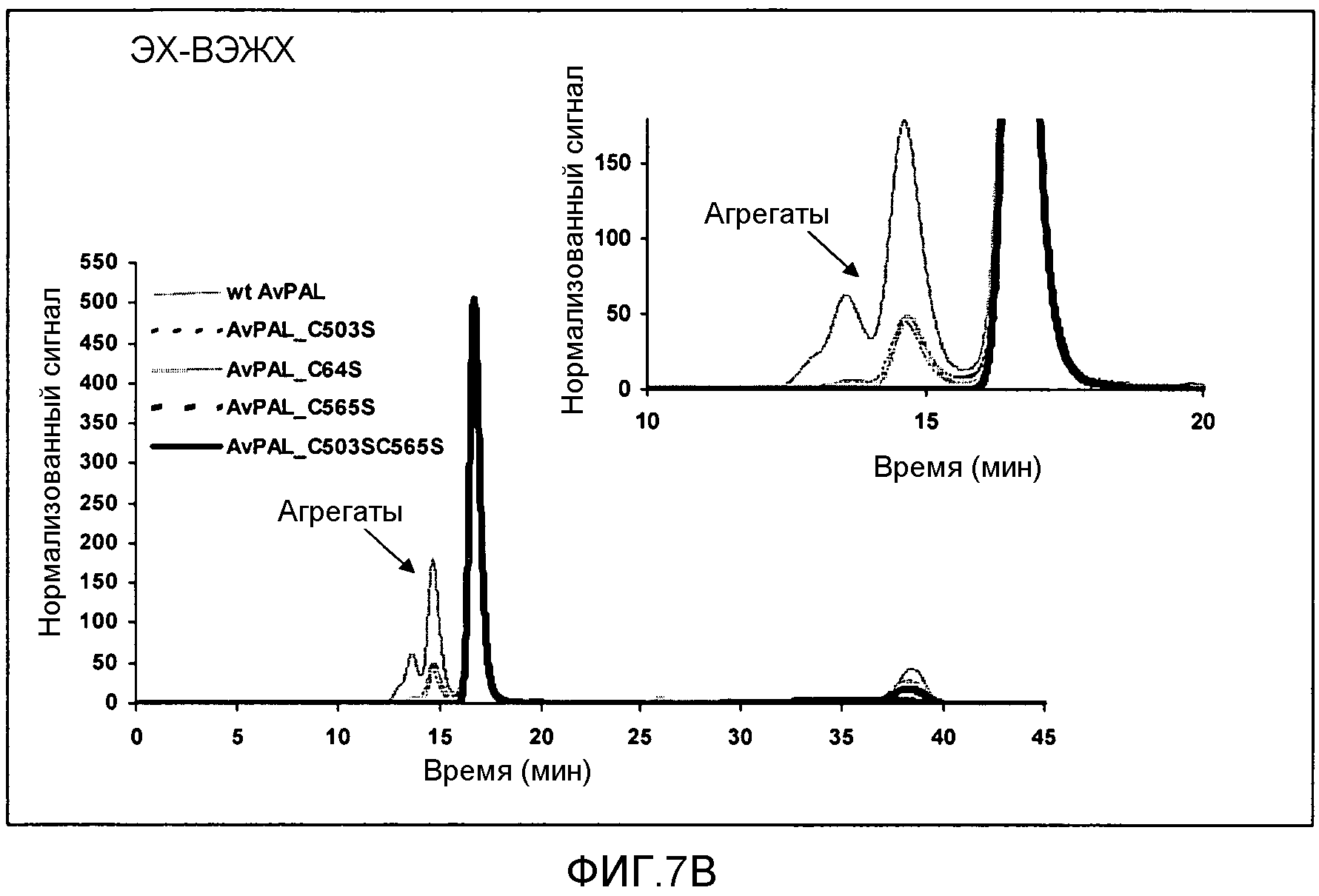
Фигура 7. Фигура 7A: Влияние замен цистеина на серин в AvPAL на образование агрегатов белка в растворе, как было проанализировано с помощью гель-электрофореза в денатурирующих условиях (левая панель) или в нативных условиях (правая панель). Фигура 7B: Влияние замен цистеина серином в AvPAL на образование агрегатов белка в растворе, как было проанализировано с помощью эксклюзионной хроматографии (ЭХ)-ВЭЖХ.
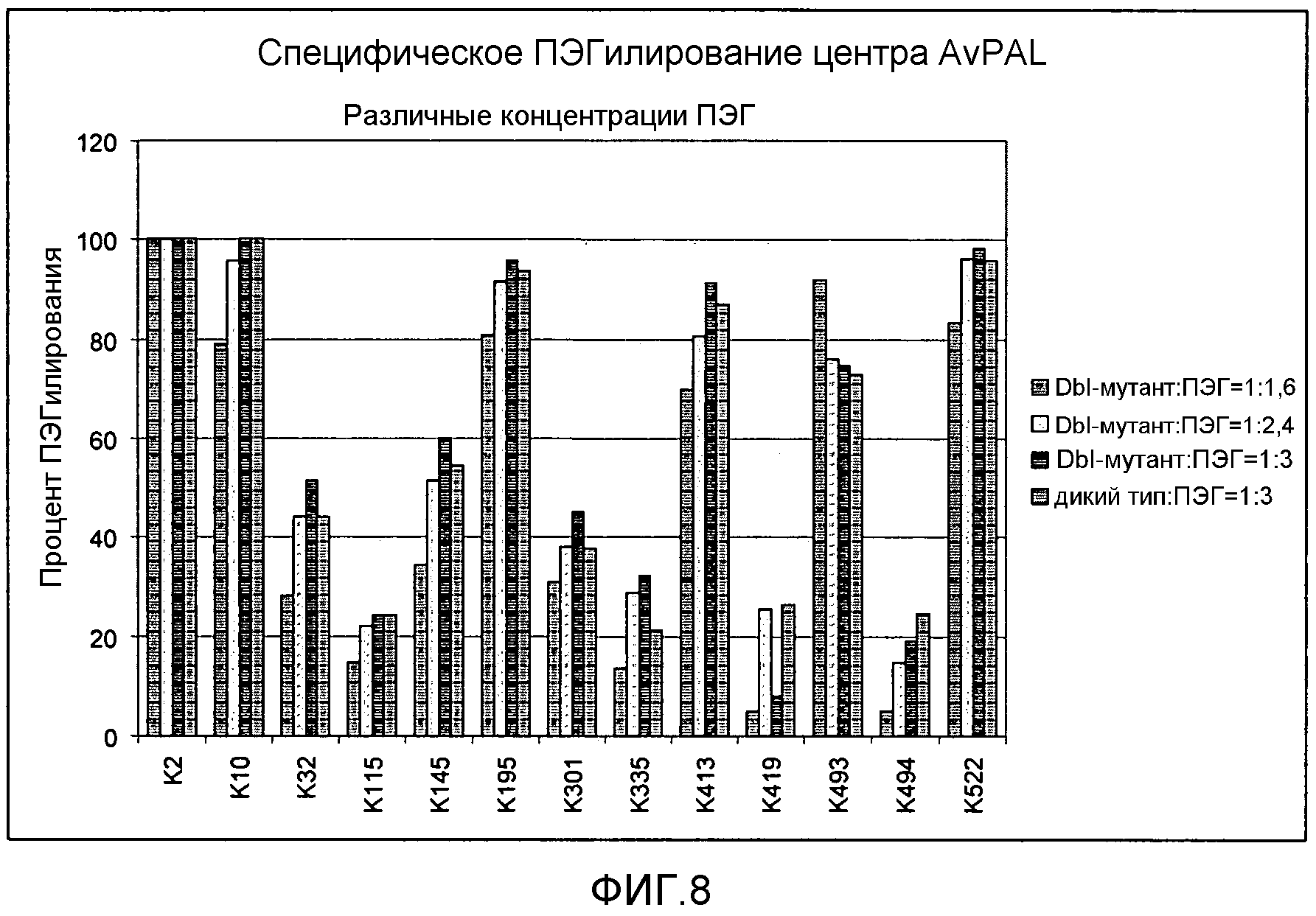
Фигура 8. Влияние замен цистеина на серин в положениях 565 и 503 (мутант dbl) в AvPAL на сайт-специфическое ПЭГилирование при различных концентрациях ПЭГ.
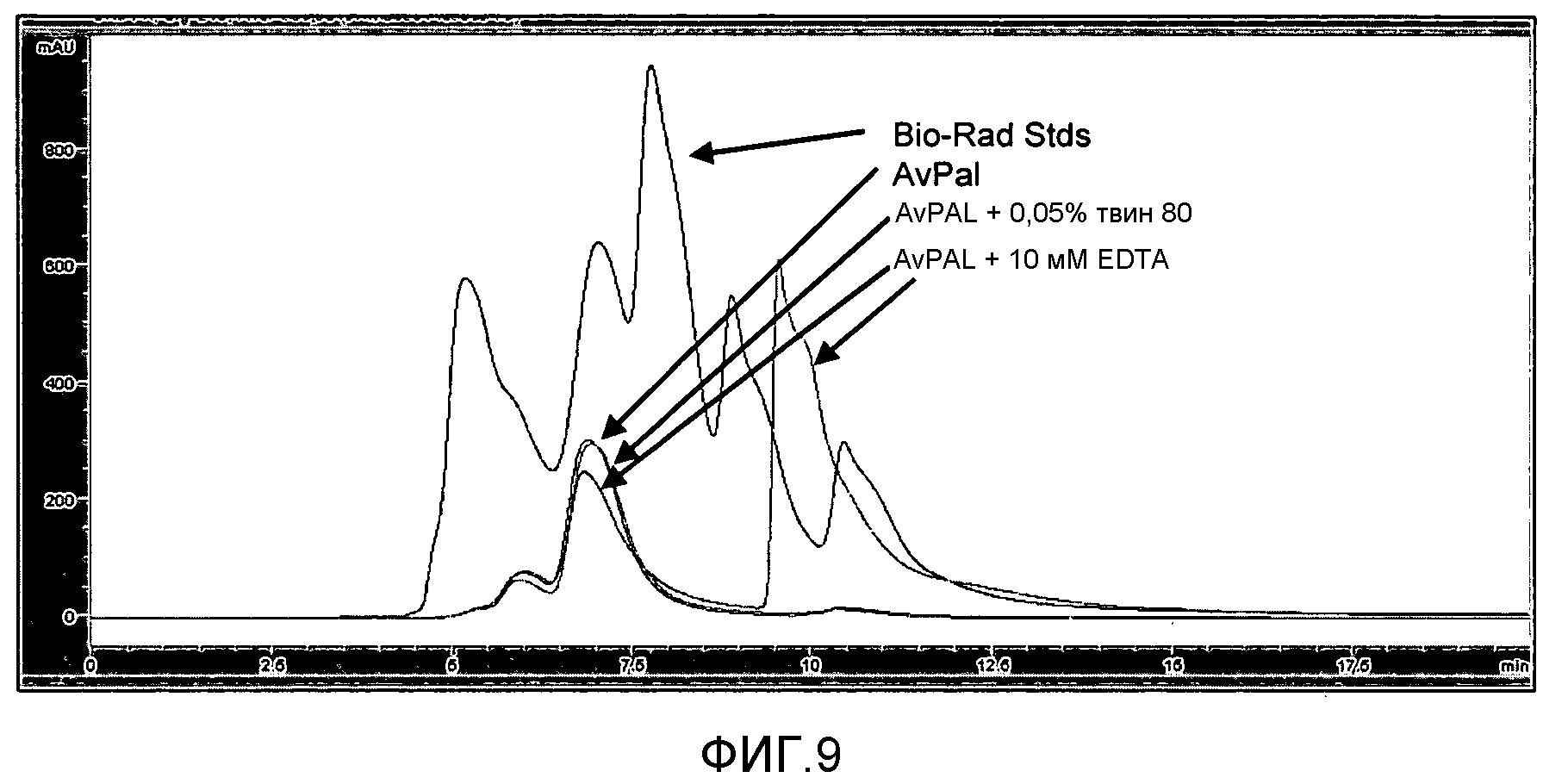
Фигура 9. Влияние обработки AvPAL 0,05% твином 80 или 10 мМ EDTA на образование агрегатов белка в растворе, как было проанализировано с помощью ЭХ-ВЭЖХ.
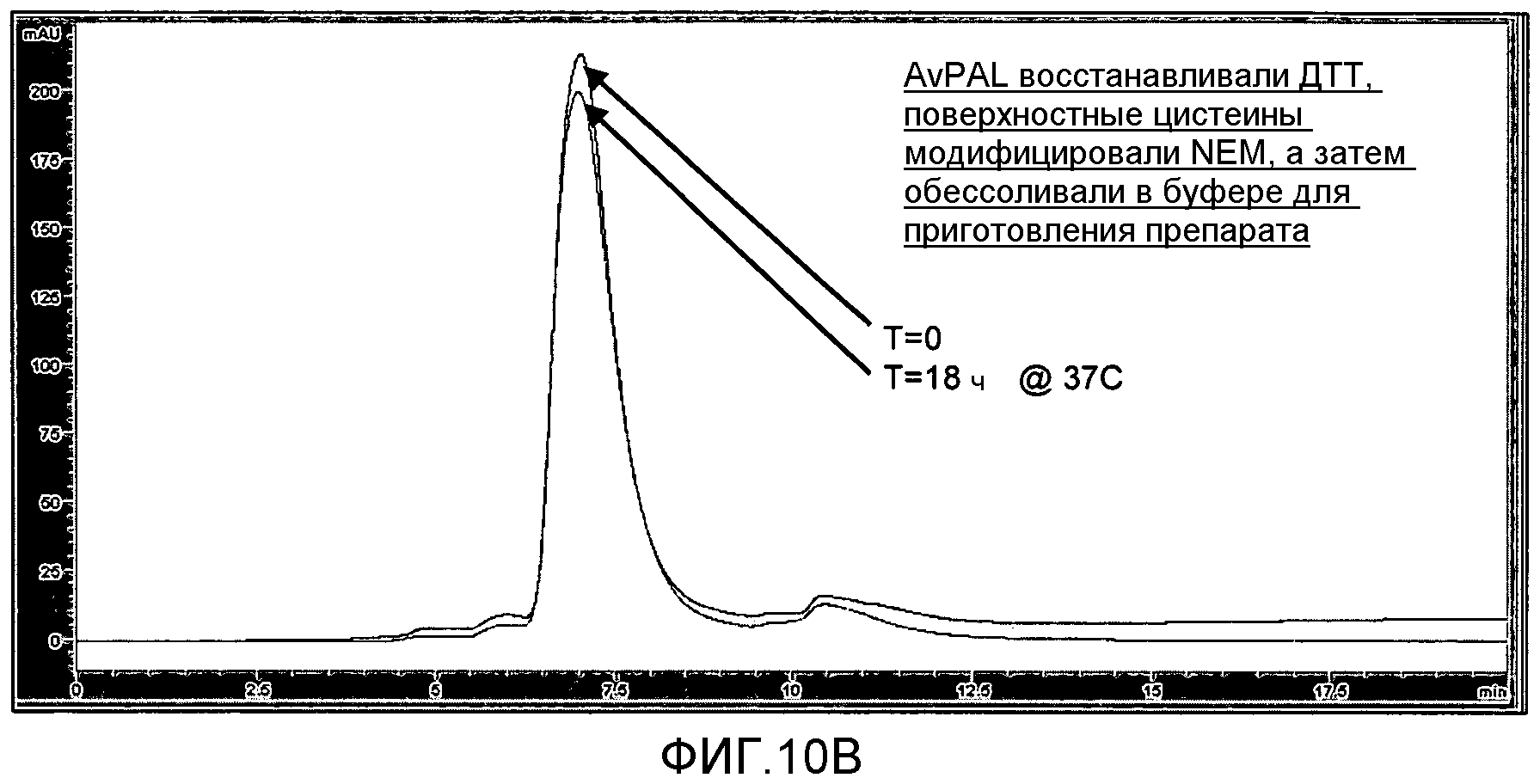
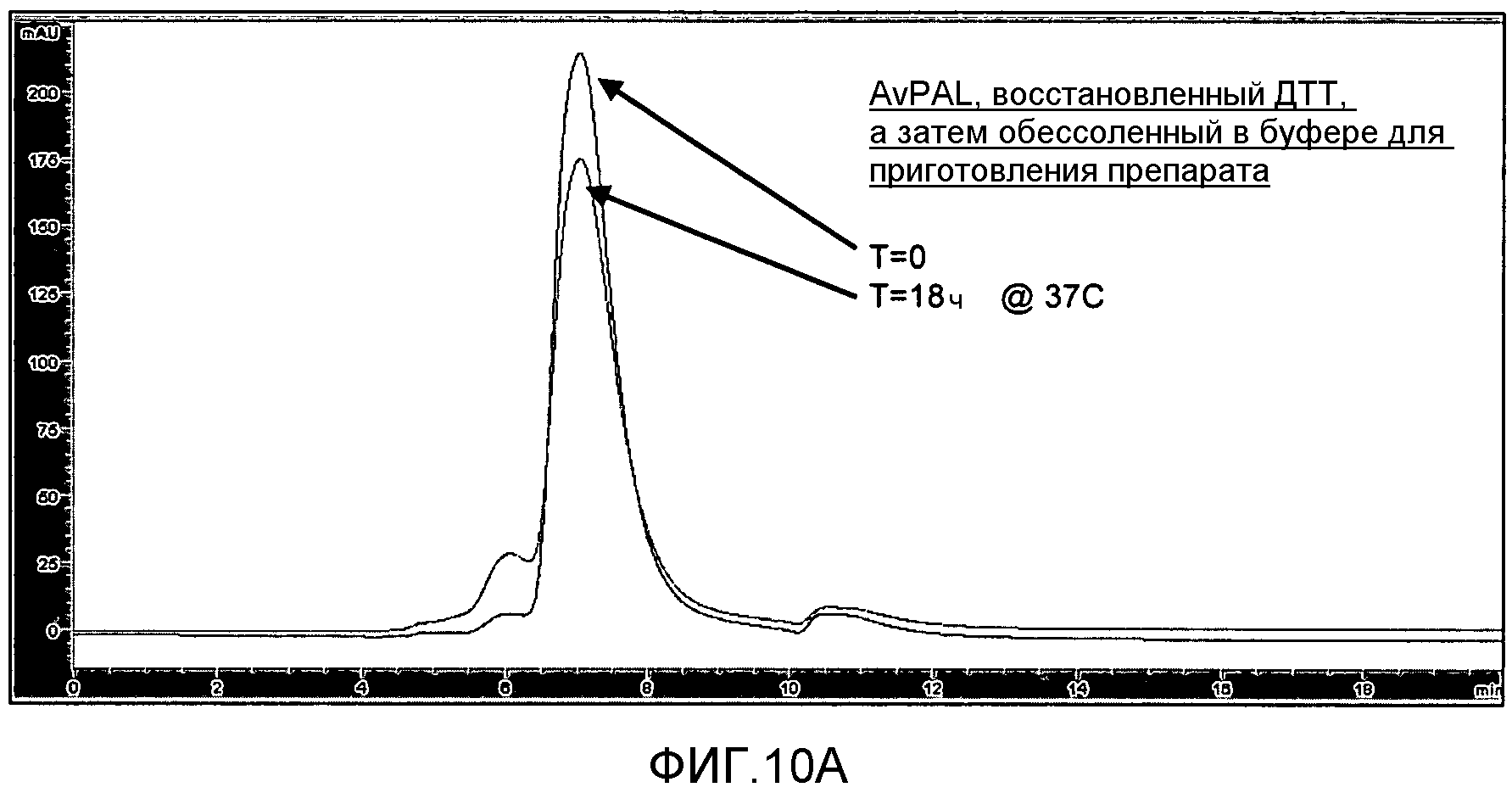
Фигура 10. Фигура 10A: Влияние обработки AvPAL дитиотреитолом (DTT) на образование агрегатов белка в растворе, как было проанализировано с помощью ЭХ-ВЭЖХ. Фигура 10B: Влияние обработки AvPAL дитиотреитолом (DTT) и N-этилмалеимидом (NEM) на образование агрегатов белка в растворе, как было проанализировано с помощью ЭХ-ВЭЖХ.
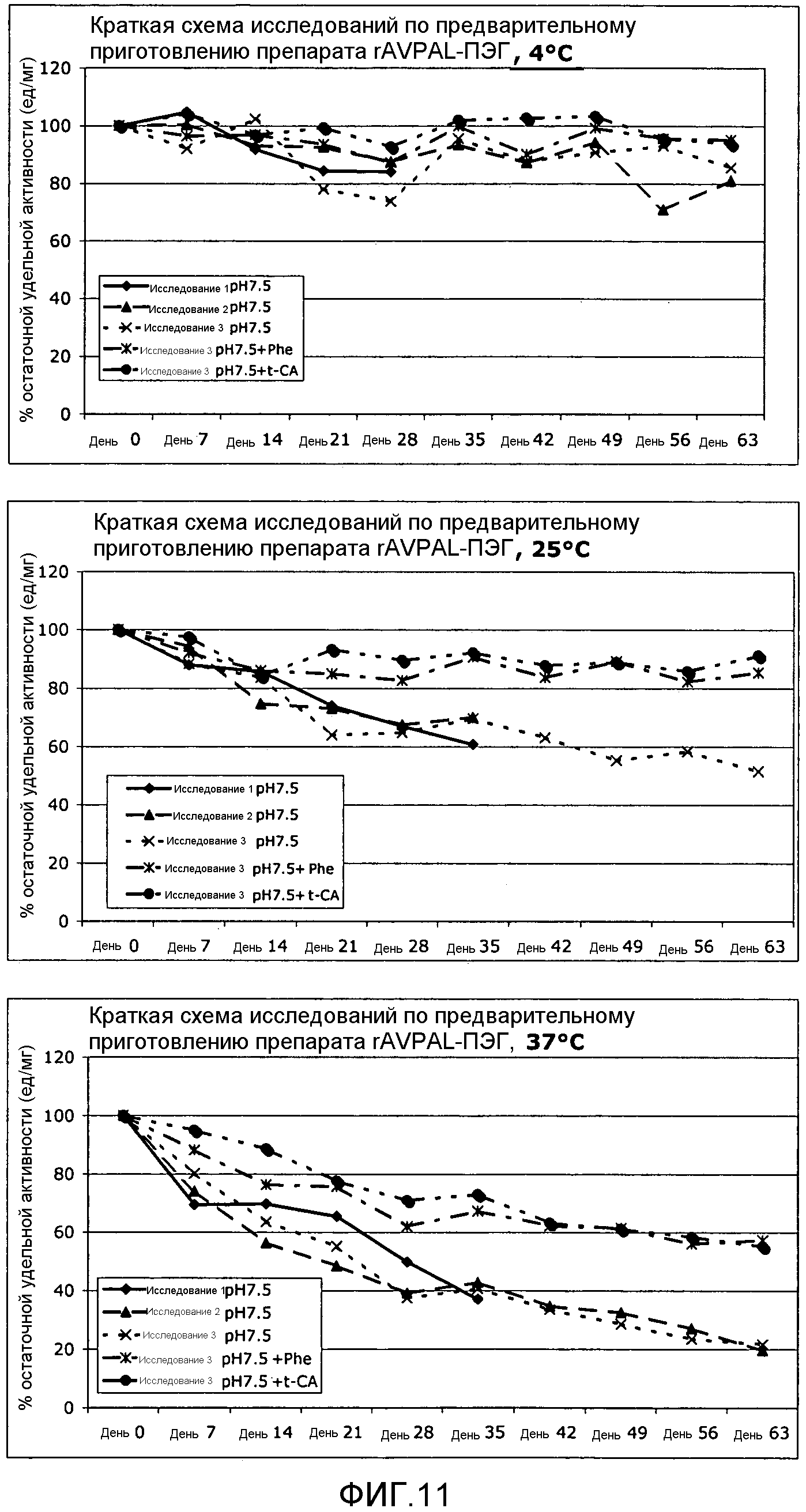
Фигура 11. На этой фигуре показано влияние фенилаланина (Phe) и транс-коричной кислоты (t-CA) на ферментативную активность ПЭГилированного AvPAL с заменой цистеина на серин в положениях 565 и 503 (AvPAL_C565SC503S) (rAV-PAL-PEG), где указанная активность сохранялась в различные промежутки времени (дни) при 4°С (верхняя панель), при 25°С (средняя панель) и при 37°С (нижняя панель).
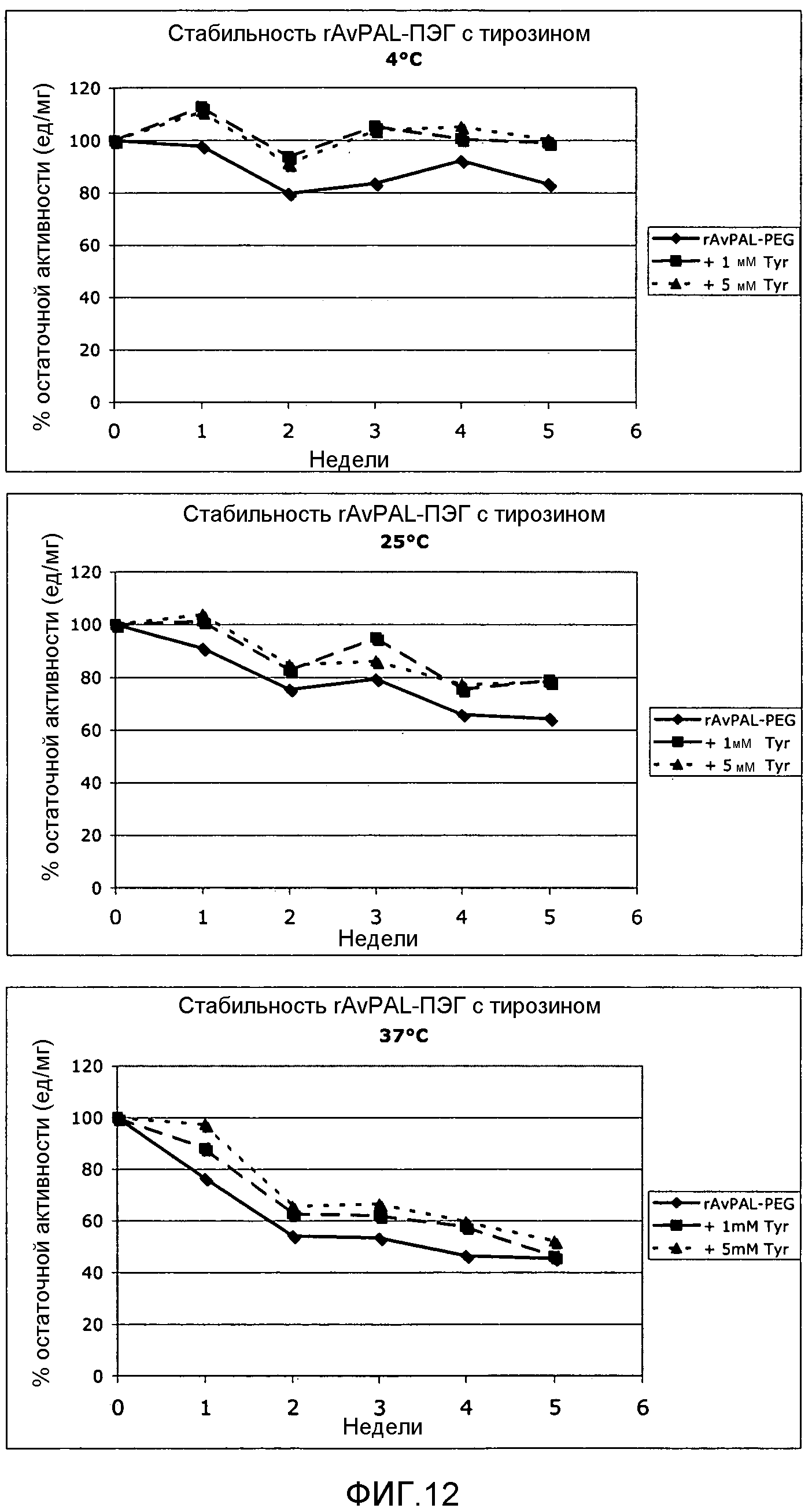
Фигура 12. На этой фигуре показано влияние тирозина (Tyr) при 1 и 5 мМ на ферментативную активность ПЭГилированного AvPAL с заменой цистеина на серин в положениях 565 и 503 (AvPAL_C565SC503S) (rAV-PAL-PEG), где указанная активность сохранялась в различные промежутки времени (дни) при 4°С (верхняя панель), при 25°С (средняя панель) и при 37°С (нижняя панель).
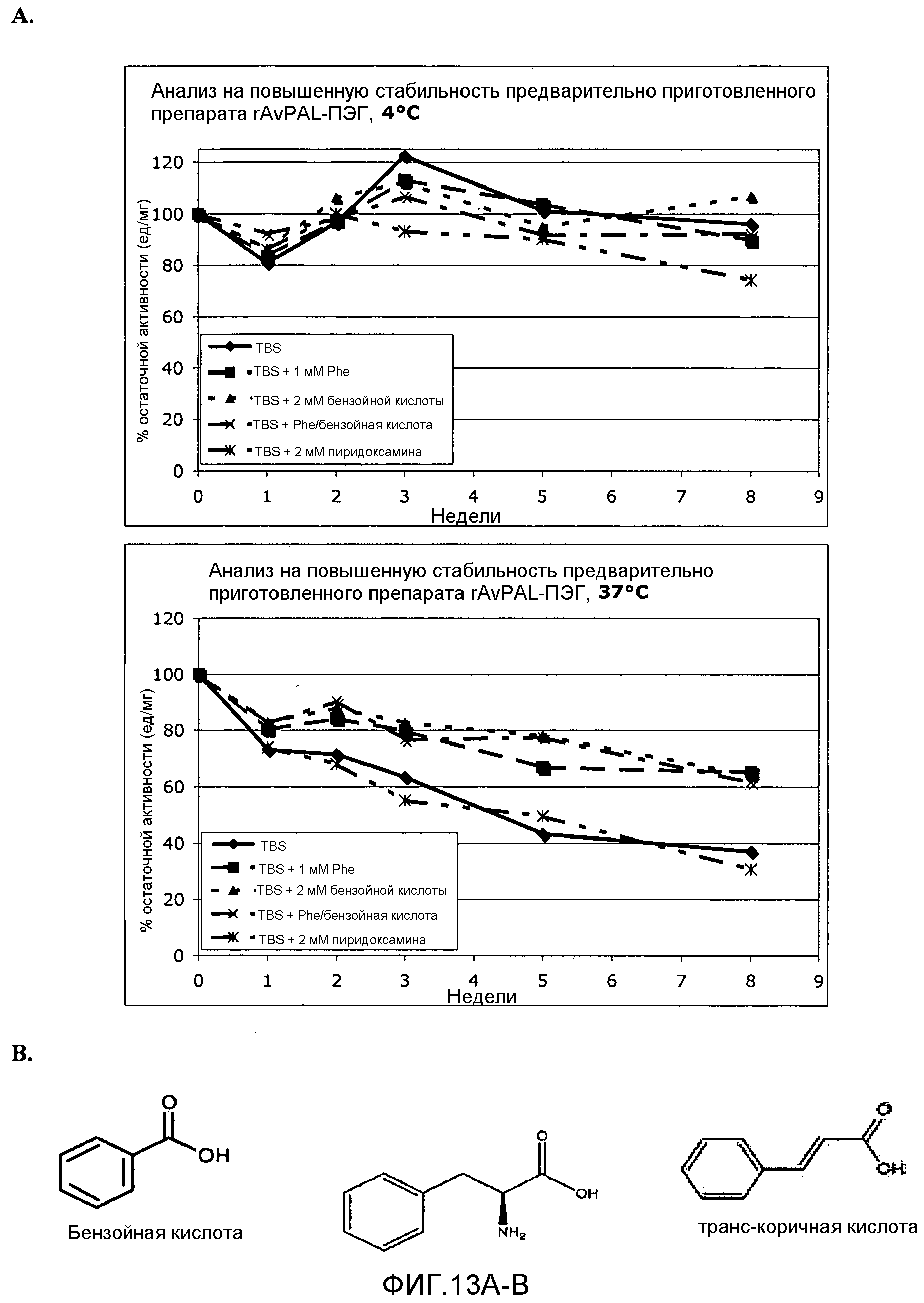
Фигура 13. Фигура 13 A: На этой фигуре показано влияние фенилаланина (Phe), бензойной кислоты и пиридоксамина, взятых отдельно или в комбинации друг с другом, на ферментативную активность ПЭГилированного AvPAL с заменой цистеина на серин в положениях 565 и 503 (AvPAL_C565SC503S) (rAV-PAL-PEG), где указанная активность сохранялась в различные промежутки времени (дни) при 4°С (верхняя панель) и при 37°С (нижняя панель). Фигура 13B: Представлены химические структуры бензойной кислоты (слева), фенилаланина (в середине) и транс-коричной кислоты (справа).
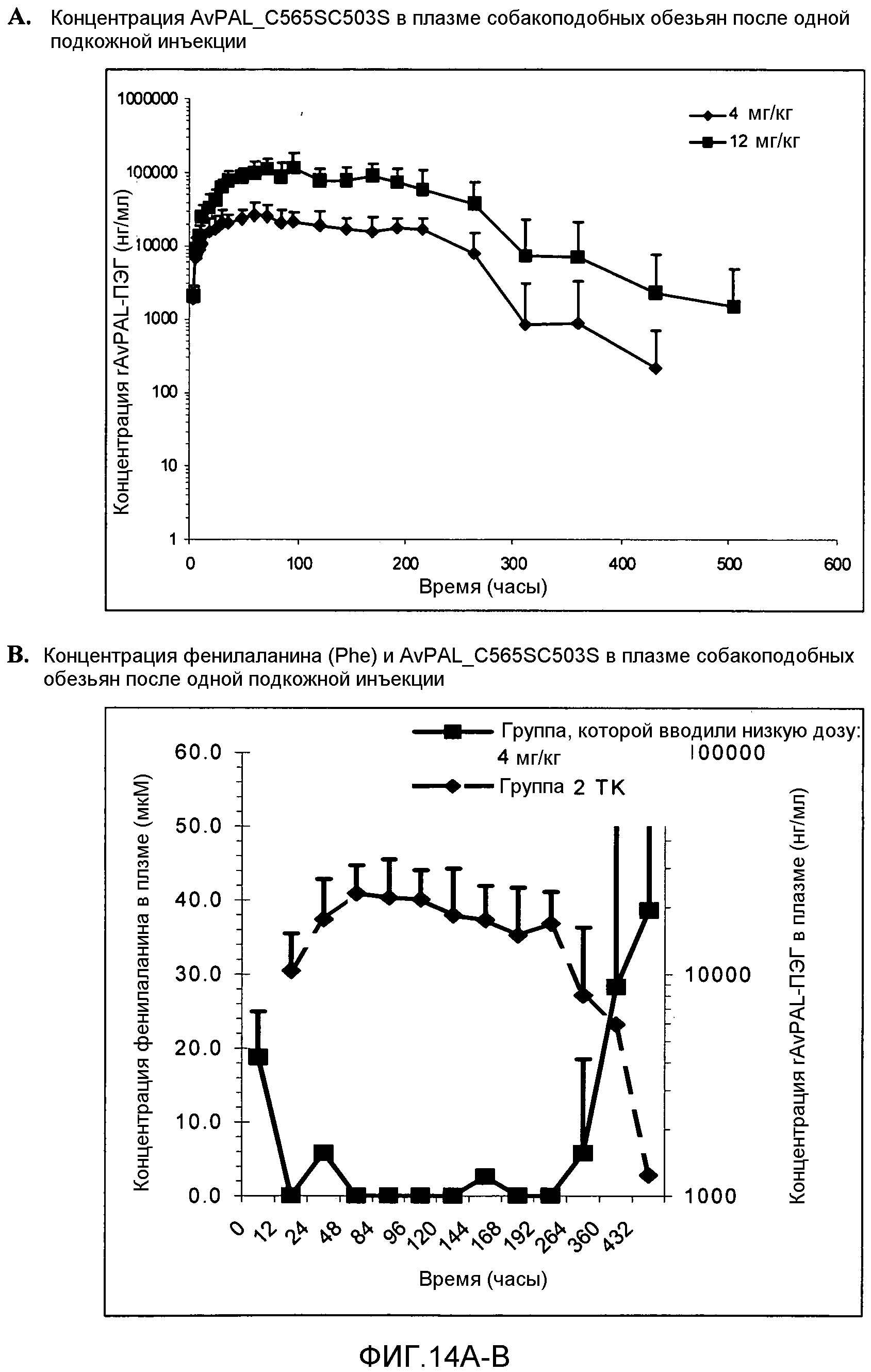
Фигура 14. Фигура 14A: Влияние одной подкожной инъекции собакоподобным обезьянам ПЭГилированного AvPAL с заменой цистеина на серин в положениях 565 и 503 (AvPAL_C565SC503S) при 4 мг/кг (ромбы) и при 12 мг/кг (квадраты) на уровни AvPAL_C565SC503S в плазме в течение определенного периода времени (часы). Фигура 14B: Влияние введения одной подкожной инъекции AvPAL_C565SC503S собакоподобным обезьянам в дозе 4 мг/кг на уровни AvPAL_C565SC503S (ромбы) и фенилаланина (квадраты) в плазме в течение определенного периода времени (часы).
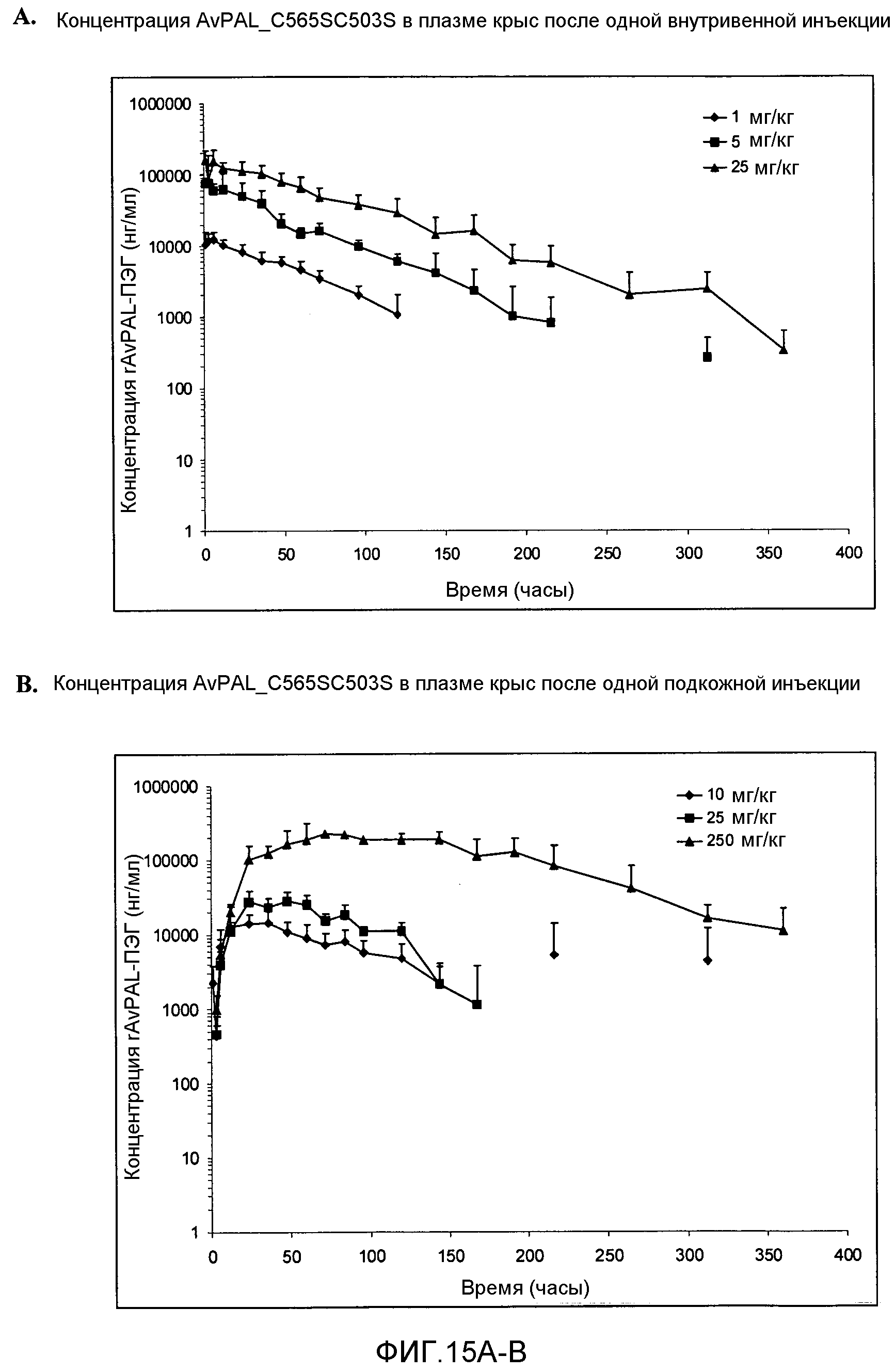
Фигура 15. Фигура 15A: Влияние одной внутривенной инъекции крысам ПЭГилированного AvPAL с заменой цистеина на серин в положениях 565 и 503 (AvPAL_C565SC503S) при 1 мг/кг (ромбы), при 5 мг/кг (квадраты) и при 25 мг/кг (треугольники) на уровни AvPAL_C565SC503S в плазме в течение определенного периода времени (часы). Фигура 15A: Влияние одной подкожной инъекции AvPAL_C565SC503S крысам в дозах 10 мг/кг (ромбы), 25 мг/кг (квадраты) и 250 мг/кг (треугольники) на уровни AvPAL_C565SC503S в плазме в течение определенного периода времени (часы).
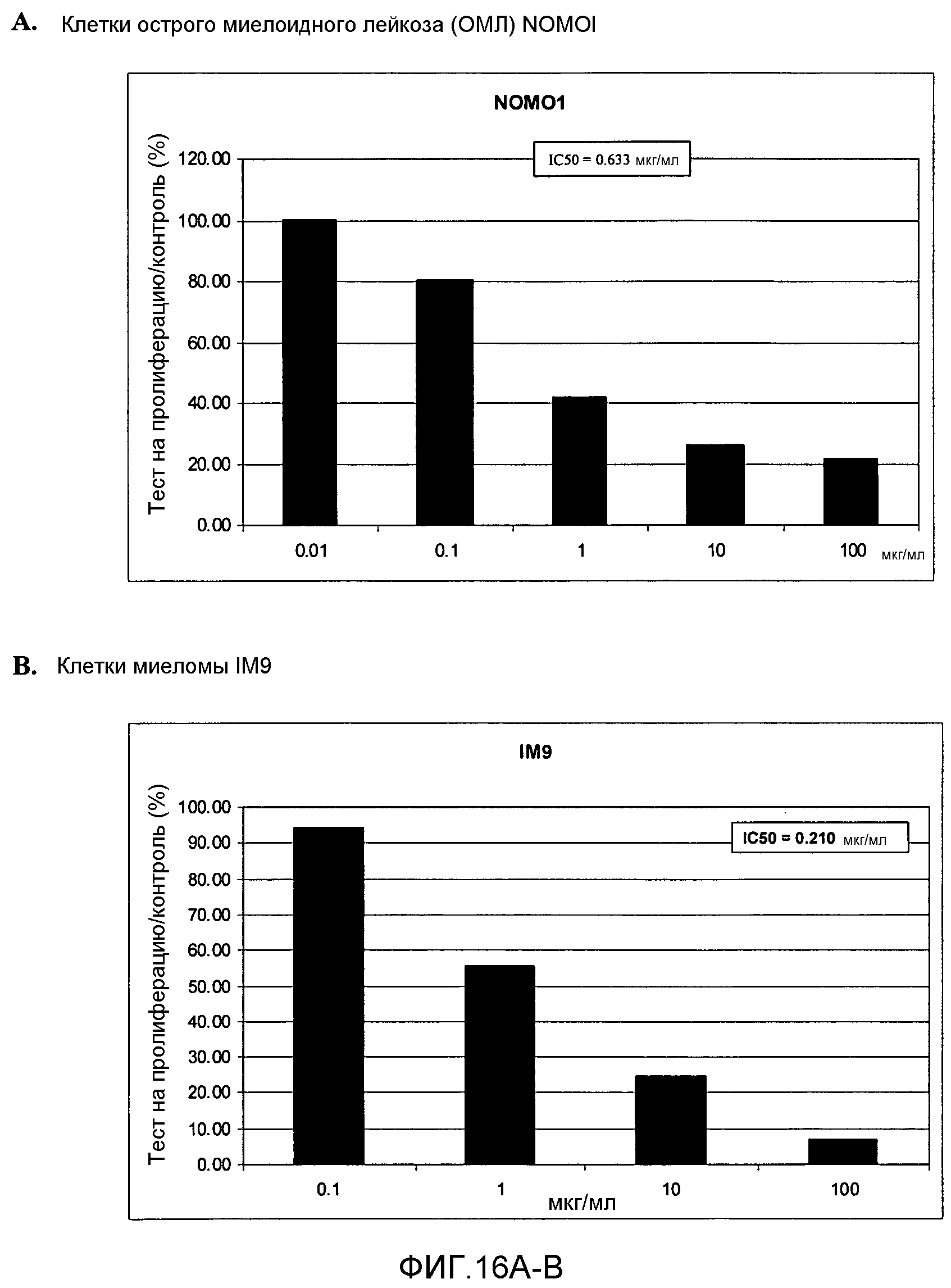
Фигура 16. Фигура 16A: На этой фигуре показано влияние ПЭГилированного AvPAL с заменой цистеина на серин в положениях 565 и 503 (AvPAL_C565SC503S) в концентрациях 0,01, 0,1, 1, 10 и 100 мкг/мл на пролиферацию (как было определено путем окрашивания иодидом пропидия) клеток острого миелоидного лейкоза (ОМЛ) NOMOl in vitro. Фигура 16B: На этой фигуре показано влияние AvPAL_C565SC503S в концентрациях 0,1, 1, 10 и 100 мкг/мл на пролиферацию клеток миеломы IM9 in vitro.
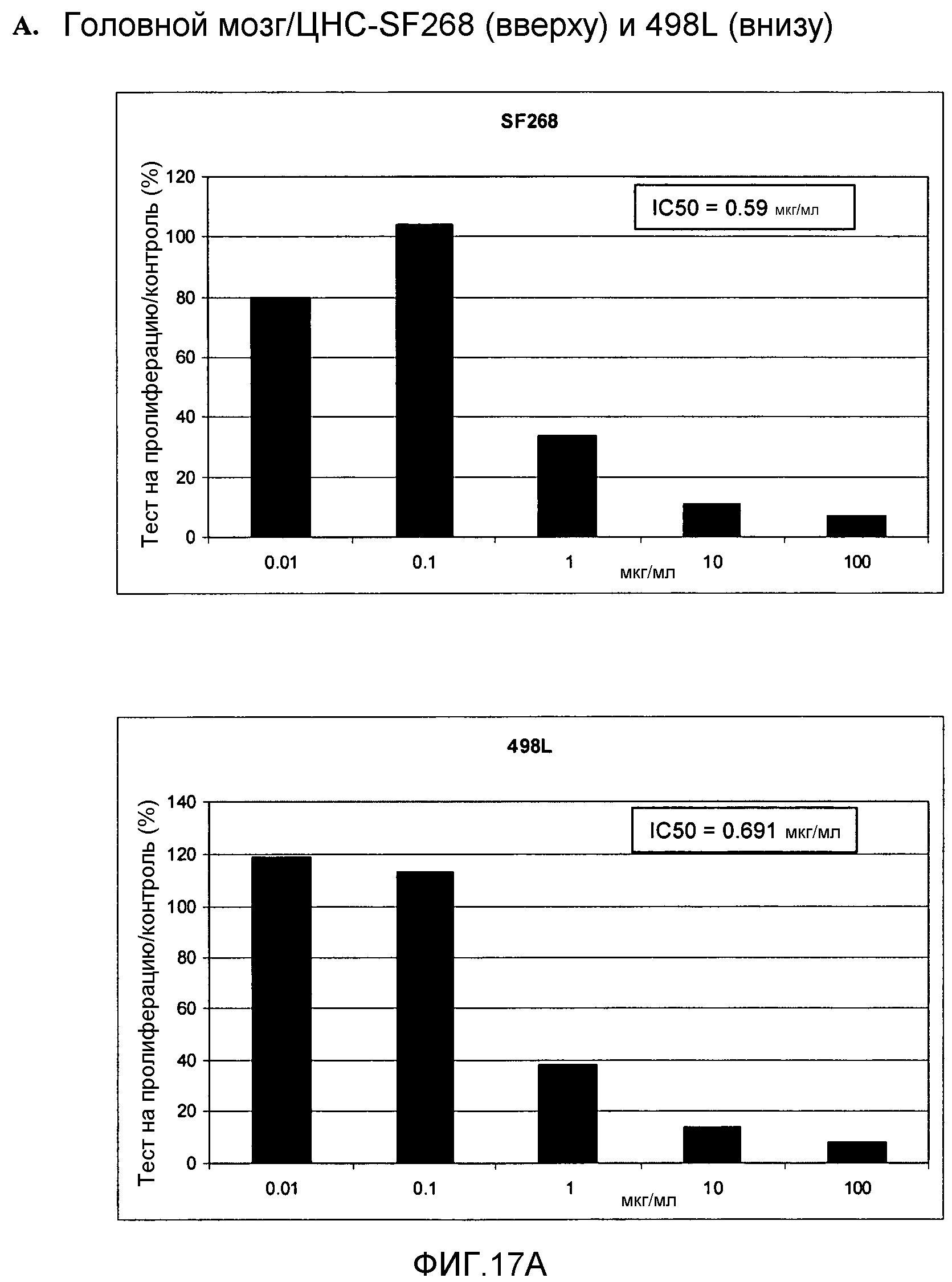
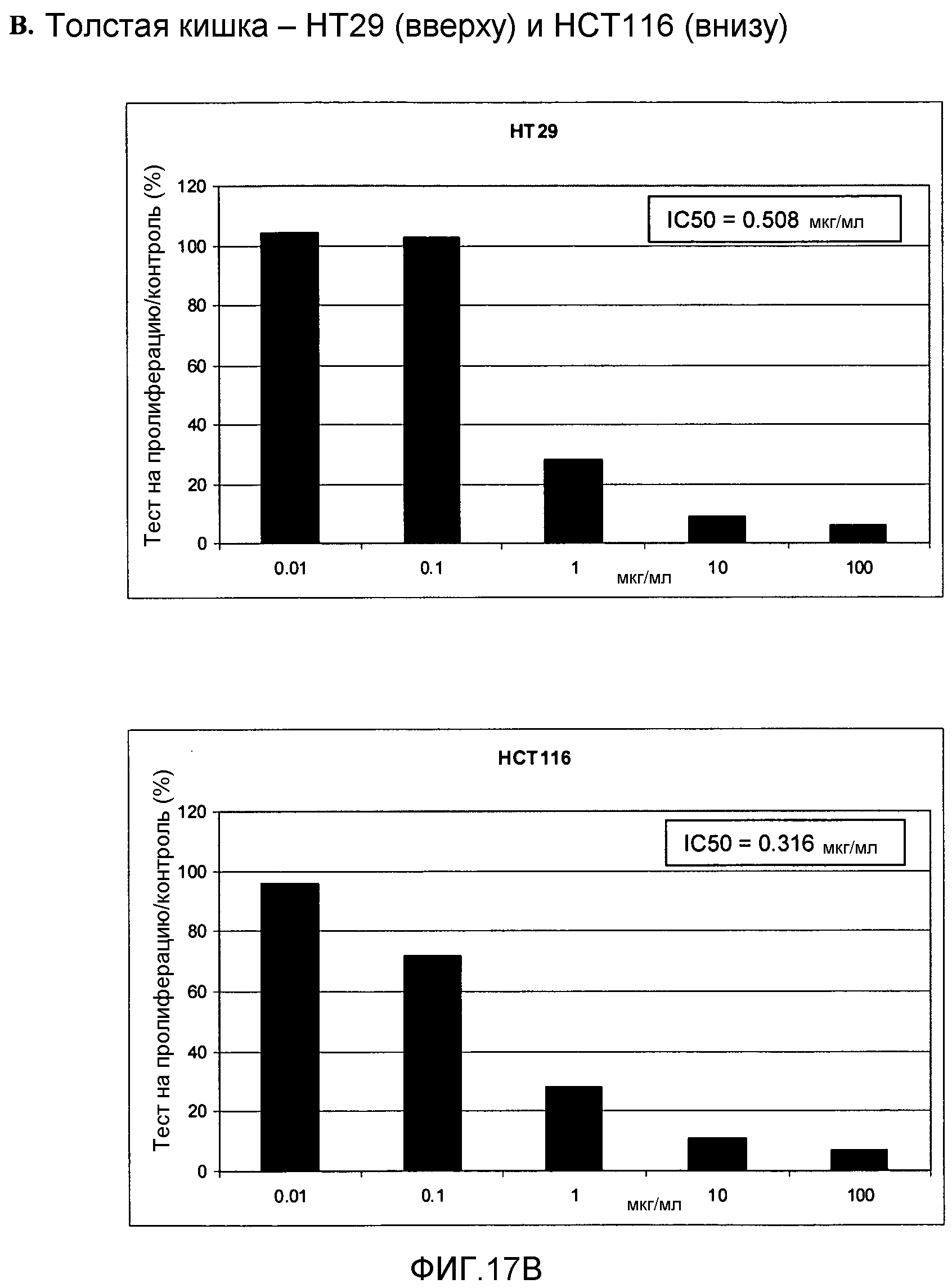
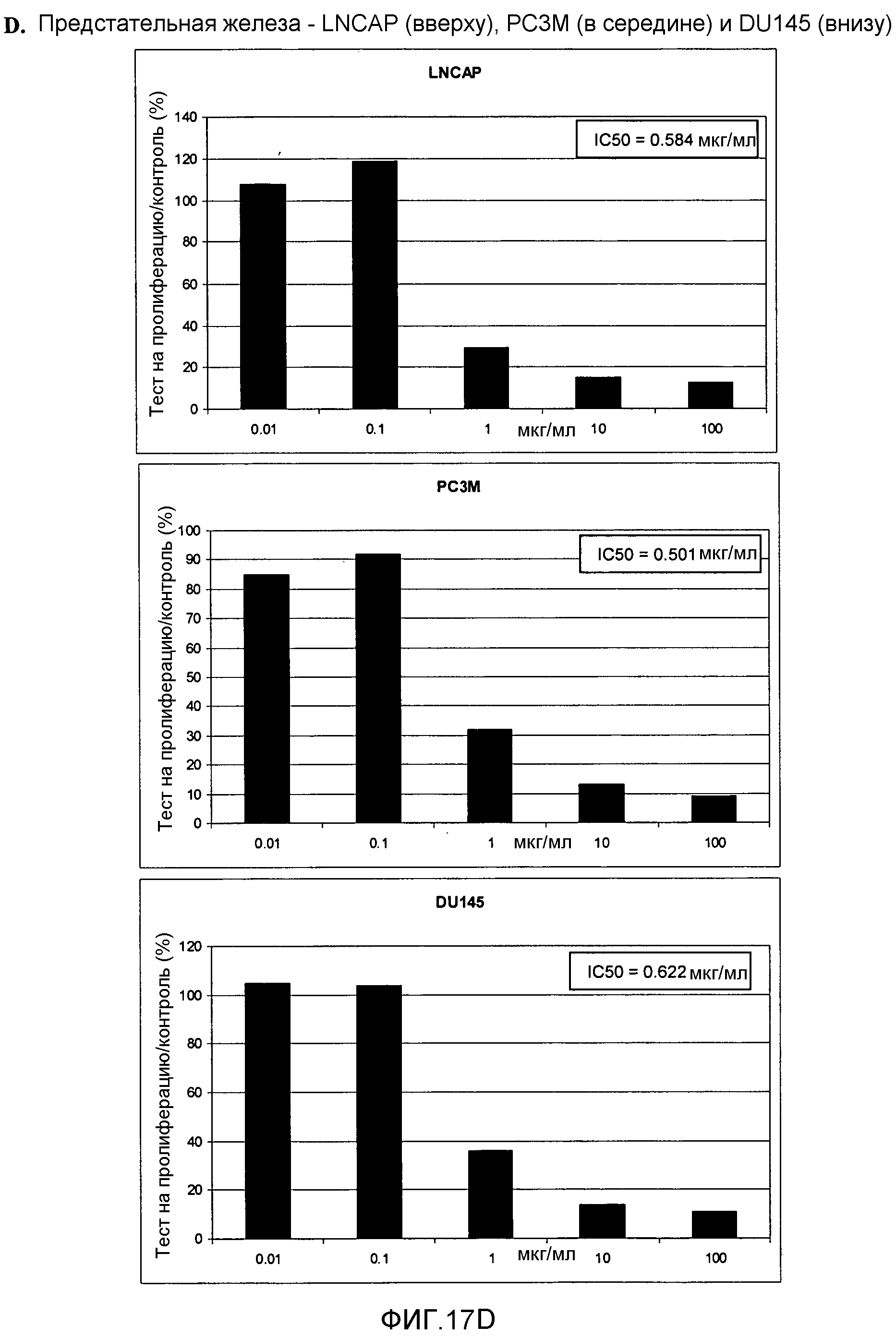
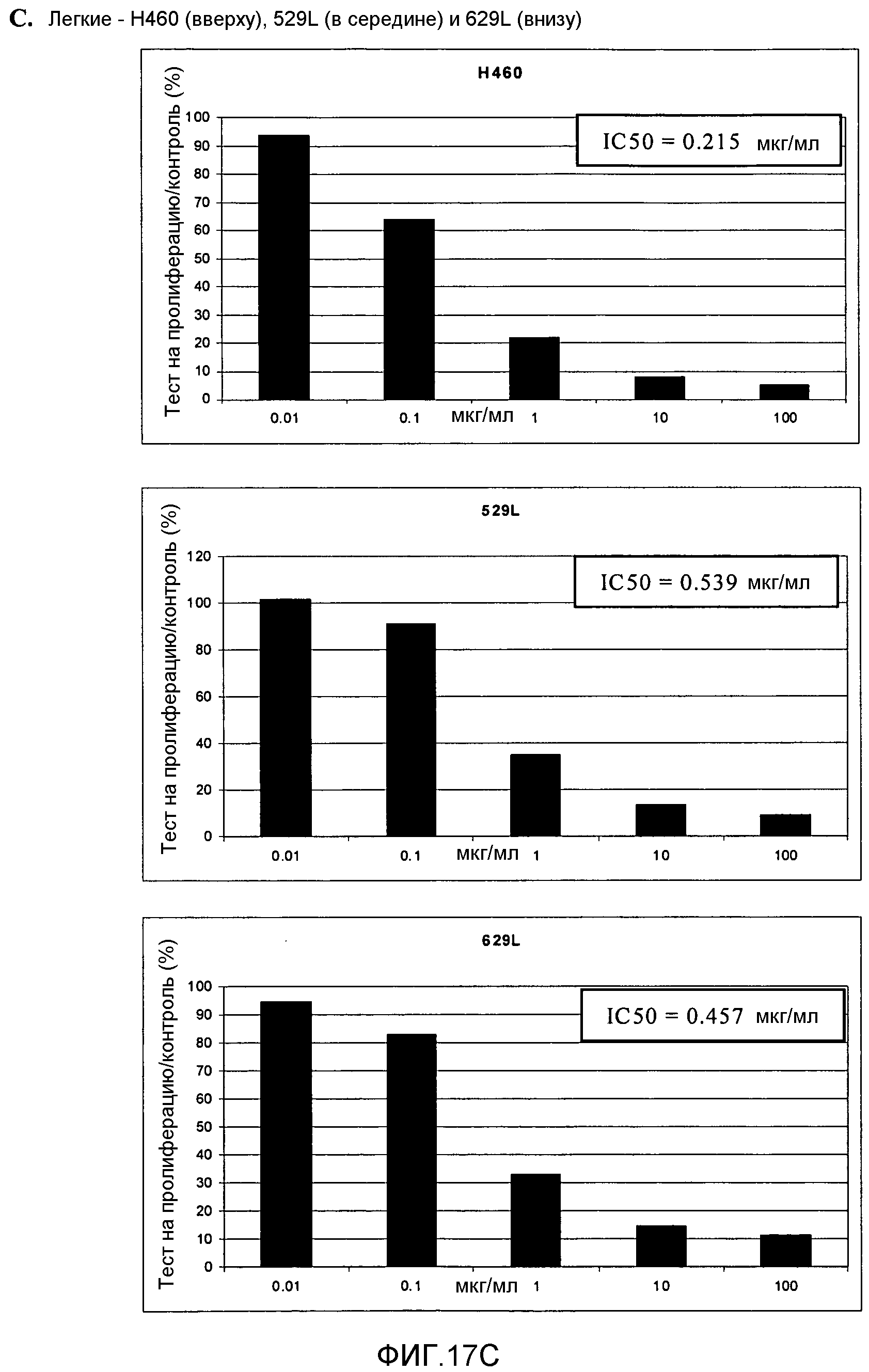
Фигура 17. Фигура 17A: На этой фигуре показано влияние ПЭГилированного AvPAL с заменой цистеина на серин в положениях 565 и 503 (AvPAL_C565SC503S) в концентрациях 0,01, 0,1, 1, 10 и 100 мкг/мл на пролиферацию (как было определено путем окрашивания иодидом пропидия) опухолевых клеток SF268 (вверху) и 498L (внизу) головного мозга/ЦНС in vitro. Фигура 17В: На этой фигуре показано влияние AvPAL_C565SC503S в концентрациях 0,01, 0,1, 1, 10 и 100 мкг/мл на пролиферацию опухолевых клеток толстой кишки НТ29 (вверху) и НСТ116 (внизу). Фигура 17С: На этой фигуре показано влияние AvPAL_C565SC503S в концентрациях 0,01, 0,1, 1, 10 и 100 мкг/мл на пролиферацию опухолевых клеток легких H460 (вверху), 529L (в середине) и 629L (внизу) in vitro. Фигура 17D: На этой фигуре показано влияние AvPAL_C565SC503S при концентрациях 0,01, 0,1, 1, 10 и 100 мкг/мл на пролиферацию опухолевых клеток предстательной железы LNCAP (вверху), PC3M (в середине) и DU145 (внизу) in vitro.
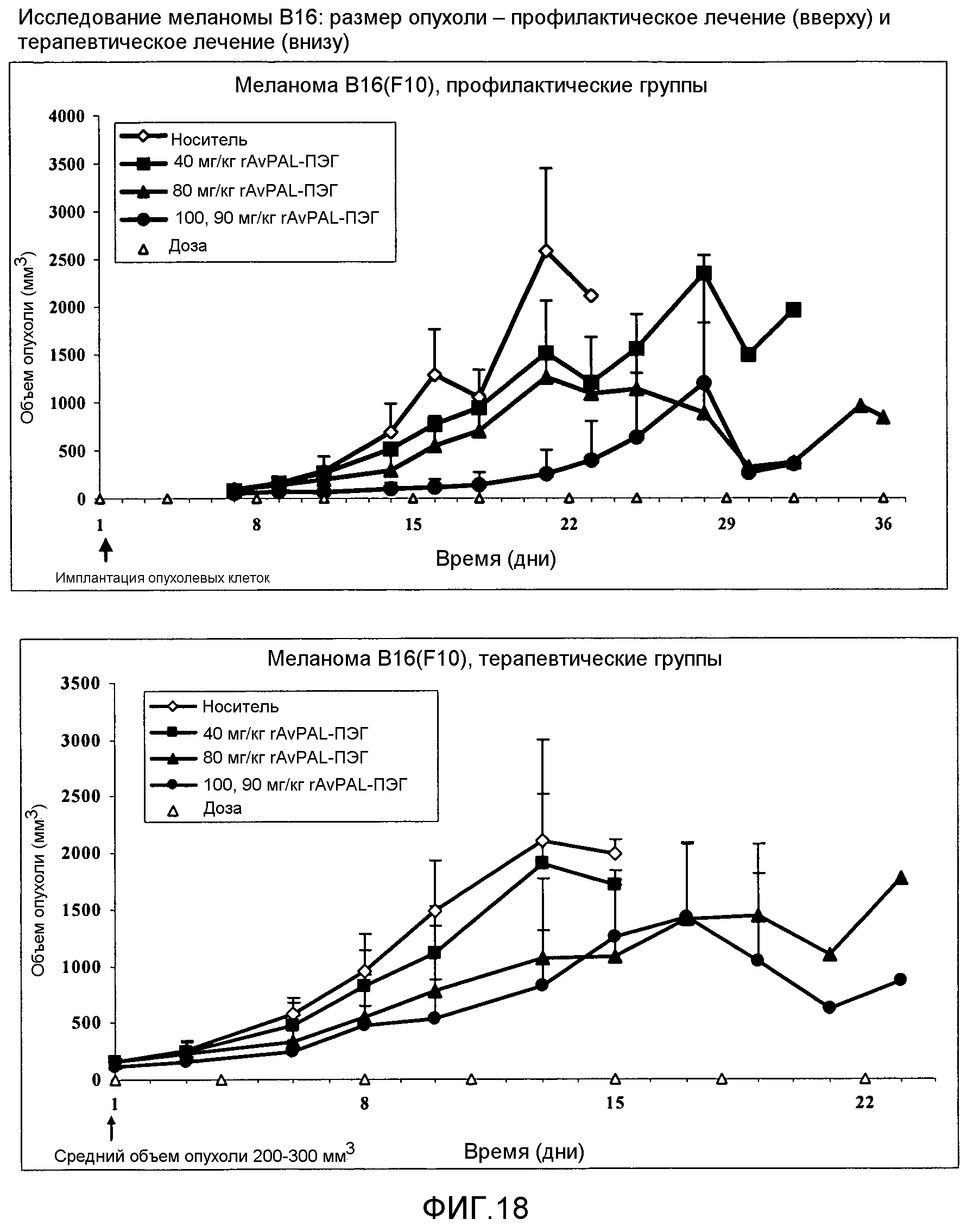
Фигура 18. Влияние ПЭГилированного AvPAL с заменами цистеина серином в положениях 565 и 503 (AvPAL_C565SC503S) на размер опухоли у модели ксенотрансплантата опухолевой клеточной линии меланомы В16. Как показано на этой фигуре, фермент вводили в профилактических целях (вверху) или в терапевтических целях (внизу) путем подкожной инъекции при концентрации 40, 80 или 100 мг/кг.
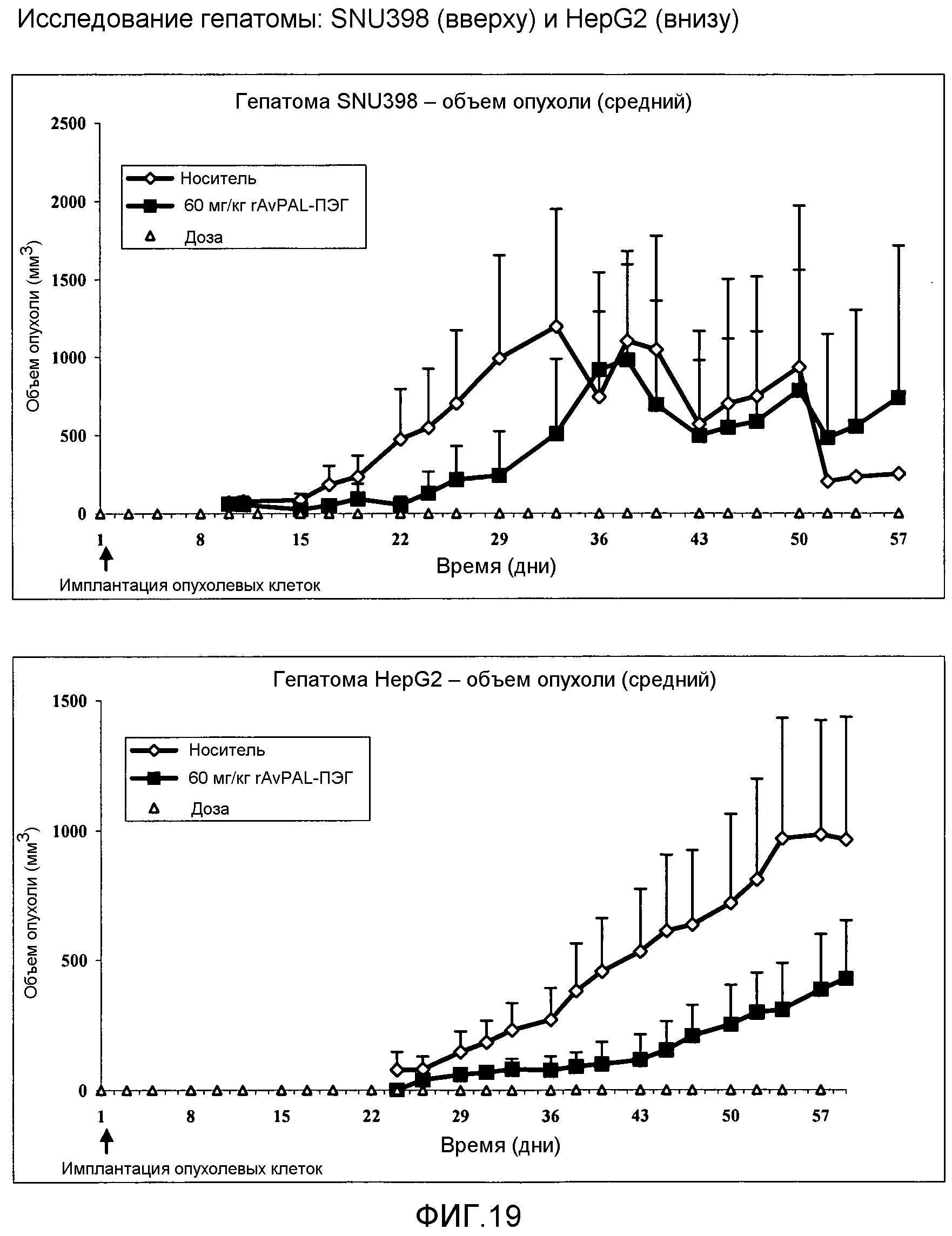
Фигура 19: Влияние ПЭГилированного AvPAL с заменами цистеина серином в положениях 565 и 503 (AvPAL_C565SC503S) на размер опухоли у моделей ксенотрансплантата опухолевой клеточной линии гепатомы SNU398 (вверху) и HepG2 (внизу). Как показано на этой фигуре, фермент вводили в профилактических целях путем подкожной инъекции при концентрации 60 мг/кг.
Подробное описание изобретения
Несколько бактериальных PAL было уже идентифицировано как часть семейства HAL/PAL, включая, но не ограничиваясь ими, PAL от Streptomyces maritimus (также известного как EncP, SEQ ID NO: 5, Фигура 4), PAL/HAL от Nostoc punctiforme (рег. № ZP_00105927 от Nostoc punctiforme ATCC 29133, утвержденный 1 октября 2004 в соответствии с программой по присвоению номеров геномам микроорганизмов, NCBI) (SEQ ID NO:2, фигура 4), PAL/HAL от Anabaena variabilis (Gene ID 3679622, фенилаланин/гистидин-аммиак-лиаза Ava_3988, Anabaena variabilis ATCC 29413, 31 марта, 2006) (SEQ ID NO:4, фигура 4), от фотосинтетических прокариотов Anacystis nidulans (Lofflehardt, Z. Naturforsch. 31(11-12):693-9 (1976)), грам-отрицательных бактерий, принадлежащих к семейству Enterobacteriaceae, Photorabdus luminescens TT01 (Williams, et al., Microbiology 151:2543-2550 (2005)) и Streptomyces verticillatus (Bezanson, et al., Can. J. Microbiol. 16(3): 147-51 (1970)). Кроме того, PAL-активность оценивали на Streptomyces maritimus (Xiang, et al., J. Biol. Chem. 277:32505-32509 (2002)). Цианобактерии, такие как Anabaena и Nostoc, исследовали на продуцирование биологически активных натуральных продуктов, которые образуются посредством смешанного поликетид-пептидного биосинтеза (Moore, Nat. Prod. Rep. 22(5):580-593 (2005); Becker, et al., Gene 325:35-42 (2004); Hoffman, et al., Gene 311:171-180 (2003)).
Хотя PAL представляет собой широко распространенный фермент, который присутствует в высших растениях и катализирует не-окислительное дезаминирование фенилаланина до коричной кислоты в стадии коммитирования с образованием фенилпропаноидных метаболитов (Hahlbrock, et al., Annu. Rev. Plant Phys. Plant Mol. Biol. 40:347-369 (1989)), однако PAL встречается лишь в некоторых бактериях, где он участвует в биосинтезе бензоил-CoA в «S. maritimus» (Xiang, et ai, J. Biol. Chem. 277:32505-32509 (2002)) и в Sorangium cellulosum (Hill, et al., Chem. Commun. 1358-1359 (2003)), и в биосинтезе циннамамида в Streptomyces verticillatus (Bezanson, et al., Can. J. Microbiol. 16:147-151 (1970)). Бактериостатический агент энтероцин представляет собой природный продукт морской бактерии «Streptomyces maritimus», биосинтез которого имеет ряд отличительных признаков (Hertweck, et al., Chem. Biol. 11:461-468 (2004); Piel, et al., Chem. Biol. 7:943-955 (2000); Piel, et al., J. Am. Chem. Soc. 122:5415-5416 (2000); Xiang, et al., Proc. Natl. Acad. Sci. USA 101:15609-15614 (2004)). Такими признаками является образование редкой поликетид-синтазы (PKS), которая инициирует образование цепи бензоил-кофермента A (CoA) (Moore, et al. , Nat. Prod. Rep. 19:70-99 (2002)). Начальная биохимическая реакция заключается в превращении аминокислоты L-фенилаланина в транс-коричную кислоту под действием новой бактериальной фенилаланин-аммиак-лиазы (PAL, EC 4.3.1.5) EncP (Xiang, et al., J. Biol. Chem. 277:32505-32509 (2002)). Активация коричной кислоты с образованием тиоэфира CoA и с последующим проходящим в один раунд бета-окислением приводит к продуцированию бензоил-CoA (Hertweck, et al., Chem. Bio. Chem. 2:784-786 (2001); Hertweck, et al., Tetrahedron 56:9115-9120 (2000); Xiang, et al., J. Bacteriol. 185:399-404 (2003)), который служит затравкой для продуцирования в PKS в стадии синтеза энтероцина типа II, образующего PKS, под действием которой происходит удлинение цепи на семь молекул малонил-СоА.
Был охарактеризован первый ген, кодирующий прокариотический PAL (encP) (SEQ ID NO: 5), и была установлена его роль в синтезе de novo коричной кислоты и энтероцина в «S.maritimus» (Kalaitzis, et al., J. Am. Chem. Soc. 125:9290-9291 (2003); Xiang, et al., J. Biol. Chem. 277:32505-32509 (2002)). Ген encP кодирует белок из 522 аминокислот, который значительно меньше эукариотических PAL почти на 200 аминокислотных остатков. Хотя последовательность этого белка гомологична последовательностям растительных PAL, таких как PAL от Petroselinum crispum (Röther, et al., Eur. J. Biochem. 269:3065-3075 (2002)) (CAA57056, идентичность 30% и сходство 48%), однако она имеет значительно большую гомологию с последовательностью бактериальной гистидин-аммиак-лиазы (HAL, EC 4.3.1.3), такой как гистидин-аммиак-лиаза от Pseudomonas putida (Schwede, et al., Biochemistry 27:5355-5361 (1999)) (A35251, идентичность 36% и сходство 54%, SEQ ID NO: 6, фигура 4), и с последовательностью тирозин-аммиак-лиазы (TAL) от Rhodobacter capsulatus (Kyndt, et al., FEBS Lett. 512:240-244 (2002)) (фигура 3). Гомологичная последовательность включает консервативный сериновый остаток активного центра в положении 143 фермента семейства фенилаланин/гистидин/тирозин-аммиак-лиаз, где указанный остаток является вероятным предшественником модифицированного дегидроаланинового остатка в простетической группе 4-метилиденимидазол-5-она (MIO) (Langer, et al., Adv. Prot. Chem. 58:175-188 (2001); Poppe, Curr. Opin. Chem. Biol. 5:512-524 (2001); Schwede, et al., Biochemistry 27:5355-5361 (1999)). EncP имеет наибольшую гомологию с последовательностью AdmH (AAO39102, идентичность 63% и сходство 76%), то есть, с предполагаемой фенилаланинаминомутазой, участвующей в биосинтезе андримида в Pantoea agglomerans и являющейся родственной тирозин-аминомутазе Sgc4 от Streptomyces globisporus (Christenson, et al., J. Am. Chem. Soc. 125:6062-6063 (2003); Christenson, et al., Biochemistry 42:12708-12718 (2003)).
Было показано, что HAL и PAL имеют общий механизм химически затрудненного отщепления аммиака от гистидина и фенилаланина, соответственно. В обоих ферментах, суперэлектрофильная простетическая группа 5-метилен-3,5-дигидроимидазол-4-она (MIO) активирует не-кислотные бета-атомы водорода их соответствующих субстратов в результате атаки типа Фриделя-Крафтса в ароматическом кольце. Образующийся сигма-комплекс предотвращает экстракцию протонов из кольца посредством блокирования доступа любых оснований в связывающий карман фермента. Образование экзоциклической двойной связи является ключевым фактором в отщеплении аммиака, в реароматизации и фрагментации. В результате такой реакции происходит регенерация простетической группы MIO и образуется уроканатный или циннаматный продукт (Poppe, et al., Angew. Chem. Int. Ed. 44:3668-3688 (2005)).
Поскольку между HAL и PAL имеется высокая гомология, то консервативные области HAL и PAL называются консервативной областью HAL/PAL. Такая высокая гомология может создавать некоторую неоднозначность в базах данных, таких как NCBI, в отношении потенциальной ферментативной активности белка «PAL-HAL», что может приводить к неправильной идентификации, например, как в случае последовательностей белка, представленных в базе данных NCBI для Nostoc punctiforme и Anabaena variabilis. Поэтому некоторые ферменты PAL могут быть ошибочно идентифицированы как ферменты HAL. Хотя активные центры PAL и HAL имеют очень высокую степень сходства, однако было предсказано, что они отличаются по некоторым ключевым остаткам (Calabrese, et al., Biochemistry 43(36):11403-11416 (2004); Xiang et al., (2002), там же; Williams et al., (2005), там же). В частности, в HAL, метионин 383 и глутаминовая кислота 415 от Pseudomonas putida (SEQ ID NO: 6) являются в высокой степени консерватиными во всех HAL, как описано выше, но во всех PAL они всегда заменены (в эукариотах или прокариотах) лизином и глутамином, соответственно (фигура 4). Поэтому можно сказать, что все белки, содержащие область «PAL-HAL» и имеющие гомологию в положениях лизина 383 и глутаминовой кислотыглутамина 415, имеют последовательность-«сигнатуру», характерную для белка с PAL-активностью. Такая относительно недавно описанная «сигнатура» PAL (Williams, et al., (2005), там же) позволяет правильно отличать некоторые ферменты PAL от ферментов HAL и может быть использована для идентификации некоторых новых ферментов PAL от ферментов, уже имеющихся в базах данных генов и белков.
Настоящее изобретение также относится к композициям таких прокариотических PAL и их биологически активных фрагментов, мутантов, вариантов или аналогов, и к их применению в терапевтических целях, включая лечение рака.
A. Определения
Если это не оговорено особо, то нижеследующие термины, используемые в настоящей заявке, включая ее описание и формулу изобретения имеют значения, определенные ниже. При этом следует отметить, что подразумевается, что существительные, используемые в контексте настоящего изобретения могут присутствовать как в единственном числе, так и во множественном числе, если это не оговорено особо, и если это явно не противоречит контексту изобретения. Определение стандартных химических терминов можно найти в научной литературе, включая публикацию Carey and Sundberg, Advanced Organic Chemistry, 3rd Edition, Vols. A and B (Plenum Press, New York 1992). Для осуществления настоящего изобретения могут быть применены, если это не оговорено особо, стандартные методы химического органического синтеза, масс-спектроскопии, препаративной и аналитической хроматографии, химии белков и биохимии, а также методы рекомбинантных ДНК и фармакологические методы, известные специалистам. См., например, T.E. Creighton, Proteins: Structures and Molecular Properties (W.H. Freeman and Company, 1993); A.L. Lehninger, Biochemistry (Worth Publishers, Inc., 4th Edition, 2004); Sambrook, et al., Molecular Cloning: A Laboratory Manual (2nd Edition, 1989); Methods In Enzymology (S. Colowick and N. Kaplan eds., Academic Press, Inc.); Remington's Pharmaceutical Sciences, 18th Edition (Easton, Pennsylvania: Mack Publishing Company, 1990).
Все цитируемые здесь публикации, патенты и патентные заявки, приведенные выше или ниже, во всей своей полноте вводятся в настоящее описание посредством ссылки.
В тексте настоящего описания используются нижеследующие аббревиатуры аминокислот:
|
Термин «полинуклеотид» означает полимер, состоящий из нуклеотидных звеньев. Полинуклеотидами являются природные нуклеиновые кислоты, такие как дезоксирибонуклеиновая кислота («ДНК») и рибонуклеиновая кислота («РНК»), а также аналоги нуклеиновых кислот. Аналогами нуклеиновых кислот являются нуклеиновые кислоты, включающие неприродные основания, нуклеотиды, которые участвуют в связывании с другими нуклеотидами, отличающимися от нуклеотидов, имеющих природную фосфодиэфирную связь, или нуклеотиды, включающие основания, связанные между собой не-фосфодиэфирными связями. Таким образом, нуклеотидными аналогами являются, например, но не ограничиваются ими, фосфортиоаты, фосфордитиоаты, фосфортриэфиры, фосфорамидаты, боранофосфаты, метилфосфонаты, хиральные метилфосфонаты, 2-О-метилрибонуклеотиды, связанные с пептидом нуклеиновые кислоты (PNA) и т.п. Такие полинуклеотиды могут быть синтезированы, например, на автоматическом синтезаторе ДНК. Термин «нуклеиновая кислота» обычно означает крупные полинуклеотиды. Термин «олигонуклеотид» обычно означает короткие полинуклеотиды, в основном, имеющие не более чем примерно 50 нуклеотидов. Следует также отметить, что если нуклеотидная последовательность представлена последовательностью ДНК (то есть, A, T, G, C), то она также включает последовательность РНК (то есть, A, U, G, C), где вместо «Т» присутствует «U».
Термин «кДНК» означает ДНК, которая комплементарна или идентична мРНК, независимо от того, присутствует ли она в одноцепочечной или в двухцепочечной форме.
В настоящей заявке, для полинуклеотидных последовательностей используется следующая стандартная система записи: левым концом одноцепочечной полинуклеотидной последовательности является 5'-конец, а считывание двухцепочечной полинуклеотидной последовательности происходит в направлении слева направо и записывается в 5'-направлении. Направление 5' → 3' присоединения нуклеотидов к растущей цепи РНК-транскриптов называется направлением транскрипции. ДНК-цепь, имеющая такую же последовательность, как мРНК-цепь, называется «кодирующей цепью»; последовательности ДНК-цепи, идентичные последовательностям мРНК-цепи, транскрибируемой с этой ДНК, и локализованные с 5'-стороны по отношению к 5'-концу РНК-транскрипта, называются «вышерасположенными последовательностями», а последовательности ДНК-цепи, идентичные последовательностям РНК-цепи и локализованные с 3'-стороны по отношению к 3'-концу кодирующего РНК-транскрипта, называются «нижерасположенными последовательностями».
Термин «комплементарный» означает топологическую совместимость или взаимное соответствие взаимодействующих поверхностей этих двух полинуклеотидов. Так, например, две молекулы могут быть определены как комплементарные, а также имеющие свойства контактирующих поверхностей, которые являются комплементарными друг другу. Первый полинуклеотид является комплементарным второму полинуклеотиду, если нуклеотидная последовательность первого полинуклеотида идентична нуклеотидной последовательности полинуклеотид-связывающего партнера второго полинуклеотида. Таким образом, полинуклеотид, имеющий последовательность 5'-TATAC-3', является комплементарным полинуклеотиду, имеющему последовательность 5'-GTATA-3'.
Нуклеотидная последовательность является «по существу, комплементарной» сравниваемой последовательности, если последовательность, комплементарная рассматриваемой нуклеотидной последовательности, по существу, идентична сравниваемой нуклеотидной последовательности.
Термин «кодирующий» относится к природному свойству специфических последовательностей нуклеотидов в полинуклеотиде, таких как ген, кДНК или мРНК, заключающемуся в том, что эти последовательности могут служить в качестве матрицы для биологического синтеза других полимеров и макромолекул, имеющих определенную последовательность нуклеотидов (то есть, рРНК, тРНК и мРНК) или определенную последовательность аминокислот, и к биологическим свойствам, приобретаемым в результате такого синтеза. Таким образом, ген кодирует белок, если в результате транскрипции и трансляции мРНК, продуцируемой этим геном, в клетке или в другой биологической системе образуется белок. Обе кодирующие цепи, нуклеотидная последовательность которых идентична последовательности мРНК и обычно приводится в списках последовательностей, и не-кодирующая цепь, используемая в качестве матрицы для транскрипции гена или кДНК, могут называться цепями, кодирующими белок или другой продукт этого гена или кДНК. Термин «нуклеотидная последовательность, кодирующая аминокислотную последовательность», если это не оговорено особо, включает все нуклеотидные последовательности, которые являются вырожденными вариантами по отношению друг к другу, и которые кодируют одну и ту же аминокислотную последовательность. Нуклеотидные последовательности, кодирующие белки и РНК, могут включать интроны.
Термин «рекомбинантный полинуклеотид» означает полинуклеотид, имеющий последовательности, которые не ассоциируются друг с другом в природе. Амплифицированный или подвергнутый сборке рекомбинантный полинуклеотид может быть включен в подходящий вектор, и такой вектор может быть использован для трансформации подходящей клетки-хозяина. Клетка-хозяин, содержащая рекомбинантный полинуклеотид, называется «рекомбинантной клеткой-хозяином». Затем ген экспрессируется в рекомбинантной клетке-хозяине с образованием, например, «рекомбинантного полипептида». Рекомбинантный полинуклеотид может также обладать не-кодирующей функцией (например, служить в качестве промотора, ориджина репликации, сайта связывания с рибосомой и т.п.).
Термин «последовательность регуляции экспрессии» означает нуклеотидную последовательность в полинуклеотиде, которая регулирует экспрессию (транскрипцию и/или трансляцию) функционально присоединенной к ней нуклеотидной последовательности. Термин «функционально присоединенный» относится к функциональной взаимосвязи между двумя частями, где активность одной части (например, способность регулировать транскрипцию) стимулирует действие другой части (например, транскрипцию последовательности). Последовательностями регуляции экспрессии могут быть, например, но не ограничиваются ими, промоторы (например, индуцибельные или конститутивные), энхансеры, терминаторы транскрипции, старт-кодон (то есть, ATG), сигналы сплайсинга интронов и стоп-кодоны.
Термин «экспрессионный вектор» означает вектор, содержащий рекомбинантный полинуклеотид, включающий последовательности регуляции экспрессии, функционально присоединенные к экспрессируемой нуклеотидной последовательности. Экспрессионный вектор содержит достаточное количество цис-действующих элементов для экспрессии, а другие элементы для экспрессии могут поставляться клеткой-хозяином или экспрессионной системой in vitro. Экспрессионными векторами являются все векторы, известные специалистам, такие как космиды, плазмиды (например, «оголенные» или содержащиеся в липосомах) и вирусы, которые включают рекомбинантный полинуклеотид.
Термин «амплификация» означает любые процессы, в результате которых полинуклеотидная последовательность образует копии и удлиняется с образованием большего числа полинуклеотидных молекул, например, посредством обратной транскрипции, полимеразной цепной реакции и лигазной цепной реакции.
Термин «праймер» означает полинуклеотид, способный специфически гибридизоваться со сконструированной полинуклеотидной матрицей и обеспечивать точку инициации синтеза комплементарного полинуклеотида. Такой синтез происходит в том случае, если полинуклеотидный праймер помещают в условия, при которых индуцируется синтез, то есть, в присутствии нуклеотидов, комплементарной полинуклеотидной матрицы и агента полимеризации, такого как ДНК-полимераза. Праймер обычно является одноцепочечным, но может быть и двухцепочечным. Праймерами обычно являются дезоксирибонуклеиновые кислоты, однако для многих целей может быть использован широкий ряд синтетических и природных праймеров. Праймер является комплементарным матрице, с которой он должен гибридизоваться для того, чтобы служить в качестве сайта инициации синтеза, но он необязательно должен точно соответствовать последовательности матрицы. В таком случае, специфическая гибридизация праймера с матрицей зависит от жесткости условий гибридизации. Праймеры могут быть помечены, например, хромогенными, радиоактивными или флуоресцентными молекулами и могут быть использованы в качестве детектируемых молекул.
Термин «полипептид» означает полимер, состоящий из аминокислотных остатков; родственные природные структурные варианты такого полимера и их синтетические природные аналоги, связанные пептидными связями, их родственные природные структурные варианты и синтетические не-природные аналоги. Синтетические полипептиды могут быть синтезированы, например, на автоматическом синтезаторе полипептидов. Термин «белок» обычно означает крупные полипептиды. Термин «пептид» обычно означает короткие полипептиды.
В настоящей заявке, для иллюстрации полипептидных последовательностей используется следующая стандартная система записи: левым концом полипептидной последовательности является амино-конец, а правым концом полипептидной последовательности является карбокси-конец.
«Консервативная замена» означает замену аминокислоты в полипептиде аминокислотой с аналогичными функциональными свойствами. Ниже представлено шесть групп, каждая из которых содержит аминокислоты, которые могут быть подвергнуты взаимным консервативным заменам в пределах данной группы:
1) аланин (A), серин (S), треонин (T);
2) аспарагиновая кислота (D), глутаминовая кислота (E);
3) аспарагин (N), глутамин (Q);
4) аргинин (R), лизин (K);
5) изолейцин (I), лейцин (L), метионин (M), валин (V); и
6) фенилаланин (F), тирозин (Y), триптофан (W).
Аминокислоты могут быть также подразделены на нижеследующие группы:
(1) гидрофобные: Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr;
(3) кислотные: Asp, Glu;
(4) основные: Asn, Gln, His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: GIy, Pro; и
(6) ароматические: Trp, Tyr, Phe.
Термины «идентичный» или процент «идентичности», относящиеся к двум или более полинуклеотидным или полипептидным последовательностям, означают, что две или более последовательностей или подпоследовательностей имеют одинаковое число нуклеотидов или аминокислотных остатков, или имеют конкретный процент одинаковых нуклеотидов или аминокислотных остатков, при их сравнении и выравнивании на максимальное соответствие, как было определено с помощью алгоритма сравнения последовательностей, описанного в предварительной совместно рассматриваемой заявке на патент США № 11/230374, поданной 19 сентября 2005, которая во всей своей полноте вводится в настоящее описание посредством ссылки, или путем визуальной оценки.
Термины «по существу гомологичный» или «по существу идентичный», если они относятся к двум нуклеиновым кислотам или полипептидам, обычно означают, что указанные две или более последовательности или подпоследовательности имеют по меньшей мере 40%, 60%, 80%, 90%, 95%, 98% идентичность нуклеотидов или аминокислотных остатков при их сравнении и выравнивании на максимальное соответствие, как было определено с помощью одного из алгоритмов сравнения последовательностей, описанных ниже, или путем визуальной оценки. Предпочтительно, по существу, идентичными являются последовательности, которые имеют области, состоящие по меньшей мере примерно из 50 идентичных остатков, более предпочтительно, по меньшей мере примерно из 100 идентичных остатков, а наиболее предпочтительно, по меньшей мере примерно из 150 идентичных остатков. В наиболее предпочтительном варианте изобретения последовательности являются, по существу, идентичными по всей длине любого одного или обоих сравниваемых биополимеров.
Термины «по существу, чистый» или «выделенный» относятся к рассматриваемой молекуле, которая является преобладающей в организме конкретного вида (то есть, присутствует в большей молярной концентрации или в большем количестве, чем отдельные макромолекулы другого вида, имеющиеся в данной композиции), а, «по существу, очищенной» фракцией является композиция, в которой рассматриваемые молекулы составляют по меньшей мере примерно 50% (в молярной концентрации) от всех присутствующих макромолекул. Обычно, термин «по существу, чистая композиция» означает, что в данной композиции присутствует примерно 80%-90% или более представляющих интерес макромолекул. Рассматриваемые молекулы считаются очищенными, в основном, до гомогенности (то есть, где примесные молекулы не могут быть обнаружены в данной композиции стандартными методами детектирования), если данная композиция состоит, в основном, лишь из рассматриваемых макромолекул. В данном определении, растворители, небольшие молекулы (<500 дальтон), стабилизаторы (например, BSA) и ионы химических элементов не рассматриваются как макромолекулы. В некоторых вариантах изобретения композиции варианта прокариотического PAL согласно изобретению являются, по существу, чистыми или выделенными. В некоторых вариантах изобретения композиции варианта прокариотического PAL согласно изобретению, по существу, очищены или отделены от макромолекулярных исходных веществ, используемых для их синтеза. В некоторых вариантах изобретения фармацевтические композиции согласно изобретению содержат, по существу, очищенный или выделенный вариант прокариотического PAL, смешанный с одним или несколькими фармацевтически приемлемыми наполнителями.
Термин «природный», применяемый к определенному объекту, фактически означает, что данный объект может существовать в природе. Так, например, природной считается полипептидная или полинуклеотидная последовательность, которая присутствует в организме (включая вирусы), и которая может быть выделена из природного источника, а также не является искусственно модифицированной человеком в лаборатории.
Термин «дикого типа» (wt) относится к природной генетической форме организма. Организм дикого типа отличается от мутантной формы (организма с генетической мутацией).
Термины «полипептид» и «белок» означают полимер из аминокислотных остатков и не ограничиваются минимальной длиной данного продукта. Так, например, в это определение входят пептиды, олигопептиды, димеры, мультимеры и т.п. В это определение также входят полноразмерные белки и их фрагменты. Данные термины также включают постэкспрессионные модификации полипептида, например, гликозилированные, ацетилированные, фосфорилированные полипептиды и т.п. Кроме того, термин «полипептид», используемый в настоящем изобретении, означает белок, включающий модификации, такие как делеции, добавления и замены (обычно консервативные по своей природе), внесенные в нативную последовательность, при условии, что такой белок будет сохранять желаемую активность. Такие полипептиды могут называться здесь «мутантами». Указанные модификации могут быть внесены искусственно, например, посредством сайт-направленного мутагенеза, либо они могут быть случайными, например, внесенными в результате мутаций, возникающих в хозяевах, продуцирующих белки, или в результате ошибок при ПЦР-амплификации.
Используемые здесь термины «вариант», «аналог» или «производное» означают соединение, например, пептид, имеющий последовательность, которая примерно более чем на 70%, но менее чем на 100% аналогична последовательности исходного соединения, например, пептида. Такие варианты, аналоги или производные могут состоять из не-природных аминокислотных остатков, включая, например, но не ограничиваясь ими, гомоаргинин, орнитин, пеницилламин и норвалин, а также природные аминокислотные остатки. Такие варианты, аналоги или производные могут также состоять из одного или из множества D-аминокислотных остатков и могут содержать не-пептидные связи между двумя или более аминокислотными остатками.
Используемый здесь термин «отношение» полипептида PAL (например, AvPAL) к водорастворимому полимеру (например, полиэтиленгликолю или ПЭГ) означает молярное отношение полипептида PAL к водорастворимому полимеру в данных условиях реакции. Так, например, отношение AvPAL к полиэтиленгликолю, составляющее примерно 1:3 (AvPAL:ПЭГ=1:3), означает, что химически модифицированный PAL был продуцирован в данных условиях реакции с использованием примерно 1 моля AvPAL на 3 моля полиэтиленгликоля. В условиях реакции, описанных ниже в примере 6, отношение AvPAL:ПЭГ, составляющее примерно 1:3, дает примерно 10-12 моль ПЭГ на один моль мономера AvPAL.
Используемые здесь термины «лечение» или «терапия» означают профилактическое лечение, терапевтическое лечение или диагностику.
«Профилактическое» лечение означает лечение индивидуума, у которого отсутствуют признаки заболевания или патологии, то есть, рака, либо у которого наблюдаются лишь ранние признаки этого заболевания или патологии, где указанное лечение осуществляют в целях снижения риска развития данной патологии. Композиции прокариотического PAL согласно изобретению могут быть использованы в профилактических целях для снижения вероятности развития патологии, то есть, рака, или для минимизации тяжести данной патологии, если она имеется.
«Терапевтическое» лечение означает лечение индивидуума, у которого наблюдаются признаки или симптомы патологии, то есть, рака, где указанное лечение проводят в целях ослабления тяжести или устранения таких признаков или симптомов. Такие признаки или симптомы могут быть биохимическими, клеточными, гистологически детектируемыми, функциональными, субъективными или объективными. Композиции прокариотического PAL согласно изобретению могут быть использованы в терапевтических целях или для диагностики.
Термин «диагностика» означает идентификацию присутствия или природы патологического состояния, то есть, рака. Методы диагностики отличаются по своей специфичности и селективности. Если конкретный диагностический метод не может дать окончательный диагноз состояния, то достаточно, чтобы этот метод давал какое-либо позитивное указание, которое могло бы облегчить установление диагноза.
Термин «фармацевтическая композиция» означает композицию, подходящую для ее фармацевтического применения в целях лечения животного, включая человека и млекопитающих. Фармацевтическая композиция содержит фармакологически эффективное количество прокариотического полипептида PAL, а также фармацевтически приемлемый носитель. Термин «фармацевтическая композиция» включает композицию, содержащую активный(е) ингредиент(ы) и инертный(е) ингредиент(ы), который(е) включают носитель, а также любой продукт, который, прямо или опосредованно, продуцируется в результате комбинирования, образования комплексов или агрегации любых двух или более ингредиентов, или в результате диссоциации одного или нескольких ингредиентов, или других реакций или взаимодействий одного или нескольких указанных ингредиентов. В соответствии с этим, термин «фармацевтические композиции» согласно изобретению включает любую композицию, приготовленную путем смешивания прокариотического полипептида PAL согласно изобретению и фармацевтически приемлемого носителя.
Термин «фармацевтически приемлемый носитель» означает любые стандартные фармацевтические эксципиенты, наполнители, разабавители, стабилизаторы, консерванты, солюбилизаторы, эмульгаторы, адъюванты и/или носители, такие как, например, но не ограничивающиеся ими, забуференный фосфатом физиологический раствор, 5% водный раствор декстрозы и эмульсии, такие как эмульсия типа «масло в воде» или «вода в масле», и смачивающие агенты и/или адъюванты различных типов. Подходящие фармацевтические носители и препараты описаны в руководстве Remington's Pharmaceutical Sciences, 19th Ed. (Mack Publishing Co., Easton, 1995). Выбор предпочтительных фармацевтических носителей зависит от предусматриваемого способа введения активного агента. Типичными способами введения являются энтеральное введение (например, пероральное введение) или парентеральное введение (например, подкожная, внутримышечная, внутривенная или внутрибрюшинная инъекция; или местное введение, чрескожное введение или введение через слизистую). Термин «фармацевтически приемлемая соль» означает соль, которая может быть включена в композицию варианта прокариотического PAL, используемую в фармацевтике, и такой солью могут быть, например, соли металлов (натрия, калия, магния, кальция и т.п.) и соли аммиака или органических аминов.
Термины «фармацевтически приемлемый» или «фармакологически приемлемый» относятся к материалу, который не является биологически нежелательным или нежелательным с какой-либо другой точки зрения, то есть, к материалу, который может быть введен индивидууму и не вызывает каких-либо нежелательных биологических эффектов, или не вступает в какие-либо нежелательные взаимодействия с любыми компонентами композиции, в которой он содержится.
Используемый здесь термин «унифицированная лекарственная форма» означает физически дискретные единицы, которые являются подходящими в качестве разовых доз, вводимых человеку и животному, каждая из которых содержит предварительно определенное количество варианта прокариотического PAL согласно изобретению, достаточное для продуцирования желаемого эффекта в комбинации с фармацевтически приемлемым разбавителем, носителем или наполнителем. Спецификации для новых унифицированных лекарственных форм согласно изобретению зависят от конкретного используемого варианта прокариотического PAL и желаемого эффекта, а также от фармакодинамических свойств, ассоциированных с каждым вариантом прокариотического PAL, присутствующего у хозяина.
«Физиологический pH» или «рН в физиологическом интервале значений» означают рН в пределах приблизительно от 7,2 до 8,0 включительно, а обычно в пределах приблизительно от 7,2 до 7,6 включительно.
Используемый здесь термин «индивидуум» включает млекопитающих и животных, не являющихся млекопитающими. Примерами млекопитающих являются, но не ограничиваются ими, любой вид, принадлежащий к классу млекопитающих, а именно, человек, приматы, не являющиеся человеком, такие как шимпанзе, и другие виды человекообразных обезьян и мартышек; сельскохозяйственные животные, такие как крупный рогатый скот, лошади, овцы, козы и свиньи; домашние животные, такие как кролики, собаки и кошки; лабораторные животные, включая грызунов, таких как крысы, мыши и морские свинки и т.п. Примерами животных, не относящихся к млекопитающим, являются, но не ограничиваются ими, птицы, рыбы и т.п. Этот термин не определяет конкретный возраст или пол животного.
B. Варианты прокариотического PAL
Определение соответствующей трехмерной структуры или структурной модели конкретной макромолекулы позволяет создать рациональный план разработки продуктивного метода оптимизации конкретной структуры и/или функции указанной макромолекулы. Методы использования трехмерной структуры или структурной модели для оптимизации ферментов PAL описаны в предварительной одновременно рассматриваемой заявке на патент США № 11/230374, поданной 19 сентября 2005, которая во всей своей полноте вводится в настоящее описание посредством ссылки. Трехмерная кристаллическая структура белка прокариотического PAL высокого разрешения может быть использована в методах белковой инженерии для улучшения биохимических и биофизических свойств прокариотического PAL и для повышения терапевтической эффективности прокариотического PAL in vivo. В настоящем изобретении рассматриваются варианты прокариотического PAL, обладающие более высокой фенилаланин-конвертирующей активностью и/или более низкой иммуногенностью в отличие от прокариотического PAL дикого типа. В настоящем изобретении также рассматриваются варианты прокариотического PAL, обладающие более высокой биохимической стабильностью и/или имеющие более продолжительное биохимическое время полужизни в отличие от прокариотического PAL дикого типа.
Варианты прокариотического PAL, обладающие повышенной каталитической активностью
Биологически активные центры прокариотического PAL дикого типа согласно изобретению могут быть модифицированы, если это необходимо, для оптимизации кинетических свойств PAL. Km, концентрация субстрата, которая дает полумаксимальную активность, тесно связана с терапевтической эффективностью PAL с точки зрения поддержания уровней Phe в приемлемых пределах, то есть, в пределах от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, примерно менее чем 20 мкМ, а еще более предпочтительно, примерно менее чем 10 мкМ, как было определено стандартными методами детектирования, хорошо известными специалистам. Km означает аффинность фермента к субстрату. Путем регуляции аффинности можно ограничивать или регулировать действие любого фермента на субстрат в различных концентрациях. Так, например, если Km составляет 1000 мкМ (например, PAL от Rhodosporidium toruloides), то активность этого фермента будет снижаться примерно до 12,5% при уровнях Phe в крови, составляющих 240 мкМ, и примерно до 3% при уровнях Phe в крови, составляющих 60 мкМ. Если Km составляет 240 мкМ, то активность этого фермента будет снижаться примерно до 50% при уровнях Phe в крови, составляющих 240 мкМ и примерно до 12% при уровнях Phe в крови, составляющих 60 мкМ. Предпочтительным терапевтическим ферментом PAL должен быть прокариотический фермент PAL, который обладает активностью, достаточной для снижения, а также поддержания уровней Phe после обработки в пределах от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, примерно менее чем 20 мкМ, а еще более предпочтительно, примерно менее чем 10 мкМ, как было определено стандартными методами детектирования, хорошо известными специалистам. Фермент, имеющий Km примерно 1000 мкМ, будет быстро терять активность по мере снижения уровней Phe до нормальных уровней (приблизительно 55-60 мкМ, см. Kaufmann, Proc. Natl. Acad. Sci USA 96:3160-3164 (1999)), а также будет требовать практически нецелесообразного введения в высокой степени концентрированных доз или доз в большом объеме. Фермент, имеющий более низкий Km, может быстро истощать Phe и поддерживать уровни Phe после обработки в пределах от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, примерно менее чем 20 мкМ, а еще более предпочтительно, примерно менее чем 10 мкМ, а поэтому такой фермент может быть использован для лечения рака.
В предпочтительных вариантах изобретения биологически активный вариант прокариотического PAL имеет kcat по меньшей мере примерно 0,1 с-1, предпочтительно, более чем примерно 0,5 с-1, а еще более предпочтительно, более чем примерно 1,0 с-1. В наиболее предпочтительных вариантах изобретения биологически активный вариант прокариотического PAL имеет kcat по меньшей мере примерно 0,4 с-1, предпочтительно, более чем примерно 2,0 с-1, а еще более предпочтительно, более чем примерно 4,0 с-1. В других предпочтительных вариантах изобретения биологически активный вариант прокариотического PAL имеет Km примерно от 10 мкМ до 2000 мкМ. В более предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL имеет Km примерно от 10 мкМ до 1000 мкМ. В еще более предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL имеет Km примерно от 10 мкМ до 500 мкМ. В других предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL обладает ферментативной активностью, которая составляет по меньшей мере примерно 50% от ферментативной активности PAL дикого типа, и примерно до величины, в 10 раз превышающей активность PAL дикого типа. В других предпочтительных вариантах изобретения биологически активный модифицированный прокариотический PAL обладает ферментативной активностью, которая примерно на 50%-100% превышает ферментативную активность PAL дикого типа. Такие биологически активные варианты прокариотического PAL могут быть получены методами, хорошо известными специалистам, такими как сайт-направленный мутагенез.
Варианты прокариотического PAL, имеющие пониженную иммуногенность
В настоящее время существует ряд стратегий, применяемых для снижения иммуногенности белка. Предпочтительно, модификации, которые вносят для минимизации иммунного ответа, не оказывают негативного влияния на структуру, функцию или стабильность макромолекулы. Используемыми эффективными стратегиями являются увеличение содержания человеческих последовательностей (методы конструирования химер и/или другие методы «гуманизации»), улучшение свойств в растворе, удаление эпитопов для антител, осуществление химической дериватизации (такой как ПЭГилирование) и/или идентификация и удаление агретопов MHC. Что касается введения терапевтического средства, то иммунореактивность in vivo может быть достигнута путем картирования эпитопов с последующим осуществлением подходящего мутагенеза для модификации и/или какой-либо другой мутации этих сайтов иммуногенности, проводимого отдельно и в комбинации с сайт-специфическим ПЭГилированием (Hershfield, et al., Proc. Natl. Acad. Sci. USA 88:7185-7189 (1991); Leong, et al., Cytokine 16(3): 106-119 (2001); Lee, et al., Pharm. Res. 20(5): 818-825 (2003)), или другими химическими методами дериватизации для доведения иммунореактивности белка до приемлемого уровня. Модификация областей антигенного поверхностного белка приводит к снижению иммуногенности (Chirino, et al., Drug Discov. Today 9(2):82-90 (2004)). Один из методов такого улучшения свойств включает конструирование белков меньшего размера, которые сохраняют каталитическую активность (например, для определения активности применяется анализ на оптическую плотность). Для идентификации мутантов с пониженной иммунореактивностью может быть также применен метод конструирования белков в комбинации с ELISA-скринингом. Другой метод включает внесение точечных мутаций в дополнительные поверхностные Lys-сайты для дериватизации путем ПЭГилирования, где этот метод, как было показано, позволяет снижать иммуногенность с использованием фермента пурин-нуклеозид-фосфорилазы (Hershfield, et al. (1991), там же). В альтернативном методе осуществляют мутацию остатков, локализованных в эпитопных областях белка, в целых удалениях имунногенных сайтов (Yeung, et al., J. Immunol. 172(11):6658-6665 (2004)). В методе, аналогичном методу гуманизации антитела, гомологичные области петли и/или остатки человеческих антител заменяют на соответствующие области петли гомологичного белка.
Улучшение свойств белков в растворе может повышать удельную активность фермента и/или снижать иммуногенность. Одним из свойств белка в растворе, типичных для экспрессируемых в бактериях рекомбинантных белков, является продуцирование белковых агрегатов, обусловленное, например, образованием межцепочечных дисульфидных связей, гидрофобными взаимодействиями и/или двухвалентными катионами (Chi, et al., Pharm. Res. 20(9): 1325-1336 (2003)). Агрегация рекомбинантно экспрессируемых белков может повышать иммунный ответ (Hermeling, et al., Pharm. Res. 21(6):897-903 (2994); Schellekens, Nephrol. Dial. Transplant. 20(suppl 6):vi3-9 (2005)). Один из методов улучшения свойств включает замену поверхностных цистеиновых остатков другими аминокислотными остатками (например, серином) для минимизации возможности образования межцепочечных дисульфидных связей. Так, например, замена двух поверхностных цистеиновых остатков сериновыми остатками приводит к снижению степени агрегации хоризмат-лиазы с минимальным влиянием на ферментативную активность (Holden, et al., Biochim. Biophys. Acta 1594(l):160-167 (2002)). В настоящем изобретении рассматриваются варианты прокариотического PAL, в которых один или несколько цистеиновых остатков заменены другим аминокислотным остатком, а предпочтительно, сериновым остатком. В некоторых вариантах изобретения один или несколько цистеиновых остатков прокариотического PAL заменены другим аминокислотным остатком. В предпочтительных вариантах изобретения прокариотическим PAL является AvPAL. в более предпочтительных вариантах изобретения один или несколько цистеиновых остатков AvPAL заменены цистеиновым остатком.
С. Химически модифицированные варианты прокариотического PAL
Химическая модификация макромолекул может быть осуществлена неспецифическим методом (который приводит к образованию смесей дериватизированных молекул) или сайт-специфическим методом (на основе дериватизации, направленной на изменение реактивности макромолекулы дикого типа, и/или сайт-селективной модификации с использованием комбинации сайт-направленного мутагенеза и химической модификации), или, альтернативно, с применением методов лигирования экспрессируемых белков (Hofmann, et al., Curr. Opin. Biotechnol. 13(4):297-303 (2002)). Предпочтительно, химическая модификация используется для снижения иммуногенности. Известным методом снижения иммуногенности белков является ПЭГилирование (Bhadra, et al. , Pharmazie 57(l):5-29 (2002)), но могут быть также применены методы гликозилирования и другие методы химической дериватизации посредством модификации, проводимой путем фосфорилирования, амидирования, карбоксилирования, ацетилирования, метилирования, получения кислотно-аддитивных солей, амидов, сложных эфиров и N-ацильных производных (Davis, Science 303:480-482 (2004)). Методы ПЭГилирования белков PAL и определения оптимальной степени ПЭГилирования описаны в предварительной одновременно рассматриваемой заявке на патент США № 11/230374, поданной 19 сентября 2005, которая во всей своей полноте вводится в настоящее описание посредством ссылки. В настоящем изобретении рассматриваются варианты прокариотического PAL, содержащие водорастворимый полимер (то есть, полиэтиленгликоль или ПЭГ).
В настоящем изобретении рассматривается введение одного или нескольких лизиновых остатков в активный центр или рядом с активным центром варианта прокариотического PAL для усиления каталитической активности, снижения иммуногенности и/или повышения биохимической стабильности, частично путем блокирования возможного ПЭГилирования других аминокислотных остатков (например, тирозина) в активном центре или рядом с активным центром фермента, или путем блокирования возможного ПЭГилирования лизинового остатка, играющего важную роль в ферментативной активности. Не ограничиваясь какой-либо конкретной теорией, можно лишь высказать предположение, что тирозиновый остаток, находящийся в активном центре или рядом с активным центром прокариотического PAL (то есть, в положении 78 или 314 в AvPAL), может быть сайтом для ПЭГилирования, которое снижает ферментативную активность. В некоторых вариантах изобретения один или несколько аминокислотных остатков, которые расположены в активном центре или рядом с активным центром прокариотического PAL и которые не требуются для ферментативной активности, заменены лизиновым остатком. В предпочтительном варианте изобретения прокариотическим PAL является AvPAL. В более предпочтительном варианте изобретения тирозиновый остаток AvPAL в положении 78 или 314 не доступен для ПЭГилирования. Не ограничиваясь какой-либо конкретной теорией, можно лишь высказать предположение, что, в этом случае, лизиновый остаток прокариотического PAL (то есть, в положении 419 в AvPAL), ПЭГилирование которого обычно блокируется ПЭГилированием соседнего лизинового остатка PAL (то есть, остатка в положении 413 в AvPAL), может быть сайтом для ПЭГилирования, что будет приводить к снижению уровня связывания с субстратом и/или к снижению каталитической активности. В некоторых вариантах изобретения один или несколько аминокислотных остатков прокариотического PAL заменены лизиновым остатком, в результате чего лизиновый остаток, играющий важную роль в связывании фермента с субстратом и/или в каталитической активности, становится недоступным для ПЭГилирования. В предпочтительном варианте изобретения прокариотическим PAL является AvPAL. В более предпочтительном варианте изобретения лизиновый остаток AvPAL в положении 419 недоступен для ПЭГилирования.
ПЭГилированные варианты прокариотического PAL
В примерах 7-9 предварительной одновременно рассматриваемой заявки на патент США № 11/451999, поданной 12 июня 2006, которая во всей своей полноте вводится в настоящее описание посредством ссылки, описано влияние ПЭГилированных и не-ПЭГилированных форм мутантного по лизину PAL R91K от Rhodosporidium toruloides (RtPAL), PAL, продуцируемого цианобактерией Nostoc punctiforme (NpPAL), и PAL, продуцируемого цианобактерией Anabaena variabilis (AvPAL), на уровни фенилаланина (Phe) у мышей ENU2 или BTBRenu2. Такое животное-модель является гомозиготным мутантом по локусу гена фенилаланин-гидроксилазы (PAH), где указанная мутация приводит к развитию у данного животного тяжелой гиперфенилаланемии. Высокие уровни Phe в плазме позволяют использовать такое животное в качестве подходящей модели для оценки способности PAL снижать уровни Phe в плазме. Введение ПЭГилированных форм NpPAL и AvPAL приводит к значительному снижению уровней Phe у мышей ENU2 по сравнению с уровнями, наблюдаемыми в присутствии не-ПЭГилированного NpPAL и AvPAL, соответственно. Такие эффекты сохранялись для NpPAL после еженедельных инъекций NpPAL в течение десяти недель. Полученные результаты показали, что ПЭГилирование PAL, происходящего от цианобактерий, Nostoc punctiforme и Anabaena variabilis, приводит к значительному снижению уровней Phe у мышей с ФКУ.
В примере 14 предварительной одновременно рассматриваемой заявки на патент США № 11/451999, поданной 12 июня 2006, которая во всей своей полноте вводится в настоящее описание посредством ссылки, описано влияние замены цистеиновых остатков сериновыми остатками (например, в положениях 503 и 565) в полипептиде AvPAL на уровни Phe у мышей ENU2. Введение ПЭГилированного мутанта AvPAL по двум цистеиновым остаткам, а именно AvPAL_C565SC503S, приводило к снижению уровней Phe в плазме, которое было сравнимо с уровнями, достигаемыми с использованием ПЭГилированого AvPAL дикого типа. Кроме того, титры анти-PAL антитела были ниже у животных, которым был инъецирован ПЭГилированный вариант AvPAL, по сравнению с животными, которым вводили ПЭГилированный AvPAL дикого типа. Эти результаты показали, что ПЭГилированный вариант AvPAL имел (1) PAL-ферментативную активность in vivo, сравнимую с активностью ПЭГилированного AvPAL дикого типа, (2) пониженную иммуногенность по сравнению с иммуногенностью ПЭГилированного AvPAL дикого типа.
D. Терапевтическое применение и введение вариантов прокариотических вариантов PAL
1. Различные формы рака
Настоящее изобретение относится к лечению рака методами, включающими использование композиций прокариотического PAL отдельно или в комбинации с другими терапевтическими схемами лечения, например, такими как, но не ограничивающимися ими, схемы лечения с использованием противораковых терапевтических средств или противораковых терапевтических средств направленного действия. В частности, предусматривается, что композиции прокариотического PAL могут быть использованы для лечения групп пациентов, которые имеют концентрации фенилаланина (Phe) в крови, сыворотке или в плазме на любом уровне (например, примерно от 40 мкМ до 2000 мкМ), при этом нормальный уровень Phe в плазме человека составляет примерно от 55 мкМ до 60 мкМ (Kaufman, Proc. Natl. Acad. Sci. USA 96:3160-3164 (1999)).
Используемый здесь термин «противораковое терапевтическое средство» означает любое соединение, например, небольшую молекулу или пептид/полипептид, которые, как было показано, оказывают терапевтическое действие на раковые клетки (то есть, ингибируют пролиферацию и/или выживаемость раковых клеток). Обычно противораковым терапевтическим средством является цитотоксическое средство или цитостатическое средство.
Используемый здесь термин «противораковое терапевтическое средство направленного действия» означает любое соединение, например, небольшую молекулу или пептид/полипептид, или полипептид или конъюгированный полипептид, которые, как было показано, оказывают терапевтическое действие на конкретные раковые клетки или ткани (то есть, ингибируют пролиферацию и/или выживаемость таких раковых клеток или тканей). Обычно, противораковым терапевтическим средством направленного действия является антитело, полипептид, имеющий антитело-подобный домен, или другой полипептид, например, фермент, гормон, фактор роста, цитокин и т.п., которые селективно связываются с поверхностью клетки-мишени. Антитело, полипептид, имеющий антитело-подобный домен, или другой полипептид могут быть не-конъюгированными, либо они могут быть конъюгированы с противораковым терапевтическим средством. Противораковым терапевтическим средством направленного действия может быть соединение, оказывающее терапевтическое действие на конкретные раковые клетки или ткани.
Композиции прокариотического PAL согласно изобретению могут быть использованы для лечения любого ракового заболевания, для которого требуется ингибирование пролиферации и/или выживаемости раковых клеток в результате ограничения или снижения уровней Phe. Идентификация ракового заболевания, для лечения которого могут быть использованы композиции прокариотического PAL согласно изобретению, может быть осуществлена на основе экспериментов по in vitro культивированию (см. пример 14) или исследований in vivo человеческих опухолевых ксенотрансплантатов у мышей (см. пример 15), проводимых, например, путем взятия биоптатов опухоли или путем их сравнения с опухолями такого типа, имеющими известную или продемонстрированную чувствительность к ограничению или снижению уровней Phe у животных с моделями человеческого рака. В предпочтительных вариантах изобретения раковыми заболеваниями являются рак легких, рак головного мозга или центральной нервной системы, рак толстой кишки, рак предстательной железы, рак почек или метастатическая меланома. В других предпочтительных вариантах изобретения указанным раковым заболеванием является рак головы и шеи, рак матки, лейкоз (например, острый миелоидный лейкоз или острый лимфобластный лейкоз) или миелома. В других предпочтительных вариантах изобретения указанным раковым заболеванием является рак у детей или резистентный рак (то есть, рак, который, как было обнаружено, является резистентным к противораковым терапевтическим средствам или к противораковым терапевтическим средствам направленного действия).
В некоторых своих вариантах, настоящее изобретение относится к лечению рака путем введения индивидууму композиции, содержащей прокариотический PAL или его биологически активный фрагмент, мутант, вариант или аналог в комбинации с приемом пищи с ограниченным содержанием белка (то есть, не содержащей фенилаланина), где комбинированное введение прокариотического PAL вместе с пищей с ограниченным содержанием белка является эффективным для снижения концентрации Phe в крови, в плазме или в сыворотке указанного индивидуума по сравнению с концентрацией, наблюдаемой без такого комбинированного введения.
При этом предусматривается, что способы согласно изобретению позволяют проводить мониторинг концентрации Phe в плазме индивидуума, подвергаемого лечению композициями прокариотического PAL. Затем пациенту, для его лечения, вводят композиции прокариотического PAL отдельно или в комбинации с другими терапевтическими схемами лечения, например, такими как схемы лечения с использованием противораковых терапевтических средств или противораковых терапевтических средств направленного действия, или комбинированные схемы лечения с использованием прокариотического PAL и пищи с ограниченным содержанием белка (то есть, не содержащей фенилаланина), в результате чего у данного пациента наблюдается по меньшей мере 10% снижение концентраций Phe в крови, в плазме или в сыворотке. Предпочтительно, данный способ позволяет снижать концентрацию Phe в крови, в плазме или в сыворотке по меньшей мере на 25%, а более предпочтительно, по меньшей мере на 50%. Еще более предпочтительно, данный способ позволяет снижать концентрацию Phe в крови, в сыворотке или в плазме индивидуума по меньшей мере на 50%, 60%, 70%, 80%, 90%, 95% или более (например, если у пациента, подвергаемого лечению, концентрация Phe в плазме составляет 60 мкМ, то 50%, 70% или 90% снижение концентрации Phe будет давать концентрацию Phe в плазме, составляющую 30 мкМ, 18 мкМ или 6 мкМ, соответственно). При этом очевидно, что способы лечения согласно изобретению позволят снизить концентрации Phe в крови, в сыворотке или в плазме пациента, после проведенного лечения, от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, примерно менее чем 20 мкМ, а еще более предпочтительно, примерно менее чем 10 мкМ, как было определено стандартными методами детектирования, хорошо известными специалистам.
Парентеральное введение, пероральное введение или другие стандартные способы введения доз могут быть осуществлены стандартными методами.
2. Композиции, используемые для лечения
В настоящем изобретении рассматривается терапевтическое лечение рака. Такое лечение основано, главным образом, на использовании композиций, фармацевтических композиций и препаратов прокариотического PAL, которые могут быть использованы отдельно или в комбинации с другими терапевтическими схемами лечения, такими как схемы лечения с использованием противораковых терапевтических средств или противораковых терапевтических средств направленного действия или комбинированные схемы лечения, которые включают прием пищи с низким содержанием белка (то есть, с низким содержанием фенилаланина) и введение прокариотического PAL или того и другого. Кроме того, прокариотический PAL и/или пища с ограниченным содержанием белка могут быть также введены в комбинации с другими терапевтическими композициями, предназначенными, например, для устранения симптомов низких уровней фенилаланина, такими как, например, но не ограничивающихся ими, симптомы, вызываемые введением тирозина. В этом разделе обсуждаются композиции, фармацевтические композиции и препараты, которые могут быть использованы в рассматриваемых здесь способах лечения.
Композиции, фармацевтические композиции и препараты, содержащие прокариотический PAL
В общих чертах, в настоящем изобретении рассматриваются фармацевтические композиции, содержащие терапевтически эффективное количество композиций прокариотического PAL вместе с одним или несколькими фармацевтически приемлемыми эксципиентами, наполнителями, разбавителями, стабилизаторами, консервантами, солюбилизаторами, эмульгаторами, адъювантами и/или носителями. Такие фармацевтические композиции включают разбавители с различным содержанием буферов (например, трис-HCl, фосфата), с различными pH и концентрациями ионов; добавки, такие как детергенты и солюбилизирующие агенты (например, полисорбат 20, полисорбат 80), антиоксиданты (например, аскорбиновую кислоту, метабисульфит натрия), консерванты (например, тимерозол, бензиловый спирт) и вещества, придающие объем (например, лактозу, маннит); см., например, руководство Remington's Pharmaceutical Sciences, 18th Edition (1990, Mack Publishing Co., Easton, Pa.) pages 1435:1712, которое вводится в настоящее описание посредством ссылки. Эффективным количеством активного ингредиента является терапевтически, профилактически или диагностически эффективное количество, которое может быть легко определено специалистом в данной области с учетом таких факторов, как масса тела, возраст и цель терапевтического применения.
Фармацевтические композиции прокариотического PAL согласно изобретению могут включать забуферивающий агент для поддержания рН раствора в желаемых пределах. Предпочтительными забуферивающими агентами являются трис-HCl, ацетат натрия, фосфат натрия и цитрат натрия. Могут быть также использованы смеси этих забуферивающих агентов. Количество забуферивающего агента, используемого в данной композиции, главным образом зависит от конкретно используемого буфера и рН раствора. Так, например, ацетат является более эффективным буфером при pH 5, чем при pH 6, поскольку в растворе при рН 5 может быть использовано меньшее количество ацетата, чем при рН 6. Более предпочтительным забуферивающим агентом является трис-HCl. Предпочтительным рН для фармацевтических композиций согласно изобретению является pH примерно 6,0-8,5. Более предпочтительным рН для фармацевтических композиций согласно изобретению является pH примерно 7,0-8,0. Наиболее предпочтительным рН для фармацевтических композиций согласно изобретению является pH примерно 7,0-7,6.
Фармацевтические композиции согласно изобретению могут также включать агент, корректирующий изотоничность, для сообщения раствору изотоничности и для придания ему большей совместимости с инъекцией. Предпочтительным агентом является хлорид натрия в концентрации 50-200 мМ. Более предпочтительным агентом является хлорид натрия в концентрации 100-150 мМ. Наиболее предпочтительным агентом является хлорид натрия в концентрации 130-150 мМ.
Фармацевтически приемлемые носители или наполнители могут включать стабилизаторы, которые представляют собой молекулы, стабилизирующие композиции прокариотического PAL согласно изобретению. Используемый здесь термин «стабилизировать» означает, например, но не ограничивается ими, увеличение срока хранения прокариотического фермента PAL, защиту прокариотического фермента PAL от протеолитического расщепления, поддержание прокариотического фермента PAL в активной конформации и сохранение активности прокариотического фермента PAL при выдерживании при повышенных температурах.
Стабилизаторами согласно изобретению являются L-фенилаланин (Phe) и его структурные аналоги, такие как транс-коричная кислота (t-CA), бензойная кислота, тирозин (Tyr) и т.п. Было показано, что при удалении субстрата L-фенилаланина после аффинной очистки происходит потеря активности растительного PAL от Phaseolus vulgaris (PvPAL) (Da Cunha, Eur. J. Biochem. 178:243-248 (1988)), и было показано, что дрожжевой PAL от Rhodosporidium toruloides (RtPAL) был защищен от инактивации протеазой при введении тирозина (Wang, et al., Mol. Genet. Metab. 86:134-140 (2005); Pilbak, et al., FEBS J. 273:1004-1019 (2006)). Как показано ниже, Phe и некоторые его структурные аналоги обладают способностью стабилизировать конъюгаты ПЭГ:PAL прокариотического PAL, происходящего от Anabaena variabilis (AvPAL) (см. пример 11). Не ограничиваясь какой-либо конкретной теорией, можно лишь предположить, что прокариотический фермент PAL является более стабильным в виде комплекса фермент-субстрат, где связанный субстрат Phe превращается в продукт t-CA или в аналог переходного состояния t-CA. t-CA остается связанной с каким-либо другим в высокой степени реакционноспособным активным центром (группой MIO), что обеспечивает стабилизацию фермента PAL. В соответствии с этим, субстрат фермента PAL, Phe, продукт, t-CA или их структурные аналоги являются стабилизаторами согласно изобретению.
В настоящем изобретении рассматривается фармацевтическая композиция, содержащая вариант прокариотического PAL и фармацевтически приемлемый носитель, где указанный фармацевтически приемлемый носитель содержит стабилизатор. Таким стабилизатором является Phe или его структурный аналог. Указанный стабилизатор выбирают из группы, состоящей из L-фенилаланина, транс-коричной кислоты и бензойной кислоты. Предпочтительная концентрация стабилизаторов согласно изобретению составляет примерно от 0,1 до 20 моль стабилизатора на один моль активного центра прокариотического PAL. Более предпочтительная концентрация стабилизаторов согласно изобретению составляет примерно от 0,5 до 10 моль стабилизатора на один моль активного центра прокариотического PAL. Наиболее предпочтительная концентрация стабилизаторов согласно изобретению составляет примерно от 1 до 10 моль стабилизатора на один моль активного центра прокариотического PAL.
В некоторых вариантах изобретения фармацевтическая композиция содержит вариант прокариотического PAL и фармацевтически приемлемый носитель, где указанный вариант прокариотического PAL имеет более высокую фенилаланин-конвертирующую активность и/или более низкую иммуногенность, чем PAL дикого типа, и является эффективной в отношении снижения концентрации Phe в крови, сыворотки или в плазме индивидуума от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, примерно до менее чем 20 мкМ, а еще более предпочтительно, примерно до менее чем 10 мкМ, и где указанный фармацевтически приемлемый носитель включает стабилизатор. В некоторых вариантах изобретения указанным стабилизатором является Phe или его структурный аналог. В некоторых вариантах изобретения указанный стабилизатор выбран из группы, состоящей из L-фенилаланина, транс-коричной кислоты и бензойной кислоты.
В предпочтительных вариантах изобретения фармацевтическая композиция содержит вариант прокариотического PAL и фармацевтически приемлемый носитель, где указанным вариантом прокариотического PAL является вариант PAL Anabaena variabilis (AvPAL), в котором цистеиновые остатки в положениях 503 и 565 варианта AvPAL были заменены сериновыми остатками; при этом указанный вариант AvPAL также содержит водорастворимый полимер полиэтиленгликоля, где отношение варианта AvPAL к полиэтиленгликолю составляет примерно 1:3; и где указанный вариант AvPAL является эффективным для снижения концентрации фенилаланина в крови, сыворотке или в плазме индивидуума до нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, примерно до менее чем 20 мкМ, а еще более предпочтительно, примерно до менее чем 10 мкМ, где указанный фармацевтически приемлемый носитель включает стабилизатор. В некоторых вариантах изобретения указанным стабилизатором является Phe или его структурный аналог. В предпочтительных вариантах изобретения указанный стабилизатор выбран из группы, состоящей из L-фенилаланина, транс-коричной кислоты и бензойной кислоты.
Используемый здесь термин «терапевтически эффективное количество», если он относится к композициям варианта прокариотического PAL, означает количество, которое является эффективным для достижения желаемого благоприятного воздействия на состояние здоровья пациента, страдающего раком. В некоторых вариантах изобретения терапевтически эффективное количество варианта прокариотического PAL способствует снижению уровней L-фенилаланина в крови, плазме или сыворотке, а предпочтительно, в плазме, что является благоприятным эффектом для данного пациента. Такое количество может варьироваться для различных пациентов и зависит от ряда факторов, включая общее физическое состояние пациента, его режим питания и тип патологического состояния пациента. Количество прокариотического PAL, используемое в терапии, обеспечивает приемлемое снижение уровней L-фенилаланина в крови, плазме или сыворотке, а предпочтительно, в плазме, и такая пониженная величина сохраняется в процессе лечения с использованием PAL на желаемом уровне (обычно в пределах от менее чем примерно 5% до примерно 35%-100%, предпочтительно, в пределах от менее чем примерно 5% до 35%, а еще более предпочтительно, в пределах от менее чем примерно 5% до 15% от нормального уровня L-фенилаланина в крови, плазме или сыворотке, а предпочтительно, в плазме). В некоторых вариантах изобретения терапевтически эффективное количество варианта прокариотического PAL способствует снижению роста опухоли, размера опухоли или опухолевой нагрузки примерно более чем на 10%, 30%, 50%, 70%, 90%, 95%, 98% или 99% у пациента, подвергаемого лечению, по сравнению с пациентом, не подвергаемым лечению. В некоторых вариантах изобретения терапевтически эффективное количество варианта прокариотического PAL способствует поддерживанию опухоли в устойчивом состоянии у пациента, подвергаемого лечению, по сравнению с пациентом, не подвергаемым лечению. В некоторых вариантах изобретения терапевтически эффективное количество варианта прокариотического PAL способствует повышению выживаемости или увеличению времени ремиссии по меньшей мере примерно на 10%, 20%, 50%, 100%, или в 2 раза, в 5 раз или в 10 раз у пациента, подвергаемого лечению, по сравнению с пациентом, не подвергаемым лечению. Терапевтически эффективное количество композиций варианта прокариотического PAL согласно изобретению может быть легко определено специалистом с применением общедоступных материалов и процедур.
Настоящее изобретение относится к введению вариантов прокариотического PAL, которое может быть осуществлено менее часто, чем введение нативного PAL. Частота введения доз варьируется в зависимости от состояния, подвергаемого лечению, но обычно такое введение осуществляют примерно один раз в неделю. При этом следует отметить, что фактическая частота введения доз может несколько отличаться от описанной здесь частоты введения, что обусловлено изменением ответа у различных индивидуумов на введение вариантов прокариотического PAL, где слово «примерно» отражает такие изменения. При этом предусматривается, что варианты прокариотического PAL могут быть введены примерно два раза в неделю, примерно один раз в неделю, примерно один раз через каждые две недели, примерно один раз в месяц или более чем примерно один раз в месяц.
Таким образом, настоящее изобретение может быть также использовано для снижения уровней L-фенилаланина в крови, плазме или сыворотке. Различные состояния, ассоциированные с раком, при которых может оказаться желательным снижение уровней L-фенилаланина в крови, плазме или сыворотке, могут быть подвергнуты лечению с использованием фармацевтических композиций варианта прокариотического PAL согласно изобретению.
Фармацевтические композиции прокариотического PAL, полученные в соответствии с настоящим изобретением, предпочтительно, вводят путем парентеральной инъекции, а именно, внутривенно, внутрибрюшинно, подкожно, внутримышечно, внутриартериально или интратекально. Однако для каждого специалиста очевидно, что фармацевтические композиции согласно изобретению могут быть также с успехом введены и другими способами доставки.
В описанных здесь способах используются фармацевтические композиции прокариотического PAL, содержащие описанные выше молекулы вместе с одним или несколькими фармацевтически приемлемыми эксципиентами, наполнителями, разбавителями, стабилизаторами, консервантами, солюбилизаторами, эмульгаторами, адъювантами и/или носителями, и, необязательно, вместе с другими терапевтическими и/или профилактическими ингредиентами. Указанными наполнителями являются жидкости, такие как вода, физиологический раствор, глицерин, полиэтиленгликоль, гиалуроновая кислота, этанол, циклодекстрины, модифицированные циклодекстрины (то есть, циклодекстрины, содержащие сульфобутиловый эфир) и т.п. Подходящие наполнители для не-жидких препаратов также известны специалистам.
В композициях согласно изобретению могут быть использованы фармацевтически приемлемые соли, и такими солями являются, например, соли минеральных кислот, такие как гидрохлориды, гидробромиды, фосфаты, сульфаты и т.п.; и соли органических кислот, такие как ацетаты, пропионаты, малонаты, бензоаты и т.п. Подробное обсуждение фармацевтически приемлемых наполнителей и солей приводится в руководстве Remington's Pharmaceutical Sciences, 18th Edition (Easton, Pennsylvania: Mack Publishing Company, 1990).
Кроме того, в таких носителях могут присутствовать добавки, такие как смачивающие или эмульгирующие агенты, биологические забуферивающие вещества, поверхностно-активные вещества и т.п. Биологическим буфером фактически может быть любой раствор, который является фармакологически приемлемым и который доводит данный препарат до нужного рН, то есть, рН, имеющего значения, входящие в физиологически приемлемые интервалы. Примерами буферных растворов являются физиологический раствор, забуференный фосфатом физиологический раствор, забуференный трисом физиологический раствор, физиологический раствор, забуференный раствором Хэнкса, и т.п.
В зависимости от предполагаемого способа введения, фармацевтические композиции могут быть приготовлены в твердых, полутвердых или жидких лекарственных формах, таких как, например, таблетки, суппозитории, драже, капсулы, порошки, жидкости, суспензии, кремы, мази, лосьоны или т.п., а предпочтительно, в унифицированной лекарственной форме, подходящей для одного введения определенной лекарственной формы. Композиции могут включать терапевтически эффективное количество прокариотического PAL в комбинации с фармацевтически приемлемым носителем, и кроме того, они могут включать и другие фармацевтические средства, адъюванты, разбавители, буферы и т.п.
В общих чертах, фармацевтические композиции прокариотического PAL согласно изобретению могут быть введены в виде фармацевтических препаратов, включая препараты, подходящие для перорального введения (включая трансбуккальное и подъязычное введение), ректального введения, интраназального введения, местного введения, внутрилегочного введения, вагинального введения или парентерального введения (включая внутримышечное, внутриартериальное, интратекальное, подкожное и внутривенное введение), или в виде препарата, подходящего для введения путем ингаляции или инсуффляции. Предпочтительным способом введения является внутривенное введение, осуществляемое по стандартной схеме суточного введения доз, которая может быть скорректирована в зависимости от степени поражения.
Для твердых композиций стандартными нетоксичными твердыми носителями являются, например, маннит, лактоза, крахмал, стеарат магния, натрийсодержащий сахарин, тальк, целлюлоза, глюкоза, сахароза и карбонат магния фармацевтической чистоты и т.п. Жидкие фармацевтически приемлемые композиции могут быть получены, например, путем растворения, диспергирования и т.п. описанной здесь композиции варианта прокариотического PAL в необязательных фармацевтических адъювантах в наполнителе, таком как, например, вода, физиологический раствор, водный раствор декстрозы, глицерин, этанол и т.п. с образованием раствора или суспензии. При желании, вводимая фармацевтическая композиция может также содержать небольшие количества нетоксичных добавок, таких как смачивающие или эмульгирующие агенты, рН-забуферивающие агенты, агенты, придающие тоничность и т.п., например, ацетат натрия, монолаурат сорбитана, ацетат триэтаноламина-натрия, олеат триэтаноламина и т.п. Фактические методы получения таких лекарственных форм являются известными или могут быть разработаны способами, известными специалистам, например, см. вышеупомянутое руководство Remington's Pharmaceutical Sciences.
Для перорального введения, композицию обычно приготавливают в форме таблетки, капсулы или мягкой гелевой капсулы, либо такой композицией может быть водный или безводный раствор, суспензия или сироп. Предпочтительными формами для перорального введения являются таблетки и капсулы. Таблетки и капсулы для перорального введения, в основном, включают один или несколько обычно используемых носителей, таких как лактоза и кукурузный крахмал. В указанную композицию также обычно добавляют замасливатели, такие как стеарат магния. При использовании жидких суспензий, активный агент может быть объединен с эмульгирующими и суспендирующими агентами. При желании могут быть также добавлены ароматизаторы, красители и/или подсластители. Другими необязательными компонентами, которые могут быть включены в описанный здесь препарат для перорального введения, являются, но не ограничиваются ими, консерванты, суспендирующие агенты, загустители и т.п.
Препараты для парентерального введения могут быть приготовлены в стандартных формах, либо в виде жидких растворов или суспензий, либо в виде твердых или лиофилизованных форм, подходящих для разведения, солюбилизации или суспендирования в жидкости перед инъекцией, либо в виде эмульсий. Стерильные суспензии для инъекций, предпочтительно, приготавливают методами, известными специалистам, с использованием подходящих носителей, диспергирующих или смачивающих агентов, и суспендирующих агентов. Стерильным препаратом для инъекций может быть также стерильный раствор или стерильная суспензия для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе. Подходящими носителями и растворителями, которые могут быть использованы, являются вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителей или суспендирующих сред обычно используются стерильные жирные масла, сложные эфиры жирных кислот или полиолы. Кроме того, для парентерального введения может быть использована система замедленного или пролонгированного высвобождения, которая обеспечивала бы постоянный уровень дозы.
Композиции прокариотического PAL согласно изобретению, описанные в настоящей заявке, могут быть введены пациенту в дозах, которые являются терапевтически эффективными для лечения рака. Токсичность и терапевтическая эффективность таких композиций прокариотического PAL могут быть определены с применением стандартных фармацевтических методов в клеточных культурах или у экспериментальных животных, например, путем определения LD50 (дозы, которая является летальной для 50% популяции) и ED50 (дозы, которая является терапевтически эффективной для 50% популяции). Отношение токсической дозы и терапевтически эффективной дозы называется терапевтическим индексом, и этот индекс может быть записан как отношение LD50/ED50. Обычно, предпочтительными являются композиции прокариотического PAL, имеющие высокий терапевтический индекс.
Данные, полученные из анализов клеточных культур и исследований на животных, могут быть использованы для приготовления ряда доз, подходящих для введения человеку. Такие дозы, предпочтительно, составляют в пределах циркулирующих концентраций, соответствующих ED50 с низкой или минимальной токсичностью. Эта доза может варьироваться в указанном интервале в зависимости от используемой лекарственной формы и способа введения. Терапевтически эффективная доза или терапевтически эффективное количество могут быть определены из анализов клеточных культур и из экспериментов, проводимых на животных-моделях.
Пищевой белок
В настоящем изобретении предусматривается, что, помимо введения композиций прокариотического PAL пациенту с раком, может быть также ограничено употребление пациентом пищевого белка, либо этот белок может быть модифицирован. Специалисту в данной области известны различные коммерчески доступные белковые препараты, используемые для лечения ФКУ. Такими препаратами являются MAXIMAID, PHENEX 1, PHENEX 2 (Ross Laboratories, Liverpool, UK), LOFENALAC, PHENYL-FREE (Mead-Johnson) и т.п.
Специалистами в данной области могут быть использованы стандартные белковые препараты, по существу, не содержащие Phe. В белковые препараты часто добавляют аминокислоты, дефицит которых наблюдается у пациентов с ФКУ. Такими аминокислотами являются, например, L-тирозин и L-глутамин.
Кроме того, помимо приема пищи с ограниченным содержанием белка, необходимо также введение L-карнитина и таурина, которые, как известно, обычно присутствуют в человеческом молоке и в других пищевых продуктах животного происхождения. В некоторых вариантах изобретения в целях пополнения количества указанных веществ, обычно присутствующих в человеческом молоке и в пищевых продуктах животного происхождения, L-карнитин может быть добавлен в количестве 20 мг/100 г белковой добавки, а таурин может быть добавлен в количестве 40 мг/100 г белковой добавки.
Кроме того, специалисты в данной области могут обратиться в Национальную академию наук за информацией о нормах потребления питательных веществ, рекомендуемых Национальным советом по исследованиям, 2000, с просьбой о предоставлении дополнительного списка других компонентов, таких как основные витамины и минеральные вещества, которые должны быть введены в организм пациента вместе с пищей и, несмотря на ограниченное потребление им пищевого белка, должны обеспечивать доставку других вспомогательных веществ.
Обращаясь к вышеприведенной дискуссии относительно количества общего белка и желательных концентраций Phe в плазме, специалист в данной области способен определить степень требуемого ограничения пищевого белка и соответственно скорректировать пищевой рацион пациента. После введения прокариотического PAL данному индивидууму определяют, являются ли способы согласно изобретению эффективными для регулярного определения концентраций Phe в плазме пациента в целях гарантии сохранения концентраций Phe в плазме в интревалах от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, примерно до менее чем 20 мкМ, а еще более предпочтительно, примерно до менее чем 10 мкМ. Тесты для определения таких концентраций описаны ниже. При этом предпочтительно, чтобы эти концентрации были меньше величин в пределах от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, более предпочтительно, примерно до менее чем 20 мкМ, а еще более предпочтительно, примерно до менее чем 10 мкМ.
В некоторых своих вариантах, настоящее изобретение относится к способу лечения рака, включающему введение индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, содержащей вариант прокариотической фенилаланин-аммиак-лиазы (PAL) и фармацевтически приемлемый носитель, где указанный вариант PAL обладает более высокой фенилаланин-конвертирующей активностью и/или более низкой иммуногенностью по сравнению с PAL дикого типа, и является эффективным для снижения концентрации фенилаланина в крови, сыворотке или плазме индивидуума от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, примерно до менее чем 20 мкМ, а еще более предпочтительно, примерно до менее чем 10 мкМ, и где указанный способ включает прием указанным индивидуумом пищи с ограниченным содержанием белка (то есть, пищи, не содержащей фенилаланина).
Некоторые способы согласно изобретению включают комбинированное введение прокариотического PAL вместе с приемом пищи с органиченным содержанием белка для достижения терапевтического эффекта у пациентов с различными формами рака. Для достижения подходящего терапевтического эффекта при проведении рассматриваемой здесь комбинированной терапии, указанному индивидууму, по существу, предпочтительно вводить композицию прокариотического PAL вместе с пищей с ограниченным содержанием белка в количестве, эффективном для достижения желаемого терапевтического эффекта (то есть, для снижения концентрации Phe в плазме от нижнего детектируемого уровня и примерно оптимально до 20 мкМ-60 мкМ, предпочтительно, примерно до менее чем 20 мкМ, а еще более предпочтительно, примерно до менее чем 10 мкМ, как было определено стандартными методами детектирования, хорошо известными специалистам). Этот способ может включать одновременное введение композиции, содержащей прокариотический PAL, и терапевтической композиции, содержащей пищевой белок. Это может быть достигнуто путем введения одной композиции или фармакологического белкового препарата, который удовлетворяет всем потребностям в пищевом белке, а также включает прокариотический PAL. Альтернативно, прием пищевого белка (добавки или нормальной белковой пищи) может быть осуществлен почти одновременно с введением фармакологического препарата (таблетки, инъекции или напитка), содержащего прокариотический PAL. Прокариотический PAL может быть также приготовлен в виде белкового брикета или другого пищевого продукта, такого как шоколадное пирожное с орехами, блины и печенье, подходящих для их употребления.
Поскольку введение прокариотического PAL не приводит к образованию тирозина (в отличие от введения PAH), такое лечение, кроме того, приводит к продуцированию тирозина, который является незаменимой аминокислотой для данных пациентов. Поэтому тирозин-содержащая пищевая добавка может быть желательной для пациентов, получающих прокариотический PAL отдельно или в комбинации с лечебной белковой терапией.
В других альтернативных способах, лечение прокариотическим PAL может быть осуществлено до или после лечебной белковой терапии, проводимой с интервалами от нескольких минут до нескольких часов. В тех вариантах изобретения, в которых белок и композиции прокариотического PAL вводят отдельно, по существу, необходимо, чтобы интервал между введениями не был слишком большим, то есть, он должен быть таким, чтобы PAL мог оказывать преимущественное воздействие на пациента. В таких случаях, предусматривается, чтобы введение PAL осуществлялось за 2-6 часов до приема или через 2-6 часов после приема пищевого белка, а наиболее предпочтительным является перерыв примерно только в 1 час. В некоторых вариантах изобретения предусматривается, что PAL-терапией должна быть непрерывная терапия, при которой пациенту в течение неопределенного периода времени вводят суточную дозу PAL.
3. Комбинированная терапия
Кроме того, помимо терапии, основанной только на доставке прокариотического PAL и регуляции количества пищевого белка, способы согласно изобретению также включают комбинированную терапию с использованием композиции, которая специфически направлена на один или несколько симптомов рака. Такие композиции включают, например, но не ограничиваются ими, противораковые терапевтические средства и противораковые терапевтические средства направленного действия.
Противораковые терапевтические средства
В соответствии с описанными здесь способами согласно изобретению, в качестве противоракового терапевтического средства в комбинации с композициями прокариотического PAL согласно изобретению может быть использован любой агент, который оказывает терапевтическое действие на раковые клетки (например, ингибирует пролиферацию и/или выживаемость раковых клеток). Обычно таким противораковым терапевтическим средством является цитотоксическое средство или цитостатическое средство.
Противораковое терапевтическое средство может быть введено в целях проявления противораковой комбинированной терапии вместе с композициями прокариотического PAL согласно изобретению. Используемый здесь термин «противораковая комбинированная терапия» означает, что противораковое терапевтическое средство и композицию прокариотического PAL вводят одновременно или последовательно, либо сначала вводят противораковое терапевтическое средство, а затем композицию прокариотического PAL, или наоборот.
Обычно используемыми классами цитотоксических средств являются, например, антитубулиновые агенты, ауристатины, низкомолекулярные вещества, связывающиеся с ДНК-бороздкой, ингибиторы репликации ДНК, алкилирующие агенты (например, платиновые комплексы, такие как цисплатин, моно(платина), бис(платина) и трициклические платиновые комплексы и антикарбоплатин), антрациклины, антибиотики, антифолаты, антиметаболиты, химиотерапевтические сенсибилизирующие вещества, дуокармицины, этопозиды, фторированные пиримидины, ионофоры, лекситропсины, нитрозомочевины, платинолы, соединения для предварительного формования, пуриновые антиметаболиты, пуромицины, радиоактивные сенсибилизаторы, стероиды, таксаны, ингибиторы топоизомеразы, винкаалкалоиды и т.п.
Конкретными цитотоксическими средствами являются, например, андроген, антрамицин (AMC), аспарагиназа, 5-азацитидин, азатиоприн, блеомицин, бусульфан, бутионинсульфоксимин, камптотецин, карбоплатин, кармустин (BSNU), СС-1065, хлорамбуцил, цисплатин, колхицин, циклофосфамид, цитарабин, арабинозид цитидина, цитохалазин В, дакарбазин, дактиномицин (прежнее название - актиномицин), даунорубицин, декарбазин, доцетаксел, доксорубицин, эстроген, 5-фтордезоксиуридин, 5-фторурацил, грамицидин D, гидроксимочевина, идарубицин, ифосфамид, иринотекан, ломустин (CCNU), мехлоретамин, мелфалан, 6-меркаптопурин, метотрексат, митрамицин, митомицин C, митоксантрон, нитроимидазол, паклитаксел, пликамицин, прокарбизин, стрептозотоцин, тенопозид, 6-тиогуанин, тиотепа, топотекан, винбластин, винкристин, винорелбин, VP-16 и VM-26.
В некоторых вариантах изобретения указанным противораковым терапевтическим средством является цитотоксическое средство. Подходящими цитотоксическими средствами являются, например, доластатины (например, ауристатин E, AFP, MMAF, MMAE), низкомолекулярные вещества, связывающиеся с ДНК-бороздкой (например, энедиины и лекситропсины), дуокармицины, таксаны (например, паклитаксел и доцетаксел), пуромицины, винкаалкалоиды, CC-1065, SN-38, топотекан, морфолино-доксорубицин, ризоксин, цианоморфолинодоксорубицин, эхиномицин, комбретастатин, нетропсин, эпотилон A и B, эстрамустин, криптофизины, сематодин, майтанзиноиды, дискодермолид, элеутеробин и митоксантрон.
В некоторых вариантах изобретения цитотоксическим средством является стандартное химиотерапевтическое средство, такое как, например, доксорубицин, паклитаксел, мелфалан, винкаалкалоиды, метотрексат, митомицин С или этопозид. Кроме того, могут быть использованы сильнодействующие средства, такие как аналоги СС-1065, калихеамицин, майтанзин, аналоги доластатина 10, ризоксин и палитоксин.
В некоторых вариантах изобретения цитотоксическим средством является низкомолекулярное вещество, связывающееся с ДНК-бороздкой, например, соединение CBI или энедиин (например, калихеамицин).
В некоторых вариантах изобретения указанным противораковым терапевтическим средством является антитубулиновое средство. Примерами антитубулиновых средств являются, но не ограничиваются ими, таксаны (например, TAXOL (паклитаксел), TAXOTERE (доцетаксел)), T67 (Туларик), винкаалкалоиды (например, винкристин, винбластин, виндезин и винорелбин) и доластатины (например, ауристатин E, AFP, MMAF, MMAE, AEB, AEVB). Другими антитубулиновыми средствами являются, например, производные баккатина, аналоги таксана (например, эпотилон A и B), нокодазол, колхицин и кольцимид, эстрамустин, криптофизины, цемадотин, майтанзиноиды, комбретастатины, дискодермолид и элеутеробин.
В некоторых вариантах изобретения цитотоксическим средством является майтанзиноид, антитубулиновые средства другой группы, например, майтанзин или DM-1.
В некоторых вариантах изобретения указанным противораковым терапевтическим средством является радиоактивный изотоп. В некоторых других вариантах изобретения указанное противораковое терапевтическое средство не является радиоактивным изотопом.
В некоторых вариантах изобретения указанным цитотоксическим средством является антиметаболит. Указанными антиметаболитами могут быть, например, пуриновый антагонист (например, азотиоприн или микофенолят мофетил), ингибитор дигидрофолатредуктазы (например, метотрексат), ацикловир, гангцикловир, зидовудин, видарабин, рибаварин, азидотимидин, арабинозид цитидина, амантадин, дидезоксиуридин, иоддезоксиуридин, поскарнет или трифлуридин.
В других вариантах изобретения указанным цитотоксическим средством является такролимус, циклоспорин или рапамицин. В других вариантах изобретения указанным цитотоксическим средством является альдеслейкин, алемтузумаб, алитретиноин, аллопуринол, альтретамин, амифостин, анастрозол, триоксид мышьяка, бексаротен, калустерон, капецитабин, целекоксиб, кладрибин, дарбепоэтин альфа, денилейкин дифтитокс, дексразоксан, пропионат дромостанолона, эпирубицин, эпоэтин альфа, эстрамустин, экземестан, филграстим, флоксуридин, флударабин, фульвестрант, гемцитабин, гемтузумаб озогамицин, гозерелин, идарубицин, ифосфамид, мезилат иматиниба, интерферон альфа-2а, иринотекан, летрозол, лейковорин, левамизол, меклоретамин или азотный аналог горчичного газа, мегестрол, месна, метотрексат, метокссален, митомицин С, митотан, фенпропионат нандролона, опрелвекин, оксалиплатин, памидронат, пегадемаза, пегаспаргаза, пегфилграстим, пентостатин, пипоброман, пликамицин, порфимер-натрий, прокарабзин, хинакрин, расбуриказа, ритуксимаб, сарграмостин, стрептозоцин, тамоксифен, темозоломид, тенипозид, тестолактон, тиогуанин, торемифен, тозитумомаб, трастузумаб, третиноин, урациловый аналог горчичного газа, валрубицин, винбластин, винкристин, винорелбин и золедронат.
В некоторых своих вариантах, настоящее изобретение относится к способу лечения рака, включающему введение индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, содержащей вариант прокариотической фенилаланин-аммиак-лиазы (PAL) и фармацевтически приемлемый носитель, где указанный вариант PAL обладает более высокой фенилаланин-конвертирующей активностью и/или более низкой иммуногенностью по сравнению с PAL дикого типа, и является эффективным для снижения концентрации Phe в крови, сыворотке или плазме индивидуума от нижнего детектируемого уровня и примерно оптимально до 20 мкМ-60 мкМ, предпочтительно, примерно до менее чем 20 мкМ, а еще более предпочтительно, примерно до менее чем 10 мкМ, и где указанный способ также включает введение терапевтически эффективного количества фармацевтической композиции, содержащей противораковое терапевтическое средство.
Противораковые терапевтические средства направленного действия
В соответствии с описанными здесь способами, любой агент, который оказывает терапевтическое действие на конкретные раковые клетки (то есть, ингибирует пролиферацию и/или выживаемость клеток), может быть использован в качестве противоракового терапевтического средства направленного действия в комбинации с композициями прокариотического PAL согласно изобретению. Обычно, противораковым терапевтическим средством направленного действия является антитело, фермент или белок, которые селективно связываются с опухолевыми клетками или тканями конкретного типа, например, посредством антитело-подобного нацеливающего домена или в результате опосредуемого рецептором связывания и т.п. Антитело; полипептид, имеющий антитело-подобный нацеливающий домен; фермент или белок могут быть радиоактивно меченными, либо они могут быть конъюгированы с токсином или с другим агентом, который оказывает цитотоксическое или цитостатическое действие на клетки- или ткани-мишени. Альтернативно, противораковым терапевтическим средством направленного действия может быть агент, который оказывает терапевтическое действие на конкретные раковые клетки или ткани (то есть, ингибирует пролиферацию и/или выживаемость клеток) в результате ингибирования или активации белка, такого как, например, но не ограничивающегося ими, фермент или рецептор, которые преимущественно экспрессируются или являются активными в опухолевых клетках или тканях конкретных типов.
Противораковое терапевтическое средство направленного действия может быть введено посредством комбинированной терапии вместе с композициями прокариотического PAL согласно изобретению. Термин «противораковая комбинированная терапия направленного действия» означает, что противораковое терапевтическое средство направленного действия и композицию прокариотического PAL вводят одновременно или последовательно, либо сначала вводят противораковое терапевтическое средство направленного действия, а затем композицию прокариотического PAL, или наоборот.
В некоторых вариантах изобретения противораковым терапевтическим средством направленного действия является гуманизованное моноклональное анти-HER2 антитело, ритуксан (ритуксимаб; Genentech; химерное моноклональное анти-CD20 антитело); OVAREX (AltaRex Corporation, MA); PANOREX (Glaxo Wellcome, NC; мышиное антитело IgG2a); Cetuximab Erbitux (Imclone Systems Inc., NY; химерное анти-EGFR антитело, IgG); витаксин (Medlmmune, Inc., MD; Campath I/H (Leukosite, MA; гуманизованное антитело IgGl)); Smart MI95 (Protein Design Labs, Inc., CA; гуманизованное анти-CD33 антитело IgG); LymphoCide (Immunomedics, Inc., NJ; гуманизованное анти-CD22 антитело IgG); Smart ID10 (Protein Design Labs, Inc., CA; гуманизованное анти- HLA-DR антитело); Oncolym (Techniclone, Inc., CA; радиоактивно меченное мышиное анти-HLA-Dr10 антитело); Allomune (BioTransplant, CA; гуманизованное анти-CD2 mAb); авастин (Genentech, Inc., CA; гуманизованное анти-VEGF антитело); эпратузумаб (Immunomedics, Inc., NJ and Amgen, CA; анти-CD22 антитело); и CEAcide (Immunomedics, NJ; гуманизованное анти-CEA антитело).
Другими подходящими антителами являются, но не ограничиваются ими, антитела против нижеследующих антигенов: CA125, CA15-3, CA19-9, L6, Lewis Y, Lewis X, альфа-фетопротеина, CA242, щелочной фосфатазы плаценты, специфического антигена предстательной железы, кислой фосфатазы предстательной железы, эпидермального фактора роста, MAGE-1, MAGE-2, MAGE-3, MAGE-4, трансферринового рецептора, p97, MUCl-KLH, CEA, gp100, MARTl, специфического антигена предстательной железы, рецептора IL-2, CD20, CD52, CD33, CD22, человеческого хорионического гонадотропина, CD38, CD40, муцина, P21, MPG и онкогенного продукта Neu.
В некоторых вариантах изобретения противораковым терапевтическим средством направленного действия являются фермент или другой белок, имеющие антитело-подобный нацеливающий домен или обладающие способностью селективно связываться с конкретными клетками или тканями (например, в результате связывания лиганда с рецептором). Обычно белок, имеющий антитело-подобный нацеливающий домен, фермент или другой белок конъюгируют с противораковым терапевтическим средством, например, с соединением или пептидом/полипептидом, таким как токсин, например, рицин, дифтерийный токсин, эндотоксин Pseudomonas и т.п. (Kreitman, AAPS J. 8(3):E532-E551 (2006)), или с другим агентом, который способен оказывать цитотоксическое или цитостатическое действие на клетки- или ткани-мишени.
В некоторых вариантах изобретения противораковым терапевтическим средством направленного действия является соединение (например, небольшая молекула или пептид/полипептид), например, ингибитор серин/треонинкиназы, ингибитор тирозинкиназы, агонист ядерного рецептора, антагонист ядерного рецептора и т.п., которые оказывают терапевтическое действие на конкретные раковые клетки или ткани.
В некоторых своих вариантах, настоящее изобретение относится к способу лечения рака, включающему введение индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, содержащей вариант прокариотической фенилаланин-аммиак-лиазы (PAL) и фармацевтически приемлемый носитель, где указанный вариант PAL обладает более высокой фенилаланин-конвертирующей активностью и/или более низкой иммуногенностью по сравнению с PAL дикого типа, и является эффективным для снижения концентрации Phe в крови, сыворотке или плазме индивидуума от нижнего детектируемого уровня и примерно до 20 мкМ-60 мкМ, предпочтительно, примерно до менее чем 20 мкМ, а еще более предпочтительно, примерно до менее чем 10 мкМ, и где указанный способ также включает введение терапевтически эффективного количества фармацевтической композиции, содержащей противораковое терапевтическое средство направленного действия.
4. Идентификация и мониторинг групп пациентов
Как обсуждается в настоящей заявке, в различных вариантах осуществления изобретения необходимо определить, может ли данный пациент, страдающий раком, быть восприимчивым к терапии прокариотическим PAL, а также определить концентрации фенилаланина (Phe) у данного пациента в начале и во время проведения терапевтического лечения для мониторинга эффективности данной схемы лечения в отношении снижения концентрации Phe в плазме. Примеры таких методов описаны ниже.
Идентификация пациентов, восприимчивых к терапии прокариотическим PAL
Идентификация пациентов, для лечения которых могут быть использованы композиции прокариотического PAL согласно изобретению, может быть осуществлена на основе экспериментов по культивированию in vitro или исследований in vivo человеческого опухолевого ксенотрансплантата на мышах, или путем сравнения этих опухолей с опухолями известных типов или с опухолям, которые продемонстрировали зависимость их роста от Phe и их чувствительность к снижению или истощению Phe у животных с моделями человеческого рака.
Эксперименты по культивированию in vitro, в которых опухолевые клетки (например, взятые из биоптата опухоли или клинического аспирата) культивируют в отсутствие или в присутствии композиций прокариотического PAL или в отсутствие или в присутствии среды с дефицитом фенилаланина, могут быть осуществлены в соответствии с протоколами, известными специалистам (см., например, Abell, et al., Cancer Res. 32:285-290 (1972); Stith, et al., Cancer Res. 33:966-971 (1973); Fu, et al., Cancer Res. 59:758-765 (1999); Fu, et al., J. Cell. Physiol. 209:522-534 (2006); Elstad, et al., Nutr. Cancer 25:47-60 (1996); Nunez, et al., Cancer Lett. 236:133-141 (2006)). См. также пример 14.
Исследования in vivo человеческого опухолевого ксенотрансплантата на мышах, в которых опухолевые клетки (например, взятые из опухолевого биоптата или клинического аспирата) инъецируют «голым» мышам или мышам SCID, а затем трансплантируют мышам, ранее не участвовавшим в экспериментах, или мышам SCID, которым вводили или не вводили композиции прокариотического PAL, или которым давали или не давали корм с дефицитом фенилаланина, могут быть осуществлены в соответствии с протоколами, известными специалистам (см., например, Abell, et al., Cancer Res. 33:2529-2532 (1973); Shen, et al., Cancer Res. 37:1051-105 (1977); Fu, et al., Nutr. Cancer 31:1-7 (1998); Fu, et al., Nutr. Cancer 45:60-73 (2003); Meadows, et al., Cancer Res. 42:3056-3063, 1982; Elstad, et al., Anticancer Res. 13:523-528, (1993)). См. также пример 15.
Опухолями, рост которых, как известно или как было продемонстрировано, зависит от уровня Phe и от их чувствительности к снижению или истощению Phe у животных с моделями человеческого рака, являются, например, лейкоз, метастатическая миелома и андроген-независимый рак предстательной железы (Abell, et al., (1973), там же; Shen, et al., (1977), там же; Fu, et al., (1998), там же; Fu, et al., (2003), там же; Meadows, et al., (1982), там же; Elstad, et al., (1993), там же).
В примере 14 показано, что пролиферация и/или выживаемость опухолевых клеток, происходящих от рака легких, рака головного мозга или центральной нервной системы, рака толстой кишки, рака предстательной железы, рака почек, метастатической меланомы, рака головы и шеи, рака матки, лейкоза (например, острого миелоидного лейкоза или острого лимфобластного лейкоза) и миеломы, являются восприимчивыми к снижению уровня Phe после инкубирования этих клеток с композицией прокариотического PAL согласно изобретению.
Определение концентраций фенилаланина
Методы определения концентрации фенилаланина (Phe) в крови, сыворотке или в плазме известны специалистам, и некоторые из них описаны в предварительной одновременно рассматриваемой заявке на патент США № 11/230374, поданной 19 сентября 2005, которая во всей своей полноте вводится в настоящее описание посредством ссылки. Также предусматривается, что мониторинг уровней Phe в плазме пациентов проводят через соответствующие промежутки времени проведения (например, ежедневно, через день или еженедельно) курса терапевтического лечения. Благодаря мониторингу уровней Phe в плазме, проводимому с указанной регулярностью, врач-клиницист может определить эффективность данного лечения и соответственно скорректировать потребности в прокариотическом PAL и/или в пищевом белке.
E. Продуцирование прокариотического PAL
В другом своем аспекте, настоящее изобретение относится к способу продуцирования прокариотического PAL или его биологически активного фрагмента, мутанта, варианта или аналога. В предпочтительном варианте изобретения рекомбинантный прокариотический PAL или его биологически активный фрагмент, мутант, вариант или аналог сверхэкспрессируются в присутствии или в отсутствие N-концевой метки (например, октагистидиловой метки) в векторе, предпочтительно, pIBXl (Su, et al., Appl. Environ. Microbiol. 62:2723-2734 (1996)) или pET28a (Invitrogen), содержащем индуцибельный промотор, такой как промотор IPTG (изопропил-бета-D-тиогалактопиранозида), в клетках E.coli BLR(DE3)/pLysS (Novagen) или в клетках E.coli BL21(DE3)/pLysS (Invitrogen). Посевную культуру для биореактора/ферментера выращивают из глицеринового маточного раствора в шейкерных колбах. Затем такую посевную культуру помещают в управляемый биореактор в режиме с подпиткой. После этого добавляют глюкозу, pH корректируют добавлением основания (NH4OH), а затем смесь перемешивают со скоростью до 1200 об/мин. Подпитку О2 проводят до тех пор, пока уровень растворенного кислорода не будет превышать 20%. Клетки культивируют при 37°С до клеточной плотности OD600=70-100 (~22-25 часов) и индуцируют 0,4 мМ IPTG. Температуру снижают до 30°С, и клетки культивируют до тех пор, пока величина активности не будет составлять <0,1 МЕ/мл (приблизительно 40-48 часов, а OD600 обычно составляет 200). Среда для культивирования клеток обычно состоит из белка дрожжевого экстракта, пептона-триптона, глюкозы, глицерина, казаминокислот, следовых количеств солей и забуферивающих фосфатных солей. Рекомбинантный продукт прокариотического PAL или его биологически активного фрагмента, мутанта, варианта или аналога продуцируется внутри клеток и не секретируется из этих клеток. Бактерии собирают путем непрерывного центрифугирования (Alfa-Laval, Carr, Ceba или эквивалент).
F. Очистка прокариотического PAL
В другом своем аспекте настоящее изобретение относится к способу очистки прокариотического PAL или его биологически активного фрагмента, мутанта, варианта или аналога. В соответствии с первым вариантом изобретения трансформированную клеточную массу культивируют и разрушают с выделением неочищенного рекомбинантного фермента. Экзогенные материалы обычно отделяют от неочищенной массы во избежание загрязнения колонок. Хроматографическую очистку проводят с использованием одной или нескольких хроматографических смол. Затем очищенный белок приготавливают в буфере в целях обеспечения стабильной активности в течение длительного периода времени. В другом предпочтительном варианте изобретения способ очистки прокариотического PAL или его биологически активного фрагмента, мутанта, варианта или аналога включает: (a) лизис бактерий, содержащих рекомбинантный прокариотический PAL или его биологически активный фрагмент, мутант, вариант или аналог, с использованием гомогенизатора, работающего под давлением (но этот лизис может быть проведен с использованием других физических средств, таких как стеклянные сферы); (b) термообработку; (c) осветление этого лизата путем проведения второй стадии непрерывного центрифугирования и/или глубокой фильтрации (на таких фильтрах как Cuono Zeta Plus или Maximizer, Pall Filtron, или Millipore Millistak или Opticao); (d) пропускание осветленного лизата через угольный фильтр (такой как Millipore Millistak 40AC); (e) пропускание фильтрата через фильтр в последней стадии фильтрации (через 0,2 мкм-фильтр Sartorious Sartopore); (f) пропускание фильтрата через гидрофобную хроматографическую смолу (такую как бутиловая смола Toyopearl Butyl 650M от Tosoh Biosciences); (g) пропускание через ионообменную колонку Q (такую как Macroprep High Q от BioRad); и (h) выделение конечного продукта путем буферного обмена с фильтрацией в тангенциальном потоке (на Sartorious Hydrosart или на 100 кДа-мембране PES). Для специалиста в данной области совершенно очевидно, что одна или несколько стадий хроматографии могут не проводиться, либо они могут быть заменены, либо порядок проведения хроматографических стадий может быть изменен, и такие изменения входят в объем настоящего изобретения. И наконец, при желании могут быть проведены соответствующие стадии стерилизации.
Настоящее изобретение будет более понятным исходя из представленного здесь его общего описания, которое приводится со ссылками на нижеследующие примеры. Эти примеры приводятся лишь в целях иллюстрации и не должны рассматриваться как ограничение объема изобретения. При этом были приложены все усилия для обеспечения точности числовых значений (например, количеств, температур и т.п.), но при этом все же необходимо принимать в расчет возможность наличия некоторых экспериментальных ошибок и отклонений.
Примеры
Пример 1
Клонирование PAL от Nostoc punctiforme и Anabaena variabilis
Модификации ДНК
Геномную ДНК N. punctiforme закупали у ATCC (29133D), а ген PAL (ZP_00105927) подвергали ПЦР-амплификации с использованием праймеров 5'-CACTGTCATATGAATATAACATCTCTACAACAGAACAT-3' (SEQ ID NO: 12) и 5'-GACAGTGGCGGCCGCTCACGTTGACTTTAAGCTCGAAAAAATATG-3' (SEQ ID NO: 13). Полученный ПЦР-продукт гидролизовали ферментами Ndel и Notl, и 1,7 т.п.н.-фрагмент лигировали в N-His-меченные и немеченные pET-28a(+) и pET-30a(+) (Novagen), соответственно.
Клетки A. variabilis закупали у ATCC (29413). Геномную ДНК экстрагировали (Qiagen), и ген PAL (YP_324488) амплифицировали с помощью ПЦР с вероятностью ошибки (SOE-ПЦР) для удаления Nhel-сайта. Праймер 1 (5'-CACTGTGCTAGCATGAAGACACTATCTCAAGCACAAAG-3') (SEQ ID NO:14) и праймер 2 (5'- GGAAATTTCCTCCATGATAGCTGGCTTGGTTATCAACATCAATTAGTGG-3') (SEQ ID NO:15) использовали для амплификации нуклеотидов 1-1190, а праймер 3 (5'- CCACTAATTGATGTTGATAACCAAGCCAGCTATCATGGAGGAAATTTCC-3') (SEQ ID NO:16) и праймер 4 (5'-CACTGTGCGGCCGCTTAATGCAAGCAGGGTAAGATATCTTG-3') (SEQ ID NO: 17) использовали для амплификации нуклеотидов 1142-1771. Эти два ПЦР-праймера объединяли для амплификации полноразмерного гена с использованием праймеров 1 и 4. Полученный ПЦР-продукт гидролизовали ферментом Nhel, затупляли фрагментом Кленова (NEB), а затем гидролизовали Notl. 1,7 т.п.н.-фрагмент лигировали в pET-28a(+) и pET-30a(+) (Novagen). Эту плазмиду обозначали 3p86-23.
Ген PAL от A. variabilis (AvPAL) также клонировали в вектор pIBX7 (Tkalec, et al., Appl. Environ. Microbiol. 66:29-35 (2000)), который был получен из pIBXl (Su, et al., Appl. Environ. Microbiol. 62:2723-2734 (1996)) (см. пример 7).
Бактериальные штаммы и условия культивирования
Для получения PAL N. punctiforme (NpPAL), клетки E. coli BL21(DE3) (Stratagene) трансформировали pGro7 (TaKaRa), и компетентные клетки BL21(DE3)pGro7 получали методом Inoue (Sambrook and Russell, Molecular Cloning: A Laboratory Manual, 3rd Edition (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, 2001)). Эти клетки трансформировали вектором pET-28-NpPAL и культивировали в 25 мл среды LB, содержащей 50 мг/л канамицина и 20 мг/л хлорамфеникола, в течение ночи при 37°С. Двадцать миллилитров этой культуры высевали в 1 л среды LB, содержащей канамицин, хлорамфеникол и 500 мг/л L-арабинозы, и культивировали при 37°С. При плотности OD600=0,6 культуру охлаждали на льду. Через 5 минут культуру индуцировали 0,3 мМ IPTG и выращивали в течение 16 часов при 20°С. Клетки собирали путем центрифугирования.
Клетки BL21(DE3)pLysS (Stratagene) трансформировали AvPAL и культивировали в условиях, идентичных условиям культивирования NpPAL, но без индуцирования арабинозой.
AvPAL, клонированный в вектор pIBX7 (см. пример 7), вводили путем трансформации в клетки BLR(DE3)/pLysS (Novagen), и эти клетки культивировали в 25 мл среды LB, содержащей 50 мг/л канамицина, в течение ночи при 37°С. Двадцать миллилитров этой культуры высевали в 1 л среды LB, содержащей канамицин, и культивировали при 37°С. При плотности OD600=0,6 культуру охлаждали на льду. Через 5 минут культуру индуцировали 0,3 мМ IPTG и выращивали в течение 16 часов при 30°С. Клетки собирали путем центрифугирования.
Пример 2
Очистка NpPAL и AvPAL
Культуры центрифугировали на лабораторной центрифуге при 5000 × g в течение 20 минут, и супернатант отбрасывали. Перед дальнейшей обработкой клеточный осадок обычно замораживали при -70°С. После оттаивания клеточный осадок суспендировали приблизительно до оптической плотности 80 единиц (600 нм) в TBS (25 мМ трис, 150 мМ NaCl, pH 7,8). Клетки подвергали лизису путем двойного пропускания через гомогенизатор APV под давлением 12-14000 фунт/кв. дюйм (82800-96600 кПа). Очищенный лизат подвергали термообработке при 55°С в течение 2 часов. Лизат центрифугировали при 10000 × g в течение 30 минут, а супернатант оставляли и фильтровали через вакуумный 0,2 мкм-фильтр (Corning).
PAL очищали от осветленного лизата путем последовательного пропускания через колонку с бутиловой смолой 650M (Tosoh BioSciences) и колонку MacroPrep High Q (BioRad). Элюированный продукт имел высокую степень чистоты, на что указывали электрофорез в ДСН-ПААГ и обращенно-фазовая ВЭЖХ.
Пример 3
Получение ПЭГилированных вариантов PAL
Метод ПЭГилирования PAL от Rhodosporidium toruloides (RtPAL) описан ниже. Аналогичные методы ПЭГилирования прокариотического PAL (например, PAL от Nostoc punctiforme (NpPAL) или от Anabaena variabilis (AvPAL)) описаны в примере 6.
ПЭГилирование белка
ПЭГилирование осуществляли с применением модифицированных методов, описанных в литературе (Hershfield, et al., (1991), там же; патент США No. 6057292; Lu, et al., Biochemistry 40(44):13288-13301 (2001); Nektar Therapeutics, 2003 catalog). Активированными ПЭГ являются сукцинимидилсукцинаты ПЭГ с прямой цепью (mPEG-SPA, MW 5 кДа или MW 20 кДа) и гидросукцинимиды ПЭГ с разветвленной цепью (NHS-эфир mPEG2, MW 10 кДа или MW 40 кДа), которые были кэпированы по одному концу метокси-группой, и такие ПЭГ поставляются компанией Nektar Therapeutics; при этом обычно требуется экспериментальное определение оптимальных ПЭГилированных белков (Veronese, et al., J. Bioactive Compatible Polymers 12:196-207 (1997)). Оптимальные условия ПЭГилирования определяли с использованием различных отношений PAL:ПЭГ (с учетом молярного отношения белка и числа лизинов на один мономер белка), различных рН, различных буферов, различных температур и различных периодов времени инкубирования. Высокое отношение белок PAL:ПЭГ при дериватизации является необходимым, поскольку нативный PAL имеет большое число лизинов (29 на мономер Rhodosporidium toruloides (Rt)), а немодифицированный PAL обнаруживает иммунореактивность после его повторной инъекции мышам, и поскольку чистый PAL (дикого типа) быстро инактивируется под действием протеаз. Реакции ПЭГилирования прекращали путем замораживания при -20°С, и образцы анализировали с помощью электрофореза в ДСН-ПААГ, масс-спектроскопии MALDI-TOF и анализа на активность, протеолитическую чувствительность и иммунореактивность.
Перед проведением анализа на активность, протеолиз и иммунный ответ, и для удаления избытка непрореагировавшего ПЭГ, реакционные смеси диализовали против 0,05 М фосфатно-калиевого буфера, рН 8,5, в течение ночи при 4°С, с перемешиванием в присутствии диализаторов Tube-O-Dialyzers (GenoTechnology). После определения концентрации белка с использованием набора для анализа белка NI (GenoTechnology), PAL-активность измеряли на не-дериватизированных и ПЭГ-дериватизированных образцах PAL в стандартных условиях реакции, описанных ранее. После характеризации in vitro, проводили испытания in vivo на мышах с моделью ФКУ с использованием наиболее перспективных ПЭГилированных терапевтических средств-кандидатов.
Характеризация
Концентрацию белка определяли с использованием коэффициента экстинкции PAL (0,5 и 0,75 мг·мл-1·см-1 для RtPAL и AvPAL, соответственно) на 280 нм для образцов немодифицированного белка, а для образцов ПЭГилированного белка концентрацию вычисляли с помощью анализа белка NI (GenoTechnology), который включает обработку образца для удаления небелковых примесей, которые могут препятствовать точному определению концентрации белка.
ПЭГ-PAL-продукты характеризовали методами пептидного картирования для определения сайт-специфического ПЭГилирования (LC/ESI-MSD), и с использованием сульфоната тринитробензола (TNBS) для определения титра свободного амина до и после ПЭГилирования. Пептидное картирование позволяет определить относительную степень «занятости» при ПЭГилировании у большинства триптических пептидов, которые заканчиваются лизином, однако из-за большого размера и множества соседних лизиновых триптических пептидов, не все сайты могут быть визуально обнаружены с применением такого метода. TNBS-анализ позволяет более точно определить среднее число молекул ПЭГ на моль фермента, однако этот анализ не дает какой-либо информации о том, какой из сайтов становится ПЭГилированным. По этой причине осуществляют оба анализа, которые дополняют друг друга. Грубая оценка процента ПЭГ-дериватизации продуктов PAL может быть осуществлена с помощью электрофореза в ДСН-ПААГ и анализов, проводимых в нативном геле. До и после ПЭГилирования проводили ферментативные анализы для оценки удельной активности и для получения информации об отсутствии потери тетрамерной структуры PAL.
Анализ на PAL-активность
Анализ на PAL-активность проводили на УФ-спектрофотометре Cary (Cary 50) в кинетическом режиме. Активность взаимодействия PAL с L-фенилаланиновым субстратом анализировали при комнатной температуре (25°С) путем определения уровня продуцирования транс-циннамата, мониторинг которого осуществляли по увеличению оптической плотности при 290 нм (Hodgins, (1968), там же). Молярный коэффициент экстинкции транс-коричной кислоты при 290 нм составлял 10238 л·M-1·см-1. Реакционные смеси содержат 22,5 мМ фенилаланина в 100 мМ трис-HCl-буфере, pH 8,5. Для проведения стандартных измерений конечная концентрация фермента составляла 0,0035 мг/мл, а для кинетических исследований концентрацию фермента в данном анализе корректировали так, чтобы величина угла наклона кривой при 290 нм в минуту составляла в пределах 0,005-0,02. Данные активности записывали как удельную активность (мкмоль × мин-1·мг-1). Одну единицу PAL определяли как количество фермента, которое продуцирует 1 мкмоль транс-коричной кислоты в минуту при комнатной температуре.
Пример 4
Анализ времени полужизни и иммуногенности in vitro
После биохимической характеризации наиболее перспективные кандидаты ПЭГ-PAL скринировали на иммунореактивность по отношению к антителам, вырабатываемым у мышей с ФКУ, которым вводили инъекцию нативного PAL (не-ПЭГилированного), с применением трех различных и дополняющих друг друга методов (вестерн-блот-анализа, ELISA и иммунопреципитации (IP)).
Для проведения вестерн-блот-анализа антисыворотку против PAL (взятую у мышей, которым инъецировали нативный PAL) использовали при разведении 1:10000. В качестве негативного контроля также использовали сыворотку, взятую у мышей, обработанных буфером, в том же самом разведении. «Второе» антитело, а именно конъюгированное со щелочной фосфатазой козье антитело против мышиных IgG (Promega) разводили 1:5000, и окраску проявляли с использованием ЩФ-субстрата Western Blue (Promega). ELISA-анализ проводили на планшетах Nunc/Immuno Maxisorp (Nalge Nunc International) в соответствии со стандартными процедурами с использованием 1 мг/мл PAL в PBS и путем блокирования буфером PBS, 0,05% твин-20, 2% BSA. Мышиную антисыворотку (взятую у мышей, обработанных нативным PAL) разводили 1:10000 в блокирующем растворе ЕВ (PBS, 0,05% твин-20, 2% BSA), а в качестве «второго» антитела использовали ПХ-конъюгированное козье антитело против мышиных IgG вместе с TMB, применяемым для детекции на 450 нм.
Для тестирования на связывание антитела с PAL проводили иммунопреципитацию. Образцы белка (PAL или ПЭГилированного PAL) инкубировали в TTBS-буфере (забуференном трисом физиологическом растворе, содержащем 0,1% твина), и PAL-активность измеряли перед добавлением образца антитела. Каждый образец инкубировали с 8-кратным избытком анти-PAL антисыворотки, используемой в качестве позитивного контроля, а в качестве двойного негативного контроля использовали неиммунную мышиную сыворотку. После инкубирования добавляли избыток G-белка-сефарозы 4 (50% об/об) с учетом способности мышиного IgG связываться со сферами, и образцы снова инкубировали при перемешивании в течение ночи при 4°С. Супернатанты выделяли путем центрифугирования, и на этих супернатантах проводили анализ на PAL-активность каждого образца. Осадки на сферах не отбрасывали для того, чтобы можно было проводить дальнейший вестерн-блот-анализ. В целях подтверждения связывания антитела со сферами проводили вестерн-блот-анализ для детектирования антигена PAL на сферах. Сферы, которые были выделены путем центрифугирования после проведения стадии связывания с PAL, несколько раз промывали TTBS и TBS-буферами. После этих промывок на сферы наносили загрузочный буфер для электрофореза в ДСН-ПААГ, и образцы нагревали при 95°С в течение 5 минут. Затем образцы анализировали с помощью вестерн-блот-анализа с использованием анти-PAL антисывортки. Для вариантов ферментов, обнаруживающих плохое связывание с антителом, наблюдались соответствующие низкие уровни PAL во фракциях осажденных сфер, как было обнаружено с помощью вестерн-блот-анализа, а более высокие активности PAL наблюдались в супернатанте по сравнению с немодифицированным нативным PAL, который обнаруживал высокий уровень связывания с антителом.
Пример 5
Тест на чувствительность к протеазе
Исследования, проводимые путем протеазного картирования на нативном PAL от R. toruloides, обнаруживали первичные сайты протеолитической чувствительности. Удаление таких сайтов может приводить к снижению или элиминации протеолитической чувствительности и способствовать разработке эффективной фермент-заместительной терапии ФКУ. Однако элиминация таких сайтов для оценки протеолитической чувствительности может приводить к снижению или к потере ферментативной активности.
После конструирования белка были получены мутанты PAL (и ПЭГ-PAL) с улучшенными свойствами, которые сохраняли активность, а затем эти мутанты подвергали скринингу на резистентность к протеазе, проводимому путем инкубирования с протеазной смесью трипсина/химотрипсина, с последующим мониторингом на сохранение активности (путем измерения OD290) и на снижение уровня расщепления белка (с помощью анализа посредством электрофореза в ПААГ), что позволило идентифицировать мутанты, которые обладают соответствующими свойствами in vitro, и которые могут быть использованы для тестирования in vivo.
Протеолитическую стабильность оценивали путем инкубирования со смесью протеаз, которая имитировала среду тонкого кишечника и содержала 2,3 мМ трипсина, 3,5 мМ химотрипсина, 3,05 мМ карбоксипептидазы A и 3,65 мМ карбоксипептидазы B. Для определения степени чувствительности к протеазам для различных оцениваемых вариантов белков (нативного или мутантного ПЭГилированного или не-ПЭГилированного белка или белка с другими химическими модификациями), включая время сохранения активности и стабильности после обработки протеазой, проводили тест на протеолиз, который включал инкубирование в присутствии ферментов и добавление протеаз в растворы PAL. Для определения локализации каких-либо чувствительных к протеазе сайтов были проведены эксперименты по картированию с применением электрофореза в ДСН-ПААГ и масс-спектрометрии MALDI-TOF (Kriwacki, R. W., et al., J. Biomol. Tech. 9(3):5-15 (1980)). Результаты такого картирования имели важное значение для определения первичных сайтов чувствительности к протеазе (таких как два уже идентифицированых ранее первичных сайта), где такое определение осуществляли в целях нейтрализации всех основных чувствительных к протеазе сайтов путем защиты посредством ПЭГилирования и/или путем введения мутаций для удаления чувствительных областей из структуры PAL и/или их защиты.
Пример 6
Генерирование ПЭГилированных NpPAL и AvPAL
В общих чертах, ПЭГилирование NpPAL и AvPAL осуществляли путем смешивания белка с 20 кДа NHS-активированного ПЭГ SUNBRIGHT ME-200HS (NOF).
Протокол для ПЭГилирования стандартным методом «HC» с использованием 20 кДа NHS-активированного ПЭГ с прямой цепью:
1) Оценка белка на присутствие эндотоксина. Раствор белка (0,1 мл) разводили в 0,9 мл свежей воды MQ и тестировали на лабораторном аппарате Charles River (EndoPTS) на эндотоксин при уровне чувствительности 0,5 э.е./мл. Если уровень эндотоксина превышал 0,5 э.е./мл, то его количество снижали сначала путем фильтрации на фильтре Mustang E, а затем на смоле Sterogene Etox, а менее предпочтительно, путем последующего проведения хроматографической очистки. Снижение может быть достаточно эффективно, хотя и на ограниченном уровне, осуществлено путем пропускания через DEAE FF (Amersham) при pH 7,8.
2) Концентрирование белка и замена буфера. Белок концентрировали до уровня более чем 25 мг/мл, но до уровня менее чем или равного 75 мг/мл, и буфер заменяли на 50 мМ KPO4, pH 8,5. Если для достижения такой концентрации использовался центрифужный фильтр, то этот фильтр сначала анализировали на присутствие эндотоксина путем центрифугирования на пониженной скорости в течение небольшого периода времени (3000 об/мин, 3 минуты) только с одним буфером, а затем оставшийся буфер анализировали на эндотоксин таким же способом, как и белок в стадии 1. Смесь для периодической регистрации/идентификации с заменой буфера на 50 мМ KPO4, pH 8,5, состояла из воды (дост. колич. до 1 л), двухосновного фосфата калия (8,4913 г/л 48,75 мМ) и одноосновного фосфата калия (0,17011 г/л 1,25 мМ). Раствор фильтровали через 0,2 мкм-фильтр и хранили при комнатной температуре. Концентрированный продукт медленно фильтровали (1-2 мл/мин) через фильтр Mustang E с акродиском. Образец, разведенный и уравновешенный стерильным TBS, pH 7,5, анализировали при A280 для определения концентрации белка. Для NpPAL коэффициент экстинкции составлял 0,83, а для AvPAL он составлял 0,75.
3) ПЭГилирование NpPAL и AvPAL. ПЭГ, который обычно хранили при -80°С, нагревали до комнатной температуры. К этому ПЭГ добавляли KPO4-буфер и ресуспендировали путем перемешивания на максимальной скорости, после чего пробирку сильно встряхивали вручную для гарантии суспендирования всех крупных частиц. Затем после первоначального введения ПЭГ, проводимого в течение одной минуты, в тщательно суспендированный раствор ПЭГ добавляли белок, и смесь перемешивали путем очень осторожного переворачивания. Пробирки, обернутые алюминиевой фольгой, помещали на станину шейкера и очень осторожно встряхивали при комнатной температуре в течение 3 часов. Затем пробирки наполняли TBS (pH 7,5) и подвергали стерильной фильтрации. После этого суспензии либо сразу приготавливали в виде препарата, либо хранили при 4°С до получения препарата.
4) Получение препарата. Получали буфер для периодической регистрации/идентификации, который состоял из воды (дост. кол. до 1 л), трис-основания (3,2 мМ), трис-HCl (16,8 мМ) и хлорида натрия, а затем буферный раствор фильтровали через 0,2 мкм-фильтр и хранили при комнатной температуре. Буферный раствор подвергали фильтрации в тангенциальном потоке на фильтрах Vivaflow 50 (более мелких партий) или Vivafiow 200 (более крупных партий) через регенерированную целлюлозную мембрану с отсечкой молекулярной массы 100. Раствор продували водой MQ, 0,1 н NaOH, и снова 200 мл воды. Раствор уравновешивали TBS, pH 7,5, при скорости перекрестного потока 50 мл/мин. Затем определяли pH пермеата, чтобы убедиться в том, что рН составляет 7,5.
Этот раствор подвергалии буферному обмену сначала путем примерно 3-кратного разведения TBS и по меньшей мере 4-кратного возвращения к исходному объему. Скорость перекрестного потока для обоих фильтров Vivaflow 50 и 200 обычно составляла 180-200 мл/мин.
Конечный продукт фильтровали через фильтр Mustang E. Наличие эндотоксина оценивали после разведения 0,1 мл продукта 1,9 миллилитрами стерильной свежей воды. Если уровень эндотоксина превышал 1 э.е./мл, то его снижение проводили на геле Sterogene Etox. После приготовления стерильные ПЭГилированные NpPAL или AvPAL герметично запаивали в сосуды, и эти сосуды помещали на хранение при -70°С до проведения исследований in vivo.
Пример 7
Получение вариантов AvPAL (цистеиновых мутантов)
В полипептид AvPAL вводили аминокислотные замены в целях снижения уровня агрегации, которая происходит в рекомбинантных белках, экспрессируемых в бактериях. Агрегация белка может приводить к снижению ферментативной активности и/или к повышению иммуногенности in vivo. Одна из таких форм агрегации обусловлена образованием межцепочечных дисульфидных связей. Для минимизации вероятности такой агрегации цистеиновые остатки различных AvPAL, взятые отдельно или в комбинации, заменяли сериновыми остатками.
Полипептид AvPAL имел 6 цистеиновых остатков в положениях 64, 235, 318, 424, 503 и 565 (SEQ ID NO:4). Были получены следующие AvPAL-мутанты с одной заменой цистеина: AvPAL_C64S (SEQ ID NO:7), AvPAL_C318S (SEQ ID NO:8), AvPAL_C503S (SEQ ID NO:9) и AvPAL_C565S (SEQ ID NO:10). Был также получен мутант AvPAL с двумя заменами цистеина, AvPAL_S565SC503S (SEQ ID NO:11). На фигурах 5A-5E представлены аминокислотные последовательности таких цистеиновых мутантов AvPAL.
Клонирование
Ген AvPAL амплифицировали из геномной ДНК Anabaena variabilis (ATCC 29413-U, набор Qiagen DNeasy) с использованием прямого праймера AvarPALfor (5'-CACTGTCATATGAAGACACTATCTCAAGCACAAAG-3') (SEQ ID NO:18) и обратного праймера AvarPALrev (5'-CACTGTCTCGAGATGCAAGCAGGGTAAGATATCTTG-3') (SEQ ID NO:19). Полученный ПЦР-продукт обрабатывали полимеразой Taq, а затем лигировали в pCR2.1 TOPO TA (Invitrogen). Полученную плазмиду обозначали 1p40.
Затем добавляли 5'-Nhel-сайт, а внутренний Nhel-сайт удаляли с помощью SOE-ПЦР (ПЦР с небольшой вероятностью ошибки). Вышерасположенный фрагмент AvPAL амплифицировали из 1p40 с использованием прямого праймера N-Nhe-AvPAL (5'-CACTGTGCTAGCATGAAGACACTATCTCAAGCACAAAG-3') (SEQ ID NO:20) и обратного праймера Nhe-AvPALrev (5'- GGAAATTTCCTCCATGATAGCTGGCTTGGTTATCAACATCAATTAGTGG-3') (SEQ ID NO:21), а нижерасположенный фрагмент AvPAL амплифицировали из 1p40 с использованием прямого праймера Nhe-AvPALfor (5'- CCACTAATTGATGTTGATAACCAAGCCAGCTATCATGGAGGAAATTTCC-3') (SEQ ID NO:22) и обратного праймера AvPALrev-r (5'- ACAGTGGCGGCCGCTTAATGCAAGCAGGGTAAGATATCTTG-3') (SEQ ID NO:23). В одной ПЦР-реакции, два ПЦР-продукта гибридизовали и удлиняли с использованием ДНК-полимеразы с получением полноразмерного гена AvPAL, а затем полученный продукт амплифицировали с использованием праймеров N-Nhe-AvPAL и AvPALrev-r. Полученный ПЦР-продукт гидролизовали ферментом NheI, затупляли фрагментом Кленова, гидролизовали ферментом NotI и лигировали в вектор pET28a+ (полученный путем гидролиза ферментом Ndel, затупления фрагментом Кленова и гидролиза ферментом NotI). Полученную плазмиду обозначали 3p86-23.
Новые рестрикционные сайты добавляли с помощью ПЦР. AvPAL амплифицировали из плазмиды 3p86-23 с использованием прямого праймера AvEcoRIfor (5'- CACTGTGAATTCATGAAGACACTATCTCAAGCACAAAG-3') (SEQ ID NO:24) и обратного праймера AvSmalrev (5'- CACTGTCCCGGGTTAATGCAAGCAGGGTAAGATATCT-3') (SEQ ID NO:25). Полученный ПЦР-продукт гидролизовали ферментами EcoRI и Smal и лигировали в EcoRI- и SmaI-гидролизованный вектор pIBX7. Полученную плазмиду обозначали 7p56 Av3.
Цистеиновые мутанты
Два цистеиновых кодона в гене AvPAL, соответствующие положениям 503 и 565 полипептида AvPAL, заменяли сериновыми кодонами с помощью сайт-направленного мутагенеза (QuickChange XL II, Stratagene). Цистеиновый кодон в положении 503 заменяли сериновым кодоном в плазмиде 7p56 Av3 с помощью ПЦР с использованием прямого праймера Av_C503S (5'- GTCATTACGATGCACGCGCCTCTCTATCACCTGCAACTGAG-3') (SEQ ID NO:26) и обратного праймера Av_C503Srev (5'-CTCAGTTGCAGGTGATAGAGAGGCGCGTGCATCGTAATGAC-3') (SEQ ID NO:27). Сериновый кодон подчеркнут, а замена G на C в кодирующей цепи (мутация C на G в некодирующей цепи) выделена жирным шрифтом. Полученную плазмиду обозначали j282. Цистеиновый кодон в положении 565 заменяли на сериновый кодон в плазмиде j282 с использованием прямого праймера Av_C565S (5'-CAGTTCAAGATATCTTACCCTCCTTGCATTAACCCGGGCTGC-3') (SEQ ID NO:28) и обратного праймера Av_C565Srev (5'-GCAGCCCGGGTTAATGCAAGGAGGGTAAGATATCTTGAACTG-3') (SEQ ID NO:29). Сериновый кодон подчеркнут, а замена G на C в кодирующей цепи (замена C на G в некодирующей цепи) выделена жирным шрифтом. Полученную плазмиду обозначали j298a.
Цистеиновые кодоны в гене AvPAL в положениях 64, 318 и 565 полипептида AvPAL были аналогичным образом заменены сериновыми кодонами с использованием нижеследующих пар праймеров: C64S, прямого праймера Av_C64S (5'-GCAGGGTATTCAGGCATCTTCTGATTACATTAATAATGCTGTTG-3') (SEQ ID NO:30) и обратного праймера Av_C64Srev (5'- CAACAGCATTATTAATGTAATCAGAAGATGCCTGAATACCCTGC-3') (SEQ ID NO:31); C318S, прямого праймера Av_C318S (5'- CAAGATCGTTACTCACTCCGATCCCTTCCCCAGTATTTGGGGC-3') (SEQ ID NO:32) и обратного праймера Av_C318Srev (5'- GCCCAAATACTGGGGAAGGGATCGGAGTGAGTAACGATCTTG-3') (SEQ ID NO:33); и C565S, прямого праймера Av_C565S (SEQ ID NO:28) и обратного праймера Av_C565Srev (SEQ ID NO:29). Сериновые кодоны подчеркнуты, а замены G на C в кодирующих цепях и C на G в не-кодирующих цепях выделены жирным шрифтом.
Пример 8
In vitro ферментативная активность вариантов AvPAL (цистеиновых мутантов)
Целью настоящего исследования является определение влияния замены различных цистеиновых остатков сериновыми остатками в полипептиде AvPAL на ферментативную активность in vitro фенилаланин-аммиак-лиазы (PAL).
Варианты AvPAL (то есть, цистеиновые мутанты) клонировали как описано в примере 7. Плазмиды, экспрессирующие цистеиновый мутант AvPAL, были перенесены в бактерии, а затем полипептиды цистеинового мутанта AvPAL экспрессировали, как описано в примере 1, и очищали, как описано в примере 2.
AvPAL дикого типа (WT) и цистеиновые мутанты AvPAL тестировали in vitro на ферментативную PAL-активность как описано в примере 3. Как показано в таблице 1, при сравнении с не-ПЭГилированным AvPAL дикого типа было обнаружено, что очищенные не-ПЭГилированные цистеиновые мутантные белки AvPAL, полученные путем замены цистеинового остатка сериновым остатком в положении 64 (AvPAL_C64S), имели пониженную удельную PAL-активность in vitro, однако, замены цистеиновых остатков сериновыми остатками в положениях 503 или 565, или в обоих положениях 503 и 565 (AvPAL_C503S, AvPAL_C565S, и AvPAL_C565SC503S, соответственно) не оказывали какого-либо негативного воздействия на указанную активность.

Для того чтобы определить, оказывает ли введение сериновых остатков какое-либо влияние на ферментативную активность ПЭГилированных белков AvPAL, AvPAL дикого типа и мутант с заменой двух цистеинов AvPAL_C565SC503S подвергали ПЭГилированию как описано в примере 6. Как показано в таблице 1, замена цистеиновых остатков сериновыми остатками в положениях 503 и 565 не оказывала какого-либо негативного влияния на in vitro удельную PAL-активность ПЭГилированного белка AvPAL.
Пример 9
In vitro биохимическая характеризация вариантов AvPAL (цистеиновых мутантов)
Целью настоящего исследования является определение влияния замены различных цистеиновых остатков сериновыми остатками в полипептиде AvPAL: (1) на повышение стабильности; (2) на образование агрегатов и (3) на сайт-специфическое ПЭГилирование.
Повышенная стабильность
Влияние замены цистеиновых остатков сериновыми остатками в AvPAL на in vitro стабильность определяли путем хранения очищенных цистеиновых мутантов ПЭГилированных или не-ПЭГилированных AvPAL в различные периоды времени при 37°С, и последующего измерения in vitro удельной PAL-активности этих белков как описано в примере 3.
AvPAL дикого типа и не-ПЭГилированные или ПЭГилированные цистеиновые мутанты AvPAL получали как описано в примере 8.
Как показано на фигуре 6A, удельная активность не-ПЭГилированных белков AvPAL оставалась стабильной по меньшей мере в течение 5 дней при 37°С, а замена цистеиновых остатков сериновыми остатками в положении 565 или в положениях 503 и 565 не оказывала какого-либо негативного влияния на такую активность. Аналогичным образом, как показано на фигуре 6В, удельная активность ПЭГилированных белков AvPAL оставалась стабильной по меньшей мере в течение 6 дней при 37°С. Мутант AvPAL с одной заменой цистеина, AvPAL_C565S, по сравнению с AvPAL дикого типа и мутантом AvPAL с двумя заменами цистеина, AvPAL_C565SC503S, обнаруживал некоторое снижение стабильности через 6 дней при 37°С.
Образование агрегатов
Влияние замены цистеиновых остатков сериновыми остатками в AvPAL на образование агрегатов белка в растворе определяли путем разделения очищенных, не-ПЭГилированных AvPAL дикого типа и цистеиновых мутантов AvPAL с помощью электрофореза в денатурирующем и нативном геле или с помощью ЭХ-ВЭЖХ.
Очищенные препараты AvPAL разделяли с помощью гель-электрофореза либо в денатурирующих условиях (4-12% бис-трис-NuPAGE), либо в нативных условиях (8% трис-Gly, pH 8,3). Разделенные белки AvPAL окрашивали кумасси синим.
Очищенные препараты AvPAL разделяли с помощью ЭХ-ВЭЖХ. Белки AvPAL загружали на колонку с гелем TSK (G3000SWxl, 7,8 мм × 30 см, 5 мкм (Tosoh Bioscience, LLC)) в 20 мМ Na-фосфате, 300 мМ NaCl, pH 6,9, и элюировали при скорости потока 0,5 мл/мин. Разделенные белки AvPAL анализировали на спектрометре Agilent серии 1100.
Агрегаты присутствовали в препарате AvPAL дикого типа и в препаратах AvPAL_C503S и AvPAL_C64S, но не в препаратах AvPAL_C565S и AvPAL_C565SC503S, как было оценено либо с помощью гель-электрофореза (фигура 7A), либо ЭХ-ВЭЖХ (фигура 7B).
Сайт-специфическое ПЭГилирование
Влияние замены цистеиновых остатков сериновыми остатками в AvPAL на сайт-специфическое ПЭГилирование определяли путем ПЭГилирования AvPAL дикого типа и мутанта AvPAL_C503SC565S с заменами двух цистеинов как описано в примере 6, с последующим сравнением относительного уровня ПЭГилирования в положениях лизиновых остатков AvPAL: K2, K10, K32, Kl15, K145, K195, K301, K335, K413, K419, K493, K494 и K522.
Приблизительно 100 мкг (10 мкл при 10 мкг/мкл) не-ПЭГилированных или ПЭГилированных белков AvPAL денатурировали в 8 M мочевины. Затем денатурированные белки в реакционном объеме 100 мкл гидролизовали трипсином в 0,8 M мочевине при pH 8,2 в течение ночи (~20 часов) при 37°С. Гидролизованные трипсином белки восстанавливали путем обработки 1 мкл 1 M ДТТ в течение 1 часа при 37°С, с последующим гашением реакции 3 микролитрами 15% TFA. Гидролизованные белки разделяли на обращенно-фазовой колонке с C18. Процент ПЭГилирования каждого ПЭГилированного пептида AvPAL вычисляли методом субтрактивного пептидного картирования соответствующего не-ПЭГилированного пептида.
Как показано на фигуре 8, при отношении «белок AvPAL:ПЭГ», равном 1:3, какого-либо заметного различия в процентах ПЭГилирования в любом положении лизинового (K) остатка не наблюдалось, за исключением, возможно, K419, в котором процент ПЭГилирования мутанта C565SC503S с заменой двух цистеинов был ниже, чем у AvPAL дикого типа. Однако, результаты, полученные с использованием мутанта с заменой двух цистеинов при возрастающих отношениях «белок AvPAL:ПЭГ», где не наблюдалось зависимости «доза-ответ», и наблюдался относительно низкий процент ПЭГилирования, показали, что наблюдаемые различия в положении K1419, вероятно, не являются значимыми. Таким образом, замена цистеиновых остатков сериновыми остатками в положениях 503 и 565, очевидно, не влияла на сайт-специфическое ПЭГилирование AvPAL.
Пример 10
Мехинизм агрегации белков AvPAL
Целью данных исследований является изучение механизма агрегации белков AvPAL, экспрессируемых в бактериях.
Концентрирование очищенных препаратов AvPAL и инкубирование концентрированных растворов белка в течение 2 часов при 37°С приводило к ускорению агрегации очищенных белков AvPAL в растворе. Агрегацию детектировали путем разделения белков AvPAL с помощью ЭХ-ВЭЖХ. Для того, чтобы определить, ответственно ли образование перекрестных дисульфидных связей за агрегацию, к концентрированному раствору белка добавляли 50 мМ дитиотреитола (DTT), а затем смесь инкубировали в течение 2 часов при 37°С.
Белки AvPAL, экспрессируемые в бактериях, очищали как описано в примере 2 и концентрировали на центрифужном фильтре (Millipore Biomax -10K NMWL). Белки центрифугировали примерно при 15000 g в течение нескольких минут в центрифуге Эппендорфа 5415C. Для цистеиновых мутантов, которые имели тенденцию к агрегации (например, AvPAL_C503S и AvPAL_C64S), белки концентрировали приблизительно до 20 мг/мл и инкубировали в течение 2 часов при 37°С. Для цистеиновых мутантов, которые были резистентными к агрегации (например, AvPAL_C565S и AvPAL_C565SC503S), белки концентрировали приблизительно до 40 мг/мл и инкубировали в течение 2 часов при 37°С.
Как показано в таблице 2, препараты очищенных цистеиновых мутантов AvPAL, AvPAL_C64S и AvPAL_C503S, образовывали агрегаты после инкубирования в течение 2 часов при 37°С. Как и ожидалось, такая агрегация усиливалась в том случае, когда белки AvPAL концентрировали перед инкубированием в течение 2 часов при 37°С. Агрегация может блокироваться при DTT-обработке концентрированных белков, что указывает на то, что такая агрегация обусловлена образованием перекрестных дисульфидных связей. В противоположность этому, препараты очищенных цистеиновых мутантов AvPAL, AvPAL_C565S и AvPAL_C565SC503S, не образовывали агрегатов после инкубирования в течение 2 часов при 37°С, что указывало на то, что цистеиновый остаток в положении 565 участвует в агрегации AvPAL в результате образования перекрестных дисульфидных связей.

Для того чтобы определить, присутствуют ли цистеиновые остатки в виде свободных сульфгидрилов, очищенный препарат AvPAL денатурировали в присутствии 8 M мочевины, алкилировали иодацетамидом, гидролизовали трипсином и анализировали с помощью ЖХ/МС. Все цистеиновые остатки AvPAL были помечены иодацетамидом, что указывало на то, что все цистеиновые остатки AvPAL, экспрессируемого бактериями, присутствуют в виде свободных сульфгидрилов (данные не приводятся).
Для того чтобы определить, присутствуют ли цистеиновые остатки на поверхности нативного белка, очищенный препарат AvPAL сначала обрабатывали N-этилмалеимидом (NEM), а затем денатурировали в присутствии 8 M мочевины, алкилировали иодацетамидом, гидролизовали трипсином и анализировали с помощью ЖХ/МС. Цистеиновые остатки в положениях 235 и 424 не алкилировались под действием NEM, а цистеиновый остаток в положении 318 алкилировался под действием NEM лишь частично, что указывало на то, что цистеиновые остатки в положениях 64, 503 и 565 находятся на поверхности нативного AvPAL, а цистеиновый остаток в положении 318 находится на поверхности нативного AvPAL лишь частично (данные не приводятся).
Для того чтобы определить, участвуют ли цистеиновые остатки в образовании межцепочечных перекрестных дисульфидных связей, 67 мкл 0,7 мг/мл раствора очищенного не-ПЭГилированного препарата AvPAL дикого типа денатурировали и алкилировали в 8 M мочевине, содержащей 20 мМ иодацетамид, в течение 1 часа при 37°С, а затем в реакционном объеме 100 мкл гидролизовали трипсином при pH 8,2 в течение ночи (~17,5 часа) при 25°С. Гидролизованные трипсином белки разделяли и анализировали с помощью масс-спектрометрии, при которой пептиды, соответствующие предсказанным дисульфидным парам, были идентифицированы и количественно оценены как общее число ионов (TIC).
В таблице 3 показано, что были детектированы дисульфидные пары C503-C503, C503-C565, C565-C318 и C565-C565. В дисульфидных парах, содержащихся в очищенном препарате AvPAL, цистеиновые остатки были обнаружены в положении 565, и в меньшей степени в положении 503.

Были проведены исследования для того, чтобы определить, участвуют ли в агрегации белка AvPAL какие-либо другие механизмы, кроме образования перекрестных дисульфидных связей.
Очищенные препараты AvPAL инкубировали либо с 0,05% твина, либо с 10 мМ EDTA, а затем разделяли с помощью ЭХ-ВЭЖХ как описано в примере 9. Твин способствовал снижению уровня агрегации белка, что обусловлено гидрофобными взаимодействиями, а EDTA снижал агрегацию белка благодаря присутствию двухвалентных катионов. Как показано на фигуре 9, обработка 0,05% твином или 10 мМ EDTA не оказывала влияния на агрегацию белка AvPAL. Дополнительный пик, наблюдаемый через 10 минут после обработки AvPAL 10 мМ EDTA, соответствовал оптической плотности EDTA на 210 нм.
Для дополнительного выявления роли образования перекрестных дисульфидных связей в агрегации белка AvPAL, очищенный AvPAL восстанавливали путем обработки ДТТ, а затем обессоливали и разделяли с помощью ЭХ-ВЭЖХ. Как показано на фигуре 10A, в результате обработки ДТТ, агрегация белка AvPAL снижалась до минимума, а после инкубирования в течение 18 часов при 37°С, агрегаты образовывались снова. В противоположность этому, как показано на фигуре 10B, агрегаты не образовывались снова в случае модификации поверхностных цистеинов AvPAL (то есть, их алкилирования) путем обработки N-метилмалеимидом (NEM), проводимой после ДТТ-обработки, но перед обессоливанием и инкубированием в течение 18 часов при 37°С.
Исходя из вышесказанного, следует отметить, что агрегация экспрессируемого бактериями AvPAL, очевидно, обусловлена лишь образованием межцепочечных дисульфидных связей, а не гидрофобным действием или присутствием двухвалентных катионов. В образовании межцепочечных дисульфидных связей в препаратах AvPAL участвуют цистеиновые остатки, находящиеся в положениях 565 и 503.
Пример 11
Жидкие препараты ПЭГилированных форм вариантов AvPAL (цистеиновых мутантов)
Настоящие исследования проводили в целях определения действия различных наполнителей, например, стабилизаторов, на повышение стабильности ПЭГилированных форм варианта полипептида AvPAL (например, при замене цистеиновых остатков сериновыми остатками в положениях 503 и 565) в препаратах согласно изобретению.
ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, получали как описано в примере 7.
Повышенную стабильность различных препаратов ПЭГилированного AvPAL_C565SC503S определяли с помощью in vitro анализа на активность, проводимого либо в кюветах, либо в планшетах. Для анализа, проводимого в кюветах, очищенный ПЭГилированный AvPAL_C565SC503S разводили в TBS-буфере для разведения, а затем добавляли к аналитическому буферу, содержащему 22,5 мМ фенилаланина (Phe), 100 мМ трис-HCl, pH 8,5. После инкубирования в течение 2 минут при 30°С, количество высвобождаемой транс-коричной кислоты (t-CA) определяли по оптической плотности на 290 нм. Для анализа на планшетах, очищенный ПЭГилированный AvPAL_C565SC503S разводили в TBS-буфере для разведения плюс BSA/Phe/Brij, а затем добавляли к аналитическому буферу, содержащему 22,5 мМ Phe, 100 мМ трис-HCl, pH 8,5. После инкубирования в течение 10-20 минут при 30°С, количество высвобождаемой транс-коричной кислоты (t-CA) определяли по оптической плотности на 290 нм. Одна МЕ PAL-активности равна 1 мкмоль TCA/мин.
В первом исследовании по повышению стабильности оценивали влияние pH на стабильность ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S. Очищенный ПЭГилированный AvPAL_C565SC503S предварительно приготавливали в 10 мМ буфера и 140 мМ NaCl при различных pH, составляющих от 4 до 9. Тестируемые буферы включали: цитрат (pH 4), ацетат (pH 5), гистидин (pH 6), фосфат (pH 7), трис (pH 7,5, pH 8) и аргинин (pH 9). После хранения ферментных препаратов в течение периода времени до 30 дней при 4°С, 25°С или 37°С определяли in vitro активность. Общая потеря активности фермента PAL наблюдалась при рН4. Для дополнительной оценки был выбран препарат, имеющий рН в пределах от 7 до 8.
Во втором исследовании по повышению стабильности оценивали влияние pH и различных наполнителей на стабильность ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S. Очищенный ПЭГилированный AvPAL_C565SC503S предварительно приготавливали в 10 мМ триса и 140 мМ NaCl при pH 7, 7,5 или 8,0 в отсутствие или в присутствии 0,5% EDTA, 0,5% EDTA плюс 0,5% аскорбиновой кислоты или 0,5% EDTA плюс 5 мМ метионина (Met). После хранения ферментных препаратов в течение периода времени до 60 дней при 4°С, 25°С или 37°С оценивали in vitro активность. Очевидно, что для поддержания ферментативной активности эквивалентными pH являются рН 7,0 и 7,5, EDTA оказывает минимальное воздействие или вообще не оказывает воздействия на ферментативную активность, а антиоксиданты аскорбиновая кислота и метионин оказывают негативное воздействие на ферментативную активность.
В том же самом исследовании по повышению стабильности оценивали эффект ПЭГилирования мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S. Степень потери ферментативной активности была аналогичной для не-ПЭГилированного и ПЭГилированного AvPAL_C565SC503S.
В третьем исследовании по повышению стабильности оценивали влияние субстрата фермента и продукта, используемого в качестве наполнителя, на стабильность ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S. Очищенный ПЭГилированный AvPAL_C565SC503S приблизительно в концентрации 12 мг/мл (0,2 мМ) предварительно приготавливали в 10 мМ триса и 140 мМ NaCl при pH 7,5 в отсутствие или в присутствии 1 мМ Phe (5 моль субстрата на один моль активного центра), 2 мМ TCA (10 моль продукта на моль активного центра) или 0,05% твина 80 (поверхностно-активного вещества). После хранения ферментных препаратов в различные периоды времени при 4°С, 25°С или 37°С еженедельно оценивали in vitro активность. Phe и t-CA значительно повышали стабильность фермента, а твин не оказывал какого-либо влияния на стабильность фермента.
Систематизированные данные анализов 1, 2 и 3 на повышенную стабильность представлены на фигуре 11.
В четвертом исследовании по повышению стабильности оценивали влияние Phe и t-CA, используемых в качестве наполнителя при низких концентрациях, на стабильность ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S. Очищенный ПЭГилированный AvPAL_C565SC503S приблизительно в концентрации 12 мг/мл (0,2 мМ) предварительно приготавливали в 10 мМ триса и 140 мМ NaCl при pH 7,5 в отсутствие или в присутствии 0,4 мМ Phe (2 моль субстрата на один моль активного центра) или 0,4 мМ TCA (2 моль продукта на моль активного центра). После хранения ферментных препаратов в различные периоды времени при 4°С, 25°С или 37°С еженедельно оценивали in vitro активность. Phe и t-CA при низких концентрациях были эффективными в отношении стабилизации ферментативной активности.
В пятом исследовании по повышению стабильности оценивали влияние слабого субстрата фермента, тирозина (Tyr), используемого в качестве наполнителя, на стабильность ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S. Очищенный ПЭГилированный AvPAL_C565SC503S приблизительно в концентрации 12 мг/мл (0,2 мМ) предварительно приготавливали в 10 мМ триса и 140 мМ NaCl при pH 7,5 в отсутствие или в присутствии 1 или 5 мМ Tyr (5 или 25 моль субстрата на один моль активного центра, соответственно). После хранения ферментных препаратов в различные периоды времени при 4°С, 25°С или 37°С еженедельно оценивали in vitro активность. Tyr оказывал минимальное стабилизирующее действие на ферментативную активность, которое не зависило от дозы (фигура 12).
В шестом исследовании по повышению стабильности оценивали влияние акцепторов нуклеофилов, используемых в качестве наполнителя, на стабильность ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S. Очищенный ПЭГилированный AvPAL_C565SC503S приблизительно в концентрации 20 мг/мл (0,2 мМ) предварительно приготавливали в 10 мМ триса и 140 мМ NaCl при pH 7,5 в отсутствие или в присутствии 1 мМ Phe (3 моль субстрата на один моль активного центра), 2 мМ акцептора нуклеофилов (бензойной кислоты или пиридоксамина в концентрации 6 моль на моль активного центра) или 1 мМ Phe и 2 мМ акцептора нуклеофилов. После хранения ферментных препаратов в различные периоды времени при 4°С или 37°С еженедельно оценивали in vitro активность. Эффективной в отношении стабилизации ферментативной активности оказалась бензойная кислота, а не пиридоксамин (фигура 13А). Какого-либо аддитивного эффекта Phe и бензойной кислоты не наблюдалось, что позволяет предположить об их аналогичном механизме стабилизации.
Стабилизирующее действие бензойной кислоты и t-CA позволяет предположить, что они действуют как структурные аналоги Phe (см. фигуру 13B).
Данные, полученные в шести исследованиях на повышенную стабильность, объединяли в целях определения срока хранения ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, в различных препаратах. Оценка срока хранения включала следующие стадии: (1) определение скорости ослабления активности (kdecay), которая соответствует кинетическому параметру первого порядка для каждого условия приготовления; (2) построение графика зависимости ln(kdecay)ν·1/температура (°K); (3) определение величины Ea (ΔGdecay), необходимой для ослабления активности для данного условия приготовления; (4) экстраполяцию kdecay при 4°С с использованием вычисленной величины Ea и наблюдаемого kdecay при данной температуре; и (5) определение срока хранения (T90), который представляет собой время, за которое удельная ферментативная активность падает на ≥10% при 4°С.
В таблице 4 показано, что Phe и t-CA способствуют значительному увеличению предсказанного срока хранения ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S.

Вкратце, вышеописанные эксперименты по предварительному получению препаратов показали, что оптимальным pH для ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, является рН 7-7,5. Присутствие антиоксидантов приводит к значительной потере ферментативной активности. Фенилаланин (Phe) и транс-коричная кислота (t-CA) повышали стабильность rAvPAL-ПЭГ на 50% или более в условиях повышенных температур (25°С и 37°С). 2-кратный избыток Phe или t-CA на активный центр rAvPAL-ПЭГ является достаточным для стабилизации активности, однако, Phe и t-CA при более высоких концентрациях не дают какого-либо дополнительного благоприятного эффекта. Более слабый субстрат PAL, тирозин (Tyr), очевидно, не стабилизирует ферментативную активность, тогда как бензойная кислота стабилизирует активность rAvPAL-ПЭГ в той же степени, как и ее структурный аналог Phe. При комбинировании бензойной кислоты с Phe, какой-либо дополнительной стабилизации активности не наблюдалось, что позволяет предположить, что они имеют общий механизм стабилизации активности.
Пример 12
Лиофилизованные препараты ПЭГилированных форм вариантов AvPAL (цистеиновых мутантов)
Проводили исследования для оценки влияния различных твердых (например, лиофилизованных) препаратов на активность ПЭГилированной формы полипептидного варианта AvPAL (например, с заменой цистеиновых остатков на сериновые остатки в положениях 503 и 565) согласно изобретению.
ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, получали как описано в примере 7.
ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, получали в виде нижеследующих препаратов: (F1) 10 мг/мл AvPAL_C565SC5O3S, 10 мМ триса, pH 7,5; (F2) 10 мг/мл AvPAL_C565SC503S, 10 мМ триса, pH 7,5, 25 мг/мл маннита; или (F3) 10 мг/мл AvPAL_C565SC503S, 10 мМ триса, pH 7,5, 20 мг/мл маннита, 5 мг/мл сахарозы. После приготовления, активность каждого фермента PAL составляла 1,7-1,8 ед/мг. После лиофилизации препараты хранили в течение периода времени до 26 дней при 4°С, а затем ресуспендировали в свежей стерильно отфильтрованной воде MilliQ. Активность ферментов PAL определяли как описано в примере 11. В таблице 5 показано, что какой-либо потери активности после лиофилизации, хранения или ресуспендирования различных препаратов AvPAL_C565SC503S не наблюдалось.

Пример 13
Исследования на токсичность и фармакокинетику ПЭГилированных форм вариантов AvPAL (цистеиновых мутантов) у собакоподобных обезьян и крыс
Исследования на токсичность и фармакокинетику проводили в целях определения эффекта введения одной дозы ПЭГилированой формы полипептидного варианта AvPAL (например, с заменой двух цистеиновых остатков сериновыми остатками в положениях 503 и 565) у собакоподобных обезьян и крыс.
ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, получали как описано в примере 7.
Исследования на токсичность/фармакокинетику, проводимые на собакоподобных обезьянах
В этом исследовании участвовали четыре (4) группы обезьян, каждая из которых состояла из трех самцов и трех самок. Группа 1 получала плацебо (мл/кг), а обезьянам группы 2, 3 и 4 подкожно вводили одну инъекцию ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, в растворе в дозах 4, 12 и 60 мг/кг, соответственно. Пробы плазмы брали у обезьян перед введением дозы и в различные интервалы времени после введения дозы, от 3 часов до 504 часов после введения. Было установлено, что доза 60 мг/кг является токсичной для обезьян, а поэтому часть обезьян группы 4 была исключена из исследования.
На фигуре 14A показана концентрация ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, в плазме в различные периоды времени после одной подкожной инъекции в дозах 4 и 12 мг/кг. Полученные данные указывали на монофазную элиминацию ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S. Очевидно, что однокамерная модель абсорбции 1-го порядка определяет профиль ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, в плазме после одной подкожной инъекции.
На фигуре 14B представлены концентрации фенилаланина (Phe) и ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, в плазме в различные периоды времени после одной подкожной инъекции в дозе 4 мг/кг. При введении этой дозы, концентрация Phe в плазме снижалась до величины ниже предела количественной оценки в анализе ГХ/МС в течение 24 часов, и такое снижение концентрации Phe в плазме продолжалось в течение 10 дней.
Исследования на токсичность и фармакокинетику, проводимые на крысах
В этом исследовании участвовали восемь (8) групп крыс, которые включали 3 самца и 3 самки в плацебо-группе и 6 самцов и 6 самок в тест-группе. Животным группы 1 и 5 вводили одну внутривенную и подкожную инъекцию плацебо. Животным группы 2, 3 и 4 вводили одну внутривенную инъекцию ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, в дозах 1, 5 и 25 мг/кг, соответственно. Животным группы 6, 7 и 8 вводили одну подкожную инъекцию ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, в дозах 10, 25 и 250 мг/кг, соответственно. Пробы плазмы брали у крыс перед введением дозы и в различные интервалы времени после введения дозы, от 1 до 360 часов после введения. Кровь брали у 3 крыс каждой группы в каждый момент времени сбора. В этом исследовании какой-либо токсичности у крыс не наблюдалось.
На фигуре 15A показана концентрация ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, в плазме в различные периоды времени после одной внутривенной инъекции в дозах 1, 5 и 25 мг/кг. Полученные данные указывали на монофазную элиминацию ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, из плазмы после введения одной внутривенной инъекции.
На фигуре 15В показана концентрация ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, в плазме в различные периоды времени после одной подкожной инъекции в дозах 10, 25 и 250 мг/кг. Очевидно, что однокамерная модель абсорбции 1-го порядка определяет профиль ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, в плазме после одной подкожной инъекции.
В таблице 6 представлены фармакокинетические параметры ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, после внутривенной или подкожной инъекции одной дозы.

В этом фармакокинетическом исследовании не наблюдалось различий по полу. AUCinf и Cmax были приблизительно пропорциональны дозам, вводимым внутривенно и подкожно.
Исследования на токсичность при введении многократных доз крысам и собакоподобным обезьянам
Безопасность ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, оценивали в исследованиях на токсичность многократных доз, вводимых крысам и собакоподобным обезьянам.
У крыс, которым два раза в неделю в течение 28 дней подкожно вводили до 25 мг/кг ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, какой-либо токсичности не наблюдалось.
У собакоподобных обезьян, которым два раза в неделю в течение 28 дней подкожно вводили дозу 1 мг/кг ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, какой-либо значимой токсичности не наблюдалось. Дозозависимое снижение уровней Phe в плазме наблюдалось после введения первой дозы, однако после введения седьмой дозы, уровни Phe в плазме возвращались до базального уровня у всех групп, которым вводили указанные дозы, что указывало на возможное вырабатывание антител в ответ на вводимый фермент. Минимальные титры анти-AvPAL_C565SC503S IgG наблюдались у большинства животных, которым вводили дозу 1 мг/кг, на 28-й день. Ни у одного животного, участвующего в данном исследовании, на 28-й день каких-либо титров IgM не обнаруживалось.
Пример 14
Влияние вариантов AvPAL (цистеиновых мутантов) на опухолевые клетки в культуре
Данные исследования проводили для определения влияния ПЭГилированной формы полипептидного варианта AvPAL (с заменой цистеиновых остатков на сериновые остатки в положениях 503 и 565) на пролиферацию опухолевых клеток, выращиваемых в кульуре in vitro.
ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, получали как описано в примере 7.
Пролиферацию опухолевых клеток in vitro определяли с помощью флуоресцентного анализа с использованием иодида пропидия как описано в публикации Dengler, et al., Anti-Cancer Drugs 6:522-532 (1995).
Гематологические опухоли
Панель из двадцати четырех (24) гематологических опухолевых клеточных линий, включая 14 клеточных линий лейкоза, 5 клеточных линий лимфомы и 5 клеточных линий миеломы, оценивали на влияние, которое оказывает ПЭГилированный мутант с заменой двух цистеинов, AvPAL_C565SC503S, на пролиферацию клеток in vitro.
Гематологические опухолевые клеточные линии высевали в планшеты для культивирования клеток при плотности 5000 клеток/лунку на день 0. На день 1, в культуры добавляли ПЭГилированный мутант с заменой двух цистеинов, AvPAL_C565SC503S, в различных концентрациях, от 0,01 до 100 мкг/мл. На день 5, клетки собирали и определяли содержание ДНК путем окрашивания иодидом пропидия. Затем определяли IC50, IC70 и IC90. Эти эксперименты проводили два или три раза для каждой гематологической опухолевой клеточной линии.
В таблице 7 показано, что ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, эффективно ингибировал in vitro пролиферацию нескольких гематологических опухолевых клеточных линий, как было определено путем окрашивания иодидом пропидия.
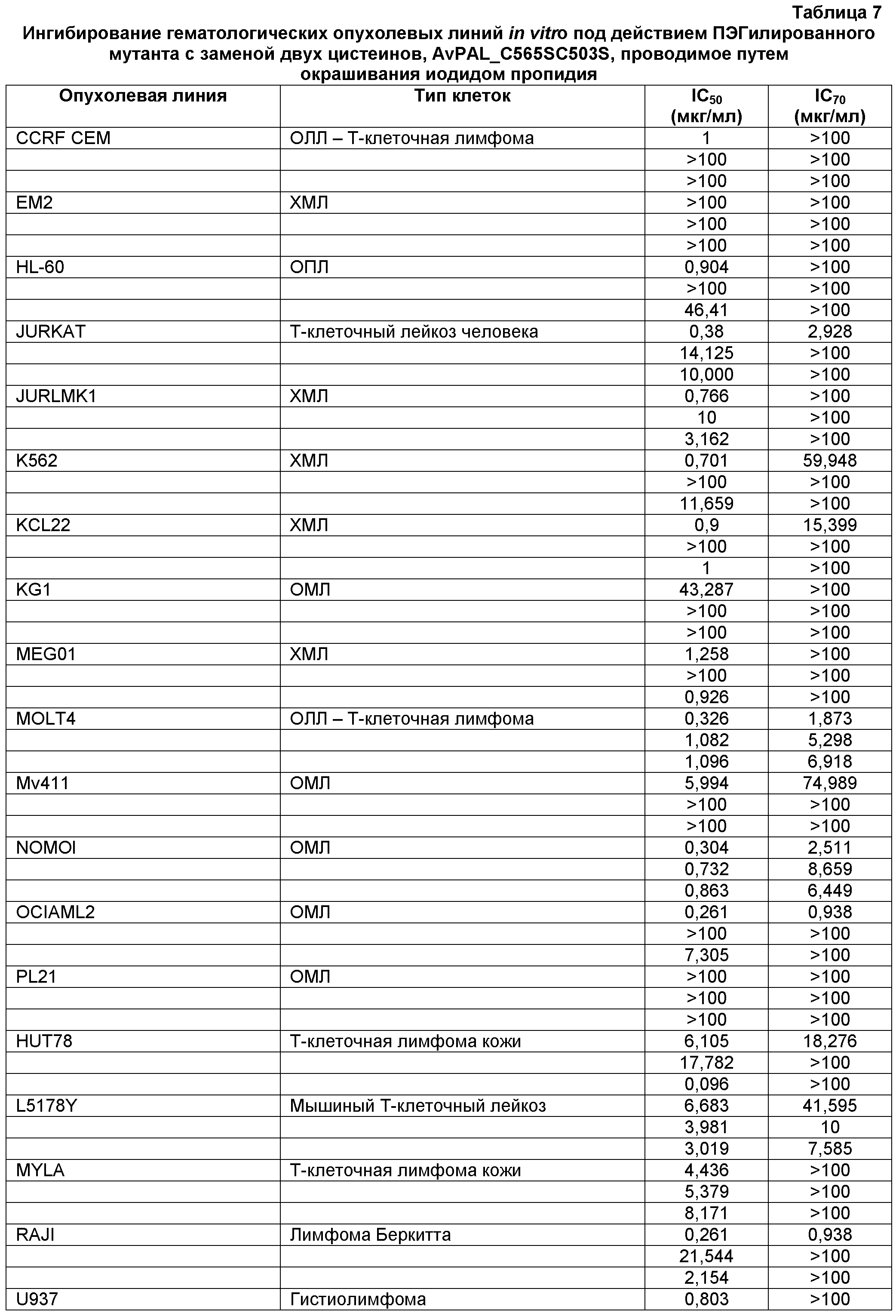

Дозозависмое ингибирование пролиферации клеток, определенное по снижению интенсивности окрашивания иодидом пропидия, и достигаемое путем обработки двух чувствительных гематологических опухолевых клеток, NOMO1 и IM9, ПЭГилированным мутантом с заменой двух цистеинов, AvPAL_C565SC503S, показано на фигуре 14А и 21В, соответственно. Такие опухолевые клеточные линии имели IC50 и IC70 менее чем 1,0 и 10,0 мкг/мл, соответственно. Для сравнения, в клеточных линиях человеческого лейкоза, аспарагиназа имела IC50 1-10 мкг/мл. Однако, в основном, гематологические опухолевые клеточные линии были более резистентными, на что указывали величины IC70, чем клеточные линии солидной опухоли (см. ниже).
Солидные опухоли
Панель из тридцати шести (36) солидных опухолевых клеточных линий, включая опухоли, происходящие от клеток мочевого пузыря, головного мозга, толстой кишки, желудка, головы и шеи, легких, молочной железы, яичника, поджелудочной железы, предстательной железы, почек и матки, оценивали на влияние, которое оказывает ПЭГилированный мутант с заменой двух цистеинов, AvPAL_C565SC503S, на пролиферацию клеток in vitro. Солидные опухолевые клеточные линии высевали в планшеты для культивирования клеток при плотности 5000 клеток/лунку на день 0. На день 1, в культуры добавляли ПЭГилированный мутант с заменой двух цистеинов, AvPAL_C565SC503S, в различных концентрациях, от 0,01 до 100 мкг/мл. На день 5 определяли содержание ДНК путем окрашивания иодидом пропидия. Затем определяли IC50, IC70 и IC90.
В таблице 8 показано, что ПЭГилированный мутант с заменой двух цистеинов, AvPAL_C565SC503S, эффективно ингибировал in vitro пролиферацию нескольких солидных опухолевых клеточных линий, как было определено путем окрашивания иодидом пропидия.
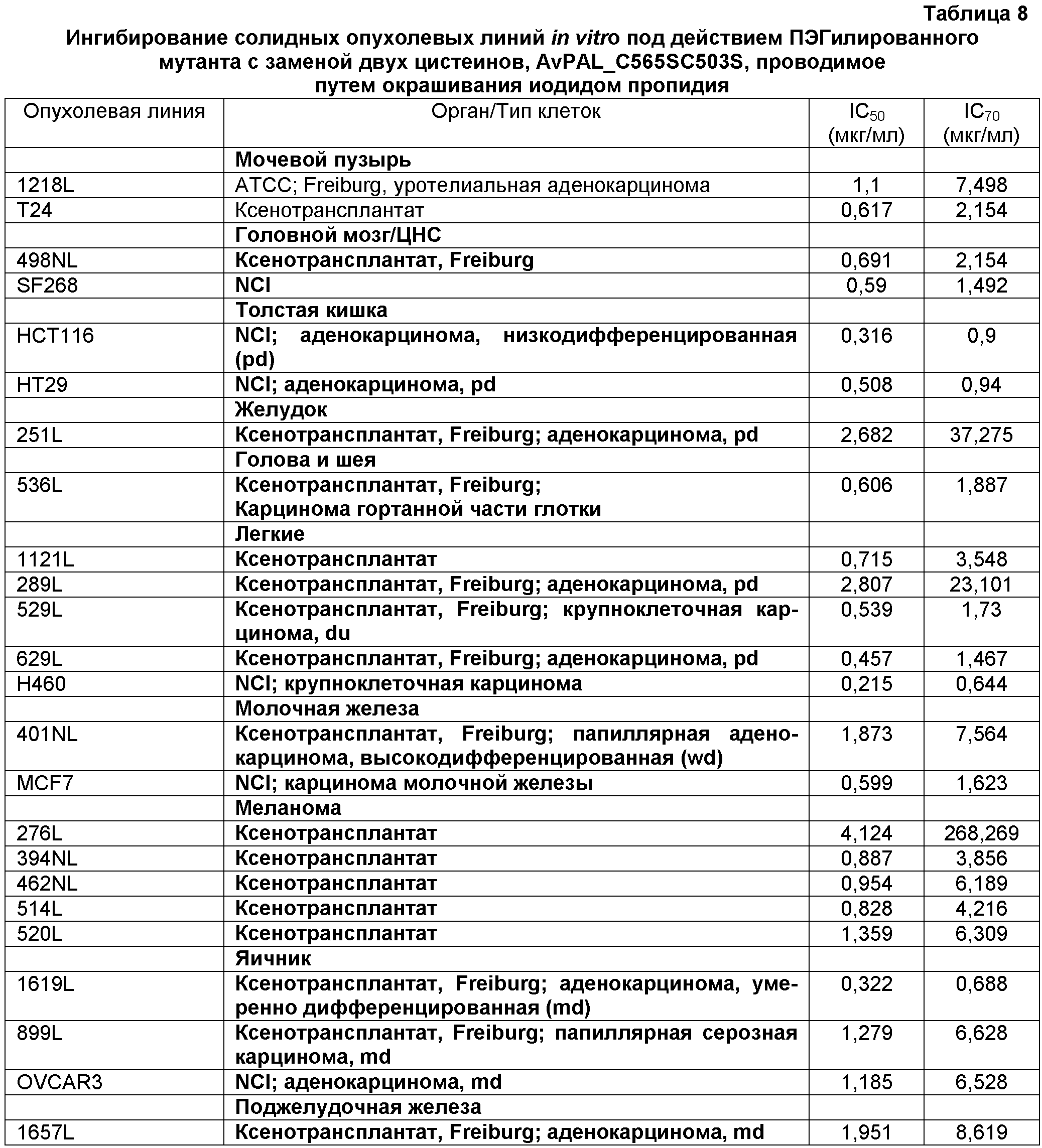

Дозозависимое ингибирование пролиферации клеток, определенное по снижению интенсивности окрашивания иодидом пропидия, под действием ПЭГилированныого мутанта с заменой двух цистеинов, AvPAL_C565SC503S, в опухолевых клеточных линиях рака головного мозга/ЦНС, толстой кишки, легких и предстательной железы показано на фигурах 17A-D, соответственно.
AvPAL_C565SC503S обнаруживал селективную антипролиферативную активность в указанной широкой панели клеточных линий солидных опухолей и его действие было особенно эффективным (то есть, IC50 составляла 0,2-0,7 мкг/мл) в опухолевых клеточных линиях легких, головного мозга/ЦНС, толстой кишки, предстательной железы и почек. Опухолевые клеточные линии, происходящие по меньшей мере от рака мочевого пузыря, головы и шеи, молочной железы, яичника и матки, были также чувствительными к цитолизу под действием AvPAL_C565SC503S. Чувствительными к цитолизу под действием AvPAL_C565SC503S также оказались некоторые меланомы.
Пример 15
Противоопухолевая активность вариантов AvPAL (цистеиновых мутантов) у «голых» мышей
Данные исследования проводили для определения влияния ПЭГилированной формы полипептидного варианта AvPAL (с заменой цистеиновых остатков на сериновые остатки в положениях 503 и 565) на пролиферацию опухолевых клеток, выращиваемых у «голых» мышей in vivo.
ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, получали как описано в примере 7.
Подкожные ксенотрансплантаты человеческих опухолевых клеток у иммунодефицитных «голых» мышей или мышей SCID были с успехом использованы в качестве моделей человеческих раковых опухолей для оценки in vivo эффективности противораковых терапевтических средств, а также противораковых терапевтических средств направленного действия, таких как конъюгаты антител и токсинов (см. Kerbel, Cancer Biol. Ther. 2(4):Suppl. 1:S134-S139 (2003)).
Противоопухолевая in vivo активность ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, может быть протестирована отдельно или в комбинации с противораковыми терапевтическими средствами или с противораковыми терапевтическими средствами направленного действия, или в комбинации с приемом пищи с ограниченным содержанием фенилаланина, с использованием ксенотрансплантатов человеческих опухолевых клеток, введенных «голым» мышам.
Для приживления ксенотрансплантатов человеческих опухолей, «голым» мышам подкожно вводили примерно 5 × 106 человеческих опухолевых клеток в 0,2 мл PBS. Средний размер опухолей со временем увеличивался. Затем ксенотрансплантаты человеческих опухолей, развивающиеся у «голых» мышей, вырезали и приготавливали блоки опухолевых тканей размером приблизительно 30 мм3. Для оценки in vivo противоопухолевой активности ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, каждой «голой» мыши, которая ранее не участвовала в эксперименте, подкожно имплантировали один блок опухолевой ткани. Терапевтическое лечение начинали перед стадией инициации опухоли или когда средний размер опухоли у группы «голых» мышей достигал приблизительно 100-150 мм3 (модель предупреждения развития опухоли), и/или после приживления опухолей, когда средний размер опухоли у группы «голых» мышей превышал 500 мм3 (модель лечения опухоли).
В первой стадии определяли дозу ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, которая снижала уровни фенилаланина (Phe) в плазме примерно до нуля. Эксперименты осуществляли как описано в примерах 7-9 и 14 в предварительной одновременно рассматриваемой заявке на патент США № 11/451999, поданной 12 июня 2006, за исключением того, что вместо мышей ENU2 использовали «голых» мышей. В этой начальной стадии определяли дозу фермента PAL и частоту его введения.
Во второй стадии противоопухолевую активность ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, оценивали с использованием различных ксенотрансплантатов человеческих опухолей, взятых у пациентов или выделенных из клеточных линий. Моделями опухолей являются различные раковые заболевания, такие как, например, но не ограничивающиеся ими, раковые заболевания центральной нервной системы (ЦНС), толстой кишки, легких и предстательной железы, а также метастатическая меланома и рак почек. Неисчерпывающий список опухолей и опухолевых клеточных линий, которые могут быть протестированы, приводится в таблице 7 (гематологические опухоли) и 8 (солидные опухоли).
Для оценки противоопухолевой активности ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, «голым» мышам, несущим различные подкожно введенные ксенотрансплантаты человеческих опухолей, подкожно инъецировали AvPAL_C565SC503S, например, в трех различных дозах, составляющих, например, приблизительно от 5 до 500 мг/кг. На основе этой дозы может быть вычислена доза для человека, составляющая примерно от 0,1 до 10 мг/кг. Противоопухолевую активность анализировали как снижение объема опухоли и/или как абсолютное прекращение роста опухоли. Толерантность к AvPAL_C565SC503S также оценивали как процент смертности и/или изменение массы тела.
В каждом исследовании на противоопухолевую активность in vivo использовали по меньшей мере четыре группы, из которых одной группе вводили носитель в качестве контроля, а по меньшей мере трем другим группам вводили прокариотический фермент PAL. Каждая группа состояла по меньшей мере из 8 мышей, а в целом эти группы включали 32 мыши, которым подкожно имплантировали опухоли. Мышей с аналогичными размерами опухолей (100-150 мм3) использовали для рандомизации (день 0).
В случае достижения противоопухолевого эффекта может быть проведен мониторинг мышей в течение еще 2 недель после окончания лечения прокариотическим ферментом PAL в целях детектирования возможной реинициации роста опухоли. В соответствии с разрешением регуляторных органов, осуществляющих контроль за проведением экспериментов на животных, мышей умерщвляли, когда диаметры опухоли превышали 1,6 см.
Диаметры опухоли измеряли два раза в неделю вместе с определением массы тела. Объем опухоли вычисляли по формуле a*b2/2 (где «а» означает наибольший диаметр опухоли, а «b» означает меньший (перпендикулярный) диаметр). Относительные объемы опухолей и массы тела вычисляли для каждой отдельной опухоли, исходя из величин, полученных на день 0 (первый день введения дозы). Обработку начинали после того, как объем опухоли достигал приблизительно 100-150 мм3. В соответствии с разрешением регуляторных органов, осуществляющих контроль за проведением экспериментов на животных, мышей умерщвляли, когда объем опухоли превышал 1600 мм3.
Опухоли, взятые от пациентов и прижившиеся в результате серийных пассажей «голым» мышам, могут быть также использованы в качестве тест-опухолей. Обычно такие опухоли сохраняют основные свойства исходных опухолей пациентов, включая их гистологические свойства и чувствительность к лекарственному средству. Для продуцирования некоторых опухолей, например, одной раковой опухоли ЦНС и двух раковых опухолей предстательной железы, были использованы опухоли, происходящие от раковых клеточных линий.
Пример 16
Репрезентативные препараты прокариотических PAL
В нижеследующем примере приводятся параметры, рекомендованные для приготовления композиций, содержащих прокариотический PAL или его биологически активные фрагменты, мутанты, варианты или аналоги, которые могут быть применены для лечения опухолевого заболевания и рака. Параметрами, используемыми для приготовления композиций прокариотического PAL согласно изобретению, являются, но не ограничиваются ими, забуферивающие агенты для поддержания рН; агенты, корректирующие изотоничность; отсутствие или присутствие стабилизаторов и отсутствие или присутствие других наполнителей, носителей, разбавителей и т.п.
В примере 11 ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, приготавливали в концентрации примерно 12-20 мг/мл (примерно 0,2-0,33 мМ). Предпочтительно, вариант прокариотического PAL приготавливают в концентрации примерно от 1 до 50 мг/мл (примерно 0,016-0,8 мМ), более предпочтительно, примерно от 5 до 20 мг/мл (примерно 0,08-0,33 мМ), а еще более предпочтительно, примерно от 5 до 15 мг/мл (примерно от 0,08 до 0,25 мМ). Наиболее предпочтительный препарат композиций прокариотического PAL согласно изобретению имеет концентрацию фермента PAL примерно 10±5 мг/мл (примерно 0,16±0,08 мМ).
В примере 11 ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, приготавливали в 10 мМ трис-HCl, 140 мМ NaCl при pH 7,0, 7,5 и 8,0. Предпочтительным забуферивающим агентом является трис-HCl или его эквивалент в концентрации от 5 до 50 мМ, предпочтительно, от 5 до 20 мМ, а еще более предпочтительно, от 5 до 15 мМ. Наиболее предпочтительный препарат композиций прокариотического PAL согласно изобретению имеет буфер трис-HCl в концентрации примерно 10±5 мМ.
Предпочтительный pH фармацевтической композиции составляет примерно 6,0-8,5, предпочтительно, примерно 7,0-8,0, а более предпочтительно, примерно 7,0-7,6. Наиболее предпочтительный препарат композиций прокариотического PAL согласно изобретению имеет pH примерно 7,3±0,3.
Предпочтительным агентом, корректирующим изотоничность, является NaCl или его эквивалент в концентрации примерно от 100 до 200 мМ, предпочтительно, примерно от 130 до 170 мМ, а более предпочтительно, примерно от 130 до 150 мМ. Наиболее предпочтительный препарат композиций прокариотического PAL согласно изобретению имеет NaCl в концентрации примерно 140±10 мМ.
Как показано в примере 11, ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, был стабилизирован в присутствии фенилаланина (Phe) и некоторых его структурных аналогов, включая, например, транс-коричную кислоту (t-CA) и бензойную кислоту; при этом тирозин (Tyr) оказывает минимальное стабилизирующее действие на фермент PAL. Предпочтительным стабилизатором является Phe или его структурный аналог, где указанный стабилизатор присутствует в концентрации примерно от 0,1 до 20 моль на моль активного центра прокариотического PAL, предпочтительно, в концентрации примерно от 0,5 до 10 моль на моль активного центра прокариотического PAL, а более предпочтительно, в концентрации примерно от 1 до 10 моль на моль активного центра прокариотического PAL. Наиболее предпочтительный препарат композиций прокариотического PAL согласно изобретению имеет концентрацию стабилизатора примерно 5±4 моль на моль активного центра прокариотического PAL.
ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, не был в значительной степени стабилизирован при pH<7 или pH>7,6, или в присутствии EDTA, аминогуанидина или твина 80; при этом антиоксиданты, такие как аскорбиновая кислота и метионин, оказывали дестабилизирующее действие на фермент PAL (пример 11, данные не приводятся).
Композиции прокариотического PAL согласно изобретению, предпочтительно, приготавливают в виде жидких препаратов, однако они могут быть также приготовлены в виде твердых (например, лиофилизованных) препаратов. В этом случае могут быть добавлены наполнители, например, агенты, придающие объем, такие как маннит и/или сахароза. В примере 12, ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, был приготовлен и лиофилизован в 10 мМ трис-HCl, 140 мМ NaCl при pH 7,5 в отсутствие маннита или сахарозы, в присутствии 25 мг/мл маннита или в присутствии 20 мг/мл маннита плюс 5 мг/мл сахарозы. Предпочтительный лиофилизованный препарат содержит маннит в концентрации примерно от 1 до 5% (масс/об) или 10-50 мг/мл, предпочтительно, примерно от 2 до 4%, а более предпочтительно, примерно от 2 до 3%. Другой предпочтительный лиофилизованный препарат содержит маннит и сахарозу, где концентрация маннита составляет примерно от 1 до 5% (масс/об) или от 10 до 50 мг/мл, предпочтительно, примерно от 1 до 3%, а более предпочтительно, примерно от 1,5 до 2,5%, а концентрация сахарозы составляет примерно от 0,1 до 2% (масс/об) или от 0,1 до 2 мг/мл, предпочтительно, примерно от 0,2% до 1%, а более предпочтительно, примерно от 0,3% до 0,7%. Наиболее предпочтительный лиофилизованный препарат композиций прокариотического PAL согласно изобретению имеет концентрацию маннита примерно 2,5±0,5% или содержит 2,0±0,5% маннита плюс 0,5±0,2% сахарозы.
В соответствии с этим, предпочтительный препарат композиций прокариотического PAL согласно изобретению представлен в таблице 9.

Пример 17
Клиническое испытание композиций прокариотического PAL, используемых для лечения рака
В нижеследующем примере приводятся параметры, рекомендованные для проведения клинического испытания композиций, содержащих прокариотический PAL или его биологически активные фрагменты, мутанты, варианты или аналоги, которые могут быть применены в способах терапии согласно изобретению. Как обсуждается в настоящей заявке, композиции прокариотического PAL могут быть использованы для лечения рака. Были проведены клинические испытания, которые включали вычисление безопасных пероральных или подкожных доз прокариотического PAL, оценку фармакокинетических свойств и предварительную реакцию воздействия этих доз на «суррогатные» (промежуточные) и определенные клинические конечные точки. Для сбора достаточной информации о безопасности для 100 оцениваемых пациентов могут быть проведены испытания в течение как минимум, но необязательно, 24 недель. Первоначальная доза, используемая в этих испытаниях, может варьироваться в пределах примерно от 0,001 до 1,0 мг/кг в неделю. В тех случаях, когда такая доза не дает снижения уровней фенилаланина (Phe) в плазме пациента, например, снижения от нормального уровня, составляющего примерно 50 мкМ-70 мкМ до нижнего детектируемого уровня и примерно до менее чем 30 мкМ, предпочтительно, примерно менее чем 20 мкМ, а еще более предпочтительно, примерно менее чем 10 мкМ, такая доза должна быть, при необходимости, увеличена, и должна поддерживаться еще как минимум, но необязательно, в течение 24 недель для обеспечения безопасности и для дальнейшей оценки эффективности.
Оценка безопасности включает выявление побочных эффектов и аллергических реакций, проведение всех биохимических анализов (функции почек и печени), анализы мочи и клинический анализ крови с определением лейкоцитарной формулы. Кроме того, может быть также проведен мониторинг других параметров, включая тесты на снижение уровней Phe в крови, нейропсихологические тесты, тесты на познавательную способность и общую оценку состояния пациента. В настоящем примере также рассматривается определение фармакокинетических параметров лекарственного средства в кровотоке, общего распределения и времени полужизни PAL в кровотоке. Предполагается, что эти параметры позволят определить зависимость «доза - клинический ответ».
Методы
До испытания, у контрольных пациентов, не страдающих раком, и пациентов, у которых была диагностирована определенная форма рака, собирали анамнезы, и этих пациентов подвергали врачебному обследованию, нейропсихологическим тестам и тестам на познавательную способность, а также проводили серию стандартных клинических лабораторных анализов (клинический анализ крови, серия 20, CH50, UA) и определяли уровни птеринов в моче, уровни дигидроптеридин-редуктазы (DHPR) и панель сывороточных аминокислот в крови (в плазме) натощак. Были измерены базальные уровни Phe в крови, сыворотке или плазме. Затем пациенты должны были посещать клинику почти каждую неделю. Через неделю после завершения лечения пациенты снова проходили полное клиническое обследование. Если требовалось увеличение дозы, то пациенты должны были проходить лечение по схеме, описанной выше. Мониторинг безопасности проводили на протяжении всего испытания.
Установление диагноза и критерии включения в испытание/исключения из испытания
Пациентом может быть мужчина или женщина с зарегистрированным диагнозом рака определенной формы. В этом исследовании участвовали пациенты с раком, которые ранее подвергались хирургической операции, проходили химиотерапию, лучевую терапию и/или другую противораковую терапию, и у которых наблюдалась ремиссия (например, отсутствие заболевания по меньшей мере в течение 5 лет). Пациента исключали из предварительного обследования, если у него была диагностирована определенная форма рака, но он еще не подвергался какой-либо противораковой терапии.
Безопасность прокариотического PAL
Терапия с использованием прокариотического PAL считалась безопасной, если во время всего испытания не наблюдалось каких-либо значимых острых или хронических реакций на лекарственные средства. Длительное лечение лекарственными средствами считалось безопасным, если при проведении клинической оценки, клинических лабораторных анализов или других соответствующих исследований не наблюдалось каких-либо значительных патологий.
Эффективность прокариотического PAL
После того, как было определено, что терапия с использованием прокариотического PAL является безопасной и эффективной для снижения уровней фенилаланина (Phe) в плазме пациента, например, снижения от нормального уровня, составляющего примерно 50 мкМ-70 мкМ до нижнего детектируемого уровня и примерно до менее чем 30 мкМ, предпочтительно, примерно менее чем 20 мкМ, а еще более предпочтительно, примерно менее чем 10 мкМ, композиции прокариотического PAL согласно изобретению могут быть протестированы у пациентов с раком, которые ранее подвергались хирургической операции, проходили химиотерапию, лучевую терапию и/или другую противораковую терапию, и у которых наблюдалась ремиссия (например, отсутствие заболевания по меньшей мере в течение 5 лет), а также у пациентов, у которых была диагностирована определенная форма рака, но которые еще не подвергались какой-либо противораковой терапии.
В случаях, когда у пациентов с раком наблюдалась ремиссия, прокариотический PAL вводили отдельно или в комбинации с проведением стандартной противораковой терапии для конкретной формы рака, для того, чтобы определить, способствует ли данная PAL-терапия продолжению периода ремиссии (то есть, периода без проявления заболевания) в отличие от периода ремиссии у пациентов, которые не проходили терапию с использованием композиций прокариотического PAL согласно изобретению.
В случаях, когда у пациентов наблюдалась активная форма рака, прокариотический PAL вводили отдельно или в комбинации с проведением стандартной противораковой терапии для конкретной формы рака, для того, чтобы определить, наблюдается ли у данных пациентов, прошедших PAL-терапию, лучший ответ на противораковую терапию (например, более длительный период ремиссии, большая продолжительность жизни или снижение роста опухоли, размера опухоли или опухолевой нагрузки), чем у пациентов, которые не проходили терапию с использованием композиций прокариотического PAL согласно изобретению.
Терапия с использованием прокариотического PAL может быть проведена отдельно или в комбинации с введением противоракового терапевтического средства или противоракового терапевтического средства направленного действия, и/или с приемом пищи с ограниченным содержанием белка (то есть, не содержащей фенилаланина).
Пример 18
Противоопухолевая активность вариантов AvPAL (цистеиновых мутантов) в модели ксенотрансплантата опухолевой клеточной линии меланомы B16
Противоопухолевое действие профилактических или терапевтических доз ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, полученного как описано в примере 7 и приготовленного в концентрации 2,86 и 7,14 мг/мл в 10 мМ трис-HCl, 140 мМ NaCl, 1 мМ транс-коричной кислоты (t-CA), pH 7,5, оценивали в модели ксенотрансплантата опухолевой клеточной линии меланомы B16. «Профилактическое лечение» означает лечение индивидуума, у которого не наблюдаются признаки заболевания, а «терапевтическое лечение» означает лечение индивидуума, у которого наблюдаются признаки заболевания. Противоопухолевую эффективность профилактического или терапевтического лечения с использованием ПЭГилированного варианта AvPAL оценивали по замедлению роста ксенотрансплантата меланомы В16 и по увеличению продолжительности жизни мышей.
Для приживления опухолевых ксенотрансплантатов, девяносто шести 6-недельным самкам мышей B6J в заднюю боковую часть подкожно инъецировали приблизительно 1 × 106 опухолевых клеток меланомы Bl6. Мышей, которым вводили инъекции, произвольно распределяли на две группы, одну из которых подвергали профилактическому лечению, а другую - терапевтическому лечению.
Мышей, относящихся к профилактической группе, дополнительно разделяли на четыре группы, каждой из которых еженедельно вводили две подкожных инъекции носителя (10 мМ трис-HCl, 140 мМ NaCl, 1 мМ транс-коричной кислоты (t-CA), pH 7,5) или ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, в различных дозах (40, 80 или 100 мг/кг). Для группы профилактического лечения, день 1 означает день, в который мышам инъецировали клетки меланомы В16, как показано на фигуре 18 (вверху).
Однако, для группы терапевтического лечения, день 1 означает день, в который опухоли меланомы B16, инъецированные мышам, достигали объема 200-300 мм3, как показано на фигуре 18 (внизу). Когда опухоли у мышей, относящихся к группе терапевтического лечения, достигали объема 200-300 мм3, этих мышей дополнительно разделяли на четыре группы, в которых каждой мыши в бок, противоположный месту расположения опухоли, еженедельно вводили две подкожных инъекции носителя (10 мМ трис-HCl, 140 мМ NaCl, 1 мМ t-CA, pH 7,5) или ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, в различных дозах (40, 80 или 100 мг/кг).
Всех мышей ежедневно обследовали путем пальпации до тех пор, пока опухоли не достигали измеряемого размера. Объем опухоли измеряли три раза в неделю с помощью цифрового штангенциркуля по формуле (l × w 2)/2, где w означает наименьший из 2 перпендикулярных диаметров опухоли.
Массу тела измеряли три раза в неделю и ежедневно проводили клиническое обследование (на смертность, наличие патологий и признаков боли или дискомфорта). Забор крови путем пункции из ретроорбитального синуса проводили еженедельно до введения дозы (в 1-й день каждой недели), через 48 часов после введения дозы (на 3-й день каждой недели) и по окончании исследования.
Мышей умерщвляли на 36-й день, или отдельных мышей умерщвляли, когда объем их опухоли достигал 1500 мм3, независимо от времени, когда это происходило. После умерщвления мышей, опухоли собирали и фиксировали формалином для гистологического анализа.
Некоторые мыши в профилактической группе имели опухоли объемом 1500 мм3 на 16-й день (см. фигуру 18 (вверху)). Некоторые мыши в терапевтической группе имели опухоли объемом 1500 мм3 на 10-й день (см. фигуру 18 (внизу)).
На фигуре 18 показано, что ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, при его введении в профилактических (вверху) или в терапевтических (внизу) целях, был способен приостанавливать рост опухоли ксенотрансплантата опухолевой клеточной линии меланомы B16 в зависимости от дозы.
В таблице 10 показано, что ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, при его введении в профилактических или терапевтических целях, способствовал увеличению выживаемости мышей в зависимости от дозы, как было определено по проценту мышей, имеющих объем опухоли менее 1500 мм3.

Это исследование показало, что ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, при его введении в профилактических или в терапевтических целях мышам с моделью меланомы, обладал противоопухолевым действием.
Пример 19
Противоопухолевая активность вариантов AvPAL (цистеиновых мутантов) в модели ксенотрансплантата опухолевой клеточной линии гепатомы
Противоопухолевое действие профилактических доз ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, полученного как описано в примере 7 и приготовленного в концентрации 9,1 мг/мл в 10 мМ трис-HCl, 140 мМ NaCl, 1 мМ транс-коричной кислоты (t-CA), pH 7,5, оценивали в двух моделях ксенотрансплантата опухолевой клеточной линии гепатомы. «Профилактическое лечение» означает лечение индивидуума, у которого не наблюдаются признаки заболевания. Противоопухолевую эффективность профилактического лечения с использованием ПЭГилированного варианта AvPAL оценивали по замедлению роста ксенотрансплантатов гепатомы и по увеличению продолжительности жизни мышей.
Для приживления опухолевых ксенотрансплантатов, двадцати 6-недельным самкам мышей B6J в заднюю боковую часть подкожно инъецировали приблизительно 1 × 107 опухолевых клеток гепатомы SNU398 или приблизительно 5 × 106 опухолевых клеток гепатомы HepG2.
Мышей, которым вводили SNU398 и HepG2, разделяли на две группы, каждой из которых еженедельно вводили три подкожных инъекции носителя (10 мМ трис-HCl, 140 мМ NaCl, 1 мМ транс-коричной кислоты (t-CA), pH 7,5) или ПЭГилированного мутанта AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, в дозе 60 мг/кг. День 1 означает день, в который мышам были инъецировали клетки SNU398 или HepG2, как показано на фигуре 19.
Всех мышей ежедневно обследовали путем пальпации до тех пор, пока опухоли не достигали измеряемого размера. Объем опухоли измеряли три раза в неделю с помощью цифрового штангенциркуля по формуле (l × w 2)/2, где w означает наименьший из 2 перпендикулярных диаметров опухоли.
Массу тела измеряли три раза в неделю и ежедневно проводили клиническое обследование (на смертность, наличие патологий и признаков боли и дискомфорта). Забор крови путем пункции из ретроорбитального синуса проводили до начала исследования, через 48 часов после введения 7-ой дозы и по окончании исследования.
Мышей умерщвляли на 60-й день, либо отдельных мышей умерщвляли, когда объем их опухоли достигал 1500 мм3, независимо от времени, когда это происходило. После умерщвления мышей, опухоли собирали и фиксировали формалином для гистологического анализа.
На фигуре 19 показано, что ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, при его введении в профилактических целях, был способен приостанавливать рост ксенотрансплантатов клеточной линии гепатомы SNU398 (вверху) и HepG2 (внизу).
В таблице 11 показано, что ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, при его введении в профилактических целях, способствовал увеличению выживаемости мышей, как было определено по проценту мышей, имеющих объем опухолевых ксенотрансплантатов клеточной линии гепатомы SNU398 и HepG2 менее 1500 мм3.

Эти исследования показали, что ПЭГилированный мутант AvPAL с заменой двух цистеинов, AvPAL_C565SC503S, при его введении в профилактических целях двум мышам с моделью гепатомы, обладал противоопухолевым действием.
В настоящее изобретение, проиллюстрированное на вышеприведенных примерах, могут быть внесены различные модификации и изменения, очевидные для специалиста в данной области. Отсюда следует, что ограничения настоящего изобретения определяются лишь прилагаемой формулой изобретения.