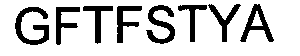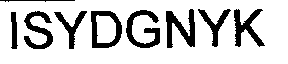НЕЙТРАЛИЗУЮЩИЕ АНТИТЕЛА ПРОТИВ ВИРУСА ГРИППА А И ИХ ИСПОЛЬЗОВАНИЕ
Вид РИД
Изобретение
Данная заявка претендует на приоритет временных заявок США №№61/083838 и 61/181582, поданных 25 июля 2008 г., и 27 мая 2009 г., соответственно, описания которых настоящим целиком включены сюда в качестве ссылок.
Уровень техники
Считается, что иммунный ответ на вирус гриппа А с образованием нейтрализующих антител является специфическим по отношению к данному вирусному субтипу. Существует 16 субтипов гриппа А, определяемых их гемагглютининами (ГА). Эти 16 ГА, Н1-Н16, могут быть разделены на две группы. Группа 1 состоит из субтипов Н1, Н2, Н5, Н6, Н8, Н9, Н11, Н12, Н13 и Н16, и группа 2 включает субтипы Н3, Н4, Н7, Н10, Н14 и Н15. Хотя все субтипы присутствуют у птиц, болезнь у людей вызывают преимущественно субтипы Н1, Н2 и Н3. Субтипы Н5, Н7 и Н9 вызывают спорадические тяжелые инфекции у людей и могут вызвать новую пандемию. Вирусы Н1 и Н3 непрерывно эволюционируют, образуя новые варианты, в результате явления, называемого антигенным дрейфом. Вследствие этого, антитела, продуцируемые в ответ на предшествующие варианты вирусов, плохо или совсем не защищают от новых дрейфовых вариантов вирусов. Это приводит к тому, что каждый год необходимо готовить новую вакцину против вирусов Н1 и Н3, появление которых прогнозируется, что является очень дорогостоящим процессом, а также не всегда эффективным. То же самое относится к производству вакцины гриппа Н5. Действительно, точно не известно, будут ли современные вакцины Н5 на основе вьетнамских или индонезийских изолятов вируса гриппа А защищать против будущей пандемии вируса Н5.
По этим причинам было бы очень желательно создать вакцину, которая индуцирует нейтрализующие антитела широкого спектра действия, способные нейтрализовать все субтипы вируса гриппа А, а также их ежегодные варианты (обзор Gerhard et al., 2006). Кроме того нейтрализующие гетеросубтиповые антитела широкого спектра действия могут быть использованы по профилактическому или терапевтическому назначению.
Антитела, распознающие вирус гриппа А, были охарактеризованы. Антитела к М2 (инвариантный малый белок, экспрессируемый инфицированными клетками, но не вызывающими инфекцию вирусами) продемонстрировали некоторый защитный эффект in vivo, возможно, путем превращения инфицированных клеток в мишени для разрушения NK-клетками (природными клетками-киллерами) или цитотоксичными Т-клетками. Однако основной мишенью нейтрализующих антител является ГА. Он содержит большой эктодомен из ок.500 аминокислот, который расщепляется ферментами хозяина с образованием 2 полипептидов, остающихся связанными дисульфидной связью. Более крупный N-концевой фрагмент (НА1, 320-330 аминокислот) образует удаленный от мембраны глобулярный домен, который содержит рецепторсвязывающий сайт и большинство детерминант, распознаваемых нейтрализующими вирус антителами. Меньший по размеру C-концевой участок (НА2, ок.180 аминокислот) образует стеблеобразную структуру, с помощью которой глобулярный домен крепится к клеточной или вирусной мембране. Степень гомологии последовательностей между субтипами у полипептидов НА1 меньше (34-59% гомологии между субтипами), чем у полипептида НА2 (51-80% гомологии). Наиболее консервативной областью является последовательность вокруг места расщепления, особенно N-концевые 11 аминокислот НА2, называемые пептидом слияния, который является консервативным для всех субтипов вируса гриппа А. Часть этой области выходит на поверхность в виде петли в молекуле-прекурсоре ГА (НА0), но становится недоступной после расщепления НА0 на НА1/НА2. Таким образом, существуют консервативные участки в разных субтипах ГА, особенно, в соединительном участке НА1-НА2 и в области НА2. Однако такие участки могут быть малодоступными для нейтрализующих антител.
Был достигнут лишь ограниченный успех в идентификации антител, которые нейтрализуют более одного субтипа вируса гриппа А, и их спектр нейтрализации является узким, а их активность - низкой. Okuno et al. иммунизировали мышей вирусом гриппа A/Okuda/57 (H2N2) и выделяли моноклональное антитело (С179), которое связывается с консервативным конформационным эпитопом в НА2 и нейтрализует субтипы Н2, Н1 и Н5 группы 1 вирусов гриппа A in vitro и in vivo на животных моделях (Okuno et al., 1993; Smirnov et al., 1999; Smirnov et al., 2000).
Недавно, Gioia et al. описали присутствие антител, нейтрализующих вирус H5N1, в сыворотке некоторых особ, которым была введена обычная сезонная вакцина против гриппа. (Gioia et al., 2008). Авторы выдвинули предположение, что нейтрализующая активность может быть вызвана антителами к нейраминидазе (N1). Однако, моноклональные антитела не были выделены и эпитопы-мишени не были охарактеризованы. Неясно, нейтрализуют ли антитела сыворотки другие субтипы вируса гриппа А.
Несмотря на десятилетия исследований, на рынке нет антител, которые бы нейтрализовали или ингибировали инфекцию вируса гриппа А с широким спектром действия или ослабляли болезнь, вызванную вирусом гриппа А. Таким образом, существует необходимость в идентификации новых антител, которые защищали бы против множественных субтипов вируса гриппа А.
Сущность изобретения
Данное изобретение основано, частично, на выделении у особ, вакцинированных сезонной вакциной против гриппа, природных моноклональных антител человека, которые связываются с НА и нейтрализуют инфекцию нескольких субтипов вируса гриппа А, а также новых эпитопов, с которыми связываются антитела по изобретению. Соответственно, в одном аспекте изобретения, изобретение предусматривает антитело и его антигенсвязывающие фрагменты, которые нейтрализуют инфекцию нескольких субтипов вируса гриппа А, выбранных из субтипов группы 1 и группы 2.
В одном варианте исполнения изобретения, изобретение предусматривает антитело или его антигенсвязывающий фрагмент, которые нейтрализуют инфекцию субтипа группы 1 и субтипа группы 2 вируса гриппа А. В другом варианте исполнения изобретения, изобретение предусматривает антитело или его антигенсвязывающий фрагмент, содержащие по меньшей мере одну последовательность участка, определяющего комплементарность (CDR), имеющую по меньшей мере 95% идентичности последовательности с любым одним из SEQ ID NO:1-6 или 17-22, причем антитело нейтрализует вирус гриппа А.
В еще одном варианте исполнения изобретения, изобретение предусматривает CDR1 тяжелой цепи с аминокислотной последовательностью SEQ ID NO:1 или SEQ ID NO:17; CDR2 тяжелой цепи с аминокислотной последовательностью SEQ ID NO:2 или SEQ ID NO:18; и CDR3 тяжелой цепи с аминокислотной последовательностью SEQ ID NO:3 или SEQ ID NO:19, причем антитело нейтрализует вирус гриппа А. В еще одном варианте исполнения изобретения, изобретение предусматривает антитело или его антигенсвязывающий фрагмент, содержащие CDR1 легкой цепи с аминокислотной последовательностью SEQ ID NO:4 или SEQ ID NO:20; CDR2 легкой цепи с аминокислотной последовательностью SEQ ID NO:5 или SEQ ID NO:21; и CDR3 легкой цепи с аминокислотной последовательностью SEQ ID NO:6 или SEQ ID NO:22, причем антитело нейтрализует вирус гриппа А.
В еще одном варианте исполнения изобретения, изобретение предусматривает антитело или его антигенсвязывающий фрагмент, где антитело содержит вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:13, и вариабельный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:14; или вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:33, и вариабельный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:14; или вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:29, и вариабельный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:30; или вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:35, и вариабельный участок легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:30, причем антитело нейтрализует вирус гриппа А. Изобретение далее предусматривает антитело или его антигенсвязывающий фрагмент, где антитело представляет собой вариант 1 FI6 или вариант 2 FI6.
В еще одном варианте исполнения изобретения, изобретение предусматривает антитело или его антигенсвязывающий фрагмент, которые нейтрализуют инфекцию субтипа группы 1 и субтипа группы 2 вируса гриппа А, где антитело или его фрагмент экспрессируются иммортализованным клоном В-клеток.
В другом аспекте, изобретение предусматривает молекулу нуклеиновой кислоты, содержащую полинуклеотид, кодирующий антитело или фрагмент антитела по изобретению. В еще одном аспекте, изобретение предусматривает вектор, содержащий молекулу нуклеиновой кислоты по изобретению или клетку, экспрессирующую антитело по изобретению или его антигенсвязывающий фрагмент. В еще одном аспекте, изобретение предусматривает выделенный или очищенный иммуногенный полипептид, содержащий эпитоп, который связывается с антителом или антигенсвязывающим фрагментом по изобретению.
Изобретение далее предусматривает фармацевтическую композицию, содержащую антитело по изобретению или его антигенсвязывающий фрагмент, молекулу нуклеиновой кислоты по изобретению, вектор, содержащий молекулу нуклеиновой кислоты по изобретению, клетку, экспрессирующую антитело или фрагмент антитела по изобретению, или иммуногенный полипептид по изобретению, и фармацевтически приемлемый разбавитель или носитель. Изобретение также предусматривает фармацевтическую композицию, содержащую первое антитело или его антигенсвязывающий фрагмент и второе антитело или его антигенсвязывающий фрагмент, где первое антитело представляет собой антитело по изобретению и второе антитело представляет собой антитело или его антигенсвязывающий фрагмент, которые нейтрализуют инфекцию вируса гриппа А.
Также предусматривается, что использование антитела по изобретению, или его антигенсвязывающего фрагмента, нуклеиновой кислоты по изобретению, вектора, содержащего нуклеиновую кислоту по изобретению, клетки, экспрессирующей вектор по изобретению, выделенного или очищенного иммуногенного полипептида, содержащего эпитоп, который связывается с антителом или фрагментом антитела по изобретению, или фармацевтической композиции по изобретению (i) в производстве лекарственного средства для лечения инфекции вируса гриппа A, (ii) в вакцине, или (iii) в диагностике инфекции вируса гриппа А, входит в объем изобретения. Кроме того, предусматривается также, что использование антитела по изобретению или его антигенсвязывающего фрагмента для контроля качества вакцин против вируса гриппа А путем проверки того, чтобы антиген указанной вакцины содержал специфический эпитоп в правильной конформации, входит в объем изобретения.
В другом аспекте, изобретение предусматривает способ ослабления инфекции вируса гриппа А или снижения риска инфекции вируса гриппа А, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества антитела или антигенсвязывающего фрагмента антитела по изобретению.
В другом аспекте, изобретение предусматривает эпитоп, который специфически связывается с антителом по изобретению или его антигенсвязывающим фрагментом, предназначенный для использования (i) в терапии, (ii) в производстве лекарственного средства для лечения инфекции вируса гриппа A, (iii) в качестве вакцины, или (iv) при скрининге лигандов, способных нейтрализовать инфекцию вируса гриппа А.
Детальное описание изобретения
Изобретение основано, частично, на открытии и выделении у особ, которые были вакцинированы сезонной вакциной против гриппа А, природных антител человека, нейтрализующих, с широким спектром, действия вирус гриппа А разных субтипов, а также новых эпитопов, с которыми связываются антитела по изобретению. Такие антитела являются желательными, поскольку для нейтрализации разных субтипов вируса гриппа А потребуется только одно или несколько антител. Кроме того, эпитопы, распознаваемые такими антителами, могут быть частью вакцины, способной индуцировать широкое защитное действие против как сезонных, так и возможных пандемичных изолятов разных субтипов.
Соответственно, в одном аспекте, изобретение предусматривает антитело и его антигенсвязывающие фрагменты, которые нейтрализуют по меньшей мере два вируса гриппа А в субтипах группы 1 и группы 2. В одном варианте исполнения, изобретение предусматривает антитело или его антигенсвязывающий фрагмент, которые нейтрализуют инфекцию вируса гриппа А субтипа группы 1 и субтипа группы 2.
В другом аспекте изобретения, оно предусматривает нейтрализующее антитело и его антигенсвязывающие фрагменты, обладающие широкой специфичностью против ГА разных субтипов вируса гриппа А. В одном варианте исполнения, антитело или антигенсвязывающие фрагменты по изобретению специфически связываются с эпитопом в области стебля ГА, являющимся консервативным для двух или более субтипов вируса гриппа А, выбранных из группы 1 и группы 2. В другом варианте исполнения, антитело или антигенсвязывающие фрагменты по изобретению специфически связываются с полипептидом, содержащим аминокислотную последовательность любой из SEQ ID NO:37, 38, 39 или 40.
Моноклональные антитела человека, иммортализованные клоны В-клеток или трансфицированные клетки-хозяева, которые секретируют антитела по изобретению, и нуклеиновая кислота, кодирующая антитела по изобретению также включены в объем изобретения.
В используемом тут значении, термины "антигенсвязывающий фрагмент", "фрагмент" и "фрагмент антитела" используются взаимозаменяемо для обозначения любого фрагмента антитела по изобретению, который сохраняет антигенсвязывающую активность антитела. Типичные примеры фрагментов антител включают, без ограничений, одноцепочечное антитело, Fab, Fab', F(ab')2, Fv или scFv. Термин "антитело", в используемом тут значении, включает как антитела, так и их антигенсвязывающие фрагменты.
В используемом тут значении, термин "широкая специфичность" используется для описания антитела или антигенсвязывающего фрагмента по изобретению, которые могут связываться с и/или нейтрализовать один или несколько субтипов группы 1 и один или несколько субтипов группы 2 вируса гриппа А.
В используемом тут значении, "нейтрализующее антитело" представляет собой антитело, которое может нейтрализовать, т.е., предупреждать, ингибировать, ослаблять, затруднять или препятствовать способности патогена инициировать и/или поддерживать инфекцию хозяина. Термины "нейтрализующее антитело" и "антитело, которое нейтрализует" или "антитела, которые нейтрализуют" используются тут взаимозаменяемо. Такие антитела могут быть использованы, сами или в комбинации, в качестве профилактических или терапевтических агентов при соответствующем составлении композиций, в сочетании с активной вакцинацией, в качестве диагностического инструмента или в качестве производственного инструмента, как описано тут.
Антитело или антигенсвязывающие фрагменты по изобретению нейтрализуют один или несколько субтипов вируса гриппа А из группы 1 (Н1, Н2, Н5, Н6, Н8, Н9, НИ, Н12, Н13 и Н16 и их варианты) и один или несколько вирусов гриппа А из группы 2 (Н3, Н4, Н7, Н10, Н14 и Н15 и их варианты). В одном варианте исполнения, типичные примеры субтипов группы 1 включают Н1, Н2, Н5, Н6 и Н9 и типичные примеры субтипов группы 2 включают Н3 и Н7.
Антитело и фрагмент антитела по изобретению способны нейтрализовать различные комбинации субтипов вируса гриппа А. В одном варианте исполнения, антитело может нейтрализовать субтипы Н1 и Н3 вируса гриппа А, или субтипы Н2 и Н3, или субтипы Н3 и Н5, или субтипы Н3 и Н9, или субтипы Н1 и Н7, или субтипы Н2 и Н7, или субтипы Н5 и Н7, или субтипы Н7 и Н9.
В другом варианте исполнения, антитело и фрагмент антитела по изобретению могут нейтрализовать субтипы вируса гриппа А Н1, Н2 и Н3, или субтипы Н1, Н3 и Н5, или субтипы Н1, Н3 и Н9, или субтипы Н2, H3 и Н5, или субтипы Н2, H3 и Н9, или субтипы H3, Н5 и Н9, или субтипы Н1, Н2 и Н7, или субтипы Н1, Н5 и Н7, или субтипы Н1, Н7 и Н9, или субтипы Н2, Н5 и Н7, или субтипы Н2, Н7 и Н9, или субтипы Н5, Н7 и Н9, или субтипы Н1, H3 и Н7, или субтипы Н2, H3 и Н7, или субтипы H3, Н5 и Н7, или субтипы H3, Н7 и Н9.
В еще одном варианте исполнения, антитело может нейтрализовать субтипы вируса гриппа А Н1, Н2, H3 и Н7, или субтипы Н1, H3, Н5 и Н7, или субтипы Н1, H3, Н7 и Н9, или субтипы Н2, H3, Н5 и Н7, или субтипы Н2, H3, Н7 и Н9, или субтипы H3, Н5, Н7 и Н9 или субтипы Н1, Н2, H3 и Н5, или субтипы Н1, Н2, H3 и Н9, или субтипы Н1, H3, Н5 и Н9, или субтипы Н2, H3, Н5 и Н9, или субтипы Н1, Н2, Н5 и Н7, или субтипы Н1, Н2, Н7 и Н9, или субтипы Н1, Н5, Н7 и Н9, или субтипы Н2, Н5, Н7 и Н9.
В еще одном варианте исполнения, антитело по изобретению может нейтрализовать субтипы вируса гриппа А Н1, Н2, H3, Н5 и Н7, или субтипы Н1, Н2, H3, Н7 и Н9, или субтипы Н1, H3, Н5, Н7 и Н9, или субтипы Н2, H3, Н5, Н7 и Н9, или субтипы Н1, Н2, H3, Н5 и Н9, или субтипы Н1, Н2, Н5, Н7 и Н9, или субтипы Н1, Н2, H3, Н5, Н7 и Н9. В еще одном варианте исполнения, антитело и антигенсвязывающие фрагменты по изобретению нейтрализуют одну или несколько вышеуказанных комбинаций в дополнении к нейтрализации субтипа Н6 вируса гриппа А.
Антитело и антигенсвязывающий фрагмент по изобретению обладают высокой нейтрализующей активностью. Концентрация антитела по изобретению, необходимая для 50% нейтрализации вируса гриппа А, может составлять, например, примерно 50 мкг/мл или меньше. В одном варианте исполнения, концентрация антитела по изобретению, необходимая для 50% нейтрализации вируса гриппа А, составляет примерно 50, 45, 40, 35, 30, 25, 20, 17,5, 15, 12,5, 11, 10, 9, 8, 7, 6, 5, 4,5, 4, 3,5, 3, 2,5, 2, 1,5 или примерно 1 мкг/мл или меньше. В другом варианте исполнения, концентрация антитела по изобретению, необходимая для 50% нейтрализации вируса гриппа А, составляет примерно 0,9, 0,8, 0,75, 0,7, 0,65, 0,6, 0,55, 0,5, 0,45, 0,4, 0,35, 0,3, 0,25, 0,2, 0,15, 0,1, 0,075, 0,05, 0,04, 0,03, 0,02, 0,01, 0,008, 0,006, 0,004, 0,003, 0,002 или примерно 0,001 мкг/мл или меньше. Это означает, что лишь низкие концентрации антитела будут необходимы для 50% нейтрализации вируса гриппа А. Специфичность и активность могут быть измерены с использованием стандартного анализа нейтрализации, известного квалифицированным специалистам.
Антитела по изобретению
Изобретение предусматривает антитело, обладающее особенно широкой специфичностью к ГА, которое нейтрализует один или несколько субтипов вируса гриппа А из группы 1 и один или несколько субтипов вируса гриппа А из группы 2. Антитело по изобретению связывается с эпитопом в области ГА, являющейся консервативной для двух или более субтипов вируса гриппа А, выбранных из группы 1 и группы 2.
В одном варианте исполнения, изобретение предусматривает антитело, например, выделенное антитело или очищенное антитело, которые специфически связываются с консервативным эпитопом в области стебля ГА субтипов вируса гриппа А группы 1 и группы 2 и препятствуют вирусной репликации или распространению. Изобретение также предусматривает антитело, например, выделенное антитело или очищенное антитело, которое специфически связывается с консервативным эпитопом в области стебля ГА субтипов группы 1 и группы 2 и ингибирует проникновение вируса в клетку. Без ограничений какой-либо теорией, в типичном варианте исполнения антитело или антигенсвязывающие фрагменты по изобретению связываются с консервативным эпитопом в области стебля вируса гриппа А и ингибируют проникновение вируса в клетку путем препятствования стадии слияния. Эпитоп или антигенная детерминанта белка соответствует тем частям молекулы, которые специфически распознаются связывающим сайтом (или паратопом) антитела. Эпитопы, таким образом, представляют собой родственные структуры, которые нуждаются в комплементарных паратопах для их функционального распознавания. Эпитоп, консервативный для разных вариантов белка, означает, что один и тот же паратоп может специфически распознавать такие разные варианты путем вхождения в контакт с одинаковыми частями молекул.
Антитела по изобретению могут быть моноклональными, например, моноклональными антителами человека, или рекомбинантными антителами. Изобретение также предусматривает фрагменты антител по изобретению, особенно фрагменты, которые сохраняют антигенсвязывающую активность антител. Хотя описание, включая формулу изобретения, может, в некоторых местах, недвузначно указывать на антигенсвязывающий фрагмент(ы), фрагмент(ы) антитела, вариант(ы) и/или производное (производные) антител, подразумевается, что термин "антитело" или "антитело по изобретению" включает все категории антител, а именно, антигенсвязывающий фрагмент(ы), фрагмент(ы) антитела, вариант(ы) и производное (производные) антител.
В одном варианте исполнения, антитела и фрагменты антител по изобретению нейтрализуют комбинацию двух или больше субтипов вируса гриппа А группы 1 и группы 2. Типичные примеры субтипов вируса гриппа А включают, без ограничений, H5N1 (A/Vietnam/1203/04), H1N1 (A/New Caledonia/20/99), H1N1 (A/Salomon lsland/3/2006), H3N2 (A/Wyoming/3/03) и H9N2 (A/chicken/Hong Kong/G9/97). В другом варианте исполнения, антитела нейтрализуют и/или являются специфическими по отношению к комбинации 3, 4, 5, 6, 7 или больше субтипов группы 1 и группы 2 вируса гриппа А.
В типичном варианте исполнения, изобретение предусматривает антитело или фрагмент антитела, являющиеся специфическими по отношению к субтипам вируса гриппа А Н1 и H3 (например H1N1 и H3N2); или Н1, H3, Н5 и Н9 (например H1N1, H3N2, H5N1 и H9N2). В еще одном варианте исполнения, антитело или фрагменты антител являются специфическими по отношению к Н1, H3, Н5, Н7 и Н9 (например, H1N1, H3N2, H5N1, H7N1, H7N7, H9N2). Другие типичные примеры комбинаций субтипов вируса гриппа А приведены ранее в заявке.
Номера SEQ ID аминокислотных последовательностей вариабельных участков тяжелой цепи (VH) и вариабельных участков легкой цепи (VL) типичных примеров антител по изобретению, а также номера SEQ ID кодирующих их последовательностей нуклеиновых кислот приведены в Таблице 1.
|
|
В одном варианте исполнения, антитело или фрагмент антитела по изобретению предусматривает вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, примерно на 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% или 100% идентичную последовательности, приведенной в любой из SEQ ID NO:13, 33, 29 или 35. В другом варианте исполнения, антитело или фрагмент антитела по изобретению предусматривает вариабельный участок легкой цепи, имеющий аминокислотную последовательность, примерно на 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% или 100% идентичную последовательности, приведенной в SEQ ID NO:14 или 30.
В еще одном варианте исполнения, вариабельный участок тяжелой цепи антитела по изобретению может кодироваться нуклеиновой кислотой, имеющей последовательность, примерно на 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% или 100% идентичную последовательности, приведенной в любой из SEQ ID NO:15, 34, 31 или 36. В еще одном варианте исполнения, вариабельный участок легкой цепи антитела по изобретению может кодироваться нуклеиновой кислотой, имеющей последовательность, примерно на 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% или 100% идентичную последовательности, приведенной в SEQ ID NO:16 или 32.
CDR тяжелых цепей антитела обозначены CDRH1, CDRH2 и CDRH3, соответственно. Аналогично, CDR легких цепей антитела обозначены CDRL1, CDRL2 и CDRL3, соответственно. Положения аминокислот CDR определяются в соответствии с системой нумерации IMGT следующим образом: CDR1 - положения 27-38 по IMGT, CDR2 - положения 56-65 по IMGT и CDR3 - положения 105-117 по IMGT.
В Таблице 2 приведены номера SEQ ID аминокислотных последовательностей шести CDR тяжелых и легких цепей, соответственно, для типичных примеров антитела по изобретению.
|
В одном варианте исполнения, антитело или фрагмент антитела по изобретению предусматривает по меньшей мере один CDR с последовательностью, имеющей по меньшей мере 95% идентичности последовательности с любым одним из SEQ ID NO:1-6 или 17-22.
В другом варианте исполнения, изобретение предусматривает антитело, содержащее тяжелую цепь, содержащую один или несколько (т.е. один, два или все три) CDR тяжелой цепи из варианта 1 FI6, варианта 2 FI6, варианта 1 FI28 или варианта 2 FI28. В типичном варианте исполнения, антитело или антигенсвязывающий фрагмент по изобретению предусматривают CDR1 тяжелой цепи с аминокислотной последовательностью SEQ ID NO:1 или SEQ ID NO:17; CDR2 тяжелой цепи с аминокислотной последовательностью SEQ ID NO:2 или SEQ ID NO:18; и CDR3 тяжелой цепи с аминокислотной последовательностью SEQ ID NO:3 или SEQ ID NO:19. В определенных вариантах исполнения, антитело или фрагмент антитела, предусматриваемые тут, содержат тяжелую цепь, содержащую (i) SEQ ID NO:1 в качестве CDRH1, SEQ ID NO:2 в качестве CDRH2 и SEQ ID NO:3 в качестве CDRH3, или (ii) SEQ ID NO:17 в качестве CDRH1, SEQ ID NO:18 в качестве CDRH2 и SEQ ID NO:19 в качестве CDRH3.
Также предусматривается антитело, содержащее легкую цепь, содержащую один или несколько (т.е. один, два или все три) CDR легкой цепи из варианта 1 FI6, варианта 2 FI6, варианта 1 FI28 или варианта 2 FI28, В типичном варианте исполнения, антитело или антигенсвязывающий фрагмент по изобретению предусматривают CDR1 легкой цепи с аминокислотной последовательностью SEQ ID NO:4 или SEQ ID NO:20; CDR2 легкой цепи с аминокислотной последовательностью SEQ ID NO:5 или SEQ ID NO:21; и CDR3 легкой цепи с аминокислотной последовательностью SEQ ID NO:6 или SEQ ID NO:22. В определенных вариантах исполнения, предусматриваемое тут антитело содержит легкую цепь, содержащую (i) SEQ ID NO:4 в качестве CDRL1, SEQ ID NO:5 в качестве CDRL2 и SEQ ID NO:6 в качестве CDRL3, или (ii) SEQ ID NO:20 в качестве CDRL1, SEQ ID NO:21 в качестве CDRL2 и SEQ ID NO:22 в качестве CDRL3.
В одном варианте исполнения, антитело по изобретению или его антигенсвязывающий фрагмент содержат все CDR варианта 1 антитела FI6, указанные в Таблице 2, и нейтрализуют инфекцию вируса гриппа А. В другом варианте исполнения, антитело по изобретению или его антигенсвязывающий фрагмент содержат все CDR варианта 2 антитела FI6, указанные в Таблице 2, и нейтрализуют инфекцию вируса гриппа А. В еще одном варианте исполнения, антитело по изобретению или его антигенсвязывающий фрагмент содержат все CDR варианта 1 антитела FI28, указанные в Таблице 2, и нейтрализуют инфекцию вируса гриппа А. В еще одном варианте исполнения, антитело по изобретению или его антигенсвязывающий фрагмент содержат все CDR варианта 2 антитела FI28, указанные в Таблице 2, и нейтрализуют инфекцию вируса гриппа А.
Типичные примеры антител по изобретению включают, без ограничений, вариант 1 FI6, вариант 2 FI6, вариант 1 FI28 или вариант 2 FI28.
Изобретение далее предусматривает антитело, или его фрагмент, которые связываются с тем же эпитопом, что и антитело по изобретению, или антитело, конкурирующее с антителом или антигенсвязывающим фрагментом по изобретению.
Антитела по изобретению также включают гибридные молекулы антитела, содержащие один или несколько CDR из антитела по изобретению и один или несколько CDR из другого антитела к этому же эпитопу. В одном варианте исполнения, такие гибридные антитела содержат три CDR из антитела по изобретению и три CDR из другого антитела к этому же эпитопу. Типичные примеры гибридных антител включают i) три CDR легкой цепи из антитела по изобретению и три CDR тяжелой цепи из другого антитела к этому же эпитопу, или ii) три CDR тяжелой цепи из антитела по изобретению и три CDR легкой цепи из другого антитела к этому же эпитопу.
Варианты антител также включены в объем изобретения. Таким образом, варианты последовательностей, указанные в заявке, также включены в объем изобретения. Такие варианты включают природные варианты, образующиеся в результате соматической мутации in vivo при иммунном ответе или in vitro при культивировании иммортализованных клонов В-клеток. Альтернативно, варианты могут возникать вследствие вырожденности генетического кода, как было указано выше, или могут продуцироваться в результате ошибок транскрипции или трансляции.
Дополнительные варианты последовательностей антител, обладающих повышенной аффинностью и/или активностью, могут быть получены с использованием способов, известных специалистам, и включены в объем изобретения. Например, замещения аминокислот могут быть использованы для получения антител с дополнительно повышенной аффинностью. Альтернативно, оптимизация кодонов нуклеотидной последовательности может быть использована для повышения эффективности трансляции в системах экспрессии для продуцирования антитела. Кроме того, полинуклеотиды, содержащие последовательности, оптимизированные по специфичности или нейтрализующей активности антитела путем применения способа напрвленной эволюции к любой из последовательностей нуклеиновой кислоты по изобретению, также входят в объем изобретения.
В одном варианте исполнения, последовательности вариантов антител могут иметь 70% или больше (т.е. 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% или больше) идентичности аминокислотной последовательности с последовательностями, указанными в заявке. В некоторых вариантах исполнения, такая идентичность последовательностей рассчитывается по отношению к полной длине референсной последовательности (т.е. последовательности, указанной в заявке). В некоторых дополнительных вариантах исполнения, процент идентичности, указываемый тут, рассчитывается с помощью BLAST версии 2.1.3 с использованием параметров по умолчанию, определенных NCBI (National Center for Biotechnology Information; http://www.ncbi.nlm.nih.gov/) [матрица Blosum 62; штраф за открытие пробела=11 и штраф за продолжение пробела=1].
В другом аспекте, изобретение также включает последовательности нуклеиновой кислоты, кодирующие часть или все легкие и тяжелые цепи и CDR антител по настоящему изобретению. Предусматриваются последовательности нуклеиновой кислоты, кодирующие часть или все легкие и тяжелые цепи и CDR типичных примеров антител по изобретению. В Таблице 1 приведены номера SEQ ID для последовательностей нуклеиновой кислоты, кодирующих вариабельные участки тяжелой цепи и легкой цепи типичных примеров антител по изобретению. Например, предусматриваемые тут последовательности нуклеиновой кислоты включают SEQ ID NO:15 (кодирующую вариабельный участок тяжелой цепи варианта 1 FI6), SEQ ID NO:34 (кодирующую вариабельный участок тяжелой цепи варианта 2 FI6), SEQ ID NO:16 (кодирующую вариабельный участок легкой цепи варианта 1 FI6 и варианта 2 FI6), SEQ ID NO:31 (кодирующую вариабельный участок тяжелой цепи варианта 1 FI28); SEQ ID NO:36 (кодирующую вариабельный участок тяжелой цепи варианта 2 FI28) и SEQ ID NO:32 (кодирующую вариабельный участок легкой цепи варианта 1 и варианта 2 FI28).
В Таблице 3 приведены номера SEQ ID для последовательностей нуклеиновой кислоты, кодирующих CDR типичных примеров антител по изобретению. Вследствие избыточности генетического кода, будут существовать варианты таких последовательностей, которые кодируют те же самые аминокислотные последовательности.
|
В одном варианте исполнения, последовательности нуклеиновой кислоты в соответствии с изобретением включают последовательности нуклеиновой кислоты, имеющие по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%, или по меньшей мере 99% идентичности с нуклеиновой кислотой, кодирующей тяжелую или легкую цепь антитела по изобретению. В другом варианте исполнения, последовательность нуклеиновой кислоты по изобретению имеет последовательность нуклеиновой кислоты, кодирующей тяжелую или легкую цепь CDR антитела по изобретению. Например, последовательность нуклеиновой кислоты в соответствии с изобретением предусматривает последовательность, являющуюся по меньшей мере на 75% идентичной с последовательностями нуклеиновой кислоты SEQ ID NO:7-12, 15, 16, 34, 23-28, 31, 32 или 36.
В объем изобретения дополнительно включены векторы, например, векторы экспрессии, содержащие последовательность нуклеиновой кислоты в соответствии с изобретением. Клетки, трансформированные такими векторами, также включены в объем изобретения. Примеры таких клеток включают, без ограничений, эукариотические клетки, например, дрожжевые клетки, животные клетки или растительные клетки. В одном варианте исполнения, клетки принадлежат млекопитающему, например, клетки человека, СНО, HEK293T, PER.C6, NS0, миеломы или гибридомы.
Изобретение также относится к моноклональным антителам, которые связываются с эпитопом, способным связывать антитела по изобретению, включая, без ограничений, моноклональное антитело, выбранное из группы, состоящей из варианта 1 FI6, варианта 2 FI6, варианта 1 FI28 и варианта 2 FI28.
Моноклональные и рекомбинантные антитела являются особенно пригодными для идентификации и очистки индивидуальных полипептидов или других антигенов, против которых они направлены. Антитела по изобретению дополнительно полезны тем, что они могут быть использованы в качестве реагентов для иммунологических анализов, радиоиммунологических анализов (RIA) или твердофазовых иммуноферментных анализов (ELISA). Для такого применения, антитела могут быть мечеными аналитически детектируемым реагентом, таким как радиоизотоп, флуоресцентная молекула или фермент. Антитела также могут быть использованы для молекулярной идентификации и характеризации (картирования эпитопов) антигенов.
Антитела по изобретению могут быть сцеплены с лекарственным препаратом для доставки к месту лечения или сцеплены с детектируемой меткой для облегчения визуализации участка, содержащего представляющие интерес клетки, такие как клетки, инфицированные вирусом гриппа А. Методы сцепления антител с лекарственными средствами и детектируемыми метками хорошо известны специалистам, так же как и методы визуализации с использованием детектируемых меток. Меченые антитела могут быть использованы для проведения различных анализов с использованием разнообразных меток. Детектированию образования комплекса антитело-антиген между антителом по изобретению и представляющим интерес эпитопом (эпитоп вируса гриппа А) может способствовать присоединение детектируемого вещества к антителу. Пригодные средства детектирования включают использование меток, таких как радионуклиды, ферменты, коферменты, люминофоры, хемилюминофоры, хромогены, субстраты или кофакторы ферментов, ингибиторы ферментов, комплексы простетических групп, свободные радикалы, частицы, красители и т.п. Примеры пригодных ферментов включают пероксидазу хрена, щелочную фосфатазу, β-галактозидазу или ацетилхолинэстеразу; примеры пригодных комплексов простетических групп включают стрептавидин/биотин и авидин/биотин; примеры пригодных флуоресцентных материалов включают умбеллиферон, флуоресцеин, флуоресцеинизотиоцианат, родамин, дихлортриазиниламинфлуоресцеин, дансил хлорид или фикоэритрин; примером люминесцентного материала является люминол; примеры биолюминесцентных материалов включают люциферазу, люциферин и экворин; и примеры пригодных радиоактивных материалов включают 125I, 131I, 35S или 3H. Такие меченые реагенты могут быть использованы в различных хорошо известных анализах, таких как радиоиммунологические анализы, ферментные иммунологические анализы, например, ELISA, флуоресцентные иммунологические анализы и т.п. (см., например, US 3766162; US 3791932; US 3817837; и US 4233402).
Антитело по изобретению может быть конъюгировано с терапевтическим фрагментом, таким как цитотоксин, терапевтический агент или ион радиоактивного металла или радиоизотоп. Примеры радиоизотопов включают, без ограничений, I-131, I-123, I-125, Y-90, Re-188, Re-186, At-211, Cu-67, Bi-212, Bi-213, Pd-109, Tc-99, In-111 и т.п. Такие конъюгаты антител могут быть использованы для модификации определенной биологической реакции; фрагмент лекарственного средства не должен пониматься как ограниченный классическими химическими терапевтическими агентами. Например, фрагмент лекарственного средства может быть белком или полипептидом, обладающим желательной биологической активностью. Такие белки могут включать, например, токсин, такой как абрин, рицин А, экзотоксин Pseudomonas или дифтерийный токсин.
Методики конъюгирования таких терапевтических фрагментов с антителами хорошо известны. См., например, Arnon et al. (1985) "Monoclonal Antibodies for Immunotargeting of Drugs in Cancer Therapy," в Monoclonal Antibodies and Cancer Therapy, ed. Reisfeld et al. (Alan R. Liss, Inc.), pp.243-256; ed. Hellstrom et al. (1987) "Antibodies for Drug Delivery," в Controlled Drug Delivery, ed. Robinson et al. (2d ed; Marcel Dekker, Inc.), pp.623-653; Thorpe (1985) "Antibody Carriers of Cytotoxic Agents in Cancer Therapy: A Review," в Monoclonal Antibodies '84: Biological and Clinical Applications, ed. Pinchera et al. pp.475-506 (Editrice Kurtis, Milano, Italy, 1985); "Analysis, Results, and Future Prospective of the Therapeutic Use of Radiolabeled Antibody in Cancer Therapy," в Monoclonal Antibodies for Cancer Detection and Therapy, ed. Baldwin et al. (Academic Press, New York, 1985), pp.303-316; и Thorpe etal. (1982) Immunol. Rev. 62:119-158.
Альтернативно, антитело или фрагмент антитела могут быть конъюгированы со вторым антителом или фрагментом антитела с образованием гетероконъюгата антител, как описано в US 4676980. В дополнение к этому, могут быть использованы линкеры между метками и антителами по изобретению (например, US 4831175). Антитела или их антигенсвязывающие фрагменты могут быть непосредственно мечеными радиоактивными йодом, индием, иттрием или другими радиоактивными частицами, известными специалистам (например, US 5595721). Лечение может состоять из комбинации лечения конъюгированными и неконъюгированными антителами, которые вводятся одновременно или последовательно (например, WO00/52031; WO00/52473).
Антитела по изобретению также могут быть связаны с твердой подложкой. Дополнительно, антитела по изобретению или функциональные фрагменты таких антител могут быть химически модифицированы путем образования ковалентных связей с полимером, например, для увеличения их периода полувыведения из циркуляции. Примеры полимеров и способов их присоединения к пептидам приведены в документах US 4766106; US 4179337; US 4495285 и US 4609546. В некоторых вариантах исполнения, полимеры могут быть выбраны из полиоксиэтилированных полиолов и полиоксиэтиленгликоля (ПЭГ). ПЭГ является растворимым в воде при комнатной температуре и имеет общую формулу: R(O-CH2-CH2)nO-R, где R может обозначать водород или защитную группу, такую как алкильная или алканольная группа. В одном варианте исполнения, защитная группа может содержать от 1 до 8 атомов углерода. В дополнительном варианте исполнения, защитная группа является метилом. Символ n обозначает положительное целое число. В одном варианте исполнения n имеет значение в интервале от 1 до 1000. В другом варианте исполнения n имеет значение в интервале от 2 до 500. В одном варианте исполнения ПЭГ имеет средний молекулярный вес от 1000 до 40000. В дополнительном варианте исполнения, ПЭГ имеет молекулярный вес от 2000 до 20000. В еще одном варианте исполнения ПЭГ имеет молекулярный вес от 3000 до 12000. В одном варианте исполнения ПЭГ содержит по меньшей мере одну гидроксильную группу. В другом варианте исполнения ПЭГ содержит терминальную гидроксильную группу. В еще одном варианте исполнения она представляет собой терминальную гидроксильную группу, которая активируется для реакции со свободной аминогруппой ингибитора. Однако, следует понимать, что тип и количество реакционноспособных групп могут меняться для получения ковалентно конъюгированных ПЭГ/антитело по настоящему изобретению.
Водорастворимые полиоксиэтилированные полиолы также являются пригодными по настоящему изобретению. Они включают полиоксиэтилированный сорбит, полиоксиэтилированную глюкозу, полиоксиэтилированный глицерин (POG) и т.п. В одном варианте исполнения, используется POG. Без ограничений какой-либо теорией, укажем, что, поскольку глицериновая основная цепь полиоксиэтилированного глицерина является такой же самой цепью, которая встречается в природных условиях, например, у животных и людей, в моно-, ди- и триглицеридах, такая разветвленность не обязательно будет восприниматься организмом как чужеродный агент. В некоторых вариантах исполнения POG имеет молекулярный вес в таком же интервале значений, что и ПЭГ. Другой системой доставки лекарственного средства, которая может быть использована для увеличения периода полувыведения из циркуляции, являются липосомы. Методы приготовления систем доставки на основе липосом описаны в Gabizon et al. (1982), Cafiso (1981) и Szoka (1980). Другие системы доставки лекарственных средств известны специалистам и описаны, например, в Poznansky et al. (1980) и Poznansky(1984).
Антитела по изобретению могут быть обеспечены в очищенной форме. Типично, антитело будет входить в состав композиций, которые по существу не содержат других полипептидов, например, в которых менее 90% (мас.), обычно, менее 60%, и чаще всего, менее 50% композиции состоит из других полипептидов.
Антитела по изобретению могут быть иммуногенными в не принадлежащих человеку (или гетерологичных) организмах-хозяевах, например, у мышей. В частности, антитела могут иметь идиотипическую детерминанту (idiotope), иммуногенную в организмах хозяев, кроме человека, но не в организме человека-хозяина. Антитела по изобретению для использования у людей включают антитела, которые не могут быть легко выделены из организмов хозяев, таких как мыши, козы, кролики, крысы, млекопитающие кроме приматов и т.д., и обычно не могут быть получены путем гуманизации или у мышей с ксенотрансплантатами (xeno-mice).
Антитела по изобретению могут принадлежать к любому изотипу (например, IgA, IgG, IgM т.е., α-, γ- или µ-тяжелая цепь), но обычно будут представлять собой IgG. В рамках изотипа IgG, антитела могут принадлежать к подклассам IgG1, IgG2, IgG3 или IgG4. Антитела по изобретению могут иметь κ- или λ-легкую цепь.
Продуцирование антител
Антитела в соответствии с изобретением могут быть получены любым способом, известным специалистам. Например, общая методология получения моноклональных антител с использованием гибридомной технологии хорошо известна (Kohler, G. and Milstein, С,. 1975; Kozbar et al. 1983). В одном варианте исполнения, используется альтернативный метод иммортализации EBV, описанный в WO2004/076677.
Используя метод, описанный в WO2004/076677, В-клетки, продуцирующие антитело по изобретению, могут быть трансформированы с помощью EBV в присутствии поликлонального активатора В-клеток. Трансформация с помощью EBV является стандартной методикой и может быть легко адаптирована с включением поликлональных активаторов В-клеток.
Дополнительные стимуляторы клеточного роста и дифференцировки могут быть необязательно добавлены на стадии трансформации для дополнительного увеличения эффективности. Такие стимуляторы могут быть цитокинами, такими как IL-2 и IL-15. В одном аспекте, IL-2 добавляют на стадии иммортализации для дополнительного увеличения эффективности иммортализации, но его использование не является существенным. Иммортализованные В-клетки, полученные с использованием этих методов, могут затем культивироваться с использованием методов, известных специалистам, и из них выделяются антитела.
При использовании способа, описанного в патентной заявке UK 0819376.5, отдельные клетки плазмы могут культивироваться на культуральных микропланшетах. Антитела могут быть выделены из культур отдельных клеток плазмы. Кроме того, из культур отдельных клеток плазмы может быть экстрагирована РНК и может быть проведена ПЦР отдельных клеток с использованием известных специалистам способов. Участки VH и VL антител могут быть амплифицированы методом ОТ-ПЦР, секвенированы и клонированы в вектор экспрессии, который затем трансфицируют в клетки HEK293T или другие клетки-хозяева. Клонирование нуклеиновой кислоты в векторы экспрессии, трансфекция клеток-хозяев, культивирование трансфицированных клеток-хозяев и выделение продуцируемых антител могут быть выполнены любыми способами, известными квалифицированному специалисту.
Моноклональные антитела могут быть дополнительно очищены, при необходимости, с использованием фильтрации, центрифугирования и различных хроматографических методов, таких как ВЭЖХ или аффинная хроматография. Методики очистки антител, например, моноклональных антител, включая методики получения антител для фармацевтического применения, хорошо известны специалистам.
Фрагменты антител по изобретению могут быть получены из антител методами, которые включают гидролиз ферментами, такими как пепсин или папаин, и/или путем расщепления дисульфидных связей химическим восстановлением. Альтернативно, фрагменты антител могут быть получены путем клонирования и экспрессии части последовательностей тяжелых или легких цепей. "Фрагменты" антител могут включать фрагменты Fab, Fab', F(ab')2 и Fv. Изобретение также охватывает одноцепочечные фрагменты Fv (scFv), выделенные из тяжелых и легких цепей моноклонального антитела по изобретению, например, изобретение включает scFv, содержащий CDR антитела по изобретению. Также включены мономеры и димеры тяжелых или легких цепей, однодоменные антитела из фрагмента тяжелой цепи, однодоменные антитела из фрагмента легкой цепи, а также одноцепочечные антитела, например, одноцепочечный Fv, в котором вариабельные домены тяжелой и легкой цепей соединены пептидным линкером.
Фрагменты антител по изобретению могут придавать способность к моновалентным или мультивалентным взаимодействиям и входить в состав различных структур, как описано выше. Например, могут быть синтезированы молекулы scFv для создания тривалентного "триатела" (triabody) или тетравалентного "тетратела" (tetrabody). Молекулы scFv могут включать домен из области Fc, с образованием в результате бивалентных минител. Кроме того, последовательности по изобретению могут быть компонентом мультиспецифических молекул, в которых последовательности по изобретению нацелены на эпитопы по изобретению, и другие участки молекулы связываются с другими мишенями. Типичные примеры молекул включают, без ограничений, биспецифический Fab2, триспецифический Fab3, биспецифический scFv и диатела (Holligerand Hudson, 2005, Nature Biotechnology 9:1126-1136).
Стандартные методики молекулярной биологии могут быть использованы для получения ДНК последовательностей, кодирующих антитела или фрагменты антител по настоящему изобретению. Желательные ДНК последовательности могут быть синтезированы полностью или частично с использованием методик олигонуклеотидного синтеза. При необходимости, могут быть использованы методики сайт-направленного мутагенеза и полимеразной цепной реакции (ПЦР).
Любая пригодная система клетка-хозяин/вектор может быть использована для экспрессии ДНК последовательностей, кодирующих молекулы антител по настоящему изобретению или их фрагменты. Бактериальные, например, Е.coli, и другие микробиологические системы могут быть использованы, частично, для экспрессии фрагментов антител, таких как фрагменты Fab и F(ab')2 и, особенно, фрагменты Fv и одноцепочечные фрагменты антител, например, одноцепочечные Fv. Системы экспрессии на основе эукариотических, например, принадлежащих млекопитающим, клеток-хозяев могут быть использованы для продуцирования более крупных молекул антител, включая полные молекулы антител. Пригодные клетки-хозяева млекопитающих включают клетки СНО, HEK293T, PER.C6, NS0, миеломы или гибридомы.
Настоящее изобретение также предусматривает способ продуцирования молекулы антитела в соответствии с настоящим изобретением, включающий культивацию клетки-хозяина, содержащей вектор, кодирующий нуклеиновую кислоту по настоящему изобретению, в условиях, пригодных для обеспечения экспрессии белка из ДНК, кодирующей молекулу антитела по настоящему изобретению, и выделение молекулы антитела.
Молекула антитела может содержать только полипептид тяжелой или легкой цепи, и в этом случае для трансфекции клеток-хозяев должна быть использована последовательность, кодирующая только полипептид тяжелой цепи или легкой цепи. Для получения продуктов, содержащих как тяжелые, так и легкие цепи, клеточная линия может быть трансфицирована двумя векторами, причем первый вектор кодирует легкую цепь полипептида и второй вектор кодирует тяжелую цепь полипептида. Альтернативно, может быть использован один вектор, содержащий последовательности, кодирующие полипептиды легкой цепи и тяжелой цепи.
Альтернативно, антитела в соответствии с изобретением могут быть получены путем i) экспрессии последовательности нуклеиновой кислоты в соответствии с изобретением в клетке-хозяине, и ii) выделения экспрессируемого продукта антитела. Дополнительно, способ может включать iii) очистку антитела.
Скрининг трансформированных В-клеток, культивируемые отдельные клетки плазмы и трансфицированные клетки HEK293T
Трансформированные В клетки и культивируемые отдельные клетки плазмы могут быть подвергнуты скринингу для определения клеток, продуцирующих антитела с желательной специфичностью или функцией.
Стадия скрининга может быть проведена методом иммунологического анализа, например, ELISA, окрашиванием тканей или клеток (включая трансфицированные клетки), методом анализа нейтрализации или одним из ряда других известных специалистам методов идентификации желательной специфичности или функции. Анализ может осуществлять селекцию на основании простого распознавания одного или нескольких антигенов, или может осуществлять селекцию на основании дополнительной желательной функции, например, отбирать нейтрализующие антитела, а не просто антигенсвязывающие антитела, отбирать антитела, которые могут изменять характеристики клеток-мишеней, такие как их сигнальные каскады, их форму, их скорость роста, их способность влиять на другие клетки, их реакцию на воздействие других клеток или других реагентов или на изменение условий, их состояние дифференцировки и т.д.
Индивидуальные трансформированные клоны В-клеток могут затем быть получены из культур позитивных трансформированных В-клеток. Стадия клонирования для выделения индивидуальных клонов из смеси позитивных клеток может быть проведена с использованием предельного разбавления, микроманипуляции, осаждения отдельных клеток путем сортировки клеток или другим способом, известным специалистам.
Нуклеиновая кислота из культивируемых отдельных клеток плазмы может быть выделена, клонирована и экспрессирована в клетках HEK293T или других клетках-хозяевах с использованием способов, известных специалистам.
Иммортализованные клоны В-клеток или трансфицированных клеток HEK293T по изобретению могут быть использованы различными способами, например, в качестве источника моноклональных антител, в качестве источника нуклеиновой кислоты (ДНК или мРНК), кодирующей моноклональное антитело, представляющее интерес для исследований, и т.д.
Изобретение предусматривает композицию, содержащую иммортализованные В-клетки памяти или трансфицированные клетки-хозяева, продуцирующие антитела, которые нейтрализуют по меньшей мере два разных субтипа вируса гриппа А, выбранных из субтипов группы 1 и группы 2.
Эпитопы
Как было указано выше, антитела по изобретению могут быть использованы для картирования эпитопов, с которыми они связываются. Авторы изобретения обнаружили, что антитела, нейтрализующие инфекцию вируса гриппа А, направлены против эпитопов, присутствующих на ГА. В одном варианте исполнения, антитела направлены на один или несколько эпитопов в области стебля ГА, являющихся консервативными для одного или нескольких субтипов вируса гриппа А группы 1 и группы 2. Эпитопы, с которыми связываются антитела по изобретению, могут быть линейными (непрерывными) или конформационными (прерывистыми). В одном варианте исполнения, антитела и фрагменты антител по изобретению связываются с участком полипептида, содержащим SEQ ID NO:37, 38, 39 или 40, как описано тут.
Эпитопы, распознаваемые антителами по настоящему изобретению, могут использоваться в различных целях. Эпитоп и его мимотопы в очищенной или синтетической форме могут быть использованы для усиления иммунных ответов (т.е., в качестве вакцины или для продуцирования антител для другого применения) или для скрининга сывороток на антитела, иммунореактивные по отношению к эпитопу или его мимотопам. В одном варианте исполнения, такой эпитоп или мимотоп, или антиген, содержащий такой эпитоп или мимотоп, могут быть использованы в качестве вакцины для усиления иммунного ответа. Антитела и фрагменты антител по изобретению также могут быть использованы в методах контроля качества вакцины. В частности, антитела могут быть использованы для проверки того, чтобы антиген в вакцине содержал точный иммуногенный эпитоп в правильной конформации.
Эпитоп может также использоваться для скрининга лигандов, которые связываются с указанным эпитопом. Такие лиганды, включают, без ограничений, антитела; включая полученные от верблюдов, акул и других видов животных, фрагменты антител, пептиды, продукты технологии фагового дисплея, аптамеры, аднектины или фрагменты других вирусных или клеточных белков, которые могут блокировать эпитоп и, таким образом, предотвращать инфекцию. Такие лиганды включены в объем изобретения.
Рекомбинантная экспрессия
Иммортализованные клоны В-клеток или культивируемые клетки плазмы по изобретению также могут быть использованы в качестве источника нуклеиновой кислоты для клонирования генов антител для последующей рекомбинантной экспрессии. Экспрессия из рекомбинантных источников чаще используется в фармацевтических целях, чем экспрессия из В-клеток или гибридом, например, по причинам стабильности, воспроизводимости, простоты культивации и т.д.
Таким образом, изобретение предусматривает способ получения рекомбинантной клетки, включающий стадии: (i) получения одной или нескольких нуклеиновых кислот (например, мРНК тяжелой и/или легкой цепи) из клона В-клеток или культивируемых отдельных клеток плазмы, которые кодируют представляющее интерес антитело; (ii) вставки нуклеиновой кислоты в вектор экспрессии, и (iii) трансфекции вектора в клетку-хозяина для обеспечения экспрессии представляющего интерес антитела в данной клетке-хозяине.
Аналогично, изобретение предусматривает способ получения рекомбинантной клетки, включающий стадии: (i) секвенирования нуклеиновой кислоты (кислот) из клона В-клеток или культивируемых отдельных клеток плазмы, которые кодируют антитело, представляющее интерес; и (ii) использование информации о последовательности со стадии (i) для получения нуклеиновой кислоты (кислот) для вставки в клетку-хозяина с целью обеспечения экспрессии антитела, представляющего интерес, в данной клетке-хозяине. Нуклеиновая кислота может, но не обязательно, быть подвергнута манипуляциям между стадиями (i) и (ii) для введения сайтов рестрикции, для изменения частоты использования кодонов, и/или для оптимизации регуляторных последовательностей транскрипции и/или трансляции.
Изобретение также предусматривает способ получения трансфицированной клетки-хозяина, включающий стадию трансфекции клетки-хозяина одной или несколькими нуклеиновыми кислотами, кодирующими представляющее интерес антитело, где нуклеиновые кислоты представляют собой нуклеиновые кислоты, полученные из иммортализованного клона В-клеток или культивируемых отдельных клеток плазмы по изобретению. Таким образом, процедуры получения сначала нуклеиновой кислоты (кислот) и затем ее использования для трансфекции клетки-хозяина могут производиться в разное время разными людьми в разных местах (например, в разных странах).
Такие рекомбинантные клетки по изобретению могут быть затем использованы для экспрессии и культивации. Они являются особенно пригодными для экспрессии антител в крупномасштабном фармацевтическом производстве. Они также могут быть использованы в качестве активного ингредиента фармацевтической композиции. Могут быть использованы любые пригодные методики культивации, включая, без ограничений, статическую культуру, культуру во вращающемся флаконе, асцитическую жидкость, картриджи биореактора из пустотелого волокна, модульные мини-ферментеры, емкость с перемешиванием, культуру на микроносителях, перфузию через керамическую сердцевину и т.д.
Способы получения и секвенирования генов иммуноглобулина из В-клеток или клеток плазмы хорошо известны специалистам (например, см. Главу 4 в Kuby Immunology, 4th edition, 2000).
Трансфицированная клетка-хозяин может быть эукариотической клеткой, включая дрожжевые и животные клетки, особенно, клетки млекопитающих (например, клетки СНО, клетки NS0, клетки человека, такие как клетки PER.C6 (Jones et al 2003) или HKB-11 (Cho et al. 2001; Cho et al. 2003), клетки миеломы (US 5807715; US 6300104 и т.д.)), а также растительные клетки. Предпочтительные хозяева экспрессии могут гликозилировать антитело по изобретению, в частности, углеводными структурами, которые сами по себе не являются иммуногенными для людей. В одном варианте исполнения, трансфицировання клетка-хозяин может быть способной к росту в бессывороточной среде. В дополнительном варианте исполнения, трансфицированная клетка-хозяин может быть способной к росту в культуре, не содержащей продуктов животного происхождения. Трансфицированная клетка-хозяин также может культивироваться для получения клеточной линии.
Изобретение предусматривает способ получения одной или нескольких молекул нуклеиновых кислот (например, генов тяжелой и легкой цепей), кодирующих представляющее интерес антитело, включающий стадии: (i) получения иммортализованного клона В-клеток или культивирования клетки плазмы в соответствии с изобретением; (ii) получения из клона В-клеток или культивируемой отдельной клетки плазмы нуклеиновой кислоты, которая кодирует представляющее интерес антитело. Изобретение также предусматривает способ получения последовательности нуклеиновой кислоты, кодирующей представляющее интерес антитело, включающий стадии: (i) получения иммортализованного клона В-клеток или культивирования отдельной клетки плазмы в соответствии с изобретением; (ii) секвенирования из клона В-клеток или культивируемой клетки плазмы нуклеиновой кислоты, которая кодирует представляющее интерес антитело.
Изобретение также предусматривает способ получения молекулы (молекул) нуклеиновой кислоты, которые кодируют представляющее интерес антитело, включающий стадию получения нуклеиновой кислоты, получаемой из клона трансформированных В-клеток или культивируемой клетки плазмы по изобретению. Таким образом, процедуры получения сначала клона В-клеток или культивируемой клетки плазмы и затем получения нуклеиновой кислоты (кислот) из клона В-клеток или культивируемой клетки плазмы могут производиться в совершенно разное время разными людьми в разных местах (например, в разных странах).
Изобретение предусматривает способ получения антитела (например, для фармацевтического применения), включающий стадии: (i) получения и/или секвенирования одной или нескольких нуклеиновых кислот (например, генов тяжелой и легкой цепей) из выбранного клона В-клеток или культивируемой клетки плазмы, экспрессирующих представляющее интерес антитело; (ii) введения нуклеиновой кислоты (кислот) в, или использования последовательности (последовательностей) нуклеиновой кислоты (кислот), для получения вектора экспрессии; (iii) трансфекции клетки-хозяина, которая может экспрессировать представляющее интерес антитело; (iv) культивации или субкультивации трансфицированной клетки-хозяина в условиях, при которых протекает экспрессия представляющего интерес антитела; и, необязательно, (v) очистки антитела, представляющего интерес.
Изобретение также предусматривает способ получения антитела, включающий стадии: культивации или субкультивации популяции трансфицированных клеток-хозяев в условиях, при которых протекает экспрессия представляющего интерес антитела и, необязательно, очистки антитела, представляющего интерес, в котором указанная популяция трансфицированных клеток-хозяев была получена путем (i) обеспечения нуклеиновой кислоты (кислот), кодирующих выбранное представляющее интерес антитело, продуцируемое клоном В-клеток или культивируемой клеткой плазмы, полученными, как описано выше, (ii) вставки нуклеиновой кислоты (кислот) в вектор экспрессии, (iii) трансфекции вектора в клетку-хозяина, которая может экспрессировать представляющее интерес антитело, и (iv) культивации или субкультивации трансфицированной клетки-хозяина, содержащей вставленные нуклеиновые кислоты для получения представляющего интерес антитела. Таким образом, процедуры получения сначала рекомбинантной клетки-хозяина и затем ее культивации с целью экспрессии антитела могут производиться в совершенно разное время разными людьми в разных местах (например, в разных странах).
Фармацевтические композиции
Изобретение предусматривает фармацевтическую композицию, содержащую антитела и/или фрагменты антител по изобретению и/или нуклеиновую кислоту, кодирующую такие антитела, и/или эпитопы, распознаваемые антителами по изобретению. Фармацевтическая композиция может также содержать фармацевтически приемлемый носитель для обеспечения возможности введения. Носитель не должен сам по себе индуцировать продуцирования антител, вредных для особы, принимающей композицию, и не должен быть токсичным. Пригодными носителями могут быть крупные, медленно метаболизирующиеся макромолекулы, такие как белки, полипептиды, липосомы, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот и инактивированные вирусные частицы.
Могут быть использованы фармацевтически приемлемые соли, например, соли минеральных кислот, такие как гидрохлориды, гидробромиды, фосфаты и сульфаты, или соли органических кислот, такие как ацетаты, пропионаты, малонаты и бензоаты.
Фармацевтически приемлемые носители в терапевтических композициях могут дополнительно содержать жидкости, такие как вода, солевой раствор, глицерин и этанол. Дополнительно, в таких композициях могут присутствовать вспомогательные вещества, такие как смачивающие агенты или эмульгаторы, или буферные вещества для регулирования рН. Такие носители позволяют изготавливать фармацевтические композиции в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, дисперсий и суспензий, для приема внутрь пациентом.
В пределах объема изобретения, формы для введения могут включать формы, пригодные для парентерального введения, например, путем инъекции или инфузии, например, болюсной инъекции или непрерывной инфузии. В тех случаях, когда продукт предназначен для инъекции или инфузии, он может иметь форму суспензии, раствора или эмульсии в масляном или водном носителе, и может содержать агенты для приготовления композиций, такие как суспендирующие агенты, консерванты, стабилизаторы и/или диспергенты. Альтернативно, молекула антитела может находиться в сухой форме, предназначенной для восстановления перед применением соответствующей стерильной жидкостью.
После составления рецептуры, композиции по изобретению могут быть введены непосредственно субъекту. В одном варианте исполнения, композиции адаптированы для введения людям.
Фармацевтическая композиция по настоящему изобретению может быть введена с использованием любого числа путей, включая, без ограничений, пероральный, внутривенный, внутримышечный, интраартериальный, интрамедуллярный, интраперитонеальный, интратекальный, интравентрикулярный, трансдермальный, чрескожный, местный, подкожный, интраназальный, энтеральный, сублингвальный, интравагинальный или ректальный пути. Продукты в аэрозольных упаковках (hyposprays) также могут быть использованы для введения фармацевтических композиций по изобретению. Типично, терапевтические композиции могут быть приготовлены в виде препаратов для инъекций, таких как жидкие растворы или суспензии. Также могут быть приготовлены твердые формы, пригодные для растворения или суспендирования в жидких носителях перед инъекцией.
Прямая доставка композиций будет обычно осуществляться путем инъекции, подкожно, интраперитонеально, внутривенно или внутримышечно, или путем доставки в интерстициальное пространство ткани. Композиции также могут быть введены на участки поражения. Дозировка курса лечения может предусматривать введение однократной дозы или введение кратных доз по графику. Известные фармацевтические препараты на основе антител позволяют получить общее представление о частоте введения, например, должен ли фармацевтический препарат вводиться ежедневно, еженедельно, ежемесячно и т.д. Частота и дозировка могут также зависеть от тяжести симптомов.
Композиции по изобретению могут быть приготовлены в различных формах. Например, композиции могут быть приготовлены в виде препаратов для инъекций, таких как жидкие растворы или суспензии. Также могут быть изготовлены твердые формы, пригодные для растворения или суспендирования в жидких носителях перед инъекцией (например, лиофилизированные композиции, такие как Synagis™ и Herceptin™, предназначенные для восстановления стерильной водой, содержащей консервант). Композиция может быть приготовлена для местного введения, например, в виде жидкой мази, крема или порошка. Композиция может быть приготовлена для перорального введения, например, в виде таблетки или капсулы, в виде спрея или сиропа (необязательно, с вкусовыми добавками). Композиция может быть приготовлена для легочного введения, например, в виде ингалятора, с использованием тонкодисперсного порошка или спрея. Композиция может быть изготовлена в виде суппозитория или вагинального суппозитория. Композиция может быть приготовлена для назального, ушного или глазного введения, например, в виде капель. Композиция может иметь форму набора, составленного таким образом, чтобы объединенная композиция восстанавливалась непосредственно перед введением пациенту. Например, лиофилизированное антитело может быть обеспечено в виде набора со стерильной водой или стерильным буфером.
Следует понимать, что активным ингредиентом в композиции будет молекула антитела, фрагмент антитела или его варианты и производные. Как таковые, они будут подвергаться деградации в желудочно-кишечном тракте. Таким образом, если композиция должна вводиться путем, проходящим через желудочно-кишечный тракт, композиция должна будет содержать агенты, которые защищают антитело от деградации, но высвобождают антитело после его всасывания из желудочно-кишечного тракта.
Детальное описание фармацевтически приемлемых носителей приведено в Gennaro (2000) Remington: The Science and Practice of Pharmacy, 20th edition, ISBN: 0683306472.
Фармацевтические композиции по изобретению обычно имеют значение рН от 5,5 до 8,5, в некоторых вариантах исполнения оно может находиться в интервале значений от 6 до 8 и, в дополнительном варианте исполнения, быть равным примерно 7. Величина рН может поддерживаться с помощью буфера. Композиция может быть стерильной и/или апирогенной. Композиция может быть изотонической для людей. В одном варианте исполнения, фармацевтические композиции по изобретению поставляются в герметично упакованных контейнерах.
Фармацевтические композиции будут содержать эффективное количество одного или нескольких антител по изобретению и/или полипептида, содержащего эпитоп, который связывает антитело по изобретению, т.е., количество, являющееся достаточным для лечения, облегчения или предотвращения требуемого заболевания или состояния, или для проявления детектируемого терапевтического эффекта. Терапевтические эффекты также включают ослабление физических симптомов. Точная величина эффективного количества для любого конкретного субъекта будет зависеть от его размеров и состояния здоровья, характера и степени проявления состояния, и терапевтического средства или комбинации терапевтических средств, выбранных для введения. Эффективное количество в конкретной ситуации определяется обычным экспериментированием и на усмотрение клинического врача. В целях настоящего изобретения, эффективная доза будет обычно составлять от примерно 0,01 мг/кг до примерно 50 мг/кг, или от примерно 0,05 мг/кг до примерно 10 мг/кг, композиций по настоящему изобретению для индивидуума, которому производится введение. Известные фармацевтические средства на основе антител позволяют получить об этом общее представление, например, Herceptin™ вводится путем внутривенной инфузии раствора с концентрацией 21 мг/мл, при начальной ударной дозе 4 мг/кг веса тела и еженедельной поддерживающей дозе 2 мг/кг веса тела; Rituxan™ вводится еженедельно по 375 мг/м2; и т.д.
В одном варианте исполнения, композиции могут содержать более одного (например, 2, 3, и т.д.) антитела по изобретению для обеспечения аддитивного или синергичного терапевтического эффекта. В другом варианте исполнения, композиция может содержать одно или несколько (например, 2, 3, и т.д.) антител по изобретению и одно или несколько (например, 2, 3, 4, 5 и т.д.) дополнительных антител против вируса гриппа А. Например, одно антитело может связываться с эпитопом ГА, а другое может связываться с другим эпитопом ГА, или с эпитопом, расположенным на нейраминидазе и/или белках матрикса. Кроме того, в объем изобретения входит введение антител по изобретению вместе с вакциной против гриппа А или с антителами, обладающими специфичостями, отличными от вируса гриппа А. Антитела по изобретению могут быть введены в комбинации/одновременно или в разное время, с вакциной против гриппа или с антителами, обладающими специфичостями, отличными от вируса гриппа А.
В другом варианте исполнения, изобретение предусматривает фармацевтическую композицию, содержащую два или больше антител, в которой первое антитело представляет собой антитело по изобретению и является специфическим по отношению к эпитопу ГА, и второе антитело является специфическим по отношению к эпитопу нейраминидазы, второму эпитопу ГА и/или эпитопу матрикса. Например, изобретение предусматривает фармацевтическую композицию, содержащую два или больше антител, в которой первое антитело является специфическим по отношению к эпитопу в стебле ГА вируса гриппа А, и второе антитело является специфическим по отношению к эпитопу нейраминидазы, второму эпитопу ГА (например, эпитопу в глобулярной головке ГА, второму эпитопу в стебле ГА), и/или эпитопу матрикса. Второй эпитоп в стебле или эпитоп в глобулярной головке ГА вируса гриппа А может, но не обязательно, быть консервативным для нескольких субтипов вируса гриппа А.
В еще одном варианте исполнения, изобретение предусматривает фармацевтическую композицию, содержащую два или больше антител, в которой первое антитело является специфическим по отношению к эпитопу нейраминидазы и второе антитело является специфическим по отношению к второму эпитопу нейраминидазы, эпитопу ГА и/или эпитопу матрикса.
В еще одном варианте исполнения, изобретение предусматривает фармацевтическую композицию, содержащую два или больше антител, в которой первое антитело является специфическим по отношению к эпитопу матрикса и второе антитело является специфическим по отношению к второму эпитопу матрикса, эпитопу на ГА и/или нейраминидазе.
Типичные примеры антител по изобретению, специфических по отношению к белку-мишени вируса гриппа А, включают, без ограничений, вариант 1 FI6, вариант 2 FI6, вариант 1 FI28 или вариант 2 FI28.
В одном варианте исполнения, изобретение предусматривает фармацевтическую композицию, содержащую вариант 1 антитела FI6 или его антигенсвязывающий фрагмент и фармацевтически приемлемый носитель. В другом варианте исполнения, изобретение предусматривает фармацевтическую композицию, содержащую вариант 2 антитела FI6 или его антигенсвязывающий фрагмент и фармацевтически приемлемый носитель. В еще одном варианте исполнения, изобретение предусматривает фармацевтическую композицию, содержащую вариант 1 антитела FI28 или его антигенсвязывающий фрагмент и фармацевтически приемлемый носитель. В еще одном варианте исполнения, изобретение предусматривает фармацевтическую композицию, содержащую вариант 2 антитела FI28 или его антигенсвязывающий фрагмент и фармацевтически приемлемый носитель.
Антитела могут быть введены (в комбинации или раздельно) с другими терапевтическими средствами, например, с химиотерапевтическими соединениями, с радиотерапией и т.д. В одном варианте исполнения, терапевтические соединения включают антивирусные соединения, такие как Tamiflu™. Такая комбинированная терапия обеспечивает аддитивное или синергичное увеличение терапевтической эффективности по сравнению с индивидуальными терапевтическими агентами при их введении по отдельности. Термин "синергия" используется для описания объединенного эффекта двух или больше активных агентов, который превышает сумму индивидуальных эффектов для каждого соответствующего активного агента. Таким образом, в тех случаях. когда комбинированный эффект двух или больше агентов приводит к "синергичному ингибированию" активности или процесса, подразумевается, что степень ингибирования активности или процесса превышает сумму ингибирующих эффектов каждого соответствующего активного агента. Термин "синергичный терапевтический эффект" относится к терапевтическому эффекту, наблюдаемому для комбинации двух или больше терапий, когда терапевтический эффект (измеряемый по любому числу параметров) превышает сумму индивидуальных терапевтических эффектов, наблюдаемых при соответствующих индивидуальных терапиях.
Антитела или фрагменты антител могут быть введены тем пациентам, которые ранее не проявляли отклика на лечение инфекции вируса гриппа А, т.е., оказались невосприимчивыми к противогриппозному лечению. Такое лечение может включать предшествующее лечение антивирусным агентом. Это может быть связано, например, с инфекцией штаммом вируса гриппа А, резистентным к антивирусным средствам.
В одном варианте исполнения, композиция по изобретению может содержать антитела по изобретению, где антитела могут составлять по меньшей мере 50% мае. (например, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% или больше) от общего белка в композиции. В такой композиции, антитела находятся в очищенной форме.
Изобретение предусматривает способ приготовления фармацевтического средства, включающий стадии: (i) получения антитела по изобретению; и (ii) смешения очищенного антитела с одним или несколькими фармацевтически приемлемыми носителями.
Изобретение также предусматривает способ приготовления фармацевтического средства, включающий стадию смешения антитела с одним или несколькими фармацевтически приемлемыми носителями, в котором антитело представляет собой моноклональное антитело, полученое из трансформированной В-клетки или культивируемой клетки по изобретению. Таким образом, процедуры сначала получения моноклонального антитела и затем приготовления фармацевтического средства могут производиться в совершенно разное время разными людьми в разных местах (например, в разных странах).
В качестве альтернативы доставке антитела или В-клеток в терапевтических целях, можно осуществлять доставку субъекту нуклеиновой кислоты (типично, ДНК), полученной из В-клетки или культивируемой клетки плазмы, которая кодирует представляющее интерес моноклональное антитело (или его активный фрагмент), так чтобы нуклеиновая кислота могла экспрессироваться у субъекта in situ для обеспечения желательного терапевтического эффекта. Пригодные методы генной терапии и векторы доставки нуклеиновых кислот известны специалистам.
Композиции по изобретению могут быть иммуногенными композициями и, в некоторых вариантах исполнения, могут быть композициями вакцины, содержащими антиген, содержащий эпитоп, распознаваемый антителом по изобретению. Вакцины в соответствии с изобретением могут быть профилактическими (т.е., для предотвращения инфекции) или терапевтическими (т.е., для лечения инфекции). В одном варианте исполнения, изобретение предусматривает вакцину, содержащую полипептид, содержащий аминокислотную последовательность SEQ ID NO:37, 38, 39 или 40.
Композиции могут содержать противомикробное средство, особенно, упакованные в виде кратных доз. Композиции могут содержать поверхностно-активное вещество, например, твин (Tween) (полисорбат), такой как Tween 80. Поверхностно-активные вещества обычно присутствуют в низких количествах, например, <0,01%. Композиции могут также содержать соли натрия (например, хлорид натрия) для обеспечения тоничности. Типичная концентрация составляет 10±2 мг/мл NaCl.
Композиции могут содержать сахароспирт (например, маннит) или дисахарид (например, сахарозу или трегалозу) например, в количестве примерно 15-30 мг/мл (например, 25 мг/мл), особенно в тех случаях, когда они должны быть лиофилизированы или когда они содержат материал, восстановленный из лиофилизированного материала. Величина рН композиции для лиофилизации может быть отрегулирована до примерно 6,1 перед лиофилизацией.
Композиции по изобретению могут также содержать один или несколько иммунорегуляторных агентов. В одном варианте исполнения, один или несколько иммунорегуляторных агентов включает (включают) адъювант.
Композиции эпитопа по изобретению могут вызывать медиируемый клетками иммунный ответ, а также гуморальный иммунный ответ, с целью эффективного реагирования на инфекцию вируса гриппа А. Этот иммунный ответ может индуцировать длительный (например, нейтрализующий) гуморальный и клеточно-опосредованный иммунитет, которые могут быстро проявляться при воздействии вируса гриппа А.
Консервативные виды лечения и применение
Антитела и фрагменты антител по изобретению или их производные и варианты могут быть использованы для лечения инфекции вируса гриппа А, для профилактики инфекции вируса гриппа А или для диагностики инфекции вируса гриппа А.
Способы диагностики могут включать введение в контакт антитела или фрагмента антитела с образцом. Такие образцы могут быть образцами ткани, взятыми, например, из носовых ходов, полостей пазух, слюнных желез, легких, печени, поджелудочной железы, почки, уха, глаза, плаценты, пищеварительного тракта, сердца, яичников, гипофиза, надпочечников, щитовидной железы, мозга или кожи. Способы диагностики могут также включать детектирование комплекса антиген/антитело.
Изобретение, таким образом, предусматривает (i) антитело, фрагмент антитела или их варианты и производные в соответствии с изобретением, (ii) иммортализованный клон В-клеток в соответствии с изобретением, (iii) эпитоп, способный связывать антитело по изобретению, или (iv) лиганд, предпочтительно, антитело, способный связывать эпитоп, который связывает антитело по изобретению, для использования в терапии.
Изобретение также предусматривает способ лечения субъекта, включающий введение данному субъекту антитела, фрагмента антитела или их вариантов и производных в соответствии с изобретением, или лиганда, предпочтительно, антитела, способного связывать эпитоп, который связывает антитело по изобретению. В одном варианте исполнения, способ приводит к ослаблению инфекции вируса гриппа А у субъекта. В другом варианте исполнения, способ предупреждает, снижает риск или замедляет инфекцию вируса гриппа А у субъекта.
Изобретение также предусматривает использование (i) антитела, фрагмента антитела или их вариантов и производных в соответствии с изобретением, (ii) иммортализованного клона В-клеток в соответствии с изобретением, (iii) эпитопа, способного связывать антитело по изобретению, или (iv) лиганда, предпочтительно, антитела, которое связывается с эпитопом, способным связывать антитело по изобретению, в производстве лекарственного средства для профилактики или лечения инфекции вируса гриппа А.
Изобретение предусматривает композицию по изобретению для использования в качестве лекарственного средства для профилактики или лечения инфекции вируса гриппа А. Оно также предусматривает использование антитела по изобретению и/или белка, содержащего эпитоп, с которым связывается такое антитело, в производстве лекарственного средства для лечения субъекта и/или диагностики субъекта. Оно также предусматривает способ лечения субъекта, включающий стадию введения субъекту композиции по изобретению. В некоторых вариантах исполнения, субъект может быть человеком. Один из способов проверки эффективности терапевтического лечения включает мониторинг симптомов болезни после введения композиции по изобретению. Лечение может проводиться путем введения разовой дозы или по схеме введения кратных доз.
В одном варианте исполнения, антитело, фрагмент антитела, иммортализованный клон В-клеток, эпитоп, или композиция в соответствии с изобретением вводятся субъекту, нуждающемуся в таком лечении. Такой субъект включает, без ограничений, особу, подверженную риску, или восприимчивую к, инфекции вируса гриппа А, включая, например, иммунологически скомпрометированного субъекта. Антитело или фрагмент антитела по изобретению также могут быть использованы для пассивной иммунизации или активной вакцинации.
Антитела и их фрагменты, как описано в настоящем изобретении, также могут быть использованы в наборе для диагностики инфекции вируса гриппа А. Кроме того, эпитопы, способные связывать антитело по изобретению, могут быть использованы в наборе для контроля эффективности процедур вакцинации путем детектирования присутствия защитных антител против вируса гриппа А. Антитела, фрагменты антител или их варианты и производные, как описано в настоящем изобретении, также могут быть использованы в наборе для контроля производства вакцины с желательной иммуногенностью.
Изобретение также предусматривает способ изготовления фармацевтического средства, включающий стадию смешения моноклонального антитела с одним или несколькими фармацевтически приемлемыми носителями, где моноклональное антитело представляет собой моноклональное антитело, полученное от трансфицированной клетки-хозяина по изобретению. Таким образом, процедуры сначала получения монокпонального антитела (например, его экспрессией и/или его очисткой) и затем его смешения с фармацевтическим носителем (носителями) могут производиться в совершенно разное время разными людьми в разных местах (например, в разных странах).
Начиная с трансформированной В-клетки или культивируемой клетки плазмы по изобретению, могут выполняться различные стадии культивации, субкультивации, клонирования, субклонирования, секвенирования, получения нуклеиновых кислот и т.д., с целью увеличения продолжительности жизни антитела, экспрессируемого трансформированной В-клеткой или культивируемой клеткой плазмы, с необязательной оптимизацией каждой стадии. В предпочтительном варианте исполнения, вышеуказанные способы дополнительно включают методики оптимизации (например, созревание или оптимизация аффинности), применяемые к нуклеиновым кислотам, кодирующим антитело. Изобретение охватывает все клетки, нуклеиновые кислоты, векторы, последовательности, антитела и т.д., используемые и получаемые на таких стадиях.
Во всех таких способах, нуклеиновая кислота, используемая в хозяине экспрессии, может подвергаться манипуляциям с целью вставки, делеции или внесения изменений в определенные последовательности нуклеиновой кислоты. Изменения, полученные в результате таких манипуляций, включают, без ограничений, изменения с целью введения сайтов рестрикции, изменения статистики употребления кодонов, добавления или оптимизации регуляторных последовательностей транскрипции и/или трансляции, и т.д. Можно также производить замены нуклеиновых кислот для изменения кодируемых аминокислот. Например, может оказаться полезным выполнение одного или нескольких (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и т.д.) замещений, делеции и/или инсерций аминокислот в аминокислотной последовательности антитела. Такие точечные мутации могут модифицировать эффекторные функции, антигенсвязывающее сродство, посттрансляционные модификации, иммуногенность и т.д., могут вводить аминокислоты для присоединения ковалентно связанных групп (например, меток), или могут вводить метки (например, с целью очистки). Мутации могут вводиться в конкретные сайты или могут вводиться случайным образом, с последующей селекцией (например, молекулярной эволюцией). Например, одна или несколько нуклеиновых кислот, кодирующих любой из участков CDR, вариабельные участки тяжелой цепи или вариабельные участки легкой цепи антител по изобретению, могут быть случайным образом или направленно мутированы для придания различных свойств кодируемым аминокислотам. Такие изменения могут быть результатом итерационного процесса, при котором сохраняются начальные изменения и вводятся новые изменения в других положениях нуклеотидов. Кроме того, изменения, полученные на независимых стадиях, могут быть объединены. Различные свойства, придаваемые кодированным аминокислотам, могут включать, без ограничений, повышение аффинности.
Общие положения
Термин "содержащий" охватывает "включающий", а также "состоящий из", например, композиция, "содержащая" X, может состоять исключительно из Х или можеть включать что-то дополнительно, например, Х+Y.
Слова "по существу" не исключают "полностью", например, композиция, которая "по существу не содержит" Y, могут совершенно не содержать Y. При необходимости, слова "по существу" в формулировках изобретения могут быть опущены.
Термин "примерно", по отношению к численному значению х, означает, например, х±10%.
Термин "болезнь", в используемом тут значении, должен рассматриваться как в общем синонимичный, и используемый взаимозаменяемо, с терминами "расстройство" и "состояние" (такое как медицинское состояние), в той мере, в которой все они описывают аномальное состояние организма человека или животного или одной из его частей, нарушающее нормальное функционирование, что типично проявляется посредством отличительных признаков и симптомов и приводит к снижению продолжительности или качества жизни человека или животного.
В используемом тут значении, указание на "лечение" субъекта или пациента должно включать предотвращение, профилактику и терапию. Термины "субъект" или "пациент" используются в данном описании взаимозаменяемо для обозначения всех млекопитающих, включая людей. Примеры субъектов включают людей, коров, собак, кошек, лошадей, коз, овец, свиней и кроликов. В одном варианте исполнения, пациент является человеком.
Примеры
Типичные варианты исполнения настоящего изобретения представлены в приведенных ниже примерах. Приведенные ниже примеры даны только с целью иллюстрации и в помощь рядовым специалистам при использовании изобретения. Примеры никоим образом не должны иначе ограничивать объем изобретения.
Пример 1. Получение и характеризация нейтрализующих антител с широким спектром действия против вируса гриппа А из клеток плазмы
Для идентификации особ, которые могут продуцировать гетеросубтиповые антитела в ответ на сезонную вакцину против гриппа (содержащую ГА Н1 и H3), мы провели скрининг с использованием методики ELISPOT циркулирующих клеток плазмы, отобранных в день 7 после ревакцинации, на их способность секретировать антитела, которые связываются с вакциной или с неродственным ГА Н5 (A/VN/1203/04). Неожиданно было обнаружено, что, в то время как у четырех из пяти обследованых доноров Н5-специфические клетки плазмы не детектировались, у одного донора 14% lgG-секретирующих клеток плазмы продуцировали антитела к Н5, а 57% продуцировали антитела к вакцине. Клетки CD138"" плазмы были выделены из моноядерных клеток периферической крови (РВМС), отобранных через 7 дней после вакцинации с помощью магнитных микробусин с последующей сортировкой клеток с использованием машины FACSAria. Предельные количества клеток плазмы высеивали на культуральные микропланшеты. Супернатанты культур тестировали в трех параллельных ELISA с использованием в качестве антигенов рекомбинантных ГА Н5 или Н9 и неспецифического антигена столбнячного анатоксина. Из 4928 подвергнутых скринингу супернатантов культур 12 связывались с ГА Н5, но не Н9, 25 - с ГА Н9, но не Н5, и 54 - с обоими Н5 и Н9. Некоторые из 54 культур с наивысшими сигналами оптической плотности (OD) подвергали ОТ-ПЦР, и были получены два спаренных гена VH и VL.
Гены VH и VL клонировали в векторы экспрессии и рекомбинантные антитела продуцировали путем трансфекции клеток HEK293T. Два моноклональные антитела, FI6 и FI28, содержат большинство одинаковых генных фрагментов V, D и J (IGHV3-30*01, IGHD3-9*01, IGHJ4*02 и IGKV4-1*01), но различаются в области N, по статистике использования IGKJ и по характеру соматических мутаций, и потому клонально не являются родственными.
Специфичность рекомбинантных антител исследовали методом ELISA с использованием панели ГА, принадлежащих к разным субтипам. Примечательно, что F16 связывал все тестируемые субтипы ГА гриппа А, включая группу 1 (Н1, Н5 и Н9) и группу 2 (H3 и Н7), но не связывал ГА вируса гриппа В. В отличие от него, FI28 связывался только с тремя ГА группы 1 (Н1, Н5 и Н9).
|
С учетом гомологии последовательностей VH и VL двух антител, были проведены эксперименты по перемешиванию (shuffling) с использованием Н- и L-цепей FI6, FI28 и 7113, hCMV-специфического антитела, использующего те же самые элементы V, D и J Н-цепи. Если связывание с Н7 требовало спаривания Н- и L-цепей FI6, связывание с Н5 сохранялось при перемешивании L-цепей FI6 и FI28. Кроме того, связывание Н5 также наблюдалось при спаривании Н-цепи FI6 с неродственной L-цепью 7113. В отличие от этого, связывание Н5 не наблюдалось, когда гомологичная Н-цепь 7113 спаривалась с L-цепью FI6. Без ограничения какой-либо конкретной теорией, эти результаты позволяют предположить, что основной вклад в связывание Н5 вносит Н-цепь, тогда как связывание Н7 требует точного спаривания Н- и L-цепей FI6.
Затем FI6 и FI28 были протестированы на их способность нейтрализовать субтипы группы 1 и группы 2 гриппа А с использованием псевдотипированных вирусов (Таблица 5), а также инфекционных вирусов (Таблица 6). Примечательно, что FI6 нейтрализовал все протестированные псевдовирусы, включая шесть изолятов Н5, принадлежащих к антигенно дивергентным кладам 0, 1, 2.1, 2.2 и 2.3, и два изолята птичьего Н7, Кроме того, FI6 нейтрализовал все протестированные инфекционные вирусы, включая два вируса H3N2 и четыре вируса H1N1, охватывающие несколько десятилетий, вплоть до изолята недавней пандемии H1N1 А/СА/04/09 (Таблица 6). FI28 нейтрализовал все псевдовирусы Н5, но не нейтрализовал псевдовирусы Н7, а также все протестированные инфекционные вирусы. Нейтрализующие титры к псевдовирусам были выше, чем титры к инфекционным вирусам.
|
|
Пример 2. Антигенсвязывающие сайты FI6 и FI28
Для идентификации антигенных сайтов, с которыми связываются антитела FI6 и FI28, мы сначала проверили их способность ингибировать связывание С179, мышиного моноклонального антитела, которое было картировано в консервативном участке области стебля ГА (Y, Okuno, et al., J Virol 67, 2552 (1993)). Как FI6, так и FI28 полностью ингибировали связывание С179 с рекомбинантным Н5 VN/1203/04 ГА, указывая на то, что они распознают перекрывающийся эпитоп. В отличие от этого, FI6 и FI28 не конкурировали с панелью Н5-специфических антител, выделенных у H5N1-иммунных доноров, которые распознают разные эпитопы в глобулярной головке ГА (С.Р. Simmons et al., PLoS Med 4, e178 (2007); S. Khurana et al., PLoS Med 6, e1000049 (2009)). Попытки картировать эпитоп FI6 путем селекции "ускользнувших" мутантов были неудачными, указывая на то, что его эпитоп не может легко мутировать без компрометации адекватности вируса (viral fitness).
Затем мы провели пептидное картирование с использованием библиотек линейных и циклизированных пептидов ГА A/VN/1194/04, а также сканирования спирали (helix-scan) с использованием систем Pepscan Presto BV (Leiystad, The Netherlands). Этот анализ идентифицировал связывающий участок FI6, который включает пептид слияния FGAIAG НА2 (аминокислоты 3-8, в соответствии с нумерацией H3; SEQ ID NO:37), пептид DGVTNKVNS А-спирали НА2 (аминокислоты 46-54; SEQ ID NO:38), пептид MENERTLDFHDSNVK В-спирали НА2 (аминокислоты 102-116; SEQ ID NO:39) и C-концевой пептид LVLATGLRNSP НА1 (аминокислоты 315-325; SEQ ID NO:40). Связывающие участки FI28 и FI6 отличались друг от друга, поскольку это антитело не реагировало с C-концевым пептидом НА1 и пептидом В-спирали НА2.
Список литературы
Okuno et al., (1993) Journal of Virology 67:2552-2558.
Gerhard et al., (2006) Emerging Infectious Diseases 12:569-574.
Gioia et al., (2008) Emerging Infectious Diseases 14:121-128.
US 3,766,162
US 3,791,932
US 3,817,837
US 4,233,402
US 4,676,980
US 4,831,175
US 5,595,721
WO00/52031
WO00/52473
US 4,766,106
US 4,179,337
US 4,495,285
US 4,609,546
Gabizon et al., (1982) Cancer Research 42:4734
Cafiso (1981) Biochem Biophys Acta 649:129
Szoka (1980) Ann. Rev. Biophys. Eng. 9:467
Poznansky et al., (1980) Drug Delivery Systems (R.L. Juliano, ed, Oxford, N.Y.) pp.253-315
Poznansky (1984) Pharm Revs 36:277
Kohler, G. and Milstein, C,. 1975, Nature 256:495-497.
Kozbar et al., 1983, Immunology Today 4:72.
WO2004/076677
Chapter 4 of Kuby Immunology (4th edition, 2000; ASIN: 0716733315
Jones et al., Biotechnol Prog 2003, 19(1):163-8
Cho et al., Cytotechnology 2001, 37:23-30
Cho et al., Biotechnol Prog 2003, 19:229-32
US 5,807,715
US 6,300,104
Rowe et al., (1999) J Clin Microbiol 37(4):937-43.
Temperton, et al., (2005). Emerg Infect Dis 11, 411-416.
Smirnov et al., (2000). Arch Virol 145, 1733-1741.
Smirnov et al., (1999). Acta Virol 43, 237-244.
Simmons et al., (2007). PLoS Med 4, e178.
Traggiai et al., (2004). Nat Med 10, 871-875.
|
|
|
|