Результат интеллектуальной деятельности: СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ГЕПАТИТА У ДЕТЕЙ
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к эфферентной терапии, и может быть использовано в медицинской практике для лечения хронического гепатита у детей
Хронический гепатит (ХГ) - полиэтиологическое воспалительное заболевание печени, продолжающееся не менее 6 месяцев. Распространенность данного заболевания в европейских странах составляет 0,69 случаев на 100000 населения, наиболее часто заболевание встречается среди лиц европеоидной расы. В структуре ХГ лидирующее место занимают ХГ B и ХГ C. ХГ C у детей, как правило, протекает клинически мягко, цитолитическая активность чаще не регистрируется, а морфологические изменения в печени весьма умеренны, однако у в 4-6% больных развивается выраженный фиброз и цирроз печени, поэтому им необходимо проводить противовирусную терапию. Основная цель лечения - уничтожить инфекцию с целью предотвращения более поздних осложнений в виде прогрессирования болезней печени, развития цирроза печени и гепатоцеллюлярной карциномы.
Аутоиммунный гепатит (АИГ) у детей - редкое заболевание, встречается у 1,2%-7,7% больных ХГ. В то же время АИГ в детском возрасте без лечения принимает чрезвычайно неблагоприятное течение и плохой прогноз: 5-летняя выживаемость у таких больных составляет 50%, 10-летняя - 10%, что и определяет актуальность их изучения.
В настоящее время известен способ лечения ХГ у детей вне зависимости от этиологии заболевания патогенетическими препаратами растительного происхождения (карсил, лив-52, легалон и т.д.), патент РФ №2175237, A61K 35/78, A61P 1/16, 2001, они препятствуют разрушению фосфолипидов мембран гепатоцитов и снижению проницаемости мембран печеночных клеток, они также обладают общим поддерживающим и стимулирующим действием на обмен веществ в клетке. Однако наряду с положительным действием этих препаратов наблюдается и ряд нежелательных моментов при их применении. Эффект достигается лишь при использовании длительных курсов лечения (2-2,5 месяцев) и он отмечается непостоянно (не более чем у 20% больных), является относительным, нормализуются или снижаются лишь показатели АлАТ, но и она бывает кратковременной, отсутствует действие на холестаз и белково-синтетическую функцию печени. Кроме того, в настоящее время практически все гепатопротекторы разрешены к применению у детей старше 7 лет.
Известен этиотропный способ лечения хронических вирусных гепатитов (ХВГ) с использованием монотерапии интерфероном альфа (ИФН-а) и комбинированной (сочетание ИФН-а с рибавирином). Этот способ позволяет достичь стойкого вирусологического ответа, но лишь у 30-57% детей (Волынец Г.В., Потапов А.С, Пахомовская Н.Л. Российский педиатрический журнал, 2011 г, №6, с.9-13), а сочетание пегилированного ИФН-а с рибавирином повышает эффективность до 70-80%. Однако данная терапия сопровождается высокой частотой побочных эффектов.
Известен способ лечения АИГ с использованием иммуносупрессивной терапии - преднизолон в монотерапии или в комбинации с азатиоприном. Такая терапия позволяет индуцировать клиническую, лабораторную и гистологическую ремиссию у 80% больных в течение 3-х лет лечения, предотвращает фиброзирование печени и приводит к увеличению выживаемости пациентов (Czaja A.J. Difficult treatment decisions in autoimmune hepatitis. World J. Gastroenterol 2010; 16(8): 934-947). Но и эта терапия ограничена множеством нежелательных явлений: синдром Иценко-Кушинга, остеопороз (40-70%), нарушение менструального цикла (12-16%), стероидные язвы, сахарный диабет, артериальная гипертензия. Часто возникают раздражительность, нарушение сна. Кроме того, большое число побочных эффектов от проводимой терапии кортикостероидами приводит к невысокой приверженности к такому способу лечения у больных.
Таким образом, эффективность используемой сегодня комбинированной лекарственной терапии ХГ колеблется в широких пределах от 30 до 80%, вызывая большое количество побочных эффектов и рецидивов.
Известно использование в клинической практике методов вторичной обработки аутоплазмы больного с последующей ее реинфузией - криоплазмосорбция (КПС). Одним из эффективных патогенетических способов лечения ХГ вирусных и аутоиммунных является плазмоферез, позволяющий существенно улучшать состояние больных путем удаления из организма больного определенных агрессивных биологически активных веществ и вирусов. Отмечается улучшение общего состояния, уменьшение симптомов интоксикации, исчезновение явлений токсической энцефалопатии и кожного зуда у больных, например, с печеночной недостаточностью. Отмечается эффективное действие противовирусных препаратов и препаратов, активирующих противовирусный иммунитет.
Отмечается положительная динамика биохимических, иммунологических, реологических показателей крови после проведенной эфферентной терапии
Известен способ непрерывного плазмофереза у детей раннего возраста (патент РФ №2208455, A61M 1/38, 2003). Проводят плазмаферез непрерывно в перфузионном режиме через плазмофильтр с экстракорпоральным контуром малого объема 22-24 мл. При этом одновременно с эксфузией плазмы проводят ее замещение, гепаринизацию осуществляют в дозе 5-7 ЕД/кг/ч после болюсного введения 20 ЕД/кг, а магистрали экстракорпорального контура представляют собой неонатальные кровопроводящие магистрали. Данное изобретение способствует повышению эффективности плазмафереза и снижению осложнений при его проведении у детей раннего возраста с массой тела до 15 кг с тяжелыми гемодинамическими нарушениями.
Однако этот способ лечения имеет существенные недостатки:
- Плазмоферез - процедура не селективная.
- Удаляется цельная плазма, обязательно требуется замещение донорской плазмой со всеми вытекающими последствиями.
- Используется у детей только раннего возраста, до года, лишь при тяжелых состояниях (сепсис, период выхаживания после тяжелых травм, операций, синдром Лейлла и т.д.).
Наиболее близким к предлагаемому изобретению является способ лечения гепатита C (патент РФ №2336096, A61M 1/38, A61K 38/21, 2008).
Перед началом курса лекарственной терапии, выполняют 5 процедур криоплазмосорбции (КПС) с интервалом 2 суток, а в дальнейшем эти процедуры повторяют 1 раз в месяц до окончания курса лекарственной терапии. Предлагаемый способ позволяет у взрослых повысить эффективность лекарственной противовирусной терапии за счет удаления из крови вместе с криопреципитатом значительного количества вирусных частиц и криоглобулинов. Последние накапливаются в малых и средних кровеносных сосудах, вызывая затруднение в них тока крови и способствуя развитию криоглобулинемии, клинические проявления которой весьма разнообразны (васкулиты, болезнь Рейно перифирическая невропатия, не-Ходжкинскую лимфому)
Недостатками способа КПС являются:
- не использовался у детей;
- длительность и многократность сеансов криоплазмосорбции: курс лечения включает 10-15 сеансов в течении 6-12 месяцев;
- криосорбционная обработка плазмы проводится не во время, а после процедуры с использованием отдельного экстракорпорального контура, и собственная плазма возвращается назад пациенту только на следующей процедуре,
- т.к. при КПС после разморозки плазма перфузируется через углеродный адсорбент, в нее могут попадать микрочастички адсорбента, которые у пациентов с повышенной реактивностью организма могут приводить к возникновению побочных реакций;
- большая вероятность развития стресса, особенно у маленьких у детей, в результате частого и затрудненного доступа к венам;
- трудоемкость и необходимость дополнительного специального оборудования (морозильные камеры для длительного хранения плазмы);
- полуселективность, вместе с вирусными и другими патологически активными субстанциями удаляется ряд важных биологических компонентов плазмы (фибриноген, факторы свертывания, компоненты комплемента C1, C3, C5 и др.).
Таким образом, представленный прототипный способ не обеспечивает достаточно высокую степень очистки плазмы от вируса, а следовательно, эффективность лечения.
С целью устранения вышеуказанных недостатков авторы предлагают принципиально новый способ лечения хронического гепатита у детей, технический результат, достигаемый в данном способе, заключается в повышении эффективности лечения и сокращения побочных явлений в результате проведения каскадной плазмофильтрации.
Это достигается тем, что перед началом этиотропной терапии проводят 2-3 сеанса каскадной плазмофильтрации в объеме 1-1.2 объема циркулирующей плазмы, полученную плазму пропускают через фильтры капиллярного типа диаметром пор: при вирусных гепатитах - 30 нм, при аутоиммунных - 10 нм.
В результате многолетнего опыта работы в области лечения ХГ у детей и анализа результатов лечения авторы обнаружили, что при использовании схем лечения, включающих и каскадную плазмофильтрацию, и специфическую противовирусную или иммуносупрессивную терапию, у больных ХГ (вирусным гепатитом B, C, и АИГ) повышается не только ее эффективность и снижается частота побочных явлений, но возможно снижение длительности и дозы использования гормональных препаратов при АИГ.
Авторы обратили внимание, что использование именно каскадной плазмофильтрации (КПФ) в терапии детей ХГ различной этиологии позволяет селективно убирать из кровотока патогенетически важные провоцирующие факторы. Данный результат был достигнут благодаря тому, что при каждом сеансе каскадной плазмофильтрации очистке подвергается весь объем циркулирующей плазмы. Авторы обнаружили большую значимость эффективности лечения использование фильтров капиллярного типа с оптимальным размером пор мембраны: с диаметром пор 30 нм при вирусных гепатитах, а при аутоиммунных гепатитах - 10 нм.
В отличие от обычного плазмафереза эксфузированная у пациента плазма непрерывно подается на фильтр с диаметром пор 30 нМ. Таким образом обеспечивается надежная преграда вирусам гепатита B и C, размеры которых 35-65 нМ, а также ЦИК и криоглобулинами при отсутствии влияния на уровень эритроцитов, гемоглобина и общего белка крови, не требуя их замещения. Фильтр с диаметром пор 10 нМ способен задерживать более мелкие белковые молекулы, имеющие важнейшее значение в патогенезе развития аутоиммунных заболеваний - аутоантитела, ЦИК и другие.
Метод КПФ, применяемый нами, является атравматичным, и проведение его за счет высокой гемосовместимости используемых фильтров возможно с минимальной гепаринизацией.
В процессе анализа клинических и лабораторных данных больных с ХГ нами установлены наиболее оптимальные сроки начала терапии, обеспечивающие точность результата, что и легло в основу изобретения.
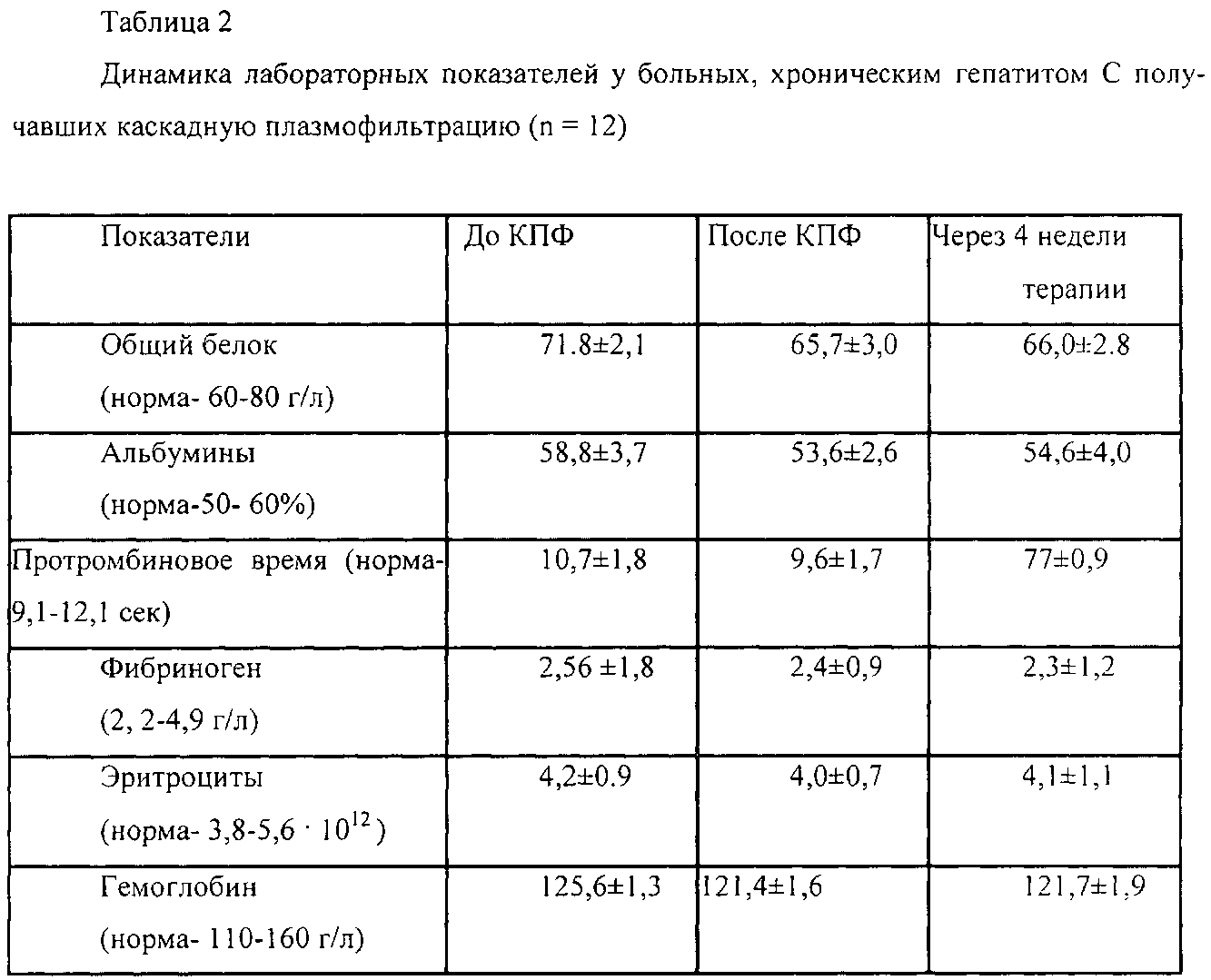
Так, при лечении больных хроническим вирусным гепатитом C (ХВГ C) оптимальным сроком проведения каскадной плазмофильтрации (КПФ) является первый день противовирусной терапии. КПФ, выполненная перед первой инъекцией ИНФ-а, снижает уровень вирусной нагрузки на 21g и более у 70% больных (табл.1). Авторы установили, что повторные ее сеансы, проводимые с интервалом 3-7 дней, так же перед введением препарата, способствовали достижению быстрого вирусологического ответа (прекращению выявления РНК вируса в крови) - уже на 2-3 неделе терапии (табл.1). Таким образом, эффективность курса каскадной плазмофильтрации, состоящего всего из 2-3 сеансов, при лечении детей с ХВГ C противовирусными препаратами сопоставима с курсом, включающим 10-12 сеансов криоплазмосорбции у взрослых.

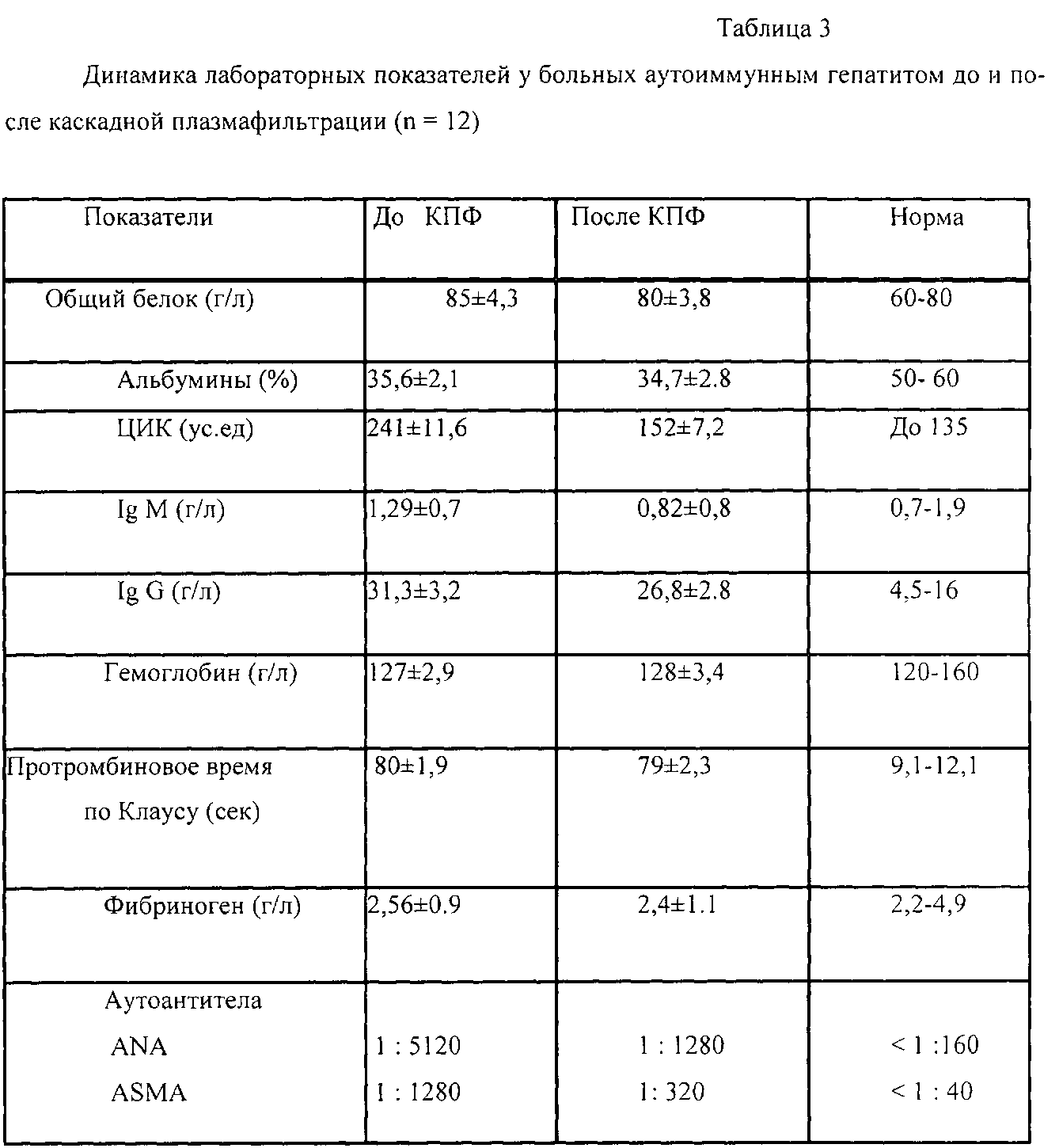
У детей, больных АИГ, с высокой цитолитической и аутоиммунной активностью процесса подключение каскадной плазмофильтрации может быть как на начальном этапе лечения до назначения иммуносупрессивной терапии, так и на фоне ее проведения при отсутствии стабилизации процесса или достижения ремиссии на высоких дозах глюкокортикоидов. При этом используется фильтр с размером пор мембран 10 нм, который способен задерживать не только ЦИК и криоглобулины, но и более мелкие белковые молекулы - аутоантитела, IgG, существенно не влияя на белковый состав плазмы, но снижая аутоиммунную агрессию (табл.3), что позволяет в дальнейшем уменьшить дозу гормональной терапии.
Таким образом, предложенный авторами способ отличается новизной, неочевидностью, изобретательским уровнем и эффективностью терапии. В доступной нам литературе подобного способа лечения ХГ у детей не обнаружено, а совокупность предложенных авторами признаков позволяет нам заявить способ как заявочный материал на изобретение.
Под нашим наблюдением находились 68 детей в возрасте от 4 до 18 лет (56 с ХВГ C и 12 с АИГ).
Больные ХГС получали следующие схемы терапии:
- КПФ + Интрон А + Рибавирин - 18 чел.
- КПФ + ПегИнтрон + Рибавирин - 8 чел.
- Интрон А + Рибавирин - 20 чел. (контрольная группа).
Длительность наблюдения составляет более 3-х лет. Среди 18 детей ХВГ C, получивших комбинированную противовирусную терапию (Интрон А + рибивирин) и каскадную плазмофильтрацию у 66,7% пациентов был достигнут быстрый вирусологический ответ (БВО) - снижение вирусной нагрузки на 21g и более, а у 77,7% непосредственный вирусологический ответ (НВО) - отсутствие РНК HCV и нормализация АЛТ после окончания курса лечения. Колебания этого показателя в зависимости от генотипа вируса составили 66,7-83,3%. Эти показатели существенно выше результатов, полученных в контрольной группе - 45% (30-60%). Через год терапии стабильный вирусологический ответ (СВО) - полная биохимическая и вирусологическая ремиссия регистрировалась в 72,2% случаев, в 22,2% лишь биохимическая ремиссия и отсутствие эффекта в 5,5% случаев (табл.4).
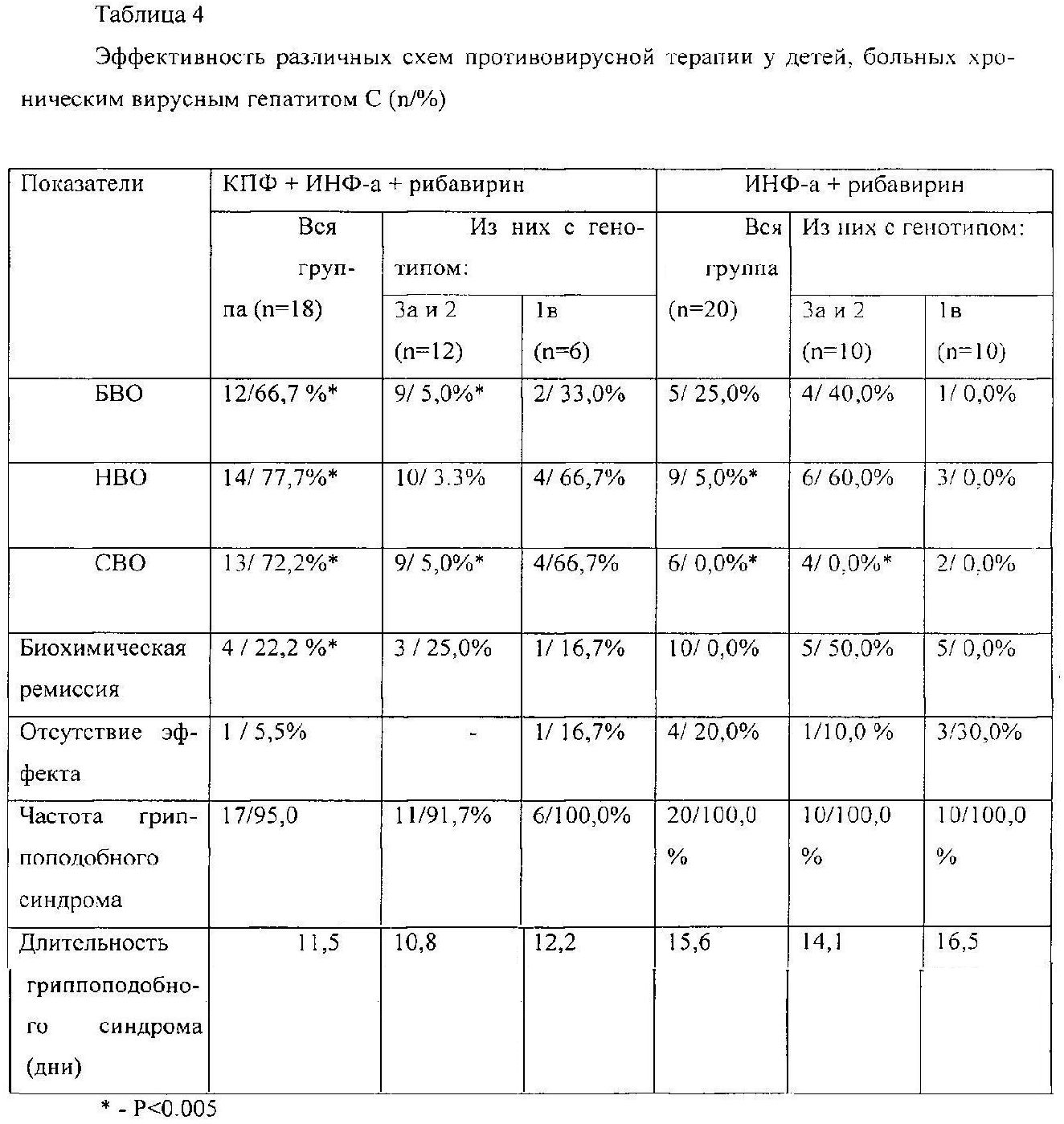
Из 8 детей с ХВГ C, получавших КПФ и Пегинтрон в сочетании с рибавирином БВО был зарегистрирован в у 50%, а НВО - полная ремиссия после окончания курса терапии в 87,5% случаев.
Среди 12 детей с АИГ биохимическая ремиссия и улучшение морфологической картины по данным эластографии было достигнуто у 10 (83,3%) больных, а у 7 (58,3%) удалось снизить дозу иммуносупрессивной терапии.
При проведении КПФ ни у одного из 48 детей (102 КПФ) не было зарегистрировано нежелательных явлений и осложнений данной процедуры, лишь у одного ребенка, страдающего вегетососудистой дистонией отмечалось головокружение в течение 10-15 минут.
Оценка чувствительности данного метода дала высокие результаты и составила 90,5%, а специфичность - 79,3%.
Способ осуществляется следующим образом.
Больной госпитализируется в стационар с подтвержденным диагнозом ХГ на основании определения вирусных/аутоиммунных маркеров Далее по результатам биохимического обследования (АЛТ, ACT, ЩФ, общего белка крови и его фракции, билирубина, фибриногена, протромбинового комплекса и клинического анализа крови) устанавливаются фаза заболевания и показания для проведения КПФ. При ХВГ - это наличие показаний и отсутствие противопоказаний к проведению противовирусной терапии (высокая вирусная нагрузка, наличие цитолиза, фиброза, отсутствие сопутствующих заболеваний в стадии обострения или декомпенсации и др.), при АИГ - высокая цитолитическая и аутоиммунная активность, отсутствие стойкого эффекта от проводимой иммуносупрессивной терапии. Противопоказанием к проведению КПФ является нарушение свертывающей системы крови. Исключение данной патологии позволяет снизить риски гематологических осложнений процедуры КПФ до минимума.
При ХВГ С назначались 2 процедуры КПФ, каждая из которых проводилась в объеме 1,2 ОЦП с использованием аппарата с двумя насосами роликового типа (нами использован отечественный прибор «Гемма») и фильтров капиллярного типа с диаметром пор 30 нм. Первый сеанс КПФ проводится перед началом противовирусной терапии, второй - через 3-7 дней (перед вторым или третьим введением ИНФ-а).
Доступ к сосудам осуществляется через 2 вены или через двухпросветный катетер, установленный в центральную вену. В результате одномоментного использования двухроликовых насосов и мембранного плазмофильтра достигается разделение крови на клеточную массу и плазму. А далее получаемая плазма подается на фракционатор плазмы (капиллярный фильтр с размером пор 30 нм) и пропускается через него, затем в очищенном виде она возвращается в кровеносное русло больного. Продолжительность процедуры составляет 2-4 часа. Скорость роликового насоса до плазмофильтра (разделяющего на клеточную массу и плазму) 50-80 мл/мин, скорость второго роликового насоса (подающего плазму на фракционатор) 15-30 мл/мин. Замещения плазмой или альбумином во время процедур не производилось.
Препараты ИНФ-а должны вводится не позже чем через 3-4 часа после завершения КПФ.
Больным АИГ назначалось 2-3 процедуры плазмофильтрации в объеме 1,2 ОЦП с использованием в качестве фракционатора плазмы фильтров капиллярного типа с диаметром пор 10 нм, Методика проведения КПФ аналогична той, что и у больных ХВГ С и может подключаться на любом этапе иммуносупрессивной терапии (до ее начала, либо на фоне применения стандартной схемы преднизолона и азатиоприна). Поскольку у данной категории больных изначально могут быть выраженные нарушения белково-синтетической функции печени в ходе проведения каскадной плазмофильтрации, возможны инфузии плазмы и альбумина (по показаниям).
Эффективность предлагаемого способа лечения ХГ может быть подтверждена конкретными клиническими примерами:
Пример 1
Пациентка В.Л., 6 лет. Из анамнеза известно, что росла и развивалась соответственно возрасту. С ноября 2009 г появилась желтушность кожи. Дважды лежала в стационарах с д-зом «Неверифицированный гепатит», этиология его оказалась не ясна, вирусные гепатиты A, B, C исключены. В связи с сохраняющейся гиперферментемией до 800 ед/л, гепатомегалией госпитализирована в НИИДИ (17.11.2010 по 10.12.2010). При иммунологическом обследовании выявлен высокий уровень ANA 1:1280, ЦИК 516 ус.ед и установлен диагноз Аутоиммунный гепатит 1 типа. Девочке была начата терапия, согласно предлагаемому способу: проведено 2 сеанса КПФ в объеме 1,2 ОЦП при помощи фильтров капиллярного типа с диаметром пор 10 нм, которые переносились хорошо, осложнений и нежелательных явлений не регистрировалось. Затем начата иммуносупрессивная терапия преднизолоном в дозе 60 мг с последующим снижением. При обследовании уже через месяц у девочки снизились активность трансаминаз (АлТ 55,3 ед/л, АсТ 23 е/л), титры аутоантител (ANA 1:640) и ЦИК до 346 ус.ед. Доза преднизолона была доведена до поддерживающей (10 мг/сутки) на 1 месяц раньше. После подключения в терапию 50 мг азатиоприна ребенок был выписан домой под наблюдение инфекциониста. В течение года стойко сохранялась лекарственно-индуцированная ремиссия. При контрольном осмотре через 12 месяцев отмечалась положительная динамика данных УЗИ - нормализация размеров и структуры печени, нормальный уровень трансаминаз и снижение титров ANA до 1:320.
Пример 2
Больная С.К., 11 лет 5 мес, наблюдалась в НИИДИ по поводу ХВГ C с 2008 г. Впервые диагноз был установлен в 1,5 г. (перинатальное инфицирование от матери). Ранее показатели трансфераз были в норме. При обследовании в НИИДИ в 2010 г: АлАТ - 72.0 ед/л, АсАТ - 65,0 ед/л, ЩФ - 1081,0 Ед/л, общ. билирубин 12,9 мкмоль/л, сахар 3,8 ммоль/л, мочевина 4,8; креатинин 53; Общий белок 83,5 г/л, альбумины - 58%, СРБ (-), протромбиновое время 11,6 с, фибриноген 3,6 г/л, выявлена RNA HCV полож. 1-b генотип, уровень вирусной нагрузки 6,8×105 (МЕ/мл). В гемограмме без отклонений - эритроциты 3,68×1012/л, Нв - 123 г/л, лейкоциты 4,2×109/л, тромб. - 225×109, с - 44%, э - 4%, лф - 50%, м - 2%, СОЭ 10 мм/ч. Девочке была начата терапия согласно предлагаемому способу: проведено 2 сеанса КПФ в объеме 1,2 ОЦП при помощи фильтров капиллярного типа с диаметром пор 30 нм. Начата противовирусная терапия ПегИнтроном 80 мкг 1 раз в неделю и рибаверином 0,2 по 2 т 2 раза в день. Сеансы КПФ переносились хорошо, осложнений и побочных реакций не было. При обследовании после двух сеансов КПФ вирусная нагрузка снизилась до неопределяемых цифр, отрицательной динамики в гемограмме зарегистрировано не было (Hb 137 г/л, Эр - 4,2×1012/л, тромб. - 225×109, с - 44%, э - 1%, лф - 51, б - 2%, м - 2%, СОЭ 10 мм/ч. фибриноген - 3,4 г/л, протромбиновое время - 11,4 сек, общий белок - 84,2 г/л, альбумины - 56%). Через месяц RNA HCV оставалась неопределяемой, курс противовирусной терапии продолжался 12 мес. При контрольном обследовании после окончания терапии у ребенка была зарегистрирована полная ремиссия - НВО, которая сохраняется до настоящего времени (более 1 года), т.е. имеет место стойкий вирусологический ответ.
Пример 3
Больной М.Н., 9 лет, наблюдается в НИИДИ по поводу ХВГ C с 2009 г. ДЗ: ХГС был установлен в 2,5 г. Показатели трансфераз колебались в пределах 56-74 Ед/л. При обследовании в НИИДИ в 2010 г выявлена высокая вирусная нагрузка - 3,4 млн. ME в мл и 1в генотип. При обследовании АлАТ - 72,0 ед/л, АсАТ - 65,0 ед/л, ЩФ - 988,0 Ед/л, общ. билирубин 7,5 мкмоль/л, сахар 3,2 ммоль/л, мочевина 4,8; креатинин 54; Общий белок 78,0 г/л, альбумины - 58%, СРБ (-), протромбиновое время 11,6 с, фибриноген 3,6 г/л; в гемограмме без особенностей - эритроциты 4,0×1012/л, Нв - 128 г/л, лейкоциты 3,8×109/л, тромб - 230×109, с - 38%, э - 1%, лф - 56%, м - 5%, СОЭ 8 мм/ч. Мальчику была начата терапия согласно предлагаемому способу: проведено 2 сеанса КПФ в объеме 1,2 ОЦП при помощи фильтров капиллярного типа с диаметром пор 30 нм. Побочных реакций и осложнений во время проведения КПФ не было. Затем начата противовирусная терапия ПегИнтроном в дозе 80 мкг 1 раз в неделю и рибаверином 0,2 по 2 т. 2 раза в день. При обследовании после двух сеансов КПФ отрицательной динамики в гемограмме зарегистрировано не было (Hb 138 г/л, Эр - 4,2×1012/л, тромб. - 220×109, с - 36%, э - 1%, лф - 61, б - 2%, м - 2%, СОЭ 10 мм/ч. фибриноген - 3,4 г/л, протромбиновое время - 11,4 с, общий белок - 84,2 г/л, альбумины - 56%), вирусная нагрузка снизилась до 9,7×104 МЕ/мл. Курс противовирусной терапии продолжался 12 мес. При контрольном обследовании после окончания противовирусной терапии сохранялась полная ремиссия, однако через 6 мес после окончания терапии у ребенка было зарегистрировано обострение.
Пример 4
Больная Д.Н., 11 лет, наблюдается в НИИДИ по поводу ХВГ C с 2009 г. ДЗ: ХГС был установлен в 6 лет. Показатели трансфераз колебались в пределах 86-112 Ед/л. При обследовании в НИИДИ в 2010 г. выявлена высокая вирусная нагрузка - 2,6×106 МЕ/ мл и 3а генотип. При обследовании АлАТ - 112,0 ед/л, АсАТ - 88,0 ед/л, ЩФ - 688,0 Ед/л, общ. билирубин 7,5 мкмоль/л, сахар 4,0 ммоль/л, мочевина 4,8; креатинин 54; Общий белок 72,0 г/л, альбумины - 54%, СРБ (-), протромбиновое время 11,6 с, фибриноген 3,6 г/л, в гемограмме без особенностей - эритроциты 3,2×1012/л, Нв - 132 г/л, лейкоциты 4,2×109/л, тромб. - 226×109, с - 38%, э - 1%, лф - 56%, м - 5%, СОЭ 8 мм/ч. Девочке была начата терапия, согласно предлагаемому способу: проведено 2 сеанса КПФ в объеме 1.2 ОЦП при помощи фильтров капиллярного типа с диаметром пор 30 нм. После 1 сеанса отмечалось небольшое головокружение в течение 15 минут (в анамнезе вегетосостудистая дистония), других осложнений и побочных реакций не было. Через 3 часа после сеанса КПФ начата противовирусная терапия Интроном А в дозе 3 млн ME 3 раза в неделю и рибаверином 0,2 по 2 т 2 раза в день. При обследовании после двух сеансов КПФ отрицательной динамики в гемограмме зарегистрировано не было (Hb 128 г/л, Эр - 3,8×1012/л, тромб. - 230×109, с - 36%, э - 1%, лф - 61, б - 2%, м - 2%, СОЭ 10 мм/ч фибриноген - 3,4 г/л, протромбиновое время - 11,4 с, общий белок - 70,0 г/л, альбумины - 56%), вирусная нагрузка снизилась до 2,7×103 МЕ/мл. При обследовании через месяц у мальчика снизилась вирусная нагрузка до неопределяемых цифр, курс противовирусной терапии продолжался 6 мес. При контрольном обследовании после окончания противовирусной терапии и через 12 мес лечения сохранялась полная ремиссия.
Таким образом, применение предложенного нами способа лечения ХГ у детей позволяет повысить эффективность терапии за счет использования комбинации патогенетической терапии в виде каскадной плазмофильтрации и специфической терапии в зависимости от этиологии заболевания, а также снизить регистрацию осложнений. Включение в схему терапии детей, больных ХВГ C, каскадной плазмофильтрации усиливает воздействие комбинации противовирусных препаратов предварительным снижением виремии уже на начальном этапе терапии, а также повышает ее эффективность в течение всего курса на 21,7%. У больных АИГ использование данного способа позволило снизить дозу гормональной терапии у 58,7% больных до минимально поддерживающей дозы, что позволяет значительно уменьшить, а иногда и исключить проявления медикаментозного синдрома Кушинга. Вышеперечисленные преимущества позволяют улучшить качество жизни больных с ХГ. Данный способ прост и может найти широкое применение в клинической практике в стационарах и консультативно-диагностических центрах.
Способ лечения хронического гепатита у детей путем проведения экстракорпоральной гемокоррекции, отличающийся тем, что перед началом этиотропной терапии проводят 2-3 сеанса каскадной плазмофильтрации в объеме 1-1,2 объема циркулирующей плазмы, полученную плазму пропускают через фильтры капиллярного типа c диаметром пор: при вирусных гепатитах - 30 нм, при аутоиммунных - 10 нм.
