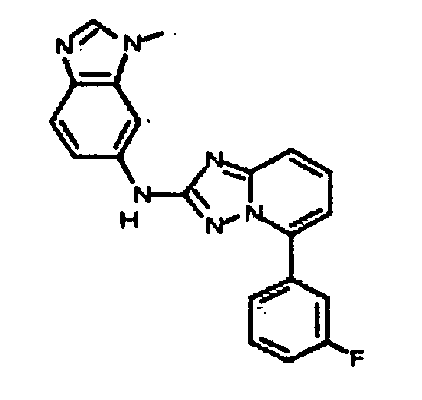
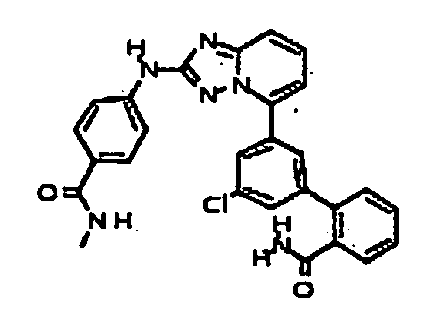
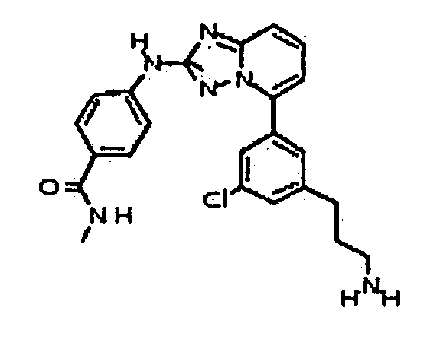
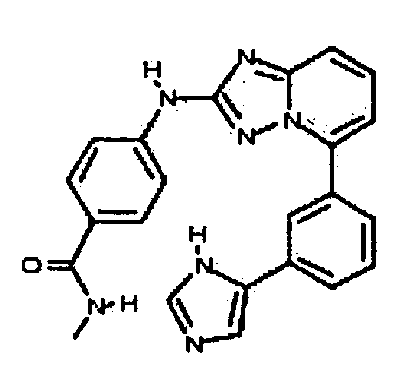
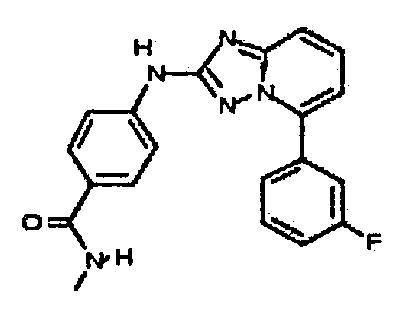
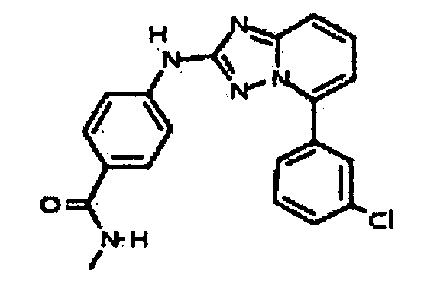
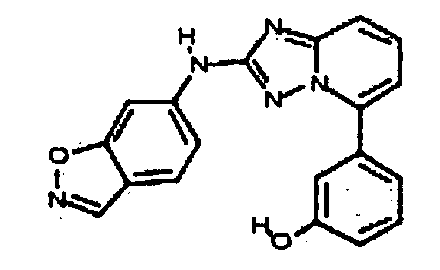
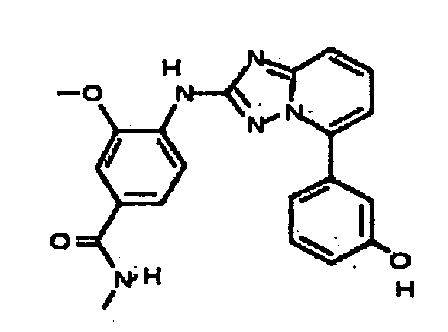
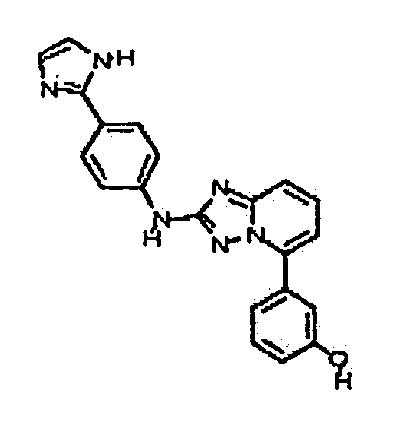
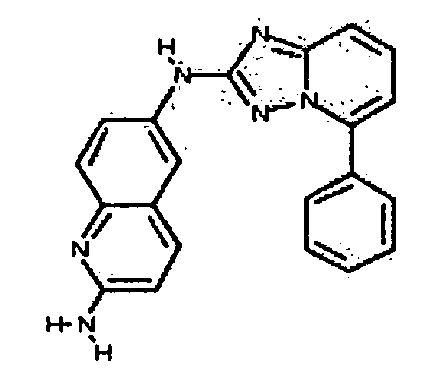
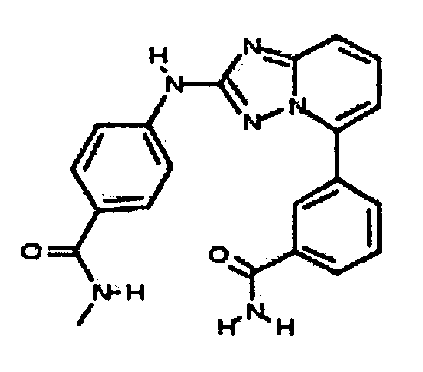
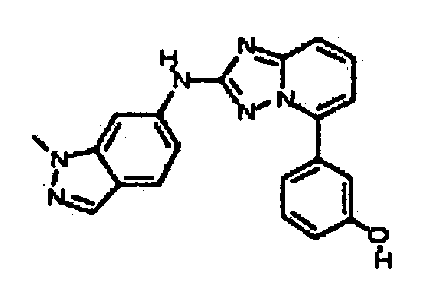
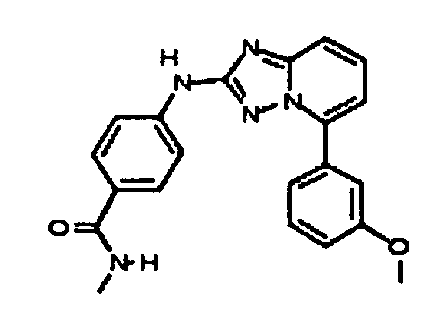
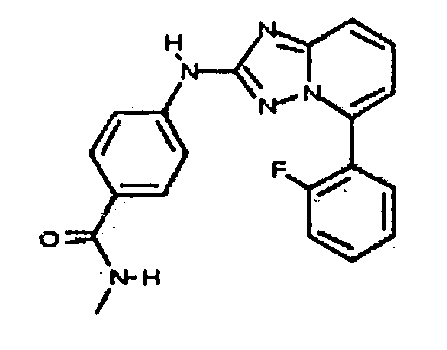
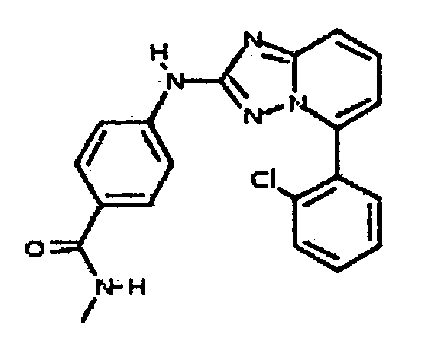
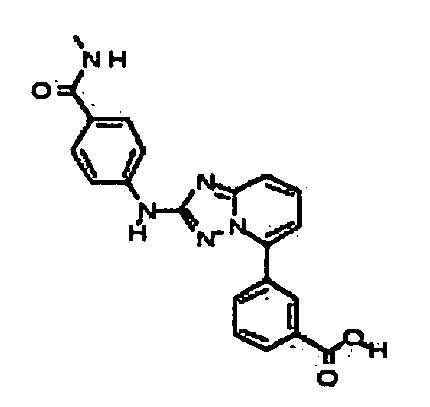
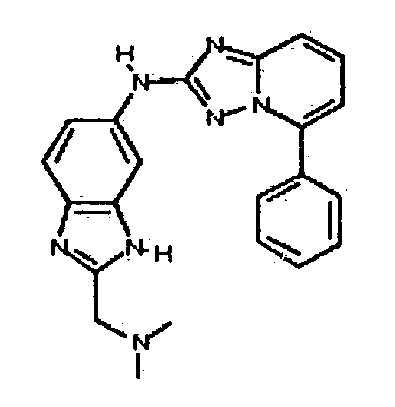
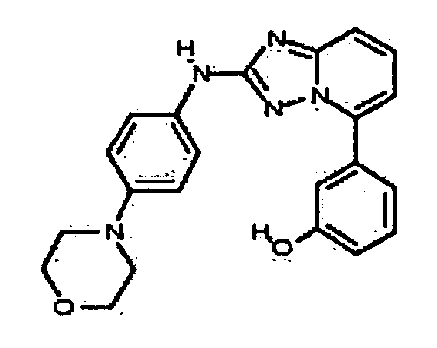
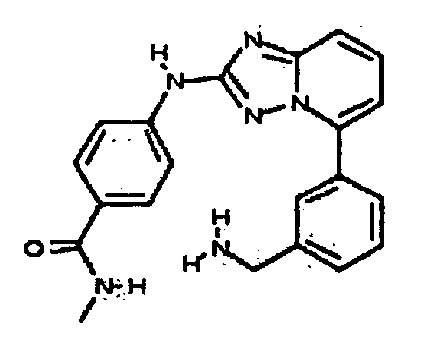
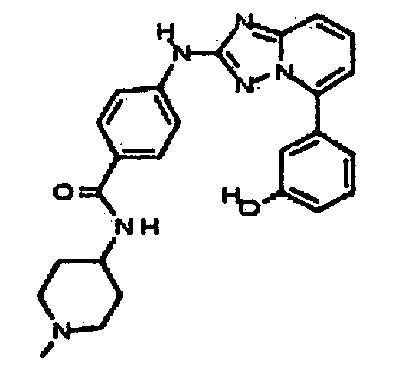
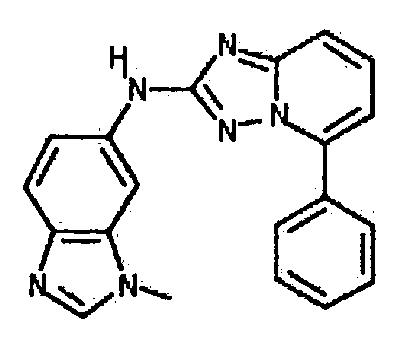
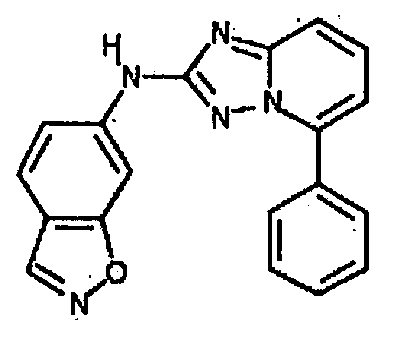
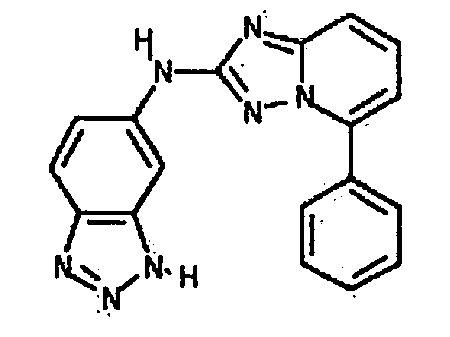
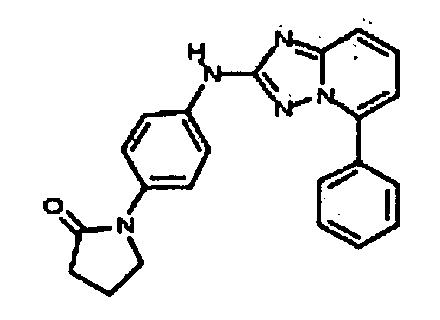
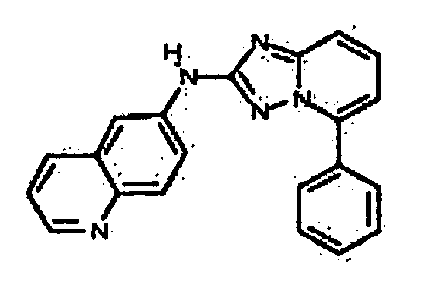
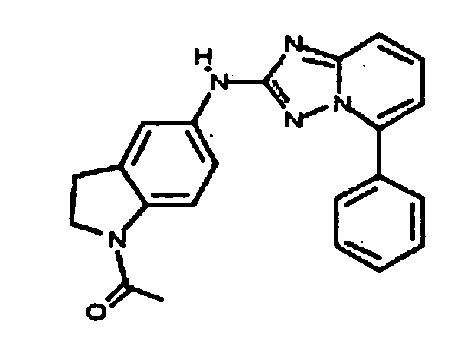
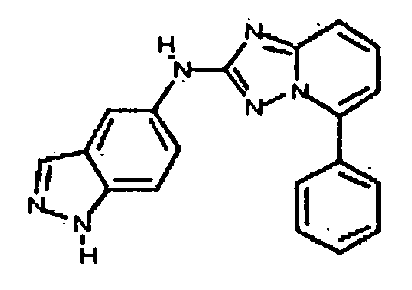
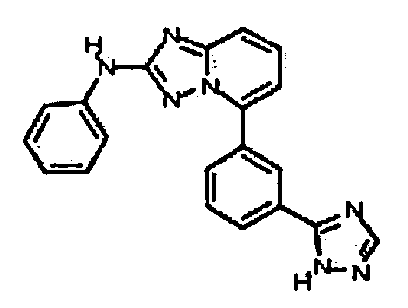
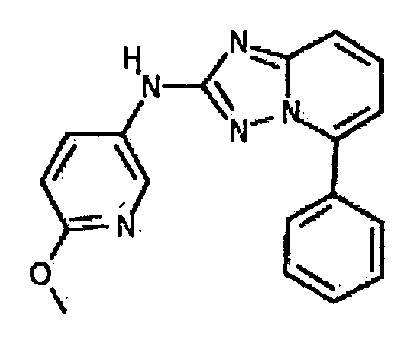
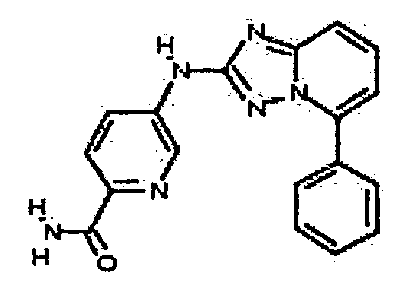
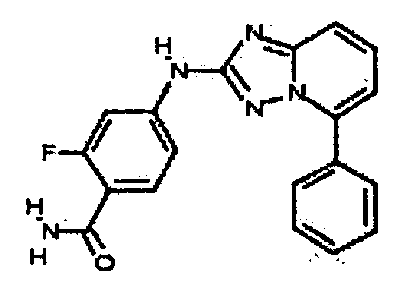
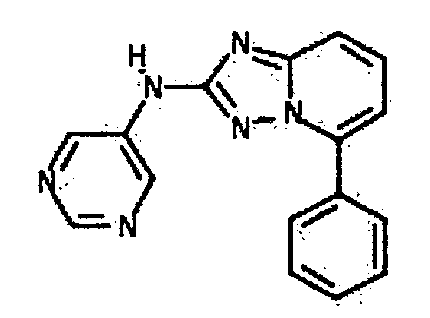
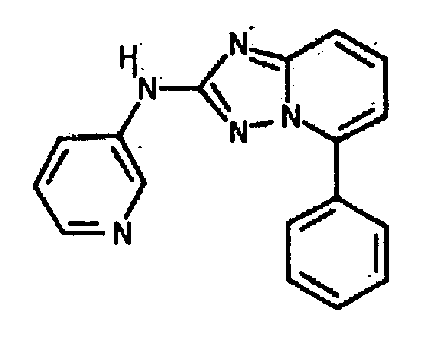
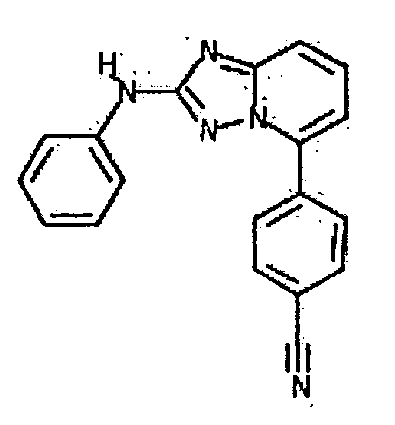
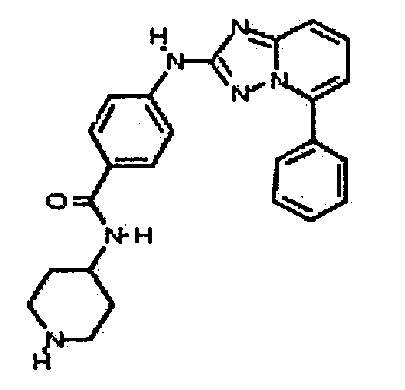
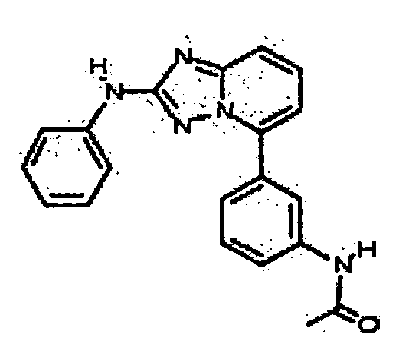
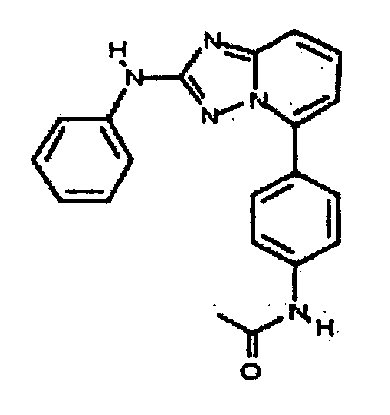
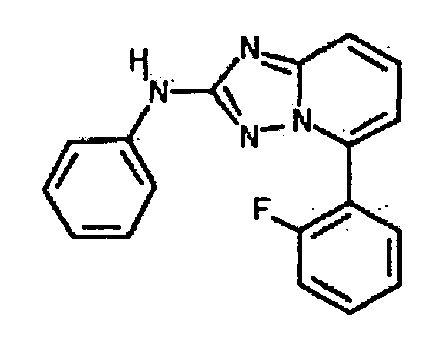
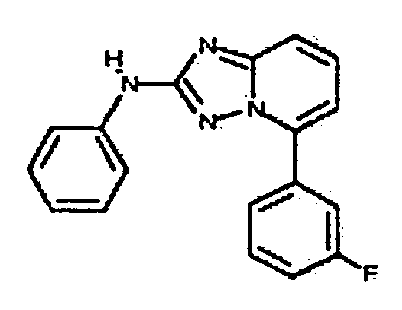
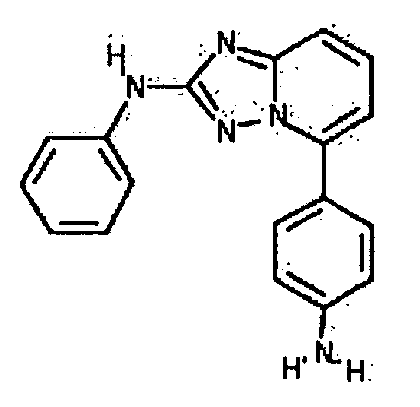
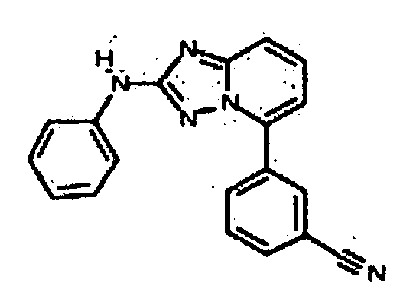
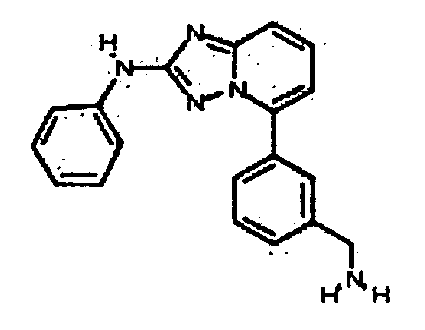
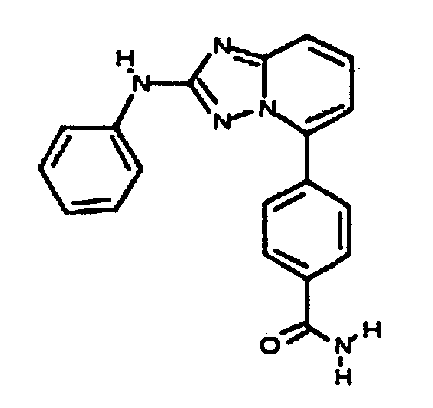
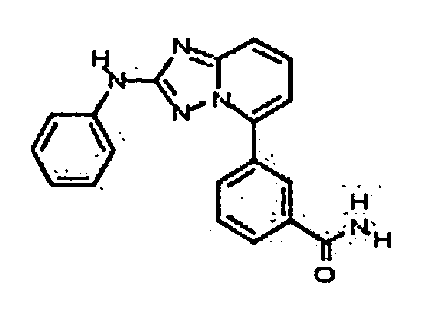
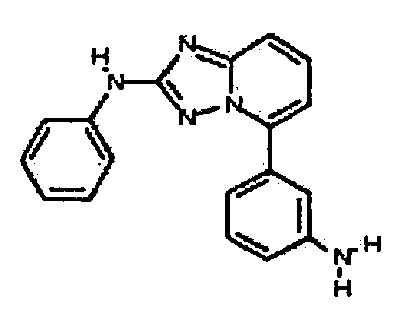
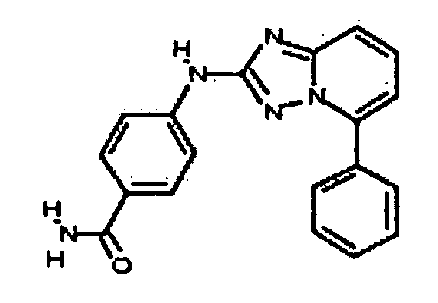
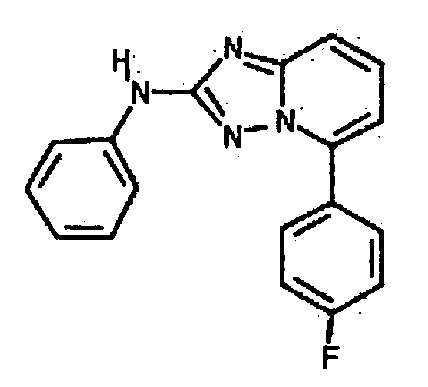
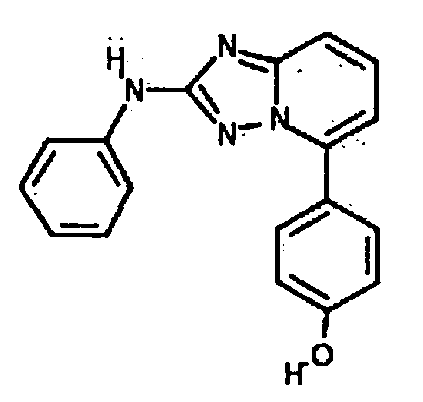
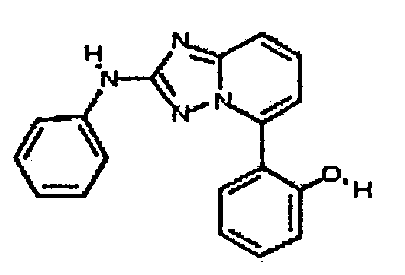
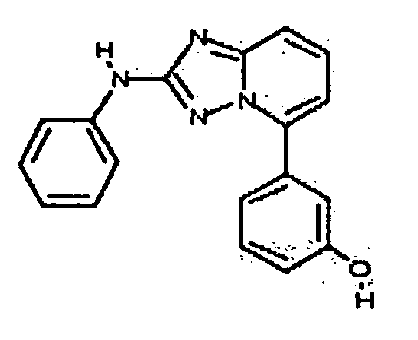
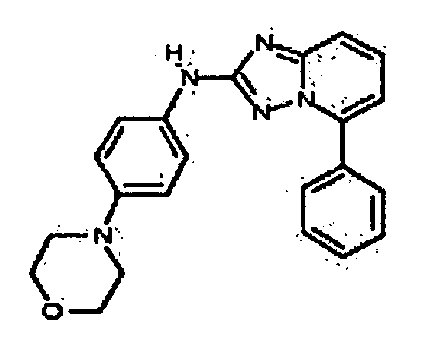
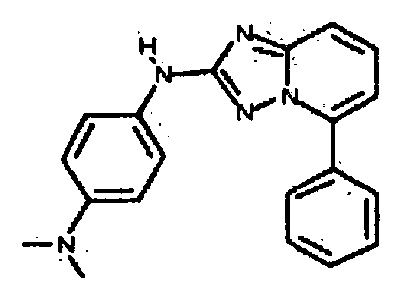
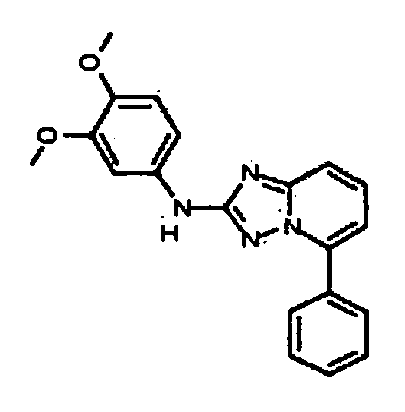
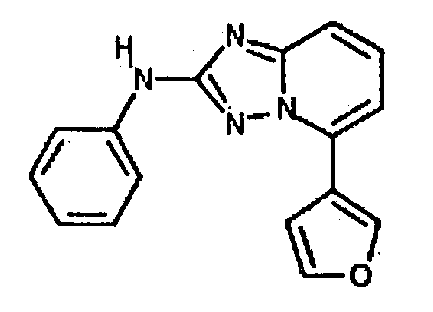
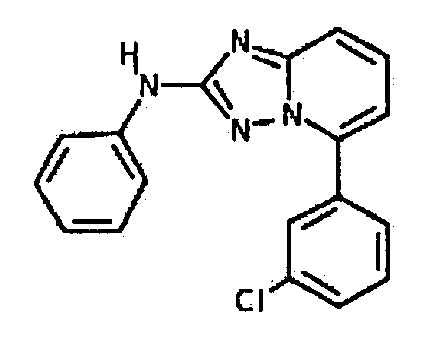
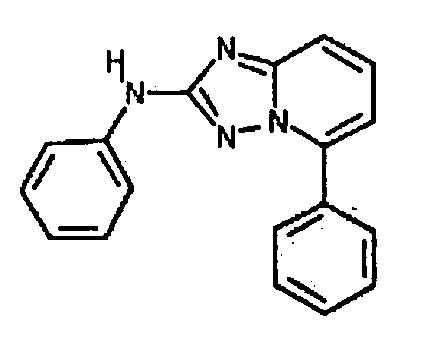
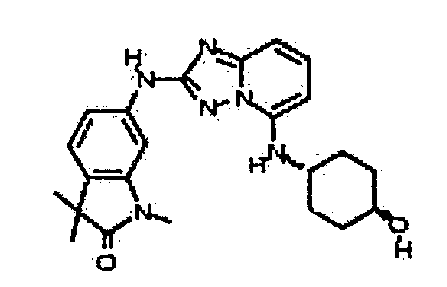
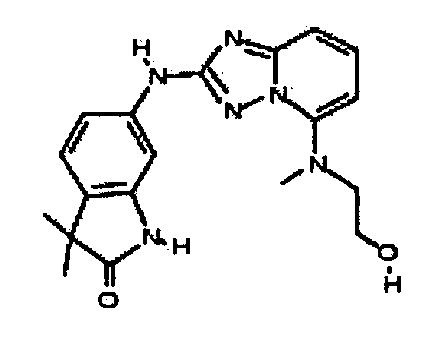
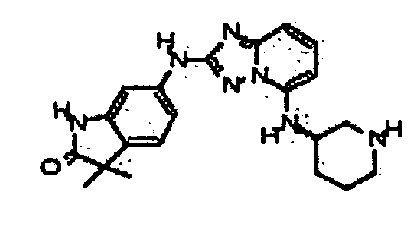
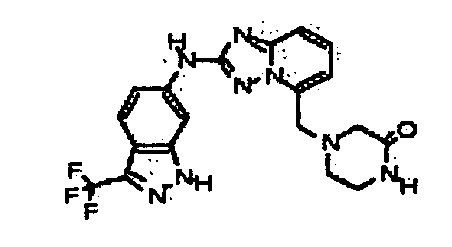
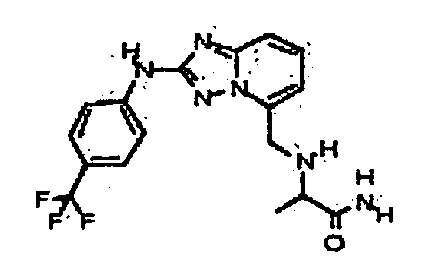
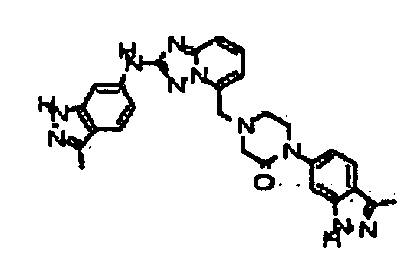
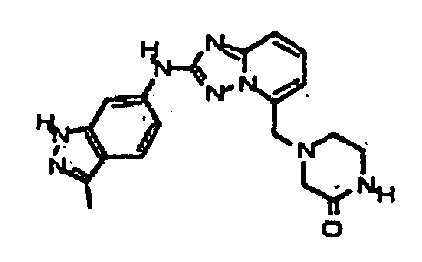
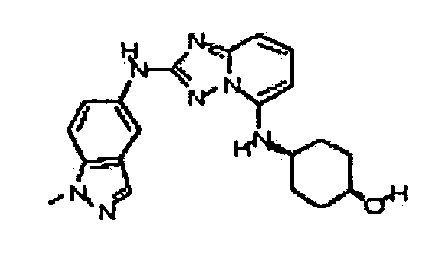
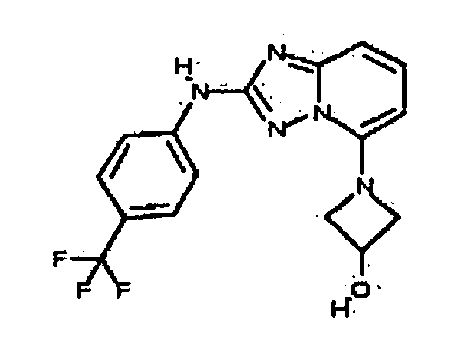
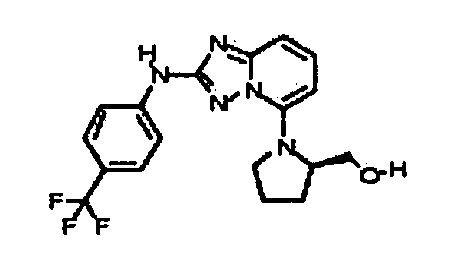
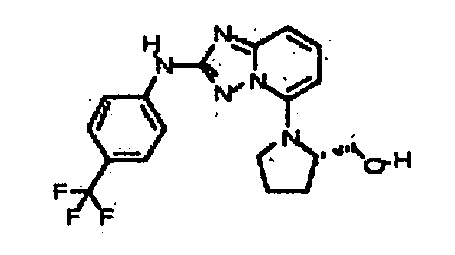
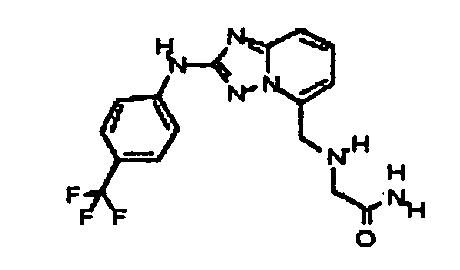
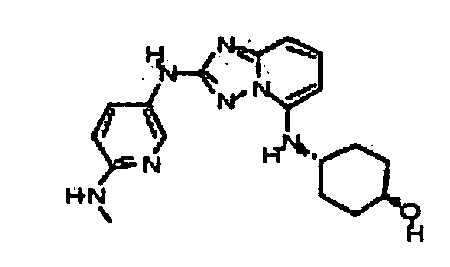
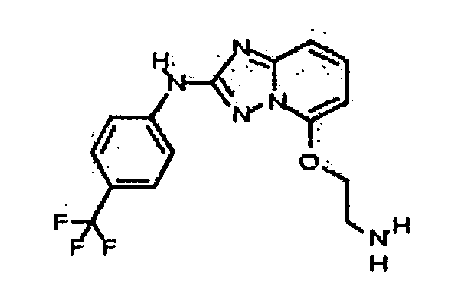
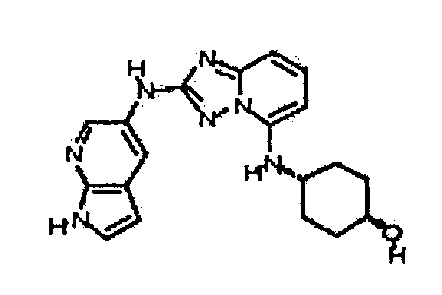
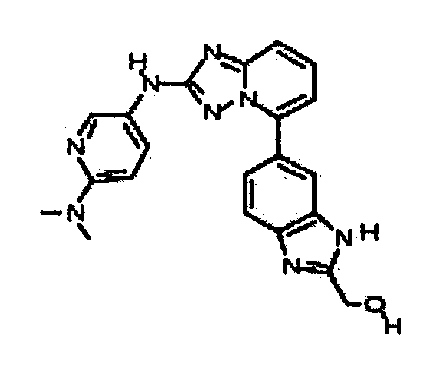
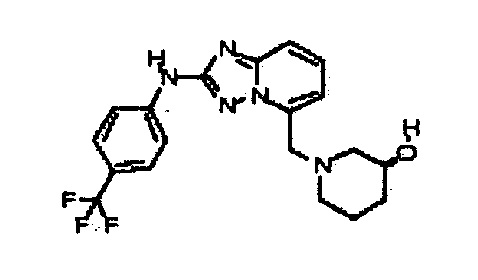
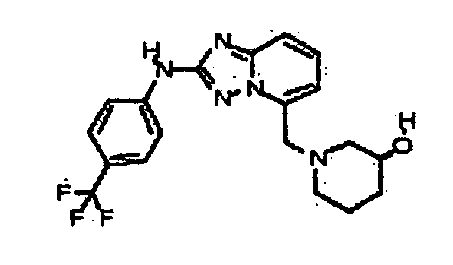
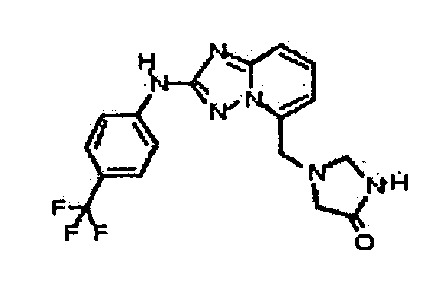
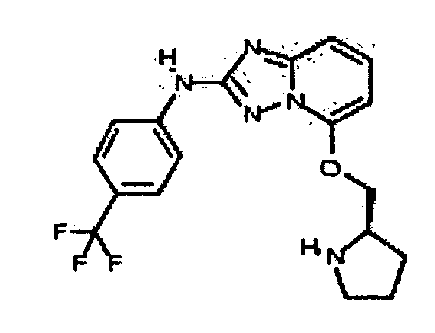
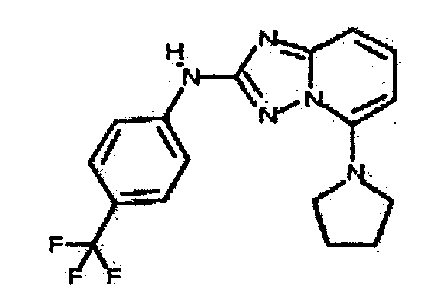
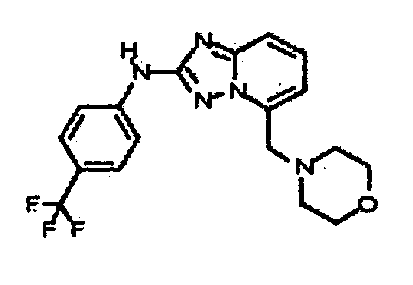
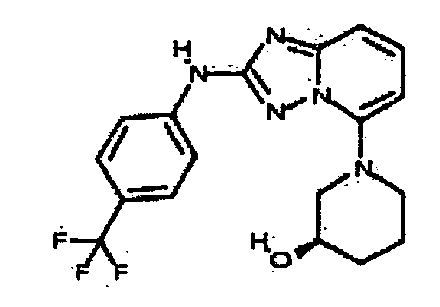
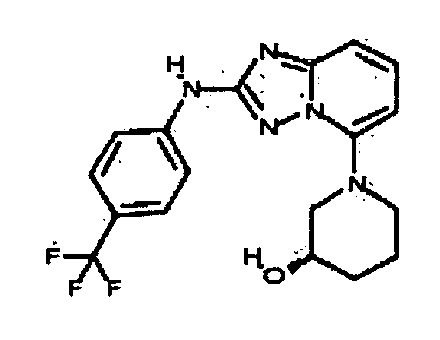
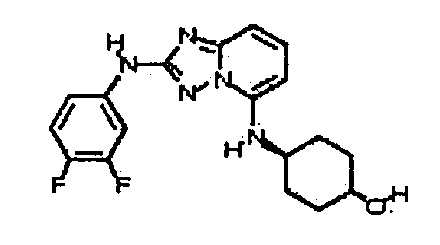
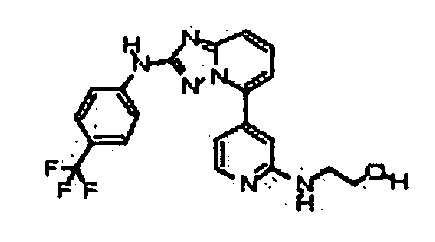
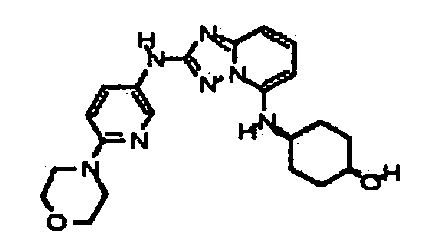
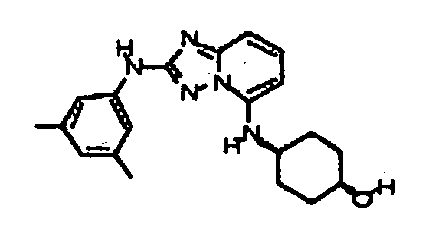
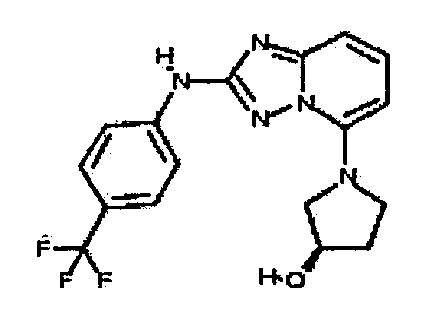
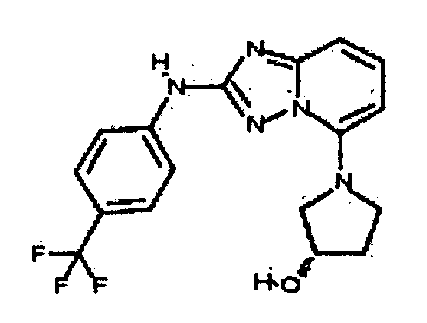
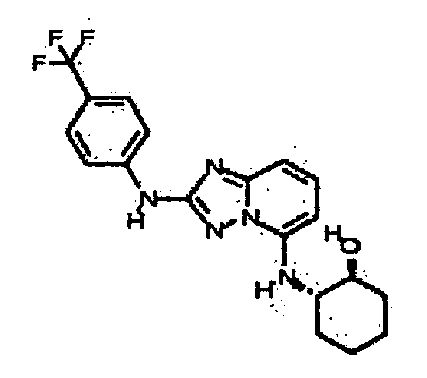
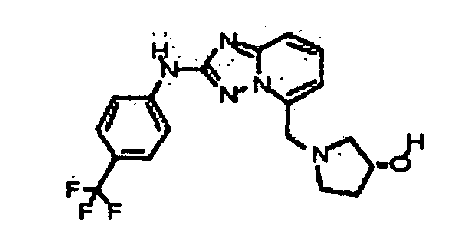
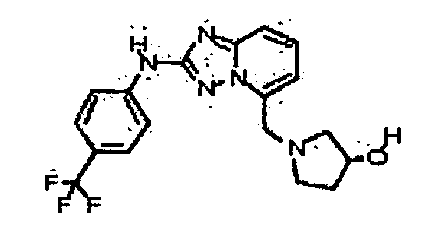
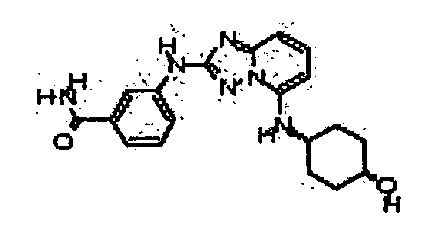
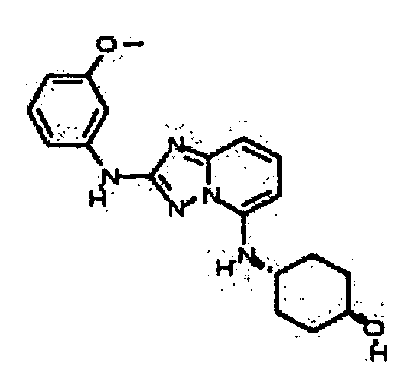
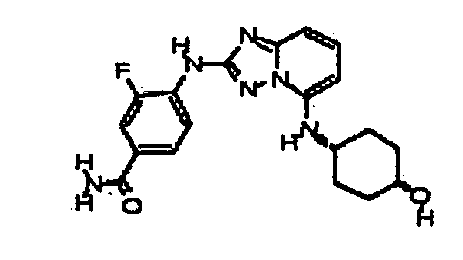
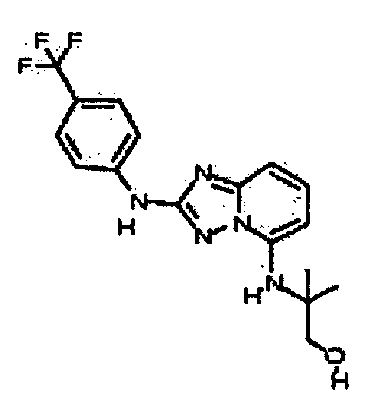
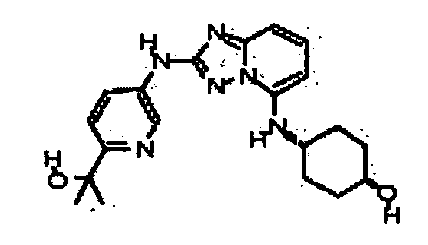
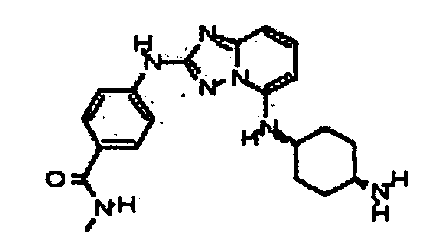
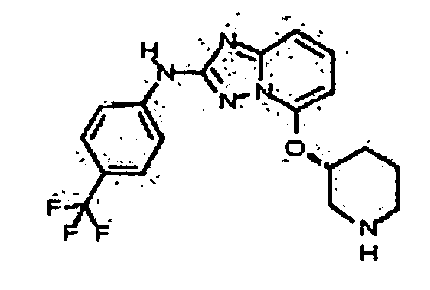
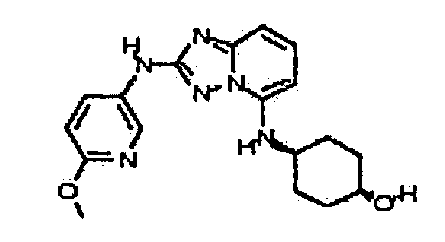
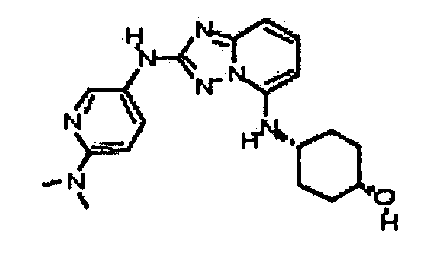
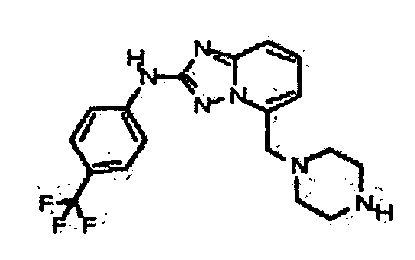
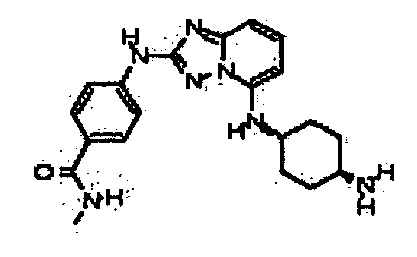
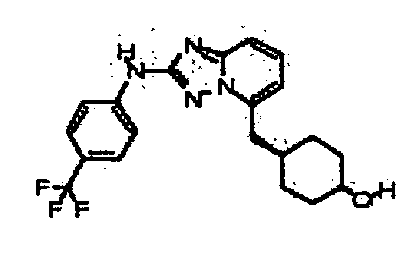
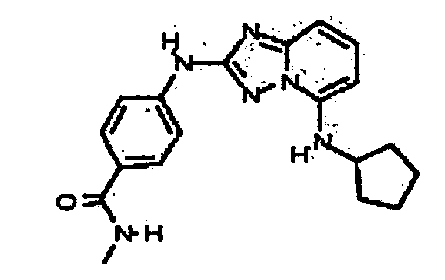
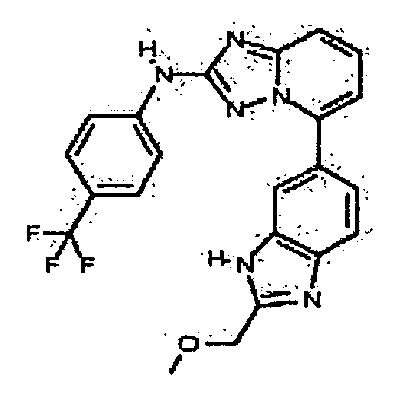
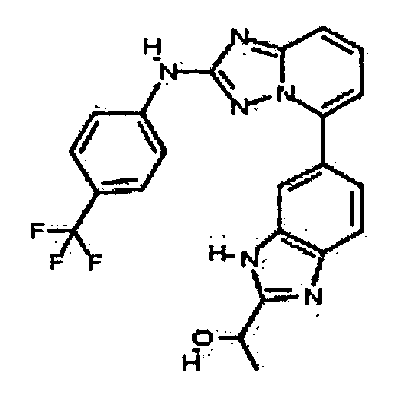
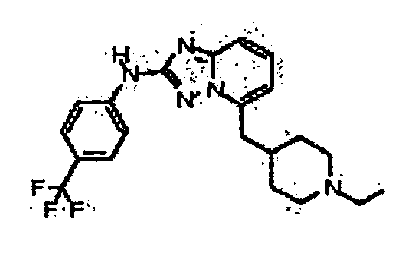
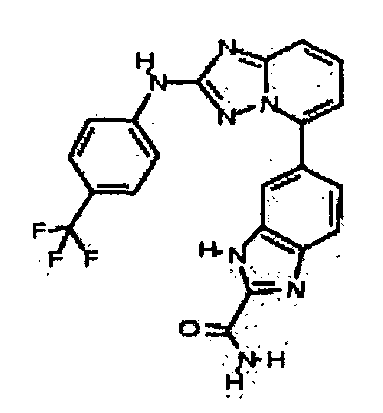
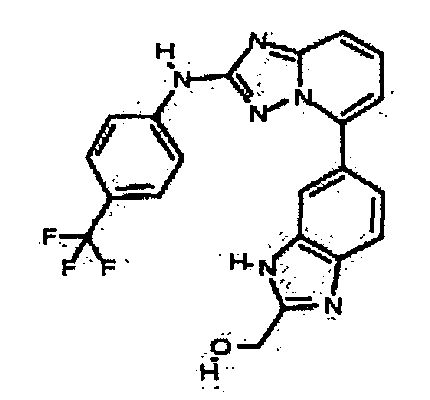
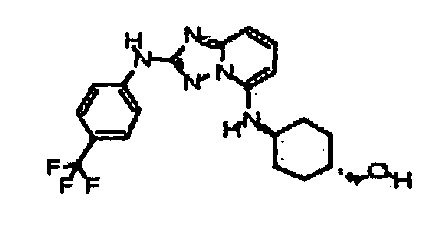
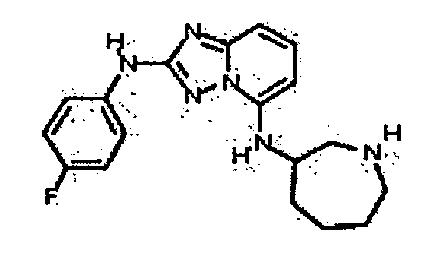
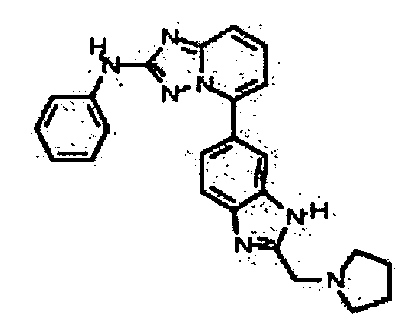
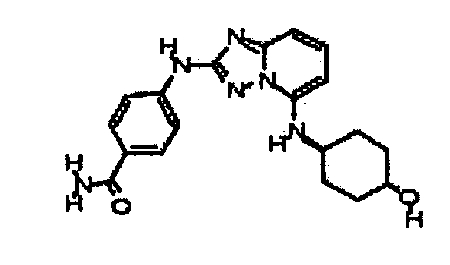
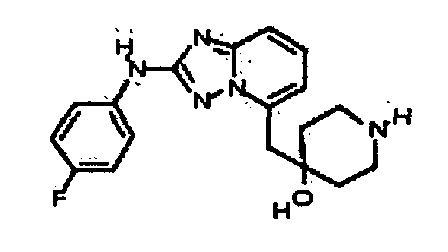
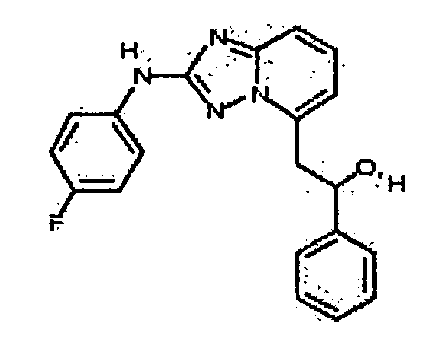
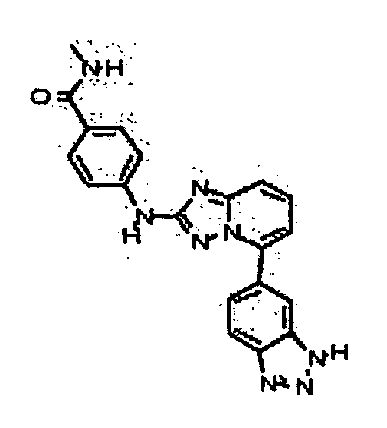
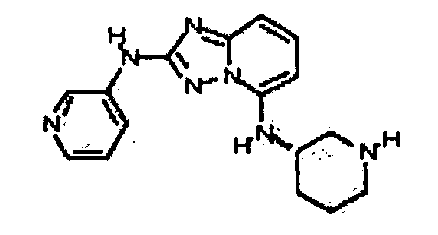
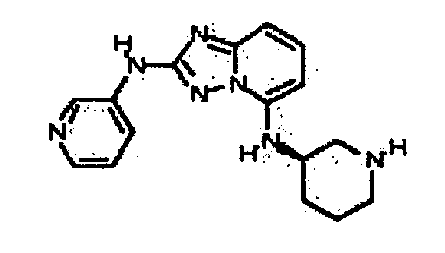
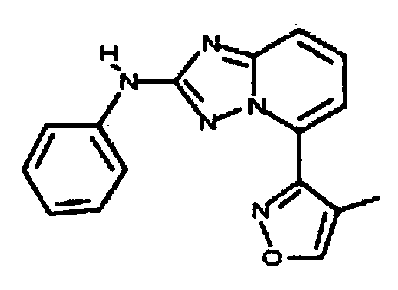
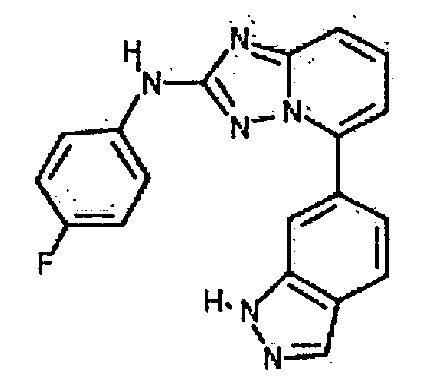
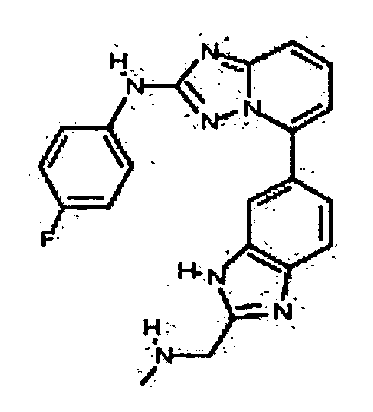
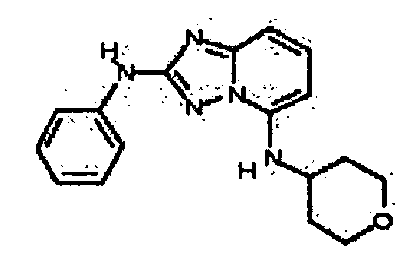
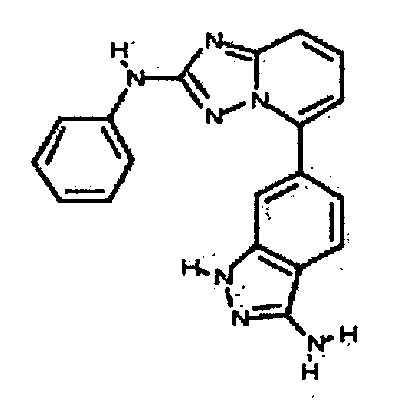
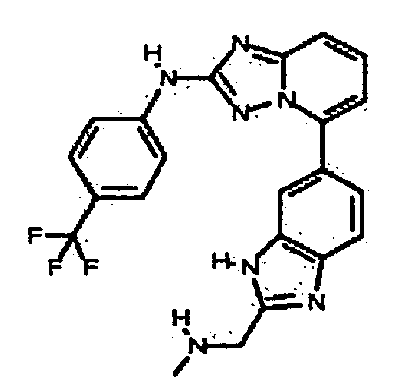
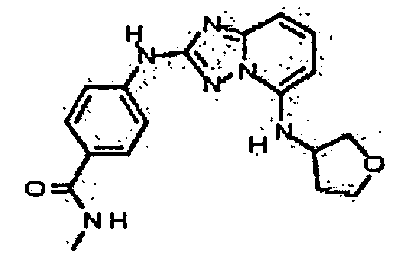
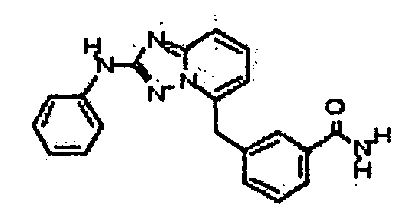
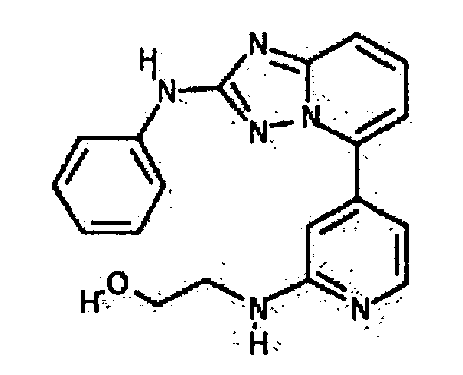
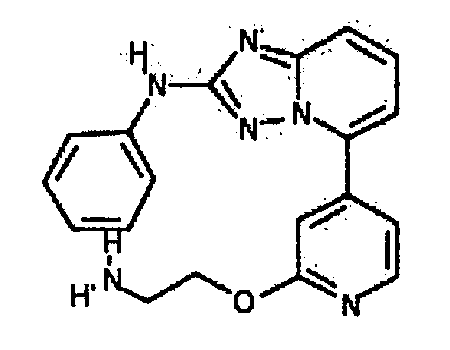
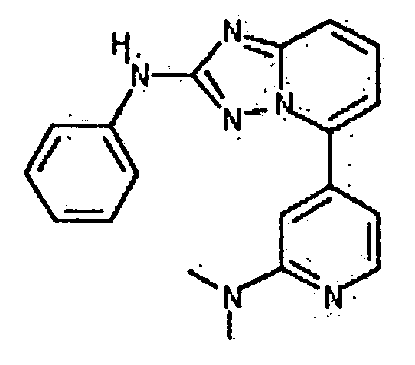
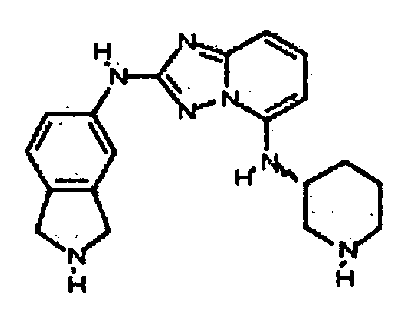
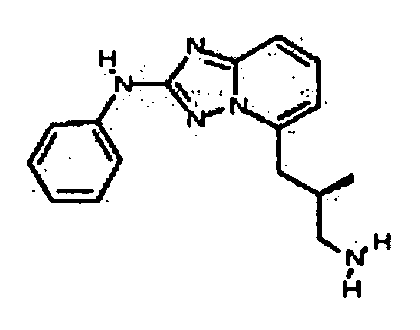
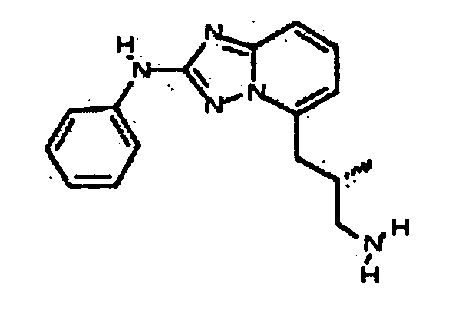
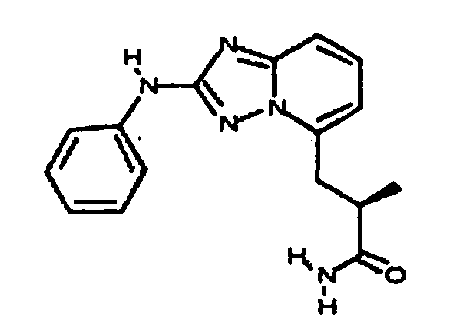
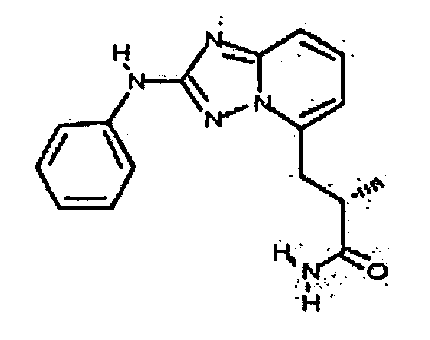
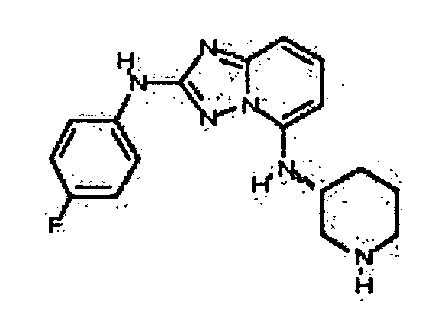
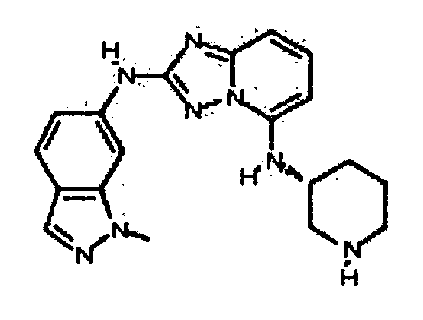
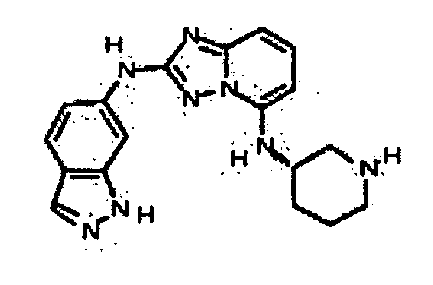
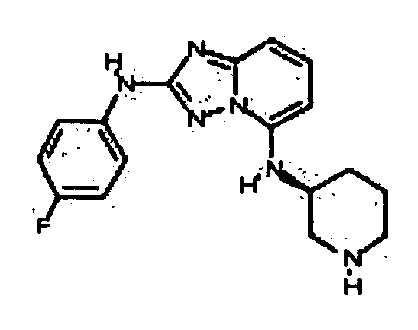
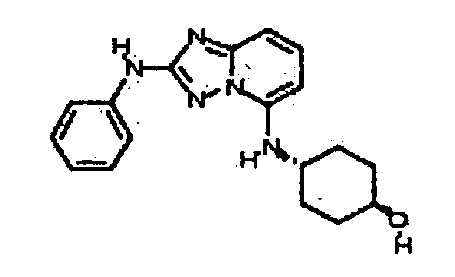
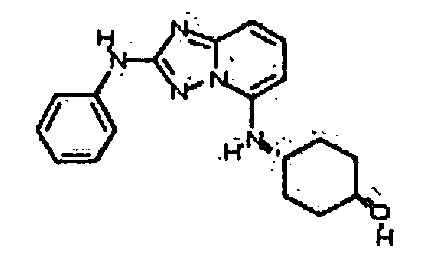
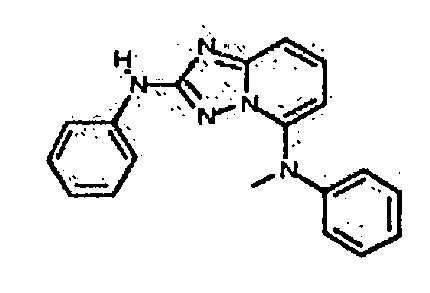
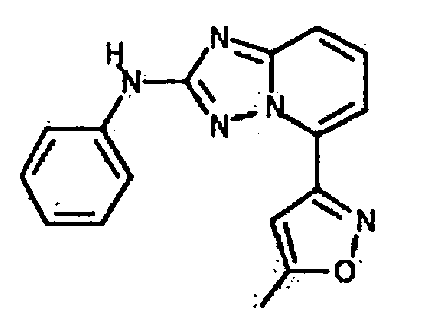
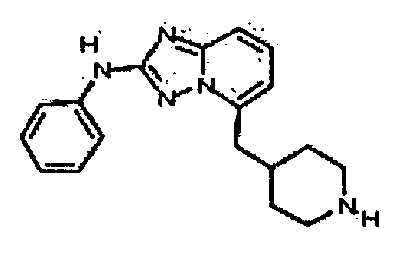
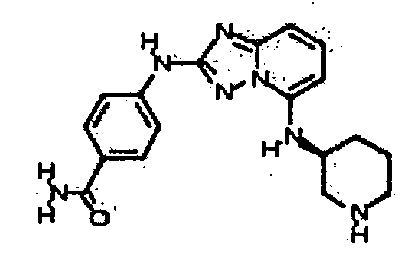
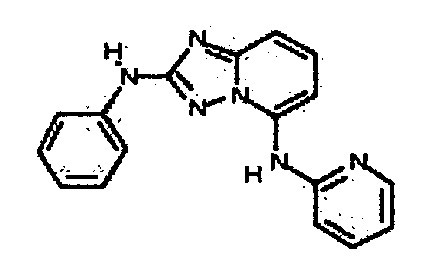
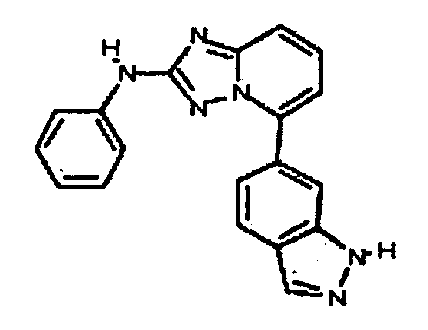
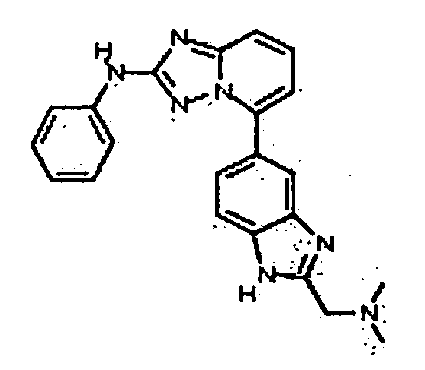
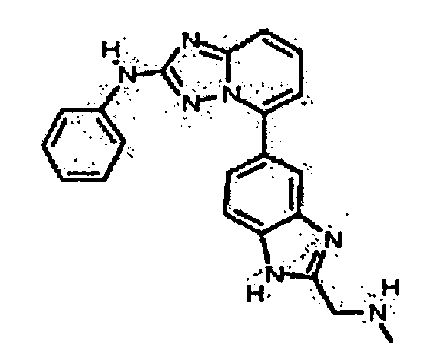
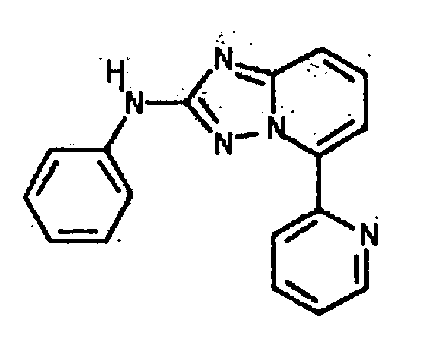
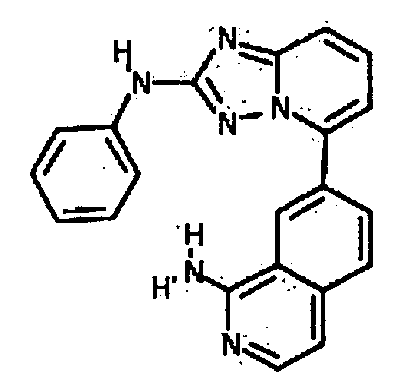
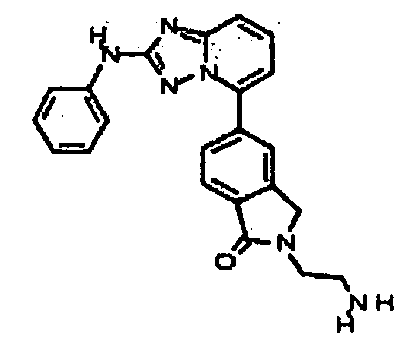
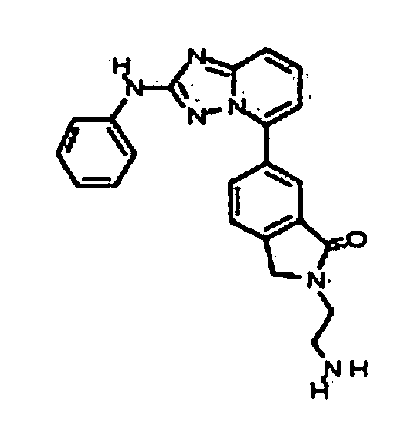
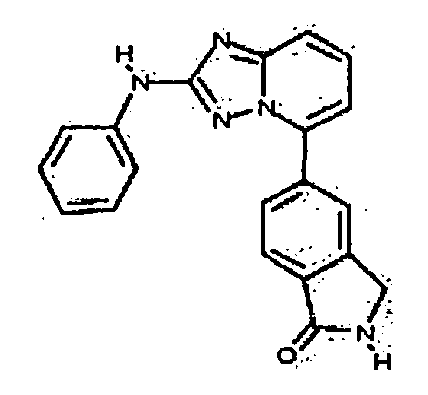
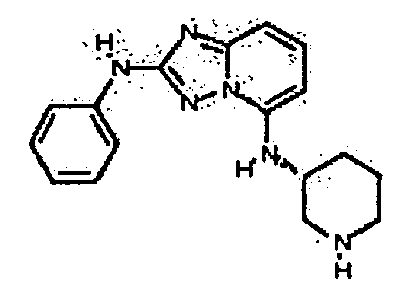
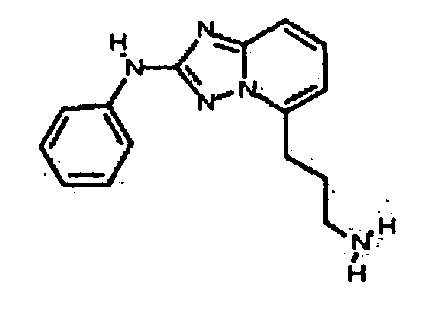
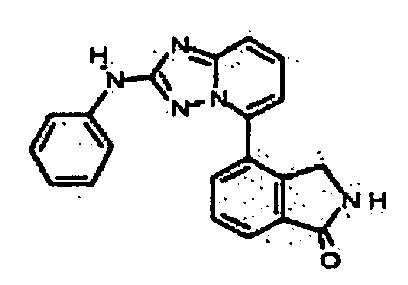
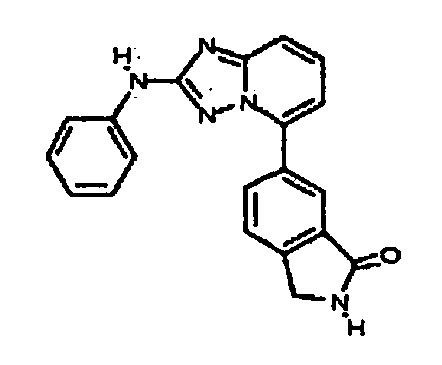
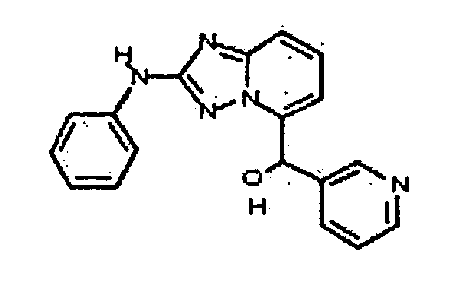
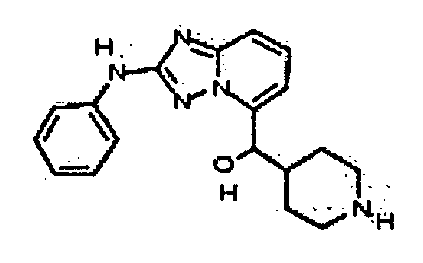
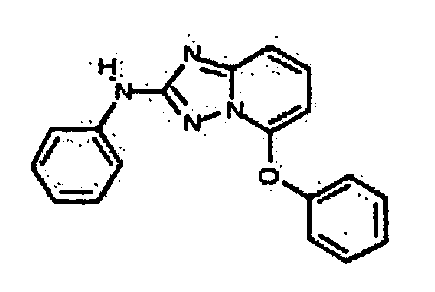
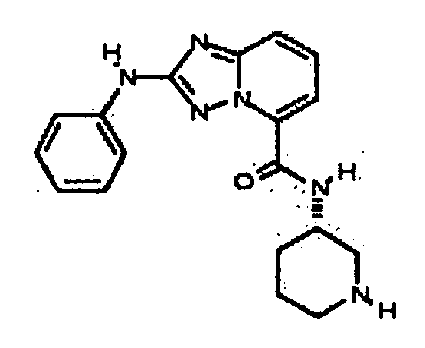
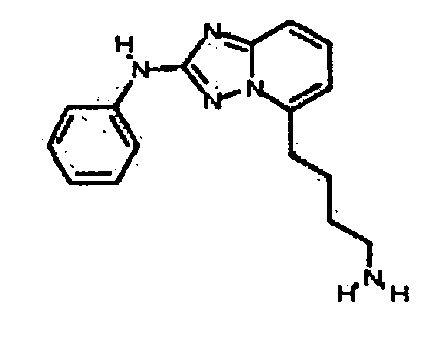
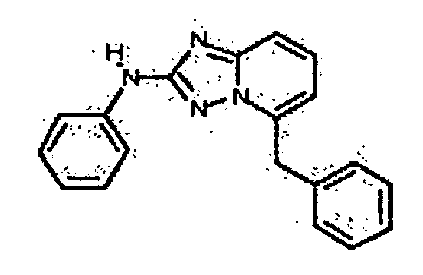
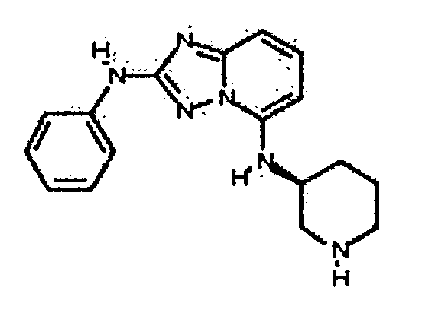
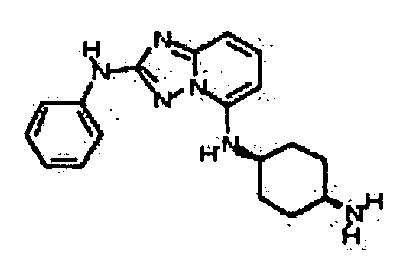
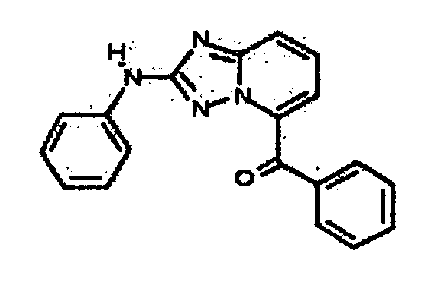
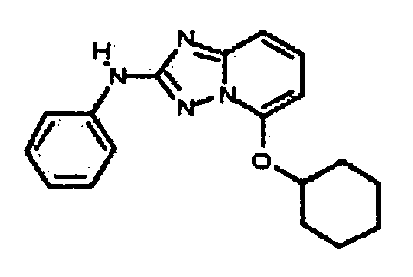
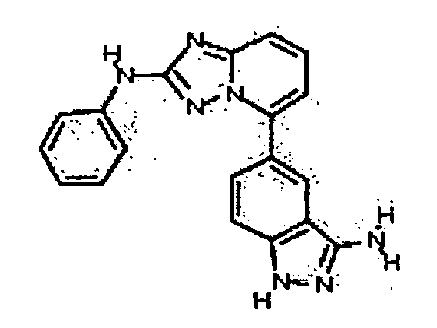
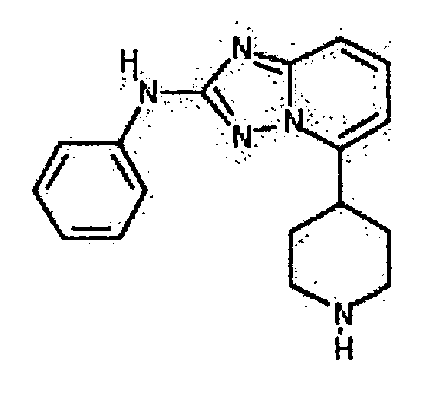
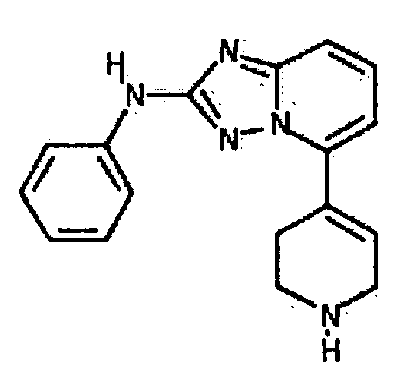
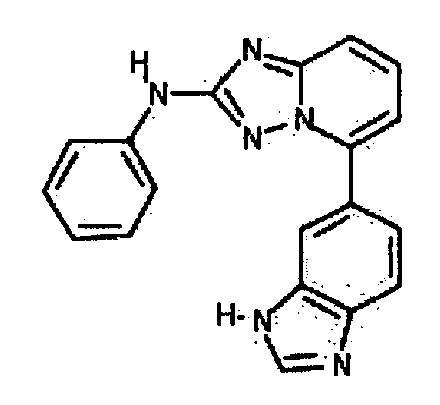
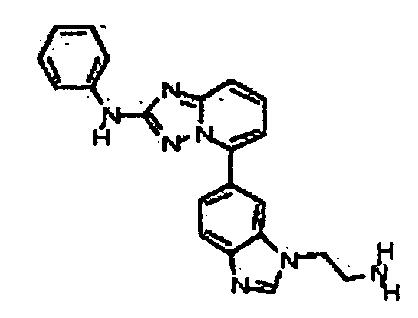
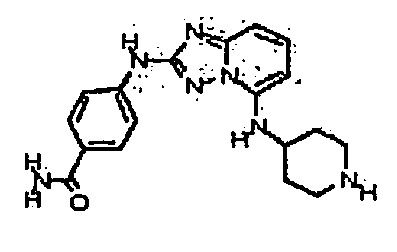
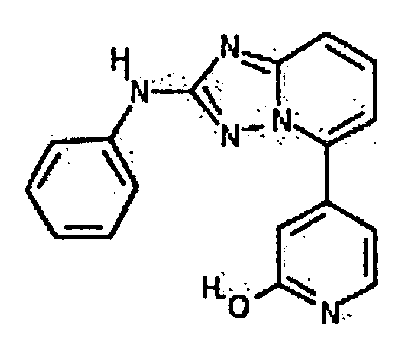
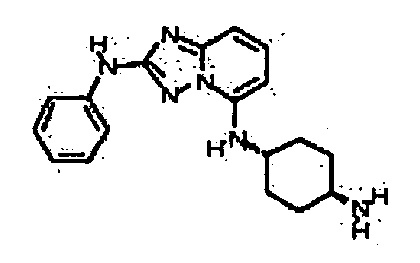
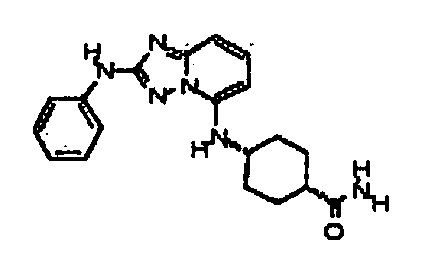
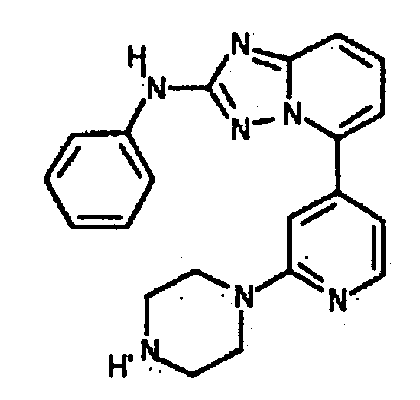
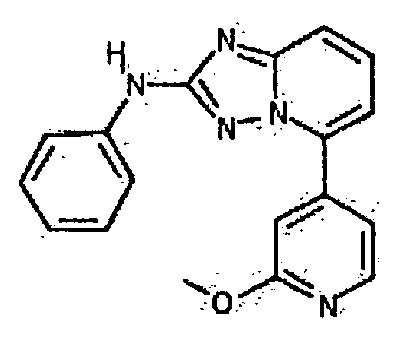
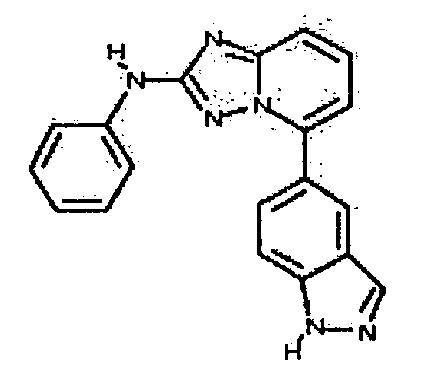
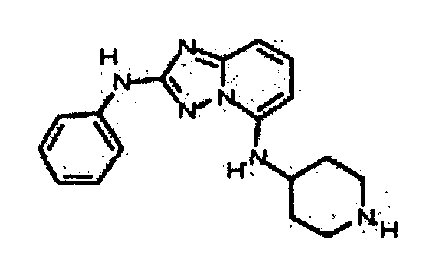
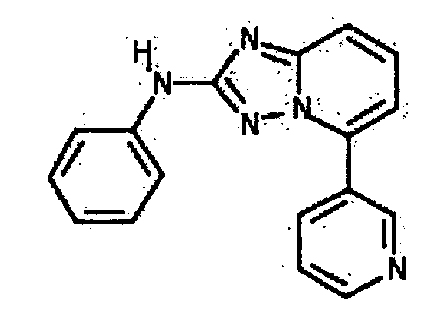
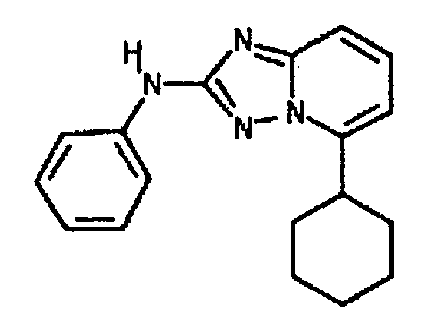
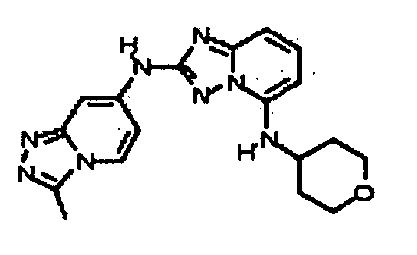
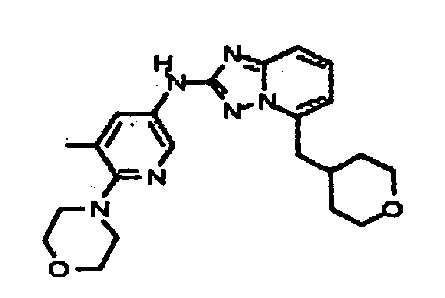
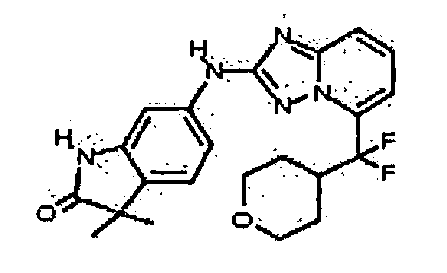
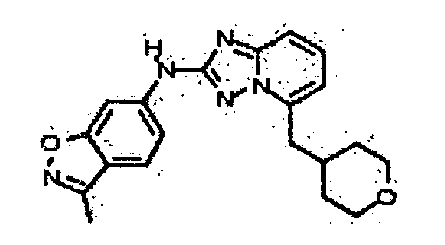
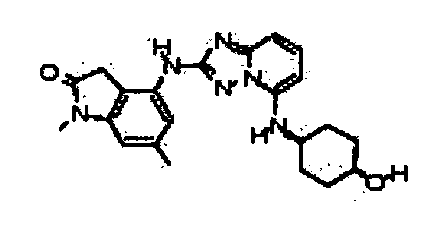
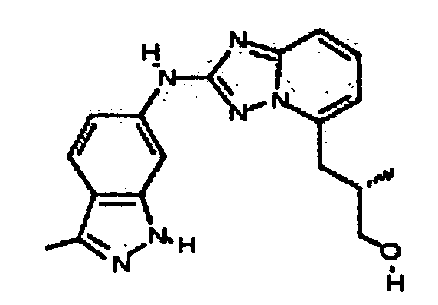
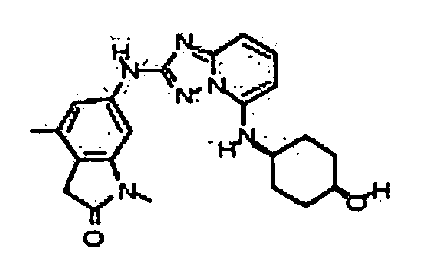
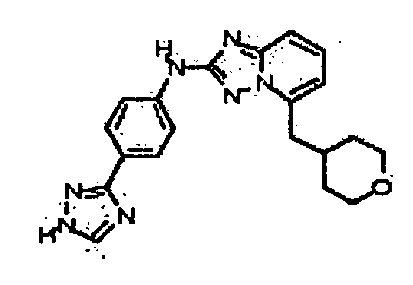
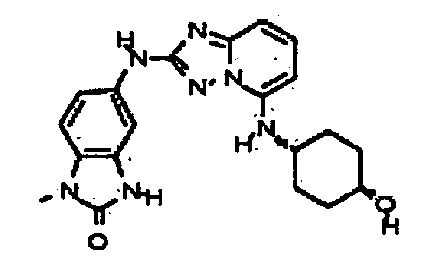
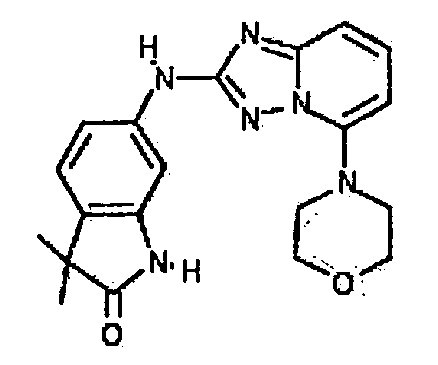
Результат интеллектуальной деятельности: АМИНОТРИАЗОЛОПИРИДИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ
Вид РИД
Изобретение
Настоящая заявка заявляет преимущество Временной Заявки США № 61/095217, поданной 8 сентября 2008 года и Временной Заявки США № 61/230479, поданной 31 июля 2009 года, полное содержание которых включено в настоящую заявку посредством ссылки.
1. Область изобретения
В настоящей заявке представлены некоторые гетероарильные соединения, композиции, включающие эффективное количество одного или нескольких таких соединений, и способы лечения или профилактики рака, воспалительных состояний, иммунологических состояний, метаболических состояний и состояний, которые можно лечить или предотвратить путем ингибирования киназы или киназного пути, включающие введение эффективного количества гетероарильного соединения субъекту, нуждающемуся в этом.
2. Предпосылки изобретения
Связь между аномальным фосфорилированием белка и причиной или последствием заболеваний известна уже более 20 лет. Соответственно, протеинкиназы представляют очень важную группу объектов, являющихся мишенями для лекарственных средств. См. Cohen, Nature, 1: 309-315 (2002). Различные ингибиторы протеинкиназы клинически используются для лечения широкого ряда заболеваний, таких как рак и хронические воспалительные заболевания, включая диабет и удар. См. Cohen, Eur. J. Biochem., 268:5001-5010 (2001).
Протеинкиназы представляют собой большое и разнообразное семейство ферментов, которые катализируют фосфорилирование белка и играют критическую роль в клеточной передаче сигнала. Протеинкиназы могут проявлять положительные или отрицательные регуляторные эффекты, в зависимости от их белка-мишени. Протеинкиназы вовлечены в специфические сигнальные пути, которые регулируют клеточные функции, такие как, но не ограничиваясь этим, метаболизм, развитие клеточного цикла, клеточная адгезия, функция сосудов, апоптоз, воспаление и ангиогенез. Нарушение клеточной передачи сигнала связывают с многими заболеваниями, наиболее характерные из которых включают воспаление, рак и диабет. Регуляция сигнальной трансдукции цитокинами и связь сигнальных молекул с протоонкогенезом и опухоль-супрессорными генами подробно описана в различных документах. Подобным образом, была продемонстрирована связь между диабетом и связанным с ним состояниями и нарушенной регуляцией уровней протеинкиназ. См., например, Sridhar et al. Pharmaceutical Research, 17(11):1345-1353 (2000). Вирусные инфекции и состояния, связанные с ними, также связывают с регуляцией протеинкиназ. Park et al. Cell 101 (7): 777-787 (2000).
Протеинкиназы можно подразделить на широкие группы на основании идентичности аминокислоты(аминокислот), на которые они нацелены (серин/треонин, тирозин, лизин и гистидин). Например, тирозиновые киназы включают тирозиновые киназы рецепторов (RTKs), такие как факторы роста, и не-рецепторные тирозиновые киназы, такие как семейство src киназ. Существуют также протеинкиназы с двойной специфичностью, которые нацелены как на тирозин, так и серин/треонин, такие как циклин-зависимые киназы (CDKs) и митоген-активируемые протеинкиназы (MAPKs).
Поскольку протеинкиназы регулируют почти каждый клеточный процесс, включая метаболизм, клеточную пролиферацию, клеточную дифференциацию и клеточное выживание, они являются привлекательными мишенями для терапевтического вмешательства при различных болезненных состояниях. Например, контроль клеточного цикла и ангиогенез, в которых протеинкиназы играют существенную роль, представляют собой клеточные процессы, связанные с различныеми болезненными состояниями, такими как, но не ограничиваясь этим, рак, воспалительные заболевания, аномальный ангиогенез и заболевания, связанные с ними, атеросклероз, дегенерация желтого пятна, диабет, ожирение и боль.
Одним из ключевых событий в сигнальном пути после активации тучных клеток является активация тирозиновой киназы Syk. Тучные клетки играют критическую роль в астме и аллергических расстройствах путем высвобождения про-воспалительных медиаторов и цитокинов. Антиген-опосредованная агрегация FcεRI, высоко-аффинного рецептора для IgE, приводит к активации тучных клеток. Это запускает серию сигнальных событий, приводящих к высвобождению медиаторов, включая гистамин, протеазы, лейкотриены и цитокины. Эти медиаторы вызывают повышенную сосудистую проницаемость, продукцию слизи, бронхостеноз, разрушение ткани и воспаление, таким образом, они играют ключевые роли в этиологии и симптомах астмы и аллергических расстройств. Syk киназа действует как центральный инициатор всех последующих сигнальных событий, приводя к высвобождению медиатора. Критическая роль Syk киназы в сигнальном пути была продемонстрирована путем полного ингибирования высвобождения медиатора белком, содержащим SH2 домены Syk киназы, который функционировал как ингибитор Syk киназы (J. A. Taylor et al, Molec. and Cell Biol, 15: 4149-4157 (1995). Кроме того, было обнаружено, что непосредственное образование кластеров Syk, введенного в линию тучных клеток как часть химерного трансмембранного белка, является достаточным для стимуляции событий, приводя к высвобождению медиатора, обычно индуцируемого образованием кластеров FcεRI (V. M. Rivera et al, Molec. and Cell Biol, 15: 1582-1590 (1995).
Активация и активность Syk киназы необходима для FcεRI-опосредованного высвобождения медиаторов из тучных клеток. Поэтому агенты, которые блокируют активность Syk киназы, обладают действием блокирования высвобождения аллергических и про-воспалительных медиаторов и цитокинов. Эти агенты имеют потенциальное применение в лечении воспалительных и аллергических расстройств, включая астму, хроническое обструктивное легочное заболевание (COPD), респираторный дистресс-синдром взрослых или острый респираторный дистресс-синдром (ARDS), язвенный колит, болезнь Крона, бронхит, конъюнктивит, псориаз, склеродерму, крапивницу, дерматит и аллергический ринит.
Помимо тучных клеток, Syk экспрессируется в других гематопоэтических клетках, включая B-клетки, где, как считают, он играет существенную роль в трансдукции сигналов, необходимой для перехода незрелых B-клеток в зрелые рециркулирующие B-клетки (M. Turner et al, Immunology Today, 21: 148 (2000). Есть сообщения о том, что B-клетки играют важную роль в некоторых воспалительных состояниях, таких как волчанка (O. T. Chan et al. Immunological Rev, 169: 107-121 (1999) и ревматоидный артрит (A. Gause et al, Biodrugs, 15(2): 73-79 (2001).
Также сообщалось о том, что Syk является элементом сигнального каскада в бета-амилоидных и прионных фибриллах, приводя к продукции нейротоксичных продуктов (C. K. Combs et al, J. Neurosci, 19: 928-939 (1999). Кроме того, ингибитор Syk блокировал продукцию этих нейротоксичных продуктов. Таким образом, гетероарильное соединение потенциально может быть полезным для лечения болезни Альцгеймера и соответствующих нейровоспалительных заболеваний. Другое сообщение (Y. Kuno et al., Blood, 97, 1050-1055 (2001) демонстрирует, что Syk играет важную роль в прогрессировании злокачественного заболевания. Было обнаружено, что TEL-Syk гибридный белок трансформирует гематопоэтические клетки, что говорит о его роли в патогенезе гематопоэтических злокачественных опухолей. Поэтому гетероарильное соединение может быть полезным для лечения некоторых типов рака.
Другие тирозиновые протеинкиназы, которые вовлечены в гематологические злокачественные опухоли, включают ABL (ABLl), ARG (ABL2), PDGFβR, PDGFaR, JAK2, TRKC, FGFRl, FGFR3, FLT3 и FRK. Janus киназы (JAK) представляют собой семейство тирозиновых киназ, включающее JAK1, JAK2, JAK3 и TYK2. JAKs играют критическую роль в сигнальной активности цитокинов. Находящиеся далее на этом пути субстраты JAK семейства киназ включают белки, являющиеся сигнальными трансдукторами и активаторами транскрипции (STAT). Передача сигнала JAK/STAT участвует в опосредовании многих аномальных иммунных ответов, таких как аллергии, астма, аутоиммунные заболевания, такие как отторжение трансплантата(аллотрансплантата), ревматоидный артрит, амиотрофический боковой склероз и рассеянный склероз, а также в солидных и гематологических злокачественных опухолях, таких как лейкоз и лимфомы (обзор фармацевтического вмешательства в отношении JAK/STAT пути см. в Frank, Mol. Med. 5, 432:456 (1999) и Seidel et al, Oncogene 19, 2645-2656 (2000). JAK2 является общепризнанной мишенью с большим потенциалом для лечения миелопролиферативных расстройств (MPDs), которые включают истинную полицитемию (PV), эссенциальную тромбоцитемию, хронический идиопатический миелофиброз, миелоидную метаплазию с миелофиброзом, хронический миелоидный лейкоз, хронический миеломоноцитарный лейкоз, хронический эозинофильный лейкоз, гиперэозинофильный синдром и системный мастоцитоз.
Fms-подобная тирозинкиназа 3 (FLT3), которая также известна как FLK-2 (фетальная печеночная киназа 2) и STK-I (киназа 1 стволовых клеток), играет важную роль в пролиферации и дифференциации гематопоэтических стволовых клеток. FLT3 рецепторная киназа экспрессируется в нормальных гематопоэтических клетках, плаценте, половых железах и головном мозге. Однако этот фермент экспрессируется на очень высоких уровнях на клетках у более чем 80% миелогенных пациентов и в определенной доли клеток острого лимфобластного лейкоза. Кроме того, этот фермент также можно обнаружить на клетках пациентов с хроническим миелогенным лейкозом в лимфоидном бластном кризисе. Сообщалось о том, что FLT3 киназа мутирует в 30% случаев острого миелоидного лейкоза (AML), а также в определенной доли случаев острого лимфобластного лейкоза (ALL) (Gilliland et al, Blood 100, 1532-1542 (2002); Stirewalt et al, Nat. Rev. Cancer, 3, 650-665 (2003). Наиболее распротраненными активирующими мутациями в FLT3 являются внутренние тандемные дупликации в околомембранной области, тогда как точечные мутации, инсерции или делеции в киназном домене менее типичны. Некоторые из этих мутантных FLT3 киназ являются конститутивно активными. FLT3 мутации связывают с плохим прогнозом (Malempati et al., Blood, 104, 11 (2004). Более дюжины известных ингибиторов FLT3 было разработано, и некоторые показали многообещающие клинические эффекты против AML (Levis et al Int. J. Hematol, 52, 100- 107 (2005). Сообщалось, что некоторые малые молекулы-ингибиторы FLT3 являются эффективными в индукции апоптоза в клеточных линиях с FLT3-активирующими мутациями и продлении периода выживания мышей, которые экспрессируют мутантный FLT3 в их клетках костного мозга (Levis et al, Blood, 99, 3885-3891 (2002); Kelly et al, Cancer Cell, 1, 421-432 (2002); Weisberg et al, Рак Cell, 1, 433-443 (2002); Yee et al, Blood, 100, 2941-2949 (2002).
Выяснение сложности протеинкиназных путей и сложности взаимосвязей и взаимодействий среди и между различными протеинкиназами и киназными путями подчеркивает важность разработки фармацевтических средств, способных действовать как модуляторы, регуляторы или ингибиторы протеинкиназ, имеющих благоприятное действие на несколько киназ или несколько киназных путей. Соответственно, остается потребность в новых модуляторах киназ.
Цитирование или указание какого-либо ссылочного документа в разделе 2 настоящей заявки не должно рассматриваться как допущение того, что этот ссылочный документ является известным из уровня техники аналогом настоящего изобретения.
3. Краткое описание изобретения
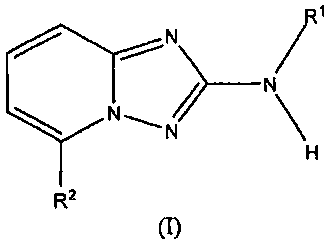
В настоящей заявке представлены гетероарильные соединения, имеющие следующую формулу (I):
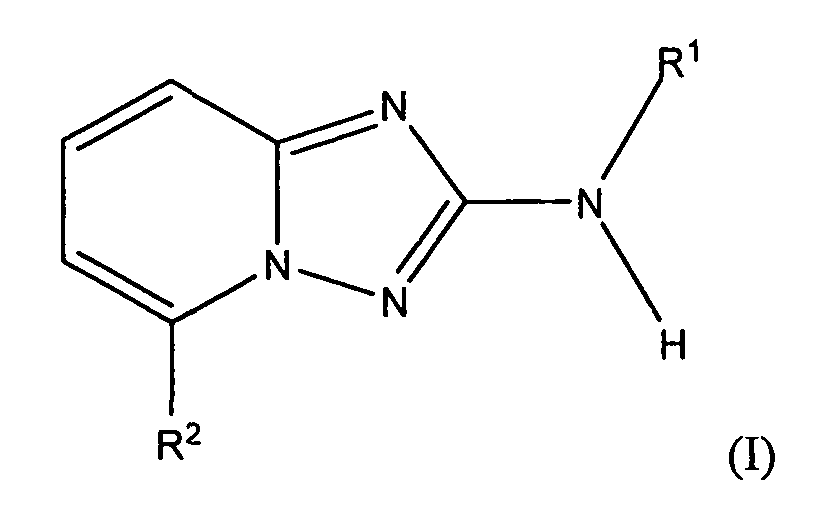
и их фармацевтически приемлемые соли, таутомеры, стереоизомеры, сольваты или пролекарства, где R1 и R2 имеют значения, определенные ниже.
В одном аспекте, в настоящей заявке представлены гетероарильные соединения, представленные в Таблице 1 настоящего раскрытия, и их фармацевтически приемлемые соли, таутомеры, стереоизомеры, сольваты и пролекарства.
В одном аспекте, в настоящей заявке представлены фармацевтические композиции, включающие эффективное количество гетероарильного соединения, описанного в настоящей заявке, или его фармацевтически приемлемой соли, таутомера, стереоизомера, сольвата или пролекарства и фармацевтически приемлемый носитель, эксципиент или наполнитель. В некоторых вариантах воплощения фармацевтическая композиция является подходящей для введения пероральным, парентеральным, через слизистую оболочку, чрескожным или местным путем.
В одном аспекте, в настоящей заявке представлены способы лечения или профилактики воспалительных состояний иммунологических состояний, аутоиммунных состояний, аллергических состояний, ревматических состояний, тромботических состояний, рака, инфекций, нейродегенеративных заболеваний, нейровоспалительных заболеваний, сердечно-сосудистых заболеваний и метаболических состояний, включающие введение субъекту, нуждающемуся в этом, эффективного количества гетероарильного соединения, описанного в настоящей заявке, или его фармацевтически приемлемой соли, таутомера, стереоизомера, сольвата или пролекарства; и фармацевтически приемлемого носителя, эксципиента или наполнителя. В некоторых вариантах воплощения, способы дополнительно включают введение дополнительных терапевтических ингредиентов, описанных в настоящей заявке.
В одном аспекте, в настоящей заявке представлены способы ингибирования киназы в клетке, экспрессирующей указанную киназу, включающие контактирование указанной клетки с эффективным количеством гетероарильного соединения, описанного в настоящей заявке, или его фармацевтически приемлемой соли, таутомера, стереоизомера, сольвата или пролекарства.
В одном аспекте, в настоящей заявке представлены способы лечения или профилактики рака, включающие введение субъекту, страдающему раком, определенного количества гетероарильного соединения, описанного в настоящей заявке, или его фармацевтически приемлемой соли, таутомера, стереоизомера, сольвата или пролекарства.
Представленные варианты воплощения будут более понятны со ссылкой на подробное описание и примеры, которые предназначены для иллюстрации, а не для ограничения вариантов воплощения.
4. Подробное описание изобретения
4.1 Определения
"Алкильная" группа представляет собой насыщенный, частично насыщенный или ненасыщенный линейный или разветвленный нециклический углеводород, содержащий от 1 до 10 атомов углерода, типично от 1 до 8 атомов углерода или, в некоторых вариантах воплощения, от 1 до 6, от 1 до 4 или от 2 до 6 атомов углерода. Реперезентативные алкильные группы включают -метил, -этил, -н-пропил, -н-бутил, -н-пентил и -н-гексил; тогда как насыщенные разветвленные алкилы включают -изопропил, -втор-бутил, -изобутил, -трет-бутил, - изопентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2,3-диметилбутил и подобные. Примеры ненасыщенных алкильных групп включают, но не ограничиваются этим, винил, аллил, -CH=CH(CH3), -CH=C(CH3)2, -C(CH3)=CH2, -C(CH3)=CH(CH3), -C(CH2CH3)=CH2, -C≡CH, -OC(CH3), -C≡C(CH2CH3), -CH2C≡CH, -CH2C≡C(CH3) и -CH2C≡C(CH7CH3), среди прочих. Алкильная группа может быть замещенной или незамещенной.
"Циклоалкильная" группа представляет собой насыщенную, частично насыщенную или ненасыщенную циклическую алкильную группу, содержащую от 3 до 10 атомов углерода, содержащую одно циклическое кольцо или несколько конденсированных или связанных мостиковой связью колец, которые, необязательно, могут быть замещены 1-3 алкильными группами. В некоторых вариантах воплощения, циклоалкильная группа содержит от 3 до 8 кольцевых членов, тогда как в других вариантах воплощения количество кольцевых атомов углерода составляет от 3 до 5, от 3 до 6 или от 3 до 7. Такие циклоалкильные группы включают, в качестве примера, структуры с одним кольцом, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, 1-метилциклопропил, 2-метилциклопентил, 2-метилциклооктил и подобные, или структуры, включающие несколько или связанных мостиковой связью колец, такие как адамантил и подобные. Примеры ненасыщенных циклоалкильных групп включают циклогексенил, циклопентенил, циклогексадиенил, бутадиенил, пентадиенил, гексадиенил, среди прочих. Циклоалкильная группа может быть замещенной или незамещенной. Такие замещенные циклоалкильные группы включают, в качестве примера, циклогексанон и подобные.
"Арильная" группа представляет собой ароматическую карбоциклическую группу, содержащую от 6 до 14 атомов углерода, содержащую одно кольцо (например, фенил) или несколько конденсированных колец (например, нафтил или антрил). В некоторых вариантах воплощения, арильные группы содержат 6-14 атомов углерода, а в других от 6 до 12 или даже от 6 до 10 атомов углерода в кольцевых частях таких групп. Конкретные арилы включают фенил, бифенил, нафтил и подобные. Арильная группа может быть замещенной или незамещенной. Термин "арильные группы" также включает группы, содержащие конденсированные кольца, такие как конденсированные ароматические-алифатические кольцевые системы (например, инданил, тетрагидронафтил и подобные).
"Гетероарильная" группа представляет собой арильную кольцевую систему, содержащую от одного до четырех гетероатомов в качестве кольцевых атомов в гетероароматической кольцевой системе, где остальные атомы представляют собой атомы углерода. В некоторых вариантах воплощения, гетероарильные группы содержат от 3 до 6 кольцевых атомов, а в других от 6 до 9 или даже от 6 до 10 атомов в кольцевых частях таких групп. Подходящие гетероатомы включают кислород, серу и азот. В некоторых вариантах воплощения, гетероарильная кольцевая система является моноциклической или бициклической. Неограничивающие примеры включают, но не ограничиваются этим, группы, такие как пирролильная, пиразолильная, имидазолильная, триазолильная, тетразолильная, оксазолильная, изоксазолильная, бензизоксазолильная (например, бензо[d]изоксазолил), тиазолильная, пирролильная, пиридазинильная, пиримидильная, пиразинильная, тиофенильная, бензотиофенильная, фуранильная, бензофуранильная, индолильная (например, индолил-2-онил или изоиндолин-1-онил), азаиндолильная (пирролопиридил или 1H-пирроло[2,3-b]пиридил), индазолильная, бензимидазолильная (например, 1H-бензо[d]имидазолил), имидазопиридильная (например, азабензимидазолил или 1H-имидазо[4,5-b]пиридил), пиразолопиридильная, триазолопиридильная, бензотриазолильная (например, 1H-бензо[d][1,2,3]триазолил), бензоксазолильная (например, бензо[d]оксазолил), бензотиазолильная, бензотиадиазолильная, изоксазолопиридильная, тианафталинильная, пуринильная, ксантинильная, аденинильная, гуанинильная, хинолинильная, изохинолинильная (например, 3,4-дигидроизохинолин-1(2H)-онил), тетрагидрохинолинильная, хиноксалинильная и хиназолинильная группы.
"Гетероциклил" представляет собой ароматический (также указан как гетероарил) или неароматический циклоалкил, в котором от одного до четырех кольцевых атомов углерода независимо замещены гетероатом, выбранным из группы, включающей O, S и N. В некоторых вариантах воплощения, гетероциклильные группы включают от 3 до 10 кольцевых членов, тогда как в других такие группы содержат от 3 до 5, от 3 до 6 или от 3 до 8 кольцевых членов. Гетероциклилы также могут быть связаны с другими группами по любому кольцевому атому (т.е. по любому углеродному атому или гетероатому гетероциклического кольца). Гетероциклоалкильная группа может быть замещенной или незамещенной. Гетероциклильные группы охватывают ненасыщенные, частично насыщенные и насыщенные кольцевые системы, такие как, например, имидазолильная, имидазолинильная и имидазолидинильная (например, имидазолидин-4-он или имидазолидин-2,4-дионил) группы. Гетероциклил включает конденсированные кольцевые типы, включая типы, включающие конденсированные ароматические и неароматические группы, такие как, например, бензотриазолил (например, 1H-бензо[d][1,2,3]триазолил), бензимидазолил (например, 1H-бензо[d]имидазолил), 2,3-дигидробензо[1,4]диоксинил и бензо[1,3]диоксолил. Этот термин также включает связанные мостиковой связью полициклические кольцевые системы, содержащие гетероатом, такие как, но не ограничиваясь этим, хинуклидил. Реперезентативные примеры гетероциклильной группы включают, но не ограничиваются этим, азиридинильную, азетидинильную, азепанильную, пирролидильную, имидазолидинильную (например, имидазолидин-4-онил или имидазолидин-2,4-дионил), пиразолидинильную, тиазолидинильную, тетрагидротиофенильную, тетрагидрофуранильную, диоксолильную, фуранильную, тиофенильную, пирролильную, пирролинильную, имидазолильную, имидазолинильную, пиразолильную, пиразолинильную, триазолильную, тетразолильную, оксазолильную, изоксазолильную, бензизоксазолильную (например, бензо[d]изоксазолил), тиазолильную, тиазолинильную, изотиазолильную, тиадиазолильную, оксадиазолильную, пиперидильную, пиперазинильную (например, пиперазин-2-онил), морфолинильную, тиоморфолинильную, тетрагидропиранильную (например, тетрагидро-2H-пиранил), тетрагидротиопиранильную, оксатианильную, диоксильную, дитианильную, пиранильную, пиридильную, пиримидильную, пиридазинильную, пиразинильную, триазинильную, дигидропиридильную, дигидродитиинильную, дигидродитионильную, гомопиперазинильную, хинуклидильную, индолильную (например, индолил-2-онил или изоиндолин-1-онил), индолинильную, изоиндолильную, изоиндолинильную, азаиндолильную (пирролопиридил или 1H-пирроло[2,3-b]пиридил), индазолильную, индолизинильную, бензотриазолильную (например, 1H-бензо[d][1,2,3]триазолил), бензимидазолильную (например, 1H-бензо[d]имидазолил или 1H-бензо[d]имидазол-2(3H)-онил), бензофуранильную, бензотиофенильную, бензотиазолильную, бензоксадиазолильную, бензоксазинильную, бензодитиинильную, бензоксатиинильную, бензотиазинильную, бензоксазолильную (т.е. бензо[d]оксазолил), бензотиазолильную, бензотиадиазолильную, бензо[1,3]диоксолильную, пиразолопиридильную (например, 1H-пиразоло[3,4-b]пиридильную, 1H-пиразоло[4,3-b]пиридил), имидазопиридильную (например, азабензимидазолил или 1H-имидазо[4,5-b]пиридил), триазолопиридильную, изоксазолопиридильную, пуринильную, ксантинильную, аденинильную, гуанинильную, хинолинильную, изохинолинильную (например, 3,4-дигидроизохинолин-1(2H)-онил), хинолизинильную, хиноксалинильную, хиназолинильную, циннолинильную, фталазинильную, нафтиридинильную, птеридинильную, тианафталинильную, дигидробензотиазинильную, дигидробензофуранильную, дигидроиндолильную, дигидробензодиоксинильную, тетрагидроиндолильную, тетрагидроиндазолильную, тетрагидробензимидазолильную, тетрагидробензотриазолильную, тетрагидропирролопиридильную, тетрагидропиразолопиридильную, тетрагидроимидазопиридильную, тетрагидротриазолопиридильную, тетрагидропиримидин-2(1H)-он и тетрагидрохинолинильную группы. Реперезентативные замещенные гетероциклильные группы могут быть моно-замещенными или замещены более чем один раз, например, но не ограничиваясь этим, пиридильные или морфолинильные группы, которые являются 2-, 3-, 4-, 5- или 6-замещенными или дизамещенными различными заместителями, такими как перечисленные ниже.
"Аралкильная" группа представляет собой радикал формулы: -алкил-арил, где алкил и арил определены выше. Замещенные аралкильные группы могут быть замещены по алкильному, арильному или по обоим алкильному и арильному фрагментам группы. Реперезентативные аралкильные группы включают, но не ограничиваются этим, бензильные и фенетильные группы и конденсированные (циклоалкиларил)алкильные группы, такие как 4-этил-инданил.
"Гетероциклилалкил" группа представляет собой радикал формулы: -алкил-гетероциклил, где алкил и гетероциклил определены выше. Замещенные гетероциклилалкильные группы могут быть замещены по алкильному, гетероциклильному или по обоим алкильному и гетероциклильному фрагментам группы. Реперезентативные гетероциклилалкильные группы включают, но не ограничиваются этим, 4-этил-морфолинил, 4-пропилморфолинил, фуран-2-илметил, фуран-3-илметил, пиридин-3-илметил, тетрагидрофуран-2-илэтил и индол-2-илпропил.
"Галоген" представляет собой фтор, хлор, бром или иод.
"Гидроксиалкильная" группа представляет собой алкильную группу, описанную выше, замещенную одной или несколькими гидроксигруппами.
"Алкокси" группа представляет собой -O-(алкил), где алкил определен выше.
"Алкоксиалкильная" группа представляет собой -(алкил)-O-(алкил), где алкил определен выше.
"Амино" группа представляет собой радикал формулы: -NH2.
"Алкиламино" группа представляет собой радикал формулы: -NH-алкил или -N(алкил)2, где каждый алкил независимо определен выше.
"Карбокси" группа представляет собой радикал формулы: -C(O)OH.
"Аминокарбонильная группа представляет собой радикал формулы: -C(O)N(R#)2, -C(O)NH(R#) или -C(O)NH2, где каждый R# независимо представляет собой замещенную или незамещенную алкильную, циклоалкильную, арильную, аралкильную, гетероциклильную или гетероциклильную группу, как она определена в настоящей заявке.
"Ациламино" группа представляет собой радикал формулы: -NHC(O)(R#) или -N(алкил)C(O)(R#), где каждый алкил и R# независимо имеют значения, определенные выше.
"Сульфониламино" группа представляет собой радикал формулы: -NHSO2(R#) или -N(алкил)SO2(R#), где каждый алкил и R# определены выше.
Группа "мочевины" представляет собой радикал формулы: -N(алкил)C(O)N(R#)2, -N(алкил)C(O)NH(R#), -N(алкил)C(O)NH2, -NHC(O)N(R#)2, -NHC(О)NH(R#) или -NH(CO)NHR#, где каждый алкил и R# независимо имеют значения, определенные выше.
В одном варианте воплощения, когда группы, описанные в настоящей заявке, указаны как "замещенные", они могут быть замещены любым подходящим заместителем или заместителями. Иллюстративными примерами заместителей являются заместители, которые можно найти в иллюстративных соединениях и вариантах воплощения, раскрытых в настоящей заявке, а также галоген (хлор, иод, бром или фтор); алкил; гидроксил; алкокси; алкоксиалкил; амино; алкиламино; карбокси; нитро; циано; тиол; тиоэфир; имин; имид; амидин; гуанидин; енамин; аминокарбонил; ациламино; фосфонато; фосфин; тиокарбонил; сульфонил; сульфон; сульфонамид; кетон; альдегид; сложный эфир; мочевина; уретан; оксим; гидроксиламин; алкоксиамин; аралкоксиамин; N-оксид; гидразин; гидразид; гидразон; азид; изоцианат; изотиоцианат; цианат; тиоцианат; кислород (=О); B(OH)2, O(алкил)аминокарбонил; циклоалкил, который может быть моноциклическим или конденсированным или неконденсированным полициклическим (например, циклопропил, циклобутил, циклопентил или циклогексил), или гетероциклил, который может быть моноциклическим или конденсированным или неконденсированным полициклическим (например, пирролидил, пиперидил, пиперазинил, морфолинил или тиазинил); моноциклический или конденсированный или неконденсированный полициклический арил или гетероарил (например, фенил, нафтил, пирролил, индолил, фуранил, тиофенил, имидазолил, оксазолил, изоксазолил, тиазолил, триазолил, тетразолил, пиразолил, пиридил, хинолинил, изохинолинил, акридинил, пиразинил, пиридазинил, пиримидил, бензимидазолил, бензотиофенил или бензофуранил) арилокси; аралкилокси; гетероциклилокси; и гетероциклил алкокси.
Как он используется в настоящем изобретении, термин "гетероарильное соединение" относится к соединениям формулы (I), а также к следующим вариантам воплощения, представленным в настоящей заявке. В одном варианте воплощения, "гетероарильное соединение" представляет собой соединение, представленное в Таблице 1. Термин "гетероарильное соединение" включает фармацевтически приемлемые соли, таутомеры, стереоизомеры, сольваты и пролекарства соединений, представленных в настоящей заявке.
Как он используется в настоящем изобретении, термин "фармацевтически приемлемая соль(соли)" относится к соли, полученной из фармацевтически приемлемой нетоксичной кислоты или основания, включая неорганическую кислоту и основание и органическую кислоту и основание. Подходящие фармацевтически приемлемые основно-аддитивные соли гетероарильных соединений включают, но не ограничиваются этим, соли металлов алюминия, кальция, лития, магния, калия, натрия и цинка, или органические соли, полученные из лизина, N,N'-дибензилэтилендиамина, хлорпрокаина, холина, диэтаноламина, этилендиамина, меглумин (N-метилглюкамин) и прокаина. Подходящие нетоксичные кислоты включают, но не ограничиваются этим, неорганические и органические кислоты, такие как уксусная, альгиновая, антраниловая, бензолсульфоновая, бензойная, камфорсульфоновая, лимонная, этенсульфоновая, муравьиная, фумаровая, фуроевая, галактуроновая, глюконовая, глюкуроновая, глутаминовая, гликолевая, бромистоводородная, хлористоводородная, изетионовая, молочная, малеиновая, яблочная, миндальная, метансульфоновая, слизевая, азотная, памовая, пантотеновая, фенилуксусная, фосфорная, пропионовая, салициловая, стеариновая, янтарная, сульфаниловая, серная, винная кислота и п-толуолсульфоновая кислота.
Конкретные нетоксичные кислоты включают хлористоводородную, бромистоводородную, малеиновую, фосфорную, серную и метансульфоновую кислоты. Примеры конкретных солей, таким образом, включают гидрохлоридную и мезилатную соли. Другие примеры, хорошо известные из уровня техники, см., например, в Remington's Pharmaceutical Sciences, 18th eds., Mack Publishing, Easton PA (1990) или Remington: The Science and Practice of Pharmacy, 19th eds., Mack Publishing, Easton PA (1995).
Как он используется в настоящем изобретении, и если не указано иное, термин "сольват" означает гетероарильное соединение или его соль, которые дополнительно включают стехиометрическое или нестехиометрическое количество растворителя, связанного нековалентными межмолекулярными силами. В некоторых вариантах воплощения, сольват представляет собой гидрат. Как он используется в настоящем изобретении, и если не указано иное, термин "гидрат" означает гетероарильное соединение или его соль, которые дополнительно включают стехиометрическое или нестехиометрическое количество воды, связанной нековалентными межмолекулярными силами.
Как он используется в настоящем изобретении, и если не указано иное, термин "пролекарство" означает производное гетероарильного соединения, которое может гидролизоваться, окисляться или иным образом реагировать в биологических условиях (in vitro или в vivo) с получением активного соединения, в частности, гетероарильного соединения. Примеры пролекарств включают, но не ограничиваются этим, производные и метаболиты гетероарильного соединения, которые включают биогидролизуемые фрагменты, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые уреиды и биогидролизуемые фосфатные аналоги. В некоторых вариантах воплощения, пролекарства соединений с карбоксильными функциональными группами представляют собой низшие алкиловые сложные эфиры карбоновой кислоты. Карбоксилатные сложные эфиры удобным образом получают этерификацией любых карбоновокислотных фрагментов, присутствоующих в молекуле. Пролекарства типично могут быть получены с использованием хорошо известных способов, таких как описанные в Burger's Medicinal Chemistry and Drug Discovery 6th ed. (Donald J. Abraham ed., 2001, Wiley) и Design and Application of Prodrugs (H. Bundgaard ed., 1985, Harwood Academic Publishers Gmfh).
Как он используется в настоящем изобретении, и если не указано иное, термин "стереоизомер" или "стереомерно чистый" означает один стереоизомер гетероарильного соединения, который, по существу, не содержит других стереоизомеров этого соединения. Например, стереомерно чистое соединение, содержащее один хиральный центр, по существу, не содержит противоположного энантиомера соединения. Стереомерно чистое соединение, содержащее два хиральных центра, по существу, не содержит других диастереомеров соединения. Типичное стереомерно чистое соединение включает больше чем около 80% масс. одного стереоизомера соединения и меньше чем около 20% масс. других стереоизомеров соединения, больше чем около 90% масс. одного стереоизомера соединения и меньше чем около 10% масс. других стереоизомеров соединения, больше чем около 95% масс. одного стереоизомера соединения и меньше чем около 5% масс. других стереоизомеров соединения или больше чем около 97% масс. одного стереоизомера соединения и меньше чем около 3% масс. других стереоизомеров соединения. Гетероарильные соединения могут содержать хиральные центры и могут существовать в виде рацематов, индивидуальных энантиомеров или диастереомеров и их смесей. Все такие изомерные формы включены в варианты воплощения, раскрытые в настоящей заявке, включая их смеси.
Использование стереомерно чистых форм таких Гетероарильных Соединений, а также использование смесей этих форм охватывается вариантами воплощения, раскрытыми в настоящей заявке. Например, смеси, включающие равные или неравные количества энантиомеров конкретного гетероарильного соединения, можно использовать в способах и композициях, раскрытых в настоящей заявке. Эти изомеры могут быть ассиметрично синтезированы или разделены с использованием стандартных методов, таких как хиральные колонки или хиральные агенты разделения. См., например, Jacques, J., et al, Enantiomers, Racemates and Resolutions (Wiley-Interscience, New York, 1981); Wilen, S. H., et al, Tetrahedron 33:2725 (1977); Eliel, E. L., Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962); и Wilen, S. H., Tables of Resolving Agents and Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN, 1972).
Также следует отметить, что гетероарильные соединения могут включать E и Z изомеры или их смесь, и цис и транс изомеры или их смесь. В некоторых вариантах воплощения, гетероарильные соединения выделяют в виде либо E, либо Z изомера. В других вариантах воплощения, гетероарильные соединения представляют собой смесь E и Z изомеров.
Термин "таутомеры" относится к изомерным формам соединения, которые находятся в равновесии друг с другом. Концентрации изомерных форм зависят от окружения, в котором обнаружено соединение, и могут быть разными, например, в зависимости от того, является ли соединение твердым или находится в органическом или водном растворе. Например, в водном растворе, пиразолы могут существовать в следующих изомерных формах, которые указаны как таутомеры друг друга:
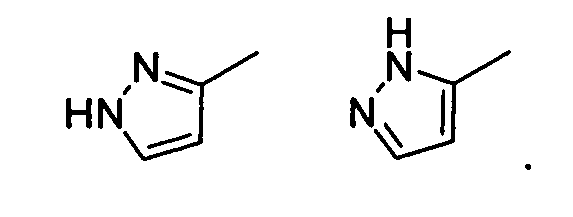
Как будет легко понятно специалистам в данной области, множество различных функциональных групп и других структур могут демонстрировать таутомерию, и все таутомеры соединений формулы (I) входят в объем настоящего изобретения.
Также следует отметить, что гетероарильные соединения могут содержать отличные от естественных пропорций атомных изотопов по одному или нескольким атомам. Например, соединения могут быть мечены радиоактивными изотопами, такими как например тритий (3H), иод-125 (125I), сера-35 (35S) или углерод-14 (14C), или могут быть изотопно обогащенными, например, дейтерием (2H), углеродом-13 (13C) или азотом-15 (15N). Как он используется в настоящем изобретении, термин "изотополог" означает изотопно обогащенное соединение. Термин "изотопно обогащенный" относится к атому, имеющему изотопный состав, отличный от природного изотопного состава этого атома. "Изотопно обогащенный" также может относиться к соединению, содержащему, по меньшей мере, один атом, имеющий изотопный состав, отличный от природного изотопного состава этого атома. Термин "изотопный состав" относится к количеству каждого присутствующего изотопа для данного атома. Меченные радиоактивным изотопом и изотопно обогащенные соединения являются полезными в качестве терапевтических средств, например, терапевтическ средств для лечения рака и воспаления, исследовательских реагентов, например, реагентов для анализа связывания и диагностических агентов, например, агентов визуализации in vivo. Все изотопные варианты Гетероарильных Соединений, описанных в настоящей заявке, независимо от того, являются ли они радиоактивными или нет, предполагаются как включенные в объем вариантов воплощения, представленных в настоящей заявке. В некоторых вариантах воплощения, обеспечиваются изотопологи Гетероарильных Соединений, например, изотопологи представляют собой дейтерий-, углерод-13- или азот-15-обогащенные гетероарильные соединения.
"Лечение", как этот термин используется в настоящем изобретении, означает облегчение, в целом или частично, симптомов, связанных с расстройством или заболеванием, или замедление или остановку дальнейшего прогрессирования или ухудшения этих симптомов, или предотвращение или обеспечение профилактики заболевания или расстройства у субъекта, имеющего риск развития такого заболевания или расстройства.
Термин "эффективное количествое" в связи с Гетероарильным Соединением может означать количество, способное облегчать, в целом или частично, симптомы, связанные с расстройством или заболеванием, или замедлять или останавливать дальнейшее прогрессирование или ухудшение этих симптомов, или предотвращать или обеспечивать профилактику заболевания или расстройства у субъекта, имеющего риск развития заболевания, раскрытого в настоящей заявке, такого как воспалительные состояния, иммунологические состояния, рак, метаболические состояния или состояния, которые можно лечить или предотвратить путем ингибирования киназы или киназного пути, в одном варианте воплощения, Syk, FLT-3, JAKl и/или JAK2 пути. В одном варианте воплощения эффективное количество гетероарильного соединения представляет собой такое количество, которое ингибирует киназу в клетке, например, in vitro или in vivo. В некоторых вариантах воплощения, эффективное количество гетероарильного соединения ингибирует киназу в клетке на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 99%, по сравнению с активностью киназы в необработанной клетке. Эффективное количество гетероарильного соединения, например в фармацевтической композиции, может находиться на уровне, который будет обеспечивать желаемый эффект; например, около 0,005 мг/кг массы тела субъекта до около 10 мг/кг массы тела субъекта в расчете на стандартную дозу как для перорального, так и для парентерального введения.
"Ингибитор киназы" в контексте настоящего изобретения представляет собой соединение, которое при концентрации 10 мкМ ингибирует способность к форсфорилированию фермента киназы на около 50% или больше чем 50%, как определено при помощи HTRF ферментных анализов, описанных в настоящей заявке. В некоторых вариантах воплощения, киназа представляет собой Syk киназу, в других вариантах воплощения киназа представляет собой Syk, FLT3, JAK1, и/или JAK2.
"Fc Рецептор" относится к члену семейства молекул клеточной поверхности, которые связываются с Fc частью (содержащей специфическую константную область) иммуноглобулина. Каждый Fc рецептор связывается с иммуноглобулинами конкретного типа. Например, Fc альфа рецептор ("FcαR") связывается с IgA, FcεR связывается с IgE, а FcγR связывается с IgG.
FcαR семейство включает полимерный Ig рецептор, вовлеченый в эпителиальный транспорт IgA/IgM, миелоидный специфический рецептор RcαRI (также называемый как CD89), Fcα/μR и, по меньшей мере, два альтернативных IgA рецептора (см. обзор Monteiro & van de Winkel, 2003, Annu. Rev. Immunol, advanced e-publication. FcαRI экспрессируется на нейтрофилах, эозинофилах, моноцитах/макрофагах, дендритных клетках и kupfer клетках. FcαRI включает одну альфа цепь и FcR гамма гомодимер, который содержит мотив активации (ITAM) в цитоплазматическом домене и фосфорилирует Syk киназу.
FcεR семейство включает два типа, обозначенных как FcεRI и FcεRII (также известные как CD23). FcεRI представляет собой высоко-аффинный рецептор, обнаруженный в тучных клетках, базофилах и эозинофилах, который закрепляет мономерный IgE на клеточной поверхности. FcεRI содержит одну альфа цепь, одну бета цепь и гамма гомодимер, обсуждаемый выше. FcεRII представляет собой низко-аффинный рецептор, экспрессируемый на мононуклеарных фагоцитах, B лимфоцитах, эозинофилах и тромбоцитах. FcεRII включает одну полипептидную цепь и не включают гомодимер гамма цепи.
FcγR семейство включает три типа, обозначенных как FcγRI (также известный как CD64), FcγRII (также известный как CD32) и FcγRIII (также известный как CD 16). FcγRI представляет собой высоко-аффинный рецептор, обнаруженный в тучных клетках, базофилах, мононуклеарных клетках, нейтрофилах, эозинофилах, дендритных клетках и фагоцитах, который закрепляет мономерный IgG на клеточной поверхности. FcγRI включает одну альфа цепь и димер гамма цепи, общий для FcαRI и FcεRI.
FcγRII представляет собой низко-аффинный рецептор, экспрессируемый на нейтрофилах, моноцитах, эозинофилах, тромбоцитах и B лимфоцитах. FcγRII включает одну альфа цепь и не включают гомодимер гамма цепи, обсуждаемый выше.
FcγRIII представляет собой низко-аффинный рецептор, экспрессируемый на NK, эозинофилах, макрофагах, нейтрофилах и тучных клетках. Он включает одну альфа цепь и гамма гомодимер, общий для FcαRI, FcεRI и FcγRI.
"Клеточно-пролиферативное расстройство" относится к расстройству, характеризующемуся аномальной пролиферацией клеток. Пролиферативное расстройство не предполагает какого-либо ограничения в том, что касается скорости клеточного роста, но просто указывает на потерю нормальных контролей, которые влияют на рост и деление клеток. Таким образом, в некоторых вариантах воплощения, клетки пролиферативного расстройства могут иметь такие же скорости деления клеток, как у нормальных клеток, но не отвечают на сигналы, которые ограничивают такой рост. В понятие "клеточно-пролиферативное расстройство" входит новообразование или опухоль, которая представляет собой аномальный рост ткани. Рак относится к любому из различных злокачественных новообразований, характеризующихся пролиферацией клеток, которые обладают способностью к инвазии, окружая ткань, и/или способностью метастазировать к новым участкам колонизации.
"Гематопоэтическое новообразование" относится к клеточно-пролиферативному расстройству, возникающему из клеток гематопоэтического происхождения. Как правило, гематопоэз представляет собой физиологический процесс, посредством которого недифференцированные клетки или стволовые клетки развиваются в различные клетки, присутствующие в периферийной крови. В начальной фазе развития гематопоэтические стволовые клетки, типично присутствующие в костном мозге, претерпевают серию клеточных делений с образованием мультипотентных клеток-предшественников, у которых происходит коммитирование на два основные пути: лимфоидная линия и миелоидная линия. Коммитированные клетки-предшественники миелоидного происхождения дифференцируют на три основные подветви, включающие эритроидный, мегакариоцитный и гранулоцитный/моноцитный пути развития. Дополнительный путь приводит к образованию дендритных клеток, которые вовлечены в презентацию антигена. Эритроидная линия дает начало эритроцитам, тогда как мегакариоцитная линия дает начало тромбоцитам крови. Коммитированные клетки гранулоцитной/моноцитной линии разбиваются на гранулоцитный или моноцитный пути развития, при этом первый путь приводит к образованию нейтрофилов, эозинофилов и базофилов, а последний путь дает начало моноцитам и макрофагам крови.
"Лимфоидное новообразование" относится к пролиферативному расстройству с участием клеток лимфоидной линии гематопоэза. Лимфоидные новообразования могут возникать из гематопоэтических стволовых клеток, а также лимфоидных коммитированных (недифференцированных)клеток-предшественников, клеток-предшественников и в конечном счете дифференцированных клеток. Эти новообразования можно подразделить на основании фенотипических признаков аберрантных клеток или дифференцированного состояния, из которого возникают аномальные клетки. Подразделения включают, среди прочих, B-клеточные новообразования, T-клеточные новообразования, NK-клеточные новообразования и лимфому Ходжкина.
"Миелоидное новообразование" относится к пролиферативному расстройству клеток миелоидной линии гематопоэза. Новообразования могут возникать из гематопоэтических стволовых клеток, миелоидных коммитированных (недифференцированных)клеток-предшественников, клеток-предшественников и, в конечном счете, дифференцированных клеток. Миелоидные новообразования можно подразделить на основании фенотипических признаков аберрантных клеток или дифференцированного состояния, из которого возникают аномальные клетки. Подразделения включают, среди прочих, миелопролиферативные заболевания, миелодиспластические/миелопролиферативные заболевания, миелодиспластические синдромы, острый миелоидный лейкоз и острый бифенотипический лейкоз.
"Вирусно-опосредованная опухоль" относится к новообразованию или опухоли, связанными с вирусной инфекцией или активностью вирусно-кодируемого продукта. Новообразование может возникать в результате присутствия латентного вируса, интегрированного в клеточный геном, или может возникать в результате активности вирусно-ассоциированного генного продукта. Инфицирование вирусом необязательно должно точно соотноситься по времени с образованием опухоли, поскольку инкубационные периоды могут продолжаться от нескольких месяцев до нескольких лет до того, как развивается опухолевых фенотип. Поскольку в некоторых вариантах воплощения лечения, раскрываемые в настоящей заявке, направленные на использование Syk-ингибирующих Гетероарильных Соединений, вирусно-ассоциируемые опухоли, к которым они применимы, представляют собой такие, в которых вирусная модуляция Syk активности коррелирует с аберрантной клеточной пролиферацией. С использованием способов, раскрытых в настоящей заявке, можно осуществлять таргетирование любого вируса, включая РНК и ДНК вирусы и вирусы, которые существуют эписомально или интегрируют в клеточный геном, в котором активация Syk является следствием вирусной инфекции.
"Опухолевые метастазы" относятся к способности опухолевых клеток мигрировать из начального участка опухоли и колонизировать другие ткани. Опухоли, образованные из клеток, которые распространились, называют "вторичными опухолями", и они содержат клетки, которые аналогичны клеткам в изначальной "первичной" опухоли. Метастатические опухоли типично образуются в результате миграции опухолевых клеток из изначального участка опухоли через систему крови и лимфы в другие ткани.
Термины "пациент" и "субъект" включают животное, включая, но не ограничиваясь этим, таких животных как коровы, обезьяны, лошади, овца, свиньи, куры, индюки, перепела, кошки, собаки, мыши, крысы, кролики или морские свинки. В одном варианте воплощения субъектом является млекопитающее, в другом - человек. В некоторых вариантах воплощения, пациент или субъект, “нуждающийся в этом”, является пациентом или субъектом, имеющим определенное заболевание или расстройство или, имеющим риск того, что он может иметь такое заболевание или расстройство.
4.2 Гетероарильные соединения
В настоящей заявке представлены гетероарильные соединения, имеющие следующую формулу (I):
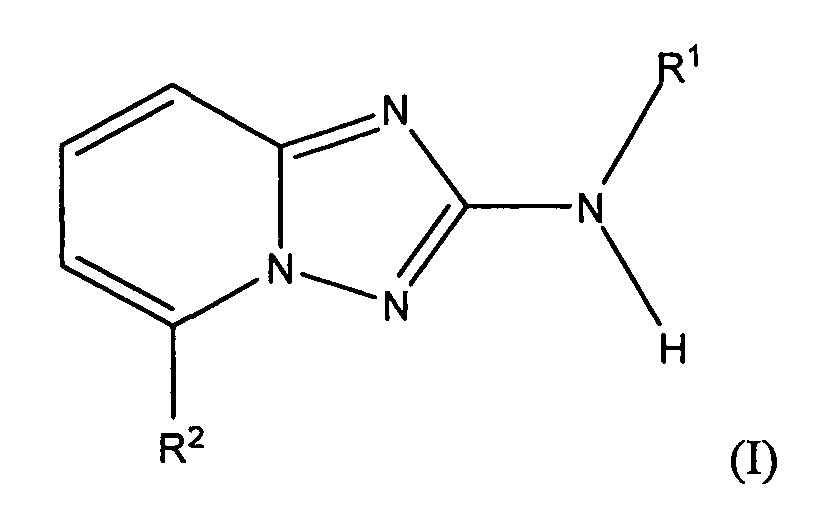
и их фармацевтически приемлемые соли, таутомеры, стереоизомеры, сольваты и пролекарства, где:
R1 представляет собой замещенный или незамещенный арил или замещенный или незамещенный гетероциклил;
R2 представляет собой замещенный или незамещенный C1-8 алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклилалкил, замещенный или незамещенный аралкил, -NR3R4, -OR3, -C(=O)R5, -C(=O)NR3R4, -NHC(=O)R3, -(CH2)0-2CR6(OR3)R4 или замещенный или незамещенный гетероциклил, выбранный из азетидинила, пирролидила, пиперидила, морфолинила, пиперазин-2-онила, 1,2,3,6-тетрагидропиридила, изоксазолила, имидазолила, индазолила, бензимидазолила, 1H-бензо[d][1,2,3]триазолила, бензизоксазолила, бензо[d]оксазолила, изоиндолин-1-онила, 1H-имидазо[4,5-b]пиридила, изохинолинила или хинолила; или R2 представляет собой пиридил, при условии, что R1 не является (2-(пирролидин-1-ил)этокси)фенил-4-илом;
R3 и R4 в каждом случае независимо представляют собой -Η, замещенный или незамещенный C1-8 алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный аралкил или замещенный или незамещенный гетероциклилалкил;
R5 представляет собой замещенный или незамещенный C1-8 алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный аралкил или замещенный или незамещенный гетероциклилалкил; и
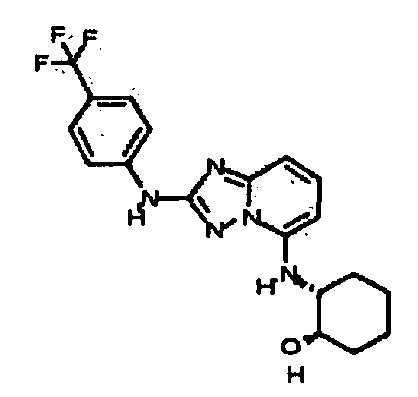
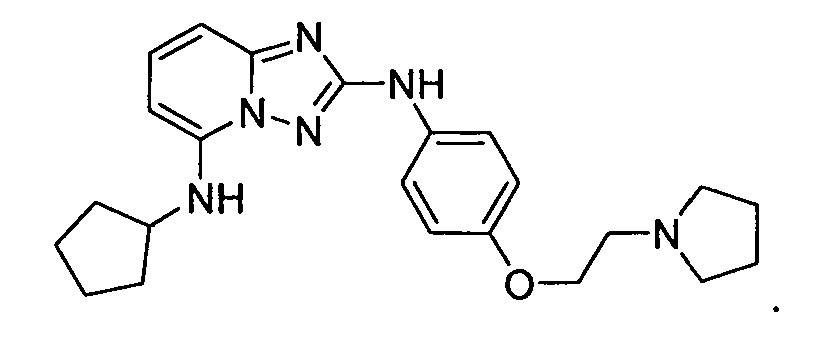
R6 представляет собой -H или замещенный или незамещенный C1-8 алкил, или вместе с R4 и с атомами, с которыми они связаны, образуют замещенный или незамещенный гетероциклил; при условии, что соединение не является N5-циклопентил-N2-(4-(2-(пирролидин-1-ил)этокси)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамином, представленным ниже:
В одном варианте воплощения, гетероарильное соединение представляет собой соединение формулы (I), где R1 представляет собой замещенный или незамещенный арил, например, замещенный или незамещенный фенил. В некоторых таких вариантах воплощения, R1 представляет собой фенил, замещенный одним или несколькими замещенным или незамещенным C1-4 алкилом, замещенным или незамещенным гетероциклилом, галогеном, гидроксилом, алкокси, карбокси, -CN, -(C0-4алкил)NR2, -O(C1-4алкил)NR2, -NR2 или -C(=O)NR2, где каждый R независимо представляет собой H, замещенный или незамещенный C1-6 алкил, или замещенный или незамещенный гетероциклил. Например, в некоторых вариантах воплощения, R1 представляет собой фенил, замещенный одним или несколькими -F, -Cl, -CF3, -CN, гидроксилом, карбокси, метилом, -(C0-4алкил)NH2, -(C0-4алкил)NH(C1-4алкил), -O(C1-4алкил), -O(C1-4алкил)O(C1-4алкил), -O(C1-4алкил)NH2, -N(C1-4алкил)2, -C(=O)NH2, -C(=O)NH(C1-4алкил), -C(=O)NH(замещенный или незамещенный пиперидил), или замещенный или незамещенный гетероциклил, выбранный из морфолинила, триазолила, пирролидила, имидазолила или пирролидинонила.
В некоторых вариантах воплощения, гетероарильное соединение представляет собой соединение формулы (I), где R1 представляет собой замещенный или незамещенный гетероциклил. Например, в некоторых вариантах воплощения, R1 представляет собой замещенный или незамещенный гетероциклил, выбранный из изоиндолин-1-онила, пиридила, пиримидила, индазолила, индолинила, изоиндолинила, индолин-2-онила, хинолинила, дигидроизохинолин-1-онила, бензотриазолила, бензимидазолила, 1H-пиразоло[3,4-b]пиридила, 1H-пиразоло[4,3-b]пиридила, 1H-бензо[d]имидазол-2(3H)-онила, бензизоксазолила, изохинолинила, дигидробензизотиазол-1,1-дионила или пирролопиридила. В некоторых таких вариантах воплощения, R1 замещен одним или несколькими замещенным или незамещенным C1-4 алкилом, замещенным или незамещенным гетероциклилом, галогеном, гидроксилом, гидроксиалкилом, алкокси, -CN, -OR, -NR2, -(C1-4 алкил)NR2, -C(=O)NR2 или -C(O)R, где каждый R независимо представляет собой -H, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный гетероциклил или замещенный или незамещенный гетероциклилалкил.
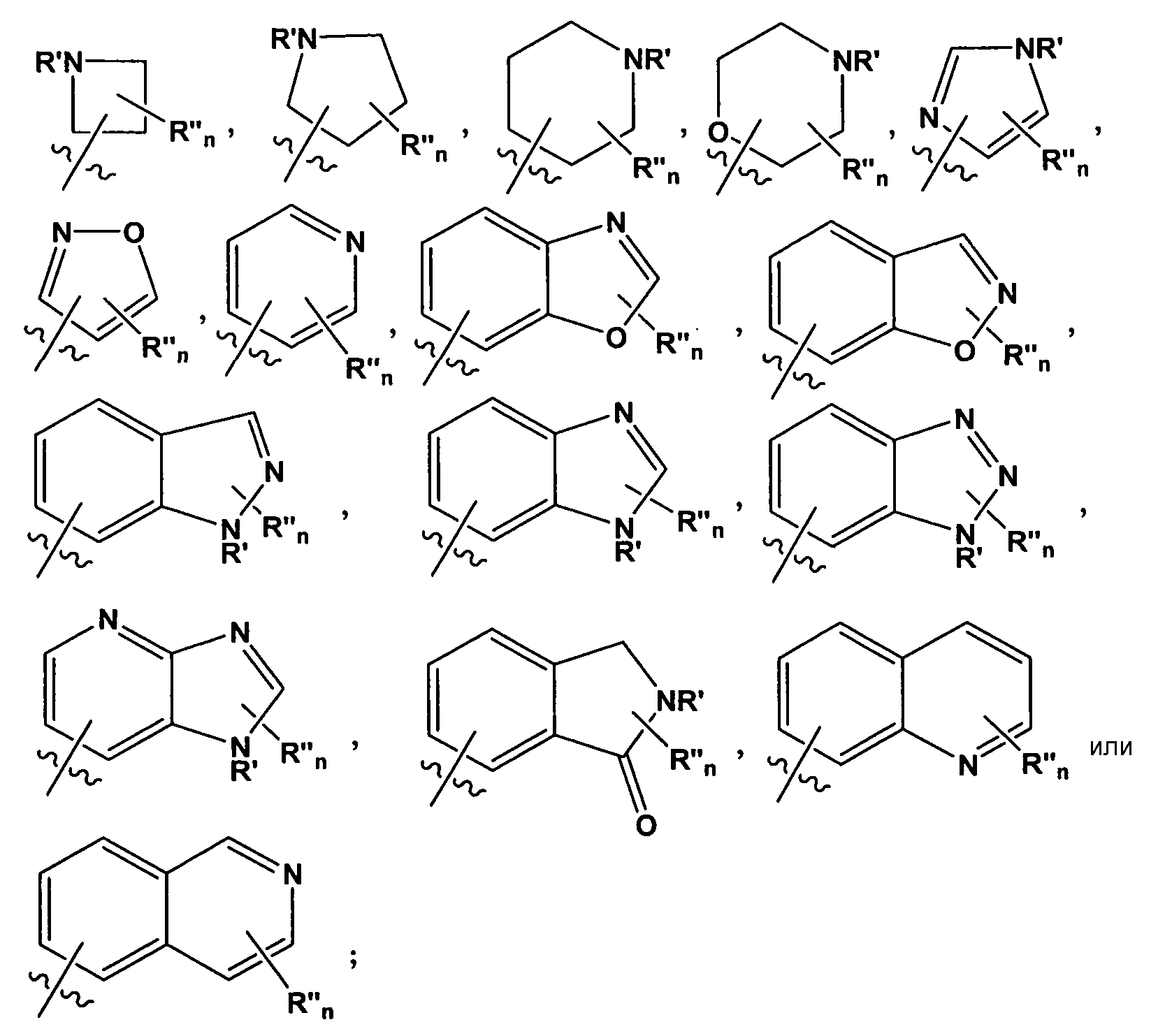
В некоторых таких вариантах воплощения, R1 представляет собой
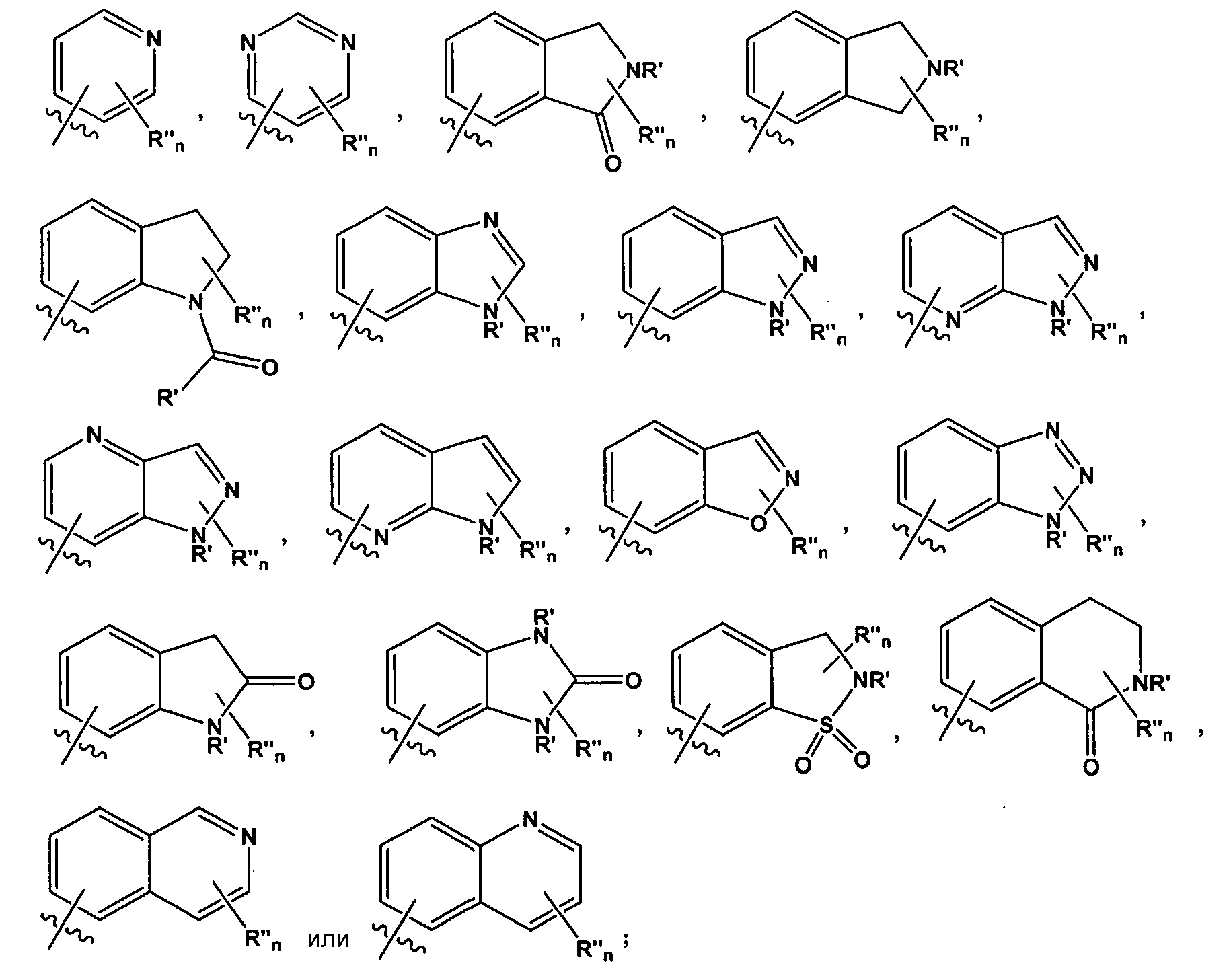
где R' представляет собой -H или замещенный или незамещенный C1-6 алкил; каждый R" независимо представляет собой замещенный или незамещенный C1-4 алкил, замещенный или незамещенный гетероциклил, незамещенный гетероциклилалкил, гидроксил, галоген, алкокси, -CN, -OR, -NR2, -(C1-4 алкил)NR2, -C(=O)NR2, где каждый R независимо представляет собой -H, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный гетероциклил или замещенный или незамещенный гетероциклилалкил; и n имеет значение 0-2.
Специалистам в данной области должно быть понятно, что любой из заместителей R" может быть присоединен к любому подходящему атому любого из колец в конденсированных кольцевых системах. Например, в некоторых вариантах воплощения, R1 представляет собой
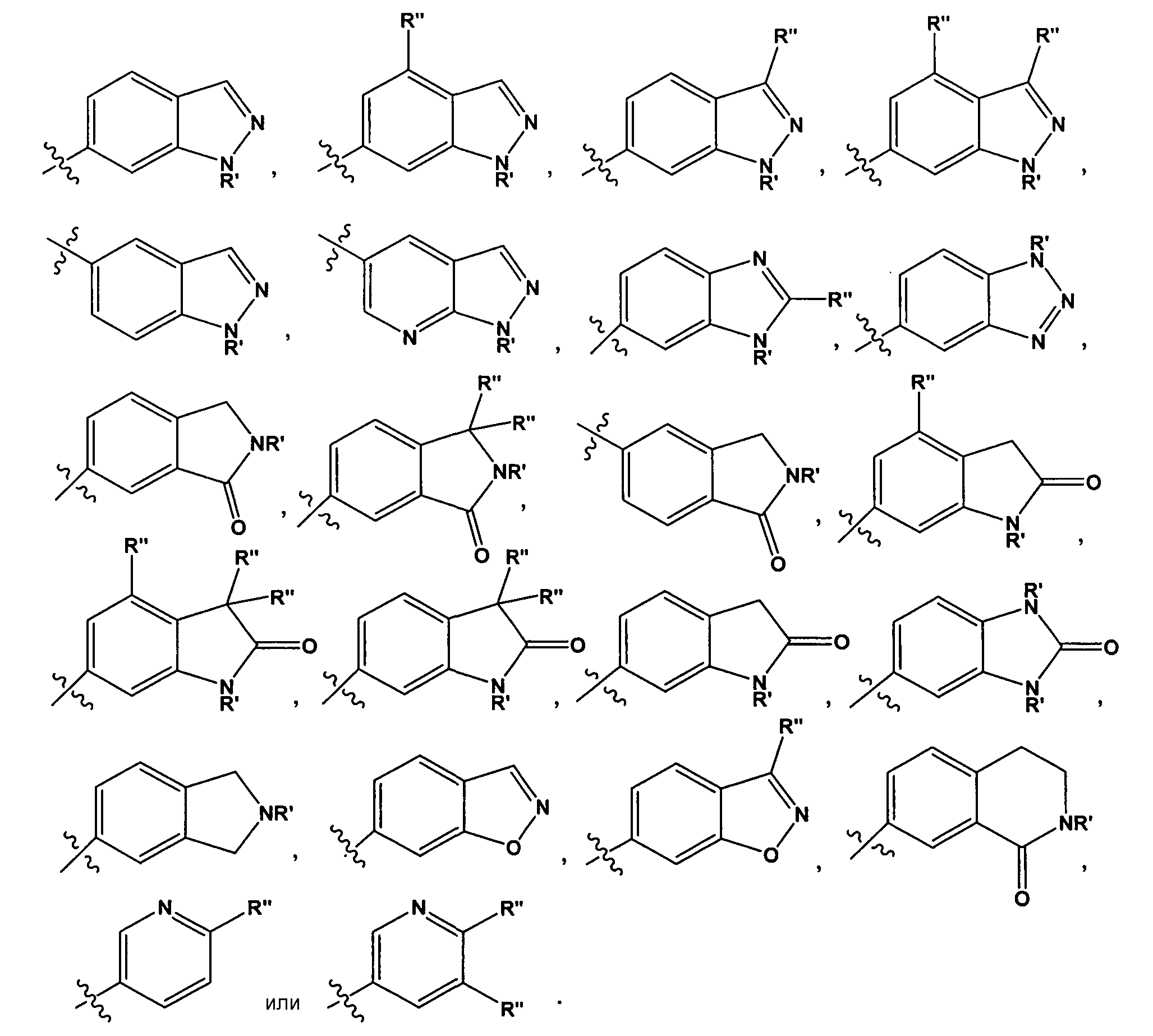
В некоторых вариантах воплощения, R' представляет собой -H, -CH3, -CH2CH3, изопропил, -(CH2)2OH, -(CH2)2NH2, или -(CH2)2OCH3. В других вариантах воплощения, R" представляет собой -F, -CH3, -CH2CH3, изопропил, -NH(C1-3 алкил)NH2, -NH(CH2)2OH, -CF3, -OH, -OCH3, -O(CH2)2OCH3, -O(CH2)2OH, -O(CH2)2NH2, -O(CH2)2пирролидил, -CH2OH, -(CH2)2OH, -CH2OCH3, -(CH2)2OCH3, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2, -C(CH3)2OH, -CN, -NH2, -NHCH3, -N(CH3)2, -NH(CH2)2NH2, -C(=O)NH2, -C(=О)NHCH3, -NH(CH2)2пирролидил, -NH(замещенный или незамещенный пиперидил), замещенный или незамещенный пиперидил, -NH(замещенный или незамещенный тетрагидропиранил) или замещенный или незамещенный морфолинил.
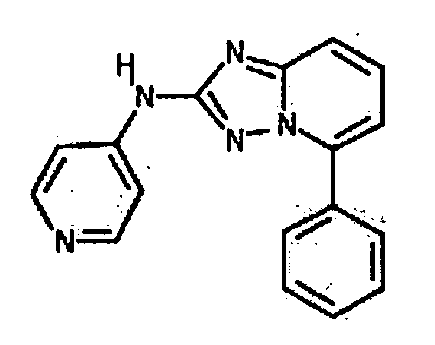
В некоторых вариантах воплощения, гетероарильное соединение представляет собой соединение формулы (I), где R2 представляет собой пиридил, при условии, что R1 не является (2-(пирролидин-1-ил)этокси)фенил-4-илом, т.е. R1 не может представлять собой
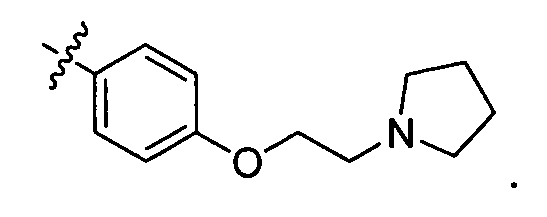
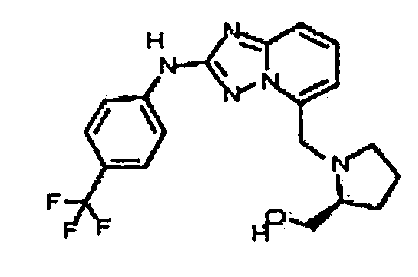
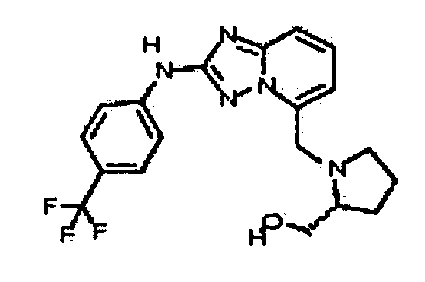
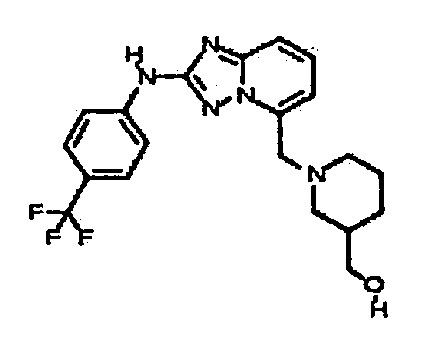
В некоторых вариантах воплощения, гетероарильное соединение представляет собой соединение формулы (I), где R2 представляет собой замещенный или незамещенный C1-6 алкил. Например, в некоторых вариантах воплощения, R2 представляет собой метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил или трет-бутил, необязательно замещенный одним или несколькими -OH, -C(O)NH2, -NH2, алкиламино, -NHCH2C(=O)NH2, циклопентилом, циклопентанолом, циклогексилом, циклогексанолом или 1-метилциклогексанол-4-илом. В некоторых вариантах воплощения, R2 представляет собой замещенный или незамещенный циклоалкил, например, R2 представляет собой циклогексил. В других вариантах воплощения, R2 представляет собой замещенный или незамещенный гетероциклилалкил, например, -CH2-азетидинил, -CH2-пиперидил, -CH2-пиридин-2(1H)-онил, -CH2-пиридил, -CH2-пиперазин-2-онил, -CH2-пиперазин-2,6-дионил, -CH2-пиперазинил, -CH2-пирролидил, -CH2-1,4-диоксанил, -CH2-пиперидин-2,6-дионил, -CH2-имидазолидинил, -CH2-имидазолидин-4-онил, -CH2-морфолинил, -CH2-тетрагидропиримидин-2(1H)-онил, -CH2-1,4-диазепан-5-онил, -CH2-тетрагидро-2H-пиранил или -CH2-имидазолидин-2,4-дионил; где гетероциклилалкил необязательно замещен одним или несколькими метилом, этилом, изопропилом, галогеном, -OH, -(CH2)OH или -C(=О)NH2. Например, в некоторых вариантах воплощения, R2 представляет собой -CF2-(тетрагидро-2H-пиран-4-ил) или -CF2-(1,4-диоксан-2-ил).
В некоторых вариантах воплощения, гетероарильное соединение представляет собой соединение формулы (I), где R2 представляет собой -NR3R4. Например, в некоторых вариантах воплощения, R2 представляет собой -NH(C1-6 алкил), -N(C1-6 алкил)2, -N(C1-6алкил)(циклоалкил), -NH(арил), -NH(гетероарил), -NH(циклоалкил), -NH(циклоалкилалкил), -NH(гетероциклил), -N(C1-6 алкил)(гетероциклил) или - NH(гетероциклилалкил), где каждый алкил, арил, гетероарил, циклоалкил, циклоалкилалкил, гетероциклил и гетероциклилалкил, независимо, является замещенным или незамещенным. В некоторых вариантах воплощения, R2 представляет собой -NH(метил), -N(метил)2, -N(метил)(этил), -NH(этил), -NH(пропил), -NH(изопропил), -NH(циклопентил), -NH(циклогексил), -N(циклогексил)(метил), -NHCH2(циклопентил), -NHCH2(циклогексил), -NH(фенил), -NH(пиридил), -NH(пиперидил), -NH(тетрагидро-2H-пиранил), -N(метил)(тетрагидро-2H-пиранил), -NH(азепанил), -NH(тетрагидрофуранил), -N(метил)(тетрагидрофуранил), -NH(пирролидил) или -NHCH2(тетрагидро-2H-пиранил), где каждый метил, этил, пропил, изопропил, циклопентил, циклогексил, фенил, пиридил, пиперидил, пирролидил, тетрагидро-2H-пиранил, азепанил или тетрагидрофуранил, независимо, является замещенным или незамещенным. В некоторых таких вариантах воплощения, метил, этил, пропил, изопропил, циклопентил, циклогексил, фенил, пиридил, пиперидил, пирролидил, тетрагидро-2H-пиранил, азепанил или тетрагидрофуранил замещен одним или несколькими фенилом, C1-4алкилом, гидроксиалкилом, -NR2, -OR или -C(=O)NR2, где каждый R независимо представляет собой -H, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный гетероциклил или замещенный или незамещенный гетероциклилалкил.
В некоторых вариантах воплощения, гетероарильное соединение представляет собой соединение формулы (I), где R2 представляет собой -NHC(=O)R3, где R3 представляет собой замещенный или незамещенный C1-4 алкил. В других вариантах воплощения, R2 представляет собой -C(=O)NR3R4, и R3 и R4 независимо представляют собой -H или замещенный или незамещенный C1-4 алкил или замещенный или незамещенный гетероциклил. В следующих вариантах воплощения, R2 представляет собой -OR3. В некоторых таких вариантах воплощения, R3 представляет собой циклогексил, метил, этил, пропил, пиперидил, тетрагидро-2H-пиранил, тетрагидрофуранил, -CH2(пирролидил) или фенил, необязательно замещенный одним или несколькими -OH, -NH2 или -(C=O)NH2. В следующих вариантах воплощения, R2 представляет собой -C(=O)R5. Например, в некоторых вариантах воплощения, R5 представляет собой фенил.
В некоторых вариантах воплощения, гетероарильное соединение представляет собой соединение формулы (I), где R2 представляет собой -(CH2)0-2CR6(OR3)R4. Например, в некоторых вариантах воплощения, R2 представляет собой -CH(OR3)R4. В некоторых таких вариантах воплощения, R3 представляет собой -H, и R4 представляет собой фенил, пиперидил, пиридил, пиримидин-4(3H)-онил или тетрагидрофуранил. В некоторых других вариантах воплощения, R3 представляет собой -H, и R4 и R6, вместе с атомами, с которыми они связаны, образуют пиперидил.
В некоторых вариантах воплощения, гетероарильное соединение представляет собой соединение формулы (I), где R2 представляет собой замещенный или незамещенный гетероциклил, выбранный из азетидинила, пирролидила, пиперидила, морфолинила, пиперазин-2-онила, 1,2,3,6-тетрагидропиридила, изоксазолила, имидазолила, пиридила, индазолила, бензимидазолила, 1H-бензо[d][1,2,3]триазолила, бензизоксазолила, бензо[d]оксазолила, изоиндолин-1-онила, 1H-имидазо[4,5-b]пиридила, хинолинила или изохинолинила. В некоторых таких вариантах воплощения, R2 замещен одним или несколькими замещенным или незамещенным C1-4 алкилом, замещенным или незамещенным гетероциклилалкилом, гидроксилом, -OR, -NR2 или -C(=O)NR2, где каждый R независимо представляет собой -Η, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный гетероциклил или замещенный или незамещенный гетероциклилалкил.
В некоторых вариантах воплощения, R2 представляет собой
где R' представляет собой -H или замещенный или незамещенный C1-6 алкил; каждый R" независимо представляет собой замещенный или незамещенный C1-4 алкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный гетероциклилалкил, гидроксил, галоген, алкокси, -CN, -OR, -NR2, -(C1-4 алкил)NR2, -C(=О)NR2, где каждый R независимо представляет собой -H, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный гетероциклил или замещенный или незамещенный гетероциклилалкил; и n=0-2. Например, в некоторых вариантах воплощения, R" представляет собой -CH3, -CH2CH3, изопропил, -CH2OH, -CH2OCH3, -CH(CH3)OH, -(CH2)2NH2, -CH2NHCH3, -CH2N(CH3)2, -OH, -OCH3, -O(CH2)2NH2, -NH2, -NHCH3, -N(CH3)2, -NH(CH2)2OH, -NH(CH2)2NH2, -C(=O)NH2, -CH2(пирролидил) или замещенный или незамещенный пиперазинил.
Специалистам в данной области должно быть понятно, что любой из заместителей R" может быть присоединен по любому подходящему атому любого из колец в конденсированных кольцевых системах. Например, в некоторых вариантах воплощения, R2 представляет собой -(C1-4 алкил), -(C1-4 алкил)OH,
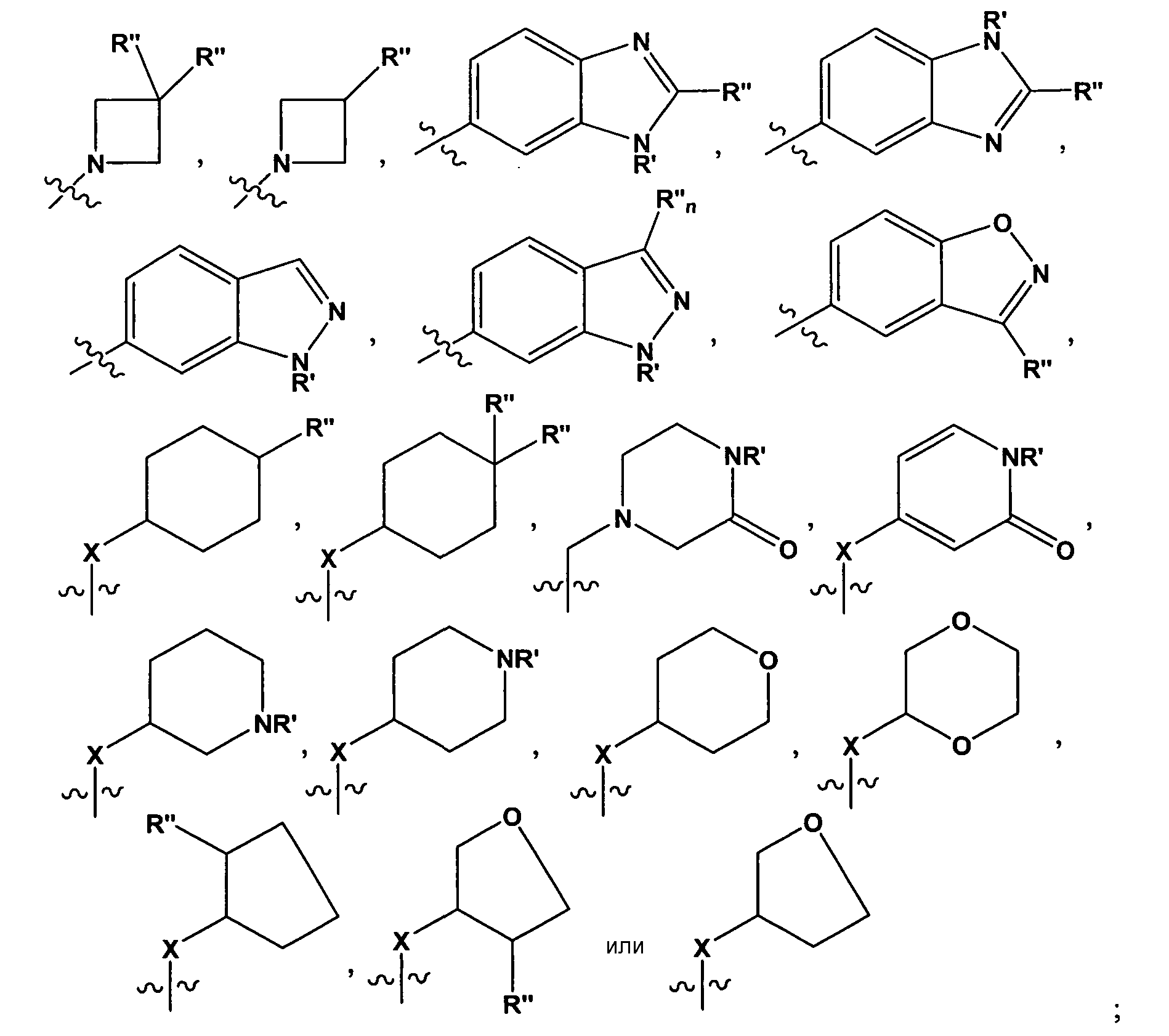
где R' представляет собой -H или замещенный или незамещенный C1-6 алкил; каждый R" независимо представляет собой замещенный или незамещенный C1-4 алкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный гетероциклилалкил, гидроксил, галоген, алкокси, -CN, -OR, -NR2, -(C1-4 алкил)NR2, -C(=O)NR2, где каждый R независимо представляет собой -H, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный гетероциклил или замещенный или незамещенный гетероциклилалкил; и X = CH2, CF2 или NR'.
В некоторых вариантах воплощения, гетероарильные соединения содержат R1 группу, описанную в настоящей заявке, и R2 группу, описанную в настоящей заявке. В некоторых таких вариантах воплощения, где R2 имеет значение, указанное в настоящей заявке, R1 представляет собой
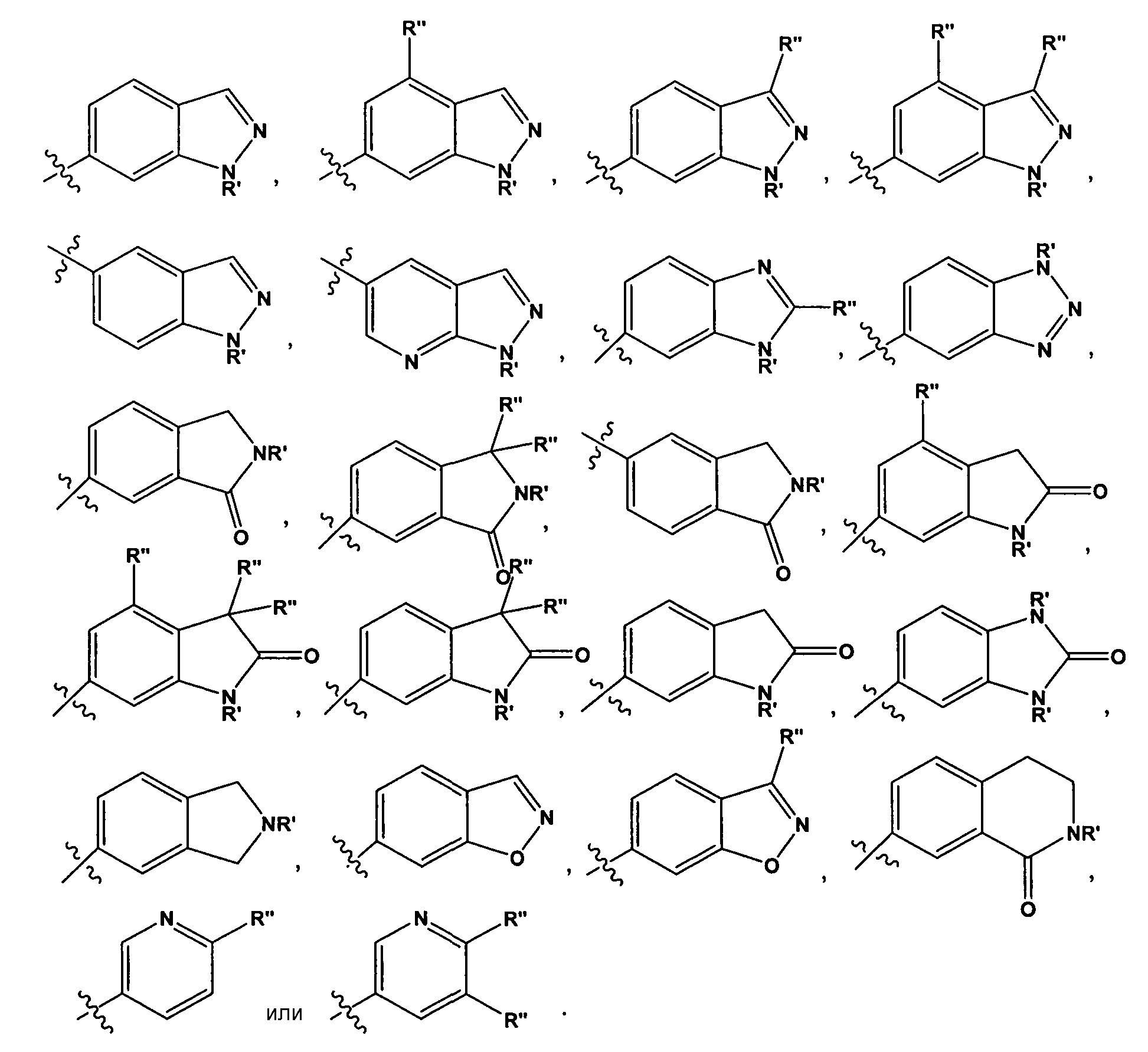
где R' представляет собой -H или замещенный или незамещенный C1-6 алкил; каждый R" независимо представляет собой замещенный или незамещенный C1-4 алкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный гетероциклилалкил, гидроксил, галоген, алкокси, -CN, -OR, -NR2, -(C1-4 алкил)NR2, -C(=O)NR2, где каждый R независимо представляет собой -H, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный гетероциклил или замещенный или незамещенный гетероциклилалкил; и n имеет значение 0-2. В некоторых таких вариантах воплощения, R" представляет собой -F, -CH3, -CH2CH3, изопропил, -NH(C1-3 алкил)NH2, -NH(CH2)2OH, -CF3, -OH, -OCH3, -O(CH2)2OCH3, -O(CH2)2OH, -O(CH2)2NH2, -O(CH2)2пирролидил, -CH2OH, -(CH2)2OH, -CH2OCH3, -(CH2)2OCH3, -CH(CH3)OH, -CH2NH2, -(CH2)2NH2, -CH2NHCH3, -CH2N(CH3)2, -C(CH3)2OH, -CN, -NH2, -NHCH3, -N(CH3)2, -NH(CH2)2NH2, -NH(CH2)2OH, -C(=O)NH2, -C(=O)NHCH3, -NH(CH2)2пирролидил, -NH(замещенный или незамещенный пиперидил), -NH(замещенный или незамещенный тетрагидропиранил), -CH2(пирролидил), замещенный или незамещенный пиперидил, замещенный или незамещенный морфолинил, или замещенный или незамещенный пиперазинил.
В одном варианте воплощения, гетероарильное соединение представляет собой соединение, описанное в настоящей заявке, где это соединение при концентрации 10 мкМ ингибирует Syk на, по меньшей мере, около 50%.
Следующие варианты воплощенияя, представленные в настоящей заявке, включают комбинации одного или нескольких из конкретных вариантов воплощения, описанных выше.
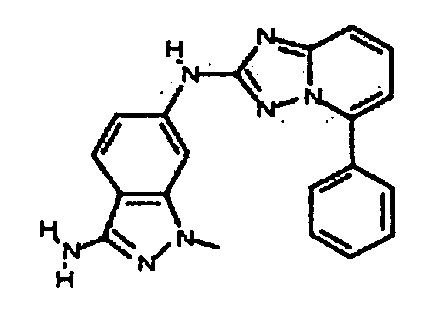
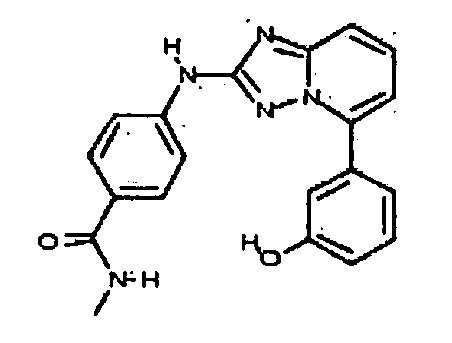
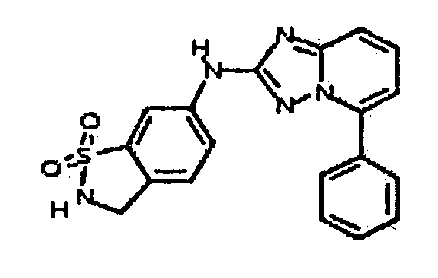
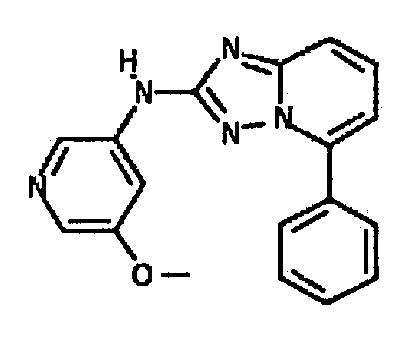
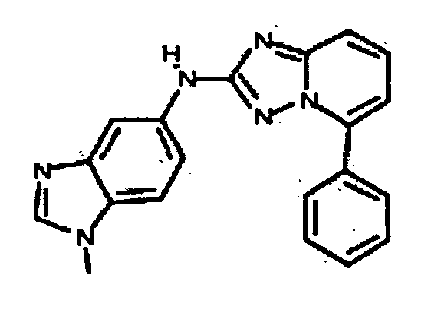
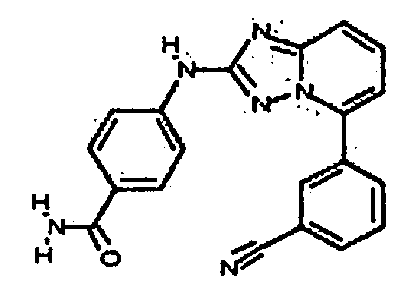
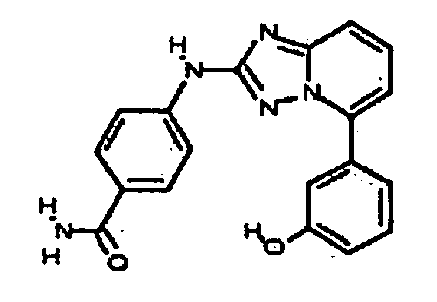
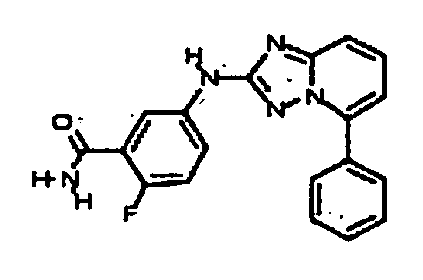
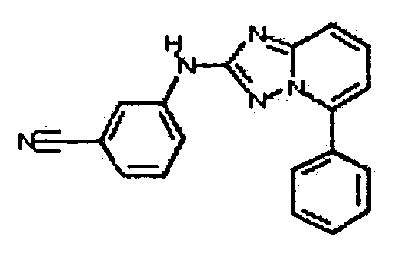
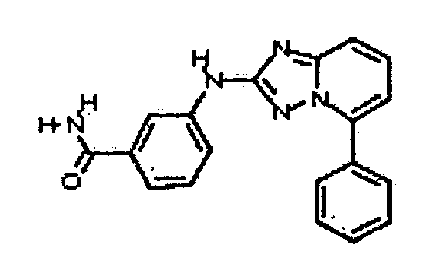
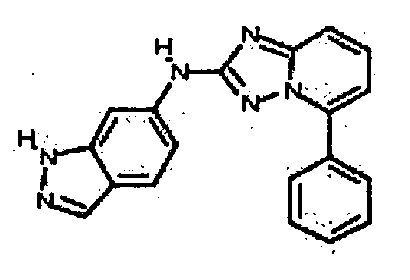
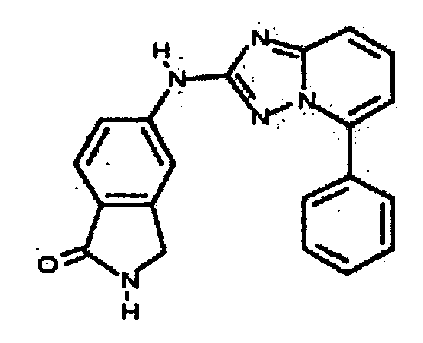
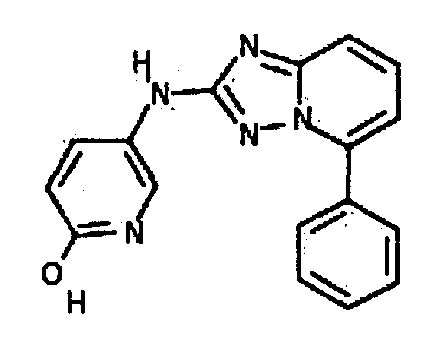
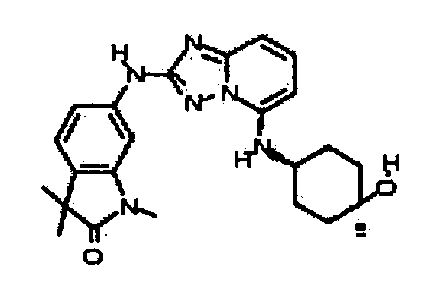
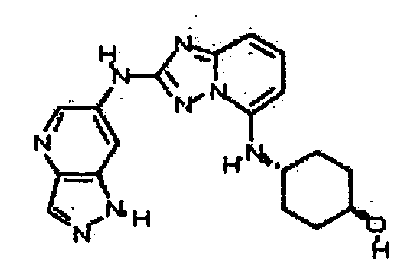
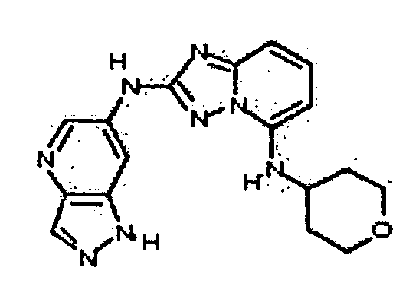
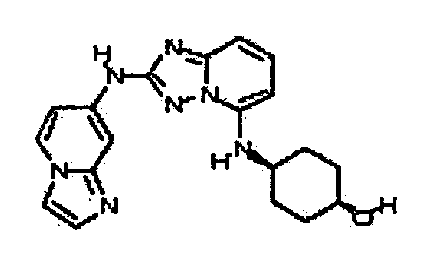
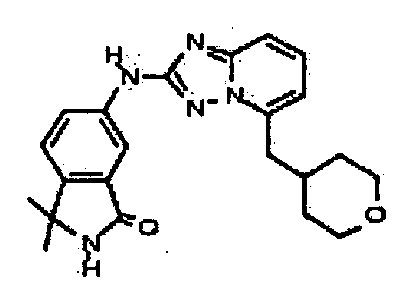
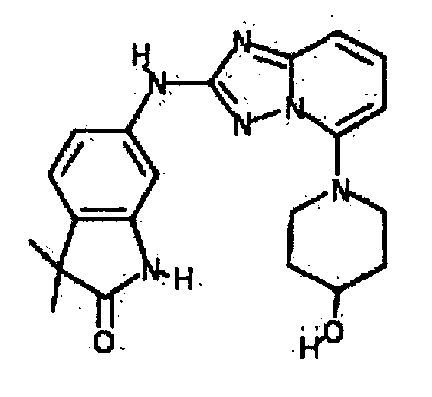
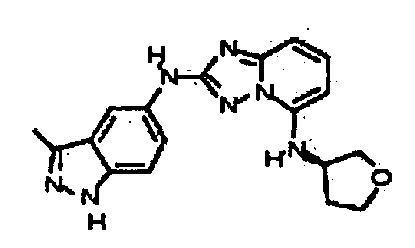
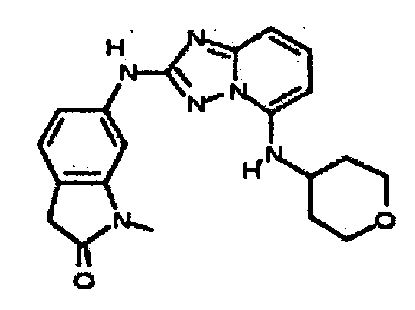
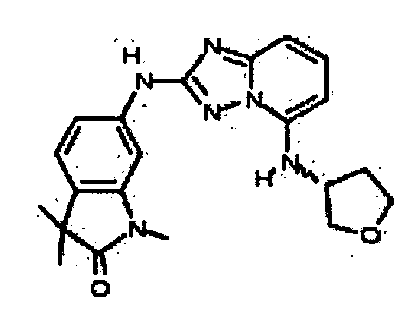
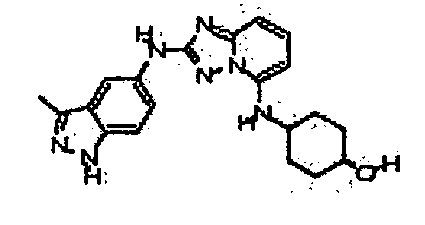
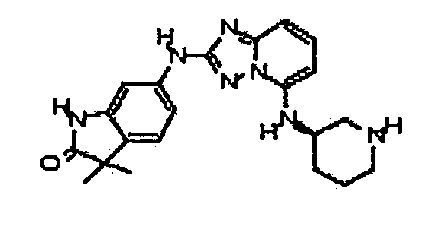
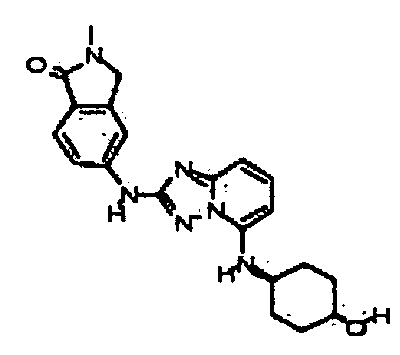
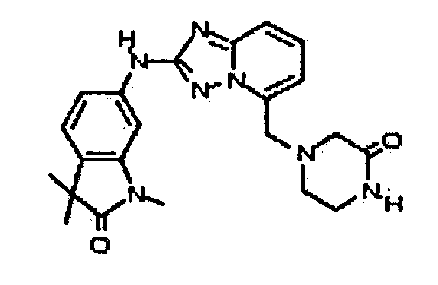
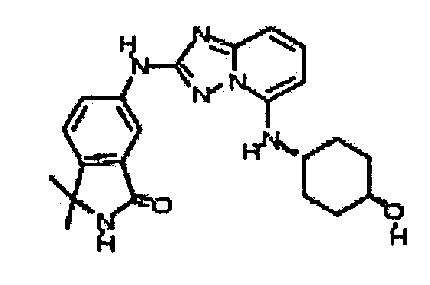
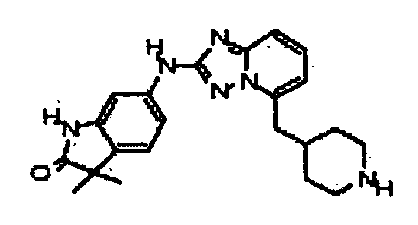
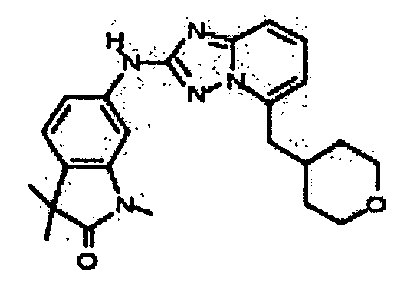
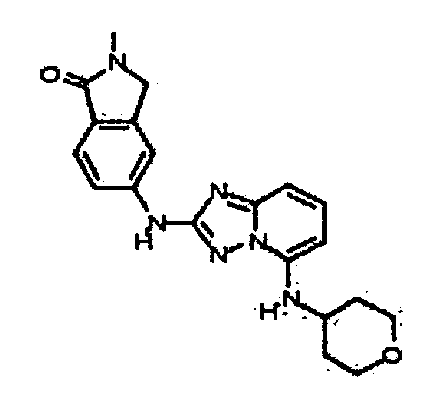
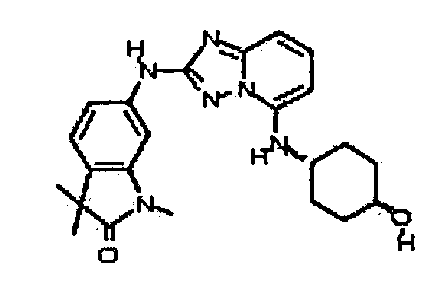
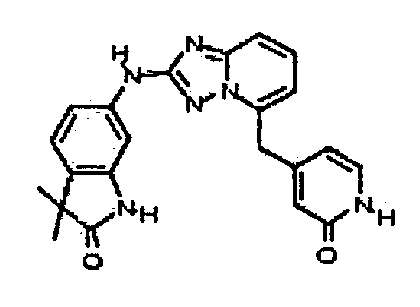
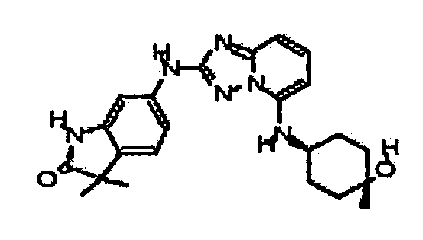
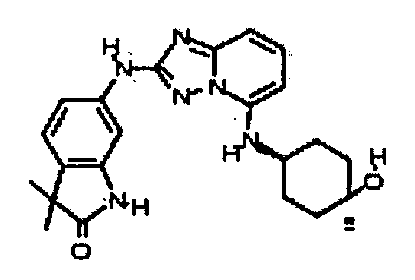
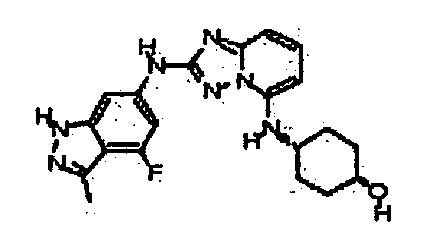
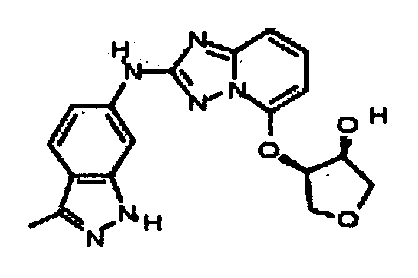
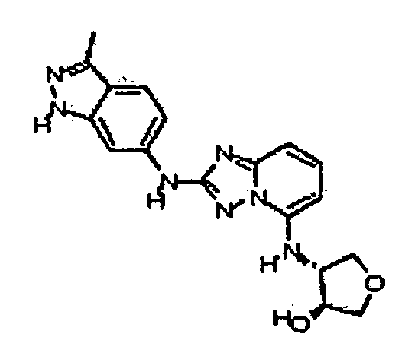
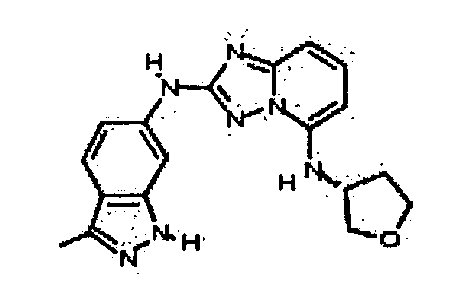
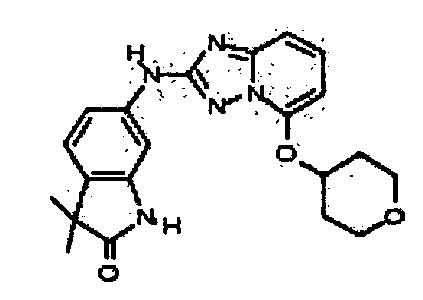
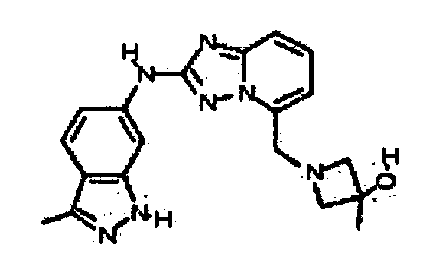
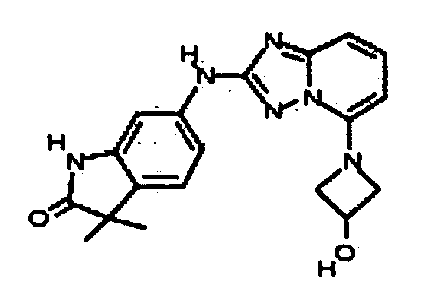
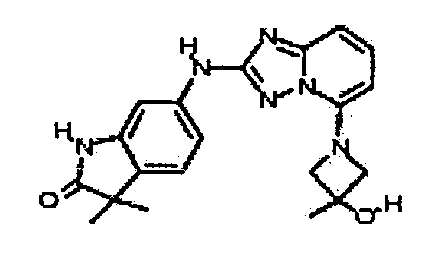
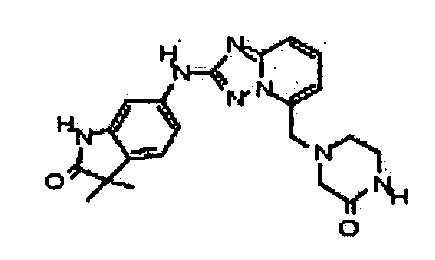
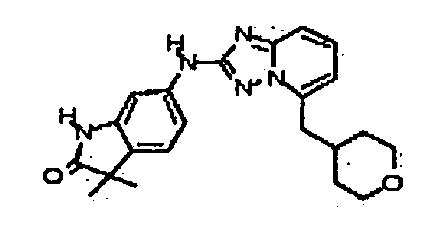
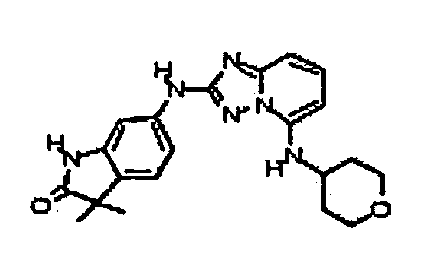
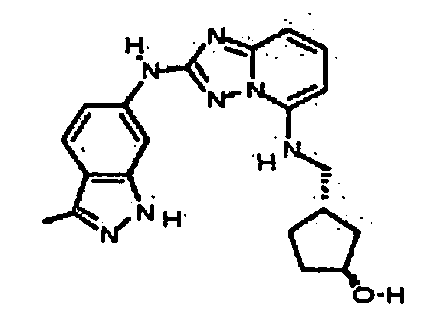
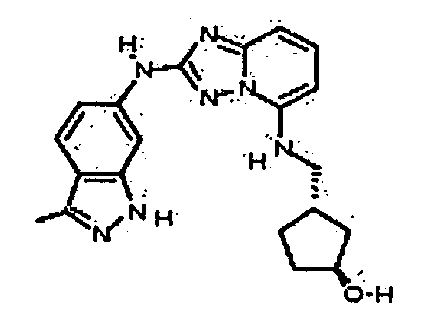
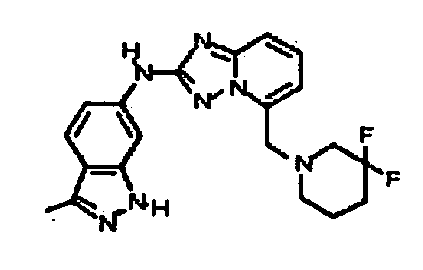
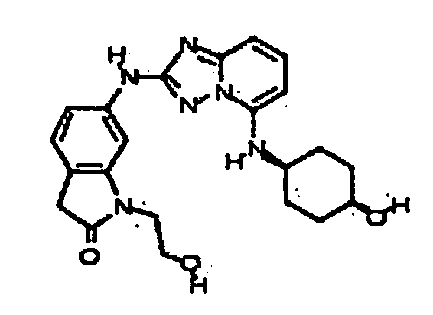
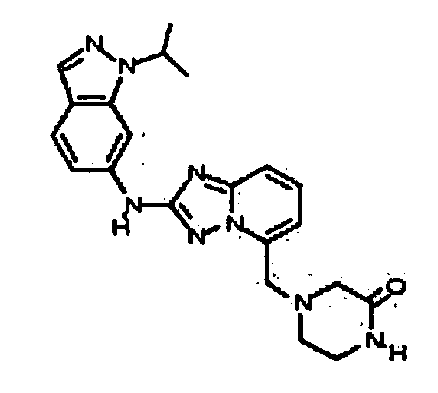
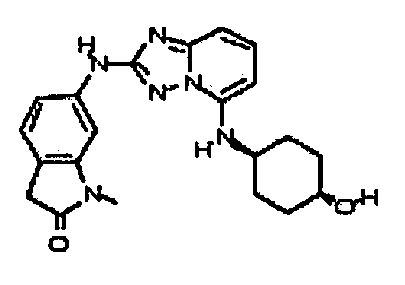
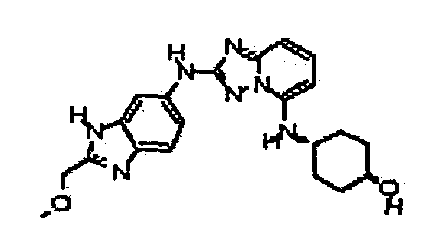
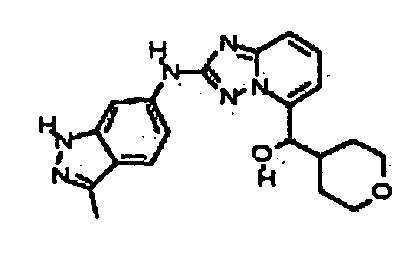
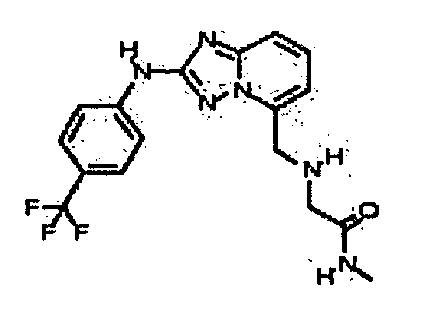
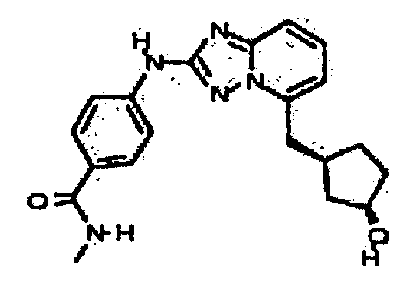
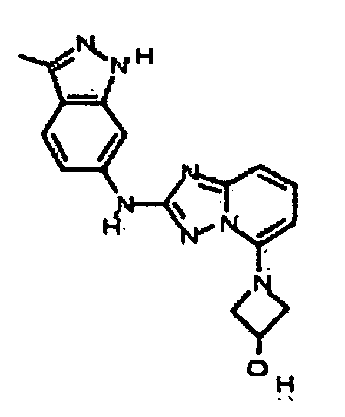
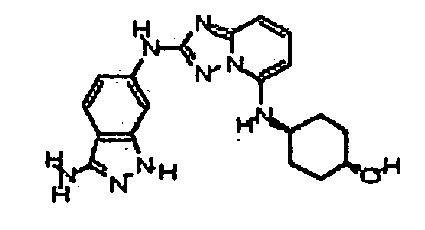
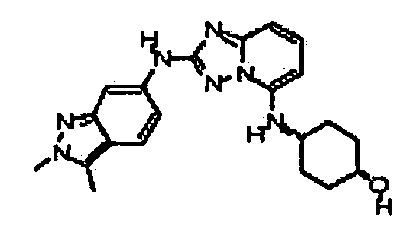
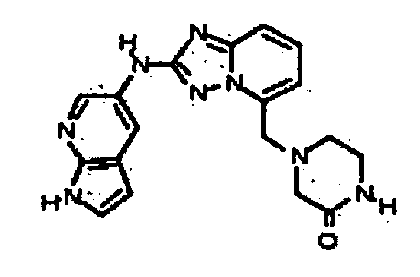
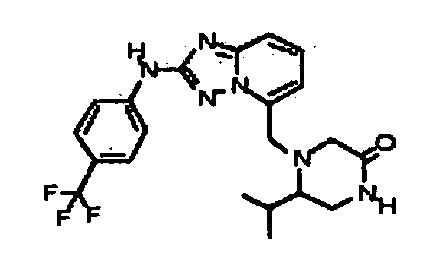
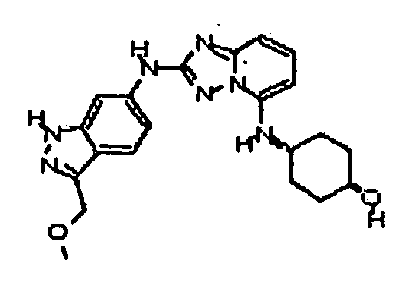
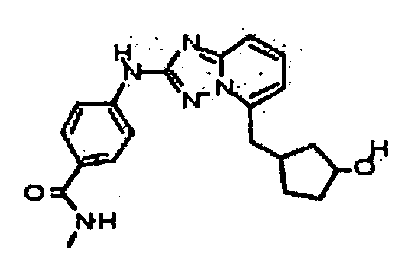
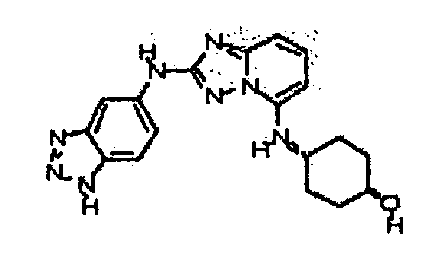
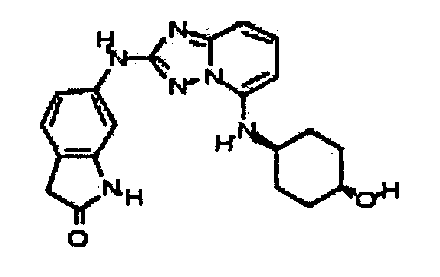
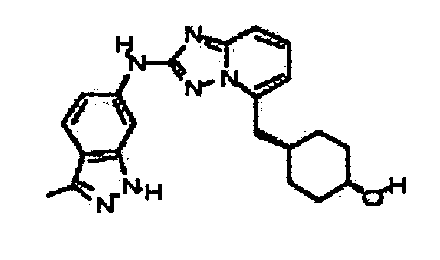
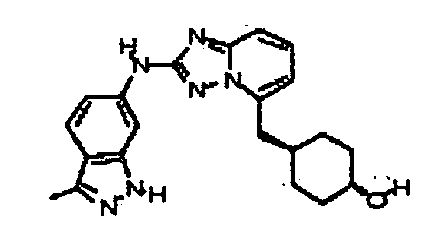
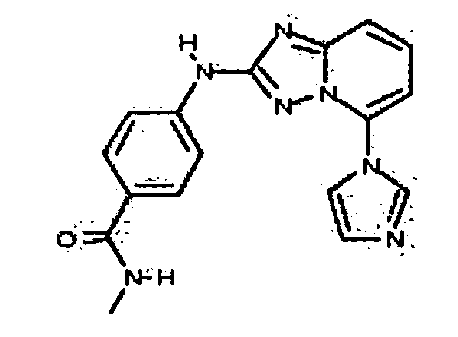
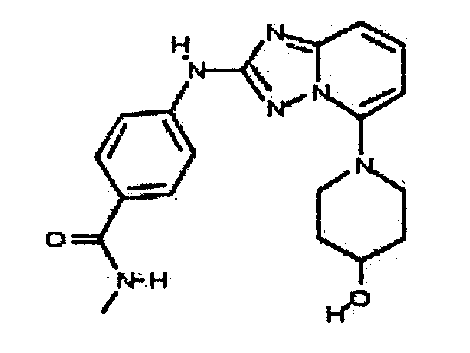
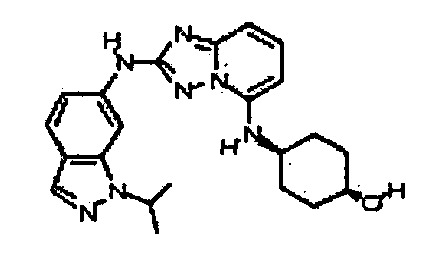
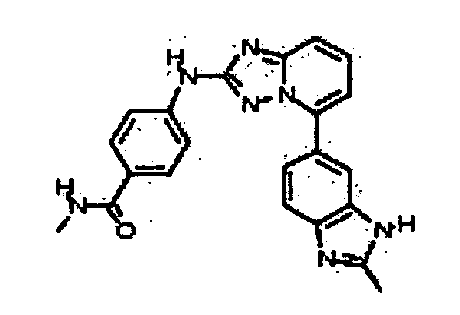
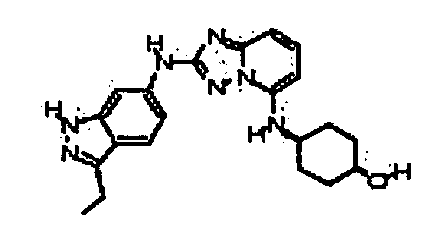
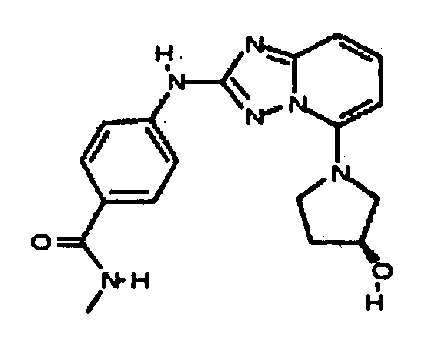
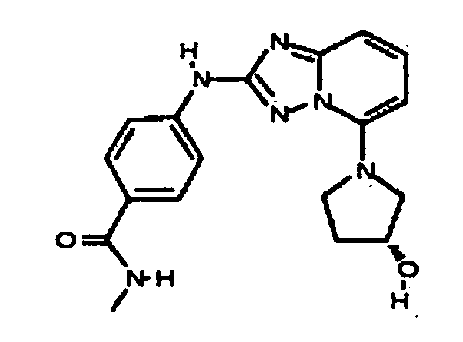
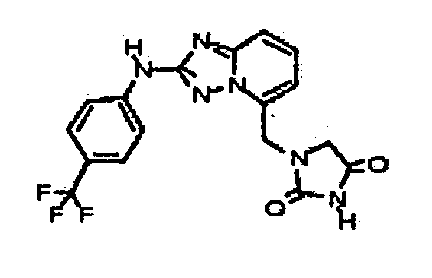
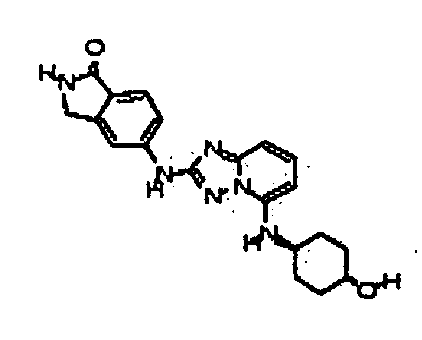
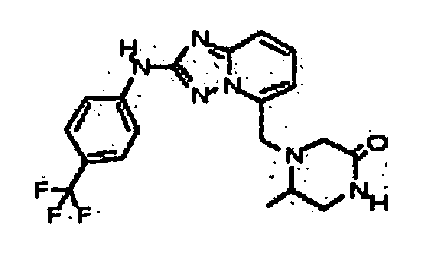
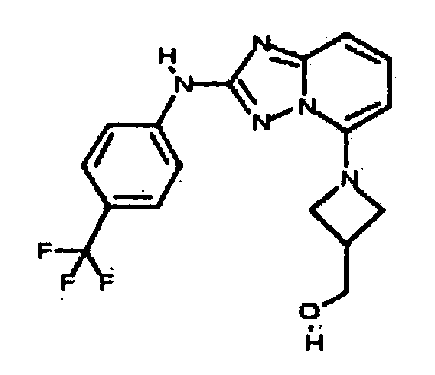
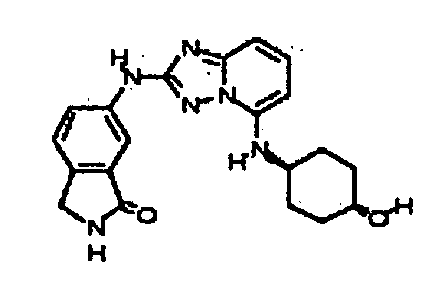
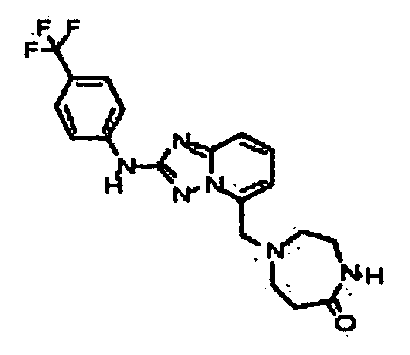
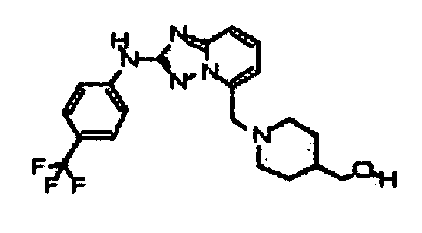
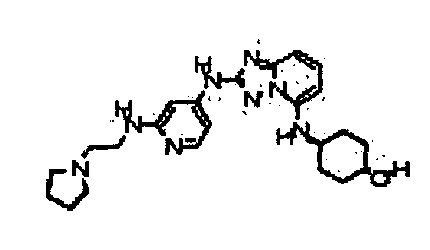
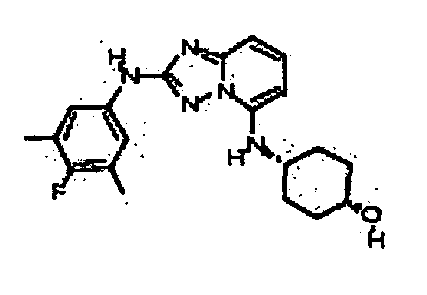
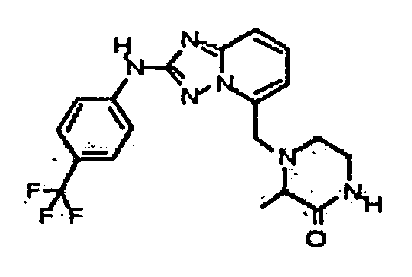
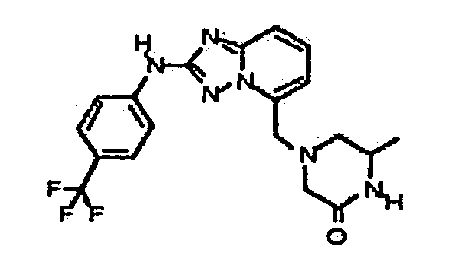
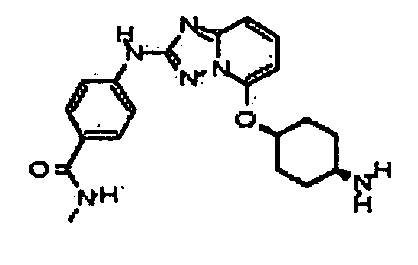
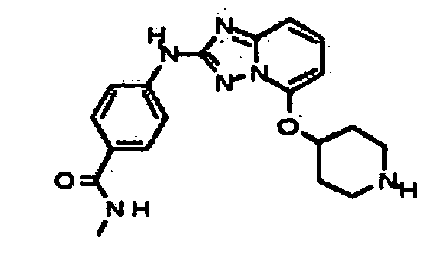
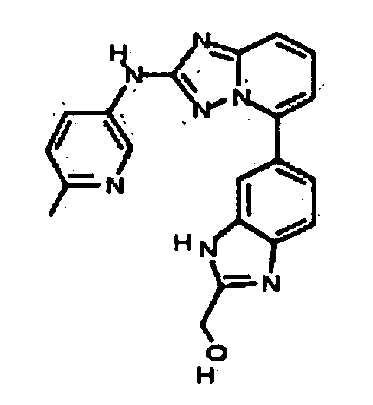
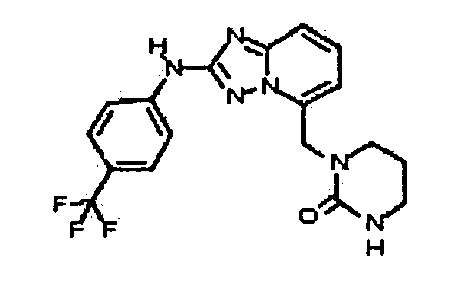
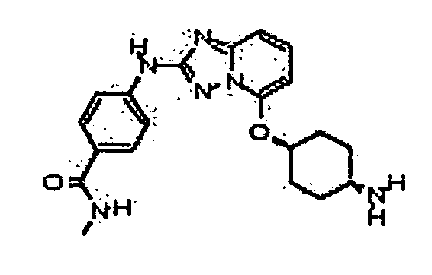
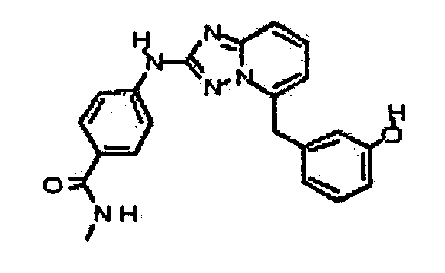
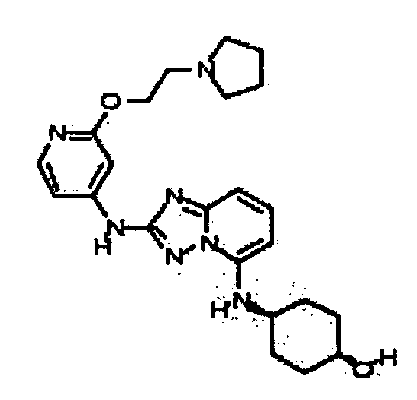
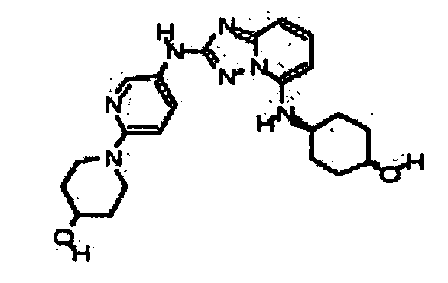
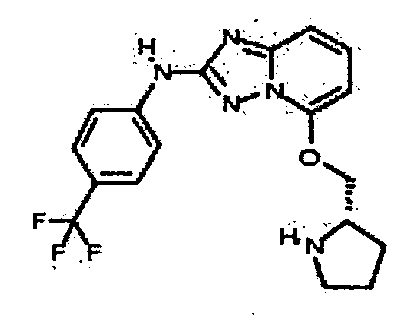
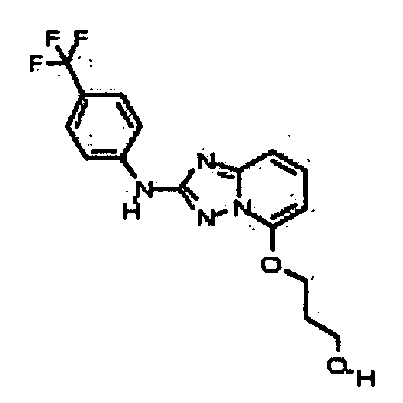
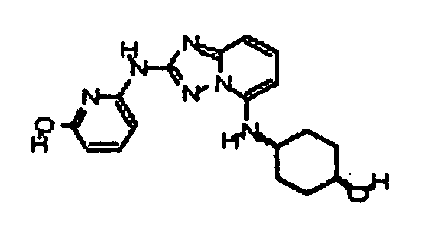
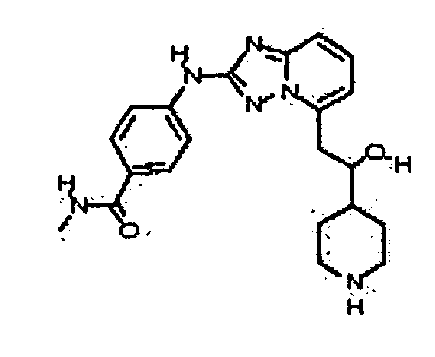
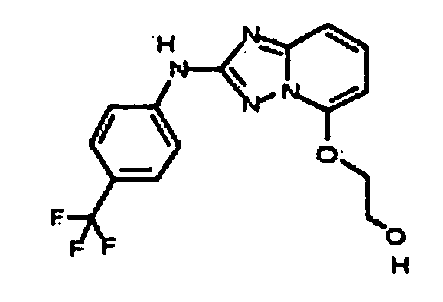
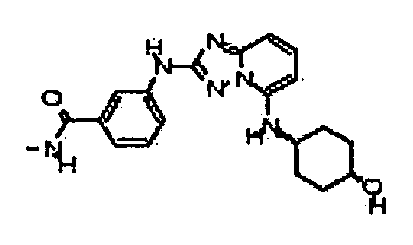
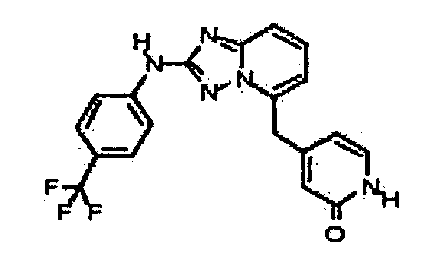
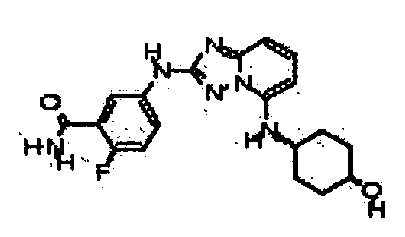
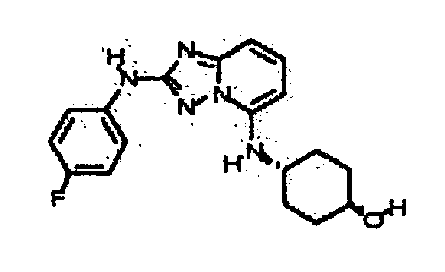
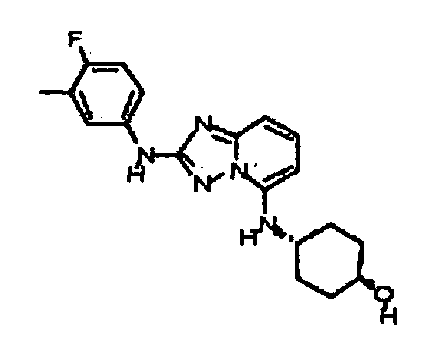
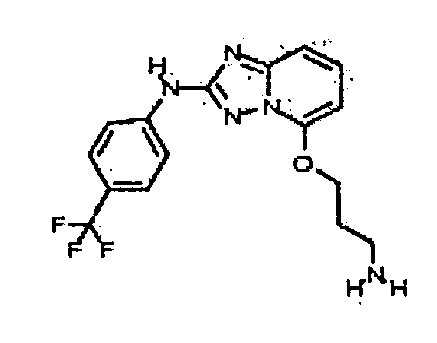
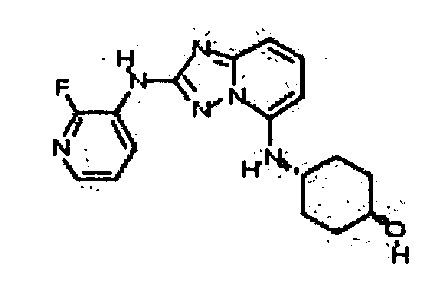
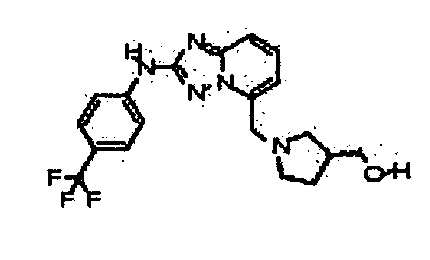
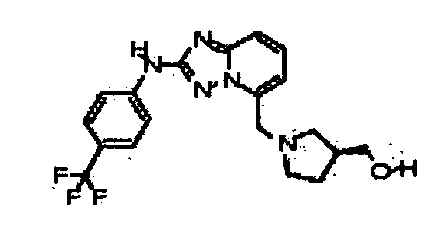
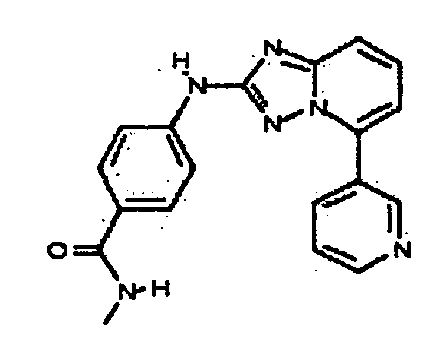
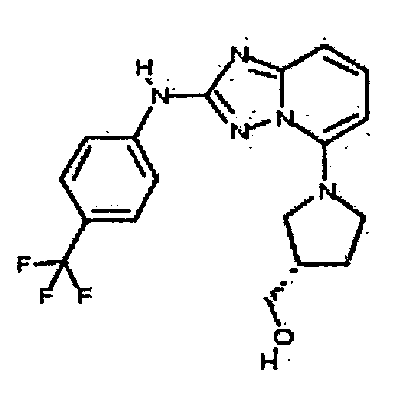
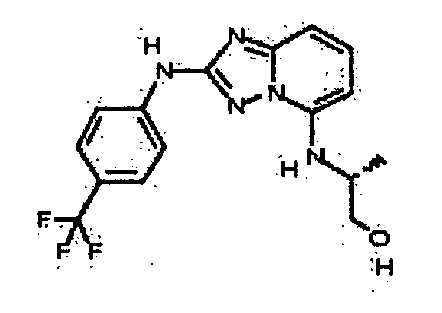
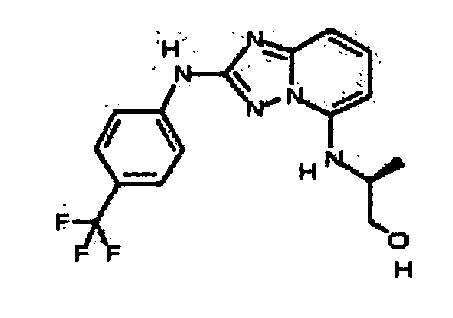
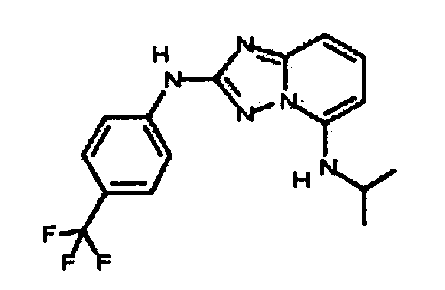
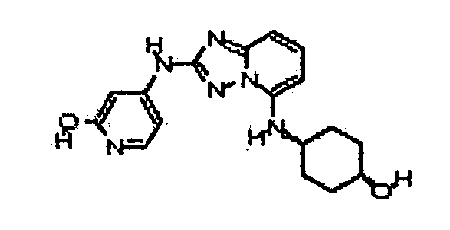
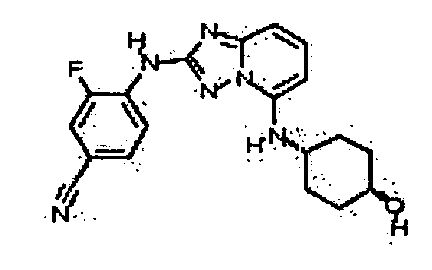
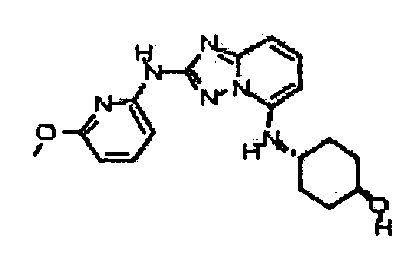
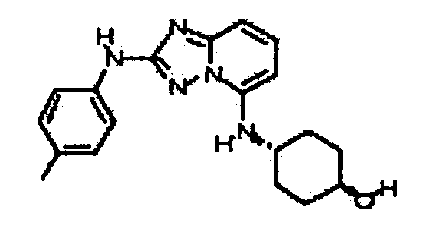
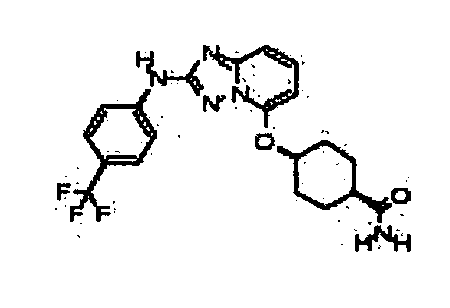
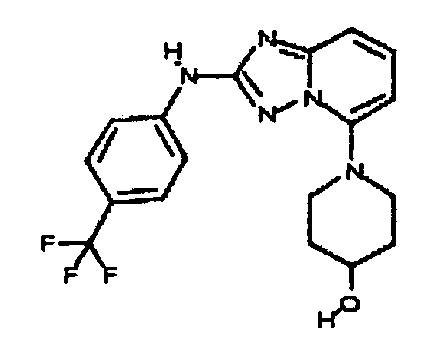
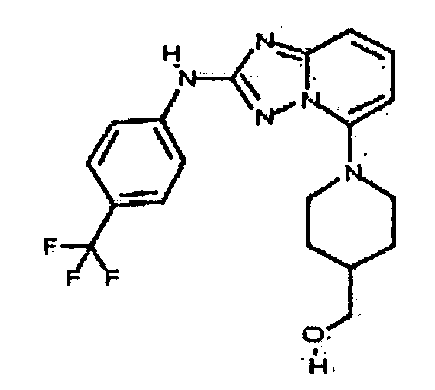
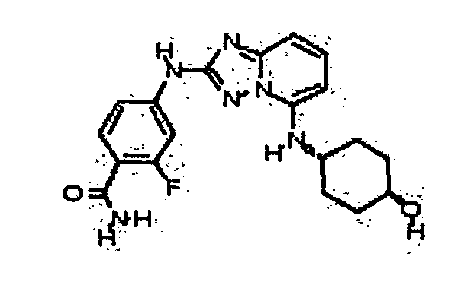
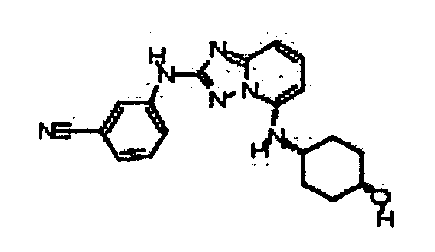
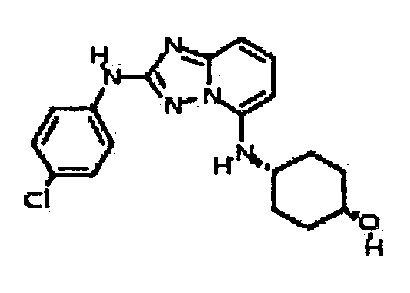
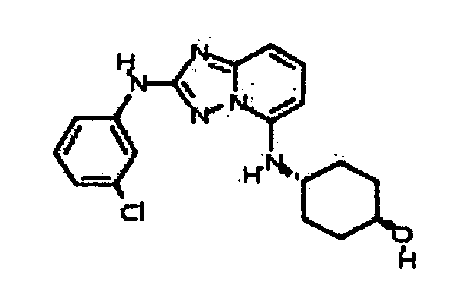
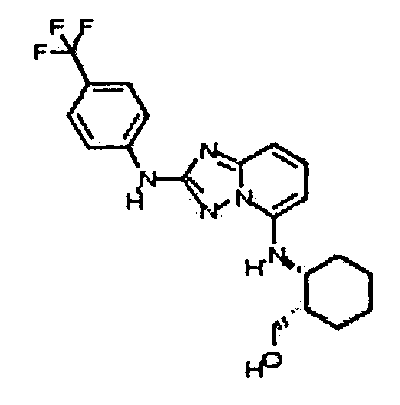
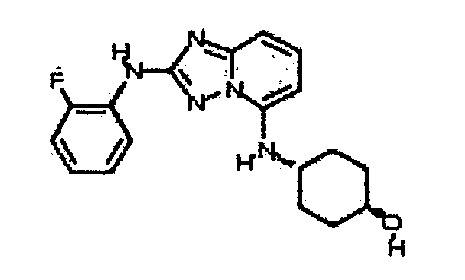
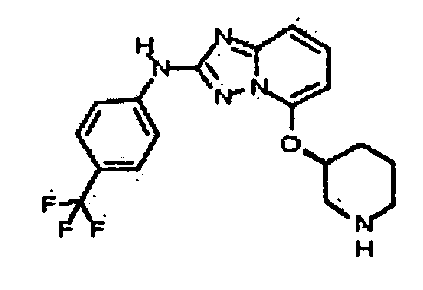
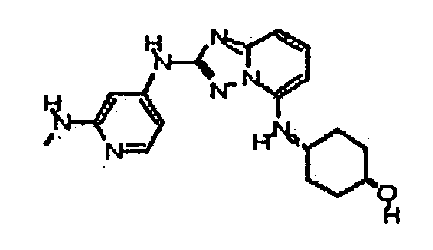
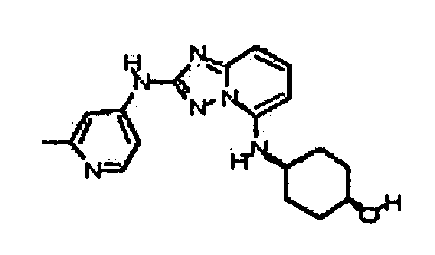
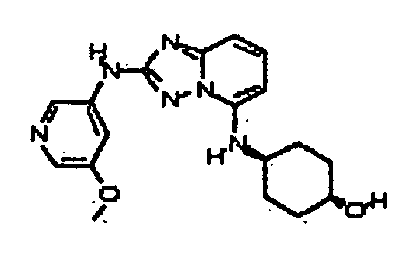
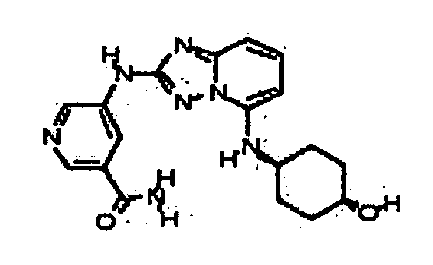
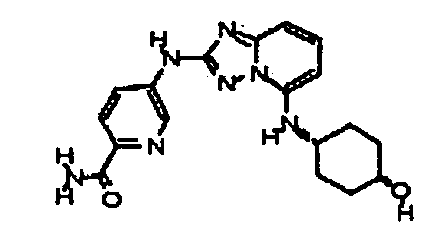
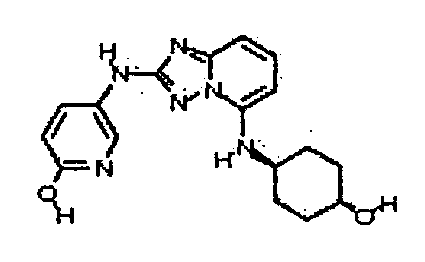
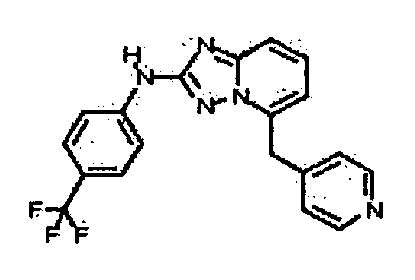
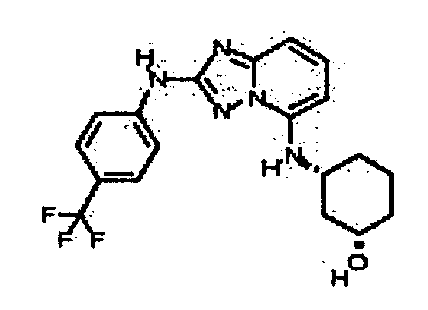
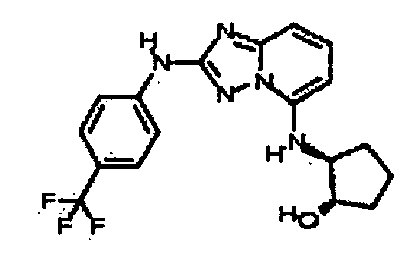
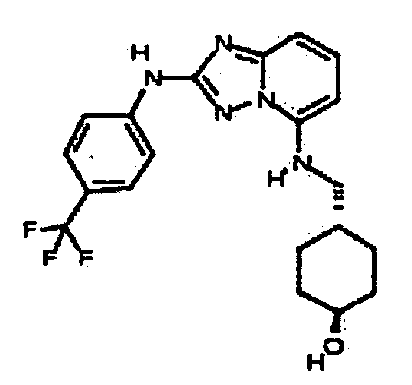
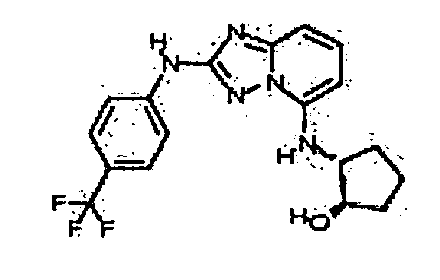
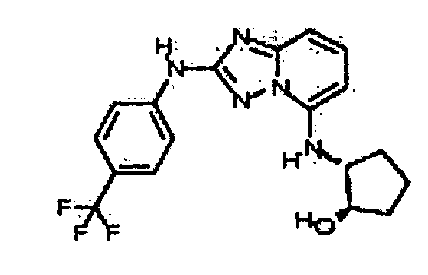
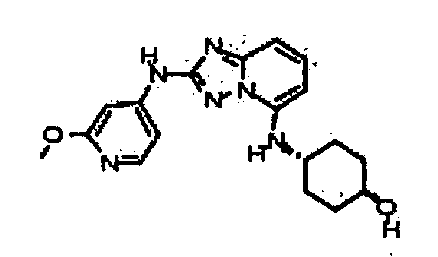
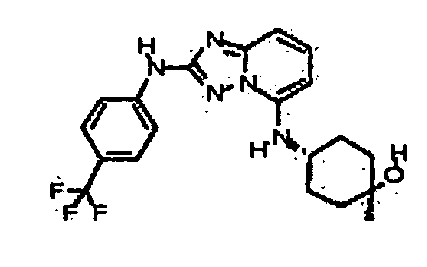
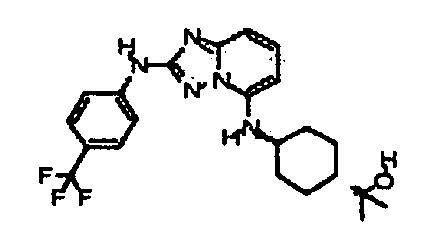
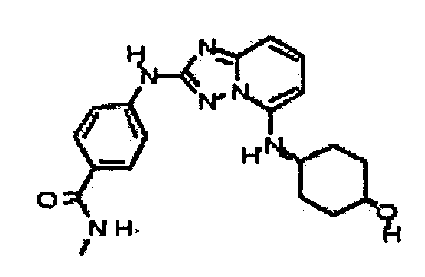
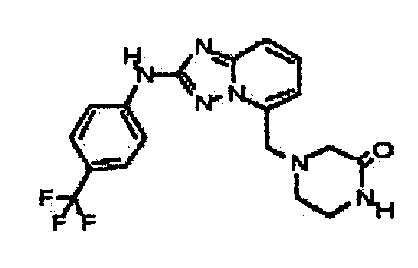
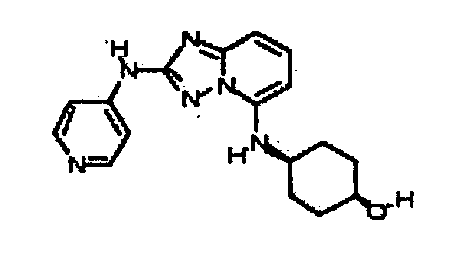
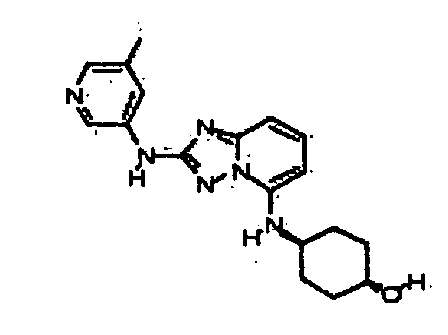
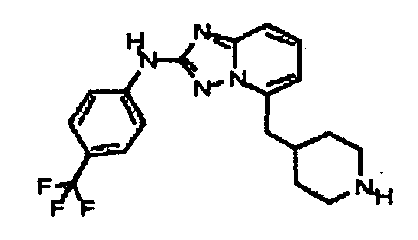
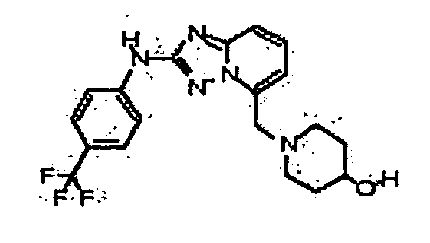
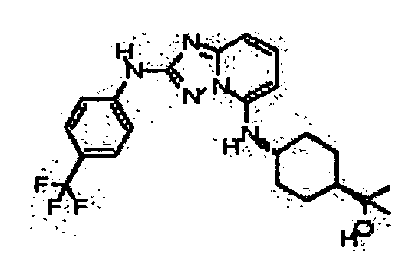
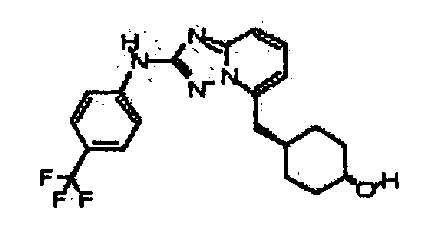
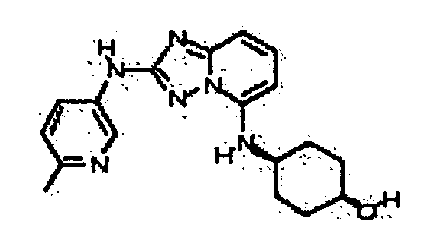
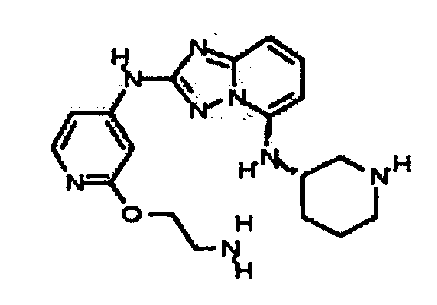
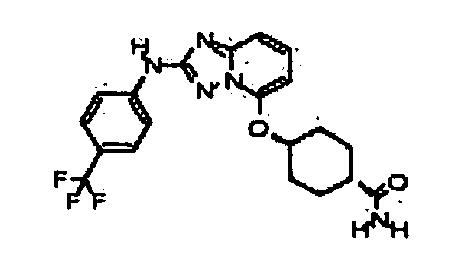
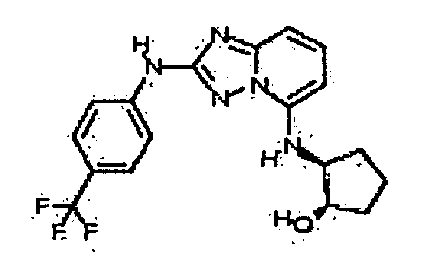
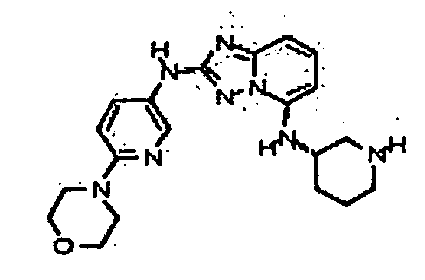
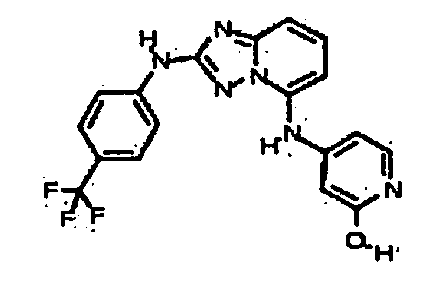
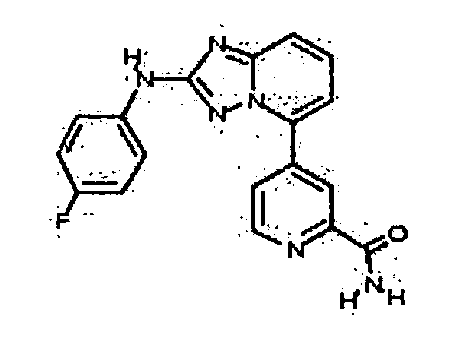
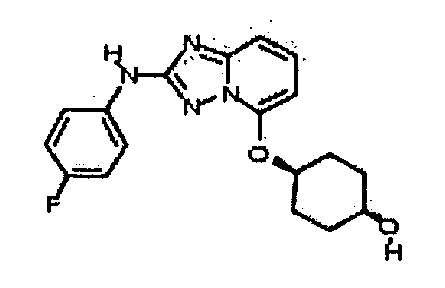
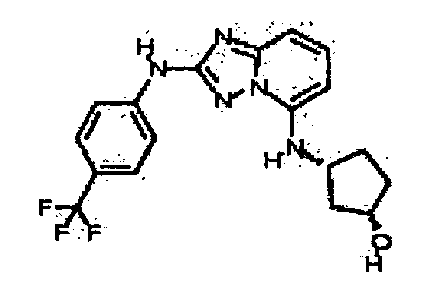
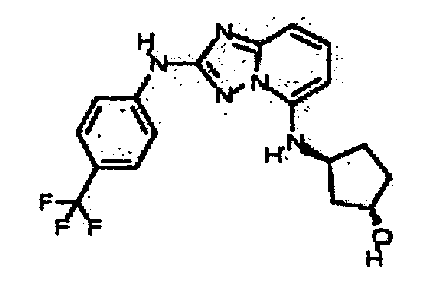
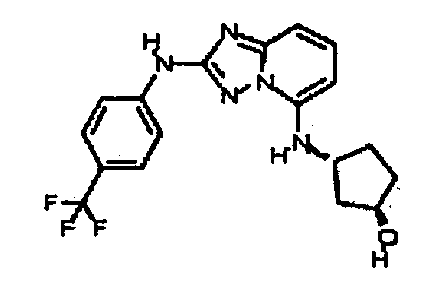
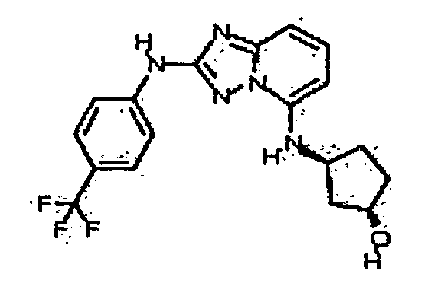
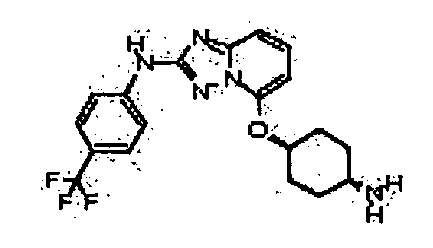
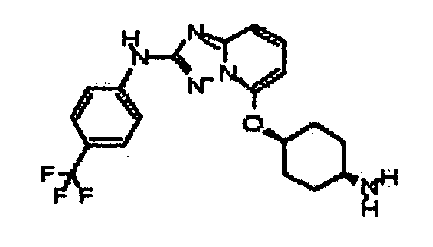
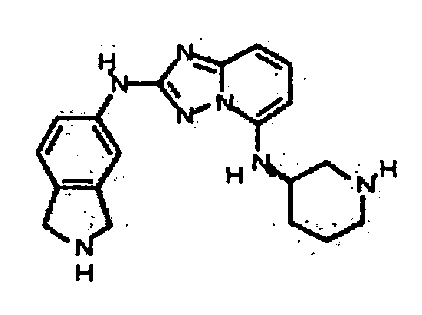
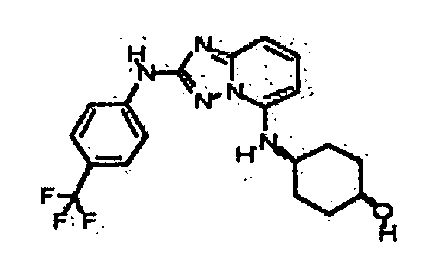
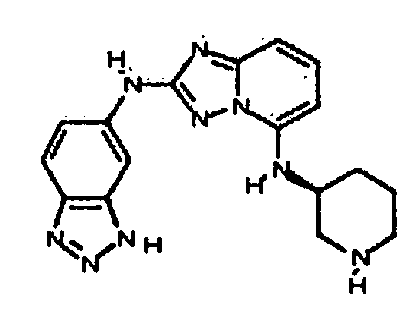
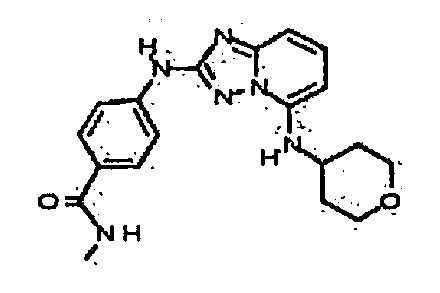
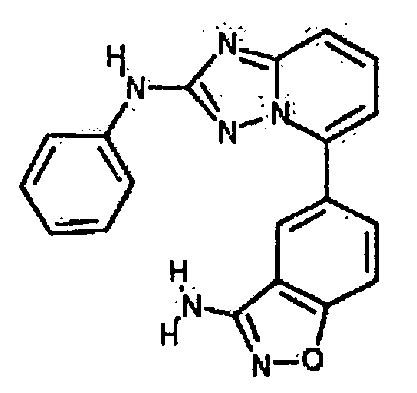
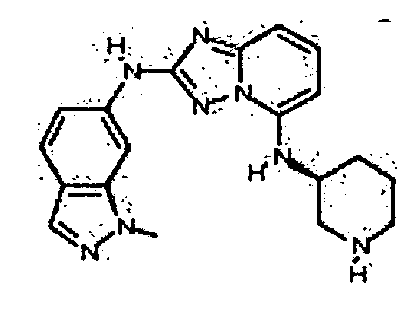
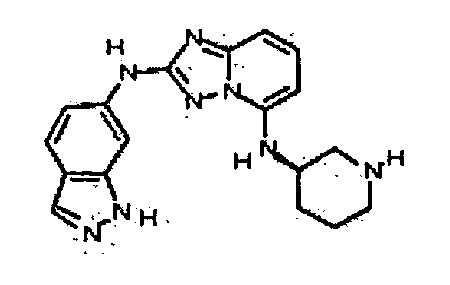
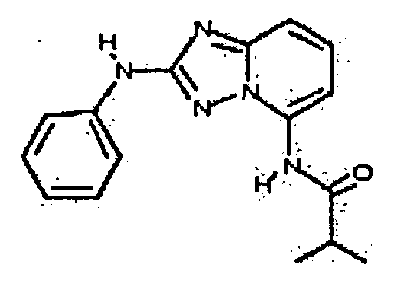
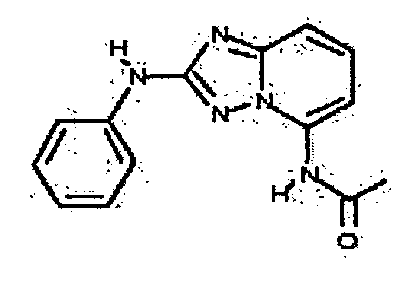
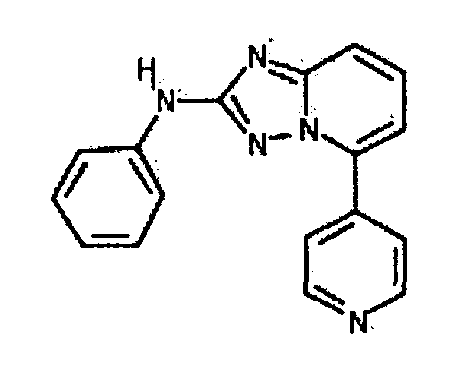
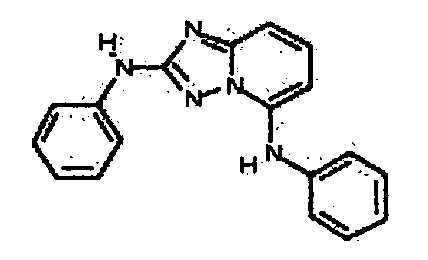
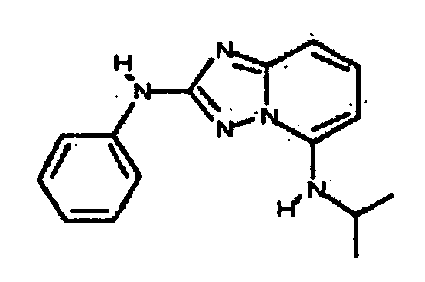
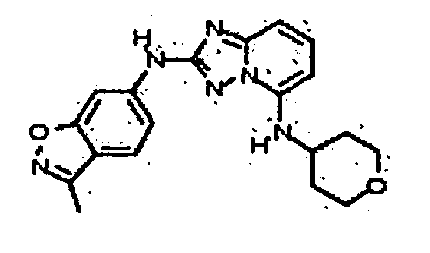
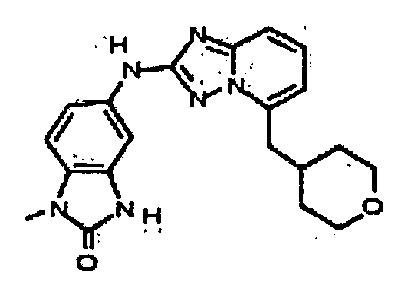
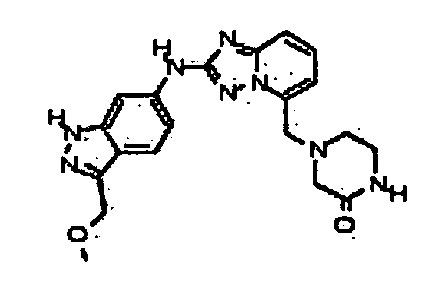
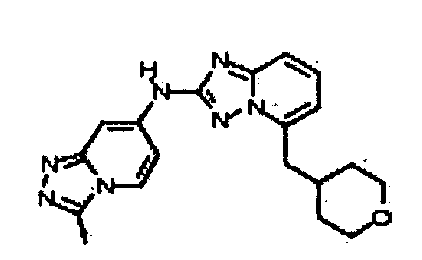
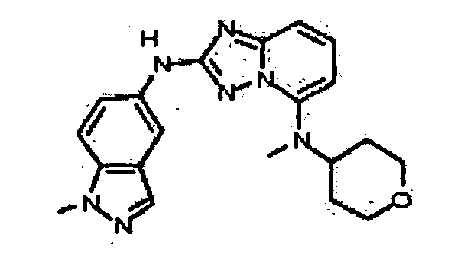
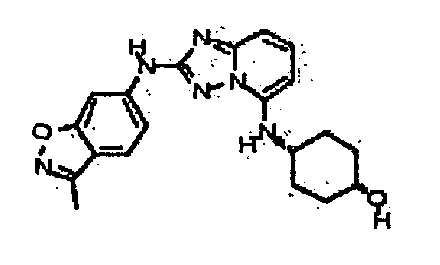
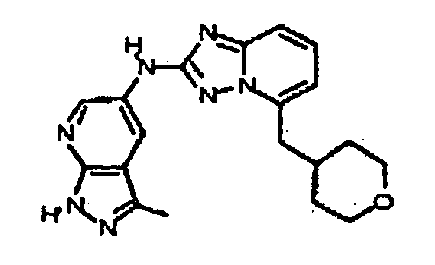
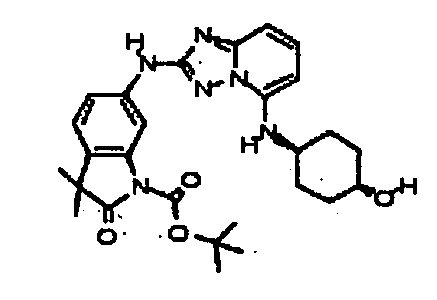
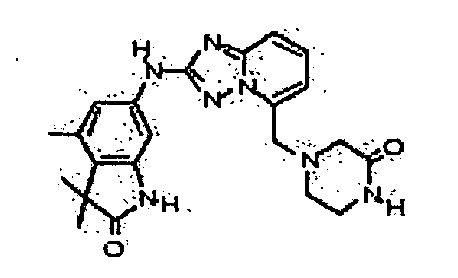
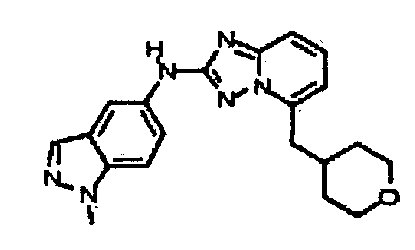
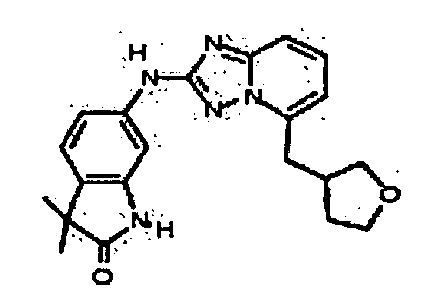
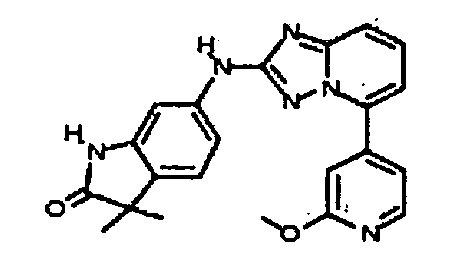
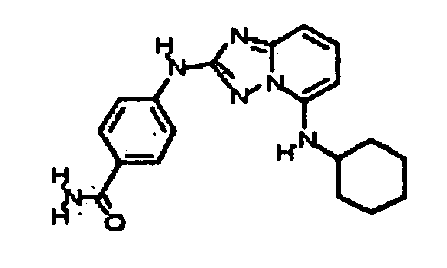
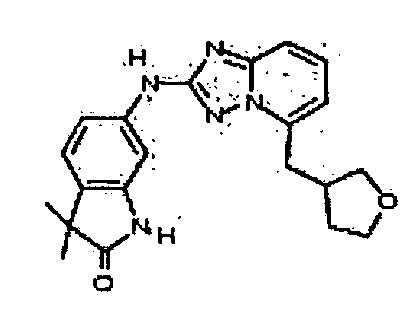
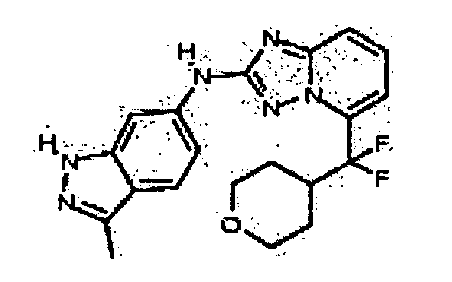
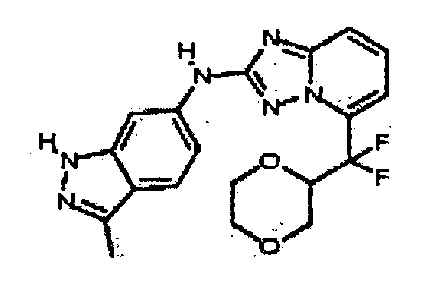
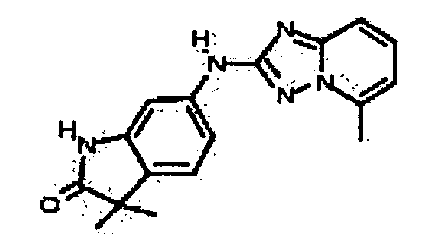
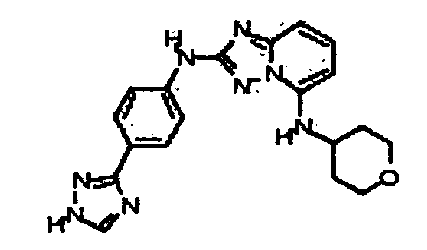
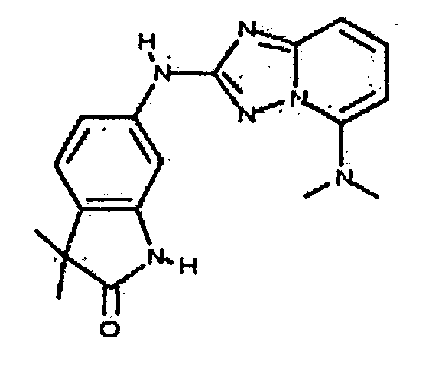
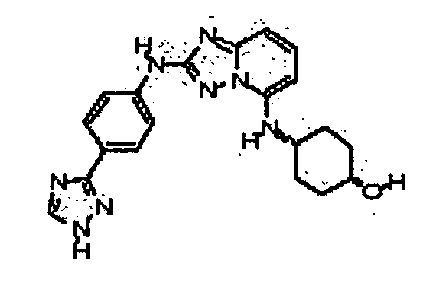
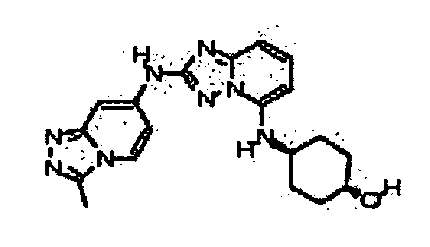
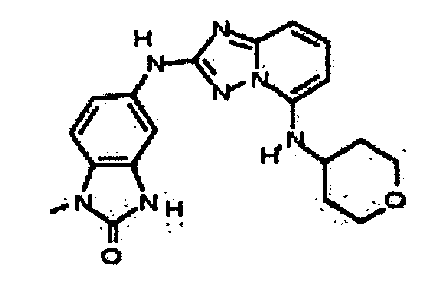
В некоторых вариантах воплощения, гетероарильное соединение представляет собой:
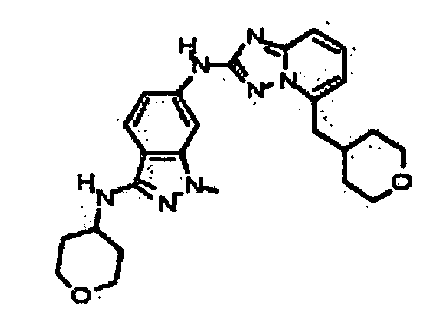
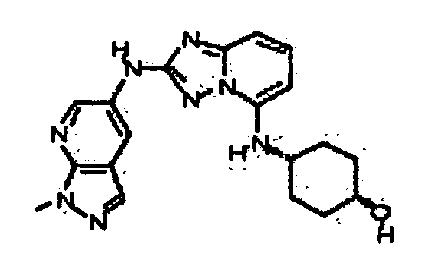
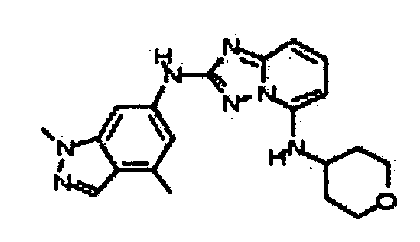
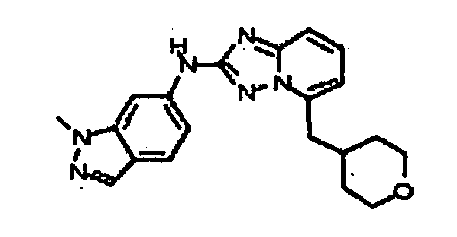
1-метил-N3-(тетрагидро-2H-пиран-4-ил)-N6-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-ил)-1H-индазол-3,6-диамин;
N3-(тетрагидро-2H-пиран-4-ил)-N6-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-ил)-1H-индазол-3,6-диамин;
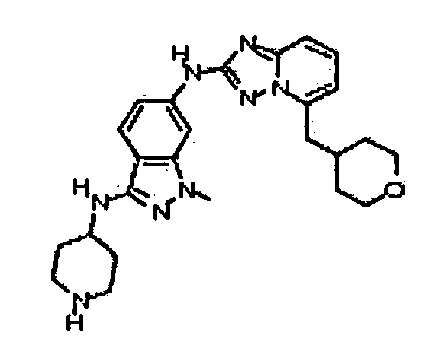
1-метил-N3-(пиперидин-4-ил)-N6-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-ил)-1H-индазол-3,6-диамин;
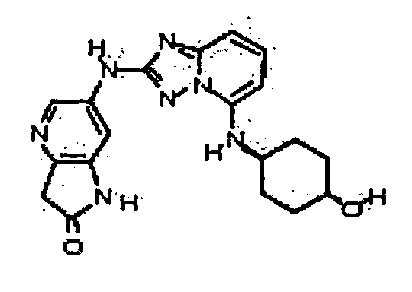
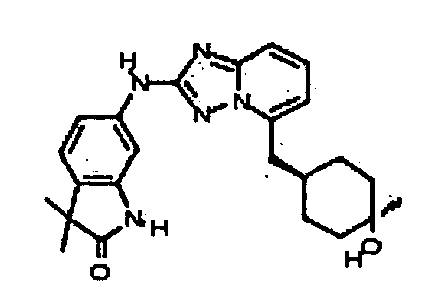
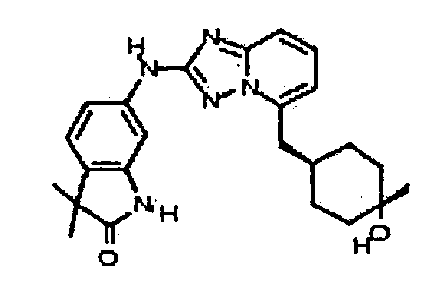
цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-1H-пирроло[3,2-b]пиридин-2(3H)-он;
цис-6-(5-(4-гидрокси-4-метилциклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-1,3,3-триметилиндолин-2-он;
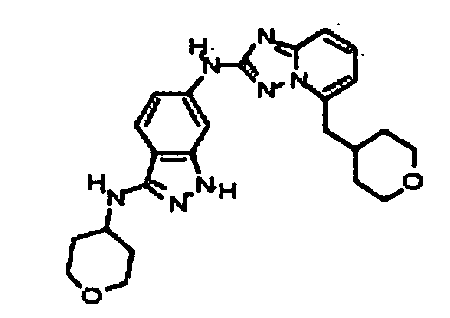
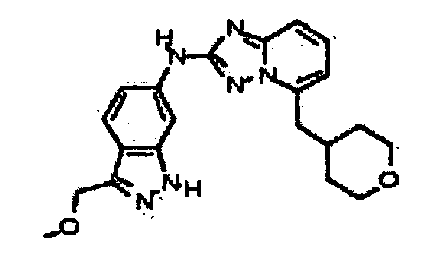
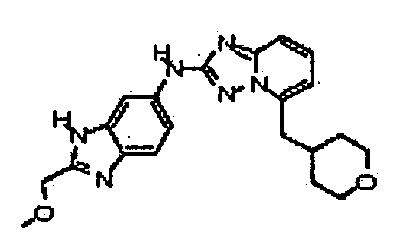
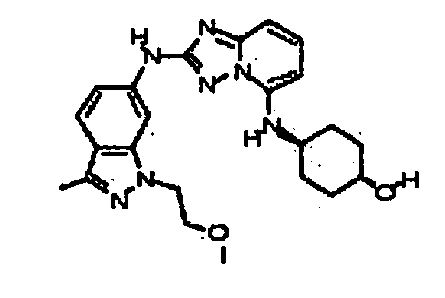
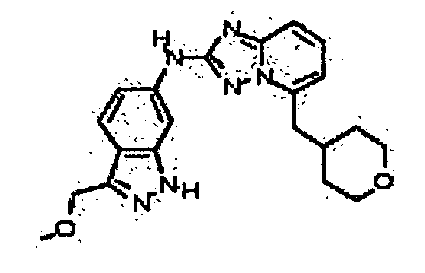
N-(3-(метоксиметил)-1H-индазол-6-ил)-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
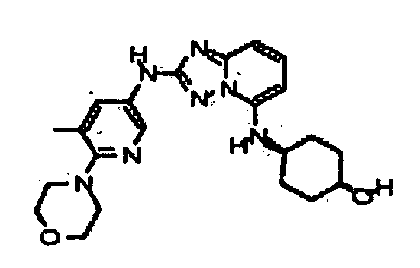
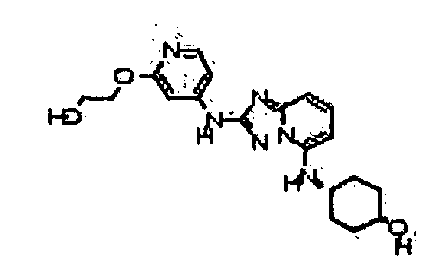
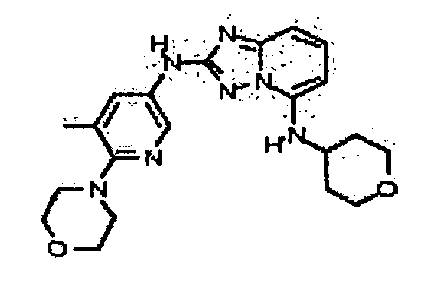
цис-4-(2-(5-метил-6-морфолинопиридин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
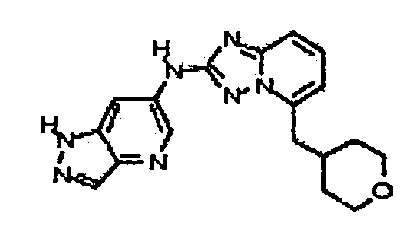
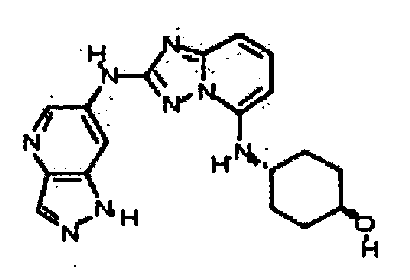
N-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-ил)-1H-пиразоло[4,3-b]пиридин-6-амин;
цис-4-(2-(1H-пиразоло[4,3-b]пиридин-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
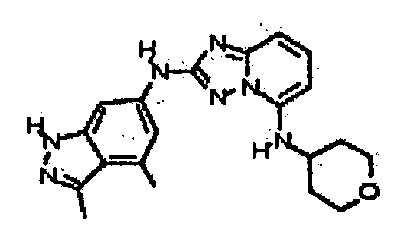
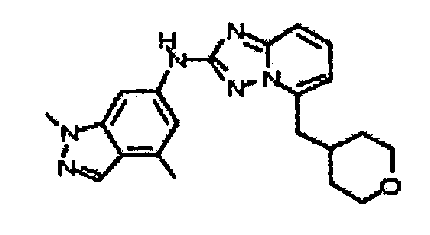
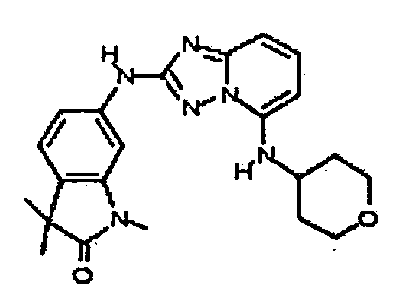
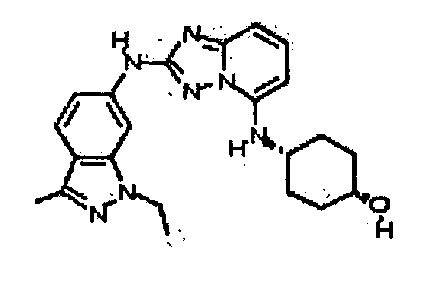
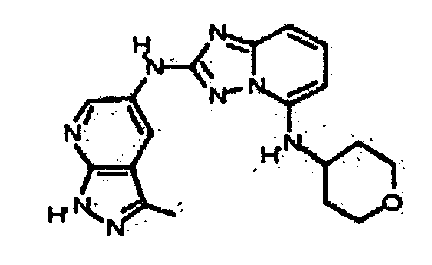
N2-(3,4-диметил-1H-индазол-6-ил)-N5-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3,4-триметилиндолин-2-он;
транс-6-(5-(4-гидрокси-4-метилциклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-1,3,3-триметилиндолин-2-он;
N2-(1H-пиразоло[4,3-b]пиридин-6-ил)-N5-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
цис-4-(2-(имидазо[1,2-a]пиридин-7-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
3,3-диметил-6-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)изоиндолин-1-он;
6-(5-(4-гидроксипиперидин-1-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он;
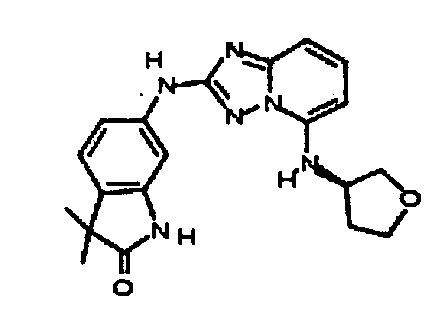
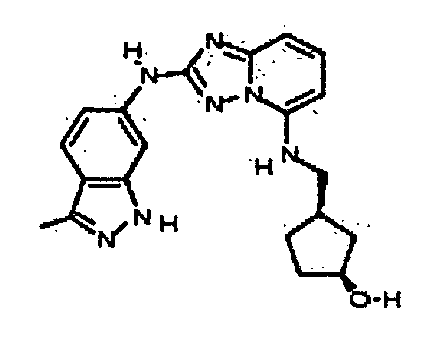
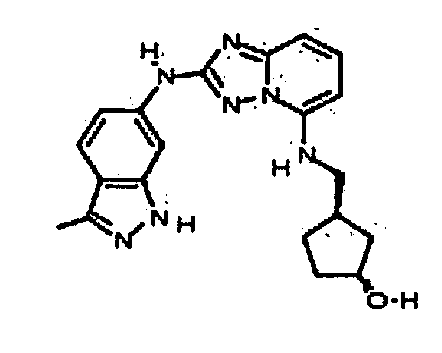
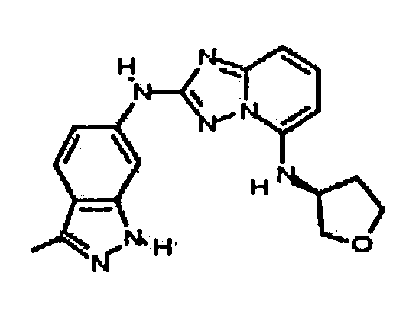
(R)-N2-(3-метил-1H-индазол-5-ил)-N5-(тетрагидрофуран-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
N-(3-метил-1H-индазол-5-ил)-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N2-(3-метил-1H-индазол-5-ил)-N5-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
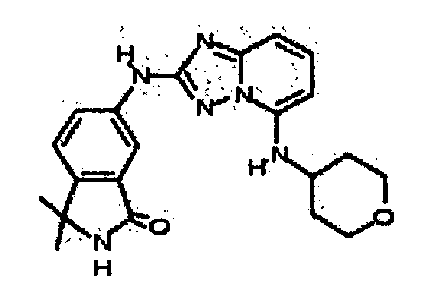
1-метил-6-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
1-метил-6-(5-(тетрагидро-2H-пиран-4-иламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилизоиндолин-1-он;
(S)-3,3-диметил-6-(5-(метил(тетрагидрофуран-3-ил)амино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
(R)-3,3-диметил-6-(5-(метил(тетрагидрофуран-3-ил)амино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
(R)-1,3,3-триметил-6-(5-(тетрагидрофуран-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
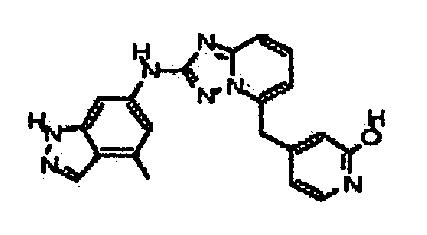
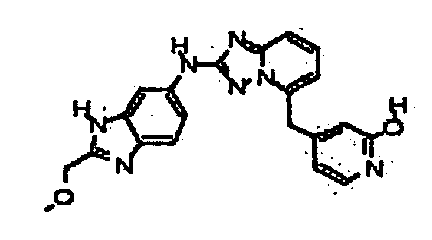
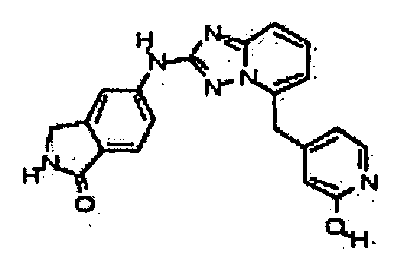
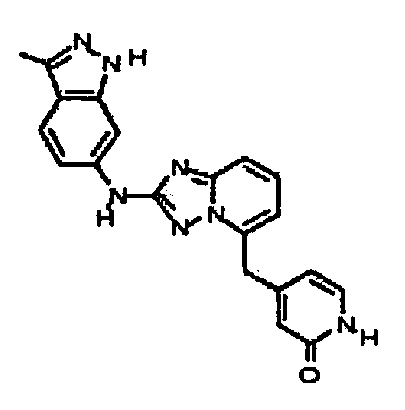
4-((2-(4-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиридин-2-ол;
3,3,4-триметил-6-(5-(тетрагидро-2H-пиран-4-иламино)-[1,2,4]триазоло [1,5-a]пиридин-2-иламино)индолин-2-он;
3,3,4-триметил-6-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
транс-4-(2-(3-метил-1H-индазол-5-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
3,3-диметил-6-(5-(тетрагидро-2H-пиран-4-иламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)изоиндолин-1-он;
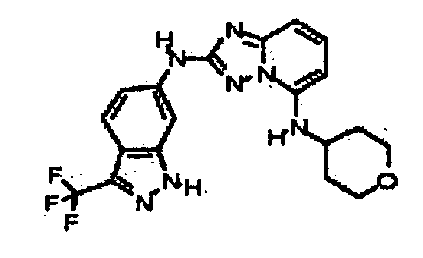
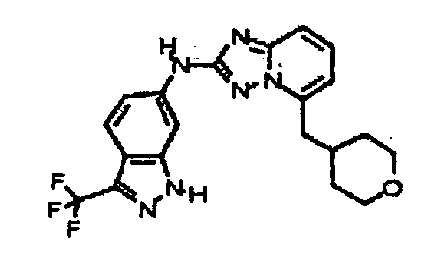
N5-(тетрагидро-2H-пиран-4-ил)-N2-(3-(трифторметил)-1H-индазол-6-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
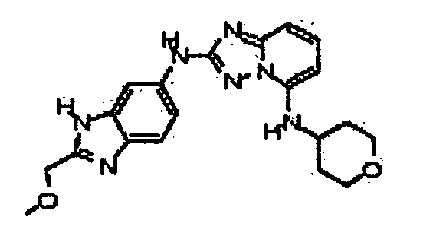
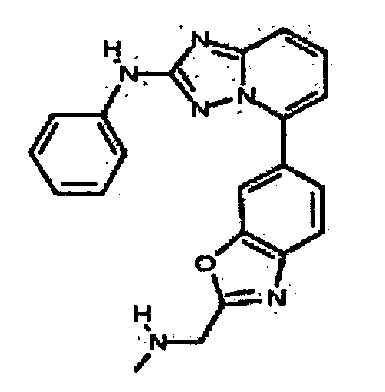
4-((2-(2-(метоксиметил)-1H-бензо[d]имидазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиридин-2-ол;
(R)-3,3-диметил-6-(5-(пиперидин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
N-(2-(метоксиметил)-1H-бензо[d]имидазол-6-ил)-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
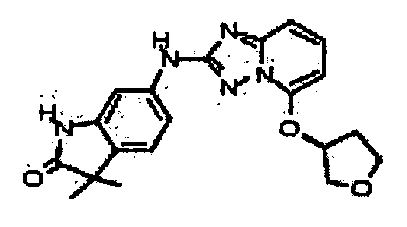
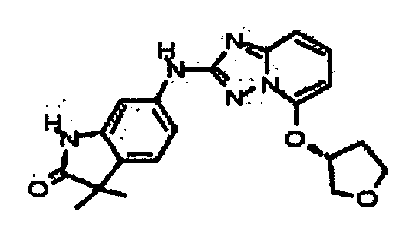
(S)-3,3-диметил-6-(5-(тетрагидрофуран-3-илокси)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
(R)-3,3-диметил-6-(5-(тетрагидрофуран-3-илокси)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
цис-5-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-2-метилизоиндолин-1-он;
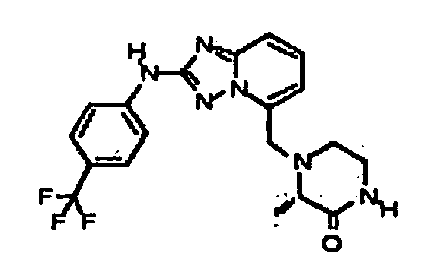
1,3,3-триметил-6-(5-((3-оксопиперазин-1-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
транс-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилизоиндолин-1-он;
3,3-диметил-6-(5-(пиперидин-4-илметил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
цис-4-(2-(1-метил-1H-пиразоло[3,4-b]пиридин-5-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-6-(5-((4-гидрокси-4-метилциклогексил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он;
транс-6-(5-((4-гидрокси-4-метилциклогексил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он;
N2-(2-(метоксиметил)-1H-бензо[d]имидазол-6-ил)-N5-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
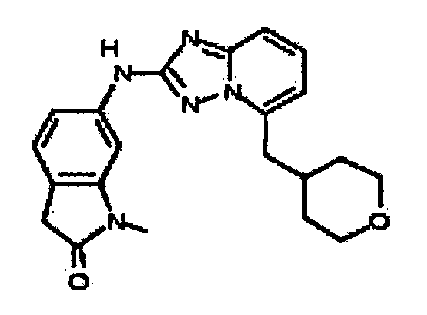
1,3,3-триметил-6-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
2-метил-5-(5-(тетрагидро-2H-пиран-4-иламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)изоиндолин-1-он;
2-метил-5-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)изоиндолин-1-он;
транс-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-1,3,3-триметилиндолин-2-он;
N-(1,4-диметил-1H-индазол-6-ил)-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N2-(l,4-диметил-1H-индазол-6-ил)-N5-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
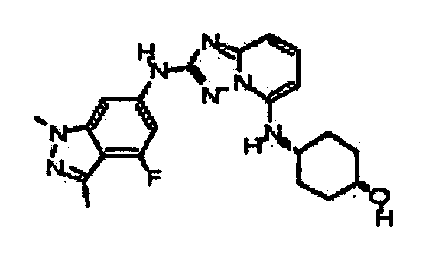
цис-4-(2-(4-фтор-1,3-диметил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
(R)-3,3-диметил-6-(5-(тетрагидрофуран-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
1,3,3-триметил-6-(5-(тетрагидро-2H-пиран-4-иламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-1,3,3-триметилиндолин-2-он;
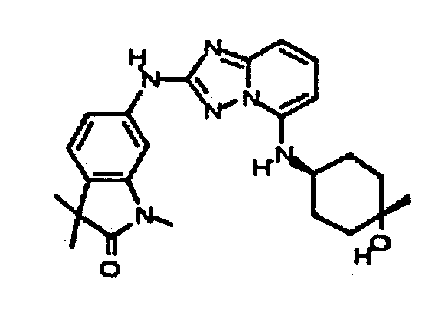
6-(5-((2-гидроксиэтил)(метил)амино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он;
(S)-3,3-диметил-6-(5-(пиперидин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
4-((2-(3-(трифторметил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-он;
3,3-диметил-6-(5-((2-оксо-1,2-дигидропиридин-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
5-(5-((2-гидроксипиридин-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)изоиндолин-1-он;
3,3-диметил-6-(5-(метил(тетрагидро-2H-пиран-4-ил)амино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
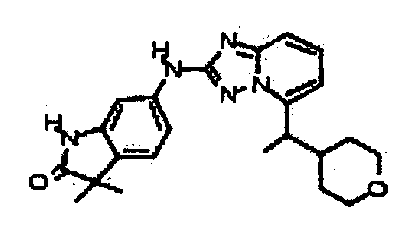
3,3-диметил-6-(5-(1-(тетрагидро-2H-пиран-4-ил)этил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
N-(1-метил-1H-индазол-6-ил)-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N2-(1-метил-1H-индазол-6-ил)-N5-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
транс-6-(5-(4-гидрокси-4-метилциклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он;
цис-6-(5-(4-гидрокси-4-метилциклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он;
цис-4-(2-(4-фтор-3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
(±)-цис-4-(2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-илокси)тетрагидрофуран-3-ол;
(±)-транс-4-(2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)тетрагидрофуран-3-ол;
(R)-N2-(3-метил-1H-индазол-6-ил)-N5-(тетрагидрофуран-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
3,3-диметил-6-(5-(тетрагидро-2H-пиран-4-илокси)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
3-метил-1-((2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)азетидин-3-ол;
6-(5-(3-гидроксиазетидин-1-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он;
6-(5-(3-гидрокси-3-метилазетидин-1-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он;
3,3-диметил-6-(5-((3-оксопиперазин-1-ил)метил)-[1,2,4]триазоло [1,5-a]пиридин-2-иламино)индолин-2-он;
6-(5-(гидрокси(тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он;
цис-5-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-2-(2-метоксиэтил)изоиндолин-1-он;
транс-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он;
3,3-диметил-6-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
3,3-диметил-6-(5-(тетрагидро-2H-пиран-4-иламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
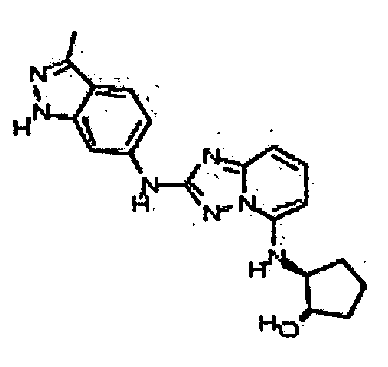
(1S,3R)-3-((2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)метил)циклопентанол;
(1R,3S)-3-((2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-а]пиридин-5-иламино)метил)циклопентанол;
(1R,3S)-3-((2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)метил)циклопентанол;
(1S,3S)-3-((2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)метил)циклопентанол;
(S)-N2-(3-метил-1H-индазол-6-ил)-N5-(тетрагидрофуран-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
4-((2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиридин-2(1H)-он;
5-((3,3-дифторпиперидин-1-ил)метил)-N-(3-метил-1H-индазол-6-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
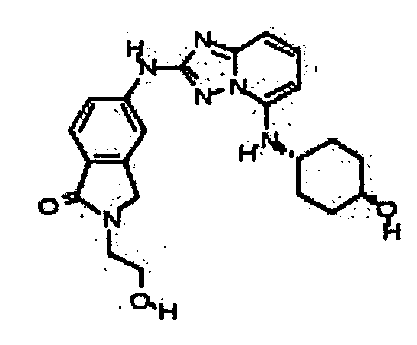
цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-1-(2-гидроксиэтил)индолин-2-он;
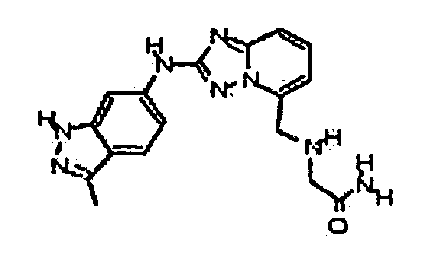
2-((2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метиламино)ацетамид;
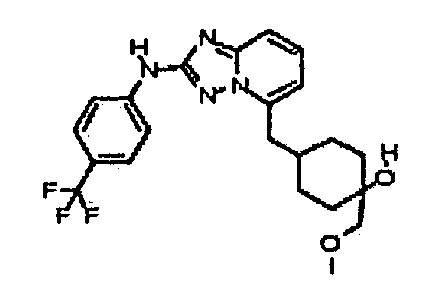
цис-1-(метоксиметил)-4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)циклогексанол;
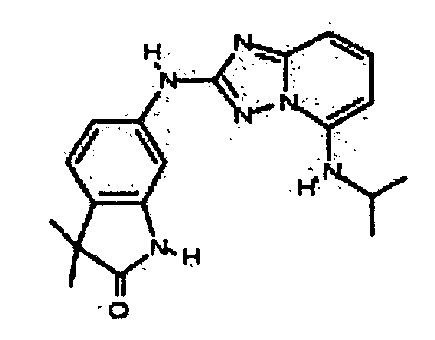
4-((2-(1-изопропил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-он;
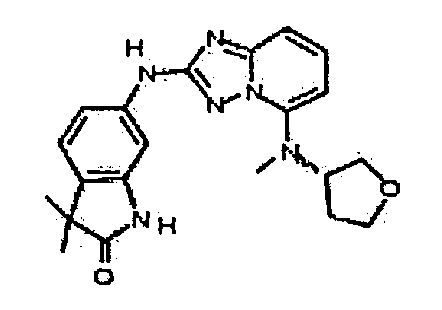
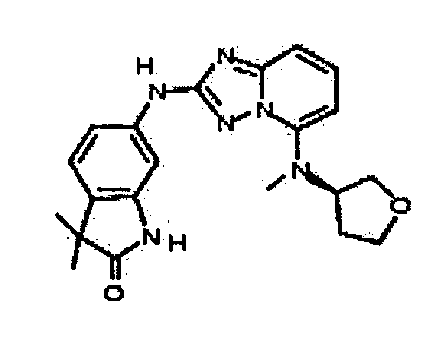
N5-метил-N2-(3-метил-1H-индазол-6-ил)-N5-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
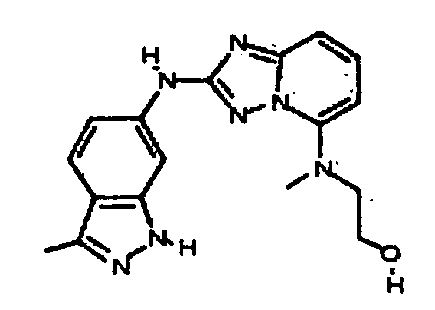
2-(метил(2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)амино)этанол;
цис-4-(2-(1-(2-гидроксиэтил)-3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-1-метилиндолин-2-он;
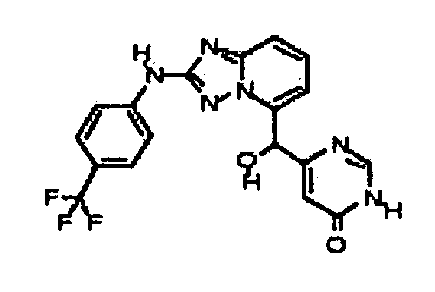
6-(гидрокси(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиримидин-4(3H)-он;
цис-4-(2-(1-(2-метоксиэтил)-3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
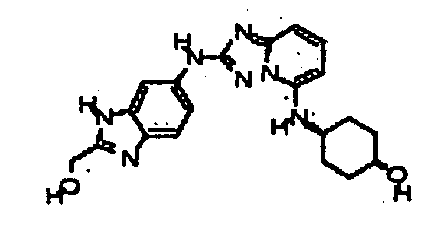
цис-4-(2-(2-(гидроксиметил)-1H-бензо[d]имидазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(2-(метоксиметил)-1H-бензо[d]имидазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(1-этил-3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-5-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-2-(2-гидроксиэтил)изоиндолин-1-он;
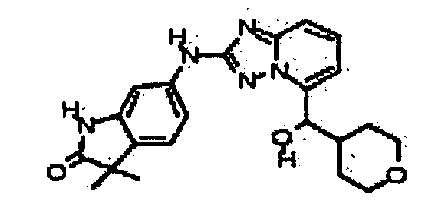
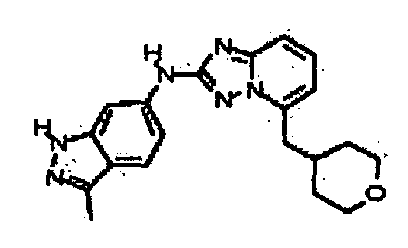
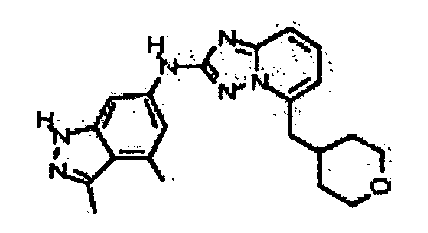
N-(3-метил-1H-индазол-6-ил)-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
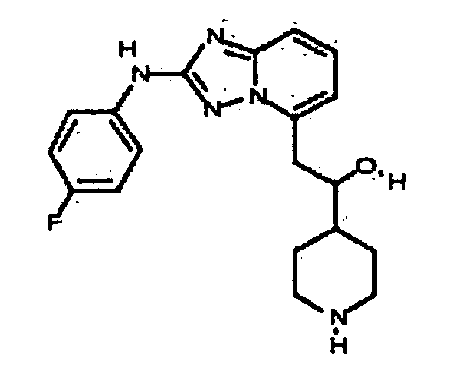
(2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)(тетрагидро-2H-пиран-4-ил)метанол;
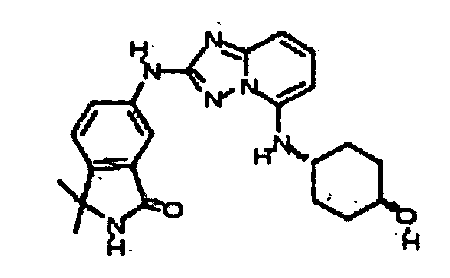
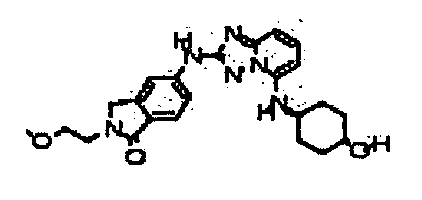
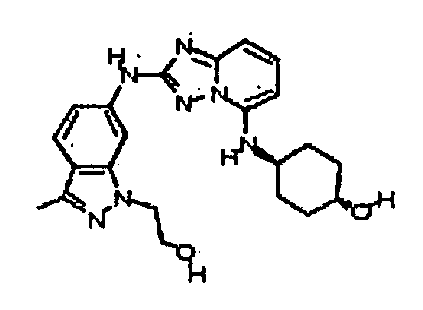
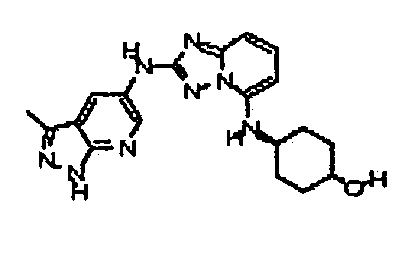
транс-4-(2-(3-метил-1H-индазол-6-иламино)-[1,2)4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он;
цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,4-дигидроизохинолин-1(2H)-он;
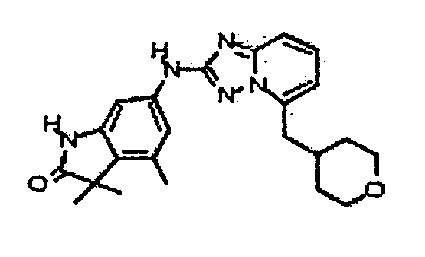
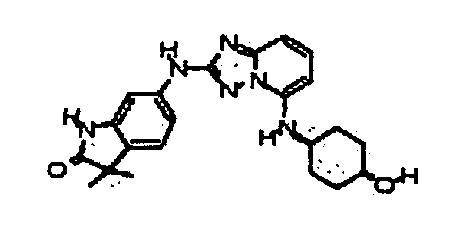
цис-4-(2-(4-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
(R)-3-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метиламино)пирролидин-2-он;
цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-2-(2-гидроксиэтил)изоиндолин-1-он;
(±)-3-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метиламино)пирролидин-2-он;
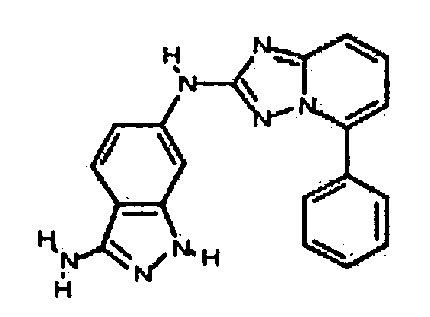
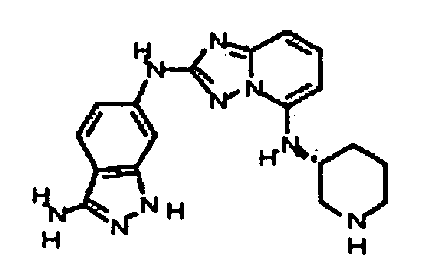
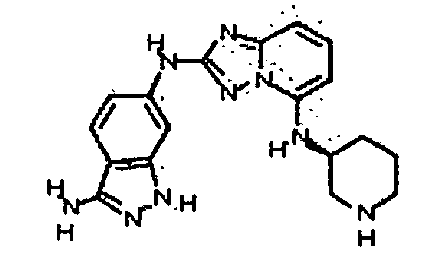
4-((2-(3-амино-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)циклогексанол;
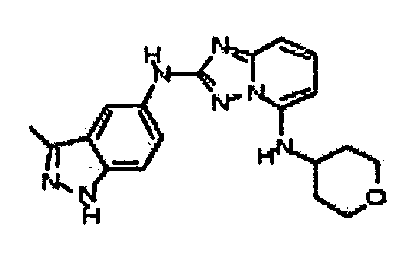
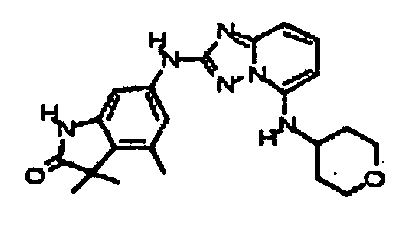
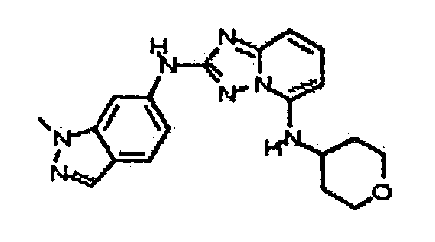
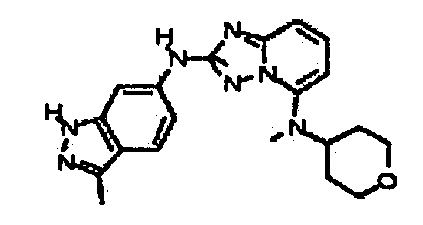
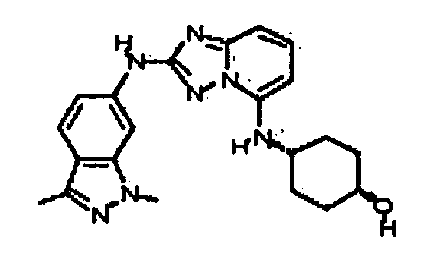
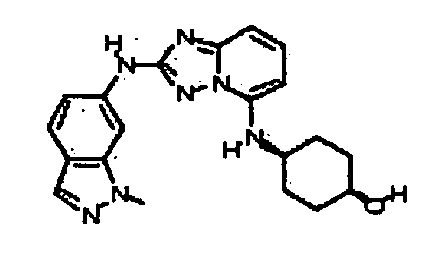
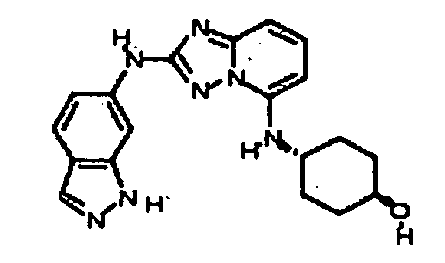
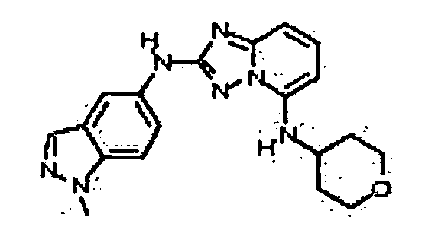
N2-(3-метил-1H-индазол-6-ил)-N5-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
цис-4-(2-(4-фтор-3-(2-метоксиэтокси)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
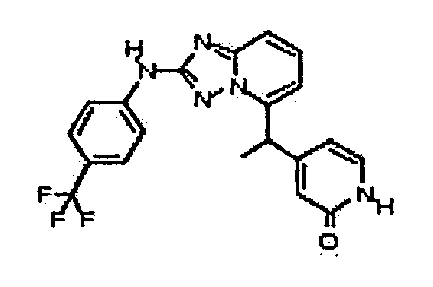
4-(1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)этил)пиридин-2(1H)-он;
(1S,2S)-2-(2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклопентанол;
N-метил-2-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метиламино)ацетамид;
4-(5-((3-гидроксициклопентил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид (диастереомер 2);
1-(2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)азетидин-3-ол;
цис-4-(2-(3-амино-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(2,3-диметил-2H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(l,3-диметил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
4-((2-(4-фтор-3-метилфениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиридин-2-ол;
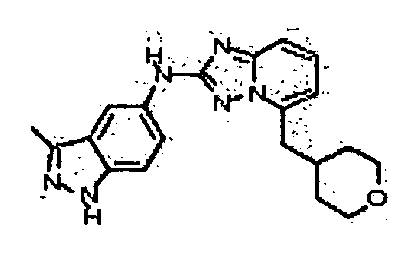
N2-(3-метил-1Н-индазол-6-ил)-N5-((тетрагидро-2Н-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
4-((2-(6-(4-гидроксипиперидин-1-ил)пиридин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-он;
(S)-2-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метиламино)пропанамид;
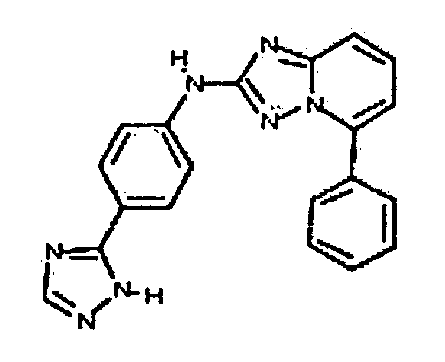
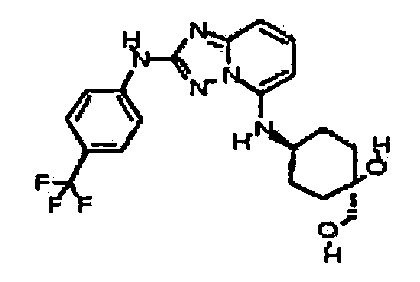
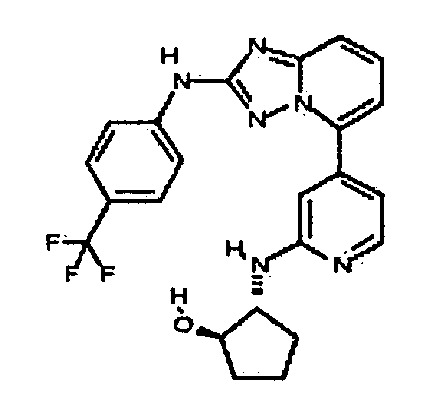
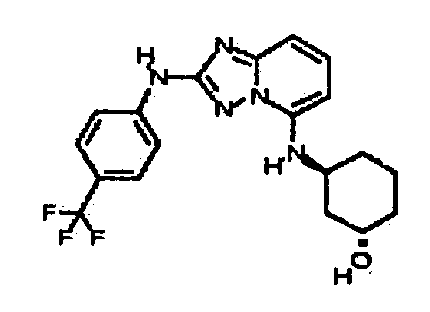
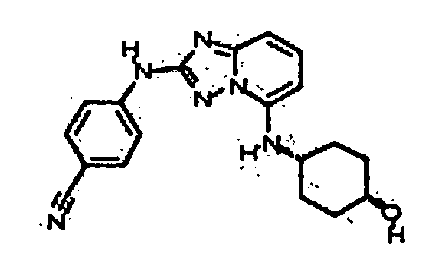
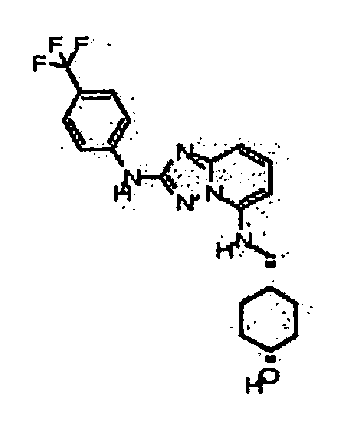
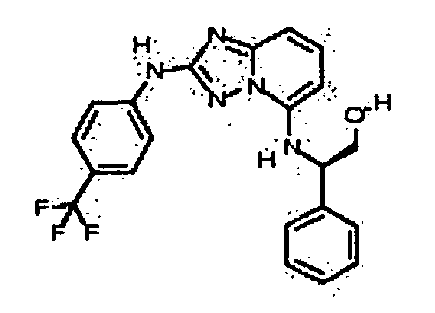
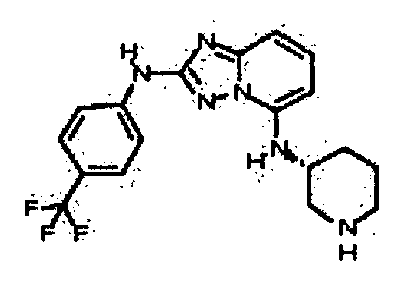
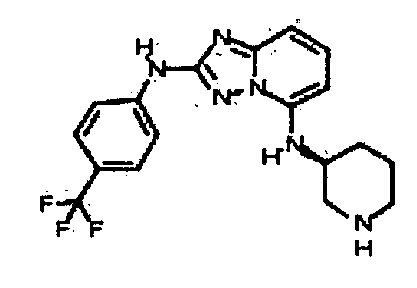
цис-3-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол(энантиомер 1);
цис-3-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол (энантиомер 2);
транс-3-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол (энантиомер 1);
транс-3-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол (энантиомер 2);
цис-1-(гидроксиметил)-4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
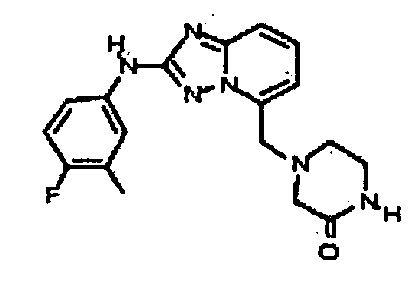
4-((2-(4-фтор-3-метилфениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-он;
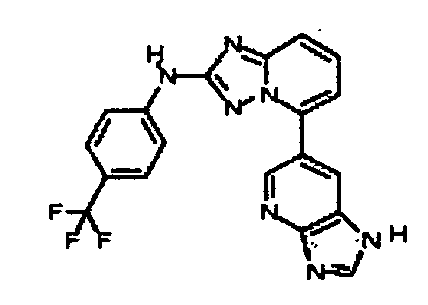
4-((2-(1H-пирроло[2,3-b]пиридин-5-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-он;
(±)-5-изопропил-4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-он;
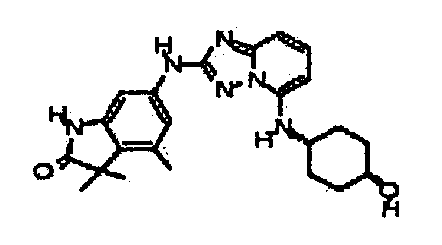
цис-4-(2-(3-(метоксиметил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
4-(5-((3-гидроксициклопентил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид (диастереомер 1);
(±)-2-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метиламино)пропанамид;
1-(3-метил-1H-индазол-6-ил)-4-((2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-он;
4-((2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-он;
цис-4-(2-(1-метил-1H-индазол-5-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(1H-бензо[d][1,2,3]триазол-5-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
цис-4-((2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)циклогексанол;
транс-4-((2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)циклогексанол;
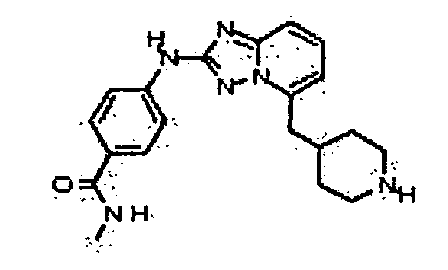
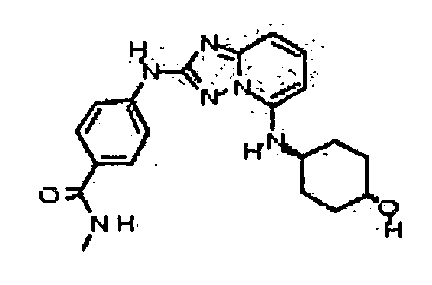
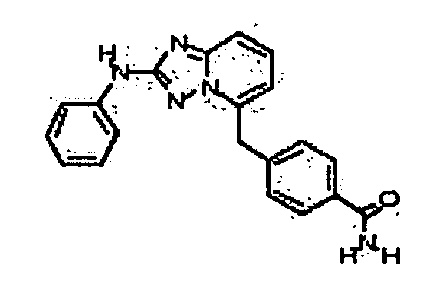
4-(5-(1H-имидазол-1-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
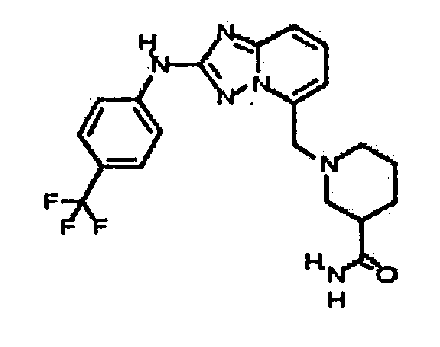
4-(5-(4-гидроксипиперидин-1-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
цис-4-(2-(1-изопропил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
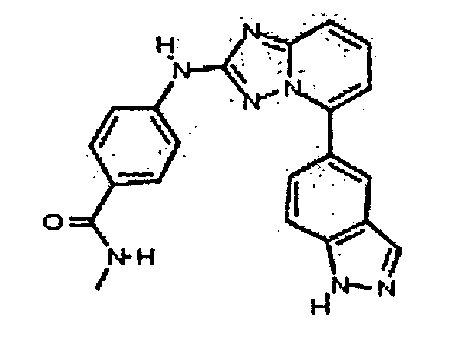
N-метил-4-(5-(2-метил-1H-бензо[d]имидазол-6-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
цис-4-(2-(3-этил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
(1R,2R)-2-(4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пиридин-2-иламино)циклопентанол;
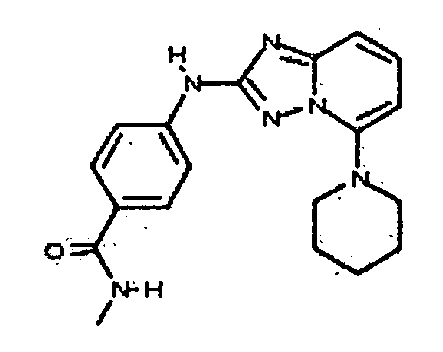
N-метил-4-(5-(пиперидин-1-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
(±)-транс-3-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
(S)-4-(5-(3-гидроксипирролидин-1-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
(R)-4-(5-(3-гидроксипирролидин-1-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
N-метил-4-(5-(пирролидин-1-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)имидазолидин-2,4-дион;
цис-5-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)изоиндолин-1-он;
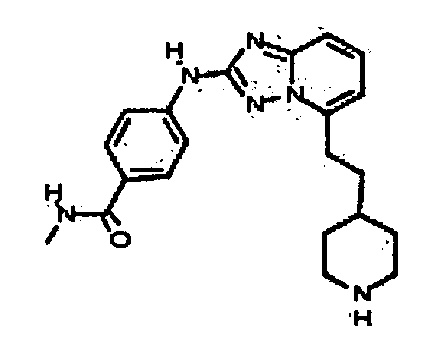
N-метил-4-(5-(2-(пиперидин-4-ил)этил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
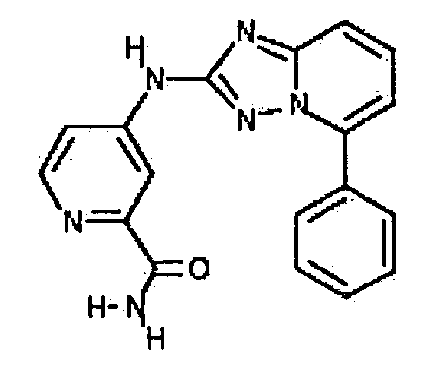
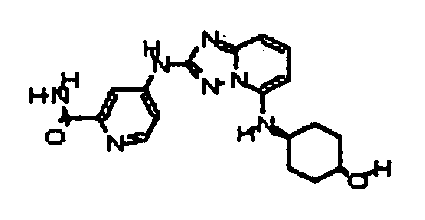
цис-4-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)пиколинамид;
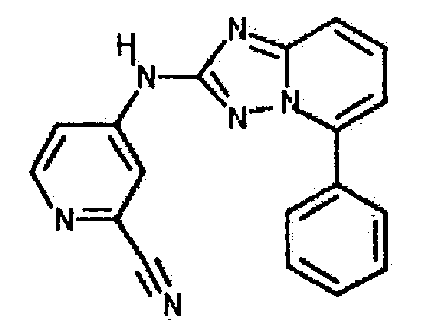
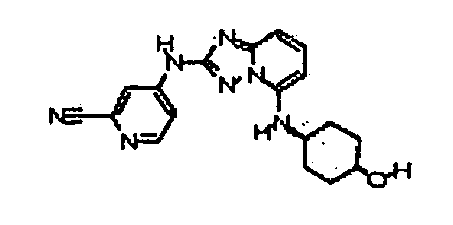
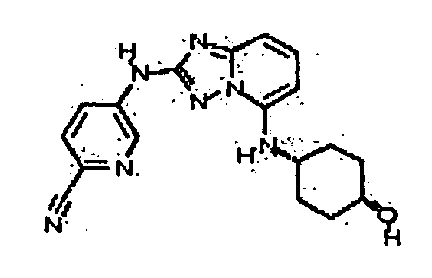
цис-4-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)пиколинонитрил;
1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперидин-3-карбоксамид;
5-метил-4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-он;
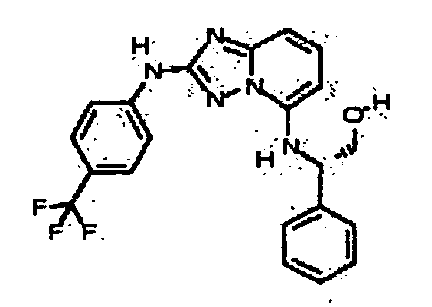
(1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)азетидин-3-ил)метанол;
цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)изоиндолин-1-он;
цис-4-(2-(2,6-диметилпиридин-4-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
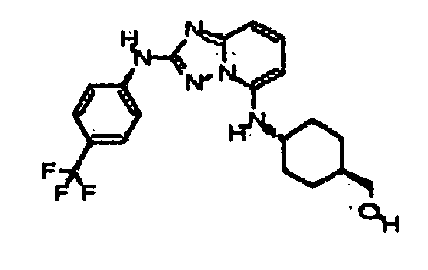
4-(5-((4-аминоциклогексил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
4-(1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)этил)пиперазин-2-он;
4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2,6-дион;
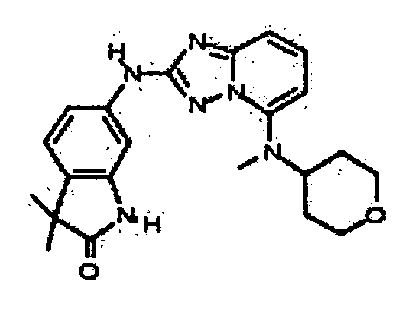
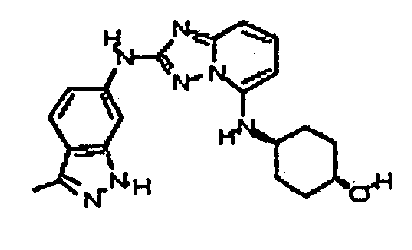
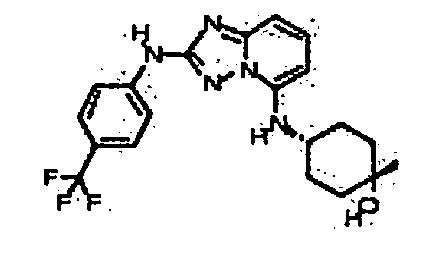
цис-N5-(4-метоксициклогексил)-N5-метил-N2-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
цис-4-(метил(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)амино)циклогексанол;
N-метил-4-(5-(пирролидин-3-илметил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
5-(5-(2-(гидроксиметил)-1H-бензо[d]имидазол-6-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)пиридин-2-ол;
1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)-1,4-диазепан-5-он;
(1S,2R)-2-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
(S)-(1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пирролидин-2-ил)метанол;
(R)-(1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пирролидин-2-ил)метанол;
(1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперидин-3-ил)метанол;
(1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперидин-4-ил)метанол;
(S)-3-метил-4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-он;
N-метил-4-(5-(пиперидин-4-илметил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
цис-4-(2-(2-(2-гидроксиэтокси)пиридин-4-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(2-(2-(пирролидин-1-ил)этиламино)пиридин-4-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(4-фтор-3,5-диметилфениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
(6-(2-(6-метоксипиридин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)-1H-бензо[d]имидазол-2-ил)метанол;
3-метил-4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-он;
6-метил-4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-он;
цис-4-(5-(4-аминоциклогексилокси)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
N-метил-4-(5-(пиперидин-4-илокси)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
(6-(2-(6-метилпиридин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)-1H-бензо[d]имидазол-2-ил)метанол;
1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)тетрагидропиримидин-2(1H)-он;
1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)азетидин-3-ол;
(R)-(1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пирролидин-2-ил)метанол;
(S)-(1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пирролидин-2-ил)метанол;
2-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метиламино)ацетамид;
транс-4-(5-(4-аминоциклогексилокси)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
4-(5-(3-гидроксибензил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
цис-4-(2-(2-(2-(пирролидин-1-ил)этокси)пиридин-4-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-1-(5-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло [1,5-a]пиридин-2-иламино)пиридин-2-ил)пиперидин-4-ол;
цис-4-(2-(6-(метиламино)пиридин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
5-(2-аминоэтокси)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
цис-4-(2-(1H-пирроло[2,3-b]пиридин-5-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
(6-(2-(6-(диметиламино)пиридин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)-1H-бензо[d]имидазол-2-ил)метанол;
(R)-1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперидин-3-ол;
(S)-1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперидин-3-ол;
1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)имидазолидин-4-он;
(R)-5-(пирролидин-2-илметокси)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
(S)-5-(пирролидин-2-илметокси)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
3-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-илокси)пропан-1-ол;
цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)пиридин-2-ол;
4-(5-(2-гидрокси-2-(пиперидин-4-ил)этил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
5-(пирролидин-1-ил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(морфолинометил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
(R)-1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пиперидин-3-ол;
(S)-1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пиперидин-3-ол;
цис-4-(2-(3,4-дифторфениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
2-(4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пиридин-2-иламино)этанол;
цис-4-(2-(6-морфолинопиридин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(3,5-диметилфениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
2-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-илокси)этанол;
цис-3-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиридин-2(1H)-он;
цис-2-фтор-5-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
цис-4-(2-(4-фторфениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(4-фтор-3-метилфениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
5-(3-аминопропокси)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
цис-4-(2-(2-фторпиридин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
(R)-(1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пирролидин-3-ил)метанол;
(S)-(1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пирролидин-3-ил)метанол;
N-метил-4-(5-(пиридин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
(R)-(1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пирролидин-3-ил)метанол;
(S)-(1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пирролидин-3-ил)метанол;
(R)-2-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)пропан-1-ол;
(S)-2-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)пропан-1-ол;
N5-изопропил-N2-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
цис-4-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)пиридин-2-ол;
(R)-1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пирролидин-3-ол;
(S)-1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пирролидин-3-ол;
(1S,2S)-2-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
(R)-1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пирролидин-3-ол;
(S)-1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пирролидин-3-ол;
цис-3-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
цис-4-(2-(3-метоксифениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(2-метоксифениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-3-фтор-4-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
цис-3-фтор-4-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензонитрил;
цис-4-(2-(6-метоксипиридин-2-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(п-толиламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-илокси)циклогексанкарбоксамид;
1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пиперидин-4-ол;
(1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пиперидин-4-ил)метанол;
цис-2-фтор-4-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
цис-3-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензонитрил;
цис-4-(2-(пиридин-2-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(м-толиламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
5-(пиперидин-4-илокси)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
цис-4-(2-(4-хлорфениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(3-хлорфениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(3-фторфениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
(1S,2R)-(2-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексил)метанол;
цис-4-(2-(2-фторфениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
2-метил-2-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)пропан-1-ол;
цис-4-(2-(6-(2-гидроксипропан-2-ил)пиридин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
4-(5-(цис-4-аминоциклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
(R)-5-(пиперидин-3-илокси)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
(S)-5-(пиперидин-3-илокси)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
4-(5-(цис-4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензонитрил;
цис-4-(2-(1-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(2-(метиламино)пиридин-4-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(2-метилпиридин-4-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(5-метоксипиридин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-5-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)никотинамид;
цис-5-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)пиколинамид;
цис-5-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)пиридин-2-ол;
5-(пиридин-4-илметил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
(±)-транс-3-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
(1S,2S)-2-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклопентанол;
транс-4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)метил)циклогексанол;
(1S,2R)-2-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклопентанол;
(1R,2R)-2-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклопентанол;
цис-4-(2-(2-метоксипиридин-4-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
2-(6-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)-1H-бензо[d]имидазол-2-ил)пропан-2-ол;
5-(1H-имидазо[4,5-b]пиридин-6-ил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
цис-5-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)пиколинонитрил;
цис-4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)метил)циклогексанол;
транс-1-метил-4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-1-метил-4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-2-(4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексил)пропан-2-ол;
цис-4-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
транс-4-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-он;
цис-4-(2-(пиридин-4-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(5-метилпиридин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(6-метоксипиридин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(6-(диметиламино)пиридин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
5-(пиперазин-1-илметил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
транс-4-(5-(4-аминоциклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
5-(пиперидин-4-илметил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперидин-4-ол;
транс-2-(4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексил)пропан-2-ол;
транс-4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)циклогексанол;
цис-4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)циклогексанол;
4-(5-(циклопентиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
5-(2-(метоксиметил)-1H-бензо[d]имидазол-6-ил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
1-(6-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)-1H-бензо[d]имидазол-2-ил)этанол;
цис-4-(2-(6-метилпиридин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
(S)-N2-(2-(2-аминоэтокси)пиридин-4-ил)-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
транс-4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-илокси)циклогексанкарбоксамид;
(1R,2S)-2-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклопентанол;
5-((1-этилпиперидин-4-ил)метил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
6-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)-1H-бензо[d]имидазол-2-карбоксамид;
(6-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)-1H-бензо[d]имидазол-2-ил)метанол;
цис-(4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексил)метанол;
(S)-N2-(6-морфолинопиридин-3-ил)-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
(R)-2-фенил-2-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)этанол;
(S)-2-фенил-2-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)этанол;
транс-(4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[l>5-a]пиридин-5-иламино)циклогексил)метанол;
4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)пиридин-2-ол;
4-(2-(4-фторфениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пиколинамид;
цис-4-(2-(4-фторфениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-илокси)циклогексанол;
(1S,3R)-3-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклопентанол;
(1S,3S)-3-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклопентанол;
(1R,3R)-3-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклопентанол;
(1R,3S)-3-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклопентанол;
транс-5-(4-аминоциклогексилокси)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
цис-5-(4-аминоциклогексилокси)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(2-((метиламино)метил)бензо[d]оксазол-6-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
2-(2-(4-фторфениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)-1-(пиперидин-4-ил)этанол;
4-(5-(1H-индазол-5-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
N5-(азепан-3-ил)-N2-(4-фторфенил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
N-фенил-5-(2-(пирролидин-1-илметил)-1H-бензо[d]имидазол-6-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
цис-4-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
4-((2-(4-фторфениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперидин-4-ол;
2-(2-(4-фторфениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)-1-фенилэтанол;
4-(5-(1H-бензо[d][1,2,3]триазол-6-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
(S)-N5-(пиперидин-3-ил)-N2-(пиридин-3-ил)-[1,2,4]триазоло [1,5-a]пиридин-2,5-диамин;
(R)-N5-(пиперидин-3-ил)-N2-(пиридин-3-ил)-[1,2,4]триазоло [1,5-a]пиридин-2,5-диамин;
5-(4-метилизоксазол-3-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N-(4-фторфенил)-5-(1H-индазол-6-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N-(4-фторфенил)-5-(2-((метиламино)метил)-1H-бензо[d]имидазол-6-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N2-фенил-N5-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
5-(3-амино-1H-индазол-6-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(2-((метиламино)метил)-1H-бензо[d]имидазол-6-ил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N-метил-4-(5-(тетрагидрофуран-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
3-((2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)бензамид;
2-(4-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пиридин-2-иламино)этанол;
5-(2-(2-аминоэтокси)пиридин-4-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(2-аминопиридин-4-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(2-(диметиламино)пиридин-4-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N1-(4-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пиридин-2-ил)этан-1,2-диамин;
(R)-N2-(изоиндолин-5-ил)-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
(S)-N2-(изоиндолин-5-ил)-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
(R)-N2-(3-амино-1H-индазол-6-ил)-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
(S)-N2-(3-амино-1H-индазол-6-ил)-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
4-((2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)бензамид;
цис-4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
(S)-N2-(1H-бензо[d][1,2,3]триазол-6-ил)-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
(R)-N2-(1H-бензо[d][1,2,3]триазол-6-ил)-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
N-метил-4-(5-(тетрагидро-2H-пиран-4-иламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
5-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)бензо[d]изоксазол-3-амин;
(R)-5-(3-амино-2-метилпропил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
(S)-5-(3-амино-2-метилпропил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
(R)-2-метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пропанамид;
(S)-2-метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пропанамид;
(R)-N2-(4-фторфенил)-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
(R)-N2-(1-метил-1H-индазол-6-ил)-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
(S)-N2-(1H-индазол-6-ил)-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
(S)-N2-(4-фторфенил)-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
(S)-N2-(1-метил-1H-индазол-6-ил)-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
(R)-N2-(1H-индазол-6-ил)-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
(R)-N5-(пиперидин-3-ил)-N2-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
(S)-N5-(пиперидин-3-ил)-N2-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
транс-4-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
N5-метил-N2,N5-дифенил-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
5-(5-метилизоксазол-3-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
(R)-N2-фенил-N5-(пирролидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
(S)-N2-фенил-N5-(пирролидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
(R)-4-(5-(пиперидин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
N5,N5-диметил-N2-фенил-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
N-фенил-5-(пиперидин-3-илметил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
(R)-2-метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пропан-1-ол;
(S)-2-метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пропан-1-ол;
5-(2-(метиламино)-1H-бензо[d]имидазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N-фенил-5-(пиперидин-4-илметил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
(S)-4-(5-(пиперидин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
N2-фенил-N5-(пиридин-2-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
5-(1H-индазол-6-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(2-((диметиламино)метил)-1H-бензо[d]имидазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(2-((метиламино)метил)-1H-бензо[d]имидазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N-фенил-5-(пиридин-2-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
7-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)изохинолин-1-амин;
5-(1-(2-аминоэтил)-1H-бензо[d]имидазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
(1-бензилпиперидин-4-ил)(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метанол;
транс-4-(5-(4-аминоциклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
цис-4-(5-(4-аминоциклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
2-(2-аминоэтил)-5-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)изоиндолин-1-он;
2-(2-аминоэтил)-6-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)изоиндолин-1-он;
5-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)изоиндолин-1-он;
(R)-N2-фенил-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
5-(3-аминопропил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
4-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)изоиндолин-1-он;
6-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)изоиндолин-1-он;
(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)(пиридин-3-ил)метанол;
(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)(пиперидин-4-ил)метанол;
5-фенокси-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
(S)-2-(фениламино)-N-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-5-карбоксамид;
5-(4-аминобутил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-бензил-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
(S)-N2-фенил-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
цис-N5-(4-аминоциклогексил)-N2-фенил-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
фенил(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метанон;
5-(циклогексилокси)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(3-амино-1H-индазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N-фенил-5-(пиперидин-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N-фенил-5-(1,2,3,6-тетрагидропиридин-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(1H-бензо[d]имидазол-6-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(1-(2-аминоэтил)-1H-бензо[d]имидазол-6-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
4-(5-(пиперидин-4-иламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
4-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пиридин-2-ол;
транс-N5-(4-аминоциклогексил)-N2-фенил-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
цис-4-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанкарбоксамид;
N-фенил-5-(2-(пиперазин-1-ил)пиридин-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(2-метоксипиридин-4-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(1H-индазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N2-фенил-N5-(пиперидин-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
N-фенил-5-(пиридин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-циклогексил-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)изобутирамид;
N-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)ацетамид;
N-фенил-5-(пиридин-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N2, N5-дифенил-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
N5-изопропил-N2-фенил-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
N2-(3-метилбензо[d]изоксазол-6-ил)-N5-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
1-метил-5-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-1H-бензо[d]имидазол-2(3H)-он;
4-((2-(3-(метоксиметил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-он;
N2-(3-метил-[1,2,4]триазоло[4,3-a]пиридин-7-ил)-N5-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
N-(5-метил-6-морфолинопиридин-3-ил)-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
6-(5-(дифтор(тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он;
3-метил-N-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-ил)бензо[d]изоксазол-6-амин;
3-метил-N-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-ил)-[1,2,4]триазоло[4,3-a]пиридин-7-амин;
N2-(3-метил-1H-пиразоло[3,4-b]пиридин-5-ил)-N5-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
5-((тетрагидро-2H-пиран-4-ил)метил)-N-(3-(трифторметил)-1H-индазол-6-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
цис-4-(2-(3-метил-1H-пиразоло[3,4-b]пиридин-5-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
N5-метил-N2-(1-метил-1H-индазол-5-ил)-N5-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
цис-4-(2-(3-метилбензо[d]изоксазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
3-метил-N-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-ил)-1H-пиразоло[3,4-b]пиридин-5-амин;
цис-трет-бутил 6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметил-2-оксоиндолин-1-карбоксилат;
3,3,4-триметил-6-(5-((3-оксопиперазин-1-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
N2-(5-метил-6-морфолинопиридин-3-ил)-N5-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
N-(3,4-диметил-1H-индазол-6-ил)-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
6-(5-(изопропиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он;
N-(1-метил-1H-индазол-5-ил)-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N2-(1-метил-1H-индазол-5-ил)-N5-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
N-(3-(метоксиметил)-1H-индазол-6-ил)-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
цис-4-(2-(1H-пиразоло[4,3-b]пиридин-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-1,6-диметилиндолин-2-он;
(S)-2-метил-3-(2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пропан-1-ол;
цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-1,4-диметилиндолин-2-он;
N-(4-(1H-1,2,4-триазол-3-ил)фенил)-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
3,3-диметил-6-(5-((тетрагидрофуран-3-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
6-(5-(2-метоксипиридин-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он;
4-(5-(циклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
3,3-диметил-6-(5-((тетрагидрофуран-3-ил)метил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
5-(дифтор(тетрагидро-2H-пиран-4-ил)метил)-N-(3-метил-1H-индазол-6-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-((l,4-диоксан-2-ил)дифторметил)-N-(3-метил-1H-индазол-6-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
3,3-диметил-6-(5-метил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он;
N2-(4-(1H-1,2,4-триазол-3-ил)фенил)-N5-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2,5-диамин;
6-(5-(диметиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он;
цис-4-(2-(4-(1H-1,2,4-триазол-3-ил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
цис-4-(2-(3-метил-[1,2,4]триазоло[4,3-a]пиридин-7-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)циклогексанол;
1-метил-5-(5-(тетрагидро-2H-пиран-4-иламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-1H-бензо[d]имидазол-2(3H)-он;
цис-5-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-1-метил-1H-бензо[d]имидазол-2(3H)-он или
3,3-диметил-6-(5-морфолино-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он.
Кроме того, представлены следующие гетероарильные соединения:
N-(2-((диметиламино)метил)-1H-бензо[d]имидазол-6-ил)-5-(3-фторфенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(3-фторфенил)-N-(1H-индазол-5-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
(6-(5-(3-фторфенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-1H-бензо[d]имидазол-2-ил)метанол;
5-(3-фторфенил)-N-(1-метил-1H-бензо[d]имидазол-6-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
3'-хлор-5'-(2-(4-(метилкарбамоил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)бифенил-2-карбоксамид;
4-(5-(3-(3-аминопропил)-5-хлорфенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
4-(5-(3-(1H-имидазол-5-ил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
4-(5-(3-(3-аминопропил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
4-(5-(4-(1H-имидазол-4-ил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
3-(2-(2-метил-1H-бензо[d]имидазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)фенол;
4-(5-(3-(2-аминоэтил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
4-(5-(3-фторфенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
4-(5-(3-хлорфенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
3-(2-(бензо[d]изоксазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)фенол;
4-(5-(3-гидроксифенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3-метокси-N-метилбензамид;
3-(2-(4-(1H-имидазол-2-ил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)фенол;
N6-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-ил)хинолин-2,6-диамин;
4-(5-(3-карбамоилфенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
3-(2-(1-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)фенол;
4-(5-(3-метоксифенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
4-(5-(2-фторфенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
4-(5-(2-хлорфенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
N6-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-ил)-N3-(пиперидин-4-ил)-1H-индазол-3,6-диамин;
3-(2-(4-(аминометил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)фенол;
4-(5-(3-гидроксифенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензойная кислота;
6-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)хинолин-2-ол;
3-(2-(1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)фенол;
3-(2-(1-метил-1H-бензо[d][1,2,3]триазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)фенол;
4-(2-(4-(метилкарбамоил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)бензойная кислота;
3-(2-(4-(метилкарбамоил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)бензойная кислота;
N-(2-((диметиламино)метил)-1H-бензо[d]имидазол-6-ил)-5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
3-(2-(4-морфолинофениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)фенол;
4-(5-(3-(аминометил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
4-(5-(3-гидроксифенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-(1-метилпиперидин-4-ил)бензамид;
1-метил-N6-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-ил)-1H-индазол-3,6-диамин;
4-(5-(3-гидроксифенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид;
N-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-ил)-2,3-дигидробензо[d]изотиазол-6-амин дион;
N-(5-метоксипиридин-3-ил)-5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N2-(2-аминоэтил)-N4-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-ил)пиридин-2,4-диамин;
N4-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-ил)пиридин-2,4-диамин;
N-(6-морфолинопиридин-3-ил)-5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N5-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-ил)бензо[d]изоксазол-3,5-диамин;
N-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-ил)бензо[d]изоксазол-5-амин;
N6-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-ил)бензо[d]изоксазол-3,6-диамин;
2-(2-аминоэтил)-5-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)изоиндолин-1-он;
N-(2-метил-1H-бензо[d]имидазол-5-ил)-5-фенил-[1,2,4]триазоло [1,5-a]пиридин-2-амин;
N-(1-метил-1H-бензо[d]имидазол-6-ил)-5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-ил)бензо[d]изоксазол-6-амин;
N-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-ил)-1H-бензо[d][1,2,3]триазол-6-амин;
1-(4-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)фенил)пирролидин-2-он;
4-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)пиколинамид;
4-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)пиколинонитрил;
N-(изоиндолин-5-ил)-5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N-(1-метил-1H-индазол-6-ил)-5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N-(1-метил-1H-бензо[d]имидазол-5-ил)-5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N-(4-(1H-1,2,4-триазол-5-ил)фенил)-5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N6-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-ил)-1H-индазол-3,6-диамин;
5-фенил-N-(пиридин-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-ил)хинолин-6-амин;
1-(5-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-1-ил)этанон;
N-(1H-индазол-5-ил)-5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(3-(1H-1,2,4-триазол-5-ил)фенил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
4-(5-(3-цианофенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
4-(5-(3-гидроксифенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
2-фтор-5-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
3-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензонитрил;
3-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
N-(1H-индазол-6-ил)-5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)изоиндолин-1-он;
5-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)пиридин-2-ол;
N-(6-метоксипиридин-3-ил)-5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)пиколинамид;
2-фтор-4-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
5-фенил-N-(пиримидин-5-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-фенил-N-(пиридин-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
4-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)бензонитрил;
4-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-(пиперидин-4-ил)бензамид;
N-(3-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)фенил)ацетамид;
N-(4-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)фенил)ацетамид;
5-(2-фторфенил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(3-фторфенил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(4-аминофенил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
3-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)бензонитрил;
5-(3-(аминометил)фенил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
4-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)бензамид;
3-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)бензамид;
5-(3-аминофенил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
4-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид;
5-(4-фторфенил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
4-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)фенол;
2-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)фенол;
3-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)фенол;
N-(4-морфолинофенил)-5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
N1,N1-диметил-N4-(5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-ил)бензол-1,4-диамин;
N-(3,4-диметоксифенил)-5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(фуран-3-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин;
5-(3-хлорфенил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин или
N,5-дифенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин; и их фармацевтически приемлемые соли, таутомеры, стереоизомеры, сольваты или пролекарства.
4.3 Способы получения Гетероарильных Соединений
Специалисты в данной области смогут получить гетероарильные соединения с использованием традиционных способов органического синтеза и коммерчески доступных веществ. В качестве примера, а не для ограничения, гетероарильные соединения можно получить, как показано на схемах 1-12, представленных ниже, а также в примерах, описанных в Разделе 5.1. Следует отметить, что специалист в данной области сможет модифицировать процедуры, описанные в иллюстративных схемах и примерах, с выходом на желаемый продукт.
Схема 1
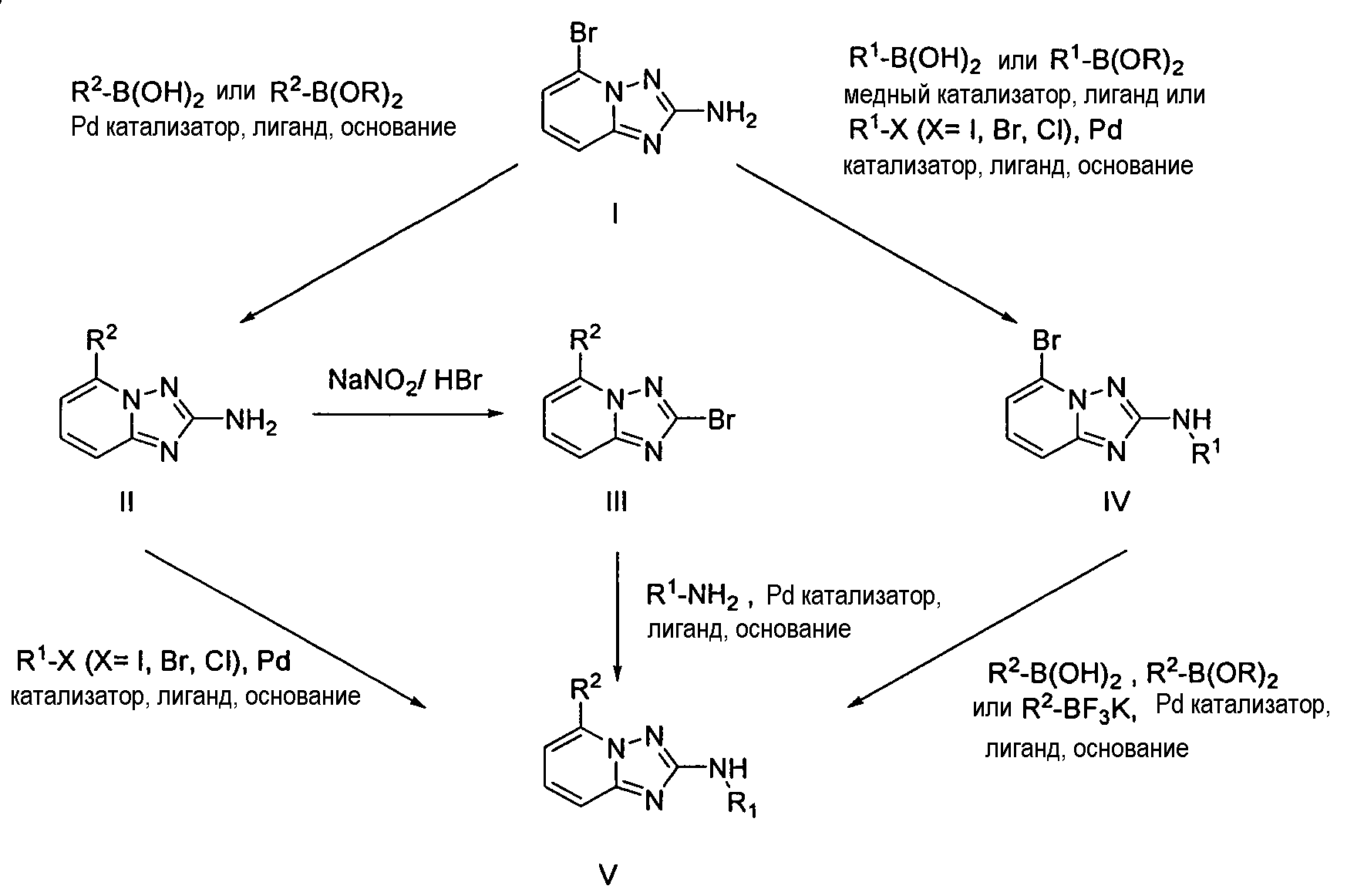
Гетероарильные Соединения можно синтезировать, исходя из соединения I, путем обработки подходящей бороновой кислотой или боронатным сложным эфиром в присутствии палладиевого катализатора (такого как ацетат палладия), лиганда (такого как трифенилфосфин или трициклогексилфосфин) и основания (такого как фосфат калия или фторид цезия) для введения R2 заместителя (см. соединение II). Полученное соединение затем можно подвергнуть взаимодействию с подходящим галогенсодержащим соединением в присутствии палладиевого катализатора (такого как трис(дибензилиденацетон)дипалладий (0)), лиганда (такого как 4,5-бис(дифенилфосфино)-9,9-диметилксантен или (R)-(+)-2,2'-бис(дифенилфосфино)1,1'-бинафтил) и основания (такого как карбонат цезия, трет-бутоксид натрия или трет-бутоксид калия) для введения R1 заместителя.
Альтернативно, соединение II можно подвергнуть взаимодействию с нитритом натрия в бромистоводородной кислоте с получением соединения III, которое затем можно подвергнуть взаимодействию с подходящим амином в присутствии палладиевого катализатора (такого как трис(дибензилиденацетон)дипалладий (0)), лиганда (такого как 4,5-бис(дифенилфосфино)-9,9-диметилксантен или (R)-(+)-2,2'-бис(дифенилфосфино) и основания (такого как карбонат цезия, трет-бутоксид натрия или трет-бутоксид калия).
Альтернативно, R1 заместитель можно ввести сначала через сочетание соединения I с подходящей бороновой кислотой или боронатным сложным эфиром в присутствии медного катализатора (такого как ацетат меди(II)) и лиганда (такого как бипиридин), или путем взаимодействия с подходящим галогенсодержащим соединением в присутствии палладиевого катализатора (такого как трис(дибензилиденацетон)дипалладий (0)), лиганда (такого как 4,5-бис(дифенилфосфино)-9,9-диметилксантен или (R)-(+)-2,2'-бис(дифенилфосфино) и основания (такого как карбонат цезия, трет-бутоксид натрия или трет-бутоксид калия). Соединение IV затем можно подвергнуть взаимодействию с подходящей бороновой кислотой, боронатным сложным эфиром или трифторборатом калия в присутствии палладиевого катализатора (такого как, так как 1-1'-бис(дифенилфосфино)ферроценпалладийдихлорид или тетракис(трифенилфосфин)палладий(0) или диацетат палладия) и основания (такого как карбонат натрия или калия, фосфат калия или ацетат калия) для введения R2 заместителя.
Схема 2
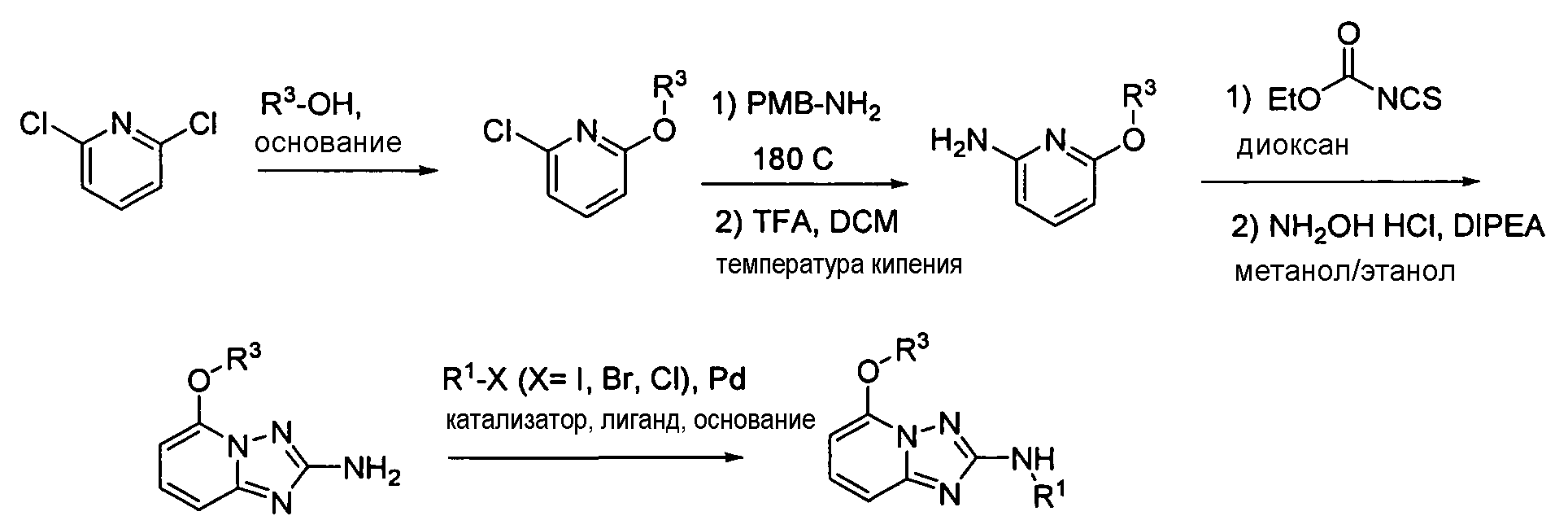
Соединения, где R2 = OR3, можно получить, как показано на Схеме 2. 2,6-Дихлорпиридин подвергают взаимодействию с подходяще замещенным спиртом в присутствии основания (такого как гидроксид натрия или металлический натрий), и второй атом хлора может быть преобразован в аминогруппу посредством обработки пара-метоксибензиламином с последующим удалением защиты с использованием кислоты, такой как трифторуксусная кислота. Полученное соединение можно обработать последовательно этоксикарбонилизотиоцианатом в диоксане и гидроксиламином с получением циклизованного соединения, которое затем можно подвергнуть взаимодействию с подходящим галогенсодержащим соединением в присутствии палладиевого катализатора (такого как трис(дибензилиденацетон) дипалладий(0)), лиганда (такого как 4,5-бис(дифенилфосфино)-9,9-диметилксантен или (R)-(+)-2,2'-бис(дифенилфосфино)1,1'-бинафтил) и основания (такого как карбонат цезия, трет-бутоксид натрия или трет-бутоксид калия) для введения R1 заместителя.
Схема 3

Соединения, где R2 = NR3R4, можно получить, как показано на схеме 3. Соединение IV можно подвергнуть взаимодействию с вторичным амином с использованием теплового режима, микроволнового облучения или путем взаимодействия палладиевым катализатором (таким как трис(дибензилиденацетон)дипалладий(0)), лигандом (таким как 4,5-бис(дифенилфосфино)-9,9-диметилксантен или (R)-(+)-2,2'-бис(дифенилфосфино)1,1'-бинафтил)) и основанием (таким как карбонат цезия, трет-бутоксид натрия или трет-бутоксид калия).
Схема 4
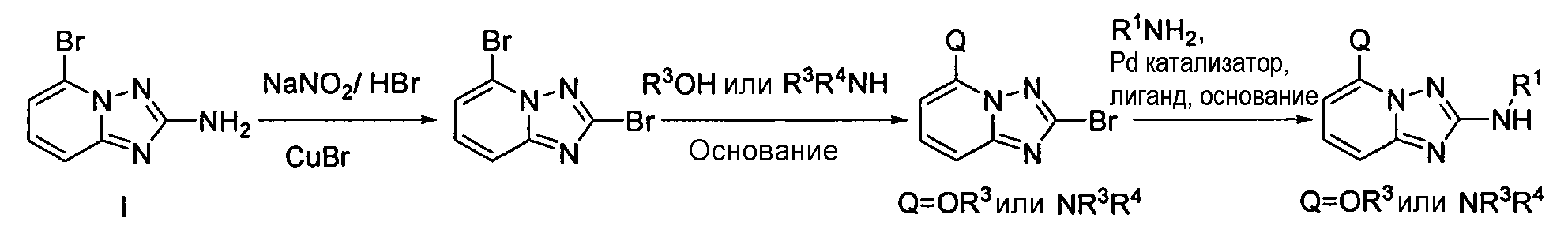
Соединения, где R2 представляет собой -OR3 или -NR3R4 (где R4 может представлять собой H), можно получить, как показано на Схеме 4. Соединение I можно подвергнуть взаимодействию с нитритом натрия и бромистоводородной кислотой в присутствии бромид меди (I). Полученное дибром-соединение затем можно обработать подходящим спиртом или амином в присутствии основания, такого как гидрид натрия или N,N-диизопропилэтиламин. R1 заместитель затем может быть введен путем взаимодействия с подходящим амином в присутствии палладиевого катализатора (такого как трис(дибензилиденацетон)дипалладий(0)), лиганда (такого как 4,5-бис(дифенилфосфино)-9,9-диметилксантен или (R)-(+)-2,2'-бис(дифенилфосфино)1,1'-бинафтил) и основания (такого как карбонат цезия, трет-бутоксид натрия или трет-бутоксид калия).
Схема 5
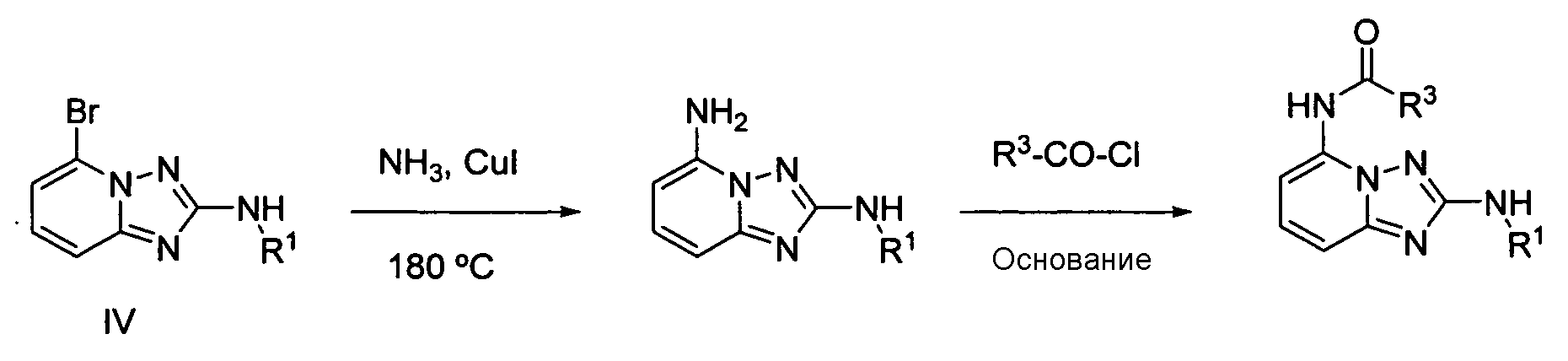
Соединения, где R2 = NHC(O)R3, можно получить, как показано на Схеме 5. Соединение IV можно подвергнуть взаимодействию с аммиаком и иодидом меди для введения аминогруппы, которую затем можно подвергнуть взаимодействию с подходящим ацетилхлоридом в присутствии основания, такого как триэтиламин.
Схема 6
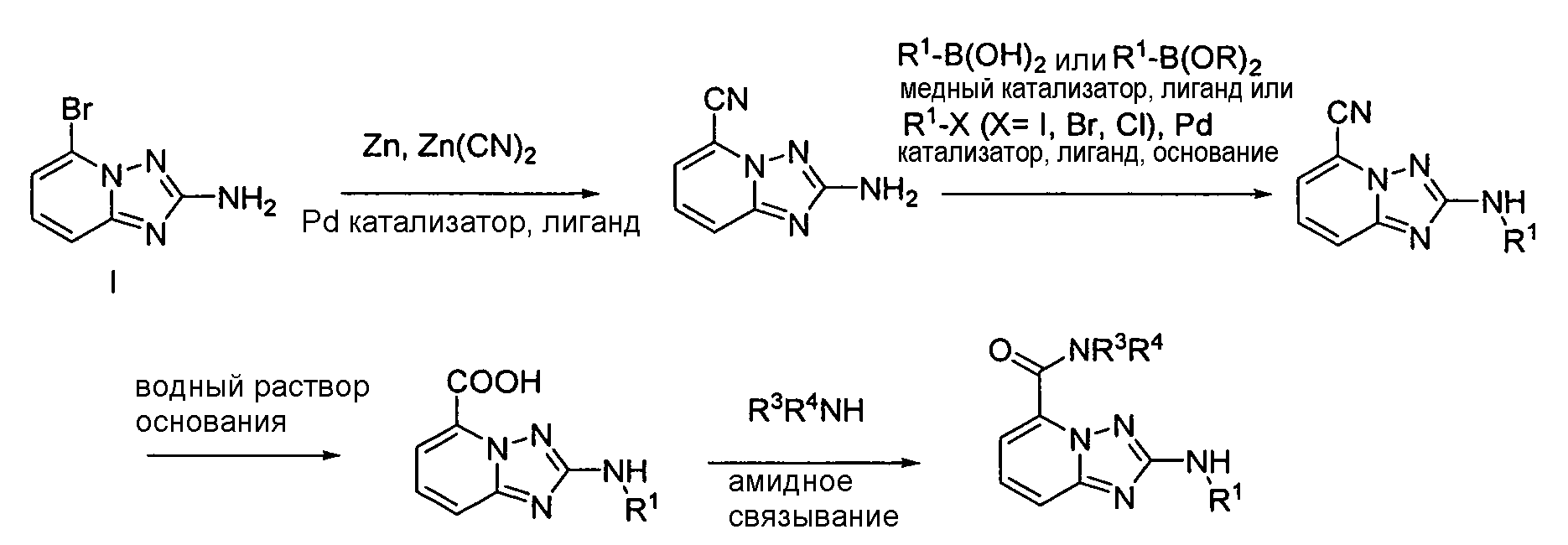
Соединения, где R2 = C(O)NR3R4, можно получить, как показано на Схеме 6. Соединение I можно подвергнуть взаимодействию с цинковой пылью и цианидом цинка в присутствии палладиевого катализатора (такого как трис(дибензилиденацетон)дипалладий(0)) и лиганда (такого как 1,1'-бис(дифенилфосфино)ферроцен). Полученное соединение затем можно обработать подходящей бороновой кислотой или боронатным сложным эфиром в присутствии медного катализатора (такого как ацетат меди(II)) и лиганда (такого как бипиридин), или путем взаимодействия с подходящим галогенсодержащим соединением в присутствии палладиевого катализатора (такого как трис(дибензилиденацетон)дипалладий(0)), лиганда (такого как 4,5-бис(дифенилфосфино)-9,9-диметилксантен или (R)-(+)-2,2'-бис(дифенилфосфино)1,1'-бинафтил)) и основания (такого как карбонат цезия, трет-бутоксид натрия или трет-бутоксид калия). Цианогруппу затем гидролизуют при помощи основания (такого как гидроксид натрия) и полученную кислоту подвергают взаимодействию с подходящим амином в стандартных условиях амидного связывания.
Схема 7
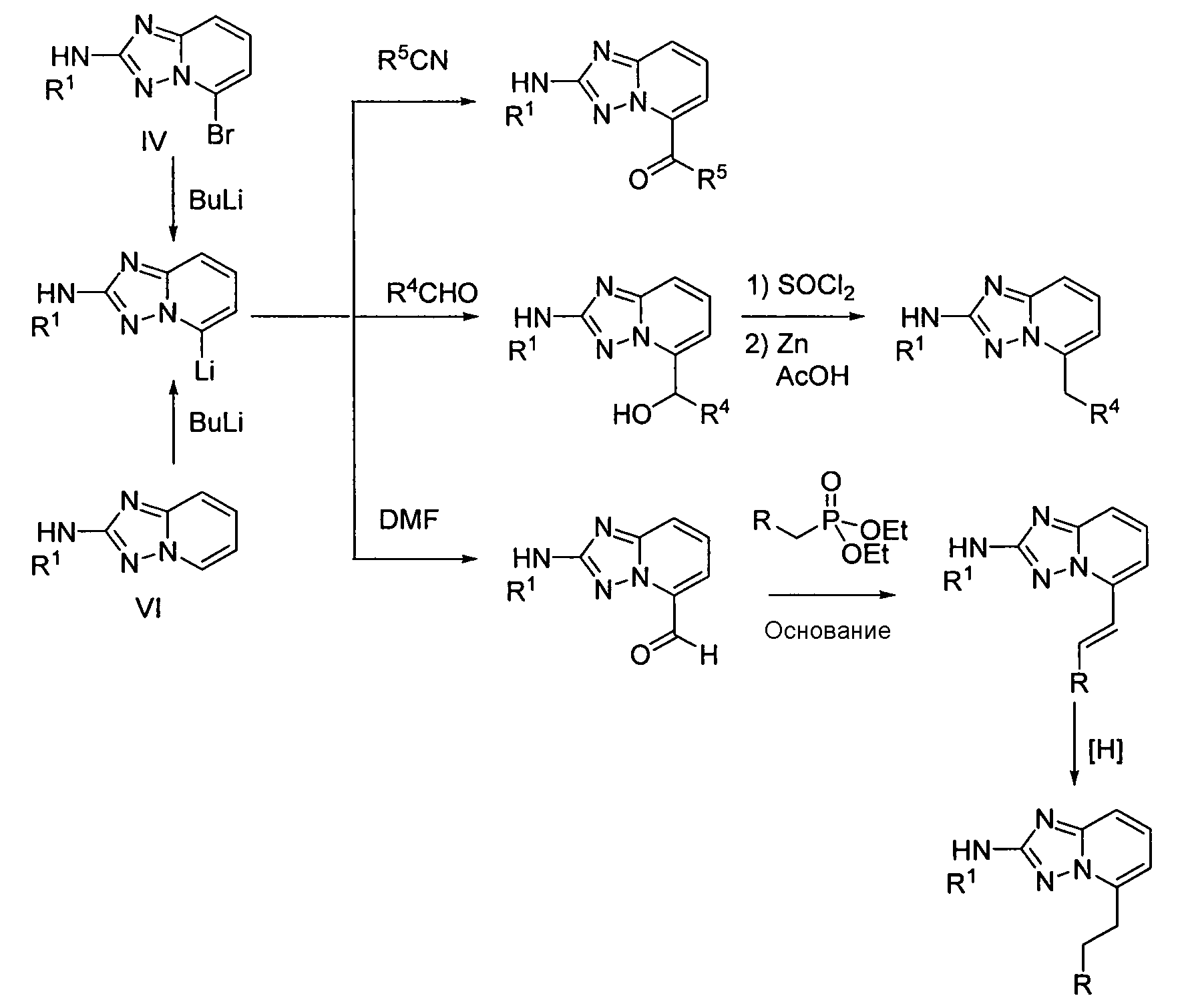
Соединения, где R2 = C(O)R5, CH(OH)R4 или замещенный или незамещенный алкил, можно получить, как показано на Схемах 7, 8, 9 и/или 11. Соединение IV можно подвергнуть взаимодействию с бутиллитием для образования литиированного промежуточного соединения, которое затем можно подвергнуть взаимодействию с подходящим нитрилом или альдегидом. Когда его подвергают взаимодействию с альдегидом, полученный спирт можно восстановить при помощи тионилхлорида и цинковой пыли. Альтернативно, литийсодержащие вещества можно подвергнуть взаимодействию с N,N-диметилформамидом для образования альдегида, который затем можно подвергнуть взаимодействию с подходящим илидом (полученным из фосфоната и основания, такого как водный раствор гидроксида натрия). Двойную связь затем можно восстановить через каталитическое гидрирование с использованием катализатора, такого как палладий на углероде, в атмосфере водорода.
Схема 8
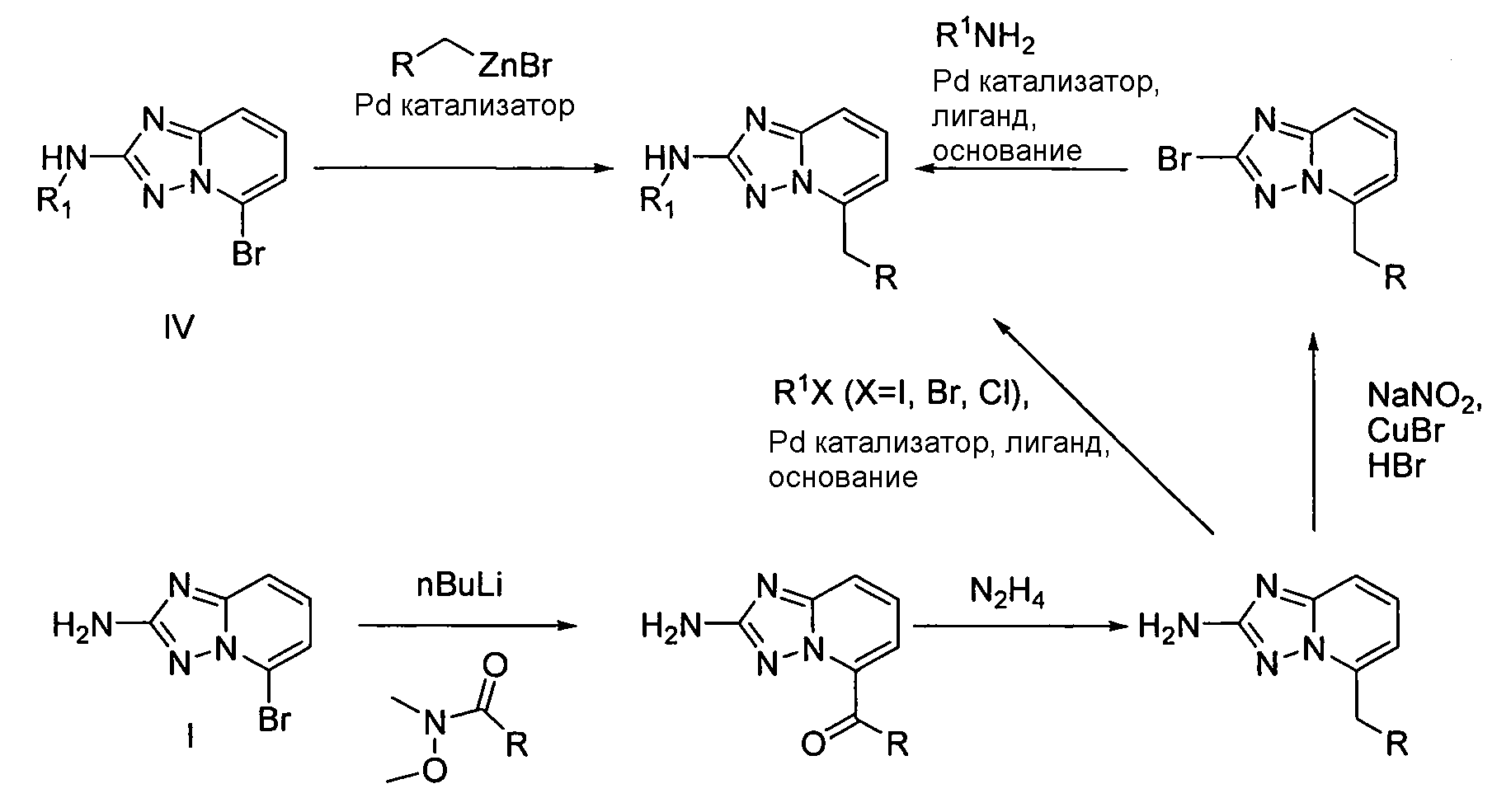
Соединения, где R2 = -CH2-R, можно получить, как показано на Схеме 8. Соединение IV можно подвергнуть взаимодействию с подходящим бромидом цинка в присутствии палладиевого катализатора (такого как тетракис(трифенилфосфин)палладий(0)). Альтернативно, соединение I можно подвергнуть взаимодействию с н-бутиллитием и подвергнуть конденсации с подходящим амидом Вайнреба. Полученный кетон затем можно восстановить при помощи восстановителя, такого как гидразин. R1 заместитель можно ввести путем сочетания с подходящим галогенсодержащим соединением в присутствии палладиевого катализатора (такого как трис(дибензилиденацетон)дипалладий(0)), лиганда (такого как 4,5-бис(дифенилфосфино)-9,9-диметилксантен или (R)-(+)-2,2'-бис(дифенилфосфино)1,1'-бинафтил) и основания (такого как карбонат цезия, трет-бутоксид натрия или трет-бутоксид калия) или путем преобразования амина в бромсодержащее соединение посредством обработки нитритом натрия и бромидом меди(I) в бромистоводородной кислоте и затем сочетания с подходящим амином в присутствии палладиевого катализатора (такого как трис(дибензилиденацетон)дипалладий(0)), лиганда (такого как 4,5-бис(дифенилфосфино)-9,9-диметилксантен или (R)-(+)-2,2'-бис(дифенилфосфино)1,1'-бинафтил) и основания (такого как карбонат цезия, трет-бутоксид натрия или трет-бутоксид калия).
Схема 9
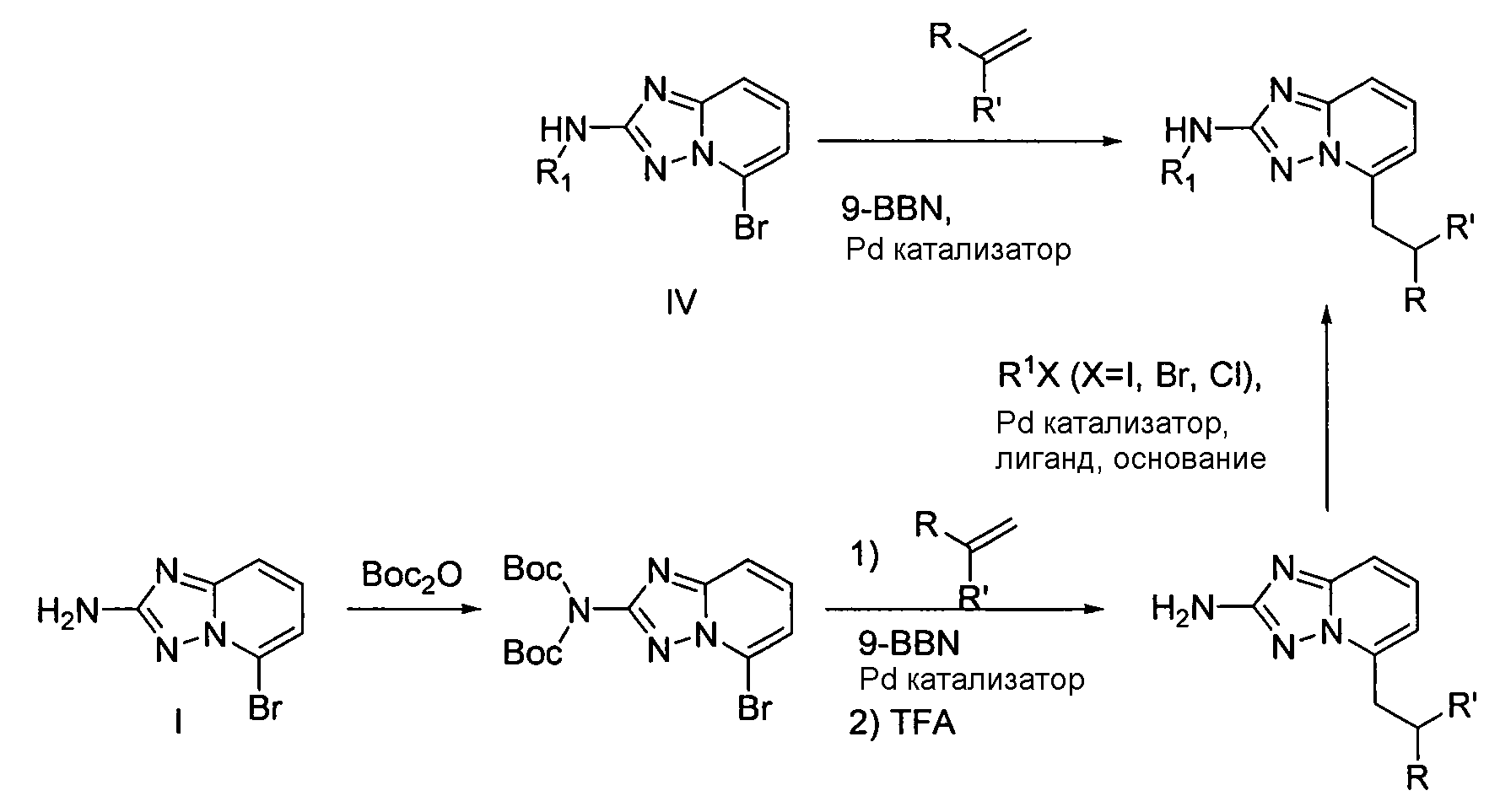
Соединения, где R2=-(CH2)-CHRR' можно получить, как показано на Схеме 9. Соединение IV можно подвергнуть взаимодействию с подходящим алкеном в присутствии борана (такого как (1S,5S)-9-борабицикло[3.3.1]нонан), палладиевого катализатора (такого как [1,1'-бис(дифенилфосфино) ферроцен]дихлорпалладий(II), комплекс с дихлорметаном) и основания, такого как карбонат калия. Альтернативно, соединение I можно подвергнуть взаимодействию с ди-трет-бутилдикарбонатом и затем обработать подходящим алкеном в присутствии борана (такого как (1S,5S)-9-борабицикло[3.3.1]нонан), палладиевого катализатора (такого как [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II), комплекс с дихлорметаном) и основания, такого как карбонат калия. R1 заместитель затем можно ввести путем взаимодействия с подходящим галогенсодержащим соединением в присутствии палладиевого катализатора (такого как трис(дибензилиденацетон)дипалладий(0)), лиганда (такого как 4,5-бис(дифенилфосфино)-9,9-диметилксантен или (R)-(+)-2,2'-бис(дифенилфосфино)1,1'-бинафтил) и основания (такого как карбонат цезия, трет-бутоксид натрия или трет-бутоксид калия).
Схема 10
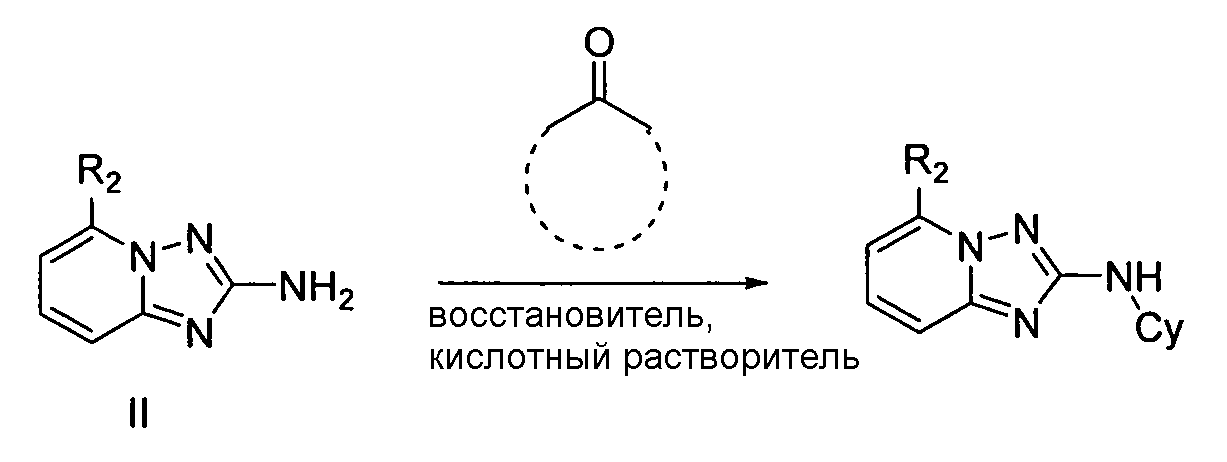
Соединения, где R1 представляет собой замещенный или незамещенный циклоалкил, можно получить, как показано на Схеме 10. Соединение II можно подвергнуть взаимодействию с подходяще замещенным циклическим кетоном в присутствии восстановителя, такого как триацетоксиборогидрид натрия, в присутствии кислоты (такой как уксусная кислота).
Схема 11
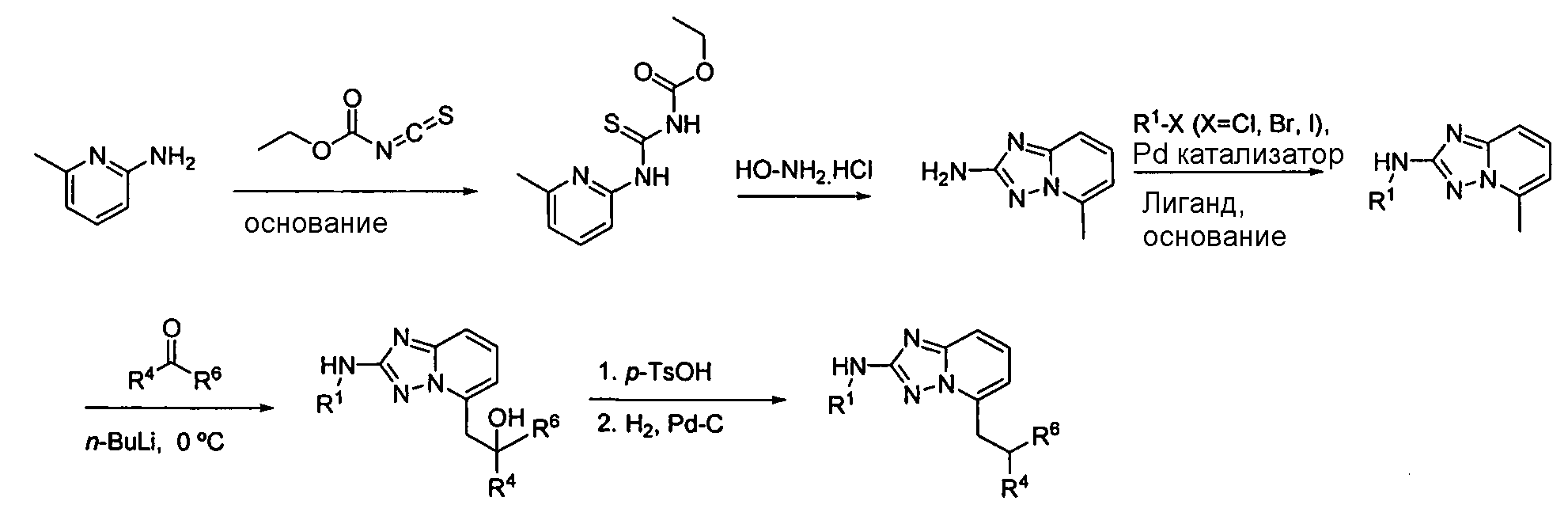
Соединения, где R2 представляет собой -(CH2)CR6(OR3)R4 или алкил, можно получить, как показано на Схеме 11. 6-Метилпиридин-2-амин можно подвергнуть последовательному взаимодействию с этоксикарбонилизотиоцианатом и гидроксиламином в присутствии N,N-диизопропилэтиламина. Циклизованное соединение затем можно подвергнуть взаимодействию с подходящим галогенсодержащим соединением в присутствии палладиевого катализатора (такого как трис(дибензилиденацетон)дипалладий(0)), лиганда (такого как 4,5-бис(дифенилфосфино)-9,9-диметилксантен или (R)-(+)-2,2'-бис(дифенилфосфино)1,1'-бинафтил) и основания (такого как карбонат цезия, трет-бутоксид натрия или трет-бутоксид калия). Затем может быть образовано литиированное промежуточное соединение путем обработки бутиллитием, и его можно подвергнуть взаимодействию с подходящим альдегидом или кетоном. Когда используют кетон, полученный третичный спирт можно обработать кислотой (такой как п-толуолсульфоновая кислота) с получением соответствующего алкена, который затем можно восстановить до соответствующего алкана через каталитическое гидрирование.
Схема 12
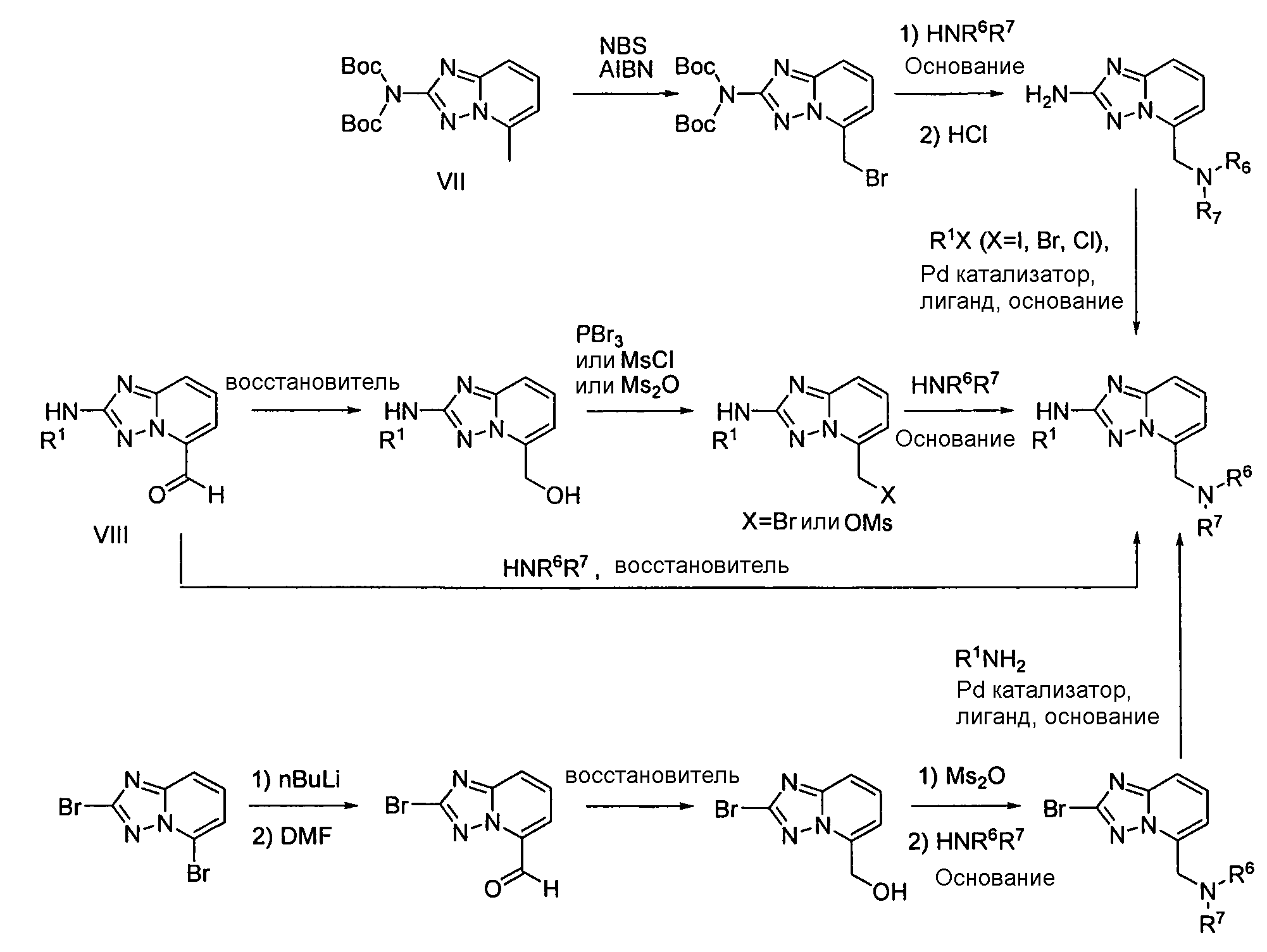
Соединения, где R2 представляет собой -(CH2)-NR6R7, можно синтезировать, как показано на Схеме 12. Соединение VII можно подвергнуть взаимодействию с N-бромсукцинимидом и 2,2'-азобис(2-метилпропионитрил)ом, с последующим взаимодействием с подходящим амином в присутствии основания, такого как карбонат калия. R1 заместитель можно ввести путем сочетания с подходящим галогенсодержащим соединением в присутствии палладиевого катализатора (такого как трис(дибензилиденацетон)дипалладий(0)), лиганда (такого как 4,5-бис(дифенилфосфино)-9,9-диметилксантен или (R)-(+)-2,2'- бис(дифенилфосфино)1,1'-бинафтил) и основания (такого как карбонат цезия, трет-бутоксид натрия или трет-бутоксид калия). Альтернативно, соединение VIII можно восстановить до спирта при помощи восстановителя, такого как борогидрид натрия или триацетоксиборогидрид натрия, и затем преобразовать в удаляемую группу, такую как бромид или мезилат, посредством обработки трибромидом фосфора, метансульфонилхлоридом или метансульфоновым ангидридом. Полученное соединение можно подвергнуть взаимодействию с подходящим амином в присутствии основания, такого как карбонат калия. Альтернативно, эти соединения можно получить в одну стадию, исходя из соединения VIII, путем взаимодействия с подходящим амином в присутствии восстановителя, такого как триацетоксиборогидрид натрия. Альтернативно, 2,5-дибром-[1,2,4]триазоло[1,5-α]пиридин можно обработать н-бутиллитием с последующей обработкой N,N-диметилформамидом. Полученный альдегид затем можно подвергнуть взаимодействию с восстановителем, таким как борогидрид натрия, с получением соответствующего спирта, который, в свою очередь, подвергают обработке метансульфоновым ангидридом и подходящим амином. R1 группу можно ввести путем взаимодействия с подходящим амино-соединением в присутствии палладиевого катализатора (такого как трис(дибензилиденацетон)дипалладий(0)), лиганда (такого как 4,5-бис(дифенилфосфино)-9,9-диметилксантен или (R)-(+)-2,2'-бис(дифенилфосфино)1,1'-бинафтил) и основания (такого как карбонат цезия, трет-бутоксид натрия или трет-бутоксид калия).
Фармацевтически приемлемые соли Гетероарильных Соединений могут быть образованы с использованием традиционных и известных методов, например, путем взаимодействия гетероарильного соединения с подходящей кислотой, как раскрыто выше. Такие соли типично получают с высокими выходами при умеренных температурах, и их часто получают просто путем выделения соединения из подходящей кислотной промывки на конечной стадии синтеза. Солеобразующую кислоту можно растворить в подходящем органическом растворителе или водно-органическом растворителе, таком как алканол, кетон или сложный эфир. С другой стороны, если желательно получить гетероарильное соединение в форме свободного основания, его можно выделить из щелочной промывки на конечной стадии в соответствии с известными методами. Например, типичный метод получения гидрохлоридной соли включает растворение свободного основания в подходящем растворителе и тщательную сушку раствора, например, над молекулярными ситами, с последующим барботированием газообразным хлористым водородом.
4.4 Способы применения
В одном аспекте в настоящей заявке представлены способы лечения или профилактики воспалительного состояния иммунологического состояния, аутоиммунного состояния, аллергического состояния, ревматического состояния, тромботического состояния, рака, инфекции, нейродегенеративного заболевания, нейровоспалительного заболевания, сердечно-сосудистого заболевания или метаболического состояния, включающие введение субъекту, нуждающемуся в этом, эффективного количества гетероарильного соединения или его фармацевтически приемлемой соли, таутомера, стереоизомера, сольвата или пролекарства. В некоторых вариантах воплощения, способы дополнительно включают введение дополнительных терапевтических ингредиентов, описанных в настоящей заявке.
В другом аспекте, в настоящей заявке представлены способы ингибирования киназы в клетке, экспрессирующей указанную киназу, включающие контактирование указанной клетки с эффективным количеством гетероарильного соединения или его фармацевтически приемлемой соли, таутомера, стереоизомера, сольвата или пролекарства. В одном варианте воплощения киназа представляет собой Syk, FLT3, JAK1 или JAK2, или их мутанты или изоформы, или сочетания двух или более из вышеуказанных. Например, гетероарильное соединение представляет собой соединение из Таблицы 1.
Гетероарильные Соединения, описанные в настоящей заявке, могут применяться в качестве фармацевтических средств для лечения или профилактики заболеваний у субъектов, таких как животные или человек. Кроме того, гетероарильные соединения, описанные в настоящей заявке, являются активными против киназ (например, протеинкиназ), включая киназы, вовлеченные в воспалительные состояния, иммунологические состояния, аутоиммунные состояния, аллергические состояния, ревматические состояния, тромботические состояния, рак, инфекции, нейродегенеративные заболевания, нейровоспалительные заболевания, сердечно-сосудистые заболевания и метаболические состояния. Без какого-либо теоретического ограничения, считают, что гетероарильные соединения являются эффективными для лечения и профилактики воспалительных состояний, иммунологических состояний, аутоиммунных состояний, аллергических состояний, ревматических состояний, тромботических состояний, рака, инфекций, нейродегенеративных заболеваний, нейровоспалительных заболеваний, сердечно-сосудистых заболеваний и метаболических состояний, благодаря их способности модулировать (например, ингибировать) киназы, которые вовлечены в этиологию этих состояний. Соответственно, в настоящей заявке представлены многие применения Гетероарильных Соединений, включая лечение или профилактику заболеваний, описанных ниже. Способы, представленные в настоящей заявке, включают введение эффективного количества одного или нескольких Гетероарильных Соединений субъекту, нуждающемуся в этом. В некоторых вариантах воплощения гетероарильное соединение вводят в сочетании с другим активным агентом.
Реперезентативные иммунологические состояния, для лечения или профилактики которых гетероарильные соединения являются полезными, включают, но не ограничиваются этим, синдром Бехета, не-аллергические мастоцитозы (например, мастоцитоз и лечение анафилаксии), анкилозирующий спондилит, остеоартрит, ревматоидный артрит (RA), рассеянный склероз, волчанку, воспалительное заболевание кишечника, язвенный колит, болезнь Крона, злокачественную миастению, болезнь Грейва, отторжение трансплантата, гуморальное отторжение трансплантата, не-гуморальное отторжение трансплантата, клеточное отторжение трансплантата, иммунную тромбоцитопеническую пурпуру (ITP), идиопатическую тромбоцитопеническую пурпуру, диабет, иммунологический ответ на бактериальную, паразитическую, глистную инвазию или вирусную инфекцию, экзему, дерматит, болезнь «трансплантат против хозяина», болезнь Гудпастера, гемолитическое заболевание новорожденных, аутоиммунную гемолитическую анемию, анти-фосфолипидный синдром, ANCA-ассоциированный васкулит, Синдром Churg-Strauss, грануломатоз Вегенера, обыкновенную пузырчатку, сывороточную болезнь, криоглобулинемию смешанного типа, периферическую невропатию, связанную с IgM антителом, микроскопический полиангиит, тиреоидит Хашимото, синдром Шегрена, фиброзирующие состояния (такие как состояния, зависимые от врожденной или адаптивной иммунных систем или локальных мезенхимальных клеток) или первичный билиарный цирроз.
Реперезентативные аутоиммунные состояния, для лечения или профилактики которых гетероарильные соединения являются полезными, включают, но не ограничиваются этим, аутоиммунную гемолитическую анемию (AIHA), синдром Бехета, болезнь Крона, диабет типа I, болезнь Гудпастера, болезнь Грейва, тиреоидит Хашимото, идиопатическую тромбоцитопеническую пурпуру, волчанку, рассеянный склероз, амиотрофический боковой склероз, злокачественную миастению, обыкновенную пузырчатку, первичный билиарный цирроз, ревматоидный артрит, склеродерму, синдром Шегрена, язвенный колит или грануломатоз Вегенера.
Реперезентативные аллергические состояния, для лечения или профилактики которых гетероарильные соединения являются полезными, включают, но не ограничиваются этим, анафилаксии, сенную лихорадку, аллергический конъюнктивит, аллергический ринит, аллергическую астму, атопический дерматит, экзему, крапивницу, расстройства слизистой оболочки, расстройства тканей и некоторые желудочно-кишечные расстройства.
Реперезентативные ревматические состояния, для лечения или профилактики которых гетероарильные соединения являются полезными, включают, но не ограничиваются этим, ревматоидный артрит, подагру, анкилозирующий спондилит или остеоартрит.
Реперезентативные воспалительные состояния, для лечения или профилактики которых гетероарильные соединения являются полезными, включают, но не ограничиваются этим, не-ANCA (анти-нейтрофильное цитоплазматическое аутоантитело) васкулит (например, где Syk функция связана с адгезией, диапедезом и/или активацией нейтрофилов), псориаз, астму, аллергический ринит, аллергический конъюнктивит, хроническую крапивницу, крапивницу, анафилаксию, бронхит, хроническое обструктивное легочное заболевание, муковисцидоз, воспалительное заболевание кишечника, синдром раздраженной толстой кишки, подагру, болезнь Крона, слизистый колит, язвенный колит, аллергию на кишечные антигены (такую как глютеновая энтеропатия), диабет (например, диабет типа I и диабет типа II) и ожирение. В некоторых вариантах воплощения, воспалительное состояние представляет собой дерматологическое состояние, такое как, например, псориаз, крапивница, экзема, склеродерма или дерматит. В других вариантах воплощения, воспалительное состояние представляет собой легочное воспалительное состояние, такое как, например, астма, бронхит, хроническое обструктивное легочное заболевание (COPD) или острый респираторный дистресс-синдром взрослых (ARDS). В других вариантах воплощения, воспалительное состояние представляет собой желудочно-кишечное состояние, такое как, например, воспалительное заболевание кишечника, язвенный колит, болезнь Крона, идиопатическое воспалительное заболевание кишечника, синдром раздраженной толстой кишки или слизистый колит.
Реперезентативные инфекции, для лечения или профилактики которых гетероарильные соединения являются полезными, включают, но не ограничиваются этим, бактериальные, паразитические, прионовые, вирусные инфекции или глистное заражение.
Реперезентативные типы рака, для лечения или профилактики которых гетероарильные соединения являются полезными, включают, но не ограничиваются этим, рак головы, шеи, глаза, рта, горла, пищевода, бронхов, глотки, гортани, грудной клетки, кости, легкого, толстой кишки, прямой кишки, желудка, предстательной железы, мочевого пузыря, матки, шейки матки, молочной железы, яичников, мужских половых желез или других репродуктивных органов, кожи, щитовидной железы, крови, лимфатических узлов, почки, печени, поджелудочной железы, головного мозга, центральной нервной системы, солидные опухоли и опухоли кровяного происхождения.
Реперезентативные сердечно-сосудистые заболевания, для лечения или профилактики которых гетероарильные соединения являются полезными, включают, но не ограничиваются этим, рестеноз, атеросклероз и его последствия, такие как удар, инфаркт миокарда, ишемическое поражение сердца, легкого, кишечника, почки, печени, поджелудочной железы, селезенки или головного мозга.
Реперезентативные метаболические состояния, для лечения или профилактики которых гетероарильные соединения являются полезными, включают, но не ограничиваются этим, ожирение и диабет (например, диабет типа I и II). В конкретном варианте воплощения, в настоящей заявке представлены способы лечения или профилактики резистентности к инсулину. В некоторых вариантах воплощения, в настоящей заявке представлены способы лечения или профилактики резистентности к инсулину, которая приводит к диабету (например, диабету типа II). В другом варианте воплощения, в настоящей заявке представлены способы лечения или профилактики синдрома X или метаболического синдрома. В другом варианте воплощения, в настоящей заявке представлены способы лечения или профилактики диабета типа II, диабета типа I, медленно развивающегося диабета типа I, несахарного диабета (например, нейрогенного несахарного диабета, нефрогенного несахарного диабета, дипсогенного несахарного диабета или гестагенного несахарного диабета), сахарного диабета, гестационного сахарного диабета, синдрома поликистоза яичников, диабета, развивающегося во взрослом возрасте, юношеского диабета, инсулин-зависимого диабета, инсулин-независимого диабета, диабета, связанного с неправильным питанием, кетоз-склонного диабета, пред-диабетического состояния (например, нарушение метаболизма глюкозы), связанного с муковисцидозом диабета, гемохроматоз и кетоз-резистентного диабета.
Реперезентативные нейродегенеративные и нейровоспалительные заболевания, для лечения или профилактики которых гетероарильные соединения являются полезными, включают, но не ограничиваются этим, болезнь Гентингтона, болезнь Альцгеймера, вирусные (например, ВИЧ) или бактериально-ассоциированные энцефалит и поражение.
В другом варианте воплощения, в настоящей заявке представлены способы лечения или профилактики фиброзных заболеваний и расстройств. В конкретном варианте воплощения, в настоящей заявке представлены способы лечения или профилактики идиопатического фиброза легких, миелофиброза, фиброз печени, стеатофиброза и стеатогепатита.
В другом варианте воплощения, в настоящей заявке представлены способы лечения или профилактики заболеваний, связанных с тромботическими явлениями, таких как, но не ограничиваясь этим, атеросклероз, инфаркт миокарда и ишемический инсульт.
Также представлены способы, которые делают возможной регуляцию и, в частности, ингибирование развивающихся далее процессов, которые являются результатом активации сигнального каскада(каскадов) Fc рецептора. Такие развивающиеся далее процессы включают, но не ограничиваются этим, FcεRI-опосредованную и/или FcγRI-опосредованную дегрануляцию, продукцию цитокинов и/или продукцию и/или высвобождение липидных медиаторов, таких как лейкотриены и простагландины. Способ, в основном, включает контактирование клетки, экспрессирующей Fc рецептор, такой как типы клеток, обсуждаемые выше, с количеством гетероарильного соединения, описанного в настоящей заявке, эффективным для регулирования или ингибирования сигнального каскада Fc рецептора, и/или дальнейшего процесса, являющегося результатом активации этого сигнального каскада. Способ можно осуществить в in vitro контекстах или в in vivo контекстах в качестве терапевтического подхода к лечению или профилактике заболеваний, характеризующихся, вызванных или, связанных с сигнальным каскадом Fc рецептора, таких как заболевания, являющиеся результатом высвобождения грануло-специфических химических медиаторов при дегрануляции, высвобождения и/или синтеза цитокинов и/или высвобождения и/или синтеза липидных медиаторов, таких как лейкотриены и простагландины.
Еще в одном аспекте, также обеспечиваются способы лечения или профилактики заболеваний, характеризующихся, вызванных или связанных с высвобождением химических медиаторов как следствие активации сигнальных каскадов Fc рецептора, таких как FcεRI и/или FcγRI-сигнальных каскадов. Способы, как правило, включают введение субъекту количества гетероарильного соединения, эффективного для лечения или профилактики такого заболевания. Как обсуждалось выше, активация сигнального каскада FcεRI или FcγRI рецептора в некоторых иммунных клетках приводит к высвобождению и/или синтезу различных химических веществ, которые являются фармакологическими медиаторами широкого ряда заболеваний. Любые из этих заболеваний можно лечить или предотвратить в соответствии со способами, описанными в настоящей заявке.
Например, в тучных клетках и базофилах, активация FcεRI или FcγRI сигнального каскада приводит к непосредственному (т.е. в течение 1-3 мин после активации рецептора) высвобождению предварительно образованных медиаторов атопических и/или типа I аллергических реакций (например, гистамины, протеазы, такие как триптаза и т.д.) через процесс дегрануляции. Такие атопические или типа I аллергические реакции включают, но не ограничиваются этим, анафилактические реакции на присутствующие в окружающей среде и другие аллергены (например, пыльца, яды насекомых и/или животных, пища, лекарственные средства, контрастные красители и т.д.), анафилактоидные реакции, сенную лихорадку, аллергический конъюнктивит, аллергический ринит, аллергическую астму, атопический дерматит, экзему, крапивницу, расстройства слизистой оболочки, расстройства тканей и некоторые желудочно-кишечные расстройства. После непосредственного высвобождения предварительно образованных медиаторов через дегрануляцию следует высвобождение и/или синтез различных других химических медиаторов, включая, среди прочего, фактор активации тромбоцитов (PAF), простагландины и лейкотриены (например, LTC4) и de novo синтез и высвобождение цитокинов, таких как TNFα, IL-4, IL-5, IL-6, IL-13 и т.д. Первый из этих двух процессов происходит в течение 3-30 мин после активации рецептора; последний - примерно в течение 30 минут - 7 часов после активации рецептора. Считается, что эти медиаторы "поздней стадии" частично ответственны за хронические симптомы перечисленных выше атопических и аллергических реакций типа I и, кроме того, являются химическими медиаторами воспаления и воспалительных заболеваний (например, остеоартрит, воспалительное заболевание кишечника, язвенный колит, болезнь Крона, идиопатическое воспалительное заболевание кишечника, синдром раздраженной толстой кишки, спастическая толстая кишка и т.д.), поздней стадии рубцевания (например, склеродерма, усиленный фиброз, келоиды, послеоперационные шрамы, фиброз легких, сосудистые спазмы, мигрень, реперфузионное поражение и после инфаркта миокарда) и комплекса или синдрома сухости. Все эти заболевания можно лечить или предотвратить в соответствии со способами, описанными в настоящей заявке.
Дополнительные заболевания, которые можно лечить или предотвратить в соответствии со способами, описанными в настоящей заявке, включают заболевания, связанные с патологией базофилов и/или тучных клеток. Примеры таких заболеваний включают, но не ограничиваются этим, заболевания кожи, такие как склеродерма, сердечные заболевания, такие как после инфаркта миокарда, легочные заболевания, такие как изменение или ремоделирование мышц легких, хроническое обструктивное легочное заболевание (COPD), и заболевания кишечника, такие как синдром воспаленной толстой кишки (спастическая толстая кишка).
Гетероарильные Соединения, описанные в настоящей заявке, также являются сильными ингибиторами тирозиновой киназы Syk. Таким образом, в следующем аспекте, обеспечиваются способы регуляции и, в частности, ингибирования активности Syk киназы. Способ, как правило, включает контактирование Syk киназы или клетки, включающей Syk киназу, с количеством гетероарильного соединения, эффективным для регулирования или ингибирования активности Syk киназы. В одном варианте воплощения, Syk киназа представляет собой выделенную или рекомбинантную Syk киназу. В другом варианте воплощения, Syk киназа представляет собой эндогенную или рекомбинантную Syk киназу, экспрессируемую клеткой, например тучной клеткой или базофилом. Способ можно осуществить в in vitro контекстах или в in vivo контекстах в качестве терапевтического подхода к лечению или профилактике заболеваний, характеризующихся, вызванных или, связанных с активностью Syk киназы.
В одном варианте воплощения, в настоящей заявке представлены способы ингибирования Syk киназы в клетке, экспрессирующей указанную Syk киназу, включающие контактирование указанной клетки с эффективным количеством гетероарильного соединения, где соединение не является цис-4-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино) циклогексанкарбоксамидом.
Известно, что Syk киназа играют критическую роль в других сигнальных каскадах. Например, Syk киназа является эффектором передачи сигнала B-клеточного рецептора (BCR) (Turner et al., Immunology Today 21:148-154 (2000) и является существенным компонентом передачи сигнала интегрин бета (1), бета(2) и бета(3) в нейтрофилах (Mocsai et al., Immunity 16:547-558 (2002). Поскольку гетероарильные соединения, описанные в настоящей заявке, являются сильными ингибиторами Syk киназы, их можно использовать для регулирования и, в частности, для ингибирования любого сигнального каскада, где Syk играет определенную роль, такого как, например, сигнальные каскады Fc рецептора, BCR и интегрина, а также клеточных ответов, проявляющихся через эти сигнальные каскады. Конкретный клеточный ответ, регулируемый или ингибируемый, будет зависеть, частью, от конкретного типа клеток и сигнального каскада рецептора, как это хорошо известно из предшествующего уровня техники. Неограничивающие примеры клеточных ответов, которые можно регулировать или ингибировать Гетероарильными Соединениями, включают респираторный импульс, клеточную адгезию, клеточную дегрануляцию, распластывание клеток, клеточную миграцию, фагоцитоз (например, в макрофагах), поток кальциевых ионов (например, в тучных клетках, базофилах, нейтрофилах, эозинофилах и B-клетках), агрегацию тромбоцитов и клеточное созревание (например, в B-клетках).
Таким образом, в другом аспекте, обеспечиваются способы регуляции и, в частности, ингибирования каскадов сигнальной трансдукции, в которых Syk играет роль. Способ, как правило, включает контактирование Syk-зависимого рецептора или клетки, экспрессирующей Syk-зависимый рецептор, с количеством гетероарильного соединения, описанного в настоящей заявке, эффективным для регулирования или ингибирования каскада сигнальной трансдукции. Способы также можно использовать для регулирования и, в частности, ингибирования развивающихся далее процессов или клеточных ответов, вызываемых активацией конкретного Syk-зависимого каскада сигнальной трансдукции. Способы можно осуществить для регулирования любого каскада сигнальной трансдукции, где Syk, как это еще неизвестно или может быть определено позднее, играет определенную роль. Способы можно осуществить в in vitro контекстах или в in vivo контекстах в качестве терапевтического подхода к лечению или профилактике заболеваний, характеризующихся, вызванных или, связанных с активацией Syk-зависимого каскада сигнальной трансдукции. Неограничивающие примеры таких заболеваний включают заболевания, обсуждаемые выше.
Эти заболевания включают различные опухоли и типы рака, доброкачественные или злокачественные, метастатические или неметастатические. Специфические характеристики рака, такие как ткани инвазивности или метастазы, могут представлять собой мишени для направленного воздействия с использованием способов, описанных в настоящей заявке. Клеточно-пролиферативное расстройства включают различные типы рака, включая, среди прочих, рак молочной железы, рак яичника, почечный рак, желудочно-кишечный рак, рак почки, рак мочевого пузыря, рак поджелудочной железы, сквамозно-клеточную карциному легкого и аденокарциному.
В некоторых вариантах воплощения, клеточно-пролиферативное расстройство, которое можно лечить, представляет собой гематопоэтическое новообразование, которое представляет собой аберрантный рост клеток гематопоэтической системы.
В некоторых вариантах воплощения, гематопоэтическое новообразование, которое можно лечить, представляет собой лимфоидное новообразование, где аномальные клетки происходят из и/или демонстрируют характерный фенотип клеток лимфоидного происхождения. Лимфоидные новообразования можно подразделить на B-клеточные новообразования, T- и NK-клеточные новообразования, лимфому Ходжкина и не-ходжкинскую лимфому. B-клеточные новообразования можно далее подразделить на новообразования, включающие предшественники B-клеток, и новообразования, включающие зрелые/периферийные B-клетки. Иллюстративные B-клеточные новообразования представляют собой лимфобластный лейкоз/лимфому с B-клетками-предшественниками (острый лимфобластный лейкоз с B-клетками-предшественниками), тогда как иллюстративные новообразования с участием зрелых/периферийных B-клеток представляют собой B-клеточный хронический лимфоцитарный лейкоз/мелко-лимфоцитарную лимфому, B-клеточный пролимфоцитарный лейкоз, лимфоплазмацитарную лимфому, B-клеточную лимфому селезеночной краевой зоны, волосисто-клеточный лейкоз, плазменно-клеточную миелому/плазмацитому, B-клеточную лимфому экстранодальной краевой зоны MALT типа, B-клеточную лимфому нодальной краевой зоны, фолликулярную лимфома, лимфому области мантии, диффузную крупно-B-клеточную лимфому, медиастинальную крупно-B-клеточную лимфому, первичную эффузионную лимфому и лимфому Беркитта/Беркитт-клеточный лейкоз. Т-клеточные и Nk-клеточные новообразования далее подразделяются на новообразования с участием Т-клеток-предшественников и новообразования с участием зрелых (периферийных) Т-клеток. Иллюстративным новообразованием с участием Т-клеток-предшественников является лимфобластная лимфома/лейкоз с участием Т-клеток-предшественников (острый лимфобластный лейкоз с участием Т-клеток-предшественников), тогда как иллюстративными новообразованиями с участием зрелых (периферийных) Т-клеток являются Т-клеточный пролимфоцитарный лейкоз, Т-клеточный гранулярный лимфоцитарный лейкоз, агрессивный NK-клеточный лейкоз, Т-клеточная лимфома/лейкоз взрослых (HTLV-I), экстранодальная NK/T-клеточная лимфома, Т-клеточная лимфома назального типа, типа энтеропатии, сплето-гепатическая гамма-дельта Т-клеточная лимфома, подкожная панникулито-подобная Т-клеточная лимфома, фунгоидная гранулема/синдром Sezary, анапластическая крупно-клеточная лимфома, T/нулликлеточная первичная кожного типа, периферийно-Т-клеточная лимфома, не охарактеризованная каким-либо иным образом, ангиоиммунобластная Т-клеточная лимфома, анапластическая крупно-клеточная лимфома, T/нулликлеточная, первичного системного типа. Третий член лимфоидных новообразований представляет собой лимфому Ходжкина, также указываемую как болезнь Ходжкина. Иллюстративные диагнозы этого класса, которые можно лечить Гетероарильным Соединением, включают, среди прочих, нодулярную лимфому Ходжкина с преобладанием лимфоцитов и различные классические формы болезни Ходжкина, иллюстративными членами которых являются лимфома Ходжкина с нодулярным склерозом (стадии 1 и 2), классическая лимфома Ходжкина с высоким содержанием лимфоцитов, смешанно-клеточная лимфома Ходжкина и лимфома Ходжкина с низким содержанием лимфоцитов. Четвертый член лимфоидных новообразований представляет собой не-ходжкинскую лимфому, также называемую не-ходжкинской боезнью. Иллюстративные расстройства этого класса, которые можно лечить Гетероарильным Соединением, включают, среди прочих, макроглобулинемию Валденстрема; моноклональную гаммопатию неопределенного значения; доброкачественную моноклональную гаммопатию; заболевание тяжелой цепи, лимфому области мантии, MCL, лимфоцитарную лимфому промежуточной дифференциации, промежуточную лимфоцитарную лимфому, ILL, диффузную плохо дифференцированную лимфоцитарную лимфому, PDL, центроцитарную лимфому, диффузную лимфому с мелкоклеточным дроблением, DSCCL, фолликулярную лимфому и любой тип лимфом области мантии, которые можно наблюдать под микроскопом (нодулярная, диффузная, бластная лимфома и лимфома области мантии). В различных вариантах воплощения, любое из лимфоидных новообразований, которые связаны с аберрантной активностью Syk, можно лечить Гетероарильными Соединениями.
В некоторых вариантах воплощения, гематопоэтическое новообразование, которое можно лечить, представляет собой миелоидное новообразование. Миелоидные новообразования можно подразделить на миелопролиферативные заболевания, миелодиспластические/миелопролиферативные заболевания, миелодиспластические синдромы и острые миелоидные лейкозы. Иллюстративными миелопролиферативными заболеваниями являются хронический миелогенный лейкоз (например, Philadelphia хромосома-положительный (t(9;22)(qq34;q1 1)), хронический нейтрофильный лейкоз, хронический эозинофильный лейкоз/гиперэозинофильные синдромы, хронический идиопатический миелофиброз, истинная полицитемия и эссенциальная тромбоцитемия. Иллюстративными миелодиспластическими/миелопролиферативными заболеваниями являются хронический миеломоноцитарный лейкоз, атипичный хронический миелогенный лейкоз и юношеский миеломоноцитарный лейкоз. Иллюстративные миелодиспластические синдромы представляют собой рефракторную анемию, с кольцевидными сидеробластами и без кольцевидных сидеробластов, рефракторную цитопению (миелодиспластический синдром) с мультилинеарной дисплазией, множественные миеломы, такие как, но не ограничиваясь этим, медленно развивающаяся множественная миелома, несекреторная миелома, остеосклеротическая миелому, плазма-клеточный лейкоз, одиночная плазмацитома и экстрамедуллярная плазмацитома, рефракторная анемия (миелодиспластический синдром) с избыточным количеством бластных клеток, 5q-синдром и миелодиспластический синдром с t(9;12)(q22;pl2) (TEL-Syk гибрид; см., например, Kuno et al, Blood 97: 1050 (2001). В различных вариантах воплощения, любое из миелоидных новообразований, которые связаны с аберрантной активностью Syk, можно лечить Гетероарильными Соединениями, описанными в настоящей заявке.
В некоторых вариантах воплощения, гетероарильные соединения можно использовать для лечения острых миелоидных лейкозов (AML), которые представляют собой большой класс миелоидных новообразований, имеющий свое собственное подразделение расстройств. Эти подразделения включают, среди прочих, AMLs с периодически повторяющимися цитогенетическими транслокациями, AML с мультилинеарной дисплазией и другие AML, не классифицированные каким-либо иным образом. Иллюстративные AMLs с периодически повторяющимися цитогенетическими транслокациями включают, среди прочих, AML ct(8;21)(q22;q22), AML1(CBF-альфа)/ETO, острый промиелоцитарный лейкоз (AML с t(15;17)(q22;q11-12) и варианты, PML/R AR-альфа), AML с аномальными эозинофилами костного мозга (inv(16)(pl3q22) или t(16;16)(pl3;q11), CBFb/MYH1 1X) и AML с I 1q23 (MLL) аномалиями. Иллюстративными AML с мультилинеарной дисплазией являются такие, которые связаны с миелодиспластическим синдромом, или без предшествующего миелодиспластического синдрома. Другие острые миелоидные лейкозы, не отнесенные к какой-либо определенной группе, включают, минимально дифференцированный AML, AML без созревания, AML с созреванием, острый миеломоноцитарный лейкоз, острый моноцитарный лейкоз, острый эритроидный лейкоз, острый мегакариоцитарный лейкоз, острый базофильный лейкоз и острый панмиелоз с миелофиброзом.
В некоторых вариантах воплощения, гетероарильные соединения можно использовать для лечения сарком кости и соединительных тканей, таких как, но не ограничиваясь этим, саркома кости, остеосаркома, хондросаркома, саркома Эвинга, злокачественная гиганто-клеточная опухоль, фибросаркома кости, хордома, периостеальная саркома, саркомы мягких тканей, ангиосаркома (гемангиосаркома), фибросаркома, саркома Капоши, лейомиосаркома, липосаркома, лимфангиосаркома, метастатический рак, неврилеммома, рабдомиосаркома, синовиальная саркома; рак молочной железы, включая, но не ограничиваясь этим, аденокарциному, лобуллярную (мелкоклеточную) карциному, интрадуктальную карциному, медуллярный рак молочной железы, муцинозный рак молочной железы, тубулярный рак молочной железы, папиллярный рак молочной железы, первичный рак молочной железы, болезнь Педжета и воспалительный рак молочной железы; сквамозно-клеточную карциному; и карциному головы и шеи.
В других аспектах, клеточно-пролиферативные расстройства, которые могут быть мишенями для Гетероарильных Соединений, включают вирусно-опосредованные опухоли. Они могут возникать как результат инфицирования клеток онкогенным вирусом, который обладает способностью трансформировать нормальную клетку в опухолевую клетку. В некоторых вариантах воплощения, вирусно-опосредованная опухоль, которую можно лечить соединениями, раскрытыми в настоящей заявке, связана с любым вирусом, который кодирует тирозиновый активационный мотив (ITAM) иммунорецептора, способный модулировать активность Syk. Этот мотив относится к мотиву консервативной аминокислотной последовательности, который функционирует путем взаимодействия с и активирования не-рецепторными тирозиновыми киназами. ITAM мотивы, среди прочего, обнаружены в β и γ цепях FcεRI, ε субъединице T-клеточного рецептора, и иммуноглобулине β (Igβ) и Igα B-клеточного рецептора. Мотив с канонической последовательностью типично представляет собой Yxx(L/I)x6-8Yxx(L/I), где x представляет собой любую аминокислоту. Как правило, тирозиновые остатки в этом мотиве вовлечены в передачу сигнала ITAM и являются субстратами для фосфорилирования Src семейством киназ. Фосфорилированные формы ITAMs функционируют как сайты взаимодействия для SH2 (область гомологии src), содержащего сигнальные белки, такие как Syk/ZAP-70 киназы. Помимо его присутствия в различных клеточно-поверхностных молекулах, ITAM последовательности были идентифицированы в вирусно-кодируемых белках. В свете описания, содержащегося в настоящей заявке, указывающего функцию Syk киназы как онкогена, опухоли, связанные с вирусами, содержащими гены, кодирующие белки с ITAM последовательностями, можно лечить Гетероарильными Соединениями.
Соответственно, в некоторых вариантах воплощения, вирусно-опосредованная опухоль, которую можно лечить Гетероарильными Соединениями, связана с вирусом герпеса, ассоциированным с саркомой Капоши (KS), лимфотропным вирусом, который связан с саркомой Капоши, редким злокачественным заболеванием, часто встречающимся у ВИЧ-инфицированных. В некоторых вариантах воплощения, вирусно-опосредованная опухоль связана с вирусом Эпштейна-Барра (EBV).
В некоторых вариантах воплощения, вирусно-опосредованная опухоль, которую можно лечить Гетероарильным Соединением, связана с человеческим Т-клеточным лимфотропным вирусом (HTLV-I вирус), ретровирусом в этом же классе вирусом, такой как вирус СПИДа, ВИЧ-I.
В некоторых вариантах воплощения, вирусно-опосредованная опухоль связана с вирусом опухоли молочной железы (MTV). ITAM последовательности обнаружены в Env гене вируса опухоли молочной железы мыши (MMTV), ретровирусе B типа, идентифицированном как этиологический агент для рака молочной железы у мышей.
Должно быть понятно, что применение Гетероарильных Соединений для лечения вирусно-опосредованных опухолей не ограничивается опухолями, связанными с вирусами, указанными выше. Как указано, любые опухоли, связанные с онкогенным вирусом, в котором Syk является активированной как часть его онкогенного механизма, независимо от включения ITAM последовательностей, могут быть мишенями для направленного действия на них Гетероарильных Соединений.
В других аспектах, настощее раскрытие направлено на лечение метастазов опухолей с использованием Гетероарильных Соединений. Метастазы являются характерным признаком злокачественных опухолевых клеток, посредством чего опухолевые клетки отделяются от участка их происхождения и затем распространяются для колонизации на других участках. Эти вторичные опухоли могут образовываться в тканях, не связанных с клетками, из которых происходят опухолевые клетки. Именно образование этих вторичных опухолей метастазами, как оказалось, является основной причиной смертности от злокачественных форм рака. Метастазы начинаются, когда злокачественные клетки отделяются от первичной опухоли и проникают в кровь или лимфатическую систему и затем мигрируют к другим участкам колонизации. Как правило, нормальные клетки не отделяются и не инвазируют в другие ткани из-за различных сигналов, которые ингибируют адгезию диссемилирующих клеток друг к другу, а также сигналов между клетками, которые ингибируют клеточный рост. Клеточная трансформация, однако, изменяет эти нормальные регуляторные программы таким образом, что опухолевые клетки взаимодействуют с локальными клетками ткани с изменением локального внеклеточного матрикса, стимулируя миграцию и промотируя пролиферацию и выживание. Изменения молекул клеточной адгезии (CAMs), таких как члены семейств иммуноглобулинов и кальций-зависимых кадгеринов, а также интегринов, как оказалось, играют критическую роль в инвазии и метастазах. Например, изменение N-CAM от высокоадгезивной изоформы до низкоадгезивной изоформы, которое, вместе с его даун-регуляцией, может привести к инвазивному раку поджелудочной железы.
Активность Syk киназы связана с различными интегринами, экспрессируемыми в клетках гематопоэтического происхождения, но также в не-гематопоэтических клетках. Syk киназа участвует в передаче сигнала β1 интегрина в эпителиальных клетках легких (Ulanova et al, Am. J. Physiol. Lung Cell Mol. Physiol. 288:L497-L507 (2004) и моноцитах (Lin et al, Biol. Chem. 270(27): 16189-97 (1995), передаче сигнала β2 интегрина в гранулоцитах/нейтрофилах (Miura et al, Blood 96(5): 1733-9 (2000); Kusumoto et al, Microbiol Immunol. 45(3):241-8 (2001) и передаче сигнала β3 интегрина в активации тромбоцитов и клеточной адгезии (Gao et al, EMBO J. 16(21):6414-25 (1997). С учетом указанной связи между активностью Syk киназы и онкогенезом, использование Syk-ингибирующих Гетероарильных Соединений для уменьшения инвазивных и метастатических свойств опухолей показано через связь между активностью Syk киназы и некоторыми интегринами (Mocsai et al, Immunity 16(4): 547-58 (2002). Таким образом, в некоторых вариантах воплощения, гетероарильные соединения можно использовать для модулирования метастатических свойств опухолей, опосредованных через активность интегринов. В некоторых вариантах воплощения, гетероарильные соединения можно использовать для уменьшения инвазивности опухолевых клеток в ткани и метастатического потенциала, опосредуемых βl интегринами (Lin et al, Biol. Chem. 270:16189-16197 (1995); Kusumoto et al, Microbiol Jmmunol, 45(3):241-8 (2001); Ortiz-Stern et al, J Leukoc Biol. 77(5):787-99 (2005). Иллюстративным интегрином этого типа является интегрин α2β1.
В некоторых вариантах воплощения, гетероарильные соединения можно использовать для уменьшения инвазивности опухолевых клеток в ткани и метастатического потенциала, опосредуемых активностью β2 интегринов (CD 18) (Willeke et al, J. Leukoc. Biol. 74(2):260-9 (2003). Они включают, среди прочих, CD1 1a/CD18, CD1 1b/CD18, CD1 1c/CD18 и CD11d/CD18. В следующих вариантах воплощения, гетероарильные соединения можно использовать для уменьшения инвазивности опухолевых клеток в ткани и метастатического потенциала, опосредуемых активностью β3 интегринов. Иллюстративным интегринами этого типа являются αIibβ3 и αvβ3.
Различные типы опухолей, способных метастазировать, можно лечить Гетероарильными Соединениями. Такие опухоли включают, в качестве примера, а не для ограничения, рак молочной железы, рак яичника, почечный рак, желудочно-кишечные рак, рак почки, рак мочевого пузыря, рак поджелудочной железы, сквамозно-клеточную карциному легкого и аденокарциному (см., например, Felding-Habermann et al, Proc Natl Acad Sci USA 98(4): 1853-8 (2001). Терапевтическое лечение для уменьшения метастазов установленных опухолей может следовать после диагностирования метастазов. Если метастазы не диагностированы, гетероарильное соединение можно вводить профилактически для уменьшения возможности образования метастазов.
В другом варианте воплощения, способы и композиции представленные в настоящей заявке, также являются полезными для введения субъектам, нуждающимся в трансплантации костного мозга, для лечения злокачественного заболевания (например, субъектам, страдающим острым лимфоцитарным лейкозом, острым миелогенным лейкозом, хроническим миелогенным лейкозом, хроническим лимфоцитарным лейкозом, миелодиспластическим синдромом ("пре-лейкоз"), синдромом моносомии 7, не-ходжкинской лимфомой, нейробластомой, опухолями головного мозга, множественной миеломой, тестикулярными зародышево-клеточными опухолями, раком молочной железы, раком легкого, раком яичника, меланомой, глиомой, саркомой или другими солидными опухолями), субъектам, нуждающимся в трансплантации костного мозга, для лечения незлокачественного заболевания (например, субъектам, страдающим гематологическими расстройствами, врожденным иммунодефицитом, мукополисахаридозами, липидозами, остеопорозом, гистиоцитозом клеток Лангерганса, синдромом Леша-Найхана или гликогеновой болезнью), субъектам, проходящим курс химиотерапии или лучевой терапии, субъектам, готовящимся к лечению химиотерапией или лучевой терапией, и субъектам, которые ранее проходили курс химиотерапии или лучевой терапии.
В другом варианте воплощения, в настоящей заявке представлены способы лечения рака или опухолей, резистентных к другим ингибиторам киназы, таким как иматиниб мезилат (STI-571 или Gleevec™), включающие введение субъекту, нуждающемуся в этом, эффективного количества гетероарильного соединения или содержащей его композиции. В конкретном варианте воплощения, в настоящей заявке представлены способы лечения лейкозов, включая, но не ограничиваясь этим, желудочно-кишечную стромальную опухоль (GIST), острый лимфоцитарный лейкоз или хронический миелоцитарный лейкоз, резистентных к лечению иматиниб мезилатом (STI-571 или Gleevec™), включающие введение субъекту, нуждающемуся в этом, эффективного количества гетероарильного соединения или содержащей его композиции.
В специальном варианте воплощения, в настоящей заявке представлены способы лечения или профилактики лейкоза (т.е. злокачественных новообразований кровеобразующих тканей) включая, но не ограничиваясь этим, хронический лимфоцитарный лейкоз, хронический миелоцитарный лейкоз, острый лимфобластный лейкоз, острый миелогенный лейкоз и острый миелобластный лейкоз. Лейкоз может быть рецидивирующим, рефракторным или резистентным к традиционной терапии. Термин "рецидивирующий" относится к ситуации, когда у субъектов, у которых была ремиссия лейкоза после терапии наблюдается возврат лейкозных клеток в костном мозге и уменьшение нормальных кровяных клеток. Термин "рефракторный или резистентный" относится к обстоятельствам, когда субъекты, даже после интенсивного лечения, имеют остаточные лейкозные клетки в костном мозге.
Также в настоящей заявке обеспечиваются способы лечения субъектов, которых ранее лечили от рака, но которые невосприимчивы к стандартной терапии, а также тех, которых ранее не лечили. Также в настоящей заявке представлены способы лечения субъектов независимо от возраста, хотя некоторые типы рака наиболее характерны для определенных возрастных групп. Кроме того, в настоящей заявке представлены способы лечения субъектов, которые перенесли операцию как попытку лечения рака, а также тех, у которых не было операции. Поскольку субъекты с раком имеют гетерогенные клинические проявления и различный клинический результат, лечение субъекта может варьировать в зависимости от его/ее прогноза. Опытный врач сможет легко определить без излишнего экспериментирования вторичные средства, типы хирургии и типы не-лекарственной стандартной терапии, которые можно эффективно использовать для лечения конкретного субъекта, страдающего раком.
Должно быть понятно, что гетероарильные соединения можно использовать независимо от какого-либо другого лечения или использовать в сочетании с другими методами лечения рака, включая хирургию, радиологию или другие химиотерапии. Гетероарильное соединение можно сочетать с другими фармакологически активными соединениями ("вторые активные средства") в способах и композициях, описанных в настоящей заявке. Считается, что некоторые сочетания могут работать синергически для лечения конкретных типов заболеваний или расстройств, а также состояний и симптомов, связанных с такими заболеваниями или расстройствами. Гетероарильное соединение также может быть полезным для уменьшения побочных эффектов, связанных с некоторыми вторыми активными средствами, и наоборот.
Соответственно, в некоторых вариантах воплощения, гетероарильные соединения можно использовать в сочетании с другими химиотерапевтическими средствами. Комбинированное лечение Гетероарильными Соединениями может прицельно действовать на различные клеточные компоненты путем подходящего выбора второго химиотерапевтического средства. Например, гетероарильные соединения можно использовать в некоторых вариантах воплощения для ограничения метастатического потенциала опухолевых клеток, тогда как другое химиотерапевтическое средство можно использовать для устранения или убивания аберрантных клеток.
Различные химиотерапевтические средства можно использовать в сочетании с Гетероарильными Соединениями для лечения клеточно-пролиферативных расстройств. Эти химиотерапевтические средства могут представлять собой общие цитотоксические средства или средства, прицельно действующие на специфическую клеточную молекулу. Различные классы противораковых химиотерапевтических средств включают, среди прочих, антиметаболиты, средства, которые взаимодействуют с ДНК {например, алкилирующие средства, координационные соединения и т.д.), ингибиторы транскрипционных ферментов, ингибиторы топоизомеразы, соединения, связывающиеся с малой бороздкой ДНК, антимитотические средства {например, алкалоиды барвинка), противоопухолевые антибиотики, гормоны и ферменты. Иллюстративные алкилирующие средства включают, в качестве примера, а не для ограничения, мехлоротамин, циклофосфамид, ифосфамид, мелфалан, хлорамбуцил, этиленимины, метилмеламины, алкилсульфонаты (например, бусулфан) и кармустин. Иллюстративные антиметаболиты включают, в качестве примера, а не для ограничения, фоливую кислоту аналог метотрексата; пиримидин аналог фторурацила, цитозин араббинозид; и пурин аналог мекаптопурина, тиогуанин и азатиоприн. Иллюстративные алкалоиды барвинка включают, в качестве примера, а не для ограничения, винбластин, винкристин, паклитаксел и колхицин. Иллюстративные противоопухолевые антибиотики включают, в качестве примера, а не для ограничения, актиномицин D, даунорубицин и блеомицин. Иллюстративным ферментом, эффективным в качестве противоопухолевого средства является L-аспарагиназа. Иллюстративные координационные соединения включают, в качестве примера, а не для ограничения, цисплатин и карбоплатин. Иллюстративные гормоны и гормональные соединения включают, в качестве примера, а не для ограничения, адренокортикостероиды преднизон и дексаметазон; ингибиторы ароматазы аминоглутетимид, форместан и анастрозол; прогестиновые соединения гидроксипрогестерон капроат, медроксипрогестерон; и анти-эстрогеновое соединение тамоксифен. Иллюстративные ингибиторы топоизомеразы включают, в качестве примера, а не для ограничения, амсакрин (m-AMSA); митоксантрон, топотекан, иринотекан и камптотецин.
Эти и другие полезные противораковые соединения описаны в Merck Index, 13th Ed. (O'Neil, MJ. Et al., ed) Merck Publishing Group (2001), и в Goodman and Gilman's The Pharmacological Basis of Therapeutics, 10th Edition, Hardman, J.G. and Limbird, L.E. eds., pg. 1381-1287, McGraw Hill, (1996), которые оба включены в настоящую заявку посредством ссылки.
Типично, любое химиотерапевтическое средство, которое обладает активностью против новообразования, подлежащего лечению, можно использовать в сочетании с Гетероарильными Соединениями, описанными в настоящей заявке, при условии, что конкретное средство является клинически совместимым с терапией, использующей гетероарильное соединение, описанное в настоящей заявке. Типичные противоопухолевые средства, полезные в способах, описанных в настоящей заявке, включают, но не ограничиваются этим, средства против структур микротрубочек, такие как дитерпеноиды и алкалоиды барвинка; платиновые координационные комплексы; алкилирующие средства, такие как азотные иприты, оксазафосфорины, алкилсульфонаты, нитрозомочевины и триазены; антибиотики, такие как антрациклины, актиномицины и блеомицины; ингибиторы топоизомеразы II, такие как эпиподофиллотоксины; антиметаболиты, такие как пуриновые и пиримидиновые аналоги и анти-фолатные соединения; ингибиторы топоизомеразы I, такие как камптотецины; гормоны и гормональные аналоги; ингибиторы пути сигнальной трансдукции; ингибиторы связанных с ангиогенезом не-рецепторных тирозиновых киназ; иммунотерапевтические средства; проапоптические средства; и ингибиторы передачи сигналов клеточного цикла.
Ингибиторы пути сигнальной трансдукции представляют собой такие ингибиторы, которые блокируют или ингибируют химический процесс, который вызывает внутриклеточное изменение. Как это используется в настоящем изобретении, изменение представляет собой клеточную пролиферацию, выживание, ангиогенез или дифференциацию. Ингибиторы сигнальной трансдукции, которые являются полезными в способах по настоящему изобретению, включают ингибиторы рецепторных тирозиновых киназ, не-рецепторных тирозиновых киназ, блокаторы SH2/SH3 домена, сериновых/треониновых киназ, фосфатидил-инозит-3 киназ, сигнала миоинозита и Ras онкогенеза.
Некоторые тирозиновые протеинкиназы катализируют фосфорилирование специфических тирозиновых остатков в различных белках, вовлеченных в регуляцию клеточного роста. Такие тирозиновые протеинкиназы подразделяют на широкие классы рецепторных или не-рецепторных киназ.
Тирозиновые киназы-рецепторы представляют собой трансмембранные белки, содержащие внеклеточный лиганд-связывающий домен, трансмембранный домен и тирозинкиназный домен. Тирозиновые киназы-рецепторы вовлечены в регуляцию клеточного роста, и их иногда называют рецепторами факторов роста. Неподходящая или неконтролируемая активация многих из этих киназ, т.е. аберрантная киназная активность рецептора фактора роста, например, путем сверх-экспрессии или мутации, как было показано, приводит к неконтролируемому клеточному росту. Соответственно, аберрантную активность таких киназ связывают с ростом злокачественной ткани. Следовательно, ингибиторы таких киназ смогли бы обеспечить способы лечения рака. Рецепторы факторов роста включают, например, рецептор эпидермального фактора роста (EGFr, ErbB2 и ErbB4), рецептор фактора роста тромбоцитов (PDGFR), рецептор фактора роста сосудистого эндотелия (VEGFR), тирозиновую киназу с иммуноглобин-подобными и гомологичными эпидермальному фактору роста доменами (Tie-2), рецептор инсулинового фактора роста-I (IGF-I), рецепторы макрофагального колониестимулирующего фактора (MCSF), BTK, ckit, cmet, фактора роста фибробластов (FGF), рецепторы Trk (TrkA, TrkB и TrkC), рецепторы эфрина (eph) и RET протоонкоген. Некоторые ингибиторы рецепторов факторов роста находятся в стадии разработки и включают антагонисты лигандов, антитела, ингибиторы тирозиновой киназы, анти-смысловые олигонуклеотиды и аптамеры. Рецепторы факторов роста и средства, которые ингибируют функцию рецепторов факторов роста, описаны, например, в Kath, John C, Exp. Opin. Ther. Patents 10{8):803-818 (2000); и Lofts, F. J. et al, "Growth Factor Receptors as Targets", New Molecular Targets for Cancer Chemotherapy, Ed. Workman, Paul and Kerr, David, CRC Press 1994, London.
Тирозиновые киназы, которые не являются киназами рецепторов факторов роста, называют не-рецепторными тирозиновыми киназами. Не-рецепторные тирозиновые киназы, полезные в способах по настоящему изобретению, являются мишенями или потенциальными мишенями для противоопухолевых лекарственных средств, и они включают cSrc, Lck, Fyn, Yes, Jak, cAbl, FAK (киназа фокальной адгезии), Brutons тирозиновую киназу и Bcr-Abl. Такие не-рецепторные киназы и средства, которые ингибируют функцию не-рецепторных тирозиновых киназ, описаны в Sinh, S. et al, J. Hematother. Stem Cell Res. 8 (5): 485-80 (1999); и Bolen, J.B. et al, Ann. Rev. Immunol. 15: 371-404 (1997).
Блокаторы SH2/SH3 домена представляют собой средства, которые разрушают связывание SH2 или SH3 домена в различных ферментах или адапторных белках, включая, PI3-K p85 субъединицу, киназы семейства Src, адапторные молекулы (She, Crk, Nek, Grb2) и Ras-GAP. SH2/SH3 домены в качестве мишеней для противораковых лекарственных средств обсуждаются в Smithgall, T.E. (1995), Journal of Pharmacological and Toxicological Methods 34(3) 125-32.
Ингибиторы сериновых/треониновых киназ, включая блокаторы каскада MAP киназы, которые включают блокаторы Raf киназ (Rafk), митоген или внеклеточных регулируемых киназ (MEKs) и внеклеточных регулируемых киназ (ERKs); и блокаторы членов семейства протеинкиназ C, включая блокаторы подтипов PKCs (альфа, бета, гамма, эпсилон, мю, лямбда, иота, зета), семейства IkB киназ (IKKa, IKKb), семейства PKB киназ, членов семейства Akt киназ и киназ рецепторов TGF бета. Такие сериновые/треониновые киназы и их ингибиторы описаны в Yamamoto, T. et al, J. Biochem. 126(5): 799-803 (1999); Brodt, P. et al. Biochem. Pharmacol. 60: 1101-1107 (2000); Massague, J. et al. Cancer Surveys 27:41-64 (1988); Philip, PA. et al, Cancer Treat. Res. 78: 3-27 (1995), Lackey, K. et al. Bioorg. Med. Chem. Lett. 10: 223-228 (2000); и Martinez-Lacaci, L., et al, Int. J. Cancer 88(1): 44-52 (2000).
Ингибиторы членов семейства фосфатидил-инозит-3 киназы, включая блокаторы PI3-киназы, ATM, ДНК-PK и Ku, также являются полезными в сочетании с соединениями, описанными в настоящей заявке. Такие киназы обсуждаются в Abraham, RT. Curr. Op. Jmmunol. 8(3):412-8 (1996); Canman, CE. et al Oncogene 17(25):3301-3308 (1998); Jackson, SP. Int. J. Biochem. Cell Biol 29(7):935-938 (1997); и Zhong, H. et al, Cancer Res. 60(6):1541-1545 (2000).
Также полезными в сочетании с Гетероарильными Соединениями, описанными в настоящей заявке, являются ингибиторы сигнала Myo-инозита, такие как блокаторы фосфолипазы C и аналоги миоинозита. Такие ингибиторы сигналов описаны в Powis, G. et al. New Molecular Targets for Cancer Chemotherapy ed., Paul Workman and David Kerr, CRC Press 1994, London.
Другая группа ингибиторов пути сигнальной трансдукции, полезных в сочетании с Гетероарильными Соединениями, включает ингибиторы Ras онкогена. Такие ингибиторы включают ингибиторы фарнезилтрансферазы, геранил-геранил-трансферазы и CAAX протеаз, а также анти-смысловые олигонуклеотиды, рибозимы и иммунотерапию. Было показано, что такие ингибиторы блокируют активацию Ras в клетках, содержащих мутантный Ras дикого типа, действуя, таким образом, как антипролиферативные средства. Ингибирование Ras онкогена обсуждается в Scharovsky, CG. et al. J. Biomed. Sci. 7(4) 292-298 (2000): Ashby, MM, Curr. Op. Lipid. 9(2)99-102 (1998); и Oliff, A., Biochim. Biophys. Acta, 1423(3): C19-C30 (1999).
Как указано выше, антитела к связыванию рецепторной киназы с лигандом также могут служить в качестве ингибиторов сигнальной трансдукции. Эта группа ингибиторов пути сигнальной трансдукции включает использование гуманизированных антител к внеклеточному лиганд-связывающему домену тирозиновых киназ-рецепторов. Например, Imclone C225 EGFR специфическое антитело (см. Green, M. C. et al Cancer Treat. Rev., 26(4), 280-286 (2000)); Herceptin® ErbB2 антитело (см. Stern, DF Breast Cancer Res., 2(3), 176-183 (2000)); и 2CB VEGFR2 специфическое антитело (см. Brekken, RA et al, Cancer Res. 80, 5117-5124 (2000)).
Ингибиторы связанных с ангиогенезом рецепторных киназ также могут найти применение в способах по настоящему изобретению. Ингибиторы связанных с ангиогенезом VEGFR и TIE2 обсуждаются выше в связи с ингибиторами сигнальной трансдукции (оба рецептора представляют собой рецепторные тирозиновые киназы). Другие ингибиторы можно использовать в сочетании с Гетероарильными Соединениями, описанными в настоящей заявке. Например, анти-VEGF антитела, которые не распознают VEGFR (рецепторная тирозиновая киназа), но связываются с лигандом; малые молекулы-ингибиторы интегрина (альфаv бета3), которые будут ингибировать ангиогенез: эндостатин и ангиостатин (не-RTK) также могут быть полезными в сочетании с PLK ингибиторами.
Средства, используемые в иммунотерапевтических схемах лечения, также могут быть полезными в сочетании с Гетероарильным Соединением, описанным в настоящей заявке.
Средства, используемые в проапоптических схемах лечения (например, bcl-2 антисмысловые олигонуклеотиды), также можно использовать в сочетаниях, раскрываемых в настоящей заявке. Члены Bcl-2 семейства белков блокируют апоптоз. Поэтому активацию bcl-2 связывают с хеморезистентностью. Исследования показали, что эпидермальный фактор роста (EGF) стимулирует анти-апоптические члены bcl-2 семейства (т.е. mcl-1). Поэтому стратегии, разработанные для даун-регуляции экспрессии bcl-2 в опухолях, продемонстрировали клиническую пользу и в настоящее время находятся в фазе II/III испытаний, а именно Genta's G3139 bcl-2 антисмысловой олигонуклеотид. Такие проапоптические стратегии с использованием стратегии антисмыслового олигонуклеотида для bcl-2 обсуждаются в Water JS et al, J. Clin. Oncol. 18:1812-1823 (2000); и Kitada S et al, Antisense Res. Dev. 4:71-79 (1994).
Ингибиторы сигналов клеточного цикла ингибируют молекулы, вовлеченные в контроль клеточного цикла. Циклин-зависимые киназы (CDKs) и их взаимодействие с циклинами контролируют прохождение через эукариотический клеточный цикл. Координированная активация и инактивация различных циклин/CDK комплексов является необходимой для нормального продвижения через клеточный цикл. Некоторые ингибиторы сигналов клеточного цикла находятся в стадии разработки. Например, примеры циклин-зависимых киназ, включая CDK2, CDK4 и CDK6, и их ингибиторов описаны, например, в Rosania, et al, Exp. Opin Ther, Patents 10(2):215-230 (2000).
Другие антипролиферативные соединения, полезные в сочетании с Гетероарильными Соединениями, включают, в качестве примера, а не для ограничения, антитела, направленные против рецепторов факторов роста {например, анти-Her2); цитокины, такие как интерферон-α и интерферон-γ, интерлейкин-2 и GM-CSF; и антитела для клеточно-поверхностных маркеров (например, анти-CTLA-4, анти-CD20 (ритуксимаб); анти-CD33). Когда используют антитела против клеточно-поверхностных маркеров, химиотерапевтическое средство может быть конъюгировано с таким антителом специфического таргетирования опухолевых клеток. Подходящие конъюгаты включают радиоактивные соединения (например, радиоактивный металл, связанный с конъюгированным с антителом хелатообразующим соединением), цитотоксичные соединения и активирующие лекарственные средства ферменты (например, аллиназа, пептидазы, эстеразы, каталитические антитела и т.д.) (см., например, Arditti et al, Mol. Cancer Therap. 4(2):325-331 (2005); Патент США №. 6258360; которые включены в настоящую заявку посредством ссылки).
В некоторых вариантах воплощения, гетероарильные соединения можно использовать с вторым ингибитором киназы, который направленно действует на онкогенную киназу, отличную от Syk. Хотя гетероарильные соединения раскрыты в настоящей заявке для лечения гематопоэтических новообразований, также можно использовать и другие совместимые ингибиторы киназы, используемые лечения гематопоэтических новообразований. В некоторых вариантах воплощения, второй ингибитор киназы представляет собой ингибитор Abl киназы. Хронический миелогенный лейкоз представляет собой миелоидное новообразование, характеризующее злокачественной пролиферацией лейкемических стволовых клеток в костный мозг. Большинство случаев хронического миелогенного лейкоза связано с цитогенетической аномалией, определяемой реципрокной транслокацией t(9;22)(q34;ql 1). Эта хромосомная аберрация приводит к образованию BCR/ABL гибридного белка с активированной киназной активностью. Ингибиторы активности гибридной протеинкиназы могут быть эффективными в лечении хронического миелогенного лейкоза, но при продолжительном лечении могут развиваться резистентные формы. Применение гетероарильного соединения в сочетании с ингибиторами Abl киназы может уменьшить вероятность резистентных клеток путем направленного действия на другой клеточный процесс, отличный от того, на который направлено действие второго ингибитора киназы. Иллюстративным ингибитором Abl киназы является 2-фениламинопиримидин, также известный как иматиниб мезилат и Gleevec®. Таким образом, в некоторых вариантах воплощения, гетероарильные соединения можно использовать в сочетании с ингибитором Abl киназы 2-фениламинопиримидином и его производными. В других вариантах воплощения, второй ингибитор киназы может представлять собой пиридол[2-3-d]пиримидин и его производные, которые изначально были идентифицированы как ингибиторы Src киназы. В следующих вариантах воплощения, второй ингибитор киназы может представлять собой тирфостины и их производные (например, адафостин), которые могут влиять на ассоциацию киназы с ее субстратами. Другие соединения-ингибиторы киназы должны быть очевидны для специалистов в данной области.
Другие вторые активные средства, полезные в сочетании с Гетероарильными Соединениями, обладающими активностью против Syk киназы, включают, в качестве примера, а не для ограничения, Fc-домен-содержащие терапевтические антитела или гибридные белки, такие как ифликсимаб или этанерсепт. В одном варианте воплощения, в настоящей заявке представлены способы лечения или профилактики аутоиммунного расстройства, такого как расстройства, известные из уровня техники или перечисленные в настоящей заявке, включающие введение субъекту, нуждающемуся в этом сочетания гетероарильного соединения, обладающего активностью против Syk киназы, и Fc-домен-содержащего антитела, такого как ифликсимаб или этанерсепт. В одном варианте воплощения, в настоящей заявке представлены способы лечения или профилактики воспалительного расстройства, такого как расстройства, известные из уровня техники или перечисленные в настоящей заявке, включающие введение субъекту, нуждающемуся в этом сочетания гетероарильного соединения, обладающего активностью против Syk киназы и Fc-домен-содержащего антитела, так как ифликсимаб. В конкретном варианте воплощения, гетероарильное соединение вводят в качестве хронической терапии, начиная до или сразу после начального введения Fc-домен-содержащего терапевтического антитела или гибридного белка. Не желая быть ограниченным теорией, считают, что гетероарильное соединение с активностью против Syk киназы может продлить период полусуществования в сыворотке Fc-домен-содержащего терапевтического антитела и гибриднных белков у субъекта.
Один или несколько вторых активных ингредиентов или средств можно использовать в способах и композициях, описанных в настоящей заявке. Вторые активные средства могут представлять собой крупные молекулы (например, белки) или малые молекулы (например, синтетические неорганические металлоорганические или органические молекулы).
Примеры крупных молекул вторых активных средств включают, но не ограничиваются этим, гематопоэтические факторы роста, цитокины и моноклональные и поликлональные антитела. Конкретные примеры активных средств включают миметики тромбопоэтина или агонисты рецепторов, такие как Ромбиплозим и Промакта, анти-CD40 моноклональные антитела (такие как, например, SGN-40); ингибиторы гистон-деацетилазы (такие как, например, SAHA и LAQ 824); ингибиторы белка-90 теплового шока (такие как, например, 17-AAG); ингибиторы киназы-рецептора инсулиноподобного фактора роста-1; ингибиторы киназы-рецептора фактора роста сосудистого эндотелия (такие как, например, PTK787); ингибиторы рецептора фактора роста инсулина; ингибиторы ацилтрансферазы лизофосфатидиновой кислоты; ингибиторы IkB киназы; ингибиторы p38MAPK; ингибиторы EGFR (такие как, например, гефитиниб и эрлотиниб HCL); антитела к HER-2 (такие как, например, трастузумаб (Герцептин®) и пертузумаб (Omnitarg™)); антитела к VEGFR (такие как, например, бевацизумаб (Avastin™)); ингибиторы VEGFR (такие как, например, flk-1 специфические ингибиторы киназы, SU5416 и ptk787/zk222584); ингибиторы P13K (такие как, например, вортманнин); ингибиторы C-Met (такие как, например, PHA-665752); моноклональные антитела (такие как, например, ритуксимаб (Rituxan®), тозитумомаб (Bexxar®), эдреколомаб (Panorex®) и G250); и анти-TNF-α антитела. Примеры активных средств, представляющих собой малые молекулы, включают, но не ограничиваются этим, противораковые средства и антибиотики на основе малых молекул (например, кларитромицин).
Конкретные вторые активные соединения, которые можно сочетать с Гетероарильным Соединением, варьируют в зависимости от конкретного показания, подлежащего лечению, профилактике или облегчению.
Например, для лечения, профилактики или облегчения воспалительного, аутоиммунного заболевания или рака, вторые активные средства включают, но не ограничиваются этим: семаксаниб; циклоспорин; этанерсепт; доксициклин; бортезомиб; ацивицин; акларубицин; акодазол гидрохлорид; акронин; адозелезин; альдеслейкин; алтретамин; амбомицин; аметантрон ацетат; амсакрин; анастрозол; антрамицин; аспарагиназу; асперлин; азацитидин; азетепа; азотомицин; батимастат; бензодепа; бикалутамид; бисантрен гидрохлорид; биснафид димезилат; бизелезин; блеомицин сульфат; бреквинар натрий; бропиримин; бусульфан; кортикостероиды; сактиномицин; калустерон; карацемид; карбетимер; карбоплатин; кармустин; карубицин гидрохлорид; карзелезин; цедефингол; целекоксиб; хлорамбуцил; циролемицин; цисплатин; кладрибин; криснатол мезилат; циклофосфамид; цитарабин; дакарбазин; дактиномицин; даунорубицин гидрохлорид; децитабин; дексормаплатин; дезагуанин; дезагуанин мезилат; диазиквон; доцетаксел; доксорубицин; доксорубицин гидрохлорид; дролоксифен; дролоксифен цитрат; дромостанолон пропионат; дуазомицин; эдатрексат; эфлорнитин гидрохлорид; элсамитруцин; энлоплатин; энпромат; эпипропидин; эпирубицин гидрохлорид; эрбулозол; эзорубицин гидрохлорид; эстрамустин; эстрамустин натрий фосфат; этанидазол; этопозид; этопозид фосфат; этоприн; фадрозол гидрохлорид; фазарабин; фенретинид; флоксуридин; флударабин фосфат; фторурацил; флуроцитабин; фосквидон; фостриецин натрий; гемцитабин; гемцитабин гидрохлорид; гидроксимочевину; идарубицин гидрохлорид; ифосфамид; илмофосин; ипроплатин; иринотекан; иринотекан гидрохлорид; ланреотид ацетат; летрозол; леупролид ацетат; лиарозол гидрохлорид; лометрексол натрий; ломустин; лозоксантрон гидрохлорид; мазопрокол; майтансин; мехлоретамин гидрохлорид; мегестрол ацетат; меленгестрол ацетат; мелфалан; меногарил; меркаптопурин; метотрексат; метотрексат натрий; метоприн; метуредепа; митиндомид; митокарцин; митокромин; митогиллин; митомальцин; митомицин; митоспер; митотан; митоксантрон гидрохлорид; микофеноловую кислоту; нокодазол; ногаламицин; ормаплатин; оксизуран; паклитаксел; пегаспаргазу; пелиомицин; пентамустин; пепломицин сульфат; перфосфамид; пипоброман; пипосульфан; пироксантрон гидрохлорид; пликамицин; пломестан; порфимер натрий; порфиромицин; преднимустин; прокарбазин гидрохлорид; пуромицин; пуромицин гидрохлорид; пиразофурин; рибоприн; сафингол; сафингол гидрохлорид; семустин; симтразен; спарфосат натрия; спарсомицин; спирогерманий гидрохлорид; спиромустин; спироплатин; стрептонигрин; стрептозоцин; сулофенур; тализомицин; текогалан натрий; таксотер; тегафур; телоксантрон гидрохлорид; темопорфин; тенипозид; тероксирон; тестолактон; тиамиприн; тиогуанин; тиотепа; тиазофурин; тирапазамин; торемифен цитрат; трестолон ацетат; трицирибин фосфат; триметрексат; триметрексат глюкуронат; трипторелин; тубулозол гидрохлорид; урацилиприт; уредепа; вапреотид; вертепорфин; винбластин сульфат; винкристин сульфат; виндезин; виндезин сульфат; винепидин сульфат; винглицинат сульфат; винлеурозин сульфат; винорелбин тартрат; винрозидин сульфат; винзолидин сульфат; ворозол; зениплатин; зиноостатин и зорубицин гидрохлорид.
Другие вторые средства включают, но не ограничиваются этим: 20-epi-1,25 дигидроксивитамин D3; 5-этинилурацил; абиратерон; акларубицин; ацилфулвен; адеципенол; адозелезин; альдеслейкин; антагонисты ALL-TK; алтретамин; амбамустин; амидокс; амифостин; аминолевулиновую кислоту; амрубицин; амсакрин; анагрелид; анастрозол; андрографолид; ингибиторы ангиогенеза; антагонист D; антагонист G; антареликс; анти-дорсализирующий морфогенетический белок-1; антиандроген, от карциномы предстательной железы; антиэстроген; антинеопластон; антисмысловые олигонуклеотиды; афидиколин глицинат; модуляторы генов апоптоза; регуляторы апоптоза; апуриновую кислоту; ara-CDP-DL-PTBA; аргининдеаминазу; азулакрин; атаместан; атримустин; аксинастатин 1; аксинастатин 2; аксинастатин 3; азасетрон; азатоксин; азатирозин; производные баккатина III; баланол; батимастат; антагонисты BCR/ABL; бензохлорины; бензоилстауроспорин; бета-лактамные производные; бета-алетин; бетакламицин B; бетулиновую кислоту; ингибитор bFGF; бикалутамид; бисантрен; бисазиридинилспермин; биснафид; бистратен A; биселезин; брефлат; бропиримин; будотитан; бутионин сульфоксимин; кальципотриол; калфостин C; камптотециновые производные; капецитабин; карбоксамид-амино-триазол; карбоксиамидотриазол; CaRest M3; CARN 700; выделенный из хряща ингибитор; карзелезин; ингибиторы казеинкиназы (ICOS); кастаноспермин; цекропин B; цетрореликс; хлорины; хлорхиноксалин сульфонамид; цикапрост; цис-порфирин; кладрибин; клатромицин; аналоги кломифена; клотримазол; коллисмицин A; коллисмицин B; комбретастатин A4; аналог комбретастатина; конагенин; крамбесцидин 816; криснатол; криптофицин 8; производные криптофицина A; курацин A; циклопентантрахиноны; циклоплатам; ципемицин; цитарабин окфосфат; цитолитический фактор; цитостатин; дакликсимаб; децитабин; дегидродидемнин B; деслорелин; дексаметазон; дексифосфамид; дексразоксан; дексверапамил; диазиквон; дидемнин B; дидокс; диэтилнорспермин; дигидро-5-азацитидин; дигидротаксол, 9-; диоксамицин; дифенилспиромустин; доцетаксел; доконазол; доласетрон; доксифлиридин; доксорубицин; дролоксифен; дронабинол; дуокармицин SA; эбселен; экомустин; эделфосин; эдреколомаб; эфлорнитин; элемен; эмитефур; эпирубицин; эпристерид; эстрамустиновый аналог; агонисты эстрогена; антагонисты эстрогена; этанидазол; этопозид фосфат; эксеместан; фадрозол; фазарабин; фенретинид; филграстим; финастерид; флавопиридол; флезеластин; флуастерон; флударабин; фтордаунорубицин гидрохлорид; форфенимекс; форместан; фостриецин; фотемустин; гадолиний тексафирин; галлий нитрат; галоцитабин; ганиреликс; ингибиторы желатиназы; гемцитабин; ингибиторы глутатиона; гепсульфам; герегулин; гексаметилен бисацетамид; гиперицин; ибандроновую кислоту; идарубицин; идоксифен; идрамантон; илмофосин; иломастат; иматиниб (Gleevec®), имиксимод; иммуностимулирующие пептиды; ингибитор рецептора инсулиноподобного фактора роста-1; агонисты интерферона; интерфероны; интерлейкины; иобенгуан; иододоксорубицин; ипомеанол, 4-; ироплакт; ирсогладин; изобенгазол; изогомогаликондрин B; итасетрон; йасплакинолид; кагалалид F; ламелларин-N триацетат; ланреотид; лейнамицин; ленограстим; лентинан сульфат; лептолстатин; летрозол; лейкоз-ингибирующий фактор; лейкоцитарный альфа-интерферон; леупролид+эстроген+прогестерон; леупрорелин; левамизол; лиарозол; аналог линейного полиамина; липофильный дисахаридный пептид; липофильные платиновые соединения; лиссоклинамид 7; лобаплатин; ломбрицин; лометрексол; лонидамин; лозоксантрон; локсорибин; луртотекан; лютециум тексафирин; лизофиллин; литические пептиды; майтансин; манностатин A; маримастат; мазопрокол; маспин; ингибиторы матрилизина; ингибиторы металлопротеиназы матрикса; меногарил; мербарон; метерелин; метиониназу; метоклопрамид; ингибитор MIF; мифепристон; милтефосин; миримостим; митогуазон; митолактол; аналоги митомицина; митонафид; митотоксиновый фактор роста фибробластов-сапорин; митоксантрон; мофаротен; молграмостим; Эрбитукс, человеческий хорионный гонадотрофин; монофосфориллипид A + sk клеточной оболочки миобактерий; мопидамол; ипритное противораковое средство; микапероксид B; экстракт клеточных оболочек микобактерий; мириапорон; N-ацетилдиналин; N-замещенные бензамиды; нафарелин; нагрестип; налоксон+пентазоцин; напавин; нафтерпин; натрограстим; недаплатин; неморубицин; неридроновую кислоту; нилутамид; низамицин; модуляторы оксида азота; нитроксидный антиоксидант; нитруллин; облимерсен (Genasense®); О6-бензилгуанин; остреотид; окиценон; олигонуклеотиды; онапристон; ондансетрон; орацин; пероральный индуктор цитокинов; ормаплатин; осатерон; оксалиплатин; оксауномицин; паклитаксел; аналоги паклитаксела; производные паклитаксела; палауамин; пальмитоилризоксин; памидроновую кислоту; панакситриол; паномифен; парабактин; пацеллиптин; пегаспаргазу; пелдесин; пентосан полисульфат натрий; пентостатин; пентрозол; перфлуброн; перфосфамид; периллиловый спирт; феназиномицин; фенилацетат; ингибиторы фосфатазы; пецибанил; пилокарпин гидрохлорид; пирарубицин; пиретриксим; плацетин A; плацетин B; ингибитор активатора плазминогена; платиновый комплекс; платиновые соединения; платина-триамин комплекс; порфимер натрий; порфиромицин; преднизон; пропил бис-акридон; простагландин J2; ингибиторы протеасомы; иммунномодулятор на основе белка A; ингибитор протеинкиназы C; ингибиторы протеинкиназы C, микроальгал; ингибиторы тирозин-протеинфосфатазы; ингибиторы пурин-нуклеозид-фосфорилазы; пурпурины; пиразолоакридин; пиридоксилированный гемоглобин-полиоксиэтиленовый конъюгат; антагонисты raf; ралтитрексет; рамосетрон; ингибиторы фарнезил-протеинтрансферазы ras; ингибиторы ras; ингибитор ras-GAP; ретелептин деметилированный; рений Re 186 этидронат; ризоксин; рибозимы; RII ретинамид; рогитукин; ромуртид; роквинимекс; рубигвинон Bl; рубоксил; сафингол; сайнтопин; SarCNU; саркофитол A; сарграмостим; миметики Sdi 1; семустин; ингибитор старения 1; смысловые олигонуклеотиды; ингибиторы сигнальной трансдукции; сизофиран; собузоксан; натрий борокаптат; натрий фенилацетат; солверол; соматомедин-связывающий белк; сонермин; спарфосиновую кислоту; спикамицин D; спиромустин; спленопентин; спонгистатин 1; скваламин; стипиамид; ингибиторы стромелизина; сульфиносин; суперактивный вазоактивный кишечный пептидный антагонист; сурадиста; сурамин; свайнсонин; таллимустин; тамоксифен метиодид; тауромустин; тазаротен; текогалан натрий; тегафур; теллурапирилий; ингибиторы теломеразы; темопорфин; тенипозид; тетрахлордекаоксид; тетразомин; талибластин; тиокоралин; тромбопоэтин; миметик тромбопоэтина; тималфасин; агонист рецептора тимопоэтина; тимотринан; тиреостимулирующий гормон; этилолово этиопурпурин; тирапазамин; титаноцен бихлорид; топсентин; торемифен; ингибиторы трансляции; третиноин; триацетилуридин; трицирибин; триметрексат; трипторелин; трописетрон; туростерид; ингибиторы тирозиновой киназы; тирфостины; ингибиторы UBC; убенимекс; происходящий из мочеполового синуса ингибитор роста; антагонисты рецептора урокиназы; вапреотид; вариолин B; веларезол; верамин; вердины; вертепорфин; винорелбин; винксалтин; витаксин; ворозол; занотерон; зениплатин; зиласкорб; и зиностатин стималамер.
Специфические вторые активные средства включают, но не ограничиваются этим, 2-метоксиэстрадиол, теломестатин, индукторы апоптоза в клетках множественной миеломы (такие как, например, TRAIL), бортезомиб, статины, семаксаниб, циклоспорин, этанерсепт, доксициклин, бортезомиб, облимерсен (Genasense®), ремикаде, доцетаксел, целекоксиб, мелфалан, дексаметазон (Decadron®), стероиды, гемцитабин, цисплатин, темозоломид, этопозид, циклофосфамид, темодар, карбоплатин, прокарбазин, глиадел, тамоксифен, топотекан, метотрексат, Arisa®, таксол, таксотер, фторурацил, лейковорин, иринотекан, кселода, CPT-11, интерферон альфа, ПЭГилированный интерферон альфа (например, PEG INTRON-A), капецитабин, цисплатин, тиотепа, флударабин, карбоплатин, липосомальный даунорубицин, цитарабин, доксетаксол, пацилитаксел, винбластин, IL-2, GM-CSF, дакарбазин, винорелбин, золедроновую кислоту, палмитронат, биаксин, бусульфан, преднизон, бисфосфонат, триоксид мышьяка, винкристин, доксорубицин (Doxil®), паклитаксел, ганцикловир, адриамицин, эстрамустин натрий фосфат (Emcyt®), сулиндак и этопозид.
Подобным образом, примеры специфического второго средства в соответствии с показаниями, подлежащими лечению, профилактике или облегчению, можно найти в следующих ссылочных документах, которые все включены в настоящую заявку во всей их полноте: Патенты США №№. 7189740, 6281230 и 5635517; Патентные заявки США №№ 11/085905, 11/111188, 11/271963, 11/284403, 11/289723, 11/022075, 10/411656, 10/693794, 10/699154 и 10/981189.
Примеры дополнительных вторых активных средств включают, но не ограничиваются этим, традиционные терапевтические средства, используемые для лечения или профилактики боли, такие как антидепрессанты, противосудорожные средства, гипотензивные средства, анксиолитические средства, блокаторы кальциевых каналов, мышечные релаксанты, не-наркотические анальгетики, опиоидные анальгетики, противовоспалительные средства, ингибиторы cox-2, иммуномодуляторы, агонисты или антагонисты альфа-адренергического рецептора, иммуносупрессанты, кортикостероиды, гипербарический кислород, кетамин, другие анестезирующие средства, антагонисты NMDA и другие терапевтические средства, которые можно найти, например, в Physician's Desk Reference 2003. Конкретные примеры включают, но не ограничиваются этим, ацетат салициловой кислоты (Aspirin®), целекоксиб (Celebrex®), Enbrel®, кетамин, габапентин (Neurontin®), фенитоин (Dilantin®), карбамазепин (Tegretol®), окскарбазепин (Trileptal®), валпроевую кислоту (Depakene®), морфин сульфат, гидроморфон, преднизон, гризеофулвин, пентониум, алдендронат, дифенгидрамид, гванетидин, кеторолак (Acular®), тирокальцитонин, диметилсульфоксид (ДМСО), клонидин (Catapress®), бретилиум, кетансерин, резерпин, дроперидол, атропин, фентоламин, бупивакаин, лидокаин, ацетаминофен, нортриптилин (Pamelor®), амитриптилин (Elavil®), имипрамин (Tofranil®), доксепин (Sinequan®), кломипрамин (Anafranil®), флуоксетин (Prozac®), сертралин (Zoloft®), нефазодон (Serzone®), венлафаксин (Effexor®), тразодон (Desyrel®), бупропион (Wellbutrin®), мексилетин, нифедипин, пропранолол, трамадол, ламотригин, зиконотид, кетамин, декстрометорфан, бензодиазепины, баклофен, тизанидин и феноксибензамин.
Примеры дополнительных вторых активных средств включают, но не ограничиваются этим, стероид, легкий сенсибилизатор, интегрин, антиоксидант, интерферон, производное ксантина, гормон роста, нейротрофический фактор, регулятор неоваскулизации, анти-VEGF антитело, простагландин, антибиотик, фитоэстроген, противовоспалительное соединение или соединение против ангиогенеза, или сочетание таких средств. Конкретные примеры включают, но не ограничиваются этим, вертепорфин, пурлитин, ангиостатический стероид, rhuFab, интерферон-2α, пентоксифиллин, олово этиопурпурин, мотексафин лютетиум, 9-фтор-11,21-дигидрокси-16,17-1-метилэтилидин-бис(окси)прегна-1,4-диен-3,20-дион, латанопрост (см. Патент США №. 6225348), тетрациклин и его производные, рифамицин и его производные, макролиды, метронидазол (Патенты США №№. 6218369 и 6015803), генистеин, генистин, 6'-О-Mal генистин, 6'-О-Ac генистин, даидзеин, даидзин, 6'-О-Mal даидзин, 6'-О-Ac даидзин, глицитеин, глицитин, 6'-О-Mal глицитин, биохаин A, формононетин (Патент США №. 6001368), триамцинолон ацетомид, дексаметазон (Патент США №. 5770589), талидомид, леналидомид и помалидомид или Иммуномодулирующий продукт марки IMiDs®, глутатион (Патент США №. 5632984), основный фактор роста фибробластов (bFGF), трансформирующий фактор роста b (TGF-b), происходящий из головного мозга нейрофильный фактор (BDNF), активатор плазминогена типа 2 (PAI-2), EYE101 (Eyetech Pharmaceuticals), LY333531 (Eli Lilly), Miravant и RETISERT имплантат (Bausch & Lomb). Все перчисленные выше ссылочные документы включены в настоящую заявку во всей их полноте посредством ссылки.
Примеры дополнительных вторых активных средств включают, но не ограничиваются этим, антикоагулянты, диуретики, сердечные гликозиды, блокаторы кальциевых каналов, сосудо-расширяющие средства, аналоги простациклина, антагонисты эндотелина, ингибиторы фосфодиэстеразы (например, ингибиторы PDE V), ингибиторы эндопептидазы, средства, снижающие уровень липидов, ингибиторы тромбоксана и другие терапевтические средства, известные как снижающие легочное артериальное давление. Конкретные примеры включают, но не ограничиваются этим, варфарин (Coumadin®), диуретик, сердечный гликозид, дигоксин-кислород, дилтиазем, нифедипин, сосудо-расширяющее средство, такое как простациклин (например, простагландин 12 (PGI2), эпопростенол (EPO, Floran®), трепростинил (Remodulin®), оксид азота (NO), босентан (Tracleer®), амлодипин, эпопростенол (Floran®), трепростинил (Remodulin®), простациклин, тадалафил (Cialis®), симвастатин (Zocor®), омапатрилат (Vanlev®), ирбесартан (Avapro®), правастатин (Pravachol®), дигоксин, L-аргинин, илопрост, бетапрост и силденафил (Viagra®).
Примеры дополнительных вторых активных средств включают, но не ограничиваются этим, антрациклин, платину, алкилирующее средство, облимерсен (Genasense®), цисплатин, циклофосфамид, темодар, карбоплатин, прокарбазин, глиадел, тамоксифен, топотекан, метотрексат, таксотер, иринотекан, капецитабин, цисплатин, тиотепа, флударабин, карбоплатин, липосомальный даунорубицин, цитарабин, доксетаксол, пацилитаксел, винбластин, IL-2, GM-CSF, дакарбазин, винорелбин, золедроновую кислот, палмитронат, биаксин, бусульфан, преднизон, бисфосфонат, триоксид мышьяка, винкристин, доксорубицин (Doxil®), паклитаксел, ганцикловир, адриамицин, блеомицин, гиалуронидазу, митомицин C, мепакрин, тиотепа, тетрациклин и гемцитабин.
Примеры дополнительных вторых активных средств включают, но не ограничиваются этим, хлорохин, хинин, хинидин, пириметамин, сульфадиазин, доксициклин, клиндамицин, мефлоквин, галофантрин, примаквин, гидроксихлороквин, прогуанил, атоваквон, азитромицин, сурамин, пентамидин, меларсопрол, нифуртимокс, бензнидазол, амфотерицин B, соединения пятивалентной сурьмы (например, стибоглюкуронат натрия), интерферон гамма, интраконазол, мертвых промастиготных форм и BCG, лейковорин, кортикостероиды, сульфонамид, спирамицин, IgG (серология), триметоприм и сульфаметоксазол.
Примеры дополнительных вторых активных средств включают, но не ограничиваются этим: антибиотики (терапевтические или профилактические), такие как, но не ограничиваясь этим, ампициллин, кларитромицин, тетрациклин, пенициллин, цефалоспорины, стрептомицин, канамицин и эритромицин; противовирусные средства, такие как, но не ограничиваясь этим, амантадин, римантадин, ацикловир и рибавирин; иммуноглобулин; плазму; повышающие иммунитет лекарственные средства, такие как, но не ограничиваясь этим, левамизол и изопринозин; биопрепараты, такие как, но не ограничиваясь этим, гаммаглобулин, фактор переноса, интерлейкины и интерфероны; гормоны, такие как, но не ограничиваясь этим, гормон вилочковой железы; и другие иммунологические средства, такие как, но не ограничиваясь этим, стимуляторы B-клеток (например, BAFF/BlyS), цитокины (например, IL-2, IL-4 и IL-5), факторы роста (например, TGF-β), антитела (например, анти-CD40 и IgM), олигонуклеотиды, содержащие неметилированные CpG мотивы, и вакцины (например, противовирусные и противоопухолевые пептидные вакцины).
Примеры дополнительных вторых активных средств включают, но не ограничиваются этим: агонист или антагонист допамина, такой как, но не ограничиваясь этим, Леводопа, L-DOPA, кокаин, α-метил-тирозин, резерпин, тетрабеназин, бензотропин, паргилин, фенодолфам мезилат, каберголин, прамипексол дигидрохлорид, ропинорол, амантадин гидрохлорид, селегинид гидрохлорид, карбидопа, перголид мезилат, Синемет CR и Симметрел; ингибитор MAO, такой как, но не ограничиваясь этим, ипрониазид, клоргилин, фенелзин и изокарбоксазид; ингибитор COMT, такой как, но не ограничиваясь этим, толкапоне и энтакапоне; ингибитор холинэстеразы, такой как, но не ограничиваясь этим, физостигмин салицилат, физостигмин сульфат, физостигмин бромид, меостигмин бромид, неостигмин метилсульфат, амбеноний хлорид, эдрофоний хлорид, такрин, пралидоксим хлорид, обидоксим хлорид, тримедоксим бромид, диацетил монооксим, эндрофониум, пиридостигмин и демекарим; противовоспалительное средство, такое как, но не ограничиваясь этим, напроксен натрий, диклофенак натрий, диклофенак калий, целекоксиб, сулиндак, оксапрозин, дифлунизал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, Rho-D Иммуноглобулин, микофенилат мофетил, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловую кислоту, ацетилсалициловую кислоту, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенамовую кислоту, меклофенамат натрий, толметин, кеторолак, диклофенак, флурбипрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилеутон, ауротиоглюкозу, золото-натрий тиомалат, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон и бензбромарон или бетаметазон и другие глюкокортикоиды; и противорвотное средство, такое как, но не ограничиваясь этим, метоклопромид, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамид, ондастерон, гранисетрон, гидроксизин, ацетиллейцин моноэтаноламин, ализаприд, азасетрон, бензхинамид, биетанаутин, бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, металлатал, метопимазин, набилон, оксиперндил, пипамазин, скополамин, сулпирид, тетрагидроканнабинол, тиэтилперазин, тиопроперазин, трописетрон и их смесь.
Примеры дополнительных вторых активных средств включают, но не ограничиваются этим, иммуномодуляторы, иммуносупрессанты, гипотензивные средства, противосудорожные средства, фибринолитические средства, антитромбоцитарные средства, антипсихотические средства, антидепрессанты, бензодиазепины, буспирон, амантадин и другие известные или традиционные средства, используемые для субъектов с травмой/поражением ЦНС и связанными с этим синдромами. Конкретные примеры включают, но не ограничиваются этим: стероиды (например, глюкокортикоиды, такие как, но не ограничиваясь этим, метилпреднизолон, дексаметазон и бетаметазон); противовоспалительное средство, включая, но не ограничиваясь этим, напроксен натрий, диклофенак натрий, диклофенак калий, целекоксиб, сулиндак, оксапрозин, дифлунизал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, Rho-D Иммуноглобулин, микофенилат мофетил, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловую кислоту, ацетилсалициловую кислоту, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенамовую кислоту, меклофенамат натрий, толметин, кеторолак, диклофенак, флурбипрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилеутон, ауротиоглюкозу, золото-натрий тиомалат, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон и бензбромарон; аналог cAMP, включая, но не ограничиваясь этим, db-cAMP; средство, включающее метилфенидат, которое включает l-трео-метилфенидат, d-трео-метилфенидат, dl-трео-метилфенидат, l-эритро-метилфенидат, d-эритро-метилфенидат, dl-эритро-метилфенидат и их смесь; и диуретик, такой как, но не ограничиваясь этим, маннит, фуросемид, глицерин и мочевина.
Примеры дополнительных вторых активных средств включают, но не ограничиваются этим: интерлейкины, такие как IL-2 (включая рекомбинантный IL-II ("rIL2") и канарипокс IL-2), IL-10, IL-12 и IL-18; интерфероны, такие как интерферон альфа-2a, интерферон альфа-2b, интерферон альфа-n1, интерферон альфа-n3, интерферон бета-I a и интерферон гамма-I b; и G-CSF; гидроксимочевину; бутираты или бутиратные производные; оксид трехвалентного азота; HEMOXIN™ (NIPRISAN™; см. Патент США № 5800819); антагонисты Gardos каналов, такие как клотримазол и триарилметановые производные; Дефероксамин; белок C; и препараты для трансфузии крови или кровезаменителей, такие как Hemospan™ или Hemospan™ PS (Sangart).
Некоторые гетероарильные соединения, описанные в настоящей заявке, являются ингибиторами PLK, в частности, PLK1. Под ингибитором PLK подразумевается соединение, которое демонстрирует значение ИК50 меньше чем 10 мкМ в анализе ингибирования PLK, описанном ниже в примерах, или значение ИК50 меньше чем 10 мкМ в анализах с использованием Cell-Titer Glo или p-TCTP биомаркеров, описанных ниже в примерах; более конкретно, ингибитор PLK представляет собой соединение, которое демонстрирует значение ИК50 меньше чем 10 мкМ в анализе ингибирования PLK или значение ИК50 меньше чем 1 мкМ в анализе с использованием Cell-Titer Glo или p-TCTP биомаркеров, с использованием способов, описанных в примерах ниже.
Как описано в настоящей заявке, обеспечиваются способы регулирования, модуляции, связывания или ингибирования PLK для лечения состояний, опосредованных PLK, в частности, PLK1. "Регулирование, модуляция, связывание или ингибирование PLK" относится к регулированию, модуляции, связыванию или ингибированию активности PLK, в частности, PLK1, а также регулированию, модуляции, связыванию или ингибированию сверхэхкспрессии PLK, в частности, PLK1. Такие состояния включают некоторые новообразования (включая рак и опухоли), которые связывают с PLK, в частности, PLK1, и состояния, характеризующиеся аномальной клеточной пролиферацией.
Также обеспечиваются способы лечения PLK-чувствительных новообразований (рака или опухоли) у субъекта, такого как млекопитающее (например, человек), нуждающегося в этом, при этом способ включает введение субъекту терапевтически эффективного количества гетероарильного соединения, описанного в настоящей заявке. "PLK-чувствительное новообразование", как это используется в настоящем изобретении, относится к новообразованиям, которые поддаются лечению ингибитором PLK, в частности, PLK1. Новообразования, которые связывают с PLK и которые поэтому поддаются лечению ингибитором PLK, известны из уровня техники и включают как первичные, так и метастатические опухоли и типы рака. См., например, M. Whitfield el al, Nature Reviews/Cancer, 6:99 (2006). Например, PLK-чувствительные новообразования включают, но не ограничиваются этим, рак молочной железы, рак толстой кишки, рак легкого (включая мелкоклеточный рак легкого и не-мелкоклеточный рак легкого), рак предстательной железы, рак эндометрия, рак желудка, меланому, рак яичника, рак поджелудочной железы, сквамозно-клеточную карциному, карциному головы и шеи, карциному пищевода, гепатоклеточную карциному, рак клеток почек, саркому (включая рак соединительных тканей), рак мочевого пузыря, глиому и гематологические злокачественные опухоли, такие как лимфома, включая агрессивные лимфомы и не-ходжкинскую лимфому, и лейкоз, включая острые лейкозы. В одном конкретном варианте воплощения, представлен способ лечения рака молочной железы у субъекта, такого как млекопитающее (например, человек), нуждающегося в этом, путем введения терапевтически эффективного количества гетероарильного соединения, описанного в настоящей заявке. В другом конкретном варианте воплощения, представлен способ лечения рака яичника у субъекта, такого как млекопитающее (например, человек), нуждающегося в этом, путем введения терапевтически эффективного количества гетероарильного соединения, описанного в настоящей заявке. В другом конкретном варианте воплощения, представлен способ лечения не-мелкоклеточного рака легкого у субъекта, такого как млекопитающее (например, человек), нуждающегося в этом, путем введения терапевтически эффективного количества гетероарильного соединения, описанного в настоящей заявке. В другом конкретном варианте воплощения, представлен способ лечения рака предстательной железы у субъекта, такого как млекопитающее (например, человек), нуждающегося в этом, путем введения терапевтически эффективного количества гетероарильного соединения, описанного в настоящей заявке. В другом конкретном варианте воплощения, представлен способ лечения гематологических злокачественных опухолей, включая лимфому, такую как агрессивная лимфома и не-ходжкинская лимфома, и лейкоза, такого как острый лейкоз, у субъекта, такого как млекопитающее (например, человек), нуждающегося в этом, путем введения терапевтически эффективного количества гетероарильного соединения, описанного в настоящей заявке. "Острый лейкоз" включает как острые миелоидные лейкозы, так и острые лимфоидные лейкозы. См., H. Harris, et al, J Clin. Onc. 17(12):3835-3849, (1999). "Агрессивные лимфомы" - это термин, используемый в данной области, См., J. Chan, Hematological Onc. 19:128-150 (2001).
Также обеспечиваются способы лечения состояния, характеризующегося аномальной клеточной пролиферацией, у субъекта, такого как млекопитающее (например, человек), нуждающегося в этом. Способ включает введение терапевтически эффективного количества гетероарильного соединения, описанного в настоящей заявке. Под "аномальной клеточной пролиферацией" подразумевается клеточная пролиферация, являющаяся результатом аномального клеточного роста, клеточная пролиферация, являющаяся результатом чрезмерного клеточного деления, клеточная пролиферация, являющаяся результатом клеточного деления с повышенной скоростью, клеточная пролиферация, являющаяся результатом аномального клеточного выживания, и/или клеточная пролиферация в нормальной клетке, происходящая с нормальной скоростью, которая, тем не менее, является нежелательной. Состояния, характеризующиеся аномальной клеточной пролиферацией, включают, но не ограничиваются этим, новообразования, пролиферативные расстройства кровеносных сосудов, фиброзные расстройства, мезангиальные клеточно-пролиферативные расстройства и воспалительные/иммуно-опосредованные заболевания. Пролиферативные расстройства кровеносных сосудов включают артрит и рестеноз. Фиброзные расстройства включают цирроз печени и атеросклероз. Мезангиальные клеточно-пролиферативные расстройства включают гломерулонефрит, злокачественный нефросклероз и гломерулопатии. Воспалительные/иммуно-опосредованные расстройства включают псориаз, долгое заживление ран, отторжение трансплантата органа, тромботические микроангиопатические синдромы и нейродегенеративные заболевания. Остеоартрит и другие зависимые от пролиферации остеокластов заболевания с чрезмерной резорбцией кости являются примерами состояний, характеризующихся аномальной клеточной пролиферацией, при которых клеточная пролиферация происходит в нормальных клетках с нормальной скоростью, но, тем не менее, является нежелательной.
Также обеспечиваются способы ингибирования пролиферации клеток, при этом такие способы включают контактирование клетки с количеством гетероарильного соединения, описанного в настоящей заявке, достаточным для ингибирования пролиферации клетки. В одном конкретном варианте воплощения клетка представляет собой опухолевую клетку. В одном конкретном варианте воплощения, клетка представляет собой аномально пролиферирующую клетку. Термин "аномально пролиферирующая клетка", как он используется в настоящем изобретении, относится к клеткам, которые растут неподходящим образом (аномально), клеткам, которые делятся чрезмерно или ускоренно, клеткам, которые неподходящим образом (аномально) выживают, и/или нормальным клеткам, которые пролиферируют с нормальной скоростью, но для которых пролиферация является нежелательной. Опухолевые клетки (включая раковые клетки) являются примером аномально пролиферующих клеток, но не являются единственными аномально пролиферующими клетками.
PLK является существенно важным для клеточного митоза и, соответственно, соединения, описанные в настоящей заявке, считаются эффективными для ингибирования митоза. "Ингибирование митоза" относится к ингибированию вступления в M фазу клеточного цикла, ингибированию нормального прохождения M фазы клеточного цикла после вступления в M фазу и ингибирование нормального выхода из M фазы клеточного цикла. Таким образом, гетероарильные соединения, описанные в настоящей заявке, могут ингибировать митоз путем ингибирования вступления клетки в митоз, путем ингибирования прохождения клетки через митоз или путем ингибирования выхода клетки из митоза. В одном аспекте, обеспечиваются способы ингибирования митоза в клетке, которые включают введение в клетку количества соединения, описанного в настоящей заявке, достаточного для ингибирования митоза, и, в одном конкретном варианте воплощения, клетка представляет собой опухолевую клетку. В одном конкретном варианте воплощения, клетка представляет собой аномально пролиферирующую клетку.
Кроме того, обеспечивается применение гетероарильного соединения, описанного в настоящей заявке, для получения лекарственного средства для лечения состояния, опосредованного PLK, в частности, PLK1, у субъекта, такого как млекопитающее {например, человек). Также обеспечивается применение гетероарильного соединения для получения лекарственного средства для лечения PLK-чувствительных новообразований у субъекта, в частности, млекопитающего (например, человека). В частности, обеспечивается применение гетероарильного соединения для получения лекарственного средства для лечения рака молочной железы. Кроме того, также обеспечивается применение гетероарильного соединения для получения лекарственного средства для лечения рака яичника, применение гетероарильного соединения для получения лекарственного средства для лечения не-мелкоклеточного рака легкого, применение гетероарильного соединения для получения лекарственного средства для лечения рака предстательной железы и применение гетероарильного соединения для получения лекарственного средства для лечения гематологических злокачественных опухолей, таких как острые лейкозы, агрессивные лимфомы и не-ходжкинские лимфомы. Кроме того, обеспечивается применение гетероарильного соединения для получения лекарственного средства для лечения состояния, характеризующегося аномальной клеточной пролиферацией, применение гетероарильного соединения для получения лекарственного средства для ингибирования пролиферации клетки и применение гетероарильного соединения для получения лекарственного средства для ингибирования митоза в клетке.
В описанных выше способах лечения и применениях, соединение, описанное в настоящей заявке, можно использовать отдельно, в сочетании с одним или несколькими другими соединениями, описанными в настоящей заявке, или в сочетании с другими терапевтическими средствами и/или в сочетании с другими противоопухолевыми терапиями. В частности, в способах лечения состояний, опосредованных PLK, и в способах лечения PLK-чувствительных новообразований, предусматривается сочетание с другими химиотерапевтическими средствами, а также сочетание с хирургическим лечением и лучевой терапией. Термин "химиотерапевтический", как он используется в настоящем изобретении, относится к любому химическому веществу, средству, обладающему терапевтическим эффектом у субъекта, которому его вводят. "Химиотерапевтические" средства включают, но не ограничиваются этим, противоопухолевые средства, анальгетики и противорвотные средства. Как это используется в настоящем изобретении, "противоопухолевые средства" включают как цитостатические, так и цитотоксические средства, такие как, но не ограничиваясь этим, цитотоксичную химиотерапию, гормональную терапию, направленно действующие ингибиторы киназы и терапевтические моноклональные антитела. Комбинированные терапии, описанные в настоящей заявке, таким образом, включают введение, по меньшей мере, одного гетероарильного соединения, описанного в настоящей заявке, и применение, по меньшей мере, одного другого способа лечения рака. В одном варианте воплощения, комбинированные терапии, описанные в настоящей заявке, включают введение, по меньшей мере, одного соединения, описанного в настоящей заявке, и, по меньшей мере, одного другого химиотерапевтического средства. Один конкретный вариант воплощения включает введение, по меньшей мере, одного гетероарильного соединения, описанного в настоящей заявке, и, по меньшей мере, одного противоопухолевого средства. В качестве дополнительного аспекта, также обеспечиваются способы лечения и применения, описанные выше, которые включают введение гетероарильного соединения, описанного в настоящей заявке, вместе с, по меньшей мере, одним химиотерапевтическим средством. В одном конкретном варианте воплощения, химиотерапевтическое средство представляет собой противоопухолевое средство. В другом варианте воплощения, в настоящей заявке представлена фармацевтическая композиция, описанная выше, дополнительно включающая, по меньшей мере, одно другое химиотерапевтическое средство, более конкретно, химиотерапевтическое средство представляет собой противоопухолевое средство.
Как описано далее в настоящей заявке, введение других химиотерапевтических средств можно осуществить в форме композиции, или их можно вводить как вспомогательные средства в сочетании с Гетероарильным Соединением. Когда они являются вспомогательными, химиотерапевтические средства можно вводить одновременно или последовательно с введением гетероарильного соединения.
Способы и применения с использованием этих сочетаний могут включать введение гетероарильного соединения, описанного в настоящей заявке, и второго активного средства, либо последовательно в любом порядке, либо одновременно в отдельных или комбинированных фармацевтических композициях. При объединении в одной композиции, необходимо, чтобы эти два соединения были стабильны и совместимы друг с другом и с другими компонентами композиции, и чтобы их можно было формулировать для введения.
Введение гетероарильного соединения и второго активного средства субъекту можно осуществлять одновременно или последовательно, одним и тем же или разными путями введения. Является ли конкретный используемый путь введения подходящим для конкретного активного средства, зависит от самого активного средства (например, является ли оно подходящим для перорального введения без разложения до поступления в кровоток) и от заболевания, подлежащего лечению. Один путь введения для Гетероарильных Соединений представляет собой пероральный путь. Предпочтительные пути введения для вторых активных средств или ингредиентов, описанных в настоящей заявке, известны специалистам в данной области. См., например, Physicians' Desk Reference, 1755-1760 (56th ed., 2002).
В одном варианте воплощения, второе активное средство вводят внутривенно или подкожно. В другом варианте воплощения, второе активное средство вводят внутривенно или подкожно один раз или два раза в день в количестве от около 1 до около 1000 мг, от около 5 до около 500 мг, от около 10 до около 350 мг, или от около 50 до около 200 мг. Конкретное количество второго активного средства зависит от конкретно используемого средства, типа заболевания, подлежащего лечению или облегчению, тяжести и стадии заболевания и количества(количеств) гетероарильного соединения и любых необязательных дополнительных активных средств, одновременно вводимых субъекту.
Кроме того, в настоящей заявке представлены способы снижения, лечения и/или профилактики неблагоприятных или нежелательных эффектов, связанных с традиционным лечением, включая, но не ограничиваясь этим, хирургию, химиотерапию, лучевую терапию, гормональную терапию, биологическую терапию и иммунотерапию. Гетероарильные соединения и другие активные ингредиенты можно вводить субъекту до, в процессе или после возникновения неблагоприятного эффекта, связанного с традиционным лечением.
4.5 Фармацевтические композиции и пути введения
В одном аспекте, в настоящей заявке представлены фармацевтические композиции, включающие эффективное количество гетероарильного соединения или его фармацевтически приемлемой соли, таутомера, стереоизомера, сольвата или пролекарства; и фармацевтически приемлемый носитель, эксципиент или наполнитель.
В одном варианте воплощения, в настоящей заявке представлены фармацевтические композиции, подходящие для перорального, парентерального введения, введения через слизистую оболочку, чрескожного или местного введения.
Гетероарильные соединения можно вводить субъекту перорально или парентерально в традиционной форме препаратов, таких как капсулы, микрокапсулы, таблетки, гранулы, порошок, драже, пилюли, суппозитории, инъекции, суспензии и сиропы. Подходящие композиции можно получить широко известными способами с использованием традиционных органических или неорганических добавок, таких как эксципиент (например, сахароза, крахмал, маннит, сорбит, лактоза, глюкоза, целлюлоза, тальк, фосфат кальция или карбонат кальция), связующее (например, целлюлоза, метилцеллюлоза, гидроксиметилцеллюлоза, полипропилпирролидон, поливинилпирролидон, желатин, аравийская камедь, полиэтиленгликоль, сахароза или крахмал), разрыхлитель (например, крахмал, карбоксиметилцеллюлоза, гидроксипропилкрахмал, низко-замещенная гидроксипропилцеллюлоза, бикарбонат натрия, фосфат кальция или цитрат кальция), смазывающее вещество (например, стеарат магния, светлая безводная кремневая кислота, тальк или лаурилсульфат натрия), отдушка (например, лимонная кислота, ментол, глицин или апельсиновый порошок), консервант (например, бензоат натрия, бисульфит натрия, метилпарабен или пропилпарабен), стабилизатор (например, лимонная кислота, цитрат натрия или уксусная кислота), суспендирующий агент (например, метилцеллюлоза, поливинилпирролидон или стеарат алюминия), диспергирующий агент (например, гидроксипропилметилцеллюлоза), разбавитель (например, вода) и воскообразная основа (например, масло какао, вазелин или полиэтиленгликоль). Эффективное количество гетероарильного соединения в фармацевтической композиции может быть на уровне, который даст желаемый эффект; например, от около 0,005 мг/кг массы тела субъекта до около 10 мг/кг массы тела субъекта, в стандартной лекарственной форме как для перорального, так и парентерального введения.
Доза гетероарильного соединения для введения субъекту варьирует в достаточно широких пределах и зависит от суждения лечащего врача. Как правило, гетероарильные соединения можно вводить субъекту от одного до четырех раз в день в дозе от около 0,005 мг/кг массы тела субъекта до около 10 мг/кг массы тела субъекта, но указанные выше дозы будут соответственно варьировать в зависимости от возраста, массы тела и медицинского состояния субъекта и типа введения. В одном варианте воплощения, доза составляет от около 0,01 мг/кг массы тела субъекта до около 5 мг/кг массы тела субъекта, от около 0,05 мг/кг массы тела субъекта до около 1 мг/кг массы тела субъекта, от около 0,1 мг/кг массы тела субъекта до около 0,75 мг/кг массы тела субъекта, или от около 0,25 мг/кг массы тела субъекта до около 0,5 мг/кг массы тела субъекта. В одном варианте воплощения, вводят одну дозу в день. В каждом конкретном случае, вводимое количество гетероарильного соединения будет зависеть от таких факторов, как растворимость активного компонента, используемая композиция и путь введения.
В другом варианте воплощения, в настоящей заявке представлены способы лечения или профилактики заболевания или расстройства, включающие введение от около 0,375 мг/день до около 750 мг/день, от около 0,75 мг/день до около 375 мг/день, от около 3,75 мг/день до около 75 мг/день, от около 7,5 мг/день до около 55 мг/день, или от около 18 мг/день до около 37 мг/день гетероарильного соединения субъекту, нуждающемуся в этом.
В другом варианте воплощения, в настоящей заявке представлены способы лечения или профилактики заболевания или расстройства, включающие введение от около 1 мг/день до около 1200 мг/день, от около 10 мг/день до около 1200 мг/день, от около 100 мг/день до около 1200 мг/день, от около 400 мг/день до около 1200 мг/день, от около 600 мг/день до около 1200 мг/день, от около 400 мг/день до около 800 мг/день, или от около 600 мг/день до около 800 мг/день гетероарильного соединения субъекту, нуждающемуся в этом. В конкретном варианте воплощения, способы, раскрытые в настоящей заявке, включают введение 400 мг/день, 600 мг/день или 800 мг/день гетероарильного соединения субъекту, нуждающемуся в этом.
В другом варианте воплощения, в настоящей заявке представлены стандартные лекарственные формы, включающие в своем составе от около 1 мг до 200 мг, от около 35 мг до около 1400 мг, от около 125 мг до около 1000 мг, от около 250 мг до около 1000 мг, или от около 500 мг до около 1000 мг гетероарильного соединения.
В конкретном варианте воплощения, в настоящей заявке представлена стандартная лекарственная форма, включающая в своем составе около 100 мг или 400 мг гетероарильного соединения.
В другом варианте воплощения, в настоящей заявке представлена стандартная лекарственная форма, включающая в своем составе 1 мг, 5 мг, 10 мг, 15 мг, 20 мг, 30 мг, 35 мг, 50 мг, 70 мг, 100 мг, 125 мг, 140 мг, 175 мг, 200 мг, 250 мг, 280 мг, 350 мг, 500 мг, 560 мг, 700 мг, 750 мг, 1000 мг или 1400 мг гетероарильного соединения.
Гетероарильное Соединение можно вводить один раз, два раза, три, четыре или более раз в день. В конкретном варианте воплощения, дозы 600 мг или меньше вводят в виде разовой суточной дозы, и дозы более чем 600 мг вводят два раза в день в количестве, равном половине общей суточной дозы.
Гетероарильное Соединение можно вводить перорально для удобства. В одном варианте воплощения, в случае перорального введения, гетероарильное соединение вводят с пищей и водой. В другом варианте воплощения, гетероарильное соединение диспергируют в воде или соке (например, яблочном соке или апельсиновом соке) и вводят перорально в виде суспензии.
Гетероарильное Соединение также можно вводить внутрикожно, внутримышечно, интраперитонеально, чрескожно, внутривенно, подкожно, интраназально, эпидурально, сублингвально, интрацеребрально, интравагинально, чрескожно, ректально, через слизистую оболочку, путем ингаляции или местно путем введения в ухо, нос, глаз или кожу. Способ введения определяет лечащий врач, и он частично зависит от локализации медицинского состояния.
В одном варианте воплощения, в настоящей заявке представлены капсулы, содержащие гетероарильное соединение без дополнительного носителя, эксципиента или наполнителя.
В другом варианте воплощения, в настоящей заявке представлены композиции, включающие эффективное количество гетероарильного соединения и фармацевтически приемлемый носитель или наполнитель, где фармацевтически приемлемый носитель или наполнитель может включать эксципиент, разбавитель или их смесь. В одном варианте воплощения, композиция представляет собой фармацевтическую композицию.
Композиции могут быть в форме таблеток, жевательных таблеток, капсул, растворов, парентеральных растворов, драже, суппозиториев и суспензий и т.п.. Композиции можно сформулировать таким образом, чтобы они содержали суточную дозу или удобную часть суточной дозы, в стандартной лекарственной форме, которая может представлять собой одну таблетку или капсулу или удобный объем жидкости. В одном варианте воплощения, растворы получают из водорастворимых солей, таких как гидрохлоридная соль. Как правило, все композиции получают в соответствии со способами, известными в фармацевтической химии. Капсулы можно получить путем смешивания гетероарильного соединения с подходящим носителем или разбавителем и заполнения капсул подходящим количеством смеси. Обычно используемые носители и разбавители включают, но не ограничиваются этим, инертные порошообразные вещества, такие как крахмал многих различных видов, порошкообразная целлюлоза, особенно кристаллическая и микрокристаллическая целлюлоза, сахара, такие как фруктоза, маннит и сахароза, мука из злаков и подобные пищевые порошки.
Таблетки можно получить путем прямого прессования, мокрого гранулирования или сухого гранулирования. Композиции обычно включают разбавители, связующие, смазывающие вещества и разрыхлители, а также соединение. Типичные разбавители включают, например, различные типы крахмала, лактозу, маннит, каолин, фосфат или сульфат кальция, неорганические соли, такие как хлорид натрия, и сахарный порошок. Порошкообразные производные целлюлозы также являются полезными. В одном варианте воплощения, фармацевтическая композиция не содержит лактозу. Типичные связующие для таблеток представляют собой вещества, такие как крахмал, желатин и сахара, такие как лактоза, фруктоза, глюкоза и подобные. Природные и синтетические смолы также являются удобными для использования, включая аравийскую камедь, альгинаты, метилцеллюлозу, поливинилпирролидин и подобные. Полиэтиленгликоль, этилцеллюлоза и воски также могут служить в качестве связующих.
Смазывающее вещество может быть необходимым в композиции таблеток для предотвращения прилипания таблеток и пуансонов в штампе. Смазывающее вещество может быть выбрано из таких скользящих веществ, как тальк, стеарат магния и кальция, стеариновая кислота и гидрированные растительные масла. Разрыхлители для таблеток представляют собой вещества, которые набухают при смачивании с разрушением таблетки и высвобождением соединения. Они включают крахмалы, глины, целлюлозы, альгины и смолы. Более конкретно, можно использовать, например, кукурузный и картофельный крахмал, метилцеллюлозу, агар, бентонит, древесную целлюлозу, порошкообразную природную губку, катионо-обменные смолы, альгиновую кислоту, гуаровую камедь, цитрусовую пульпу и карбоксиметилцеллюлозу, а также лаурилсульфат натрия. На таблетки можно нанести покрытие с использованием сахара в качестве вкусового и уплотняющего вещества или пленкообразующего защитного вещества для модификации свойств растворения таблетки. Композиции также можно сформулировать в виде жевательных таблеток, например, с использованием в композиции таких веществ, как манит.
Когда желательно введение гетероарильного соединения в виде суппозитория, можно использовать типичные основы. Масло какао является традиционной основой для суппозиториев, которую можно модифицировать путем добавления восков для некоторого повышения ее точки плавления. Широко используются смешиваемые с водой основы для суппозиториев, включающие, в частности, полиэтиленгликоли с различной молекулярной массой.
Действие гетероарильного соединения может быть замедленным или пролонгированным путем соответствующего формулирования. Например, можно получить медленно растворимые гранулы гетероарильного соединения и включить в таблетку или капсулу или использовать имплантируемое устройство медленного высвобождения. Такие способы также включают получение гранул с несколькими разными скоростями растворения заполнение капсул смесью таких гранул. Таблетки или капсулы могут иметь пленочное покрытие, которое задерживает растворение на определенный период времени. Даже парентеральные препараты можно сделать долго действующими путем растворения или суспендирования гетероарильного соединения в масляных или эмульгированных носителях, которые делают возможным его медленное диспергирование в сыворотке.
5. Примеры
Следующие аббревиатуры использовали в описании и примерах:
9-BBN 9-Борабицикло[3.3.1]нонан
ATP Аденозинтрифосфат
BSA Бычий сывороточный альбумин
DPBS фосфатно-буферный солевой раствор Дульбекко
DCM Дихлорметан
DIPEA N,N-Диизопропилэтиламин
DMF N,N-Диметилформамид
ДМСО Диметилсульфоксид
DNP 2,4-Динитрофенол
DTT Дитиотреитол
EDTA Этилендиаминтетрауксусная кислота
ESI Ионизация электроспреем
FBS Фетальная бычья сыворотка
HEPES (4-(2-Гидроксиэтил)-1-пиперазинэтансульфоновая кислота
ВЭЖХ Высоко-эффективная жидкостная хроматография
HTRF Гомогенная флуоресценция с разрешением по времени
ЖХМС Жидкостная хроматография - масс-спектрометрия
MS Масс-спектрометрия
n-BuLi н-Бутиллитий
ЯМР Ядерный магнитный резонанс
p-TsOH пара-толуолсульфоновая кислота
RPMI Среда Roswell Park Memorial Institute
SN Супернатант
TFA Трифторуксусная кислота
ТСХ Тонкослойная хроматография
TsCl 4-Метилбензолсульфонилхлорид
μw Микроволновой
Соединения названы с использованием автоматического инструмента для наименования соединений, обеспечиваемого в программе Chemdraw Ultra 9.0 (Cambridgesoft), который образует системные названия для химических структур, с использованием правил Cahn-Ingold-Prelog для стереохимии.
Следующие далее Примеры представлены в качестве иллюстрации, а не для ограничения.
5.1 Примеры синтеза
5.1.1 Синтез промежуточных соединений
Промежуточное соединение 1: трет-Бутил 5-бром-1-оксоизоиндолин-2-карбоксилат
A. Метил 4-бром-2-метилбензоат. К перемешиваемому раствору 4-бром-2-метилбензойной кислоты (1 г, 4,7 ммоль) в метаноле (20 мл) добавляли по каплям дихлорид серы (1,4 г, 11,7 ммоль) при 0°C и полученную смесь нагревали при кипячении с обратным холодильником в течение 2 часов. После того, как анализ ТСХ (этилацетат) показал, что исходное вещество израсходовано, растворитель удаляли при пониженном давлении и остаток растворяли в этилацетате и воде. Слои разделяли и водную фазу экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и упаривали в вакууме с получением метил 4-бром-2-метилбензоата (0,8 г, 75% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,80 (д, J=8,4 Гц, 1H), 7,46-7,38 (м, 2H), 3,90 (с, 3H), 2,60 (с, 3H).
B. Метил 4-бром-2-(бромметил)бензоат. Суспензию метил 4-бром-2-метилбензоата (0,8 г, 3,5 ммоль), N-бромсукцинимида (0,69 г, 3,8 ммоль), бензоилпероксида (15 мг, 0,06 ммоль) в тетрахлорметане (10 мл) нагревали при кипячении с обратным холодильником в течение 5 часов. Когда ТСХ (этилацетат) показал, что исходное вещество израсходовано, смесь охлаждали до комнатной температуры. Осадок отфильтровывали и фильтрат концентрировали с получением метил 4-бром-2-(бромметил)бензоата (0,9 г, 84% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,86 (д, J=8,8 Гц, 1H), 7,65 (с, 1H), 7,52 (дд, J=8,4 Гц, J=2,0 Гц, 1H), 4,91 (с, 2H), 3,95 (с, 3H).
C. 5-Бромизоиндолин-1-он. К раствору метил 4-бром-2-(бромметил)бензоата (0,8 г, 2,6 ммоль) в тетрагидрофуране (40 мл) добавляли водный раствор аммиака (5 мл) в герметично закрытом сосуде и реакционную смесь перемешивали при 40°C в течение 3 дней. Осадок собирали и сушили в вакууме с получением 5-бромизоиндолин-1-она (220 мг, 40% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,62 (шир.с, 1H), 7,81 (с, 1H), 7,64 (д, J=8 Гц, 1H), 7,57 (д, J=8 Гц, 1H), 4,34 (с, 2H).
D. трет-Бутил 5-бром-1-оксоизоиндолин-2-карбоксилат. Смесь 5-бромизоиндолин-1-она (40 мг, 0,19 ммоль), ди-трет-бутилдикарбоната (41 мг, 0,19 ммоль), N,N-диметилпиридин-4-амина (2,3 мг, 0,02 ммоль) в дихлорметане (3 мл) перемешивали при комнатной температуре в течение ночи. Когда ТСХ анализ (этилацетат) показал, что исходное вещество израсходовано, реакционную смесь промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и упаривали в вакууме с получением трет-бутил 5-бром-1-оксоизоиндолин-2-карбоксилата (30 мг, 51% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,89 (с, 1H), 7,71-7,65 (м, 2H), 4,75 (с, 2H), 1,49 (с, 9H).
Промежуточное соединение 2: трет-Бутил 4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)пиперазин-1-карбоксилат
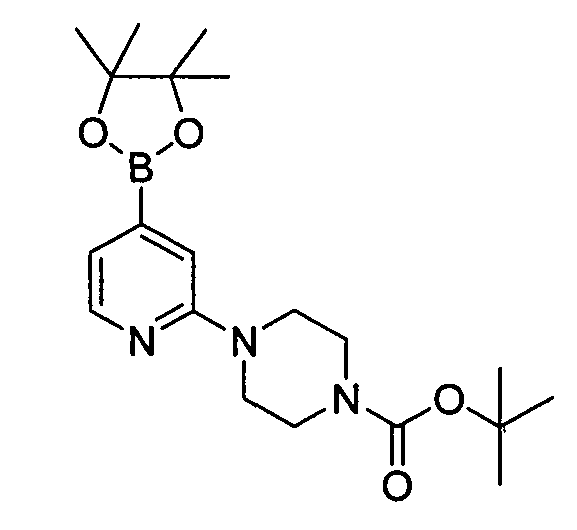
A. трет-Бутил 4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)пиперазин-1-карбоксилат. Раствор 1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)пиперазина (0,5 г, 1,729 ммоль) в дихлорметане (13 мл) охлаждали до 0°C и обрабатывали триэтиламином (0,265 мл, 1,902 ммоль) с последующей обработкой ди-трет-бутилдикарбонатом (0,377 г, 1,73 ммоль). Реакционную смесь медленно нагревали до комнатной температуры. Реакционную смесь промывали водой. Органическую фазу сушили над сульфатом магния и упаривали досуха. Продукт сушили в течение ночи в вакууме при комнатной температуре, трет-бутил 4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)пиперазин-1-карбоксилат (0,606 г, 1,557 ммоль, 90% выход) выделяли в виде белого твердого вещества. MS (ESI) m/z 290 [M-Boc+1]+.
Промежуточное соединение 3: 4-(5-Бромпиримидин-2-ил)морфолин
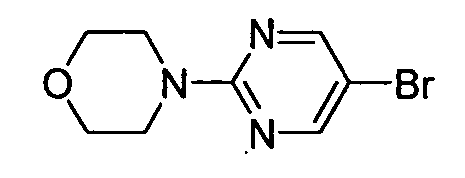
A. 4-(5-Бромпиримидин-2-ил)морфолин. Раствор 5-бром-2-хлорпиримидина (0,5 г, 2,58 ммоль) в ацетонитриле (10,5 мл) обрабатывали морфолином (0,225 г, 2,58 ммоль) и диизопропилэтиламином (0,677 мл, 3,88 ммоль) и перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении (белое липкое вещество). Остаток нельзя было распределить между водой и этилацетатом, но образование белого твердого вещества происходило при суспендировании смеси в насыщенном водном растворе хлорида аммония, это вещество собирали фильтрованием и промывали водой. 4-(5-Бромпиримидин-2-ил)морфолин (0,550 г, 2,253 ммоль, 87% выход) выделяли в виде белого твердого вещества. MS (ESI) m/z 244 [M]+ 246 [M+2]+.
Промежуточное соединение 4: трет-Бутил 2-(6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол-1-ил)этилкарбамат
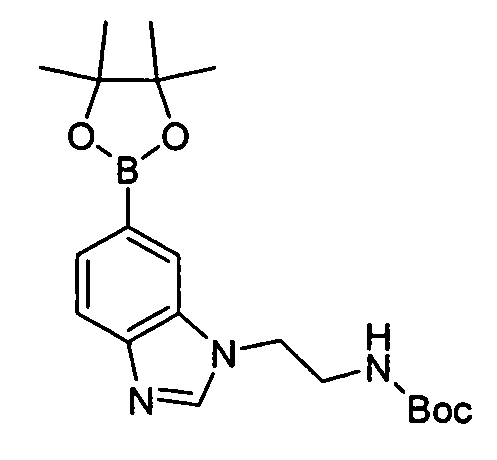
A. трет-Бутил 2-(5-бром-2-нитрофениламино)этилкарбамат. Раствор 4-бром-2-фтор-1-нитро-бензола (3 г, 13,7 ммоль), трет-бутил-2-аминоэтилкарбамата (2,2 г, 13,7 ммоль) и триэтиламина (2,78 г, 27,4 ммоль) в N,N-диметилацетамиде (25 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 5-15% этилацетата в петролейном эфире) с получением трет-бутил 2-(5-бром-2-нитрофениламино)этилкарбамата в виде желтого твердого вещества. (3,1 г, 63% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,24 (шир.с, 1H), 8,07 (д, J=9,2 Гц, 1H), 7,10 (с, 1H), 6,82 (д, J=9,2 Гц, 1H), 4,82 (шир.с, 1H), 3,47 (с, 4H), 1,48 (с, 9H).
B. трет-Бутил 2-(2-амино-5-бромфениламино)этилкарбамат. Смесь трет-бутил 2-(5-бром-2-нитрофениламино)этилкарбамата (2,0 г, 5,57 ммоль), цинковой пыли (3,64 г, 55,70 ммоль) и хлорида аммония (3,0 г, 55,7 ммоль) в смеси тетрагидрофурана и метанола (1:1, 30 мл) перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток распределяли между водой и этилацетатом и водный слой экстрагировали этилацетатом три раза. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме с получением трет-бутил 2-(2-амино-5-бромфениламино)этилкарбамата (1,65 г, 90% выход) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 6,79 (дд, J1=8,1 Гц, J2=2,1 Гц, 1H), 6,71 (д, J=2,1 Гц, 1H), 6,59 (д, J=8,1 Гц, 1H), 4,87 (шир.с, 1H), 3,46 (с, 4H), 3,24 (шир.с, 2H), 1,48 (с, 9H).
C. трет-Бутил 2-(6-бром-1H-бензо[d]имидазол-1-ил)этилкарбамат. К смеси трет-бутил 2-(2-амино-5-бромфениламино)этилкарбамата (1,55 г, 4,7 ммоль) в уксусной кислоте (1 мл) добавляли триэтилортоформиат (65 мл) по каплям при комнатной температуре и полученную смесь нагревали при кипячении с обратным холодильником в течение 0,5 часов. Триэтилортоформиат удаляли при пониженном давлении и остаток разбавляли водой и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили и упаривали с получением трет-бутил 2-(6-бром-1H-бензо[d]имидазол-1-ил)этилкарбамата (1,4 г, 87% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,77 (с, 1H), 7,53 (дд, J1=8,0 Гц, J2=2,0 Гц, 1H), 7,28 (д, J=8,0 Гц, 1H), 7,19 (д, J=2,0 Гц, 1H), 4,84 (шир.с, 1H), 4,24 (т, J=6,0 Гц, 2H), 3,45 (т, J=6,0 Гц, 2H), 1,38 (с, 9H); MS (ESI): m/z 339,9 [M+1]+.
D. трет-Бутил 2-(6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол-1-ил)этилкарбамат. После того, как смесь трет-бутил 2-(6-бром-1H-бензо[d]имидазол-1-ил)этилкарбамата (1,29 г, 3,81 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан)а (1,45 г, 5,71 ммоль) и ацетата калия (0,93 г, 9,51 ммоль) в N,N-диметилформамиде (10 мл) дегазировали три раза, добавляли 1,1'-бис(дифенилфосфино)ферроценпалладийдихлорид (0,129 г, 0,17 ммоль) и полученную смесь нагревали при 100°C в течение ночи. Растворитель удаляли при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 10% этилацетата в петролейном эфире) с получением трет-бутил 2-(6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[cf]имидазол-1-ил)этилкарбамата (0,89 г, 59,3% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d)δ (м.д.) 8,33 (с, 1H), 7,95 (с, 1H), 7,89-7,82 (м, 2H), 4,81 (шир.с, 1H), 4,47 (т, J=6,0 Гц, 2H), 3,62 (т, J=6,0 Гц, 2H), 1,38 (с, 21H); MS (ESI): m/z 388,1 [M+1]+.
Промежуточное соединение 5: 2-Нитро-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин
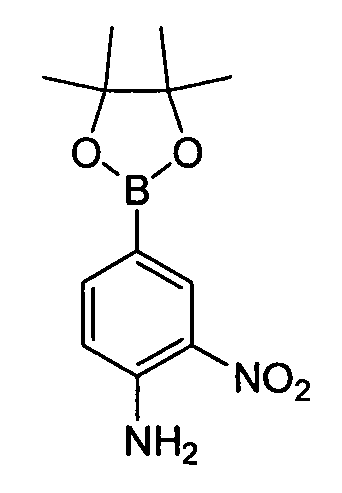
A. 2-Нитро-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин. После того, как смесь 4-бром-2-нитро-фениламина (3,09 г, 13,89 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан)а (3,9 г, 15,28 ммоль) и ацетата калия (2,7 г, 27,8 ммоль) в N,N-диметилформамиде (20 мл) дегазировали три раза, добавляли 1,1'-бис(дифенилфосфино)- ферроценпалладийдихлорид (0,3 г, 0,40 ммоль) и полученную смесь нагревали при 100°C в течение ночи. Растворитель удаляли при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 10-15% этилацетата в петролейном эфире) с получением 2-нитро-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (3,0 г, 81% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,24 (с, 1H), 7,68 (шир.с, 2H), 7,54 (д, J=8,4 Гц, 1H), 6,96 (д, J=8,4 Гц, 1H), 1,25 (с, 12H); MS (ESI): m/z 265,0 [M+1]+.
Промежуточное соединение 6: 1-(Тетрагидро-2H-пиран-2-ил)-1H-индазол-6-амин
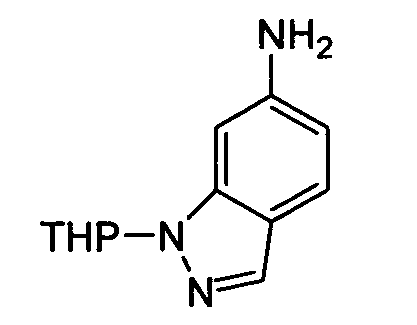
A. 6-Нитро-1H-индазол. К перемешиваемому раствору 2-метил-5-нитро-фениламина (50 г, 0,33 моль) в уксусной кислоте (500 мл) добавляли по каплям раствор нитрита натрия (34 г, 0,49 моль) в воде (100 мл) при 0°C и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Когда исходное вещество было израсходовано, реакционную смесь выливали в воду. Осадок собирали фильтрованием и очищали на колонке с силикагелем (элюируя дихлорметаном) с получением 6-нитро-1H-индазола (40 г, 75% выход) в виде твердого вещества. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,50 (с, 1H), 8,23 (с, 1H), 8,02-7,95 (м, 2H); MS (ESI): m/z 164,1 [M+1]+.
B. 6-Нитро-1-(тетрагидро-пиран-2-ил)-1H-индазол. Перемешиваемую смесь 6-нитро-1H-индазола (5,0 г, 30 ммоль), 3,4-дигидро-2H-пирана (5,2 г, 60 ммоль) и 4-метилбензолсульфоновой кислоты (516 мг, 3 ммоль) в тетрагидрофуране (25 мл) нагревали при кипячении с обратным холодильником в течение ночи. После удаления растворителя остаток очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 10% этилацетата в петролейном эфире) с получением 6-нитро-1-(тетрагидро-2H- пиран-2-ил)-1H-индазола (4 г, 52% выход) в виде желтого твердого вещества. MS (ESI): m/z 248,1 [M+1]+.
C. 1-(Тетрагидро-2Н-пиран-2-ил)-1H-индазол-6-амин. К раствору 6-нитро-1-(тетрагидро-2H-пиран-2-ил)-1H-индазола (1,0 г, 4,0 ммоль) в смеси тетрагидрофурана и метанола (об/об, 1:1, 20 мл) добавляли цинковую пыль (2,6 г, 40 ммоль) и хлорид аммония (2,2 г, 40 ммоль) в атмосфере азота. Смесь перемешивали при комнатной температуре в течение ночи и ТСХ анализ (50% этилацетата в петролейном эфире) показал, что исходное вещество было израсходовано. Реакционную смесь фильтровали и фильтрат концентрировали. Остаток разбавляли водой и водный слой экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 1-(тетрагидро-2H-пиран-2-ил)-1H-индазол-6-амина (750 мг, 85% выход). MS (ESI): m/z 218,1 [M+1]+.
Промежуточное соединение 7: трет-Бутил 5-бромизоиндолин-2-карбоксилат
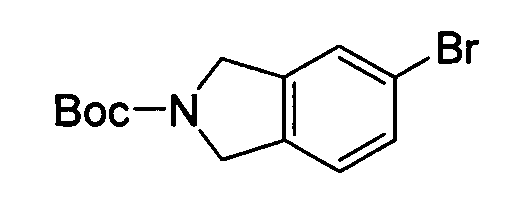
A. 5-Бромизоиндолин. К перемешиваемому раствору 5-бромизоиндолин-1,3-диона (10 г, 0,044 моль) в безводном тетрагидрофуране (500 мл) при 0°C добавляли борогидрид натрия (17,5 г, 0,46 моль) по порциям. Реакционную смесь охлаждали до -10°C и добавляли по каплям комплекс трифторида бора с диэтиловым эфиром (63 мл, 0,5 моль). По завершении добавления, реакционную смесь нагревали при кипячении с обратным холодильником в течение 4 часов. После охлаждения до комнатной температуры реакционную смесь выливали медленно в холодную воду (100 мл) при 0-5°C. Смесь разбавляли этилацетатом (480 мл) и подщелачивали путем добавления 6 н водного раствора гидроксида натрия при 0~5°C до pH=10. Органический слой промывали насыщенным солевым раствором (4×100 мл), сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученное масло разбавляли диэтиловым эфиром (100 мл) и подкисляли (pH~2) 6 н водным раствором хлористоводородной кислоты при 0°C. Водный слой подщелачивали 6 н водным раствором гидроксида натрия и экстрагировали этилацетатом (400 мл). Органический слой промывали насыщенным солевым раствором (3×150 мл), сушили над сульфатом натрия и концентрировали при пониженном давлении с получением неочищенного 5-бромизоиндолина (4 г, 46% выход) в виде коричневого масла. MS (ESI): m/z 199,7 [M+1]+.
B. трет-Бутил 5-бромизоиндолин-2-карбоксилат. К смеси 5-бромизоиндолина (4,0 г, 20 ммоль) и триэтиламина (10,1 г, 100 ммоль) в дихлорметане (20 мл) добавляли раствор ди-трет-бутилдикарбоната (6,54 г, 30 ммоль) в дихлорметане (30 мл) при 0°C и реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали и остаток очищали при помощи хроматографии на силикагеле (элюируя при помощи 10% этилацетата в петролейном эфире) с получением трет-бутил 5-бромизоиндолин-2-карбоксилата (3,9 г, 65% выход). MS (ESI): m/z 297,7 [M+1]+.
Промежуточное соединение 8: 6-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)изоиндолин-1-он
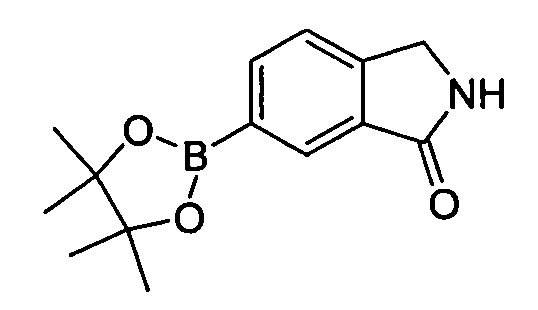
A. 6-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)изоиндолин-1-он. Дегазированную смесь 6-бромизоиндолин-1-она (2,8 г, 13,6 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'- би(1,3,2-диоксаборолан)а (6,9 г, 27 ммоль), ацетата калия (3,33 г, 34 ммоль) и 1,1'-бис(дифенилфосфино)ферроценпалладийдихлорида (1 г, 1,3 ммоль) в диоксане (50 мл) нагревали при 90°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 10% этилацетата в петролейном эфире) с получением 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)изоиндолин-1-она (2,2 г, 62% выход) в виде белого твердого вещества. MS (ESI): m/z 259,9 [M+1]+.
Промежуточное соединение 9: 5-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)изоиндолин-1-он
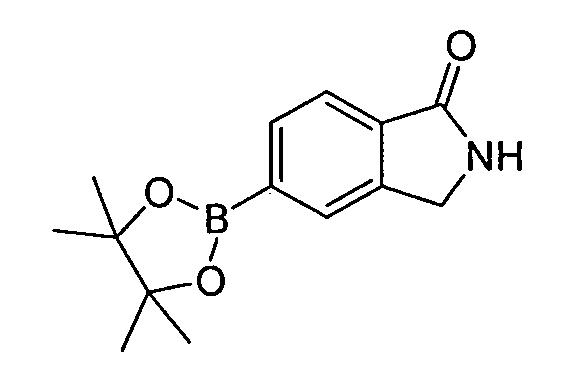
A. Метил 4-бром-2-(бромметил)бензоат. Смесь метил 4-бром-2-метилбензоата (22,8 г, 0,1 моль), 2,2'-азобис(2-метилпропионитрил)а (1,64 г, 0,01 моль) и N-бромсукцинимида (17,7 г, 0,1 моль) нагревали при кипячении с обратным холодильником в течение ночи. Растворитель удаляли и остаток распределяли между водой и дихлорметаном. Органический слой отделяли и водный слой экстрагировали дихлорметаном. Объединенные органический слой сушили и упаривали с получением неочищенного метил 4-бром-2-(бромметил)бензоата (30 г), который использовали на следующей стадии без дополнительной очистки. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,83 (м, 1H), 7,63 (с, 1H), 7,51 (м, 1H), 4,90 (с, 2H), 3,94 (с, 3H).
B. 5-Бромизоиндолин-1-он. К раствору метил 4-бром-2-(бромметил)бензоата (15 г, 0,05 моль) в метаноле (20 мл) добавляли гидроксид аммония (200 мл) и смесь перемешивали при комнатной температуре в течение 18 часов. Растворитель удаляли и остаток промывали этилацетатом и метанолом (об/об, 10:1, 110 мл) с получением 5-бромизоиндолин-1-она (4,5 г, 42% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,65 (шир.с, 1H), 7,84 (с, 1H), 7,65 (м, 1H), 7,59 (м, 1H), 4,37 (с, 2H).
C. 5-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)изоиндолин-1-он. Дегазированную смесь 5-бромизоиндолин-1-она (1,05 г, 5,0 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'- би(1,3,2-диоксаборолан)а (2,54 г, 10 ммоль), ацетата калия (1,20 г, 12,5 ммоль) и 1,1'-бис(дифенилфосфино)ферроценпалладийдихлорида (0,38 г, 0,5 ммоль) в диоксане (50 мл) нагревали до 80°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры, реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 10% этилацетата в петролейном эфире) с получением 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)изоиндолин-1-она (400 мг, 31% выход) в виде белого твердого вещества. MS (ESI): m/z 259,9 [M+1]+.
Промежуточное соединение 10: 1-Оксоизоиндолин-4-илбороновая кислота
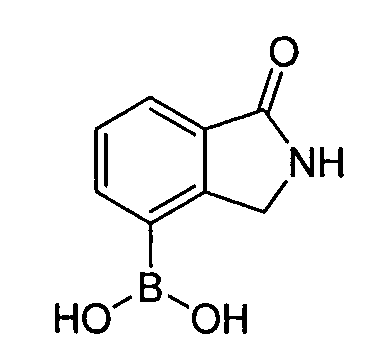
A. 1-Оксоизоиндолин-4-илбороновая кислота. К раствору 4-бромизоиндолин-1-она (3,0 г, 14,2 ммоль) в безводном тетрагидрофуране (50 мл) добавляли по каплям н-бутиллитий (2,5 M в гексан, 12 мл, 30 ммоль) при -78°C в атмосфере азота. После перемешивания в течение 1 часа при этой температуре добавляли по каплям раствор триметилбората (4,41 г, 40,0 ммоль) в безводном тетрагидрофуране (20 мл). Реакционную смесь перемешивали при -78°C в течение 2 часов и при комнатной температуре в течение ночи. Реакцию гасили путем добавления 1 н водного раствора хлористоводородной кислоты и осадок собирали и промывали водой с получением 1-оксоизоиндолин-4-илбороновой кислоты (400 мг, 16% выход) в виде твердого вещества. MS (ESI): m/z 178,1 [M+1]+.
Промежуточное соединение 11: трет-Бутил 2-(1-оксо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)изоиндолин-2-ил)этилкарбамат
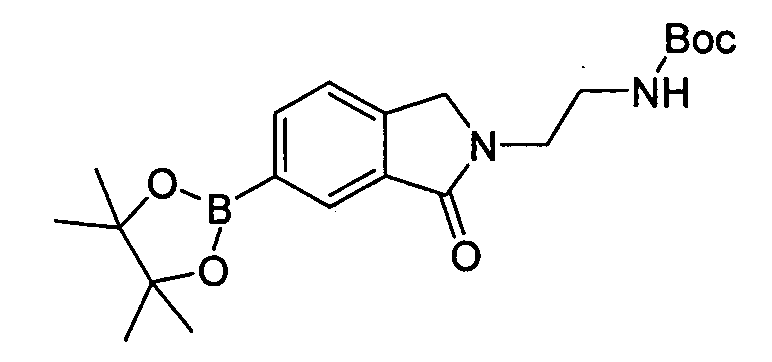
A. трет-Бутил 2-(6-бром-1-оксоизоиндолин-2-ил)этилкарбамат. Раствор метил 5-бром-2-(бромметил)бензоата (3 г, 0,01 моль) и трет-бутил 2-аминоэтилкарбамата (3,15 г, 0,02 ммоль) в метаноле (50 мл) нагревали при кипячении с обратным холодильником в атмосфере азота в течение ночи. После охлаждения до комнатной температуры, реакционную смесь фильтровали и фильтрат концентрировали в вакууме с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 50% этилацетата в петролейном эфире) с получением трет-бутил 2-(6-бром-1-оксоизоиндолин-2-ил)этилкарбамата (2,5 г, 71% выход) в виде твердого вещества. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,85 (с, 1H), 7,72 (д, J=8,0 Гц, 1H), 7,49 (д, J=7,6 Гц, 1H), 4,52 (с, 2H), 3,68 (т, J=5,6 Гц, 2H), 3,34 (т, J=5,6 Гц, 2H), 1,30 (с, 9H).
B. трет-Бутил 2-(1-оксо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)изоиндолин-2-ил)этилкарбамат. Дегазированный раствор трет-бутил 2-(6-бром-1-оксоизоиндолин-2-ил)этилкарбамата (750 мг, 2,11 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан)а (1,07 г, 4,22 ммоль), ацетата калия (409 мг, 4,22 ммоль) и 1,1'- бис(дифенилфосфино)ферроценпалладийдихлорида (153 мг, 0,2 ммоль) в диоксане (20 мл) нагревали до 90°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры, реакционную смесь фильтровали и фильтрат концентрировали в вакууме с получением неочищенного продукта, который очищали при помощи хроматографии на силикагеле (элюируя при помощи 50% этилацетата в петролейном эфире) с получением трет-бутил 2-(1-оксо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)изоиндолин-2-ил)этилкарбамата (600 мг, 71% выход) в виде твердого вещества. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,12 (с, 1H), 7,95 (д, J=7,6 Гц, 1H), 7,56 (д, J=7,2 Гц, 1H), 4,58 (с, 2H), 3,70 (т, J=5,6 Гц, 2H), 3,35 (т, J=5,6 Гц, 2H), 1,36 (с, 9H), 1,30 (с, 6H), 1,24 (с, 6H).
Промежуточное соединение 12: трет-Бутил 2-(1-оксо-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)изоиндолин-2-ил)этилкарбамат
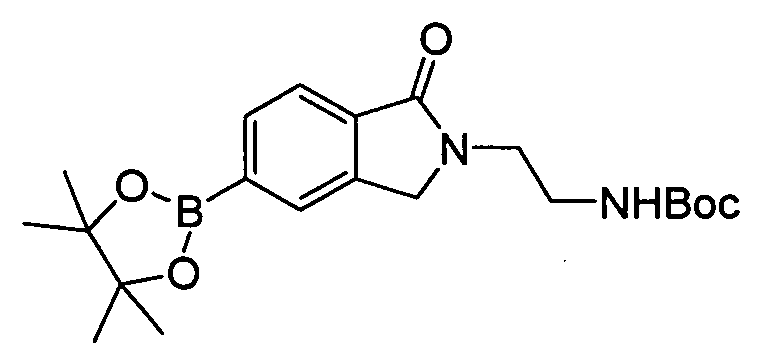
A. трет-Бутил 2-(5-бром-1-оксоизоиндолин-2-ил)этилкарбамат. К раствору метил 4-бром-2-(бромметил)бензоата (5 г, 16,3 ммоль) в метаноле (50 мл) добавляли трет-бутил 2-аминоэтилкарбамат (5,12 г, 32 ммоль) и смесь перемешивали при 65°C в течение ночи. Растворитель удаляли и остаток очищали на колонке с силикагелем с получением трет-бутил 2-(5-бром-1-оксоизоиндолин-2-ил)этилкарбамата (3,58 г, 63% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,85 (с, 1H), 7,63 (д, J=8,0 Гц, 1H), 7,56 (д, J=8,0 Гц, 1H), 6,92 (шир.с, 1H), 4,46 (с, 2H), 3,50 (т, J=6,0 Гц, 2H), 3,14 (т, J=6,0 Гц, 2H), 1,26 (с, 9H).
B. трет-Бутил 2-(1-оксо-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)изоиндолин-2-ил)этилкарбамат. Дегазированную смесь трет-бутил 2-(5-бром-1-оксоизоиндолин-2-ил)этилкарбамата (0,89 г, 2,5 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан)а (1,27 г, 5,0 ммоль), 1,1'-бис(дифенилфосфино)ферроценпалладийдихлорида (0,19 г, 0,25 ммоль) и ацетата калия (0,61 г, 6,25 ммоль) в диоксане (25 мл) нагревали при 80°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры, реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта, который очищали при помощи хроматографии на силикагеле (элюируя при помощи 10% этилацетата в петролейном эфире) с получением трет-бутил 2-(1-оксо-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)изоиндолин-2-ил)этилкарбамата (600 мг, 60% выход) в виде белого твердого вещества. MS (ESI): m/z 303,0 [M-99]+.
Промежуточное соединение 13: трет-Бутил 2-(5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол-1-ил)этилкарбамат
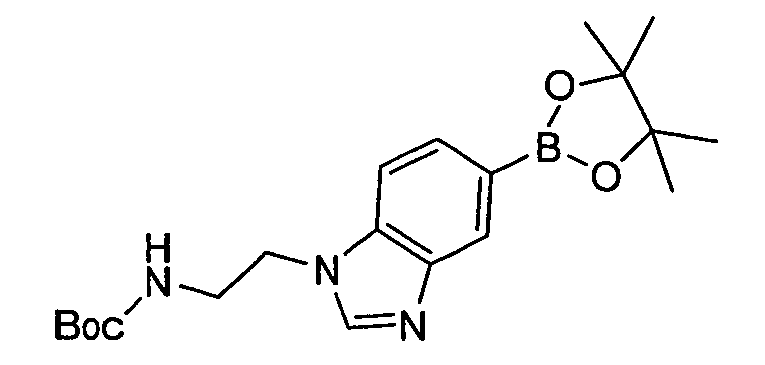
A. трет-Бутил 2-(4-бром-2-нитрофениламино)этилкарбамат. Раствор 4-бром-1-фтор-2-нитро-бензола (3,2 г, 13,7 ммоль), трет-бутил 2-аминоэтилкарбамата (4,8 г, 30,0 ммоль) в N,N-диметилформамиде (100 мл) перемешивали при 120°C в течение ночи. Реакционную смесь концентрировали при пониженном давлении с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 10% этилацетата в петролейном эфире) с получением неочищенного трет-бутил 2-(4-бром-2-нитрофениламино)этилкарбамата (5,4 г, 100% выход) в виде желтого твердого вещества. MS (ESI): m/z 305,8 [M+1]+.
B. трет-Бутил 2-(2-амино-4-бромфениламино)этилкарбамат. Раствор трет-бутил 2-(4-бром-2-нитрофениламино)этилкарбамата (5,4 г, 15 ммоль), цинковой пыли (9,80 г, 150 ммоль) и хлорида аммония (8,10 г, 150 ммоль) в смеси тетрагидрофурана и метанола (об/об, 1:1, 100 мл) перемешивали при комнатной температуре в течение 12 часов. После фильтрования фильтрат концентрировали при пониженном давлении и остаток растворяли в этилацетате. Органический раствор промывали водой три раза, сушили над сульфатом натрия и концентрировали в вакууме с получением трет-бутил 2-(2-амино-4-бромфениламино)этилкарбамата (4,8 г, 97% выход) в виде желтого твердого вещества. MS (ESI): m/z 329,9 [M+1]+.
C. трет-Бутил 2-(5-бром-1Н-бензо[d]имидазол-1-ил)этилкарбамат. Смесь трет-бутил 2-(2-амино-4-бромфениламино)этилкарбамата (1,55 г, 4,7 ммоль) в триэтилортоформиате (100 мл) нагревали при 100°C в течение 1,5 часов. Триэтилортоформиат удаляли при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 5% этилацетата в петролейном эфире) с получением трет-бутил 2-(5-бром-1H-бензо[d]имидазол-1-ил)этилкарбамата (3,0 г, 61% выход). MS (ESI): m/z 341,7 [M+1]+.
D. трет-Бутил 2-(5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол-1-ил)этилкарбамат. Дегазированную смесь трет-бутил 2-(5-бром-1H-бензо[d]имидазол-1-ил)этилкарбамата (1,02 г, 3,00 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан)а (2,29 г, 9,00 ммоль), 1,1'-бис(дифенилфосфино)ферроценпалладийдихлорида (0,23 г, 0,30 ммоль) и ацетата калия (0,74 г, 7,50 ммоль) в 1,4-диоксане (30 мл) нагревали при 100°C в течение ночи в атмосфере азота. Растворитель удаляли при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя этилацетатом) с получением трет-бутил 2-(5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)- 1H-бензо[d]имидазол-1-ил)этилкарбамата (0,90 г, 77% выход) в виде твердого вещества. MS (ESI): m/z 388,2 [M+1]+.
Промежуточное соединение 14: N-Метил-6-(4,4,S,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол-2-амин
A. 5-Бром-1H-бензо[d]имидазол-2(3Н)-он. Раствор 4-бромбензол-1,2-диамина (5 г, 27,0 ммоль), триэтиламина (8,1 г, 81,0 ммоль) и трифосгена (3,96 г, 14,0 ммоль) в диоксане (20 мл) перемешивали при 120°C в течение ночи. Осадок собирали и промывали водой с получением 5-бром-1H-бензо[d]имидазол-2(3H)-она (3 г, 52% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,75 (шир.с, 2H), 7,04 (д, J=8,4 Гц, 1H), 7,02 (с, 1H), 6,84 (д, J=8,0 Гц, 1H); MS (ESI): m/z 212,8 [M+1]+.
B. 6-Бром-2-хлор-1H-бензо[d]имидазол. Смесь 5-бром-1H-бензо[d]имидазол-2(3H)-она (2 г, 9,4 ммоль) в фосфорил трихлориде (20 мл) нагревали при кипячении с обратным холодильником в течение ночи. Реакционную смесь концентрировали в вакууме. К остатку добавляли ледяную воду и водный слой экстрагировали этилацетатом и объединенные органический слой сушили над сульфатом натрия. Растворитель удаляли в вакууме с получением 6-бром-2-хлор-1H-бензо[d]имидазола (1,5 г, 69% выход) в виде твердого вещества. MS (ESI): m/z 232,7 [M+1]+.
C. 6-Бром-N-метил-1H-бензо[d]имидазол-2-амин. Раствор 6-бром-2-хлор-1H-бензо[J]имидазола (1 г, 4,35 ммоль), триэтиламина (1,4 г, 13,8 ммоль) и метиламингидрохлорида (430 г, 6,42 ммоль) в 1-метил-2-пирролидиноне (10 мл) перемешивали при 120°C в течение ночи. После охлаждения до комнатной температуры реакционную смесь экстрагировали этилацетатом. Объединенные органический слой сушили над сульфатом натрия и концентрировали с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 50% этилацетата в петролейном эфире) с получением 6-бром-N-метил-1H-бензо[d]имидазол-2-амина (400 мг, 43% выход). MS (ESI): m/z 227,8 [M+1]+.
D. N-метил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-бензо[d]имидазол-2-амин. Смесь 6-бром-N-метил-1H-бензо[d]имидазол-2-амина (500 мг, 2,2 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан)а (1,13 г, 4,4 ммоль) и ацетата калия (540 г, 5,5 ммоль) в диоксане (5 мл) дегазировали три раза и затем добавляли 1,1'-бис(дифенилфосфино)ферроценпалладийдихлорид (170 г, 0,22 ммоль). Полученную смесь нагревали при 100°C в атмосфере азота в течение ночи и растворитель удаляли при пониженном давлении. Остаток очищали на колонке с силикагелем (элюируя при помощи 50% этилацетата в петролейном эфире) с получением N-метил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол-2-амина (500 мг, 83% выход) в виде твердого вещества. MS (ESI): m/z 273,9 [M+1]+.
Промежуточное соединение 15: 1-Хлоризохинолин-7-илбороновая кислота.
A. 1-Хлоризохинолин-7-илбороновая кислота. Раствор 7-бром-1-хлоризохинолина (1 г, 4,1 ммоль) в тетрагидрофуране (5 мл) охлаждали до -78°C в атмосфере азота и добавляли триизопропилборат (2,4 г, 11,5 ммоль) с последующим добавлением по каплям н-бутиллития (5 мл, 1,5 M). Реакционную смесь нагревали до -20°C в течение 30 минут, гасили 1 M водным раствором хлористоводородной кислоты и нейтрализовали при помощи триэтиламина до pΗ=7. Остаток распределяли между водой и этилацетатом, водный слой экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили при помощи безводного сульфата магния и концентрировали с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя этилацетатом), с получением l-хлоризохинолин-7-илбороновой кислоты (0,5 г, 58,8% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,74 (с, 1H), 8,58 (шир.с, 2H), 8,28 (д, J=5,2 Гц, 1H), 8,19 (д, J=8,4 Гц, 1H), 7,98 (д, J=8,4 Гц, 1H), 7,85 (д, J=5,6 Гц, 1H); MS (ESI): m/z 208,1 [M+1]+.
Промежуточное соединение 16: трет-Бутил 6-бромбензо[d]изоксазол-3-илкарбамат
A. 4-Бром-2-(пропан-2-илиденаминоокси)бензонитрил. Смесь пропан-2-он оксима (730 мг, 10 ммоль) и трет-бутоксида калия (24 мг, 0,58 ммоль) в тетрагидрофуране (10 мл) перемешивали при 0°C в течение 1 часа и добавляли 4-бром-2-фторбензонитрил (1,0 г, 5,02 ммоль) при 0°C. Смесь нагревали при 55°C в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли водой и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 4-бром-2-(пропан-2-илиденаминоокси)бензонитрила (1,2 г, 94% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,75 (с, 1H), 7,53 (д, J=8,0 Гц, 1H), 7,27 (д, J=8,0 Гц, 1H), 2,14 (с, 3H), 2,07 (с, 3H); MS (ESI): m/z 254,8 [M+1]+.
B. 6-Бромбензо[d]изоксазол-3-амин. Раствор 4-бром-2-(пропан-2-илиденаминоокси)бензонитрила (1,2 г, 4,76 ммоль) в смеси хлористоводородной кислоты (5 M, 1 мл) и 2,2,2-трифторуксусной кислоты (4 мл) перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали при пониженном давлении с получением 6-бромбензо[d]изоксазол-3-амина (900 мг, 90% выход) в виде гидрохлоридной соли. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,76 (м, 2H), 7,41 (м, 1H), 6,50 (шир.с, 2H).
C. трет-Бутил 6-бромбензо[d]изоксазол-3-илкарбамат. Смесь 6-бромбензо[d]изоксазол-3-амина (900 мг, 4,25 ммоль), ди-трет-бутилдикарбоната (1,2 г, 5,1 ммоль), триэтиламина (686 мг, 6,8 ммоль) и N,N-диметилпиридин-4-амина (72 мг, 0,6 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение ночи. Добавляли воду и органический слой отделяли, водную фазу экстрагировали дихлорметаном. Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали при пониженном давлении. Неочищенный продукт очищали на колонке с силикагелем с получением трет-бутил 6-бромбензо[d]изоксазол-3-илкарбамата (900 мг, 68% выход) в виде твердого вещества. MS (ESI): m/z 313,9 [M+1]+.
Промежуточное соединение 17: 6-Бром-1-метил-1H-бензо[d]имидазол
A. 5-Бром-N-метил-2-нитроанилин. К раствору 4-бром-2-фтор-1-нитробензола (10 г, 0,043 моль) в этаноле (100 мл) добавляли метиламиновый спиртовой раствор (3 г, 0,1 моль) медленно при 0°C и смесь перемешивали при комнатной температуре в течение 3 часов. Смесь концентрировали с получением 5-бром-N-метил-2-нитроанилина в виде белого твердого вещества (9 г, 85,7%). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,23 (с, 1H), 7,98 (д, J=8,8 Гц, 1H), 7,14 (с, 1H), 6,80 (дд, J1=9,2 Гц, J2=2,0 Гц, 1H), 2,92 (д, J=4,8 Гц, 3H); MS (ESI): m/z 231,1 [M+1]+.
B. 5-Бром-N-метилбензол-1,2-диамин. 5-Бром-N-метил-2-нитроанилин (9 г, 0,039 моль), хлорид аммония (53 г, 0,39 моль) и цинковый порошок (21 г, 0,39 моль) смешивали в метаноле и тетрагидрофуране (об/об, 1:1, 80 мл) и смесь перемешивали при комнатной температуре в течение 4 часов. Раствор фильтровали и фильтрат концентрировали с получением неочищенного продукта, который распределяли между этилацетатом и водой, водный слой экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали с получением 5-бром-N-метилбензол-1,2-диамина в виде твердого вещества (7,5 г, 60% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 6,50 (д, J=8,0 Гц, 1H), 6,42 (д, J=8,4 Гц, 1H), 6,38 (с, 1H), 4,87 (д, J=4,8 Гц, 1H), 4,59 (шир.с, 2H), 2,66 (д, J=5,2 Гц, 3H); MS (ESI): m/z 201,1 [M+1]+.
C. 6-Бром-1-метил-1H-бензо[d]имидазол. Раствор 5-бром-N-метилбензол-1,2-диамина (7,5 г, 0,037 ммоль) в муравьиной кислоте (25 мл) нагревали при кипячении с обратным холодильником в течение ночи. Растворитель удаляли при пониженном давлении с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 20-30% этилацетата в петролейном эфире), с получением 6-бром-1-метил-1H-бензо[d]имидазола в виде твердого вещества (6,5 г, 86% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,21 (с, 1H), 8,85 (с, 1H), 7,55 (д, J=8,0 Гц, 1H), 7,32 (д, J=8,4 Гц, 3H), 3,81 (с, 3H); MS (ESI): m/z 211,1 [M+1]+.
Промежуточное соединение 18: 6-Бром-2-метил-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол
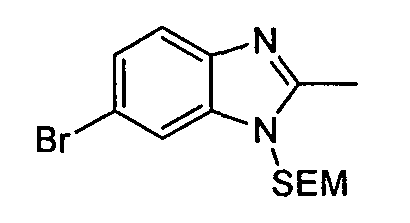
A. 6-Бром-2-метил-1H-бензо[d]имидазол. Раствор 4-бромбензол-1,2-диамина (3 г, 0,02 ммоль) в уксусной кислоте (20 мл) перемешивали при 120°C в течение ночи. Когда ТСХ анализ (3% дихлорметана в метаноле) показал, что исходное вещество было израсходовано, смесь доводили до pH=7 при помощи водного раствора карбоната натрия и водный слой экстрагировали этилацетатом. Объединенный органический слой сушили над сульфатом натрия и концентрировали с получением 6-бром-2-метил-1H-бензо[d]имидазола (2,8 г, 83% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 12,34 (шир.с, 1H), 7,60 (с, 1H), 7,37 (д, J=8,8 Гц, 1H), 7,20 (дд, J1=SA Гц, J2=2,0 Гц, 1H), 2,44 (с, 3H).
B. 6-Бром-2-метил-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол. Смесь 6-бром-2-метил-1H-бензо[d]имидазола (1 г, 4,76 ммоль) и гидрида натрия (60% в минеральном масле, 226 мг, 5,17 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при 0°C в течение 1 часа. Добавляли по каплям при этой температуре раствор (2-(хлорметокси)этил)триметилсилан (948 мг, 5,17 ммоль) в N,N-диметилформамиде (2 мл) и полученную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду и смесь экстрагировали этилацетатом. Органический слой сушили, концентрировали в вакууме и очищали при помощи хроматографии на силикагеле (элюируя при помощи 50% этилацетата в петролейном эфире) с получением 6-бром-2-метил-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазола (1,2 г, 75% выход) в виде твердого вещества. MS (ESI): m/z 341,9 [M+1]+.
Промежуточное соединение 19: трет-Бутил 5-бромбензо[d]изоксазол-3-илкарбамат
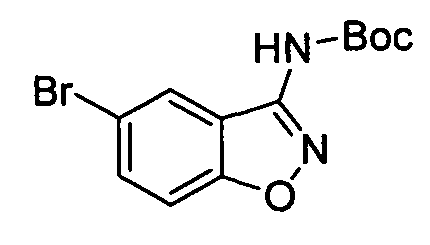
A. 5-Бром-2-(пропан-2-илиденаминоокси)бензонитрил. Смесь пропан-2-он оксима (730 мг, 10 ммоль) и трет-бутоксида калия (1,12 г, 10 ммоль) в тетрагидрофуране (10 мл) перемешивали при 0°C в течение 1 часа и добавляли 5-бром-2-фторбензонитрил (1,0 г, 5,02 ммоль) при 0°C. Полученную смесь нагревали при 55°C в течение 2 часов. После охлаждения до комнатной температуры, реакционную смесь разбавляли водой и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 5-бром-2-(пропан-2-илиденаминоокси)бензонитрила (800 мг, 64% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,64 (м, 2H), δ (м.д.) 7,47 (д, J=9,2 Гц, 1H), δ (м.д.) 2,17 (с, 3H), δ (м.д.) 2,07 (с, 3H); MS (ESI): m/z 254,7 [M+1]+.
B. 5-Бромбензо[d]изоксазол-3-амин. Раствор 5-бром-2-(пропан-2-илиденаминоокси)бензонитрила (504 мг, 2,0 ммоль) в смеси хлористоводородной кислоты (5 M, 1 мл) и 2,2,2-трифторуксусной кислоты (4 мл) перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали при пониженном давлении с получением 5-бромбензо[d]изоксазол-3-амина (324 мг, 76% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,70 (д, J=1,6 Гц, 1H), δ (м.д.) 7,62 (дд, J1=2,0 Гц, J2=8,8 Гц, 1H), δ (м.д.) 7,35 (д, J=9,2 Гц, 1H), 4,43 (шир.с, 2H).
C. трет-Бутил 5-бромбензо[d]изоксазол-3-илкарбамат. Смесь 5-бромбензо[d]изоксазол-3-амина (424 мг, 2,0 ммоль), ди-трет-бутилдикарбоната (654 мг, 3,0 ммоль), триэтиламина (808 мг, 8,0 ммоль) и N,N-диметилпиридин-4-амина (24 мг, 0,2 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение ночи. Добавляли воду, органический слой отделяли и водную фазу экстрагировали дихлорметаном. Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали при пониженном давлении. Неочищенный продукт очищали на колонке с силикагелем (элюируя при помощи 10% этилацетата в петролейном эфире) с получением трет-бутил 5-бромбензо[d]изоксазол-3-илкарбамата (476 мг, 76% выход) в виде твердого вещества. MS (ESI): m/z 313,9 [M+1]+.
Промежуточное соединение 20: 2-Фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрил
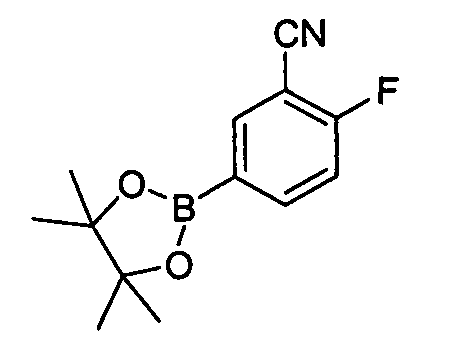
A. 2-Фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрил. Смесь 5-бром-2-фторбензонитрила (3 г, 0,015 моль), 4,4,4',4',5,5,5,5'-октаметил-2,2'-би(1,3,2-диоксаборолан)а (7,6 г, 0,03 моль) и ацетата калия (3,6 г, 0,038 ммоль) в диоксане (10 мл) дегазировали три раза и добавляли 1,1'-бис(дифенилфосфино)ферроценпалладийдихлорид (1,1 г, 1,5 ммоль). Полученную смесь нагревали при 100°C в течение ночи и растворитель удаляли при пониженном давлении. Остаток очищали на колонке с силикагелем (элюируя при помощи 25% этилацетата в петролейном эфире) с получением 2-фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрила (1 г, 27,0% выход) в виде твердого вещества. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,05 (м, 2H), 7,37 (т, J=9,2 Гц, 1H), 1,37 (с, 12H); MS (ESI): m/z 248,1 [M+1]+.
Промежуточное соединение 21: 6-Иод-1-((2-(триметилсилил)этокси)метил)-1H-индазол
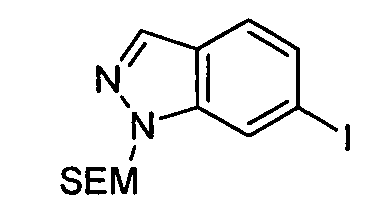
A. 6-Нитро-1H-индазол. К раствору 2-метил-5-нитро-фениламина (50 г, 329 ммоль) в хлористоводородной кислоте (5 M, 200 мл) добавляли раствор нитрита натрия (45 г, 658 ммоль) при 0°C и реакционную смесь нагревали при 60°C в течение ночи. Осадок собирали фильтрованием, промывали водой и сушили в вакууме с получением 6-нитро-1H-индазола (40 г, 75% выход) в виде гидрохлоридной соли.
B. 6-Нитро-1-((2-(триметилсилил)этокси)метил)-1Н-индазол. К раствору 6-нитро-1H-индазола (8 г, 49 ммоль) в N,N-диметилформамиде (80 мл) добавляли гидрид натрия (60% в минеральном масле, 4 г, 100 ммоль) по порциям при 0°C. После перемешивания при этой температуре в течение 1 часа добавляли по каплям раствор (2-хлорметокси-этил)триметилсилана (8,3 г, 50 ммоль) в N,N-диметилформамиде (30 мл) и полученную смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали при пониженном давлении и остаток очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 5-20% этилацетата в петролейном эфире) с получением 6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазола (5,8 г, 40% выход). MS (ESI): m/z 293,9 [M+1]+.
C. 1-((2-(Триметилсилил)этокси)метил)-1Н-индазол-6-амин. К смеси 6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазола (5,8 г, 19,8 ммоль) и хлорида аммония (53,5 г, 198 ммоль) в смеси метанол и тетрагидрофурана (100 мл, об/об=1:1) добавляли цинковую пыль (13 г, 198 ммоль) при 0°C и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали и фильтрат концентрировали с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 5% этилацетата в петролейном эфире), с получением 1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-амина (3,5 г, 67% выход) в виде твердого вещества. MS (ESI): m/z 263,9 [M+1]+.
D. 6-Иод-1-((2-(триметилсилил)этокси)метил)-1H-индазол. К раствору 1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-амина (3,4 г, 13 ммоль) в хлористоводородной кислоте (20 мл, 6 M) добавляли раствор нитрита натрия (0,9 г, 13 ммоль) в воде (5 мл) при 0°C. После перемешивания в течение 30 минут добавляли раствор иодид калия (2,2 г, 13 ммоль) в воде (10 мл) добавляли в течение 30 минут и реакционную смесь перемешивали при комнатной температуре в течение ночи. Осадок собирали фильтрованием, промывали водой и сушили в вакууме с получением 6-иод-1-((2-(триметилсилил)этокси)метил)-1H-индазола (1,64 г, 33% выход) в виде твердого вещества. MS (ESI): m/z 375,1 [M+1]+.
Промежуточное соединение 22: 6-Иод-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d][1,2,3]триазол
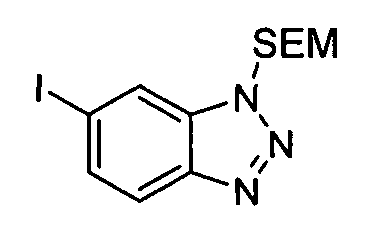
A. 4-Иодбензол-1,2-диамин. К смеси 4-иод-2-нитроанилина (10 г, 37,8 ммоль) и хлорида аммония (20 г, 378 ммоль) в смеси метанола и тетрагидрофурана (400 мл, об/об=1:1) добавляли цинковую пыль (24,6 г, 378 ммоль) по порциям при 0°C и реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь фильтровали и органический слой концентрировали с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 1% метанола в дихлорметане), с получением 4-иодбензол-1,2-диамин (7,6 г, 88% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 6,75 (с, 1H), 6,58 (м, 1H), 6,21 (м, 1H), 4,59 (шир.с, 4H).
B. 6-Иод-1Н-бензо[d][1,2,3]триазол. К раствору 4-иодбензол-1,2-диамина (6 г, 25,6 ммоль) в водном растворе серной кислоты (23,7 мл, 40%) добавляли по каплям раствор нитрита натрия (2,36 г, 34,3 ммоль) в воде (10 мл) при 0°C. Смесь перемешивали при комнатной температуре в течение 3 часов. Осадок собирали фильтрованием, промывали водой и сушили в условиях высокого вакуума с получением 6-иод-1H-бензо[d][1,2,3]триазола (5,6 г, 90% выход) в виде сульфатной соли. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,32 (с, 1H), 7,72 (д, J=8 Гц, 1H), 7,65 (д, J=8 Гц, 1H).
C. 6-Иод-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d][1,2,3]триазол. К смеси 6-иод-1H-бензо[d][1,2,3]триазола (5,6 г, 20 ммоль) в N,N-диметилформамиде (100 мл) добавляли гидрид натрия (60% в минеральном масле, 1,44 г, 36 ммоль) по порциям при 0°C. После перемешивания при 0°C в течение 1 часа, добавляли по каплям раствор (2-хлорметокси-этил)триметилсилана (3,98 г, 24 ммоль) в N,N-диметилформамиде (10 мл) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали при пониженном давлении и остаток очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 5-15% этилацетата в петролейном эфире) с получением 6-иод-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d][1,2,3]триазола (6,6 г, 88% выход). MS (ESI): m/z 376,2 [M+1]+.
Промежуточное соединение 23: 6-Иод-1-метил-1H-индазол
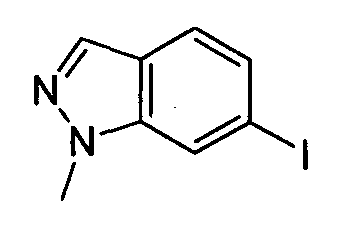
A. 1-метил-6-нитро-1H-индазол. К раствору 6-нитро-1H-индазола (20 г, 0,1 моль) в N,N-диметилформамиде (250 мл) добавляли гидрид натрия (60% в минеральном масле, 6,0 г, 0,15 моль) по порциям при 0°C. По завершении добавления смесь перемешивали в течение 30 минут при 0°C и добавляли иодметан (14,2 г, 0,1 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили путем добавления воды (500 мл) и смесь экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали. Остаток очищали на колонке с силикагелем (элюируя при помощи 5-10% этилацетата в петролейном эфире) с получением 1-метил-6-нитро-1H-индазола (11 г, 62% выход) в виде желтого твердого вещества. MS (ESI): m/z 178,7 [M+1]+.
B. 1-метил-1Н-индазол-6-амин. К смеси 1-метил-6-нитро-1H-индазола (1,77 г, 10 ммоль) и хлорид аммония (5,3 г, 100 ммоль) в смеси метанола и тетрагидрофурана (25 мл, об/об=l:l) добавляли цинковую пыль (6,5 г, 100 ммоль) по порциям при 0°C. По завершении добавления реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали и фильтрат концентрировали с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 1% метанола в дихлорметане) с получением 1-метил-1H-индазол-6-амина (1,1 г, 74,8% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,65 (с, 1H), 7,31 (д, J=8,0 Гц, 1H), 6,48 (д, J=8,0 Гц, 1H), 6,42 (с, 1H), 5,30 (шир.с, 2H), 3,78 (с, 3H).
C. 6-Иод-1-метил-1Н-индазол. К раствору 1-метил-1H-индазол-6-амина (1,0 г, 7 ммоль) в хлористоводородной кислоте (15 мл, 6 M) добавляли по каплям раствор нитрита натрия (0,48 г, 7 ммоль) в воде (2 мл) при 0°C. После перемешивания при этой температуре в течение 30 минут добавляли раствор иодида калия (1,16 г, 7 ммоль) в воде (10 мл) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Осадок собирали фильтрованием, промывали водой с получением 6-иод-1-метил-1H-индазола (0,8 г, 44% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,95 (с, 1H), 7,84 (с, 1H), 7,48 (д, J=8,0 Гц, 1H), 7,42 (д, J=8,0 Гц, 1H), 4,06 (с, 3H).
Промежуточное соединение 24: трет-Бутил 5-иодизоиндолин-2-карбоксилат
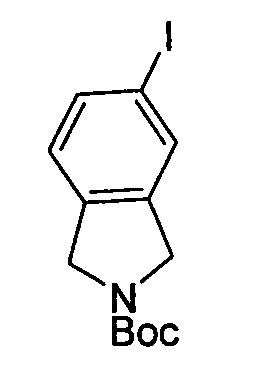
A. 5-Иодизоиндолин-1,3-дион. К раствору 5-аминоизоиндолин-1,3-диона (5 г, 0,03 моль) в 2 н хлористоводородной кислоте (20 мл) добавляли по каплям раствор нитрита натрия (2,1 г, 0,03 моль) в воде (10 мл) при 0°C и смесь перемешивали при этой температуре в течение 0,5 часов. Добавляли раствор иодида натрия (5,1 г, 0,03 моль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Осадок собирали фильтрованием, промывали водой с получением 5-иодизоиндолин-1,3-диона (4 г, 48% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,38 (с, 1H), 8,17 (д, J=7,6 Гц, 1H), 8,11 (с, 1H), 7,56 (д, J=8,0 Гц, 1H), 2,07 (с, 3H).
B. 5-Иодизоиндолин. К перемешиваемому раствору 5-иодизоиндолин-1,3-диона (700 мг, 2,57 ммоль) в безводном тетрагидрофуране (20 мл) при 0°C добавляли борогидрид натрия (974 г, 25,7 ммоль) по порциям и реакционную смесь охлаждали до -10°C. Добавляли по каплям комплекс трифторида бора с диэтиловым эфиром (3,9 мл, 25,7 ммоль). Реакционную смесь нагревали при кипячении с обратным холодильником в течение ночи. После охлаждения до комнатной температуры реакционную смесь выливали медленно в холодную воду (100 мл) при 0-5°C. Смесь разбавляли этилацетатом (480 мл) и смесь подщелачивали водным раствором гидроксида натрия (6 M) при 0-5°C до pH=10. Органический слой отделяли и промывали насыщенным солевым раствором (4×100 мл), сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученное масло разбавляли диэтиловым эфиром (100 мл) и подкисляли (pH~2) при помощи водного раствора хлористоводородной кислоты (6 M) при 0°C. Водный слой отделяли и подщелачивали водным раствором гидроксида натрия (6 н), смесь экстрагировали этилацетатом (400 мл). Органический слой промывали насыщенным солевым раствором (3×150 мл), сушили над сульфатом натрия и концентрировали при пониженном давлении с получением 5-иодизоиндолина (300 мг, 48% выход) в виде твердого вещества. MS (ESI): m/z 245,7 [M+1]+.
C. трет-Бутил 5-иодизоиндолин-2-карбоксилат. Смесь 5-иодизоиндолина (730 мг, 2,95 ммоль), ди-трет-бутилдикарбоната (1,2 г, 5,95 ммоль), триэтиламина (600 мг, 5,95 ммоль) и N,N-диметилпиридин-4-амина (72 мг, 0,6 ммоль) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение ночи. Добавляли воду и органический слой отделяли. Водную фазу экстрагировали дихлорметаном. Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали при пониженном давлении. Неочищенный продукт очищали на колонке с силикагелем с получением трет-бутил 5-иодизоиндолин-2-карбоксилата (800 мг, 79% выход) в виде твердого вещества.
Промежуточное соединение 25: N-(4-Хлорпиридин-2-ил)пиваламид
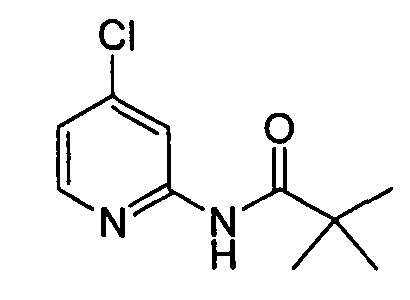
A. N-(4-Хлорпиридин-2-ил)пиваламид. К смеси 4-хлорпиридин-2-амина (1,7 г, 13,28 ммоль) и триэтиламина (1,61 г, 15,94 ммоль) в дихлорметане (30 мл) добавляли по каплям пивалоилхлорид (1,91 г, 15,94 ммоль) при 0°C. По завершении добавления смесь перемешивали при комнатной температуре в течение ночи. Смесь промывали водой три раза, органический слой сушили над безводным сульфатом натрия и концентрировали. Остаток сушили в вакууме с получением N-(4-хлорпиридин-2-ил)пиваламида (2,67 г, 95,0% выход) в виде белого твердого вещества. MS (ESI) m/z: 212,8 [M+1]+.
Промежуточное соединение 26: 4-Иод-N-метилбензамид
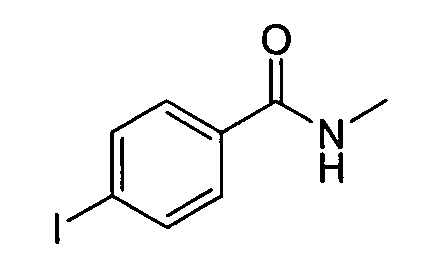
A. 4-Иод-N-метилбензамид. К раствору метанамина (15 мл) в воде (15 мл) добавляли по каплям 4-иод-бензоилхлорид (6 г, 22,6 ммоль) при 0°C. Смесь перемешивали при комнатной температуре и реакцию отслеживали при помощи ТСХ. Через 5 часов реакционную смесь экстрагировали дихлорметаном, органический слой сушили над сульфатом натрия и упаривали с получением 4-иод-N-метилбензамида (4,0 г, 68% выход), который использовали без дополнительной очистки. MS (ESI): m/z 262,1[M+1]+.
Промежуточное соединение 27: 4-Иод-N-(1-метилпиперидин-4-ил)бензамид
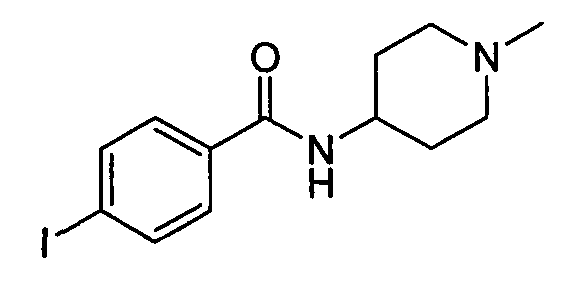
A. 4-Иод-N-(1-метил-пиперидин-4-ил)бензамид. К раствору 1-метилпиперидин-4-амина (0,91 г, 8 ммоль) и триэтиламина (1,21 г, 12 ммоль) в дихлорметане (10 мл) добавляли по каплям 4-иод-бензоилхлорид (1,06 г, 4 ммоль) при 0°C в атмосфере азота. Смесь нагревали медленно до комнатной температуры и перемешивали в течение ночи. Реакционную смесь выливали в ледяную воду и органический слой отделяли, водную фазу экстрагировали дихлорметаном. Объединенный органический слой сушили над сульфатом натрия и упаривали с получением 4-иод-N-(1-метил-пиперидин-4-ил)бензамида (1,10 г, 79,7% выход), который использовали без дополнительной очистки. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,72 (м, 2H), 7,42 (д, J=8,4 Гц, 2H), 5,92 (шир.с, 1H), 3,92 (м, 1H), 2,79 (д, J=11,2 Гц, 2H), 2,24 (с, 3H), 2,12 (т, J=11,2 Гц, 2H), 1,97 (д, J=11,2 Гц, 2H), 1,57 (м, 3H).
Промежуточное соединение 28: трет-Бутил 6-бром-1-метил- 1Н-индазол-3-илкарбамат
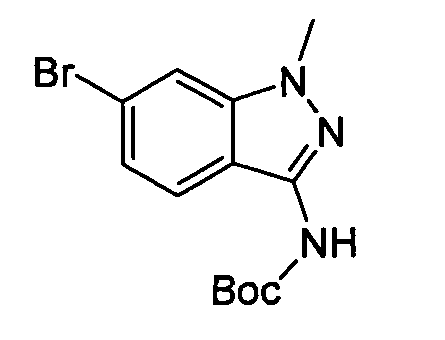
A. 6-Бром-1H-индазол-3-амин. К раствору 4-бром-2-фторбензонитрила (2 г, 10 ммоль) в бутан-1-оле (30 мл) добавляли по каплям гидразингидрат (2 мл, 40 ммоль) и реакционную смесь нагревали при 100°C в течение ночи. Растворитель удаляли при пониженном давлении и осадок собирали фильтрованием, промывали водой и сушили в вакууме с получением 6-бром-1H-индазол-3-амина (2,11 г, 98% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,47 (с, 1H), 7,32 (д, J=8,4 Гц, 1H), 7,39 (с, 1H), 6,99 (д, J=8,4 Гц, 1H), 5,42 (шир.с, 2H).
B. 6-Бром-1-метил-1H-индазол-3-амин. К раствору 6-бром-1H-индазол-3-амина (2,11 г, 10 ммоль) в N,N-диметилформамиде (10 мл) добавляли гидрид натрия (60% в минеральном масле, 0,4 г, 10 ммоль) по порциям при 0°C. По завершении добавления смесь перемешивали в течение 30 минут при 0°C и добавляли иодметан (1,42 г, 10 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили путем добавления воды (50 мл) и смесь экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали. Остаток очищали на колонке с силикагелем (элюируя при помощи 10-25% этилацетата в петролейном эфире) с получением 6-бром-1-метил-1H-индазол-3-амина (1,36 г, 61% выход) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,60 (м, 2H), 6,99 (д, J=8,0 Гц, 1H), 5,52 (с, 2H), 3,68 (с, 3H); MS (ESI): m/z 326,1 [M+1]+.
C. трет-Бутил 6-бром-1-метил-1H-индазол-3-илкарбамат. Смесь 6-бром-1-метил-1H-индазол-3-амина (1,36 г, 6 ммоль), ди-трет-бутилдикарбоната (2,62 г, 12 ммоль), триэтиламина (1,22 г, 12 ммоль) и N,N-диметилпиридин-4-амина (24 мг, 0,2 ммоль) в дихлорметане (40 мл) перемешивали при комнатной температуре в течение ночи. Добавляли воду и органический слой отделяли, водную фазу экстрагировали дихлорметаном. Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали при пониженном давлении. Неочищенный продукт очищали на колонке с силикагелем (элюируя при помощи 10% этилацетата в петролейном эфире) с получением трет-бутил 6-бром-1-метил-1H-индазол-3-илкарбамата (480 мг, 25% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,80 (с, 1H), 7,29 (д, J=8,4 Гц, 1H), 7,16 (д, J=8,4 Гц, 1H), 3,98 (с, 3H), 1,41 (с, 9H); MS (ESI): m/z 426,1 [M+1]+.
Промежуточное соединение 29: Смесь 1-(тетрагидро-2H-пиран-2-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазола и 1-(тетрагидро-2H-пиран-2-ил)-5-(4,4,5,5- тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазола
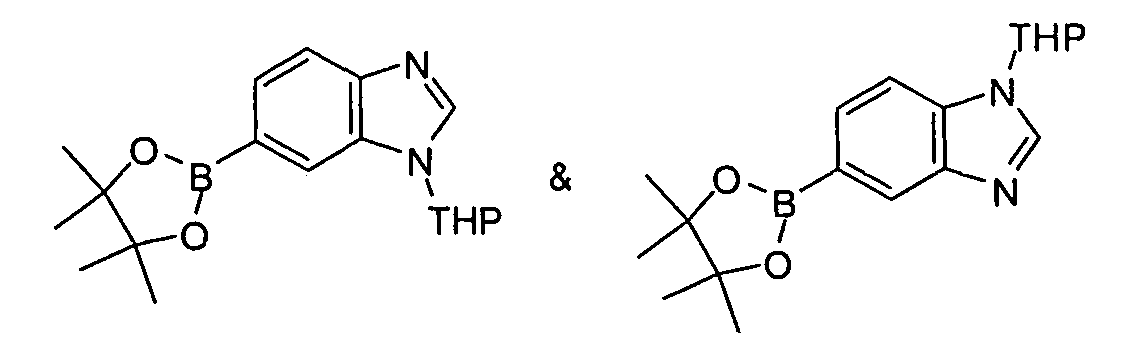
A. 6-Бром-1H-бензо[d]имидазол. Смесь 4-бромбензол-1,2-диамина (2 г, 0,011 моль), триэтилортоформиата (10 мл) и пиридиний п-толуолсульфонат (300 мг, 0,001 моль) нагревали при кипячении с обратным холодильником в течение ночи. Смесь упаривали в вакууме. Остаток очищали на колонке с силикагелем (элюируя при помощи 10-20% этилацетата в петролейном эфире) с получением 6-бром-1H-бензо[d]имидазола (1,3 г, 65% выход). 1H ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 12,60 (шир.с, 1H), 8,24 (с, 1H), 7,83 (м, 1H), 7,60 (м, 1H), 7,32 (м, 1H).
B. 6-Бром-1-(тетрагидро-2Н-пиран-2-ил)-1H-бензо[d]имидазол и 5-бром-1-(тетрагидро-2H-пиран-2-ил)-1H-бензо[d]имидазол. Смесь 6-бром-1H-бензо[d]имидазола (1,3 г, 6,6 ммоль), 3,4-дигидро-2H-пирана (7 мл) и п-толуолсульфоновой кислоты (300 мг, 1,57 ммоль) в тетрагидрофуране (50 мл) нагревали при 60°C в течение ночи. Реакционную смесь выливали в ледяную воду и водную фазу экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия, фильтровали и фильтрат упаривали при пониженном давлении. Остаток очищали на колонке с силикагелем (элюируя при помощи 2-10% этилацетата в петролейном эфире) с получением смеси 6-бром-1-(тетрагидро-2H-пиран-2-ил)-1H-бензо[d]имидазола и 5-бром-1-(тетрагидро-2H-пиран-2-ил)-1H-бензо[d]имидазола (800 мг, 44% выход).
C. 1-(Тетрагидро-2H-пиран-2-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол и 1-(тетрагидро-2H-пиран-2-ил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазол. Дегазированную смесь 6-бром-1-(тетрагидро-2H-пиран-2-ил)-1H-бензо[d]имидазола и 5-бром-1-(тетрагидро-2H-пиран-2-ил)-1H-бензо[d]имидазола (800 мг, 2,8 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан)а (1,4 г, 5,6 ммоль), ацетата палладия (65 мг, 0,28 ммоль), трифенилфосфина (220 мг, 0,84 ммоль) и фосфата калия (1 г, 4,7 ммоль) в 1,2-диметоксиэтане (15 мл) нагревали при 100°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры, смесь фильтровали и фильтрат упаривали под давлениием. Остаток очищали на колонке с силикагелем с получением смеси 1-(тетрагидро-2H-пиран-2-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазола и 1-(тетрагидро-2H-пиран-2-ил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-бензо[d]имидазола (470 мг, выход 51%). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,48 (с, 0,55H), 8,42 (с, 0,45H), 7,95 (с, 0,45H), 7,93 (с, 0,55H), 7,60-7,54 (м, 2H), 5,79 (дд, J1=10,4 Гц, J2=2,0 Гц, 0,55H), 5,69 (дд, J1=10,4 Гц, J2=2,0 Гц, 0,45H), 3,99 (м, 1H), 3,77 (м, 1H), 2,20-1,60 (м, 6H), 1,32 (с, 12H).
Промежуточное соединение 30: 1-(Тетрагидро-2H-пиран-2-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индазол
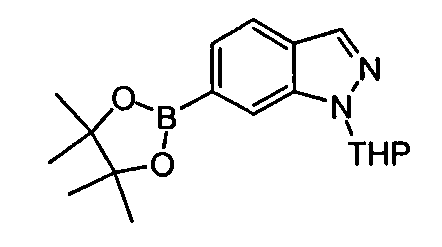
A. 6-Бром-1H-индазол. Смесь 4-бром-2-фторбензальдегида (2 г, 10 ммоль) и водного раствора гидразина (10 мл, 85%) нагревали при кипячении с обратным холодильником в течение ночи. После охлаждения до комнатной температуры реакционную смесь экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и упаривали при пониженном давлении. Неочищенный продукт очищали на колонке с силикагелем (элюируя при помощи 10-20% этилацетата в петролейном эфире) с получением 6-бром-1H-индазола (1,3 г, 68% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 13,17 (шир.с, 1H), 8,09 (с, 1H), 7,75 (с, 1H), 7,73 (д, J=8,8 Гц, 1H), 7,23 (дд, J1=8,8 Гц, J2=1,6 Гц, 1H).
B. 6-Бром-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол. Смесь 6-бром-1H-индазола (1,3 г, 6,6 ммоль), 3,4-дигидро-2H-пирана (7 мл) и п-толуолсульфоновой кислоты (300 мг, 1,57 ммоль) в тетрагидрофуране (50 мл) нагревали при 60°C в течение ночи. Реакционную смесь выливали в ледяную воду и водную фазу экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и фильтровали. Фильтрат упаривали при пониженном давлении. Остаток очищали на колонке с силикагелем (элюируя при помощи 5-15% этилацетата в петролейном эфире) с получением 6-бром-1-(тетрагидро-2H-пиран-2-ил)-1H-индазола (800 мг, выход 44%). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,13 (с, 1H), 8,03 (с, 1H), 7,74 (д, J=8,4 Гц, 1H), 7,32 (дд, J1=8,4 Гц, J2=1,6 Гц, 1H), 5,88 (дд, J1=9,6 Гц, J2=2,4 Гц, 1H), 3,90-3,70 (м, 2H), 2,40 (м, 1H), 2,05-1,90 (м, 2H), 1,65 (м, 1H), 1,53-1,45 (м, 2H).
C. 1-(Тетрагидро-2H-пиран-2-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индазол. Дегазированную смесь 6-бром-1-(тетрагидро-2H-пиран-2-ил)-1H-индазола (800 мг, 2,8 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан)а (1,4 г, 5,6 ммоль), ацетата палладия (65 мг, 0,28 ммоль), трифенилфосфина (220 мг, 0,84 ммоль) и фосфата калия (1 г, 4,7 ммоль) в 1,2-диметоксиэтане (15 мл) нагревали при 100°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры смесь фильтровали и фильтрат упаривали при пониженном давлении. Остаток очищали на колонке с силикагелем (элюируя при помощи 5-15% этилацетата в петролейном эфире) с получением 1-(тетрагидро-2H-пиран-2-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индазола (470 мг, 51% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,13 (с, 1H), 7,99 (с, 1H), 7,77 (д, J=8,4 Гц, 1H), 7,45 (д, J=8,0 Гц, 1H), 5,98 (дд, J1=9,6 Гц, J2=2,4 Гц, 1H), 3,83-3,77 (м, 2H), 2,39 (м, 1H), 2,01-1,96 (м, 2H), 1,81 (м, 1H), 1,58-1,56 (м, 2H), 1,32 (с, 12H).
Промежуточное соединение 31: 1-(6-Бром-1-((2-(триметилсилил)этокси)метил)-1Н-бензо[d]имидазол-2-ил)-N,N-диметилметанамин
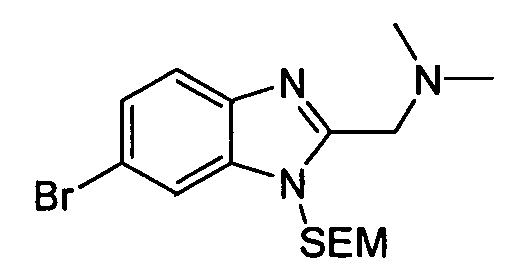
A. 6-Бром-2-(хлорметил)-1H-бензо[d]имидазол. Смесь 4-бромбензол-1,2-диамина (1,8 г, 0,01 моль) и гидрохлорида этил 2-хлорацетимидата (1,59 г, 0,01 моль) в безводном этаноле (20 мл) перемешивали при комнатной температуре в течение 4 часов. Растворитель удаляли при пониженном давлении, остаток выливали в воду и водный слой экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия, фильтровали и фильтрат концентрировали в вакууме с получением 6-бром-2-(хлорметил)-1H-бензо[d]имидазола (2,0 г, 82% выход) в виде твердого вещества. MS (ESI): m/z 246,7 [M+1]+.
B. 1-(6-Бром-1H-бензо[d]мидазол-2-ил)-N,N-диметилметанамин. Смесь 6-бром-2-(хлорметил)-1H-бензо[d]имидазола (2,0 г, 8,23 ммоль) и водного раствора диметиламина (6,7 г, 0,04 моль) в ацетонитриле (25 мл) перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении с получением неочищенного продукта, который очищали при помощи хроматографии на силикагеле (элюируя этилацетатом) с получением 1-(6-бром-1H-бензо[d]имидазол-2-ил)-N,N-диметилметанамина (1,2 г, 57,7% выход) в виде твердого вещества. MS (ESI): m/z 255,8 [M+1]+.
C. 1-(6-Бром-1-((2-(триметилсилил)этокси)метил)-1Н-бензо[d]имидазол-2-ил)-N,N-диметилметанамин. К раствору 1-(6-бром-1H-бензо[d]имидазол-2-ил)-N,N-диметилметанамина (1,1 г, 4,35 ммоль) в N,N-диметилформамиде (10 мл) при 0°C добавляли гидрид натрия (191 мг, 4,78 ммоль) по порциям в атмосфере азота. По завершении добавления смесь перемешивали при 0°C в течение 30 минут, добавляли (2-(хлорметокси)этил)триметилсилан (794 мг, 4,78 ммоль) и полученную смесь перемешивали при 0°C в течение 1 часа, затем нагревали до комнатной температуры и перемешивали в течение ночи. Добавляли воду и полученную смесь экстрагировали этилацетатом. Органический слой концентрировали в вакууме и остаток очищали на колонке с силикагелем (элюируя при помощи 50% этилацетата в петролейном эфире) с получением 1-(6-бром-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)-N,N-диметилметанамина (1,2 г, 72,3% выход) в виде твердого вещества. MS (ESI): m/z 385,9 [M+1]+.
Промежуточное соединение 32: 6-Бром-2-метоксихинолин
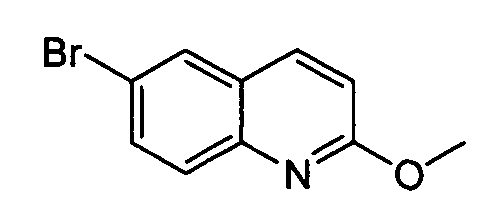
A. 3,4-Дигидрохинолин-2(1Н)-он. Смесь (Е)-3-(2-нитрофенил)акриловой кислоты (60 г, 0,31 моль) и палладия на угле (10% масс/масс, 6 г) в метаноле (1 л) гидрировали при давлении водорода 50 ф/дюйм2(3,515 кг/см2) при комнатной температуре в течение ночи. Катализатор отфильтровывали и фильтрат концентрировали с получением 3,4-дигидрохинолин-2(1H)-он (36 г, 79% выход) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,01 (с, 1H), 7,07 (м, 2H), 6,84 (м, 1H), 6,79 (м, 1H), 2,80 (т, J=7,2 Гц, 2H), 2,38 (т, J=7,2 Гц, 2H).
B. 6-Бром-3,4-дигидрохинолин-2(1Н)-он. Смесь 3,4-дигидрохинолин-2(1H)-она (10 г, 0,068 моль) и N-бромсукцинимида (4,3 г, 0,075 моль) в дихлорметане (300 мл) нагревали при 80°C в течение ночи. После охлаждения до комнатной температуры осадок отфильтровывали и фильтрат концентрировали. Остаток очищали на колонке с силикагелем (элюируя при помощи 10% этилацетата в петролейном эфире) с получением 6-бром-3,4-дигидрохинолин-2(1H)-она (9,5 г, 62% выход) в виде твердого вещества. MS (ESI): m/z 226,1 [M+1]+.
C. 6-Бром-2-хлорхинолин. Смесь 6-бром-3,4-дигидрохинолин-2(1H)-она (1 г, 4,4 ммоль), 2,3-дихлор-5,6-дициано-1,4-бензохинона (DDQ) (1 г, 4,5 ммоль) и окситрихлорида фосфора (3 мл) в толуоле (10 мл) перемешивали при 90°C в течение ночи. Растворитель выпаривали в вакууме, остаток разбавляли водой и полученную смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и упаривали при пониженном давлении с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 10-15% этилацетата в петролейном эфире), с получением 6-бром-2-хлорхинолина (960 мг, 91% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,38 (д, J=8,8 Гц, 1H), 8,32 (с, 1H), 7,91 (д, J=8,8 Гц, 1H), 7,85 (д, J=8,8 Гц, 1H), 7,62 (д, J=8,8 Гц, 1H).
D. 6-Бром-2-метоксихинолин. Металлический натрий (95 мг, 4,1 ммоль) растворяли в безводном метаноле (50 мл) и добавляли 6-бром-2-хлорхинолин (500 мг, 2,1 ммоль), затем смесь нагревали до 80°C в течение 5 часов. Растворитель выпаривали при пониженном давлении и остаток разбавляли водой. Полученную смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и упаривали при пониженном давлении с получением 6-бром-2-метоксихинолина (483 мг, 98% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,10 (д, J=9,2 Гц, 1H), 8,04 (с, 1H), 7,65 (д, J=8,8 Гц, 1H), 7,59 (д, J=8,8 Гц, 1H), 6,96 (д, J=9,2 Гц, 1H), 3,86 (с, 3H).
Промежуточное соединение 33: 6-Бром-1-метил-1H-бензотриазол
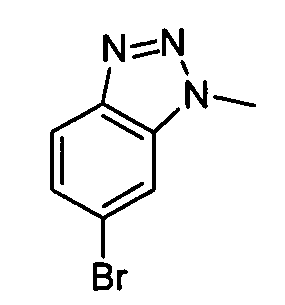
A. 6-Бром-1-метил-1H-бензо[d][1,2,3]триазол. К раствору 5-бром-N1-метилбензол-1,2-диамина (1,6 г, 8 ммоль) в хлористоводородной кислоте (5 M, 20 мл) добавляли раствор нитрита натрия (1,1 г, 16 ммоль) при 0°C и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Раствор нейтрализовали до pΗ=7~8 при помощи насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (20 мл ×3). Органический слой сушили над безводным сульфатом натрия, концентрировали в вакууме с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 0-10% этилацетата в петролейном эфире), с получением 6-бром-1-метил-1H-бензо[d]1,2,3]триазола (800 мг, 47% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,85 (д, J=8,8 Гц, 1H), 7,64 (д, J=1,6 Гц, 1H ), 7,40 (дд, J1=8,8 Гц J2=1,6 Гц, 1H), 4,19 (с, 3H); MS (ESI): m/z 212,2 [M+1]+.
Промежуточное соединение 34: гидрохлорид (±)-цис-3-аминоциклогексанола
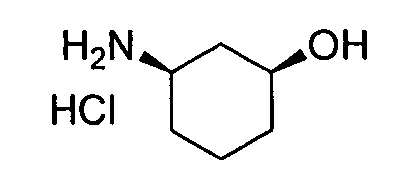
A. 2-(Циклогекс-2-енил)изоиндолин-1,3-дион. Трифенилфосфин на полимерной подложке (12,01 г, 30,6 ммоль), изоиндолин-1,3-дион (5,01 г, 34,1 ммоль) и циклогекс-2-енол (3,05 мл, 30,6 ммоль) отвешивали в 200-мл колбу. Добавляли тетрагидрофуран (60 мл). Смесь перемешивали и охлаждали до 0°C, затем добавляли по каплям диизопропилазодикарбоксилат (DIAD) (6,5 мл, 33,4 ммоль) в течение 2 минут. Реакционную смесь перемешивали и давали медленно нагреться до комнатной температуры. Через 20 часов реакционную смесь фильтровали через целит с использованием этилацетата, затем концентрировали до получения желтого твердого вещества. Это вещество растворяли в горячем этилацетате (~40 мл) и добавляли гексан (~15 мл), чтобы инициировать кристаллизацию побочного продукта. Желтую надосадочную жидкость сливали, концентрировали, затем снова растворяли в тетрагидрофуране и очищали флэш-хроматографией на силикагеле (0-20% этилацетата в гексане) с получением 2-(циклогекс-2-енил)изоиндолин-1,3-диона (3,2053 г, 14,10 ммоль, 46,1% выход). (ESI): m/z 228,6 [M+1]+.
B. Промежуточное соединение A. В 200-мл колбу добавляли 2-(циклогекс-2-енил)изоиндолин-1,3-дион (3,2053 г, 14,10 ммоль), хлороформ (50 мл) и этанол (2,0 мл). Раствор перемешивали при комнатной температуре и добавляли N-бромсукцинимид (3,19 г, 17,92 ммоль) (свежеперекристаллизованный из горячей воды). Колбу закрывали и реакционную смесь пемешивали при комнатной температуре. Через 16 часов реакцию гасили путем добавления 10% раствора бисульфита натрия, затем разбавляли этилацетатом и водой. Органический слой удаляли и водный слой экстрагировали этилацетатом. Объединенный органический раствор сушили над сульфатом магния, фильтровали и концентрировали, затем снова растворяли в дихлорметане и вводили в колонку Biotage 40+M. Элюирование продукта осуществляли с использованием 0-20% этилацетата/гексан, с получением желаемого Промежуточного соединения A (1,975 г, 5,61 ммоль, 39,8% выход) в виде бесцветного масла. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,78 (д, J=7,03 Гц, 1H), 7,59-7,66 (м, 1H), 7,50-7,57 (м, 2H), 5,58 (шир.с, 1H), 4,57 (шир.с, 1H), 4,38 (шир.с, 1H), 3,33-3,49 (м, 1H), 2,98-3,11 (м, 1H), 2,57 (д, J=14,45 Гц, 1H), 2,06-2,30 (м, 2H), 1,67 (д, J=14,84 Гц, 1H), 1,30-1,43 (м, 2H), 1,15 (т, J=7,03 Гц, 3H).
C. (±)-2-((1S,2R,3R)-2-Бром-3-гидроксициклогексил)изоиндолин-1,3-дион. Промежуточное соединение A (1,975 г, 5,61 ммоль) растворяли в метаноле (25 мл) и добавляли 2н раствор хлористоводородной кислоты (водн.) (5 мл, 10,00 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 часов, затем фильтровали через стеклянный фильтр со средним размером пор и белое твердое вещество промывали водой. Это твердое вещество сушили при комнатной температуре в вакууме с получением (±)-2-((1S,2R,3R)-2-бром-3-гидроксициклогексил)изоиндолин-1,3-диона (1,2218 г, 3,77 ммоль, 67,2% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,68-8,13 (м, 4H), 5,39 (д, J=6,64 Гц, 1H), 4,42-4,78 (м, 1H), 4,25 (тд, J=11,71, 4,30 Гц, 1H), 3,47-3,71 (м, 1H), 1,90-2,12 (м, 2H), 1,79-1,89 (м, 1H), 1,67-1,77 (м, 1H), 1,40-1,56 (м, 1H), 1,25-1,40 (м, 1H). (ESI): m/z 326,5 [M+1]+.
D. (±)-цис-2-(3-Гидроксициклогексил)изоиндолин-1,3-дион. (±)-2-((1S,2R,3R)-2-Бром-3-гидроксициклогексил)изоиндолин-1,3-дион (1,0933 г, 3,37 ммоль), трибутилстаннан (1,10 мл, 4,15 ммоль), толуол (18 мл), метанол (2 мл) и (E)-2,2'-(диазен-1,2-диил)бис(2-метилпропаннитрил) (AIBN) (0,039 г, 0,236 ммоль) добавляли в 100-мл колбу. Колба была снабжена обратным холодильником и вводом для азота, и аппарат продували азотом. Колбу затем помещали в 120°C масляную баню для перемешивания. Через 16 часов ЖХ/МС анализ показал отношение ~1:1 продукт:исходное вещество. К реакционной смеси добавляли еще одну порцию трибутилстаннана (1,1 мл, 3,37 ммоль) и (E)-2,2'-(диазен-1,2-диил)бис(2-метилпропаннитрил)а (AIBN) (0,051 г, 0,311 ммоль) и раствор нагревали до температуры кипения с обратным холодильником в течение 24 часов. Охлажденную реакционную смесь затем концентрировали до получения белого полутвердого вещества, снова растворяли в тетрагидрофуране и метаноле и вводили в колонку Biotage 40+M. Флэш-хроматография в 10-60% этилацетата/гексан дала желаемый (±)-цис-2-(3-гидроксициклогексил)изоиндолин-1,3-дион (0,5213 г, 2,125 ммоль, 63,0% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,78-7,91 (м, 2H), 7,66-7,76 (м, 2H), 4,18 (т, J=12,49 Гц, 1H), 3,71 (тд, J=10,25, 5,27 Гц, 1H), 2,27 (кв., J=11,84 Гц, 1H), 1,98-2,19 (м, 3H), 1,85-1,96 (м, 1H), 1,69 (д, J=12,49 Гц, 1H), 1,51 (д, J=5,47 Гц, 1H), 1,25-1,44 (м, 3H). (ΕSI): m/z 246,4 [M+1]+.
Ε. Гидрохлорид (±)-цис-3-аминоциклогексанола. В колбу, содержащую (±)-цис-2-(3-гидроксициклогексил)изоиндолин-1,3-дион (0,5213 г, 2,125 ммоль), добавляли этанол (10 мл), затем гидразингидрат (0,12 мл, 2,474 ммоль). Колбу закрывали и помещали для перемешивания в 80°C масляную баню. В течение 5 часов все содержимое растворялось. Через 20 часов к реакционной смеси снова добавляли гидразин (0,04 мл) и реакционную смесь нагревали до температуры кипения с обратным холодильником еще в течение 5 часов, к этому времени анализ ТСХ показал, что исходное вещество израсходовано. Реакционную смесь концентрировали до приблизительно половины объема, затем добавляли 1 мл концентрированной HCl. Суспензию концентрировали до получения твердого вещества, и это твердое вещество растирали в порошок с водой, фильтровали для удаления твердого осадка. Фильтрат концентрировали с получением желаемого гидрохлорида (±)-цис-3-аминоциклогексанола (0,3338 г, 2,201 ммоль, 104% выход) в виде соли HCl. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,04 (шир.с, 3H), 3,32-3,54 (м, 1H), 2,96 (д, J=4,69 Гц, 1H), 2,11 (д, J=11,71 Гц, 1H), 1,57-1,90 (м, 3H), 1,08-1,33 (м, 3H), 0,93-1,07 (м, 1H).
Промежуточное соединение 35: гидрохлорид транс-(4-аминоциклогексил)метанола
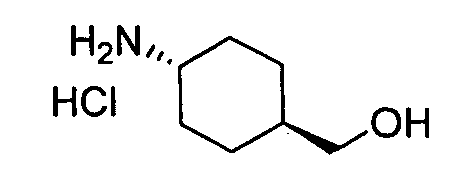
A. гидрохлорид транс-(4-аминоциклогексил)метанола. транс-4-(трет-Бутоксикарбониламино)циклогексанкарбоновую кислоту (2,5 г, 10,28 ммоль) растворяли в тетрагидрофуране (100 мл) и затем добавляли комплекс 1M боран•тетрагидрофуран (10,28 мл, 10,28 ммоль). Раствор нагревали до 60°C и затем к реакционной смеси добавляли по каплям метанол (25 мл). Реакционную смесь перемешивали 30 минут и затем концентрировали. К остатку добавляли 4н раствор хлористого водорода в диоксане, перемешивали в течение 5 минут и затем концентрировали. Это твердое вещество растирали в порошок в 10% метанола в этилацетате с получением белого твердого вещества (1,11 г, 6,70 ммоль, 65,2% выход). MS (ESI) m/z 230,4 [M]+.
Промежуточное соединение 36: гидрохлорид цис-(4-аминоциклогексил)метанола
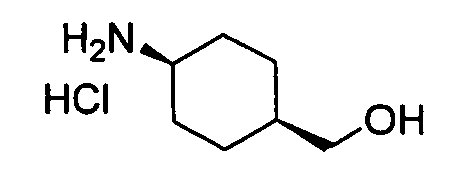
A. Гидрохлорид цис-(4-аминоциклогексил)метанола. К цис-4-аминоциклогексанкарбоновой кислоте (2 г, 13,97 ммоль) добавляли тетрагидрофуран (100 мл) и боран-метилсульфидный комплекс (13,26 мл, 140 ммоль). Раствор нагревали до 60°C в течение 24 часов в атмосфере азота. Реакцию гасили метанолом и затем концентрировали. Остаток очищали на колонке с силикагелем (0-100% этилацетата в гексане). Фракции, содержащие продукт, концентрировали и затем добавляли 4н раствор хлористого водорода в диоксане. Раствор концентрировали и затем растирали в порошок с 10% раствором метанола в этилацетате с получением белого твердого вещества (1,6 г, 9,66 ммоль, 69,1% выход). MS (ESI) m/z 130,1 [M]+.
Промежуточное соединение 37: гидрохлорид транс-2-(4-Аминоциклогексил)пропан-2-ола
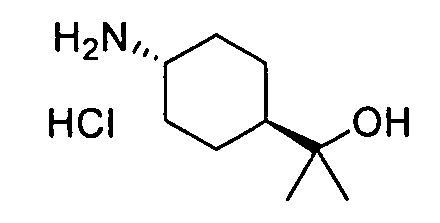
A. транс-Метил 4-(трет-бутоксикарбониламино)циклогексанкарбоксилат. транс-4-(трет-Бутоксикарбониламино)циклогексанкарбоновую кислоту (2 г, 8,22 ммоль), иодметан (0,771 мл, 12,33 ммоль), карбонат калия (3,41 г, 24,66 ммоль) и ацетон (20 мл) нагревали в колбе высокого давления до 70°C в течение 16 часов. Реакционную смесь фильтровали, концентрировали и очищали на колонке с силикагелем (элюируя при помощи 0-20% этилацетата в гексане). Фракции, содержащие продукт, концентрировали и затем растирали в порошок в гексане с получением белого твердого вещества (1,08 г, 4,20 ммоль, 51,1% выход). MS (ESI) m/z 258,4 [M] +.
B. Гидрохлорид транс-2-(4-аминоциклогексил)пропан-2-ола. транс-Метил 4-(трет-бутоксикарбониламино)циклогексанкарбоксилат (0,5 г, 1,943 ммоль) растворяли в тетрагидрофуране (3 мл) и затем охлаждали до -78°C в атмосфере азота. Добавляли метилмагнийбромид (6,48 мл, 19,43 ммоль, 3M в диэтиловом эфире) и реакционной смеси давали нагреться до комнатной температуры в течение 18 часов. Реакцию гасили путем добавления насыщенного раствора хлорида аммония и затем экстрагировали этилацетатом. Органический слой сушили над сульфатом магния, фильтровали и затем концентрировали. Остаток обрабатывали 4н раствором хлористого водорода в диоксане при комнатной температуре в течение 4 часов и затем концентрировали с получением белого твердого вещества. MS (ESI) m/z 158,3 [M+1] +.
Промежуточное соединение 38: N 2 -(4-метоксибензил)хинолин-2,6-диамин
A. 2-Хлор-6-нитрохинолин. К смеси 6-нитро-3,4-дигидрохинолин-2(1H)-она (1,5 г, 7,8 ммоль) и 2,3-дихлор-5,6-дициано-1,4-бензохинона (DDQ) (1,77 г, 7,8 ммоль) в толуоле (20 мл) добавляли по каплям оксихлорид фосфора (3,75 ммоль) и полученный раствор нагревали при 90°C в течение 3 часов. После охлаждения до комнатной температуры реакцию гасили путем добавления 50 мл ледяной воды. Смесь подщелачивали при помощи 4н водного раствора гидроксида натрия до pH=7. Осадок собирали фильтрованием, промывали этиловым эфиром и сушили в условиях высокого вакуума с получением 2-хлор-6-нитрохинолина (550 мг, 34% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,15 (с, 1H), 8,76 (д, J=8,8 Гц, 1H), 8,51 (м, 1H), 8,15 (д, J=9,2 Гц, 1H), 7,81 (д, J=8,4 Гц, 1H).
B. N-(4-Метоксибензил)-6-нитрохинолин-2-амин. Смесь 2-хлор-6-нитрохинолина (500 мг, 2,4 ммоль) и 4-метоксибензиламина (10 мл) нагревали при 120°C в течение ночи. Смесь охлаждали до комнатной температуры, разбавляли этилацетатом (50 мл) и органический слой промывали водой 3 раза, сушили над безводным сульфатом натрия и концентрировали. Остаток очищали на колонке с силикагелем (элюируя при помощи 2-10% этилацетата в петролейном эфире) с получением N-(4-метоксибензил)-6-нитрохинолин-2-амина (96 мг, 13% выход) в виде вязкой жидкости. MS (ESI): m/z 309,9 [M+1]+.
C. N2-(4-Метоксибензил)хинолин-2,6-диамин. К раствору N-(4-метоксибензил)-6-нитрохинолин-2-амина (96 мг, 0,31 ммоль) в смеси тетрагидрофурана и метанола (об/об, 1:1, 20 мл) добавляли цинковый порошок (202 мг, 3,1 ммоль) и хлорид аммония (167 мг, 3,1 ммоль) при комнатной температуре и смесь перемешивали при комнатной температуре в течение ночи. ТСХ и ЖХ/МС анализ показали, что реакция завершена. После фильтрования фильтрат концентрировали и остаток очищали на колонке с силикагелем (элюируя при помощи 10-50% этилацетата в петролейном эфире) с получением N2-(4-метоксибензил)хинолин-2,6-диамина (50 мг, 57,7% выход) в виде жидкости. MS (ESI): m/z 279,9 [M+1]+.
Промежуточное соединение 39: (±)-трет-Бутил 3-аминоазепан-1-карбоксилат
A. (±)-Азепан-3-амин. К раствору (±)-3-аминоазепан-2-она (3,65 г, 28,5 ммоль) в тетрагидрофуране (30 мл) при 0°C в атмосфере азота добавляли литийалюминийтетрагидрид (2,71 г, 71,3 ммоль) по порциям. По завершении добавления реакционной смеси давали нагреться до комнатной температуры, затем нагревали при кипячении с обратным холодильником в течение 5 дней. Медленно добавляли воду и реакционную смесь фильтровали, фильтровальную лепешку промывали тетрагидрофураном (3×100 мл). Объединенную тетрагидрофурановую фазу упаривали в вакууме с получением азепан-3-амина (2,28 г, 69,5% выход) в виде желтого масла, которое использовали непосредственно на следующей стадии. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 2,85 (м, 2H), 2,75 (м, 2H), 1,76 (м, 1H), 1,60 (м, 9H); MS (ESI): m/z 115,3 [M+1]+.
B. (±)-N-Бензилиденазепан-3-амин. К раствору (±)-азепан-3-амина (2,28 г, 0,02 моль) в дихлорметане (100 мл) добавляли бензальдегид (2,54 г, 0,024 моль) с последующим добавлением безводного сульфата натрия (3,41 г, 0,024 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь фильтровали и фильтрат концентрировали с получением неочищенного (±)-N-бензилиденазепан-3-амина (4,61 г), который использовали непосредственно на следующей стадии. MS (ESI): m/z 203,4 [M+1]+.
C. (±)-трет-Бутил 3-(бензилиденамино)азепан-1-карбоксилат. К смеси (±)-N-бензилиденазепан-3-амина (4,04 г, 0,02 ммоль) и триэтиламин (6,06 г, 0,06 ммоль) в дихлорметане (60 мл) добавляли по каплям раствор ди-трет-бутилдикарбоната (5,18 г, 0,024 ммоль) в дихлорметане (20 мл) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду и смесь экстрагировали дихлорметаном (3×50 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали с получением неочищенного (±)-трет-бутил 3-(бензилиденамино)азепан-1-карбоксилата (4,98 г) в виде вязкой жидкости. MS (ESI): m/z 303,2 [M+1]+.
D. (±)-трет-Бутил 3-аминоазепан-1-карбоксилат. Раствор трет-бутил 3-(бензилиденамино)азепан-1-карбоксилата (1 г, 3,31 ммоль) в смеси уксусной кислоты и дихлорметана (1:4, 20 мл) перемешивали при комнатной температуре в течение 24 часов. Растворитель удаляли и остаток подщелачивали при помощи раствора бикарбоната натрия, смесь экстрагировали этилацетатом три раза. Органический слой сушили над безводным сульфатом натрия и концентрировали с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 5% метанола в дихлорметане) с получением (±)-трет-бутил 3-аминоазепан-1-карбоксилата (360 мг, 42% выход для трех стадий). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 2,87 (м, 1H), 2,77 (м, 1H), 2,52 (м, 1H), 1,80-1,30 (м, 8H); MS (ESI): m/z 215,4 [M+1]+.
Промежуточное соединение 40: цис-4-(трет-Бутилдиметилсилилокси)циклогексанол
A. цис-4-(трет-бутилдиметилсилилокси)циклогексанол. К раствору цис-циклогексан-1,4-диола (500 мг, 4,31 ммоль) и трет-бутилхлордиметилсилана (650 мг, 4,31 ммоль) в N,N- диметилформамиде (3 мл) добавляли по каплям раствор триэтиламина (436 мг, 4,31 ммоль) и 4-(диметиламино)пиридина (21 мг) в N,N-диметилформамиде (1 мл) при 0°C. По завершении добавления смесь перемешивали при 0°C еще в течение 1 часа. Реакционную смесь разбавляли этилацетатом и органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 20% этилацетата в петролейном эфире) с получением цис-4-(трет-бутилдиметилсилилокси)циклогексанола (420 мг, 42,4% выход) в виде жидкости. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 3,81 (м, 2H), 1,84 (м, 8H), 0,90 (с, 9H), 0,03 (с, 6H).
Промежуточное соединение 41: 2-(4-Иодфенил)-1-((2-(триметилсилил)этокси)метил)-1H-имидазол
A. 2-(4-Иодфенил)-1H-имидазол. К раствору 4-иодбензальдегид (500 мг, 2,16 ммоль) в метаноле (20 мл) добавляли оксалальдегид (40%) (5 мл) и 25% водный раствор гидроксида аммония (5 мл) и смесь перемешивали при комнатной температуре в течение ночи. Осадок собирали фильтрованием, промывали петролейным эфиром и сушили в условиях высокого вакуума с получением 2-(4-иодфенил)-1H-имидазола (500 мг, 86% выход). MS (ESI): m/z 270,9 [M+1]+.
B. 2-(4-Иодфенил)-1-((2-(триметилсилил)этокси)метил)-1H-имидазол. К раствору 2-(4-иодфенил)-1H-имидазола (268 мг, 1 ммоль) в N,N-диметилформамиде (10 мл) добавляли гидрид натрия (60 мг, 1,5 ммоль) при 0°C по порциям. После перемешивания смеси при комнатной температуре в течение одного часа добавляли по каплям (2-(хлорметокси)этил)триметилсилан (196 мг, 1,2 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду, смесь экстрагировали этилацетатом 3 раза, органический слой концентрировали и промывали насыщенным раствором хлорида натрия 3 раза. Органический слой сушили над безводным сульфатом натрия и концентрировали с получением 2-(4-иодфенил)-1-((2-триметилсилил)этокси)метил)-1H-имидазола (217 мг, 54,7% выход) в виде жидкости, которую использовали непосредственно на следующей стадии. MS (ESI): m/z 400,9 [M+1]+.
Промежуточное соединение 42: 6-Морфолинопиридин-3-амин
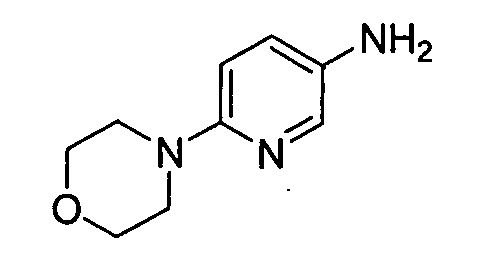
A. 4-(5-Нитропиридин-2-ил)морфолин. 2-Бром-5-нитропиридин (1 г, 5 ммоль) растворяли в морфолине (5 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Осадок собирали фильтрованием, промывали н-гексаном, сушили в условиях высокого вакуума с получением 4-(5-нитропиридин-2-ил)морфолина (0,9 г, 90% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 9,04 (с, 1H), 8,23 (д, J=6,8 Гц, 1H), 8,51 (д, J=9,2 Гц, 1H), 3,83 (м, 4H), 3,75 (м, 4H).
B. 6-Морфолинопиридин-3-амин. К раствору 4-(5-нитро-пиридин-2-ил)морфолина (0,8 г, 3,83 ммоль) в смеси метанола и тетрагидрофурана (об/об, 1:1, 40 мл) при комнатной температуре добавляли хлорид аммония (2,07 г, 38,3 ммоль), с последующим добавлением цинковой пыли (2,49 г, 38,3 ммоль), затем смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали на целите и промывали метанолом. Объединенные фильтраты концентрировали и остаток разбавляли насыщенным солевым раствором (20 мл) и экстрагировали этилацетатом (15 мл ×3). Органические слои сушили над сульфатом натрия и концентрировали с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 10- 70% этилацетата в петролейном эфире), с получением 6-морфолинопиридин-3-амина (330 мг, 48,2% выход) в виде черного твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,59 (с, 1H), 6,91 (м, 1H), 6,60 (д, J=8,8 Гц, 1H), 4,57 (шир.с, 2H), 3,66 (м, 4H), 3,16 (м, 4H); MS (ESI): m/z 180,0 [M+1]+.
Промежуточное соединение 43: цис-4-Амино-1-метилциклогексанол
A. транс-4-(Дибензиламино)циклогексанол. транс-4-Аминоциклогексанол (15,69 г, 136 ммоль) и бикарбонат натрия (37,8 г, 450 ммоль) суспендировали в этаноле (300 мл), обрабатывали бензилхлоридом (45,9 мл, 395 ммоль) и перемешивали при 75°C в течение 16 часов. Суспензию фильтровали и полученный фильтрат концентрировали с получением желтого воскообразного твердого вещества. Это твердое вещество затем растворяли в метиленхлориде (400 мл) и промывали 1 н раствором гидроксида натрия (2×100 мл), насыщенным солевым раствором (1×100 мл), сушили над сульфатом магния и концентрировали с получением не совсем белого воскообразного твердого вещества, которое при выстаивании при комнатной температуре образовывало желтую жидкость, содержащую воскообразное твердое вещество, которое по данным анализа ТСХ содержало как продукт, так и избыток бензилхлорида. Это вещество растворяли в простом эфире (300 мл) и желаемый продукт экстрагировали в виде соли амина с 1н водным раствором хлористоводородной кислоты (1×300 мл). ТСХ анализ показал бензилхлорид в эфирном слое и продукт в водном слое. Водный слой затем промывали этилацетатом (200 мл), затем его нейтрализовали с использованием 6н водного раствора гидроксида натрия, затем 1н водного раствора гидроксида натрия и экстрагировали в виде свободного амина с использованием этилацетата (300 мл). Органический слой затем сушили над сульфатом магния и концентрировали с получением продукта в виде белого твердого вещества (37,12 г, 92%). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,31 (дт, J=7,26, 14,47 Гц, 8H), 7,17-7,23 (м, 2H), 4,42-4,46 (м, 1H), 3,55 (с, 4H), 3,26-3,33 (м, 1H), 2,29-2,41 (м, 1H), 1,71-1,88 (м, 5H), 1,34-1,46 (м, 2H), 0,91-1,12 (м, 3H). Rf= 0,11 (TLC, 20% этилацетат в гексане); MS (ESI) m/z 296,5 [M+1]+.
B. 4-(Дибензиламино)циклогексанон. Раствор диметилсульфоксида (5,77 мл, 81 ммоль) в метиленхлориде (20 мл) добавляли по каплям к раствору оксалилхлорида (3,26 мл, 37,2 ммоль) в метиленхлориде (150 мл) при перемешивании при -78°C. После перемешивания в течение 15 минут при -78°C добавляли по каплям раствор транс-4-(дибензиламино)циклогексанола (10,0 г, 33,9 ммоль) в метиленхлориде (100 мл). После перемешивания при -78°C еще в течение 15 минут добавляли по каплям триэтиламин (23,59 мл, 169 ммоль) и реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 16 часов. Реакционная смесь принимала вид суспензии, и ее промывали насыщенным солевым раствором (100 мл). Органический слой отделяли, сушили над сульфатом магния и концентрировали с получением бесцветного масла, которое очищали с использованием колоночной флэш-хроматографии на силикагеле (5-100% этилацетата в гексане) с получением указанного в заголовке соединения в виде бесцветного масла (8,11 г, 82% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,35-7,39 (м, 4H), 7,28-7,33 (м, 4H), 7,18-7,24 (м, 2H), 3,61 (с, 4H), 2,89-2,99 (м, 1H), 2,26-2,38 (м, 2H), 2,14-2,24 (м, 2H), 2,06 (тд, J=2,81, 6,43 Гц, 2H), 1,81 (квд, J=4,27, 12,49 Гц, 2H), Rf= 0,36 (TLC, 20% этилацетата в гексане); MS (ESI) m/z 294,4 [M+1]+.
C. цис-4-(Дибензиламино)-1-метилциклогексанол и транс-4-(дибензиламино)-1-метилциклогексанол. Раствор 3,0 M метилмагнийбромида/простой эфир (11,95 мл, 35,8 ммоль) в безводном простом эфире (100 мл) добавляли по каплям в течение 15 минут к раствору 4-(дибензиламино)циклогексанона (8,09 г, 27,6 ммоль) в безводном простом эфире (200 мл). Мутную реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Было обнаружено, что реакция завершена только на 75% по данным ЯМР и ЖХ/МС (с использованием TIC). Дополнительно добавляли 3,0 M метилмагнийбромида/простой эфир (3 мл, 9 ммоль) и смесь перемешивали еще в течение 20 часов. Реакцию гасили, когда осторожно выливали в водный раствор хлорида аммония (250 мл), вызывая образование осадка. Оба слоя (и суспензию) перемешивали в течение 10 минут, вызывая переход всего осажденного вещества в раствор. Эфирный слой отделяли, сушили над сульфатом магния и концентрировали с получением бесцветного масла, которое очищали с использованием колоночной флэш-хроматографии на силикагеле (0-50% этилацетата в гексане) для разделения цис и транс изомеров (цис: Rƒ= 0,33; транс: Rƒ= 0,20, 20% этилацетата в гексане). Для обоих изомеров требовалась дополнительная хроматография. Фракции, содержащие цис-изомер, очищали с использованием колоночной флэш-хроматографии на силикагеле (0-20% этилацетата в гексане) с получением продукта в виде белого твердого вещества (1,54 г, 18%). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,32-7,37 (м, 4H), 7,25-7,32 (м, 4H), 7,16-7,22 (м, 2H), 4,00 (с, 1H), 3,59 (с, 4H), 2,29-2,40 (м, 1H), 1,66-1,79 (м, 2H), 1,54 (д, 4H), 1,07-1,19 (м, 2H), 1,02 (с, 3H).
Транс-изомер также нуждался в дополнительной колоночной хроматографии (0-20% этилацетата в гексане), с получением транс-изомера в виде белого твердого вещества (1,70 г, 20%). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,32-7,37 (м, 4H), 7,26-7,32 (м, 4H), 7,16-7,24 (м, 2H), 4,18 (с, 1H), 3,57 (с, 4H), 2,33-2,44 (м, 1H), 1,69 (д, J=10,15 Гц, 2H), 1,55 (д, J=12,20 Гц, 2H), 1,36-1,49 (м, 2H), 1,16-1,29 (м, 2H), 1,09 (с, 3H). MS (ESI) m/z 310,5 [M+1]+.
D. цис-4-Амино-1-метилциклогексанол. цис-4-(Дибензиламино)-1-метилциклогексанол (0,770 г, 2,488 ммоль) растворяли в этаноле (25 мл), обрабатывали 20% гидроксидом палладия на углероде (0,349 г, 2,488 ммоль) и перемешивали в атмосфере водорода, в течение 2 дней. Суспензию фильтровали через Целит и полученный фильтрат концентрировали с получением продукта в виде бледно-серого твердого вещества (0,308 г, 96% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 2,42 (тт, 1H), 1,29-1,54 (м, 6H), 1,18-1,29 (м, 2H). MS (ESI) m/z 130,1 [M+1]+.
Промежуточное соединение 44: транс-4-Амино-1-метилциклогексанол
A. транс-4-Амино-1-метилциклогексанол. транс-4-(Дибензиламино)-1-метилциклогексанол (0,787 г, 2,54 ммоль) растворяли в этаноле (25 мл), обрабатывали 20% гидроксидом палладия на углероде (0,357 г, 2,54 ммоль) и перемешивали в атмосфере водорода, в течение 16 часов. Суспензию фильтровали через слой целита и концентрировали с получением продукта в виде не совсем белого твердого вещества (0,311 г, 95% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 3,44 (кв., J=6,98 Гц, 2H), 2,55-2,66 (м, 1H), 1,64 (дд, J=3,83, 12,96 Гц, 2H), 1,50 (д, J=13,03 Гц, 2H), 1,25-1,38 (м, 2H), 1,00-1,15 (м, 6H). MS (ESI) m/z 130,1 [M+1]+.
Промежуточное соединение 45: трет-Бутил 4-метиленпиперидин-1-карбоксилат
A. трет-Бутил 4-метиленпиперидин-1-карбоксилат. К раствору 1-бензил-4-метиленпиперидина (1,0 г, 5,34 ммоль) в дихлорметане (53,4 мл) при 0°C добавляли по каплям 1-хлорэтилкарбонохлоридат (0,840 г, 5,87 ммоль). Реакционную смесь затем нагревали до температуры кипения растворителя в течение 2 часов. Растворитель удаляли при пониженном давлении и замещали метанолом (20 мл). Раствор затем нагревали до 75°C в течение 4 часов. Растворитель удаляли при пониженном давлении и остаток растворяли в 5 мл 0,5 н водного раствора HCl. Раствор промывали диэтиловым эфиром 3 раза и водную фазу упаривали досуха. Воду подвергали азеотропной перегонке с метанолом (2×5 мл). ЖХ/МС анализ подтвердил поглощение исходного вещества. Вещество (бесцветные игольчатые кристаллы) использовали без дополнительной очистки.
Раствор 4-метиленпиперидингидрохлорида (0,714 г, 5,34 ммоль) в дихлорметане (39,6 мл) охлаждали до 0°C и обрабатывали триэтиламином (1,563 мл, 11,21 ммоль), а затем ди-трет-бутилдикарбонатом (1,240 мл, 5,34 ммоль). Баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь промывали водой и органическую фазу сушили над сульфатом магния и упаривали досуха. Остаток очищали колоночной хроматографией на силикагеле (5-20% этилацетата в гексане). трет-Бутил 4-метиленпиперидин-1-карбоксилат (0,974 г, 4,94 ммоль, 92% выход) выделяли в виде бесцветного масла. 1H ЯМР (400 МГц, METHANOL-d4) δ (м.д.) 4,75 (с, 2H), 3,40 (т, J=5,86 Гц, 4H), 2,11-2,21 (м, 4H), 1,40-1,47 (м, 9H).
Промежуточное соединение 46: трет-Бутилдиметил(4-метиленциклогексилокси)силан
A. трет-Бутилдиметил(4-метиленциклогексилокси)силан. К суспензии метилтрифенилфосфонийбромида (6,26 г, 17,51 ммоль) в тетрагидрофуране (88 мл) при 0°C добавляли по каплям раствор н-бутиллития в гексане (2,5 M, 7,29 мл, 18,21 ммоль) при интенсивном перемешивании. Суспензия становилась ярко-оранжевой. Реакционную смесь нагревали до комнатной температуры, затем добавляли раствор 4-(трет-бутилдиметилсилилокси)циклогексанона (4,0 г, 17,51 ммоль) в безводном тетрагидрофуране (10 мл) при комнатной температуре. При добавлении образовывался желтый осадок, и его количество увеличивалось к концу добавления. Реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь затем декантировали и фильтровали. Полученное твердое вещество промывали гексаном и фильтрат упаривали досуха. Остаток очищали при помощи колоночной хроматографии (2 колонки, образец загружали в виде раствора в дихлорметане) и элюировали при помощи 5-10% этилацетата в гексане. трет-Бутилдиметил(4-метиленциклогексилокси)силан (3,339 г, 14,75 ммоль, 84% выход) выделяли в виде светлого желто-зеленого масла. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 4,52 (с, 2H), 3,76-3,86 (м, 1H), 2,23-2,32 (м, 2H), 1,92-2,03 (м, 2H), 1,61-1,74 (м, 2H), 1,35-1,49 (м, 2H), 0,78-0,85 (м, 9H), -0,04-0,03 (м, 6H).
Промежуточное соединение 47: 2-(5-Бромпиридин-2-ил)пропан-2-ол
A. 2-(5-Бромпиридин-2-ил)пропан-2-ол. 2,5-Дибромпиридин (15 г, 63,3 ммоль) растворяли в толуоле (750 мл) и затем охлаждали до -78°C в атмосфере азота. К раствору добавляли по каплям н-бутиллитий (1,7 M в пентане, 30,4 мл, 76 ммоль) и затем перемешивали в течение 2 часов. К раствору добавляли ацетон (5,58 мл, 76 ммоль) и затем перемешивали в течение 1 часа при -78°C. Реакционной смеси давали нагреться до -10°C и затем добавляли насыщенный раствор хлорида аммония (150 мл). Реакционную смесь экстрагировали этилацетатом и водой. Органический слой сушили над сульфатом магния, фильтровали и затем концентрировали. Остаток очищали при помощи хроматографии на силикагеле (0-30% этилацетата в гексане) с получением прозрачного слегка окрашенного масла (11,6 г, 53,7 ммоль, 85% выход). MS (ESI) m/z 216,1 [M]+.
Промежуточное соединение 48: N 2 ,N 2 -Диметилпиридин-2,5-диамин
A. N,N-Диметил-5-нитропиридин-2-амин. 2-Бром-5-нитропиридин (5 г, 24,8 ммоль) в водном растворе диметиламина (33%, 20 мл) перемешивали при комнатной температуре в течение ночи. Осадок собирали фильтрованием и перекристаллизовывали из метанола с получением N,N-диметил-5-нитропиридин-2-амина (2,6 г, 63% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,95 (д, J=2,0 Гц, 1H), 8,18 (дд, J1=9,6 Гц, J2=2,0 Гц, 1H), 6,73 (д,J=9,6 Гц, 1H), 3,18 (с, 6H).
B. N2,N2-Диметилпиридин-2,5-диамин. Смесь N,N-диметил-5-нитропиридин-2-амина (500 мг, 3 ммоль) и 10% палладия на углероде (10% масс/масс, 50 мг) в этаноле (20 мл) гидрировали под давлением водорода 1 атм при комнатной температуре в течение 1 часа. Катализатор отфильтровывали и фильтрат концентрировали с получением N2,N2-диметилпиридин-2,5-диамина (340 мг, 83% выход) в виде вязкой жидкости. MS (ESI): m/z 138,1 [M+1]+.
Промежуточное соединение 49: 5-Аминоникотинамид
A. 5-Аминоникотинамид. Смесь метил 5-аминоникотината (500 мг, 3,28 ммоль) в смеси метанола (5 мл) и гидроксида аммония (5 мл) перемешивали при комнатной температуре в течение ночи. Добавляли воду (30 мл) и смесь экстрагировали дихлорметаном (15 мл ×4). Объединенный органический слой промывали насыщенным солевым раствором (25 мл), сушили над сульфатом натрия и упаривали при пониженном давлении с получением 5-аминоникотинамида (300 мг, 67% выход) в виде твердого вещества.
Промежуточное соединение 50: 5-Метоксипиридин-3-амин
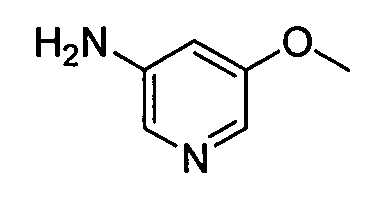
A. 2,6-Дибромпиридин-3-ол. Охлажденный льдом раствор брома (50 г, 320 моль) в 10% водном растворе гидроксида натрия (320 мл) добавляли по каплям к перемешиваемому раствору пиридин-3-ола (10 г, 105 ммоль) в 10% водном растворе гидроксида натрия (110 мл). Раствор перемешивали при 0°C в течение 1 часа и затем при комнатной температуре в течение 4 часов. Небольшое количество белого твердого вещества отфильтровывали. Фильтрат охлаждали и добавляли концентрированную хлористоводородную кислоту до pH=1. Твердое вещество фильтровали, промывали водой, сушили и перекристаллизовывали из тетрахлорида углерода с получением 2,6-дибром-пиридин-3-ола (9,93 г, 37% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,17 (с, 1H), 7,47 (м, 1H), 7,25 (м, 1H); MS (ESI): m/z 253,7 [M+H]+.
B. 2,6-Дибром-3-метоксипиридин. Смесь 2,6-дибромпиридин-3-ола (9,49 г, 37,5 ммоль), карбоната калия (4,75 г, 34,4 ммоль), диметилсульфоксида (16 мл) и метилиодида (8 мл) нагревали при кипячении с обратным холодильником в течение 2 часов. Реакционную смесь выливали в воду (50 мл), смесь нагревали осторожно при перемешивании до выпаривания остаточного метилиодида. Метоксипиридин, осажденный при охлаждении водного раствора, и твердое вещество перекристаллизовывали из гексана с получением 2,6-дибром-3-метоксипиридина (4,0 г, 40% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,66 (д, J=8,0 Гц, 1H), 7,52 (д, J=8,4 Гц, 1H), 3,89 (с, 3H); MS (ESI): m/z 267,6 [M+H]+.
C. 2,6-Дибром-3-метокси-5-нитропиридин. К раствору 2,6-дибром-3-метоксипиридина (4,0 г, 0,015 моль) в серной кислоте (20 мл) добавляли смесь серной кислоты и азотной кислоты (об/об, 1:1) (40 мл) при 0°C. Смесь нагревали при 60-65°C в течение ночи, охлаждали и нейтрализовали насыщенным водным раствором карбоната натрия. Полученную смесь экстрагировали этилацетатом (50 мл ×3). Объединенный органический слой сушили над сульфатом натрия и концентрировали с получением 2,6-дибром-3-метокси-5-нитропиридина (1,3 г, 28% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,24 (с, 1H), 3,99 (с, 3H).
D. 5-Метоксипиридин-3-амин. Смесь 2,6-дибром-3-метокси-5-нитропиридина (0,3 г, 0,98ммоль), 10% палладия на углероде (50% масс/масс, 30 мг) в метаноле (20 мл) гидрировали под давлением водорода 1 атмосфера при комнатной температуре в течение ночи. Катализатор отфильтровывали и фильтрат концентрировали в вакууме с получением 5-метоксипиридин-3-амина (0,1 г, 92% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,54 (д, J=2,0 Гц, 1H), 7,45 (д, J=2,8 Гц, 1H), 6,48 (т, J=2,4 Гц, 1H), 5,31 (с, 2H), 3,71 (с, 3H).
Промежуточное соединение 51: 6-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)-1-(2-(триметилсилил)этокси)метил)-1H-имидазо[4,5-b]пиридин
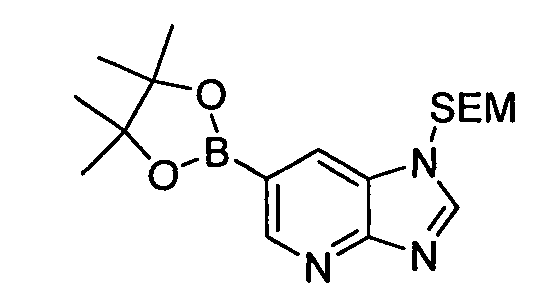
A. 6-Бром-1Н-имидазо[4,5-b]пиридин. Раствор 4-бромбензол-1,2-диамина (2 г, 11 ммоль) в муравьиной кислоте (20 мл) нагревали при кипячении с обратным холодильником в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении с получением 6-бром-1H-имидазо[4,5-b]пиридина в виде коричневого твердого вещества (2 г, 94% выход).
B. 6-Бром-1-((2-(триметилсилил)этокси)метил)-1Н-имидазо[4,5-b]пиридин. К раствору 6-бром-1H-имидазо[4,5-b]пиридина (1 г, 5 ммоль) в N,N-диметилформамиде (10 мл) добавляли гидрид натрия (300 мг, 7,5 ммоль) по порциям при 0°C. После перемешивания в течение 0,5 часов добавляли по каплям (2-хлорметоксиэтил)-триметилсилан (996 мг, 6 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Добавляли насыщенный водный раствор хлорида аммония (20 мл) и смесь экстрагировали этилацетатом (15 мл ×3). Объединенный органический слой промывали насыщенным солевым раствором (20 мл), сушили над сульфатом натрия и концентрировали. Остаток очищали на колонке с силикагелем (элюируя при помощи 10-15% этилацетата в петролейном эфире) с получением 6-бром-1-((2-(триметилсилил)этокси)метил)-1H-имидазо[4,5-b]пиридина (600 мг, 36,6% выход) в виде бледно-желтого масла. ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,47 (с, 1H), 8,23 (с, 1H), 8,19 (с, 1H), 5,65 (с, 2H), 3,61 (м, 2H), 0,93 (м, 2H), 0,04 (с, 9H).
C. 6-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)-1-((2-(триметилсилил)этокси)метил)-1Н-имидазо[4,5-b]пиридин. Смесь 6-бром-1-((2-(триметилсилил)этокси)метил)-1H-имидазо[4,5-b]пиридина (400 мг, 1,22 ммоль), бис(пинаколато)дибора (466 мг, 1,83 ммоль), трициклогексилфосфина (68 мг, 0,24 ммоль), трис(дибензилиденацетон)палладия(0) (112 мг, 0,12 ммоль) и ацетата калия (240 мг, 2,4 ммоль) в диоксане (10 мл) дегазировали и нагревали при 100°C в атмосфере азота в течение ночи. Реакционную смесь фильтровали и фильтрат концентрировали в вакууме с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 0-1% метанола в дихлорметане), с получением 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-((2-(триметилсилил)этокси)метил)-1H-имидазо[4,5-b]пиридина (330 мг, 72% выход) в виде масла. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,78 (с, 1H), 8,49 (с, 1H), 8,21 (с, 1H), 5,70 (с, 2H), 3,61 (т, J=8,0 Гц, 2H), 1,36 (с, 12H), 0,92 (т, J=8,0 Гц, 2H), 0 (с, 9H); MS (ESI): m/z 376,1 [M+1]+.
Промежуточное соединение 52: 2-Метилпиридин-4-амин
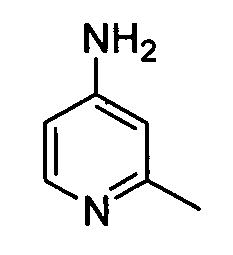
A. 2-Метилпиридин-4-амин. Смесь 2-метил-4-нитропиридина (500 мг, 3,6 ммоль) и порошка железа (1 г, 18 ммоль) в уксусной кислоте (20 мл) перемешивали 110°C в течение 4 часов. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали при помощи препаративной ТСХ (элюируя при помощи 5% метанола в дихлорметане) с получением 2-метилпиридин-4-амина (100 мг, 26% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,81 (д, J=5,6 Гц, 1H), 6,28 (с, 1H), 6,25 (д, J=5,6 Гц, 1H), 5,82 (шир.с, 2H), 2,19 (с, 3H).
Промежуточное соединение 53: 2-(Бензилокси)пиридин-4-амин
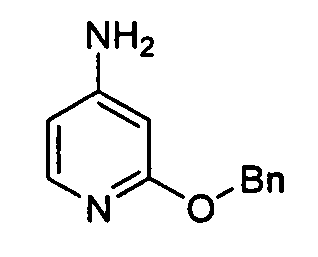
A. 2-(Бензилокси)пиридин-4-амин. К раствору бензилового спирта (2,53 г, 23,4 ммоль) в диоксане (10 мл) добавляли гидрид натрия (1,15 г, 28,75 ммоль) при комнатной температуре и смесь нагревали при кипячении с обратным холодильником в течение 1,5 часов. После охлаждения до комнатной температуры добавляли 2-хлорпиридин-4-амин (1,5 г, 11,7 ммоль) и смесь нагревали до 160°C в течение 12 часов в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь выливали в воду (30 мл) и смесь экстрагировали этилацетатом (20 мл ×3). Органический слой концентрировали при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 10% метанола в этилацетате) с получением 2-(бензилокси)пиридин-4-амина (800 мг, 34,1% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,95 (д, J=5,6 Гц, 1H), 7,51 (шир.с, 5H), 6,27 (с, 1H), 6,01 (с, 1H), 5,39 (с, 2H), 4,11 (шир.с, 2H).
Промежуточное соединение 54: 2-Метоксипиридин-4-амин
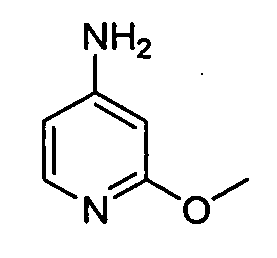
A. 2-Метоксипиридин-4-амин. Смесь метанола (10 мл) и гидрида натрия (60% в минеральном масле, 624 мг, 15,6 ммоль) нагревали при кипячении с обратным холодильником в течение 1,5 часов. Смесь охлаждали до комнатной температуры и добавляли 2-хлорпиридин-4-амин (1,0 г, 7,8 ммоль). Реакционную смесь нагревали до 160°C в течение 12 часов в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь выливали в воду (30 мл) и смесь экстрагировали этилацетатом (15 мл ×3). Объединенный органический слой концентрировали при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 10% метанола в этилацетате) с получением 2-метоксипиридин-4-амина (210 мг, 21,6% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,83 (д, J=6,0 Гц, 1H), 6,21 (дд, J1=2,0 Гц, J1=6,0 Гц, 1H), 5,93 (д, J=1,6 Гц, 1H), 4,07 (шир.с, 2H), 3,87 (с, 3H).
Промежуточное соединение 55: N 2 -(4-Метоксибензил)-N 2 -метилпиридин-2,4-диамин
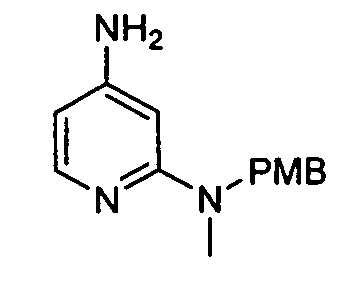
A. N-(4-Метоксибензил)-N-метил-4-нитропиридин-2-амин. Раствор 2-хлор-4-нитропиридина (1,0 г, 6,3 ммоль) и 1-(4-метоксифенил)-N-метилметанамина (1,5 г, 9,6 ммоль) в диметоксиэтане (15 мл) перемешивали при 100°C в течение 4 часов. Растворитель выпаривали при пониженном давлении с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя петролейным эфиром) с получением N-(4-метоксибензил)-N-метил-4-нитропиридин-2-амина (0,65 г, 38% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,39 (д, J=4,2 Гц, 1H), 7,22 (м, 2H), 7,16 (д, J=8,8 Гц, 2H), 6,88 (д, J=8,4 Гц, 2H), 4,80 (с, 2H), 3,71 (с, 3H), 3,10 (с, 3H).
B. N2-(4-Метоксибензил)-N2-метилпиридин-2,4-диамин. Смесь N-(4-метоксибензил)-N-метил-4-нитропиридин-2-амина (0,5 г, 1,83ммоль) и 10% палладия на углероде (50 мг, 50% масс/масс) в метаноле (20 мл) под давлением водорода 1 атмосфера перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали и фильтрат концентрировали с получением N2-(4-метокси-бензил)-N2-метил-пиридин-2,4-диамина (0,41 г, 92% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,60 (д, J=5,6 Гц, 1H), 7,10 (д, J=8,4 Гц, 2H), 6,85 (д, J=8,8 Гц, 2H), 5,86 (м, 1H), 5,69 (д, J=1,6 Гц, 1H), 5,60 (с, 2H), 4,62 (с, 2H), 3,71 (с, 3H) 2,84 (с, 3H); MS (ESI): m/z 244,0 [M+1]+.
Промежуточное соединение 56: 1-метил-1H-индазол-6-амин
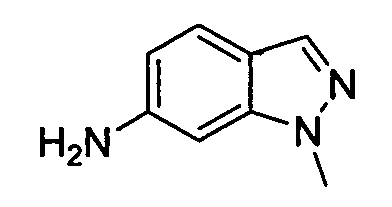
A. 1-метил-6-нитро-1Н-индазол. Смесь 6-нитро-1H-индазола (3,3 г, 20 ммоль) и гидрида натрия (60% в минеральном масле, 1,2 г, 30 ммоль) в N,N-диметилформамиде (15 мл) перемешивали при 0°C в течение 1 часа. Добавляли метилиодид (8,52, 60 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили водой (50 мл) и экстрагировали этилацетатом (50 мл ×3). Объединенный органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали на колонке с силикагелем (элюируя при помощи 2-5% этилацетата в петролейном эфире) с получением 1-метил-6-нитро-1H-индазола (1,9 г, 53% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,52 (м, 1H), 8,08 (д, J=1,2 Гц, 1H), 7,81 (м, 2H), 3,98 (с, 3H).
B. 1-метил-1Н-индазол-6-амин. Смесь 1-метил-6-нитро-1H-индазола (1 г, 5,6 ммоль) в этаноле (50 мл) и 10% палладия на углероде (50% масс/масс, 100 мг) гидрировали под давлением водорода 1 атмосфера при комнатной температуре в течение 2 часов. Катализатор отфильтровывали и фильтрат упаривали с получением 1-метил-1H-индазол-6-иламина (790 мг, 95,1%) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,67 (с, 1H), 7,33 (д, J=8,4 Гц, 1H), 7,49 (м, 2H), 5,31 (шир.с, 2H), 3,80 (с, 3H).
Промежуточное соединение 57: 3-Метил-1-((2-(триметилсилил)этокси)метил)-1Н-индазол-6-амин
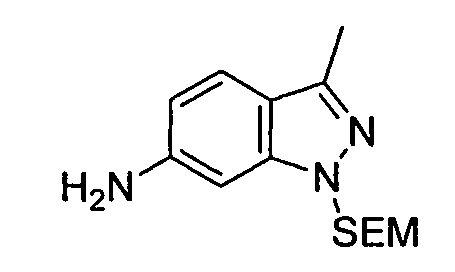
A. S-Иод-6-нитро-1Н-индазол. Раствор 6-нитро-1H-индазола (2,0 г, 12 ммоль) в смеси 1,4-диоксана (50 мл) и водного раствора гидроксида натрия (7,5 мл, 2 M) перемешивали при комнатной температуре около 1 часа. Добавляли кристаллы иода (3,8 г, 15 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Реакцию гасили 10% водным раствором лимонной кислоты и экстрагировали этилацетатом (100 мл ×3). Органический слой промывали 10% водным раствором бикарбоната натрия (100 мл) и насыщенным солевым раствором (100 мл), сушили над сульфатом натрия, фильтровали и концентрировали с получением 3-иод-6-нитро-1H-индазола (3,2 г, 92% выход) в виде оранжевого твердого вещества. MS (ESI): m/z 289,9 [M+1]+.
B. 3-Иод-6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазол. К раствору 3-иод-6-нитро-1H-индазола (1,45 г, 5 ммоль) в N,N-диметилформамиде (10 мл) добавляли гидрид натрия (60% в минеральном масле, 0,24 г, 6 ммоль) при 0°C. После перемешивания в течение 1 часа к полученной смеси добавляли по каплям (2-хлорметоксиэтил)триметилсилан (1,0 г, 6 ммоль) при 0°C и реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду (50 мл) и смесь экстрагировали этилацетатом (30 мл ×4). Объединенный органический слой сушили и упаривали при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 2-5% этилацетата в петролейном эфире) с получением 3-иод-6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазола (0,78 г, 37% выход). MS (ESI): m/z 420,9 [M+1]+.
Эту реакцию также осуществляли с использованием тетрагидрофурана в качестве растворителя, с получением 57% выхода 3-иод-6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазола.
C. 3-Метил-6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазол. Дегазированную смесь 3-иод-6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазола (754 мг, 1,8 ммоль), метилбороновой кислоты в тетрагидрофуране (432 мг, 3,6 ммоль), водного раствора фосфата калия (2 M, 5 мл) и тетракис(трифенилфосфин)палладия(0) (104 мг, 0,09 ммоль) в диоксане (5 мл) нагревали при 100°C в течение ночи. Растворитель удаляли при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 25-50% этилацетата в петролейном эфире) с получением 3-метил-6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазола (0,48 г, неочищенный). MS (ESI): m/z 308,1 [M+1]+.
Эту реакцию также можно осуществить в безводном диоксане с использованием 3 эквивалентов метилбороновой кислоты, 3 эквивалентов карбоната цезия в качестве основания и 0,1 эквивалента тетракис(трифенилфосфин)палладия(0) при 90°C в течение ночи. Следуя этой процедуре, 3-метил-6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазол получали с 82% выходом после хроматографии.
D. 3-Метил-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-амин. К раствору 3-метил-6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазола (0,48 г, неочищенный) в метаноле (5 мл) добавляли 10% палладий на углероде (0,3 г, 50% масс/масс) и смесь гидрировали под давлением водорода 1 атмосфера при комнатной температуре в течение 30 минут. Катализатор отфильтровывали и фильтрат концентрировали. Остаток очищали на колонке с силикагелем (элюируя при помощи 3-5% этилацетата в петролейном эфире) с получением 3-метил-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-амина (138 мг, 32% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,42 (д, J=8,4 Гц, 1H), 6,66 (д, J=2,0 Гц,1H), 6,58 (дд, J1=2,0 Гц, J2=8,4 Гц, 1H), 5,54 (с, 2H), 5,34 (с, 2H), 3,89 (шир.с, 2H), 3,56 (т, J=8,0 Гц, 2H), 2,48 (с, 3H), 0,91 (м, 2H), -0,05 (д, J=3,2 Гц, 9H).
Выход этой стадии увеличивали до 100%, когда использовали очищенный 3-метил-6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазол, устраняя необходимость в хроматографии.
Промежуточное соединение 58: 4-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-((2-(триметилсилил)этокси)метил)-1H-имидазол
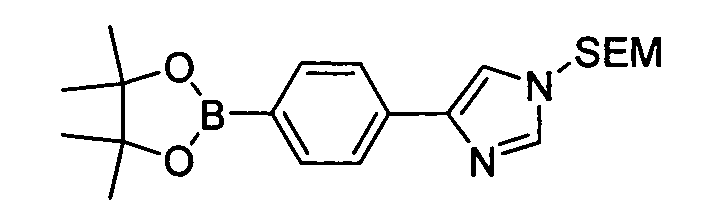
A. 4-(4-Бромфенил)-1-((2-(триметилсилил)этокси)метил)-1H-имидазол. К перемешиваемому раствору 4-(4-бромфенил)-1H-имидазола (446 мг, 2 ммоль) в безводном N,N-диметилформамиде (10 мл) добавляли гидрид натрия (60% в минеральном масле, 96 мг, 2,4 ммоль) при 0°C и смесь перемешивали при этой температуре в течение 2 часов. Добавляли по каплям раствор (2-(хлорметокси)этил)триметилсилана (545 мг, 3 ммоль) в N,N-диметилформамиде (5 мл) и полученную смесь перемешивали при комнатной температуре в течение 4 часов. Когда исходное вещество было израсходовано, реакцию гасили водой (50 мл) и смесь экстрагировали этилацетатом (15 мл ×3). Объединенный органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток очищали на колонке с силикагелем (элюируя при помощи 5-10% этилацетата в петролейном эфире) с получением 4-(4-бромфенил)-1-((2-(триметилсилил)этокси)метил)-1H-имидазола (440 мг, 62% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,80-7,84 (м, 2H), 7,71 (д, J=8,4 Гц, 2H), 7,52 (д, J=8,4 Гц, 2H), 5,32 (с, 2H), 3,49 (т, J=8,0 Гц, 2H), 0,84 (т, J=8,0 Гц, 2H), -0,06 (с, 9H); MS (ESI): m/z 353,0 [M+1]+.
B. 4-(4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-((2-(триметилсилил)этокси)метил)-1Н-имидазол. Дегазированную смесь 4-(4-бромфенил)-1-((2-(триметилсилил)этокси)метил)-1H-имидазола (200 мг, 0,56 ммоль), бис(пинаколато)дибора (158 мг, 0,62 ммоль), ацетата калия (139 мг, 1,42 ммоль) и [1,1'- бис(дифенилфосфино)ферроцен]дихлорпалладия(II) (42 мг, 0,06 ммоль) в N,N-диметилформамиде (5 мл) перемешивали при 80°C в течение ночи. Реакционную смесь выливали в ледяную воду (30 мл) и смесь экстрагировали этилацетатом (15 мл ×2). Органический слой сушили над сульфатом натрия и упаривали в вакууме. Остаток очищали на колонке с силикагелем (элюируя при помощи 10-20% этилацетата в петролейном эфире) с получением 4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-((2-(триметилсилил)этокси)метил)-1H-имидазола (120 мг, 62% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,90 (с, 1H), 7,77 (с, 4H), 7,69 (с, 1H), 5,42 (с, 2H), 3,62 (т, J=8,0 Гц, 2H), 1,37 (с, 12H), 0,94 (т, J=8,0 Гц, 2H), 0,01 (с, 9H); MS (ESI): m/z 386,2 [M+1]+.
Промежуточное соединение 59: трет-Бутил 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенетилкарбамат
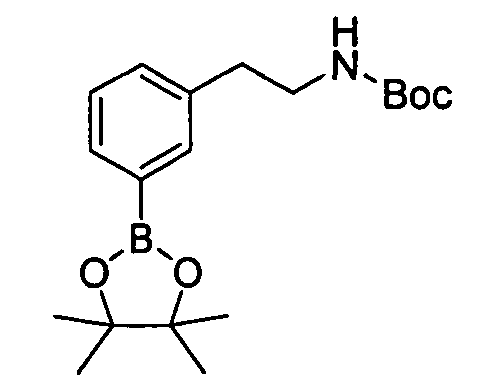
A. трет-Бутил 3-бромфенетилкарбамат. Смесь 2-(3- бромфенил)этанамина (1 г, 5,03 ммоль), ди-трет-бутилдикарбоната (1,64 мг, 7,5 ммоль) в дихлорметане (20 мл) перемешивали при комнатной температуре в течение 1 часа. Растворитель удаляли с получением трет-бутил 3-бромфенетилкарбамата (1,5 г, 99,1% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,37 (д, J=7,6 Гц, 2H), 7,23 (м, 2H), 6,87 (т, J=5,6 Гц, 1H), 3,13 (м, 2H), 2,69 (т, J=7,2 Гц, 2H), 1,35 (с, 9H).
B. трет-Бутил 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенетилкарбамат. Дегазированную смесь трет-бутил 3-бромфенетилкарбамата (1,9 г, 6,35 ммоль), бис(пинаколато)дибора (2,4 г, 9,53 ммоль), ацетата калия (1,56 г, 19 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) (475 мг, 0,64 ммоль) в диоксане (20 мл) нагревали при 100°C в атмосфере азота в течение 2 часов. Реакционную смесь выливали в воду (50 мл) и смесь экстрагировали этилацетатом (20 мл ×2). Объединенный органический слой сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток очищали на колонке с силикагелем (элюируя при помощи 0-5% этилацетата в петролейном эфире) с получением трет-бутил 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенетилкарбамата (1,9 г, 86,4% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,48 (м, 2H), 7,30 (м, 2H), 6,86 (т, J=5,6 Гц, 1H), 3,10 (м, 2H), 2,68 (т, J=7,2 Гц, 1H), 1,29 (с, 12H), 1,16 (с, 9H).
Промежуточное соединение 60: 3-(3-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаннитрил
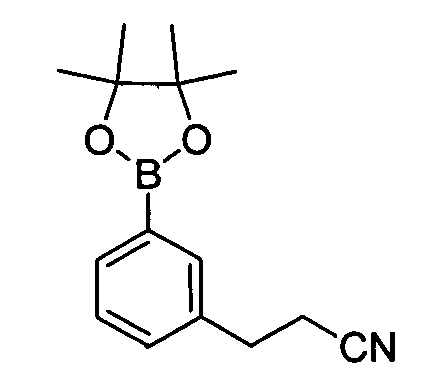
A. 3-(3-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаннитрил. Дегазированную смесь 3-(3-бромфенил)пропаннитрила (1,05 г, 5 ммоль), бис(пинаколато)дибора (1,9 г, 7,5 ммоль), ацетата калия (1,47 г, 15 ммоль) и [1,1'- бис(дифенилфосфино)ферроцен]дихлорпалладия(II) (0,37 г, 0,5 ммоль) в диоксане (10 мл) нагревали при 120°C в атмосфере азота в течение 4 часов. Реакционную смесь фильтровали и фильтрат концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 5% этилацетата в петролейном эфире) с получением 3-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаннитрила (1 г, 74% выход) в виде бесцветного масла. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,73-7,70 (м, 2H), 7,64 (с, 1H), 7,36-7,32 (м, 2H), 2,97 (т, J=7,6 Гц, 2H), 2,63 (т, J=7,6 Гц, 2H), 1,35 (с, 12H).
Промежуточное соединение 61: 6-Метоксипиридин-2-амин
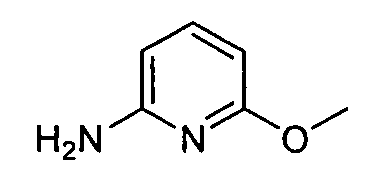
A. 6-Метоксипиридин-2-амин. Смесь натрия (0,8 г, 34,8 ммоль) в метаноле (20 мл) нагревали при кипячении с обратным холодильником при 80°C. После поглощения натрия добавляли 6-бромпиридин-2-амин (3 г, 17,4 ммоль) и реакционную смесь нагревали до 160°C в автоклаве в течение 3 часов. После охлаждения до комнатной температуры добавляли этилацетат (30 мл) и смесь фильтровали. Фильтрат концентрировали в вакууме с получением 6-метоксипиридин-2-амина (1,4 г, 63,6% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,33 (т, J=8,0 Гц, 1H), 6,06 (м, 2H), 3,83 (с, 1H).
Промежуточное соединение 62: 4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)пиколинонитрил
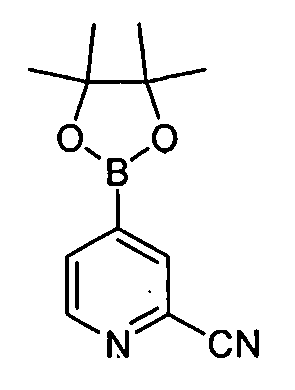
A. 4-Бромпиридин 1-оксид. К суспензии 4-бромпиридингидрохлорида (5,0 г, 25,9 ммоль) в дихлорметане (50 мл) добавляли триэтиламин (2,62 г, 25,9 ммоль) при комнатной температуре. После перемешивания в течение 0,5 часов добавляли по порциям 3-хлорбензопероксокислоту (4,46 г, 25,9 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 5 часов. Раствор промывали насыщенным водным раствором тиосульфата натрия (30 мл), насыщенным водным раствором карбоната натрия (30 мл) и насыщенным солевым раствором (30 мл) и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 50-100% этилацетата в метаноле), с получением 4-бромпиридин 1-оксида в виде твердого вещества (2,1 г, 44,8% выход).
B. 4-Бромпиколинонитрил. Смесь 4-бромпиридин 1-оксида (2,0 г, 11,56 ммоль), триметилсилилцианида (3,43 г, 34,68 ммоль) и триэтиламина (2,34 г, 23,12 ммоль) в ацетонитриле (10 мл) перемешивали при 110°C в атмосфере азота в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 20% этилацетата в петролейном эфире) с получением 4-бромпиколинонитрила (1,52 г, 72,4% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,56 (д, J=4,2 Гц, 1H), 7,88 (с, 1H), 7,73 (д, J=4,2 Гц, 1H).
C. 4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)пиколинонитрил. Дегазированную смесь 4-бромпиколинонитрила (1,50 г, 8,24 ммоль), бис(пинаколато)дибора (4,19 г, 16,48 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) (600 мг, 0,82 ммоль) и ацетата калия (2,0 г, 20,6 ммоль) в диоксане (10 мл) нагревали при 100°C в атмосфере азота в течение ночи. Реакционную смесь фильтровали и фильтрат концентрировали в вакууме с получением неочищенного продукта, который очищали при помощи хроматографии на силикагеле (элюируя при помощи 0-30% этилацетата в петролейном эфире) с получением 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиколинонитрила (1,8 г, 9,2% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,73 (д, J=3,3 Гц, 1H), 8,02 (с, 1H), 7,83 (д, J=3,6 Гц, 1H), 1,35 (с, 12H).
Промежуточное соединение 63: трет-Бутил 2-(4-аминопиридин-2-илокси)этилкарбамат
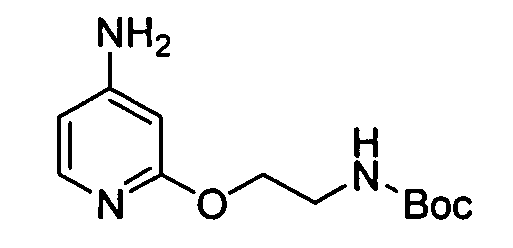
A. 2-Хлорпиридин-4-амин. К раствору 2-хлор-4-нитропиридина (13 г, 82,3 ммоль) в смеси 80% водного этанола (50 мл) и концентрированной хлористоводородной кислоты (5 мл) добавляли порошок железа (20 г, 357,1 ммоль) и смесь нагревали при кипячении с обратным холодильником в течение 3 часов. Добавляли карбонат натрия для нейтрализации остаточной кислоты. Полученную смесь фильтровали через Целит и концентрировали. Остаток очищали на колонке с силикагелем (элюируя при помощи 0-10% метанола в дихлорметане) с получением 2-хлорпиридин-4-амина (6,8 г, 53,1 ммоль, 64,5% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,92 (т, J=7,6 Гц, 1H), 6,47 (д, J=2,0 Гц, 1H), 6,38 (дд, J1=7,6 Гц, J2=2,0 Гц, 1H), 4,36 (шир.с, 2H).
B. 2-(2-Аминоэтокси)пиридин-4-амин. Смесь 2-аминоэтанола (2,1 г, 34,4 ммоль) и гидрида натрия (825 мг, 34,4 ммоль) в диоксане (20 мл) нагревали при кипячении с обратным холодильником в течение 1,5 часов и смесь охлаждали до комнатной температуры и добавляли 2-хлорпиридин-4-амин (4,0 г, 31,3 ммоль). Полученную смесь нагревали до 160°C в атмосфере азота в течение 12 часов. После охлаждения до комнатной температуры реакционную смесь выливали в воду (50 мл). Смесь экстрагировали этилацетатом (30 мл ×3), органический слой объединяли, сушили и концентрировали при пониженном давлении. Остаток очищали на колонке с силикагелем (элюируя при помощи 10% метанола в этилацетате) с получением 2-(2-аминоэтокси)пиридин-4-амина (1,0 г, 20,9% выход) в виде твердого вещества. MS (ESI): m/z 154,2 [M+1]+.
C. трет-Бутил 2-(4-аминопиридин-2-илокси)этилкарбамат. Смесь 2-(2-аминоэтокси)пиридин-4-амина (1,0 мг, 6,54 ммоль), ди-трет-бутилдикарбоната (1,42 мг, 6,54 ммоль) в дихлорметане (20 мл) перемешивали при комнатной температуре в течение 1 часа. Растворитель удаляли и остаток очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 30-50% этилацетата в петролейном эфире) с получением трет-бутил 2-(4-аминопиридин-2-илокси)этилкарбамата (900 мг, 54,5% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,59 (д, J=6,0 Гц, 1H), 6,90 (шир.с, 1H), 6,15 (дд, J1=2,0 Гц, J2=5,6 Гц, 1H), 5,90 (шир.с, 2H), 5,78 (д, J=1,6 Гц, 1H), 4,10 (т, J=6,0 Гц, 2H), 3,22 (м, J=6,0 Гц, 2H), 1,37 (с, 9H).
Промежуточное соединение 64: 6-(Бензилокси)пиридин-2-амин
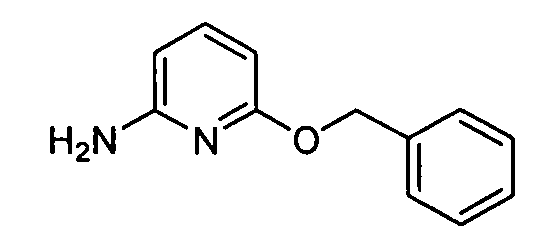
A. 6-(Бензилокси)пиридин-2-амин. Смесь натрия (0,54 г, 23,2 ммоль) и бензилового спирта (2,5 г, 23,2 ммоль) в диоксане (20 мл) нагревали при кипячении с обратным холодильником. После поглощения натрия диоксан удаляли и добавляли 6-бромпиридин-2-амин (2 г, 11,6 ммоль). Смесь нагревали при 160°C в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток очищали на колонке с силикагелем (элюируя при помощи 10-100% этилацетата в петролейном эфире) с получением 6-(бензилокси)пиридин-2-амина (0,6 г, 26% выход). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,83 (т, J=8,8 Гц, 1H), 7,45 (д, J=7,2 Гц, 2H), 7,37 (д, J=7,6 Гц, 2H), 7,28 (д, J=6,4 Гц, 1H), 6,49 (д, J=8,8 Гц, 1H), 6,39 (д, J=8,4 Гц, 1H), 5,29 (с, 2H).
Промежуточное соединение 65: 2-Фторпиридин-3-амин
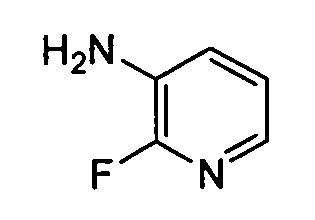
A. 2-Фторпиридин-3-амин. К раствору 2-фтор-3-нитропиридина (600 мг, 4,2 ммоль) в 80% водном этаноле (50 мл) и концентрированной хлористоводородной кислоте (1 мл) добавляли порошок железа (2,4 г, 42 ммоль) и смесь нагревали при кипячении с обратным холодильником в течение 3 часов. Добавляли карбонат натрия для нейтрализации остаточной кислоты и полученную смесь фильтровали через Целит. Фильтрат концентрировали досуха и остаток очищали на колонке с силикагелем (элюируя при помощи 0-10% метанола в дихлорметане) с получением 2-фторпиридин-3-амина (300 мг, 63% выход) в виде твердого вещества. MS (ESI): m/z 112,9 [M+1]+.
Промежуточное соединение 66: 1-((2-(Триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-5-амин
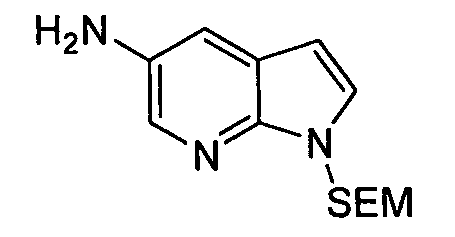
A. 1-((2-(Триметилсилил)этокси)метил)-1H-пирроло[2,3-6]пиридин-5-амин. К раствору 1H-пирроло[2,3-6]пиридин-5-амина (250 мг, 1,88 ммоль) в N,N-диметилформамиде (10 мл) добавляли гидрид натрия (75 мг, 1,88 ммоль) по порциям при 0°C в атмосфере азота. Реакционную смесь перемешивали при этой температуре в течение 1 часа, добавляли по каплям 2-(триметилсилил)этоксиметилхлорид (312 г, 1,88 ммоль) и полученную смесь перемешивали при комнатной температуре в течение ночи. Когда ТСХ анализ показал, что исходное вещество израсходовано, растворитель удаляли при пониженном давлении. Остаток разбавляли этилацетатом, органический слой промывали водой и насыщенным солевым раствором, сушили и упаривали. Неочищенный продукт очищали на колонке с силикагелем (элюируя при помощи 10% этилацетата в петролейном эфире) с получением 1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-5-амина (300 мг, 67,6% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,93 (д, J=2,4 Гц, 1H), 7,27 (м, 2H), 6,34 (д, J=3,6 Гц, 1H), 5,60 (с, 2H), 3,54 (м, 4H), 0,92 (м, 2H), -0,05 (с, 9H).
Промежуточное соединение 67: трет-Бутил-3-гидроксипропилкарбамат
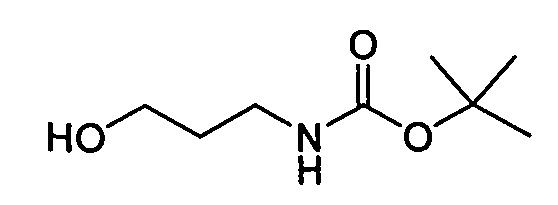
A. трет-Бутил 3-гидроксипропилкарбамат. К раствору 3-аминопропан-1-ола (4,6 г, 61 ммоль) в дихлорметане (40 мл) добавляли раствор ди-трет-бутилдикарбоната (14 г, 64 ммоль) в дихлорметане (40 мл) в течение 30 минут и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь промывали водой и насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали при пониженном давлении с получением неочищенного продукта, который промывали петролейным эфиром и сушили с получением трет-бутил-3-гидроксипропилкарбамата (8,9 г, 83,1% выход) в виде бесцветного масла.
Промежуточное соединение 68: N 2 -Метилпиридин-2,5-диамин
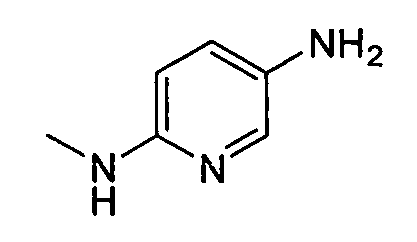
A. N-Метил-5-нитропиридин-2-амин. Раствор 2-бром-5-нитропиридина (1,2 г, 5,9 ммоль) в метиламине (водный раствор, 10 мл) перемешивали при комнатной температуре в течение 5 часов. Добавляли насыщенный солевой раствор и осадок собирали и промывали водой с получением N-метил-5-нитропиридин-2-амина (870 мг, 96% выход) в виде твердого вещества.
B. N2-Метилпиридин-2,5-диамин. Смесь N-метил-5-нитропиридин-2-амина (870 мг, 5,7 ммоль) и 10% палладия на угле (50% влажности, масс/масс, 170 мг) в метаноле гидрировали под давлением водорода 1 атмосфера в течение 4 часов. Катализатор отфильтровывали и фильтрат концентрировали. Остаток очищали на колонке с силикагелем (элюируя при помощи 10-33% этилацетата в петролейном эфире) с получением N2-метилпиридин-2,5-диамина (300 мг, 42% выход) в виде масла. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,63 (с, 1H), 6,90 (д, J=8,4 Гц, 1H), 6,25 (д, J=8,4 Гц, 1H), 4,05 (шир.с, 1H), 3,15 (шир.с, 1H), 2,77 (с, 3H).
Промежуточное соединение 69: 6-(4-(трет-Бутилдиметилсилилокси)пиперидин-1-ил)пиридин-3-амин
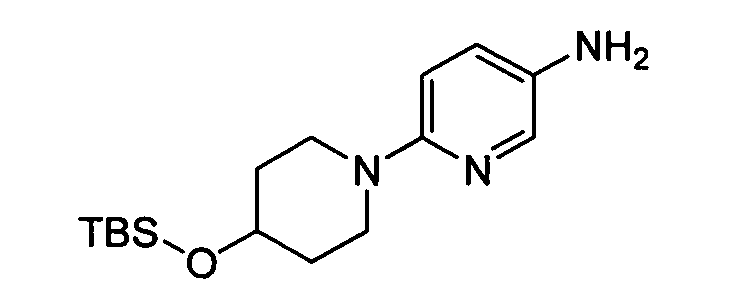
A. 1-(5-Нитропиридин-2-ил)пиперидин-4-ол. Смесь 2-бром-5-нитропиридина (1 г, 4,98 ммоль), пиперидин-4-ола (503 мг, 4,98 ммоль), триэтиламина (503 мг, 4,98 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали в вакууме с получением неочищенного продукта, который очищали при помощи хроматографии на силикагеле (элюируя при помощи 10% этилацетата в петролейном эфире), с получением 1-(5-нитропиридин-2-ил)пиперидин-4-ола (1 г, 90,5% выход).
B. 2-(4-(трет-Бутилдиметилсилилокси)пиперидин-1-ил)-5-нитропиридин. К раствору 1-(5-нитропиридин-2-ил)пиперидин-4-ола (2 г, 8,96 ммоль) и трет-бутилхлордиметилсилана (1,34 г, 8,96 ммоль) в N,N-диметилформамиде (15 мл) добавляли по каплям раствор триэтиламина (0,9 г, 8,96 ммоль) и 4-(диметиламино)пиридин (110 мг, 0,896 ммоль) в N,N-диметилформамиде (5 мл) при 0°C. После перемешивания в течение одного часа реакционную смесь распределяли между водой и этилацетатом. Органический слой отделяли, промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 20% этилацетата в петролейном эфире) с получением 2-4-(трет-бутилдиметилсилилокси)пиперидин-1-ил-5-нитропиридина (2 г, 75% выход).
C. 6-(4-(трет-Бутилдиметилсилилокси)пиперидин-1-ил)пиридин-3-амин. Смесь 2-(4-(трет-бутилдиметилсилилокси)пиперидин-1-ил)-5-нитропиридина (500 мг, 1,48 ммоль), 10% палладия на углероде (50% влажности, 50 мг) в метаноле (2 мл) гидрировали под давлением водорода 1 атмосфера при комнатной температуре в течение ночи. Реакционную смесь фильтровали и фильтрат концентрировали в вакууме с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 50% этилацетата в петролейном эфире), с получением 6-(4-(трет- бутилдиметилсилилокси)пиперидин-1-ил)пиридин-3-амина (200 мг, 44,0% выход).
Промежуточное соединение 70: 2-(2-(Пирролидин-1-ил)этокси)пиридин-4-амин
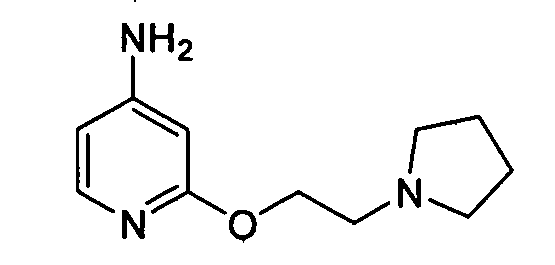
A. 2-(2-(Пирролидин-1-ил)этокси)пиридин-4-амин. Смесь гидрида натрия (0,4 г, 8,6 ммоль) и 2-(пирролидин-1-ил)этанола (0,98 г, 8,6 ммоль) в диоксане (20 мл) нагревали при кипячении с обратным холодильником в течение 1 часа (110°C). После поглощения натрия смесь концентрировали для удаления диоксана. Добавляли 2-хлорпиридин-4-амин (1 г, 7,8 ммоль) и смесь нагревали до 160°C в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом и органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток очищали на колонке с силикагелем (элюируя при помощи 33-100% этилацетата в петролейном эфире) с получением 2-(2-(пирролидин-1-ил)этокси)пиридин-4-амина (0,5 г, 31,3%). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,58 (д, J=6,0 Гц, 1H), 6,23 (м, 1H), 5,95 (д, J=1,6 Гц, 1H), 4,25 (т, J=6,0 Гц, 2H), 2,89 (т, J=6,0 Гц, 2H), 2,67 (м, 4H), 1,82 (м, 4H).
Промежуточное соединение 71: N 2 -(2-Пирролидин-1-ил-этил)-пиридин-2,4-диамин
A. 2-Хлорпиридин 1-оксид. К раствору 2-хлорпиридина (5 г, 0,04 моль) в дихлорметане (50 мл) добавляли 3-хлорбензопероксокислоту (15,2 г, 0,08 ммоль) по порциям при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 1 часа. После того, как исходное вещество было израсходовано, добавляли насыщенный водный раствор тиосульфата натрия. Органический слой отделяли и промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали при пониженном давлении с получением 2-хлорпиридин 1-оксида (4 г, 71% выход) в виде твердого вещества.
B. 2-Хлор-4-нитропиридин 1-оксид. 2-Хлорпиридин 1-оксид (4 г, 0,03 моль) смешивали с серной кислотой (16 г, 0,18 моль) и дымящей азотной кислотой (9 г, 0,15 моль) и смесь перемешивали при 90°C в течение 2,5 часов. После охлаждения до комнатной температуры реакционную смесь выливали медленно в холодную воду (100 мл) при 0-5°C. Смесь разбавляли этилацетатом (480 мл) и подщелачивали путем добавления 6н водного раствора гидроксида натрия при 0-5°C до pH=10. Органический слой отделяли, промывали насыщенным солевым раствором (100 мл ×4), сушили над сульфатом натрия и концентрировали при пониженном давлении с получением 2-хлор-4-нитропиридин 1-оксида (1,2 г, 24% выход) в виде твердого вещества.
C. 4-Нитро-2-(2-(пирролидин-1-ил)этиламино)пиридин 1-оксид. Смесь 2-хлор-4-нитропиридин 1-оксида (400 мг, 2,3 ммоль) и 2-(пирролидин-1-ил)этанамина (524 мг, 4,6 ммоль) в этаноле (5 мл) нагревали при 80°C в течение ночи. Реакционную смесь концентрировали в вакууме и остаток очищали на колонке с силикагелем (10% метанол в этилацетате) с получением 4-нитро-2-(2-(пирролидин-1-ил)этиламино)пиридин 1-оксида (300 мг, 51% выход) в виде твердого вещества. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,33 (д, J=7,2 Гц, 1H), 7,71 (д, J=4,2 Гц, 1H), 7,50 (дд, J1=7,2 Гц, J2=2,8 Гц, 1H), 3,64 (т, J=6,4 Гц, 2H), 2,96 (с, 2H), 2,80 (с, 4H), 1,90 (с, 4H).
D. N2-(2-Пирролидин-1-ил-этил)-пиридин-2,4-диамин. Смесь 4-нитро-2-(2-(пирролидин-1-ил)этиламино)пиридин 1-оксида (300 мг, 1,19 ммоль) и никеля Ренея (50 мг) в метаноле (10 мл) гидрировали под давлением водорода 1 атм в течение 1 часа. Катализатор отфильтровывали и фильтрат концентрировали с получением N2-(2-(пирролидин-1-ил)этил)пиридин-2,4-диамина (210 мг, 85% выход). MS (ESI): m/z 206,9 [M+1]+.
Промежуточное соединение 72: 2,6-Диметилпиридин-4-амин
A. 2,6-Диметилпиридин 1-оксид. К раствору 2,6-диметилпиридина (10,7 г, 0,1 моль) в дихлорметане (100 мл) добавляли 3-хлорбензопероксокислоту (32,4 г, 0,15 ммоль) по порциям при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 1 часа. После того, как исходное вещество было израсходовано, добавляли насыщенный водный раствор тиосульфата натрия. Органический слой отделяли, промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали при пониженном давлении с получением 2,6-диметилпиридин 1-оксида (12 г, 97% выход) в виде твердого вещества.
B. 2,6-Диметил-4-нитропиридин 1-оксид. К раствору 2,6-диметилпиридин 1-оксида (7 г, 0,057 моль) в серной кислоте (20 мл) добавляли смесь серной кислоты и азотной кислоты (об/об, 1:1, 50 мл) при 0°C. Смесь нагревали при 100°C до поглощения исходного вещества. Смесь охлаждали, нейтрализовали насыщенным раствором карбоната натрия и экстрагировали этилацетатом. Объединенные органические слои сушили над сульфатом натрия и концентрировали с получением 2,6-диметил-4-нитропиридин 1-оксида (3,1 г, 33% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,01 (с, 2H), 2,57 (с, 6H).
C. 2,6-Диметилпиридин-4-иламин. К раствору 2,6-диметил-4-нитропиридин 1-оксида (2 г, 11,9 ммоль) в ледяной уксусной кислоте добавляли 10% палладий на активированном угле (0,2 г) и смесь гидрировали при давлении водорода 45 ф/дюйм2(3,164 кг/см2) при 50°C в течение 19 часов. Реакционную смесь фильтровали и фильтрат доводили до pH=12 при помощи 6н раствора гидроксида натрия. Смесь экстрагировали хлороформом, сушили, фильтровали и упаривали с получением 2,6-диметилпиридин-4-иламина (600 мг, 47% выход). MS (ESI): m/z 113,1 [M+1]+.
Промежуточное соединение 73: трет-Бутил 6-амино-1-оксоизоиндолин-2-карбоксилат
A. Метил 2-метил-5-нитробензоат. К перемешиваемому раствору 2-метил-5-нитробензойной кислоты (2 г, 11 ммоль) в метаноле добавляли по каплям тионилхлорид (3,2 г, 27,5 ммоль) при 0°C и полученную смесь нагревали при кипячении с обратным холодильником в течение 2 часов. После того, как тонкослойная хроматография показала, что исходное вещество израсходовано, растворитель удаляли при пониженном давлении и остаток растворяли в смеси этилацетата и воды. Органический слой отделяли и водную фазу экстрагировали этилацетатом три раза. Объединенный органический слой сушили над сульфатом натрия и упаривали при пониженном давлении с получением метил 2-метил-5-нитробензоата (2,08 г, 96,7% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,69 (с, 1H), 8,16 (д, J=6,0 Гц, 1H), 7,36 (д, J=8,4 Гц, 1H), 3,89 (с, 3H), 2,65 (с, 3H).
B. Метил 2-(бромметил)-5-нитробензоат. Суспензию метил 2-метил-5-нитробензоата (2,08 г, 10,67 ммоль), N-бромсукцинимида (2,06 г, 11,58 ммоль), 2,2'-азобис(2-метилпропионитрил)а (AIBN) (40 мг, 0,244 ммоль) в тетрахлорметане (25 мл) нагревали при кипячении с обратным холодильником в течение 5 часов. Когда тонкослойная хроматография показала, что исходное вещество израсходовано, смесь охлаждали до комнатной температуры. Осадок отфильтровывали и фильтрат упаривали с получением метил 2-(бромметил)-5-нитробензоата (2,2 г), который использовали непосредственно на следующей стадии.
C. 6-Нитроизоиндолин-1-он. Неочищенный метил 2-(бромметил)-5-нитробензоат (2,2 г) растворяли в метанольном растворе аммиака (7н) и смесь перемешивали при комнатной температуре в течение ночи. Осадок отфильтровывали и промывали этанолом с получением 6-нитроизоиндолин-1-она (616 мг, 32% выход для двух стадий) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,97 (с, 1H), 8,44 (д, J=2,0 Гц, 1H), 8,33 (с, 1H), 7,86 (д, J=8,4 Гц, 1H), 4,53 (с, 2H).
D. трет-Бутил 6-нитро-1-оксоизоиндолин-1-карбоксилат. К смеси 6-нитроизоиндолин-1-она (500 мг, 2,8 ммоль) и ди-трет-бутилдикарбоната (610 мг, 228 ммоль) в дихлорметане (50 мл) добавляли N,N-диметилпиридин-4-амин (34 мг, 0,28 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением трет-бутил 6-нитро-1-оксоизоиндолин-2-карбоксилата (778 мг, 90,6% выход) в виде твердого вещества.
E. трет-Бутил 6-амино-1-оксоизоиндолин-2-карбоксилат. Смесь трет-бутил 6-нитро-1-оксоизоиндолин-2-карбоксилата (426 мг, 1,53 ммоль) и 10% палладия на активированном угле (40 мг) в метаноле (50 мл) гидрировали под давлением водорода 1 атмосфера при комнатной температуре в течение 40 минут. Катализатор отфильтровывали и фильтрат концентрировали с получением трет-бутил 6-амино-1-оксоизоиндолин-2-карбоксилата (273 мг, 64% выход). MS (ESI): m/z 249,2 [M+1]+.
трет-Бутил 5-амино-1-оксоизоиндолин-2-карбоксилат получали, следуя процедуре, аналогичной используемой для получения трет-бутил 6-амино-1-оксоизоиндолин-2-карбоксилата, с использованием 2-метил-4-нитробензойной кислоты в качестве исходного вещества.
Промежуточное соединение 74: 3-Этил-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-амин
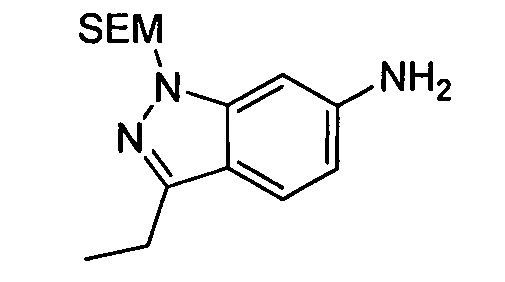
A. 6-Нитро-1-((2-(триметилсилил)этокси)метил)-3-винил-1H-индазол. Дегазированную смесь 3-иод-6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазола (1,1 г, 2,63 ммоль), 4,4,5,5-тетраметил-2-винил-1,3,2-диоксаборолана (486 мг, 3,16 ммоль), карбоната натрия (558 мг, 5,26 ммоль) и 1,1'-бис(дифенилфосфино)ферроценпалладийдихлорида (191 мг, 0,26 ммоль) в смеси диоксана и воды (об/об, 3:1, 24 мл) нагревали при 100°C в течение ночи в атмосфере азота. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Объединенные органические слои сушили над безводным сульфатом натрия, упаривали при пониженном давлении и очищали на колонке с силикагелем (элюируя при помощи 0-2% этилацетата в петролейном эфире) с получением 6-нитро-1-((2-(триметилсилил)этокси)метил)-3-винил-1H-индазола (610 мг, 72,8% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,79 (т, J=1,6 Гц, 1H), 8,30 (д, J=9,2 Гц, 1H), 8,04 (м, 1H), 7,08 (м, 1H), 6,23 (м, 1H), 5,91 (с, 2H), 5,63 (м, 1H), 3,55 (т, J=8,0 Гц, 2H), 0,80 (т, J=7,6 Гц, 2H), -0,12 (с, 9H).
B. 3-Этил-1-((2-(триметилсилил)этокси)метил)-1Н-индазол-6-амин. Смесь 6-нитро-1-((2-(триметилсилил)этокси)метил)-3-винил-1H-индазола (610 мг, 1,91 ммоль) и 10% палладия на активированном угле (30 мг) в метаноле (10 мл) гидрировали под давлением водорода 1 атмосфера при комнатной температуре в течение ночи. Катализатор отфильтровывали и фильтрат концентрировали в вакууме, неочищенный продукт очищали на колонке с силикагелем (элюируя при помощи 4-20% этилацетата в петролейном эфире) с получением 3-этил-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-амина (390 мг, 69,9% выход). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,43 (м, 1H), 6,70 (т, J=0,8 Гц, 1H), 6,63 (м, 1H), 5,51 (с, 2H), 3,51 (т, J=7,6 Гц, 2H), 2,86 (м, 2H), 1,32 (кв., J=7,6 Гц, 1H), 0,82 (т, J=8,0 Гц, 8H), 0,09 (м, 9H); MS (ESI): m/z 292,18 [M+1]+.
Промежуточное соединение 75: 1-Изопропил-1Н-индазол-6-амин
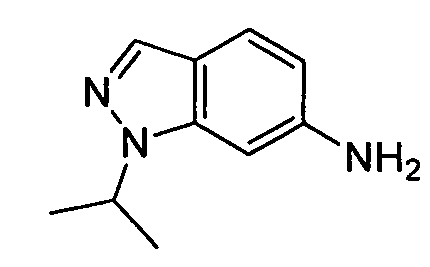
A. 1-Изопропил-6-нитро-1H-индазол. К раствору 6-нитро-1H-индазола (5 г, 31 ммоль) в N,N-диметилформамиде (75 мл) добавляли гидрид натрия (60% в минеральном масле, 1,4 г, 34 ммоль) по порциям при 0°C. По завершении добавления смесь перемешивали в течение 30 минут при 0°C и добавляли 2-иод-2-метилпропан (27,6 г, 150 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи, гасили путем добавления воды (250 мл) и экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали. Остаток очищали на колонке с силикагелем (элюируя при помощи 5-10% этилацетата в петролейном эфире) с получением 1-изопропил-6-нитро-1H-индазола (2,48 г, 40% выход) в виде желтого твердого вещества. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,50 (с, 1H), 8,08 (д, J=8,0 Гц, 1H), 7,86 (д, J=8,0 Гц, 1H), 7,82 (с, 1H), 5,02 (м, 1H), 1,47 (д, J=4,0 Гц, 6H).
B. 1-Изопропил-1H-индазол-6-амин. К смеси 1-изопропил-6-нитро-1H-индазола (1 г, 4,88 ммоль) и хлорида аммония (2,6 г, 4,88 ммоль) в метаноле (30 мл) добавляли цинковую пыль (3,18 г, 4,88 ммоль) по порциям при 0°C. По завершении добавления реакционную смесь перемешивали при комнатной температуре в течение ночи, фильтровали, концентрировали и очищали на колонке с силикагелем (элюируя при помощи 1% метанола в дихлорметане) с получением 1-изопропил-1H-индазол-6-амина (0,56 г, 65,9% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,75 (с, 1H), 7,41 (д, J=8,0 Гц, 1H), 6,56 (д, J=8,0 Гц, 2H), 5,33 (шир.с, 2H), 4,68 (м, 1H), 1,50 (с, 6H).
Промежуточное соединение 76: 1-((2-(Триметилсилил)этокси)метил)-1H-бензо[d][1,2,3]триазол-5-амин
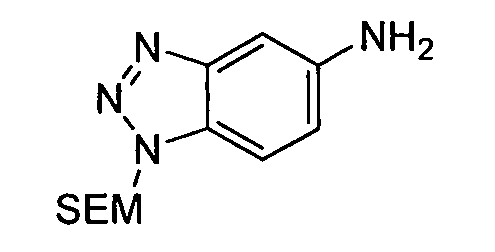
A. 1-((2-(Триметилсилил)этокси)метил)-1H-бензо[d][1,2,3]триазол-5-амин. К раствору 1H-бензо[d][1,2,3]триазол-5-амина (500 мг, 3,73 ммоль) в N,N-диметилформамиде (15 мл) добавляли гидрид натрия (149 мг, 3,73 ммоль, 60% в минеральном масле) при 0°C в атмосфере азота и смесь перемешивали в течение 1 часа при комнатной температуре. (2-(Хлорметокси)этил)триметилсилан (619 мг, 3,73 ммоль) добавляли по каплям при 0°C и полученную смесь продолжали перемешивать еще в течение 2 часов при комнатной температуре. Реакционную смесь выливали в ледяную воду (50 мл), экстрагировали этилацетатом (100 мл ×3). Объединенные органические слои сушили над безводным сульфатом натрия и упаривали при пониженном давлении с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 5-10% этилацетата в петролейном эфире), с получением 1-((2-(триметилсилил)этокси)метил)-1H-бензо[d][1,2,3]триазол-5-амина (400 мг, 40,6% выход), который получали в виде масла. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,60 (д, J=9,2 Гц, 1H), 6,98 (м, 1H), 6,83 (д, 1=I,6 Гц, 1H), 5,81 (с, 2H), 3,68 (т, J=8,0 Гц, 2H), 0,88 (т, J=8,0 Гц, 2H), -0,07 (с, 9H); MS (ESI): m/z 265,2 [M+1]+.
Промежуточные соединения 77 и 78: 6-Бром-1,3-диметил-1H-индазол и 6-бром-2,3-диметил-2H-индазол

A. 6-Бром-1,3-диметил-1H-индазол и 6-бром-2,3-диметил-2H-индазол. 6-Бром-3-метил-1H-индазол (3 г, 14,21 ммоль) растворяли в 20 мл N,N-диметилформамида и добавляли гидрид натрия (60% дисперсия в минеральном масле, 0,682 г; 17,06 ммоль) при 0°C в атмосфере азота. Реакционную смесь перемешивали при 0°C в течение 1 часа и добавляли иодметан (1,06 мл, 17,06 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи в атмосфере азота. Когда реакция завершалась, как показал анализ ЖХ/МС, реакционную смесь выливали в воду/насыщенный солевой раствор и экстрагировали этилацетатом несколько раз. Объединенный органический слой сушили над безводным сульфат магния и концентрировали. Неочищенную смесь очищали при помощи хроматографии с использованием градиента 0-100% этилацетата в гексане с получением 6-бром-1,3-диметил-1H-индазола в виде желтого твердого вещества (2,04 г, 64% выход) и 6-бром-2,3-диметил-2H-индазола в виде желтого твердого вещества (1,02 г, 32% выход).
1H ЯМР 6-бром-1,3-диметил-1H-индазола (400 МГц, ДМСО-d6) δ (м.д.) 7,88-7,92 (м, 1H), 7,64-7,69 (м, 1H), 7,21 (дд, J=1,64, 8,52 Гц, 1H), 3,94 (с, 3H), 2,46 (с, 3H). MS (ESI) m/z 226 [M+1]+
1H ЯМР 6-бром-2,3-диметил-2H-индазола (400 МГц, ДМСО-d6) δ (м.д.) 7,71-7,77 (м, 1H), 7,62-7,68 (м, 1H), 7,05 (дд, J=1,68, 8,81 Гц, 1H), 4,03 (с, 3H), 2,60 (с, 3H). MS (ESI) m/z 226 [M+1]+
Промежуточное соединение 79: 4-Фтор-3-(2-метоксиэтокси)-анилин
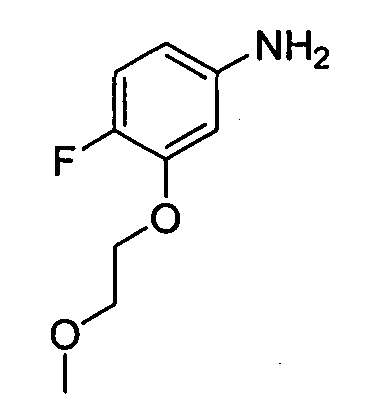
A. 1-Фтор-2-(2-метоксиэтокси)-4-нитробензол. Диизопропилазодикарбоксилат (1,356 мл, 7,00 ммоль) добавляли по каплям к перемешиваемому раствору 2-фтор-5-нитрофенола (1,00 г, 6,37 ммоль), трифенилфосфина (1,837 г, 7,00 ммоль) и 2-метоксиэтанола (0,533 г, 7,00 ммоль) в тетрагидрофуране (10 мл), который охлаждали на водяной бане. Полученную темно-красную смесь перемешивали при комнатной температуре в атмосфере азота в течение 1,5 часов. Полученную смесь очищали с использованием флэш-хроматографии (Biotage) (0-30% этилацетата в гексане). Фракции, содержащие желаемый продукт, объединяли и промывали два раза водой и один раз насыщенным солевым раствором. Органические слои сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе почти досуха. Остаток разбавляли холодным гексаном. Твердые вещества собирали при помощи вакуумной фильтрации, промывали холодным гексаном и сушили в условиях высокого вакуума с получением желаемого продукта (0,865 г, 4,02 ммоль, 63% выход) в виде желтоватых игольчатых кристаллов. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,01 (дд, J=2,73, 7,42 Гц, 1H), 7,91 (ддд, J=2,73, 3,90, 8,98 Гц, 1H), 7,54 (дд, J=8,98, 10,93 Гц, 1H), 4,31-4,39 (м, 2H), 3,67-3,76 (м, 2H), 3,32 (с, 3H); MS (ESI) m/z 216,3 [M+1]+.
B. 4-Фтор-3-(2-метоксиэтокси)анилин. 1-Фтор-2-(2-метоксиэтокси)-4-нитробензол (0,862 г, 4,01 ммоль) растворяли в этилацетате (5 мл) и этаноле (15 мл) при перемешивании при комнатной температуре. Подсоединяли насадку для подачи вакуума/азота/водорода. Атмосферу в колбе удаляли и замещали азотом два раза. Добавляли палладий (10% масс. на активированном угле) (0,213 г, 0,200 ммоль) и атмосферу в колбе удаляли и замещали водородом три раза. Полученную смесь интенсивно перемешивали под баллоном водорода при комнатной температуре в течение 2,5 часов. Полученную черную смесь фильтровали через Целити фильтровальную лепешку тщательно промывали метанолом. Фильтрат концентрировали на роторном испарителе и сушили в условиях высокого вакуума с получением желаемого продукта (0,731 г, 3,95 ммоль, 99% выход) в виде твердого вещества янтарного цвета. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 6,81 (дд, J=8,59, 11,71 Гц, 1H), 6,32 (дд, J=2,73, 7,42 Гц, 1H), 6,01-6,09 (м, 1H), 4,92 (с, 2H), 3,99-4,05 (м, 2H), 3,61-3,67 (м, 2H), 3,31 (с, 3H); 19F ЯМР (376 МГц, ДМСО-d6) δ (м.д.) -151,45 (м, 1F); MS (ESI) m/z 186,2 [M+1]+.
Промежуточное соединение 80: 2-(2-(трет-Бутилдиметил-силилокси)этокси)пиридин-4-амин
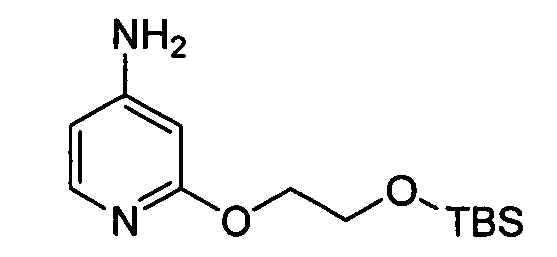
A. 2-(трет-Бутилдиметилсилилокси)этанол. Смесь этан-1,2-диола (6,2 г, 0,1 моль), имидазола (10 г, 0,15 моль) и трет-бутилхлордиметилсилана (10 г, 0,15 моль) в N,N-диметилформамиде (15 мл) перемешивали при комнатной температуре в течение ночи. Реакцию гасили путем добавления воды и смесь экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и концентрировали с получением 2-(трет-бутилдиметил-силилокси)этанола в виде масла (10 г, 56,8% выход).
B. 2-(2-(трет-Бутилдиметилсилилокси)этокси)пиридин-4-амин. К раствору 2-(трет-бутилдиметилсилилокси)этанола (4,1 г, 23,3 ммоль) в диоксане (20 мл) добавляли гидрид натрия (60% в минеральном масле, 0,96 г, 24 ммоль). Смесь нагревали при кипячении с обратным холодильником в течение 1,5 часов. Когда реакционную смесь охлаждали до комнатной температуры, добавляли 2-хлорпиридин-4-амин (2,0 г, 15,5 ммоль) и реакционную смесь нагревали при 160°C в течение 7 часов в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Органический слой концентрировали при пониженном давлении и очищали на колонке с силикагелем (элюируя при помощи 1-10% этилацетата в петролейном эфире) с получением 2-(2-(трет-бутилдиметилсилилокси)этокси)пиридин-4-амина (180 мг, 4,4% выход) в виде твердого вещества. MS (ESI): m/z 268,9 [M+1]+.
Промежуточное соединение 81: цис-4-Амино-1-((трет-бутилдифенилсилилокси)метил)циклогексанол
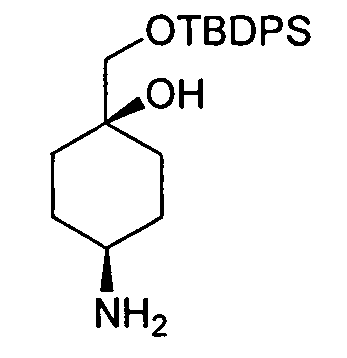
A. цис-трет-Бутил-1-оксаспиро[2,5]октан-6-илкарбамат. К раствору иодида триметилсульфоксония (12,5 г, 57 ммоль) в N,N-диметилформамиде (100 мл) добавляли гидрид натрия (2,5 г, 62,5 ммоль, 60% в минеральном масле) при 10°C и смесь перемешивали при комнатной температуре в течение 40 минут. Смесь охлаждали до 10°C, добавляли трет-бутил 4-оксоциклогексилкарбамат (9,5 г, 44,6 ммоль) и перемешивали при комнатной температуре еще в течение 2 часов. Добавляли воду (150 мл) и смесь экстрагировали этилацетатом (200 мл). Органическую фазу сушили над безводным сульфатом натрия, концентрировали и очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 10% этилацетата в петролейном эфире) с получением цис-трет-бутил-1-оксаспиро[2,5]октан-6-илкарбамата (5 г, 50% выход) в виде белого порошка. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 6,78 (д, J=7,6 Гц, 1H), 3,39 (м, 1H), 2,56 (с, 2H), 1,87 (м, 4H), 1,45 (м, 11H), 1,22 (м, 2H).
B. цис-трет-Бутил-4-гидрокси-4-(гидроксиметил)-циклогексилкарбамат. К раствору цис-трет-бутил-1-оксаспиро[2,5]октан-6-илкарбамата (4,54 г, 20 ммоль) в 1,2-диметоксиэтане (50 мл) добавляли гидроксид калия (5,6 г, 100 ммоль) в 200 мл воды. Смесь перемешивали при температуре кипения с обратным холодильником в течение 10 часов, концентрировали до тех пор, пока не осталось 150 мл растворителя. После фильтрования фильтровальную лепешку промывали водой (50 мл) и простым эфиром (20 мл) с получением цис-трет-бутил-4-гидрокси-4-(гидроксиметил)циклогексилкарбамата (2,8 г, 57% выход) в виде белого порошка. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 6,70 (д, J=8,0 Гц, 1H), 4,49 (шир.с, 1H), 3,83 (шир.с, 1H), 3,15 (м, 3H), 1,50 (м, 17H).
C. цис-трет-Бутил-4-((трет-бутилдифенилсилилокси)метил)-4-гидроксициклогексилкарбамат. К смеси цис-трет-бутил-4-гидрокси-4-(гидроксиметил)циклогексилкарбамата (735 мг, 3 ммоль) и имидазол (340 мг, 5 ммоль) в N,N-диметилформамиде (10 мл) добавляли трет-бутилхлордифенилсилан (2,2 г, 8 ммоль) и смесь перемешивали при 50°C в течение 12 часов. Добавляли воду (30 мл) и раствор экстрагировали этилацетатом (30 мл). Органическую фазу сушили над сульфатом натрия, концентрировали и очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 7-10% этилацетата в петролейном эфире) с получением цис-трет-бутил-4-((трет-бутилдифенилсилилокси)метил)-4-гидроксициклогексилкарбамата (420 мг, 29% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,62 (м, 4H), 7,49 (м, 6H), 6,74 (д, J=7,6 Гц, 1H), 4,09 (с, 1H), 3,31 (с, 2H), 3,12 (шир.с, 1H), 1,58 (м, 6H), 1,44 (м, 11H), 1,00 (с, 9H).
D. цис-4-Амино-1-((трет-бутилдифенилсилилокси)метил)циклогексанол. К перемешиваемому раствору цис-трет-бутил-4-((трет-бутилдифенилсилилокси)метил)-4-гидроксициклогексилкарбамата (966 мг, 2 ммоль) в дихлорметане (15 мл) добавляли по каплям трифторуксусную кислоту (2 мл) при -5°C и смесь перемешивали при 0°C в течение 2 часов. Когда ЖХ-МС анализ показал, что осталось 70% исходного вещества, добавляли дополнительно 2 мл трифторуксусной кислоты и смесь перемешивали еще в течение 6 часов при 0°C пока исходное вещество не было израсходовано. Смесь доводили до pH=8 при помощи насыщенного водного раствора карбоната натрия и полученную смесь экстрагировали этилацетатом (20 мл). Органическую фазу сушили при помощи сульфата натрия и концентрировали с получением неочищенного цис-4-амино-1-((трет-бутилдифенилсилилокси)метил)циклогексанола, который использовали непосредственно без дополнительной очистки.
Промежуточное соединение 82: 6-Бром-1-метилиндолин-2,3-дион
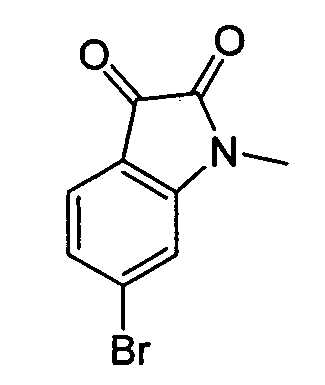
A. 6-Бром-1-метилиндолин-2,3-дион. К раствору 6-броминдолин-2,3-диона (4,5 г, 20 ммоль) в N,N-диметилформамиде (20 мл) добавляли карбонат калия (4,14 г, 30 ммоль) и добавляли по каплям диметилсульфат (3,15 г, 25 ммоль) при перемешивании. После перемешивания при комнатной температуре в течение 2 часов реакционную смесь выливали в ледяную воду (400 мл) и экстрагировали этилацетатом (200 мл). Органический слой сушили при помощи сульфата натрия, концентрировали и очищали колоночной хроматографией на силикагеле (элюируя при помощи 15% этилацетата в петролейном эфире) с получением 6-бром-1-метилиндолин-2,3-диона (3,7 г, 77% выход) в виде красного твердого вещества.
Промежуточное соединение 83: 3-(Метоксиметил)-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-амин
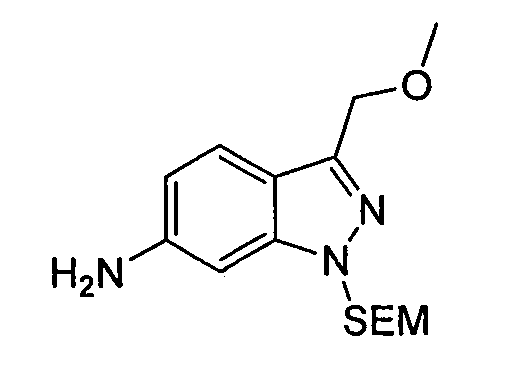
A. Метил 6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазол-3-карбоксилат. Дегазированную смесь 3-иод-6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазола (4,62 г, 11 ммоль), карбоната калия (4,55 г, 33 ммоль), ацетата палладия (250 мг, 1,1 ммоль) и 1,1'-бис(дифенилфосфино)ферроцена (610 мг, 1,1 ммоль) в смеси метанола (25 мл) и N,N-диметилформамида (25 мл) интенсивно перемешивали и нагревали при 80°C под давлением оксида углерода (50 ф/дюйм2(3,515 кг/см2)) в течение 24 часов. После охлаждения до комнатной температуры реакционную смесь фильтровали и фильтрат разбавляли водой (100 мл). Водную смесь экстрагировали этилацетатом (250 мл ×3). Экстракты промывали водой и насыщенным солевым раствором, сушили над сульфатом натрия, концентрировали в вакууме и очищали на колонке с силикагелем (элюируя при помощи 10-25% этилацетата в петролейном эфире) с получением метил 6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазол-3-карбоксилата в виде оранжевого масла (1,8 г, 47% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,36 (д, J=8,8 Гц, 1H), 8,29 (с, 1H), 8,04 (д, J=8,8 Гц, 1H), 5,93 (с, 2H), 4,09 (с, 3H), 3,63 (т, J=8,4 Гц, 2H), 0,92 (т, J=8,4 Гц, 2H), -0,06 (с, 9H).
B. (6-Нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазол-3-ил)метанол. К раствору метил 6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазол-3-карбоксилата (1,8 г, 5,1 ммоль) в безводном тетрагидрофуране (100 мл) добавляли литийалюминийгидрид (5,81 г, 15,3 ммоль) по порциям при 0°C. Когда исходное вещество было израсходовано, реакцию гасили водным раствором гидроксида натрия (0,15 M, 100 мл) и фильтровали. Фильтрат экстрагировали этилацетатом (150 мл ×3). Экстракты промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме с получением (6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазол-3-ил)метанола (800 мг, 48% выход) в виде оранжевого масла. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,16 (с, 1H), 7,90 (м, 2H), 5,78 (с, 2H), 5,10 (с, 2H), 3,61 (м, 2H), 0,93 (м, 2H), -0,05 (с, 9H).
C. 3-(Метоксиметил)-6-нитро-1-((2-(триметилсилил)этокси)метил)-1Н-индазол. К раствору (6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазол-3-ил)метанола (800 мг, 2,47 ммоль) в N,N-диметилформамидее (15 мл) добавляли гидрид натрия (60% в минеральном масле, 148 мг, 3,71 ммоль) по порциям при 0°C и смесь перемешивали при 0°C в течение 30 минут. Добавляли иодметан (527 мг, 3,71 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли воду (50 мл) и водную смесь экстрагировали этилацетатом (50 мл ×3). Экстракты промывали водой и насыщенным солевым раствором, сушили над сульфатом натрия, концентрировали в вакууме и очищали на колонке с силикагелем (элюируя при помощи 20-30% этилацетата в петролейном эфире) с получением 3-(метоксиметил)-6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазола (500 мг, 60% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,18 (с, 1H), 7,95 (д, J=8,0 Гц, 1H), 7,90 (д, J=8,0 Гц, 1H), 5,81 (с, 2H), 4,88 (с, 2H), 3,62 (м, 2H), 3,46 (с, 3H), 0,93 (м, 2H), -0,05 (с, 9H).
D. 3-(Метоксиметил)-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-амин. Дегазированную смесь 3-(метоксиметил)-6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазола (500 мг, 1,48 ммоль) и никеля Ренея(100 мг) в метаноле (150 мл) перемешивали при комнатной температуре под давлением водорода 1 атмосфера в течение ночи. Катализатор отфильтровывали и раствор концентрировали в вакууме с получением 3-(метоксиметил)-1-((2-(триметилсилил)этокси)метил)-1Н-индазол-6-амина (380 мг, 83% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,39 (д, J=8,4 Гц, 1H), 6,53 (м, 2H), 5,47 (с, 2H), 5,43 (с, 2H), 4,56 (с, 2H), 3,46 (т, J=8,0 Гц, 2H), 3,23 (с, 3H), 0,78 (т, J=8,0 Гц, 2H), -0,10 (с, 9H); MS (ESI): m/z 308,1 [M+1]+.
Промежуточное соединение 84: трет-Бутил 6-бром-1-оксо-3,4-дигидроизохинолин-2(1Н)-карбоксилат

A. 6-Бром-3,4-дигидроизохинолин-1(2Н)-он. К перемешиваемому раствору 5-бром-2,3-дигидро-1H-инден-1-она (10 г, 47,6 ммоль) в смеси метилсульфоновой кислоты и дихлорметаны (об/об = 1:1, 100 мл) добавляли азид натрия (6 г, 95,2 ммоль) по порциям при температуре в пределах от 22°C до 29°C. Когда добавление было завершено, смесь перемешивали при комнатной температуре в течение 16 часов, охлаждали до 0°C и нейтрализовали путем добавления 5н водного раствора гидроксида натрия. Водный слой экстрагировали дихлорметаном (250 мл ×3). Объединенные органические слои промывали водой (100 мл ×3) и насыщенным солевым раствором (100 мл ×3), сушили над безводным сульфатом натрия, концентрировали и очищали на колонке с силикагелем (элюируя при помощи 10-33,3% этилацетата в петролейном эфире) с получением 6-бром-3,4-дигидроизохинолин-1(2H)-она (2,1 г, 19,6% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,03 (с, 1H), 7,75 (д, J=8,0 Гц, 1H), 7,54 (д, J=8,0 Гц, 1H), 7,51 (с, 1H), 3,35 (т, J=6,4 Гц, 2H), 2,90 (д, J=6,4 Гц, 2H).
B. трет-Бутил 6-бром-1-оксо-3,4-дигидроизохинолин-2(1Н)-карбоксилат. К смеси 6-бром-3,4-дигидроизохинолин-1(2H)-она (600 мг, 2,67 ммоль) и ди-трет-бутилдикарбоната (872 мг, 4,0 ммоль) в дихлорметане (50 мл) добавляли N,N-диметилпиридин-4-амин (49 мг, 0,40 ммоль) и полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 10% этилацетата в петролейном эфире) с получением трет-бутил-6-бром-1-оксо-3,4-дигидроизохинолин-2(1H)-карбоксилата (730 мг, 84,2% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,86 (д, J=8,8 Гц, 1H), 7,61 (д, J=8,0 Гц, 1H), 7,58 (с, 1H), 3,88 (т, J=7,2 Гц, 2H), 3,00 (д, J=6,0 Гц, 2H), 1,49 (с, 9H).
Промежуточное соединение 85: 5-Амино-2-(2-(трет-бутилдиметилсилилокси)этил)изоиндолин-1-он
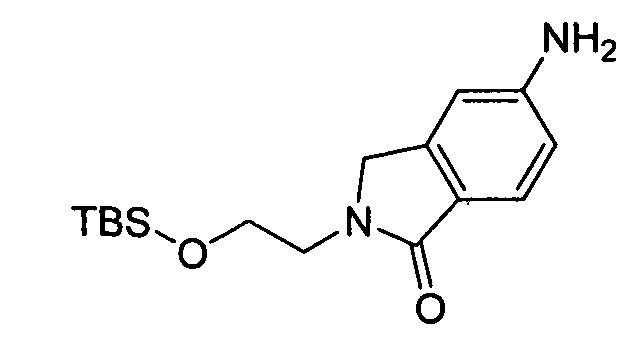
A. 2-(трет-Бутилдиметилсилилокси)этанамин. К раствору 2-аминоэтанола (6,12 г, 0,1 моль) и трет-бутилхлордиметилсилана (18,22 г, 0,12 моль) в дихлорметане (200 мл) добавляли по каплям раствор триэтиламина (46 мл, 0,3 моль) и 4-(диметиламино)пиридина (68 мг) в дихлорметане (100 мл) при 0°C. По завершении добавления смесь перемешивали при комнатной температуре в течение 24 часов. Добавляли воду и органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении с получением неочищенного продукта, который использовали непосредственно на следующей стадии.
B. 2-(2-(трет-Бутилдиметилсилилокси)этил)-5-нитроизоиндолин-1-он. К смеси метил 2-(бромметил)-4-нитробензоата (2,0 г, 7,3 ммоль) в метаноле (30 мл) добавляли 2-(трет-бутилдиметилсилилокси)этанамин (3,5 г, 20 ммоль). Смесь нагревали при кипячении с обратным холодильником в течение 6 часов. Реакционную смесь концентрировали и остаток очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 10% этилацетата в петролейном эфире) с получением 2-(2-(трет-бутилдиметилсилилокси)этил)-5-нитроизоиндолин-1-она в виде белого твердого вещества (1,1 г, 44,9% выход).
C. 5-Амино-2-(2-(трет-бутилдиметилсилилокси)этил)изоиндолин-1-он. Смесь 2-(2-(трет-бутилдиметилсилилокси)этил)-5-нитроизоиндолин-1-она (1,1 г, 3,27 ммоль) и 10% палладия на активированном угле (0,2 г) в метаноле (10 мл) гидрировали под давлением водорода 1 атмосфера (с использованием баллона) при 30°C в течение 1,5 часов. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 20-30% этилацетата в петролейном эфире) с получением 5-амино-2-(2-(трет-бутилдиметилсилилокси)этил)изоиндолин-1-она (600 мг, 60% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,29 (д, J=8,0 Гц, 1H), 6,61 (м, 2H), 5,71 (с, 2H), 4,34 (с, 2H), 3,74 (т, J=6,4 Гц, 2H), 3,50 (т, J=6,4 Гц, 2H), 0,83 (с, 9H), 0,00 (с, 6H).
Промежуточное соединение 86: 6-Амино-2-(2-(трет-бутилдиметилсилилокси)этил)изоиндолин-1-он
A. 2-(2-(трет-Бутилдиметилсилилокси)этил)-6-нитроизоиндолин-1-он. Неочищенный метил 2-(бромметил)-5-нитробензоат (2,2 г), 2-(трет-бутилдиметилсилилокси)этанамин (10,5 г, 60 ммоль) растворяли в метаноле и смесь перемешивали при комнатной температуре в течение ночи. Осажденные вещества фильтровали и промывали этанолом с получением 2-(2-(трет- бутилдиметилсилилокси)этил)-6-нитроизоиндолин-1-она (800 мг, 32% выход) в виде твердого вещества. MS (ESI): m/z 337,1 [M+1]+.
B. 6-Амино-2-(2-(трет-бутилдиметилсилилокси)этил)изоиндолин-1-он. Смесь 2-(2-(трет-бутилдиметилсилилокси)этил)-6-нитроизоиндолин-1-она (900 мг, 2,67 ммоль) и 10% палладия на активированном угле (90 мг) в метаноле (50 мл) гидрировали под давлением водорода 1 атмосфера при комнатной температуре в течение ночи. Катализатор отфильтровывали и фильтрат концентрировали с получением 6-амино-2-(2-(трет-бутилдиметилсилилокси)этил)изоиндолин-1-она (500 мг, 60,9% выход). MS (ESI): m/z 307,2 [M-H]+.
Промежуточное соединение 87: 6-Бром-1-(2-(трет-бутилдиметилсилилокси)этил)индолин-2,3-дион
A. 6-Бром-1-(2-(трет-бутилдиметилсилилокси)этил)индолин-2,3-дион. К раствору 6-броминдолин-2,3-диона (4,5 г, 20 ммоль) в N,N-диметилформамиде (20 мл) добавляли карбонат калия (4,14 г, 30 ммоль) и (2-бромэтокси)(трет-бутил)диметилсилан (5,95 г, 25 ммоль) по каплям при перемешивании. После перемешивания в течение 2 часов реакционную смесь выливали в ледяную воду (400 мл) и экстрагировали этилацетатом (200 мл). Органический слой сушили при помощи сульфата натрия, концентрировали и очищали колоночной хроматографией на силикагеле (элюируя при помощи 10% этилацетата в петролейном эфире) с получением 6-бром-1-(2-(трет- бутилдиметилсилилокси)этил)индолин-2,3-диона (3,2 г, 41,7% выход) в виде красного твердого вещества.
Промежуточное соединение 88: 6-Бром-1-этил-3-метил-1H-индазол
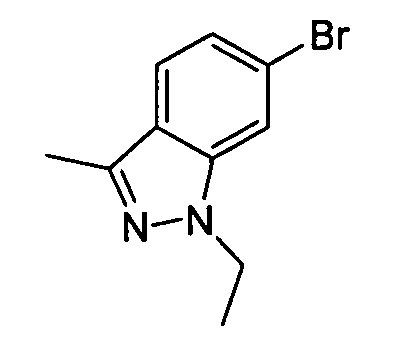
A. 6-Бром-1-этил-3-метил-1H-индазол. К раствору 6-бром-3-метил-1Н-индазол (2 г, 9,5 ммоль) в N,N-диметилформамиде (30 мл) добавляли гидрид натрия (60% в минеральном масле, 0,23 г, 11,4 ммоль) по порциям при 0°C. По завершении добавления смесь перемешивали в течение 30 минут при 0°C, добавляли иодэтан (1,48 г, 19,4 ммоль) и полученную смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили путем добавления воды (50 мл) и смесь экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, упаривали и очищали на колонке с силикагелем (элюируя при помощи 5-10% этилацетата в петролейном эфире) с получением 6-бром-1-этил-3-метил-1Н-индазола (1,2 г, 53% выход) в виде желтого масла. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,39 (м, 2H), 7,07 (м, 1H), 4,20 (с, 2H), 2,40 (с, 3H), 1,32 (с, 3H).
Промежуточное соединение 89: 6-Бром-1-(2-(трет-бутилдиметилсилилокси)этил)-3-метил-1H-индазол
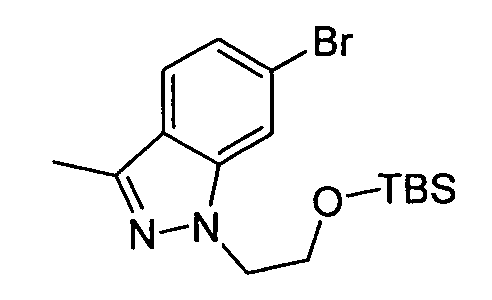
A. 6-Бром-1-(2-(трет-бутилдиметилсилилокси)этил)-3-метил-1H-индазол. К раствору 6-бром-3-метил-1H-индазола (2,1 г, 10 ммоль) в N,N-диметилформамиде (50 мл) добавляли гидрид натрия (440 мг, 11 ммоль) по порциям при 0°C. После перемешивания в течение 0,5 часов добавляли (2-бромэтокси)(трет-бутил)диметилсилан (2,38 г, 10 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду (100 мл) и смесь экстрагировали этилацетатом (100 мл ×3). Объединенный органический слой промывали насыщенным солевым раствором (200 мл), сушили над сульфатом натрия, концентрировали и очищали при помощи хроматографии на силикагеле (элюируя при помощи 0-10% этилацетата в петролейном эфире) с получением 6-бром-1-(2-(трет- бутилдиметилсилилокси)этил)-3-метил-1Н-индазола (1,5 г, 40,7% выход). MS (ESI): m/z 371,0 [M+1]+.
Промежуточное соединение 90: 6-Иод-4-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол
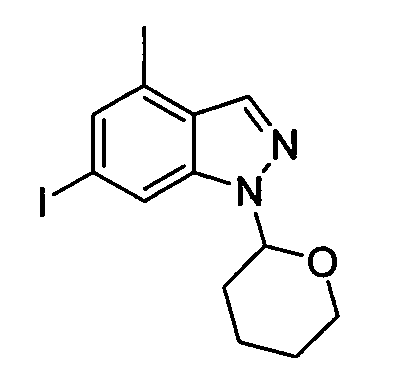
A. 6-Иод-4-метил-1-(тетрагидро-2Н-пиран-2-ил)-1H-индазол. 6-Иод-4-метил-1Н-индазол (0,250 г, 0,969ммоль) растворяли в тетрагидрофуране (10 мл) и добавляли 3,4-дигидро-2H-пиран (0,133 мл, 1,453 ммоль) и метансульфоновую кислоту (9,44 мкл, 0,145 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь перемешивали при 75°C в течение ночи. Когда реакция завершалась, как показал анализ ЖХ/МС, реакционную смесь разбавляли триэтиламином (0,5 мл) и конденсировали при пониженном давлении. Неочищенную смесь очищали при помощи хроматографии с использованием градиента 0-50% этилацетата в гексане с получением 6-иод-4-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазола в виде белого твердого вещества (0,336 г, 99% выход); 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,16 (дд, J=0,10, 0,93 Гц, 1H), 7,96-8,03 (м, 1H), 7,29 (дд, J=0,63, 1,71 Гц, 1H), 5,84 (дд, J=2,64, 9,71 Гц, 1H), 3,83-3,90 (м, 1H), 3,71-3,81 (м, 1H), 2,29-2,43 (м, 1H), 1,99-2,06 (м, 1H), 1,88-1,97 (м, 1H), 1,65-1,80 (м, 1H), 1,52-1,62 (м, 2H); MS (ESI) m/z 343 [M+1]+.
Промежуточное соединение 91: 2-(Метоксиметил)-1-тозил-1H-бензо[d]имидазол-6-амин
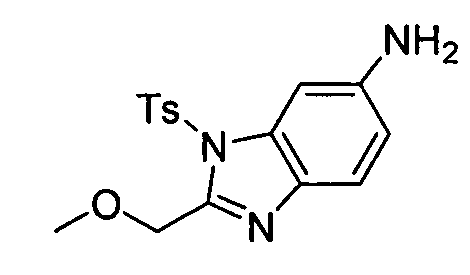
A. 2-(Метоксиметил)-6-нитро-1H-бензо[d]имидазол. 4-Нитробензол-1,2-диамин (1,5 г, 9,80 ммоль) и 2-метоксиуксусную кислоту (0,882 г, 9,80 ммоль) растворяли в 4 M хлористоводородной кислоте (20 мл, 80 ммоль) и нагревали до 100°C в течение 2 часов. Реакционную смесь охлаждали до 0°C и нейтрализовали при помощи 1M гидроксида натрия (80 мл). Образовавшийся осадок фильтровали и сушили с получением желаемого продукта в виде светло-желтого твердого вещества, которое затем дополнительно очищали кристаллизацией с помощью этилацетата и гексана. Полученное твердое вещество сушили в условиях высокого вакуума при 50°C с получением желаемого продукта в виде белого твердого вещества (1,23 г, 60,6% выход). MS (ESI) m/z 207,9 [M+1]+.
B. 2-(Метоксиметил)-5-нитро-1-тозил-1Н-бензо[d]имидазол. 2-(Метоксиметил)-5-нитро-1H-бензо[d]имидазол (1,23 г, 5,94 ммоль) и 4-метилбензол-1-сульфонилхлорид (1,358 г, 7,12 ммоль) растворяли в тетрагидрофуране (50 мл) и добавляли трет-бутоксид натрия (1,141 г, 11,87 ммоль). Смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь выливали в делитульную воронку, содержащую воду и 50% этилацетат. Органический слой концентрировали на роторном испарителе почти досуха и очищали на колонке с диоксидом кремния, элюируя при помощи 0-50% этилацетата в гексане. Фракции, содержащие продукт, концентрировали на роторном испарителе с получением желаемого продукта в виде белого твердого вещества (0,9 г, 42% выход). MS (ESI) m/z 362,3 [M+1]+.
C. 2-(Метоксиметил)-1-тозил-1H-бензо[d]имидазол-5-амин. 2-(Метоксиметил)-5-нитро-1-тозил-1H-бензо[d]имидазол (0,9 г, 2,491 ммоль) растворяли в этаноле и продували азотом. Добавляли палладий на активированном угле (0,530 г, 0,498 ммоль), азот откачивали и реакционную смесь перемешивали под давлением водорода 1 атмосфера в течение 16 часов. Реакционную смесь фильтровали через Целит и промывали этанолом. Органический слой концентрировали на роторном испарителе досуха с получением желаемого продукта в виде фиолетового твердого вещества, которое затем кристаллизовали из этилацетата в гексане с получением желаемого соединения в виде белого твердого вещества (0,7 г, 85% выход). MS (ESI) m/z 332,2[M+1]+.
Промежуточное соединение 92: 6-Бром-1-изопропил-1H-индазол
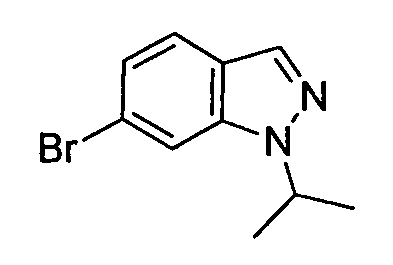
A. 6-бром-1-изопропил-1Н-индазол. Раствор/суспензию 6-бром-1H-индазола (1 г, 5,08 ммоль), в N,N-диметилформамиде (5 мл) охлаждали до 0°C с последующим добавлением гидрида натрия (0,244 г, 6,09 ммоль). Реакционную смесь оставляли для перемешивания в течение 10 минут, затем добавляли 2-иодпропан (0,609 мл, 6,09 ммоль). Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение ночи. ЖХ/МС анализ показал только продукт. К реакционной смеси добавляли воду и продукт экстрагировали этилацетатом два раза, органические слои промывали насыщенным солевым раствором, затем сушили над сульфатом натрия. Растворитель удаляли в вакууме. Неочищенное масло загружали на колонку Biotage и элюировали при помощи 0-100% этилацетата в гексане. Собирали два региоизомера и осуществляли ряд ΝOE анализов для определения региоселективности. Первый проявившийся пик представлял собой желаемый региоизомер 6-бром-1-изопропил-1H-индазол (638 мг, 2,67 ммоль, 52,6% выход), который собирали в виде прозрачного масла. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,10 (с, 1H), 8,04 (с, 1H), 7,72 (д, J=8,59 Гц, 1H), 7,25 (дд, J=1,76, 8,39 Гц, 1H), 5,02 (с, 1H), 1,46 (д, J=6,64 Гц, 6H). MS (ESI): m/z 241,2 [M+1]+.
Промежуточное соединение 93: 6-Амино-2,3-дигидро-1,2-бензизотиазол-1,1-диоксид
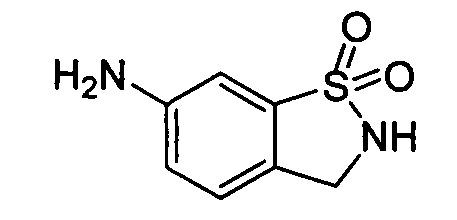
A. 6-Нитро-1,2-бензизотиазол-3(2Н)-он-1,1-диоксид. Смесь дигидрата перйодной кислоты (42 г, 0,184 моль), оксида хрома (VI) (0,23 г, 2,3 ммоль) и 2-метил-5-нитробензолсульфонамида (5 г, 0,023 моль) в ацетонитриле (100 мл) нагревали при кипячении с обратным холодильником до завершения окисления (реакцию отслеживали при помощи ТСХ). Добавляли по каплям изопропиловый спирт (25 мл). По завершении добавления смесь нагревали до температуры кипения с обратным холодильником еще в течение 10 минут, смесь охлаждали до комнатной температуры, фильтровали и твердые вещества промывали ацетоном (60 мл). Фильтраты объединяли и концентрировали при пониженном давлении. Остаток растирали в порошок с раствором серной кислоты (2 н, 69 мл) и 6-нитро-1,2-бензизотиазол-3(2H)-он-1,1-диоксид (2,5 г, 47,2% выход) собирали фильтрованием. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,82 (с, 1H), 8,57 (дд, J1=8,4 Гц, J2=2,0 Гц, 1H), 8,0 (д, J=8,0 Гц, 1H); MS (ESI): m/z 228,9 [M+1]+.
B. 6-Амино-1,2-бензизотиазол-3(2H)-он-1,1-диоксид. Диоксид платины (259 мг, 1,2 ммоль) и 6-нитро-1,2-бензизотиазол-3(2H)-он-1,1-диоксид (1 г, 4,4 ммоль) суспендировали в смеси этанола (52 мл) и диметилформамида (4 мл) и смесь перемешивали в атмосфере водорода в течение ночи. Смесь фильтровали через целит и фильтрат упаривали в вакууме с получением 6-амино-1,2-бензизотиазол-3(2H)-он-1,1-диоксида (700 мг, 80,6% выход).
C. 6-Амино-2,3-дигидро-1,2-бензизотиазол-1,1-диоксид. К суспензии 6-амино-1,2-бензизотиазол-3(2H)-он-1,1-диоксида (700 мг, 3,53 ммоль) в смеси этанола (39 мл), диметилформамида (3 мл) и концентрированной хлористоводородной кислоты (10 мл) добавляли цинковую пыль (2,95 г, 31,8 ммоль) по порциям и реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь осторожно подщелачивали при помощи насыщенного водного раствора бикарбоната натрия и твердого бикарбоната натрия и полученную смесь экстрагировали этилацетатом три раза. Объединенные органические слои сушили над безводным сульфатом натрия и концентрировали с получением 6-амино-2,3-дигидро-1,2-бензизотиазол-1,1-диоксида в виде твердого вещества (250 мг, 38,5% выход). 1H ЯМР (400 МГц, ДМСО-d6): δ (м.д.) 7,53 (с, 1H), 7,12 (д, J=8,4 Гц, 1H), 6,82 (дд, J1=8,4 Гц, J2=2,0 Гц, 1H), 6,77 (с, 2H), 4,16 (д, J=3,2 Гц, 2H); MS (ESI): m/z 184,9 [M+1]+.
Промежуточное соединение 94: трет-Бутил 6-амино-3,3-диметил-2-оксоиндолин-1-карбоксилат
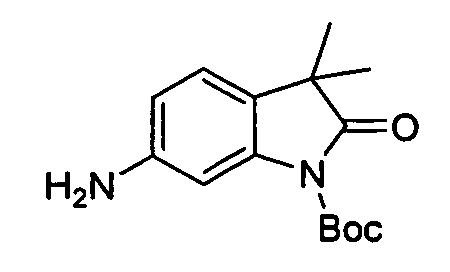
A. 2-Бром-5-нитроанилин. К раствору 2-броманилина (20 г, 0,117 моль) в растворе концентрированной серной кислоты (120 мл) добавляли нитрат калия (11,8 г, 0,117 моль) при 0°C по порциям в течение 1,5 часов. Смесь перемешивали при указанной температуре в течение 0,5 часа и нейтрализовали при помощи водного раствора аммиака (800 мл) до pH>5. Желтый осадок собирали фильтрованием, промывали водой (300 мл ×3) и сушили в вакууме с получением 2-бром-5-нитроанилин (25 г, 100% выход) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,62 (м, 2H), 7,49 (дд, J1=2,4 Гц, J2=8,4 Гц, 1H), 4,46 (шир.с, 2H).
B. N-(2-Бром-5-нитрофенил)метакриламид. К перемешиваемому раствору метакриловой кислоты (2,0 г, 23 ммоль) в N,N-диметил-ацетамиде (15 мл) добавляли по каплям тионилхлорид (2,77 г, 23 ммоль) при 0°C в атмосфере азота и смесь перемешивали в течение 0,5 часов при этой температуре. Добавляли 2-бром-5-нитроанилин (5,0 г, 23 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду (150 мл). Желтый осадок собирали фильтрованием, промывали водой (50 мл ×3) и сушили в вакууме с получением N-(2-бром-5-нитрофенил)метакриламида (5,2 г, 80% выход) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,78 (с, 1H), 8,50 (с, 1H), 8,07 (м, 2H), 6,03 (с, 1H), 5,69 (с, 1H), 2,06 (с, 3H).
C. 3,3-Диметил-6-нитроиндолин-2-он. Раствор N-(2-бром-5-нитрофенил)метакриламида (5,0 г, 17,6 ммоль), диацетоксипалладия(II) (79 мг, 0,35 ммоль), тетрабутиламмонийбромида (5,7 г, 17,6 ммоль) и триэтиламина (6,1 мл, 44 ммоль) в безводном N,N-диметилформамиде (150 мл) в атмосфере азота нагревали при 80°C в течение 1 часа. Добавляли формиат натрия (1,2 г, 17,6 ммоль) и смесь перемешивали при 80°C в течение 10 часов. Добавляли воду (600 мл) и смесь экстрагировали этилацетатом (400 мл ×3). Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, концентрировали и очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 10-25% этилацетата в петролейном эфире) с получением 3,3-диметил-6-нитроиндолин-2-она (2,5 г, 69% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,73 (с, 1H), 7,87 (м, 1H), 7,55 (м, 2H), 1,28 (с, 6H).
D. трет-Бутил 3,3-диметил-6-нитро-1-оксоиндолин-1-карбоксилат. К раствору 3,3-диметил-6-нитроиндолин-2-она (250 мг, 1,21 ммоль) в растворе бикарбоната натрия (204 мг, 2,43 ммоль) в тетрагидрофуране (10 мл) добавляли ди-трет-бутилдикарбонат (529 мг, 2,43 ммоль) при 0°C в атмосфере азота и смесь перемешивали в течение 6 часов при комнатной температуре. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток очищали на колонке с силикагелем (элюируя при помощи 1-10% этилацетата в петролейном эфире) с получением трет-бутил 3,3-диметил-6-нитро-2-оксоиндолин-1-карбоксилата (290 мг, 78,4% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,70 (д, J=1,6 Гц, 1H), 8,04 (дд, J1=2,0 Гц, J2=8,0 Гц, 1H), 7,30 (д, J=8,0 Гц, 1H), 1,61 (с, 9H), 1,40 (с, 6H).
E. трет-Бутил 6-амино-3,3-диметил-2-оксоиндолин-1-карбоксилат. К раствору трет-бутил 3,3-диметил-6-нитро-2-оксоиндолин-1-карбоксилат (0,29 г, 0,95 ммоль) в метаноле (5 мл) добавляли 10% палладий на активированном угле (0,15 г) и смесь гидрировали под давлением водорода 1 атмосфера при комнатной температуре в течение 3 часов. Когда ТСХ анализ (50% этилацетата в петролейном эфире) показал, что исходное вещество было израсходовано, реакционную смесь фильтровали и фильтрат концентрировали с получением трет-бутил 6-амино-3,3-диметил-2-оксоиндолин-1-карбоксилата (230 мг, 88% выход). MS (ESI): m/z 211 A [M+1]+.
Промежуточное соединение 95: 6-Иод-3,3-диметил-1-((2-(триметилсилил)этокси)метил)индолин-2-он
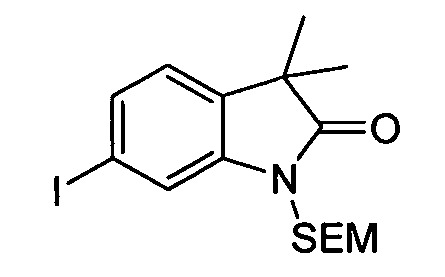
A. 6-Амино-3,3-диметилиндолин-2-он. Смесь 3,3-диметил-6-нитроиндолин-2-она (2,5 г, 12,1 ммоль) и 10% палладия на углероде (50% влажности, масс/масс, 250 мг) в смеси метанола и этилацетата (об:об=1:1, 20 мл) гидрировали под давлением водорода 1 атмосфера при комнатной температуре в течение 3 часов. Катализатор отфильтровывали и фильтрат концентрировали в вакууме с получением 6-амино-3,3-диметилиндолин-2-она (2,0 г, 95% выход).
B. 6-Иод-3,3-диметилиндолин-2-он. К раствору 6-амино-3,3-диметилиндолин-2-она (1,04 г, 5,9 ммоль) в хлористоводородной кислоте (3 M, 30 мл) добавляли нитрит натрия (406 мг, 5,9 ммоль) при 0°C. После перемешивания в течение 0,5 часов добавляли по каплям раствор иодида калия (978 мг, 5,9 ммоль) и реакционную смесь перемешивали при 0°C в течение 2 часов. Реакционную смесь нейтрализовали при помощи карбоната натрия и экстрагировали этилацетатом. Органический слой объединяли, сушили над сульфатом натрия, фильтровали и концентрировали с получением неочищенного продукта, который очищали при помощи хроматографии на силикагеле (элюируя при помощи 10% этилацетата в петролейном эфире), с получением 6-иод-3,3-диметилиндолин-2-она в виде бледно-желтого твердого вещества (780 мг, выход 46%); MS (ESI): m/z 287,9 [M+1]+.
C. 6-Иод-3,3-диметил-1-((2-(триметилсилил)этокси)метил)индолин-2-он. К раствору 6-иод-3,3-диметилиндолин-2-она (780 мг, 2,7 ммоль) в N,N-диметилформамиде (20 мл) добавляли гидрид натрия (162 мг, 4,1 ммоль, 60% в минеральном масле) по порциям при 0°C. Смесь перемешивали в течение 0,5 часов при 0°C и добавляли (2-(хлорметокси)этил)триметилсилан (678 мг, 4,1 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакцию гасили путем добавления раствора хлорида аммония (30 мл) и смесь экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали. Остаток очищали на колонке с силикагелем (элюируя при помощи 10% этилацетата в петролейном эфире) с получением 6-иод-3,3-диметил-1-((2-(триметилсилил)этокси)метил)индолин-2-она (950 мг, 84% выход) в виде желтого масла. 1H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,47 (д, J=7,8 Гц, 1H), 7,44 (с, 1H), 6,99 (д, J=7,8 Гц, 1H), 5,16 (с, 2H), 3,57 (т, J=8,1 Гц, 2H), 1,41 (с, 6H), 0,96 (т, J=8,1 Гц, 2H), 0 (с, 9H).
Промежуточное соединение 96: 4-Иод-3-метокси-N-метилбензамид
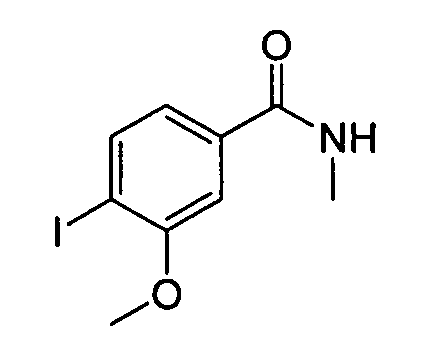
A. 4-Иод-3-метоксибензойная кислота. Раствор нитрита натрия (1,7 г, 24,4 ммоль) в воде (3,5 мл) добавляли медленно к перемешиваемому раствору 4-амино-3-метоксибензойной кислоты (4,0 г, 23,9 ммоль) в смеси воды (61 мл) и концентрированной хлористоводородной кислоты (18 мл) при 0°C. После перемешивания в течение 1 часа при 0°C добавляли иодид натрия (3,67 г, 24,4 ммоль). Полученную смесь медленно нагревали до комнатной температуры в течение 5 минут и нагревали при 60°C в течение 2 часов. После охлаждения до комнатной температуры осадок собирали фильтрованием и промывали водой с получением 4-иод-3-метоксибензойной кислоты (4,0 г, 60,1% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,92 (д, J=8,0 Гц, 1H), 7,42 (д, J=1,6 Гц, 1H), 7,31 (дд, J1=7,6 Гц, J2=1,6 Гц, 1H), 2,27 (с, 3H).
B. 4-Иод-3-метокси-N-метилбензамид. N,N-Диметилформамид (0,1 мл) добавляли к раствору 4-иод-3-метоксибензойной кислоты (2,0 г, 7,2 ммоль) в сульфурилдихлориде (20 мл) и смесь нагревали до температуры кипения с обратным холодильником в течение 2 часов. Избыток сульфурилдихлорида удаляли при пониженном давлении с получением неочищенного продукта 4-иод-3-метокси-бензоилхлорида. К раствору метиламина (0,72 г, 10,8 ммоль) и триэтиламина (2,18 г, 21,6 ммоль) в дихлорметане (20 мл) добавляли по каплям раствор указанного выше 4-иод-3-метокси-бензоилхлорида в дихлорметане (15 мл) при 0°C. После завершения реакции добавляли воду, органический слой отделяли, сушили над сульфатом натрия упаривали с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 10-17% этилацетата в петролейном эфире), с получением 4-иод-3-метокси-N-метилбензамида (0,92 г, 46% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,92 (д, J=8,0 Гц, 1H), 7,42 (д, J=5,6 Гц, 1H), 7,31 (дд, J1=8,0 Гц, J2=2,0 Гц, 1H), 3,88 (с, 3H).
Промежуточное соединение 97: 5-(3-Бромфенил)-1-((2-(триметилсилил)этокси)метил)-1H-имидазол
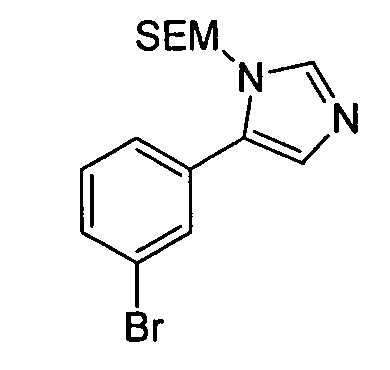
5-(3-Бромфенил)-1-((2-(триметилсилил)этокси)метил)-1Н-имидазол. К перемешиваемому раствору 5-(3-бромфенил)-1H-имидазола (1 г, 4,5 ммоль) в безводном N,N-диметилформамиде (20 мл) добавляли гидрид натрия (60% в минеральном масле, 160 мг, 4,7 ммоль) при 0°C и смесь перемешивали при этой температуре в течение 0,5 часа. Добавляли по каплям раствор (2-(хлорметокси)этил)триметилсилана (0,9 мл, 5,36 ммоль) в N,N-диметилформамиде (5 мл) и полученную смесь перемешивали при комнатной температуре в течение 4 часов. Когда исходное вещество было израсходовано, реакцию гасили водой. Смесь экстрагировали этилацетатом и объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и упаривали в вакууме. Остаток очищали на колонке с силикагелем (элюируя при помощи 5-10% этилацетата в петролейном эфире) с получением 5-(3-бромфенил)-1-((2-(триметилсилил)этокси)метил)-1H-имидазола (1,1 мг, 69,6% выход) в виде желтого твердого вещества. MS (ESI): m/z 353,0 [M+1]+.
Промежуточное соединение 98: (R)-Пиперидин-3-илметанол
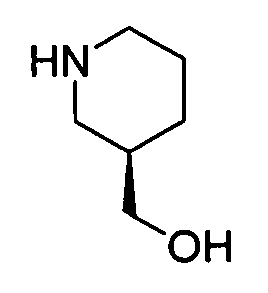
A. (R)-Пиперидин-3-илметанол. (R)-Пиперидин-3-карбоновую кислоту (2 г, 15,49 ммоль) добавляли к тетрагидрофурану (20 мл). К суспензии добавляли по каплям литийалюминийгидрид (23,23 мл, 23,23 ммоль, 1M раствор в тетрагидрофуране) и затем нагревали до 60°C в течение 18 часов в атмосфере азота. Реакционную смесь охлаждали и гасили при помощи гептагидрата сульфата натрия (0,5 г). Смесь перемешивали при комнатной температуре в течение 2 часов и затем фильтровали. Фильтрат пропускали через ионообменную колонку (Strata-XC) и затем выделяли при помощи 2M аммиака в метаноле. Раствор концентрировали с получением a прозрачного масла (0,55 г, 4,78 ммоль, 30,8% выход). MS (ESI) m/z 116,2 [M+1]+.
(S)-Пиперидин-3-илметанол синтезировали, следуя такой же процедуре, исходя из (S)-пиперидин-3-карбоновой кислоты.
Промежуточное соединение 99: гидрохлорид (S)-пиперидин-3-карбоксамида
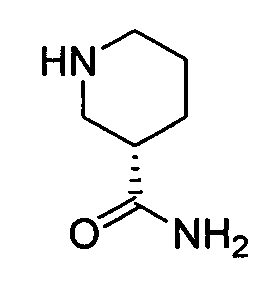
A. (S)-1-(трет-Бутоксикарбонил)пиперидин-3-карбоновая кислота. К (S)-пиперидин-3-карбоновой кислоте (1 г, 7,74 ммоль) добавляли этанол (50 мл) и N,N-диметилформамид (1 мл) с последующим добавлением ди-трет-бутилдикарбоната (2,157 мл, 9,29 ммоль) и затем перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали и затем очищали при помощи хроматографии на силикагеле (0-100% этилацетата в гексане) с получением белого твердого вещества, (1,6 г, 6,98 ммоль, 90% выход). MS (ESI) m/z 230,4 [M+1]+.
B. Гидрохлорид (S)-пиперидин-3-карбоксамида. К (S)-1-(трет-бутоксикарбонил)пиперидин-3-карбоновой кислоте (1,6 г, 6,98 ммоль) добавляли ацетонитрил (70 мл), триэтиламин (2,92 мл, 20,94 ммоль) и О-бензотриазол-N,N,N',N'-тетраметил-уроний-гексафторфосфат (2,91 г, 7,68 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 минут, затем добавляли хлорид аммония (0,747 г, 13,96 ммоль) и перемешивали при комнатной температуре в течение 20 минут. Реакционную смесь концентрировали в вакууме и затем очищали при помощи хроматографии на силикагеле (0-100% этилацетата в гексане). Фракции, содержащие продукт, концентрировали и затем обрабатывали 4н раствором хлористого водорода в диоксане (5 мл). Раствор перемешивали при комнатной температуре в течение 1 часа и затем концентрировали. Остаток фильтровали и промывали этилацетатом с получением белого твердого вещества (0,32 г, 1,944 ммоль, 27,9% выход). MS (ESI) m/z 129,0 [M+1]+.
Гидрохлорид (R)-пиперидин-3-карбоксамида синтезировали, следуя такой же процедуре, с использованием (R)-пиперидин-3-карбоновой кислоты в качестве исходного вещества.
Промежуточное соединение 100: 5-Бром-1-тозил-1H-пирроло[2,3-b]пиридин
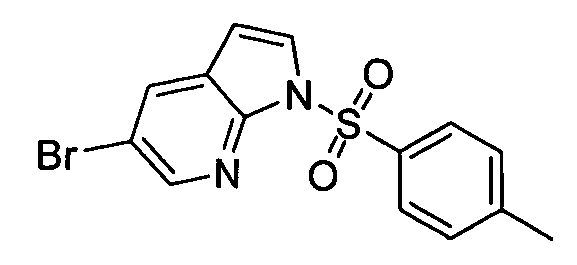
A. 5-Бром-1-тозил-1H-пирроло[2,3-6]пиридин. Перемешиваемый раствор 5-бром-1Н-пирроло[2,3-b]пиридина (0,682 г, 3,46 ммоль) в тетрагидрофуране (10 мл) охлаждали до -50°C в атмосфере азота. Добавляли п-толуолсульфонилхлорид (0,693 г, 3,63 ммоль) и полученную смесь перемешивали при -50°C до полного растворения п-толуолсульфонилхлорида. Добавляли гидрид натрия (0,100 г, 4,15 ммоль) с получением мутной оранжевой смеси. Полученную смесь медленно нагревали до 0°C в течение 40 минут и затем добавляли водный раствор гидроксида аммония для гашения реакции. Полученную смесь разбавляли водой и этилацетатом и встряхивали в делительной воронке. Слои разделяли и органические слои промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе. Остаток растворяли в дихлорметане и очищали с использованием флэш-хроматографии (Biotage) (2-40% этилацетата в гексане) с получением желаемого продукта (1,133 г, 3,23 ммоль, 93% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,47 (д, J=2,34 Гц, 1H), 8,33 (д, J=2,34 Гц, 1H), 7,92-8,02 (м, 3H), 7,43 (д, J=8,20 Гц, 2H), 6,80 (д, J=3,90 Гц, 1H), 2,35 (с, 3H); MS (ESI) m/z 351,1 [M]+, 353,2 [M+2]+.
Промежуточное соединение 101: 6-Бром-3-метил-1-(тетрагидро-2Н-пиран-2-ил)-1Н-индазол
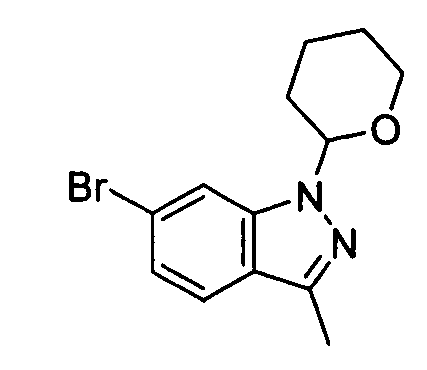
A. 6-Бром-3-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол. 6-Бром-3-метил-1H-индазол (2,5 г, 11,85 ммоль), тетрагидрофуран (20,0 мл), моногидрат п-толуолсульфоновой кислоты (0,113 г, 0,592 ммоль), 3,4-дигидро-2H-пиран (1,625 мл, 17,77 ммоль) и сульфат магния (1,426 г, 11,85 ммоль) добавляли в микроволновой реакционный сосуд, герметично закрывали и нагревали до 70°C в течение 4 часов. Реакционную смесь фильтровали, концентрировали и затем очищали при помощи хроматографии на силикагеле на Emrys Biotage SP1 (элюируя при помощи 0-50% этилацетата в гексане). Желаемые фракции объединяли и органические летучие вещества удаляли при пониженном давлении с получением 6-бром-3-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазола (1,6103 г, 5,46 ммоль, 46,1% выход) в виде белого твердого вещества. MS (ESI) m/z 295,2 [M]+, 297,2 [M+2]+.
Промежуточное соединение 102: 6-Бром-3-метил-1-тозил-1H-индазол
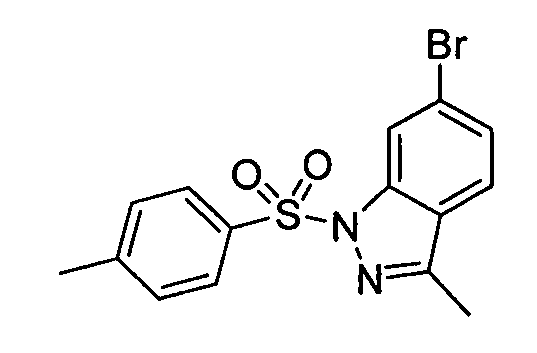
A. 6-Бром-3-метил-1-тозил-1H-индазол. Перемешиваемую смесь 6-бром-3-метил-1Н-индазола (2,33 г, 11,04 ммоль) и п-толуолсульфонилхлорида (2,126 г, 11,15 ммоль) в 1,4-диоксане (25 мл) в атмосфере азота быстро нагревали при помощи аппарата для нагревания струей теплого воздуха до растворения всех твердых частиц. Полученный прозрачный раствор янтарного цвета охлаждали на бане с ледяной водой. Добавляли гидрид натрия (0,318 г, 13,25 ммоль), охлаждающую баню удаляли и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение 1 часа. Добавляли насыщенный водный раствор хлорида аммония (2 мл) с последующим добавлением воды (40 мл). Твердые вещества собирали при помощи вакуумной фильтрации и промывали водой. Твердые частицы затем промывали 50% раствором диэтилового эфира в гексане (50 мл) и сушили в вакууме с получением желаемого продукта (3,66 г, 10,02 ммоль, 91% выход) в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,23 (д, J=1,56 Гц, 1H), 7,76-7,87 (м, 3H), 7,60 (дд, J=1,56, 8,59 Гц, 1H), 7,41 (д, J=8,20 Гц, 2H), 2,48 (с, 3H), 2,34 (с, 3H); MS (ESI) m/z 365,2 [M]+, 367,1 [M+2]+.
Промежуточное соединение 103: 8-Метилен-1,4-диоксаспиро[4,5]декан

A. 8-Метилен-1,4-диоксаспиро[4,5]декан. К суспензии метилтрифенилфосфонийбромида (9,15 г, 25,6 ммоль) в безводном тетрагидрофуране (88 мл) при 0°C добавляли по каплям н-бутиллитий (16,65 мл, 26,6 ммоль, 1,6 M раствор в гексане) при интенсивном перемешивании. Суспензия становилась ярко-оранжевой и прозрачной. Реакционную смесь нагревали до комнатной температуры в течение 1 часа, затем добавляли раствор 1,4-диоксаспиро[4,5]декан-8-она (4,0 г, 25,6 ммоль) в безводном тетрагидрофуране (10 мл) при комнатной температуре. После добавления медленно образовывался желтый осадок. Реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь фильтровали и твердое вещество промывали гексаном. Фильтрат упаривали досуха и остаток очищали при помощи колоночной хроматографии с использованием biotage (элюируя при помощи 5-15% этилацетата в гексане). 8-Метилен-1,4-диоксаспиро[4,5]декан (3,1 г, 20,10 ммоль, 78% выход) выделяли в виде бесцветного масла. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 4,66 (с, 2H), 3,87 (с, 4H), 2,11-2,25 (м, 4H), 1,50-1,66 (м, 4H).
Промежуточное соединение 104: 3-Хлор-5-гидроксифенилбороновая кислота
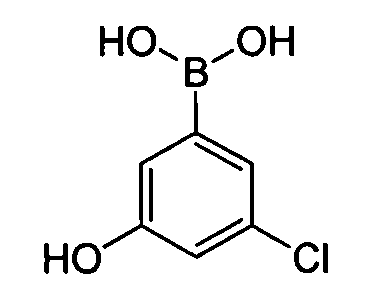
A. 1-Бром-3-хлор-5-метоксибензол. К раствору 1-бром-3-хлор-5-фторбензола (10 г, 48 ммоль) в метаноле (250 мл) добавляли метоксид натрия (5,18 г, 96 ммоль) при комнатной температуре в атмосфере азота и смесь нагревали при кипячении с обратным холодильником в течение 24 часов. Реакционную смесь упаривали при пониженном давлении и остаток растворяли в этилацетат. Органический раствор промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и упаривали в вакууме с получением 1-бром-3-хлор-5-метоксибензола (4 г, 36% выход) в виде белого твердого вещества.
B. 3-Хлор-5-метоксифенилбороновая кислота. К перемешиваемому раствору 1-бром-3-хлор-5-метоксибензола (4,0 г, 18 ммоль) в тетрагидрофуране (50 мл) добавляли по каплям н-бутиллитий (0,76 мл, 1,9 ммоль, 2,5 M в гексане) при -78°C в атмосфере азота. После перемешивания смеси в течение 1 часа при этой температуре добавляли триметилборат (5,68 г, 54 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду (100 мл) по каплям, затем добавляли концентрированную хлористоводородную кислоту для доведения pH=3. Органический растворитель удаляли в вакууме и водный слой экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и упаривали в вакууме с получением неочищенного продукта, который промывали простым эфиром с получением 3-хлор-5-метоксифенилбороновой кислоты (1,2 г, 36% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,26 (шир.с, 1H), 7,36 (с, 1H), 7,30 (с, 1H), 7,04 (м, 1H), 3,74 (с, 3H).
C. 3-Хлор-5-гидроксифенилбороновая кислота. К перемешиваемому раствору 3-хлор-5-метоксифенилбороновой кислоты (1,2 г, 66 ммоль) в дихлорметане (20 мл) добавляли по каплям трибромборан (4,8 г, 20 ммоль) при -78°C и смесь перемешивали при комнатной температуре в течение ночи. Смесь гасили метанолом при -78°C, нагревали до комнатной температуры и концентрировали в вакууме. Остаток разбавляли водой и водный слой экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и упаривали в вакууме с получением 3-хлор-5-гидроксифенилбороновой кислоты (1,08 г, 95% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,71 (шир.с, 1H), 8,14 (шир.с, 2H), 7,35 (с, 1H), 7,21 (с, 1H), 6,82 (с, 1H).
Промежуточное соединение 105: 5-Метил-6-морфолинопиридин-3-амин

A. 4-(3-Метил-5-нитропиридин-2-ил)морфолин. 2-Хлор-3-метил-5-нитропиридин (5 г, 29,0 ммоль), карбонат калия (8,01 г, 57,9 ммоль), диметилсульфоксид (20 мл) и морфолин (5,05 мл, 57,9 ммоль) нагревали вместе до 80°C в течение 16 часов. Реакционную смесь разбавляли водой, фильтровали и затем сушили с получением 4-(3-метил-5-нитропиридин-2-ил)морфолина (7,1 г, 31,8 ммоль, 110% выход) в виде ярко-желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,91 (д, J=2,7 Гц, 1H), 8,24 (дд, J=0,8, 2,7 Гц, 1H), 3,67-3,76 (м, 4H), 3,44 (м, 4H), 2,34 (с, 3H). MS (ESI) m/z 224,2 [M+1]+.
B. 5-Метил-6-морфолинопиридин-3-амин. К 4-(3-метил-5-нитропиридин-2-ил)морфолину (6,47 г, 29 ммоль) добавляли 4н раствор хлористого водорода в диоксане (4 мл), 10% палладий на углероде (100 мг), метанол (60 мл) и затем встряхивали в гидрогенизаторе Парра при давлении водорода 40 ф/дюйм2(2,812 кг/см2) в течение 16 часов. Реакционную смесь фильтровали через целит, концентрировали и затем очищали на силикагеле (0-100% метанола в этилацетате) и сушили с получением ржаво-коричневого твердого вещества, 5-метил-6-морфолинопиридин-3-амина, который получали в виде гидрохлоридной соли (2,7 г, 11,75 ммоль, 40,5% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 2,29 (с, 3H) 3,08-3,16 (м, 4H) 3,69-3,79 (м, 4H) 7,51 (д, J=2,34 Гц, 1H) 7,78 (шир.с, 1H). MS (ESI) m/z 194,1 [M+1]+.
Промежуточное соединение 106: трет-Бутил 6-амино-3,3,4-триметил-2-оксоиндолин-1-карбоксилат
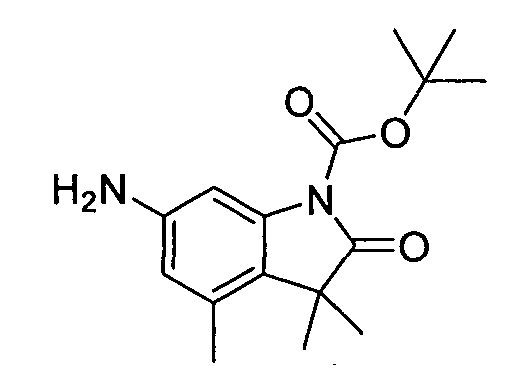
A. 2-Бром-3-метил-5-нитроанилин. 2-Бром-3-метиланилин (4,420 г, 23,76 ммоль) растворяли в серной кислоте (25 мл, 469 ммоль) при комнатной температуре с использованием ультразвуковой обработки. Раствор охлаждали до 0°C и добавляли нитрат калия (2,62 г, 25,9 ммоль) одной порцией. Раствор через некоторое время становился коричневым. ЖХ/МС анализ через 45 минут показал соотношение ~10:1 продукт:исходное вещество. Добавляли еще одну порцию нитрата калия (240 мг, 2,374 ммоль). Через 2 часа реакционную смесь выливали медленно в смесь 100 мл раствора гидроксида аммония и измельченного льда, поддерживая температуру ниже комнатной температуры с использованием дополнительного количества измельченного льда. Красновато-желтое твердое вещество собирали фильтрованием и сушили в вакуумной печи при 60°C в течение 16 часов с получением желаемого 2-бром-3-метил-5-нитроанилина (5,3792 г, 23,28 ммоль, 98% выход). 1H ЯМР анализ неочищенного продукта показал два региоизомера нитрования, при этом желаемый региоизомер составлял ~85% смеси. Неочищенный нитроанилин использовали непосредственно в следующей реакции. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,94 (с, 1H), 7,85 (д, J=8,98 Гц, 1H), 7,48 (д, J=2,34 Гц, 1H), 7,44 (д, J=2,73 Гц, 1H), 4,46 (шир.с, 2H), 2,46 (с, 3H); MS (ESI): m/z 233,2 [M+1]+.
B. N-(2-Бром-3-метил-5-нитрофенил)метакриламид.
Метакриловую кислоту (1,961 мл, 23,12 ммоль) отвешивали в 200-мл колбу и растворяли в безводном N,N-диметилацетамиде (30 мл). Раствор охлаждали до 0°C и добавляли по каплям тионилхлорид (1,70 мл, 23,29 ммоль) в течение 1 минуты. Раствор перемешивали в течение 20 минут и затем добавляли 2-бром-3-метил-5-нитроанилин (3,8150 г, 16,51 ммоль) в виде твердого вещества. Через 30 минут охлаждающую баню удаляли. Через 1 час ЖХ/МС анализ показал сильный пик продукта. Добавляли воду (~100 мл), вызывая осаждение коричневого твердого вещества. Это твердое вещество собирали при помощи вакуумной фильтрации в 60-мл воронку со стеклянным фильтром со средним размером пор, затем сушили в вакуумной печи при 60°C в течение 2 часов с получением неочищенного N-(2-бром-3-метил-5-нитрофенил)метакриламида (4,5198 г, 15,11 ммоль, 92% выход). MS (ESI): m/z 299,4 [M+1]+.
C. 3,3,4-Триметил-6-нитроиндолин-2-он. N-(2-бром-3-метил-5-нитрофенил)метакриламид (2,5451 г, 8,51 ммоль), ацетат палладия (II) (106,4 мг, 0,474 ммоль), тетрабутиламмонийбромид (2,80 г, 8,69 ммоль) и N,N-диметилформамид (24 мл) добавляли в 200-мл колбу, которую затем закрывали мембранной перегородкой и продували азотом. Добавляли N,N-диметилформамид (24 мл) через шприц и раствор барботировали азотом через иглу в течение 5 минут. Добавляли триэтиламин (3,0 мл, 21,52 ммоль) через шприц и сосуд помещали для перемешивания в 80°C масляную баню на 30 минут. Крышку затем быстро удаляли и к горячей реакционной смеси добавляли формиат натрия (0,675 г, 9,93 ммоль). Сосуд затем закрывали, раствор барботировали азотом в течение 2 минут с использованием иглы и реакционную смесь помещали для перемешивания в условия 80°C на 15 часов. Реакционную смесь фильтровали через целит и концентрировали до получения коричневого масла. Флэш-хроматография на силикагеле дала желаемый 3,3,4-триметил-6-нитроиндолин-2-он (0,9092 г, 4,13 ммоль, 48,5% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,44 (шир.с, 1H), 7,76 (д, J=1,56 Гц, 1H), 7,61 (д, J=1,95 Гц, 1H), 2,50 (с, 3H), 1,52 (с, 6H). MS (ESI): m/z 221,4 [M+1]+.
D. трет-Бутил 3,3,4-триметил-6-нитро-1-оксоиндолин-1-карбоксилат. 3,3,4-Триметил-6-нитроиндолин-2-он (0,9092 г, 4,13 ммоль), ди-трет-бутилдикарбонат (1,602 мл, 6,90 ммоль), тетрагидрофуран (10 мл) и бикарбонат натрия (748,8 мг, 8,91 ммоль) помещали в 100-мл колбу. Добавляли 4-(диметиламино)пиридин (51,8 мг, 0,424 ммоль) и неплотно закрытую колбу оставляли для тщательного перемешивания при 60°C на масляной бане. Через 1,5 часа реакционную смесь разбавляли этилацетатом и 10% лимонной кислотой. С использованием некоторого количества насыщенного солевого раствора для разделения эмульсии органический слой удаляли и водный слой экстрагировали этилацетатом. Объединенные органические растворы сушили над сульфатом магния, фильтровали и концентрировали. Флэш-хроматография на силикагеле с элюированием 0-25% этилацетата в гексане дала желаемый трет-бутил 3,3,4-триметил-6-нитро-2-оксоиндолин-1-карбоксилат (1,1263 г, 3,52 ммоль, 85% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,64 (д, J=1,95 Гц, 1H), 7,87 (д, J=1,56 Гц, 1H), 2,52 (с, 3H), 1,68 (с, 9H), 1,55 (с, 6H). MS (ESI): m/z 265,2 [M+1]+.
E. трет-Бутил 6-амино-3,3,4-триметил-2-оксоиндолин-1-карбоксилат. 10% Палладий на углероде (72,3 мг, 0,068 ммоль) и трет-бутил 3,3,4-триметил-6-нитро-2-оксоиндолин-1-карбоксилат (1,1263 г, 3,52 ммоль) растворяли в этилацетате (15 мл). Колбу продували водородом и оставляли для перемешивания под баллоном водорода в течение 3 дней, затем фильтровали через целит и концентрировали с получением желаемого трет-бутил 6-амино-3,3,4-триметил-2-оксоиндолин-1-карбоксилата (1,0589 г, 3,65 ммоль, 104% выход). MS (ESI): m/z 291,1 [M+1]+.
Промежуточное соединение 107: 6-Аминоиндолин-2-он
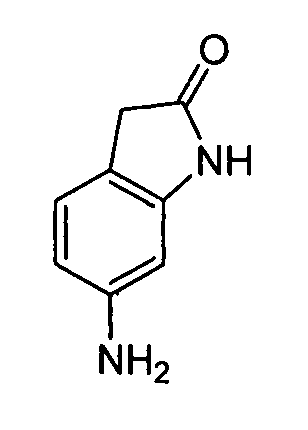
A. Метил 2-(2,4-динитрофенил)ацетат. К перемешиваемому раствору 2-(2,4-динитрофенил)уксусной кислоты (11,3 г, 0,5 моль) в метаноле (150 мл) добавляли концентрированую серную кислоту (2 мл) и смесь перемешивали при температуре кипения с обратным холодильником в течение 10 часов. Реакционную смесь концентрировали в вакууме и остаток промывали водой с получением метил 2-(2,4-динитрофенил)ацетата (9,4 г, 78,3% выход) в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,73 (д, J=2,4 Гц, 1H), 8,51 (дд, J=2,4, 8,4 Гц, 1H), 7,83 (д, J=8,4 Гц, 1H), 4,19 (с, 2H), 3,57 (с, 3H); MS (ESI): m/z: 241,0 [M+H]+.
B. 6-Аминоиндолин-2-он. Смесь метил 2-(2,4-динитрофенил)ацетата (4,8 г, 20 ммоль) и 10% палладия на углероде (50% влажности, масс/масс, 100 мг) в метаноле (50 мл) гидрировали под давлением водорода 1 атмосфера при комнатной температуре в течение ночи. Суспензию отфильтровывали, фильтрат нагревали при 60°C в течение 12 часов. Смесь охлаждали до комнатной температуры и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 60% этилацетата в петролейном эфире) с получением 6-аминоиндолин-2-она (220 мг, 7,4% выход) в виде серого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 6,80 (д, J=8,4 Гц, 1H), 6,12 (м, 2H), 5,01 (с, 2H), 3,24 (с, 2H).
Промежуточное соединение 108: 6-Бром-3-этил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол
A. 1-(4-Бром-2-фторфенил)пропан-1-ол. Этилмагнийбромид (64,3 мл, 192,9 ммоль, 3 M раствор в тетрагидрофуране) добавляли по каплям к раствору 4-бром-2-фторбензальдегида (30,0 г, 148 ммоль) в тетрагидрофуране (500 мл) в атмосфере азота при 0°C в течение 30 минут. Полученную смесь нагревали до комнатной температуры в течение 2 часов, гасили водным раствором хлорида аммония и экстрагировали этилацетатом. Объединенный органический слой сушили над сульфатом натрия, упаривали при пониженном давлении и сушили в вакууме с получением 1-(4-бром-2-фторфенил)пропан-1-ола (16 г, 47%) в виде масла. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,45 (м, 3H), 5,36 (с, 1H), 4,70 (т, J=6,4 Гц, 1H), 1,63 (кв., J=7,2 Гц, 2H), 0,80 (м, 3H).
B. 1-(4-Бром-2-фторфенил)пропан-1-он. Смесь 1-(4-бром-2-фторфенил)пропан-1-ола (15 г, 64,6 ммоль) и оксида марганца (IV) (22,5 г, 258 ммоль) в дихлорметане (250 мл) нагревали при кипячении с обратным холодильником в течение ночи. После охлаждения до комнатной температуры реакционную смесь фильтровали и фильтрат удаляли при пониженном давлении с получением 1-(4-бром-2-фторфенил)пропан-1-она (9 г, 60,5%) в виде твердого вещества. MS (ESI): m/z 230,8 [M+1]+.
C. 6-Бром-3-этил-1H-индазол. Смесь 1-(4-бром-2- фторфенил)пропан-1-она (9 г, 39,0 ммоль) и водного раствора гидразина (50 мл, 85%) нагревали при кипячении с обратным холодильником в течение ночи. После охлаждения до комнатной температуры реакционную смесь фильтровали и фильтровальную лепешку сушили в вакууме с получением 6-бром-3-этил-1H-индазола (4,4 г, 50,3% выход) в виде твердого вещества. MS (ESI): m/z 224,8 [M+1]+.
D. 6-Бром-3-этил-1-(тетрагидро-2Н-пиран-2-ил)-1Н-индазол. Смесь 6-бром-3-этил-1H-индазола (4,4 г, 19,5 ммоль), 3,4-дигидро-2H-пирана (3,3 г, 39 ммоль) и п-толуолсульфоновой кислоты (374 мг, 1,95 ммоль) в тетрагидрофуране (60 мл) нагревали при 60°C в течение ночи. Реакционную смесь выливали в ледяную воду и водную фазу экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия, фильтровали и упаривали при пониженном давлении. Остаток очищали на колонке с силикагелем с получением 6-бром-3-этил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазола (4,4 г, 73,2% выход). MS (ESI): m/z 310,8 [M+3]+.
Промежуточное соединение 109: 5-Бром-2-(2-метоксиэтил)изоиндолин-1-он
A. 5-Бром-2-(2-метоксиэтил)изоиндолин-1-он. Смесь метил 4-бром-2-(бромметил)бензоата (2,4 г, 7,8 ммоль) и 2-метоксиэтанамина (2,9 г, 39 ммоль) в метаноле (20 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали и очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 5-20% этилацетата в петролейном эфире) с получением 5-бром-2-(2-метоксиэтил)изоиндолин-1-она в виде белого твердого вещества (1,2 г, 57% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,71 (д, J=7,6 Гц, 1H), 7,59 (м, 2H), 7,45 (с, 2H), 3,78 (т, J=6,4 Гц, 2H), 3,63 (т, J=6,4 Гц, 2H), 3,39 (с, 3H).
Промежуточное соединение 110: 6-Бром-4-фтор-3-метил-1-(тетрагидро-2Н-пиран-2-ил)-1Н-индазол
A. (4-Бром-2,6-дифторфенил)метанол. К раствору 4-бром-2,6-дифторбензойной кислоты (5 г, 21 ммоль) в тетрагидрофуране (200 мл) добавляли по каплям раствор боран•диметилсульфидного комплекса (16,1 г, 212 ммоль) в тетрагидрофуране (100 мл) при 0°C в атмосфере азота и полученную смесь перемешивали при комнатной температуре в течение 3 часов. Добавляли метанол (300 мл) для гашения реакции и растворитель удаляли при пониженном давлении. Остаток растворяли в этилацетате, раствор промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и упаривали в вакууме с получением (4-бром-2,6- дифторфенил)метанола (4,56 г, 97% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,13 (д, J=8,8 Гц, 2H), 4,75 (с, 2H).
B. 4-Бром-2,6-дифторбензальдегид. Смесь (4-бром-2,6-дифторфенил)метанола (4,56 г, 20,5 ммоль) и диоксида марганца (IV) (7,14 г, 82,2 ммоль) в дихлорметане (200 мл) нагревали при кипячении с обратным холодильником в течение ночи. После охлаждения до комнатной температуры реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением 4-бром-2,6-дифторбензальдегида (3,54 г, 78%) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 10,22 (с, 1H), 7,19-7,14 (м, J=8,8 Гц, 2H).
C. 1-(4-Бром-2,6-дифторфенил)этанол. Метилмагнийбромид (6,4 мл, 19,3 ммоль, 3 M раствор в тетрагидрофуране) добавляли по каплям к раствору 4-бром-2,6-дифторбензальдегида (3,54 г, 16,1 ммоль) в тетрагидрофуране (100 мл) в атмосфере азота при 0°C в течение 30 минут. Полученную смесь нагревали до комнатной температуры в течение 2 часов, гасили водным раствором хлорида аммония и экстрагировали этилацетатом. Объединенный органический слой сушили над сульфатом натрия, упаривали при пониженном давлении и сушили в вакууме с получением 1-(4-бром-2,6-дифторфенил)этанола (2,2 г, 58%) в виде масла. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,12 (м, 2H), 5,14 (м, 1H), 1,54 (м, 3H).
D. 1-(4-Бром-2,6-дифторфенил)этанон. Смесь 1-(4-бром-2,6-дифторфенил)этанола (2,2 г, 9,3 ммоль) и диоксида марганца (IV) (3,2 г, 37,3 ммоль) в дихлорметане (50 мл) нагревали при кипячении с обратным холодильником в течение ночи. После охлаждения до комнатной температуры реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением 1-(4-бром-2,6-дифторфенил)этанона (1,7 г, 78%) в виде масла. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,14 (м, 2H), 1,54 (с, 3H).
E. 6-Бром-4-фтор-3-метил-1H-индазол. Смесь 1-(4-бром-2,6-дифторфенил)этанона (1,1 г, 4,7 ммоль) и водного раствора гидразина (235 мг, 4,7 ммоль, 85%) в тетрагидрофуране нагревали при кипячении с обратным холодильником в течение ночи. После охлаждения до комнатной температуры реакционную смесь концентрировали и остаток растворяли этилацетатом, раствор промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, упаривали при пониженном давлении и очищали на колонке с силикагелем с получением 6-бром-4-фтор-3-метил-1H-индазола (510 мг, 47,7% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 9,85 (шир.с, 1H), 7,31 (д, J=0,8 Гц, 1H), 6,86 (дд, J1=1,2 Гц, J2=9,2 Гц, 1H), 2,60 (с, 3H).
F. 6-Бром-4-фтор-3-метил-1-(тетрагидро-2Н-пиран-2-ил)-1Н-индазол. Смесь 6-бром-4-фтор-3-метил-1Н-индазола (510 мг, 2,24 ммоль), 3,4-дигидро-2H-пирана (376 мг, 4,47 ммоль), и п-толуолсульфоновой кислоты (42,5 мг, 0,224 ммоль) в тетрагидрофуране (20 мл) нагревали при 80°C в течение ночи. Реакционную смесь выливали в ледяную воду и водную фазу экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия, упаривали при пониженном давлении и очищали на колонке с силикагелем с получением 6-бром-4-фтор-3-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазола (590 мг, 84,5% выход). 1H ЯМР (300 МГц, δ (м.д.) 7,85 (с, 1H), 7,20 (д, J=8,7 Гц, 1H), 5,81 (д, J=9,2 Гц, 1H), 3,88 (м, 2H), 2,55 (с, 3H), 1,98-1,91 (м, 2H), 1,67-1,47 (м, 4H).
Промежуточное соединение 111: 6-Бром-4-фтор-1,3-диметил-1H-индазол
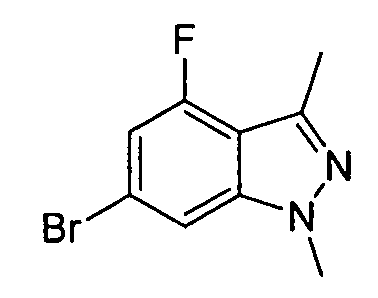
A. 6-Бром-4-фтор-1,3-диметил-1H-индазол. К раствору 6-бром-4-фтор-3-метил-1H-индазола (500 мг, 2,19 ммоль) в N,N-диметилформамиде (15 мл) добавляли гидрид натрия (100 мг, 2,49 ммоль, 60% в минеральном масле) по порциям при 0°C. По завершении добавления смесь перемешивали в течение 30 минут при 0°C, добавляли иодметан (1,25 г, 8,8 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакцию гасили путем добавления воды (10 мл) и смесь экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, упаривали и очищали на колонке с силикагелем (элюируя при помощи 5% этилацетата в петролейном эфире) с получением 6-бром-4-фтор-1,3-диметил-1H-индазола (426 мг, 80% выход) в виде белого твердого вещества. 1H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,19 (д, J=1,2 Гц, 1H), 6,80 (дд, J1=1,5 Гц, J2=9,6 Гц, 1H), 3,87 (с, 3H), 2,54 (с, 3H).
Промежуточное соединение 112: Диэтил 2-(5-бром-3-нитропиридин-2-ил)малонат
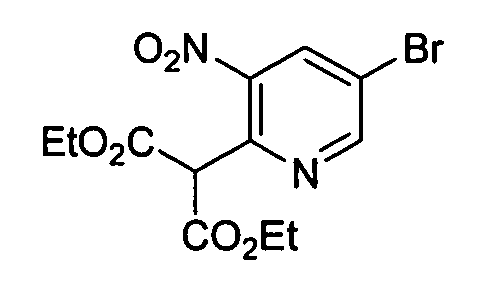
A. Диэтил 2-(5-бром-3-нитропиридин-2-ил)малонат. К раствору диэтилмалоната (6,35 г, 40 ммоль) в N,N-диметилформамиде (30 мл) добавляли гидрид натрия (2,0 г, 50 моль, 60% в минеральном масле) при 0-2°C в атмосфере азота. После того, как добавление было завершено, реакционную смесь перемешивали при указанной температуре в течение 10 минут. Медленно добавляли раствор 5-бром-2-хлор-3-нитропиридина (5 г, 21 ммоль) в N,N-диметилформамиде (10 мл) и реакционную смесь поддерживали при температуре примерно 40°C в течение 1 часа. Реакцию гасили водой (50 мл), экстрагировали диэтиловым эфиром (150 мл ×3), сушили над сульфатом натрия и упаривали в вакууме с получением коричневого масла, которое очищали на колонке с силикагелем (элюируя при помощи 0-10% этилацетата в петролейном эфире), с получением диэтил 2-(5-бром-3-нитропиридин-2-ил)малоната (5 г, 65,6% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,87 (д, J=2,0 Гц, 1H), 8,62 (д, J=2,0 Гц, 1H), 5,45 (с, 1H), 4,32 (м, 4H), 1,30 (м, 6H).
Промежуточное соединение 113: 1-метил-1H-пиразоло[3,4-6]пиридин-5-амин
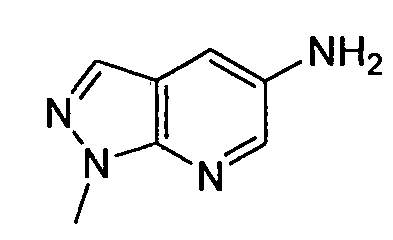
A. 5-Бром-1-метил-1H-пиразоло[3,4-6]пиридин. К раствору 1-метил-1Н-пиразол-5-амина (5 г, 51,5 ммоль) в уксусной кислоте (50 мл) добавляли 2-броммалональдегид (7,5 г, 50 ммоль) и концентрированную серную кислоту (0,5 мл) и смесь нагревали при кипячении с обратным холодильником в течение 2 дней. Раствор концентрировали и распределяли между водой (100 мл) и этилацетатом (100 мл). Водный слой экстрагировали этилацетатом (100 мл ×2). Объединенные органические слои сушили, концентрировали и очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 10% этилацетата в петролейном эфире) с получением 5-бром-1-метил-1H-пиразоло[3,4-b]пиридина (3,0 г, 27% выход) в виде белого порошок. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,63 (д, J=2,0 Гц, 1H), 8,53 (д, J=2,0 Гц, 1H), 8,13 (с, 1H), 4,05 (с, 3H).
B. 1-метил-1Н-пиразоло[3,4-b]пиридин-5-амин. Дегазированную смесь 5-бром-1-метил-1H-пиразоло[3,4-b]пиридина (880 мг, 4 ммоль), дифенилметанимина (1,08 г, 6 ммоль), трис(дибензилиденацетон)палладия (0) (734 мг, 0,8 ммоль), (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила (1,24 г, 2 ммоль) и трет-бутоксида натрия (576 мг, 6 ммоль) в толуоле (18 мл) нагревали при 115°C в атмосфере азота в течение ночи. Реакционную смесь очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 4% этилацетата в петролейном эфире) с получением N-(дифенилметилен)-1-метил-1H-пиразоло[3,4-b]пиридин-5-амина (1,2 г, неочищенный). Неочищенный N-(дифенилметилен)-1-метил-1Н-пиразоло[3,4-b]пиридин-5-амин растворяли в тетрагидрофуране (10 мл) и добавляли хлористоводородную кислоту (2 н, 5 мл). Смесь перемешивали при комнатной температуре в течение 2 часов. Смесь доводили до pΗ=8 при помощи насыщенного раствора карбоната натрия и экстрагировали этилацетатом. Органическую фазу сушили, концентрировали и очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 33% этилацетата в петролейном эфире) с получением 1-метил-1H-пиразоло[3,4-b]пиридин-5-амина (420 мг, 68,4% выход) в виде не совсем белого твердого вещества.
Промежуточное соединение 114: 3-(Трифторметил)-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-амин
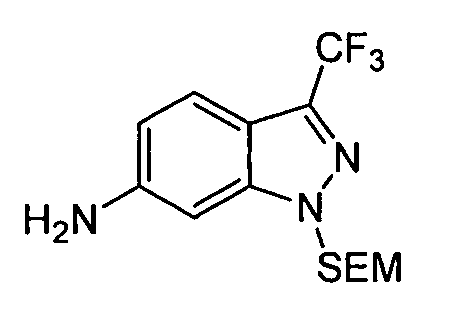
A. 6-Нитро-3-(трифторметил)-1-((2-(триметилсилил)этокси)метил)-1H-индазол. Перемешиваемый раствор 3-иод-6-нитро-1-((2-(триметилсилил)этокси)метил)-1H-индазола (15 г, 35,8 ммоль), метил 2,2-дифтор-2-(фторсульфонил)ацетата (3,4 г, 17,9 ммоль) и иодида меди (I) (1,36 г, 7,2 ммоль) в диметилсульфоксиде (50 мл) нагревали при 120°C в течение 3 часов в атмосфере азота. Добавляли дополнительное количество метил 2,2-дифтор-2-(фторсульфонил)ацетата (1,72 г, 8,95 ммоль) и смесь нагревали при 120°C в течение 16 часов. Реакционную смесь концентрировали в вакууме и очищали на колонке с силикагелем (элюируя при помощи 1% этилацетата в петролейном эфире) с получением 6-нитро-3-(трифторметил)-1-((2-(триметилсилил)этокси)метил)-1Н-индазола (2,0 г, 15,5% выход) в виде масла. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,63 (с, 1H), 8,22 (д, J=8,8 Гц, 1H), 8,01 (д, J=8,8 Гц, 1H), 5,87 (с, 2H), 3,62 (т, J=8,4 Гц, 1H), 0,93 (т, J=8,4 Гц, 1H), -0,05 (с, 9H).
B. 3-(Трифторметил)-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-амин. Смесь 6-нитро-3-(трифторметил)-1-((2-(триметилсилил)этокси)метил)-1H-индазола (1,0 г, 2,77 ммоль) и 10% палладия на углероде (50% влажности, масс/масс, 100 мг) в метаноле (10 мл) гидрировали под давлением водорода 1 атмосфера при комнатной температуре в течение 2 часов. Суспензию отфильтровывали и фильтрат концентрировали с получением 3-(трифторметил)-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-амина (900 мг, 98% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,57 (д, J=8,4 Гц, 1H), 6,71 (м, 2H), 5,62 (с, 2H), 4,00 (шир.с, 2H), 3,56 (т, J=8,4 Гц, 2H), 0,88 (т, J=8,4 Гц, 2H), -0,05 (с, 9H).
Промежуточное соединение 115: трет-Бутил 4-(6-бром-1-метил-1H-индазол-3-иламино)пиперидин-1-карбоксилат
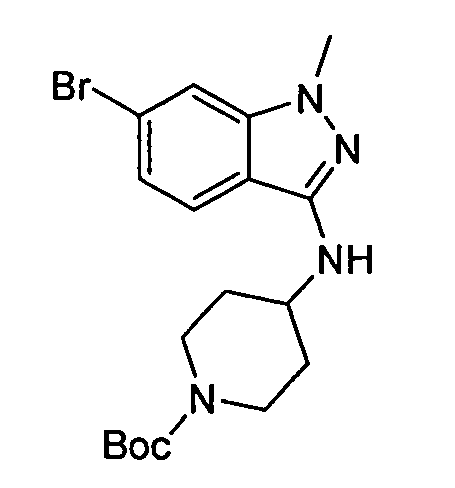
A. трет-Бутил 4-(6-бром-1-метил-1H-индазол-3-иламино)пиперидин-1-карбоксилат. К 6-бром-1-метил-1Н-индазол-3-амину (400 мг, 1,77 ммоль) в смеси уксусной кислоты (2 мл) и метанола (40 мл) добавляли трет-бутил 4-оксопиперидин-1-карбоксилат (525 мг, 2,65 ммоль) и смесь перемешивали при комнатной температуре в течение 10 минут. Смесь охлаждали до 0°C и добавляли цианоборогидрид натрия (223 мг, 3,54 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, концентрировали при пониженном давлении и очищали на колонке с силикагелем (элюируя при помощи 5-25% этилацетата в петролейном эфире) с получением трет-бутил 4-(6-бром-1-метил-1Н-индазол-3-иламино)пиперидин-1-карбоксилата (700 мг, 97% выход) в виде твердого вещества. MS (ESI): m/z 309,0 [M+1]+.
Промежуточное соединение 116: 6-Бром-1-(тетрагидро-2H-пиран-2-ил)-N-(тетрагидро-2Н-пиран-4-ил)-1Н-индазол-3-амин
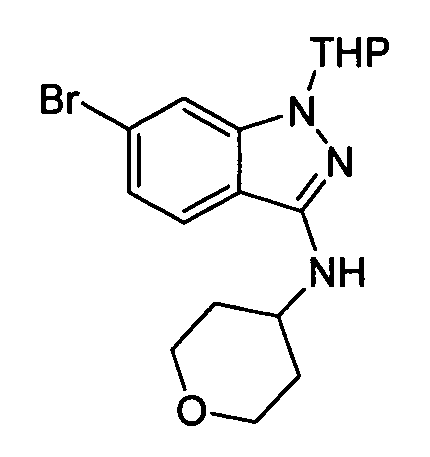
A. 6-Бром-N-(тетрагидро-2Н-пиран-4-ил)-1H-индазол-3-амин. Раствор 6-бром-1H-индазол-3-амина (915 мг, 4,34 ммоль) в смеси уксусной кислоты (4 мл) и метанола (80 мл) добавляли дигидро-2H-пиран-4(3H)-он (650 мг, 6,50 ммоль) и смесь перемешивали при комнатной температуре в течение 10 минут. Смесь охлаждали до 0°C и добавляли цианоборогидрид натрия (547 мг, 8,68 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, концентрировали при пониженном давлении и очищали на колонке с силикагелем (элюируя при помощи 5-25% этилацетата в петролейном эфире) с получением 6-бром-N-(тетрагидро-2H-пиран-4-ил)-1H-индазол-3-амина (860 мг, 67% выход) в виде твердого вещества. MS (ESI): m/z 295,9 [M+1]+.
B. 6-Бром-1-(тетрагидро-2H-пиран-2-ил)-N-(тетрагидро-2H-пиран-4-ил)-1H-индазол-3-амин. К смеси 6-бром-N-(тетрагидро-2H-пиран-4-ил)-1H-индазол-3-амина (860 мг, 2,91 ммоль) и п-толуолсульфоновой кислоты (50 мг, 0,29 ммоль) в тетрагидрофуране (40 мл) добавляли 3,4-дигидро-2H-пиран (489 мг, 5,82 ммоль) и смесь нагревали при кипячении с обратным холодильником при 70°C в атмосфере азота в течение ночи. Реакционную смесь концентрировали и очищали на колонке с силикагелем (элюируя при помощи 5-25% этилацетата в петролейном эфире) с получением 6-бром-1-(тетрагидро-2H-пиран-2-ил)-N-(тетрагидро-2H-пиран-4-ил)-1H-индазол-3-амина.
Промежуточное соединение 117: 6-Бром-1-метил-N-(тетрагидро-2Н-пиран-4-ил)-1H-индазол-3-амин
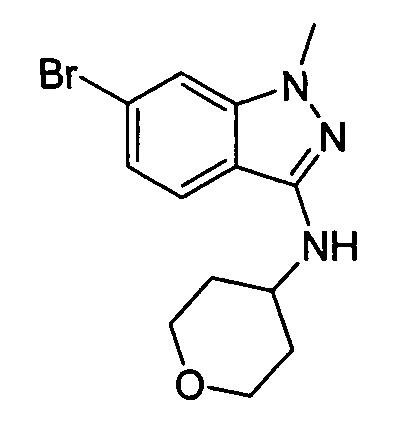
A. 6-Бром-1-метил-N-(тетрагидро-2H-пиран-4-ил)-1H-индазол-3-амин. К смеси 6-бром-1-метил-1H-индазол-3-амина (420 мг, 1,86 ммоль) в смеси уксусной кислоты (2 мл) и метанола (40 мл) добавляли дигидро-2H-пиран-4(3H)-он (279 мг, 2,79 ммоль) и смесь перемешивали при комнатной температуре в течение 10 минут. Смесь охлаждали до 0°C, добавляли цианоборогидрид натрия (234 мг, 3,72 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, концентрировали при пониженном давлении и очищали на колонке с силикагелем (элюируя при помощи 5-25% этилацетата в петролейном эфире) с получением 6-бром-1-метил-N-(тетрагидро-2H-пиран-4-ил)-1H-индазол-3-амина (570 мг, 84% выход, 85% чистота) в виде твердого вещества. MS (ESI): m/z 309,9 [M+1]+.
Промежуточное соединение 118: трет-Бутил 5-амино-3-метил-1H-индазол-1-карбоксилат
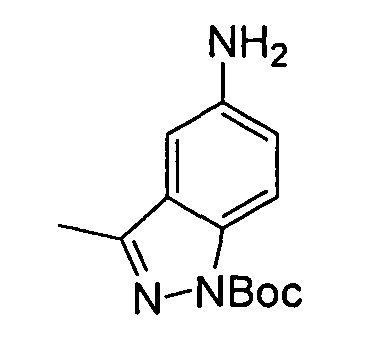
A. трет-Бутил 3-метил-5-нитро-1H-индазол-1-карбоксилат. К раствору 3-метил-5-нитро-1H-индазола (0,95 г, 5,36 ммоль) в этаноле (12 мл) добавляли ди-трет-бутилдикарбонат (1,755 г, 8,04 ммоль). Реакционную смесь перемешивали при 50°C в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры и растворитель удаляли при пониженном давлении. Неочищенное вещество разбавляли этилацетатом (150 мл), промывали насыщенным раствором бикарбоната натрия (100 мл) и насыщенным солевым раствором (100 мл). Органический слой сушили над сульфатом магния, фильтровали и концентрировали с получением указанного в заголовке соединения в виде не совсем белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. MS (ESI) m/z 278,4 [M+1]+.
B. трет-Бутил 5-амино-3-метил-1H-индазол-1-карбоксилат. К раствору трет-бутил 3-метил-5-нитро-1H-индазол-1-карбоксилата (1,486 г, 5,36 ммоль) в этаноле (25 мл) добавляли палладий на углероде (0,057 г, 0,536 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 часов под давлением водорода 1 атмосфера. Реакционную смесь фильтровали через Целит и концентрировали. Неочищенное вещество очищали при помощи колоночной хроматографии (Biotage, элюируя 0-100% этилацетата в гексане) с получением желаемого соединения в виде желтого твердого вещества (1 г, 75% выход). MS (ESI) m/z 248,9 [M+1]+.
Промежуточное соединение 119: 6-Амино-3,3-диметилизоиндолин-1-он
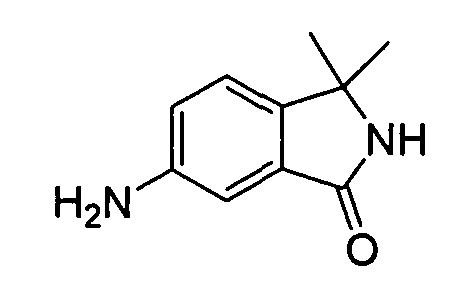
A. 3,3-Диметилизоиндолин-1-он. 2-Цианобензойную кислоту (3 г, 20,39 ммоль) растворяли в тетрагидрофуране (300 мл) и затем охлаждали до -78°C. Добавляли по каплям метиллитий (127 мл, 204 ммоль) и реакционную смесь медленно нагревали до комнатной температуры в течение 2 часов. Реакцию гасили насыщенным солевым раствором, затем экстрагировали два раза этилацетатом. Объединенные органические слои промывали 1 н раствором HCl, насыщенным раствором бикарбоната натрия и водой, сушили над сульфатом магния и концентрировали. Остаток очищали при помощи колоночной хроматографии с получением желаемого продукта. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,58-8,69 (м, 1H), 7,53-7,66 (м, 3H), 7,45 (дд, J=1,56, 7,42 Гц, 1H), 1,44 (с, 6H). MS (ESI) m/z 162,2 [M+1]+.
B. 3,3-Диметил-6-нитроизоиндолин-1-он. 3,3-Диметилизоиндолин-1-он (0,600 г, 3,72 ммоль) растворяли в серной кислоте (6,7 мл) и затем охлаждали до 0°C. К раствору добавляли нитрат калия (0,587 г, 5,81 ммоль). Смесь перемешивали в течение ночи, постепенно повышая температуру до комнатной температуры. Реакционный раствор выливали в ледяную воду и затем экстрагировали этилацетатом. Экстракт промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Органический слой сушили и упаривали с получением 3,3-диметил-6-нитроизоиндолин-1-она (0,700 г, 3,39 ммоль, 91% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,67 (д, J=1,95 Гц, 1H), 8,47 (дд, J=2,15, 8,40 Гц, 1H), 7,59 (д, J=8,20 Гц, 1H), 7,08-7,25 (м, 1H), 1,63 (с, 6H).
C. 3,3-Диметил-6-аминоизоиндолин-1-он. 3,3-Диметил-6-нитроизоиндолин-1-он (1,5 г, 7,27 ммоль) брали для поглощения в метаноле (60 мл) и добавляли каталитическое количество палладия на углероде. Реакционную смесь затем перемешивали под давлением газообразного водорода 1 атмосфера в течение 18 часов. Реакционную смесь фильтровали через целит и растворитель удаляли при пониженном давлении с получением 6-амино-3,3-диметилизоиндолин-1-она (1,218 г, 6,91 ммоль, 95% выход). MS (ESI) m/z 177,1 [M+1]+.
Промежуточное соединение 120: 3,4-Диметил-1-(тетрагидро-2Н-пиран-2-ил)-1H-индазол-6-амин
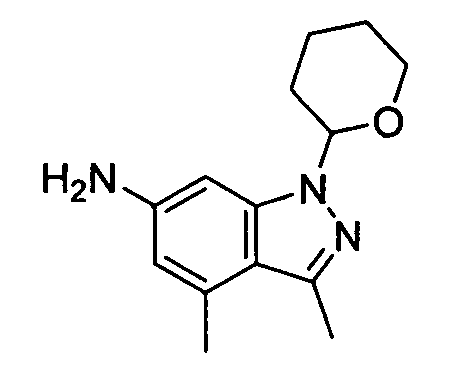
A. 2,3-Диметил-5-нитроанилин. В 250-мл круглодонную колбу добавляли концентрированую серную кислоту (40 мл, 750 ммоль) при 0°C. К этому добавляли 2,3-диметиланилин (5 г, 41,3 ммоль) небольшими порциями и после завершения добавления колбу охлаждали до -10°C. Добавляли смесь дымящей азотной кислоты (2,2 мл, 49,2 ммоль) и концентрированной серной кислоты (6,6 мл) в течение 45 минут и смесь перемешивали еще в течение часа при 0°C. Смесь выливали на ледяную воду, полученный осадок фильтровали, промывали водой и сушили в вакууме с получением 2,3-диметил-5-нитроанилина (3,63 г, 21,84 ммоль, 52,9% выход) в виде желтого твердого вещества. MS (ESI) m/z 167,4 [M+1]+.
B. 4-Метил-6-нитро-1H-индазол. Раствор нитрита натрия (0,415 г, 6,02 ммоль) в воде (1,4 мл) добавляли к раствору 2,3-диметил-5-нитроанилина (1 г, 6,02 ммоль) в уксусной кислоте (137 мл). Полученный раствор перемешивали при комнатной температуре в течение 24 часов. Растворители удаляли в вакууме с получением твердого вещества, которое растворяли в этилацетате и фильтровали через пробку из диоксида кремния. Этилацетат в конце удаляли с получением 4-метил-6-нитро-1H-индазола (0,900 г, 5,08 ммоль, 84% выход) в виде желтого твердого вещества. MS (ESI) m/z 178,2 [M+1]+.
C. 3-Иод-4-метил-6-нитро-1H-индазол. Раствор 4-метил-6-нитро-1H-индазола (0,900 г, 5,08 ммоль) в смеси диоксана (25 мл) и гидроксидв натрия (2 н в воде, 3,81 мл, 7,62 ммоль) перемешивали при комнатной температуре в течение 1 часа. Добавляли иод (1,547 г, 6,10 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Водный слой нейтрализовали при помощи хлористого водорода (6 н в воде) и экстрагировали три раза этилацетатом. После этого объединенные органические слои промывали насыщенным водным раствором тиосульфата натрия, водой и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали с получением 3-иод-4-метил-6-нитро-1H-индазола (1,38 г, 4,55 ммоль, 90% выход). MS (ESI) m/z 304,2 [M+1]+.
D. 3-Иод-4-метил-6-нитро-1-(тетрагидро-2Н-пиран-2-ил)-1H-индазол. 3-Иод-4-метил-6-нитро-1H-индазол (1,38 г, 4,55 ммоль), 3,4-дигидро-2H-пиран (0,457 мл, 5,01 ммоль) и метансульфоновую кислоту (0,035 мл, 0,546 ммоль) растворяли в тетрагидрофуране (15 мл) и перемешивали при 75°C. Через 6 часов раствор разбавляли триэтиламином (0,5 мл) и конденсировали при пониженном давлении. Остаток очищали при помощи хроматографии на силикагеле (0-15% этилацетата в гексане) с получением 3-иод-4-метил-6-нитро-1-(тетрагидро-2H-пиран-2-ил)-1H-индазола (1,4 г, 3,62 ммоль, 79% выход). MS (ESI) m/z 388,2 [M+1]+.
E. 3,4-Диметил-6-нитро-1-(тетрагидро-2Н-пиран-2-ил)-1Н-индазол. Смесь 3-иод-4-метил-6-нитро-1-(тетрагидро-2H-пиран-2-ил)-1H-индазола (1,4 г, 3,62 ммоль), метилбороновой кислоты (0,649 г, 10,85 ммоль), тетракис(трифенилфосфин)-палладия(0) (0,418 г, 0,362 ммоль) и карбоната цезия (3,53 г, 10,85 ммоль) в диоксане (15 мл) дегазировали и нагревали до 90°C в течение ночи. После охлаждения до комнатной температуры смесь фильтровали через Целит, растворитель удаляли при пониженном давлении и остаток очищали при помощи хроматографии на силикагеле (0-20% этилацетата в гексане) с получением 3,4-диметил-6-нитро-1-(тетрагидро-2H-пиран-2-ил)-1H-индазола (0,897 г, 3,26 ммоль, 90% выход). MS (ESI) m/z 276,5 [M+1]+.
F. 3,4-Диметил-1-(тетрагидро-2Н-пиран-2-ил)-1H-индазол-6-амин. 3,4-Диметил-6-нитро-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол (0,897 г, 3,26 ммоль) растворяли в этилацетате (60 мл) и метаноле (10 мл) и продували азотом, обрабатывали при помощи 10% палладия на активированном угле (0,173 г, 1,629 ммоль) и перемешивали в атмосфере водорода, в течение 24 часов. Реакционную смесь фильтровали через слой целита и концентрировали с получением темно-оранжевого твердого вещества, которое очищали с использованием обращенно-фазовой препаративной ВЭЖХ (10-80% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 мин) с получением 3,4-диметил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол-6-амина (0,528 г, 2,150 ммоль, 66% выход). MS (ESI) m/z 246,5 [M+1]+.
Промежуточное соединение 121: 6-Амино-1,3,3-триметилиндолин-2-он
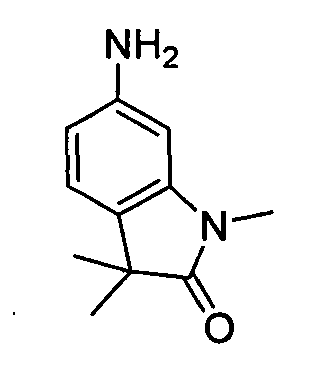
A. 1,3,3-Триметил-6-нитроиндолин-2-он. К коричневой суспензии 3,3-диметил-6-нитроиндолин-2-она (1,82 г, 8,83 ммоль) в N,N-диметилформамиде (15 мл) при комнатной температуре добавляли карбонат калия (1,830 г, 13,24 ммоль), с последующим добавлением диметилсульфата (1,054 мл, 11,03 ммоль) по каплям (неразбавленный). После перемешивания в течение 24 часов реакция не была полностью завершена, согласно данным анализа ТСХ. Добавляли дополнительное количество диметилсульфата (0,5 мл, 5,5 ммоль) и реакционную смесь перемешивали в течение ночи. Реакционную смесь распределяли между этилацетатом (100 мл) и водой (30 мл). Органический слой отделяли, сушили над сульфатом магния и концентрировали с получением коричневого масла, которое очищали с использованием колоночной флэш-хроматографии на силикагеле (элюируя при помощи 100% дихлорметана), с получением продукта в виде желтого твердого вещества (1,46 г, 54%). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,98 (дд, 1H), 7,83 (д, J=2,15 Гц, 1H), 7,66 (д, J=8,10 Гц, 1H), 3,23 (с, 3H), 1,32 (с, 6H); Rf= 0,50, (33% этилацетата в гексане).
B. 6-Амино-1,3,3-триметилиндолин-2-он. 1,3,3-Триметил-6-нитроиндолин-2-он (1,42 г, 6,45 ммоль) суспендировали в этилацетате (30 мл) и метаноле (5 мл) и добавляли 10% палладий на углероде (0,343 г, 3,22 ммоль). Реакционную смесь перемешивали под давлением водорода 1 атмосфера при 30°C в течение 1 часа, затем при комнатной температуре в течение 4 часов. Реакционную смесь продували азотом и фильтровали через слой целита, промывая этилацетатом и метанолом. Фильтрат концентрировали с получением 6-амино-1,3,3-триметилиндолин-2-она в виде бледно-серого твердого вещества (0,997 г, 81% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 6,83-6,99 (м, 1H), 6,12-6,27 (м, 2H), 5,10 (с, 2H), 3,03 (с, 3H), 1,17 (с, 6H); MS (ESI) m/z 191,0 [M+1]+.
Промежуточное соединение 122: N,2-Диметокси-N-метилизоникотинамид
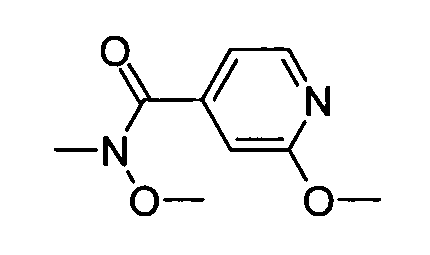
A. N,2-Диметокси-N-метилизоникотинамид. Оксалилхлорид (6,27 мл, 71,8 ммоль) медленно добавляли по каплям к перемешиваемой суспензии 2-метоксиизоникотиновой кислоты (10,00 г, 65,3 ммоль) и N,N-диметилформамида (0,101 мл, 1,306 ммоль) в дихлорметане (300 мл). Полученную белую смесь перемешивали при комнатной температуре в атмосфере азота в течение 2 часов. Наболюдалось выделение газа, но не происходило никакой генерации тепла. Полученную смесь охлаждали до 0°C в атмосфере азота. Добавляли гидрохлорид N,O-диметилгидроксиламина (9,56 г, 98 ммоль) с последующим медленным добавлением триэтиламина (45,5 мл, 327 ммоль). Полученную вязкую суспензию перемешивали при комнатной температуре в атмосфере азота. ЖХ/МС анализ через 10 минут показал полную конверсию в желаемый продукт. Добавляли воду и реакционную смесь экстрагировали дихлорметаном. Объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе. Остаток очищали с использованием флэш-хроматографии (5-60% этилацетата в гексане) с получением N,2-диметокси-N-метилизоникотинамида (11,0 г, 56,0 ммоль, 86% выход) в виде желтого масла. MS (ESI) m/z 197,3[M+1]+.
Промежуточное соединение 123: 5-Амино-2-(2,4-диметоксибензил)изоиндолин-1-он
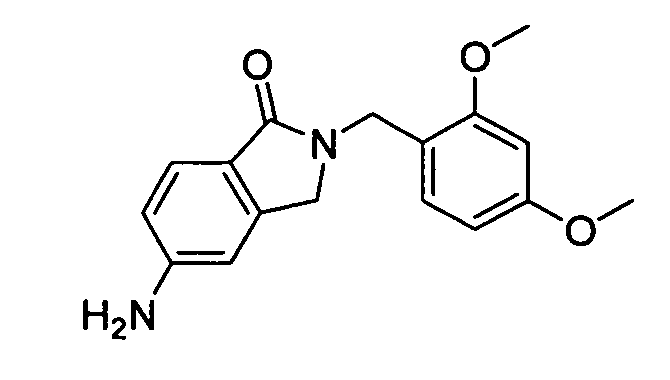
A. Метил 2-(бромметил)-4-нитробензоат. Метил 2-метил-4-нитробензоат (5 г, 25,6 ммоль) растворяли в тетрахлориде углерода (60 мл) и затем продували азотом в течение 10 минут. К раствору добавляли N-бромсукцинимид (5,47 г, 30,7 ммоль) и бензоилпероксид (0,124 г, 0,512 ммоль) и затем нагревали до 70°C в течение 16 часов. Реакционную смесь концентрировали и затем очищали при помощи хроматографии на силикагеле (0-60% этилацетата в гексане) с получением оранжевого твердого вещества (3,5 г, 12,77 ммоль, 49,8% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,35 (д, J=2,34 Гц, 1H), 8,16-8,25 (м, 1H), 8,12 (д, J=8,59 Гц, 1H), 4,98 (с, 2H), 3,97-4,09 (м, 3H).
B. 2-(2,4-Диметоксибензил)-5-нитроизоиндолин-1-он. Смесь метил 2-(бромметил)-4-нитробензоата (2,5 г, 9,12 ммоль), (2,4-диметоксифенил)метанамина (1,525 г, 9,12 ммоль), триэтиламина (3,81 мл, 27,4 ммоль) в метаноле (25 мл) нагревали при кипячении с обратным холодильником в течение 16 часов. Смесь разбавляли этилацетатом, промывали разбавленной хлористоводородной кислотой и насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе досуха. Флэш-хроматография (30-50% этилацетата в гексане) дала желаемый продукт в виде желтого твердого вещества (2,5 г, 7,68 ммоль, 84% выход). MS (ESI) m/z 329,9[M+1]+.
C. 5-Амино-2-(2,4-диметоксибензил)изоиндолин-1-он. 2-(2,4-Диметоксибензил)-5-нитроизоиндолин-1-он (1 г, 3,05 ммоль) растворяли в этаноле и продували азотом. Добавляли палладий на углероде (0,530 г, 0,498 ммоль) и реакционную смесь перемешивали под давлением водорода 1 атмосфера в течение 16 часов. Реакционную смесь фильтровали через Целит и промывали этанолом. Органический слой концентрировали на роторном испарителе досуха с получением желаемого продукта в виде фиолетового твердого вещества. Неочищенное вещество кристаллизовали из этилацетата и гексана с получением 5-амино-2-(2,4-диметоксибензил)изоиндолин-1-она в виде белого твердого вещества (0,9 г, 3,02 ммоль, 99%). MS (ESI) m/z 299,2[M+1]+.
Промежуточное соединение 124: N-Метокси-N-метилтетрагидро-2Н-пиран-4-карбоксамид
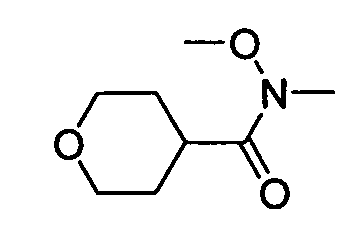
A. N-Метокси-N-метилтетрагидро-2Н-пиран-4-карбоксамид. N-Метокси-N-метилтетрагидро-2H-пиран-4-карбоксамид получали в соответствии с процедурой, описанной для получения N,2-диметокси-N-метилизоникотинамида, из тетрагидро-2H-пиран-4-карбоновой кислоты (10 г, 77 ммоль), оксалилхлорида (7,40 мл, 85 ммоль), гидрохлорида N,О-диметилгидроксиламина (9,4 г, 115 ммоль) и триэтиламина (53,5 мл, 384 ммоль). После очистки при помощи флэш-хроматографии (элюировали при помощи 30-70% этилацетата в гексане) получали N-метокси-N-метилтетрагидро-2H-пиран-4-карбоксамид в виде желтого масла (11,3 г, 65,2 ммоль, 85% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 4,02 (ддд, J=11,52, 4,10, 1,95 Гц, 2H), 3,73 (с, 3H), 3,47 (тд, J=11,81, 2,15 Гц, 2H), 3,19 (с, 3H), 2,81-2,98 (м, 1H), 1,75-1,97 (м, 2H), 1,66 (дд, 2H); MS (ESI) m/z 174,2 [M+1]+.
Промежуточное соединение 125: 1-(Тетрагидро-2H-пиран-2-ил)-1H-пиразоло[4,3-b]пиридин-6-амин
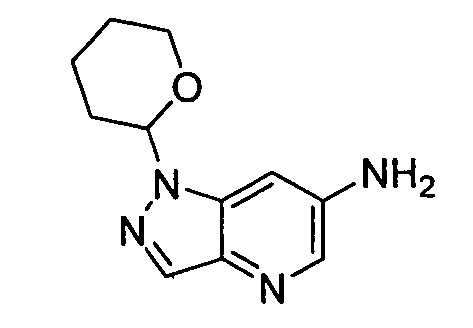
A. 6-Нитро-1Н-пиразоло[4,3-b]пиридин. Раствор нитрита натрия (2,163 г, 31,3 ммоль) в воде (20 мл) добавляли к перемешиваемому раствору 2-метил-5-нитропиридин-3-амина (4 г, 26,1 ммоль) в уксусной кислоте (70 мл). Полученный оранжевый раствор перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь охлаждали до 0°C и реакционную смесь доводили до pH=7 путем добавления водного раствора гидроксида натрия (6 M). Добавляли воду и этилацетат. Полученную смесь встряхивали в делительной воронке и слои разделяли. Органические слои промывали водой и насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе. Остаток растирали в порошок с диэтиловым эфиром. Твердые вещества собирали при помощи вакуумной фильтрации, промывали диэтиловым эфиром и сушили в условиях высокого вакуума с получением желаемого продукта в виде темно-оранжевого твердого вещества (2,3 г, 14,01 ммоль, 53,7% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,29 (д, J=2,34 Гц, 1H), 8,91 (шир.с, 1H), 8,59 (шир.с, 1H). MS (ESI) m/z 165,2 [M+1]+.
B. 6-Нитро-1-(тетрагидро-2Н-пиран-2-ил)-1H-пиразоло[4,3-b]пиридин. Раствор 6-нитро-1H-пиразоло[4,3-b]пиридина (2 г, 12,19 ммоль), 3,4-дигидро-2H-пирана (1,538 г, 18,28 ммоль) и метансульфоновой кислоты (0,119 мл, 1,828 ммоль) в тетрагидрофуране (100 мл) нагревали до 70°C в течение ночи. Реакционную смесь охлаждали и нейтрализовали при помощи водного раствора бикарбоната натрия до pΗ 7 и затем экстрагировали этилацетатом. Объединенные органические слои сушили над сульфатом магния, фильтровали, концентрировали на роторном испарителе. Флэш-хроматография (элюировали при помощи 0-50% этилацетата в гексане) дала желаемый продукт в виде не совсем белого твердого вещества (1,3 г, 5,24 ммоль, 43,0% выход). (ESI) m/z 249,3[M+1]+.
C. 1-(Тетрагидро-2Н-пиран-2-ил)-1H-пиразоло[4,3-b]пиридин-6-амин. 6-Нитро-1-(тетрагидро-2H-пиран-2-ил)-1H-пиразоло[4,3-b]пиридин (1 г, 4,03 ммоль) растворяли в 50% этанола в этилацетате и реакционную смесь продували азотом. Добавляли палладий на углероде (0,6 г, 0,564 ммоль) и реакционную смесь перемешивали под давлением водорода 1 атмосфера в течение 16 часов. Реакционную смесь фильтровали через Целит и промывали этанолом. Органический слой концентрировали на роторном испарителе досуха с получением желаемого продукта в виде фиолетового твердого вещества, которое очищали при помощи кристаллизации из этилацетата в гексане с получением 1-(тетрагидро-2H-пиран-2-ил)-1H-пиразоло[4,3-b]пиридин-6-амина (0,8 г, 3,67 ммоль, 91% выход) в виде белого твердого вещества. (ESI) m/z 219 A [M+1]+.
Промежуточное соединение 126: 1,4-Диметил-1H-индазол-6-амин

A. M-Диметил-6-нитро-1H-индазол. 4-Метил-6-нитро-1H-индазол (0,75 г, 4,23 ммоль) растворяли в N,N-диметилформамиде (10 мл). Затем добавляли гидрид натрия (0,203 г, 5,08 ммоль, 60% дисперсия в минеральном масле) при температуре окружающей среды. Через 15 минут к раствору добавляли по каплям метилиодид (0,318 мл, 5,08 ммоль) в N,N-диметилформамиде (0,5 мл) и оставляли для перемешивания при температуре окружающей среды. Через 2 часа ЖХ/МС анализ показал два пика в УФ области, оба с такими же массами продукта, как геометрических изомерs. Раствор конденсировали при пониженном давлении с получением коричневого твердого вещества. Это твердое вещество разбавляли водой (25 мл) и обрабатывали ультразвуком в течение 5 минут. Полученное твердое вещество фильтровали и промывали дополнительно водой, а затем гексаном с получением ржаво-коричневого твердого вещества. Это твердое вещество очищали при помощи колоночной хроматографии (Biotage, элюировали при помощи 0-100% этилацетата в гексане) с получением указанного в заголовке соединения (0,480 г, 2,51 ммоль, 59% выход), как было подтверждено 1H ЯМР и NOE ЯМР. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 4,18 (Излучающий пик). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,55 (с, 1H), 8,35 (с, 1H), 7,77 (с, 1H), 4,18 (с, 3H), 2,66 (с, 3H); MS (ESI) m/z 192,4 [M+1]+.
B. 1,4-Диметил-1H-индазол-6-амин. 1,4-Диметил-6-нитро-1H-индазол (0,49 г, 2,56 ммоль) разбавляли этанолом (20 мл), а затем палладием на углероде (0,049 г, 0,460 ммоль). Из раствора отводили газ и продували газообразным водородом, два раза. Раствор оставляли для перемешивания при температуре окружающей среды. Через 1 час ЖХ/МС анализ показал преобладающее количество исходных веществ при некотором определяемом количестве гидроксиламинового промежуточного соединения. Раствор продолжали перемешивать при температуре окружающей среды. Через 4 часа ЖХ/МС анализ показал полное поглощение исходных веществ. Раствор фильтровали через целит и фильтрат конденсировали при пониженном давлении с получением красноватого твердого вещества (0,409 г, 2,54 ммоль, 99% выход). MS(ESI) m/z 162,5 [M+1]+.
Промежуточное соединение 127: 5-Амино-2-метилизоиндолин-1-он
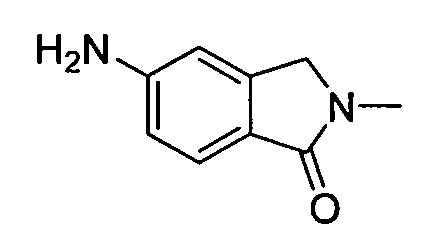
A. 2-Метил-5-нитроизоиндолин-1-он. К раствору/суспензии метил 2-(бромметил)-4-нитробензоата (7 г, 25,5 ммоль) в метаноле (50 мл) добавляли метанамингидрохлорид (1,724 г, 25,5 ммоль) и триэтиламин (17,80 мл, 128 ммоль). Реакционную смесь нагревали до 70°C и перемешивали в течение ночи. Реакционную смесь охлаждали до комнатной температуры, и происходило образование кристаллов продукта. Продукт затем оставляли кристаллизоваться в течение уикэнда при 0°C. Образовавшиеся твердые вещества фильтровали и растворяли в дихлорметане. Этот неочищенный раствор загружали в колонку и очищали при помощи колоночной хроматографии (элюируя при помощи 0-10% метанола в дихлорметане). Фракции, содержащие продукт, объединяли и растворитель удаляли в вакууме. 2-Метил-5-нитроизоиндолин-1-он (3 г, 15,61 ммоль, 61,1% выход) получали в виде неочищенного оранжево-желтого твердого вещества. Это твердое вещество использовали в следующей реакции без дополнительной очистки. MS (ESI): m/z 193,0 [M+1]+.
B. 5-Амино-2-метилизоиндолин-1-он. К раствору/суспензии 2-метил-5-нитроизоиндолин-1-она (3 г, 15,61 ммоль) в метаноле (50 мл) и этаноле (50,0 мл) добавляли палладий на углероде. Устанавливали баллон, заполненный газообразным водородом, и реакционную смесь перемешивали в течение ночи. Реакционную смесь фильтровали и растворитель удаляли в вакууме. 5-Амино-2-метилизоиндолин-1-он (2 г, 12,33 ммоль, 79% выход) получали в виде светло-желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,27 (д, J=7,81 Гц, 1H), 6,47-6,66 (м, 2H), 5,70 (с, 2H), 4,24 (с, 2H), 2,96 (с, 3H); MS (ESI): m/z 163,0 [M+1]+.
Промежуточное соединение 128: 6-Бром-3-метилбензо[d]изоксазол
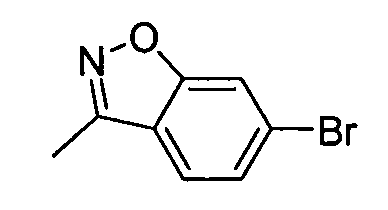
A. (Е)-1-(4-Бром-2-гидроксифенил)этанон оксим. К раствору 1-(4-бром-2-гидроксифенил)этанона (2,8 г, 13,02 ммоль) и воды (10 мл) добавляли ацетат натрия (1,602 г, 19,53 ммоль) и гидрохлорид гидроксиламина (1,176 г, 16,93 ммоль). Смесь оставляли для перемешивания при температуре окружающей среды в течение 16 часов. Раствор конденсировали при пониженном давлении и разбавляли водой и обрабатывали ультразвуком. Полученное твердое вещество фильтровали и сушили в вакуумной печи с получением указанного в заголовке соединения (1,90 г, 8,26 ммоль, 63,4% выход). MS(ESI) m/z 230,3 [M]+, 232,4 [M+2]+.
B. (Е)-1-(4-Бром-2-гидроксифенил)этанон О-ацетилоксим. (E)-1-(4-Бром-2-гидроксифенил)этанон оксим (0,75 г, 3,26 ммоль) разбавляли уксусным ангидридом (7,69 мл, 82 ммоль). Раствор оставляли для перемешивания при 110°C в колбе с закручивающейся крышкой. Через 5 минут смесь оставляли для перемешивания при температуре окружающей среды на 30 минут. Раствор конденсировали при пониженном давлении и распределяли между pH 7 фосфатным буфером и этилацетатом (×2). Органические слои сушили над сульфатом натрия, фильтровали и растворитель удаляли при пониженном давлении с получением ацетата оксима в виде белого твердого вещества (0,880 г). ЖХ/МС анализ этого вещества показал, что это выглядит как 2 разных пика, оба с массой продукта, однако они оба показывали разные высокие расщепления Br линий масс-спектра. Это твердое вещество очищали при помощи колоночной хроматографии с использованием biotage (100% гексана (100 мл), затем 0-45% этилацетата в гексане (700 мл), затем 45-100% этилацетата (100 мл)) с получением два чисто разделенных продукта. 1H-ЯМР подтвердил (Е)-1-(4-бром-2-гидроксифенил)этанон O-ацетилоксим в качесте первого элюата (0,252 г, 0,926 ммоль, 28% выход) и бис-ацетат в качестве второго элюата (0,487 г, 1,550 ммоль, 48% выход). Первый элюат: 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 11,46 (с, 1H), 7,32 (д, J=8,59 Гц, 1H), 7,22 (д, J=1,95 Гц, 1H), 7,05 (дд, J=8,59, 1,95 Гц, 1H), 2,43 (с, 3H), 2,26 (с, 3H); Второй элюат: 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,41-7,46 (м, 1H), 7,37 (с, 1H), 7,34-7,36 (м, 1H), 2,31 (с, 3H), 2,30 (с, 3H), 2,23 (с, 3H).
C. 6-Бром-3-метилбензо[d]изоксазол. (Е)-(4-Бром-2- гидроксифенил)этанон О-ацетилоксим (1,6 г, 6,95 ммоль) разбавляли пиридином (10 мл) в колбе с закручивающейся крышкой и нагревали до 125°C в течение 16 часов. ТСХ анализ (40% этилацетата в гексане) подтвердил поглощение исходного вещества и образование продукта. Раствор конденсировали при пониженном давлении и масло очищали при помощи колоночной хроматографии с использованием biotage (100% гексана (100 мл), затем 0-50% этилацетата в гексане (750 мл)) с получением 6-бром-3-метилбензо[d]изоксазола (1,19 г, 5,6 ммоль, 68% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,75 (д, J=1,17 Гц, 1H), 7,48-7,52 (м, 1H), 7,42-7,47 (м, 1H), 2,58 (с, 3H); MS(ESI) m/z 212,2 [M] +, 214,2 [M+2]+.
Промежуточное соединение 129: 1-метил-1H-индазол-5-амин
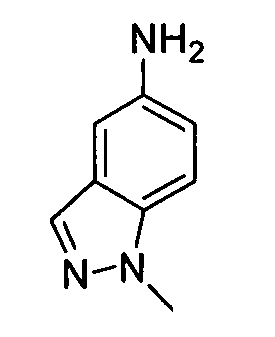
A. 1-метил-1H-индазол-5-амин. К раствору 1-метил-5-нитро-1H-индазола (1 г, 5,64 ммоль) в этаноле (10 мл) добавляли палладий на углероде (0,060 г, 0,564 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 часов под давлением водорода 1 атмосфера. Реакционную смесь фильтровали через Целит и концентрировали. Неочищенное вещество растирали в порошок этилацетатом и дихлорметаном с получением указанного в заголовке соединения в виде светло-фиолетового твердого вещества (0,65 г, 78% выход). MS (ESI) m/z 148,2 [M+1]+.
Промежуточное соединение 130: трет-Бутил 3-метил-6-амино-2-оксо-3-гидробензимидазолкарбоксилат
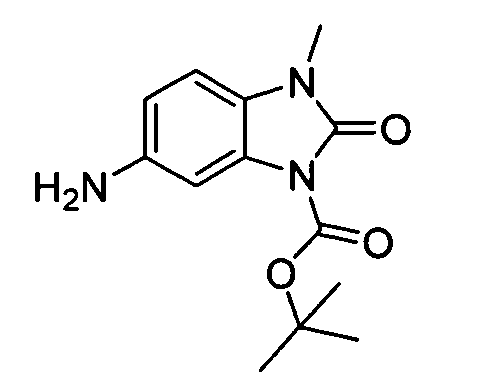
A. (2-Амино-4-нитрофенил)метиламин. 2-Фтор-5-нитроанилин (2 г, 12,81 ммоль) добавляли в герметично закрываемую пробирку с метиламином (5 мл, 40% в вод) и реакционную смесь нагревали при 95°C в течение ночи. Реакционную смесь упаривали и остаток очищали на силикагеле (0 до 85% этилацетата в гексане) с получением (2-амино-4-нитрофенил)метиламина в виде красно-оранжевого твердого вещества. MS (ESI) m/z 168,2 [M+1]+.
B. 1-Метил-5-нитро-3-гидробензимидазол-2-он. Раствор (2-амино-4-нитрофенил)метиламина (1,62 г, 9,69 ммоль) и ди(1H-имидазол-1-ил)метанона (1,571 г, 9,69 ммоль) в тетрагидрофуране (25 мл) перемешивали при 65°C в течение 18 часов. Реакционную смесь затем охлаждали до 0°C. Полученный осадок отфильтровывали и сушили с получением 1-метил-5-нитро-3-гидробензимидазол-2-она (1,81 г, 9,37 ммоль, 97% выход) в виде чистого бежевого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,36-11,49 (м, 1H), 8,03 (дд, J=2,34, 8,59 Гц, 1H), 7,76 (д, J=2,34 Гц, 1H), 7,31 (д, J=8,98 Гц, 1H), 3,36 (с, 3H); MS (ESI) m/z 194,5 [M+1]+.
C. трет-Бутил 3-метил-6-нитро-2-оксо-3-гидробензимидазолкарбоксилат. Смесь 1-метил-5-нитро-1H-бензо[d]имидазол-2(3H)-она (1 г, 5,18 ммоль), ди-трет-бутилдикарбоната (2,404 мл, 10,35 ммоль) и бикарбоната натрия (0,870 г, 10,35 ммоль) в тетрагидрофуране (37 мл) перемешивали при комнатной температуре в течение 3 дней. Полученное белое твердое вещество фильтровали, промывали водой и тетрагидрофураном и сушили с получением трет-бутил 3-метил-6-нитро-2-оксо-3-гидробензимидазолкарбоксилата (1,39 г, 4,74 ммоль, 92% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,52 (д, J=2,34 Гц, 1H), 8,22 (дд, J=2,34, 8,59 Гц, 1H), 7,43 (д, J=8,59 Гц, 1H), 3,37 (с, 3H), 1,62 (с, 9H).
D. трет-Бутил 3-метил-6-амино-2-оксо-3-гидробензимидазолкарбоксилат. трет-Бутил 3-метил-6-нитро-2-оксо-2,3-дигидро-1H-бензо[d]имидазол-1-карбоксилат (1,38 г, 4,71 ммоль) брали для поглощения в метанол (30 мл) и добавляли каталитическое количество палладия на углероде. Реакционную смесь перемешивали в атмосфере газообразного водорода в течение 18 часов, фильтровали через целит и затем упаривали с получением трет-бутил 3-метил-6-амино-2-оксо-3-гидробензимидазолкарбоксилата (1,12 г, 4,25 ммоль, 90% выход). MS (ESI) m/z 264,2 [M+1]+.
Промежуточное соединение 131: 3-Метил-[1,2,4]триазоло[4,3-α]пиридин-7-амин
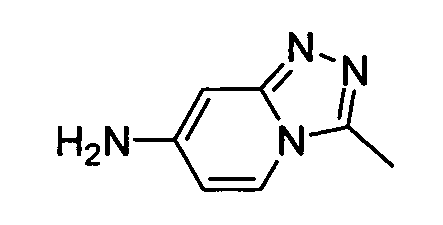
A. Ди-трет-бутил 1-(4-нитропиридин-2-ил)гидразин-1,2-дикарбоксилат. В пробирку загружали трис(дибензилиденацетон)дипалладий(0) (0,695 г, 0,759 ммоль), 1,1'-бис(дифенилфосфино)ферроцен (1,277 г, 2,278 ммоль), карбонат цезия (6,19 г, 18,99 ммоль) и ди-трет-бутил гидразин-1,2-дикарбоксилат (3,53 г, 15,19 ммоль). Пробирку продували аргоном и затем добавляли толуол (20 мл) и 2-хлор-4-нитропиридин (3,01 г, 18,99 ммоль). Реакционную смесь нагревали при 100°C при перемешивании в течение 16 часов. Реакционную смесь охлаждали, фильтровали через Целит и концентрировали в вакууме. Неочищенный остаток очищали при помощи хроматографии на силикагеле (0-20% этилацетата в гексане) с получением ди-трет-бутил 1-(4-нитропиридин-2-ил)гидразин-1,2-дикарбоксилата (4,5 г, 12,70 ммоль, 66,9% выход). MS (ESI) m/z 355,2 [M+1]+.
B. Дигидрохлорид 2-гидразинил-4-нитропиридина. К перемешиваемой смеси ди-трет-бутил-1-(4-нитропиридин-2-ил)гидразин-1,2-дикарбоксилата (6,7 г, 18,91 ммоль) в этаноле (30 мл) при комнатной температуре добавляли хлористый водород (142 мл, 567 ммоль, 4 н в диоксан). Полученную смесь перемешивали в атмосфере азота в течение 16 часов. Полученную суспензию концентрировали до половины объема на роторном испарителе, фильтровали и промывали небольшим количеством диэтилового эфира с получением дигидрохлорида 2-гидразинил-4-нитропиридина (3,09 г, 13,61 ммоль, 72% выход) в виде желтого твердого вещества. MS (ESI) m/z 155,2 [M+1]+.
C. N'-(4-Нитропиридин-2-ил)ацетогидразид. К перемешиваемой смеси дигидрохлорида 2-гидразинил-4-нитропиридина (1,6 г, 7,05 ммоль) в пиридине (54 мл) при комнатной температуре добавляли уксусный ангидрид (0,799 мл, 8,46 ммоль). Полученную смесь перемешивали в атмосфере азота при 50°C в течение 16 часов. Полученную суспензию концентрировали на роторном испарителе и остаток очищали с использованием флэш-хроматографии (0-10% метанола в дихлорметане) с получением N'-(4-нитропиридин-2-ил)ацетогидразида (0,646 г, 3,29 ммоль, 46,7% выход) в виде желтого твердого вещества. MS (ESI) m/z 197,3 [M+1]+.
D. 3-Метил-7-нитро-[1,2,4]триазоло[4,3-α]пиридин. К раствору N'-(4-нитропиридин-2-ил)ацетогидразида (0,641 г, 3,27 ммоль) в тетрагидрофуране (25 мл) добавляли при комнатной температуре (метоксикарбонилсульфамоил)триэтиламмонийгидроксид, внутреннюю соль (2,336 г, 9,80 ммоль). Смесь нагревали при 65°C в течение 18 часов и охлаждали до комнатной температуры. Реакционную смесь концентрировали и остаток загружали на колонку biotage и очищали флэш-хроматографией (0-10% метанола в дихлорметане) с получением 3-метил-7-нитро-[1,2,4]триазоло[4,3-α]пиридина (0,467 г, 2,62 ммоль, 80% выход) в виде желтовато-белого твердого вещества. MS (ESI) m/z 179,2 [M+1]+.
E. 3-Метил-[1,2,4]триазоло[4,3-α]пиридин-7-амин. 3-Метил-7-нитро-[1,2,4]триазоло[4,3-α]пиридин (0,467 г, 2,62 ммоль) суспендировали в метаноле (10 мл) с последующим добавлением платины, 1% на активированном угле, и введением ванадия (порошок с 50% влажностью)Evonik F4 (0,100 г). Из раствора отводили газ и продували свежим газообразным водородом, три раза, и смесь оставляли для перемешивания при температуре окружающей среды в течение 4 часов. Раствор фильтровали через Целит и растворитель удаляли при пониженном давлении с получением 3-метил-[1,2,4]триазоло[4,3-α]пиридин-7-амина (0,388 г, 2,62 ммоль, 100% выход) в виде коричневого твердого вещества. MS (ESI) m/z 149,3 [M+1]+.
Промежуточное соединение 132: 3-Метил-1-((2-(триметилсилил)этокси)метил)-1H-пиразоло[3,4-b]пиридин-5-амин
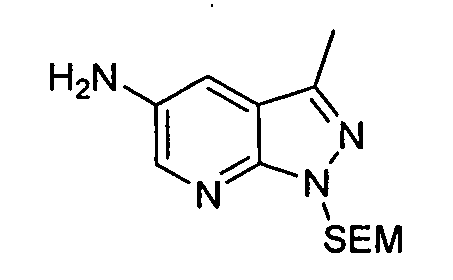
A. 5-Бром-1-хлор-N-метокси-N-метилникотинамид. К смеси 5-бром-2-хлорникотиновой кислоты (6 г, 25,5 ммоль) в тионилхлориде (30 мл) добавляли каплю N,N-диметилформамида и реакционную смесь нагревали при 80°C в течение 2 часов. Смесь охлаждали до комнатной температуры и концентрировали с получением неочищенного 5-бром-2-хлорникотиноилхлорида. Раствор гидрохлоридной соли О,N-диметил-гидроксиламина (3,45 г, 35,6 ммоль) и триэтиламина (7,48 г, 74,1 ммоль) в дихлорметане (80 мл) и раствор полученного выше 5-бром-2-хлорникотиноилхлорида в дихлорметане (20 мл) добавляли и реакционную смесь перемешивали в течение ночи. Смесь выливали в воду и экстрагировали дихлорметаном (50 мл ×3). Объединенный органический слой концентрировали при пониженном давлении и очищали на колонке с силикагелем (элюируя при помощи 5-10% этилацетата в петролейном эфире) с получением 5-бром-2-хлор-N-метокси-N-метилникотинамида в виде твердого вещества (6,2 г, 71,4% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,65 (с, 1H), 8,39 (с, 1H), 3,49 (с, 3H), 3,30 (с, 3H).
B. 1-(5-Бром-2-хлорпиридин-3-ил)этанон. Метилмагнийбромид (6,0 мл, 18 ммоль, 3 M раствор в тетрагидрофуране) добавляли по каплям к раствору 5-бром-2-хлор-N-метокси-N-метилникотинамида (5 г, 18 ммоль) в тетрагидрофуране (80 мл) в атмосфере азота при 0°C в течение 30 минут. Полученную смесь нагревали до комнатной температуры в течение 2 часов, гасили водным раствором хлорида аммония и экстрагировали этилацетатом. Объединенный органический слой сушили над сульфатом натрия, упаривали при пониженном давлении и сушили в вакууме с получением 1-(5-бром-2-хлорпиридин-3-ил)этанона (3,1 г, 73,8% выход) в виде масла. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,54 (с, 1H), 8,00 (с, 1H), 2,69 (с, 3H).
C. 5-Бром-3-метил-1H-пиразоло[3,4-6]пиридин. Смесь 1-(5-бром-2-хлорпиридин-3-ил)-этанона (3,1 г, 13,3 ммоль), водного раствора гидразина (782 мг, 13,3 ммоль, 85%) и карбоната калия (1,83 г, 13,3 ммоль) в тетрагидрофуране (20 мл) нагревали при кипячении с обратным холодильником в течение ночи. После охлаждения до комнатной температуры реакционную смесь концентрировали и остаток растворяли в этилацетате. Органический раствор промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, упаривали при пониженном давлении и очищали на колонке с силикагелем с получением 5-бром-3-метил-1H-пиразоло[3,4-b]пиридина (2,0 г, 71,4% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 12,33 (шир.с, 1H), 8,58 (с, 1H), 8,16 (с, 1H), 2,58 (с, 3H).
D. 5-Бром-3-метил-1-((2-(триметилсилил)этокси)метил)-1H-пиразоло[3,4-b]пиридин. К раствору 5-бром-3-метил-1H-пиразоло[3,4-b]пиридина (2,0 г, 9,47 ммоль) в N,N-диметилформамиде (15 мл) добавляли гидрид натрия (455 мг, 11,4 ммоль, 60% в минеральном масле) при 0°C в атмосфере азота и смесь перемешивали в течение 1 часа при 0°C. Затем добавляли по каплям (2-(хлорметокси)этил)триметилсилан (1,88 г, 11,4 ммоль), смесь продолжали перемешивали в течение 1 часа при 0°C, выливали в ледяную воду (50 мл) и экстрагировали этилацетатом (100 мл ×3). Объединенный органический слой сушили над безводным сульфатом натрия, упаривали при пониженном давлении и очищали на колонке с силикагелем (элюируя при помощи 20-25% этилацетата в петролейном эфире) с получением 5-бром-3-метил-1-((2-(триметилсилил)этокси)метил)-1H-пиразоло[3,4-b]пиридина (1,6 г, 50% выход) в виде масла. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,55 (с, 1H), 8,12 (с, 1H), 5,76 (с, 2H), 3,62 (т, J=8,8 Гц, 2H), 2,55 (с, 3H), 0,93 (т, J=8,4 Гц, 2H), -0,06 (с, 9H); MS (ESI): m/z 341,9 [M+1]+.
E. 3-Метил-1-((2-(триметилсилил)этокси)метил)-1Н-пиразоло[3,4-b]пиридин-5-амин. Дегазированную смесь 5-бром-3-метил-1-((2-(триметилсилил)этокси)метил)-1H-пиразоло[3,4-6]пиридина (1,7 г, 5 ммоль), дифенилметанимина (1,36 г, 7,5 ммоль), трис(дибензилиденацетон)палладия(0) (920 мг, 1 ммоль), (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила (1,55 г, 2,5 ммоль) и трет-бутоксида натрия (720 мг, 7,5 ммоль) в толуоле (30 мл) нагревали при 115°C в атмосфере азота в течение ночи. Реакционную смесь концентрировали и очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 5-20% этилацетата в петролейном эфире) с получением N-(дифенилметилен)-3-метил-1-((2-(триметилсилил)этокси)метил)-1Н-пиразоло[3,4-b]пиридин-5-амина (2,5 г, неочищенный), который растворяли в тетрагидрофуране (10 мл) и добавляли хлористоводородную кислоту (2 н, 10 мл). Смесь перемешивали при комнатной температуре в течение 2 часов. Смесь доводили до pΗ=8 насыщенным раствором карбоната натрия, экстрагировали этилацетатом, сушили, концентрировали и очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 10-25% этилацетата в петролейном эфире) с получением 3-метил-1-((2-(триметилсилил)этокси)метил)-1H-пиразоло[3,4-δ]пиридин-5-амина (1,1 г, 79,1% выход) в виде масла. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,10 (с, 1H), 7,18 (с, 1H), 5,7 (с, 1H), 3,58 (д, J=11,2 Гц, 2H), 3,34 (с, 2H), 2,47 (с, 3H), 0,90 (т, J=11,2 Гц, 2H), -0,09 (с, 9H).
Промежуточное соединение 133: N-Метокси-N-метилтетрагидрофуран-3-карбоксамид
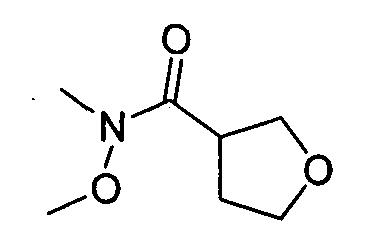
A. N-Метокси-N-метилтетрагидрофуран-3-карбоксамид. Смесь тетрагидрофуран-3-карбоновой кислоты (5 г, 43 ммоль), гидрохлорида N,О-диметилгидроксиламина (4,58 г, 48 ммоль), гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида (9,55 г, 50 ммоль), 1-гидроксибензотриазола (6,75 г, 50 ммоль) и 4-метилморфолина (10,1 г, 100 ммоль) в безводном дихлорметане (200 мл) перемешивали при 0°C в течение 1 часа. Смесь нагревали до комнатной температуры, перемешивали в течение ночи и выливали в воду (200 мл). Органический слой отделяли, водный слой экстрагировали дихлорметаном. Объединенную органическую фазу сушили над сульфатом натрия, концентрировали в вакууме и очищали колоночной хроматографией на силикагеле (элюируя при помощи 8% этилацетата в петролейном эфире) с получением N-метокси-N-метилтетрагидрофуран-3-карбоксамида (3 г, 44,1% выход) в виде бесцветного масла.
Промежуточное соединение 134: 4-(1-(Тетрагидро-2Н-пиран-2-ил)-1Н-1,2,4-триазол-3-ил)анилин
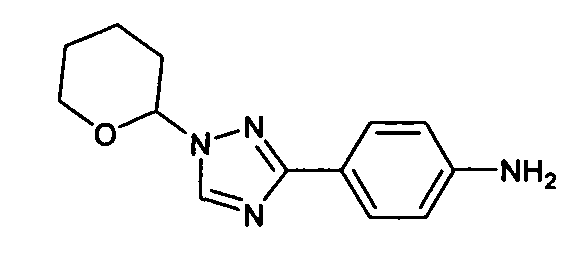
A. 3-Бром-1-(тетрагидро-2Н-пиран-2-ил)-1H-1,2,4-триазол. К раствору/суспензии 3,4-дигидро-2H-пирана (0,674 мл, 7,43 ммоль), 3-бром-1H-1,2,4-триазола (1 г, 6,76 ммоль) в тетрагидрофуране (15 мл) добавляли метансульфоновую кислоту (0,053 мл, 0,811 ммоль). Реакционную смесь нагревали при кипячении с обратным холодильником в течение 2 часов при 75°C. Реакционную смесь затем охлаждали и растворитель удаляли в вакууме. К смеси добавляли воду и смесь экстрагировали три раза этилацетатом. Органические слои объединяли и сушили над сульфатом натрия. Растворитель удаляли в вакууме с получением 3-бром-1-(тетрагидро-2H-пиран-2-ил)-1H-1,2,4-триазола (1,493 г, 6,43 ммоль, 95% выход) в виде масла, которое использовали на следующей стадии без дополнительной очистки. MS (ESI): m/z 232,0 [M+1]+.
B. 3-(4-Нитрофенил)-1-(тетрагидро-2H-пиран-2-ил)-1H-1,2,4-триазол. К суспензии/раствору 4-нитрофенилбороновой кислоты (1 г, 5,99 ммоль) в диметоксиэтане (20 мл) и воде (10 мл) добавляли 3-бром-1-(тетрагидро-2H-пиран-2-ил)-1H-1,2,4-триазол (1,390 г, 5,99 ммоль) с последующим добавлением карбоната калия. Реакционную смесь барботировали азотом в течение 3 минут. Добавляли тетракис(трифенилфосфин)палладий(0) (0,346 г, 0,300 ммоль) и герметично закрытую реакционную колбу перемешивали при 120°C в течение ночи. Реакционную смесь охлаждали и добавляли воду (50 мл). Смесь экстрагировали три раза этилацетатом. Органические слои объединяли, промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли в вакууме. Остаток очищали при помощи колоночной хроматографии (элюируя при помощи 0-100% этилацетата в гексане) с получением 3-(4-нитрофенил)-1-(тетрагидро-2H-пиран-2-ил)-1H-1,2,4-триазола (400 мг, 1,458 ммоль, 24,34% выход) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,91 (с, 1H), 8,31-8,38 (м, 2H), 8,22-8,30 (м, 2H), 5,66 (дд, J=2,73, 9,76 Гц, 1H), 3,98 (дтд, 1H), 3,58-3,80 (м, 1H), 1,86-2,35 (м, 3H), 1,48-1,83 (м, 3H). MS (ESI): m/z 275,2 [M+1]+.
C. 4-(1-(Тетрагидро-2,H-пиран-2-ил)-1Н-1,2,4-триазол-3-ил)анилин. К дегазированному раствору 3-(4-нитрофенил)-1-(тетрагидро-2H-пиран-2-ил)-1H-1,2,4-триазола (400 мг, 1,458 ммоль) в метаноле (100 мл) добавляли палладий на углероде (155 мг, 1,458 ммоль). Реакционную смесь перемешивали при комнатной температуре в условиях давления водорода 1 атмосфера в течение ночи. Раствор фильтровали и растворитель удаляли в вакууме с получением 4-(1-(тетрагидро-2H-пиран-2-ил)-1H-1,2,4-триазол-3-ил)анилина (0,356 г, 1,458 ммоль, 100% выход), который использовали на следующей стадии без дополнительной очистки. MS (ESI): m/z 245,0 [M+1]+.
Промежуточное соединение 135: N-Метокси-N-метил-1,4-диоксан-2-карбоксамид
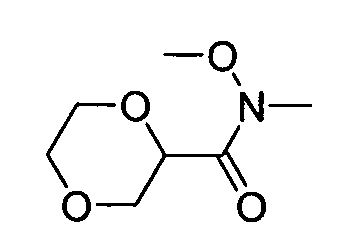
A. 1,4-Диоксан-2-карбонитрил. 4 M Хлористого водорода в 1,4-диоксане (23 мл, 93 ммоль) добавляли по каплям к перемешиваемому раствору 2,3-дигидро-1,4-диоксина (8 г, 93 ммоль) в толуоле (20 мл) при комнатной температуре в атмосфере азота. Через 15 минут бесцветный раствор переносили в капельную воронку и добавляли по каплям к перемешиваемой суспензии цианосеребра (12,44 г, 93 ммоль) в толуоле (100 мл) при комнатной температуре в атмосфере азота. По завершении добавления полученную смесь нагревали при 115°C в условиях кипячения с обратным холодильником в атмосфере азота в течение 16 часов. Смесь охлаждали до комнатной температуры и фильтровали через Целит и фильтровальную лепешку промывали диэтиловым эфиром. Фильтрат концентрировали на роторном испарителе и очищали с использованием флэш-хроматографии (элюируя при помощи 0-100% этилацетата в гексане). Фракции, содержащие желаемый продукт, объединяли и растворитель удаляли на роторном испарителе. Остаток разбавляли гексаном и концентрировали на роторном испарителе три раза с получением желаемого продукта (6,2 г, 54,8 ммоль, 59,0% выход) в виде прозрачного масла. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 4,55 (т, J=3,32 Гц, 1H), 4,04 (ддд, J=12,59, 9,27, 2,73 Гц, 1H), 3,87 (д, J=3,12 Гц, 2H), 3,77-3,84 (м, 1H), 3,70-3,77 (м, 2H).
B. 1,4-Диоксан-2-карбоновая кислота. Раствор гидроксида натрия (5,0 г, 125 ммоль) в дистиллированной воде (45 мл) добавляли к 1,4-диоксан-2-карбонитрилу (6,5 г, 57 ммоль). Смесь нагревали при кипячении с обратным холодильником в течение четырех часов, подкисляли при помощи 6 н раствора серной кислоты (15 мл) и экстрагировали простым эфиром (3×30 мл). Водный раствор упаривали при пониженном давлении и экстрагировали простым эфиром. Эфирный раствор сушили над безводным сульфатом натрия, упаривали, с получением прозрачного масла, которое кристаллизовалось при охлаждении. Перекристаллизация из тетрахлорида углерода давала 1,4-диоксан-2-карбоновую кислоту (4,1 г, 31,0 ммоль, 54% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,88 (шир.с, 1H), 4,32 (дд, J=8,59, 3,12 Гц, 1H), 4,07 (дд, J=11,52, 3,32 Гц, 1H), 4,00 (дт, J=11,71, 2,93 Гц, 1H), 3,64-3,83 (м, 4H).
C. N-Метокси-N-метил-1,4-диоксан-2-карбоксамид. Оксалилхлорид (1,093 мл, 12,49 ммоль) добавляли по каплям к перемешиваемому раствору 1,4-диоксан-2-карбоновой кислоты (1,5 г, 11,35 ммоль) и N,N-диметилформамида (0,018 мл, 0,227 ммоль) в дихлорметане (50 мл). Полученный бесцветный раствор перемешивали при комнатной температуре в атмосфере азота в течение 2 часов. Полученную смесь охлаждали до 0°C в атмосфере азота, затем добавляли гидрохлорид N,О-диметилгидроксиламина (1,7 г, 17,03 ммоль). Смесь в виде густой суспензии перемешивали при комнатной температуре в атмосфере азота в течение 10 минут. Полученную смесь разбавляли дихлорметаном и промывали насыщенным водным раствором бикарбоната натрия. Органические слои промывали насыщенным солевым раствором и затем сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе. Остаток очищали с использованием флэш-хроматографии (30-70% этилацетата в гексане) с получением указанного в заголовке соединения (1,5 г, 8,56 ммоль, 75%) в виде прозрачного масла. MS (ESI) m/z 176,4 [M+1]+.
Промежуточные соединения 136 и 137: 6-Бром-1,4-диметилиндолин-2,3-дион и 4-бром-1,6-диметилиндолин-2,3-дион
A. 3-Бром-N,N,5-триметиланилин. К раствору гидрохлоридной соли 3-бром-5-метиланилина (0,419 г, 2,25 ммоль) в 1,2-диметоксиэтане (6 мл) добавляли гидрид натрия (0,162 г, 6,75 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 15 минут. Добавляли иодметан (0,7 мл, 11,25 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 17 часов. Добавляли воду и реакционную смесь экстрагировали этилацетатом (3×50 мл). Органические слои промывали насыщенным раствором хлорида аммония (100 мл) и насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали. Неочищенное вещество очищали при помощи колоночной хроматографии (элюируя при помощи 0-40% этилацетата в гексане) с получением 3-бром-N,N,5-триметиланилина (0,31 г, 66,4% выход) в виде желтой жидкости. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 6,62 (д, J=1,95 Гц, 2H), 6,51 (с, 1H), 2,88 (с, 6H), 2,22 (с, 3H). MS (ESI) m/z 213,9 [M+2]+.
B. 6-Бром-1,4-диметилиндолин-2,3-дион и 4-бром-1,6-диметилиндолин-2,3-дион. Раствор 1,4-диазабицикло[2,2,2]октана (DABCO) (1,912 г, 17,05 ммоль) в хлороформе (5 мл) охлаждали до 0°C в атмосфере азота и добавляли по каплям оксалилхлорид (1,492 мл, 17,05 ммоль) с получением бледно-желтого твердого вещества. К этому твердому веществу медленно добавляли 3-бром-N,N,5-триметиланилин (0,73 г, 3,41 ммоль) в хлороформе (3 мл) при 0°C. Реакционная смесь из желтой суспензии становилась коричневой суспензией. Реакционную смесь затем нагревали до комнатной температуры, переносили в герметично закрываемую пробирку и нагревали до 90°C в течение 3 часов. Реакционную смесь нейтрализовали при помощи 10% раствора гидроксида натрия до pH 8-9. Водный слой экстрагировали этилацетатом (3×100 мл), промывали насыщенным раствором хлорида аммония и насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали с получением смеси региоизомеров в виде красно-коричневого твердого вещества. Региоизомеры разделяли при помощи колоночной хроматографии (элюируя при помощи 0-100% этилацетата в гексане). Менее полярное соединение идентифицировали как 6-бром-1,4-диметилиндолин-2,3-дион (0,34 г, 39,2%). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,27 (с, 1H), 7,21 (с, 1H), 3,12 (с, 3H), 2,44 (с, 3H). MS (ESI) m/z 256,1 [M+2]+.
Региохимию подтверждали при помощи NOE (NOE-ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 2,44 (испускаемый пик подавлял один основной пик при 7,21 м.д.). Наиболее полярное соединение было идентифицировано как 4-бром-1,6-диметилиндолин-2,3-дион, и его дополнительно очищали путем растирания в порошок с метанолом (0,146 г, 17%). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,16 (с, 1H), 7,02 (с, 1H), 3,11 (с, 3H), 2,38 (с, 3H). MS (ESI) m/z 256,1 [M+2]+.
Региохимию подтверждали при помощи NOE (NOE-ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 2,38 (испускаемый пик подавлял два основных пика при 7,02 и 7,16 м.д.).
ПРИМЕРЫ
Пример 1: N,5-Дифенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин
A. 2-(3-Этоксикарбонил-2-тиоуреидо)-6-бромпиридин. К раствору 2-амино-6-бромпиридина (8 г, 46,5 ммоль) в диоксане (160 мл) добавляли по каплям этоксикарбонилизотиоцианат (6,09 г, 46,5 ммоль) в атмосфере азота при комнатной температуре и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Реакцию отслеживали при помощи ТСХ (петролейный эфир:этилацетат=5:1). Когда исходное вещество было израсходовано, диоксан удаляли при пониженном давлении с получением неочищенного 2-(3-этоксикарбонил-2-тиоуреидо)-6-бромпиридина (14,81 г) в виде твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 12,16 (шир.с, 1H), 11,65 (шир.с, 1H), 8,65 (д, J=8,1 Гц, 1H), 7,84 (дд, J1=8,1, J2=12 Гц, 1H), 7,49 (д, J=7,2 Гц, 1H), 4,24 (кв., J=7,2 Гц, 2H), 1,27 (т, J=7,2 Гц, 3H); MS (ESI): m/z 303,9 [M+1]+.
B. 5-Бром-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К раствору гидроксиламингидрохлорида (16,16 г, 232,5 ммоль) и N,N-диизопропилэтиламина (23,89 мл, 139,5 ммоль) в смеси метанола и этанола (об/об, 1:1, 95 мл) добавляли 2-(3-этоксикарбонил-2-тиоуреидо)-6-бромпиридин (14,81 г, 46,5 ммоль) одной порцией при комнатной температуре. После перемешивания при комнатной температуре в течение 2 часов реакционную смесь нагревали при 60°C в течение ночи. ТСХ анализ (этилацетат:метанол=20:1) показал, что исходное вещество израсходовано. Летучие вещества удаляли при пониженном давлении и остаток обрабатывали водой. Осадок собирали фильтрованием, промывали смесью метанола и диэтилового эфира (4:1, 18,5 мл). После сушки в условиях высокого вакуума 5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амин (7,29 г, общий выход 74% для двух стадий) получали в виде не совсем белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 7,34 (м, 2H), 7,20 (м, 1H), 6,24 (шир.с, 2H); MS (ESI): m/z 213,0 [M+1]+.
C. 5-Фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Смесь 5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амина (2,5 г, 11,8 ммоль), фенилбороновой кислоты (2,88 г, 23,6 ммоль), трифенилфосфина (618 мг, 2,36 ммоль) и фосфата калия (5,00 г, 23,6 ммоль) в 1,2-диметоксиэтане (35 мл) дегазировали и добавляли ацетат палладия (0,5 г, 1,77 ммоль) в атмосфере азота. Реакционную смесь нагревали при кипячении с обратным холодильником в атмосфере азота в течение ночи. После охлаждения до комнатной температуры реакционную смесь распределяли между этилацетатом (50 мл) и водой (50 мл) и водный слой экстрагировали этилацетатом (30 мл ×3). Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали. Остаток очищали на колонке с силикагелем (элюируя при помощи 15-25% этилацетата в петролейном эфире) с получением 5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (1,7 г, 68,5% выход) в виде твердого вещества. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,92 (м, 2H), 7,59-7,34 (м, 5H), 7,40 (д, J=7,2, 1H); MS (ESI): m/z 211,0 [M+1]+.
D. N,5-Дифенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Смесь 5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (200 мг, 0,94 ммоль), фенилбромида (163 мг, 1,03 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (54 мг, 0,094 ммоль) и карбоната цезия (430 мг, 1,32 ммоль) в диоксане (8 мл) дегазировали и добавляли трис(дибензилиденацетон)дипалладий (0) (43 мг, 0,047 ммоль) в атмосфере азота. Реакционную смесь нагревали при 120°C при перемешивании в течение ночи. Реакцию гасили путем добавления воды и смесь экстрагировали этилацетатом (25 мл ×3). Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, концентрировали. Остаток очищали при помощи препаративной ТСХ (элюируя при помощи 25% этилацетата в петролейном эфире) с получением N,5-дифенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (130 мг, 48% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,62 (с, 1H), 8,04 (д, J=8,4 Гц, 2H), 7,68-7,51 (м, 6H), 7,22 (т, J=7,6 Гц, 2H), 7,18 (д, J=8,4 Гц, 1H), 6,83 (т, J=7,6 Гц, 1H); MS (ESI): m/z 286,9 [M+1]+.
Иодиды или хлориды можно использовать вместо бромидов для этой реакции сочетания.
Пример 2: N-(4-Морфолинофенил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин
A. N-(4-Морфолинофенил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. После того, как смесь 5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (100 мг, 0,47 ммоль), 4-(4-бром-фенил)морфолина (137 мг, 0,57 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (27 мг, 0,047 ммоль) и трет-бутоксида калия (105 мг, 0,94 ммоль) в диоксане (6 мл) дегазировали, добавляли трис(дибензилиденацетон)дипалладий (0) (21,6 мг, 0,024 ммоль) в атмосфере азота и реакционную смесь нагревали при 80°C при перемешивании в атмосфере азота в течение ночи. Реакцию гасили путем добавления воды и смесь экстрагировали этилацетатом (15 мл ×3). Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали. Остаток очищали при помощи препаративной ТСХ (элюируя при помощи 25% этилацетата в петролейном эфире) с получением N-(4-морфолинофенил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина в форме свободного основания, которое преобразовывали в соответствующую гидрохлоридную соль с использованием метанольного раствора гидрохлорида (28 мг, 15,8% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,91 (шир.с, 1H), 8,02 (д, J=8,0 Гц, 2H), 7,75-7,52 (м, 9H), 7,20 (д, J=6,8 Гц, 1H), 3,97 (с, 4H), 3,45 (с, 4H); MS (ESI): m/z 372,2 [M+1]+.
Пример 3: 5-(Фуран-3-ил)-N-фенил-[1,2,4]триазоло[1,5-a] пиридин-2-амин
Пример 4: 5-(2-Фторфенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин
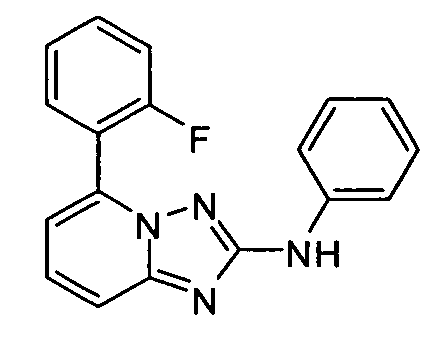
A. 5-(2-Фторфенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. 5-(2-Фторфенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин получали из 5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амина и 2-фторфенилбороновой кислоты, следуя процедуре, описанной для синтеза 5-(фуран-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина. Дегазированную смесь 5-(2-фторфенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (73 мг, 0,3 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (37 мг, 0,064 ммоль), трис(дибензилиденацетон)дипалладия(0) (29 мг, 0,032 ммоль), бромбензола (47 мг, 0,3 ммоль) и трет-бутоксид калия (72 мг, 0,64 ммоль) в диоксане (5 мл) нагревали при 120°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры добавляли этилацетат (30 мл) и воду (30 мл). Органический слой отделяли и затем водную фазу экстрагировали этилацетатом (30 мл ×3). Объединенный органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат упаривали при пониженном давлении. Остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (40-70% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 мин) с получением 5-(2-фторфенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина в форме соли трифторуксусной кислоты, которую преобразовывали в соответствующую гидрохлоридную соль с использованием метанольного раствора гидрохлорида (23 мг, 24% выход). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,10 (т, J=8,0 Гц, 1H), 7,81 (м, 2H), 7,71 (м, 1H), 7,58 (м, 1H), 7,50 (м, 2H), 7,42 (м, 2H), 7,32 (м, 2H), 7,07 (м, 1H); MS (ESI): m/z 305,1 [M+1]+.
Пример 5: N-(5-Метоксипиридин-3-ил)-5-фенил-[1,2,4]триазоло[1,5-α] пиридин-2-амин
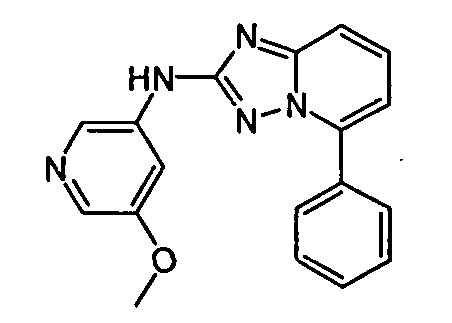
A. N-(5-Метоксипиридин-3-ил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Смесь 5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (303 мг, 1,44 ммоль), 3-бром-5-метокси-пиридина (245 мг, 1,31 ммоль), (R)-(+)-2,2'-бис(дифенилфосфино) 1,1'-бинафтила (162 мг, 0,26 ммоль) и трет-бутоксида натрия (252 мг, 2,88 ммоль) в толуоле (10 мл) дегазировали и добавляли трис(дибензилиденацетон)дипалладий(0) (119 мг, 0,13 ммоль). Реакционную смесь нагревали при 80°C в атмосфере азота при перемешивании в течение ночи. Толуол удаляли при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 5-30% этилацетата в петролейном эфире) с получением неочищенного продукта, который перекристаллизовывали из метанола с получением N-(5-метоксипиридин-3-ил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (170 мг, 41,0% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,94 (с, 1H), 8,30 (д, J=2,0 Гц, 1H), 8,01 (д, J=2,0 Гц, 2H), 7,94 (с, 1H), 7,78 (д, J=2,4 Гц, 1H), 7,65 (м, 1H), 7,61 (с, 1H), 7,55 (м, 3H), 7,28 (д, 1H), 3,76 (с, 3H); MS (ESI): m/z 318,1 [M+1]+.
Пример 6: N 2 -(2-Аминоэтил)-N 4 -(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)пиридин-2,4-диамин
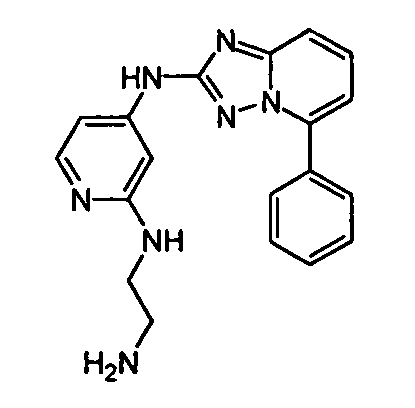
A. N-(2-Хлорпиридин-4-ил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Дегазированную смесь 5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (420 мг, 2,0 ммоль), 2-хлор-4-иод-пиридина (478 мг, 2,0 ммоль), трис(дибензилиденацетон)дипалладия(0)(180 мг, 0,2 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (230 мг, 0,4 ммоль) и карбоната цезия (1,3 г, 4,0 ммоль) в диоксане (5 мл) нагревали при 80°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры реакционную смесь фильтровали и фильтрат концентрировали в вакууме. Неочищенный продукт промывали водой (10 мл) и метанолом (20 мл) и сушили в вакууме с получением N-(2-хлорпиридин-4-ил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (502 мг, 78% выход) в виде твердого вещества, которое использовали без дополнительной очистки. MS (ESI): m/z 321,9 [M+H]+.
B. N2-(2-аминоэтил)-N4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)пиридин-2,4-диамин. Смесь N-(2-хлорпиридин-4-ил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (160 мг, 0,5 ммоль), этан-1,2-диамина (5 мл) и иодида меди (I) (10 мг, 0,05 ммоль) в герметично закрытой пробирке подвергали облучению в микроволновой печи (150 Вт) при 150°C в атмосфере азота в течение 45 минут. Добавляли воду и смесь экстрагировали дихлорметаном. Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали при пониженном давлении. Неочищенный продукт очищали при помощи обращенно-фазовой препаративной ВЭЖХ (24-54%: ацетонитрил + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 20 мин) с получением N2-(2-аминоэтил)-N4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)пиридин-2,4-диамина в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль, используя метанольный раствор гидрохлорида, (35 мг, 20% выход), в виде твердого вещества. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,92 (м, 2H), 7,71 (м, 2H), 7,59 (м, 1H), 7,51 (м, 4H), 7,21 (дд, J1=M Гц, J2=7,6 Гц, 1H), 6,9 (д, J=1,2 Гц, 1H), 3,55 (т, J=6,0 Гц, 2H), 3,02 (т, J=6,0, 2H); MS (ESI): m/z 346,1 [M+1].
Пример 7: 3-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)фенол
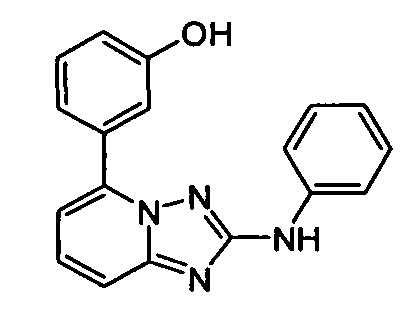
A. 5-Бром-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин. К раствору 5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амина (2 г, 9,39 ммоль) в 100 мл диоксана добавляли иодбензол (3,83 г, 18,78 ммоль), трет-бутоксид натрия (1,804 г, 18,78 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (1,086 г, 1,878 ммоль) и трис(дибензилиденацетон)палладий (0,903 г, 0,986 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь нагревали при 100°C в течение 2 часов. После завершения реакции, как показал анализ ЖХ/МС, реакционную смесь выливали в воду/насыщенный солевой раствор и экстрагировали этилацетатом несколько раз. Объединенные органические слои сушили над безводным сульфатом магния и концентрировали. Неочищенную смесь очищали колоночной хроматографией на силикагеле (элюируя при помощи 0-80% этилацетата в гексане) с получением указанного в заголовке соединения в виде коричневого твердого вещества (1,3 г, 48% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,84 (с, 1H), 7,74-7,71 (м, 2H), 7,62-7,60 (м, 1H), 7,52-7,48 (м, 1H), 7,40-7,38 (м, 1H), 7,32-7,28 (м, 2H), 6,92-6,88 (м, 1H); MS (ESI) m/z 290,13 [M+1]+.
B. 3-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)фенол. Дегазированный раствор 5-бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (60 мг, 0,286 ммоль), 3-гидрокси-фенилбороновой кислоты (43 мг, 0,312 ммоль), 1-1'-бис(дифенилфосфино)ферроценпалладийдихлорида (15 мг, 0,020 ммоль) и водного раствора карбоната натрия (2 M, 1 мл) в диоксане (3 мл) нагревали при кипячении с обратным холодильником в течение 2 часов в атмосфере азота. Реакционную смесь фильтровали и фильтрат распределяли между этилацетатом и водой. Водный слой экстрагировали этилацетатом. Органические слои объединяли, сушили при помощи сульфата натрия и упаривали в вакууме. Остаток очищали при помощи препаративной ТСХ (элюируя при помощи 15-20% этилацетата в петролейном эфире) с получением 3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)фенола (45 мг, 52% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,81 (шир.с, 1H), 9,62 (шир.с, 1H), 7,68-7,56 (м, 4H), 7,42-7,35 (м, 3H), 7,24 (т, J=8,0 Гц, 2H), 7,11 (д, J=6,8 Гц, 1H), 6,93 (м, 1H), 6,83 (м, 1H); MS (ESI): m/z 303,0 [M+1]+.
Пример 8: 5-(1Н-Индазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин
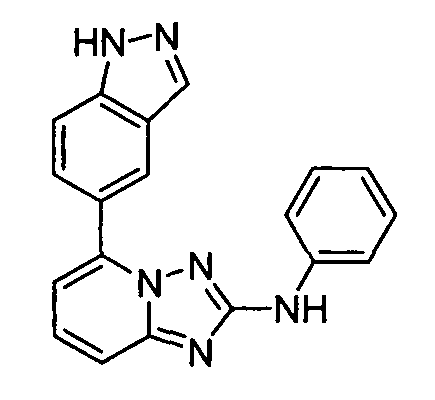
A. 5-(1H-индазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Смесь 5-бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (180 мг, 0,625 ммоль), трет-бутил 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индазол-1-карбоксилата (258 мг, 0,72 ммоль), тетракис(трифенилфосфин)палладия(0) (72 мг, 0,06 ммоль) и водного раствора фосфата калия (2 M, 0,625 мл, 1,3 ммоль) в диметилсульфоксиде (5 мл) в пробирке нагревали при 85°C при перемешивании в атмосфере азота в течение ночи. Добавляли насыщенный водный раствор хлорида натрия и осажденное вещество собирали фильтрованием. Бледно-желтое твердое вещество растворяли в этилацетате (5 мл) и добавляли по каплям метанольный раствор гидрохлорида (2 M, 2 мл). Смесь концентрировали в вакууме и остаток промывали этилацетатом с получением 5-(1H-индазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (82 мг, 41% выход) в виде гидрохлоридной соли. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,65 (шир.с, 1H), 8,49 (с, 1H), 8,23 (с, 1H), 7,98 (д, J=8,8 Гц, 1H), 7,68 (м, 4H), 7,56 (д, J=8,8 Гц, 1H), 7,22 (м, 3H), 6,83 (т, J=7,2 Гц, 1H); MS (ESI): m/z 327,1 [M+1]+.
Альтернативно, эту реакцию можно осуществить в N,N-диметилформамиде в качестве растворителя и при температуре 100°C.
Пример 9: 5-(2-((Метиламино)метил)-1H-бензо[d]имидазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин
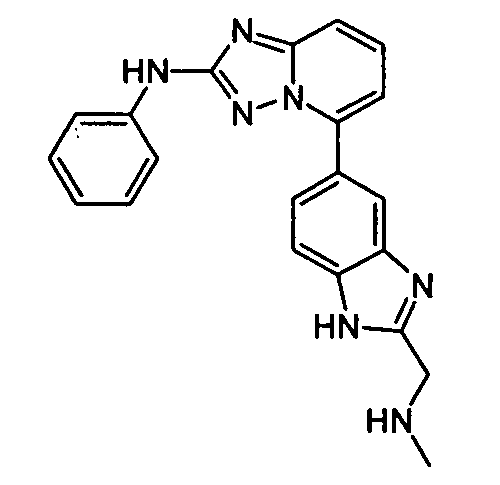
A. 5-(4-Амино-3-нитрофенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Дегазированную смесь 2-нитро-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (0,5 г мг, 1,89 ммоль), 5-бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,54 г, 1,89 ммоль), карбоната натрия (0,4 г, 3,78 ммоль) и тетракис(трифенил-фосфин)палладия(0) (50 мг, 0,043 ммоль) в 1,2-диметоксиэтане и воде (об/об, 3:1, 12 мл) нагревали до 85°C в течение ночи. Реакционную смесь экстрагировали этилацетатом и органический слой упаривали. Неочищенный продукт очищали на колонке с силикагелем (элюируя при помощи 15% этилацетата в петролейном эфире) с получением 5-(4-амино-3-нитрофенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,39 г, 60% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,63 (шир.с, 1H), 9,23 (шир.с, 1H), 8,08-8,06 (дд, J1=9,2 Гц, J2=2,4 Гц, 1H), 7,82 (с, 2H), 7,73 (д, J=7,6 Гц, 2H), 7,63 (д, J=8,8 Гц, 1H), 7,51 (д, J=8,8 Гц, 1H), 7,29-7,23 (м, 3H), 7,18 (д, J=8,8 Гц, 1H), 6,85 (т, J=7,2 Гц, 1H); MS (ESI): m/z 347,0 [M+1]+.
B. 4-(2-Фениламино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-бензол-1,2-диамин. Смесь 5-(4-амино-3-нитрофенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,59 г, 1,72 ммоль), цинковой пыли (1,12 г, 17,2 ммоль) и хлорида аммония (0,92 г, 17,2 ммоль) в смеси тетрагидрофурана и метанола (1:1, 30 мл) перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток распределяли между водой и этилацетатом и водный раствор экстрагировали этилацетатом три раза. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме с получением 4-(2-фениламино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-бензол-1,2-диамина (0,36 г, 61% выход) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,54 (шир.с, 1H), 7,70 (м, 2H), 7,55 (м, 1H), 7,39 (м, 1H), 7,25-7,21 (м, 4H), 6,95 (д, J=7,2 Гц, 1H), 6,84 (м, 1H), 6,63 (д, J=6,8 Гц, 1H), 4,99 (шир.с, 2H), 4,63 (шир.с, 2H); MS (ESI): m/z 317,0 [M+1]+.
C. 5-(2-(Хлорметил)-1H-бензо[d]имидазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Смесь 4-(2-фениламино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-бензол-1,2-диамина (0,34 г, 1,1 ммоль) и гидрохлорида этил 2-хлорацетимидата (0,17 г, 1,1 моль) в безводном этаноле (50 мл) перемешивали при комнатной температуре в течение 4 часов. Растворитель удаляли при пониженном давлении и остаток выливали в воду. Водный слой экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия, фильтровали и фильтрат концентрировали в вакууме с получением 5-(2-(хлорметил)-1H-бензо[d]имидазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,34 г, 84% выход). 1H ЯМР (400 МГц, δ (м.д.) 13,03 (шир.с, 1H), 9,61 (шир.с, 1H), 8,33-8,25 (м, 1H), 7,88-7,51 (м, 6H), 7,39-7,21 (м, 3H), 6,64 (д, J=7,6 Гц, 1H), 4,97 (с, 2H); MS (ESI): m/z 375,0 [M+1]+.
D. 5-(2-((Метиламино)метил)-1H-бензо[d]имидазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Смесь 5-(2-(хлорметил)-1H-бензо[ύ(]имидазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,18 г, 0,4 ммоль) и водного раствора метиламина(0,24 г, 2,0 ммоль) в ацетонитриле (25 мл) перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении с получением неочищенного продукта, который очищали при помощи обращенно-фазовой препаративной ВЭЖХ (20-54% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 мин), с получением 5-(2-((метиламино)метил)-1H-бензо[fif]имидазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль с использованием метанольного раствора гидрохлорида (0,65 г, 37% выход). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,53 (с, 1H), 8,21-8,13 (м, 2H), 8,03 (д, J=8,4 Гц, 1H), 7,85 (д, J=8,4 Гц, 1H), 7,78 (д, J=7,6 Гц, 1H), 7,57 (д, J=7,6 Гц, 2H), 7,40 (т, J=8,0 Гц, 2H), 7,14 (т, J=7,6 Гц, 1H), 4,69 (с, 2H), 2,97 (с, 3H); MS (ESI): m/z 370,1 [M+1]+.
Пример 10: 7-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)изохинолин-1-амин
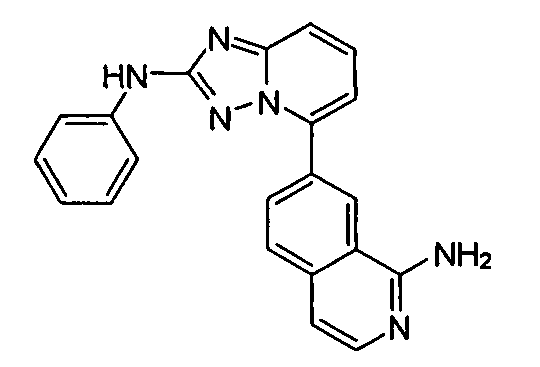
A. 5-(1-Хлоризохинолин-7-ил)-N-фенил-[1,2,4]триазоло[1,5-α] пиридин-2-амин. Дегазированную смесь 1-хлоризохинолин-7-илбороновой кислоты (288 мг, 1,38 ммоль), 5-бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (400 мг, 1,38 ммоль), фосфата калия (296 мг, 2,76 ммоль) и тетракис(трифенилфосфин)палладия(0)(160 мг, 0,138 ммоль) в диметилсульфоксиде (10 мл) нагревали при 90°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры реакционную смесь фильтровали и фильтрат концентрировали в вакууме с получением неочищенного продукта, который промывали этилацетатом с получением 5-(1-хлоризохинолин-7-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (200 мг, 38,7% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,68 (шир.с, 1H), 9,23 (с, 1H), 8,45 (д, J=8,4 Гц, 1H), 8,41 (д, J=5,2 Гц, 1H), 8,27 (д, J=8,8 Гц, 1H), 8,01 (д, J=5,6 Гц, 1H), 7,69 (м, 4H)3 7,44 (д, J=6,0 Гц, 1H), 7,23 (т, J=7,6 Гц, 2H), 6,85 (т, J=7,2 Гц, 1H); MS (ESI) m/z: 372,1 [M+1]+.
B. N-(4-Метоксибензил)-7-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)изохинолин-1-амин. Смесь 5-(1-хлоризохинолин-7-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (200 мг, 0,54 ммоль) и (4-метоксифенил)-метанамина (20 мл) нагревали при 180°C в течение 6 часов. Затем реакционную смесь концентрировали в вакууме с получением неочищенного продукта, который очищали при помощи обращенно-фазовой препаративной ВЭЖХ (34-54%: ацетонитрил + 0,1% трифторуксусной кислоты в воде, в течение 15 мин) с получением N-(4-метоксибензил)-7-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)изохинолин-1-амина в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль с использованием метанольного раствора гидрохлорида (120 мг, 47% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,67 (шир.с, 1H), 9,19 (с, 1H), 8,65 (м, 1H), 8,14 (м, 1H), 7,72 (м, 5H), 7,35 (м, 4H), 7,21 (т, J=7,6 Гц, 2H), 6,89 (м, 2H), 6,83 (т, J=6,8 Гц, 1H), 4,76 (д, J=5,2 Гц, 2H), 3,70 (с, 3H); MS (ESI): m/z 473,1 [M+1]+.
C. 7-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)изохинолин-1-амин. Раствор N-(4-метоксибензил)-7-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)изохинолин-1-амина (120 мг, 0,25 ммоль) в трифторуксусной кислоте (20 мл) нагревали при кипячении с обратным холодильником в течение 6 часов. Реакционную смесь концентрировали в вакууме с получением неочищенного продукта, который очищали при помощи обращенно-фазовой препаративной ВЭЖХ (30-50%: ацетонитрил + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 12 мин) с получением 7-(2-(фениламино)-[1,2,4]триазоло[1,5-а]пиридин-5-ил)изохинолин-1-амина в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль с использованием метанольного раствора гидрохлорида (28 мг, 31,5% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,18 (шир.с, 1H), 8,67 (д, J=6,8 Гц, 1H), 8,15 (д, J=8,4 Гц, 1H), 7,96 (м, 1H), 7,71 (м, 2H), 7,58 (м, 3H), 7,36 (д, J=7,2 Гц, 1H), 7,31 (м, 2H), 7,01 (м, 1H); MS (ESI): m/z 353,1 [M+1]+.
Пример 11: 5-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензо[d]изоксазол-3-амин
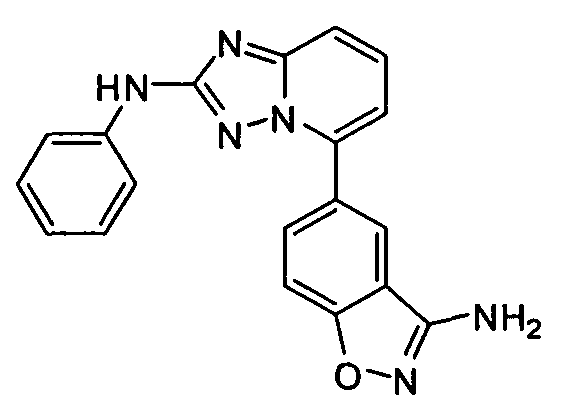
A. 2-Фтор-5-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензонитрил.
К дегазированной смеси 2-фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрила (700 мг, 2,8 ммоль), 5-бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (400 мг, 1,4 ммоль) и ацетата калия (317 мг, 9,51 ммоль) в диоксане (10 мл) добавляли 1,1'-бис(дифенилфосфино)ферроценпалладийдихлорид (104 мг, 0,14 ммоль) и полученную смесь нагревали при 100°C в атмосфере азота в течение ночи. Реакционную смесь фильтровали и фильтрат упаривали при пониженном давлении. Остаток промывали этилацетатом с получением 2-фтор-5-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензонитрила (300 мг, 65% выход) в виде твердого вещества. 1H ЯМР (400 МГц, δ (м.д.) 9,70 (с, 1H), 8,34 (д, J=1,2 Гц, 1H), 8,16 (м, 2H), 7,69 (м, 3H), 7,37 (т, J=4,4 Гц, 1H), 7,25 (м, 2H), 6,86 (м, 1H); MS (ESI): m/z 330,0 [M+1]+.
B. 5-(2-(Фениламино[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-(пропан-2-илиденаминоокси)бензонитрил. Пропан-2-он оксим (131 мг, 1,8 ммоль) добавляли к раствору трет-бутоксида калия (202 мг, 1,8 ммоль) в тетрагидрофуране (15 мл) и смесь перемешивали в течение 1 часа при комнатной температуре. Добавляли 2-фтор-5-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензонитрил (300 мг, 0,9 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Смесь экстрагировали этилацетатом и объединенный органический слой сушили над сульфатом натрия и фильтровали. Фильтрат упаривали при пониженном давлении и остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (30-60%: ацетонитрил + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 25 мин) с получением 5-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-(пропан-2-илиденаминоокси)-бензонитрила в форме соли трифторуксусной кислоты (150 мг, 43,7% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,52 (с, 1H), 8,19 (с, 1H), 7,81 (д, J=8,0 Гц, 1H), 7,56 (д, J=8,4 Гц, 1H), 7,51 (м, 4H), 7,12 (дд, J1=6,4 Гц, J2=2,0 Гц, 1H), 7,05 (т, J=8,0 Гц, 2H), 6,68 (т, J=7,2 Гц, 1H), 1,98 (с, 3H), 1,80 (с, 3H); MS (ESI): m/z 383,0 [M+1]+.
C. 5-(2-(Фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)бензо[d]изоксазол-3-амин. Раствор 5-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-(пропан-2-илиденаминоокси)бензонитрила (150 мг, 0,39 ммоль) в трифторуксусной кислоте и 5 н хлористоводородной кислоте (4:1, 50 мл) перемешивали при комнатной температуре в атмосфере азота в течение ночи. Растворитель концентрировали в вакууме с получением неочищенного продукта, который очищали при помощи обращенно-фазовой препаративной ВЭЖХ (27-57%: ацетонитрил + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 мин), с получением 5-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензо[d]изоксазол-3-амина в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль, (67 мг, 47,0% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,67 (с, 1H), 8,18 (с, 1H), 8,00 (д, J=8,0 Гц, 1H), 7,89 (д, J=8,4 Гц, 1H), 7,65 (м, 4H), 7,31 (д, J=7,2 Гц, 1H), 7,24 (т, J=8,0 Гц, 2H), 6,86 (т, J=7,6 Гц, 1H); MS (ESI): m/z 343,0 [M+1]+.
Пример 12: 4-(5-(3-Гидроксифенил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензамид
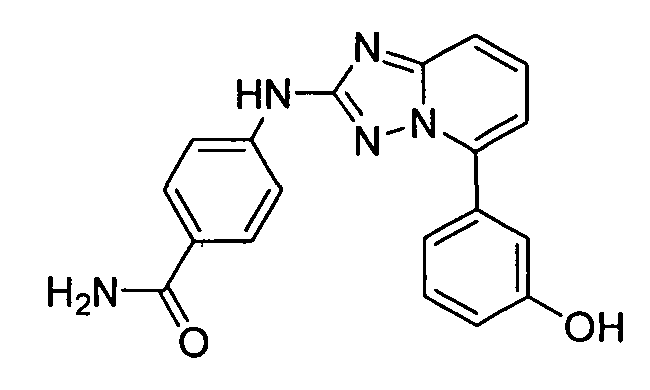
A. 4-(5-Бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензонитрил. К оранжевому раствору 5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амина (2,00 г, 9,39 ммоль) в диоксане (100 мл) добавляли 4-иодбензонитрил (4,30 г, 18,78 ммоль), карбонат цезия (6,12 г, 18,78 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (1,086 г, 1,878 ммоль) и трис(дибензилиденацетон)палладий (0,903 г, 0,986 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь нагревали при 100°C в течение 18 часов в атмосфере азота. После завершения реакции, как показал анализ ЖХ/МС, реакционную смесь выливали в воду/насыщенный солевой раствор и экстрагировали этилацетатом несколько раз. Объединенные органические слои сушили над безводным сульфатом магния и концентрировали. Неочищенную смесь растирали в порошок этилацетатом с получением указанного в заголовке соединения в виде коричневато-желтого твердого вещества (0,565 г, 20% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,55 (с, 1H), 7,89-7,87 (м, 2H), 7,77-7,75 (м, 2H), 7,71-7,69 (м, 1H), 7,58-7,54 (м, 1H), 7,49-7,46 (м, 1H); MS (ESI) m/z 315,14[M+1]+.
B. 4-(5-Бром-[1,2,4]триазол[1,5-α]пиридин-2-иламино)бензамид. Бледно-желтый раствор 4-(5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензонитрила (0,909 г, 2,89 ммоль) в 85% фосфорной кислоте (15 мл) нагревали при 100°C в течение 2 часов. После завершения реакции, как показал анализ ЖХ/МС, реакционную смесь выливали в минимальное количество воды и нейтрализовали 1 н раствором гидроксида натрия (pH 6-7). Смесь экстрагировали при помощи 20% изопропанола в хлороформе несколько раз. Объединенные органические слои сушили над безводным сульфатом магния и концентрировали. Неочищенную смесь очищали при помощи хроматографии на силикагеле с использованием градиента 0-8% насыщенного метанольного раствора аммиака в хлороформе с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (0,677 г, 71% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,20 (с, 1H), 7,84 (д, 2H, J=8 Гц), 7,78-7,75 (м, 3H), 7,66 (д, 1H, J=8 Гц), 7,53 (т, 1H, J=8 Гц), 7,45-7,42 (м, 1H), 7,16 (шир.с, 1H); MS (ESI) m/z 332,16 и 334,16 [M]+ и [M+2]+.
C. 4-(5-(3-Гидроксифенил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензамид.
К бесцветному раствору 4-(5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензамида (0,150 г, 0,452 ммоль) в диоксане (10 мл) добавляли 3-оксифенилбороновую кислоту (0,069 г, 0,497 ммоль), карбонат натрия (0,020 г, 0,189 ммоль), растворенный в минимальном количестве воды, и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (0,026 г, 0,032 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь нагревали при 100°C в течение 18 часов в атмосфере азота. После завершения реакции, как показал анализ ЖХ/МС, реакционную смесь выливали в воду/насыщенный солевой раствор и экстрагировали этилацетатом несколько раз. Объединенные органические слои сушили над безводным сульфатом магния и концентрировали. Неочищенную смесь очищали при помощи хроматографии на силикагеле с использованием градиента 0-15% насыщенного метанольного раствора аммиака в хлороформе с получением бледно-желтого твердого вещества. Это твердое вещество промывали метанолом и фильтрат концентрировали с получением чистого указанного в заголовке соединения в виде коричневатого твердого вещества (92,1% чистоты, 0,036 г, 23% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,01 (с, 1H), 9,78 (с, 1H), 7,82-7,76 (м, 3H), 7,74-7,71 (м, 2H), 7,69-7,61 (м, 2H), 7,43-7,37 (м, 3H), 7,17 (д, 1H, J=8 Гц), 7,12 (шир.с, 1H), 6,97-6,95 (м, 1H); MS (ESI) m/z 346,35[M+1]+.
Пример 13: N 5 -Изопропил-N 2 -фенил-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамин
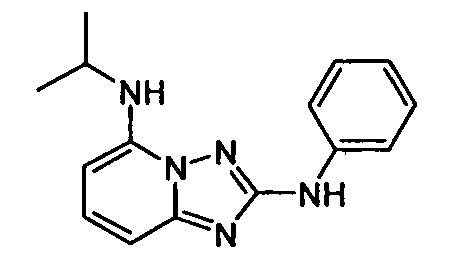
A. N5-Изопропил-N2-фенил-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамин. Смесь 5-бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (60 мг, 0,286 ммоль) и изопропиламина (5 мл) в герметично закрытом сосуде нагревали при 120°C в течение ночи. Растворитель удаляли при пониженном давлении и неочищенный продукт очищали при помощи препаративной ТСХ (элюируя при помощи 15-20% этилацетата в петролейном эфире) с получением N5-изопропил-N2-фенил-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамина (20 мг, 35,9%) в виде твердого вещества. 1H ЯМР (300 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,63 (м, 2H), 7,46 (м, 1H), 7,32-7,27 (м, 2H), 6,95 (м, 1H), 6,71 (м, 1H), 6,15 (д, J=7,8 Гц, 1H), 3,86 (м, 1H), 1,38 (д, J=6,6 Гц, 6H); MS (ESI): m/z 268,2 [M+1]+.
Пример 14: цис-4-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанол
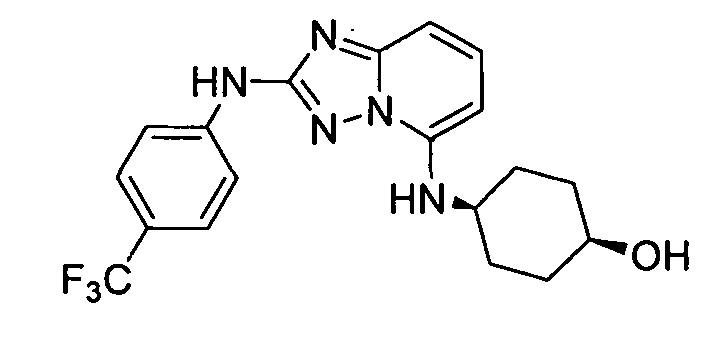
A. 5-Бром-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К оранжевому раствору 5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амина (1,00 г, 4,69 ммоль) в диоксане (40 мл) добавляли 1-иод-4-(трифторметил)бензол (2,55 г, 1,3 мл, 9,39 ммоль), трет-бутоксид натрия (0,902 г, 9,39 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0,543 г, 0,939 ммоль) и трис(дибензилиденацетон)дипалладий(0) (0,451 г, 0,492 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь нагревали при 100°C в течение 1 часа в атмосфере азота. Когда реакция завершалась, как показал анализ ЖХ/МС, реакционную смесь выливали в воду/насыщенный солевой раствор и экстрагировали этилацетатом несколько раз. Объединенный органический слой сушили над безводным сульфатом магния и концентрировали. Неочищенную смесь очищали колоночной хроматографией на силикагеле (элюируя при помощи 0-50% этилацетата в гексане) с получением 5-бром-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина в виде желтовато-коричневого твердого вещества (0,306 г, 18% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,39 (с, 1H), 7,87-7,93 (м, 2H), 7,64-7,72 (м, 3H), 7,52-7,58 (м, 1H), 7,44-7,49 (м, 1H); MS (ESI) m/z 358,13 [M+1]+.
B. цис-4-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанол. К оранжевому раствору 5-бром-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,300 г, 0,840 ммоль) в диоксане (15 мл) добавляли цис-4-аминоциклогексанолгидрохлорид (0,255 г, 1,680 ммоль), трет-бутоксид натрия (0,242 г, 2,52 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0,097 г, 0,168 ммоль) и трис(дибензилиденацетон)дипалладий(0) (0,081 г, 0,088 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь нагревали при 100°C в течение 1 часа в атмосфере азота. Когда реакция завершалась, как показал анализ ЖХ/МС, реакционную смесь выливали в воду/насыщенный солевой раствор и экстрагировали этилацетатом несколько раз. Объединенный органический слой сушили над безводным сульфатом магния и концентрировали. Неочищенную смесь очищали колоночной хроматографией на силикагеле (элюируя при помощи 0-100% этилацетата в гексане) с получением указанного в заголовке соединения в виде коричневато-желтого твердого вещества (100% чистоты, 0,078 г, 24% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,03 (с, 1H), 7,90-7,98 (м, 2H), 7,58-7,66 (м, 2H), 7,44 (т, J=8,27 Гц, 1H), 6,77 (дд, J=1,00, 8,57 Гц, 1H), 6,19-6,26 (м, 2H), 4,51 (д, J=3,17 Гц, 1H), 3,80 (д, J=2,54 Гц, 1H), 3,55-3,66 (м, 1H), 1,83-1,96 (м, 2H), 1,56-1,78 (м, 6H); MS (ESI) m/z 392,39[M+1]+.
Пример 15: (S)-4-(5-(Пиперидин-3-иламино)-[1,2,4]триазоло[1,5-α] пиридин-2-иламино)бензамид
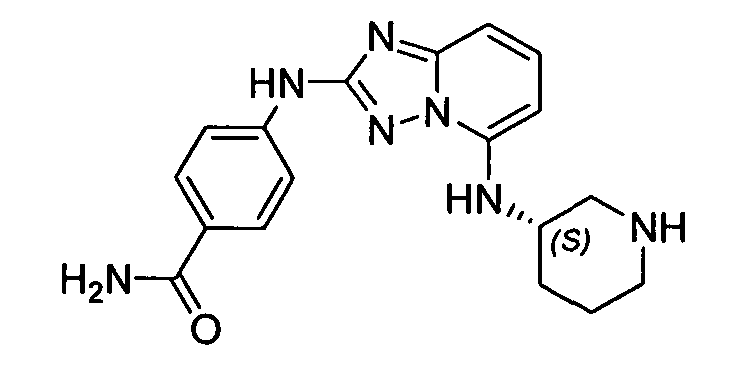
A. (S)-трет-Бутил 3-(2-(4-цианофениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)пиперидин-1-карбоксилат. К оранжевому раствору 4-(5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензонитрила (0,250 г, 0,796 ммоль) в диоксане (10 мл) добавляли (S)-трет-бутил 3-аминопиперидин-1-карбоксилат (0,319 г, 1,592 ммоль), карбонат цезия (0,519 г, 1,592 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0,092 г, 0,159 ммоль) и трис(дибензилиденацетон)палладий (0,077 г, 0,084 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь нагревали при 100°C в течение 1,5 часов в атмосфере азота. После завершения реакции, как показал анализ ЖХ/МС, реакционную смесь выливали в насыщенный солевой раствор и экстрагировали этилацетатом несколько раз. Объединенные органические слои сушили над безводным сульфатом магния и концентрировали. Неочищенную смесь очищали при помощи колоночной хроматографии (элюируя при помощи 0-80% этилацетата в гексане) с получением указанного в заголовке соединения в виде ржаво-коричневого твердого вещества (0,122 г, 35% выход). MS (ESI) m/z 434,51[M+1]+.
B. (S)-4-(5-(Пиперидин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензамид. Бледно-желтый раствор (S)-трет-бутил 3-(2-(4-цианофениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)пиперидин-1-карбоксилата (0,118 г, 0,272 ммоль) в 85% фосфорной кислоте (7 мл) нагревали при 100°C в течение 4 часов. После завершения реакции, как показал анализ ЖХ/МС, реакционную смесь пропускали через 5 г stratta колонку для удаления фосфорной кислоты с получением бледно-желтого пенистого вещества, которое очищали при помощи хроматографии на силикагеле (элюируя при помощи 0-20% насыщенного метанольного раствора аммиака в хлороформе), с получением указанного в заголовке соединения в виде белого твердого вещества (92,1% чистоты, 100% эи, 0,053 г, 55% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,88 (с, 1H), 7,80-7,85 (м, 2H), 7,73-7,79 (м, 3H), 7,44 (т, J=8,27 Гц, 1H), 7,12 (шир.с, 1H), 6,78 (дд, J=0,63, 8,49 Гц, 1H), 6,45 (д, J=8,78 Гц, 1H), 6,21 (д, J=7,71 Гц, 1H), 3,65-3,73 (м, 1H), 3,03 (д, J=14,40 Гц, 1H), 2,71-2,79 (м, 2H), 2,62-2,70 (м, 1H), 1,80-1,89 (м, 1H), 1,70-1,80 (м, 1H), 1,59-1,68 (м, 1H), 1,42-1,53 (м, 1H); MS (ESI) m/z 352,41 [M+1]+.
Пример 16: цис-4-(5-(4-Аминоциклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензамид
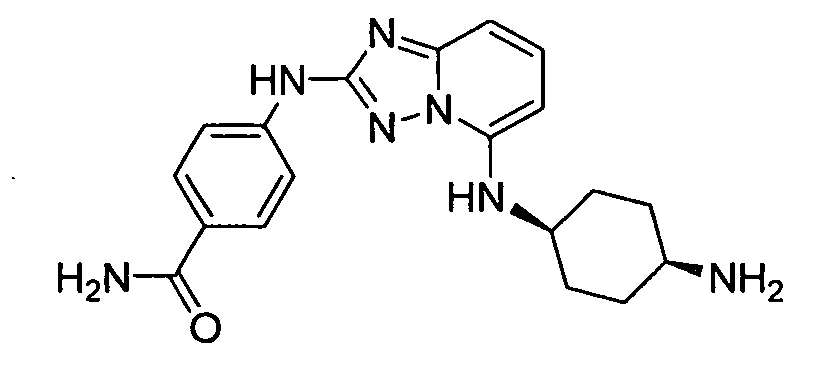
A. трет-Бутил цис-4-(2-(4-цианофениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексилкарбамат. К оранжевому раствору 4-(5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензонитрила (0,200 г, 0,637 ммоль) в диоксане (10 мл) добавляли трет-бутил цис-4-аминоциклогексилкарбамат (0,273 г, 1,273 ммоль), карбонат цезия (0,415 г, 1,273 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0,074 г, 0,127 ммоль) и трис(дибензилиденацетон)палладий (0,061 г, 0,0669 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь нагревали при 100°C в течение 1 часа в атмосфере азота. После завершения реакции, как показал анализ ЖХ/МС, реакционную смесь выливали в насыщенный солевой раствор и экстрагировали этилацетатом несколько раз. Объединенные органические слои сушили над безводным сульфатом магния и концентрировали. Неочищенную смесь очищали при помощи колоночной хроматографии (элюируя при помощи 0-80% этилацетата в гексане) с получением указанного в заголовке соединения в виде ржаво-коричневого твердого вещества (0,082 г, 29% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,22 (с, 1H), 7,89 (д, 2H, J=8 Гц), 7,73 (д, 2H, J=8 Гц), 7,46 (т, 1H, J=8 Гц), 6,81 (д, 1H, J=8 Гц), 6,25 (д, 1H, J=8 Гц), 6,02 (д, 1H, J=8 Гц), 3,71-3,64 (м, 1H), 3,56-3,34 (м, 1H), 1,90-1,73 (м, 4H), 1,66-1,61 (м, 4H), 1,40 (с, 9H); MS (ESI) m/z 448,53 [M+1]+.
B. трет-Бутил цис-4-(2-(4-карбамоилфениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексилкарбамат. К бледно-желтому раствору трет-бутил цис-4-(2-(4-цианофениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексилкарбамата (0,078 г, 0,174 ммоль) в этаноле (10 мл) (нагретый при помощи аппарата для нагревания струей теплого воздуха для получения исходного вещества в растворе) добавляли 3 н раствор карбоната натрия (4 мл) и 30% масс/масс пероксид водорода (4 мл) при комнатной температуре. Реакционную смесь перемешивали в течение ночи при комнатной температуре. После завершения реакции, как показал анализ ЖХ/МС, реакционную смесь выливали в насыщенный солевой раствор и экстрагировали этилацетатом несколько раз. Объединенный органический слой сушили над безводным сульфатом магния и концентрировали. Неочищенную смесь очищали при помощи колоночной хроматографии (элюируя при помощи 0-10% насыщенного метанольного раствора аммиака в хлороформе) с получением указанного в заголовке соединения в виде бледно-розового твердого вещества (0,066 г, 81% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,86 (с, 1H), 7,84 (д, 2H, J=8 Гц), 7,76 (д, 3H, J=8 Гц), 7,44 (т, 1H, J=8 Гц), 7,12 (с, 1H), 6,78 (д, 1H, J=8 Гц), 6,22 (д, 1H, J=8 Гц), 5,96 (д, 1H, J=8 Гц), 3,73-3,65 (м, 1H), 3,58-3,51 (м, 1H), 1,91-1,82 (м, 2H), 1,81-1,73 (м, 2H), 1,69-1,58 (м, 4H), 1,40 (с, 9H); MS (ESI) m/z 466,55 [M+1]+.
C. Цис 4-(5-(4-Аминоциклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензамид. К прозрачному оранжевому раствору трет-бутил цис-4-(2-(4-карбамоилфениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексилкарбамата (0,057 г, 0,122 ммоль) в дихлорметане (10 мл) добавляли трифторуксусную кислоту (5 мл) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение ночи. После завершения реакции, как показал анализ ЖХ/МС, реакционную смесь концентрировали и остаток очищали при помощи хроматографии на силикагеле (элюируя при помощи 0-25% насыщенного метанольного раствора аммиака в хлороформе) с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества. Это твердое вещество пропускали через stratta колонку с получением формы свободного основания желаемого продукта в виде бледно-желтого твердого вещества (98,7% чистоты, 0,026 г, 58% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,86 (с, 1H), 7,84 (д, 2H, J=8 Гц), 7,77 (д, 3H, J=8 Гц), 7,44 (т, 1H, J=8 Гц), 7,12 (с, 1H), 6,78 (д, 1H, J=8 Гц), 6,21 (д, 1H, J=8 Гц), 6,07 (д, 1H, J=8 Гц), 3,71-3,63 (м, 1H), 2,95-2,92 (м, 1H), 1,95-1,85 (м, 2H), 1,74-1,63 (м, 4H), 1,50-1,43 (м, 2H); MS (ESI) m/z 366,43 [M+1]+.
Пример 17: N 2 -фенил-N 5 -(пиридин-2-ил)-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамин
A. N2-Фенил-N5-(пиридин-2-ил)-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамин. Дегазированную смесь 5-бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (200 мг, 0,868 ммоль) и пиридин-2-амина (1,5 г, 15,96 ммоль) подвергали облучению в микроволновой печи (150 Вт) при 220°C в течение 1 часа, в атмосфере азота. Реакционную смесь разбавляли этилацетатом и промывали водой и насыщенным солевым раствором. Органическую фазу сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (30-50% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 мин) с получением N2-фенил-N5-(пиридин-2-ил)-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамина (65 мг, 31% выход) в виде масла. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,35 (д, J=6,4 Гц, 1H), 8,17 (м, 1H), 8,03 (т, J=8,4 Гц, 1H), 7,91 (д, J=8,4 Гц, 1H), 7,54 (м, 3H), 7,47 (д, J=8,4 Гц, 1H), 7,36 (м, 3H), 7,12 (т, J=7,6 Гц, 1H); MS (ESI): m/z 303,0 [M+1]+.
Другие примеры получали, следуя аналогичной процедуре, изменяя температуру и время реакции.
Пример 18: N 5 -Метил-N 2 ,N 5 -дифенил-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамин
A. N5-Метил-N2,N5-дифенил-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамин. Смесь 5-бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (150 мг, 0,521 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (60 мг, 0,104 ммоль), карбоната цезия (338 мг,1,04 ммоль), трет-бутоксида натрия (120 мг, 1,04 ммоль), метил-фениламина (111 мг, 1,04 ммоль) и трис(дибензилиденацетон)дипалладия(0) (48 мг, 0,052 ммоль) в диоксане (5 мл) нагревали при 100°C в течение 1 часа в атмосфере азота при встряхивании. Реакционную смесь выливали в воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (28-58% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 20 мин) с получением N5-Метил-N2,N5-дифенил-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамина в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль (30 мг, 18,3%) с использованием метанольного раствора гидрохлорида. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,99 (м, 1H), 7,43 (м, 2H), 7,26 (м, 2H), 7,15 (м, 5H), 7,03 (м, 3H), 3,62 (с, 3H); MS (ESI): m/z 316,0 [M+1]+.
Синтез некоторых примеров, приведенных в настоящей заявке, может потребовать удаления одной или нескольких защитных групп, таких как Boc, SEM или THP группы. Удаление защиты осуществляли с использованием стандартных процедур, таких как процедура, описанная ниже.
Пример 19: N-(Изоиндолин-5-ил)-5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин
A. N-(Изоиндолин-5-ил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. трет-Бутил 5-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)изоиндолин-2-карбоксилат получали из трет-бутил 5-бромизоиндолин-2-карбоксилата и 5-фенил-[1,2,4]триазоло[1,5-а]пиридин-2-амина, следуя процедуре, описанной для синтеза N-(4-морфолинофенил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина. Раствор трет-бутил 5-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)изоиндолин-2-карбоксилата (120 мг, 0,28 ммоль) в метанольном растворе гидрохлорида (2 M, 2 мл) перемешивали при комнатной температуре в течение 3 часов. Растворитель удаляли при пониженном давлении с получением N-(изоиндолин-5-ил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (110 мг, 100% выход) в виде гидрохлоридной соли. 1H ЯМР (300 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,24 (м, 1H), 8,03 (м, 2H), 7,80 (м, 2H), 7,77 (м, 5H), 7,64 (м, 1H), 4,60 (д, J=4,5 Гц, 4H); MS (ESI): m/z 328,1 [M+1]+.
Пример 20: 5-(3-Аминофенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин
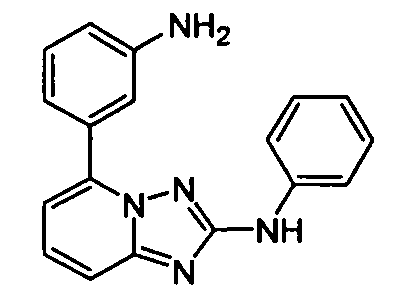
A. 5-(3-Аминофенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. 5-(3-Нитрофенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин получали из 5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амина, 3-нитро-фенилбороновой кислоты и фенилбромида в соответствии с процедурой, описанной для синтеза 5-(фуран-3-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина. Смесь 5-(3-нитрофенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (170 мг, 0,51 ммоль), цинковой пыли (338 мг, 5,1 ммоль) и хлорида аммония (270 мг, 5,1 ммоль) в смеси метанола и тетрагидрофурана (об/об, 1:1, 8 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали через целит и фильтрат концентрировали в вакууме с получением неочищенного продукта, который промывали этиловым эфиром с получением 5-(3-аминофенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (79 мг, 51% выход). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,62-7,59 (м, 3H), 7,44 (м, 1H), 7,37 (м, 1H), 7,30-7,24 (м, 4H), 7,08 (м, 1H), 6,89 (м, 2H); MS (ESI): m/z 302,1 [M+1]+.
Пример 21: 5-Циклогексил-N-фенил-[1,2,4]триазоло[1,5-α] пиридин-2-амин
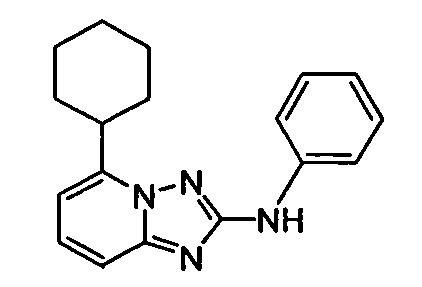
A. 5-Циклогексил-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин. 5-Циклогексенил-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин получали из 5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амина, циклогексенилбороновой кислоты и фенилбромида в соответствии с процедурой, описанной для синтеза 5-(фуран-3-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина. Смесь 5-циклогексенил-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амина (350 мг, 1,21 ммоль) и гидроксида палладия (10% масс/масс, 100 мг) гидрировали под давлением газообразного водорода 1 атмосфера в течение ночи. Катализатор отфильтровывали и фильтрат концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюируя при помощи 15-20% этилацетата в петролейном эфире) с получением 5-циклогексил-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (40 мг, 11% выход). 1H ЯМР (300 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,67 (д, J=6,9 Гц, 2H), 7,55 (м, 1H), 7,33-7,26 (м, 3H), 6,94 (т, J=7,2 Гц, 1H), 6,86 (м, 1H), 3,45 (м, 1H), 2,23 (м, 2H), 1,94-1,65 (м, 3H), 1,65-1,28 (м, 5H); MS (ESI): m/z 293,2 [M+1]+.
Другие катализаторы (такие как палладий на углероде) также можно использовать для подобного преобразования.
Пример 22: 5-(3-Амино-1Н-индазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-α] пиридин-2-амин
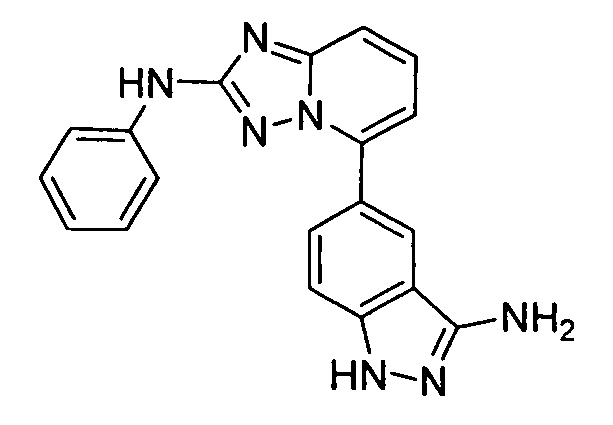
A. 5-(3-Амино-1H-индазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-α] пиридин-2-амин. 2-Фтор-5-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензонитрил получали из 5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амина, 3-циано-4-фторфенилбороновой кислоты и иодбензола, следуя процедуре, описанной для синтеза N,5-дифенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина. Суспензию 2-фтор-5-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензонитрила (0,274 г, 0,832 ммоль) в воде (1,5 мл) и гидразинмоногидрата (0,522 мл, 4,99 ммоль) нагревали до 105°C. Поскольку реакция не была полностью завершена через 3 часа, добавляли неразбавленный гидразинмоногидрат (1,5 мл) и поддерживали нагревание при 105°C в течение 3 часов. Добавляли воду (20 мл) и полученное черное твердое вещество собирали фильтрованием и промывали метанолом. Это твердое вещество очищали при помощи обращенно-фазовой полу-препаративной ВЭЖХ (20-100% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты в течение 30 минут, 4 впрыска). Желаемые фракции объединяли, нейтрализовали при помощи 1,75 M водного раствора карбоната калия. Продукт, который осаждался в виде белого твердого вещества при выпаривании ацетонитрила, собирали фильтрованием и промывали водой до достижения нейтрального pH и сушили в вакуумной печи в течение ночи. 5-(3-Амино-1H-индазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,092 г, 0,270 ммоль, 32,4% выход) собирали в виде белого твердого вещества (97,2% чисты). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,70 (шир.с, 1H), 9,62 (с, 1H), 8,44 (с, 1H), 7,91 (д, J=8,78 Гц, 1H), 7,71 (д, J=8,00 Гц, 2H), 7,65 (т, J=8,00 Гц, 1H), 7,54 (д, J=8,64 Гц, 1H), 7,40 (д, J=8,74 Гц, 1H), 7,25 (т, J=7,78 Гц, 2H), 7,13 (д, J=7,17 Гц, 1H), 6,85 (д, J=7,22 Гц, 1H), 5,61 (шир.с, 1H); MS (ESI) m/z 342 [M+1]+.
Пример 23: N-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)бензо[d]изоксазол-6-амин
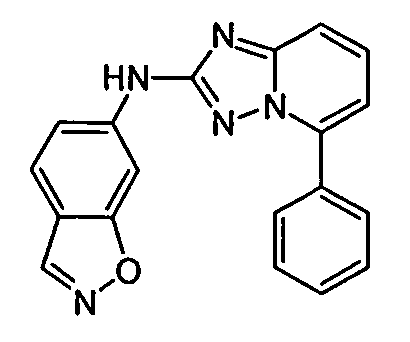
A. N-(5-Фенил-[1,2,4]триазоло[1,5-a]пиридин-2-ил)бензо[d]изоксазол-6-амин. 2-Фтор-4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензальдегид получали из 5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина и 4-бром-2-фтор-бензальдегида, следуя процедуре, описанной для синтеза N,5-дифенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина. Раствор гидрида натрия (60% в минеральном масле, 640 мг, 16 ммоль) в N,N-диметилформамиде (5 мл) добавляли по порциям к смеси гидроксиламингидрохлорида (556 мг, 8 ммоль) в N,N-диметилформамиде (5 мл) при 0°C. Через один час добавляли раствор 2-фтор-4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензальдегида (260 мг, 0,8 ммоль) в N,N-диметилформамиде (5 мл) и полученную смесь перемешивали при 80°C в течение около 20 часов. Смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта, который очищали при помощи обращенно-фазовой препаративной ВЭЖХ (20 50%: ацетонитрил + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 мин), с получением N-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)бензо[d]изоксазол-6-амина в форме соли трифторуксусной кислоты, которую преобразовывали в форму свободного основания (80 мг, 30% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,15 (шир.с, 1H), 7,98 (м, 2H), 7,65 (м, 2H), 7,59 (м, 3H), 7,41 (м, 2H), 7,59 (м, 2H); MS (ESI): m/z 328,1 [M+1]+.
Пример 24: 2-Фтор-5-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензамид
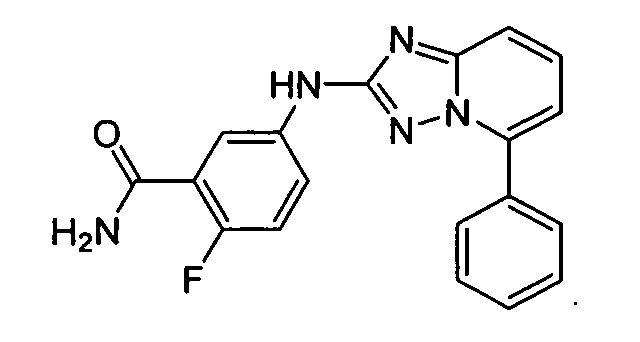
A. 2-Фтор-5-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензамид. 2-Фтор-5-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензонитрил получали из 5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина и 5-бром-2-фторбензонитрила, следуя процедуре, описанной для синтеза N,5-дифенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина. Смесь 2-фтор-5-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензонитрила (100 мг, 0,3 ммоль), водного раствора пероксида водорода (30%, 1 мл) и карбоната калия (123 мг, 0,9 ммоль) в диметилсульфоксиде (5 мл) перемешивали при комнатной температуре в течение ночи. Смесь выливали в ледяную воду и осадок собирали, промывали водой, сушили в вакууме с получением 2-фтор-5-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензамида (60 мг, 57% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,80 (шир.с, 1H), 8,05 (м, 2H), 7,60 (м, 6H), 7,19 (м, 2H); MS (ESI): m/z 348,1 [M+1]+.
Для некоторых примеров, использовали гидроксид натрия вместо карбоната калия.
Пример 25: (S)-N 2 -(3-Амино-1Н-индазол-6-ил)-N 5 -(пиперидин-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамин
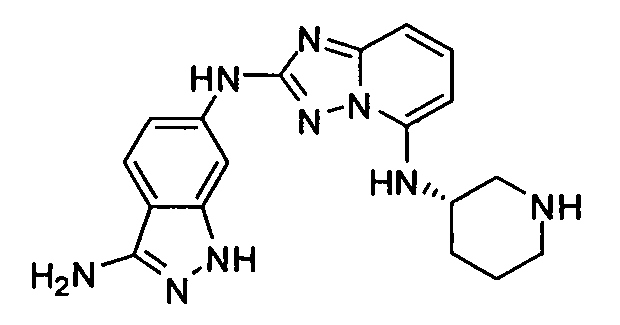
A. 4-(5-Бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-2-фторбензонитрил. Дегазированную смесь 5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амина (800 мг, 3,78 ммоль), 2-фтор-4-иодбензонитрила (1,3 г, 5,29 ммоль), трет-бутоксида натрия (720 мг, 7,56 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (432 мг, 0,756 ммоль) и трис(дибензилиденацетон)дипалладия(0) (352 мг, 0,378 ммоль) в диоксане (20 мл) нагревали при 100°C в атмосфере азота в течение 2 часов. Реакцию гасили путем добавления воды и смесь экстрагировали этилацетатом три раза. Объединенный органический слой сушили над безводным сульфатом натрия и концентрировали. Неочищенное вещество очищали на колонке с силикагелем (элюируя при помощи 0-25% этилацетата в петролейном эфире) с получением 4-(5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-2-фторбензонитрила в виде коричневого твердого вещества (600 мг, 48,4% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,83 (с, 1H), 7,94 (дд, J,=12,8 Гц, J2=1,6 Гц, 1H), 7,78 (т, J=8,0 Гц, 1H), 7,70 (д, J=8,8 Гц, 1H), 7,54 (т, J=7,6 Гц, 1H), 7,48 (т, J=6,4 Гц, 2H); MS (ESI): m/z 331,9 [M+1]+.
B. (S)-трет-Бутил 3-(2-(4-циано-3-фторфениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)пиперидин-1-карбоксилат. Дегазированную смесь 4-(5-бром-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-2-фторбензонитрила (300 мг, 0,9 ммоль), (S)-трет-бутил 3-аминопиперидин-1-карбоксилата (272 мг, 1,4 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (105 мг, 0,18 ммоль), трис(дибензилиденацетон)дипалладия(0) (83 мг, 0,09 ммоль) и карбоната цезия (590 мг, 1,8 ммоль) в диоксане (10 мл) нагревали при 100°C в атмосфере азота в течение ночи. Реакцию гасили путем добавления воды и смесь экстрагировали этилацетатом три раза. Объединенный органический слой сушили над безводным сульфатом натрия и концентрировали. Неочищенное вещество очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 0-25% этилацетата в петролейном эфире) с получением (S)-трет-бутил-3-(2-(4-циано-3-фторфениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)пиперидин-1-карбоксилата в виде твердого вещества (200 мг, 49,4% выход).
C. (S)-2-Фтор-4-(5-(пиперидин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензонитрил. Раствор (S)-трет-бутил 3-(2-(4-циано-3-фторфениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)пиперидин-1-карбоксилата (200 мг, 0,44 ммоль) в метанольном растворе гидрохлорида (15 мл, 2 M) перемешивали в течение 30 минут при комнатной температуре. Растворитель удаляли при пониженном давлении и остаток промывали этилацетатом, сушили в вакууме с получением (S)-2-фтор-4-(5-(пиперидин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензонитрила (150 мг, 96,2%) в виде гидрохлоридной соли.
D. (S)-N2-(3-Амино-1H-индазол-6-ил)-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамин. Раствор (S)-2-фтор-4-(5-(пиперидин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензонитрила (150 мг, 0,43 ммоль) и гидразингидрата (0,50 мл) в н-бутаноле (10 мл) перемешивали при 120°C в атмосфере азота в течение ночи. Растворитель концентрировали в вакууме с получением неочищенного продукта, который очищали при помощи обращенно-фазовой препаративной ВЭЖХ (7-37%: ацетонитрил + 0,1% трифторуксусной кислоты в воде, в течение 15 мин) с получением (S)-N2-(3-амино-1H-индазол-6-ил)-N5-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамина в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль с использованием метанольного раствора гидрохлорида (99,14% эи, 70 мг, 44,9% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 12,46 (с, 1H), 10,15 (с, 1H), 9,27 (м, 2H), 8,17 (с, 1H), 7,87 (д, J=8,8 Гц, 1H), 7,50 (т, J=8,0 Гц, 1H), 7,32 (д, J=2,0 Гц, 1H), 6,84 (д, J=8,8 Гц, 1H), 6,74 (д, J=8,8 Гц, 1H), 6,34 (д, J=8,0 Гц, 1H), 4,05 (м, 1H), 3,42 (м, 1H), 3,23 (м, 1H), 3,08 (м, 1H) 2,80 (м, 1H), 2,05 (м, 1H), 1,88 (м, 3H); MS (ESI): m/z 364,0 [M+1]+.
Пример 26: 5-(3-(Аминометил)фенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин
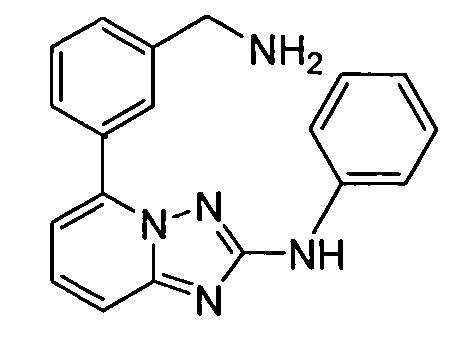
A. 5-(3-(Аминометил)фенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Смесь (3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензонитрил)а (70 мг 0,225 ммоль) и Ni Ренея (100 мг) в смеси метанола (10 мл) и водного раствора аммиака (0,5 мл) гидрировали под давлением водорода 1 атм при комнатной температуре в течение 2 часов. После того, как исходное вещество было израсходовано (реакцию отслеживали при помощи ТСХ), реакционную смесь фильтровали и фильтрат упаривали. Остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (35-65% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 мин) с получением 5-(3-(аминометил)фенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина в форме соли трифторуксусной кислоты, которую преобразовывали в соответствующую гидрохлоридную соль при помощи метанольного раствора гидрохлорида (35 мг, 49% выход). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,18 (м, 1H), 8,01 (с, 1H), 8,07 (м, 1H), 7,76-7,72 (м, 3H), 7,59-7,55 (м, 3H), 7,36-7,32 (м, 2H), 7,08 (м, 1H), 4,27 (с, 2H); MS (ESI): m/z 316,1 [M+H]+.
Пример 27: N-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)ацетамид
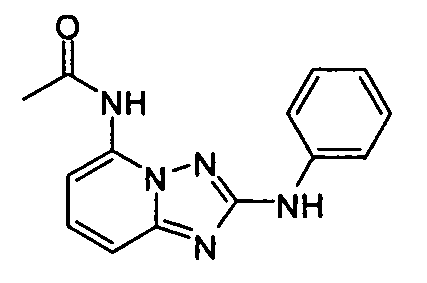
A. N-(6-Аминопиридин-2-ил)ацетамид. К смеси пиридин-2,6-диамина (1,5 г, 13,7 ммоль) и триэтиламина (1,4 г, 13,8 ммоль) в дихлорметане (30 мл) добавляли по каплям ацетилхлорид (1,39 г, 13,7 ммоль) при комнатной температуре. По завершении добавления реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь промывали водой, сушили над сульфатом натрия и упаривали с получением N-(6-аминопиридин-2-ил)ацетамида (0,95 г, 46% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,84 (с, 1H), 7,31 (т, J=7,6 Гц, 1H), 7,26 (шир.с, 1H), 6,15 (д, J=8,0 Гц, 1H), 5,70 (шир.с, 2H).
B. N-(6-(3-(этоксикарбонил)тиоуреидо)пиридин-2-ил)ацетамид. Раствор N-(6-амино-пиридин-2-ил)ацетамида (0,9 г, 5,96 ммоль) и этоксикарбонил изотиоцианат (0,94 г, 5,96 ммоль) в диоксане (10 мл) перемешивали при комнатной температуре в течение 5 часов. Растворитель удаляли с получением N-(6-(3-(этоксикарбонил)тиоуреидо)пиридин-2-ил)ацетамида (1,4 г, 83,3% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 12,10 (шир.с, 1H), 11,52 (шир.с, 1H), 10,51 (шир.с, 1H), 8,37 (м, 1H), 7,91 (д, J=8,0 Гц, 1H), 7,91 (т, J=8,0 Гц, 1H), 4,25 (кв., J=7,2 Гц, 2H), 2,1 (с, 3H), 1,28 (т, J=7,2 Гц, 3H).
C. N-(2-Амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)ацетамид. К раствору гидроксиламингидрохлорида (1,22 г, 17,7 ммоль) и N,N-этилдиизопропиламина (1,37 г, 10,6 ммоль) в смеси этанола и метанола (1:1, 20 мл) добавляли N-(6-(3-(этоксикарбонил)тиоуреидо)пиридин-2-ил)ацетамид (1,00 г, 3,54 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов и при 70°C в течение 5 часов. Летучие вещества удаляли при пониженном давлении и остаток обрабатывали водой. Полученный осадок промывали 20% раствором диэтилового эфира в метаноле (10 мл) и диэтиловым эфиром (10 мл). После сушки в условиях высокого вакуума получали не совсем белые кристаллы N-(2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)ацетамида) (0,50 г, 62%). 1H ЯМР: (400 МГц, ДМСО-d6) δ (м.д.) 10,2 (шир.с, 1H), 7,41 (м, 2H), 7,05 (дд, J1=7,2, J2=I,6 Гц, 1H), 5,94 (шир.с, 2H), 2,19 (с, 3H).
D. N-(2-(Фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)ацетамид. К дегазированной смеси N-(2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)ацетамид)а (300 мг 1,58 ммоль), фенилбромида (270 мг 1,74 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (91 мг, 0,158 ммоль) и карбоната цезия (1,03 г, 3,16 ммоль) в диоксане (15 мл) добавляли трис(дибензилиденацетон)дипалладий(0) (45 мг, 0,079 ммоль) в атмосфере азота и смесь нагревали при 80°C в атмосфере азота в течение ночи. Реакцию гасили путем добавления воды и смесь экстрагировали этилацетатом (15 мл ×3). Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали. Остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (35-68% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 мин) с получением N-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)ацетамида в форме соли трифторуксусной кислоты, которую преобразовывали в соответствующее свободное основание (50 мг, 12% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,24 (шир.с, 1H), 9,53 (шир.с, 1H), 7,76 (д, J=7,6 Гц, 2H), 7,55 (м, 2H), 7,30 (м, 3H), 6,88 (т, J=7,2 Гц, 1H), 2,27 (с, 3H); MS (ESI): m/z 267,9 [M+1]+.
Пример 28: N-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)изобутирамид
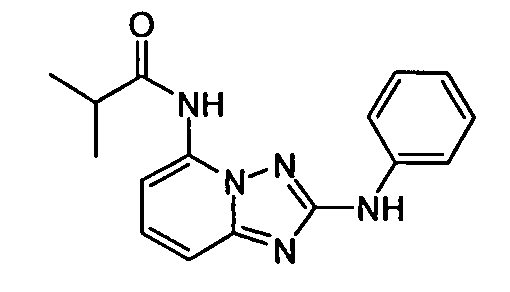
A. N2-Фенил-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамин. К суспензии иодида меди (10 мг, 0,053 ммоль) в жидком аммиаке (10 мл) в автоклаве при -40°C добавляли 5-бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин (50 мг, 0,174 ммоль). Автоклав затем герметично закрывали и нагревали при 180°C в течение 4 часов. Реакционную смесь охлаждали, автоклав промывали этилацетатом три раза и объединенный органический слой сушили и упаривали. Остаток очищали колоночной хроматографией на силикагеле (элюируя при помощи 10-15% этилацетата в петролейном эфире) с получением N2-фенил-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамина (30 мг, 77% выход) в виде твердого вещества. MS (ESI): m/z 226,1 [M+1]+.
B. N-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-изобутирамид. К раствору N2-фенил-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамина (30 мг, 0,13 ммоль) и триэтиламина (26 мг, 0,26 ммоль) в дихлорметане (5 мл) добавляли изобутирилхлорид (14 мг, 0,13 ммоль) при 0°C и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в ледяную воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали досуха. Остаток очищали при помощи препаративной ТСХ (элюируя при помощи 15-20% этилацетата в петролейном эфире) с получением N-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)изобутирамида (15 мг, 38% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,67 (м, 3H), 7,48 (м, 1H), 7,30 (м, 3H), 6,95 (м, 1H), 2,93 (м, 1H), 1,31 (т, J=6,8 Гц, 6H); MS (ESI): m/z 296,1 [M+1]+.
Пример 29: N-(3-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)фенил)ацетамид
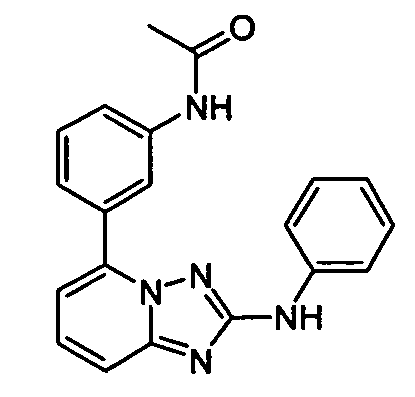
A. N-(3-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)фенил)ацетамид. Смесь 5-(3-аминофенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (50 мг, 0,17 ммоль), пиридина (26,9 мг, 0,34 ммоль), уксусного ангидрида (33,8 мг, 0,34 ммоль) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение ночи. Осадок собирали фильтрованием и фильтровальную лепешку промывали водой и этиловым эфиром с получением N-[3-(2-фениламино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)фенил]ацетамида (40 мг, 70% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,15 (шир.с, 1H), 9,61 (шир.с, 1H), 8,26 (с, 1H), 7,70-7,46 (м, 7H), 7,21 (м, 2H), 7,10 (м, 1H), 6,82 (м, 1H), 2,06 (с, 3H); MS (ESI): m/z 344,1 [M+1]+.
Пример 30: 4-(5-Фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-(пиперидин-4-ил)бензамид
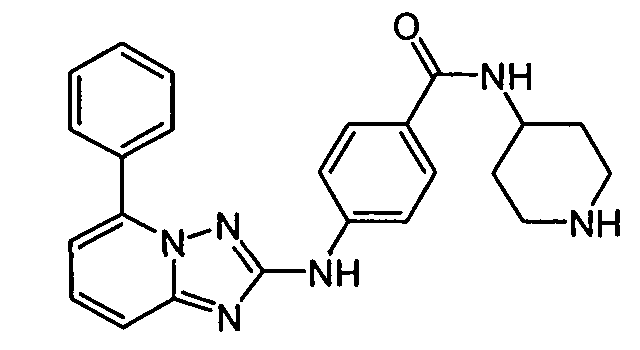
A. 4-(5-Фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензойная кислота. Суспензию метил 4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензоата (260 мг, 0,76 ммоль) (полученного из 5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина и метил 4-бромбензоата, следуя процедуре, описанной для синтеза N,5-дифенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина) в 10% водном растворе гидроксида натрия (5 мл) нагревали при кипячении с обратным холодильником в течение ночи. После охлаждения до комнатной температуры реакционную смесь нейтрализовали при помощи 3% водного раствора хлористоводородной кислоты до pH=3. Осадок собирали фильтрованием и промывали водой с получением 4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензойной кислоты (220 мг, 88% выход) в виде твердого вещества. MS (ESI): m/z 331,1 [M+1]+.
B. трет-Бутил 4-(4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензамидо)пиперидин-1-карбоксилат. Смесь 4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензойной кислоты (200 мг, 0,6 ммоль), трет-бутил 4-аминопиперидин-1-карбоксилата (121 мг, 0,6 ммоль), гексафторфосфата 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония(V) (460 мг, 1,2 ммоль) и N-метилморфолина (306 мг, 3,0 ммоль) в N,N-диметилформамиде (2 мл) перемешивали при комнатной температуре в течение ночи. Добавляли воду (5 мл) и осадок собирали фильтрованием и промывали водой с получением трет-бутил 4-(4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензамидо)пиперидин-1-карбоксилата (220 мг, 72% выход) в виде твердого вещества. MS (ESI): m/z 535,1 [M+23]+.
C. 4-(5-Фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-(пиперидин-4-ил)бензамид. Раствор трет-бутил 4-(4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензамидо)пиперидин-1-карбоксилата (50 мг, 0,1 ммоль) в метанольном растворе гидрохлорида (10 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали в вакууме с получением 4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-(пиперидин-4-ил)бензамида (25 мг, 60% выход) в виде гидрохлоридной соли. 1H ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 9,99 (шир.с, 1H), 8,65 (шир.с, 2H), 8,22 (д, J=7,5 Гц, 1H), 8,03 (д, J=6,9 Гц, 2H), 7,81-7,58 (м, 8H), 7,21 (д, J=6,9 Гц, 1H), 4,01 (м, 1H), 3,30 (м, 2H), 2,99 (м, 2H), 1,96 (м, 2H), 1,74 (м, 2H); MS (ESI): m/z 413,2 [M+1]+.
Пример 31: 5-(5-Фенил-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)пиридин-2-ол
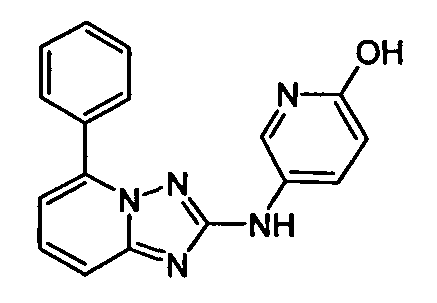
A. 5-(5-Фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)пиридин-2-ол. Смесь N-(6-метоксипиридин-3-ил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (100 мг, 0,31 ммоль) (полученного, следуя процедуре, описанной для синтеза N-(4-морфолинофенил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина) в растворе бромистого водорода в уксусной кислоте (6 мл, 35%) нагревали при 120°C в герметично закрытом сосуде в течение 0,5 часов. После охлаждения до комнатной температуры смесь подщелачивали насыщенным водным раствором бикарбоната натрия до pH=7. Полученную смесь экстрагировали этилацетатом и объединенный органический слой сушили над сульфатом натрия и фильтровали. Фильтрат упаривали при пониженном давлении и остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (40-70% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 25 мин) с получением 5-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)пиридин-2-ола в форме соли трифторуксусной кислоты, которую преобразовывали в соответствующую гидрохлоридную соль с использованием метанольного раствора гидрохлорида (40 мг, 38% выход). 1H ЯМР (300 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,56 (м, 1H), 8,18 (м, 1H), 8,00 (м, 2H), 8,83 (м, 1H), 7,63-7,57 (м, 4H), 7,32 (дд, J1=7,2 Гц, J2=1,8 Гц, 1H), 7,09 (м, 1H); MS (ESI): m/z 304,1 [M+1]+.
Пример 32: 4-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пиридин-2-ол
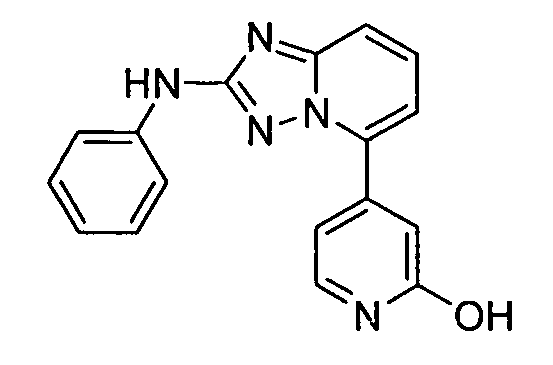
A. 4-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пиридин-2-ол. Исходное вещество в общем количестве 60 мг деметилировали двумя партиями (20 мг и 40 мг) в соответствии с процедурой, описанной ниже. Неочищенные вещества затем объединяли для очистки. Суспензию 5-(2-метоксипиридин-4-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,040 г, 0,126 ммоль) (полученного в соответствии с процедурой, описанной для синтеза N,5-дифенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина) в дихлорметане (3 мл) при комнатной температуре обрабатывали трибромидом бора (0,555 мл, 0,555 ммоль) и перемешивали при комнатной температуре в течение 2 дней. Поскольку конверсия не была полной, использовали дополнительное количество трибромида бора (0,555 мл, 0,555 ммоль) и реакционную смесь перемешивали при комнатной температуре еще в течение 12 часов. Хотя оставалось непрореагировавшее исходное вещество, реакцию гасили водой (1 мл) и экстрагировали этилацетатом (3 раз, 25 мл), затем дихлорметаном (3×15 мл). Объединенные экстракты сушили над сульфатом натрия и остаток, полученный после выпаривания растворителя, растворяли в смеси 10:1 ДМСО:метанол и очищали при помощи полу-препаративной ВЭЖХ (20-80% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты в течение 30 минут - 5 впрысков). Желаемые фракции объединяли и нейтрализовали при помощи 1,75 M водного раствора карбоната калия. В результате удаления ацетонитрила при пониженном давлении происходило образование белого твердого вещества, которое собирали фильтрованием, промывали водой до достижения нейтрального pH и сушили в вакуумной печи при слабом нагревании. 4-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пиридин-2-ол (7 мг, 12% выход общий выход) выделяли в виде белого твердого вещества (99,6% чистоты). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,53 (шир.с, 1H), 8,14 (д, J=9,47 Гц, 1H), 7,56-7,77 (м, 2H), 7,45-7,55 (м, 1H), 7,17-7,36 (м, 2H), 6,88 (м, 1H), 6,53 (д, J=9,52, 1H); MS (ESI) m/z 304 [M+1]+.
Пример 33: 5-(3-(1H-1,2,4-Триазол-5-ил)фенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин
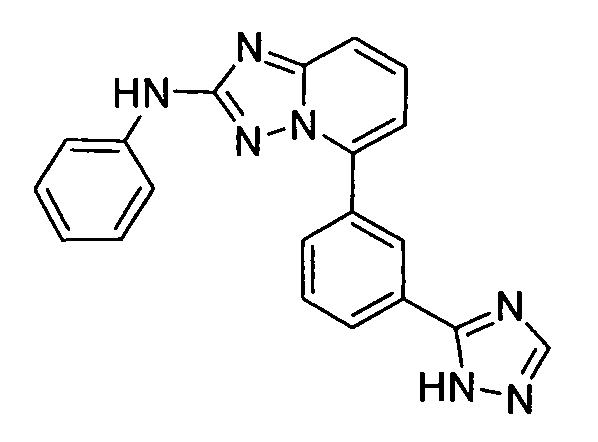
A. Гидрохлорид этил 3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензимидата. Через суспензию 3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензонитрила (0,115 г, 0,369 ммоль) (полученного в соответствии с процедурой, описанной для синтеза N,5-дифенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина) в этаноле (10 мл) барботировали газообразный HCl в течение 10 минут при 0°C. Суспензия становилась прозрачной сразу после введения HCl (газ) и через некоторое время частично расслаивалась. Через 6 часов растворитель удаляли при пониженном давлении и использовали на следующей стадии без дополнительной очистки. MS (ESI) m/z 358 [M+1]+.
B. 5-(3-(1H-1,2,4-Триазол-5-ил)фенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К суспензии этил гидрохлорида 3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензимидата (0,145 г, 0,369 ммоль) в этаноле (10 мл) добавляли формогидразид (0,111 г, 1,845 ммоль) и диизопропилэтиламин (0,226 мл, 1,292 ммоль). Реакционную смесь нагревали в течение ночи до 120°C в герметично закрытой пробирке. Реакционную смесь охлаждали до комнатной температуры и растворитель выпаривали. Остаток очищали при помощи полу-препаративной ВЭЖХ (20-100% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты в течение 30 минут, 4 впрыска). Желаемые фракции объединяли и нейтрализовали при помощи 1,75 M водного раствора карбоната калия. После выпаривания ацетонитрила образовывался гелеобразный осадок, который собирали фильтрованием и промывали водой до достижения нейтрального pH промывок. 5-(3-(1H-1,2,4-Триазол-5-ил)фенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,033 г, 0,093 ммоль, 25,3% выход) выделяли в виде не совсем белого твердого вещества (99,8% чистоты). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,65 (с, 1H), 8,87 (шир.с, 1H), 8,71 (шир.с, 1H), 8,16-8,26 (м, 1H), 7,58-7,82 (м, 6H), 7,32 (д, J=6,39 Гц, 1H), 7,16-7,25 (м, 2H), 6,79-6,89 (м, 1H); MS (ESI) m/z 354 [M+1]+.
Пример 34: (S)-2-(Фениламино)-N-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-5-карбоксамид
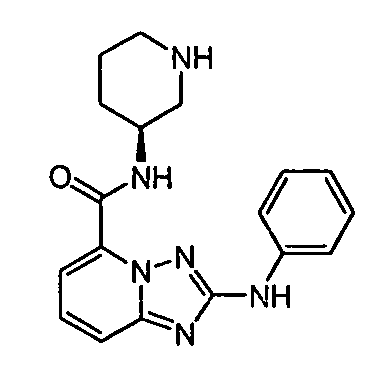
A. 2-Амино-[1,2,4]триазоло[1,5-α]пиридин-5-карбонитрил. Смесь 5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амина (4,26 г, 20 ммоль), цинковой пыли (0,97 г, 15 ммоль), трис(дибензилиденацетон)дипалладия(0) (1,1 г, 1,2 ммоль), 1,1'-бис(дифенилфосфино)ферроцена (1,32 г, 2,4 ммоль) и цианида цинка (4,3 г, 39 ммоль) в N,N-диметилацетамиде (60 мл) в 250-мл круглодонной колбе дегазировали. В атмосфере азота реакционную смесь нагревали при 100°C в течение ночи. Когда основное количество растворитель удаляли в вакууме, добавляли насыщенный водный раствор хлорида натрия и смесь экстрагировали этилацетатом. Объединенный органический слой сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюируя при помощи 10-30% этилацетата в петролейном эфире) на силикагеле с получением 2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-карбонитрила (910 мг, 28% выход) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,69 (дд, J=8,8 Гц, 1H), 7,64 (дд, J=8,8 Гц, 1H), 7,51 (т, J=8,2 Гц, 1H), 6,47 (шир.с, 1H).
B. 2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбонитрил. Дегазированный раствор 2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-карбонитрила (0,9 г, 5,7 ммоль), 1-бромбензола (0,89 г, 5,7 ммоль), трис(дибензилиденацетон)дипалладия(0) (326 мг, 0,35 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (526 мг, 0,91 ммоль) и карбоната цезия (3,68 г, 12 ммоль) в диоксане (20 мл) нагревали при 100°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры реакционную смесь фильтровали и фильтрат концентрировали в вакууме с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле (элюируя при помощи 10-30% этилацетата в петролейном эфире), с получением 2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбонитрила (0,7 г, 52% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,96 (шир.с, 1H), 7,93 (дд, J1=8,8, J2=0,8 Гц, 1H), 7,82 (дд, J1=7,6, J2=0,8 Гц, 1H), 7,75 (м, 3H), 7,29 (т, J=8,0 Гц, 2H), 6,90 (т, J=7,6 Гц, 1H); MS (ESI): m/z 236,1 [M+1]+.
C. 2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбоновая кислота. Раствор 2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбонитрила (700 мг, 3 ммоль) и гидроксида натрия (1,2 г, 30 ммоль) в смеси этанола (30 мл) и воды (15 мл) нагревали при 80°C, пока анализ ТСХ не показал, что исходное вещество было израсходовано. Растворитель удаляли в вакууме и добавляли воду. Смесь промывали этилацетатом два раза. Водный слой подкисляли путем добавления водного раствора хлористоводородной кислоты до pH=3 и затем смесь экстрагировали этилацетатом. Объединенный органический слой сушили и концентрировали с получением 2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбоновой кислоты (560 мг, 73% выход) в виде бледно-желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,77 (шир.с, 1H), 7,72 (м, 3H), 7,60 (т, J=7,2 Гц, 1H), 7,44 (д, J=7,2 Гц, 1H), 7,25 (т, J=7,6 Гц, 2H), 6,86 (т, J=7,6 Гц, 1H); MS (ESI): m/z 255,3 [M+1]+.
D. (S)-трет-Бутил 3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбоксамидо)пиперидин-1-карбоксилат. Смесь 2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбоновой кислоты (70 мг, 0,27 ммоль), (S)-трет-бутил 3-аминопиперидин-1-карбоксилата (55 мг, 0,27 ммоль), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (106 мг, 0,55 ммоль), гидроксибензотриазола (74 мг, 0,55 ммоль) и N-метилморфолина (75 мг, 0,55 ммоль) в N,N-диметилформамиде (2 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли насыщенным солевым раствором. Образовавшийся осадок собирали, промывали водой и петролейным эфиром с получением (S)-трет-бутил 3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбоксамидо)пиперидин-1-карбоксилата (102 мг, 85% выход) в виде твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
E. (S)-2-(Фениламино)-N-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-5-карбоксамид. Раствор (S)-трет-бутил 3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбоксамидо)пиперидин-1-карбоксилата (102 мг, 0,24 ммоль) в метанольном растворе гидрохлорида (2 мл, 2 M) перемешивали при комнатной температуре, пока анализ ТСХ не показал, что исходное вещество было израсходовано. Растворитель выпаривали при пониженном давлении с получением неочищенного продукта, который очищали при помощи обращенно-фазовой препаративной ВЭЖХ (35-65% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 мин), с получением (S)-2-(фениламино)-N-(пиперидин-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-5-карбоксамида в форме соли трифторуксусной кислоты, которую преобразовывали в соответствующую гидрохлоридную соль (69 мг, 88% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,95 (д, J=6,8 Гц, 1H), 9,87 (шир.с, 1H), 9,13 (шир.с, 2H), 7,78 (дд, J1=8,4, J2=1,2 Гц, 1H), 7,72-760 (м, 4H), 7,32 (т, J=8,0 Гц, 2H), 6,94 (т, J=7,6 Гц, 1H), 4,26 (м, 1H), 3,40 (м, 1H), 3,14 (м, 1H), 2,90 (м, 2H), 2,10 (м, 1H), 1,79 (м, 1H), 1,75 (м, 2H); MS (ESI): m/z 337,4 [M+1]+.
Пример 35: N-Фенил-5-(пиридин-2-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин
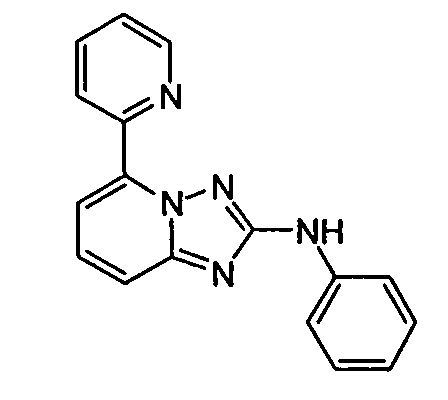
A. 2,2'-Бипиридин 1-оксид. К раствору 2,2'-бипиридина (10 г, 64 ммоль) в дихлорметане (250 мл) добавляли 3-хлорбензопероксокислоту (33 г, 192 ммоль) по порциям при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 1 часа. После того, как исходное вещество было израсходовано, добавляли насыщенный водный раствор тиосульфата натрия. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали при пониженном давлении с получением 2,2'-бипиридин 1-оксида (5,5 г, 50% выход) в виде твердого вещества. 1H ЯМР (300 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,73 (д, J=5,1 Гц, 1H), 8,50 (д, J=5,7 Гц, 1H), 8,42 (д, J=6,3 Гц, 1H), 8,06 (дд, J1=2,1 Гц, J2=5,1 Гц, 1H), 7,96 (дд, J1=7,2 Гц, J2=9,0 Гц, 1H), 7,70 (т, J=7,5 Гц, 1H), 7,58-7,48 (м, 2H).
B. 6-Хлор-2,2'-бипиридин. Смесь 2,2'-бипиридин 1-оксида (5,5 г, 32 ммоль) и фосфорилтрихлорида (20 мл) нагревали при кипячении с обратным холодильником в течение 4 часов. Фосфорилтрихлорид отгоняли и остаток разбавляли этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и концентрировали при пониженном давлении. Остаток очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 10% этилацетата в петролейном эфире) с получением 6-хлор-2,2'-бипиридина (3,5 г, 57% выход) в виде твердого вещества.
C. N-(4-Метоксибензил)-2,2'-бипиридин-6-амин. Раствор 6-хлор-2,2'-бипиридина (1 г, 5,2 ммоль) в (4-метоксифенил)метанамине (5 мл) перемешивали при 180°C в течение 4 часов. Смесь очищали на колонке с силикагелем (элюируя при помощи 10-80% этилацетата в петролейном эфире) с получением N-(4-метоксибензил)-2,2'-бипиридин-6-амина (1,2 г, 80% выход). MS (ESI): m/z 291,9 [M+1]+.
D. 2,2'-Бипиридин-6-амин. Раствор N-(4-метоксибензил)-6-(пиридин-2-ил)пиридин-2-амина (600 мг, 2 ммоль) в трифторуксусной кислоте (10 мл) перемешивали при 80°C в течение ночи. Когда ТСХ анализ (3% дихлорметана в метаноле) показал, что исходное вещество было израсходовано, смесь доводили до pH=7 при помощи водного раствора карбоната натрия и водный слой экстрагировали этилацетатом. Объединенные органические слои сушили над сульфатом натрия и концентрировали с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 0,5-1% метанола в дихлорметане), с получением 2,2'-бипиридин-6-амина (280 мг, 79% выход). MS (ESI): m/z 172,1 [M+1]+.
E. Этил 6-(пиридин-2-ил)пиридин-2-илкарбамотиоилкарбамат. К раствору 2,2'-бипиридин-6-амина (280 мг, 1,63 ммоль) в диоксане (10 мл) добавляли этоксикарбонилизотиоцианат (213 мг, 1,63 ммоль) по каплям в атмосфере азота при комнатной температуре и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Реакцию отслеживали при помощи ТСХ (50% этилацетата в петролейном эфире) и, когда исходное вещество было израсходовано, растворитель удаляли при пониженном давлении с получением неочищенного этил 6-(пиридин-2-ил)пиридин-2-илкарбамотиоилкарбамата (340 мг) в виде твердого вещества. MS (ESI): m/z 303,1 [M+1]+.
F. 5-(Пиридин-2-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К раствору гидрохлорида гидроксиламина (388 мг, 5,5 ммоль) и N,N-диизопропилэтиламина (435 мг, 3,3 ммоль) в смеси метанола и этанола (об/об, 1:1, 6 мл) добавляли этил 6-(пиридин-2-ил)пиридин-2-илкарбамотиоилкарбамат (340 мг, 1,1 ммоль) одной порцией при комнатной температуре. После перемешивания при комнатной температуре в течение 2 часов реакционную смесь нагревали при 60°C в течение ночи. Когда ТСХ анализ (10% этилацетата в метаноле) показал, что исходное вещество израсходовано, растворитель удаляли при пониженном давлении и остаток обрабатывали водой. Осадок собирали и промывали смесью метанола и этилового эфира (об/об, 4:1, 8 мл) с получением 5-(пиридин-2-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (100 мг, 51% выход) в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,77 (д, J=8,0 Гц, 2H), 7,99 (т, J=7,6 Гц, 1H), 7,50 (м, 2H), 7,46 (м, 2H), 6,21 (шир.с, 2H); MS (ESI): m/z 211,9 [M+1]+.
G. N-Фенил-5-(пиридин-2-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Дегазированный раствор 5-(пиридин-2-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (100 мг, 0,47 ммоль), бромбензола (81 мг, 0,52 ммоль), трис(дибензилиденацетон)дипалладия(0) (27 мг, 0,047 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (43 мг, 0,09 ммоль) и трет-бутоксида калия (100 мг, 0,9 ммоль) в диоксане (5 мл) нагревали при 80°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры реакционную смесь фильтровали и фильтрат концентрировали в вакууме с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 2% метанола в дихлорметане), с получением N-фенил-5-(пиридин-2-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (52 мг, 38% выход). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,81 (м, 2H), 8,16 (т, J=8,0 Гц, 1H), 7,76 (м, 2H), 7,64 (м, 4H), 7,31 (т, J=7,6 Гц, 2H), 6,97 (т, J-7,2 Гц, 1H); MS (ESI): m/z 288,1 [M+1]+.
Пример 36: N-(lH-Индазол-6-ил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин
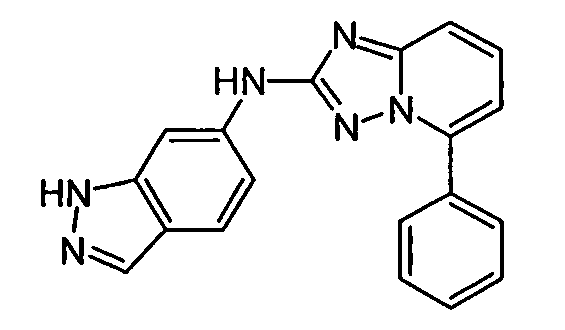
A. 2-Бром-5-фенил-[1,2,4]триазоло[1,5-α]пиридин. К раствору 5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (2 г, 9,5 ммоль) в смеси бромноватой кислоты (40% в воде) и уксусной кислоты (об/об, 2:1, 20 мл) добавляли нитрит натрия (3,2 г, 47,5 ммоль) при комнатной температуре и смесь перемешивали при этой температуре в течение 0,5 часа, затем перемешивали при 50°C еще в течение 0,5 часа. Смесь охлаждали и подщелачивали при помощи карбоната натрия до pH>9 и экстрагировали этилацетатом три раза. Объединенный органический слой сушили над безводным сульфатом натрия и концентрировали. Неочищенную смесь очищали при помощи колоночной хроматографии (элюируя при помощи 0-25% этилацетата в петролейном эфире) с получением 2-бром-5-фенил-[1,2,4]триазоло[1,5-α]пиридина (1,5 г, выход 57,7%) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,82 (м, 2H), 7,71 (м, 2H), 7,47 (м, 3H), 7,29 (м, 1H); MS (ESI): m/z 274,1 [M+1]+.
B. 5-Фенил-N-(1-(тетрагидро-2Н-pyraii-2-ил)-1Н-индазол-6-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Дегазированный раствор 1-(тетрагидро-2H-пиран-2-ил)-1Н-индазол-6-амина (365 мг, 1,7 ммоль), 2-бром-5-фенил-[1,2,4]триазоло[1,5-α]пиридина (460 мг, 1,7 ммоль), 4,5-бис(дифенил фосфино)-9,9-диметилксантена (156 мг, 0,34 ммоль), трис(дибензилиденацетон)дипалладия(0) (96 мг, 0,17 ммоль) и карбоната цезия (1 г, 3,4 ммоль) в диоксане (10 мл) нагревали при 80°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры реакционную смесь фильтровали и фильтрат концентрировали в вакууме с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 1% метанола в дихлорметане), с получением 5-фенил-N-(1-(тетрагидро-2H-пиран-2-ил)-1H-индазол-6-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (100 мг, 15% выход). MS (ESI): m/z 411,0 [M+1]+.
C. N-(lH-Индазол-6-ил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Смесь 5-фенил-N-(1-(тетрагидро-2H-пиран-2-ил)-1H-индазол-6-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (100 мг, 0,24 ммоль) и метанольного раствора гидрохлорида (2 M, 5 мл) перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали при пониженном давлении с получением N-(1H-индазол-6-ил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (75 мг, 86% выход) в виде гидрохлоридной соли. 1H ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 9,91 (шир.с, 1H), 8,14 (с, 1H), 8,07 (д, J=7,2 Гц, 2H), 7,73 (с, 1H), 7,72-7,54 (м, 7H), 7,25-7,21 (м, 2H); MS (ESI): m/z 327,1 [M+1]+.
Пример 37: 5-Фенокси-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин
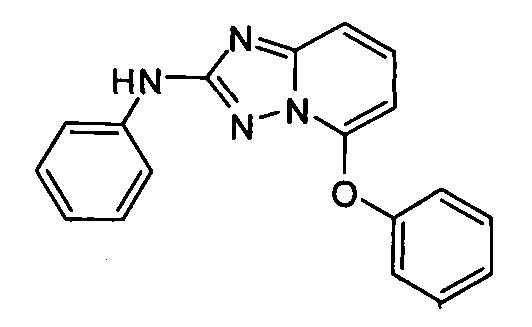
A. 2-Хлор-6-феноксипиридин. Дегазированную смесь 2,6-дихлорпиридина (2,9 г, 20 ммоль) (1,72 г, 10 ммоль), фенола (12 г, 0,13 ммоль) и гидроксида натрия (4,8 г, 0,12 ммоль) в воде (20 мл) нагревали при 140°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом и органическую фазу промывали водой два раза. Органический слой сушили над сульфатом натрия и фильтровали. Фильтрат упаривали и остаток очищали на колонке с силикагелем (элюируя при помощи 10% этилацетата в петролейном эфире) с получением 2-хлор-6-феноксипиридина (1,7 г, 41% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,78 (т, J=8,0 Гц, 1H), 7,43 (т, J=8,0 Гц, 2H), 7,25 (т, J=7,6 Гц, 1H), 7,13 (м, 3H), 6,83 (д, J=8,0 Гц, 1H).
B. N-(4-Метоксибензил)-6-феноксипиридин-2-амин. Дегазированную смесь (4-метоксифенил)метанамина (10 мл) и 2-хлор-6-феноксипиридина (1,7 г, 8,29 ммоль) нагревали при 180°C в атмосфере азота при перемешивании в течение 5 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом и смесь промывали насыщенным солевым раствором два раза. Органический слой сушили над сульфатом натрия и фильтровали. Фильтрат упаривали и остаток очищали на колонке с силикагелем (элюируя при помощи 10% этилацетата в петролейном эфире) с получением N-(4-метоксибензил)-6-феноксипиридин-2-амина (1,5 г, 29% выход) в виде белого твердого вещества. MS (ESI): m/z 306,9 [M+1]+.
C. 6-Феноксипиридин-2-амин. Раствор N-(4-метоксибензил)-6-феноксипиридин-2-амина (700 мг, 2,61 ммоль) в смеси 2,2,2-трифторуксусной кислоты и дихлорметана (об/об, 1/2) нагревали при кипячении с обратным холодильником в течение 2 часов. Растворитель удаляли при пониженном давлении и остаток очищали на колонке с силикагелем (10% этилацетата в петролейном эфире) с получением чистого 6-феноксипиридин-2-амина (260 мг, 53% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,37 (м, 3H), 7,16 (т, J=7,2 Гц, 1H), 7,04 (м, 2H), 6,24 (д, J=8,0 Гц, 1H), 5,93 (д, J=7,8 Гц, 1H); MS (ESI): m/z 186,9 [M+1]+.
D. 5-Фенокси-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Смесь 6-феноксипиридин-2-амина (260 мг, 1,4 ммоль) и этоксикарбонилизотиоцианата (183 мг, 1,4 ммоль) в диоксане (10 мл) перемешивали при комнатной температуре в течение 5 часов. Растворитель выпаривали с получением промежуточное тиоуреидо-соединения (440 мг, 99% выход) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
К раствору гидрохлорида гидроксиламина (486 мг, 7,0 ммоль) и N,N-диизопропилэтиламина (541 мг, 4,2 ммоль) в смеси этанола и метанола (20 мл, 1:1) добавляли промежуточное тиоуреидо-соединение (440 мг, 1,4 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 часов и при 70°C в течение 5 часов. Летучие вещества удаляли при пониженном давлении и остаток разбавляли водой. Осадок собирали фильтрованием, промывали метанолом (10 мл) и этиловом эфиром (10 мл). После сушки в вакууме получали 5-фенокси-[1,2,4]триазоло[1,5-α]пиридин-2-амин (280 мг, 88% выход) в виде не совсем белого кристаллического твердого вещества. MS (ESI): m/z 226,9 [M+1]+.
E. 5-Фенокси-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Дегазированную смесь 5-фенокси-[1,2,4]триазоло[1,5-α]пиридин-2-амина (226 мг, 1,00 ммоль), бромбензола (156 мг, 1,00 ммоль), трис(дибензилиденацетон)дипалладия(0) (20 мг, 0,022 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (25 мг, 0,044 ммоль) и трет-бутоксида калия (244 мг, 2,00 ммоль) в диоксане (5 мл) нагревали при 80°C в атмосфере азота в течение ночи. Реакцию гасили водой и водный слой экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и фильтровали. Фильтрат упаривали при пониженном давлении и остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (38-68% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 20 минут) с получением 5-фенокси-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль с использованием метанольного раствора гидрохлорида, (60 мг, 20% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,92 (т, J=8,4 Гц, 1H), 7,57 (м, 4H), 7,42 (м, 6H), 7,12 (т, J=7,2 Гц, 1H), 6,67 (д, J=8,4 Гц, 1H); MS (ESI): m/z 303,1 [M+1]+.
Пример 38: 5-(Циклогексилокси)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин
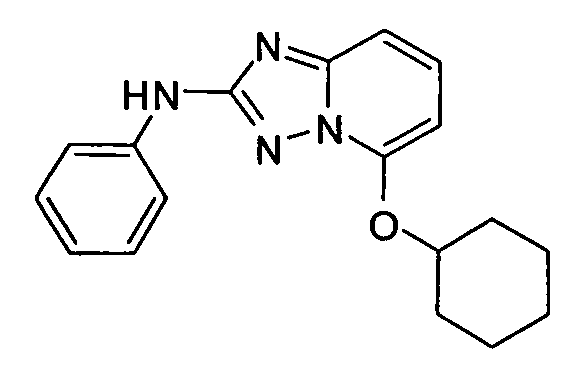
A. 2-Хлор-6-(циклогексилокси)пиридин. К раствору циклогексанола (26 г, 26 ммоль) в толуоле (300 мл) добавляли натрий (624 мг, 26 ммоль) по порциям и смесь нагревали при кипячении с обратным холодильником в течение ночи. После охлаждения до комнатной температуры добавляли 2,6-дихлорпиридин (29 г, 20 ммоль) и полученную смесь нагревали при кипячении с обратным холодильником в течение ночи. Реакционную смесь фильтровали и фильтрат упаривали досуха. Неочищенный продукт очищали на колонке с силикагелем (элюируя при помощи 20% этилацетата в петролейном эфире) с получением 2-хлор-6-(циклогексилокси)пиридина (30 г, 71% выход). 1H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,46 (т, J=7,6 Гц, 1H), 6,84 (д, J=7,5 Гц, 1H), 6,59 (д, J=8,1 Гц, 1H), 5,01 (м, 1H), 1,94 (м, 2H), 1,77 (м, 2H), 1,20 (м, 6H).
B. 6-(Циклогексилокси)-N-(4-метоксибензил)пиридин-2-амин. Дегазированную смесь (4-метоксифенил)метанамина (10 мл) и 2-хлор-6-(циклогексилокси)пиридина (1,0 г, 4,73 ммоль) перемешивали и нагревали при 180°C в атмосфере азота в течение 5 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом и смесь промывали насыщенным солевым раствором два раза. Органический слой сушили над сульфатом натрия и фильтровали. Фильтрат упаривали и остаток очищали на колонке с силикагелем (элюируя при помощи 10% этилацетата в петролейном эфире) с получением 6-(циклогексилокси)-N-(4-метоксибензил)пиридин-2-амина (800 мг, 54% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,17 (м, 3H), 6,94 (т, J=6,0 Гц, 1H), 6,81 (д, J=8,4 Гц, 2H), 5,93 (д, J=8,0 Гц, 1H), 5,72 (д, J=8,0 Гц, 1H), 4,76 (м, 1H), 4,28 (д, J=6,0 Гц, 2H), 3,67 (с, 3H), 1,81 (м, 2H), 1,64 (м, 2H), 1,50 (м, 1H), 1,24 (м, 5H); MS (ESI): m/z 313,4 [M+1]+.
C. 6-(Циклогексилокси)пиридин-2-амин. Раствор 6-(циклогексилокси)-N-(4-метоксибензил)пиридин-2-амина (800 мг, 2,68 ммоль) в смеси 2,2,2-трифторуксусной кислоты и дихлорметана (об/об, 1:2, 10 мл) нагревали при кипячении с обратным холодильником в течение 2 часов. Растворитель удаляли при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 10% этилацетата в петролейном эфире) с получением 6-(циклогексилокси)пиридин-2-амина (500 мг, 97% выход) в виде белого твердого вещества. MS (ESI): m/z 193,2 [M+1]+.
D. 5-(Циклогексилокси)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Смесь 6-(циклогексилокси)пиридин-2-амина (500 мг, 2,6 ммоль) и этоксикарбонилизотиоцианата (341 мг, 2,6 ммоль) в диоксане (15 мл) перемешивали при комнатной температуре в течение 5 часов. Смесь упаривали с получением промежуточного тиоуреидо-соединения (800 мг, 90% выход), которое использовали на следующей стадии без дополнительной очистки.
К раствору гидрохлорида гидроксиламина (903 мг, 7,0 ммоль) и N,N-диизопропилэтиламина (1,00 мг, 7,8 ммоль) в смеси этанола и метанола (20 мл, 1:1) добавляли промежуточное тиоуреидо-соединение (800 мг, 2,6 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Смесь нагревали при 70°C в течение 5 часов и летучие вещества удаляли при пониженном давлении. Остаток разбавляли водой. Осадок промывали метанолом (10 мл) и этиловым эфиром (10 мл). После сушки в условиях высокого вакуума получали 5-(циклогексилокси)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (500 мг, 83% выход) в виде не совсем белого кристаллического твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,37 (т, J=8,0 Гц, 1H), 6,86 (д, J=8,4 Гц, 1H), 6,40 (д, J=7,6 Гц, 1H), 5,92 (шир.с, 2H), 4,64 (м, 1H), 1,95 (м, 2H), 1,72 (м, 2H), 1,52 (м, 3H), 1,26 (м, 3H); MS (ESI): m/z 233,1 [M+1]+.
E. 5-(Циклогексилокси)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Дегазированную смесь 5-(циклогексилокси)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (150 мг, 0,64 ммоль), бромбензола (100 мг, 0,64 ммоль), трис(дибензилиденацетон)дипалладия(0) (118 мг, 0,129 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (149 мг, 0,256 ммоль) и трет-бутоксида калия (144 мг, 1,28 ммоль) в диоксане (10 мл) нагревали при 80°C в атмосфере азота в течение ночи. Реакцию гасили водой и водный слой экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и фильтровали. Фильтрат упаривали при пониженном давлении и остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (53-67%: ацетонитрил + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 20 минут) с получением 5-(циклогексилокси)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль с использованием метанольного раствора гидрохлорида, (130 мг, 65,9% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,62 (шир.с, 1H), 7,65 (д, J=8,0 Гц, 2H), 7,47 (т, J=8,0 Гц, 1H), 7,21 (т, J=8,0 Гц, 2H), 7,10 (д, J=8,0 Гц, 1H), 6,58 (д, J=8,0 Гц, 1H), 4,75 (м, 1H), 2,01 (м, 2H), 1,73 (м, 2H), 1,23 (м, 6H); MS (ESI): m/z 309,2 [M+1]+.
Пример 39: Фенил(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанон
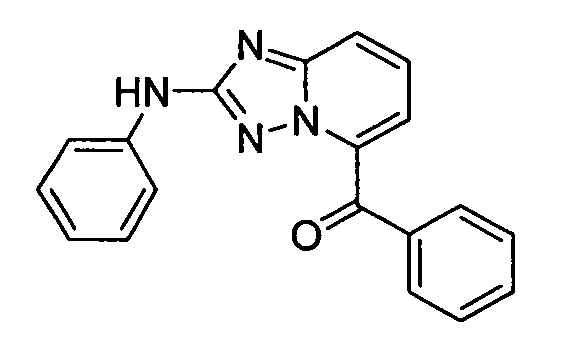
A. Фенил(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанон. К раствору 5-бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,1 г, 0,346 ммоль) в тетрагидрофуране (1,729 мл) (бесцветный) при -78°C добавляли по каплям н-бутиллитий (2,5 M, 0,291 мл, 0,726 ммоль). Реакционная смесь становилась ярко-желтой, и ее поддерживали при низкой температуре в течение 1 часа. Затем добавляли неразбавленный бензонитрил (0,039 г, 0,380 ммоль). Реакционная смесь сразу становилась оранжевой, и ей давали медленно нагреться до комнатной температуры в течение ночи. По данным ЖХ/МС, все исходное вещество было преобразовано с получением желаемого продукта (основной) и дебромированного ядра (побочный продукт).
Темно-оранжевый/коричневый раствор охлаждали до 0°C и обрабатывали при помощи 2,5 мл 3 н водного раствора HCl. Реакционную смесь перемешивали при 0°C в течение 20 минут, затем слои разделяли. Водную фазу затем экстрагировали этилацетатом и объединенные органические экстракты сушили над сульфатом натрия и упаривали досуха (ярко-желтый). Остаток суспендировали в метаноле и образовавшийся желтый осадок собирали фильтрованием. Полученное твердое вещество очищали при помощи полу-препаративной ВЭЖХ (20-80% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты - 1 впрыск, в течение 30 мин). Желаемую фракцию нейтрализовали при помощи 1,75 M водного раствора карбоната калия и ацетонитрил удаляли при пониженном давлении. Ярко-желтое твердое вещество собирали фильтрованием, промывали водой до нейтрального значения рН и сушили в вакууме в течение ночи. Фенил(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанон (0,021 г, 0,067 ммоль, 19,32% выход) собирали в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,67 (шир.с, 1H) 7,69-7,90 (м, 2H) 7,53-7,64 (м, 1H) 7,44 (д, 1H) 7,32 (д, 1H) 7,15 (т, 1H) 6,82 (1H) 2,50 (д, J=1,90 Гц, 22H); MS (ESI): m/z 315,3 [M+1]+.
Пример 40: 5-Бензил-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин

A. 5-Бензил-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К смеси 5-бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,1 г, 0,346 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,020 г, 0,017 ммоль) при комнатной температуре в атмосфере азота добавляли безводный тетрагидрофуран (6,92 мл). Смесь сразу становилась прозрачной. Добавляли 0,5 M раствор бензилхлорида цинка(II) в тетрагидрофуране (1,383 мл, 0,692 ммоль) и реакционную смесь перемешивали при 65°C в течение 20 часов. Через 2,5 часа наблюдали конверсию около 25%, при незначительном восстановлении ядра. Для доведения реакции до завершения, добавляли дополнительные реагенты при комнатной температуре (раствор бензилхлорида цинка(II) (1,383 мл, 0,692 ммоль) и нагревание возобновляли в течение 4 часов. Реакцию гасили льдом и неочищенный продукт экстрагировали этилацетатом. Экстракты сушили над сульфатом натрия и упаривали досуха. Остаток очищали при помощи полу-препаративной ВЭЖХ (30-80% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 минут, 4 впрыска). Желаемые фракции объединяли и нейтрализовали путем добавления 1,75 M водного раствора карбоната калия. После удаления ацетонитрила образовывался белый осадок, который собирали фильтрованием и промывали водой до тех пор, пока рН промывок не становился нейтральным. Это твердое вещество сушили в течение ночи в вакуумной печи при слабом нагреве. 5-Бензил-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,090 г, 0,300 ммоль, 87% выход) собирали в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,60 (шир.с, 1H), 7,69 (д, J=7,96 Гц, 3H), 7,49-7,57 (м, 2H), 7,44-7,49 (м, 1H), 7,38-7,43 (м, 3H), 7,32-7,37 (м, 3H), 7,20-7,30 (м, 4H), 6,84-6,91 (м, 1H), 6,77-6,83 (м, 1H), 4,44 (шир.с, 3H); MS (ESI): m/z 301,1 [M+1]+.
Пример 41: 5-(4-Аминобутил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин
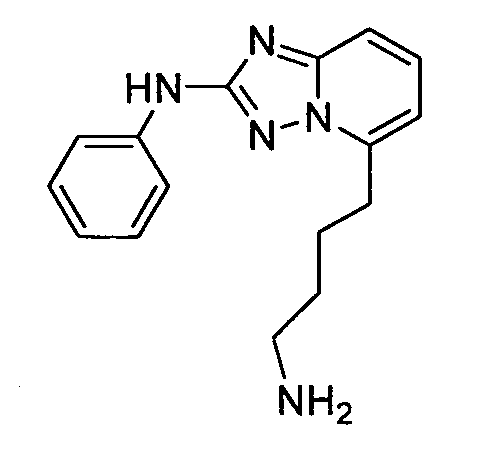
A. 2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбальдегид. К бесцветному раствору/суспензии 5-бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,2 г, 0,692 ммоль) в тетрагидрофуране (3,46 мл) при -78°C добавляли н-бутиллитий (2,5 M, 0,581 мл, 1,453 ммоль) по каплям. Реакционная смесь становилась ярко-желтой, и ее поддерживали при этой температуре в течение 1 часа. Затем добавляли неразбавленный N,N-диметилформамид (0,106 г, 1,453 ммоль). Реакционной смеси давали медленно нагреться до комнатной температуры и перемешивали в течение ночи. Реакцию гасили путем добавления при 0°C уксусной кислоты (1 мл) и воды (10 мл). Неочищенный продукт экстрагировали этилацетатом. Экстракты сушили над сульфатом натрия и упаривали досуха. Остаток очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 50% этилацетата в гексане) с получением 2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбальдегида (0,125 г, 0,525 ммоль, 76% выход) в виде ярко-желтого твердого вещества. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,66-7,70 (м, 2H), 7,60 (дд, J=7,27, 8,83 Гц, 1H), 7,47 (дд, J=1,27, 8,83 Гц, 1H), 7,27-7,33 (м, 2H), 7,22 (дд, J=1,17, 7,32 Гц, 1H), 6,91-6,96 (м, 1H), 6,16 (шир.с, 1H).
B. (Е)-4-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бут-3-еннитрил. К суспензии 2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбальдегида (0,125 г, 0,525 ммоль) в тетрагидрофуране (1,049 мл) добавляли диэтил 2-цианоэтилфосфонат (0,092 мл, 0,525 ммоль) с последующим добавлением 100 мг 50% водного раствора гидроксида натрия (0,050 г, 0,630 ммоль). Суспензия сразу становилась прозрачно-желтой, затем появлялся желтый осадок. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли воду и продукт экстрагировали в этилацетат. Объединенные экстракты сушили над сульфатом натрия и упаривали досуха. (E)-4-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бут-3-еннитрил выделяли в виде желтого твердого вещества (0,145 г, количественный выход). MS (ΕSI): m/z 276,1 [M+1]+.
C. 4-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бутаннитрил. Суспензию (Е)-4-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бут-3-еннитрила (0,145 г, 0,527 ммоль) в этаноле (20 мл) продували азотом. Добавляли избыточное количество палладия на углероде (10% масс) (0,056 г, 0,527 ммоль) и смесь помещали в атмосферу водорода. Реакционную смесь перемешивали при комнатной температуре в течение 48 часов с добавлением катализатора и продувкой реакционной колбы дополнительным количеством водорода в течение ночи. После завершения реакции катализатор удаляли фильтрованием и промывали обильно метанолом. Фильтрат упаривали досуха. Остаток очищали на колонке с силикагелем (элюируя при помощи 50% этилацетата в гексане). 4-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бутаннитрил (0,07 г, 0,252 ммоль, 47,9% выход) собирали в виде белого твердого вещества. MS (ESI): m/z 278,1 [M+1]+.
D. 5-(4-Аминобутил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Раствор 4-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бутаннитрила (0,07 г, 0,252 ммоль) в тетрагидрофуране (2,52 мл) охлаждали до 0°C и обрабатывали при помощи 1,0 M раствора литийалюминийгидрида (0,505 мл, 0,505 ммоль) в тетрагидрофуране. Раствор становился желто-зеленым как только начинали добавление. Реакционную смесь перемешивали при 0°C в течение 2,5 часов. Реакционная смесь становилась ярко-желтой, и образовывался осадок. Реакцию гасили при 0°C насыщенным раствором сульфата натрия и 10% водным раствором гидроксида натрия. Надосадочный раствор собирали фильтрованием и упаривали досуха. Остаток брали для поглощения в метанол и очищали при помощи полу-препаративной ВЭЖХ (20-80% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты - 3 впрыска). Желаемые фракции объединяли и ацетонитрил удаляли при пониженном давлении. Продукт нейтрализовали с использованием ионообменной колонки. Элюат упаривали в тарированном сосуде. После сушки в вакуумной печи 5-(4-аминобутил)-N-фенил-[1,2,4]триазоло[1,5-а]пиридин-2-амин (0,045 г, 0,160 ммоль, 63,4% выход) выделяли в виде масла, которое отверждалось при высушивании (не совсем белое твердое вещество). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,63-7,67 (м, 2H), 7,52 (дд, J=7,17, 9,03 Гц, 1H), 7,38 (дд, J=1,22, 8,83 Гц, 1H), 7,27-7,33 (м, 2H), 6,94 (дд, J=1,12, 7,37 Гц, 1H), 6,89 (дд, J=1,12, 7,17 Гц, 1H), 3,24-3,29 (м, 1H), 2,99 (дд, J=7,61, 13,71 Гц, 1H), 2,59-2,73 (м, 2H), 2,31-2,40 (м, 1H), 1,04 (д, J=6,78 Гц, 3H); MS (ESI): m/z 282,3 [M+1]+.
Пример 42: 5-(3-Аминопропил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин
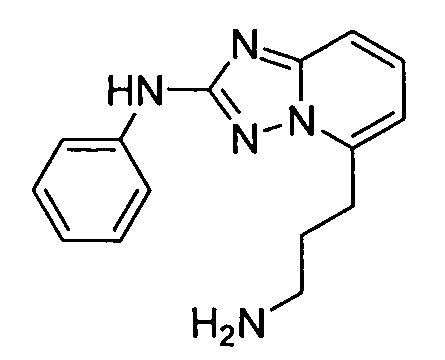
A. 3-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)акрилонитрил. К раствору 2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбальдегид (0,108 г, 0,453 ммоль) в тетрагидрофуране (4,0 мл) добавляли диэтилцианометилфосфонат (0,080 г, 0,453 ммоль) с последующим добавлением 100 мг 50% водного раствора гидроксида натрия (0,044 г, 0,544 ммоль). Добавляли дополнительное количество основания через 30 минут (всего 0,5 мл с 0,1 мл инкрементами) и реакционную смесь перемешивали в течение 24 часов. Реакцию гасили водой и продукт экстрагировали в этилацетат. Экстракты сушили над сульфатом натрия и упаривали досуха. Полученное масло очищали при помощи колоночной хроматографии (элюируя при помощи 25% этилацетата в гексане). Хотя они были разделяемыми, оба изомера собирали и объединяли (0,070 г, 84% выход). MS (ESI): m/z 262,0 [M+1]+.
B. 5-(3-Аминопропил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин. Раствор 3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)акрилонитрила (0,05 г, 0,191 ммоль) в тетрагидрофуране (2,52 мл) охлаждали до 0°C и обрабатывали раствором литийалюминийгидрида в тетрагидрофуране (0,383 мл, 0,383 ммоль). Раствор становился оранжевым, затем коричневым после нагревания до комнатной температуры. Реакционную смесь затем нагревали до 35-40°C в течение ночи. Добавляли еще 2 эквивалента литийалюминийгидрида и нагревание до 50°C продолжали в течение 9 часов. Реакцию гасили при 0°C насыщенным раствором сульфата натрия и 10% водным раствором гидроксида натрия. Неочищенное вещество экстрагировали в этилацетат. Экстракты сушили над сульфатом натрия и упаривали досуха. Осуществляли поглощение остатка в метанол и очищали при помощи полу-препаративной ВЭЖХ (10-50% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 минут, 2 впрыска). Желаемые фракции нейтрализовали с использованием ионообменной колонки. Элюат упаривали в тарированном сосуде. 5-(3-Аминопропил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,006 г, 0,022 ммоль, 11,73% выход) выделяли в виде масла, которое отверждалось при высушивании (не совсем белое твердое вещество). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,64-7,69 (м, 2H), 7,54 (дд, J=7,22, 8,83 Гц, 1H), 7,38 (дд, J=1,22, 8,83 Гц, 1H), 7,28-7,33 (м, 2H), 6,89-6,97 (м, 2H), 3,22-3,27 (м, 2H), 2,82-2,89 (м, 2H), 2,08-2,18 (м, 2H). MS (ESI): m/z 268,0 [M+1]+.
Пример 43: (1-Бензилпиперидин-4-ил)(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанол
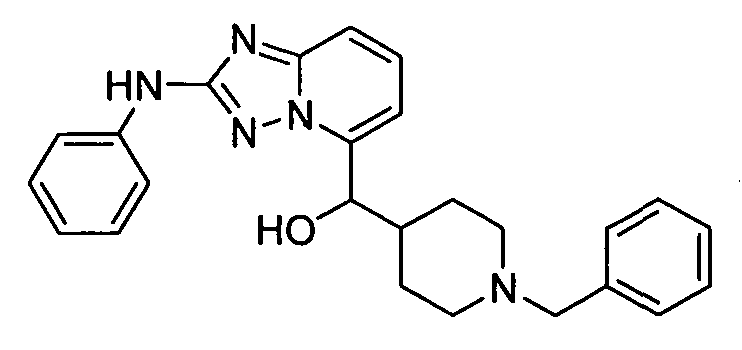
A. (1-Бензилпиперидин-4-ил)(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанол. К раствору 5-бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,270 г, 0,934 ммоль) в тетрагидрофуране (4,67 мл), охлажденному до -78°C, добавляли 2,5 M раствор н-бутиллития в гексане (0,784 мл, 1,961 ммоль). Желтый раствор перемешивали при низкой температуре в течение 30 минут, затем добавляли неразбавленный 1-бензилпиперидин-4-карбальдегид (0,389 мл, 1,961 ммоль). Реакционную смесь перемешивали при низкой температуре в течение 1,5 часов. Реакционную смесь затем выливали в содержащий лед хлорид аммония. Неочищенное вещество экстрагировали этилацетатом и экстракты сушили над сульфатом магния. Остаток очищали на колонке с силикагелем (элюируя при помощи 0-10% метанола в этилацетате). (1-Бензилпиперидин-4-ил)(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанол с примесью N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,321 г, 0,592 ммоль, 63,4% выход) собирали в виде светло-желтого масла, которое частично отверждалось в вакууме.
Часть остатка затем очищали при помощи полу-препаративной ВЭЖХ (20-80% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 30 минут, 2 впрыска). Желаемые фракции объединяли и нейтрализовали через колонку с катионообменной смолой. (1-Бензилпиперидин-4-ил)(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанол (0,076 г) выделяли в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,64 (шир.с, 1H), 1,69-1,15 (м, 2H), 7,59 (дд, J=7,32, 8,78 Гц, 1H), 7,47 (дд, J=1,32, 8,74 Гц, 1H), 7,18-7,33 (м, 7H), 7,01-7,06 (м, 1H), 6,84-6,90 (м, 1H), 5,75 (д, J=5,08 Гц, 1H), 5,16 (т, J=4,78 Гц, 1H), 3,36-3,44 (м, 2H), 2,74-2,87 (м, 2H), 1,92-2,04 (м, 1H), 1,61-1,89 (м, 3H), 1,33-1,55 (м, 3H). MS (ESI): m/z 414,2 [M+1]+.
Пример 44: (2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(пиперидин-4-ил)метанол
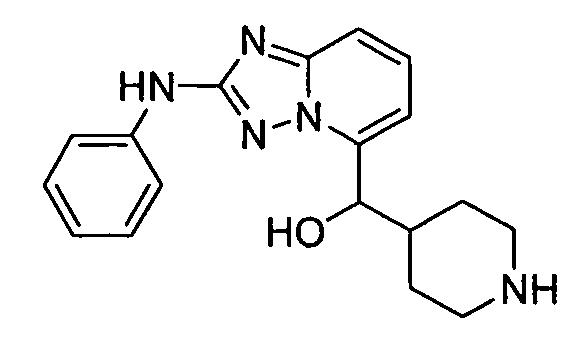
A. (2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(пиперидин-4-ил)метанол. К дегазированному раствору (1-бензилпиперидин-4-ил)(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанола (0,245 г, 0,592 ммоль) в этаноле (25 мл) добавляли избыточное количество палладия на углероде (10% масс) и реакционную смесь перемешивали в атмосфере водорода в течение ночи. Добавляли дополнительное количество катализатора и использовали свежую атмосферу водорода и реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Для завершения реакции требовалось добавление уксусной кислоты (10 капель) и перемешивание при комнатной температуре. Катализатор удаляли при пониженном давлении и промывали обильно метанолом и этилацетатом. Фильтрат упаривали досуха. Полученное светло-желтое масло очищали при помощи полу-препаративной ВЭЖХ (10-50% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 минут - 4 впрыска). Желаемые фракции объединяли и ацетонитрил удаляли при пониженном давлении. Желаемый продукт преобразовывали в форму его свободного основания путем элюирования водного раствора соли через колонку с ионообменной смолой STRATA-XC. (2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(пиперидин-4-ил)метанол (0,056 г, 0,173 ммоль, 29,2% выход) выделяли в виде масла, которое отверждалось в вакууме. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,58-7,67 (м, 3H), 7,40 (дд, J=1,17, 8,88 Гц, 1H), 7,27-7,33 (м, 2H), 7,12 (дд, J=0,68, 7,27 Гц, 1H), 6,91-6,96 (м, 1H), 5,30 (д, J=4,64 Гц, 1H), 3,09-3,21 (м, 2H), 2,63-2,73 (м, 1H), 2,54-2,63 (м, 1H), 2,29-2,39 (м, 1H), 1,72-1,84 (м, 1H), 1,56-1,68 (м, 3H); MS (ESI): m/z 324,0 [M+1]+.
Пример 45: N-Фенил-5-(пиперидин-4-илметил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин
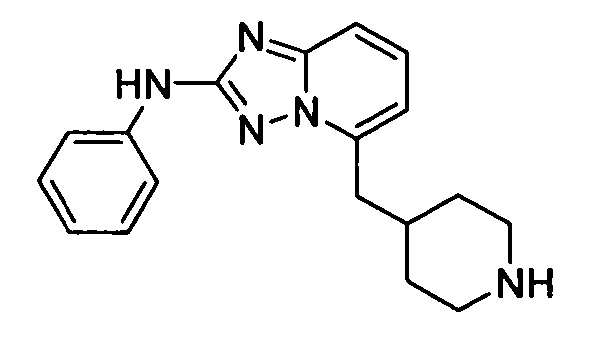
A. трет-Бутил 4-((2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперидин-1-карбоксилат. Раствор трет-бутил 4-метиленпиперидин-1-карбоксилата (0,154 г, 0,778 ммоль) в (1S,5S)-9-борабицикло[3.3.1]нонане (1,038 мл, 0,519 ммоль) (0,5 н в тетрагидрофуране) нагревали до температуры кипения с обратным холодильником в течение 3 часов в атмосфере азота. Реакционную смесь затем охлаждали до комнатной температуры и осуществляли взаимодействие с комплексом [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II)•дихлорметан (0,030 г, 0,036 ммоль), карбонатом калия (0,072 г, 0,519 ммоль) и 5-бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амином (0,150 г, 0,519 ммоль) в N,N-диметилформамиде (2 мл). Реакционную смесь нагревали до 90°C в течение 36 часов. Для доведения реакции до завершения необходимо было 4 дополнительных эквивалента боранового реагента и нагревание в течение 3 часов до 90°C. Реакцию гасили водой и смесь перемешивали при комнатной температуре в течение ночи. Органические экстракты сушили над сульфатом натрия и упаривали досуха. Остаток очищали колоночной хроматографией на силикагеле (элюируя при помощи 50% этилацетата в гексане). трет-Бутил 4-((2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперидин-1-карбоксилат с примесью N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина выделяли в виде масла (выход не рассчитывали). Смесь использовали без дополнительной очистки в последующей реакции удаления защиты. MS (ESI): m/z 408,5 [M+1]+.
B. N-Фенил-5-(пиперидин-4-илметил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. трет-Бутил 4-((2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперидин-1-карбоксилат растворяли в дихлорметане (5 мл) и обрабатывали неразбавленной трифторуксусной кислотой (1,5 мл, 19,47 ммоль). По прошествии 15 минут при комнатной температуре реакция завершалась. Растворитель удаляли при пониженном давлении и остаток нейтрализовали с использованием катионообменной смолы. Вещество в форме свободного основания растворяли в метаноле и очищали при помощи полу-препаративной ВЭЖХ (20-80% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 30 минут 2 впрыска). Желаемые фракции нейтрализовали с использованием катионообменной смолы и сушили в вакууме при слабом нагревании. N-Фенил-5-(пиперидин-4-илметил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,038 г, 0,124 ммоль, 15,9% выход) собирали в виде масла, которое отверждалось при комнатной температуре после сушки. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,62 (с, 1H), 7,73 (дд, J=1,02, 8,64 Гц, 2H), 7,42-7,54 (м, 2H), 7,24-7,31 (м, 2H), 6,83-6,92 (м, 2H), 2,99 (д, J=7,22 Гц, 2H), 2,90 (д, J=12,05 Гц, 2H), 2,34-2,43 (м, 2H), 2,01-2,15 (м, 1H), 1,51 (д, J=11,66 Гц, 2H), 1,12-1,25 (м, 2H); MS (ESI): m/z 308,3 [M+1]+.
Пример 46: (S)-2-Метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропан-1-ол
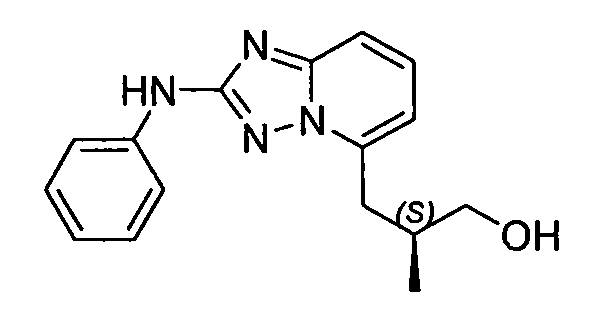
A. (S)-Метил 2-метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропаноат. К смеси 5-бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,200 г, 0,692 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,200 г, 0,173 ммоль) при комнатной температуре в атмосфере азота добавляли безводный тетрагидрофуран (6,92 мл). Смесь сразу становилась прозрачной. Затем добавляли 0,5 M раствор бромида (R)-(3-этокси-2-метил-3-оксопропил)цинка(II) в тетрагидрофуране (0,901 г, 3,46 ммоль) и реакционную смесь перемешивали при 65°C в течение 2 часов. Реакцию гасили льдом и неочищенный продукт экстрагировали этилацетатом. Экстракты сушили над сульфатом магния и упаривали досуха. Остаток очищали колоночной хроматографией на силикагеле с использованием 50% этилацетата в гексане. Фракции объединяли и упаривали досуха. (S)-Метил 2-метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропаноат (0,21 г, 0,677 ммоль, 98% выход) выделяли в виде желтого твердого вещества. MS (ESI): m/z 311,1 [M+1]+.
B. (-S)-2-Метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пропан-1-ол. К раствору (S)-метил 2-метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропаноата (0,05 г, 0,161 ммоль) в тетрагидрофуране (0,895 мл) при -78°C добавляли 1,0 M раствор литийалюминийгидрида в тетрагидрофуране (0,322 мл, 0,322 ммоль). Реакционную смесь затем нагревали до комнатной температуры через 30 минут и перемешивали в течение 30 минут. Реакционную смесь затем гасили путем добавления насыщенного водного раствора хлорида аммония и продукт экстрагировали в этилацетат. Полученное светло-коричневое масло очищали при помощи полу-препаративной ВЭЖХ (20-70% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 30 минут, 2 впрыска). Желаемые фракции нейтрализовали при помощи 1,75 н водного раствора карбоната калия и ацетонитрил удаляли при пониженном давлении. Вещество экстрагировали в этилацетат и экстракты промывали водой. Экстракты сушили в вакуумной печи в течение ночи. (S)-2-Метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-а]пиридин-5-ил)пропан-1-ол (0,034 г, 0,120 ммоль, 74,7% выход) собирали в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,61 (с, 1H), 7,73 (д, J=7,66 Гц, 2H), 7,48-7,55 (м, 1H), 7,41-7,46 (м, 1H), 7,24-7,31 (м, 2H), 6,83-6,92 (м, 2H), 4,61-4,67 (м, 1H), 3,35-3,42 (м, 2H), 3,18 (дд, J=6,25, 13,81 Гц, 1H), 2,85 (дд, J=8,05, 14,01 Гц, 1H), 2,24-2,35 (м, 1H), 0,90 (д, J=6,74 Гц, 3H); MS (ESI): m/z 283,2 [M+1]+.
Пример 47: (S)-2-Метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропанамид
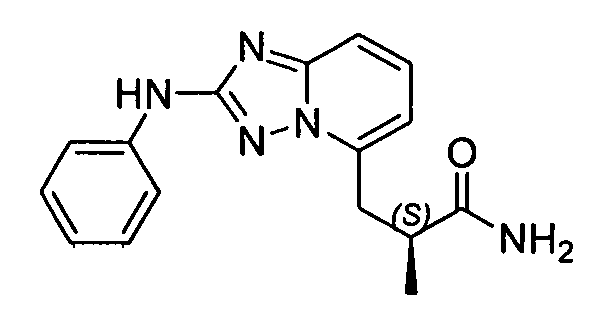
A. (S)-2-Метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропановая кислота. Раствор (S)-метил 2-метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропаноата (0,11 г, 0,354 ммоль) в метаноле (5 мл) обрабатывали при помощи 4,0 н водного раствора гидроксида натрия (3,90 мл, 15,60 ммоль) и нагревали при кипячении с обратным холодильником. Через 1 час реакционную смесь охлаждали до комнатной температуры и pH снижали до 2-3 при помощи 4 н водного раствора HCl. Осажденное не совсем белое твердое вещество собирали фильтрованием и промывали водой и сушили в вакууме. (S)-2-Метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропановую кислоту (0,096 г, 0,324 ммоль, 91% выход) выделяли в виде не совсем белого твердого вещества. MS (ESI): m/z 297,1 [M+1]+.
B. (S)-2-Метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропанамид. Раствор (S)-2-метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропановой кислоты (0,096 г, 0,324 ммоль), хлорида аммония (0,026 г, 0,486 ммоль), N-метилморфолина (0,053 мл, 0,486 ммоль) в N,N-диметилформамиде (1,296 мл) получали при комнатной температуре и обрабатывали гексафторфосфатом бензотриазол-1-илокси-трис(диметиламино)фосфония (0,215 г, 0,486 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили путем добавления насыщенного водного раствора бикарбоната натрия и неочищенное вещество экстрагировали этилацетатом. Экстракты сушили над сульфатом магния и упаривали досуха. Остаток очищали при помощи полу-препаративной ВЭЖХ (20-80% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 30 минут, 4 впрыска). Желаемые фракции нейтрализовали при помощи 1,75 M водного раствора карбоната калия, что приводило к образованию осадка. Ацетонитрил удаляли при пониженном давлении и полученное белое твердого вещество собирали фильтрованием и промывали водой до тех пор, пока pH промывок не становился нейтральным. (S)-2-Метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропанамид (0,071 г, 0,240 ммоль, 74,2% выход) собирали в виде похожего на хлопок белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,64 (с, 1H), 7,74 (д, J=7,76 Гц, 2H), 7,42-7,54 (м, 2H), 7,36 (с, 1H), 7,24-7,31 (м, 2H), 6,78-6,91 (м, 3H), 3,26-3,33 (м, 1H), 2,94-3,09 (м, 2H), 1,15 (д, 3H); MS (ESI): m/z 296,1 [M+1]+.
Пример 48: (S)-5-(3-амино-2-метилпропил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин
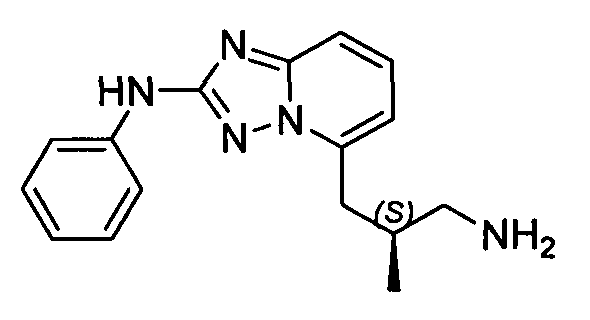
A. (S)-5-(3-амино-2-метилпропил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Смесь (S)-2-метил-3-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропан-1-ола (0,045 г, 0,161 ммоль), фталимида (0,047 г, 0,322 ммоль), полимер-связанного трифенилфосфина (3 ммоль/г, 0,107 г, 0,322 ммоль) в тетрагидрофуране (1,610 мл) обрабатывали диизопропилазодикарбоксилатом (0,063 мл, 0,322 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Смолу удаляли фильтрованием и фильтрат упаривали досуха. Остаток растворяли в этаноле (2 мл) и обрабатывали гидразинмоногидратом (0,025 мл, 0,805 ммоль). Реакционную смесь нагревали до 40°C в течение ночи. Реакционную смесь упаривали досуха и суспендировали в метаноле. Фильтрат упаривали досуха и растворяли в диметилсульфоксиде (2 мл) для очистки при помощи полу-препаративной ВЭЖХ (20-100% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 30 минут, 2 впрыска). Желаемые фракции объединяли и нейтрализовали с использованием колонки с катионообменной смолой (STRATA колонка). Остаток упаривали в тарированной колбе и сушили в вакуумной печи. (S)-5-(3-амино-2-метилпропил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,023 г, 0,082 ммоль, 50,8% выход) выделяли в виде прозрачного масла, которое отверждалось при высушивании. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,61 (с, 1H), 7,69-7,77 (м, 2H), 7,47-7,53 (м, 1H), 7,41-7,46 (м, 1H), 7,23-7,31 (м, 2H), 6,83-6,92 (м, 2H), 3,20 (д, J=6,30, 13,71 Гц, 1H), 2,84 (дд, J=8,00, 13,91 Гц, 1H), 2,52-2,58 (м, 2H), 2,11-2,21 (м, 1H), 0,88 (д, J=6,74 Гц, 3H); MS (ESI): m/z 282,2 [M+1]+.
Пример 49: N-(6-Морфолинопиридин-3-ил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин
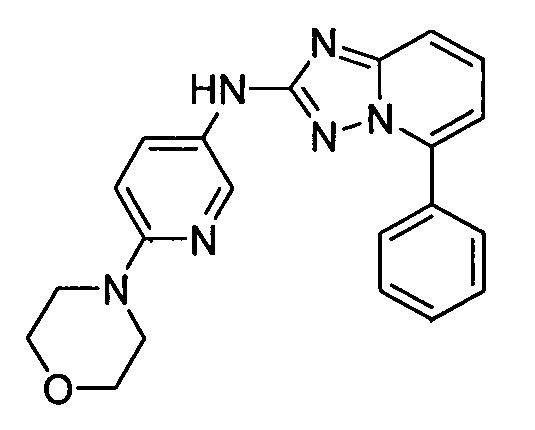
A. N-(6-Хлорпиридин-3-ил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. В атмосфере азота к смеси 5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,3 г, 1,43 ммоль), 2-хлор-5-иодпиридина (0,402 г, 1,68 ммоль), ацетата палладия(II) (8 мг, 0,035 ммоль), 2,2'-бис(дифенилфосфино)1-1'-бинафтила (0,021 г, 0,034 ммоль), карбоната цезия (2,73 г, 8,39 ммоль) добавляли толуол. Раствор продували азотом, перемешивали при комнатной температуре в течение 30 минут и нагревали до 120°C в течение ночи. Реакцию гасили водой и экстрагировали этилацетатом. Органический слой сушили над сульфатом магния и упаривали досуха (желтое масло). Остаток очищали при помощи колоночной хроматографии с использованием 50% этилацетата в гексане. N-(6-Хлорпиридин-3-ил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,08 г, 0,249 ммоль, 14,81% выход) выделяли в виде желтого твердого вещества. MS (ESI): m/z 322,0 [M+1]+.
B. N-(6-Морфолинопиридин-3-ил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Раствор N-(6-хлорпиридин-3-ил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,08 г, 0,249 ммоль) в морфолине (5 мл, 57,4 ммоль) нагревали до 150°C в течение 6 дней, при ежедневном отслеживании конверсии (55% конверсии). Реакционную смесь охлаждали до комнатной температуры и морфолин удаляли при пониженном давлении. Остаток суспендировали в метаноле и фильтрат очищали при помощи полу-препаративной ВЭЖХ (20-100% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 2 впрыска, 30 мин). Желаемые фракции нейтрализовали с использованием катионообменной смолы, упаривали досуха и сушили в течение ночи в вакуумной печи. N-(6-Морфолинопиридин-3-ил)-5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,021 г, 0,056 ммоль, 22,7% выход) собирали в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,41 (с, 1H), 8,46 (д, J=2,39 Гц, 1H), 8,00-8,06 (м, 2H), 7,92 (дд, J=2,78, 9,08 Гц, 1H), 7,52-7,68 (м, 5H), 7,16 (дд, J=1,32, 7,22 Гц, 1H), 6,83 (д, J=9,08 Гц, 1H), 3,67-3,74 (м, 4H), 3,27-3,33 (м, 4H); MS (ESI): m/z 373,3 [M+1]+.
Пример 50: 5-(5-Метилизоксазол-3-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин
A. N-(6-Бромпиридин-2-ил)пиваламид. К смеси 6-бром-пиридин-2-иламина (100 г, 0,6 моль) и триэтиламина (70,5 г, 0,72 моль) в дихлорметане (200 мл) добавляли по каплям пивалоилхлорид (83,5 г, 0,72 моль) при комнатной температуре и реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь промывали водой, сушили над сульфатом натрия и упаривали с получением N-(6-бромпиридин-2-ил)пиваламида (120 г, выход 80,5%) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,11 (с, 1H), 8,04 (д, J=8,0 Гц, 1H), 7,68 (т, J=8,0 Гц, 1H), 7,28 (д, J=7,6 Гц, 1H), 1,19 (с, 9H); MS (ESI): m/z 257,1 [M+1]+.
B. N-(6-Формилпиридин-2-ил)пиваламид. Раствор N-(6-бромпиридин-2-ил)пиваламида (40 г, 0,16 моль) в толуоле охлаждали до 3-5°C и добавляли по каплям раствор изопропилмагнийхлорида в тетрагидрофуране (200 мл, 2 M) в течение 1 часа при температуре ниже 5°C. Полученную смесь перемешивали при 5°C в течение 12 часов и добавляли безводный N,N-диметилформамид (58,4 г, 0,8 моль) в течение 20 минут при 10~15°C и смесь перемешивали в течение 30 минут при 10~15°C. Реакцию гасили водой и полученную смесь экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали с получением N-(6-формилпиридин-2-ил)пиваламида (22 г, 68,8% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,16 (с, 1H), 9,90 (с, 1H), 8,29 (д, J=8,0 Гц, 1H), 7,99 (т, J=8,0 Гц, 1H), 7,64 (д, J=7,6 Гц, 1H), 1,25 (с, 9H); MS (ESI): m/z 207,1 [M+1]+.
C. N-(6-((Гидроксиимино)метил)пиридин-2-ил)пиваламид. К раствору гидроксида натрия (3,2 г, 0,08 моль) в смеси воды и этанола (об/об, 5:1) добавляли гидрохлорид гидроксиламина (5,6 г, 0,08 моль) и раствор N-(6-формилпиридин-2-ил)пиваламида (15 г, 0,073 моль) в этаноле (50 мл) при 0°C. Смесь перемешивали при 0°C в течение 4 часов и при комнатной температуре в течение 1 часа. Осадок собирали фильтрованием, промывали водой и этанолом с получением N-(6-((гидроксиимино)метил)пиридин-2-ил)пиваламида (15 г, 93,7% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,68 (с, 1H), 9,84 (с, 1H), 7,98 (м, 1H), 7,77 (т, J=8,0 Гц, 1H), 7,46 (д, J=7,6 Гц, 1H), 1,21 (с, 9H); MS (ESI): m/z 222,1 [M+1]+.
D. N-(6-(5-Метилизоксазол-3-ил)пиридин-2-ил)пиваламид. N-Хлорсукцинимид (3,3 г, 0,015 моль) добавляли по каплям к раствору N-(6-((гидроксиимино)метил)пиридин-2-ил)пиваламида (5 г, 0,02 ммоль) в N,N-диметилформамиде (40 мл) и смесь нагревали до 50°C в течение 1 часа. Медленно добавляли смесь проп-1-ен-2-илацетата (11 г, 0,1 моль) и триэтиламина (5,7 г, 0,056 моль) и реакционную смесь перемешивали при 50°C в течение ночи. Реакцию гасили путем добавления воды, смесь экстрагировали этилацетатом (15 мл ×3). Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 20% этилацетата в петролейном эфире) с получением N-(6-(5-метилизоксазол-3-ил)пиридин-2-ил)пиваламида (1,5 г, 25,8% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,15 (д, J=8,4 Гц, 1H), 7,93 (т, J=8,0 Гц, 1H), 7,70 (д, J=7,6 Гц, 1H), 6,72 (с, 1H), 2,51 (с, 1H), 1,34 (с, 9H); MS (ESI): m/z 260,1 [M+1]+.
E. 6-(5-Метилизоксазол-3-ил)пиридин-2-амин. Смесь N-(6-(5-метилизоксазол-3-ил)пиридин-2-ил)пиваламида (1,5 г, 5,8 ммоль) и водного раствора гидроксида калия (10 мл, 2 M) перемешивали при 100°C в течение 12 часов. Реакционную смесь экстрагировали этилацетатом и объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 50% этилацетата в петролейном эфире) с получением 6-(5-метилизоксазол-3-ил)пиридин-2-амина (450 мг, 47% выход) в виде белого твердого вещества.
F. 5-(5-Метилизоксазол-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин. Раствор 6-(5-метилизоксазол-3-ил)пиридин-2-амина (450 мг, 2,57 ммоль) и этоксикарбонилизотиоцианата (337 мг, 2,57 ммоль) в диоксане (10 мл) перемешивали при комнатной температуре в течение 5 часов. Растворитель удаляли при пониженном давлении с получением промежуточного тиоуреидо-соединения в виде твердого вещества, которое использовали непосредственно без дополнительной очистки.
К раствору гидрохлорида гидроксиламина (900 мг, 12,85 ммоль) и N,N-этилдиизопропиламина (994 мг, 7,71 ммоль) в смеси этанола и метанола (об/об, 1:1, 20 мл) добавляли тиоуреидо-соединение (786 мг, 2,57 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов и при 70°C в течение ночи. Летучие вещества удаляли при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 50% этилацетата в петролейном эфире) с получением 5-(5-метилизоксазол-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (200 мг, 36,2% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,54 (м, 2H), 7,39 (д, J=8,8 Гц, 1H), 7,13 (с, 1H), 6,18 (с, 2H), 2,52 (с, 3H); MS (ESI): m/z 216,2 [M+1]+.
G. 5-(5-Метилизоксазол-3-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К дегазированной смеси 5-(5-метилизоксазол-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (200 мг, 0,93 ммоль), иодбензола (190 мг, 0,93 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (108 мг, 0,186 ммоль) и трет-бутоксида натрия (108 мг, 1,1 ммоль) в диоксане (20 мл) добавляли трис(дибензилиденацетон)дипалладий(0) (84 мг, 0,093 ммоль) в атмосфере азота и смесь нагревали при 100°C в атмосфере азота в течение 2 часов. Реакцию гасили путем добавления воды и смесь экстрагировали этилацетатом (15 мл ×3). Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали. Остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (48-68% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 мин) с получением 5-(5-метилизоксазол-3-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль с использованием метанольного раствора гидрохлорида (75 мг, 27,8% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,73 (с, 1H), 7,71 (м, 4H), 7,56 (д, J=8,8, 1H), 7,29 (т, J=8,0, 2H), 7,22 (с, 1H), 6,88 (т, J=7,2, 1H), 2,57 (с, 3H); MS (ESI): m/z 291,9 [M+1]+.
Пример 51: N 4 -(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)пиридин-2,4-диамин
A. N-(4-(5-Фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)пиридин-2-ил)пиваламид. К дегазированной смеси 5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (200 мг, 0,95 ммоль), N-(4-хлорпиридин-2-ил)пиваламида (244 мг, 1,15 ммоль), трет-бутоксида натрия (184 мг, 1,92 ммоль) и (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила (120 мг, 0,19 ммоль) в толуоле (8 мл) добавляли трис(дибензилиденацетон) дипалладий(0)(88 мг, 0,10 ммоль) в атмосфере азота и реакционную смесь подвергали облучению в микроволновой печи (150 Вт) при 150°C в атмосфере азота в течение 1 часа. После фильтрования растворитель фильтрата удаляли с использованием роторного испарителя и остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (30-60%: ацетонитрил + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 17,2 минут) с получением N-(4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)пиридин-2-ил)пиваламида (52 мг, 14,2% выход) в виде белого твердого вещества. MS (ESI): m/z 387,1 [M+1]+.
B. N4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)пиридин-2,4-диамин. N-(4-(5-Фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)пиридин-2-ил)пиваламид (52 мг, 0,135 ммоль) растворяли в растворе гидроксида калия в этаноле (2 M, 5 мл) и смесь перемешивали при 90°C в атмосфере азота в течение ночи. Этанол удаляли с использованием роторного испарителя и остаток разбавляли водой. Водный слой экстрагировали этилацетатом пять раз. Органический слой объединяли, сушили над безводным сульфатом натрия, концентрировали в условиях высокого вакуума с получением N4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)пиридин-2,4-диамина (30 мг, 75% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,02 (м, 2H), 7,91 (д, J=6,0 Гц, 1H), 7,58 (м, 6H), 7,07 (м, 2H), 6,68 (м, 1H); MS (ESI): m/z 303,1 [M+1]+.
Пример 52: 4-(5-(3-Гидроксифенил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамид
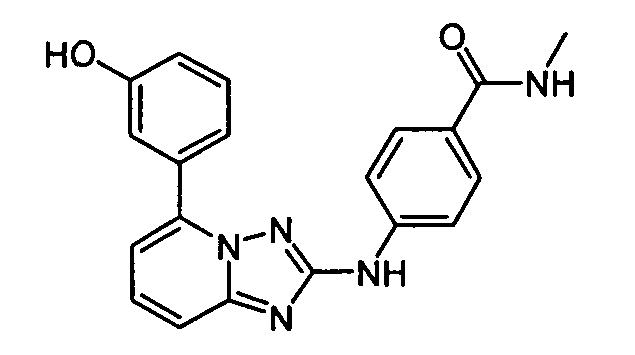
A. 4-(5-Бром-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид. К дегазированной смеси 5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амина (2,12 г, 10 ммоль), 4-иод-N-метилбензамида (2,87 г, 11 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (1,15 г, 2,0 ммоль) и трет-бутоксида натрия (1,92 г, 20 ммоль) в диоксане (30 мл) добавляли трис(дибензилиденацетон)дипалладий (0) (913 мг, 1 ммоль) и реакционную смесь нагревали при 90°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры реакционную смесь фильтровали и фильтрат концентрировали в вакууме с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 10-80% этилацетата в петролейном эфире) с получением 4-(5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамида (2,2 г, 64% выход). MS (ESI): m/z 347,7 [M+1]+.
B. 4-(5-(3-Гидроксифенил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамид. Смесь 4-(5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамида (104 мг, 0,3 ммоль), 3-гидрокси-фенилбороновой кислоты (82 мг, 0,6 ммоль), трифенилфосфина (16 мг, 0,06 ммоль) и фосфата калия (127 мг, 0,6 ммоль) в 1,2-диметоксиэтане (5 мл) дегазировали и добавляли ацетат палладия (7 мг, 0,03 ммоль) в атмосфере азота. Реакционную смесь нагревали до температуры кипения с обратным холодильником при 80°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры реакционную смесь распределяли между этилацетатом (20 мл) и водой (20 мл) и водный слой экстрагировали этилацетатом (20 мл ×3). Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали. Неочищенный продукт очищали при помощи обращенно-фазовой препаративной ВЭЖХ (20-55%: ацетонитрил + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислот, в течение 15 мин) с получением 4-(5-(3-гидроксифенил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамида в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль (30 мг, 30% выход). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,97 (т, J=8,8 Гц, 1H), 7,75 (м, 2H), 7,64 (дд, J1=1,2 Гц, J2=8,8 Гц, 1H), 7,61 (м, 2H), 7,46 (дд, J1=0,8 Гц, J2=7,6 Гц, 1H), 7,38 (м, 3H), 6,96 (м, 1H), 2,81 (с, 3H). MS (ESI): m/z 360,1 [M+1]+.
Пример 53: 2-(2-(4-Фторфениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1-фенилэтанол
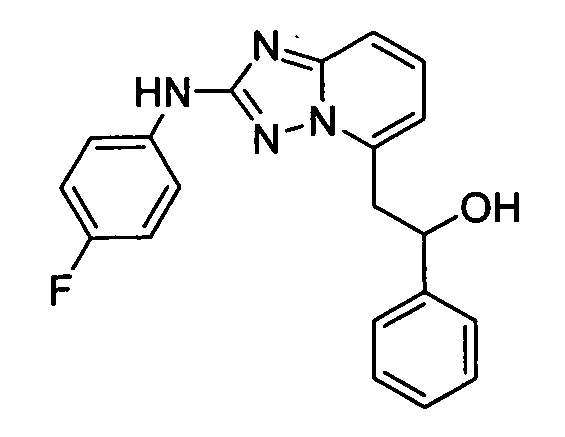
A. 2-(3-Этоксикарбонил-2-тиоуреидо)-6-метилпиридин. К раствору 6-метилпиридин-2-амина (5,0 г, 46,2 ммоль) в 1,4-диоксане (185 мл), охлажденному до 0°C, добавляли неразбавленный этоксикарбонилизотиоцианат (5,23 мл, 46,2 ммоль) по каплям. Бане давали расстаять и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь поддерживали при комнатной температуре в течение 48 часов. Растворитель удаляли при пониженном давлении. 2-(3-Этоксикарбонил-2-тиоуреидо)-6-метилпиридин выделяли в виде светло-желтого твердого вещества с количественным выходом и использовали без какой-либо дополнительной очистки (остаточный растворитель/реагент). MS (ESI): m/z 240,1 [M+1]+.
B. 5-Метил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К раствору гидрохлорида гидроксиламина (16,05 г, 231 ммоль) и N,N-диизопропилэтиламина (24,21 мл, 139 ммоль) в смеси метанола (50,0 мл) и этанола (50 мл) добавляли 2-(3-этоксикарбонил-2-тиоуреидо)-6-метилпиридин (11,06 г, 46,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении, добавляли воду (50 мл) и светло-желтую суспензию перемешивали при комнатной температуре в течение 30 минут. Когда все вещество переходило в раствор, неочищенное вещество экстрагировали в этилацетат. Экстракты сушили над сульфатом магния и упаривали досуха. Экстракты суспендировали в этилацетат (5 мл) и полученную белую суспензию собирали фильтрованием. Водная фаза также содержала некоторое количество продукта с примесью N,N-диизопропилэтиламина, но попытки дополнительной экстракции водной фазы диэтиловым эфиром или смесью метанола в диэтиловом эфире или этилацетате, чтобы получить какое-либо существенное количество вещества, не удались. 5-Метил-[1,2,4]триазоло[1,5-α]пиридин-2-амин (4,05 г, 27,3 ммоль, 59,2% выход) выделяли в виде белого твердого вещества. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,42 (т, 1H), 7,23 (д, J=8,20 Гц, 1H), 6,80 (д, J=7,42 Гц, 1H), 2,63 (с, 3H); MS (ESI): m/z 149,4 [M+1]+.
C. N-(4-Фторфенил)-5-метил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К суспензии 5-метил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (1 г, 6,75 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,781 г, 1,350 ммоль), трет-бутоксида натрия (1,297 г, 13,50 ммоль) и трис(дибензилиденацетон)дипалладия(0) (0,451 г, 0,492 ммоль) в 1,4-диоксане (40 мл) в атмосфере азота добавляли 1-фтор-4-иодбензол (1,557 мл, 13,50 ммоль). Реакционную смесь (темно-коричневая суспензия) перемешивали при комнатной температуре в течение 30 минут, затем при 40°C в течение 30 минут. Нагревание останавливали через 2 часа и реакцию гасили водой. Неочищенное вещество экстрагировали этилацетатом и сушили над сульфатом магния. Экстракты упаривали досуха (коричневое твердое вещество). Остаток суспендировали в дихлорметане и полученное светло-серое твердое вещество собирали фильтрованием и промывали дихлорметаном. Фильтрат концентрировали и полученный коричневого остаток суспендировали в минимальном объеме метанола (5 мл). Суспензию собирали фильтрованием и быстро промывали метанолом. N-(4-Фторфенил)-5-метил-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,839 г, 3,46 ммоль, 51,3% выход), с примесью около 10% дефторированного продукта выделяли в виде не совсем белого твердого вещества, которое сушили в вакууме и использовали без дополнительной очистки. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,59-7,73 (м, 2H), 7,43-7,54 (м, 1H), 7,20-7,39 (м, 2H), 7,02 (т, J=8,59 Гц, 2H), 6,86 (д, J=7,42 Гц, 1H), 2,73 (шир.с, 3H); 19F ЯМР (400 МГц, ДМСО-d6) δ (м.д.) -125,97; MS (ESI): m/z 243,3 [M+1]+.
D. 2-(2-(4-Фторфениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1-фенилэтанол. Суспензию N-(4-фторфенил)-5-метил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,15 г, 0,619 ммоль) в диэтиловом эфире (6,0 мл) охлаждали до 0°C. Затем добавляли по каплям раствор н-бутиллития в гексане (0,508 мл, 1,269 ммоль, 2,5 M). Реакционная смесь превращалась в коричневую более густую суспензию. Реакционную смесь перемешивали при 0°C в течение 30 минут, затем 30 минут при комнатной температуре. Реакционную смесь снова охлаждали до 0°C, затем добавляли бензальдегид (0,075 мл, 0,743 ммоль) в виде раствора в диэтиловом эфире (6,0 мл). По прошествии 1 часа при 0°C температуре давали медленно подняться до комнатной температуры и реакционную смесь перемешивали в течение ночи. Не наблюдали никакой дальнейшей конверсии после завершения добавления 1,1 эквивалентов бензальдегида. Реакцию гасили водой и неочищенное вещество экстрагировали этилацетатом. Экстракты сушили над сульфатом магния и упаривали досуха. Желтый остаток (2/3 вещества) очищали при помощи полу-препаративной ВЭЖХ (20-80% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 39 минут, 2 впрыска). Желаемые фракции нейтрализовали при помощи 1,75 M водного раствора карбоната калия и ацетонитрил удаляли при пониженном давлении, что приводило к осаждению продукта. 2-(2-(4-Фторфениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1-фенилэтанол (0,021 г, 0,060 ммоль, 9,74% выход) выделяли в виде белого твердого вещества, которое сушили в вакуумной печи в течение ночи. Непрореагировавшее исходное вещество выделяли (0,030 г). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,66 (с, 1H), 7,72-7,82 (м, 2H), 7,41-7,55 (м, 4H), 7,34-7,40 (м, 2H), 7,28 (д, J=7,42 Гц, 1H), 7,11-7,20 (м, 2H), 6,87 (дд, J=1,56, 6,64 Гц, 1H), 5,52 (д, J=4,69 Гц, 1H), 5,25-5,34 (м, 1H), 3,38-3,48 (м, 1H), 3,23-3,31 (м, 1H); 19F ЯМР (376 МГц, ДМСО-d6) δ (м.д.) -124,4; MS (ESI): m/z 349,2 [M+1]+.
Пример 54: 4-((2-(4-Фторфениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперидин-4-ол
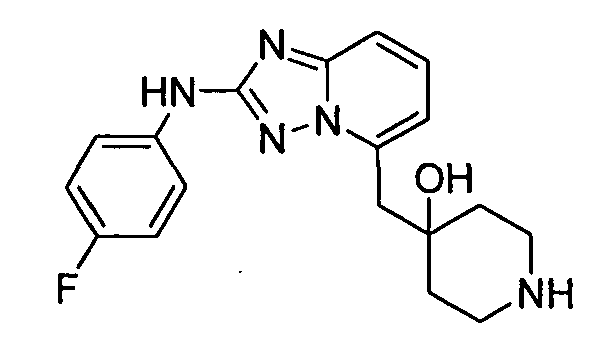
A. трет-Бутил 4-((2-(4-фторфениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)-4-гидроксипиперидин-1-карбоксилат. Суспензию N-(4-фторфенил)-5-метил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,15 г, 0,619 ммоль) в диэтиловом эфире (2,064 мл) охлаждали до 0°C. Затем добавляли по каплям раствор н-бутиллития в гексане (0,508 мл, 1,269 ммоль). Реакционная смесь превращалась в густую коричневую суспензию. Реакционную смесь перемешивали при 0°C в течение 30 минут, затем 30 минут при комнатной температуре. Температуру снова понижали до 0°C, затем добавляли трет-бутил 4-оксопиперидин-1-карбоксилат (0,123 г, 0,619 ммоль) в виде раствора в диэтиловом эфире (2,064 мл). По прошествии 30 минут при 0°C температуре давали медленно подняться до комнатной температуры и реакционную смесь перемешивали в течение ночи. Реакцию гасили водой и неочищенный продукт экстрагировали этилацетатом. Экстракты сушили над сульфатом натрия и упаривали досуха. Зеленый маслянистый остаток очищали колоночной хроматографией на силикагеле (элюируя при помощи 0-50% этилацетата в гексане). Желаемые фракции объединяли и упаривали досуха с получением трет-бутил 4-((2-(4-фторфениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)-4-гидроксипиперидин-1-карбоксилата (0,109 г, 0,247 ммоль, 39,9% выход) в виде белого твердого вещества, которое сушили в вакууме. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,57-7,64 (м, 2H), 7,48-7,54 (м, 1H), 7,36 (д, J=7,42 Гц, 1H), 6,98-7,06 (м, 2H), 6,93 (д, J=7,03 Гц, 1H), 3,74-3,83 (м, 2H), 3,37-3,43 (м, 2H), 3,05-3,21 (м, 2H), 1,63-1,74 (м, 2H), 1,49-1,60 (м, 2H), 1,38-1,44 (м, 8H), 1,31-1,34 (м, 1H), 1,26-1,30 (м, 1H); MS (ESI): m/z 442,5 [M+1]+.
B. 4-((2-(4-Фторфениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперидин-4-ол. трет-Бутил 4-((2-(4-фторфениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)-4-гидроксипиперидин-1-карбоксилат (0,109 г, 0,247 ммоль) растворяли в дихлорметане (5 мл) и обрабатывали при комнатной температуре неразбавленной трифторуксусной кислотой (1,5 мл, 19,47 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Растворители удаляли при пониженном давлении с получением желтого масла. Вещество очищали при помощи полу-препаративной ВЭЖХ (1 впрыск с использованием 20-80 и 3 впрыска с использованием 10-50% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 30 мин). Желаемые фракции объединяли и нейтрализовали с использованием колонки с ионообменной смолой. 4-((2-(4-Фторфениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперидин-4-ол (0,073 г, 0,214 ммоль, 87% выход) выделяли в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,61 (с, 1H), 7,67-7,77 (м, 2H), 7,47-7,56 (м, 1H), 7,39-7,47 (м, 1H), 7,08-7,18 (м, 2H), 6,96 (д, J=5,86 Гц, 1H), 4,64 (с, 1H), 3,29 (с, 2H), 2,69-2,79 (м, 2H), 2,57-2,69 (м, 2H), 1,42-1,55 (м, 2H), 1,32-1,42 (м, 2H); 19F ЯМР (376 МГц, ДМСО-d6) δ (м.д.) -124,5; MS (ESI): m/z 342,2 [M+1]+.
Пример 55: N 1 -(4-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пиридин-2-ил)этан-1,2-диамин
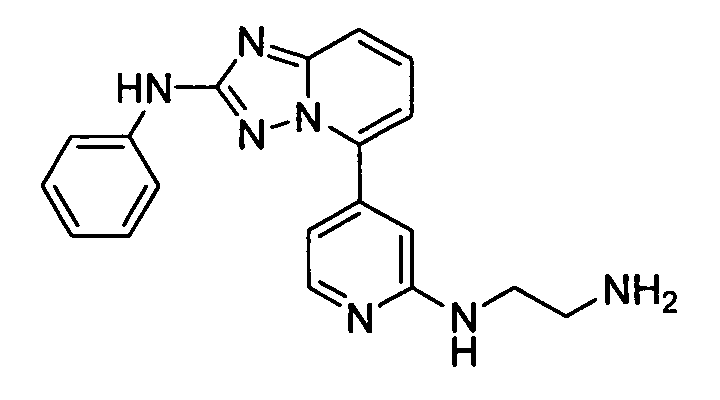
A. 5-(2-Фторпиридин-4-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин. 5-Бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,44 г, 1,522 ммоль), 2-фторпиридин-4-илбороновую кислоту (0,257 г, 1,826 ммоль), раствор 1M карбоната натрия (4,57 мл, 4,57 ммоль), дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий(II) в виде аддукта присоединения с дихлорметаном (0,037 г, 0,046 ммоль) и диоксан (10 мл) нагревали до 100°C в течение 5 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и затем фильтровали. Это твердое вещество промывали метанолом с получением 5-(2-фторпиридин-4-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,29 г, 62% выход) в виде зеленого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,76 (с, 1H), 8,50 (д, J=5,1 Гц, 1H), 8,09 (д, J=5,1 Гц, 1H), 8,00 (с, 1H), 7,67-7,78 (м, 4H), 7,48 (дд, J=6,2, 2,3 Гц, 1H), 7,28 (т, J=8,0 Гц, 2H), 6,89 (т, J=7,2 Гц, 1H). MS (ESI) m/z 306,1 [M+1]+.
B. N1-(4-(2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пиридин-2-ил)этан-1,2-диамин. 5-(2-Фторпиридин-4-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин (90 мг, 0,295 ммоль), N,N-диметилформамид (1,5 мл) и этан-1,2-диамин (0,030 мл, 0,442 ммоль) нагревали до 80°C в течение 16 часов в атмосфере азота. Реакционную смесь очищали при помощи обращенно-фазовой ВЭЖХ (10-70% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 мин). Фракции, содержащие продукт, пропускали через Strata колонку для удаления трифторуксусной кислоты и затем выделяли при помощи 2M раствора аммиака в метаноле с получением N1-(4-(2-(фениламино)-[1,2,4]триазоло[1,5-ύi]пиридин-5-ил)пиридин-2-ил)этан-1,2-диамина (96 мг, 32% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,69 (с, 1H), 8,15 (д, J=5,5 Гц, 1H), 7,69 (дд, J=8,6, 1,2 Гц, 2H), 7,60-7,67 (м, 2H), 7,27 (т, J=7,8 Гц, 2H), 7,20 (дд, J=6,4, 2,1 Гц, 1H), 7,10 (с, 1H), 6,99-7,04 (м, 1H), 6,87 (т, J=7,2 Гц, 1H), 6,80 (т, J=5,5 Гц, 1H), 3,30 (д, J=6,4 Гц, 2H), 2,73 (т, J=6,4 Гц, 2H). MS (ESI) m/z 346,0 [M+1]+.
Пример 56: 3-((2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)бензамид
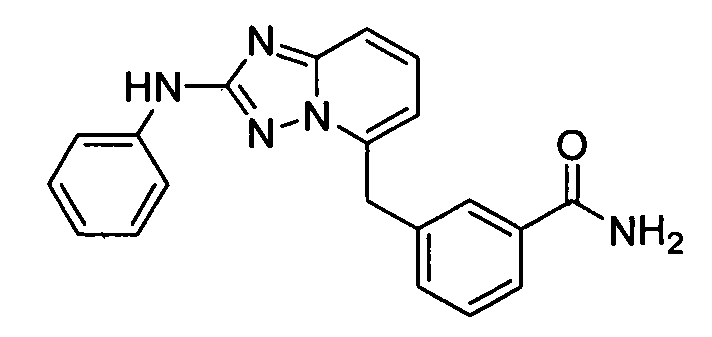
A. 3-((2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)бензонитрил. Получение органоцинковой суспензии: в атмосфере азота цинковый порошок (0,654 г, 10,000 ммоль) суспендировали в тетрагидрофуране (3 мл) и обрабатывали 1,2-дибромэтаном (0,080 мл, 0,865 ммоль). Смесь нагревали до температуры кипения с обратным холодильником в течение 5 минут и охлаждали до комнатной температуры. Затем добавляли неразбавленный триметилсилилхлорид (0,120 мл, 0,940 ммоль) с последующим добавлением раствора 3-(бромметил)бензонитрила (0,980 г, 5,000 ммоль) в тетрагидрофуране (20 мл) в течение 15 минут. Реакционную смесь перемешивали при комнатной температуре в течение 20 минут. В атмосфере азота отвешивали палладий тетракистрифенилфосфин (0,5 г, 0,433 ммоль) и 5-бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,25 г, 0,865 ммоль). Добавляли тетрагидрофуран (10 мл) с последующим добавлением 20 мл органоцинкового раствора, описанного выше. Реакционную смесь перемешивали при 65°C в течение 1 часа, что приводило к конверсии около 50%, согласно данным ЖХ/МС. Затем добавляли остальное количество органоцинковой суспензии и реакционную смесь перемешивали при температуре кипения растворителя в течение ночи. Поскольку конверсия была полной, реакцию гасили насыщенным раствором бикарбоната натрия и экстрагировали этилацетатом. Экстракты сушили над сульфатом натрия и упаривали досуха. Очистку осуществляли при помощи колоночной хроматографии на силикагеле с использованием 50% этилацетата в гексане. 3-((2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)бензонитрил (0,150г, 0,461 ммоль, 53,3% выход) с примесью продукта восстановления в следовых количествах выделяли в виде желтого масла, которое использовали без дополнительной очистки. MS (ESI): m/z 326,1 [M+1]+.
B. 3-((2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)бензамид. К суспензии 3-((2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)бензонитрила (0,150 г, 0,461 ммоль) в этаноле (3,0 мл) добавляли по каплям при комнатной температуре пероксид водорода (3,0 мл, 98 ммоль) и 6,0 н водный раствор гидроксида натрия (0,03 мл, 0,180 ммоль). Суспензию затем нагревали до 45°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и обрабатывали при помощи 0,05 мл 6,0 н водного раствора HCl. Добавляли воду (20 мл) и образовавшийся осадок собирали и промывали водой. Продукт, растворенный в 6 мл диметилсульфоксида, очищали при помощи полу-препаративной ВЭЖХ (20-80% затем 30-80% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 30 минут, 4 впрыска). Желаемые фракции нейтрализовали при помощи 1,75 M водного раствора карбоната калия. Продукт осаждался после удаления ацетонитрила. Осадок собирали фильтрованием и промывали водой до тех пор, пока pH промывок не становился нейтральным. 3-((2-(Фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)бензамид (0,055 г, 0,160 ммоль, 34,7% выход) выделяли в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,60 (шир.с, 1H), 7,95 (д, J=16,40 Гц, 2H), 7,62-7,81 (м, 3H), 7,08-7,59 (м, 7H), 6,88 (д, J=6,64 Гц, 2H), 3,35 (с, 2H); MS (ESI): m/z 344,3 [M+1]+.
Пример 57: 3-(2-(1-метил-1H-бензо[d][1,2,3]триазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)фенол
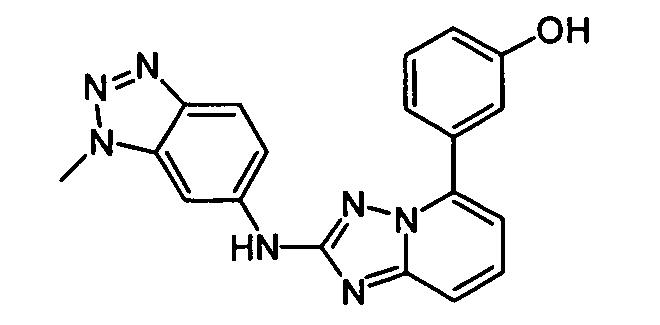
A. N-(5-(3-метоксифенил)-[1,2,4]триазоло[1,5-a]пиридин-2-ил)-1-метил-1H-бензо[d][1,2,3]триазол-6-амин. К дегазированной смеси 6-бром-1-метил-1Н-бензо[d][1,2,3]триазола (126 мг 0,6 ммоль), 5-(3-метоксифенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (144 мг, 0,6 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (69 мг, 0,12 ммоль) и карбоната цезия (390 мг, 1,2 ммоль) в диоксане (3 мл) добавляли трис(дибензилиденацетон)палладий(0) (55 мг 0,06 ммоль) в атмосфере азота и смесь нагревали при 100°C при перемешивании в атмосфере азота в течение ночи. Смесь фильтровали и промывали водой (20 мл), затем промывали метанолом (20 мл) с получением неочищенного N-(5-(3-метоксифенил)-[1,2,4]триазоло[1,5-α]пиридин-2-ил)-1-метил-1H-бензо[d][1,2,3]триазол-6-амина (80 мг, 36% выход), который использовали на следующей стадии без дополнительной очистки. MS (ESI): m/z 372,0 [M+1]+.
B. 3-(2-(1-метил-1Н-бензо[d][1,2,3]триазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)фенол. Смесь N-(5-(3-метоксифенил)-[1,2,4]триазоло[1,5-α]пиридин-2-ил)-1-метил-1H-бензо[d][1,2,3]триазол-6-амина (80 мг, 0,21 ммоль) и иодида натрия (65 мг, 0,42 ммоль) в растворе бромистого водорода (6 мл, 48%) нагревали при 80°C в герметично закрытом сосуде в течение ночи. После охлаждения до комнатной температуры раствор нейтрализовали до pΗ=7~8 насыщенным раствором бикарбоната натрия. Осадок собирали фильтрованием, очищали при помощи обращенно-фазовой препаративной ВЭЖХ (28-58%: ацетонитрил + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 мин) с получением 3-(2-(1-метил-1H-бензо[d][1,2,3]триазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)фенола в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль. (30 мг, 39% выход). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,32 (д, J=2,0 Гц, 1H), 8,04 (т, J=8,0 Гц, 1H), 7,86 (д, J=9,2 Гц, 1H), 7,72 (д, J=8,8 Гц, 1H), 7,55 (м, 2H), 7,40 (м, 3H), 7,01 (д, J=7,2 Гц, 1H), 4,19 (с, 3H); MS (ESI): m/z 358,1 [M+1]+.
Пример 58: 5-(2-((Метиламино)метил)бензо[d]оксазол-6-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин
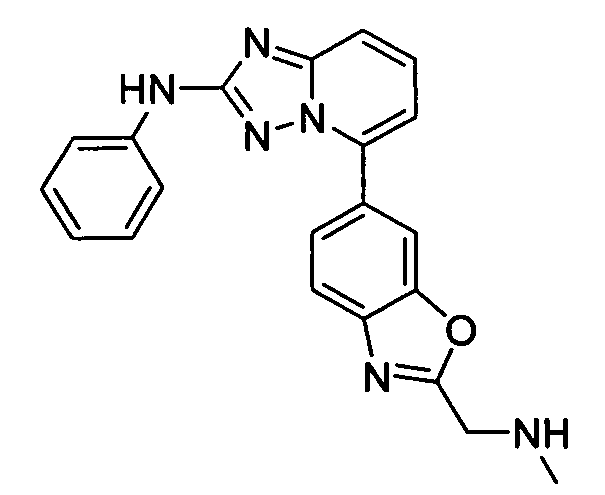
A. Гидрохлорид 5-(4-амино-3-метоксифенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина. 5-Бром-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,631 г, 2,184 ммоль), 4-(трет-бутоксикарбониламино)-3-метоксифенилбороновую кислоту (0,7 г, 2,62 ммоль), раствор 1M карбоната натрия (6,55 мл, 6,55 ммоль), дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий(II) в виде продукта присоединения с дихлорметаном (0,054 г, 0,066 ммоль) и диоксан (20 мл) нагревали до 80°C в течение 5 часов в атмосфере азота. Реакционную смесь концентрировали и очищали на колонке с силикагелем (0-70% этилацетата в гексане). Фракции, содержащие продукт, концентрировали и затем перемешивали с 4н раствором хлористого водорода в диоксане (4 мл) в течение 4 часов при комнатной температуре. Реакционную смесь концентрировали и затем растирали в порошок с 10% раствором метанола в простом эфире с получением светло-желтого твердого вещества (0,56 г, 1,522 ммоль, 69,7% выход). MS (ESI) m/z 332,3 [M+1]+.
B. 2-Амино-5-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)фенол. Гидрохлорид 5-(4-амино-3-метоксифенил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,43 г, 1,169 ммоль), дихлорметан (10 мл) и 1M раствор трибромида бора (3,51 мл, 3,51 ммоль в дихлорметане) перемешивали при комнатной температуре в течение 20 часов. Реакцию гасили метанолом и затем концентрировали. Остаток растирали в порошок в 10% растворе этилацетата в гексане с получением темного твердого вещества. MS (ESI) m/z 318,3 [M+1]+.
C. 5-(2-((Метиламино)метил)бензо[d]оксазол-6-ил)-N-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-амин. 2-(трет-Бутоксикарбонил(метил)амино)уксусную кислоту (0,143 г, 0,756 ммоль), триэтиламин (0,316 мл, 2,269 ммоль), O-бензотриазол-N,N,N',N'-тетраметил-уроний-гексафторфосфат (0,574 г, 1,513 ммоль) и N,N-диметилформамид (3 мл) перемешивали вместе в течение 15 минут, затем к реакционной смеси добавляли 2-амино-5-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)фенол (0,24 г, 0,756 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов с получением желаемого продукта с уже удаленной защитой. Реакционную смесь концентрировали и затем очищали на колонке с силикагелем (0-100% этилацетата в гексане). Смесь, содержащую продукт, концентрировали и затем растирали в порошок в минимальном количестве метанола и затем фильтровали с получением желаемого продукта в виде белого твердого вещества (0,015 г, 0,040 ммоль, 5,35% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,65 (с, 1H), 8,22 (д, J=1,6 Гц, 1H), 7,88 (дд, J=8,2, 1,6 Гц, 1H), 7,71 (д, J=7,8 Гц, 2H), 7,63 (д, J=7,0 Гц, 1H), 7,50-7,59 (м, 1H), 7,43 (д, J=8,2 Гц, 1H), 7,17-7,31 (м, 3H), 6,86 (т, J=7,2 Гц, 1H), 3,20 (с, 6H). MS (ESI) m/z 371,4 [M+1]+.
Пример 59: цис-2-(4-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексил)пропан-2-ол
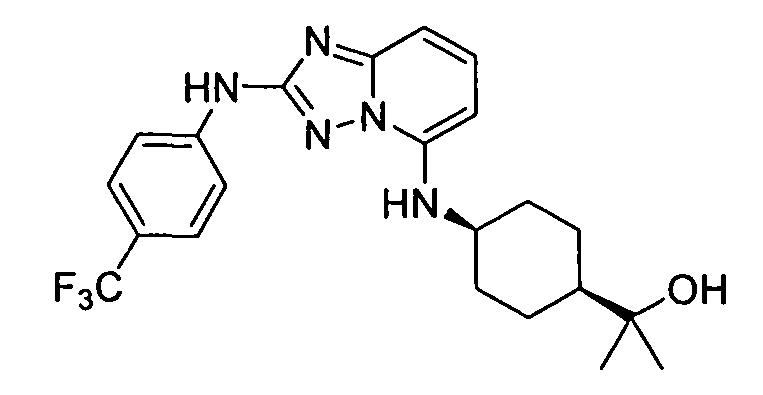
A. цис-Этил 4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанкарбоксилат. 5-Бром-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,1 г, 0,280 ммоль), цис-этил 4-аминоциклогексанкарбоксилат гидрохлорид (0,076 г, 0,364 ммоль), карбонат цезия (0,274 г, 0,840 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0,032 г, 0,056 ммоль), трис(дибензилиденацетон)палладий(0) (0,026 г, 0,028 ммоль) и диоксан (5 мл) нагревали до 90°C в атмосфере азота в течение 16 часов. Реакционную смесь фильтровали и затем концентрировали. Остаток очищали при помощи хроматографии на силикагеле (0-50% этилацетата в гексане) с получением белого твердого вещества (0,1 г, 0,223 ммоль, 80% выход). MS (ESI) m/z 448,3 [M+1]+.
B. цис-2-(4-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексил)пропан-2-ол. цис-Этил 4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанкарбоксилат (0,1 г, 0,223 ммоль) растворяли в тетрагидрофуране (1 мл) и затем охлаждали до -78°C в атмосфере азота. Добавляли метилмагнийбромид (0,745 мл, 2,235 ммоль, 3M в диэтиловом эфире) и реакционной смеси давали нагреться до комнатной температуры в течение 18 часов. Реакцию гасили насыщенным раствором хлорида аммония и затем экстрагировали этилацетатом. Органический слой сушили над сульфатом магния, фильтровали и затем концентрировали. Остаток очищали при помощи обращенно-фазовой ВЭЖХ (10-100% ацетонитрила и вода с 0,1% трифторуксусной кислоты). Фракции, содержащие продукт, пропускали через ионообменную колонку и затем выделяли с использованием 2M аммиака в метаноле. Элюент концентрировали и затем растирали в порошок в гексане с получением белого твердого вещества (0,045 г, 0,104 ммоль, 46,5% выход). 1H (400 МГц, ДМСО-d6) δ (м.д.) 10,12 (с, 1H), 7,89 (м, J=8,6 Гц, 2H), 7,60 (м, J=8,6 Гц, 2H), 7,48 (т, J=8,4 Гц, 1H), 6,83 (д, J=8,6 Гц, 1H), 6,25 (д, J=7,8 Гц, 1H), 5,89 (д, J=8,2 Гц, 1H), 4,16 (с, 1H), 3,97 (шир.с, 1H), 1,98 (д, J=12,9 Гц, 2H), 1,71 (д, J=12,9 Гц, 2H), 1,62 (т, J=13,1 Гц, 2H), 1,18-1,40 (м, 3H), 1,08 (с, 6H). MS (ESI) m/z 434,5 [M+1]+.
Пример 60: N 6 -(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)-N 3 -(пиперидин-4-ил)-1H-индазол-3,6-диамин

A. 2-Фтор-4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензонитрил. Смесь 5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (300 мг, 1,43 ммоль), 4-бром-2-фторбензонитрила (314 мг, 1,57 ммоль), карбоната цезия (928 мг, 2,86 ммоль), трис(дибензилиденацетон)дипалладия(0) (240 мг, 0,28 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (324 мг, 0,56 ммоль) в диоксане (10 мл) нагревали при 120°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры реакционную смесь фильтровали и фильтрат упаривали при пониженном давлении. Остаток очищали при помощи препаративной ТСХ с получением 2-фтор-4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензонитрила (38 мг, 8% выход) в виде твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 10,66 (с, 1H), 8,00 (д, J=3,9 Гц, 2H), 7,92 (м, 1H), 7,74 (м, 3H), 7,57 (м, 3H), 7,46 (д, J=9,0 Гц, 1H), 7,27 (м, 1H); MS (ESI): m/z 330,1 [M+1]+.
B. N6-(5-Фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)-1Н-индазол-3,6-диамин. Смесь 2-фтор-4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензонитрила (200 мг, 0,61 ммоль) и гидразингидрата (0,10 мл) в н-бутаноле (4 мл) перемешивали при 120°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры осадок собирали фильтрованием, промывали метанолом и сушили в вакууме с получением N6-(5-Фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)-1Н-индазол-3,6-диамина (60 мг, 29% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,11 (шир.с, 1H), 9,67 (шир.с, 1H), 8,04 (д, J=7,2 Гц, 2H), 7,81 (с, 1H), 7,62 (м, 5H), 7,46 (д, J=6,8 Гц, 1H), 7,18 (д, J=6,8 Гц, 1H), 6,98 (д, J=8,4 Гц, 1H), 5,15 (шир.с, 2H); MS (ESI): m/z 341,9 [M+1]+.
C. трет-Бутил 4-(6-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1Н-индазол-3-иламино)пиперидин-1-карбоксилат. К смеси N6-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)-1H-индазол-3,6-диамина (350 мг, 1,02 ммоль) в смеси уксусной кислоты и метанола (1:20, 40 мл) добавляли трет-бутил 4-оксопиперидин-1-карбоксилат (300 мг, 1,5 ммоль) и смесь перемешивали при комнатной температуре в течение 10 минут. Смесь охлаждали до 0°C и добавляли цианоборогидрид натрия (130 мг, 2,01 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, концентрировали при пониженном давлении и очищали на колонке с силикагелем (элюируя при помощи 30% этилацетата в петролейном эфире) и при помощи обращенно-фазовой препаративной ВЭЖХ (30-60% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты) с получением желаемого трет-бутил 4-(6-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1H-индазол-3-иламино)пиперидин-1-карбоксилата (70 мг, 13% выход) в виде твердого вещества. MS (ESI): m/z 525,1 [M+1]+.
D. N6-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)-N3-(пиперидин-4-ил)-1H-индазол-3,6-диамин. Раствор трет-бутил 4-(6-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1H-индазол-3-иламино)пиперидин-1-карбоксилата (70 мг, 0,13 ммоль) в метанольном растворе гидрохлорида (2 M, 5 мл) перемешивали при комнатной температуре в течение 1 часа. Полученную смесь концентрировали при пониженном давлении с получением N6-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)-N3-(пиперидин-4-ил)-1H-индазол-3,6-диамина в виде гидрохлоридной соли (55 мг, 98% выход). 1H ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 12,84 (шир.с, 1H), 10,31 (с, 1H), 9,16 (шир.с, 2H), 8,07 (м, 4H), 7,73 (м, 5H), 7,28 (м, 2H), 3,41 (м, 2H), 3,03 (м, 2H), 2,19 (м, 2H), 1,73 (м, 2H); MS (ESI): m/z 425,1 [M+1]+.
Пример 61: N 6 -(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)хинолин-2,6-диамин
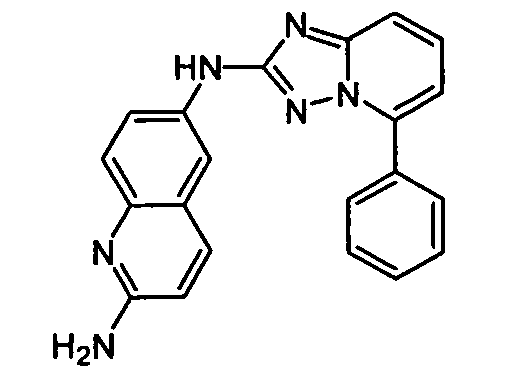
A. N6-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)хинолин-2,6-диамин. N2-(4-метокси-бензил)-N5-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)-хинолин-2,6-диамин получали, следуя такой же процедуре, которую использовали для получения 5-фенил-N-(1-(тетрагидро-2H-пиран-2-ил)-1H-индазол-6-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина из 2-бром-5-фенил-[1,2,4]триазоло[1,5-α]пиридина и N2-(4-метоксибензил)хинолин-2,6-диамина, с использованием трет-бутоксида калия в качестве основания и нагревания до 100°C. Раствор N2-(4-метокси-бензил)-N6-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)-хинолин-2,6-диамина (40 мг, 0,085 ммоль) в трифторуксусной кислоте (10 мл) перемешивали при 50°C в течение 1 часа. Реакционную смесь упаривали при пониженном давлении и остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (элюируя при помощи 31-61% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 10 мин) с получением N6-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)хинолин-2,6-диамина (28 мг, 93% выход), который преобразовывали в гидрохлоридную соль, в виде желтого твердого вещества. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,22 (с, 1H), 8,16 (м, 4H), 7,91 (д, J=8,8 Гц, 1H), 7,81 (д, J=8,8 Гц, 1H), 7,69 (м, 5H), 7,11 (д, J=9,2 Гц, 1H); MS (ESI): m/z 353,1 [M+1]+.
Пример 62: цис-4-(2-(4-Фторфениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-илокси)циклогексанол
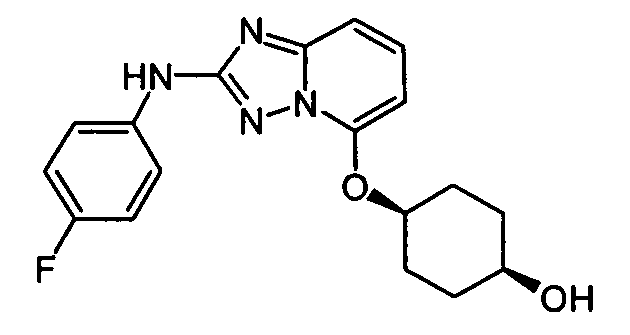
A. 2,5-Дибром-[1,2,4]триазоло[1,5-α]пиридин. К 5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амину (2 г, 9,39 ммоль) добавляли 48% раствор бромистоводородной кислоты (20 мл). Белую суспензию перемешивали в течение 5 минут и охлаждали до 0°C. Медленно добавляли нитрат натрия (1,943 г, 28,2 ммоль) в воде (9 мл) (происходила генерация коричневого газа). По завершении добавления коричневую суспензию перемешивали при 0°C в течение 30 минут и затем давали нагреться до комнатной температуры. Добавляли бромид меди(I) (2,69 г, 18,78 ммоль) в 48% растворе бромистоводородной кислоты (10 мл), и реакционная смесь превращалась в черную суспензию. Суспензию перемешивали при комнатной температуре в течение 3 часов и добавляли воду (100 мл). Реакционную смесь фильтровали через целит и водный слой экстрагировали этилацетатом (3×100 мл). Объединенные Органические слои промывали бикарбонатом натрия (100 мл, насыщенный раствор) и насыщенным солевым раствором (100 мл), сушили над сульфатом магния, фильтровали и концентрировали с получением 2,5-дибром-[1,2,4]триазоло[1,5-α]пиридина (1,8 г, 69,2% выход) в виде светло-желтого твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,70 (д, J=8,59 Гц, 1H), 7,42-7,53 (м, 1H), 7,33 (д, J=7,03 Гц, 1H). MS (ESI): m/z 278,2 [M+1]+.
B. цис-2-Бром-5-(4-(трет-бутилдиметилсилилокси)циклогексилокси)-[1,2,4]триазоло[1,5-α]пиридин. К раствору цис-4-(трет-бутилдиметилсилилокси)циклогексанола (200 мг, 0,87 ммоль) в N,N-диметилформамине (5 мл) добавляли гидрид натрия (52 мг, 1,31 ммоль) по порциям при 0°C. По завершении добавления смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли 2,5-дибром-[1,2,4]триазоло[1,5-α]пиридин (239 мг, 0,87 ммоль) и полученную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду и раствор экстрагировали этилацетатом. Объединенный органический слой концентрировали, промывали два раза насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия и концентрировали. Остаток очищали при помощи препаративной ТСХ (элюируя при помощи 30% этилацетата в петролейном эфире) с получением цис-2-бром-5-(4-(трет-бутилдиметилсилилокси)циклогексилокси)-[1,2,4]триазоло[1,5-α]пиридина (115 мг, 31,1% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,68 (т, J=8,4 Гц, 1H), 7,33 (д, J=8,8 Гц, 1H), 6,81 (д, J=8,0 Гц, 1H), 4,84 (м, 1H), 3,88 (м, 1H), 1,92 (м, 4H), 1,64 (м, 4H), 0,87 (с, 1H), 0,04 (с, 6H); MS (ESI): m/z 426,0 [M+1]+.
C. цис-5-(4-(трет-бутилдиметилсилилокси)циклогексилокси)-N-(4-фторфенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Смесь цис-2-Бром-5-(4-(трет-бутилдиметилсилилокси)циклогексилокси)-[1,2,4]триазоло[1,5-α]пиридина (110 мг, 0,26 ммоль), 4-фтор-фениламина (35 мг, 0,31 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (30 мг, 0,052 ммоль) и трет-бутоксида калия (58 мг, 0,52 ммоль) в диоксане (10 мл) дегазировали и добавляли трис(дибензилиденацетон)дипалладий(0) (24 мг, 0,026 ммоль) в атмосфере азота. Смесь перемешивали при 100°C в атмосфере азота в течение ночи. После концентрирования остаток разбавляли метанолом и фильтровали. Фильтрат концентрировали при пониженном давлении и очищали при помощи препаративной ТСХ (элюируя при помощи 30% этилацетата в петролейном эфире) с получением цис-5-(4-(трет-бутилдиметилсилилокси)циклогексилокси)-N-(4-фторфенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (110 мг, 93,2% выход) в виде твердого вещества. MS (ESI): m/z 457,3 [M+1]+.
D. цис-4-(2-(4-Фторфениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-илокси)циклогексанол. Раствор цис-5-(4-(трет-бутилдиметилсилилокси)циклогексилокси)-N-(4-фторфенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (100 мг, 0,22 ммоль) в метанольном растворе гидрохлорида (2 M, 20 мл) перемешивали при 50°C в течение 10 минут. Раствор концентрировали при пониженном давлении и остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (30-60% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 10 мин) с получением цис-4-(2-(4-фторфениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-илокси)циклогексанола в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль (58 мг, 77,3% выход). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,99 (т, J=8,4 Гц, 1H), 7,66 (м, 2H), 7,29 (д, J=8,4 Гц, 1H), 7,17 (т, J=8,8 Гц, 2H), 7,06 (д, J=8,4 Гц, 1H), 5,03 (м, 1H), 3,82 (м, 1H), 2,19 (м, 2H), 1,91 (м, 6H); MS (ESI): m/z 343,1 [M+1]+.
Пример 63: 3-(2-(4-(Аминометил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)фенол
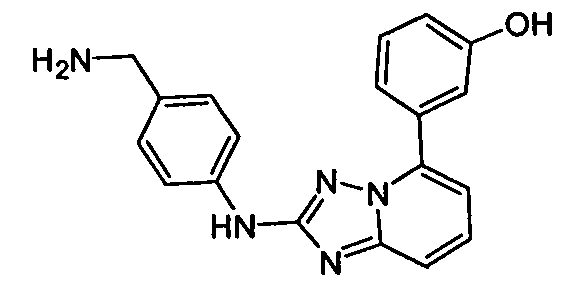
A. 4-(5-(3-Гидроксифенил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензонитрил. К дегазированной смеси 4-(5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензонитрила (160 мг, 0,51 ммоль) и 3-гидроксифенилбороновой кислоты (99 мг, 0,72 ммоль) в диметилсульфоксиде (5 мл) добавляли тетракис(трифенилфосфин)палладий(0) (59 мг, 0,05 ммоль) и фосфат калия (0,5 мл, 2 M). Смесь нагревали при кипячении с обратным холодильником в атмосфере азота в течение ночи. После охлаждения до комнатной температуры реакционную смесь фильтровали, фильтрат концентрировали при пониженном давлении с получением неочищенного продукта, который очищали при помощи препаративной ТСХ (элюируя при помощи 2% метанола в дихлорметане), с получением 4-(5-(3-гидроксифенил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензонитрила (60 мг, 36% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,22 (с, 1H), 9,68 (с, 1H), 7,73 (м, 1H), 7,537 (м, 6H), 7,27 (м, 2H), 7,06 (м, 1H), 6,85 (м, 1H); MS (ESI): m/z 328,1 [M+1]+.
B. 3-(2-(4-(Аминометил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)фенол. Смесь 4-(5-(3-гидроксифенил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензонитрила (60 мг, 0,18 ммоль) и никеля Ренея (20 мг) в метаноле (10 мл) гидрировали под давлением водорода 1 атм в течение 1 часа. Катализатор отфильтровывали и фильтрат концентрировали. Остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (10-65% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 мин) с получением 3-(2-(4-(аминометил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)фенола в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль (45 мг, 74% выход) с использованием метанольного раствора гидрохлорида. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,78 (с, 1H), 8,14 (шир.с, 2H), 7,70 (м, 2H), 7,57 (м, 1H), 7,63 (м, 1H), 7,39 (м, 5H), 7,13 (м, 1H), 6,95 (м, 1H), 3,91 (с, 2H); MS (ESI): m/z 332,1 [M+1]+.
Пример 64: N-Фенил-5-(2-(пирролидин-1-илметил)-1H-бензо[d]имидазол-6-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин
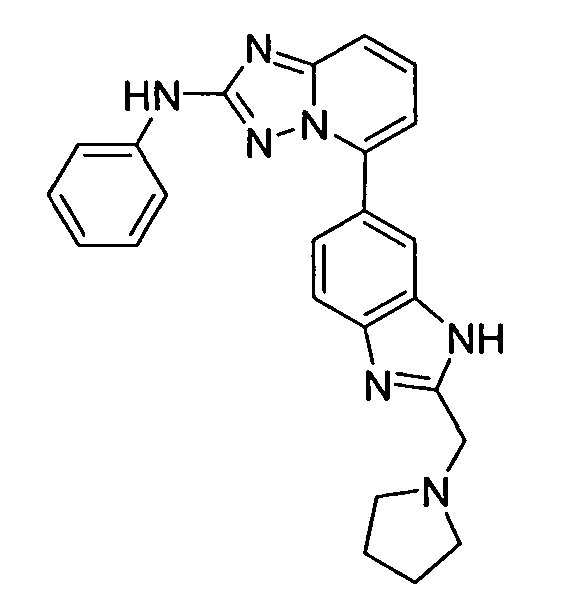
A. 2-(Пирролидин-1-ил)уксусная кислота. 2-Хлоруксусную кислоту (3,66 г, 38,7 ммоль), раствор 1M гидроксида натрия (77 мл, 77 ммоль) и пирролидин (3,20 мл, 38,7 ммоль) перемешивали вместе при комнатной температуре в течение 3 дней. Реакционную смесь концентрировали и остаток фильтровали с горячим этанолом. Фильтрат концентрировали и затем растирали в порошок с этилацетатом с получением 2-(пирролидин-1-ил)уксусной кислоты (4,4 г, 88% выход) в виде белого твердого вещества. MS (ESI) m/z 130,1 [M+1]+.
B. N-Фенил-5-(2-(пирролидин-1-илметил)-1Н-бензо[d]имидазол-6-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. 2-(Пирролидин-1-ил)уксусную кислоту (0,104 г, 0,806 ммоль), O-бензотриазол-N,N,N',N'-тетраметил-уроний-гексафторфосфат (0,224 г, 0,591 ммоль), триэтиламин (0,225 мл, 1,612 ммоль) и ацетонитрил (3 мл) перемешивали при комнатной температуре в течение 10 минут. К реакционной смеси добавляли 4-(2-(фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензол-1,2-диамин (0,17 г, 0,537 ммоль) и затем перемешивали при комнатной температуре в течение 16 часов. Твердое вещество отфильтровывали из реакционной смеси и фильтрат концентрировали. К остатку из фильтрата добавляли 50% раствор трифторуксусной кислоты в ледяной уксусной кислоте и затем нагревали в микроволновой печи (200°C, 20 мин). Реакционную смесь концентрировали и затем очищали при помощи обращенно-фазовой ВЭЖХ (элюируя при помощи 5-40% ацетонитрила и воды +0,1% трифторуксусной кислоты). Фракции, содержащие продукт, пропускали через Strata колонку для удаления трифторуксусной кислоты. Основный продукт выделяли из колонки с использованием 2M аммиака в метаноле с получением N-фенил-5-(2-(пирролидин-1-илметил)-1Н-бензо[d]имидазол-6-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,027 г, 12% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,63 (с, 1H), 7,70 (дд, J=8,6, 1,2 Гц, 2H), 7,67 (д, J=7,4 Гц, 1H), 7,64 (д, J=7,0 Гц, 1H), 7,52-7,58 (м, 1H), 7,25 (т, J=7,8 Гц, 2H), 7,20 (дд, J=7,4 Гц, 1,2, 1H), 6,85 (т, J=7,2 Гц, 1H), 3,89 (с, 2H), 2,53-2,62 (м, 4H), 1,76 (ддд, J=6,4 Гц, 3,1, 2,9, 4H). MS (ESI) m/z 410,4 [M+1]+.
Пример 65: 6-(5-Фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)хинолин-2-ол
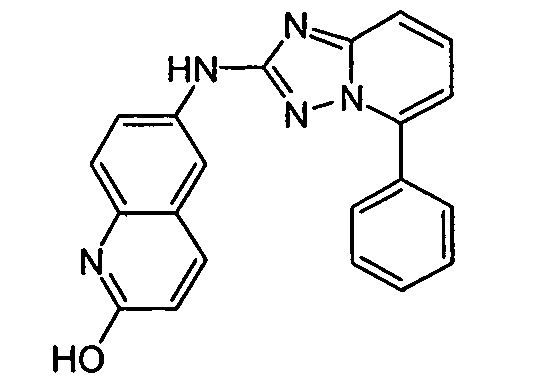
A. 6-(5-Фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)хинолин-2-ол. 2-Метокси-N-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)хинолин-6-амин синтезировали из 5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина и 6-бром-2-метокси-хинолина в соответствии с процедурой, описанной для получения N,5-дифенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина. Смесь 2-метокси-N-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-ил)хинолин-6-амина (90 мг, 0,24 ммоль) в концентрированной хлористоводородной кислоте (12 M, 20 мл) перемешивали при 100°C в течение ночи. Смесь упаривали в вакууме с получением 6-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)хинолин-2-ола в виде гидрохлоридной соли (66 мг, 78% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,62 (шир.с, 1H), 9,72 (с, 1H), 8,06 (м, 3H), 7,73 (д, J=9,2 Гц, 1H), 7,60 (м, 6H), 7,21 (м, 2H), 6,47 (д, J=9,2 Гц, 1H); MS (ESI): m/z 354,0 [M+1]+.
Пример 66: 4-(5-(3-карбамоилфенил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамид
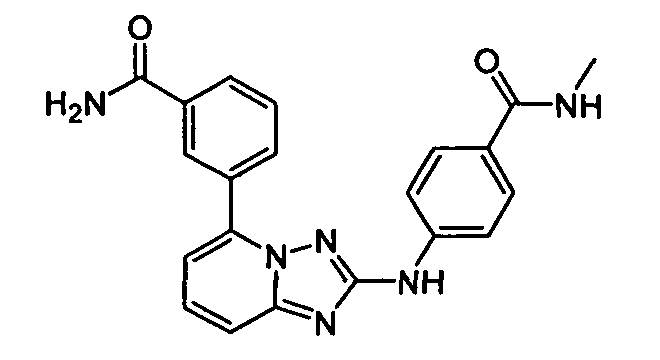
A. 4-(5-(3-Карбамоилфенил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамид. Смесь 4-(5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамида (200 мг, 0,58 ммоль), 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрила (102 мг, 0,69 ммоль), тетракис(трифенилфосфин) палладия (100 мг, 0,09 ммоль) и водного раствора карбоната натрия (2 M, 0,625 мл, 1,3 ммоль) в 1,2-диметоксиэтане (5 мл) дегазировали три раза и перемешивали при 80°C в атмосфере азота в течение ночи. Растворитель удаляли при пониженном давлении и остаток промывали этилацетатом. Твердое вещество растворяли в диметилсульфоксиде (3 мл), с последующим добавлением пероксида водорода (1,0 мл, 30%) и карбоната калия (160 мг, 1,16 ммоль). Смесь перемешивали при комнатной температуре в течение ночи, выливали в воду (20 мл) и экстрагировали этилацетатом (15×3). Объединенный органический слой сушили над сульфатом натрия, концентрировали в вакууме с получением неочищенного продукта, который промывали этилацетатом и очищали при помощи обращенно-фазовой препаративной ВЭЖХ (35-65%: ацетонитрил + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 10 минут) с получением 4-(5-(3-карбамоилфенил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамида в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль (45 мг, 20,0% выход) с использованием метанольного раствора гидрохлорида. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,01 (с, 1H), 8,56 (с, 1H), 8,21 (д, J=6,4 Гц, 2H), 8,14 (с, 1H), 8,06 (д, J=7,6 Гц, 1H), 7,77 (м, 7H), 7,54 (с, 1H), 7,32 (д, J=6,8 Гц, 1H), 2,76 (д, J=3,2 Гц, 3H); MS (ESI): m/z 387,16 [M+1]+.
Пример 67: транс-4-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-илокси)циклогексанкарбоксамид
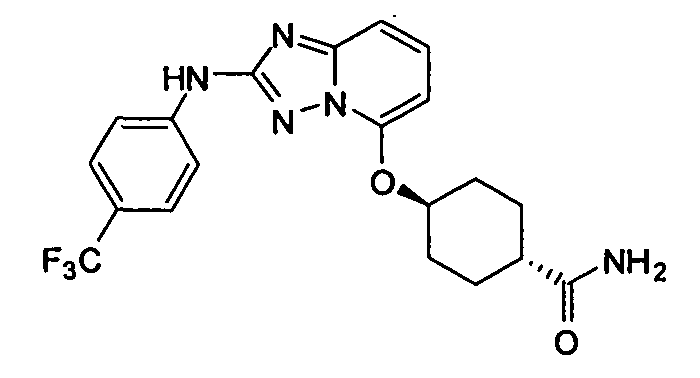
A. транс-4-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-илокси)циклогексанкарбоновая кислота. транс-Этил 4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-илокси)циклогексанкарбоксилат синтезировали из 2,5-дибром-[1,2,4]триазоло[1,5-α]пиридина, транс-этил 4-гидроксициклогексанкарбоксилата и 4-(трифторметил)анилина, следуя процедуре, описанной для получения цис-4-(2-(4-фторфениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-илокси)циклогексанола. К раствору транс-этил 4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-илокси)циклогексанкарбоксилата (10 мг, 0,022 ммоль) в метаноле (5 мл) добавляли гидроксид лития (5 мг, 0,2 ммоль) и смесь нагревали до температуры кипения с обратным холодильником в течение 2 часов. Реакционную смесь нейтрализовали и концентрировали в вакууме. Остаток разбавляли водой и экстрагировали этилацетатом. Объединенный органический слой сушили над сульфатом натрия и упаривали с получением транс-4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-илокси)циклогексанкарбоновой кислоты (6 мг, 70% выход). MS (ESI): m/z 420,9 [M+1]+.
B. транс-4-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-илокси)циклогексанкарбоксамид. Смесь транс-4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-илокси)циклогексанкарбоновой кислоты (6 мг, 0,014 ммоль), хлорида аммония (1,5 мг, 0,03 ммоль), гексафторфосфата [диметиламино-([1,2,3]триазоло[4,5-b]пиридин-3-илокси)-метилен]-диметил-аммония (11 мг, 0,03 ммоль), N-метилморфолина (2 мг, 0,02 ммоль) в N,N-диметилформамиде (2 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали и остаток очищали при помощи препаративной ТСХ (элюируя при помощи 75% этилацетата в петролейном эфире) с получением транс-4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-илокси)циклогексанкарбоксамида (3 мг, 50% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,16 (с, 1H), 7,84 (д, J=8,4 Гц, 2H), 7,61 (д, J=8,4 Гц, 2H), 7,55 (т, J=8,4 Гц, 1H), 7,27 (д, J=8,4 Гц, 1H), 7,27 (с, 1H), 7,19 (д, J=8,4 Гц, 1H), 6,74 (с, 1H), 4,71 (м, 1H), 2,22 (м, 3H), 1,86 (м, 2H), 1,53 (м, 4H); MS (ESI): m/z 420,1 [M+1]+.
Пример 68: 5-((1-Этилпиперидин-4-ил)метил)-Ν-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин
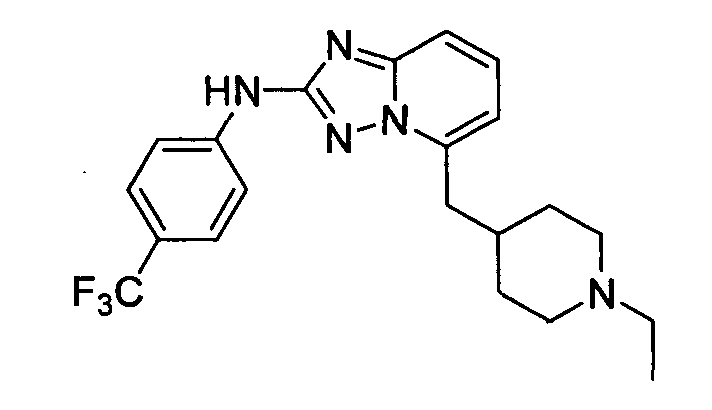
A. 5-((1-Этилпиперидин-4-ил)метил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. 5-((1-Бензилпиперидин-4-ил)метил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин синтезировали из 1-бензил-4-метиленпиперидина и 5-бром-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина, следуя процедуре, описанной для получения N-фенил-5-(пиперидин-4-илметил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина. 5-((1-Бензилпиперидин-4-ил)метил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,165 г, 0,354 ммоль) растворяли в этаноле (30 мл) и обрабатывали каталитическим количеством палладия на углероде (10% масс.). Реакционную смесь перемешивали в атмосфере газообразного водорода в течение ночи при комнатной температуре. Поскольку наблюдали только следовую конверсию, добавляли каплю уксусной кислоты и реакционную смесь перемешивали при комнатной температуре в течение ночи. Основное количество исходного вещества было преобразовано в указанное в заголовке соединение с примесью небольшого количества 5-(пиперидин-4-илметил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина. Катализатор удаляли фильтрованием промывали метанолом и фильтрат концентрировали при пониженном давлении. Остаток очищали при помощи полу-препаративной ВЭЖХ (20-70% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 3 впрыска, 30 минут). Желаемые фракции объединяли и нейтрализовали с использованием колонки с катионообменной смолой STRATA. Элюат концентрировали при пониженном давлении и сушили в вакуумной печи в течение 5 часов. 5-((1-Этилпиперидин-4-ил)метил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин (0,019 г, 0,047 ммоль, 13,29% выход) выделяли в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,18 (с, 1H), 7,91 (д, J=8,59 Гц, 2H), 7,64 (д, J=8,59 Гц, 2H), 7,48-7,59 (м, 2H), 6,95 (с, 1H), 3,03 (д, J=6,64 Гц, 2H), 2,82 (шир.с, 2H), 2,26 (с, 2H), 1,99 (шир.с, 1H), 1,78 (шир.с, 2H), 1,55 (шир.с, 2H), 1,33 (шир.с, 2H), 0,89-1,02 (м, 3H); 19F ЯМР (400 МГц, ДМСО-d6) δ (м.д.) -59,9 м.д.; MS (ESI): m/z 404,2 [M+1]+.
Пример 69: 5-(Пиперазин-1-илметил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин
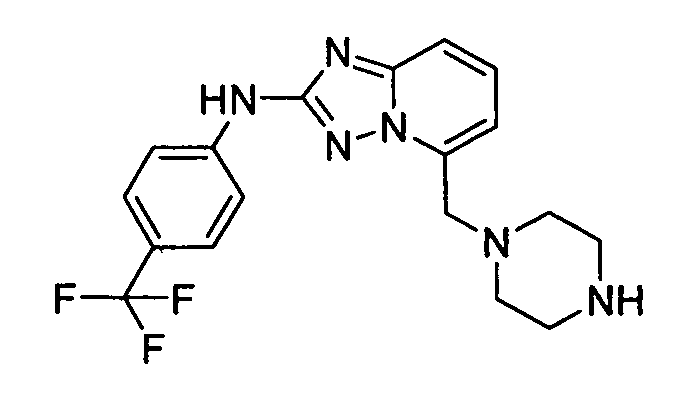
А. 2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбальдегид. К суспензии 5-бром-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,2 г, 0,560 ммоль) в тетрагидрофуране (2,80 мл) (бесцветный) при -78°C добавляли н-бутиллитий в гексане (0,470 мл, 1,176 ммоль, 2,5 M раствор в гексане) по каплям. Реакционная смесь становилась ярко-желтой, и ее поддерживали при низкой температуре в течение 1 часа. Затем добавляли неразбавленный N,N-диметилформамид (0,086 г, 1,176 ммоль) и реакционной смеси давали медленно нагреться до комнатной температуры. Через 2 часа реакция завершалась, и ее гасили при 0°C путем добавления 1 мл уксусной кислоты и 10 мл воды. Неочищенный продукт экстрагировали этилацетатом и экстракты сушили над сульфатом натрия и упаривали досуха. Остаток суспендировали в нескольких мл этилацетата и собирали фильтрованием. 2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбальдегид (0,13 г, 0,424 ммоль, 76% выход) собирали в виде ярко-желтого твердого вещества и использовали без дополнительной очистки. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,58 (с, 1H), 10,41 (с, 1H), 7,87-8,05 (м, 3H), 7,72-7,84 (м, 1H), 7,53-7,70 (м, 3H).
B. трет-Бутил 4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-1-карбоксилат. К суспензии 2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбальдегида (0,150 г, 0,490 ммоль) в дихлорэтане (2,449 мл) добавляли трет-бутилпиперазин-1-карбоксилат (0,100 г, 0,539 ммоль). Смесь перемешивали при комнатной температуре в течение 30 минут, затем добавляли триацетоксиборогидрид натрия (0,114 г, 0,539 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили водой и неочищенный продукт экстрагировали этилацетатом. Экстракты сушили над сульфатом магния и упаривали досуха. Остаток очищали при помощи колоночной хроматографии на biotage с использованием 5-100% этилацетата в гексане. Желаемые фракции объединяли и упаривали досуха. трет-Бутил 4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-1-карбоксилат (0,142 г, 0,298 ммоль, 60,8% выход) выделяли в виде светло-желтого твердого вещества, которое сушили в вакууме и использовали без дополнительной очистки. MS (ESI): m/z 477,1 [M+1]+.
C. 5-(Пиперазин-1-илметил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Суспензию трет-бутил 4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-1-карбоксилата (0,233 г, 0,490 ммоль) в дихлорметане (3 мл) обрабатывали при комнатной температуре трифторуксусной кислотой (1 мл, 12,98 ммоль). Раствор перемешивали при комнатной температуре в течение 1 часа. Растворители удаляли при пониженном давлении и остаток очищали при помощи препаративной ВЭЖХ (10-80% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 30 минут, 1 впрыск). Желаемые фракции объединяли и нейтрализовали с использованием STRATA колонки с ионообменной смолой. 5-(Пиперазин-1-илметил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,066 г, 0,175 ммоль, 35,8% выход) собирали в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,19 (с, 1H), 7,91 (д, J=8,59 Гц, 2H), 7,59-7,70 (м, 3H), 7,51-7,59 (м, 1H), 7,11 (д, J=7,03 Гц, 1H), 3,95 (с, 2H), 3,34 (шир.с, 4H), 2,70-2,82 (м, 4H); 19F ЯМР (376 МГц, δ (м.д.) -60,01 м.д.; MS (ESI): m/z 377,2 [M+1]+.
Пример 70: цис-3-(5-(4-Гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамид
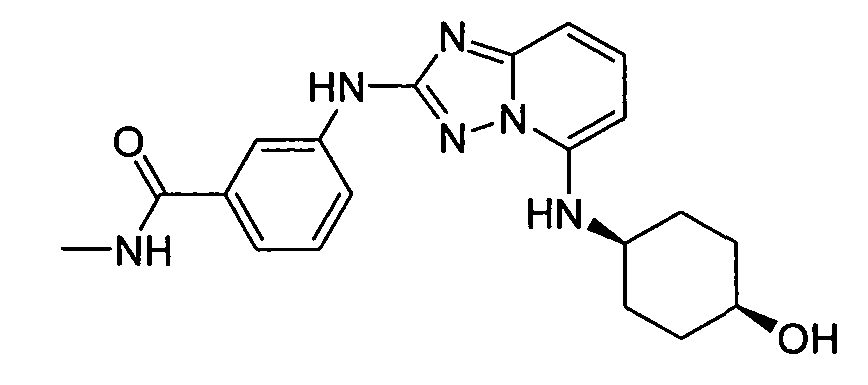
A. цис-4-(2-Бром-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанол. 2,5-Дибром-[1,2,4]триазоло[1,5-α]пиридин (4,15 г, 14,99 ммоль), цис-4-аминоциклогексанолгидрохлорид (3,12 г, 20,58 ммоль) и карбонат калия (4,93 г, 35,7 ммоль) добавляли в 200-мл колбу. Добавляли ДМСО (15 мл) и реакционную смесь помещали для тщательного перемешивания в 100°C масляную баню на 3 часа. Реакционную смесь охлаждали до комнатной температуры и добавляли воду (~50 мл). Смесь перемешивали в течение 15 минут, затем фильтровали через стеклянный фильтр со средним размером пор, собирая не совсем белое твердое вещество, которое сушили в вакууме при 60°C в течение 2 часов, с получением желаемого цис-4-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанола (4,0438 г, 13,00 ммоль, 87% выход). 1H ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 7,88 (д, J=7,97 Гц, 1H), 7,66 (с, 1H), 7,56 (т, J=8,38 Гц, 1H), 6,92 (д, J=8,52 Гц, 1H), 6,82 (д, J=7,97 Гц, 1H), 6,35 (д, J=7,97 Гц, 1H), 4,39 (шир.с, 1H), 3,78 (шир.с, 1H), 3,45-3,64 (м, 1H), 1,76-1,98 (м, 2H), 1,45-1,76 (м, 7H), (ESI): m/z 311,3 [M+1]+.
B. Этил цис-3-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензоат. цис-4-(2-Бром-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанол (976,7 мг, 3,14 ммоль), этил 3-аминобензоат (734,9 мг, 4,45 ммоль), трис(дибензилиденацетон)дипалладий(0) (268,0 мг, 0,293 ммоль), (9,9-диметил-9H-ксантен-4,5-диил)бис(дифенилфосфин) (489,5 мг, 0,846 ммоль) и 2-метилпропан-2-олат калия (352 мг, 3,14 ммоль) отвешивали в 25-мл колбу. Колбу закрывали мембранной перегородкой и продували азотом. Добавляли диоксан (4 мл), свежедегазированный путем 5-минутного барботирования азота, через шприц и реакционную смесь помещали для тщательного перемешивания в 95°C масляную баню. Через 3 часа реакционную смесь охлаждали до комнатной температуры, фильтровали через целит с использованием ТГФ, затем концентрировали. Неочищенный продукт снова растворяли в дихлорметане/метаноле и загружали в колонку Biotage. Флэш-хроматография в метаноле:дихлорметане (0-7%) дала желаемый этил цис-3-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)бензоат (0,719 г, 1,818 ммоль, 57,9% выход). (ESI): m/z 396,2 [M+1]+.
C. цис-3-(5-(4-Гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензойная кислота. Этил цис-3-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензоат (0,719 г, 1,818 ммоль) обрабатывали тетрагидрофураном (5 мл) и 1,0 M раствором гидроксида натрия (2,5 мл, 2,5 ммоль). Реакционную смесь нагревали до 60°C в течение 2 часов, к этому времени ЖХ/МС анализ показал, что оставалось исходное вещество. Добавляли этанол (2 мл) и нагревание продолжали еще в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом и дихлорметаном и промывали 1 н раствором гидроксида натрия. Водный слой подкисляли при помощи 10% раствора дигидрофосфата калия, экстрагировали этилацетатом и органический раствор сушили над сульфатом магния, фильтровали и концентрировали с получением цис-3-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензойной кислоты (299,4 мг, 0,815 ммоль, 44,8% выход). 1H ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 9,83 (с, 1H), 8,35 (шир.с, 1H), 8,21 (д, J=6,59 Гц, 1H), 7,41-7,67 (м, 4H), 6,86 (д, J=8,52 Гц, 1H), 6,31 (д, J=7,97 Гц, 1H), 6,12 (д, J=7,97 Гц, 1H), 4,61 (шир.с, 1H), 3,87 (шир.с, 1H), 3,72 (шир.с, 1H), 1,59-2,07 (м, 15H), (ESI): m/z 368,5 [M+1]+.
D. цис-3-(5-(4-Гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамид. цис-3-(5-(4-Гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензойную кислоту (299,4 мг, 0,815 ммоль) и метиламингидрохлорид (357,6 мг, 5,30 ммоль) обрабатывали N,N-диметилформамидом (2 мл) в 20-мл сцинтилляционном сосуде. Добавляли диизопропилэтиламин (0,9 мл, 5,15 ммоль) с последующим добавлением гексафторфосфата О-(7-азабензотриазол-1-ил)-N,N)N',N'-тетраметилурония (HATU) (1,74 г, 4,58 ммоль) и реакционную смесь тщательно перемешивали в 50°C алюминиевом блоке. Через 1 час реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом и тетрагидрофураном и промывали водой. Органический слой сушили над сульфатом магния, фильтровали и концентрировали. Образец растворяли в минимальном количестве смеси 1:1 ДМСО:вода и очищали при помощи полу-препаративной обращенно-фазовой ВЭЖХ (0-100% ацетонитрила:вода с 0,1% TFA). Продукт выделяли в виде свободного основания путем растворения в этилацетате, с промывкой насыщенным раствором бикарбоната натрия, сушкой над сульфатом магния, с последующим фильтрованием и концентрированием с получением цис-3-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамида (77,7 мг, 0,204 ммоль, 25,06% выход) в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 9,66 (с, 1H), 8,42 (д, J=4,40 Гц, 1H), 8,19 (с, 1H), 7,90 (д, J=7,69 Гц, 1H), 7,19-7,54 (м, 3H), 6,74 (д, J=8,52 Гц, 1H), 6,08-6,30 (м, 2H), 4,53 (шир.с, 1H), 3,77 (шир.с, 1H), 3,63 (д, J=7,69 Гц, 1H), 2,79 (д, J=4,12 Гц, 3H), 1,49-2,01 (м, 8H), (ESI): m/z 381,1 [M+1]+.
Пример 71: цис-4-(2-(3-Метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанол
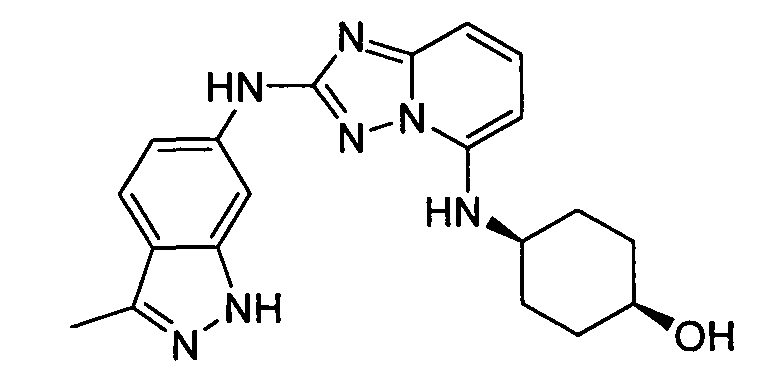
A. цис-4-(2-(3-Метил-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанол. Дегазированную смесь цис-4-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанола (160 мг, 0,5 ммоль), 3-метил-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-амина (138 мг, 0,50 ммоль), трис(дибензилиденацетон)дипалладия(0) (46 мг, 0,05 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (57 мг, 0,1 ммоль) и трет-бутоксида калия (112 мг, 1,0 ммоль) в диоксане (5 мл) нагревали при 100°C в атмосфере азота в течение ночи. Реакционную смесь выливали в воду (20 мл), экстрагировали этилацетатом (15 мл ×3). Объединенный органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток очищали на колонке с силикагелем (элюируя при помощи 5-50% этилацетата в петролейном эфире) с получением цис-4-(2-(3-метил-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанола (180 мг, 72% выход). MS (ESI): m/z 508,2 [M+1]+.
B. цис-4-(2-(3-Метил-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-а]пиридин-5-иламино)циклогексанол. Смесь цис-4-(2-(3-метил-1-((2-(триметилсилил)этокси)метил)-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанола (180 мг, 0,36 ммоль) и метанольного раствора гидрохлорида (2 M, 5 мл) перемешивали при 55°C в течение ночи. Растворитель выпаривали при пониженном давлении с получением неочищенного продукта, который очищали при помощи обращенно-фазовой препаративной ВЭЖХ (17-43%: ацетонитрил + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 20 минут), с получением цис-4-(2-(3-метил-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанола (80 мг, 60% выход) в виде гидрохлоридной соли. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,06 (д, J=1,6 Гц, 1H), 7,78 (т, J=8,8 Гц, 2H), 7,24 (дд, J1=8,8 Гц, J2=2,0 Гц, 1H), 6,86 (д, J=8,4 Гц, 1H), 6,62 (д, J=8,0 Гц, 1H), 3,98 (м, 1H), 3,76 (м, 1H), 2,59 (с, 3H), 2,00 (м, 8H); MS (ESI): m/z 377,1 [M+1]+.
Пример 72: (6-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1Н-бензо[d]имидазол-2-ил)метанол
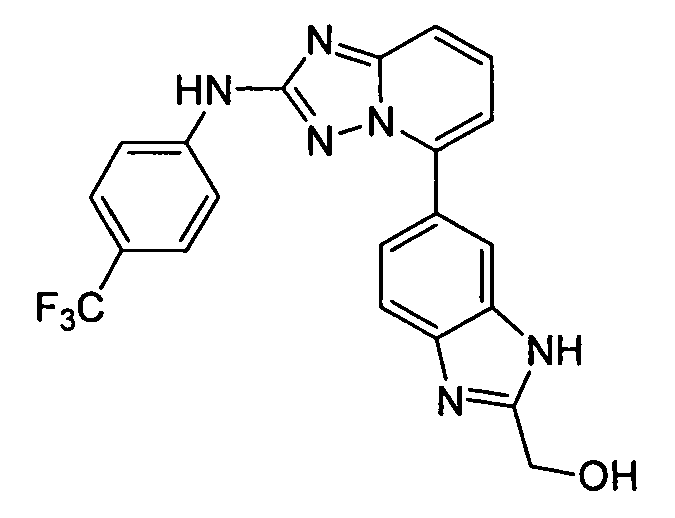
A. (6-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1Н-бензо[d]имидазол-2-ил)метанол. 4-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензол-1,2-диамин синтезировали, следуя процедуре, аналогичной описанной для получения 4-(2-фениламино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-бензол-1,2-диамина. Смесь 4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)бензол-1,2-диамина (250 мг, 0,65 ммоль) и 2-гидроксиуксусной кислоты (198 мг, 2,6 ммоль) в хлористоводородной кислоте (4н, 30 мл) нагревали при кипячении с обратным холодильником в течение 3 дней. Смесь упаривали при пониженном давлении. Остаток очищали обращенно-фазовой препаративной ВЭЖХ (20-50% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 минут) с получением (6-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1Н-бензо[d]имидазол-2-ил)метанола в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль (65 мг, 23,6% выход) с использованием метанольного раствора гидрохлорида. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,21 (с, 1H), 8,50 (с, 1H), 8,08 (дд, J1=8,4 Гц, J2=1,2 Гц, 1H), 7,95 (д, J=8,8 Гц, 1H), 7,83 (д, J=8,4 Гц, 2H), 7,73-7,60 (м, 4H), 7,31 (д, J=6,0, 1H), 5,07 (с, 2H); MS (ESI): m/z 425,1 [M+1]+.
Пример 73: 1-(6-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1H-бензо[d]имидазол-2-ил)этанол
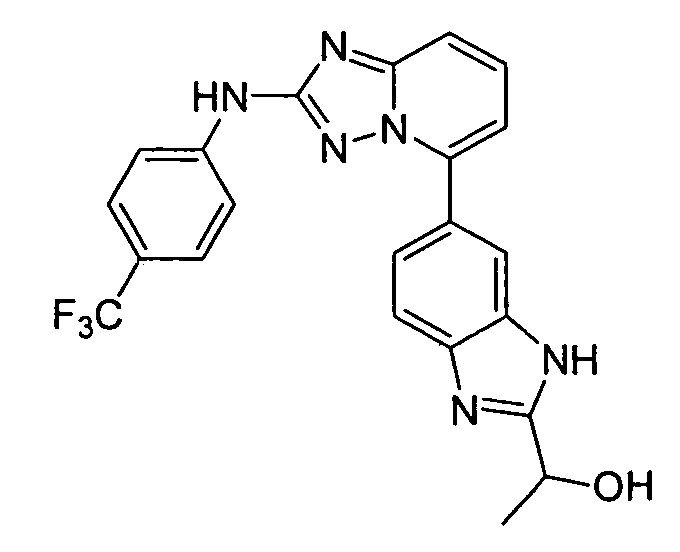
A. 1-(6-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1Н-бензо[d]имидазол-2-ил)этанол. 4-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензол-1,2-диамин синтезировали, следуя процедуре, аналогичной описанной для получения 4-(2-фениламино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-бензол-1,2-диамина. Смесь 4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-а]пиридин-5-ил)бензол-1,2-диамина (700 мг, 1,82 ммоль) и 2-гидроксипропановой кислоты (328 мг, 3,65 ммоль) в хлористоводородной кислоте (4н, 30 мл) нагревали при кипячении с обратным холодильником в течение 48 часов. Смесь упаривали при пониженном давлении. Остаток очищали обращенно-фазовой препаративной ВЭЖХ (20-50% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 минут) с получением 1-(6-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1H-бензо[d]имидазол-2-ил)этанола (330 мг, 41,4% выход) в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль с использованием метанольного раствора гидрохлорида. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,53 (с, 1H), 8,24 (д, J=8,8 Гц, 1H), 8,08 (м, 2H), 7,82 (д, J=8,8 Гц, 1H), 7,77 (д, J=8,4 Гц, 2H), 7,66 (м, 3H), 5,42 (м, 1H), 1,78 (д, J=6,8 Гц, 3H); MS (ESI): m/z 439,1 [M+1]+.
Пример 74: 2-(6-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1Н-бензо[d]имидазол-2-ил)пропан-2-ол

A. 1-(6-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1Н-бензо[d]имидазол-2-ил)этанон. Смесь 1-(6-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1H-бензо[d]имидазол-2-ил)этанола (200 мг, 0,457 ммоль) и оксида марганца (IV) (398 мг, 4,57 ммоль) в хлороформе (30 мл) нагревали при кипячении с обратным холодильником в течение 72 часов. Смесь фильтровали и фильтрат упаривали при пониженном давлении. Остаток очищали при помощи препаративной ТСХ с получением 1-(6-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1H-бензо[d]имидазол-2-ил)этанона (100 мг, 50,3% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 13,66 (с, 1H), 10,19 (с, 1H), 8,55 (с, 1H), 8,32 (с, 1H), 8,04 (м, 1H), 7,88 (м, 2H), 7,76-7,59 (м, 4H), 7,31 (д, J=7,2 Гц, 1H), 2,74 (с, 3H); MS (ESI): m/z 437,1 [MH+1]+.
B. 2-(6-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1Н-бензо[d]имидазол-2-ил)пропан-2-ол. Смесь 1-(6-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1H-бензо[d]имидазол-2-ил)этанона (100 мг, 0,23 ммоль) в безводном тетрагидрофуране (10 мл) перемешивали при 0°C в течение 0,5 часов. Затем медленно добавляли метилмагнийбромид (0,5 мл, 1,6 M в диэтиловом эфире) и метиллитий (2,0 мл, 3,0 M в диэтиловом эфире) и полученную смесь перемешивали при 0°C в течение 2 часов, нагревали до комнатной температуры и перемешивали в течение ночи. Добавляли насыщенный водный раствор хлорида аммония (15 мл) и смесь экстрагировали этилацетатом (10 мл ×3). Органический слой сушили над сульфатом натрия, фильтровали и фильтрат концентрировали. Остаток очищали при помощи препаративной ТСХ с получением 2-(6-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1H-бензо[d]имидазол-2-ил)пропан-2-ола (28 мг, 26,9% выход) в виде твердого вещества. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,34 (с, 1H), 7,90 (шир.с, 1H), 7,81 (д, J=8,8 Гц, 2H), 7,72 (м, 2H), 7,55 (м, 3H), 7,23 (д, J=7,2 Гц, 1H), 1,74 (с, 6H); MS (ESI): m/z 453,1 [M+1]+.
Пример 75: 6-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1H-бензо[d]имидазол-2-карбоксамид
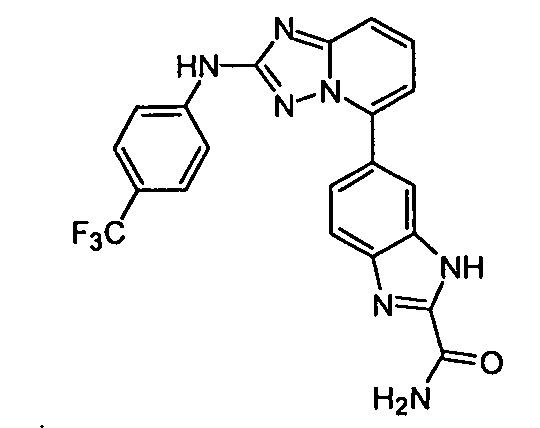
A. 5-(2-(Трихлорметил)-1H-бензо[d]имидазол-6-ил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Смесь 4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензол-1,2-диамина (300 мг, 0,78 ммоль) и метилтрихлорацетата (165 мг, 0,94 ммоль) в уксусной кислоте (10 мл) перемешивали при комнатной температуре в течение 3 часов. К смеси добавляли воду (15 мл) и осадок собирали фильтрованием. Твердое вещество промывали водой и сушили в вакууме с получением 5-(2-(трихлорметил)-1H-бензо[d]имидазол-6-ил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (380 мг, 95,5% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,18 (с, 1H), 8,38 (с, 1H), 7,98 (д, J=8,0 Гц, 1H), 7,86 (д, J=8,4 Гц, 3H), 7,74-7,59 (м, 4H), 7,30 (дд, J1=1,2 Гц, J2=1,2 Гц, 1H); MS (ESI): m/z 511,0 [M+1]+.
B. 6-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1Н-бензо[d]имидазол-2-карбонитрил. Раствор 5-(2-(трихлорметил)-1H-бензо[d]имидазол-6-ил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (380 мг, 0,745 ммоль) в метанольном растворе аммиака (20 мл) перемешивали при 0°C до комнатной температуры в течение 2 часов. Растворитель удаляли при пониженном давлении с получением неочищенного 6-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1H-бензо[d]имидазол-2-карбонитрила (300 мг, 96,1% выход). MS (ESI): m/z 420,1 [M+1]+.
C. 6-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1Н-бензо[d]имидазол-2-карбоксамид. Смесь 6-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1H-бензо[d]имидазол-2-карбонитрила (300 мг, 0,5 ммоль), пероксида водорода (30%, 1,0 мл) и гидроксида натрия (40 мг, 1,0 ммоль) в диметилсульфоксиде (5 мл) перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали в воду (15 мл) и смесь экстрагировали этилацетатом (15 мл ×3). Объединенный органический слой сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (35-65% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 минут) с получением 6-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1H-бензо[d]имидазол-2-карбоксамида (65 мг, 29,7% выход) в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль с использованием метанольного раствора гидрохлорида. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,19 (с, 1H), 8,37 (с, 1H), 7,95 (м, 5H), 7,73 (м, 4H), 7,29 (д, J=7,2 Гц, 1H); MS (ESI): m/z 438,1 [M+1]+.
Пример 76: 5-(2-(Метоксиметил)-1Н-бензо[d]имидазол-6-ил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин
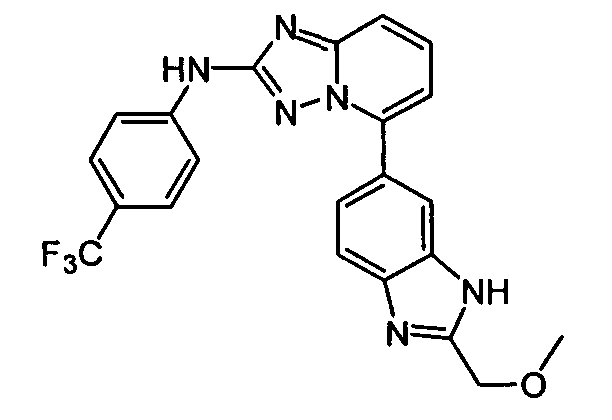
A. 5-(2-(Метоксиметил)-1Н-бензо[d]имидазол-6-ил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. 5-(2-(Хлорметил)-1H-бензо[d]имидазол-6-ил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин синтезировали, следуя процедуре, аналогичной той, которую использовали для получения 5-(2-(хлорметил)-1Н-бензо[d]имидазол-5-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина. Смесь 5-(2-(хлорметил)-1H-бензо[d]имидазол-6-ил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (150 мг, 0,339 ммоль) и метанолята натрия (55 мг, 1,02 ммоль) в метаноле (10 мл) нагревали при кипячении с обратным холодильником в течение 1 часа. Растворитель удаляли при пониженном давлении и остаток выливали в воду (10 мл). Водный слой экстрагировали этилацетатом (10 мл ×3). Органический слой сушили над сульфатом натрия, фильтровали и фильтрат концентрировали. Остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (25-55% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 минут) с получением 5-(2-(метоксиметил)-1H-бензо[d]имидазол-6-ил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (55 мг, 37% выход) в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль с использованием метанольного раствора гидрохлорида. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,57 (с, 1H), 8,24 (д, J=8,8 Гц, 1H), 8,13-8,05 (м, 2H), 7,84 (д, J=8,8 Гц, 1H), 7,76 (д, J=8,4 Гц, 2H), 7,69 (д, J=7,2 Гц, 1H), 7,63 (д, J=8,4 Гц, 2H), 5,12 (с, 2H), 3,69 (с, 3H); MS (ESI): m/z 385,1 [M+1]+.
Пример 77: 1-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пиперидин-4-ол
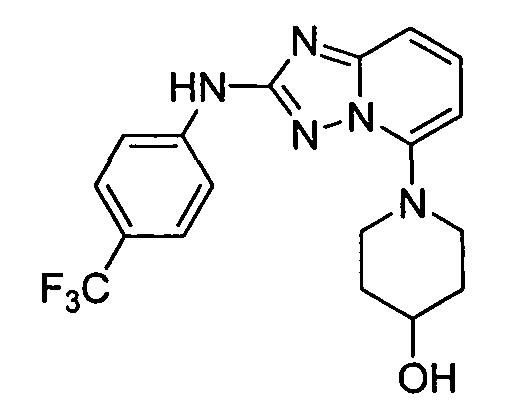
A. 1-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пиперидин-4-ол. 5-Бром-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,200 г, 0,549 ммоль) и пиперидин-4-ол (0,170 г, 1,680 ммоль) растворяли в N,N-диметилформамиде (2 мл) и перемешивали при 80°C в течение 20 часов. Раствор охлаждали до комнатной температуры и разбавляли водой (8 мл) и полученный не совсем белый осадок собирали и промывали водой (2 мл). Вещество очищали с использованием колоночной флэш-хроматографии на силикагеле (5-100% этилацетата в гексане) с получением продукта в виде белого твердого вещества (0,152 г, 72% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,08 (с, 1H), 7,92 (д, J=8,59 Гц, 2H), 7,63 (д, J=8,74 Гц, 2H), 7,52 (т, J=8,20 Гц, 1H), 7,17 (д, J=8,54 Гц, 1H), 6,47 (д, J=7,76 Гц, 1H), 4,81 (д, J=4,20 Гц, 1H), 3,71-3,85 (м, 3H), 3,10 (т, J=9,59 Гц, 2H), 1,97 (д, J=11,08 Гц, 2H), 1,59-1,74 (м, 2H). MS (ESI) m/z 378,2 [M+1]+.
Пример 78: (S)-2-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)пропан-1-ол
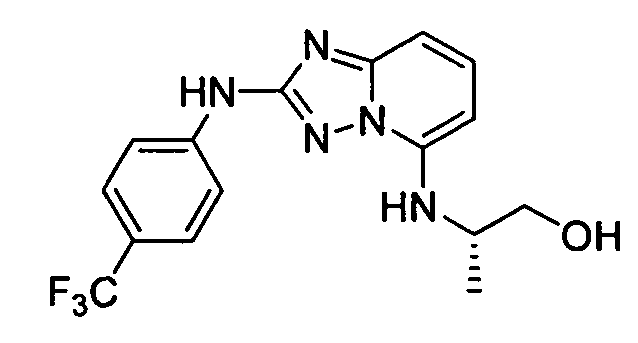
A. (S)-2-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)пропан-1-ол. 5-Бром-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,250г, 0,700 ммоль) суспендировали в (S)-2-аминопропан-1-оле (3,0 мл, 38,5 ммоль) и перемешивали при 110°C в течение 24 часов. Оранжевый раствор охлаждали до комнатной температуры и добавляли к воде (20 мл) и растирали в порошок. Полученный не совсем белый осадок собирали, промывали водой (20 мл) и сушили в вакууме при 60°C в течение 12 часов с получением продукта в виде не совсем белого твердого вещества (0,210 г, 85% выход). 1H ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 10,13 (с, 1H), 8,02 (д, J=8,58 Гц, 2H), 7,72 (д, J=8,72 Гц, 2H), 7,55 (т, J=8,28 Гц, 1H), 6,88 (д, J=8,41 Гц, 1H), 6,28-6,38 (м, 2H), 5,13 (т, J=5,29 Гц, 1H), 3,83-3,95 (м, 1H), 3,65-3,72 (м, 2H), 1,37 (д, J=6,46 Гц, 3H). MS (ESI) m/z 352,2 [M+1]+.
(R)-2-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)пропан-1-ол получали, следуя такой же процедуре, с использованием (R)-2-аминопропан-1-ола в качестве исходного вещества.
Пример 79: (S)-5-(Пиперидин-3-илокси)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин
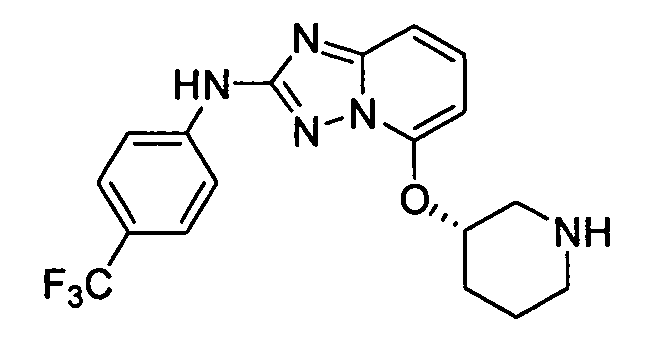
A. ((S)-трет-Бутил 3-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-илокси)пиперидин-1-карбоксилат. К прозрачному бесцветному раствору (S)-трет-бутил 3-гидроксипиперидин-1-карбоксилата (0,262 г, 1,3 ммоль) в N,N-диметилформамиде (10 мл) добавляли гидрид натрия (0,102 г, 2,52 ммоль, 60% в минеральном масле) медленно по порциям при 0°C в атмосфере азота. Реакционную смесь перемешивали при 0°C в течение 1 часа с последующим добавлением 2,5-дибром-[1,2,4]триазоло[1,5-α]пиридина (0,300 г, 1,083 ммоль) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение ночи в атмосфере азота. Когда реакция завершалась, как показал анализ ЖХ/МС, реакционную смесь выливали в воду/насыщенный солевой раствор и экстрагировали этилацетатом несколько раз. Объединенный органический слой сушили над безводным сульфатом магния и концентрировали. Неочищенную смесь очищали хроматографией (элюируя при помощи 0-100% этилацетата в гексане) с получением (S)-трет-бутил 3-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-илокси)пиперидин-1-карбоксилата в виде белого твердого вещества (0,273 г, 63% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,74 (м, 1H), 7,40 (д, J=8,69 Гц, 1H), 6,82-6,89 (м, 1H), 4,95 (шир.с, 1H), 4,06-4,16 (м, 1H), 3,78-3,88 (м, 1H), 3,29 (д, J=13,42 Гц, 1H), 1,92-2,08 (м, 2H), 1,79-1,92 (м, 1H), 1,48-1,58 (м, 1H), 1,33 (шир.с, 2H), 0,91 (шир.с, 6H); MS (ESI) m/z 398,27 [M+1]+.
B. (S)-трет-Бутил 3-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-илокси)пиперидин-1-карбоксилат. К раствору (S)-трет-бутил 3-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-илокси)пиперидин-1-карбоксилата (0,270 г, 0,680 ммоль) в диоксане (10 мл) добавляли 4-(трифторметил)анилин (0,219 г, 1,359 ммоль), трет-бутоксид натрия (0,131 г, 1,359 ммоль), (4,5-бис(дифенилфосфино)-9,9-диметилксантен (0,079 г, 0,136 ммоль) и трис(дибензилиденацетон)палладий (0,065 г, 0,071 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь нагревали при 100°C в течение 1,5 часов. Когда реакция завершалась, как показал анализ ЖХ/МС, реакционную смесь выливали в воду/насыщенный солевой раствор и экстрагировали этилацетатом несколько раз. Объединенный органический слой сушили над безводным сульфатом магния и концентрировали. Неочищенную смесь очищали хроматографией (элюируя при помощи 0-100% этилацетата в гексане) с получением (S)-трет-бутил 3-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-илокси)пиперидин-1-карбоксилата в виде желтого твердого вещества (0,280 г, 86% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,19 (с, 1H), 7,84-7,92 (м, 2H), 7,56-7,66 (м, 3H), 7,19-7,27 (м, 1H), 6,70 (д, J=7,86 Гц, 1H), 4,92 (шир.с, 1H), 4,09-4,18 (м, 1H), 3,29 (шир.с, 1H), 2,93-3,05 (м, 1H), 1,88-2,09 (м, 1H), 1,45-1,60 (м, 1H), 1,21-1,40 (м, 4H), 0,82-0,99 (м, 6H); MS (ESI) m/z 478,48 [M+1]+.
C. (S)-5-(Пиперидин-3-илокси)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К прозрачному оранжевому раствору (S)-трет-бутил 3-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-илокси)пиперидин-1-карбоксилата (0,275 г, 0,576 ммоль) в метиленхлориде (10 мл) добавляли трифторуксусную кислоту (5 мл) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Когда реакция завершалась, как показал анализ ЖХ/МС, реакционную смесь концентрировали и остаток очищали колоночной хроматографией на силикагеле (элюируя при помощи 0-15% метанольного раствора аммиака в хлороформе) и желаемые фракции пропускали через STRATA колонку с получением формы свободного основания указанного в заголовке соединения в виде бледно-желтого твердого вещества (99,8% чистоты, 0,176 г, 81% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,23 (с, 1H), 7,87 (д, J=8,49 Гц, 2H), 7,63 (д, J=8,54 Гц, 2H), 7,57 (т, J=8,32 Гц, 1H), 7,22 (д, J=8,69 Гц, 1H), 6,69 (д, J=7,86 Гц, 1H), 4,63-4,72 (м, 1H), 3,20 (д, J=13,47 Гц, 1H), 2,76-2,84 (м, 1H), 2,69 (дд, J=7,98, 12,23 Гц, 1H), 2,57 (шир.с, 1H), 2,13-2,21 (м, 1H), 1,63-1,79 (м, 2H), 1,46-1,57 (м, 1H); MS (ESI) m/z 378,36 [M+1]+.
(R)-5-(Пиперидин-3-илокси)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин получали, следуя такой же процедуре, с использованием (S)-трет-бутил 3-гидроксипиперидин-1-карбоксилата в качестве исходного вещества.
Пример 80: 5-(Морфолинометил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин
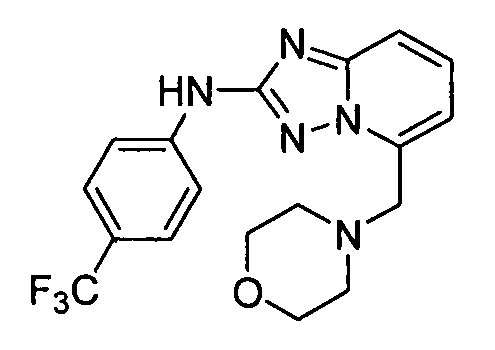
A. 5-(Морфолинометил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К раствору/суспензии 5-бром-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (300 мг, 0,8400 ммоль) в диоксане (2 мл) и воде (1 мл) добавляли трифтор(морфолинометил)борат калия (348 мг, 1,680 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (24,3 мг, 0,042 ммоль), ацетат палладия(II) (9,43 мг, 0,042 ммоль), трис(дибензилиденацетон)дипалладий(0) (38 мг, 0,042 ммоль) и карбонат калия (348 мг, 2,52 ммоль) в инертной атмосфере. Через реакционную смесь барботировали азот в течение 5 минут и затем реакционную смесь нагревали до 100°C в течение 3 часов. Развитие реакции контролировали при помощи ЖХ/МС анализа. После того, как исходное вещество было израсходовано, реакционную смесь фильтровали через фильтровальный картридж и растворитель удаляли в вакууме. Неочищенное вещество снова растворяли в диметилсульфоксиде и очищали при помощи полу-препаративной ВЭЖХ (20-100% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 20 мин). Фракции, содержащие продукт, загружали в strata-X колонку для удаления трифторуксусной кислоты, затем метанол выпаривали в вакууме. Твердое вещество сушили в вакууме. 5-(Морфолинометил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (20,7 мг, 0,055 ммоль, 6,53% выход) получали в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,19 (с, 1H), 7,91 (д, J=8,59 Гц, 2H), 7,48-7,73 (м, 4H), 7,12 (с, 1H), 4,00 (с, 5H), 3,58-3,74 (м, 4H), 2,59 (д, J=8,98 Гц, 4H). MS (ESI): m/z 378,2 [M+1]+.
Пример 81: цис-6-(5-(4-Гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он
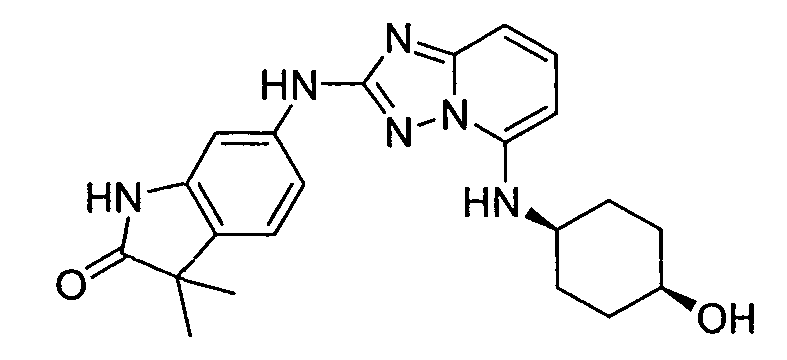
A. цис-трет-Бутил 6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметил-2-оксоиндолин-1-карбоксилат. Дегазированную смесь цис-4-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанола (225 мг, 0,72 ммоль), трис(дибензилиденацетон)дипалладия(0) (66 мг, 0,072 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (83 мг, 0,14 ммоль), карбоната цезия (476 мг, 1,45 ммоль) и трет-бутил 6-амино-3,3-диметил-2-оксоиндолин-1-карбоксилата (200 мг, 0,72 ммоль) в безводном диоксане (5 мл) нагревали при 100°C в атмосфере азота в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Объединенный органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток очищали на колонке с силикагелем (элюируя при помощи 0-10% метанола в дихлорметане) с получением цис-трет-бутил 6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметил-2-оксоиндолин-1-карбоксилата (156 мг, 42,8% выход). MS (ESI) m/z 507,3 [M+1]+.
B. цис-6-(5-(4-Гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он. Раствор цис-трет-бутил 6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметил-2-оксоиндолин-1-карбоксилата (156 мг, 0,31 ммоль) в метанольном растворе гидрохлорида (2 M, 15 мл) перемешивали при комнатной температуре в течение 30 минут. Растворитель выпаривали при пониженном давлении, неочищенный продукт очищали при помощи обращенно-фазовой препаративной ВЭЖХ (17-43%: ацетонитрил + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 20 мин) с получением цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-она (80 мг, 64% выход) в виде гидрохлоридной соли. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,69 (т, J=8,4 Гц, 1H), 7,28 (д, J=2,0 Гц, 1H), 7,20 (т, J=8,0 Гц, 1H), 7,15 (дд, J1=2,0 Гц, J2=8,0 Гц, 1H), 6,75 (д, J=8,0 Гц, 1H), 6,54 (д, J=8,4 Гц, 1H), 3,89 (с, 1H), 3,66 (с, 1H), 1,90 (м, 8H), 1,29 (с, 6H); MS (ESI): m/z 407,3 [M+1]+.
Пример 82: 4-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он
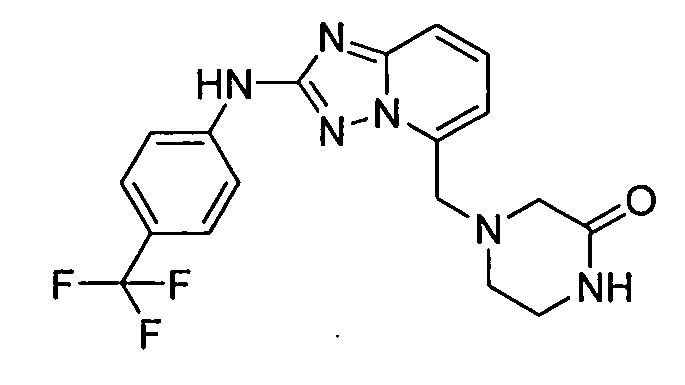
A. 2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбальдегид. К раствору/суспензии 5-бром-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,810 г, 2,268 ммоль) в тетрагидрофуране (11,34 мл) (бесцветный) при -78°C добавляли по каплям н-бутиллитий (1,905 мл, 4,76 ммоль, 2,5 M раствор в гексане). Реакционная смесь становилась ярко-желтой, и ее поддерживали при низкой температуре в течение 1 часа. Затем добавляли неразбавленный N,N-диметилформамид (0,369 мл, 4,76 ммоль) и реакционной смеси давали медленно нагреться до комнатной температуры. Реакцию контролировали через 1 час и гасили при 0°C путем добавления 1,5 мл уксусной кислоты и воды (20 мл). Неочищенный продукт экстрагировали этилацетатом и экстракты сушили над сульфатом натрия и упаривали досуха. Остаток затем суспендировали в метаноле и полученный ярко-желтый осадок отделяли от оранжевой надосадочной жидкости. Это твердое вещество сушили в вакууме при комнатной температуре. 2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбальдегид (0,558 г, 1,822 ммоль, 80% выход) выделяли в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,58 (с, 1H), 10,40 (шир.с, 1H), 7,93-8,01 (м, 3H), 7,73-7,80 (м, 1H), 7,61-7,70 (м, 3H).
B. (2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанол. К суспензии 2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбальдегида (0,2 г, 0,653 ммоль) в 1,2-дихлорэтане (2,61 мл) добавляли триацетоксиборогидрид натрия (0,228 г, 1,077 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили водой и две фазы разделяли. Водную фазу затем экстрагировали этилацетатом и объединенные органические фазы сушили над сульфатом магния и упаривали досуха. Очистку осуществляли при помощи колоночной хроматографии на biotage с использованием 5-50% этилацетата в гексане. (2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанол (0,172 г, 0,558 ммоль, 85% выход) выделяли в виде белого твердого вещества и использовали без дополнительной очистки. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,20 (с, 1H), 7,90 (д, J=8,59 Гц, 2H), 7,60-7,74 (м, 3H), 7,50-7,60 (м, 1H), 7,13 (д, J=7,03 Гц, 1H), 5,85 (с, 1H), 4,93 (д, 2H).
C. 5-(Бромметил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К раствору (2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанола (0,172 г, 0,558 ммоль) в диоксане (1,006 мл) при 40°C добавляли трибромид фосфора (0,053 мл, 0,558 ммоль). Реакционную смесь перемешивали при 40°C в течение 5 часов. Реакцию гасили путем добавления 20 мл насыщенного водного раствора бикарбоната натрия и неочищенное вещество экстрагировали этилацетатом. Неочищенное вещество очищали при помощи колоночной хроматографии на biotage с использованием 10-60% этилацетата в гексане. Желаемые фракции объединяли и упаривали досуха. 5-(Бромметил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,180 г, 0,485 ммоль, 87% выход) выделяли в виде светло-желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,31 (с, 1H), 7,85-8,02 (м, 2H), 7,54-7,75 (м, 4H), 7,33 (д, J=7,03 Гц, 1H), 5,10 (с, 2H); 19F ЯМР (376 МГц, ДМСО-d6) δ (м.д.) -59,83 м.д.
D. 4-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-он. Суспензию 5-(бромметил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,075 г, 0,202 ммоль) в ацетонитриле (2,021 мл) обрабатывали пиперазин-2-оном (0,061 г, 0,606 ммоль) и карбонатом калия (0,279 г, 2,021 ммоль) и реакционную смесь нагревали до 60°C в течение 20 минут. Растворитель удаляли при пониженном давлении и неочищенное вещество растирали в порошок в воде. Полученное твердое вещество собирали фильтрованием, промывали водой и сушили в вакуумной печи в течение ночи. 4-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он (0,075 г, 0,192 ммоль, 95% выход) собирали в виде белого твердого вещества. 1H ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 10,18 (с, 1H), 7,89 (шир.с, 3H), 7,52-7,71 (м, 4H), 7,13 (д, 1H), 4,09 (с, 2H), 3,10-3,27 (м, 4H), 2,77 (шир.с, 2H); MS (ESI): m/z 391,2 [M+1]+.
Пример 83: N-метил-4-(5-(тетрагидро-2Н-пиран-4-иламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензамид
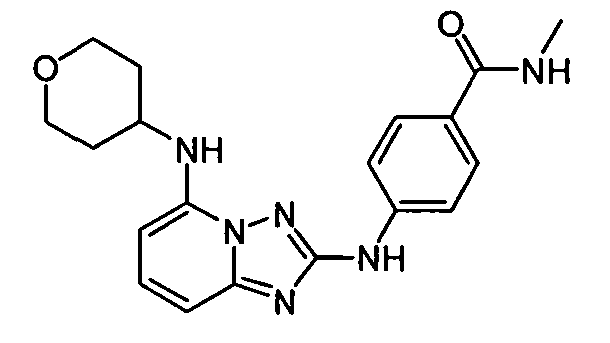
A. N-метил-4-(5-(тетрагидро-2H-пиран-4-иламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензамид. К дегазированной смеси 4-(5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамида (104 мг 0,30 ммоль), ацетата тетрагидропиран-4-иламина (96,6 мг 0,6 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (35 мг, 0,06 ммоль) и карбоната цезия (390 мг, 1,2 ммоль) в диоксане (3 мл) добавляли трис(дибензилиденацетон)палладий(0) (27 мг 0,03 ммоль) в атмосфере азота и смесь нагревали при 95°C при перемешивании в атмосфере азота в течение ночи. Смесь гасили водой и смесь экстрагировали этилацетатом. Растворитель удаляли в вакууме и остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (20-50%: ацетонитрил + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 минут) с получением N-метил-4-(5-(тетрагидро-2H-пиран-4-иламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензамида в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль (55 мг, 50% выход). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,81 (м, 3H), 7,72 (м, 2H), 6,80 (д, J=8,4 Гц, 1H), 6,73 (д, J=8,8 Гц, 1H), 3,97 (дд, J1=2,8 Гц, J2=10,8 Гц, 2H), 3,88 (м, 1H); 3,53 (м, 2H), 2,83 (с, 3H), 1,96 (д, J=12,8 Гц, 2H); 1,83 (м, 2H); MS (ESI): m/z 367,0 [M+H]+.
Пример 84: 5-(4-Метилизоксазол-3-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин
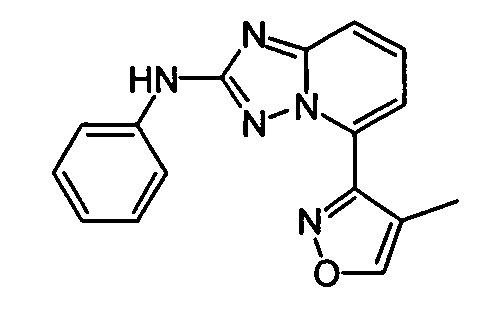
A. N-(6-(5-Этокси-4-метил-4,5-дигидроизоксазол-3-ил)пиридин-2-ил)пиваламид. N-хлорсукцинимид (2 г, 0,015 моль) добавляли по каплям к раствору N-(6-((гидроксиимино)метил)пиридин-2-ил)пиваламида (3 г, 0,014 ммоль) в диметилформамиде (40 мл) и смесь нагревали до 50°C в течение 1 часа, с последующим медленным добавлением смеси 1-этоксипроп-1-ена (5,8 г,0,07 моль) и триэтиламина (3,4 г, 0,035 моль). Реакционную смесь перемешивали при 50°C в течение ночи, гасили путем добавления воды и экстрагировали этилацетатом (15 мл ×3). Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 20% этилацетата в петролейном эфире) с получением N-(6-(5-этокси-4-метил-4,5-дигидроизоксазол-3-ил)пиридин-2-ил)пиваламида (2 г, 46,8% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,56 (с, 1H), 7,93 (д, J=8,4 Гц, 1H), 7,72 (т, J=8,0 Гц, 1H), 7,40 (д, J=1,6 Гц, 1H), 5,54 (д, J=7,2 Гц, 1H), 3,67 (м, 2H), 3,48 (м, 1H), 1,12 (с, 9H), 1,04 (т, J=7,2 Гц, 3H); MS (ESI): m/z 306,1 [M+1]+.
B. 6-(4-Метилизоксазол-3-ил)пиридин-2-амин. Смесь N-(6-(5-этокси-4-метил-4,5-дигидроизоксазол-3-ил)пиридин-2-ил)пиваламида (1 г, 3,3 ммоль) и серной кислоты (33 мг, 0,33) в толуоле перемешивали при 100°C в течение 12 часов. Смесь охлаждали, подщелачивали при помощи карбоната натрия и экстрагировали этилацетатом три раза. Объединенный органический слой сушили над безводным сульфатом натрия и концентрировали. Неочищенную смесь очищали при помощи колоночной хроматографии на силикагеле с использованием градиента 0-30% этилацетата в петролейном эфире с получением 6-(4-метилизоксазол-3-ил)пиридин-2-амина (400 мг, 69,2% выход) в виде масла. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,72 (с, 1H), 7,47 (д, J=10,8 Гц, 1H), 6,98 (д, J=9,6 Гц, 1H), 6,52 (д, J=11,2 Гц, 1H), 6,11 (с, 2H), 2,23 (с, 3H); MS (ESI): m/z 176,1 [M+1]+.
C. Промежуточное соединение A. Раствор 6-(4-метилизоксазол-3-ил)пиридин-2-амина (400 мг, 2,28 ммоль) и О-этил карбонизотиоцианатидат (300 мг, 2,28ммоль) в диоксане (10 мл) перемешивали при комнатной температуре в течение 5 часов. Растворитель удаляли при пониженном давлении с получением промежуточного соединения A в виде твердого вещества, которое использовали непосредственно без дополнительной очистки.
D. 5-(4-Метилизоксазол-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К раствору гидрохлорида гидроксиламина (800 мг, 11,42 ммоль) и N,N-диизопропилэтиламина (884 мг, 6,85 ммоль) в смеси этанола и метанола (об/об, 1:1, 20 мл) добавляли промежуточное соединение A (699 мг, 2,28 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов и при 70°C в течение ночи. Летучие вещества удаляли при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 40% этилацетата в петролейном эфире) с получением 5-(4-метилизоксазол-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (250 мг, 51,0%) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,78 (с, 1H), 7,41 (д, J=4,8 Гц, 1H), 6,95 (т, J=4,0 Гц, 1H), 6,03 (с, 2H), 1,85 (с, 3H); MS (ESI): m/z 216,1 [M+1]+.
E. 5-(4-Метилизоксазол-3-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К дегазированной смеси 5-(4-метилизоксазол-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (250 мг, 1,16 ммоль), иодбензола (238 мг, 1,16 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (135 мг, 0,116 ммоль) и трет-бутоксида натрия (135 мг, 1,38 ммоль) в диоксане (20 мл) добавляли трис(дибензилиденацетон)дипалладий(0) (105 мг, 0,116 ммоль) в атмосфере азота и смесь нагревали при 100°C в атмосфере азота в течение 2 часов. Реакцию гасили путем добавления воды и смесь экстрагировали этилацетатом (15 мл ×3). Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали. Остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (40-70%: ацетонитрил + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 минут) с получением 5-(4-метилизоксазол-3-ил)-N-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль с использованием метанольного раствора гидрохлорида, в виде твердого вещества (92 мг, 27,2% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,77 (с, 1H), 8,99 (с, 1H), 7,79 (д, J=8,4 Гц, 1H), 7,73 (м, 3H), 7,27 (м, 3H), 6,87 (т, J=7,2 Гц, 1H), 2,04 (с, 3H); MS (ESI): m/z 291,9 [M+1]+.
Пример 85: 2-Метил-2-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)пропан-1-ол
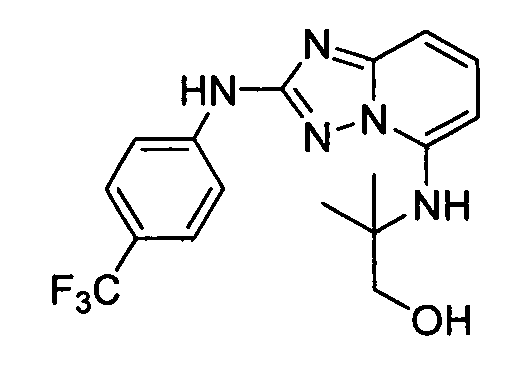
A. 2-метил-2-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)пропан-1-ол. К раствору/суспензии 5-бром-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (300 мг, 0,8400 ммоль) в диоксане (7 мл) добавляли 2-амино-2-метилпропан-1-ол (74,9 мг, 0,840 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (24,3 мг, 0,042 ммоль), трет-бутоксид натрия (242 мг, 2,52 ммоль) и трис(дибензилиденацетон)дипалладий(0) (38 мг, 0,042 ммоль) при барботировали азота через реакционную смесь в течение 5 минут и затем нагревали до 100°C в течение 3 часов. Развитие реакции контролировали при помощи ЖХ/МС анализа. После того, как исходное вещество было израсходовано, реакционную смесь фильтровали через фильтровальный картридж и растворитель удаляли в вакууме. Неочищенное вещество снова растворяли в диметилсульфоксиде и очищали при помощи полу-препаративной ВЭЖХ (20-100% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 20 мин). Фракции, содержащие продукт, загружали на strata-X колонку для удаления трифторуксусной кислоты, затем метанол выпаривали в вакууме. Твердое вещество сушили в вакууме при комнатной температуре. 2-метил-2-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)пропан-1-ол (42 мг, 0,115 ммоль, 13,68% выход) получали в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,22 (с, 1H), 7,92 (д, J=8,59 Гц, 2H), 7,46-7,74 (м, 2H), 7,24 (д, J=8,20 Гц, 1H), 6,61 (д, J=7,42 Гц, 1H), 4,08 (с, 2H), 1,22 (с, 6H); 19F ЯМР (376 МГц, ДМСО-d6) δ (м.д.) -59,83 м.д. MS (ESI): m/z 366,2 [M+1]+.
Пример 86: 4-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиридин-2(1H)-он
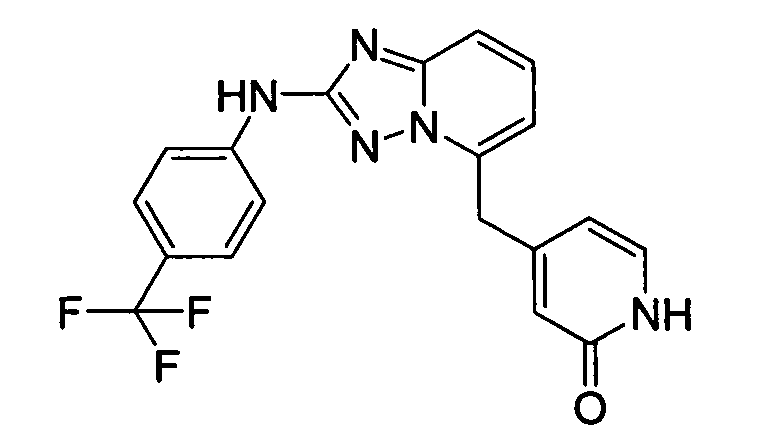
2-Метоксипиридин-4-ил)(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанол. Реакцию осуществляли с использованием исходного вещества двумя партиями (0,397 г и 0,310 г), в соответствии со следующей процедурой, которые снова объединяли для конечной обработки и очистки. Суспензию 5-бром-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,397 г, 1,111 ммоль) в безводном тетрагидрофуране (6,0 мл) охлаждали до -78°C. Смесь затем подвергали взаимодействию с н-бутиллитием (0,933 мл, 2,333 ммоль, 2,5 M в гексане). Реакционную смесь перемешивали при низкой температуре в течение 1 часа. Затем добавляли по каплям раствор 2-метоксиизоникотинальдегида (0,32 г, 2,333 ммоль) в безводном тетрагидрофуране (3 мл). Низкую температуру поддерживали в течение 2 часов. Контроль осуществляли через 30 минут, развитие реакции привело к смеси желаемого продукта с примесью де-галогенированного исходного вещества. Реакцию гасили водой и неочищенное вещество экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом магния и упаривали досуха. Остаток очищали при помощи колоночной хроматографии на biotage с использованием следующего градиента: 800 мл градиент 10-50% этилацетата в гексане, затем 1,100 л при 50% этилацетата в гексане. Желаемые фракции объединяли и упаривали досуха. (2-Метоксипиридин-4-ил)(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанол (0,574 г, 1,382 ммоль, 69,8% выход) собирали в виде желтого масла. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,04 (д, J=5,47 Гц, 1H), 7,63-7,70 (м, 3H), 7,54 (д, J=8,59 Гц, 2H), 7,47 (д, J=9,37 Гц, 1H), 7,32 (д, J=7,03 Гц, 1H), 7,04 (с, 1H), 7,01 (д, J=5,47 Гц, 1H), 6,32 (с, 1H), 3,86 (с, 3H); MS (ESI): m/z 416,2 [M+1]+.
5-(Хлор(2-метоксипиридин-4-ил)метил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Реакцию осуществляли с использованием исходного вещества двумя партиями (0,250 г и 0,324 г), в соответствии со следующей процедурой. Неочищенные реакционные смеси снова объединяли и использовали на следующей стадии без дополнительной очистки или идентификации. К суспензии (2-метоксипиридин-4-ил)(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанола (0,324 г, 0,780 ммоль) в хлороформе (3,90 мл) при 0°C добавляли по каплям тионилхлорид (0,153 мл, 2,090 ммоль). Реакционную смесь перемешивали при 0°C в течение 45 минут, затем при комнатной температуре в течение ночи. Потребовались дополнительное количество тионилхлорида (0,05 мл) и время реакции (5 часов) для доведения реакции до завершения. Реакцию гасили водой и нейтрализовали карбонатом натрия. 5-(Хлор(2-метоксипиридин-4-ил)метил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин получали в виде желтого масла, которое не подвергали дополнительной очистке или идентификации. MS (ESI): m/z 434,2 [M+1]+.
5-((2-Метоксипиридин-4-ил)метил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. 5-(Хлор(2-метоксипиридин-4-ил)метил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,442 г, 1,019 ммоль) растворяли в уксусной кислоте (3,90 мл) и обрабатывали цинковой пылью (0,333 г, 5,09 ммоль). Смесь нагревали при кипячении с обратным холодильником (117°C) в течение 1 часа, что приводило к конверсии в желаемый продукт с последующим де-метилированием до 4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиридин-2(1H)-она. Хотя нагревание поддерживали в целом в течение 6 часов, смесь оставалась без изменения. Нагревание останавливали. Реакционную смесь разбавляли водой и нейтрализовали карбонатом натрия. Продукт затем экстрагировали в этилацетат. Экстракты сушили над сульфатом магния и упаривали досуха. Никакой очистки или разделения не предпринимали. 5-((2-Метоксипиридин-4-ил)метил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,307 г, 0,769 ммоль, 75% выход) с примесью 4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-o]пиридин-5-ил)метил)пиридин-2(1H)-он использовали как таковой на конечной стадии. MS (ESI): m/z 400,3, 386,0 [M+1]+.
4-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиридин-2(1Н)-он. Преобразование осуществляли двумя партиями (0,215 г и 0,092 г), которые снова объединяли перед завершающей обработкой и очисткой. К суспензии 5-((2-метоксипиридин-4-ил)метил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,215 г, 0,538 ммоль) в ацетонитриле (1,252 мл) добавляли триметилсилилхлорид (0,076 мл, 0,592 ммоль) и иодид калия (0,098 г, 0,592 ммоль). Реакционную смесь нагревали до 60°C в течение ночи. Неочищенную реакционную смесь гасили водой. После объединения реакционных смесей неочищенное вещество экстрагировали в этилацетат, экстракты сушили над сульфатом магния и упаривали досуха. После того, как выпаренные экстракты снова суспендировали в этилацетате, образовывалось желтое твердое вещество, которое собирали фильтрованием и промывали метанолом и водой. Продукт далее очищали путем растирания в порошок в 1:1 смеси диметилсульфоксида и воды. Твердое вещество собирали фильтрованием и промывали 1:1 смесью метанола и воды и сушили в течение ночи в вакуумной печи. 4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиридин-2(1H)-он (0,203 г, 0,527 ммоль, 68,5% выход) собирали в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,50 (шир.с, 1H), 10,16 (с, 1H), 7,85 (д, J=8,98 Гц, 2H), 7,54-7,66 (м, 4H), 7,32 (д, J=7,42 Гц, 1H), 7,04 (дд, J=1,56, 6,64 Гц, 1H), 6,27 (с, 1H), 6,08-6,16 (м, 1H), 4,30 (с, 2H); 19F ЯМР (376 МГц, ДМСО-d6) δ (м.д.) 60,09; m/z 386,1 [M+1]+. Меньшую партию с примесью исходного вещества очищали при помощи полу-препаративной ВЭЖХ (20-80% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты), что приводило к выделению желаемого продукта с 40% выходом.
Альтернативно, завершающую обработку можно модифицировать следующим образом: после гашения водой ацетонитрил удаляли в вакууме, пока не оставалось приблизительно 2/3 начального объема, добавляли трет-бутилметиловый эфир и раствор промывали тиосульфатом натрия. Твердые частицы удаляли фильтрованием, промывали водой, трет-бутилметиловым эфиром, холодным метанолом и ацетонитрилом и сушили в условиях высокого вакуума с получением желаемого продукта с 77% выходом.
Пример 87: 4-(5-(3-Гидроксибензил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамид
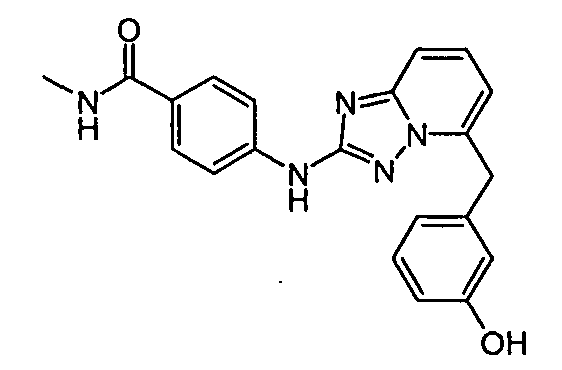
A. (2-Бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(3-метоксифенил)метанон. Смесь 2-(3-метоксифенил)ацетонитрила (1,17 г, 8 ммоль) и гидрида натрия (60% в минеральном масле, 480 мг, 12 ммоль) в N,N-диметилацетамиде (10 мл) перемешивали при температуре окружающей среды в течение 10 минут и при 45°C. Добавляли 2,5-дибром-[1,2,4]триазоло[1,5-α]пиридин (1,1 г, 4 ммоль). Реакционную смесь перемешивали при 45°C под давлением кислорода 1 атмосфера в течение 12 часов, выливали в ледяную воду и экстрагировали этилацетатом три раза. Объединенные органические слои сушили над безводным сульфатом натрия и концентрировали. Остаток очищали на колонке с силикагелем (элюируя при помощи 20% этилацетата в петролейном эфире) с получением (2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(3-метоксифенил)метанона (780 мг, 58,6% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,05 (д, J=8,8 Гц, 1H), 7,88 (м, 1H), 7,55 (м, 3H), 7,38 (м, 2H), 3,82 (с, 3H).
B. (2-Бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(3-метоксифенил)метанол. Смесь (2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(3-метоксифенил)метанона (660 мг, 2 ммоль), борогидрида натрия (76 мг, 2 ммоль) в тетрагидрофуране (20 мл) перемешивали при температуре окружающей среды в течение 1 часа. Добавляли дополнительное количество борогидрида натрия (76 мг, 2 ммоль). Смесь перемешивали при температуре окружающей среды еще в течение 2 часов и концентрировали. Остаток растворяли в дихлорметане (20 мл) и органический слой промывали водой, сушили и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (элюируя дихлорметаном) с получением (2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(3-метоксифенил)метанола (522 мг, 78,6% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,81 (м, 2H), 7,36 (д, J=6,8 Гц, 1H), 7,24 (т, J=8,0 Гц, 1H), 7,03 (с, 1H), 6,98 (д, J=7,6 Гц, 1H), 6,84 (дд, J1=2,4 Гц, J2=8,0 Гц, 1H), 6,55 (д, J=4,4 Гц, 1H), 6,28 (д, J=4,8 Гц, 1H), 3,72 (с, 3H).
C. 2-Бром-5-(3-метоксибензил)-[1,2,4]триазоло[1,5-α]пиридин. Смесь (2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(3-метоксифенил)метанола (520 мг, 1,56 ммоль) в смеси триэтилсилана (5 мл) и трифторуксусной кислоты (5 мл) перемешивали при 80°C в течение 10 часов. Когда анализ ТСХ показал, что исходное вещество израсходовано, смесь концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 30% петролейного эфира в диметилхлориде) с получением 2-бром-5-(3-метоксибензил)-[1,2,4]триазоло[1,5-α]пиридина (300 мг, 60,6% выход) в виде желтого масла. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,75 (м, 2H), 7,26 (т, J=8,0 Гц, 1H), 6,98 (м, 2H), 6,86 (д, J=2,0 Гц, 1H), 6,84 (д, J=2,0 Гц, 1H), 4,44 (с, 2H), 3,73 (с, 3H).
D. 4-(5-(3-Гидроксибензил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-N-метилбензамид. Дегазированную смесь 2-бром-5-(3-метоксибензил)-[1,2,4]триазоло[1,5-α]пиридина (200 мг, 0,63 ммоль), 4-амино-N-метилбензамида (113 мг, 0,75 ммоль), трис(дибензилиденацетон)палладия(0) (29 мг, 0,03 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (34 мг, 0,06 ммоль) и трет-бутоксида калия (154 мг, 1,26 ммоль) в диоксане (5 мл) нагревали при 100°C в атмосфере азота в течение ночи. Реакционную смесь фильтровали и фильтрат концентрировали в вакууме с получением неочищенного продукта, который очищали при помощи хроматографии на силикагеле (элюируя при помощи 50% этилацетата в петролейном эфире), с получением 4-(5-(3-гидроксибензил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамида (80 мг, 32,6% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,95 (с, 1H), 8,22 (м, 1H), 7,80 (м, 4H), 7,60 (м, 2H), 7,27 (т, J=8,0 Гц, 1H), 7,02 (м, 2H), 6,89 (м, 2H), 4,44 (с, 2H), 3,72 (с, 3H), 2,78 (д, J=4,4 Гц, 3H); MS (ESI): m/z 373,2 [M+1]+.
Пример 88: 1-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)тетрагидропиримидин-2(1Н)-он
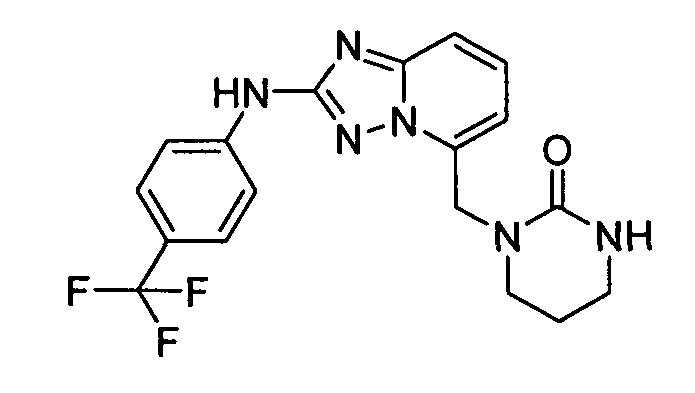
A. 5-(Азидометил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин. (2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанол (989,2 мг, 3,21 ммоль) обрабатывали диоксаном (6 мл), затем дифенилфосфорилазидом (1,40 мл, 6,48 ммоль) и 1,8-диазабицикло[5,4,0]ундец-7-еном (1,0 мл, 6,63 ммоль). Реакционную смесь перемешивали и подвергали слабому нагреву в 55 °C алюминиевом блоке в течение 1 минуты до полного растворения твердого вещества, затем оставляли для перемешивания при комнатной температуре. Через 18 часов реакционную смесь разбавляли этилацетатом, водой и некоторым количеством раствора бикарбоната натрия. Органический слой удаляли и водный слой экстрагировали этилацетатом. Объединенный органический раствор сушили над сульфатом магния, фильтровали и концентрировали. Неочищенный продукт очищали флэш-хроматографией на силикагеле (элюируя при помощи 0-6% метанола в дихлорметане для шести объемов колонки и затем 6-8% для шести объемов колонки) с получением 5-(азидометил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,5473 г, 1,642 ммоль, 51,2% выход) в виде желтого твердого вещества. (ESI): m/z 334,5 [M+1]+.
B. 5-(Аминометил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. 5-(Азидометил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,5473 г, 1,642 ммоль) обрабатывали тетрагидрофураном (10 мл) и водой (0,30 мл, 16,65 ммоль). Добавляли трифенилфосфин (1,1966 г, 4,56 ммоль) и гомогенную реакционную смесь нагревали до 55°C. Через 3 часа реакционную смесь разбавляли этилацетатом и 1н раствором хлористоводородной кислоты и водный слой удаляли. Водный слой затем подщелачивали насыщенным раствором бикарбоната натрия и экстрагировали 4 раза этилацетатом:ТГФ и объединенный органический раствор сушили над сульфатом магния, фильтровали и концентрировали с получением 5-(аминометил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (303,1 мг, 0,986 ммоль, 60,1% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,19 (с, 1H), 7,91 (д, J=8,20 Гц, 2H), 7,59-7,70 (м, 3H), 7,50-7,57 (м, 1H), 7,15 (д, J=7,03 Гц, 1H), 4,15 (с, 2H), (ESI): m/z 308,4 [M+1]+.
C. 1-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)тетрагидропиримидин-2(1Н)-он. 5-(Аминометил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (109,1 мг, 0,355 ммоль) растворяли в тетрагидрофуране (4 мл) и добавляли 1-хлор-3-изоцианатопропан (0,060 мл, 0,585 ммоль). Через 10 минут ЖХ/МС анализ показал сильный пик для мочевины, все еще с содержанием хлорида. К суспензии молочного цвета добавляли гидрид натрия (21,0 мг, 0,831 ммоль, 95%) с получением густой смеси. Добавляли N,N-диметилформамид (1 мл), способствующий солюбилизации. Добавляли еще одну порцию гидрида натрия (25,1 мг, 1,046 ммоль) и реакционную смесь оставляли для перемешивания при комнатной температуре в течение 20 часов. Образец растворяли в воде и ацетонитриле с использованием трифторуксусной кислоты и вещество затем очищали обращенно-фазовой препаративной ВЭЖХ (20-100% ацетонитрила:вода с 0,1% TFA). Продукт выделяли путем растворения в этилацетате, промывая насыщенным раствором бикарбоната натрия, сушили над сульфатом магния, затем фильтровали и концентрировали с получением 1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)тетрагидропиримидин-2(1H)-она (72,8 мг, 0,186 ммоль, 52,5% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,21 (с, 1H), 7,93 (д, J=8,59 Гц, 2H), 7,59-7,69 (м, 3H), 7,53-7,58 (м, 1H), 6,85 (д, J=7,03 Гц, 1H), 6,56 (шир.с, 1H), 4,85 (с, 2H), 3,41 (т, J=5,66 Гц, 2H), 3,22 (шир.с, 2H), 1,93 (т, 2H), (ESI): m/z 391,7 [M+1]+.
Пример 89: 4-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2,6-дион
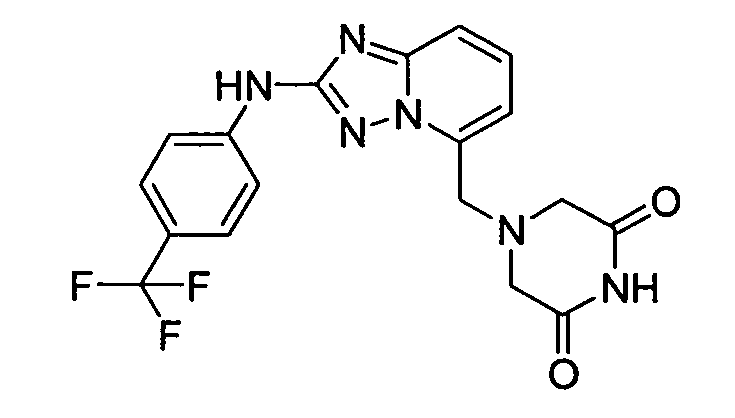
A. Диметил 2,2'-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метилазандиил)диацетат. 5-(Аминометил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (146,9 мг, 0,478 ммоль) растворяли в N,N-диметилформамиде (2,5 мл). Добавляли диизопропилэтиламин (0,50 мл, 2,86 ммоль) и реакционную смесь охлаждали до 0°C. Затем добавляли одной порцией метилбромацетат (0,15 мл, 1,628 ммоль) и реакционной смеси давали нагреться до комнатной температуры в течение 20 часов. Реакционную смесь разбавляли этилацетатом и водой. Органический слой удаляли и водный слой экстрагировали этилацетатом. Объединенный органический раствор сушили над сульфатом магния, фильтровали и концентрировали. Вещество очищали флэш-хроматографией на силикагеле в смеси 2-3% аммиака-насыщенный раствор метанола в дихлорметане с получением диметил 2,2'-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метилазандиил)диацетата (189,1 мг, 0,419 ммоль, 88% выход) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,71 (д, J=8,20 Гц, 2H), 7,60 (д, J=8,20 Гц, 2H), 7,41-7,55 (м, 3H), 7,18 (д, J=6,64 Гц, 1H), 4,47 (с, 2H), 3,77 (с, 4H), 3,71 (с, 6H), (ESI): m/z 452,4 [M+1]+.
B. 4-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2,6-дион. Диметил 2,2'-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метилазандиил)диацетат (116,9 мг, 0,259 ммоль) растворяли в формамиде (4 мл, 0,259 ммоль) в трубке высокого давления, которую закрывали и помещали в 120°C масляную баню. Через 18 часов реакционную смесь очищали непосредственно при помощи обращенно-фазовой препаративной ВЭЖХ (0-100% ацетонитрила:вода с 0,1% трифторуксусной кислоты). Продукт выделяли в виде свободного основания путем разбавления некоторых фракций этилацетатом, водой и раствором бикарбоната натрия. Органический слой удаляли и водный слой экстрагировали этилацетатом. Объединенный органический раствор сушили над сульфатом магния, фильтровали и концентрировали с получением желаемого продукта 4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2,6-диона (10,4 мг, 0,026 ммоль, 9,93% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,23 (с, 1H), 10,19 (с, 1H), 7,90 (д, J=8,59 Гц, 2H), 7,52-7,71 (м, 6H), 7,12 (д, J=6,25 Гц, 1H), 4,22 (с, 2H), 3,56 (с, 4H), (ESI): m/z 405,1 [M+1]+.
Пример 90: 1-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)имидазолидин-2,4-дион
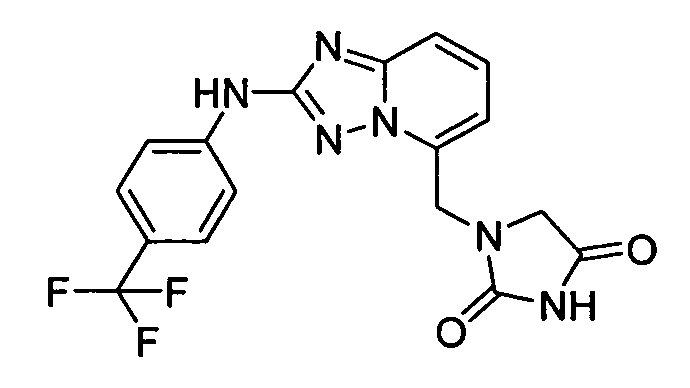
A. Этил 2-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метиламино)ацетат. 2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбальдегид (308,6 мг, 1,008 ммоль), гидрохлорид этиламиноацетата (203,7 мг, 1,459 ммоль) и ацетат калия (128,1 мг, 1,305 ммоль) отвешивали в реакционный сосуд. Добавляли метанол (2 мл) и сосуд нагревали до 55°C в течение 2 минут. Затем добавляли тетрагидрофуран (2 мл) для облегчения растворения и реакционную смесь охлаждали до комнатной температуры. К реакционной смеси добавляли цианоборогидрид натрия (83 мг, 1,321 ммоль), вызывая некоторое выделение газа. Через 1 час реакционную смесь разбавляли этилацетатом и водой. Органический слой удаляли и водный слой экстрагировали этилацетатом. Объединенный органический раствор сушили над сульфатом магния, фильтровали и концентрировали. Неочищенный продукт очищали на силикагеле с получением желаемого этил 2-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метиламино)ацетата (0,2696 г, 0,685 ммоль, 68,0% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,73 (д, J=8,59 Гц, 2H), 7,60 (д, J=8,59 Гц, 2H), 7,44-7,50 (м, 2H), 6,96 (дд, J=5,47, 2,73 Гц, 1H), 4,30 (с, 2H), 4,18 (кв., J=7,29 Гц, 2H), 3,51 (с, 2H), 1,26 (т, J=7,03 Гц, 3H), (ESI): m/z 394,4 [M+1]+.
B. Этил 2-(1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)уреидо)ацетат. Этил 2-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метиламино)ацетат (237,7 мг, 0,604 ммоль) растворяли в N,N-диметилформамиде (1 мл) и добавляли изоцианатотриметилсилан (0,12 мл, 0,903 ммоль). Через 18 часов ЖХ/МС анализ показал, что оставалось некоторое количество исходного вещества. Добавляли еще одну порцию изоцианатотриметилсилана (0,06 мл, 0,604 ммоль). Через 3 часа реакционную смесь разбавляли этилацетатом и промывали водой, с использованием некоторого количества метанола и тетрагидрофурана для разделения эмульсии. Органическ раствор удаляли и водный слой экстрагировали этилацетатом. Объединенный органический раствор сушили над сульфатом магния, фильтровали и концентрировали с получением этил 2-(1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)уреидо)ацетата (279,9 мг, 0,641 ммоль, 106% выход) в виде неочищенного твердого вещества, которое использовали непосредственно в следующей реакции (ESI): m/z 437,5 [M+1]+.
C. 1-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)имидазолидин-2,4-дион. Этил 2-(1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)уреидо)ацетат (241,6 мг, 0,554 ммоль) растворяли в этаноле (2 мл) и добавляли гидрид натрия (49,5 мг, 2,063 ммоль) с получением желтого раствора. Поскольку исходное вещество полностью не растворилось, добавляли тетрагидрофуран (2 мл). Через 3 часа реакцию гасили водой и разбавляли этилацетатом. Органический слой удаляли с использованием некоторого количества метанола для разделения эмульсии и водный слой экстрагировали этилацетатом. Объединенный органический раствор сушили над сульфатом магния, фильтровали и концентрировали. Твердое вещество снова растворяли в диметилсульфоксиде и ацетонитриле и очищали при помощи обращенно-фазовой препаративной ВЭЖХ (20-100% ацетонитрила:вода с 0,1% трифторуксусной кислоты). Продукт выделяли в виде свободного основания путем растворения в этилацетате, промывая насыщенным раствором бикарбоната натрия, с сушкой над сульфатом магния и последующим фильтрованием и концентрированием с получением 1-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)имидазолидин-2,4-диона (32,2 мг, 0,082 ммоль, 14,90% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,00 (с, 1H), 10,21 (с, 1H), 7,92 (д, J=8,59 Гц, 2H), 7,56-7,69 (м, 4H), 7,09 (т, J=4,10 Гц, 1H), 4,91 (с, 2H), 4,08 (с, 2H), (ESI): m/z 391,1 [M+1]+.
Пример 91: (1-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперидин-4-ил)метанол
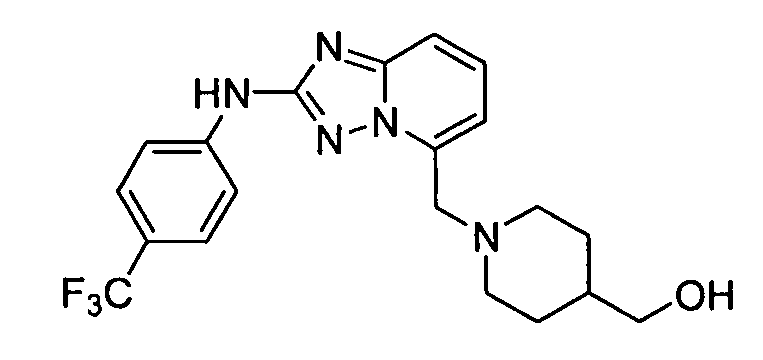
A. (1-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперидин-4-ил)метанол. (2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанол (0,2 г, 0,649 ммоль) растворяли в этилацетате (5 мл) и триэтиламине (0,271 мл, 1,946 ммоль). Затем добавляли метансульфонилхлорид (0,101 мл, 1,298 ммоль) и перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли пиперидин-4-илметанол (0,224 г, 1,946 ммоль) и перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали и затем очищали при помощи обращенно-фазовой ВЭЖХ (10-70% ацетонитрила и вода с 0,1% трифторуксусной кислоты). Фракции, содержащие продукт, пропускали через ионообменную колонку (Strata-XC) и выделяли при помощи 2M аммиака в метаноле. Раствор концентрировали и растирали в порошок с 5% метанола в этилацетате с получением белого твердого вещества, (0,086 г, 0,212 ммоль, 32,7% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,18 (с, 1H), 7,91 (д, J=8,2 Гц, 2H), 7,58-7,69 (м, 3H), 7,51-7,57 (м, 1H), 7,09 (д, J=6,6 Гц, 1H), 4,45 (т, J=4,7 Гц, 1H), 3,96 (с, 2H), 3,27 (т, J=4,5 Гц, 2H), 2,98 (д, J=11,7 Гц, 2H), 2,16 (т, J=10,9 Гц, 2H), 1,68 (д, J=11,7 Гц, 2H), 1,39 (шир.с, 1H), 1,13-1,31 (м, 3H). MS (ESI) m/z 406,3 [M+1]+.
Пример 92: 4-(5-(2-Гидрокси-2-(пиперидин-4-ил)этил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамид
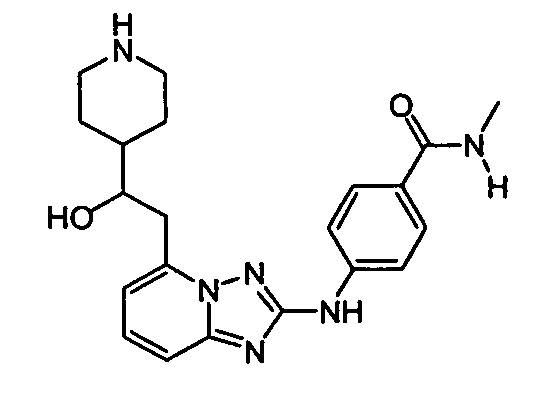
A. трет-Бутил 6-метилпиридин-2-илкарбамат. Смесь 6-метилпиридин-2-амина (5 г, 46 ммоль), ди-трет-бутилдикарбоната (20 г, 92 ммоль), триэтиламина (9,3 г, 92 ммоль) и N,N-диметилпиридин-4-амина (280 мг, 2,3 ммоль) в дихлорметане (20 мл) перемешивали при комнатной температуре в течение ночи. Добавляли воду и органический слой отделяли, водную фазу экстрагировали дихлорметаном. Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали при пониженном давлении. Неочищенный продукт очищали на колонке с силикагелем (элюируя при помощи 10% этилацетата в петролейном эфире) с получением трет-бутил 6-метилпиридин-2-илкарбамата (3 г, 30% выход) в виде твердого вещества. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,63 (т, J=8,0 Гц, 1H), 7,31 (д, J=8,0 Гц, 1H), 7,06 (д, J=7,6 Гц, 1H), 2,55 (с, 3H), 1,45 (с, 9H).
B. трет-Бутил 4-(2-(6-(трет-бутоксикарбониламино)пиридин-2-ил)ацетил)пиперидин-1-карбоксилат. К перемешиваемому раствору трет-бутил 6-метилпиридин-2-илкарбамата (1 г, 4,8 ммоль) в тетрагидрофуране (10 мл) добавляли по каплям раствор н-бутиллития в гексане (4,8 мл, 2,5 M) при -78°C в атмосфере азота в течение 1 часа. После завершения добавления реакционную смесь нагревали до комнатной температуры в течение 1 часа и охлаждали снова при -78°C. К смеси добавляли по каплям раствор трет-бутил 4-(метокси(метил)карбамоил)пиперидин-1-карбоксилата (1,6 г, 5,7 ммоль) в тетрагидрофуране (10 мл) при -78°C, реакционную смесь нагревали до комнатной температуры в течение ночи. Медленно добавляли водный раствор хлорида аммония и смесь экстрагировали этилацетатом (30 мл ×3). Объединенный органический слой промывали насыщенным солевым раствором (50 мл), сушили над сульфатом натрия и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 20% этилацетата в петролейном эфире), с получением трет-бутил 4-(2-(6-(трет-бутоксикарбониламино)пиридин-2-ил)ацетил)пиперидин-1-карбоксилата (380 мг, 19% выход) в виде твердого вещества. MS (ESI): m/z 420,1 [M+1]+.
C. трет-Бутил 4-(2-(6-(трет-бутоксикарбониламино)пиридин-2-ил)-1-гидроксиэтил)пиперидин-1-карбоксилат. Смесь трет-бутил 4-(2-(6-(трет-бутоксикарбониламино)пиридин-2-ил)ацетил)пиперидин-1-карбоксилата (380 мг, 0,9 ммоль) и борогидрида натрия (69 мг, 1,8 ммоль) в тетрагидрофуране (5 мл) нагревали при кипячении с обратным холодильником в течение 0,5 часов. Смесь концентрировали в вакууме и остаток разбавляли этилацетатом. Органический слой промывали насыщенным солевым раствором и концентрировали при пониженном давлении с получением трет-бутил 4-(2-(6-(трет-бутоксикарбониламино)пиридин-2-ил)-1-гидроксиэтил)пиперидин-1-карбоксилата (320 мг, 84% выход) в виде твердого вещества. MS (ESI): m/z 422,2 [M+1]+.
D. 2-(6-Аминопиридин-2-ил)-1-(пиперидин-4-ил)этанол. Смесь трет-бутил 4-(2-(6-(трет-бутоксикарбониламино)пиридин-2-ил)-1-гидроксиэтил)пиперидин-1-карбоксилата (320 г,0,76 ммоль) в метанольном растворе гидрохлорида (2 M, 5 мл) перемешивали в течение 2 часов. Реакционную смесь концентрировали в вакууме с получением 2-(6-амино-пиридин-2-ил)-1-пиперидин-4-ил-этанола (160 мг, 95% выход) в виде твердого вещества.
E. трет-Бутил 4-(2-(6-аминопиридин-2-ил)-1-гидроксиэтил)пиперидин-1-карбоксилат. Смесь метил 2-(6-аминопиридин-2-ил)-1-(пиперидин-4-ил)этанола (160 мг, 0,72 ммоль), ди-трет-бутилдикарбоната (158 мг, 0,72 ммоль) и триэтиламина (145 мг, 1,44 ммоль) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение ночи. Добавляли воду и органический слой отделяли. Водную фазу экстрагировали дихлорметаном и объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали при пониженном давлении. Неочищенный продукт очищали на колонке с силикагелем (элюируя при помощи 30% этилацетата в петролейном эфире) с получением трет-бутил 4-(2-(6-аминопиридин-2-ил)-1-гидроксиэтил)пиперидин-1-карбоксилата (220 мг, 95% выход) в виде твердого вещества. MS (ESI): m/z 322,1 [M+1]+.
F. трет-Бутил 4-(2-(6-(3-(этоксикарбонил)тиоуреидо)пиридин-2-ил)-1-гидроксиэтил)пиперидин-1-карбоксилат. Смесь трет-бутил 4-(2-(6-аминопиридин-2-ил)-1-гидроксиэтил)пиперидин-1-карбоксилата (220 мг, 0,68 ммоль) и этоксикарбонилизотиоцианата (89 мг, 0,68 ммоль) в диоксане (5 мл) перемешивали при комнатной температуре в течение 5 часов. Растворитель удаляли с получением трет-бутил 4-(2-(6-(3-(этоксикарбонил)тиоуреидо)пиридин-2-ил)-1-гидроксиэтил)пиперидин-1-карбоксилата (309 мг, 99%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
G. трет-Бутил 4-(2-(2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1-гидроксиэтил)пиперидин-1-карбоксилат. К раствору гидрохлорида гидроксиламина (236 мг, 3,4 ммоль) и N,N-диэтилизопропиламина (263 мг, 2,0 ммоль) в смеси этанола и метанола (20 мл, об/об, 1:1) добавляли трет-бутил 4-(2-(6-(3-(этоксикарбонил)тиоуреидо)пиридин-2-ил)-1-гидроксиэтил)пиперидин-1-карбоксилат (309 мг, 0,68 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и при 70°C в течение 5 часов. Летучие вещества удаляли при пониженном давлении, остаток разбавляли водой и водную фазу экстрагировали дихлорметаном. Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали при пониженном давлении с получением трет-бутил 4-(2-(2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1-гидроксиэтил)пиперидин-1-карбоксилата (150 мг, 61% выход) в виде твердого вещества. MS (ESI): m/z 362,1 [M+1]+.
Н. трет-Бутил 4-(1-гидрокси-2-(2-(4-(метилкарбамоил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этил)пиперидин-1-карбоксилат. Дегазированную смесь трет-бутил 4-(2-(2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1-гидроксиэтил)пиперидин-1-карбоксилата (130 мг, 0,36 ммоль), 4-иод-N-метилбензамида (113 мг, 0,43 ммоль), трис(дибензилиденацетон)дипалладия(0) (16 мг, 0,02 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (21 мг, 0,044 ммоль) и карбоната цезия (140 мг, 0,43 ммоль) в диоксане (5 мл) нагревали при 100°C в атмосфере азота в течение ночи. Реакционную смесь разбавляли водой и водный слой экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и упаривали при пониженном давлении. Остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (23-43% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 20 минут) с получением трет-бутил 4-(1-гидрокси-2-(2-(4-(метилкарбамоил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этил)пиперидин-1-карбоксилата в форме соли трифторуксусной кислоты (40 мг, выход 19%). MS (ESI): m/z 495,1 [M+1]+.
I. 4-(5-(2-Гидрокси-2-(пиперидин-4-ил)этил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамид. Смесь трет-бутил 4-(1-гидрокси-2-(2-(4-(метилкарбамоил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этил)пиперидин-1-карбоксилата (40 мг, 0,08 ммоль) соли трифторуксусной кислоты в метанольном растворе гидрохлорида (2 M, 50 мл) нагревали при кипячении с обратным холодильником в течение ночи. Реакционную смесь концентрировали в вакууме с получением 4-(5-(2-гидрокси-2-(пиперидин-4-ил)этил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамида (20 мг, 64% выход) в виде гидрохлоридной соли. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,97 (т, J=8,0 Гц, 1H), 7,90 (д, J=8,4 Гц, 2H), 7,76 (д, J=8,4 Гц, 2H), 7,69 (д, J=8,8 Гц, 1H), 7,40 (д, J=7,2 Гц, 1H), 4,08 (с, 1H), 3,67 (д, J=12,4 Гц, 1H), 3,48 (м, 2H), 3,17 (м, 2H), 3,06 (м, 2H), 2,94 (с, 3H), 2,23 (д, J=14,0 Гц, 1H), 2,13 (д, J=13,2 Гц, 1H), 1,73 (м, 2H); MS (ESI): m/z 394,9 [M+1]+.
Пример 93: цис-4-(5-Фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)циклогексанкарбоксамид
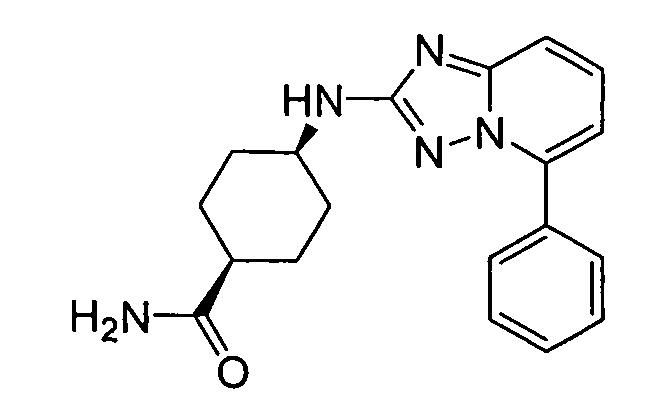
A. Этил 4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-циклогексанкарбоксилат. Раствор 5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,500 г, 2,378 ммоль) в 1,2-дихлорэтане (9,51 мл) при комнатной температуре обрабатывали этил 4-оксоциклогексанкарбоксилатом (0,607 г, 3,57 ммоль) и триацетоксиборогидридом натрия (1,00 г, 4,76 ммоль), а также уксусной кислотой (0,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Поскольку все еще присутствовали непрореагировавшие исходные вещества, использовали дополнительные реагенты и перемешивание продолжали в течение ночи. Реакцию гасили водой и перемешивали в течение 5 минут Органическую фазу отделяли и сушили над сульфатом магния и упаривали досуха. Неочищенное вещество очищали колоночной хроматографией на силикагеле (элюируя при помощи 10-20% этилацетата в гексане). Этил 4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)циклогексанкарбоксилат (0,5 г, 1,372 ммоль, 57,7% выход) использовали в виде смеси диастереомеров на последующей стадии гидролиза. MS (ESI) m/z 365 [M+1]+.
B. 4-(5-Фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)циклогексанкарбоновая кислота. Этил 4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)циклогексанкарбоксилат (0,5 г, 1,372 ммоль) суспендировали в 3,0 M водном растворе HCl (10 мл) и нагревали до 60°C. Через 2 часа реакция завершалась, и растворители удаляли при пониженном давлении. Неочищенную 4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)циклогексанкарбоновую кислоту (0,462 г, 1,372 ммоль) использовали без дополнительной очистки. MS (ESI) m/z 337 [M+1]+.
C. цис-4-(5-Фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)циклогексанкарбоксамид. При комнатной температуре 4-(5-фенил-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)циклогексанкарбоновую кислоту (0,462 г, 1,372 ммоль) растворяли в N,N-диметилформамиде (5,49 мл) и обрабатывали 4-метилморфолином (0,208 г, 2,058 ммоль), хлоридом аммония (0,110 г, 2,058 ммоль) и гексафторфосфатом (1H-бензо[d][1,2,3]триазол-1-илокси)трис(диметиламино)фосфония(V) (0,910 г, 2,058 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении и неочищенное вещество распределяли между этилацетатом и водным раствором бикарбоната натрия. Органическую фазу промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали досуха. Неочищенное вещество очищали колоночной хроматографией на силикагеле (элюируя при помощи 0-10% метанола в этилацетате). Полное разделение 2 диастереомеров осуществляли при помощи полу-препаративной ВЭЖХ (10-50% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты в течение 30 минут, 3 впрыска). Соответствующие фракции собирали и нейтрализовали при помощи 1,75 M водного раствора карбоната калия. Основное количество полярного компонента собирали в виде твердого вещества, с фильтрованием после удаления ацетонитрила при пониженном давлении. Это твердое вещество промывали водой, пока pH промывки не становился нейтральным. Вещество выделяли (0,015 г) в виде белого твердого вещества (99,8% чистоты), ассоциируемого с цис изомером, на основании его спектра протонного ЯМР. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,95-7,99 (м, 1H), 7,51-7,60 (м, 2H), 7,36 (дд, J=8,7, 1,2 Гц, 1H), 7,05 (дд, J=7,4, 1,3 Гц, 1H), 3,52-3,62 (м, 1H), 2,17-2,27 (м, 1H), 1,90-1,97 (м, 1H), 1,55-1,67 (м, 1H), 1,27-1,38 (м, 1H). Менее полярный компонент экстрагировали этилацетатом. Экстракты сушили над сульфатом магния и упаривали досуха с получением 0,033 г вещества, ассоциируемого с транс изомером (98,9% чистоты), на основании его спектра протонного ЯМР. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,93-7,99 (м, 2H)3 7,48-7,60 (м, 4H), 7,34-7,39 (м, 1H), 7,05 (дд, J=7,3, 1,1 Гц, 1H), 3,87-3,93 (м, 1H), 2,30-2,40 (м, 1H), 1,82-1,99 (м, 4H), 1,64-1,78 (м, 4H); MS (ESI) m/z 336 [M+1]+.
Пример 94: (6-(2-(6-Метилпиридин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1Н-бензо[d]имидазол-2-ил)метанол
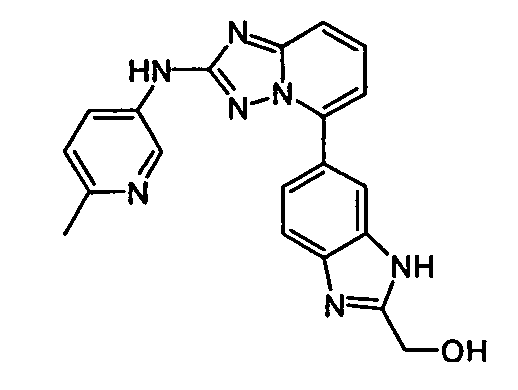
A. 4-(2-Бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-нитроанилин. Дегазированную смесь 2,5-дибром-[1,2,4]триазоло[1,5-α]пиридина (2 г, 7,28 ммоль), 2-нитро-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (2,3 г, 8,74 ммоль), карбоната натрия (1,53 г, 14,4 ммоль) и 1,1'-бис(дифенилфосфино)ферроценпалладийдихлорида (534 мг, 0,728 ммоль) в смеси диоксана и воды (об/об, 3:1, 28 мл) нагревали при 100°C в атмосфере азота в течение ночи. Реакционную смесь выливали в воду и смесь экстрагировали этилацетатом. Объединенные органические слои сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток очищали на колонке с силикагелем (элюируя при помощи 10-50% этилацетата в петролейном эфире) с получением 4-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-нитроанилина (1,38 г, 57% выход) в виде твердого вещества. MS (ESI): m/z 333,8 [M+1]+.
B. трет-Бутил 4-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-нитрофенилкарбамат. Смесь 4-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-нитроанилина (1,2 г, 3,6 ммоль), ди-трет-бутилдикарбоната (1,96 г, 9 ммоль) и N,N-диметилпиридин-4-амина (144 мг, 1,08 ммоль) в дихлорметане (50 мл) перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении и остаток разбавляли этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток очищали на колонке с силикагелем (элюируя при помощи 10-50% этилацетата в петролейном эфире) с получением трет-бутил 4-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-нитрофенилкарбамата (1,4 г, 90% выход) в виде желтого твердого вещества. MS (ESI): m/z 433,8 [M+1]+.
C. трет-Бутил 4-(2-(6-метилпиридин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-нитрофенилкарбамат. Дегазированный раствор трет-бутил 4-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-нитрофенилкарбамата (440 мг, 0,81 ммоль), 6-метилпиридин-3-амина (105 мг, 0,93 ммоль), трис(дибензилиденацетон)дипалладия(0) (75 мг, 0,081 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (92 мг, 0,162 ммоль) и трет-бутоксид калия (198 мг, 1,62 ммоль) в диоксане (20 мл) нагревали при 110°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры реакционную смесь концентрировали и остаток растворяли в смеси дихлорметана и метанола (об/об, 1:1, 20 мл). Твердые частицы фильтровали и фильтрат концентрировали. Остаток очищали на колонке с силикагелем (элюируя при помощи 10-100% этилацетата в петролейном эфире) с получением трет-бутил 4-(2-(6-метилпиридин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-нитрофенилкарбамата (310 мг, 77% выход). MS (ESI): m/z 462,1 [M+1]+.
D. 5-(4-Амино-3-нитрофенил)-N-(6-метилпиридин-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Раствор трет-бутил 4-(2-(6-метилпиридин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-нитрофенилкарбамата (310 мг, 0,67 ммоль) в метанольном растворе гидрохлорида (20 мл, 2 M) перемешивали при комнатной температуре, пока анализ ТСХ не показал, что исходное вещество было израсходовано. Растворитель выпаривали при пониженном давлении с получением неочищенного продукта, который подщелачивали путем добавления раствора бикарбоната натрия до pH=8. Раствор экстрагировали этилацетатом три раза и органические слои сушили над безводным сульфатом натрия. После упаривания при пониженном давлении 5-(4-амино-3-нитрофенил)-N-(6-метилпиридин-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (190 мг, 75% выход) получали в виде твердого вещества. MS (ESI): m/z 362,1 [M+1]+.
E. 4-(2-(6-Метилпиридин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензол-1,2-диамин. Смесь 5-(4-амино-3-нитрофенил)-N-(6-метилпиридин-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (200 мг, 0,513 ммоль), цинковой пыли (334 мг, 5,13 ммоль) и хлорида аммония (277 мг, 5,13 ммоль) в смеси тетрагидрофурана и метанола (об/об, 1:1, 40 мл) перемешивали при комнатной температуре в течение 2 часов. Смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток распределяли между водой и этилацетатом и водный раствор экстрагировали этилацетатом три раза. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме с получением 4-(2-(6-метилпиридин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензол-1,2-диамина (158 мг, 86% выход) в виде твердого вещества. MS (ESI): m/z 332,1 [M+1]+.
F. (6-(2-(6-Метилпиридин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1H-бензо[d]имидазол-2-ил)метанол. Смесь 4-(2-(6-метилпиридин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бензол-1,2-диамина (158 мг, 0,48 ммоль) и гидроксиуксусной кислоты (145 мг, 1,92 ммоль) в 4н хлористоводородной кислоте (30 мл) нагревали при кипячении с обратным холодильником в течение 24 часов. Реакционную смесь упаривали при пониженном давлении. Остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (элюируя при помощи 7-37% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 минут) с получением (6-(2-(6-метилпиридин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-1H-бензо[d]имидазол-2-ил)метанола в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль (116 мг, 65% выход), в виде твердого вещества. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 9,24 (с, 1H), 8,47 (с, 1H), 8,43 (м, 1H), 8,26 (д, J=9,6 Гц, 1H), 8,01 (д, J=8,8 Гц, 1H), 7,84 (м, 2H), 7,71 (д, J=9,2 Гц, 1H), 7,39 (д, J=7,6 Гц, 1H), 5,19 (с, 2H), 2,71 (с, 3H); MS (ESI): m/z 372,1 [M+1]+.
Пример 95: 4-(1-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этил)пиперазин-2-он
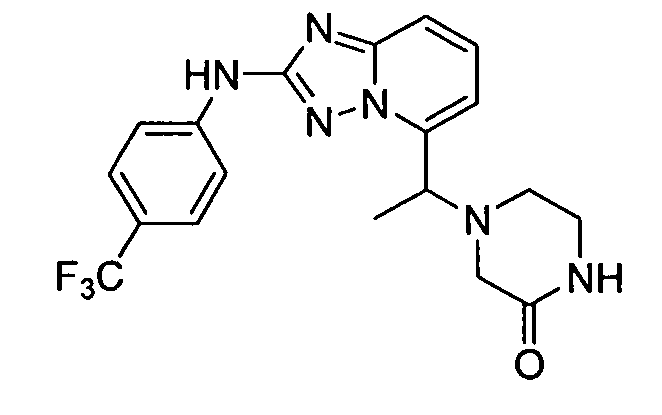
A. 1-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этанол. Суспензию 5-бром-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (1,0 г, 2,80 ммоль) в тетрагидрофуране (14 мл) охлаждали до -78°C и добавляли н-бутиллитий в гексане (2,352 мл, 5,88 ммоль) по каплям в атмосфере азота. Красновато-коричневую реакционную смесь перемешивали в течение 1 часа при -78°C и к реакционной смеси добавляли неразбавленный ацетальдегид (0,123 г, 0,16 мл, 2,80 ммоль) при -78°C в атмосфере азота. Баню с сухим льдом удаляли и реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 1 часа в атмосфере азота. Когда реакция завершалась, как показал анализ ЖХ/МС, реакцию гасили с использованием уксусной кислоты (1,5 мл) в воде (20 мл), выливали в воду/насыщенный солевой раствор и экстрагировали этилацетатом несколько раз. Объединенный органический слой сушили над безводным сульфатом магния и концентрировали. Неочищенную смесь очищали хроматографией с использованием градиента 0-100% этилацетата в гексане с получением 1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этанола в виде желтовато-коричневого твердого вещества (0,384 г, 43% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,21 (с, 1H), 7,90 (д, J=8,49 Гц, 2H), 7,62-7,70 (м, 3H), 7,52-7,58 (м, 1H), 7,15 (д, J=7,17 Гц, 1H), 5,84 (д, J=4,59 Гц, 1H), 5,33 (квин., J=5,87 Гц, 1H), 1,54 (д, 3H) 10,21 (с, 1H), 7,90 (д, J=8,49 Гц, 2H), 7,62-7,70 (м, 3H), 7,52-7,58 (м, 1H), 7,15 (д, J=7,17 Гц, 1H), 5,84 (д, J=4,59 Гц, 1H), 5,33 (квин., J=5,87 Гц, 1H), 1,54 (д, 3H); MS (ESI) m/z 323,29 [M+1]+.
B. 5-(1-Бромэтил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К раствору 1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этанола (0,374 г, 1,160 ммоль) в диоксане (20 мл) добавляли трибромид фосфора (0,328 мл, 3,48 ммоль) при комнатной температуре. Реакционную смесь перемешивали при 40°C в течение 22 часов. Когда реакция завершалась, как показал анализ ЖХ/МС, суспензию охлаждали до комнатной температуры и выливали осторожно в раствор бикарбоната натрия (100 мл) и экстрагировали этилацетатом (200 мл). Органический слой отделяли, сушили над сульфатом магния и концентрировали с получением 5-(1-бромэтил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина в виде ярко-желтого твердого вещества (0,407 г, 91% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,30 (с, 1H), 7,95 (д, J=8,78 Гц, 2H), 7,62-7,73 (м, 4H), 7,39 (дд, J=1,76, 6,93 Гц, 1H), 5,94 (кв., J=6,98 Гц, 1H), 2,21 (д, 3H); MS (ESI) m/z 385/387 [M]+ и [M+2]+.
C. 4-(1-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этил)пиперазин-2-он. Желтую суспензи 5-(1-бромэтил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,150г, 0,389 ммоль), пиперазин-2-она (0,117 г, 1,168 ммоль) и карбоната калия (0,538 г, 3,89 ммоль) в ацетонитриле (5 мл) перемешивали при 60°C в течение 2 часов в атмосфере азота. Когда реакция завершалась, как показал анализ ЖХ/МС, реакционную смесь концентрировали с получением желтого твердого вещества, которое обрабатывали водой (8 мл) и обрабатывали ультразвуком. Полученный бледно-желтый осадок собирали, промывали водой (2 мл) и сушили с получением указанного в заголовке соединения (96,8% чистоты, 0,135 г, 86% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,20 (с, 1H), 7,91 (д, J=8,39 Гц, 2H), 7,81 (шир.с, 1H), 7,54-7,69 (м, 4H), 7,15 (д, J=7,13 Гц, 1H), 4,57 (кв., J=6,36 Гц, 1H), 3,02-3,26 (м, 4H), 2,68 (шир.с, 2H), 1,47 (д, 3H); MS (ESI) m/z 405,39 [M+1]+.
Пример 96: (S)-1-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пиперидин-3-ол
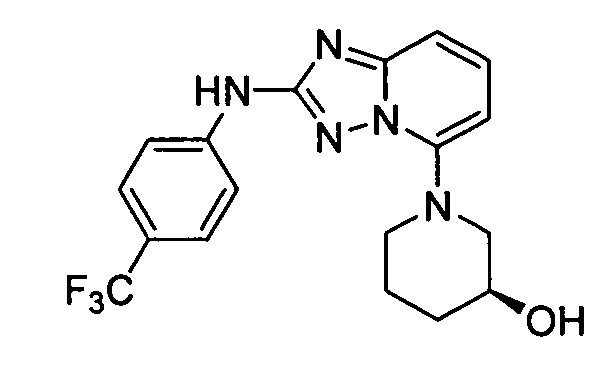
A. (S)-1-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)пиперидин-3-ол. 5-Бром-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,250г, 0,700 ммоль) и (S)-пиперидин-3-ол гидрохлорид (0,193 г, 1,400 ммоль) суспендировали в 1-метил-2-пирролидиноне (2 мл), обрабатывали при помощи диизопропилэтиламина (0,403 мл, 2,310 ммоль) и перемешивали при 80°C в течение 2 дней. Коричневый раствор распределяли между этилацетатом (10 мл) и водой (10 мл). Органический слой отделяли и концентрировали с получением коричневого масла, которое очищали с использованием обращенно-фазовой препаративной ВЭЖХ (20-80% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 мин). Трифторуксусную кислоту удаляли с использованием Strata картриджа с получением продукта в виде белого твердого вещества (0,077 г, 29% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,08 (с, 1H), 7,93 (д, J=8,54 Гц, 2H), 7,63 (д, J=8,64 Гц, 2H), 7,52 (дд, J=7,81, 8,54 Гц, 1H), 7,16 (дд, J=0,93, 8,64 Гц, 1H), 6,47 (дд, J=0,95, 7,78 Гц, 1H), 4,97 (д, J=4,69 Гц, 1H), 3,96 (дд, J=3,64, 11,88 Гц, 1H), 3,73-3,86 (м, 2H), 2,85-2,97 (м, 1H), 2,74 (дд, J=9,05, 11,01 Гц, 1H), 1,97-2,07 (м, 1H), 1,84-1,95 (м, 1H), 1,65-1,78 (м, 1H), 1,35-1,48 (м, 1H). MS (ESI) m/z 378,2 [M+1]+.
Пример 97: цис-4-(Метил(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)амино)циклогексанол
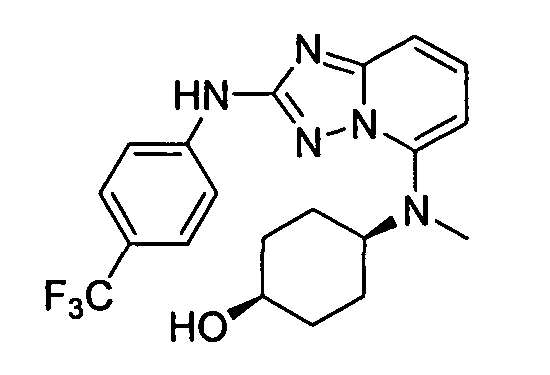
A. цис-4-(Метил(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)амино)циклогексанол. К раствору/суспензии цис-4-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанола (70 мг, 0,179 ммоль) в N,N-диметилформамиде (5 мл) добавляли гидрид натрия (14,31 мг, 0,358 ммоль). Реакционную смесь перемешивали в течение 10 минут, затем добавляли иодметан (0,012 мл, 0,197 ммоль). Реакционную смесь перемешивали в течение ночи, затем реакцию контролировали при помощи ЖХ/МС. Помимо желаемого продукта, наблюдали побочный продукт (цис-N5-(4-метоксициклогексил)-N5-метил-N2-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамин). Реакционную смесь фильтровали через фильтровальный картридж и неочищенное вещество очищали на Dionex HPLC (30-70% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 35 мин). Фракции, содержащие продукт, загружали на колонку strata-X для удаления трифторуксусной кислоты, затем метанол выпаривали в вакууме. Твердое вещество сушили в вакууме при комнатной температуре. цис-4-(Метил(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)амино)циклогексанол (10 мг, 0,025 ммоль, 13,8% выход) выделяли в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,90 (д, J=8,20 Гц, 1H), 7,69 (д, J=8,59 Гц, 1H), 7,43 (т, J=8,20 Гц, 1H), 6,76 (д, J=8,59 Гц, 1H), 6,24 (т, J=9,18 Гц, 2H), 4,48 (шир.с, 1H), 3,80 (шир.с, 1H), 3,61 (шир.с, 1H), 3,35 (шир.с, 4H), 3,15 (шир.с, 1H), 2,07 (шир.с, 1H), 1,78-1,98 (м, 3H), 1,42-1,78 (м, 6H); MS (ESI): m/z 406,2 [M+1]+.
Пример 98: 1-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)-l,4-диазепан-5-он
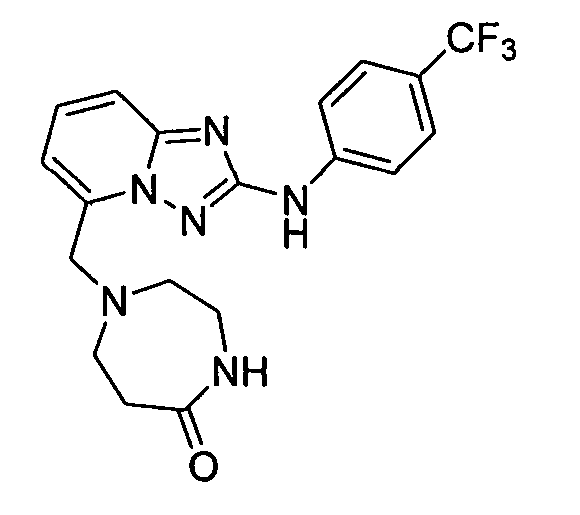
A. (2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метилметансульфонат. Суспензию (2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанола (150 мг, 0,487 ммоль), в дихлорэтане (3 мл) обрабатывали метансульфонилхлоридом (0,113 мл, 1,460 ммоль) и триэтиламином (0,203 мл, 1,460 ммоль). Реакционную смесь оставляли для перемешивания в течение одного часа и реакцию отслеживали при помощи ТСХ. После поглощения исходного вещества растворитель удаляли в вакууме и неочищенный (2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метилметансульфонат (188 мг, 0,487 ммоль, 100% выход) использовали на следующей стадии без очистки.
B. 1-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)-1,4-диазепан-5-он. К суспензии (2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метилметансульфоната (125 мг, 0,324 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли 1,4-диазепан-5-он (73,9 мг, 0,647 ммоль) с последующим добавлением карбоната калия (334,65 мг, 2,425 ммоль). Реакционную смесь нагревали до 60°C в течение трех часов и контролировали при помощи ЖХ/МС. Реакционную смесь фильтровали и очищали при помощи полу-препаративной ВЭЖХ (20-100% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 20 мин). 1-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)-1,4-диазепан-5-он (96,5 мг, 0,239 ммоль, 73,8% выход) получали в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,18 (с, 1H), 7,91 (д, J=8,59 Гц, 2H), 7,47-7,76 (м, 6H), 7,14 (д, J=7,03 Гц, 1H), 3,98-4,24 (м, 2H), 3,14-3,26 (м, 3H), 2,68-2,80 (м, 5H). MS (ESI): m/z 420,1 [M+1]+.
Пример 99: 4-((2-(1Н-Пирроло[2,3-b]пиридин-5-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он
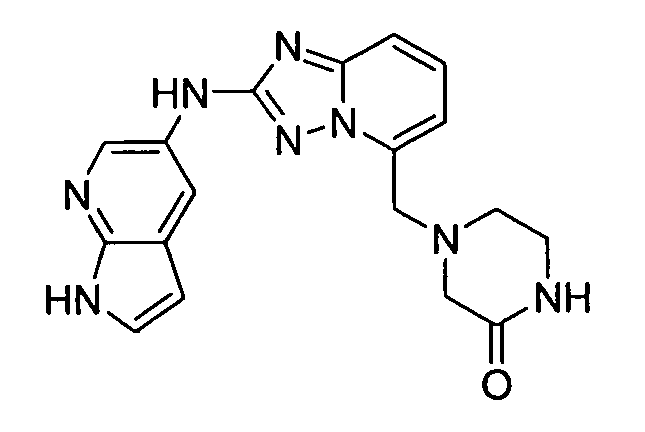
A. N,N-Ди-трет-бутоксикарбонил-5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амин. 5-Бром-[1,2,4]триазоло[1,5-α]пиридин-2-амин (2,2 г, 10,33 ммоль), ди-трет-бутилдикарбонат (5,27 мл, 22,72 ммоль), 4-(диметиламино)пиридин (0,126 г, 1,033 ммоль) и ацетонитрил (5 мл) нагревали до 60°C в течение 1 часа. Реакционную смесь концентрировали и затем очищали при помощи хроматографии на силикагеле (0-80% этилацетата в гексане) с получением N,N-ди-трет-бутоксикарбонил-5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амина (3 г, 7,26 ммоль, 70,3% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMS(W6) δ (м.д.) 7,87-7,95 (м, 1H), 7,65-7,74 (м, 2H), 1,42 (с, 18H); MS (ESI) m/z 415,2 [M+2]+.
B. N,N-Ди-трет-бутоксикарбонил-5-винил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. N,N-Ди-трет-бутоксикарбонил-5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амин (1,66 г, 4,02 ммоль), трибутил(винил)станнан (2,55 г, 8,03 ммоль), трис(дибензилиденацетон)дипалладий(0) (0,368 г, 0,402 ммоль), три-o-толилфосфин (0,245 г, 0,803 ммоль), триэтиламин (1,680 мл, 12,05 ммоль) и N,N-диметилформамид (6 мл) объединяли в 50-мл круглодонной колбе со стержневой мешалкой. Атмосферу в сосуде удаляли и замещали газообразным азотом три раза. Полученную смесь интенсивно перемешивали и нагревали при 80°C в атмосфере азота в течение 45 минут. Полученную черную смесь очищали с использованием флэш-хроматографии (Biotage) (5-100% этилацетата в гексане) с получением неочищенного N,N-ди-трет-бутоксикарбонил-5-винил-[1,2,4]триазоло[1,5-α]пиридин-2-амина в виде желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. MS (ESI) m/z 361,2 [M+1]+.
C. N,N-Ди-трет-бутоксикарбонил-5-гидроксиметил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Тетроксид осмия (2,5% в трет-бутаноле) (1,209 мл, 0,092 ммоль) добавляли к перемешиваемой смеси N,N-ди-трет-бутоксикарбонил-5-винил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (1,66 г, 4,61 ммоль) и периодата натрия (2,364 г, 11,05 ммоль) в 1,4-диоксане (15 мл), трет-бутаноле (15 мл) и воде (15 мл). Полученную смесь закрывали и интенсивно перемешивали при комнатной температуре в течение 3,5 часов. Полученную смесь разбавляли дихлорметаном и водой и встряхивали в делительной воронке. Слои разделяли и водный слой экстрагировали дихлорметаном. Объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе. Остаток растворяли в метаноле (15 мл) и охлаждали до 0°C в атмосфере азота. Добавляли борогидрид натрия (0,261 г, 6,91 ммоль) и полученную смесь перемешивали при 0°C в атмосфере азота в течение 25 минут. Основное количество растворителя удаляли на роторном испарителе. Остаток растворяли в дихлорметане и очищали с использованием флэш-хроматографии (Biotage) (10-90% этилацетата в гексане) с получением N,N-ди-трет-бутоксикарбонил-5-гидроксиметил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,656 г, 1,800 ммоль, 39% выход) в виде бесцветного пенистого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,74-7,82 (м, 2H), 7,27-7,33 (м, 1H), 5,90 (шир.с, 1H), 4,89 (с, 2H), 1,41 (с, 18H); MS (ESI) m/z 225 [M+1]+.
D. N,N-Ди-трет-бутоксикарбонил-5-((3-оксопиперазинил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Метансульфоновый ангидрид (0,374 г, 2,147 ммоль) добавляли к перемешиваемому раствору N,N-ди-трет-бутоксикарбонил-5-гидроксиметил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,652 г, 1,789 ммоль) и N,N-диизопропилэтиламина (0,935 мл, 5,37 ммоль) в дихлорметане (15 мл). Полученный светло-желтый раствор перемешивали при комнатной температуре в атмосфере азота в течение 30 минут и затем добавляли пиперазин-2-он (0,269 г, 2,68 ммоль). Полученную смесь перемешивали и нагревали при 50°C в условиях кипячения с обратным холодильником в атмосфере азота в течение 5,5 часов. Полученную смесь очищали с использованием флэш-хроматографии (Biotage) (0-10% метанола в дихлорметане) с получением желаемого продукта (0,764 г, 1,711 ммоль, 96% выход) в виде белого пенно-твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,71-7,83 (м, 3H), 7,31 (дд, J=1,37, 6,83 Гц, 1H), 4,08 (с, 2H), 3,17-3,23 (м, 2H), 3,14 (с, 2H), 2,74 (т, J=5,47 Гц, 2H), 1,40 (с, 18H); MS (ESI) m/z 447,3 [M+1]+.
E. 4-((2-Амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он. Трифторуксусную кислоту (2,55 мл, 33,1 ммоль) добавляли к перемешиваемому раствору N,N-ди-трет-бутоксикарбонил-5-((3-оксопиперазинил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,740 г, 1,657 ммоль) в дихлорметане (18,5 мл). Полученный раствор закрывали и перемешивали при комнатной температуре в течение 23 часов. Основное количество растворителя удаляли на роторном испарителе. Остаток загружали в две 5 г Strata X-C ионообменные колонки от компании Phenomenex. Колонки промывали последовательно ацетонитрилом, водой, ацетонитрилом, метанолом и затем 10% раствором гидроксида аммония в метаноле. Продукт выделяли вместе с элюентом 10% гидроксида аммония в метаноле. Элюент 10% гидроксида аммония в метаноле от двух партий концентрировали на роторном испарителе и сушили в условиях высокого вакуума при 40°C с получением желаемого продукта (0,406 г, 1,649 ммоль, 97%) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,82 (шир.с, 1H), 7,43 (дд, J=7,42, 8,59 Гц, 1H), 7,28 (д, J=8,59 Гц, 1H), 6,92 (д, J=7,03 Гц, 1H), 6,03 (с, 2H), 3,94 (с, 2H), 3,21 (шир.с, 2H), 3,12 (с, 2H), 2,71 (т, 2H); MS (ESI) m/z 247,3 [M+1]+.
F. 4-((2-(1-Тозил-1Н-пирроло[2,3-6]пиридин-5-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он. Смесь трис(дибензилиденацетон)дипалладия(0) (0,019 г, 0,020 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,023 г, 0,041 ммоль) в 1,4-диоксане (1,25 мл) добавляли к 5-бром-1-тозил-1H-пирроло[2,3-6]пиридину (0,086 г, 0,244 ммоль), 4-((2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-ону (0,050г, 0,203 ммоль) и карбонату цезия (0,265 г, 0,812 ммоль) в сосуде с массой 1 драхма с стержневой мешалкой. Осуществляли продувку азотом для удаления воздуха. Полученную смесь герметично закрывали, интенсивно перемешивали и нагревали при 100°C в течение 2 часов 20 минут. Полученную смесь разбавляли ацетонитрилом, фильтровали и очищали с использованием обращенно-фазовой полу-препаративной ВЭЖХ (10-70% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 34 мин). Фракции, содержащие желаемый продукт, объединяли и загружали на Strata X-C ионообменную колонку от компании Phenomenex. Колонку промывали последовательно водой, ацетонитрилом, метанолом и затем 5% раствором гидроксида аммония в метаноле. Продукт выделяли вместе с элюентом 5% гидроксида аммония в метаноле и концентрировали на роторном испарителе и сушили в условиях высокого вакуума при 40°C с получением желаемого продукта (0,062 г, 0,116 ммоль, 57% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,91 (с, 1H), 8,59 (с, 1H), 8,48 (с, 1H), 7,97 (д, J=7,81 Гц, 2H), 7,77-7,88 (м, 2H), 7,56-7,64 (м, 1H), 7,49-7,56 (м, 1H), 7,42 (д, J=7,81 Гц, 2H), 7,10 (д, J=7,03 Гц, 1H), 6,82 (д, J=3,90 Гц, 1H), 4,08 (с, 2H), 3,13-3,27 (м, 4H), 2,77 (шир.с, 2H), 2,34 (с, 3H); MS (ESI) m/z 517,1 [M+1]+.
G. 4-((2-(1Н-пирроло[2,3-b]пиридин-5-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он. Гидрид натрия (0,027 г, 1,142 ммоль) добавляли к перемешиваемой смеси 4-((2-(1-тозил-1H-пирроло[2,3-b]пиридин-5-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-она (0,059 г, 0,114 ммоль) и метиламина (1,142 мл, 2,284 ммоль, 2 M раствор в тетрагидрофуране) в 1,4-диоксане (6 мл). Полученную мутную смесь нагревали при 40°C в условиях кипячения с обратным холодильником в атмосфере азота в течение 2 часов, затем при 55°C в течение 18 часов, затем при 70°C в течение 5 часов. Добавляли метанол (1 мл) и 1-метил-2-пирролидинон (1 мл) для улучшения растворимости исходного вещества. Полученную мутную смесь нагревали при 70°C в условиях кипячения с обратным холодильником в атмосфере азота в течение 1 часа. Полученный прозрачный желтый раствор охлаждали до комнатной температуры и добавляли трифторуксусную кислоту (0,088 мл, 1,142 ммоль). Основное количество растворителя удаляли на роторном испарителе. Остаток растворяли в метаноле, фильтровали и очищали с использованием обращенно-фазовой полу-препаративной ВЭЖХ (5-40% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 34 мин). Фракции, содержащие желаемый продукт, загружали на Strata X-C ионообменную колонку от компании Phenomenex. Колонку промывали последовательно водой, ацетонитрилом, метанолом и затем 5% раствором гидроксида аммония в метаноле. Продукт выделяли вместе с элюентом 5% гидроксида аммония в метаноле и концентрировали на роторном испарителе и сушили в условиях высокого вакуума при 40°C с получением желаемого продукта (0,019 г, 0,052 ммоль, 46% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,42 (шир.с, 1H), 9,52 (с, 1H), 8,45 (д, J=2,34 Гц, 1H), 8,42 (д, J=2,34 Гц, 1H), 7,83 (с, 1H), 7,53-7,62 (м, 1H), 7,50 (д, J=8,59 Гц, 1H), 7,40 (т, J=2,73 Гц, 1H), 7,06 (д, J=7,03 Гц, 1H), 6,40 (шир.с, 1H), 4,08 (с, 2H), 3,23 (шир.с, 2H), 3,19 (с, 2H), 2,78 (т, 2H); MS (ESI) m/z 363,3 [M+1]+.
Пример 100: N-Метил-4-(5-(2-(пиперидин-4-ил)этил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензамид
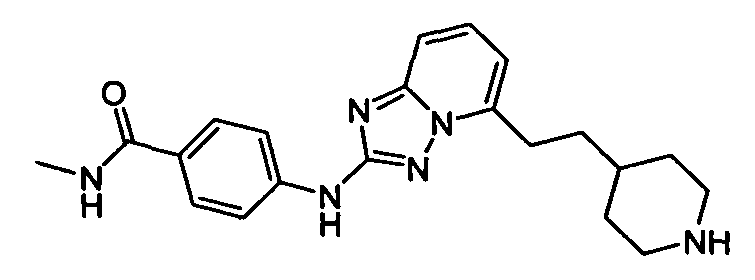
A. трет-Бутил 4-(2-(6-(трет-бутоксикарбониламино)пиридин-2-ил)-1-(метилсульфонилокси)этил)пиперидин-1-карбоксилат. К раствору трет-бутил 4-(2-(6-(трет-бутоксикарбониламино)пиридин-2-ил)-1-гидроксиэтил)пиперидин-1-карбоксилата (400 мг, 0,95 ммоль) и триэтиламина (191 мг, 1,9 ммоль) в дихлорметане (10 мл) добавляли по каплям метансульфонилхлорид (130 мг, 1,14 ммоль) на ледяной бане и реакционную смесь перемешивали при 0°C в течение 30 минут. Добавляли ледяную воду (10 мл) и органическую фазу отделяли. Водную фазу экстрагировали дихлорметаном (10 мл х2). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали при пониженном давлении с получением трет-бутил 4-(2-(6-(трет-бутоксикарбониламино)пиридин-2-ил)-1-(метилсульфонилокси)этил)пиперидин-1-карбоксилата (420 мг, 88% выход) в виде желтого масла. MS (ESI): m/z 500,3 [M+1]+.
B. трет-Бутил 4-(2-(6-(трет-бутоксикарбониламино)пиридин-2-ил)винил)пиперидин-1-карбоксилат. К перемешиваемому раствору гидрида натрия (51 мг, 1,26 ммоль) в изопропаноле (10 мл) добавляли по каплям раствор трет-бутил 4-(2-(6-(трет-бутоксикарбониламино)пиридин-2-ил)-1-(метилсульфонилокси)этил)пиперидин-1-карбоксилата (420 мг, 0,84 ммоль) в изопропаноле (10 мл) при 0°C в атмосфере азота. После перемешивания в течение 30 минут при 0°C смесь нагревали до комнатной температуры и перемешивали в течение ночи. Смесь выливали в воду (50 мл) и экстрагировали этилацетатом (20 мл ×4). Объединенные органические слои промывали насыщенным солевым раствором, сушили и концентрировали с получением трет-бутил 4-(2-(6-(трет-бутоксикарбониламино)пиридин-2-ил)винил)пиперидин-1-карбоксилата (300 мг, 88% выход) в виде масла. MS (ESI): m/z 404,1 [M+1]+.
C. трет-Бутил 4-(2-(6-(трет-бутоксикарбониламино)пиридин-2-ил)этил)пиперидин-1-карбоксилат. Смесь трет-бутил 4-(2-(6-(трет-бутоксикарбониламино)пиридин-2-ил)винил)пиперидин-1-карбоксилата (300 мг, 0,74 ммоль) и палладия на активированном угле (10% масс/масс, 50 мг) в метаноле (5 мл) гидрировали под давлением водорода 1 атмосфера в течение ночи. Катализатор отфильтровывали и фильтрат концентрировали с получением трет-бутил 4-(2-(6-(трет-бутоксикарбониламино)пиридин-2-ил)этил)пиперидин-1-карбоксилата (250 мг, 83% выход). MS (ESI): m/z 406,0 [M+1]+.
D. 6-(2-(Пиперидин-4-ил)этил)пиридин-2-амин. Раствор трет-бутил 4-(2-(6-(трет-бутоксикарбониламино)пиридин-2-ил)этил)пиперидин-1-карбоксилат (250 мг,0,61 ммоль) в метанольном растворе гидрохлорида (2 M, 5 мл) перемешивали в течение 2 часов. Реакционную смесь концентрировали в вакууме с получением 6-(2-(пиперидин-4-ил)этил)пиридин-2-амина, который использовали на следующей стадии без дополнительной очистки.
E. трет-Бутил 4-(2-(6-аминопиридин-2-ил)этил)пиперидин-1-карбоксилат. Смесь 6-(2-(пиперидин-4-ил)этил)пиридин-2-амина (126 мг, 0,61 ммоль), ди-трет-бутилдикарбоната (132 мг, 0,61 ммоль) и триэтиламина (123 мг, 1,22 ммоль) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение ночи. Добавляли воду, смесь экстрагировали дихлорметаном и объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали при пониженном давлении. Неочищенный продукт очищали на колонке с силикагелем (элюируя при помощи 50% этилацетата в петролейном эфире) с получением трет-бутил 4-(2-(6-аминопиридин-2-ил)этил)пиперидин-1-карбоксилата (150 мг, 80% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,33 (т, J=8,0 Гц, 1H), 6,44 (д, J=1,6 Гц, 1H), 6,31 (д, J=8,4 Гц, 1H), 4,78 (с, 2H), 4,01 (с, 2H), 2,59 (м, 4H), 1,57 (м, 4H), 1,38 (с, 10H), 1,08 (м, 2H).
F. трет-Бутил 4-(2-(6-(3-(этоксикарбонил)тиоуреидо)пиридин-2-ил)этил)пиперидин-1-карбоксилат. Смесь трет-бутил 4-(2-(6-аминопиридин-2-ил)этил)пиперидин-1-карбоксилата (150 мг, 0,49 ммоль) и O-этил карбонизотиоцианатидата (64 мг, 0,49 ммоль) в диоксане (5 мл) перемешивали при комнатной температуре в течение 5 часов. Смесь упаривали с получением трет-бутил 4-(2-(6-(3-(этоксикарбонил)тиоуреидо)пиридин-2-ил)этил)пиперидин-1-карбоксилата (213 мг, 99% выход) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
G. трет-Бутил 4-(2-(2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этил)пиперидин-1-карбоксилат. К раствору N,N-диэтилизопропиламина (189 мг, 1,4 ммоль) и гидрохлорида гидроксиламина (169 мг, 2,4 ммоль) в смеси этанола и метанола (10 мл, 1:1) добавляли трет-бутил 4-(2-(6-(3-(этоксикарбонил)тиоуреидо)пиридин-2-ил)этил)пиперидин-1-карбоксилат (213 мг, 0,49 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 часов и при 70°C в течение 5 часов. Летучие вещества удаляли при пониженном давлении и остаток разбавляли водой. Водную фазу экстрагировали дихлорметаном. Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали при пониженном давлении с получением трет-бутил 4-(2-(2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этил)пиперидин-1-карбоксилата (150 мг, 88% выход) в виде твердого вещества. MS (ESI): m/z 346,0 [M+1]+.
Н. трет-Бутил 4-(2-(2-(4-(метилкарбамоил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этил)пиперидин-1-карбоксилат. Дегазированную смесь трет-бутил 4-(2-(2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этил)пиперидин-1-карбоксилата (120 мг, 0,36 ммоль), 4-иод-N-метилбензамида (113 мг, 0,43 ммоль), трис(дибензилиденацетон)дипалладия(0) (16 мг, 0,02 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (21 мг, 0,044 ммоль) и карбоната цезия (87 мг, 0,72 ммоль) в диоксане (5 мл) нагревали при 100°C в атмосфере азота в течение ночи. Реакцию гасили водой (30 мл) и смесь экстрагировали этилацетатом (15 мл ×3). Объединенный органический слой сушили над сульфатом натрия и фильтровали. Фильтрат упаривали при пониженном давлении и остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (50-72% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 20 минут) с получением трет-бутил 4-(2-(2-(4-(метилкарбамоил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этил)пиперидин-1-карбоксилата (60 мг, 35% выход) в виде твердого вещества. MS (ESI): m/z 479,0 [M+1]+.
I. N-Метил-4-(5-(2-(пиперидин-4-ил)этил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензамид. Раствор трет-бутил 4-(2-(2-(4-(метилкарбамоил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этил)пиперидин-1-карбоксилата (60 мг, 0,12 ммоль) в метанольном растворе гидрохлорида (2 M, 5 мл) перемешивали в течение ночи. Реакционную смесь концентрировали в вакууме и остаток промывали этиловым эфиром с получением N-метил-4-(5-(2-(пиперидин-4-ил)этил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)бензамида (23 мг, 48% выход) в виде твердого вещества. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,81 (м, 4H), 7,59 (м, 1H), 7,45 (м, 1H), 6,98 (д, J=6,8 Гц, 1H), 3,42 (м, 2H), 3,02 (м, 2H), 2,94 (с, 3H), 2,15 (д, J=13,2 Гц, 2H), 1,93 (м, 2H), 1,80 (с, 1H), 1,50 (м, 2H); MS (ESI): m/z 379,2 [M+1]+.
Пример 101: 4-(5-((3-Гидроксициклопентил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамид
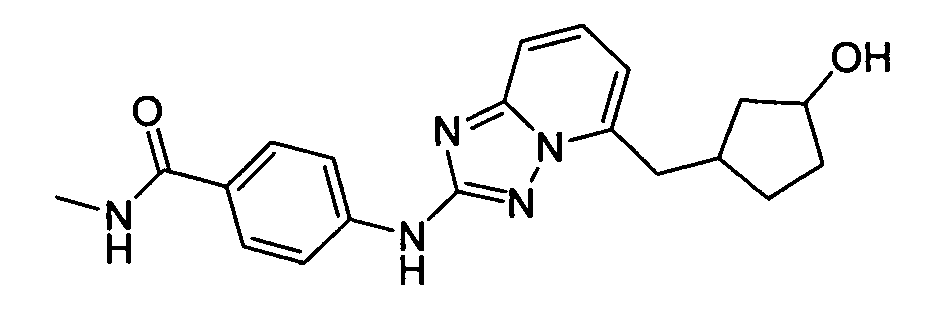
A. трет-Бутил 6-((3-оксоциклопентил)метил)пиридин-2-илкарбамат. К перемешиваемому раствору трет-бутил 6-метилпиридин-2-илкарбамата (1,25 г, 6,01 ммоль) в тетрагидрофуране (20 мл) добавляли по каплям раствор н-бутиллития в гексане (6,00 мл, 2,5 M) при -78°C в атмосфере азота в течение 1 часа. После завершения добавления реакционную смесь нагревали до комнатной температуры в течение 1 часа и охлаждали до -78°C. К смеси добавляли по каплям раствор циклопент-2-енона (591 мг, 7,21 ммоль) в тетрагидрофуране (10 мл) при -78°C и реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Медленно добавляли водный раствор хлорида аммония и смесь экстрагировали этилацетатом (30 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над сульфатом натрия и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали на колонке с силикагелем (элюируя при помощи 10% этилацетата в петролейном эфире), с получением трет-бутил 6-((3-оксоциклопентил)метил)пиридин-2-илкарбамата (750 мг, 43% выход) в виде масла. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,75 (д, J=8,4 Гц, 1H), 7,58 (т, J=7,6 Гц, 1H), 7,18 (шир.с, 1H), 6,78 (д, J=7,2 Гц, 1H), 2,77 (д, J=6,0 Гц, 2H), 2,60 (м, 1H), 2,33 (м, 2H), 2,16 (м, 2H), 1,97 (м, 1H), 1,68 (м, 1H), 1,52 (с, 9H).
B. трет-Бутил 6-((3-гидроксициклопентил)метил)пиридин-2-илкарбамат. Смесь трет-бутил 6-((3-оксоциклопентил)метил)пиридин-2-илкарбамата (700 мг, 2,41 ммоль) и борогидрида натрия (183 мг, 4,83 ммоль) в тетрагидрофуране (10 мл) нагревали при кипячении с обратным холодильником в течение 0,5 часов. Реакционную смесь концентрировали в вакууме и остаток разбавляли этилацетатом. Органический слой промывали насыщенным солевым раствором и концентрировали при пониженном давлении с получением трет-бутил 6-((3-гидроксициклопентил)метил)пиридин-2-илкарбамата (580 мг, 82% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,71 (д, J=8,4 Гц, 1H), 7,55 (т, J=8,0 Гц, 1H), 7,18 (шир.с, 1H), 6,78 (дд, J1=2,4 Гц, J2=7,2 Гц, 1H), 4,43 (м, 1H), 2,73 (д, J=7,6 Гц, 1H), 2,64 (м, 1H), 2,60-2,30 (м, 1H), 1,76 (м, 2H), 1,69 (м, 4H), 1,50 (с, 9H), 1,42 (м, 1H).
C. 3-((6-Аминопиридин-2-ил)метил)циклопентанол. Раствор трет-бутил 6-((3-гидроксициклопентил)метил)пиридин-2-илкарбамата (570 мг, 1,95 ммоль) в метанольном растворе гидрохлорида (2 M, 10 мл) перемешивали в течение 2 часов. Реакционную смесь концентрировали в вакууме с получением 3-((6-аминопиридин-2-ил)метил)циклопентанола (350 мг, 93% выход) в виде масла.
D. Промежуточное соединение A. Смесь 3-((6-аминопиридин-2-ил)метил)циклопентанола (350 мг, 1,82 ммоль) и O-этилкарбонизотиоцианатидата (263 мг, 2,00 ммоль) в диоксане (10 мл) перемешивали при комнатной температуре в течение 5 часов. Растворитель удаляли при пониженном давлении с получением промежуточного соединения A (500 мг), которое использовали на следующей стадии без дополнительной очистки.
E. 3-((2-амино-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)циклопентанол. К раствору N,N-диэтилизопропиламина (704 мг, 5,46 ммоль) и гидрохлорида гидроксиламина (628 мг, 9,1 ммоль) в смеси этанола и метанола (10 мл, 1:1) добавляли промежуточное соединение A (500 мг) и реакционную смесь перемешивали при комнатной температуре в течение 2 часов и при 70°C в течение 5 часов. Летучие вещества удаляли при пониженном давлении и остаток разбавляли водой, водную фазу экстрагировали дихлорметаном. Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали при пониженном давлении с получением 3-((2-амино-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)циклопентанола (300 мг, 71% выход для двух стадий) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,52 (м, 2H), 6,72 (д, J=7,6 Гц, 1H), 4,60 (шир.с, 2H), 4,45-4,35 (м, 1H), 3,33-3,05 (м, 2H), 2,85-2,56 (м, 1H), 2,01 (м, 2H), 1,80-1,53 (м, 3H), 1,40-1,32 (м, 1H).
F. 4-(5-((3-Гидроксициклопентил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамид. Дегазированную смесь 3-((2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)циклопентанола (280 мг, 1,2 ммоль), 4-иод-N-метилбензамида (473 мг, 1,81 ммоль), трис(дибензилиденацетон)дипалладия (0) (110 мг, 0,12 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (140 мг, 0,24 ммоль) и карбоната цезия (784 мг, 2,41 ммоль) в диоксане (5 мл) нагревали при 100°C в атмосфере азота в течение 5 часов. Реакцию гасили водой и водный слой экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и фильтровали. Фильтрат упаривали при пониженном давлении и остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (элюируя при помощи 44-74% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 20 минут) с получением 4-(5-((3-гидроксициклопентил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамида в форме соли трифторуксусной кислоты. После препаративной хиральной сверхжидкостной хроматографии (элюировали с использованием смеси сверхкритический CO2: изопропиловый спирт 55:45 при 50 мл/минут на колонке AD 250мм·20мм, 10мкм) получали два диастереомера: диастереомер 1 (20 мг, в виде гидрохлоридной соли): 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,82 (м, 4H), 7,57 (т, J=7,2 Гц, 1H), 7,42 (д, J=9,2 Гц, 1H), 6,94 (д, J=7,2 Гц, 1H), 4,86-4,70 (м, 1H), 3,33 (м, 2H), 2,98 (с, 3H), 2,70 (м, 1H), 2,10 (м, 1H), 2,01 (м, 1H), 1,85 (м, 2H), 1,66 (м, 1H), 1,41 (м, 1H), 1,33 (м, 1H), 1,20 (м, 1H); MS (ESI): m/z 366,1 [M+1]+; и диастереомер 2 (15 мг, в виде гидрохлоридной соли): 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,10 (т, J=8,4 Гц, 1H), 7,93 (д, J=8,4 Гц, 2H), 7,79 (м, 3H), 7,52 (д, J=7,2 Гц, 1H), 4,41-4,22 (м, 1H), 3,41-3,21 (м, 2H), 2,95 (с, 3H), 2,68 (м, 1H), 2,20-2,00 (м, 2H), 1,90 (м, 2H), 1,62 (м, 1H), 1,49 (м, 1H); MS (ESI): m/z 366,1 [M+1]+.
Пример 102: 4-((2-(6-(4-Гидроксипиперидин-1-ил)пиридин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он
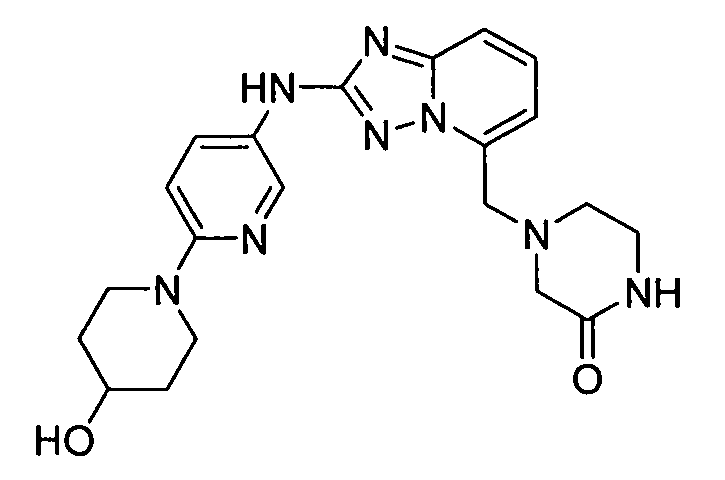
A. (2-Бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанол. Перемешиваемую смесь 2,5-дибром-[1,2,4]триазоло[1,5-α]пиридина (0,504 г, 1,820 ммоль) в тетрагидрофуране (20 мл) быстро нагревали при помощи аппарата для нагревания струей теплого воздуха в атмосфере азота до растворения большей части твердых частиц. Полученную светло-желтую смесь охлаждали на бане сухой лед-ацетон в атмосфере азота. Медленно добавляли н-бутиллитий (1,194 мл, 1,911 ммоль, 1,6 M в гексане) по каплям через шприц. В процессе добавления желтая реакционная смесь становилась все темнее и темнее и затем становилась красно-коричневой. Через 10 минут добавляли N,N-диметилформамид (1,410 мл, 18,20 ммоль). Охлаждающую баню удаляли и полученную смесь нагревали до 0°C в течение 15 минут. Добавляли воду (5 мл) и полученную смесь интенсивно перемешивали при комнатной температуре в течение 15 минут. Полученную красно-коричневую смесь разбавляли водой и этилацетатом, встряхивали в делительной воронке и слои разделяли. Органические слои промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе. Остаток очищали с использованием флэш-хроматографии (Biotage) (0-15% метанола в дихлорметане) с получением неочищенного красно-коричневого твердого вещества. MS (ESI) m/z 257,9 [M]+, 259,7 [M+2]+. Перемешиваемую смесь неочищенного 2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-карбальдегида (0,233 г, 1,031 ммоль) и этанола (12 мл) быстро нагревали при помощи аппарата для нагревания струей теплого воздуха до полного растворения твердых веществ. Полученный раствор охлаждали до 0°C в атмосфере азота. Добавляли борогидрид натрия (0,047 г, 1,237 ммоль) и полученную смесь интенсивно перемешивали при 0°C в атмосфере азота в течение 30 минут. Полученную оранжевую смесь очищали с использованием обращенно-фазовой флэш-хроматографии (Biotage) (10-100% ацетонитрила в воде). Фракции, содержащие желаемый продукт, объединяли и растворитель удаляли на роторном испарителе. Остаток сушили в условиях высокого вакуума при 40°C с получением желаемого продукта (0,092 г, 0,403 ммоль, 22% выход за две стадии) в виде белого твердого вещества с некоторым количеством желтой примеси. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,70-7,85 (м, 2H), 7,28 (д, J=7,03 Гц, 1H), 5,92 (с, 1H), 4,90 (с, 2H); MS (ESI) m/z 228,0 [M]+, 229,9 [M+2]+.
B. 4-((2-Бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он. Метансульфоновый ангидрид (0,083 г, 0,479 ммоль) добавляли к перемешиваемому раствору (2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанола (0,095 г, 0,417 ммоль) и N,N-диизопропилэтиламина (0,218 мл, 1,250 ммоль) в N,N-диметилформамиде (2,5 мл). Полученный прозрачный желтый раствор закрывали и перемешивали при комнатной температуре. Через 40 минут снова добавляли метансульфоновый ангидрид (18 мг, 0,103 ммоль). Полученный прозрачный желтый раствор закрывали и перемешивали при комнатной температуре еще в течение 30 минут. Добавляли пиперазин-2-он (0,092 г, 0,916 ммоль) и полученный прозрачный желтый раствор герметично закрывали и перемешивали при 50°C в течение 3,5 часов. Полученную смесь очищали с использованием флэш-хроматографии (Biotage) (0-15% метанола в дихлорметане) с получением желаемого продукта (0,121 г, 0,390 ммоль, 94% выход) в виде белого твердого вещества с некоторым количеством желой примеси. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,84 (шир.с, 1H), 7,72-7,80 (м, 2H), 7,26-7,34 (м, 1H), 4,08 (с, 2H), 3,18-3,26 (м, 2H), 3,16 (с, 2H), 2,69-2,79 (м, 2H); MS (ESI) m/z 310,0 [M]+, 311,8 [M+2]+.
C. 4-((2-(6-(4-Гидроксипиперидин-1-ил)пиридин-3-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-он. Смесь трис(дибензилиденацетон)дипалладия(0) (0,035 г, 0,038 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,044 г, 0,075 ммоль) в 1,4-диоксане (2,5 мл) быстро нагревали при помощи аппарата для нагревания струей теплого воздуха до растворения большей части твердых частиц и затем добавляли к 6-(4-(трет-бутилдиметилсилилокси)пиперидин-1-ил)пиридин-3-амину (0,122 г, 0,396 ммоль), 4-((2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-ону (0,117 г, 0,377 ммоль) и тонко измельченному карбонату цезия (0,504 г, 1,547 ммоль) в герметично закрываемом сосуде со стержневой мешалкой. Осуществляли продувку азотом для выдувания воздуха. Полученную смесь герметично закрывали, интенсивно перемешивали и нагревали при 100°C в течение 3,5 часов. В горячем состоянии, полученную зеленую смесь разбавляли диметилсульфоксидом и метанолом, фильтровали и концентрировали на роторном испарителе. Осуществляли поглощение остатка в горячий диметилсульфоксид и метанол, фильтровали и очищали с использованием обращенно-фазовой препаративной ВЭЖХ (10-70% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 мин). Фракции, содержащие желаемый продукт, загружали на Strata X-C ионообменную колонку от компании Phenomenex. Колонку промывали последовательно водой, ацетонитрилом, метанолом и затем 5% раствором гидроксида аммония в метаноле. Продукт выделяли вместе с элюентом 5% гидроксида аммония в метаноле и концентрировали на роторном испарителе и сушили в условиях высокого вакуума при 40°C. К перемешиваемой смеси полученных твердых веществ добавляли раствор 6 M HCl в воде (0,206 мл, 1,239 ммоль) в этаноле (10 мл) при 40°C. Полученную смесь интенсивно перемешивали и нагревали при 40°C в условиях кипячения с обратным холодильником в атмосфере азота в течение 30 минут и затем при 50°C в условиях кипячения с обратным холодильником в атмосфере азота в течение 2,5 часов. Полученную смесь охлаждали до комнатной температуры. Мелкие твердые частицы собирали при помощи вакуумной фильтрации через фильтровальную пипетку, промывали метанолом и сушили в условиях высокого вакуума с получением желаемого продукта (0,132 г, 0,288 ммоль, 97% выход в виде гидрохлоридной соли) в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6 и D2O) δ (м.д.) 8,52 (д, J=2,73 Гц, 1H), 8,07 (дд, J=2,73, 10,15 Гц, 1H), 7,57-7,69 (м, 2H), 7,41 (д, J=9,76 Гц, 1H), 7,24 (дд, J=1,37, 6,83 Гц, 1H), 4,55 (с, 2H), 3,82 (дт, J=4,25, 8,30 Гц, 3H), 3,62 (с, 2H), 3,22-3,41 (м, 6H), 1,81-1,94 (м, 2H), 1,40-1,55 (м, 2H); MS (ESI) m/z 423,3 [M+1]+.
Пример 103: N 2 -(3-метил-1H-индазол-6-ил)-N 5 -((тетрагидро-2H;-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамин
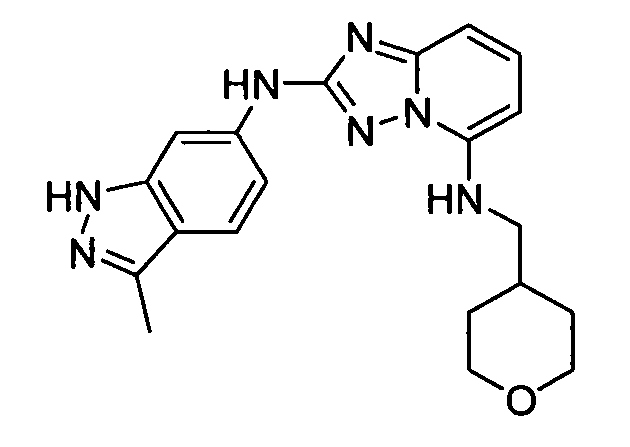
A. N5-((Тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамин. 5-Бром-[1,2,4]триазоло[1,5-α]пиридин-2-амин (1,00 г, 4,69 ммоль), карбонат калия (1,362 г, 9,86 ммоль) и (тетрагидро-2H-пиран-4-ил)метанамин (1,081 г, 9,39 ммоль) объединяли в герметично закрываемом сосуде со стержневой мешалкой. Осуществляли продувку газообразным азотом для выдувания воздуха. Полученную смесь герметично закрывали, интенсивно перемешивали и нагревали при 120°C в течение 18 часов. Добавляли воду (10 мл) и полученную смесь закрывали и встряхивали. Твердые вещества собирали при помощи вакуумной фильтрации, промывали водой и диэтиловым эфиром и сушили в условиях высокого вакуума при 40°C с получением желаемого продукта (1,079 г, 4,36 ммоль, 93% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, (ДМСО-d6) δ (м.д.) 7,26 (т, J=8,39 Гц, 1H), 6,44-6,57 (м, 2H), 6,00 (д, J=7,81 Гц, 1H), 5,76 (с, 2H), 3,84 (дд, J=2,73, 11,32 Гц, 2H), 3,25 (тд, J=1,95, 11,52 Гц, 2H), 3,18 (т, J=6,64 Гц, 2H), 1,82-1,98 (м, 1H), 1,61 (дд, J=1,76, 12,69 Гц, 2H), 1,15-1,30 (м, 2H); MS (ESI) m/z 248,3 [M-H]+.
B. N2-(3-Метил-1-тозил-1H-индазол-6-ил)-N5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамин. Смесь трис(дибензилиденацетон)дипалладия(0) (0,074 г, 0,081 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,094 г, 0,162 ммоль) в 1,4-диоксане (4 мл) быстро нагревали при помощи аппарата для нагревания струей теплого воздуха до растворения большей части твердых частиц и затем добавляли к 6-бром-3-метил-1-тозил-1H-индазолу (0,295 г, 0,809 ммоль), N5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамину (0,200 г, 0,809 ммоль) и тонко измельченному карбонату цезия (1,080 г, 3,32 ммоль) в герметично закрываемом сосуде со стержневой мешалкой. Осуществляли продувку азотом для выдувания воздуха. Полученную смесь герметично закрывали, интенсивно перемешивали и нагревали при 100°C в течение 3,5 часов. Полученную зеленую смесь охлаждали до комнатной температуры. Добавляли воду (10 мл) при интенсивном перемешивании. Твердые вещества собирали при помощи вакуумной фильтрации и тщательно промывали водой. Осуществляли поглощение твердых частиц в диметилсульфоксид и метанол. Полученную смесь нагревали при помощи аппарата для нагревания струей теплого воздуха и затем быстро фильтровали. Фильтрат закрывали и давали выстояться при комнатной температуре в течение 30 минут. Твердые вещества собирали при помощи вакуумной фильтрации, промывали метанолом и диэтиловым эфиром и сушили в условиях высокого вакуума при 40°C с получением желаемого продукта (0,345 г, 0,649 ммоль, 80% выход) в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,12 (с, 1H), 8,95 (д, J=1,17 Гц, 1H), 7,78 (д, J=8,20 Гц, 2H), 7,60-7,67 (м, 1H), 7,53-7,60 (м, 1H), 7,49 (т, J=8,20 Гц, 1H), 7,38 (д, J=8,59 Гц, 2H), 6,82 (д, J=8,59 Гц, 1H), 6,20-6,31 (м, 2H), 3,76 (дд, J=3,32, 11,13 Гц, 2H), 3,29 (т, J=6,25 Гц, 2H), 3,18 (т, J=10,93 Гц, 2H), 2,41 (с, 3H), 2,31 (с, 3H), 1,87-2,03 (м, J=4,30, 7,36, 7,36, 7,36, 7,36, 11,16 Гц, 1H), 1,73 (д, J=12,49 Гц, 2H), 1,28 (квд, 2H); MS (ESI) m/z 532,2 [M+1]+.
C. N2-(3-Метил-1H-индазол-6-ил)-N5-((тетрагидро-2Н-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамин. Гидрид натрия (0,081 г, 3,36 ммоль) добавляли к перемешиваемому раствору 1-метил-2-пирролидинона (4 мл) и метанола (12 мл) в герметично закрываемом сосуде. Через 2 минуты добавляли N2-(3-метил-1-тозил-1H-индазол-6-ил)-N5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2,5-диамин (0,325 г, 0,611 ммоль). Осуществляли продувку азотом для выдувания воздуха. Полученную смесь герметично закрывали, интенсивно перемешивали и нагревали при 70°C в течение 15,5 часов. Добавляли 6 M раствор хлористоводородной кислоты в воде (0,611 мл, 3,67 ммоль) для нейтрализации основания. Полученную смесь фильтровали и очищали с использованием обращенно-фазовой препаративной ВЭЖХ (10-70% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 мин). Фракции, содержащие желаемый продукт, загружали на Strata X-C ионообменную колонку от компании Phenomenex. Колонку промывали последовательно водой, ацетонитрилом, метанолом и затем 5% раствором гидроксида аммония в метаноле. Продукт выделяли вместе с элюентом 5% гидроксида аммония в метаноле и концентрировали на роторном испарителе и сушили в условиях высокого вакуума с получением желаемого продукта (0,204 г, 0,536 ммоль, 88% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 12,23 (с, 1H), 9,55 (с, 1H), 8,02 (д, J=1,17 Гц, 1H), 7,53 (д, J=8,98 Гц, 1H), 7,42 (т, J=8,39 Гц, 1H), 7,31 (дд, J=1,76, 8,79 Гц, 1H), 6,75 (д, J=7,81 Гц, 1H), 6,61 (т, J=6,44 Гц, 1H), 6,20 (д, J=7,42 Гц, 1H), 3,87 (дд, J=2,73, 11,32 Гц, 2H), 3,20-3,39 (м, 4H), 2,42 (с, 3H), 1,89-2,04 (м, J=4,10, 7,33, 7,33, 7,33, 7,33, 11,09 Гц, 1H), 1,59-1,73 (м, 2H), 1,29 (квд, J=4,49, 12,30 Гц, 2H); MS (ESI) m/z 378,1 [M+1]+.
Пример 104: 4-(1-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этил)пиридин-2(1Н)-он
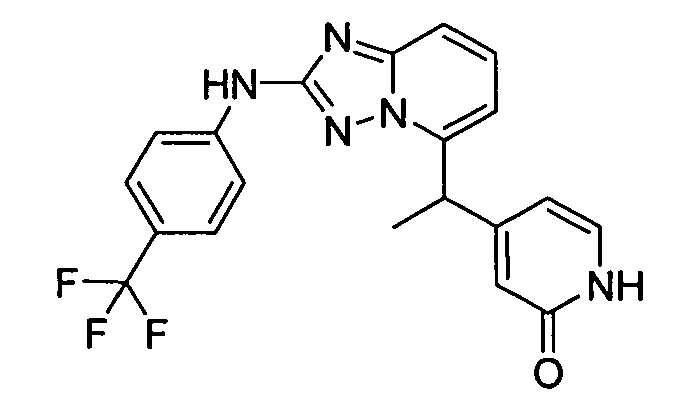
A. (2-Метоксипиридин-4-ил)(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанон. Перемешиваемую смесь 5-бром-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (1,53 г, 4,28 ммоль) в тетрагидрофуране (35 мл) быстро нагревали при помощи аппарата для нагревания струей теплого воздуха в атмосфере азота до растворения всех твердых частиц. Полученный прозрачный красный раствор охлаждали на бане сухой лед-ацетон в атмосфере азота. Медленно добавляли н-бутиллитий (5,76 мл, 9,21 ммоль, 1,6 M в гексане) по каплям через шприц. В процессе добавления реакционная смесь становилась черной. Через 40 минут добавляли N,2-диметокси-N-метилизоникотинамид (4,61 мл, 9,21 ммоль, 2 M в тетрагидрофуране). Охлаждающую баню удаляли и полученную смесь нагревали до 0°C в течение 15 минут. Через 30 минут при 0°C добавляли воду (20 мл) и полученную смесь интенсивно перемешивали при комнатной температуре в течение 15 минут. Полученную смесь разбавляли этилацетатом и встряхивали в делительной воронке. Слои разделяли и органические слои промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе. Остаток растворяли в горячем этилацетате и очищали с использованием флэш-хроматографии (Biotage) (10-100% этилацетата в гексане). Фракции, содержащие желаемый продукт, объединяли и концентрировали на роторном испарителе до ~10 мл этилацетата. Добавляли гексан (10 мл). Твердые вещества собирали при помощи вакуумной фильтрации, промывали гексаном и сушили в условиях высокого вакуума с получением желаемого продукта (0,864 г, 2,090 ммоль, 49% выход) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,23 (с, 1H), 8,43 (д, J=5,47 Гц, 1H), 7,93 (дд, J=0,98, 8,79 Гц, 1H), 7,77 (дд, J=7,42, 8,98 Гц, 1H), 7,53-7,60 (м, 2H), 7,45-7,53 (м, 3H), 7,31 (дд, J=1,37, 5,27 Гц, 1H), 7,16 (с, 1H), 3,91 (с, 3H); 19F ЯМР (376 МГц, ДМСО-d6) δ (м.д.) -60,23 (с, 3F); MS (ESI) m/z 414,2 [M+1]+.
B. 1-(2-Метоксипиридин-4-ил)-1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этанол. Метилмагнийбромид (1,390 мл, 4,17 ммоль, 3 M раствор в диэтиловом эфире) добавляли по каплям к перемешиваемому раствору (2-метоксипиридин-4-ил)(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанона (0,431 г, 1,043 ммоль) в тетрагидрофуране (20 мл) при 0°C в атмосфере азота. Реакционная смесь моментально становилась красной при добавлении метилмагнийбромида, но затем меняла цвет на более желтый. Полученную смесь перемешивали при 0°C в атмосфере азота в течение 50 минут. Добавляли насыщенный водный раствор хлорида аммония (2 мл) для гашения реакции. Полученную смесь разбавляли водой и этилацетатом и встряхивали в делительной воронке. Слои разделяли. Органические слои промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе. Остаток растворяли в дихлорметане и очищали с использованием флэш-хроматографии (Biotage) (20-90% этилацетата в гексане) с получением желаемого продукта (0,417 г, 0,971 ммоль, 93% выход) в виде желтого пенистого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,01 (с, 1H), 8,06 (д, J=5,47 Гц, 1H), 7,74 (дд, J=7,42, 8,59 Гц, 1H), 7,61 (дд, J=1,17, 8,98 Гц, 1H), 7,50-7,59 (м, 4H), 7,47 (дд, J=1,17, 7,42 Гц, 1H), 6,94 (д, J=0,78 Гц, 1H), 6,86 (дд, J=1,56, 5,47 Гц, 1H), 6,44 (с, 1H), 3,82 (с, 3H), 2,03 (с, 3H); 19F ЯМР (376 МГц, ДМСО-d6) δ (м.д.) -60,20 (с, 3F); MS (ESI) m/z 430,3 [M+1]+.
C. 5-(1-(2-Метоксипиридин-4-ил)этил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. 1-(2-Метоксипиридин-4-ил)-1-(2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этанол (0,348 г, 0,810 ммоль), метансульфоновый ангидрид (0,353 г, 2,026 ммоль), N,N-диизопропилэтиламин (0,565 мл, 3,24 ммоль) и N,N-диметилформамид (9 мл) объединяли в герметично закрываемом сосуде со стержневой мешалкой. Осуществляли продувку газообразным азотом для выдувания воздуха. Полученную смесь герметично закрывали, интенсивно перемешивали и нагревали при 100°C в течение 24 часов. Добавляли очень большое избыточное количество как метансульфонового ангидрида, так и N,N-диизопропилэтиламина для доведения реакции до завершения. Полученную смесь герметично закрывали, интенсивно перемешивали и нагревали при 100°C еще в течение 1 часа. Полученную смесь разбавляли этилацетатом, насыщенным водным раствором бикарбоната натрия и водой и встряхивали в делительной воронке. Слои разделяли. Водный слой экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе. Остаток растворяли в этилацетате и очищали с использованием флэш-хроматографии (Biotage) (20-80% этилацетата в гексане) с получением неочищенного ржаво-коричневого твердого вещества. MS (ESI) m/z 412,0 [M+1]+. Это ржаво-коричневое твердое вещество растворяли в 1-метил-2-пирролидиноне (3 мл) при перемешивании при комнатной температуре и затем разбавляли этанолом (3 мл). Подсоединяли насадку для подачи вакуума/азота/водорода. Атмосферу в колбе удаляли и замещали азотом три раза. Добавляли палладий (10% масс. на активированном угле) (0,122 г, 0,115 ммоль) и атмосферу в колбе удаляли и замещали водородом, три раза. Полученную смесь интенсивно перемешивали под баллоном водорода при комнатной температуре в течение 2,5 часов. Атмосферу в колбе удаляли и замещали водородом, три раза. Полученную смесь интенсивно перемешивали под баллоном водорода при 50°C в течение 1,5 часов. Атмосферу в колбе удаляли и замещали водородом, три раза. Полученную смесь интенсивно перемешивали под баллоном водорода при 60°C в течение 27 часов. Полученную черную смесь фильтровали через Целит и очищали с использованием обращенно-фазовой препаративной ВЭЖХ (30-100% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 35 мин). Фракции, содержащие желаемый продукт, загружали на Strata X-C ионообменную колонку от компании Phenomenex. Колонку промывали последовательно водой, ацетонитрилом, метанолом и затем 5% раствором гидроксида аммония в метаноле. Продукт выделяли вместе с элюентом 5% гидроксида аммония в метаноле и концентрировали на роторном испарителе и сушили в условиях высокого вакуума с получением желаемого продукта (0,172 г, 0,416 ммоль, 51% выход за две стадии) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,08 (с, 1H), 8,08 (д, J=4,69 Гц, 1H), 7,77 (д, J=8,59 Гц, 2H), 7,64-7,71 (м, J=7,42, 8,98 Гц, 1H), 7,54-7,64 (м, 3H), 7,16 (д, J=7,03 Гц, 1H), 6,92 (дд, J=1,37, 5,27 Гц, 1H), 6,80 (с, 1H), 4,84 (кв., J=7,03 Гц, 1H), 3,80 (с, 3H), 1,72 (д, 3H); 19F ЯМР (376 МГц, δ (м.д.) -60,10 (с, 3F); MS (ESI) m/z 414,4 [M+1]+.
D. 4-(1-(2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)этил)пиридин-2(1Н)-он. Хлортриметилсилан (0,110 мл, 0,871 ммоль) и затем иодид калия (0,145 г, 0,871 ммоль) добавляли к перемешиваемому раствору 5-(1-(2-метоксипиридин-4-ил)этил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,144 г, 0,348 ммоль) в ацетонитриле (8 мл). Полученную смесь перемешивали и нагревали при 60°C в условиях кипячения с обратным холодильником в атмосфере азота в течение 14 часов. Полученную желтую смесь охлаждали до комнатной температуры. Добавляли воду (10 мл) при интенсивном перемешивании. Твердые вещества собирали при помощи вакуумной фильтрации и тщательно промывали водой и диэтиловым эфиром. Твердые частицы растворяли в ДМСО и ацетонитриле, фильтровали и очищали с использованием обращенно-фазовой полу-препаративной ВЭЖХ (20-80% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 мин). Фракции, содержащие желаемый продукт, загружали на Strata X-C ионообменную колонку от компании Phenomenex. Колонку промывали последовательно водой, ацетонитрилом, метанолом и затем 5% раствором гидроксида аммония в метаноле. Продукт выделяли вместе с элюентом 5% гидроксида аммония в метаноле и концентрировали на роторном испарителе и сушили в условиях высокого вакуума при 40°C с получением желаемого продукта (0,089 г, 0,223 ммоль, 64% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,46 (шир.с, 1H), 10,11 (с, 1H), 7,80 (д, J=8,59 Гц, 2H), 7,54-7,71 (м, 4H), 7,30 (д, J=6,64 Гц, 1H), 7,14 (д, J=6,64 Гц, 1H), 6,24 (д, J=1,56 Гц, 1H), 6,10 (дд, J=1,76, 6,83 Гц, 1H), 4,65 (кв., J=7,03 Гц, 1H), 1,67 (д, J=7,03 Гц, 3H); 19F ЯМР (376 МГц, ДМСО-d6) δ (м.д.) -60,01 (с, 3F); MS (ESI) m/z 400,2 [M+1]+.
Пример 105: транс-4-((2-(3-Метил-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)циклогексанол и цис-4-((2-(3-метил-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)циклогексанол
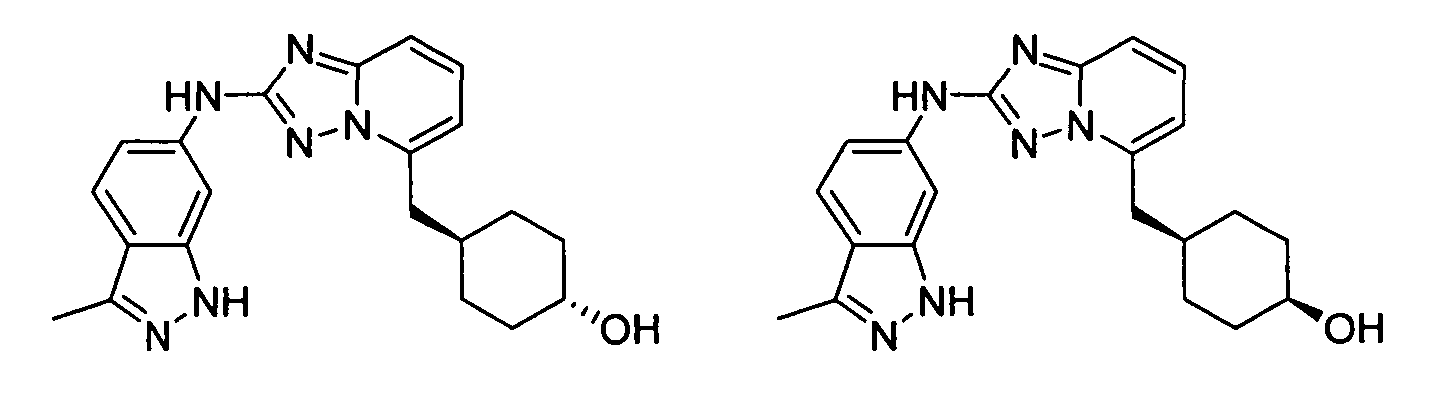
A. 4-((2-Амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)циклогексил 2,2,2-трифторацетат. Раствор трет-бутилдиметил(4-метиленциклогексилокси)силана (0,640 г, 2,83 ммоль) в (1S,5S)-9-борабицикло[3.3.1]нонане (5,65 мл, 2,83 ммоль, 0,5 н в тетрагидрофуране) нагревали при кипячении с обратным холодильником в течение 3 часов в атмосфере азота. Реакционную смесь затем охлаждали до комнатной температуры и осуществляли взаимодействие с комплексом [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II)•дихлорметан (0,734 г, 0,899 ммоль), карбонатом калия (0,391 г, 2,83 ммоль) и N,N-ди-трет-бутоксикарбонил-5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амином (1,062 г, 2,57 ммоль) в N,N-диметилформамиде (10 мл). Реакционную смесь нагревали до 90°C в течение 3 часов. Реакцию гасили водой и неочищенное вещество экстрагировали этилацетатом. Органические экстракты сушили над сульфатом магния. После выпаривания растворителя остаток очищали при помощи колоночной хроматографии на Biotage (0-30% этилацетата в гексане). 2 диастереомерных продукта проявились как почти разделенные пятна. Желаемые фракции объединяли и упаривали досуха. Получали светло-желтое масло, которое не подвергали дальнейшей идентификации. Остаток растворяли в дихлорметане (5 мл) и раствор обрабатывали трифторуксусной кислотой (0,75 мл, 9,73 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Растворитель удаляли при пониженном давлении и соединение нейтрализовали с использованием насыщенного водного раствора бикарбоната натрия и экстрагировали этилацетатом. Экстракты сушили над сульфатом магния и упаривали досуха. Остаток очищали при помощи колоночной хроматографии на Biotage с использованием быстрого градиента до 100% этилацетата. 4-((2-Амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)циклогексил 2,2,2-трифторацетат (0,045 г, 0,131 ммоль, 27,2% выход) собирали в виде бесцветного масла. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,37-7,44 (м, 1H), 7,22 (д, J=8,59 Гц, 1H), 6,71-6,79 (м, 1H), 5,16-5,22 (м, 1H), 2,95 (дд, J=7,03, 11,71 Гц, 2H), 2,14 (ддд, J=3,51, 7,42, 10,93 Гц, 1H), 2,01-2,09 (м, 1H), 1,90-2,00 (м, 2H), 1,74-1,83 (м, 1H), 1,53-1,70 (м, 2H), 1,33-1,51 (м, 1H), 1,18-1,32 (м, 1H); MS (ESI) m/z 342,9 [M+1]+.
B. 1-(2-Фтор-4-(5-((4-гидроксициклогексил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)фенил)этанон. Обработку реакционной смеси осуществляли двумя партиями. Реакционные смеси гасили отдельно, затем их объединяли для экстракции и очистки. К суспензии 4-((2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)циклогексил 2,2,2-трифторацетата (0,045 г, 0,131 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,015 г, 0,026 ммоль), трет-бутоксида натрия (0,025 г, 0,263 ммоль) и трис(дибензилиденацетон)дипалладия (0,013 г, 0,014 ммоль) в диоксане (2,63 мл) в атмосфере азота добавляли 1-(4-бром-2-фторфенил)этанон (0,057 г, 0,263 ммоль). Реакционную смесь (темно-коричневая) перемешивали при 90°C в течение 2 часов. Реакционные смеси гасили водой (10 мл), объединяли и экстрагировали этилацетатом. Экстракты (оранжевые) медленно отделяли от зеленой эмульсии. Экстракты сушили над сульфатом магния и упаривали досуха. Очистку осуществляли при помощи колоночной хроматографии на Biotage с использованием 10-100% этилацетата в гексане. Желаемые фракции объединяли и упаривали досуха. 1-(2-Фтор-4-(5-((4-гидроксициклогексил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)фенил)этанон (0,060 г, 60% выход) выделяли в виде желтого масла. MS (ESI) m/z 383,2 [M+1]+.
C. транс-4-((2-(3-Метил-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)циклогексанол и цис-4-((2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)циклогексанол. 1-(2-Фтор-4-(5-((4-гидроксициклогексил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)фенил)этанон (0,06 г, 0,157 ммоль) растворяли в этаноле (1,0 мл) и обрабатывали гидразинмоногидратом (3 мл, 96 ммоль). Реакционную смесь перемешивали при 100°C в течение 48 часов. Нагревание останавливали и добавляли воду, что приводило к образованию белого осадка, который перемешивали весь день. Твердое вещество собирали фильтрованием и промывали водой. Очистку осуществляли при помощи полу-препаративной ВЭЖХ (20-80% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 30 минут, 2 впрыска). 2 диастереомера разделяли. Желаемые фракции объединяли и нейтрализовали с использованием колонки STRATA с ионообменной смолой. Стереохимию определяли на основании спектров 1Н ЯМР, транс-4-((2-(3-Метил-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)циклогексанол (0,006 г): 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 12,33 (с, 1H), 9,79 (с, 1H), 8,12 (с, 1H), 7,44-7,57 (м, 4H), 7,23 (д, J=8,59 Гц, 1H), 6,90 (д, J=6,64 Гц, 1H), 4,47 (шир.с, 1H), 3,39 (шир.с, 1H), 2,99 (д, J=7,03 Гц, 3H), 2,42 (с, 3H), 1,94 (шир.с, 1H), 1,82 (шир.с, 2H), 1,60-1,70 (м, 2H), 1,01-1,20 (м, 4H); MS (ESI) m/z 377,2 [M+1]+. цис-4-((2-(3-Метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)циклогексанол (0,013 г): 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 12,31 (с, 1H), 9,78 (с, 1H), 8,12 (с, 1H), 7,42-7,57 (м, 3H), 7,23 (д, J=8,20 Гц, 1H), 6,90 (д, J=6,25 Гц, 1H), 4,34 (шир.с, 1H), 3,74 (шир.с, 1H), 3,04 (д, J=6,25 Гц, 2H), 2,42 (с, 3H), 2,08 (шир.с, 1H), 1,56-1,68 (м, 2H), 1,45-1,56 (м, 2H), 1,32-1,45 (м, 4H); MS (ESI) m/z 377,2 [M+1]+.
Пример 106: цис-1-(Метоксиметил)-4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)циклогексанол
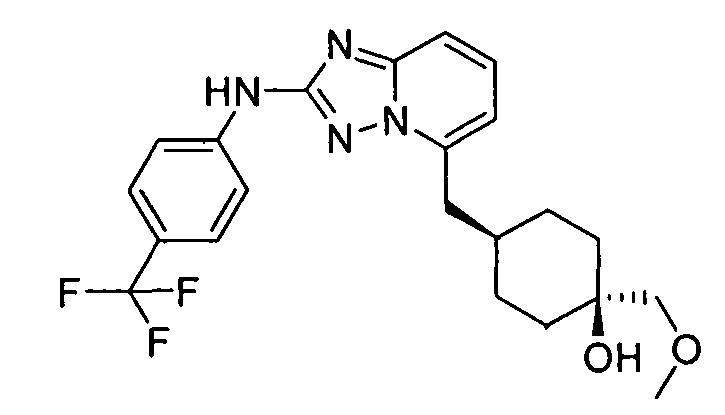
A. 5-(1,4-Диоксаспиро[4,5]декан-8-илметил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Раствор 8-метилен-1,4-диоксаспиро[4,5]декана (1,770 г, 11,48 ммоль) в (1S,5S)-9-борабицикло[3.3.1]нонане (22,40 мл, 11,20 ммоль, 0,5 н раствор в тетрагидрофуране) нагревали до температуры кипения с обратным холодильником в течение 3 часов в атмосфере азота. При комнатной температуре добавляли 5-бром-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (1,0 г, 2,80 ммоль), комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II)•дихлорметан (0,800 г, 0,980 ммоль), карбонат калия (1,548 г, 11,20 ммоль) и N,N-диметилформамид (10 мл). Реакционную смесь затем нагревали до 90°C в течение ночи. Реакцию гасили водой и неочищенное вещество экстрагировали этилацетатом. Органические экстракты сушили над сульфатом магния. После выпаривания растворителя остаток очищали при помощи колоночной хроматографии на Biotage (5-50% этилацетата в гексане). Фракции, содержащие желаемый продукт, объединяли и упаривали досуха. 5-(1,4-Диоксаспиро[4,5]декан-8-илметил)-N-(4-трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (0,9 г, 2,081 ммоль, 74,3% выход) получали в виде коричневого масла, которое отверждалось при комнатной температуре (с примесью около 50% N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина, как было установлено на основании данных ЖХ/МС). MS (ESI) m/z 433,5 [M+1]+.
B. 4-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)циклогексанон. Раствор 5-(1,4-диоксаспиро[4,5]декан-8-илметил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,6 г, 1,387 ммоль) в тетрагидрофуране (5 мл) обрабатывали 6,0 н водным раствором хлористоводородной кислоты (5 мл, 30,0 ммоль) и нагревали до температуры кипения с обратным холодильником в течение 24 часов. Реакционную смесь нейтрализовали гидроксидом натрия и экстрагировали этилацетатом. Остаток сушили над сульфатом натрия и упаривали досуха. Остаток очищали при помощи колоночной хроматографии на Biotage с использованием 0-50% этилацетата в гексане. 4-((2-(4-(Трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)циклогексанон (0,29 г, 0,747 ммоль, 53,8% выход) выделяли в виде светло-желтого масла, которое превращалось в пенистое вещество в условиях вакуума. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,20 (с, 1H), 7,93 (д, J=8,20 Гц, 2H), 7,65 (д, J=8,20 Гц, 2H), 7,50-7,61 (м, 2H), 6,99 (д, J=6,64 Гц, 1H), 3,13 (д, J=7,42 Гц, 2H), 2,31-2,44 (м, 2H), 2,18-2,29 (м, 2H), 1,88-2,03 (м, 2H), 1,57 (шир.с, 2H); MS (ESI) m/z 389,4 [M+1]+.
C. цис-5-(1-Оксаспиро[2,5]октан-6-илметил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-a]пиридин-2-амин. К суспензии гидрида натрия (0,011 г, 0,275 ммоль) в диметилсульфоксиде (2,75 мл) добавляли в виде твердого вещества и одной порцией иодид триметилсульфоксония (0,091 г, 0,413 ммоль). Через 1 час добавляли по каплям 4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)циклогексанон (0,107 г, 0,275 ммоль), растворенный в тетрагидрофуране (2,75 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакцию гасили водой и экстрагировали этилацетатом (3 раза). Органическую фазу сушили над сульфатом натрия и упаривали досуха. Остаток, отвержденный в вакууме, использовали без очистки на следующей стадии. Альтернативно, очистку можно осуществить при помощи Biotage колоночной хроматографии с нормальной фазой с использованием 5-75% этилацетата в гексане. Желаемые фракции, которые объединяли и упаривали досуха, давали цис-5-(1-оксаспиро[2,5]октан-6-илметил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин в виде белого твердого вещества с более чем 80% выходом, (стереохимии на основании механизма). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,18 (с, 1H), 7,92 (д, J=8,20 Гц, 3H), 7,63 (д, J=8,20 Гц, 3H), 7,49-7,60 (м, 2H), 6,98 (д, J=6,25 Гц, 1H), 3,07 (д, J=7,42 Гц, 2H), 2,15 (шир.с, 1H), 1,75-1,88 (м, 2H), 1,67 (д, J=12,10 Гц, 2H), 1,29-1,47 (м, 2H), 1,19 (д, J=14,06 Гц, 2H); 19F ЯМР (376 МГц, ДМСО-d6) δ (м.д.) -60,03; MS (ESI) m/z 403,5 [M+1]+.
D. цис-1-(Метоксиметил)-4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)циклогексанол. цис-5-(1-Оксаспиро[2,5]октан-6-илметил)-N-(4-(трифторметил)фенил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин суспендировали в метаноле (5 мл), осуществляли взаимодействие с 6,0 н водным раствором гидроксида калия (0,092 мл, 0,551 ммоль) и нагревали до 40°C в течение ночи. Реакцию гасили путем добавления 0,1 мл водного раствора хлористоводородной кислоты и упаривали досуха. Остаток очищали при помощи полу-препаративной ВЭЖХ (20-80% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 30 минут, 2 впрыска). Желаемые фракции объединяли, концентрировали при пониженном давлении и нейтрализовали при помощи 1,75 M водного раствора карбоната калия. Происходило осаждение белого твердого вещества, которое собирали и сушили в вакууме. цис-1-(Метоксиметил)-4-((2-(4-(трифторметил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)циклогексанол (0,041 г, 0,094 ммоль, 34,3% выход) собирали в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,17 (с, 1H), 7,91 (д, J=8,59 Гц, 2H), 7,63 (д, J=8,59 Гц, 2H), 7,43-7,58 (м, 2H), 6,94 (д, J=6,25 Гц, 1H), 4,10 (шир.с, 1H), 3,22 (с, 3H), 3,06 (с, 2H), 3,00 (д, J=7,03 Гц, 2H), 1,93 (шир.с, 1H), 1,19-1,56 (м, 8H); 19F ЯМР (376 МГц, ДМСО-d6) δ (м.д.) -60,04; MS (ESI) m/z 435,5 [M+1]+.
Пример 107: 3'-Хлор-5'-(2-(4-(метилкарбамоил)фениламино)-[1,2,4]триазоло[1,5-a]пиридин-5-ил)бифенил-2-карбоксамид
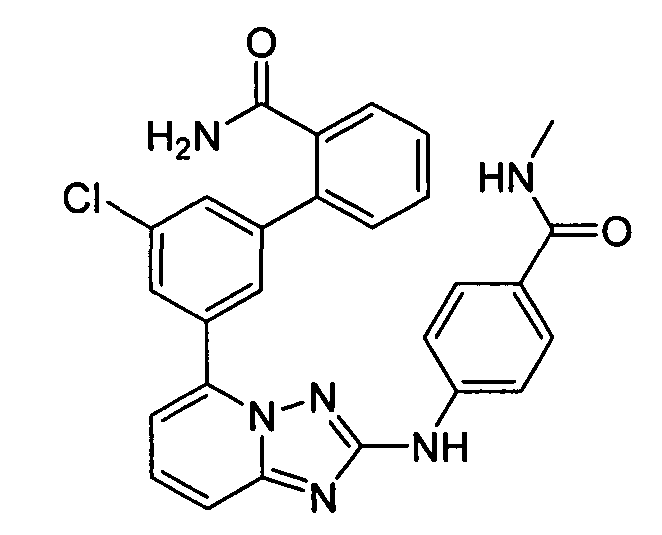
A. 4-(5-(3-Хлор-5-гидроксифенил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамид. К дегазированному раствору 3-хлор-5-гидроксифенилбороновой кислоты (258 мг, 1,5 ммоль), 4-(5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамида (345 мг, 1,0 ммоль), водного раствора фосфата калия (2M, 1 мл) в N,N-диметилформамиде (5 мл) добавляли тетракис(трифенилфосфин)палладий (0) (115 мг, 0,1 ммоль) и реакционную смесь нагревали при 90°C в атмосфере азота в течение 4 часов. После охлаждения до комнатной температуры реакционную смесь выливали в воду и экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, упаривали при пониженном давлении и очищали на колонке с силикагелем (элюируя при помощи 5-80% этилацетата в петролейном эфире) с получением 4-(5-(3-хлор-5-гидроксифенил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамида (130 мг, 33% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,33 (с, 1H), 10,03 (с, 1H), 8,24 (с, 1H), 7,78 (м, 4H), 7,67 (м, 3H), 7,37 (с, 1H), 7,25 (т, J=2,8 Гц, 1H), 7,01 (с, 1H), 7,45 (д, J=4,4 Гц, 3H).
B. 3-Хлор-5-(2-(4-(метилкарбамоил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)фенилтрифторметансульфонат. К смеси 4-(5-(3-хлор-5-гидроксифенил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамида (120 мг, 0,30 ммоль), триэтиламина (303 мг, 1,0 ммоль) в тетрагидрофуране (5 мл) добавляли по каплям трифторметансульфоновый ангидрид (168 мг, 0,6 ммоль) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 4 часов и концентрировали и остаток распределяли между этилацетатом и водой. Органический слой отделяли и водный слой экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, упаривали при пониженном давлении и очищали на колонке с силикагелем (элюируя при помощи 5-50% этилацетата в петролейном эфире) с получением 3-хлор-5-(2-(4-(метилкарбамоил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)фенилтрифторметансульфоната (120 мг, 76% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,23 (с, 1H), 7,78 (м, 7H), 7,67 (д, J=5,6 Гц, 1H), 7,58 (с, 1H), 7,37 (с, 1H); 7,01 (с, 1H), 2,80 (д, J=4,0 Гц, 3H); MS (ESI): m/z 525,9 [M+1]+.
C. 4-(5-(5-Хлор-2'-цианобифенил-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамид. К дегазированному раствору 2-цианофенилбороновой кислоты (50 мг, 0,34 ммоль), 3-хлор-5-(2-(4-(метилкарбамоил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)фенилтрифторметансульфоната (120 мг, 0,23 ммоль), водного раствора карбоната натрия (2 M, 1 мл) в N,N-диметилформамиде (3 мл) добавляли 1,1'-бис(дифенилфосфино)ферроценпалладийдихлорид (17 мг, 0,023 ммоль) и реакционную смесь нагревали при 90°C в атмосфере азота в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, упаривали при пониженном давлении и очищали на колонке с силикагелем (элюируя при помощи 5-50% этилацетата в петролейном эфире) с получением 4-(5-(5-хлор-2'-цианобифенил-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамида (80 мг, 72% выход). MS (ESI): m/z 479,1 [M+1]+.
D. 3'-Хлор-5'-(2-(4-(метилкарбамоил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бифенил-2-карбоксамид. К раствору 4-(5-(5-хлор-2'-цианобифенил-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-N-метилбензамида (80 мг, 0,16 ммоль) и водного раствора гидроксида натрия (1 мл, 2 M) в диметилсульфоксиде (5 мл) добавляли по каплям пероксид водорода (1 мл, 30%) при 0°C и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, упаривали при пониженном давлении и очищали при помощи обращенно-фазовой препаративной ВЭЖХ (элюируя при помощи 20-55%: ацетонитрил + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 минут) с получением 3'-хлор-5'-(2-(4-(метилкарбамоил)фениламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)бифенил-2-карбоксамида в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль (20 мг, 25% выход). 1H ЯМР (400 МГц, МЕТАНОЛ-d4): δ (м.д.) 8,25 (т, J=2,0 Гц, 1H), 8,06 (т, J=2,0 Гц, 1H), 7,99 (м, 1H), 7,83 (д, J=8,8 Гц, 2H), 7,75 (дд, J1=1,2 Гц, J2=8,8 Гц, 4H), 7,63 (м, 5H), 2,80 (с, 3H); MS (ESI): m/z 497,1 [M+1]+.
Пример 108: цис-6-(5-(4-Гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1-метилиндолин-2-он
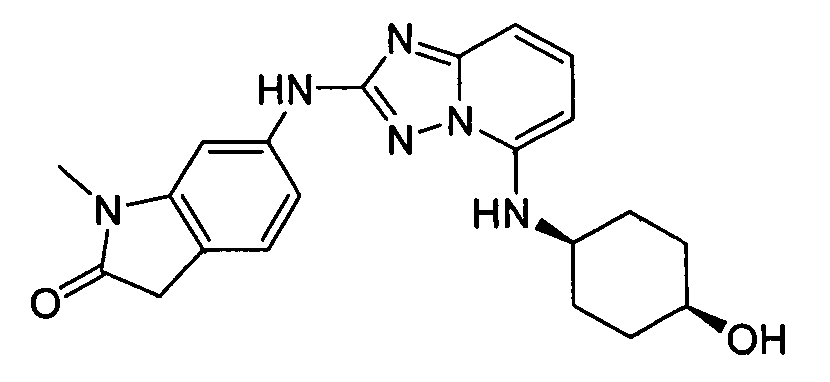
A. цис-4-(2-Амино-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанол. 5-Бром-[1,2,4]триазоло[1,5-α]пиридин-2-амин (10 г, 46,9 ммоль), гидрохлорид цис-4-аминоциклогексанола (21,35 г, 141 ммоль) и карбонат калия (25,9 г, 188 ммоль) добавляли в 200-мл герметично закрываемую колбу. Добавляли ДМСО (150 мл) и реакционную смесь помещали для интенсивного перемешивания на 120°C масляную баню на 16 часов. Добавляли дополнительное количество гидрохлорида цис-4-аминоциклогексанола (1,068 г, 7,04 ммоль) и карбоната калия (другие 1,5 эквивалента) и реакционную смесь нагревали до 120°C в течение 18 часов. Реакционную смесь фильтровали, подкисляли до pH=6 и очищали с использованием обращенно-фазовой препаративной ВЭЖХ (3-30% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 мин). Фракции, содержащие желаемый продукт, объединяли и ацетонитрил удаляли на роторном испарителе с получением цис-4-(2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанола в форме соли трифторуксусной кислоты в виде прозрачного масла. Фракции, содержащие желаемый продукт, объединяли и загружали на Strata X-C ионообменную колонку от компании Phenomenex. Колонку промывали последовательно водой, ацетонитрилом, метанолом и затем 5% раствором гидроксида аммония в метаноле. Продукт выделяли вместе с 5% гидроксидом аммония в метаноле, и его концентрировали на роторном испарителе и сушили в условиях высокого вакуума при 40°C с получением желаемого продукта (8,5 г, 34,4 ммоль, 73% выход) в виде коричневого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,27 (т, J=7,81 Гц, 1H), 6,55 (д, J=8,59 Гц, 1H), 6,04 (д, J=7,81 Гц, 1H), 5,85 (с, 2H), 5,77 (д, J=8,20 Гц, 1H), 4,48 (д, J=3,12 Гц, 1H), 3,72 (д, J=3,51 Гц, 1H), 3,56 (дд, J=8,00, 3,71 Гц, 1H), 1,53-1,84 (м, 8H); MS (ESI): m/z 248,3 [M+1]+.
B. цис-6-(5-(4-Гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1-метилиндолин-2-он. Дегазированный раствор 6-бром-1-метилиндолин-2,3-диона (720 мг, 3 ммоль), цис-4-(2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанола (494 мг, 2 ммоль), трис(дибензилиденацетон)дипалладия (0) (290 мг, 0,3 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (308 мг, 0,6 ммоль) и карбоната цезия (1,14 г, 3,5 ммоль) в диоксане (70 мл) нагревали при 100°C в атмосфере азота в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали и остаток очищали при помощи колоночной флэш-хроматографии на силикагеле (элюируя при помощи 50-100% этилацетата в петролейном эфире) с получением неочищенного цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1-метилиндолин-2,3-диона в виде желтого твердого вещества. Неочищенное промежуточное соединение растворяли в гидразингидрате (85% водн, раствор, 10 мл) и смесь перемешивали при 140°C в течение 1,5 часов. Когда реакционная смесь становилась бесцветной, раствор охлаждали до комнатной температуры и выливали в воду (200 мл). Осадок собирали фильтрованием и очищали при помощи обращенно-фазовой препаративной ВЭЖХ (45-65% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 15 мин) с получением цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1-метилиндолин-2-она в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль с использованием метанольного раствора гидрохлорида (140 мг, 16,6% выход, две стадии). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,87 (т, J=8,4 Гц, 1H), 7,37 (м, 3H), 6,88 (д, J=8,0, 1H), 6,76 (д, J=8,8 Гц, 1H), 3,99 (м, 1H), 3,81 (м, 1H), 3,58 (с, 2H), 3,29 (с, 3H), 2,00 (м, 8H); MS (ESI): m/z: 393,3 [M+H]+.
Пример 109: 3,3-Диметил-6-(5-(тетрагидро-2Н-пиран-4-иламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он
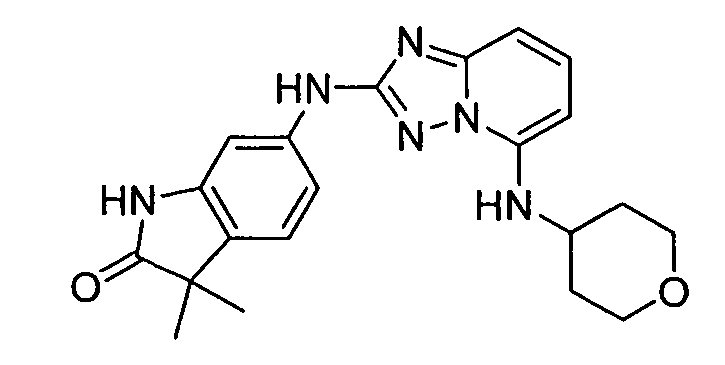
A. 2-Бром-N-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-α]пиридин-5-амин. 2,5-Дибром-[1,2,4]триазоло[1,5-α]пиридин (511,1 мг, 1,846 ммоль), тетрагидро-2H-пиран-4-амин (626 мг, 6,19 ммоль) загружали в 200-мл колбу. Добавляли ДМСО (2 мл) и реакционную смесь помещали для тщательного перемешивания на 100°C масляную баню на 4 часа. Через 4 часа ЖХ/МС анализ показал 2:1 отношение продукта к исходному веществу. Добавляли еще одну порцию тетрагидро-2H-пиран-4-амина (205,8 мг, 2,035 ммоль) и температуру понижали до 80°C в течение 16 часов. Реакционную смесь разбавляли этилацетатом и промывали водой и насыщенным раствором бикарбоната натрия. Вещество растворяли в дихлорметане и очищали при помощи колоночной хроматографии (элюируя при помощи 0-4% метанола в дихлорметане) с получением 2-бром-N-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-α]пиридин-5-амина (0,5066 г, 1,705 ммоль, 92% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,47 (т, J=8,39 Гц, 1H), 7,00 (д, J=8,59 Гц, 1H), 6,11 (д, J=7,81 Гц, 1H), 5,65 (д, J=7,42 Гц, 1H), 4,07 (дт, J=11,81, 3,47 Гц, 2H), 3,63-3,81 (м, 1H), 3,56 (тд, J=11,62, 2,15 Гц, 2H), 2,02-2,19 (м, 2H), 1,63-1,78 (м, 2H), (ESI): m/z 297,4 [M+1]+.
B. трет-Бутил 3,3-диметил-2-оксо-6-(5-(тетрагидро-2Н-пиран-4-иламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-1-карбоксилат. Смесь трис(дибензилиденацетон)дипалладия(0) (0,099 г, 0,109 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,126 г, 0,217 ммоль) в 1,4-диоксане (1,5 мл) быстро нагревали при помощи аппарата для нагревания струей теплого воздуха, пока смесь не становилась очень горячей, и затем смесь добавляли к трет-бутил 6-амино-3,3-диметил-2-оксоиндолин-1-карбоксилату (0,150 г, 0,543 ммоль), 2-бром-N-(тетрагидро-2H-пиран-4-ил)-[1,2,4]триазоло[1,5-α]пиридин-5-амину (0,161 г, 0,543 ммоль) и тонко измельченному карбонату калия (0,308 г, 2,226 ммоль) в герметично закрываемом сосуде со стержневой мешалкой. Осуществляли продувку азотом для выдувания воздуха. Полученную смесь герметично закрывали, интенсивно перемешивали и нагревали при 100°C в течение 4 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли горячим ДМСО и фильтровали через фильтровальный шприц. Фильтровальную лепешку промывали горячим ДМСО. Фильтрат разбавляли метанолом и очищали с использованием обращенно-фазовой препаративной ВЭЖХ (10-80% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 мин). Фракции, содержащие желаемый продукт, объединяли, нейтрализовали насыщенным водным раствором бикарбоната натрия и удаляли ацетонитрил на роторном испарителе. Полученную смесь экстрагировали этилацетатом. Органические слои сушили над сульфатом магния, фильтровали, концентрировали на роторном испарителе и сушили в условиях высокого вакуума с получением желаемого продукта (0,148 г, 0,300 ммоль, 55% выход) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,63 (с, 1H), 8,47 (д, J=1,95 Гц, 1H), 7,38-7,47 (м, 2H), 7,27 (д, J=8,20 Гц, 1H), 6,74 (д, J=8,20 Гц, 1H), 6,29 (д, J=7,81 Гц, 1H), 6,07 (д, J=8,20 Гц, 1H), 3,87-3,97 (м, 2H), 3,73-3,87 (м, 1H), 3,42-3,55 (м, 2H), 2,01 (дд, J=2,34, 12,49 Гц, 2H), 1,63-1,74 (м, 2H), 1,61 (с, 9H), 1,32 (с, 6H); MS (ESI) m/z 493,2 [M+1]+.
C. 3,3-Диметил-6-(5-(тетрагидро-2Н-пиран-4-иламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он. Перемешиваемый раствор трет-бутил 3,3-диметил-2-оксо-6-(5-(тетрагидро-2H-пиран-4-иламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-1-карбоксилата (0,117 г, 0,238 ммоль) в уксусной кислоте (5 мл) нагревали при 110°C в условиях кипячения с обратным холодильником в атмосфере азота в течение 2,5 часов. Полученную смесь разбавляли при помощи ДМСО, фильтровали и очищали с использованием обращенно-фазовой препаративной ВЭЖХ (5-50% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 мин). Фракции, содержащие желаемый продукт, загружали на Strata X-C ионообменную колонку от компании Phenomenex. Колонку промывали последовательно водой, ацетонитрилом, метанолом, 5% раствором гидроксида аммония в метаноле и затем 5% раствором гидроксида аммония в 50% растворе метанола в дихлорметане. Продукт выделяли вместе с элюентом гидроксидом аммония и концентрировали на роторном испарителе и сушили в условиях высокого вакуума при 50°C с получением желаемого продукта (0,072 г, 0,183 ммоль, 77% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,26 (с, 1H), 9,44 (с, 1H), 7,41 (т, J=8,20 Гц, 1H), 7,35 (д, J=1,95 Гц, 1H), 7,29-7,34 (м, J=1,95, 8,20 Гц, 1H), 7,13 (д, J=8,20 Гц, 1H), 6,74 (дд, J=1,17, 8,59 Гц, 1H), 6,28 (д, J=7,42 Гц, 1H), 6,09 (д, J=8,59 Гц, 1H), 3,93 (дд, J=2,54, 8,00 Гц, 2H), 3,72-3,86 (м, 1H), 3,48 (тд, J=1,95, 11,71 Гц, 2H), 1,98 (дд, J=1,95, 12,49 Гц, 2H), 1,61-1,77 (м, 2H), 1,22 (с, 6H); MS (ESI) m/z 393,2 [M+1]+.
Пример 110: 4-((2-(3-Метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он
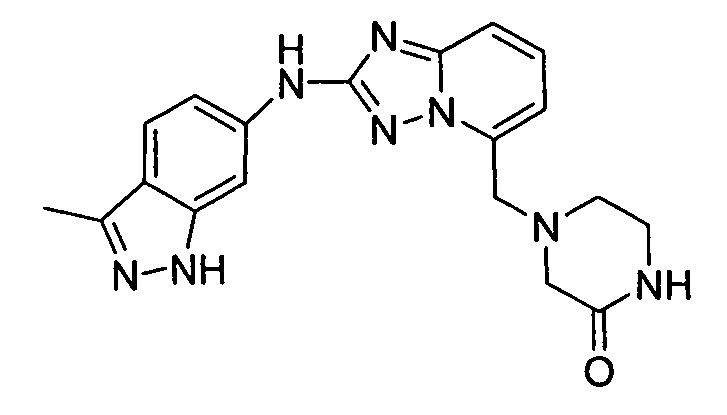
A. Метил 2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-карбоксилат. Раствор O-этил карбонизотиоцианатидата (2,229 мл, 19,72 ммоль) в диоксане (100 мл) охлаждали на ледяной бане. Добавляли небольшими порциями метил 6-аминопиколинат (3 г, 19,72 ммоль) и затем перемешивали в течение 1 часа, пока ЖХ/МС анализ не показал, что было образовано тиомочевинное промежуточное соединение. К реакционной смеси добавляли триэтиламин (2,75 мл, 19,72 ммоль) с последующим добавлением гидрохлорида гидроксиламина (1,370 г, 19,72 ммоль). Реакционную смесь нагревали до 100°C в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом, фильтровали и промывали этилацетатом. Фильтрат концентрировали и затем очищали на колонке с силикагелем (0-50% метанол в этилацетат). Фракции, содержащие продукт, концентрировали и затем растирали в порошок с 50% этилацетата в гексане и затем фильтровали с получением метил 2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-карбоксилата в виде белого твердого вещества (1,13 г, 5,88 ммоль, 29,8% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,56-7,65 (м, 1H), 7,51 (т, J=8,0 Гц, 1H), 7,38-7,45 (м, 1H), 6,25 (с, 2H), 3,93 (с, 3H); MS (ESI) m/z 193,1 [M+1]+.
B. Метил 2-(3-метил-1-тозил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбоксилат. 6-Бром-3-метил-1-тозил-1H-индазол (0,66 г, 1,807 ммоль), метил 2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-карбоксилат (0,382 г, 1,988 ммоль), карбонат цезия (1,766 г, 5,42 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0,105 г, 0,181 ммоль), трис(дибензилиденацетон)палладий(0) (0,083 г, 0,090 ммоль) и диоксан (20 мл) нагревали до 90°C в атмосфере азота в течение 2 часов. Реакционную смесь фильтровали и затем концентрировали. Остаток очищали на колонке с силикагелем (0-100% этилацетата в гексане, затем 0-20% метанола в этилацетате). Фракции, содержащие продукт, концентрировали и затем растирали в порошок в простом эфире с получением указанного в заголовке соединения в виде ярко-желтого твердого вещества (0,66 г, 77% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,35 (с, 1H), 8,75 (д, J=1,6 Гц, 1H), 7,83 (д, J=8,6 Гц, 2H), 7,70-7,75 (м, 1H), 7,63-7,68 (м, 2H), 7,37 (д, J=8,2 Гц, 2H), 4,03 (с, 3H), 2,42 (с, 3H), 2,30 (с, 3H). MS (ESI) m/z 477,5 [M+1]+.
C. (2-(3-Метил-1-тозил-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанол. К метил 2-(3-метил-1-тозил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-карбоксилату (0,66 г, 1,385 ммоль) добавляли этанол (25 мл). Добавляли борогидрид натрия (0,157 г, 4,16 ммоль) тремя порциями. Реакционную смесь нагревали до 50°C в течение 4 часов. Реакционную смесь концентрировали и затем растирали в порошок в воде, фильтровали и затем растирали в порошок снова в 10% растворе метанола в этилацетате с получением указанного в заголовке соединения в виде серого твердого вещества, (0,22 г, 35,4% выход). MS (ESI) m/z 449,5 [M+1]+.
D. 4-((2-(3-Метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он. (2-(3-Метил-1-тозил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанол (0,22 г, 0,491 ммоль), N,N-диметилформамид (1 мл), метансульфоновый ангидрид (0,51 г, 2,94 ммоль) и триэтиламин (0,684 мл, 4,91 ммоль) перемешивали вместе в течение 4 часов. К реакционной смеси добавляли пиперазин-2-он (0,147 г, 1,472 ммоль) и нагревали при 60°C в течение 16 часов. Реакционную смесь очищали при помощи обращенно-фазовой ВЭЖХ (10-70% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты). Фракции, содержащие продукт, пропускали через ионообменную колонку (Strata-XC) и затем выделяли при помощи 2M аммиака в метаноле. Раствор концентрировали и растирали в порошок с 5% раствором метанола в этилацетате с получением белого твердого вещества. Это твердое вещество брали для поглощения в метанол (20 мл) и затем добавляли 25% раствор метоксида натрия в метаноле. Реакционную смесь нагревали в микроволновой печи (120°C, 30 мин). Реакционную смесь концентрировали, нейтрализовали при помощи 1M гидроксида натрия и затем фильтровали с получением ржаво-коричневого твердого вещества. Это твердое вещество очищали при помощи обращенно-фазовой ВЭЖХ (10-70% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты). Фракции, содержащие продукт, пропускали через ионообменную колонку (Strata-XC) и затем выделяли при помощи 2M аммиака в метаноле. Раствор концентрировали и затем растирали в порошок с 10% раствором метанола в простом эфире с получением указанного в заголовке соединения в виде белого твердого вещества, (0,043 г, 23,29% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 12,32 (с, 1H), 9,81 (с, 1H), 8,13 (д, J=1,6 Гц, 1H), 7,85 (с, 1H), 7,57-7,63 (м, 1H), 7,54-7,56 (м, 1H), 7,51-7,54 (м, 1H), 7,20 (дд, J=1,8, 8,8 Гц, 1H), 7,06-7,14 (м, 1H), 4,11 (с, 2H), 3,18-3,27 (м, 4H), 2,79 (т, J=5,5 Гц, 2H), 2,42 (с, 3H). MS (ESI) m/z 377,1 [M+1]+.
Пример 111: 1-(3-Метил-1Н-индазол-6-ил)-4-((2-(3-метил-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он
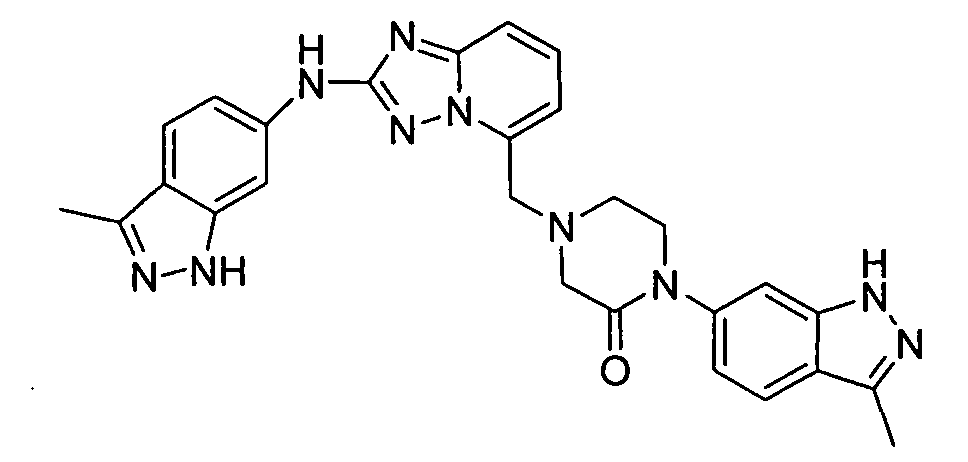
A. N,N-Ди-трет-бутоксикарбонил-5-метил-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К раствору 5-метил-[1,2,4]триазоло[1,5-α]пиридин-2-амина (5 г, 33,7 ммоль) в ацетонитриле (50 мл) добавляли 4-(диметиламино)пиридин (0,412 г, 3,37 ммоль) и ди-трет-бутилдикарбонат (19,59 мл, 84 ммоль). Реакционную смесь нагревали до 70°C в течение 4 часов. Реакционную смесь концентрировали и очищали при помощи хроматографии на силикагеле (0-50% этилацетата в гексане) с получением белого твердого вещества, (7,9 г, 67% выход). MS (ESI) m/z 349,4 [M+1]+.
B. N,N-Ди-трет-бутоксикарбонил-5-(бромметил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. N,N-Ди-трет-бутоксикарбонил-5-метил-[1,2,4]триазоло[1,5-α]пиридин-2-амин (2 г, 5,74 ммоль) растворяли в ацетонитриле (50 мл) и затем продували азотом в течение 10 минут. К раствору добавляли N-бромсукцинимид (1,226 г, 6,89 ммоль) и 2,2'-азобис(2-метилпропионитрил) (0,094 г, 0,574 ммоль) и затем нагревали до 70°C. В реакционную смесь снова загружали свежий N-бромсукцинимид и 2,2'-азобис(2-метилпропионитрил) через каждые 24 часа в течение первых двух дней. Реакционную смесь нагревали в целом в течение 5 дней. Реакционную смесь концентрировали и затем экстрагировали водой и этилацетатом. Органический слой сушили над безводным сульфатом магния, фильтровали и затем концентрировали. Остаток очищали при помощи хроматографии на силикагеле (0-50% этилацетата в гексане) с получением белого твердого вещества (1,05 г, 42,8% выход). MS (ESI) m/z 427,2 [M]+.
C. Гидрохлорид 4-((2-Амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-она. N,N-Ди-трет-бутоксикарбонил-5-(бромметил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (1 г, 2,340 ммоль), пиперазин-2-он (0,293 г, 2,93 ммоль), карбонат калия (0,970 г, 7,02 ммоль) и ацетонитрил (10 мл) нагревали в микроволновой печи (120°C, 10 мин). Реакционную смесь концентрировали и затем очищали на колонке с силикагелем (0-100% этилацетата в гексане). Фракции, содержащие продукт, концентрировали и затем обрабатывали 4н раствором хлористого водорода в диоксане (5 мл) в течение 1 часа. Реакционную смесь концентрировали и затем растирали в порошок этилацетатом с получением белого твердого вещества, (0,8 г, 91% выход). MS (ESI) m/z 247,3 [M+1]+.
D. 1-(3-Метил-1H-индазол-6-ил)-4-((2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он. 6-Бром-3-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол (0,240 г, 0,812 ммоль), 4-((2-амино-[1,2,4]триазоло[1,5-a]пиридин-5-ил)метил)пиперазин-2-он (0,2 г, 0,812 ммоль), трет-бутоксид натрия (0,234 г, 2,4 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0,047 г, 0,081 ммоль), трис(дибензилиденацетон)палладий(0) (0,037 г, 0,041 ммоль) и диоксан (8 мл) нагревали до 100°C в атмосфере азота в течение 16 часов. Реакционную смесь фильтровали и затем обрабатывали 4н раствором хлористого водорода (5 мл) в течение 2 часов. Реакционную смесь концентрировали и очищали при помощи обращенно-фазовой ВЭЖХ (10-70% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты). Фракции, содержащие продукт, пропускали через Strata-XC ионообменную колонку и затем выделяли при помощи 2M аммиака в метаноле с получением белого твердого вещества, (5 мг, 1,2% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 12,68 (с, 1H), 12,33 (с, 1H), 9,84 (с, 1H), 8,15 (д, J=1,6 Гц, 1H), 7,69 (д, J=8,2 Гц, 1H), 7,50-7,66 (м, 3H), 7,40 (д, J=1,2 Гц, 1H), 7,17-7,26 (м, 2H), 7,04 (дд, J=2,0, 8,6 Гц, 1H), 4,21 (с, 2H), 3,79 (т, J=5,5 Гц, 2H), 3,49 (с, 2H), 3,06 (т, J=5,5 Гц, 2H), 2,48 (с, 3H), 2,42 (с, 3H). MS (ESI) m/z 507,4 [M+1]+.
Пример 112: (2-(3-Метил-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(тетрагидро-2Н-пиран-4-ил)метанол и N-(3-метил-1H-индазол-6-ил)-5-((тетрагидро-2Н-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин
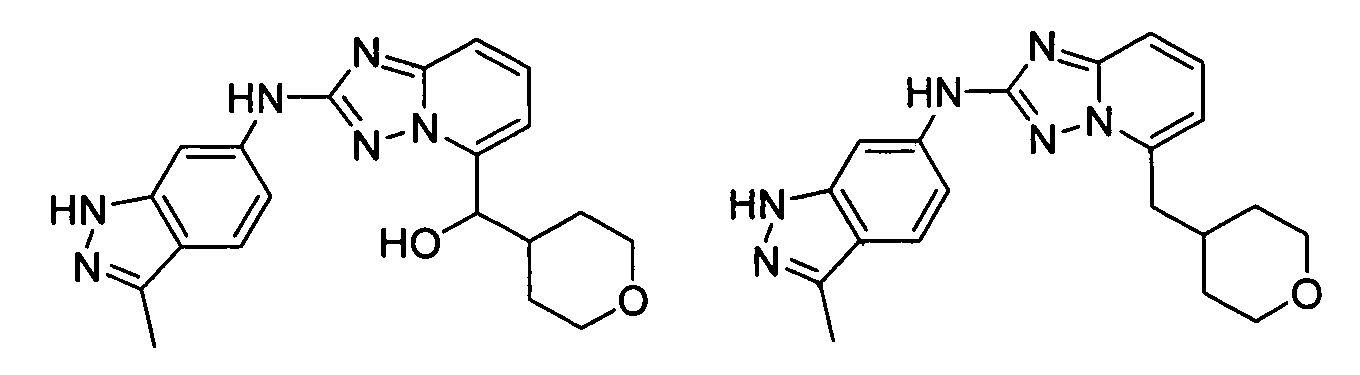
A. N-(3-метил-1-тозил-1Н-индазол-6-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. [1,2,4]Триазоло[1,5-α]пиридин-2-амин синтезировали, следуя процедуре, аналогичной используемой для получения 5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амина, с использованием пиридин-2-амина в качестве исходного вещества. Смесь трис(дибензилиденацетон)дипалладия(0) (0,341 г, 0,373 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,431 г, 0,745 ммоль) в 1,4-диоксане (6 мл) быстро нагревали при помощи аппарата для нагревания струей теплого воздуха до растворения большей части твердых частиц и затем добавляли к 6-бром-3-метил-1-тозил-1H-индазолу (1,361 г, 3,73 ммоль), [1,2,4]триазоло[1,5-α]пиридин-2-амину (0,500 г, 3,73 ммоль), тонко измельченному карбонату цезия (4,98 г, 15,28 ммоль) и 1,4-диоксану (6 мл) в герметично закрываемом сосуде со стержневой мешалкой. Осуществляли продувку азотом для выдувания воздуха. Полученную смесь герметично закрывали, интенсивно перемешивали и нагревали при 120°C в течение 2 часов. После охлаждения до комнатной температуры полученную смесь разбавляли водой и этилацетатом и фильтровали через воронку с пористой стеклянной пластиной. Фильтровальную лепешку тщательно промывали горячим 5% раствором метанола в этилацетате для промывки всего желаемого продукта. Слои фильтрата разделяли и органические слои промывали один раз насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе. Остаток растирали в порошок с диэтиловым эфиром. Твердые вещества собирали при помощи вакуумной фильтрации, промывали диэтиловым эфиром и сушили в условиях высокого вакуума при 40°C с получением желаемого продукта (1,49 г, 3,56 ммоль, 96% выход) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,14 (с, 1H), 8,84 (д, J=6,64 Гц, 1H), 8,65 (с, 1H), 7,79 (д, J=8,59 Гц, 2H), 7,57-7,70 (м, 4H), 7,38 (д, J=8,20 Гц, 2H), 7,09 (тд, J=1,95, 6,64 Гц, 1H), 2,42 (с, 3H), 2,31 (с, 3H); MS (ESI) m/z 419,3 [M+1]+.
B. (2-(3-Метил-1-тозил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(тетрагидро-2Н-пиран-4-ил)метанол. Тетрагидро-2H-пиран-4-карбальдегид хранили в ТГФ над 3 Å молекулярными ситами в течение ночи при 0°C. N-(3-метил-1-тозил-1Н-индазол-6-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин сушили в условиях высокого вакуума при 40°C в течение ночи в реакционной колбе со стержневой мешалкой. Перемешиваемую смесь N-(3-метил-1-тозил-1H-индазол-6-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,681 г, 1,627 ммоль) в тетрагидрофуране (25 мл) быстро нагревали при помощи аппарата для нагревания струей теплого воздуха в атмосфере азота до растворения всех твердых частиц. Полученный желтый раствор охлаждали на бане сухой лед-ацетон в атмосфере азота. Медленно добавляли н-бутиллитий (2,187 мл, 3,50 ммоль, 1,6 M в гексане) по каплям через шприц. Через 45 минут добавляли тетрагидро-2H-пиран-4-карбальдегид (4,07 мл, 4,07 ммоль, 1 M в тетрагидрофуране). Охлаждающую баню удаляли и полученную смесь нагревали до 0°C в течение 15 минут. Добавляли воду (5 мл) и полученную смесь интенсивно перемешивали при комнатной температуре в течение 15 минут. Полученную смесь разбавляли водой и этилацетатом и встряхивали в делительной воронке. Слои разделяли и органические слои промывали водой, затем насыщенным солевым раствором и затем сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе почти досуха. Остаток очищали с использованием флэш-хроматографии (Biotage) (20-100% этилацетата в гексане) с получением желаемого продукта (0,525 г, 0,986 ммоль, 61% выход) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,25 (с, 1H), 8,97 (с, 1H), 7,78 (д, J=8,20 Гц, 2H), 7,60-7,71 (м, 2H), 7,54 (д, J=8,59 Гц, 1H), 7,42 (дд, J=1,56, 8,98 Гц, 1H), 7,37 (д, 8,20 Гц, 2H), 7,12 (д, J=7,03 Гц, 1H), 5,86 (д, J=5,08 Гц, 1H), 5,39 (т, J=4,88 Гц, 1H), 3,73-3,85 (м, 2H), 3,09-3,27 (м, 2H), 2,41 (с, 3H), 2,31 (с, 3H), 2,18-2,28 (м, 1H), 1,74 (квд, J=4,10, 12,43 Гц, 1H), 1,50-1,62 (м, 1H), 1,47 (д, J=12,49 Гц, 1H), 1,34 (д, 1H); MS (ESI) m/z 533,4 [M+1]+.
C. (2-(3-Метил-1-тозил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(тетрагидро-2H-пиран-4-ил)метилацетат и N-(3-метил-1-тозил-1Н-индазол-6-ил)-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Тионилхлорид (0,231 мл, 3,18 ммоль) добавляли к перемешиваемой смеси (2-(3-метил-1-тозил-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(тетрагидро-2H-пиран-4-ил)метанола (0,423 г, 0,794 ммоль) и N,N-диизопропилэтиламина (1,176 мл, 6,75 ммоль) в хлороформе (20 мл). Полученную смесь темного цвета перемешивали при комнатной температуре в атмосфере азота в течение 3 часов и затем растворитель удаляли на роторном испарителе. Добавляли уксусную кислоту (10 мл) с последующим добавлением цинковой пыли (<10 микрон) (1,038 г, 15,88 ммоль). Полученную смесь перемешивали и нагревали при 100°C в условиях кипячения с обратным холодильником в атмосфере азота в течение 18 часов. Полученную смесь фильтровали через Целит и фильтровальную лепешку тщательно промывали метанолом. Фильтрат очищали с использованием обращенно-фазовой препаративной ВЭЖХ (20-100% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 мин). Фракции, содержащие желаемый продукт, объединяли, нейтрализовали насыщенным водным раствором бикарбоната натрия и удаляли ацетонитрил на роторном испарителе. Остаток экстрагировали три раза этилацетатом. Органические экстракты промывали насыщенным солевым раствором, концентрировали на роторном испарителе и сушили в условиях высокого вакуума с получением 24:76 смеси (2-(3-метил-1-тозил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(тетрагидро-2H-пиран-4-ил)метилацетата : N-(3-метил-1-тозил-1H-индазол-6-ил)-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,176 г) в виде ржаво-коричневого твердого вещества. Это вещество использовали на следующей стадии без дополнительной очистки.
D. (2-(3-Метил-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(тетрагидро-2Н-пиран-4-ил)метанол и N-(3-метил-1H-индазол-6-ил)-5-((тетрагидро-2Н-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Смесь (2-(3-метил-1-тозил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(тетрагидро-2H-пиран-4-ил)метилацетата и N-(3-метил-1-тозил-1H-индазол-6-ил)-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,175 г, 0,339 ммоль) растворяли в 1-метил-2-пирролидиноне (2 мл) при перемешивании при комнатной температуре и затем разбавляли метанолом (4 мл). Добавляли гидрид натрия (0,041 г, 1,694 ммоль) в атмосфере азота и полученную смесь перемешивали и нагревали при 70°C в условиях кипячения с обратным холодильником в атмосфере азота в течение 17 часов. Полученную смесь охлаждали до комнатной температуры и добавляли трифторуксусную кислоту (0,209 мл, 2,71 ммоль). Полученную смесь фильтровали и очищали с использованием обращенно-фазовой полу-препаративной ВЭЖХ (5-60% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 мин). Фракции, содержащие желаемые продукты, загружали в отдельные Strata X-C ионообменные колонки от компании Phenomenex. Колонки промывали последовательно водой, ацетонитрилом, метанолом и затем 10% гидроксидом аммония в 70% метанола в дихлорметане. Продукт выделяли вместе с элюентом 10% гидроксида аммония в 70% метанола в дихлорметане и концентрировали на роторном испарителе и сушили в условиях высокого вакуума при 40°C с получением желаемого продукта (2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(тетрагидро-2H-пиран-4-ил)метанола (0,016 г, 0,042 ммоль, 12% выход) в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 12,36 (с, 1H), 9,82 (с, 1H), 8,12 (д, J=1,17 Гц, 1H), 7,62 (дд, J=7,42, 8,59 Гц, 1H), 7,47-7,57 (м, 2H), 7,21 (дд, J=1,76, 8,79 Гц, 1H), 7,07 (д, J=7,03 Гц, 1H), 5,83 (д, J=4,69 Гц, 1H), 5,22 (т, J=4,69 Гц, 1H), 3,77-3,92 (м, 2H), 3,24 (т, J=10,93 Гц, 1H), 3,09-3,20 (м, 1H), 2,42 (с, 3H), 2,16 -2,29 (м, J=3,86, 3,86, 7,91, 11,71 Гц, 1H), 1,72 (квд, J=4,49, 12,56 Гц, 1H), 1,53 (квд, J=4,69, 12,49 Гц, 1H), 1,43 (д, J=11,71 Гц, 1H), 1,30 (д, 1H); MS (ESI) m/z 379,2 [M+1]+ и N-(3-метил-1H-индазол-6-ил)-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (0,051 г, 0,141 ммоль, 42% выход) в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 12,34 (с, 1H), 9,80 (с, 1H), 8,14 (д, J=1,56 Гц, 1H), 7,44-7,57 (м, 3H), 7,21 (дд, J=1,56, 8,59 Гц, 1H), 6,92 (дд, J=1,37, 6,83 Гц, 1H), 3,84 (дд, J=2,54, 11,52 Гц, 2H), 3,26 (т, J=10,93 Гц, 2H), 3,07 (д, J=7,03 Гц, 2H), 2,42 (с, 3H), 2,19-2,36 (м, 1H), 1,54 (д, J=11,32 Гц, 2H), 1,29-1,45 (м, 2H); MS (ESI) m/z 363,3 [M+1]+.
Пример 113: цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1H-пирроло[3,2-6]пиридин-2(3H)-он
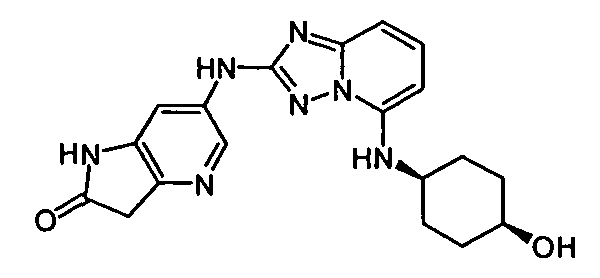
A. Диэтил цис-2-(3-амино-5-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)пиридин-2-ил)малонат. Смесь цис-4-(2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанола (600 мг, 2,43 ммоль), диэтил 2-(5-бром-3-нитропиридин-2-ил)малоната (835 мг, 2,31 ммоль), трис(дибензилиденацетон)дипалладия (423 мг, 0,46 ммоль), карбоната цезия (1,5 г, 4,62 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (267 мг, 0,46 ммоль) в диоксане (10 мл) дегазировали в атмосфере азота, смесь нагревали при кипячении с обратным холодильником в течение ночи. Смесь выливали в воду (30 мл) и экстрагировали этилацетатом. Органический слой сушили, концентрировали и очищали на колонке с силикагелем (элюируя при помощи 0,5-1,5% дихлорметана в метаноле) с получением диэтил цис-2-(3-амино-5-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)пиридин-2-ил)малоната (120,0 мг, 10% выход).
B. Метил цис-2-(3-амино-5-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)пиридин-2-ил)ацетат. К смеси диэтил цис-2-(3-амино-5-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)пиридин-2-ил)малоната (120,0 мг, 0,23 ммоль) в смеси дихлорметана (10 мл) и метанола (50 мл) добавляли никель Ренея (100 мг) и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 24 часов. ЖХ/МС анализ показал, что основной продукт представлял собой желаемый продукт (если реакция не была завершена, просто продолжали гидрирование вплоть до завершения реакции). Смесь фильтровали, концентрировали при пониженном давлении и очищали на колонке с силикагелем (элюируя при помощи 1-2% дихлорметана в метаноле) с получением метил цис-2-(3-амино-5-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)пиридин-2-ил)ацетата.
C. цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1H-пирроло[3,2-6]пиридин-2(3H)-он. К смеси метил цис-2-(3-амино-5-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)пиридин-2-ил)ацетата (130 мг, 0,32 ммоль) в этилацетате (10 мл) добавляли раствор концентрированной хлористоводородной кислоты (0,5 мл) и смесь нагревали при кипячении с обратным холодильником в течение 1 часа. Смесь нейтрализовали насыщенным водным раствором карбоната натрия до pH=9 и экстрагировали этилацетатом. Объединенный органический слой промывали водой и насыщенным водным раствором хлорида натрия, сушили, концентрировали при пониженном давлении и очищали на колонке с силикагелем (элюируя при помощи 2-5% дихлорметана в метаноле) с получением цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1H-пирроло[3,2-b]пиридин-2(3H)-она (15 мг, 17,9%). 1H ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 10,48 (с, 1H), 9,69 (с, 1H), 8,40 (с, 1H), 7,73 (с, 1H), 7,44 (т, J=7,8 Гц, 1H), 6,76 (д, J=8,7 Гц, 1H), 6,23 (д, J=8,1 Гц, 1H), 5,96 (д, J=7,8 Гц, 1H), 4,52 (с, 1H ), 3,78 (с, 2H), 1,84-1,65 (м, 8H); MS (ESI): m/z 380,3 [M+1]+.
Пример 114: 4-((2-(3-(Трифторметил)-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он
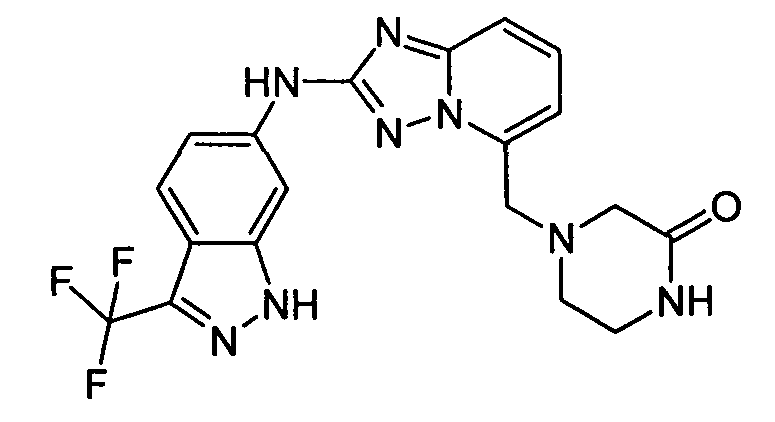
A. Метил 2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-карбоксилат. К раствору метилового эфира 2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-карбоновой кислоты (4,0 г, 21 ммоль) в смеси бромистоводородной кислоты (40% в воде) и уксусной кислоты (об/об, 2:1, 150 мл) добавляли нитрит натрия (8,7 г, 126 ммоль) при комнатной температуре и смесь перемешивали при комнатной температуре в течение ночи. Когда исходное вещество было израсходовано, реакционную смесь подщелачивали при помощи бикарбоната натрия до pH>9. Твердое вещество промывали водой и сушили с получением метил 2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-карбоксилата (4,2 г, 78% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,88 (м, 1H), 7,75 (м, 1H), 7,61 (м, 1H), 4,06 (с, 3H); MS (ESI): m/z 255,8 [M+1]+.
B. 2-Бром-[1,2,4]триазоло[1,5-α]пиридин-5-карбоновая кислота. Смесь метил 2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-карбоксилата (3,38 г, 13,2 ммоль) и гидроксида лития (3,17 г, 132 ммоль) в смеси тетрагидрофурана и воды (об/об, 1:1, 70 мл) нагревали при 80°C в течение ночи. Когда исходное вещество было израсходовано, органический слой отделяли. Водный слой нейтрализовали хлористоводородной кислотой до pH=6 и экстрагировали этилацетатом. Объединенный органический слой сушили над сульфатом натрия и упаривали в вакууме с получением 2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-карбоновой кислоты (2,9 г, 91% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,06 (м, 1H), 7,81 (м, 2H); MS (ESI): m/z 241,9 [M+1]+.
C. (2-Бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанол. К раствору 2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-карбоновой кислоты (2,9 г, 12,2 ммоль) в тетрагидрофуране (40 мл) добавляли по каплям раствор комплекса боран•диметилсульфид (9,27 г, 122 ммоль) в тетрагидрофуране (10 мл) при комнатной температуре. Когда анализ ТСХ показал, что исходное вещество израсходовано, добавляли метанол для гашения реакции и смесь концентрировали в вакууме с получением неочищенного продукта (2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанола (2,6 г, 94% выход). MS (ESI): m/z 229,9 [M+1]+.
D. 2-Бром-5-(бромметил)-[1,2,4]триазоло[1,5-α]пиридин. К раствору (2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанола (2,6 г, 11,45 ммоль) в диоксане (20 мл) добавляли трибромид фосфора (1,6 мл, 17,18 ммоль) при 0°C и реакционную смесь перемешивали при 40°C в течение ночи. Когда исходное вещество было израсходовано, реакцию гасили путем добавления насыщенного водного раствора бикарбоната натрия и экстрагировали этилацетатом. Объединенный органический слой сушили над безводным сульфатом натрия, упаривали при пониженном давлении и очищали на колонке с силикагелем (элюируя при помощи 10-11% этилацетата в петролейном эфире) с получением 2-бром-5-(бромметил)-[1,2,4]триазоло[1,5-α]пиридина (2,0 г, 61% выход) в виде твердого вещества. MS (ESI): m/z 291,9 [M+1]+.
E. 4-(2-Бром-[1,2,4]триазоло[1,5-α]пиридин-5-илметил)-пиперазин-2-он. Суспензию 2-бром-5-(бромметил)-[1,2,4]триазоло[1,5-α]пиридина (0,6 г, 2,1 ммоль), пиперазин-2-она (0,63 г, 6,3 ммоль) и карбоната калия (3,0 г, 21 ммоль) в ацетонитриле (20 мл) нагревали при 60°C. Когда исходное вещество было израсходовано, растворитель удаляли при пониженном давлении и остаток обрабатывали водой. Осадок собирали фильтрованием, промывали водой и сушили в условиях высокого вакуума с получением 4-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-илметил)-пиперазин-2-она (0,49 г, 75% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,84 (с, 1H), 7,76 (м, 2H), 7,30 (м, 1H), 4,08 (с, 2H), 3,22 (с, 2H), 3,16 (с, 2H), 2,74 (м, 2H); MS (ESI): m/z 309,9 [M+1]+.
F. 4-((2-(3-(Трифторметил)-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он. Дегазированную смесь 4-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-илметил)пиперазин-2-она (380 мг, 1,23 ммоль), 3-(трифторметил)-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-амина (410 мг, 1,23 ммоль), трис(дибензилиденацетон)палладия(0) (110 мг, 0,123 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (140 мг, 0,246 ммоль) и карбоната цезия (920 мг, 2,46 ммоль) в диоксане (20 мл) нагревали при 100°C в атмосфере азота в течение ночи. Реакционную смесь концентрировали в вакууме и очищали на колонке с силикагелем (элюируя при помощи 0,5-2% метанола в дихлорметане) с получением 4-((2-(3-(трифторметил)-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-она (510 мг, 74% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,32 (с, 1H), 8,12 (шир.с, 1H), 7,72 (м, 1H), 7,50 (м, 2H), 7,26 (м, 1H), 7,04 (д, J=8,0 Гц, 1H), 6,46 (шир.с, 1H), 5,78 (с, 2H), 4,19 (с, 2H), 3,59 (м, 2H), 3,46 (м, 2H), 3,43 (с, 2H), 2,95 (м, 2H), 0,89 (м, 2H), -0,09 (с, 9H).
G. 4-((2-(3-(Трифторметил)-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он. Смесь 4-((2-(3-(трифторметил)-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-она (250 мг, 0,446 ммоль) в смеси дихлорметана и трифторуксусной кислоты (об/об, 3:1, 15 мл) перемешивали при комнатной температуре в течение 2 часов. Когда исходное вещество было израсходовано, растворитель удаляли и остаток растворяли в смеси метанола (20 мл) и водного раствора гидроксида аммония. После поглощения вещества растворитель удаляли и остаток промывали водой и метанолом с получением 4-((2-(3-(трифторметил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-она в виде гидрохлоридной соли (100 мг, 52% выход). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,40 (с, 1H), 7,67 (м, 2H), 7,51 (д, J=8,8 Гц, 1H), 7,33 (д, J=9,6 Гц, 1H), 7,17 (м, 1H), 4,26 (с, 2H), 3,45 (с, 2H), 3,41 (м, 2H), 2,96 (м, 2H); MS (ESI): m/z 431,3 [M+1]+.
Пример 115: 3,3-Диметил-6-(5-(пиперидин-4-илметил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он
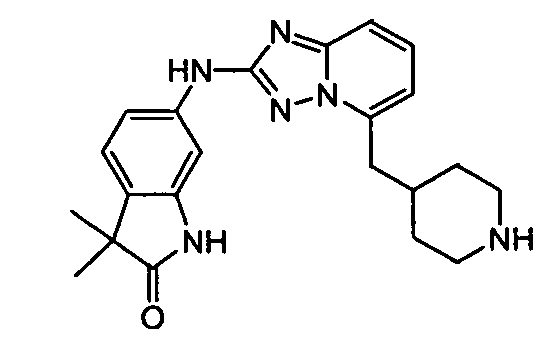
A. 6-(5-Бром-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметил-1-((2-(триметилсилил)этокси)метил)индолин-2-он. Дегазированную смесь 5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амина (1,0 г, 4,72 ммоль), 6-иод-3,3-диметил-1-((2-(триметилсилил)этокси)метил)индолин-2-она (2,15 г, 5,19 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (546 мг, 0,95 ммоль), трис(дибензилиденацетон)палладия(0) (430 мг, 0,47 ммоль) и карбоната цезия (4,6 г, 14,2 ммоль) в диоксане (30 мл) нагревали при 80°C в атмосфере азота в течение 2 часов. Реакционную смесь выливали в воду (20 мл), экстрагировали этилацетатом (15 мл ×3), сушили над безводным сульфатом натрия, упаривали при пониженном давлении и очищали на колонке с силикагелем (элюируя при помощи 10-16% этилацетата в петролейном эфире) с получением 6-(5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметил-1-((2-(триметилсилил)этокси)метил)индолин-2-она (600 мг, 26%). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,87 (с, 1H), 7,63 (м, 2H), 7,53 (д, J=7,2 Гц, 1H), 7,42 (м, 2H), 7,29 (д, J=8,0 Гц, 1H), 5,10 (с, 2H), 3,56 (т, J=8,0 Гц, 2H), 1,31 (с, 6H), 0,89 (т, J=8,0 Гц, 2H), -0,06 (с, 9H); MS (ESI): m/z 504,1 [M+1]+.
B. трет-Бутил 4-((2-(3,3-диметил-2-оксо-1-((2-(триметилсилил)этокси)метил)индолин-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперидин-1-карбоксилат. К раствору трет-бутил 4-метиленпиперидин-1-карбоксилата (480 мг 2,4 ммоль) в тетрагидрофуране (10 мл) добавляли 9-борабицикло[3.3.1]нонан (6 мл, 0,5 M в тетрагидрофуране) при комнатной температуре в атмосфере азота и полученную смесь нагревали при 75°C в течение 3 часов. Смесь 6-(5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметил-1-((2-(триметилсилил)этокси)метил)индолин-2-она (600 мг, 1,2 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) (90 мг, 0,12 ммоль) и карбоната калия (498 мг, 3,6 ммоль) в смеси N,N-диметилформамида (10 мл) и воды (1 мл) перемешивали при 60°C в течение 4 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли водой (50 мл) и смесь экстрагировали этилацетатом (50 мл ×3). Объединенный органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали при помощи обращенно-фазовой препаративной ВЭЖХ (70-100% ацетонитрила + 0,75% трифторуксусной кислоты в воде, в течение 15 мин), с получением трет-бутил 4-((2-(3,3-диметил-2-оксо-1-((2-(триметилсилил)этокси)метил)индолин-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперидин-1-карбоксилата (250 мг, 34% выход). MS (ESI): m/z 621,2 [M+1]+.
C. 3,3-Диметил-6-(5-(пиперидин-4-илметил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он. К раствору трет-бутил 4-((2-(3,3-диметил-2-оксо-1-((2-(триметилсилил)этокси)метил)индолин-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперидин-1-карбоксилата (250 мг, 0,4 ммоль) в дихлорметане (15 мл) добавляли трифторуксусную кислоту (5 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в смеси метанола (5 мл) и гидрата аммиака (2 мл). Смесь перемешивали при комнатной температуре в течение около 18 часов, концентрировали при пониженном давлении и очищали при помощи обращенно-фазовой препаративной ВЭЖХ (37-57% ацетонитрила + 0,75% трифторуксусной кислоты в воде, в течение 15 мин) с получением 3,3-диметил-6-(5-(пиперидин-4-илметил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-она в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль (85 мг, 57% выход). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,77 (т, J=7,6 Гц, 1H), 7,52 (д, J=8,8 Гц, 1H), 7,30 (с, 1H), 7,17 (м, 3H), 3,32 (д, J=8,8 Гц, 2H), 3,18 (д, J=7,2 Гц, 2H), 2,90 (т, J=8,0 Гц, 2H), 2,33 (с, 1H), 1,89 (д, J=8,8 Гц, 2H), 1,57 (м, 2H), 1,28 (с, 6H); MS (ESI): m/z 391,3 [M+1]+.
Пример 116: 1-Метил-N 3 -(пиперидин-4-ил)-N 6 -(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-ил)-1Н-индазол-3,6-диамин
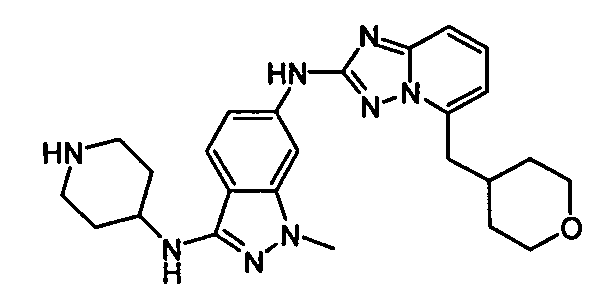
A. трет-Бутил 6-((тетрагидро-2H-пиран-4-ил)метил)пиридин-2-илкарбамат. В атмосфере азота к раствору 4-метилентетрагидро-2H-пирана (3,42 г, 34,9 ммоль) в тетрагидрофуране (10 мл) добавляли 9-борабицикло[3.3.1]нонан (70 мл, 34,9 ммоль) и смесь перемешивали при 75°C в течение 2 часов. К смеси добавляли трет-бутил 6-бромпиридин-2-илкарбамат (6,5 г, 23,9 ммоль), карбонат калия (7,29 г, 52,4 ммоль), 1,1'-бис(дифенилфосфино)ферроценпалладийдихлорид (2,55 г, 3,49 ммоль), N,N-диметилформамид (80 мл) и воду (20 мл). Полученную смесь перемешивали при 60°C в течение 3 часов, охлаждали до комнатной температуры, фильтровали, концентрировали при пониженном давлении и очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 10-20% этилацетата в петролейном эфире) с получением трет-бутил 6-((тетрагидро-2H-пиран-4-ил)метил)пиридин-2-илкарбамата (6,0 г, 86% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,75 (д, J=8,4 Гц, 1H), 7,31 (т, J=8,4 Гц, 1H), 7,35 (шир.с, 1H), 6,77 (д, J=7,2 Гц, 1H), 3,95 (дд, J1=4,0 Гц, J2=I 1,6 Гц, 2H), 3,37 (т, J=11,2 Гц, 2H), 2,58 (д, J=7,2 Гц, 2H), 1,93 (м, 1H), 1,85 (м, 2H), 1,51 (с, 9H), 1,37 (м, 2H).
B. 6-((Тетрагидро-2H-пиран-4-ил)метил)пиридин-2-амин. Раствор трет-бутил 6-((тетрагидро-2H-пиран-4-ил)метил)пиридин-2-илкарбамата (6,0 г, 20,5 ммоль) в метанольном растворе гидрохлорида (80 мл, 2 M) перемешивали при 50°C в течение 2 часов. Когда исходное вещество было израсходовано, реакционную смесь концентрировали в вакууме с получением желаемого продукта в виде гидрохлоридной соли. Остаток растворяли в этилацетате и смесь промывали насыщенным раствором дикарбоната натрия и сушили над сульфатом натрия. Растворитель удаляли с получением 6-((тетрагидро-2H-пиран-4-ил)метил)пиридин-2-амина (3,6 г, 91,5% выход). 1H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,34 (т, J=7,2 Гц, 1H), 6,46 (д, J=7,5 Гц, 1H), 6,33 (д, J=7,1 Гц, 1H), 4,45 (шир.с, 2H), 3,95 (дд, J1=4,0 Гц, J2=11,6 Гц, 2H), 3,38 (т, J=11,2 Гц, 2H), 2,52 (д, J=7,2 Гц, 2H), 1,93 (м, 1H), 1,85 (м, 2H), 1,37 (м, 2H).
C. 5-((Тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Смесь 6-((тетрагидро-2H-пиран-4-ил)метил)пиридин-2-амина (3,6 г, 18,8 ммоль) и O-этил карбонизотиоцианатидата (2,5 г, 18,8 ммоль) в диоксане (40 мл) перемешивали при комнатной температуре. Когда исходное вещество было израсходовано, смесь концентрировали в вакууме. Остаток растворяли в смеси метанола (25 мл) и этанола (25 мл), добавляли гидрохлорид гидроксиламина (6,5 г, 93,8 ммоль) и N,N-диэтилизопропиламин (7,26 г, 56,3 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов и при 75°C в течение 3 часов. Смесь концентрировали в вакууме и очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 20-50% этилацетата в петролейном эфире) с получением 5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (3,6 г, 82% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,36 (т, J=8,4 Гц, 1H), 7,22 (д, J=8,4 Гц, 1H), 6,72 (д, J=6,8 Гц, 1H), 6,00 (шир.с, 2H), 3,81 (д, J=9,2 Гц, 2H), 3,22 (т, J=10,8 Гц, 2H), 2,90 (д, J=7,2 Гц, 2H), 2,19 (м, 1H), 1,44 (м, 2H), 1,32 (м, 2H).
D. трет-Бутил 4-(1-метил-6-(5-((тетрагидро-2Н-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1H-индазол-3-иламино)пиперидин-1-карбоксилат. Дегазированный раствор трет-бутил 4-(6-бром-1-метил-1H-индазол-3-иламино)пиперидин-1-карбоксилата (723 мг, 1,77 ммоль), трис(дибензилиден ацетон)дипалладия(0) (147 мг, 0,16 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (185 мг, 0,32 ммоль), 5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (374 мг, 1,61 ммоль) и карбоната цезия (1,05 г, 3,22 ммоль) в диоксане (40 мл) нагревали при 100°C в атмосфере азота в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали и остаток растворяли в 20 мл смеси дихлорметана и метанола (об/об, 1: 1). Реакционную смесь фильтровали, концентрировали и очищали на колонке с силикагелем (элюируя при помощи 10-100% этилацетата в петролейном эфире) и при помощи обращенно-фазовой препаративной ВЭЖХ (33-63%: ацетонитрил + 0,075% трифторуксусной кислоты в воде + 0,075% трифторуксусной кислоты, в течение 15 мин) с получением трет-бутил 4-(1-метил-6-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1H-индазол-3-иламино)пиперидин-1-карбоксилата (400 мг, 44% выход) в виде твердого вещества. MS (ESI): m/z 561,3 [M+1]+.
E. 1-Метил-N3-(пиперидин-4-ил)-N6-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-ил)-1Н-индазол-3,6-диамин. Раствор трет-бутил 4-(1-метил-6-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1H-индазол-3-иламино)пиперидин-1-карбоксилата (400 мг, 0,714 ммоль) в метанольном растворе гидрохлорида (20 мл, 2 M) перемешивали при комнатной температуре, пока анализ ТСХ не показал, что исходное вещество было израсходовано. Растворитель выпаривали при пониженном давлении с получением 1-метил-N3-(пиперидин-4-ил)-N6-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-ил)-1Н-индазол-3,6-диамина в виде гидрохлоридной соли (305 мг, 93% выход). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,04 (м, 2H), 7,93 (м, 1H), 7,69 (д, J=8,8 Гц, 1H), 7,35 (м, 2H), 3,97 (м, 2H), 3,86 (с, 3H), 3,57 (м, 2H), 3,32 (м, 4H), 2,41 (м, 3H), 2,01 (м, 2H), 1,66 (м, 2H), 1,55 (2H); MS (ESI): m/z 461,4 [M+1]+.
Пример 117: (S)-3,3-диметил-6-(5-(пиперидин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он
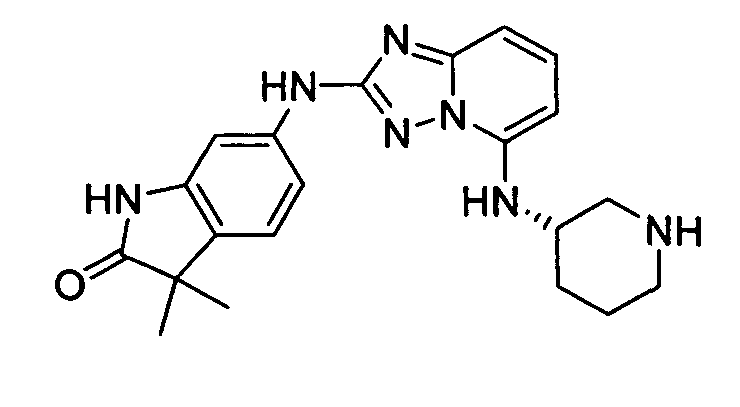
A. (S)-трет-Бутил 3-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)пиперидин-1-карбоксилат. 2,5-Дибром-[1,2,4]триазоло[1,5-α]пиридин (0,500 г, 1,806 ммоль), карбоната калия (0,998 г, 7,22 ммоль) и (S)-трет-бутил 3-аминопиперидин-1-карбоксилат (1,085 г, 5,42 ммоль) объединяли в герметично закрываемом сосуде со стержневой мешалкой в атмосфере азота. Добавляли диметилсульфоксид (3 мл) и полученную смесь герметично закрывали, интенсивно перемешивали и нагревали при 100°C в течение 14 часов. Полученную суспензию фильтровали и концентрировали в вакууме с получением темного масла, которое очищали флэш-хроматографией (0-50% этилацетата в гексане), с получением (S)-трет-бутил 3-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)пиперидин-1-карбоксилата (0,529 г, 1,335 ммоль, 73,9% выход). MS (ESI) m/z 396,2 [M]+.
B. (S)-трет-бутил 6-(5-(1-(трет-бутоксикарбонил)пиперидин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметил-2-оксоиндолин-1-карбоксилат. Смесь трис(дибензилиденацетон)дипалладия(0) (0,244 г, 0,267 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,309 г, 0,534 ммоль) в 1,4-диоксане (1,5 мл) быстро нагревали при помощи аппарата для нагревания струей теплого воздуха, пока смесь не становилась очень горячей, и затем добавляли к трет-бутил 6-амино-3,3-диметил-2-оксоиндолин-1-карбоксилату (0,369 г, 1,335 ммоль), (S)-трет-бутил 3-(2-бром-[1,2,4]триазоло[1,5-a]пиридин-5-иламино)пиперидин-1-карбоксилату (0,529 г, 1,335 ммоль) и тонко измельченному карбонату калия (0,756 г, 5,47 ммоль) в герметично закрываемом сосуде со стержневой мешалкой. Осуществляли продувку азотом для выдувания воздуха. Полученную смесь герметично закрывали, интенсивно перемешивали и нагревали при 100°C в течение 5 часов. После охлаждения до комнатной температуры твердое вещество удаляли фильтрованием и растворитель удаляли при пониженном давлении. Остаток очищали при помощи хроматографии на силикагеле (0-4% насыщенного аммиаком метанола в метиленхлориде) с получением (S)-трет-бутил 6-(5-(1-(трет-бутоксикарбонил)пиперидин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметил-2-оксоиндолин-1-карбоксилата (0,462 г, 0,781 ммоль, 58,5% выход). MS (ESI) m/z 592,7 [M+1]+.
C. (S)-3,3-диметил-6-(5-(пиперидин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он. К перемешиваемой смеси (S)-трет-бутил 6-(5-(1-(трет-бутоксикарбонил)пиперидин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметил-2-оксоиндолин-1-карбоксилата (0,462 г, 0,781 ммоль) в этаноле (30 мл) добавляли хлористый водород (4 н в диоксане, 1,952 мл, 7,81 ммоль). Полученную смесь нагревали при 50°C в атмосфере азота в течение 16 часов. Полученную суспензию концентрировали до половины объема на роторном испарителе, фильтровали и промывали небольшим количеством этанола с получением дигидрохлорида (S)-3,3-диметил-6-(5-(пиперидин-3-иламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-она (0,300 г, 0,646 ммоль, 83% выход) в виде желтого-белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,38 (с, 1H), 9,85 (шир.с, 1H), 9,18-9,36 (м, 2H), 7,51-7,61 (м, 2H), 7,31 (дд, J=2,15, 8,00 Гц, 1H), 7,17 (д, J=8,20 Гц, 1H), 6,82-6,93 (м, 2H), 6,44 (д, J=8,20 Гц, 1H), 4,10 (шир.с, 1H), 3,37 (д, J=11,32 Гц, 1H), 3,27 (д, J=12,89 Гц, 1H), 3,13 (кв., J=9,89 Гц, 1H), 2,82 (д, J=10,15 Гц, 1H), 2,05 (шир.с, 1H), 1,82-1,97 (м, 2H), 1,23 (с, 6H); MS (ESI) m/z 392,6 [M+1]+.
Пример 118: 5-(5-((2-Гидроксипиридин-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)изоиндолин-1-он
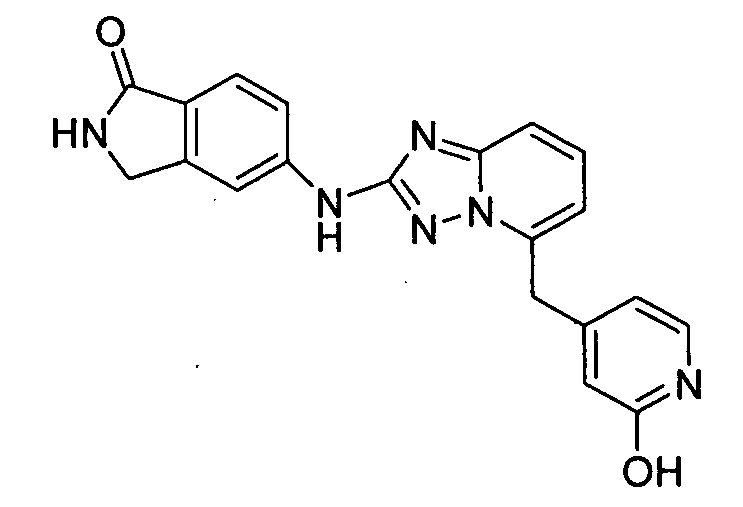
A. (2-Амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(2-метоксипиридин-4-ил)метанон. 5-Бром-[1,2,4]триазоло[1,5-α]пиридин-2-амин (10 г, 46,9 ммоль) суспендировали в безводном тетрагидрофуране (300 мл) и охлаждали до -78°C. Добавляли н-бутиллитий (64,5 мл, 103 ммоль) в течение 30 минут и раствор оставляли для перемешивания в течение 1 часа (коричневая суспензия). N,2-диметокси-N-метилизоникотинамид (9,21 г, 46,9 ммоль) растворяли в тетрагидрофуране (50 мл, сушили над молекулярными ситами) и добавляли по каплям через шприц (коричневая суспензия). Реакционную смесь перемешивали в течение 1 часа и давали медленно нагреться до комнатной температуры в течение 3 часов (реакционная смесь становилась прозрачным раствором при нагревании до комнатной температуры). ЖХ/МС анализ показал желаемый продукт. Реакцию гасили путем добавления по каплям воды (20 мл) и затем нейтрализовали водным раствором хлористоводородной кислоты до pH=7. Флэш-хроматография (30-100% этилацетата в гексане) дала желаемый продукт в виде светло-желтого твердого вещества (6,5 г, 24,14 ммоль, 51,4% выход). MS (ESI) m/z 270,2 [M+1]+.
B. 5-((2-Метоксипиридин-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К раствору (2-амино-[1,2,4]триазоло[1,5-o]пиридин-5-ил)(2-метоксипиридин-4-ил)метанона (3,5 г, 13,00 ммоль) в этиленгликоле (50 мл) добавляли гидразинмоногидрат (3,5 мл, 112 ммоль) и перемешивали в течение 5 минут до получения прозрачного раствора. Добавляли твердый гидроксид калия (0,729 г, 13,00 ммоль), растворенный в этиленгликоле (20 мл), и нагревали при 130°C в течение 16 часов. К реакционной смеси добавляли воду (100 мл) и затем нейтрализовали до pH=7 при помощи трифторуксусной кислоты. Реакционную смесь затем экстрагировали этилацетатом (2×200 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе. Флэш-хроматография (50-100% этилацетата в гексане) дала желаемый продукт в виде белого твердого вещества (3,2 г, 12,54 ммоль, 96% выход). MS (ESI) m/z 256,3 [M+1]+.
C. 2-Бром-5-((2-метоксипиридин-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин. 5-((2-Метоксипиридин-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (3 г, 11,75 ммоль) суспендировали в холодной бромистоводородной кислоте (50 мл, 48% раствор) и затем охлаждали на ледяной бане. Добавляли по каплям нитрит натрия (1,216 г, 17,63 ммоль), растворенный в холодной воде (20 мл), и оставляли для перемешивания при 0°C в течение 1 часа. Добавляли бромид меди(I) (2,023 г, 14,10 ммоль), растворенный в 48% бромистоводородной кислоте (10 мл), и реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 16 часов. Реакционную смесь затем охлаждали до 0°C, нейтрализовали гидроксидом натрия (1н водн.) и экстрагировали этилацетатом. Водный слой упаривали досуха и неочищенное вещество кристаллизовали из этилацетата с получением 2-бром-5-((2-метоксипиридин-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридина в виде белого твердого вещества (2,5 г, 7,83 ммоль, 66,7% выход). MS (ESI) m/z 320,9 [M+2]+.
D. 5-(5-((2-Гидроксипиридин-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)изоиндолин-1-он. Смесь трис(дибензилиденацетон)дипалладия(0) (0,192 г, 0,210 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,091 г, 0,157 ммоль) в 1,4-диоксане (5 мл) добавляли к 5-амино-2-(2,4-диметоксибензил)изоиндолин-1-ону (0,234 г, 0,783 ммоль), 2-бром-5-((2-метоксипиридин-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридину (0,250г, 0,783 ммоль) и карбонату калия (0,433 г, 3,13 ммоль) в герметично закрываемом сосуде со стержневой мешалкой. Осуществляли продувку азотом для выдувания воздуха. Полученную смесь герметично закрывали и нагревали при 110°C в течение 3 часов. Полученную смесь фильтровали и добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали досуха на роторном испарителе и очищали с использованием обращенно-фазовой полу-препаративной ВЭЖХ (10-70% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 34 мин). Растворитель удаляли на роторном испарителе, добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали досуха на роторном испарителе с получением 2-(2,4-диметоксибензил)-5-(5-((2-метоксипиридин-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)изоиндолин-1-она в виде белого твердого вещества (0,2 г, 0,373 ммоль, 47,6% выход). Белое твердое вещество растворяли в этаноле:воде (100 мл) при комнатной температуре и добавляли водный раствор хлористоводородной кислоты (5 мл, 6M). Этот раствор перемешивали в течение 3 часов. Растворитель удаляли на роторном испарителе и неочищенное вещество очищали с использованием обращенно-фазовой полу-препаративной ВЭЖХ (5-40% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 39 мин). Фракции, содержащие желаемый продукт, загружали на Strata X-C ионообменную колонку от компании Phenomenex. Колонку промывали последовательно водой, ацетонитрилом, метанолом и затем горячим 10% гидроксидом аммония в метаноле. Продукт элюировали при помощи 10% гидроксида аммония в метаноле, концентрировали на роторном испарителе досуха, кристаллизовали из этилацетата:гексана и сушили в условиях высокого вакуума при 40°C с получением желаемого продукта в виде белого твердого вещества (0,05 г, 0,134 ммоль, 17%). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,36 (с, 1H), 8,23 (шир.с, 3H), 8,03 (д, J=8,59 Гц, 1H), 7,91 (д, J=1,95 Гц, 1H), 7,74 (дд, J=8,79, 2,15 Гц, 1H), 7,50-7,70 (м, 2H), 7,35 (д, J=6,64 Гц, 1H), 7,12 (д, J=7,03 Гц, 1H), 6,49 (с, 1H), 6,19 (дд, J=6,64, 1,56 Гц, 1H), 4,36 (с, 2H), 4,31 (д, 1H). MS (ESI) m/z 373,2 [M+1]+.
Пример 119: N-(2-(метоксиметил)-1H-бензо[d]имидазол-6-ил)-5-((тетрагидро-2Н-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин
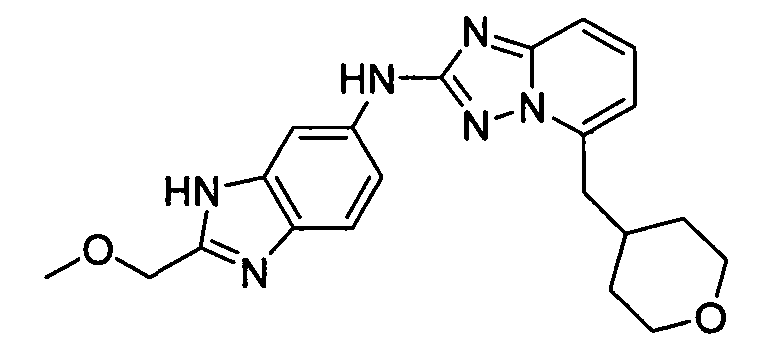
A. (2-Амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(тетрагидро-2H-пиран-4-ил)метанон. 5-Бром-[1,2,4]триазоло[1,5-α]пиридин-2-амин (11,07 г, 52,0 ммоль) суспендировали в безводном тетрагидрофуране (200 мл) и охлаждали до -78°C. Добавляли н-бутиллитий (71,4 мл, 114 ммоль) в течение 30 минут и раствор оставляли для перемешивания в течение 2 часов (коричневая суспензия) при -78°C. Добавляли по каплям через шприц N-метокси-N-метилтетрагидро-2H-пиран-4-карбоксамид (9 г, 52,0 ммоль), растворенный в тетрагидрофуране (50 мл, сушили над молекулярными ситами). Реакционную смесь перемешивали в течение 1 часа при -78°C и давали медленно нагреться до комнатной температуры в течение 3 часов (реакционная смесь превращалсь в прозрачный раствор при нагревании до комнатной температуры). ЖХ/МС анализ показал желаемый продукт. Реакцию гасили насыщенным раствором бикарбоната натрия. Слои разделяли и водный слой экстрагировали этилацетатом (2×200 мл). Органические слои сушили при помощи сульфата натрия и летучие вещества удаляли в вакууме. Неочищенное вещество очищали путем кристаллизации из этилацетата с получением (2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(тетрагидро-2H-пиран-4-ил)метанона (8,4 г, 34,1 ммоль, 65,6% выход) в виде желтого твердого вещества. MS (ESI) m/z 247,0 [M+1]+.
B. 5-((Тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К раствору (2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(тетрагидро-2H-пиран-4-ил)метанона (8 г, 32,5 ммоль) в этиленгликоле (100 мл) добавляли гидразинмоногидрат (8,16 мл, 260 ммоль) и реакционную смесь перемешивали в течение 5 минут до получения прозрачного раствора. Добавляли твердый гидроксид калия (3,65 г, 65,0 ммоль), растворенный в этиленгликоле (20 мл), и реакционную смесь нагревали при 160°C в течение 16 часов. К реакционной смеси добавляли воду (100 мл) и смесь нейтрализовали до pΗ=7 при помощи хлористоводородной кислоты. Реакционную смесь затем экстрагировали этилацетатом (2×400 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали, концентрировали на роторном испарителе с получением желаемого продукта (7 г, 30,1 ммоль, 93% выход) в виде не совсем белого твердого вещества. MS (ESI) m/z 233,2 [M+1]+. Это вещество использовали без дополнительной очистки на следующей стадии.
C. 2-Бром-5-((тетрагидро-2Н-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин. 5-((Тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин (7 г, 30,1 ммоль) суспендировали в холодной бромистоводородной кислоте (60 мл, 48% раствор) и затем охлаждали на ледяной бане. Добавляли по каплям нитрит натрия (3,12 г, 45,2 ммоль), растворенный в холодной воде (40 мл), и оставляли для перемешивания при 0°C в течение 1 часа. Добавляли по каплям бромид меди(I) (5,19 г, 36,2 ммоль), растворенный в бромистоводородной кислоте (20 мл, 48% раствор), и реакционной смеси давали нагреться до комнатной температуры и затем перемешивали в течение 1 часа. Реакционную смесь охлаждали до 0°C, нейтрализовали гидроксидом натрия (6н водн.) и экстрагировали этилацетатом. Неочищенный продукт очищали флэш-хроматографией (элюируя при помощи 30-60% этилацетата в гексане) с получением 2-бром-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридина в виде фиолетового масла (3,4 г, 11,48 ммоль, 38,1% выход). Это соединение дополнительно очищали путем кристаллизации из метанола (3 мл) с получением указанного в заголовке соединения в виде розового твердого вещества (3,0 г). MS (ESI) m/z 298,3 [M+1]+.
D. N-(2-(метоксиметил)-1H-бензо[d]имидазол-6-ил)-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К смеси трис(дибензилиденацетон)дипалладия(0) (0,077 г, 0,084 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,098 г, 0,169 ммоль) в 1,4-диоксане (10 мл) добавляли 2-(метоксиметил)-1-тозил-1H-бензо[d]имидазол-5-амин (0,280 г, 0,844 ммоль), 2-бром-5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин (0,25 г, 0,844 ммоль) и тонко измельченный карбонат калия (0,35 г, 2,53 ммоль) в герметично закрываемом сосуде со стержневой мешалкой. Осуществляли продувку азотом для выдувания воздуха. Полученную смесь герметично закрывали, перемешивали и нагревали при 120°C. ЖХ/МС анализ через 3 часа показал полную конверсию в желаемый продукт. Полученную смесь фильтровали. Добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали досуха на роторном испарителе и очищали с использованием обращенно-фазовой препаративной ВЭЖХ (элюируя при помощи 20-70% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 39 мин). Фракции, содержащие желаемый продукт, концентрировали на роторном испарителе и добавляли водный раствор хлористоводородной кислоты (25 мл, 6M) и нагревали до 70°C в течение ночи. Растворитель удаляли на роторном испарителе и очищали с использованием обращенно-фазовой полу-препаративной ВЭЖХ (элюируя при помощи 5-40% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 39 мин). Фракции, содержащие желаемый продукт, загружали на Strata X-C ионообменную колонку от компании Phenomenex. Колонку промывали последовательно водой, ацетонитрилом, метанолом и затем горячим 10% раствором гидроксида аммония в метаноле. Продукт элюировали при помощи 10% раствора гидроксида аммония в метаноле и концентрировали на роторном испарителе досуха. Это вещество кристаллизовали из 20% этилацетата в гексане и сушили в условиях высокого вакуума при 40°C с получением желаемого продукта в виде белого твердого вещества (0,130 г, 0,331 ммоль, 39,2% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 12,30 (шир.с, 1H), 9,56 (шир.с, 1H), 8,14 (с, 1H), 7,30-7,55 (м, 4H), 6,89 (д, J=5,86 Гц, 1H), 4,58 (с, 2H), 3,84 (дд, J=11,32, 2,73 Гц, 2H), 3,36 (с, 3H), 3,26 (т, J=10,93 Гц, 2H), 3,06 (д, J=7,03 Гц, 2H), 2,19-2,36 (м, 1H), 1,54 (д, J=11,32 Гц, 2H), 1,29-1,45 (м, 2H); MS (ESI) m/z 393,2 [M+1]+.
Пример 120: 6-(5-(Гидрокси(тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он и 3,3-диметил-6-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он
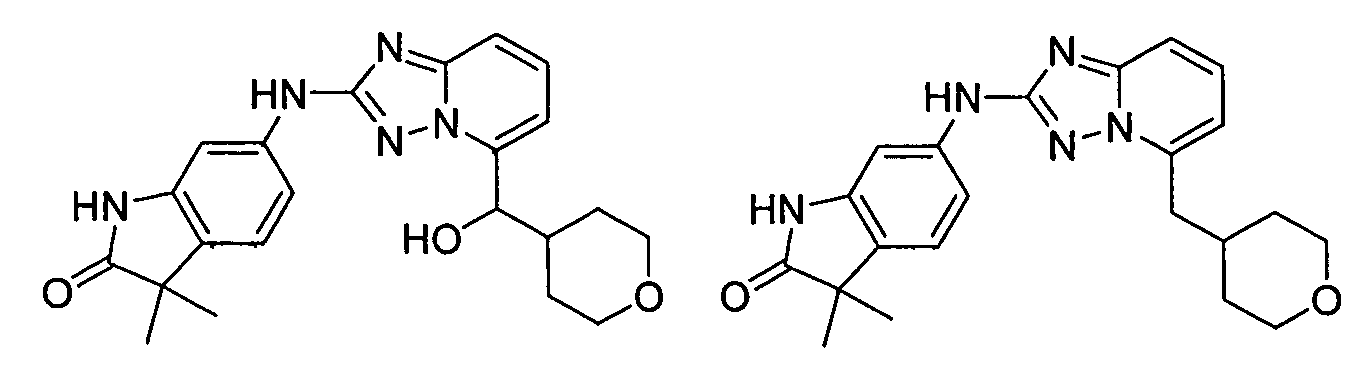
A. (2-Бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(тетрагидро-2Н-пиран-4-ил)метанол. Раствор тетрагидро-2H-пиран-4-карбальдегида в тетрагидрофуране сушили над 3Å молекулярными ситами перед использованием. 2,5-дибром-[1,2,4]триазоло[1,5-α]пиридин сушили в условиях высокого вакуума в реакционной колбе со стержневой мешалкой при 40°C в течение ночи перед использованием. н-Бутиллитий (2,70 мл, 4,32 ммоль, 1,6 M в гексане) добавляли медленно по каплям к перемешиваемому раствору 2,5-дибром-[1,2,4]триазоло[1,5-α]пиридина (1,14 г, 4,12 ммоль) в тетрагидрофуране (30 мл) при охлаждении на бане сухой лед/ацетон, в атмосфере азота. В процессе добавления реакционная смесь становилась более темно-желтой. Через 10 минут добавляли тетрагидро-2H-пиран-4-карбальдегид (4,53 мл, 4,53 ммоль, 1 M в тетрагидрофуране). Охлаждающую баню удаляли и полученную смесь нагревали до 0°C в течение ~15 минут. Полученную смесь разбавляли метанолом (1 мл) и основное количество растворителя удаляли на роторном испарителе. Остаток очищали с использованием флэш-хроматографии (Biotage) (элюируя при помощи 10-100% этилацетата в гексане) с получением желаемого продукта (0,792 г, 2,54 ммоль, 62% выход) в виде белого пенистого твердого вещества. MS (ESI) m/z 312,1 [M]+, 314,2 [M+2]+.
B. трет-Бутил 6-(5-(гидрокси(тетрагидро-2Η-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметил-2-оксоиндолин-1-карбоксилат. Смесь трис(дибензилиденацетон)дипалладия(0) (0,101 г, 0,110 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,128 г, 0,221 ммоль) в 1,4-диоксане (1,5 мл) быстро нагревали при помощи аппарата для нагревания струей теплого воздуха, пока смесь не становилась очень горячей, и затем добавляли к трет-бутил 6-амино-3,3-диметил-2-оксоиндолин-1-карбоксилату (0,305 г, 1,104 ммоль), (2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(тетрагидро-2H-пиран-4-ил)метанолу (0,345 г, 1,104 ммоль), 1,4-диоксан (2 мл) и тонко измельченному карбонату калия (0,625 г, 4,53 ммоль) в герметично закрываемом сосуде со стержневой мешалкой. Осуществляли продувку азотом для выдувания воздуха. Полученную смесь герметично закрывали, интенсивно перемешивали и нагревали при 100°C в течение 2,5 часов. После охлаждения до комнатной температуры реакционную смесь фильтровали через фильтровальный шприц. Фильтровальную лепешку промывали при помощи ДМСО. Фильтрат разбавляли 0,1% раствором трифторуксусной кислоты в ацетонитриле и метаноле и очищали с использованием обращенно-фазовой препаративной ВЭЖХ (15-75% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 мин). Фракции, содержащие желаемый продукт, объединяли, нейтрализовали насыщенным водным раствором бикарбоната натрия и удаляли ацетонитрил на роторном испарителе. Полученную смесь экстрагировали этилацетатом. Органические слои сушили над сульфатом магния, фильтровали, концентрировали на роторном испарителе и сушили в условиях высокого вакуума с получением желаемого продукта (0,442 г, 0,871 ммоль, 79% выход) в виде желтого твердого вещества. MS (ESI) m/z 507,7 [M+1]+.
C. 6-(5-(Гидрокси(тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он и 3,3-диметил-6-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он. Тионилхлорид (0,095 мл, 1,303 ммоль) в хлороформе (1,5 мл) добавляли к перемешиваемому раствору трет-бутил 6-(5-(гидрокси(тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметил-2-оксоиндолин-1-карбоксилата (0,441 г, 0,869 ммоль) и N,N-диизопропилэтиламина (1,286 мл, 7,39 ммоль) в хлороформе (20 мл) при -45°C. Полученный желтый раствор перемешивали при медленном нагревании до 0°C в течение 30 минут. Полученный желтый раствор снова охлаждали до -45°C. Добавляли дополнительное количество тионилхлорида (0,019 мл, 0,261 ммоль) в хлороформе (0,3 мл). Полученный желтый раствор перемешивали при медленном нагревании до 0°C в течение 30 минут Полученный желто-оранжевый раствор переносили в делительную воронку с использованием дихлорметана и встряхивали с насыщенным водным раствором бикарбоната натрия. Слои разделяли и водный слой экстрагировали снова дихлорметаном. Объединенные органические слои промывали 0,5 M раствором бисульфат натрия в воде (2×10 мл), затем насыщенным солевым раствором и затем сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе. Остаток растворяли в уксусной кислоте (10 мл) при перемешивании при комнатной температуре. Добавляли цинковую пыль (<10 микрон) (1,136 г, 17,38 ммоль). Полученную серу и оранжевую смесь перемешивали и нагревали при 110°C в условиях кипячения с обратным холодильником в атмосфере азота в течение 1,5 часов. Полученную смесь фильтровали через Целит и фильтровальную лепешку промывали 20% раствором метанола в дихлорметане. Фильтрат концентрировали на роторном испарителе. Остаток растворяли в ДМСО/метаноле, фильтровали и очищали с использованием обращенно-фазовой препаративной ВЭЖХ (15-65% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 мин). Фракции, содержащие желаемые продукты, загружали на Strata X-C ионообменные колонки от компании Phenomenex. Колонки промывали последовательно водой, ацетонитрилом, метанолом и затем 5% раствором гидроксида аммония в метаноле. Продукты выделяли вместе с элюентом 5% гидроксида аммония в метаноле и концентрировали на роторном испарителе и сушили в условиях высокого вакуума при 50°C с получением 6-(5-(гидрокси(тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-она (0,148 г, 0,363 ммоль, 42% выход) в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,34 (с, 1H), 9,65 (с, 1H), 7,60 (дд, J=7,42, 8,59 Гц, 1H), 7,46 (дд, J=1,37, 8,79 Гц, 1H), 7,41 (д, J=1,95 Гц, 1H), 7,26 (дд, J=1,95, 8,20 Гц, 1H), 7,14 (д, J=8,20 Гц, 1H), 7,05 (д, J=7,03 Гц, 1H), 5,80 (д, J=5,08 Гц, 1H), 5,18 (т, J=4,88 Гц, 1H), 3,84 (ддд, J=3,12, 11,71, 15,23 Гц, 2H), 3,20-3,30 (м, 1H), 3,16 (тд, J=1,95, 11,71 Гц, 1H), 2,19 (tq, J=3,86, 11,79 Гц, 1H), 1,70 (квд, J=4,30, 12,49 Гц, 1H), 1,51 (квд, J=4,49, 12,43 Гц, 1H), 1,39 (д, J=11,71 Гц, 1H), 1,31 (д, J=12,49 Гц, 1H), 1,23 (с, 6H); MS (ESI) m/z 408,3 [M+1]+. 3,3-Диметил-6-(5-((тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он (0,055 г, 0,140 ммоль, 16% выход) также выделяли в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,33 (с, 1H), 9,63 (с, 1H), 7,47-7,54 (м, 1H), 7,43 (дд, J=1,37, 11,52 Гц, 2H), 7,27 (дд, J=1,95, 8,20 Гц, 1H), 7,14 (д, J=7,81 Гц, 1H), 6,91 (д, J=7,03 Гц, 1H), 3,84 (дд, J=2,34, 11,32 Гц, 2H), 3,26 (т, J=10,93 Гц, 2H), 3,04 (д, J=7,42 Гц, 2H), 2,16-2,31 (м, 1H), 1,52 (д, J=11,32 Гц, 2H), 1,36 (квд, J=4,30, 12,10 Гц, 2H), 1,23 (с, 6H); MS (ESI) m/z 392,3 [M+1]+.
Пример 121: 3,3-Диметил-6-(5-(1-(тетрагидро-2Н-пиран-4-ил)этил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-он
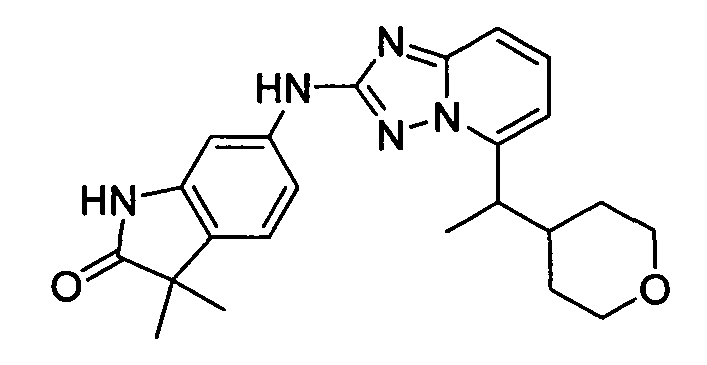
A. (2-Бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(тетрагидро-2H-пиран-4-ил)метанон. Раствор N-метокси-N-метилтетрагидро-2H-пиран-4-карбоксамида в тетрагидрофуране сушили над 3Å молекулярными ситами перед использованием. 2,5-Дибром-[1,2,4]триазоло[1,5-α]пиридин сушили в условиях высокого вакуума в реакционной колбе со стержневой мешалкой при 40°C в течение ночи перед использованием. н-Бутиллитий (2,96 мл, 4,74 ммоль, 1,6 M в гексане) добавляли медленно по каплям к перемешиваемому раствору 2,5-дибром-[1,2,4]триазоло[1,5-α]пиридина (1,25 г, 4,51 ммоль) в тетрагидрофуране (25 мл) при охлаждении на бане сухой лед/ацетон, в атмосфере азота. В процессе добавления цвет реакционной смеси становился более темно-желтым, а затем темно- красным. Через 10 минут добавляли N-метокси-N-метилтетрагидро-2H-пиран-4-карбоксамид (4,97 мл, 4,97 ммоль, 1M раствор в тетрагидрофуране). Охлаждающую баню удаляли и полученную смесь нагревали до 0°C в течение ~15 минут. Полученную смесь разбавляли метанолом (1 мл) и основное количество растворителя удаляли на роторном испарителе. Остаток очищали с использованием флэш-хроматографии (Biotage) (10-100% этилацетата в гексане). Фракции, содержащие желаемый продукт, объединяли и основное количество растворителя удаляли на роторном испарителе. Остаток растирали в порошок с 20% раствором этилацетата в гексане. Твердые вещества собирали при помощи вакуумной фильтрации, промывали гексаном и сушили в условиях высокого вакуума с получением желаемого продукта (0,658 г, 2,122 ммоль, 47% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,08 (дд, J=1,17, 8,98 Гц, 1H), 7,86 (дд, J=7,42, 8,98 Гц, 1H), 7,74 (дд, J=1,17, 7,03 Гц, 1H), 3,84-3,96 (м, 3H), 3,42 (тд, J=2,15, 11,42 Гц, 2H), 1,80 (дд, J=1,56, 12,89 Гц, 2H), 1,52-1,66 (м, 2H); MS (ESI) m/z 310,2 [M]+, 312,1 [M+2]+.
B. трет-Бутил-3,3-диметил-2-оксо-6-(5-(тетрагидро-2Н-пиран-4-карбонил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-1-карбоксилат. Смесь трис(дибензилиденацетон)дипалладия(0) (0,050г, 0,054 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,063 г, 0,109 ммоль) в 1,4-диоксане (2 мл) быстро нагревали при помощи аппарата для нагревания струей теплого воздуха, пока смесь не становилась очень горячей, и затем добавляли к трет-бутил 6-амино-3,3-диметил-2-оксоиндолин-1-карбоксилату (0,150 г, 0,543 ммоль), (2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(тетрагидро-2H-пиран-4-ил)метанону (0,168 г, 0,543 ммоль) и тонко измельченному карбонату калия (0,308 г, 2,226 ммоль) в герметично закрываемом сосуде со стержневой мешалкой. Осуществляли продувку азотом для выдувания воздуха. Полученную смесь герметично закрывали, интенсивно перемешивали и нагревали при 100°C в течение 1,5 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом и водой при интенсивном перемешивании. Полученную смесь фильтровали через фильтровальный шприц и фильтровальную лепешку промывали этилацетатом. Слои фильтрата разделяли в делительной воронке и органические слои концентрировали на роторном испарителе. Осуществляли поглощение остатка в дихлорметан и очищали с использованием флэш-хроматографии (Biotage) (20-80% этилацетата в гексане) с получением желаемого продукта (0,183 г, 0,362 ммоль, 67% выход) в виде желтого твердого вещества. MS (ESI) m/z 506,2 [M+1]+.
C. 3,3-Диметил-6-(5-(1-(тетрагидро-2H-пиран-4-ил)винил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он. (Триметилсилилметил)магнийхлорид (0,700 мл, 0,700 ммоль, 1 M в диэтиловом эфире) добавляли по каплям медленно к перемешиваемому раствору трет-бутил 3,3-диметил-2-оксо-6-(5-(тетрагидро-2H-пиран-4-карбонил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-1-карбоксилата (0,118 г, 0,233 ммоль) в тетрагидрофуране (10 мл) при -70°C в атмосфере азота. Реакционная смесь становилась темно-красной при добавлении реагента Гриньяра. Полученную смесь перемешивали в атмосфере азота при медленном нагревании до 0°C в течение 2 часов. Добавляли дополнительное количество (триметилсилилметил)-магнийхлорида (0,233 мл, 0,233 ммоль, 1 M в диэтиловом эфире) и полученный красный раствор перемешивали при 0°C в атмосфере азота в течение 35 минут. Снова добавляли (триметилсилилметил)-магнийхлорид (0,350 мл, 0,350 ммоль, 1 M в диэтиловом эфире) и полученную смесь перемешивали при 0°C в атмосфере азота в течение 1,5 часов. Добавляли дополнительное количество (триметилсилилметил)магнийхлорид (0,350 мл, 0,350 ммоль, 1 M в диэтиловом эфире) и полученную смесь перемешивали при 0°C в атмосфере азота в течение 1 часа. Добавляли насыщенный водный раствор хлорида аммония для гашения реакции. Полученную смесь разбавляли этилацетатом и водой и встряхивали в делительной воронке. Слои разделяли и органические слои промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе. Осуществляли поглощение остатка в дихлорметан и очищали с использованием флэш-хроматографии (Biotage) (20-100% этилацетата в гексане) с получением неочищенного белого твердого вещества. MS (ESI) m/z 594,5 [M+1]+. К этому белому твердому веществу добавляли уксусную кислоту (5 мл). Полученную смесь перемешивали и нагревали при 120°C в условиях кипячения с обратным холодильником в течение 85 часов. Полученную смесь фильтровали и очищали с использованием обращенно-фазовой препаративной ВЭЖХ (10-60% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 мин). Фракции, содержащие желаемый продукт, загружали на Strata X-C ионообменную колонку от компании Phenomenex. Колонку промывали последовательно водой, ацетонитрилом, метанолом и затем смесью 5% гидроксида аммония, 45% метанола и 50% дихлорметана. Продукт выделяли вместе с элюентом гидроксидом аммония и концентрировали на роторном испарителе и сушили в условиях высокого вакуума с получением желаемого продукта (0,035 г, 0,087 ммоль, 64% выход) в виде не совсем белого твердого вещества. MS (ESI) m/z 404,5 [M+1]+.
D. 3,3-Диметил-6-(5-(1-(тетрагидро-2Н-пиран-4-ил)этил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он. Получали смесь 3,3-диметил-6-(5-(1-(тетрагидро-2H-пиран-4-ил)винил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-она (0,035 г, 0,087 ммоль) в этаноле (6 мл) при перемешивании. Подсоединяли насадку для подачи вакуума/азота/водорода. Атмосферу в колбе удаляли и замещали азотом три раза. Добавляли палладий (10% масс. на активированном угле) (4,62 мг, 4,34 мкМ) и атмосферу в колбе удаляли и замещали водородом, три раза. Полученную смесь интенсивно перемешивали под баллоном водорода при 50°C в течение 2 часов. Добавляли 1-метил-2-пирролидинон (1 мл) для улучшения растворимости исходного вещества и полученную смесь интенсивно перемешивали под баллоном водорода при 70°C в течение 10 часов. Полученную смесь фильтровали через фильтровальный шприц и загружали на Strata X-C ионообменную колонку от компании Phenomenex. Колонку промывали последовательно водой, ацетонитрилом, метанолом и затем смесью 5% гидроксида аммония, 45% метанола и 50% дихлорметана. Продукт выделяли вместе с элюентом гидроксидом аммония и концентрировали на роторном испарителе и сушили в условиях высокого вакуума при 50°C с получением желаемого продукта (0,034 г, 0,084 ммоль, 97% выход) в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,35 (с, 1H), 9,60 (с, 1H), 7,53 (дд, J=7,22, 8,79 Гц, 1H), 7,38-7,45 (м, 2H), 7,26 (дд, J=1,95, 8,20 Гц, 1H), 7,14 (д, J=7,81 Гц, 1H), 6,91 (д, J=7,42 Гц, 1H), 3,90 (дд, J=3,12, 11,32 Гц, 1H), 3,77 (дд, J=2,54, 11,52 Гц, 1H), 3,50 (квин., J=7,32 Гц, 1H), 3,13-3,31 (м, 2H), 2,07-2,21 (м, 1H), 1,70 (д, J=13,28 Гц, 1H), 1,36 (д, J=7,03 Гц, 3H), 1,25-1,34 (м, 3H), 1,23 (с, 6H); MS (ESI) m/z 406,2 [M+1]+.
Пример 122: транс-6-(5-((4-гидрокси-4-метилциклогексил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он и цис-6-(5-((4-гидрокси-4-метилциклогексил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он
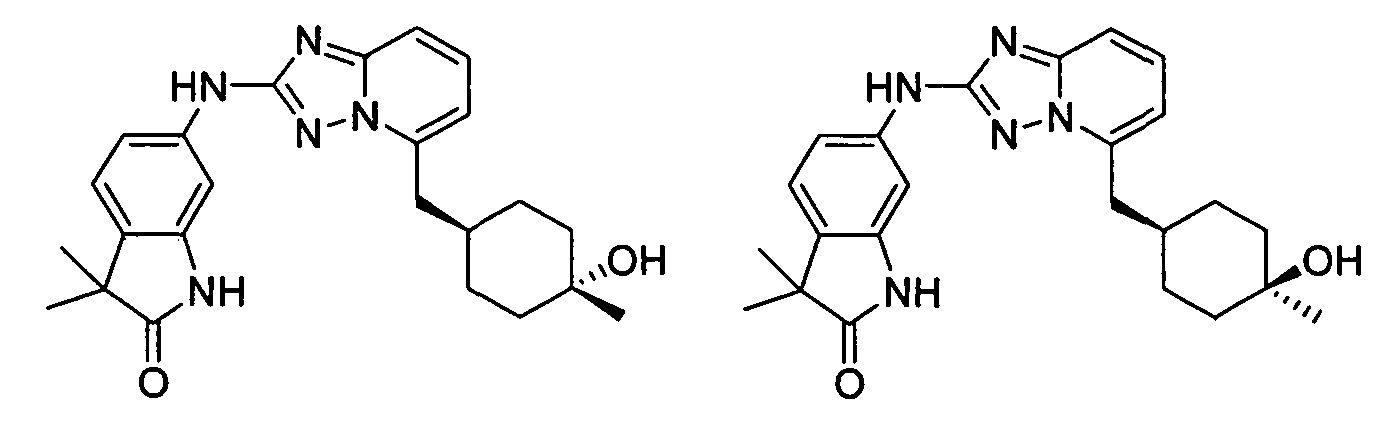
A. 2-Бром-[1,2,4]триазоло[1,5-α]пиридин. Суспензию [1,2,4]триазоло[1,5-α]пиридин-2-амина (0,500 г, 3,73 ммоль, получали из пиридин-2-амина, следуя процедуре, аналогичной описанной для получения 5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амина) в 48% HBr (5 мл) охлаждали до 0°C и медленно обрабатывали раствором нитрита натрия (0,386 г, 5,59 ммоль) в воде (2 мл), что приводило к темно-коричневой суспензии с выделением коричневого газа. Смесь перемешивали в течение 1 часа. Добавляли темно-фиолетовый раствор бромида меди(I) (0,642 г, 4,47 ммоль) в 48% HBr (2 мл) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Фиолетовую суспензию выливали в воду (15 мл) и полученную желто-оранжевую суспензию собирали и сушили с получением оранжевого твердого вещества, которое затем очищали при помощи колоночной хроматографии (элюируя при помощи 100% дихлорметана) с получением 2-бром-[1,2,4]триазоло[1,5-α]пиридина (0,455 г, 61% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,96 (дт, 1H), 7,81-7,91 (м, 1H), 7,68-7,79 (м, 1H), 7,27 (тд, J=1,37, 6,93 Гц, 1H); MS (ESI) m/z 197,9 [M]+ и 200,1 [M+2]+.
B. 6-([1,2,4]Триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он. Смесь трис(дибензилиденацетон)дипалладия(0) (0,116 г, 0,126 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,146 г, 0,252 ммоль), 2-бром-[1,2,4]триазоло[1,5-α]пиридина (0,25 г, 1,262 ммоль), карбоната цезия (1,687 г, 5,18 ммоль) и трет-бутил 6-амино-3,3-диметил-2-оксоиндолин-1-карбоксилата (0,349 г, 1,262 ммоль) в 1,4-диоксане (4 мл) помещали в атмосферу азота и нагревали до 75°C в течение 3,5 часов, затем до 65°C в течение ночи. Поскольку оставалось непрореагировавшее исходное вещество, смесь нагревали до 75°C еще в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли 20% раствором метанола в дихлорметане при интенсивном перемешивании. Полученную смесь фильтровали через Целит и фильтровальную лепешку промывали 20% раствором метанола в дихлорметане. Фильтрат концентрировали на роторном испарителе и очищали при помощи колоночной хроматографии на Biotage (элюируя при помощи 5-75% этилацетата в гексане). Оба анализа ЖХ/МС и 1H-ЯМР показали, что Boc защитная группа была удалена на стадии очистки. 6-([1,2,4]Триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он (0,202 г, 0,689 ммоль, 54,5% выход) выделяли в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,29 (с, 1H), 9,56 (с, 1H), 8,69-8,75 (м, 1H), 7,52-7,60 (м, 2H), 7,36 (д, J=1,95 Гц, 1H), 7,19-7,25 (м, 1H), 7,10-7,16 (м, 1H), 6,98-7,05 (м, 1H), 1,18-1,26 (м, 6H); MS (ESI) m/z 294,2 [M+1]+.
C. 6-(5-Бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он. Раствор 6-([1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-она (0,200 г, 0,682 ммоль) в безводном тетрагидрофуране (2,73 мл) охлаждали до -78°C и обрабатывали н-бутиллитием (1,321 мл, 2,114 ммоль, 1,6 M в гексане). Через 30 минут при низкой температуре добавляли 1,2-дибром-1,1,2,2-тетрафторэтан (0,549 г, 2,114 ммоль). Через 20 минут охлаждающую баню удаляли и реакционную смесь перемешивали в течение ночи. Наблюдали конверсию более чем 50% в чистых показаниях ЖХ/МС. К реакционной смеси добавляли воду (10 мл) и неочищенное вещество экстрагировали этилацетатом. Экстракты сушили над сульфатом натрия и упаривали досуха. Остаток загружали в смесь диметилформамид/метанол на колонку biotage с силикагелем и соединение элюировали при помощи 5-100% этилацетата в гексане. Все фракции, содержащие продукт, объединяли, упаривали досуха, и потребовалась дополнительная очистка при помощи колоночной хроматографии на Biotage с использованием 10-75% этилацетата в гексане. 6-(5-Бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он (0,091 г, 0,244 ммоль, 35,9% выход) выделяли в виде желтого твердого вещества. MS (ESI) m/z 372,1 [M+1]+.
D. 6-(5-(1,4-Диоксаспиро[4,5]декан-8-илметил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он. Раствор 8-метилен-1,4-диоксаспиро[4,5]декана (0,117 г, 0,758 ммоль) в 0,5 M растворе (1S,5S)-9-борабицикло[3.3.3]нонана в тетрагидрофуране (1,467 мл, 0,733 ммоль) нагревали до температуры кипения с обратным холодильником в течение 2 часов в атмосфере азота. Реакционную смесь затем охлаждали до комнатной температуры и осуществляли взаимодействие с комплексом [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II)•дихлорметан (0,070 г, 0,086 ммоль), карбонатом калия (0,101 г, 0,733 ммоль) и 6-(5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-оном (0,091 г, 0,244 ммоль) в диметилформамиде (2,445 мл). Реакционную смесь нагревали до 90°C в течение ночи. ЖХ/МС анализ показал более чем 50% конверсию в желаемый M+1, с примесью восстановленного исходного вещества 6-([1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-она. Реакцию гасили водой и неочищенное вещество экстрагировали этилацетатом. Органические экстракты сушили над сульфатом натрия и после выпаривания растворителя остаток очищали хроматографией на колонке biotage с силикагелем (50-100% этилацетата в гексане). Фракции, содержащие желаемый M+1, объединяли и упаривали досуха. Получали светло-желтое масло. MS (ESI) m/z 448,6 [M+1]+.
E. 3,3-Диметил-6-(5-((4-оксоциклогексил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он. Раствор 6-(5-(1,4-диоксаспиро[4,5]декан-8-илметил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-она (0,081 г, 0,181 ммоль) с примесью 6-([1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-она в безводном тетрагидрофуране (1,810 мл) обрабатывали при помощи 6,0 н водного раствора хлористоводородной кислоты (0,5 мл, 3,00 ммоль) и нагревали до 50°C в течение 1 часа. Через 2 часа конверсия, которую отслеживали при помощи ЖХ/МС, не развивалась, поэтому использовали дополнительное количество кислоты: добавляли 0,5 мл 6,0 н раствора хлористоводородной кислоты и температуру повышали до температуры кипения с обратным холодильником и поддерживали в течение ночи. Хотя удаление защиты все еще было неполным, реакционную смесь подвергали завершающей обработке. Смесь нейтрализовали водным раствором гидроксида натрия и экстрагировали этилацетатом. Остаток сушили над сульфатом натрия и упаривали досуха. Неочищенное вещество очищали хроматографией на колонке biotage с силикагелем (0-100% этилацетата в гексане). 3,3-Диметил-6-(5-((4-оксоциклогексил)метил)-[,1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он (0,048 г, 0,119 ммоль, 65,7% выход) с примесью 6-([1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-она выделяли в виде бесцветного твердого вещества, которое использовали без дополнительной очистки. MS (ESI) m/z 404,4 [M+1]+.
F. транс-6-(5-((4-гидрокси-4-метилциклогексил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он и цис-6-(5-((4-гидрокси-4-метилциклогексил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он. 3,3-Диметил-6-(5-((4-оксоциклогексил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он (0,052 г, 0,129 ммоль) растворяли в безводном тетрагидрофуране (1,289 мл) и обрабатывали при помощи 3,0 M коммерческого раствора метилмагнийбромида в диэтиловом эфире (0,133 мл, 0,400 ммоль) при комнатной температуре. Реакционная смесь сразу становилась ярко-желтой, и образовывалось твердое вещество. Реакцию отслеживали при помощи ЖХ/МС, и анализ показал неполную конверсию через 1 час. Использовали дополнительное количество 0,03 мл раствора метилмагнийбромида при комнатной температуре. Реакцию гасили через 3 часа путем медленного добавления воды и неочищенное вещество экстрагировали в этилацетат. Экстракты сушили над сульфатом натрия и упаривали досуха. Бесцветный твердый остаток очищали при помощи полу-препаративной ВЭЖХ (20-100% ацетонитрила + 0,1% трифторуксусной кислоты + 0,1% трифторуксусной кислоты в воде, 1 впрыск, 30 мин). 2 диастереомера разделяли. Соответствующие фракции, содержащие желаемый M+1, объединяли отдельно, ацетонитрил удаляли при пониженном давлении и pH нейтрализовали путем добавления 1,75 M водного раствора карбоната калия. Стереохимию определяли на основании химических сдвигов. транс-6-(5-((4-Гидрокси-4-метилциклогексил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он (0,006 г, 0,014 ммоль, 11,10% выход) выделяли в виде белого твердого вещества: 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,31 (с, 1H), 9,61 (с, 1H), 7,46-7,55 (м, 1H), 7,37-7,45 (м, 2H), 7,28 (д, J=7,81 Гц, 1H), 7,13 (д, J=8,59 Гц, 1H), 6,87 (д, J=7,03 Гц, 1H), 4,21 (с, 1H), 3,01 (д, J=6,64 Гц, 2H), 2,01 (шир.с, 1H), 1,49-1,65 (м, 4H), 1,27-1,39 (м, 2H), 1,16-1,26 (м, 8H), 1,12 (с, 3H); MS (ESI) m/z 420 [M+1]+. цис-6-(5-((4-гидрокси-4-метилциклогексил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он (0,006 г, 0,014 ммоль, 11,10% выход): 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,30 (с, 1H), 9,61 (с, 1H), 7,45-7,55 (м, 1H), 7,36-7,45 (м, 2H), 7,28 (д, J=6,64 Гц, 1H), 7,13 (д, J=8,20 Гц, 1H), 6,88 (д, J=6,25 Гц, 1H), 3,96 (с, 1H), 2,98 (д, J=6,25 Гц, 2H), 1,92 (шир.с, 1H), 1,41-1,59 (м, 4H), 1,30-1,40 (м, 2H), 1,22 (с, 8H), 1,06 (с, 3H); MS (ESI) m/z 420 [M+1]+.
Пример 123: 4-((2-(3-Метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиридин-2(1Н)-он
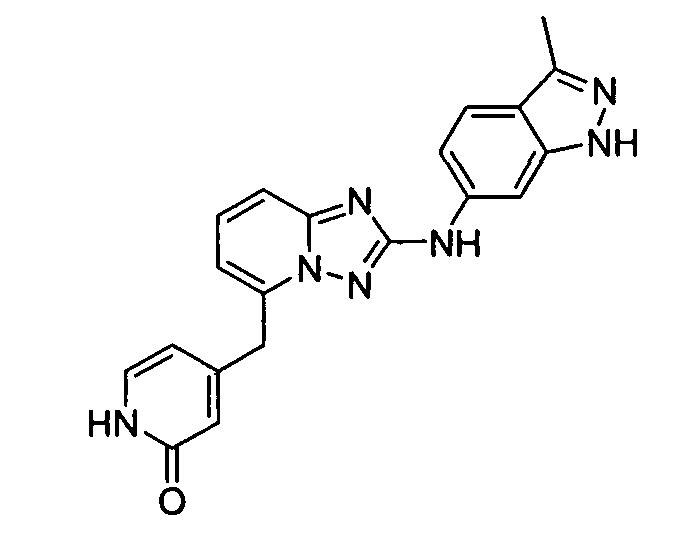
A. N-(3-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол-6-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К раствору/суспензии [1,2,4]триазоло[1,5-α]пиридин-2-амина (500 мг, 3,73 ммоль) в диоксане (4 мл) и воде (4,00 мкл) добавляли трет-бутоксид натрия (853 мг, 8,87 ммоль), 6-бром-3-метил-1-(тетрагидро-2H-пиран-2-ил)-1Н-индазол (1048 мг, 3,55 ммоль), трис(дибензилиденацетон)дипалладий (81 мг, 0,089 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (103 мг, 0,177 ммоль). Реакционную смесь барботировали азотом и реакционную смесь перемешивали в течение ночи при 100°C. К реакционной смеси добавляли воду и продукт экстрагировали при помощи 10% раствора метанола в дихлорметане, затем промывали насыщенным солевым раствором. Неочищенный продукт очищали на biotage, элюируя при помощи 0-20% метанола в дихлорметане, с получением N-(3-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол-6-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (800 мг, 2,296 ммоль, 64,7% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,82 (с, 1H), 8,81 (д, J=6,64 Гц, 1H), 8,14 (д, J=1,56 Гц, 1H), 7,47-7,72 (м, 3H), 7,34 (дд, J=1,95, 8,59 Гц, 1H), 6,94-7,15 (м, 1H), 5,60 (дд, J=2,54, 9,96 Гц, 1H), 3,94 (д, J=12,49 Гц, 2H), 3,71 (ддд, J=6,05, 7,81, 11,52 Гц, 2H), 2,42 (с, 3H), 2,06 (д, J=13,28 Гц, 1H), 1,95 (дд, J=2,73, 13,28 Гц, 1H), 1,78 (шир.с, 1H), 1,50-1,67 (м, 2H).
B. (2-Метоксипиридин-4-ил)(2-(3-метил-1-(тетрагидро-2Н-пиран-2-ил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанон. Раствор/суспензию N-(3-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол-6-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (600 мг, 1,722 ммоль) в тетрагидрофуране (15 мл) охлаждали до -78°C и добавляли по каплям н-бутиллитий (1,292 мл, 2,067 ммоль). Реакционная смесь становилась темно-красной. Реакционную смесь перемешивали в течение 15 минут, затем добавляли по каплям раствор N,2-диметокси-N-метилизоникотинамида (405 мг, 2,067 ммоль) в тетрагидрофуране (2 мл). Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 2 часов. ЖХ/МС анализ показал продукт. Реакцию гасили водой, затем добавляли 1н HCl (2 мл). Цвет реакционной смеси менялся. Продукт экстрагировали этилацетатом два раза, затем его промывали насыщенным солевым раствором. Неочищенный продукт очищали при помощи колоночной хроматографии (элюируя при помощи 12-100% этилацетата в гексане в Biotage) с получением (2-метоксипиридин-4-ил)(2-(3-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанона (670 мг, 1,386 ммоль, 80% выход). MS (ESI): m/z 484,4 [M+1]+.
C. (2-Метоксипиридин-4-ил)(2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанон. К раствору/суспензии (2-метоксипиридин-4-ил)(2-(3-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанона (670 мг, 1,386 ммоль) в диоксане добавляли хлористый водород (2 мл, 4 M в диоксане). Реакционную смесь перемешивали при 45°C в течение 2 часов. Растворитель затем удаляли в вакууме и это неочищенное вещество использовали на следующей стадии без дополнительной очистки. MS (ESI): m/z 400,4 [M+1]+.
D. 4-((2-(3-метил-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиридин-2(1Н)-он. К раствору/суспензии (2-метоксипиридин-4-ил)(2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метанона (400 мг, 0,847 ммоль), в 50-мл сосуде высокого давления, добавляли гидразингидрат (1,232 мл, 25,4 ммоль) и гидроксид калия (1188 мг, 21,17 ммоль) с последующим добавлением этиленгликоля (10 мл). Реакционную смесь нагревали до 190°C и оставляли для перемешивания в течение ночи, затем контролировали при помощи ЖХ/МС. Когда реакция завершалась, к неочищенной смеси добавляли воду и продукт экстрагировали этилацетатом три раза. Органические слои промывали насыщенным солевым раствором и сушили над сульфатом натрия. Неочищенное вещество очищали при помощи полу-препаративной ВЭЖХ (20-100% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 20 мин). Фракции, содержащие продукт, загружали на колонку strata-X для удаления трифторуксусной кислоты, затем метанол выпаривали в вакууме. 4-((2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиридин-2-ол (15 мг, 0,040 ммоль, 4,77% выход) получали в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 12,38 (с, 1H), 11,70 (шир.с, 1H), 9,76 (с, 1H), 8,07 (д, J=1,17 Гц, 1H), 7,56-7,65 (м, 1H), 7,49-7,55 (м, 2H), 7,34 (д, J=6,64 Гц, 1H), 7,08 (тд, J=1,56, 7,81 Гц, 2H), 6,53 (д, J=0,78 Гц, 1H), 6,19 (дд, J=1,56, 6,64 Гц, 1H), 4,31 (с, 2H), 2,43 (с, 3H); MS (ESI): m/z 371,7 [M+1]+.
Пример 124: 6-(5-(3-Гидрокси-3-метилазетидин-1-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он
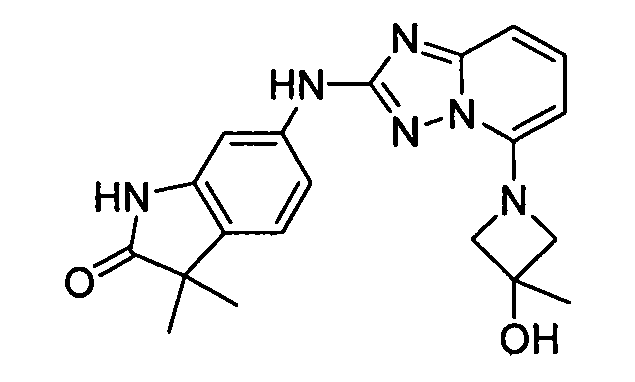
A. 1-(2-Бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-3-метилазетидин-3-ол. 2,5-Дибром-[1,2,4]триазоло[1,5-α]пиридин (0,500 г, 1,806 ммоль), гидрохлорид 3-метилазетидин-3-ола (0,446 г, 3,61 ммоль), карбонат калия (0,749 г, 5,42 ммоль) и диметилсульфоксид (2,86 мл) добавляли в микроволновой реакционный сосуд и нагревали до 100°C в течение 16 часов. Реакционную смесь экстрагировали водой и этилацетатом. Органический слой сушили над сульфатом магния, фильтровали и сушили. Остаток очищали при помощи хроматографии на силикагеле (0-100% этилацетата в гексане) в течение 1,2 л. Желаемые фракции концентрировали и затем растирали в порошок в гексане с получением 1-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-3-метилазетидин-3-ола (298,8 мг, 1,055 ммоль, 58,4% выход) в виде белого твердого вещества. MS (ESI) m/z 283,1 [M]+, 285,1 [M+2]+.
B. 6-(5-(3-Гидрокси-3-метилазетидин-1-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он. Смесь трис(дибензилиденацетон)дипалладия(0) (133,0 мг, 0,145 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (168,0 мг, 0,290 ммоль) в 1,4-диоксане (1,5 мл) быстро нагревали при помощи аппарата для нагревания струей теплого воздуха, пока смесь не становилась очень горячей, и затем добавляли трет-бутил 6-амино-3,3-диметил-2-оксоиндолин-1-карбоксилат (200,0 мг, 0,724 ммоль), 1-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-3-метилазетидин-3-ол (205,0 мг, 0,724 ммоль) и тонко измельченный карбонат калия (410,0 мг, 2,97 ммоль) в герметично закрываемом сосуде со стержневой мешалкой. Сосуд продували азотом. Полученную смесь герметично закрывали, интенсивно перемешивали и нагревали до 110°C в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли горячим диметилсульфоксидом и фильтровали через фильтровальный шприц. Фильтровальную лепешку промывали горячим диметилсульфоксидом. Фильтрат разбавляли метанолом и очищали с использованием обращенно-фазовой препаративной ВЭЖХ (10-70% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 мин). Фракции, содержащие желаемый продукт, объединяли и органические летучие вещества удаляли при пониженном давлении. Добавляли этилацетат и насыщенный раствор бикарбоната натрия и продукт экстрагировали. Органический слой сушили над сульфатом магния. Органические летучие вещества удаляли при пониженном давлении. Остаток обрабатывали 4M раствором хлористоводородной кислоты в диоксане (1,0 мл) и диоксаном (2,0 мл) и раствор нагревали до 60°C в течение 1 часа. Органические летучие вещества удаляли при пониженном давлении. Остаток растирали в порошок в гексане, обрабатывали ультразвуком, фильтровали и сушили в вакууме с получением 6-(5-(3-гидрокси-3-метилазетидин-1-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-она в виде гидрохлоридной соли (1,12 мг, 2,70 мкМ, 0,373% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,43 (с, 1H), 9,44 (с, 1H), 7,39 (т, J=8,2 Гц, 1H), 7,34 (д, J=2,0 Гц, 1H), 7,19-7,23 (м, 1H), 7,13-7,16 (м, 1H), 6,80 (д, J=7,8 Гц, 1H), 5,93 (д, J=7,0 Гц, 1H), 4,25 (д, J=8,6 Гц, 2H), 4,11 (д, J=7,8 Гц, 2H), 1,54 (с, 3H), 1,22 (с, 6H). MS (ESI) m/z 379,3 [M+1]+.
Пример 125: (R)-3,3-Диметил-6-(5-(метил(тетрагидрофуран-3-ил)амино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он
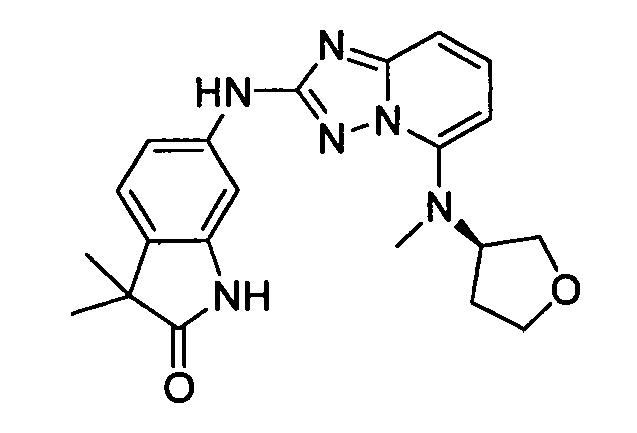
A. (R)-2-Бром-N-(тетрагидрофуран-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-5-амин. 2,5-Дибром-[1,2,4]триазоло[1,5-α]пиридин (1,5 г, 5,42 ммоль), гидрохлорид ((R)-тетрагидрофуран-3-амина (0,669 г, 5,42 ммоль), карбонат калия (2,246 г, 16,25 ммоль) и диметилсульфоксид (8,57 мл) нагревали в микроволновом сосуде при 100°C в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры и экстрагировали водой и этилацетатом. Органический слой затем промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и сушили в вакууме. Остаток обрабатывали этилацетатом (4 мл) и дихлорметаном (4 мл) и очищали с использованием хроматографии на силикагеле (5-100% этилацетата в гексане) более 1,2 л. Желаемые фракции объединяли и органические летучие вещества удаляли при пониженном давлении. Остаток растирали в порошок в 10% этилацетата в гексане, фильтровали, промывали гексаном и сушили в вакууме с получением (R)-2-бром-N-(тетрагидрофуран-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-5-амина (602,0 мг, 2,126 ммоль, 39,3% выход) в виде белого твердого вещества. MS (ESI) m/z 283,1 [M]+, 285,1 [M+2]+.
B. (R)-2-Бром-N-метил-N-(тетрагидрофуран-3-ил)-[1,2,4]триазоло[1,5-a]пиридин-5-амин. (R)-2-Бром-N-(тетрагидрофуран-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-5-амин (500,0 мг, 1,766 ммоль) суспендировали в 1,2-диметоксиэтане (8,83 мл) и охлаждали до 0°C. Реакционную смесь продували азотом с последующим добавлением гидрида натрия (89,0 мг, 3,53 ммоль, 95%). Смесь оставляли для перемешивания в течение 10 минут. Добавляли по каплям иодметан (330,0 мкл, 5,30 ммоль) и реакционной смеси давали нагреться до комнатной температуры при перемешивании в течение 16 часов. К реакционной смеси добавляли этилацетат и оставляли для перемешивания в течение 1 минуты с последующим экстрагированием этилацетатом и водой. Органические слои промывали насыщенным солевым раствором и сушили при помощи сульфата магния. Органические летучие вещества удаляли при пониженном давлении и очищали с использованием хроматографии на силикагеле на Emrys Biotage SP1 (10-100% этилацетата в гексане) более 1,2 л. Желаемые фракции объединяли и органические летучие вещества удаляли при пониженном давлении с получением (R)-2-бром-N-метил-N-(тетрагидрофуран-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-5-амина (373,8 мг, 1,258 ммоль, 71,2% выход). MS (ESI) m/z 297,1 [M]+, 299,1 [M+2]+.
C. (R)-3,3-Диметил-6-(5-(метил(тетрагидрофуран-3-ил)амино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он. Смесь трис(дибензилиденацетон)дипалладия(0) (230,0 мг, 0,251 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (291,0 мг, 0,502 ммоль) в 1,4-диоксане (1,5 мл) быстро нагревали при помощи аппарата для нагревания струей теплого воздуха, пока смесь не становилась очень горячей, и затем добавляли к трет-бутил 6-амино-3,3-диметил-2-оксоиндолин-1-карбоксилату (347,0 мг, 1,255 ммоль), ((R)-бром-N-метил-N-(тетрагидрофуран-3-ил)-[1,2,4]триазоло[1,5-α]пиридин-5-амину (373,0 мг, 1,255 ммоль) и карбонату цезия (1227,0 мг, 3,77 ммоль) в герметично закрываемом сосуде со стержневой мешалкой. Сосуд продували азотом. Полученную смесь герметично закрывали, интенсивно перемешивали и нагревали при 80°C в течение 16 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом и экстрагировали с использованием этилацетата и воды, затем насыщенного солевого раствора и сушили на сульфате магния. Органические летучие вещества удаляли при пониженном давлении и остаток растворяли в минимальном количестве этилацетата и очищали с использованием хроматографии на силикагеле (0-100% этилацетата в гексане) более 1,2 л. Желаемые фракции объединяли и органические летучие вещества удаляли при пониженном давлении. Остаток обрабатывали диоксаном (4,0 мл) и 4н раствором HCl в диоксане (1,0 мл) и нагревали до 70°C в течение 6 часов. Органические летучие вещества удаляли при пониженном давлении. Твердые вещества брали для поглощения в гексан, фильтровали, промывали гексаном и сушили в вакууме с получением (R)-3,3-диметил-6-(5-(метил(тетрагидрофуран-3-ил)амино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)индолин-2-она в виде гидрохлоридной соли (222,2 мг, 0,518 ммоль, 41,3% выход, эи 100%). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,34 (с, 1H), 9,58 (с, 1H), 7,49 (дд, J=8,6, 7,8 Гц, 1H), 7,37 (д, J=2,0 Гц, 1H), 7,26 (дд, J=8,0, 2,1 Гц, 1H), 7,15 (д, J=8,2 Гц, 1H), 7,10 (дд, J=8,6, 1,2 Гц, 1H), 6,46 (дд, J=7,6, 1,0 Гц, 1H), 4,89-4,97 (м, 1H), 3,99 (тд, J=8,5, 4,9 Гц, 1H), 3,86-3,92 (м, 1H), 3,80-3,86 (м, 1H), 3,61-3,68 (м, 1H), 2,96 (с, 3H), 2,15-2,25 (м, 1H), 1,98-2,08 (м, 1H), 1,23 (с, 6H). MS (ESI) m/z 393,2 [M+1]+.
Пример 126: 6-(5-(Дифтор(тетрагидро-2Н-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он
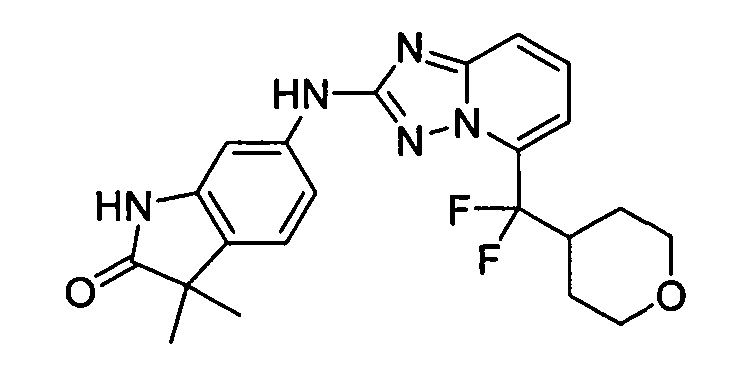
A. 2-Бром-5-(дифтор(тетрагидро-2Н-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин. Трифторид (диэтиламино)серы (0,845 мл, 6,45 ммоль) добавляли к перемешиваемому раствору (2-бром-[1,2,4]триазоло[1,5-a]пиридин-5-ил)(тетрагидро-2H-пиран-4-ил)метанона (0,400 г, 1,290 ммоль) в хлороформе (5 мл) в герметично закрываемом сосуде. Осуществляли продувку азотом для выдувания воздуха. Реакционную смесь герметично закрывали и нагревали при 50°C в течение 4 часов и затем при 40°C в течение 12 часов. Полученную смесь выливали на ацетонитрил (20 мл) при перемешивании и затем разбавляли метанолом (10 мл). Полученный желтый раствор концентрировали на роторном испарителе и затем очищали с использованием флэш-хроматографии (Biotage) (5-50% этилацетата в гексане) с получением 2-бром-5-(дифтор(тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридина (0,317 г, 0,954 ммоль, 74% выход) в виде светло-желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,04 (д, J=8,98 Гц, 1H), 7,85 (дд, J=7,42, 8,98 Гц, 1H), 7,51 (дд, J=1,17, 7,42 Гц, 1H), 3,82-3,92 (м, 2H), 3,28 (тд, J=3,71, 11,03 Гц, 2H), 3,06-3,24 (м, 1H), 1,42-1,58 (м, 4H); 19F ЯМР (376 МГц, ДМСО-d6) δ (м.д.) -109,11 (д, J=14,93 Гц, 2F); MS (ESI) m/z 332,2 [M]+, 334,2 [M+2]+.
B. трет-Бутил 6-(5-(дифтор(тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметил-2-оксоиндолин-1-карбоксилат. Смесь трис(дибензилиденацетон)дипалладия(0) (0,085 г, 0,093 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,108 г, 0,187 ммоль) в 1,4-диоксане (1,5 мл) быстро нагревали при помощи аппарата для нагревания струей теплого воздуха, пока смесь не становилась очень горячей, и затем добавляли к трет-бутил 6-амино-3,3-диметил-2-оксоиндолин-1-карбоксилату (0,284 г, 1,027 ммоль), 2-бром-5-(дифтор(тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридину (0,310 г, 0,933 ммоль), тонко измельченному карбонату калия (0,529 г, 3,83 ммоль) и 1,4-диоксану (2 мл) в герметично закрываемом сосуде со стержневой мешалкой. Осуществляли продувку азотом для выдувания воздуха. Полученную смесь герметично закрывали, интенсивно перемешивали и нагревали при 100°C в течение 2,5 часов. После охлаждения до комнатной температуры полученную смесь разбавляли водой и этилацетатом, фильтровали через Целит и фильтровальную лепешку тщательно промывали этилацетатом. Слои фильтрата разделяли в делительной воронке. Органические слои промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе. Осуществляли поглощение остатка в дихлорметан и очищали с использованием флэш-хроматографии (Biotage) (20-80% этилацетата в гексане) с получением трет-бутил 6-(5-(дифтор(тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметил-2-оксоиндолин-1-карбоксилата (0,423 г, 0,802 ммоль, 86% выход) в виде желтого пенистого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,97 (с, 1H), 8,22 (д, J=1,56 Гц, 1H), 7,72-7,77 (м, 1H), 7,68 (дд, J=7,03, 8,59 Гц, 1H), 7,50 (дд, J=1,95, 8,20 Гц, 1H), 7,32 (д, J=8,20 Гц, 1H), 7,29 (дд, J=1,17, 7,03 Гц, 1H), 3,85-3,95 (м, 2H), 3,36-3,54 (м, 1H), 3,27 (тд, J=2,34, 11,32 Гц, 2H), 1,62 (с, 9H), 1,44-1,58 (м, 4H), 1,32 (с, 6H); 19F ЯМР (376 МГц, ДМСО-d6) δ (м.д.) -109,47 (с, 2F); MS (ESI) m/z 528,4 [M+1]+.
C. 6-(5-(дифтор(тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он. Перемешиваемый раствор трет-бутил 6-(5-(дифтор(тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметил-2-оксоиндолин-1-карбоксилата (0,416 г, 0,789 ммоль) в уксусной кислоте (7 мл) нагревали при 110°C в условиях кипячения с обратным холодильником в атмосфере азота в течение 4,5 часов. Полученный желтый раствор загружали на Strata X-C ионообменную колонку от компании Phenomenex. Колонку промывали последовательно водой, ацетонитрилом, метанолом и затем смесью 5% гидроксида аммония, 45% метанола и 50% дихлорметана. Продукт выделяли вместе с элюентом гидроксидом аммония и концентрировали на роторном испарителе и сушили в условиях высокого вакуума при 45°C с получением 6-(5-(дифтор(тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-она (0,141 г, 0,330 ммоль, 42% выход) в виде слегка желтоватого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 10,35 (с, 1H), 9,81 (с, 1H), 7,76 (д, J=8,20 Гц, 1H), 7,67 (дд, J=7,22, 8,79 Гц, 1H), 7,34 (д, J=1,95 Гц, 1H), 7,24-7,32 (м, 2H), 7,17 (д, J=7,81 Гц, 1H), 3,86-3,96 (м, 2H), 3,36-3,51 (м, 1H), 3,27 (тд, J=2,54, 11,42 Гц, 2H), 1,42-1,62 (м, 4H), 1,23 (с, 6H); 19F ЯМР (376 МГц, ДМСО-d6) δ (м.д.) -109,47 (д, J=14,93 Гц, 2F); MS (ESI) m/z 428,3 [M+1]+.
Пример 127: 4-((2-(3-(Метоксиметил)-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он
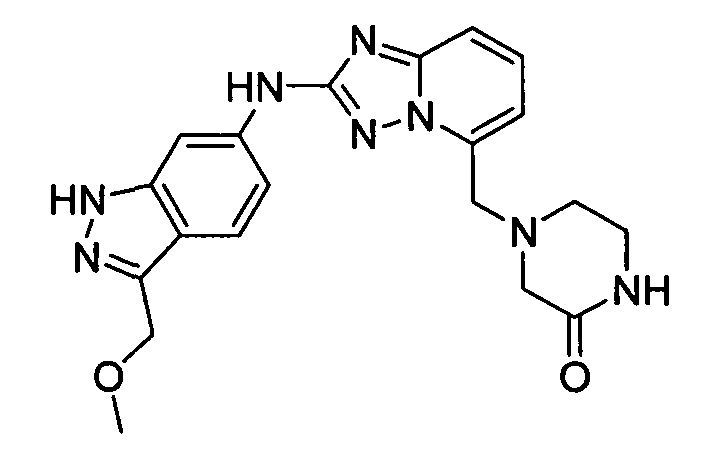
A. 4-((2-(3-(Метоксиметил)-1-((2-(триметилсилил)этокси)метил)-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он. Смесь трис(дибензилиденацетон)дипалладия(0) (0,074 г, 0,081 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,094 г, 0,163 ммоль) в 1,4-диоксане (1,5 мл) быстро нагревали при помощи аппарата для нагревания струей теплого воздуха, пока смесь не становилась очень горячей, и затем добавляли к 3-(метоксиметил)-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-амину (0,250г, 0,813 ммоль), 4-((2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-ону (0,252 г, 0,813 ммоль), тонко измельченному карбонату калия (0,461 г, 3,33 ммоль) и 1,4-диоксану (2 мл) в герметично закрываемом сосуде со стержневой мешалкой. Осуществляли продувку азотом для выдувания воздуха. Полученную смесь герметично закрывали, интенсивно перемешивали и нагревали при 100°C в течение 5,5 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли 20% раствором метанола в дихлорметане при интенсивном перемешивании. Полученную смесь фильтровали через Целит и фильтровальную лепешку промывали 20% раствором метанола в дихлорметане. Фильтрат концентрировали на роторном испарителе, растворяли в ДМСО и метаноле, фильтровали и очищали с использованием обращенно-фазовой препаративной ВЭЖХ (15-70% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 мин). Фракции, содержащие желаемый продукт, загружали на Strata X-C ионообменную колонку от компании Phenomenex. Колонку промывали последовательно водой, ацетонитрилом, метанолом и затем 5% раствором гидроксида аммония в метаноле. Продукт выделяли вместе с элюентом 5% гидроксида аммония в метаноле, концентрировали на роторном испарителе и сушили в условиях высокого вакуума при 45°C с получением 4-((2-(3-(метоксиметил)-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-она (0,133 г при 90% чистоте, 0,223 ммоль, 27% выход) в виде желтого твердого вещества.
B. 4-((2-(3-(Метоксиметил)-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-он. 6 M HCl в воде (0,410 мл, 2,459 ммоль) добавляли к перемешиваемой смеси 4-((2-(3-(метоксиметил)-1-((2-(триметилсилил)этокси)метил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)метил)пиперазин-2-она (0,132 г, 0,246 ммоль) в этаноле (5 мл) при 60°C. Полученную смесь интенсивно перемешивали и нагревали при 60°C в условиях кипячения с обратным холодильником в атмосфере азота в течение 12 часов. Растворитель удаляли на роторном испарителе. Остаток растворяли в горячем ДМСО, разбавляли метанолом, фильтровали и очищали с использованием обращенно-фазовой полу-препаративной ВЭЖХ (5-30% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 30 мин). Фракции, содержащие желаемый продукт, загружали на Strata X-C ионообменную колонку от компании Phenomenex. Колонку промывали последовательно водой, ацетонитрилом, метанолом и затем 5% раствором гидроксида аммония в метаноле. Продукт выделяли вместе с элюентом 5% гидроксида аммония в метаноле и концентрировали на роторном испарителе и сушили в условиях высокого вакуума при 45°C с получением желаемого продукта (0,012 г, 0,030 ммоль, 12% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 12,67 (с, 1H), 9,86 (с, 1H), 8,19 (д, J=1,17 Гц, 1H), 7,86 (с, 1H), 7,51-7,65 (м, 3H), 7,24 (дд, J=1,76, 8,79 Гц, 1H), 7,11 (д, J=7,03 Гц, 1H), 4,66 (с, 2H), 4,11 (с, 2H), 3,29 (с, 3H), 3,17-3,27 (м, 4H), 2,80 (т, J=5,27 Гц, 2H); MS (ESI) m/z 407,5 [M+1]+.
Пример 128: (R)-3,3-диметил-6-(5-((тетрагидрофуран-3-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он и (S)-3,3-диметил-6-(5-((тетрагидрофуран-3-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он
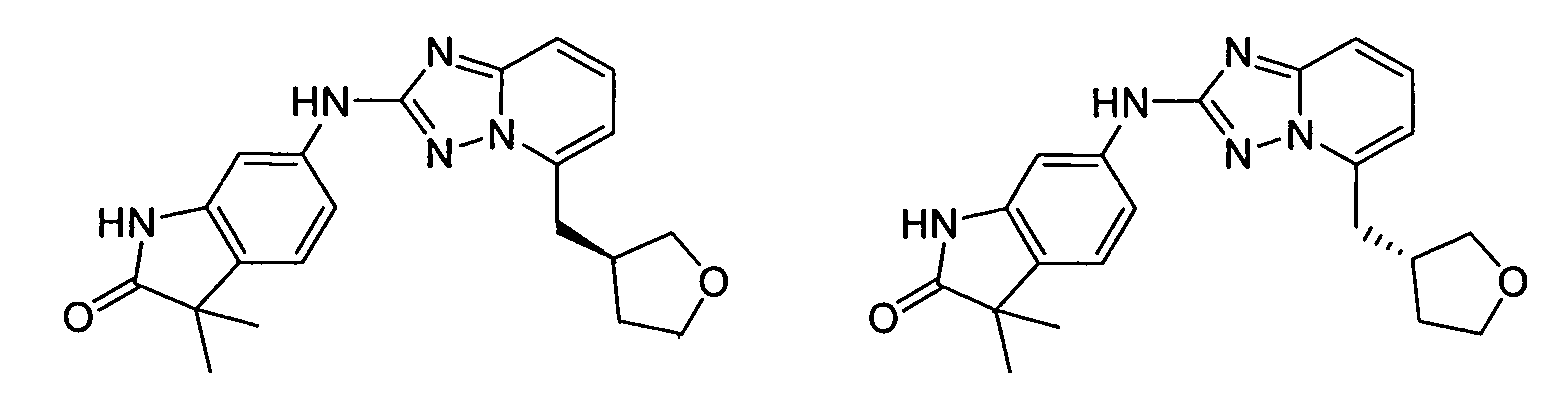
A. N-(6-(Тетрагидрофуран-3-карбонил)пиридин-2-ил)пиваламид. Раствор N-(6-бромпиридин-2-ил)пиваламида (5,0 г, 19,5 моль) в толуоле охлаждали до 3-5°C и добавляли по каплям раствор изопропилмагнийхлорида в тетрагидрофуране (24,4 мл, 2 M) в течение 1 часа, поддерживая при этом температуру ниже 5°C. После перемешивания полученной смеси при 5°C в течение 12 часов, добавляли безводный N-метокси-N-метилтетрагидрофуран-3-карбоксамид (4,65 г, 29,3 моль) в течение 20 минут при 10-15°C и смесь перемешивали в течение 30 минут при этой температуре. Реакцию гасили водой и полученную смесь экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, концентрировали и очищали на колонке с силикагелем (элюируя при помощи 5-50% этилацетата в петролейном эфире) с получением N-(6-(тетрагидрофуран-3-карбонил)пиридин-2-ил)пиваламида (4,8 г, 89% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,46 (д, J=7,8 Гц, 1H), 8,00 (шир.с, 1H), 7,87 (м, 2H), 4,45 (м, 1H), 4,22 (т, J=7,8 Гц, 1H), 3,94 (м, 3H), 2,33 (м, 1H), 2,16 (м, 1H), 1,36 (с, 9H).
B. N-(6-(Гидрокси(тетрагидрофуран-3-ил)метил)пиридин-2-ил)пиваламид. К раствору N-(6-(тетрагидрофуран-3-карбонил)пиридин-2-ил)пиваламида (4,7 г, 17,0 ммоль) в этаноле (30 мл) добавляли борогидрид натрия (1,30 г, 34,0 ммоль) по порциям при комнатной температуре. Когда исходное вещество было израсходовано, реакцию гасили водой и концентрировали. Остаток промывали водой и сушили с получением N-(6-(гидрокси(тетрагидрофуран-3-ил)метил)пиридин-2-ил)пиваламида (4,0 г, 85% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,16 (дд, J1=2,0 Гц, J2=8,4 Гц, 1H), 8,02 (шир.с, 1H), 7,71 (т, J=8,0 Гц, 1H), 7,00 (д, J=7,6 Гц, 1H), 4,59 (м, 1H), 4,12-3,68 (м, 6H), 2,63 (м, 1H), 1,32 (с, 9H).
C. N-(6-((Тетрагидрофуран-3-ил)метил)пиридин-1-ил)пиваламид. К раствору N-(6-(гидрокси(тетрагидрофуран-3-ил)метил)пиридин-2-ил)пиваламида (3,95 г, 14,2 ммоль) и триэтиламина (1,44 г, 14,2 ммоль) в дихлорметане (15 мл) добавляли метансульфонилхлорид (1,62 г, 14,2 ммоль) при 0°C и полученный раствор перемешивали при 0°C в течение 30 минут. Реакционную смесь упаривали при пониженном давлении и остаток растворяли в уксусной кислоте (5 мл). Добавляли цинковую пыль (4,62 г, 71 ммоль) и смесь перемешивали при 40°C в течение ночи в атмосфере азота. Реакционную смесь концентрировали, разбавляли этилацетатом (50 мл) и водой (10 мл) и нейтрализовали до pH=9 водным раствором гидроксида натрия (5н). Органический слой отделяли и водный слой экстрагировали этилацетатом (10 мл ×3). Объединенный органический слой сушили, концентрировали и очищали на колонке с силикагелем (элюируя при помощи 10-50% этилацетата в петролейном эфире) с получением N-(6-((тетрагидрофуран-3-ил)метил)пиридин-2-ил)пиваламида (2,8 г, 75% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,08 (д, J=8,1 Гц, 1H), 7,95 (шир.с, 1H), 7,62 (т, J=8,1 Гц, 1H), 6,87 (д, J=7,5 Гц, 1H), 3,91 (м, 3H), 3,50 (м, 1H), 2,76 (м, 3H), 2,03 (м, 1H), 1,66 (м, 1H), 1,32 (с, 9H).
D. 6-((Тетрагидрофуран-3-ил)метил)пиридин-2-амин. Смесь N-(6-((тетрагидрофуран-3-ил)метил)пиридин-2-ил)пиваламида (2,8 г, 10,7 ммоль) и гидроксида калия в водном растворе (10 мл, 2 M) перемешивали при 100°C в течение 12 часов. Реакционную смесь экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, концентрировали при пониженном давлении и очищали при помощи колоночной хроматографии на силикагеле (элюируя при помощи 50% этилацетата в петролейном эфире) с получением 6-((тетрагидрофуран-3-ил)метил)пиридин-2-амина (1,5 г, 78% выход). 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,08 (т, J=8,0 Гц, 1H), 6,48 (д, J=8,0 Гц, 1H), 6,33 (д, J=8,0 Гц, 1H), 4,42 (шир.с, 2H), 3,91 (м, 2H), 3,77 (м, 1H), 3,47 (м, 1H), 2,67 (м, 3H), 2,04 (м, 1H), 1,66 (с, 1H).
E. 5-((Тетрагидрофуран-3-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. Раствор 6-((тетрагидрофуран-3-ил)метил)пиридин-2-амина (1,5 г, 8,4 ммоль) и О-этилкарбонизотиоцианатидата (1,1 г, 8,4 ммоль) в диоксане (20 мл) перемешивали при комнатной температуре в течение 5 часов. Когда исходное вещество было израсходовано, смесь концентрировали в вакууме. Остаток растворяли в смеси метанола (15 мл) и этанола (15 мл). Добавляли смешанный раствор раствора гидрохлорида гидроксиламина (2,9 г, 42 ммоль) и N,N-этилдиизопропиламина (3,26 г, 25,3 ммоль) в смеси этанола и метанола (об/об, 1:1, 20 мл) и смесь перемешивали при комнатной температуре в течение 2 часов и при 70°C в течение ночи. Летучие вещества удаляли при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 50% этилацетата в петролейном эфире) с получением 5-((тетрагидрофуран-3-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (1,7 г, 93% выход) в виде твердого вещества. 1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ (м.д.) 7,34 (м, 2H), 6,64 (дд, J1=1,6 Гц, J2=6,4 Гц, 1H), 4,56 (шир.с, 2H), 3,95 (м, 1H), 3,91 (м, 1H), 3,80 (м, 1H), 3,55 (м, 1H), 3,08 (д, J=7,6 Гц, 1H), 2,96 (м, 1H), 2,08 (м, 1H), 1,69 (с, 1H).
F. 3,3-Диметил-6-(5-((тетрагидрофуран-3-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1-((2-(триметилсилил)этокси)метил)индолин-2-он. Дегазированную смесь 5-((тетрагидрофуран-3-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-амина (700 мг, 3,21 ммоль), 6-иод-3,3-диметил-1-((2-(триметилсилил)этокси)метил)индолин-2-она (1,6 г, 3,85 ммоль), трис(дибензилиденацетон)дипалладия(0) (294 мг, 0,32 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (372 мг, 0,64 ммоль) и карбоната цезия (2,09 г, 6,42 ммоль) в диоксане (20 мл) перемешивали в атмосфере азота. Смесь нагревали при 100°C в атмосфере азота в течение 1 часа, гасили путем добавления воды и экстрагировали этилацетатом (15 мл ×3). Объединенный органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали. Летучие вещества удаляли при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 50% этилацетата в петролейном эфире) с получением 3,3-диметил-6-(5-((тетрагидрофуран-3-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1-((2-(триметилсилил)этокси)метил)индолин-2-она (500 мг, 31% выход). MS (ESI): m/z 508,4 [M+1]+.
G. (R)-3,3-Диметил-6-(5-((тетрагидрофуран-3-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он и (S-3,3-диметил-6-(5-((тетрагидрофуран-3-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-он. К раствору 3,3-диметил-6-(5-((тетрагидрофуран-3-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1-((2-(триметилсилил)этокси)метил)индолин-2-она (500 мг, 0,95 ммоль) в дихлорметане (10 мл) добавляли 2,2,2-трифторуксусную кислоту (3 мл) и смесь перемешивали в течение 2 часов. Раствор концентрировали в вакууме и остаток растворяли в смеси диоксана (10 мл) и водного раствора аммиака (10 мл). Смесь перемешивали в течение 30 минут, растворитель удаляли и остаток экстрагировали этилацетатом. Растворитель удаляли и остаток очищали при помощи обращенно-фазовой препаративной ВЭЖХ (элюируя при помощи 24-54% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 13 мин) с получением 3,3-диметил-6-(5-((тетрагидрофуран-3-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)индолин-2-она (200 мг, 54% выход) в форме соли трифторуксусной кислоты. Два энантиомера разделяли при помощи хиральной сверхкритической жидкостной хроматографии (Оборудование: Berger MultiGram™ SFC, Mettler Toledo Co, Ltd; Колонка: OJ 250мм ×20мм, 5мкм; Подвижная фаза: A: Сверхкритический CO2, B: EtOH, A:B =65:35 при 40 мл/мин; Температура колонки: 38°C; Давление в насадке: 100 бар; Температура насадки: 60°C; Температура испарителя: 20°C; Температура триммера: 25°C; Длина волны: 220 нм). Первый энантиомер элюировал к 8,42 минуте (35 мг, 96,14% эи): 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,55 (м, 2H), 7,47 (с, 1H), 7,39 (д, J=8,8 Гц, 1H), 7,22 (д, J=7,6 Гц, 1H), 7,17 (д, J=8,4 Гц, 1H), 6,93 (д, J=6,8 Гц, 1H), 3,98 (м, 2H), 3,82 (м, 1H), 3,63 (м, 1H), 3,25 (м, 2H), 3,04 (м, 1H), 2,12 (м, 1H), 1,79 (м, 1H), 1,34 (м, 6H); MS (ESI): m/z 378,2 [M+1]+. Второй энантиомер элюировал к 8,90 минуте (36 мг, 100% эи): 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,57 (т, J=8,4 Гц, 2H), 7,50 (с, 1H), 7,41 (д, J=8,8 Гц, 1H), 7,24 (д, J=7,6 Гц, 1H), 7,17 (д, J=8,4 Гц, 1H), 6,93 (д, J=6,8 Гц, 1H), 3,98 (м, 2H), 3,82 (м, 1H), 3,63 (м, 1H), 3,25 (м, 2H), 3,04 (м, 1H), 2,12 (м, 1H), 1,79 (м, 1H), 1,34 (м, 6H); MS (ESI): m/z 378,2 [M+1]+.
Пример 129: цис-6-(5-(4-гидрокси-4-метилциклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он
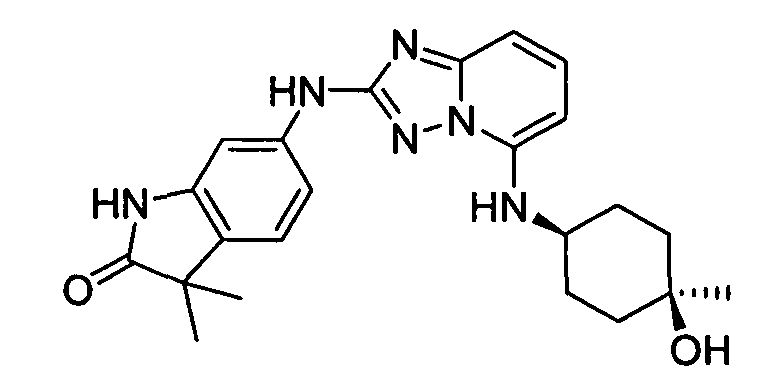
A. цис-4-(2-Бром-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)-1-метилциклогексанол. Смесь 2,5-дибром-[1,2,4]триазоло[1,5-α]пиридина (639 мг, 2,3 ммоль), цис-4-амино-1-метилциклогексанола (300 мг, 2,3 ммоль) и триэтиламина (464 мг, 4,6 ммоль) в N,N-диметилацетамиде (10 мл) перемешивали при 125°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, выливали в воду и экстрагировали этилацетатом. Органический слой концентрировали при пониженном давлении и очищали на колонке с силикагелем (элюируя при помощи 50% этилацетата в петролейном эфире) с получением цис-4-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)-1-метилциклогексанола (150 мг, 53% выход). 1H ЯМР (300 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,56 (т, J=8,1 Гц, 1H), 6,83 (т, J=8,4 Гц, 1H), 6,28 (д, J=7,5 Гц, 1H), 3,42 (м, 1H), 1,70 (м, 8H), 1,20 (с, 3H); MS (ESI): m/z 326,6 [M+1]+.
B. цис-6-(5-(4-Гидрокси-4-метилциклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он. Смесь цис-4-(2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)-1-метилциклогексанола (400 мг, 1,2 ммоль), трет-бутил 6-амино-3,3-диметил-2-оксоиндолин-1-карбоксилата (340 мг, 1,2 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (69 мг, 0,12 ммоль) и карбоната цезия (585 мг, 1,8 ммоль) в диоксане (10 мл) дегазировали, затем добавляли трис(дибензилиденацетон)дипалладий (0)(55 мг, 0,06 ммоль) в атмосфере азота и реакционную смесь перемешивали при 100°C в атмосфере азота в течение ночи. Диоксан удаляли при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 50% этилацетата в петролейном эфире) с получением цис-6-(5-(4-гидрокси-4-метилциклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-она (100 мг, 20% выход). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,47 (м, 2H), 7,16 (с, 2H), 6,71 (д, J=8,4 Гц, 1H), 6,19 (д, J=8,0 Гц, 1H), 3,51 (с, 1H), 1,99 (м, 2H), 1,82 (м, 4H), 1,63 (м, 2H), 1,28 (м, 11H); MS (ESI): m/z 421,3 [M+1]+.
Пример 130: 5-(Дифтор(тетрагидро-2H-пиран-4-ил)метил)-N-(3-метил-1Н-индазол-6-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин
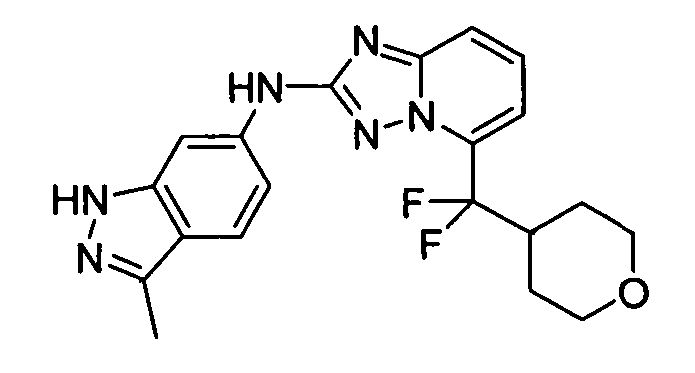
A. 2-Бром-5-(дифтор(тетрагидро-2J7-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин. Трифторид (диэтиламино)серы (4,26 мл, 32,2 ммоль) добавляли к перемешиваемому раствору (2-бром-[1,2,4]триазоло[1,5-α]пиридин-5-ил)(тетрагидро-2H-пиран-4-ил)метанона (2 г, 6,45 ммоль) в хлороформе (40 мл) в колбе высокого давления в атмосфере азота. Колбу герметично закрывали и нагревали при 50°C в течение 16 часов. Реакцию гасили метанолом (1 мл). Полученную смесь разбавляли этилацетатом (200 мл) и промывали насыщенным водным раствором бикарбоната натрия. Органические слои промывали насыщенным солевым раствором и затем сушили над сульфатом магния, фильтровали и концентрировали на роторном испарителе. Остаток очищали с использованием флэш-хроматографии (5-50% этилацетата в гексане) с получением желаемого продукта (1,7 г, 5,12 ммоль, 79% выход) в виде светло-желтого твердого вещества. MS (ESI) m/z 334,2 [M+2]+.
B. 5-(Дифтор(тетрагидро-2H-пиран-4-ил)метил)-N-(3-метил-1H-индазол-6-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-амин. К смеси трис(дибензилиденацетон)дипалладия(0) (0,082 г, 0,090 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,105 г, 0,181 ммоль) в 1,4-диоксане (10 мл) добавляли 3-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол-6-амин (0,209 г, 0,903 ммоль), 2-бром-5-(дифтор(тетрагидро-2H-пиран-4-ил)метил)-[1,2,4]триазоло[1,5-α]пиридин (0,3 г, 0,903 ммоль) и тонко измельченный карбонат калия (0,372 г, 2,69 ммоль). Полученную смесь герметично закрывали и перемешивали при 120°C в течение 3 часов. Полученную смесь разбавляли этилацетатом (20 мл) и фильтровали. Добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали досуха на роторном испарителе. Остаток растворяли в 50% растворе метанола в диметилсульфоксиде и очищали с использованием обращенно-фазовой препаративной ВЭЖХ (20-70% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 39 мин). Фракции, содержащие желаемый продукт, концентрировали на роторном испарителе и добавляли водный раствор хлористоводородной кислоты 6M (25 мл) и перемешивали в течение 5 часов. Растворитель удаляли на роторном испарителе и остаток очищали с использованием обращенно-фазовой полу-препаративной ВЭЖХ (5-40% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, в течение 39 мин). Фракции, содержащие желаемый продукт, загружали на Strata X-C ионообменную колонку от компании Phenomenex. Колонку промывали последовательно водой, ацетонитрилом, метанолом и затем горячим 10% раствором гидроксида аммония в метаноле. Продукт выделяли вместе с 10% гидроксидом аммония в метаноле и концентрировали на роторном испарителе досуха. Остаток кристаллизовали из этилацетата в гексане и сушили в условиях высокого вакуума при 40°C с получением желаемого продукта (0,165 г, 0,414 ммоль, 45,9% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 12,41 (с, 1H) 10,00 (с, 1H) 8,10 (с, 1H) 7,81 (д, J=8,59 Гц, 1H) 7,62-7,75 (м, 1H) 7,56 (д, J=8,59 Гц, 1H) 7,30 (д, J=7,42 Гц, 1H) 7,24 (дд, J=8,79, 1,76 Гц, 1H) 3,92 (д, J=10,93 Гц, 2H) 3,38-3,58 (м, 1H) 3,27 (тд, J=11,13, 3,12 Гц, 2H) 2,44 (с, 3H) 1,40-1,66 (м, 4H). MS (ESI) m/z 399,2 [M+1]+.
Пример 131: (S)-2-Метил-3-(2-(3-метил-1Н-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропан-1-ол
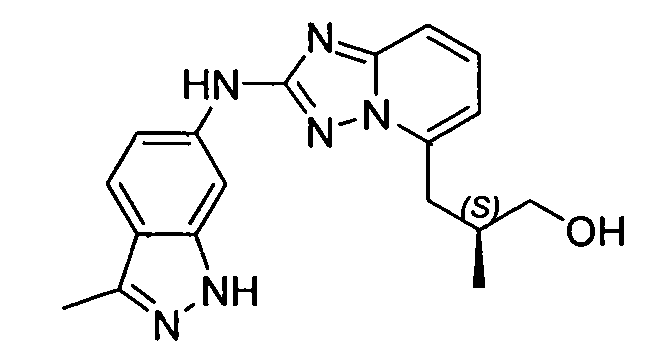
A. (S)-Метил 3-(2-(бис(трет-бутоксикарбонил)амино[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-метилпропаноат. К смеси N,N-ди-трет-бутоксикарбонил-5-бром-[1,2,4]триазоло[1,5-α]пиридин-2-амина (3,0 г, 7,26 ммоль) и тетракистрифенилфосфинпалладия (0) (2,097 г, 1,815 ммоль) в атмосфере азота добавляли при комнатной температуре безводный тетрагидрофуран (12,10 мл). Затем добавляли 0,5 M раствор бромида (R)-(3-этокси-2-метил-3-оксопропил)цинка(II) в тетрагидрофуране (43,6 мл, 21,78 ммоль) без разбавителя и реакционную смесь перемешивали при 65°C в течение 3 часов. Реакцию гасили льдом и неочищенный продукт экстрагировали этилацетатом. Большое количество солей медленно отделяли от ярко-желтых экстрактов. Экстракты сушили над сульфатом магния. Экстракты упаривали досуха. Остаток суспендировали в небольшом объеме дихлорметана, твердое вещество удаляли фильтрованием и фильтрат очищали колоночной хроматографией с нормальной фазой (5-100% этилацетата в гексане с последующим добавлением 10% метанола в этилацетате). Продукт выделяли в виде смеси моно-Boc-защищенного продукта и продукта с удаленной защитой, с примесью трифенилфосфиноксида. Желаемые фракции объединяли и упаривали до получения желтого масла, которое превращалось в пенистое вещество в условиях вакуума. (S)-Метил 3-(2-(бис(трет-бутоксикарбонил)амино[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-метилпропаноат (3,6 г, 8,29 ммоль, >95% выход) с примесью (S)-метил 3-(2-(трет-бутоксикарбониламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-метилпропаноата и трифенилфосфиноксида выделяли без дополнительной попытки удаления примесей; MS (ESI) m/z 235,2 [M+1-Boc]+.
B. (S)-Метил 3-(2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-метилпропаноат 2,2,2-трифторацетат. Суспензию смеси (S)-метил 3-(2-(бис(трет-бутоксикарбонил)амино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-метилпропаноата и (S)-метил 3-(2-(трет-бутоксикарбониламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-метилпропаноата (1,1 г, 3,29 ммоль) в дихлорметане (5 мл) обрабатывали при комнатной температуре трифторуксусной кислотой (5,0 мл, 64,9 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Растворители удаляли при пониженном давлении и полученное оранжевое масло суспендировали в метаноле (3 мл). Твердое вещество удаляли фильтрованием и фильтрат очищали при помощи препаративной обращено-фазовой ВЭЖХ (10-65% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 30 минут, 1 цикл очистки). Желаемые фракции объединяли и упаривали досуха. (S)-Метил 3-(2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-метилпропаноат 2,2,2-трифторацетат (0,511 г, 1,467 ммоль, 44,6% выход) выделяли в виде белого твердого вещества. 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 7,76 (ддт, J=1,00, 7,80, 9,76 Гц, 1H), 7,48 (д, J=8,98 Гц, 1H), 7,16 (д, J=7,42 Гц, 1H), 3,59 (с, 3H), 3,39-3,47 (м, 1H), 3,15-3,26 (м, 2H), 1,19-1,25 (м, 3H); MS (ESI) m/z 235,3 [M+1]+.
C. (2S)-Метил 2-метил-3-(2-(3-метил-1-(тетрагидро-2Н-пиран-2-ил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропаноат. Суспензию (S)-метил 3-(2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-ил)-2-метилпропаноата 2,2,2-трифторацетата (0,25 г, 0,718 ммоль), 6-бром-3-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазола (0,254 г, 0,861 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,083 г, 0,144 ммоль), трис(дибензилиденацетон)дипалладия (0,066 г, 0,072 ммоль) и карбоната цезия (1,403 г, 4,31 ммоль) в диоксане (4 мл) в атмосфере азота нагревали до 75°C. Через 1 час реакционную смесь охлаждали до комнатной температуры, гасили водой и экстрагировали этилацетатом. Остаток очищали при помощи колоночной хроматографии на Biotage (5-100% этилацетата в гексане). Желаемые фракции объединяли и упаривали досуха. (2S)-Метил 2-метил-3-(2-(3-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропаноат (0,201 г, 0,448 ммоль, 62,4% выход) выделяли в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,89 (д, J=1,56 Гц, 1H), 8,24 (дд, J=1,17, 5,47 Гц, 1H), 7,46-7,60 (м, 3H), 7,18-7,28 (м, 1H), 6,88-6,97 (м, 1H), 5,55-5,68 (м, 1H), 3,92 (д, J=11,32 Гц, 1H), 3,69 (д, J=2,73 Гц, 1H), 3,54 (д, J=5,86 Гц, 3H), 3,48 (дд, J=6,64, 10,15 Гц, 1H), 3,21-3,32 (м, 3H), 2,38-2,45 (м, 3H), 2,01-2,11 (м, 1H), 1,91-2,01 (м, 1H), 1,79 (шир.с, 1H), 1,59 (шир.с, 2H), 1,22 (дд, J=1,95, 6,64 Гц, 3H); MS (ESI) m/z 449,6 [M+1]+.
D. (2S)-2-Метил-3-(2-(3-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропан-1-ол. Суспензию (2S)-метил 2-метил-3-(2-(3-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропаноата (0,2 г, 0,446 ммоль) в безводном тетрагидрофуране (1,784 мл) охлаждали до -78°C и подвергали взаимодействию с 1,0 M раствором литийалюминийгидрида в тетрагидрофуране/гептане (0,892 мл, 0,892 ммоль). После выдерживания в течение 30 минут при низкой температуре реакционную смесь нагревали до комнатной температуры и перемешивали еще в течение 30 минут. Реакцию гасили насыщенным водным раствором хлорида аммония и продукт экстрагировали этилацетатом. Экстракты сушили над сульфатом натрия и упаривали досуха. (2S)-2-Метил-3-(2-(3-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропан-1-ол (0,191 г, 0,454 ммоль, количественный выход) выделяли в виде ржаво-коричневого твердого вещества, которое использовали без дополнительной очистки. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,85 (с, 1H), 8,25 (д, J=7,42 Гц, 1H), 7,49-7,61 (м, 2H), 7,42-7,49 (м, 1H), 7,23 (д, J=8,59 Гц, 1H), 6,92 (д, J=7,42 Гц, 1H), 5,61 (д, J=7,81 Гц, 1H), 4,64-4,73 (м, 1H), 3,88-3,98 (м, J=12,00 Гц, 1H), 3,71 (шир.с, 1H), 3,36-3,50 (м, 2H), 3,22-3,31 (м, 1H), 2,86-3,02 (м, 1H), 2,30-2,47 (м, 5H), 2,02-2,11 (м, 1H), 1,92-2,02 (м, 1H), 1,78 (шир.с, 1H), 1,58 (шир.с, 2H), 0,87-1,00 (м, 3H); MS (ESI) m/z 221,3 [M+1]+.
E. (S)-2-Метил-3-(2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропан-1-ол. Суспензию (2S)-2-метил-3-(2-(3-метил-1-(тетрагидро-2H-пиран-2-ил)-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропан-1-ола (0,111 г, 0,264 ммоль) в метаноле (2,0 мл) обрабатывали при комнатной температуре 6,0 н водным раствором хлористоводородной кислоты (1,0 мл, 6,00 ммоль) и реакционную смесь перемешивали при 40°C в течение 30 минут. Растворитель затем удаляли при пониженном давлении с получением не совсем белого твердого вещества. Остаток очищали при помощи полу-препаративной ВЭЖХ (10-60% ацетонитрила + 0,1% трифторуксусной кислоты в воде + 0,1% трифторуксусной кислоты, 2 цикла очистки, 30 мин). Желаемые фракции объединяли и нейтрализовали при помощи 1,75 M водного раствора карбоната калия. После удаления органического растворителя образовывался белый осадок, который собирали фильтрованием и промывали водой до достижения нейтрального pΗ. Это твердое вещество сушили в условиях высокого вакуума в течение 2 часов. (S)-2-Метил-3-(2-(3-метил-1H-индазол-6-иламино)-[1,2,4]триазоло[1,5-α]пиридин-5-ил)пропан-1-ол (0,056 г, 0,166 ммоль, 63,1% выход) выделяли в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 12,31 (с, 1H), 9,77 (с, 1H), 8,12 (с, 1H), 7,40-7,58 (м, 3H), 7,22 (д, J=8,98 Гц, 1H), 6,91 (д, J=6,64 Гц, 1H), 4,56-4,67 (м, 1H), 3,36-3,46 (м, 2H), 3,14-3,25 (м, 1H), 2,84-2,95 (м, 1H), 2,42 (с, 3H), 2,32 (д, J=7,03 Гц, 1H), 0,92 (д, J=6,64 Гц, 3H); MS (ESI) m/z 337,0 [M+1]+.
Пример 132: цис-6-(5-(4-Гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1,4-диметилиндолин-2-он
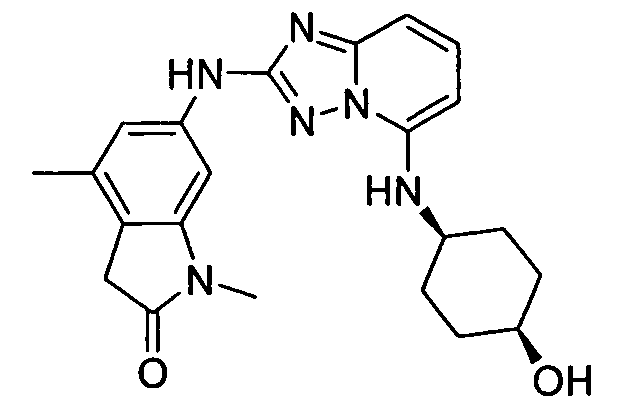
A. цис-6-(5-(4-Гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1,4-диметилиндолин-2,3-дион. Смесь 6-бром-1,4-диметилиндолин-2,3-диона (0,34 г, 1,338 ммоль), цис-4-(2-амино-[1,2,4]триазоло[1,5-α]пиридин-5-иламино)циклогексанола (0,446 г, 1,804 ммоль), карбоната цезия (1,308 г, 4,01 ммоль), трис(дибензилиденацетон) дипалладия(0)(0,245 г, 0,268 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,310 г, 0,535 ммоль) в 1,4-диоксане (6 мл) дегазировали в течение 2 минут и затем перемешивали при 90°C в течение 17 часов. Охлажденный реакционный раствор фильтровали через Целит и фильтровальную лепешку промывали дихлорметаном и метанолом. Растворитель удаляли при пониженном давлении. Очистка при помощи колоночной хроматографии (элюироали при помощи 0-10% метанола в дихлорметане) дала указанное в заголовке соединение в виде желтого твердого вещества (0,22 г, 39,1% выход). MS (ESI) m/z 421,5 [M+1]+.
B. цис-6-(5-(4-Гидроксициклогексиламино)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-1,4-диметилиндолин-2-он. Суспензию цис-6-(5-(4-гидроксициклогексиламино)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-1,4-диметилиндолин-2,3-диона (200 мг, 0,476 ммоль) в гидразингидрате (4,6 мл, 95 ммоль) нагревали до 140°C в микроволновой печи в течение 2,25 часов. Реакционную смесь охлаждали до комнатной температуры и неочищенное вещество очищали при помощи колоночной хроматографии (элюировали при помощи 0-10% метанола в дихлорметане). Полученное твердое вещество растирали в порошок с метанолом и этанолом с получением указанного в заголовке продукта в виде желтого твердого вещества (60 мг, 31% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,53 (шир.с, 1H), 7,43 (т, J=8,20 Гц, 1H), 7,38 (с, 1H), 7,09 (д, J=1,56 Гц, 1H), 6,74 (д, J=8,20 Гц, 1H), 6,22 (д, J=7,81 Гц, 1H), 3,70-3,76 (м, 1H), 3,40 (с, 1H), 3,14 (с, 3H), 2,20 (с, 3H), 1,80-1,92 (м, 2H), 1,69-1,78 (м, 2H), 1,55-1,69 (м, 4H). MS (ESI) m/z 407,1 [M+1]+.
Пример 133: 6-(5-(2-Метоксипиридин-4-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-он

A. 2-Бром-5-(2-метоксипиридин-4-ил)-[1,2,4]триазоло[1,5-α]пиридин. Дегазированный раствор 2,5-дибром-[1,2,4]триазоло[1,5-α]пиридина (540 мг, 1,96 ммоль), 2-метоксипиридин-4-илбороновой кислоты (300 мг, 1,96 ммоль), насыщенного раствора карбоната натрия (3,92 мл) и 1,1'-бис(дифенилфосфино)ферроценпалладийдихлорида (143 мг, 0,196 ммоль) в диоксане (10 мл) нагревали при 100°C в течение 5 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении и остаток очищали на колонке с силикагелем (элюируя при помощи 5-25% этилацетата в петролейном эфире) с получением 2-бром-5-(2-метоксипиридин-4-ил)-[1,2,4]триазоло[1,5-α]пиридина (340 мг, 57% выход). 1H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ (м.д.) 8,28 (д, J=7,2 Гц, 1H), 7,70 (м, 1H), 7,59 (м, 1H), 7,34 (м, 1H), 7,25 (с, 1H), 7,15 (м, 1H), 3,95 (с, 3H); MS (ESI): m/z 304,9 [M+1]+.
B. трет-Бутил 6-(5-(2-метоксипиридин-4-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметил-2-оксоиндолин-1-карбоксилат. Смесь 2-бром-5-(2-метоксипиридин-4-ил)-[1,2,4]триазоло[1,5-α]пиридина (334 мг, 1,1 ммоль), трет-бутил 6-амино-3,3-диметил-2-оксоиндолин-1-карбоксилата (303 мг, 1,1 ммоль), карбоната цезия (717 мг, 2,2 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (127 мг, 0,22 ммоль) и трис(дибензилиденацетон)дипалладия(0) (101 мг, 0,11 ммоль) в диоксане (20 мл) нагревали при 100°C в атмосфере азота в течение 1,5 часов. Растворитель удаляли и остаток очищали на колонке с силикагелем (элюируя при помощи 5-100% этилацетата в петролейном эфире) с получением трет-бутил 6-(5-(2-метоксипиридин-4-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметил-2-оксоиндолин-1-карбоксилата (230 мг, 42% выход) в виде твердого вещества. MS (ESI): m/z 501,1 [M+1]+.
C. 6-(5-(2-Метоксипиридин-4-ил)-[1,2,4]триазоло[1,5-a]пиридин-2-иламино)-3,3-диметилиндолин-2-он. Раствор трет-бутил 6-(5-(2-метоксипиридин-4-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметил-2-оксоиндолин-1-карбоксилата (230 мг, 0,46 ммоль) в метанольном растворе гидрохлорида (10 мл, 2 M) перемешивали при комнатной температуре пока ЖХ/МС анализ не показал, что исходное вещество было израсходовано. Реакционную смесь упаривали при пониженном давлении и очищали при помощи обращенно-фазовой препаративной ВЭЖХ (элюируя при помощи 35-65%: ацетонитрил + 0,075% трифторуксусной кислоты в воде + 0,075% трифторуксусной кислоты, в течение 15 мин) с получением 6-(5-(2-метоксипиридин-4-ил)-[1,2,4]триазоло[1,5-α]пиридин-2-иламино)-3,3-диметилиндолин-2-она в форме соли трифторуксусной кислоты, которую преобразовывали в гидрохлоридную соль (102 мг, 55,4% выход). 1H ЯМР (400 МГц, МЕТАНОЛ-d4) δ (м.д.) 8,53 (д, J=5,6 Гц, 1H), 8,11 (м, 1H), 7,91 (м, 4H), 7,26 (м, 3H), 4,21 (с, 3H), 1,37 (с, 6H); MS (ESI): m/z 401,2 [M+1]+.
5.2 Биологические примеры
5.2.1 Протокол анализа Syk HTRF
Испытываемые соединения получали в концентрации 1,5 мМ в ДМСО с последующими 3-кратными разведениями в 394-луночных полипропиленовых планшетах Greiner. Затем осуществляли 1:4 разведение соединений путем 8 мкл/лунка переноса из полипропиленовых планшетов в Costar 3710 384-луночные черные планшеты с 24 мкл/лунка буфера для анализа. Киназы (13 мкл/лунка) или только буфер для анализа (фоновые контроли; 50 мМ HEPES pH 7,6, 1 мМ DTT, 10 мМ MgCl2, 0,01% Triton X100, 0,01% BSA и 0,1 мМ EDTA) добавляли в 384-луночные черные планшеты Costar 3710 для HTRF анализов (Carna Biosciences) и соединение добавляли из планшета с 1:4 разведением. Добавляли исходную смесь Syk (87,5 мкМ ATP, 80 нМ пептидного субстрата (American Peptide Company 332722) и смесь инкубировали при комнатной температуре в течение 1 часа. Syk стоп раствор (120 мМ EDTA в разбавляющем буфере) затем добавляли в Syk HTRF аналитический планшет и инкубировали при комнатной температуре на встряхивающем устройстве в течение 2 минут. Смесь Syk антитела (4,86 мкг/мл DyLight 647 Стрептавидина (Pierce 21824); 1 мкг/мл Lance Eu-Анти-Фосфотирозина (PerkinElmer AD0069)) добавляли в Syk HTRF аналитический планшет и смесь затем инкубировали при комнатной температуре в течение >4 часов. Флуоресценцию с разрешением по времени считывали в аналитических планшетах на PerkinElmer EnVision. HTRF анализы осуществляли с использованием 320 нм возбуждения, 60 мксек задержки, 665 нм и 615 нм эмиссии. Данные выражали путем деления эмиссии при 665 нм на эмиссию при 615 нм.
5.2.2 HTRF-Ulight PLK1 ферментный анализ
Анализ, описанный ниже, предназначен для измерения активности of PLK1 киназы путем переноса фосфата в пептидный субстрат. PLK1 киназный анализ осуществляли в 384-луночном черном планшете (Corning cat#3710) в конечном объеме 25 мкл. АТФ использовали в конечной концентрации 3 мкМ, 1X кажущаяся Km. PLK1 киназу закупали у компании Carna Biosciences (cat #05-157) и разбавляли в буфере для анализа (50 мМ HEPES pH 7,6, 1мМ DTT, 10 мМ MgCl2, 0,01% triton X-100, 0,01% BSA, 0,1 мМ EDTA) с получением конечной анализируемой концентрации 15 нг/лунка (11 нМ). Пептидый субстрат, ULight-p70 S6K (Thr389) Пептид и Европий-анти-фосфо-p70 S6K (Thr389) Антитело закупали у компании PerkinElmer (cat# TRF0126, TRF0214). Испытываемое соединение разбавляли в 100% ДМСО и 0,5 мкл добавляли к 14,5 мкл киназы. Фермент и соединение оставляли для уравновешивания при комнатной температуре в течение 15 минут. Реакцию начинали путем добавления 10 мкл 2,5X АТФ и 2,5X ULight-p70S6K пептида (конечное условие анализа 25 нМ) в буфер для анализа. Реакциям давали осуществиться в течение 90 минут перед добавлением 10 мкл смеси стоп раствора/детекция (14 мМ EDTA, 0,5 нМ Eu-анти-phos-p70 AB конечная концентрация). После 30 минут инкубации при комнатной температуре реакции считывали на Envision (возбуждение при 330 нм и фильтры эмиссии при 665 нм и 615 нм).
Гетероарильные соединения, описанные в настоящей заявке, имеют, или ожидается, что они должны иметь, значение ИК50 <10 мкМ, при этом некоторые соединения имеют значение ИК50 <1 мкМ, а другие имеют значение ИК50 <0,1 мкМ.
5.2.3 Протокол анализа FLT3 HTRF
Испытываемые соединения получали при концентрации 1,5 мМ в ДМСО с последующими 3-кратными разведениями в Greiner 394-луночных полипропиленовых планшетах. Затем осуществляли 1:4 разведение соединений путем 8 мкл/лунка переноса из полипропиленовых планшетов в 24 мкл/лунка буфер для анализа (50 мМ HEPES pH 7,6, 1 мМ DTT, 10 мМ MgCl2, 0,01% Triton X100, 0,01% BSA и 0,1 мМ EDTA) в Costar 3573 384-луночные черные планшеты. Киназу (13 мкл/лунка 154 нг/мл FLT3, SignalChem F 12-11G-05) или только буфер для анализа (фоновые контроли) добавляли в Costar 3573 384-луночные черные планшеты и соединение (2 мкл/лунка) добавляли из планшета с 1:4 разведением. Добавляли смесь субстрат/детекция (10 мкл/лунка) (1250 мкМ АТФ, 500 нМ Gastin предшественника (Tyr 87) биотинилированного пептида (Cell Signalling Technology 1310), 1,65 мкг/мл (30 нМ) DyLight 649 стрептавидина (Pierce 21845), 750 нг/мл Lance Eu-анти-фосфотирозина (PerkinElmer AD0069)) и смесь инкубировали при комнатной температуре в течение 1 часа. 10 мкл/лунка смеси 60 мМ EDTA/0,01% Triton X100 затем добавляли в FLT3 HTRF аналитический планшет и смешивали на встряхивающем устройстве в течение 2 минут. Смесь затем инкубировали при комнатной температуре в течение >1 часа. Флуоресценцию с разрешением по времени считывали в аналитических планшетах на PerkinElmer EnVision. HTRF анализы осуществляли с использованием 320 нм возбуждения, 60 мксек задержки, 665 нм и 615 нм эмиссии. Данные выражали путем деления эмиссии при 665 нм на эмиссию при 615 нм.
Гетероарильные соединения, описанные в настоящей заявке, как было показано или будет показано, имеют значение ИК50 <10 мкМ, при этом некоторые соединения имеют значение ИК50 <1 мкМ, а другие имеют значение ИК50 <0,1 мкМ.
5.2.4 Протокол анализа JAK2 HTRF
Испытываемые соединения получали при концентрации 1,5 мМ в ДМСО с последующими 3-кратными разведениями в Greiner 394-луночных полипропиленовых планшетах. Затем осуществляли 1:4 разведение соединений путем 8 мкл/лунка переноса из полипропиленовых планшетов в 24 мкл/лунка буфер для анализа (50 мМ HEPES pH 7,6, 1 мМ DTT, 10 мМ MgCl2, 0,01% Triton X100, 0,01% BSA и 0,1 мМ EDTA) в Costar 3573 384-луночные черные планшеты. Киназу (13 мкл/лунка 4,6 нг/мл JAK2, Millipore 14-511) или только буфер для анализа (фоновые контроли) добавляли в Costar 3573 384-луночные черные планшеты и соединение (2 мкл/лунка) добавляли из планшета с 1:4 разведением. Добавляли смесь субстрат/детекция (10 мкл/лунка) (30 нМ DyLight 647-Стрептавидина (Pierce 21824), 750 нг/мл Eu-анти-фосфотирозина PerkinElmer AD0069), 37,5 мкМ АТФ и 500 nM FLT3 (Tyr 589) биотинилированного пептида (Cell Signalling Technology 1305) и смесь инкубировали при комнатной температуре в течение 1 часа. Затем в JAK2 HTRF аналитический планшет добавляли 10 мкл/лунка смеси 60 мМ EDTA/0,01% Triton Х100 и смешивали на встряхивающем устройстве в течение 2 минут. Смесь затем инкубировали при комнатной температуре в течение >1 часа. Флуоресценцию с разрешением по времени считывали в аналитических планшетах на PerkinElmer EnVision. HTRF анализы осуществляли с использованием 320 нм возбуждения, 60 мксек задержки, 665 нм и 615 нм эмиссии. Данные выражали путем деления эмиссии при 665 нм на эмиссию при 615 нм.
Гетероарильные соединения, описанные в настоящей заявке, как было показано или будет показано, имеют значение ИК50 <10 мкМ, при этом некоторые соединения имеют значение ИК50 <1 мкМ, и другие имеют значение ИК50 <0,1 мкМ.
5.2.5 Протокол функционального анализа Syk:CD69 экспрессия в анти-IgM стимулированных первичных B-клетках
Первичные B-клетки очищали из клеточных препаратов лейкоцитных пленок, полученных от здоровых людей-доноров в Банке Крови Сан Диего (SDBB). Клетки поддерживали в RPMI/10% FBS. Клетки подсчитывали и плотность клеток доводили до 1 млн/мл в RPMI питательной среде. Подготавливали планшет для предварительной обработки соединением в 96-луночном круглодонном формате с достаточным объемом клеточного препарата для покрытия желаемого количества лунок, предположительно 50 мкл клеток/лунка в планшете для обработки. В отдельном 96-луночном планшете, соединения разводили 1:50 в RPMI питательной среде. 22 мкл раствора разведенного соединения добавляли к 200 мкл клеток в планшете для предварительной обработки соединением. Смесь помещали в инкубатор для тканевых культур на 30-60 минут. Получали 20 мкг/мл раствора анти-IgM в RPMI питательной среде и 50 мкл добавляли в каждую лунку в новый 96-луночный круглодонный планшет (планшет для стимуляции клеток). 50 мкл предварительно обработанных соединением клеток добавляли в планшет, содержащий анти-IgM, с использованием многоканальной пипетки и смесь инкубировали в течение 12-14 часов при 37°C. После инкубации планшет центрифугировали при 1200 об/мин в течение 5 минут и среду удаляли. Добавляли 100 мкл раствора CD69 антитела на лунку, планшет осторожно постукивали для смешивания, затем инкубировали в темноте при комнатной температуре в течение 30 минут. После 30 минут инкубации планшет центрифугировали и промывали один раз при помощи 250 мкл окрашивающего буфера, затем центрифугировали для восстановления конечного клеточного осадка, который ресуспендировали в 100 мкл окрашивающего буфера и считывали на цитометре для определения % положительных клеток.
Гетероарильные соединения, описанные в настоящей заявке, имеют, или ожидается, что они должны иметь, значение ИК50 <10 мкМ, при этом некоторые соединения имеют значение ИК50 <1 мкМ, и другие имеют значение ИК50 <0,1 мкМ.
5.2.6 Функциональный анализ Syk: IgE-зависимая секреция бета-гексозоаминидазы из LAD2 линии тучных клеток человека
LAD2 клетки (NIH; Kirshenbaum, et al, Leukemia Research 27:677-682, 2003) высевали в 96-луночный формат, сенсибилизировали через FcεR при помощи NP-IgE и дегранулировали путем сшивки с NP16-BSA. Супернатанты собирали и секреторные компоненты гранул, включая бета-гексозоаминидазу, измеряли в различных колориметрических анализах.
Вкратце, LAD2 клетки осторожно извлекали из колбы для культивирования, собирали и центрифугировали при 1200 об/мин в течение 5 минут. Использованную культуральную среду удаляли и сохраняли и клетки ресуспендировали при 0,8-1 миллион/мл в использованной культуральной среде. 100 мкл 0,5 мкг/мл NP-IgE высевали в использованную культуральную среду в круглодонный 96-луночный планшет. 100 мкл клеток добавляли в планшет и помещали обратно в инкубатор для тканевых культур на 12-14 часов для сенсибилизации клеток и нагрузки FcεR рецепторов. После 12-14-часовой инкубации планшет центрифугировали при 1200 об/мин в течение 5 минут. Среду удаляли при помощи многоканальной пипетки и клеточные осадки ресуспендировали в 100 мкл модифицированном буфере Тирода. Клетки оставляли в покое в течение 3,5 часов в инкубаторе для тканевых культур. Соединения разводили 1:50 в модифицированном буфере Тирода и затем 11 мкл раствора соединения добавляли в каждую лунку (с получением конечной концентрации ДМСО 0,2%). Соединение предварительно инкубировали в течение 30-60 минут в инкубаторе для тканевых культур. После предварительной инкубации добавляли 12 мкл 1,0 мкг/мл NP16-BSA, разведенного в модифицированном буфере Тирода, с получением общего объема в лунке 123 мкл. Иономицин при конечной концентрации 100 нМ можно добавить вместо NP-BSA в качестве Syk-независимого контроля для стимуляции. Планшет инкубировали в инкубаторе для тканевых культур в течение 90 минут. После инкубации планшет центрифугировали при 1200 об/мин в течение 5 минут и 75 мкл супернатанта (SN) переносили к пустой 96-луночный планшет для хранения. Оставшийся SN удаляли из планшета с клетками и отбрасывали. Добавляли 125 мкл 0,1% triton X-100 в модифицированном буфере Тирода к клеточному осадку, пипетировали вверх/вниз для лизирования клеток и смесь инкубировали на льду в течение 15 минут. 30 мкл SN из планшета для хранения или 5 мкл лизата осажденных клеток плюс 25 мкл 0,1% раствора Triton добавляли в новый 96-луночный плоскодонный планшет идентичным образом для конечного считывания планшета. 150 мкл PNAG субстрата добавляли во все лунки и планшет инкубировали при 37°C в течение 1 часа. 50 мкл стоп раствора (0,32 M глицина, 2,4 г/100 мл; 0,2 M карбонат натрия, 2,5 г/100 мл) добавляли в каждую лунку и планшет считывали сразу при 405 нм. Данные выражали как % выделения в расчете на лунку (после вычитания фонового значения из всех лунок)=100×(SN/(SN+6×клеточного лизата)).
Гетероарильные соединения, описанные в настоящей заявке, имеют, или ожидается, что они должны иметь, значение ИК50 <10 мкМ, при этом некоторые соединения имеют значение ИК50 <1 мкМ, и другие имеют значение ИК50 <0,1 мкМ.
5.2.7 Клеточный анализ на основе CD14+ выделенных макрофагов
Криоконсервированные человеческие CD14+ моноцитные клетки выделяли из периферической крови у специально выбранных здоровых доноров, которым давали G-CSF (Neupogen) в течение 4 дней для мобилизации клеток в периферическую кровь (Lonza). CD 14+ Моноциты выделяли с использованием положительной иммуномагнитной селекции, направленной против CD14. Клетки культивировали в питательной среде, содержащей RPMI 1640, 10% FBS и Пенициллин + Стрептомицин, и затем высевали при 50000 клеток/200 мкл/лунка питательной среды, дополненной 100 нг/мл GM-CSF (Pepro Tech), в течение 5 дней в 5% CO2 и 37°C инкубаторе для дифференциации клеток в макрофаги. После дифференциации происходящие из CD14+ макрофаги предварительно обрабатывали соединением в течение 30 минут и стимулировали при помощи Биотин-SP конъюгированного козлиного анти-человеческого IgG (Jackson ImmunoResearch Labs) в течение 8 часов в 96-луночном формате в 5% CO2 и 37°C инкубаторе. После инкубации 100 мкл/лунка надосадочной жидкости собирали и переносили в новый 96-луночный планшет с U-образным дном для измерения TNF-α с использованием Mesoscale Discovery анализа человеческих TNF-α цитокинов.
Гетероарильные Соединения, описанные в настоящей заявке, имеют, или ожидается, что они должны иметь, значение ИК50 <10 мкМ, при этом некоторые соединения имеют значение ИК50 <1 мкМ, и другие имеют значение ИК50 <0,1 мкМ.
5.2.8 Протокол анализа Syk биомаркера:измерение фосфоBLNK при помощи PhosFlow в анти-IgM стимулированных Ramos.
Клетки Ramos B-клеточной лимфомы (клон RA1, CRL1596; ATCC) суспендировали при 1 млн/мл в использованной культуральной среде. Планшет для предварительной обработки соединением подготавливали в 96-луночном круглодонном формате с достаточным объемом клеточного препарата для покрытия желаемого количества лунок, предположительно 50 мкл клеток/лунка в планшете для обработки (например, для 4 лунок добавляли 200 мкл клеток). В отдельном 96-луночном планшете, соединения разводили 1:50 в использованной культуральной среде. 22 мкл раствора разведенного соединения добавляли к 200 мкл клеток в планшете для предварительной обработки соединением и планшет снова помещали в инкубатор для тканевых культур на 30-60 минут. 50 мкл анти-IgM (AffiniPure F(ab') фрагмента козлиного анти-человеческого IgM (Jackson, cat. 109-006-129, 1,3 мг/ мл) (40 мкг/мл в использованной культуральной среде) на лунку добавляли в новый 96-луночный круглодонный планшет (планшет для стимуляции клеток). С использованием многоканальной пипетки, 50 мкл предварительно обработанных соединением клеток быстро добавляли в планшет, содержащий анти-IgM, и планшет снова помещали в инкубатор для тканевых культур на 10 минут. Равный объем (100 мкл) предварительно нагретого CytoFix реагента добавляли во все лунки планшета для стимуляции клеток и и планшет снова помещали в инкубатор для тканевых культур на 10 минут, затем центрифугировали при 1200 об/мин в течение 5 минут. Среду осторожно сливали и планшет высушивали при помощи промокательной бумаги. Perm/промывочный буфер (100 мкл) добавляли во все лунки и планшет оставляли при комнатной температуре в течение 10 минут, затем центрифугировали при 1200 об/мин в течение 5 минут. Среду осторожно сливали и планшет высушивали при помощи промокательной бумаги. Клетки затем промывали три раза при помощи 200 мкл BSA окрашивающего буфера (BD Pharmingen, cat 554657), планшет центрифугировали и супернатант удаляли. В планшет добавляли 100 мкл раствора pBLNK антитела (PE мышиное анти-фосфоBLNK (pY84, BD Pharmingen, cat. 558442) в каждую лунку, осторожно смешивали и затем инкубировали в темноте при комнатной температуре в течение 30 минут. Планшет промывали один раз при помощи 200 мкл BSA окрашивающего буфера, центрифугировали и супернатант удаляли. Конечный клеточный осадок ресуспендировали в 100 мкл BSA окрашивающего буфера и считывали на цитометре.
Гетероарильные соединения, описанные в настоящей заявке, имеют, или ожидается, что они должны иметь, значение ИК50 ниже 30 мкМ в этом анализе, при этом некоторые соединения имеют значение ИК50 ниже 10 мкМ, и другие имеют значение ИК50 ниже 1 мкМ.
5.2.9 Протокол анализа Syk биомаркера: экспрессия pSyk (Y525/526) в тетрациклин-индуцированных TEL-Syk экспрессирующих HEK 293 клетках, определенная анализом In-Cell Western.
Стабильный клон, экспрессирующий Tel-Syk белок, содержащий N-концевой Tel (аминокислоты 1-336), гибридизованный с каталитическим доменом (аминокислоты 341-612) Syk, получали в HEK 293 T-REx™ клеточной линии. Клетки поддерживали в среде DMEM/FBS без 10% тетрациклина, содержащей 0,5 мг/мл зеоцина и 5 мкг/мл бластицидина. Клетки высевали при плотности 50000 на лунку в черный имеющий поли-D-лизиновое покрытие 96-луночный планшет и оставляли в течение ночи при 37°C, 5% CO2. Tel-Syk экспрессию индуцировали при помощи 1 мкг/мл тетрациклина в течение 6 часов при 37°C, 5% CO2. После индукции клетки обрабатывали разведенными соединениями в течение 90 минут. После инкубации с соединением клетки фиксировали в 150 мкл 4% формальдегида в течение 20 минут, затем пермеабилизировали в PBS + 0,1% Triton X-100 при помощи промывки пять раз по 5 минут, всего в течение 25 минут. Планшет блокировали при помощи 100 мкл Odyssey блокирующего буфера (Licor), по меньшей мере, в течение 90 минут, затем инкубировали в 100 мкл раствора первичного антитела (кроличье анти-Syk pY525/526 при 1:1000 и мышиное анти-V5 при 1:2500 в Odyssey блокирующем буфере) в течение ночи при 4°C на качающейся платформе. Планшет промывали 5 раз в течение 5 минут при помощи PBS + 0,1% Tween-20 (PBST) на встряхивающем устройстве при комнатной температуре. Добавляли раствор вторичного антитела (анти-кроличье AF680 при 1:1000 и анти-мышиное IR800 при 1:1000 в Odyssey блокирующем буфере) при 100 мкл на лунку и планшет инкубировали в течение одного часа при комнатной температуре, при встряхивании. Планшет затем промывали 5 раз в течение 5 минут при помощи PBST и буфер удаляли пуьтем аспирации после конечной промывки. Планшет сканировали на Licor Odyssey и экспрессию pSyk нормализовали к V5.
Гетероарильные соединения имеют, или ожидается, что они должны иметь, значение ИК50 ниже 30 мкМ в этом анализе, при этом некоторые соединении имеют значение ИК50 ниже 10 мкМ, и другие имеют значение ИК50 ниже 1 мкМ.
5.2.10 Функциональный анализ Syk: анализ жизнеспособности с использованием Cell-Titer Glo в клетках SU-DHL-4, SU-DHL-5 и Pfeiffer.
Анализ предназначен для измерения цитотоксичной активности Гетероарильных Соединений в DLBCL клетках. SU-DHL-4, SU-DHL-5 и Pfeiffer клетки получали от DSMZ (German Collection of Microorganisms and Cell Cultures). Культуральная среда представляла собой RPMI-1640, дополненную 10% фетальной бычьей сывороткой (FBS) и 100 единиц/мл пенициллина/100 мкг/мл стрептомицина.
Вкратце, 100 мкл клеточной суспензии, содержащей 10000 клеток, высевали в каждую лунку 96-луночных планшетов с непрозрачными стенками. Соединения и контроли серийно разводили в ДМСО и культуральной среде, в соответствии со стандартным протоколом разведения соединений. 11 мкл разведений соединений, включая ДМСО контроль, добавляли в трех повторах к клеткам с использованием устройства для повторного пипетирования. Это давало конечные концентрации 30 мкМ, 10 мкМ, 3 мкМ, 1 мкМ и 0,3 мкМ, содержащие 0,2% ДМСО в каждой лунке. После 72 часов обработки соединениями, жизнеспособность клеток определяли при помощи CellTiter-Glo реагента в соответствии с протоколом изготовителя. Вкратце, 100 мкл восстановленного CellTiter-Glo реагента добавляли в каждую лунку 96-луночного планшета. Сигналы люминисценции измеряли с использованием устройства для считывания микропланшетов Victor 2. Для каждой клеточной линии ИК50 рассчитывали с использованием носителя ДМСО в качестве контроля, который принимали за 100%.
Гетероарильные соединения имеют, или ожидается, что они должны иметь, значение ИК50 ниже 30 мкМ в этом анализе, при этом некоторые соединения имеют значение ИК50 ниже 10 мкМ, и другие имеют значение ИК50 ниже 1 мкМ.
5.2.11 Скрининговый анализ раковых клеток
Все клеточные линии гематологических и солидных раковых опухолей, если не указано иное, получали из коммерческих источников (ATCC, DMSZ, NCI или CellTrends). OCI-LY-3 и OCI-LY-10 получали от Dr. Louis Staudt. Все гематологические раковые клеточные линии, если не указано иное, поддерживали в RPMI 1640, дополненной 10% фетальной бычьей сывороткой. OCI-LY-3, OCI-LY-7, OCI-LY-10 поддерживали в IMDM + 20% человеческой плазмы и 55 мкМ B-меркаптоэтанола. Все клеточные линии рака молочной железы, если не указано иное, поддерживали в RPMI 1640, дополненной 10% фетальной бычьей сывороткой. BT-20, CAL-120, CAL-51, CAL-85-1, CAMA-1, KPL-1, MDA-MB-134-VI, MDA-MB-157, MDA-MB-361, MDA-MB-415, MDA-MB-436, MDA-MB-453, MDA-MB-468, UACC-812 поддерживали в DMEM, дополненной 10% фетальной бычьей сывороткой. MCF-12A поддерживали в DMEM/F12 + 5% лошадиной сыворотки, 20 нг/мл EGF, 100 нг/мл токсина холеры, 0,01 мг/мл инсулина и 500 нг/мл гидрокортизона.
Все раковые клеточные линии оптимизировали на плотность и время в 384-луночных планшетах. Что касается гематологических раковых клеточных линий, 40 мкл клеток высевали при оптимальной плотности и давали расти в течение ночи при 37°C/5% CO2 и затем обрабатывали серийным разведением гетероарильного соединения. Через 72 часа жизнеспособность клеток измеряли с использованием CellTiterGlo (Promega) и считывали для определения люминисценции. Что касается клеточных линий рака молочной железы, серийные разведения соединения наносили пятнами через акустическое распределительное устройство в пустые 384-луночные планшеты, герметично закрывали и хранили при -20°C вплоть до 1 месяца. Сорок мкл клеток затем высевали и давали расти в течение 96 часов при 37°C/5% CO2. Через 96 часов жизнеспособность клеток измеряли с использованием CellTiterGlo (Promega) и считывали для определения люминисценции. Результаты выражали в виде значения ИК50, которое представляет собой концентрацию соединения, необходимую для ингибирования 50% от необработанных контрольных клеток. Результаты также выражали в виде значения GI50, которое представляет собой концентрацию соединения, необходимую для ингибирования роста необработанных контрольных клеток в течение 96 часов обработки соединением.
Некоторые из типичных человеческих раковых клеточных линий, которые можно использовать в описанном выше анализе, представляют собой следующие: AU565, BT-20, BT-474, BT-483, BT-549, CAL-120, CAL-51, CAL-85-1, CAMA-1, DU4475, EFM-19, EFM-192A, HCC1143, HCC1187, HCC1428, HCC1500, HCC1569, HCC1937, HCC1954, HCC202, HCC2157, HCC38, HCC70, HS578T, KPL-1, MCF10A, MCF12A, MCF7, MDA-MB-134-VI, MDA-MB-157, MDA-MB-175-VII, MDA-MB-231, MDA-MB-361, MDA-MB-415, MDA-MB-435, MDA-MB-436, MDA-MB-453, MDA-MB-468, NCI/ADR-RES, SK-BR-3, T47D, UACC-812, ZR-75-1, ZR-75-30, как представляющие клеточные линии рак молочной железы; и BL-41, CCRF-CEM, Daudi, DG-75, DOHH-2, EHEB, Farage, GRANTA-519, HL-60, HT, JEKO-1, JIYOYE, JVM02, K562, KARPAS-1106P, Karpas-231, KARPAS-299, Karpas-422, Kasumi-1, Kasumi-2, Kasumi-3, KG-1, KM-H2, KMS-12-PE, KOPN-8, L-1236, L-363, LP-1, MEC-1, MHH-PREB-1, Mino, MN-60, MOLM-13, Molt-4, NALM-19, Namalwa, Namalwa.CSN/70, NCI-H929, OCI-LY-10, OCI-LY-19, OCI-LY-3, OCI-LY-7, OPM-2, Pfeiffer, RAMOS, RC-K8, REC-1, RI-1, RL, RPMI-8226, SC-1, SK-MM-2, SR, SU-DHL-1, SU-DHL-10, SU-DHL-16, SU-DHL-4, SU-DHL-5, SU-DHL-6, U-DHL-8, Tanoue, THP-1, TOLEDO, U266B1, U-698-M, WSU-DLCL2, WSU-FSCCL, WSU-NHL, как представляющие гематологические раковые клеточные линии.
Гетероарильные соединения, описанные в настоящей заявке, имеют, или ожидается, что они должны иметь, значение ИК50 или значение GI50 <10 мкМ, при этом некоторые соединении имеют значение ИК50 или GI50 <1 мкМ, и другие имеют значение ИК50 или GI50 <0,1 мкМ.
5.2.12 Цитотоксическая активность в CLL клетках
Замороженные PBMC от CLL пациентов (Conversant Healthcare Системs, Inc.) оттаивали, промывали один раз и суспендировали в RPMI (Invitrogen), дополненной 10% FBS (HyClone) при 1 миллион клеток/мл. Типично для этих анализов использовали PBMC, презентирующие более чем 90% CD19+CD5+ бластных клеток, как определено методом проточной цитометрии (с использованием BD Biosciences антител). Клетки (100 мкл) высевали в 96-луночные планшеты. Гетероарильные соединения добавляли в 100 мкл среды в концентрации, варьирующей от 0,001 до 10 мкМ. Соединения можно добавлять отдельно или в сочетании с другими средствами (например, леналидомидом при 0,1-10 мкМ, флударабином при 0,01-10 мкМ или CD40L (Invitrogen) при 1-100 нг/мл). Клетки инкубировали в течение 3 дней.
Альтернативно, клетки можно предварительно обработать в течение ночи вторыми активными средствами в 50 мкл (дозировака, как указано выше) и затем обработать Гетероарильными Соединениями (0,001-10 мкМ) и инкубировать еще в течение 3 дней.
Цитотоксическую активность измеряли при помощи Annexin V/7AAD (BD Pharmingen) с использованием проточного цитометра FACSArray. Данные анализировали с использованием программы FlowJo. Результаты выражали либо в виде процента апоптических клеток (Аннексин V положительные клетки), либо в виде процента жизнеспособных клеток (Аннексин V отрицательные клетки).
Гетероарильные соединения, описанные в настоящей заявке, имеют, или ожидается, что они должны иметь, значение ИК50 <10 мкМ, при этом некоторые соединении имеют значение ИК50 <1 мкМ, и другие имеют значение ИК50 <0,1 мкМ.
5.2.13 In vivo пассивная кожная анафилаксия и пассивная реакция Arthus у крыс
Внутрикожная инъекция антител, специфических к динитрофенолу (DNP; крысиное-антиDNP IgE (PCA) или анти-DNP IgG (реакция Arthus)) с последующим добавлением внутривенной (IV) инъекцией антигена (DNP-BSA) вызывала быстрый воспалительный ответ, характеризующийся дегрануляцией тучных клеток, сосудистую проницаемость и отложение иммунного комплекса в местах инъекции. В этой модельной системе испытываемые соединения вводят в нескольких временных точках до введения антигена. Раствор крысиного анти-DNP IgE или IgG (1:1000 разведение) вводили путем внутрикожной инъекции. Через двадцать четыре часа вводили внутривенную инъекцию DNP, конъюгированного с бычьим сывороточным альбумином (DNP-BSA; 1 мг/кг массы тела) в растворе, содержащем 2% красителя Эванса синего. Степень отека измеряли в дорсальной коже крыс CD/IGS с использованием красителя Эванса синего в качестве индикатора локального отека ткани. Краситель экстрагировали из ткани после инкубации с формамидом и поглощательную способность этого экстракта определяли при 610 нм.
Гетероарильные соединения, описанные в настоящей заявке, имеют, или ожидается, что они должны иметь, значение ED50 <100 мг/кг, при этом некоторые соединения имеют значение ED50 <10 мг/кг, и другие имеют значение ED50 <1 мг/кг.
5.2.14 Модель коллаген-индуцированного артрита (CIA) у крысы in vivo
Ревматоидный артрит (RA) характеризуется хроническим воспалением суставов, которое в конце концов приводит к необратимому разрушению хряща. IgG-содержащие иммунные комплексы в большом количестве присуствуют в синовиальной ткани у субъектов с RA. CIA представляет собой широко принятую животную модель RA, который приводит к хроническому воспалительному синовиту, характеризующемуся образованием паннуса и разрушению сустава. В этой модели внутрикожная иммунизация природным коллагеном II типа, эмульгированным с неполным адъювантом Фрейнда, приводила к воспалительному полиартриту в течение 10 или 11 дней и последующему разрушению сустава в течение от 3 до 4 недель.
Вкратце, свиной коллаген II типа эмульгировали 1:1 с неполным адъювантом Фрейнда и самкам крыс Lewis вводили внутрикожно в 10 местах дорсальной области, используя 100 мкл коллагена на участок введения, в день 0. Начиная с дня развития артрита (День 10) животным вводили либо носитель качестве контроля, либо соединение. Задние лапы ежедневно оценивали на тяжесть клинического артрита с использованием стандартизированного способа на основании степени воспаления суставов. Рентгенограммы задних конечностей получали в конце испытания, и эти задние конечности анализировали на гистопатологические изменения. Можно было определить количество IgG антител к природному коллагену.
Гетероарильные соединения, описанные в настоящей заявке, имеют, или ожидается, что они должны иметь, значение ED50 <100 мг/кг, при этом некоторые соединения имеют значение ED50<10 мг/кг, и другие имеют значение ED50 <1 мг/кг.
5.2.15 Модель ксенотрансплантата рака
Человеческие раковые клеточные линии инъецировали бестимусным “голым” мышам. Для клеток, поддерживаемых in vitro, опухоли образовывали путем инъекции мышам точно определенных количеств клеток. Для опухолей, которые лучше распространялись in vivo, фрагменты опухолей от донорных мышей имплантировали небольшому числу мышей для сохранения или большему числу мышей для начала исследования. Типичный план эксперимента для определения эффективности включает введение одного или нескольких лекарственных средств имеющим опухоль мышам. Кроме того, аналогичным образом вводят и поддерживают сравнительные химиотерпевтические средства (положительный контроль) и отрицательные контроли. Пути введения могут включать подкожный (SC), интраперитонеальный (IP), внутривенный (IV), внутримышечный (IM) и пероральный (PO). Измерения опухолей и массы тела осуществляли в ходе испытания и регистрировали распространение болезни и смертность. Также можно осуществлять некропсию, гистопатологию, бактериологию, паразитологию, серологию и РЦР для лучшего понимания заболевания и действия лекарственного средства.
Некоторые из типичных человеческих раковых клеточных линий, которые можно использовать в описанных выше моделях ксенотрансплантата, представляют собой следующие: MDA MB-231, MCF7, MDA-MB-435 и T-47D клеточные линии для рака молочной железы; KM12, HCT-15, COLO 205, HCT-116 и HT29 клеточные линии для рака толстой кишки; NCI-H460 и A549 клеточные линии для рака легкого; CRW22, LNCAP, PC-3, PCC-3 и DU-145 клеточные линии для рака предстательной железы; LOX-IMVI и A375 клеточные линии для меланомы; SK-OV-3 и A2780 клеточные линии для рака яичника; и CAKI-I, A498, SN12C клеточные линии для рака почки U-87MG клеточная линия для глиомы и SU-DHL-4 клеточная линия для гематологического рака.
Гетероарильные соединения, описанные в настоящей заявке, имеют, или ожидается, что они должны иметь, значение ED50 <100 мг/кг, при этом некоторые соединения имеют значение ED50 <10 мг/кг, и другие имеют значение ED50 <1 мг/кг.
5.2.16 Гломерулонефрит с крысиными анти-GBM, модель для болезни Гудпастера
Инбредных крыс Sprague-Dawley иммунизировали при помощи 5 мг (подкожно) овечьего IgG в полном адъюванте Фрейнда, а через 5 дней (день 0) внутривенной инъекцией овечьей анти-крысиной гломерулярно-базально-мембранной (GBM) сыворотки (10 мг). Аккумуляцию нейтрофилов и макрофагов в почках измеряли при помощи иммуногистохимии (IHC) в момент времени 3 часа, 6 часов и 24 часа после iv инъекции овечьего анти-крысиного GBM. Через 24 часа заболевание прогрессировало с возрастанием тяжести протеинурии и развитием существенного гломерулярного и тубулоинтерстициального поражения к дню 14. Это измеряли при помощи гистологии, сывороточный креатинин и мочу собирали для определения содержания белка в моче методом с использованием бензетонийхлорида (McDowell TL, Benzethonium Chloride method for proteins adapted to centrifugal analysis, Clin Chem 31 (6); 864 (1985). Животным вводили либо носитель в качестве контроля, либо соединение, до или в определенные точки времени после IV инъекции овечьей анти-крысиной GBM сыворотки.
Гетероарильные соединения, описанные в настоящей заявке, имеют, или ожидается, что они должны иметь, значение ED50 <100 мг/кг, при этом некоторые соединения имеют значение ED50 <10 мг/кг, и другие имеют значение ED50 <1 мг/кг.
5.3 Активность Гетероарильных Соединений
Каждое из соединений в Таблице 1 испытывали в Syk HTRF анализе, и было обнаружено, что они обладают активностью, при этом все соединения имеют ИК50 ниже 10 мкМ в этом анализе, некоторые соединения имеют ИК50 между 0,005 нМ и 250 нМ (уровень активности D), некоторые соединения имеют ИК50 между 250 нМ и 500 нМ (уровень активности C), некоторые соединения имеют ИК50 между 500 нМ и 1 мкМ (уровень активности B), а другие имеют ИК50 между 1 мкМ и 10 мкМ (уровень активности A).
|
|
|
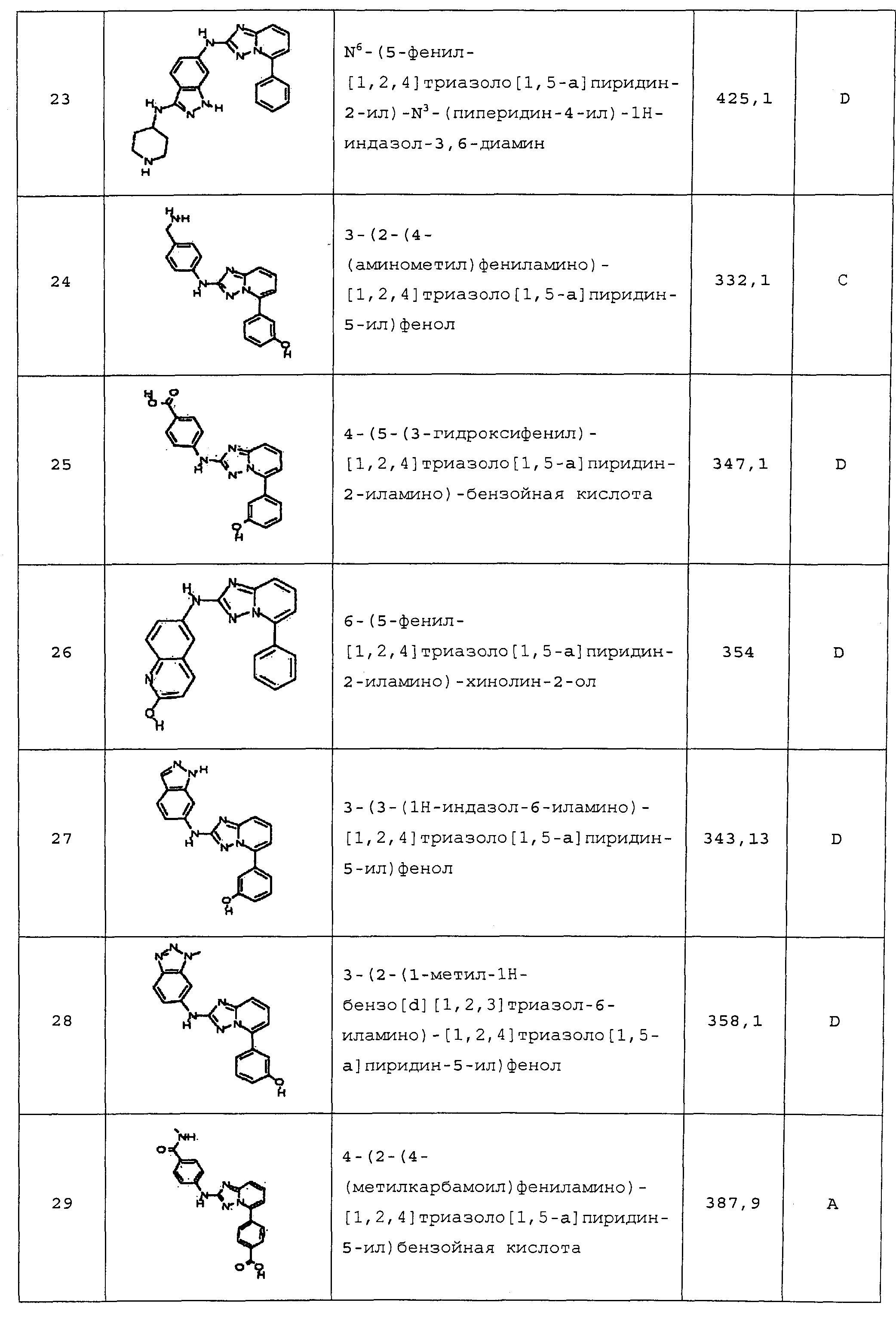
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
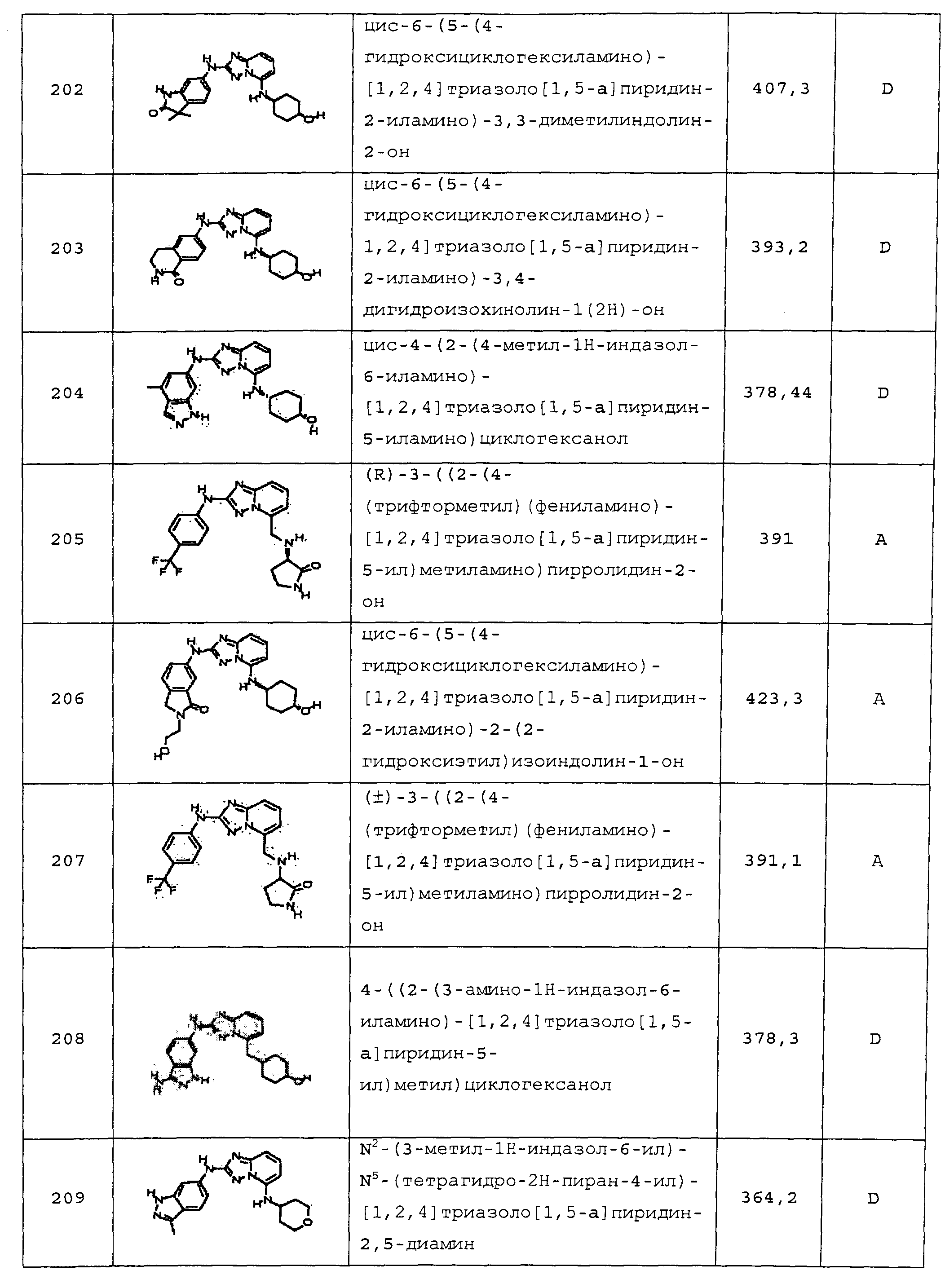
|
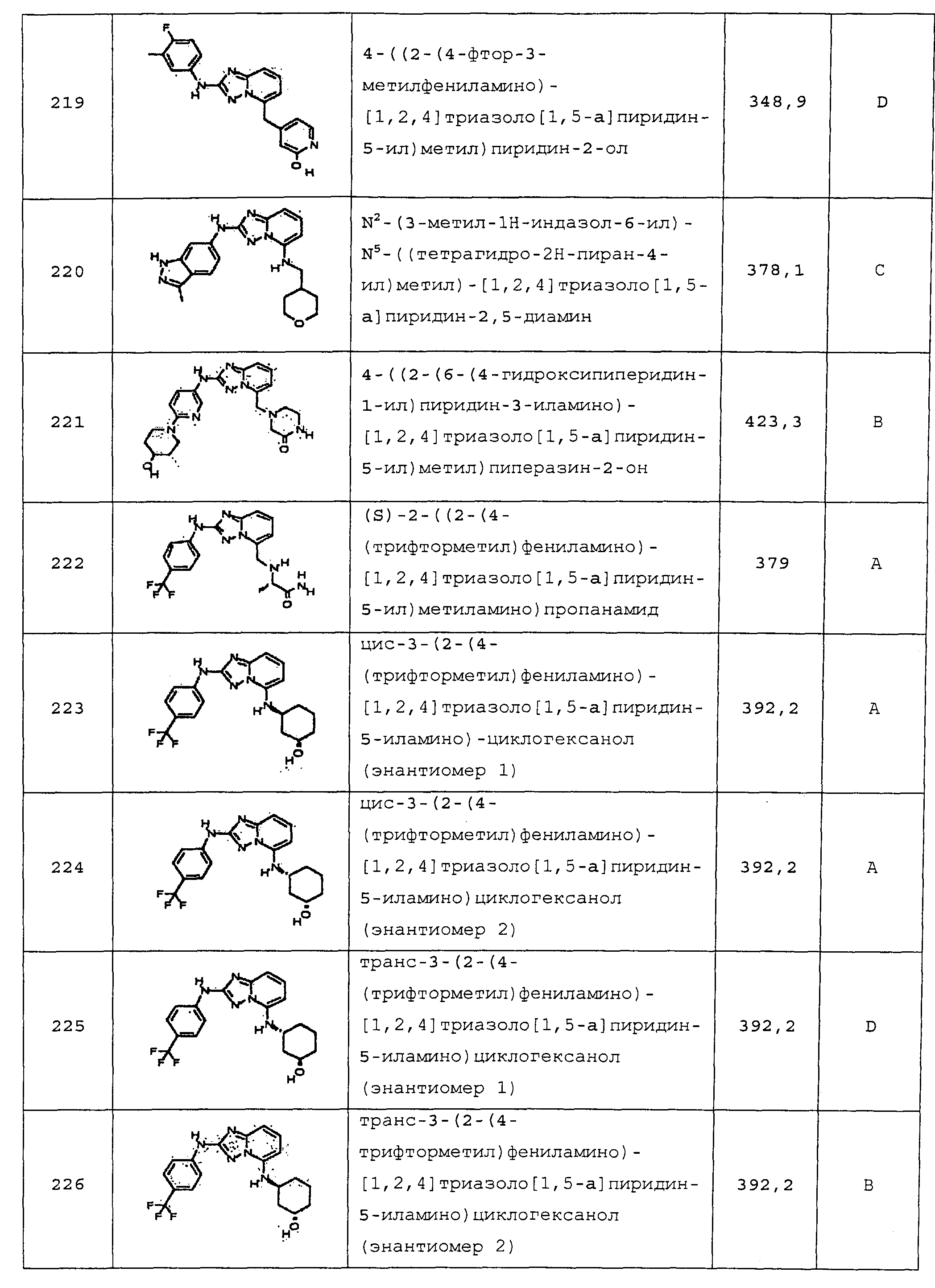
|
|
|
|
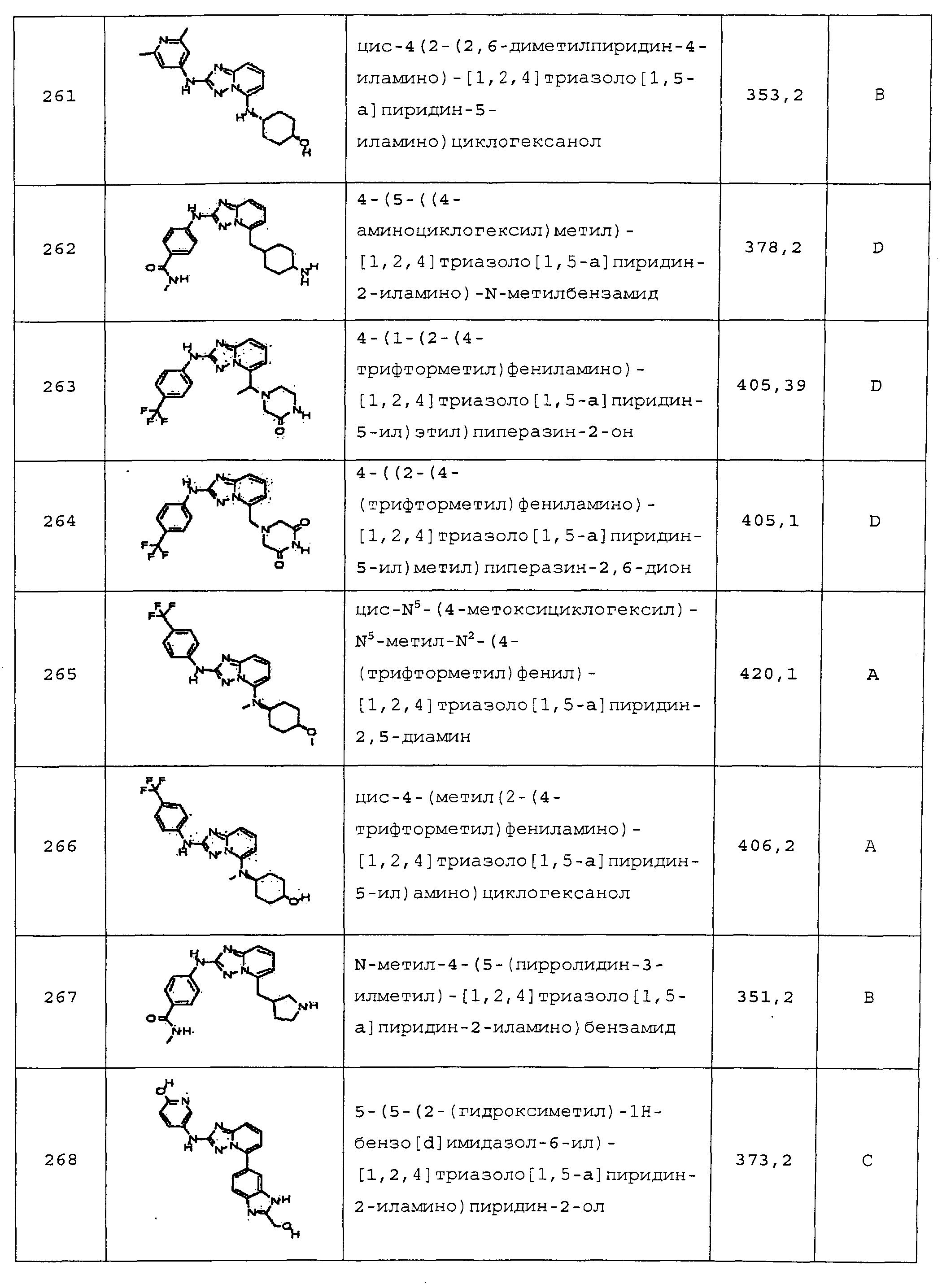
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Варианты воплощения, раскрытые в настоящей заявке, не ограничиваются объемом конкретных вариантов воплощения, раскрытых в примерах, которые предназначены в качестве иллюстрации некоторых аспектов раскрываемых вариантов воплощения, и любые варианты воплощения, которые являются функционально эквивалентными, охватываются настоящим раскрытием. Действительно, различные модификации вариантов воплощения, раскрытых в настоящей заявке, в дополнение к тем, которые показаны и описаны в настоящей заявке, будут очевидны специалистам в данной области и включены в объем прилагаемой далее формулы изобретения.
В настоящей заявке имеются ссылки на различные источники, раскрытие которых включено в настоящую заявку посредством ссылки во всей их полноте.