Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ СИСТЕМЫ НАПРАВЛЕННОЙ ДОСТАВКИ БЕЛКОВЫХ МОЛЕКУЛ (ОНКОЛИТИЧЕСКИХ БЕЛКОВ) В ОПУХОЛЕВЫЕ ТКАНИ НА ОСНОВЕ АКТИВИРОВАННЫХ ЛИМФОЦИТОВ
Вид РИД
Изобретение
Изобретение относится к области медицины и биотехнологии.
Современные методы противораковой терапии основаны на применении комплексного подхода с использованием сочетания средств, нацеленных на те или иные особенности биологических свойств опухолевых клеток. По мере углубления знаний об опухолевых клетках и выяснения наиболее универсальных механизмов, отличающих раковые клетки от нормальных, появляется возможность для разработки более эффективных, специфичных и безвредных для организма средств биологической терапии. В отличие от недостаточно специфично действующих химиотерапевтических средств, биологические методы терапии призваны использовать природные активности и механизмы для выявления и уничтожения раковых клеток.
В настоящее время все большее внимание исследователей привлекают перспективы использования подходов к терапии злокачественных новообразований, основанных на использовании биомолекул - белков, обладающих избирательным ингибирующим или даже токсическим действием в отношении опухолевых клеток, при этом не оказывая аналогичных эффектов на нормальные клетки. К подобным подходам можно отнести также использование специально разработанных антител против опухолеспецифичных эпитопов, которые подавляют опухолевый рост либо за счет блокирования рецепторов, необходимых для активной пролиферации опухоли, либо путем прямого цитотоксического влияния токсина, ковалентно соединенного с антителом. Другой группой белковых молекул, обладающих не меньшим потенциалом применения в терапии, являются онколитические белки - молекулы, которые при попадании в опухолевую клетку инициируют каскад проапоптотических сигналов, зависимый от патологических сигнальных путей, характерных для трансформированных клеток, но не для нормальных.
Главное преимущество белковых молекул по сравнению с традиционно используемыми цитотоксическими химическими соединениями состоит в том, что механизм их действия нацелен на фундаментальные особенности раковых клеток, что обеспечивает исключительно высокую избирательность их действия, в сочетании с низкой токсичностью для организма и отсутствием побочных эффектов. За счет этого, сильный кумулятивный эффект от воздействия нескольких препаратов на опухоль может быть достигнут без осложнений, обычно наблюдаемых при противораковой терапии.
В последнее время все больше работ описывают инактивацию опухолевого супрессора р53 как одну из основных причин возникновения рака. Как известно, р53 - это ключевой компонет, ответственный за запуск защитных сигнальных путей в ответ на повреждения ДНК в клетках млекопитающих. Накопление повреждений в генетическом аппарате клетки ведет к активации белка р53, результатом чего является остановка клеточного цикла и репликации ДНК, при сильных повреждениях происходит программируемая клеточная смерть или апоптоз. Таким образом работает механизм, способный предупреждать и удалять потенциально онкогенные клетки, а мутация или потеря р53 гена ведет к накоплению множества повреждений ДНК, перерождению клетки и, в конце концов, к раку. Примерно в 50% всех злокачественных опухолей обнаруживается мутация именно гена р53. Поэтому большое научное и прикладное значение имеют исследования, посвященные поиску альтернативных, р53-независимых путей апоптоза. Недавно было установлено, что таким механизмом обладает апоптоз, индуцируемый Апоптином.
Апоптин (продукт гена VP3 генома вируса инфекционной анемии кур) - пролин-богатый белок с молекулярной массой 13,6 кДа, состоящий из 121 аминокислотного остатка.
Больший интерес вызывает способность апоптина селективно индуцировать апоптоз трансформированных клеток птиц и млекопитающих, при этом не воздействуя на нормальные, нетрансформированные клетки. Исходя из полученных данных можно говорить о 70 различных опухолевых линиях, которые оказываются чувствительны к апоптину. Апоптин имеет область ядерной локализации, расположенную в С-концевом регионе белка между 80-121 аминокислотными остатками, и область ядерного экспорта, расположенную в Ν-концевом регионе, между 33 и 46 аминокислотными остатками. Во многих исследованиях показано, что ядерная локализация апоптина в опухолевых клетках необходима для индукции апоптоза, тогда как в нормальных клетках белок локализуется преимущественно в цитоплазме, где он нестабилен и быстро деградирует.
Как уже упоминалось, VP3 способен вызывать гибель только раковых клеток, при этом, не оказывая влияния на нормальные. Такую избирательность можно объяснить нуклео-цитоплазматическим переносом. Экспериментальные данные показали, что ядерный экспорт апоптина в нормальных клетках определяется уникальной сигнальной последовательностью (последовательность ядерного экспорта) с которой взаимодействует экспортин CRM1, осуществляя, таким образом, постоянный вывод белка из ядра. В раковых клетках обратного переноса не происходит, из-за фосфорилирования 108 треонина (108 Thr) в последовательности ядерного экспорта, которое блокирует данное взаимодействие с CRM1. Таким образом, фософрилирование Thr-108, как кажется, может являться одним из ключевых событий, необходимых для накопления апоптина в ядре и апоптин-индуцированного апоптоза. Дальнейшее, более подробное изучение этого явления показало, что фосфорилирование апоптина не является обязательным условием его опухоле-специфичного накопления в ядре. Так, замена 107 и 108 треонина на остатки аланина, и дальнейшая проверка субклеточной локализации мутантного апоптина в клетках MCF-7 и нормальных клетках не выявила каких-либо изменений. Данный белок все также накапливался в ядрах опухолевых клеток и в дальнейшем приводил к апоптозу. Это говорит о существовании других механизмов накопления апоптина в ядрах опухолевых клеток.
Медицинское применение онколитических белков, в том числе и апоптина, пока осложнено низкой эффективностью используемых способов доставки биологических препаратов в участки расположения опухоли. Еще одной проблемой является доставка белка непосредственно в опухолевую клетку, ведь в отличие от малых химических молекул, белки лишены способности проникать через плазматическую мембрану. Существенным ограничением также является иммуногенность белков и быстрое образование антител, которые, со временем, могут полностью нейтрализовать активность онколитического белка. Для того чтобы онколитические белки стали эффективным средством противоопухолевой терапии, нужно найти пути эффективного решения этих проблем: определить модификации структуры белка, необходимые для его беспрепятственного прохождения через плазматическую мембрану и разработать принципиально новые средства направленной доставки таких терапевтических агентов к опухолевым клеткам. Такие способы доставки должны, с одной стороны, защитить белок от действия антител, а с другой - приблизить высвобождение активного белка к месту расположения опухолевой клетки.
В настоящее время предпринимаются попытки адаптировать апоптин, как наиболее перспективный онколитический белок, для клинического применения.
Обладая высокой избирательностью действия в отношении опухолевых клеток, апоптин имеет хорошие перспективы для применения в терапии онкологических заболеваний. Для того чтобы обеспечить доставку апоптина в клетки опухоли, необходимо либо ввести в эти клетки генетический конструкт, экспрессирующий апоптин, либо модифицировать структуру апоптина, придав ему способность проникать в опухолевые клетки через плазматическую мембрану. Указанный первый способ доставки используется в противоопухолевой терапии при помощи онколитических вирусов, в то время как второй способ доставки позволяет использовать апоптин самыми различными способами: как традиционно, вводя синтетический рекомбинантный апоптин, так и с использованием биологических средств доставки.
Медицинские перспективы применения апоптина и онколитических белков, в целом, зависят от разработки средств доставки рекомбинантных белков в опухоль. Парентеральное введение синтезированного белка не позволит создать локальную высокую концентрацию в опухоли и несет риск иммунизации пациента к вводимому белку или развития аллергических реакций. Провести инъекцию непосредственно в опухоль возможно далеко не всегда, кроме того, такая инъекция может вызвать целый ряд осложнений. Оптимальным вариантом применения онколитических белков было бы присутствие в опухоли клеток-продуцентов этих белков. В этом случае воздействие было бы продолжительным, а концентрация препарата - максимальной в области опухоли. Для достижения этой цели обычно используют рекомбинантные вирусные векторы, собранные на основе лентивируса или аденовируса.
Векторы на основе лентивируса описаны, например, в Ye Feng и др., Construction of three recombinant lentiviruses containing apoptin driven by survivin promoter of different lengths and comparison of their tumor suppressing efficency in vitro, Journal of Third Military Medical University, 2012-01. Лентивирусные векторы позволят ввести и конститутивно экспрессировать рекомбинантный апоптин в клетках опухоли и окружающих ее тканях. Такая экспрессия будет более длительной, при этом опасности иммунизации против вируса практически не возникает, поскольку он не способен реплицироваться. Однако характер интеграции вирусной ДНК в геном несет риск его повреждения и, как следствие, дополнительной малигнизации опухоли.
Известен патент RU 2252255, описывающий рекомбинантные аденовирусные вектора, содержащие апоптин, для лечения рака, которые получают путем котрансфекции в хелперную клеточную линию 911 адапторных плазмид p.AMb-VP3 (в случае экспрессии белка VP3) или плазмид pMAb-VP2 (в случае экспрессии белка VP2) и плазмидной ДНК JM17. Плазмиды pAMb-VP3 несут ген апоптина в ориентации 5′-3′, экспрессия которого осуществляется под контролем аденовирусного главного позднего промотора. Плазмидная ДНК JM17 содержит полную ДНК аденовируса за исключением области Е1 и Е3. Плазмиды pMAb-VP2 несут ген апоптина, с 2 точечными мутациями в пределах кодирующей области.
Вектор доставки генов, способный индуцировать апоптоз в клетке, включающий фрагмент ДНК, кодирующий белок, обладающий апоптиноподобной активностью, при этом апоптоз индуцируется в раковых клетках и в меньшей степени или вообще не происходит в нормальных диплоидных нетрансформированных/незлокачественных клетках, причем вектор доставки генов является независимо инфицирующим вектором и представляет собой аденовирус.
Существенным недостатком этого метода является постепенно возникающая иммунизация пациента к конкретному аденовирусному штамму.
Известен патент RU 2492238 С1, который относится к рекомбинантной плазмидной ДНК pGEM-Puro-DS-Apo, несущей синтетический ген апоптина размером 363 п.н. с определенной нуклеотидной последовательностью, фланкированный фрагментами генома вируса осповакцины, имеющей размер 6298 п.н., молекулярную массу 4.19 мДа, и рекомбинантным штаммам вируса осповакцины, продуцирующим апоптин вируса анемии цыплят. При использовании этого метода будет наблюдаться также постепенно возникающая иммунизация пациента.
Описанные недостатки обуславливают необходимость разработки нового, невирусного, способа доставки и экспрессии рекомбинантных белков в опухоли
Известен патент US 5656465, касающийся способов доставки генов in vivo. Описано использование неинтегральных вирусных векторов, имеющих низкую репликативную эффективность для вставки гена в клетку, такую как лимфоцит или опухолевая клетка, является привилегированной системой для того, чтобы преобразовать такие клетки для использования в терапии соматической клетки или генотерапии. Гены вставляются в клетки-мишени, в частности в клетку-мишень, представляющую собой лимфоциты, проникающие в опухолевые ткани. Отмечается, что интерес представляют гены, кодирующие TNF, TGF-α, TGF-β, гемоглобин, интерлейкин-1 и тому подобное, а также биологически активные мутеины этих белков. Не упомянута возможность направленной доставки апоптина.
Задачей настоящего изобретения является разработка нового средства направленной доставки апоптина к опухолевым клеткам, которое позволяет, с одной стороны, защитить белок от действия антител, а с другой - приблизить высвобождение активного белка к месту расположения опухолевой клетки.
Технический результат: повышение способности апоптина проникать в опухолевые клетки и оказывать онколитический эффект в отношении всех клеток опухоли. Такая терапия может быть использована в сочетании с другими противоопухолевыми препаратами, что позволит сократить продолжительность лечения и снизить побочные эффекты.
Задача решается способом получения системы направленной доставки апоптина в опухолевые ткани. Способ характеризуюется тем, что модифицируют апоптин путем слияния с секреторным сигналом лактотрансферрина и трансдукторным сигналом (ST-CTP-апоптин), получают лентивирусный конструкт, экспрессирующий ST-CTP-апоптин, указанный конструкт используется для получения рекомбинантных лентивирусных частиц, дефектных по репликации и несущих модифицированный апоптин, которые затем вводятся в аутотрансплантированные лимфоциты, проникающие в опухолевые ткани.
В качестве средства доставки и продуцента онколитических белков предложены аутотрансплантированные лимфоциты, проникающие в опухолевые ткани (TIL, tumor infiltrating lymphocytes). Лимфоциты могут быть получены в ходе хирургического удаления опухоли или в процессе получения биопсии. Также могут быть использованы выделенные из периферической крови лимфоциты, активированные путем культивации в присутствие интерлейкина-2. Такая культивация повышает тропизм лимфоцитов к опухоли, и, после введения обратно в кровоток, существенная часть лимфоцитов локализуется в опухолевой ткани.
Основное отличие предлагаемого изобретения - использование онкотоксических лимфоцитов в качестве носителя и продуцента апоптина - является новым и не описанным в литературе. Такой подход позволит сочетать онколитическое действие апоптина с противоопухолевым эффектом клеточной и иммунотерапии злокачественных новообразований. Отличие от известного решения также в том, что в нем описаны конструкты неинтегрирующиеся в геном вектора, в то время как заявленный лентивирусный конструкт интегрируется.
Для решения задачи были разработаны сигнальные пептиды, обеспечивающие секрецию экспрессируемого онколитического белка из клетки и последующее проникновение внутрь окружающих клеток за счет белкового домена, обеспечивающего проникновение через плазматическую мембрану. В изобретении использовано свойство цитотоксических лимфоцитов проникать и накапливаться в опухоли. Экспрессия секретируемого онколитического белка лимфоцитом позволит высвобождать активные терапевтические молекулы непосредственно по месту расположения раковых клеток и снизить вероятность нейтрализации активного белка антителами.
Возможность осуществления изобретения продемонстрирована ниже представленными примерами.
Пример 1. Определение оптимального варианта рекомбинантного апоптина, обладающего максимальной онколитической активностью
В кДНК апоптина методом ПЦР интегрированы домен цитоплазматической трансдукции (СТР) и секреторный сигнал, и полученная последовательность клонирована в лентивирусный вектор. Создана серия конструктов, содержащих различные варианты СТР-домена (4 варианта, фрагмент ТАТ-белка ВИЧ (PTD-домен) и 3 синтетических пептида), и различные варианты ST-пептида (5 вариантов, 3 из которых синтетические, полученные на основании предсказаний НММ-алгоритма определения эффективности трансдукторного пептида, а 2 варианта взяты из естественных секретируемых белков, цистатина С и лактотрансферрина). Серия полученных конструктов введена в клетки-продуценты, и из них произведен отбор наиболее эффективного варианта. Для этого фильтрованной средой, в которой культивировались продуценты, обработаны клетки опухолевых линий SAOS2 и RKO, и проведена сравнительная оценка цитотоксичности каждого варианта белка. Такой подход позволяет определить функциональную активность белка в условиях, приближенным к реальным. В качестве контрольных конструкций, а также для визуальной оценки эффективности секреции и захвата модифицированного белка, получен набор продуцентов, секретирующих флуоресцентный белок, слитый с тестируемыми СТР- и ST-доменами.
Была создана серия генно-инженерных конструкций, направленных на экспрессию различных вариантов онколитического белка апоптина и красного флуоресцентного белка tagRFP. Были созданы конструкции, экспрессирующие «дикий» апоптин (wt-apoptin), апоптин, слитый с сигналами секреции (ST-apoptin), полученными из белков лактоферрина, цистатина С, а также тремя синтетическими ST-сигналами, полученными на основании предсказаний НММ-алгоритма определения эффективности секреторного пептида. Также получены конструкции, экспрессирующие апоптин, слитый с сигналами цитоплазматической трансдукции - один вариант, представляющий собой фрагмент ТАТ-белка ВИЧ (PTD-домен), и три синтетических пептида. Помимо конструкций, экспрессирующих апоптин, слитый по отдельности с сигналами секреции и цитоплазматической трансдукции (5 и 4 штуки, соответственно), были получены экспрессорные векторы, содержащие все варианты апоптина, слитого и с секреторным, и с трансдуктивным сигналом одновременно.
Все апоптин-экспрессирующие конструкции были введены методом лентивирусной трансфекции в культуры опухолевых клеток линий SAOS2 и RKO, и проведена сравнительная оценка цитотоксичности каждого варианта белка. Для этого у полученных рекомбинантных лентивирусов, после проведения концентрирования с полиэтиленгликолем, был определен титр (методом ОТ-ПЦР в реальном времени), а затем, после инфекции клеточных культур равным количеством вирусных частиц, было определено, в каком случае цитотоксичность максимальна. Фактически, различные варианты апоптина демонстрировали цитотоксичность, меньшую чем «дикий» апоптин (что и ожидалось), однако некоторые варианты, в том числе апоптин, слитый с секреторным сигналом лактотрансферрина и трансдукторным сигналом PTD, показали практически не изменившийся уровень цитотоксичности.
В параллели с этими опытами, клетки линий SAOS2 и RKO были трансфицированы tagRFP-содержащими конструкциями. После проведения селекции и сортинга, в результате которого 90-95% клеток в культуре стали tagRFP-экспрессирующими, клетки были смешаны в пропорции 1/1 с нетрансфицированными SAOS2 и RKO, соответственно. После ко-культивирования в течение 24 часов, сравнительная флуоресценция двух популяций ко-культивированных клеток была изменена на цитометре. На основании усиления характерной флуоресценции tagRFP в нетрансфицированных клеках были сделаны выводы об эффективности той или иной пары секреторного и трансдукторного пептидов. В результате экспериментов выяснилось, что наибольшей эффективностью из протестированных вариантов обладает пара секреторного сигнала лактотрансферрина и трансдукторного сигнала PTD.
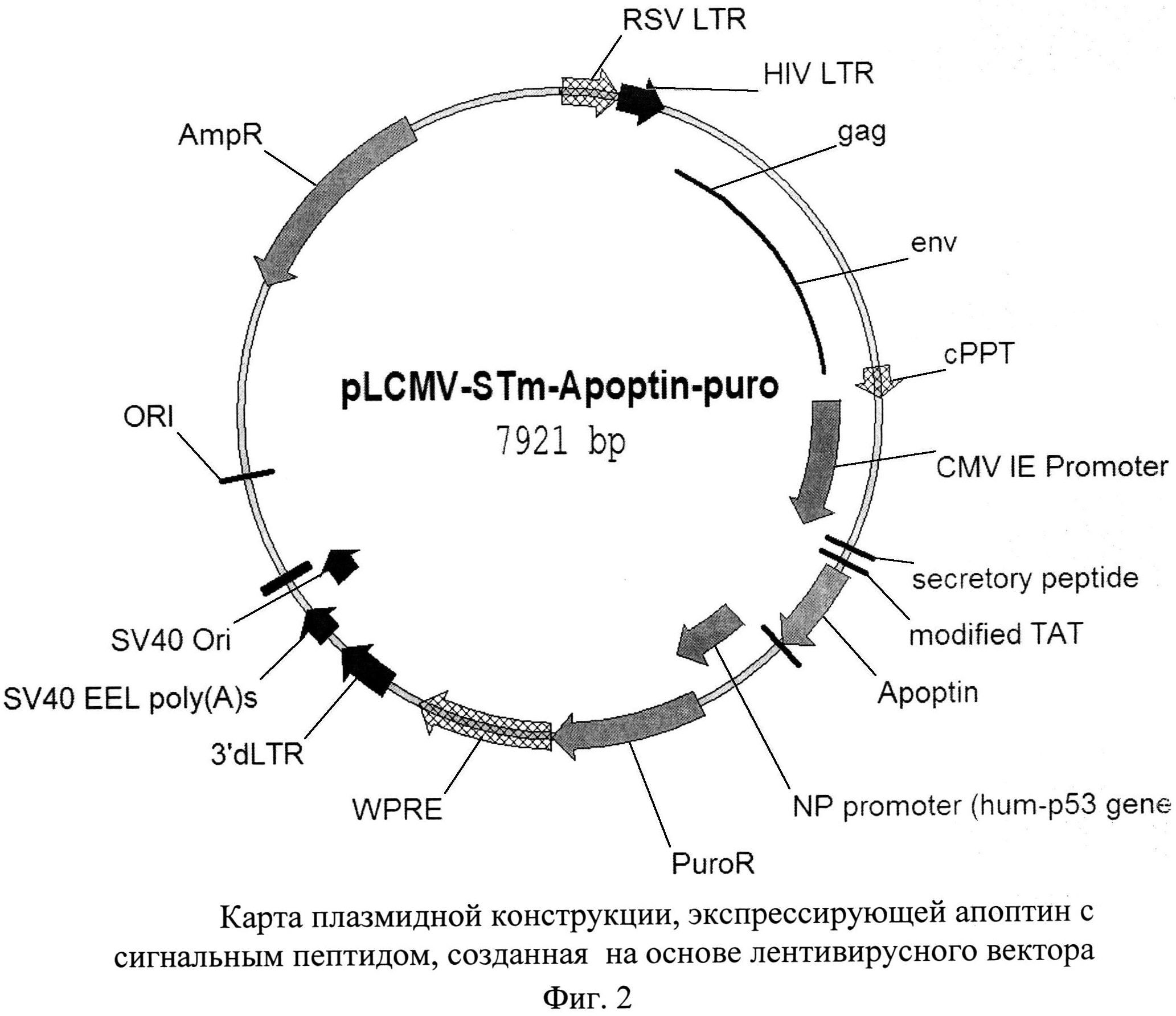
Последовательность апоптина с секреторными и трансдукторными пептидами SEQ ID NO 1 представлена на фиг. 1. Пример экспрессирующей конструкции, содержащей апоптин с сигнальным пептидом, представлен на фиг. 2.
Таким образом, была определена наиболее эффективная структура, с помощью которой онкотоксические белки могут быть введены в опухолевые клетки- ST-CTP-апоптин. Экспрессия ST-CTP-апоптина в небольшой части клеток опухоли, или клеток ткани, соседствующей с ней, приводит к долговременному присутствию высоких концентраций апоптина в межклеточном пространстве опухоли.
Пример 2. Культивирование и активация лимфоцитов на модельных животных, линии бестимусных мышей
Гомозиготам бестимусных мышей была привита опухоль, параллельно, у гетерозиготных животных той же линии из периферической крови были выделены клетки мононуклеарной фракции. Лимфоциты были трансдуцированы лентивирусным экспрессором tagRFP, и подвергнуты культивации в различных активирующих условиях (фитогемагглютинин, IL-2, IL-4, GM-CSF, лектины). После наработки достаточного количества активированных лимфоцитов, они были введены бестимусным мышам с привитыми опухолями. Затем, удаленная опухоль была проанализирована на проточном цитометре, с целью определения количества содержащихся в ней флуоресцентных лимфоцитов.
Пример 3. Сравнительное исследование противоопухолевой эффективности
Лентивирусный конструкт, экспрессирующий ST-CTP-апоптин, был введен в лимфоциты параллельно с контрольным лентивирусным конструктом. Клетки были подвергнуты идентичным условиям культивации и введены животным с привитыми опухолями. Противоопухолевая эффективность ST-CTP-апоптина оценена in vivo по измерению динамики развития опухолей у мышей, получивших апоптин-экспрессирующие и контрольные лимфоциты, экспрессирующие флуоресцентный белок. Введение лимфоцитов, экспрессирующих апоптин обуславливает значительно более высокую эффективность данного метода в отношении панели опухолевых клеток человека, культивируемых на бестимусных мышах.
Способ получения системы направленной доставки апоптина в опухолевые ткани, включающий получение лентивирусного конструкта, экспрессирующего модифицированный апоптин, отличающийся тем, что модифицированный апоптин представляет собой апоптин, слитый с секреторным сигналом лактотрансферрина и трансдукторным сигналом (ST-CTP-апоптин) и имеющий последовательность SEQ ID NO 1, представленную на фиг. 1, получают лентивирусный конструкт, экспрессирующий ST-CTP-апоптин, имеющий расположение элементов, указанное на фиг. 2, с последующим получением рекомбинантных лентивирусных частиц, дефектных по репликации и несущих модифицированный апоптин, которые затем вводятся в Т-лимфоциты (TILs), полученные при хирургическом удалении опухоли или в процессе получения биопсии, которые обладают способностью проникать в опухолевые ткани, с последующей аутотрансплантацией указанных лимфоцитов указанному пациенту.