Результат интеллектуальной деятельности: ПРОИЗВОДНОЕ 5-ГИДРОКСИПИРИМИДИН-4-КАРБОКСАМИДА
Вид РИД
Изобретение
ПРОИЗВОДНОЕ 5-ГИДРОКСИПИРИМИДИН-4-КАРБОКСАМИДА
ОПИСАНИЕ
Область техники, к которой относится изобретение
Настоящее изобретение относится к соединениям с низкой молекулярной массой, обладающим активностью, усиливающей продуцирование эритропоэтина.
Уровень техники
Эритропоэтин (далее сокращенно обозначаемый как ЕРО) является гликопротеиновым гормоном, который имеет существенное значение для гемопоэза эритроцитов. Он обычно секретируется из почек и стимулирует продуцирование эритроцитов воздействием на эритроцитные стволовые клетки, присутствующие к костном мозге. При заболеваниях, у которых имеется присущее им снижение в продуцировании ЕРО (таких как хроническая почечная недостаточность), поскольку продуцирование эритроцитов снижается и обнаруживаются симптомы анемии, предложено лечение в форме заместительной терапии с применением ген-рекомбинантного ЕРО человека. Однако, этот ген-рекомбинантный ЕРО человека характеризуется как имеющий недостатки, заключающиеся в том, что он является биологическим препаратом и связан с большими затратами за заботу о здоровье, является мало удобным из-за того, что вводится инъекцией, и обладает антигенностью.
С другой стороны, известно, что такие соединения, как производные пиридина, производные циннолина, производные хинолина, производные изохинолина (см. патентные документы 1-6 и 8), производные 6-гидрокси-2,4-диоксотетрагидропиримидина (см. патентный документ 7) или производные 4-гидроксипиримидин-5-карбоксамида (см. патентный документ 9), являются имеющими низкую молекулярную массу индукторами ЕРО. Кроме того, известны производные 5-гидроксипиримидин-4-карбоксамида (международная публикация № WO 2009/131127 или международная публикация № WO 2009/131129).
Документы известного уровня техники
Патентные документы
[Патентный документ 1] международная публикация № WO 2003/049686
[Патентный документ 2] международная публикация № WO 2003/053997.
[Патентный документ 3] международная публикация № WO 2004/108681.
[Патентный документ 4] международная публикация № WO 2006/133391.
[Патентный документ 5] международная публикация № WO 2007/038571.
[Патентный документ 6] международная публикация № WO 2007/136990.
[Патентный документ 7] международная публикация № WO 2007/150011.
[Патентный документ 8] международная публикация № WO 2008/002576.
[Патентный документ 9] международная публикация № WO 2009/117269.
Описание изобретения
Задача изобретения
Авторы настоящего изобретения провели исследования с целью предоставления новых соединений с низкой молекулярной массой, которые обладают превосходной, повышающей продуцирование ЕРО активностью и являются применимыми для лечения заболеваний, вызванных пониженным продуцированием ЕРО, и с целью предоставления лекарственного средства, содержащего такие соединения.
Способы достижения цели
При разрешении указанных выше проблем авторами настоящего изобретения обнаружено, что новые соединения, имеющие структуру 5-гидроксипиримидин-4-карбоксамида, обладают превосходной, повышающей продуцирование ЕРО активностью и что они являются эффективными для лечения заболеваний, вызванных пониженным продуцированием ЕРО, что, таким образом, привело к завершению настоящего изобретения.
Согласно настоящему изобретению, предложены новые производные 5-гидроксипиримидин-4-карбоксамида, представленные нижеследующей общей формулой (1), их фармакологически приемлемые сложные эфиры или их фармакологически приемлемые соли (далее сообща называемые соединениями настоящего изобретения).
А именно, настоящее изобретение относится к следующим пунктам:
(1) соединению, представленному следующей общей формулой (1):
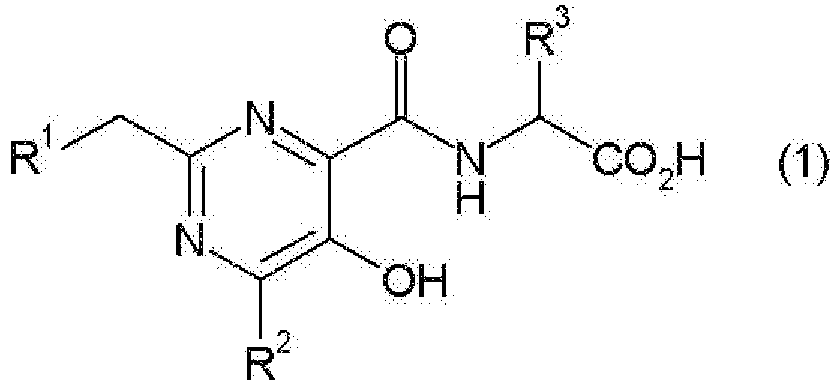
в которой
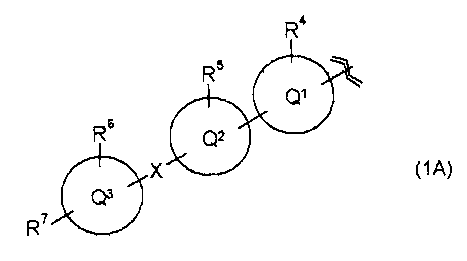
R1 представляет собой группу, представленную следующей общей формулой (1А)
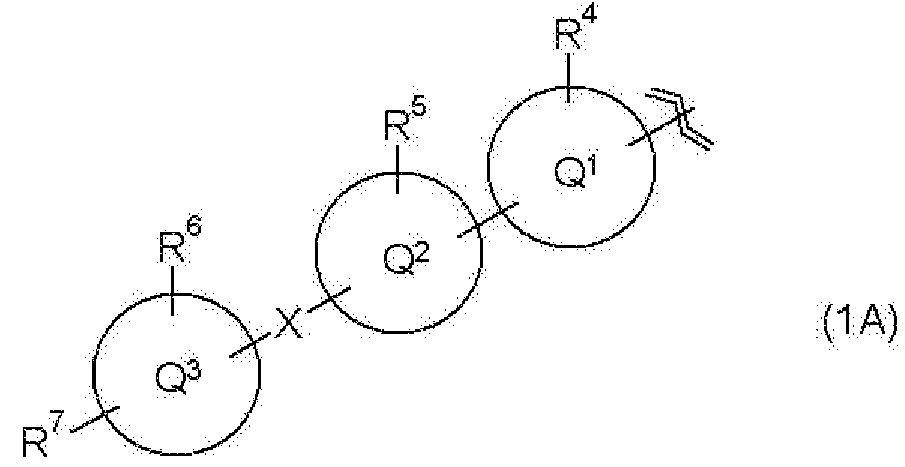
в которой
R4 и R5, каждый независимо, представляет собой атом водорода, атом галогена или С1-С6алкильную группу,
R6 представляет собой атом водорода, атом галогена, С1-С6алкильную группу, карбамоильную группу, (С1-С6алкил)карбамоильную группу или (С1-С6алкил)(С1-С6алкил)карбамоильную группу,
R7 представляет собой гидроксиС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, гидроксигалогенС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, С1-С6алкоксиС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, (С1-С6алкокси)карбонильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, С1-С6алкоксиС1-С6алкоксиС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, гидроксиС1-С6алкоксигруппу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, С1-С6алкилкарбамоильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, (С1-С6алкил)(С1-С6алкил)карбамоильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, С1-С6алкоксикарбамоильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, С1-С6алкилкарбамоилС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, (С1-С6алкил)(С1-С6алкил)карбамоилС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, С2-С7алканоиламиногруппу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, С2-С7алканоиламиноС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, или С2-С7алканоилоксиС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α,
группа заместителей α представляет собой группу, состоящую из оксогруппы, гидроксигруппы, аминогруппы, карбоксигруппы, карбамоильной группы, С1-С6алкоксигруппы, галогенС1-С6алкоксигруппы, С2-С7алканоиламиногруппы, гидроксииминогруппы и С1-С6алкоксииминогруппы,
кольцо Q1 представляет собой моноциклическую гетероциклическую группу (где гетероциклическая группа включает в себя 5-7-членный ароматический гетероцикл и неароматический гетероцикл и содержит 1 или 2 атома, выбранные из группы, состоящей из атома азота, атома серы и атома кислорода),
кольцо Q2 представляет собой моноциклическую углеводородную циклическую группу (где углеводородная циклическая группа включает в себя 5-7-членное ароматическое углеводородное кольцо и неароматическое углеводородное кольцо), или моноциклическую гетероциклическую группу (где гетероциклическая группа включает в себя 5-7-членный ароматический гетероцикл и неароматический гетероцикл и содержит 1 или 2 атома, выбранные из группы, состоящей из атома азота, атома серы и атома кислорода),
кольцо Q3 представляет собой моноциклическую углеводородную циклическую группу (где углеводородная циклическая группа включает в себя 5-7-членное ароматическое углеводородное кольцо и неароматическое углеводородное кольцо), или моноциклическую гетероциклическую группу (где гетероциклическая группа включает в себя 5-7-членный ароматический гетероцикл и неароматический гетероцикл и содержит 1 или 2 атома, выбранные из группы, состоящей из атома азота, атома серы и атома кислорода), и
Х представляет собой простую связь, метилен или этилен,
R2 представляет собой С1-С3алкильную группу или метилсульфанильную группу и
R3 представляет собой атом водорода или метильную группу, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли,
(2) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно указанному выше пункту (1), где R2 представляет собой метильную группу или метилсульфанильную группу,
(3) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно указанному выше пункту (1), где R2 представляет собой метильную группу,
(4) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(3), где R3 представляет собой атом водорода,
(5) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(4), где R4 представляет собой атом водорода,
(6) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(5), где R5 представляет собой атом водорода, атом галогена или метильную группу,
(7) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(5), где R5 представляет собой атом водорода,
(8) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(7), где R6 представляет собой атом водорода, атом галогена или метильную группу,
(9) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(7), где R6 представляет собой атом водорода,
(10) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(9), где R7 представляет собой гидроксиС1-С6алкильную группу, гидроксигалогенС1-С6алкильную группу, С1-С6алкоксиС1-С6алкильную группу, гидроксиС1-С6алкоксиС1-С6алкильную группу, (С1-С6алкокси)карбонильную группу, С1-С6алкоксиС1-С6алкоксиС1-С6алкильную группу, гидроксиС1-С6алкоксигруппу, С1-С6алкилкарбамоильную группу, (С1-С6алкил)(С1-С6алкил)карбамоильную группу, гидроксиС1-С6алкилкарбамоильную группу, С1-С6алкоксикарбамоильную группу, С1-С6алкилкарбамоилС1-С6алкильную группу, (С1-С6алкил)(С1-С6алкил)карбамоилС1-С6алкильную группу или гидроксиС1-С6алкилкарбамоилС1-С6алкильную группу,
(11) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(9), где R7 представляет собой гидроксиметильную группу, 1-гидроксиэтильную группу, 2-гидроксиэтильную группу, 1,1-дифтор-2-гидроксиэтильную группу, 2-гидроксипропильную группу, 3-гидроксипропильную группу, 1,1-дифтор-2-гидроксипропильную группу, 2-гидроксибутильную группу, 2-гидрокси-1,1-диметилэтильную группу, 1,1-дифтор-2-гидрокси-2-метилпропильную группу, метоксиметильную группу, 2-гидрокси-3-метоксипропильную группу, метоксикарбонильную группу, этоксикарбонильную группу, метоксиметоксиметильную группу, 1-метоксиметоксиэтильную группу, 2-гидроксиэтоксигруппу, метилкарбамоильную группу, диметилкарбамоильную группу, метилкарбамоилметильную группу, диметилкарбамоилметильную группу, гидроксиэтилкарбамоильную группу или гидроксиэтилкарбамоилметильную группу,
(12) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(9), где R7 представляет собой гидроксиметильную группу, 1-гидроксиэтильную группу, 2-гидроксиэтильную группу, 2-гидроксипропильную группу, 3-гидроксипропильную группу, 2-гидроксибутильную группу, 2-гидрокси-1,1-диметилэтильную группу, метоксиметильную группу, 2-гидрокси-3-метоксипропильную группу, этоксикарбонильную группу, 1-метоксиметоксиэтильную группу, 2-гидроксиэтоксигруппу, метилкарбамоильную группу, диметилкарбамоильную группу или диметилкарбамоилметильную группу,
(13) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(12), где кольцо Q1 представляет собой моноциклическую гетероциклическую группу (где гетероциклическая группа включает в себя 6-членный ароматический гетероцикл и неароматический гетероцикл и содержит 1 или 2 атома азота),
(14) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(12), где кольцо Q1 представляет собой пиперидильную группу,
(15) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(14), где кольцо Q2 представляет собой моноциклическую углеводородную циклическую группу (где углеводородная циклическая группа включает в себя 6-членное ароматическое углеводородное кольцо и неароматическое углеводородное кольцо) или моноциклическую гетероциклическую группу (где гетероциклическая группа включает в себя 6-членный ароматический гетероцикл и неароматический гетероцикл и содержит 1 или 2 атома азота),
(16) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(14), где кольцо Q2 представляет собой фенильную группу или пиридильную группу,
(17) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(16), где кольцо Q3 представляет собой моноциклическую углеводородную циклическую группу (где углеводородная циклическая группа включает в себя 6-членное ароматическое углеводородное кольцо и неароматическое углеводородное кольцо) или моноциклическую гетероциклическую группу (где гетероциклическая группа включает в себя 6-членный ароматический гетероцикл и неароматический гетероцикл и содержит 1 или 2 атома азота),
(18) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(16), где кольцо Q3 представляет собой фенильную группу или пиридильную группу,
(19) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(18), где Х представляет собой одинарную связь или метилен,
(20) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(4), где
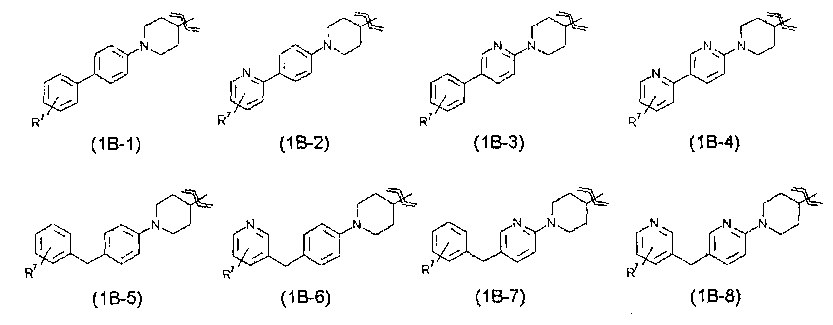
R1 представляет собой группу, представленную следующей общей формулой (1В)
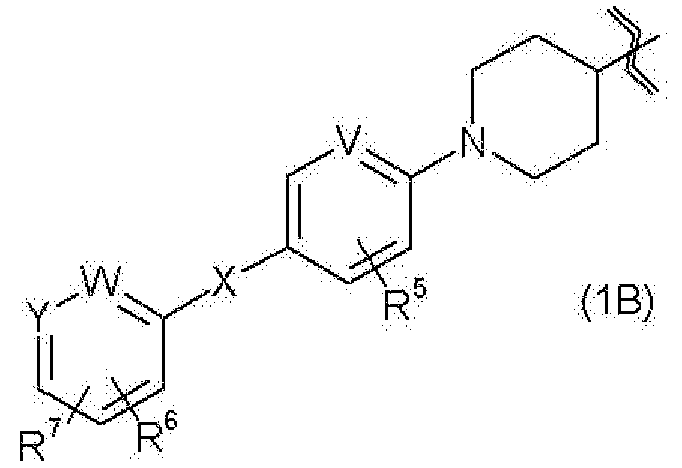
где
R5 представляет собой атом водорода, атом галогена или С1-С6алкильную группу,
R6 представляет собой атом водорода, атом галогена, С1-С6алкильную группу, карбамоильную группу, С1-С6алкилкарбамоильную группу или (С1-С6алкил)(С1-С6алкил)карбамоильную группу,
R7 представляет собой гидроксиметильную группу, 1-гидроксиэтильную группу, 2-гидроксиэтильную группу, 1,1-дифтор-2-гидроксиэтильную группу, 2-гидроксипропильную группу, 3-гидроксипропильную группу, 1,1-дифтор-2-гидроксипропильную группу, 2-гидроксибутильную группу, 2-гидрокси-1,1-диметилэтильную группу, 1,1-дифтор-2-гидрокси-2-метилпропильную группу, метоксиметильную группу, 2-гидрокси-3-метоксипропильную группу, метоксикарбонильную группу, этоксикарбонильную группу, метоксиметоксиметильную группу, 1-метоксиметоксиэтильную группу, 2-гидроксиэтоксигруппу, метилкарбамоильную группу, диметилкарбамоильную группу, метилкарбамоилметильную группу, диметилкарбамоилметильную группу, гидроксиэтилкарбамоильную группу или гидроксиэтилкарбамоилметильную группу,
V, W и Y, каждый независимо, представляют собой атом углерода (имеющий 1 атом водорода) или атом азота и
Х представляет собой одинарную связь или метилен,
(21) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(4), где
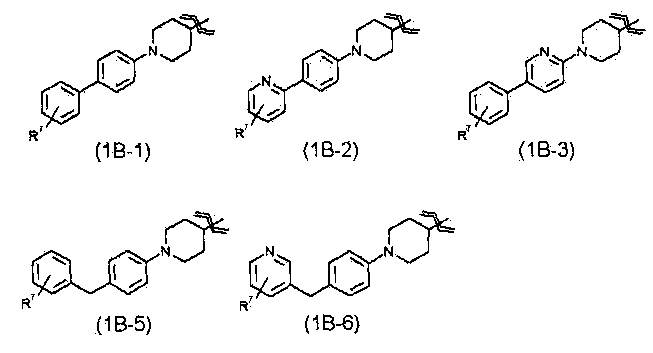
R1 представляет собой группу, представленную любой из следующих формул от общей формула (1В-1) до общей формулы (1В-8)
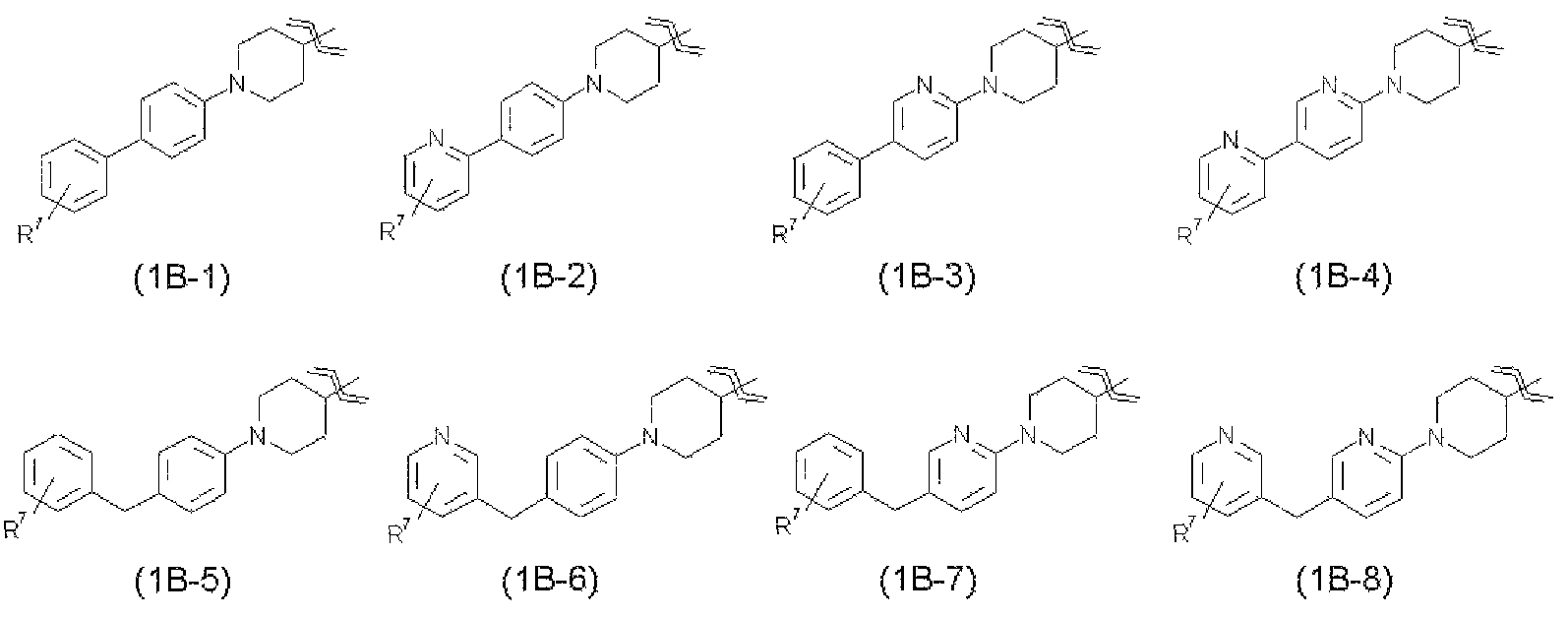
где
R7 представляет собой гидроксиметильную группу, 1-гидроксиэтильную группу, 2-гидроксиэтильную группу, 1,1-дифтор-2-гидроксиэтильную группу, 2-гидроксипропильную группу, 3-гидроксипропильную группу, 1,1-дифтор-2-гидроксипропильную группу, 2-гидроксибутильную группу, 2-гидрокси-1,1-диметилэтильную группу, 1,1-дифтор-2-гидрокси-2-метилпропильную группу, метоксиметильную группу, 2-гидрокси-3-метоксипропильную группу, метоксикарбонильную группу, этоксикарбонильную группу, метоксиметоксиметильную группу, 1-метоксиметоксиэтильную группу, 2-гидроксиэтоксигруппу, метилкарбамоильную группу, диметилкарбамоильную группу, метилкарбамоилметильную группу, диметилкарбамоилметильную группу, гидроксиэтилкарбамоильную группу или гидроксиэтилкарбамоилметильную группу,
(22) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(4), где
R1 представляет собой группу, представленную любой из следующей общей формулы (1В-1), общей формулы (1В-2), общей формулы (1В-3), общей формулы (1В-4), общей формулы (1В-5) или общей формула (1В-6)
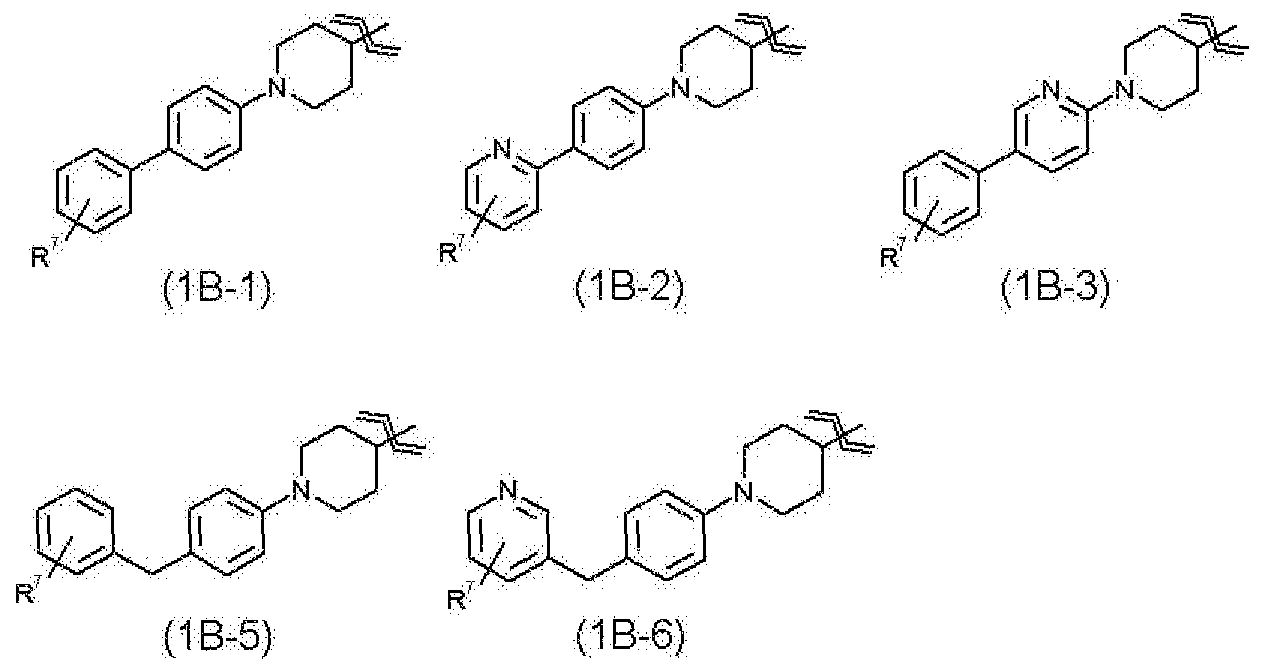
где
R7 представляет собой гидроксиметильную группу, 1-гидроксиэтильную группу, 2-гидроксиэтильную группу, 1,1-дифтор-2-гидроксиэтильную группу, 2-гидроксипропильную группу, 3-гидроксипропильную группу, 1,1-дифтор-2-гидроксипропильную группу, 2-гидроксибутильную группу, 2-гидрокси-1,1-диметилэтильную группу, 1,1-дифтор-2-гидрокси-2-метилпропильную группу, метоксиметильную группу, 2-гидрокси-3-метоксипропильную группу, метоксикарбонильную группу, этоксикарбонильную группу, метоксиметоксиметильную группу, 1-метоксиметоксиэтильную группу, 2-гидроксиэтоксигруппу, метилкарбамоильную группу, диметилкарбамоильную группу, метилкарбамоилметильную группу, диметилкарбамоилметильную группу, гидроксиэтилкарбамоильную группу или гидроксиэтилкарбамоилметильную группу,
(23) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (20)-(22), где R7 представляет собой гидроксиметильную группу, 1-гидроксиэтильную группу, 2-гидроксиэтильную группу, 2-гидроксипропильную группу, 3-гидроксипропильную группу, 2-гидроксибутильную группу, 2-гидрокси-1,1-диметилэтильную группу, метоксиметильную группу, 2-гидрокси-3-метоксипропильную группу, этоксикарбонильную группу, 1-метоксиметоксиэтильную группу, 2-гидроксиэтоксигруппу, метилкарбамоильную группу, диметилкарбамоильную группу или диметилкарбамоилметильную группу,
(24) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (20)-(22), где в случае, когда R7 представляет собой группу, имеющую гидроксигруппу, (гидроксиС1-С6алкильную группу, гидроксигалогенС1-С6алкильную группу, гидроксиС1-С6алкоксигруппу, гидроксиС1-С6алкилкарбамоильную группу или гидроксиС1-С6алкилкарбамоилС1-С6алкильную группу), гидроксигруппа образует сложноэфирную связь с С1-С6алканоильной группой,
(25) соединению или его фармакологически приемлемой соли согласно указанному выше пункту (1), выбранному из следующих соединений:
({[5-гидрокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[4'-(ацетоксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(1-гидроксиэтил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(2-гидроксиэтил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(2-гидроксипропил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(2-гидрокси-1,1-диметилэтил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[4'-(диметилкарбамоил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-6-метил-2-({1-[4'-(метилкарбамоил)дифенил-4-ил]пиперидин-4-ил}метил)пиримидин-4-ил]карбонил}амино)уксусной кислоты,
[({2-[(1-{4'-[2-(диметиламино)-2-оксоэтил]дифенил-4-ил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({5-гидрокси-2-[(1-{4-[4-(гидроксиметил)бензил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({5-гидрокси-2-[(1-{4-[3-(гидроксиметил)бензил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({5-гидрокси-2-[(1-{4-[5-(1-гидроксиэтил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
{[(5-гидрокси-2-{[1-(4-{5-[1-(метоксиметокси)этил]пиридин-2-ил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил)карбонил]амино}уксусной кислоты,
[({2-[(1-{4-[5-(1-ацетоксиэтил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({5-гидрокси-2-[(1-{4-[5-(гидроксиметил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({2-[(1-{4-[5-(этоксикарбонил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({2-[(1-{4-[2-(этоксикарбонил)бензил]фенил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
{[(5-гидрокси-2-{[1-(4-{[6-(2-гидроксиэтокси)пиридин-3-ил]метил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил)карбонил]амино}уксусной кислоты,
[({5-гидрокси-2-[(1-{5-[4-(гидроксиметил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({5-гидрокси-2-[(1-{5-[4-(2-гидроксипропил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({5-гидрокси-2-[(1-{5-[4-(2-гидрокси-1,1-диметилэтил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
({[2-({1-[2-хлор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(гидроксиметил)-2-метилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[3'-хлор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(гидроксиметил)-2'-метилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(гидроксиметил)-2,3'-диметилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(2-гидроксибутил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
[({5-гидрокси-2-[(1-{4-[4-(2-гидроксипропил)бензил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({5-гидрокси-2-[(1-{4-[4-(2-гидрокси-1,1-диметилэтил)бензил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
({[2-({1-[4'-(1,1-дифтор-2-гидроксиэтил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[4'-(1,1-дифтор-2-гидроксипропил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[4'-(1,1-дифтор-2-гидрокси-2-метилпропил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
{[(5-[(2,2-диметилпропаноил)окси]-2-{[1-(4'-{[(2,2-диметилпропаноил)окси]метил}дифенил-4-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил)карбонил]амино}уксусной кислоты,
{[(2-{[1-(4'-{[(2,2-диметилпропаноил)окси]метил}дифенил-4-ил)пиперидин-4-ил]метил}-5-гидрокси-6-метилпиримидин-4-ил)карбонил]амино}уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(метоксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[2'-фтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[3'-фтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[2-фтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[3-фтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(гидроксиметил)-3'-метилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[3',5'-дифтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[3',5'-дихлор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[3',5'-диметил-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
[({5-гидрокси-2-[(1-{4'-[2-гидрокси-3-метоксипропил]дифенил-4-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(3-гидроксипропил]дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(гидроксиметил)-3'-изопропилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
[({2-[(1-{5-[3-фтор-4-(гидроксиметил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({2-[(1-{5-[3-хлор-4-(гидроксиметил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты или
[({5-гидрокси-2-[(1-{5-[4-(гидроксиметил)-3-метилфенил]пиридин-2-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
(26) фармацевтической композиции, содержащей в качестве активного ингредиента соединение, его фармакологически приемлемый сложный эфир или его фармакологически приемлемую соль согласно любому из указанных выше пунктов от (1) до (25),
(27) фармацевтической композиции согласно указанному выше пункту (26) для профилактики и/или лечения анемии,
(28) фармацевтической композиции согласно указанному выше пункту (27), где анемия является нефрогенной анемией, анемией недоношенности, анемией, сопутствующей хроническим заболеваниям, анемией, сопутствующей химиотерапии рака, раковой анемией, анемией, связанной с воспалением, или анемией, сопутствующей застойной сердечной недостаточности,
(29) фармацевтической композиции согласно указанному выше пункту (27), где анемия является анемией, сопутствующей хроническому заболеванию почек,
(30) фармацевтической композиции согласно указанному выше пункту (26) для продуцирования эритропоэтина,
(31) применению соединения, его фармакологически приемлемого сложного эфира или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(25) для получения лекарственного средства,
(32) применению согласно указанному выше пункту (31), где лекарственное средство является лекарственным средством для профилактики и/или лечения анемии,
(33) применению согласно указанному выше пункту (32), где анемия является нефрогенной анемией, анемией недоношенности, анемией, сопутствующей хроническим заболеваниям, анемией, сопутствующей химиотерапии рака, раковой анемией, анемией, связанной с воспалением, или анемией, сопутствующей застойной сердечной недостаточности,
(34) анемия согласно указанному выше пункту (32), где анемия является анемией, сопутствующей хроническому заболеванию почек,
(35) способу продуцирования эритропоэтина, содержащему введение фармакологически эффективного количества соединения, его фармакологически приемлемого сложного эфира или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(25) млекопитающему или птице,
(36) способу лечения или профилактики заболевания, содержащий введение фармакологически эффективного количества соединения, его фармакологически приемлемого сложного эфира или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(25) млекопитающему,
(37) способу согласно указанному выше пункту (36), где заболеванием является анемия,
(38) способу согласно указанному выше пункту (36), где заболеванием является нефрогенная анемия, анемия недоношенности, анемия, сопутствующая хроническим заболеваниям, анемия, сопутствующая химиотерапии рака, раковая анемия, анемия, связанная с воспалением, или анемия, сопутствующая застойной сердечной недостаточности,
(39) способу согласно указанному выше пункту (36), где заболеванием является анемия, сопутствующая хроническому заболеванию почек,
(40) способу согласно любому из указанных выше пунктов (36)-(39), где млекопитающим является человек,
(41) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно любому из указанных выше пунктов (1)-(25) для применения в способе лечения или профилактики заболевания,
(42) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно указанному выше пункту (41), где заболеванием является анемия,
(43) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно указанному выше пункту (41), где заболеванием является нефрогенная анемия, анемия недоношенности, анемия, сопутствующая хроническим заболеваниям, анемия, сопутствующая химиотерапии рака, раковая анемия, анемия, связанная с воспалением, или анемия, сопутствующая застойной сердечной недостаточности, или
(44) соединению, его фармакологически приемлемому сложному эфиру или его фармакологически приемлемой соли согласно указанному выше пункту (41), где заболеванием является анемия, сопутствующая хроническому заболеванию почек.
В одном аспекте настоящее изобретение предлагает
(45) соединение, его фармакологически приемлемый сложный эфир или его фармакологически приемлемую соль согласно указанному выше пункту (1), где
R6 представляет собой атом водорода, атом галогена или С1-С6алкильную группу и
R7 представляет собой гидроксиС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, гидроксигалогенС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, (С1-С6алкокси)карбонильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, С1-С6алкоксиС1-С6алкоксиС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, гидроксиС1-С6алкоксигруппу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, С1-С6алкилкарбамоильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, (С1-С6алкил)(С1-С6алкил)карбамоильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, С1-С6алкоксикарбамоильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, С1-С6алкилкарбамоилС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, (С1-С6алкил)(С1-С6алкил)карбамоилС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, С2-С7алканоиламиногруппу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α, или С2-С7алканоиламиноС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы заместителей α.
Соединение настоящего изобретения, представленное указанной выше общей формулой (1), имеет скелет 5-гидроксипиримидин-4-карбоксамида. Заместитель в положении 2 указанного кольца пиримидина имеет 3 циклические группы и указанные циклические группы имеют определенный заместитель. Соединение настоящего изобретения, его фармакологически приемлемый сложный эфир или его фармакологически приемлемая соль обладает превосходной активностью, усиливающей продуцирование ЕРО.
Ниже представлено объяснение заместителей в соединении настоящего изобретения.
“Атом галогена” в символах R4, R5 и R6 относится к атому фтора, атому хлора, атому брома или атому иода, предпочтительно атому фтора.
“C1-C3алкильная группа” в символе R2 относится к алкильной группе с неразветвленной или разветвленной цепью, имеющей 1-3 атома углерода. Примеры ее включают в себя метильную группу, этильную группу, пропильную группу и изопропильную группу.
“C1-C6алкильная группа” в символах R4, R5 и R6 относится к алкильной группе с неразветвленной или разветвленной цепью, имеющей 1-6 атомов углерода. Примеры ее включают в себя метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, втор-бутильную группу, трет-бутильную группу, пентильную группу, изопентильную группу, 2-метилбутильную группу, неопентильную группу, 1-этилпропильную группу, гексильную группу, 4-метилпентильную группу, 3-метилпентильную группу, 2-метилпентильную группу, 1-метилпентильную группу, 3,3-диметилбутильную группу, 2,2-диметилбутильную группу, 1,1-диметилбутильную группу, 1,2-диметилбутильную группу, 1,3-диметилбутильную группу, 2,3-диметилбутильную группу, 2-этилбутильную группу и тому подобное. C1-C6алкильная группа предпочтительно представляет собой C1-C4алкильную группу, более предпочтительно C1-C3алкильную группу.
“ГидроксиC1-C6алкильная группа” в символе R7 относится к группе, в которой один или несколько атомов водорода (предпочтительно 1 или 2 атома водорода) указанной выше “C1-C6алкильной группе” замещены гидроксигруппой. Примеры ее включают в себя гидроксиметильную группу, 1-гидроксиэтильную группу, 2-гидроксиэтильную группу, 1-гидроксипропильную группу, 2-гидроксипропильную группу, 3-гидроксипропильную группу, 2-гидрокси-1,1-диметилэтильную группу, 2-гидроксибутильную группу, 2-гидроксипентильную группу и тому подобную группу. ГидроксиC1-C6алкильная группа предпочтительно представляет собой гидроксиC1-C4алкильную группу, предпочтительно гидроксиC1-C3алкильную группу.
“ГидроксигалогенC1-C6алкильная группа” в символе R7 относится к группе, в которой 1 или 2 атома водорода у атома углерода указанной выше “гидроксиC1-C6алкильной группы” замещены указанным выше “атомом галогена”. Примеры ее включают в себя 1-фтор-2-гидроксиэтильную группу, 1,1-дифтор-2-гидроксиэтильную группу, 1-фтор-2-гидроксипропильную группу, 1,1-дифтор-2-гидроксипропильную группу, 1,1-дифтор-3-гидроксипропильную группу, 1,1-дифтор-2-гидрокси-2-метилпропильную группу и тому подобной группе. ГидроксигалогенC1-C6алкильная группа предпочтительно представляет собой гидроксигалогенC1-C4алкильную группу, более предпочтительно гидроксигалогенC1-C3алкильную группу.
“C1-C6АлкоксиC1-C6алкильная группа” в символе R7 относится к группе, в которой 1 атом водорода указанной выше “C1-C6алкильной группы” замещен следующей “C1-C6алкоксигруппой”. Примеры ее включают в себя метоксиметильную группу, метоксиэтильную группу, метоксипропильную группу, метоксибутильную группу, этоксиметильную группу, этоксиэтильную группу, этоксипропильную группу, этоксибутильную группу, метоксипентильную группу и тому подобное. C1-C6АлкоксиC1-C6алкильная группа предпочтительно представляет собой C1-C4алкоксиC1-C4алкильную группу, более предпочтительно C1-C2алкоксиC1-C2алкильную группу.
“C1-C6Алкоксигруппа” в определении группы α заместителей относится к группе, в которой указанная выше “C1-C6алкильная группа” связана с атомом кислорода. Примеры ее включают в себя метоксигруппу, этоксигруппу, н-пропоксигруппу, н-бутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу, н-пентоксигруппу и тому подобное. C1-C6Алкоксигруппа предпочтительно представляет собой C1-C4алкоксигруппу, более предпочтительно C1-C2алкоксигруппу.
“ГалогенC1-C6алкоксигруппа” в определении группы α заместителей относится к группе, в которой 1 или 2 атома водорода указанной выше “C1-C6алкоксигруппы” замещены указанным выше “атомом галогена”. Примеры ее включают в себя фторметоксигруппу, хлорметоксигруппу, 1-фторэтоксигруппу, 1-хлорэтоксигруппу, 2-фторэтоксигруппу, 1,2-дифторпропоксигруппу и тому подобное. ГалогенC1-C6алкоксигруппа предпочтительно представляет собой галогенC1-C4алкоксигруппу, более предпочтительно галогенC1-C3алкоксигруппу.
“C1-C6Алкоксииминогруппа” в определении группы α заместителей относится к группе, в которой указанная выше “C1-C6алкоксигруппа” связана с иминогруппой. Примеры ее включают в себя метоксиимино, этоксиимино, н-пропоксиимино, изопропоксиимино, н-бутоксиимино, изобутоксиимино, втор-бутоксиимино, трет-бутоксиимино, н-пентоксиимино, изопентоксиимино, 2-метилбутоксиимино и тому подобное. C1-C6Алкоксииминогруппа предпочтительно представляет собой C1-C4алкоксииминогруппу, более предпочтительно C1-C3алкоксииминогруппу.
“(C1-C6Алкокси)карбонильная группа” в определении R7 относится к группе, в которой указанная выше “C1-C6алкоксигруппа” связана с карбонильной группой. Примеры ее включают в себя метоксикарбонильную группу, этоксикарбонильную группу, н-пропоксикарбонильную группу, н-бутоксикарбонильную группу и тому подобное. (C1-C6Алкокси)карбонильная группа предпочтительно представляет собой (C1-C4алкокси)карбонильную группу, более предпочтительно (C1-C3алкокси)карбонильную группу.
“C1-C6АлкоксиC1-C6алкоксиC1-C6алкильная группа” в определении R7 относится к группе, в которой 1 атом водорода в C1-C6алкокси указанной выше “C1-C6алкоксиC1-C6алкильной группе” замещен указанной выше “C1-C6алкоксигруппой”. Примеры ее включают в себя метоксиметоксиметильную группу, этоксиметоксиметильную группу, метоксиметоксиэтильную группу (например, 1-метоксиметоксиэтильную группу), 2-этоксиметоксиэтильную группу, 3-метоксиметоксипропильную группу и тому подобное. C1-C6АлкоксиC1-C6алкоксиC1-C6алкильная группа предпочтительно представляет собой C1-C4алкоксиC1-C4алкоксиC1-C4алкильную группу, более предпочтительно C1-C2алкоксиC1-C2алкоксиC1-C2алкильную группу.
“ГидроксиC1-C6алкоксигруппа” в определении R7 относится к группе, в которой 1 атом водорода указанной выше “C1-C6алкоксигруппы” замещен гидроксигруппой. Примеры ее включают в себя гидроксиметоксигруппу, гидроксиэтоксигруппу (например, 2-гидроксиэтоксигруппу), 2-гидроксипропоксигруппу и тому подобное. ГидроксиC1-C6алкоксигруппа предпочтительно представляет собой гидроксиC1-C4алкоксигруппу, более предпочтительно гидроксиC1-C2алкоксигруппу.
“C1-C6Алкилкарбамоильная группа” в определениях R6 и R7 относится к группе, в которой 1 атом водорода карбамоильной группы замещен указанной выше “C1-C6алкильной группой”. Примеры ее включают в себя метилкарбамоильную группу, этилкарбамоильную группу, пропилкарбамоильную группу и тому подобное. C1-C6Алкилкарбамоильная группа предпочтительно представляет собой C1-C4алкилкарбамоильную группу, более предпочтительно C1-C3алкилкарбамоильную группу.
“(C1-C6Алкил)(C1-C6алкил)карбамоильная группа” в определениях R6 и R7 относится к группе, в которой каждый из 2 атомов водорода карбамоильной группы замещен указанной выше “C1-C6алкильной группой”. Примеры ее включают в себя диметилкарбамоильную группу, метилэтилкарбамоильную группу, метилпропилкарбамоильную группу, диэтилкарбамоильную группу и тому подобное. (C1-C6Алкил)(C1-C6алкил)карбамоильная группа предпочтительно представляет собой (C1-C4алкил)(C1-C4алкил)карбамоильную группу, более предпочтительно (C1-C2алкил)(C1-C2алкил)карбамоильную группу.
“C1-C6Алкоксикарбамоильная группа” в определении R7 относится к группе, в которой 1 атом водорода карбамоильной группы замещен указанной выше “C1-C6алкоксигруппой”. Примеры ее включают в себя метоксикарбамоильную группу, этоксикарбамоильную группу, н-пропоксикарбамоильную группу и тому подобное. C1-C6Алкоксикарбамоильная группа предпочтительно представляет собой C1-C4алкоксикарбамоильную группу, более предпочтительно C1-C3алкоксикарбамоильную группу.
“C1-C6АлкилкарбамоилC1-C6алкильная группа” в определении R7 относится к группе, в которой 1 атом водорода указанной выше “C1-C6алкильной группы” замещен указанной выше “C1-C6алкилкарбамоильной группой”. Примеры ее включают в себя метилкарбамоилметильную группу, этилкарбамоилметильную группу, пропилкарбамоилметильную группу, метилкарбамоилэтильную группу, этилкарбамоилэтильную группу и тому подобное. C1-C6АлкилкарбамоилC1-C6алкильная группа предпочтительно представляет собой C1-C4алкилкарбамоилC1-C4алкильную группу, более предпочтительно C1-C2алкилкарбамоилC1-C2алкильную группу.
“(C1-C6Алкил)(C1-C6алкил)карбамоилC1-C6алкильная группа” в определении R7 относится к группе, в которой 1 атом водорода указанной выше “C1-C6алкильной группы” замещен указанной выше “(C1-C6алкил)(C1-C6алкил)карбамоильной группой”. Примеры ее включают в себя диметилкарбамоилметильную группу, этилметилкарбамоилметильную группу и тому подобное. (C1-C6Алкил)(C1-C6алкил)карбамоилC1-C6алкильная группа предпочтительно представляет собой (C1-C4алкил)(C1-C6алкил)карбамоилC1-C4алкильную группу, более предпочтительно (C1-C2алкил)(C1-C2алкил)карбамоилC1-C2алкильную группу.
“C2-C7Алканоиламиногруппа” в определениях R7 и группы α заместителей относится, например, к группе, в которой алканоильная группа с неразветвленной или разветвленной цепью, имеющая 2-7 атомов углерода (например, ацетильная группа, пропионильная группа, бутирильная группа, изобутирильная группа, пентаноильная группа, пивалоильная группа, валерильная группа, изовалерильная группа, гексаноильная группа, гептаноильная группа и тому подобное) связана с аминогруппой. Примеры ее включают в себя ацетиламиногруппу, пропиониламиногруппу, бутириламиногруппу, изобутириламиногруппу, пентаноиламиногруппу и тому подобное. C2-C7Алканоиламиногруппа предпочтительно представляет собой C2-C5алканоиламиногруппу, более предпочтительно C2-C4алканоиламиногруппу.
“C2-C7АлканоиламиноC1-C6алкильная группа” в определении R7 относится к группе, в которой 1 атом водорода указанной выше “C1-C6алкильной группы” замещен указанной выше “C2-C7алканоиламиногруппой”. Примеры ее включают в себя ацетиламинометильную группу, пропиониламинометильную группу, бутириламинометильную группу, изобутириламинометильную группу, пентаноиламинометильную группу и тому подобное. C2-C7АлканоиламиноC1-C6алкильная группа предпочтительно представляет собой C2-C5алканоиламиноC1-C4алкильную группу, более предпочтительно C2-C3алканоиламиноC1-C2алкильную группу.
“C2-C7АлканоилоксиC1-C6алкильная группа” в определении R7 относится к группе, в которой атом водорода у атома кислорода указанной выше “гидроксиC1-C6алкильной группы” замещен указанной выше “C2-C7алканоильной группой”. Примеры ее включают в себя ацетилоксиметильную группу, пропионилоксиметильную группу, бутирилоксиметильную группу, изобутирилоксиметильную группу, пентаноилоксиметильную группу и тому подобное. C2-C7АлканоилоксиC1-C6алкильная группа предпочтительно представляет собой C2-C5алканоилоксиC1-C4алкильную группу, более предпочтительно C2-C3алканоилоксиC1-C2алкильную группу.
“Моноциклическая углеводородная группа” в определениях кольца Q2 и кольца Q3 относится к насыщенной, частично ненасыщенной или ненасыщенной 5-7-членной моноциклической углеводородной группе. Примеры ее включают в себя моноциклические ароматические углеводородные группы, такие как фенильная группа; и моноциклические неароматические углеводородные группы, такие как циклопентильная группа, циклогексильная группа, циклогептильная группа, циклопентенильная группа, циклогексенильная группа и циклогептенильная группа. В настоящем изобретении предпочтительной является 6-членная ароматическая углеводородная группа или неароматическая углеводородная группа и более предпочтительной является 6-членная ароматическая углеводородная группа.
“Моноциклическая гетероциклическая группа” в определениях кольца Q1, кольца Q2 и кольца Q3 относится к насыщенной, частично ненасыщенной или ненасыщенной 5-7-членной моноциклической гетероциклической группе, содержащей 1 или 2 атома, выбранные из группы, состоящей из атома азота, атома серы и атома кислорода. Примеры ее включают в себя моноциклические неароматические гетероциклические группы, такие как тетрагидрофуранильная группа, тетрагидропиранильная группа, диоксоланильная группа, диоксанильная группа, диоксепанильная группа, пирролидинильная группа, пиперидильная группа, азепанильная группа, дигидропирролильная группа, дигидропиридильная группа, тетрагидропиридильная группа, пиперадинильная группа, морфолинильная группа, дигидрооксазолильная группа и дигидротиазолильная группа; моноциклические ароматические гетероциклические группы, такие как пирролильная группа, пиридильная группа, тиенильная группа, фурильная группа, пиримидинильная группа, пиранильная группа, пиридазинильная группа, пиразинильная группа, пиразолильная группа, имидазолильная группа, тиазолильная группа, изотиазолильная группа, оксазолильная группа и изоксазолильная группа и тому подобное. В качестве “моноциклической гетероциклической группы” в настоящем изобретении предпочтительной является 6-членная ароматическая гетероциклическая группа или неароматическая гетероциклическая группа, содержащая 1 или 2 атома азота, и более предпочтительной является 6-членная ароматическая гетероциклическая группа или неароматическая гетероциклическая группа, содержащая 1 атом азота. В качестве моноциклической гетероциклической группы в кольце Q1 еще более предпочтительной является 6-членная неароматическая гетероциклическая группа, содержащая 1 атом азота.
Значения R1 в соединении настоящего изобретения указываются ниже.
В соединении настоящего изобретения R1 относится к группе, представленной следующей общей формулой (1А)
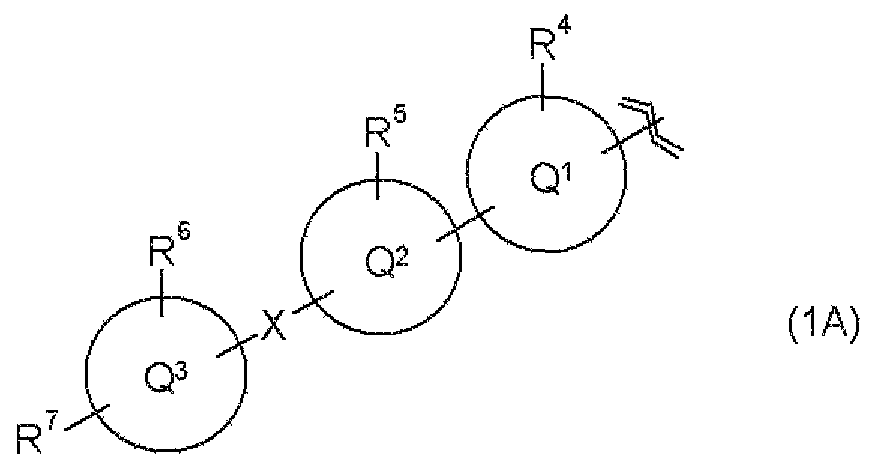
В указанной выше общей формуле (1А) каждый из R4 и R5 независимо относится к атому водорода, атому галогена или С1-С6алкильной группе и R6 относится к атому водорода, атому галогена, С1-С6алкильной группе, карбамоильной группе, С1-С6алкилкарбамоильной группе или (С1-С6алкил)(С1-С6алкил)карбамоильной группе.
В настоящем изобретении R4 предпочтительно представляет собой атом водорода.
В настоящем изобретении R5 предпочтительно представляет собой атом водорода, атом галогена или метильную группу и более предпочтительно атом водорода.
В настоящем изобретении R6 предпочтительно представляет собой атом водорода, атом галогена или метильную группу, более предпочтительно атом водорода, атом хлора или метильную группу и еще более предпочтительно атом водорода.
В настоящем изобретении R7 представляет собой гидроксиС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы α заместителей, гидроксигалогенС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы α заместителей, С1-С6алкоксиС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы α заместителей, (С1-С6алкокси)карбонильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы α заместителей, С1-С6алкоксиС1-С6алкоксиС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы α заместителей, гидроксиС1-С6алкоксигруппу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы α заместителей, С1-С6алкилкарбамоильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы α заместителей, (С1-С6алкил)(С1-С6алкил)карбамоильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы α заместителей, С1-С6алкоксикарбамоильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы α заместителей, С1-С6алкилкарбамоилС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы α заместителей, (С1-С6алкил)(С1-С6алкил)карбамоилС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы α заместителей, С2-С7алканоиламиногруппу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы α заместителей, С2-С7алканоиламиноС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы α заместителей, или С2-С7алканоилоксиС1-С6алкильную группу, которая может иметь 1 или 2 заместителя, независимо выбранные из группы α заместителей, и группа α заместителей относится к группе, состоящей из оксогруппы, гидроксигруппы, аминогруппы, карбоксигруппы, карбамоильной группы, С1-С6алкоксигруппы, галогенС1-С6алкоксигруппы, С2-С7алканоиламиногруппы, гидроксииминогруппы и С1-С6алкоксииминогруппы.
Группа α заместителей в настоящем изобретении предпочтительно является группой, состоящей из гидроксигруппы, С1-С6алкоксигруппы, галогенС1-С6алкоксигруппы и С2-С7алканоиламиногруппы, более предпочтительно группой, состоящей из гидроксигруппы и С1-С2алкоксигруппы.
В настоящем изобретении R7 предпочтительно представляет собой гидроксиС1-С6алкильную группу, дигидроксиС1-С6алкильную группу, (С1-С6алкокси)гидроксиС1-С6алкильную группу, (галогенС1-С6алкокси)гидроксиС1-С6алкильную группу, (С2-С7алканоиламино)гидроксиС1-С6алкильную группу, гидроксигалогенС1-С6алкильную группу, дигидроксигалогенС1-С6алкильную группу, (С1-С6алкокси)гидроксигалогенС1-С6алкильную группу, (галогенС1-С6алкокси)гидроксигалогенС1-С6алкильную группу, (С2-С7алканоиламино)гидроксигалогенС1-С6алкильную группу, С1-С6алкоксиС1-С6алкильную группу, гидроксиС1-С6алкоксиС1-С6алкильную группу, дигидроксиС1-С6алкоксиС1-С6алкильную группу, (галогенС1-С6алкокси)С1-С6алкоксиС1-С6алкильную группу, (С2-С7алканоиламино)С1-С6алкоксиС1-С6алкильную группу, (С1-С6алкокси)карбонильную группу, (гидроксиС1-С6алкокси)карбонильную группу, (С1-С6алкоксиС1-С6алкокси)карбонильную группу, (галогенС1-С6алкоксиС1-С6алкокси)карбонильную группу, (С2-С7алканоиламиноС1-С6алкокси)карбонильную группу, С1-С6алкоксиС1-С6алкоксиС1-С6алкильную группу, гидроксиС1-С6алкоксиС1-С6алкоксиС1-С6алкильную группу, С1-С6алкоксиС1-С6алкоксиС1-С6алкоксиС1-С6алкильную группу, галогенС1-С6алкоксиС1-С6алкоксиС1-С6алкоксиС1-С6алкильную группу, С2-С7алканоиламиноС1-С6алкоксиС1-С6алкоксиС1-С6алкильную группу, гидроксиС1-С6алкоксигруппу, дигидроксиС1-С6алкоксигруппу, (С1-С6алкокси)гидроксиС1-С6алкоксигруппу, (галогенС1-С6алкокси)гидроксиС1-С6алкоксигруппу, (С2-С7алканоил)аминогидроксиС1-С6алкоксигруппу, С1-С6алкилкарбамоильную группу, гидроксиС1-С6алкилкарбамоильную группу, С1-С6алкоксиС1-С6алкилкарбамоильную группу, галогенС1-С6алкоксиС1-С6алкилкарбамоильную группу, (С2-С7алканоиламино)С1-С6алкилкарбамоильную группу, (С1-С6алкил)(С1-С6алкил)карбамоильную группу, (гидроксиС1-С6алкил)(С1-С6алкил)карбамоильную группу, (С1-С6алкоксиС1-С6алкил)(С1-С6алкил)карбамоильную группу, (галогенС1-С6алкоксиС1-С6алкил)(С1-С6алкил)карбамоильную группу, (С2-С7алканоиламиноС1-С6алкил)(С1-С6алкил)карбамоильную группу, дигидроксиС1-С6алкилкарбамоильную группу, (С1-С6алкокси)гидроксиС1-С6алкилкарбамоильную группу, (галогенС1-С6алкокси)гидроксиС1-С6алкилкарбамоильную группу, (С2-С7алканоиламино)гидроксиС1-С6алкилкарбамоильную группу, С1-С6алкоксикарбамоильную группу, гидроксиС1-С6алкоксикарбамоильную группу, (С1-С6алкоксиС1-С6алкокси)карбамоильную группу, (галогенС1-С6алкоксиС1-С6алкокси)карбамоильную группу, (С2-С7алканоиламиноС1-С6алкокси)карбамоильную группу, С1-С6алкилкарбамоилС1-С6алкильную группу, гидроксиС1-С6алкилкарбамоилС1-С6алкильную группу, (С1-С6алкоксиС1-С6алкил)карбамоилС1-С6алкильную группу, (галогенС1-С6алкоксиС1-С6алкил)карбамоилС1-С6алкильную группу, (С2-С7алканоиламиноС1-С6алкил)карбамоилС1-С6алкильную группу, (С1-С6алкил)(С1-С6алкил)карбамоилС1-С6алкильную группу, (гидроксиС1-С6алкил)(С1-С6алкил)карбамоилС1-С6алкильную группу, (С1-С6алкоксиС1-С6алкил)(С1-С6алкил)карбамоилС1-С6алкильную группу, (галогенС1-С6алкоксиС1-С6алкил)(С1-С6алкил)карбамоилС1-С6алкильную группу, (С2-С7алканоиламиноС1-С6алкил)(С1-С6алкил)карбамоилС1-С6алкильную группу, (С1-С6алкокси)гидроксиС1-С6алкилкарбамоилС1-С6алкильную группу, (галогенС1-С6алкокси)гидроксиС1-С6алкилкарбамоилС1-С6алкильную группу или (С2-С7алканоиламино)гидроксиС1-С6алкилкарбамоилС1-С6алкильную группу, более предпочтительно гидроксиС1-С6алкильную группу, гидроксигалогенС1-С6алкильную группу, С1-С6алкоксиС1-С6алкильную группу, гидроксиС1-С6алкоксиС1-С6алкильную группу, (С1-С6алкокси)карбонильную группу, С1-С6алкоксиС1-С6алкоксиС1-С6алкильную группу, гидроксиС1-С6алкоксигруппу, С1-С6алкилкарбамоильную группу, (С1-С6алкил)(С1-С6алкил)карбамоильную группу, гидроксиС1-С6алкилкарбамоильную группу, С1-С6алкоксикарбамоильную группу, С1-С6алкилкарбамоилС1-С6алкильную группу, (С1-С6алкил)(С1-С6алкил)карбамоилС1-С6алкильную группу или гидроксиС1-С6алкилкарбамоилС1-С6алкильную группу, еще более предпочтительно гидроксиметильную группу, 1-гидроксиэтильную группу, 2-гидроксиэтильную группу, 1,1-дифтор-2-гидроксиэтильную группу, 2-гидроксипропильную группу, 3-гидроксипропильную группу, 1,1-дифтор-2-гидроксипропильную группу, 2-гидроксибутильную группу, 2-гидрокси-1,1-диметилэтильную группу, 1,1-дифтор-2-гидрокси-2-метилпропильную группу, метоксиметильную группу, 2-гидрокси-3-метоксипропильную группу, метоксикарбонильную группу, этоксикарбонильную группу, метоксиметоксиметильную группу, 1-метоксиметоксиэтильную группу, 2-гидроксиэтоксигруппу, метилкарбамоильную группу, диметилкарбамоильную группу, метилкарбамоилметильную группу, диметилкарбамоилметильную группу, гидроксиэтилкарбамоильную группу или гидроксиэтилкарбамоилметильную группу, и особенно предпочтительно гидроксиметильную группу, 1-гидроксиэтильную группу, 2-гидроксиэтильную группу, 2-гидроксипропильную группу, 3-гидроксипропильную группу, 2-гидроксибутильную группу, 2-гидрокси-1,1-диметилэтильную группу, метоксиметильную группу, 2-гидрокси-3-метоксипропильную группу, этоксикарбонильную группу, 1-метоксиметоксиэтильную группу, 2-гидроксиэтоксигруппу, метилкарбамоильную группу, диметилкарбамоильную группу или диметилкарбамоилметильную группу.
В настоящем изобретении Х предпочтительно представляет собой одинарную связь или метилен и более предпочтительно одинарную связь.
В настоящем изобретении R1 представляет собой предпочтительно группу, представленную следующей общей формулой (1В).
Химическая формула 7

В указанной выше формуле (1В) каждый из V, W и Y независимо относится к атому углерода (имеющему 1 атом водорода) или атому азота, Х относится к одинарной связи или метилену, R5 относится к атому водорода, атому галогена или С1-С6алкильной группе, R6 относится к атому водорода, атому галогена, С1-С6алкильной группе, карбамоильной группе, С1-С6алкилкарбамоильной группе или (С1-С6алкил)(С1-С6алкил)карбамоильной группе и R7 относится к гидроксиметильной группе, 1-гидроксиэтильной группе, 2-гидроксиэтильной группе, 1,1-дифтор-2-гидроксиэтильной группе, 2-гидроксипропильной группе, 3-гидроксипропильной группе, 1,1-дифтор-2-гидроксипропильной группе, 2-гидроксибутильной группе, 2-гидрокси-1,1-диметилэтильной группе, 1,1-дифтор-2-гидрокси-2-метилпропильной группе, метоксиметильной группе, 2-гидрокси-3-метоксипропильной группе, метоксикарбонильной группе, этоксикарбонильной группе, метоксиметоксиметильной группе, 1-метоксиметоксиэтильной группе, 2-гидроксиэтоксигруппе, метилкарбамоильной группе, диметилкарбамоильной группе, метилкарбамоилметильной группе, диметилкарбамоилметильной группе, гидроксиэтилкарбамоильной группе или гидроксиэтилкарбамоилметильной группе. Указанный выше R7 предпочтительно представляет собой гидроксиметильную группу, 1-гидроксиэтильную группу, 2-гидроксиэтильную группу, 2-гидроксипропильную группу, 3-гидроксипропильную группу, 2-гидроксибутильную группу, 2-гидрокси-1,1-диметилэтильную группу, метоксиметильную группу, 2-гидрокси-3-метоксипропильную группу, этоксикарбонильную группу, 1-метоксиметоксиэтильную группу, 2-гидроксиэтоксигруппу, метилкарбамоильную группу, диметилкарбамоильную группу или диметилкарбамоилметильную группу.
В соединениях настоящего изобретения более предпочтительно R1 представляет собой группу, представленную от следующей общей формулы (1В-1) до общей формулы (1В-8).
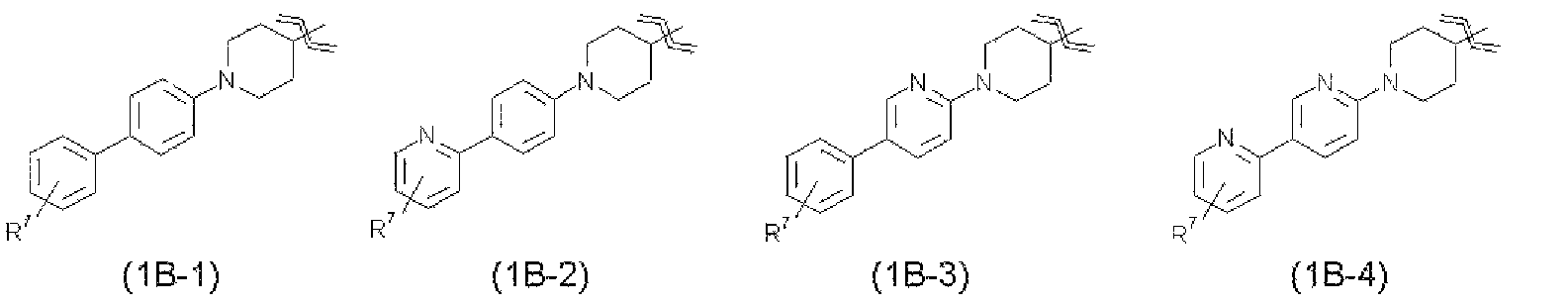
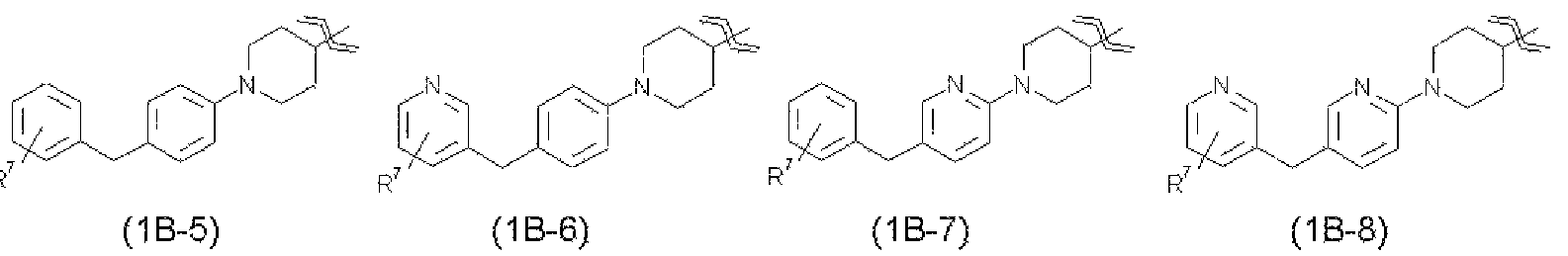
Еще более предпочтительно, R1 представляет собой группу, представленную следующей общей формулой (1В-1), общей формулой (1В-2), общей формулой (1В-3), общей формулой (1В-5) или общей формулой (1В-6).

В указанных выше формулах от общей формулы (1В-1) до общей формулы (1В-8) R7 относится к гидроксиметильной группе, 1-гидроксиэтильной группе, 2-гидроксиэтильной группе, 1,1-дифтор-2-гидроксиэтильной группе, 2-гидроксипропильной группе, 3-гидроксипропильной группе, 1,1-дифтор-2-гидроксипропильной группе, 2-гидроксибутильной группе, 2-гидрокси-1,1-диметилэтильной группе, 1,1-дифтор-2-гидрокси-2-метилпропильной группе, метоксиметильной группе, 2-гидрокси-3-метоксипропильной группе, метоксикарбонильной группе, этоксикарбонильной группе, метоксиметоксиметильной группе, 1-метоксиметоксиэтильной группе, 2-гидроксиэтоксигруппе, метилкарбамоильной группе, диметилкарбамоильной группе, метилкарбамоилметильной группе, диметилкарбамоилметильной группе, гидроксиэтилкарбамоильной группе или гидроксиэтилкарбамоилметильной группе. Указанный выше R7 предпочтительно представляет собой гидроксиметильную группу, 1-гидроксиэтильную группу, 2-гидроксиэтильную группу, 2-гидроксипропильную группу, 3-гидроксипропильную группу, 2-гидроксибутильную группу, 2-гидрокси-1,1-диметилэтильную группу, метоксиметильную группу, 2-гидрокси-3-метоксипропильную группу, этоксикарбонильную группу, 1-метоксиметоксиэтильную группу, 2-гидроксиэтоксигруппу, метилкарбамоильную группу, диметилкарбамоильную группу или диметилкарбамоилметильную группу.
В соединениях настоящего изобретения R2 относится к С1-С3алкильной группе или метилсульфанильной группе, предпочтительно метильной группе или метилсульфанильной группе и более предпочтительно метильной группе.
В соединениях настоящего изобретения R3 относится к атому водорода или метильной группе, предпочтительно атому водорода.
Термин “фармакологически приемлемый сложный эфир” в настоящем изобретении относится в случае, когда соединение настоящего изобретения имеет гидроксильную группу и/или карбоксигруппу, к сложноэфирному соединению, получаемому образованием сложноэфирной связи между этими группами и фармакологически приемлемой группой.
Примеры группы, которая образует сложноэфирную связь с гидроксигруппой соединений настоящего изобретения, включают в себя “С2-С7алканоильные группы”, имеющие 2-7 атомов углерода, такие как ацетильная группа, пропионильная группа, бутирильная группа, изобутирильная группа, пентаноильная группа, пивалоильная группа, валерильная группа и изовалерильная группа; “арил-С2-С7алканоильные группы”, такие как фенилацетильная группа; или арилкарбонильные группы, такие как бензоильная группа, и предпочтительной группой является ацетильная группа. В данном контексте “арил-С2-С7алканоильная группа” относится к группе, в которой 1 атом водорода указанной выше “С2-С7алканоильной группы” замещен группой ароматического углеводородного кольца, такой как фенильная группа.
В соединениях настоящего изобретения в случае, когда R7 относится к заместителю, имеющему гидроксигруппу (гидроксиС1-С6алкильной группе, гидроксигалогенС1-С6алкильной группе, гидроксиС1-С6алкоксигруппе, гидроксиС1-С6алкилкарбамоильной группе или гидрокси С1-С6алкилкарбамоилС1-С6алкильной группе), причем указанная гидроксигруппа может образовывать сложноэфирную связь с указанной выше “С2-С7алканоильной группой” (предпочтительно ацетильной группой).
Примеры группы, которая образует сложноэфирную связь с карбоксигруппой соединений настоящего изобретения, включают в себя указанную выше “С1-С6алкильную группу”, предпочтительно метильную группу или этильную группу.
Фармакологически приемлемый сложный эфир соединений настоящего изобретения может иметь сам по себе фармакологическую активность или его можно применять в качестве пролекарства. В случае, когда указанный выше фармакологически приемлемый сложный эфир применяют в качестве пролекарства, эфир сам по себе не обладает фармакологической активностью, но соединение, образованное гидролизом сложноэфирной связи in vivo, может обладать фармакологической активностью.
Соединением настоящего изобретения предпочтительно является соединение, выбранное из нижеследующих соединений, или его фармакологически приемлемые соли:
({[5-гидрокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[4'-(ацетоксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(1-гидроксиэтил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(2-гидроксиэтил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(2-гидроксипропил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(2-гидрокси-1,1-диметилэтил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[4'-(диметилкарбамоил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-6-метил-2-({1-[4'-(метилкарбамоил)дифенил-4-ил]пиперидин-4-ил}метил)пиримидин-4-ил]карбонил}амино)уксусной кислоты,
[({2-[(1-{4'-[2-(диметиламино)-2-оксоэтил]дифенил-4-ил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({5-гидрокси-2-[(1-{4-[4-(гидроксиметил)бензил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({5-гидрокси-2-[(1-{4-[3-(гидроксиметил)бензил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({5-гидрокси-2-[(1-{4-[5-(1-гидроксиэтил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
{[(5-гидрокси-2-{[1-(4-{5-[1-(метоксиметокси)этил]пиридин-2-ил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил)карбонил]амино}уксусной кислоты,
[({2-[(1-{4-[5-(1-ацетоксиэтил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({5-гидрокси-2-[(1-{4-[5-(гидроксиметил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({2-[(1-{4-[5-(этоксикарбонил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({2-[(1-{4-[2-(этоксикарбонил)бензил]фенил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
{[(5-гидрокси-2-{[1-(4-{[6-(2-гидроксиэтокси)пиридин-3-ил]метил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил)карбонил]амино}уксусной кислоты,
[({5-гидрокси-2-[(1-{5-[4-(гидроксиметил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({5-гидрокси-2-[(1-{5-[4-(2-гидроксипропил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({5-гидрокси-2-[(1-{5-[4-(2-гидрокси-1,1-диметилэтил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
({[2-({1-[2-хлор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(гидроксиметил)-2-метилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[3'-хлор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(гидроксиметил)-2'-метилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(гидроксиметил)-2,3'-диметилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(2-гидроксибутил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
[({5-гидрокси-2-[(1-{4-[4-(2-гидроксипропил)бензил]фенил}пиперидин-4-ил}метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({5-гидрокси-2-[(1-{4-[4-(2-гидрокси-1,1-диметилэтил)бензил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
({[2-({1-[4'-(1,1-дифтор-2-гидроксиэтил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[4'-(1,1-дифтор-2-гидроксипропил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[4'-(1,1-дифтор-2-гидрокси-2-метилпропил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
{[(5-[(2,2-диметилпропаноил)окси]-2-{[1-(4'-{[(2,2-диметилпропаноил)окси]метил}дифенил-4-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил)карбонил]амино}уксусной кислоты,
{[(2-{[1-(4'-{[(2,2-диметилпропаноил)окси]метил}дифенил-4-ил)пиперидин-4-ил]метил}-5-гидрокси-6-метилпиримидин-4-ил)карбонил]амино}уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(метоксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[2'-фтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[3'-фтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[2-фтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[3-фтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(гидроксиметил)-3'-метилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[3',5'-дифтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[3',5'-дихлор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[2-({1-[3',5'-диметил-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
[({5-гидрокси-2-[(1-{4'-[2-гидрокси-3-метоксипропил]дифенил-4-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(3-гидроксипропил]дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
({[5-гидрокси-2-({1-[4'-(гидроксиметил)-3'-изопропилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусной кислоты,
[({2-[(1-{5-[3-фтор-4-(гидроксиметил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты,
[({2-[(1-{5-[3-хлор-4-(гидроксиметил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты или
[({5-гидрокси-2-[(1-{5-[4-(гидроксиметил)-3-метилфенил]пиридин-2-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусной кислоты.
В соединениях настоящего изобретения в зависимости от типов заместителей могут присутствовать геометрические изомеры или таутомеры. Кроме того, в случае, когда соединения настоящего изобретения имеют асимметричный атом углерода, могут присутствовать оптические изомеры. Эти разделенные изомеры (например, энантиомеры или диастереомеры) и их смеси (например, рацематы или диастереомерные смеси) включены в настоящее изобретение. Кроме того, меченые соединения, а именно, соединения, у которых один или несколько атомов соединений настоящего изобретения замещены соответствующим радиоактивным изотопом или нерадиоактивным изотопом в произвольном отношении, также включены в настоящее изобретение.
В случае, когда соединение настоящего изобретения имеет основную группу, такую как аминогруппу, можно, при желании, получить фармакологически приемлемую кислотно-аддитивную соль. Примеры таких кислотно-аддитивных солей включают в себя соли галогеноводородных кислот, такие как гидрофториды, гидрохлориды, гидробромиды или гидроиодиды; соли неорганических кислот, такие как нитраты, перхлораты, сульфаты или фосфаты; низшие алкансульфонаты, такие как метансульфонаты, трифторметансульфонаты или этансульфонаты; арилсульфонаты, такие как бензолсульфонаты или п-толуолсульфонаты; соли органических кислот, такие как ацетаты, малаты, фумараты, сукцинаты, цитраты, тартраты, оксалаты или малеаты, и соли аминокислот, такие как орнитинаты, глутаматы или аспартаты, причем предпочтительными являются соли галогеноводородных кислот и соли органических кислот.
В случае, когда соединение настоящего изобретения имеет кислотную группу, такую как карбоксигруппу, обычно можно получить фармакологически приемлемую основно-аддитивную соль. Примеры таких основно-аддитивных солей включают в себя соли щелочных металлов, такие как соли натрия, соли калия или соли лития; соли щелочноземельных металлов, такие как соли кальция или соли магния; неорганические соли, такие как соли аммония, и соли органических аминов, такие как соли дибензиламина, соли морфолина, соли алкилового эфира фенилглицина, соли этилендиамина, соли N-метилглюкамина, соли диэтиламина, соли триэтиламина, соли циклогексиламина, соли дициклогексиламина, соли N,N'-дибензилэтилендиамина, соли диэтаноламина, соли N-бензил-N-(2-фенилэтокси)амина, соли пиперазина, соли тетраметиламмония или соли трис(гидроксиметил)аминометана.
Соединения настоящего изобретения могут также присутствовать в виде свободной формы или сольвата. Хотя не имеются конкретные ограничения по сольвату, при условии, что он является фармакологически приемлемым, предпочтительные конкретные примеры его включают в себя гидраты и этаноляты или тому подобное. Кроме того, в случае, когда в соединении, представленном общей формулой (1), присутствует атом азота, он может быть в форме N-оксида, и эти сольваты и формы N-оксида также включены в объем настоящего изобретения.
Хотя соединения настоящего изобретения могут присутствовать в форме различных изомеров, включающих в себя геометрические изомеры, такие как цис-форма или транс-форма, таутомеры или оптические изомеры, такие как d-форма или l-форма, в зависимости от типов заместителей и их комбинаций, соединения настоящего изобретения включают в себя также все изомеры и смеси изомеров в любом их отношении, если отношения конкретно не ограничены.
Кроме того, соединения настоящего изобретения могут содержать неприродное отношение изотопов в одном или нескольких атомах, составляющих такие соединения. Примеры изотопов включают в себя дейтерий (2Н;D), тритий (3Н;Т), иод-125 (125I), углерод-14 (14С) или тому подобное. Кроме того, соединения настоящего изобретения могут быть радиомечеными радиоизотопами, такими как, например, тритий (3Н), иод-125 (125I), углерод-14 (14С) или тому подобное. Радиомеченое соединение является применимым в качестве терапевтического или профилактического агента, реагента для исследования (например, реагента для анализа) и диагностического агента (например, агента для диагностической визуализации in vivo). Соединения настоящего изобретения, содержащие все отношения радиоактивных или нерадиоактивных изотопов, включены в объем настоящего изобретения.
Соединения настоящего изобретения можно также получить посредством применения различных известных синтетических методов в зависимости от его основного скелета или типов заместителей. При этом, в зависимости от типов функциональных групп, можно защитить эту функциональную группу подходящей защитной группой на стадиях от исходного соединения до промежуточного продукта или заместить ее группой, которую можно легко превратить в эту функциональную группу. Примеры таких функциональных групп включают в себя аминогруппу, гидроксигруппу, карбоксигруппу и тому подобное, и примеры их защитных групп включают в себя защитные группы, описанные, например, в публикации Protective Groups in Organic Synthesis, 3rd ed., Greene, T.W. and Wuts, P.G.M., John Wiley & Sons, Inc., New York, 1999, и эти защитные группы можно подходящим образом выбрать и применять в зависимости от их условий реакции. Соответственно таким способам, требуемое соединение можно получить введением такой защитной группы и проведением реакции с последующим удалением защитной группы, если необходимо, или превращением ее в требуемую группу. Образовавшиеся соединения настоящего изобретения можно идентифицировать и их состав или чистоту можно анализировать стандартными аналитическими способами, такими как элементный анализ, ЯМР, масс-спектроскопия или ИК-анализ.
Исходные вещества или реагенты, применяемые для получения соединений настоящего изобретения, можно купить у коммерческих поставщиков или можно синтезировать согласно способам, описанным в литературе.
В настоящем изобретении примеры анемии включают в себя нефрогенную анемию, анемию недоношенности, анемию, сопутствующую хроническим заболеваниям, анемию, сопутствующую химиотерапии рака, раковую анемию, анемию, связанную с воспалением, и анемию, сопутствующую застойной сердечной недостаточности. Примеры анемии, сопутствующей хроническим заболеваниям, включают в себя анемию, сопутствующую хроническим почечным заболеваниям, и примеры анемии, сопутствующей хроническим почечным заболеваниям, включают в себя хроническую почечную недостаточность. Кроме того, пациентом, которому вводят соединение настоящего изобретения, может быть пациент, который получает или не получает диализ.
[Действия изобретения]
Соединения настоящего изобретения, их фармакологически приемлемые сложные эфиры или их фармакологически приемлемые соли демонстрируют превосходную повышающую продуцирование ЕРО активность в системе для анализа, в которой применяют клетки Hep3B, и имеют превосходную безопасность. А именно, продуцирование ЕРО можно повысить введением фармацевтической композиции, содержащей соединение настоящего изобретения, его фармакологически приемлемый сложный эфир или его фармакологически приемлемую соль, млекопитающему (такому как человек, корова, лошадь или свинья) или птице (такой как цыпленок). Таким образом, фармацевтическую композицию, содержащую соединение настоящего изобретения, его фармакологически приемлемый сложный эфир или его фармакологически приемлемую соль, можно применять для профилактики и/или лечения заболеваний, вызванных пониженным ЕРО, или заболеваний или патологических состояний, при которых содержание ЕРО уменьшается, таких как ишемическое цереброваскулярное заболевание, или для аутогемотрансфузии пациентам, которых планируется подвергнуть хирургической операции. Примеры заболеваний, вызванных пониженным содержанием ЕРО, включают в себя анемию и особенно нефрогенную анемию (стадия диализа, стадия консервирования), анемию недоношенности, анемию, сопутствующую хроническим заболеваниям, анемию, сопутствующую раковой химиотерапии, раковую анемию, анемию, связанную с воспалением, и анемию, сопутствующую застойной сердечной недостаточности.
Способ осуществления изобретения
Ниже представлены примеры репрезентативных способов получения соединений настоящего изобретения. Кроме того, способы получения настоящего изобретения не ограничиваются указанными ниже примерами.
Соединения, имеющие общую формулу (1) настоящего изобретения, можно получить согласно способам, описанным ниже.
(Стадия 1)
Стадией 1 является стадия получения соединения, имеющего общую формулу (1), из соединения, имеющего общую формулу (2), которая затем будет описана.
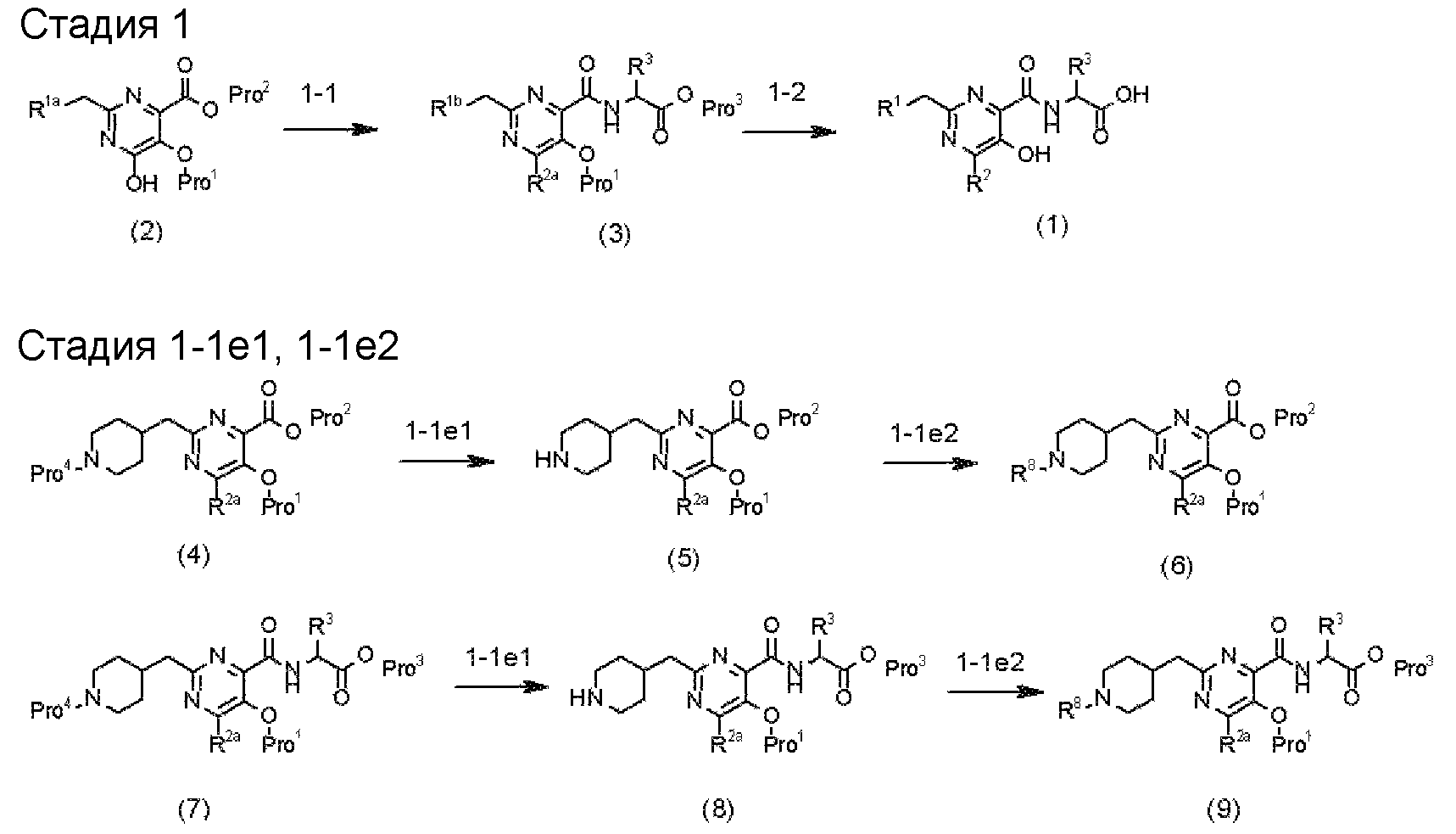
В указанных выше формулах R1 - R3 имеют такие же значения, как указаны ранее, R8 относится к замещенной или незамещенной арильной группе или гетероарильной группе, R1а и R1b относятся к группе, которая может быть указанной выше R1 или ее предшественником, R2а относится к группе, которая может быть указанной выше R2 или ее предшественником, и группы от Pro1 до Pro4 относятся к защитным группам соответствующих функциональных групп, выбранным из известных защитных групп (например, указанных в Protective Groups in Organic Synthesis, 3rd ed., Greene, T.W., Wuts, P.G.M., John Wiley & Sons, Inc., New York, 1999, и т.д.). Хотя не имеются конкретные ограничения для групп от Pro1 до Pro4, при условии, что они являются стабильными во время реакции и не ингибируют реакцию, предпочтительно Pro1 представляет собой бензильную группу, Pro2 представляет собой трет-бутильную группу, Pro3 представляет собой метильную группу, этильную группу, трет-бутильную группу или бензильную группу и Pro4 представляет собой трет-бутоксикарбонильную группу. Хотя не имеются конкретные ограничения для Х1 в стадии 1-1с, стадии 1-1d или стадии 1-1е, при условии, что она является заместителем, который образует уходящую группу вместе с кислородом, к которому она присоединена, она предпочтительно представляет собой трифторметансульфонильную группу.
Ниже представлено подробное описание каждой стадии.
(Стадия 1-1)
Стадией 1-1 является стадия получения соединения, имеющего общую формулу (3), из соединения, имеющего общую формулу (2), которая затем будет описана. Примеры основных реакций включают в себя:
стадия 1-1а: реакцию удаления защитной группы Pro2;
стадия 1-1b: реакцию конденсации с аминокислотой или солью аминокислоты, имеющей общую формулу Н2NCH(R3)CO2Pro3;
стадия 1-1с: реакцию введения уходящей группы (-ОХ1) в гидроксильную группу в положении 6 и
стадия 1-1d: реакцию превращения уходящей группы (-ОХ1) в заместитель R2a. Кроме того, если необходимо, можно добавить
стадию 1-1е: реакцию превращения R1a в R1b. Стадии от 1-1а до 1-1е можно проводить в любом порядке.
(Стадия 1-1а)
Эта стадия является стадией удаления защитной группы Pro2. Подходящим образом можно выбрать известный способ, описанный, например, в Protective Groups in Organic Synthesis, 3rd ed., Greene, T.W., Wuts, P.G.M., John Wiley & Sons, Inc., New York, 1999, и т.д., соответствующий применяемому Pro2, и эту стадию проводят в соответствии с ним. В контексте трет-бутильную группу выбирают в качестве предпочтительной Pro2, и описывают способ, в которой Pro2 превращают в атом водорода с применением основания в инертном растворителе (стадия 1-1а1), и способ, в котором Pro2 превращают в атом водорода с применением кислоты в инертном растворителе (стадия 1-1а2), но эта стадия не ограничивается этим.
(Стадия 1-1а1)
Эта стадия является стадией превращения Pro2 в атом водорода с применением подходящего основания в инертном растворителе.
Хотя не имеются конкретные ограничения для применяемого растворителя, при условии, что он не ингибирует реакцию и растворяет исходное соединение до определенной степени, предпочтительные примеры растворителя включают в себя ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как дихлорметан или хлороформ; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, 1,4-диоксан или 1,2-диметоксиэтан; спирты, такие как метанол, этанол или трет-бутанол; сложные эфиры, такие как этилацетат или пропилацетат; нитрилы, такие как ацетонитрил; амиды, такие как формамид или N,N-диметилформамид; сульфоксиды, такие как диметилсульфоксид; смесь многих органических растворителей в произвольном отношении и их смеси с водой в произвольном отношении.
Хотя не имеются конкретные ограничения для применяемого основания, при условии, что его применяют в качестве основания в общепринятых реакциях, примеры его включают в себя органические основания, такие как триэтиламин, N,N-диизопропилэтиламин, N-метилморфолин, лутидин или пиридин; карбонаты щелочных металлов, такие как карбонат натрия или карбонат калия; карбонаты щелочноземельных металлов, такие как карбонат кальция; гидрокарбонаты щелочных металлов, такие как гидрокарбонат калия, гидрокарбонаты щелочноземельных металлов, такие как гидрокарбонат кальция, гидроксиды щелочных металлов, такие как гидроксид натрия или гидроксид калия; гидроксиды щелочноземельных металлов, такие как гидроксид кальция, и фосфаты щелочных металлов, такие как трикалийфосфат.
Изменяющаяся в соответствии с исходными соединениями, реагентами и тому подобному, температура реакции обычно бывает от -10 до 150°С и предпочтительно от 10 до 90°С.
Изменяющееся в соответствии с исходными соединениями, реагентами и тому подобному, время реакции обычно бывает от 1 минуты до 24 часов и предпочтительно от 10 минут до 6 часов.
После завершения реакции нужное соединение можно получить в виде твердого вещества отгонкой органического растворителя и добавлением кислоты. С другой стороны, в случае, когда невозможно получить твердое вещество добавлением кислоты, нужное соединение можно получить экстракцией органического вещества органическим растворителем, таким как этилацетат, сушкой органического слоя обычно применяемой процедурой и затем концентрированием его при пониженном давлении.
Образовавшееся соединение можно дополнительно очищать, если необходимо, с применением обычного способа, например, перекристаллизацией, повторным осаждением, колоночной хроматографией на силикагеле или подобным способом.
(Стадия 1-1а2)
Данная стадия является стадией превращения Pro2 в атом водорода с применением подходящей кислоты в инертном растворителе.
Хотя не имеются конкретные ограничения для применяемого растворителя, при условии, что он не ингибирует реакцию и растворяет исходное соединение до определенной степени, предпочтительные примеры растворителя включают в себя ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как дихлорметан или хлороформ; сложные эфиры, такие как этилацетат или пропилацетат; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, 1,4-диоксан или 1,2-диметоксиэтан; спирты, такие как метанол или этанол; нитрилы, такие как ацетонитрил; амиды, такие как формамид или N,N-диметилформамид; сульфоксиды, такие как диметилсульфоксид; смесь многих органических растворителей в произвольном отношении и их смеси с водой в произвольном отношении.
Хотя не имеются конкретные ограничения для применяемой кислоты, при условии, что ее применяют в качестве кислоты в общепринятых реакциях, примеры ее включают в себя неорганические кислоты, такие как хлористоводородная кислота или серная кислота; кислоты Льюиса, такие как трифторид бора, трихлорид бора, трибромид бора или иодтриметилсилан; и органические кислоты, такие как трифторуксусная кислота.
Изменяющаяся в соответствии с исходными соединениями, реагентами и тому подобному, температура реакции обычно бывает от -100 до 150°С и предпочтительно от -78 до 100°С.
Изменяющееся в соответствии с исходными соединениями, реагентами и тому подобному, время реакции обычно бывает от 5 минут до 24 часов и предпочтительно от 10 минут до 6 часов.
После завершения реакции нужное соединение можно получить в виде твердого вещества отгонкой органического растворителя и добавлением основания. С другой стороны, в случае, когда невозможно получить твердое вещество добавлением основания, нужное соединение можно получить экстракцией органического вещества органическим растворителем, таким как этилацетат, сушкой органического слоя обычно применяемой процедурой и затем концентрированием его при пониженном давлении.
Образовавшееся соединение можно дополнительно очищать, если необходимо, с применением общепринятого способа, например, перекристаллизацией, повторным осаждением, колоночной хроматографией на силикагеле или подобным способом.
(Стадия 1-1b)
Эта стадия является стадией конденсации карбоновой кислоты, полученной на стадии 1-1а, и аминокислоты или соли аминокислоты, имеющей общую формулу Н2NCH(R3)CO2Pro3, и конденсацию проводят с применением агента конденсации в инертном растворителе и в присутствии или в отсутствие основания.
Хотя не имеются конкретные ограничения для применяемого растворителя, при условии, что он не ингибирует реакцию и растворяет исходное соединение до определенной степени, предпочтительные примеры растворителя включают в себя ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как дихлорметан или хлороформ; сложные эфиры, такие как этилацетат или пропилацетат; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, 1,4-диоксан или 1,2-диметоксиэтан; спирты, такие как метанол, этанол или трет-бутанол; нитрилы, такие как ацетонитрил; амиды, такие как формамид или N,N-диметилформамид; сульфоксиды, такие как диметилсульфоксид; смесь многих органических растворителей в произвольном отношении и их смесь с водой в произвольном отношении.
Хотя не имеются конкретные ограничения для применяемого основания, при условии, что его применяют в качестве основания в общепринятых реакциях, предпочтительные примеры его включают в себя органические основания, такие как триэтиламин, N,N-диизопропилэтиламин, N-метилморфолин, лутидин или пиридин; карбонаты щелочных металлов, такие как карбонат натрия или карбонат калия; карбонаты щелочноземельных металлов, такие как карбонат кальция; гидрокарбонаты щелочных металлов, такие как гидрокарбонат калия; гидрокарбонаты щелочноземельных металлов, такие как гидрокарбонат кальция; гидроксиды щелочных металлов, такие как гидроксид натрия; гидроксиды щелочноземельных металлов, такие как гидроксид кальция, и фосфаты щелочных металлов, такие как трикалийфосфат.
Хотя не имеются конкретные ограничения по применяемому агенту конденсации, при условии, что его применяют в качестве агента конденсации, который образует амидную связь (например, Shoichi Kusumoto et al., Experimental Science Course IV, Chemical Society of Japan, Maruzen Publishing, 1990; Nobuo Izumiya et al., Peptide Synthesis Basics and Experimentation, Maruzen Publishing, 1985), предпочтительные примеры его включают в себя гексафторфосфат О-бензотриазол-N,N,N',N'-тетраметилурония (HBTU), тетрафторборат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (TBTU), гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCI), пара-толуолсульфонат 4-(2-{[(циклогексилимино)метилен]амино}этил-4-метилморфолин-4-ия (СМС), дициклогексилкарбодиимид (DCC), 1,1'-карбонилбис-(1Н-имидазол) (CDI), гексафторфосфат (1Н-бензотриазол-1-илокси)(трипирролидин-1-ил)фосфония (PyBOP), гексафторфосфат бром(трипирролидин-1-ил)фосфония (PyBrOP), хлорид 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния (DMT-MM), 2-хлор-4,6-диметокси-1,3,5-триазин (DMT) и тому подобное. Можно также добавлять добавку, такую как 1-гидроксибензотриазол (НОВТ) или N,N-диметиламинопиридин.
Изменяющаяся в соответствии с исходными соединениями, реагентами и тому подобному, температура реакции обычно бывает от -10°С до 150°С и предпочтительно от 0°С до 100°С.
Изменяющееся в соответствии с исходными соединениями, реагентами и тому подобному, время реакции обычно бывает от 5 минут до 48 часов и предпочтительно от 10 минут до 24 часов.
После завершения реакции нужное соединение данной реакции можно получить, например, концентрированием реакционной смеси, добавлением органического растворителя, такого как этилацетат, и промыванием водой с последующим отделением органического слоя, содержащего нужное соединение, сушкой безводным сульфатом натрия и тому подобным и отгонкой растворителя.
Образовавшееся соединение можно дополнительно очищать, если необходимо, с применением общепринятого способа, например, перекристаллизацией, повторным осаждением, колоночной хроматографией на силикагеле или подобным способом.
(Стадия 1-1с)
Данная стадия является стадией превращения гидроксильной группы в положении 6 в уходящую группу (-ОХ1) и превращение проводят реакцией гидроксильной группы с хлорангидридом кислоты или ангидридом кислоты в инертном растворителе и в присутствии или в отсутствие основания.
Хотя не имеются конкретные ограничения для применяемого растворителя, при условии, что он не ингибирует реакцию и растворяет исходное соединение до определенной степени, предпочтительные примеры растворителя включают в себя ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как дихлорметан или хлороформ; сложные эфиры, такие как этилацетат или пропилацетат; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, 1,4-диоксан или 1,2-диметоксиэтан; нитрилы, такие как ацетонитрил; амиды, такие как формамид или N,N-диметилформамид; сульфоксиды, такие как диметилсульфоксид; смесь многих органических растворителей в произвольном отношении.
Хотя не имеются конкретные ограничения для применяемого хлорангидрида кислоты или ангидрида кислоты, при условии, что он является хлорангидридом кислоты или ангидридом кислоты, который имеет Х1, так что группа -ОХ1 становится известной уходящей группой, предпочтительные примеры его включают в себя ангидриды замещенных или незамещенных алкилсульфоновых кислот или ангидриды арилсульфоновых кислот, такие как ангидрид трифторметансульфоновой кислоты, замещенные или незамещенные алкилсульфонилхлориды или арилсульфонилхлориды, такие как метансульфонилхлорид или п-толуолсульфонилхлорид, и хлорангидриды замещенных или незамещенных алкилфосфорных кислот или хлорангидриды арилфосфорных кислот.
Хотя не имеются конкретные ограничения для применяемого основания, при условии, что его применяют в качестве основания в общепринятых реакциях, предпочтительные примеры его включают в себя органические основания, такие как триэтиламин, N,N-диизопропилэтиламин, N-метилморфолин, лутидин или пиридин; карбонаты щелочных металлов, такие как карбонат натрия или карбонат калия; карбонаты щелочноземельных металлов, такие как карбонат кальция; гидрокарбонаты щелочных металлов, такие как гидрокарбонат калия; гидрокарбонаты щелочноземельных металлов, такие как гидрокарбонат кальция; гидроксиды щелочных металлов, такие как гидроксид натрия; гидроксиды щелочноземельных металлов, такие как гидроксид кальция, и фосфаты щелочных металлов, такие как трикалийфосфат.
Изменяющаяся в соответствии с исходными соединениями, реагентами и тому подобному температура реакции обычно бывает от -100°С до 150°С и предпочтительно от -80°С до 40°С.
Изменяющееся в соответствии с исходными соединениями, реагентами и тому подобному время реакции обычно бывает от 5 минут до 24 часов и предпочтительно от 10 минут до 6 часов.
После завершения реакции нужное соединение данной реакции можно получить, например, концентрированием реакционной смеси, добавлением органического растворителя, такого как этилацетат, и промыванием водой с последующим отделением органического слоя, содержащего нужное соединение, сушкой безводным сульфатом натрия и тому подобным и отгонкой растворителя.
Образовавшееся соединение можно дополнительно очищать, если необходимо, с применением общепринятого способа, например, перекристаллизацией, повторным осаждением, колоночной хроматографией на силикагеле или подобным способом.
(Стадия 1-1d)
Данная стадия является стадией превращения уходящей группы (-ОХ1) в заместитель R2a. В случае, когда R2a представляет собой алкильную группу или алкенильную группу, эту стадию проводят реакцией уходящей группы с соединением алкилбора или соединением алкенилбора в инертном растворителе, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки и в присутствии металлического катализатора (1-1d1). Кроме того, в случае, когда R2a представляет собой метилсульфанильную группу, эту стадию проводят реакцией уходящей группы с метантиолом или солью металла метантиола в инертном растворителе и в присутствии или в отсутствие основания (1-1d2).
(Стадия 1-1d1)
Данная стадия является стадией превращения уходящей группы (-ОХ1) в алкильную группу или алкенильную группу и ее проводят реакцией уходящей группы с соединением алкилбора или соединением алкенилбора в инертном растворителе, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки и в присутствии металлического катализатора. Условия данной реакции подходящим образом выбирают из условий известных способов, описанных, например, Zou, G., Reddy, Y.K., Falck, J.R., Tetrahedron Lett., 2001, 42, 7213; Molander, G.A., Yun, C.-S., Tetrahedron, 2002, 58, 1465; Tsuji, J., Palladium Peagents and Catalysts, John Wiley & Sons, Inc., England, 2004; Metal-Catalyzed Cross-Coupling Reactions, de Meijere, A., Diederich, F., Wiley-VCH, Weinheim, 2004, and the like, и эту стадию проводят в соответствии с ними. Хотя условия реакции данной стадии предпочтительно являются нижеследующими, они не ограничиваются ими.
Хотя не имеются конкретные ограничения для применяемого растворителя, при условии, что он не ингибирует реакцию и растворяет исходное соединение до определенной степени, предпочтительные примеры растворителя включают в себя ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как дихлорметан или хлороформ; сложные эфиры, такие как этилацетат или пропилацетат; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, 1,4-диоксан или 1,2-диметоксиэтан; спирты, такие как метанол, этанол или трет-бутанол; нитрилы, такие как ацетонитрил; амиды, такие как формамид или N,N-диметилформамид; сульфоксиды, такие как диметилсульфоксид; смесь многих органических растворителей в произвольном отношении и смесь их с водой в произвольном отношении.
Хотя не имеются конкретные ограничения для применяемого основания, при условии, что его применяют в качестве основания в общепринятых реакциях, предпочтительные примеры его включают в себя органические основания, такие как триэтиламин, N,N-диизопропилэтиламин, N-метилморфолин, лутидин или пиридин; карбонаты щелочных металлов, такие как карбонат натрия или карбонат калия; карбонаты щелочноземельных металлов, такие как карбонат кальция; гидрокарбонаты щелочных металлов, такие как гидрокарбонат калия; гидрокарбонаты щелочноземельных металлов, такие как гидрокарбонат кальция, гидроксиды щелочных металлов, такие как гидроксид натрия; гидроксиды щелочноземельных металлов, такие как гидроксид кальция, фосфаты щелочных металлов, такие как трикалийфосфат, и алкоксиды металлов, такие как трет-бутоксид натрия или трет-бутоксид калия.
Хотя не имеются конкретные ограничения для применяемой добавки, при условии, что ее применяют в известных способах, предпочтительные примеры ее включают в себя оксиды металлов, такие как оксид серебра или оксид алюминия; фосфины, такие как трифенилфосфин, три-трет-бутилфосфин, трициклогексилфосфин, три-(о-толил)фосфин, дифенилфосфиноферроцен, 2-дициклогексилфосфино-2',6'-диметокси-1,1'-дифенил (S-PHOS), 2-дициклогексилфосфино-2',4',6'-триизопропил-1,1'-дифенил (X-PHOS) или 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (BINAP); оксиды фосфинов, такие как оксид трифенилфосфина; соли металлов, такие как хлорид лития, фторид калия или фторид цезия, и соли аммония, такие как бромид тетрабутиламмония. Их можно также применять в комбинации в произвольном отношении.
Хотя не имеются конкретные ограничения для применяемого металлического катализатора, при условии, что его применяют в известных способах, предпочтительные примеры его включают в себя палладиевые катализаторы, такие как тетракис(трифенилфосфин)палладий, бис(три-трет-бутилфосфин)палладий, диацетат палладия, комплекс дихлорид палладия-дифенилфосфиноферроцен, комплекс дихлорид палладия-бензонитрил, комплекс дихлорид палладия-ацетонитрил, бис(дибензилиденацетон)палладий, трис(дибензилиденацетон)дипалладий, бис-[1,2-бис(дифенилфосфино)этан]палладий, 3-хлорпиридин-[1,3-бис-(2,6-диизопропилфенил)имидазол-2-илиден]палладий или палладий на активированном угле.
Хотя не имеются конкретные ограничения для применяемого соединения алкилбора или соединения алкенилбора, при условии, что его применяют в качестве реагента известной реакции, примеры его включают в себя метилборат, эфир метилбората, соль металла трифтор(метил)борануида, этилборат, эфир этилбората или соль металла этилтрифторборануида, в случае, когда R2a представляет собой алкильную группу, и винилборат, 4,4,5,5-тетраметил-2-винил-1,3,2-диоксаборолан, эфир винилбората, соль металла винилтрифторборануида, аллилборат, эфир аллилбората или соль металла аллил(трифтор)борануида в случае, когда R2a представляет собой алкенильную группу.
Не имеются конкретные ограничения для эфирной части эфира алкилбората, металла соли металла трифтор(алкил)борануида, эфирной части эфира алкенилбората и металла соли металла трифтор(алкенил)борануида, при условии, что они являются известными соединениями или синтезированы согласно известным способам.
Изменяющаяся в соответствии с исходными соединениями, реагентами и тому подобному температура реакции обычно бывает от -10°С до 200°С и предпочтительно от 0°С до 150°С.
Изменяющееся в соответствии с исходными соединениями, реагентами и тому подобному время реакции обычно бывает от 5 минут до 48 часов и предпочтительно от 10 минут до 12 часов.
После завершения реакции нужное соединение данной реакции можно получить, например, концентрированием реакционной смеси, добавлением органического растворителя, такого как этилацетат, и промыванием водой с последующим отделением органического слоя, содержащего нужное соединение, сушкой безводным сульфатом натрия и тому подобным и отгонкой растворителя.
Образовавшееся соединение можно дополнительно очищать, если необходимо, с применением общепринятого способа, например, перекристаллизацией, повторным осаждением, колоночной хроматографией на силикагеле или подобным способом.
Кроме того, в случае, когда R2a представляет собой алкенильную группу, эту алкенильную группу можно превратить в соответствующую алкильную группу проведением реакции гидрирования согласно условиям реакции, аналогичным условиям реакции в стадии 1-2а1, которые описаны позже.
(Стадия 1-1d2)
Данная стадия является стадией превращения уходящей группы (-ОХ1) в метилсульфанильную группу и ее проводят реакцией метантиола или соли металла метантиола в инертном растворителе и в присутствии или в отсутствие основания.
Хотя не имеются конкретные ограничения для применяемого растворителя, при условии, что он не ингибирует реакцию и растворяет исходное соединение до определенной степени, предпочтительные примеры растворителя включают в себя ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как дихлорметан или хлороформ; сложные эфиры, такие как этилацетат или пропилацетат; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, 1,4-диоксан или 1,2-диметоксиэтан; нитрилы, такие как ацетонитрил; амиды, такие как формамид или N,N-диметилформамид; спирты, такие как метанол или этанол; сульфоксиды, такие как диметилсульфоксид; смесь многих органических растворителей в произвольном отношении и смеси их с водой в произвольном отношении.
Хотя не имеются конкретные ограничения для применяемого металла в соли металла метантиола, предпочтительные примеры его включают в себя щелочные металлы, такие как натрий, и щелочноземельные металлы, такие как магний.
Хотя не имеются конкретные ограничения для применяемого основания, при условии, что его применяют в качестве основания в общепринятых реакциях, предпочтительные примеры его включают в себя органические основания, такие как триэтиламин, N,N-диизопропилэтиламин, N-метилморфолин, лутидин или пиридин; карбонаты щелочных металлов, такие как карбонат натрия или карбонат калия; карбонаты щелочноземельных металлов, такие как карбонат кальция; гидрокарбонаты щелочных металлов, такие как гидрокарбонат калия; гидрокарбонаты щелочноземельных металлов, такие как гидрокарбонат кальция; гидроксиды щелочных металлов, такие как гидроксид натрия; гидроксиды щелочноземельных металлов, такие как гидроксид кальция; фосфаты щелочных металлов, такие как трикалийфосфат, и алкоксиды металлов, такие как трет-бутоксид натрия или трет-бутоксид калия.
Изменяющаяся в соответствии с исходными соединениями, реагентами и тому подобному температура реакции обычно бывает от -10°С до 150°С и предпочтительно от 0°С до 100°С.
Изменяющееся в соответствии с исходными соединениями, реагентами и тому подобному время реакции обычно бывает от 5 минут до 48 часов и предпочтительно от 10 минут до 12 часов.
После завершения реакции нужное соединение данной реакции можно получить, например, концентрированием реакционной смеси, добавлением органического растворителя, такого как этилацетат, и промыванием водой с последующим отделением органического слоя, содержащего нужное соединение, сушкой безводным сульфатом натрия и тому подобным и отгонкой растворителя.
Образовавшееся соединение можно дополнительно очищать, если необходимо, с применением общепринятого способа, например, перекристаллизацией, повторным осаждением, колоночной хроматографией на силикагеле или подобным способом.
(Стадия 1-1е)
Эта стадия является стадией превращения R1a в R1b, и способ синтеза изменяется согласно типам гетероциклов кольца Q1. Ниже представлено описание случая, когда R1a имеет кольцо Q1, кольцо Q1 представляет собой гетероцикл, содержащий атом азота, и гетероцикл имеет защитную группу Pro4 у этого атома азота.
Примеры важных реакций (стадии 1-1е) включают в себя следующие реакции:
стадия 1-1е1: реакцию удаления защитной группы Pro4 и
стадия 1-1е2: реакцию введения заместителя R8.
Указанные выше реакции стадии 1-1е1 и стадии 1-1е2 показывают случай, когда R1a представляет собой пиперидин-4-ильную группу, имеющую защитную группу Pro4 в положении 1, и нижеследующее объяснение стадии 1-1е1 показывают случай, когда Pro4 представляет собой трет-бутоксикарбонильную группу, но стадия 1-1е1 не ограничивается им.
(Стадия 1-1е1)
Данная стадия является стадией получения соединения, имеющего общую формулу (5) или (8). В зависимости от Pro4, применяемой в качестве защитной группы, подходящим образом выбирают известный способ, например, описанный в Protective Groups in Organic Synthesis, 3rd ed., Greene, T.W., Wuts, P.G.M., John Wiley & Sons, Inc., New York, 1999, или подобный способ, и данную стадию проводят в соответствии с ним. В случае, когда Pro4 представляет собой трет-бутоксикарбонильную группу, эту стадию проводят добавлением подходящего реагента к соединению, имеющему общую формулу (4) или (7), в инертном растворителе.
Хотя не имеются конкретные ограничения для применяемого растворителя, при условии, что он не ингибирует реакцию и растворяет исходное соединение до определенной степени, предпочтительные примеры растворителя включают в себя ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как дихлорметан или хлороформ; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, 1,4-диоксан или 1,2-диметоксиэтан; сложные эфиры, такие как этилацетат или пропилацетат; нитрилы, такие как ацетонитрил; амиды, такие как формамид или N,N-диметилформамид; сульфоксиды, такие как диметилсульфоксид, и смесь многих органических растворителей в произвольном отношении.
Хотя не имеются конкретные ограничения для применяемого реагента, при условии, что его применяют в качестве реагента, который удаляет защитную трет-бутоксикарбонильную группу в общепринятых реакциях, предпочтительные примеры его включают в себя неорганические кислоты, такие как хлористоводородная кислота или серная кислота; органические кислоты, такие как уксусная кислота или трифторуксусная кислота; кислоты Льюиса, такие как триметилсилилиодид или трифторид бора, хлорангидриды кислот, такие как ацетилхлорид; гидроксиды щелочных металлов, такие как гидроксид натрия.
Изменяющаяся в соответствии с исходными соединениями, реагентами и тому подобному температура реакции обычно бывает от -10°С до 100°С и предпочтительно от 10°С до 50°С.
Изменяющееся в соответствии с исходными соединениями, реагентами и тому подобному время реакции обычно бывает от 5 минут до 24 часов и предпочтительно от 10 минут до 6 часов.
После завершения реакции твердое вещество можно получить отгонкой растворителя и добавлением н-гексана или подобного растворителя к образовавшемуся остатку. Это вещество получают фильтрованием и затем сушат, получая при этом соль соединения, имеющего общую формулу (5) или (8). С другой стороны, в случае, когда невозможно получить твердое вещество добавлением н-гексана, требуемое соединение можно получить экстракцией органического вещества органическим растворителем, таким как этилацетат, с последующим концентрированием органического слоя после сушки его обычно применяемой процедурой или концентрированием его, когда он находится при пониженном давлении.
(Стадия 1-1е2)
Эту стадию можно проводить в соответствии со (i) стадией 1-1е2-1; (ii) комбинацией стадий 1-1е2-2 и 1-1е2-3 или (iii) комбинацией стадий 1-1е2-2, 1-1е2-4 и 1-1е2-5.
[Стадия 1-1е2-1]
Данная стадия является стадией получения соединения, имеющего общую формулу (6) или (9), и ее проводят реакцией замещенного или незамещенного арилгалогенида или гетероарилгалогенида, или арилпсевдогалогенида или гетероарилпсевдогалогенида, содержащего кольцо Q2 и кольцо Q3, с соединением, имеющим общую формулу (5) или (8), в инертном растворителе, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки и в присутствии металлического катализатора. Это условие реакции подходящим образом выбирают из известных способов, описанных, например, Tsuji, J., Palladium Peagents and Catalysts, John Wiley & Sons, Inc., England, 2004; Jiang, L., Buchwald, S.L., Palladium-Catalyzed Aromatic Carbon-Nitrogen Bond Formation; Metal-Catalyzed Cross-Coupling Reactions, de Meijere, A., Diederich, F., Wiley-VCH, Weinheim, 2004, Chapter 13 и т.д., и эту стадию проводят в соответствии с ними. Хотя условия реакции этой стадии предпочтительно являются такими, как описано ниже, они не ограничиваются ими.
Хотя не имеются конкретные ограничения для применяемого растворителя, при условии, что он не ингибирует реакцию и растворяет исходное соединение до определенной степени, предпочтительные примеры растворителя включают в себя ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как дихлорметан или хлороформ; сложные эфиры, такие как этилацетат или пропилацетат; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, 1,4-диоксан или 1,2-диметоксиэтан; спирты, такие как метанол, этанол или трет-бутанол; нитрилы, такие как ацетонитрил; амиды, такие как формамид или N,N-диметилформамид; сульфоксиды, такие как диметилсульфоксид; смесь многих органических растворителей в произвольном отношении и смесь их с водой в произвольном отношении.
Хотя не имеются конкретные ограничения для применяемого основания, при условии, что его применяют в качестве основания в общепринятых реакциях, предпочтительные примеры его включают в себя органические основания, такие как триэтиламин, N,N-диизопропилэтиламин, N-метилморфолин, лутидин или пиридин; карбонаты щелочных металлов, такие как карбонат натрия или карбонат калия; карбонаты щелочноземельных металлов, такие как карбонат кальция; гидрокарбонаты щелочных металлов, такие как гидрокарбонат калия; гидрокарбонаты щелочноземельных металлов, такие как гидрокарбонат кальция; гидроксиды щелочных металлов, такие как гидроксид натрия; гидроксиды щелочноземельных металлов, такие как гидроксид кальция; ацетаты щелочных металлов, такие как ацетат натрия или ацетат калия; фосфаты щелочных металлов, такие как трикалийфосфат; алкоксиды металлов, такие как трет-бутоксид натрия или трет-бутоксид калия; металлорганические амиды, такие как диизопропиламид лития или гексаметилдисилазид натрия, металлорганические соединения, такие как трет-бутиллитий, и гидриды металлов, такие как гидрид калия.
Хотя не имеются конкретные ограничения для применяемой добавки, при условии, что ее применяют в известных способах, предпочтительные примеры ее включают в себя оксиды металлов, такие как оксид серебра или оксид алюминия; фосфины, такие как трифенилфосфин, три-трет-бутилфосфин, трициклогексилфосфин, три-(о-толил)фосфин, дифенилфосфиноферроцен, 2-дициклогексилфосфино-2',6'-диметокси-1,1'-дифенил (S-PHOS), 2-дициклогексилфосфино-2',4',6'-триизопропил-1,1'-дифенил (X-PHOS) или 2,2'-бис(дифенилфосфино)-1,1'-динафтил (BINAP); оксиды фосфинов, такие как оксид трифенилфосфина; соли металлов, такие как хлорид лития, фторид калия или фторид цезия, и соли аммония, такие как бромид тетрабутиламмония. Их можно применять в комбинации в произвольном отношении.
Хотя не имеются конкретные ограничения для применяемого металлического катализатора, при условии, что его применяют в известных способах, предпочтительные примеры его включают в себя палладиевые катализаторы, такие как тетракис(трифенилфосфин)палладий, бис(три-трет-бутилфосфин)палладий, диацетат палладия, комплекс дихлорид палладия-дифенилфосфиноферроцен, комплекс дихлорид палладия-бензонитрил, комплекс дихлорид палладия-ацетонитрил, бис(дибензилиденацетон)палладий, трис(дибензилиденацетон)дипалладий, бис-[1,2-бис(дифенилфосфино)этан]палладий, 3-хлорпиридин-[1,3-бис(2,6-диизопропилфенил)имидазол-2-илиден]палладий или палладий на активированном угле.
Псевдогалогенид относится к соединению, имеющему группу псевдогалогена, и группа псевдогалогена относится к группе, которая, как известно, подвергается окислительному присоединению к катализатору переходного металла с низкой валентностью, таким же способом, как атомы галогена в реакции сочетания, с применением катализатора переходного металла. Хотя не имеются конкретные ограничения для группы псевдогалогена, при условии, что она является группой, которая принимает участие в указанной выше реакции окислительного присоединения, примеры ее включают в себя сульфонилоксигруппы, такие как трифторметансульфонилоксигруппа, метансульфонилоксигруппа или п-толуолсульфонилоксигруппа; ацилоксигруппы, такие как ацетилоксигруппа; диазониевые группы и фосфонилоксигруппы.
Не имеются конкретные ограничения для применяемого замещенного или незамещенного арилгалогенида или гетероарилгалогенида, или арилпсевдогалогенида или гетероарилпсевдогалогенида, при условии, что он является известным соединением или синтезирован согласно известным способам.
Изменяющаяся в соответствии с исходными соединениями, реагентами и тому подобному температура реакции обычно бывает от -10°С до 200°С и предпочтительно от 0°С до 150°С.
Изменяющееся в соответствии с исходными соединениями, реагентами и тому подобному время реакции обычно бывает от 5 минут до 48 часов и предпочтительно от 10 минут до 12 часов.
После завершения реакции нужное соединение данной реакции можно получить, например, концентрированием реакционной смеси, добавлением органического растворителя, такого как этилацетат, и промыванием водой с последующим отделением органического слоя, содержащего нужное соединение, сушкой безводным сульфатом натрия и тому подобным и отгонкой растворителя.
Образовавшееся соединение можно дополнительно очищать, если необходимо, с применением общепринятого способа, например, перекристаллизацией, повторным осаждением, колоночной хроматографией на силикагеле или подобным способом.
(Стадия 1-1е2-2)
Данная стадия является стадией реакции замещенного или незамещенного арилгалогенида или гетероарилгалогенида, или арилпсевдогалогенида или гетероарилпсевдогалогенида, содержащего кольцо Q2 и не содержащего кольцо Q3, с соединением, имеющим общую формулу (5) или (8), в инертном растворителе, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки и в присутствии металлического катализатора.
Данную стадию можно проводить согласно стадии 1-1е2-1.
(Стадия 1-1е2-3)
Данная стадия является стадией реакции соединения, имеющего уходящую группу, такую как атом галогена или группу -ОХ1 у кольца Q2, полученного на стадии 1-1е2-2, с замещенной или незамещенной арилбороновой кислотой или гетероарилбороновой кислотой в инертном растворителе, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки и в присутствии металлического катализатора, с получением соединения, имеющего общую формулу (6) или (9). Условие этой реакции подходящим образом выбирают из известных способов, описанных, например, в публикациях Miyaura, N., Yamada, K., Suzuki, A., Tetrahedron Lett., 1979, 36, 3437; Miyaura, N., Suzuki, A., Chem. Rev., 1995, 95, 2457 и т.д., и эту стадию проводят в соответствии с ними. Хотя условия реакции этой стадии предпочтительно являются такими, какие описаны ниже, они не ограничиваются ими.
Хотя не имеются конкретные ограничения для применяемого растворителя, при условии, что он не ингибирует реакцию и растворяет исходное соединение до определенной степени, предпочтительные примеры его включают в себя ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как дихлорметан или хлороформ; сложные эфиры, такие как этилацетат или пропилацетат; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, 1,4-диоксан или 1,2-диметоксиэтан; спирты, такие как метанол, этанол или трет-бутанол; нитрилы, такие как ацетонитрил; амиды, такие как формамид или N,N-диметилформамид; сульфоксиды, такие как диметилсульфоксид; смесь многих органических растворителей в произвольном отношении и смесь их с водой в произвольном отношении.
Хотя не имеются конкретные ограничения для применяемого основания, при условии, что его применяют в качестве основания в общепринятых реакциях, предпочтительные примеры его включают в себя органические основания, такие как триэтиламин, N,N-диизопропилэтиламин, N-метилморфолин, лутидин или пиридин; карбонаты щелочных металлов, такие как карбонат натрия или карбонат калия; карбонаты щелочноземельных металлов, такие как карбонат кальция; гидрокарбонаты щелочных металлов, такие как гидрокарбонат калия; гидрокарбонаты щелочноземельных металлов, такие как гидрокарбонат кальция, гидроксиды щелочных металлов, такие как гидроксид натрия; гидроксиды щелочноземельных металлов, такие как гидроксид кальция; ацетаты щелочных металлов, такие как ацетат натрия или ацетат калия; фосфаты щелочных металлов, такие как трикалийфосфат; алкоксиды металлов, такие как трет-бутоксид натрия или трет-бутоксид калия; металлорганические амиды, такие как диизопропиламид лития или гексаметилдисилазид натрия, металлорганические соединения, такие как трет-бутиллитий, и гидриды металлов, такие как гидрид калия.
Хотя не имеются конкретные ограничения для применяемой добавки, при условии, что ее применяют в известных способах, предпочтительные примеры ее включают в себя оксиды металлов, такие как оксид серебра или оксид алюминия; фосфины, такие как трифенилфосфин, три-трет-бутилфосфин, трициклогексилфосфин, три-(о-толил)фосфин, дифенилфосфиноферроцен, 2-дициклогексилфосфино-2',6'-диметокси-1,1'-дифенил (S-PHOS), 2-дициклогексилфосфино-2',4',6'-триизопропил-1,1'-дифенил (X-PHOS) или 2,2'-бис(дифенилфосфино)-1,1'-динафтил (BINAP); оксиды фосфинов, такие как оксид трифенилфосфина; соли металлов, такие как хлорид лития, фторид калия или фторид цезия, и соли аммония, такие как бромид тетрабутиламмония. Их можно применять в комбинации в произвольном отношении.
Хотя не имеются конкретные ограничения для применяемого металлического катализатора, при условии, что его применяют в известных способах, предпочтительные примеры его включают в себя палладиевые катализаторы, такие как тетракис(трифенилфосфин)палладий, бис(три-трет-бутилфосфин)палладий, диацетат палладия, комплекс дихлорид палладия-дифенилфосфиноферроцен, комплекс дихлорид палладия-бензонитрил, комплекс дихлорид палладия-ацетонитрил, бис(дибензилиденацетон)палладий, трис(дибензилиденацетон)дипалладий, бис-[1,2-бис(дифенилфосфино)этан]палладий, 3-хлорпиридин-[1,3-бис-(2,6-диизопропилфенил)имидазол-2-илиден]палладий или палладий на активированном угле.
Изменяющаяся в соответствии с исходными соединениями, реагентами и тому подобному температура реакции обычно бывает от -10°С до 200°С и предпочтительно от 0°С до 150°С.
Изменяющееся в соответствии с исходными соединениями, реагентами и тому подобному время реакции обычно бывает от 5 минут до 48 часов и предпочтительно от 10 минут до 12 часов.
После завершения реакции нужное соединение данной реакции можно получить, например, концентрированием реакционной смеси, добавлением органического растворителя, такого как этилацетат, и промыванием водой с последующим отделением органического слоя, содержащего нужное соединение, сушкой безводным сульфатом натрия и тому подобным и отгонкой растворителя.
Образовавшееся соединение можно дополнительно очищать, если необходимо, с применением общепринятого способа, например, перекристаллизацией, повторным осаждением, колоночной хроматографией на силикагеле или подобным способом.
(Стадия 1-1е2-4)
Данная стадия является стадией реакции соединения, имеющего уходящую группу, такую как атом галогена или группу -ОХ1 у кольца Q2, полученного на стадии 1-1е2-2, с реагентом бора в инертном растворителе в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки и в присутствии металлического катализатора, для превращения его тем самым в соответствующее соединение бора. Условие этой реакции подходящим образом выбирают из известных способов, описанных, например, в публикациях Ishiyama, T., Murata, M., Miyaura, N., J. Org. Chem., 1995, 60, 7508; Ishiyama, T., Takagi, J., Ishida, K., Miyaura, N., Anastasi, N. R., Hartwig, J. F., J. Am. Chem. Soc., 2002, 124, 390; Ishiyama, T., Takagi, J., Hartwig, J. F., Miyaura, N., Angew. Chem. Int. Ed., 2002, 41, 3056, и подобных публикациях, и эту стадию проводят в соответствии с ними. Хотя условия реакции этой стадии предпочтительно являются такими, как описаны ниже, они не ограничиваются ими.
Хотя не имеются конкретные ограничения для применяемого растворителя, при условии, что он не ингибирует реакцию и растворяет исходное соединение до определенной степени, предпочтительные примеры его включают в себя ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как дихлорметан или хлороформ; сложные эфиры, такие как этилацетат или пропилацетат; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, 1,4-диоксан или 1,2-диметоксиэтан; спирты, такие как метанол, этанол или трет-бутанол; нитрилы, такие как ацетонитрил; амиды, такие как формамид или N,N-диметилформамид; сульфоксиды, такие как диметилсульфоксид; смесь многих органических растворителей в произвольном отношении и смесь их с водой в произвольном отношении.
Хотя не имеются конкретные ограничения для применяемого реагента бора, при условии, что его применяют в известных способах, предпочтительные примеры его включают в себя 4,4,4',4',5,5,5',5'-октаметил-2,2'-ди-1,3,2-диоксаборолан.
Хотя не имеются конкретные ограничения для применяемого основания, при условии, что его применяют в качестве основания в общепринятых реакциях, предпочтительные примеры его включают в себя органические основания, такие как триэтиламин, N,N-диизопропилэтиламин, N-метилморфолин, лутидин или пиридин; карбонаты щелочных металлов, такие как карбонат натрия или карбонат калия; карбонаты щелочноземельных металлов, такие как карбонат кальция; гидрокарбонаты щелочных металлов, такие как гидрокарбонат калия; гидрокарбонаты щелочноземельных металлов, такие как гидрокарбонат кальция; гидроксиды щелочных металлов, такие как гидроксид натрия; гидроксиды щелочноземельных металлов, такие как гидроксид кальция; ацетаты щелочных металлов, такие как ацетат натрия или ацетат калия; фосфаты щелочных металлов, такие как трикалийфосфат; алкоксиды металлов, такие как трет-бутоксид натрия или трет-бутоксид калия; металлорганические амиды, такие как диизопропиламид лития или гексаметилдисилазид натрия; металлорганические соединения, такие как трет-бутиллитий, и гидриды металлов, такие как гидрид калия.
Хотя не имеются конкретные ограничения для применяемой добавки, при условии, что ее применяют в известных способах, предпочтительные примеры ее включают в себя оксиды металлов, такие как оксид серебра или оксид алюминия; фосфины, такие как трифенилфосфин, три-трет-бутилфосфин, трициклогексилфосфин, три-(о-толил)фосфин, дифенилфосфиноферроцен, 2-дициклогексилфосфино-2',6'-диметокси-1,1'-дифенил (S-PHOS), 2-дициклогексилфосфино-2',4',6'-триизопропил-1,1'-дифенил (X-PHOS) или 2,2'-бис(дифенилфосфино)-1,1'-динафтил (BINAP); оксиды фосфинов, такие как оксид трифенилфосфина; соли металлов, такие как хлорид лития, фторид калия или фторид цезия, и соли аммония, такие как бромид тетрабутиламмония. Их можно применять в комбинации в произвольном отношении.
Хотя не имеются конкретные ограничения для применяемого металлического катализатора, при условии, что его применяют в известных способах, предпочтительные примеры его включают в себя палладиевые катализаторы, такие как тетракис(трифенилфосфин)палладий, бис(три-трет-бутилфосфин)палладий, диацетат палладия, комплекс дихлорид палладия-дифенилфосфиноферроцен, комплекс дихлорид палладия-бензонитрил, комплекс дихлорид палладия-ацетонитрил, бис(дибензилиденацетон)палладий, трис(дибензилиденацетон)дипалладий, бис-[1,2-бис(дифенилфосфино)этан]палладий, 3-хлорпиридин-[1,3-бис-(2,6-диизопропилфенил)имидазол-2-илиден]палладий или палладий на активированном угле.
Изменяющаяся в соответствии с исходными соединениями, реагентами и тому подобному температура реакции обычно бывает от -10°С до 200°С и предпочтительно от 0°С до 150°С.
Изменяющееся в соответствии с исходными соединениями, реагентами и тому подобному время реакции обычно бывает от 5 минут до 48 часов и предпочтительно от 10 минут до 12 часов.
После завершения реакции нужное соединение данной реакции можно получить, например, концентрированием реакционной смеси, добавлением органического растворителя, такого как этилацетат, и промыванием водой с последующим отделением органического слоя, содержащего нужное соединение, сушкой безводным сульфатом натрия и тому подобным и отгонкой растворителя.
Образовавшееся соединение можно дополнительно очищать, если необходимо, с применением общепринятого способа, например, перекристаллизацией, повторным осаждением, колоночной хроматографией на силикагеле или подобным способом.
(Стадия 1-1е2-5)
Данная стадия является стадией реакции соединения бора, полученного на стадии 1-1е2-4, с замещенным или незамещенным арилгалогенидом или гетероарилгалогенидом, или арилпсевдогалогенидом или гетероарилпсевдогалогенидом, содержащим кольцо Q3, в инертном растворителе, в присутствии или в отсутствие основания, в присутствии или в отсутствие добавки и в присутствии металлического катализатора, с получением тем самым соединения, имеющего общую формулу (6) или (9).
Эту стадию можно проводить в соответствии со стадией 1-1е2-3.
(Стадия 1-2)
Стадия 1-2 является стадией получения соединения, имеющего общую формулу (1), из соединения, имеющего формулу (3).
Примеры важных реакций включают в себя:
стадия 1-2а: реакцию удаления защитной группы Pro1;
стадия 1-2b: реакцию удаления защитной группы Pro3.
Кроме того, если необходимо, можно добавить:
стадию 1-2с: реакцию превращения R1b в R1 и
стадию 1-2d: реакцию превращения R2a в R2. Стадии от 1-2а до 1-2d можно проводить в любом порядке.
(Стадия 1-2а)
Данная стадия является стадией удаления защитной группы Pro1. В зависимости от применяемого Pro1, можно подходящим образом выбрать известный способ, описанный, например, в публикации Protective Groups in Organic Syntesis, 3rd ed., Greene, T.W., Wuts, P.G.M., John Wiley & Sons, Inc., New York, 1999 и подобных публикациях, и эту реакцию проводят согласно им. В данном контексте бензильная группа выбрана в качестве предпочтительной Pro1, и описан способ, в котором Pro1 превращают в атом водорода с применением катализатора в атмосфере водорода, в инертном растворителе, в присутствии или в отсутствие добавки (стадия 1-2а1), способ, в котором Pro1 превращают в атом водорода с применением катализатора в присутствии органического соединения, которое может служить в качестве источника водорода, в атмосфере азота или аргона, в инертном растворитель и в присутствии или в отсутствие добавки (стадия 1-2а2), или способ, в котором Pro1 превращают в атом водорода с применением подходящей кислоты в инертном растворителе (стадия 1-2а3), но этот способ не ограничивается ими.
(Стадия 1-2а1)
Эта стадия является стадией превращения Pro1 в атом водорода с применением катализатора в атмосфере водорода, в инертном растворителе и в присутствии или в отсутствие добавки.
Хотя не имеются конкретные ограничения для применяемого растворителя, при условии, что он не ингибирует реакцию и растворяет исходное соединение до определенной степени, предпочтительные примеры его включают в себя ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как дихлорметан или хлороформ; сложные эфиры, такие как этилацетат или пропилацетат; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, 1,4-диоксан или 1,2-диметоксиэтан; спирты, такие как метанол или этанол; нитрилы, такие как ацетонитрил; амиды, такие как формамид или N,N-диметилформамид; сульфоксиды, такие как диметилсульфоксид; смесь многих органических растворителей в произвольном отношении и смесь их с водой в произвольном отношении.
Хотя не имеются конкретные ограничения для применяемой добавки, при условии, что ее применяют в известных способах, примеры ее включают в себя хлористоводородную кислоту.
Хотя не имеются конкретные ограничения для применяемого металлического катализатора, при условии, что его применяют в известных способах, предпочтительные примеры его включают в себя палладий на активированном угле, трис(трифенилфосфин)родийхлорид или гидроксид палладия.
Изменяющаяся в соответствии с исходными соединениями, реагентами и тому подобному температура реакции обычно бывает от -100°С до 150°С и предпочтительно от 0°С до 100°С.
Изменяющееся в соответствии с исходными соединениями, реагентами и тому подобному время реакции обычно бывает от 1 минуты до 24 часов и предпочтительно от 5 минут до 10 часов.
После завершения реакции нужное соединение данной реакции можно получить, например, фильтрованием для отделения нерастворимого вещества и концентрированием фильтрата при пониженном давлении. Образовавшееся соединение можно дополнительно очищать, если необходимо, с применением общепринятого способа, такого как перекристаллизация, повторное осаждение, колоночная хроматография на силикагеле или подобный способ.
В случае, когда R2a представляет собой алкенильную группу, эту алкенильную группу можно превратить в соответствующую алкильную группу в этой стадии.
(Стадия 1-2а2)
Эта стадия является стадией превращения Pro1 в атом водорода с применением катализатора в присутствии органического соединения, которое может служить в качестве источника водорода, в атмосфере азота или аргона, в инертном растворителе и в присутствии или в отсутствие добавки.
Хотя не имеются конкретные ограничения для применяемого растворителя, при условии, что он не ингибирует реакцию и растворяет исходное соединение до определенной степени, предпочтительные примеры его включают в себя ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как дихлорметан или хлороформ; сложные эфиры, такие как этилацетат или пропилацетат; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, 1,4-диоксан или 1,2-диметоксиэтан; спирты, такие как метанол или этанол; нитрилы, такие как ацетонитрил; амиды, такие как формамид или N,N-диметилформамид; сульфоксиды, такие как диметилсульфоксид; смесь многих органических растворителей в произвольном отношении и смесь их с водой в произвольном отношении.
Хотя не имеются конкретные ограничения для применяемого органического соединения, при условии, что его применяют в известных способах, примеры его включают в себя муравьиную кислоту.
Хотя не имеются конкретные ограничения для применяемой добавки, при условии, что ее применяют в известных способах, примеры ее включают в себя хлористоводородную кислоту.
Хотя не имеются конкретные ограничения для применяемого металлического катализатора, при условии, что его применяют в известных способах, предпочтительные примеры его включают в себя палладий на активированном угле, трис(трифенилфосфин)родийхлорид, гидроксид палладия или тому подобное.
Изменяющаяся в соответствии с исходными соединениями, реагентами и тому подобному температура реакции обычно бывает от -100°С до 150°С и предпочтительно от -78°С до 100°С.
Изменяющееся в соответствии с исходными соединениями, реагентами и тому подобному время реакции обычно бывает от 5 минут до 24 часов и предпочтительно от 10 минут до 6 часов.
После завершения реакции нужное соединение данной реакции можно получить, например, концентрированием реакционной смеси, добавлением органического растворителя, такого как этилацетат, и промыванием водой с последующим отделением органического слоя, содержащего нужное соединение, сушкой безводным сульфатом натрия и тому подобным и отгонкой растворителя.
Образовавшееся соединение можно дополнительно очищать, если необходимо, с применением общепринятого способа, такого как перекристаллизация, повторное осаждение, колоночная хроматография на силикагеле или подобный способ.
(Стадия 1-2а3)
Данная стадия является стадией превращения Pro1 в атом водорода с применением подходящей кислоты в инертном растворителе. Эту стадию можно проводить согласно стадии 1-1а2.
(Стадия 1-2b)
Данная стадия является стадией удаления защитной группы Pro3. Эту стадию можно проводить согласно стадии 1-1а. В случае, когда Pro3 представляет собой бензильную группу, эту стадию можно также проводить согласно стадии 1-2а1.
(Стадия 1-2с)
Данная стадия является стадией превращения R1b в R1. Эту стадию можно проводить согласно стадии 1-1е2. В случае, когда R1b имеет защитную группу, эта стадия дополнительно включает в себя стадию такого же удаления защиты. В зависимости от применяемой защитной группы, выбирают подходящий известный способ, описанный, например, в публикации Protective Groups in Organic Synthesis, 3rd ed., Greene, T.W., Wuts, P. G. M., John Wiley & Sons, Inc., New York, 1999, и т.д., и эту стадию проводят согласно им. В данном контексте в качестве предпочтительной защитной группы применяют метоксиметильную группу или трет-бутил(диметил)силильную группу, и описывают способ, в котором защитную метоксиметильную группу удаляют с применением кислоты в инертном растворителе (стадия 1-2с1), способ, в котором защитную трет-бутил(диметил)силильную группу удаляют с применением кислоты в инертном растворителе (стадия 1-2с2) или способ, в котором защитную трет-бутил(диметил)силильную группу удаляют с применением соединения фтора в инертном растворителе (стадия 1-2с3), но данный способ не ограничивается ими.
(Стадия 1-2с1)
Данная стадия является стадией удаления защитной метоксиметильной группы и ее можно проводить согласно стадии 1-1а2.
(Стадия 1-2с2)
Данная стадия является стадией удаления защитной трет-бутил(диметил)силильной группы и ее можно проводить согласно стадии 1-1а2.
(Стадия 1-2с3)
Данная стадия является стадией удаления защитной трет-бутил(диметил)силильной группы и ее проводят с применением соединения фтора в инертном растворителе.
Хотя не имеются конкретные ограничения для применяемого растворителя, при условии, что он не ингибирует реакцию и растворяет исходное соединение до определенной степени, предпочтительные примеры его включают в себя ароматические углеводороды, такие как бензол, толуол или ксилол; галогенированные углеводороды, такие как дихлорметан или хлороформ; сложные эфиры, такие как этилацетат или пропилацетат; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, 1,4-диоксан или 1,2-диметоксиэтан; спирты, такие как метанол, этанол или трет-бутанол; нитрилы, такие как ацетонитрил; амиды, такие как формамид или N,N-диметилформамид; сульфоксиды, такие как диметилсульфоксид; смесь многих органических растворителей в произвольном отношении и смесь их с водой в произвольном отношении.
Хотя не имеются конкретные ограничения для применяемого соединения фтора, при условии, что его применяют при удалении защитной силильной группы, предпочтительные примеры его включают в себя фторид тетрабутиламмония, дифтортриметилсиликат трис(диметиламино)сульфония или тому подобное.
Изменяющаяся в соответствии с исходными соединениями, реагентами и тому подобному температура реакции обычно бывает от -100°С до 150°С и предпочтительно от -20°С до 100°С.
Изменяющееся в соответствии с исходными соединениями, реагентами и тому подобному время реакции обычно бывает от 5 минут до 24 часов и предпочтительно от 10 минут до 6 часов.
После завершения реакции нужное соединение данной реакции можно получить, например, концентрированием реакционной смеси, добавлением органического растворителя, такого как этилацетат, и промыванием водой с последующим отделением органического слоя, содержащего нужное соединение, сушкой безводным сульфатом натрия и тому подобным и отгонкой растворителя.
Образовавшееся соединение можно дополнительно очищать, если необходимо, с применением общепринятого способа, такого как перекристаллизация, повторное осаждение, колоночная хроматография на силикагеле или подобный способ.
(Стадия 1-2d)
Данная стадия является стадией превращения R2a в R2, и в случае, когда R2a представляет собой алкенильную группу, эту алкенильную группу можно превратить в соответствующую алкильную группу согласно стадии 1-2а1.
(Стадия 2)
Стадия 2 является стадией получения соединения (2), применяемого в стадии 1.
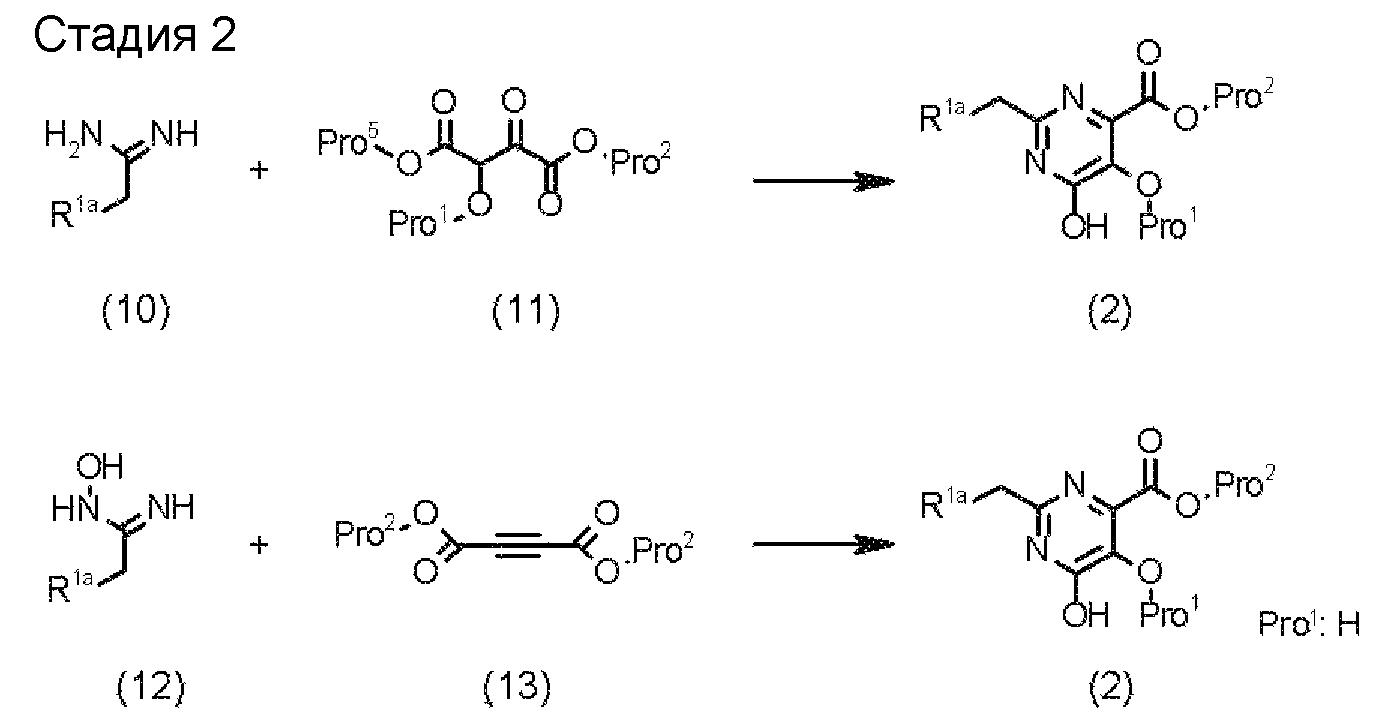
В указанных выше формулах R1a имеет такое же значение, как указано ранее, и Pro5 относится к защитной группе каждой функциональной группы, выбранной из известных защитных групп (например, групп из публикации Protective Groups in Organic Synthesis, 3rd ed., Greene, T.W., Wuts, P.G.M., John Wiley & Sons, Inc., New York, 1999, и т.д.). Хотя не имеются конкретные ограничения для Pro5, при условии, что она является стабильной во время реакции и не ингибирует реакцию, предпочтительной является метильная группа.
Соединение, имеющее общую формулу (2), можно синтезировать с применением известного способа (например, (i) способа, в котором замещенный этанимидамид (10) и диэфир 2-алкилокси-3-оксоянтарной кислоты (11), синтезированные согласно известным способом, конденсируют в присутствии основания: Dreher, S.D., Ikemoto, N., Gresham, V., Liu, J., Dormer, P.G., Balsells, J., Mathre, D., Novak, T., Armstrong III, J.D., Tetrahedron Lett., 2004, 45, 6023, или (ii) способа, в котором конденсируют N-гидроксизамещенные этанимидамиды (12) и диэфир ацетилендикарбоновой кислоты (13): Culbertson, T.P., J. Heterocycl. Chem., 1979, 16, 1423), или с применением способа согласно известному способу.
Продукты реакции, полученные согласно каждой из указанных выше стадий, выделяют и очищают в виде несольватов, их солей или различных типов сольватов, таких как гидраты. Их соли можно получить согласно общепринятому способу. Выделение или очистку проводят с применением общепринятых способов, таких как экстракция, концентрирование, дистилляция, кристаллизация, фильтрование, перекристаллизация, различные типы хроматографии или тому подобное.
Каждый тип изомера можно выделить согласно общепринятым способам с применением различий в физико-химических свойствах изомеров. Например, оптические изомеры можно разделить обычными способами разделения оптических изомеров (например, фракционной кристаллизацией, хроматографией и т.д.). Кроме того, оптические изомеры можно также получить из подходящих оптически активных исходных соединений.
Препарат, содержащий соединение настоящего изобретения в качестве активного ингредиента, получают с применением добавок, таких как носитель и эксципиент, применяемых для общепринятого препарата. Введение соединения настоящего изобретения можно проводить пероральным введением в форме таблеток, пилюль, капсул, гранул, порошков, жидкостей и т.д. или парентеральным введением в форме инъекций (например, внутривенной инъекции, внутримышечной инъекции и т.д.), суппозиторий, чрескожных агентов, назальных агентов, форм для ингаляции или тому подобных форм. Дозу и частоту введения соединения настоящего изобретения подходящим образом определяют на индивидуальной основе, принимая во внимание такие факторы, как симптомы и возраст или пол субъекта, которому вводят соединение. Доза обычно составляет 0,001-100 мг/кг на введение для взрослого человека в случае перорального введения и в случае внутривенного введения доза обычно бывает 0,0001-10 мг/кг на введения для взрослого человека. Частота введения обычно бывает 1-6 раз в день или от одного раза в день до одного раза в 7 дней. Введение пациенту, который получает диализ, предпочтительно проводят один раз до или после каждого диализа (предпочтительно перед диализом), который получает пациент.
Твердые препараты для перорального введения согласно настоящему изобретению могут быть таблетками, порошками, гранулами или подобными формами. Такие препараты получают согласно общепринятому способу смешиванием одного или нескольких активных веществ с инертным эксципиентом, смазывающим веществом, дезинтегрирующим агентом или вспомогательным средством для растворения. Эксципиентом может быть, например, лактоза, маннит или глюкоза. Смазывающим веществом может быть, например, стеарат магния. Дезинтегрирующим агентом может быть, например, натриевая соль карбоксиметилкрахмала. Таблетки или пилюли можно изготовить с сахарным покрытием или, если необходимо, с покрытием, растворимым в желудке, или с энтеросолюбильным покрытием.
Жидкие препараты для перорального введения могут быть фармацевтически приемлемыми эмульсиями, жидкостями, суспензиями, сиропами, эликсирами или тому подобными формами. Такие препараты могут содержать обычно применяемые инертные растворители (например, очищенную воду или этанол) и могут дополнительно содержать солюбилизаторы, смачивающие агенты, суспендирующие агенты, подслащивающие вещества, корригенты, ароматизирующие агенты или консерванты.
Инъекциями для парентерального введения могут быть стерильные водные или неводные жидкие препараты, суспензии или эмульсии. Водными растворителями для инъекционных препаратов могут быть, например, дистиллированная вода или физиологический солевой раствор. Неводными растворителями для инъекций могут быть, например, пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, спирты, такие как этанол, и полисорбат 80 (название фармакопеи Японии). Такие препараты могут дополнительно содержать изотонические агенты, консерванты, смачивающие агенты, эмульгаторы, диспергаторы, стабилизаторы или средства, способствующие растворению. Эти препараты могут быть стерилизованы, например, пропусканием через удерживающий бактерии фильтр, включением в них бактерицида или облучением. Кроме того, в качестве этих препаратов можно также применять композиции, полученные растворением или суспендированием стерильной твердой композиции в стерильной воде или растворителе для инъекции перед применением.
Примеры
Хотя ниже представлены примеры и примеры испытания для объяснения настоящего изобретения более подробно, объем настоящего изобретения не ограничивается ими.
(Пример 1)
({[5-Гидрокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 12]
(1) трет-Бутил-4-(цианометилен)пиперидин-1-карбоксилат
[Химическая формула 13]
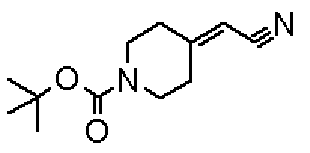
Диэтилцианометилфосфонат (16 мл, 100 ммоль) растворяли в тетрагидрофуране (360 мл) и к раствору в атмосфере азота при -78°С добавляли раствор гексаметилдисилазида лития в тетрагидрофуране (1 М, 100 мл, 100 ммоль) и раствор трет-бутил-4-оксопиперидин-1-карбоксилата (18 г, 91 ммоль) в тетрагидрофуране (36 мл) с последующим перемешиванием смеси при такой же температуре в течение 40 минут. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом и экстракт промывали насыщенным водным раствором хлорида аммония. После отгонки растворителя при пониженном давлении, образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,41 (гексан/этилацетат=3/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (22 г) в виде белого твердого вещества (количественный выход).
1H-ЯМР (500 МГц, CDCl3) δ: 5,19 (1H, с), 3,56-3,46 (4H, м), 2,56 (2H, т, J=5 Гц), 2,33 (2H, т, J=5 Гц), 1,48 (9H, с).
(2) трет-Бутил-4-(цианометил)пиперидин-1-карбоксилат
[Химическая формула 14]
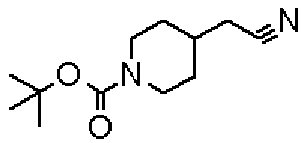
трет-Бутил-4-(цианометилен)пиперидин-1-карбоксилат (20 г, 91 ммоль) растворяли в этилацетате (400 мл) и добавляли 10% палладий на активированном угле с последующим перемешиванием смеси при комнатной температуре в течение 3,5 часа в атмосфере водорода. Реакционный раствор фильтровали через целит и фильтрат концентрировали при пониженном давлении. Образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,38 (гексан/этилацетат=3/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (23 г) в виде белого твердого вещества (количественный выход).
1H-ЯМР (500 МГц, CDCl3) δ: 4,24-4,07 (2H, м), 2,78-2,64 (2H, м), 2,32 (2H, д, J=6 Гц), 1,89-1,75 (3H, м), 1,46 (9H, с), 1,32-1,21 (2H, м).
(3) Ацетат трет-бутил-4-(2-амино-2-иминоэтил)пиперидин-1-карбоксилата
[Химическая формула 15]
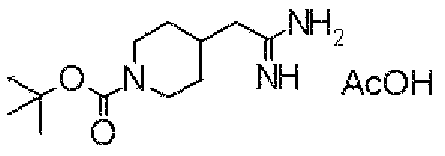
трет-Бутил-4-(цианометил)пиперидин-1-карбоксилат (91 ммоль) растворяли в этаноле (200 мл) и добавляли водный раствор гидроксиламина (50%, 17 мл, 170 ммоль) с последующим нагреванием смеси для кипячения с обратным холодильником в течение 3,5 часа. Реакционный раствор охлаждали и затем концентрировали при пониженном давлении, получая при этом трет-бутил-4-[2-амино-2-(гидроксиимино)этил]пиперидин-1-карбоксилат в виде бесцветного аморфного твердого вещества.
Это вещество растворяли в 1,4-диоксане (100 мл) и при комнатной температуре добавляли уксусный ангидрид (17 мл, 180 ммоль) и триэтиламин (15 мл, 180 ммоль) с последующим перемешиванием смеси при такой же температуре в течение 2 часов. После разбавления реакционного раствора этилацетатом его промывали последовательно водой, разбавленной хлористоводородной кислотой и водой и органический слой сушили над безводным сульфатом натрия. После отгонки растворителя при пониженном давлении образовавшееся твердое вещество промывали гексаном, получая при этом трет-бутил-4-[2-(ацетоксиимино)-2-аминоэтил]пиперидин-1-карбоксилат в виде белого твердого вещества.
Его растворяли в этаноле (200 мл) и добавляли дихлорметан (40 мл) и 10% палладий на активированном угле (3,6 г) с последующим перемешиванием в атмосфере водорода при комнатной температуре в течение 5 часов. Реакционный раствор фильтровали через целит и затем фильтрат концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (24 г, 79 ммоль) в виде белого твердого вещества (выход 85%).
1Н-ЯМР (500 МГц, DMSO-d6) δ: 3,99-3,86 (2H, м), 2,81-2,58 (2Н, м), 2,23 (2Н, д, J=8 Гц), 1,85 (1H, м), 1,64 (3H, с), 1,64-1,56 (2H, м), 1,40 (9H, с), 0,99-1,08 (2H, м).
(4) трет-Бутил-5-(бензилокси)-2-{[1-(трет-бутоксикарбонил)пиперидин-4-ил]метил}-6-гидроксипиримидин-4-карбоксилат
[Химическая формула 16]
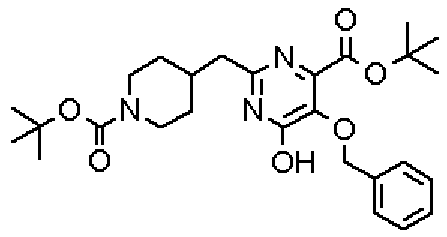
Диизопропиламин (30 мл, 210 ммоль) растворяли в тетрагидрофуране (100 мл) и по каплям при 3°С добавляли раствор н-бутиллития в гексане (2,77 М, 77 мл, 210 ммоль) с последующим перемешиванием при -78°С в течение 30 минут, получая при этом раствор диизопропиламида лития (LDA) в тетрагидрофуране.
трет-Бутилметилоксалат (34 г, 210 ммоль) и метил(бензилокси)ацетат (35 г, 190 ммоль) растворяли в тетрагидрофуране (250 мл) и по каплям в атмосфере азота добавляли раствор LDA в тетрагидрофуране, полученный при -78°С, с последующим перемешиванием при такой же температуре в течение 3 часов. Температуру реакционного раствора постепенно повышали до -40°С и затем добавляли хлористоводородную кислоту (2 М, 210 мл) с последующей экстракцией смеси этилацетатом. Экстракт промывали водой и насыщенным водным раствором хлорида натрия с последующей сушкой над безводным сульфатом магния и растворитель отгоняли при пониженном давлении, получая при этом 4-трет-бутил-1-метил-2-(бензилокси)-3-оксосукцинат (62 г) в виде желтого масла.
Часть этого масла (36 г, 120 ммоль) и ацетат трет-бутил-4-(2-амино-2-иминоэтил)пиперидин-1-карбоксилата (24 г, 79 ммоль) растворяли в метаноле (240 мл) и при 3°С добавляли раствор метоксида натрия в метаноле (28%, 48 мл, 240 ммоль) с последующим перемешиванием смеси при комнатной температуре в течение 14,5 часа. К реакционному раствору добавляли хлористоводородную кислоту (1 М, 130 мл) и затем осажденное твердое вещество собирали фильтрованием, получая при этом указанное в заголовке соединение (26 г, 52 ммоль) в виде белого твердого вещества (выход 66%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,47-7,44 (2H, м), 7,40-7,31 (3H, м), 5,23 (2H, с), 4,21-3,91 (2H, м), 2,74-2,58 (2H, м), 2,62 (2H, д, J=7 Гц), 2,06 (1H, м), 1,69-1,60 (2H, м), 1,53 (9H, с), 1,43 (9H, с), 1,28-1,16 (2H, м).
(5) трет-Бутил-5-(бензилокси)-2-{[1-(трет-бутоксикарбонил)пиперидин-4-ил]метил}-6-{[(трифторметил)сульфонил]окси}пиримидин-4-карбоксилат
[Химическая формула 17]
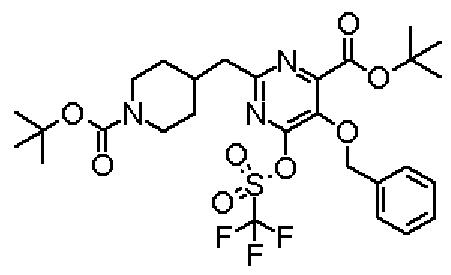
трет-Бутил-5-(бензилокси)-2-{[1-(трет-бутоксикарбонил)пиперидин-4-ил]метил}-6-гидроксипиримидин-4-карбоксилат (5,0 г, 10 ммоль) растворяли в дихлорметане (100 мл) и при -78°С добавляли трифторметансульфоновый ангидрид (2,1 мл, 12 ммоль) и триэтиламин (2,1 мл, 15 ммоль) с последующим перемешиванием при такой же температуре в течение 30 минут. После концентрирования реакционного раствора при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,63 (гексан/этилацетат=2/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (6,0 г, 9,5 ммоль) в виде желтого масла (выход 95%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,44-7,36 (5H, м), 5,14 (2H, с), 4,21-3,95 (2H, м), 2,88 (2H, д, J=7 Гц), 2,80-2,62 (2H, м), 2,07 (1H, м), 1,67-1,60 (2H, м), 1,57 (9H, с), 1,46 (9H, с), 1,27-1,17 (2H, м).
(6) трет-Бутил-5-(бензилокси)-2-{[1-(трет-бутоксикарбонил)пиперидин-4-ил]метил}-6-метилпиримидин-4-карбоксилат
[химическая формула 18]
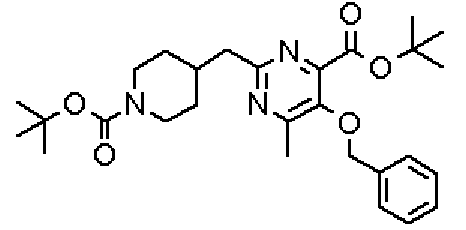
трет-Бутил-5-(бензилокси)-2-{[1-(трет-бутоксикарбонил)пиперидин-4-ил]метил}-6-{[(трифторметил)сульфонил]окси}пиримидин-4-карбоксилат (6,0 г, 9,5 ммоль) растворяли в тетрагидрофуране (90 мл) и при комнатной температуре добавляли метилбороновую кислоту (1,8 г, 30 ммоль), оксид серебра (6,7 г, 29 ммоль), карбонат калия (4,0 г, 29 ммоль) и комплекс [1,1'-бис(дифенилфосфино)ферроцен]палладийдихлорид-дихлорметан (0,78 г, 0,96 ммоль) с последующим нагреванием для кипячения с обратным холодильником в течение 3 часов в атмосфере азота. Реакционный раствор охлаждали до комнатной температуры и затем нерастворимые вещества отделяли фильтрованием. После концентрирования фильтрата при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,34 (гексан/этилацетат=2/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (4,4 г, 8,8 ммоль) в виде желтого масла (выход 93%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,44-7,34 (5H, м), 5,00 (2H, с), 4,17-3,98 (2H, м), 2,85 (2H, д, J=7 Гц), 2,77-2,64 (2H, м), 2,44 (3H, с), 2,09 (1H, м), 1,66-1,59 (2H, м), 1,59 (9H, с), 1,45 (9H, с), 1,30-1,19 (2H, м).
(7) Гидрохлорид трет-бутил-5-(бензилокси)-6-метил-2-(пиперидин-4-илметил)пиримидин-4-карбоксилата
[химическая формула 19]
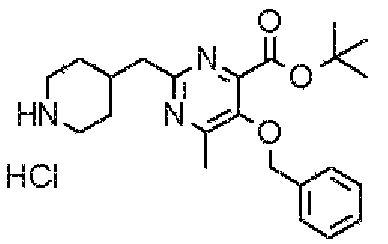
трет-Бутил-5-(бензилокси)-2-{[1-(трет-бутоксикарбонил)пиперидин-4-ил]метил}-6-метилпиримидин-4-карбоксилат (4,4 г, 8,8 ммоль) растворяли в этилацетате (44 мл) и добавляли раствор хлорида водорода в этилацетате (4 М, 68 мл, 270 ммоль) с последующим перемешиванием смеси при комнатной температуре в течение 3 часов. К реакционному раствору добавляли гексан (100 мл) и этилацетат (100 мл), тем самым осаждая твердое вещество. Образовавшееся твердое вещество собирали фильтрованием и сушили при пониженном давлении, получая при этом указанное в заголовке соединение (3,7 г, 8,5 ммоль) в виде белого твердого вещества (выход 95%).
1H-ЯМР (500 МГц, DMSO-d6) δ: 7,47-7,34 (5H, м), 4,99 (2H, с), 3,26-3,1 8 (2H, м), 2,90-2,78 (2H, м), 2,78 (2H, д, J=7 Гц), 2, 46 (3H, с), 2,12 (1H, м), 1,78-1,70 (2H, м), 1,51 (9H, с), 1,51-1,39 (2H, м).
(8) [(4'-Бромфенил-4-ил)метокси](трет-бутил)диметилсилан
[химическая формула 20]
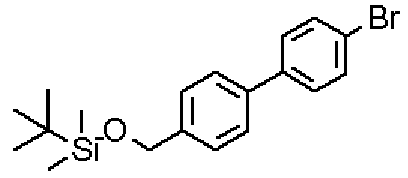
(4'-Бромдифенил-4-ил)метанол (0,70 г, 2,7 ммоль) и имидазол (0,54 г, 8,0 ммоль) растворяли в тетрагидрофуране (20 мл) и в атмосфере азота добавляли трет-бутилдиметилхлорсилан (1,2 г, 8,0 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. К реакционному раствору добавляли воду, раствор экстрагировали этилацетатом и затем промывали последовательно насыщенным раствором гидрокарбоната натрия, водой и насыщенным раствором хлорида натрия. После концентрирования органического слоя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,90 (гексан/этилацетат=9/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,92 г, 2,4 ммоль) в виде белого твердого вещества (выход 91%).
1Н-ЯМР (500 МГц, CDCl3) δ: 7,55 (2H, д, J=8 Гц), 7,52 (2H, д, J=8 Гц), 7,45 (2H, д, J=8 Гц), 7,40 (2H, д, J=8 Гц), 4,78 (2H, с), 0, 96 (9H, с), 0,12 (6H, с).
(9) трет-Бутил-5-(бензилокси)-2-({1-[4'-({[трет-бутил(диметил)силил]окси}метил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-карбоксилат
[Химическая формула 21]
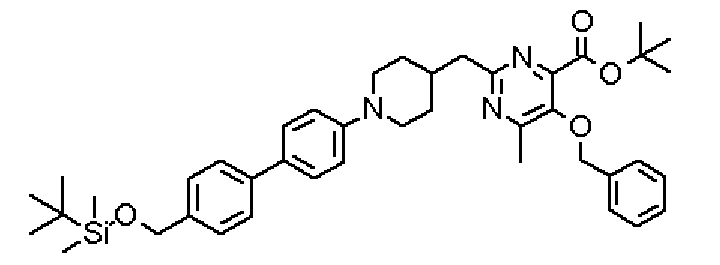
Гидрохлорид трет-бутил-5-(бензилокси)-6-метил-2-(пиперидин-4-илметил)пиримидин-4-карбоксилата (1,0 г, 2,3 ммоль), [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилан (0,92 г, 2,4 ммоль), трет-бутоксид натрия (0,67 г, 7,0 ммоль), 2-дициклогексилфосфино-2',4',6'-триизопропилдифенил (Х-PHOS) (0,11 г, 0,23 ммоль) и трис(дибензилиденацетон)дипалладий (0,11 г, 0,12 ммоль) суспендировали в толуоле (50 мл) с последующим нагреванием смеси для кипячения с обратным холодильником в течение 3 часов в атмосфере азота. Реакционный раствор охлаждали до комнатной температуры и фильтровали через целит и затем фильтрат концентрировали при пониженном давлении. Образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,50 (гексан/этилацетат=2/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,98 г, 1,4 ммоль) в виде желтого масла (выход 61%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,52 (2H, д, J=8 Гц), 7,49 (2H, д, J=8 Гц), 7,45-7,32 (7H, м), 6,99 (2H, д, J=8 Гц), 5,01 (2H, с), 4,76 (2H, с), 3,73 (2H, д, J=12 Гц), 2,91 (2H, д, J=7 Гц), 2,75 (2H, т, J=12 Гц), 2,46 (3H, с), 2,17-2,06 (1H, м), 1,80 (2H, д, J=12 Гц), 1,59 (9H, с), 1,54 (2H, кв, J=12 Гц), 0,95 (9H, с), 0,11 (6H, с).
(10) трет-Бутил-5-(бензилокси)-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-карбоксилат
[Химическая формула 22]
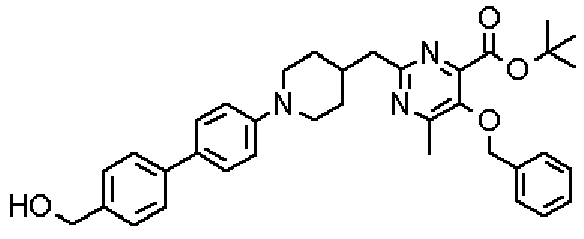
трет-Бутил-5-(бензилокси)-2-({1-[4'-({[трет-бутил(диметил)силил]окси}метил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-карбоксилат (0,98 г, 1,4 ммоль) растворяли в 1,4-диоксане (10 мл) и добавляли раствор хлорида водорода в диоксане (4 М, 1,0 мл, 4 ммоль) с последующим перемешиванием при комнатной температуре в течение 1,5 часа. К реакционному раствору для нейтрализации добавляли насыщенный раствор гидрокарбоната натрия с последующей экстракцией смеси этилацетатом и затем органический слой концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,81 г, 1,4 ммоль) в виде желтого масла (выход 99%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,56 (2H, д, J=8 Гц), 7,50 (2H, д, J=8 Гц), 7,45-7,34 (7H, м), 7,00 (2H, д, J=8 Гц), 5,01 (2H, с), 4,72 (2H, с), 3,73 (2H, д, J=12 Гц), 2,91 (2H, д, J=7 Гц), 2,76 (2H, т, J=12 Гц), 2,46 (3H, с), 2,17-2,06 (1H, м), 1,80 (2H, д, J=12 Гц), 1,59 (9H, с), 1,54 (2H, кв, J=12 Гц).
(11) Этил-({[5-(бензилокси)-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетат
[Химическая формула 23]
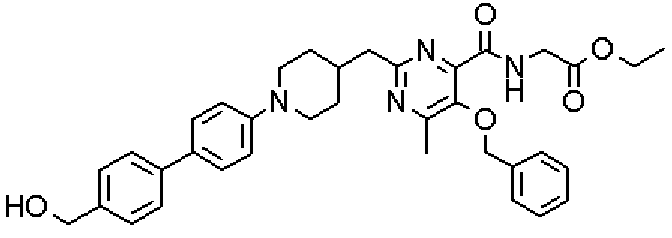
трет-Бутил-5-(бензилокси)-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-карбоксилат (0,81 г, 1,4 ммоль) растворяли в смешанном растворителе тетрагидрофурана (10 мл) и метанола (10 мл) и добавляли водный раствор гидроксида натрия (5 М, 10 мл, 50 ммоль) с последующим перемешиванием при 50°С в течение 15 минут. Реакционный раствор охлаждали до комнатной температуры и добавляли хлористоводородную кислоту (5 М, 10 мл, 50 ммоль) с последующей экстракцией смеси этилацетатом. Органический слой концентрировали при пониженном давлении, получая при этом 5-(бензилокси)-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-карбоновую кислоту в виде желтого твердого вещества.
Это вещество растворяли в смешанном растворителе тетрагидрофурана (10 мл) и метанола (10 мл) и добавляли гидрохлорид этилового эфира глицина (0,30 г, 2,1 ммоль), хлорид 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния (0,51 г, 1,8 ммоль) и N-метилморфолин (0,39 мл, 3,5 ммоль) с последующим перемешиванием смеси при комнатной температуре в течение 14 часов. Реакционный раствор концентрировали при пониженном давлении и образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: дихлорметан/этилацетат) и фракцию, соответствующую величине Rf=0,60 (гексан/этилацетат=1/4) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,32 г, 0,53 ммоль) в виде желтого твердого вещества (выход 38%).
1Н-ЯМР (500 МГц, CDCl3) δ: 8,36 (1H, т, J=6 Гц), 7,56 (2H, д, J=8 Гц), 7,52-7,47 (4H, м), 7,43-7,34 (5H, м), 7, 00 (2H, д, J=8 Гц), 5,12 (2H, с), 4,73 (2H, д, J=6 Гц), 4,30-4,19 (4H, м), 3,75 (2H, д, J=12 Гц), 2,90 (2H, д, J=7 Гц), 2,78 (2H, т, J=12 Гц), 2,47 (3H, с), 2,17-2,07 (1H, м), 1,79 (2H, д, J=12 Гц), 1,59-1,48 (2H, м), 1,32 (3H, т, J=7 Гц).
(12) Этил-({[5-гидрокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетат
[Химическая формула 24]
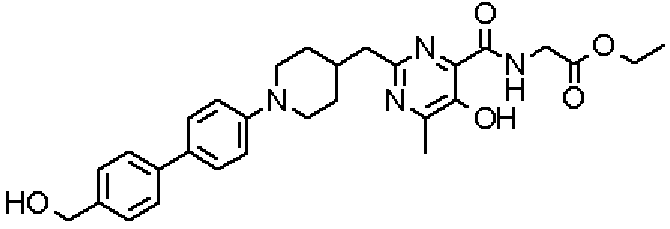
Этил-({[5-(бензилокси)-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетат (0,43 г, 0,71 ммоль) растворяли в смешанном растворителе этилацетата (20 мл) и дихлорметана (20 мл) и добавляли 10% палладий на активированном угле (0,080 г) с последующим перемешиванием при комнатной температуре в течение 2,5 часа в атмосфере водорода. Реакционный раствор фильтровали через целит и фильтрат концентрировали при пониженном давлении, тем самым осаждая твердое вещество. Образовавшееся твердое вещество собирали фильтрованием и сушили при пониженном давлении, получая при этом указанное в заголовке соединение (0,34 г, 0,66 ммоль) в виде белого твердого вещества (выход 93%).
МС m/z: 519 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 11,83 (1H, с), 9,52 (1H, т, J=6 Гц), 7,54 (2H, д, J=8 Гц), 7,50 (2H, д, J=8 Гц), 7,34 (2H, д, J=8 Гц), 6,99 (2H, д, J=8 Гц), 5,17 (1H, шир.с), 4,50 (2H, с), 4,15 (2H, кв, J=7 Гц), 4,09 (2H, д, J=6 Гц), 3,74 (2H, д, J=12 Гц), 2,79 (2H, д, J=7 Гц), 2,70 (2H, т, J=12 Гц), 2,45 (3H, с), 2,15-2,05 (1H, м), 1,68 (2H, д, J=12 Гц), 1,37 (2H, кв, J=12 Гц), 1,21 (3H, т, J=7 Гц).
(13) ({[5-Гидрокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Этил-({[5-гидрокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетат (0,22 г, 0,42 ммоль) растворяли в смешанном растворителе метанола (5 мл) и тетрагидрофурана (5 мл) и добавляли водный раствор гидроксида натрия (1 М, 5,0 мл) с последующим перемешиванием смеси при комнатной температуре в течение 30 минут. Реакционный раствор концентрировали при пониженном давлении и к образовавшемуся остатку добавляли хлористоводородную кислоту (1 М, 5,0 мл), тем самым осаждая твердое вещество. Образовавшееся твердое вещество собирали фильтрованием и сушили при пониженном давлении, получая при этом указанное в заголовке соединение (0,17 г, 0,35 ммоль) в виде бледно-желтовато-белого твердого вещества (выход 82%).
МС m/z: 491 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,87 (1H, шир.с), 11,92 (1H, с), 9,42 (1H, т, J=6 Гц), 7,54 (2H, д, J=8 Гц), 7,50 (2H, д, J=8 Гц), 7,34 (2H, д, J=8 Гц), 7,00 (2H, д, J=8 Гц), 5,17 (1H, т, J=6 Гц), 4,51 (2H, д, J=6 Гц), 4,01 (2H, д, J=6 Гц), 3,74 (2H, д, J=12 Гц), 2,78 (2H, д, J=7 Гц), 2,70 (2H, т, J=12 Гц), 2,45 (3H, с), 2,15-2,04 (1H, м), 1,68 (2H, д, J=12 Гц), 1,37 (2H, кв, J=12 Гц).
(Пример 2)
({[2-({1-[4'-(Ацетоксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 25]
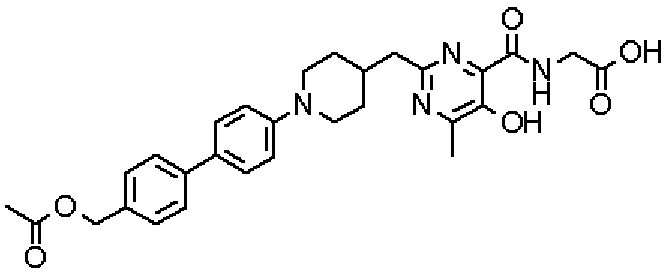
({[5-Гидрокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусную кислоту (0,13 г, 0,27 ммоль) растворяли в ацетонитриле (8 мл) и добавляли уксусный ангидрид (0,063 мл, 0,67 ммоль), триэтиламин (0,092 мл, 0,66 ммоль) и 4-диметиламинопиридин (0,081 г, 0,66 ммоль) с последующим перемешиванием смеси при комнатной температуре в течение 3 часов. После концентрирования реакционного раствора при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: дихлорметан/метанол) и фракцию, соответствующую величине Rf=0,20 (дихлорметан/метанол=9/1) тонкослойной хроматографии, концентрировали при пониженном давлении, тем самым осаждая твердое вещество. Образовавшееся твердое вещество собирали фильтрованием и сушили при пониженном давлении, получая при этом указанное в заголовке соединение (0,070 г, 0,13 ммоль) в виде бледно-желтовато-белого твердого вещества (выход 50%).
МС m/z: 533 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,86 (1H, шир.с), 11,91 (1H, с), 9,42 (1H, шир.с), 7,59 (2H, д, J=8 Гц), 7,52 (2H, д, J=8 Гц), 7,39 (2H, д, J=8 Гц), 7,00 (2H, д, J=8 Гц), 5,08 (2H, с), 4,01 (2H, д, J=6 Гц), 3,75 (2H, д, J=12 Гц), 2,78 (2H, д, J=6 Гц), 2,71 (2H, т, J=12 Гц), 2,44 (3H, с), 2,16-2,03 (1H, м), 2,07 (3H, с), 1,68 (2H, д, J=12 Гц), 1,36 (2H, кв, J=12 Гц).
(Пример 3)
({[5-Гидрокси-2-({1-[4'-(1-гидроксиэтил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 26]
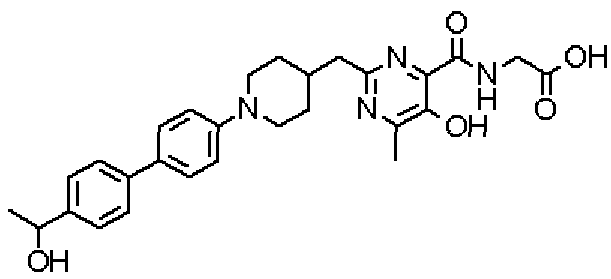
(1) Этил-({[2-{[1-(4'-ацетилдифенил-4-ил)пиперидин-4-ил]метил}-5-(бензилокси)-6-метилпиримидин-4-ил]карбонил}амино)ацетат
[Химическая формула 27]
Согласно примерам 1-(9) и 1-(11), но с применением 1-(4'-бромдифенил-4-ил)этанона вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение (выход 35%) получали в виде желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 8,35 (1H, т, J=5 Гц), 7,99 (2H, д, J=9 Гц), 7,65 (2H, д, J=9 Гц), 7,56 (2H, д, J=9 Гц), 7,51-7,47 (2H, м), 7,42-7,34 (3H, м), 7,01 (2H, д, J=9 Гц), 5,13 (2H, с), 4,27 (2H, кв, J=7 Гц), 4,25 (2H, д, J=5 Гц), 3,79 (2H, д, J=13 Гц), 2,90 (2H, д, J=7 Гц), 2,81 (2H, т, J=13 Гц), 2,62 (3H, с), 2,47 (3H, с), 2,20-2,09 (1H, м), 1,80 (2H, д, J=13 Гц), 1,59-1,47 (2H, м), 1,32 (3H, т, J=7 Гц).
(2) Этил-({[5-гидрокси-2-({1-[4'-(1-гидроксиэтил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетат
[Химическая формула 28]
Этил-({[2-{[1-(4'-ацетилдифенил-4-ил)пиперидин-4-ил]метил}-5-(бензилокси)-6-метилпиримидин-4-ил]карбонил}амино)ацетат (0,67 г, 1,1 ммоль) растворяли в смешанном растворителе этилацетата (35 мл) и дихлорметана (35 мл) и добавляли 10% платину на активированном угле (0,65 г) с последующим перемешиванием при комнатной температуре в течение 8 часов в атмосфере водорода. После фильтрования реакционного раствора через целит фильтрат концентрировали при пониженном давлении. Образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: дихлорметан/этилацетат) и фракцию, соответствующую величине Rf=0,27 (дихлорметан/этилацетат=1/3) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,44 г, 0,82 ммоль) в виде белого твердого вещества (выход 77%).
МС m/z: 533 (М+Н)+;
1H-ЯМР (400 МГц, CDCl3) δ: 11,37 (1H, с), 8,50 (1H, т, J=6 Гц), 7,54 (2H, д, J=8 Гц), 7,49 (2H, д, J=9 Гц), 7,41 (2H, д, J=9 Гц), 6,99 (2H, д, J=8 Гц), 4,98-4,90 (1H, м), 4,29 (2H, кв, J=7 Гц), 4,23 (2H, д, J=6 Гц), 3,74 (2H, д, J=12 Гц), 2,84 (2H, д, J=7 Гц), 2,76 (2H, т, J=12 Гц), 2,54 (3H, с), 2,13-2,01 (1H, м), 1,78 (2H, д, J=12 Гц), 1,59-1,45 (2H, м), 1,54 (3H, д, J=7 Гц), 1,33 (3H, т, J=7 Гц).
(3) ({[5-Гидрокси-2-({1-[4'-(1-гидроксиэтил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Согласно примеру 1-(13), но с применением этил-({[5-гидрокси-2-({1-[4'-(1-гидроксиэтил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетата вместо этил-({[5-гидрокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетата, указанное в заголовке соединение (выход 96%) получали в виде бледно-коричневого твердого вещества.
МС m/z: 505 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 9,31 (1H, т, J=6 Гц), 7,52 (2H, д, J=8 Гц), 7,48 (2H, д, J=9 Гц), 7,35 (2H, д, J=8 Гц), 6,98 (2H, д, J=9 Гц), 5,13 (1H, шир.с), 4,72 (1H, кв, J=7 Гц), 3,92 (2H, д, J=6 Гц), 3,72 (2H, д, J=13 Гц), 2,78 (2H, д, J=7 Гц), 2,69 (2H, т, J=13 Гц), 2,43 (3H, с), 2,14-2,03 (1H, м), 1,68 (2H, д, J=13 Гц), 1,33 (3H, д, J=6 Гц), 1,42-1,30 (2H, м).
(Пример 4)
({[5-Гидрокси-2-({1-[4'-(2-гидроксиэтил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 29]
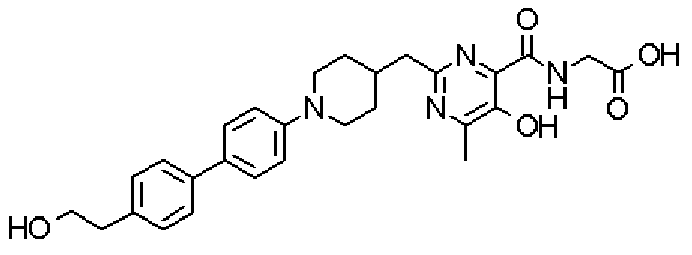
(1) трет-Бутил-[2-(4-иодфенил)этокси]диметилсилан
[Химическая формула 30]
Согласно примеру 1-(8), но с применением 2-(4-иодфенил)этанола вместо (4'-бромдифенил-4-ил)метанола, указанное в заголовке соединение получали (выход 97%) в виде бесцветного масла.
1H-ЯМР (500 МГц, CDCl3) δ: 7,59 (2H, д, J=8 Гц), 6,96 (2H, д, J=8 Гц), 3,77 (2H, т, J=7 Гц), 2,75 (2H, т, J=7 Гц), 0,86 (9H, с), -0,03 (6H, с).
(2) [2-(4'-Бромдифенил-4-ил)этокси](трет-бутил)диметилсилан
[Химическая формула 31]
трет-Бутил-[2-(4-иодфенил)этокси]диметилсилан (7,1 г, 19,6 ммоль), (4-бромфенил)бороновую кислоту (4,8 г, 23,9 ммоль), n-гидрат трикалийфосфата (10,4 г, 49,0 ммоль) и комплекс [1,1'-бис(дифенилфосфино)ферроцен]палладийдихлорид-дихлорметан (0,80 г, 0,98 ммоль) суспендировали в 1,2-диметоксиэтане (150 мл) с последующим перемешиванием смеси при комнатной температуре в течение 4 часов в атмосфере азота. После фильтрования реакционного раствора через целит фильтрат концентрировали при пониженном давлении. Образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан) и фракцию, соответствующую величине Rf=0,90 (гексан/этилацетат=19/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (2,0 г, 5,1 ммоль) в виде белого твердого вещества (выход 26%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,57 (2H, д, J=8 Гц), 7,50 (2H, д, J=8 Гц), 7,47 (2H, д, J=8 Гц), 7,31 (2H, д, J=8 Гц), 3,86 (2H, т, J=7 Гц), 2,89 (2H, т, J=7 Гц), 0,91 (9H, с), 0,03 (6H, с).
(3) ({[5-Гидрокси-2-({1-[4'-(2-гидроксиэтил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Согласно примерам от 1-(9) до 1-(13), но с применением [2-(4'-бромдифенил-4-ил)этокси](трет-бутил)диметилсилана вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 15%) в виде бледно-желтовато-белого твердого вещества.
МС m/z: 505 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,88 (1H, шир.с), 11,91 (1H, с), 9,41 (1H, т, J=6 Гц), 7,48 (4H, д, J=8 Гц), 7,24 (2H, д, J=8 Гц), 6,99 ( 2H, д, J=8 Гц), 4,65 (1H, т, J=6 Гц), 4,01 (2H, д, J=6 Гц), 3,73 (2H, д, J=12 Гц), 3,61 (2H, кв, J=6 Гц), 2,78 (2H, д, J=7 Гц), 2,75-2,66 (4H, м), 2,44 (3H, с), 2,15-2,04 (1H, м), 1,68 (2H, д, J=12 Гц), 1,37 (2H, кв, J=12 Гц).
(Пример 5)
({[5-Гидрокси-2-({1-[4'-(2-гидроксипропил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 32]
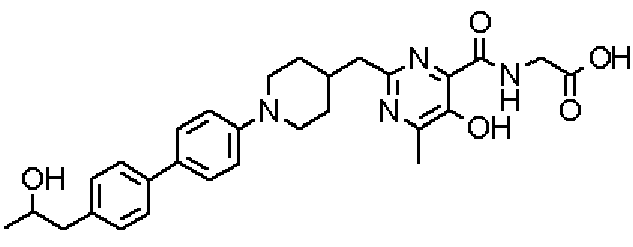
(1) 2-(4'-Бромдифенил-4-ил)-N-метокси-N-метилацетамид
[Химическая формула 33]
(4'-Бромдифенил-4-ил)уксусную кислоту (12 г, 37 ммоль) растворяли в смешанном растворителе тетрагидрофурана (200 мл) и метанола (200 мл) и добавляли гидрохлорид N,O-диметилгидроксиламина (5,4 г, 56 ммоль), хлорид 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния (15 г, 60 ммоль) и N-метилморфолин (6,1 мл, 56 ммоль) с последующим перемешиванием смеси при комнатной температуре в течение 1 часа. После концентрирования реакционного раствора при пониженном давлении к образовавшемуся остатку добавляли этилацетат и органический слой промывали водой. После отгонки растворителя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,45 (гексан/этилацетат=1/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (12 г, 37 ммоль) в виде белого твердого вещества (выход 100%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,55 (2H, д, J=8 Гц), 7,51 (2H, д, J=8 Гц), 7,45 (2H, д, J=8 Гц), 7,37 (2H, д, J=8 Гц), 3,82 (2H, с), 3,67 (3H, с), 3,22 (3H, с).
(2) (4'-Бромдифенил-4-ил)ацетон
[Химическая формула 34]
Раствор метиллития в диэтиловом простом эфире (40 мл, 44 ммоль) разбавляли тетрагидрофураном (120 мл) и при -78°С добавляли раствор 2-(4'-бромдифенил-4-ил)-N-метокси-N-метилацетамида (12 г, 37 ммоль) в тетрагидрофуране (50 мл) с последующим перемешиванием при такой же температуре в течение 30 минут. К реакционному раствору добавляли воду с последующей экстракцией смеси этилацетатом и затем растворитель отгоняли при пониженном давлении. Образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,50 (гексан/этилацетат=4/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (7,6 г, 26 ммоль) в виде белого твердого вещества (выход 71%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,56 (2H, д, J=8 Гц), 7,53 (2H, д, J=8 Гц), 7,45 (2H, д, J=8 Гц), 7,27 (2H, д, J=8 Гц), 3,76 (2H, с), 2,21 (3H, с).
(3) 1-(4'-Бромдифенил-4-ил)пропан-2-ол
[Химическая формула 35]
(4'-Бромдифенил-4-ил)ацетон (7,6 г, 26 ммоль) растворяли в этаноле (250 мл) и при 0°С добавляли борогидрид натрия (1,2 г, 32 ммоль) с последующим перемешиванием смеси при такой же температуре в течение 30 минут. После концентрирования реакционного раствора при пониженном давлении к образовавшемуся остатку добавляли этилацетат и органический слой промывали водой. После отгонки растворителя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,45 (гексан/этилацетат=4/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (7,6 г, 26 ммоль) в виде белого твердого вещества (выход 99%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,56 (2H, д, J=8 Гц), 7,51 (2H, д, Гц), 7,45 (2H, д, J=8 Гц), 7,30 (2H, д, J=8 Гц), 4,07 (1H, 2,84 (1H, дд, J=13 Гц, 5 Гц), 2,73 (1H, дд, J=13 Гц, 3 Гц), 1,58-1,49 (1H, м), 1,28 (3H, д, J=6 Гц).
(4) [2-(4'-Бромдифенил-4-ил)-1-метилэтокси](трет-бутил)диметилсилан
[Химическая формула 36]
Согласно примеру 1-(8), но с применением 1-(4'-бромдифенил-4-ил)пропан-2-ола вместо (4'-бромдифенил-4-ил)метанола, указанное в заголовке соединение получали (96%) в виде белого твердого вещества.
1H-ЯМР (500 МГц, CDCl3) δ: 7,54 (2H, д, J=8 Гц), 7,45 (2H, д, J=8 Гц), 7,44 (2H, д, J=8 Гц), 7,24 (2H, д, J=8 Гц), 4,04-3,93 (1H, м), 2,80-2,67 (2H, м), 1,17 (3H, д, J=6 Гц), 0,83 (9H, с), -0,05 (3H, с), -0,17 (3H, с).
(5) ({[5-Гидрокси-2-({1-[4'-(2-гидроксипропил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Согласно примерам от 1-(9) до 1-(13), но с применением [2-(4'-бромдифенил-4-ил)-1-метилэтокси](трет-бутил)диметилсилана вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 35%) в виде белого твердого вещества.
МС m/z: 519 (М+Н)+;
1H-ЯМР (400 МГц, DMSO-d6) δ: 12,89 (1H, шир.с), 11,92 (1H, с), 9,41 (1H, т, J=6 Гц), 7,49 (2H, д, J=9 Гц), 7,48 (2H, д, J=9 Гц), 7,22 ( 2H, д, J=8 Гц), 6,98 (2H, д, J=8 Гц), 4,58 (1H, д, J=5 Гц), 4,01 (2H, д, J=6 Гц), 3,86-3,79 (1H, м), 3,73 (2H, д, J=12 Гц), 2,78 (2H, д, J=7 Гц), 2,74-2,65 (3H, м), 2,57 (1H, дд, J=13 Гц, 6 Гц), 2,44 (3H, с), 2,09-2,00 (1H, м), 1,69 (2H, д, J=12 Гц), 1,36 (2H, дкв, J=12 Гц, 3 Гц), 1,05 (3H, д, J=6 Гц).
(Пример 6)
({[5-Гидрокси-2-({1-[4'-(2-гидрокси-1,1-диметилэтил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 37]
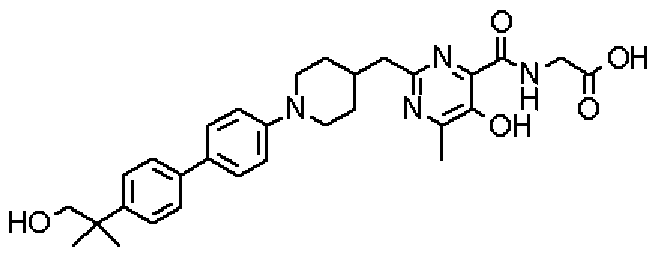
(1) Этил-2-(4'-бромдифенил-4-ил)-2-метилпропионат
[Химическая формула 38]
Этил-(4'-бромдифенил-4-ил)ацетат (7,6 г, 24 ммоль) растворяли в тетрагидрофуране (130 мл) и при 0°С добавляли гидрид натрия (55%, 3,1 г, 71 ммоль) с последующим перемешиванием при комнатной температуре в течение 30 минут. К реакционному раствору добавляли метилиодид (4,4 мл, 71 ммоль) с последующим перемешиванием при комнатной температуре в течение дополнительных 20 часов. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией смеси этилацетатом и затем растворитель отгоняли при пониженном давлении. Образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,50 (гексан/этилацетат=10/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (6,2 г, 18 ммоль) в виде желтого масла (выход 76%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,55 (2H, д, J=8 Гц), 7,52 (2H, д, J=8 Гц), 7,45 (2H, д, J=8 Гц), 7,40 (2H, д, J=8 Гц), 4,14 (2H, кв, J=7 Гц), 1,61 (6H, с), 1,21 (3H, т, J=7 Гц).
(2) 2-(4'-Бромдифенил-4-ил)-2-метилпропан-1-ол
[Химическая формула 39]
Этил-2-(4'-бромдифенил-4-ил)-2-метилпропионат (6,2 г, 18 ммоль) растворяли в тетрагидрофуране (150 мл) и при 0°С добавляли литийалюминийгидрид (0,68 г, 18 ммоль) с последующим перемешиванием смеси при такой же температуре в течение 1,5 часа. К реакционному раствору добавляли воду и нерастворимые вещества отделяли фильтрованием через целит с последующей экстракцией этилацетатом. После отгонки растворителя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,40 (гексан/этилацетат=1/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (5,0 г, 16 ммоль) в виде белого твердого вещества (выход 92%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,59-7,51 (4H, м), 7,49-7,43 (4H, м), 3,66 (2Н, с), 1,38 (6Н, с).
(3) 4-Бром-4'-[2-(метоксиметокси)-1,1-диметилэтил]дифенил
[Химическая формула 40]
2-(4'-Бромдифенил-4-ил)-2-метилпропан-1-ол (5,0 г, 16 ммоль) растворяли в толуоле (40 мл) и добавляли хлорметилметиловый простой эфир (2,5 мл, 33 ммоль) и N,N-диизопропилэтиламин (3,6 мл, 21 ммоль) с последующим перемешиванием при комнатной температуре в течение 17 часов. После разбавления реакционного раствора этилацетатом органический слой промывали водой. После отгонки растворителя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,45 (гексан/этилацетат=10/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (5,8 г, 16 ммоль) в виде белого твердого вещества (выход 100%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,54 (2H, д, J=8 Гц), 7,51 (2H, д, J=8 Гц), 7,47 (2H, д, J=8 Гц), 7,45 (2H, д, J=8 Гц), 4,58 (2H, с), 3, 60 (2H, с), 3,27 (3H, с), 1,39 (6H, с).
(4) ({[5-Гидрокси-2-({1-[4'-(2-гидрокси-1,1-диметилэтил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Согласно примерам от 1-(9) до 1-(13), но с применением 4-бром-4'-[2-(метоксиметокси)-1,1-диметилэтил]дифенила вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 25%) в виде белого твердого вещества.
МС m/z: 533 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,86 (1H, шир.с), 11,91 (1H, с), 9,41 (1H, т, J=5 Гц), 7,50 (2H, д, J=9 Гц), 7,48 (2H, д, J=9 Гц), 7,39 (2H, д, J=8 Гц), 6,99 (2H, д, J=8 Гц), 4,67 (1H, шир.с), 4,00 (2H, д, J=5 Гц), 3,73 (2H, д, J=12 Гц), 3,42 (2H, с), 2,78 (2H, д, J=7 Гц), 2,70 (2H, т, J=12 Гц), 2,45 (3H, с), 2,15-2,05 (1H, м), 1,68 (2H, д, J=12 Гц), 1,36 (2H, дкв, J=12 Гц, 3 Гц), 1,23 (6H, с)
(Пример 7)
({[2-({1-[4'-(Диметилкарбамоил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 41]
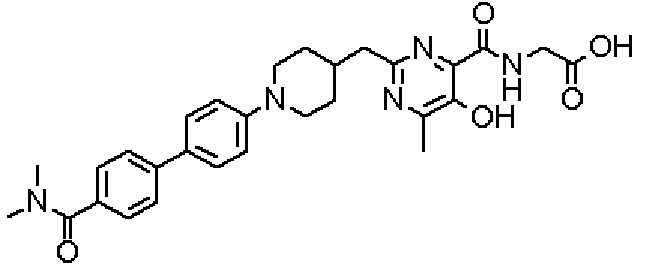
Согласно примерам 1-(9) и от 1-(11) до 1-(13), но с применением 4'-бром-N,N-диметилдифенил-4-карбоксамида вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 29%) в виде бледно-желтовато-белого твердого вещества.
МС m/z: 532 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,88 (1H, шир.с), 11,91 (1H, с), 9,40 (1H, т, J=6 Гц), 7,65 (2H, д, J=8 Гц), 7,56 (2H, д, J=8 Гц), 7,43 ( 2H, д, J=8 Гц), 7,01 (2H, д, J=8 Гц), 4,01 (2H, д, J=6 Гц), 3,7 7 (2H, д, J=12 Гц), 2,97 (6H, шир.с), 2,78 (2H, д, J=7 Гц), 2,73 (2H, т, J=12 Гц), 2,44 (3H, с), 2,16-2,05 (1H, м), 1,69 (2H, д, J=1 2 Гц), 1,36 (2H, кв, J=12 Гц).
(Пример 8)
({[5-Гидрокси-6-метил-2-({1-[4'-(метилкарбамоил)дифенил-4-ил]пиперидин-4-ил}метил)пиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 42]
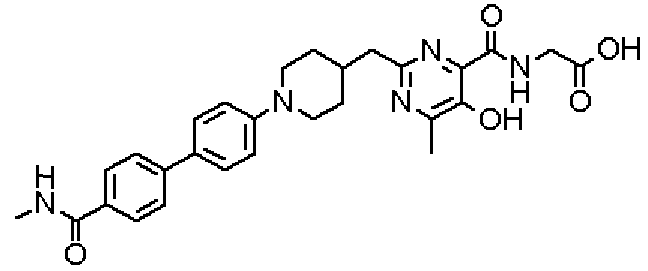
Согласно примерам 1-(9) и от 1-(11) до 1-(13), но с применением 4'-бром-N-метилдифенил-4-карбоксамида вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 20%) в виде желтого твердого вещества.
МС m/z: 518 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 9,28 (1H, шир.с), 8,42 (1H, д, J=4 Гц), 7,86 (2H, д, J=8 Гц), 7,68 (2H, д, J=8 Гц), 7,59 (2H, д, J=8 Гц), 7,01 (2H, д, J=8 Гц), 3,86 (2H, шир.с), 3,78 (2H, д, J=12 Гц), 2,81-2,69 (7H, м), 2,44 (3H, с), 2,15-2,05 (1H, м), 1,69 (2H, д, J=12 Гц), 1,36 (2H, кв, J=12 Гц).
(Пример 9)
[({2-[(1-{4'-[2-(Диметиламино)-2-оксоэтил]дифенил-4-ил}пиперидин-4-ил)метил]-5-метокси-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 43]
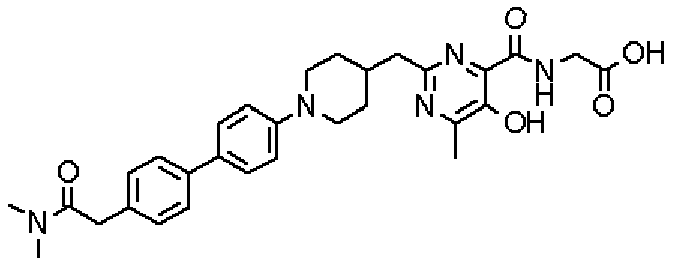
(1) 2-(4'-Бромдифенил-4-ил)-N,N-диметилацетамид
[Химическая формула 44]
(4'-Бромдифенил-4-ил)уксусную кислоту (1,0 г, 3,4 ммоль) растворяли в смешанном растворителе тетрагидрофурана (20 мл) и метанола (20 мл) и добавляли гидрохлорид диметиламина (0,42 г, 5,2 ммоль), хлорид 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния (1,3 г, 4,7 ммоль) и N-метилморфолин (0,95 мл, 8,6 ммоль) с последующим перемешиванием смеси при комнатной температуре в течение 18 часов. После концентрирования реакционной смеси при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: дихлорметан/этилацетат) и фракцию, соответствующую величине Rf=0,55 (дихлорметан/этилацетат=1/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,82 г, 2,6 ммоль) в виде белого твердого вещества (выход 75%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,55 (2H, д, J=8 Гц), 7,51 (2H, д, J=8 Гц), 7,44 (2H, д, J=8 Гц), 7,33 (2H, д, J=8 Гц), 3,75 (2H, с), 3,04 (3Н, с), 2,99 (3H, с).
(2) [({2-[(1-{4'-[2-(Диметиламино)-2-оксоэтил]дифенил-4-ил}пиперидин-4-ил)метил]-5-метокси-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
Согласно примерам 1-(9) и от 1-(11) до 1-(13), но с применением 2-(4'-бромдифенил-4-ил)-N,N-диметилацетамида вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 11%) в виде бледно-желтовато-белого твердого вещества.
МС m/z: 546 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 11,92 (1H, шир.с), 9,39 (1H, т, J=6 Гц), 7,52 (2H, д, J=8 Гц), 7,49 (2H, д, J=8 Гц), 7,24 (2H, д, J=8 Гц ), 6,99 (2H, д, J=8 Гц), 4,00 (2H, д, J=6 Гц), 3,74 (2H, д, J=12 Гц), 3,69 (2H, с), 3,01 (3H, с), 2,84 (3H, с), 2,78 (2H, д, J=7 Гц), 2,70 (2H, т, J=12 Гц), 2,44 (3H, с), 2,15-2,04 (1H, м), 1,68 (2H, д, J=12 Гц), 1,37 (2H, кв, J=12 Гц).
(Пример 10)
[({5-Гидрокси-2-[(1-{4-[4-(гидроксиметил)бензил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 45]
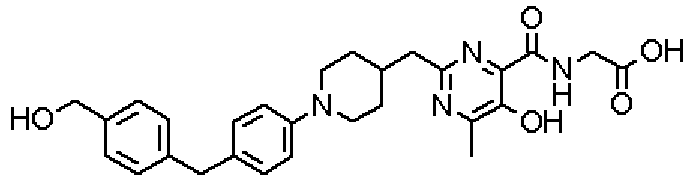
(1) 1-Бром-4-{4-[(метоксиметокси)метил]бензил}бензол
[Химическая формула 46]
[4-(4-Бромбензил)фенил]метанол (2,7 г, 9,6 ммоль) растворяли в тетрагидрофуране (50 мл) и при 0°С добавляли гидрид натрия (55%, 0,50 г, 12 ммоль) с последующим перемешиванием при такой же температуре в течение 30 минут в атмосфере азота. К реакционному раствору при 0°С по каплям добавляли раствор хлорметилметилового простого эфира (1,0 г, 13 ммоль) в тетрагидрофуране (10 мл) с последующим перемешиванием при комнатной температуре в течение 4 часов. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией его этилацетатом и органический слой сушили над безводным сульфатом натрия. После отгонки растворителя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,55 (гексан/этилацетат=4/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (2,5 г, 7,8 ммоль) в виде бесцветного масла (выход 81%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,39 (2H, д, J=8 Гц), 7,28 (2H, д, J=8 Гц), 7,15 (2H, д, J=8 Гц), 7,04 (2H, д, J=8 Гц), 4,70 (2H, с), 4,56 (2H, с), 3,92 (2H, с), 3,41 (3H, с).
(2) Этил-{[(5-Гидрокси-2-{[1-{4-{4-[(метоксиметокси)метил]бензил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил)карбонил]амино}ацетат
[Химическая формула 47]
Согласно примерам 1-(9), 1-(11) и 1-(12), но с применением 1-бром-4-{4-[(метоксиметокси)метил]бензил}бензола вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 33%) в виде желтого масла.
1H-ЯМР (500 МГц, CDCl3) δ: 11,36 (1H, с), 8,49 (1H, т, J=5 Гц), 7,28-7,23 (2H, м), 7,16 (2H, д, J=8 Гц), 7,04 (2H, д, J=7 Гц), 6,86 (2H, д, J=7 Гц), 4,69 (2H, с), 4,55 (2H, с), 4,28 (2H, кв, J=7 Гц), 4,22 (2H, д, J=5 Гц), 3,89 (2H, с), 3,61 (2H, д, J=12 Гц), 3,40 (3H, с), 2,82 (2H, д, J=7 Гц), 2,66 (2H, т, J=12 Гц), 2,53 (3H, с), 2,05-1,98 (1H, м), 1,75 (2H, д, J=12 Гц), 1,54-1,44 (2H, м), 1,32 (3H, т, J=7 Гц).
(3) Этил-[({2-[(1-{4-[4-(ацетоксиметил)бензил]фенил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]ацетат
[Химическая формула 48]
Этил-{[(5-гидрокси-2-{[1-{4-{4-[(метоксиметокси)метил]бензил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил)карбонил]амино}ацетат (1,1 г, 1,9 ммоль) растворяли в этилацетате (14 мл) и при комнатной температуре добавляли раствор хлорида водорода в диоксане (4 М, 7 мл, 28 ммоль) с последующим перемешиванием при такой же температуре в течение 12 часов. К реакционному раствору добавляли насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией этилацетатом и затем органический слой сушили над безводным сульфатом натрия. После отгонки растворителя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,60 (гексан/этилацетат=1/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,74 г, 1,3 ммоль) в виде желтого масла (выход 69%).
1H-ЯМР (500 МГц, CDCl3) δ: 11,35 (1H, с), 8,48 (1H, т, J=5 Гц), 7,28-7,23 (2H, м), 7,17 (2H, д, J=7 Гц), 7,04 (2H, д, J=7 Гц), 6,86 (2H, д, J=7 Гц), 5,06 (2H, с), 4,28 (2H, кв, J=7 Гц), 4,22 (2H, д, J=5 Гц), 3,89 (2H, с), 3,61 (2H, д, J=12 Гц), 2,82 (2H, д, J=7 Гц), 2,66 (2H, т, J=12 Гц), 2,53 (3H, с), 2,08 (3H, с), 2,05-1,97 (1H, м), 1,77-1,70 (2H, м), 1,54-1,46 (2H, м), 1,32 (3H, т, J=7 Гц).
(4) [({5-Гидрокси-2-[(1-{4-[4-(гидроксиметил)бензил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
Согласно примеру 1-(13), но с применением этил-[({2-[(1-{4-[4-(ацетоксиметил)бензил]фенил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]ацетата вместо этил-({[5-гидрокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетата, указанное в заголовке соединение получают (выход 61%) в виде желтого твердого вещества.
МС m/z: 505 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 11,90 (1H, с), 9,38 (1H, т, J=6 Гц), 7,20 (2H, д, J=7 Гц), 7,13 (2H, д, J=7 Гц), 7,02 (2H, д, J=8 Гц), 6,82 (2H, д, J=8 Гц), 5,08 (1H, т, J=6 Гц), 4,42 (2H, д, J=6 Гц), 4,00 (2H, д, J=6 Гц), 3,79 (2H, с), 3,58 (2H, д, J=12 Гц), 2,76 (2H, д, J=7 Гц), 2,58 (2H, т, J=12 Гц), 2,43 (3H, с), 2,03 (1H, шир.с), 1,65 (2H, д, J=12 Гц), 1,38-1,29 (2H, м).
(Пример 11)
[({5-Гидрокси-2-[(1-{4-[3-(гидроксиметил)бензил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 49]
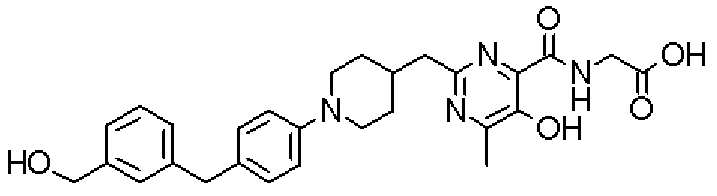
(1) [3-(4-Бромбензил)фенил]метанол
[Химическая формула 50]
4-Бромбензилбромид (6,1 г, 22 ммоль) и [3-(гидроксиметил)фенил]бороновую кислоту (3,0 г, 20 ммоль) растворяли в смешанном растворителе толуола (40 мл), этанола (30 мл) и воды (20 мл) и в атмосфере азота добавляли тетракис(трифенилфосфин)палладий (1,1 г, 1,0 ммоль) и карбонат натрия (4,2 г, 40 ммоль) с последующим нагреванием смеси для кипячения с обратным холодильником в течение 6 часов. К реакционному раствору добавляли воду с последующей экстракцией его этилацетатом и затем органический слой сушили над безводным сульфатом натрия. После отгонки растворителя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,75 (гексан/этилацетат=1/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (4,7 г, 17 ммоль) в виде желтого масла (выход 85%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,40 (2H, д, J=8 Гц), 7,29 (1H, т, J=8 Гц), 7,22 (1H, д, J=8 Гц), 7,17 (1H, с), 7,10 (1H, д, J=8 Гц), 7,06 (2H, д, J=8 Гц), 4,66 (2H, с), 3,93 (2H, с), 1,65 (1H, шир.с).
(2) 1-Бром-4-{3-[(метоксиметокси)метил]бензил}бензол
[Химическая формула 51]
Согласно примеру 10-(1), но с применением [3-(4-бромбензил)фенил]метанола вместо [4-(4-бромбензил)фенил]метанола, указанное в заголовке соединение (выход 65%) получали в виде бесцветного масла.
1H-ЯМР (500 МГц, CDCl3) δ: 7,40 (2H, д, J=7 Гц), 7,28 (1H, т, J=7 Гц), 7,21 (1H, д, J=7 Гц), 7,16 (1H, с), 7,08 (1H, д, J=7 Гц), 7,06 (2H, д, J=7 Гц), 4,70 (2H, с), 4,56 (2H, с), 3,93 (2H, с), 3,40 (3H, с).
(3) [({5-Гидрокси-2-[(1-{4-[3-(гидроксиметил)бензил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
Согласно примерам 1-(9), 1-(11), 1-(12), 1-(10) и 1-(13), но с применением 1-бром-4-{3-[(метоксиметокси)метил]бензил}бензола вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 23%) в виде желтого твердого вещества.
МС m/z: 505 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,89 (1H, шир.с), 11,91 (1H, с), 9,41 (1H, т, J=6 Гц), 7,21 (1H, т, J=7 Гц), 7,14 (1H, с), 7,10 (1H, д, J=7 Гц), 7,06 (1H, д, J=7 Гц), 7,05-7,00 (2H, м), 6,87-6,79 (2H, м), 5,14 (1H, шир.с), 4,44 (2H, с), 4,00 (2H, д, J=6 Гц), 3,80 (2H, шир.с), 3,58 (2H, д, J=12 Гц), 2,76 (2H, д, J=7 Гц), 2,64-2,54 (2H, м), 2,43 (3H, с), 2,04 (1H, шир.с), 1,70-1,61 (2H, м), 1,40-1,29 (2H, м).
(Пример 12)
[({5-Гидрокси-2-[(1-{4-[5-(1-гидроксиэтил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 52]
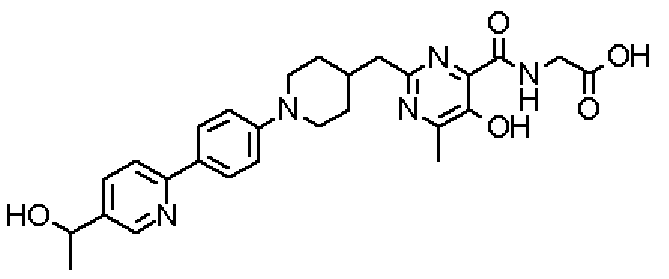
(1) 2-(4-Бромфенил)-5-[1-(метоксиметокси)этил]пиридин
[Химическая формула 53]
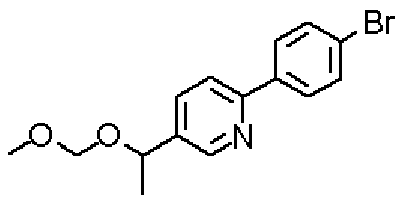
6-(4-Бромфенил)никотинальдегид (3,2 г, 12 ммоль) растворяли в тетрагидрофуране (50 мл) и по каплям при -78°С в атмосфере азота добавляли раствор метиллития в диэтиловом простом эфире (1,0 М, 15 мл, 15 ммоль) с последующим перемешиванием при такой же температуре в течение 1 часа. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией смеси этилацетатом и затем органический слой концентрировали при пониженном давлении. Образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,30 (гексан/этилацетат=2/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом 1-[6-(4-бромфенил)пиридин-3-ил]этанол (2,0 г, 7,2 ммоль) в виде белого твердого вещества (выход 59%).
Согласно примеру 10-(1), но с применением 1-[6-(4-бромфенил)пиридин-3-ил]этанола (2,0 г, 7,2 ммоль) вместо [4-(4-бромбензил)фенил]метанола, указанное в заголовке соединение получали (1,8 г, 5,6 ммоль) в виде бледно-желтого твердого вещества (выход 78%).
1H-ЯМР (500 МГц, CDCl3) δ: 8,64 (1H, с), 7,87 (2H, д, J=9 Гц), 7,76 (1H, д, J=8 Гц), 7,70 (1H, д, J=8 Гц), 7,60 (2H, д, J=9 Гц), 4,84 (1H, кв, J=6 Гц), 4,64 (1H, д, J=7 Гц), 4,58 (1H, д, J=7 Гц), 3,38 (3Н, с), 1,54 (3Н, д, J=6 Гц)
(2) Бензил-({[5-(бензилокси)-2-{[1-(4-{5-[1-(метоксиметокси)этил]пиридин-2-ил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил]карбонил}амино)ацетат
[Химическая формула 54]
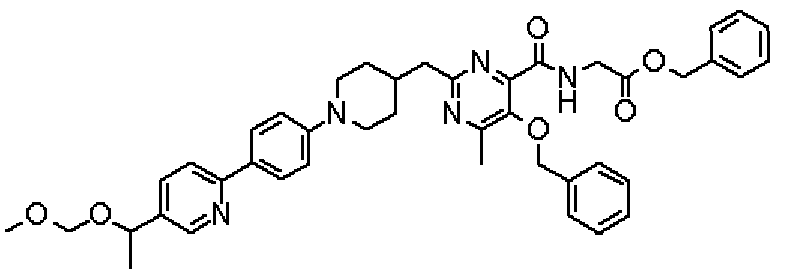
Согласно примеру 1-(9), но с применением 2-(4-бромфенил)-5-[1-(метоксиметокси)этил]пиридина вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, трет-бутил-5-(бензилокси)-2-{[1-(4-{5-[1-(метоксиметокси)этил]пиридин-2-ил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-карбоксилат получали в виде желтого масла (выход 45%).
Согласно примеру 1-(11), но с применением п-толуолсульфоната бензилового эфира глицина вместо гидрохлорида этилового эфира глицина и трет-бутил-5-(бензилокси)-2-{[1-(4-{5-[1-(метоксиметокси)этил]пиридин-2-ил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-карбоксилата вместо трет-бутил-5-(бензилокси)-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-карбоксилата, указанное в заголовке соединение получали (количественный выход) в виде желтого масла.
1H-ЯМР (500 МГц, CDCl3) δ: 8,58 (1H, с), 8,39 (1H, т, J=5 Гц), 7,91 (2H, д, J=9 Гц), 7,69-7,64 (2H, м), 7,48 (2H, д, J=7 Гц), 7,40-7,22 (8H, м), 7,00 (2H, д, J=9 Гц), 5,24 (2H, с), 5,11 (2H, с), 4,81 (1Н, кв, J=7 Гц), 4,62 (1H, д, J=7 Гц), 4,58 (1H, д, J=7 Гц), 4,30 (2H, д, J=5 Гц), 3,80 (2H, д, J=12 Гц), 3,38 (3H, с), 2,88 (2H, д, J=7 Гц), 2,80 (2H, т, J=12 Гц), 2,47 (3H, с), 2,18-2,08 (1H, м), 1,78 (2H, д, J=12 Гц), 1,55-1,48 (2H, м), 1,52 (3H, д, J=7 Гц).
(3) Бензил-[({5-(бензилокси)-2-[(1-{4-[5-(1-гидроксиэтил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]ацетат
[Химическая формула 55]
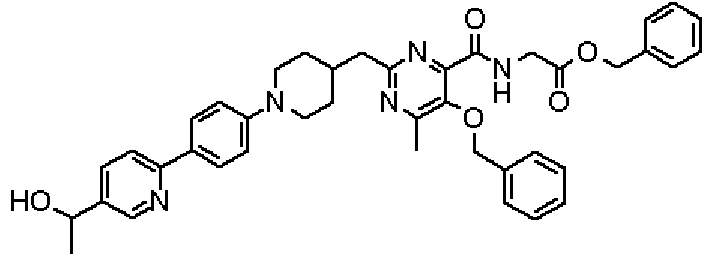
Бензил-({[5-(бензилокси)-2-{[1-(4-{5-[1-(метоксиметокси)этил]пиридин-2-ил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил]карбонил}амино)ацетат (0,80 г, 1,1 ммоль) растворяли в этилацетате (6 мл) и добавляли раствор хлорида водорода в диоксане (4 М, 1,5 мл, 6,0 ммоль) с последующим перемешиванием при комнатной температуре в течение 1,5 часа. После добавления к реакционному раствору гексана осажденное твердое вещество собирали фильтрованием с применением гексана. К нему добавляли насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией этилацетатом и затем органический слой концентрировали при пониженном давлении. Образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,30 (гексан/этилацетат=1/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,32 г, 0,49 ммоль) в виде желтого твердого вещества (выход 44%).
МС m/z 686 (М+Н)+.
(4) [({5-Гидрокси-2-[(1-{4-[5-(1-гидроксиэтил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
Бензил-[({5-бензилокси-2-[(1-{4-[5-(1-гидроксиэтил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]ацетат (0,10 г, 0,16 ммоль) растворяли в этилацетате (30 мл) и добавляли 10% палладий на активированном угле (0,25 г) с последующим перемешиванием при комнатной температуре в течение 9 часов в атмосфере водорода. После фильтрования реакционного раствора через целит фильтрат концентрировали при пониженном давлении. Образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: этилацетат/метанол) и фракцию, соответствующую величине Rf=0,10 (этилацетат/метанол=4/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,045 г, 0,089 ммоль) в виде желтого твердого вещества (выход 56%).
МС m/z: 506 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 9,42 (1H, т, J=5 Гц), 9,06 (1H, с), 8,23 (1H, д, J=8 Гц), 8,04 (2H, д, J=8 Гц), 7,98 (1H, д, J=8 Гц), 7,04 (2H, д, J=8 Гц), 4,35 (1H, кв, J=7 Гц), 4,00 (2H, д, J=5 Гц), 3,88 (2H, д, J=13 Гц), 2,83-2,77 (4H, м), 2,44 (3H, с), 2,20-2,17 (1H, м), 1,68 (2H, д, J=13 Гц), 1,38 (3H, д, J=7 Гц), 1,36-1,33 (2H, м).
(Пример 13)
{[(5-Гидрокси-2-{[1-(4-{5-[1-(метоксиметокси)этил]пиридин-2-ил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил)карбонил]амино}уксусная кислота
[Химическая формула 56]
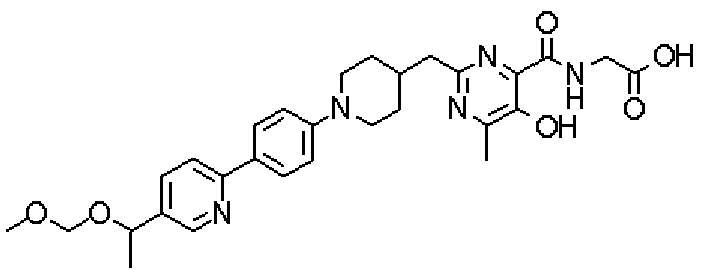
Согласно примеру 12-(4), но с применением бензил-({[5-(бензилокси)-2-{[1-(4-{5-[1-(метоксиметокси)этил]пиридин-2-ил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил]карбонил}амино)ацетата, полученного в примере 12-(2), вместо бензил-[({5-(бензилокси)-2-[(1-{4-[5-(1-гидроксиэтил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]ацетата, указанное в заголовке соединение получали в виде бледно-коричневого твердого вещества (выход 39%).
МС m/z: 550 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 9,23 (1H, шир.с), 8,52 (1H, д, J=2 Гц), 7,93 (2H, д, J=8 Гц), 7,82 (1H, д, J=8 Гц), 7,74 (1H, дд, J=8 Гц, 2 Гц), 7,00 (2H, д, J=8 Гц), 4,76 (1H, кв, J=7 Гц), 4,61 (1H, д, J=7 Гц), 4,50 (1H, д, J=7 Гц), 3,84-3,76 (4H, м), 3,25 (3H, с), 2,78-2,72 (4H, м), 2,43 (3H, с), 2,13-2,05 (1H, м), 1,69 (2H, д, J=12 Гц), 1,44 (3H, д, J=7 Гц), 1,40-1,30 (2H, м).
(Пример 14)
[({2-[(1-{4-[5-(1-Ацетоксиэтил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 57]
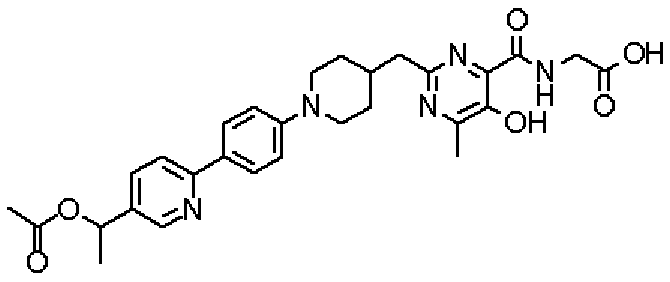
(1) Бензил-[({2-[(1-{4-[5-(1-ацетоксиэтил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-5-(бензилокси)-6-метилпиримидин-4-ил}карбонил)амино]ацетат
[Химическая формула 58]
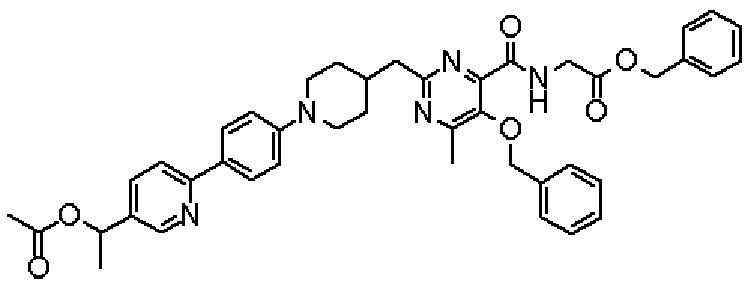
Бензил-[({5-(бензилокси)-2-[(1-{4-[5-(1-гидроксиэтил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]ацетат (0,24 г, 0,35 ммоль), полученный в примере 12-(3), растворяли в дихлорметане (30 мл) и добавляли уксусный ангидрид (0,050 мл, 0,52 ммоль) и триэтиламина (1,8 мл) с последующим перемешиванием при комнатной температуре в течение 12 часов. К реакционному раствору добавляли уксусный ангидрид (1,8 мл) и пиридин (0,90 мл) с последующим перемешиванием в течение дополнительных 12 часов и затем добавляли насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией смеси этилацетатом. После концентрирования органического слоя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,40 (гексан/этилацетат=1/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,12 г, 0,17 ммоль) в виде желтого масла (выход 48%).
1H-ЯМР (500 МГц, CDCl3) δ: 8,62 (1H, с), 8,38 (1H, т, J=5 Гц), 7,90 (2H, д, J=9 Гц), 7,68-7,63 (2H, м), 7,48 (2H, д, J=7 Гц), 7,40-7,21 (8H, м), 7,00 (2H, д, J=9 Гц), 5,92 (1H, кв, J=6 Гц), 5,24 (2H, с), 5,11 (2H, с), 4,30 (2H, д, J=5 Гц), 3,80 (2H, д, J=13 Гц), 2,88 (2H, д, J=7 Гц), 2,81 (2H, т, J=13 Гц), 2,47 (3H, с), 2,16-2,05 (1H, м), 2,09 (3H, с), 1,78 (2H, д, J=13 Гц), 1,58 (3H, д, J=6 Гц), 1,57-1,48 (2H, м).
(2) [({2-[(1-{4-[5-(1-Ацетоксиэтил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
Согласно примеру 12-(4), но с применением бензил-[({2-[(1-{4-[5-(1-ацетоксиэтил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-5-(бензилокси)-6-метилпиримидин-4-ил}карбонил)амино]ацетата вместо бензил-[({5-(бензилокси)-2-[(1-{4-[5-(1-гидроксиэтил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]ацетата, указанное в заголовке соединение получали (выход 98%) в виде бледно-желтого твердого вещества.
МС m/z: 548 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 9,40 (1H, т, J=6 Гц), 8,57 (1H, д, J=2 Гц), 7,93 (2H, д, J=9 Гц), 7,82 (1H, д, J=8 Гц), 7,78 (1H, дд, J=8 Гц, 2 Гц), 7,00 (2H, д, J=9 Гц), 5,83 (1H, кв, J=6 Гц), 3,98 (2H, д, J=6 Гц), 3,81 (2H, д, J=12 Гц), 2,79-2,73 (4H, м), 2,44 (3H, с), 2,16-2,08 (1H, м), 2,05 (3H, с), 1,68 (2H, д, J=12 Гц), 1,52 (3H, д, J=6 Гц), 1,40-1,30 (2H, м).
(Пример 15)
[({5-Гидрокси-2-[(1-{4-[5-(гидроксиметил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 59]
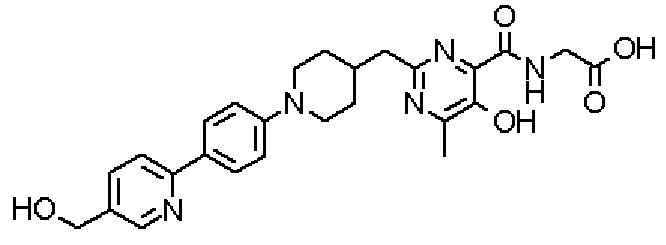
(1) 2-(4-Бромфенил)-5-[(метоксиметокси)метил]пиридин
[Химическая формула 60]
Согласно примеру 11-(1), но с применением (6-бромпиридин-3-ил)метанола вместо 4-бромбензилбромида и 4-бромфенилбороновой кислоты вместо [3-(гидроксиметил)фенил]бороновой кислоты, [6-(4-бромфенил)пиридин-3-ил]метанол получали в виде белого твердого вещества (выход 51%).
Согласно примеру 10-(1), но с применением [6-(4-бромфенил)пиридин-3-ил]метанола вместо [4-(4-бромбензил)фенил]метанола указанное в заголовке соединение получали (количественный выход) в виде белого твердого вещества.
1H-ЯМР (500 МГц, CDCl3) δ: 8,66 (1H, с), 7,88 (2H, д, J=8 Гц), 7,77 (1H, д, J=8 Гц), 7,70 (1H, д, J=8 Гц), 7,60 (2H, д, J=8 Гц), 4,74 (2H, с), 4,65 (2H, с), 3,43 (3H, с).
(2) Этил-{[(5-гидрокси-2-{[1-(4-{5-[(метоксиметокси)метил]пиридин-2-ил}фенил)пиридин-4-ил]метил}-6-метилпиримидин-4-ил)карбонил]амино}ацетат
[Химическая формула 61]
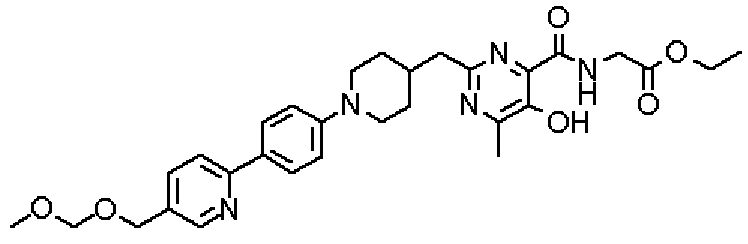
Согласно примерам 1-(9), 1-(11) и 1-(12), но с применением 2-(4-бромфенил)-5-[(метоксиметокси)метил]пиридина вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 22%) в виде белого твердого вещества.
МС m/z: 564 (М+ + Н);
1H-ЯМР (500 МГц, CDCl3) δ: 11,37 (1H, с), 8,60 (1H, с), 8,50 (1H, т, J=5 Гц), 7,90 (2H, д, J=8 Гц), 7,70 (1H, д, J=8 Гц), 7,65 (1H, д, J=8 Гц), 7,00 (2H, д, J=8 Гц), 4,73 (2H, с), 4,62 (2H, с), 4,28 (2H, кв, J=7 Гц), 4,22 (2H, д, J=5 Гц), 3,79 (2H, д, J=12 Гц), 3,42 (3H, с), 2,84-2,77 (4H, м), 2,54 (3H, с), 2,13-2,07 (1H, м), 1,78 (2H, д, J=12 Гц), 1,54-1,46 (2H, м), 1,33 (3H, т, J=7 Гц).
(3) [({5-Гидрокси-2-[(1-{4-[5-(гидроксиметил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
Согласно примерам 12-(3) и 1-(13), но с применением этил-{[(5-гидрокси-2-{[1-(4-{5-(метоксиметокси)метил]пиридин-2-ил}фенил)пиперидин-4-ил]метил)-6-метилпиримидин-4-ил)карбонил]амино}ацетата вместо бензил-({[5-(бензилокси)-2-{[1-(4-{5-[1-(метоксиметокси)этил]пиридин-2-ил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил]карбонил}амино)ацетата, указанное в заголовке соединение получали (выход 87%) в виде желтого твердого вещества.
Мс m/z: 492 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 9,39 (1H, т, J=5 Гц), 8,50 (1H, с), 7,92 (2H, д, J=8 Гц), 7,80 (1H, д, J=8 Гц), 7,71 (1H, д, J=8 Гц), 7,00 (2H, д, J=8 Гц), 5,28 (1H, т, J=5 Гц), 4,52 (2H, д, J=5 Гц), 3,98 (2H, д, J=5 Гц), 3,80 (2H, д, J=13 Гц), 2,79-2,72 (4H, м), 2,44 (3H, с), 2,17-2,07 (1H, м), 1,68 (2H, д, J=13 Гц), 1,40-1,30 (2H, м).
(Пример 16)
[({2-[(1-{4-[5-(Этоксикарбонил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 62]
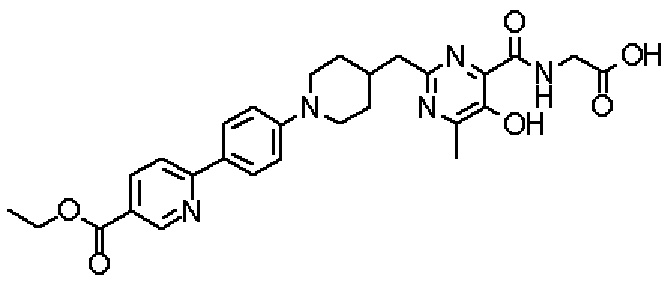
(1) Этил-6-(4-бромфенил)никотинат
[Химическая формула 63]
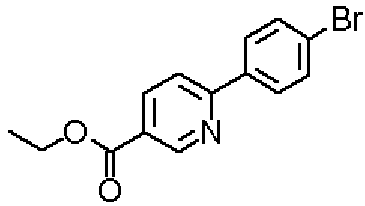
Согласно примеру 11-(1), но с применением этил-6-бромникотината вместо 4-бромбензилбромида и 4-бромфенилбороновой кислоты вместо [3-(гидроксиметил)фенил]бороновой кислоты, указанное в заголовке соединение получали (выход 98%) в виде белого твердого вещества.
1H-ЯМР (500 МГц, CDCl3) δ: 9,28 (1H, с), 8,36 (1H, д, J=8 Гц), 7,96 (2H, д, J=8 Гц), 7,80 (1H, д, J=8 Гц), 7,64 (2H, д, J=8 Гц), 4,44 (2H, кв, J=7 Гц), 1,43 (3H, т, J=7 Гц).
(2) трет-Бутил-5-(бензилокси)-2-[(1-{4-[5-(этоксикарбонил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-карбоксилат
[Химическая формула 64]
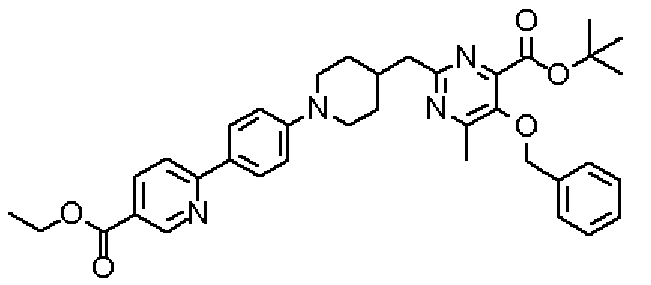
Согласно примеру 1-(9), но с применением этил-6-(4-бромфенил)никотината вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 23%) в виде желтого масла.
1H-ЯМР (500 МГц, CDCl3) δ: 9,21 (1H, с), 8,26 (1H, д, J=8 Гц), 7,99 (2H, д, J=8 Гц), 7,72 (1H, д, J=8 Гц), 7,43-7,38 (5H, м), 7,00 (2H, д, J=8 Гц), 5,01 (2H, с), 4,42 (2H, кв, J=7 Гц), 3,83 (2H, д, J=12 Гц), 2,91-2,81 (4H, м), 2,46 (3H, с), 2,20-2,12 (1H, м), 1,80 (2H, д, J=12 Гц), 1,59 (9H, с), 1,57-1,48 (2H, м), 1,42 (3H, т, J=7 Гц).
(3) Этил-6-{4-[4-({4-[(2-трет-бутокси-2-оксоэтил)карбамоил]-5-гидрокси-6-метилпиримидин-2-ил}метил)пиперидин-1-ил]фенил}никотинат
[Химическая формула 65]
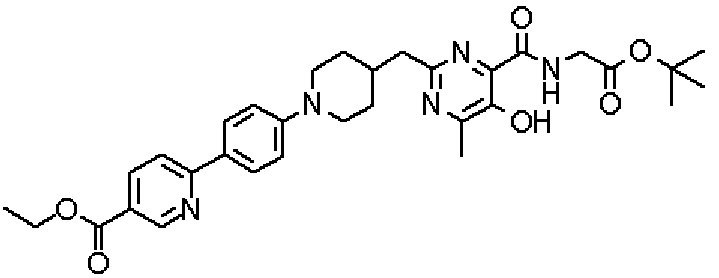
трет-Бутил-5-(бензилокси)-2-[(1-{4-[5-(этоксикарбонил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-карбоксилат (0,25 г, 0,40 ммоль) растворяли в дихлорметане (5 мл) и добавляли трифторуксусную кислоту (10 мл) с последующим перемешиванием смеси при комнатной температуре в течение 12 часов. Реакционный раствор концентрировали при пониженном давлении и добавляли насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией смеси этилацетатом. После сушки органического слоя над безводным сульфатом натрия растворитель отгоняли при пониженном давлении, получая при этом 2-[(1-{4-[5-(этоксикарбонил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-карбоновую кислоту.
Эту кислоту растворяли в смешанном растворителе тетрагидрофурана (20 мл) и метанола (20 мл) и добавляли гидрохлорид трет-бутилового эфира глицина (0,13 г, 0,80 ммоль), хлорид 4-(4,6-диметокси-1,3,5-триазин-2-мл)-4-метилморфолиния (0,22 г, 0,80 ммоль) и N-метилморфолин (0,40 мл, 4,0 ммоль) с последующим перемешиванием при комнатной температуре в течение 12 часов. Реакционный раствор концентрировали при пониженном давлении и добавляли этилацетат и затем органический слой промывали водой. После отгонки растворителя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,70 (гексан/этилацетат=1/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,043 г, 0,073 ммоль) в виде желтого твердого вещества (выход 18%).
1H-ЯМР (500 МГц, CDCl3) δ: 11,45 (1H, с), 9,21 (1H, с), 8,46 (1H, т, J=5 Гц), 8,29-8,23 (1H, м), 7,99 (2H, д, J=7 Гц), 7,74-7,68 (1H, м), 6,99 (2H, д, J=7 Гц), 4,42 (2H, кв, J=7 Гц), 4,12 (2H, д, J=5 Гц), 3,84 (2H, д, J=13 Гц), 2,89-2,79 (4H, м), 2,54 (3H, с), 2,15-2,08 (1H, м), 1,86-1,45 (4H, м), 1,52 (9H, с), 1,42 (3H, т, J=7 Гц).
(4) [({2-[(1-{4-[5-(Этоксикарбонил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
Этил-6-{4-[4-({4-[(2-трет-бутокси-2-оксоэтил)карбамоил]-5-гидрокси-6-метилпиримидин-2-ил}метил)пиперидин-1-ил]фенил}никотинат (0,043 г, 0,073 ммоль) растворяли в дихлорметане (5 мл) и при комнатной температуре добавляли трифторуксусную кислоту (5 мл) с последующим перемешиванием в течение 12 часов. К реакционному раствору добавляли хлористоводородную кислоту (1 М) с последующей экстракцией его этилацетатом и затем органический слой концентрировали при пониженном давлении. После очистки образовавшегося остатка хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: этилацетат/метанол), фракцию, соответствующую величине Rf=0,10 (этилацетат/метанол=4/1) тонкослойной хроматографии, концентрировали при пониженном давлении. Образовавшийся остаток растворяли в этилацетате с последующим добавлением диизопропилового простого эфира и затем осажденное твердое вещество собирали фильтрованием с применением диизопропилового простого эфира, получая при этом указанное в заголовке соединение (0,020 г, 0,037 ммоль) в виде бледно-желтого твердого вещества (выход 51%).
МС m/z: 534 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 9,36 (1H, шир.с), 9,06 (1H, д, J=2 Гц), 8,23 (1H, дд, J=8 Гц, 2 Гц), 8,04 (2H, д, J=9 Гц), 7,99 (1H, д, J=8 Гц), 7,04 (2H, д, J=9 Гц), 4,35 (2H, кв, J=7 Гц), 3,93 (2H, шир. с), 3,88 (2H, д, J=12 Гц), 2,83-2,77 (4H, м), 2,45 (3H, с), 2,19-2,11 (1H, м), 1,70 (2H, д, J=12 Гц), 1,39-1,30 (2H, м), 1,35 (3H, т, J=7 Гц).
(Пример 17)
[({2-[(1-{4-[2-(Этоксикарбонил)бензил]фенил}пиперидин-4-ил)-метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)-амино]уксусная кислота
[Химическая формула 66]
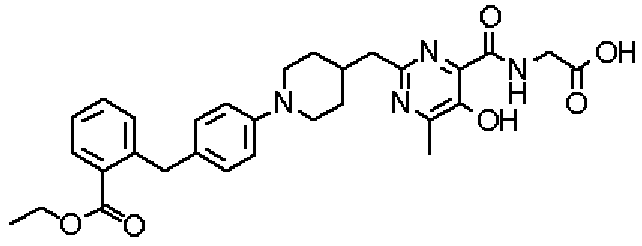
(1) Этил-2-(4-бромбензил)бензоат
[Химическая формула 67]
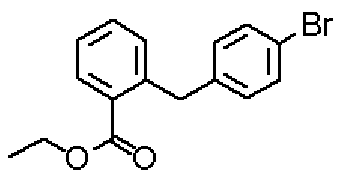
Согласно примеру 11-(1), но с применением [2-(этоксикарбонил)фенил]бороновой кислоты вместо [3-(гидроксиметил)фенил]бороновой кислоты, указанное в заголовке соединение получали (выход 78%) в виде бесцветного масла.
1H-ЯМР (500 МГц, CDCl3) δ: 7,92 (1H, д, J=8 Гц), 7,44 (1H, т, J=8 Гц), 7,37 (2H, д, J=8 Гц), 7,31 (1H, т, J=8 Гц), 7,20 (1H, д, J=8 Гц), 7,02 (2H, д, J=8 Гц), 4,33 (2H, с), 4,28 (2H, кв, J=7 Гц), 1,31 (3H, т, J=7 Гц).
(2) Гидрохлорид трет-бутил-({[5-(бензилокси)-6-метил-2-(пиперидин-4-илметил)пиримидин-4-ил]карбонил}амино)ацетата
[Химическая формула 68]
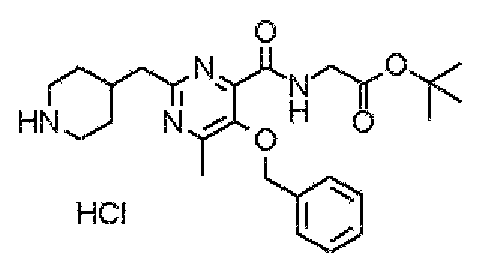
Согласно примерам 1-(11) и 1-(7), но с применением трет-бутил-5-(бензилокси)-2-{[1-(трет-бутоксикарбонил)пиперидин-4-ил]метил}-6-метилпиримидин-4-карбоксилата, полученного в примере 1-(6), вместо трет-бутил-5-(бензилокси)-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-карбоксилата и гидрохлорида трет-бутилового эфира глицина вместо гидрохлорида этилового эфира глицина, указанное в заголовке соединение получали (выход 72) в виде белого твердого вещества.
1H-ЯМР (500 МГц, CD3OD) δ: 7,46-7,45 (2H, м), 7,36-7,35 (3H, м), 5,11 (2H, с), 4,05 (2H, с), 3,38 (2H, д, J=13 Гц), 2,99 (2H, т, J=13 Гц), 2,90 (2H, д, J=7 Гц), 2,45 (3H, с), 2,36-2,27 (1H, м), 1,92 (2H, д, J=13 Гц), 1,56-1,49 (2H, м), 1,49 (9H, с).
(3) Этил-2-{4-[4-({5-(бензилокси)-4-[(2-трет-бутокси-2-оксоэтил)карбамоил]-6-метилпиримидин-2-ил}метил)пиперидин-1-ил]бензил}бензоат
[Химическая формула 69]
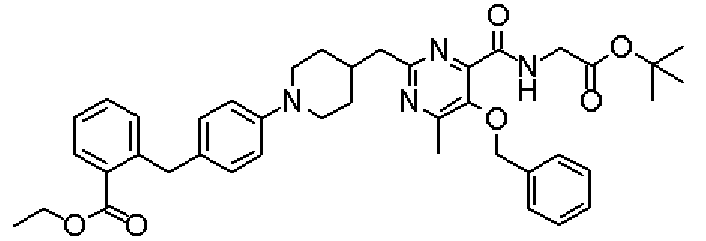
Согласно примеру 1-(9), но с применением гидрохлорида трет-бутил-({[5-(бензилокси)-6-метил-2-(пиперидин-4-илметил)пиримидин-4-ил]карбонил}амино)ацетата вместо гидрохлорида трет-бутил-5-(бензилокси)-6-метил-2-(пиперидин-4-илметил)пиримидин-4-карбоксилата и этил-2-(4-бромбензил)бензоата вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 72%) в виде белого твердого вещества.
МС m/z: 693 (М+Н)+.
(4) [({2-[(1-{4-[2-(Этоксикарбонил)бензил]фенил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
Согласно примеру 16(4), но с применением этил-2-{4-[4-({5-(бензилокси)-4-[(2-трет-бутокси-2-оксоэтил)карбамоил]-6-метилпиримидин-2-ил}метил)пиперидин-1-ил]бензил}бензоата вместо этил-6-{4-[4-({4-[(2-трет-бутокси-2-оксоэтил)карбамоил]-5-гидрокси-6-метилпиримидин-2-ил}метил)пиперидин-1-ил]фенил}никотината, указанное в заголовке соединение получали (выход 12%) в виде желтого твердого вещества.
МС m/z: 547 (М+Н)+;
1H-ЯМР (500 МГц, CD3OD) δ: 7,82 (1H, д, J=8 Гц), 7,46 (1H, т, J=8 Гц), 7,30 (1H, т, J=8 Гц), 7,27 (1H, д, J=8 Гц), 7,07 (4H, шир.с), 4,30 (2H, с), 4,24 (2H, кв, J=7 Гц), 4,05 (2H, с), 3,58 (2H, д, J=12 Гц), 2,90 (2H, т, J=12 Гц), 2,84 (2H, д, J=7 Гц), 2,49 (3H, с), 2,21-2,12 (1H, м), 1,82 (2H, д, J=12 Гц), 1,62-1,53 (2H, м), 1,27 (3H, т, J=7 Гц).
(Пример 18)
{[(5-Гидрокси-2-{[1-(4-{[6-(2-гидроксиэтокси)пиридин-3-ил]метил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил)карбонил]амино}уксусная кислота
[Химическая формула 70]
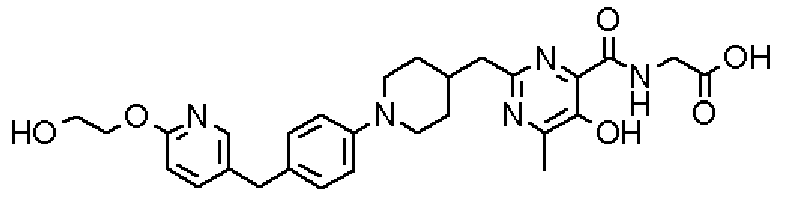
(1) N,6-Диметокси-N-метилникотинамид
[Химическая формула 71]
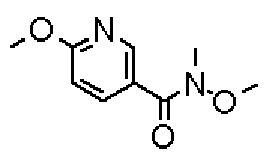
Согласно примеру 5-(1), но с применением 6-метоксиникотиновой кислоты вместо (4'-бромдифенил-4-ил)уксусной кислоты, указанное в заголовке соединение получали (выход 92%) в виде бесцветного масла.
1H-ЯМР (500 МГц, CDCl3) δ: 8,65 (1H, с), 8,00 (1H, д, J=9 Гц), 6,76 (1H, д, J=9 Гц), 3,99 (3H, с), 3,58 (3H, с), 3,38 (3H, с).
(2) (4-Бромфенил)(6-метоксипиридин-3-ил)метанон
[Химическая формула 72]
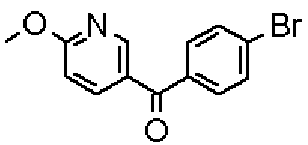
1,4-Дибромбензол (6,5 г, 27 ммоль) растворяли в тетрагидрофуране (120 мл) и при -78°С добавляли раствор н-бутиллития в гексане (2,6 М, 10 мл, 27 ммоль) с последующим перемешиванием при такой же температуре в течение 30 минут. К реакционному раствору добавляли раствор N,6-диметокси-N-метилникотинамида (2,7 г, 14 ммоль) в тетрагидрофуране (20 мл) с последующим перемешиванием при -78°С в течение дополнительных 30 минут. К реакционному раствору добавляли воду с последующей экстракцией раствора этилацетатом и затем органический слой концентрировали при пониженном давлении. Образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,50 (гексан/этилацетат=10/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (2,8 г, 9,4 ммоль) в виде белого твердого вещества (выход 69%).
1H-ЯМР (500 МГц, CDCl3) δ: 8,59 (1H, с), 8,07 (1H, д, J=8 Гц), 7,66 (4H, с), 6,85 (1H, д, J=8 Гц), 4,03 (3H, с).
(3) 2-{[5-(4-Бромбензил)пиридин-2-ил]окси}этанол
[Химическая формула 73]
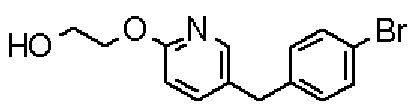
(4-Бромфенил))6-метоксипиридин-3-ил)метанон (0,88 г, 3,0 ммоль), моногидрат гидразина (1,5 мл, 30 ммоль) и гидроксид калия (0,60 г, 12 ммоль) растворяли в этиленгликоле (10 мл) с последующим перемешиванием раствора при 140°С в течение 20 минут. После охлаждения реакционного раствора до комнатной температуры добавляли воду с последующей экстракцией диэтиловым простым эфиром. После концентрирования органического слоя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,30 (гексан/этилацетат=1/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,38 г, 1,2 ммоль) в виде бесцветного масла (выход 41%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,95 (1H, с), 7,41 (2H, д, J=8 Гц), 7,36 (1H, д, J=9 Гц), 7,03 (2H, д, J=8 Гц), 6,72 (1H, д, J=9 Гц), 4,48-4,35 (2H, м), 3,97-3,90 (2H, м), 3,85 (2H, с), 3,84-3,75 (1H, м).
(4) 5-(4-Бромбензил)-2-(2-{[трет-бутил(диметил)силил]окси}этокси)пиридин
[Химическая формула 74]
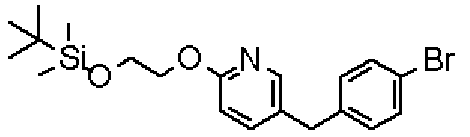
Согласно примеру 1-(8), но с применением 2-{[5-(4-бромбензил)пиридин-2-ил]окси}этанола вместо (4'-бромдифенил-4-ил)метанола, указанное в заголовке соединение получали (выход 77%) в виде бесцветного масла.
1H-ЯМР (500 МГц, CDCl3) δ: 7,96 (1H, с), 7,40 (2H, д, J=8 Гц), 7,31 (1H, д, J=8 Гц), 7,02 (2H, д, J=8 Гц), 6,68 (1H, д, J=8 Гц), 4,37-4,32 (2H, м), 3,98-3,92 (2H, м), 3,83 (2H, с), 0,89 (9H, с), 0,07 (6H, с).
(5) Этил-({[5-(бензилокси)-2-{[1-(4-{[6-(2-{[трет-бутил(диметил)силил]окси}этокси)пиридин-3-ил]метил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил]карбонил}амино)ацетат
[Химическая формула 75]
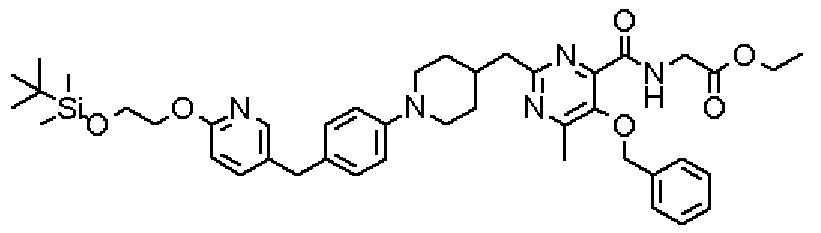
Согласно примерам 1-(9) и 1-(11), но с применением 5-(4-бромбензил)-2-(2-{[трет-бутил(диметил)силил]окси}этокси)пиридина вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали в виде сырого продукта.
МС m/z: 768 (М+Н)+.
(6) Этил-({[5-(бензилокси)-2-{[1-(4-{[6-(2-гидроксиэтокси)пиридин-3-ил]метил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил]карбонил}амино)ацетат
[Химическая формула 76]
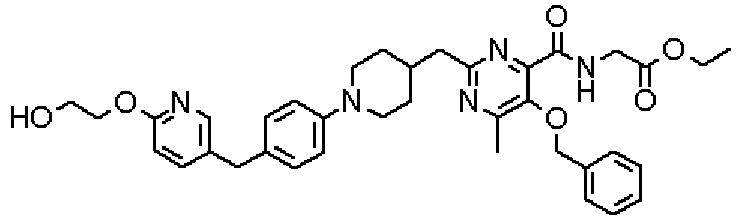
Сырой продукт этил-({[5-(бензилокси)-2-{[1-(4-{[6-(2-{[трет-бутил(диметил)силил]окси}этокси)пиридин-3-ил]метил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил]карбонил}амино)ацетата растворяли в тетрагидрофуране (20 мл) и при 0°С добавляли раствор фторида тетрабутиламмония в тетрагидрофуране (1,0 М, 1,4 мл, 4,8 ммоль) с последующим перемешиванием смеси при такой же температуре в течение 1 часа. К реакционному раствору добавляли воду с последующей экстракцией этилацетатом и затем органический слой концентрировали при пониженном давлении. Образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,50 (этилацетат) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,31 г, 0,47 ммоль) в виде желтого масла (выход 66%).
1H-ЯМР (500 МГц, CDCl3) δ: 8,35 (1H, т, J=5 Гц), 7,95 (1H, с), 7,48 (1H, д, J=6 Гц), 7,43-7,32 (5H, м), 7,03 (2H, д, J=9 Гц), 6,87 (2 H, д, J=9 Гц), 6,71 (1H, д, J=6 Гц), 5,12 (2H, с), 4,46-4,40 (2H, м), 4,27 (2H, кв, J=7 Гц), 4,25 (2H, д, J=5 Гц), 4,04-3,96 (1H, м), 3,97-3,90 (2H, м), 3,81 (2H, с), 3,63 (2H, д, J=12 Гц), 2,89 (2H, д, J=7 Гц), 2,69 (2H, т, J=12 Гц), 2,46 (3H, с), 2,11-2,04 (1H, м), 1,76 (2H, д, J=12 Гц), 1,53 (2H, дкв, J=12 Гц, 3 Гц), 1,32 (3H, т, J=7 Гц).
(7) {[(5-Гидрокси-2-{[1-(4-{[6-(2-гидроксиэтокси)пиридин-3-ил]метил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил)карбонил]амино}уксусная кислота
Согласно примерам 1-(12) и 1-(13), но с применением этил-({[5-(бензилокси)-2-{[1-(4-{[6-(2-гидроксиэтокси)пиридин-3-ил]метил}фенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил]карбонил}амино)ацетата вместо этил-({[5-(бензилокси)-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил-6-метилпиримидин-4-ил]карбонил}амино)ацетата, указанное в заголовке соединение получали (выход 50%) в виде белого твердого вещества.
МС m/z: 536 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,87 (1H, шир.с), 11,90 (1H, с), 9,39 (1H, т, J=5 Гц), 8,00 (1H, с), 7,48 (1H, д, J=8 Гц), 7,03 (2H, д, J=8 Гц), 6,83 (2H, д, J=8 Гц), 6,71 (1H, д, J=8 Гц), 4,80 (1H, шир.с), 4,25-4,16 (2H, м), 4,00 (2H, д, J=5 Гц), 3,74 (2H, с), 3,72-3,63 (2H, м), 3,58 (2H, д, J=12 Гц), 2,76 (2H, д, J=7 Гц), 2,59 (2H, т, J=12 Гц), 2,43 (3H, с), 2,09-2,00 (1H, м), 1,64 (2H, д, J=12 Гц), 1,33 (2H, дкв, J=12 Гц, 3 Гц).
(Пример 19)
[({5-Гидрокси-2-[(1-{5-[4-(гидроксиметил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 77]
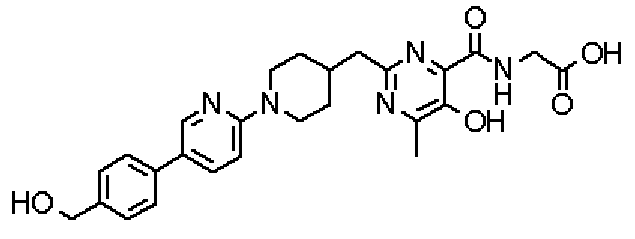
(1) трет-Бутил-5-(бензилокси)-2-{[1-(5-бромпиридин-2-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-карбоксилат
[Химическая формула 78]
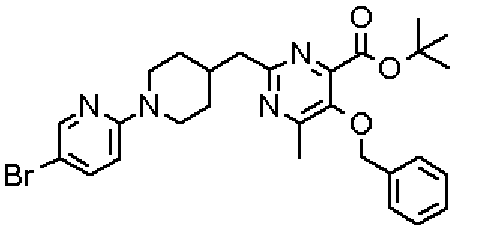
Гидрохлорид трет-бутил-5-(бензилокси)-6-метил-2-(пиперидин-4-илметил)пиримидин-4-карбоксилата (6,5 г, 15 ммоль), 2,5-дибромпиридин (5,3 г, 7,5 ммоль) и карбонат калия (6,2 г, 45 ммоль) суспендировали в N,N-диметилформамиде (150 мл) с последующим перемешиванием суспензии при 100°С в течение 22 часов. Реакционный раствор концентрировали при пониженном давлении с последующим добавлением этилацетата и затем органический слой промывали водой. После отгонки растворителя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,40 (гексан/этилацетат=4/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (2,3 г, 4,1 ммоль) в виде бесцветного масла (выход 27%).
1H-ЯМР (500 МГц, CDCl3) δ: 8,16 (1H, с), 7,49 (1H, д, J=9 Гц), 7,45-7,33 (5H, м), 6,55 (1H, д, J=9 Гц), 5,01 (2H, с), 4,21 (2H, д, J=12 Гц), 2,87 (2H, т, J=7 Гц), 2,83 (2H, т, J=12 Гц), 2,45 (3H, с), 2,24-2,14 (1H, м), 1,75 (2H, д, J=12 Гц), 1,59 (9H, с), 1,37 (2H, дкв, J=12 Гц, 3 Гц).
(2) трет-Бутил-5-(бензилокси)-2-[(1-{5-[4-({[трет-бутил(диметил)силил]окси}метил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-карбоксилат
[Химическая формула 79]
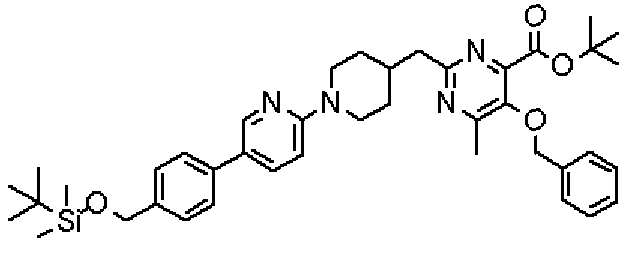
трет-Бутил-5-(бензилокси)-2-{[1-(5-бромпиридин-2-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-карбоксилат (1,1 г, 2,0 ммоль) растворяли в 1,4-диоксане (20 мл) и добавляли бис(пинаколято)диборон (0,60 г, 2,4 ммоль), комплекс [1,1'-бис(дифенилфосфино)ферроцен]палладийдихлорид-дихлорметан (0,16 г, 0,20 ммоль) и ацетат калия (0,59 г, 6,0 ммоль) с последующим нагреванием смеси для кипячения с обратным холодильником в течение 21 часа. Реакционный раствор охлаждали до комнатной температуры и затем нерастворимые вещества отделяли фильтрованием через целит и фильтрат концентрировали при пониженном давлении, получая при этом трет-бутил-5-(бензилокси)-6-метил-2-({1-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил}пиперидин-4-ил)метил]пиримидин-4-карбоксилат.
Данный продукт растворяли в смешанном растворителе толуола (16 мл), этанола (10 мл) и воды (10 мл) и добавляли трет-бутил-[(4-иодбензил)окси]диметилсилан (0,84 г, 2,4 ммоль), тетракис(трифенилфосфин)палладий (0,46 г, 0,40 ммоль) и карбонат натрия (1,1 г, 10 ммоль) с последующим нагреванием для кипячения с обратным холодильником в течение 1 часа. После охлаждения реакционного раствора до комнатной температуры добавляли воду с последующей экстракцией смеси этилацетатом. После концентрирования органического слоя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,40 (гексан/этилацетат=4/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,82 г, 1,2 ммоль) в виде бледно-желтого масла (выход 59%).
1H-ЯМР (500 МГц, CDCl3) δ: 8,43 (1H, с), 7,69 (1H, д, J=9 Гц), 7,49 (2H, д, J=8 Гц), 7,43-7,35 (5H, м), 7,41 (2H, д, J=8 Гц), 6,73 (1H, д, J=9 Гц), 5,01 (2H, с), 4,77 (2H, с), 4,32 (2H, д, J=12 Гц), 2,87 (2H, т, J=7 Гц), 2,83 (2H, т, J=12 Гц), 2,46 (3H, с), 2,26-2,16 (1H, м), 1,78 (2H, д, J=12 Гц), 1,60 (9H, с), 1,43 (2H, дкв, J=12 Гц, 3 Гц), 0,96 (9H, с), 0,12 (6H, с).
(3) [({5-Гидрокси-2-[(1-{5-[4-(гидроксиметил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
Согласно примерам от 1-(10) до 1-(13), но с применением трет-бутил-5-(бензилокси)-2-[(1-{5-[4-({[трет-бутил(диметил)силил]окси}метил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-карбоксилата вместо трет-бутил-5-(бензилокси)-2-({1-[4'-({[трет-бутил(диметил)силил]окси}метил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-карбоксилата, указанное в заголовке соединение получали (выход 50) в виде белого твердого вещества.
МС m/z: 492 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 8,99 (1H, шир.с), 8,42 (1H, с), 7,80 (1H, д, J=9 Гц), 7,56 (2H, д, J=8 Гц), 7,35 (2H, д, J=8 Гц), 6,90 (1H, д, J=9 Гц), 5,20 (1H, шир.с), 4,51 (2H, с), 4,32 (2H, д, J=13 Гц), 3,51 (2H, шир.с), 2,83 (2H, т, J=13 Гц), 2,74 (2H, д, J=7 Гц), 2,42 (3H, с), 2,20-2,08 (1H, м), 1,68 (2H, д, J=13 Гц), 1,26 (2H, дкв, J=13 Гц, 3 Гц).
(Пример 20)
[({5-Гидрокси-2-[(1-{5-[4-(2-гидроксипропил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 80]
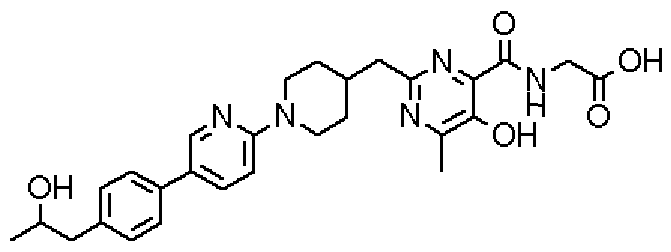
(1) 1-Бром-4-[2-(метоксиметокси)пропил]бензол
[Химическая формула 81]
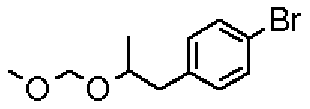
Согласно примеру 6-(3), но с применением 1-(4-бромфенил)пропан-2-ола вместо 2-(4'-бромдифенил-4-ил)-2-метилпропан-1-ола, указанное в заголовке соединение получали (выход 89%) в виде бесцветного масла.
1H-ЯМР (500 МГц, CDCl3) δ: 7,40 (2H, д, J=8 Гц), 7,09 (2H, д, J=8 Гц), 4,64 (1H, д, J=7 Гц), 4,50 (1H, д, J=7 Гц), 3,96-3,83 (1H, м), 3,18 (3H, с), 2,84-2,73 (1H, м), 2,72-2,61 (1H, м), 1,17 (3H, д, J=6 Гц).
(2) [({5-Гидрокси-2-[(1-{5-[4-(2-гидроксипропил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
Согласно примерам 19-(2) и от 1-(10) до 1-(13), но с применением 1-бром-4-[2-(метоксиметокси)пропил]бензола вместо трет-бутил-[(4-иодбензил)окси]диметилсилана, указанное в заголовке соединение получали (выход 11%) в виде белого твердого вещества.
МС m/z: 520 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 9,32 (1H, т, J=5 Гц), 8,40 (1H, с), 7,79 (1H, д, J=9 Гц), 7,50 (2H, д, J=8 Гц), 7,23 (2H, д, J=8 Гц), 6,89 (1H, д, J=9 Гц), 4,60 (1H, шир.с), 4,32 (2H, д, J=12 Гц), 3,90 (2H, д, J=5 Гц), 3,86-3,80 (1H, м), 2,83 (2H, т, J=7 Гц), 2,76 (2H, д, J=7 Гц), 2,71-2,63 (2H, м), 2,44 (3H, с), 2,09-2,00 (1H, м), 1,66 (2H, д, J=12 Гц), 1,25 (2H, дкв, J=12 Гц, 3 Гц), 1,04 (3H, д, J=6 Гц).
(Пример 21)
[({5-Гидрокси-2-[(1-{5-[4-(2-гидрокси-1,1-диметилэтил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 82]
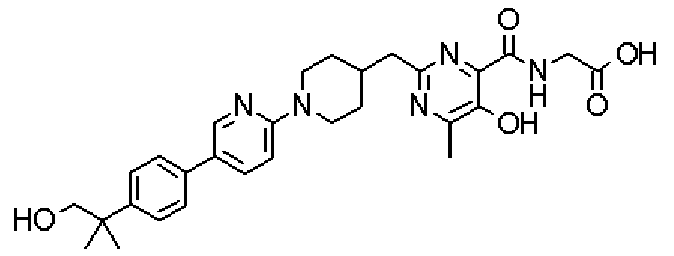
Согласно примерам 20-(1) и 20-(2), но с применением 2-(4-бромфенил)-2-метилпропан-1-ола вместо 1-(4-бромфенил)пропан-2-ола, указанное в заголовке соединение получали (выход 11%) в виде белого твердого вещества.
МС m/z: 534 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 9,42 (1H, т, J=5 Гц), 8,40 (1H, д, J=3 Гц), 7,79 (1H, дд, J=9 Гц, 3 Гц), 7,51 (2H, д, J=8 Гц), 7,40 (2H, д, J=8 Гц), 6,89 (1H, д, J=9 Гц), 4,67 (1H, шир.с), 4,32 (2H, д, J=13 Гц), 4,00 (2H, д, J=5 Гц), 3,42 (2H, с), 2,83 (2H, д, J=7 Гц), 2,76 (2H, т, J=12 Гц), 2,44 (3H, с), 2,25-2,10 (1H, м), 1,68 (2H, д, J=12 Гц), 1,36 (2H, дкв, J=12 Гц, 3 Гц), 1,23 (6H, с).
(Пример 22)
({[2-({1-[2-Хлор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 83]
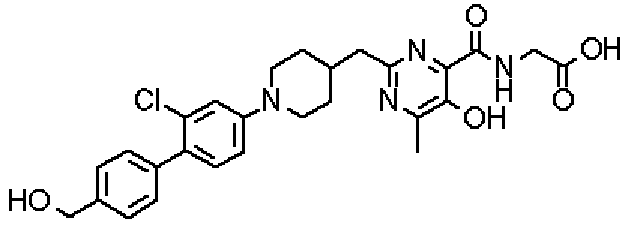
(1) (4'-Бром-2'-хлордифенил-4-ил)метанол
[Химическая формула 84]
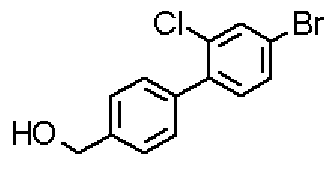
Согласно примеру 4-(2), но с применением [4-(гидроксиметил)фенил]бороновой кислоты вместо 4-бромфенилбороновой кислоты и 4-бром-2-хлор-1-иодбензола вместо трет-бутил-[2-(4-иодфенил)этокси]диметилсилана, указанное в заголовке соединение получали (выход 12%) в виде желтого твердого вещества.
1H-ЯМР (500 МГц, CDCl3) δ: 7,65 (1H, д, J=2 Гц), 7,48-7,40 (5H, м), 7,21 (1H, д, J=8 Гц), 4,77 (2H, д, J=6 Гц), 1,71 (1H, т, J=6 Гц).
(2) [(4'-Бром-2'-хлордифенил-4-ил)метокси](трет-бутил)диметилсилан
[Химическая формула 85]
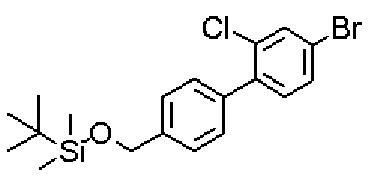
Согласно примеру 1-(8), но с применением (4'-бром-2'-хлордифенил-4-ил)метанола вместо (4'-бромдифенил-4-мл)метанола, указанное в заголовке соединение получали (выход 90%) в виде бесцветного масла.
1H-ЯМР (500 МГц, CDCl3) δ: 7,64 (1H, д, J=2 Гц), 7,45 (1H, дд, J=8 Гц, 2 Гц), 7,41-7,36 (4H, м), 7,21 (1H, д, J=8 Гц), 4,80 (2H, с), 0,96 (9H, с), 0,13 (6H, с).
(3) Этил-({[5-(бензилокси)-2-({1-[2-хлор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетат
[Химическая формула 86]
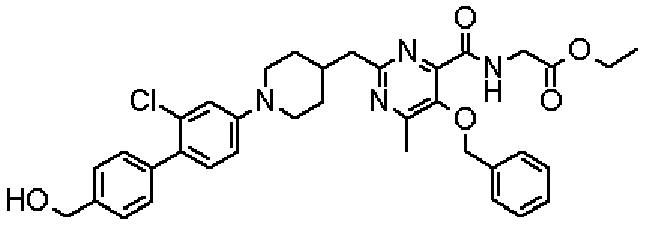
Согласно примерам от 1-(9) до 1-(11), но с применением [(4'-бром-2'-хлордифенил-4-ил)метокси](трет-бутил)диметилсилана вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 62%) в виде желтого аморфного твердого вещества.
1H-ЯМР (500 МГц, CDCl3) δ: 8,37 (1H, т, J=5 Гц), 7,53-7,17 (10H, м), 7,00 (1H, с), 6,88 (1H, д, J=8 Гц), 5,13 (2H, с), 4,75 (2H, д, J=6 Гц), 4,28 (2H, кв, J=7 Гц), 4,26 (2H, д, J=5 Гц), 3,73 (2H, д, J=12 Гц), 2,90 (2H, д, J=7 Гц), 2,80 (2H, т, J=12 Гц), 2,47 (3H, с), 2,19-2,08 (1H, м), 1,79 (2H, д, J=12 Гц), 1,62-1,45 (2H, м), 1,32 (3H, т, J=7 Гц).
(4) Этил-[({2-[(1-(2-хлор-4'-[(2,2,2-трифторацетокси)метил]дифенил-4-ил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]ацетат
[Химическая формула 87]
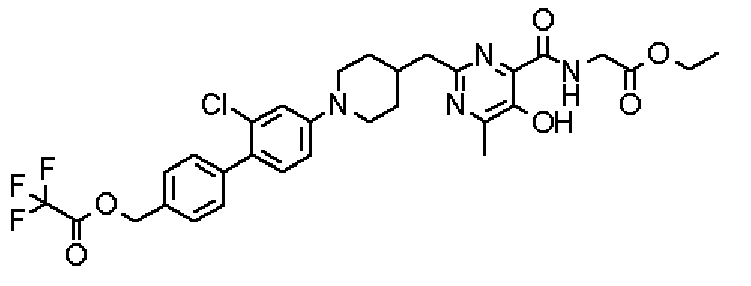
Этил-({[5-(бензилокси)-2-({1-[2-хлор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетат (0,96 г, 1,5 ммоль) растворяли в дихлорметане (20 мл) и в атмосфере азота добавляли трифторуксусную кислоту (20 мл) с последующим перемешиванием при комнатной температуре в течение 7 часов. К реакционному раствору для нейтрализации добавляли водный раствор гидрокарбоната натрия с последующей экстракцией смеси дихлорметаном и затем органический слой концентрировали при пониженном давлении. Образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: дихлорметан/этилацетат) и фракцию, соответствующую величине Rf=0,80 (дихлорметан/этилацетат = 4/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,74 г, 1,3 ммоль) в виде желтого масла (выход 90%).
1H-ЯМР (500 МГц, CDCl3) δ: 11,39 (1H, с), 8,50 (1H, т, J=5 Гц), 7,48 (2H, д, J=8 Гц), 7,43 (2H, д, J=8 Гц), 7,20 (1H, д, J=9 Гц), 6,99 (1H, с), 6,87 (1H, д, J=9 Гц), 5,40 (2H, с), 4,29 (2H, кв, J=7 Гц), 4,23 (2H, д, J=5 Гц), 3,73 (2H, д, J=12 Гц), 2,84 (2H, д, J=7 Гц), 2,79 (2H, т, J=12 Гц), 2,55 (3H, с), 2,14-2,04 (1H, м), 1,78 (2H, д, J=12 Гц), 1,49 (2H, кв, J=12 Гц), 1,33 (3H, т, J=7 Гц).
(5) ({[2-({1-[2-Хлор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Согласно примеру 1-(13), но с применением этил-[({2-[(1-{2-хлор-4'-[(2,2,2-трифторацетокси)метил]дифенил-4-ил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]ацетата вместо этил-({[5-гидрокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетата, указанное в заголовке соединение получали (выход 55%) в виде белого твердого вещества.
МС m/z: 525 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 9,34 (1H, т, J=5 Гц), 7,37-7,32 (4H, м), 7,20 (1H, д, J=9 Гц), 7,01 (1H, с), 6,97 (1H, д, J=9 Гц), 5,22 (1H, шир.с), 4,53 (2H, с), 3,92 (2H, д, J=5 Гц), 3,76 (2H, д, J=12 Гц), 2,78 (2H, д, J=7 Гц), 2,74 (2H, т, J=12 Гц), 2,44 (3H, с), 2,15-2,05 (1H, м), 1,68 (2H, д, J=12 Гц), 1,34 (2H, кв, J=12 Гц).
(Пример 23)
({[5-Гидрокси-2-({1-[4'-(гидроксиметил)-2-метилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 88]
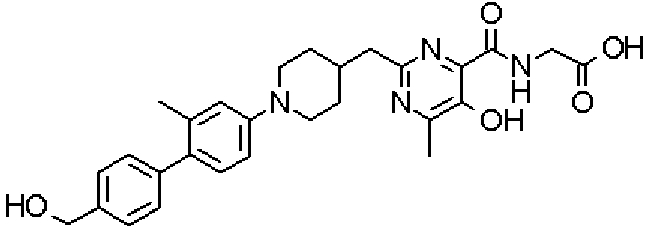
(1) (4'-Бром-2'-метилдифенил-4-ил)метанол
[Химическая формула 89]
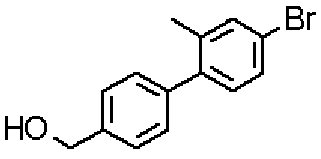
Согласно примеру 4-(2), но с применением [4-(гидроксиметил)фенил]бороновой кислоты вместо (4-(бромфенил)бороновой кислоты и 4-бром-1-иод-2-метилбензола вместо трет-бутил-[2-(4-иодфенил)этокси]диметилсилана, указанное в заголовке соединение получали (выход 7,1%) в виде желтого масла.
1H-ЯМР (500 МГц, CDCl3) δ: 7,45-7,41 (3H, м), 7,37 (1H, д, J=8 Гц), 7,29 (2H, д, J=8 Гц), 7,09 (1H, д, J=8 Гц), 4,77 (2H, д, J=6 Гц), 2,24 (3H, с), 1,70 (1H, т, J=6 Гц).
(2) [(4'-Бром-2'-метилдифенил-4-ил)метокси](трет-бутил)диметилсилан
[Химическая формула 90]
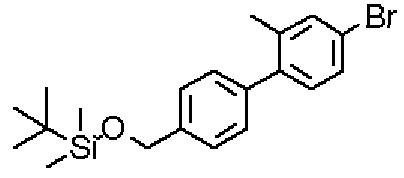
Согласно примеру 1-(8), но с применением (4'-бром-2'-метилдифенил-4-ил)метанола вместо (4'-бромдифенил-4-ил)метанола, указанное в заголовке соединение получали (выход 89%) в виде бесцветного масла.
1H-ЯМР (500 МГц, CDCl3) δ: 7,42 (1H, с), 7,39-7,34 (3H, м), 7,25 (2H, д, J=8 Гц), 7,09 (1H, д, J=8 Гц), 4,79 (2H, с), 2,24 (3H, с), 0,9 7 (9H, с), 0,13 (6H, с).
(3) ({[5-Гидрокси-2-({1-[4'-(гидроксиметил)-2-метилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Согласно примерам от 1-(9) до 1-(13), но с применением [(4'-бром-2'-метилдифенил-4-ил)метокси](трет-бутил)диметилсилана вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 27%) в виде бледно-желтовато-белого твердого вещества.
МС m/z: 505 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 9,15 (1H, шир.с), 7,33 (2H, д, J=8 Гц), 7,24 (2H, д, J=8 Гц), 7,02 (1H, д, J=8 Гц), 6,84 (1H, с), 6,80 (1H, д, J=8 Гц), 4,52 (2H, с), 3,75-3,66 (4H, м), 2,77 (2H, д, J=7 Гц), 2,66 (2H, т, J=12 Гц), 2,43 (3H, с), 2,20 (3H, с), 2,10-1,99 (1H, м), 1,69 (2H, д, J=12 Гц), 1,36 (2H, кв, J=12 Гц).
(Пример 24)
({[2-({1-[3'-Хлор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 91]
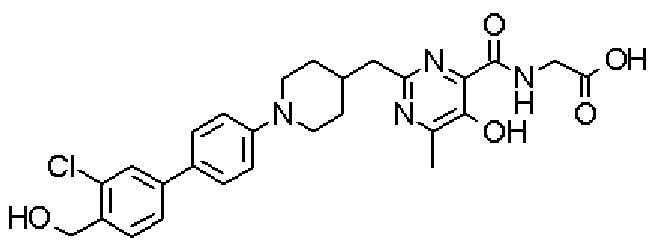
(1) трет-Бутил-[(2-хлор-4-иодбензил)окси]диметилсилан
[Химическая формула 92]
2-Хлор-4-иодбензойную кислоту (5,0 г, 18 ммоль) растворяли в тетрагидрофуране (7 мл) и при 0°С добавляли раствор комплекса боран-тетрагидрофуран в тетрагидрофуране (1 М, 21 мл, 23 ммоль) с последующим перемешиванием смеси при комнатной температуре в течение 3 дней. К реакционному раствору добавляли воду и насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией раствора этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия и затем растворитель отгоняли при пониженном давлении, получая при этом (2-хлор-4-иодфенил)метанол (4,8 г, 18 ммоль) в виде белого твердого вещества (выход количественный).
Согласно примеру 1-(8), но с применением (2-хлор-4-иодфенил)метанола вместо (4'-бромдифенил-4-ил)метанола, указанное в заголовке соединение получали (выход 95%) в виде бесцветного масла.
1H-ЯМР (500 МГц, CDCl3) δ: 7,65 (1H, с), 7,61 (1H, д, J=9 Гц), 7,29 (1H, д, J=9 Гц), 4,72 (2H, с), 0,95 (9H, с), 0,12 (6H, с).
(2) [(4'-Бром-3-хлордифенил-4-ил)метокси](трет-бутил)диметилсилан
[Химическая формула 93]
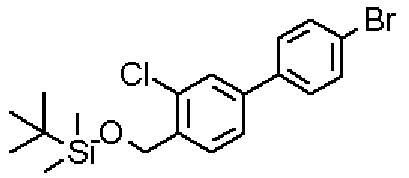
Согласно примеру 11-(1), но с применением трет-бутил-[(2-хлор-4-иодбензил)окси]диметилсилана вместо 4-бромбензилбромида и (4-бромфенил)бороновой кислоты вместо [3-(гидроксиметил)фенил]бороновой кислоты, указанное в заголовке соединение получали (выход 96%) в виде бесцветного масла.
1H-ЯМР (500 МГц, CDCl3) δ: 7,63 (1H, д, J=8 Гц), 7,57 (2H, д, J=8 Гц), 7,52-7,41 (4H, м), 4,82 (2H, с), 0,98 (9H, с), 0,15 (6H, с).
(3) ({[2-({1-[3'-Хлор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Согласно примерам от 1-(9) до 1-(13), но с применением [(4'-бром-3-хлордифенил-4-ил)метокси](трет-бутил)диметилсилана вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 31%) в виде бледно-желтовато-белого твердого вещества.
МС m/z: 525 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,90 (1H, шир.с), 11,92 (1H, с), 9,42 (1H, т, J=6Гц), 7,61-7,51 (5H, м), 7,02-6,96 (2H, м), 5,38 (1H, шир.с), 4,57 (2H, д, J=5 Гц), 4,00 (2H, д, J=6 Гц), 3,75 (2H, д, J=12 Гц), 2,80-2,66 (4H, м), 2,44 (3H, с), 2,16-2,04 (1H, м), 1,67 (2H, д, J=12 Гц), 1,35 (2H, кв, J=12 Гц).
(Пример 25)
({[5-Гидрокси-2-({1-[4'-(гидроксиметил)-2'-метилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 94]
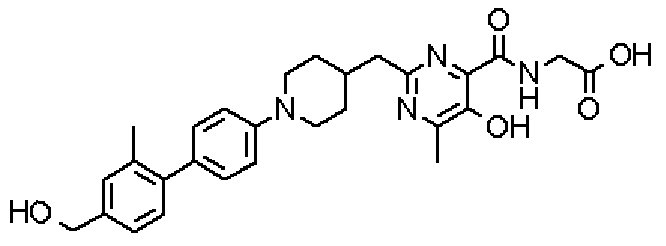
(1) Метил-4'-бром-2-метилдифенил-4-карбоксилат
[Химическая формула 95]
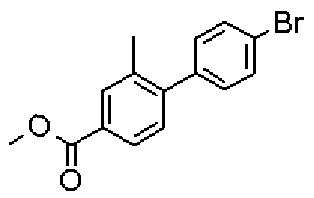
Согласно примеру 19-(2), но с применением метил-4-бром-3-метилбензоата вместо трет-бутил-5-(бензилокси)-2-{[1-(5-бромпиридин-2-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-карбоксилата и 1-бром-4-иодбензола вместо трет-бутил-[4-иодбензил)окси]диметилсилана, указанное в заголовке соединение получали (выход 23%) в виде белого твердого вещества.
1H-ЯМР (500 МГц, CDCl3) δ: 7,96 (1H, с), 7,90 (1H, д, J=9 Гц), 7,57 (2H, д, J=9 Гц), 7,27 (1H, д, J=9 Гц), 7,20 (2H, д, J=9 Гц), 3,94 (3H, с), 2,30 (3H, с).
(2) [(4'-Бром-2-метилдифенил-4-ил)метокси](трет-бутил)диметилсилан
[Химическая формула 96]
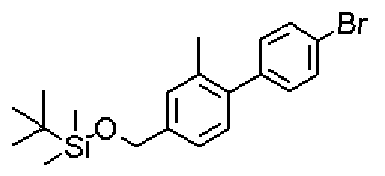
Согласно примеру 6-(2), но с применением метил-4'-бром-2-метилдифенил-4-карбоксилата вместо этил-2-(4'-бромдифенил-4-ил)-2-метилпропионата, (4'-бром-2-метилдифенил-4-ил)метанол получали (выход 97%) в виде бесцветного масла.
Согласно примеру 1-(8), но с применением (4'-бром-2-метилдифенил-4-ил)метанола вместо (4'-бромдифенил-4-ил)метанола, указанное в заголовке соединение получали (выход 71%) в виде бесцветного масла.
1H-ЯМР (500 МГц, CDCl3) δ: 7,53 (2Н, д, J=8 Гц), 7,24-7,14 (5H, м) 4,75 (2H, с), 2,25 (3H, с), 0,96 (9H, с), 0,13 (6H, с).
(3) ({[5-Гидрокси-2-({1-[4'-(гидроксиметил)-2'-метилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Согласно примерам от 1-(9) до 1-(13), но с применением [(4'-бром-2-метилдифенил-4-ил)метокси](трет-бутил)диметилсилана вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 17%) в виде бледно-желтовато-белого твердого вещества.
МС m/z: 505 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 11,94 (1H, шир.с), 9,41 (1H, шир.с), 7,20-7,08 (5H, м), 6,99-6,94 (2H, м), 4,47 (2H, с), 3,99 (2H, д, J=6 Гц), 3,71 (2H, д, J=12 Гц), 2,79 (2H, д, J=7 Гц), 2,68 (2H, т, J=12 Гц), 2,45 (3H, с), 2,23 (3H, с), 2,13-2,02 (1H, м), 1,69 (2H, д, J=12 Гц), 1,37 (2H, кв, J=12 Гц).
(Пример 26)
({[5-Гидрокси-2-({1-[4'-(гидроксиметил)-2,3'диметилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 97]
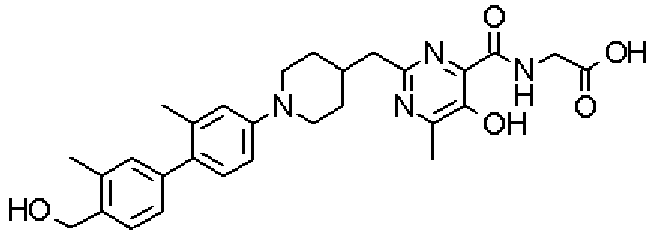
(1) [(4'-Бром-2',3-диметилдифенил-4-ил)метокси](трет-бутил)диметилсилан
[Химическая формула 98]
Согласно примеру 19-(2), но с применением [(4-бром-2-метилбензил)окси](трет-бутил)диметилсилана вместо трет-бутил-5-(бензилокси)-2-{[1-(5-бромпиридин-2-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-карбоксилата и 4-бром-1-иод-2-метилбензола вместо трет-бутил-[(4-иодбензил)окси]диметилсилана, указанное в заголовке соединение получали (выход 34%) в виде желтого масла.
1H-ЯМР (500 МГц, CDCl3) δ: 7,46 (1H, д, J=8 Гц), 7,41 (1Н, с), 7,35 (1H, д, J=8 Гц), 7,11 (1H, д, J=8 Гц), 7,08 (1H, д, J=8 Гц), 7,04 (1H, с), 4,75 (2H, с), 2,30 (3H, с), 2,24 (3H, с), 0,97 (9Н, с), 0,13 (6H, с).
(2) ({[5-Гидрокси-2-({1-[4'-(гидроксиметил)-2,3'-диметилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Согласно примерам от 1-(9) до 1-(13), но с применением [(4'-бром-2',3-диметилдифенил-4-ил)метокси](трет-бутил)диметилсилана вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 45%) в виде бледно-желтовато-белого твердого вещества.
МС m/z: 519 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 9,36 (1H, т, J=5 Гц), 7,35 (1H, д, J=8 Гц), 7,08 (1H, д, J=8 Гц), 7,05 (1H, с), 7,01 (1H, д, J=8 Гц), 6,83 (1H, с), 6,79 (1H, д, J=8 Гц), 4,51 (2H, с), 3,96 (2H, д, J=5 Гц), 3,70 (2H, д, J=12 Гц), 2,78 (2H, д, J=7 Гц), 2,66 (2H, т, J=12 Гц), 2,44 (3H, с), 2,27 (3H, с), 2,19 (3H, с), 2,13-2,02 (1H, м), 1,68 (2H, д, J=12 Гц), 1,37 (2H, кв, J=12 Гц).
(Пример 27)
({[5-Гидрокси-2-({1-[4'-(2-гидроксибутил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 99]
Согласно примерам от 5-(2) до 5-(5), но с применением смешанного раствора этиллития в бензоле и циклогексане (бензол/циклогексан=9/1) вместо раствора метиллития в диэтиловом простом эфире, указанное в заголовке соединение получали (выход 3,6%) в виде бледно-желтого твердого вещества.
МС m/z: 533 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,89 (1H, шир.с), 11,91 (1H, с), 9,29 (1H, т, J=5 Гц), 7,48 (2H, д, J=9 Гц), 7,47 (2H, д, J=9 Гц), 7,22 (2H, д, J=8 Гц), 6,98 (2H, д, J=8 Гц), 4,48 (1H, д, J=5 Гц), 4,00 (2H, д, J=5 Гц), 3,86-3,80 (1H, м), 3,73 (2H, д, J=12 Гц), 2,78 (2H, д, J=7 Гц), 2,74-2,67 (2H, м), 2,63 (2H, д, J=6 Гц), 2,44 ( 3H, с), 2,15-2,03 (1H, м), 1,68 (2H, д, J=12 Гц), 1,36 (2H, дкв, J=12 Гц, 3 Гц), 1,35-1,22 (2H, м), 0,88 (3H, т, J=7 Гц).
(Пример 28)
[({5-Гидрокси-2-[(1-{4-[4-(2-гидроксипропил)бензил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 100]
Согласно примеру 19-(2), но с применением 1-бром-4-[2-(метоксиметокси)пропил]бензола вместо трет-бутил-5-(бензилокси)-2-{[1-(5-бромпиридин-2-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-карбоксилата и 1-бром-4-(бромметил)бензола вместо трет-бутил-[(4-иодбензил)окси]диметилсилана, сырой продукт 1-бром-4-{4-[2-(метоксиметокси)пропил]бензил}бензола получали в виде желтого масла.
Согласно примерам от 1-(9) до 1-(13), но с применением сырого продукта 1-бром-4-{4-[2-(метоксиметокси)пропил]бензил}бензола вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 15%) в виде белого твердого вещества.
МС m/z: 533 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,87 (1H, шир.с), 11,91 (1H, с), 9,42 (1H, т, J=5 Гц), 7,08 (4H, с), 7,03 (2H, д, J=7 Гц), 6,83 (2H, д, J=7 Гц), 4,53 (1H, шир.с), 4,00 (2H, д, J=5 Гц), 3,76 (2H, с), 3,79-3,72 (1H, м), 3,58 (2H, д, J=12 Гц), 2,76 (2H, т, J=7 Гц), 2,66-2,45 (4H, м), 2,44 (3H, с), 2,09-2,00 (1H, м), 1,66 (2H, д, J=12 Гц), 1,35 (2H, дкв, J=12 Гц, 3 Гц), 1,00 (3H, д, J=6 Гц).
(Пример 29)
[({5-Гидрокси-2-[(1-{4-[4-(2-гидрокси-1,1-диметилэтил)бензил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 101]
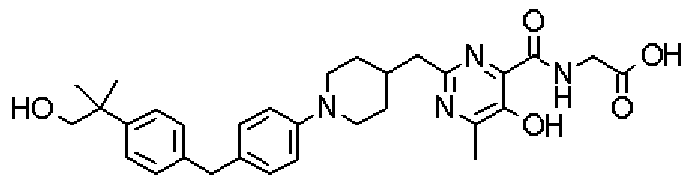
Согласно примеру 28, но с применением 1-бром-4-[2-(метоксиметокси)-1,1-диметилэтил]бензола вместо 1-бром-4-[2-(метоксиметокси)пропил]бензола, указанное в заголовке соединение получали (выход 12%) в виде белого твердого вещества.
МС m/z: 547 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 11,92 (1H, с), 9,43 (1H, т, J=5 Гц), 7,23 (2H, д, J=5 Гц), 7,11 (2H, д, J=5 Гц), 7,04 (2H, шир.с), 6,84 (2H, шир.с), 4,65 (1H, шир.с), 4,00 (2H, д, J=5 Гц), 3,76 (2H, с), 3,58 (2H, д, J=12 Гц), 3,42 (2H, с), 2,78 (2H, д, J=7 Гц), 2,70 (2H, т, J=12 Гц), 2,44 (3H, с), 2,11-2,00 (1H, м), 1,66 (2H, д, J=12 Гц), 1,36 (2H, дкв, J=12 Гц, 3 Гц), 1,17 (6H, с)
(Пример 30)
({[2-({1-[4'-(1,1-Дифтор-2-гидроксиэтил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 102]
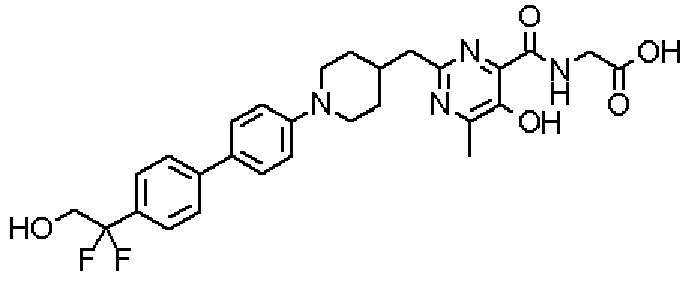
(1) Этил-(4'-бромдифенил-4-ил)(дифтор)ацетат
[Химическая формула 103]
Согласно примеру 11-(1), но с применением этил-4-иодфенилацетата вместо 4-бромбензилбромида и (4-бромфенил)бороновой кислоты вместо [3-(гидроксиметил)фенил]бороновой кислоты, этил-(4'-бромдифенил-4-ил)ацетат получали (выход 71%) в виде белого твердого вещества.
Этил-(4'-бромдифенил-4-ил)ацетат (3,1 г, 9,8 ммоль) растворяли в тетрагидрофуране (50 мл) с последующим добавлением раствора гексаметилдисилазида лития в тетрагидрофуране (1 М, 12 мл, 12 ммоль) при -78°С в атмосфере азота и перемешиванием в течение 20 минут и затем добавляли при такой же температуре N-фторбензолсульфонимид (3,7 г, 12 ммоль) с последующим перемешиванием в течение 20 минут. К реакционному раствору при -78°С добавляли раствор гексаметилдисилазида лития в тетрагидрофуране (1 М, 12 мл, 12 ммоль) с последующим перемешиванием в течение 20 минут и затем при такой же температуре добавляли N-фторбензолсульфонимид (3,7 г, 12 ммоль) с последующим перемешиванием в течение еще 1 часа. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией раствора этилацетатом и затем экстракт концентрировали при пониженном давлении. Образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,70 (гексан/этилацетат=4/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (2,8 г, 7,8 ммоль) в виде бледно-желтого масла (выход 79%).
1H-ЯМР (500 МГц, CDCl3) д: 7,68 (2H, д, J=8 Гц), 7,63 (2H, д, J=8 Гц), 7,61 (2H, д, J=8 Гц), 7,46 (2H, д, J=8 Гц), 4,33 (2H, кв, J=7 Гц), 1,33 (3H, т, J=7 Гц).
(2) 2-(4'-Бромдифенил-4-ил)-2,2-дифторэтанол
[Химическая формула 104]
Этил-(4'-бромдифенил-4-ил)(дифтор)ацетат (2,8 г, 7,8 ммоль) растворяли в метаноле (20 мл) и при 0°С добавляли борогидрид натрия (0,59 г, 16 ммоль) с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционный раствор концентрировали при пониженном давлении и к остатку добавляли хлористоводородную кислоту (1 М) и смесь затем экстрагировали этилацетатом и органический слой сушили над безводным сульфатом натрия. После отгонки растворителя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,50 (гексан/этилацетат=1/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (2,4 г, 7,7 ммоль) в виде белого твердого вещества (выход 99%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,64-7,58 (6H, м), 7,49-7,44 (2H, м), 4,02 (2H, дт, J=13 Гц, 6 Гц).
(3) [2-(4'-Бромдифенил-4-ил)-2,2-дифторэтокси](трет-бутил)диметилсилан
[Химическая формула 105]
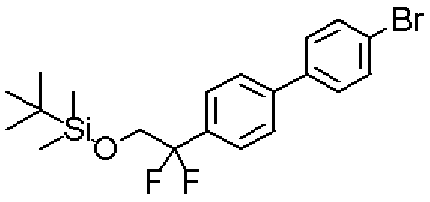
Согласно примеру 1-(8), но с применением 2-(4'-бромдифенил-4-ил)-2,2-дифторэтанола вместо (4'-бромдифенил-4-ил)метанола, указанное в заголовке соединение получали (выход 97%) в виде бесцветного масла.
1H-ЯМР (500 МГц, CDCl3) δ: 7,61-7,56 (6H, м), 7,47 (2H, д, J=7 Гц), 3,99 (2H, т, J=12 Гц), 0,85 (9H, с), 0,02 (6H, с).
(4) Этил-({[5-(бензилокси)-2-({1-[4'-(1,1-дифтор-2-гидроксиэтил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетат
[Химическая формула 106]
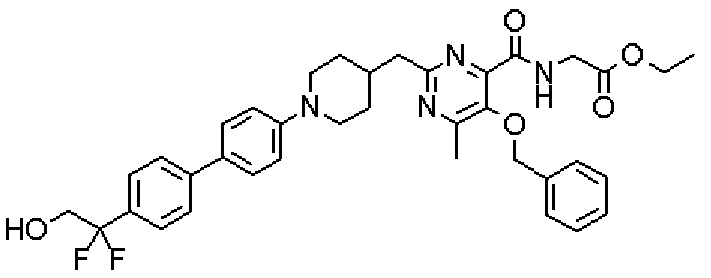
Согласно примерам от 1-(9) до 1-(11), но с применением [2-(4'-бромдифенил-4-ил)-2,2-дифторэтокси](трет-бутил)диметилсилана вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 59%) в виде белого твердого вещества.
MS m/z: 659 (M+H)+;
1H-ЯМР (500 МГц, CDCl3) δ: 8,37 (1H, д, J=5 Гц), 7,62 (2H, д, J=8 Гц), 7,55-7,48 (6H, м), 7,41-7,35 (3H, м), 7,01 (2H, д, J=8 Гц), 5,12 (2H, с), 4,27 (2H, кв, J=6 Гц), 4,24 (2H, д, J=5 Гц), 4,00 (2H, т, J=13 Гц), 3,76 (2H, д, J=12 Гц), 2,90 (2H, д, J=7 Гц), 2,80 (2H, т, J=12 Гц), 2,47 (3H, с), 2,19-2,08 (1H, м), 1,78 (2H, д, J=12 Гц), 1,60-1,48 (2H, м), 1,32 (3H, т, J=6 Гц).
(5) ({[2-({1-[4'-(1,1-Дифтор-2-гидроксиэтил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Согласно примерам 1-(12) и 1-(13), но с применением этил-({[5-(бензилокси)-2-({1-[4'-(1,1-дифтор-2-гидроксиэтил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетата вместо этил-({[5-(бензилокси)-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетата, указанное в заголовке соединение получали (выход 84%) в виде бледно-желтого твердого вещества.
МС m/z: 541 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 11,92 (1H, с), 9,43 (1H, т, J=6 Гц), 7,70 (2H, д, J=8 Гц), 7,56 (2H, д, J=8 Гц), 7,54 (2H, д, J=8 Гц), 7,09-6,97 (2H, м), 5,67 (1H, шир.с), 4,02 (2H, д, J=6 Гц), 3,87 (2H, т, J=14 Гц), 3,76 (2H, д, J=12 Гц), 2,78 (2H, д, J=7 Гц), 2,78-2,67 (2H, м), 2,45 (3H, с), 2,18-2,06 (1H, м), 1,69 (2H, д, J=12 Гц), 1,43-1,31 (2H, м).
(Пример 31)
({[2-({1-[4'-(1,1-Дифтор-2-гидроксипропил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 107]
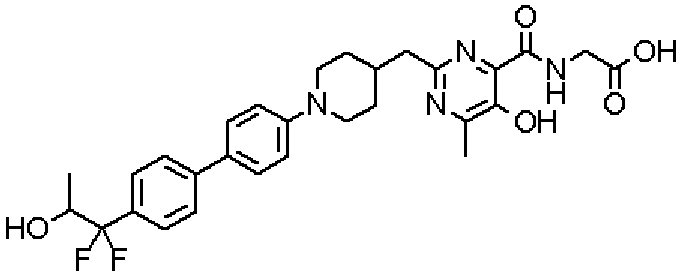
(1) 1-(4'-Бромдифенил-4-ил)-1,1-дифторпропан-2-ол
[Химическая формула 108]
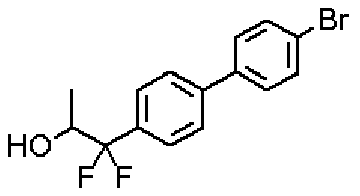
Этил-(4'-бромдифенил-4-ил)(дифтор)ацетат (1,8 г, 5,1 ммоль), полученный в примере 30-(1), растворяли в тетрагидрофуране (20 мл) и в атмосфере азота при -78°С добавляли раствор метиллития в диэтиловом простом эфире (1,1 М, 14 мл, 15 ммоль) с последующим перемешиванием смеси при такой же температуре в течение 30 минут. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом и затем экстракт концентрировали при пониженном давлении, получая при этом 1-(4'-бромдифенил-4-ил)-1,1-дифторацетон в виде бледно-желтого масла.
Масло растворяли в тетрагидрофуране (30 мл) и добавляли борогидрид натрия (0,59 г, 16 ммоль) с последующим перемешиванием раствора при комнатной температуре в течение 30 минут. К реакционному раствору добавляли хлористоводородную кислоту (1 М) с последующей экстракцией смеси этилацетатом и затем экстракт промывали насыщенным водным раствором хлорида натрия и органический слой сушили над безводным сульфатом натрия. После отгонки растворителя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,30 (гексан/этилацетат=4/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,89 г, 2,7 ммоль) в виде желтого масла (выход 53%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,63-7,57 (6H, м), 7,46 (2H, д, J=9 Гц), 4,25-4,16 (1H, м), 1,27 (3H, д, J=7 Гц).
(2) ({[2-({1-[4'-(1,1-Дифтор-2-гидроксипропил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Согласно примерам 1-(9) и от 1-(11) до 1-(13), но с применением 1-(4'-бромдифенил-4-ил)-1,1-дифторпропан-2-ола вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 19%) в виде бледно-желтого твердого вещества.
МС m/z: 555 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 11,93 (1H, с), 9,44 (1H, т, J=6 Гц), 7,71 (2H, д, J=8 Гц), 7,70-7,52 (4H, м), 7,51 (2H, д, J=8 Гц), 4,13-4,04 (1H, м), 4,01 (2H, д, J=6 Гц), 3,79-3,70 (2H, м), 2,84-2,72 (2H, м), 2,80 (2H, д, J=7 Гц), 2,45 (3H, с), 2,21-2,10 (1H, м), 1,78-1,69 (2H, м), 1,52-1,33 (2H, м), 1,10 (3H, д, J=6 Гц).
(Пример 32)
({[2-({1-[4'-(1,1-Дифтор-2-гидрокси-2-метилпропил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 109]
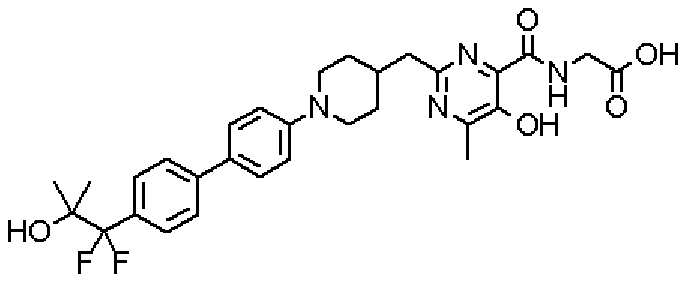
(1) 1-(4'-Бромдифенил-4-ил)-1,1-дифтор-2-метилпропан-2-ол
[Химическая формула 110]
Этил-(4'-бромдифенил-4-ил)(дифтор)ацетат (0,10 г, 0,28 ммоль), полученный в примере 30-(1), растворяли в тетрагидрофуране (20 мл) и в атмосфере азота при комнатной температуре добавляли раствор метилмагнийиодид в диэтиловом простом эфире (3,0 М, 1,0 мл, 3,0 ммоль) с последующим перемешиванием смеси при такой же температуре в течение 5 часов. К реакционному раствору добавляли хлористоводородную кислоту (1 М) с последующей экстракцией смеси этилацетатом и затем экстракт сушили над безводным сульфатом натрия. После отгонки растворителя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,35 (гексан/этилацетат=4/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,063 г, 0,18 ммоль) в виде желтого масла (выход 62%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,63-7,56 (6H, м), 7,46 (2H, д, J=8 Гц), 1,35 (6H, с).
(2) ({[2-({1-[4'-(1,1-Дифтор-2-гидрокси-2-метилпропил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Согласно примерам 1-(9) и от 1-(11) до 1-(13), но с применением 1-(4'-бромдифенил-4-ил)-1,1-дифтор-2-метилпропан-2-ола вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 11%) в виде бледно-желтого твердого вещества.
МС m/z: 569 (М+Н)+.
1H-ЯМР (500 МГц, DMSO-d6) δ: 11,92 (1H, с), 9,43 (1H, т, J=6 Гц), 7,67 (2H, д, J=8 Гц), 7,59-7,55 (2H, м), 7,49 (2H, д, J=8 Гц), 7,08-7,00 (2H, м), 4,00 (2H, д, J=6 Гц), 3,76 (2H, д, J=12 Гц), 2,78 (2H, д, J=7 Гц), 2,78-2,70 (2H, м), 2,45 (3H, с), 2,16-2,06 (1H, м), 1,70 (2H, д, J=12 Гц), 1,44-1,32 (2H, м), 1,19 (6H, с).
(Пример 33)
{[(5-[(2,2-Диметилпропаноил)окси]-2-{[1-(4'-{[(2,2-диметилпропаноил)окси]метил}дифенил-4-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил)карбонил]амино}уксусная кислота
[Химическая формула 111]
(1) Бензил-({[5-гидрокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетат
[Химическая формула 112]
({[5-Гидрокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусную кислоту (0,30 г, 0,61 ммоль), полученную в примере 1-(13), растворяли в дихлорметане (10 мл) и добавляли бензилбромид (0,21 г, 1,2 ммоль) и триэтиламин (0,26 мл, 1,8 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 дней. После концентрирования реакционного раствора при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: дихлорметан/метанол) и фракцию, соответствующую величине Rf=0,55 (дихлорметан/метанол=10/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,14 г, 0,24 ммоль) в виде бледно-желтого твердого вещества (выход 39%).
1H-ЯМР (400 МГц, CDCl3) δ: 11,34 (1H, с), 8,50 (1H, т, J=6 Гц), 7,56 (2H, д, J=9 Гц), 7,50 (2H, д, J=9 Гц), 7,40 (2H, д, J=9 Гц), 7,42-7,34 (5H, м), 7,00 (2H, д, J=9 Гц), 5,25 (2H, с), 4,72 (2H, с), 4,28 (2H, д, J=6 Гц), 3,73 (2H, д, J=12 Гц), 2,83 (2H, д, J=7 Гц), 2,76 (2H, т, J=12 Гц), 2,54 (3H, с), 2,12-1,99 (1H, м), 1,77 (2H, д, J=12 Гц), 1,71-1,43 (2H, м).
(2) 4-{[2-(Бензилокси)-2-оксоэтил]карбамоил}-2-{[1-(4'-{[(2,2-диметилпропаноил)окси]метил}дифенил-4-ил)пиперидин-4-ил]метил}-6-метилпиримидин-5-илпивалат
[Химическая формула 113]
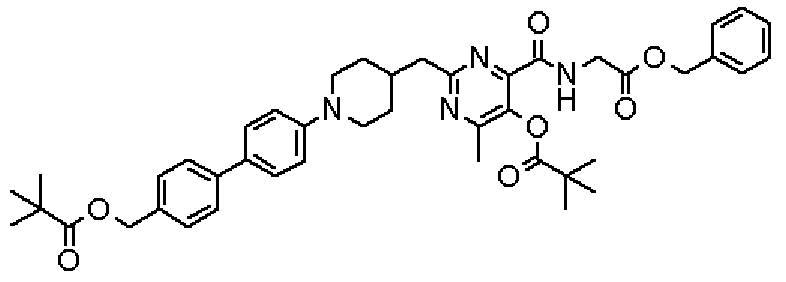
Бензил-({[5-гидрокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетат (0,025 г, 0,043 ммоль) и пивалоилхлорид (0,016 г, 0,13 ммоль) растворяли в дихлорметане (3 мл) и добавляли пиридин (0,010 мл, 0,12 ммоль) и 4-диметиламинопиридин (0,016 г, 0,13 ммоль) с последующим перемешиванием смеси при комнатной температуре в течение 2 дней. После концентрирования реакционного раствора при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: дихлорметан/метанол) и фракцию, соответствующую величине Rf=0,35 (гексан/этилацетат=2/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,017 г, 0,022 ммоль) в виде бледно-желтого твердого вещества (выход 52%).
1H-ЯМР (400 МГц, CDCl3) δ: 8,44 (1H, т, J=5 Гц), 7,55 (2H, д, J=9 Гц), 7,50 (2H, д, J=9 Гц), 7,40-7,32 (7H, м), 7,00 (2H, д, J=9 Гц), 5,22 (2H, с), 5,13 (2H, с), 4,24 (2H, д, J=5 Гц), 3,74 (2H, д, J=12 Гц), 2,92 (2H, д, J=7 Гц), 2,77 (2H, т, J=12 Гц), 2,47 (3H, с), 2,18-2,04 (1H, м), 1,80 (2H, д, J=12 Гц), 1,61-1,47 (2H, м), 1,43 (9H, с), 1,24 (9H, с).
(3) {[(5-[(2,2-Диметилпропаноил)окси]-2-{[1-(4'-{[2,2-диметилпропаноил)окси]метил}дифенил-4-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил)карбонил]амино}уксусная кислота
Согласно примеру 12-(4), но с применением 4-{[2-(бензилокси)-2-оксоэтил]карбамоил}-2-{[1-(4'-{[(2,2-диметилпропаноил)окси]метил}дифенил-4-ил)пиперидин-4-ил]метил}-6-метилпиримидин-5-илпивалата вместо бензил-[({5-(бензилокси)-2-[(1-{4-[5-(1-гидроксиэтил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]ацетата, указанное в заголовке соединение получали (выход 43%) в виде бледно-желтого твердого вещества.
МС m/z: 659 (М+Н)+.
1H-ЯМР (400 МГц, CDCl3) δ: 8,71 (1H, шир.с), 7,47 (2H, д, J=8 Гц), 7,38 (2H, д, J=8 Гц), 7,32 (2H, д, J=8 Гц), 6,84 (2H, д, J=8 Гц), 5,10 (2H, с), 3,80 (2H, шир.с), 3,56 (2H, д, J=12 Гц), 2,79 (2H, д, J=7 Гц), 2,57 (2H, т, J=12 Гц), 2,32 (3H, с), 2,05-1,91 (1H, м), 1,64 (2H, д, J=12 Гц), 1,45-1,31 (2H, м), 1,28 (9H, с), 1,22 (9H, с).
(Пример 34)
{[(2-{[1-(4'-{[(2,2-Диметилпропаноил)окси]метил}дифенил-4-ил)пиперидин-4-ил]метил}-5-гидрокси-6-метилпиримидин-4-ил)карбонил]амино}уксусная кислота
[Химическая формула 114]
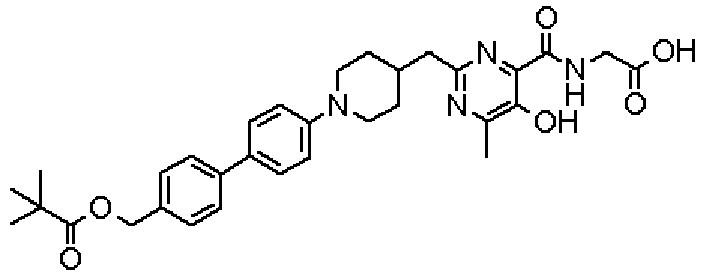
(1) Бензил-({[5-бензилокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетат
[Химическая формула 115]
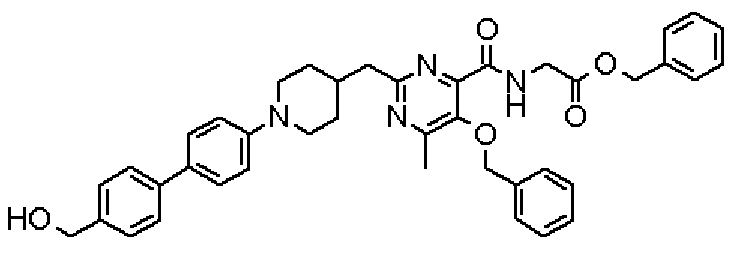
Согласно примеру 1-(11), но с применением бензилового эфира глицина вместо гидрохлорида этилового эфира глицина, указанное в заголовке соединение получали (выход 42) в виде белого твердого вещества.
1H-ЯМР (500 МГц, CDCl3) δ: 8,37 (1H, т, J=5 Гц), 7,56 (2H, д, J=8 Гц), 7,50 (2H, д, J=9 Гц), 7,48 (2H, д, J=8 Гц), 7,42-7,31 (10H, м), 7,00 (2H, д, J=9 Гц), 5,24 (2H, с), 5,11 (2H, с), 4,72 (2H, д, J=5 Гц), 4,30 (2H, д, J=5 Гц), 3,74 (2H, д, J=12 Гц), 2,89 (2H, д, J=7 Гц), 2,78 (2H, т, J=12 Гц), 2,46 (3H, с), 2,16-2,06 (1H, м), 1,78 (2H, д, J=12 Гц), 1,65 (1H, т, J=5 Гц), 1,60-1,48 (2H, м).
(2) [4'-(4-{[5-(Бензилокси)-4-{[2-(бензилокси)-2-оксоэтил]карбамоил}-6-метилпиримидин-2-ил]метил}пиперидин-1-ил)дифенил-4-ил]метилпивалат
[Химическая формула 116]
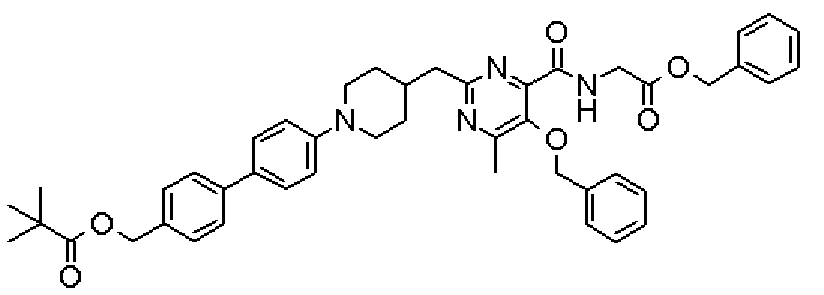
Согласно примеру 33-(2), но с применением бензил-({[5-бензилокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетата вместо бензил-({[5-гидрокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетата, указанное в заголовке соединение получали (выход 79%) в виде бледно-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ: 8,37 (1H, т, J=5 Гц), 7,55 (2H, д, J=8 Гц), 7,50 (2H, д, J=9 Гц), 7,48 (2H, д, J=8 Гц), 7,42-7,33 (10H, м), 7,00 (2H, д, J=9 Гц), 5,24 (2H, с), 5,13 (2H, с), 5,11 (2H, с), 4,30 (2H, д, J=5 Гц), 3,75 (2H, д, J=12 Гц), 2,89 (2H, д, J=7 Гц), 2,78 (2H, т, J=12 Гц), 2,47 (3H, с), 2,18-2,06 (1H, м), 1,79 (2H, д, J=12 Гц), 1,60-1,47 (2H, м), 1,24 (9H, с).
(3) {[(2-{[1-(4'-{[(2,2-Диметилпропаноил)окси]метил}дифенил-4-ил)пиперидин-4-ил]метил}-5-гидрокси-6-метилпиримидин-4-ил)карбонил]амино}уксусная кислота
Согласно примеру 12-(4), но с применением [4'-(4-{[5-(бензилокси)-4-{[2-(бензилокси)-2-оксоэтил]карбамоил}-6-метилпиримидин-2-ил]метил}пиперидин-1-ил)дифенил-4-ил]метилпивалата вместо бензил-[({5-(бензилокси)-2-[(1-{4-[5-(1-гидроксиэтил)пиридин-2-ил]фенил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]ацетата, указанное в заголовке соединение получали (выход 28%) в виде желтого твердого вещества.
МС m/z: 575 (М+Н)+;
1H-ЯМР (400 МГц, CDCl3) δ: 11,53 (1H, шир.с), 8,58 (1H, шир.с), 7,51 (4H, д, J=8 Гц), 7,36 (2H, д, J=8 Гц), 7,16 (2H, д, J=8 Гц), 5,12 (2 H, с), 3,69 (2H, д, J=12 Гц), 3,52 (2H, шир.с), 2,93-2,74 (4H, м), 2,50 (3H, с), 2,13-1,98 (1H, м), 1,87-1,59 (4H, м), 1,24 (9H, с).
(Пример 35)
({[5-Гидрокси-2-({1-[4'-(метоксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 117]
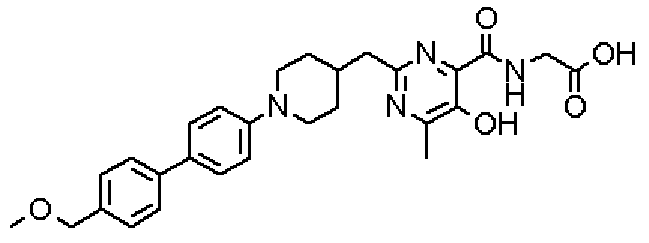
(1) (4'-Бромдифенил-4-ил)метилметиловый простой эфир
[Химическая формула 118]
(4'-Бромдифенил-4-ил)метанол (1,2 г, 4,6 ммоль) растворяли в тетрагидрофуране (20 мл) и в атмосфере азота при 4°С добавляли метилиодид (0,97 г, 6,8 ммоль) и затем гидрид натрия (63%, 0,26 г, 6,8 ммоль) с последующим перемешиванием смеси при комнатной температуре в течение 30 минут. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. После отгонки растворителя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/дихлорметан) и фракцию, соответствующую величине Rf=0,50 (гексан/дихлорметан=1/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (1,2 г, 4,3 ммоль) в виде белого твердого вещества (выход 95%).
1H-ЯМР (500 МГц, CDCl3) δ: 7,58-7,53 (4H, м), 7,48-7,44 (2Н, м), 7,43-7,40 (2H, м), 4,50 (2H, с), 3,42 (3H, с).
(2) ({[5-Гидрокси-2-({1-[4'-(метоксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Согласно примерам 1-(9), 1-(11), 22-(4) и 1-(13), но с применением (4'-бромдифенил-4-ил)метилметиловый простого эфира вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 26%) в виде бледно-желтовато-белого твердого вещества.
МС m/z: 505 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,90 (1H, шир.с), 11,92 (1H, с), 9,40 (1H, т, J=6 Гц), 7,57 (2H, д, J=8 Гц), 7,51 (2H, д, J=8 Гц), 7,34 ( 2H, д, J=8 Гц), 7,00 (2H, д, J=8 Гц), 4,41 (2H, с), 4,00 (2H, д, J=6 Гц), 3,75 (2H, д, J=12 Гц), 3,29 (3H, с), 2,78 (2H, д, J=7 Гц), 2,71 (2H, т, J=12 Гц), 2,44 (3H, с), 2,15-2,05 (1H, м), 1,68 (2H, д, J=12 Гц), 1,37 (2H, дкв, J=12 Гц, 3 Гц).
(Пример 36)
({[2-({1-[2'-Фтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 119]
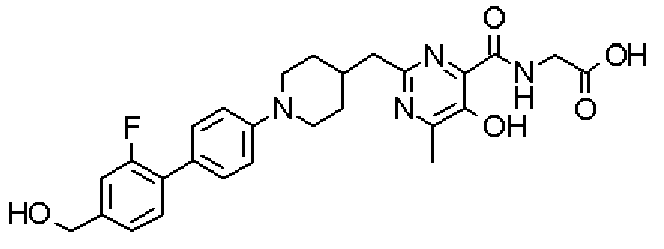
(1) трет-Бутил-5-(бензилокси)-2-{[1-(4-бромфенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-карбоксилат
[Химическая формула 120]
Согласно примеру 1-(9), но с применением 1,4-дибромбензола вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 18%) в виде оранжевого масла.
1H-ЯМР (500 МГц, CDCl3) δ: 7,46-7,35 (5H, м), 7,31 (2H, д, J=8 Гц), 6,80 (2H, д, J=8 Гц), 5,01 (2H, с), 3,62 (2H, д, J=12 Гц), 2,89 (2H, д, J=7 Гц), 2,69 (2H, т, J=12 Гц), 2,46 (3H, с), 2,15-2,03 (1 H, м), 1,77 (2H, д, J=12 Гц), 1,59 (9H, с), 1,51 (2H, кв, J=12 Гц).
(2) трет-Бутил-5-(бензилокси)-2-({1-[4'-({[трет-бутил(диметил)силил]окси}метил)-2'-фтордифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-карбоксилат
[Химическая формула 121]
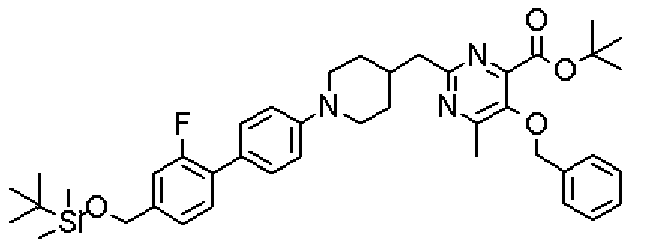
Согласно примеру 19-(2), но с применением трет-бутил-5-(бензилокси)-2-{[1-(4-бромфенил)пиперидин-4-ил]метил}-6-метилпиримидин-4-карбоксилата вместо трет-бутил-5-(бензилокси)-2-{[1-(5-бромпиридин-2-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-карбоксилата и [(4-бром-3-фторбензил)окси](трет-бутил)диметилсилана вместо трет-бутил-[(4-иодбензил)окси]диметилсилана, указанное в заголовке соединение получали (выход 16%) в виде бледно-желтого масла.
1H-ЯМР (500 МГц, CDCl3) δ: 7,48-7,35 (8H, м), 7,14-7,08 (2H, м), 6,99 (2H, д, J=8 Гц), 5,01 (2H, с), 4,75 (2H, с), 3,74 (2H, д, J=12 Гц), 2,91 (2H, д, J=7 Гц), 2,76 (2H, т, J=12 Гц), 2,47 (3H, с), 2,17-2,06 (1H, м), 1,79 (2H, д, J=12 Гц), 1,58 (9H, с), 1,54 (2H, кв, J=12 Гц), 0,96 (9H, с), 0,12 (6H, с).
(3) ({[2-({1-[2'-Фтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Согласно примерам 1-(10), 1-(11), 22-(4) и 1-(13), но с применением трет-бутил-5-(бензилокси)-2-({1-[4'-({[трет-бутил(диметил)силил]окси}метил)-2'-фтордифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-карбоксилата вместо трет-бутил-5-(бензилокси)-2-({1-[4'-({[трет-бутил(диметил)силил]окси}метил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-карбоксилата, указанное в заголовке соединение получали (выход 37%) в виде белого твердого вещества.
МС m/z: 509 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,91 (1H, шир.с), 11,92 (1H, с), 9,43 (1H, т, J=5 Гц), 7,42 (1H, т, J=9 Гц), 7,39 (2H, д, J=8 Гц), 7,20-7,15 (2H, м), 7,01 (2H, д, J=8 Гц), 5,33 (1H, шир.с), 4,52 (2H, с), 4,00 (2H, д, J=5 Гц), 3,75 (2H, д, J=12 Гц), 2,78 (2H, д, J=7 Гц), 2,71-2,63 (2H, м), 2,45 (3H, с), 2,16-2,06 (1H, м), 1,69 (2H, д, J=12 Гц), 1,36 (2H, дкв, J=12 Гц, 3 Гц).
(Пример 37)
({[2-({1-[3'-Фтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 122]
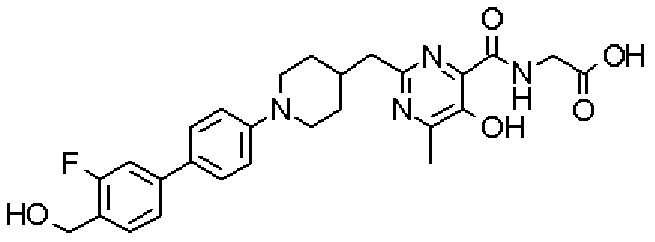
Согласно примерам 36-(2), 1-(10), 1-(11), 22-(4) и 1-(13), но с применением [(4-бром-2-фторбензил)окси](трет-бутил)диметилсилана вместо [(4-бром-3-фторбензил)окси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 12%) в виде бледно-красного твердого вещества.
МС m/z: 509 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,91 (1H, шир.с), 11,92 (1H, с), 9,43 (1H, т, J=5 Гц), 7,55 (2H, д, J=8 Гц), 7,50-7,41 (2H, м), 7,38 (1H, д, J=12 Гц), 6,99 (2H, д, J=8 Гц), 5,26 (1H, шир.с), 4,54 (2H, д, J=4 Гц), 4,00 (2H, д, J=5 Гц), 3,76 (2H, д, J=12 Гц), 2,78 (2H, д, J=7 Гц), 2,77-2,67 (2H, м), 2,45 (3H, с), 2,18-2,06 (1H, м), 1,69 (2H, д, J=12 Гц), 1,36 (2H, дкв, J=12 Гц, 3 Гц).
(Пример 38)
({[2-({1-[2-Фтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 123]
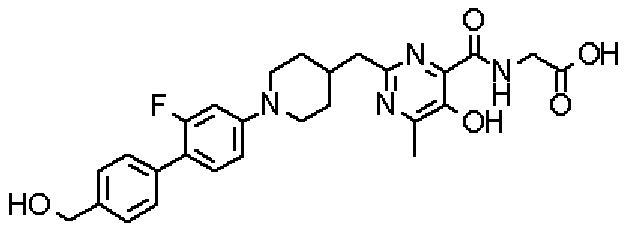
(1) [(4'-Бром-2'-фтордифенил-4-ил)метокси](трет-бутил)диметилсилан
[Химическая формула 124]
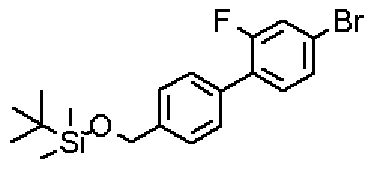
Согласно примеру 4-(2), но с применением трет-бутил-[(4-иодбензил)окси]диметилсилана вместо трет-бутил-[2-(4-иодфенил)этокси]диметилсилана и (4-бром-2-фторфенил)бороновой кислоты вместо (4-бромфенил)бороновой кислоты, указанное в заголовке соединение получали (выход 57%) в виде желтого масла.
1H-ЯМР (500 МГц, CDCl3) δ: 7,48 (2H, д, J=7 Гц), 7,40 (2H, д, J=7 Гц), 7,38-7,27 (3H, м), 4,79 (2H, с), 0,97 (9H, с), 0,12 (6H, с).
(2) ({[2-({1-[2-Фтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Согласно примерам от 1-(9) до 1-(11), 22-(4) и 1-(13), но с применением [(4'-бром-2'-фтордифенил-4-ил)метокси](трет-бутил)диметилсилана вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 19%) в виде белого твердого вещества.
МС m/z: 509 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,91 (1H, шир.с), 11,92 (1H, с), 9,43 (1H, т, J=5 Гц), 7,43 (2H, д, J=8 Гц), 7,35 (2H, д, J=8 Гц), 7,33 ( 1H, д, J=8Гц), 6,86-6,77 (2H, м), 5,21 (1H, шир.с), 4,51 (2H, с), 4,00 (2H, д, J=5 Гц), 3,78 (2H, д, J=12 Гц), 2,77 (2H, д, J=7 Гц), 2,77-2,70 (2H, м), 2,44 (3H, с), 2,17-2,06 (1H, м), 1,66 (2H, д, J=12 Гц), 1,34 (2H, дкв, J=12 Гц, 3 Гц).
(Пример 39)
({[2-({1-[3-Фтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 125]
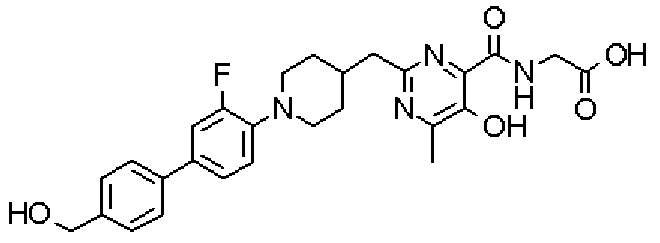
(1) [(4'-Бром-3'-фтордифенил-4-ил)метокси](трет-бутил)диметилсилан
[Химическая формула 126]
Согласно примеру 4-(2), но с применением трет-бутил-[(4-иодбензил)окси]диметилсилана вместо трет-бутил-[2-(4-иодфенил)этокси]диметилсилана и (4-бром-3-фторфенил)бороновой кислоты вместо (4-бромфенил)бороновой кислоты, указанное в заголовке соединение получали (выход 73%) в виде белого твердого вещества.
1H-ЯМР (500 МГц, CDCl3) δ: 7,59 (1H, т, J=6 Гц), 7,52 (2H, д, J=7 Гц), 7,40 (2H, д, J=7 Гц), 7,35 (1H, д, J=11 Гц), 7,25 (1H, д, J=6 Гц), 4,79 (2H, с), 0,97 (9H, с), 0,12 (6H, с).
(2) ({[2-({1-[3-Фтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Согласно примерам от 1-(9) до 1-(11), 22-(4) и 1-(13), но с применением [(4'-бром-3'-фтордифенил-4-ил)метокси](трет-бутил)диметилсилана вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 5,2%) в виде белого твердого вещества.
МС m/z: 509 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,91 (1H, шир.с), 11,93 (1H, с), 9,42 (1H, т, J=5 Гц), 7,60 (2H, д, J=8 Гц), 7,47-7,39 (2H, м), 7,36 (2H, д, J=8 Гц), 7,09 (1H, т, J=9 Гц), 5,22 (1H, т, J=5 Гц), 4,51 (2H, д, J=5 Гц), 4,00 (2H, д, J=5 Гц), 3,36 (2H, д, J=12 Гц), 2,81 (2H, д, J=7 Гц), 2,73-2,63 (2H, м), 2,45 (3H, с), 2,13-2,03 (1H, м), 1,71 (2H, д, J=12 Гц), 1,44 (2H, дкв, J=12 Гц, 3 Гц).
(Пример 40)
({[5-Гидрокси-2-({1-[4'-(гидроксиметил)-3'-метилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 127]
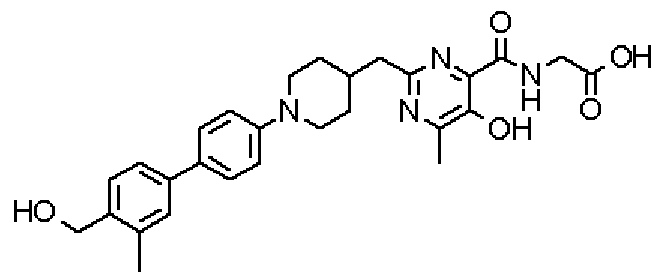
Согласно примерам 36-(2), 1-(10), 1-(11), 22-(4) и 1-(13), но с применением [(4-бром-2-метилбензил)окси](трет-бутил)диметилсилана вместо [(4-бром-3-фторбензил)окси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 15%) в виде белого твердого вещества.
МС m/z: 505 (М+Н)+;
1H-ЯМР (400 МГц, DMSO-d6) δ: 12,88 (1H, шир.с), 11,91 (1H, с), 9,38 (1H, т, J=6 Гц), 7,49 (2H, д, J=9 Гц), 7,37 (1H, д, J=9 Гц), 7,36 (1H, с), 7,35 (1H, д, J=9 Гц), 6,98 (2H, д, J=9 Гц), 5,02 (1H, шир.с), 4,49 (2H, д, J=3 Гц), 4,00 (2H, д, J=6 Гц), 3,73 (2H, д, J=12 Гц), 2,78 (2H, д, J=7 Гц), 2,70 (2H, дт, J=12 Гц, 3 Гц), 2,44 (3H, с), 2,29 (3H, с), 2,17-2,01 (1H, м), 1,69 (2H, д, J=12 Гц), 1,37 (2H, дкв, J=12 Гц, 3 Гц).
(Пример 41)
({[2-({1-[3',5'-Дифтор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 128]
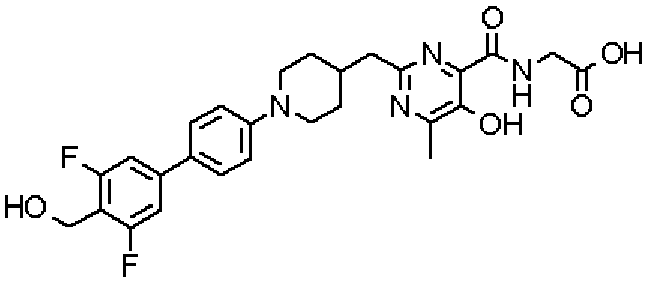
Согласно примерам 36-(2), 1-(10), 1-(11), 22-(4) и 1-(13), но с применением [(4-бром-2,6-дифторбензил)окси](трет-бутил)диметилсилана вместо [(4-бром-3-фторбензил)окси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 9%) в виде белого твердого вещества.
МС m/z: 527 (М+Н)+;
1H-ЯМР (400 МГц, DMSO-d6) δ: 12,86 (1H, шир.с), 11,90 (1H, с), 9,39 (1H, т, J=6 Гц), 7,60 (2H, д, J=9 Гц), 7,33 (2H, д, J=9 Гц), 6,99 (2H, д, J=9 Гц), 5,19 (1H, шир.с), 4,49 (2H, с), 4,01 (2H, д, J=6 Гц), 3,79 (2H, д, J=12 Гц), 2,78 (2H, д, J=7 Гц), 2,75 (2H, т, J=12 Гц), 2,44 (3H, с), 2,19-2,04 (1H, м), 1,68 (2H, д, J=12 Гц), 1,35 (2H, дкв, J=12 Гц, 3 Гц).
(Пример 42)
({[2-({1-[3',5'-Дихлор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 129]
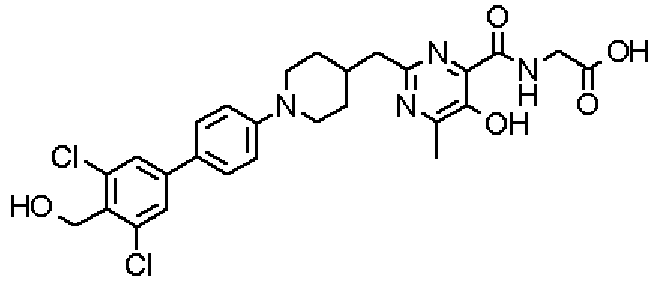
Согласно примерам 36-(2), 1-(10), 1-(11), 22-(4) и 1-(13), но с применением [(4-бром-2,6-дихлорбензил)окси](трет-бутил)диметилсилана вместо [(4-бром-3-фторбензил)окси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 15%) в виде белого твердого вещества.
МС m/z: 559 (М+Н)+;
1H-ЯМР (400 МГц, DMSO-d6) δ: 12,88 (1H, шир.с), 11,91 (1H, с), 9,40 (1H, т, J=6 Гц), 7,67 (2H, с), 7,60 (2H, д, J=9 Гц), 6,99 (2H, д, J=9 Гц), 5,18 (1H, т, J=4 Гц), 4,68 (2H, д, J=4 Гц), 4,01 (2H, д, J=6 Гц), 3,79 (2H, д, J=12 Гц), 2,78 (2H, д, J=7 Гц), 2,73 (2H, т, J=12 Гц), 2,44 (3H, с), 2,19-2,05 (1H, м), 1,68 (2H, д, J=12 Гц), 1,34 (2H, дкв, J=12 Гц, 3 Гц).
(Пример 43)
({[2-({1-[3',5'-Диметил-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-5-гидрокси-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 130]
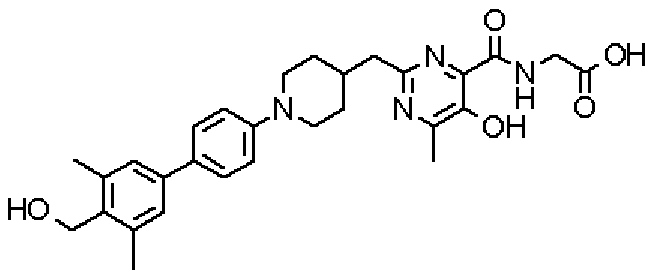
Согласно примерам 36-(2), 1-(10), 1-(11), 22-(4) и 1-(13), но с применением [(4-бром-2,6-диметилбензил)окси](трет-бутил)диметилсилана вместо [(4-бром-3-фторбензил)окси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 4%) в виде белого твердого вещества.
МС m/z: 519 (М+Н)+;
1H-ЯМР (400 МГц, DMSO-d6) δ: 12,87 (1H, шир.с), 11,90 (1H, с), 9,39 (1H, т, J=6 Гц), 7,48 (2H, д, J=9 Гц), 7,21 (2H, с), 6,97 (2H, д, J=9 Гц), 4,65 (1H, т, J=5 Гц), 4,49 (2H, д, J=5 Гц), 4,01 (2H, д, J=6 Гц), 3,72 (2H, д, J=12 Гц), 2,78 (2H, д, J=7 Гц), 2,70 (2H, дт, J=12 Гц, 3 Гц), 2,44 (3H, с), 2,39 (6H, с), 2,16-2,02 (1H, м), 1,68 (2H, д, J=12 Гц), 1,37 (2H, дкв, J=12 Гц, 3 Гц).
(Пример 44)
({[5-Гидрокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота-d2
[Химическая формула 131]
(1) Этил-({[5-(бензилокси)-2-{[1-(4'-формилдифенил-4-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил]карбонил}амино)ацетат
[Химическая формула 132]
Оксалилхлорид (0,31 г, 2,5 ммоль) растворяли в дихлорметане (5 мл) и по каплям при -78°С добавляли раствор диметилсульфоксида (0,18 г, 2,3 ммоль) в дихлорметане (4 мл) с последующим перемешиванием смеси при такой же температуре в течение 15 минут. К реакционному раствору по каплям добавляли раствор этил-({[5-(бензилокси)-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетата (1,0 г, 1,6 ммоль), полученного в примере 1-(11), в дихлорметане (26 мл) с последующим перемешиванием при такой же температуре в течение 25 минут и затем по каплям добавляли триэтиламин (1,1 мл, 8,2 ммоль) и температуру повышали до комнатной температуры на протяжении 1,5 часа. К реакционному раствору добавляли воду с последующей экстракцией смеси дихлорметаном и затем экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. После отгонки растворителя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Biotage Ltd., растворитель для элюирования: дихлорметан/этилацетат), получая при этом указанное в заголовке соединение (0,85 г, 1,4 ммоль) в виде желтого твердого вещества (выход 85%).
1H-ЯМР (400 МГц, CDCl3) δ: 10,01 (1H, с), 8,34 (1H, т, J=5 Гц), 7,90 (2H, д, J=8 Гц), 7,72 (2H, д, J=8 Гц), 7,57 (2H, д, J=9 Гц), 7,51-7,46 (2H, м), 7,42-7,33 (3H, м), 7,01 (2H, д, J=9 Гц), 5,12 (2H, с), 4,27 (2H, кв, J=7 Гц), 4,24 (2H, д, J=5 Гц), 3,79 (2H, д, J=12 Гц), 2,90 (2H, д, J=7 Гц), 2,83 (2H, дт, J=12 Гц, 3 Гц), 2,47 (3H, с), 2,23-2,07 (1H, м), 1,80 (2H, д, J=12 Гц), 1,53 (2H, дкв, J=12 Гц, 3 Гц), 1,32 (3H, т, J=7 Гц).
(2) Этил-({[5-(бензилокси)-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетат-d1
[Химическая формула 133]
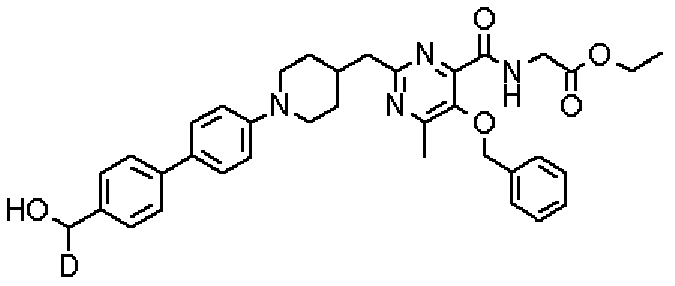
Этил-({[5-(бензилокси)-2-{[1-[4'-формилдифенил-4-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил]карбонил}амино)ацетат (0,85 г, 1,4 ммоль) растворяли в смешанном растворителе дейтерированного метанола (7,5 мл) и дихлорметана (7,5 мл) и при 0°С добавляли дейтерированный борогидрид натрия (0,059 г, 1,4 ммоль) с последующим перемешиванием смеси при такой же температуре в течение 45 минут. К реакционному раствору добавляли дейтерированную воду, растворитель отгоняли при пониженном давлении и затем образовавшийся остаток очищали хроматографией на колонке с силикагелем (Biotage Ltd., растворитель для элюирования: дихлорметан/этилацетат), получая при этом указанное в заголовке соединение (0,74 г, 1,2 ммоль) в виде белого твердого вещества (выход 87%).
1H-ЯМР (400 МГц, CDCl3) δ: 8,35 (1H, т, J=5 Гц), 7,55 (2H, д, J=8 Гц), 7,52-7,46 (2H, м), 7,50 (2H, д, J=9 Гц), 7,40 (2H, д, J=8 Гц), 7,38-7,35 (3H, м), 7,00 (2H, д, J=9 Гц), 5,12 (2H, с), 4,69 (1H, с), 4,26 (2H, кв, J=7 Гц), 4,24 (2H, д, J=5 Гц), 3,74 (2H, д, J=12 Гц), 2,90 (2H, д, J=7 Гц), 2,78 (2H, дт, J=12 Гц, 3 Гц), 2,46 (3H, с), 2,19-2,05 (1H, м), 1,79 (2H, д, J=12 Гц), 1,71 (1H, шир.с), 1,54 (2H, дкв, J=12 Гц, 3 Гц), 1,32 (3H, т, J=7 Гц).
(3) Этил-({[5-(бензилокси)-2-{[1-[4'-формилдифенил-4-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил]карбонил}амино)ацетат-d1
[Химическая формула 134]
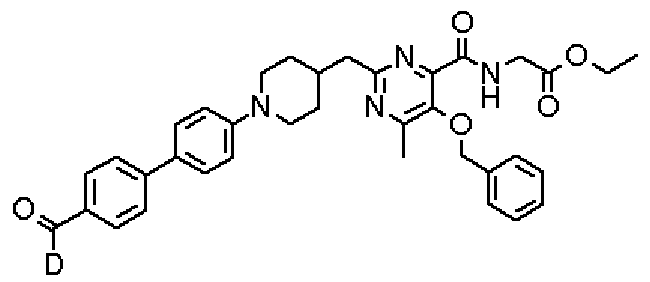
Согласно примеру 44-(1), но с применением этил-({[5-(бензилокси)-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетата-d1 вместо этил-({[5-(бензилокси)-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетата, указанное в заголовке соединение и этил-({[5-(бензилокси)-2-{[1-[4'-формилдифенил-4-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил]карбонил}амино)ацетат получали в виде смеси 5:1 (выход 87%).
1H-ЯМР (400 МГц, CDCl3) δ: 10,01 (0,2H, с), 8,34 (1H, т, J=5 Гц), 7,90 (2H, д, J=8 Гц), 7,72 (2H, д, J=8 Гц), 7,57 (2H, д, J=9 Гц), 7,51-7,46 (2H, м), 7,42-7,32 (3H, м), 7,01 (2H, д, J=9 Гц), 5,12 (2H, с), 4,27 (2H, кв, J=7 Гц), 4,24 (2H, д, J=5 Гц), 3,80 (2H, д, J=12 Гц), 2,90 (2H, д, J=7 Гц), 2,83 (2H, дт, J=12 Гц, 3 Гц), 2,47 (3H, с), 2,22-2,08 (1H, м), 1,79 (2H, д, J=12 Гц), 1,53 (2H, дкв, J=12 Гц, 3 Гц), 1,32 (3H, т, J=7 Гц).
(4) Этил-({[5-(бензилокси)-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетат-d2
[Химическая формула 135]
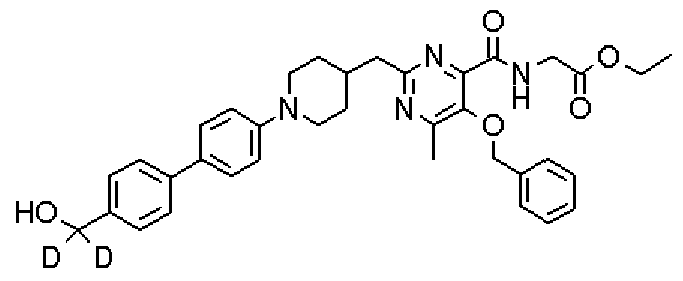
Операции примеров 44-(2) и 44-(3) повторяли дважды с применением этил-({[5-(бензилокси)-2-{[1-[4'-формилдифенил-4-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил]карбонил}амино)ацетата-d1 и затем проводили операцию примера 44-(2), получая при этом указанное в заголовке соединение (выход 51%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 8,35 (1H, т, J=5 Гц), 7,56 (2H, д, J=8 Гц), 7,52-7,46 (2H, м), 7,50 (2H, д, J=9 Гц), 7,40 (2H, д, J=8 Гц), 7,42-7,33 (3H, м), 7,00 (2H, д, J=9 Гц), 5,12 (2H, с), 4,27 (2H, кв, J=7 Гц), 4,24 (2H, д, J=5 Гц), 3,74 (2H, д, J=12 Гц), 2,90 (2H, д, J=7 Гц), 2,78 (2H, дт, J=12 Гц, 2 Гц), 2,47 (3H, с), 2,20-2,05 (1H, м), 1,79 (2H, д, J=12 Гц), 1,64-1,49 (3H, м), 1,32 (3H, т, J=7 Гц).
(5) ({[5-Гидрокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота-d2
Согласно примерам 22-(4) и 1-(13), но с применением этил-({[5-(бензилокси)-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетата-d2 вместо этил-({[5-(бензилокси)-2-({1-[2-хлор-4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетата и дейтерированной трифторуксусной кислоты, метанола, водного раствора гидроксида натрия и хлористоводородной кислоты, указанное в заголовке соединение получали (выход 80%) в виде желтовато-белого твердого вещества.
МС m/z: 493 (М+Н)+;
1H-ЯМР (400 МГц, DMSO-d6) δ: 12,88 (1H, шир.с), 11,91 (1H, с), 9,38 (1H, т, J=5 Гц), 7,54 (2H, д, J=9 Гц), 7,50 (2H, д, J=9 Гц), 7,34 (2H, д, J=9 Гц), 6,99 (2H, д, J=9 Гц), 5,10 (1H, с), 4,00 (2H, д, J=5 Гц), 3,73 (2H, д, J=12 Гц), 2,78 (2H, д, J=7 Гц), 2,71 (2H, дт, J=12 Гц, 3 Гц), 2,44 (3H, с), 2,19-2,02 (1H, м), 1,69 (2H, д, J=12 Гц), 1,37 (2H, дкв, J=12 Гц, 3 Гц).
(Пример 45)
[({5-Гидрокси-2-[(1-{4'-[(2S)-2-гидроксипропил]дифенил-4-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 136]
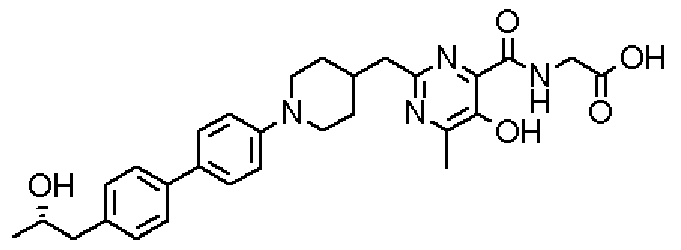
(1) (2S)-1-(4'-Бромдифенил-4-ил)пропан-2-ол
[Химическая формула 137]
Раствор н-бутилмагнийхлорида в тетрагидрофуране (2 М, 0,40 мл, 0,80 ммоль) разбавляли тетрагидрофураном (1 мл) и в атмосфере азота при 0°С добавляли раствор н-бутиллития в гексане (2,8 М, 0,57 мл, 1,6 ммоль) с последующим перемешиванием при такой же температуре в течение 10 минут, получая при этом раствор три-н-бутилмагнийлития в тетрагидрофуране.
4,4'-Дибромдифенил (0,62 г, 2,0 ммоль) растворяли в тетрагидрофуране (5 мл) и в атмосфере азота при 0°С добавляли раствор три-н-бутилмагнийлития в тетрагидрофуране, смесь перемешивали при такой же температуре в течение 1 часа с последующим добавлением (2S)-2-метилоксирана (0,15 мл, 2,2 ммоль). Температуру реакционного раствора повышали до комнатной температуры с последующим перемешиванием в течение 30 минут и затем добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией смеси этилацетатом. После отгонки растворителя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,40 (гексан/этилацетат=2/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,23 г, 0,79 ммоль) в виде белого твердого вещества (выход 39%).
Спектр 1Н ЯМР был таким же, как в примере 5-(3).
(2) [(1S)-2-(4'-Бромдифенил-4-ил)-1-метилэтокси](трет-бутил)диметилсилан
[Химическая формула 138]
(2S)-1-(4'-Бромдифенил-4-ил)пропан-2-ол (0,23 г, 0,79 ммоль) и имидазол (0,11 г, 1,6 ммоль) растворяли в N,N-диметилформамиде (5 мл) и в атмосфере азота добавляли трет-бутилдиметилхлорсилан (0,24 г, 1,6 ммоль) с последующим перемешиванием смеси при комнатной температуре в течение 1 часа. К реакционному раствору добавляли диэтиловый простой эфир с последующим последовательным промыванием водой и хлористоводородной кислотой (1 М). После отгонки растворителя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Moritex Corporation, растворитель для элюирования: гексан/этилацетат) и фракцию, соответствующую величине Rf=0,80 (гексан/этилацетат=10/1) тонкослойной хроматографии, концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение (0,25 г, 0,62 ммоль) в виде белого твердого вещества (выход 78%).
Спектр 1Н ЯМР был таким же, как в примере 5-(4).
(3) [({5-Гидрокси-2-[(1-{4'-[(2S)-2-гидроксипропил]дифенил-4-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
Согласно примерам от 1-(9) до 1-(13), но с применением [(1S)-2-(4'-бромдифенил-4-ил)-1-метилэтокси](трет-бутил)диметилсилана вместо [(4'-бромдифенил-4-ил)метокси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 37%) в виде белого твердого вещества.
[α]D 20 +8,9° (с=1,00, ДМФА).
Спектры МС и 1Н ЯМР были такими же, как в примере 5-(5).
(Пример 46)
[({5-Гидрокси-2-[(1-{4'-[(2R)-2-гидроксипропил]дифенил-4-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 139]
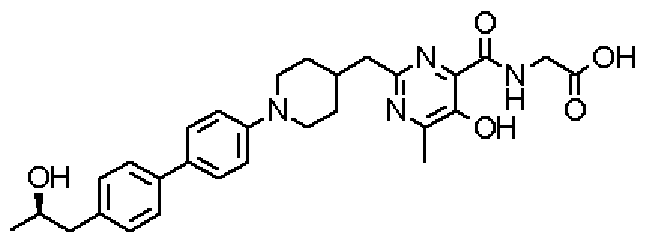
Согласно примерам от 45-(1) до 45-(3), но с применением (2R)-2-метилоксирана вместо (2S)-2-метилоксирана, указанное в заголовке соединение получали (выход 18%) в виде белого твердого вещества.
[α]D 20 -8,9° (с=1,00, ДМФА).
Спектры МС и 1Н ЯМР были такими же, как в примере 5-(5).
(Пример 47)
[({5-Гидрокси-2-[(1-{4'-[(2S)-2-гидроксибутил]дифенил-4-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 140]
Согласно примерам от 45-(1) до 45-(3), но с применением (2S)-2-этилоксирана вместо (2S)-2-метилоксирана, указанное в заголовке соединение получали (выход 8,2%) в виде белого твердого вещества.
[α]D 19 +14,3° (с=1,00, ДМФА).
Спектры МС и 1Н ЯМР были такими же, как в примере 27.
(Пример 48)
[({5-Гидрокси-2-[(1-{4'-[(2R)-2-гидроксибутил]дифенил-4-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 141]
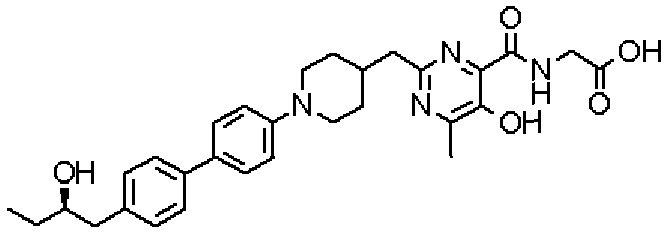
Согласно примерам от 45-(1) до 45-(3), но с применением (2R)-2-этилоксирана вместо (2S)-2-метилоксирана, указанное в заголовке соединение получали (выход 8,2%) в виде белого твердого вещества.
[α]D 20 -14,3° (с=1,00, ДМФА).
Спектры МС и 1Н ЯМР были такими же, как в примере 27.
(Пример 49)
[({5-Гидрокси-2-[(1-{4'-[(2R)-2-гидрокси-3-метоксипропил]дифенил-4-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 142]
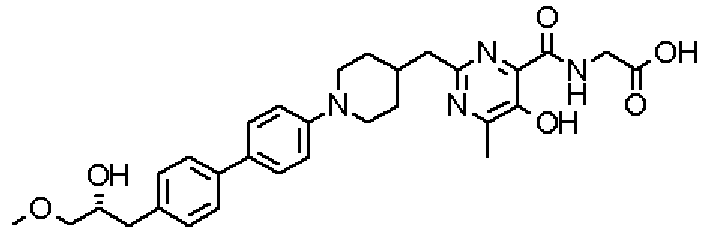
Согласно примерам от 45-(1) до 45(3), но с применением (2R)-2-(метоксиметил)оксирана вместо (2S)-2-метилоксирана, указанное в заголовке соединение получали (выход 6,6%) в виде белого твердого вещества.
[α]D 20 +6,5° (с=1,00, ДМФА).
МС m/z: 549 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,87 (1H, шир.с), 11,91 (1H, с), 9,40 (1H, т, J=5 Гц), 7,48 (2H, д, J=9 Гц), 7,47 (2H, д, J=9 Гц), 7,23 (2H, д, J=8 Гц), 6,99 (2H, д, J=8 Гц), 4,75 (1H, шир.с), 4,00 (2H, д, J=5 Гц), 3,83-3,73 (1H, м), 3,73 (2H, д, J=12 Гц), 3,26 (3H, с), 3,23 (2H, д, J=5 Гц), 2,78 (2H, д, J=7 Гц), 2,74-2,67 (2H, м), 2,63 (2H, д, J=6 Гц), 2,44 (3H, с), 2,15-2,03 (1H, м), 1,68 (2H, д, J=12 Гц), 1,36 (2H, дкв, J=12 Гц, 3 Гц).
(Пример 50)
[({5-Гидрокси-2-[(1-{4'-[(2S)-2-гидрокси-3-метоксипропил]дифенил-4-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 143]
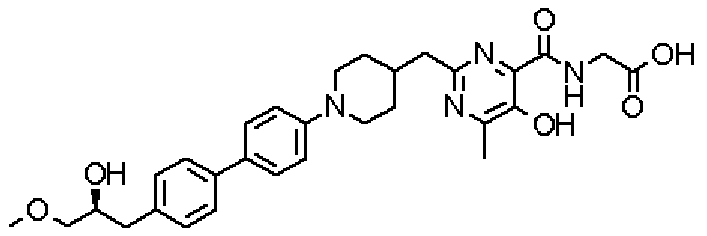
Согласно примерам от 45-(1) до 45(3), но с применением (2S)-2-(метоксиметил)оксирана вместо (2S)-2-метилоксирана, указанное в заголовке соединение получали (выход 9,4%) в виде белого твердого вещества.
[α]D 21 -6,7° (с=1,00, ДМФА).
Спектры МС и 1Н ЯМР были такими же, как в примере 49.
(Пример 51)
({[5-Гидрокси-2-({1-[4'-(3-гидроксипропил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 144]
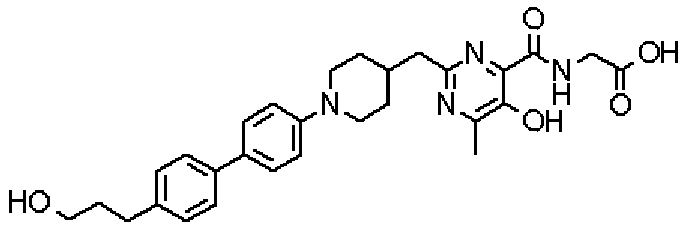
Согласно примерам 36-(2) и от 1-(10) до 1-(13), но с применением [3-(4-бромфенил)пропокси](трет-бутил)диметилсилана вместо [(4-бром-3-фторбензил)окси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 9%) в виде бледно-желтовато-белого твердого вещества.
МС m/z: 519 (М+ + Н);
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,88 (1H, шир.с), 11,91 (1H, с), 9,40 (1H, т, J=6 Гц), 7,49 (2H, д, J=8 Гц), 7,48 (2H, д, J=8 Гц), 7,22 (2H, д, J=8 Гц), 6,98 (2H, д, J=8 Гц), 4,47 (1H, т, J=6 Гц), 4,01 (2H, д, J=6 Гц), 3,73 (2H, д, J=12 Гц), 3,43 (2H, кв, J=6 Гц), 2,78 (2H, д, J=7 Гц), 2,70 (2H, т, J=12 Гц), 2,61 (2H, т, J=7 Гц), 2,44 (3H, с), 2,14-2,04 (1H, м), 1,76-1,65 (4H, м), 1,37 (2H, дкв, J=12 Гц, 3 Гц).
(Пример 52)
({[5-Гидрокси-2-({1-[4'-(гидроксиметил)-3'-изопропилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
[Химическая формула 145]
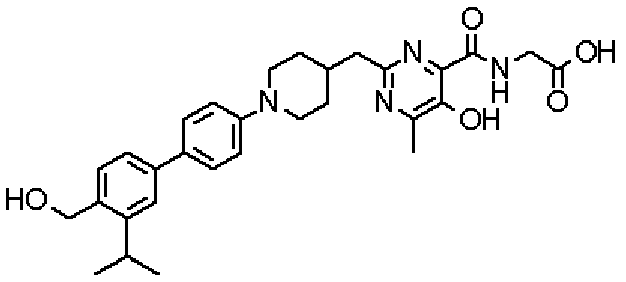
(1) 2-[5-Бром-2-({[трет-бутил(диметил)силил]окси}метил)фенил]пропан-2-ол
[Химическая формула 146]
2-[5-Бром-2-(гидроксиметил)фенил]пропан-2-ол (1,1 г, 4,4 ммоль) и имидазол (0,78 г, 12 ммоль) растворяли в N,N-диметилформамиде (5 мл) и добавляли трет-бутилдиметилхлорсилан (0,86 г, 5,7 ммоль) с последующим перемешиванием смеси при комнатной температуре на протяжении ночи. К реакционному раствору добавляли воду с последующей экстракцией гексаном и затем экстракт последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. После концентрирования органического слоя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Biotage Ltd., растворитель для элюирования: гексан/этилацетат), получая при этом указанное в заголовке соединение (1,1 г, 3,1 ммоль) в виде бесцветного масла (выход 70%).
1H-ЯМР (400 МГц, CDCl3) δ: 7,43 (1Н, д, J=2 Гц), 7,31 (1Н, дд, J=8,2 Гц), 7,16 (1H, д, J=8 Гц), 4,93 (2H, с), 4,34 (1H, с), 1,61 (6H, с), 0,91 (9H, с), 0,11 (6H, с).
(2) [(4-Бром-2-изопропенилбензил)окси](трет-бутил)диметилсилан
[Химическая формула 147]
2-[5-Бром-2-({[трет-бутил(диметил)силил]окси}метил)-фенил]пропан-2-ол (0,79 г, 2,2 ммоль) растворяли в дихлорметане (7 мл) и к раствору последовательно по каплям при 0°С добавляли триэтиламин (0,61 мл, 4,4 ммоль) и метансульфонилхлорид (0,34 мл, 4,4 ммоль) с последующим перемешиванием смеси при комнатной температуре в течение 3 часов. К реакционному раствору добавляли воду, гексан и этилацетат с последующей экстракцией смеси гексаном. Экстракт промывали последовательно хлористоводородной кислотой (1 М), насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия.
После концентрирования органического слоя при пониженном давлении образовавшийся остаток растворяли в дихлорметане (12 мл) и добавляли 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) (3,3 мл, 22 ммоль) с последующим перемешиванием смеси при комнатной температуре на протяжении ночи. Реакционный раствор концентрировали при пониженном давлении и добавляли воду и гексан с последующей экстракцией смеси гексаном. Экстракт последовательно промывали хлористоводородной кислотой (1 М), насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. После отгонки растворителя при пониженном давлении образовавшийся остаток очищали хроматографией на колонке с силикагелем (Biotage Ltd., растворитель для элюирования: гексан), получая при этом указанное в заголовке соединение (0,56 г, 1,6 ммоль) в виде бесцветного масла (выход 74%).
1H-ЯМР (400 МГц, CDCl3) δ: 7,39 (1H, д, J=9 Гц), 7,38 (1H, д, J=9 Гц), 7,25 (1H, шир.с), 5,21 (1H, с), 4,84 (1H, с), 4,65 (2H, с), 2,01 (3H, с), 0,92 (9H, с), 0,08 (6H, с).
(3) трет-Бутил-5-(бензилокси)-2-({1-[4'-(гидроксиметил)-3'-изопропенилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-карбоксилат
[Химическая формула 148]
Согласно примерам 36-(2) и 18-(6), но с применением [(4-бром-2-изопропенилбензил)окси](трет-бутил)диметилсилана вместо [(4-бром-3-фторбензил)окси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 72%) в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ: 7,52-7,33 (8H, м), 7,49 (2H, д, J=9 Гц), 6,99 (2H, д, J=9 Гц), 5,28-5,23 (1H, м), 5,01 (2H, с), 4,97-4,93 (1H, м), 4,71 (2H, с), 3,73 (2H, д, J=12 Гц), 2,91 (2H, д, J=7 Гц), 2,75 (2H, дт, J=12 Гц, 3 Гц), 2,46 (3H, с), 2,17-2,06 (4H, м), 1,80 (2H, д, J=12 Гц), 1,74 (1H, шир.с), 1,59 (9H, с), 1,53 (2H, дкв, J=12 Гц, 3 Гц).
(4) Этил-({[5-(бензилокси)-2-({1-[4'-(гидроксиметил)-3'-изопропенилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетат
[Химическая формула 149]
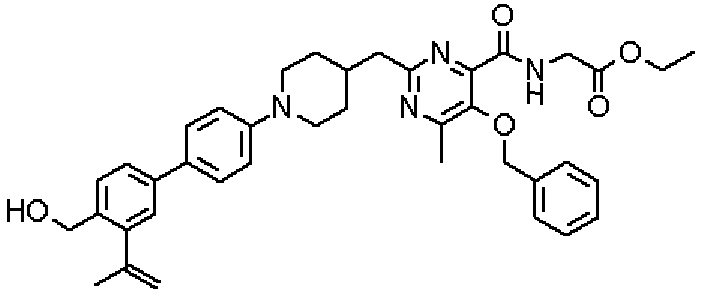
Согласно примеру 1-(11), но с применением трет-бутил-5-(бензилокси)-2-({1-[4'-(гидроксиметил)-3'-изопропенилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-карбоксилата вместо трет-бутил-5-(бензилокси)-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-карбоксилата, указанное в заголовке соединение получали (выход 83%) в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ: 8,36 (1H, т, J=5 Гц), 7,53-7,45 (6H, м), 7,41-7,30 (4H, м), 6,99 (2H, д, J=9 Гц), 5,28-5,23 (1H, м), 5,12 (2H, с), 4,97-4,94 (1H, м), 4,72 (2H, д, J=4 Гц), 4,27 (2H, кв, J=7 Гц), 4,25 (2H, д, J=5 Гц), 3,74 (2H, д, J=12 Гц), 2,90 (2H, д, J=7 Гц), 2,78 (2H, дт, J=12 Гц, 3 Гц), 2,47 (3H, с), 2,17-2,07 (4H, м), 1,79 (2H, д, J=12 Гц), 1,74 (1H, шир.с), 1,54 (2H, дкв, J=12 Гц, 3 Гц), 1,32 (3H, т, J=7 Гц).
(5) Этил-({[5-гидрокси-2-({1-[4'-(гидроксиметил)-3'-изопропилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетат
[Химическая формула 150]
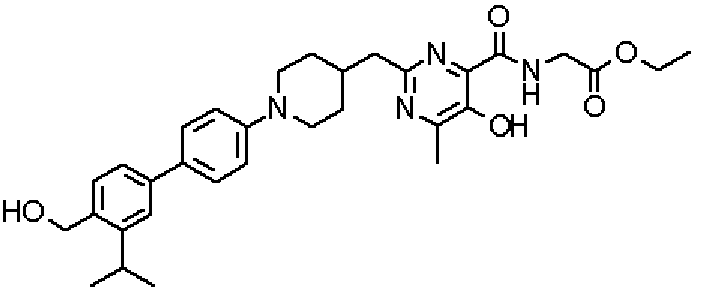
Этил-({[5-(бензилокси)-2-({1-[4'-(гидроксиметил)-3'-изопропенилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетат (0,094 г, 0,14 ммоль) растворяли в метаноле (3 мл) и добавляли комплекс палладий на активированном угле-этилендиамин (0,090 г) с последующим перемешиванием смеси при комнатной температуре в течение 2 часов в атмосфере водорода. Реакционный раствор фильтровали через целит, фильтрат концентрировали при пониженном давлении и затем образовавшийся остаток очищали хроматографией на колонке с силикагелем (Biotage Ltd., растворитель для элюирования: дихлорметан/этилацетат), получая при этом указанное в заголовке соединение (0,049 г, 0,088 ммоль) в виде желтовато-белого аморфного твердого вещества (выход 60%).
1H-ЯМР (400 МГц, CDCl3) δ: 11,37 (1Н, шир.с), 8,51 (1Н, т, J=5 Гц), 7,50 (1H, с), 7,49 (2H, д, J=9 Гц), 7,36 (2H, с), 7,00 (2H, д, J=9 Гц), 4,76 (2H, с), 4,28 (2H, кв, J=7 Гц), 4,22 (2H, д, J=5 Гц), 3,73 (2H, д, J=12 Гц), 3,38-3,25 (1H, м), 2,83 (2H, д, J=7 Гц), 2,76 (2H, дт, J=12 Гц, 3 Гц), 2,54 (3H, с), 2,14-1,99 (1H, м), 1,78 (2H, д, J=12 Гц), 1,74 (1H, шир.с), 1,52 (2H, дкв, J=12 Гц, 3 Гц), 1,33 (3H, т, J=7 Гц), 1,30 (6H, д, J=7 Гц).
(6) ({[5-Гидрокси-2-({1-[4'-(гидроксиметил)-3'-изопропилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)уксусная кислота
Согласно примеру 1-(13), но с применением этил-({[5-гидрокси-2-({1-[4'-(гидроксиметил)-3'-изопропилдифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетата вместо этил-({[5-гидрокси-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-ил]карбонил}амино)ацетата, указанное в заголовке соединение получали (выход 85%) в виде белого твердого вещества.
МС m/z: 533 (М+Н)+;
1H-ЯМР (400 МГц, DMSO-d6) δ: 12,88 (1H, с), 11,92 (1H, с), 9,41 (1H, т, J=6 Гц), 7,51 (2H, шир.с), 7,45 (1H, с), 7,36 (2H, шир.с), 7,02 (2H, шир.с), 4,56 (2H, с), 4,01 (2H, д, J=6 Гц), 3,72 (2H, д, J=12 Гц), 3,28-3,15 (1H, м), 2,87-2,62 (2H, м), 2,80 (2H, д, J=7 Гц), 2,45 (3H, с), 2,12 (1H, шир.с), 1,80-1,61 (2H, м), 1,53-1,31 (2H, м), 1,23 (6H, д, J=7 Гц).
(Пример 53)
[({2-[(1-{5-[3-Фтор-4-(гидроксиметил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 151]
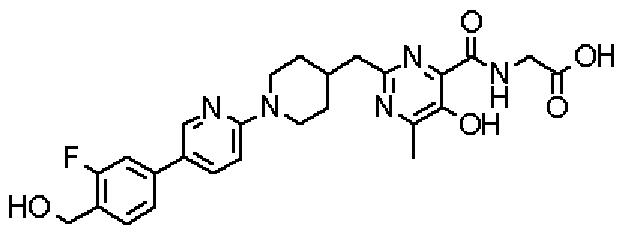
Согласно примеру 1-(11), но с применением трет-бутил-5-(бензилокси)-2-{[1-(5-бромпиридин-2-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-карбоксилата (1,8 г, 3,2 ммоль), полученного в примере 19-(1), вместо трет-бутил-5-(бензилокси)-2-({1-[4'-(гидроксиметил)дифенил-4-ил]пиперидин-4-ил}метил)-6-метилпиримидин-4-карбоксилата, этил-({[5-(бензилокси)-2-{[1-(5-бромпиридин-2-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил]карбонил}амино)ацетат получали (1,7 г, 2,9 ммоль) в виде бледно-желтого масла (выход 92%).
Согласно примерам 19-(2), 1-(10), 22-(4) и 1-(13), но с применением этил-({[5-(бензилокси)-2-{[1-(5-бромпиридин-2-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-ил]карбонил}амино)ацетата вместо трет-бутил-5-(бензилокси)-2-{[1-(5-бромпиридин-2-ил)пиперидин-4-ил]метил}-6-метилпиримидин-4-карбоксилата и [(4-бром-2-фторбензил)окси](трет-бутил)диметилсилана вместо трет-бутил-[(4-иодбензил)окси]диметилсилана, указанное в заголовке соединение получали (выход 21%) в виде белого твердого вещества.
МС m/z: 510 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,87 (1H, шир.с), 11,92 (1H, с), 9,38 (1H, т, J=5 Гц), 8,46 (1H, д, J=3 Гц), 7,85 (1H, дд, J=9 Гц, 3 Гц), 7,50-7,40 (3H, м), 6,99 (1H, д, J=9 Гц), 5,25 (1H, т, J=6 Гц), 4,54 (2H, д, J=6 Гц), 4,33 (2H, д, J=13 Гц), 3,99 (2H, д, J=5 Гц), 2,85 (2H, т, J=13 Гц), 2,76 (2H, д, J=7 Гц), 2,44 (3H, с), 2,25-2,14 (1H, м), 1,66 (2H, д, J=13 Гц), 1,24 (2H, дкв, J=13 Гц, 3 Гц).
(Пример 54)
[({2-[(1-{5-[3-Хлор-4-(гидроксиметил)фенил]пиридин-2-ил}пиперидин-4-ил)метил]-5-гидрокси-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 152]
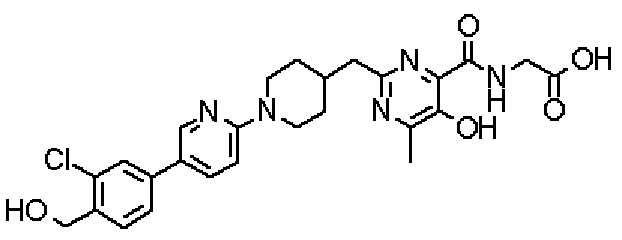
Согласно примеру 53, но с применением [(4-бром-2-хлорбензил)окси](трет-бутил)диметилсилана вместо [(4-бром-2-фторбензил)окси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 22%) в виде белого твердого вещества.
МС m/z: 526 (М+Н)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,89 (1H, шир.с), 11,92 (1H, с), 9,39 (1H, т, J=5 Гц), 8,46 (1H, д, J=3 Гц), 7,86 (1H, дд, J=9 Гц, 3 Гц), 7,66 (1H, с), 7,63-7,54 (2H, м), 6,90 (1H, д, J=9 Гц), 5,40 (1H, т, J=5 Гц), 4,57 (2H, д, J=5 Гц), 4,35 (2H, д, J=13 Гц), 4,00 (2H, д, J=5 Гц), 2,85 (2H, т, J=13 Гц), 2,77 (2H, д, J=7 Гц), 2,45 (3H, с), 2,25-2,16 (1H, м), 1,67 (2H, д, J=13 Гц), 1,25 (2H, дкв, J=13 Гц, 3 Гц).
(Пример 55)
[({5-Гидрокси-2-[(1-{5-[4-(гидроксиметил)-3-метилфенил]пиридин-2-ил}пиперидин-4-ил)метил]-6-метилпиримидин-4-ил}карбонил)амино]уксусная кислота
[Химическая формула 153]
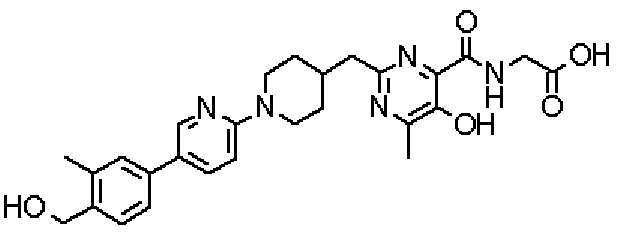
Согласно примеру 53, но с применением [(4-бром-2-метилбензил)окси](трет-бутил)диметилсилана вместо [(4-бром-2-фторбензил)окси](трет-бутил)диметилсилана, указанное в заголовке соединение получали (выход 18%) в виде белого твердого вещества.
MS m/z: 506 (M+H)+;
1H-ЯМР (500 МГц, DMSO-d6) δ: 12,89 (1H, шир.с), 11,91 (1H, с), 9,39 (1H, т, J=5 Гц), 8,41 (1H, д, J=2 Гц), 7,80 (1H, дд, J=9 Гц, 2 Гц), 7,41-7,35 (3H, м), 6,88 (1H, д, J=9 Гц), 5,05 (1H, т, J=5 Гц), 4,49 (2H, д, J=5 Гц), 4,32 (2H, д, J=13 Гц), 4,00 (2H, д, J=5 Гц), 2,83 (2H, т, J=13 Гц), 2,76 (2H, д, J=7 Гц), 2,44 (3H, с), 2,29 (3H, с), 2,24-2,14 (1H, м), 1,66 (2H, д, J=13 Гц), 1,24 (2H, дкв, J=13 Гц, 3 Гц).
Примеры препаратов
Пример 1 препарата (для инъекции)
1,5% масс. соединения примеров перемешивают в 10% об. пропиленгликоле, затем добавляют воду для инъекции для установления заданного объема и затем стерилизуют, получая при этом препарат для инъекции.
Пример 2 препарата (твердая капсула)
100 мг порошкообразного соединения примеров, 128,7 мг лактозы, 70 мг целлюлозы и 1,3 мг стеарата магния смешивали, пропускали через сито 60 меш и затем полученные порошки помещали в 250 мг желатиновую капсулу № 3, получая при этом капсулы.
Пример 3 препарата (таблетка)
100 мг порошкообразного соединения примеров, 124 мг лактозы, 25 мг целлюлозы и 1 мг стеарата магния смешивали и смесь таблетировали в таблеточной машине, получая при этом таблетки, причем каждая имела массу 200 мг. На таблетку, если необходимо, можно наносить покрытие.
Пример испытания
Фармакологическую активность соединений настоящего изобретения подтверждали указанным ниже испытанием.
Активность испытуемых соединений в отношении индуцирования in vitro эритропоэтина (ЕРО) оценивали с применением линии раковых клеток Hep3B печени человека (АТСС, Manassas, VA). Клетки Нер3В культивировали на протяжении ночи при 37°С в среде Игла, модифицированной по способу Дульбекко (DMEM), в присутствии 10% сыворотки плода коровы (FBS) (24-луночный планшет, 1,0×105 клеток/лунку). После замены указанной выше среды свежей DMEM (+10% FBS), содержащей испытуемое соединение, растворенное в 0,5% диметилсульфоксида (ДМСО) (полученной до концентрации 12,5 мкМ), или контроль в виде растворителя (0,5% ДМСО), клетки культивировали в течение 24 часов при 37°С. После выделения супернатанта культуры концентрацию ЕРО в супернатанте культуры количественно определяли с применением набора ELISA EPO человека (StemCell Technologies).
Концентрацию ЕРО в случае применения соединения каждого примера в качестве испытуемого соединения выражали как кратное число концентрации ЕРО в контроле. Результаты показаны в таблице 1. Концентрация ЕРО в случае применения соединения каждого примера значительно увеличивалась по сравнению с концентрацией ЕРО контроля (растворителя). То есть соединения настоящего изобретения демонстрировали превосходную, повышающую продуцирование ЕРО активность и являются применимыми в качестве лекарственного средства (в частности, лекарственного средства для профилактики или лечения анемии).

Промышленная применимость
Соединение настоящего изобретения, его фармакологически приемлемый сложный эфир или его фармакологически приемлемая соль обладает превосходной, повышающей продуцирование ЕРО активностью и является применимым для заболеваний или тому подобного, вызванных пониженным продуцированием ЕРО. В частности, соединение настоящего изобретения, его фармакологически приемлемый сложный эфир или его фармакологически приемлемая соль является применимой в качестве лекарственного средства для профилактики и/или лечения анемии, предпочтительно нефрогенной анемии, анемии недоношенности, анемии, сопутствующей хроническим заболеваниям, анемии, сопутствующей химиотерапии рака, раковой анемии, анемии, связанной с воспалением, или анемии, сопутствующей застойной сердечной недостаточности, более предпочтительно анемии, сопутствующей хроническому заболеванию почек, а также может применяться в качестве лекарственного средства для профилактики и/или лечения ишемического цереброваскулярного заболевания.