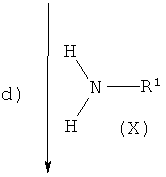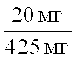Результат интеллектуальной деятельности: АЗАЦИКЛИЧЕСКИЕ СПИРО-СОЕДИНЕНИЯ
Вид РИД
Изобретение
Настоящее изобретение относится к новым производным азациклических спиро-соединений, которые можно применять как ингибиторы гормончувствительной липазы (HSL) для лечения диабета.
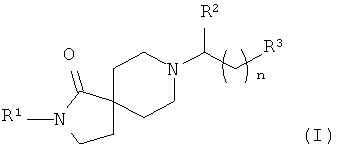
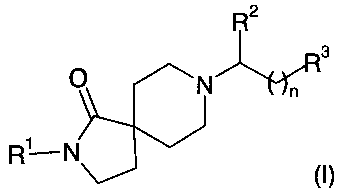
В частности, изобретение относится к соединениям формулы (I)
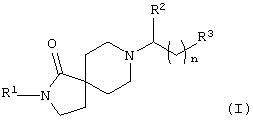
в которых
R1 - это замещенный фенил, который содержит от одного до трех заместителей, независимо выбранных из группы, включающей алкил, циклоалкил, галоалкил, гидрокси, алкокси, гидроксиалкокси, алкоксиалкокси и галоалкокси, и который может дополнительно содержать заместители, независимо выбранные из галогена;
R2 - это водород, алкил, циклоалкил, фенил, фенилалкил, замещенный фенил или замещенный фенилалкил, причем замещенный фенил и замещенный фенилалкил содержат от одного до трех заместителей, независимо выбранных из группы, включающей алкил, циклоалкил, галоген, галоалкил, гидрокси, алкокси, гидроксиалкокси, алкоксиалкокси и галоалкокси;
R3 - это -R4, -C(OH)R5R6 или -C(O)NR7R8;
R4 - это фенил, фенилкарбонил, фенилалкил, замещенный фенил, замещенный фенилкарбонил или замещенный фенилалкил, причем указанные замещенный фенил, замещенный фенилкарбонил и замещенный фенилалкил содержат от одного до трех заместителей, независимо выбранных из группы, включающей алкил, циклоалкил, галоген, галоалкил, гидрокси, алкокси, гидроксиалкокси, алкоксиалкокси и галоалкокси;
один из R5 и R6 - это водород, алкил или циклоалкил, а другой из них - это аминокарбонил, фенил, фенилалкил, замещенный фенил или замещенный фенилалкил, причем замещенный фенил и замещенный фенилалкил содержат от одного до трех заместителей, независимо выбранных из группы, включающей алкил, циклоалкил, галоген, галоалкил, гидрокси, алкокси, гидроксиалкокси, алкоксиалкокси и галоалкокси;
один из R7 и R8 - это водород, алкил, циклоалкил, гидроксиалкил или алкоксиалкил, а другой из них - это алкил, циклоалкил, гидроксиалкил, алкоксиалкил, фенил, фенилалкил, замещенный фенил или замещенный фенилалкил, причем указанные замещенный фенил и замещенный фенилалкил содержат от одного до трех заместителей, независимо выбранных из группы, включающей алкил, циклоалкил, галоген, галоалкил, гидрокси, алкокси, гидроксиалкокси, алкоксиалкокси и галоалкокси;
или же R7 и R8 совместно с атомом азота, к которому они присоединены, образуют пирролидинил, пиперидинил, азепанил, пиперидазинил, морфолинил или тиоморфолинил;
n равно нулю или 1;
или же к их фармацевтически приемлемым солям.
Главная физиологическая роль белой жировой ткани (WAT) - поставлять энергию, когда в ней нуждаются другие ткани. У млекопитающих белая жировая ткань является главным энергетическим депо, аккумулирующим запасы топлива в форме триацилглицерина (TAG) в периоды избытка энергии (Wang М. et al., Спет.Biol., 2006, 13, 1019-1027; Gregoire F.M. et al., Physiol. Rev., 1998, 78, 783-809). При этом, в отличие от синтеза TAG, который в больших количествах осуществляется также и в печени с целью продукции липопротеинов очень низкой плотности (VLDL), липолиз с целью запасания жирных кислот в качестве источника энергии, потребляемой другими органами, характерен только для адипоцитов. Высвобождение свободных жирных кислот (FFA) является регулируемым и упорядоченным процессом (Unger R.H, Annu. Rev. Med. 2002, 53, 319-336; Duncan RE. et al, 2007, Annu Rev Nutr, 27, 79-101; Jaworski K. et al, 2007, Am J Physiol Gastrointest Liver Physiol, 293, G1-4), стимулируется катехоламинами и регулируется гормонами, такими как инсулин, глюкагон и эпинефрин.
Наиболее важным ферментом белой жировой ткани, который, как полагают, отвечает за гормонально регулируемый гидролиз триглицерида, является гормончувствительная липаза (HSL). Этот фермент присутствует также в печени, скелетных мышцах, поджелудочной железе и надпочечниках. В базальном состоянии пациента этот фермент обладает минимальной активностью по отношению к своему субстрату. Стимуляция адипоцитов гормонами активирует протеинкиназу A, что приводит к фосфорилированию HSL и белка перилипина, обволакивающего липидную каплю. Фосфорилирование перилипина приводит к тому, что белок уходит с поверхности липидной капли, а фосфорилированная HSL мигрирует из цитозоля в липидную каплю, где она катализирует гидролиз триглицеридов (Wang М. etal., Chem. Biol., 2006, 13, 1019-1027).
Нарушение регуляции липолиза в адипоцитах, приводящее к повышению уровня циркулирующих неэстерифицированных жирных кислот (NEFA), взаимосвязано с ожирением и сопутствующими заболеваниями, включая развитие диабета 2 типа (linger R.H, Annu. Rev. Med. 2002, 53, 319-336). Для тучных или инсулинрезистентных пациентов характерны увеличенные депо висцеральной жировой ткани. Эти депо содержат повышенные количества белка HSL (Large, V. et al., 1998, J. Lipid. Res.39, 1688-1695) и характеризуются повышенной липолитической активностью, поскольку они устойчивы к инсулин-опосредованному подавлению липолиза. Это приводит к повышению уровня свободных жирных кислот в плазме крови, что еще больше усиливает инсулиновую резистентность из-за накопления триглицеридов в тканях, отличных от WAT, например в печени, поджелудочной железе и мышцах. Эктопическое депонирование триглицеридов вызывает патологические эффекты, например повышение продукции глюкозы в печени, снижение секреции инсулина поджелудочной железой, а также снижение захвата глюкозы и окисления жирных кислот в скелетных мышцах. Таким образом, повышенный уровень FFA в крови, обусловленный повышенной активностью HSL, вносит свой вклад и усугубляет инсулиновую резистентность у тучных лиц и лиц с диабетом 2 типа. Кроме того, имеется взаимосвязь между повышенным уровнем FFA и повышенной продукцией жировой тканью провоспалительного цитокина - фактора некроза опухолей альфа (TNF-a) (Hotamisigil, G.S.,1995, J. Clin. Invest. 95, 2409-2415). TNF-a еще более нарушает инсулиновую сигнализацию за счет активации сериновых киназ, например JNK-1, фосфорилирующей белок IRS-1, который подавляет инсулиновую сигнализацию (Gao, Z. et. al., Mol Endocrinol, 2004, 18, 2024-2034). Таким образом, нормализация повышенного уровня FFA и триглицеридов в крови за счет ингибирования HSL будет снижать накопление триглицеридов в тканях, отличных от WAT, таких как печень, мышцы и поджелудочная железа, что приведет к понижению продукции глюкозы печенью, усилению окисления жирных кислот в мышцах и улучшению функции (3-клеток. Продукция провоспалительных цитокинов также будет снижаться, что приведет к дальнейшему сокращению продукции FFA и улучшению инсулиновой сигнализации. Повышенный уровень FFAs, помимо прочего, взаимосвязан с повышенным риском сердечно-сосудистых заболеваний, включая атеросклероз и дисфункцию миокарда (Lopaschuk, et. al., Physiol Rev 2005, 85, 1093-129; Oliver, MF, QJM 2006, 99, 701-9). Было также показано, что хроническая инфузия низких доз липидов здоровым пациентам индуцирует маркеры эндотелиальной активации независимо от ее метаболических эффектов (Cusi, et. al., J. Cardiometab. Syndr. 2009, 3, 141-6). Здесь было показано, что умеренная инфузия липидов повышает уровень маркеров эндотелиальной активации ЕТ-1, ICAM-1, VCAM-1. Кроме того, высокая липолитическая активность и повышенный уровень FFAs приводят к повышенной инсулиновой резистентности и гипертензии у крыс-гипертоников (Mauriege, et. al. J Physiol Biochem. 2009, 65, 33-41).
Поскольку HSL является главной гормон-регулируемой липазой, известно, что при инсулинрезистентных состояниях снижается способность инсулина подавлять липолиз, что вносит свой вклад в повышение уровня FFA, т.е. липотоксичность. Свободные жирные кислоты накапливаются в печени, вызывая повышение продукции триглицеридов, поступающих внутрь VLDLs, которые затем секретируются. Происходит также накопление липидов в печени, что приводит к синдрому ожирения печени. При диабете и ожирении повышен липолиз, что способствует развитию этого синдрома. Следовательно, снижение активности HSL будет уменьшать высвобождение FFA в кровоток, лимитируя таким образом поступление FFA в печень и последующий синтез TAG. Поэтому ингибиторы HSL могут оказывать благоприятный эффект при лечении NAFLD (неалкогольная жировая дистрофия печени) и NASH (неалкогольный стеатогепатит) (Jeffry R. Lewis et al, Dig Dis Sci 2010, 55: 560-578).
Объектами настоящего изобретения являются соединения формулы (I) и их упомянутые выше соли и эфиры, а также их применение в качестве терапевтически активных веществ; способ получения указанных соединений, промежуточных продуктов, фармацевтических композиций, лекарственных препаратов, включающих указанные соединения, их фармацевтически приемлемые соли или эфиры; применение указанных соединений, солей или эфиров для лечения или профилактики заболеваний, особенно для лечения и профилактики диабета, метаболического синдрома, дислипидемии, атеросклероза, ожирения, сердечно-сосудистых заболеваний, дисфункции миокарда, воспаления, неалкогольной жировой дистрофии или неалкогольного стеатогепатита.
Термин "алкил", в отдельности или в сочетании, обозначает алкильную группу с линейной или разветвленной цепью, включающую от 1 до 8 атомов углерода, предпочтительно алкильную группу с линейной или разветвленной цепью, включающую от 1 до 6 атомов углерода и, в частности, предпочтительно, алкильную группу с линейной или разветвленной цепью, включающую от 1 до 4 атомов углерода. Примерами являются: метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, изомерные пентилы, изомерные гексилы, изомерные гептилы и изомерные октилы, предпочтительно метил, этил, пропил, изопропил, бутил и изобутил. В частности, предпочтительными алкилами являются метил, этил, пропил и бутил.
Термин "циклоалкил", в отдельности или в сочетании, обозначает циклоалкильное кольцо, включающее от 3 до 8 атомов углерода, предпочтительно, циклоалькилное кольцо, включающее от 3 до 6 атомов углерода. Примерами являются циклопропил, метил-циклопропил, диметил-циклопропил, циклобутил, метил-циклобутил, циклопентил, метил-циклопентил, циклогексил, метил-циклогексил, диметил-циклогексил, циклогептил и циклооктил. Предпочтительными циклоалкилами являются циклопропил и циклогексил.
Термин "алкокси", в отдельности или в сочетании, обозначает группу формулы алкил-O-, в которой термин "алкил" имеет указанное выше значение. Примерами являются метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси и трет-бутокси, предпочтительно метокси и этокси. В частности, предпочтительной алкоксигруппой является метоксигруппа.
Термин "гидроксиалкил", в отдельности или в сочетании, обозначает алкильную группу согласно приведенному выше определению, в которой один или более атомов водорода замещены гидроксигруппой. Примерами гидроксиалкилов являются гидроксиметил, гидроксиэтил, гидроксипропил, гидроксиметилпропил и дигидроксипропил. Предпочтительными гидроксиалкилами являются гидроксиэтил и гидроксиметилпропил.
Термин "галоген", в отдельности или в сочетании, обозначает фтор, хлор, бром или йод. Предпочтительными галогенами являются фтор и хлор.
Термин "галоалкил", в отдельности или в сочетании, обозначает алкильную группу согласно приведенному выше определению, в которой один или более атомов водорода замещены на галоген. Примерами галоалкилов являются фторметил, дифторметил, трифторметил, трифторэтил, трифторметилэтил или пентафторэтил. Предпочтительным галоалкилом является трифторметил.
Термин "галоалкокси", в отдельности или в сочетании, обозначает алкоксигруппу согласно приведенному выше определению, в которой один или более атомов водорода, присоединенных к углероду, замещены на галоген. Примерами галогеналкилов являются фторметокси-, дифторметокси-, трифторметокси-, трифторэтокси-, трифторметилэтокси-, трифтордиметилэтокси- или пентафторэтокси-группа. Предпочтительной галоалкоксигруппой является трифторметоксигруппа.
Термин "гидрокси", в отдельности или в сочетании, обозначает ОН-группу.
Термин "амино", в отдельности или в сочетании, обозначает первичную, вторичную или третичную аминогруппу, присоединенную через атом азота, при этом вторичная аминогруппа содержит алкильный или циклоалкильный заместитель, а третичная аминогруппа содержит два одинаковых или различных алкильных или циклоалкильных заместителя, или же два заместителя при атоме азота образуют кольцо. Примерами являются -NH2, метиламино, этиламино, диметиламино, диэтиламино, метил-этиламино, пирролидинил, морфолинил или пиперидинил, предпочтительно -NH2, диметиламино и диэтиламино и, в частности, -NH2.
Термин "защитная группа" относится к группам, которые применяются для блокировки реакционной способности функциональных групп, например аминогрупп или гидроксигрупп.Примерами защитных групп являются трет-бутилоксикарбонил (Boc), бензилоксикарбонил (Cbz), флуоренилметилоксикарбонил (Fmoc) или бензил (Bn). Предпочтительными защитными группами являются трет-бутилоксикарбонил (Boc) и бензил (Bn).
Отщепление защитной группы можно проводить стандартными методами, известными специалисту в данной области, например посредством гидрирования или в присутствии кислот, например HCl или TFA, предпочтительно HCl, или основания, например триэтиламина.
Термин "фармацевтически приемлемые соли" относится к таким солям, которые сохраняют биологическую активность и свойства свободных оснований или свободных кислот и которые не являются нежелательными с биологической или иной точки зрения. Соли могут быть образованы неорганическими кислотами, например хлороводородной кислотой, бромоводородной кислотой, серной кислотой, азотной кислотой, фосфорной кислотой и т.п., предпочтительно хлороводородной кислотой, и органическими кислотами, например уксусной кислотой, пропионовой кислотой, гликолевой кислотой, пировиноградной кислотой, щавелевой кислотой, малеиновой кислотой, малоновой кислотой, янтарной кислотой, фумаровой кислотой, виноградной кислотой, лимонной кислотой, бензойной кислотой, коричной кислотой, миндальной кислотой, этансульфоновой кислотой, п-толуолсульфоновой кислотой, салициловой кислотой, N-ацетилцистеином и т.п. Кроме того, эти соли могут быть получены путем добавления неорганического основания или органического основания к свободной кислоте. Соли, образованные неорганическими основаниями, включают, без ограничения, соли натрия, калия, лития, аммония, кальция, магния и т.п.Соли, образованные органическими основаниями, включают, без ограничения, соли первичных, вторичных и третичных аминов, включая природные замещенные амины, циклические амины и основные ионообменные смолы, например изопропиламиновые, триметиламиновые, диэтиламиновые, триэтиламиновые, трипропиламиновые, этаноламиновые, лизиновые, аргининовые, N-этилпиперидиновые, пиперидиновые, полииминовые смолы и т.п. В частности, предпочтительные фармацевтически приемлемые солями соединений формулы (I) - это соли хлороводородной, метансульфоновой и лимонной кислот.
Соединения формулы (I) могут быть также сольватированы, например гидратированы. Сольватация может осуществляться в ходе производственного процесса или происходить, например, как следствие гигроскопических свойств изначально безводного вещества формулы (I) (гидратация). Термин "фармацевтически приемлемые соли" включает также физиологически приемлемые сольваты.
"Фармацевтически приемлемые эфиры" означает, что соединение общей формулы (I) можно дериватизировать по функциональным группам с получением производных, которые способны превращаться обратно в исходные соединения in vivo. Примеры таких соединений включают физиологически приемлемые и метаболически лабильные эфирные производные, например метоксиметиловые эфиры, метилтиометиловые эфиры и пивалоилоксиметиловые эфиры. Кроме того, любые физиологически приемлемые эквиваленты соединений общей формулы (I), аналогичные метаболически лабильным эфирам, которые способны образовывать исходные соединения общей формулы (I) в vivo, входят в объем данного изобретения. Предпочтительными фармацевтически приемлемыми эфирами соединений формулы (I) являются метиловые и этиловые эфиры.
Соединения формулы (I) могут содержать несколько асимметрических центров и могут находиться в форме оптически чистых энантиомеров, смесей энантиомеров, например рацематов, оптически чистых диастереоизомеров, смесей диастереоизомеров, диастеромерных рацематов или смесей диастеромерных рацематов.
Согласно правилу Кана-Ингольда-Прелонга, асимметрический атом углерода может иметь конфигурацию "R" или "S".
Предпочтительным является соединение согласно формуле (I), описанное выше, и его фармацевтически приемлемые соли или эфиры.
Кроме того, предпочтительным является соединение согласно формуле (I), описанное выше, и его фармацевтически приемлемые соли или эфиры, в частности соединение согласно формуле (I), описанное выше.
Также предпочтительным является соединение формулы (I), в котором
R1 - это замещенный фенил, который содержит от одного до трех заместителей, независимо выбранных из группы, включающей алкил, циклоалкил, галоалкил, гидрокси, алкокси, гидроксиалкокси, алкоксиалкокси и галоалкокси, причем замещенный фенил может содержать дополнительно один или два заместителя, независимо выбранных из галогена;
R2 - это водород, алкил, циклоалкил, фенил, фенилалкил, замещенный фенил или замещенный фенилалкил, причем замещенный фенил и замещенный фенилалкил содержат от одного до трех заместителей, независимо выбранных из группы, включающей алкил, циклоалкил, галоген, галоалкил, гидрокси, алкокси, гидроксиалкокси, алкоксиалкокси и галоалкокси;
R3 - это -R4, -C(OH)R5R6 или -C(O)NR7R8;
R4 - это фенил, фенилалкил, замещенный фенил или замещенный фенилалкил, причем замещенный фенил и замещенный фенилалкил содержат от одного до трех заместителей, независимо выбранных из группы, включающей алкил, циклоалкил, галоген, галоалкил, гидрокси, алкокси, гидроксиалкокси, алкоксиалкокси и галоалкокси;
один из R5 и R6 - это водород, алкил или циклоалкил, а другой из них - это фенил, фенилалкил, замещенный фенил или замещенный фенилалкил, причем замещенный фенил и замещенный фенилалкил содержат от одного до трех заместителей, независимо выбранных из группы, включающей алкил, циклоалкил, галоген, галоалкил, гидрокси, алкокси, гидроксиалкокси, алкоксиалкокси и галоалкокси;
один из R7 и R8 - это водород, алкил, циклоалкил, гидроксиалкил или алкоксиалкил, а другой из них - это алкил, циклоалкил, гидроксиалкил, алкоксиалкил, фенил, фенилалкил, замещенный фенил или замещенный фенилалкил, причем замещенный фенил и замещенный фенилалкил содержат от одного до трех заместителей, независимо выбранных из группы, включающей алкил, циклоалкил, галоген, галоалкил, гидрокси, алкокси, гидроксиалкокси, алкоксиалкокси и галоалкокси;
или же R7 и R8 совместно с атомом азота, к которому они присоединены, образуют пирролидинил, пиперидинил, азепанил, пиперидазинил, морфолинил или тиоморфолинил;
n равно нулю или 1;
или его фармацевтически приемлемые соли.
Кроме того, предпочтительно также соединение согласно формуле (I), описанное выше, в котором R1 - это замещенный фенил, который содержит от одного до трех заместителей, независимо выбранных из группы, включающей циклоалкил и галоалкокси, и замещенный фенил может дополнительно содержать один или два заместителей, независимо выбранных из галогена.
Кроме того, предпочтительно соединение согласно формуле (I), описанное выше, в котором R1 - это замещенный фенил, причем замещенный фенил содержит от одного до трех заместителей, независимо выбранных из циклоалкила.
В частности, предпочтительно соединение согласно формуле (I), описанное выше, в котором R1 - это замещенный фенил, который в качестве заместителя содержит циклопропил.
Кроме того, предпочтительно соединение согласно формуле (I), описанное выше, в котором R3 - это -C(OH)R5R6.
Кроме того, предпочтительно соединение согласно формуле (I), описанное выше, в котором один из R5 и R6 - это водород или алкил, а другой из них - это фенил, фенилалкил, замещенный фенил или замещенный фенилалкил, причем замещенный фенил и замещенный фенилалкил содержат от одного до трех заместителей, независимо выбранных из группы, включающей алкил, циклоалкил, галоген, галоалкил, гидрокси, алкокси, гидроксиалкокси, алкоксиалкокси и галоалкокси.
Кроме того, предпочтительно соединение согласно формуле (I), описанное выше, в котором один из R5 и R6 - это водород, а другой из них - это фенил, фенилалкил, замещенный фенил или замещенный фенилалкил, причем замещенный фенил и замещенный фенилалкил содержат от одного до трех заместителей, независимо выбранных из группы, включающей алкил, циклоалкил, галоген, галоалкил, гидрокси, алкокси, гидроксиалкокси, алкоксиалкокси и галоалкоксигруппу.
В частности, предпочтительно соединение согласно формуле (I), описанное выше, в котором один из R5 и R6 - это водород или алкил, а другой них - это фенилили замещенный фенил, причем замещенный фенил содержит от одного до трех заместителей, независимо выбранных из галогена.
Помимо этого, предпочтительно соединение согласно формуле (I), описанное выше, в котором один из R5 и R6 - это водород, а другой - фенил или замещенный фенил, причем замещенный фенил содержит от одного до трех заместителей, независимо выбранных из галогена.
Также предпочтительно соединение согласно формуле (I), описанное выше, в котором R3 - это -C(OH)R5R6, и n равно нулю.
Другим предпочтительным вариантом осуществления настоящего изобретения является соединение согласно формуле (I), описанное выше, в котором R3 - это -C(O)NR7R8.
Предпочтительно также соединение согласно формуле (I), описанное выше, в котором один из R7 и R8 - это водород или алкил, а другой из них - это алкил, циклоалкил, алкоксиалкил, фенилалкил, замещенный фенил или замещенный фенилалкил, причем замещенный фенил и замещенный фенилалкил содержат от одного до трех заместителей, независимо выбранных из группы, включающей галоген и галоалкил.
Кроме того, предпочтительно соединение согласно формуле (I), описанное выше, в котором один из R7 и R8 - это водород, а другой из них - это алкил, замещенный фенил или замещенный фенилалкил, причем замещенный фенил и замещенный фенилалкил содержат от одного до трех заместителей, независимо выбранных из группы, включающей галоген и галоалкил.
Также предпочтительно соединение согласно формуле (I), описанное выше, в котором R7 и R8 вместе с атомом азота, к которому они присоединены, образуют пирролидинил.
Другим предпочтительным вариантом осуществления настоящего изобретения является соединение согласно формуле (I), описанное выше, в котором R4 - это фенил, фенилалкил или замещенный фенил, причем замещенный фенил содержит от одного до трех заместителей, независимо выбранных из галоалкила.
Помимо этого, предпочтительно соединение согласно формуле (I), описанное выше, в котором R4 - это фенил, бензил, фенилэтил, фенилпропил или замещенный фенил, причем замещенный фенил содержит в качестве заместителя трифторметил.
В частности, предпочтительно соединение согласно формуле (I), описанное выше, в котором R4 - это фенил.
Также предпочтительно соединение согласно формуле (I), описанное выше, в котором R2 - это водород, алкил или фенил.
Кроме того, предпочтительно соединение согласно формуле (I), описанное выше, в котором R2 - это водород или алкил.
В частности, предпочтительно соединение согласно формуле (I), описанное выше, в котором R2 - это водород.
В частности, предпочтительно также соединение согласно формуле (I), описанное выше, в котором R2 - это алкил.
Примеры предпочтительного соединения согласно формуле (I), описанного выше, выбирают из группы, включающей:
2-(4-циклопропил-фенил)-8-(3-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-он;
2-(4-циклопропил-фенил)-8-фенэтил-2,8-диаза-спиро[4.5]декан-1-он;
2-(4-циклопропил-фенил)-8-(4-трифторметил-бензил)-2,8-диаза-спиро[4.5]декан-1-он;
2-(4-циклопропил-фенил)-8-(1-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-он;
2-(4-циклопропил-фенил)-8-[1-(3-трифторметил-фенил)-этил]-2,8-диаза-спиро[4.5]декан-1-он;
2-(2-хлор-4-циклопропил-фенил)-8-(1-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-он;
2-(4-циклопропил-фенил)-8-(1-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-он;
8-бензил-2-(4-трифторметокси-фенил)-2,8-диаза-спиро[4.5]декан-1 -он;
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамид;
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N,N-диэтил-ацетамид;
N-бутил-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-ацетамид;
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-трифторметил-бензил)-ацетамид;
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-фтор-фенил)-ацетамид;
2-(4-циклопропил-фенил)-8-(2-оксо-2-пирролидин-1-ил-этил)-2,8-диаза-спиро[4.5]декан-1-он;
N-бензил-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-метил-ацетамид;
N-циклогексил-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-метил-ацетамид;
2-[2-(4-цикл опропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(3-метокси-пропил)-ацетамид;
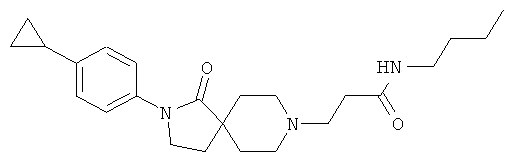
N-бутил-3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионамид;
3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-трифторметил-бензил)-пропионамид;
3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-фтор-фенил)-пропионамид;
N-бензил-3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-метил-пропионамид;
N-циклогексил-3-[2-(4-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-метил-пропионамид;
2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-он;
8-[2-(4-хлор-фенил)-2-гидрокси-этил]-2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-он;
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-фтор-фенил)-пропионамид;
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-фтор-фенил)-бутирамид;
N-бутил-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионамид;
N-бутил-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-бутирамид;
N-бутил-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-2-фенил-ацетамид;
бутиламид 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-гексановой кислоты;
N-бутил-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-3-метил-бутирамид;
2-(4-циклопропил-фенил)-8-((S)-2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-он;
2-(4-циклопропил-фенил)-8-((R)-2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-он;
2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-он;
2-(4-циклопропил-фенил)-8-[(R)-2-(4-фтор-фенил)-2-гидрокси-этил]-2,8-диаза-спиро[4.5]декан-1-он;
8-[(К)-2-(3-хлор-фенил)-2-гидрокси-этил]-2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1 -он;
2-(4-циклопропил-фенил)-8-[2-(3,4-дихлор-фенил)-2-гидрокси-этил]-2,8-диаза-спиро[4.5]декан-1-он; и
2-(4-циклопропил-фенил)-8-[2-(2,4-дихлор-фенил)-2-гидрокси-этил]-2,8-диаза-спиро[4.5]декан-1 -он.
Кроме того, примеры предпочтительного соединения согласно формуле (I), описанного выше, выбирают из группы, включающей:
8-[2-(2-хлор-6-фтор-фенил)-2-гидрокси-этил]-2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-он;
3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-2-гидрокси-3-(4-метокси-фенил)-пропионамид;)
бутиламид (S)-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-гексановой кислоты;
бутиламид(R)-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-гексановой кислоты;
8-[2-(2,4-дихлор-фенил)-2-оксо-этил]-2-(4-этил-фенил)-2,8-диаза-i спиро[4.5]декан-1-он;
8-[2-(2,4-дихлор-фенил)-2-гидрокси-этил]-2-[4-(2,2,2-трифтор-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-он;
8-[2-(2,4-дихлор-фенил)-2-гидрокси-этил]-2-[6-((R)-2,2,2-трифтор-1-метил-этокси)-пиридин-3-ил]-2,8-диаза-спиро[4.5]декан-1-он;
8-[2-(2,4-дихлор-фенил)-2-гидрокси-этил]-2-[4-(2,2,2-трифтор-этил)-фенил]-2,8-диаза-спиро[4.5]декан-1-он;
8-[2-(2-хлор-6-фтор-фенил)-2-гидрокси-этил]-2-[4-(2,2,2-трифтор-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-он;
8-[2-(2-хлор-6-фтор-фенил)-2-гидрокси-этил]-2-[4-((К)-2,2,2-трифтор-1-метил-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-он;
8-[2-(2-хлор-6-фтор-фенил)-2-гидрокси-этил]-2-[6-((R)-2,2,2-трифтор-1-метил-этокси)-пиридин-3-ил]-2,8-диаза-спиро[4.5]декан-1-он;
8-[2-(2-хлор-6-фтор-фенил)-2-гидрокси-этил]-2-[4-(2,2,2-трифтор-этил)-фенил]-2,8-диаза-спиро[4.5]декан-1-он;
8-[2-(2,4-дихлор-фенил)-2-гидрокси-этил]-2-[4-((R)-2,2,2-трифтор-1-метил-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-он;
8-[2-(2,4-дихлор-фенил)-2-гидрокси-этил]-2-[4-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-он;
8-[2-(2,4-дихлор-фенил)-2-гидрокси-этил]-2-[6-((S)-2,2,2-трифтор-1-метил-этокси)-пиридин-3-ил]-2,8-диаза-спиро[4.5]декан-1-он;
8-[2-(2-хлор-6-фтор-фенил)-2-гидрокси-этил]-2-[4-((8)-2,2,2-трифтор-1-метил-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-он; и
8-[2-(2-хлор-6-фтор-фенил)-2-гидрокси-этил]-2-[6-((8)-2,2,2-трифтор-1-метил-этокси)-пиридин-3-ил]-2,8-диаза-спиро[4.5]декан-1-он.
Другие предпочтительные примеры соединения согласно формуле (I), описанного выше, выбирают из группы, включающей:
2-(4-циклопропил-фенил)-8-(1-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-он;
N-бутил-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-ацетамид;
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-трифторметил-бензил)-ацетамид;
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-фтор-фенил)-ацетамид;
3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-трифторметил-бензил)-пропионамид;
3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-фтор-фенил)-пропионамид;
2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-он;
8-[2-(4-хлор-фенил)-2-гидрокси-этил]-2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-он;
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-фтор-фенил)-пропионамид;
бутиламид 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-гексановой кислоты;
N-бутил-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-3-метил-бутирамид;
2-(4-циклопропил-фенил)-8-((R)-2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-он; и
2-(4-циклопропил-фенил)-8-[(R)-2-(4-фтор-фенил)-2-гидрокси-этил]-2,8-диаза-спиро[4.5]декан-1-он.
Кроме того, предпочтительные примеры соединения согласно формуле (I), описанного выше, выбирают из группы, включающей
бутиламид (R)-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-гексановой кислоты;
8-[2-(2,4-дихлор-фенил)-2-гидрокси-этил]-2-[4-(2,2,2-трифтор-этил)-фенил]-2,8-диаза-спиро[4.5]декан-1-он;
8-[2-(2,4-дихлор-фенил)-2-гидрокси-этил]-2-[4-((8)-2,2,2-трифтор-1-метил-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-он.
Способы получения соединений формулы (I) являются объектом настоящего изобретения.
Получение соединений формулы (I) по настоящему изобретению можно осуществлять последовательными или сходящимися путями синтеза. Способы синтеза по настоящему изобретению отображены в нижеследующих общих схемах. Навыки, необходимые для проведения реакции и очитки конечного продукта, известны квалифицированным специалистам в данной области техники. В случае если в ходе реакции получают смесь энантиомеров или диастереоизомеров, эти энантиомеры или диастереоизомеры можно разделить способами, которые включены в данное описание или известны специалистам, квалифицированным в данной области техники, такими как, например, хиральная хроматография или кристаллизация. Заместители и индексы, использованные в нижеследующем описании способов, имеют приведенное здесь значение.
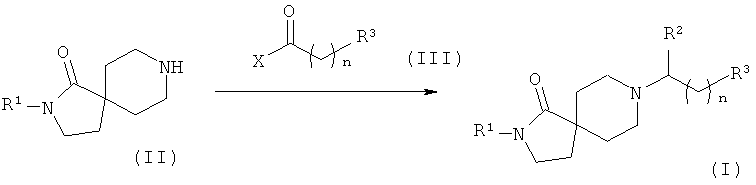
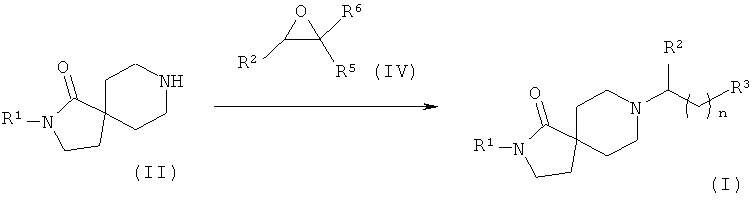
Соединения формулы (I), в которых R3 - это -R4, легко можно получить путем восстановительного аминирования, как показано на Схеме 1. Соединения общей формулы (II) вводят в реакцию с соединениями общей формулы (III) в присутствии восстанавливающего агента, такого как триацетоксиборогидрид натрия, борогидрид натрия или цианоборогидрид натрия, в растворителе, таком как, например, THF, метанол или этанол, в присутствии или отсутствии уксусной кислоты, с образованием соединений формулы (I), в котором R3 - это -R4.
Схема 1
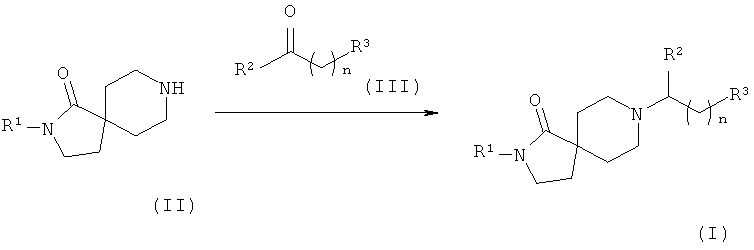
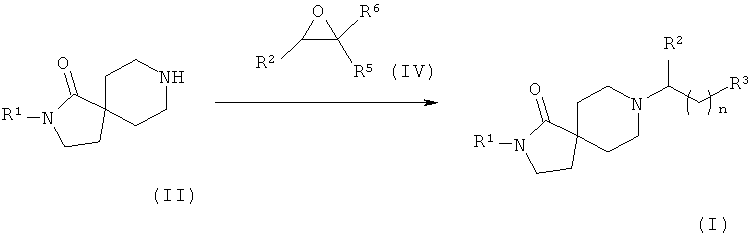
Соединения формулы (I), в которых R3 - это -C(OH)R5R6, а n равно нулю, легко получить, как показано на Схеме 2.
Соединения общей формулы (II) вводят в реакцию с соединениями общей формулы (IV) в присутствии основания, такого как, например, триэтиламин, в растворителе, таком как, например, дихлорметан, с образованием соединений формулы (I), в которых R3 - это -C(OH)R5R6, а n равно нулю.
Схема 2
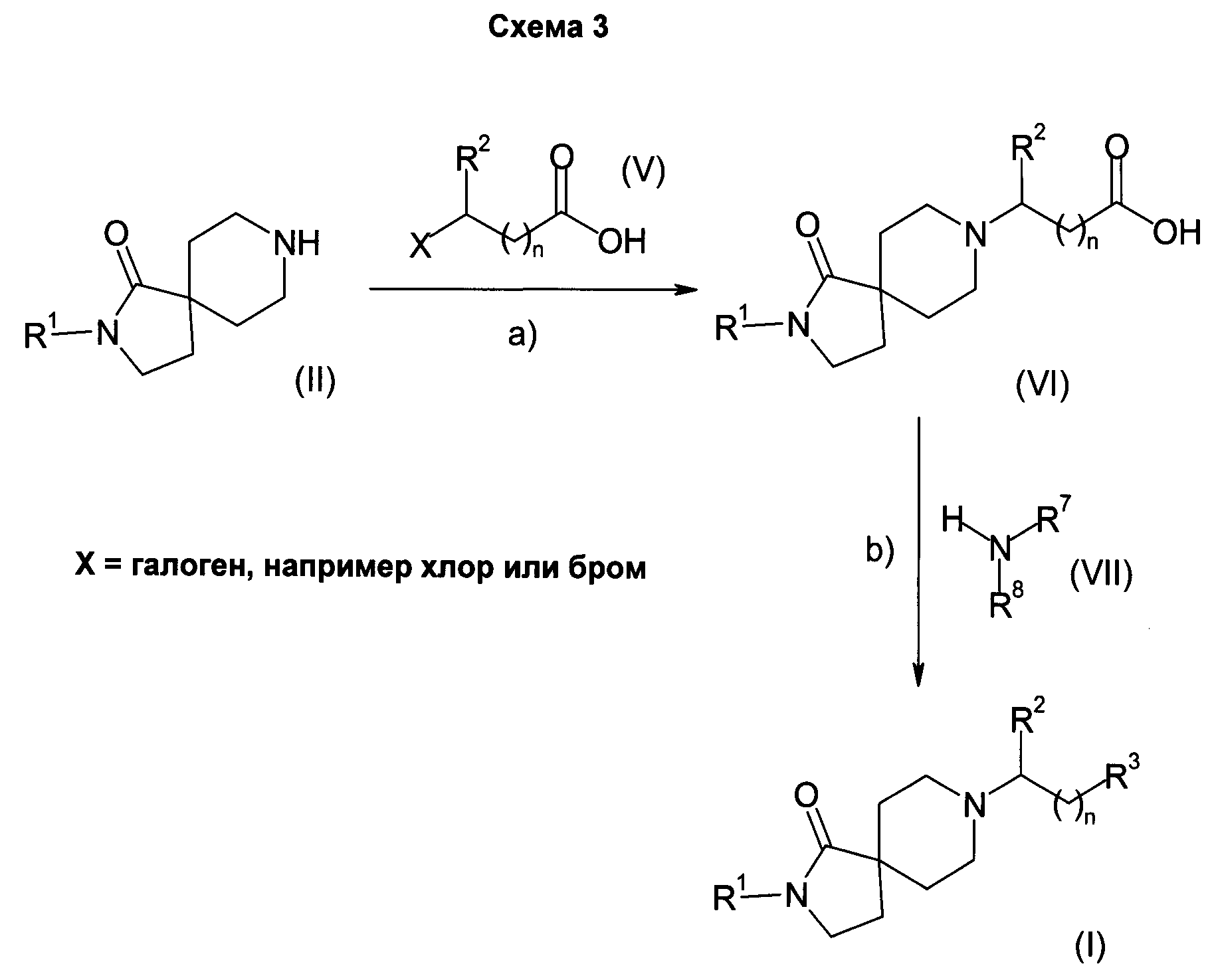
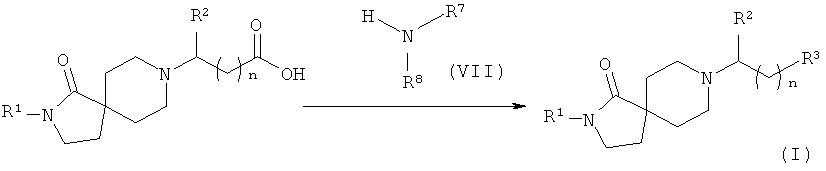
Соединения формулы (I), в которых R3 - это -C(O)NR7R8, легко получить в несколько стадий, как показано на Схеме 3.
Соединения общей формулы (II) вводят в реакцию с соединениями общей формулы (V) в присутствии основания, такого как, например, триэтиламин, в растворителе, таком как, например, дихлорметан (стадия a)), с получением соединений общей формулы (VI).
Соединения общей формулы (VI) вводят в реакцию с соединениями общей формулы (VII) в присутствии сшивающего агента, такого как N,N-карбонилдиимидазол (CDI), 1-гидрокси-1,2,3-бензотриазол (НОВТ) или O-бензотриазол-1-ил-N,N,N,N-тетраметилурониум тетрафторборат (TBTU), в растворителе, таком как N.N-диметилформамид (DMF) или диоксан, в присутствии или отсутствии основания, такого как триэтиламин, диизопропилэтиламин или 4-(диметиламино)пиридин (стадия b)), с образованием соединений формулы (I), в которых R3 - это -C(O)NR7R8.
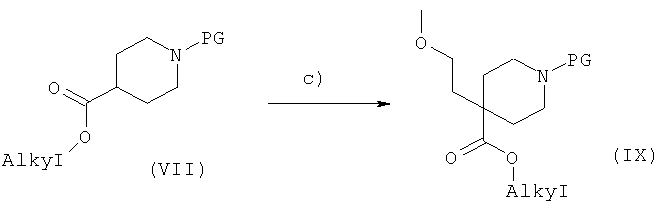
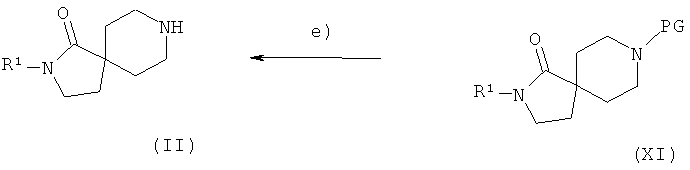
Соединения формулы (II) легко можно получить в несколько стадий, как показано на Схеме 4.
Соединения общей формулы (VIII) можно алкилировать по нужному положению путем обработки подходящим основанием, таким как, например, диизопропиламид лития или бутиллитий, в подходящем растворителе, таком как THF, DMF, диэтиловый эфир, с последующим добавлением подходящего электрофила, такого как, например, 1-бром-2-метоксиэтан или 1-хлор-2-метоксиэтан, с получением соединений общей формулы (IX) (стадия c)).
Соединения формулы (IX) далее вводят в реакцию с производными общей формулы (X) в присутствии алюминийорганического реагента, такого как, например, диметилалюминий хлорид или триметилалюминий, в растворителе, таком как толуол или диоксан, с образованием спироциклических соединений общей формулы (XI) (стадия d)).
Защитную группу (PG) соединений общей формулы (XI) можно затем удалить в стандартных условиях, например, путем гидрирования или взаимодействия с кислотой, предпочтительно HCI или TFA, с образованием соединений общей формулы (II) (стадия е)).
Схема 4
Alkyl - например, метил или этил
|
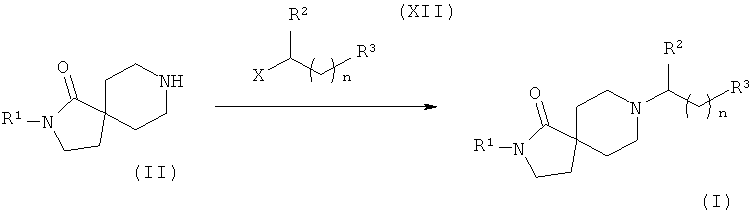
Соединения формулы (I) также легко можно получить в ходе одностадийного процесса, как показано на Схеме 5.
Схема 5
X - галоген, например хлор или бром
Соединения общей формулы (II) вводят в реакцию с соединениями общей формулы (XII) в присутствии основания, такого как, например, триэтиламин, в растворителе, таком как, например, дихлорметан, с получением соединений общей формулы (I).
Предпочтителен способ получения соединения согласно формуле (I), описанный выше, включающий следующие стадии:
a) реакция соединения формулы (II) в присутствии соединения формулы (III).
предпочтительно в присутствии восстановителя, в частности триацетоборогидрида натрия, в растворителе, в частности, THF, в присутствии или отсутствии кислоты, в т.ч. в присутствии уксусной кислоты, и при температуре от -20°C до температуры дефлегмации растворителя, в частности при комнатной температуре, в которых R1, R2 и п определены выше, a R3 - это -R4;
b) реакция соединения формулы (II) в присутствии соединения формулы (IV)
предпочтительно осуществление в присутствии основания, в частности триэтиламина, в растворителе, в частности дихлорметана, и при температуре от 0°C до температуры дефлегмации растворителя, в частности при температуре дефлегмации растворителя, в которых R1, R2, R5 и R6 определены выше, R3 - это -C(OH)R5R6, а n равно нулю;
или
c) реакция соединения формулы (VI) в присутствии соединения формулы
предпочтительно в присутствии сшивающего агента, в частности TBTU, в присутствии или отсутствии основания, в частности в присутствии триэтиламина, в растворителе, в частности DMF, и при температуре от -20°C до температуры дефлегмации растворителя, в частности, при комнатной температуре, в которых R1, R2, R7, R8 и n определены выше, a R3 - это -C(0)NR7R8.
Предпочтительные промежуточные соединения выбирают из группы, включающей
1-трет-бутиловый 4-этиловый диэфир 4-(2-метокси-этил)-пиперидин-1,4-дикарбоновой кислоты;
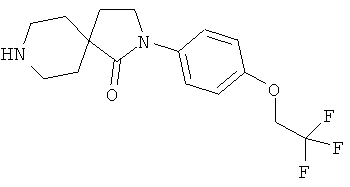
2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-он;
2-(2-хлор-4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-он;
этиловый эфир 1-бензил-4-(2-метокси-этил)-пиперидин-4-карбоновой кислоты;
[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-уксусная кислота;
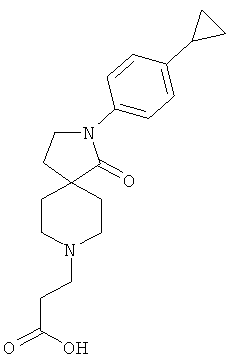
3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионовая кислота;
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионовая кислота;
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-масляная кислота;
[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-фенилуксусная кислота;
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-гексановая кислота; и
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-3-метил-масляная кислота.
Еще один объект настоящего изобретения включает соединение согласно формуле (I), описанное выше, полученное согласно одному из описанных способов.
Еще одним объектом настоящего изобретения является соединение согласно формуле (I), описанное выше, предназначенное для применения в качестве терапевтически активного вещества.
Аналогично, объектом настоящего изобретения является фармацевтическая композиция, включающая соединение согласно формуле (I), описанное выше, и терапевтически инертный наполнитель.
Еще одним объектом настоящего изобретения является применение соединения согласно формуле (I), описанного выше, для лечения и профилактики диабета, метаболического синдрома, дислипидемии, атеросклероза или ожирения.
Предпочтительно также применение соединения согласно формуле (I), описанного выше, для лечения или профилактики сердечно-сосудистых заболеваний, дисфункции миокарда или воспаления.
В частности, предпочтительно применение соединения согласно формуле (I), описанного выше, для лечения или профилактики диабета.
Кроме того, предпочтительно применение соединений согласно формуле (I), описанных выше, для лечения или профилактики диабета II типа.
Еще одним предпочтительным вариантом осуществления настоящего изобретения является применение соединений согласно формуле (I), описанных выше, для изготовления лекарственного препарата для лечения или профилактики диабета, метаболического синдрома, дислипидемии, атеросклероза или ожирения.
Кроме того, предпочтительно применение соединения согласно формуле (I), описанного выше, для изготовления лекарственного препарата для лечения или профилактики сердечно-сосудистых заболеваний, дисфункции миокарда или воспаления.
В частности, предпочтительно применение соединения согласно формуле (I), описанного выше, для изготовления лекарственного препарата для лечения или профилактики диабета.
Кроме того, предпочтительно применение соединения согласно формуле (I), описанного выше, для изготовления лекарственного препарата для лечения или профилактики диабета II типа.
Объектом настоящего изобретения является также соединение согласно формуле (I), описанное выше, для лечения или профилактики заболеваний, которые вызваны расстройствами, связанными, например, с ферментом гормончувствительной липазой.
Кроме того, предпочтительным является соединение согласно формуле (I), описанное выше, для лечения или профилактики диабета, метаболического синдрома, дислипидемии, атеросклероза или ожирения.
Кроме того, предпочтительно также соединение согласно формуле (I), описанное выше, для лечения или профилактики сердечно-сосудистых заболеваний, дисфункции миокарда или воспаления.
В частности, предпочтительно соединение согласно формуле (I), описанное выше, для лечения или профилактики диабета.
Кроме того, предпочтительным является соединение согласно формуле (I), описанное выше, для лечения или профилактики диабета II типа.
Объектом настоящего изобретения является также способ лечения или профилактики диабета, метаболического синдрома, дислипидемии, атеросклероза или ожирения, который включает введение эффективного количества соединения согласно формуле (I), описанного выше.
Также предпочтительным является способ лечения или профилактики сердечно-сосудистых заболеваний, дисфункции миокарда или воспаления, который включает введение эффективного количества соединения согласно формуле (I), описанного выше.
В частности, предпочтителен способ лечения или профилактики диабета, который включает введение эффективного количества соединения согласно формуле (I), описанного выше.
Кроме того, предпочтителен способ лечения или профилактики диабета II типа, который включает введение эффективного количества соединения согласно формуле (I), описанного выше.
Одним из вариантов осуществления настоящего изобретения является также применение соединения согласно формуле (I), описанного выше, для лечения или профилактики неалкогольной жировой дистрофии печени или неалкогольного стеатогепатита.
Кроме того, одним из вариантов осуществления настоящего изобретения является применение соединения согласно формуле (I), описанного выше, для изготовления лекарственного препарата для лечения или профилактики неалкогольной жировой дистрофии печени или неалкогольного стеатогепатита.
В частности, еще одним вариантом осуществления настоящего изобретения является применение соединения согласно формуле (I), описанного выше, для лечения или профилактики неалкогольной жировой дистрофии печени или неалкогольного стеатогепатита.
Одним из вариантов осуществления настоящего изобретения является также способ лечения или профилактики неалкогольной жировой дистрофии печени или неалкогольного стеатогепатита, который включает введение эффективного количества соединения согласно формуле (I), описанного выше.
Описание методов
Получение человеческой полноразмерной гормончувствительной липазы - His6:
1) Клонирование: получали к-ДНК из коммерчески доступной polyA+РНК мозга человека и использовали ее в качестве матрицы в ПЦР по методу перекрывающегося сплайсинг-расширения с получением полноразмерной человеческой HSL ORF с 3′-концевой гистидиновой меткой (His6). Эту полноразмерную вставку клонировали в вектор pFast-BAC и верифицировали ДНК-последовательности от нескольких отдельных клонов. ДНК из подходящего полноразмерного клона, содержащую 3′-концевую His, использовали для трансформации штамма E.coli DH10BAC. Полученную бакмидную ДНК использовали для получения стока бакуловирусов с известным титром для генерации белка. Последовательность закодированной HSL соответствует элементу под номером Q05469 в базе Swissprot с дополнительной C-концевой меткой His6.
2) Очистка белка: Культура: 5.5 л, клетки High Five, экспрессирующие человеческую полноразмерную HSL-His6, 48 ч, содержащая 25 мкмоль Е-64. Количество клеток: 1.78×1010 клеток/мл, 90% жизнеспособность.
Клетки разморозили. Суспендировали клетки на льду в Основном Буфере следующего состава: 10% глицерин, 25 мМ Трис-Cl, 300 мМ NaCl, 10 мМ имидазол, 10 мМ 2-меркаптоэтанол, пепстатин 2 мкг/мл, леупептин 2 мкг /мл, антипаин 2 мкг/мл, pH 8.0, при 4°C, в конечном объеме 475 мл, содержащем 3.75×107 клеток/ мл. Дезинфекцию проводили 3 раза по 30 сек, добавляли Lubrol РХ до конечной концентрации 0.2% с последующим перемешиванием в течение 15 мин при 4°C и центрифугированием при 25000×g, 60 мин, 4°C. Растворимые белки смешивали с 60 мл предварительно промытой и уравновешенной Ni-NTA агарозой (Qiagen 30210), после чего перемешивали вращением в течение 45 мин, 4°C, центрифугировали при 1000 об/мин 5 мин и оставляли для осаждения смолы на 5 мин. Супернатант удаляли, смолу промывали в сосуде для центрифугирования пятью объемами Основного Буфера, содержащего 0.2% Lubrol РХ. Снова центрифугировали, после чего супернатант отбрасывали. Смолу переливали на мембрану с диаметром пор 0.8 мкм в одноразовую ячейку для фильтрации (Nalge 450-0080) и промывали пятью объемами Основного Буфера, содержащего 0.2% Lubrol РХ. Затем ее промывали 30 объемами Основного Буфера, содержащего 60 мМ имидазол, рН 7.5, при 4°C. Белок элюировали пятью объемами буфера следующего состава: 25 мМ Tris-Cl, 300 мМ NaCl, 200 мМ имидазол, 10 мМ 2-меркаптоэтанол, pH 7.5, при 4°C, для чего смолу с буфером перемешивали вращением в течение 30 мин, 4°C. Смолу помещали в мембранную одноразовую ячейку для фильтрации с диаметром пор 0.2 мкм (Millipore SCGP U02 RE) и собирали элюат. Элюат концентрировали с помощью фильтрующей центрифуги 30k MWCO (Sartorius Vivascience Vivacell 100, VC1022) до 20 мл. Затем его диализовали в течение ночи при 4°C, два раза против 2 л буфера следующего состава: 10% глицерин, 25 мМ Tris-Cl, 300 мМ NaCl, 0.2 мМ EDTA, 0.2 мМ DTT, pH 7.5, при 4°C. Белок фильтровали через одноразовую ячейку для фильтрования с диаметром пор 0.22 мкм (Millipore SCGP00525). Концентрацию белка вычисляли по поглощению при 280 нм, используя коэффициент 280=0.67 сN-1 мг-1. Общий выход составил 235 мг. Белок хранили при -80°C.
Анализ ингибирования Фермента гормончувствительной липазы (HSL) человека:
Ферментную активность HSL измеряли в ходе колориметрического анализа с использованием 2,3-димеркапто-1-пропанол трибутирата (Aldrich, St. Louis, МО) в качестве субстрата. Как правило, готовили 1.5 мМ раствор 2,3-димеркапто-1-пропанол трибутират (DMPT) в 100 мМ MOPS, рН 7.2, содержащий 0.2 мг/мл BSA, свободного от жирных кислот, посредством обработки ультразвуком при 4°C до получения гомогенной суспензии. Готовили серию трехкратных разведений исследуемых веществ в DMSO (из 2 мМ стока в DMSO). Растворы соединений разводили в 24 раза в растворе, содержащем 1.5 мМ DMPT, и наносили по 18 мкл в лунку на 384-луночные микропланшеты (Corning Costar). Добавляли по 12 мкл в лунку человеческой HSL (15 мкг/мл) и инкубировали реакционную смесь при 37°C в течение 20 минут. Добавляли 6 мкл 12 мМ раствора дитио-бис-(2-нитробензойной кислоты) (DTNB) в DMSO, содержащего 1.2% SDS и 0.6% Triton X-100, и инкубировали смесь при комнатной температуре в течение 15 минут. Образование продукта контролировали считыванием абсорбции при 405 нм на спектрофотометре вертикального сканирования Envision Reader (PerkinElmer Life and Analytical Sciences, Shelton, CT).
Клеточный анализ:
Для количественной оценки ингибирующего эффекта соединений на липолиз в интактных клетках (адипоцитах) использовали следующий метод.
Пре-адипоцитные клетки 3T3-L1 высевали на 96-луночные планшеты с плотностью 20000 клеток на лунку, в 200 мкл питательной среды (DMEM / 10% телячья сыворотка/1х антибиотик-антимикотик) вплоть до слияния. Через 48 ч после наступления слияния среду удаляли и проводили дифференцировку клеток в адипоциты с помощью среды для дифференцировки (DMEM/10% FBS/1х антибиотик-антимикотик, содержащей 1 мкМ IBMX (3-изобутил-1-метилксантин) ингибитор фосфодиэстераз, 1 мкМ дексаметазон, 1 мкМ росиглитазон, 10 мкг/мл инсулин). Клетки инкубировали в указанной среде в течение 3 дней, после чего среду заменяли пост-диференцирующей средой (DMEM/10% FBS, содержащей 10 мкг/мл инсулин), и клетки инкубировали еще 3 дня. После этого среду заменяли поддерживающей средой (DMEM/10% FBS). Клетки подпитывали каждые три дня поддерживающей средой до момента использования. Анализ липолиза можно проводить на 9-14 день после инициации дифференцировки в 96-луночных планшетах.
Анализ липолиза проводили следующим образом. Адипоциты промывали дважды с помощью 200 мкл бикарбонатного Hepes-буфера Кребса-Рингера (KRBH), содержащего 3% BSA. Концентрация тестируемых соединений в DMSO составляла 10 мМ, первоначально их разбавляли до 5 мМ в DMSO. Затем готовили серию пятикратных разведений этих веществ в DMSO (от 5 мМ до 320 пМ). Каждое соединение затем разводили в 200 раз в KRBH/3% BSA (итого, 0.5% DMSO). Диапазон концентраций полученных растворов составлял от 25 мкМ до 1.6 пМ. Добавляли по 150 мкл разведенных соединений в каждую лунку (в трипликатах) и преинкубировали клетки 30 мин при 37°C. Добавляли форсколин (конечная концентрация 50 мкМ) в лунки и инкубировали клетки в течение 120 минут при 37°C. Отбирали по 100 мкл в новый 96-луночный планшет для анализа на глицерин. Количество продуцированного глицерина определяли с помощью набора для определения глицерина (Sigma).
|
У описанных выше соединений величина IC50 находится в интервале от 0.005 мкМ до 1000 мкМ, у предпочтительных соединений величина IC50 находится в интервале от 0.01 мкМ до 10 мкМ. В частности, у предпочтительных соединений величина IC50 находится в интервале от 0.01 мкМ до 0.5 мкМ. Эти результаты были получены с помощью описанного выше анализа ингибирования фермента HSL (мкМ означает «микромолярный»).
Соединения формулы (I) и их фармацевтически приемлемые соли могут применяться как лекарственные вещества (например, в форме фармацевтических препаратов). Фармацевтические препараты можно вводить внутрь, например, орально (например, в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий), интраназально (например, в форме назальных спрэев) или ректально (например, в форме суппозиториев). Кроме того, введение можно осуществлять парентерально, например внутримышечно или внутривенно (например, в форме растворов для инъекций).
Соединения формулы (I) и их фармацевтически приемлемые соли можно процессировать с фармацевтически инертными, неорганическими или органическими наполнителями для изготовления таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул. Для таблеток, драже и твердых желатиновых капсул в качестве таких адъювантов можно использовать, например, лактозу, кукурузный крахмал или их дериваты, тальк, стеариновую кислоту или ее соли и т.п.
Подходящими адъювантами для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые вещества и жидкие полиолы и т.п.
Подходящими адъювантами для изготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертированный сахар, глюкоза и т.п.
Подходящими адъювантами для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин, растительные масла и т.п.
Подходящими адъювантами для суппозиториев являются, например, натуральные или отвержденные масла, воски, жиры, полутвердые или жидкие полиолы и т.п.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, вещества, повышающие вязкость, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать и другие терапевтически значимые вещества.
В соответствии с настоящим изобретением, соединения формулы (I) и их фармацевтически приемлемые соли можно применять для профилактики или лечения диабета, метаболического синдрома, дислипидемии, атеросклероза и ожирения. Дозировку можно варьировать в широком диапазоне и, разумеется, подбирать в соответствии с индивидуальными требованиями в каждом отдельном случае. В общем случае, для орального введения подходит суточная доза от 0.1 мг да 20 мг на 1 кг веса, предпочтительно около 0.5 мг-4 мг на кг веса (например, около 300 мг на человека), разделенная предпочтительно на 1-3 отдельных доз, состоящих, например, из одинаковых количеств. При этом следует иметь в виду, что вышеуказанный верхний предел дозы можно превысить, если к этому имеются показания.
Настоящее изобретение проиллюстрировано далее в Примерах, которые не носят ограничивающий характер.
В тех случаях, где приведенные в качестве примера вещества получают в виде смеси энантиомеров, чистые энантиомеры можно выделить описанными здесь способами или способами, известными специалисту в данной области техники, например, с помощью хиральной хроматографии или кристаллизации.
Примеры
Пример 1
2-(4-циклопропил-фенил)-8-(3-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-он
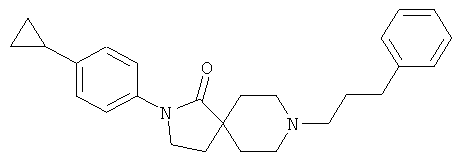
Стадия 1:
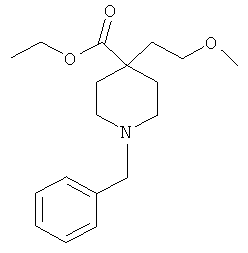
1-трет-бутиловый-4-этиловый диэфир 4-(2-метокси-этил)-пиперидин-1,4-дикарбоновой кислоты
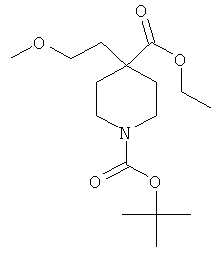
К раствору 38 мл (76 ммоль) LDA в THF (2Н) добавляли 9.8 г (38 ммоль) 1-трет-бутил 4-этил пиперидин-1,4-дикарбоксилата (коммерчески доступного) в 10 мл THF при -5°C и перемешивали при -5°C в течение 3 ч. Добавляли по каплям 10.58 г (76 ммоль) 1-бром-2-метоксиэтана в 10 мл THF, перемешивали в течение 1 ч при -5°C, после чего перемешивали при комнатной температуре в течение ночи. Добавляли KHSO4 водн. (1М) и экстрагировали смесь этилацетатом. Объединенные органические слои сушили над MgSO4 и выпаривали досуха. Осадок очищали в ходе колоночной хроматографии на силикагеле, элиюровали градиентом этилацетата и гептана. После выпаривания содержащих продукт фракций получали 8.19 г (68%) вещества, указанного в названии, в виде желтого масла. MS m/e: 315.2 [М+Н]+.
Стадия 2:
2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-он
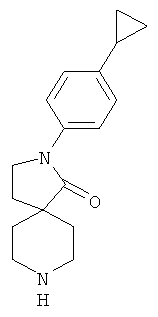
Смесь 1.3 г (4.1 ммоль) 1-трет-бутилового-4-этилового диэфира 4-(2-метокси-этил)-пиперидин-1,4-дикарбоновой кислоты, 0.604 г (4.5 ммоль) 4-циклопропиланилина и 8.24 мл (8.24 ммоль) диметилалюминийхлорида (1Н в гексане) в 100 мл толуола перемешивали при 115°C в течение 15 ч. После охлаждения до комнатной температуры смесь помещали на лед, подкисляли водным HCl до pH 2 и экстрагировали этилацетатом. Водный слой подщелачивали гранулами NaOH до pH 8 и экстрагировали с помощью DCM. Объединенные органические слои сушили над MgSO4 и выпаривали досуха. Осадок очищали с помощью колоночной хроматографии на силикагеле (амин), с помощью градиента, образованного этилацетатом и метанолом. После выпаривания содержащих продукт фракций получали 0.468 г (42%) вещества, указанного в названии, в виде светло-желтых кристаллов. MS m/e: 270.0 [М+Н]+.
Стадия 3:
2-(4-циклопропил-фенил)-8-(3-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-он
Смесь 20 мг (0.074 ммоль) 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она, 42 мкл уксусной кислоты, 44 мг (0.148 ммоль) триацетоксиборогидрида натрия и избытка 3-фенил-пропиональдегида в 2 мл THF перемешивали при комнатной температуре в течение ночи. Добавляли воду, смесь экстрагировали этилацетатом, и объединенные органические слои выпаривали досуха. Осадок растворяли в метаноле и очищали с помощью препаративной обращенно-фазной HPLC, элюировали градиентом ацетонитрила, воды и NEt3. Содержащие продукт фракции выпаривали с образованием 7.1 мг (25%) вещества, указанного в названии. MS m/e: 389.4 [М+Н]+.
Пример 2
2-(4-циклопропил-фенил)-8-фенэтил-2,8-диаза-спиро[4.5]декан-1-он
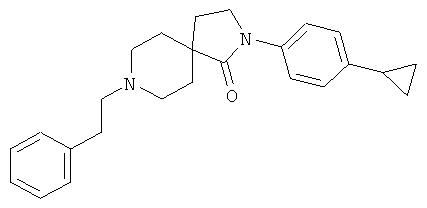
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(3-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-она (пример 1), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и фенил-ацетальдегида (коммерчески доступного) путем восстановительного аминирования. MS m/e: 375.4 [М+Н]+.
Пример 3
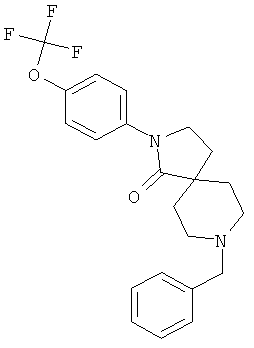
2-(4-циклопропил-фенил)-8-(4-трифторметил-бензил)-2,8-диаза-спиро[4.5]декан-1-он
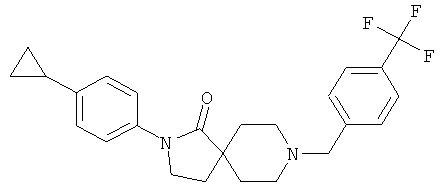
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(3-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-она (пример 1), указанное в названии вещество получали из 2-(4-цикпопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и 4-трифторметил-бензальдегида (коммерчески доступного) путем восстановительного аминирования. MS m/e: 429.4 [М+Н]+.
Пример 4
2-(4-циклопропил-фенил)-8-(1-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-он
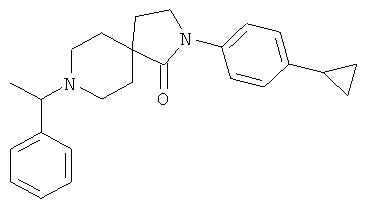
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(3-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-он (пример 1), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и 1-фенил-этанона (коммерчески доступного) путем восстановительного аминирования. MS m/e: 375.3 [М+Н]+.
Пример 5
2-(4-циклопропил-фенил)-8-[1-(3-трифторметил-фенил)-этил]-2,8-диаза-спиро[4.5]декан-1-он
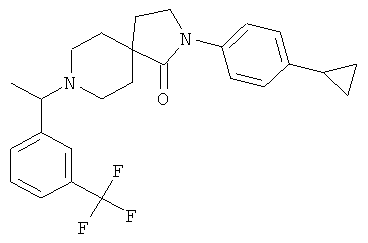
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(3-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-она (пример 1), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и 1-(3-трифторметил-фенил)-этанона (коммерчески доступного) путем восстановительного аминирования. MS m/e: 443.4 [М+Н]+.
Пример 6
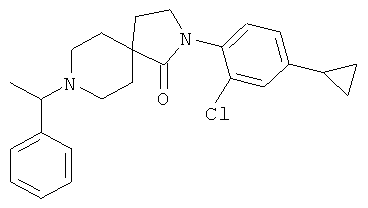
2-(2-хлор-4-циклопропил-фенил)-8-(1-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-он
Стадия 1:
2-(2-хлор-4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-он
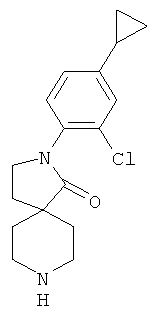
Смесь 0.275 г (1 ммоль) 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она, 1.57 г (11.3 ммоль) сульфурилхлорида и 0.154 г (1.52 ммоль) NEt3 в 50 мл CHCI3 перемешивали при комнатной температуре. После выпаривания летучих веществ остаток растворяли в DMF и очищали с помощью препаративной обращенно-фазной HPLC, элюировали градиентом ацетонитрила, воды и NEt3. Фракции, содержащие продукт, выпаривали с получением 94 мг (30%) вещества, указанного в названии, в виде светло-желтой смолы. MS m/e: 305.1 [М+Н]+.
Стадия 2:
2-(2-хлор-4-циклопропил-фенил)-8-(1-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-он
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(3-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-она (пример 1), указанное в названии вещество получали из 2-(2-хлор-4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и 1-фенил-этанона (коммерчески доступного) путем восстановительного аминирования. MS m/e: 409.4 [М+Н]+.
Пример 7
2-(4-циклопропил-фенил)-8-(1-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-он
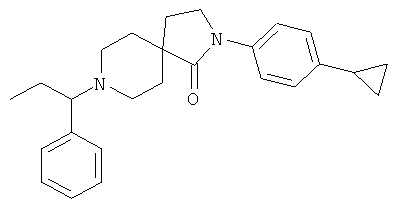
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(3-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-она (пример 1), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и 1-фенил-пропан-1-она (коммерчески доступного) путем восстановительного аминирования. MS m/e: 389.4 [М+Н]+.
Пример 8
8-бензил-2-(4-трифторметокси-фенил)-2,8-диаза-спиро[4.5]декан-1-он
Стадия 1:
этиловый эфир 1-бензил-4-(2-метокси-этил)-пиперидин-4-карбоновой кислоты
По аналогии со способом, описанным для синтеза 1-трет-бутилового-4-этилового диэфира 4-(2-метокси-этил)-пиперидин-1,4-дикарбоновой кислоты (пример 1, стадия 1), указанное в названии вещество получали из этилового эфира 1-бензил-пиперидин-4-карбоновой кислоты и 1-бром-2-метокси-этана путем депротонирования с помощью LDA. MS m/e: 306.2 [М+Н]+.
Стадия 2:
8-бензил-2-(4-трифторметокси-фенил)-2,8-диеза-спиро[4,5]декан-1-он
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она (пример 1, стадия 2), указанное в названии вещество получали из этилового эфира 1-бензил-4-(2-метокси-этил)-пиперидин-4-карбоновой кислоты и 4-трифторметокси-фениламина в присутствии хлорида диметилалюминия. MS m/e: 405.4 [М+Н]+.
Пример 9
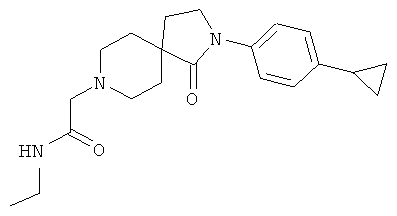
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамид
Стадия 1:
[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-уксусная кислота
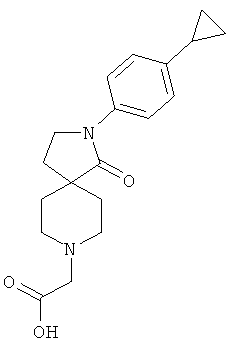
Смесь 0.4 г (1.47 ммоль) 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она, 0.226 г (1.63 ммоль) бромуксусной кислоты и 0.299 г (2.96 ммоль) NEt3 в 50 мл DCM перемешивали при комнатной температуре в течение 16 ч. Смесь концентрировали и использовали без дополнительной очистки в последующей стадии. MS m/e: 329.3 [М+Н]+.
Стадия 2:
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамид
Смесь 42.7 мг (0.13 ммоль) [2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-уксусной кислоты, 54.2 мг (0.195 ммоль) TBTU, 26 мг (0.26 ммоль) NEt3 и 8.7 мг (0.195 ммоль) этиламина в 2 мл DMF перемешивали при комнатной температуре в течение 16 ч и выпаривали досуха. Остаток растворяли в DMF и очищали с помощью препаративной обращенно-фазной HPLC, элюировали градиентом ацетонитрила, воды и NEt3. Фракции, содержащие продукт, выпаривали с получением 16.2 мг (35%) вещества, указанного в названии. MS m/e: 356.3 [М+Н]+.
Пример 10
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N,N-диэтил-ацетамид
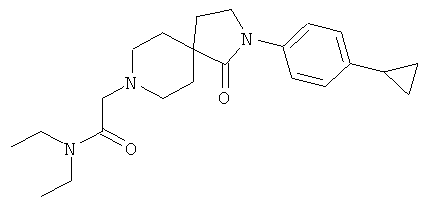
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из [2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-уксусной кислоты и диэтиламина. MS m/e: 384.4 [М+Н]+.
Пример 11
N-бутил-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-ацетамид
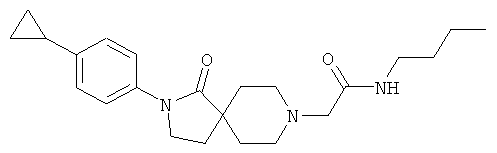
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из [2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-уксусной кислоты и бутиламина. MS m/e: 384.4 [М+Н]+.
Пример 12
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-трифторметил-бензил)-ацетамид
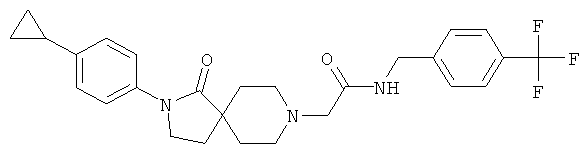
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из [2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-уксусной кислоты и 4-трифторметил-бензиламина. MS m/e: 486.4 [М+Н]+.
Пример 13
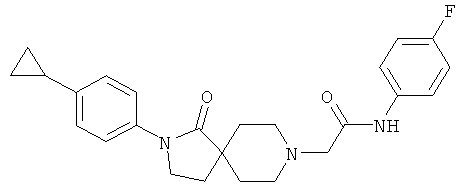
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из [2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-уксусной кислоты и 4-фтор-фениламина. MS m/e: 422.3 [М+Н].
Пример 14
2-(4-циклопропил-фенил)-8-(2-оксо-2-пирролидин-1-ил-этил)-2,8-диаза-спиро[4.5]декан-1-он
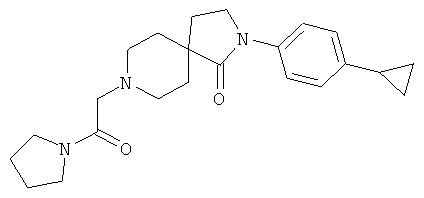
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из [2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-уксусной кислоты и пирролидина. MS m/e: 382.3 [М+Н]+.
Пример 15
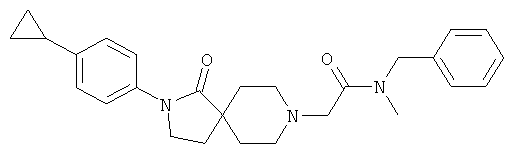
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из [2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-уксусной кислоты и бензил-метил-амина. MS m/e: 432.4 [М+Н]+.
Пример 16
N-Циклогексил-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-метил-ацетамид
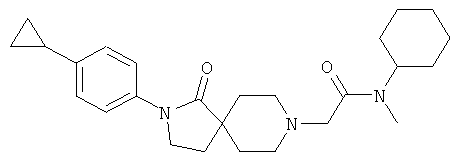
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из [2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-уксусной кислоты и циклогексил-метил-амина. MS m/e: 424.4 [М+Н]+.
Пример 17
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(3-метокси-пропил)-ацетамид
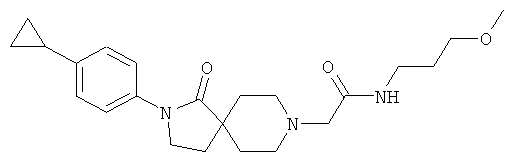
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из [2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-уксусной кислоты и 3-метокси-пропиламина. MS m/e: 400.4 [М+Н].
Пример 18
N-бутил-3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионамид
Стадия 1:
3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионовая кислота
По аналогии со способом, описанным для синтеза [2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-уксусной кислоты (пример 9, стадия 1), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и 3-бром-пропионовой кислоты. MS m/e: 343.3 [М+Н]+.
Стадия 2:
N-бутил-3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионамид
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из 3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионовой кислоты и бутиламина. MS m/e: 398.4 [М+Н]+.
Пример 19
3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-трифторметил-бензил)-пропионамид
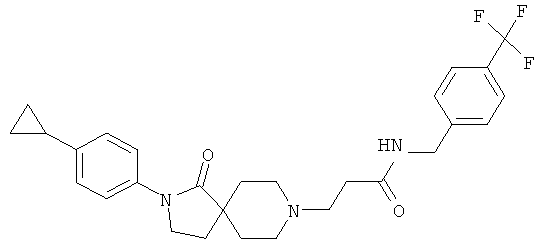
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из 3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионовой кислоты и 4-трифторметил-бензиламина. MS m/e: 500.4 [М+Н]+.
Пример 20
3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-фтор-фенил)-пропионамид
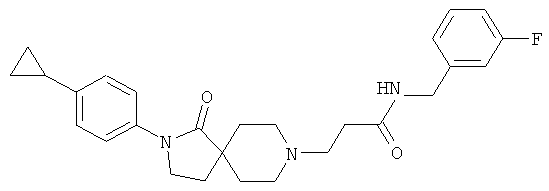
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из 3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионовой кислоты и 4-фтор-фениламина. MS m/e: 436.4 [М+Н]+.
Пример 21
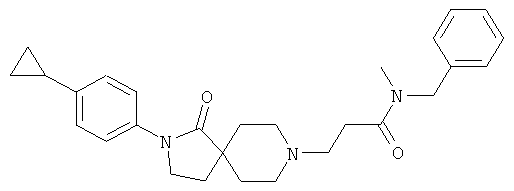
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из 3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионовой кислоты и бензил-метил-амина. MS m/e: 446.4 [М+Н]+.
Пример 22
N-Циклогексил-3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-метил-пропионамид
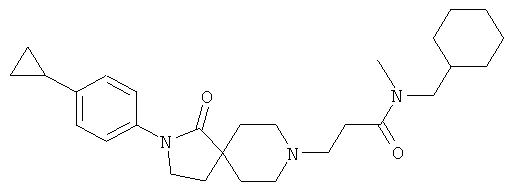
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из 3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионовой кислоты и циклогексил-метил-амина. MS m/e: 438.4 [М+Н]+.
Пример 23
2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-он
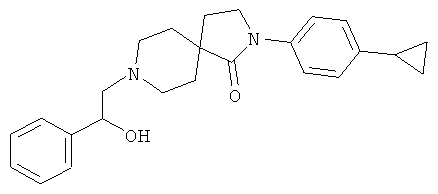
Смесь 34.6 мг (0.128 ммоль) 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она, 23 мг (0.192 ммоль) 2-фенил-оксирана и 38 мг (0.384 ммоль) NEt3 в 2 мл DCM перемешивали при 50°С в течение 2 ч и концентрировали. Остаток растворяли в метаноле и очищали с помощью препаративной обращенно-фазной HPLC, элюировали градиентом ацетонитрила, воды и NEt3. Фракции, содержащие продукт, выпаривали с получением 7.1 мг (14%) вещества, указанного в названии. MS m/e: 391.4 [М+Н]+.
Пример 24
8-[2-(4-хлор-фенил)-2-гидрокси-этил]-2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-он
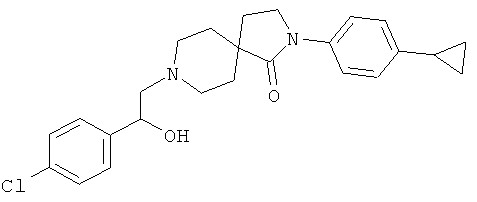
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и 2-(4-хлор-фенил)-оксирана. MS m/e: 425.4 [М+Н]+.
Пример 25
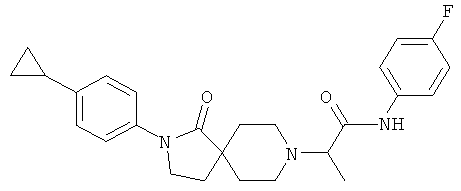
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-фтор-фенил)-пропионамид
Стадия 1:
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионовая кислота
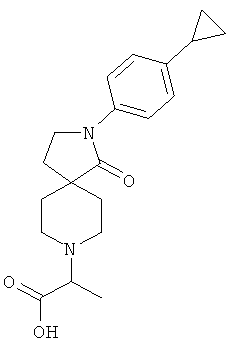
Смесь 200 мг (0.74 ммоль) 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она, 168 мг (1.11 ммоль) 2-бром-пропионовой кислоты и 224 мг (2.21 ммоль) NEt3 в 5 мл DCE нагревали до 80°С в течение 2 ч и концентрировали. Остаток растворяли в метаноле и очищали с помощью препаративной обращенно-фазной HPLC, элюировали градиентом ацетонитрила, воды и муравьиной кислоты. Фракции, содержащие продукт, выпаривали с получением 49.4 мг (19%) вещества, указанного в названии. MS m/e: 343.2 [М+Н]+.
Стадия 2:
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-фтор-фенил)-пропионамид
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионовой кислоты и 4-фтор-фениламина. MS m/e: 436.3 [М+Н]+.
Пример 26
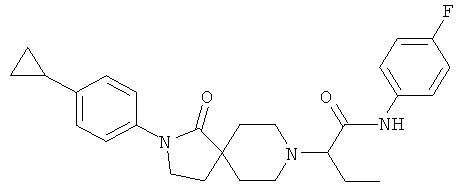
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-фтор-фенил)-бутирамид
Стадия 1:
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-масляная кислота
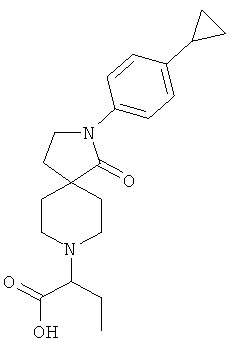
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионовой кислоты (пример 25, стадия 1), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и 2-бром-масляной кислоты. MS m/e: 357.3 [М+Н]+.
Стадия 2:
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-(4-фтор-фенил)-бутирамид
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-масляной кислоты и 4-фтор-фениламина. MS m/e: 450.4 [М+Н]+.
Пример 27
N-бутил-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионамид
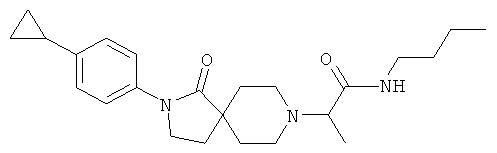
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионовой кислоты и бутиламина. MS m/e: 398.4 [М+Н]+.
Пример 28
N-бутил-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-бутирамид
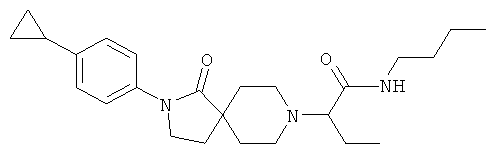
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-масляной кислоты и бутиламина. MS m/e: 412.2 [М+Н]+.
Пример 29
N-бутил-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4,5]дек-8-ил]-2-фенил-ацетамид
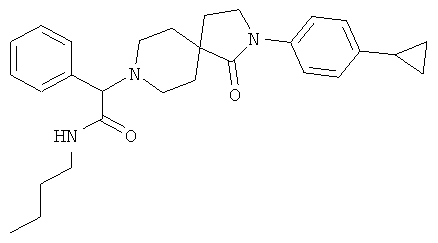
Стадия 1:
[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-фенил-уксусная кислота
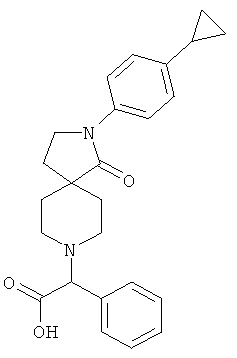
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионовой кислоты (пример 25, стадия 1), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и бром-фенил-уксусной кислоты. MS m/e: 460.4 [М+Н]+.
Стадия 2:
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из [2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-фенил-уксусной кислоты и бутиламина. MS m/e: 460.4 [М+Н]+.
Пример 30
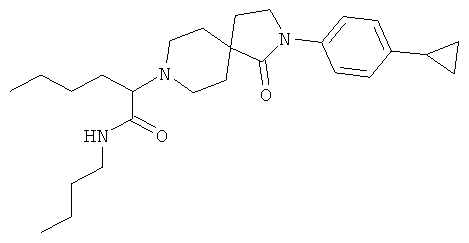
бутиламид 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-гексановой кислоты
Стадия 1:
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-гексановая кислота

По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионовой кислоты (пример 25, стадия 1), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и 2-бром-гексановой кислоты. MS m/e: 385.3 [М+Н]+.
Стадия 2:
бутиламид 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-гексановой кислоты
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-гексановой кислоты и бутиламина. MS m/e: 440.4 [М+Н]+.
Пример 31
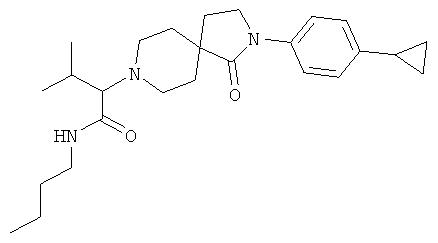
N-бутил-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-3-метил-бутирамид
Стадия 1:
2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-3-метил-масляная кислота
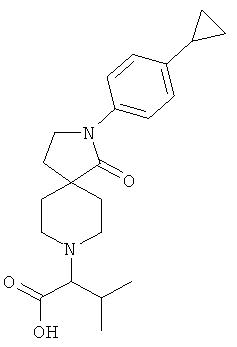
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-пропионовой кислоты (пример 25, стадия 1), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и 2-бром-3-метил-масляной кислоты. MS m/e:
371.3 [М+Н]\
Стадия 2:
N-бутил-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-3-метил-бутирамид
По аналогии со способом, описанным для синтеза 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-N-этил-ацетамида (пример 9), указанное в названии вещество получали из 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-3-метил-масляной кислоты и бутиламина. MS m/e:
426.4 [М+Н]+.
Пример 32
2-(4-циклопропил-фенил)-8-((5)-2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-он
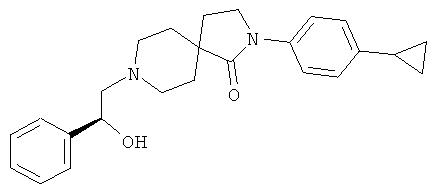
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и (8)-2-фенил-оксирана. MS m/e: 391.3 [М+Н]+.
Пример 33
2-(4-циклопропил-фенил)-8-((S)-2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-он
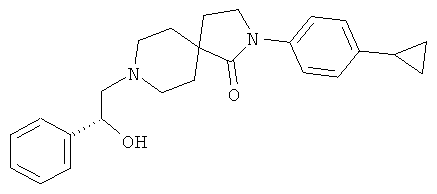
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и (R)-2-фенил-оксирана. MS m/e: 391.3 [М+Н]+.
Пример 34
2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-он
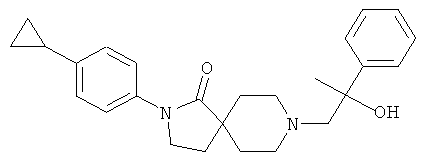
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и 2-метил-2-фенил-оксирана. MS m/e: 405.3 [М+Н]+.
Пример 35
2-(4-циклопропил-фенил)-8-[(R)-2-(4-фтор-фенил)-2-гидрокси-этил]-2,8-диаза-спиро[4.5]декан-1 -он
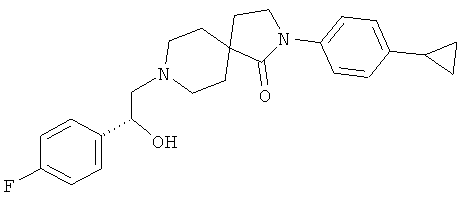
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1 -она (пример 23), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и (R)-2-(4-фтор-фенил)-оксирана. MS m/e: 409.3 [М+Н]+.
Пример 36
8-[(R)-2-(3-хлор-фенил)-2-гидрокси-этил]-2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-он
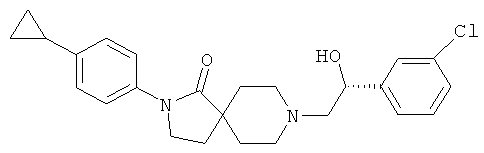
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и (R)-2-(3-хлор-фенил)-оксирана. MS m/e: 425.3 [М+Н]+.
Пример 37
2-(4-циклопропил-фенил)-8-[2-(3,4-дихлор-фенил)-2-гидрокси-этил]-2,8-диаза-спиро[4.5]декан-1-он
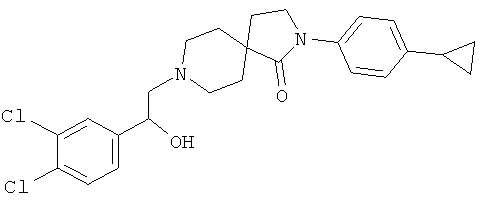
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и (R)-2-(3,4-дихлор-фенил)-оксирана. MS m/e: 459.3 [М+Н]+.
Пример 38
2-(4-циклопропил-фенил)-8-[2-(2,4-дихлор-фенил)-2-гидрокси-этил]-2,8-диаза-спиро[4.5]декан-1-он
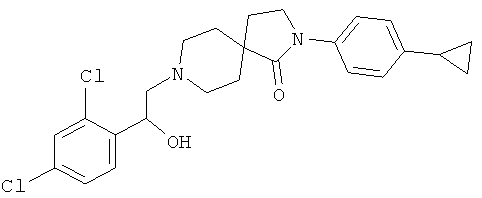
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и 2-(2,4-дихлор-фенил)-оксирана. MS m/e: 459.3 [М+Н]+.
Пример 39
8-[2-(2-хлор-6-фтор-фенил)-2-гидрокси-этил]-2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1 -он
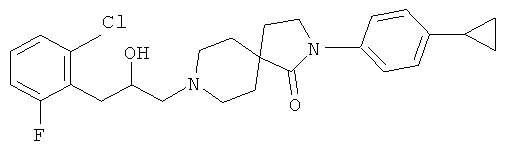
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и 2-(2-хлор-6-фтор-бензил)-оксирана. MS m/e: 443.3 [М+Н]+.
Пример 40
3-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-2-гидрокси-3-(4-метокси-фенил)-пропионамид
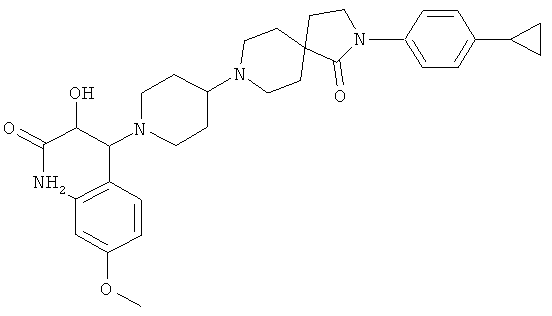
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-(4-циклопропил-фенил)-2,8-диаза-спиро[4.5]декан-1-она и амида 3-(4-метокси-фенил)-оксиран-2-карбоновой кислоты. MS m/e: 464.4 [М+Н]+.
Пример 41
Бутиламид (5)-2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-гексановой кислоты
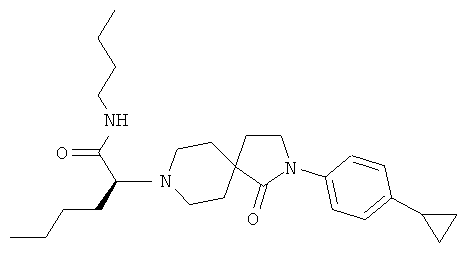
Соединение, указанное в названии, получали из бутиламида 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-гексановой кислоты (пример 30) путем разделения с помощью хиральной HPLC. MS m/e: 464.4 [М+Н]+.
Пример 42
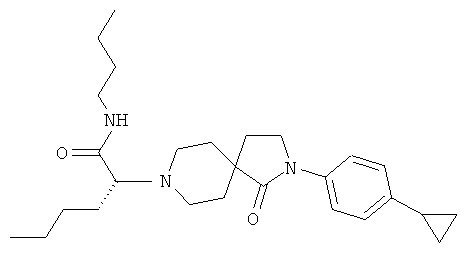
Указанное в название соединение получали из бутиламида 2-[2-(4-циклопропил-фенил)-1-оксо-2,8-диаза-спиро[4.5]дек-8-ил]-гексановой кислоты (пример 30) путем разделения с помощью хиральной HPLC. MS m/e: 464.4 [М+Н]+.
Пример 43
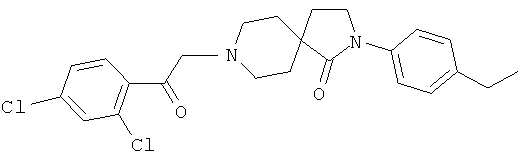
8-[2-(2,4-дихлор-фенил)-2-оксо-этил]-2-(4-этил-фенил)-2,8-диаза-спиро[4.5]декан-1-он
Стадия 1:
2-(4-Этил-фенил)-2,8-диаза-спиро[4.5]декан-1-он
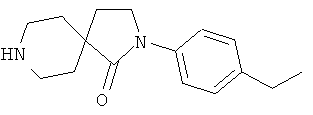
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(3-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-она (пример 1, стадия 2), указанное в названии вещество получали из 1-трет-бутилового-4-этилового диэфира 4-(2-метокси-этил)-пиперидин-1,4-дикарбоновой кислоты и 4-этил-фениламина. MS m/e: 259.2 [М+Н]+.
Смесь 320 мг (1.24 ммоль) 2-(4-этилфенил)-2,8-диазаспиро[4.5]декан-1-она, 431 мг (1.61 ммоль) 2-бром-1-(2,4-дихлорфенил)этанона и 376 мг (3.72 ммоль) триэтиламина в 50 мл DCM перемешивали при 22°C в течение 16 ч. Неочищенную реакционную смесь концентрировали в вакууме. Неочищенный материал очищали в ходе флэш-хроматографии, элюировали градиентом этилацетата и гептана и получали после выпаривания содержащих продукт фракций 435 мг (79%) вещества, указанного в названии, в виде оранжевых кристаллов. MS m/e: 445.2 [М+Н]+.
Пример 44
8-[2-(2,4-дихлор-фенил)-2-гидрокси-этил]-2-[4-(2,2,2-трифтор-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-он
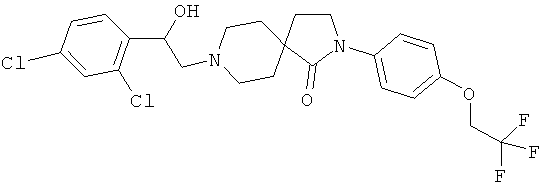
Стадия 1:
2-[4-(2,2,2-трифтор-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-он
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(3-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-она (пример 1, стадия 2), указанное в названии вещество получали из 1-трет-бутилового-4-этилового диэфира 4-(2-метокси-этил)-пиперидин-1,4-дикарбоновой кислоты и 4-(2,2,2-трифтор-этокси)-фениламина. MS m/e: 329.2 [М+Н]+.
Стадия 2:
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-[4-(2,2,2-трифтор-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-она и 2-(2,4-дихлор-фенил)-оксирана. MS m/e: 517.3 [М+Н]+.
Пример 45
8-[2-(2,4-дихлор-фенил)-2-гидрокси-этил]-2-[6-((R)-2,2,2-трифтор-1-метил-этокси)-пиридин-3-ил]-2,8-диаза-спиро[4.5]декан-1-он
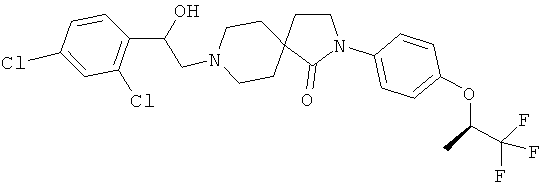
Стадия 1:
2-[6-((R)-2,2,2-трифтор-1-метил-этокси)-пиридин-3-ил]-2,8-диаза-спиро[4.5]декан-1-он
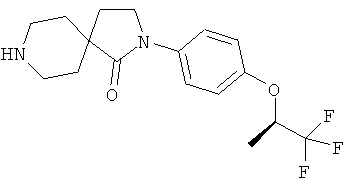
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(3-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-она (пример 1, стадия 2), указанное в названии вещество получали из 1-трет-бутилового-4-этилового диэфира 4-(2-метокси-этил)-пиперидин-1,4-дикарбоновой кислоты и 6-((R)-2,2,2-трифтор-1-метил-этокси)-пиридин-3-иламина. MS m/e: 344.2 [М+Н]+.
Стадия 2:
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-[6-((R)-2,2,2-трифтор-1-метил-этокси)-пиридин-3-ил]-2,8-диаза-спиро[4.5]декан-1-она и 2-(2,4-дихлор-фенил)-оксирана. MS m/e: 532.3 [М+Н]+.
Пример 46
8-[2-(2,4-дихлор-фенил)-2-гидрокси-этил]-2-[4-(2,2,2-трифтор-этил)-фенил]-2,8-диаза-спиро[4.5]декан-1-он
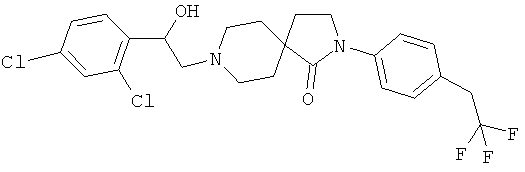
Стадия 1:
2-[4-(2,2,2-трифтор-этил)-фенил]-2,8-диаза-спиро[4.5]декан-1-он
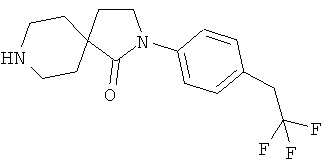
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(3-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-она (пример 1, стадия 2), указанное в названии вещество получали из 1-трет-бутилового-4-этилового диэфира 4-(2-метокси-этил)-пиперидин-1,4-дикарбоноваой кислоты и 4-(2,2,2-трифтор-этил)-фениламина. MS m/e: 313.2 [М+Н]+.
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1 -она (пример 23), указанное в названии вещество получали из 2-[4-(2,2,2-трифтор-этил)-фенил]-2,8-диаза-спиро[4.5]декан-1-она и 2-(2,4-дихлор-фенил)-оксирана. MS m/e: 501.3 [М+Н]+.
Пример 47
8-[2-(2-хлор-6-фтор-фенил)-2-гидрокси-этил]-2-[4-(2,2,2-трифтор-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-он
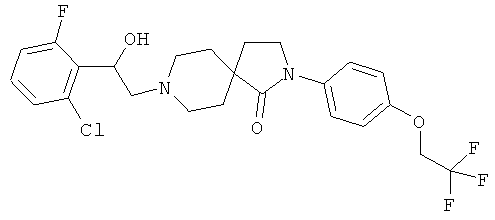
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-[4-(2,2,2-трифтор-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-она и 2-(2-хлор-6-фтор-фенил)-оксирана. MS m/e: 501.3 [М+Н]+.
Пример 48
8-[2-(2-хлор-6-фтор-фенил)-2-гидрокси-этил]-2-[4-((К)-2,2,2-трифтор-1-метил-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-он
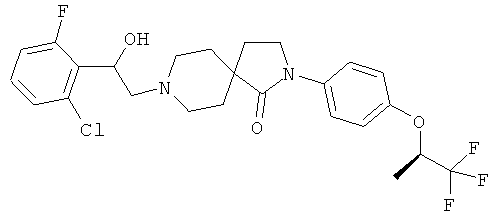
2-[4-((К)-2,2,2-трифтор-1-метил-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-он
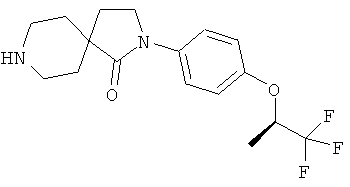
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(3-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-она (пример 1, стадия 2), указанное в названии вещество получали из 1-трет-бутилового-4-этилового диэфира 4-(2-метокси-этил)-пиперидин-1,4-дикарбоновой кислоты и 4-((R)-2,2,2-трифтор-1-метил-этокси)-фениламина. MS m/e: 343.2 [М+Н]+.
Стадия 2:
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-[4-((R)-2,2,2-трифтор-1-метил-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1 -она и 2-(2-хлор-6-фтор-фенил)-оксирана. MS m/e: 515.3 [М+Н]+.
Пример 49
8-[2-(2-хлор-6-фтор-фенил)-2-гидрокси-этил]-2-[6-((Р)-2,2,2-трифтор-1-метил-этокси)-пиридин-3-ил]-2,8-диаза-спиро[4.5]декан-1-он
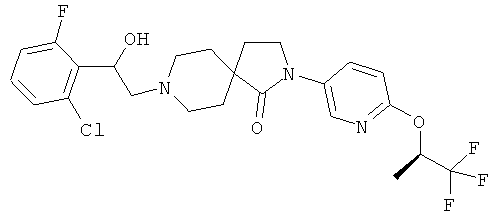
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-[6-((R)-2,2,2-трифтор-1-метил-этокси)-пиридин-3-ил]-2,8-диаза-спиро[4.5]декан-1-она и 2-(2-хлор-6-фтор-фенил)-оксирана. MS m/e: 516.3 [М+Н]+.
Пример 50
8-[2-(2-хлор-6-фтор-фенил)-2-гидрокси-этил]-2-[4-(2,2,2-трифтор-этил)-фенил]-2,8-диаза-спиро[4.5]декан-1-он
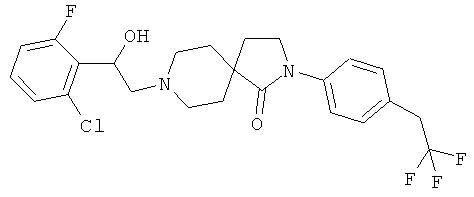
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1 -она (пример 23), указанное в названии вещество получали из 2-[4-(2,2,2-трифтор-этил)-фенил]-2,8-диаза-спиро[4.5]декан-1-она и 2-(2-хлор-6-фтор-фенил)-оксирана. MS m/e: 485.3 [М+Н]+.
Пример 51
8-[2-(2,4-дихлор-фенил)-2-гидрокси-этил]-2-[4-((R)-2,2,2-трифтор-1-метил-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-он
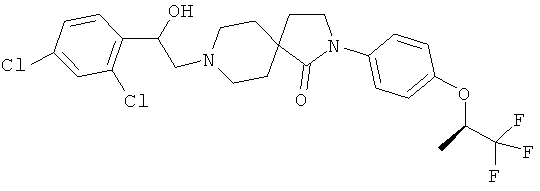
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-[4-((R)-2,2,2-трифтор-1-метил-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-она и 2-(2,4-дихлор-фенил)-оксирана. MS m/e: 531.3 [М+Н]+.
Пример 52
8-[2-(2,4-дихлор-фенил)-2-гидрокси-этил]-2-[4-((5)-2,2,2-трифтор-1-метил-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-он
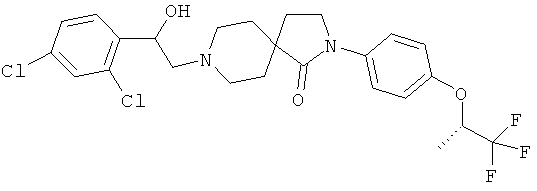
Стадия 1:
2-[4-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-он
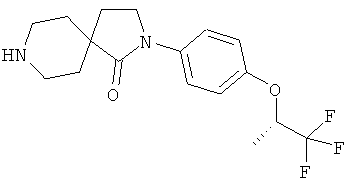
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(3-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-она (пример 1, стадия 2), указанное в названии вещество получали из 1-трет-бутилового-4-этилового диэфира 4-(2-метокси-этил)-пиперидин-1,4-дикарбоновой кислоты и 4-((S)-2,2,2-трифтор-1-метил-этокси)-фениламина. MS m/e: 343.2 [М+Н]+.
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1 -она (пример 23), указанное в названии вещество получали из 2-[4-((8)-2,2,2-трифтор-1-метил-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-она и 2-(2,4-дихлор-фенил)-оксирана. MS m/e: 531.3 [М+Н]+.
Пример 53
8-[2-(2,4-дихлор-фенил)-2-гидрокси-этил]-2-[6-((8)-2,2,2-трифтор-1-метил-этокси)-пиридин-3-ил]-2,8-диаза-спиро[4.5]декан-1-он
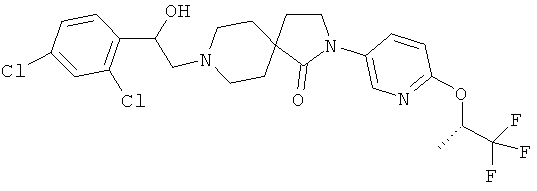
Стадия 1:
2-[6-((5)-2,2,2-трифтор-1-метил-этокси)-пиридин-3-ил]-2,8-диаза-спиро[4.5]декан-1-он
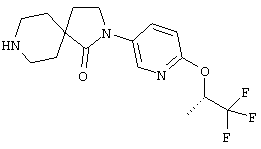


По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(3-фенил-пропил)-2,8-диаза-спиро[4.5]декан-1-она (пример 1, стадия 2), указанное в названии вещество получали из 1-трет-бутилового-4-этилового диэфира 4-(2-метокси-этил)-пиперидин-1,4-дикарбоновой кислоты и 6-((S)-2,2,2-трифтор-1-метил-этокси)-пиридин-3-иламина. MS m/e: 344.2 [М+Н]+.
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-[6-((S)-2,2,2-трифтор-1-метил-этокси)-пиридин-3-ил]-2,8-диаза-спиро[4.5]декан-1-она и 2-(2,4-дихлор-фенил)-оксирана. MS m/e: 532.3 [М+Н]+.
Пример 54
8-[2-(2-хлор-6-фтор-фенил)-2-гидрокси-этил]-2-[4-((8)-2,2,2-трифтор-1-метил-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-он
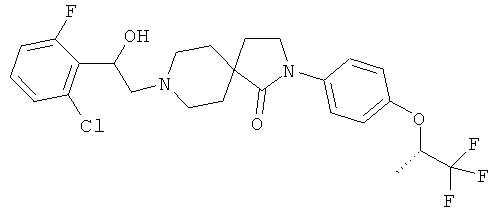
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-[4-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-2,8-диаза-спиро[4.5]декан-1-она и 2-(2-хлор-6-фтор-фенил)-оксирана. MS m/e: 515.3 [М+Н]+.
Пример 55
8-[2-(2-хлор-6-фтор-фенил)-2-гидрокси-этил]-2-[6-((S)-2,2,2-трифтор-1-метил-этокси)-пиридин-3-ил]-2,8-диаза-спиро[4.5]декан-1-он
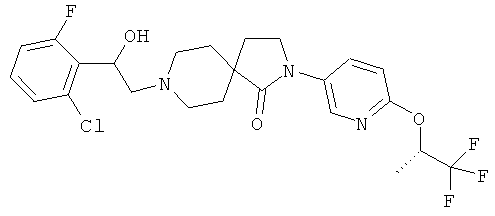
По аналогии со способом, описанным для синтеза 2-(4-циклопропил-фенил)-8-(2-гидрокси-2-фенил-этил)-2,8-диаза-спиро[4.5]декан-1-она (пример 23), указанное в названии вещество получали из 2-[6-((S)-2,2,2-трифтор-1-метил-этокси)-пиридин-3-ил]-2,8-диаза-спиро[4.5]декан-1-она и 2-(2-хлор-6-фтор-фенил)-оксирана. MS m/e: 516.3 [М+Н]+.
Пример A
Соединение согласно формуле (I), описанное выше, можно применять известным, по существу, способом в качестве активного ингредиента для производства таблеток следующего состава:
На одну таблетку
|
Пример B
Соединение согласно формуле (I), описанное выше, можно применять известным, по существу, способом в качестве активного ингредиента для производства капсул следующего состава:
На одну капсулу
|