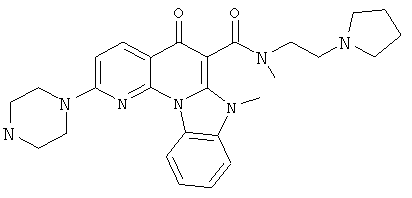
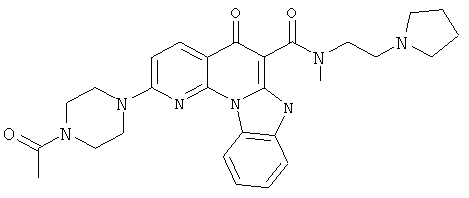
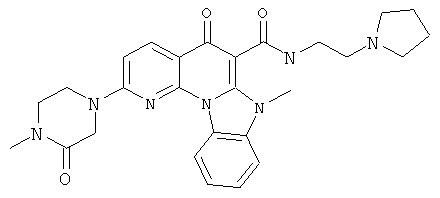
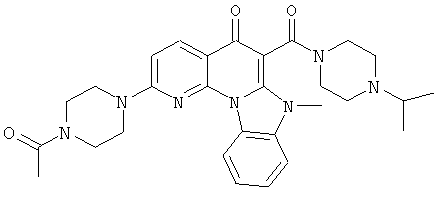
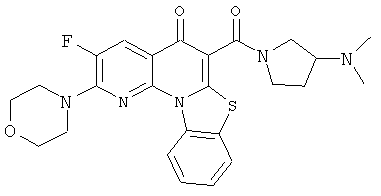
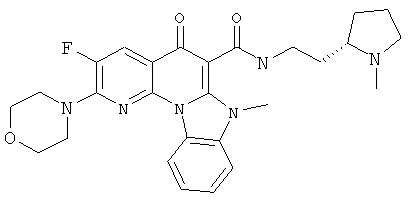
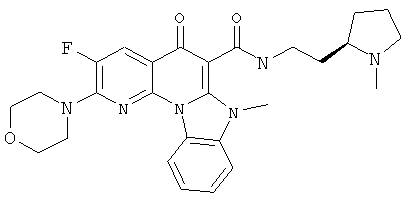
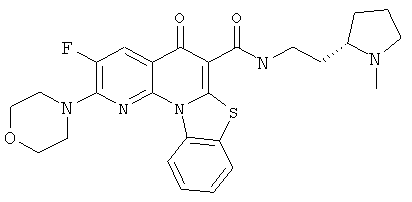
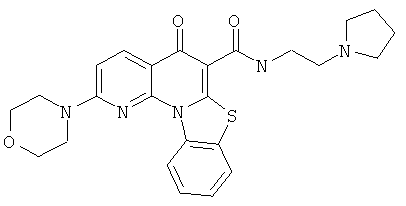
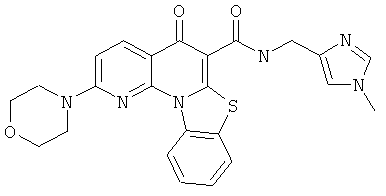
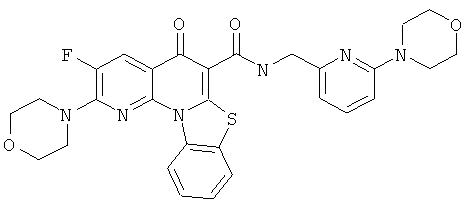
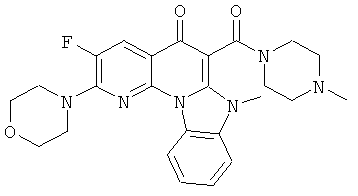
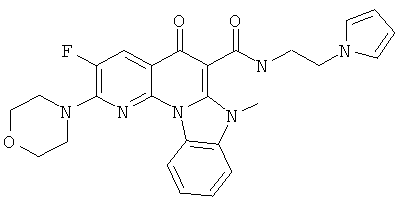
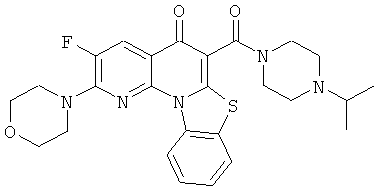
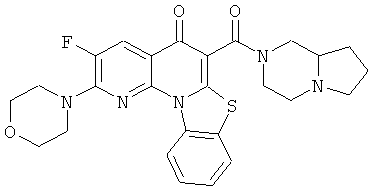
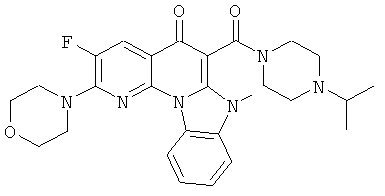
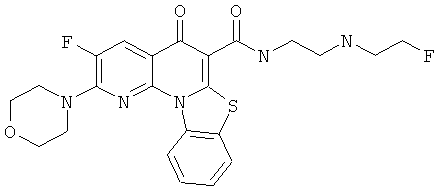
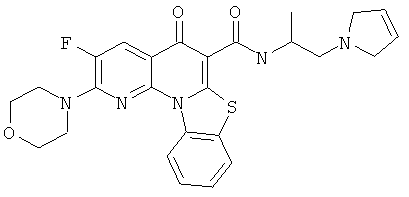
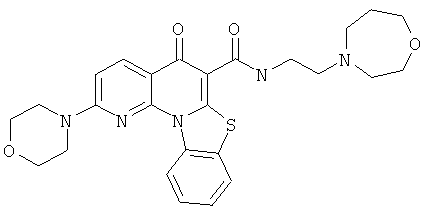
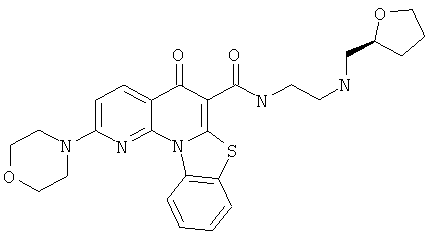
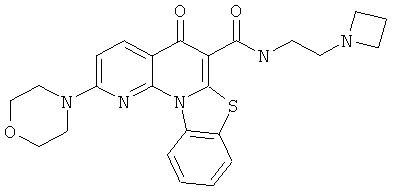
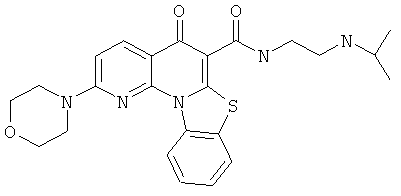
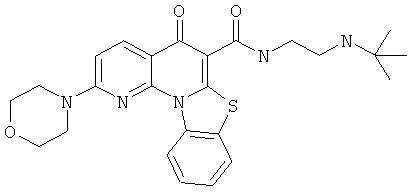
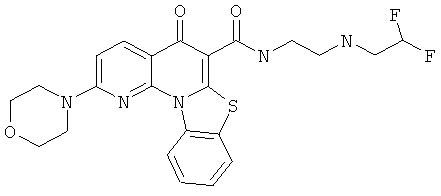
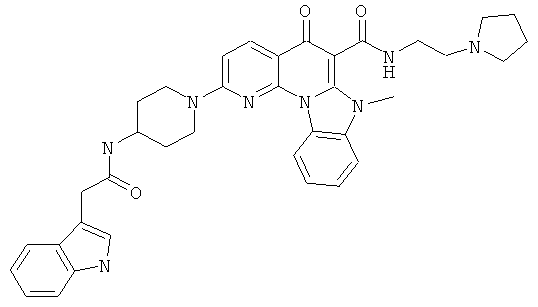
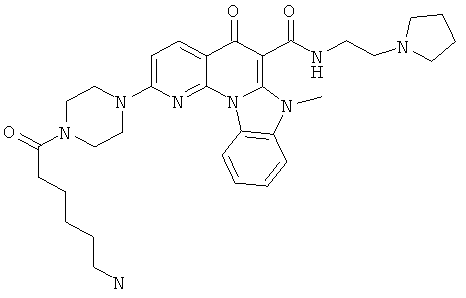
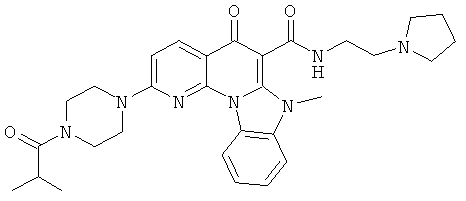
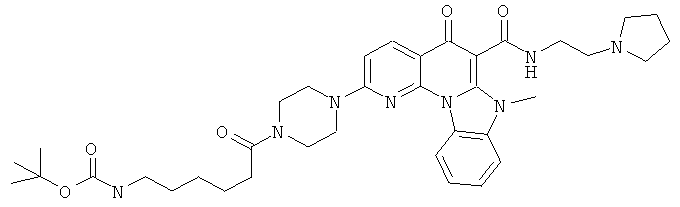
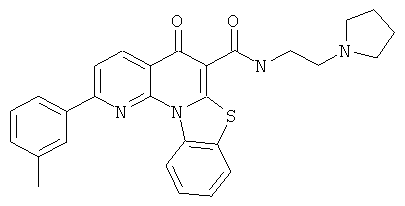
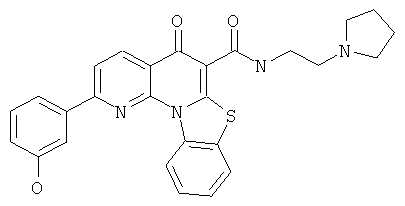
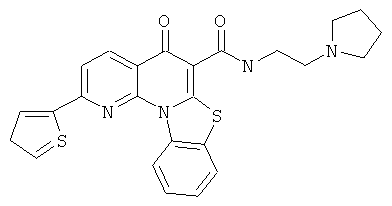
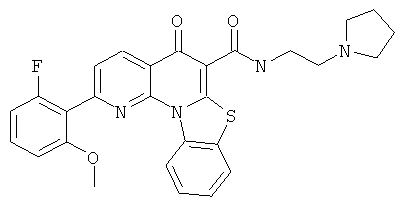
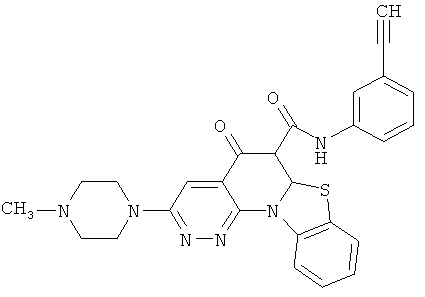
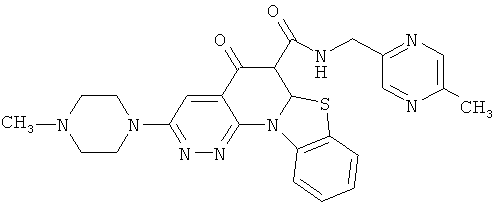
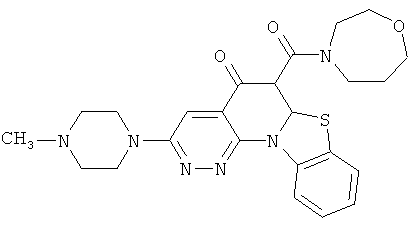
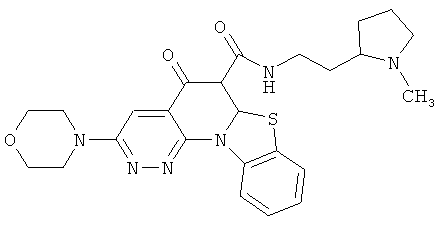
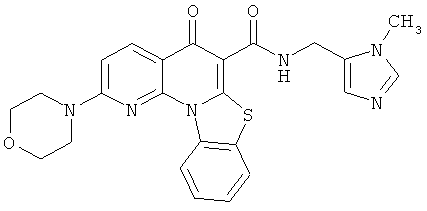
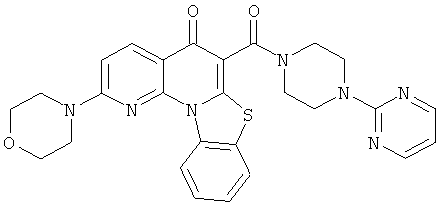
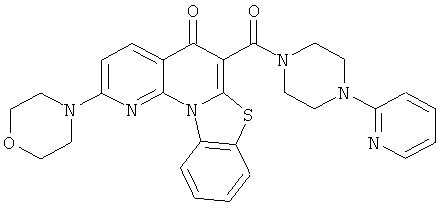
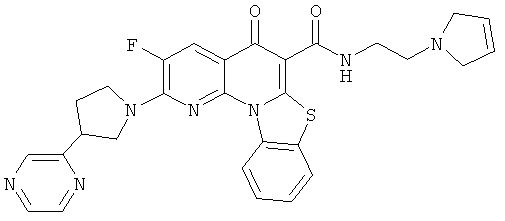
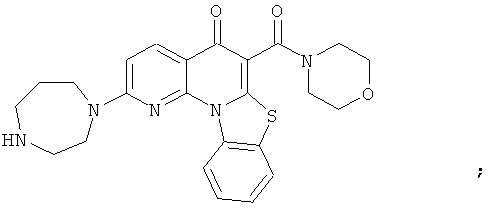
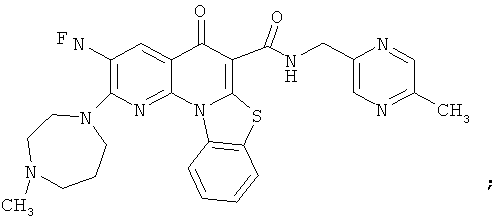
АНАЛОГИ ХИНОЛОНА И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение касается новых хинолоновых соединений и их фармацевтических композиций. Настоящее изобретение касается также способов применения и получения таких хинолоновых соединений и композиций для ингибирования клеточной пролиферации и/или индуцирования апоптоза клеток.
Раскрытие изобретения
В настоящем изобретении описаны новые хинолоновые соединения и их фармацевтические композиции, которые могут ингибировать пролиферацию клеток и/или индуцировать апоптоз клеток. В настоящем изобретении также описаны способы получения таких хинолоновых соединений и композиций, и способы лечения клеточно-пролиферативных расстройств введением указанных соединений.
В одном аспекте, в настоящем изобретении описано соединение Формулы (I),
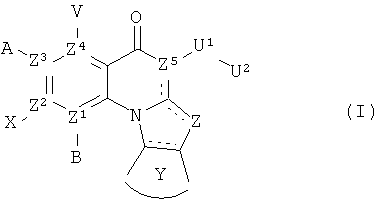
или его фармацевтически приемлемая соль или сложный эфир;
где 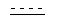 обозначает необязательно ненасыщенную связь;
обозначает необязательно ненасыщенную связь;
каждый из В, X, А или V отсутствует, если Z1, Z2, Z3 и Z4, соответственно, представляет собой N; и
каждый из В, X, А и V независимо представляет собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0, -L-N(R)-W0, А2 или А3, когда каждый из Z1, Z2, Z3 и Z4, соответственно, представляет собой С;
Z представляет собой О, S, CR4 2, NR4R4, CR4R4, CR4, NR4 или N;
каждый из Z1, Z2, Z3 и Z4 независимо представляет собой С или N, при условии, что никакие три атома N не являются соседними;
Z5 представляет собой С; или Z5 может представлять собой N, когда Z представляет собой N;
Y представляет собой необязательно замещенное 5-6 членное карбоциклическое или гетероциклическое кольцо;
U1 представляет собой -C(=T)N(R)-, -C(=T)N(R)O-, -С(=Т)-, -SO2N(R)-, -SO2N(R)N(R0)-, -SO2- или -SO3-, где Т представляет собой О, S или NH; или U1 может представлять собой связь, когда Z5 представляет собой N или U2 представляет собой Н или -CN;
U2 представляет собой Н, -CN, или С3-С7 циклоалкильную, С1-С10 алкильную, С1-С10 гетероалкильную, С2-С10 алкенильную или С2-С10 гетероалкенильную группу, каждая из которых может быть при необходимости замещена одним или более атомами галогена, группой =O, или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом; или U2 представляет собой -W, -L-W, -L-N(R)-W00 A2 или А3;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
R1 представляет собой Н или С1-С6 алкил, необязательно замещенный одним или более атомами галогена или группой =O;
R2 представляет собой Н или С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил, или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O, или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом;
R3 представляет собой необязательно замещенный С1-С10 алкил, С2-С10 алкенил, С5-С10 арил или С6-С12 арилалкил, или гетероформу одного из них, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом;
каждый R4 независимо представляет собой Н или С1-С6 алкил; или R4 может представлять собой -W, -L-W или -L-N(R)-W0;
каждый R и R0 независимо представляет собой Н или С1-С6 алкил;
L представляет собой С1-С10 алкиленовый, С1-С10 гетероалкиленовый, С2-С10 алкениленовый или С2-С10 гетероалкениленовый связующий фрагмент, каждый из которых может быть при необходимости замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена, оксо-группы (=O) или С1-С6 алкила;
W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
W0 представляет собой необязательно замещенное 3-4 членное карбоциклическое кольцо или С1-С6 алкильную группу, замещенную 1-4 атомами фтора;
при условии, что один из U2, V, А, Х и В представляет собой вторичный амин А или третичный амин А, где
вторичный амин А2 представляет собой -NH-W0, и
третичный амин А3 представляет собой полностью насыщенное и необязательно замещенное шестичленное или семичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла, или третичный амин А3 представляет собой частично ненасыщенное или ароматическое необязательно замещенное пятичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла;
при условии, что когда 7} представляет собой N, Z2 и Z4 представляют собой С, Z5 представляет собой С, U1 представляет собой -C(O)NH-, U2 представляет собой -L-W, и L представляет собой этиленовый связующий фрагмент, один из V, А и Х независимо представляет собой необязательно замещенное арильное, гетероарильное или 7-членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла, если W представляет собой пирролидин-1-ил, N-метил-пирролидин-2-ил, пиперидин-1-ил или морфолин-1-ил.
В некоторых вариантах осуществления описаны соединения формулы (I), при условии, что когда каждый из Z1, Z2, Z4 и Z5 представляет собой С, Z3 представляет собой С или N, U1 представляет собой -C(O)NH-, U2 представляет собой -L-W, и L представляет собой этиленовый связующий фрагмент, один из V, А, В и Х независимо представляет собой необязательно замещенное арильное, гетероарильное или 7-членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла, если W представляет собой пирролидин-1-ил, N-метил-пирролидин-2-ил, пиперидин-1-ил или морфолин-1-ил.
В другом аспекте, в настоящем изобретении описано соединение формулы (II),
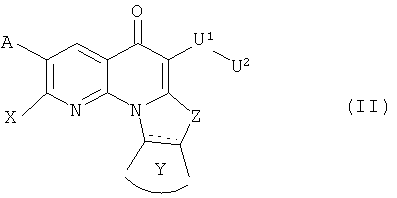
или его фармацевтически приемлемая соль или сложный эфир;
где  обозначает необязательно ненасыщенную связь;
обозначает необязательно ненасыщенную связь;
каждый из А и Х независимо представляет собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0, -L-N(R)-W0, А2 или А3;
Z представляет собой О, S, CR4 2, NR4R4, СR4R4 или NR4;
Y представляет собой необязательно замещенное 5-6 членное карбоциклическое или гетероциклическое кольцо;
U1 представляет собой -C(=T)N(R)-, -C(=T)N(R)O-, -C(=T)-, -SO2N(R)-, -SO2N(R)N(R0)-, -SO2- или -SO3-, где Т представляет собой О, S или NH; или U1 может представлять собой связь, когда U2 представляет собой Н или -CN;
U2 представляет собой Н, -CN или С3-С7 циклоалкильную, С1-С10 алкильную, С1-С10 гетероалкильную, С2-С10 алкенильную или С2-С10 гетероалкенильную группу, каждая из которых может быть при необходимости замещена одним или более атомами галогена, группой =O, или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом; или U2 представляет собой -W, -L-W, -L-N(R)-W0, A2 или А3;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
R1 представляет собой Н или С1-С6 алкил, необязательно замещенный одним или более атомами галогена или группой =O;
R2 представляет собой Н или С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O, или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом;
R3 представляет собой необязательно замещенный С1-С10 алкил, С2-С10 алкенил, С5-С10 арил или С6-С12 арилалкил, или гетероформу одного из них, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом;
каждый R4 независимо представляет собой Н или С1-С6 алкил; или R может представлять собой -W, -L-W или -L-N(R)-W0;
каждый R и R0 независимо представляет собой Н или С1-С6 алкил;
L представляет собой С1-С10 алкиленовый, С1-С10 гетероалкиленовый, С2-С10 алкениленовый или С2-С10 гетероалкениленовый связующий фрагмент, каждый из которых может быть при необходимости замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена, оксо-группы (=O) или С1-С6 алкила;
W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
W0 представляет собой необязательно замещенное 3-4 членное карбоциклическое кольцо или С1-С6 алкильную группу, замещенную 1-4 атомами фтора;
при условии, что один из U2, А и Х представляет собой вторичный амин А2 или третичный амин А3, где
вторичный амин А2 представляет собой -NH-W0, и
третичный амин А3 представляет собой полностью насыщенное и необязательно замещенное шестичленное или семичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла, или третичный амин А3 представляет собой частично ненасыщенное или ароматическое необязательно замещенное пятичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла;
при условии, что когда U1 представляет собой -C(O)NH-, U2 представляет собой -L-W, и L представляет собой этиленовый связующий фрагмент, один из А и Х независимо представляет собой необязательно замещенное арильное, гетероарильное или 7-членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла, если W представляет собой пирролидин-1-ил, N-метил-пирролидин-2-ил, пиперидин-1-ил или морфолин-1-ил.
В другом аспекте, в настоящем изобретении описано соединение формулы (III),
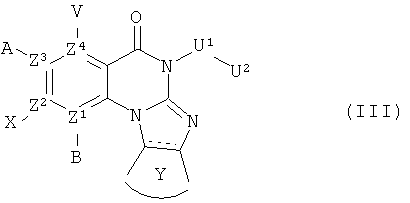
или его фармацевтически приемлемая соль или сложный эфир;
где  обозначает необязательно ненасыщенную связь; и А, В, V, X, Z1, Z2, Z3, Z4, U1, U2 и Y имеют те же определения, как для Формулы (I).
обозначает необязательно ненасыщенную связь; и А, В, V, X, Z1, Z2, Z3, Z4, U1, U2 и Y имеют те же определения, как для Формулы (I).
В другом аспекте, в настоящем изобретении описано соединение Формулы (IV),
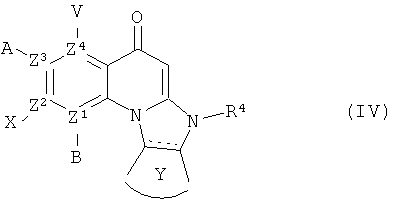
или его фармацевтически приемлемая соль или сложный эфир;
где  обозначает необязательно ненасыщенную связь;
обозначает необязательно ненасыщенную связь;
каждый из В, X, А или V отсутствует, если Z1, Z2, Z3 и Z4, соответственно, представляет собой N; и
каждый из В, X, А и V независимо представляет собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0, -L-N(R)-W0, А2 или А3, когда каждый из Z1, Z2, Z3 и Z4, соответственно, представляет собой С;
каждый из Z1, Z2, Z3 и Z4 независимо представляет собой С или N, при условии, что никакие три атома N не являются соседними;
Y представляет собой необязательно замещенное 5-6 членное карбоциклическое или гетероциклическое кольцо;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
R1 представляет собой Н или С1-С6 алкил, необязательно замещенный одним или более атомами галогена или группой =O;
R2 представляет собой Н или С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил, или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O, или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом;
R3 представляет собой необязательно замещенный С1-С10 алкил, С2-С10 алкенил, С5-С10 арил или С6-С12 арилалкил, или гетероформу одного из них, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом;
R4 представляет собой -W, -L-W или -L-N(R)-W; и
каждый R независимо представляет собой Н или С1-С6 алкил;
L представляет собой С1-С10 алкиленовый, С1-С10 гетероалкиленовый, С2-С10 алкениленовый или С2-С10 гетероалкениленовый связующий фрагмент, каждый из которых может быть при необходимости замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена, оксо-группы (=O) или С1-С6 алкила;
W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла; и
W0 представляет собой необязательно замещенное 3-4 членное карбоциклическое кольцо или С1-С6 алкильную группу, замещенную 1-4 атомами фтора.
В другом аспекте, в настоящем изобретении описано соединение Формулы (V),
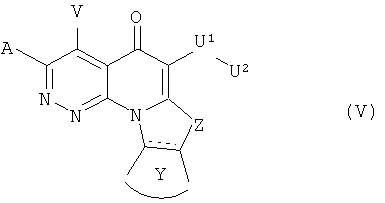
или его фармацевтически приемлемая соль или эфир;
где:  обозначает необязательно ненасыщенную связь;
обозначает необязательно ненасыщенную связь;
А и V независимо представляют собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0, -L-N(R)-W0, А2 или А3;
Z представляет собой О, S, CR4 2, NR4R4, CR4R4 или NR4;
Y представляет собой необязательно замещенное 5-6 членное карбоциклическое или гетероциклическое кольцо;
U1 представляет собой -C(=T)N(R)-, -C(=T)N(R)O-, -С(=Т)-, -SO2N(R)-, -SO2N(R)N(R0)-, -SO2- или -SO3-, где Т представляет собой О, S или NH; или U' может представлять собой связь, когда U2 представляет собой Н или -CN;
U2 представляет собой Н, -CN или С3-С7 циклоалкильную, С1-С10 алкильную, С1-С10 гетероалкильную, С2-С10 алкенильную или С2-С10 гетероалкенильную группу, каждая из которых может быть при необходимости замещена одним или более атомами галогена, группой =O, или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом; или U2 представляет собой -W, -L-W или -L-N(R)-W0, A2 или А3;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
R1 представляет собой Н или С1-С6 алкил, необязательно замещенный одним или более атомами галогена или группой =O;
R2 представляет собой Н или С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O, или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом;
R3 представляет собой необязательно замещенный С1-С10 алкил, С2-С10 алкенил, С5-С10 арил или С6-С12 арилалкил, или гетероформу одного из них, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом;
каждый R4 независимо представляет собой Н или С1-С6 алкил; или R4 может представлять собой -W, -L-W или -L-N(R)-W;
каждый R и R0 независимо представляет собой Н или С1-С6 алкил;
L представляет собой С1-С10 алкиленовый, С1-С10 гетероалкиленовый, С2-С10 алкениленовый или С2-С10 гетероалкениленовый связующий фрагмент, каждый из которых может быть при необходимости замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена, оксо-группы (=O) или С1-С6 алкила;
W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
W0 представляет собой необязательно замещенное 3-4 членное карбоциклическое кольцо или С1-С6 алкильную группу, замещенную 1-4 атомами фтора;
при условии, что один из U2, А и V представляет собой вторичный амин А2 или третичный амин А3, где
вторичный амин А2 представляет собой -NH-W0, и
третичный амин А3 представляет собой полностью насыщенное и необязательно замещенное шестичленное или семичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла, или третичный амин А3 представляет собой частично ненасыщенное или ароматическое необязательно замещенное пятичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла.
В некоторых вариантах осуществления, в соединениях формулы (V) один из U2, А и V представляет собой вторичный амин А или третичный амин А, где вторичный амин А2 представляет собой -NH-W0, где W0 такой как определено для Формулы (I), и третичный амин А3 представляет собой полностью насыщенное и необязательно замещенное шестичленное или семичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла, или третичный амин А3 представляет собой частично ненасыщенное или ароматическое необязательно замещенное пятичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла. В некоторых вариантах осуществления, описаны соединения формулы (V) при условии, что когда U1 представляет собой -C(O)NH-, U2 представляет собой -L-W, и L представляет собой этиленовый связующий фрагмент, один из А и V представляет собой необязательно замещенное арильное, гетероарильное или 7-членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла, если W представляет собой пирролидин-1-ил, "М-метил-пирролидин-2-ил, пиперидин-1-ил или морфолин-1-ил.
В другом аспекте, настоящее изобретение включает соединение Формулы (VI),
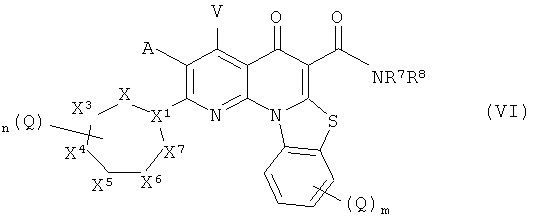
или его фармацевтически приемлемую соль или сложный эфир;
где:
X1 представляет собой СН или N;
X2, X3, X4, X5, X6 и X7 независимо представляют собой NR4, CH2, CHQ или C(Q)2, при условии, что: (i) ни одного, один или два из Х, Х, X4, X5, X6 и X7 представляют собой NR4; (ii) когда X1 представляет собой N, то X2 и X7 оба не являются NR4; (iii) когда X1 представляет собой N, X3 и X6 не являются NR4; и (iv) когда X1 представляет собой СН и два из X2, X3, X4, X5, X6 и X7 представляют собой NR4, указанные два NR4 расположены в соседних положениях в цикле или разделены двумя или более другими положениями в цикле;
А и V независимо представляют собой Н, галоген, азидо, -CN, -СF3, -CONR1R, -NR1R2, -SR2, -OR2, -R3. -W, -L-W, -W0 или -L-N(R)-W0;
каждый Q независимо представляет собой атом галогена, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее один дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
R1 представляет собой Н или С1-С6 алкил, необязательно замещенный одним или более атомами галогена или группой =O;
R2 представляет собой Н или С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O, или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом;
R3 представляет собой необязательно замещенный С1-С10 алкил, С2-С10 алкенил, С5-С10 арил или С6-С12 арилалкил, или гетероформу одного из них, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенное 3-6 членное карбоциклическое или гетероциклическое кольцо;
каждый R4 независимо представляет собой Н или С1-С6 алкил; или R4 может представлять собой -W, -L-W или -L-N(R)-W0;
каждый R независимо представляет собой Н или С1-С6 алкил;
R7 представляет собой Н, и R8 представляет собой С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O, или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом; или в -NR7R8, R7 и R8 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3, 4 или 5;
L представляет собой С1-С10 алкиленовый, С1-С10 гетероалкиленовый, С2-С10 алкениленовый или С2-С10 гетероалкениленовый связующий фрагмент, каждый из которых может быть при необходимости замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена, оксо-группы (=O) или С1-С6 алкила;
W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла; и
W0 представляет собой необязательно замещенное 3-4 членное карбоциклическое кольцо или С1-С6 алкильную группу, замещенную 1-4 атомами фтора.
В некоторых вариантах осуществления описанных соединений, X1 представляет собой СН, и два из X2, X3, X4, X5, X6 и X7 представляют собой NR4. В некоторых вариантах осуществления, X1 представляет собой СН, и один из X2, X3, X4, X5, X6 и X7 представляет собой NR4. В других вариантах осуществления, X' представляет собой СН, и ни один из X2, X3, X4, X5, X6 и X7 не представляет собой NR4. В других вариантах осуществления, X' представляет собой N и ни один из X2, X3, X4, X5, X6 и X7 не представляет собой NR4. В других вариантах осуществления, Х представляет собой N, и один из X4 или X5 представляет собой NR4.
В другом аспекте настоящего изобретения описано соединение формулы (VI'),
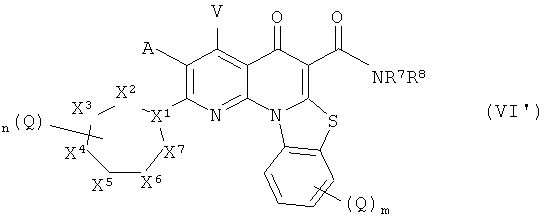
или его фармацевтически приемлемая соль или сложный эфир; где:
X1 представляет собой СН или N;
X2, X3, X4, X5, X6 и X7 независимо представляют собой NR4, СН2, CHQ или C(Q)2, при условии, что ни одного, один или два из X2, X3, X4, X5, X6 и X7 представляют собой NR4;
А и V независимо представляют собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
каждый Q независимо представляет собой атом галогена, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее один дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
R1 представляет собой Н или С1-С6 алкил, необязательно замещенный одним или более атомами галогена или группой =O;
R2 представляет собой Н или С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил, или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O, или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом;
R3 представляет собой необязательно замещенный С1-С10 алкил, С2-С10 алкенил, С5-С10 арил или С6-С12 арилалкил, или гетероформу одного из них, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом;
каждый R4 независимо представляет собой Н или С1-С6 алкил; или R4 может представлять собой -W, -L-W или -L-N(R)-W0;
каждый R независимо представляет собой Н или С1-С6 алкил;
R7 представляет собой Н, и R представляет собой С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O, или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом; или в -NR7R8, R7 и R8 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3, 4 или 5;
L представляет собой С1-С10 алкиленовый, С1-С10 гетероалкиленовый, С2-С10 алкениленовый или С2-С10 гетероалкениленовый связующий фрагмент, каждый из которых может быть при необходимости замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена, оксо-группы (=O) или С1-С6 алкила;
W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла; и
W0 представляет собой необязательно замещенное 3-4 членное карбоциклическое кольцо или С1-С6 алкильную группу, замещенную 1-4 атомами фтора.
В другом аспекте, в настоящем изобретении описано соединение Формулы (VII),
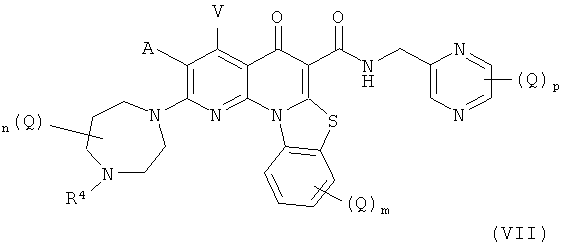
или его фармацевтически приемлемая соль или сложный эфир;
где:
А и V независимо представляют собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
каждый Q независимо представляет собой атом галогена, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
R1 представляет собой Н или С1-С6 алкил, необязательно замещенный одним или более атомами галогена или группой =O;
R2 представляет собой Н или С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O, или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом;
R3 представляет собой необязательно замещенный С1-С10 алкил, С2-С10 алкенил, С5-С10 арил, или С6-С12 арилалкил, или гетероформу одного из них, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом;
каждый R4 независимо представляет собой Н или С1-С6 алкил; или R4 может представлять собой -W, -L-W или -L-N(R)-W0;
каждый R независимо представляет собой Н или С1-С6 алкил;
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3, 4 или 5;
р равно 0, 1, 2 или 3;
L представляет собой С1-С10 алкиленовый, С1-С10 гетероалкиленовый, С2-С10 алкениленовый или С2-С10 гетероалкениленовый связующий фрагмент, каждый из которых может быть при необходимости замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена, оксо-группы (=O) или С1-С6 алкила;
W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла; и
W0 представляет собой необязательно замещенное 3-4 членное карбоциклическое кольцо или С1-С6 алкильную группу, замещенную 1-4 атомами фтора.
В другом варианте осуществления, в настоящем изобретении описано соединение Формулы (VIII),
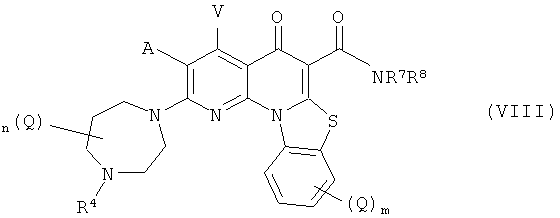
или его фармацевтически приемлемая соль или сложный эфир;
где:
А и V независимо представляют собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
каждый Q независимо представляет собой атом галогена, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
R1 представляет собой Н или С1-С6 алкил, необязательно замещенный одним или более атомами галогена или группой =O;
R2 представляет собой Н или С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O, или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом;
R3 представляет собой необязательно замещенный С1-С10 алкил, С2-С10 алкенил, С5-С10 арил или С6-С12 арилалкил, или гетероформу одного из них, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом;
каждый R4 независимо представляет собой Н или С1-С6 алкил; или R4 может представлять собой -W, -L-W или -L-N(R)-W0;
каждый R независимо представляет собой Н или С1-С6 алкил;
R7 представляет собой Н, и R8 представляет собой С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O, или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом; или в -NR7R8, R7 и R8 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
m равно 0,1, 2, 3 или 4;
n равно 0, 1, 2, 3, 4 или 5;
р равно О, 1, 2 или 3;
L представляет собой С1-С10 алкиленовый, С1-С10 гетероалкиленовый, С2-С10 алкениленовый или С2-С10 гетероалкениленовый связующий фрагмент, каждый из которых может быть при необходимости замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена, оксо-группы (=O) или С1-С6 алкила;
W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла; и
W0 представляет собой необязательно замещенное 3-4 членное карбоциклическое кольцо или С1-С6 алкильную группу, замещенную 1-4 атомами фтора.
В другом аспекте, в настоящем изобретении описана фармацевтическая композиция, содержащая соединение Формулы (I), Формулы (II), Формулы (III), Формулы (IV), Формулы (V), Формулы (VI), Формулы (VI'), Формулы (VII) или Формулы (VIII), как описано далее в настоящем тексте. В некоторых вариантах осуществления, данная фармацевтическая композиция пригодна для перорального введения. В других вариантах осуществления, данная фармацевтическая композиция пригодна для внутривенного введения.
В другом аспекте, в настоящем изобретении описан способ лечения или смягчения клеточного пролиферативного расстройства у пациента, при этом указанный способ включает введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения Формулы (I), Формулы (II), Формулы (III), Формулы (IV), Формулы (V), Формулы (VI), Формулы (VI'), Формулы (VII) или Формулы (VIII), или их фармацевтической композиции, как описано далее в настоящем тексте.
В некоторых вариантах осуществления, клеточное пролиферативное расстройство представляет собой опухоль или рак. В некоторых вариантах осуществления, пациент является человеком или животным.
В другом аспекте, в настоящем изобретении описан способ уменьшения или ингибирования пролиферации клеток, включающий контакт системы или пациента, нуждающегося в таком лечении, с эффективным количеством соединения Формулы (I), Формулы (II), Формулы (III), Формулы (IV), Формулы (V), Формулы (VI), Формулы (VI'), Формулы (VII) или Формулы (VIII), или его фармацевтической композиции, тем самым уменьшая или ингибируя пролиферацию клеток.
В другом аспекте, в настоящем изобретении описан способ уменьшения микробного титра и/или ослабления микробной инфекции, включающий контакт системы или пациента, нуждающегося в таком лечении, с эффективным количеством соединения Формулы (I), Формулы (II), Формулы (III), Формулы (IV), Формулы (V), Формулы (VI), Формулы (VI'), Формулы (VII) или Формулы (VIII), или его фармацевтической композиции и, при необходимости, с противомикробным средством, тем самым уменьшая микробный титр и/или ослабляя указанную микробную инфекцию.
В некоторых вариантах осуществления, указанная система представляет собой клетку или ткань, и пациент является человеком или животным. В некоторых вариантах осуществления, микробный титр и/или микробная инфекция представляют собой вирусный, бактериальный или грибковый титр.
В другом аспекте, в настоящем изобретении описан способ индуцирования некроза клеток и/или индуцирования апоптоза, включающий введение в систему или пациенту, нуждающемуся в таком лечении, эффективного количества соединения Формулы (I), Формулы (II), Формулы (III), Формулы (IV), Формулы (V), Формулы (VI), Формулы (VI'), Формулы (VII) или Формулы (VIII), или его фармацевтической композиции, и, при необходимости, с применением процедуры и/или химиотерапевтического средства, тем самым индуцируя некроз клеток и/или индуцируя апоптоз.
В некоторых вариантах осуществления, указанная система представляет собой клетку или ткань, и пациент является человеком или животным.
В соединениях Формулы (I), каждый из В, X, А или V отсутствует, если Z1, Z2, Z3 и Z4, соответственно, представляет собой N; и каждый из В, X, А и V независимо представляет собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0, -L-N(R)-W0, А2 или А3, когда каждый из Z1, Z2, Z3 и Z4, соответственно, представляет собой С.
В соединениях Формулы (I), каждый из Z1, Z2, Z3 и Z4 независимо представляет собой С или N, при условии, что никакие три атома N не являются соседними. В предпочтительных вариантах осуществления, по меньшей мере один из Z1, Z2, Z3 и Z4 представляет собой N. В других предпочтительных вариантах осуществления, по меньшей мере два из Z1, Z2, Z3 и Z4 представляют собой N. В некоторых вариантах осуществления Формулы (I), Z1 представляет собой N, и В отсутствует, или Z1 представляет собой С, и В представляет собой Н или атом галогена. В некоторых вариантах осуществления, Z1 представляет собой N, и каждый из Z2, Z3 и Z4 представляет собой С. В других вариантах осуществления, Z1 и Z2 представляют собой N, и Z3 и Z4 представляют собой С.
В соединениях Формулы (I), Z представляет собой О, S, CR4 2, NR3R4, CR3R4, CR4, NR4 или N. Во многих вариантах осуществления, Z представляет собой S или NR. В некоторых вариантах осуществления, Z представляет собой N, когда Z5 представляет собой N. В некоторых вариантах осуществления, цикл, содержащий Z, представляет собой пятичленный цикл (например, когда Z представляет собой О, S, CR4 2, CR4, NR4 или N). В других вариантах осуществления, в которых Z5 представляет собой N, цикл, содержащий Z, представляет собой шестичленный цикл (например, когда Z представляет собой NR4CR4 или CR4R4). В некоторых вариантах осуществления, Z представляет собой S.
Во многих вариантах осуществления Формулы (I), Z5 представляет собой С. В некоторых вариантах осуществления, Z5 может представлять собой N, когда Z представляет собой N.
Y в соединениях Формулы (I) представляет собой необязательно замещенное 5-6 членное карбоциклическое или гетероциклическое кольцо. В некоторых вариантах осуществления, Y представляет собой необязательно замещенную фенильную, пиридильную или нафтильную циклическую систему.
Примеры возможных заместителей, при наличии их в Y, включают один или более C1-6 алкил, C1-6 гетероалкил, С6-12 арилалкил, С6-12 гетероарилалкил, галоген, -CN, -NO2, азидо, -СF3, -ОСF3 или -OR1, -SR1, -NR1 2, -COOR1 или -CONR1 2, где каждый R1 независимо представляет собой Н или С1-4 алкил, или где две группы R1 в любом NR1z могут замыкать цикл с образованием 5-6 членного азациклического кольца. Y также может быть при необходимости заменен на необязательно замещенное карбоциклическое или гетероциклическое кольцо, которое может быть насыщенным, частично ненасыщенным или ароматическим.
В соединениях Формулы (I), U1 представляет собой -C(=X)N(R)-, -C(=X)N(R)O-, -С(=Х)-, -SO2N(R)-, -SO2N(R)N(R)-, -SO2- или -SO3-, где Х представляет собой О, S или NH, где каждый R независимо представляет собой Н или С1-С6 алкил.
Во многих вариантах осуществления, U1 представляет собой -C(O)N(R)-. В некоторых таких вариантах осуществления, R представляет собой Н или С1-4 алкил. В частных вариантах осуществления, R представляет собой Н или метил. В некоторых вариантах осуществления, U' представляет собой -С(O)- или -SO2N(R)-, где R представляет собой Н или метил. В других вариантах осуществления, U1 может представлять собой связь, когда Z5 представляет собой N, или U1 может представлять собой связь, когда U2 представляет собой Н или -CN.
В соединениях Формулы (I), U2 представляет собой Н, -CN или С3-С7 циклоалкильную, С1-С10 алкильную, С1-С10 гетероалкильную, С2-С10 алкенильную или С2-С10 гетероалкенильную группу, каждая из которых может быть при необходимости замещена одним или более атомами галогена, группой =O или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом; или U представляет собой -W, -L-W, -L-N(R)-W0, А2 или А3.
В соединениях Формулы (I), в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла.
В соединениях Формулы (I), R1 представляет собой Н или С1-С6 алкил, необязательно замещенный одним или более атомами галогена или группой =O. Часто R представляет собой Н или метил.
R2 в соединениях Формулы (I) представляет собой Н или С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом.
В соединениях Формулы (I), R3 представляет собой необязательно замещенный С1-С10 алкил, С2-С10 алкенил, С5-С10 арил или С6-С12 арилалкил, или гетероформу одного из них, каждый из которых может быть при необходимости замещен одним или более атомами галогена, или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом; и где алкильные и алкенильные фрагменты и их соответствующие гетероформы могут быть при необходимости замещены группой =O.
В соединениях Формулы (I), каждый R4, при наличии, независимо представляет собой Н или необязательно замещенный С1-С6 алкил; или R4 может представлять собой -W, -L-W или -L-N(R)-W0;
L в соединениях Формулы (I) представляет собой С1-С10 алкиленовый, С1-С10 гетероалкиленовый, С2-С10 алкениленовый или С2-С10 гетероалкениленовый связующий фрагмент, каждый из которых может быть при необходимости замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена, оксо-группы (=O) или С1-С6 алкила.
В соединениях Формулы (I), W представляет собой необязательно замещенное 4-7 членное насыщенное, частично ненасыщенное или ароматическое азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла, где цикл W может быть соединен связью, обозначенной R4, или связующей группой -L- или -L-N(R)- через любое положение на азациклическом кольце.
В соединениях Формулы (I), W0 представляет собой необязательно замещенное 3-4 членное карбоциклическое кольцо или С1-С6 алкильную группу, замещенную 1-4 атомами фтора.
В некоторых вариантах осуществления, W содержит по меньшей мере одну двойную связь. Например, W может представлять собой необязательно замещенный имидазольный, имидазолиновый, пиррольный, пирролиновый, пиридиновый, дигидропиридиновый, тетрагидропиридиновый, пиримидиновый, пиразиновый или пиридазиновый цикл.
В других вариантах осуществления, W представляет собой необязательно замещенное насыщенное азациклическое кольцо. Например, W может представлять собой необязательно замещенный азетидиновый, пирролидиновый, пиперидиновый, пиперазиновый, морфолиновый, тиоморфолиновый, гомопиперазиновый, гомоморфолиновый или гомотиоморфолиновый цикл.
В некоторых вариантах осуществления Формулы (I), U2 представляет собой -W или -L-W, где W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла.
В некоторых таких вариантах осуществления, W представляет собой полностью насыщенное и необязательно замещенное шестичленное или 7-членное азациклическое кольцо, при необходимости содержащее один дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла. В частных вариантах осуществления, W представляет собой необязательно замещенный пиперидиновый, пиперазиновый, морфолиновый, тиоморфолиновый или гомопиперазиновый цикл.
В других вариантах осуществления, W представляет собой необязательно замещенное частично ненасыщенное или ароматическое пятичленное азациклическое кольцо, при необходимости содержащее один дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла. В частных вариантах осуществления, W представляет собой необязательно замещенный пиррольный, пирролиновый, имидазольный, имидазолиновый, пиразольный, пиразолиновый, тиазольный, тиазолиновый, оксазольный, оксазолиновый, изоксазольный или изоксазолиновый цикл.
В других вариантах осуществления, W представляет собой необязательно замещенное ароматическое шестичленное азациклическое кольцо, при необходимости содержащее один или два дополнительных атома N в качестве члена цикла. В частных вариантах осуществления, W представляет собой при необходимости замещенный пиридиновый, пиримидиновый, пиразиновый, пиридазиновый цикл или триазин.
В других вариантах осуществления Формулы (I), U2 представляет собой циклопропильное кольцо или -L-N(R)-W0, где L, R и W такие, как определено выше. В некоторых вариантах осуществления, L представляет собой С1-С6 алкиленовый или гетероалкиленовый связующий фрагмент, и R представляет собой Н или метил. В частных вариантах осуществления, W0 представляет собой циклопропильное или циклобутильное кольцо или представляет собой С1-С4 алкильную группу, замещенную 1-4 атомами фтора.
В соединениях Формулы (I), когда Z1 представляет собой N, Z и Z представляют собой С, Z5 представляет собой С, U1 представляет собой -C(O)NH-, U2 представляет собой -L-W, и L представляет собой этиленовый связующий фрагмент, один из V, А и Х независимо представляет собой необязательно замещенный арильный или гетероарильный цикл или необязательно замещенное 7-членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла, если W представляет собой пирролидин-1-ил, N-метил-пирролидин-2-ил, пиперидин-1-ил или морфолин-1-ил. В частных вариантах осуществления, указанный арильный или гетероарильный цикл в V, А или Х представляет собой необязательно замещенный фенильный, пиридинильный, пиримидинильный, тиофенильный, оксазолильный, изоксазолильный или индолильный цикл. В частных вариантах осуществления, 7-членное азациклическое кольцо в V, А или Х представляет собой необязательно замещенный гомопиперазиновый цикл.
В некоторых вариантах осуществления описаны соединения Формулы (I), при условии, что когда каждый из Z1, Z2, Z4 и Z5 представляет собой С, Z3 представляет собой С или N, U1 представляет собой -C(O)NH-, U2 представляет собой -L-W, и L представляет собой этиленовый связующий фрагмент, один из V, А, В и Х независимо представляет собой необязательно замещенное арильное, гетероарильное или 7-членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла, если W представляет собой пирролидин-1-ил, N-метил-пирролидин-2-ил, пиперидин-1-ил или морфолин-1-ил.
В соединениях Формулы (I), по меньшей мере один из U2, V, А, Х и В представляет собой вторичный амин А2 или третичный амин А3. Вторичный амин А2 представляет собой -NH-W0, где W0 такой, как определено выше. Третичный амин А3 представляет собой полностью насыщенное и необязательно замещенное шестичленное или семичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла, или третичный амин А3 представляет собой частично ненасыщенное или ароматическое пятичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла, и которое может при необходимости иметь заместители.
Например, в некоторых вариантах осуществления, А3 может представлять собой необязательно замещенный пиперидиновый, пиперазиновый, гомопиперазиновый, морфолиновый, тиоморфолиновый, гомоморфолиновый или гомотиоморфолиновый цикл. В других вариантах осуществления. А3 может представлять собой необязательно замещенный пиррольный, пирролиновый, имидазольный, имидазолиновый, пиразольный, пиразолиновый, тиазольный, тиазолиновый, оксазольный, оксазолиновый, изоксазольный или изоксазолиновый цикл.
В предпочтительном варианте осуществления Формулы (I), Z1 представляет собой N, В отсутствует, и каждый из Z2-Z5 представляет собой С.
В другом предпочтительном варианте осуществления Формулы (I), U2 содержит необязательно замещенный 3-пирролиновый цикл.
В другом предпочтительном варианте осуществления Формулы (I), U2 содержит необязательно замещенный имидазольный цикл.
В другом предпочтительном варианте осуществления Формулы (I), U2 содержит циклопропильное кольцо.
В других предпочтительных вариантах осуществления Формулы (I), U2 содержит необязательно замещенный пиразиновый цикл.
В других предпочтительных вариантах осуществления Формулы (I), X представляет собой третичный амин А3.
В других предпочтительных вариантах осуществления Формулы (I), A представляет собой Н или фтор.
В некоторых предпочтительных вариантах осуществления, соединение Формулы (I) содержит два или более предпочтительных признаков, иногда три или более предпочтительных признаков.
Те же группы, описанные в настоящем тексте для А, В, X, V, Z, Z1, Z2, Z3, Z4, Z5, U1, U2 и Y, в соединениях Формулы (I), подходят также для соединений Формулы (II), (III), (IV), (V), (VI), (VI-), (VII) или (VIII).
В соединениях Формулы (II), каждый из А, X, U1, U2 и Y имеют такие же значения, как для Формулы (I).
В некоторых вариантах осуществления Формулы (II), один из А или Х замещен вторичным амином А2 или третичным амином А3, как определено в настоящем тексте. В предпочтительных вариантах осуществления, один из А или Х представляет собой третичный амин А3. В особенно предпочтительных вариантах осуществления, один из А или X представляет собой третичный амин А3, где А выбран из группы, состоящей из необязательно замещенного морфолина, тиоморфолина, пирролидина, пиперазина, гомопиперазина, гомоморфолина или гомотиоморфолина.
В других вариантах осуществления Формулы (II), один из А или Х представляет собой атом галогена. В некоторых таких вариантах осуществления, один из А или Х предпочтительно представляет собой фтор или хлор.
В соединениях формулы (II), Z может представлять собой О, S, CR4 2 или NR4, где R4 такой, как определен для Формулы (I). В некоторых вариантах осуществления, Z представляет собой S или NR4, где R4 представляет собой Н или С1-С6 алкил. В других вариантах осуществления, R4 может представлять собой -W, -L-W или -L-N(R)W0, где W, L, R и W0 такие, как определено для Формулы (I). Во многих вариантах осуществления, Z представляет собой S.
В некоторых вариантах осуществления Формулы (II), U1 представляет собой -C(O)N(R)- или -SO2N(R)-, где R представляет собой Н или См алкил, предпочтительно метил. В некоторых таких вариантах осуществления, U2 представляет собой циклопропил или -W, -L-W, -L-N(R)W0.
Во многих вариантах осуществления, U1 представляет собой -C(O)N(R)-, и U2 представляет собой -L-W или -L-N(R)W0, где L представляет собой С1-С4 алкиленовую группу, каждый R независимо представляет собой Н или метил, и W и W0 такие, как определено далее в настоящем тексте. В других вариантах осуществления, U2 представляет собой А2 или А3.
В предпочтительном варианте осуществления Формулы (II), Z представляет собой S.
В предпочтительном варианте осуществления Формулы (II), Y представляет собой необязательно замещенное фенильное кольцо.
В другом предпочтительном варианте осуществления Формулы (II), U2 содержит необязательно замещенный 3-пирролиновый цикл.
В другом предпочтительном варианте осуществления Формулы (II), U2 содержит необязательно замещенный имидазольный цикл.
В другом предпочтительном варианте осуществления Формулы (II), U2 содержит циклопропильное кольцо.
В других предпочтительных вариантах осуществления Формулы (II), U2 содержит необязательно замещенный пиразиновый цикл.
В других предпочтительных вариантах осуществления Формулы (II), U2 представляет собой -L-W или -L-N(R)W0, где L представляет собой С1-С4 алкиленовую группу, каждый R независимо представляет собой Н или метил, и W и W0 такие, как определено далее в настоящем тексте. В особенно предпочтительных вариантах осуществления, W представляет собой необязательно замещенное пяти- или шестичленное частично ненасыщенное или ароматическое азациклическое кольцо, и W0 представляет собой циклопропильную группу. В частных вариантах осуществления, W представляет собой необязательно замещенное пяти- или шестичленное частично ненасыщенное или ароматическое азациклическое кольцо, выбранное из группы, состоящей из 3-пирролина, имидазола, пиразола, пиридина, пиримидина, пиразина и пиридазина.
В других предпочтительных вариантах осуществления Формулы (II), Х представляет собой третичный амин А3. В особенно предпочтительных вариантах осуществления, Х представляет собой третичный амин А3, где А3 выбран из группы, состоящей из необязательно замещенного морфолина, тиоморфолина, пиперидина, пиперазина, гомопиперазина, гомоморфолина и гомотиоморфолина. Иногда А выбран из группы, состоящей из необязательно замещенного имидазола, имидазолина и пирролина.
В других предпочтительных вариантах осуществления Формулы (II), А представляет собой Н или фтор.
В некоторых особенно предпочтительных вариантах осуществления, соединение Формулы (II) содержит два или более предпочтительных признаков, иногда три или более предпочтительных признаков.
В соединениях Формулы (III), каждый из А, В, V, X, Z1, Z2, Z3, Z4, U1, U2 и Y такие, как определено для Формулы (I).
В некоторых вариантах осуществления Формулы (III), U1 представляет собой связь и U2 представляет собой -L-W, где L и W такие, как определено для Формулы (I). В предпочтительных вариантах осуществления, L представляет собой необязательно замещенный С1-С6 алкиленовый или гетероалкиленовый связующий фрагмент, и W представляет собой 5-6 членное насыщенное, ненасыщенное или ароматическое азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, и данное кольцо может быть при необходимости замещенным. В частных вариантах осуществления, W представляет собой необязательно замещенный пирролидиновый, пирролиновый, имидазольный, имидазолиновый, пиперидиновый, пиридиновый, пиперазиновый, пиримидиновый, пиридазиновый, морфолиновый или тиоморфолиновый цикл.
В других вариантах осуществления Формулы (III), U1 представляет собой связь и U2 представляет собой -L-N(R)-W0, где L, R и W0 такие, как определено для Формулы (I).
В предпочтительных вариантах осуществления, L представляет собой необязательно замещенный С1-С6 алкиленовый или гетероалкиленовый связующий фрагмент, и R представляет собой Н или метил. В некоторых таких вариантах осуществления, W представляет собой циклопропильное или циклобутильное кольцо. В других вариантах осуществления, W0 представляет собой С1-С4 алкильную группу, замещенную 1-4 атомами фтора.
В некоторых вариантах осуществления Формулы (III), Z1 представляет собой N, и каждый из Z2, Z3 и Z представляет собой С. В некоторых из таких вариантов осуществления, по меньшей мере один из А и Х представляет собой вторичный амин А2 или третичный амин А, и V представляет собой Н.
В предпочтительных вариантах осуществления Формулы (III), Z1 представляет собой N, В отсутствует, и каждый из Z2-Z4 представляет собой С.
В другом предпочтительном варианте осуществления Формулы (III), U1 представляет собой связь и U представляет собой -L-W, где W представляет собой необязательно замещенный пирролидиновый или пирролиновый цикл.
В другом предпочтительном варианте осуществления Формулы (III), U1 представляет собой связь и U2 представляет собой -LN(R)W0, где W0 представляет собой циклопропильное кольцо.
В другом предпочтительном варианте осуществления Формулы (III), U представляет собой связь и U2 представляет собой -LN(R)W0, где W0 представляет собой С1-С6 алкил, замещенный 1-4 атомами фтора.
В другом предпочтительном варианте осуществления Формулы (III), X представляет собой третичный амин А3.
В другом предпочтительном варианте осуществления Формулы (III), A представляет собой Н или фтор.
В некоторых особенно предпочтительных вариантах осуществления, соединение Формулы (III) содержит два или более предпочтительных признаков, иногда три или более предпочтительных признаков.
В соединениях формулы (IV), R4 представляет собой -W, -L-W или -L-N(R)-W0, и каждый из А, В, V, X, Z1, Z2, Z3, Z4, Y, L, W, R и W0 такие, как определено для Формулы (I).
В некоторых вариантах осуществления Формулы (IV), Z1 представляет собой N, и каждый из Z, Z и Z представляет собой С. В некоторых из таких вариантов осуществления, по меньшей мере один из А и Х представляет собой А2 или А3, и V представляет собой Н или атом галогена. В некоторых вариантах осуществления, Х представляет собой А3, и каждый из А и V независимо представляет собой Н или атом галогена.
В частных вариантах осуществления Формулы (IV), L представляет собой необязательно замещенный С1-С6 алкиленовый или гетероалкиленовый связующий фрагмент. В частных вариантах осуществления, R представляет собой -L-W, где W представляет собой необязательно замещенный пирролидиновый, пирролиновый, имидазольный, имидазолиновый, пиперидиновый, пиридиновый, пиперазиновый, пиримидиновый, пиридазиновый, морфолиновый или тиоморфолиновый цикл.
В других вариантах осуществления, R4 представляет собой -L-N(R)-W0, и W0 представляет собой циклопропильное или циклобутильное кольцо или С1-С4 алкильную группу, замещенную 1-4 атомами фтора.
В предпочтительном варианте осуществления Формулы (IV), Z* представляет собой N, В отсутствует, и каждый из Z^Z4 представляет собой С.
В другом предпочтительном варианте осуществления Формулы (IV), R4 представляет собой -L-W, где W представляет собой необязательно замещенный пирролидиновый или пирролиновый цикл.
В другом предпочтительном варианте осуществления Формулы (IV), R4 представляет собой -LN(R)W0, где W0 представляет собой циклопропильное кольцо.
В другом предпочтительном варианте осуществления Формулы (IV), R4 представляет собой -LN(R)W0, где W0 представляет собой С1-С6 алкил, замещенный 1-4 атомами фтора.
В других предпочтительных вариантах осуществления Формулы (IV), Y представляет собой необязательно замещенное фенильное кольцо.
В других предпочтительных вариантах осуществления Формулы (IV), Х представляет собой третичный амин А.
В других предпочтительных вариантах осуществления Формулы (IV), А представляет собой Н или фтор.
В некоторых особенно предпочтительных вариантах осуществления, соединение Формулы (IV) содержит два или более предпочтительных признаков, иногда три или более предпочтительных признаков.
В некоторых вариантах осуществления Формулы (V), А2 представляет собой вторичный амин А3 или третичный амин А2, где вторичный амин А представляет собой -NH-W0, где W0 такой как определено для Формулы (I), и третичный амин А3 представляет собой полностью насыщенное и необязательно замещенное шестичленное или семичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла, или третичный амин А3 представляет собой частично ненасыщенное или ароматическое необязательно замещенное пятичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла.
В некоторых вариантах осуществления Формулы (V), U1 представляет собой -CON(R)- и U2 представляет собой циклоалкил, -W, -L-W или LN(R)W0, где каждый R независимо представляет собой Н или С1-С6 алкил, и W, L и W0 определены выше.
В предпочтительном варианте осуществления Формулы (V), U1 представляет собой -CON(R)-, R представляет собой Н или С 1-4 алкил, предпочтительно метил; и U представляет собой -L-W, где L представляет собой С1-С4 алкиленовый связующий фрагмент и W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла. В некоторых из таких вариантов осуществления, W представляет собой необязательно замещенный пирролидиновый, пирролиновый или имидазольный цикл.
В других предпочтительных вариантах осуществления, U1 представляет собой -CON(R)-, R представляет собой Н или C1-4 алкил, предпочтительно метил, и U2 представляет собой С1-С6 алкильную или С1-С6 гетероалкильную группу, необязательно замещенную необязательно замещенным карбоциклическим или гетероциклическим кольцом. В некоторых из таких вариантов осуществления, гетероциклическое кольцо представляет собой необязательно замещенный пиридиновый, пиразиновый, пиримидиновый, пиперидиновый, пирролидиновый или имидазольный цикл.
В других предпочтительных вариантах осуществления Формулы (V), U1 представляет собой -С(O)-, и U2 представляет собой W, где W такой, как определено выше.
В некоторых предпочтительных вариантах осуществления Формулы (V), А представляет собой третичный амин А. В некоторых из таких вариантов осуществления, А представляет собой необязательно замещенный морфолиновый, тиоморфолиновый, пиперазиновый или гомопиперазиновый цикл.
В предпочтительном варианте осуществления Формулы (V), V представляет собой Н или атом галогена.
В другом предпочтительном варианте осуществления Формулы (V), Z представляет собой S или N(Me).
В другом предпочтительном варианте осуществления Формулы (V), Y представляет собой необязательно замещенное фенильное кольцо.
В некоторых вариантах осуществления Формулы (V), когда U1 представляет собой
-C(O)NH-, U2 представляет собой -L-W, и L представляет собой этиленовый связующий фрагмент, один из А и V представляет собой необязательно замещенное арильное, гетероарильное или 7-членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла, если W представляет собой пирролидин-1-ил, Н-метил-пирролидин-2-ил, пиперидин-1-ил или морфолин-1-ил.
В некоторых особенно предпочтительных вариантах осуществления, соединение Формулы (V) содержит два или более предпочтительных признаков, иногда три или более предпочтительных признаков.
В некоторых вариантах осуществления Формулы (VI), X' представляет собой СН или N, и X2, X3, X4, X5, X6 и X7 независимо представляют собой NR4, ЭД, CHQ или C(Q)2, при условии, что ни одного, один или два из X2, X3, X4, X5, X6 и X7 представляют собой NR4.
В некоторых вариантах осуществления Формулы (VI), А и V независимо представляют собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0. Во многих вариантах осуществления, А и V независимо представляют собой Н или атом галогена.
В некоторых вариантах осуществления Формулы (VI), каждый Q независимо представляет собой атом галогена, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0. Понятно, что каждое положение, необязательно замещенное группой Q, замещено атомом водорода, когда m или n равно 0. В предпочтительных вариантах осуществления, каждый из m или n равен 0 или 1.
В некоторых предпочтительных вариантах осуществления Формулы (VI), X1 представляет собой N, один или два из X3, X4, X5 и X6 независимо представляет/представляют собой NR4, и оставшиеся X2, X3, X4, X5, X6 и X7 независимо представляют собой CH2.
В некоторых предпочтительных вариантах осуществления Формулы (VI), X1 представляет собой N; один из X3, X4, X5 и X6 представляет собой NR4; оставшиеся Х, X4, X5, X6 и X2 и X7 независимо представляют собой СН3.
В некоторых предпочтительных вариантах осуществления, X' представляет собой N, и один из X4 или X5 представляет собой NR4, а другой представляет собой СН2, и X2, X3 и X6 представляют собой CH2.
В некоторых вариантах осуществления Формулы (VI), R7 представляет собой H, и R8 представляет собой С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом. В других вариантах осуществления, R7 и R8 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла.
В некоторых предпочтительных вариантах осуществления Формулы (VI), R7 представляет собой Н, и R8 выбран из -CH2CH2ОСН3, -СН2СН2OСН(СН3)2, -СН2-(пиридин), -СН2-(метилпиридин), -СН2-(метилпиримидин), -СН2-(метилпиримидин), -СН2-(пиразин), -СН2-(метилпиразин), -СН2-(имидазол); -СН2-(N-метилимидазол); -СН2-(пирролидин); -СН2-(N-метилпирролидин); -СН2-(тиазол); и СН2-(N-метил тиазол).
В некоторых предпочтительных вариантах осуществления Формулы (VI), R7 и R8 вместе с N в -NR7R8 образуют необязательно замещенный морфолиновый, тиоморфолиновый, пиперидиновый или пиперазиновый цикл.
В некоторых особенно предпочтительных вариантах осуществления, соединение Формулы (VI) содержит два или более предпочтительных признака, иногда три или более признака.
Описанные в настоящем тексте варианты осуществления Формулы (VI) также применимы для Формулы (VI').
В некоторых вариантах осуществления Формулы (VII), А и V независимо представляют собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0, где R1, R2, -R3, -W, -L, -W0 и R такие, как определено выше.
В некоторых вариантах осуществления Формулы (VII), А и V независимо представляют собой Н и атом галогена, предпочтительно фтор. В некоторых предпочтительных вариантах осуществления, А и V каждый представляют собой Н. В других предпочтительных вариантах осуществления, А представляет собой фтор, и V представляет собой Н.
В некоторых вариантах осуществления Формулы (VII), каждый Q независимо представляет собой атом галогена, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0. Понятно, что каждое необязательно замещенное группой
Q положение замещено атомом водорода, когда m, n или р равно 0.
В предпочтительном варианте осуществления, каждый из m и n равен 0 или 1. В другом предпочтительном варианте осуществления Формулы (VII), тип каждый равен 0.
В других предпочтительных вариантах осуществления Формулы (VII), р равно 0 или 1.
В особенно предпочтительном варианте осуществления, тип равны 0, р равно 1, и Q представляет собой С1-С4 алкил, предпочтительно метил.
В предпочтительном варианте осуществления Формулы (VII), R представляет собой Н или С1-С4 алкил или С3-С7 циклоалкил. В особенно предпочтительном варианте осуществления, R4 представляет собой метил. В другом предпочтительном варианте осуществления, R4 представляет собой Н.
В некоторых особенно предпочтительных вариантах осуществления, соединение Формулы (VII) содержит два или более предпочтительных признака, иногда три или более предпочтительных признака.
В некоторых вариантах осуществления Формулы (VIII), А и V независимо представляют собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0, где R1, R2, -R3, -W, -L, -W0 и R такие, как определено выше.
В некоторых вариантах осуществления, А и V независимо представляют собой Н и атом галогена, предпочтительно фтор. В некоторых предпочтительных вариантах осуществления, А и V каждый представляют собой Н. В других предпочтительных вариантах осуществления, А представляет собой фтор, и V представляет собой Н.
В некоторых вариантах осуществления Формулы (VIII), каждый Q независимо представляет собой атом галогена, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0. Понятно, что каждое необязательно замещенное группой Q положение замещено атомом водорода, когда m, n или р равно 0.
В предпочтительном варианте осуществления, каждый из m и n равен 0 или 1. В другом предпочтительном варианте осуществления Формулы (VIII), тип каждый равен 0.
В предпочтительном варианте осуществления, тип равны 0. В предпочтительном варианте осуществления Формулы (VIII), R4 представляет собой С1-С4 алкил или С3-С7 циклоалкил. В особенно предпочтительном варианте осуществления, R4 представляет собой метил. В другом предпочтительном варианте осуществления, R4 представляет собой Н.
В некоторых вариантах осуществления Формулы (VIII), R7 представляет собой Н, и R8 представляет собой С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом. В некоторых из таких вариантов осуществления, R8 представляет собой С 1-4 алкил, замещенный необязательно замещенным ароматическим гетероциклическим кольцом. В некоторых предпочтительных вариантах осуществления, R представляет собой С1-4 алкил, замещенный необязательно замещенным имидазольным, пиридиновым, пиримидиновым, пиридазиновьм или пиразиновым кольцом. В других вариантах осуществления, R7 и R8 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла.
В некоторых вариантах осуществления, R7 представляет собой Н, и R8 представляет собой С1-4 алкил, замещенный необязательно замещенным ароматическим гетероциклическим кольцом. В некоторых из таких вариантов осуществления, необязательно замещенное ароматическое гетероциклическое кольцо выбрано из пиридина, пиримидина, пиразина, имидазола, пирролидина и тиазола.
В некоторых предпочтительных вариантах осуществления Формулы (VIII), R7 представляет собой Н, и R8 выбран из -CH2CH2OCH3, -СН2СН2OСН(СН3)2, -СН2-(пиридин), -СН2-(метилпиридин), -СН2-(метилпиримидин), -СН2-(метилпиримидин), -СН2-(пиразин), -СН2-(метилпиразин), -СН2-(имидазол); -СН2-(Н-метилимидазол); -СН2-(пирролидин); -СН2-(N-метилпирролидин); -СН2-(тиазол); и СН2-(N-метилтиазол).
В некоторых предпочтительных вариантах осуществления Формулы (VIII), R7 и R8 вместе с N в -NR7R8 образуют необязательно замещенный морфолиновый или пиперазиновый цикл.
В некоторых особенно предпочтительных вариантах осуществления, соединение Формулы (VIII) содержит два или более предпочтительных признака, иногда три или более предпочтительных признака.
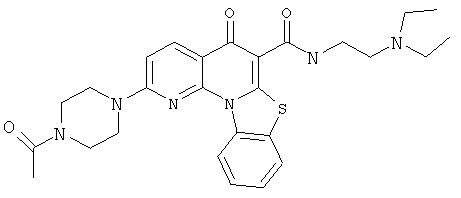
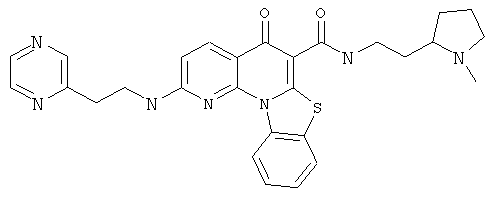
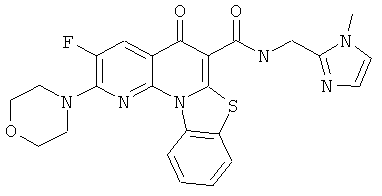
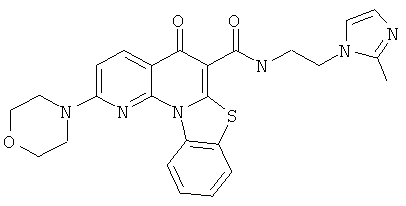
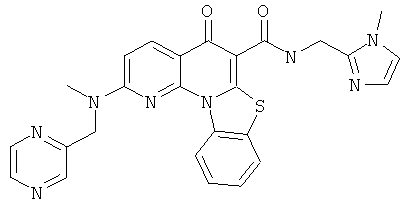
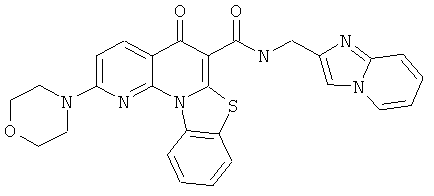
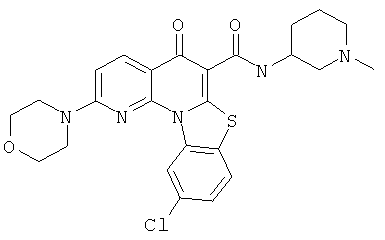
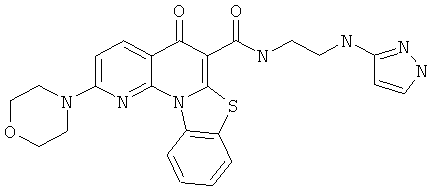
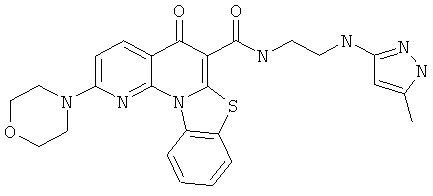
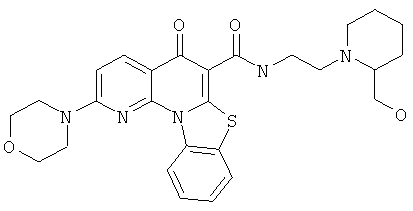
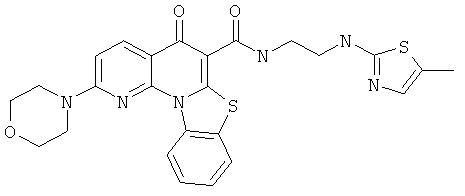
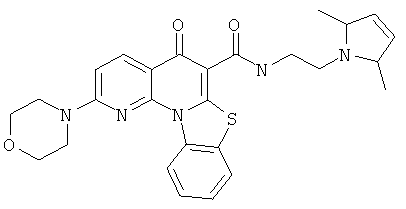
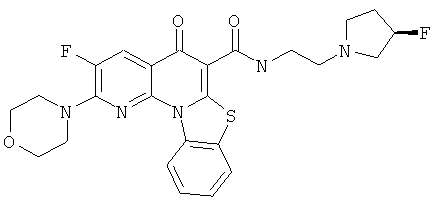
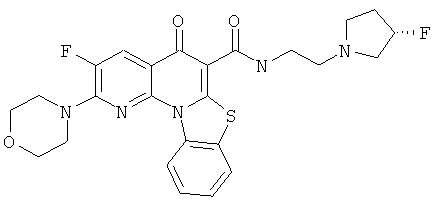
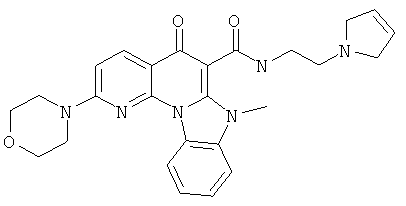
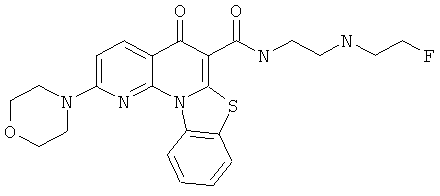
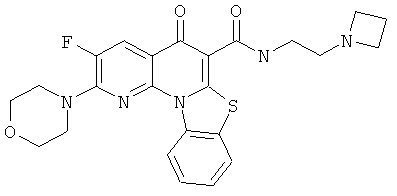
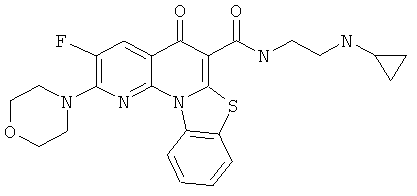
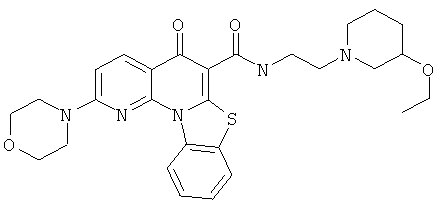
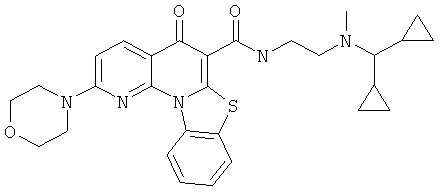
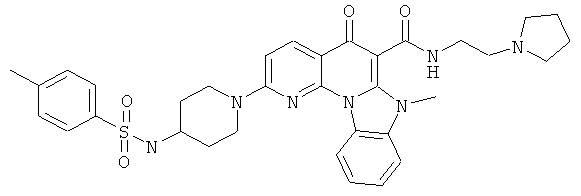
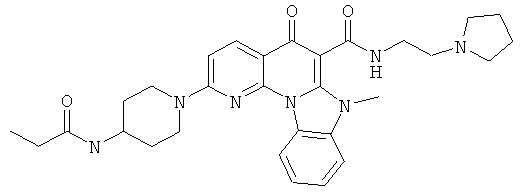
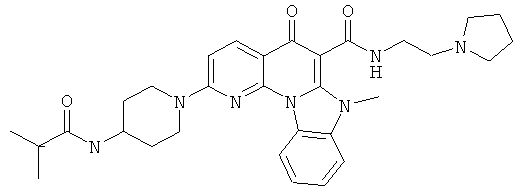
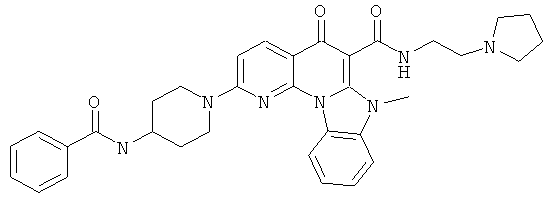
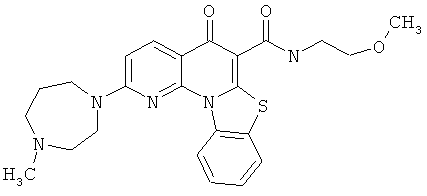
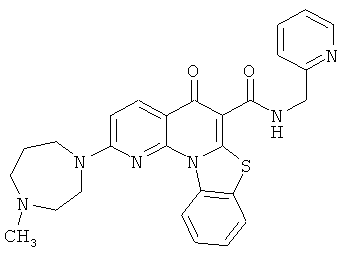
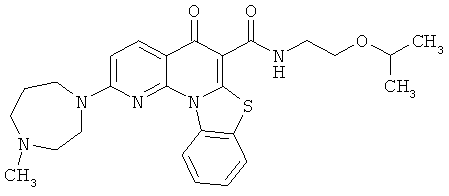
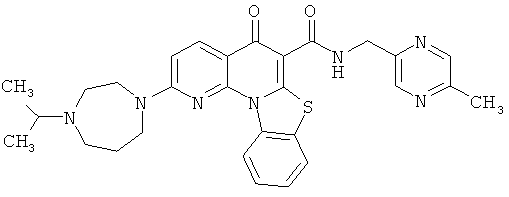
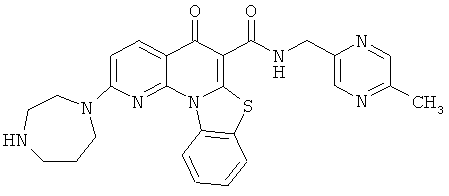
Предпочтительные варианты осуществления настоящего изобретения включают соединения, приведенные в Таблицах 1-8 и в Примерах.
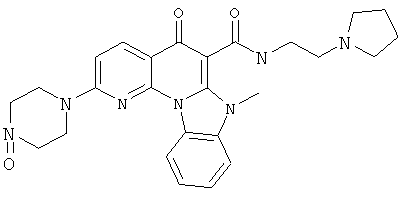
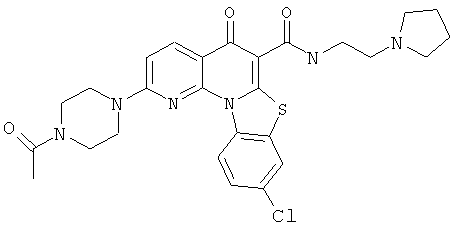
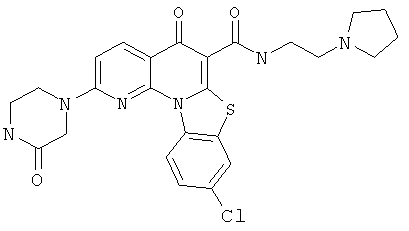
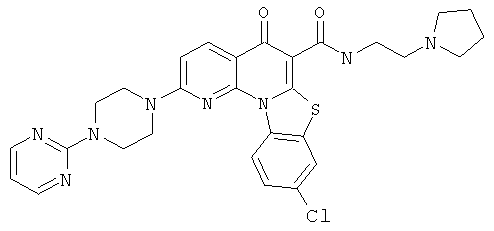
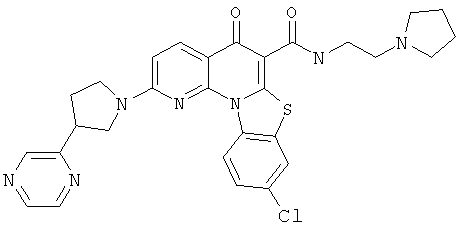
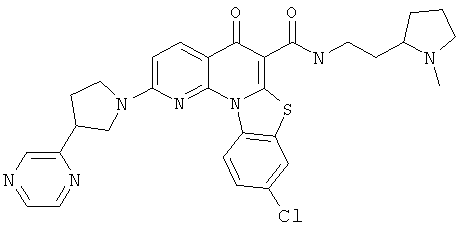
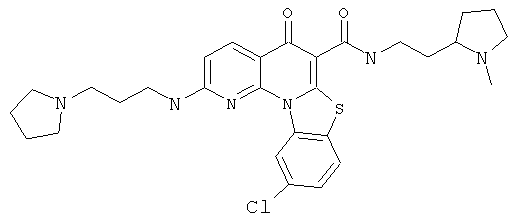
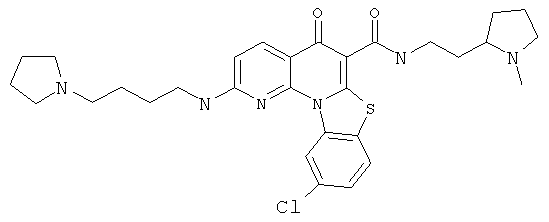
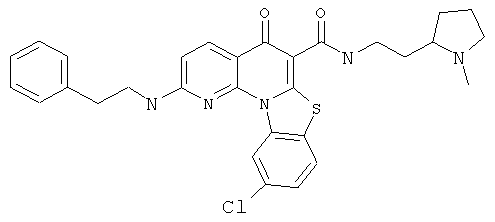
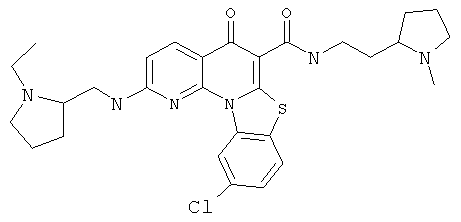
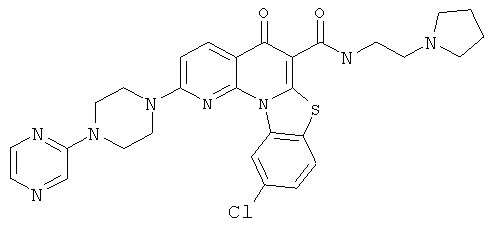
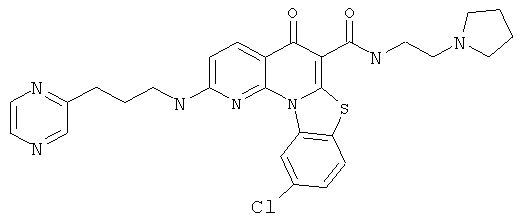
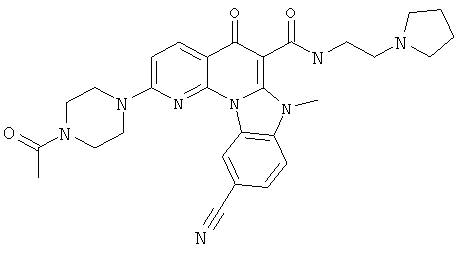
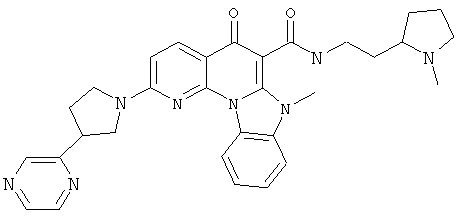
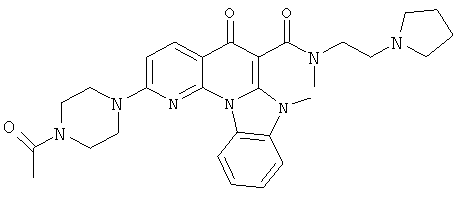
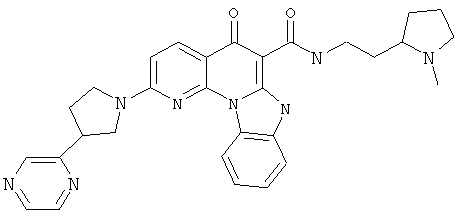
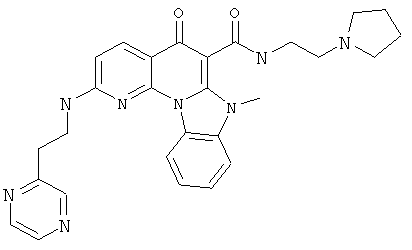
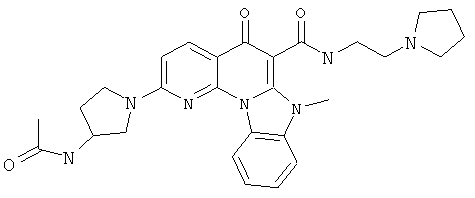
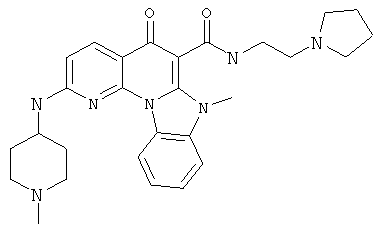
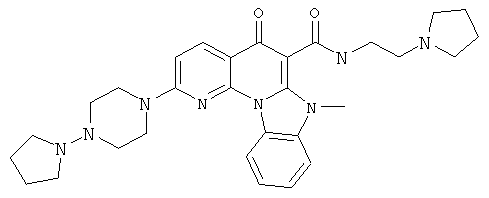
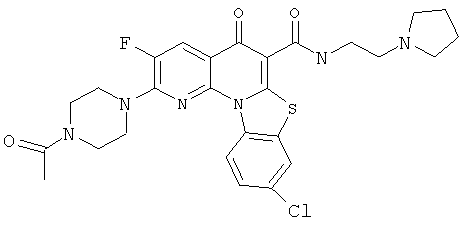
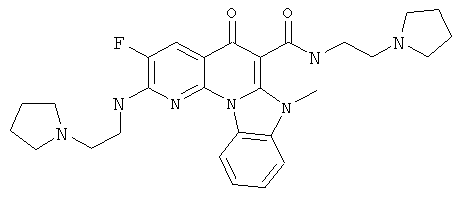
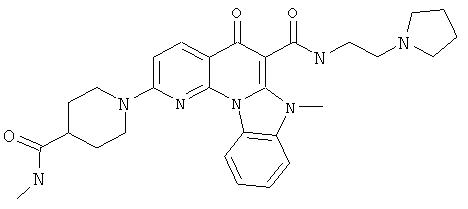
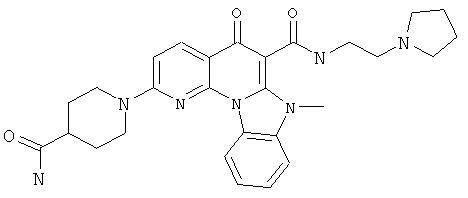
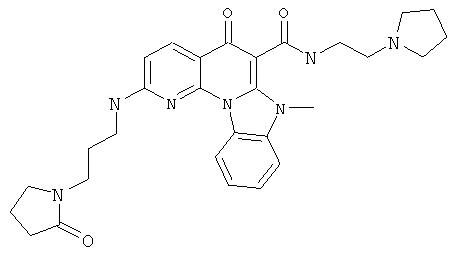
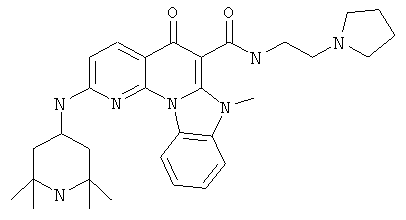
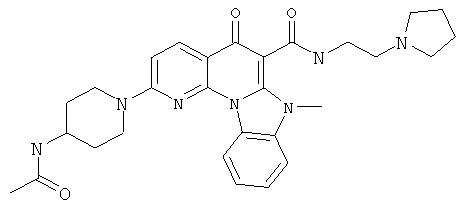
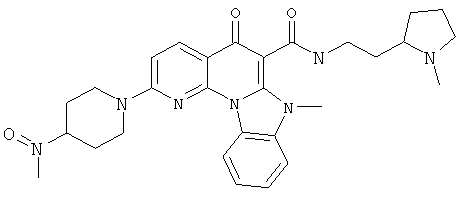
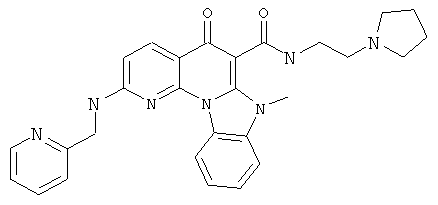
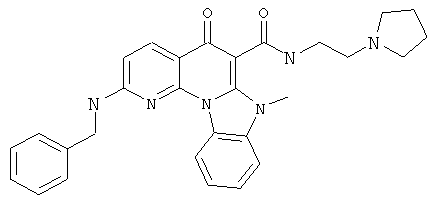
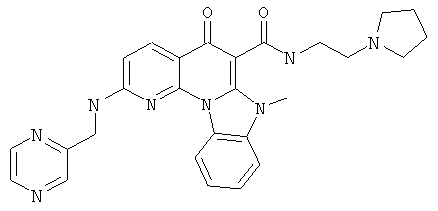
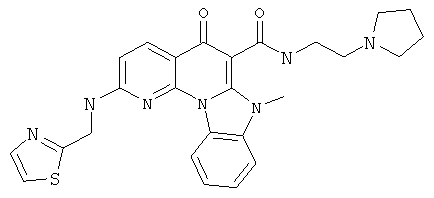
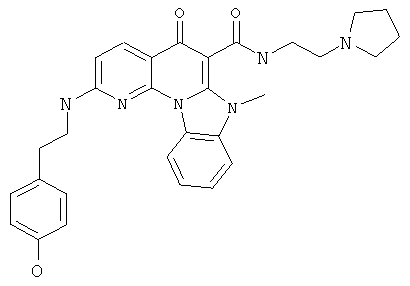
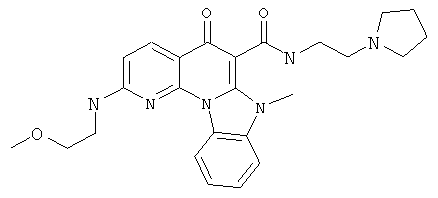
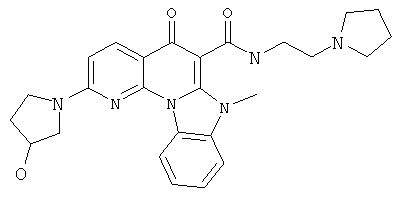
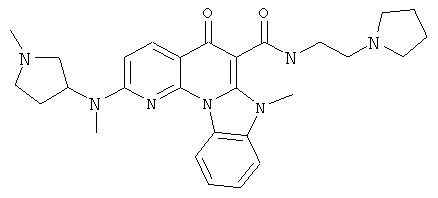
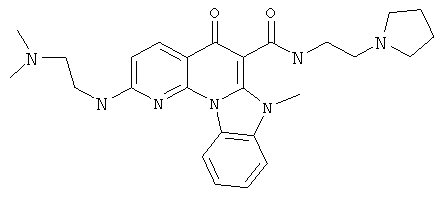
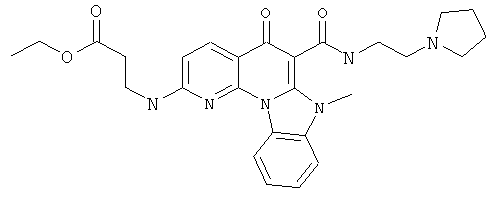
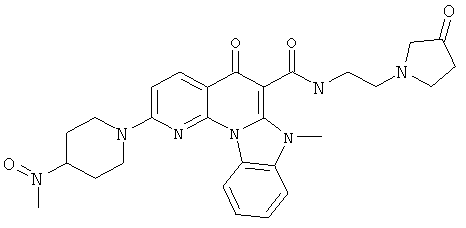
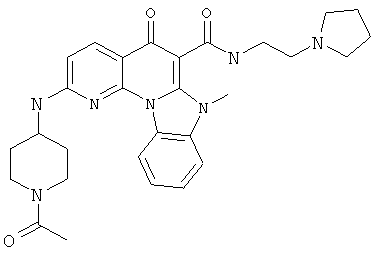
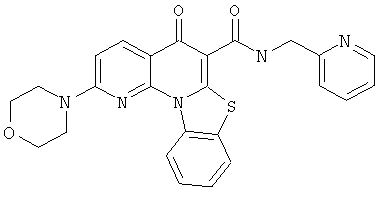
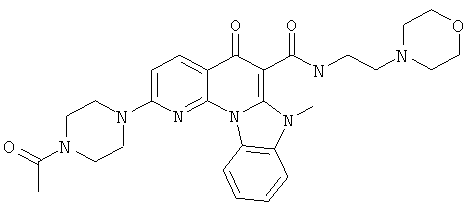
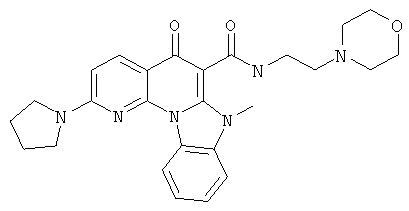
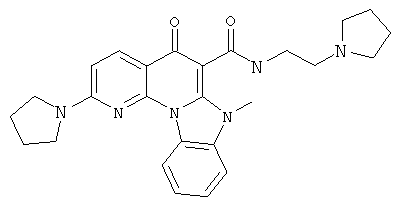
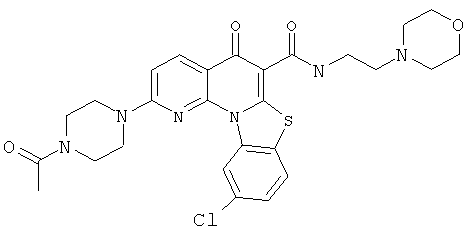
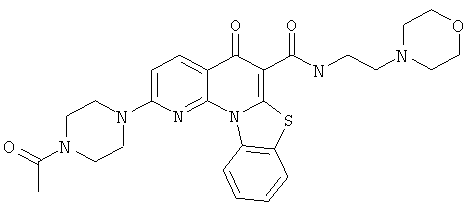
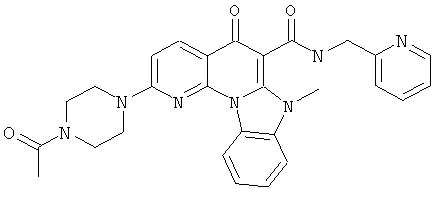
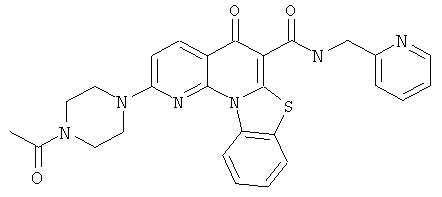
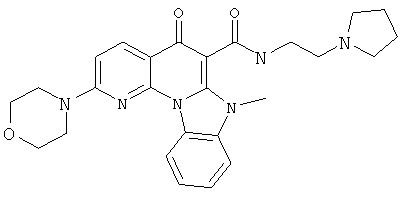
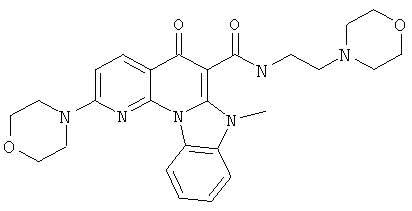
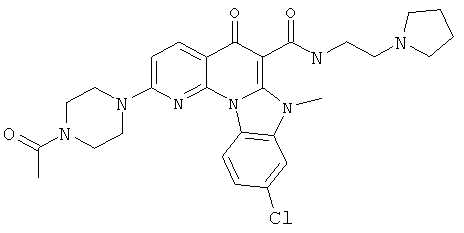
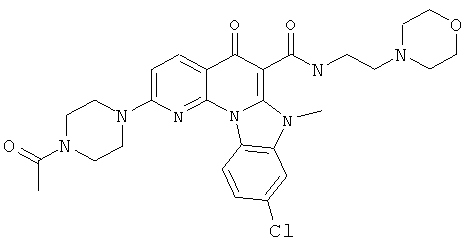
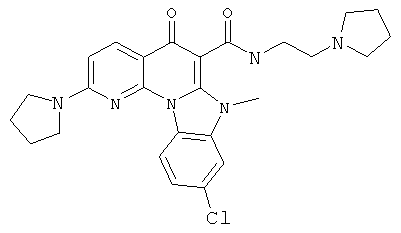
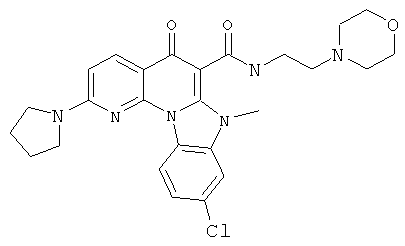
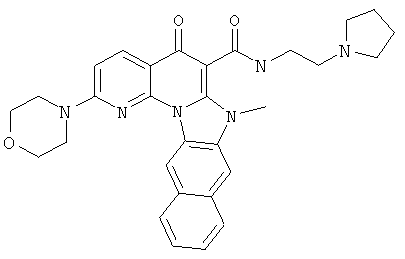
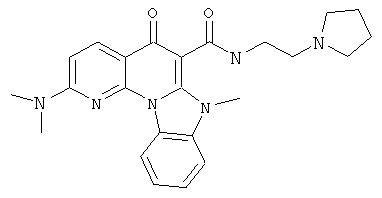
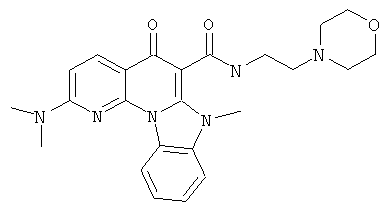
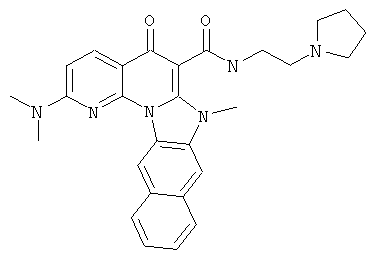
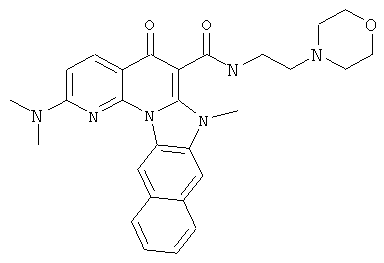
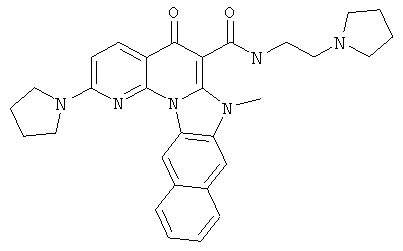
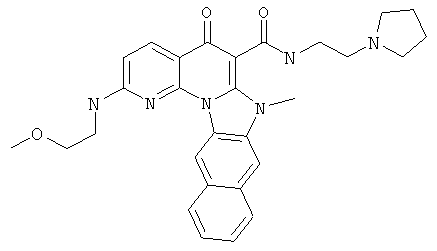
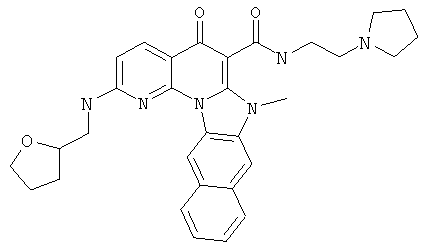
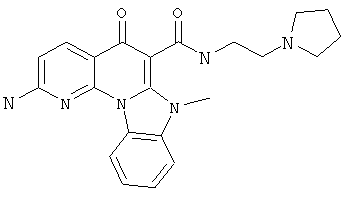
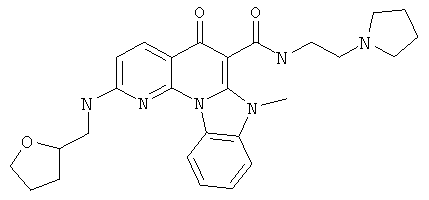
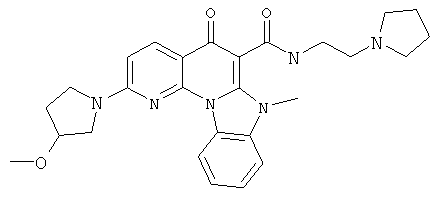
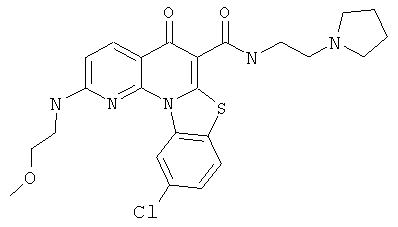
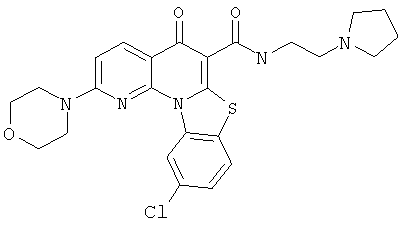
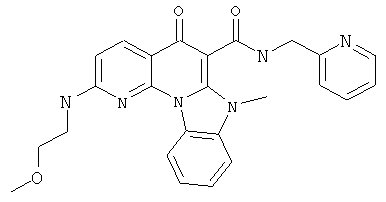
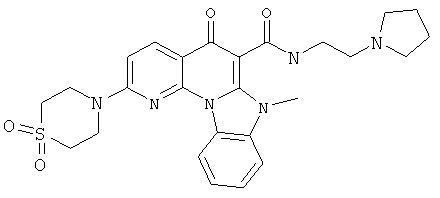
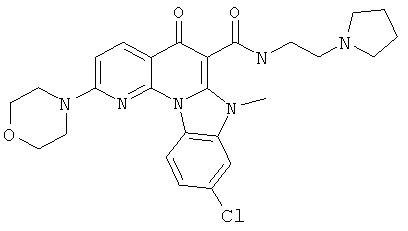
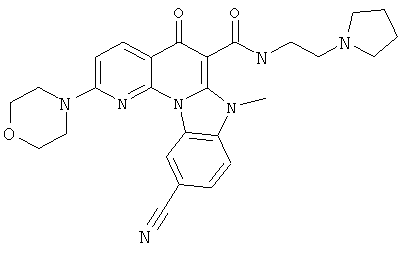
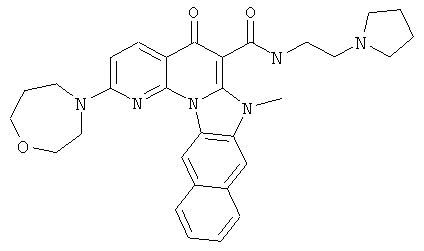
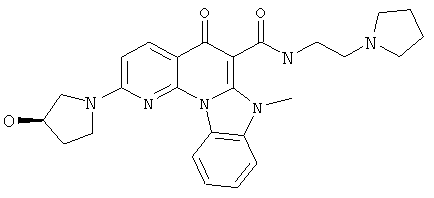
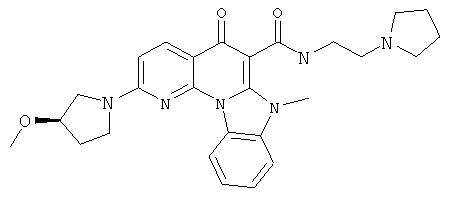
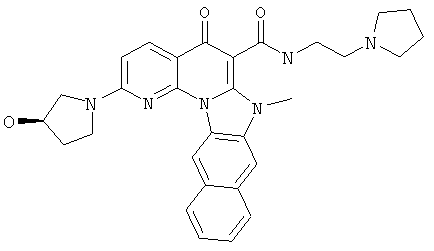
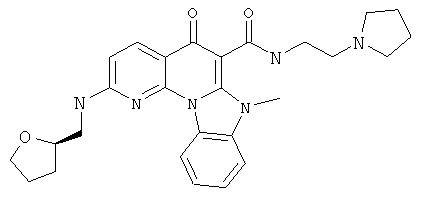
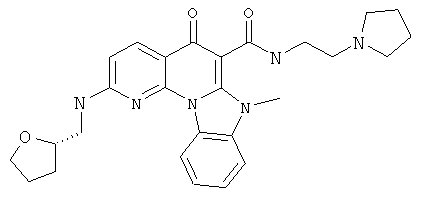
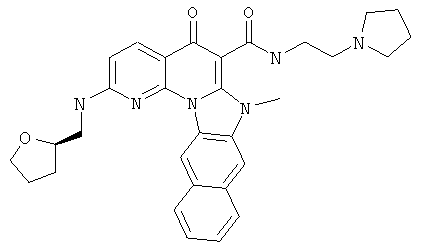
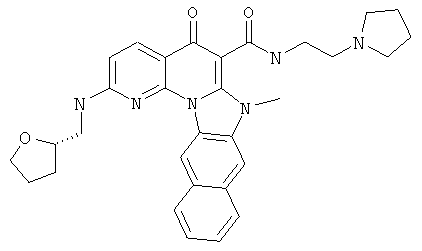
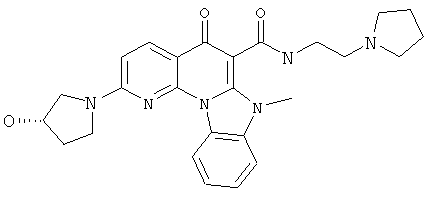
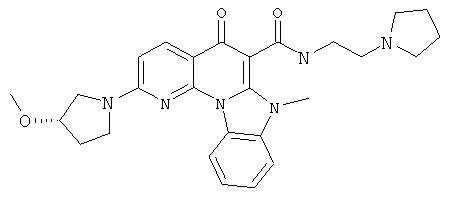
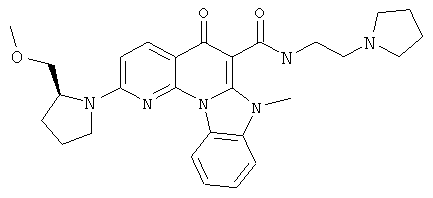
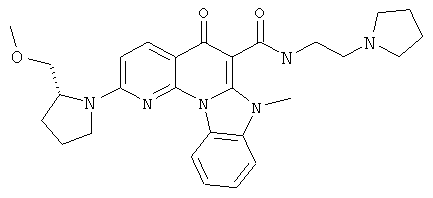
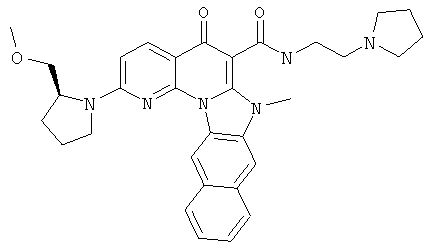
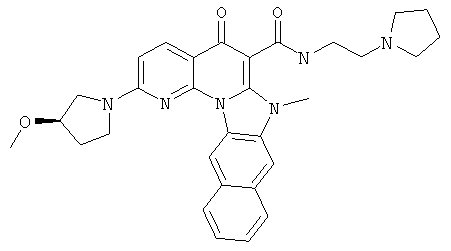
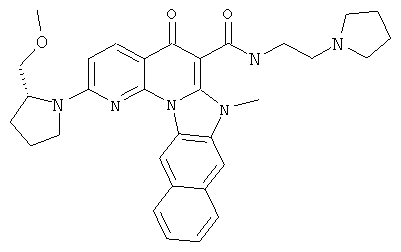
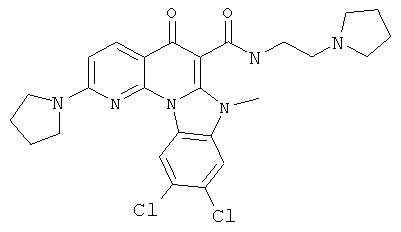
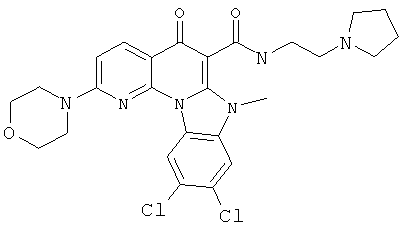
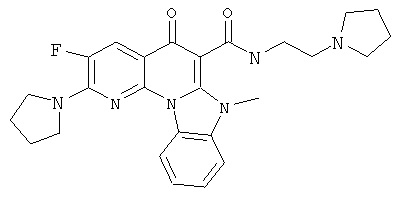
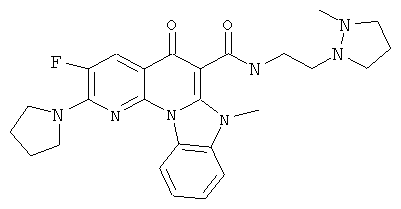
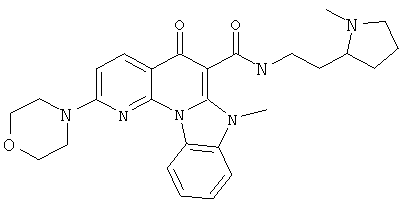
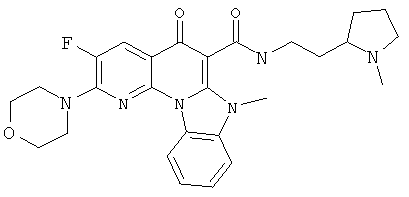
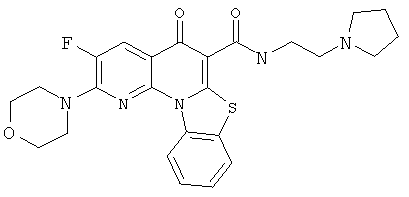
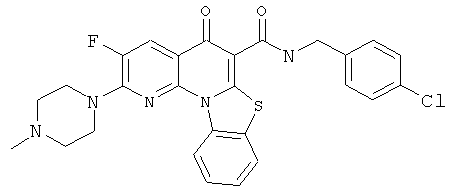
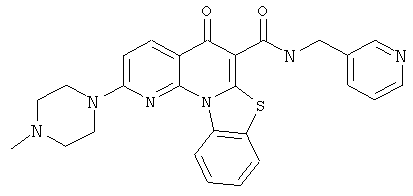
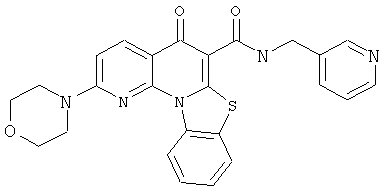
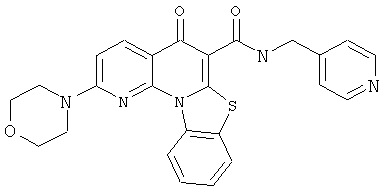
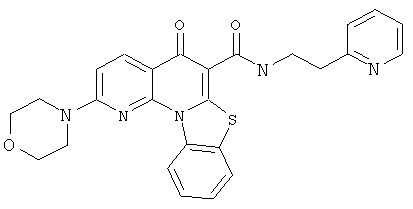
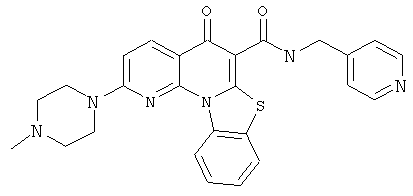
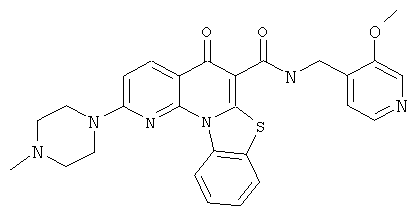
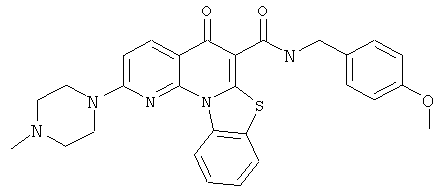
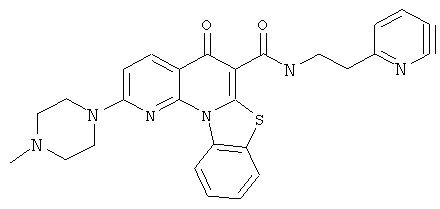
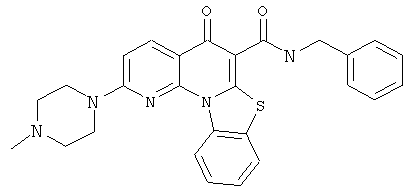
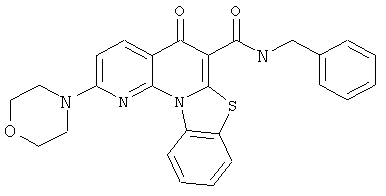
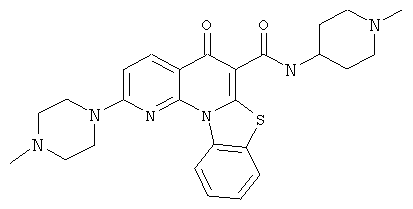
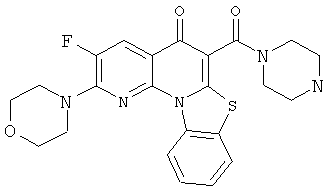
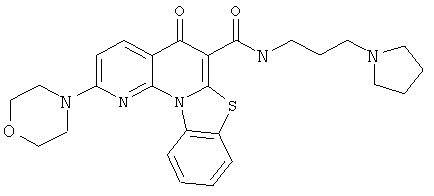
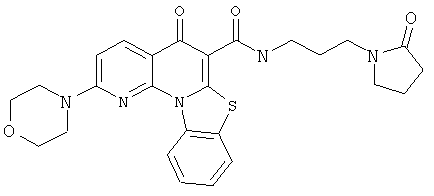
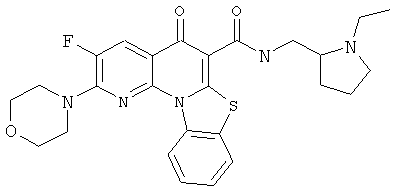
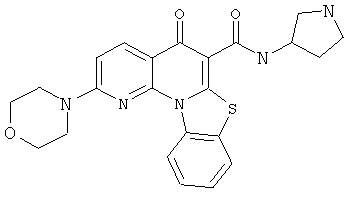
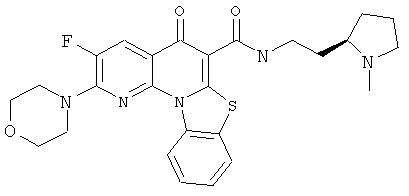
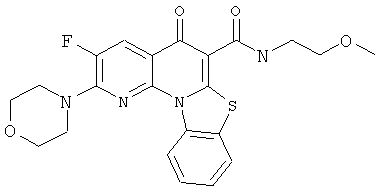
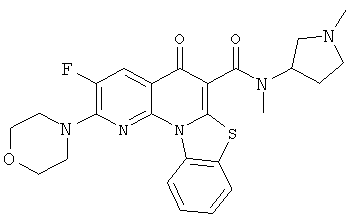
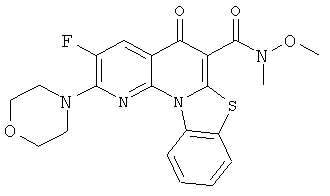
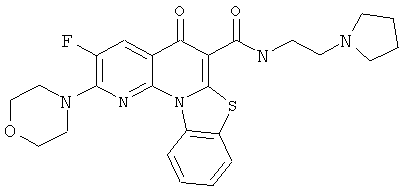
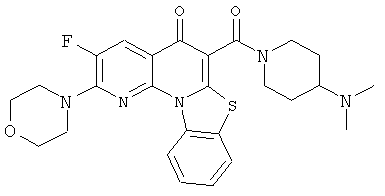
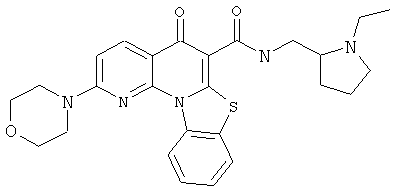
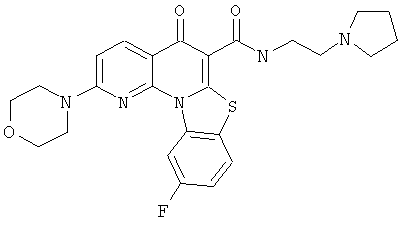
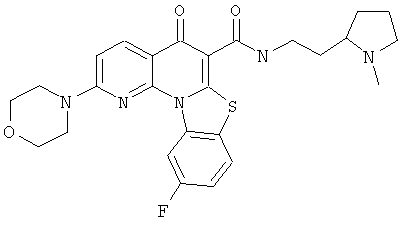
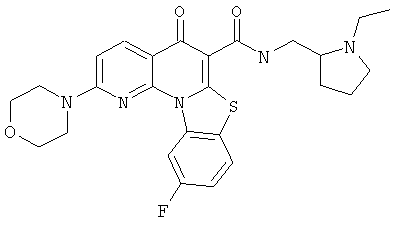
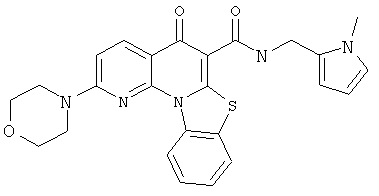
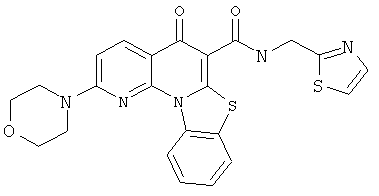
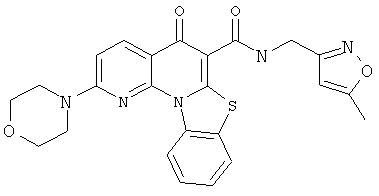
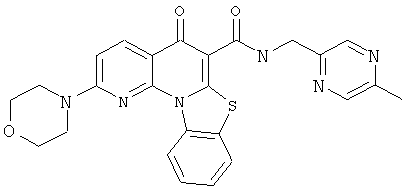
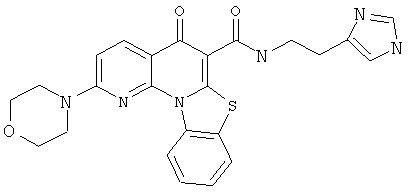
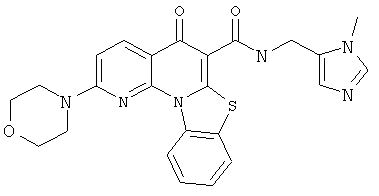
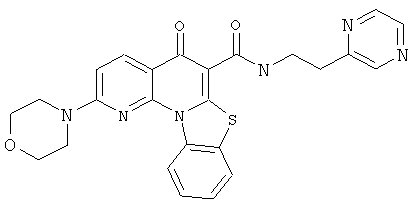
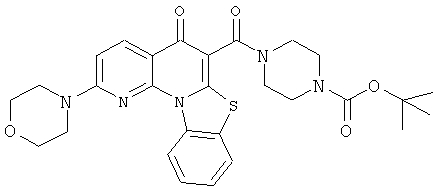
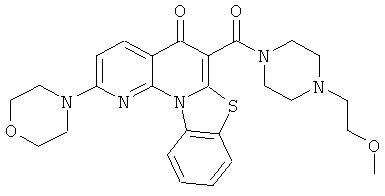
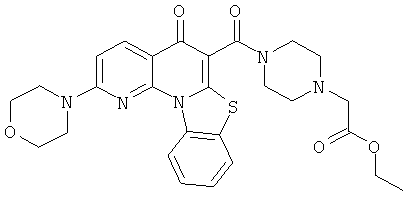
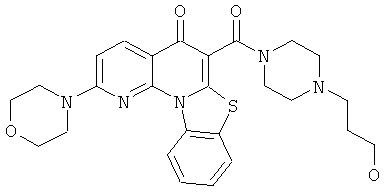
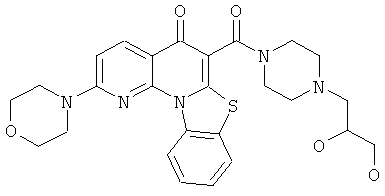
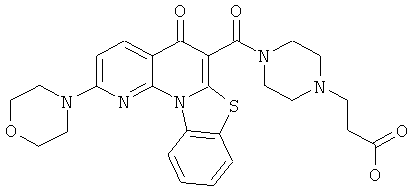
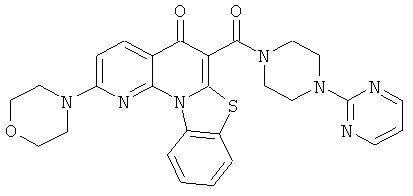
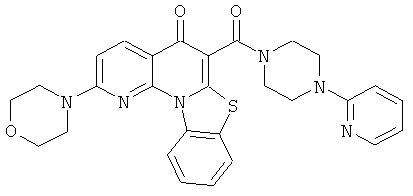
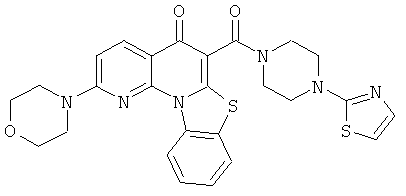
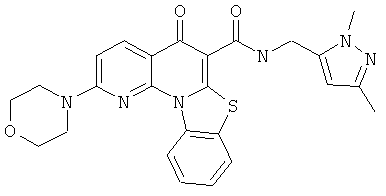
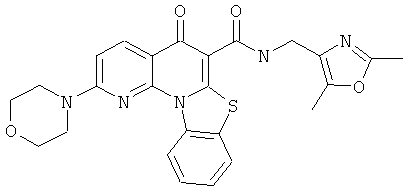
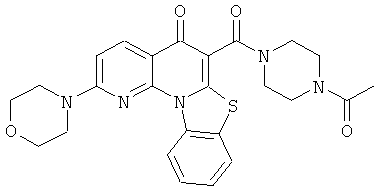
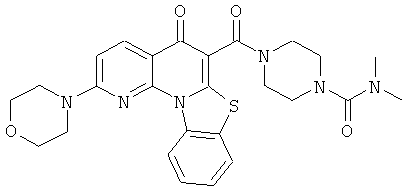
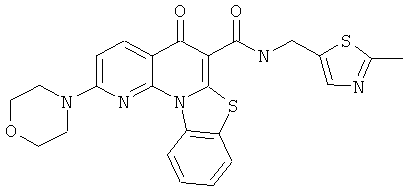
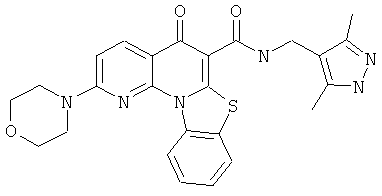
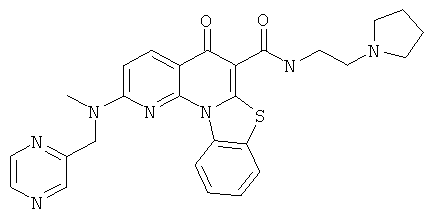
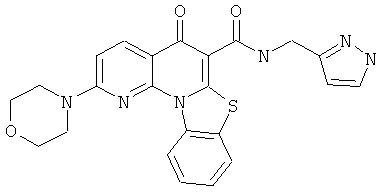
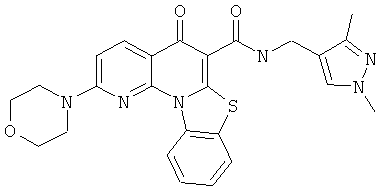
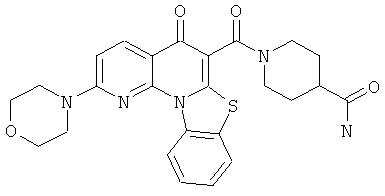
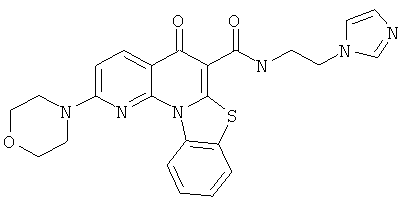
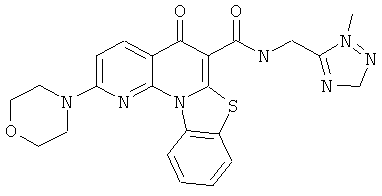
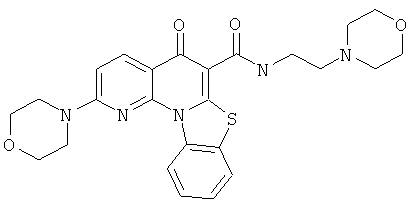
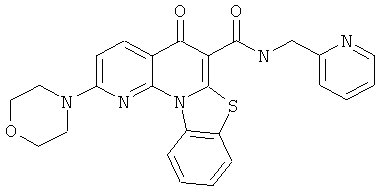
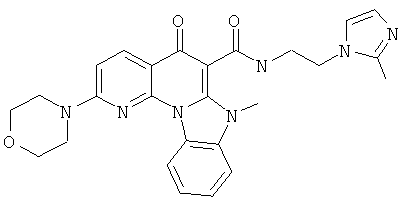
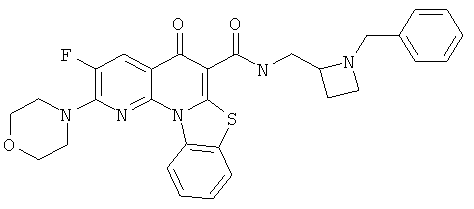
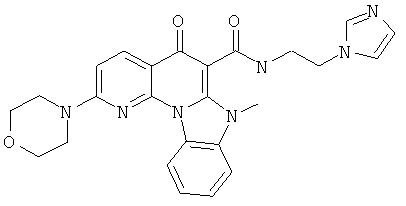
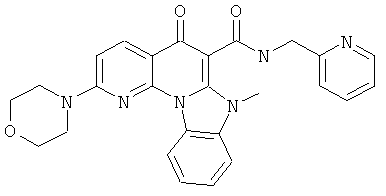
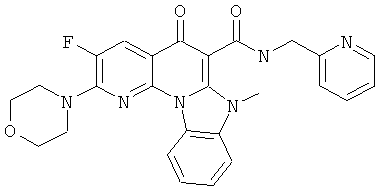
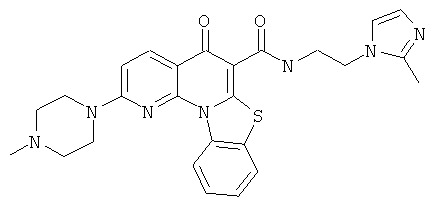
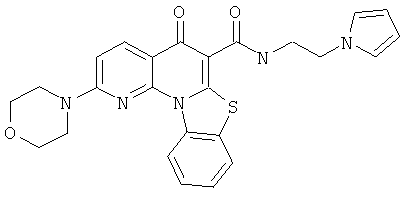
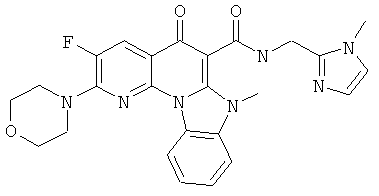
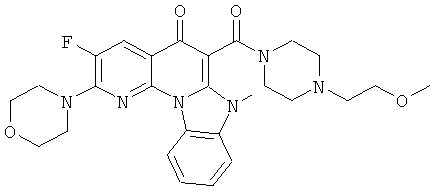
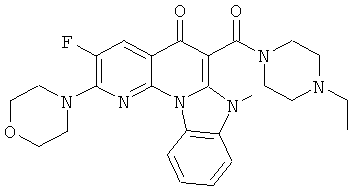
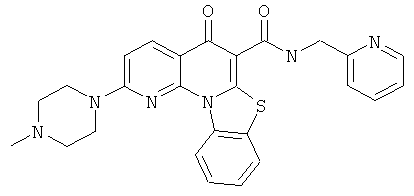
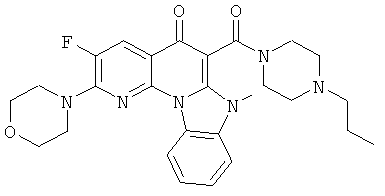
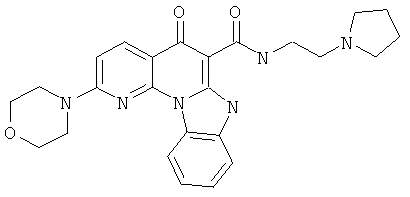
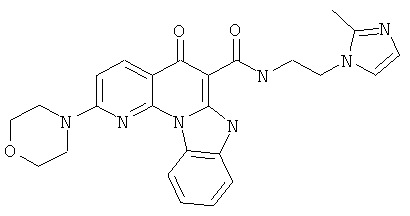
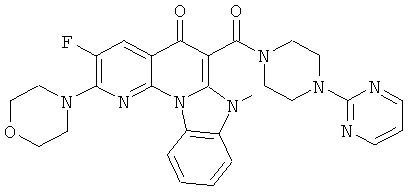
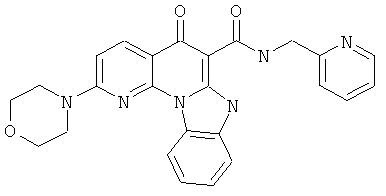
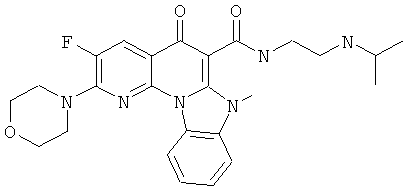
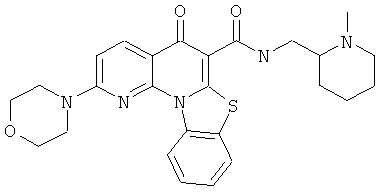
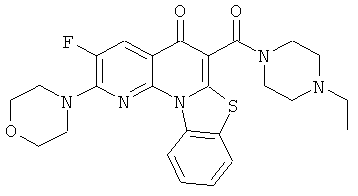
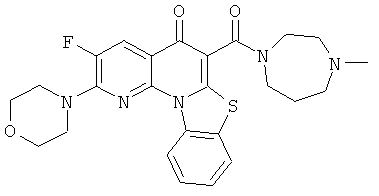
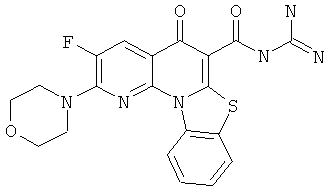
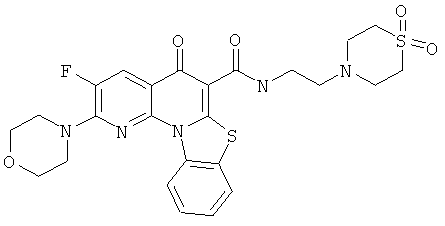
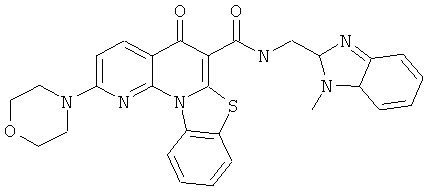
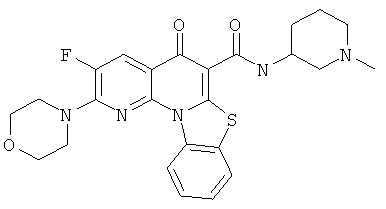
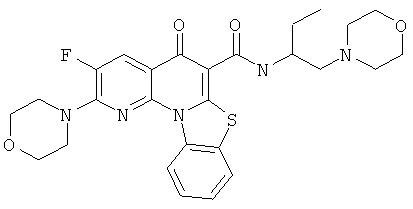
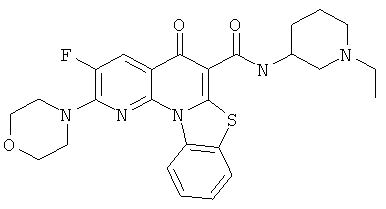
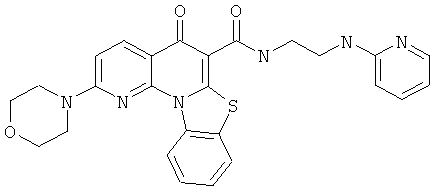
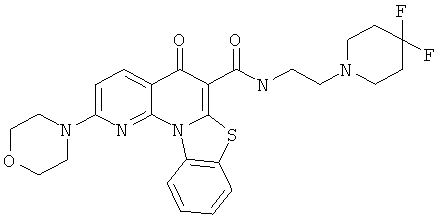
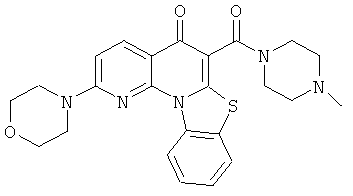
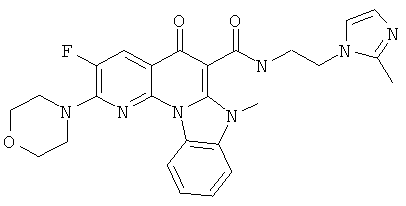
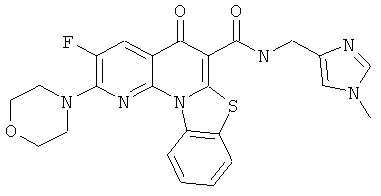
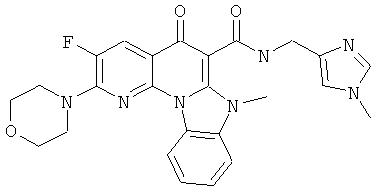
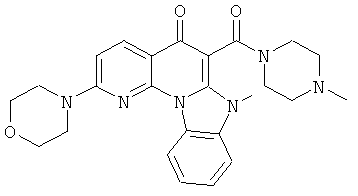
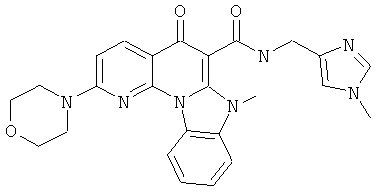
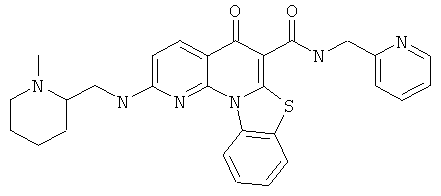
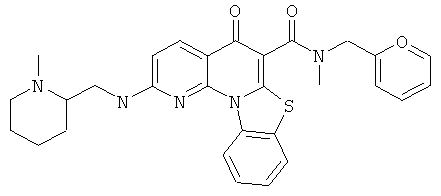
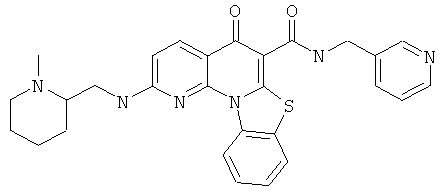
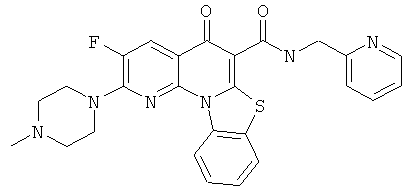
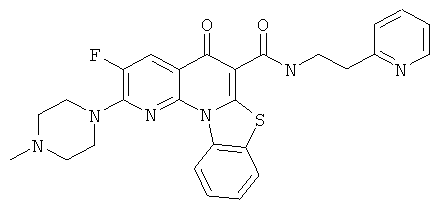
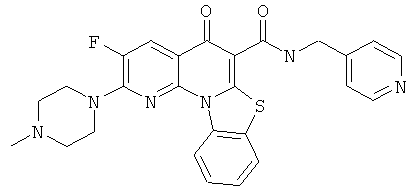
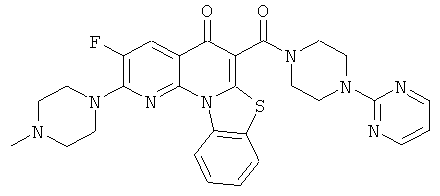
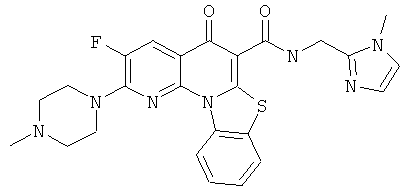
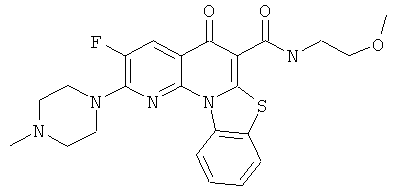
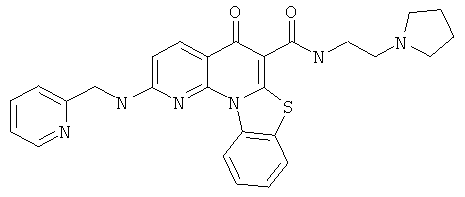
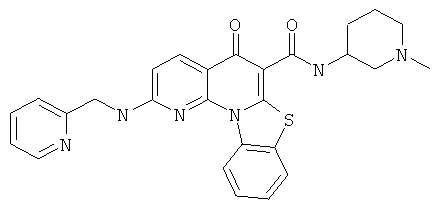
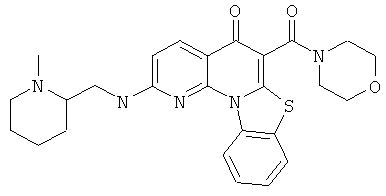
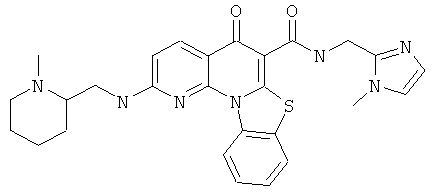
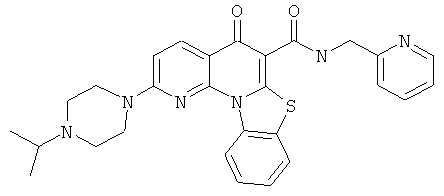
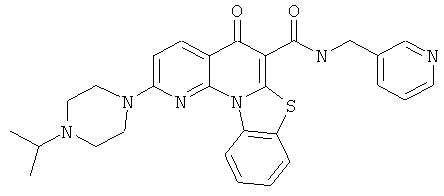
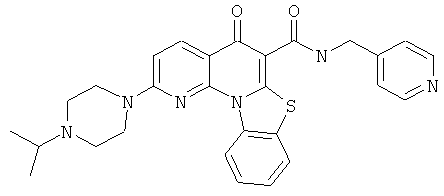
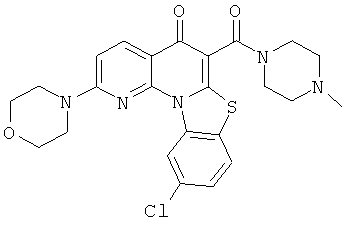
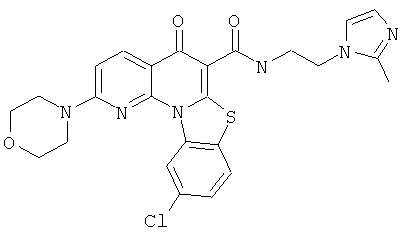
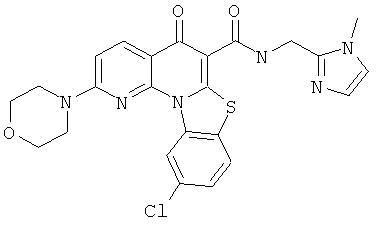
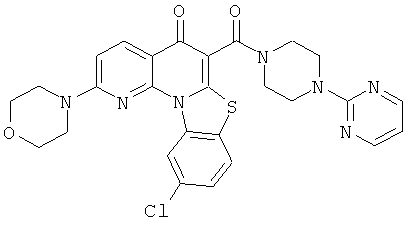
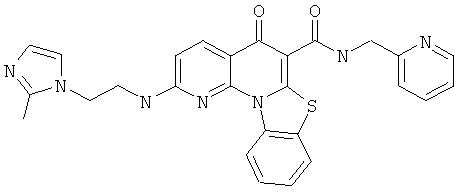
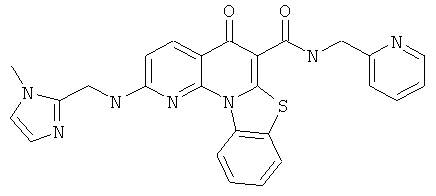
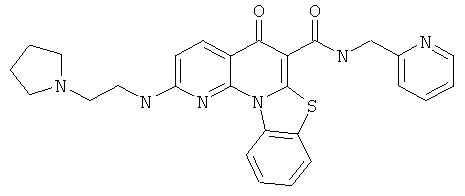
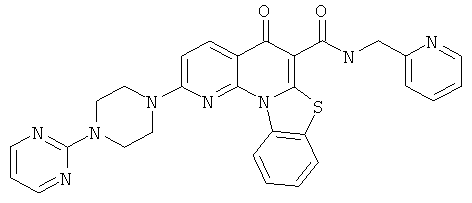
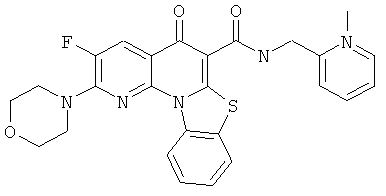
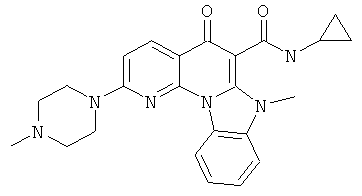
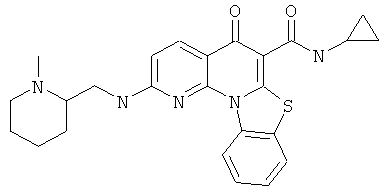
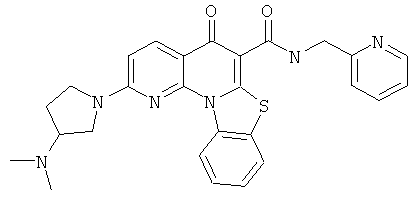
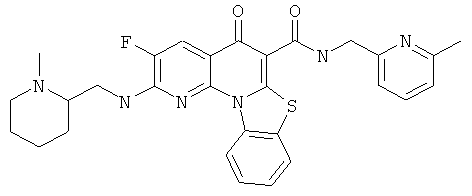
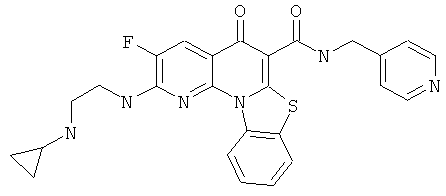
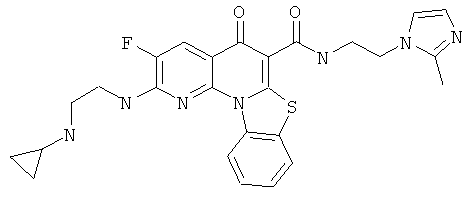
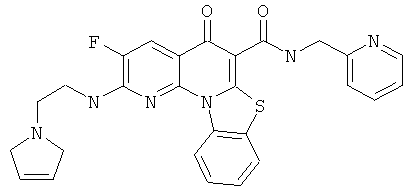
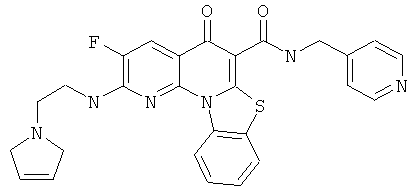
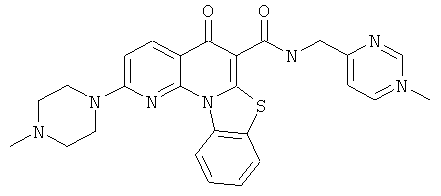
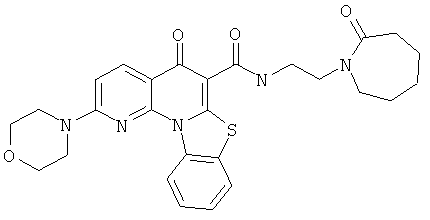
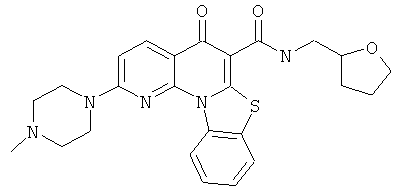
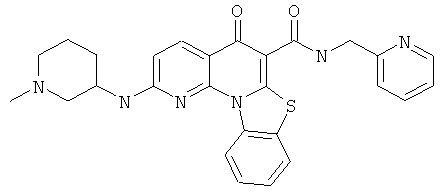
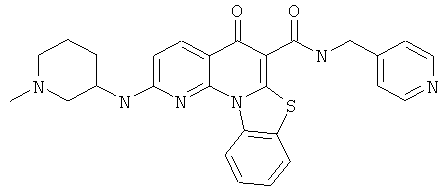
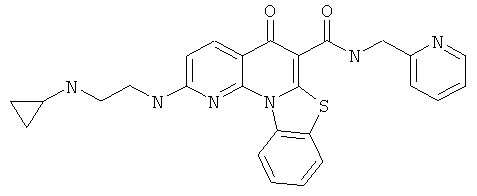
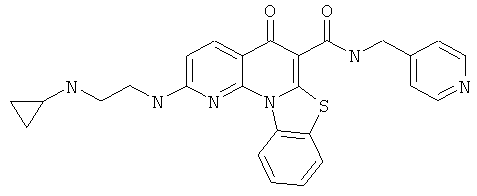
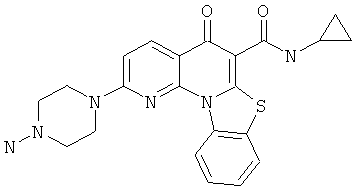
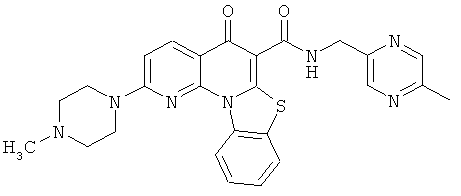
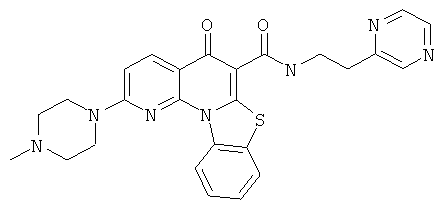
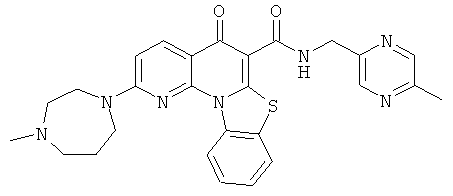
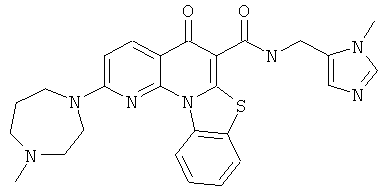
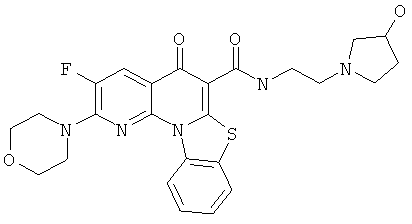
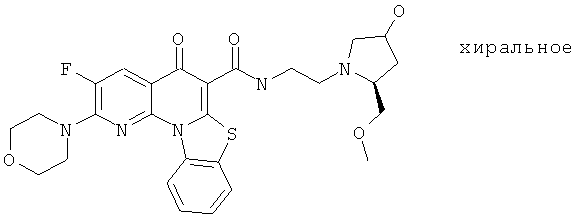
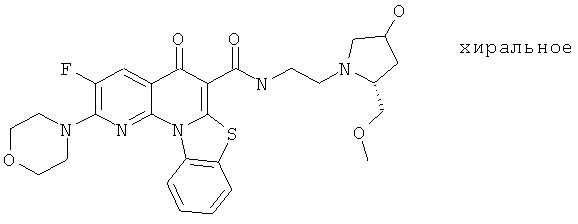
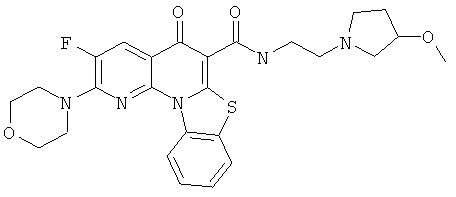
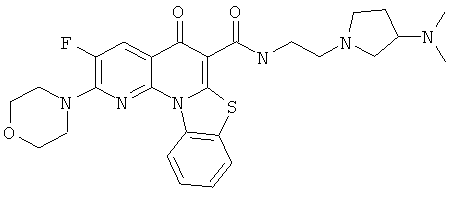
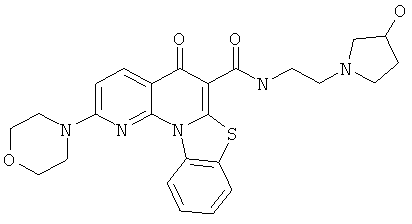
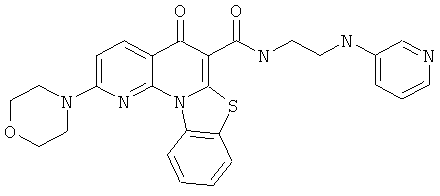
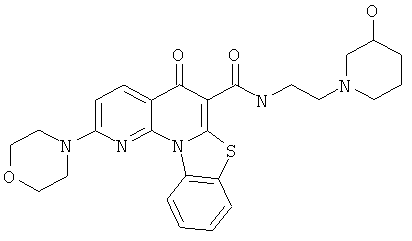
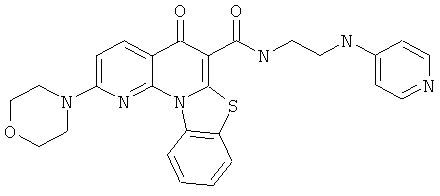
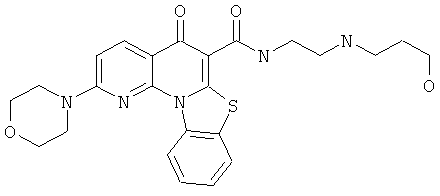
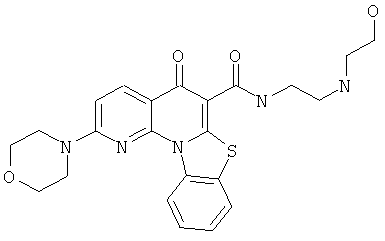
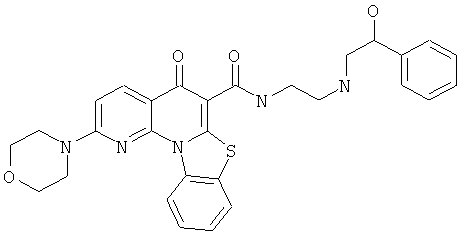
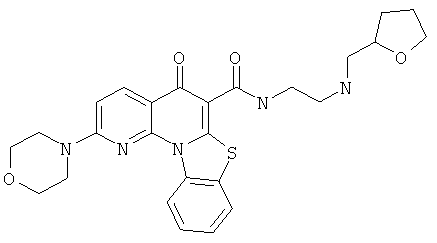
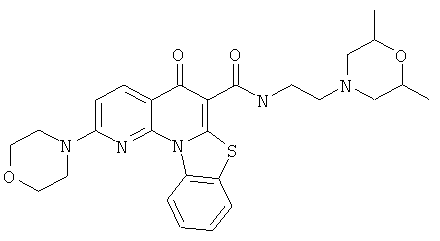
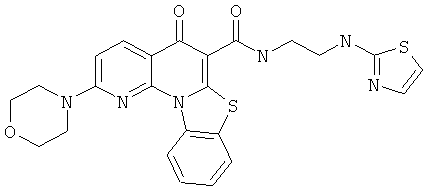
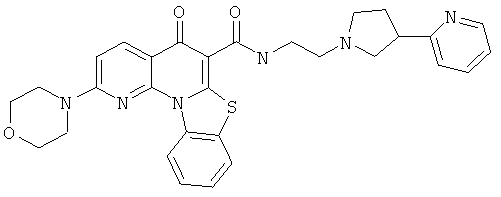
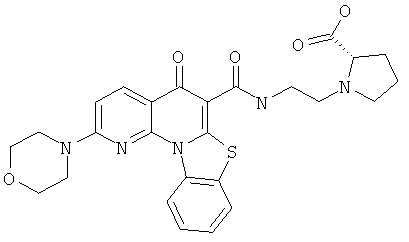
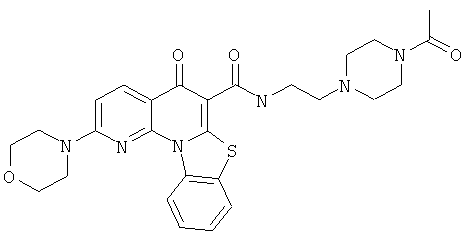
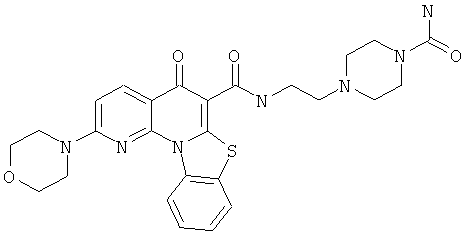
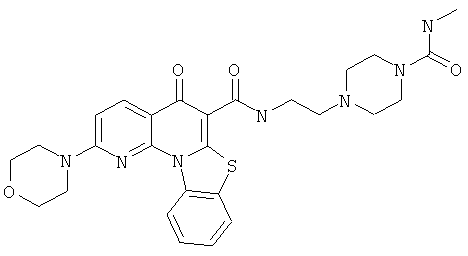
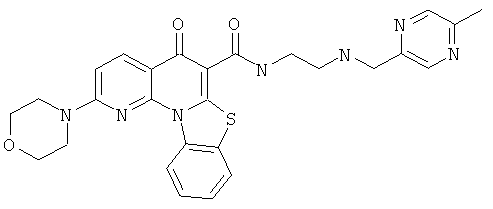
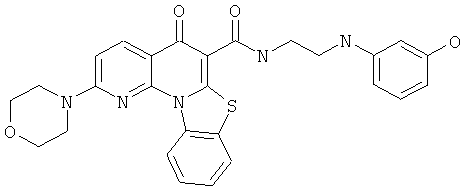
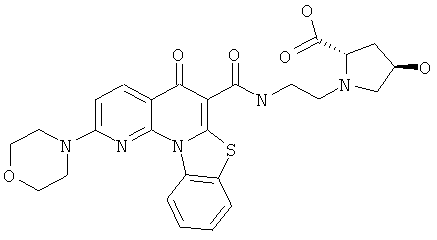
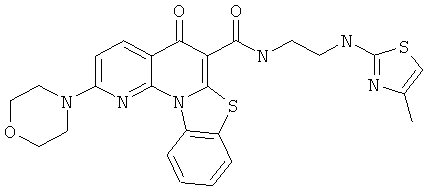
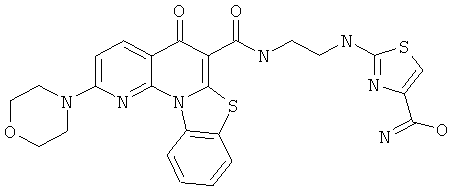
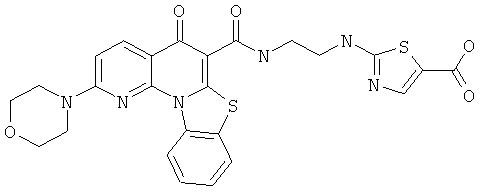
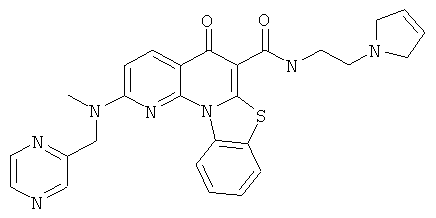
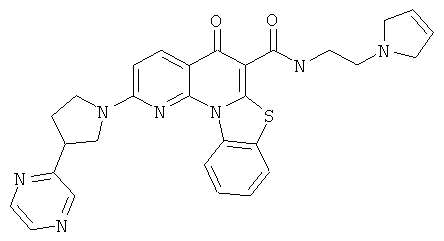
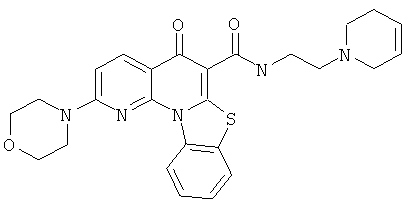
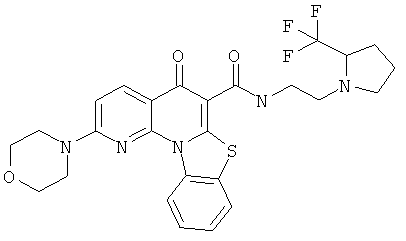
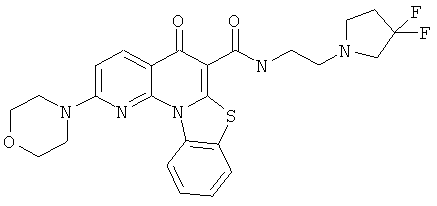
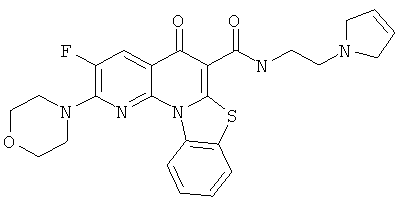
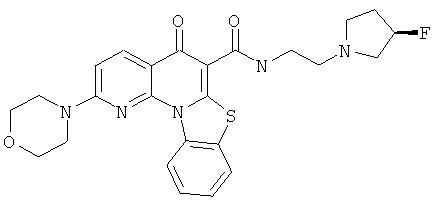
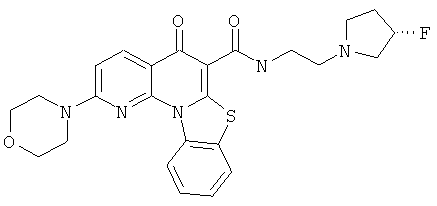
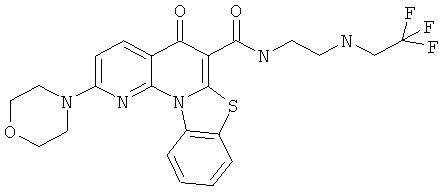
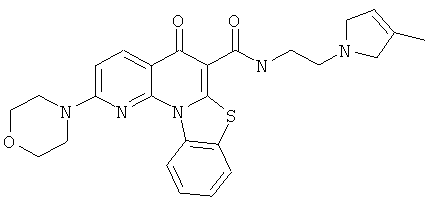
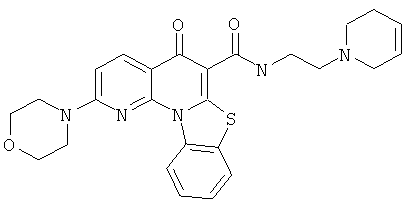
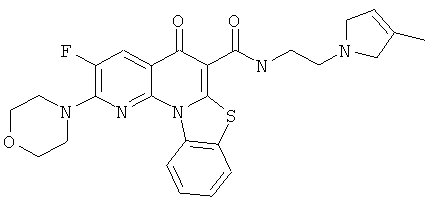
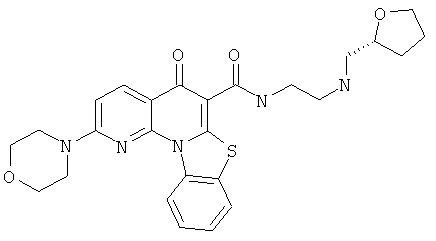
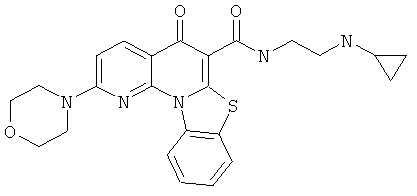
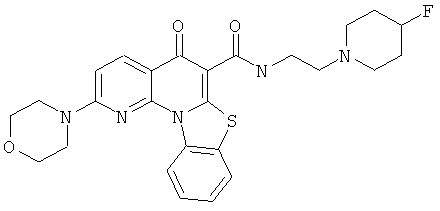
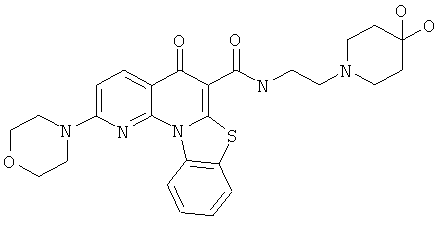
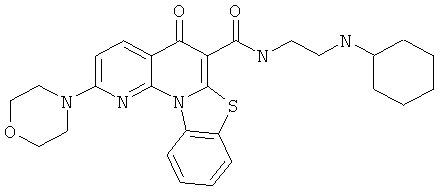
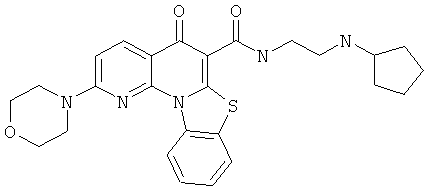
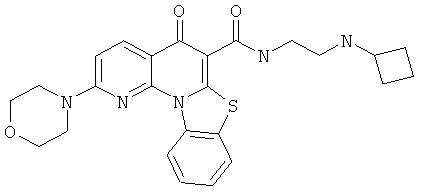
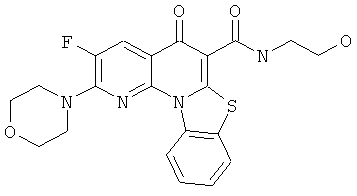
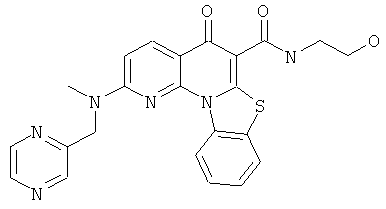
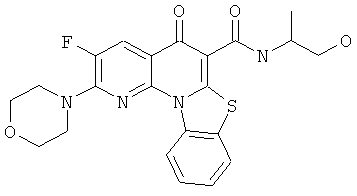
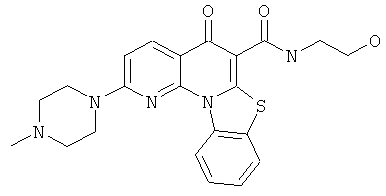
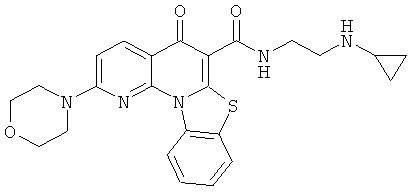
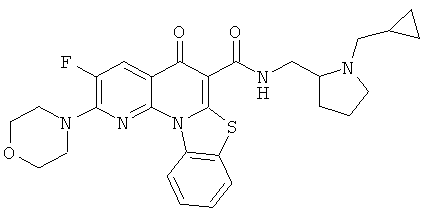
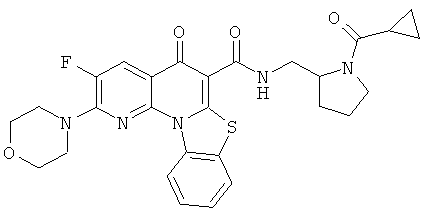
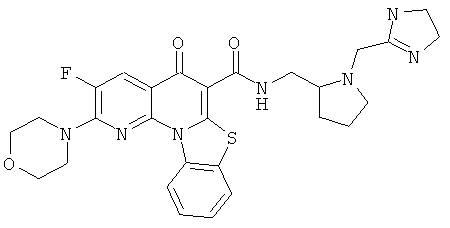
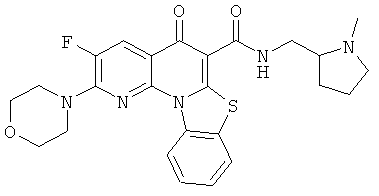
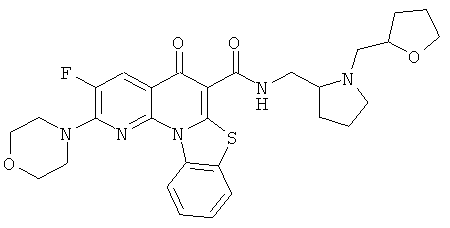
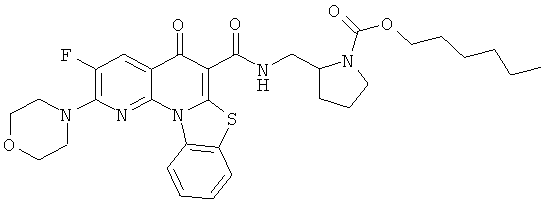
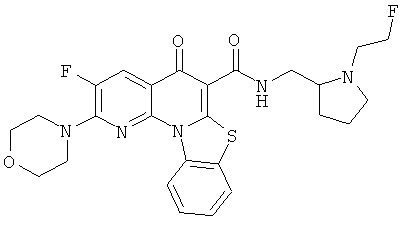
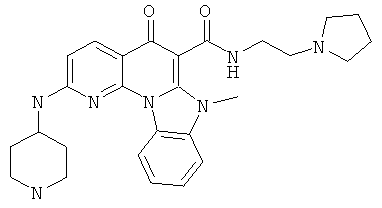
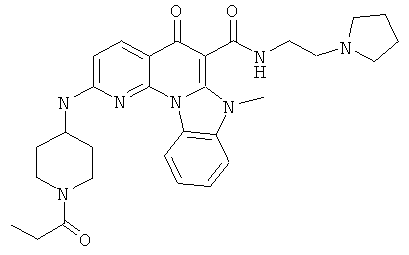
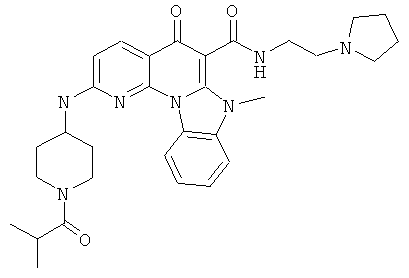
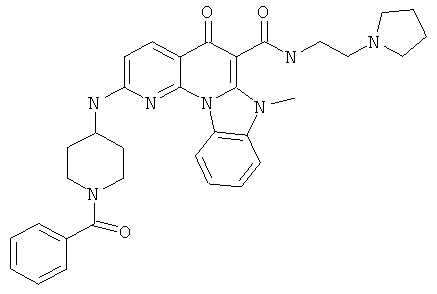
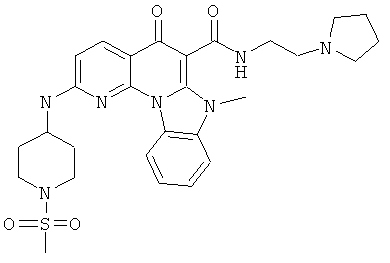
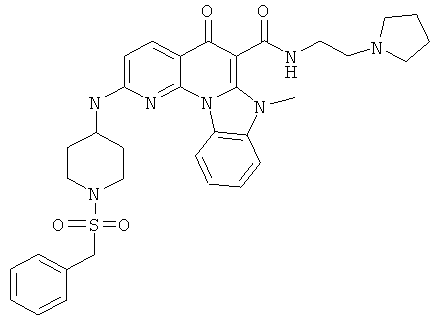
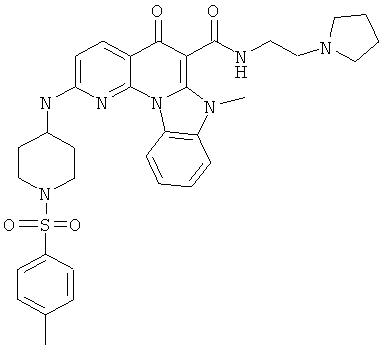
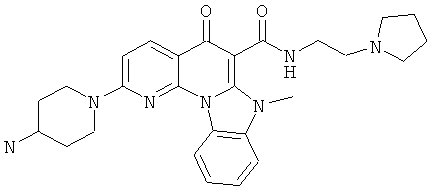
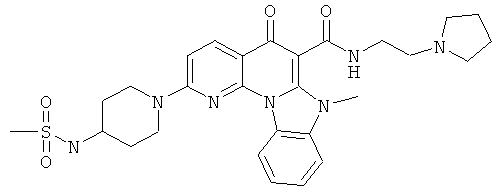
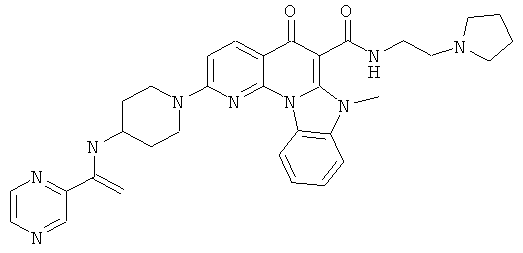
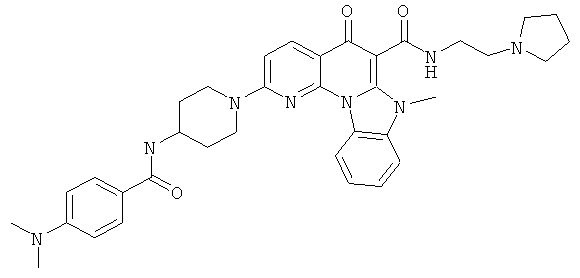
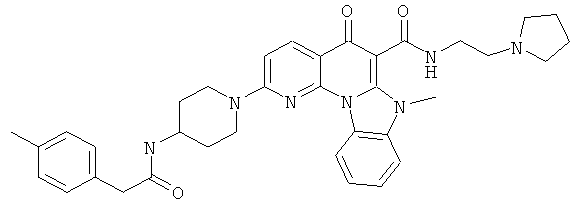
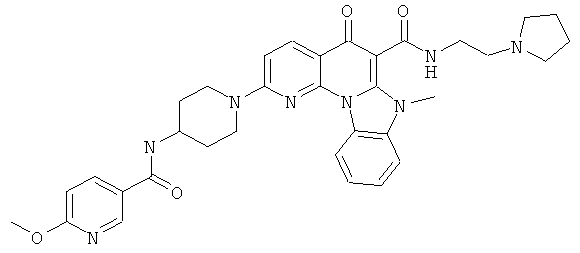
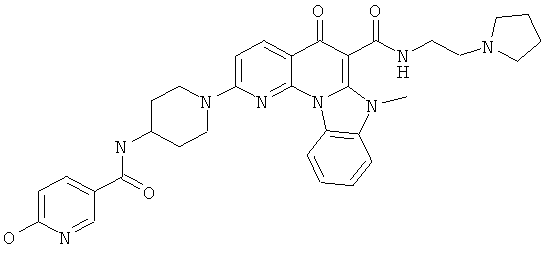
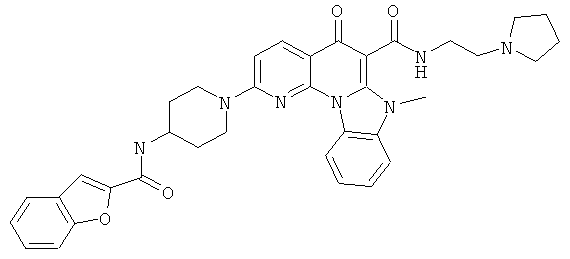
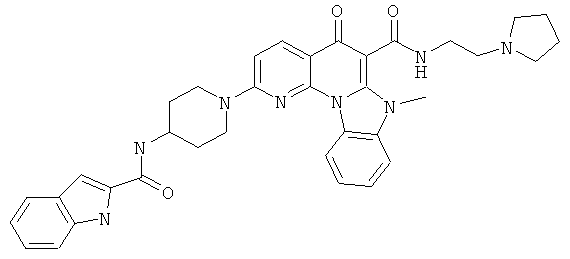
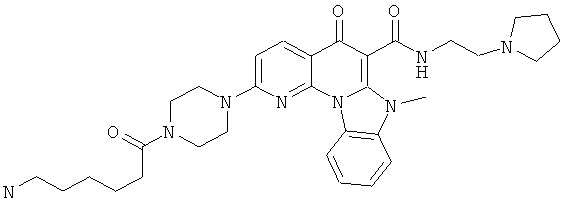
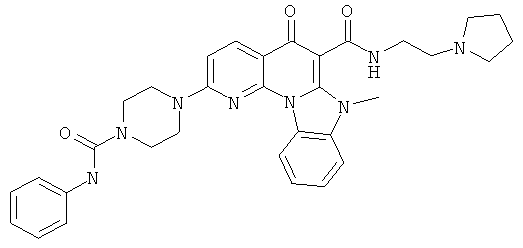
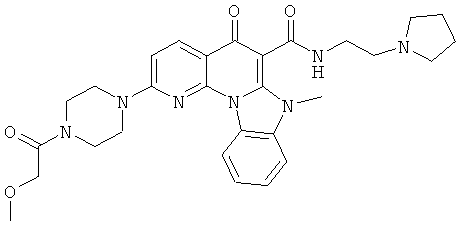
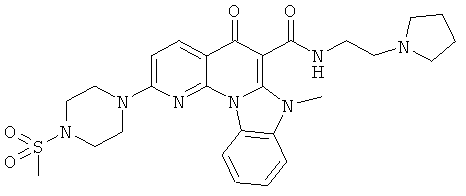
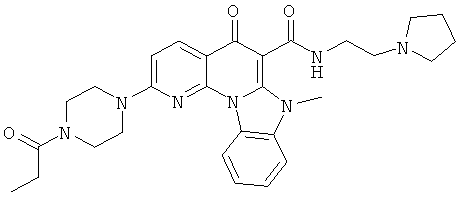
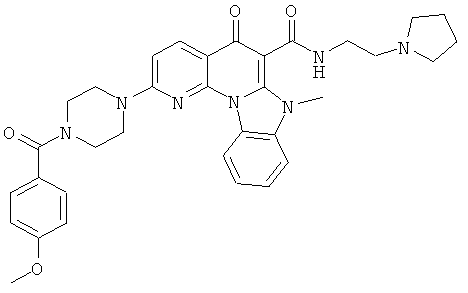
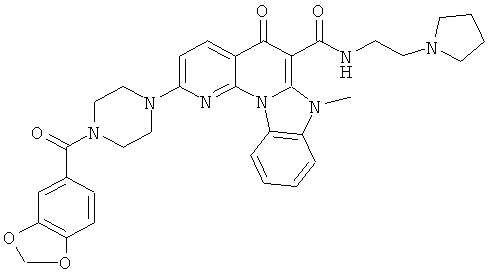
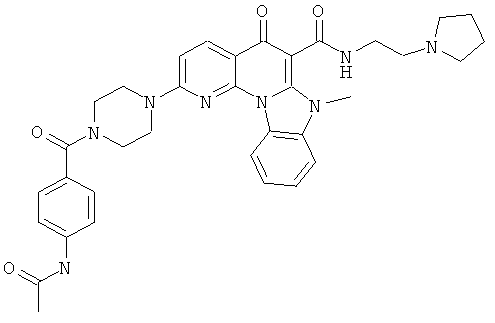
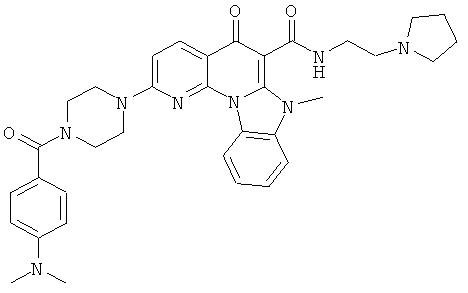
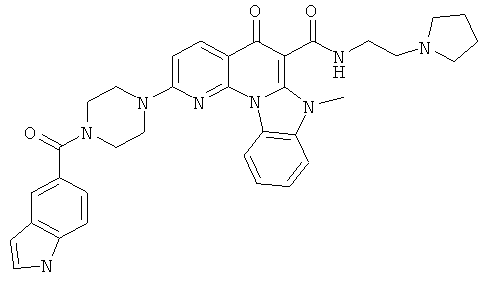
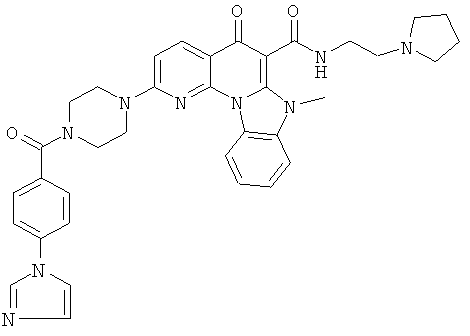
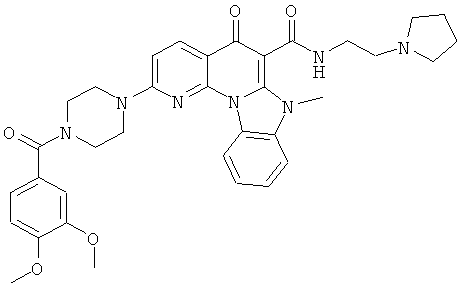
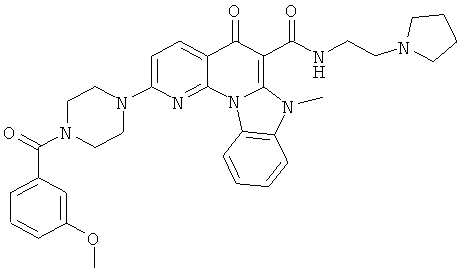
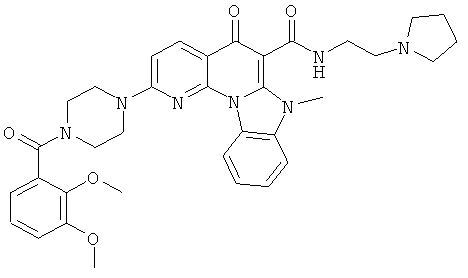
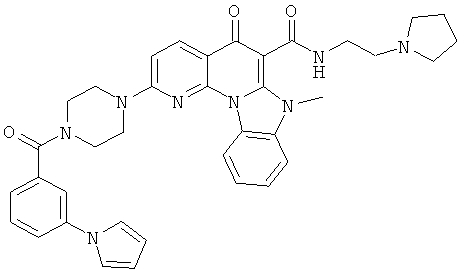
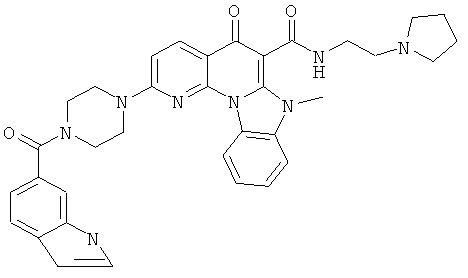
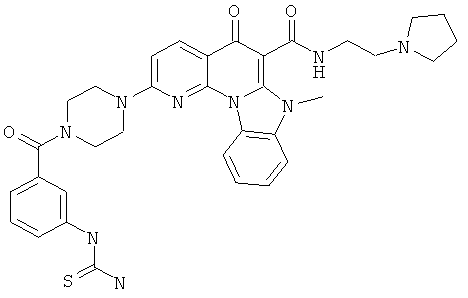
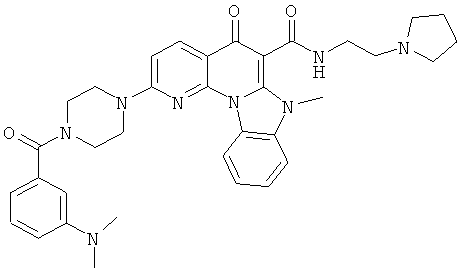
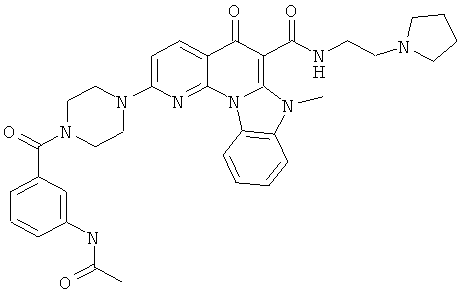
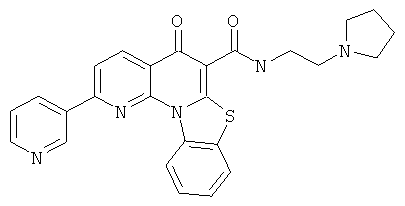
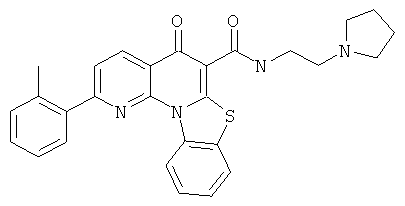
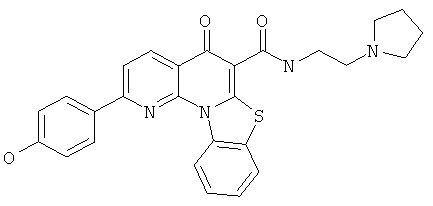
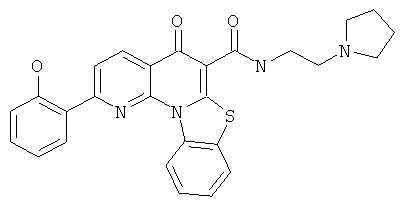
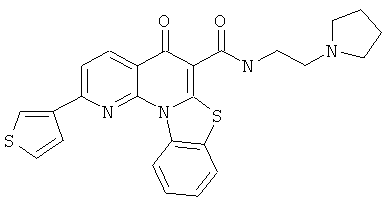
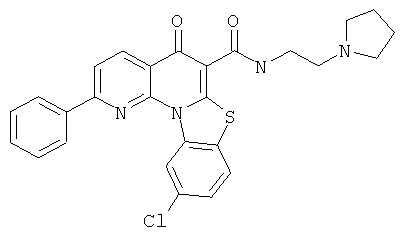
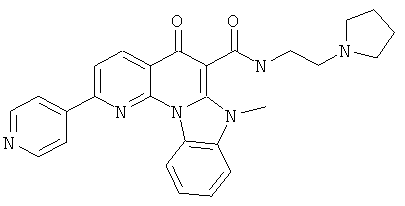
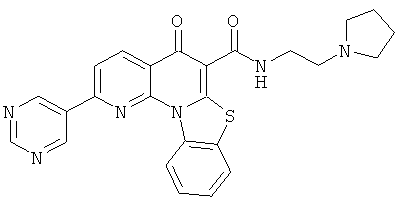
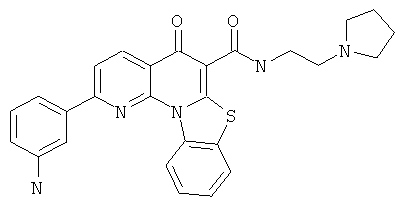
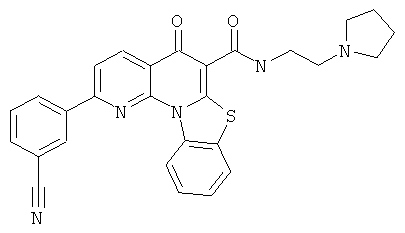
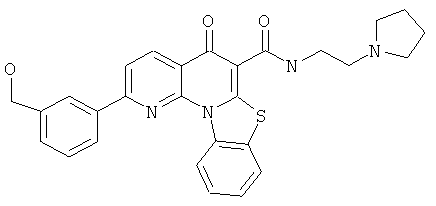
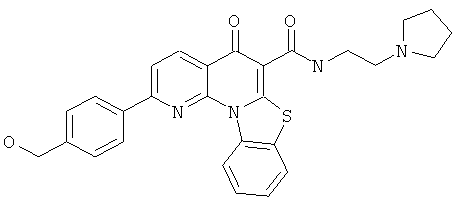
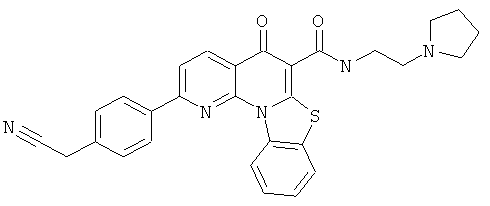
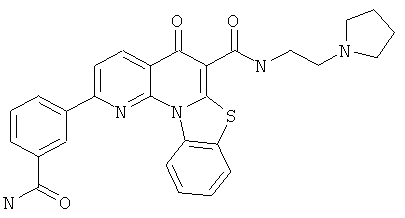
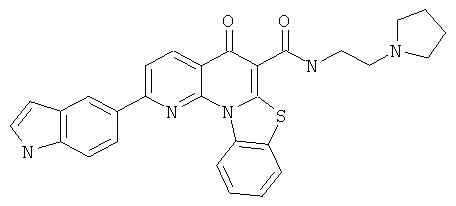
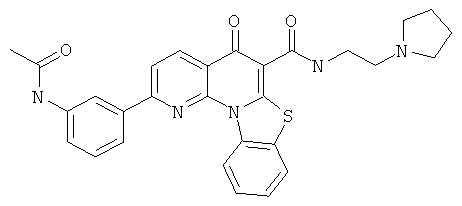
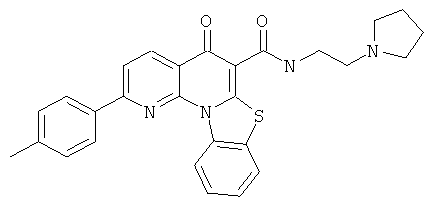
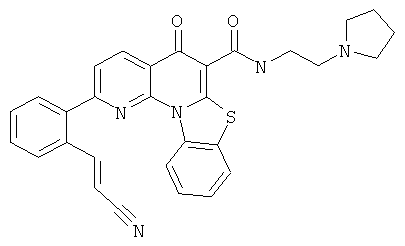
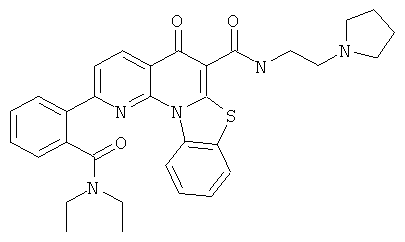
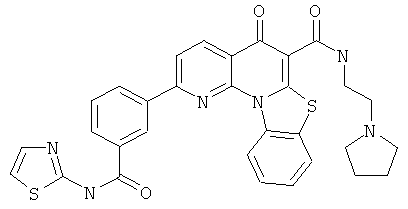
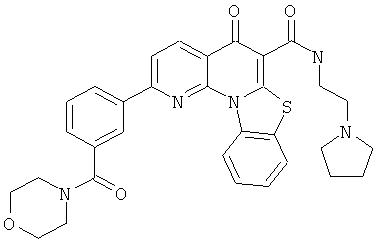
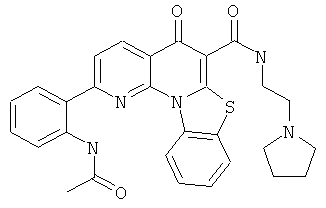
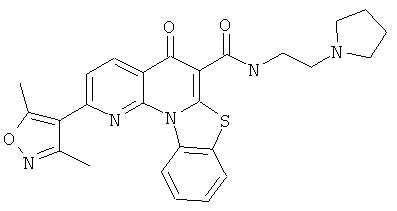
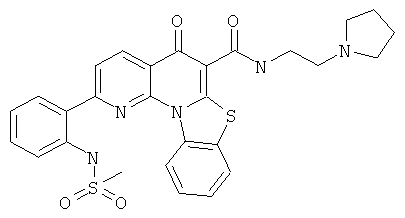
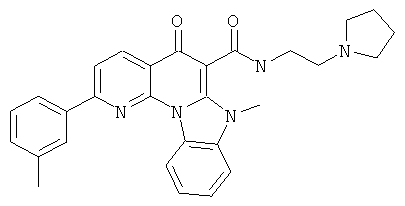
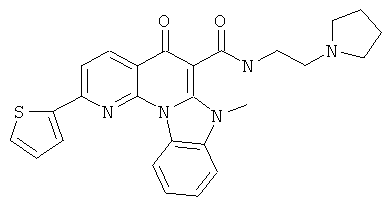
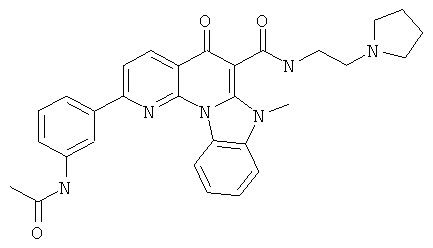
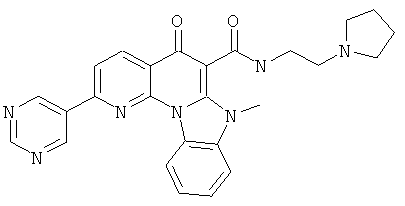
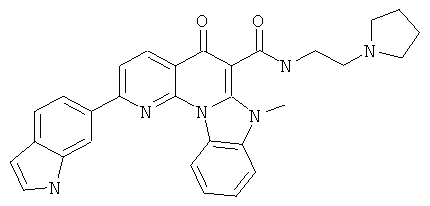
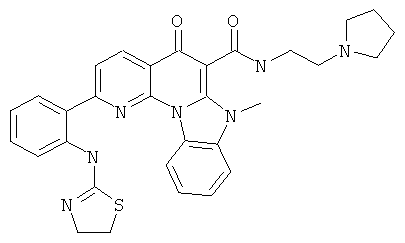
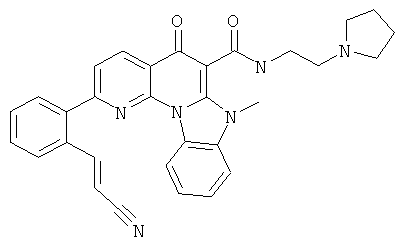
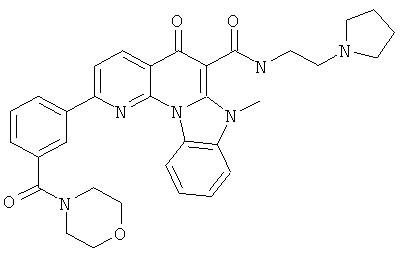
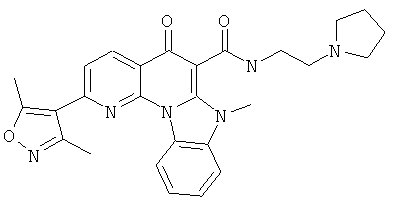
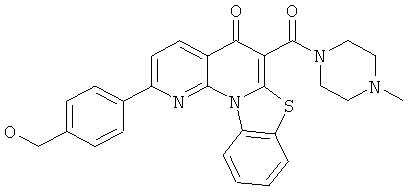
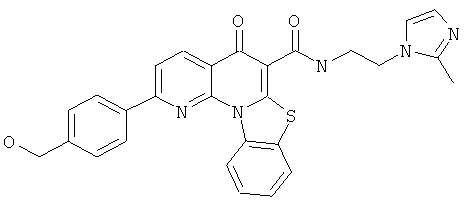
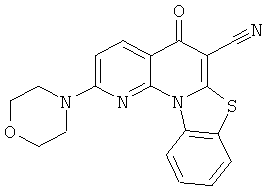
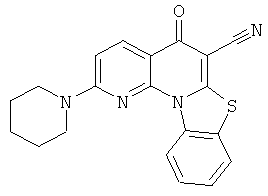
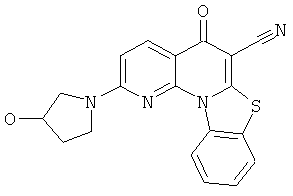
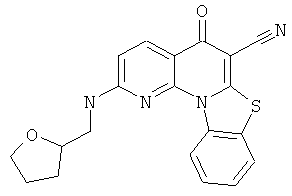
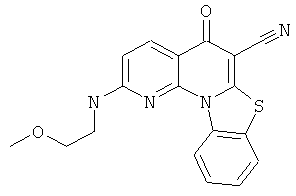
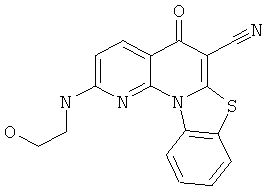
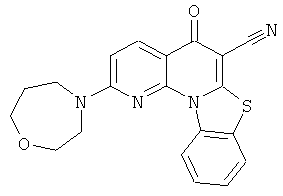
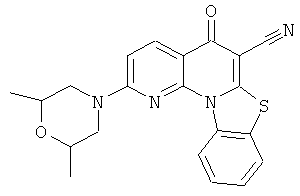
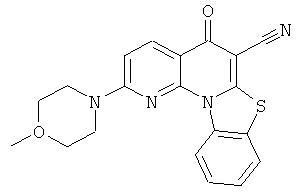
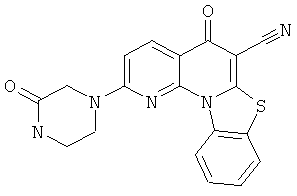
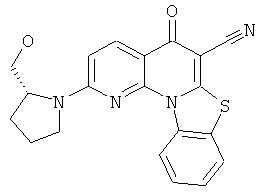
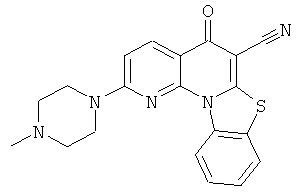
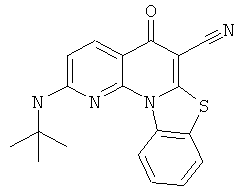
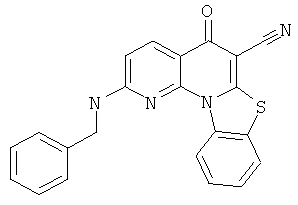
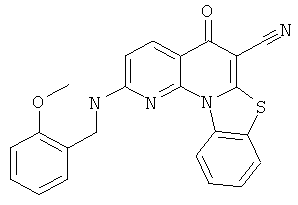
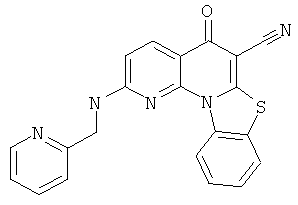
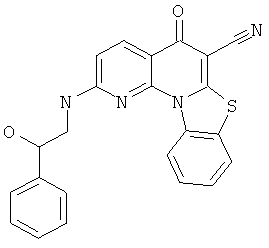
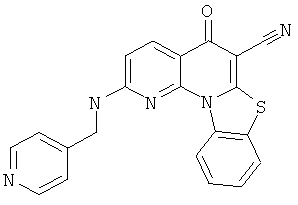
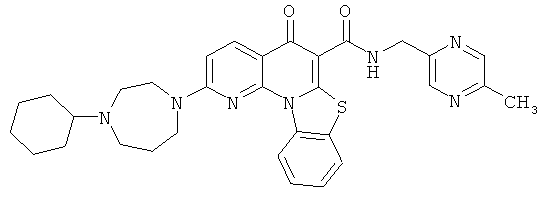
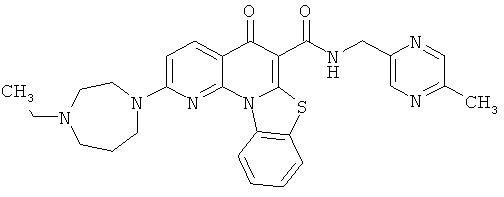
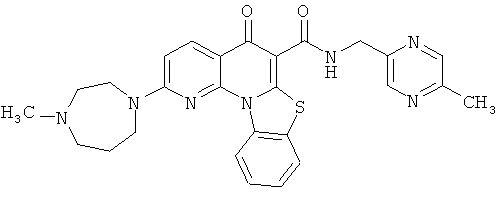
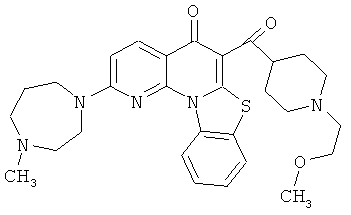
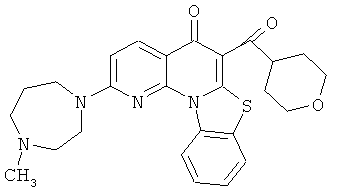
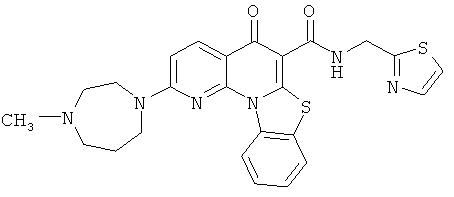
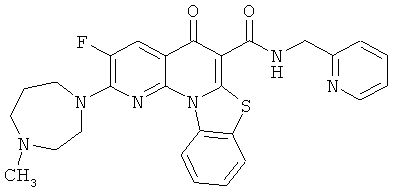
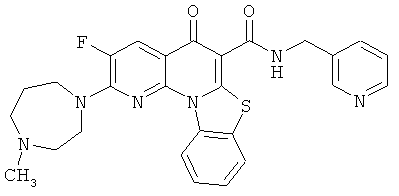
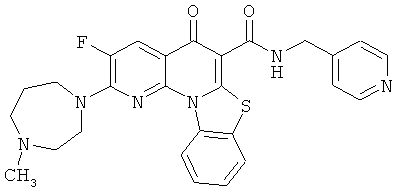
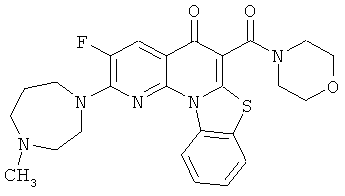
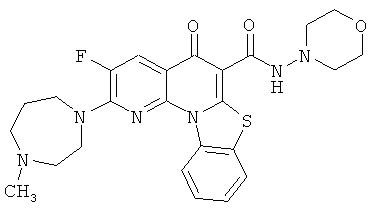
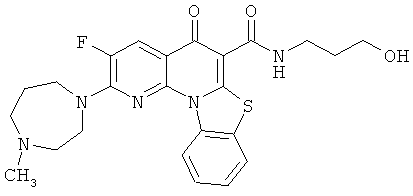
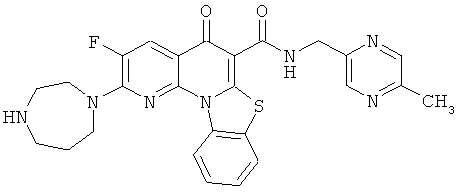
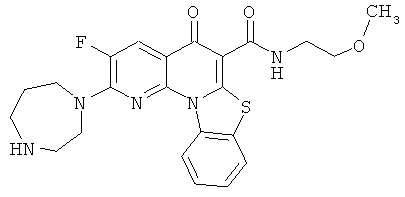
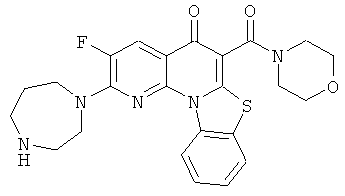
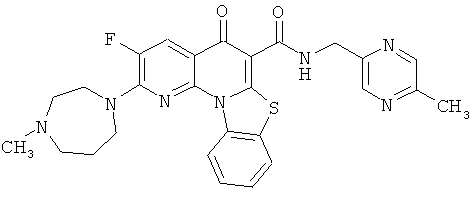
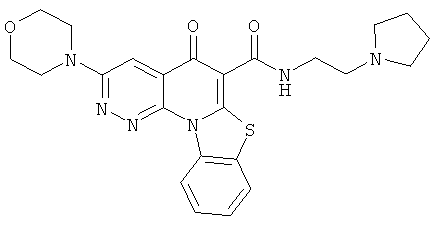
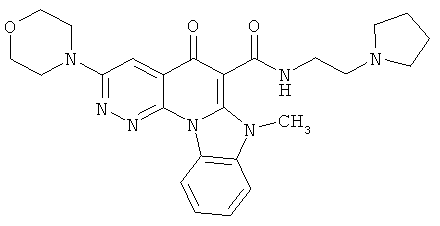
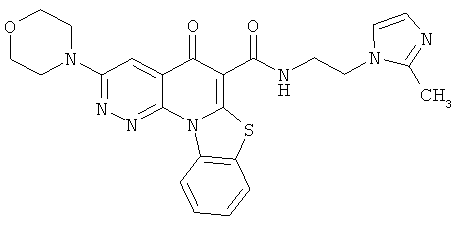
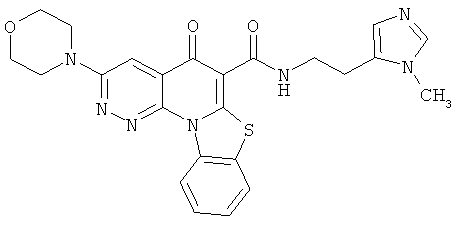
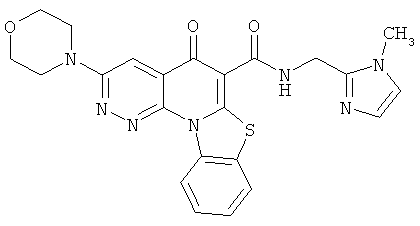
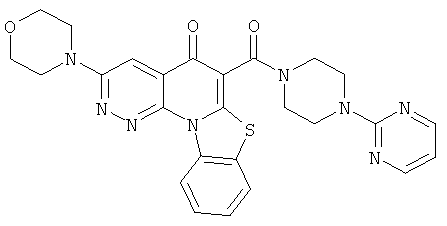
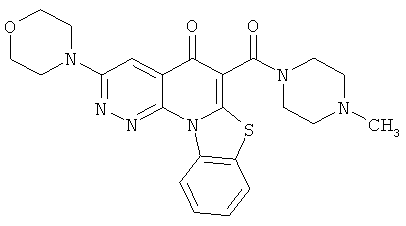
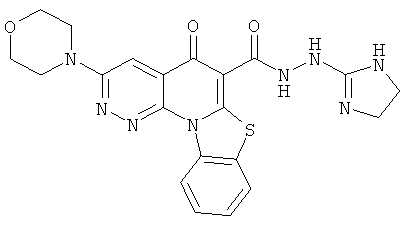
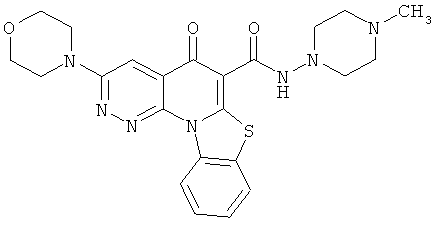
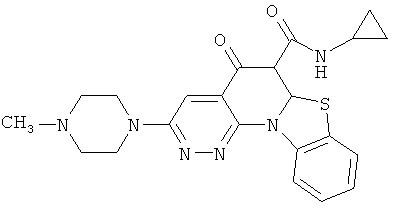
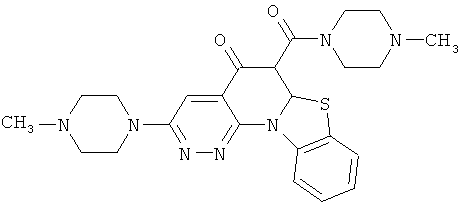
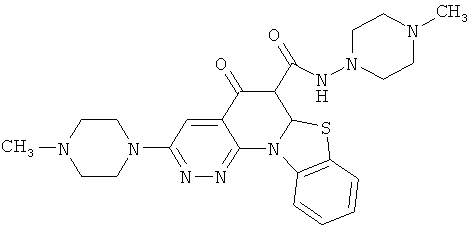
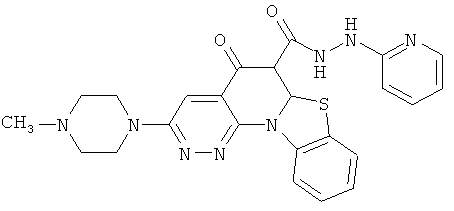
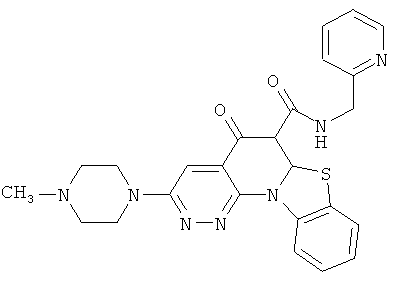
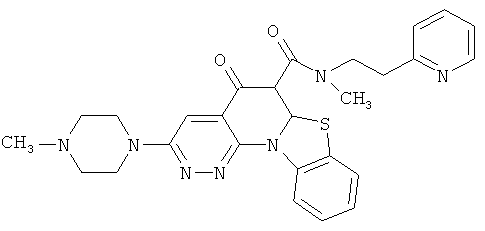
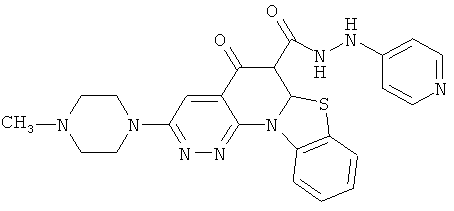
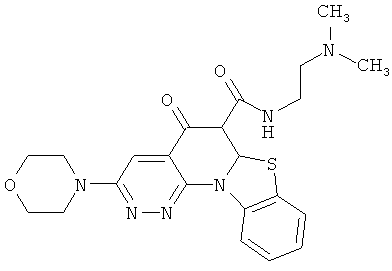
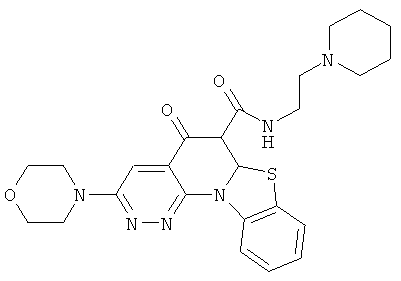
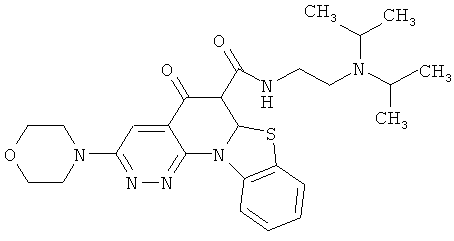
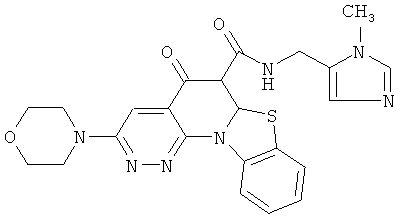
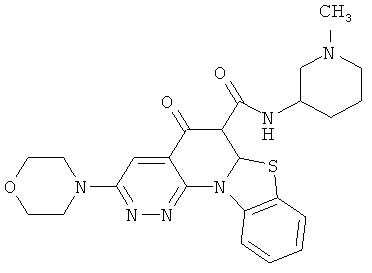
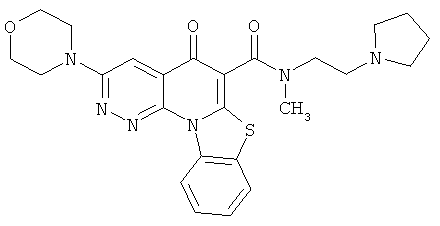
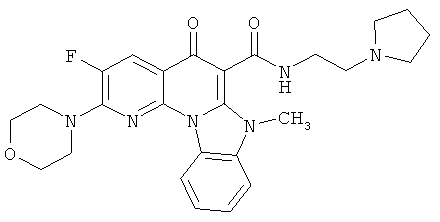
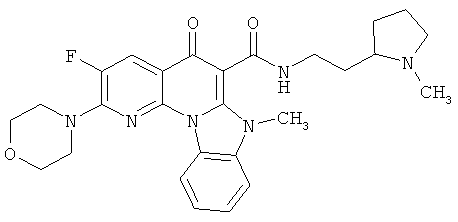
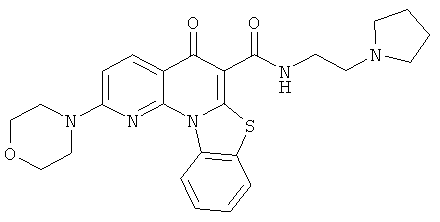
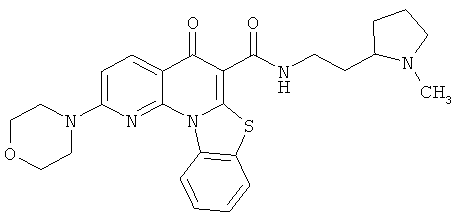
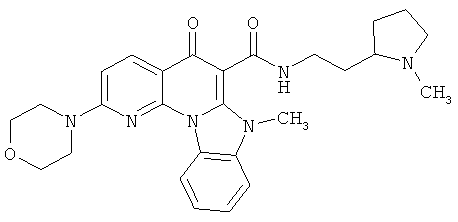
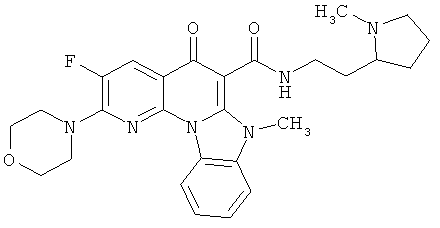
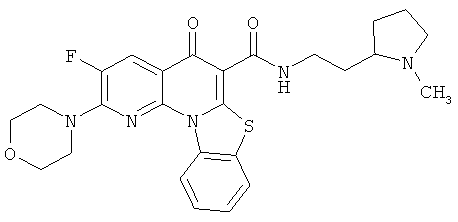
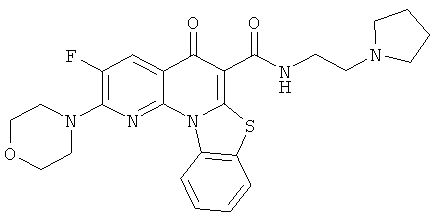
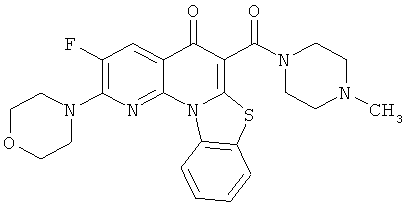
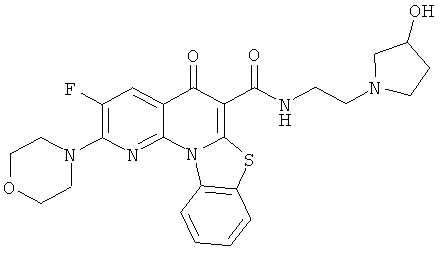
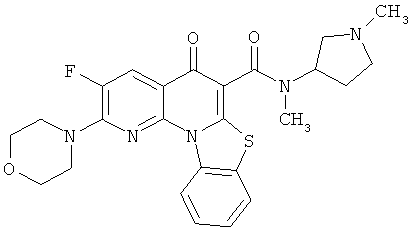
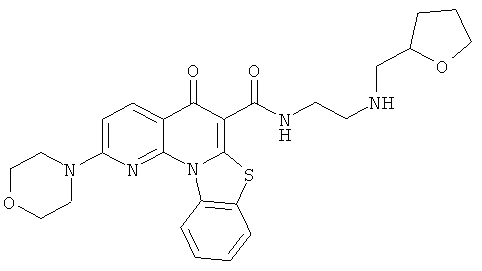
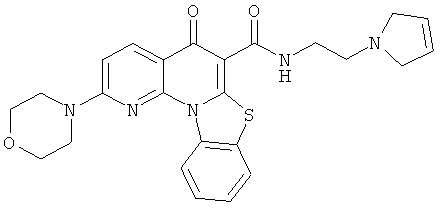
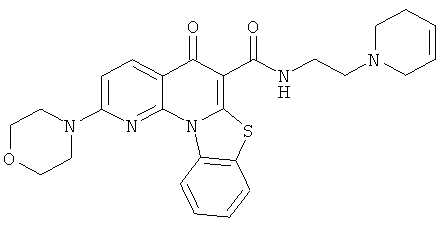
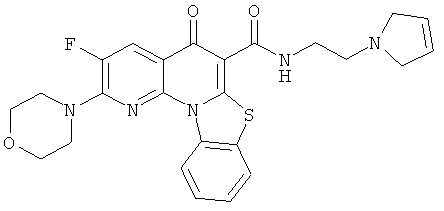
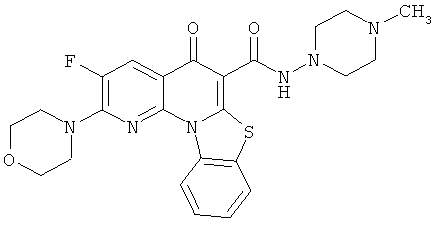
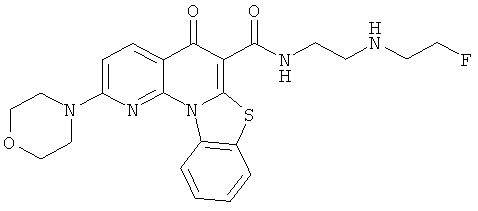
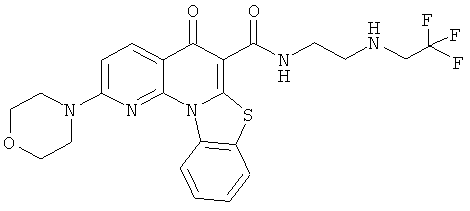
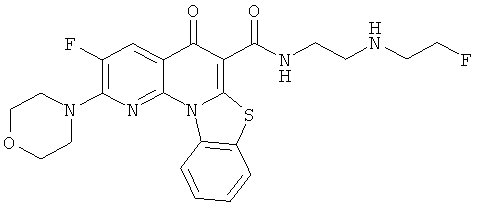
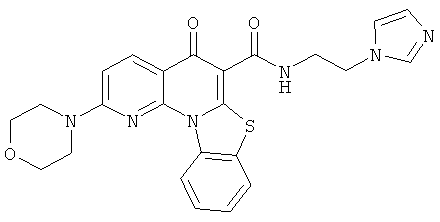
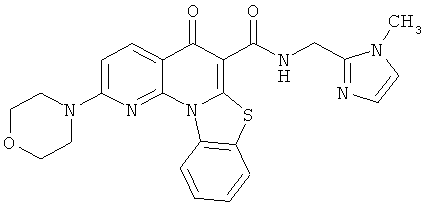
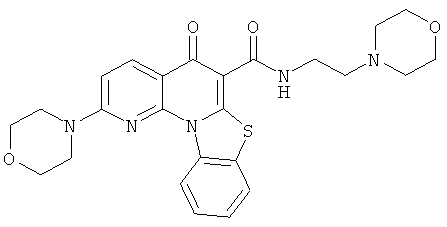
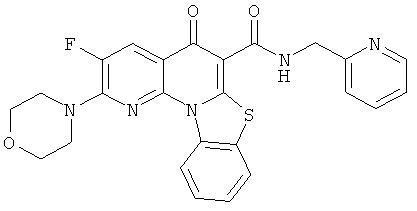
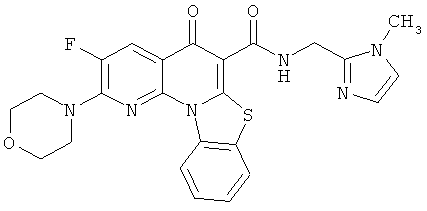
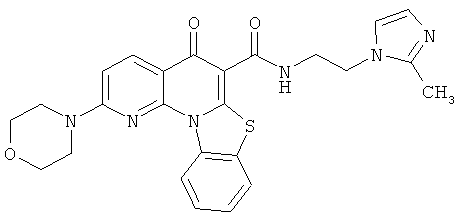
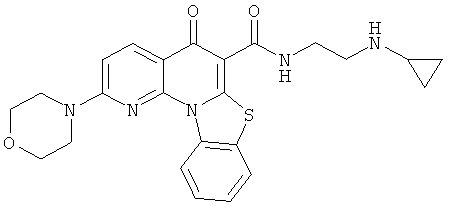
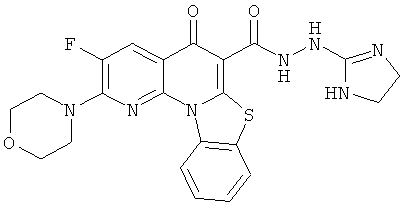
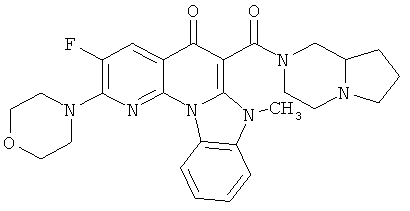
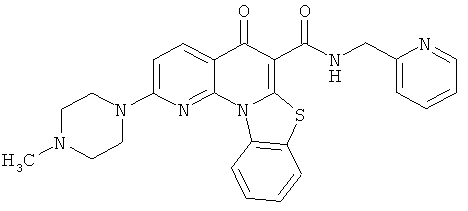
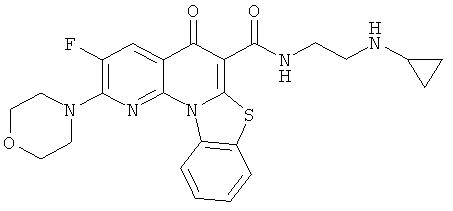
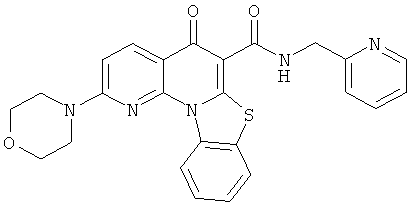
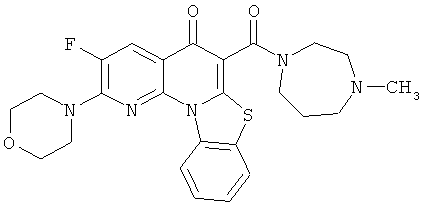
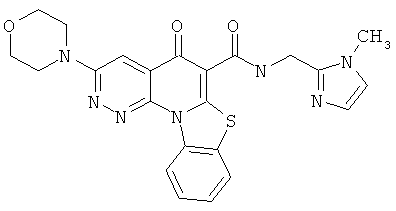
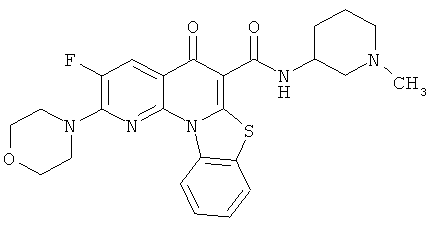
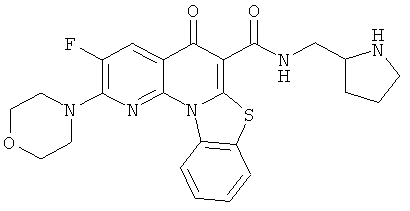
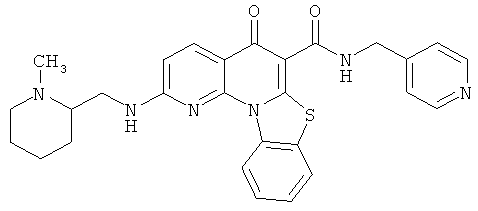
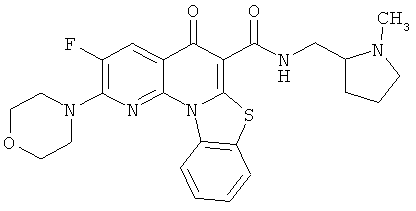
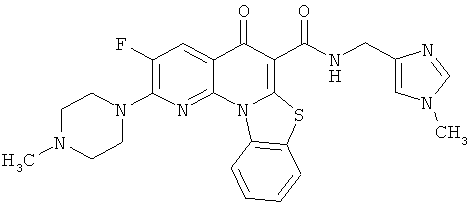
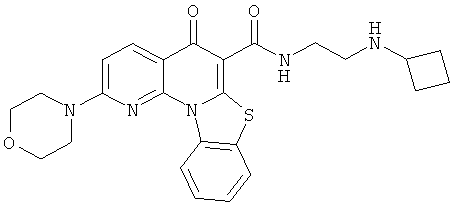
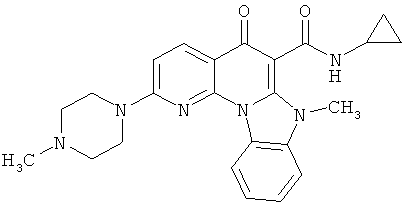
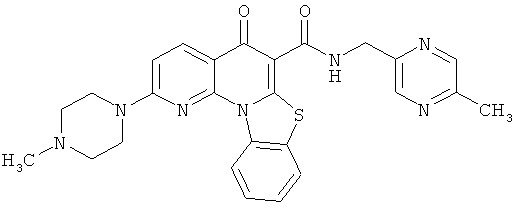
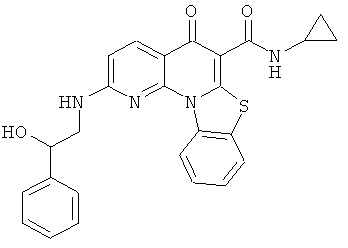
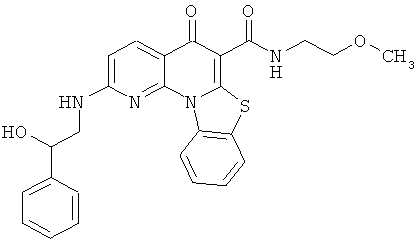
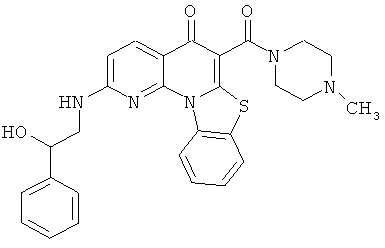
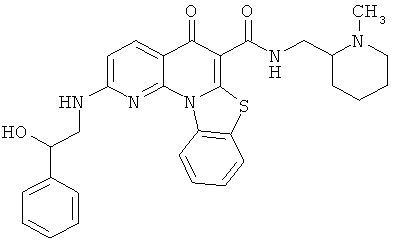
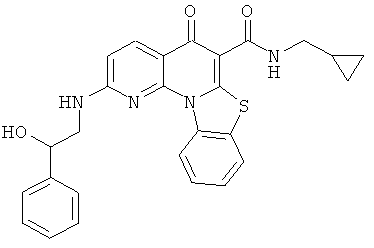
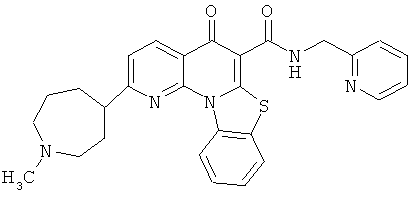
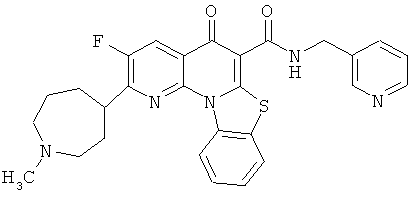
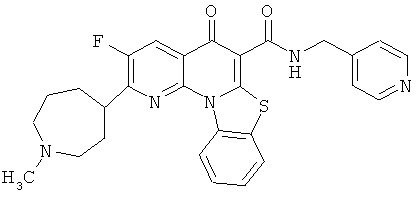
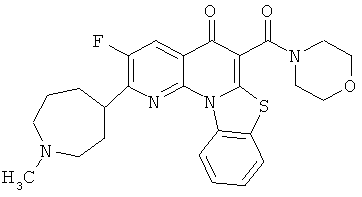
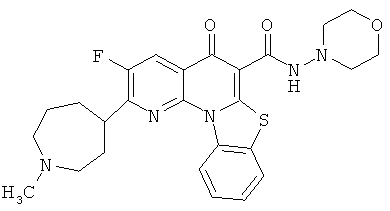
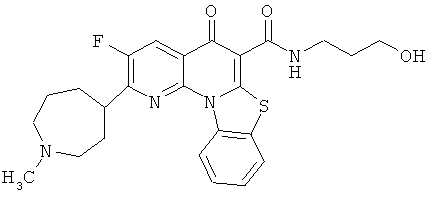
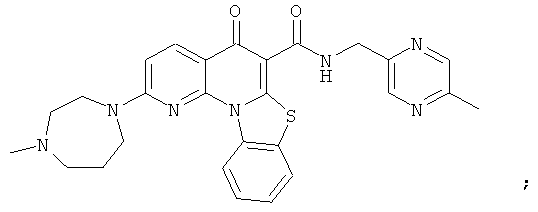
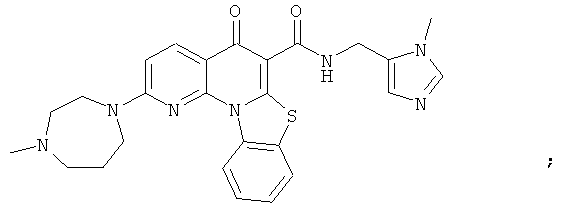
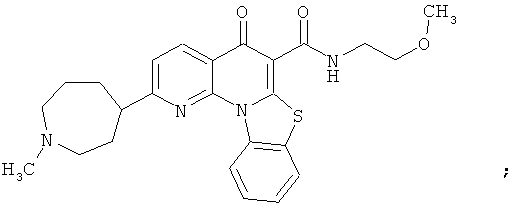
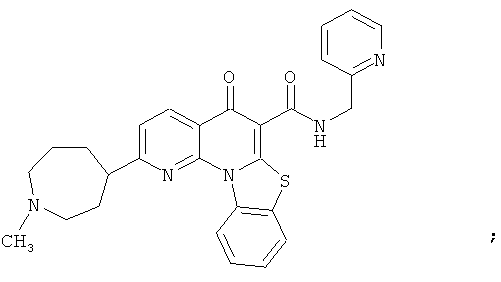
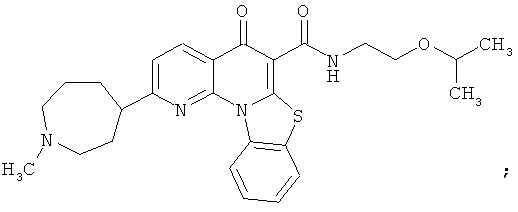
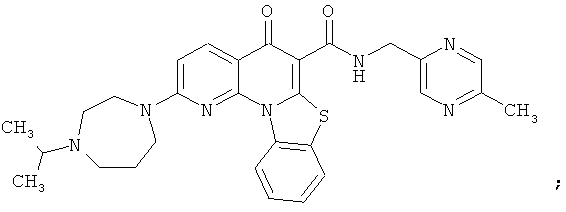
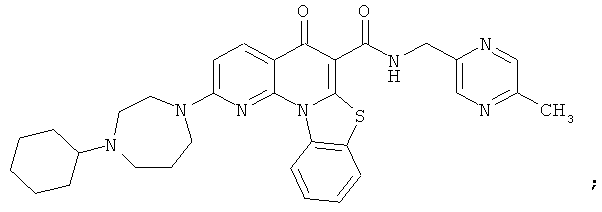
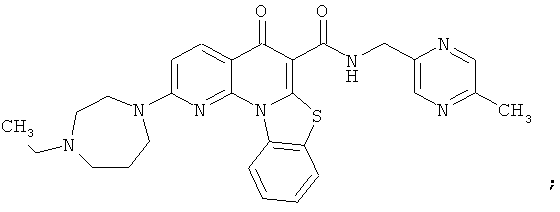
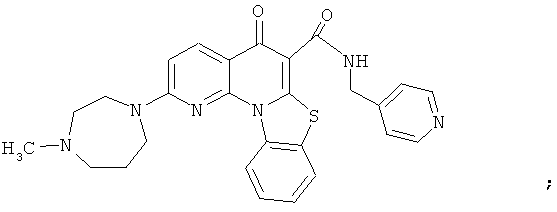
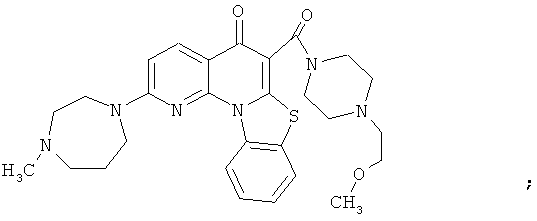
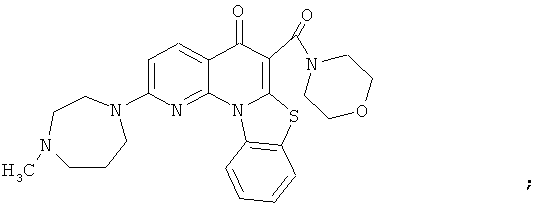
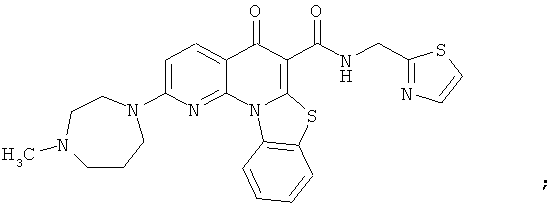
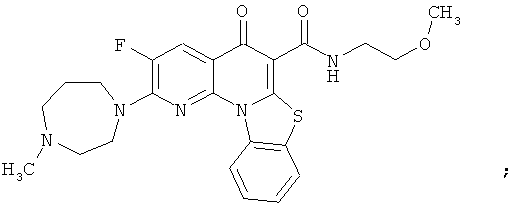
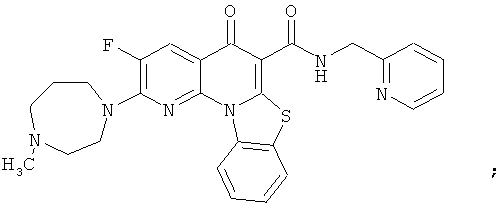
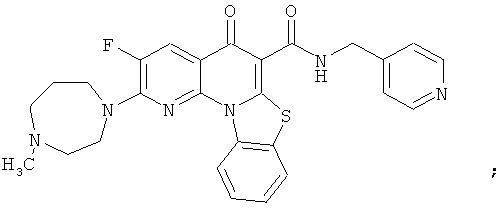
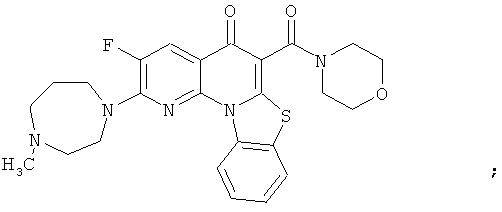
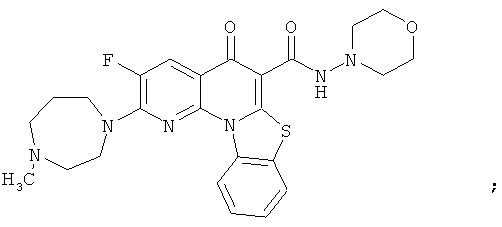
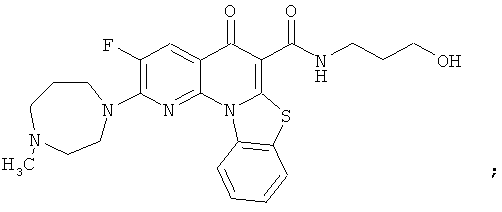
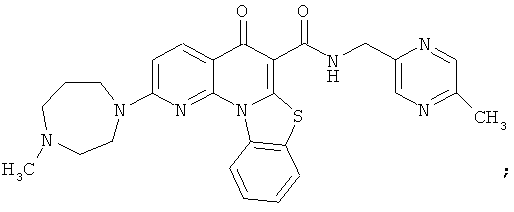
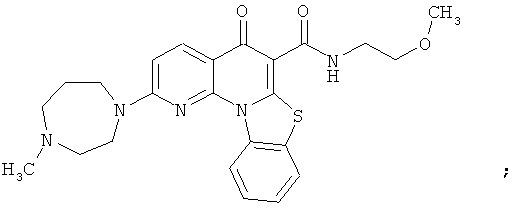
В некоторых особенно предпочтительных вариантах осуществления, соединение представляет собой одну из следующих структур:
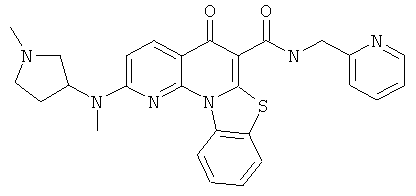
|
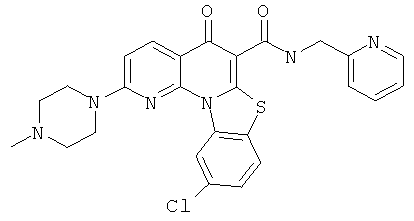
|
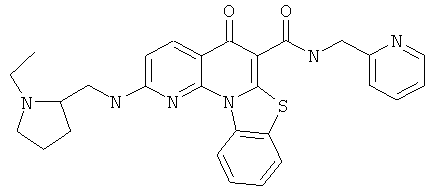
|
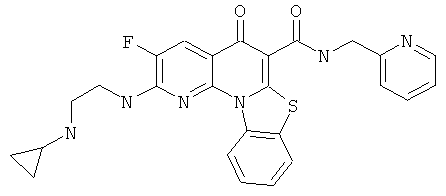
или их фармацевтически приемлемую соль или сложный эфир.
В настоящем изобретении описаны фармацевтические композиции, содержащие соединение, имеющее одну из вышеуказанных Формул (I), (II), (III), (IV), (V), (VI), (VI'), (VII) или (VIII), и фармацевтически приемлемый наполнитель. В одном примере, данная композиция содержит соединение, имеющее одну из вышеуказанных Формул, полиэтиленгликоль и пропиленгликоль в буферном растворе.
Соединения по изобретению проявляют биологическую активность в тестах, описанных в данном тексте. Например, соединения по изобретению могут ингибировать биогенез РНК и подавлять рост опухоли. Не ограничивая настоящее изобретение какой-либо теорией его действия, предполагается, что соединения могут функционировать отчасти через взаимодействие с квадруплекс-формирующими участками нуклеиновых кислот и модулируя транскрипцию рибосомной РНК. Соединения по изобретению также могут модулировать взаимодействие квадруплекс-формирующих нуклеиновых кислот с нуклеолином, белком, связанным с апоптозом; таким образом, модулирование активности, локализации или стабильности нуклеолина тоже может вносить вклад в способность представленных соединений индуцировать апоптоз. В настоящем изобретении также описаны методы получения данных соединений и методы их использования.
Соответственно, данное изобретение отчасти относится к способам уменьшения пролиферации клеток и/или индукции клеточной смерти, включающим обработку системы эффективным количеством соединения, имеющим любую из приведенных выше формул, или их фармацевтической композицией, и, возможно, в комбинации с химиотерапевтическим препаратом, тем самым уменьшая пролиферацию клеток и/или индуцируя гибель клеток, как, например, апоптоз или апоптозную смерть клеток, в указанной системе. Системой может быть клетка или ткань. В одном варианте осуществления, система включает панкреатические клетки, такие как клетки из объекта или культуры клеток (например, т vitro или ex vivo). В отдельных вариантах осуществления, система включает опухолевые панкреатические клетки. В одном варианте осуществления, система является линией клеток, такой как РС3, НСТ116, НТ29, MIA Раса-2, НРАС, Hs700T, PanclO.05, Pane 02.13, PL45, SW 190, Hs 766T, CFPAC-1, PANC-1, МУ-4-11, ТНР-1 и К-562.
В данном изобретении также описаны способы лечения или смягчения клеточных пролиферативных расстройств, включающие введение субъекту, нуждающемуся в этом, эффективного количества соединения Формулы (I), Формулы (II), Формулы (III), Формулы (IV), Формулы (V), Формулы (VI), Формулы (VI'), Формулы (VII) или Формулы (VIII), или его фармацевтической композиции, и, возможно, в комбинации с химиотерапевтическим препаратом, тем самым, излечивая или смягчая указанные клеточные пролиферативные расстройства. Например, можно уменьшить пролиферацию клеток и/или можно индуцировать гибель клеток, как, например, апоптоз или апоптозную смерть клеток. Клеточное пролиферативное расстройство может быть опухолью или раком у человека или животного. В частном варианте осуществления, рак является раком поджелудочной железы, включая не-эндокринные и эндокринные опухоли. Иллюстративные примеры не-эндокринных опухолей включают (но не ограничиваются только ими) аденокарциномы, ацинарные клеточные карциномы, аденосквамозную карциному, гигантоклеточные опухоли, внутрипротоковую папиллярномуцинозную опухоль, муцинозные цистаденокарциномы, серозную цистаденому, солидные и псевдопапиллярные опухоли. Эндокринный рак может быть опухолью островков поджелудочной железы.
Вышеупомянутые способы уменьшения клеточной пролиферации и/или индукции клеточной смерти могут также осуществляться на практике в комбинации с процедурами и/или химиотерапевтическим препаратом. Примеры процедур, которые могут быть применены в комбинации со способами по настоящему изобретению, включают (но не ограничиваются только ими) радиотерапию и хирургическую операцию. В некоторых вариантах осуществления, соединения по настоящему изобретению вводятся в комбинации с химиотерапевтическим препаратом, и используются для уменьшения клеточной пролиферации, индуцирования гибели клеток и/или смягчения клеточных пролиферативных расстройств.
В настоящем изобретении также описаны способы уменьшения или ингибирования пролиферации клеток, включающие обработку системы или субъекта, нуждающегося в этом, эффективным количеством соединения Формулы (I), Формулы (II), Формулы (III), Формулы (IV), Формулы (V), Формулы (VI), Формулы (VI'), Формулы (VII) или Формулы (VIII), или его фармацевтической композицией, тем самым уменьшая или ингибируя клеточную пролиферацию.
Кроме того, в данном изобретении описаны способы уменьшения микробных титров, включающие обработку системы эффективным количеством соединения Формулы (I), (II), (III), (IV), (V), (VI), (VI'), (VII) или (VIII), или его фармацевтической композицией, и, при необходимости, антимикробным средством, тем самым уменьшая микробные титры. Система может быть клеткой или тканью. Данное изобретение также описывает способы смягчения микробной инфекции, включающие введение субъекту, нуждающемуся в этом, эффективного количества соединения, имеющего любую из приведенных выше формул, или его фармацевтической композиции, и, возможно, в комбинации с антимикробным препаратом, тем самым смягчая указанные микробные инфекции. Субъект может быть человеком или животным. Микробные титры могут быть вирусные, бактериальные или грибковые.
Данное изобретение также относится к способам определения селективности взаимодействия между соединением, имеющим любую из приведенных выше формул, и нуклеиновыми кислотами, способными формировать квадруплексную структуру, включающим: а) обработку соединения, в отсутствии конкурентной молекулы, тремя или более нуклеиновыми кислотами, способными формировать квадруплексную структуру, где каждая нуклеиновая кислота не является теломерной нуклеиновой кислотой; b) количественную оценку прямого взаимодействия между соединением и указанными тремя или более нуклеиновыми кислотами; и с) определение селективности взаимодействия по результатам сравнения измерений уровня взаимодействия. В одном примере, три или более нуклеиновых кислоты включают нуклеотидную последовательность, расположенную на 5' конце нуклеотидной последовательности онкогена. Онкоген может представлять собой MYC, HIF, VEGF. ABL, TGF, PDGFα, MYB, SPARC, HER, VAV, RET, H-RAS, EGF, SRC, BCL-1, BCL-2, DHFR или HMGA. При определении селективности взаимодействия, соединение можно по отдельности обрабатывать каждой из указанных трех или более нуклеиновых кислот в различных пробирках. Кроме того, селективность взаимодействия можно определить по результатам сравнения значений IC50.
Соединения по настоящему изобретению могут или не могут взаимодействовать с участками ДНК, способными формировать квадруплексы. В некоторых вариантах осуществления, соединения по настоящему изобретению могут связывать и/или стабилизировать пропеллерный квадруплекс.Примеры пропеллерных квадруплексов включают (но не ограничены только ими) H-RAS, RET, BCL-1, DHFR, TGF-β, HIF-1α, VEGF, c-Myc или PDGFα. В другом варианте осуществления, соединение может связывать и/или стабилизировать различные непараллельные (chair-eller или basket) квадруплексы. В другом варианте осуществления, соединение может связывать и/или стабилизировать BCL-2.
Данное изобретение также описывает способы индуцирования гибели клеток, такие как апоптозная смерть клеток (апоптоз), включающие введение в систему или в субъект, нуждающийся в этом, эффективного количества соединения, имеющего любую из вышеупомянутых Формул (I), (II), (III), (IV), (V), (VI), (VI'), (VII) или (VIII), или его фармацевтической композиции, и, возможно, с химиотерапевтическим препаратом. Данное изобретение также описывает способы лечения или смягчения расстройства, вызванного сверхэкспрессией онкогенов, таких как сверхэкспрессия c-Myc, включающие введение в систему или в субъект, нуждающийся в этом, эффективного количества соединения, имеющего любую из вышеупомянутых формул, или его фармацевтической композиции, и, возможно, с химиотерапевтическим препаратом. Объект может быть человеком или животным, и система может быть клеткой или тканью.
Соединения, имеющие вышеупомянутые формулы, также могут быть способны модулировать активности различных протеинкиназ, поскольку они содержат структурные элементы, которые, как известно, связываются с протеинкиназами, и, соответственно, могут применяться для идентификации модуляторов протеинкиназ с использованием методов скрининга, известных в настоящее время. В настоящем тексте описаны репрезентативные методы скрининга для некоторых протеинкиназ. Соответственно, в данном изобретении описан способ идентификации модулятора протеинкиназы, иногда являющегося мощным модулятором одной или более отдельных протеинкиназ. Данный способ включает скрининг библиотеки описанных в настоящем тексте соединений по их способности модулировать активность протеинкиназ, где указанная библиотека содержит, по меньшей мере, 10 различных соединений, каждое из которых имеет Формулу (I), (II), (III), (IV), (V), (VI), (VI'), (VII) или (VIII), и часто, по меньшей мере, 100 таких соединений.
Альтернативно, данный способ включает скрининг набора протеинкиназ, состоящего из, по меньшей мере, трех или, по меньшей мере, десяти протеинкиназ, с соединениями Формул (I), (II), (III), (IV), (V), (VI), (VI'), (VII) или (VIII), для определения характерного профиля активности. Эти методы позволяют пользователю идентифицировать соединение, имеющее желаемый уровень активности и/или селективности, как модулятора активности протеинкиназы, и идентифицированное соединение может использоваться для начала программы разработки лекарства. Так, в другом варианте осуществления, настоящее изобретение описывает композицию, содержащую выделенную протеинкиназу в комплексе с соединением Формулы (I), (II), (III), (IV), (V), (VI), (VI'), (VII) или (VIII). Такие комплексы полезны для получения информации о сайтах связывания модулирующих соединений с конкретной протеинкиназой, и как исследовательский инструмент для анализа структуры киназы. Такие комплексы также полезны потому, что их легче закристаллизовать, чем свободную киназу, что позволяет осуществить кристаллизацию и определить кристаллическую структуру в тех случаях, когда это было бы не возможно без связующего модулирующего соединения.
Также, в настоящем тексте описан способ идентификации молекулы, модулирующей взаимодействие между рибосомальной нуклеиновой кислотой и белком, взаимодействующим с данной нуклеиновой кислотой, который включает: (а) обработку нуклеиновой кислоты, содержащей человеческую рибосомальную нуклеотидную последовательность, и белка тестируемой молекулой, имеющей любую из структур, раскрытых выше, где нуклеиновая кислота способна связываться с белком; и (b) определение количества нуклеиновой кислоты, связанной или не связанной с белком, на основании чего тестируемая молекула идентифицируется как молекула, которая модулирует взаимодействие, когда различные количества нуклеиновой кислоты связываются с белком в присутствии и в отсутствии тестируемой молекулы. В некоторых вариантах осуществления, белок выбирают из группы, содержащей нуклеолин, фибриллярин, RecQ, QPN1 и функциональные фрагменты вышеуказанных веществ.
В некоторых вариантах осуществления описан способ идентификации молекулы, вызывающей перемещение нуклеолина, включающий (а) обработку нуклеиновой кислоты, содержащей человеческую рибосомальную нуклеотидную последовательность, и белка нуклеолина тестируемой молекулой Формулы (I), (II), (III), (IV), (V), (VI), (VI'), (VII) или (VIII), где нуклеиновая кислота способна связываться с нуклеолином, и (b) определение количества нуклеиновой кислоты, связанной или не связанной с нуклеолином, на основании чего тестируемая молекула идентифицируется как молекула, вызывающая перемещение нуклеолина, когда в присутствии тестируемой молекулы с нуклеолином связывается меньшее количество нуклеиновой кислоты, чем в отсутствии тестируемой молекулы. В некоторых вариантах осуществления, нуклеолин находится в комплексе с поддающейся обнаружению меткой, и иногда нуклеолин связан с твердой фазой. Иногда нуклеиновая кислота находится в комплексе с поддающейся обнаружению меткой, и нуклеиновая кислота может быть связана с твердой фазой в некоторых вариантах осуществления. Нуклеиновая кислота может представлять собой ДНК, РНК или их аналог, и может включать нуклеотидную последовательность, описанную выше в частных вариантах осуществления. Также описана композиция, содержащая нуклеиновую кислоту, имеющую рибосомальную нуклеотидную последовательность, описанную в настоящем тексте, или практически идентичную ей последовательность, и/или белок, связывающийся с указанной нуклеотидной последовательностью (например, нуклеолин, фибриллярин, RecQ, QPN1 и функциональные фрагменты перечисленных веществ), и соединение Формулы (I), (II), (III), (IV), (V), (VI), (VI'), (VII) или (VIII).
Также описан способ идентификации молекулы, связывающейся с нуклеиновой кислотой, содержащей человеческую рибосомальную нуклеотидную последовательность, который включает: (а) обработку нуклеиновой кислоты, содержащей человеческую рибосомальную нуклеотидную последовательность, описанную в настоящем тексте, соединением, которое связывается с нуклеиновой кислотой, и тестируемой молекулой Формулы (I), (II), (III), (IV), (V), (VI), (VI'), (VII) или (VIII), и (b) определение количества соединения, связанного или не связанного с нуклеиновой кислотой, на основании чего тестируемая молекула идентифицируется как молекула, связывающаяся с нуклеиновой кислотой, когда в присутствии тестируемой молекулы с нуклеиновой кислотой связывается меньшее количество соединения, чем в отсутствии тестируемой молекулы. Иногда соединение находится в комплексе с поддающейся обнаружению меткой, и иногда имеет радиоактивную метку. Нуклеиновая кислота может быть связана с твердой фазой в некоторых вариантах осуществления. Нуклеиновая кислота может представлять собой ДНК, РНК или их аналог, и может включать нуклеотидную последовательность, описанную выше в частных вариантах осуществления. Нуклеиновая кислота может формировать квадруплекс, такой как внутримолекулярный квадруплекс, в некоторых вариантах осуществления.
Также в настоящем тексте описан способ идентификации модулятора синтеза нуклеиновой кислоты, который включает обработку матричной нуклеиновой кислоты, олигонуклеотидного праймера, содержащего нуклеотидную последовательность, комплементарную последовательности матричной нуклеиновой кислоты, набором нуклеотидов, полимеразой и тестируемой молекулой Формулы (I), (II), (III), (IV), (V), (VI), (VI'), (VII) или (VIII), в условиях, позволяющих олигонуклеотидному праймеру гибридизоваться с матричной нуклеиновой кислотой, где матричная нуклеиновая кислота содержит человеческую рибосомальную нуклеотидную последовательность, и определение присутствия, отсутствия или количества увеличенного праймерного продукта, синтезированного методом удлинения праймера, на основании чего тестируемая молекула идентифицируется как модулятор синтеза нуклеиновой кислоты, когда в присутствии тестируемой молекулы синтезируется меньшее количество увеличенного праймерного продукта, чем в отсутствии тестируемой молекулы.
В некоторых вариантах осуществления, описанный способ направлен на идентификацию модулятора синтеза РНК, и, в некоторых вариантах осуществления, на идентификацию модулятора синтеза нуклеолярной (ядрышковой) РНК. Матричная нуклеиновая кислота иногда является ДНК и временами РНК, и матрица может включать, в качестве примера, любые одну или более описанных в настоящем тексте рибосомальных нуклеотидных последовательностей. Полимераза иногда является ДНК полимеразой, и временами РНК полимеразой. В некоторых вариантах осуществления, клетки взаимодействуют с тестируемым соединением Формулы (I), (II), (III), (IV), (V), (VI), (VI'), (VII) или (VIII), и в них определяют уровень РНК, на основании чего тестируемое соединение, уменьшающее количество РНК в клетке по сравнению с клетками, не обработанными тестируемым соединением, идентифицируется как молекула, модулирующая синтез РНК. В последних из перечисленных вариантов осуществления можно определить уровень тотальной РНК, и, в некоторых вариантах осуществления, можно определить общее количество вновь синтезируемой РНК, как, например, путем включения в РНК и обнаружения детектируемого нуклеотида (например, радиоактивно-меченый нуклеотид (например, меченый тритием нуклеотид)).
В конкретном варианте теста, в настоящем изобретении описан способ идентификации молекулы, модулирующей синтез рибосомальной РНК (рРНК), который включает: обработку клеток тестируемой молекулой Формулы (I), (II), (III), (IV), (V), (VI), (VI'), (VII) или (VIII), контакт рибосомальной нуклеотидной последовательности с одним или более праймерами, которые амплифицируют их участок, и меченой пробой, которая гибридизуется с амплифицированным продуктом, и определение количества амплифицированного продукта гибридизацией с меченой пробой, на основании чего тестируемая молекула, уменьшающая или увеличивающая количество амплифицированного продукта, идентифицируется как молекула, модулирующая синтез рРНК. Меченая проба, в одном варианте осуществления, добавляется после добавления праймеров и амплификации рРНК, и, в некоторых вариантах осуществления, меченая проба и праймеры добавляются одновременно. Иногда амплифицируемый участок рибосомальной нуклеотидной последовательности является 5' концом рДНК.
В некоторых вариантах осуществления, настоящее изобретение описывает библиотеку соединений, которая содержит, по меньшей мере, 10 соединений Формулы (I), (II), (III), (IV), (V), (VI), (VI'), (VII) или (VIII). Библиотека предпочтительно содержит, по меньше мере, 100 таких соединений. Эту библиотеку можно использовать для идентификации соединений, имеющих один или более видов активности, описанных в настоящем тексте, или специальную комбинацию таких видов активности, с использованием известных в настоящее время методов. Данный метод особенно полезен для идентификации молекул, имеющих пороговый уровень биологической активности, включая (но не ограничиваясь только ими) (а) связывание квадруплекса нуклеиновой кислоты или ингибирование формирования квадруплекса нуклеиновой кислоты (рДНК или рРНК), (b) активность против конкретной протеинкиназы или набора протеинкиназ, и (с) активность как модулятора связывания нуклеиновой кислоты с белком, таким как, например, нуклеолин.
Краткое описание чертежей
На Фиг.1 показано сравнение кассетных и отдельных значений AUC для перорального введения описанных соединений.
Осуществление изобретения Определения
Настоящее изобретение будет более понятно при рассмотрении приведенного далее подробного описания предпочтительных вариантов осуществления настоящего изобретения и включенных в настоящий текст Примеров. Следует понимать, что используемая в настоящем тексте терминология предназначена только для описания частных вариантов осуществления и не является ограничивающей.
Если не указано иное, все технические и научные термины, используемые в настоящем тексте, имеют обычные значения, известные специалисту в той области техники, к которой относится данное изобретение.
При использовании в настоящем тексте, "около" означает, что численное значение является приблизительным и небольшие изменения не повлияют в значительной степени на практическое осуществление данного изобретения. При использовании числового ограничения, если в контексте не указано иное, "около" означает, что численное значение может варьироваться на ±10% и оставаться в рамках объема настоящего изобретения.
При использовании в настоящем тексте, термин "алкил" относится к углерод-содержащему соединению и охватывает соединения, содержащие один или более гетероатомов. Термин "алкил" также охватывает алкильные фрагменты, замещенные одним или более заместителями. "Алкильные" группы могут быть линейными, разветвленными или циклическими. В некоторых случаях, циклические алкильные группы в настоящем тексте называются "циклоалкил". "Гетероалкил" касается соединения, в котором, по меньшей мере, один атом углерода алкильного фрагмента был заменен на гетероатом, обычно N, О или S. "Алкенильные" и "алкинильные" фрагменты означают алкильные фрагменты, содержащие, по меньшей мере, одну двойную связь или тройную связь, соответственно.
Возможные заместители, при наличии на алкильном, алкенильном или алкинильном фрагментах, или гетероформе одного из них, включают, но не ограничены только ими: ОН, C1-6 алкокси, необязательно замещенный амино, амидо, CN, карбокси, атом галогена, группу =O, арил, необязательно замещенные гетероциклические или карбоциклические кольца или неорганические заместители.
При использовании в настоящем тексте, термин "карбоцикл" означает циклическое соединение, содержащее в цикле только атомы углерода, в то время как "гетероцикл" означает циклическое соединение, содержащее гетероатом в качестве члена цикла. Карбоциклические и гетероциклические структуры охватывают соединения, имеющие моноциклические, бициклические или полициклические системы, и могут быть насыщенными, частично ненасыщенными или ароматическими. Карбоциклические и гетероциклические кольца могут быть при необходимости замещены подходящими для их структуры замещающими группами.
При использовании в настоящем тексте, термин "азациклический" или "азациклическое кольцо" означает насыщенное, частично ненасыщенное или ароматическое 3-7 членное моноциклическое кольцо или 8-12 членную конденсированную бициклическую систему, содержащую, по меньшей мере, один атом азота. Такие азациклические кольца могут при необходимости содержать от 1-2 дополнительных гетероатомов, выбранных из N, О и S, в качестве членов цикла, и могут при необходимости иметь столько заместителей, сколько допустимо химически.
При использовании в настоящем тексте, термин "арил" означает полиненасыщенный, типично ароматический углеводородный заместитель, в то время как "гетероарил" или "гетероароматический" означает ароматический цикл, содержащий гетероатом в качестве члена цикла. Арильные и гетероарильные структуры охватывают соединения, имеющие моноциклические, бициклические или полициклические системы, и могут быть при необходимости замещены.
При использовании в настоящем тексте, термин "гетероатом" относится к любому атому, который не является атомом углерода или водорода, такому как атом азота, атом кислорода или атом серы.
Термин "гетероформа", при использовании в настоящем тексте, относится к группе, в которой один или более атомов углерода углеводородного фрагмента заменен на гетероатом, обычно N, О или S. Например, гетероарил представляет собой гетероформу арила, и гетероалкил представляет собой гетероформу алкила.
Иллюстративные примеры гетероциклов включают, но не ограничены только ими: тетрагидрофуран, 1,3-диоксолан, 2,3-дигидрофуран, пиран, тетрагидропиран, бензофуран, изобензофуран, 1,3-дигидро-изобензофуран, изоксазол, 4,5-дигидроизоксазол, пиперидин, пирролидин, пирролидин-2-он, пиррол, пиридин, пиримидин, октагидро-пирроло[3,4-6]пиридин, пиперазин, пиразин, морфолин, тиоморфолин, имидазол, имидазолидин-2,4-дион, 1,3-дигидробензимидазол-2-он, индол, тиазол, бензотиазол, тиадиазол, тиофен, тетрагидротиофен 1,1-диоксид, диазепин, триазол, гуанидин, диазабицикло[2.2.1]гептан, 2,5-диазабицикло[2.2.1]гептан, 2,3,4,4а,9,9а-гексагидро-1Н- -карболин, оксиран, оксетан, тетрагидропиран, диоксан, лактоны, азиридин, азетидин, пиперидин, лактамы, и может также охватывать гетероарилы. Другие иллюстративные примеры гетероарилов включают, но не ограничены только ими: фуран, пиррол, пиридин, пиримидин, имидазол, бензимидазол и триазол.
-карболин, оксиран, оксетан, тетрагидропиран, диоксан, лактоны, азиридин, азетидин, пиперидин, лактамы, и может также охватывать гетероарилы. Другие иллюстративные примеры гетероарилов включают, но не ограничены только ими: фуран, пиррол, пиридин, пиримидин, имидазол, бензимидазол и триазол.
Иллюстративные примеры азациклических колец включают, но не ограничены только ими: необязательно замещенные азиридиновые, азетидиновые, имидазольные, имидазолиновые, пиррольные, пирролиновые, пирролидиновые, пиразольные, пиразолиновые, оксазольные, оксазолиновые, изоксазольные, изоксазолиновые, тиазольные, тиазолиновые, пиридиновые, дигидропиридиновые, тетрагидропиридиновые, пиперидиновые, пиперазиновые, пиримидиновые, пиридазиновые, пиразиновые, морфолиновые, тиоморфолиновые, гомопиперазиновые, гомоморфолиновые, гомотиоморфолиновые, бензимидазольные и индольные циклы.
Предпочтительные заместители, при их наличии в азациклическом или гетероциклическом кольце, включают атом галогена, группу =O, ацил, ароил, карбамоил или необязательно замещенное карбоциклическое или гетероциклическое кольцо; или необязательно замещенный C1-6 алкил, С2-6 алкенил, C2-6 алкинил или их гетероформы; или -OR5, -NR^6, -COOR5 или -C(O)NR5R6, где каждый из R5 и R6 независимо представляет собой Н или С1-С6 алкил, арил или арилалкил или гетероформу одного из них; и где в каждом -NR5R6, R5 и R6 вместе с N могут образовывать необязательно замещенный 5-6 членный цикл, при необходимости содержащий один дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла.
Особенно предпочтительные заместители, при наличии в ароматическом азациклическом кольце, включают один или более атомов галогена или необязательно замещенные C1-6 алкильные группы, где указанные возможные заместители выбраны из группы, состоящей из атома галогена, гидрокси-группы и оксо-группы (=O).
Предпочтительные заместители, при наличии в арильном или гетероарильном цикле, включают необязательно замещенный C1-6 алкил, С2-6 алкенил, С2-6 алкинил; галоген, -CN, -СF3, -ОСF3, NO2; или -OR5, -NR5R6, -COOR5 или -C(O)NR5R6, SO2NR5R6, -NC(O)R5, или -NSO2R5, где каждый из R5 и R6 независимо представляет собой Н или С1-С6 алкил, арил или арилалкил или гетероформу одного из них; и где в каждом -NR5R6, R5 и R6 вместе с N могут образовывать необязательно замещенный 5-7 членный цикл, при необходимости содержащий один дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла.
При использовании в настоящем тексте, термин "неорганический заместитель" относится к заместителям, которые не содержат углерод или содержат углерод, связанный с элементами, отличными от водорода (например, элементарный углерод, оксид углерода, диоксид углерода и карбонат). Примеры неорганических заместителей включают, но не ограничены только ими: нитро, галоген, сульфонилы, сульфинилы, фосфаты и т.д.
Термины "лечить", "лечение" и "терапевтический эффект", при использовании в настоящем тексте, означают снижение скорости пролиферации клеток или ее остановку (например, замедление или остановка роста опухоли), или снижение количества пролиферирующих раковых клеток (например, удаление части или всей опухоли). Данные термины также относятся к снижению микробного титра в системе (т.е., клетке, ткани или пациенте), инфицированной микроорганизмом, снижению скорости размножения микробов, уменьшению числа симптомов или проявления симптома, связанного с микробной инфекцией, и/или удалению измеримого количества микробов из системы. Примеры микроорганизмов включают, но не ограничены только ими: вирусы, бактерии и грибки.
При использовании в настоящем тексте, термин "химиотерапевтический препарат" относится к терапевтическому средству, которое можно использовать для лечения или смягчения клеточного пролиферативного расстройства, такого как опухоли или рак. Примеры химиотерапевтических препаратов включают, но не ограничены только ими: противоопухолевое средство, алкилирующее средство, растительный алкалоид, противомикробное средство, сульфонамид, противовирусное средство, платина-содержащее средство и другие известные в данной области техники противораковые средства. Частные примеры химиотерапевтических препаратов включают, но не ограничены только ими: цисплатин, карбоплатин, бусульфан, метотрексат, даунорубицин, доксорубицин, циклофосфамид, мефалан, винкристин, винбластин, хлорамбуцил, паклитаксел, гемцитабин и другие известные в данной области техники средства. (Смотри, например, Goodman & Oilman's, The Pharmacological Basis of Therapeutics (9th Ed) (Goodman, et al„ eds.) (McGraw-Hill) (1996); и 1999 Physician's Desk Reference (1998)).
При использовании в настоящем тексте, термин "апоптоз" относится к встроенной программе саморазрушения или самоубийства клеток. В ответ на инициирующее стимулирование, в клетках происходит каскад событий, включающих сжимание клетки, образование полостей в клеточных оболочках и уплотнение и фрагментация хромосомного материала. Данные события в итоге приводят к превращению клетки в кластеры соединенных оболочкой частиц (апоптические тела), которые затем поглощаются макрофагами.
При использовании в настоящем тексте, термин "субъект" относится к человеку или животному. В некоторых предпочтительных вариантах осуществления, субъектом является человек.
Настоящее изобретение касается соединений Формул (I), (II), (III), (IV), (V), (VI) и (VII), и их фармацевтически приемлемых солей, сложных эфиров и пролекарств. В настоящем изобретении описаны перорально активные аналоги хинолона, которые могут ингибировать пролиферацию клеток и/или индуцировать апоптоз клеток. В настоящем изобретении также описаны способы получения таких перорально активных аналогов хинолона, и способы лечения клеточно-пролиферативных расстройств введением данных средств.
Соединения по настоящему изобретению могут взаимодействовать или не взаимодействовать с участками ДНК, способными формировать квадруплексы.
Соединения по настоящему изобретению Формул (I), (II), (III), (IV) представлены ниже:


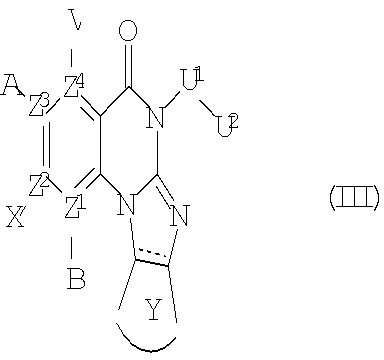
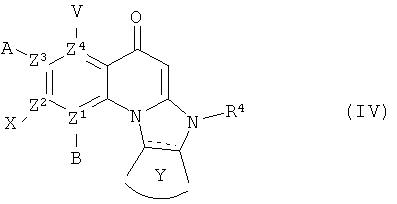
где А, В, V, X, Z, Z1, Z2, Z3, Z4, Z5, U1, U2, Y и R4 такие, как определено далее в настоящем тексте.
Соединения по настоящему изобретению Формул (V), (VI), (VI'), (VII) и (VIII) представлены ниже:
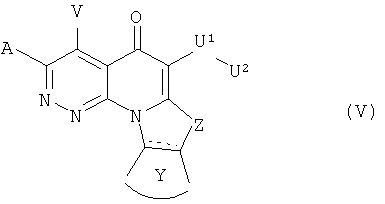
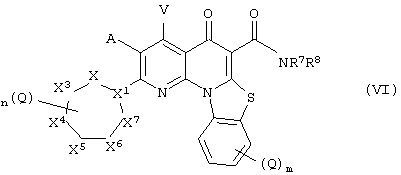
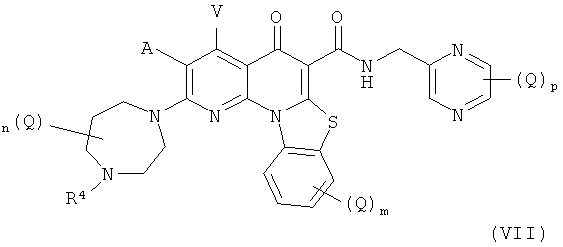
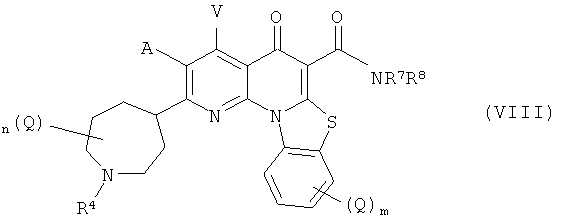
где A, V, Y, Z, U', U2, X1, X2, X3, X4, X5, X6, X7. R4, R7, R8, Q, m, n и р такие, как определено далее в настоящем тексте.
Соединения по настоящему изобретению могут быть хиральными. В настоящем тексте хиральным соединением называют соединение, отличающееся от своего зеркального отображения и имеющее энантиомер. Кроме того, соединения могут быть рацемическими или существовать в виде энантиомера или стереоизомера. Методы синтеза хиральных соединений и разделения рацемических смесей энантиомеров хорошо известны квалифицированным специалистам в данной области. Смотри, например, книгу March, "Advanced Organic Chemistry," John Wiley and Sons, Inc., New York, (1985), содержание которой включено в настоящий текст посредством ссылки.
Тестирование соединений по настоящему изобретению можно осуществлять такими методами скрининга, как описано в настоящем тексте.
Соединения, описанные в данном тексте, могут взаимодействовать с участками нуклеиновых кислот, которые могут формировать квадруплексы. Так как участки ДНК, образующие квадруплексы, являются регуляторами биологических процессов, таких как транскрипция онкогенов, модуляторы квадруплексной биологической активности могут применяться как противораковые лекарственные препараты. Молекулы, взаимодействующие с участками ДНК, формирующими квадруплексы, могут проявлять терапевтический эффект при некоторых клеточных пролиферативных расстройствах и сопутствующих состояниях. В частности, ненормальное увеличение экспрессии онкогена может вызывать клеточные пролиферативные расстройства, и квадруплексы, как правило, подавляют экспрессию онкогенов. Примеры онкогенов включают (но не ограничены только ими) MYC, HIF, VEGF, ABL, TGF, PDGFA, MYB, SPARC, HUMTEL, HER, VAV, RET, H-RAS, EOF, SRC, BCL1, BCL2, DHFR, HMGA и другие онкогены, известные квалифицированным специалистам в данной области. Кроме того, описанные в данном тексте соединения могут индуцировать клеточную смерть (например, апоптоз) и не взаимодействовать с квадруплекс-образующими участками ДНК.
Молекулы, связывающиеся с участками ДНК, способными формировать квадруплексы, могут проявлять биологическую активность по различным механизмам действия, которые включают, например, стабилизацию нативной структуры квадруплекса, ингибирование превращение нативного квадруплекса в дуплексную ДНК блокированием расхождения цепей ДНК, и стабилизацию структуры нативного квадруплекса, имеющего дестабилизирующую квадруплекс нуклеотидную замену, и другие взаимодействия, специфичные для последовательности. Таким образом, описанные в данном тексте соединения, связывающие участок ДНК, способный формировать квадруплекс, можно вводить в клетки, в ткани или в организмы с целью подавления транскрипции онкогенов и, таким образом, лечения клеточных пролиферативных расстройств.
Происходит ли модуляция биологической активности нативной ДНК, способной формировать квадруплексы, в клетках, тканях или организмах, можно определить мониторингом биологической активности квадруплекса. Мониторинг биологической активности квадруплекс-образующих участков ДНК в клетках, тканях или организмах можно осуществлять, например, детектированием уменьшения или увеличения транскрипции генов в ответ на обработку молекулой квадруплекс-образующей ДНК. Транскрипцию можно измерить прямым определением РНК транскриптов или определением полипептидов, транслируемых с транскриптов, хорошо известными в данной области техники методами.
Молекулы, взаимодействующие с квадруплекс-образующей ДНК, и нуклеиновые кислоты, образующие квадруплексы, могут быть использованы для лечения многих клеточных пролиферативных расстройств. Клеточные пролиферативные расстройства включают, например, рак кишечника и гематопоэтические неопластические заболевания (т.е., болезни, в которых участвуют гиперпластические/неопластические клетки, имеющие гематопоэтическое происхождение, такие как происходящие от миелоидного, лимфоидного или эритроидного ростка, или из их клеток предшественников). Болезни могут являться результатом слабо дифференцированных острых лейкемий, например, эритробластной лейкемии и острой мегакариотической лейкемии. Дополнительные миелоидные заболевания включают (но не ограничены только ими) острую промиелоидную лейкемию (APML), острую миелогенную лейкемию (AML) и хроническую миелогенную лейкемию (CML) (Vaickus, Crit. Rev. in Oncol./Hemotol, 11:267-297 (1991)). Лимфоидные новообразования включают (но не ограничены только ими) острую лифобластную лейкемию (ALL), которая включает В-клеточную ALL and Т-клеточную ALL, хроническую лимфоцитарную лейкемию (CLL), пролимфоцитарный лейкоз (PLL), волосато-клеточный лейкоз (HLL) и макроглобулинемию Вальденстрема (WM). Дополнительные формы злокачественных лимфом включают (но не ограничены только ими) неходжкинскую лимфому и ее варианты, периферийную Т-клеточную лимфому, Т-клеточный лейкоз/лимфому взрослых (ATL), Т-клеточную лимфому кожи (CTCL), лейкоз крупных гранулярных лимфоцитов, болезнь Ходжкина и болезнь Рид-Штернберга. Клеточные пролиферативные расстройства также включают рак прямой кишки, груди, легкого, печени, поджелудочной железы, лимфатических узлов, толстой кишки, простаты, мозга, головы и шеи, кожи, печени, почек и сердца. Соединения, взаимодействующие с квадруплекс-формирующими участками ДНК, также могут быть использованы против процессов и состояний, связанных с раком, таких как усиление ангиогенеза, путем ингибирования ангиогенеза у субъекта.
В данном изобретении описан способ уменьшения клеточной пролиферации или лечения или облегчения клеточных пролиферативных нарушений, включающий обработку системы, содержащей участок нативной ДНК, способной образовывать квадруплекс, соединением, имеющим любую из приведенных выше формул. Системой может быть группа клеток или одна или более тканей. В одном варианте осуществления, системой является объект, нуждающийся в лечении клеточного пролиферативного нарушения (например, млекопитающие, такие как мышь, крыса, обезьяна или человек). В данном изобретении также описан способ лечения рака кишечника путем введения соединения, которое взаимодействует с c-MYC квадруплекс-образующим участком, субъекту, нуждающемуся в этом, тем самым уменьшая клеточную пролиферацию рака кишечника. Кроме того, в данном изобретении описан способ ингибирования ангиогенеза и, возможно, лечения рака, связанного с ангиогенезом, включающий введение соединения, которое взаимодействует с квадруплекс-образующим участком фактора роста эндотелия сосудов (VEGF), субъекту, нуждающемуся в этом, тем самым уменьшая ангиогенез и, возможно, излечивая рак, связанный с ангиогенезом.
Соединения, которые взаимодействует с участками ДНК, образующими квадруплекс, также могут быть использованы для ослабления микробной инфекции, такой как вирусная инфекция. Ретровирусы представляют собой множество потенциальных мишеней для лекарственных средств, направленных на G-квадруплексы. G-квадруплексы являются функциональными элементами по крайней мере двух вторичных структур, формируемых вирусными РНК или ДНК ВИЧ: димерной линкерной структуры (DLS) и центральной ДНК-флэп (CDF). Кроме того, ДНК-аптамеры, способные принимать форму меж- или внутри-молекулярного квадруплекса, способны ингибировать вирусную репликацию. В одном случае, ДНК-аптамеры способны ингибировать вирусную репликацию, поражая гликопротеин оболочки вируса (предположительно). В другом случае, ДНК-аптамеры ингибируют вирусную репликацию, соответствующим образом поражая ВИЧ-интегразу, предполагая участие структур нативных квадруплексов во взаимодействии с ферментом интегразой.
Димерные линкерные структуры, характерные для всех ретровирусов, обеспечивают соединение двух копий вирусного генома путем нековалентного взаимодействия двух 5'-концов двух вирусных РНК последовательностей. В зрелой вирусной частице геномный димер стабильно ассоциирован с белком gag. В случае ВИЧ, за описанное нековалентное связывание отвечает последовательность длиной 98 пар оснований, содержащая несколько мотивов из, по меньшей мере, двух последовательно повторяющихся остатков гуанина (например, 3' для образования РНК димеров in vitro). Наблюдаемая зависимость образования и стабильности димера in vitro от катионов (ионов калия), а также то, что комплементарная антисмысловая последовательность не способна димеризоваться, позволяет утверждать, что наиболее вероятной структурой, ответственной за связывание, является структура межмолекулярного G-квадруплекса.
До интеграции в геном хозяина, вирусная ДНК, синтезированная путем обратной транскрипции, формирует прединтеграционный комплекс (ПИК) с, по меньшей мере, двумя основными вирусными белками, интегразой и обратной транскриптазой, который впоследствии транспортируется в ядро клетки. Центральный ДНК-флэп (CDF) является однонитевым концом+цепи ДНК из 99 оснований, расположенный недалеко от центра вирусной дуплексной ДНК, который, как известно, играет роль в переносе ПИК в ядро. Было показано, что олигонуклеотиды, имитирующие CDF, формируют межмолекулярные G-квадруплексы во внеклеточных системах.
Таким образом, соединения, распознающие квадруплекс-образующие участки, могут использоваться для стабилизации димерной линкерной структуры и, таким образом, предотвращать разъединение двух цепей РНК. Также, присоединение к квадруплексу, образованному CDF, может нарушить распознавание и/или связывание белка для транспорта ПИК в ядро клетки. В любом случае, это может быть значительным преимуществом перед другими антивирусными препаратами. Существующие режимы высокоактивной антиретровирусной терапии (ВААРТ) основаны на использовании комбинаций лекарств, направленных против ВИЧ-протеазы и ВИЧ-интегразы. Мультилекарственные режимы необходимы для минимизации угрозы возникновения устойчивости к препаратам, которая обычно быстро возникает при монотерапии. Причина такого быстрого развития устойчивости к терапии заключается в изменчивости фермента обратной транскриптазы, в котором происходят мутации с частотой приблизительно одна на 10000 пар оснований. Преимущество направленности терапии на квадруплексы вируса по сравнению с направленностью на белки состоит в том, что развитие устойчивости медленное или вообще невозможно. Точечная мутация в поражаемом квадруплексе может нарушить целостность квадруплексной структуры и привести к образованию нефункциональной копии вируса. Одно лекарственное средство, основанное на данной концепции, может заменить многолекарственные режимы терапии, используемые в настоящее время, с сопутствующими выгодами, заключающимися в уменьшении стоимости терапии и в устранении опасных лекарственных взаимодействий.
В данном изобретении описан способ уменьшения микробного титра в системе, включающий обработку системы, содержащей участок нативной ДНК, способной образовывать квадруплекс, соединением, имеющим любую из приведенных выше формул. Системой может быть одна или более клеток или тканей. Примеры микробных титров включают (но не ограничиваются только ими) титры вирусов, бактерий или грибков. В частном варианте осуществления, системой является объект, нуждающийся в лечении вирусной инфекции (например, млекопитающие, такие как мышь, крыса, обезьяна или человек). Примеры вирусных инфекций включают инфекции вирусами гепатитов (например, гепатиты В и С), вирусом иммунодефицита человека (ВИЧ), риновируса, вирусом опоясывающего лишая (VZV), вирусом простого герпеса (например, HSV-1 или HSV-2), цитомегаловирусом (ЦМВ), вирусом коровьей оспы, вирусом гриппа, вирусом энцефалита, хантавирусом, арбовирусом, вирусом лихорадки Западного Нила, вирусом папилломы человека (ВПЧ), вирусом Эпштейна-Барр, респираторно-синцитиальным вирусом. В данном изобретении также описан способ лечения ВИЧ инфекции путем введения соединения, имеющего любую из приведенных выше формул, объекту, нуждающемуся в этом, тем самым ослабляя ВИЧ инфекцию.
Идентификация соединений, которые могут связываться с квадруплекс-формирующими участками ДНК.
Соединения, описанные в данном тексте, могут связываться с квадруплекс-формирующими участками ДНК, где биологическая активность этого участка, часто экспрессируемая как "сигнал", продуцируемая в системе, содержащей данное соединение, отлична от сигнала, продуцируемого в системе, не содержащей соединение. Хотя фоновые сигналы можно оценивать каждый раз при проверке новой молекулы в эксперименте, определение фонового сигнала не требуется при тестировании каждой новой молекулы.
Помимо определения того, приводит ли применение тестируемой молекулы или тестируемой нуклеиновой кислоты к изменению сигнала, можно количественно определить степень сродства взаимодействия между нуклеиновой кислотой и данным соединением. Для каждого взаимодействия можно сравнить пороговые показатели IC50, Kd или Ki с измеренными значениями IC50 или Kd, и, таким образом, идентифицировать тестируемую молекулу как квадруплекс-взаимодействующую молекулу, или тестируемую нуклеиновую кислоту как квадруплекс-формирующую нуклеиновую кислоту. Например, часто используют пороговые показатели IC50 или Kd в 10 мкМ или менее, 1 мкМ или менее, 100 нМ или менее. В другом примере, для определения квадруплекс-взаимодействующих молекул и квадруплекс-формирующих нуклеиновых кислот могут быть использованы пороговые показатели в 10 нМ или менее, 1 нМ или менее, 100 пМ или менее, и 10 пМ или менее.
Много тестов доступно для идентификации соединений, имеющих сродство к участкам ДНК, формирующим квадруплекс. В некоторых из данных тестов биологической активностью является связывание квадруплекса нуклеиновой кислоты с соединением, и связывание измеряется как сигнал. В других тестах биологической активностью является функция задержки полимеразы квадруплексом, и степень задержки измеряется как уменьшение сигнала. В некоторых тестах биологической активностью является транскрипция, и уровень транскрипции может быть количественно определен как сигнал. В другом тесте, биологической активностью является гибель клеток, и количественно измеряется число погибших клеток. Другое исследование мониторит уровень пролиферации опухолевых клеток. Примерами тестов являются анализы связывания при помощи флюоресценции, анализы изменения подвижности в геле (см., например, Jin & Pike, Mol. Endocrinol. (1996) 10:196-205), реакции остановки полимеразы, реакции инициации транскрипции, тесты на пролиферацию опухолевых клеток и тесты на апоптоз (см., например, Amersham Biosciences (Piscataway, New Jersey)), варианты осуществления таких исследований описаны далее в примере 8. Также, могут использоваться топоизомеразные тесты для выяснения того, влияют ли квадруплекс-взаимодействующие молекулы на активность топоизомеразы (см., например, TopoGEN, Inc. (Columbus, Ohio)).
Препараты соединений
При использовании в настоящем тексте, термин "его фармацевтически приемлемая соль или сложный эфир" включает, но не ограничен только ими: карбоксилатные соли, аддитивные соли с аминокислотами и сложные эфиры соединений, а также их цвиттерионные формы, которые известны квалифицированным специалистам в данной области техники и могут применяться для людей и животных. (Смотри, например, Gerge, S.M., et al., "Pharmaceutical Salts," J. Pharm. Sci. (1977) 66:1-19, который включен в данный текст в виде ссылки.)
Можно приготовить любые подходящие препараты описанных в настоящем тексте соединений. В случаях, когда соединения являются достаточно основными или кислотными для образования устойчивых нетоксичных кислотных или основных солей, может быть приемлемо введение данных соединений в форме солей. Примеры фармацевтически приемлемых солей представляют собой аддитивные соли с органическими кислотами, образованные с кислотами, дающими физиологически приемлемый анион, например, тозилат, метансульфонат, ацетат, цитрат, малонат, тартрат, сукцинат, бензоат, аскорбат, α-кетоглутарат и α-глицерофосфат. Также можно получать подходящие неорганические соли, включая гидрохлоридные, сульфатные, нитратные, бикарбонатные и карбонатные соли. Фармацевтически приемлемые соли получают по стандартным методикам, хорошо известным в данной области техники. Например, фармацевтически приемлемые соли можно получать взаимодействием достаточно основного соединения, такого как амин, с подходящей кислотой, дающей физиологически приемлемый анион. Получают также соли карбоновых кислот с щелочным металлом (например, натрий, калий или литий) или щелочно-земельным металлом (например, кальций).
Соединение можно включать в состав фармацевтической композиции и вводить млекопитающему, нуждающемуся в таком лечении. В одном варианте осуществления, млекопитающее представляет собой человека. Можно использовать любой подходящий способ введения, включая, но не ограничиваясь только ими: пероральный, парентеральный, внутривенный, внутримышечный, местный и подкожный способы.
В одном варианте осуществления, соединение вводят системно (например, перорально) в комбинации с фармацевтически приемлемым носителем, таким как инертный разбавитель или усваиваемый съедобный носитель. Они могут быть заключены в желатиновые капсулы с твердой или мягкой оболочкой, спрессованы в таблетки или включены непосредственно в пищу пациента. Для перорального терапевтического введения, действующее соединение можно объединять с одним или более наполнителями и использовать в форме проглатываемых таблеток, буккальных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, пластинок и тому подобных. Такие композиции и препараты должны содержать, по меньшей мере, 0,1% действующего вещества. Процентное содержание композиций и препаратов может варьироваться, и удобно применять содержание от около 2 до около 60% от массы используемой дозированной лекарственной формы. Количество действующего вещества в таких терапевтически используемых композициях является таким, при котором достигается эффективный уровень дозирования.
Таблетки, пастилки, пилюли, капсулы и тому подобные также могут содержать следующие компоненты: связующие средства, такие как трагакантовая камедь, смола акации, кукурузный крахмал или желатин; можно добавлять наполнители, такие как дикальция фосфат; дезинтегрирующее средство, такое как кукурузный крахмал, картофельный крахмал, альгиновая кислота и тому подобные; смазывающее средство, такое как стеарат магния; и подсластитель, такой как сахароза, фруктоза, лактоза или аспартам, или ароматизатор, такой как перечная мята, винтергреновое масло или вишневая отдушка. Когда дозированная лекарственная форма представляет собой капсулу, она может содержать, помимо веществ вышеуказанного типа, жидкий носитель, такой как растительное масло или полиэтиленгликоль. Различные другие вещества могут присутствовать в качестве покрытий или для другой модификации физической формы твердой дозированной лекарственной формы. Например, таблетки, пилюли или капсулы могут быть покрыты желатином, воском, шеллаком или сахаром и тому подобными. Сироп или эликсир может содержать действующее вещество, сахарозу или фруктозу в качестве подсластителя, метил- и пропил-парабены в качестве консервантов, краситель и ароматизатор, такой как вишневая или апельсиновая отдушка. Любое вещество, используемое в получении любой дозированной лекарственной формы, является фармацевтически приемлемым и практически нетоксичным в используемых количествах. Кроме того, действующее вещество можно включать в препараты и приборы с замедленным высвобождением.
Действующее вещество также можно вводить внутривенно или интраперитонеально путем инфузии или инъекции. Растворы действующего соединения или его солей можно готовить в буферном растворе, обычно забуференном фосфатом физиологическом растворе, при необходимости смешанном с нетоксичным сурфактантом. Также можно готовить дисперсии в глицерине, жидких полиэтиленгликолях, триацетине и их смесях, и в маслах. При обычных условиях хранения и применения, данные препараты содержат консервант для предотвращения роста микроорганизмов. Для такого метода введения, соединение иногда водят в состав препарата, содержащего полимерный матрикс (например, липосома или микросома). Липосомы описаны, например, в U.S. Patent No. 5,703,055 (Felgner, et al.) и Gregoriadis, Liposome Technology vols. I to III (2nd ed. 1993).
Фармацевтические лекарственные формы, подходящие для инъекции или инфузии, могут включать стерильные водные растворы или дисперсии или стерильные порошки, содержащие действующее вещество, подготовленные для немедленного приема стерильных инъецируемых или вливаемых растворов или дисперсий, при необходимости инкапсулированных в липосомы. Во всех случаях, окончательная лекарственная форма должна быть стерильной, текучей и устойчивой в условиях производства и хранения. Жидкий носитель может представлять собой раствор или жидкую среду для диспергирования, содержащий, например, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкие полиэтиленгликоли и тому подобные), растительные масла, нетоксичные сложные эфиры глицерина и их подходящие смеси. Надлежащую текучесть можно поддерживать, например, образованием липосом, регулированием размера частиц в случае дисперсий или использованием сурфактантов. Профилактику активности микроорганизмов можно осуществлять различными антибактериальными и противогрибковыми средствами, например, парабенами, хлорбутанолом, фенолом, сорбиновой кислотой, тиомерсалом и тому подобными. Во многих случаях, предпочтительно включать изотонические средства, например, сахара, буферные агенты или хлорид натрия. Пролонгированное всасывание инъецируемых композиций может достигаться использованием в композициях средств, замедляющих всасывание, например, моностеарата алюминия и желатина.
Стерильные инъецируемые растворы готовят введением действующего вещества в нужном количестве в подходящий растворитель с различными другими компонентами, перечисленными выше, по необходимости, с последующей стерилизацией фильтрованием. В случае стерильных порошков для приготовления стерильных инъецируемых растворов, предпочтительные способы получения представляют собой вакуумную сушку и методики лиофилизации, дающие порошок действующего вещества, плюс любой дополнительный необходимый компонент, присутствующий в предварительно стерильно-отфильтрованных растворах.
Для местного применения соединения по изобретению можно использовать в жидкой форме. Часто соединения вводят в виде композиций или готовых форм, в комбинации с дерматологически приемлемым носителем, который может быть твердым или жидким. Примеры подходящих дерматологических композиций, используемых для нанесения соединений на кожу, известны в литературе (смотри, например, Jacquet, et al. (U.S. Pat. No. 4,608,392), Geria (U.S. Pat. No. 4,992,478), Smith, et al. (U.S. Pat. No. 4,559,157) и Wortzman (U.S. Pat. No. 4,820,508).
Соединения могут вводиться в состав препарата с твердым носителем, который включает мелкоизмельченные твердые вещества, такие как тальк, глина, микрокристаллическая целлюлоза, оксид кремния, оксид алюминия и тому подобные. Подходящие жидкие носители включают воду, спирты или гликоли, или смеси вода-спирт/гликоль, в которых описанные соединения можно растворять или диспергировать в эффективных количествах, при необходимости с помощью нетоксичных сурфактантов. Добавки, такие как ароматизаторы и дополнительные противомикробные средства, можно добавлять для оптимизации свойств в соответствии с конкректным способом применения. Полученные в итоге жидкие композиции могут применяться с адсорбирующими тампонами, использоваться для пропитывания бинтов и других перевязочных средств или распыляться на пораженную область с помощью насосных или аэрозольных распылителей. Загустители, такие как синтетические полимеры, жирные кислоты, соли и сложные эфиры жирных кислот, жирные спирты, модифицированные целлюлозы или модифицированные минеральные вещества, также можно использовать с жидкими носителями для образования намазываемых паст, гелей, мазей, мыл и тому подобных, для нанесения непосредственно на кожу пользователя.
В целом, концентрация соединения в жидкой композиции часто составляет от около 0,1 масс.% до около 25 масс.%, иногда от около 0,5 масс.% до около 10 масс.%. Концентрация в полутвердой или твердой композиции, такой как гель или порошок, часто составляет от около 0,1 масс.% до около 5 масс.%, иногда от около 0,5 масс.% до около 2,5 масс.%. Композицию с соединением можно готовить в виде стандартной лекарственной формы, которую получают согласно общепринятым методикам, известным в фармацевтической индустрии. В общих чертах, такие технологии включают объединение соединения и фармацевтического носителя(-ей) и/или наполнителя(-ей) в жидкой форме или в мелкоизмельченной твердой форме, или в обеих формах, и, при необходимости, последующее формование продукта.
В частном примере, фармацевтическая композиция содержит около 2% масс/масс соединения Формулы (I), около 4% маннита и около 0,5% сахарозы. В частных примерах, готовая форма имеет рН около 3,5. Для инъецируемых готовых форм, можно добавлять воду до финальной массы.
Композицию с соединением можно вводить в состав любой лекарственной формы, такой как таблетки, капсулы, гелевые капсулы, жидкие сиропы, мягкие гели, суппозитории и клизмы. Композиции также можно вводить в состав суспензий в водной, безводной или смешанной среде. Водные суспензии также могут содержать вещества, которые повышают вязкость, включая, например, натрий карбоксиметилцеллюлозу, сорбит и/или декстран. Такая суспензия также может содержать один или более стабилизаторов.
Количество соединения, или его активной соли или производного, необходимого для использования в лечении, варьируется не только в зависимости от выбранной конкретной соли, но также в зависимости от способа введения, характера состояния, которое необходимо вылечить, и возраста и состояния пациента, и в конечном итоге остается на усмотрение лечащего врача или клинициста.
Полезную дозу соединения часто определяют тестированием его т vitro активности в клеточной или тканевой системе и/или in vivo активности в животной модели. Например, в данной области техники известны способы экстраполяции эффективной дозы для мышей и для других животных на людей (смотри, например, U.S. Pat. No. 4,938,949). Такие системы можно использовать для определения LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная для 50% популяции) соединения. Соотношение между летальной и терапевтической дозой представляет собой терапевтический индекс, и он может выражаться соотношением ED50/LD50. Дозировка соединения часто находится в диапазоне концентраций в кровеносной системе, при которых ED50 является малотоксичным или нетоксичным. Дозировка может варьироваться в данном диапазоне в зависимости от используемой лекарственной формы и применяемого способа введения. Для любых соединений, применяемых в описанных в настоящем тексте способах, терапевтически эффективную дозу можно первоначально оценить с помощью тестов на клеточных культурах. Доза иногда определяется, чтобы достигнуть диапазона циркулирующей в плазме концентрации, покрывающего IС50 (т.е., концентрацию тестируемого соединения, которая обеспечивает 50%-ное от максимального ингибирование симптомов), определенное по in vitro тестам, поскольку данную информацию часто используют для более точного определения полезной дозы для человека. Уровни в плазме можно измерять, например, высокоэффективной жидкостной хроматографией.
Другим примером определения эффективной дозы для пациента является возможность непосредственного тестирования уровней "свободного" и "связанного" соединения в сыворотке крови испытуемого пациента. В таких анализах можно использовать мимики антител и/или "биосенсоры", полученные по технологиям молекулярного импринтинга. Соединение используется как шаблон, или "импринтинговая молекула", чтобы пространственно организовать полимеризующиеся мономеры перед их полимеризацией с каталитическими реагентами. Последующее удаление импринтинговой молекулы оставляет полимерную матрицу, которая содержит повторяющиеся "негативные отпечатки" соединения, и способна селективно снова связывать молекулу в условиях биологического теста (см., например, Ansell, et al.. Current Opinion in Biotechnology (1996) 7:89-94 and in Shea, Trends in Polymer Science (1994) 2:166-173). Такие "отпечатанные" аффинные матрицы пригодны (восприимчивы) для лиганд-связывающих тестов, в результате чего компоненты иммобилизованных моноклональных антител заменены должным образом отпечатанной матрицей (см., например, Vlatakis, et al.. Nature (1993) 361:645-647). При использовании изотопных меток, "свободную" концентрацию соединения можно легко определять и использовать в вычислениях значения IС50. В состав таких "отпечатанных" аффинных матриц можно также вводить флуоресцентные группы, изменения фотон-излучающих свойств которых можно измерить при локальном и селективном связывании соединения. Указанные изменения легко анализируются в реальном времени с помощью подходящих волоконно-оптических устройств, в свою очередь позволяя быстро оптимизировать дозировку для испытуемого субъекта на основе его индивидуального IC50. Пример такого "биосенсора" рассмотрен в Kriz, et al.. Analytical Chemistry (1995) 67:2142-2144.
В некоторых вариантах осуществления, описаны соединения и композиции, демонстрирующие пероральную биодоступность для мышей и человека. В частных вариантах осуществления, в настоящем изобретении описаны композиции, содержащие соединение Формул (I), (II), (III), (IV), (V), (VI), (VI'), (VII) или (VIII), демонстрирующие, по меньшей мере, 15%-ную пероральную биодоступность для мышей и человека. В других вариантах осуществления, композиции демонстрируют, по меньшей мере, мере 20%, 30%, 40% или 50%-ную пероральную биодоступность для мышей и человека. В предпочтительном варианте осуществления, пациентом является человек. Без каких-либо теоретических обоснований, предполагают, что пероральная биодоступность, демонстрируемая соединениями по настоящему изобретению, может быть вызвана, по меньшей мере, частично, протонированным состоянием основного фрагмента, имеющегося в группе, представленной как А2, А3, -W, -L-W или -L-N(R)-W0.
Иллюстративные соединения по настоящему изобретению можно выбрать таким образом, чтобы кислота, сопряженная с основанием основного фрагмента, имеющегося в группе, представленной как А2, А3, -W, -L-W или -L-N(R)-W0, имела рКа от около 7 до 9, так что данная группа протонирована примерно на 50% в диапазоне рН от около 7,0 до около 9,0. В некоторых вариантах осуществления, 7-членный цикл Х1-Х7 в Формулах (VI) или (VI'), или гомопиперазиновый цикл в Формулах (VII) и (VIII), может выступать в роли основного фрагмента, описанного выше.
В настоящем изобретении также описаны фармацевтические композиции в стандартной лекарственной форме, содержащие терапевтически эффективное количество, по меньшей мере, одного соединения Формулы (I), Формулы (II), Формулы (III), Формулы (IV), Формулы (V), Формулы (VI), Формулы (VI'), Формулы (VII) или Формулы (VIII).
В частных вариантах осуществления, в настоящем изобретении описана фармацевтическая композиция в стандартной лекарственной форме, содержащая Соединение Формулы (I), Формулы (II), Формулы (III), Формулы (IV), Формулы (V), Формулы (VI), Формулы (VI'), Формулы (VII) или Формулы (VIII), где однократное пероральное введение лекарственной формы субъекту обеспечивает AUC (8 ч) по меньшей мере 1000 нг/мл*ч, предпочтительно более 2000 нг/мл*ч, более предпочтительно более 10000 нг/мл*час.
Биодоступность (F) представляет собой степень, в которой вводимая доза лекарственного средства достигает большого круга кровообращения или запланированного места действия. Биодоступность зависит от скорости всасывания и от скорости выведения лекарственного средства или его превращения в процессе обмена веществ до попадания в большой круг кровообращения. Например, перорально вводимое лекарственное средство проходит через печень до попадания в большой круг кровообращения, и может подвергнуться пресистемному метаболизму в печени или экскреции с желчью.
Для некоторых терапевтических показаний, пероральное дозирование является предпочтительным способом введения благодаря его безопасности, удобству и экономическим преимуществам. Разработка соединений с высокой пероральной биодоступностью часто является важным вопросом при разработке биоактивных молекул в качестве терапевтических средств.
Плохая пероральная биодоступность может быть причиной непостоянного воздействия действующего вещества, и может приводить к недостатку эффективности или передозировке конкретного лекарственного средства. Например, полиморфная вариативность в ферментах, метаболизирующих лекарственные средства, таких как цитохромы Р450 или метилтрансферазы, или совместное введение лекарственных средств, ингибирующих такие энзимы, могут уменьшать пресистемное выведение и повышать уровень воздействия лекарственного средства до нежелательного или токсичного уровня.
На всасывание, которое определяет скорость и степень, с которой лекарственное средство покидает место введения, влияет ряд переменных, включая физикохимические свойства лекарственного средства, влияющие на транспорт через мембраны, и выбранную лекарственную форму. Для перорально вводимых соединений, всасывание главным образом осуществляется в желудочно-кишечном тракте (ЖКТ), и подвержено воздействию ряда факторов, включая доступную площадь поверхности для всасывания, скорость кровотока, физическое состояние лекарственного средства и локальную концентрацию лекарственного средства в месте всасывания. В частности, растворимость в воде воздействует как на скорость, так и на место всасывания. Малорастворимые лекарственные средства часто демонстрируют плохую биодоступность или недостаточное всасывание, при этом на степень всасывания влияют такие факторы, как уровень дозировки, диета пациента и лекарственная форма. В твердых лекарственных формах, скорость растворения может быть ограничивающим фактором при определении всасывания.
На растворимость лекарственного средства влияет градиент рН в желудочно-кишечном тракте (ЖКТ). Например, основные лекарственные средства, растворимые при низком рН желудка (рН~1,2) могут становиться менее растворимьми, когда лекарственное средство попадает в условия более высокого рН в тонком кишечнике (рН от 5 до 7, обычно около 6, 5), в зависимости от рКа лекарственного средства. Хотя неионизированная форма лекарственного средства всасывается быстрее ионизированной формы в конкретном участке ЖКТ, общая скорость всасывания в кишечнике выше, чем в желудке, вне зависимости от ионизации, вследствие большей площади поверхности. (Смотри, например, Goodman & Oilman's, The Pharmacological Basis of Therapeutics (9th Ed.) (Goodman, et al., eds.) (McGraw-Hill) (1996).
Многие лекарственные средства состоят из слабых кислот или слабых оснований, присутствующих в растворе в равновесии между ионизированными (т.е. заряженными) и неионизированными формами. Степень ионизации определяется величиной рКа лекарственного средства, а также значением рН раствора. Значение рН влияет на скорость диссоциации как слабых кислот, так и слабых оснований. Слабые кислоты диссоциируют, становясь ионизированными, в щелочных условиях, в то время как слабые основания ионизируются в кислых условиях.
Процент ионизации можно вычислить по уравнению 1 для НА кислот и уравнению 2 для ВН+ кислот:
% ионизации=100/(1+10(рКа-pH)) (уравнение 1)
% ионизации=100/(1+10(рН-pKa)) (уравнение 2)
Когда рН равен рКа, соединение ионизировано на 50%; т.е. соотношение ионизированного и неионизированного лекарственного средства составляет 50:50. В уравнении Хендерсона-Хассельбалха, рКа=рН когда log[сопряженное основание]/[кислота]=1. Рост значения рН на одну единицу по сравнению с рКа (т.е., рост основности раствора) вызывает снижение процента ионизации ВН+ кислоты до всего 9,1%, и НА кислота на 90,9% переходит в ионизированную форму сопряженного основания. Рост значения рН на две единицы дает значительный сдвиг ВН+ кислоты к неионизированной форме сопряженного основания (0,99%), в то время как НА кислота становится практически полностью ионизированной (99%). Обратная картина наблюдается, когда раствор делается более кисльм, по сравнению со значением рКа лекарственного средства. (Смотри, например. Block, в Textbook of Organic Medicinal and Pharmaceutical Chemistry (10th Ed.) (Delgado & Remers, eds.) (Lippincott-Raven) (1998).
В одном аспекте, перорально активное соединение в композиции по настоящему изобретению выбирают таким образом, что указанные соединения ионизированы примерно на 50% в диапазоне значений рН от около 7 до около 9. Такие соединения могут обладать оптимальной пероральной биодоступностью и эффективностью.
В некоторых вариантах осуществления, предпочтительными группами для А2, А3, -W, -L-W и -L-N(R)W0 являются такие, которые обеспечивают такое значение константы диссоциации, рКа, в водных растворах, что, по меньшей мере, часть амина является ионизированной при физиологических уровнях рН, например при значениях рН между около 4 и около 9. Особенно подходящими могут быть амины, обладающие рКа между около 6 и около 10, предпочтительно между около 7 и около 9.
Фармакокинетика
Фармакокинетические параметры можно определить на основании количества соединения в образцах, взятых в различные моменты времени. Типы фармакокинетических анализов и методология определения параметров могут быть надлежащим образом выбраны квалифицированным специалистом в данной области. Примеры фармакокинетических параметров, которые могут быть оценены, включают (но не ограничены только ими) максимальную (пиковую) концентрацию лекарства в плазме крови (Смаке) (обычно выражаемую в нг/мл); время достижения максимальной концентрации в плазме крови (время достижения пика, Тмакс); и площадь под кривой зависимости концентрации в жидкой среде (например, плазме) от времени (AUC). Квалифицированный специалист в данной области способен вычислить такие параметры (например, Mei et al., AAPS Journal (2006) 8(3) article 58 (http address www.aapsj.org))
Биодоступность при пероральном приеме можно оценить измерением "площади под кривой" (AUC) или Смаке» оба параметра хорошо известны в данной области. AUC определяется по графику зависимости сывороточной или плазматической концентрации лекарственного средства, отложенной по ординате (ось Y), от времени, отложенного по абсциссе (ось X). В целом, значения AUC представляют собой набор величин, полученных от всех субъектов исследуемой популяции, и, поэтому, представляют собой усредненные значения для всей тестируемой популяции.
AUC0-8 (нг х час/мл) представляет собой площадь под кривой зависимости концентрации от времени за промежуток времени от 0 до 8 часов, и может быть вычислена с использованием линейного правила трапеций согласно Gibaldi, M. and Perrier, D. Pharmacokinetics, Second Edition, Marcel Dekker, Inc., New York (1982). AUCo-inf представляет собой площадь под кривой зависимости концентрации от времени, экстраполированной от 0 до бесконечности (выражается в нг × час/мл).
Могут быть определены другие фармакокинетические параметры. Например, T1/2 представляет собой конечный период полувыведения (выражается в час.); Vdss представляет собой объем распределения в равновесном состоянии (выражается в л/кг); и Cls представляет собой общий клиренс (выражается в л/час/кг).
Дозы
Полезную дозу соединения часто определяют измерением его активности in vitro в системе клеток или тканей и/или активности in vivo в животной системе. Например, известны методы экстраполяции эффективной дозы для мышей и других животных на человека (см., например, патент США №4938949). Такие системы могут использоваться для определения LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная в 50% популяции) соединения. Соотношение между летальной дозой и терапевтической дозой представляет собой терапевтический индекс, и может быть выражено как отношение ED50/LD50. Доза соединения часто находится в пределах диапазона концентраций в кровеносной системе, при которых ED50 является малотоксичным или нетоксичным. Дозировка может варьироваться в данном диапазоне в зависимости от используемой лекарственной формы и применяемого способа введения. Для любых соединений, применяемых в описанных в настоящем тексте способах, терапевтически эффективную дозу можно первоначально оценить с помощью тестов на клеточных культурах. Доза иногда определяется, чтобы достигнуть диапазона циркулирующей в плазме концентрации, покрывающего IС50 (т.е., концентрацию тестируемого соединения, которая обеспечивает 50%-ное от максимального ингибирование симптомов), определенное по in vitro тестам, поскольку данную информацию часто используют для более точного определения полезной дозы для человека. Уровни в плазме можно измерять, например, высокоэффективной жидкостной хроматографией
Другим примером определения эффективной дозы для объекта является возможность непосредственного тестирования уровней "свободного" и "связанного" соединения в сыворотке крови испытуемого объекта. В таких анализах можно использовать мимики антител и/или "биосенсоры", полученные по технологиям молекулярного импринтинга. Соединение используется как шаблон, или "импринтинговая молекула", чтобы пространственно организовать полимеризующиеся мономеры перед их полимеризацией с каталитическими реагентами. Последующее удаление импринтинговой молекулы оставляет полимерную матрицу, которая содержит повторяющиеся "негативные отпечатки" соединения, и способна селективно снова связывать молекулу в условиях биологического теста (см., например, Ansell, et al.. Current Opinion in Biotechnology (1996) 7:89-94 and in Shea, Trends in Polymer Science (1994) 2:166-173).
Такие "отпечатанные" аффинные матрицы пригодны (восприимчивы) для лиганд-связывающих тестов, в результате чего компоненты иммобилизованных моноклональных антител заменены должным образом отпечатанной матрицей (см., например, Vlatakis, et al.. Nature (1993) 361:645-647). При использовании изотопных меток, "свободную" концентрацию соединения можно легко определять и использовать в вычислениях значения IС50. В состав таких "отпечатанных" аффинных матриц можно также вводить флуоресцентные группы, изменения фотон-излучающих свойств которых можно измерить при локальном и селективном связывании соединения. Указанные изменения легко анализируются в реальном времени с помощью подходящих волоконно-оптических устройств, в свою очередь позволяя быстро оптимизировать дозу для испытуемого субъекта на основе его индивидуального IС50. Пример такого "биосенсора" рассмотрен в Kriz, et al.. Analytical Chemistry (1995) 67:2142-2144.
Примерные дозы включают миллиграммовые или микрограммовые количества соединения на килограмм массы субъекта или массы образца, например, от около 1 микрограмма на килограмм до около 500 миллиграммов на килограмм, от около 100 микрограммов на килограмм до около 5 миллиграммов на килограмм, или от около 1 микрограмма на килограмм до около 50 микрограммов на килограмм. Понятно, что подходящие дозы маленькой молекулы зависят от эффективности данной маленькой молекулы в отношении модулирования экспрессии или активности. Когда одна или более из этих маленьких молекул должны вводиться животному (например, человеку) с целью модулирования экспрессии или активности полипептида или нуклеиновой кислоты, описанной в данном тексте, врачи, ветеринары или исследователи могут, например, прописать сначала относительно низкую дозу, впоследствии увеличивая дозу до получения соответствующего ответа. Кроме того, понятно, что конкретный уровень дозы для любого отдельного животного субъекта будет зависеть от множества факторов, включая активность конкретного используемого соединения, возраст, массу тела, общее здоровье, пол и диету объекта, время введения, способ введения, скорость выведения, любые лекарственные комбинации, и уровень модулирования экспрессии или активности.
Описанные далее примеры приведены для иллюстрации, а не для ограничения изобретения.
Пример 1
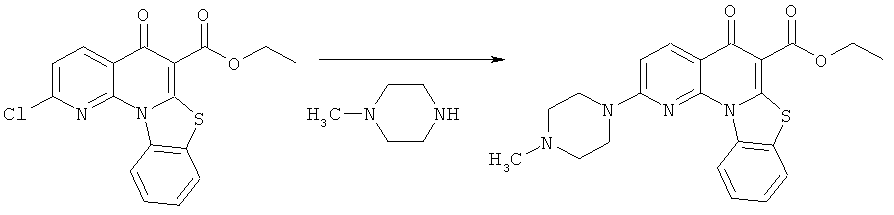
К суспензии хлорэфира (5,00 г, 13,94 ммоль) в ацетонитриле (50 мл) добавляли N-метилпиперазин (3,10 мл, 27,95 ммоль), и полученную смесь кипятили в течение ночи. Реакционную смесь охлаждали до комнатной температуры и отфильтровывали осадок, получая желаемый продукт в виде коричневатого твердого вещества (4,7 г, 80%), 1Н ЯМР (СDСl3) δ: 9,47 (д, 1Н), 8,62 (д, 1Н), 7,74 (дд, 1Н), 7,51 (м, 1Н), 7.43 (м, 1Н), 6,89 (д, 1Н), 4,50 (кв, 2Н), 3,85 (т, 4Н), 2,62 (т, 4Н), 2,40 (с, 3Н), 1,49 (т, 3Н). ЖХ/МС (ES): m/z 423 [М+1]+.
Пример 2
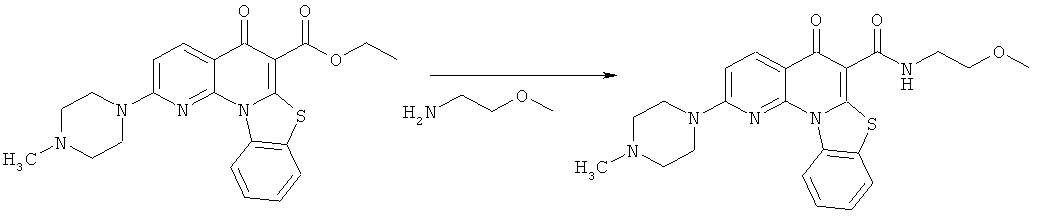
К раствору сложного эфира (150 мг, 0,34 ммоль) и 2-метоксиэтиламина (0,50 мл, 5,80 ммоль) в ДХМ (10 мл) добавляли АlСl3 (150 мг, 1,12 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли добавлением ДХМ (100 мл) и 6 н. раствора NaOH (25 мл) и перемешивали в течение 10 мин. Слои разделяли, и органический слой промывали водой (2×50 мл), насыщенным раствором соли (50 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученное твердое вещество растирали в ацетонитриле, получая желаемый продукт в виде белого твердого вещества. ЖХ/МС (ES): m/z 470 [M+1]+
Пример 3
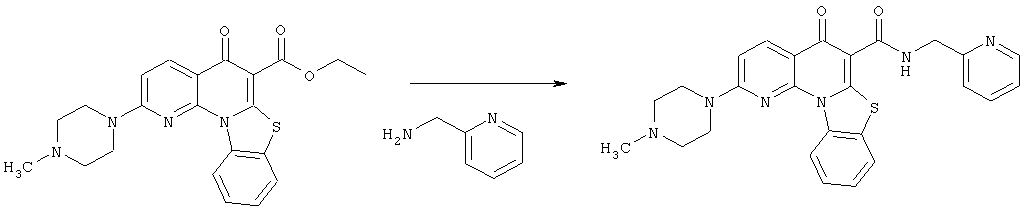
К раствору сложного эфира (1,45 г, 3,44 ммоль), пиридин-2-илметанамина (1,00 мл, 9,78 ммоль), и DBU (1,50 мл, 10,03 ммоль) в ДХМ (40 мл) добавляли АlСl3 (475 мг, 7,31 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли добавлением ДХМ (400 мл) и 1 н. раствора NaOH (200 мл) и перемешивали в течение 10 мин. Слои разделяли, и органический слой промывали водой (2×100 мл), насыщенным раствором соли (100 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученное твердое вещество растирали в ацетонитриле, получая желаемый продукт в виде белого твердого вещества (1,07 г, 64%), 1Н ЯМР (СDСl3) δ: 11,24 (т, 1Н), 9,50 (д, 1Н), 8,62 (м, 2Н), 7,77 (дд, 1Н), 7,65 (м, 1Н), 7,53 (м, 1Н), 7,49 (м, 2Н), 6,93 (д, 1Н), 4,89 (д, 2Н), 3,88 (т, 4Н), 2,63 (т, 4Н), 2,41 (с, 3Н).ЖХ/МС (ES): m/z 485 [М+1]+.
Пример 4
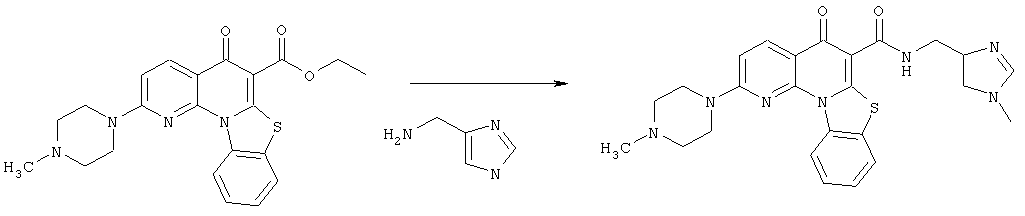
К раствору сложного эфира (150 мг, 0,34 ммоль), (1-метил-1Н-имидазол-4-ил)метанамина (0,15 мл, 1,35 ммоль) и DBU (2,00 мл, 1,33 ммоль) в ДХМ (10 мл) добавляли АlСl3 (130 мг, 0,97 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли добавлением ДХМ (100 мл) и 6 н. раствора NaOH (25 мл) и перемешивали в течение 10 мин. Слои разделяли, и органический слой промывали водой (2×50 мл), насыщенным раствором соли (50 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученный сырой продукт очищали препаративной ТСХ на силикагеле (10% МеОН/ДХМ), получая желаемый продукт. ЖХ/МС (ES): m/z 506 [M+1]+
Пример 5
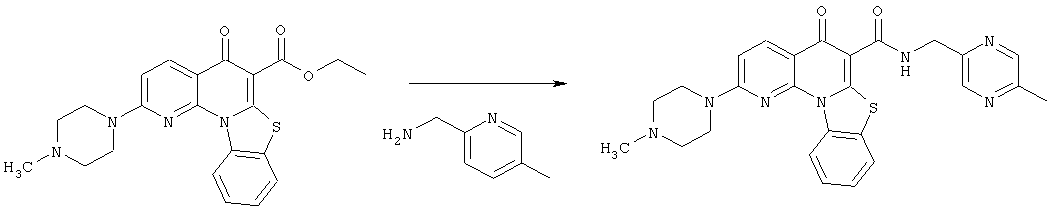
К раствору сложного эфира (72 мг, 0,17 ммоль), (5-метилпиразин-2-ил)метанамина (0,10 мл, 0,81 ммоль) и DBU (0,20 мл, 1,34 ммоль) в ДХМ (10 мл) добавляли АlСl3 (80 мг, 0,60 ммоль). Реакционную смесь перемешивали при комнатной температуре 30 мин. Реакционную смесь разбавляли добавлением ДХМ (100 мл) и 3 н. раствора NaOH (25 мл) и перемешивали в течение 10 мин. Слои разделяли, и органический слой промывали водой (2х50 мл), насыщенным раствором соли (50 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученное твердое вещество растирали в ацетонитриле, получая желаемый продукт в виде белого твердого вещества (60 мг, 71%). ЖХ/МС (ES): m/z 500 [М+1]+.
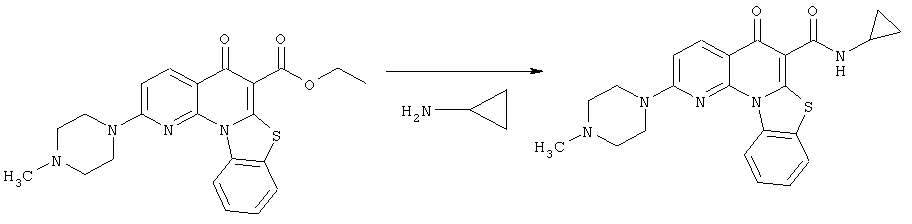
К раствору сложного эфира (100 мг, 0,238 ммоль) и циклопропиламина (37,7 мг, 0,66 ммоль) в ДХМ (10 мл) добавляли DBU (0,35 мл) и АlСl3 (130 мг). Реакционную смесь перемешивали при комнатной температуре 2 ч. Реакционную смесь разбавляли добавлением ДХМ (30 мл) и 6 н. раствора NaOH (10 мл) и перемешивали в течение 10 мин. Слои разделяли, и органический слой промывали водой (2×10 мл), насыщенным раствором соли (20 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученное твердое вещество растирали в этилацетате, получая желаемый продукт в виде белого твердого вещества. ЖХ/МС (ES): m/z 431 [M+1]+
Пример 7
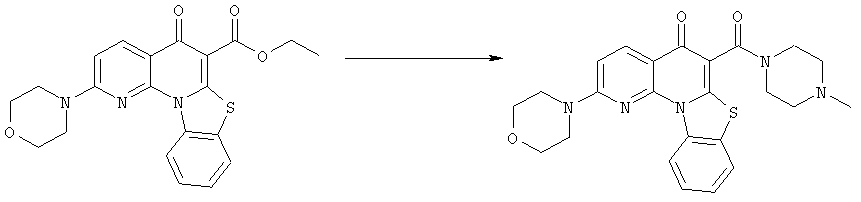
К суспензии морфолиноэфира (1,0 г, 2,44 ммоль) в метиленхлориде (20 мл) добавляли 1-метил-пиперазин (370 мг, 3,66 ммоль) и хлорид алюминия (487 мг, 3,66 ммоль), и смесь оставляли перемешиваться при комнатной температуре в течение 2 часов. Растворитель удаляли в вакууме, добавляли 1 н. раствор HCl (10 мл), затем 2 мл насыщенного раствора винной кислоты, и смесь перемешивали в течение 30 мин до гомогенизации, после чего разбавляли добавлением 50 мл воды. Полученную смесь экстрагировали этилацетатом 3×20 мл (экстракты отбрасывали), и затем подщелачивали добавлением 1 н. раствора NaOH. Выпавший осадок отфильтровывали, сушили и растирали в ацетонитриле (20 мл). После фильтрования получали конечное соединение в виде белого твердого вещества (1,184 г, немного влажное из-за оставшегося ацетонитрила). ЖХ/МС (ES): m/z 464[M+1]+.
Пример 8
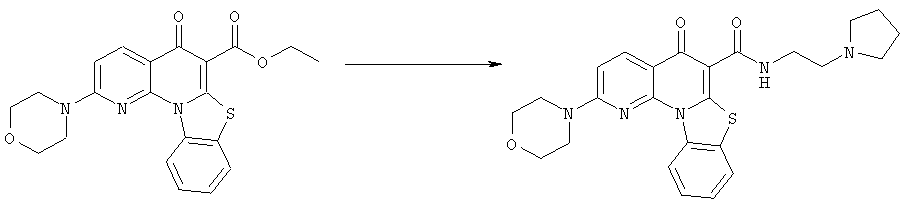
К суспензии морфолиноэфира (1,0 г, 2,44 ммоль) в метиленхлориде (20 мл) добавляли 1-2,аминоэтилпирролидин (418 мг, 3,66 ммоль) и хлорид алюминия (487 мг, 3,66 ммоль), и смесь оставляли перемешиваться при комнатной температуре на 2 ч. Растворитель удаляли в вакууме, добавляли 1 н. раствор HCl (10 мл), затем 2 мл насыщенного раствора винной кислоты, и смесь перемешивали в течение 30 мин до гомогенизации, после чего разбавляли добавлением 50 мл воды. Полученную смесь экстрагировали этилацетатом 3×20 мл (экстракты отбрасывали), и затем подщелачивали добавлением 1 н. раствора NaOH. Выпавший осадок отфильтровывали, сушили и растирали в ацетонитриле (20 мл). После фильтрования получали конечное соединение в виде белого твердого вещества (900 мг, 77%). ЖХ/МС (ES): m/z 478 [M+1]+.
Пример 9
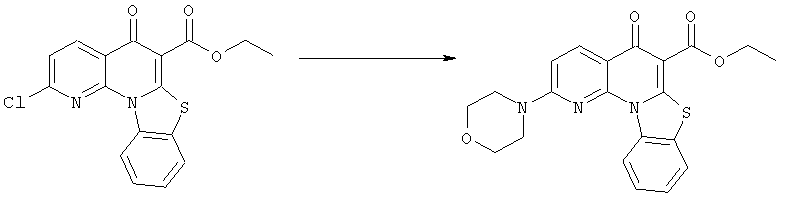
К суспензии хлорэфира (15,00 г, 41,81 ммоль) в ацетонитриле (150 мл) добавляли морфолин (7,5 мл, 85,74 ммоль), и смесь кипятили в течение ночи. Реакционную смесь охлаждали до комнатной температуры и отфильтровывали выпавший осадок. Выделенное твердое вещество затем растворяли в СНСl3 (600 мл) и пропускали через слой Celite™. Растворитель удаляли при пониженном давлении, и полученное твердое вещество растирали в ацетонитриле, получая желаемый продукт в виде не совсем белого твердого вещества (14,00 г, 82%), 1Н ЯМР (СDCl3) δ: 9,36 (д, 1Н), 8,60 (д, 1Н), 7,70 (дд, 1Н), 7,47 (м, 1Н), 7,37 (м, 1Н), 6,84 (д, 1Н), 4,51 (кв, 2Н), 3,92 (т, 4Н), 3,77 (т, 4Н), 1,49 (т, 3Н). ЖХ/МС (ES):m/z 410 [M+1]+.
Пример 10
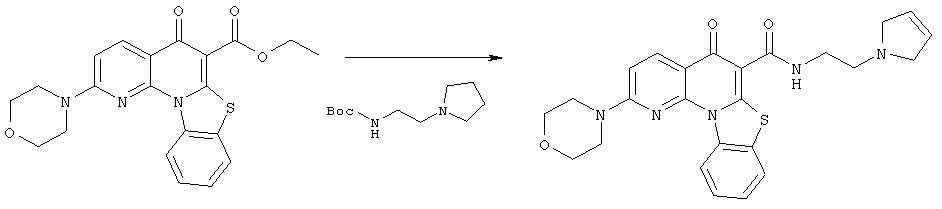
К раствору трет-бутил 2-(2,5-дигидро-1Н-пиррол-1-ил)этилкарбамата (160 мг, 0,75 ммоль) в ДХМ (1 мл) добавляли HCl (2,0 мл, 4 М раствор в диоксане). Реакционную смесь перемешивали при комнатной температуре 2 часа. Растворитель удаляли при пониженном давлении, и остаток снова растворяли в ДХМ (10 мл) и DBU (0,56 мл, 3,74 ммоль). В реакционную смесь добавляли сложный эфир (150 мг, 0,37 ммоль) и затем АlСl3 (150 мг, 1,12 ммоль), после чего перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь разбавляли добавлением ДХМ (100 мл) и 3 н. раствора NaOH (50 мл) и перемешивали в течение 10 мин. Слои разделяли, и органический слой промывали водой (2×50 мл), насыщенным раствором соли (50 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученный сырой продукт очищали колоночной хроматографией на силикагеле (0-10% МеОН/ДХМ), получая желаемый продукт в виде белого твердого вещества (130 мг, 75%), 1Н ЯМР (CDCl3) δ: 10,60 (т, 1Н), 9,44 (д, 1Н), 8,62 (д, 1Н), 7,75 (дд, 1Н), 7,48 (м, 1Н), 7,44 (м, 1Н), 6,91 (д, 1Н), 5,78 (с, 2Н), 3,94 (т, 4Н), 3,81 (т, 4Н), 3,66 (кв, 2Н), 3,63 (с, 4Н), 2,96 (т, 2Н). ЖХ/МС (ES): m/z 476 [M+1]+
Пример 11
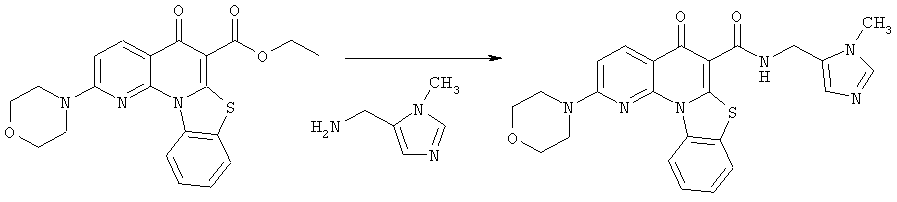
К раствору сложного эфира (150 мг, 0,37 ммоль), (1-метил-1Н-имидазол-5-у1)метанамина (0,15 мл, 1,35 ммоль) и DBU (0,20 мл, 1,34 ммоль) в ДХМ (10 мл) добавляли АlСl3 (150 мг, 1,12 ммоль). Реакционную смесь перемешивали при комнатной температуре 1 ч, добавляли еще DBU (0,30 мл, 2,01 ммоль) и перемешивали еще 30 мин. Реакционную смесь разбавляли добавлением ДХМ (150 мл) и 6 н. раствора NaOH (25 мл) и перемешивали в течение 10 мин. Слои разделяли, и органический слой промывали водой (2×50 мл), насыщенным раствором соли (50 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученный сырой продукт очищали препаративной ТСХ на силикагеле (10% МеОН/ДХМ), получая желаемый продукт (100 мг, 58%). ЖХ/МС (ES): m/z 475 [M+1]+
Пример 12
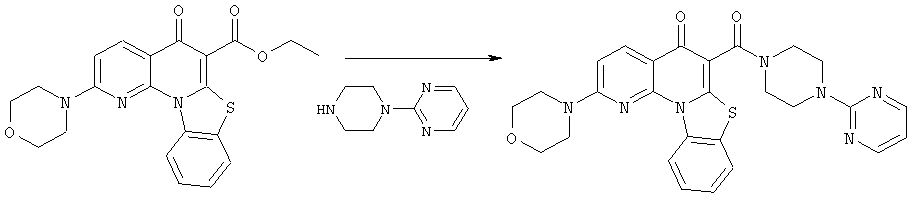
К раствору сложного эфира (100 мг, 0,24 ммоль), 2-(пиперазин-1-ил)пиримидина (0,10 мл, 0,61 ммоль) и DBU (0,10 мл, 0,67 ммоль) в ДХМ (10 мл) добавляли АlСl3 (100 мг, 0,75 ммоль). Реакционную смесь перемешивали при комнатной температуре 2 ч. Реакционную смесь разбавляли добавлением ДХМ (150 мл) и 6 н. раствора NaOH (25 мл) и перемешивали в течение 10 мин. Слои разделяли, и органический слой промывали водой (2×50 мл), насыщенным раствором соли (50 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученный сырой продукт очищали колоночной хроматографией на силикагеле (0-5% МеОН/ДХМ), получая желаемый продукт в виде белого твердого вещества (80 мг, 63%). ЖХ/МС (ES): m/z 528 [М+1]+.
Пример 13
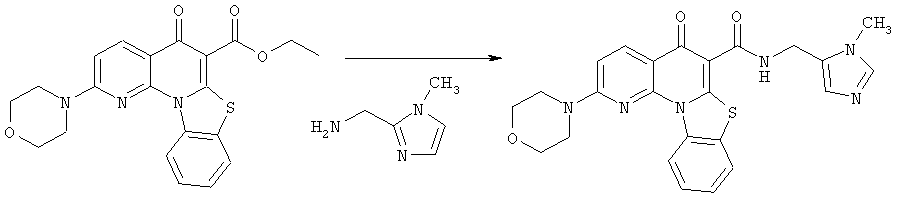
К раствору сложного эфира (750 мг, 1,83 ммоль), (1-метил-1Н-имидазол-2-у1)метанамина (0,50 мл, 4,50 ммоль) и DBU (0,80 мл, 5,35 ммоль) в ДХМ (50 мл) добавляли АlСl3 (750 мг, 5,62 ммоль). Реакционную смесь перемешивали при комнатной температуре 3 ч. Реакционную смесь разбавляли добавлением ДХМ (200 мл) и 3 н. раствора NaOH (100 мл) и перемешивали в течение 10 мин. Слои разделяли, и органический слой промывали водой (2×100 мл), насыщенным раствором соли (100 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученный сырой продукт очищали колоночной хроматографией на силикагеле (0-5% МеОН/ДХМ), получая желаемый продукт в виде белого твердого вещества (275 мг, 32%). 1Н ЯМР (CDCl3) δ: 11,0 (т, 1Н), 9,45 (д, 1Н), 8,61 (д, 1Н), 7,76 (дд, 1Н), 7,50 (м, 1Н), 7,45 (м, 1Н), 6,99 (д, 1Н), 6,90 (д, 1Н), 6,83 (д, 1Н), 4,82 (д, 2Н), 3,93 (т, 4Н), 3,81 (т, 4Н), 3,70 (с, 3Н). ЖХ/МС (ES): m/z 475 [M+1]+
Пример 14
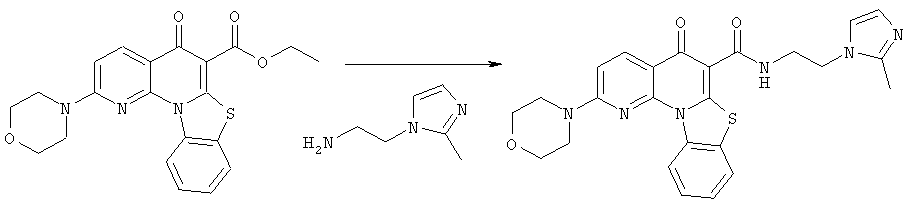
К раствору сложного эфира (500 мг, 1,22 ммоль), 2-(2-метил-1Н-имидазол-1-у1)этанамина (325 мг, 2,60 ммоль) и DBU (1,00 мл, 6,69 ммоль) в ДХМ (18 мл) добавляли АlСl3 (350 мг, 2,62 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли добавлением ДХМ (200 мл) и 3 н. раствора NaOH (50 мл) и перемешивали в течение 10 мин. Слои разделяли, и органический слой промывали водой (2х50 мл), насыщенным раствором соли (50 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученное твердое вещество растирали в ацетонитриле, получая желаемый продукт в виде не совсем белого твердого вещества (360 мг, 60%). 1Н ЯМР (CDCl3) δ: 10,77 (т, 1Н), 9,47 (д, 1Н), 8,60 (д, 1Н), 7,78 (дд, 1Н), 7,53 (м, 1Н), 7,44 (м, 1Н), 6,93 (м, 3Н), 4,15 (т, 2Н), 3,94 (т, 4Н), 3,83 (т, 4Н), 3,79 (кв, 2Н), 2,42 (с, 3Н). ЖХ/МС (ES): m/z 489 [М+1]+.
Пример 15
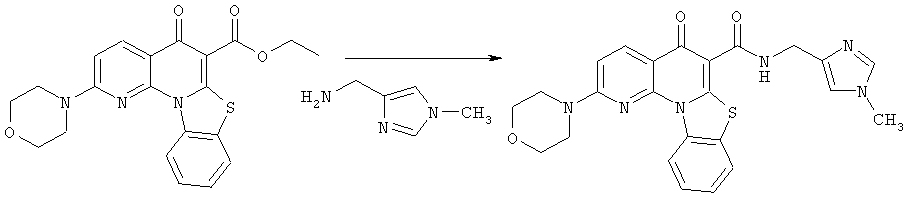
К раствору сложного эфира (105 мг, 0,26 ммоль), (1 -метил- Ш-имидазол-4-у1)метанамина (0,10 мл, 0,90 ммоль) и DBU (0,10 мл, 0,71 ммоль) в ДХМ (10 мл) добавляли АlСl3 (75 мг, 0,56 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли добавлением ДХМ (100 мл), 6 н. раствора NaOH (50 мл) и насыщенного раствора тартрата натрия-калия (50 мл), и перемешивали в течение 10 мин. Слои разделяли, и органический слой промывали водой (2×50 мл), насыщенным раствором соли (50 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученный сырой продукт очищали препаративной ТСХ на силикагеле (5% МеОН/ДХМ), получая желаемый продукт в виде белого твердого вещества (40 мг, 33%). ЖХ/МС (ES): m/z 475 [M+1]+
Пример 16
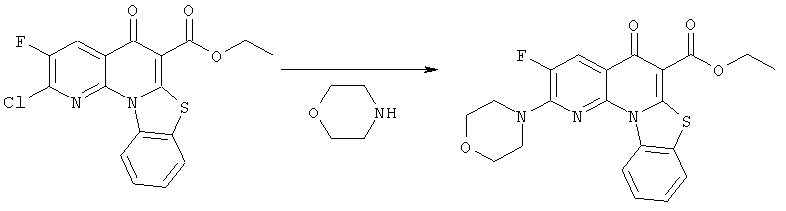
К суспензии хлорэфира (6,08 г, 16,14 ммоль) в ацетонитриле (100 мл) добавляли морфолин (2,8 мл, 32,01 ммоль), и смесь кипятили 3 часа. Реакционную смесь охлаждали до комнатной температуры и отфильтровывали выпавший осадок. Выделенное твердое вещество затем растворяли в CHCl3 (200 мл) и пропускали через слой Celite™. Растворитель удаляли при пониженном давлении, и полученное твердое вещество растирали в ацетонитриле, получая желаемый продукт в виде белого твердого вещества (5,00 г, 73%). 1Н ЯМР (СDСl3) δ: 9,37 (д, 1Н), 8,29 (д, 1Н), 7,72 (дд, 1Н), 7,47 (м, 1Н), 7,42 (м, 1Н), 4,50 (кв, 2Н), 3,94 (т, 4Н), 3,81 (т, 4Н), 1,48 (т, 3Н). ЖХ/МС (ES): m/z 428 [М+1]+.
Пример 17
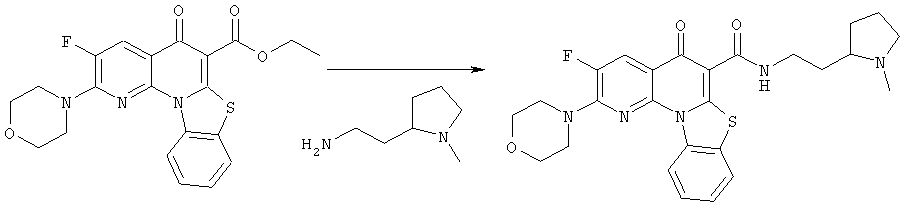
К раствору сложного эфира (700 мг, 1,64 ммоль) и 2-(1-метилпирролидин-2-ил)этанамина (0,70 мл, 4,83 ммоль) в ДХМ (25 мл) добавляли АlСl3 (645 мг, 4,84 ммоль). Реакционную смесь перемешивали при комнатной температуре 1 час.Реакционную смесь разбавляли добавлением ДХМ (150 мл), 6 н. раствора NaOH (50 мл) и насыщенного раствора тартрата натрия-калия (50 мл), и перемешивали в течение 10 мин. Слои разделяли, и органический слой промывали водой (2×50 мл), насыщенным раствором соли (50 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученный сырой продукт растирали в Et2O/EtOAc (1:1), получая желаемый продукт в виде белого твердого вещества (690 мг, 83%). 1Н ЯМР (CDCl3) δ: 10,45 (т, 1Н), 9,41 (д, 1Н), 8,29 (д, 1Н), 7.76 (дд, 1Н), 7,50 (м, 1Н), 7,49 (м, 1Н), 3,96 (т, 4Н), 3,85 (т, 4Н), 3,55 (м, 2Н), 3,06 (м, 1Н), 2,34 (с, 3Н), 2,17 (м, 1Н), 2,08 (м, 3Н), 1,80 (м, 2Н), 1,56 (м, 2Н). ЖХ/МС (ES): m/z 510 [M+1]+.
Пример 18
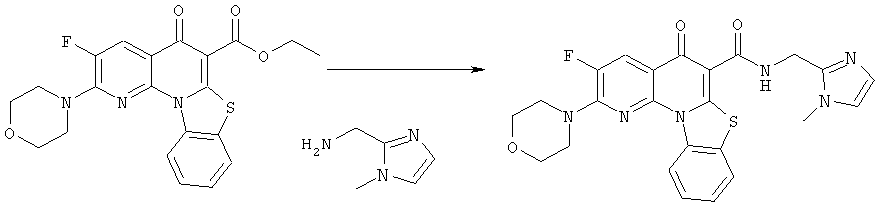
К раствору сложного эфира (515 мг, 1,20 ммоль) и С-(1-метил-1Н-имидазол-2-ил)-метиламина (199,5 мг, 1,79 ммоль) в ДХМ (40 мл) добавляли DBU (0,98 мл) и АlСl3 (352,3 мг). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли добавлением ДХМ (100 мл) и 6 н. раствора NaOH (25 мл), и перемешивали в течение 10 мин. Слои разделяли, и органический слой промывали водой (2×50 мл), насыщенным раствором соли (50 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученный сырой продукт растирали в этилацетате, получая желаемый продукт в виде белого твердого вещества. ЖХ/МС (ES): m/z 493 [M+1]+.
Пример 19
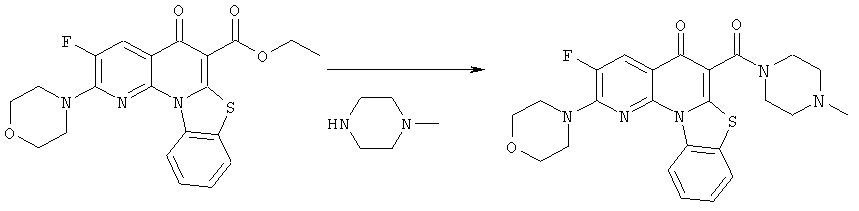
К раствору сложного эфира (300 мг, 0,70 ммоль) и 1-метилпиперазина (0,25 мл, 2,25 ммоль) в ДХМ (15 мл) добавляли АlСl3 (305 мг, 2,29 ммоль). Реакционную смесь перемешивали при комнатной температуре 1 час. Реакционную смесь разбавляли добавлением ДХМ (100 мл), 6 н. раствора NaOH (50 мл) и насыщенного раствора тартрата натрия-калия (50 мл), и перемешивали в течение 10 мин. Слои разделяли, и органический слой промывали водой (2×50 мл), насыщенным раствором соли (50 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученное твердое вещество растирали в Et2O/EtOAc (1:1), получая желаемый продукт в виде белого твердого вещества (280 мг, 83%). 1Н ЯМР (CDCl3) δ: 9,37 (д, 1Н), 8,29 (д, 1Н), 7,65 (дд, 1Н), 7,48 (м, 1Н), 7,40 (м, 1Н), 3,95 (т, 4Н), 3,88 (м, 2Н), 3,82 (т, 4Н), 3,48 (м, 2Н), 2,54 (м, 2Н), 2,44 (м, 2Н), 2,32 (с, 3Н). ЖХ/МС (ES): m/z 482 [M+1]+.
Пример 20
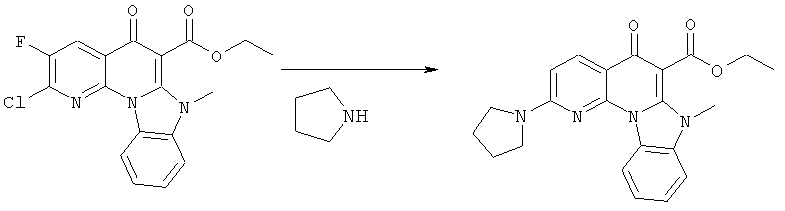
Суспензию хлорэфира (800 мг, 2,25 ммоль) и пирролидина (0,40 мл, 4,79 ммоль) в ДМФА (5,0 мл) нагревали при 65°С в течение 15 мин в микроволновой печи. Реакционную смесь разбавляли добавлением EtOAc (50 мл) и отфильтровывали образовавшийся осадок, получая желаемый продукт. ЖХ/МС (ES): m/z 391 [М+1]+
Пример 21
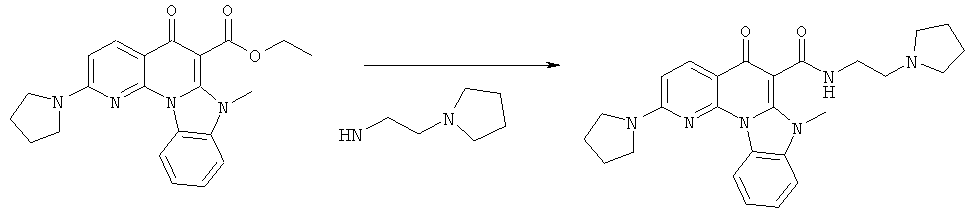
К раствору сложного эфира (675 мг, 1,73 ммоль), 2-(пирролидин-1-ил)этанамина (0,65 мл, 5,13 ммоль) и DBU (0,75 мл, 5,02 ммоль) в ДХМ (30 мл) добавляли АlСl3 (680 мг, 5,10 ммоль). Реакционную смесь перемешивали при комнатной температуре 1,5 ч. Реакционную смесь разбавляли добавлением ДХМ (100 мл), 6 н. раствора NaOH (50 мл) и насыщенного раствора тартрата натрия-калия (50 мл), и перемешивали в течение 15 мин. Слои разделяли, и органический слой промывали водой (2×100 мл), насыщенным раствором соли (100 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученный сырой продукт очищали колоночной хроматографией на силикагеле (5% МеОН/ 2% ТЭА/ ДХМ), получая желаемый продукт в виде белого твердого вещества (538 мг, 68%). 1Н ЯМР (CDCl3) δ: 9,91 (т, 1Н), 8,90 (д, 1Н), 8,45 (д, 1Н), 7,37 (м, 3Н), 6,52 (д, 1Н), 4,00-3,40 (ушир. с, 4Н), 3,81 (с, 3Н), 3,65 (кв, 2Н), 2,79 (т, 2Н), 74 2,63 (м, 4Н), 2,14 (м, 4Н), 1,81 (м, 4Н). ЖХ/МС (ES): m/z 459 [M+1]+.
Пример 22
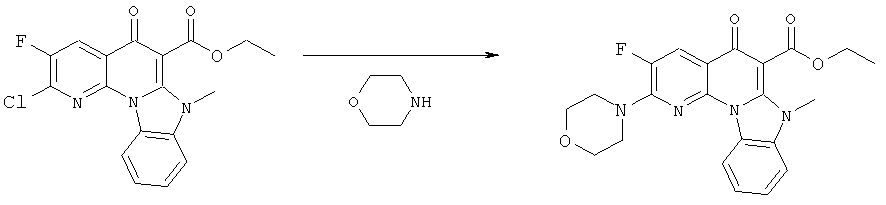
Хлорэфир (1,0 экв, 250 мг, 2,67 ммоль) вводили в реакцию с морфолином (0,29 мл) в NMP (1 мл) при нагревании в микроволновой печи при 100°С в течение 5 мин. Образовавшийся при охлаждении осадок отфильтровывали и промывали NMP. Выделенное вещество обрабатывали на ультразвуковой бане в горячем AcOEt и отфильтровывали после охлаждения. Продукт 2 был выделен в виде белого твердого вещества (173 мг, 62% выход). ЖХ/МС (ES): 95% чистота, m/z 425 [М+1]+.
Пример 23
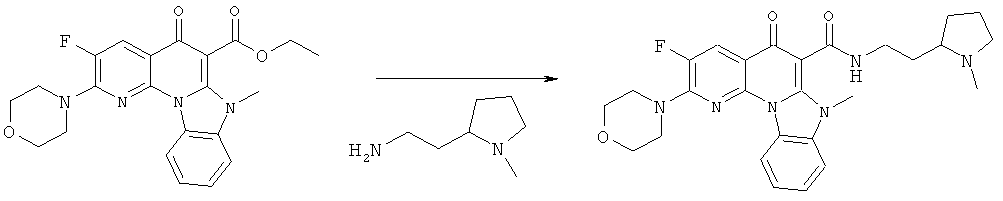
Сложный эфир (1,0 экв, 312 мг, 0,73 ммоль) и 2-(1-метилпирролидин-2-ил)этанамин (2,0 экв, 0,21 мл, 1,45 ммоль) смешивали с DBU (4,0 экв, 0,44 мл, 2,94 ммоль) в CHzClz (5 мл). Добавляли хлорид алюминия (2,0 экв, 196 мг, 1,47 ммоль) и перемешивали реакционную смесь при 45°С 5 часов. Растворитель удаляли в вакууме, и твердый остаток обрабатывали насыщенным раствором винной кислоты в течение 1 часа. После добавления воды, рН раствора доводили до 12-14 добавлением NaOH. Продукт экстрагировали СН2Сl2 (4х). Объединенные экстракты промывали водой и насыщенным раствором соли, сушили над Na2SO4 и удаляли растворитель в вакууме. Остаток растирали в смеси AcOEt и гексана, фильтровали и сушили, получая целевое соединение в виде не совсем белого твердого вещества (318 мг, 85% выход). ЖХ/МС (ES): 95% чистота, m/z 507 [М+1]+.
Представленные далее в Таблице 1 соединения получали тем же способом, используя соответствующие амины и хинолоновые этиловые эфиры.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пример 24
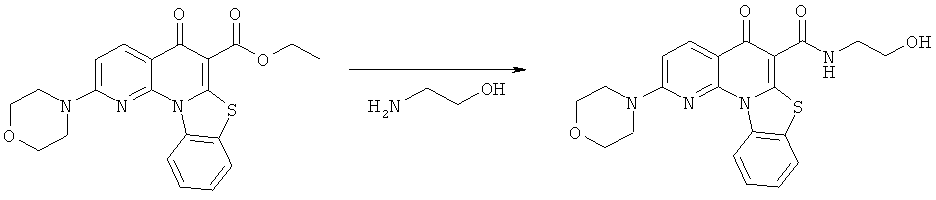
Раствор сложного эфира (6,53 г, 15,97 ммоль) в этаноламине (30 мл) перемешивали при 150°С в течение ночи. Реакционную смесь разбавляли добавлением Н2O (100 мл) и отфильтровывали выпавший осадок. Полученное твердое вещество промывали водой (2х) и ацетонитрилом (2х), получая желаемый продукт в виде белого твердого вещества (5,75 г, 85%). 1Н ЯМР (ДМСО-d6) δ: 10,57 (т, 1Н), 9,32 (д, 1Н), 8,36 (д, 1Н), 7,99 (дд, 1Н), 7,55 (м, 1Н), 7,48 (м, 1Н), 7,18 (д, 1Н), 4,85 (т, 1Н), 3,82 (т, 4Н), 3,75 (т, 4Н), 3,56 (кв, 2Н), 3,43 (кв, 2Н). ЖХ/МС (ES): m/z 425 [M+1]+.
Пример 25
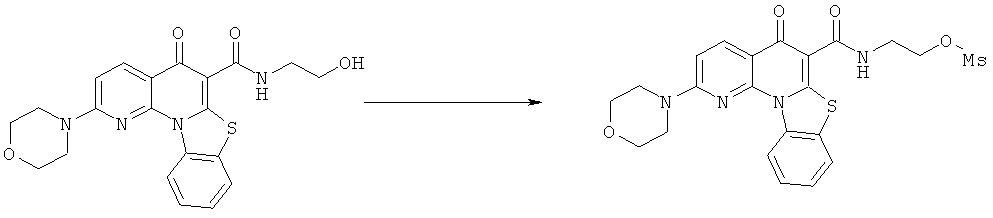
К раствору спирта (500 мг, 1,18 ммоль) и ТЭА (0,50 мл, 3,58 ммоль) в ДХМ (30 мл) добавляли MsCl (0,20 мл, 2,58 ммоль). Реакционную смесь перемешивали при комнатной температуре 1 ч, после чего разбавляли добавлением ДХМ (100 мл) и насыщенного раствора NH4Cl (50 мл). Слои разделяли, и органический слой промывали водой (100 мл), насыщенным раствором соли (50 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и остаток растирали в ацетонитриле, получая желаемый продукт в виде бледно-желтого твердого вещества (400 мг, 68%). Полученное вещество использовали далее без дополнительной очистки. ЖХ/МС (ES): m/z 503 [M+1]+
Пример 26
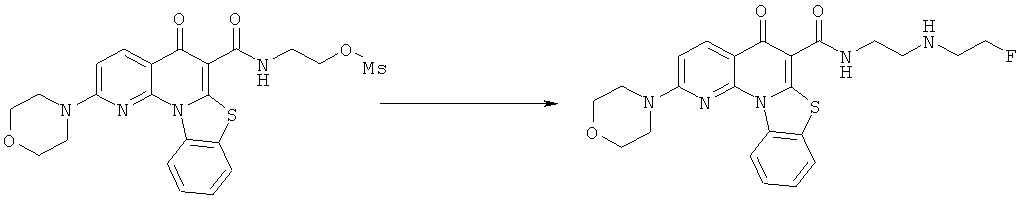
Раствор мезилата (90 мг, 0,18 ммоль), 2-фторэтанамина (40 мг, 0,40 ммоль) и ТЭА (0,05 мл) в NMP (1,5 мл) нагревали при 130°С в течение 20 мин в микроволновой печи. Реакционную смесь разбавляли добавлением ацетонитрила (5 мл), и выпавший осадок отфильтровывали. Выделенный сырой продукт очищали ТСХ на силикагеле (10% МеОН/ДХМ), получая желаемый продукт. ЖХ/МС (ES): m/z 470 [М+1]+.
Пример 27
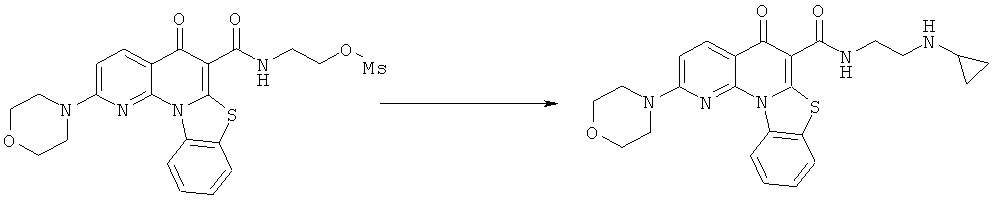
Раствор мезилата (50 мг, 0,10 ммоль), циклопропиламина (0,10 мл, 1,75 ммоль), НСl (1 н., 0,05 мл) и ТЭА (0,05 мл) в NMP (1,5 мл) нагревали при 130°С в течение 20 мин в микроволновой печи. Реакционную смесь подвергали очистке методом обращенно-фазной ВЭЖХ, получая желаемый продукт. 1H ЯМР (CDCl3) δ: 10,64 (т, 1Н), 9,45 (д, 1Н), 8,63 (д, 1Н), 7,77 (дд, 1Н), 7,50 (м, 1Н), 7,42 (м, 1Н), 6,92 (д, 1Н), 3,94 (т, 4Н), 3,82 (т, 4Н), 3,66 (кв, 2Н), 3,01 (т, 2Н), 2,00 (м, 1Н), 0,43 (м, 4Н). ЖХ/МС (ES): т/г 464 [М+1]+
Пример 28
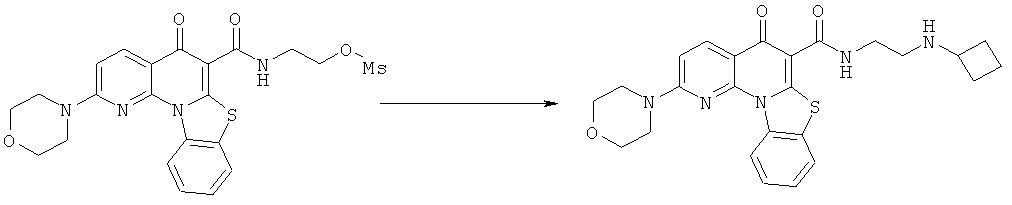
Раствор мезилата (100 мг, 0,20 ммоль), циклобутиламина (0,10 мл, 1,41 ммоль), НСl (1 н., 0,05 мл) и ТЭА (0,05 мл) в ацетонитриле (2,0 мл) нагревали при 120°С в течение 15 мин в микроволновой печи. Выпавший осадок отфильтровывали и очищали методом ТСХ на силикагеле (15% МеОН/ДХМ), получая желаемый продукт (65 мг, 98%). ЖХ/МС (ES): m/z 478 [M+1]+.
Пример 29
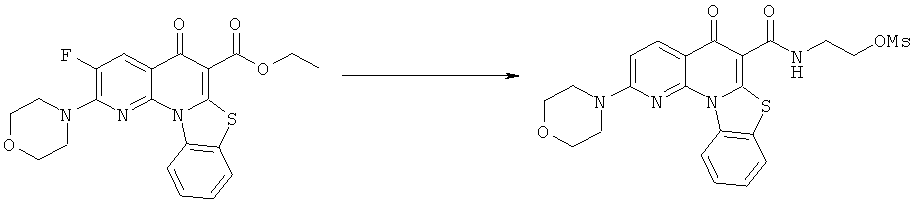
Сложный эфир (0,5 г, 1,16 ммоль) и этаноламин (0,7 мл, 11,63 ммоль) в 3 мл NMP нагревали при 160°С в течение 20 мин (микроволновая печь). Образовавшийся твердый осадок отфильтровывали, промывали несколько раз метанолом и сушили в вакууме. Спирт получали в виде не совсем белого твердого вещества и использовали на следующей стадии без дополнительной очистки. К полученному спирту (0,204 г, 0,46 ммоль) и триэтиламину в ДХМ (10 мл) добавляли MsCl при комнатной температуре. Смесь перемешивали в течение 30 мин при комнатной температуре. Добавляли дихлорметан (100 мл), и раствор промывали насыщенным раствором бикарбоната натрия (2×100 мл), насыщенным раствором соли (100 мл), сушили над сульфатом натрия и упаривали в вакууме, получая мезилат в виде желтого твердого вещества.
Пример 30

Раствор мезилата (50 мг) и циклопропиламина (0,2 мл) в ацетонитриле (1 мл) нагревали при 100°С в течение 20 мин (микроволновая печь). Растворитель удаляли в вакууме, и продукт растирали в этилацетате, получая белое твердое вещество. ЖХ/МС (ES): m/z 482 [M+1]+
Пример 31
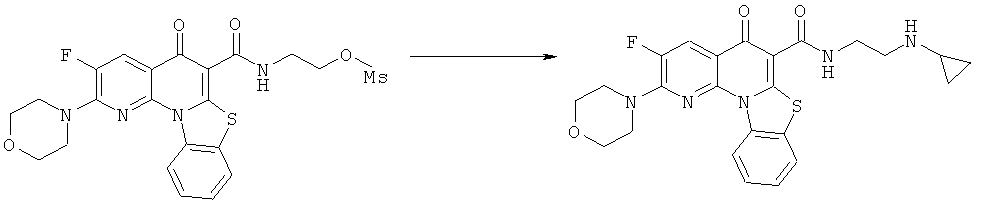
Раствор мезилата (54 мг), гидрохлорида циклобутиламина (0,2 г) и ТЭА (0,2 мл) в ацетонитриле (1 мл) нагревали при 90°С в течение 1 ч (микроволновая печь). Растворитель удаляли в вакууме, и остаток очищали методом ТСХ на силикагеле (10% МеОН/ДХМ), получая белое твердое вещество. ЖХ/МС (ES): m/z 482 [M+1]+
Представленные в Таблице 2 аналоги получали тем же способом, используя соответствующие амины и мезилат.
|
|
|
|
|
|
|
|
|
|
|
|
|
Пример 32
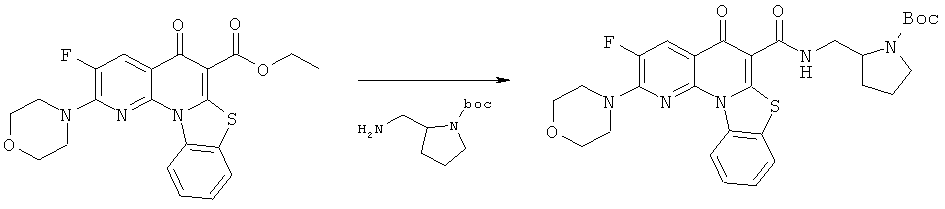
К раствору сложного эфира (1,00 г, 2,34 ммоль), (1-метилпирролидин-2-ил)метанамина (1,20 г, 5,99 ммоль) и DBU (1,80 мл, 12,06 ммоль) в ДХМ (40 мл) добавляли АlСl3 (650 мг, 4,87 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли добавлением ДХМ (150 мл) и 1 н. раствора NaOH (50 мл), и перемешивали в течение 15 мин. Слои разделяли, и органический слой промывали водой (2×100 мл), насыщенным раствором соли (100 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученное твердое вещество растирали в ацетонитриле, получая желаемый продукт в виде белого твердого вещества. ЖХ/МС (ES): m/z 582 [M+1]+.
Пример 33
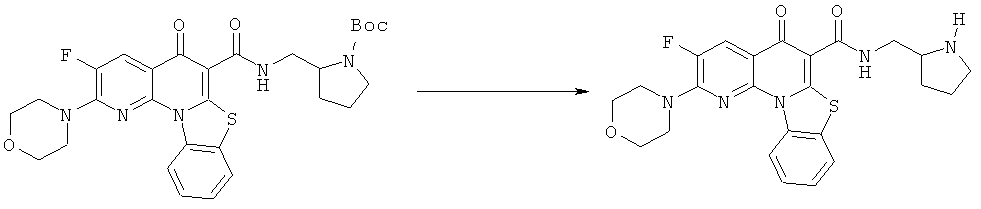
К раствору Вос-амина (321 мг, 0,55 ммоль) в ДХМ (3,0 мл) добавляли HCl (3,0 мл, 4 М раствор в диоксане) и перемешивали при комнатной температуре 1 ч. Реакционную смесь разбавляли добавлением ДХМ (150 мл) и 6 н. раствора NaOH (50 мл), и перемешивали в течение 10 мин. Слои разделяли, органический слой промывали насыщенным раствором соли (50 мл) и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, получая желаемый продукт в виде белого твердого вещества (250 мг, 94%). 1Н ЯМР (CDCl3) δ: 10,63 (т, 1Н), 9,44 (д, 1Н), 8,33 (д, 1Н), 7,77 (дд, 1Н), 7,53 (м, 1Н), 7,44 (м, 1Н), 3,91 (т, 4Н), 3,86 (т, 4Н), 3,61 (м, 1Н), 3,43 (м, 2Н), 3,03 (м, 1Н), 2,94 (м, 1Н), 1,97 (м, 1Н), 1,85 (м, 1Н), 1,75 (м, 1Н), 1,52 (м, 1Н). ЖХ/МС (ES): m/z 482 [М+1]+.
Пример 34
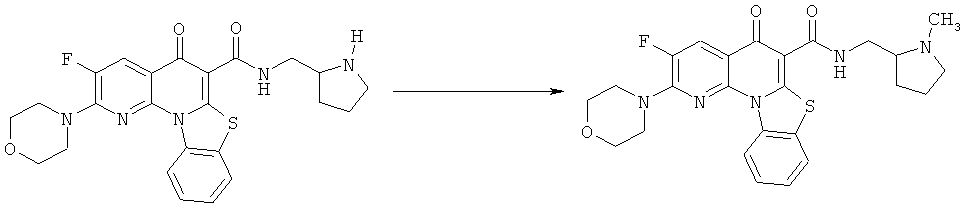
К раствору амина (40 мг, 0,08 ммоль) в ДХМ (5,0 мл) и ТЭА (0,05 мл) добавляли иодметан (0,05 мл) и перемешивали при комнатной температуре 10 мин. Растворитель удаляли при пониженном давлении, и полученное твердое вещество растирали в ацетонитриле. Сырой продукт очищали методом ТСХ на силикагеле (10% МеОН/ДХМ), получая желаемый продукт в виде белого твердого вещества. ЖХ/МС (ES): m/z 496 [M+1]+.
Представленные далее в Таблице 3 аналоги получали тем же способом, используя соответствующие аминохинолоны и алкилгалогениды, ацилгалогениды или ангидриды.
|
|
|
|
|
|
|
|
|
|
Пример 35
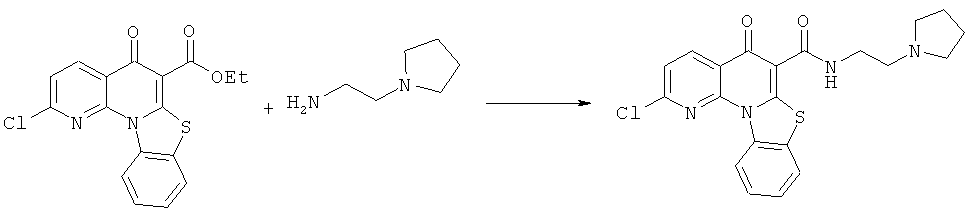
Целевой хлорамид синтезировали с выходом 72% по методике с применением хлорида алюминия, используя хлорэфир и амин. ЖХ/МС (ES): 95% чистота, m/z 427 [M+1]+.
Пример 36
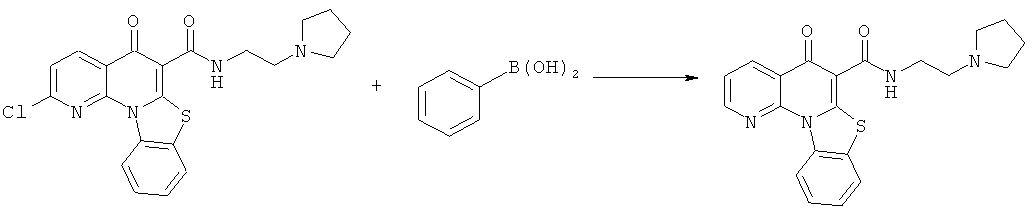
Хлорамид (1,0 экв, 100 мг, 0,23 ммоль) и бензолбороновую кислоту (2,0 экв, 57 мг, 0,47 ммоль) смешивали с ацетатом натрия (3,0 экв, 58 мг, 0,70 ммоль) в ДМФА (1 мл). После добавления PdCl2(dppf) (0,1 экв, 19 мг, 0,02 ммоль), смесь нагревали в микроволновой печи при 100°С в течение 5 мин. Раствор фильтровали через Celite™, и продукт высаживали добавлением этилацетата и гексана. После очистки препаративной ВЭЖХ, продукт выделяли в виде коричневого твердого вещества (51 мг, 47% выход). ЖХ/МС (ES): 95% чистота, m/z 469 [М+1]+.
Представленные далее в Таблице 4 аналоги получали тем же способом, используя соответствующий хлорамид и бороновую кислоту.
|
|
|
|
|
|
|
Пример 37
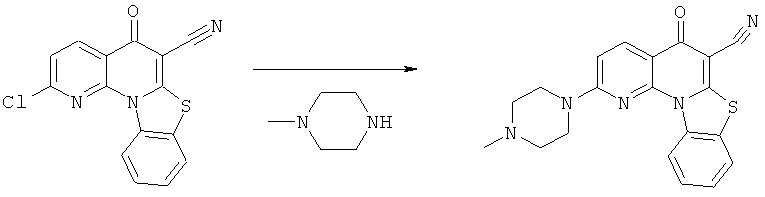
Раствор хлорида (40 мг, 0,13 ммоль) и 1-метилпиперазина (0,10 мл) в ацетонитриле (1,0 мл) нагревали при 120°С в течение 10 мин в микроволновой печи. Осадок отфильтровывали и промывали ацетонитрилом и затем EtOAc, получая желаемый продукт в виде твердого вещества. ЖХ/МС (ES): m/z 376 [M+1]+.
Представленные далее в Таблице 5 аналоги получали тем же способом, используя соответствующие хлорхинолоны и амины.
|
|
|
|
Пример 38
Синтез соединения А1
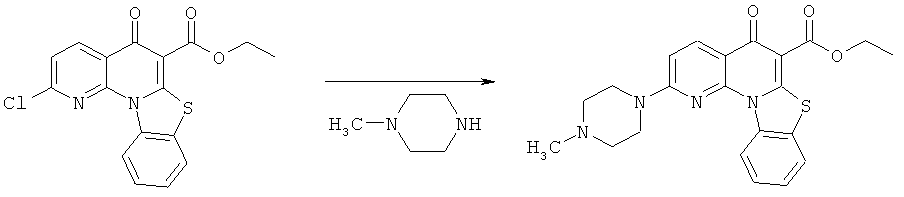
К суспензии хлорэфира (5,00 г, 13,94 ммоль) в CH3CN (50 мл) добавляли N-метилпиперазин (3,10 мл, 27,95 ммоль), и смесь кипятили в течение ночи. Реакционную смесь охлаждали до комнатной температуры и отфильтровывали осадок, получая желаемый продукт в виде коричневатого твердого вещества (4,7 г, 80%). 1Н ЯМР (CDCl3) δ: 9,47 (д, 1Н), 8,62 (д, 1Н), 7,74 (дд, 1Н), 7,51 (м, 1Н), 7,43 (м, 1Н), 6,89 (д, 1Н), 4,50 (кв, 2Н), 3,85 (т, 4Н), 2,62 (т, 4Н), 2,40 (с, 3Н), 1,49 (т, 3Н). ЖХ/МС (ES): m/z 423 [М+1]+.
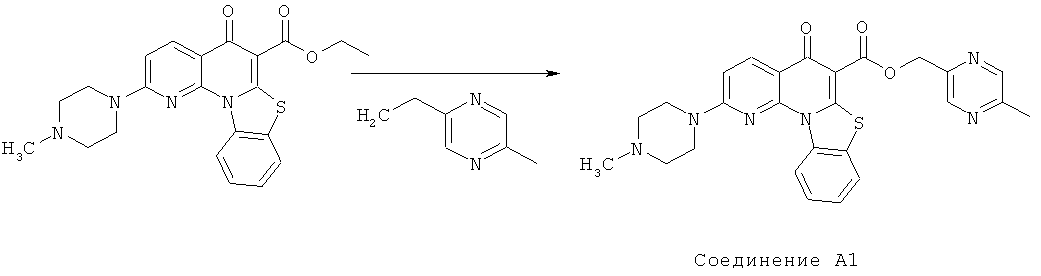
Соединение Al
К раствору сложного эфира (72 мг, 0,17 ммоль), (5-метилпиразин-2-ил)метанамина (0,10 мл, 0,81 ммоль) и DBU (0,20 мл, 1,34 ммоль) в ДХМ (10 мл) добавляли АlСl3 (80 мг, 0,60 ммоль). Реакционную смесь перемешивали при комнатной температуре 30 мин. Реакционную смесь разбавляли добавлением ДХМ (100 мл) и 3 н. раствора NaOH (25 мл), и перемешивали в течение 10 мин. Слои разделяли, и органический слой промывали водой (2×50 мл), насыщенным раствором соли (50 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученное твердое вещество растирали в ацетонитриле, получая желаемый продукт в виде белого твердого вещества (60 мг, 71%). ЖХ/МС (ES): m/z 500 [M+1]+.
Пример 39
Синтез соединения А2
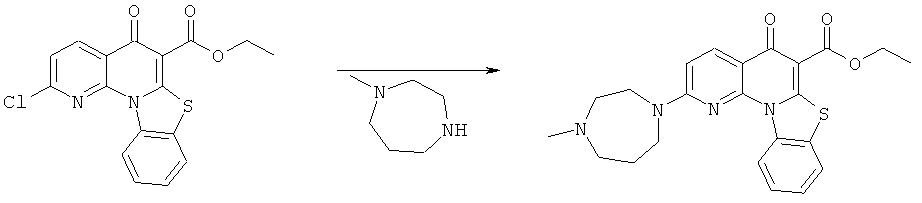
К суспензии хлорэфира (3,51 г, 9,7 ммоль) в CH3CN (50 мл) добавляли N-метилгомопиперазин (1,34 мл, 10 ммоль) и триэтиламин (1,49 мл, 10 ммоль). Смесь кипятили в течение ночи. Реакционную смесь охлаждали до комнатной температуры и отфильтровывали осадок, получая желаемый продукт в виде коричневатого твердого вещества (2,85 г). ЖХ/МС (ES): m/z 437 [М+1]+
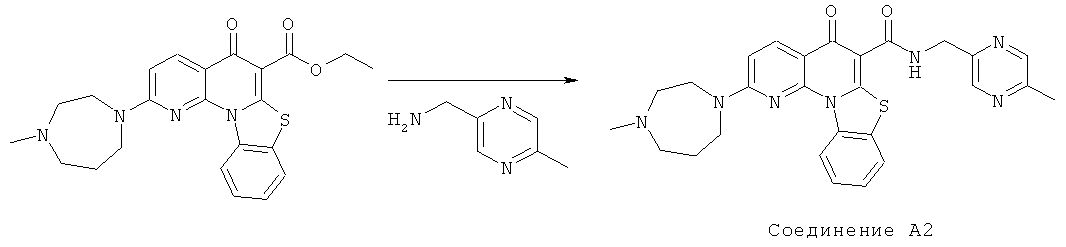
К раствору сложного эфира (2,85 мг, 6,53 ммоль), (5-метилпиразин-2-ил)метанамина (2,45 мл) и DBU (2,93 мл) в ДХМ (100 мл) добавляли АlСl3 (2,67 г). Реакционную смесь перемешивали при комнатной температуре 30 мин. Реакционную смесь разбавляли добавлением ДХМ (100 мл) и 4 н. раствора NaOH (100 мл), и перемешивали в течение 15 мин. Слои разделяли, и органический слой промывали водой (2х100 мл), насыщенным раствором соли (100 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученное твердое вещество растирали в ацетонитриле, получая желаемый продукт в виде белого твердого вещества (1,98 г). ЖХ/МС (ES): m/z 514 [M+1]+.
Пример 40
Крупномасштабный синтез соединения А2
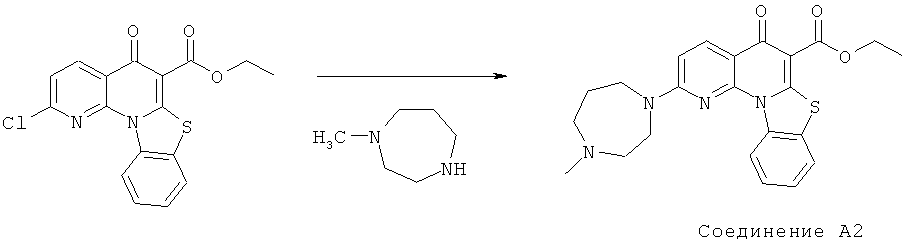 К суспензии хлорэфира (20,0 г, 55,90 ммоль) в ацетонитриле (300 мл) добавляли N-метилгомопиперазин (13,9 мл, 111,70 ммоль), и смесь кипятили в течение ночи. Реакционную смесь охлаждали до комнатной температуры и отфильтровывали осадок. Выделенное твердое вещество растворяли в СНСl3 (500 мл) и фильтровали через Celite™. Растворитель удаляли при пониженном давлении, получая желаемый продукт в виде твердого вещества (16,07 г, 66%). ЖХ/МС (ES): m/z 437 [M+1]+.
К суспензии хлорэфира (20,0 г, 55,90 ммоль) в ацетонитриле (300 мл) добавляли N-метилгомопиперазин (13,9 мл, 111,70 ммоль), и смесь кипятили в течение ночи. Реакционную смесь охлаждали до комнатной температуры и отфильтровывали осадок. Выделенное твердое вещество растворяли в СНСl3 (500 мл) и фильтровали через Celite™. Растворитель удаляли при пониженном давлении, получая желаемый продукт в виде твердого вещества (16,07 г, 66%). ЖХ/МС (ES): m/z 437 [M+1]+.
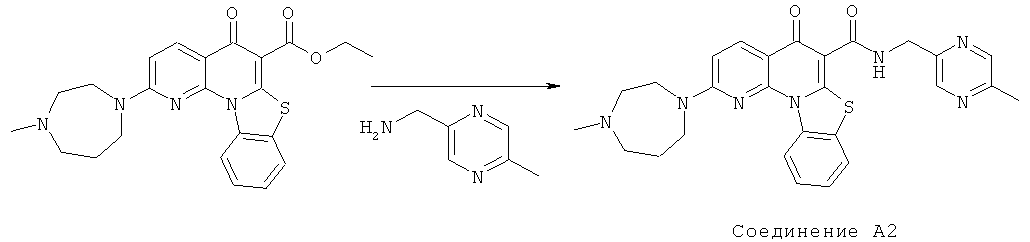
К раствору сложного эфира (2,24 г, 5,15 ммоль), 2-(аминометил)-5-метилпиразина (1,27 г, 10,32 ммоль) и DBU (2,3 мл, 15,38 ммоль) в ДХМ (50 мл) добавляли АlСl3 (2,05 г, 15,39 ммоль). Реакционную смесь перемешивали при комнатной температуре 30 мин. Реакционную смесь разбавляли добавлением ДХМ (200 мл) и 3 н. раствора NaOH (50 мл), и перемешивали в течение 10 мин. Слои разделяли, и органический слой промывали водой (2×100 мл), насыщенным раствором соли (100 мл), и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и полученное твердое вещество растирали в ацетонитриле, получая желаемый продукт (1,80 г) в виде бледно-желтого твердого вещества. 1Н ЯМР (CDCl3) δ: 11,28 (т, 1Н), 9,52 (д, 1Н), 8,57 (м, 2Н), 8,45 (д, 1Н), 7,74 (м, 1Н), 7,44 (м, 2Н), 6,78 (д, 1Н), 4,86 (д, 2Н), 3,90 (ушир, 4Н), 2,86 (м, 2Н), 2,65 (м, 2Н), 2,56 (с, 3Н), 2,42 (с, 3Н), 2,15 (м, 2Н). ЖХ/МС (ES): m/z 485 [M+1]+ ЖХ/МС (ES): m/z 514 [M+1]+
Пример 41 Синтез соединения A3
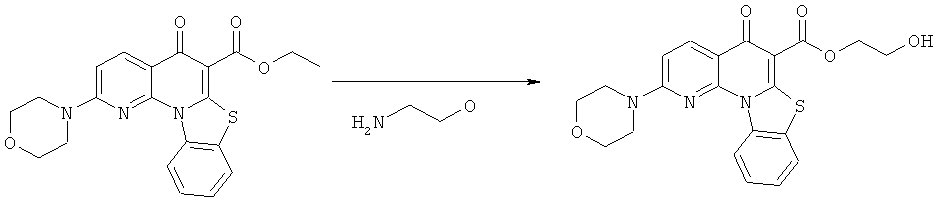
Раствор сложного эфира (6,53 г, 15,97 ммоль) в этаноламине (30 мл) перемешивали при 150°С в течение ночи. Реакционную смесь разбавляли добавлением Н2О (100 мл) и отфильтровывали осадок. Полученное твердое вещество промывали водой (2х) и ацетонитрилом (2х), получая желаемый продукт в виде белого твердого вещества (5,75 г, 85%). 1Н ЯМР (ДМСО-d6) δ: 10,57 (т, 1Н), 9,32 (д, 1Н), 8,36 (д, 1Н), 7,99 (дд, 1Н), 7,55 (м, 1Н), 7,48 (м, 1Н), 7,18 (д, 1Н), 4,85 (т, 1Н), 3,82 (т, 4Н), 3,75 (т, 4Н), 3,56 (кв, 2Н), 3,43 (кв, 2Н). ЖХ/МС (ES): m/z 425 [М+1]+
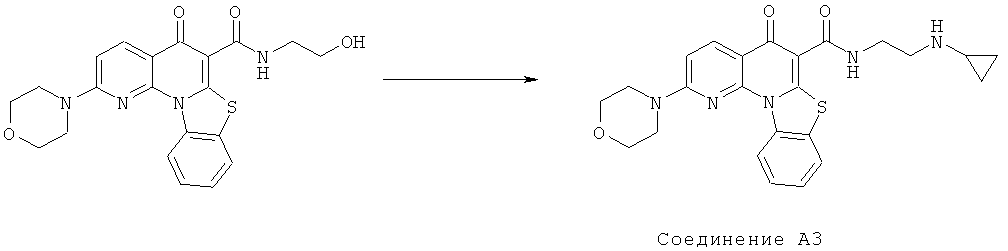
К раствору спирта (4,810 г, 11,343 ммоль) и ТЭА (4,75 мл, 34,076 ммоль) в ДХМ (125 мл) добавляли MsCl (1,70 мл, 21,964 ммоль). Реакционную смесь перемешивали при комнатной температуре 2 ч, разбавляли добавлением ДХМ (200 мл) и насыщенного раствора NH4Cl (50 мл). Слои разделяли, и органический слой сушили над Na2SO4. Растворитель удаляли при пониженном давлении, и сырой продукт растирали в ацетонитриле, получая мезилат. Раствор полученного мезилата, циклопропиламина (2,20 мл, 33,570 ммоль), НСl (1 н., 1,0 мл) и ТЭА (4,75 мл, 34,076 ммоль) в ацетонитриле (100 мл) кипятили в течение ночи. Осадок отфильтровывали и очищали колоночной хроматографией на силикагеле, получая целевой амин в виде белого твердого вещества (1,2 г). 1Н ЯМР (CDCl3) δ: 10,64 (т, 1Н), 9,45 (д, 1Н), 8,63 (д, 1Н), 7,77 (дд, 1Н), 7,50 (м, 1Н), 7,42 (м, 1Н), 6,92 (д, 1Н), 3,94 (т, 4Н), 3,82 (т, 4Н), 3,66 (кв, 2Н), 3,01 (т, 2Н), 2,00 (м, 1Н), 0,43 (м, 4Н). ЖХ/МС (ES): m/z 464 [M+1]+
Пример 42
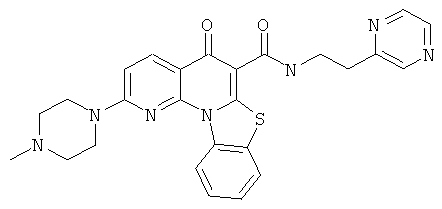
Соединение в Примере 42 получали тем же способом, как соединение А1, используя соответствующий амин и хинолоновый этиловый эфир. Мол.масса 499,6; ЖХ/МС (ES): m/z 500 [M+1]+
Пример 43
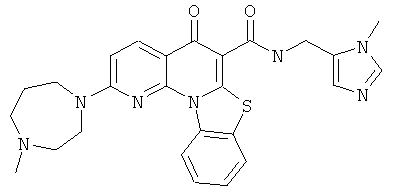
Соединение в Примере 43 получали тем же способом, как соединение А2, используя соответствующий амин и хинолоновый этиловый эфир.
Мол.масса 501,61; ЖХ/МС (ES): m/z 502 [М+1]+.
Представленные далее в Таблице 6 аналоги получали тем же способом, используя соответствующий амин и хинолоновый этиловый эфир.
|
|
|
|
Пример 44
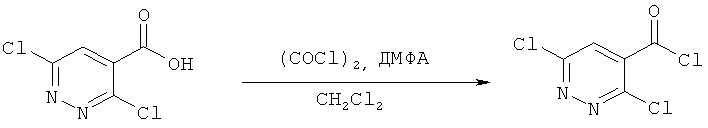
К раствору 3,6-дихлорпиридазин-4-карбоновой кислоты (2,5 г, 12,9 ммоль) в метиленхлориде (25 мл) добавляли оксалилхлорид (14,2 ммоль, 1,1 экв.), затем 2 капли ДМФА, и реакционную смесь оставляли перемешиваться на ночь при комнатной температуре. После этого растворитель удаляли в вакууме, получая неочищенный ацилхлорид в виде масла, который использовали без дополнительной очистки (выход количественный).
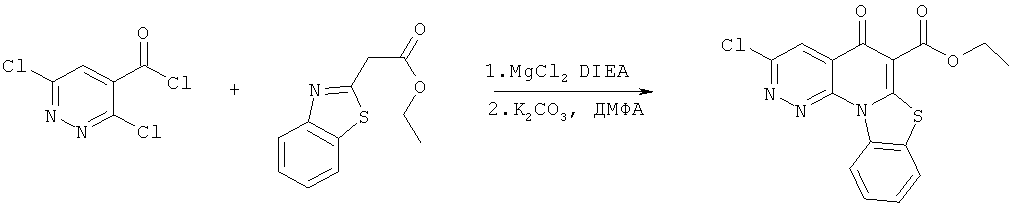
К раствору бензотиазольного эфира (2,53 г, 11,45 ммоль) в ацетонитриле (25 мл) при 0°С добавляли хлорид магния (1,63 г, 1,5 экв.), и смесь перемешивали в течение 5 мин. В смесь через капельную воронку добавляли пиридазин-4-карбонилхлорид (2,36 г, 11,45 ммоль), растворенный в ТГФ (5,0 мл), и смесь перемешивали еще 5 мин. Медленно добавляли триэтиламин (3,75 мл, 2,5 экв.), и смесь оставляли нагреваться до комнатной температуры в течение 1 ч. Растворитель удаляли в вакууме и заменяли его ДМФА (75 мл), добавляли карбонат калия (3,16 г, 22,9 ммоль) и нагревали смесь до 100°С в течение 2 ч. После охлаждения, смесь фильтровали, и выделенный твердый осадок перемешивали в воде (20 мл), после чего отфильтровывали, промывали водой (20 мл), метанолом (20 мл) и этилацетатом (20 мл), и сушили, получая пиридазинбензотиазольный эфир в виде коричневатого твердого вещества (2,9 г, 8,08 ммоль, 70%).
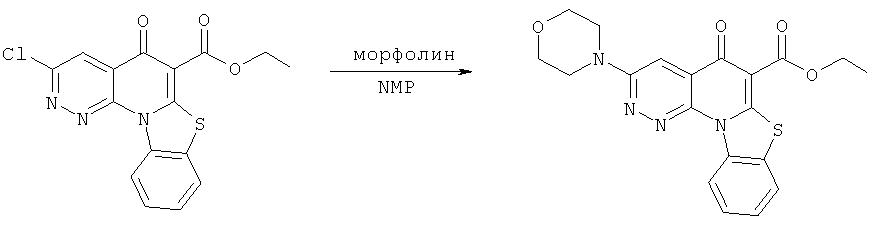
К суспензии пиридазинбензотиазольного эфира (500 мг) в сухом NMP (5 мл) добавляли морфолин (500 мг), и смесь кипятили 4 ч. Затем смесь охлаждали до комнатной температуры и фильтровали, промывали ацетонитрилом, получая морфолиновое соединение в виде коричневатого твердого вещества (505 мг).
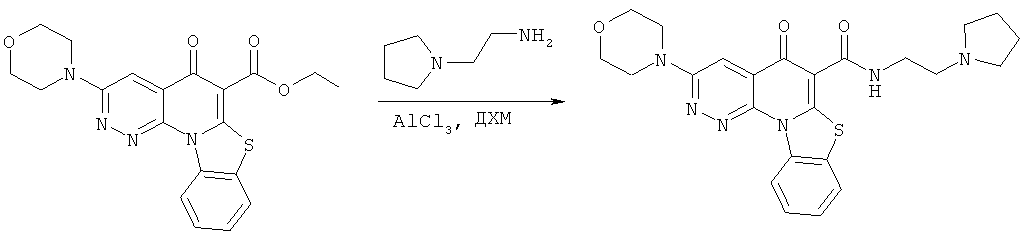
К смеси мофолинопиридазинбензотиазольного эфира (100 мг) и 1 -(2-аминоэтил)-пирролидина (100 мг) в ДХМ (2 мл) добавляли хлорид алюминия (100 мг), и смесь оставляли перемешиваться на ночь при комнатной температуре. Растворитель удаляли в вакууме, добавляли насыщенный раствор L-винной кислоты (5 мл) и перемешивали 30 мин. Раствор промывали ДХМ (5 мл) и подщелачивали добавлением 1 н. раствора NaOH. Твердый осадок отфильтровывали и растворяли в ДХМ (20 мл) и метаноле (2 мл), и полученный раствор пропускали через слой оксида алюминия. Растворитель удаляли в вакууме, и твердый остаток растирали в метаноле, получая конечное соединение в виде желтого твердого вещества.
Представленные далее в Таблице 7 аналоги получали тем же способом, используя соответствующий амин и эфир пиридазинбензотиазола.
|
|
|
|
|
Пример 45 Модулирование клеточной пролиферации
Далее описан репрезентативный протокол теста на клеточную пролиферацию с использованием окраски Аламаром голубым (Alamar Blue) (хранение при 4°С, использовать 20 мкл на лунку). Схема постановки опыта в 96-луночном планшете и внесения соединения
а. Разъединить и обработать трипсином клетки
b. Подсчитать клетки в гемоцитометре
с. Рассеять 4000-5000 клеток на лунку в 100 мкл среды в 96 луночный планшет в соотвествии со следующим планом. Добавить только клеточную культуральную среду в лунки В 10-В12. В лунках В1-В9 рассевают клетки, но не добавляют соединение.
|
d. Добавить 100 мкл 2х разведения препарата в каждую лунку в концентрации, указанной выше на плане. Одновременно добавить 100 мкл среды в контрольные лунки (лунки В 10-В12). Общий объем 200 мкл/лунку.
е. Инкубировать четыре (4) дня при 37°С, 5% CO2 в инкубаторе во влажной среде.
f. Добавить 20 мкл Аламара голубого в каждую лунку.
g. Инкубировать четыре (4) часа при 37°С, 5% СO2 в инкубаторе во влажной среде.
h. Замерить флюоресценцию на планшет-ридере при длине волны возбуждения 544 нм и длине волны испускания 590 нм.
В описанных тестах клетки инкубируют с тестируемым соединением примерно 4 дня, затем к клеткам добавляют краситель и примерно через 4 часа измеряют флюоресценцию не-восстановленного красителя. В тестах могут быть использованы различные типы клеток (например, НСТ-116 клетки человеческой колоректальной карциномы, РС-3 клетки человеческого рака простаты и MiaPaca клетки человеческой карциномы поджелудочной железы). Антипролиферативное действие репрезентативных соединений представлено далее в тексте.
Пример 46 Измерение уровня мРНК в тестах на линиях клеток
Для определения изменения количества копий исследуемого гена с-тус и эндогенного контрольного гена GAPDH в одной и той же пробирке может быть использован метод количественной ПЦР в реальном времени (QPCR). Обычно, клетки рассаживают (15000 кл/лунка) в плоскодонный 96-луночный планшет (Coming, NY) и инкубируют ночь в нормальных условиях. На следующий день меняют клеточную среду на содержащую противоопухолевые препараты в различных концентрациях и инкубируют 4 часа во влажной атмосфере при 5% CU2 при 37°С. Тотальную РНК выделяли, используя RNeasy 96 Kit (QIAGEN, CA). Концентрацию тотальной РНК определяли с помощью реагента для количественного определения РНК RiboGreen RNA Quantitation Reagent (Molecular Probes, OR).
Реакцию обратной транскрипции (RT) можно проводить в 25 мкл реакционной смеси, содержащей 50 нг тотальной РНК из каждой лунки, 1×TaqMan RT буфер, 2,5 мкМ рандомизированных гексамеров, 5,5 мМ MgClz, 0,5 мМ каждого дезоксинуклеозидтрифосфата (dNTP), 30 ед. MultiScribe обратной транскриптазы и 10 ед. ингибитора РНКазы. RT реакционную смесь инкубировали 10 мин при 25°С, проводили обратную транскрипцию 30 мин при 48°С, инактивировали 5 мин при 95°С, затем помещали на 4°С. Все RT реагенты могут быть приобретены у Applied Biosystems, CA.
Количественную ПЦР (QPCR) реакцию в реальном времени можно проводить в 50 мкл реакционной смеси, содержащей 5 мкл кДНК, 1х универсальную смесь для ПЦР (1х Universal PCR Master Mix), 1х раствор праймеров и зондов, специфичных к с-тус, и 0,8× раствор GADPH-специфичных праймеров и зондов. Т.к. линия клеток Hela содержит относительно большое количество копий гена GADPH, то концентрация GADPH-специфичных праймеров и зондов может быть подобрана так, чтобы получить точные значения порогового цикла (СT) для обоих генов в одной пробирке. Значения порогового цикла показывают количество циклов ПЦР, при котором количество амплифицируемого продукта достигает постоянной предельной величины. Таким образом, амплификация гена GADPH останавливается раньше, чем она может вызвать недостаток общих для амплификации с геном с-myс реагентов. ΔRn - это нормализованное значение репортерного сигнала, из которого вычтено фоновое значение сигнала. Значение ΔRn в ходе ПЦР увеличивается по мере роста числа копий ампликона до выхода реакции на плато.
С-myс специфичные MGB зонды содержат флюоресцентную метку 6FAM™, а GAPDH специфичные MGB зонды содержат флюоресцентную метку VIC™. Для активации AmpErase UNG фермента проводят преинкубацию в течение 2 мин. при 50°С, затем 10 мин. при 95°С для активации AmpliTaq ДНК полимеразы. Амплификация ДНК составляет 40 циклов, по 15 сек при 95°С и 1 мин. при 60°С каждый. Амплификация, обнаружение и количественное определение кДНК человеческих с-myс и GAPDH генов осуществляется в реальном времени с применением ABI Prism 7000 Sequence Detection system (Applied Biosystems, CA), настроенным на определение обоих репортеров, меченных 6-FAM и VIC, одновременно.
Данные могут быть проанализированы с применением ABI PRISM Sequence Detection System и Microsoft Excel. Относительный количественный анализ сделан с одновременным применением метода стандартной калибровочной кривой и сравнения СТ, оба метода дали эквивалентные результаты. Известно, что цикл, при котором график амплификации достигает значения СТ, точно отражает относительный уровень мРНК. (см., Heid, et al., Genome Res. (1996) 6:986-994; Gibson, et al., Genome Res. (1996) 6:995-1001). Реакции QPCR ставят в трех повторах для каждого образца кДНК и вычисляют среднее из трех значений СТ. Все реагенты, включая специфичные праймеры и зонды, могут быть приобретены у Applied Biosystems, CA.
Пример 47 In vitro исследования.
Для изучения in vitro соединений, представленных в данном изобретении, могут быть использованы различные методы, включая (но не ограничиваясь только ими): i) стоп-тесты, и) квадруплекс/дуплекс конкурентный анализ, iii) квадромный футпринтинг, и iv) прямой анализ в отсутствии молекулы конкурента.
Стоп-тесты
Стоп-тесты являются высокопроизводительными, первичными этапами скрининга для выявления препаратов, которые связывают и стабилизируют исследуемый G-квадруплекс. Как правило, синтезируют олигонуклеотид матричной ДНК, который содержит нуклеотидную последовательность «целевого» квадруплекса, против которого осуществляется скрининг препаратов. Затем ДНК праймер с флюоресцентной меткой отжигают к 3' концу матричной ДНК. Вводят ДНК полимеразу, такую как Taq полимераза, которая синтезирует комплементарную цепь ДНК, удлиняя флюоресцентно меченный праймер. При беспрепятственном продвижении Taq полимеразы происходит синтез полноразмерной копии матрицы. Добавление тестируемого препарата, который просто связывает дуплексную ДНК, но не связывает селективно участок квадруплекса, приводит к уменьшению синтеза полноразмерного продукта и увеличению количества примесей разноразмерных ДНК копий. Если, однако, тестируемый препарат селективно связывает и стабилизирует квадруплекс, процесс полимеризации останавливается только на квадруплексе, и синтезируется характеристичный "Стоп-продукт".
Соединения сначала тестируют в единственной концентрации, и "хиты" снова тестируют в диапазоне доз для определения значения IС50 (т.е. концентрация препарата, необходимая для синтеза стоп-продукта и полноразмерного продукта в соотношении 1:1). Количество этих продуктов определяют методом капиллярного электрофореза.
Квадруплекс/дуплекс конкурентный анализ.
Избирательность взаимодействия соединений с целевым участком квадруплекса относительно дуплексной ДНК может быть измерена с помощью конкурентного анализа (т.е., "селективный скрининг"). Этот селективный скрининг использует стоп-тест как систему репортер для измерения относительной способности последовательности ДНК, добавленной извне, конкурировать с целевой структурой квадруплекса, формируемой на матричной ДНК, за связывание с препаратом. Например, конкурентами являются с-mус квадруплекс, который идентичен квадруплексу матричной ДНК, или плазмидная ДНК, имитирующая комплекс геномной дуплексной ДНК. Степень "впитывания" препарата в растворе каждым конкурентом измеряется количественным уменьшением синтеза стоп-продукта. Таким образом, определяют относительное сродство связывания препарата к обеим мишеням, целевому квадруплексу и дуплексной ДНК.
Квадромный футпринтинг. Соединения также могут быть оценены по их способности связываться с другими, биологически релевантными, нативными квадруплексами, включая контрольные квадруплексные элементы, которые регулируют ряд различных онкогенов. Результаты используются для создания квадромного футпринтинга (ДНК-футпринтинга квадруплексов).
Тест прямого взаимодействия.
Соединения могут быть оценены по их способности взаимодействовать непосредственно с нуклеиновыми кислотами, способными формировать квадруплексы, в которых нуклеиновая кислота не является теломерной нуклеиновой кислотой. Тест может быть проведен в одной или различных пробирках. Например, соединение можно обработать каждой из нуклеиновых кислот в одной пробирке. В другом варианте, соединение можно обработать каждой из тестируемых нуклеиновых кислот в различных пробирках. Теломерная нуклеиновая кислота, в контексте настоящей заявки, представляет собой участок нуклеиновой кислоты с высоким содержанием повторяющихся последовательностей на конце хромосомы. В контексте настоящей заявки, прямое взаимодействие измеряется в отсутствии конкурирующей нуклеиновой кислоты.
Взаимодействие между соединением и нуклеиновой кислотой можно определить, например, измерением значений IС50, которые характеризуют связывание и/или стабилизацию квадруплекса. Селективность взаимодействий можно определить, например, сравнением измеренных величин IС50. Например, самое низкое значение IC50 может использоваться как показатель сильного взаимодействия между соединением и нуклеиновой кислотой, в то время как самые высокие значения IС50 указывают на слабое взаимодействие; таким образом, показывая селективность взаимодействия. Продукты реакции могут быть охарактеризованы методом капиллярного электрофореза.
Пример 48
Фармацевтические свойства описанных соединений
Для определения фармацевтических свойств соединений, раскрытых в данном тексте, использовали методику кассетного дозирования. В этой методике соединения выбирают для каждой кассеты (т.е. коктейль) по принципу того, что масс-спектральные сигналы каждого соединения не будут создавать помехи сигналам других соединений в масс-спектрометрическом анализе (например, не будут перекрываться). Концентрация каждого соединения в дозирующей кассете часто составляет около 20 мг/мл, чтобы достичь оральной дозы 25 мг/кг массы ICR мыши. Аспекты методики кассетного дозирования описаны далее в тексте.
Разработка методики тандемной масс-спектрометрии
Приготовить 0,5 мл дозировочного раствора (в PBS или разбавителе готовой формы) 12 соединений с концентрацией 20 мг/мл. Развести дозировочный раствор в 20 раз переносом 10 мкл каждого исходного раствора в 190 мкл ацетонитрила, содержащего 0,1% муравьиной кислоты, для достижения конечной концентрации 1 мг/мл. Затем развести 1 мг/мл раствор в 1000 раз переносом 1 мкл стокового раствора в 999 мкл ацетонитрила, содержащего 0,1% муравьиной кислоты, для достижения конечной концентрации 1 мкг/мл. Для разработки методики масс-спектрометрии прямого ввода использовать 1 мкг/мл раствор соединений. Определить материнские/дочерние масс-спектры каждого соединения с использованием мониторинга множественных реакций (MRM). Сравнить материнские/дочерние масс-спектры каждого соединения, чтобы гарантировать отсутствие перекрестной интерференции в процессе ЖХ-МС/МС измерений. Основываясь на MRM масс-спектрах определить состав всех кассет.
Подготовка дозирующих кассет
Смешать 250 мкл четырех приготовленных дозировочных растворов и перорального РК (фармакокинетического) внутреннего стандарта (20 мкг/мл каждый) в соответствии с рисунком (схемой) кассеты для достижения конечной концентрации 4 мг/мл. Тщательно встряхивать кассеты на вортексе и обрабатывать ультразвуком до получения прозрачного раствора или гомогенной суспензии. Использовать кассетные растворы для введения животным перорально в дозировке 25 мг/кг.
Животные и дозирование.
Все эксперименты in vivo ставятся в соответствии с протоколами, утвержденными Комиссией по контролю за содержанием и использованием животных. Самки ICR мышей (IcrTac:ICR), в возрасте 8-10 недель получены от Taconic (Hudson, New York). Мышей содержали по циклу 12 час/12 час день/ночь без ограничения доступа к воде и еде. После периода акклиматизации минимум 2 недели, мыши случайным образом были распределены в группы (рандомизированы), с минимальным размером группы в четыре мыши. Вес животных, использованных для фармакокинетических исследований, составлял 25-35 г. Кассетные дозы 25 мг/кг (4 мг/мл), описанные в Примере 1, перорально вводили животным, голодавшим в течение ночи.
Подготовка образцов крови. После введения соединений, собирали серию образцов крови посредством заглазной пункции капилляром в различные временные промежутки (15, 30 минут и 1, 2, 4, 6 и 8 часов). Образцы переносили в гепаринизированные 0,5 мл микроцентрифужные пробирки и помещали на лед. Плазму отделяли центрифугированием, и образцы хранили при -80°С до теста.
Приготовление стандартных рабочих растворов
Развести растворы кассетных доз (4 мг/мл) в четыре раза переносом 25 мкл стокового раствора в 75 мкл 50%-ного ацетонитрила, содержащего 0,1% муравьиной кислоты, для достижения концентрации 1 мг/мл. Затем развести полученный раствор серией разведении для получения 0,01, 0,1, 1 и 5 мкг/мл стандартных рабочих растворов.
Приготовление гасящего раствора
Приготовить 500 мл 0,5 мг/мл раствора внутреннего биоаналитического стандарта, используя 100% ацетонитрил с 0,1% муравьиной кислоты. Хранить гасящий раствор в плотно закрытых колбах при 4°С.
Подготовка калибровочного стандарта для анализов.
Перенести 15 мкл чистой плазмы мыши в 96-луночный планшет и преципитировать плазменный белок добавлением 120 мкл гасящего раствора ко всем аликвотам плазмы. Накрыть планшет соответствующей пленкой и хорошо перемешать 30-60 сек. на вертикальном мульти-пробирочном шейкере.
Добавить 15 мкл стандартного рабочего раствора соответствующей кассеты к погашенной плазме и перемешать планшет на вортексе еще 30-60 сек. Затем отцентрифугировать планшет при 4000 оборотах 10 мин при 4°С. Аккуратно, не трогая осадок белков плазмы, перенести 120 мкл супернатанта в новый 96-луночный планшет и высушить образец под азотом, используя планшетный испаритель Turbo Vap® (Caliper Life Sciences; Hopkinton, Massachusettes). Растворить сухие остатки в 120 мкл 20%-ного ацетонитрила, содержащего 0,1% муравьиной кислоты. Перемешать планшет на вортексе 30-60 сек и провести ЖХ-МС/МС анализ (описано в тексте ниже).
Приготовление исследуемых образцов для анализа
Перенести 15 мкл чистой плазмы мыши в 96-луночный планшет и преципитировать плазменный белок добавлением 120 мкл гасящего раствора ко всем аликвотам плазмы. Накрыть планшет соответствующей пленкой и хорошо перемешать 30-60 сек. на вертикальном мульти-пробирочном шейкере.
Добавить 15 мкл стандартного рабочего раствора соответствующей кассеты к погашенной плазме и перемещать планшет на вортексе еще 30-60 сек. Добавить 15 мкл 50%-ного ацетонитрила, содержащего 0,1% муравьиной кислоты, к погашенной плазме для приведения в соответствие с матрицей и перемешать планшет на вортексе еще 30-60 сек. Затем отцентрифугировать планшет при 4000 оборотах в течение 10 мин при 4°С. Аккуратно, не трогая осадок белков плазмы, перенести 120 мкл супернатанта в новый 96-луночный планшет и высушить образцы под азотом, используя планшетный испаритель TurboVap® (Caliper Life Sciences; Hopkinton, Massachusettes). Растворить сухие остатки в 120 мкл 20%-ного ацетонитрила, содержащего 0,1% муравьиной кислоты. Перемешать планшет на вортексе 30-60 сек и провести ЖХ-МС/МС анализ (описано в тексте ниже).
ЖХ-МС/МС Анализ
Анализ реакционных смесей на количество каждого химического компонента в кассетах в исходной форме при следующих условиях ВЭЖХ:
Колонка: PHENOMENEX® Synergi™ Polar RP, 20,0×2,0 мм, 3 мкМ
Защитная колонка: PHENOMENEX® C18, 4,0 x 2,0 мм
Скорость потока: 0,25 мл/мин
Температура колонки: 40°С
Температура образцов: 10°С
Вводимый объем: 10 мкл
Время анализа: 3,5 мин
Градиент системы растворителей:
Растворитель А: 0,1% Муравьиной кислоты в воде
Растворитель В: 0,1% Муравьиной кислоты в ацетонитриле
Профиль градиента растворителей:
|
Параметры масс-спектрометрии:
Режим: ESI (+)
Капилляр: 3,5 кВ
Конус: 40 В
Экстрактор:3 В
RF линза: 0,2 В
Температура источника: 120°С
Температура десольвации: 300°С
Газ-десольвациия: 450 л/час
Газ_конус: 72 л/час
LM Разрешение: 15,0
ИМ Разрешение: 15,0
Энергия Ионов: 0,5
Умножитель: 650
Фармакокинетический анализ:
Применить некомпартментный фармакокинетический анализ для перорального способа введения. Зарегистрировать наблюдаемое Смакc и Тмакс. Для подсчета AUC(0-8) использовать линейное правило трапеций согласно Gibaldi, M. and Perrier, D. Pharmacokinetics, Second Edition, Marcel Dekker, Inc., New York, 1982.
Репрезентативные данные по кассетному дозированию и биодоступности приведены в Таблице 8, наряду с данными по ингибированию клеточной пролиферации (из теста с Аламаром голубым (АВ) (например, Пример 45 в данном тексте)) и ингибированию рРНК (из теста количественной ПЦР (QPCR) (например, Пример 46 в данном тексте)).
|
|
|
|
|
|
|
|
Пример 49 Оценка фармакокинетических свойств.
Фармакокинетические свойства лекарственных средств изучают на ICR мышах после внутривенного (в/в) болюсного или перорального (РО) введения лекарственного средства в концентрации 5 мг/кг и 25 мг/кг, соответственно. В определенное время собирают образцы крови и отделяют плазму. Плазму отделяют от образцов крови, собранных на 5, 15 и 30 минутах и на 1, 2, 4, 8 и 24 часах после введения.
Уровень концентрации лекарственного средства количественно определяют описанным ниже методом ЖХ/МС/МС. Для внутривенного способа введения применяют некомпартментный фармакокинетический анализ. Для подсчета AUC(0-24) или AUC(0-8) используют линейное правило трапеций. Конечное время полувыведения (terminal 1:1/2) и Со подсчитывают, используя данные для последних трех и первых трех точек, соответственно.
Биоанализ осуществляют с помощью Quattro Micro ЖХ/МС/МС прибора в режиме обнаружения MRM, с внутренним стандартом (IS). Вкратце, образцы плазмы объемом 15 мкл подготавливают к анализу, преципитируя белок добавлением 120 мкл ацетонитрила. Супернатант переносят в 96-луночный планшет и подвергают ЖХ/МС/МС анализу с использованием ВЭЖХ колонки PHENOMENEX® Polar-RP. Подвижные фазы представляют собой 10 мМ раствор NH4HCO3 в воде (Раствор А) и 10 мМ раствор NH4HCO3 в метаноле (Раствор В). Колонка первоначально уравновешивается 25% раствором В и затем 100% раствором В в течение 5 минут. Динамический диапазон метода составляет от 1 до 10000 нг/мл. Количественное определение содержания аналитов проводится в пакетном режиме с двумя градуировочными кривыми, предваряющими и заключающими прогон образцов согласно списку биоаналитических проб.
Пример 50
Тест ингибирования цитохрома Р450 (CYP450)
Соединения по настоящему изобретению можно оценить на предмет потенциальной ингибирующей активности в отношении изоферментов цитохрома Р450. В целом, шесть пробирок для реакций с 100 мкл раствора, содержащего 50 мМ фосфат калия, рН 7,4, 2,6 мМ NADP+, 6,6 мМ глюкозо-6-фосфат, 0,8 Ед/мл глюкозо-6-фосфат дегидрогеназы, и 1:6 серийные разведения тестируемых соединений, готовятся параллельно с шестью пробирками 1:6 серийных разведении подходящего ингибитора для позитивного контроля. Реакции инициируют добавлением 100 мкл подогретого раствора фермент/субстрат в пробирки для реакций. Контроль точки нулевого времени готовят добавлением 50 мкл ацетонитрила к 100 мкл раствора кофактора для инактивации ферментов, затем добавляют 100 мкл раствора фермент/субстрат. Также можно приготовить контрольную реакцию, не содержащую ингибитора. После соответствующей инкубации при 37°С, реакции останавливают добавлением 50 мкл ацетонитрила. Реакционные смеси анализируют на метаболитные формы пробы субстрата с помощью ЖХ/МС/МС.
Пример 51
Оценка эффективности соединений в подавлении опухоли.
Репрезентативный эксперимент для оценки эффективности соединений по настоящему изобретению на моделях человеческой карциномы в голых мышах, может быть спланирован следующим образом. Используются самки и самцы животных (мыши, Sim) (NCR, nu/nu) в возрасте от пяти до шести недель и весом более 20 грамм. Животные разводят преднамеренно и не подвергают какому-либо воздействию (экспериментально чисты) до начала исследования. Опухоли распространяют инъекцией клеток или пассажем фрагментов опухолей. Используемые линии клеток включают (но не ограничены только ими) alia Раса-2, НРАС, Hs700T, Panc 10.05, Pane 02.13, PL45, SW 190, Hs 766T, CFPAC-1 и PANC-1.
Имплантация клеток. От одного до десяти миллионов клеток, суспендированных в 0,1 мл культуральной среды с матригелем (Matrigel, Collaborative Biomedical Products, Inc, Bedford, MA) или без него, прививают подкожно в правый бок шестидесяти животным. Делают только одну инъекцию на животное. Через 7-14 дней после инъекции опухоль развивается до размеров, пригодных для исследования, приблизительно 1,0 см3. Рассматривают небольшую группу (<10/60) животных. Доноры и опухоли выращивают в течение 10-28 дней и до достижения размера 1,5 см3 для использования в серии трансплантаций.
Трансплантация фрагментов. Животные-доноры умерщвляют, опухоль вырезают хирургическим путем и режут на кусочки размером 2 мм в асептических условиях. Животные перед трансплантацией слегка анестезируют изофлураном. Область трансплантации очищается 70%-ным спиртом и бетадином. Затем подкожно имплантируется одиночный фрагмент с использованием троакара.
Изучение эффективности. Группы по 50-60 животных, несущих опухоль, разделяют случайным образом (рандомизируют). Например, в репрезентативном исследовании, животные могут быть разделены случайным образом на 3-8 групп, по 7 животных в каждой группе, как описано в Таблице 9.
|
* Среда/растворитель
** Для положительного контроля используют коммерчески доступные противораковые соединения, включая (но, не ограничиваясь только ими) таксол, СРТ11 и гемцитабин.
Методика введения дозы. Соединения вводят ежедневно, через день, один раз в три дня или один раз в неделю внутрибрюшинно (в/б), внутривенно (в/в) (латеральная хвостовая вена) или перорально. Животным вводят дозы в систематическом порядке, который распределяет время введения доз равномерно по всем группам. Для болюсного внутрибрюшинного и перорального введения, животные удерживаются вручную. Для в/в болюсного введения или кратковременных в/в инфузий (одна минута), животные удерживаются механически, но не усыпляются. Для каждой дозы каждого животного используют одноразовые стерильные шприцы. Также тестируют комбинацию изучаемого соединения в концентрации около 10-100 мг/кг (например, около 40 мг/кг) с химиотерапевтическим агентом, таким как гемцитабин, обычно при введении в/б один раз в неделю.
Пример 52
Оценка максимально переносимой дозы
Репрезентативный эксперимент для оценки максимально переносимой дозы (МПД) соединений по настоящему изобретению может быть спланирован следующим образом.
Исследования острой токсичности. В репрезентативном тесте для определения МПД после однократной дозы, например, шестьдесят животных, ранее не подвергавшихся никакому воздействию, распределяют случайным образом в группы по 10 животных (5 самцов и 5 самок) и вводят либо одно соединение двумя способами введения, либо два соединения одним способом введения. Была показана переносимость однократной дозы 50 мг/кг в/в, которую используют как ориентировочно низкий уровень дозы. Низкие дозы для пероральных исследований основаны на предполагаемой переносимости и корректируются в меньшую сторону, если необходимо. Репрезентативный расчет уровней доз, объемов доз и концентрации раствора доз описаны в Таблице 10.
|
Субхронические исследования. В репрезентативном тесте для характеристики зависимости реакции от дозы после повторного введения, например, двадцать пять животных, ранее не подвергавшихся никакому воздействию, распределяют случайным образом в группы по 5 животных, как описано в Таблице 11. В каждом двухнедельном исследовании тестируется только одно соединение через один путь введения в оптимальной дозе, рассчитанной из данных предыдущих исследований острой токсичности.
|
Методика дозирования. Соединения вводят ежедневно, через день, один раз в три дня или один раз в 7 дней в/в (латеральная хвостовая вена) или перорально. Животным вводят дозы в систематическом порядке, который распределяет время введения доз равномерно по всем группам. Для перорального введения, животные удерживаются вручную. Для в/в болюсного введения или кратковременных в/в инфузий (одна минута), животные удерживаются механически, но не усыпляются. Для каждой дозы каждого животного используют одноразовые стерильные шприцы.
Пример 53
Фармацевтическая активность соединений AL A2 и A3
Ингибирующее действие соединений Al, A2 и A3 на клеточную пролиферацию определяли методом тестирования уровня жизнеспособности клеток с Аламаром Голубым (Alamar Blue) (например, Пример 39 в данном тексте) на различных типах клеток, представляющих разные виды рака. Уровни ингибирования (IС50) представлены в микромолярных концентрациях в следующей Таблице 12.
|
|
Соединения А1, А2 и A3 также были протестированы на ингибирование опухоли на ксенотрансплантированных грызунах. Грызунам, которым ксенотрансплантировали А375 клеточный рак, вводили перорально 2 раза в день 100 мг/кг, 75 мг/кг и 100 мг/кг дозы соединений А1, А2 и A3, соответственно. Каждое из перечисленных соединений значительно ингибировало рост опухоли А375 в течении 7 дней, в сравнении с контрольной группой, не подвергавшейся обработке. Также грызунам, которым ксенотрансплантировали опухоли MiaPaCa, вводили перорально 2 раза в день 100 мг/кг дозы соединений А1 и A3. Каждое из этих соединений значительно ингибировало рост MiaPaCa опухолей в течение двадцати двух дней, в сравнении с контрольной группой, не подвергавшейся обработке.
Пример 54
Репрезентативные данные IC50, рассчитанные на основании клеточного теста
Ингибирующее действие представленных соединений на клеточную пролиферацию определяли методом тестирования уровня жизнеспособности клеток с Аламаром Голубым (Alamar Blue) (например. Пример 39 в данном тексте) на различных типах клеток, представляющих разные виды рака. Уровни ингибирования (IС50) представлены в микромолярных концентрациях в Таблице 13 и Таблице 14.
|
|
|
Пример 55. Репрезентативные варианты осуществления
Следующие варианты осуществления приведены для иллюстрации, но не для ограничения изобретения
1. Соединение Формулы (I),

или его фармацевтически приемлемая соль или сложный эфир;
где  обозначает необязательно ненасыщенную связь;
обозначает необязательно ненасыщенную связь;
каждый из В, X, А или V отсутствует, если Z1, Z2, Z3 и Z4, соответственно, представляет собой N; и
каждый из В, X, А и V независимо представляет собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0, -L-N(R)-W0, А2 или А3, когда каждый из Z1, Z2, Z3 и Z4, соответственно, представляет собой С;
Z представляет собой О, S, CR4 2, NR4R4, CR4R4, CR4, NR4 или N;
каждый из Z1, Z2, Z3 и Z4 независимо представляет собой С или N, при условии, что никакие три атома N не являются соседними;
Z5 представляет собой С; или Z5 может представлять собой N, когда Z представляет собой N;
Y представляет собой необязательно замещенное 5-6 членное карбоциклическое или гетероциклическое кольцо;
U1 представляет собой -C(=T)N(R)-, -C(=T)N(R)O-, -С(=Т)-, -SO2N(R)-, -SO2N(R)N(R0)-, -SO2- или -SO3-, где Т представляет собой О, S или NH; или U1 может представлять собой связь, когда Z5 представляет собой N или U2 представляет собой Н;
U2 представляет собой Н, -CN, или С3-С7 циклоалкильную, С1-С10 алкильную, С1-С10 гетероалкильную, С2-С10 алкенильную или С2-С10 гетероалкенильную группу, каждая из которых может быть при необходимости замещена одним или более атомами галогена, группой =O, или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом; или U2 представляет собой -W, -L-W, -L-N(R)-W0, A2 или А3;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
R1 представляет собой Н или С1-С6 алкил, необязательно замещенный одним или более атомами галогена или группой =O;
R2 представляет собой Н или С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил, или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом;
R3 представляет собой необязательно замещенный С1-С10 алкил, С2-С10 алкенил, С5-С10 арил или С6-С12 арилалкил, или гетероформу одного из них, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом;
каждый R4 независимо представляет собой Н или С1-С6 алкил; или R может представлять собой -W, -L-W или -L-N(R)-W0;
каждый R и R0 независимо представляет собой Н или С1-С6 алкил;
L представляет собой С1-С10 алкиленовый, С1-С10 гетероалкиленовый, С2-С10 алкениленовый или С2-С10 гетероалкениленовый связующий фрагмент, каждый из которых может быть при необходимости замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена, оксо-группы (=O) или С1-С6 алкила;
W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
W0 представляет собой необязательно замещенное 3-4 членное карбоциклическое кольцо или С1-С6 алкильную группу, замещенную 1-4 атомами фтора;
при условии, что один из U2, V, А, Х и В представляет собой вторичный амин А2 или третичный амин А3, где
вторичный амин А2 представляет собой -NH-W0, и
третичный амин А3 представляет собой полностью насыщенное и необязательно замещенное шестичленное или семичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла, или третичный амин А представляет собой частично ненасыщенное или ароматическое необязательно замещенное пятичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла;
при условии, что когда Z1 представляет собой N, Z2 и Z4 представляют собой С, Z5 представляет собой С, U1 представляет собой -C(O)NH-, U2 представляет собой -L-W, и L представляет собой этиленовый связующий фрагмент, один из V, А и Х независимо представляет собой необязательно замещенное арильное, гетероарильное или 7-членное азациклическре кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла, если W представляет собой пирролидин-1-ил, N-метил-пирролидин-2-ил, пиперидин-1-ил или морфолин-1-ил.
2. Соединение по варианту осуществления 1, где Z представляет собой N, и каждый из Z2, Z3 и Z4 представляет собой С.
3. Соединение по варианту осуществления 1 или 2, где U2 представляет собой -W или -L-W, где W представляет собой необязательно замещенное 5-6 членное ненасыщенное или ароматическое азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S; или W представляет собой необязательно замещенное 5-7 членное насыщенное азациклическое кольцо, содержащее дополнительный гетероатом, выбранный из N и S.
4. Соединение по варианту осуществления 1 или 2, в котором U2 представляет собой -L-N(R)-W0.
5. Соединение по одному из вариантов осуществления 1-4, в котором Y представляет собой необязательно замещенное фенильное кольцо.
6. Соединение Формулы (II),

или его фармацевтически приемлемая соль или сложный эфир;
где  обозначает необязательно ненасыщенную связь;
обозначает необязательно ненасыщенную связь;
каждый из А и Х независимо представляет собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0, -L-N(R)-W0, А2 или А3;
Z представляет собой О, S, CR4 2, NR4R4, СR4R4 или NR4;
Y представляет собой необязательно замещенное 5-6 членное карбоциклическое или гетероциклическое кольцо;
U1 представляет собой -C(=T)N(R)-, -C(=T)N(R)O-, -C(=T)-, -SO2N(R)-, -SO2N(R)N(R0)-, -SO2- или -SO3-, где Т представляет собой О, S или NH; или U1 может представлять собой связь, когда U2 представляет собой Н;
U2 представляет собой Н, -CN или С3-С7 циклоалкильную, С1-С10 алкильную, С1-С10 гетероалкильную, С2-С10 алкенильную или С2-С10 гетероалкенильную группу, каждая из которых может быть при необходимости замещена одним или более атомами галогена, группой =O, или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом; или U2 представляет собой -W, -L-W, -L-N(R)-W0, A2 или А3;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
R1 представляет собой Н или С1-С6 алкил, необязательно замещенный одним или более атомами галогена или группой =O;
R2 представляет собой Н или С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O, или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом;
R3 представляет собой необязательно замещенный С1-С10 алкил, С2-С10 алкенил, С5-С10 арил или С6-С12 арилалкил, или гетероформу одного из них, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом;
каждый R4 независимо представляет собой Н или С1-С6 алкил; или R4 может представлять собой -W, -L-W или -L-N(R)-W0;
каждый R и R0 независимо представляет собой Н или С1-С6 алкил;
L представляет собой С1-С10 алкиленовый, С1-С10 гетероалкиленовый, С2-С10 алкениленовый или С2-С10 гетероалкениленовый связующий фрагмент, каждый из которых может быть при необходимости замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена, оксо-группы (=O) или С1-С6 алкила;
W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
W0 представляет собой необязательно замещенное 3-4 членное карбоциклическое кольцо или С1-С6 алкильную группу, замещенную 1-4 атомами фтора;
при условии, что один из U2, А и Х представляет собой вторичный амин А2 или третичный амин А3, где
вторичный амин А2 представляет собой -NH-W0, и
третичный амин А представляет собой полностью насыщенное и необязательно замещенное шестичленное или семичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла, или третичный амин А3 представляет собой частично ненасыщенное или ароматическое необязательно замещенное пятичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла;
при условии, что когда U1 представляет собой -C(O)NH-, U представляет собой -L-W, и L представляет собой этиленовый связующий фрагмент, один из А и Х независимо представляет собой необязательно замещенное арильное, гетероарильное или 7-членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла, если W представляет собой пирролидин-1-ил, Н-метил-пирролидин-2-ил, пиперидин-1-ил или морфолин-1-ил.
7. Соединение по варианту осуществления 6, в котором, по меньшей мере, один из А и Х представляет собой третичный амин А3.
8. Соединение по варианту осуществления 6 или 7, в котором А3 выбран из группы, состоящей из имидазола, имидазолина, пирролина, пиперидина, пиперазина, морфолина, тиоморфолина и гомопиперазина.
9. Соединение по варианту осуществления 6, 7 или 8, где U1 представляет собой C(=T)N(R)-, Т представляет собой О, и U2 представляет собой -L-W или -L-N(R)-W0.
10. Соединение Формулы (III),

или его фармацевтически приемлемая соль или сложный эфир;
где  обозначает необязательно ненасыщенную связь; и
обозначает необязательно ненасыщенную связь; и
каждый из В, X, А или V отсутствует, если Z1, Z2, Z3 и Z4, соответственно, представляет собой N; и
каждый из В, X, А и V независимо представляет собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0, -L-N(R)-W0, А2 или А3, когда каждый из Z, Z, Z и Z, соответственно, представляет собой С;
каждый из Z, Z, Z и Z независимо представляет собой С или N, при условии, что никакие три атома N не являются соседними;
Y представляет собой необязательно замещенное 5-6 членное карбоциклическое или гетероциклическое кольцо;
U1 представляет собой -C(=T)N(R)-, -C(=T)N(R)O-, -С(=Т)-, -SO2N(R)-, -SO2N(R)N(R0)-, -SO2- или -SO3-, где Т представляет собой О, S или NH; или U1 может представлять собой связь, когда Z5 представляет собой N или U представляет собой Н;
U2 представляет собой Н или С3-С7 циклоалкильную, С1-С10 алкильную, С1-С10 гетероалкильную, С2-С10 алкенильную или С2-С10 гетероалкенильную группу, каждая из которых может быть при необходимости замещена одним или более атомами галогена, группой =O или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом; или U2 представляет собой -W, -L-W, -L-N(R)-W, А или А;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
R1 представляет собой Н или С1-С6 алкил, необязательно замещенный одним или более атомами галогена или группой =O;
R2 представляет собой Н или С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил, или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом;
R3 представляет собой необязательно замещенный С1-С10 алкил, С2-С10 алкенил, С5-С10 арил или С6-С12 арилалкил, или гетероформу одного из них, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом;
каждый R4 независимо представляет собой Н или С1-С6 алкил; или R4 может представлять собой -W, -L-W или -L-N(R)-W0;
каждый R и R0 независимо представляет собой Н или С1-С6 алкил;
L представляет собой С1-С10 алкиленовый, С1-С10 гетероалкиленовый, С2-С10 алкениленовый или С2-С10 гетероалкениленовый связующий фрагмент, каждый из которых может быть при необходимости замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена, оксо-группы (=O) или С1-С6 алкила;
W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
W0 представляет собой необязательно замещенное 3-4 членное карбоциклическое кольцо или С1-С6 алкильную группу, замещенную 1-4 атомами фтора;
при условии, что один из U2, V, А, Х и В представляет собой вторичный амин А2 или третичный амин А3, где
вторичный амин А2 представляет собой -NH-W0, и
третичный амин А представляет собой полностью насыщенное и необязательно замещенное шестичленное или семичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла, или третичный амин А3 представляет собой частично ненасыщенное или ароматическое необязательно замещенное пятичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла.
11. Соединение Формулы (IV),

или его фармацевтически приемлемая соль или сложный эфир;
где  обозначает необязательно ненасыщенную связь;
обозначает необязательно ненасыщенную связь;
каждый из В, X, А или V отсутствует, если Z1, Z2, Z3 и Z4, соответственно, представляет собой N; и
каждый из В, X, А и V независимо представляет собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0, -L-N(R)-W0, А2 или А3, когда каждый из Z1, Z2, Z3 и Z4, соответственно, представляет собой С;
каждый из Z1, Z2, Z3 и Z4 независимо представляет собой С или N, при условии, что никакие три атома N не являются соседними;
Y представляет собой необязательно замещенное 5-6 членное карбоциклическое или гетероциклическое кольцо;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
R1 представляет собой Н или С1-С6 алкил, необязательно замещенный одним или более атомами галогена или группой =O;
R2 представляет собой Н или С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил, или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом;
R3 представляет собой необязательно замещенный С1-С10 алкил, С2-С10 алкенил, С5-С10 арил или С6-С12 арилалкил, или гетероформу одного из них, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом;
R4 представляет собой -W, -L-W или -L-N(R)-W0; и
каждый R независимо представляет собой Н или С1-С6 алкил;
L представляет собой С1-С10 алкиленовый, С1-С10 гетероалкиленовый, С2-С10 алкениленовый или С2-С10 гетероалкениленовый связующий фрагмент, каждый из которых может быть при необходимости замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена, оксо-группы (=O) или С1-С6 алкила;
W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла; и
W0 представляет собой необязательно замещенное 3-4 членное карбоциклическое кольцо или С1-С6 алкильную группу, замещенную 1-4 атомами фтора.
12. Соединение Формулы (V),

или его фармацевтически приемлемая соль или эфир;
где:  обозначает необязательно ненасыщенную связь;
обозначает необязательно ненасыщенную связь;
А и V независимо представляют собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0, -L-N(R)-W0, А2 или А3;
Z представляет собой О, S, CR4 2, NR4CR4, CR4NR4 или NR4;
Y представляет собой необязательно замещенное 5-6 членное карбоциклическое или гетероциклическое кольцо;
U1 представляет собой -C(=T)N(R)-, -C(=T)N(R)O-, -С(=Т)-, -SO2N(R)-, -SO2N(R)N(R0)-, -SO2-, или -SO3-, где Т представляет собой О, S или NH; или U1 может представлять собой связь, когда U2 представляет собой Н;
U2 представляет собой Н или С3-С7 циклоалкильную, С1-С10 алкильную, С1-С10 гетероалкильную, С2-С10 алкенильную или С2-С10 гетероалкенильную группу, каждая из которых может быть при необходимости замещена одним или более атомами галогена, группой =O или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом; или U2 представляет собой -W, -L-W или -L-N(R)-W0, А2 или А3;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
R1 представляет собой Н или С1-С6 алкил, необязательно замещенный одним или более атомами галогена или группой =O;
R2 представляет собой Н или С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил, или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом;
R3 представляет собой необязательно замещенный С1-С10 алкил, С2-С10 алкенил, С5-С10 арил или С6-С12 арилалкил, или гетероформу одного из них, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом;
каждый R4 независимо представляет собой Н или С1-С6 алкил; или R4 может представлять собой -W, -L-W или -L-N(R)-W0;
каждый R и R0 независимо представляет собой Н или С1-С6 алкил;
L представляет собой С1-С10 алкиленовый, С1-С10 гетероалкиленовый, С2-С10 алкениленовый или С2-С10 гетероалкениленовый связующий фрагмент, каждый из которых может быть при необходимости замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена, оксо-группы (=O) или С1-С6 алкила;
W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
W0 представляет собой необязательно замещенное 3-4 членное карбоциклическое кольцо или С1-С6 алкильную группу, замещенную 1-4 атомами фтора;
при условии, что один из U2, А и V представляет собой вторичный амин А2 или третичный амин А3, где
вторичный амин А представляет собой -NH-W0, и
третичный амин А3 представляет собой полностью насыщенное и необязательно замещенное шестичленное или семичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла, или третичный амин А3 представляет собой частично ненасыщенное или ароматическое необязательно замещенное пятичленное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О или S, в качестве члена цикла.
13. Соединение Формулы (VI),

или его фармацевтически приемлемую соль или сложный эфир;
где:
X1 представляет собой СН или N;
X2, X3, X4, X5, X6 и X7 независимо представляют собой NR4, CH2, CHQ или C(Q)2, при условии, что: (i) ни одного, один или два из Х, Х, X4, X5, X6 и X7 представляют собой NR4; (ii) когда X1 представляет собой N, то X2 и X7 оба не являются NR4; (iii) когда X1 представляет собой N, X3 и X6 не являются NR4; и (iv) когда X1 представляет собой СН и два из X2, X3, X4, X5, X6 и X7 представляют собой NR4, указанные два NR4 расположены в соседних положениях в цикле или разделены двумя или более другими положениями в цикле;
А и V независимо представляют собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
каждый Q независимо представляет собой атом галогена, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W. -L-W, -W0 или -L-N(R)-W0;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее один дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
R1 представляет собой Н или С1-С6 алкил, необязательно замещенный одним или более атомами галогена или группой =O;
R2 представляет собой Н или С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил, или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом;
R3 представляет собой необязательно замещенный С1-С10 алкил, С2-С10 алкенил, С5-С10 арил или С6-С12 арилалкил, или гетероформу одного из них, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом;
каждый R4 независимо представляет собой Н или С1-С6 алкил; или R4 может представлять собой -W, -L-W или -L-N(R)-W0;
каждый R независимо представляет собой Н или С1-С6 алкил;
R7 представляет собой Н, и R8 представляет собой С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом; или в -NR7R8, R7 и R8 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3, 4 или 5;
L представляет собой С1-С10 алкиленовый, С1-С10 гетероалкиленовый, С2-С10 алкениленовый или С2-С10 гетероалкениленовый связующий фрагмент, каждый из которых может быть при необходимости замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена, оксо-группы (=O) или С1-С6 алкила;
W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла; и
W0 представляет собой необязательно замещенное 3-4 членное карбоциклическое кольцо или С1-С6 алкильную группу, замещенную 1-4 атомами фтора.
14. Соединение по варианту осуществления 13, в котором Х представляет собой СН, и два из X2, X3, X4, X5, X6 и X7 представляют собой NR4.
15. Соединение по варианту осуществления 13, в котором X' представляет собой СН, и один из X2, X3, X4, X5, X6 и X7 представляет собой NR4.
16. Соединение по варианту осуществления 13, в котором X' представляет собой СН, и ни один из X2, X3, X4, X5, X6 и X7 не является NR4.
17. Соединение по варианту осуществления 13, в котором Х представляет собой N, и ни один из X2, X3, X4, X5, X6 и X7 не является NR4.
18. Соединение по варианту осуществления 13, в котором X1 представляет собой N, и один из X4 или X5 представляет собой NR4.
19. Соединение Формулы (VIII),
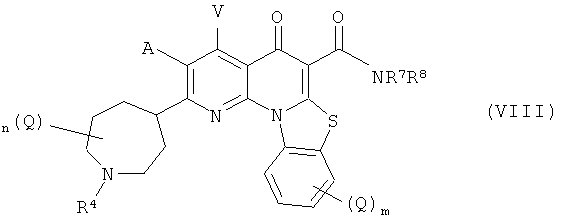
или его фармацевтически приемлемая соль или сложный эфир;
где:
А и V независимо представляют собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
каждый Q независимо представляет собой атом галогена, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
R1 представляет собой Н или С1-С6 алкил, необязательно замещенный одним или более атомами галогена или группой =O;
R2 представляет собой Н или С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом;
R3 представляет собой необязательно замещенный С1-С10 алкил, С2-С10 алкенил, С5-С10 арил или С6-С12 арилалкил, или гетероформу одного из них, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом;
каждый R4 независимо представляет собой Н или С1-С6 алкил; или R4 может представлять собой -W, -L-W или -L-N(R)-W0;
каждый R независимо представляет собой Н или С1-С6 алкил;
R7 представляет собой Н, и R8 представляет собой С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим
кольцом; или в -NR7R, R8 и R7 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3, 4 или 5;
р равно О, 1, 2 или 3;
L представляет собой С1-С10 алкиленовый, С1-С10 гетероалкиленовый, С2-С10 алкениленовый или С2-С10 гетероалкениленовый связующий фрагмент, каждый из которых может быть при необходимости замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена, оксо-группы (=O) или С1-С6 алкила;
W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла; и
W представляет собой необязательно замещенное 3-4 членное карбоциклическое кольцо или С1-С6 алкильную группу, замещенную 1-4 атомами фтора.
20. Соединение по варианту осуществления 19, в котором R7 представляет собой Н, и R8 представляет собой С1-4 алкил, замещенный необязательно замещенным ароматическим гетероциклическим кольцом.
21. Соединение по варианту осуществления 20, в котором необязательно замещенное ароматическое гетероциклическое кольцо выбрано из пиридина, пиримидина, пиразина, имидазола, пирролидина и тиазола.
22. Соединение по варианту осуществления 19, в котором R7 и R8 вместе с N в -NR7R8 образуют необязательно замещенное азациклическое кольцо, выбранное из группы, состоящей из морфолинового, тиоморфолинового, пиперидинового или пиперазинового цикла.
23. Соединение Формулы (VII),

или его фармацевтически приемлемая соль или сложный эфир;
А и V независимо представляют собой Н, галоген, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
каждый Q независимо представляет собой атом галогена, азидо, -CN, -СF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла;
R1 представляет собой Н или С1-С6 алкил, необязательно замещенный одним или более атомами галогена или группой =O;
R2 представляет собой Н или С1-С10 алкил, С1-С10 гетероалкил, С2-С10 алкенил, или С2-С10 гетероалкенил, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-7 членным карбоциклическим или гетероциклическим кольцом;
R3 представляет собой необязательно замещенный С1-С10 алкил, С2-С10 алкенил, С5-С10 арил или С6-С12 арилалкил, или гетероформу одного из них, каждый из которых может быть при необходимости замещен одним или более атомами галогена, группой =O или необязательно замещенным 3-6 членным карбоциклическим или гетероциклическим кольцом;
каждый R4 независимо представляет собой Н или С1-С6 алкил; или R4 может представлять собой -W, -L-W или -L-N(R)-W0;
каждый R независимо представляет собой Н или С1-С6 алкил;
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3, 4 или 5;
р равно 0, 1, 2 или 3;
L представляет собой С1-С10 алкиленовый, С1-С10 гетероалкиленовый, C2-C10 алкениленовый или С2-С10 гетероалкениленовый связующий фрагмент, каждый из которых может быть при необходимости замещен одним или более заместителями, выбранными из группы, состоящей из атома галогена, оксо-группы (=O) или С1-С6 алкила;
W представляет собой необязательно замещенное 4-7 членное азациклическое кольцо, при необходимости содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве члена цикла; и
W0 представляет собой необязательно замещенное 3-4 членное карбоциклическое кольцо или С1-С6 алкильную группу, замещенную 1-4 атомами фтора.
24. Соединение по варианту осуществления 23, в котором А и V независимо представляют собой Н или атом галогена.
25. Соединение по варианту осуществления 23 или 24, в котором R4 представляет собой Н или С 1-4 алкил.
26. Соединение по варианту осуществления 23, 24 или 25 в котором каждый из тип равен 0.
27. Соединение по любому из вариантов осуществления 23-26, в котором р равно 0 или 1,
28. Соединение по любому из вариантов осуществления 23-27, имеющее структуру:
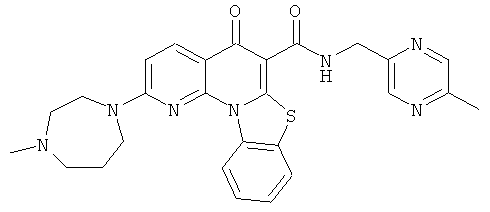
или его фармацевтически приемлемая соль или сложный эфир.
29. Соединение, выбранное из группы, состоящей из:
|
|
|
или его фармацевтически приемлемая соль или сложный эфир.
30. Соединение, выбранное из группы, состоящей из соединений в Таблицах 1-4 и 6-8, и из Примеров, или их фармацевтически приемлемая соль или сложный эфир.
31. Фармацевтическая композиция, содержащая соединение по любому из предыдущих вариантов осуществления или его фармацевтически приемлемую соль или сложный эфир, и фармацевтически приемлемый наполнитель.
32. Фармацевтическая композиция, содержащая, по меньшей мере, одно соединение по варианту осуществления 19 или его фармацевтически приемлемую соль или сложный эфир, и фармацевтически приемлемый наполнитель.
33. Способ лечения или смягчения клеточно-пролиферативного расстройства у пациента, включающий введение субъекту, нуждающемуся в данном лечении, терапевтически эффективного количества соединения Формулы (I),

или его фармацевтически приемлемой соли или сложного эфира;
где 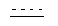 обозначает необязательно ненасыщенную связь; и
обозначает необязательно ненасыщенную связь; и
А, В, V, X, Z1, Z2, Z3, Z4, Z5, U1, U2, Y и Z такие, как определено в варианте осуществления 1;
тем самым излечивая или смягчая указанное клеточно-пролиферативное расстройство.
34. Способ лечения или смягчения клеточно-пролиферативного расстройства у пациента, включающий введение субъекту, нуждающемуся в данном лечении, терапевтически эффективного количества соединения по любому из вариантов осуществления 1-32; тем самым излечивая или смягчая указанное клеточно-пролиферативное расстройство.
35. Способ лечения или смягчения клеточно-пролиферативного расстройства у пациента, включающий введение субъекту, нуждающемуся в данном лечении, терапевтически эффективного количества соединения Формулы (VIII),

или его фармацевтически приемлемой соли или сложного эфира;
где А, V, X, Q, m, n, p, R4, R7 и R8 такие, как определено в варианте осуществления
19;
тем самым излечивая или смягчая указанное клеточно-пролиферативное расстройство.
36. Способ лечения или смягчения клеточно-пролиферативного расстройства у пациента, включающий введение субъекту, нуждающемуся в данном лечении, терапевтически эффективного количества соединения по любому из вариантов осуществления 1-32, тем самым излечивая или смягчая указанное клеточно-пролиферативное расстройство.
37. Способ по одному из вариантов осуществления 33-36, где субъектом является человек.
38. Способ снижения микробного титра и/или смягчения микробной инфекции, включающий обработку системы или субъекта, нуждающегося в таком лечении, эффективным количеством соединения Формулы (I),

или его фармацевтически приемлемой соли или сложного эфира;
где 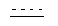 обозначает необязательно ненасыщенную связь; и
обозначает необязательно ненасыщенную связь; и
А, В, V, X, Z1, Z2, Z3, Z4, Z5, U1, U2, Y и Z такие, как определено в варианте осуществления 1;
тем самым снижая микробный титр.
38. Способ снижения микробного титра и/или смягчения микробной инфекции, включающий обработку системы или пациента, нуждающегося в таком лечении, эффективным количеством соединения по одному из вариантов осуществления 1-31, тем самым снижая микробный титр.
40. Способ по варианту осуществления 38 или 39, где система представляет собой клетку или ткань,
41. Способ по варианту осуществления 38, 39 или 40, где микробный титр и/или микробная инфекция представляют собой вирусный, бактериальный или грибковый титр.
Полное содержание каждого патента, патентной заявки, публикации и документа, упоминаемых в настоящем тексте, включено в настоящий текст в виде ссылки. Ссылка на вышеуказанные патенты, патентные заявки, публикации и документы не является признанием того, что что-либо из вышеуказанного является предшествующим уровнем техники, а также никаким образом не касается содержания или даты данных публикаций или документов.
В описанное выше могут вноситься модификации без отклонения от основных аспектов данного изобретения. Хотя настоящее изобретение было раскрыто достаточно подробно, со ссылкой на один или более частные варианты осуществления, специалистам в данной области техники понятно, что возможно внесение изменений в варианты осуществления, конкретно описанные в данной заявке, и что данные изменения и улучшения находятся в рамках объема и сути данного изобретения. Иллюстративно описанное в настоящем тексте изобретение может осуществляться на практике в отсутствие любого элемента (элементов), не описанного конкретно в настоящем тексте. Так, например, в каждом случае в настоящем тексте любой из терминов "содержащий", "состоящий в основном из" и "состоящий из" можно заменять любым из других двух терминов. Таким образом, используемые термины и выражения, применяются как термины описания, а не ограничения, не исключены эквиваленты указанных или описанных признаков или их части, и понятно, что в рамках объема данного изобретения возможны различные модификации. Варианты осуществления представлены ниже в приведенных далее аспектах.
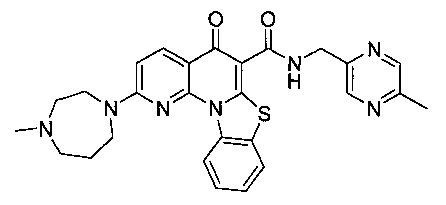
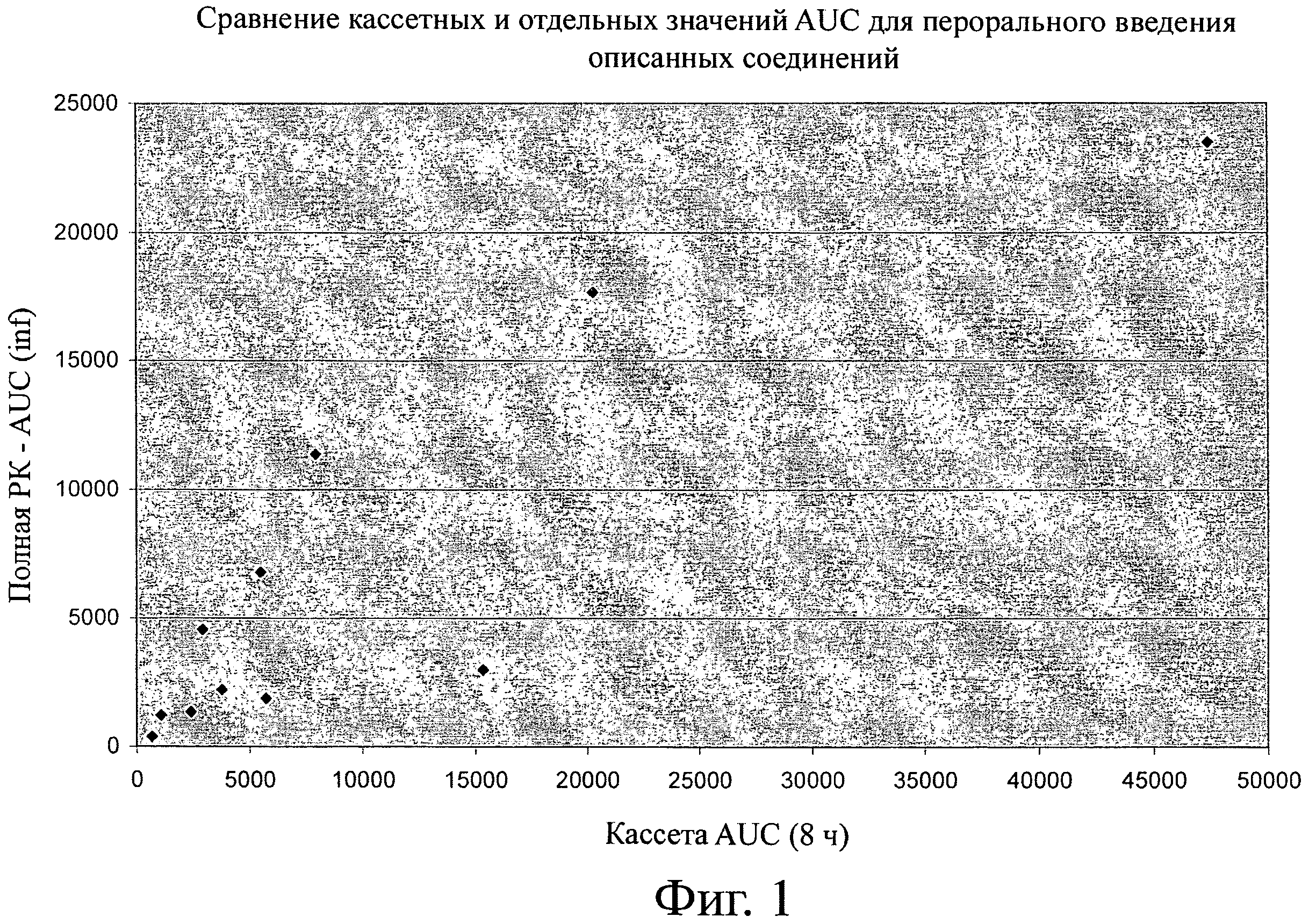
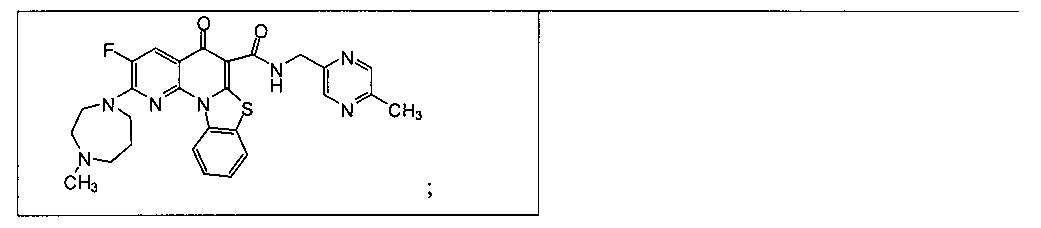
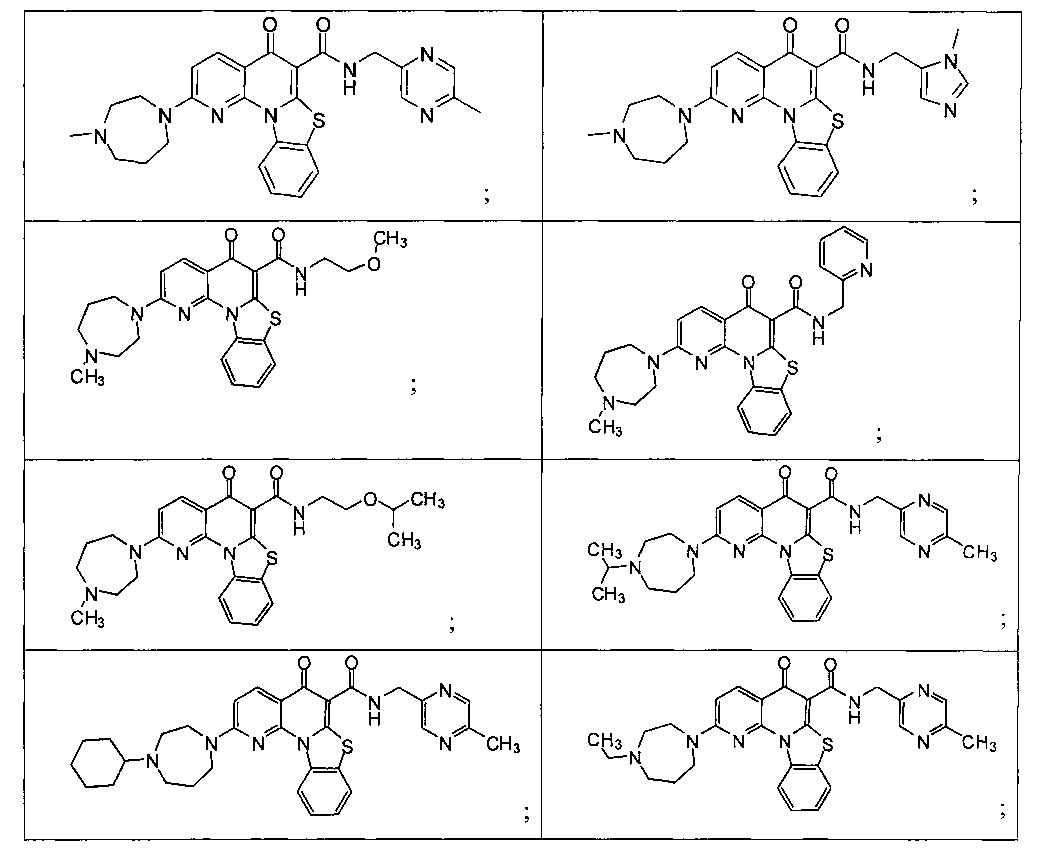
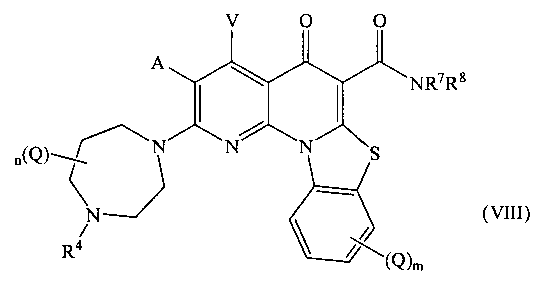
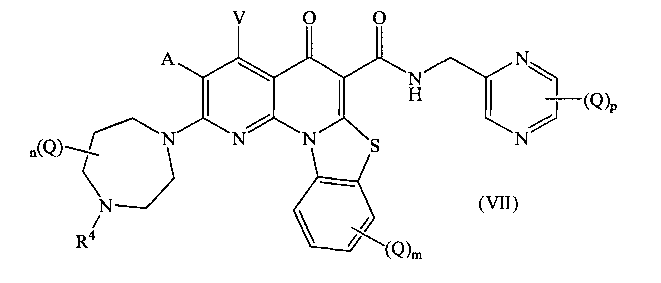
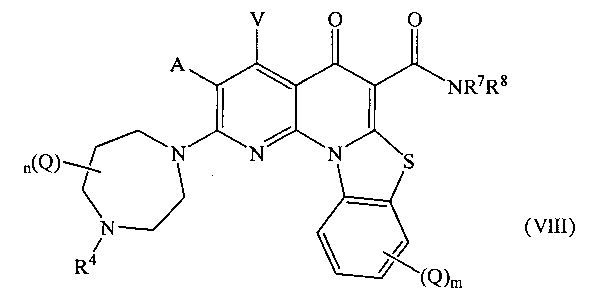
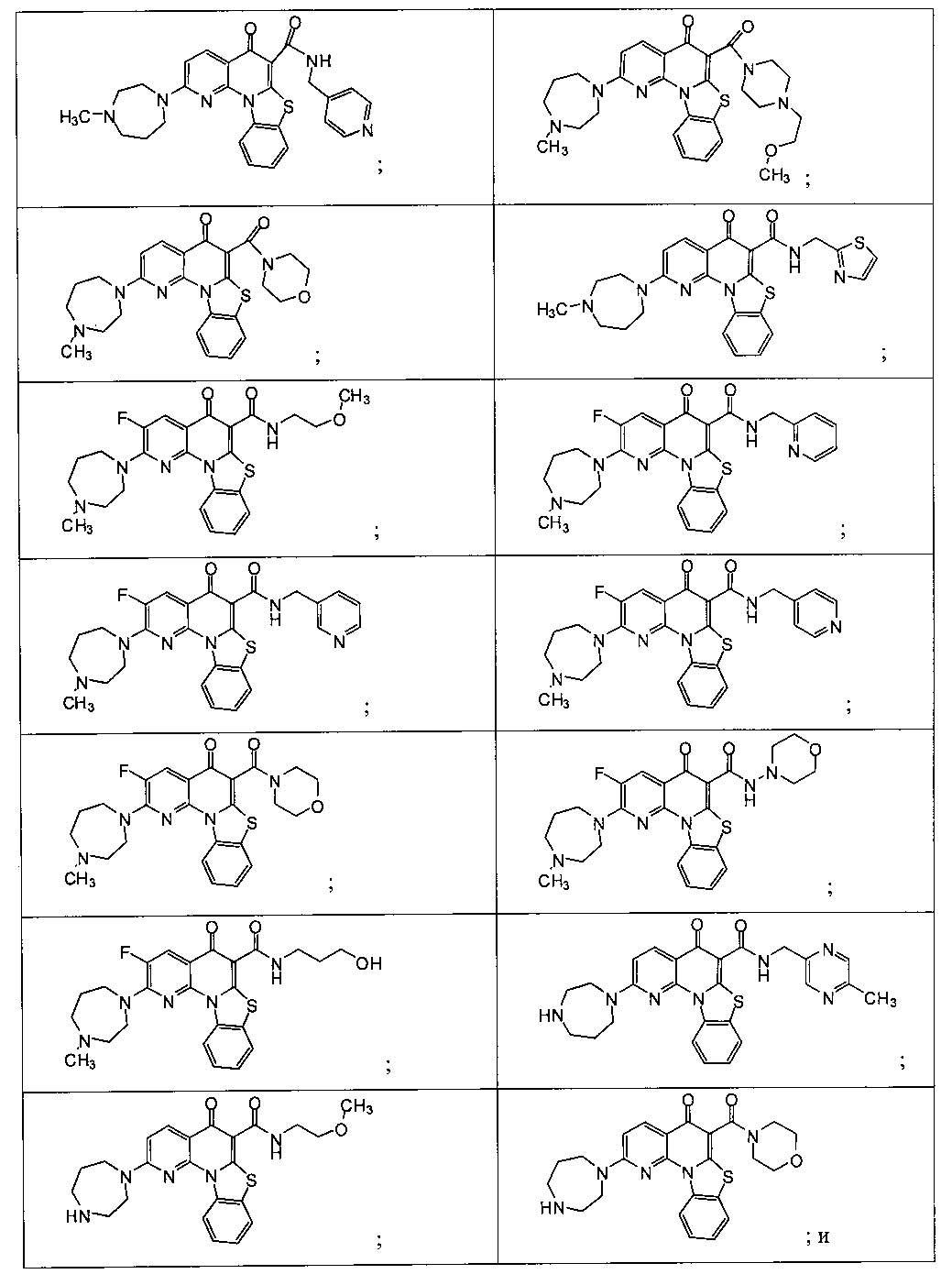
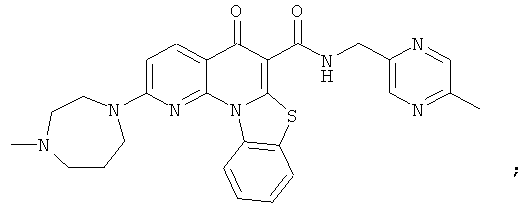
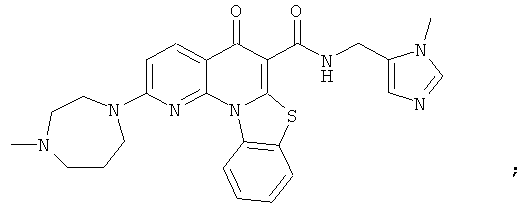
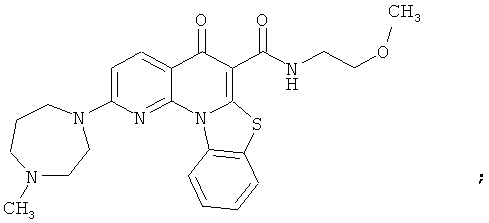
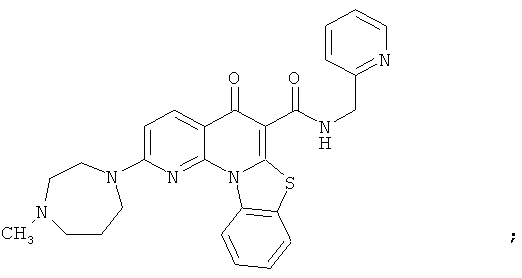
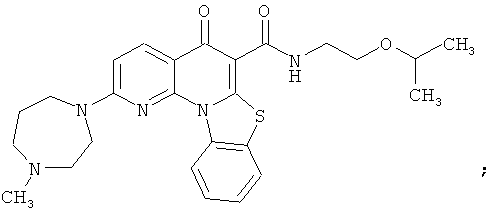
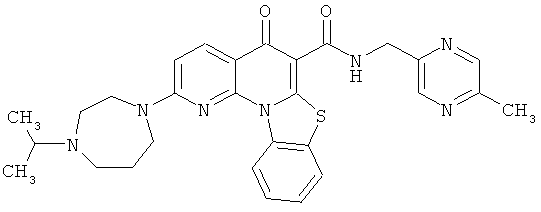
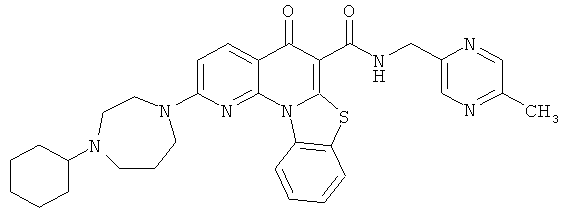
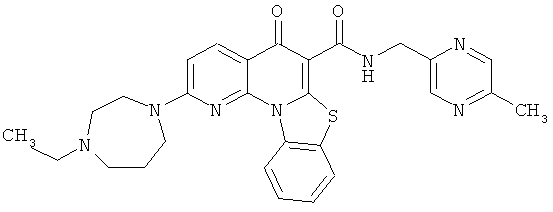
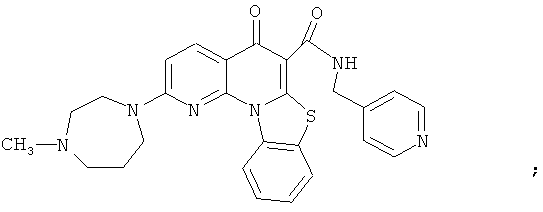
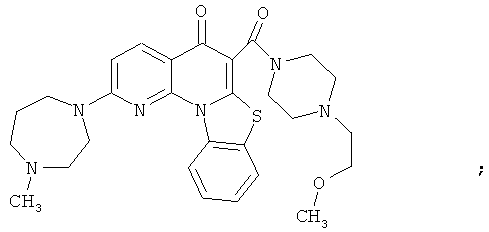
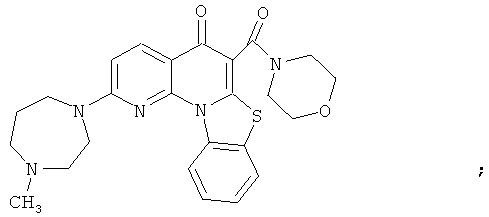
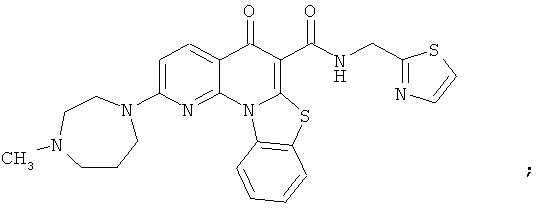

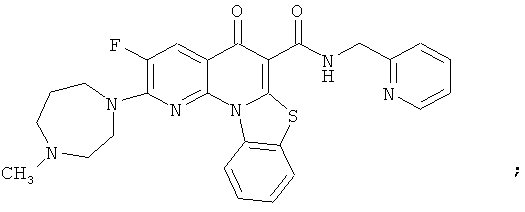
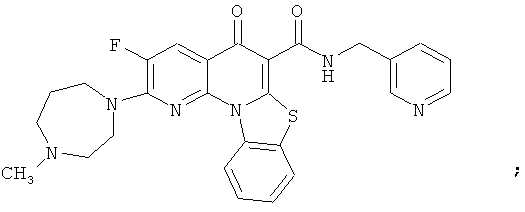
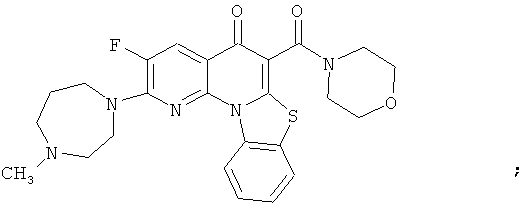

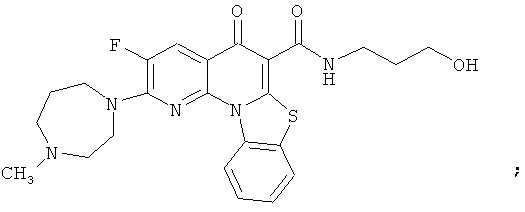
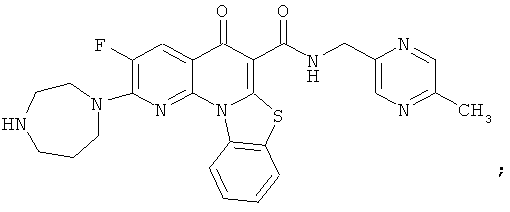
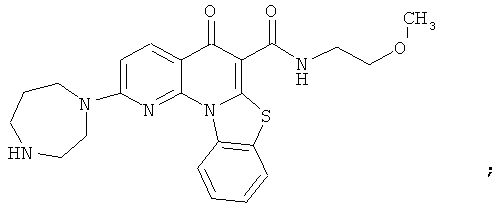
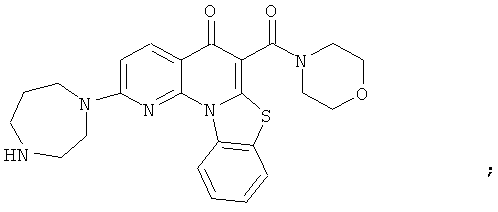 или
или