Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ
Вид РИД
Изобретение
1. РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет в соответствии с предварительной патентной заявкой США с серийным номером 61/141856, поданной 31 декабря 2008 г., озаглавленной "СПОСОБ ПОЛУЧЕНИЯ ВОРЕЛОКСИНА". Раскрытие вышеуказанной заявки включено посредством ссылки в данный документ во всей своей полноте.
2. ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В данном документе предоставлены способы получения (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты, способы получения промежуточных соединений, применимых при получении соединения, композиции, содержащие соединение, способы применения таких композиций для лечения рака и способы использования промежуточных соединений при получении SNS-595.
3. ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Соединение (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновая кислота, имеющее структуру:
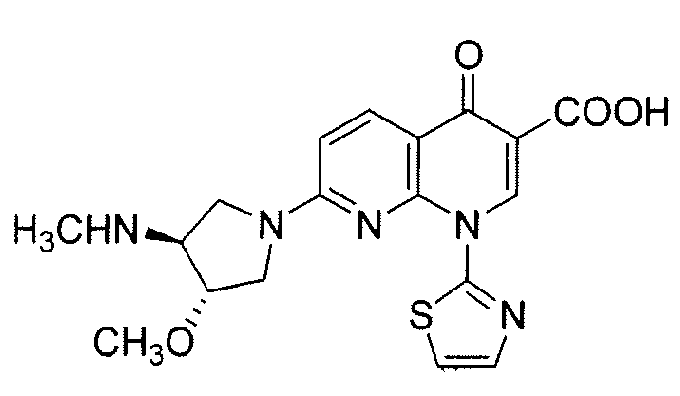
также известно как SNS-595 или AG-7352. Американский комитет по присвоению названий лекарственным средствам (USANC) присвоил этому соединению наименование "Ворелоксин".
SNS-595 известен по его противоопухолевой активности (см., Tsuzuki et al., J. Med. Chem., 47:2097-2106, 2004 и Tomita et al. J. Med. Chem., 45:5564-5575, 2002). В литературе было предложено лечение различных видов рака с помощью SNS-595, и была показана его преклиническая активность против разнообразных линий раковых клеток ксенотрансплантатов. Сообщалось о различных режимах дозирования для применения этого соединения. Например, см. опубликованные патентные заявки США №№ 2005-0203120 A1; 2005-0215583 A1 и 2006-0025437 A1, все из которых включены в данный документ посредством ссылки во всей их полноте. SNS-595 в настоящее время проходит тестирование в клинических испытаниях для оценки безопасности и эффективности действия для человеческих онкологических больных, и продемонстрировал клиническую активность против острой миелоидной лейкемии и рака яичников.
SNS-595 может быть получен с использованием методов, известных специалисту в данной области. См., например, Патент США № 5817669, выданный 6 октября 1998 г., Патентную заявку Японии № Hei 10-173986, опубликованную 26 июня 1998 г., WO 2007/146335, Tsuzuki et al., J. Med. Chem., 47:2097-2106, 2004 и Tomita et al., J. Med. Chem., 45: 5564-5575, 2002, которые включены в данный документ во всей своей полноте.
Общепринятые способы получения SNS-595 позволяют получить на выходе композиции, содержащие другие соединения, которые либо являются результатом побочных реакций, которые протекают во время процесса синтеза SNS-595, или являются реагентами, которые остаются непрореагировавшими.
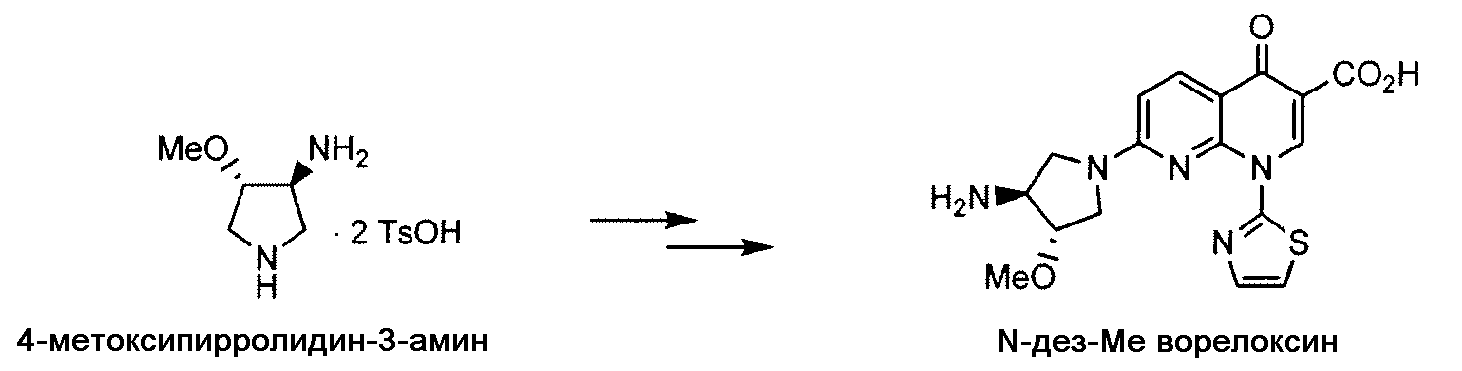
Международная патентная заявка WO 2007/146335, опубликованная 21 декабря 2007 г., описывает получение композиции, которая содержит SNS-595 и (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-амино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту, которая описана там как "N-дезметил" соединение. Представлены данные, указывающие на то, что N-дезметил соединение показало активность в анализе на цитотоксичность. N-дезметил соединение является значительным побочным продуктом общепринятого подхода к синтезу SNS-595.
Таким образом, остается потребность в улучшенных способах получения SNS-595, по существу не содержащего загрязняющих веществ, для получения соединения в по существу чистом виде, хорошо подходящем для составления в фармацевтические композиции для лечения рака без необходимости проведения трудоемких стадий очистки.
4. КРАТКОЕ СОДЕРЖАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Несмотря на то, что известно существование некоторых побочных продуктов при получении SNS-595, снижение их количества в конечном лекарственном продукте является важным. Поскольку онкологические больные проходят существенную химиотерапию и облучение и могут часто подвергать опасности иммунные системы, благоприятным является доставлять высокочистое лекарственное средство для онкологических больных. Дополнительно, для парентерального введения, чистота и процентное содержание доставляемого лекарства являются крайне важными, так как лекарственное средство поступает непосредственно в кровоток. В результате в данном документе описаны способы, которые могут обеспечить на выходе по существу чистое SNS-595. В дополнение, предоставленные способы могут быть масштабированы до промышленного производства по существу чистого SNS-595.
В одном варианте осуществления, в данном документе предоставлен способ получения промежуточных соединений, требуемых при получении SNS-595.
В некоторых вариантах осуществления, в данном документе предоставлены способы для получения SNS-595. В некоторых вариантах осуществления, способы, предоставленные в данном документе, позволяют получить на выходе композиции, содержащие SNS-595 и N-дезметил-SNS-595. В одном варианте осуществления, в данном документе предоставлен способ получения промежуточных соединений, применимый при получении SNS-595.
В одном варианте осуществления, в данном документе предоставлен способ получения SNS-595, как проиллюстрировано на Схемах 1 и 2.
Схема 1
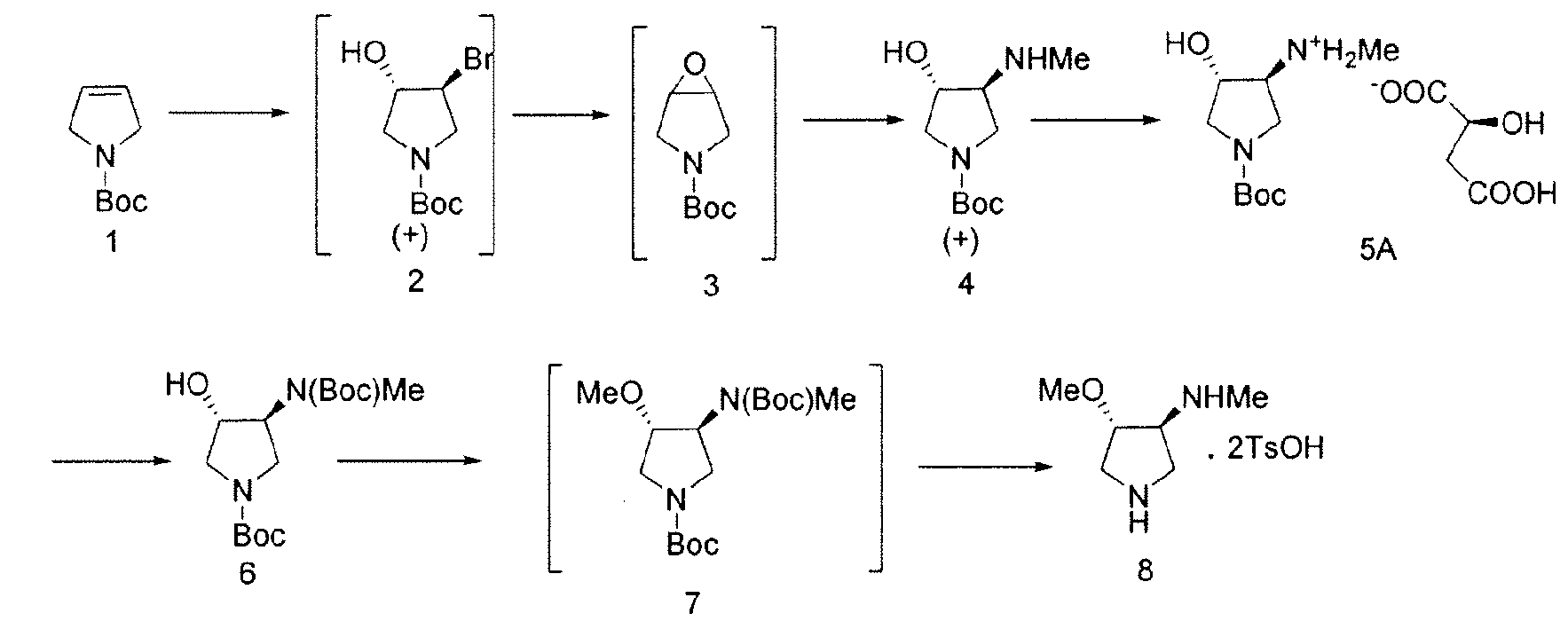
По этому пути, Соединение 4 получают посредством нуклеофильного раскрытия эпоксида (Соединение 3) метиламином, посредством чего удаляют примеси, полученные в результате неполного метилирования. В некоторых вариантах осуществления, Соединение 2 непосредственно преобразуют в Соединение 4 посредством обработки с метиламином и основанием, таким как бикарбонат натрия. Соединение 4 разделяют с хиральной кислотой, такой как L-(-)-яблочная кислота или L-(-)-пироглутаминовая кислота с образованием хиральной соли.
Соединение 8, полученное в соответствии со Схемой 1 или иным образом, далее взаимодействует с этиловым сложным эфиром 7-хлор-4-оксо-1-тиазол-2-ил-1,4-дигидро-[1,8]нафтиридин-3-карбоновой кислоты с получением SNS-595, как проиллюстрировано на Схеме 2.
Схема 2
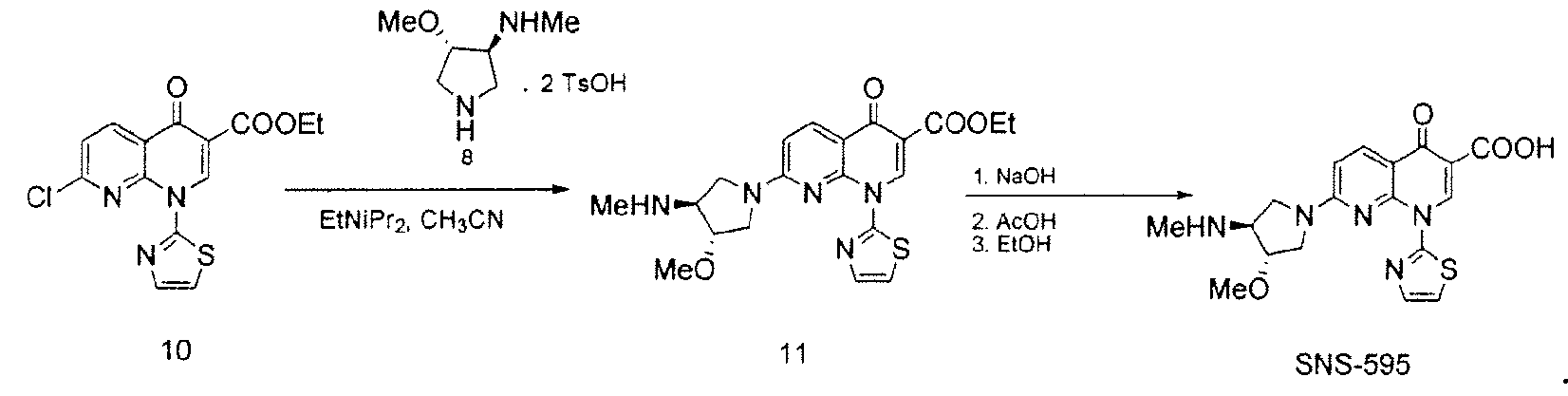
В некоторых вариантах осуществления, способы, предоставленные в данном документе, позволяют получить композиции, содержащие, по меньшей мере, приблизительно 99,5% SNS-595 и менее чем приблизительно 0,5% примеси от общей массы композиции, где процентное содержание рассчитывают от общей массы композиции. В некоторых вариантах осуществления, композиции содержат, по меньшей мере, приблизительно 99,5% SNS-595 и менее чем приблизительно 0,5% N-дезметил-SNS-595 от общей массы композиции, где каждое значение процентного содержания рассчитывают от общей массы композиции. В некоторых вариантах осуществления, композиции содержат, по меньшей мере, приблизительно 99,5% SNS-595 и менее чем приблизительно 0,5% О-дезметил-SNS-595 от общей массы композиции, где каждое значение процентного содержания рассчитывают от общей массы композиции. В некоторых вариантах осуществления, композиции содержат, по меньшей мере, приблизительно 99,5% SNS-595 и менее чем приблизительно 0,5% общего O-дезметил-SNS-595 и N-дезметил-SNS-595 от общей массы композиции, где каждое значение процентного содержания рассчитывают от общей массы композиции. В некоторых вариантах осуществления, композиции содержат, по меньшей мере, приблизительно 99,5% SNS-595 и менее чем приблизительно 0,5% N,О-бисдезметил-SNS-595 от общей массы композиции, где каждое значение процентного содержания рассчитывают от общей массы композиции. В некоторых вариантах осуществления, композиции содержат, по меньшей мере, приблизительно 99,5% SNS-595 и менее чем приблизительно 0,5% общего O-дезметил-SNS-595, N-дезметил-SNS-595 и N,O-бисдезметил-SNS-595 от общей массы композиции, где каждое значение процентного содержания рассчитывают от общей массы композиции.
В некоторых вариантах осуществления, в данном документе предоставлен способ получения по существу чистого SNS-595 в увеличенном масштабе.
В некоторых вариантах осуществления, композиции являются применимыми в способах лечения, предотвращения или контроля одного или более видов рака у человека или другого субъекта.
В некоторых вариантах осуществления, в данном документе предоставлены фармацевтические композиции, содержащие по существу чистое SNS-595 для лечения рака. Типы раков (онкологических заболеваний), которые можно лечить, предотвращать или контролировать с использованием способов, предоставленных в данном документе, включают, но не ограничены ими, солидные опухоли и переносимые с кровью опухоли.
Также предоставлены способы получения композиций и соединений, описанных здесь. В некоторых вариантах осуществления в данном документе предоставлены промежуточные соединения, применимые при получении SNS-595.
5. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
5.1. ОПРЕДЕЛЕНИЯ
Если не определено иным образом, все технические и научные термины, используемые в данном документе, имеют такое же значение, какое соответствует обычному пониманию рядовым специалистом в данной области. Все патенты, заявки, опубликованные заявки и другие публикации включены посредством ссылки во всей своей полноте. В случае, если существует множество определений для термина из данного документа, определения, данные в данном разделе, считают превалирующими, если не установлено иначе.
Как используют в данном документе, "защитная группа" является любой из признанных защитных групп для активных групп в молекуле. В способах, описанных в данном документе, свободные группы включают гидроксил, амино и карбокси. Примерные защитные группы включают, но не ограничены ими, бензилоксикарбонил, трет-бутоксикарбонил и т.п. Как используют в данном документе, "реакция введения защиты" относится к реакции, в которой активную группу блокируют защитной группой, чтобы избежать нежелательных реакций с активной группой. Как используют в данном документе, "защита" относится к блокировке активной группы на соединении с помощью защитной группы, чтобы избежать нежелательных реакций с активной группой. Как используют в данном документе, "реакция снятия защиты" относится к реакции, в которой защитную группу удаляют для регенерации активной группы. Как используют в данном документе, "снятие защиты" относится к удалению защитной группы на соединении для регенерации активной группы. Например, трет-бутоксикарбонильная защитная группа может быть удалена с амино-группы посредством реакции с реагентами для снятия защиты, такими как HCl/MeOH, триметилсилан или моногидрат п-толуолсульфоновой кислоты.
Как используют в данном документе, "раскрытие эпоксида" относится к реакции, в которой эпоксидный цикл раскрывают с помощью нуклеофила, такого как первичный амин, например, метиламин, для получения соединения, содержащего свободную гидроксильную группу.
Как используют в данном документе, "метилирование" относится к реакции, в которой свободная гидроксильная или аминная группа претерпевает реакцию с метилирующим агентом, где водород замещают метильной группой. Реакция метилирования может осуществляться, например, с диметилсульфатом.
Как используют в данном документе, "метилирование" относится к замене водорода в гидроксильной или аминной группе на метильную группу посредством реакции с метилирующим агентом. Реакция метилирования может быть осуществлена, например, с диметилсульфатом.
Как используют в данном документе "разделение" или "хиральное разделение" относится к способу разделения рацемических соединений на их энантиомеры.
Как используют в данном документе "разделение" относится к разделению рацемических соединений на их энантиомеры.
Как используют в данном документе "промышленный масштаб" или "технологический масштаб" относится к способу получения SNS-595, который позволяет получать на выходе свыше 1 килограмма SNS-595.
Как используют в данном документе, "примесь" относится к химическим веществам, отличным от (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-метиламино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты.
Как используют в данном документе, "SNS-595" означает (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-метиламино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту, а также любую ионную форму, соли, сольваты, например, гидрат, или другие формы этого соединения, включая их смеси. Таким образом, композиции, содержащие SNS-595, могут включать (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-метиламино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту или ее ионную форму, соль, сольват, например, гидрат, или другую форму соединения. В некоторых вариантах осуществления, SNS-595 предоставлен в виде фармацевтически приемлемой соли.
Как используют в данном документе, "Вещество SNS-595" означает композицию, состоящую по существу из (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-метиламино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты, включая менее чем 0,5% (по массе) любого другого индивидуального соединения или примеси в расчете от общей массы композиции. В некоторых вариантах осуществления, химический способ, предоставленный в данном документе, позволяет проводить синтез на уровне килограммов Вещества SNS-595, которое включает менее чем 0,3%, менее чем 0,2%, менее чем 0,1% или менее чем 0,05% 1,4-дигидро-7-[(3S,4S)-3-метокси-4-амино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты, где каждое значение процентного содержания рассчитывают от общей массы композиции. В некоторых вариантах осуществления, химический способ, предоставленный в данном документе, позволяет проводить синтез на уровне килограммов Вещества SNS-595, которое включает менее чем 0,3%, менее чем 0,2%, менее чем 0,1% или менее чем 0,05% 1,4-дигидро-7-[(3S,4S)-3-окси-4-метиламино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты, где каждое значение процентного содержания рассчитывают от общей массы композиции. В некоторых вариантах осуществления, химический способ, предоставленный в данном документе, позволяет проводить синтез на уровне килограммов Вещества SNS-595, которое включает менее чем 0,3%, менее чем 0,2%, менее чем 0,1%, или менее чем 0,05% 1,4-дигидро-7-[(3S,4S)-3-метокси-4-амино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты и 1,4-дигидро-7-[(3S,4S)-3-окси-4-метиламино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты, где каждое значение процентного содержания рассчитывают от общей массы композиции.
Как используют в данном документе, "Активный Ингредиент SNS-595" или "SNS-595 АФИ (Активный Фармацевтический Ингредиент)" означает композицию, содержащую (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-метиламино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту и менее чем 0,1% 1,4-дигидро-7-[(3S,4S)-3-метокси-4-амино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты и/или 1,4-дигидро-7-[(3S,4S)-3-окси-4-метиламино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты, где процентное содержание основано на расчете от общей массы композиции.
Как используют в данном документе, "N-дезметил-SNS-595" относится к (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-амино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоте и имеет следующую химическую структуру:
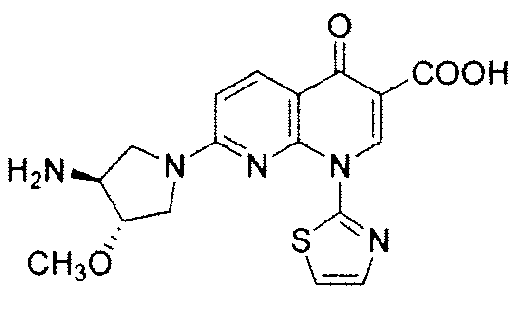
"O-дезметил-SNS-595" относится к (+)-1,4-дигидро-7-[(3S,4S)-3-гидрокси-4-метиламино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоте и имеет следующую химическую структуру:
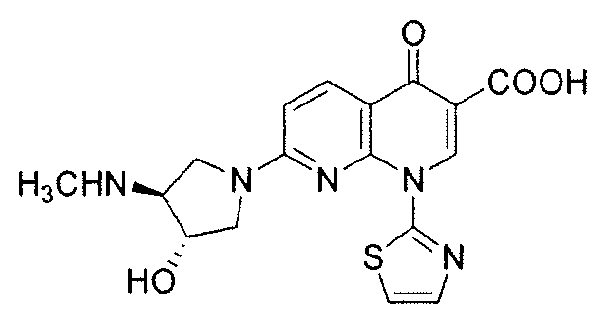
"N,O-бисдезметил-SNS-595" относится к (+)-1,4-дигидро-7-[(3S,4S)-3-гидрокси-4-амино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоте и имеет следующую химическую структуру:
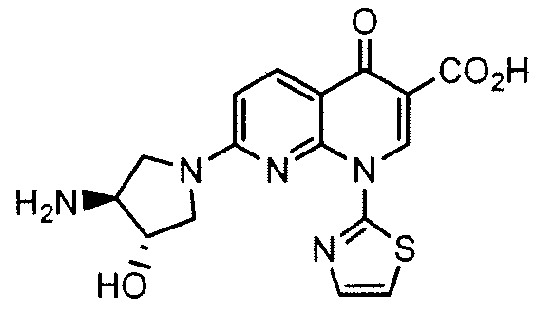
Как используют в данном документе, "Продукт SNS-595" означает водную композицию SNS-595, содержащую приблизительно 10 мг/мл АФИ SNS-595, приблизительно 45 мг/мл D-сорбитола и органическую кислоту, полученную в воде, в которой pH композиции равен приблизительно 2,3-2,7. В некоторых вариантах осуществления, органическая кислота представляет собой метансульфоновую кислоту. В некоторых вариантах осуществления, pH Продукта SNS-595 равен приблизительно 2,5. В некоторых вариантах осуществления Продукт SNS-595 является стерильным.
Как используют в данном документе, "композиция" относится к композиции SNS-595 и примесям, имеющим остов тиазолил-оксо-нафтиридин-3-карбоновой кислоты. Такие примеси включают N-дезметил-SNS-595, O-дезметил-SNS-595 и N,O-бисдезметил-SNS-595.
Как используют в данном документе, термин "по существу чистый" по отношению к SNS-595, относится к композиции, которая включает, по меньшей мере приблизительно 99,5%, 99,6%, 99,7%, 99,8%, 99,9% или вплоть до приблизительно 100% по массе SNS-595, оставшаяся часть содержит другие химические вещества. Чистота SNS-595, предоставленного в данном документе, может быть определена стандартными методами анализа, такими как высокоэффективная жидкостная хроматография (ВЭЖХ), используемыми специалистами в данной области для оценки такой чистоты. В некоторых вариантах осуществления, SNS-595 является достаточно чистым, так что дополнительная очистка не смогла бы обнаруживаемо изменить физические и химические свойства, такие как биологическую активность соединения.
Как используют в данном документе, "энантиомерно чистое SNS-595" относится к SNS-595, которое по существу не содержит (-)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты (т.е., в энантиомерном избытке). Другими словами, SNS-595 по существу не содержит(-)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту, и находится, таким образом, в энантиомерном избытке "(+)" формы. Термин "энантиомерно чистое" или "чистый энантиомер" обозначает, что соединение содержит более чем приблизительно 95%, 96%, 97%, 98%, 99%, 99,5, 99,6%, 99,7%, 99,8%, или 99,9% масс. (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-(метиламино)-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты.
Как используют в данном документе, и, если не указано иначе, термины "лечить", "лечение" и "излечение" относятся к облегчению протекания или снижения тяжести заболевания или симптома, ассоциированного с заболеванием или состоянием, подлежащих лечению.
Как используют в данном документе, "предотвратить", "предотвращение" и другие формы слова включают ингибирование наступления или развития заболевания или нарушения, или симптома конкретного заболевания или нарушения. В некоторых вариантах осуществления, пациенты с семейной историей рака являются кандидатами для режимов предотвращения (профилактики). В целом, в контексте рака, термин "предотвращение" относится к введению лекарственного средства перед наступлением признаков или симптомов рака, особенно у пациентов с риском рака.
Как используют в данном документе, и, если не указано иначе, термин "контроль" охватывает предотвращение рецидива конкретного заболевания или нарушения у пациента, который страдает от него, удлинение времени жизни пациента, который страдал от заболевания или нарушения, остающегося в ремиссии, снижение показателей смертности пациентов и/или поддержание снижения тяжести или избегания симптома, ассоциированного с заболеванием или состоянием, находящихся под контролем.
Как используют в данном документе, "субъект" означает животное, обычно, млекопитающее, включая человека. Как используют в данном документе, "пациент" означает человеческий субъект.
Как используют в данном документе, термин "рак" включает, но не ограничен ими, солидные опухоли и переносимые с кровью опухоли. В некоторых вариантах осуществления, рак может представлять собой карциному или саркому. В некоторых вариантах осуществления, рак представляет собой гемобластоз, такой как лейкемия, лимфома (например, не-ходжкинская лимфома, лимфома Ходжкина) или миелома. В некоторых вариантах осуществления, лейкемия представляет собой хроническую лимфоцитарную лейкемию, хроническую миелоидную лейкемию, острую лимфоцитарную лейкемию, острую миелогенную лейкемию и острую миелобластную лейкемию. В некоторых вариантах осуществления, рак включает солидную опухоль. В некоторых вариантах осуществления, рак представляет собой рак мочевого пузыря, рак мозга (например, астроцитому, глиому, менингиому, нейробластому или другие), рак костей (например, остеосаркому), рак молочной железы, рак шейки матки, холангиокарциному, рак пищеварительного тракта (например, полости рта, пищевода, желудка, рак толстой или прямой кишки), рак головы и шеи, леймиосаркому, липосаркому, рак печени, рак легкого (мелкоклеточный или крупноклеточный), меланому, мезотелиому, миелому, рак носоглотки, нейроэндокринный рак, рак яичников, рак поджелудочной железы, рак простаты, рак почек, рабдомиосаркому, рак слюнных желез, рак кожи, веретеноклеточную карциному, тестикулярный рак, рак щитовидной железы или рак матки (например, рак эндометрия). В некоторых вариантах осуществления, рак может быть рецидивирующим после предшествующей терапии или устойчивым к общепринятой терапии. В некоторых вариантах осуществления, рак может быть диссеменированным или метастатическим.
Как используют в данном документе, термин "предраковое состояние" означает состояние, аномальный рост ткани или повреждение, которые имеют элементы или вероятно становятся раковыми. Предраковые состояния включают, например, актинический кератоз, аденоматозные полипы толстой кишки, дисплазию шейки матки, и предшествующие гематологические нарушения, такие как миелофиброз, апластическая анемия, пароксизмальная ночная гемоглобинурия, болезнь Ослера (истинная полицитемия) и миелодиспластический синдром.
Как используют в данном документе, термин "рецидив" означает возвращение признаков или симптомов рака у субъекта, который имел предшествующее улучшение или ремиссию рака в результате терапии рака.
Как используют в данном документе, термин "рефрактерный" означает, что рак является или становится устойчивым к терапии рака.
Как используют в данном документе, и если не указано иначе, термины "терапевтически эффективное количество" и "эффективное количество" соединения относятся к количеству, достаточному для обеспечения терапевтического благоприятного эффекта при лечении, профилактике и/или контроле заболевания, для замедления или минимизации одного или более симптомов, ассоциированных с заболеванием или нарушением, подлежащих лечению. Термины "терапевтически эффективное количество" и "эффективное количество" могут охватывать количество, которое улучшает общую терапию, снижает или позволяет избежать симптомов или причин заболевания или нарушения, или усиливает терапевтическую эффективность действия еще одного терапевтического средства.
Как используют в данном документе и, если не указано иначе, термин "фармацевтически приемлемая соль" включает, но не ограничен ими, соль кислой или основной группы, которая может присутствовать в соединениях, предоставленных в данном документе. В определенных кислотных условиях, соединение может образовывать большое разнообразие солей с различными неорганическими и органическими кислотами. Кислоты, которые могут применяться для получения фармацевтически приемлемых солей таких основных соединений, представляют собой те кислоты, которые образуют соли, содержащие фармакологически приемлемые анионы, включая, но не ограничиваясь ими, ацетат, бензолсульфонат, бензоат, бикарбонат, битартрат, бромид, эдетат кальция, камзилат, карбонат, хлорид, бромид, йодид, цитрат, дигидрохлорид, эдетат, эдизилат, эстолат, эзилат, фумарат, глуцептат, глюконат, глутамат, гликоллиларсанилат, гексилрезорцинат, гидрабамин, гидроксинафтоат, изетионат, лактат, лактобионат, малат, малеат, манделат, метансульфонат (мезилат), метилсульфат, мускат, напсилат, нитрат, пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, сукцинат, сульфат, таннат, тартрат, теоклат, триэтиодид и памоат. При некоторых основных условиях, соединение может образовывать основные соли с разнообразными фармакологически приемлемыми катионами. Неограничивающие примеры таких солей включают соли щелочного металла или щелочноземельного металла и, конкретно, кальция, магния, натрия, лития, цинка, калия и железа.
Как используют в данном документе и, если не указано иначе, термин "гидрат" означает SNS-595 или его соль, дополнительно включающие стехиометрическое или нестехиометрическое количество воды, связанной посредством нековалентных межмолекулярных сил. Гидраты SNS-595 могут быть кристаллическими или некристаллическими.
Как используют в данном документе и, если не указано иначе, термин "сольват" означает сольват, образованный в результате ассоциации одной или более молекул растворителя с соединением, предоставленным в данном документе. Термин "сольват" включает гидраты (например, моногидрат, дигидрат, тригидрат, тетрагидрат, и т.п.). Сольваты SNS-595 могут быть кристаллическими или некристаллическими.
Как используют в данном документе, переходная фраза “состоящее по существу из” ограничивает объем притязаний до определенных веществ и тех, которые не оказывают материального воздействия на основные и новые характеристики заявленного объекта изобретения.
Термины "совместное введение" и "в сочетании с" включают введение двух терапевтических средств (например, SNS-595 или композиции, предоставленной в данном документе, и еще одного противоракового средства или второго средства) либо одновременно, совместно или последовательно без каких-либо конкретных ограничений по времени. В одном варианте осуществления, оба средства присутствуют в клетке или в организме пациента в одно и то же время, или проявляют их биологический или терапевтический эффект в одно время. В одном варианте осуществления, два терапевтических средства находятся в одной и той же композиции или единичной дозированной форме. В еще одном варианте осуществления, два терапевтических средства находятся в раздельных композициях или единичных дозированных формах.
Термин "средство для поддерживающей помощи " относится к любому веществу, которое лечит, предотвращает, контролирует, снижает или позволяет избежать неблагоприятный или нежелательный эффект от лечения SNS-595.
5.2. СОЕДИНЕНИЯ И КОМПОЗИЦИИ
В некоторых вариантах осуществления, в данном документе предоставлены способы для получения SNS-595. В некоторых вариантах осуществления, способы, предоставленные в данном документе, позволяют получить Вещество SNS-595. В некоторых вариантах осуществления, способы, предоставленные в данном документе, позволяют получить композиции, содержащие SNS-595, N-дезметил-SNS-595 и O-дезметил-SNS-595. В некоторых вариантах осуществления, способы, предоставленные в данном документе, позволяют получить композиции, содержащие по существу чистое SNS-595. В некоторых вариантах осуществления, способы, предоставленные в данном документе, позволяют получить композиции, состоящие по существу из SNS-595, N-дезметил-SNS-595 и O-дезметил-SNS-595. В некоторых вариантах осуществления, способы, предоставленные в данном документе, позволяют получить композиции, содержащие SNS-595 и N-дезметил-SNS-595. В некоторых вариантах осуществления, способы, предоставленные в данном документе, позволяют получить композиции, состоящие по существу из SNS-595 и N-дезметил-SNS-595. В некоторых вариантах осуществления, способы, предоставленные в данном документе, позволяют получить композиции, содержащие SNS-595 и O-дезметил-SNS-595. В некоторых вариантах осуществления, способы, предоставленные в данном документе, позволяют получить композиции, состоящие по существу из SNS-595 и O-дезметил-SNS-595. В некоторых вариантах осуществления, способы, предоставленные в данном документе, позволяют получить композиции, содержащие SNS-595 и N,O-бисдезметил-SNS-595. В некоторых вариантах осуществления, способы, предоставленные в данном документе, позволяют получить композиции, состоящие по существу из SNS-595 и N,O-бисдезметил-SNS-595. В некоторых вариантах осуществления, способы, предоставленные в данном документе, позволяют получить композиции, состоящие по существу из SNS-595, N-дезметил-SNS-595, O-дезметил-SNS-595 и N,O-бисдезметил-SNS-595.
В некоторых вариантах осуществления, композиции, предоставленные в данном документе, состоят по существу из, по меньшей мере, приблизительно 99,5% SNS-595 и менее чем приблизительно 0,5% примеси от общей массы композиции, где каждое значение процентного содержания рассчитывают от общей массы композиции. В некоторых вариантах осуществления, композиции, предоставленные в данном документе, состоят по существу из, по меньшей мере, приблизительно 99,5% SNS-595 и менее чем приблизительно 0,5% N-дезметил-SNS-595 от общей массы композиции, где каждое значение процентного содержания рассчитывают от общей массы композиции. В одном варианте осуществления, в данном документе предоставлена композиция, состоящая по существу из, по меньшей мере 99,9% SNS-595 и менее чем приблизительно 0,1% N-дезметил-SNS-595. В одном варианте осуществления, в данном документе предоставлена композиция, состоящая по существу из, по меньшей мере, 99,95% SNS-595 и менее чем приблизительно 0,05% N-дезметил-SNS-595. В одном варианте осуществления, композиция состоит по существу из, по меньшей мере, приблизительно 99,96%, по меньшей мере, приблизительно 99,97%, по меньшей мере, приблизительно 99,98%, по меньшей мере, приблизительно 99,99% SNS-595 от массы композиции. В некоторых вариантах осуществления, процентные содержания SNS-595 и N-дезметил-SNS-595 в композиции рассчитывают от общей массы двух компонентов.
В некоторых вариантах осуществления, в данном документе предоставлена композиция, состоящая по существу из SNS-595 и менее чем приблизительно 0,05% масс. N-дезметил-SNS-595. В одном варианте осуществления, композиция состоит по существу из SNS-595 и менее чем приблизительно 0,01%, 0,02%, 0,03%, 0,04% или 0,05% N-дезметил-SNS-595 в расчете от общей массы композиции.
В некоторых вариантах осуществления, композиции, предоставленные в данном документе, состоят по существу из, по меньшей мере, приблизительно 99,5% SNS-595 и менее чем приблизительно 0,5% O-дезметил-SNS-595 от общей массы композиции, где каждое значение процентного содержания рассчитывают от общей массы композиции. В одном варианте осуществления, в данном документе предоставлена композиция, состоящая по существу из, по меньшей мере, приблизительно 99,9% SNS-595 и менее чем приблизительно 0,1% O-дезметил-SNS- 595. В одном варианте осуществления, в данном документе предоставлена композиция, состоящая по существу из, по меньшей мере, приблизительно 99,95% SNS-595 и менее чем приблизительно 0,05% O-дезметил-SNS-595. В одном варианте осуществления, композиция состоит по существу из, по меньшей мере, приблизительно 99,96%, по меньшей мере, приблизительно 99,97%, по меньшей мере, приблизительно 99,98%, по меньшей мере, приблизительно 99,99% SNS-595 от массы композиции. В некоторых вариантах осуществления, процентные содержания SNS-595 и O-дезметил-SNS-595 в композиции приведены в расчете от общей массы двух компонентов.
В некоторых вариантах осуществления, в данном документе предоставлена композиция, состоящая по существу из SNS-595 и менее чем приблизительно 0,05% масс. O-дезметил-SNS-595. В одном варианте осуществления, композиция состоит по существу из SNS-595 и менее чем приблизительно 0,01%, 0,02%, 0,03%, 0,04% или 0,05% O-дезметил-SNS-595 в расчете от общей массы композиции.
В некоторых вариантах осуществления, композиции, предоставленные в данном документе, состоят по существу из SNS-595 и менее чем приблизительно 0,5%, 0,3%, 0,1%, 0,05%, 0,03% или 0,01% общего N-дезметил-SNS-595 и O-дезметил-SNS-595 от общей массы композиции, где каждое значение процентного содержания рассчитывают от общей массы композиции.
В некоторых вариантах осуществления, композиции состоят по существу из, по меньшей мере, приблизительно 99,5% SNS-595 и менее чем приблизительно 0,5%, 0,3%, 0,1%, 0,05%, 0,03% или 0,01% N,O-бисдезметил-SNS-595 от общей массы композиции, где каждое значение процентного содержания рассчитывают от общей массы композиции. В некоторых вариантах осуществления, процентные содержания SNS-595 и N,O-бисдезметил-SNS-595 в композиции приведены в расчете от общей массы двух компонентов.
В некоторых вариантах осуществления, композиции, предоставленные в данном документе, состоят по существу из SNS-595 и менее чем приблизительно 0,5%, 0,3%, 0,1%, 0,05%, 0,03% или 0,01% общего N-дезметил-SΝS-595, O-дезметил-SNS-595 и N,O-бисдезметил-SNS-595 от общей массы композиции, где каждое значение процентного содержания рассчитывают от общей массы композиции. В некоторых вариантах осуществления, процентные содержания SNS-595, N-дезметил-SNS-595, O-дезметил-SNS-595 и N,O-бисдезметил-SNS-595 в композиции приведены в расчете от общей массы четырех компонентов.
В некоторых вариантах осуществления, Вещество SNS-595, предоставленное в данном документе, может быть синтезировано в технологическом масштабе.
В некоторых вариантах осуществления, Вещество SNS-595, предоставленное в данном документе, является применимым в способах лечения, профилактики или контроля одного или более типов рака у субъекта.
В одном варианте осуществления, в данном документе предоставлены способы лечения, профилактики или улучшения состояния одного или более типов рака, включающие в себя введение Вещества SNS-595.
Также в данном документе предоставлены соединения формулы 5А и 5B и способы получения соединений.
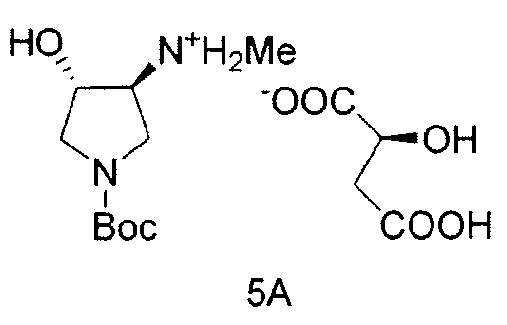 и
и 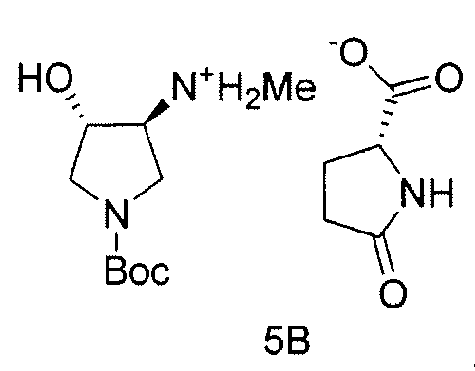
В некоторых вариантах осуществления, Соединение 5A и Соединение 5B являются применимыми в качестве промежуточных соединений в синтезе SNS-595.
5.3. СПОСОБЫ ПОЛУЧЕНИЯ
SNS-595 может быть получен из (3S,4S)-4-метокси-N-метилпирролидин-3-амина·2TsOH и этилового сложного эфира 7-хлор-4-оксо-1-тиазол-2-ил-1,4-дигидро-[1,8]нафтиридин-3-карбоновой кислоты, как описано в Примере 3.
В одном варианте осуществления, химический способ получения SNS-595, предоставленный в данном документе, позволяет получить Вещество SNS-595, состоящее по существу из, по меньшей мере, приблизительно 99,5% SNS-595, включая менее чем приблизительно 0,5% примеси. В еще одном варианте осуществления, химический способ позволяет получить Вещество SNS-595, состоящее по существу из, по меньшей мере, приблизительно 99,7% SNS-595, включая приблизительно 0,3% примеси, по меньшей мере, приблизительно 99,9% SNS-595 и менее чем приблизительно 0,1% примеси, по меньшей мере, приблизительно 99,95% SNS-595 и менее чем приблизительно 0,05% примеси, по меньшей мере, приблизительно 99,97% SNS-595 и менее чем приблизительно 0,03% примеси, по меньшей мере, приблизительно 99,98% SNS-595 и менее чем приблизительно 0,02% примеси или, по меньшей мере, приблизительно 99,99% SNS-595 и менее чем приблизительно 0,01% примеси.
В некоторых вариантах осуществления, способ, предоставленный в данном документе, позволяет получить Вещество SNS-595, состоящее по существу из SNS-595, включая менее чем приблизительно 0,1% N-дезметил-SNS-595. В одном варианте осуществления, способ, предоставленный в данном документе, позволяет получить Вещество SNS-595, состоящее по существу из SNS-595, включая менее чем приблизительно 0,01%, 0,02%, 0,03%, 0,04% или 0,05% N-дезметил-SNS-595 в расчете от общей массы композиции.
В некоторых вариантах осуществления, способ, предоставленный в данном документе, позволяет получить Вещество SNS-595, состоящее по существу из SNS-595, включая менее чем приблизительно 0,1% O-дезметил-SNS-595. В одном варианте осуществления, способ, предоставленный в данном документе, позволяет получить Вещество SNS-595, состоящее по существу из SNS-595, включая менее чем приблизительно 0,01%, 0,02%, 0,03%, 0,04% или 0,05% O-дезметил-SNS-595 в расчете от общей массы композиции.
В некоторых вариантах осуществления, способ, предоставленный в данном документе, позволяет получить Вещество SNS-595, состоящее по существу из SNS-595, включая менее чем приблизительно 0,1% общего содержания N-дезметил-SΝS-595 и O-дезметил-SNS-595. В одном варианте осуществления, способ, предоставленный в данном документе, позволяет получить Вещество SNS-595, состоящее по существу из SNS-595, включая менее чем приблизительно 0,01%, 0,02%, 0,03%, 0,04% или 0,05% общего содержания N-дезметил-SNS-595 и O-дезметил-SNS-595 в расчете от общей массы композиции.
В некоторых вариантах осуществления, способ, предоставленный в данном документе, позволяет получить Вещество SNS-595, состоящее по существу из SNS-595, включая менее чем приблизительно 0,1% N, O-бисдезметил-SΝS-595. В одном варианте осуществления, способ, предоставленный в данном документе, позволяет получить Вещество SNS-595, состоящее по существу из SNS-595, включая менее чем приблизительно 0,01%, 0,02%, 0,03%, 0,04% или 0,05% N,О-бисдезметил-SNS-595 в расчете от общей массы композиции.
Некоторые способы для получения (3S,4S)-4-метокси-N-метилпирролидин-3-амина·2TsOH представлены в литературе (см. Патент США № 5817669, WO 2007/146335, Tsuzuki et al., J. Med. Chem., 47:2097-2106, 2004 и Tomita et al., J. Med. Chem., 45: 5564-5575, 2002). Эти способы могут предоставить продукты, загрязненные значительными уровнями примесей, включающих N-дезметил- и O-дезметил-аналоги Соединения 8 и другие. Один такой способ иллюстрирован на Схеме 3.
Схема 3
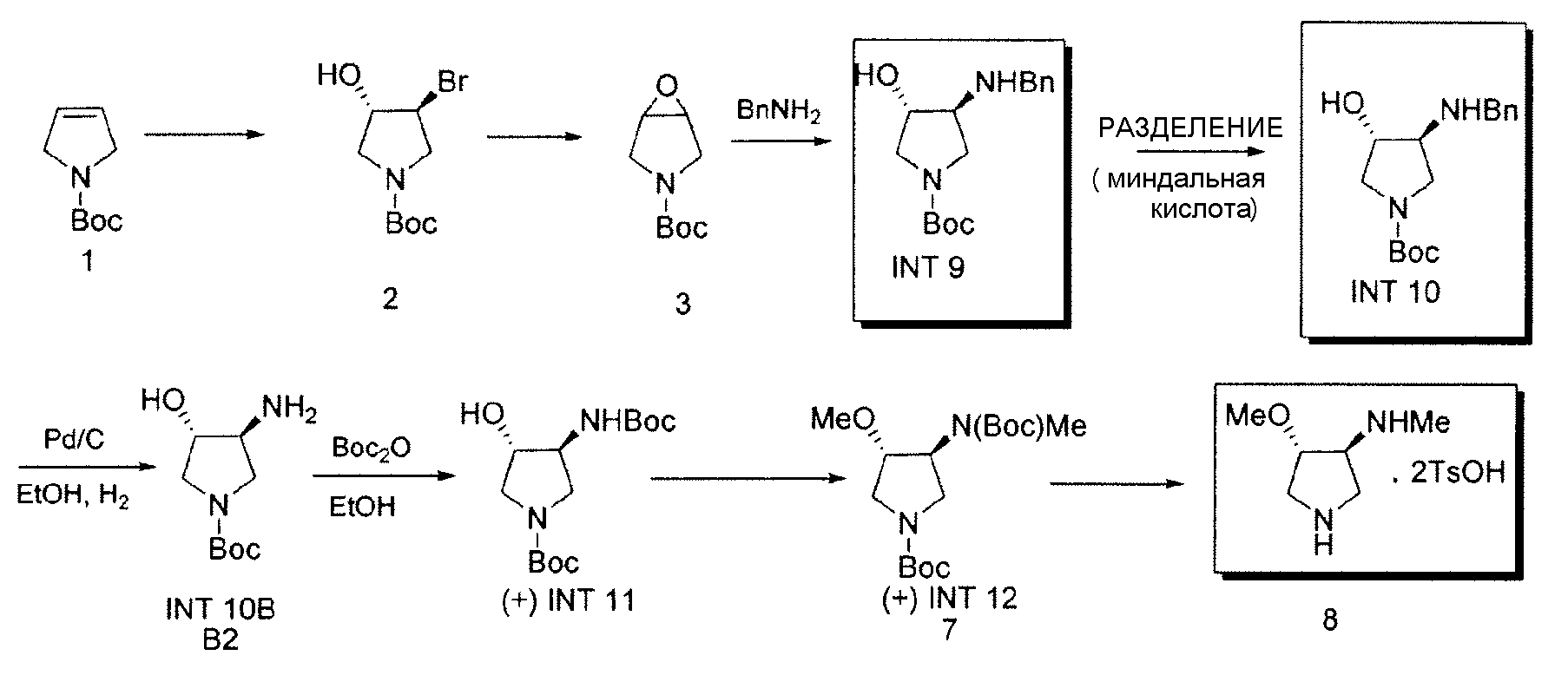
Как сообщалось ранее, например, см. WO 2007/146335, Tsuzuki et al., J. Med Chem., 47:2097-2106, 2004 и Tomita et al., J. Med. Chem., 45: 5564-5575, 2002, во время масштабирования этого способа, вплоть до 1,5% 4-метоксипирролидин-3-амина, т.е., N-дезметил-соединения 8, наблюдали примесь, предположительно образованную в результате неполного метилирования INT11 на стадии получения INT12. Эту примесь превращали во время синтеза SNS-595 в известную примесь, N-дезметил-SNS-595, как показано на Схеме 4.
Схема 4
Дополнительно, способ был невоспроизводимым, и на выход и количество примесей оказывали воздействия небольшие изменения температуры и времени реакции. Димерные и тримерные примеси (которые было трудно удалить) образовывались при слегка повышенных температурах и более длительном времени реакции. Во многих случаях, уровни примесей были настолько высокими, а выход таким низким, что продукт было трудно кристаллизовать.
Таблица 1 предоставляет профиль примеси для синтетического пути, проиллюстрированного на Схеме 3.
|
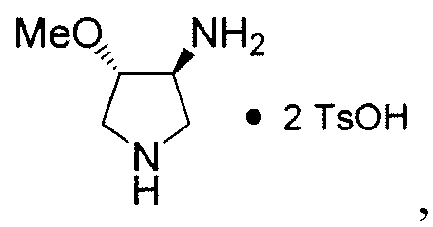
В Таблице 1, “N,O-“ относится к N,O-бис-дезметил-Соединению 8, имеющему формулу:

"O-" относится к O-дезметил-Соединению 8, имеющему формулу:
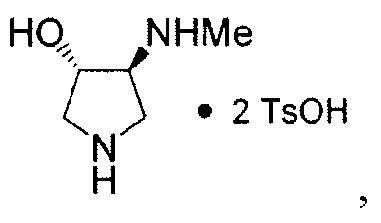
“N” относится к N-дезметил-Соединению 8, имеющему формулу:
 и
и
"НП" означает, что данные не приведены.
В некоторых вариантах осуществления, в данном документе предоставлены способы для получения SNS-595, разработанные для снижения или исключения неполного метилирования, которое приводит к образованию примеси N-дезметил-Соединения 8. Примерный способ отображен на Схеме 1.
Схема 1
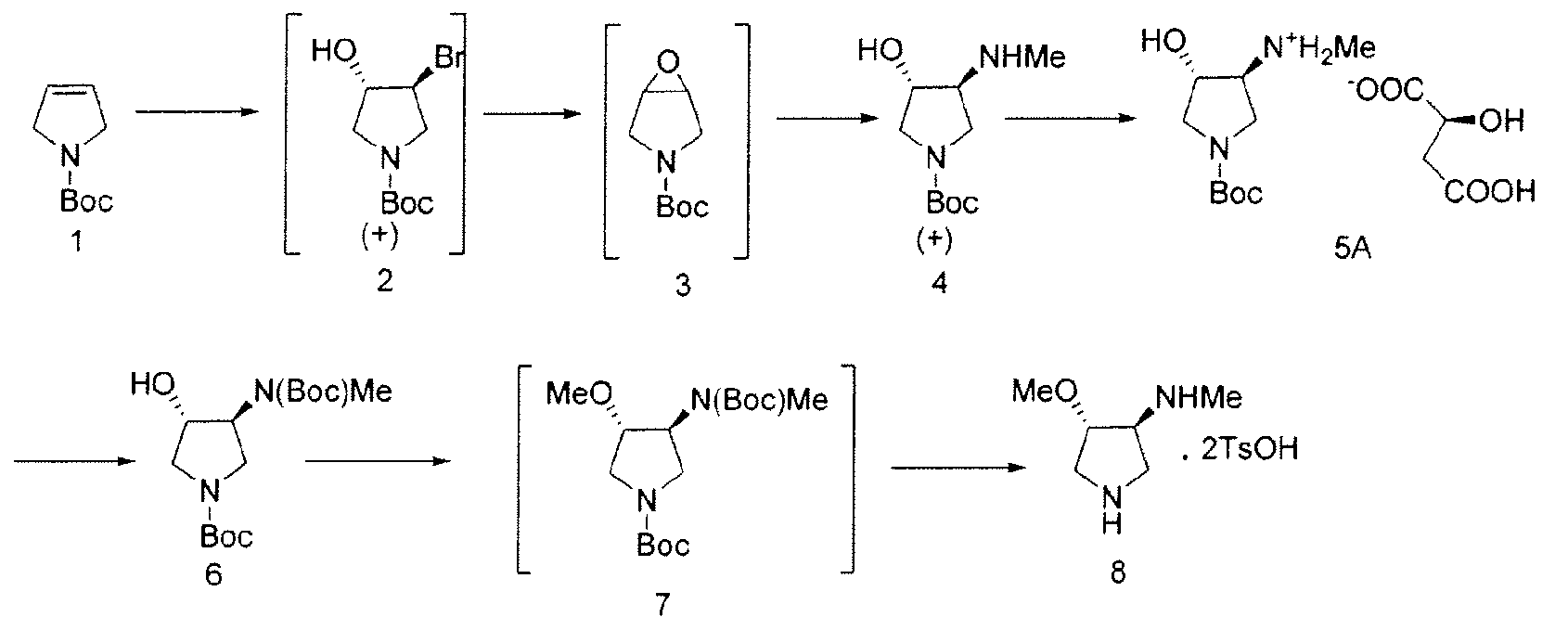
На Схеме 1, N-метильную группу вводят не посредством метилирования, а посредством нуклеофильного раскрытия эпоксида метиламином, тем самым устраняя примеси, образующиеся в результате неполного метилирования.
В некоторых вариантах осуществления, метиламин не содержит обнаруживаемое количество аммиака. В таких вариантах осуществления, Соединение 4 не содержит соответствующую N-дез-метил примесь. В некоторых вариантах осуществления, метиламин содержит менее чем приблизительно 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2% или 0,1% или менее аммиака.
Любая присутствующая примесь может быть удалена посредством кристаллизаций на стадиях получения Соединения 4, Соединения 5A и/или Соединения 6.
Как проиллюстрировано на Схеме 1, промежуточное Соединение 4 может быть получено посредством способа из доступного для приобретения Boc-3-пирролина (Соединение 1), см. например, Tetrahedron Asymmetry, 12 (2002) 2989-2997.
Промежуточное Соединение 4 может быть разделено посредством образования комплекса с хиральной кислотой. Может применяться любая хиральная кислота, считающаяся подходящей специалистом в данной области. Примерные хиральные кислоты включают, но не ограничены ими, яблочную кислоту, пироглутаминовую кислоту (PGA), винную кислоту, ди-п-толуоилвинную кислоту (DTTA), камфорсульфоновую кислоту (CSA), и миндальную кислоту.
В одном варианте осуществления, хиральная кислота представляет собой L-(-)-яблочную кислоту или L-(-)-пироглутаминовую кислоту. В одном варианте осуществления, L-(-)-яблочная кислота взаимодействует с Соединением 4 с образованием Соединения 5A. В одном варианте осуществления, L-(-)-пироглутаминовая кислота взаимодействует с Соединением 4 с образованием Соединения 5B. В некоторых вариантах осуществления применяют приблизительно от 0,25 до 2 эквивалентов хиральной кислоты. В одном варианте осуществления применяют приблизительно от 0,5 до 1,5 эквивалентов хиральной кислоты. В одном варианте осуществления применяют приблизительно от 0,9 до 1,1 эквивалентов хиральной кислоты. В некоторых вариантах осуществления применяют приблизительно от 0,25 до 2 эквивалентов L-(-)-яблочной кислоты. В одном варианте осуществления применяют приблизительно от 0,5 до 1,5 эквивалентов L-(-)-яблочной кислоты. В одном варианте осуществления применяют приблизительно от 0,9 до 1,1 эквивалентов L-(-)-яблочной кислоты.
В одном варианте осуществления, L-(-)-яблочная кислота продуцирует соль L-(-)-малата, Соединение 5A, при больше чем приблизительно 98%, 99%, 99,3%, 99,5%, 99,7%, 99,8% или 99,9% энантиомерного избытка. В одном варианте осуществления, L-(-)-яблочная кислота продуцирует соль L-(-)-малата, Соединение 5A, при вплоть до приблизительно 100% энантиомерного избытка.
Вторичный амин в Соединении 5A защищают посредством защитной группы. Может применяться любая подходящая защитная группа, включая бензил, бензилоксикарбонил, ацетил, фенилкарбонил и трет-бутоксикарбонил. Метилирование свободной гидроксильной группы осуществляют метилирующим агентом, таким как диметилсульфат, метил-п-толуолсульфонат или метансульфонат. Соединение 8 получают посредством удаления защитных групп в кислых условиях. Подходящие агенты для снятия защиты включают моногидрат п-толуолсульфоновой кислоты. На Схеме 1, вторичный амин в Соединении 5А защищают трет-бутилоксикарбонильной группой, с получением Соединения 6, посредством обработки Boс2O. Соединение 6 далее метилируют, используя условия метилирования, такие как гексаметилдисилазан калия (KHMDS) и Me2SО4 с получением Соединения 7. Снятие защиты с неочищенного продукта проводят при ранее известных условиях (см. Схему 2) с получением Соединения 8 со стабильно высокой чистотой и выходом.
Как описано в Примерах 1 и 3, этот путь может быть успешно масштабирован для получения загрузок в лабораторном масштабе (масштаб от 100 г до 1 кг) и загрузок cGMP Соединения 8 при масштабе ~16 кг из доступного для приобретения Boc-3-пирролина (Соединение 1). Все загрузки в Примерах имели небольшую N-дезметил-примесь (Таблица 2). Другие родственные вещества также находились ниже пределов количественного обнаружения, равных приблизительно 0,1%. Энантиомерная чистота (определяемая посредством ВЭЖХ) Соединения 8 была также высокой (>99,8% эи). Новых примесей при исследовательских или масштабируемых с увеличением загрузках идентифицировано не было.
|
В некоторых вариантах осуществления, энантиомерное обогащение происходит во время кристаллизации Соединения 8. В некоторых вариантах осуществления, хиральная чистота Соединения 8 может быть увеличена посредством дополнительной кристаллизации.
В некоторых вариантах осуществления, Соединение 5A с таким низким эи как 90% переносят на дополнительную стадию для получения Соединения 8 с эи >99,5%.
Неполное метилирование Соединения 6 приводит в результате к O-дезметил-Соединению 6, как технологической примеси. Уровень этой примеси составлял ниже пределов количественного определения (<0,1%) при загрузках, показанных в Таблице 2. Для контроля этой примеси в способе оценивали два успешных подхода:
a. Внутрипроизводственный контроль на стадии метилирования (превращение Соединения 6 в Соединение 7). Пределы текущего внутрипроизводственного контроля составляли <2% Соединения 6 по ВЭЖХ. Когда загрузки Соединения 7, содержащие до 2% Соединения 6, переносили через получение Соединения 8 и выделение, уровни O-дезметил-Соединения 6 были ниже 0,1%.
b. Было показано, что удаление О-дезметил-Соединения 8 происходит во время кристаллизации Соединения 8. Следовательно, О-дезметил-Соединение 8, если образуется, может быть снижено посредством дополнительной кристаллизации.
На основании описанных способов, синтетический путь, иллюстрированный на Схеме 1 и описанный в Примере 1, является надежным для масштабирования, и может приводить к получению Соединения 8 со стабильно высокой химической и энантиомерной чистотой. Конкретно, этот путь позволяет получить Соединение 8 с небольшими, если присутствуют, ранее известными примесями (N-дезметил-Соединение 8) и (О-дезметил-Соединение 8) и не производит никаких новых примесей.
Соединение 8, полученное на Схеме 1, может дополнительно взаимодействовать с этиловым сложным эфиром 7-хлор-4-оксо-1-тиазол-2-ил-1,4-дигидро-[1,8]нафтиридин-3-карбоновой кислоты с получением SΝS-595, как описано в Примере 3. Полное аналитическое тестирование SNS-595, полученного посредством способа, описанного в данном документе, показало, что никаких обнаруживаемых новых примесей не было образовано.
В некоторых вариантах осуществления, SNS-595, полученный посредством способов, предоставленных в данном документе, содержит менее чем приблизительно 0,1% N-дезметил-SNS-595 и O-дезметил-SNS-595. В некоторых вариантах осуществления, SNS-595, полученный посредством способов, предоставленных в данном документе, содержит менее чем приблизительно 0,1% N-дезметил-SNS-595. В некоторых вариантах осуществления, SNS-595, полученный посредством способов, предоставленных в данном документе, содержит менее чем приблизительно 0,09, 0,08, 0,07, 0,06, 0,05, 0,04, 0,03, 0,02 или 0,01% N-дезметил-SNS-595. В некоторых вариантах осуществления, SNS-595, полученный посредством способов, предоставленных в данном документе, содержит менее чем приблизительно 0,1% O-дезметил-SNS-595. В некоторых вариантах осуществления, SNS-595, полученный посредством способов, предоставленных в данном документе, содержит менее чем приблизительно 0,09, 0,08, 0,07, 0,06, 0,05, 0,04, 0,03, 0,02 или 0,01% O-дезметил-SNS-595. В некоторых вариантах осуществления, SNS-595, полученный посредством способов, предоставленных в данном документе, содержит менее чем приблизительно 0,1% общего содержания N-дезметил-SNS-595 и O-дезметил-SNS-595. В некоторых вариантах осуществления, SNS-595, полученный посредством способов, предоставленных в данном документе, содержит менее чем приблизительно 0,09, 0,08, 0,07, 0,06, 0,05, 0,04, 0,03, 0,02 или 0,01% общего содержания N-дезметил-SNS-595 и O-дезметил-SNS-595.
В некоторых вариантах осуществления, способы, предоставленные в данном документе, являются применимыми при получении Вещества SNS-595 в технологическом масштабе. В некоторых вариантах осуществления, предоставленные способы являются применимыми при получении 0,1, 0,3, 0,5, 1, 2, 3, 4, 5, 7, 10, 15, 20, 25, 50 и 100 кг или более Вещества SNS-595.
5.4. СПОСОБЫ ПРИМЕНЕНИЯ
В данном документе предоставлены способы лечения, профилактики и/или контроля различных типов рака, включающие введение Вещества SNS-595, полученного в соответствии с описанными здесь способами. В некоторых вариантах осуществления, способы охватывают введение по существу чистого SNS-595. Примеры раковых заболеваний включают солидные опухоли и гемобластозы. Способы, предоставленные в данном документе, могут также применяться для лечения или профилактики предраковых состояний.
Соответственно, в данном документе предоставлены способы лечения, контроля, или профилактики раковых заболеваний или предраковых состояний, включающие введение дозы, приблизительно равной 10-100 мг/м2 Вещества SNS-595 субъекту, нуждающемуся в таком лечении, контроле или профилактике. Типы рака включают, но не ограничены ими, рак яичников, рак молочной железы, мелкоклеточный рак легких и немелкоклеточный рак легких. В одном варианте осуществления, рак представляет собой рецидивирующий рак. В одном варианте осуществления, рак представляет собой рефрактерный рак. В одном варианте осуществления, рак является резистентным к общепринятым терапиям. В одном варианте осуществления, рак представляет собой рак яичников, резистентный к общепринятым терапиям. В одном варианте осуществления, рак представляет собой устойчивый к платине эпителиальный рак яичников.
В одном варианте осуществления, способы, предоставленные в данном документе, охватывают лечение, профилактику или контроль разнообразных типов лейкемии у субъекта, таких как хроническая лимфоцитарная лейкемия (CLL), хроническая миелоцитарная лейкемия (CML), острая лимфобластная лейкемия (ALL), и острая миелогенная лейкемия (AML), или острая миелобластная лейкемия (AML).
В одном варианте осуществления, в данном документе предоставлены способы лечения острой миелоидной лейкемии. В одном варианте осуществления, предоставлены способы лечения рефрактерной или рецидивирующей острой миелоидной лейкемии.
Способы, предоставленные в данном документе, охватывают лечение пациентов, которых ранее лечили от рака, но которые оказались невосприимчивыми к стандартным терапиям, а также тех пациентов, которые прежде не проходили лечение. Также охвачены способы лечения пациентов, вне зависимости от возраста пациента, хотя некоторые заболевания или нарушения являются наиболее типичными в определенных возрастных группах. Дополнительно предоставлены способы лечения пациентов, которые прошли через хирургическое вмешательство в попытке лечения рассматриваемого заболевания или состояния, а также те пациенты, которые не подвергались операции. Поскольку онкологические пациенты имеют разнородные клинические проявления и изменчивые исходы болезни, лечение, предоставляемое пациенту, может изменяться в зависимости от его/ее прогноза. Квалифицированный клиницист сможет легко определить без чрезмерного экспериментирования конкретные вторичные средства, типы хирургического вмешательства, и типы не основанной на лекарственных средствах стандартной терапии, которые могут эффективно применяться для лечения индивидуального пациента с раковым заболеванием.
5.5. ДОЗИРОВКИ
В некоторых представительных вариантах осуществления, способ лечения, профилактики или контроля раковых заболеваний, предоставленный в данном документе, включает введение пациенту, на основании площади поверхности тела, дозы, равной приблизительно 10 мг/м2 - 100 мг/м2 Вещества SNS-595. В некоторых репрезентативных вариантах осуществления, способ лечения, профилактики или контроля рака, предоставленный в данном документе, включает введение пациенту на основании площади поверхности тела, дозы, равной приблизительно 10 мг/м 2 - 110 мг/м 2 Вещества SNS-595. В некоторых вариантах осуществления, способы охватывают введение по существу чистого SNS-595. В еще одном варианте осуществления, способ включает введение дозы, равной приблизительно 20 мг/м2 - 90 мг/м2 Вещества SNS-595. В еще одном варианте осуществления, способ включает введение дозы, равной приблизительно 40 мг/м - 80 мг/м2 Вещества SNS-595. В еще одном варианте осуществления, способ включает введение дозы, равной приблизительно 30 мг/м2 - 50 мг/м2 Вещества SNS-595. В еще одном варианте осуществления, способ включает введение дозы, равной приблизительно 50 мг/м2 - 110 мг/м2 Вещества SNS-595.
Квалифицированный специалист в области лечения рака обычно использует единицу дозирования, которая позволяет осуществлять аппроксимацию воздействия на субъект вводимого активного ингредиента. Например, используемая единица дозирования может аппроксимировать воздействие на основании расчета площади поверхности тела. Расчеты площади поверхности тела (ППТ) для человека могут проводиться, например, с использованием формулы Мостеллера:
ППТ (м2)=[(рост (см) × масса тела (кг)/3600]1/2.
Наиболее часто такую единицу дозирования выражают в миллиграммах активного соединения на квадратный метр площади поверхности тела (мг/м2).
Вводимая доза SNS-595 может быть выражена в единицах, отличных от мг/м2. Например, дозы могут быть выражены в миллиграммах активного соединения на килограмм массы тела (мг/кг). Специалист в данной области сможет легко узнать, как преобразовать дозу для пациента из мг/м2 в мг/кг, исходя из роста и/или массы тела пациента (см. http:///www.fda.gov/cder/cancer/ animalframe.htm). Например, доза, равная 1 мг/м 2 - 30 мг/м2, для человека с массой тела 65 кг приблизительно равна 0,026 мг/кг - 0,79 мг/кг. Могут также использоваться другие единицы дозирования.
В некоторых вариантах осуществления, вводимая доза Вещества SNS-595, предоставленного в данном документе, может быть доставлена в виде единичного болюса, (например, внутривенной инъекции) или в течение более длительного периода (например, непрерывная инфузия или периодические болюсные дозы). Введение Вещества SNS-595 может повторяться до тех пор, пока субъект не будет испытывать стабильное протекание заболевания или его регрессию, или до тех пор, пока субъект не будет испытывать развитие заболевания или неприемлемую токсичность. Стабильное протекание заболевания или его отсутствие определяют посредством методов, известных в данной области, таких как оценка симптомов, физическое обследование и с использованием других общепринятых параметров.
Количество Вещества SNS-595, вводимого в соответствии со способами, предоставленными в данном документе, будет зависеть от разнообразных факторов, таких как общее состояние здоровья пациента, проходящего лечение, тяжесть нарушения или симптом нарушения, вводимый активный ингредиент, способ введения, частота введения, другие присутствующие лекарственные препараты и заключение лечащего терапевта. Количество для введения может эмпирически определяться терапевтом.
В некоторых вариантах осуществления, частота введения находится в интервале от приблизительно суточной дозы до приблизительно месячной дозы. В некоторых вариантах осуществления, введение осуществляют однократно в день, однократно через день, однократно в неделю, дважды в неделю, три раза в неделю, однократно каждые две недели, однократно каждые три недели или однократно каждые четыре недели. В одном варианте осуществления, фармацевтические композиции, предоставленные в данном документе, вводят однократно в неделю в течение трех недель. В еще одном варианте осуществления, фармацевтические композиции, предоставленные в данном документе, вводят однократно в неделю в течение трех недель. В одном варианте осуществления, фармацевтические композиции, предоставленные в данном документе, вводят однократно каждые три недели. В еще одном варианте осуществления, фармацевтические композиции, предоставленные в данном документе, вводят однократно каждые четыре недели.
В некоторых вариантах осуществления, Вещество SNS-595, предоставленное в данном документе, вводят пациенту в течение одного или более циклов введения. Циклическая терапия включает введение одной или более доз Вещества SNS-595 с последующим периодом покоя и повтор этого цикла введение/покой. Циклическая терапия может снизить резистентность к одной или более терапий, позволяет избежать или снизить побочные эффекты одной или более терапий и/или улучшить эффективность действия или продолжительность лечения.
Следовательно, в одном варианте осуществления, Вещество SNS-595, предоставленное в данном документе, вводят однократно в неделю, в одной дозе или в разделенных дозах, в течение трех-шестинедельного цикла периодом покоя от приблизительно 1 до приблизительно 30 днями между дозами. В некоторых вариантах осуществления, период ожидания составляет 14 дней, причем первую дозу дают в день 1, а следующую дозу дают в день 15. Лечение в таких случаях, можно, таким образом, сказать проводится с использованием "14-дневного цикла". В некоторых вариантах осуществления, дозы могут даваться через 28 дней, т.е., при 28-дневном цикле.
В еще одном варианте осуществления, способ дозирования включает цикл, где цикл включает введение дозы Вещества SNS-595 пациенту один раз в неделю в течение трех недель с последующим периодом, равным, по меньшей мере, 14 дням, в котором пациенту не вводят никакого соединения или композиции и, где цикл повторяют множество раз. В еще одном варианте осуществления, период, в который не вводят никаких соединения или композиции, составляет 18 дней. В еще одном варианте осуществления, период, в который не вводят никаких соединения или композиции, составляет 21 дней. В еще одном варианте осуществления, период, в который не вводят никаких соединения или композиции, составляет 28 дней. Частота, число и продолжительность циклов дозирования могут быть увеличены или снижены.
В одном варианте осуществления, способ предоставленный в данном документе, включает: i) введение дозы, равной приблизительно 40-80 мг/м2 Вещества SNS-595, предоставленного в данном документе, пациенту; ii) период ожидания, равный, по меньшей мере, шести дням, где пациенту не вводят никакого Вещества SNS-595; и iii) введение еще одной дозы, равной приблизительно 40-80 мг/м2 Вещества SNS-595, пациенту. В одном варианте осуществления, стадии ii)-iii) повторяют множество раз.
В одном варианте осуществления, способ, предоставленный в данном документе, включает: i) введение дозы, равной приблизительно 30-50 мг/м2 Вещества SNS-595, предоставленного в данном документе, пациенту; ii) период ожидания, равный, по меньшей мере, шести дням, в который пациенту не вводят никакого Вещества SNS-595; и iii) введение еще одной дозы, равной приблизительно 30-50 мг/м2 Вещества SNS-595, пациенту. В одном варианте осуществления, стадии ii)-iii) повторяют множество раз.
В одном варианте осуществления, способ, предоставленный в данном документе, включает: i) введение дозы, равной приблизительно 50-110 мг/м2 Вещества SNS-595, предоставленного в данном документе, пациенту; ii) период ожидания, равный, по меньшей мере, шести дням, где пациенту не вводят никакого Вещества SNS-595; и iii) введение еще одной дозы, равной приблизительно 50-110 мг/м2 Вещества SNS-595, пациенту. В одном варианте осуществления, стадии ii)-iii) повторяют множество раз.
В еще одном варианте осуществления, способ включает введение дозы, равной приблизительно 40 мг/м2, приблизительно 45 мг/м2, приблизительно 48 мг/м2, приблизительно 50 мг/м2, приблизительно 60 мг/м2, приблизительно 72 мг/м2, приблизительно 75 мг/м2, приблизительно 80 мг/м2, или приблизительно 90 мг/м2 Вещества SNS-595, предоставленного в данном документе, на каждой из указанных выше стадий i) и iii).
В еще одном варианте осуществления в данном документе предоставлен способ лечения солидных опухолей, включающий введение дозы, равной приблизительно 48 мг/м2 Вещества SNS-595, предоставленного в данном документе, пациенту однократно каждые три недели. В еще одном варианте осуществления в данном документе предоставлен способ лечения таких солидных опухолей, включающий введение дозы, равной приблизительно 60 мг/м2 Вещества SNS-595, предоставленного в данном документе, пациенту однократно каждые четыре недели. В еще одном варианте осуществления в данном документе предоставлен способ лечения таких солидных опухолей, включающий введение дозы, равной приблизительно 75 мг/м2 Вещества SNS-595, предоставленного в данном документе, пациенту однократно каждые четыре недели. В таких вариантах осуществления, способ может применяться для лечения рака яичников, такого как резистентный к платине эпителиальный рак яичников.
В еще одном варианте осуществления, в данном документе предоставлен способ лечения лейкемии, включающий введение дозы, равной приблизительно 50 мг/м2 Вещества SNS-595, предоставленного в данном документе, пациенту однократно в неделю. В еще одном варианте осуществления, в данном документе предоставлен способ лечения лейкемии, включающий введение дозы, равной приблизительно 60 мг/м2 Вещества SNS-595, предоставленного в данном документе, пациенту однократно в неделю. В еще одном варианте осуществления, в данном документе предоставлен способ лечения лейкемии, включающий введение дозы, равной приблизительно 72 мг/м2 Вещества SNS-595, предоставленного в данном документе, пациенту однократно в неделю. В еще одном варианте осуществления, в данном документе предоставлен способ лечения лейкемии, включающий введение дозы, равной приблизительно 72 мг/м2 Вещества SNS-595, предоставленного в данном документе, пациенту однократно в неделю в течение двух недель. В еще одном варианте осуществления, в данном документе предоставлен способ лечения лейкемии, включающий введение дозы, равной приблизительно 72 мг/м2 Вещества SNS-595, предоставленного в данном документе, пациенту однократно в неделю в течение трех недель. В еще одном варианте осуществления, в данном документе предоставлен способ лечения лейкемии, включающий введение дозы, равной приблизительно 90 мг/м2 Вещества SNS-595, предоставленного в данном документе, пациенту однократно в неделю в течение трех недель. В еще одном варианте осуществления, в данном документе предоставлен способ лечения лейкемии, включающий введение дозы, равной приблизительно 40 мг/м2 Вещества SNS-595, предоставленного в данном документе, пациенту дважды в неделю. В одном варианте осуществления, способ предназначен для лечения острой миелоидной лейкемии.
В некоторых вариантах осуществления, способ дозирования включает введение субъекту дозы Вещества SNS-595 дважды в неделю в течение двух недель (дозирование по дням 1, 4, 8 и 11). В еще одном варианте осуществления, способ дозирования включает введение однократно в неделю дозы Вещества SNS-595 субъекту. В еще одном варианте осуществления, способ дозирования включает введение дозы Вещества SNS-595 субъекту однократно каждые две недели. В еще одном варианте осуществления, способ дозирования включает введение дозы Вещества SNS-595 субъекту однократно каждые три недели. В еще одном варианте осуществления, способ дозирования включает введение дозы Вещества SNS-595 субъекту однократно каждые четыре недели.
В одном варианте осуществления, дозу, равную приблизительно 40-80 мг/м2 Вещества SNS-595, вводят пациенту однократно каждые три недели, где трехнедельный период включает цикл лечения, и цикл лечения повторяют, по меньшей мере, один раз. В еще одном варианте осуществления, способ включает введение дозы, равной приблизительно 40-80 мг/м2 Вещества SNS-595, пациенту однократно каждые четыре недели, где четырехнедельный период включает цикл лечения, и цикл лечения повторяют, по меньшей мере, один раз. В еще одном варианте осуществления, способ включает введение дозы, равной приблизительно 48 мг/м2 Вещества SNS-595, пациенту однократно каждые три недели, где трехнедельный период включает цикл лечения, и цикл лечения повторяют, по меньшей мере, один раз. В еще одном варианте осуществления, способ включает введение дозы, равной приблизительно 60 мг/м2 Вещества SNS-595, пациенту однократно каждые четыре недели, где четырехнедельный период включает цикл лечения, и цикл лечения повторяют, по меньшей мере, один раз. В еще одном варианте осуществления, способ включает введение дозы, равной приблизительно 75 мг/м2 Вещества SNS-595, пациенту однократно каждые четыре недели, где четырехнедельный период включает цикл лечения, и цикл лечения повторяют, по меньшей мере, один раз. В одном варианте осуществления, способ включает введение дозы, равной приблизительно 40-80 мг/м2 Вещества SNS-595, пациенту однократно в неделю где однонедельный период включает цикл лечения, и цикл лечения повторяют, по меньшей мере, три раза. В одном варианте осуществления, способ включает введение дозы, равной приблизительно 50-110 мг/м2 Вещества SNS-595, пациенту однократно в неделю, где однонедельный период включает цикл лечения, и цикл лечения повторяют, по меньшей мере, три раза. В еще одном варианте осуществления, способ включает введение дозы, равной приблизительно 30-50 мг/м2 Вещества SNS-595, пациенту дважды в неделю, где однонедельный период включает цикл лечения, и цикл лечения повторяют, по меньшей мере, два раза. В еще одном варианте осуществления, доза составляет приблизительно 50 мг/м2 Вещества SNS-595 однократно в неделю, где однонедельный период включает цикл лечения и цикл лечения повторяют, по меньшей мере, три раза. В еще одном варианте осуществления, доза составляет приблизительно 60 мг/м2 Вещества SNS-595 однократно в неделю, где однонедельный период включает цикл лечения, и цикл лечения повторяют, по меньшей мере, три раза. В еще одном варианте осуществления, доза составляет приблизительно 72 мг/м2 Вещества SNS-595 однократно в неделю, где однонедельный период включает цикл лечения, и цикл лечения повторяют, по меньшей мере, три раза. В еще одном варианте осуществления, доза составляет приблизительно 90 мг/м2 Вещества SNS-595 однократно в неделю, где однонедельный период включает цикл лечения, и цикл лечения повторяют, по меньшей мере, три раза. В еще одном варианте осуществления, способ включает введение дозы, равной 40 мг/м2 Вещества SNS-595, пациенту дважды в неделю, где однонедельный период включает цикл лечения, и цикл лечения повторяют, по меньшей мере, два раза. В некоторых вариантах осуществления, способы охватывают введение по существу чистого SNS-595.
Все способы и дозировки, описанные в данном документе, являются применимыми к лечению или профилактике рака или предракового состояния.
5.6. ВТОРЫЕ АКТИВНЫЕ СРЕДСТВА
Следует также учитывать, что Вещество SNS-595 и фармацевтические композиции, содержащие Вещество SNS-595, полученное в соответствии со способом, описанным в данном документе, могут использоваться в комплементарных комбинированных терапиях с другими активными средствами или медицинскими процедурами. В некоторых вариантах осуществления, в комбинированных терапиях применяют по существу чистое SNS-595.
Вещество SNS-595 и его фармацевтические композиции могут вводиться одновременно с введением, перед или после введения, одного или более других желательных активных средств или медицинских процедур. При проведении конкретных комбинированных терапий (средств или процедур) для использования в комбинированном режиме следует учитывать совместимость желательных терапевтических средств и/или процедур и достигаемый желательный терапевтический эффект. Следует также учитывать, что используемые терапии могут достигать желательного эффекта для одного и того же нарушения (например, Вещество SNS-595 может вводиться одновременно с еще одним активным средством, используемым для лечения такого же нарушения), или они могут достигать различных эффектов (например, контроль любых неблагоприятных эффектов). Неограничивающие примеры таких средств и процедур включают хирургическое вмешательство, лучевую терапию (например, гамма-облучение, нейтронно-лучевую радиотерапию, электронно-лучевую радиотерапию, протонную терапию, брахитерапию и системное введение радиоизотопов), эндокринную терапию, использование модификаторов биологического ответа (интерферонов, интерлейкинов и фактора некроза опухолей (TNF), чтобы привести несколько примеров), гипертермию и криотерапию, средства для ослабления каких-либо неблагоприятных эффектов (например, противорвотных средств), и другие разрешенные к применению химиотерапевтические противораковые средства.
Примеры химиотерапевтических противораковых средств, которые могут использоваться в качестве второго активного средства в комбинации с Веществом SNS-595, включают, но не ограничены ими, алкилирующие агенты (например, мехлорэтамин, хлорамбуцил, циклофосфамид, мелфалан, ифосфамид), антиметаболиты (например, метотрексат), ингибиторы киназы авроры (например, SNS-314), пуриновые антагонисты и пиримидиновые антагонисты (например, 6-меркаптопурин, 5-фторурацил (5-FU), цитарабин (Ara-C), гемцитабин), веретенные яды (например, винбластин, винкристин, винорелбин, паклитаксел), подофиллотоксины (например, этопозид, иринотекан, топотекан), антибиотики (например, доксорубицин, даунорубицин, блеомицин, митомицин), нитрозомочевины (например, кармустин, ломустин), неорганические ионы (например, комплексы платины, такие как цисплатин, карбоплатин), ферменты (например, аспарагиназа), гормоны (например, тамоксифен, леупролид, флутамид и мегэстрол), ингибиторы топоизомеразы II или яды, ингибиторы EGFR (Herl, ErbB-1) (например, гефитиниб), антитела (например, бевацизумаб, ритуксимаб), IMIDs (например, талидомид, леналидомиб), разнообразные направленные средства (например, ингибиторы HDAC, такие как вориностат), ингибиторы Bcl-2, ингибиторы VEGF, ингибиторы протеасом (например, бортезомиб), ингибиторы циклин-зависимой киназы (cdk) (например, SNS-032, селициклиб) и дексаметазон.
В одном варианте осуществления, примеры химиотерапевтических противораковых средств, которые могут использоваться в качестве второго активного средства в комбинации с Веществом SNS-595, включают доцетаксел, винорелбин, капецитабин, доксорубицин, госерели, золедроновую кислоту, паклитаксел, памидронат, анастрозол, эксеместан, циклофосфамид, эпирубицин, фулвестрант, летрозол, гемцитабин, леупролид, филграстим (G-CSF или ганулоцитарный колоние-стимулирующий фактор), торемифен, тамоксифен, пегфилграстим, эпоэтин альфа и дарбепоэтин альфа. В некоторых вариантах осуществления, SNS-595 в комбинации с этими вторыми средствами может применяться для лечения рака молочной железы.
Некоторые конкретные противораковые средства, которые могут применяться в комбинации с Веществом SNS-595, включают, но не ограничены ими: цитарабин, карбоплатин, цисплатин, гемцитабин и комбинации любых двух или более из них.
5.7. КОМБИНИРОВАННАЯ ТЕРАПИЯ СО ВТОРЫМ АКТИВНЫМ СРЕДСТВОМ
В некоторых вариантах осуществления, способ, предоставленный в данном документе, включает введение Вещества SNS-595 или фармацевтических композиций предоставленных в данном документе, в комбинации с одним или более из вторых активных средств и/или в комбинации с лучевой терапией или оперативным вмешательством. В некоторых вариантах осуществления, способы охватывают введение по существу чистого SNS-595 в комбинации с одним или более из вторых активных средств, и/или в комбинации с лучевой терапией или оперативным вмешательством.
Введение Вещества SNS-595 и вторых активных средств пациенту может происходить одновременно или последовательно посредством одного и того же или различных путей введения. Пригодность конкретного пути введения, используемого для конкретного активного средства, будет зависеть от самого активного средства (например, от того, может ли оно вводиться перорально без разложения перед попаданием в кровоток) и заболевания, которое лечат. Рекомендованные пути введения для вторых активных средств известны рядовому специалисту в данной области. См. например, Physicians' Desk Reference, 1755-1760 (56th ed., 2002) (далее здесь именуемую "Physicians' Desk Reference").
В одном варианте осуществления, второе активное средство вводят внутривенно или подкожно и один раз или дважды ежедневно в количестве от приблизительно 1 до приблизительно 1000 мг, от приблизительно 5 до приблизительно 500 мг, от приблизительно 10 до приблизительно 375 мг или от приблизительно 50 до приблизительно 200 мг.
В еще одном варианте осуществления, в данном документе предоставлены способы лечения, профилактики и/или контроля гемобластозов, которые включают введение Вещества SNS-595, предоставленного в данном документе, в сочетании с (например, перед, во время или после) общепринятой терапией включающей, но не ограничиваясь ими, хирургическое вмешательство, иммунотерапию, биологическую терапию, лучевую терапию или другую, не основанную на лекарственных средствах терапию, применяемую в настоящее время для лечения, профилактики или контроля рака.
В одном варианте осуществления, Вещество SNS-595 может вводиться в количестве приблизительно 10-100 мг/м2, 20-90 мг/м2, 40-80 мг/м2 или 30-50 мг/м2, по отдельности или в комбинации со вторым активным средством, раскрытым в данном документе (см., например, раздел 4.6), перед применением, во время или после применения общепринятой терапии.
В одном варианте осуществления, второе средство выбирают из группы, состоящей из цитарабина, карбоплатина, цисплатина, гемцитабина и сочетаний любых двух или более из них.
В некоторых вариантах осуществления, Вещество SNS-595 можно вводить в комбинации с приблизительно от 5 до 1500 мг/м2 цитарабина. Например, один вариант осуществления включает непрерывное ежедневное введение цитарабина при дозе, равной приблизительно от 200 до 400 мг/м2. Введение цитарабина может быть проведено посредством внутривенной инфузии, внутривенного струйного введения, болюсной инъекции или подкожной инъекции. В некоторых вариантах осуществления, введение цитарабина осуществляют ежедневно, например, в течение 5 дней, в то время как введение SNS-595 производят однократно или дважды в неделю. Как обсуждается в данном документе, введение SNS-595 и цитарабина, как изложено выше, в течение недели считают недельным циклом. Способы охватывают проведение одного недельного цикла, с периодом ожидания от одной недели до нескольких недель, где ни цитарабин, ни SNS-595 не вводятся, затем повторяя недельный цикл. Способы также предусматривают повторение недельных циклов непрерывно, например, в течение 4 недель или 28 дней. Дополнительно, способы предусматривают повторение цикла в течение нескольких циклов, с периодом ожидания от недели до нескольких недель, где ни цитарабин, ни Вещество SNS-595 не вводятся, затем повторяя один или более циклов. Окончательно, способы предоставляют введение Вещества SNS-595/цитарабина с недельным циклом, с последующим циклом введения только цитарабина или SNS-595.
Также предоставлены способы, в которых ежедневное введение цитарабина представляет собой введение при дозе, равной приблизительно 5-50 мг/м2, и, где Вещество SNS-595 вводят один раз в неделю или дважды в неделю. Например, цитарабин можно вводить ежедневно в течение 10 дней, а Вещество SNS-595 можно вводить по графику один раз в неделю в течение трех недель или дважды в неделю в течение двух недель.
Применение Вещества SNS-595 с цитарабином может использоваться, например, при лечении лейкемий, таких как острая миелоидная лейкемия. В одном примерном варианте осуществления может применяться цикл лечения, который включает введение пациенту приблизительно 20-90 мг/м2 или приблизительно 40-80 мг/м2 Вещества SNS-595 в дни 1 и 4 28-дневного цикла, и введение пациенту приблизительно 400 мг/м2 цитарабина в дни 1-5 цикла. В таком способе, дозы Вещества SNS-595 можно вводить посредством внутривенной (IV) инъекции, а дозы цитарабина посредством непрерывной внутривенной (CIV) инфузии. В альтернативном примерном варианте осуществления, пациент, имеющий AML, может подвергаться лечению с использованием цикла лечения, включающего введение пациенту приблизительно 20-90 мг/м2 или приблизительно 40-80 мг/м2 Вещества SNS-595 в дни 1 и 4, и введение пациенту приблизительно 1000 мг/м2/день в дни 1-5. В таком способе, дозы Вещества SNS-595 можно вводить посредством IV инъекции, и дозы цитарабина посредством IV инфузии в течение двух часов.
В одном варианте осуществления, комбинированная терапия включает введение Вещества SNS-595 и карбоплатина. В одном варианте осуществления, комбинированная терапия включает введение Вещества SNS-595 и цисплатина. В одном варианте осуществления, комбинированная терапия включает введение Вещества SNS-595 и гемцитабина.
В одном варианте осуществления, предоставленные способы включают введение Вещества SNS-595 в комбинации с приблизительно от 5 мг/м2 до приблизительно 200 мг/м2 цисплатина. Например, один вариант осуществления включает введение цисплатина при дозе, равной приблизительно 50 или 70 мг/м2 однократно каждые от 3 до 4 недель. Один вариант осуществления включает введение цисплатина при дозе, равной приблизительно 50 или 70 мг/м2 однократно каждые 3 недели. Еще один вариант осуществления включает введение цисплатина при дозе, равной приблизительно 75 или 100 мг/м2 однократно каждые 3 недели. В еще одном варианте осуществления, введение цисплатина осуществляют при дозе, равной приблизительно 20 мг/м2 ежедневно в течение до 5 дней. Введение цисплатина может быть проведено посредством внутривенной инфузии, внутривенного струйного введения, болюсной инъекции или подкожной инъекции. В одном варианте осуществления, введение цисплатина осуществляют однократно каждые 3-4 недели, в то время как введение Вещества SNS-595 производят однократно в неделю в течение трех недель или однократно каждые три недели. В одном варианте осуществления, введение цисплатина производят ежедневно в течение 5 дней, в то время как введение Вещества SNS-595 производят однократно в неделю в течение трех недель или однократно каждые три недели. В одном варианте осуществления, введение цисплатина осуществляют однократно в неделю в течение 3 недель, в то время как введение Вещества SNS-595 производят однократно в неделю в течение трех недель или однократно каждые три недели.
В одном варианте осуществления, предоставленные способы включают введение Вещества SNS-595 в комбинации с приблизительно от 50 мг/м2 до приблизительно 400 мг/м2 карбоплатина. Например, один вариант осуществления включает введение карбоплатина при дозе, равной приблизительно 300 или приблизительно 360 мг/м2 однократно каждые 3 недели. Один вариант осуществления включает введение карбоплатина при дозе, равной приблизительно 300 или 360 мг/м2 однократно каждые 4 недели. Введение карбоплатина может быть проведено посредством внутривенной инфузии, внутривенного струйного введения, болюсной инъекции или подкожной инъекции. В одном варианте осуществления, введение карбоплатина осуществляют однократно каждые 3 недели, в то время как введение Вещества SNS-595 производят однократно в неделю в течение трех недель или однократно каждые три недели. В одном варианте осуществления, введение карбоплатина осуществляют однократно в неделю в течение 3 недель, в то время как введение Вещества SNS-595 производят однократно в неделю в течение трех недель или однократно каждые три недели.
В одном варианте осуществления, предоставленные способы включают введение Вещества SNS-595 в комбинации с приблизительно от 100 мг/м2 до приблизительно 1500 мг/м2 гемцитабина. Например, один вариант осуществления включает введение гемцитабина при дозе, равной приблизительно 1000 или 1250 мг/м2 однократно каждую неделю в течение, по меньшей мере, 4 недель. Введение гемцитабина может быть проведено посредством внутривенной инфузиии, внутривенного струйного введения, болюсной инъекции или подкожной инъекции. В одном варианте осуществления, введение гемцитабина осуществляют однократно в неделю в течение до 4 недель, в то время как введение Вещества SNS-595 производят однократно в неделю в течение трех недель или однократно каждые три недели. В одном варианте осуществления, введение гемцитабина производят дважды в неделю в течение 2 недель, в то время как введение Вещества SNS-595 производят однократно в неделю в течение трех недель.
В некоторых вариантах осуществления, второе активное средство вводят совместно с Веществом SNS-595, предоставленным в данном документе, или вводят с задержкой 1-50 часов. В некоторых вариантах осуществления, Вещество SNS-595, предоставленное в данном документе, вводят первым с последующим введением второго активного средства с задержкой 1-50 часов. В других вариантах осуществления, второе активное средство вводят первым с последующим введением Вещества SNS-595, предоставленного в данном документе, с задержкой 1-50 часов. В некоторых вариантах осуществления, задержка составляет 24 часа.
В еще одном варианте осуществления, способ, предоставленный в данном документе, включает: a) введение пациенту, нуждающемуся в лечении, дозы, равной приблизительно 10-100 мг/м2 Вещества SNS-595, предоставленного в данном документе, и b) введение терапевтически эффективного количества средства поддерживающей терапии.
Средство поддерживающей терапии представляет собой любое вещество, которое лечит, предотвращает, контролирует, позволяет избежать или снижает неблагоприятный или нежелательный эффект от лечения Веществом SNS-595, предоставленным в данном документе, и которое вводят в соответствии с необходимым режимом дозирования для этого вещества. Например, различные средства поддерживающей терапии для лечения тошноты имеют различный режим дозирования. В то время как некоторые такие средства вводят профилактически, другие вводят совместно с соединением или композицией, предоставленными в данном документе, в то время как еще другие вводят после введения SNS-595. Иллюстративные примеры средств поддерживающей терапии, их дозы и режимы дозирования можно найти в Physicians' Desk Reference. Некоторые примерные средства поддерживающей терапии раскрыты в Заявке США № публикации 2006-0025437, которая включена посредством ссылки во всей своей полноте.
5.8. ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ДОЗИРОВАННЫЕ ФОРМЫ
В способах, предоставленных в данном документе, применяют фармацевтические композиции, содержащие Вещество SNS-595, предоставленное в данном документе, и фармацевтически приемлемые носители, такие как разбавители или адъюванты или в комбинации с другим активным ингредиентом, таким как еще одно противораковое средство. В определенном варианте осуществления, способы охватывают применение фармацевтических композиций, содержащих по существу чистое SNS-595. В клинической практике, Вещество SNS-595 можно вводить посредством любого общепринятого пути, включая, но не ограничиваясь ими, пероральный, парентеральный, ректальный или посредством ингаляции (например, в форме аэрозолей). Парентеральные дозированные формы могут вводиться пациентам посредством разнообразных путей, включая, но не ограничиваясь ими, подкожный, внутривенный (включая болюсную инъекцию), внутримышечный и внутриартериальный. Поскольку их введение обычно обходит природные защитные барьеры пациентов против загрязнений, парентеральные дозированные формы являются стерильными или обладают способностью к стерилизации перед введением пациенту. Примеры парентеральных дозированных форм включают, но не ограничены ими, готовые растворы для инъекций, сухие продукты, готовые для растворения или суспендирования в фармацевтически приемлемой среде для инъекции, готовые суспензии для инъекции и эмульсии. В одном варианте осуществления Вещество SNS-595 вводят посредством IV (внутривенной) инъекции.
Фармацевтические композиции для парентерального введения могут представлять собой эмульсии или гомогенные растворы. Подходящие среды, которые могут применяться для получения парентеральных дозированных форм, хорошо известны квалифицированным специалистам в области. Примеры включают, но не ограничены ими: Вода для Инъекции USP; водные среды, такие как, но не ограничиваясь ими, Хлорид Натрия для Инъекций, раствор Рингера для Инъекций, Декстроза для Инъекций, Декстроза и Хлорид Натрия для Инъекций и Раствор Рингера с Лактатом для Инъекций; смешивающиеся с водой среды, такие как, но не ограничиваясь ими, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные среды, такие как, но не ограничиваясь ими, минеральное масло, масло животного, растительного или синтетического происхождения, такое как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п., этилолеат, изопропилмиристат и бензилбензоат.
Эти фармацевтические композиции могут также содержать адъюванты, конкретно, увлажняющие, изотонизирующие, эмульгирующие, диспергирующие и стабилизирующие средства. Стерилизация может проводиться несколькими способами, например, с использованием 0,2 микронного фильтра, посредством облучения или посредством нагрева (см. Remington's Pharmaceutical Sciences, 21st ed., Mack Publishing, Easton, PA (2005) (далее в данном документе "Remington's Pharmaceutical Sciences"). Их также можно получать в форме стерильных твердых фармацевтических композиций, которые можно растворять во время применения в стерильной воде или любой другой стерильной среде для инъекций.
Фармацевтические композиции могут применяться при получении индивидуальных, однократных единичных дозированных форм. Фармацевтические композиции и дозированные формы содержат соединение и один или более эксципиентов.
Фармацевтические композиции и дозированные формы могут также содержать один или более дополнительных активных ингредиентов. Примеры необязательных второго или дополнительного активных ингредиентов раскрыты в данном документе.
В некоторых вариантах осуществления, фармацевтическая композиция, предоставленная в данном документе, представляет собой единичную стандартную дозированную форму. Фармацевтические композиции и единичные стандартные дозированные формы, предоставленные в данном документе, содержат профилактически или терапевтически эффективное количество соединения или композиции, и обычно один или более фармацевтически приемлемых носителей или эксципиентов. Термин "носитель" относится к разбавителю, адъюванту (например, адъюванту Фрейнда (полному и неполному)), эксципиенту или среде, с которой вводят терапевтическое средство. Примеры подходящих фармацевтических носителей описаны в Remington's Pharmaceutical Sciences.
Типовые фармацевтические композиции и дозированные формы содержат один или более эксципиентов. Подходящие эксципиенты хорошо известны квалифицированным специалистам в области фармации, и неограничивающие примеры подходящих эксципиентов включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рисовую муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое снятое молоко, глицерин, пропиленгликоль, воду, этанол и т.п. Является ли конкретный эксципиент подходящим для введения в фармацевтическую композицию или дозированную форму зависит от разнообразных факторов, хорошо известных в области, включая, но не ограничиваясь ими, путь, которым дозированная форма будет вводиться субъекту и конкретные активные ингредиенты в дозированной форме. Фармацевтическая композиция или единичная стандартная дозированная форма, по желанию, могут также содержать минорные количества увлажняющих или эмульгирующих средств или pH буферных средств.
Соединения, которые увеличивают растворимость одного или более активных ингредиентов, раскрытых в данном документе, могут также вводиться в парентеральные дозированные формы. Например, циклодекстрин и его производные могут применяться для увеличения растворимости активных ингредиентов. См. например, Патент США № 5134127, который включен здесь посредством ссылки.
pH фармацевтической композиции или дозированной формы может также регулироваться для улучшения доставки одного или более активных ингредиентов. Аналогично, полярность растворителя-носителя, его ионная сила или тоничность могут регулироваться для улучшения доставки. Соединения, такие как стеараты, могут также добавляться в фармацевтические композиции или дозированные формы для благоприятного изменения гидрофильности или липофильности одного или более активных ингредиентов, таким образом, чтобы улучшить доставку. В этой связи, стеараты могут служить в качестве липидной среды для готовой формы, в качестве эмульгатора или поверхностно-активного средства и в качестве улучшающего доставку или улучшающего проницаемость средства. Различные соли, гидраты или сольваты активных ингредиентов могут применяться для дополнительного регулирования свойств полученной в результате фармацевтической композиции.
Дополнительно в данном документе предоставлены фармацевтические композиции и дозированные формы, которые содержат одно или более соединений, которые снижают скорость, с которой будет распадаться активный ингредиент. Такие соединения, которые здесь называют "стабилизаторы", включают, но не ограничены ими, антиоксиданты, такие как аскорбиновая кислота, pH буферы или солевые буферы.
Фармацевтические композиции и единичные стандартные дозированные формы могут принимать форму растворов, суспензий, эмульсии, порошков и т.п. Такие композиции и лекарственные формы будут содержать профилактически или терапевтически эффективное количество профилактического или терапевтического средства, в некоторых вариантах осуществления, в очищенной форме, вместе с подходящим количеством носителя, таким образом, чтобы получить форму для должного введения субъекту. Готовая дозированная форма должна подходить для режима введения. В одном варианте осуществления, фармацевтические композиции или единичные стандартные дозированные формы являются стерильными и в подходящей форме для введения человеку или другому субъекту.
Фармацевтическую композицию, предоставленную в данном документе, составляют так, чтобы она была совместимой с предназначенным путем для введения. Примеры путей введения включают, но не ограничены ими, парентеральные пути (т.е., отличные от путей через пищеварительный тракт), например, внутривенное, внутрикожное, подкожное, внутримышечное, посредством ингаляции, интраназальное, чрескожное, местное, чресслизистое, внутриопухолевое и внутрисуставное введение. В конкретном варианте осуществления, композицию составляют в соответствии с рутинными методиками как фармацевтическую композицию, адаптированную для внутривенного, подкожного, внутримышечного, интраназального или местного введения людям. В некоторых вариантах осуществления, фармацевтическую композицию составляют в соответствии с рутинными методиками для подкожного введения людям. В одном варианте осуществления, фармацевтические композиции для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. Где необходимо, фармацевтическая композиция может также включать солюбилизирующее средство и местный анестетик, такой как лигнокаин для снижения боли в месте инъекции.
Примеры дозированных форм включают, но не ограничены ими: жидкие дозированные формы, подходящие для парентерального введения субъекту; и стерильные твердые вещества (например, кристаллические или аморфные твердые вещества), которые могут быть ресуспендированы с получением жидких дозированных форм, подходящих для парентерального введения субъекту. Примерная твердая форма представляет собой лиофилизированное твердое вещество.
Фармацевтическая композиция, форма и тип дозированных форм, предоставленных в данном документе, будут обычно изменяться в зависимости от их применения. Например, дозированная форма, применяемая при начальном лечении заболевания, может содержать большее количество одного или более активных ингредиентов, которые она содержит, чем дозированная форма, применяемая при поддерживающем лечении этой же инфекции. Аналогично, парентеральная дозированная форма может содержать меньшее количество одного или более активных ингредиентов, которые она содержит, чем пероральная дозированная форма, применяемая для лечения того же заболевания или нарушения. Эти и другие пути, посредством которых конкретные дозированные формы, охваченные здесь, будут видоизменяться одна к другой, будут явно очевидными для квалифицированных специалистов в области. См. например, Remington's Pharmaceutical Sciences.
В целом, ингредиенты фармацевтических композиций, предоставленные в данном документе, доставляются либо раздельно или смешиваются вместе в единичной стандартной дозированной форме, например, в виде сухого лиофилизированного порошка или не содержащего воду концентрата в герметически закрытом контейнере, таком как ампула или пакет-саше, с указанием количества активного средства. В тех случаях, где фармацевтическую композицию вводят посредством инфузии, ее можно распределять с помощью инфузионной бутыли, содержащей стерильные воду с фармацевтической степенью чистоты или физиологический раствор. Там, где фармацевтическую композицию вводят посредством инъекции, ампула со стерильной водой для инъекций или физиологический раствор могут быть предоставлены таким образом, что ингредиенты могут быть смешаны перед введением. В одном варианте осуществления, дозированные формы, предоставленные в данном документе, содержат достаточное количество Вещества SNS-595, чтобы обеспечить введение дозы Вещества SNS-595 в интервале приблизительно 10-100 мг/м2 в день или в неделю, вводимой как единичная доза однократно в день или как разделенные дозы на протяжении дня, необязательно принимаемые с пищей.
В некоторых вариантах осуществления, фармацевтические дозированные формы, предоставленные в данном документе, содержат первичный контейнер, содержащий Вещество SNS-595. В некоторых вариантах осуществления, первичный контейнер находится внутри светонепроницаемого вторичного контейнера. В одном варианте осуществления, первичный контейнер представляет собой стеклянный пузырек, так как прозрачный стеклянный пузырек, а вторичный контейнер представляет собой светонепроницаемый ламинированный конверт, включая светонепроницаемый металлический ламинированный конверт, такой как светонепроницаемый алюминиевый ламинированный конверт. В одном варианте осуществления, фармацевтические дозированные формы, предоставленные в данном документе, включают прозрачный стеклянный пузырек, содержащий Вещество SNS-595, где прозрачный стеклянный пузырек находится внутри светонепроницаемого алюминиевого ламинированного конверта. Дополнительно, примерные фармацевтические дозированные формы включают формы, описанные в WO 2008/016668, включенной посредством ссылки во всей своей полноте. В одном варианте осуществления, дозированные формы, предоставленные в данном документе, содержат приблизительно 1-2000, 1-1000, 1-500, 1-300, 1-100 или 1-50 мг Вещества SNS-595. Конкретные дозированные формы, предоставленные в данном документе, содержат приблизительно 10, 15, 18, 20, 24, 25, 30, 40, 48, 50, 60, 70, 72, 75, 80, 90, 100, 150, 200, 300 или 500 мг Вещества SNS-595.
6. ПРИМЕРЫ
Некоторые варианты осуществления заявленного объекта изобретения иллюстрированы посредством следующих неограничивающих примеров.
В примерах используют следующие сокращения:
BOC2O = ди-трет-бутил-дикарбонат
KHMDS = гексаметилдисилазан калия
DBDMH = 1,3-дибром-5,5-диметилгидантоин
TsOH = моногидрат п-толуолсульфоновой кислоты
CDI = карбонилдиимидазол
PGA = пироглутаминовая кислота
DTTA = ди-п-толуолвинная кислота
CSA = камфорсульфоновая кислота,
DBTA = дибензоилвинная кислота
ACN = ацетонитрил,
IPA = изопропиловый спирт,
MeOH = метанол,
ТГФ = тетрагидрофуран и
MTBE = метил-трет-бутиловый эфир.
Пример 1: Получение (+)-(4-метоксипирролидин-3-ил)метиламина
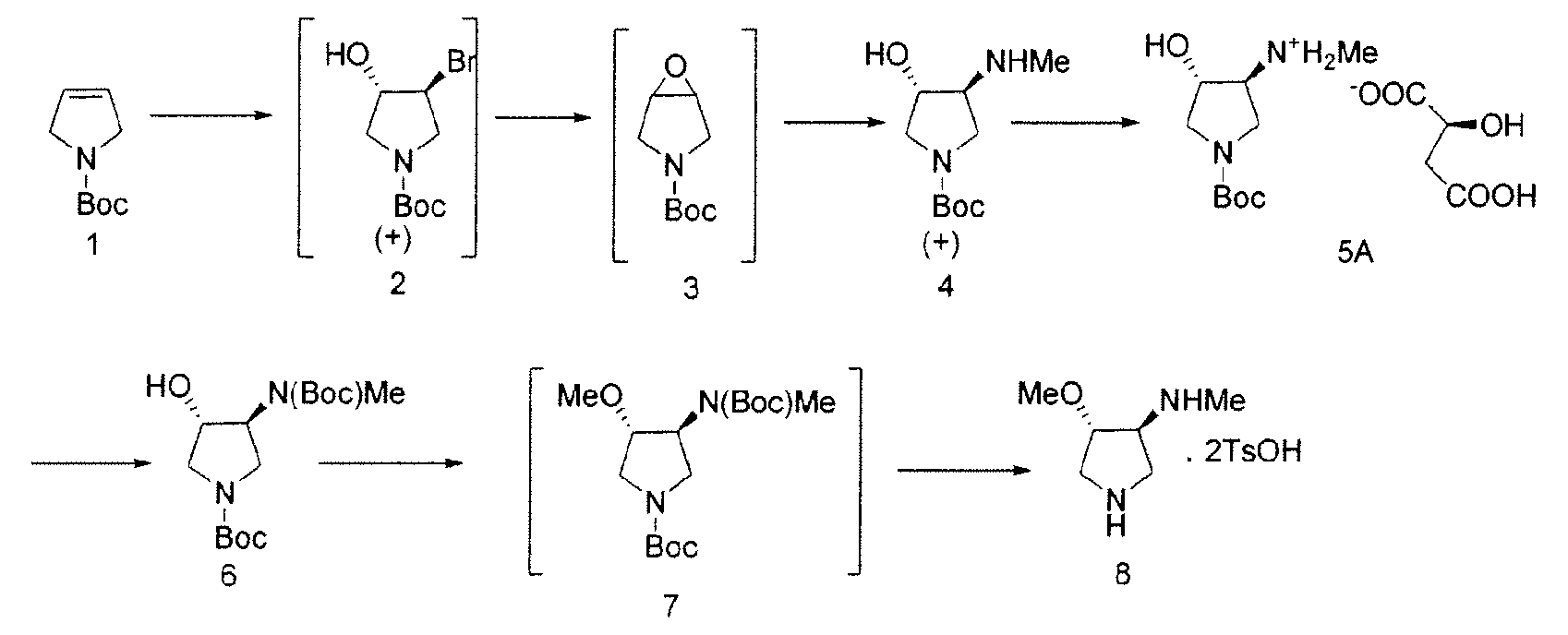
Трет-бутиловый сложный эфир (±)-3-Бром-4-гидроксипирролидин-1-карбоновой кислоты, (2). (Tetrahedron Asymmetry, 12 (2002) 2989-2997).
N-Boc-3-пирролин 1 (296 г, 1,75 молей) добавляли к взвеси 1,3-дибром-5,5-диметилгидантоина (270 г, 0,94 молей) в ацетонитриле (ACN, 1800 мл) и воде (296 мл), в то время как температуру реактора поддерживали при 0-10°C. После добавления реакционную смесь нагревали до комнатной температуры и перемешивали до тех пор, пока реакцию не считали завершенной (ТСХ или ВЭЖХ). Реакцию гасили добавлением 5% водного раствора тиосульфата натрия (600 мл) и продукт экстрагировали дихлорметаном (2×750 мл). Объединенный органический слой промывали водой (300 мл) и насыщенным солевым раствором (200 мл). Органический слой сушили над безводным Na2SО4 (75 г) и концентрировали при пониженном давлении с получением 2 (450 г), который непосредственно применяли на следующей стадии.
Трет-бутиловый сложный эфир 6-окса-3-аза-бицикло[3.1.0]гексан-3-карбоновой кислоты (3). Водный раствор гидроксида натрия (NaOH, 1,55 л, 2N) добавляли к соединению 2 (450 г, 1,69 молей), и реакционную смесь перемешивали в течение 2 час при приблизительно комнатной температуре. Продукт экстрагировали дихлорметаном (2×1,25 л) и объединенный органический слой промывали водой (2×750 мл) до нейтрального pH и затем сушили над безводным Na2SO4. Упариванием при пониженном давлении получали эпоксид 3 (291,0 г).
Трет-бутиловый сложный эфир (±)-3-гидрокси-4-метиламинопирролидин-1-карбоновой кислоты, (4). Водный раствор метиламина (40% раствор, 812 мл, 3,8 моль) добавляли к эпоксиду 3 (140 г, 0,65 моль) при комнатной температуре и реакционную смесь перемешивали до завершения реакции. Избыточный метиламин удаляли посредством перегонки при пониженном давлении. К полученному остатку добавляли диизопропиловый эфир (800 мл) и смесь перемешивали в течение приблизительно 30 мин. Твердое вещество отфильтровывали, промывали диизопропиловым эфиром (200 мл), затем сушили с получением соединения 4 (135 г).
Трет-бутиловый сложный эфир (±)-3-гидрокси-4-метиламинопирролидин-1-карбоновой кислоты, (4), из 2. Десять граммов (10 г) бромгидрина 2 обрабатывали 40% водным метиламином (50 мл) и бикарбонатом натрия (3,1 г) при комнатной температуре с получением Соединения 4 (8,5 г).
Разделение трет-бутилового сложного эфира (±)-3-гидрокси-4-метиламинопирролидин-1-карбоновой кислоты, используя L-(-)-яблочную кислоту. Аминоспирт 4 (100 г, 0,46 молей) растворяли в смеси ацетона (600 мл) и воды (13 мл) при комнатной температуре. Реакционную смесь нагревали до приблизительно 40°C и добавляли L-(-)-яблочную кислоту (62 г, 0,48 молей). Смесь нагревали до приблизительно 50-55°C с образованием прозрачного раствора и затем постепенно охлаждали до комнатной температуры и затем до 5-10°C. Образованные кристаллы отфильтровывали, промывали ацетоном (2×70 мл) и сушили при пониженном давлении с получением малатной соли 5A (60 г, 37%), с чистотой при отношении энантиомеров S к R (S:R)=100:0 по хиральной ВЭЖХ.
Небольшой образец анализировали на энантиомерную чистоту посредством превращения в соединение 6 и анализа полученного в результате 6 посредством хиральной ВЭЖХ (Chiracel OD-H SC\522; подвижная фаза: гексан:IPA 95:5; 1 мл/мин). Время удерживания для S'-энантиомера составляло 7,725 мин.
Разделение трет-бутилового сложного эфира (±)-3-гидрокси-4-метиламинопирролидин-1-карбоновой кислоты, с использованием (L-(-)-пироглутаминовой кислоты. Разделение 4 (10 г) c помощью (L)-(-)-пироглутаминовой кислоты (3,58 г) в ацетоне (120 мл) и воде (4 мл) давало пироглутаматную соль (5,7 г). Кристаллизацией из смеси ацетон-вода получали 4,2 г PGA соли с соотношением диастереомеров, равным 94:6. Дополнительной перекристаллизацией из смеси ацетон-вода получали диастереомерно чистую PGA соль (2,3г, >99% de).
Получение трет-бутилового сложного эфира 3-(трет-бутоксикарбонилметиламино)-4-гидроксипирролидин-1-карбоновой кислоты, (6) из соли L-(-)-яблочной кислоты (5A).
К смеси Соединения 5A (57 г, 0,16 молей) в метаноле (MeOH, 220 мл), добавляли K2CO3 (68,0 г, 0,49 молей) при комнатной температуре. Boc-ангидрид (40 г, 0,18 молей) добавляли по каплям к реакционной смеси в течение приблизительно 1 час и реакционную смесь перемешивали до завершения реакции (приблизительно 2 часа). Метанол отгоняли при пониженном давлении при приблизительно 55-60°C, к реакционной смеси добавляли воду (150 мл) и продукт экстрагировали метил-трет-бутиловым эфиром (MTBE, 2×150 мл). Объединенный органический слой промывали водой (200 мл) и насыщенным солевым раствором (100 мл), и затем сушили над безводным Na2SO4. Концентрированием при пониженном давлении получали соединение 6 в виде белого твердого вещества (52 г).
Трет-бутиловый сложный эфир 3-(трет-бутоксикарбонилметиламино)-4-метокси-пирролидин-1-карбоновой кислоты, (7).
Суспензию 6 (52 г, 0,16 моль) в тетрагидрофуране (ТГФ, 150 мл) перемешивали при комнатной температуре в течение приблизительно 30 мин и охлаждали до -10 - -15°C. Медленно добавляли раствор гексаметилдисилиламида калия (KHMDS, 40% раствор в ТГФ, 144 мл, 0,256 моль), в то время как температуру контролировали между -5 и -15°C. Через 15 мин, к реакционной смеси добавляли по каплям диметилсульфат (18,7 мл, 1,20 моль), в то же время поддерживая температуру между - 10 и 0°C, и полученную в результате реакционную смесь затем перемешивали при этой температуре в течение приблизительно 30 мин. Реакционную смесь гасили добавлением воды (100 мл), с последующим добавлением уксусной кислоты (50 мл). Продукт экстрагировали метил-трет-бутиловым эфиром (2×150 мл). Объединенный органический слой промывали водой (100 мл), насыщенным солевым раствором (50 мл) и сушили над безводным Na2SO4. Упариванием при пониженном давлении получали соединение 7 в виде масла (54 г).
(+)-(4-метоксипирролидин-3-ил)метиламин получали, используя толуол-4-сульфоновую кислоту (2:1). К раствору Соединения 7 (54,0 г, 0,163 молей) в ТГФ (180 мл) и MeOH (90 мл), добавляли моногидрат п-толуолсульфоновой кислоты (84 г, 0,442 молей), и реакционную смесь нагревали до 55-60°C в течение приблизительно 5 час, и за это время снятие защиты было полным. После охлаждения до приблизительно 40-45°C, 0,2 г затравочных кристаллов 8 добавляли к реакционной смеси, что приводило к немедленной кристаллизации. Взвесь поддерживали при 40-45°C в течение приблизительно 30 минут, и затем постепенно охлаждали до 0-5°C. После встряхивания в течение 2 часов при 0-5°C, твердые вещества отфильтровывали, промывали ТГФ (2×50 мл), и сушили с получением тозилатной соли 8 в виде белого твердого вещества (66 г) с чистотой по ВЭЖХ = 98,9%.
Условия ВЭЖХ были следующими: Колонка: Chiralcel AD - H, SC\523; подвижная фаза: Гептан:IPA (0,5%TFA) = 85:15; объемная скорость потока: 1,0 мл/мин, и время анализа: 20 мин.
Соединение 8 имеет время удерживания 12,66 мин. Энантиомерный избыток этого вещества составлял свыше 99%ee.
Пример 2: Разделение трет-бутилового сложного эфира (±)-3-гидрокси-4-метиламинопирролидин-1-карбоновой кислоты с использованием хиральных кислот
Разделение трет-бутилового сложного эфира (±)-3-гидрокси-4-метиламинопирролидин-1-карбоновой кислоты пытались проводить посредством образования солей с разнообразными хиральными кислотами. Таблица 3 представляет обобщенные результаты реакций. В таблице, "Соединение 4" относится к трет-бутиловому сложному эфиру (±)-3-гидрокси-4-метиламинопирролидин-1-карбоновой кислоты. В Таблице 3 энантиомерное отношение, определенное посредством хиральной ВЭЖХ представлено как S:R. В экспериментах 72, 74 и 75 далее анализ ВЭЖХ осуществляли на стадии получения соединения 6.

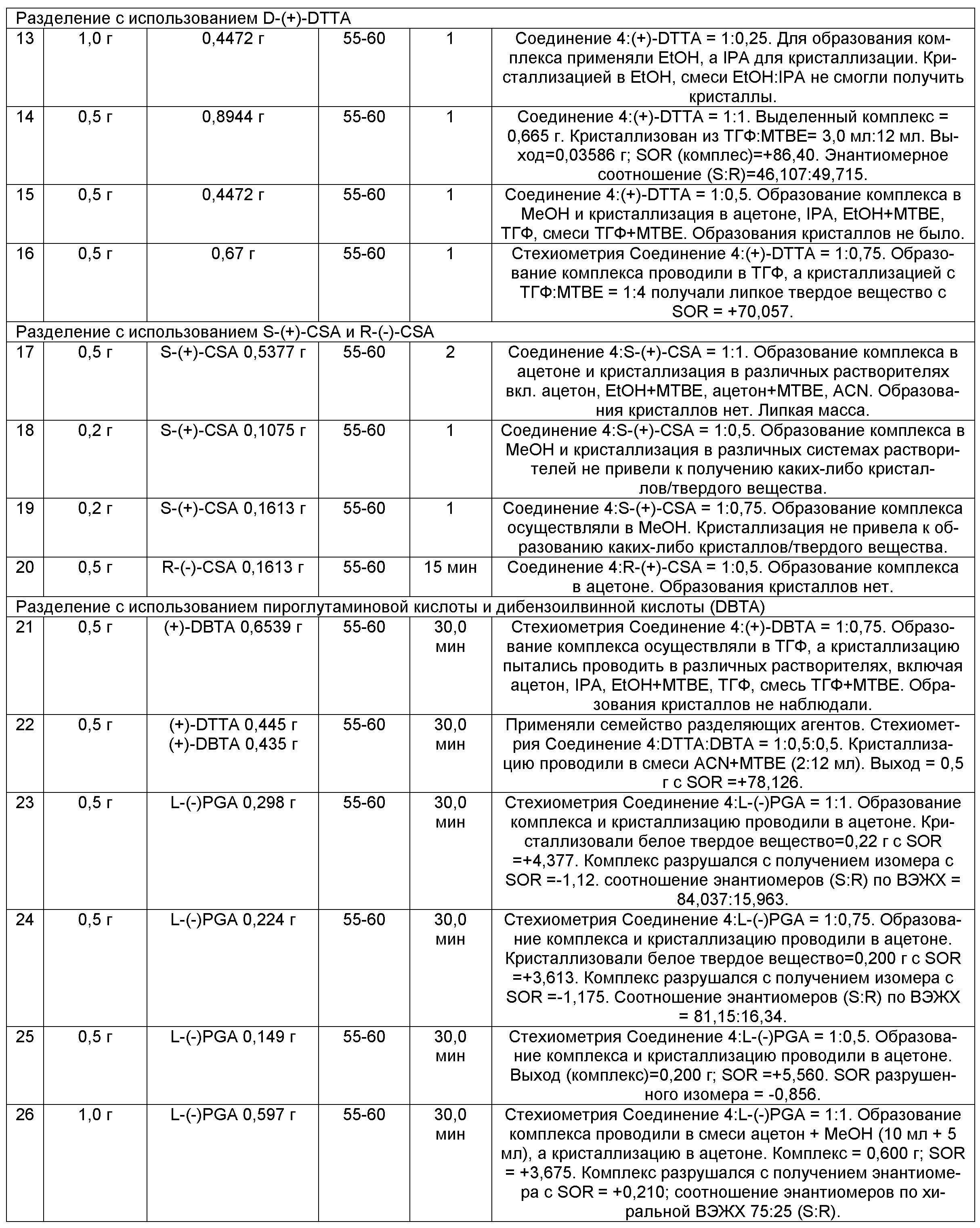

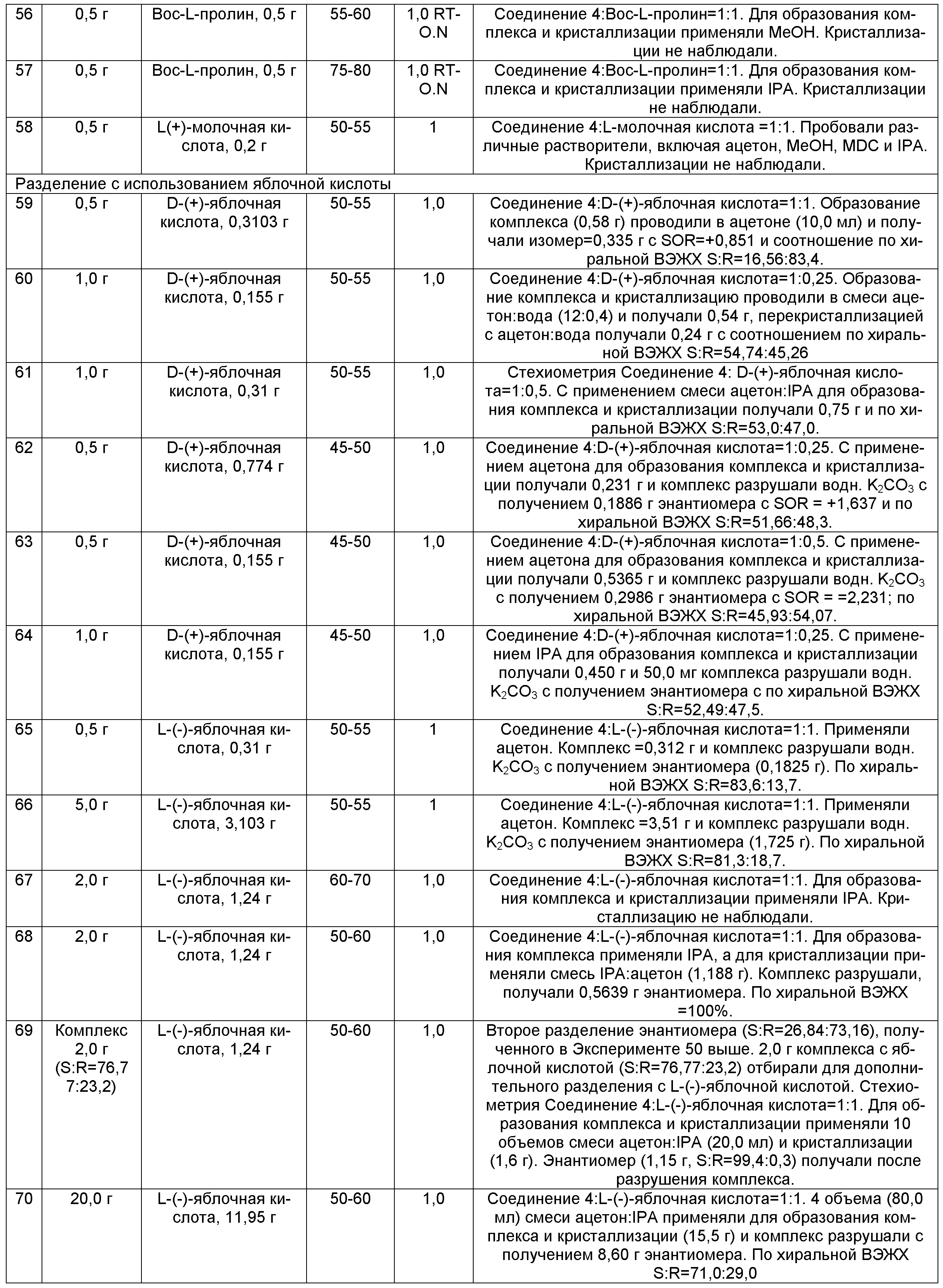

Как видно из данных, разделение трет-бутилового сложного эфира (±)-3-гидрокси-4-метиламинопирролидин-1-карбоновой кислоты с L-(-)-яблочной кислотой (1:1) позволяет получить S энантиомер с энантиомерным избытком до 100%.
Пример 3: Крупномасштабное получение SNS-595.
Синтез Соединения 8

N-Boc-3-пирролин (1) (16 кг) обрабатывали 1,3-дибром-5,5-диметилгидантоином (DBDMH) (15,2 кг) в водном ACN с образованием бромгидрина (2). После завершения реакции, избыточный бромирующий агент гасили водным раствором тиосульфата натрия и неочищенную реакционную смесь обрабатывали водным NaOH. Полученный в результате эпоксид экстрагировали MTBE и органический слой концентрировали с получением неочищенного эпоксида (3). Этот эпоксид добавляли к 40% водному метиламину и, после завершения реакции, избыточные метиламин и воду удаляли посредством перегонки, и продукт (4) (18,5 кг) выделяли из дизопропилового эфира.
Рацемическое соединение 4 (18,4 кг) разделяли посредством обработки L-(-)-яблочной кислотой (11,4 кг) в водном ацетоне. (S,S)-изомер (5) кристаллизовали в виде L-(-)-малатной соли (5A). Ее отфильтровывали и фильтровальную лепешку промывали ацетоном и сушили с получением соединения 5A (11,8 кг).
Взвесь соединения 5А (11,8 кг) и карбоната калия (11,7 кг) в метаноле обрабатывали с помощью Вос-ангидрида (Boс2O) (8,3 кг) до завершения реакции. Продукт экстрагировали MTBE. Органический слой сушили посредством перегонки и добавляли петролейный эфир. Взвесь отфильтровывали, промывали петролейным эфиром и сушили с получением соединения 6 (9,9 кг).
Соединение 6 (9,9 кг) обрабатывали раствором KHMDS (35 кг, 20% м/м) в ТГФ, с последующей обработкой диметилсульфатом (4,7 кг). После завершения реакции, реакционную смесь гасили 5% уксусной кислотой в воде. Продукт экстрагировали MTBE, и органический слой концентрировали с получением неочищенного продукта (7). Его обрабатывали моногидратом п-толуолсульфоновой кислоты (TsOH) в смеси тетрагидрофуран-метанол. После завершения реакции взвесь охлаждали и продукт выделяли посредством фильтрации с получением 12,2 кг Соединения 8.
Синтез Соединения 10
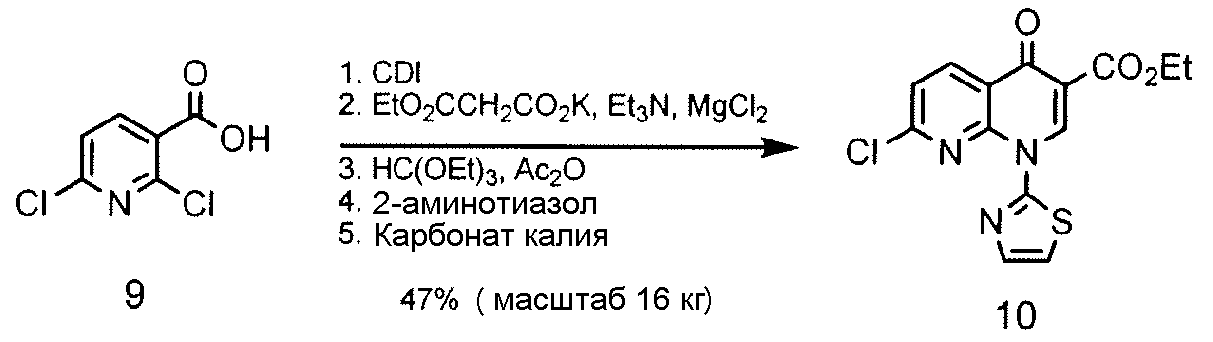
Раствор карбонилдиимидазола (CDI) (16,4 кг) в ТГФ добавляли к взвеси 2,6-дихлорникотиновой кислоты (9) (16 кг) в ТГФ. Через приблизительно 2 часа добавляли этилмалонат калия (EtO2CCH2CO2K) (19,4 кг), триэтиламин (25,9 кг) и хлорид магния (11,9 кг), и реакционную смесь перемешивали в течение приблизительно 24 час. Реакционную смесь гасили разбавленной HCl и экстрагировали этилацетатом. Органический слой концентрировали, промывали смесью водного NaCl и NaHCO3. Органический слой разбавляли метилциклогексаном и сушили перегонкой в вакууме. Раствор обрабатывали триэтилортоформатом (17,1 кг) и уксусным ангидридом (59 кг) при приблизительно 90-110°C. После того, как реакцию считали завершенной, избыточный уксусный ангидрид удаляли посредством перегонок с метилциклогексаном. Неочищенный продукт обрабатывали раствором 2-аминотиазола (8,2 кг) в ТГФ. Через приблизительно 2 часа реакционную смесь обрабатывали карбонатом калия (13,6 кг) и смесь перемешивали в течение приблизительно 6 часов. Продукт осаждали добавлением воды, выделяли посредством фильтрации, промывали смесью ACN-вода, ACN, и сушили с получением соединения 10 (13,1 кг).
Синтез SNS-595
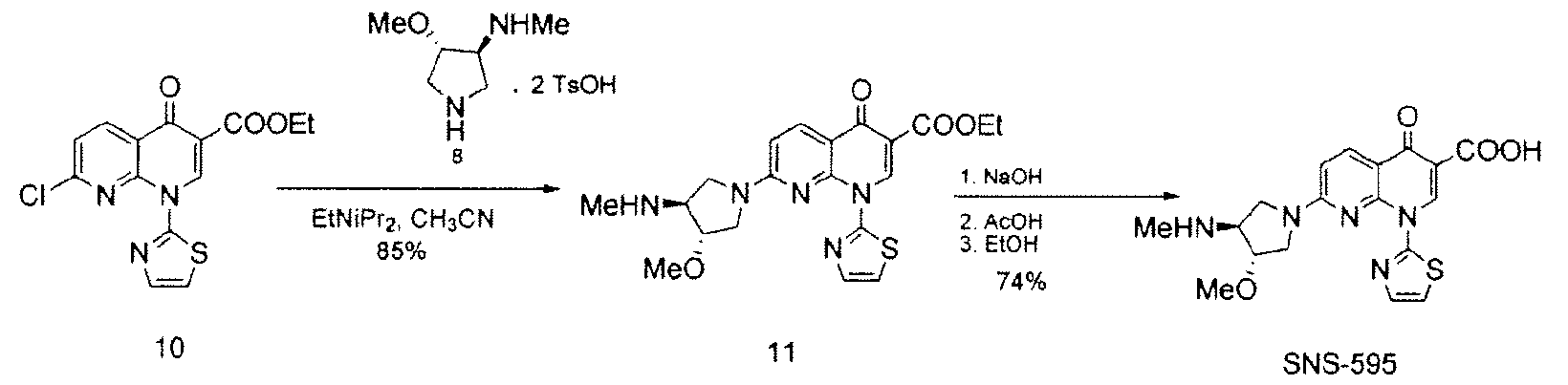
К взвеси Соединения 8 (8,0 кг) в ACN при приблизительно 5°C, добавляли N,N'-диизопропилэтиламин (EtN1Pr2) (8,7 кг). Через приблизительно 15 мин, Соединение 10 (5,0 кг) добавляли к реакционной смеси. Реакционную смесь нагревали при приблизительно 45°C в течение приблизительно 3 час, охлаждали и продукт отфильтровывали. Фильтровальную лепешку промывали ACN и сушили с получением Соединения 11 (5,5 кг).
К раствору NaOH (0,8 кг) в воде (19,5 кг) добавляли Соединение 10 (5,5 кг) и этанол (EtOH, 0,5 кг). После завершения гидролиза, реакционную смесь отфильтровывали и фильтрат подкисляли до pH 7,3-7,7 добавлением уксусной кислоты. Смесь далее нагревали при приблизительно 55-65°C в течение приблизительно 2 час. После охлаждения до температуры окружающей среды, реакционную смесь отфильтровывали и промывали водой и затем этиловым спиртом. Фильтровальную лепешку сушили под вакуумом. Неочищенный продукт суспендировали в EtOH при приблизительно 80°C. После охлаждения, продукт отфильтровывали, промывали EtOH и сушили с получением SNS-595 (3,8 кг). Определяли, что массовая процентная чистота SNS-595 составляла 99,9%.
Пример 4: Фармацевтическая композиция, пригодная для инъекции или внутривенной инфузии
Иллюстративный пример подходящей фармацевтической композиции включает: 10 мг SNS-595 и (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-амино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновую кислоту (где количество SNS-595 составляет, по меньшей мере, 99,95%, и количество (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-амино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты составляет менее чем приблизительно 0,05%) в миллилитре (мл) водного 4,5% раствора сорбитола, который доводят до pH 2,5 с помощью метансульфоновой кислоты. Один протокол получения такого раствора включает следущие компоненты для получения презентационного образца 100 мг/10 мл: 100 мг активной композиции, которая состоит по существу из, по меньшей мере, 99,95% SNS-595 и менее чем 0,05% (+)-1,4-дигидро-7-[(3S,4S)-3-метокси-4-амино-1-пирролидинил]-4-оксо-1-(2-тиазолил)-1,8-нафтиридин-3-карбоновой кислоты, и 450 мг D-сорбитола добавляют к дистиллированной воде; объем доводят до объема 10 мл; и полученный в результате раствор доводят до pH 2,5 с помощью метансульфоновой кислоты. Полученная в результате композиция также является подходящей для лиофилизации. Лиофилизированную форму далее ресуспендируют со стерильной водой до необходимой концентрации перед применением.
Пример 5: Фармацевтическая композиция, пригодная для инъекции или внутривенной инфузии
Иллюстративный пример подходящей фармацевтической композиции включает: 10 мг общего SNS-595 и примеси (где количество SNS-595 составляет, по меньшей мере, приблизительно 99,95% и общее количество примеси составляет менее чем приблизительно 0,05%) на мл водного раствора 4,5% сорбитола, который доводят до pH 2,5 с помощью метансульфоновой кислоты. Один протокол для получения такого раствора включает следующие компоненты для получения презентационного образца 100 мг/10 мл: 100 мг композиции, состоящей по существу из, по меньшей мере, приблизительно 99,95% SNS-595 и менее чем приблизительно 0,05% примесей, и 450 мг D-сорбитола добавляют к дистиллированной воде; объем доводят до объема 10 мл; и pH полученного в результате раствора доводят до 2,5 с помощью метансульфоновой кислоты. Полученная в результате композиция также является подходящей для лиофилизации. Лиофилизированную форму далее ресуспендируют со стерильной водой до необходимой концентрации перед применением.
Варианты осуществления заявленного объекта изобретения, описанного выше, предназначены для простого представления в виде примеров, и квалифицированные специалисты в области смогут распознать или убедиться в этом, используя только рутинные эксперименты, многочисленные эквиваленты конкретных соединений, вещества и методики. Все такие эквиваленты считаются входящими в объем заявленного объекта изобретения и охватываются прилагаемой формулой изобретения.
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/044d77ee6887305473355695fbaaad95.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/d14482f2600246344e3748ac149c9720.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/efe8b114509786aa6cc088846128902a.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/ede84d5fc7ff78fc7887a19f7512fabf.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/4516e947601be9f057cfdcf65af43fd2.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/400faab28e48592a5667c2a83810cce3.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/8e449014f64f1afa034a8b231363e5bd.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/e16d4c81e9ce091548dd91df09e65a30.jpg)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/e6212fc9c352669b3e71931706b7bad3.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/4a1897e8bbb0d99a1a79daf5a7ec7a60.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/df079e5220a757ddedcebcc485b680a2.jpg)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/0792e4a67e1f5e340c01d38d21cf310c.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/e5cd4d68c86d12d3be7fb631f29ae71c.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/49cebac83ef508a7fc394712301d65b6.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/75259111c8868a47612b245077500421.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/2d1e891d02a63e4ce09213745915b08b.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/4eb17dbd102687a3bd7d25c896b9c8ea.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/34b876c91f1fbfb0a1ea537bce8b5071.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/5a7c54ca4a5a026a539a1916f56a2163.jpg)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/bbafe9da9d06d8b163b5e379ef5a1b4a.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/119bde9e0e129890f0f1c2afc28a0f86.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/7eb542b6b02bc60083b01b14e3fd6d72.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/cdd0eb7493232f6bb3a70401466ca2be.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/bed7e6618f2e425c6ac6b3c957146e34.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/008ac5391b9cc0148cd2954d7df9e819.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/ce69a66e3086d6cd29c271101f22f730.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/94689ff1609ada077ff470b292727226.png)
![СПОСОБ ПОЛУЧЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S,4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/83/a4/58/5f60c8f031ddb9ded62aa8bfffd94fa7.jpg)

