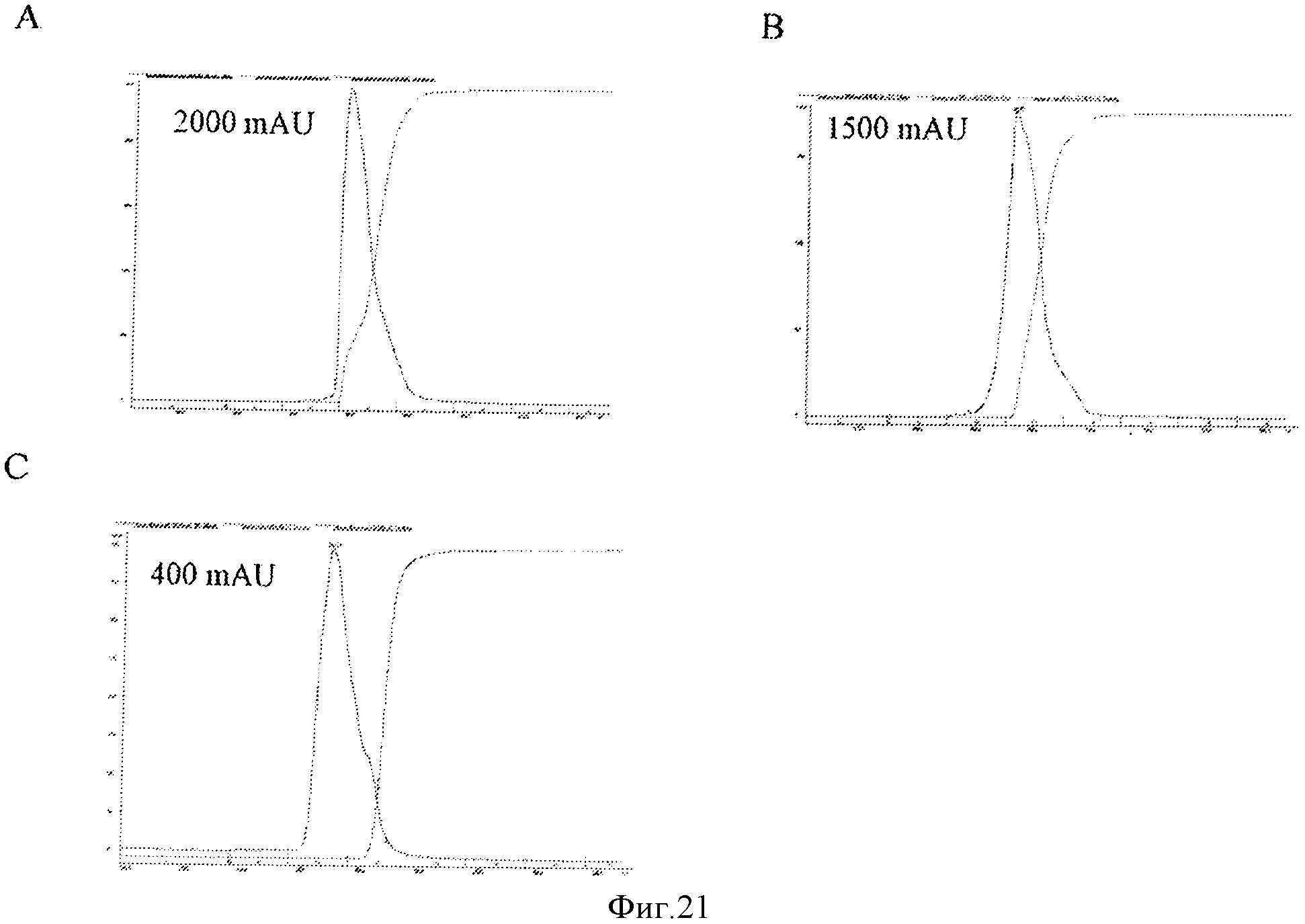Результат интеллектуальной деятельности: СПОСОБЫ КУЛЬТИВИРОВАНИЯ КЛЕТОК, РАЗМНОЖЕНИЯ И ОЧИСТКИ ВИРУСОВ
Вид РИД
Изобретение
1. Заявление в отношении прав на изобретение, сделанное в соответствии с финансируемым из бюджета исследованием и разработкой
Одно или более изобретений, описанные в данной заявке, были сделаны при поддержке правительства в соответствии с Договором № HHS 0100200600010 С, выполняемым по заказу Министерства здравоохранения и социального обеспечения США. В соответствии с этим правительство может иметь некоторые права на эти изобретения.
2. Область, к которой относится изобретение
Настоящее изобретение относится к новой среде для культивирования клеток и способам культивирования клеток, в частности неканцерогенных MDCK клеток. Настоящее изобретение также относится к способам получения вирусов (например, гриппа, RSV) в культуре клеток. Настоящее изобретение также обеспечивает способы для очистки ассоциированных с клетками вирусов из адгезивных клеток, выращиваемых в биореакторе для производства вакцин.
3. Предпосылки создания изобретения
Вакцинация представляет собой наиболее важное мероприятие системы общественного здравоохранения для предотвращения заболевания, вызванного вирусной инфекцией. Эффективное применение вакцин является зависимым от обеспечения возможности быстро получать большие количества вакцинного материала (например, вируса) из стабильного и легко культивируемого источника. Быстрая разработка вакцин и их избыточная доступность являются критическими в борьбе со многими заболеваниями человека и животных. Задержка в выпуске вакцин и их недостаточное количество может вызвать проблемы, которые приводят к вспышкам заболевания. Например, недавние исследования дают возможность предположить, что существует причина для беспокойства в отношении длительного срока, необходимого для получения вакцин против пандемического гриппа. Смотри, например, Wood, J.М., 2001, Philos. Trans. R. Soc. Lond. B. Biol. Sci., 356: 1953. В соответствие с этим современные усилия по производству вакцин были сфокусированы на выращивании вирусов для производства вакцин в культуре клеток.
3.1 Вирус гриппа
В частности, применение клеток Мадин-Дарби почек собаки (MDCK) поддерживались рядом групп. Смотри, например, US 6,455,298; US 2005/0118140; US 2005/0118698; US 6,825,306; WO 2005/113758; и Radaeva, I.F., и др. Vopr. Virusol. (2005) 50: 43-6. Однако многие из существующих MDCK клеток страдают от одного или более недостатков, включая канцерогенность, требование наличия сыворотки животных в культуре клеток и низкий выход вирусов гриппа, приемлемых для использования в вакцинах. Кроме того, многие процессы, происходящие в культурах клеток, которые были разработаны для получения вакцинного материала из этих линий клеток, часто требуют многочисленных манипуляций, включая этапы замены среды и применение больших количеств вируса для инокуляции, В дополнение, по причине постоянного возникновения (или повторного возникновения) различных штаммов гриппа, новые вакцины гриппа получают в каждое время года на основе циркулирующих штаммов вируса гриппа. К сожалению, некоторые вакцинные штаммы вируса гриппа являются весьма сложными для выращивания с высоким выходом. Выход материала из каждой партии культуры клеток не только определяет продукционную способность, но также оказывает влияние на стоимость вырабатываемого продукта, поэтому повышение выхода вируса (то есть максимального титра вируса) является желательным.
Недавно были разработаны новые, свободные от сыворотки среды и неканцерогенные линии клеток, которые позволяют выращивать вакцинный штамм с получением очень высоких титров, а также процессы для получения вирусного материала в однократно используемых биореакторах (смотри, US 2006/0188977; и USSN 11/855,769, поданная 14 сентября 2007 года). Настоящее изобретение расширяет эту работу и обеспечивает новую среду для культивирования клеток, высоковопроизводимые, эффективные, масштабируемые процессы для получения больших количеств вакцинного материала в биореакторах из MDCK клеток, в частности, неканцерогенных линий клеток, без необходимости замены среды, а также мощные процессы глубокой очистки для получения высокоочищенной живой аттенуированной вакцины. Способы, которые обеспечиваются с помощью настоящего изобретения, являются мощными, требуют минимальных манипуляций и являются эффективными по затратам.
3.2 Респираторно-синцитиальный вирус (RSV)
Респираторно-синцитиальный вирус (RSV) человека представляет собой основную причину тяжелой инфекции нижних дыхательных путей (LRTI) у младенцев и детей младшего возраста и является ответственным за значительную заболеваемость и смертность. В общей сложности 18 миллионов человек инфицируется ежегодно в семи главных рынках (США, Япония, Франция, Германия, Италия, Испания, Объединенное Королевство), включая три миллиона взрослых людей и почти 400000 недоношенных детей. По оценкам, ежегодно только на США приходится 70000-125000 госпитализаций, которые приписываются RSV LRTI. В человеческой популяции присутствуют две антигенно различные подгруппы RSV А и В. RSV также признается важным агентом инфекции у взрослых с нарушенным иммунитетом и у пожилых людей. Благодаря неполной устойчивости к RSV повторная инфекция индуцируется природной инфекцией, RSV может инфицировать человека многократно на протяжении детства и всей жизни. Цель иммунопрофилактики RSV заключается в том, чтобы индуцировать достаточную устойчивость и предотвратить серьезное заболевание, которое может быть ассоциировано с RSV инфекцией. Современная стратегия для разработки RSV вакцин принципиально, так или иначе, связана с введение очищенного вирусного антигена и живого аттенуированного RSV для интраназального введения. Однако на сегодняшний день не существует одобренных вакцин для RSV.
Вирусная геномная РНК не является инфекционной, как РНК, лишенная оболочки. РНК геном RSV является заключенным в плотную капсидную оболочку с основным нуклеокапсидным (N) белком и ассоциируется с фосфопротеином (Р) и большой (L) субъединицей полимеразы. Эти белки формируют нуклеопротеиновое ядро, которое признается в качестве минимальной единицы инфективности (Brown и др., 1967, J.Virol. 1:368-373).
Несмотря на десятилетия исследований не было разработано никакой коммерчески доступной, безопасной и эффективной RSV вакцины для предотвращения тяжелой заболеваемости и смертности, ассоциированной с RSV инфекцией. Вакцина на основе инактивированного в формалине вируса оказалась неудачной в обеспечении защиты против RSV инфекции и фактически приводила к ухудшенным симптомам при последующей инфекция с помощью вируса дикого типа у младенцев (Kapikian и др., 1969, Am. J. Epidemiol. 89: 405-21; Chin и др., 1969, Am. J. Epidemiol. 89: 449-63). Поэтому усилия были сфокусированы на разработке живых аттенуированных мутантов, полученных с помощью рекомбинантных способов, химического мутагенеза и низкотемпературного пассирования RSV дикого типа для чувствительных к температуре мутантов (Gharpure и др., 1969, J. Virol. 3: 414-21; Crowe и др., 1994, Vaccine 12: 691-9). Однако очистка живого аттенуированного вируса от его ассоциированных с клеткой белков, для получения материала, который будет соответствовать нормативным рекомендациям для эффективного профилактического лечения RSV инфекции, была показана как труднодостижимая на сегодняшний момент.
Подобно вирусу гриппа, RSV выращивают в стабильной клеточной линии, в которой вирус является тесно ассоциированным с хозяйской клеткой, что делает сложным очистку вируса от ассоциированных с клеткой белков при поддержании минимального значения инфективности. Дополнительную сложность составляет то, что RSV является нестабильным (например, чувствительным к сдвигу). Эти факторы, а именно то что вирус является в основном ассоциированным с хозяйской клеткой и нестабильным, сделали сложной очистку вируса из экстрактов хозяйских клеток (например, ДНК и белков), приводя при этом к получению клинически приемлемой иммуногенной композиции, включающей живой аттенуированный вирус. Именно эти причины, частично, определяют то, почему нет коммерчески доступных вакцин для RSV. В соответствии с этим существует потребность в процессе очистки, который может использоваться для очистки RSV и других ассоциированных с клеткой вирусов для получения и рецептирования иммуногенных композиций.
4. КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает свободную от сыворотки культуральную среду и высоковоспроизводимые, эффективные и масштабируемые процессы для получения большого количества вакцинного материала в биореакторах, включая биореакторы однократного использования и стандартные реакторы многократного применения (например, биореакторы из нержавеющей стали и стеклянные сосуды).
В одном аспекте настоящее изобретение обеспечивает обогащенную свободную от сыворотки культуральную среду, которая поддерживает пролиферацию MDCK клеток (например, неканцерогенных MDCK клеток) до получения высокой плотности клеток и устраняет необходимость в этапе замены среды для получения высоких титров вируса.
В частности, настоящее изобретение обеспечивает способы для репликации вирусов гриппа (например, адаптированных к холоду и/или чувствительных к температуре, и/или аттенуированных) в MDCK клетках для получения высокого титра, например, log10 ТСID50/мл и/или log10 FFU/мл, по крайней мере, приблизительно 7,4, по крайней мере, приблизительно 7,6, или по крайней мере, приблизительно 7,8, или по крайней мере, приблизительно 8,0, или по крайней мере, приблизительно 9,0, или по крайней мере, приблизительно 10,0 без этапа замены среды перед инфицированием.
В другом аспекте настоящее изобретение обеспечивает улучшенные способы для размножения неканцерогенньгх клеток на микроносителях, включая способы переноса с гранулы на гранулу. В другом аспекте обогащенная свободная от сыворотки культуральная среда в соответствии с изобретением поддерживает неканцерогенные характеристики неканцерогенных MDCK клеток, используемых для исходной инокуляции. В других аспектах обогащенная свободная от сыворотки культуральная среда в соответствии с изобретением используется для адаптации и поддержания неканцерогенных MDCK линий клеток.
В другом аспекте настоящее изобретение обеспечивает способы для очистки живых ассоциированных с клеткой вирусов (например, вируса гриппа, RSV) из адгезивных клеток, выращенных в культуре клеток (например, культуре клеток MDCK, Vero), что обеспечивает средний выход вирусов, по крайней мере, 30%, где очищенные вирусы включают менее чем 0,1 нг HCD, и менее чем 0,3 мкг НСР, и менее чем 0,0050 нг неспецифической нуклеазы на 7,0±0,5 log10 БОЕ вируса.
5. КРАТКОЕ ОПИСАНИЕ ФИГУР
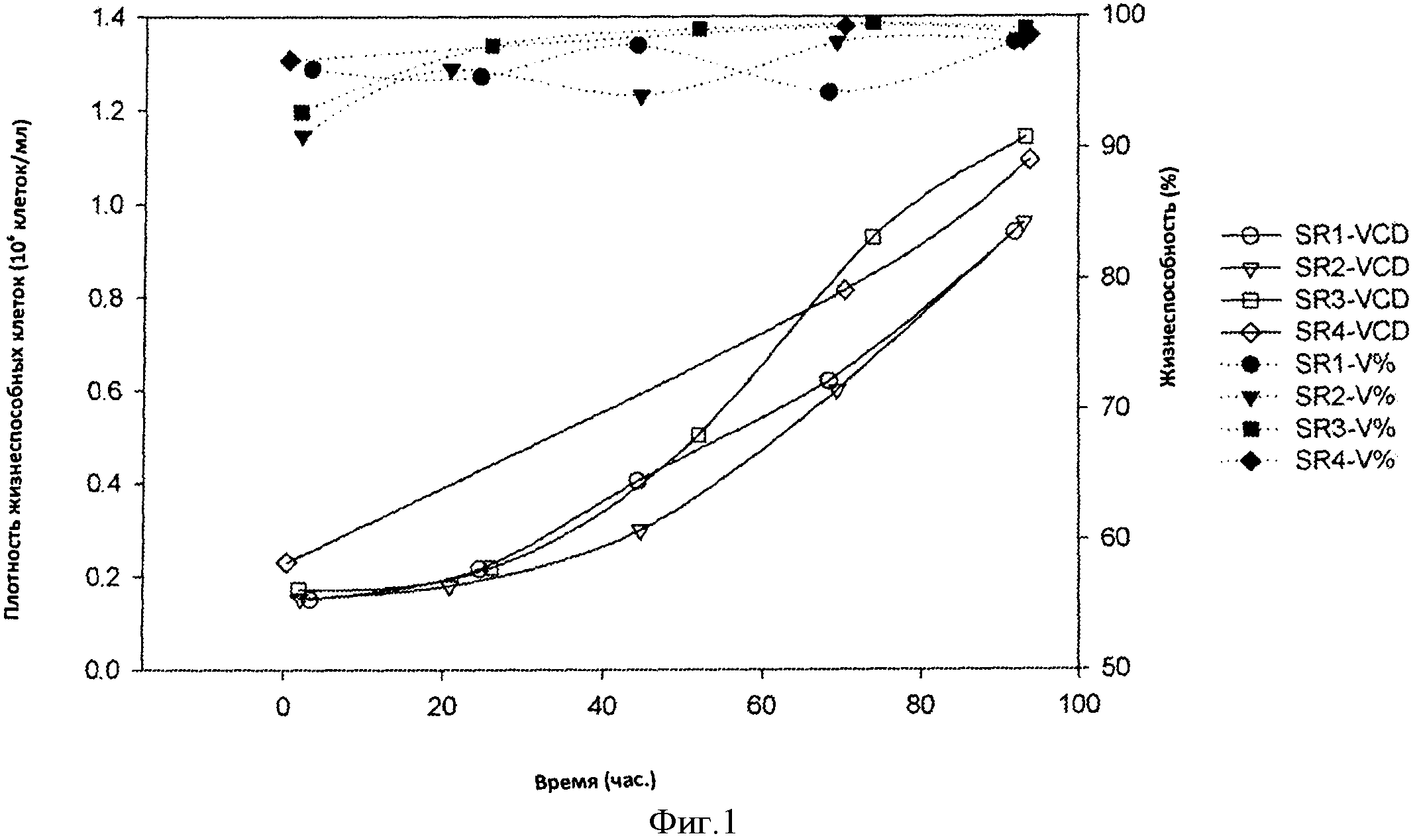
Фигура 1 представляет собой кривую плотности жизнеспособных клеток (VCD) и жизнеспособности клеток (V%) в 4×2 л биореакторах от дня 0 до дня 4 культивирования. Культивирование в биореакторах осуществляли при использовании условий посевного реактора (SR), подробно приведенных в 0.2 dps данные для SR 4 недоступны.
Фигура 2 показывает фотографии (взятые при 10Х увеличении) проб, взятых при среднем времени отбора проб между 0 и 40 мин для 3×2 л посевных реакторов (SR) для экспериментов 1, 3 и 4 во время В2В трипсинизации. Трипсинизацию осуществляли в биореакторах в соответствии с прописью переноса с гранулы на гранулу.
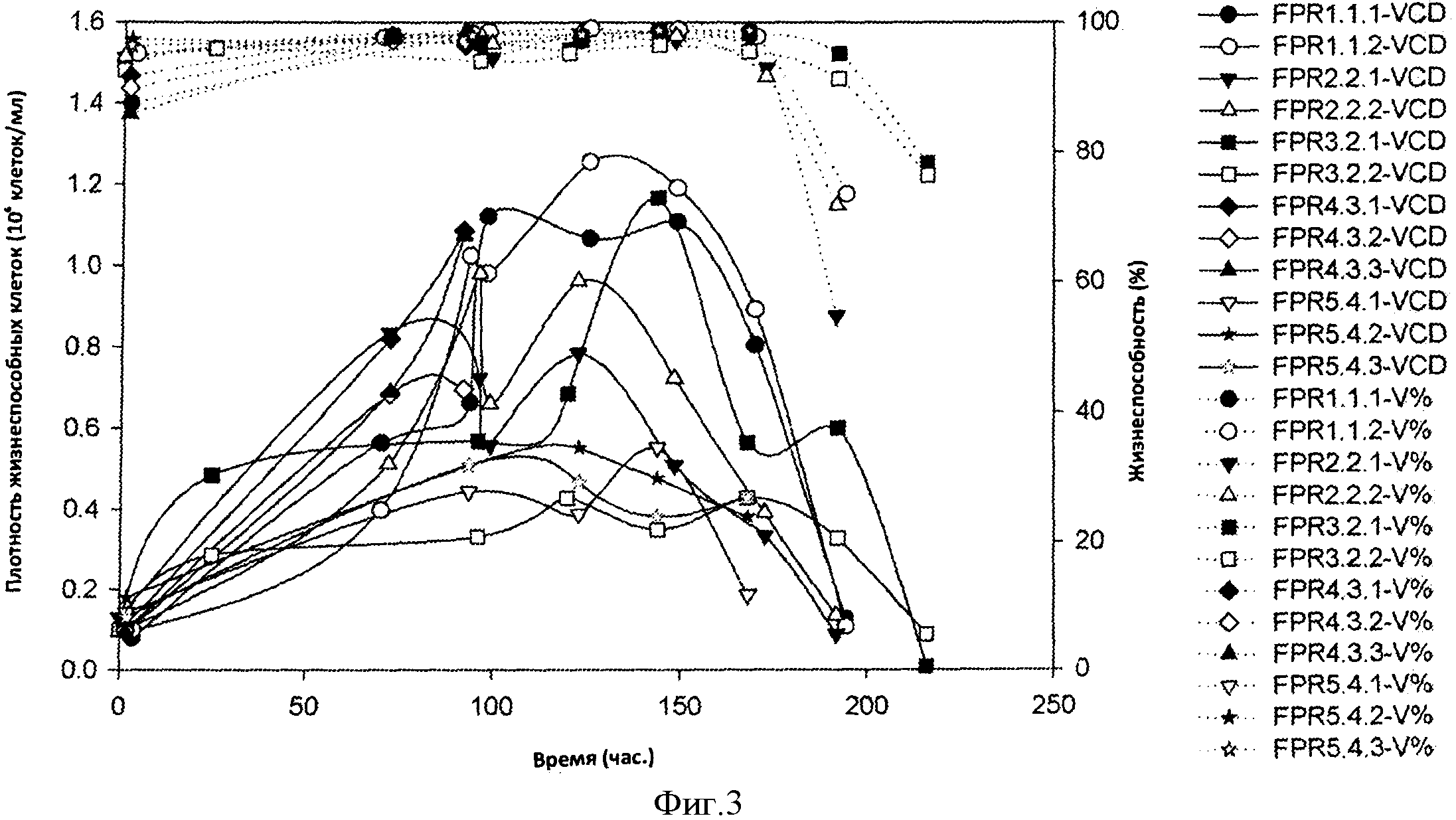
Фигура 3 представляет собой кривую плотности жизнеспособных клеток (VCD) и жизнеспособности клеток (V%) в 12×2 л биореакторах заключительного получения (FPR). Биореакторы эксперимента 3 (FPR3.X.X) инфицировали при 5 dps (~120 hps), a такие других экспериментов инфицировали при 4 dps. VCD после инфицирования и данные для эксперимента 4 недоступны.
Фигура 4 показывает фотографии (взятые при 10Х увеличении) проб, взятых при 4 dps для 12×2 л реакторов заключительного получения для всех экспериментов.
Фигура 5 показывает фотографии (взятые при 10Х увеличении) проб, взятых при 3 dpi для 9×2 л реакторов заключительного получения (FPR) для всех экспериментов.
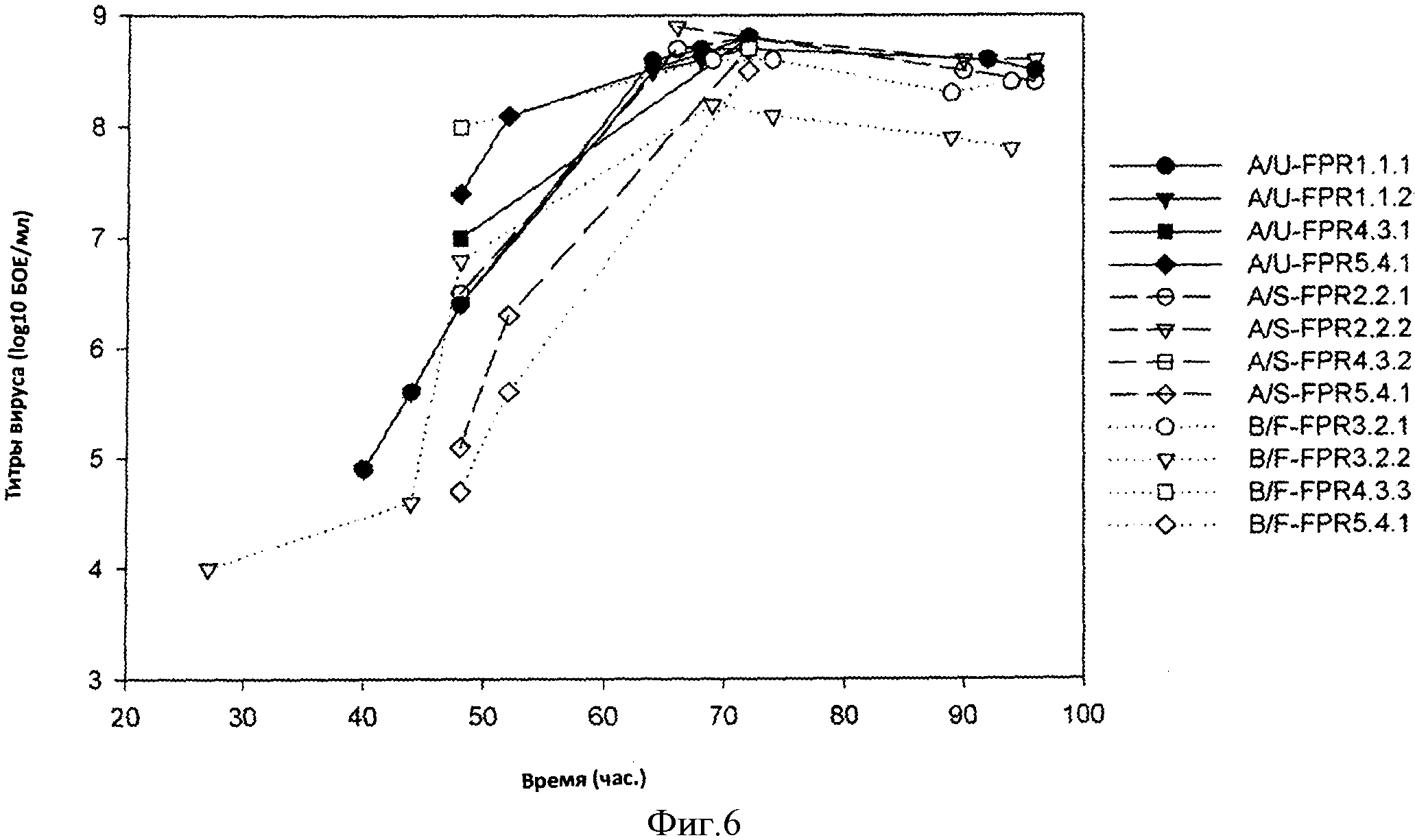
Фигура 6 представляет собой кривую титров вируса са А/Уругвай (A/U), са А/Южная Дакота (A/S) и са В/Флорида (B/F) в течение периода времени для клеток, которые исходно выращивали в 4×2 л посевных реакторах, а затем подвергали культивированию, после чего инфицировали 12×2 л реакторы заключительного получения (FPR) для всех экспериментов. Примечания: каждая точка данных представляет собой среднее значение повторностей анализа. Титры вируса, ниже границы определения (<6,4 log10 БОЕ/мл или <2,4 log10 БОЕ/мл при разведении), не регистрировали.
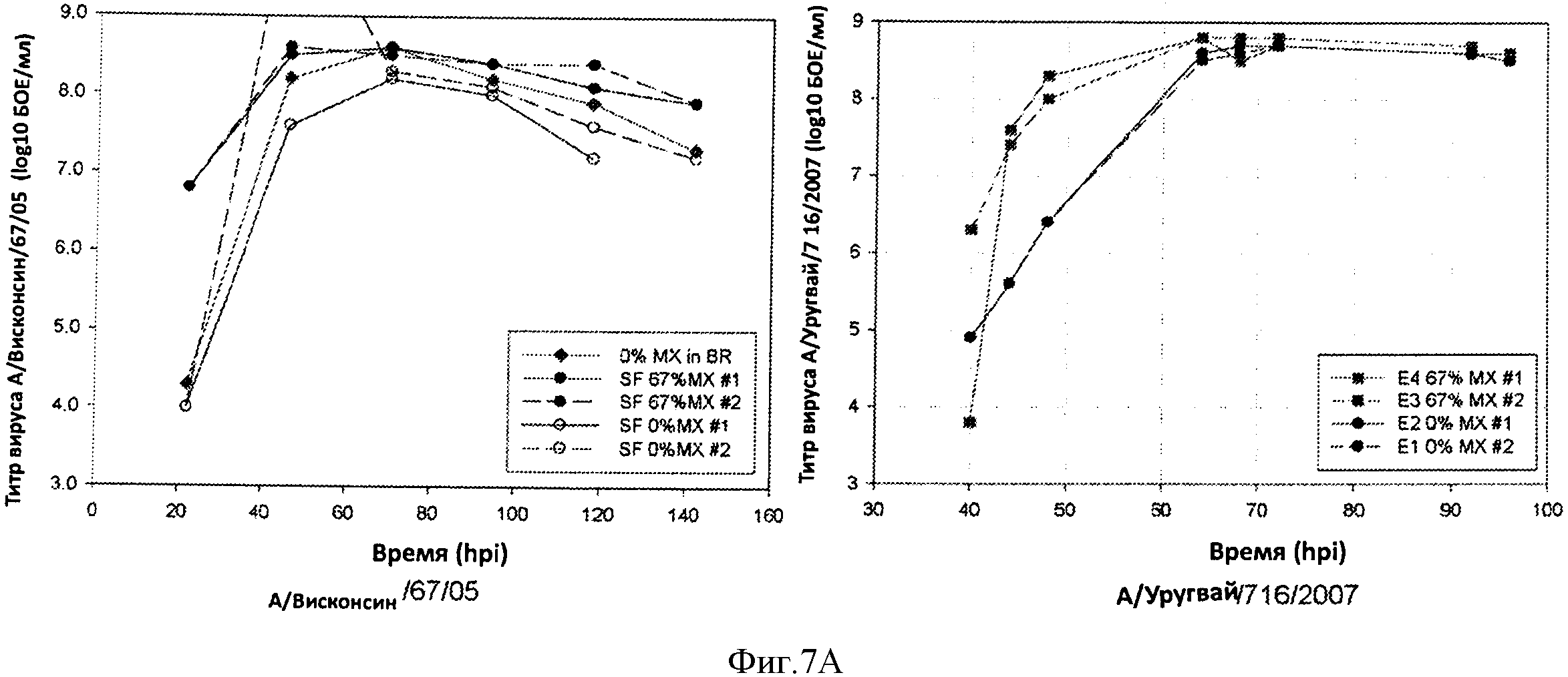
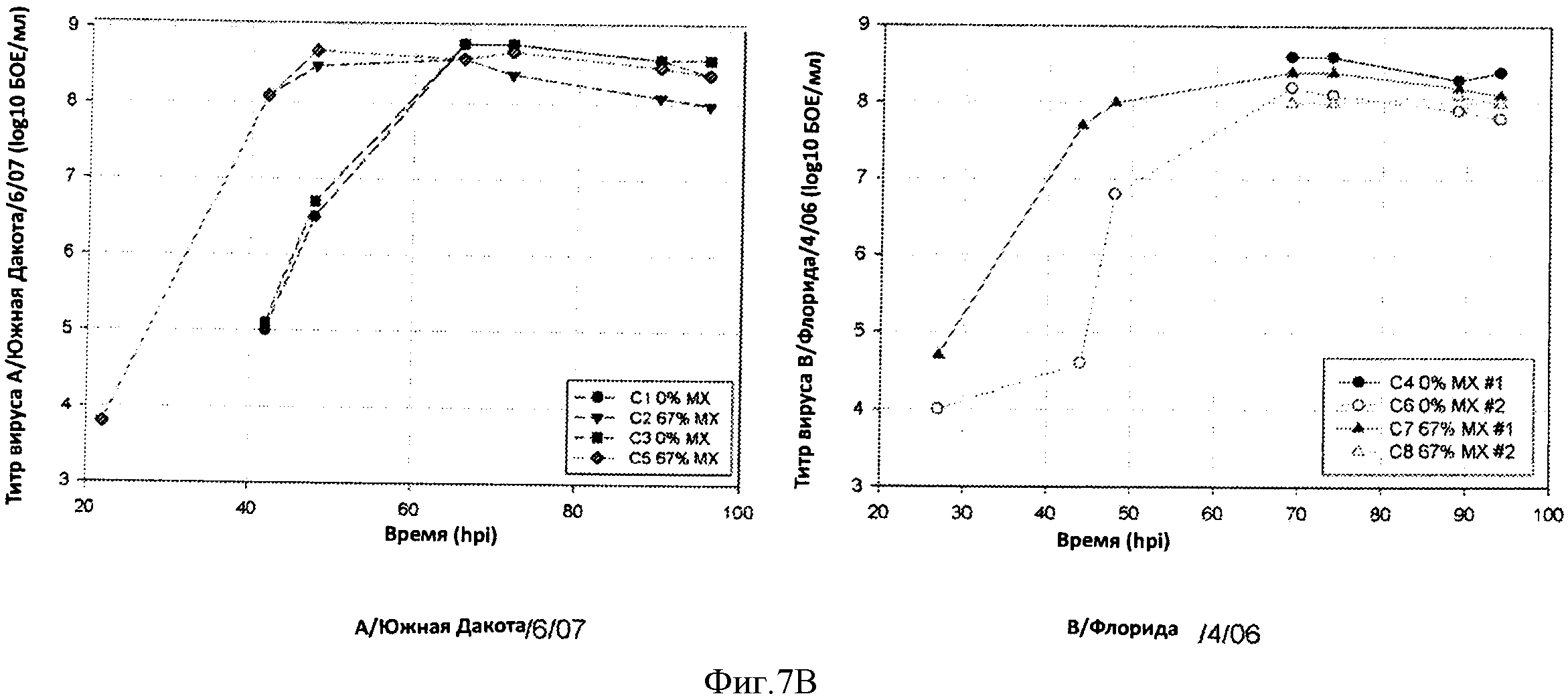
Фигура 7 показывает профили продукции вируса в течение периода времени для штамма, полученного при использовании процесса 67% замены среды (67% MX) против процесса при отсутствии замены среды (0% MX). Кривые для штаммов са А/Висконсин/67/05 и са А/Уругвай показаны на 8А, левая и правая панели, соответственно, кривые для са А/Южная Дакота и са В/Флорида показаны на 8В, левая и правая панели, соответственно.
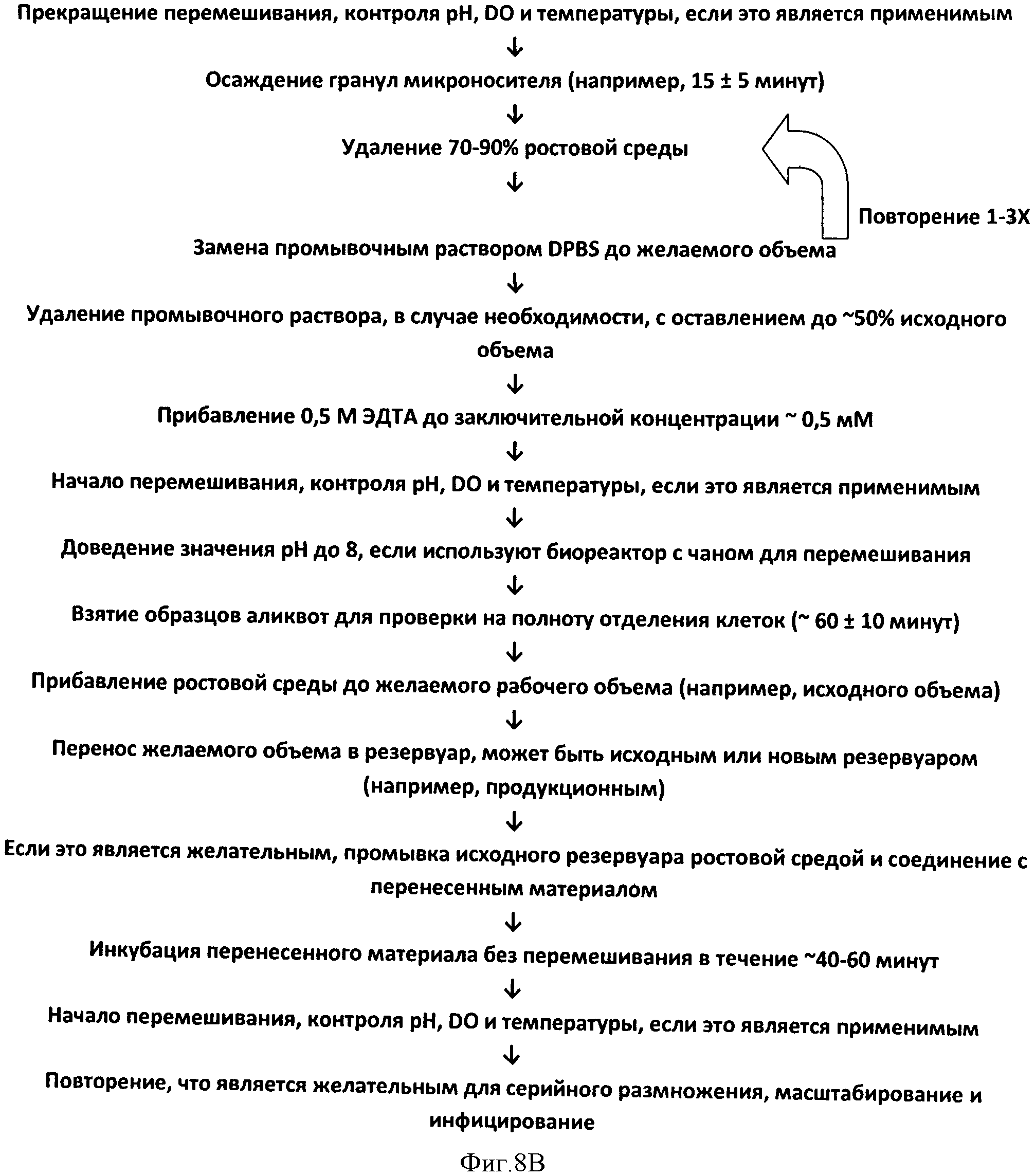
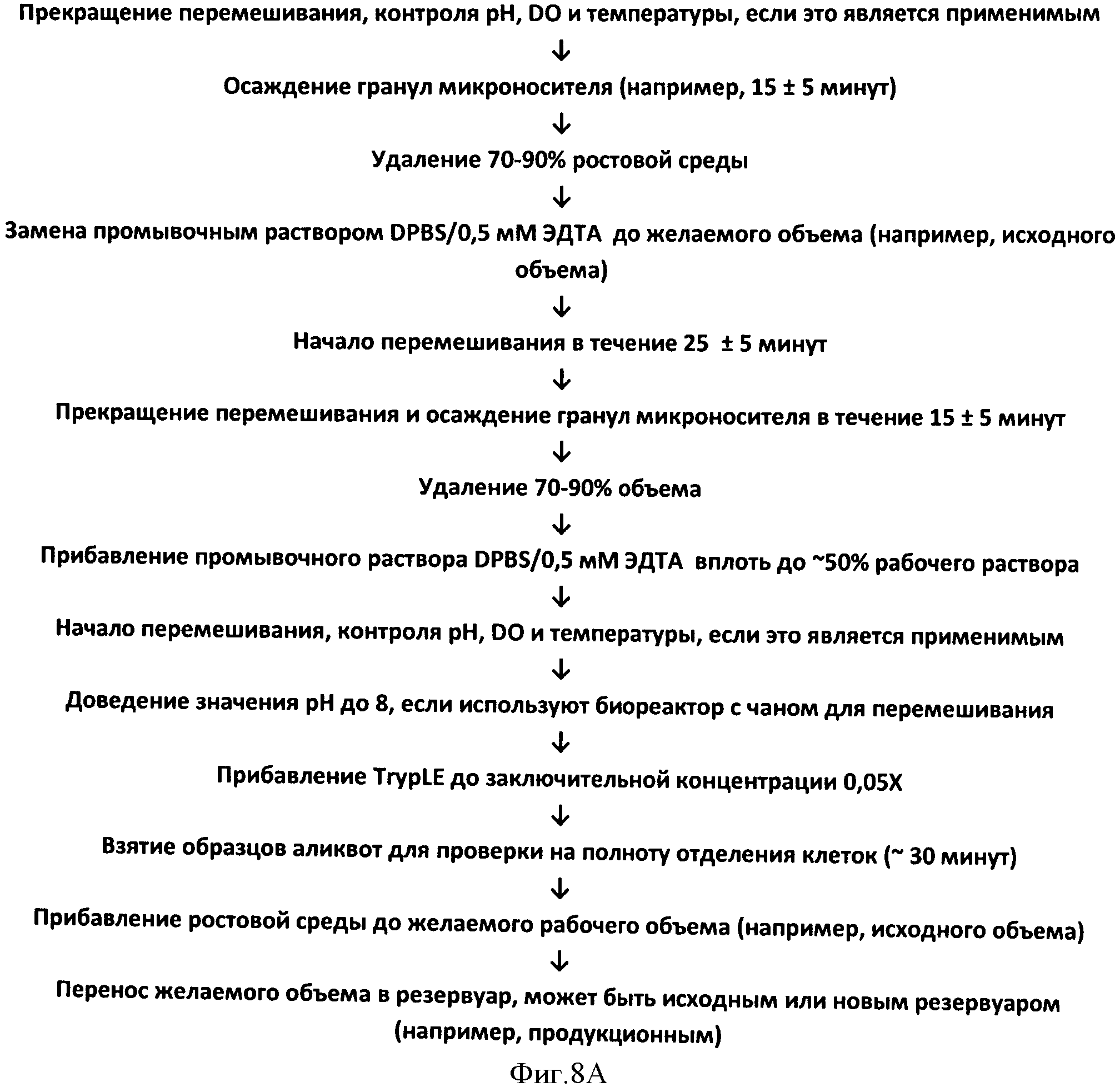
Фигура 8 представляет схему технологического процесса на основе переноса с гранулы на гранулу. Процесс, который отражен на Панеле А, использует два этапа промывки, на каждом из которых применяют забуференный солевой раствор (DPBS), включающий хелатирующий агент (EDTA) и протеазу (TrypLE™) при заключительной концентрации почти 0,05Х, что вызывает отделение клеток в течение ~30 минут. Процесс, который отражен на Панеле В, использует 2-3 этапа промывания, на которых применяют забуференный солевой раствор (DPBS), после чего осуществляют инкубацию с хелатирующим агентом (ЭДТА) при заключительной концентрации ~0,5 мМ, что вызывает отделение клеток в течение ~60 минут при отсутствии какой-либо протеазы.
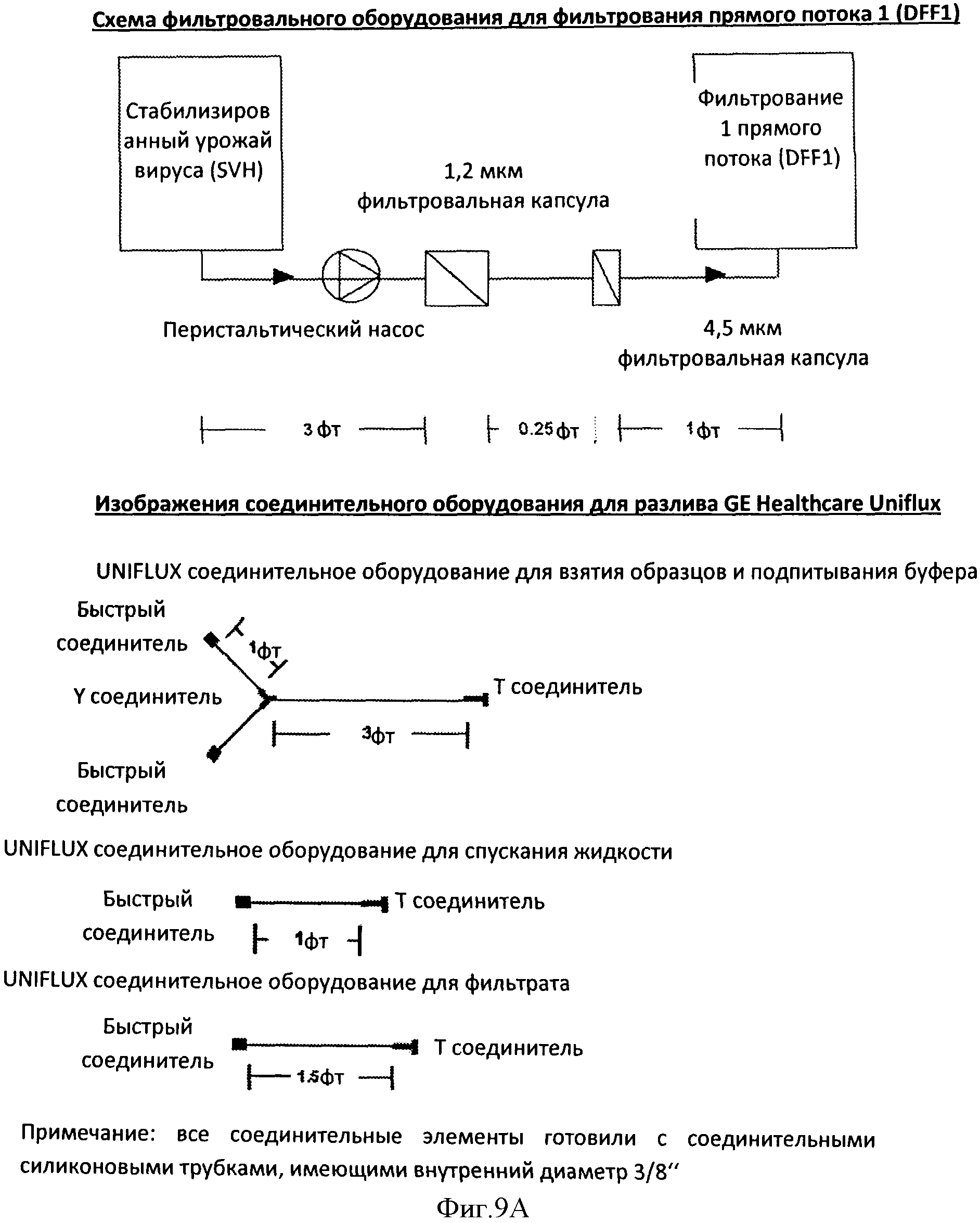
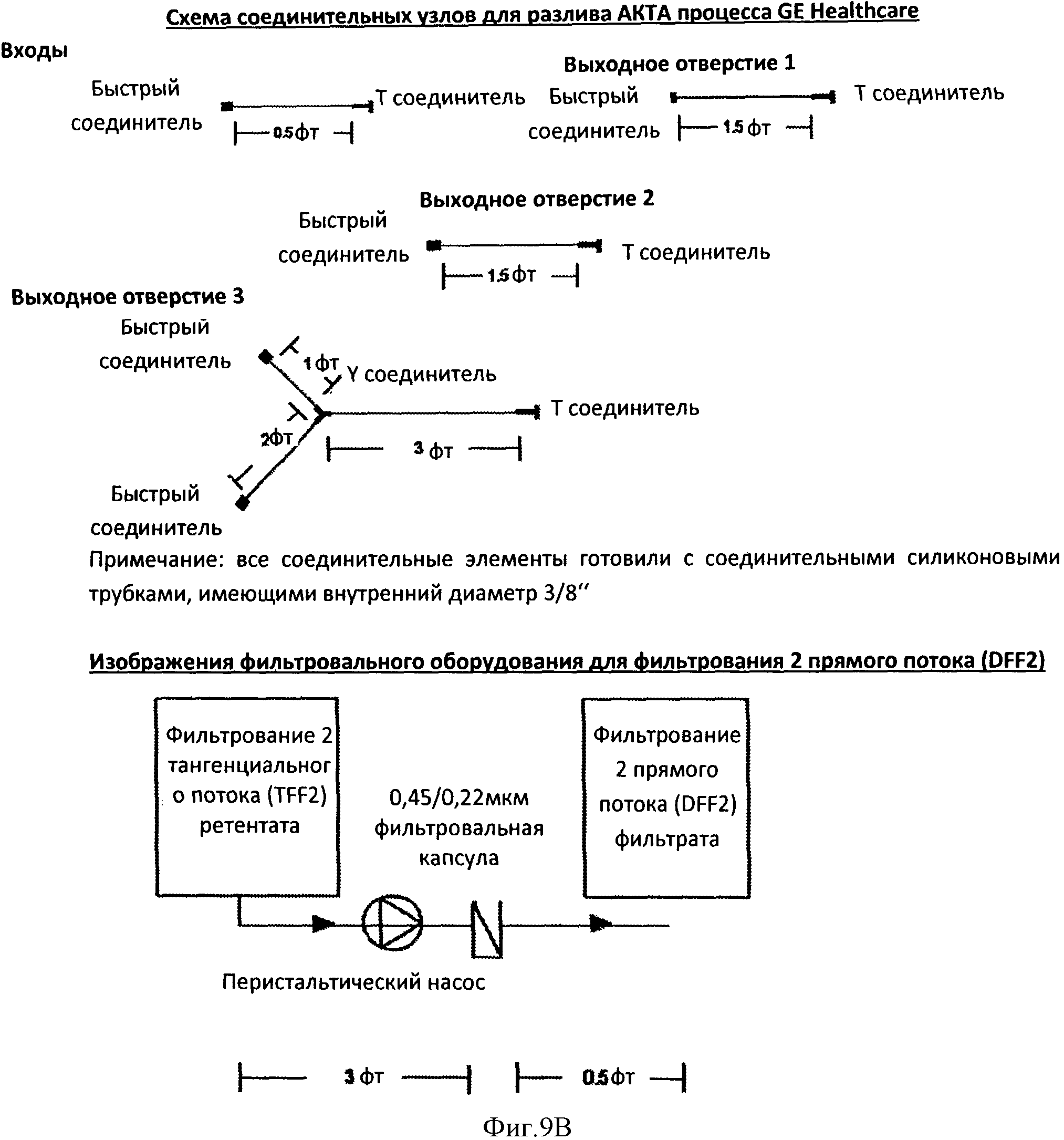
Фигура 9 представляет чертежи фильтра и установок для разлива, которые используются для фильтрования прямого потока (DFF1), установки для фильтрования (Панель А, верхняя часть), соединительное оборудование для разлива GE Healthcare Uniflux (Панель А, нижняя часть), соединительное оборудование для разлива GE Healthcare AKTAprocess (Панель В, верхняя часть), и фильтровальной установки для фильтрования прямого потока 2 (DIFF2) (Панель В, нижняя часть).
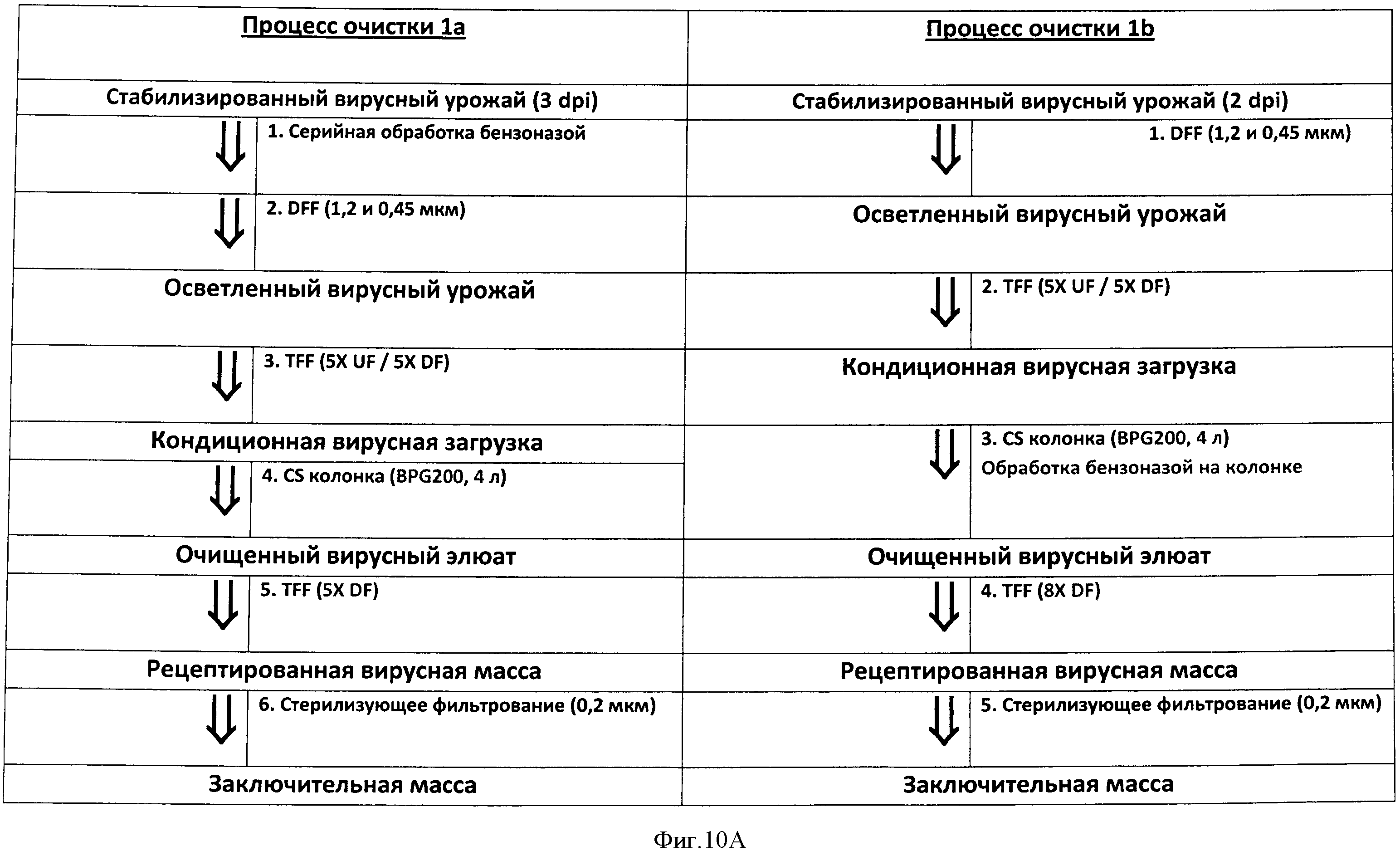
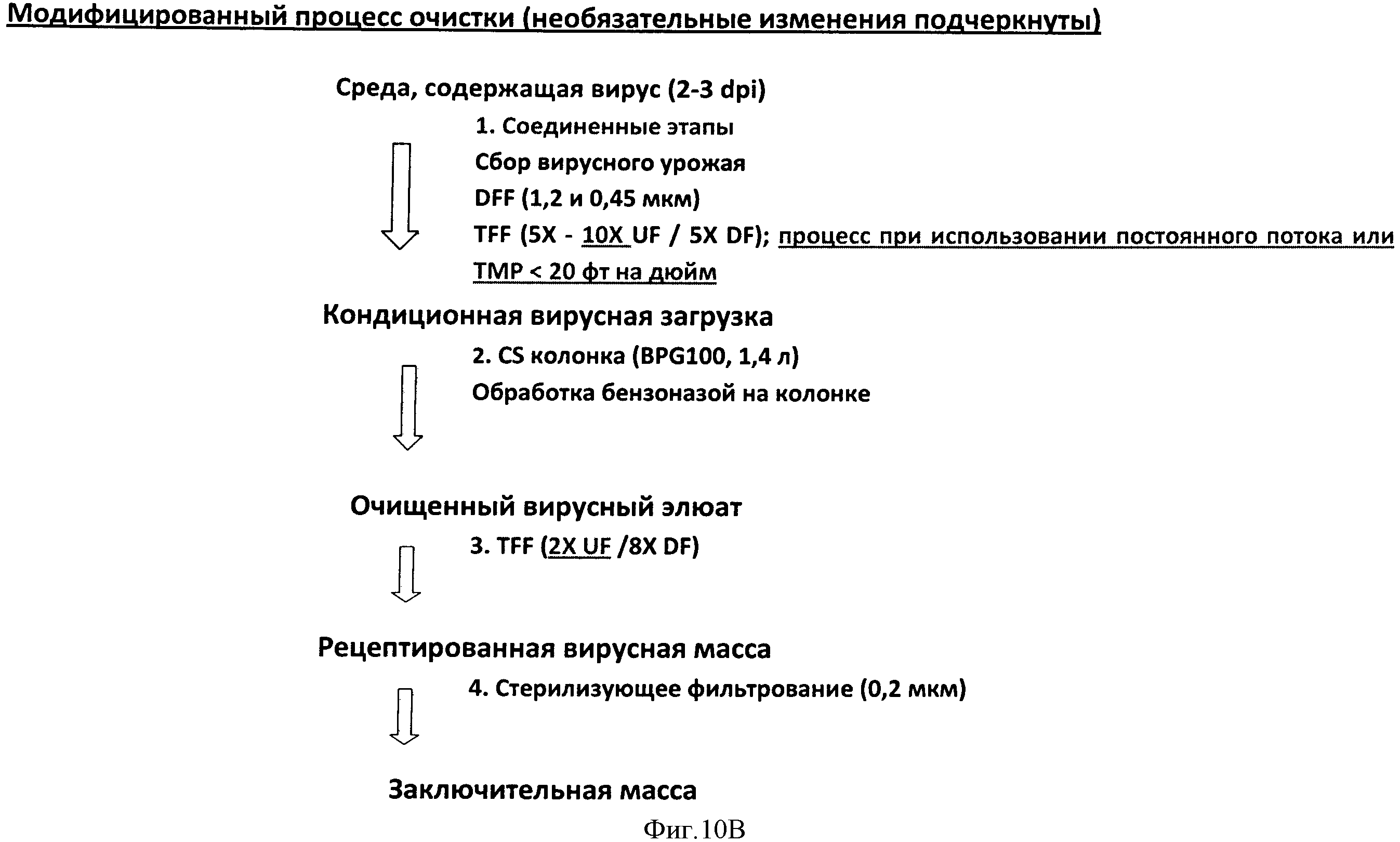
Фигура 10 представляет схему процесса начальной очистка 1а параллельно с улучшенным процессом очистка 1b в Панели А. Дополнительные модификации конкретизируются в схеме, представленной на Панели В. Детали каждого процесса обеспечиваются в Примерах 3 и 4.
Фигура 11 представляет кривую записи течения TFF1 прогона #8.
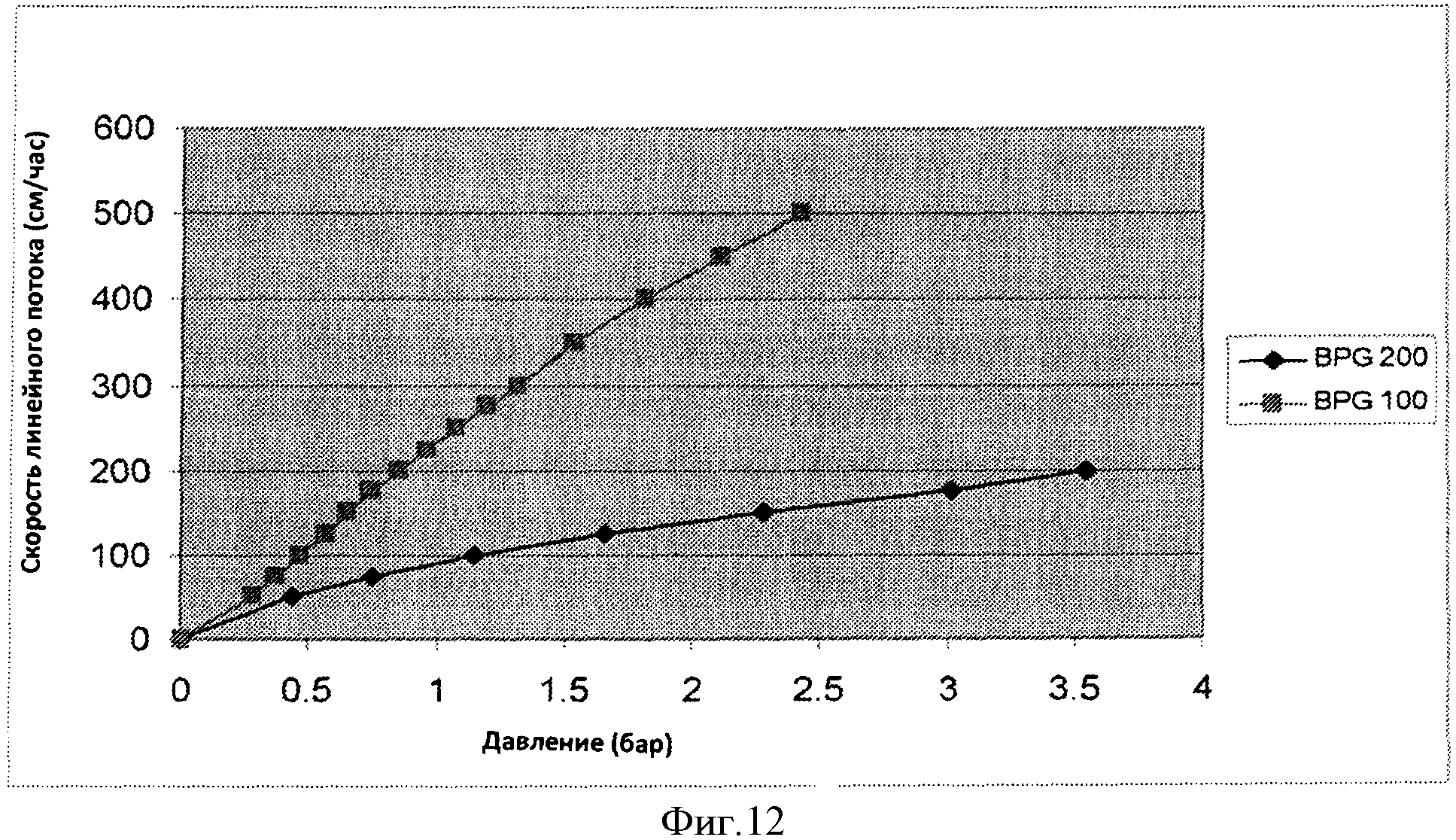
Фигура 12 представляет характеристики давления потока колонки BPG 100 и BPG 200 CS.
Фигура 13 представляет хроматограмму элюирования колонки CS прогона #9.
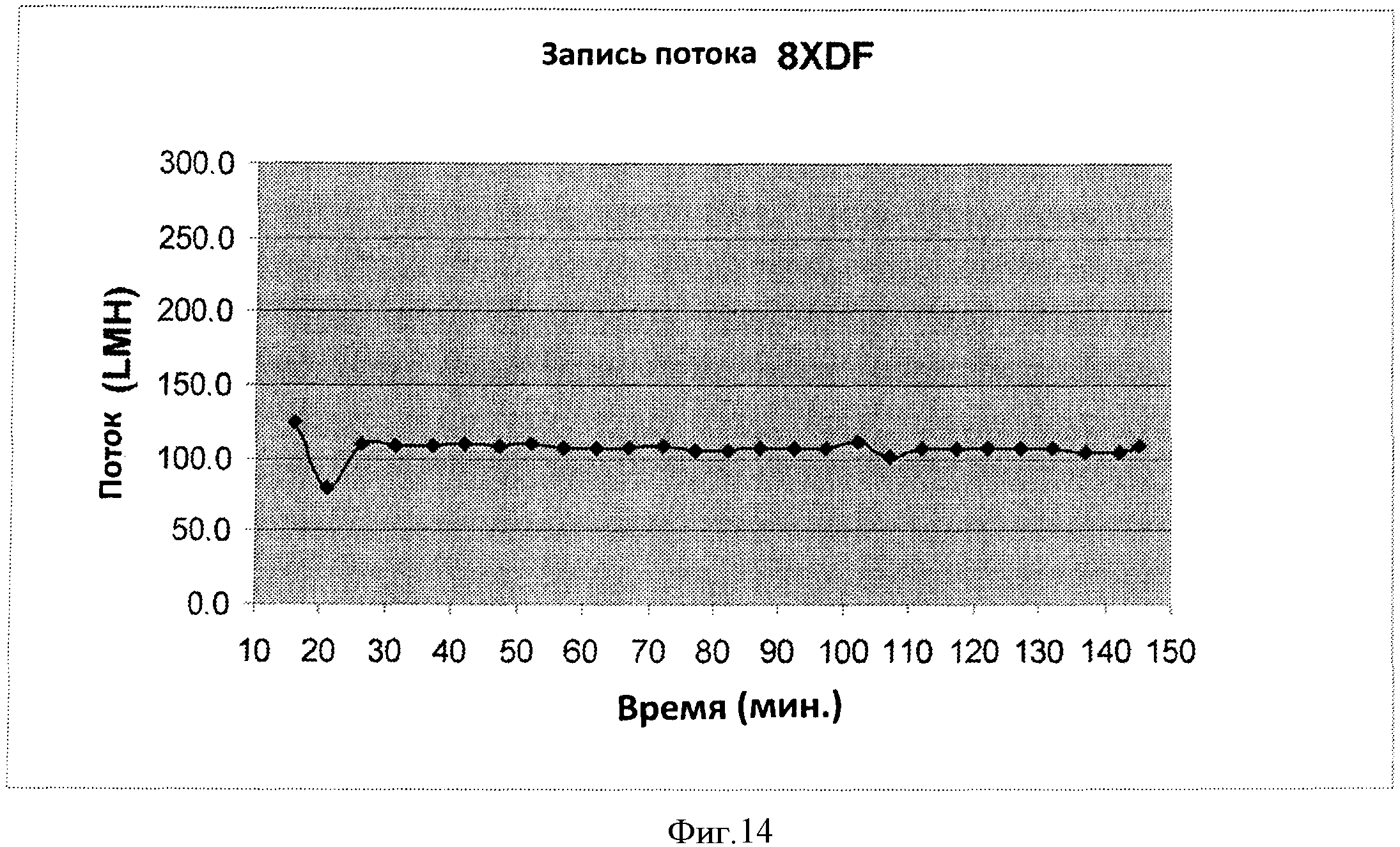
Фигура 14 представляет кривую записи потока прогона #8 TFF2 8XDF процесса.
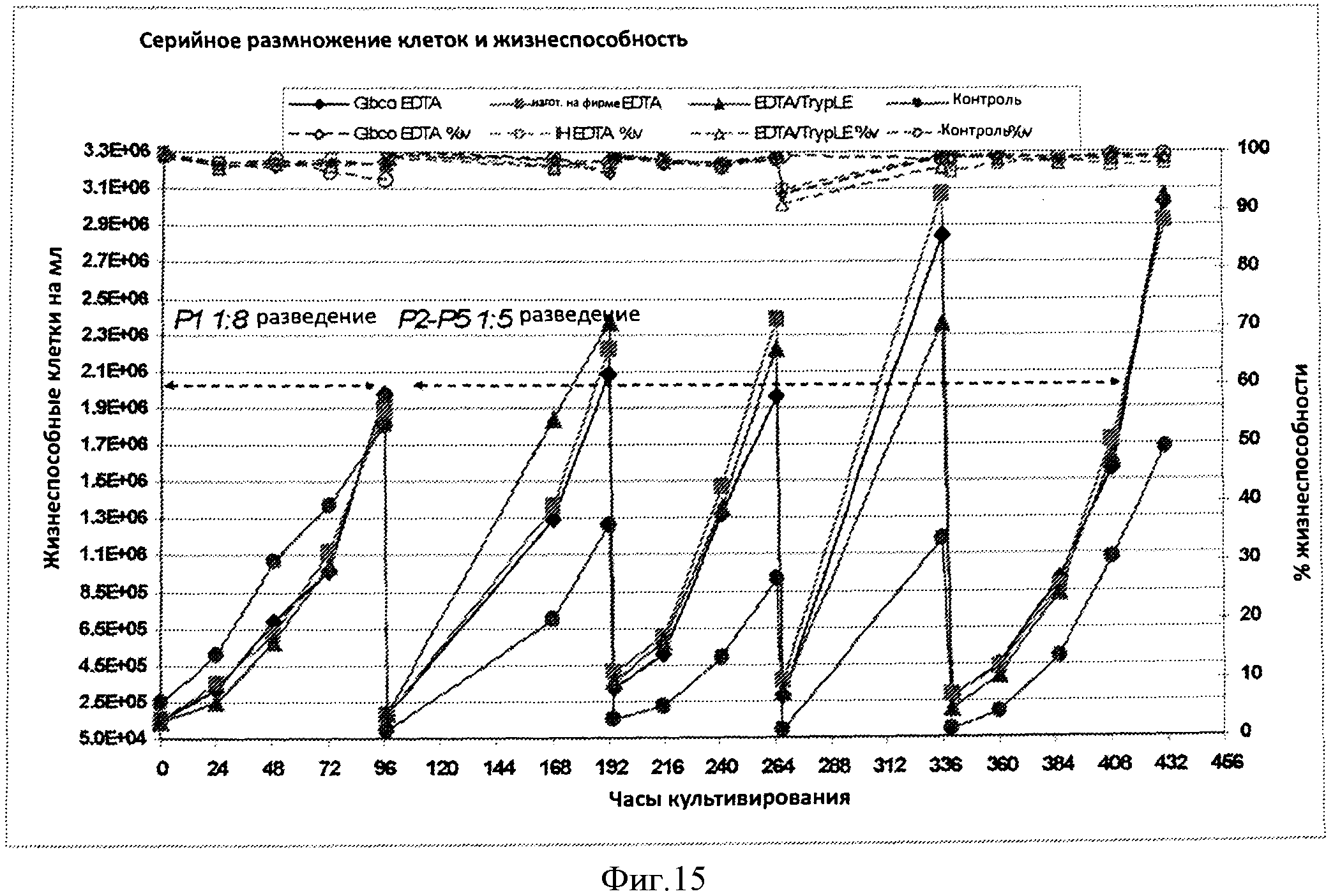
Фигура 15 представляет кривую жизнеспособных клеток на мл (заштрихованные символы/непрерывные линии) и процент жизнеспособности (незаштрихованные символы/пунктирные линии) в течение приблизительно 432 часов культивирования для клеток, серийно разведенных и размноженных при отсутствии протеазы (ромбы и квадраты), клетки серийно разводили и размножали при использовании смеси ЭДТА/протеаза (треугольники), и клетки независимо разводили и размножали при использовании способов на основе протеазы (кружочки).
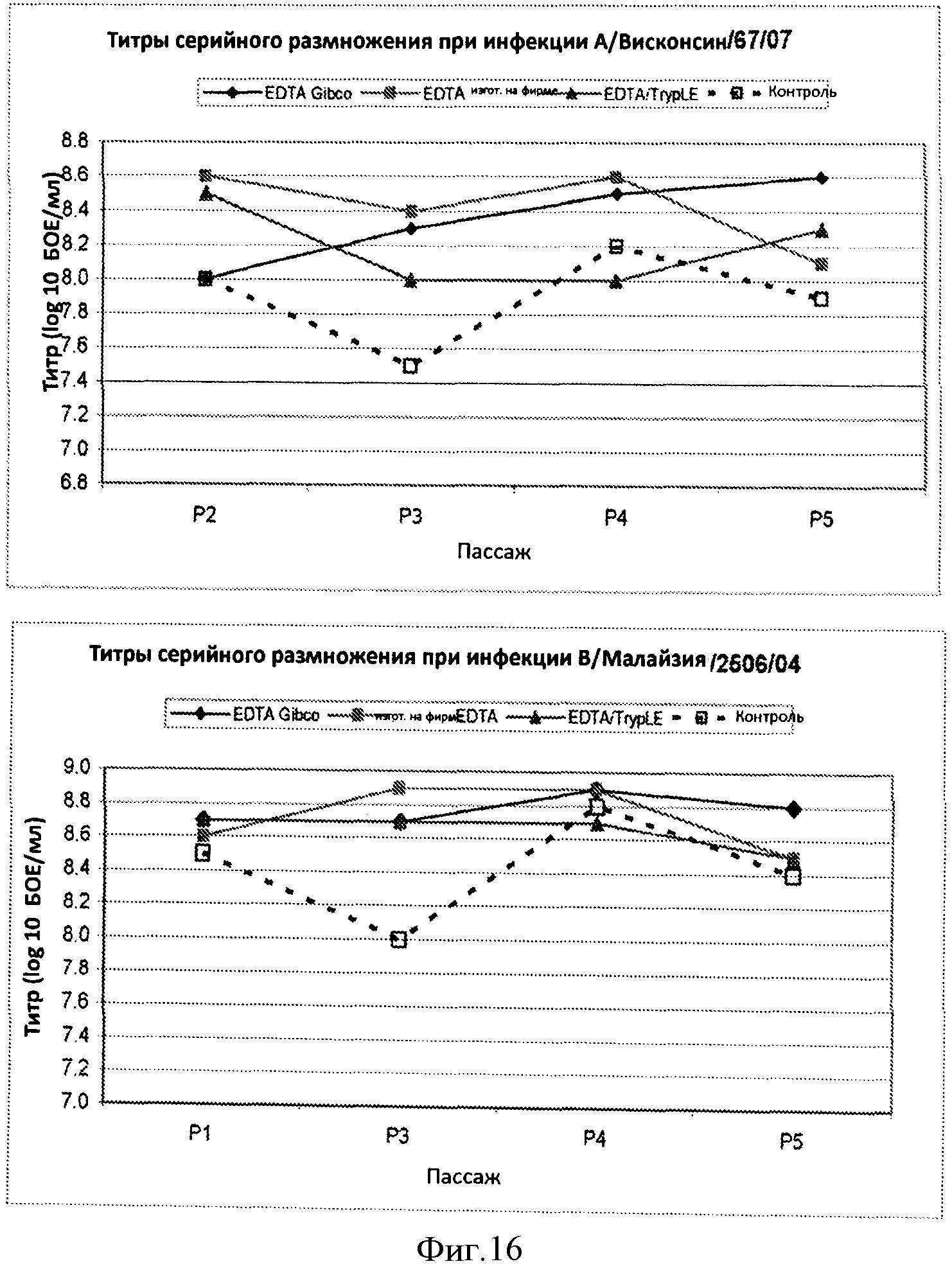
Фигура 16 представляет кривые титров штаммов са A/Висконсин/67/07 (верхняя часть), са В/Малайзия/2506/04 (нижняя часть), полученных из каждого пассажа клеток, которые серийно разводили и размножали при отсутствии протеазы (ромбы и квадраты), клетки серийно разводили и размножали при использовании смеси ЭДТА/протеаза (треугольники), клетки также независимо разводили и размножали при использовании стандартных способов на основе протеазы (незаштрихованные квадраты). Кривые показывают, что титры, по крайней мере, 8,0 log10 БОЕ/мл получали при использовании клеток, разведенных и размноженных с использованием процесса с отсутствием протеазы и с применением смеси ЭДТА/протеаза.
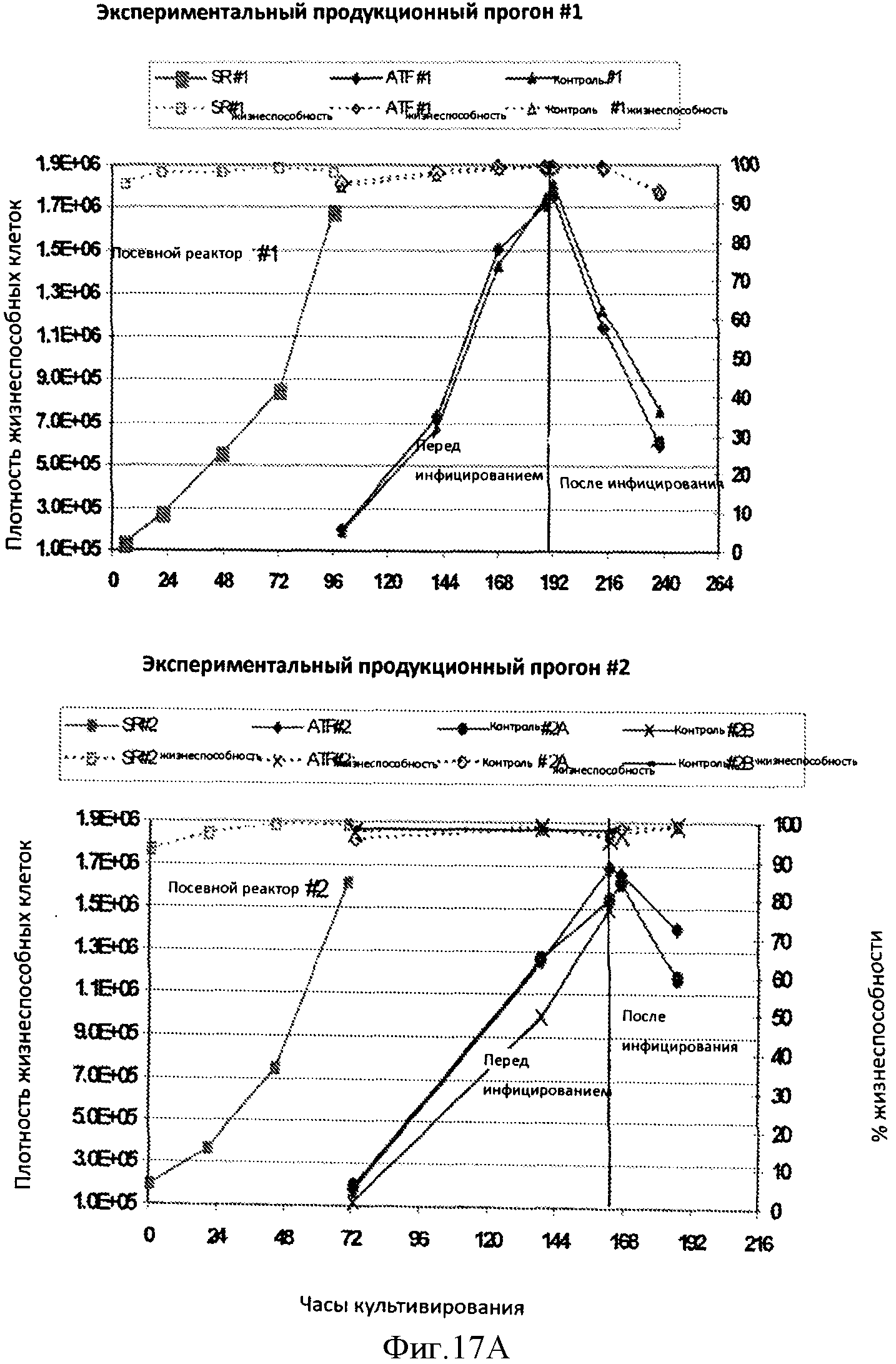
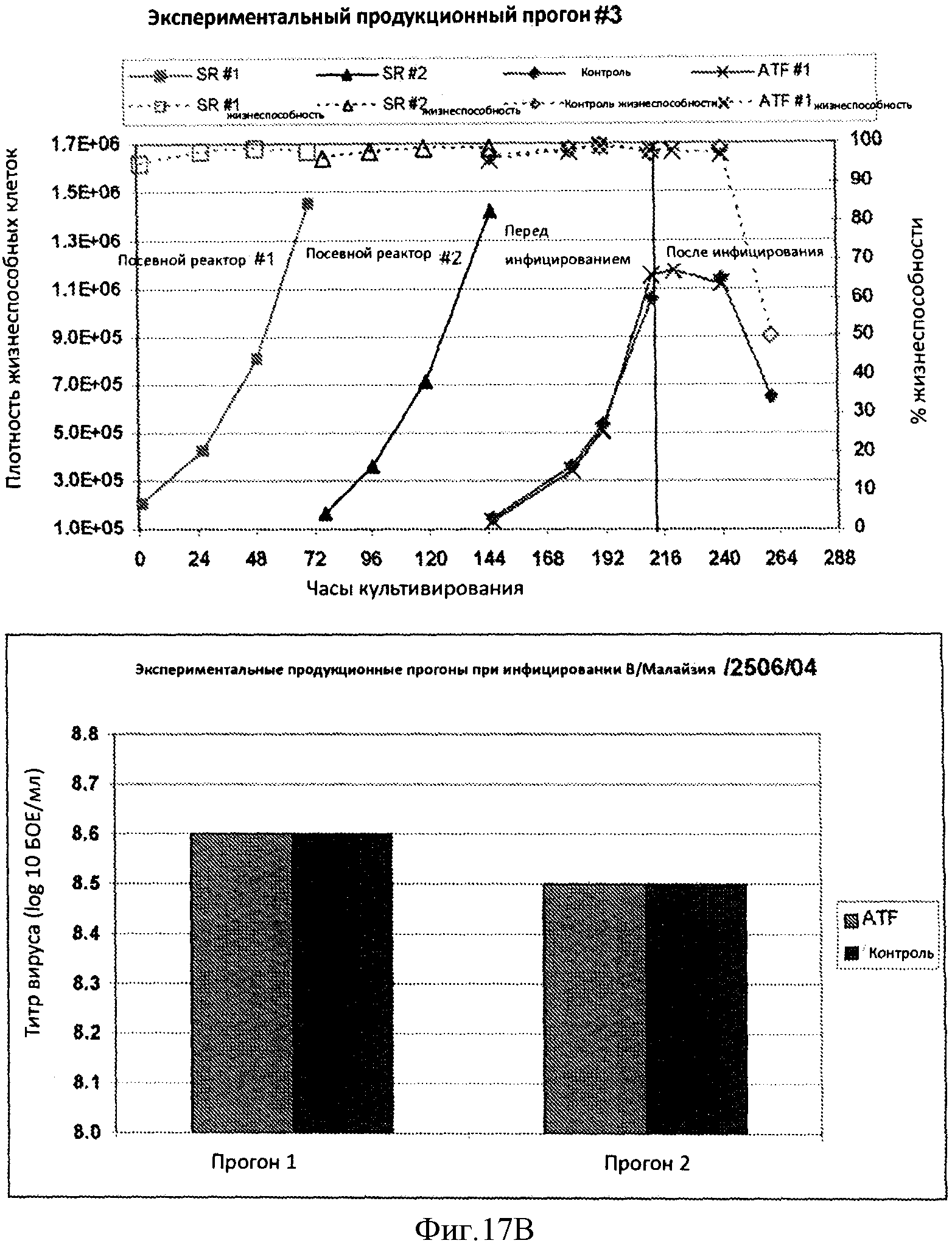
Фигура 17 представляет кривые жизнеспособных клеток на мл (заштрихованные символы/непрерывные линии) и процент жизнеспособности (незаштрихованные символы/пунктирные линии) в течение трех продукционных экспериментальных прогонов (Панель А и Панель В, верхняя часть). В каждую кривую включен(ы) посевной реактор(ы), экспериментальные прогоны продукционного(ых) реактора(ов) при использовании ATF и продукционный(ые) прогон(ы) без применения ATF. На Панеле В представлена (нижняя часть) кривая титров штамма са В/Малайзия/2506/04, полученная при двух продукционных экспериментальных прогонах, которая показывает, что титры являются сравнимыми с такими для прогонов, осуществленных при использовании ATF и без ATF.
Фигура 18 представляет фотографии жидкостей, удаленных из биореакторов при использовании ATF процесса, демонстрирующие, что они являются свободными от микроносителей. Левая панель показывает микроноситель, удаляемый промыванием при использовании ATF во время стерилизации микроносителя, правая панель показывает удаленную среду при использовании ATF во время этапа замены 66% среды в MDCK культуре клеток.
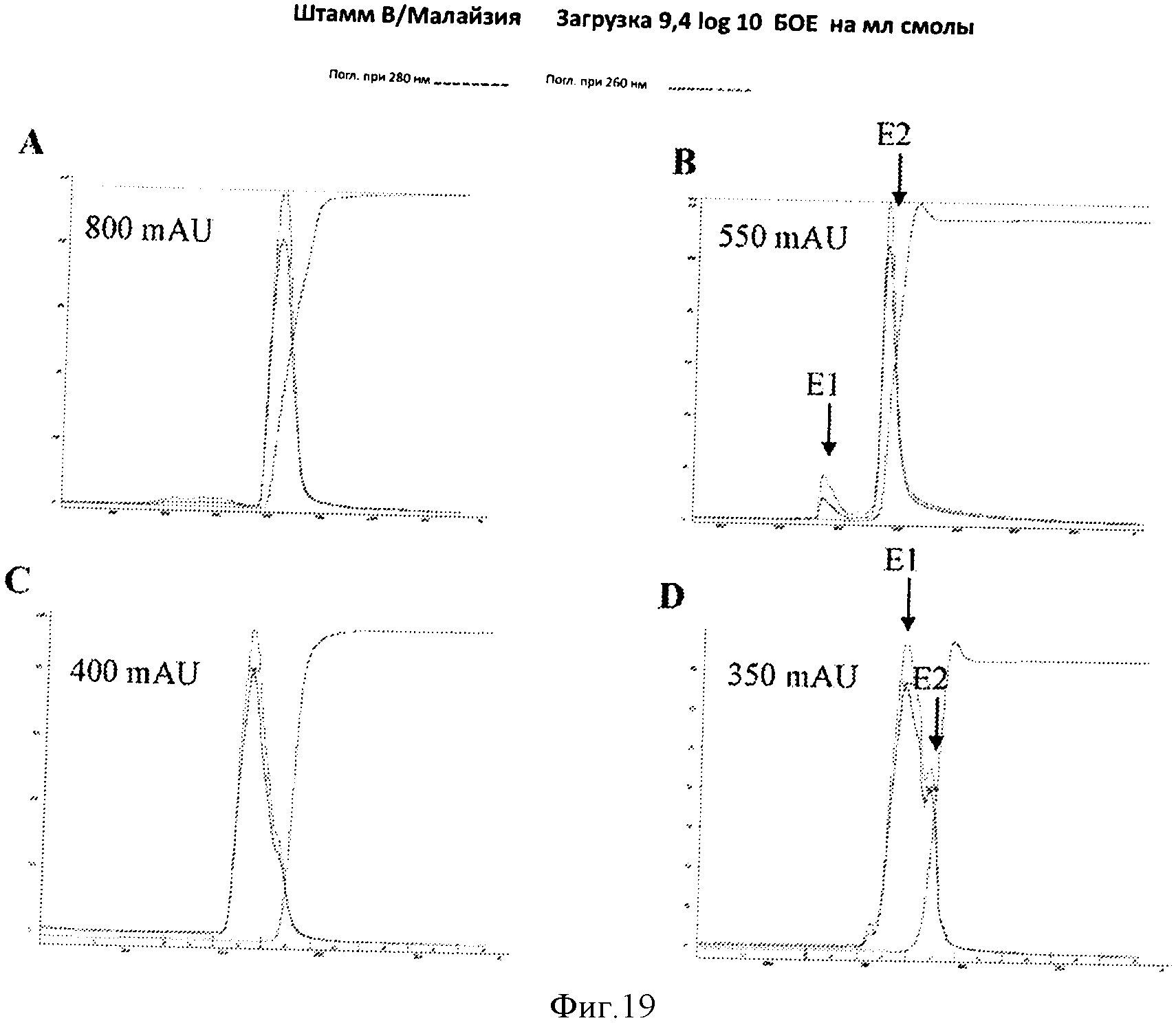
Фигура 19 представляет элютивные хроматограммы прогонов колонки с исследуемыми смолами А-D с элюированием при использовании 1 М NaCl (панели А-D, соответственно). Эти хроматограммы показывают, что исследуемые смолы А и В оказались такими, которые демонстрируют отдельные множественные пики элюирования, имеющие меньший ранний пик (смотри стрелку на панели В), в то время как исследуемые смолы С и D продемонстрировали единственный пик с "плечами" пика и гетерогенные характеристики (смотри стрелку на панели D).
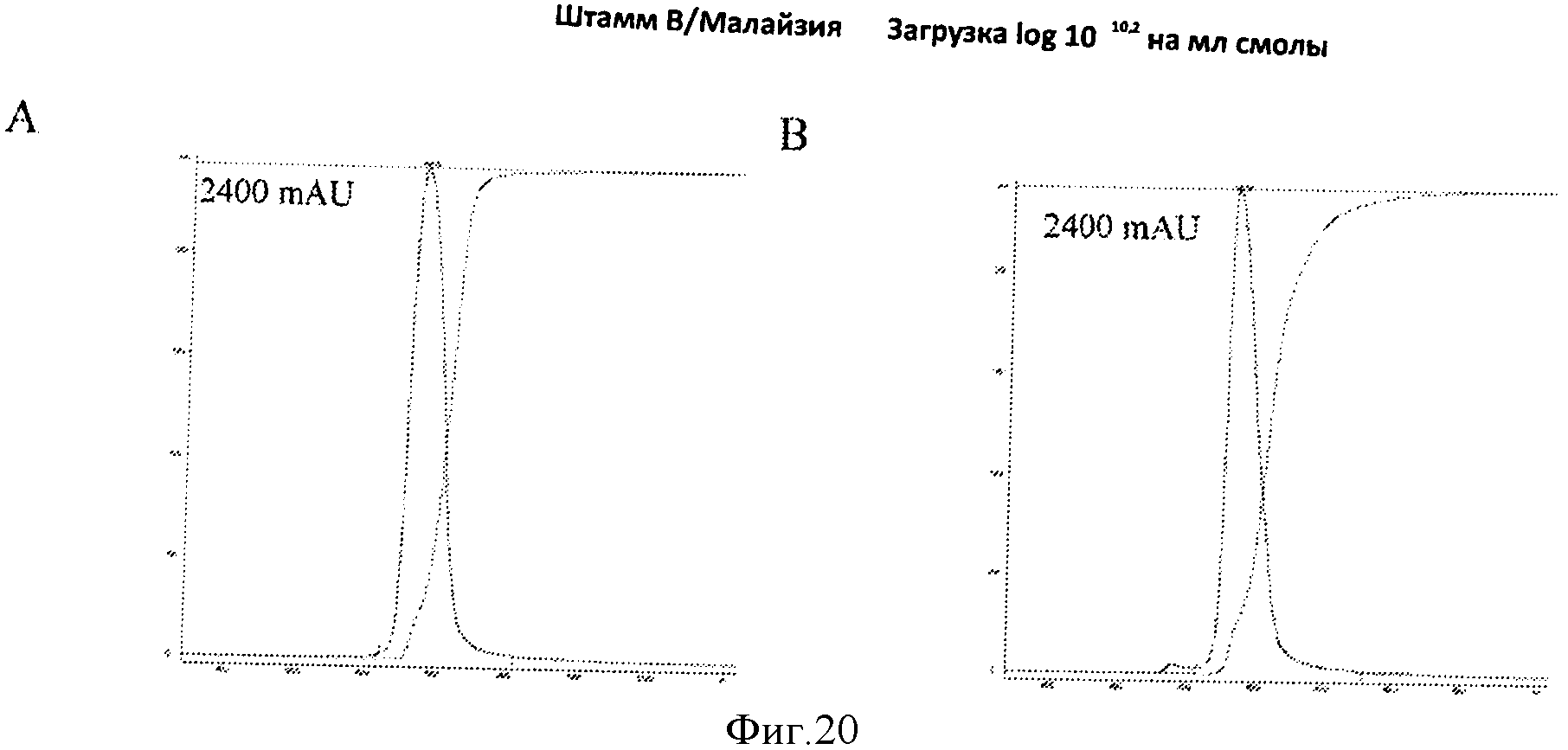
Фигура 20 представляет элютивные хроматограммы прогонов колонки с исследуемыми смолами С и D с элюированием при использовании 1 2 М NaCl (панели А и В, соответственно), которые демонстрируют, что пик элюирования заостряется при использовании элюирования при использовании 2М NaCl.
Фигура 21 представляет элютивные хроматограммы прогонов колонки с исследуемой смолой С для штаммов са А/Висконсин, са А/Соломоновы острова и са В/Малайзия, Панели А, В, и С, соответственно, показывающие, что профили пиков являются подобными и однородньми.
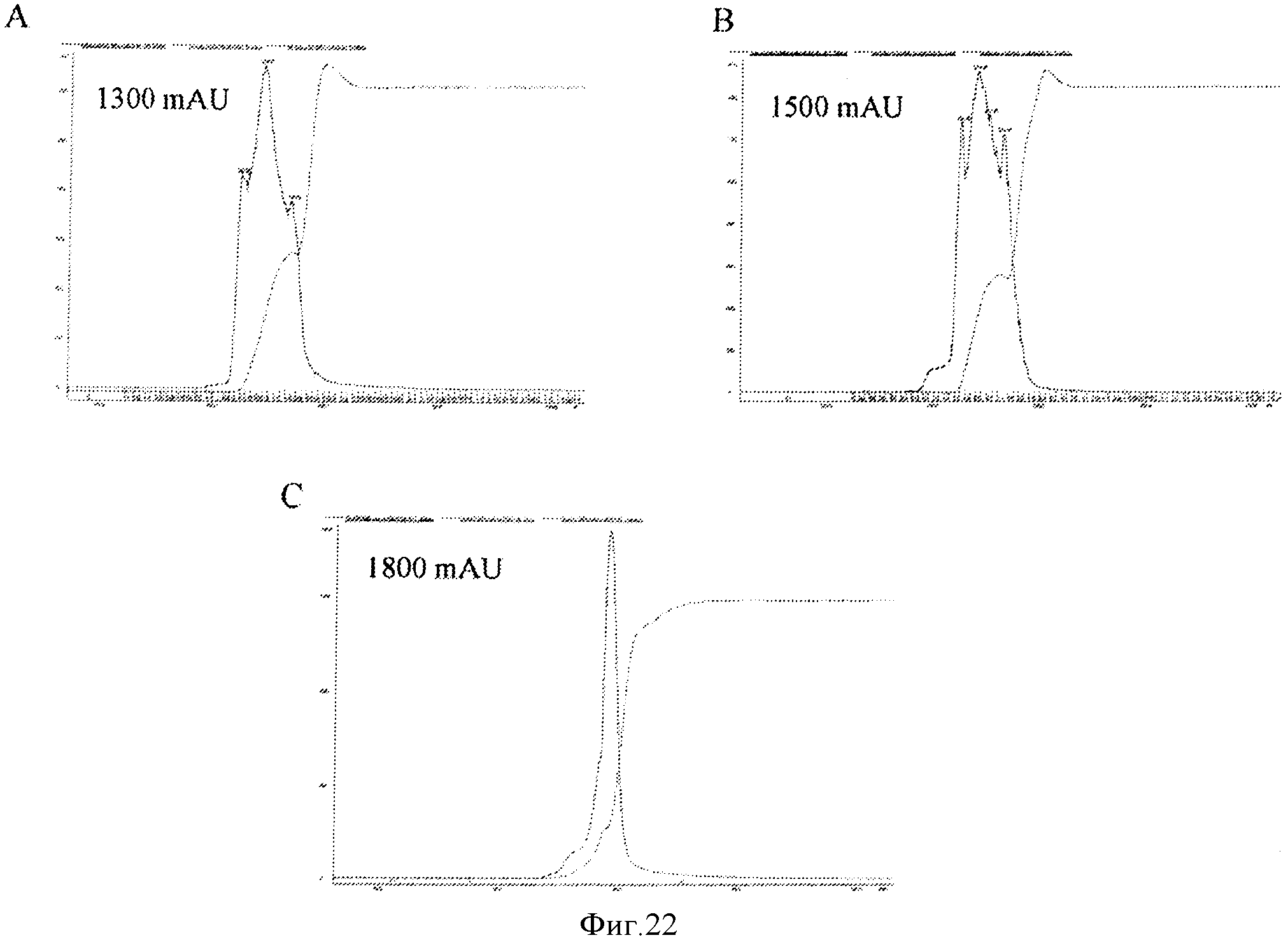
Фигура 22 представляет элютивные хроматограммы прогонов колонки. Панели А и В показывают элюирование для штаммов са А/Висконсин и са В/Малайзия, соответственно, для колонки с исследуемой смолой D, показывающие, что профили пиков являются подобными и однородными. Панель С показывает хроматограммы пика элюирования исследуемой смолы D при ХК-50 размере колонки.
Фигура 23 представляет рисунки культур для клеток А) необработанных клеток и клеток, обработанных в течение 60 минут с помощью В) 0,5 мМ ЭДТА, С) 1 мМ ЭДТА, D) 2 мМ ЭДТА, Е) 5 мМ ЭДТА и F) 10 мМ ЭДТА.
Фигура 24 представляет рисунки культур клеток для клеток, предварительно обработанных с помощью 2 мМ ЭДТА, после чего осуществляли обработку с помощью 0.0125Х TrypLE (ПанелиА и D), 0,025Х TrypLE (Панели В и Е) и 0.05Х TrypLE (Панели С и F). Фотографии сделаны через 0 минут после прибавления TrypLE (Панели А, В, и С) и вновь через 60 минут после прибавления TrypLE (Панели D, Е и F).
6. ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение обеспечивает высоковоспроизводимые, эффективные и масштабируемые процессы для получения больших количеств вируса (например, вируса гриппа или RSV) или вирусного антигена для профилактического, диагностического, иммунотерапевтического или терапевтического применения в биореакторах с адгезивными клетками (например, MDCK клетками, в частности, неканцерогенными линиями клеток или клетками Vero). В частности, настоящее изобретение обеспечивает мощные способы для получения адаптированных к холоду и/или чувствительных к температуре, и/или аттенуированных вирусов гриппа или респираторно-синцитиального вируса, для получения высокого титра, которые не требуют какой-либо замены среды.
В дополнение, настоящее изобретение обеспечивает культуральную среду, которая поддерживает культивирование MDCK клеток (например, неканцерогенных MDCK клеток) и поддерживает репликацию вируса, включая, но без ограничения, вирус гриппа (например, адаптированный к холоду и/или чувствительный к температуре, и/или аттенуированный вирус гриппа), для получения высокого титра, что не требует какой-либо замены среды.
В дополнение, настоящее изобретение также обеспечивает способы получения вакцинного материала (например, вируса гриппа) из MDCK клеток (например, неканцерогенных MDCK клеток) и способы предотвращения гриппозной инфекции, использующие вакцинные материалы, полученные в MDCK клетках. Любой ассоциированный с клеткой вирус (например, вирус гриппа и RSV) может быть очищен с помощью процесса, описанного в данной заявке, и/или может содержаться в иммуногенной композиции, описанной в данной заявке. Как используется в данной заявке, термин "ассоциированный с клеткой вирус" относится к вирусу, для которого приблизительно 60% титра вируса или более является ассоциированными с адгезивными инфицированными вирусом клетками, как определяется с помощью любой методики, известной специалисту в данной области техники. Способы в соответствии с изобретением являются особенно полезными для получения адаптированных к холоду/чувствительных к температуре/аттенуированных (ca/ts/att) штаммов вируса гриппа (например, таких в FluMist®) и RSV (например, rА2ср248/404/1030ΔSH).
Вирусы, которые могут выращиваться в неканцерогенных MDCK клетках и/или клетках Vero, включают, но без ограничения вирусы с негативной цепочкой РНК, включая, но без ограничения, вирусы гриппа, RSV, вирусы парагриппа 1, 2 и 3, и метапневмовирус человека, а также другие вирусы, включая ДНК-содержащие вирусы, ретровирусы, вирусы с позитивной цепочкой РНК, вирусы с негативной цепочкой РНК, вирусы с двухцепочечной РНК, включая, но без ограничения, паповавирус, вирус везикулярного стоматита, вирус осповакцины, вирус Коксаки, реовирус, парвовирус, аденовирус, вирус полиомиелита, вирус коревой краснухи, вирус бешенства и вирус герпеса.
6.1 Определения
Канцерогенность, как используется в данной заявке, имеет обычное значение, которое приписывается этому термину квалифицированным специалистом в данной области техники. Канцерогенность в одном воплощении определяется с помощью модели взрослых бестимусных мышей с мутацией nude (например, Stiles и др., 1976, Cancer Res, 36: 1353, и Пример 5, приведенный ниже). Канцерогенность может также подвергаться исследованию с помощью других анализов, например, путем инъекции в куриные эмбрионы и/или местного применения хорионаллантоиса (Leighton и др., 1970, Cancer, 26: 1024).
Термин "рекомбинантный" указывает на то, что материал (например, нуклеиновая кислота или белок) были изменены искусственным или синтетическим (неприродным) путем с помощью вмешательства человека. Изменения могут осуществляться на материале в его природном окружении или состоянии или извлеченном из него. В частности, когда упоминается вирус, например вирус гриппа, то вирус является рекомбинантным, когда его получают путем экспрессии рекомбинантной нуклеиновой кислоты. Рекомбинантный вирус может дополнительно содержать одну или более мутаций, введенных в его геном. Рекомбинантный вирус может также представлять собой реассортантный вирус, когда он включает компоненты, имеющие происхождение более чем от одного родительского вирусного штамма.
Термин "реассортант," когда относится к вирусу, указывает на то, что вирус включает генетические и/или полипептидные компоненты, имеющие происхождение от более чем одного исходного вирусного штамма или источника. Например, 7:1 реассортант включает 7 вирусных геномных сегментов (или генных сегментов), которые имеют происхождение от первого родительского вируса, и единственный комплементарный вирусный геномный сегмент, например кодирующий гемагглютинин или нейраминидазу, из второго родительского вируса. 6:2 реассортант включает 6 геномных сегментов, наиболее часто 6 внутренних генов из первого родительского вируса, и два комплементарных сегмента, например гемагглютинин и нейраминидазу, из другого родительского вируса.
Термин "приблизительно," как используется в данной заявке, если не указано иное, относится к значению, которое не более чем на 10% выше или ниже приведенного значения. Например, термин "приблизительно 5 мкг/кг" означает интервал от 4,5 мкг/кг до 5,5 мкг/кг. В качестве другого примера "приблизительно 1 час" означает интервал от 54 минут до 66 минут.
Термины "чувствительный к температуре," "адаптированный к холоду" и "аттенуированный" являются хорошо известными в уровне техники. Например, термин "чувствительный к температуре" ("ts") указывает на то, что вирус демонстрирует 100-кратное или более снижение титра при более высокой температуре, например при 39°С по отношению к более низкой температуре, например 33°С для штамма вируса гриппа А, и что вирус демонстрирует 100-кратное или более снижение титра при более высокой температуре, например при 37°С по отношению к более низкой температуре, например 33°С для штамма вируса гриппа В. Например, термин "адаптированный к холоду" ("са") указывает на то, что вирус демонстрирует более высокую скорость роста при более низкой температуре, например при 25°С в пределах 100-кратного от скорости своего роста при более высокой температуре, например, 33°С. Например, термин "аттенуированный" ("att") указывает на то, что вирус реплицируется в верхних дыхательных путях хорька, но не определяется в ткани легких и не вызывает заболевания, подобного гриппу у животного. При этом является понятным, что вирусы с промежуточными фенотипами, то есть вирусы, демонстрирующие снижение титра менее чем 100-кратное при 39°С (для штаммов вируса А) или 37°С (для штаммов вируса В), демонстрирующие рост при 25°С, который является большим чем 100-кратный от их роста при 33°С (например, в пределах 200-кратного, 500-кратного, 1000-кратного, 10,000-кратного) и/или демонстрирующие сниженный рост в легких по сравнению с ростом в верхних дыхательных путях хорька (то есть частично аттенуированный) и/или уменьшенное подобное гриппу заболевание у животного, также являются полезными вирусами, которые охватываются данным изобретением. Рост свидетельствует о качестве вируса, как определяется титром, размером бляшек или морфологией, плотностью частиц или другими характеристиками, известными квалифицированному специалисту в данной области техники.
6.2 Клетки
Ассоциированные с клеткой вирусы, описанные в данной заявке, могут размножаться в любой адгезивной клетке, что позволяет выращивать вирусы до титров, которые дают возможность использовать эти вирусы. В одном воплощении адгезивные клетки позволяют выращивать ассоциированные с клеткой вирусы до титров, сравнимых с теми, что определяются для соответствующих вирусов дикого типа. В специфическом воплощении ассоциированные с клеткой вирусы, описанные в данной заявке, размножают в клетках, которые являются чувствительными к вирусным инфекциям.
В одном воплощении ассоциированные с клеткой вирусы, описанные в данной заявке, размножают в клетках млекопитающих. Типичные клетки млекопитающих, которые являются ассоциированными с вирусами, описанными в данной заявке, могут размножаться, но без ограничения, в клетках Vero, СНО клетках, Нер-2 клетках, МВСК клетках, MDCK клетках, MRC-5 клетках, HeLa клетках и LLC-MK2 клетках. В специфическом воплощении ассоциированные с клеткой вирусы, описанные в данной заявке, включая респираторно синцитиальные вирусы, размножают в клетках Vero. В другом специфическом воплощении ассоциированные с клеткой вирусы, включая вирус гриппа, размножают MDCK клетках.
6.2.1 MDCK клетки
MDCK клетки являются известными для обеспечения изоляции и репликации и множества вирусов, включая, но без ограничения, ортомиксовирусы, парамиксовирусы, рабдовирусы и флавовирусы. В частности, MDCK клетки широко используются для получения вируса гриппа. Однако, как отмечалось выше, некоторые линии MDCK клеток являются канцерогенными. С учетом того, что канцерогенность представляет регуляторный интерес, настоящее изобретение обеспечивает способы для размножения неканцерогенных MDCK клеток и их применение для получения вирусов гриппа. В соответствии с этим в одном воплощении способы в соответствии с изобретением используют неканцерогенные MDCK клетки. В другом воплощении способ в соответствии с изобретением использует MDCK клетки вне зависимости от канцерогенности.
Неканцерогенные линии MDCK клеток, которые могут использоваться в способах в соответствии с изобретением, включают, но без ограничения, те, которые были задепонированы в Американской коллекции типовых культур (10801 University Boulevard, Manassas, Va. 20110-2209) 5 января 2005 года и им были присвоены номера депонирования АТСС РТА-6500 и РТА-6503 (обозначаются как MDCK-S и MDCK-SF103 соответственно); те, которые были задепонированы 5 октября 2006 года и им были присвоены номера депонирования АТСС РТА-7909 и РТА-7910 (обозначаются как субклоны 1-А и 1-В соответственно).
Другие MDCK клетки, которые могут использоваться, включают, но без ограничения, те, которые были задепонированы в Американской коллекции типовых культур и им были присвоены номера депонирования АТСС РТА-6501 и РТА-6502 (обозначаются как MDCK-SF101 и MDCK-SF102 соответственно); те, которым были присвоены номера депонирования АТСС CRL-12042 (обозначаются как MDCK, 5F1); те, которым были присвоены номера депонирования АТСС CCL34; CRL-2286; и CRL-2285.
В специфическом воплощении неканцерогенные MDCK клетки, используемые в способах в соответствии с изобретением, представляют собой неканцерогенные в модели взрослых бестимусных мышей с мутацией по гену nude (смотри, Stiles и др.). В другом специфическом воплощении неканцерогенные MDCK клетки, используемые в способах в соответствии с изобретением, являются неканцерогенными, когда вводятся в куриный эмбрион и/или местно применяются к хорионаллантоису (смотри, Leighton и др.. Id). Еще в одном воплощении неканцерогенные MDCK клетки, используемые в способах в соответствии с изобретением, являются неканцерогенными в модели взрослых бестимусных мышей с мутацией по гену nude, но не тогда, когда вводятся в куриный эмбрион и/или местно применяются к хорионаллантоису. Еще в одном воплощении неканцерогенные MDCK клетки, используемые в способах в соответствии с изобретением, являются неканцерогенными в модели взрослых бестимусных мышей с мутацией по гену nude и когда вводятся в куриный эмбрион и/или местно применяются к хорионаллантоису. Еще в одном воплощении неканцерогенные MDCK клетки, используемые в способах в соответствии с изобретением, являются неканцерогенными после, по крайней мере, 20 пассажей, или после, по крайней мере, 30 пассажей, или после, по крайней мере, 40 пассажей, или после, по крайней мере, 50 пассажей, или после по крайней мере 60 пассажей, или после по крайней мере, 70 пассажей, или после, по крайней мере, 80 пассажей, или после, по крайней мере, 90 пассажей, или после, по крайней мере, 100 пассажей. Еще в других воплощениях неканцерогенные MDCK клетки, используемые в способах в соответствии с изобретением, являются неканцерогенными после, по крайней мере, 20 пассажей, или после, по крайней мере, 30 пассажей, или после, по крайней мере, 40 пассажей, или после, по крайней мере, 50 пассажей, или после, по крайней мере, 60 пассажей, или после, по крайней мере, 70 пассажей, или после, по крайней мере, 80 пассажей, или после, по крайней мере, 90 пассажей, или после, по крайней мере, 100 пассажей в свободной от сыворотки среде в соответствии с изобретением (например, MediV SFM 105 + ТЕ, MediV SFM 109 и MediV SFM 110).
Канцерогенность может быть количественно оценена различными путями, известными специалисту в данной области техники. Один способ, который традиционно используется, представляет собой определение "TD50" значения, которое определяют как количество клеток, которое требуется для индукции опухолей у 50% исследуемых животных (смотри, например Hill R. The TD50 assay for tumor cells. в: Potten C, Hendry J. ред. Cell clones. London: Churchill Livingstone; 1985. стр.223). В одном воплощении неканцерогенные MDCK клетки, используемые в способах в соответствии с изобретением, имеют значение TD50 от приблизительно 1010 до приблизительно 101, или от приблизительно 108 до приблизительно 103, или от приблизительно 107 до приблизительно 104. В специфическом воплощении неканцерогенные MDCK клетки, используемые в способах в соответствии с изобретением, имеют значение TD50 более чем приблизительно 1010, или более чем приблизительно 109, или более чем приблизительно 108, или более чем приблизительно 107, или более чем приблизительно 106, или более чем приблизительно 105, или более чем приблизительно 104, или более чем приблизительно 103, или более чем приблизительно 102, или более чем приблизительно 101. В специфическом воплощении неканцерогенные MDCK клетки, используемые в способах в соответствии с изобретением, имеют значение TD50 107 или более.
Также предполагается, что неканцерогенные MDCK клетки, используемые в способе в соответствии с изобретением, являются также неонкогенными. Способы для определения, являются ли клетки онкогенными, обычно вовлекает инокуляцию лизатов клеток и/или ДНК в новорожденных грызунов и оценку любого образования опухоли в течение периода времени (смотри, например, Nowinski и Hays, 1978, J. ViroL, 27: 13-8; Peeper, и др., 2002, Nat Cell Biol., 4: 148-53; Code of Federal Regulation (CFR), "Oncogenicity", Издание 40, том 8, глава 1, раздел 798.330, стр.160-164). Например, клеточные лизаты и/или ДНК, содержащие, по крайней мере, 107 клеточных эквивалентов вводят новорожденным грызунам (например, хомякам, бестимусным мышам с мутацией по гену nude, крысам) типично в возрасте менее 4 дней, которых подвергают наблюдению в течение пяти месяцев или более. Анализы на онкогенность обычно осуществляют с помощью коммерческих систем для тестирования (например, BioReliance, смотри Прописи #001031 и #001030). В одном воплощении клеточные лизаты и/или ДНК, содержащие, по крайней мере, 105, или по крайней мере, 106, или, по крайней мере, 107 неканцерогенных MDCK клеток, используемых в способах в соответствии с изобретением, не индуцируют образования опухоли в течение 2 месяцев, или 3 месяцев, или 4 месяцев, или 5 месяцев, или 6 месяцев, или дольше, когда вводиться новорожденным грызунам. В другом воплощении 0,01 мг, или 0,02 мг, или 0,03 мг, или 0,04 мг, или 0,05 мг, или 0,06 мг, или 0,07 мг, или 0,08 мг, или 0,09 мг, или 0,10 мг, или более ДНК из неканцерогенных MDCK клеток, используемых в способах в соответствии с изобретением, не индуцируют образования опухоли в течение 2 месяцев, или 3 месяцев, или 4 месяцев, или 5 месяцев, или 6 месяцев, или дольше, когда вводятся новорожденным грызунам.
Предполагается, что MDCK клетки (например, неканцерогенные MDCK клетки) используемые в способах в соответствии с изобретением, поддерживают репликацию вирусов включая, но без ограничения, ортомиксовирусы (включая штаммы вируса гриппа А и/или В), парамиксовирусы (включая RSV А и/или В, вирус метапневмонии человека и парагриппа 1, 2 и/или 3), рабдовирусы и флавовирусы.
В специфическом воплощении MDCK клетки (например, неканцерогенные MDCK клетки), используемые в способах в соответствии с изобретением, поддерживают репликацию адаптированных к холоду, чувствительных к температуре, аттенуированных вирусов гриппа, таких как те, что обнаружены, например, в FluMist® (Belshe и др., 1998, N Engi J Med 338: 1405; Nichol и др., 1999, JAMA 282: 137; Jackson и др., 1999, Vaccine, 17: 1905) и/или реассортантных вирусов, включающих скелет (например, остаточные генные сегменты) этих вирусов или включающих скелет (или один или более сегмент(ов)) РНК вируса гриппа, имеющие одну или более из следующих характеристик: адаптированный к холоду, аттенуированный и чувствительный к температуре.
Одно из указаний на способность клетки поддерживать вирусную репликацию представляет собой выход инфекционного вируса, полученного из инфицированной культуры клеток. Выход вируса может определяться с помощью многочисленных анализов, предназначенных для измерения вирусной инфекции и/или роста. Например, выход вируса может быть количественно оценен с помощью определения концентрации вируса, присутствующего в образце в соответствии с анализом средней инфекционной дозы для тканевой культуры (TCID50), которая измеряется инфекционными вирионами, анализа на основе флуоресцентного анализа бляшкообразования (FFA), который определяет вирусные антигены в инфицированных клетках в монослое культуры клеток (смотри, например, US 7,262,045). TCID50 значения часто выражают как log10 ТСID50/мл, а FFA значения часто выражают как log10 БОЕ/мл (флуоресцентных бляшкообразующих единиц/мл). Способы, полезные для получения вирусов гриппа, включают, но без ограничения, те, которые раскрыты в публикации международной патентной заявки WO 08/105931 (смотри, в частности, Пример 12).
В специфическом воплощении MDCK клетки (например, неканцерогенные MDCK клетки), используемые в способах в соответствии с изобретением, поддерживают репликацию вируса гриппа (например, ca/ts штамма) до значения log10 ТСID50/мл и/или значения log10 БОЕ/мл, по крайней мере, приблизительно 7,6, по крайней мере, приблизительно 7,8, по крайней мере, приблизительно 8,0, по крайней мере, приблизительно 8,2, по крайней мере, приблизительно 8,4, по крайней мере, приблизительно 8,6, по крайней мере, приблизительно 8,8, по крайней мере, приблизительно 9,0, по крайней мере, приблизительно 9,2, по крайней мере, приблизительно 9,4, по крайней мере, приблизительно 9,6, по крайней мере, приблизительно 9,8, по крайней мере, приблизительно 10,0. В другом специфическом воплощении MDCK клетки, используемые в способах в соответствии с изобретением, поддерживают репликацию вируса гриппа (например, ca/ts штамм) до значения log10 ТСID50/мл и/или значения log10 БОЕ/мл, по крайней мере, приблизительно 7,6, по крайней мере 7,8, по крайней мере 8,0, по крайней мере 8,2, по крайней мере 8,4, по крайней мере 8,6, по крайней мере 8,8, по крайней мере 9,0, по крайней мере 9,2, по крайней мере 9,4, по крайней мере 9,6, по крайней мере 9,8, по крайней мере 10,0. В некоторых специфических воплощениях MDCK клетки, используемые в способах в соответствии с изобретением, не являются канцерогенными.
Вирусы гриппа дикого типа, используемые в получении вакцинных штаммов для ежегодной вакцинации против эпидемического гриппа, рекомендуются ежегодно Консультативной комиссией по вакцинам и родственным биологическим продуктам центрам для центров биологической оценки и исследования (CBER) или Всемирной организацией здравоохранения ВОЗ) и Европейским агентством по оценке лекарственных средств (ЕМЕА), и обеспечиваются для производителей Комиссией по контролю за лекарствами и питательными веществами или Центрами по контролю и предотвращению заболеваний (CDC). Эти штаммы могут потом использоваться для получения реассортантных вакцинных штаммов, которые в общем случае объединяют гены NA и/или НА вирусов дикого типа с остаточными генными сегментами, которые имеют происхождение от донорного вируса (часто называется как основным донорным вирусом или MDV), который будет обладать определенными желательными характеристиками. Например, MDV штамм может быть адаптирован к холоду и/или быть чувствительным к температуре, и/или аттенуированным, и/или иметь высокую скорость роста. Воплощения, которые приводятся непосредственно ниже, относятся к адаптированным к холоду и/или чувствительным к температуре, и/или аттенуированным версиям различных штаммов вируса гриппа (например, штамму дикого типа, рекомендованному одной или более организациями здравоохранения). Такие адаптированные к холоду и/или чувствительные к температуре, и/или аттенуированные вирусы гриппа могут быть получены путем создания рекомбинантных и/или реассортантных вирусов гриппа, которые включают генные сегменты НА и NA из штамма, представляющего интерес, и остаточных генных сегментов из приемлемого адаптированногок холоду и/или чувствительного к температуре, и/или аттенуированного штамма вируса гриппа (также называются в данной заявке как "адаптированный к холоду, чувствительный к температуре, аттенуированный скелет") такие, как, например, адаптированные к холоду, чувствительные к температуре, аттенуированные вирусы гриппа, обнаруженные в FluMist® (са А/Анн-Арбор/6/60 и са В/Анн-Арбор/1/66). Как используется в данной заявке, рекомбинантный и/или реассортантный вирус включает сегменты генов НА и NA из штамма вируса гриппа дикого типа и остаточные генные сегменты из вируса, который является адаптированным к холоду и/или чувствительным к температуре, и/или аттенуированным вирусом гриппа. Реассортантный и/или рекомбинантный вирус также обозначается путем предшествующего присоединения к обозначению дикого типа штамма одного или более идентификаторов «са», «att», «ts», например рекомбинантный и/или реассортантный вирус, который включает сегменты генов НА и NA из А/Новая Каледония/20/99 и остаточные сегменты из адаптированного к холоду, чувствительного к температуре, аттенуированного вируса гриппа (например, А/Анн-Арбор/6/60), может обозначаться просто как "са А/Новая Каледония/20/99."
В некоторых воплощениях MDCK клетки (например, неканцерогенные MDCK клетки), используемые в способах в соответствии с изобретением, поддерживают репликацию адаптированной к холоду и/или чувствительной к температуре, и/или аттенуированный версии (например, реассортантной), по крайней мере, одного штамма вируса гриппа (например, штамма вируса гриппа А, штамма вируса гриппа В), рекомендованного и/или обеспечиваемого ежегодно одной или более организациями здравоохранения, включая, но без ограничения, CBER, ВОЗ, ЕМЕА, FDA и CDC, до значения log10 ТСID50/мл и/или значения log10 БOE/мл, по крайней мере, приблизительно 7,6, по крайней мере, приблизительно 7,8, по крайней мере, приблизительно 8,0, по крайней мере, приблизительно 8,2, по крайней мере, приблизительно 8,4, по крайней мере, приблизительно 8,6, по крайней мере, приблизительно 8,8, по крайней мере, приблизительно 9,0, по крайней мере, приблизительно 9,2, по крайней мере, приблизительно 9,4, по крайней мере, приблизительно 9,6, по крайней мере, приблизительно 9,8, по крайней мере, приблизительно 10,0. В другом специфическом воплощении MDCK клетки (например, неканцерогенные MDCK клетки), используемые в способах в соответствии с изобретением, поддерживают репликацию адаптированной к холоду и/или чувствительной к температуре, и/или аттенуированный версии (например, реассортантной), по крайней мере одного штамма вируса гриппа (например, штамма вируса гриппа А, штамма вируса гриппа В), рекомендованного и/или обеспечиваемого ежегодно одной или более организациями здравоохранения, включая, но без ограничения, CBER, ВОЗ, ЕМЕА, FDA и CDC, до значения log10 TCID50/мл и/или значения log10 БОЕ/мл, по крайней мере, приблизительно 7,6, по крайней мере 7,8, по крайней мере 8,0, по крайней мере 8,2, по крайней мере 8,4, по крайней мере 8,6, по крайней мере 8,8, по крайней мере 9,0, по крайней мере 9,2, по крайней мере 9,4, по крайней мере 9,6, по крайней мере 9,8, по крайней мере 10,0. В некоторых специфических воплощениях MDCK клетки, используемые в способах в соответствии с изобретением, являются неканцерогенными.
В некоторых других воплощениях MDCK клетки (например, неканцерогенные MDCK клетки), используемые в способах в соответствии с изобретением, поддерживают репликацию адаптированной к холоду и/или чувствительной к температуре, и/или аттенуированный версии, по крайней мере, одного штамма вируса гриппа А. Предполагается, что штамм вируса гриппа А может быть таковым любого подтипа (например, H1N1, H3N2, H7N7, H5N1, H9N2, H1N2, H2N2). В настоящее время было идентифицировано, по крайней мере, 16 различных НА и 9 различных NA подтипов вирусов гриппа А. В соответствии с этим, штамм вируса гриппа А может включать любую комбинацию НА и NA подтипов, которые являются известными в настоящее время или будут идентифицированы в будущем и/или могут быть реассортантными. В некоторых специфических воплощениях MDCK клетки, используемые в способах в соответствии с изобретением, являются неканцерогенными.
В некоторых других воплощениях MDCK клетки (например, неканцерогенные MDCK клетки), используемые в способах в соответствии с изобретением, поддерживают репликацию адаптированной к холоду и/или чувствительной к температуре, и/или аттенуированный версии, по крайней мере, одного штамма вируса гриппа В. Вирусы гриппа В в настоящее время не разделяются на подтипы на основе их белков гемагглютинина и нейраминидазы; вместо этого они классифицируются генеалогически. В настоящее время, штаммы вируса гриппа В подразделяются на две линии, линии В/Ямагата и В/Виктория, которые содержат многочисленные сублинии. В соответствии с этим штаммы вируса гриппа В могут иметь происхождение от любой линии и/или сублинии, известной на сегодняшний день, или которая может быть идентифицирована в будущем, и/или могут быть реассортантными. В некоторых специфических воплощениях MDCK клетки, используемые в способах в соответствии с изобретением, являются неканцерогенными.
6.3 Среды и способы для культуры клеток
Настоящее изобретение обеспечивает свободную от сыворотки культуральную среду и высоковоспроизводимые, эффективные и масштабируемые процессы для получения больших количеств вакцинного материала в биореакторах, включая биореакторы однократного использования, стандартные биореакторы многократного использования (например, биореакторы из нержавеющей стали и стеклянные сосуды). В частности, настоящее изобретение обеспечивает способы для репликации вирусов гриппа (например, адаптированных к холоду и/или чувствительных к температуре, и/или аттенуированных) с высоким титром, например, со значением log10 ТСID50/мл и/или значением log10 БОЕ/мл, по крайней мере, приблизительно 7,4, или по крайней мере, приблизительно 7,6, или по крайней мере, приблизительно 7,8, или по крайней мере, приблизительно 8,0, или по крайней мере, приблизительно 9,0, или по крайней мере, приблизительно 10,0. В одном аспекте настоящее изобретение обеспечивает обогащенную свободную от сыворотки культуральную среду, которая поддерживает пролиферацию MDCK клеток (например, неканцерогенных MDCK клеток) до высокой степени плотности и устраняет необходимость в этапе замены среды для получения высоких титров вируса. Устранение этапа замены среды предлагает некоторые преимущества, такие как снижение времени осуществления процесса и применение среды. Кроме того, это снижает количество операций, которые необходимы при производстве, что, в свою очередь, снижает возможность контаминации. В другом аспекте настоящее изобретение обеспечивает улучшенные способы для размножения неканцерогенных клеток на микроносителях, включая способы переноса с гранулы на гранулу. В другом аспекте обогащенная свободная от сыворотки культуральная среда в соответствии с изобретением поддерживает неканцерогенные характеристики неканцерогенных MDCK клеток.
6.3.1 Обогащенная, не содержащая сыворотки среда
Специалисту в данной области техники является понятным, что среда для культуры клеток, используемая для размножения клеток, может оказывать влияние на одну или более характеристик клеток, включая, но без ограничения, отсутствие канцерогенности, отсутствие онкогенности, выращивание в виде адгезивных клеток, выращивание в виде неадгезивных клеток, наличие морфологии, подобной таковой для эпителиальных клеток, поддержание репликации различных вирусов при культивировании и поддержание репликации вируса гриппа с высокими титрами, как описывается в данной заявке. Для снижения риска контаминации занесенными агентами (например, микоплазмами, вирусами и прионами) применение сывороточных или животных экстрактов в культуре тканей для получения терапевтического (например, вакцинного) материала должно быть минимизировано или даже устранено. Кроме того, минимизация количества манипуляций, необходимых в процессе выращивания культуры клеток, может значительно снижать возможность контаминации. В соответствии с этим настоящее изобретение обеспечивает обогащенную, свободную от сыворотки культуральную среду, полезную для размножения MDCK клеток (например, неканцерогенных MDCK клеток), и получение вакцинного материала при использовании способов выращивания периодической культуры клеток. В частности, обогащенная, свободная от сыворотки культуральная среда в соответствии с изобретением (которая также называется в данной заявке как "свободная от сыворотки среда в соответствии с изобретением" и "среда в соответствии с изобретением") может использоваться в способах периодической культуры клеток, которые не используют замену среды или ее пополнение. В соответствии с этим, разработка и применение свободной от сыворотки среды в соответствии с изобретением преодолевает одну из наиболее затруднительных операционных проблем получения вакцинного материала (например, вируса гриппа) на основе культуры клеток, необходимость замены/пополнения среды.
В одном воплощении свободная от сыворотки среда в соответствии с изобретением поддерживает размножение неканцерогенных MDCK клеток, где клетки остаются неканцерогенными после пролиферации в среде (то есть после пассирования). В специфическом воплощении MDCK клетки являются неканцерогенными после, по крайней мере, 20 пассажей, или после, по крайней мере, 30 пассажей, или после по крайней мере, 40 пассажей, или после, по крайней мере, 50 пассажей, или после, по крайней мере, 60 пассажей, или, после по крайней мере, 70 пассажей, или после, по крайней мере, 80 пассажей, или после, по крайней мере, 90 пассажей, или после, по крайней мере, 100 пассажей в свободной от сыворотки среде в соответствии с изобретением.
В другом воплощении свободная от сыворотки среда в соответствии с изобретением поддерживает размножение MDCK клеток (например, неканцерогенных MDCK клеток) до высокой плотности. В специфическом воплощении свободная от сыворотки среда в соответствии с изобретением поддерживает размножение MDCK клеток до плотности, по крайней мере, 5×105 клеток/мл, по крайней мере, 6×105 клеток/мл, по крайней мере, 7×105 клеток/мл, по крайней мере, 8×105 клеток/мл, по крайней мере, 9×105 клеток/мл, по крайней мере, 1×106 клеток/мл, по крайней мере, 1,2×106 клеток/мл, по крайней мере, 1,4×106 клеток/мл, по крайней мере, 1,6×106 клеток/мл, по крайней мере, 1,8×106 клеток/мл, по крайней мере, 2,0×106 клеток/мл, по крайней мере, 2,5×106 клеток/мл, по крайней мере, 5×106 клеток/мл, по крайней мере, 7,5×106 клеток/мл, или, по крайней мере, 1×107 клеток/мл. В другом специфическом воплощении свободная от сыворотки среда в соответствии с изобретением поддерживает пролиферацию неканцерогенных MDCK клеток.
Еще в одном воплощении свободная от сыворотки среда в соответствии с изобретением поддерживает пролиферацию MDCK (например, неканцерогенных MDCK клеток) клеток до достижения высокой плотности и последующую репликацию вируса гриппа до получения высокого титра при отсутствии необходимости этапа замены среды. В специфическом воплощении свободная от сыворотки среда в соответствии с изобретением поддерживает размножение MDCK клеток до достижения высокой плотности и последующую репликацию вируса гриппа (например, ca/ts штамма) до значения log10 ТСID50/мл и/или значения log10 БОЕ/мл, по крайней мере, 6,0, или, по крайней мере, 6,2, или, по крайней мере, 6,4, или, по крайней мере, 6,6, или, по крайней мере, 6,8, или, по крайней мере, 7,0, или, по крайней мере, 7,2, или, по крайней мере, 7,4, или, по крайней мере, 7,6, или, по крайней мере, 7,8, или, по крайней мере, 8,0, или, по крайней мере, 8,2, или, по крайней мере, 8,4, или, по крайней мере, 8,6, или, по крайней мере, 8,8, или, по крайней мере, 9,0, или, по крайней мере, 9,2, или, по крайней мере, 9,4, или, по крайней мере, 9,6, или, по крайней мере, 9,8 или, по крайней мере, 10,0 при отсутствии необходимости этапа замены среды. В другом специфическом воплощении свободная от сыворотки среда в соответствии с изобретением поддерживает пролиферацию неканцерогенных MDCK клеток до достижения высокой плотности и последующую репликацию вируса гриппа, включая, но без ограничения вирусы гриппа, описанные выше.
В одном воплощении свободная от сыворотки среда в соответствии с изобретением включает растительный гидролизат. Растительные гидролизаты включают, но без ограничения, гидролизаты, выбранные из одного или более полученных из следующих: кукуруза, семена хлопчатника, горох, соя, солод, картофель и пшеница. Растительные гидролизаты могут быть получены путем ферментативного гидролиза и в общем случае содержат смесь пептидов, свободных аминокислот и факторов роста. Растительные гидролизаты легко получают от коммерческих поставщиков, включая, например, Marcor Development, HyClone и Organo Technie. Также предполагается, что дрожжевые гидролизаты могут использоваться вместо или в комбинации с растительными гидролизатами. Дрожжевые гидролизаты легко получают от коммерческих поставщиков, включая, например, Sigma-Aldrich, USB Corp, Gibco/BRL и другие. В некоторых воплощениях искусственные гидролизаты могут использоваться в дополнение или или вместо растительных гидролизатов. В некоторых воплощениях свободная от сыворотки среда в соответствии с изобретением включает растительный гидролизат при заключительной концентрации от приблизительно 0,1 г/л до приблизительно 5,0 г/л или от приблизительно 0,5 г/л до приблизительно 4,5 г/л, или от приблизительно 1,0 г/л до приблизительно 4,0 г/л, или от приблизительно 1,5 г/л до приблизительно 3,5 г/л, или от приблизительно 2,0 г/л до приблизительно 3,0 г/л. В специфическом воплощении свободная от сыворотки среда в соответствии с изобретением включает растительный гидролизат при заключительной концентрации 2,5 г/л. В другом специфическом воплощении свободная от сыворотки среда в соответствии с изобретением включает гидролизат пшеницы при заключительной концентрации 2,5 г/л.
В другом воплощении свободная от сыворотки среда в соответствии с изобретением включает липидную добавку. Липиды, которые могут использоваться для добавления в культуральную среду, включают, но без ограничения, химически определенные липидные добавки животного и растительного происхождения, а также липиды синтетического происхождения. Липиды, которые могут присутствовать в липидной добавке, включают, но без ограничения, холестерин, насыщенные и/или ненасыщенные жирные кислоты (например, арахидоновую, линолевую, линоленовую, миристиновую, олеиновую, пальмитиновую и стеариновую кислоты). Холестерин может присутствовать в концентрациях от 0,10 мг/мл и 0,40 мг/мл в 100Х маточной липидной добавке. Жирные кислоты могут присутствовать в концентрациях от 1 мкг/мл и 20 мкг/мл в 100Х маточной липидной добавке. Липиды, приемлемые для композиций среды, легко получают от ряда коммерческих поставщиков, включая, например HyClone, Gibco/BRL и Sigma-Aldrich. В некоторых воплощениях свободная от сыворотки среда в соответствии с изобретением включает химически определенный липидный концентрат при заключительной концентрации от приблизительно 0,1X до приблизительно 2Х или от приблизительно 0,2Х до приблизительно 1,8Х, или от приблизительно 0,3Х до приблизительно 1,7Х, или от приблизительно 0,4Х до приблизительно 1,6Х, или от приблизительно 0,5Х до приблизительно 1,5Х, или от приблизительно 0,6Х до приблизительно 1,4Х, или от приблизительно 0,7Х до приблизительно 1,3Х, или от приблизительно 0,8Х до приблизительно 1,2Х. В специфическом воплощении свободная от сыворотки среда в соответствии с изобретением включает раствор химически определенного липидного концентрата (CDCL) при заключительной концентрации 1X. В другом специфическом воплощении свободная от сыворотки среда в соответствии с изобретением включает раствор химически определенного липидного концентрата (CDCL) при заключительной концентрации 1X.
В другом воплощении свободная от сыворотки среда в соответствии с изобретением включает микроэлементы. Микроэлементы, которые могут использоваться, включают, но без ограничения, CuSO4·5H2O, ZnSO4·7H2O, Селенит·2Na, лимоннокислое железо, MnSO4·H2O, Na2SiO3·9Н2O, аммонийную соль молибденовой кислоты, NH4VO3, NiSO4·6H2O, SnCl2 (безводный), АlCl3·6Н2О, AgNO3, Ва(С2Н3O2)2, KBr, CdCl2, CoCl2·6H2O, СrСl3 (безводный), NaF, GeO2, KI, RbCl, ZrOCl2·8H2O. Концентрированные маточные растворы микроэлементов легко получают от ряда коммерческих поставщиков, включая, например Cell Grow (смотри кат. номер 99-182, 99-175 и 99-176). В некоторых воплощениях свободная от сыворотки среда в соответствии с изобретением включает растворы микроэлементов А, В и С при заключительной концентрации от приблизительно 0,1X до приблизительно 2Х или от приблизительно 0,2Х до приблизительно 1,8Х или от приблизительно 0,3Х до приблизительно 1,7Х, или от приблизительно 0,4Х до приблизительно 1,6Х, или от приблизительно 0,5Х до приблизительно 1,5Х, или от приблизительно 0,6Х до приблизительно 1,4Х, или от приблизительно 0,7Х до приблизительно 1,3Х, или от приблизительно 0,8Х до приблизительно 1,2Х. В специфическом воплощении свободная от сыворотки среда в соответствии с изобретением включают растворы микроэлементов А, В и С при заключительной концентрации 1X.
В другом воплощении свободная от сыворотки среда в соответствии с изобретением включает один или более гормонов, факторов роста и/или других биологических молекул. Гормоны включают, но без ограничения, трийодтиронин, инсулин и гидрокортизон. Факторы роста включают, но без ограничения, эпидермальный фактор роста (EGF), инсулиноподобный фактор роста (IGF), трансформирующий фактор роста (TGF) и фактор роста фибробластов (FGF). В частном воплощении свободная от сыворотки среда в соответствии с изобретением включает эпидермальный фактор роста (EGF). Другие биологические молекулы включают цитокины (например, колониестимулирующий фактор гранулоцитов-макрофагов (GM-CSF), интерфероны, интерлейкины, TNF), хемокины (например, Рантес (хемокин, выделяемый Т-клетками при активации, эотоксины, воспалительные белки макрофагов (MIP)) и простогландины (например, простагландины Е1 и Е2). В одном воплощении свободная от сыворотки среда в соответствии с изобретением включает фактор роста при заключительной концентрации от приблизительно 0,0001 до приблизительно 0,05 мг/л, или от приблизительно 0,0005 до приблизительно 0,025 мг/л, или от приблизительно 0,001 до приблизительно 0,01 мг/л, или от приблизительно 0,002 до приблизительно 0,008 мг/л, или от приблизительно 0,003 мг/л до приблизительно 0,006 мг/л. В специфическом воплощении свободная от сыворотки среда в соответствии с изобретением включает EGF при заключительной концентрации 0,005 мг/л. В одном воплощении свободная от сыворотки среда в соответствии с изобретением включает трийодтиронин при заключительной концентрации от приблизительно 1×10-12 М до приблизительно 10×10-12 М, или от приблизительно 2×10-12 М до приблизительно 9×10-12 М, или от приблизительно 3×10-12 М до приблизительно 7×10-12 М, или от приблизительно 4×10-12 М до приблизительно 6×10-12 М. В специфическом воплощении свободная от сыворотки среда в соответствии с изобретением включает трийодтиронин при заключительной концентрации 5×10-12 М. В одном воплощении свободная от сыворотки среда в соответствии с изобретением включает инсулин при заключительной концентрации от приблизительно 1 мг/л до приблизительно 10 мг/л, или от приблизительно 2,0 до приблизительно 8,0 мг/л, или от приблизительно 3 мг/л до приблизительно 6 мг/л. В специфическом воплощении свободная от сыворотки среда в соответствии с изобретением включает инсулин при заключительной концентрации 5 мг/л. В некоторых воплощениях свободная от сыворотки среда в соответствии с изобретением включает простагландин при заключительной концентрации от приблизительно 0,001 мг/л до приблизительно 0,05 мг/л, или от приблизительно 0,005 мг/л до приблизительно 0,045 мг/л, или от приблизительно 0,01 мг/л до приблизительно 0,04 мг/л, или от приблизительно 0,015 мг/л до приблизительно 0,035 мг/л, или от приблизительно 0,02 мг/л до приблизительно 0,03 мг/л. В специфическом воплощении свободная от сыворотки среда в соответствии с изобретением включает простагландин при заключительной концентрации 0,025 мг/л. В другом специфическом воплощении свободная от сыворотки среда в соответствии с изобретением включает простагландин Е1 при заключительной концентрации 0,025 мг/л.
Еще в одном воплощении свободную от сыворотки среду в соответствии с изобретением усиливают с помощью одного или более компонентов среды, выбранных из группы, состоящей из путресцина, аминокислот, витаминов, жирных кислот и нуклеозидов. В специфических воплощениях свободную от сыворотки среду в соответствии с изобретением усиливают с помощью одного или более компонентов среды так, что концентрация компонента в среде составляет приблизительно 1-кратную, или приблизительно 2-кратную, или приблизительно 3-кратную, или приблизительно 4-кратную, или приблизительно 5-кратную или более по сравнению с таковой, которая обычно имеется в среде, используемой для размножения клеток, такой как, например, модифицированная Дюльбекко среда Игла/Ham's F12 среда (DMEM/F12). Стандартный состав DMEM/F12 обеспечивается для ссылки ниже в Таблице. В специфическом воплощении свободную от сыворотки среду в соответствии с изобретением усиливают при использовании путресцина. В другом специфическом воплощении свободную от сыворотки среду в соответствии с изобретением усиливают при использовании путресцина так, что концентрация путресцина является приблизительно в раз 5 выше или более, чем типично используется в DMEM/F12.
Жирные кислоты, которые могут использоваться для усиления, включают ненасыщенную жирную кислоту, включая, но без ограничения, линолевую кислоту и α-линоленовую кислоту (также называются как эссенциальные жирные кислоты), а также тетрадеценовую кислоту, гексадециновую кислоту, олеиновую кислоту, арахидоновую кислоту, эйкозагептаноевую кислоту, эруковую кислоту, докозагексаеновую кислоту; насыщенные жирные кислоты, включая, но без ограничения, бутановую кислоту, капроновую кислоту, каприловую кислоту, декановую кислоту, додекановую кислоту, тетрадекановую кислоту, гексадекановую кислоту, октадекановую кислоту, эйкозановую кислоту, докозановую кислоту, тетракозановую кислоту и содержащие серу жирные кислоты, включая липоевую кислоту. В некоторых воплощениях свободную от сыворотки среду в соответствии с изобретением усиливают с помощью экстракта жирных кислоты в дополнение к тем, что обеспечиваются липидной добавкой, как описано выше. В специфическом воплощении свободную от сыворотки среду в соответствии с изобретением усиливают с помощью линолевой кислоты и линоленовой кислоты. В другом специфическом воплощении свободную от сыворотки среду в соответствии с изобретением усиливают с помощью линолевой кислоты и линоленовой кислоты, так что концентрации линолевой кислоты и линоленовой кислоты являются приблизительно в 5 раз выше или более, чем типично находится в DMEM/F12.
Аминокислоты, которые могут прибавляться для усиления, включают двадцать стандартных аминокислот (аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутаминовую кислоту, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин и валин), а также цистин и нестандартные аминокислоты. В некоторых воплощениях одна или более аминокислот, которые не синтезируются неканцерогенными MDCK клетками, обычно называются "эссенциальными аминокислотами", вносятся для обогащения. Например, восемь аминокислот обычно рассматриваются как эссенциальные для человека: фенилаланин, валин, треонин, триптофан, изолейцин, метионин, лейцин и лизин. В специфическом воплощении свободную от сыворотки среда в соответствии с изобретением усиливают с помощью цистина и всех стандартных аминокислот, за исключением глутамина (DMEM/F12 часто рецептируется без глутамина, который добавляют отдельно), так что концентрации цистина и стандартных аминокислот являются приблизительно в 5 раз выше или более, чем типично находится в DMEM/F12. В одном специфическом воплощении в свободную от сыворотки среду в соответствии с изобретением включают глутамин при концентрации от приблизительно 146 мг/л до приблизительно 1022 мг/л или от приблизительно 292 мг/л до приблизительно 876 мг/л, или от приблизительно 438 мг/л до приблизительно 730 мг/л. В другом специфическом воплощении в свободную от сыворотки среду в соответствии с изобретением включают глутамин при концентрации 584 мг/мл.
Витамины, которые могут прибавляться для усиления, включают, но без ограничения, аскорбиновую кислоту (витамин А), d-биотин (витамин В7 и витамин Н), D-кальцийпантетонат, холекальциферол (витами D3), холинхлорид, цианкобаламин (витамин В12), эргокальциферол (витамин D2), фолиевую кислоту (витамин В9), менахинон (витамин К2), мио-инозитол, никотинамид (витамин В3), п-аминобензойную кислоту, пантотеновую кислоту (витамин B5), филлохинон (витамин K1), пиридоксин (витамин В6), ретинол (витамин А), рибофлавин (витамин В2), альфа-токоферол (витамин Е) и тиамин (витамин B1). В специфическом воплощении свободную от сыворотки среду в соответствии с изобретением усиливают с помощью d-биотина, D-кальция, пантотената, холинхлорида, цианкобаламина, фолиевой кислоты, мио-инозитола, никотинамида, пиридоксина, рибофлавина и тиамина, так что концентрации указанных витаминов являются приблизительно в 5 раз выше или более, чем типично находится в DMEM/F12.
Нуклеозиды, которые могут прибавляться для усиления, включают, но без ограничения, цитидин, уридин, аденозин, гуанозин, тимидин, инозин и гипоксантин. В специфическом воплощении свободную от сыворотки среду в соответствии с изобретением усиливают с помощью гипоксантина и тимидина, так что концентрации гипоксантина и тимидина являются приблизительно в 5 раз выше или более, чем типично находится в DMEM/F12.
Дополнительные компоненты, которые могут прибавляться к среде для культуры клеток, включают, но без ограничения, бикарбонат натрия, источник углерода (например, глюкозу), и агенты, связывающие железо. В одном воплощении свободная от сыворотки среда в соответствии с изобретением включает бикарбонат натрия при заключительной концентрации от приблизительно 1200 мг/л до приблизительно 7200 мг/л, или от приблизительно 2400 мг/л до приблизительно 6000 мг/мл, или от приблизительно 3600 мг/мл до приблизительно 4800 мг/мл. В специфическом воплощении свободная от сыворотки среда в соответствии с изобретением включает бикарбонат натрия при заключительной концентрации 4400 мг/мл. В одном воплощении свободная от сыворотки среда в соответствии с изобретением включает глюкозу в качестве источника углерода. В другом воплощении свободная от сыворотки среда в соответствии с изобретением включает глюкозу при заключительной концентрации от приблизительно 1 г/л до приблизительно 10 г/л, или от приблизительно 2 г/л до приблизительно 10 г/л, или от приблизительно 3 г/л до приблизительно 8 г/л, или от приблизительно 4 г/л до приблизительно 6 г/л, или от приблизительно 4,5 г/л до приблизительно 9 г/л. В специфическом воплощении свободная от сыворотки среда в соответствии с изобретением включает глюкозу при заключительной концентрации 4,5 г/л. Специфически предполагается, что дополнительная глюкоза может прибавляться к свободной от сыворотки среде в соответствии с изобретением, что используется для пролиферации неканцерогенных MDCK клеток до высокой степени плотности и последующей репликации вируса гриппа для устранения истощения источников углерода. В соответствии с этим в некоторых воплощениях свободная от сыворотки среда в соответствии с настоящим изобретением включает дополнительные 1-5 г/л глюкозы для получения заключительной концентрации глюкозы от приблизительно 5,5 г/л до приблизительно 10 г/л.
Агенты для связывания железа, которые могут использоваться, включают белки, такие как трансферрин и химические соединения, такие как трополон (смотри, например, патенты США №№5,045,454; 5,118,513; 6,593,140; и публикацию заявки РСТ WO 01/16294). В одном воплощении свободная от сыворотки среда в соответствии с изобретением включает трополон (2-гидрокси-2,4,6-циклогептатриен-1) и источника железа (например, двойную соль лимоннокислого железа, железоаммониевые квасцы) вместо трансферрина. Например, трополон или производная трополона будут присутствовать в избытке молярной концентрации по отношению к железу, присутствующему в среде, при молярном соотношении между ними, которое составляет приблизительно от 5 до 1 и приблизительно от 1 до 1. В некоторых воплощениях свободная от сыворотки среда в соответствии с изобретением включает трополон или производную трополона при избытке молярной концентрации по отношению к железу, присутствующему в среде, при молярном соотношении между ними, которое составляет приблизительно от 5 до 1, или приблизительно от 3 до 1, или приблизительно от 2 до 1, или приблизительно от 1,75 до 1, или приблизительно от 1,5 до 1, или приблизительно от 1,25 до 1. В специфическом воплощении свободная от сыворотки среда в соответствии с настоящим изобретением включает трополон при заключительной концентрации 0,25 мг/л и железоаммониевые квасцы (РАС) при заключительной концентрации 0,20 мг/л (смотри, например, Таблицу).
Прибавление компонентов, описанных выше, к композиции среды может изменить осмоляльность. В соответствии с этим, в некоторых воплощениях количество одного или более компонентов, которые типично содержаться в DMEM/F12, снижают для поддержания желаемой осмоляльности. В одном воплощении концентрацию хлорида натрия (NaCI) снижают в свободной от сыворотки среде в соответствии с изобретением. В другом воплощении концентрация NaCl в свободной от сыворотки среде в соответствии с изобретением составляет от приблизительно 10% до приблизительно 90%, или от приблизительно 20% до приблизительно 80%, или от приблизительно 30% до приблизительно 70%, или от приблизительно 40% до приблизительно 60% от той, что типично содержится в DMEM/F12. В специфическом воплощении заключительная концентрация NaCl в свободной от сыворотки среде в соответствии с изобретением составляет 50% от той, что типично содержится в DMEM/F122. В другом специфическом воплощении заключительная концентрация NaCl в свободной от сыворотки среде в соответствии с изобретением составляет 3500 мг/л.
В некоторых воплощениях количество компонентов животного происхождения в свободной от сыворотки среде в соответствии с изобретением минимизируют или даже устраняют. Например, коммерчески доступные рекомбинантные белки, такие как инсулин и трансферрин, имеющие происхождение не от животных (например, Biological Industries кат. номер 01-818-1, и Millipore кат. номер 9701, соответственно), могут использоваться вместо белков, полученных из животных источников. В специфическом воплощении компоненты, имеющие животное происхождение, заменяют продуктами, имеющими происхождение не от животных, за исключением холестерина, который может быть компонентом химически определенной липидной смеси. Для минимизации рисков, которые типично ассоциируются с продуктами животного происхождения, холестерин может быть получен от овец шерстяных пород, которых выращивают в районах, не ассоциированных с адвентивными агентами, включая, но без ограничения, прионы.
В специфическом воплощении свободная от сыворотки среда в соответствии с изобретением включает все компоненты MediV SFM 110 среды, приведенной в Таблице, при указанных заключительных концентрациях. В другом специфическом воплощении свободная от сыворотки среда в соответствии с изобретением существенно состоит из всех компонентов MediV SFM 110 среды, приведенной в Таблице, при указанных заключительных концентрациях. Еще в одном специфическом воплощении MediV SFM 110 среда, состоящая из компонентов, приведенных в Таблице, представляет собой свободную от сыворотки среду в соответствии с изобретением.
|
6.3.2 Перенос с гранулы на гранулу
В одном воплощении неканцерогенные MDCK клетки культивируют как адгезивные клетки на поверхности, к которой они прикреплены. Адгезивные поверхности, на которых клетки культуры ткани выращивают, включают, но без ограничения, полистироловые пластики с модифицированной поверхностью, поверхности, покрытые белком (например, стекло/пластик, покрытые фибронетином и/или коллагеном), а также большое разнообразие коммерчески доступных микроносителей (например, гранулы микроносителя на основе DEAE-декстрана, такие как Dormacell, Pfeifer & Langen; Superbead, Flow Laboratories; гранулы на основе стиролового сополимера-триметиламина, такие как Hillex, SoloHill, Ann Arbor; Cytodex 1 и Cytodex 3, GE Healthcare Life Science). Гранулы микроносителя представляют собой маленькие сферы (с диаметром в интервале 100-200 микрон), которые обеспечивают большую площадь поверхности для роста адгезивных клеток на объем культуры клеток. Например, один литр среды может включать более чем 20 миллионов гранул микроносителя, которые обеспечивают более чем 8000 квадратных сантиметров поверхности роста. Выбор адгезивной поверхности определяется способами, которые используются для культивирования неканцерогенных MDCK клеток.
В одном воплощении микроноситель используется при концентрации от приблизительно 1 до приблизительно 4 г/л. В другом воплощении микроноситель используется при концентрации от приблизительно 2 до приблизительно 3 г/л. В некоторых воплощениях емкости для культивирования (например, биореактор) засевают MDCK клетками, которые культивируются при плотности посева от приблизительно 0,5 до приблизительно 2×105 клеток/мл. В специфическом воплощении плотность посева составляет от приблизительно 0,7 до приблизительно 1,8×105 клеток/мл, или от приблизительно 0,8 до приблизительно 1,6×105 клеток/мл, или от приблизительно 0,9 до приблизительно 1,4×105 клеток/мл, или от приблизительно 1,0 до приблизительно 1,2×105 клеток/мл. Альтернативно, плотность посева может быть подсчитана на основе микроносителя. В соответствии с этим, в некоторых воплощениях емкости для культивирования (например, биореактор) засевают MDCK клетками, которые культивируют при плотности посева, которая составляет от приблизительно 10 до приблизительно 40 клеток/микроноситель, или от приблизительно 12 до приблизительно 38 клеток/микроноситель, клеток/микроноситель, или от приблизительно 14 до приблизительно 36 клеток/микроноситель, или от приблизительно 16 до приблизительно 34 клеток/микроноситель, или от приблизительно 18 до приблизительно 32 клеток/микроноситель, или от приблизительно 20 до приблизительно 30 клеток/микроноситель.
В процессе субкультивирования адгезивных клеток (то есть пролиферации клеток, размножения культуры клеток) клетки должны переноситься с конфлюэнтной поверхности носителя (например, поверхности колбы, микроносителяи т.д.) на новую поверхность носителя. Ряд способов может использоваться для осуществления такого переноса. Например, протеазы, включая трипсин, TrypLE и коллагеназу, могут использоваться для удаления клеток из колб или микроносителей, после этого клетки потом промывают, если это является желательным, и разводят в большей емкости или в большем объеме микроносителя, содержащего среду для размножения. Этот процесс обычно называют "разведением" культуры, он может быть количественно оценен как соотношение исходной культуры к заключительной культуре. Например, соотношение разведения 1:8 указывает на то, что 1 часть исходной (например, 10 мл) культуры прибавляется к 7 частям свежей культуральной среды (например, 70 мл) с получением 80 мл. Альтернативно, определяют количество клеток в исходной культуре и разведение подсчитывают на основе желаемой плотности посева и объема заключительной культуры. Является предпочтительным использовать протеазу неживотного происхождения для таких применений, такую как TrypLE (Invitrogen, Carlsbad, CA). Альтернативно, в культурах микроносителя, после того как клетки были отделены, свежая среда и/или гранулы микроносителя могут потом прибавляться к культуре. В некоторых воплощениях культура, подвергнутая обработке протеазой, переносится в большую емкость для культивирования перед, в процессе или после прибавления свежей среды и/или микроносителей.
В специфическом воплощении культура MDCK клеток (например, неканцерогенных MDCK клеток), выращиваемых как адгезивные клетки на микроносителях, подвергается обработке протеазой (например, TrypLE). Протеаза может быть инактивированной (например, путем прибавления ингибитора протеазы, такого, как ингибитор трипсина лимской фасоли), если это является необходимым, и свежая среда и/или гранулы микроносителя могут потом прибавляться к культуре. В некоторых воплощениях обработанную протеазой культуру переносят в большую емкость для культивирования перед, в процессе или после прибавления свежей среды и/или микроносителей.
Применение протеазы в способах переноса с гранулы на гранулу может приводить к более ослабленному росту клеток и к получению низкого количества клеток. В соответствии с этим, настоящее изобретение также обеспечивает способы осуществления переноса с гранулы на гранулу, которые минимизируют количество протеазы или даже устраняют ее использование, необходимое для того, чтобы способствовать переносу с гранулы на гранулу, включая, но без ограничения, способ приведенный в Примерах Раздела 8.3, который также используется в Примерах Раздела 8.1. В частности, изобретатели определили, что количество протеазы, необходимое для высвобождения клеток с микроносителей, может быть снижено, по крайней мере, в 20 раз путем предварительной обработки клеток с помощью хелатирующего агента, в частности путем предварительной обработки при значении рН, более высоком, чем то, которое используется для пролиферации клеток.
В некоторых воплощениях перенос с гранулы на гранулу совершенствуют путем предварительной обработки клеток с помощью хелатирующего агента перед прибавлением протеазы (например, TrypLE). В других воплощениях перенос с гранулы на гранулу совершенствуется путем прибавления хелатирующего агента (например, ЭДТА) и инкубации при значении рН, более высоком, чем то, которое используется для пролиферации клеток. В специфическом воплощении культура неканцерогенных MDCK клеток, которые выращивают как адгезивные клетки на микроносителях, обрабатывается с помощью хелатирующего агента (например, ЭДТА) при значении рН, более высоком, чем то, которое используется для пролиферации клеток, перед добавлением протеазы. В некоторых воплощениях значение рН подвергают мониторингу и доводят в случае необходимости для того, чтобы способствовать отделению клеток от субстрата микроносителя. После того как клетки отделены, свежая среда и/или гранулы микроносителя могут потом прибавляться к культуре. В некоторых воплощениях культуру с исходными микроносителями или без них переносят в большую емкость перед, в процессе или после прибавления свежей среды и/или микроносителей.
В некоторых воплощениях клетки промывают с помощью промывочной среды (например, забуференного солевого раствора) перед их прикреплением. Среды, полезные для промывания клеток, включают, но без ограничения, Hepes-забуференные растворы, забуференные фосфатом солевые растворы, забуференный фосфатом солевой раствор Дюльбекко, сбалансированный солевой раствор Хенкса, сбалансированный солевой раствор Эрла. Процесс промывания клеток вовлекает замену части или всей среды (ростовой среды и/или среды для промывания) свежей промывочной средой (то есть забуференным солевым раствором). Процесс может повторяться многократно. В общем случае гранулы микроносителя оставляют для осаждения в течение определенного периода времени (например, от 10 до 40 минут) и ростовую среду удаляют из емкости. Необязательно, удаление среды из культуры клеток может осуществляться при использовании периодического тангенциального проточного устройства с низким сдвигом, смотри, например, US 6,544,424. В некоторых воплощениях во время этапа промывания удаляется от приблизительно 50% до приблизительно 90% среды (ростовой и/или промывочной среды). В некоторых воплощениях среда заменяется объемом промывочной среды (то есть забуференного солевого раствора), который является меньшим, таким же или большим, чем объем среды, которая удаляется. В одном воплощении промывочную среду прибавляют так, что полученный объем культуры клеток составляет от приблизительно 25% до приблизительно 100% от исходного рабочего объема культуры клеток. В специфическом воплощении промывочную среду прибавляют к приблизительно 40% - приблизительно 60% исходного рабочего объема культуры клеток. В другом специфическом воплощении промывочную среду прибавляют к приблизительно 90% - приблизительно 100% исходного рабочего объема культуры клеток. В некоторых воплощениях клетки промывают два или более раз.
В некоторых воплощениях промывочная среда включает хелатирующий агент. Хелатирующие агенты, которые могут использоваться, включают, но без ограничения, этилендиаминтетрауксусную кислоту (ЭДТА), диэтилентриаминпентаацетат (DTPA), этиленбис (оксиэтилен-тринитрило) тетрауксусную кислоту (EGTA). В специфическом воплощении хелатирующий агент представляет собой ЭДТА. В некоторых воплощениях промывочная среда включает хелатирующий агент при концентрации от приблизительно 0,25 мМ до приблизительно 0,75 мМ. В некоторых других воплощениях промывочная среда включает хелатирующий агент при концентрации от приблизительно 0,4 мМ до приблизительно 0,6 мМ. В специфическом воплощении промывочная среда включает хелатирующий агент в концентрации приблизительно 0,5 мМ.
В одном воплощении значение рН промывочной среды, включающей хелатирующий агент, составляет от приблизительно 7,6 до приблизительно 8,4. В специфическом воплощении значение рН промывочной среды, включающей хелатирующий агент, составляет от приблизительно 7,8 до приблизительно 8,2. В другом специфическом воплощении значение рН промывочной среды, включающей хелатирующий агент, составляет от приблизительно 7,9 до приблизительно 8,1. Прибавление промывочной среды, включающей хелатирующий агент, к культуре клеток может изменить значение рН полученной культуры клеток в промывочной среде. В соответствии с этим, в некоторых воплощениях значение рН культуры клеток, которую подвергают промыванию с помощью промывочной среды, включающей хелатирующий агент, доводят до значения от приблизительно 7,6 до приблизительно 8,4, в случае необходимости, после прибавления промывочной среды к культуре клеток. В специфическом воплощении значение рН культуры клеток, которую подвергают промыванию с помощью промывочной среды, включающей хелатирующий агент, доводят до значения от приблизительно 7,8 до приблизительно 8,2, в случае необходимости, после прибавления промывочной среды к культуре клеток. В другом специфическом воплощении значение рН культуры клеток, которую подвергают промыванию с помощью промывочной среды, включающей хелатирующий агент, доводят до значения от приблизительно 7,9 до приблизительно 8,1, в случае необходимости, после прибавления промывочной среды к культуре клеток.
В некоторых воплощениях культуру клеток перемешивают после прибавления промывочной среды, включающей хелатирующий агент, и перед дополнительным этапом промывки и/или прибавлением протеазы. Перемешивание культуры может осуществляться при использовании средств, хорошо известных в области техники, включая, но без ограничения, размешивание, встряхивание, вращение и тому подобное. Скорость и длительность перемешивания определяется объемом культуры, компонентами промывочной среды и типом клеток в культура клеток. В некоторых воплощениях культуру клеток перемешивают при той же скорости, которую используют для размножения клеток. В других воплощениях культуру клеток перемешивают при более высокой скорости, чем та, которую используют для размножения клеток. Когда используется более высокая скорость перемешивания, скорость увеличивают на приблизительно 10% - приблизительно 90%, или приблизительно 20% - приблизительно 80%, или приблизительно 30% - приблизительно 70%, или приблизительно 40% - приблизительно 65%. В специфическом воплощении используют скорость перемешивания от приблизительно 40% до приблизительно 65%. В некоторых воплощениях культуру клеток инкубируют с хелатирующим агентом перед прибавлением протеазы с достаточным перемешиванием для того, чтобы предотвратить осаждение большей части микроносителей на дне емкости для культивирования. В некоторых воплощениях культуру клеток перемешивают в течение от приблизительно 5 минут до приблизительно 60 минут. В специфическом воплощении культуру клеток перемешивают в течение от приблизительно 20 до приблизительно 40 минут.
В некоторых воплощениях протеазу (например, серинпротеазу) прибавляют к культуре клеток в процессе промывания, но после какого-либо перемешивания. В специфическом воплощении клетки промывают два или более раз, и протеазу прибавляют во время последнего промывания, но после какого-либо перемешивания. Протеаза в некоторых аспектах в соответствии с изобретением представляет собой серинпротеазу или цистеинпротеазу, или аспарагинпротеазу. В специфическом воплощении протеаза представляет собой серинпротеазу (например, трипсин, TrypLE, и т.д.). В другом воплощении используется протеаза из Streptomyces griseus, описанная в патентной заявке США №11/455,818. Трипсин может быть получен из животного источника или, более предпочтительно, из рекомбинантного источника. Количество протеазы, прибавляемой для осуществления отделения при этих условиях, будет, по крайней мере, в 5 раз меньше, чем требуется тогда, когда клетки не подвергали предварительной обработке с помощью хелатирующего агента, и это количество будет определяться объемом культуры и концентрацией протеазы. В качестве примера, коммерчески доступная TrypLE™ Express обеспечивается в виде 10Х маточного раствора, который будет в общем случае использоваться при заключительной концентрации приблизительно 1X (смотри, например, Invitrogen™ TrypLE Select Product News) для отделения высокоадгезивных клеток, таких как MDCK клетки. Как было продемонстрировано (смотри Раздел 8.3), заключительная концентрация TrypLE™, которая является необходимой для отделения клеток от микроносителей, составляет 0,05Х, 20-кратное снижение. В соответствии с этим в некоторых воплощениях заключительная концентрация протеазы, прибавляемой к культуре клеток, составляет от приблизительно 0,1X до приблизительно 0,0125Х, или от приблизительно 0,1X до приблизительно 0,0125X, или от приблизительно 0,1X до приблизительно 0,025, или от приблизительно 0,1Х до приблизительно 0,05X, или от приблизительно 0,1X до приблизительно 0,075X, или от приблизительно 0,075Х до приблизительно 0,0125Х, или от приблизительно 0,05Х до приблизительно 0,0125Х, или от приблизительно 0,025Х до приблизительно 0,0125Х, или от приблизительно 0,075Х до приблизительно 0,025Х, или приблизительно 0,5Х, или приблизительно 0,1X, или приблизительно 0,09Х, или приблизительно 0,08Х, или приблизительно 0,07Х, или приблизительно 0,06Х или приблизительно 0,05Х, или приблизительно 0,04Х или приблизительно 0,02Х, где 1X представляет заключительную концентрацию протеазы, которая является необходимой для отделения клеток, которые предварительно не подвергались обработке хелатирующим агентом, при идентичных условиях диссоциации. Является также понятным, что 1X может также представлять заключительную рабочую концентрация после разведения концентрированного маточного раствора протеазы (например, протеазы, поставляемой в виде 10Х маточного раствора) и что этот рабочий маточный раствор может дополнительно разводиться для получения концентраций менее чем 1X.
Воспроизводимый перенос с гранулы на гранулу в крупномасштабном процессе производства обычно использует применение многократных этапов промывания, например, для обеспечения предварительно обработанных протеазой культур клеток, такой промывочный раствор содержит минимум ингибиторов протеазы или, как описывается выше, для минимизации и/или устранения необходимости применения протеазы. Однако для крупномасштабных коммерческих процессов такие процедуры промывания могут быть дорогостоящими для применения и могут приводить к контаминации, способствующей неудачному осуществлению продукционного процесса, неэффективности производственных процессов и снижению продуктивности. В соответствии с этим настоящее изобретение обеспечивает новые способы для преодоления этих недостатков путем устранения этапов промывания культуры клеток во время процесса переноса с гранулы на гранулу. Способы эффективного переноса с гранулы на гранулу, которые снижают или даже устраняют необходимость процедур промывания, включают, но без ограничения, способ, приведенный в Примерах Раздела 8.5. В частности, изобретатели установили, что предварительная обработка с помощью хелатирующего агента (например, ЭДТА) перед обработкой протеазой может устранить необходимость удаления ростовой среды и промывания клеток. В дополнение, путем добавления к свежей среде дополнительных компонентов среды (например, дивалентных катионов и/или микроэлементов) нет необходимости в промывании клеток после обработки протеазой.
В некоторых воплощениях перенос с гранулы на гранулу улучшают с помощью прибавления хелатирующего агента непосредственно к культуре клеток (то есть без промывания клеток) перед прибавлением протеазы (например, TrypLE). Хелатирующие агенты, которые могут использоваться в способах, были описаны выше. В одном воплощении хелатирующий агент является способным к хелатированию дивалентных катионов (например, Са2+ и Mg2+). В специфическом воплощении хелатирующий агент представляет собой ЭДТА. В некоторых воплощениях хелатирующий агент прибавляют к культуре клеток при заключительной концентрации от 0,5 мМ до 5 мМ, или от приблизительно 0,5 мМ до приблизительно 4 мМ, или от приблизительно 0,5 мМ до приблизительно 3 мМ, или от приблизительно 0,5 мМ до приблизительно 2 мМ, или от приблизительно 0,5 мМ до приблизительно 1,5 мМ, или от приблизительно 0,5 мМ до приблизительно 1 мМ, или от приблизительно 1 мМ до приблизительно 5 мМ, или от приблизительно 1,5 мМ до приблизительно 5 мМ, или от приблизительно 2,0 мМ до приблизительно 5 мМ, или от приблизительно 3,0 мМ до приблизительно 5 мМ, или от приблизительно 4,0 мМ до приблизительно 5 мМ, или от приблизительно 1 мМ до приблизительно 2 мМ. В специфическом воплощении хелатирующий агент прибавляют к культуре клеток при заключительной концентрации приблизительно 2 мМ. После прибавления хелатирующего агента культуру клеток можно потом культивировать в течение периода времени перед добавлением протеазы. В некоторых воплощениях культуру клеток инкубируют с хелатирующим агентом в течение периода времени от приблизительно 0 мин до приблизительно 120 мин, или от приблизительно 0 мин до приблизительно 90 мин, или от приблизительно 0 мин до приблизительно 60 мин, или от приблизительно 0 мин до приблизительно 30 мин, или от приблизительно 30 мин до приблизительно 120 мин, или от приблизительно 60 мин до приблизительно 120 мин, или от приблизительно 90 мин до приблизительно 120 мин, или от приблизительно 30 мин до приблизительно 90 мин, или приблизительно 60 мин перед прибавлением протеазы. В некоторых воплощениях культуру клеток перемешивают после прибавления хелатирующего агента и перед прибавлением протеазы. Средства для перемешивания, скорость и длительность были описаны выше и могут быть оптимизированы специалистом в данной области техники без какого-либо избыточного экспериментирования. В специфическом воплощении культуру клеток инкубируют с хелатирующим агентом перед прибавлением протеазы с достаточным перемешиванием для того, чтобы предотвратить осаждение большей части микроносителей на дне емкости для культивирования.
Перед прибавлением протеазы рН хелатированной культура клеток можно доводить, например, до оптимального для протеазы значения рН. В специфическом воплощении значение рН доводят до значения от приблизительно 7,8 до приблизительно 8,2. Протеазы, которые могут использоваться после предварительной обработки с помощью хелатирующего агента, были подробно описаны выше. В некоторых воплощениях заключительная концентрация протеазы, которая прибавляется к культуре клеток после предварительной обработки с помощью хелатирующего агента, составляет от приблизительно 0,1X до приблизительно 0,0125Х, или от приблизительно 0,1X до приблизительно 0,0125X, или от приблизительно 0,1X до приблизительно 0,025, или от приблизительно 0,1Х до приблизительно 0,05X, или от приблизительно 0,1X до приблизительно 0,075X, или от приблизительно 0,075Х до приблизительно 0,0125Х, или от приблизительно 0,05Х до приблизительно 0,0125Х, или от приблизительно 0,025Х до приблизительно 0,0125Х, или от приблизительно 0,075Х до приблизительно 0,025Х. В других воплощениях заключительная концентрация протеазы, которая прибавляется к культуре клеток после предварительной обработки с помощью хелатирующего агента, составляет приблизительно 0,09Х, или приблизительно 0,08Х, или приблизительно 0,07Х, или приблизительно 0,06Х или приблизительно 0,05Х, или приблизительно 0,04Х или приблизительно 0,02Х, где 1X представляет собой заключительную рабочую концентрацию после разведения концентрированного маточного раствора протеазы (например, протеазы, которая обеспечивается в виде 10Х маточного раствора). Длительность обработки с помощью протеазы может определяться путем мониторинга отделения клеток и может варьировать в зависимости от концентрации используемой протеазы. Способы для мониторинга отделения клеток являются известными в области техники и включают микроскопическое исследование культуры клеток. После отделения клеток протеаза может быть инактивирована (например, путем прибавления ингибиторов протеазы, таких как ингибитор трипсина лимской фасоли) в случае необходимости, и свежая среда и/или гранулы микроносителя могут потом прибавляться к культуре. В некоторых воплощениях культуру, обработанную протеазой, потом переносят в больший резервуар для культуры перед, во время или после прибавления свежей среды и/или микроносителей.
Для того чтобы способствовать повторному прикреплению и росту клеток после обработки с помощью протеазы, свежая среда, которую прибавляют к культуре клеток, дополнительно содержит один или более компонентов среды, включая, но без ограничения, СаСl2, MgCl2, MgSO4, микроэлементы А, В, и С. Дополнительные гранулы микроносителя также прибавляют к культуре. Типичные концентрации CaCl2, MgCl2 и MgSO4, где 90% или более клеток являются повторно прикрепленными к микроносителям, представлены в Таблице. Типичные концентрации CaCl2, MgCl2, MgSO4, микроэлементов А, В и С, где количество клеток, подсчитанное через четыре дня после высевания, составляют, по крайней мере, 1.0Е6 клеток/мл, показаны в Таблице. В некоторых воплощениях среду дополняют приблизительно 1,25 мМ - приблизительно 1,5 мМ СаСl2, приблизительно 0,1 мМ - приблизительно 0,2 мМ MgCl2, и приблизительно 0,1 - приблизительно 0,8 мМ MgSO4. В других воплощениях в среду дополнительно вносят приблизительно 2Х микроэлементов А, В и С. В некоторых воплощениях культуру с исходными микроносителями или без них переносят в большую емкость для культивирования до, во время или после прибавления свежей дополненной среды и микроносителей.
В одном воплощении MDCK клетки культивируют как адгезивные клетки в культуральной системе. Культуральные системы, которые могут использоваться для культивирования MDCK клеток, включают, например, системы периодических культур и системы культур с подпиткой, куда добавляются дополнительные питательные вещества (например, источники углерода, аминокислоты и т.д.), поскольку они исчерпываются из исходной среды, для улучшения роста для достижения высокой плотности клеток. Альтернативно или необязательно, могут использоваться системы проточной культуры (например, при использовании систем удержания клеток, таких как, например, центрифугирование, фильтрация, центробежные фильтры и тому подобное), для того чтобы способствовать замене среды и/или восполнению истощенных питательных веществ. В специфическом воплощении неканцерогенные MDCK клетки культивируют как адгезивные клетки в системе периодической культуры без замены среды/обогащения (например, подпитки или перфузии) при использовании свободной от сыворотки среды в соответствии с изобретением (например, MediV SFM 110). Дополнительное руководство, касающееся культуры MDCK клеток (например, неканцерогенных MDCK клеток) как адгезивных клеток, может быть найдено, например, в публикациях патентных заявок США №№2003/0108860; 2005/0118140; и публикации РСТ WO 2008/105931. Традиционно используемые культуральные системы, полезные для культивирования MDCK клеток, включают биореакторы, представляющие собой резервуары с мешалкой.
6.3.3 Условия культивирования вируса гриппа
Настоящее изобретение обеспечивает способы для культивирования MDCK клеток (например, неканцерогенных MDCK клеток) и других клеток животных в свободной от сыворотки композиции среды, как представлено выше. Специфически предполагается, что дополнительные условия культивирования могут играть роль в поддержании свойств MDCK клеток, включая отсутствие канцерогенности, отсутствие онкогенности, выращивание в виде адгезивных клеток, выращивание как неадгезивных клеток, наличие морфологии, подобной такой для эпителиальных клеток, поддержание репликации различных вирусов и поддержание роста вирусов гриппа (например, адаптированных к холоду и/или чувствительных к температуре, и/или аттенуированных) до высокого титра, например, до значения log10 ТСID50/мл и/или значения log10 БОЕ/мл, по крайней мере, приблизительно 7,8, или по крайней мере, приблизительно 8,0, или по крайней мере, приблизительно 9,0. Такие условия культивирования включают, но без ограничения, выбор адгезивной поверхности, плотности клеток, температуры, концентрации CO2, способ культивирования, скорость перемешивания, содержание растворенного кислорода и значение рН.
Специфически предполагается, что условия культивирования могут быть оптимизированы в ряде случаев для оптимизации роста MDCK клеток (например, неканцерогенных MDCK клеток). Такие модификации могут также приводить к повышению продукции вирусного материала (например, вируса), как описывается, например, в публикации патентной заявки США №2005/0118698. Альтернативно, условия культивирования могут быть адаптированы для оптимизации продукции вакцинного материала из MDCK клеток без учета роста клеток. Такие культуральные условия включают, но без ограничения, адгезивную поверхность, плотность клеток, температуру, концентрацию СО2, способ культивирования, содержание растворенного кислорода и значение рН.
В одном воплощении MDCK клетки (например, неканцерогенные MDCK клетки) культивируют при концентрации CO2, по крайней мере, 1%, или, по крайней мере, 2%, или, по крайней мере, 3%, или, по крайней мере, 4%, или, по крайней мере, 5%, или, по крайней мере, 6%, или, по крайней мере, 7%, или, по крайней мере, 8%, или, по крайней мере, 9%, или, по крайней мере, 10%, или, по крайней мере, 20%.
В одном воплощении концентрация растворенного кислорода (DO) (значение рO2) благоприятным образом регулируется в процессе культивирования MDCK клеток и находится в интервале от 5% до 100% (на основе насыщения воздуха), или от 10% до 60%. В специфическом воплощении концентрация растворенного кислорода (DO) (pO2 значение) составляет, по крайней мере, 10%, или по крайней мере, 20%, или по крайней мере, 30%, или по крайней мере, 50%, или по крайней мере, 60%. В специфическом воплощении DO концентрация поддерживается на уровне 50%. В частном воплощении DO снижается до 50% и потом поддерживается на этом уровне. Способы поддержания уровней DO включают, например, барботирование с помощью чистого кислорода.
Поскольку перемешивание культуры клеток, в общем случае, и барботирование, в частности, могут приводить к образованию пены, в некоторых воплощениях антивспенивающий агент прибавляют к культуре клеток для снижения пенообразования. Противовспенивающие агенты, полезные для культуры клеток животных, легко получают от ряда коммерческих поставщиков, включая, например, Invitrogen, Dow Coming, Sigma и другие. Специфические антивспенивающие агенты включают, но без ограничения, Antifoam С Emulsion и FoamAway™. В специфическом воплощении Antifoam С Emulsion прибавляют к культуре на уровне от приблизительно 10 част. на млн. до приблизительно 1000 част. на млн., или от приблизительно 25 част. на млн. до приблизительно 750 част. на млн., или от приблизительно 50 част. на млн. до приблизительно 500 част. на млн., или от приблизительно 75 част. на млн. до приблизительно 250 част. на млн., или от приблизительно 50 част. на млн. до приблизительно 150 част. на млн. В некоторых воплощениях антивспенивающий агент прибавляют к культуре клеток два раза в день, или один раз в день, или через день. В других воплощениях антивспенивающий агент прибавляют к культуральной среде до прибавления MDCK клеток.
В другом воплощении значение рН культуральной среды, используемой для культивирования неканцерогенных MDCK клеток, регулируют в процессе культивирования и оно находится в интервале от рН 6,4 до рН 8,0, или в интервале от рН 6,8 до рН 7,4. В специфическом воплощении значение рН культуральной среды находится на уровне приблизительно 6,4 или приблизительно 6,6, или приблизительно 6,8, или приблизительно 7,0, или приблизительно 7,2, или приблизительно 7,4, или приблизительно 7,6, или приблизительно 7,8, или по крайней мере, 8,0. В частном воплощении значение рН культуральной среды составляет приблизительно 7,4.
В дополнительном воплощении MDCK клетки культивируют в свободной от сыворотки среде в соответствии с изобретением при температуре от 25°С до 39°С. Специфически предполагается, что температура культивирования может варьировать в зависимости от желаемого процесса. Например, неканцерогенные MDCK клетки могут выращиваться при 37±2°C для пролиферации клеток и при более низкой температуре (например, от 25°С до 35°С) для получения вакцинного материала (например, вируса). В другом воплощении клетки культивируют при температуре менее чем 30°С, или менее чем 31°С, или менее чем 32°С, или менее чем 33°С, или менее чем 34°С для получения вакцинного материала. В другом воплощении клетки культивируют при температуре 30°С, или 31°С, или 32°С, или 33°С, или 34°С для получения вакцинного материала. В специфическом воплощении клетки культивируют при температуре 33±2°C для получения вакцинного материала.
В некоторых воплощениях MDCK клетки культивируют в свободной от сыворотки среде в соответствии с изобретением в резервуаре биореактора с мешалкой (например, пластиковый биореактор одноразового использования, стеклянные биореакторы или биореакторы из нержавеющей стали многократного использования) и один или более параметров, выбранных из группы, которая состоит из температуры, скорости перемешивания, значения рН, растворенного кислорода (DO), скорости поступления О2 и СО2, подвергают мониторингу и/или контролю. В одном воплощении температуру поддерживают на уровне от приблизительно 30°С до приблизительно 42°С, или от приблизительно 33°С до приблизительно 39°С, или от приблизительно 35°С до приблизительно 38°С. В специфическом воплощении температуру поддерживают на уровне от приблизительно 36°С до приблизительно 38°С. В одном воплощении перемешивание поддерживают при скорости приблизительно от 100 до 200 об/мин В специфическом воплощении используется биореактор однократного применения, а скорость перемешивания поддерживают на уровне от приблизительно 80 до приблизительно 120 об/мин, или от приблизительно 90 до приблизительно 100 об/мин В другом специфическом воплощении используют реактор многократного применения и скорость перемешивания поддерживают на уровне от приблизительно 150 до приблизительно 200 об/мин, или от приблизительно 160 до приблизительно 180 об/мин Скорости перемешивания контролируют с помощью средств, известных в области техники. Тип и размер используемого биореактора, а также тип и количество используемой(ых) лопасти(ей) могут требовать доведения скорости перемешивания для максимизации роста клеток и/или минимазации потерь клеток.
В другом воплощении значение рН MDCK культуры клеток поддерживают на уровне приблизительно от 6,4 до рН 8,0. В специфическом воплощении значение рН стартовой культуры составляет от приблизительно 6,8 до приблизительно 7,6, а значение рН культуры поддерживают на уровне от приблизительно 7,0 до приблизительно 7,5 во время процесса культивирования. Исходное значение рН может быть выше или ниже, чем желательный интервал, и значение рН может быть повышено или снижено до желательного уровня (например, 7,4), который и поддерживают. В частном воплощении значение рН поддерживают на уровне приблизительно 7,4. Значение рН может контролироваться путем барботирования СО2 и/или путем прибавления кислоты (например, НСl) или основания (например, NaOH, NаНСО3, Na2CO3), в случае необходимости.
Еще в одном воплощении приемлемый интервал для DO составляет от приблизительно 100 до приблизительно 35%. В специфическом воплощении DO MDCK культуры клеток поддерживают на уровне от приблизительно 35% до приблизительно 50%, или приблизительно 50%. В другом специфическом воплощении значение DO не должно опускаться ниже приблизительно 35%. В некоторых воплощениях начальное значение DO может составлять 100% и значению DO позволяют опускаться до предварительно определенного уровня (например, 50%), на котором его и поддерживают. Значение DO поддерживается, например, путем барботирования O2. В некоторых воплощениях скорость пропускания О2 поддерживают на уровне, меньшем чем приблизительно 2,0 л/мин В некоторых воплощениях скорость пропускания СO2 поддерживают на уровне, меньшем чем приблизительно 0,4 л/мин В других воплощениях поддерживается постоянная общая скорость пропускания (например, 40 мл/мин) и N2 газ используется для поддержания скорости пропускания. В соответствии с этим, количество N2 газа может подсчитываться в соответствии с объемами O2 и CO2 газов, используемых для поддержания значений DO и рН.
Содержание глюкозы, глутамина, лактата, других компонентов среды, а также значения рН и рO2 в среде и другие параметры, такие как перемешивание, могут легко подвергаться изменению в процессе культивирования неканцерогенных MDCK клеток так, что плотность клеток и/или продукция вируса оптимизируется.
6.3.4 Условия культивирования респираторно-синцитиального вируса
В специфическом воплощении клетки культивируют перед инфицированием с помощью ассоциированного с клеткой вируса, как описано в данной заявке, для получения определенного общего количества жизнеспособных клеток. Например, Vero клетки могут культивироваться в VP-SFM, обогащенной 4 мМ L-глутамина и 1% CDLC при температуре приблизительно 37°С, при этом измеряется общее количество жизнеспособных клеток и жизнеспособность клеток. В специфическом воплощении клетки инфицируют с помощью ассоциированного с клеткой вируса тогда, когда достигают определенного среднего количества жизнеспособных клеток. Например, среднее количество жизнеспособных клеток на уровне приблизительно 1,5×108 клеток/пробирка с культурой ткани или более может быть достигнуто перед инфицированием клеток с помощью ассоциированного с клеткой вируса, описанного в данной заявке, такого, как RSV. В одном воплощении среднее количество жизнеспособных клеток на уровне от приблизительно 1×106 клеток/пробирка с культурой ткани до приблизительно 1×1014 клеток/пробирка с культурой ткани, как измеряется при использовании, например, Vi-цитометра, достигается перед инфицированием клеток с помощью ассоциированного с клеткой вируса, описанного в данной заявке. В другом воплощении среднее количество жизнеспособных клеток на уровне приблизительно 1×106 клеток/пробирка с культурой ткани, приблизительно 5×106 клеток/пробирка с культурой ткани, приблизительно 1×107 клеток/пробирка с культурой ткани, или приблизительно 5×107 клеток/пробирка с культурой ткани, как измеряется при использовании, например, Vi-цитометра, достигается перед инфицированием клеток с помощью ассоциированного с клеткой вируса, описанного в данной заявке. В другом воплощении среднее количество жизнеспособных клеток приблизительно 1×108 клеток/пробирка с культурой ткани, приблизительно 5×108 клеток/пробирка с культурой ткани, приблизительно 1×109 клеток/пробирка с культурой ткани, приблизительно 5×109 клеток/пробирка с культурой ткани, или приблизительно 1×1010 клеток/пробирка с культурой ткани, как измеряется при использовании, например, Vi-цитометра, достигается перед инфицированием клеток с помощью ассоциированного с клеткой вируса, описанного в данной заявке.
Множественность заражения (MOI), которую определяют как оптимальную для выбранных клетки, используется для инфицирования клеток. В специфическом воплощении MOI, которая составляет от приблизительно 0,0001 до приблизительно 1, илиот приблизительно 0,0005 до 0,005 используется для инфицирования клеток, описанных в данной заявке. В другом воплощении а MOI на уровне приблизительно 0,0001, приблизительно 0,0005 или приблизительно 0,00075 используется для инфицирования клеток, описанных в данной заявке. В другом воплощении MOI на уровне приблизительно 0,001, приблизительно 0,005, приблизительно 0,0075 или приблизительно 0,01 используется для инфицирования клеток, описанных в данной заявке. Еще в одном воплощении MOI на уровне приблизительно 0,05, приблизительно 0,075, приблизительно 0,1 или приблизительно 0,5 используется для инфицирования клеток, описанных в данной заявке. В специфическом воплощении MOI на уровне приблизительно 0,01 для rА2ср248/404/1030ΔSН используется для инфицирования клеток Vero.
Клетки, инфицированные ассоциированным с клеткой вирусом, могут инкубироваться в течение периода времени в среде и при условиях (например, температура, СО2 условия и рН), которые являются приемлемыми для выбранной линии клеток, и приводят к получению оптимального титра вируса. Например, клетки Vero, инфицированные с помощью RSV, такие как rА2ср248/404/1030ΔSН, могут инкубироваться в SF4MegaVir среде (Invitrogen Corp., Carlsbad CA), обогащенной 4 мМ L-глутамина, и при температуре приблизительно 30°С в течение приблизительно 10 дней без СO2 перед сбором вируса. В некоторых воплощениях инфицированные RSV клетки (например, инфицированные RSV клетки Vero) инкубируют в течение приблизительного периода времени от 8 до 14 дней перед сбором вируса. В специфических воплощениях инфицированные RSV клетки инкубируют приблизительно 8 дней, предпочтительно приблизительно 9 дней, приблизительно 10 дней, приблизительно 11 дней, или приблизительно 12 дней перед сбором вируса.
Клетки, инфицированные ассоциированным с клеткой вирусом, описанным в данной заявке, могут культивироваться в любой емкости для культуры тканей, известной специалисту в данной области техники. В некоторых воплощениях клетки, инфицированные ассоциированным с клеткой вирусом, культивируют в Т-75 колбах или Т-225 колбах. В других воплощениях клетки, инфицированные ассоциированным с клеткой вирусом, культивируют в резервуарах на 1 литр, 2 литра, 3 литра, 4 литра или 5 литра для культуры тканей. В специфическом воплощении клетки, инфицированные ассоциированным с клеткой вирусом, культивируют в роллерных флаконах, по крайней мере, с 40-500 мл рабочего объема. В специфическом воплощении клетки, инфицированные ассоциированным с клеткой вирусом, культивируют в 4-литровом резервуаре для культуры ткани, таком как роллерный флакон. В других воплощениях клетки, инфицированные ассоциированным с клеткой вирусом, культивировали в 10-литровых, 15-литровых, 20-литровых или 25-литровых резервуарах для культуры ткани. В других воплощениях клетки, инфицированные ассоциированным с клеткой вирусом, культивируют в 50-литровых, 75-литровых или 100-литровых резервуарах для культуры ткани. В других воплощениях клетки, инфицированные ассоциированным с клеткой вирусом, культивируют в 250-литровых, 500-литровых или 1000-литровых резервуарах для культуры ткани. Резервуары для культуры ткани, которые могут использоваться, включают колбы, роллерные флаконы, биореакторы и любые другие емкости для культуры ткани, известные специалисту в данной области техники.
6.4 Получение вакцинного материала
Настоящее изобретение обеспечивает эффективные способы для получения вирусов в культуре клеток, в которых MDCK клетки (например, неканцерогенные MDCK клетки) используются для продукции вирусов. В частности, настоящее изобретение обеспечивает способы для получения вирусов гриппа с высокими титрами без замены или пополнения среды.
В одном воплощении способ получения вирусов гриппа включает следующие этапы:
(а) размножение MDCK клеток в свободной от сыворотки культуральной среде, при поддержании одного или более условий культивирования, выбранных из группы, состоящей из скорости перемешивания, составляющей приблизительно от 100 до 200 об/мин, значения рН от приблизительно 6,0 до приблизительно 7,8, температуры от приблизительно 33°С до приблизительно 42°С, и содержания растворенного кислорода (DO) от приблизительно 35% до приблизительно 100%;
(b) инфицирование размноженных MDCK клеток с помощью вируса гриппа без замены культуральной среды; и
(c) инкубацию MDCK клеток при условиях, которые позволяют осуществлять репликацию вируса гриппа.
Вирусы гриппа, которые могут быть получены с помощью способов в соответствии с изобретением, описываются в данной заявке (смотри, например, Разделы 6.2 и 6.7), и включают, но без ограничения, реассортантные вирусы, которые включают выбранные антигены гемагглютинина и/или нейраминидазы в контексте аттенуированных, чувствительных к температуре, адаптированных к холоду (ca/ts/att) основных донорных вирусов. Например, вирусы могут включать скелеты (или один, или более сегментов вирусной РНК) основного донорного вируса, который представляет собой один или более из, например, чувствительных к температуре (ts), адаптированных к холоду (со), или аттенуированный (att) (например, А/Анн-Арбор/6/60, В/Анн-Арбор/1/66, PR8, В/Ленинград/14/17/55, В/14/5/1, B/USSR760/69, В/Ленинград/179/86, В/Ленинград/14/55, В/Англия/2608/76 и т.д.). Способы для получения реассортантного вакцинного штамма вируса гриппа либо в куриных эмбрионах, либо в линии клеток, включают, например, те, которые раскрыты у Kilboume, E.D. в Vaccine (2-ое изд.), ред. Plotkin и Mortimer, WB Saunders Co. (1988) и те, которые раскрыты в публикациях патентных заявок РСТ WO 05/062820 и WO 03/091401, и в патентах США №№6,951,754, 6,887,699, 6,649,372, 6,544,785, 6,001,634, 5,854,037, 5,824,536, 5,840,520, 5,820,871, 5,786,199 и 5,166,057, а также в публикациях патентных заявок США №№20060019350, 20050158342, 20050037487, 20050266026, 20050186563, 20050221489, 20050032043, 20040142003, 2003003581 и 20020164770. Другие вирусы гриппа, которые могут быть получены с помощью способов в соответствии с изобретением, включают рекомбинантные вирусы гриппа, которые могут экспрессировать гетерологичный генный продукт, смотри, например, публикации патентных заявок США №№2004/0241139 и 2004/0253273. В некоторых воплощениях способ используется для получения адаптированных к холоду и/или чувствительных к температуре, и/или аттенуированных вирусов гриппа.
В специфическом воплощении вирусы гриппа получают до максимального титра вируса, который составляет log10 ТСID50/мл и/или log10 БОЕ/мл, по крайней мере, приблизительно 8,0. В других воплощениях вирусы гриппа получают до максимального титра вируса, который составляет log10 ТСID50/мл и/или log10 БОЕ/мл, по крайней мере, приблизительно 8,1, или, по крайней мере, 8,2, или, по крайней мере, 8,3, или, по крайней мере, 8,4, или, по крайней мере, 8,5, или, по крайней мере, 8,6, или, по крайней мере, 8,7, или, по крайней мере, 8,8, или, по крайней мере, 8,9, или, по крайней мере, 9,0.
В некоторых воплощениях MDCK клетки размножают как адгезивные клетки. В специфическом воплощении MDCK клетки являются неканцерогенными MDCK клетками и размножаются как адгезивные клетки. В другом специфическом воплощении MDCK клетки являются выбранными из группы, состоящей из таких, которые имеют депозитные номера АТСС РТА-6500, РТА-6501, РТА-6502, РТА-6503, РТА-7909 и РТА-7910), и размножаются как адгезивные клетки. Биореакторы и способы, полезные для размножения адгезивных клеток были описаны выше (смотри Разделы 6.3.2 и 6.3.3). В других воплощениях MDCK клетки размножают как неадгезивные клетки. Способы размножения неадгезивных MDCK клеток являются известными в области техники, смотри, например, патент США №6,455,298. Дополнительные условия культивирования, такие, как, например, температура, скорость перемешивание, рН, рO2, СO2 концентрация и плотность посева клеток являются подробно описанными выше (смотри Разделы 6.3.2 и 6.3.3).
В специфическом воплощении MDCK клетки размножают как адгезивные клетки в биореакторе с перемешиванием. В некоторых воплощениях способа температура, скорость перемешивания, рН, рO2 значение, концентрация СО2 и другие параметры культуральной среды для культивирования клеток регулируются в процессе культивирования так, как описано выше (смотри Разделы 6.3.2 и 6.3.3). В некоторых воплощениях MDCK клетки размножают до получения плотности клеток от приблизительно 5×105 до приблизительно 3×106. Альтернативно или необязательно, MDCK клетки размножают в течение установленного периода времени. Начальная плотность посева, время удвоения и желаемая заключительная плотность клеток будут определять время размножения. В таких воплощениях клетки могут, например, размножаться в течение от 1 до 10 дней или в течение от 2 до 8 дней, или в течение от 3 до 7 дней. В некоторых воплощениях MDCK клетки размножают в течение от приблизительно 3 до приблизительно 5 дней.
В некоторых воплощениях свободная от сыворотки среда представляет собой обогащенную свободную от сыворотки среду, как описано в данной заявке (смотри Раздел 6.3.1). В одном воплощении свободная от сыворотки среда включает растительный гидролизат, липидную добавку, микроэлементы и является усиленной с помощью одного или более компонентов среды, выбранных из группы, состоящей из путресцина, аминокислот, витаминов, жирных кислот и нуклеозидов. В другом воплощении свободная от сыворотки среда включает все компоненты MediV SFM110 среды, приведенной в 0. В специфическом воплощении свободная от сыворотки среда существенно состоит из всех компонентов MediV SFM 110 среды, приведенной в 0. В другом специфическом воплощении свободная от сыворотки среда остоит из всех компонентов, приведенных в 0, при указанных заключительных концентрациях. В некоторых воплощениях свободная от сыворотки среда включает глюкозу при заключительной концентрации приблизительно 4,5 г/л. В других воплощениях свободная от сыворотки среда включает глюкозу при заключительной концентрации приблизительно 9,0 г/л.
Вирусы гриппа, которые могут использоваться для инфицирования клеток (этап (b)), включают, но без ограничения, те, которые были описаны в данной заявке (смотри, например, Разделы 6.2 и 6.7). Количество вируса, добавляемого для инфицирования клеток (в данной заявке называется как "введенный вирус"), может измеряться как количество прибавляемого вируса на клетку (также обычно называется множественностью заражения, или MOI). В некоторых воплощениях инфицирование клеток с помощью вируса осуществляют при использовании количества введенного вируса от приблизительно 0,00001 БОЕ/клетка до приблизительно 10 БОЕ/клетка, или от приблизительно 0,00001 БОЕ/клетка до приблизительно 1 БОЕ/клетка, или от приблизительно 0,00001 БОЕ/клетка до приблизительно 0,1 БОЕ/клетка, или от приблизительно 0,00001 БОЕ/клетка до приблизительно 0,001 БОЕ/клетка. В одном воплощении инфицирование клеток с помощью вируса осуществляют при использовании количества введенного вируса от приблизительно 0,00001 БОЕ/клетка до приблизительно 0,0001 БОЕ/клетка, или приблизительно 0,00002 БОЕ/клетка до приблизительно 0,0002 БОЕ/клетка. В специфическом воплощении инфицирование клеток с помощью вируса осуществляют при использовании количества введенного вируса от 0,00001 БОЕ/клетка до 0,00005 БОЕ/клетка. В другом специфическом воплощении инфицирование клеток с помощью вируса осуществляют при использовании количества введенного вируса от 0,0001 БОЕ/клетка до 0,0005 БОЕ/клетка. Приведенная ниже формула может использоваться для определения количества прибавляемого вируса:
Количество вируса в мкл = общ. кол-во клеток × введенный вирус (БОЕ/клетка)/10титр FFA вируса (БОЕ/мл)×1000.
Альтернативно, количество вируса, используемое для инфицирования клеток (то есть введенный вирус), определяют заключительной концентрацией вируса в культуре. Например, вирус может прибавляться при заключительной концентрации от приблизительно 1×103 БОЕ/мл до приблизительно 0,001×103 БОЕ/мл, или от приблизительно 0,1×103 БОЕ/мл до приблизительно 0,01×103 БОЕ/мл. Приведенная ниже формула может использоваться для определения количества прибавляемого вируса для достижения желаемой заключительной концентрации:
Количество вируса в мкл = объем культуры (мл) × заключительная концентрация (БОЕ/мл)/10титр FFA вируса (БОЕ/мл)×1000.
Необязательно, может прибавляться протеаза, которая обусловливает расщепление белка-предшественника гемагглютинина [НА0] и, таким образом, адсорбцию вируса клетками. Прибавление протеазы может осуществляться в соответствии с изобретением непосредственно до, одновременно с или непосредственно после инфицирования клеток с помощью вируса гриппа. Если прибавление осуществляют одновременно с инфицированием, то протеаза может либо прибавляться непосредственно к культуре, которую подвергают инфицированию, либо, например, в виде концентрата вместе с инокулятом вируса. В некоторых аспектах в соответствии с изобретением протеаза представляет собой серинпротеазу, или цистеинпротеазу, или аспарагинпротеазу. В одном воплощении используется трипсин. В специфическом воплощении используется обработанный ТРСК трипсин. В одном воплощении трипсин прибавляют к культуре клеток вплоть до заключительной концентрации от 1 до 5000 мЕд./мл, или от 5 до 1000 мЕд./мл, или от 100 до 500 мЕд./мл. В альтернативном воплощении трипсин прибавляют к культуре клеток вплоть до заключительной концентрации от 1 до 200 мкг/мл, или от 5 до 50 мкг/мл, или от 5 до 30 мкг/мл в культуральной среде.
Протеаза может иметь происхождение из животного источника или, более предпочтительно, из рекомбинантного источника. Рекомбинантные протеазы, приемлемые для применения, легко получают от ряда коммерческих поставщиков включая, например Invitrogen (TrypLE™) и Sigma-Aldrich (TrypZean™), в виде маточных растворов (например, 1Х-100Х). В некоторых воплощениях рекомбинантная протеаза используется при заключительной концентрации от приблизительно 0,01X до приблизительно 1X, или от приблизительно 0,02Х до приблизительно 0,8Х, или от приблизительно 0,03Х до приблизительно 0,7Х, или от приблизительно 0,04Х до приблизительно 0,6Х, или от приблизительно 0,05Х до приблизительно 0,5Х, или от приблизительно 0,06Х до приблизительно 0,4Х, или от приблизительно 0,07Х до приблизительно 0,3Х, или от приблизительно 0,8Х до приблизительно 0,2Х. В специфическом воплощении рекомбинантная протеаза используется при заключительной концентрации от приблизительно 0,02Х до приблизительно 0,06Х. В другом воплощении протеаза представляет собой рекомбинантную, подобную трипсину протеазу, включая, но без ограничения, TrypLE™ (Invitrogen). Еще в одном воплощении протеаза представляет собой такую из Streptomyces griseus, как описывается в патентной заявке США №11/455,818.
После инфицирования зараженную культуру клеток подвергают дальнейшему культивированию для репликации вирусов, в частности, до тех пор, пока не будет определен максимальный цитопатический эффект или максимальное количество вируса или антигена. В одном воплощении после инфицирования клетки культивируют при температуре от 30°С до 37°С. В некоторых воплощениях после инфицирования с помощью вирусов клетки культивируют при температуре менее чем 39°С, или менее чем 38°С, или менее чем 37°С, или менее чем 36°С, или менее чем 35°С, или менее чем 34°С, или менее чем 33°С, или менее чем 32°С, или менее чем 31°С, или менее чем 30°С. Культивирование инфицированных клеток при температурах ниже 33°С, в частности, в температурных интервалах, указанных выше, приводит к получению высокого выхода определенных вирусов гриппа, таких как, например, штаммы вируса гриппа В (смотри, например, патентную публикацию США №2006/0153872). Кроме того, культивирование инфицированных клеток при температурах ниже 35°С предполагается для получения чувствительных к температуре, адаптированных к холоду (ts/ca) вирусов гриппа. Предполагается, что ts/ca вирусы могут также быть аттенуированными (att). В другом воплощении клетки культивируют при температуре менее чем 30°С, или менее чем 31°С, или менее чем 32°С, или менее чем 33°С, или менее чем 34°С для получения ts/ca штамма вируса гриппа. В специфическом воплощении клетки культивируют при температуре 31°C для получения штамма вируса гриппа В. Еще в одном воплощении после инфицирования клетки культивируют при температуре 31±2°С.
В некоторых воплощениях инкубацию клеток (этап (с)) осуществляют в течение периода времени, достаточного для получения приемлемых выходов вируса, такого как период времени от 2 до 10 дней или, необязательно, от 3 до 7 дней, после инфицирования. В одном воплощении способа инкубацию клеток (этап (с)) осуществляют в течение 2 дней, или 3 дней, или 4 дней, или 5 дней, или 6 дней, или 7 дней после инфекции. В других воплощениях инкубацию клеток (этап (с)) осуществляют в течение от 40 до 96 часов после инфицирования. В специфическом воплощении инкубацию клеток (этап (с)) осуществляют в течение от приблизительно 48 до приблизительно 72 часов после инфицирования.
В некоторых воплощениях способа клетки могут, например, инкубироваться после инфицирования вирусами (этап (b)) так, что скорость перемешивания, рН, значение pO2, СО2 концентрация и другие параметры поддерживаются так, как описано выше (смотри Разделы 6.3.2 и 6.3.3).
В некоторых воплощениях способ дополнительно включает после этапа (с) этап сбора культуральной среды, содержащей реплицированный вирус (то есть культуральной среды, в которой выращивались инфицированные клетки). Собранная культуральная среда, содержащая реплицированный вирус, также называется в данной заявке как "урожай вируса".
В одном воплощении любые микроносители, используемые при размножении MDCK клеток, подвергают осаждению перед сбором культуральной среды, содержащей реплицированный вирус. Необязательно или альтернативно, культуральная среда, содержащая реплицированный вирус, может собираться при использовании устройства попеременного тангенциального потока с низким сдвигом (ATF), смотри, например US 6,544,424. Применение ATF устройства может снизить или даже устранить время, необходимое для осаждения микроносителей перед сбором. В другом воплощении урожай вируса стабилизируется с помощью приемлемого буфера.
В специфическом воплощении урожай вируса стабилизируется путем прибавления концентрированного буфера, включая, но без ограничения, сахароза-фосфатный буфер, который может прибавляться до получения заключительной концентрации приблизительно 218 мМ сахарозы, 11 мМ фосфатного буфера при рН 7,0-7,4 в стабилизированном урожае вируса.
В другом специфическом воплощении этап сбора культурально и среды, содержащей реплицированный вирус, соединяют с очисткой реплицированных вирусов. Например, попеременный тангенциальный поток (ATF) может использоваться для сбора культуральной среды, содержащей реплицированный вирус, и собранный материал может непосредственно подвергаться одному или более этапам очистки, подробно описанным ниже.
6.5 Очистка вакцинного материала
Настоящее изобретение обеспечивает эффективные способы для очистки вирусов, в частности, живых вирусов для клинического применения, которые были реплицированы в культуре клеток. Способы очистки в соответствии с изобретением могут использоваться для очистки вирусов от культур клеток млекопитающих, включая, но без ограничения, диплоидные линии клеток легочных фибробластов человека (например, MRC-5 и WI-38), линии клеток ретинобластомы человека, линии клеток почки человека (например, PER.C6 и 293), линии клеток легких резусных эмбрионов (например, FRhL2), линии клеток почки африканских зеленых мартышек (например, Vero), и линии клеток почки собаки (например, MDCK). Способы очистки в соответствии с изобретением обеспечивают высокий общий выход вируса, в частности живого вируса, и приводят к получению уровней ДНК хозяйских клеток (HCD), белка хозяйских клеток (НСР) и неспецифической эндонуклеазы (например, бензоназы), которые являются ниже параметров, которые требуются органами государственного регулирования.
Снижение количества HCD в вирусных препаратах является особенно важным для тех вирусов, которые являются предназначенными для клинического применения у животных (включая людей). Кроме того, предполагается, что размер остаточного HCD должен быть меньшим, чем средний размер онкогена (1925 пар оснований) для снижения онкогенного потенциала. В соответствии с этим в одном аспекте настоящее изобретение обеспечивает способы для очистки вирусов гриппа или RSV, которые снижают количество и размер любых остаточных HCD до уровней, которые являются более низкими, чем приемлемые для вакцин, которые вводятся путем инъекции (рекомендации ВОЗ составляют 10 нг на дозу парентерально вводимой вакцины; Griffiths, 1999, Dev Biol Stand. Basel, Karger, том 98, стр.153-157.).
В некоторых воплощениях очищенные вирусы включают менее чем приблизительно 10 нг HCD/доза, или менее чем приблизительно 9 нг HCD/доза, или менее чем приблизительно 8 нг HCD/доза, или менее чем приблизительно 7 нг HCD/доза, или менее чем приблизительно 6 нг HCD/доза, или менее чем приблизительно 5 нг HCD/доза, или менее чем приблизительно 4 нг HCD/доза, или менее чем приблизительно 3 нг HCD/доза, или менее чем приблизительно 2 нг HCD/доза, или менее чем приблизительно 1 нг HCD/доза, или менее чем приблизительно 0,8 нг HCD/доза, или менее чем приблизительно 0,6 нг HCD/доза, или менее чем приблизительно 0,4 нг HCD/доза, или менее чем приблизительно 0,2 нг HCD/доза. В специфическом воплощении очищенные вирусы включают менее чем приблизительно 1 нг HCD/доза, или менее чем приблизительно 0,8 нг HCD/доза, или менее чем приблизительно 0,6 нг HCD/доза, или менее чем приблизительно 0,4 нг HCD/доза, или менее чем приблизительно 0,2 нг HCD/доза.
В других воплощениях очищенные вирусы представляют собой вирусы гриппа и включают менее чем приблизительно 10 нг HCD/7,0±0,5 log10 БОЕ, или менее чем приблизительно 9 нг HCD/7,0±0,5 log10 БОЕ, или менее чем приблизительно 8 нг HCD/7,0±0,5 log10 БОЕ, или менее чем приблизительно 7 нг HCD/7,0±0,5 log10 БОЕ, или менее чем приблизительно 6 нг HCD/7,0±0,5 log10 БОЕ, или менее чем приблизительно 5 нг HCD/7,0±0,5 log10 БОЕ, или менее чем приблизительно 4 нг HCD/7,0±0,5 log10 БОЕ, или менее чем приблизительно 3 нг HCD/7,0±0,5 log10 БОЕ, или менее чем приблизительно 2 нг HCD/7,0±0,5 log10 БОЕ, или менее чем приблизительно 1 нг HCD/7,0±0,5 log10 БОЕ, или менее чем приблизительно 0,8 нг HCD/7,0±0,5 log10 БОЕ, или менее чем приблизительно 0,6 нг HCD/7,0±0,5 log10 БОЕ, или менее чем приблизительно 0,4 нг HCD/7,0±0,5 log10 БОЕ, или менее чем приблизительно 0,2 нг HCD/7,0±0,5 log10 БОЕ. В специфическом воплощении очищенные вирусы включают менее чем приблизительно 1 нг HCD/7,0±0,5 log10 БОЕ, или менее чем приблизительно 0,8 нг HCD/7,0±0,5 log10 БОЕ, или менее чем приблизительно 0,6 нг HCD/7,0±0,5 log10 БОЕ, или менее чем приблизительно 0,4 нг HCD/7,0±0,5 log10 БОЕ, или менее чем приблизительно 0,2 нг HCD/7,0±0,5 log10 БОЕ.
В одном воплощении количество HCD определяют при использовании анализа PicoGreen. В другом воплощении количество HCD определяют при использовании ПЦР с обратной транскриптазой (rtPCR). Эти анализы могут осуществляться при использовании способов, приведенных в Примерах, которые обеспечиваются в Разделе 8.6.
В некоторых воплощениях, по крайней мере, приблизительно 50%, или по крайней мере, приблизительно 60%, или по крайней мере, приблизительно 70%, или по крайней мере, приблизительно 80% HCD, присутствующего в очищенных вирусах, имеет размер менее чем приблизительно 1000 пар оснований (п.о.) в длину. В специфическом воплощении, по крайней мере, приблизительно 80% HCD, присутствующего в очищенных вирусах, имеет размер менее чем приблизительно 1000 п.о. в длину. В другом специфическом воплощении приблизительно 90% oHCD, присутствующего в очищенных вирусах, имеет размер менее чем приблизительно 1000 п.о. в длину. В других воплощениях по крайней мере, приблизительно 40%, или по крайней мере, приблизительно 50%, или по крайней мере, приблизительно 60%, или по крайней мере, приблизительно 70%, или по крайней мере, приблизительно 80% HCD, присутствующего в очищенных вирусах, имеет размер менее чем приблизительно 500 п.о. в длину. В специфическом воплощении, по крайней мере, приблизительно 60% HCD, присутствующего в очищенных вирусах, имеет размер менее чем приблизительно 500 п.о. в длину.
В некоторых воплощениях очищенные вирусы включают менее чем приблизительно 10 мкг НСР/доза, или менее чем приблизительно 9 мкг НСР/доза, или менее чем приблизительно 8 мкг НСР/доза, или менее чем приблизительно 7 мкг НСР/доза, или менее чем приблизительно 6 мкг НСР/доза, или менее чем приблизительно 5 мкг НСР/доза, или менее чем приблизительно 4 мкг НСР/доза, или менее чем приблизительно 3 мкг НСР/доза, или менее чем приблизительно 2 мкг НСР/доза, или менее чем приблизительно 1 мкг НСР/доза, или менее чем приблизительно 0,8 мкг НСР/доза, или менее чем приблизительно 0,6 мкг НСР/доза, или менее чем приблизительно 0,4 мкг НСР/доза, или менее чем приблизительно 0,2 мкг НСР/доза. В специфическом воплощении очищенные вирусы включают менее чем приблизительно 1 нг НСР/доза, или менее чем приблизительно 0,8 мкг НСР/доза, или менее чем приблизительно 0,6 мкг НСР/доза, или менее чем приблизительно 0,4 мкг НСР/доза, или менее чем приблизительно 0,2 мкг НСР/доза.
В других воплощениях очищенные вирусы представляют собой вирусы гриппа и включают менее чем приблизительно 10 мкг НСР/7,0±0,5 log10 БОЕ, или менее чем приблизительно 9 мкг НСР/7,0±0,5 log10 БОЕ, или менее чем приблизительно 8 мкг НСР/7,0±0,5 log10 БОЕ, или менее чем приблизительно 7 мкг НСР/7,0±0,5 log10 БОЕ, или менее чем приблизительно 6 мкг НСР/7,0±0,5 log10 БОЕ, или менее чем приблизительно 5 мкг НСР/7,0±0,5 log10 БОЕ, или менее чем приблизительно 4 мкг НСР/7,0±0,5 log10 БОЕ, или менее чем приблизительно 3 мкг НСР/7,0±0,5 log10 БОЕ, или менее чем приблизительно 2 мкг НСР/7,0±0,5 log10 БОЕ, или менее чем приблизительно 1 мкг НСР/7,0±0,5 log10 БОЕ, или менее чем приблизительно 0,8 мкг НСР/7,0±0,5 log10 БОЕ, или менее чем приблизительно 0,6 мкг НСР/7,0±0,5 log10 БОЕ, или менее чем приблизительно 0,4 мкг НСР/7,0±0,5 log10 БОЕ, или менее чем приблизительно 0,2 мкг НСР/7,0±0,5 log10 БОЕ. В специфическом воплощении очищенные вирусы включают менее чем приблизительно 1 нг НСР/7,0±0,5 log10 БОЕ, или менее чем приблизительно 0,8 мкг НСР/7,0±0,5 log10 БОЕ, или менее чем приблизительно 0,6 мкг НСР/7,0±0,5 log10 БОЕ, или менее чем приблизительно 0,4 мкг НСР/7,0±0,5 log10 БОЕ, или менее чем приблизительно 0,2 мкг НСР/7,0±0,5 log10 БОЕ.
В одном воплощении количество НСР определяют с помощью твердофазного иммуноферментного анализа (ELISA) при использовании антитела против НСР для определения. Этот анализ может осуществляться при использовании способов, приведенных в Примерах, которые обеспечиваются в Разделе 8.6.
Способы для получения частиц неактивного/дезинтегрированного вируса для вакцинных композиций являются хорошо известными в области техники и используются на протяжении 40 лет. Однако эти способы включают агрессивные этапы, такие как обработка с помощью детергентов на основе формальдегида, которые не могут использоваться для получения частиц интактного вируса в общем случае, и живых аттенуированных вирусов, в частности. В соответствии с этим, настоящее изобретение обеспечивает способы для очистки живых интактных вирусов (например, вирусов гриппа или RSV), использующие мембраны и условия для соответствующего отделения HCD и НСР от выделенного вируса. Способы настоящего изобретения обеспечивают высокий средний выход живого вируса. В одном воплощении средний выход очищенных вирусов составляет, по крайней мере, 15%, или по крайней мере, 20%, или по крайней мере, 25%, или по крайней мере, 30%, или по крайней мере, 40%, или по крайней мере, 50%, или по крайней мере, 60%, или по крайней мере, 70%. Способы для мониторинга выхода очищенного живого вируса включают анализы, предназначенные для измерения вирусной инфекции и/или роста. Например, флуоресцентные анализы бляшкообразования и анализы средней инфекционной дозы культуры ткани (ТСID50) могут использоваться для мониторинга выхода очищенного живого вируса гриппа. В некоторых воплощениях способ очистки вирусов в соответствии с настоящим изобретением обеспечивает средний выход вирусов, по крайней мере, 30%, где очищенные вирусы включают менее чем 0,1 нг HCD, и менее чем 0,3 мкг НСР, и менее чем 0,0050 нг неспецифической нуклеазы на 7,0±0,5 log10 БОЕ вируса.
Очистка полученного вируса включает множество этапов, которые могут оптимизироваться в зависимости от вируса и условий очистки. В некоторых воплощениях процесс очистки может включать любой из следующих, самостоятельно или в комбинации: а) осветление вирусного препарата; b) концентрация и/или замена буфера; с) очистка путем хроматографии и d) стерилизующее фильтрование. Эти этапы могут включать дополнительные этапы, такие как обработка неспецифической эндонуклеазой и стабилизация вирусного урожая или вирусной загрузки. Эти этапы могут осуществляться многократно в процессе очистки и в порядке, который максимизирует получение вируса при адекватном удалении НСР и HCD, как описывается выше.
Способы, полезные для осветления вирусного препарата, включают, но без ограничения, центрифугирование, диализ, мембранную фильтрацию, которая включает, но без ограничения, способы, такие как однократное пропускание, остановку без повторного пропускания, фильтрацию прямого потока (DFF), при которой жидкость протекает непосредственно через фильтровальную среду, и фильтрование при использовании перекрестного потока или фильтрование тангенциального потока (TFF), при котором жидкость течет тангенциально (вдоль) поверхности мембраны. TFF системы могут разгоняться так, чтобы поддерживать постоянное значение скорости истечения фильтрата (часто называется просто "истечение" и которое может измеряться в литрах фильтрата на квадратный метр мембраны в час (LMH)) или для поддержания постоянного трансмембранного давления (используется сокращение "ТМР", которое может измеряться фунтами на квадратный дюйм (psi)). Однако, как константа истечения, так и ТМР, могут регулироваться для предотвращения засорения мембраны. Мембраны для применения при фильтрации являются доступными из коммерческих источников.
В области техники существует четыре общепринятые категории мембран, которые определяются размером и материалом, который они удаляют из жидкости-носителя. Они могут представлять собой, в зависимости от самого меньшего до самого большого размера пор, мембраны обратного осмоса, нанофильтрационные мембраны, ультрафильтрационные мембраны, и микрофильтрационные мембраны. Фильтрование с помощью указанных выше мембран разделяет молекулы в соответствии с их молекулярным весом при использовании мембран с указанным размером пор. Например, разделение при использовании мембран обратного осмоса, которые имеют размеры пор менее чем 0,001 микрометров, предназначается для разделения молекул, которые имеют молекулярный вес менее чем 200 дальтон. Фильтрование с помощью нанофильтрационных мембран, которые имеют размер пор от 0,001 до 0,008 микрометров, включительно, предназначено для отделения молекул, которые имеют молекулярный вес от 200 дальтон до 15 килодальтон (кДа) включительно. Фильтрование при использовании ультрафильтрационных мембран, которые имеют размер пор 0,005-0,1 микрометров, включительно, предназначено для отделения молекул, которые имеют молекулярный вес от 5 кДа до 300 кДа, включительно. Фильтрование при использовании микрофильтрационных мембран, которые имеют размер пор 0,05-3,0 микрометров, включительно, предназначено для отделения молекул, которые имеют молекулярный вес от 100 кДа до 3000 кДа и более. В соответствии с этим, мембранная фильтрация может отделять молекулы, представляющие интерес (например, вирусы), от клеточных компонентов на основе исключения размера при использовании мембран, которые обладают способностью отсекать определенный молекулярный вес (MWCO), что определяется размером пор мембраны. MWCO, которое также называется наименьшей границей молекулярного веса (NMWL) или наименьшим отсечением молекулярного веса (NMWCO), представляет собой указание размера в килодальтонах для фильтрации с помощью мембран. MWCO определяется как молекулярный вес молекулы, которая на 90% удерживается мембраной. Поскольку, например, молекулы с одним и тем же молекулярным весом могут обладать значительно различающимися формами, MWCO не является точным показателем, но тем не менее представляет собой полезный показатель и обычно используется производителями фильтров. Мембраны могут использоваться в виде листовых материалов или в навивной конфигурации. Пористое волокно может также использоваться в зависимости от способа фильтрации. Могут использоваться любые мембранные материалы, включая, но без ограничения, регенерированную целлюлозу, полиэфирсульфоны (которые могут быть немодифицированными или модифицированными с целью изменения присущей им гидрофобности), поливинилиденфторид (PVDF) и агрегаты керамики и окисей металлов, а также поликарбонат, полипропилен, полиэтилен и PTFE (TEFLON®). Предполагается, что могут использоваться комбинации способов фильтрования и типы мембран при разделении и что способность этих фильтров, колонок и т.д., включающих мембраны для разделения, будет подвергаться доводке в зависимости от объема и/или концентрации материала, который подвергается обработке.
Способы, полезные для концентрирования и/или замены буфера, включают, но без ограничения, диализ, ультрацентрифугирование (UF) и диафильтрацию (DF). TFF может включать как UF, которое может использоваться для концентрирования, так и DF, которая может использоваться для замены буферов. Кроме того, применение UF и/или DF может приводить к дополнительной очистке с помощью фракционного процесса, который вымывает более мелкие молекулы, которые могут быть контаминантами, через мембрану и оставляет молекулы большего размера, представляющие интерес, в ретентате. В соответствии с этим, TFF, включающий UF и/или DF, может использоваться для концентрирования и/или замены буферов и/или очистки. Выбор мембран для применения при фильтровании был описан ранее. В соответствии с изобретением DF может быть либо прерывистой, либо беспрерывной DF. В прерывистой DF раствор концентрируется, и потерянный объем заменяется новым буфером. В беспрерывной DF объем раствора поддерживается путем подачи нового буферного раствора, в то время как старый буферный раствор удаляется.
В некоторых воплощениях осветленный препарат вируса концентрируют до приблизительно 2Х, или приблизительно 3Х, или приблизительно 4Х, или приблизительно 5Х, или приблизительно 6Х, или приблизительно 7Х, или приблизительно 8Х, или приблизительно 9Х, или приблизительно 10Х, или более, где "X" равняется общему исходному объему, который прибавляется к рабочему/заключительному объему ретентата. В специфическом воплощении осветленный препарат вируса концентрируется от приблизительно 3Х до приблизительно 5Х. В другом специфическом воплощении осветленный препарат вируса концентрируется приблизительно 4Х, где "X" равняется общему исходному объему, который прибавляется к рабочему/заключительному объему ретентата. В некоторых воплощениях осветленный препарат вируса концентрируется приблизительно 10Х или более для повышения загрузки всех последующих этапов очистки. В некоторых воплощениях следующая концентрация, составляющая приблизительно 1 диаобъем, или приблизительно 2 диаобъема, или приблизительно 3 диаобъема, или приблизительно 4 диаобъема, или приблизительно 5 диаобъемов, или приблизительно 6 диаобъемов, или приблизительно 7 диаобъемов, или приблизительно 8 диаобъемов, или приблизительно 9 диаобъемов, или приблизительно 10 диаобъемов, или более диаобъемов буфера заменяется с помощью DF, где диаобъем представляет собой общий объем буфера, введенный в процесс во время DF/объем ретентата. В специфическом воплощении от приблизительно 4 диаобъемов до приблизительно 6 диаобъемов буфера заменяется, где диаобъем представляет собой общий объем буфера, введенного в процесс во время DF/объем ретентата. В другом специфическом воплощении приблизительно 5 диаобъемов буфера заменяется, где диаобъем представляет собой общий объем буфера, введенного в процесс во время DF/объем ретентата.
В некоторых воплощениях ретентат, включающий вирусы (например, гриппа, RSV), собирают после того, как заменяется желаемый объем буфера. После сбора ретентата некоторые вирусы могут оставаться слабо связанными с мембраной. В соответствии с этим, в некоторых воплощениях мембрану промывают дополнительным буфером обмена, который прибавляют к собранному ретентату. Собранный ретентат также называется в данной заявке "кондиционной вирусной загрузкой" или как "#XUF #XDF", где "#" указывает либо кратность концентрации, либо количество диаобъемов обменного буфера для UF и DF процессов соответственно. В специфическом воплощении мембрана с 500 кДа MWCO используется для концентрации и замены буфера. В некоторых воплощениях мембрана может очищаться после процесса и использоваться повторно. В других воплощениях новая мембрана используется для каждой партии осветленного вируса. В другом специфическом воплощении осветленный препарат концентрируется и буфер заменяют так, как описано в Примерах, которые обеспечиваются в Разделах 8.6 и др.
Типы хроматографии, полезные для очистки вирусов (например, гриппа или RSV), включают, но без ограничения, аффинную хроматографию, а также ионообменную хроматографию и/или хроматографию при использовании гидроксиапатита. В некоторых воплощениях используется ионообменная хроматография. В одном воплощении используется катионообменная хроматография. В другом воплощении катионообменную хроматографию осуществляют при высоком значении рН. В одном воплощении используется анионообменная хроматография. В специфическом воплощении используется сильный анионообменник на основе четвертичного аммония (Q) (например, Capto™ Q, GE Healthcare). В другом воплощении анионообменную хроматографию осуществляют при низком значении рН. Анионная среда, полезная для ионообменной хроматографии, включает, но без ограничения, анионные мембранные адсорбенты (например, Sartobind® Q15, D15) и катионные мембранные адсорбенты (например, Sartobind® S15 и С15). В другом воплощении используется негативная хроматография, где загрязняющие агенты связываются при использовании анионного или катионного обмена, и вирус последовательно отделяют или очищают от загрязняющих веществ, таких как белок и/или нуклеиновая кислота хозяйской клетки. Предполагается, что хроматография может осуществляться в периодическом процессе или, альтернативно, при использовании колоночного процесса. В некоторых воплощениях кондиционную вирусную загрузку очищают с помощью колоночной хроматографии.
Способы, полезные для эффективного удаления контаминирующих HCD, включают, наряду с другими этапами процесса очистки, обработку неспецифической эндонуклазой (например, Бензоназой®). Однако для тех вирусов, которые являются предназначенными для клинического применения у животных (включая людей), является желательным, чтобы количество неспецифической эндонуклеазы в заключительном очищенном препарате вируса было минимальным. В соответствии с этим в другом аспекте настоящее изобретение обеспечивает способы для очистки вирусов, которые снижают количество какой-либо остаточной неспецифической эндонуклеазы, используемой в способе, до уровней ниже, чем те, которые являются приемлемыми для инъецируемых вакцин.
В одном воплощении очищенные вирусы включают менее чем приблизительно 0,0060 нг, или менее чем приблизительно 0,0055 нг, или менее чем приблизительно 0,0050 нг, или менее чем приблизительно 0,0045 нг, или менее чем приблизительно 0,0040 нг, или менее чем приблизительно 0,0035 нг, или менее чем приблизительно 0,0030 нг, или менее чем приблизительно 0,0025 нг, или менее чем приблизительно 0,0020 нг, или менее чем приблизительно 0,0015 нг, или менее чем приблизительно 0,0010 нг, или менее неспецифической эндонуклеазы на дозу. В специфическом воплощении очищенные вирусы включают менее чем приблизительно 0,0040 нг, или менее чем приблизительно 0,0035 нг, или менее чем приблизительно 0,0030 нг, или менее чем приблизительно 0,0025 нг неспецифической эндонуклеазы на дозу.
В других воплощениях очищенные вирусы представляют собой вирусы гриппа или RSV и включают менее чем приблизительно 0,0060 нг, или менее чем приблизительно 0,0055 нг, или менее чем приблизительно 0,0050 нг, или менее чем приблизительно 0,0045 нг, или менее чем приблизительно 0,0040 нг, или менее чем приблизительно 0,0035 нг, или менее чем приблизительно 0,0030 нг, или менее чем приблизительно 0,0025 нг, или менее чем приблизительно 0,0020 нг, или менее чем приблизительно 0,0015 нг, или менее чем приблизительно 0,0010 нг, или менее неспецифической эндонуклеазы на 7,0±0,5 log10 БОЕ. В специфическом воплощении очищенные вирусы представляют собой вирусы гриппа или RSV и включают менее чем приблизительно 0,0040 нг, или менее чем приблизительно 0,0035 нг, или менее чем приблизительно 0,0030 нг, или менее чем приблизительно 0,0025 нг неспецифической эндонуклеазы на 7,0±0,5 log10 БОЕ. В другом специфическом воплощении очищенные вирусы представляют собой RSV и включают менее чем приблизительно 0,0040 нг, или менее чем приблизительно 0,0035 нг, или менее чем приблизительно 0,0030 нг, или менее чем приблизительно 0,0025 нг неспецифической эндонуклеазы на 5,0±0,5 log10 БОЕ. Еще в одном специфическом воплощении неспецифическая эндонуклеаза представляет собой Бензоназу.
Стерильность представляет собой предмет особой важности для тех вирусов и/или вирусных компонентов, которые являются предназначенными для клинического применения у животных (включая людей). В соответствии с этим, способы для очистки вирусов (например, вируса гриппа или RSV) настоящего изобретения включают стерилизацию, которая может осуществляться как заключительный этап фильтрования (например, для RSV) или при использовании известных способов стерилизации (например, для вируса гриппа). Способы, полезные для стерилизации вакцинных компонентов (например, вирусов, устройств для доставки т.д.), включают, но без ограничения, облучение, фильтрацию, химическую обработку и другие приемлемые процедуры. В одном воплощении рецептированную партию вируса подвергают стерилизации путем фильтрования. Способы фильтрования, полезные для стерилизации, включают, но без ограничения, однократное пропускание, заключительное пропускание, фильтрование прямого потока (DFF) и фильтрование тангенциального потока (TFF), которые были описаны выше. Однако по причине хрупкости RSV этот вирус не может подвергаться стерилизации при использовании ступенчатого фильтра для стерилизации. Таким образом, в одном воплощении RSV подвергают стерилизации как часть этапа заключительного фильтрования во время процесса очистки, описанного в данной заявке.
В данной заявке обеспечиваются специфические способы для очистки вируса гриппа и RSV для вакцинной композиции.
6.5.1 Очистка вируса гриппа
В некоторых воплощениях вирусы, которые подвергают очистке, представляют собой вирусы гриппа (например, адаптированные к холоду, и/или чувствительные к температуре, и/или аттенуированные).
В одном воплощении способ очистки вирусов из культуры клеток включает следующие этапы:
(a) осветление вирусного урожая;
(b) концентрацию и/или замену буфера после этапа (а);
(c) очистку путем хроматографии после этапа (b);
(d) концентрацию и/или замену буфера после этапа (с); и
(e) стерилизацию после этапа (d).
В одном воплощении вирусы представляют собой вирусы гриппа. В специфическом воплощении вирусы гриппа представляют собой адаптированные к холоду, и/или чувствительные к температуре, и/или аттенуированные вирусы гриппа.
В специфическом воплощении этапы (а), (b), (d) и (е) осуществляют с помощью мембраной фильтрации. В другом специфическом воплощении этапы (b) и (d) осуществляют путем фильтрации тангенциального потока. Еще в одном специфическом воплощении этапы (а) и (е) осуществляют путем фильтрации прямого потока. Еще в одном специфическом воплощении этап (b) включает как концентрацию путем ультрафильтрации, так и замену буфера путем диафильтрации. Еще в одном специфическом воплощении этап (d) включает только концентрацию. Дополнительные воплощения способа очистки вирусов подробно описаны выше.
В одном специфическом воплощении этап (с) осуществляют путем аффинной колоночной хроматографии. В другом специфическом воплощении этап (с) дополнительно включает обработку с помощью неспецифической нуклеазы.
Как описывается ниже, вирусы, полученные из культуры клеток, могут быть стабилизированы (например, путем прибавления фосфата сахарозы (SP)) после сбора. В соответствии с этим, способы очистки настоящего изобретения охватывают осветление стабилизированного вирусного урожая. Альтернативно, этапы сбора и осветления могут быть объединены. Например, ATF может использоваться для сбора культуры клеток реплицированного вируса и подачи вирусного урожая непосредственно в среду и/или может использоваться устройство для осветления вируса.
Например, сырьевая среда, полученная из инфицированных культур, может сначала осветляться с помощью центрифугирования, например, при 1000-2000 × g в течение времени, достаточного для удаления клеточного дебриса и других веществ в виде частиц, например, от 10 до 30 минут. Альтернативно, среду фильтруют через полупроницаемую мембрану с определенным интервалом размера пор, достаточно большим для того, чтобы пропускать вирус при задержании интактных клеток и других веществ в виде частиц.
В одном воплощении вирусный урожай осветляют с помощью DFF и/или TFF при использовании MF мембраны, которая имеет размер пор, достаточно большой для того, чтобы вирус мог проходить через нее, однако достаточно малый для того, чтобы удерживать интактные клетки и клеточный дебрис. В одном воплощении вирусный урожай осветляют с помощью DFF и/или TFF через, по крайней мере, одну мембрану, которая имеет размер пор приблизительно 1,2 микрометров или менее. В специфическом воплощении вирусный урожай осветляют с помощью DFF через, по крайней мере, одну мембрану, которая имеет размер пор от приблизительно 1,2 микрометров до приблизительно 0,45 микрометров. В другом специфическом воплощении вирусный урожай осветляют с помощью DFF через первую мембрану, которая имеет размер пор 1,2 микрометров, и вторую мембрану, которая имеет размер пор 0,45 микрометров. В некоторых воплощениях используют мембраны из полипропилена и/или PVDF. Еще в одном специфическом воплощении вирусный урожай осветляют с помощью DFF, как описывается в Примере, который обеспечивается в Разделе 8.6. Еще в одном специфическом воплощении сбор культуры клеток с реплицированным вирусом сочетают с этапом DFF. Например, культуры клеток с реплицированным вирусом собирают и применяют непосредственно к среде и устройству, которое используется для DFF. Сочетание этапов сбора и очистки снижает количество манипуляций, обеспечивает возможность устранения необходимости резервуара для сбора и снижает общее время обработки.
В одном воплощении осветленный урожай концентрируется и/или заменяется буфер. В одном воплощении концентрацию и/или замену буфера осуществляют с помощью UF и DF. В другом воплощении TFF используется как для UF, так и для DF. Еще в одном воплощении сбор культуры клеток с реплицированным вирусом сочетают с этапом DFF, который соединяют с TFF этапом. Сочетание этапов сбора, осветления и концентрации/замены буфера снижает количество манипуляций и снижает общее время обработки. В некоторых воплощениях TFF осуществляют так, чтобы поддержать постоянную скорость пропускания фильтрата. В других воплощениях TFF осуществляют так, чтобы поддержать постоянным значение ТМР. В некоторых воплощениях осветленный вирус сначала концентрируют с помощью UF, а потом буфер заменяют с помощью DF. В некоторых воплощениях осветленный вирус концентрируется приблизительно 2Х, или приблизительно 3Х, или приблизительно 4Х, или приблизительно 5Х, или приблизительно 6Х, или приблизительно 7Х, или приблизительно 8Х, или приблизительно 9Х, или приблизительно 10Х, или более, где "X" является равным общему исходному объему, который прибавляется к рабочему/заключительному объему ретентата. В специфическом воплощении осветленный вирус концентрируется от приблизительно 3Х до приблизительно 5Х. В другом специфическом воплощении осветленный вирус концентрируется приблизительно 4Х, где "X" является равным общему исходному объему, который прибавляется к рабочему/заключительному объему ретентата. В некоторых воплощениях осветленный вирус концентрируется приблизительно 10Х или более для повышения нагрузки всех последующих этапов очистки. В некоторых воплощениях следующая концентрация, которая составляет приблизительно 1 диаобъема, или приблизительно 2 диаобъема, или приблизительно 3 диаобъема, или приблизительно 4 диаобъема, или приблизительно 5 диаобъемов, или приблизительно 6 диаобъемов, или приблизительно 7 диаобъемов, или приблизительно 8 диаобъемов, или приблизительно 9 диаобъемов, или приблизительно 10 диаобъемов, или более диаобъемой буфера, заменяется с помощью DF, где диаобъем представляет собой общий объем буфера, который является введенным в процесс во время DF/объем ретентата. В специфическом воплощении заменяют от приблизительно 4 диаобъемов до приблизительно 6 диаобъемов буфера, где диаобъем представляет собой общий объем буфера, который является введенным в процесс во время DF/объем ретентата. В другом специфическом воплощении заменяют от приблизительно 5 диаобъемов буфера, где диаобъем представляет собой общий объем буфера, который является введенным в процесс во время DF/объем ретентата. Предполагается, что буфер обмена может быть таким же или отличаться от присутствующего в вирусном урожае. В одном воплощении буфер обмена представляет собой SP буфер при нейтральном значении рН. В специфическом воплощении буфер обмена включает (в пределах 10% вариации одного или более компонентов) 218 мМ сахарозы, 11 мМ фосфатного буфера рН 7,0-7,4. В другом специфическом воплощении буфер обмена состоит из (в пределах 10% вариации одного или более компонентов) 218 мМ сахарозы, 11 мМ фосфатного буфера, рН 7,0-7,4. В некоторых воплощениях ретентат, включающий вирусы (например, вирусы гриппа), собирают после замены желаемого объема буфера. После сбора ретентата некоторое количество вирусов может оставаться слабо связанным с мембраной. В соответствии с этим, в некоторых воплощениях мембрану промывают с помощью дополнительного буфера обмена, который прибавляют к собранному ретентату. Собранный ретентат также называют в данной заявке как "кондиционированная вирусная загрузка" или как "#XUF #XDF", где "#" означает либо кратность концентрации, либо количество диаобъемов замененного буфера для UF и DF процессов, соответственно. В специфическом воплощении мембрана с 500 кДа MWCO используется для концентрации и замены буфера. В некоторых воплощениях мембрана может очищаться после процесса и использоваться повторно. В других воплощениях новая мембрана используется для каждой партии очищенного вируса. В другом специфическом воплощении осветленный урожай концентрируется и буфер подвергается замене так, как приведено в Примерах, которые обеспечиваются в Разделах 8.6 и других.
В некоторых воплощениях кондиционированную вирусную загрузку очищают путем хроматографии. В некоторых воплощениях кондиционированную вирусную загрузку очищают путем колоночной хроматографии. В некоторых воплощениях кондиционированную вирусную загрузку очищают путем аффинной хроматографии. Являются доступными разнообразные среды для аффинной хроматографии с подобными свойствами разделения, например, многочисленные среды для аффинной хроматографии являются доступными для концентрации и очистки ряда вирусов и вирусных белков, включая, но без ограничения N(п-аминофенил)оксаминовую кислоту агарозу, Целлуфин™ сульфат. Способы, полезные для оценки поведения аффинных лигандов, являются представленными в Примере 8.7. В специфическом воплощении аффинная среда на основе Целлуфин™ сульфата (Chisso Corp.) используется для аффинной хроматографии. В другом воплощении FluSelect™ используется для аффинной хроматографии. Еще в одном воплощении связывающий лиганд аффинной среды включает остаток сульфата. В некоторых воплощениях кондиционированная вирусная загрузка вносится непосредственно в аффинную среду. В некоторых воплощениях несвязанный материал может пропускаться через аффинную среду для того, чтобы способствовать связыванию дополнительных вирусов.
В одном воплощении от приблизительно 109,0 до приблизительно 1011, или от приблизительно 109,2 до приблизительно 109,8, или от приблизительно 109,4 до приблизительно 109,6 вирусных частиц, загружается на мл аффинной среды, в другом воплощении, по крайней мере, приблизительно 109,0, или по крайней мере, приблизительно 10911, или по крайней мере, приблизительно 109,2, или по крайней мере, приблизительно 109,3, или по крайней мере, приблизительно 109,4, или по крайней мере, приблизительно 109,5, или по крайней мере, приблизительно 109,6, или по крайней мере, приблизительно 109,7, или по крайней мере, приблизительно 109,8, или по крайней мере, приблизительно 109,9, или по крайней мере, приблизительно 1010, или по крайней мере, приблизительно 1010,2, или по крайней мере, приблизительно 1010,4, или по крайней мере, приблизительно 1010,6, или по крайней мере, приблизительно 1010,8, или по крайней мере, приблизительно 1011, вирусных частиц, загружается на мл аффинной среды. В некоторых воплощениях вирусные частицы представляют собой живые вирусы. Способы для определения количества живых вирусов в образце являются описанными в данной заявке.
В другом воплощении от приблизительно 9,0 log10 БОЕ до приблизительно 11 log10 БОЕ, или от приблизительно 9,2 log10 БОЕ до приблизительно 9,8 log10 БОЕ, или от приблизительно 9,4 log10 БОЕ до приблизительно 9,6 log10 БОЕ вируса, загружается на мл аффинной среды. В другом воплощении, по крайней мере, приблизительно 9,0 log10 БОЕ, или по крайней мере, приблизительно 9,1 log10 БОЕ, или по крайней мере, приблизительно 9,2 log10 БОЕ, или по крайней мере, приблизительно 9,3 log10 БОЕ, или по крайней мере, приблизительно 9,4 log10 БОЕ, или по крайней мере, приблизительно 9,5 log10 БОЕ, или по крайней мере, приблизительно 9,6 log10 БОЕ, или по крайней мере, приблизительно 9,7 log10 БОЕ, или по крайней мере, приблизительно 9,8 log10 БОЕ, или по крайней мере, приблизительно 9,9 log10 БОЕ, или по крайней мере, приблизительно 10 log10 БОЕ, или по крайней мере, приблизительно 10,1 log10 БОЕ, или по крайней мере, приблизительно 10,2 log10 БОЕ, или по крайней мере, приблизительно 10,3 log10 БОЕ, или по крайней мере, приблизительно 10,4 log10 БОЕ, или по крайней мере, приблизительно 10,5 log10 БОЕ, или по крайней мере, приблизительно 10,6 log10 БОЕ, или по крайней мере, приблизительно 10,7 log10 БОЕ, или по крайней мере, приблизительно 10,8 log10 БОЕ, или по крайней мере, приблизительно 10,9 log10 БОЕ, или по крайней мере, приблизительно 11 log10 БОЕ вируса загружается на мл аффинной среды. В специфическом воплощении используется аффинная среда на основе Целлуфин™ сульфата (Chisso Corp.) и загружается от 9,2 log10 БОЕ до 9,8 log10 БОЕ вируса на мл Целлуфин™ сульфата. В другом специфическом воплощении используется аффинная среда на основе Целлуфин™ сульфата (Chisso Corp.) и загружается от 9,4 log10 БОЕ до 9,6 log10 БОЕ вируса на мл Целлуфин™ сульфата. В другом специфическом воплощении используется аффинная среда на основе Целлуфин™ сульфата (Chisso Corp.) и загружается, по крайней мере, приблизительно 9,4 log10 БОЕ, или по крайней мере, приблизительно 9,5 log10 БОЕ, или по крайней мере, приблизительно 9,6 log10 БОЕ, или по крайней мере, приблизительно 9,7 log10 БОЕ вируса на мл Целлуфин™ сульфата.
В одном воплощении аффинную среду промывают с помощью достаточного объема буфера, в котором вирусы будут оставаться связанными с аффинной средой (например, SP буфер), для удаления несвязанных и слабо связанных контаминантов из аффинной среды. В некоторых воплощениях промывочный буфер включает (в пределах 10% вариации одного или более компонентов) 218 мМ сахарозы, 11 мМ фосфатного буфера рН 7,0-7,4. В другом специфическом воплощении промывочный буфер состоит из (в пределах 10% вариации одного или более компонентов) 218 мМ сахарозы, 11 мМ фосфатного буфера рН 7,0-7,4. В некоторых воплощениях вирусы элюируют из аффинной среды после промывания при использовании достаточного объема буфера, в котором вирусы не будут оставаться связанными с аффинной смолой, элюирования вируса без высвобождения каких-либо контаминантов, связанных с колонкой, и собирают. В некоторых воплощениях буфер для элюирования включает соль. Соли, полезные для элюирования вирусов (например, гриппа) из аффинных колонок, включают хлорид натрия, хлорид калия, хлорид аммония, хлорид магния и хлорид кальция. В общем случае буфер для элюирования применяют к смоле либо в виде градиента либо как этап в интервале концентраций от 0 до 1,0 М. Эффективность используемого катиона и аниона как солей в буфере для элюирования коррелирует с сериями Гофмейстера, где порядок расположения обычно используемых катионов является следующим: 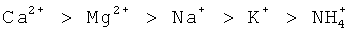 , а порядок расположения эффективности для традиционно используемых анионов является следующим:
, а порядок расположения эффективности для традиционно используемых анионов является следующим: 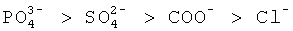 . В одном воплощении буфер для элюирования включает (в пределах 10% увариации) хлорид натрия при заключительной концентрации 1 М. В другом воплощении буфер для элюирования включает (в пределах 10% вариации одного или более компонентов) 1 М хлорида натрия, 218 мМ сахарозы и 11 мМ фосфатного буфера рН 7,0-7,4. Собранный элюированный вирус также называется в данной заявке как "очищенной вирусный элюат." Элюирование вирусов можно подвергать мониторингу путем наблюдения за поглощением ультрафиолетового излучения (UV), в частности, путем наблюдения поглощения при длине волны 280 нанометрах. В некоторых воплощениях кондиционированная вирусная загрузка подвергается очистке с помощью колоночной хроматографии, где наблюдают за элюированием вирусов и собирают специфические фракции, включающие вирусы. Такой подход может быть полезным, когда является желательным минимизировать объем элюированного вируса. В другом специфическом воплощении кондиционированную вирусную загрузку очищают с помощью хроматографии, как представлено в Примере, который обеспечивается в Разделе 8.6.
. В одном воплощении буфер для элюирования включает (в пределах 10% увариации) хлорид натрия при заключительной концентрации 1 М. В другом воплощении буфер для элюирования включает (в пределах 10% вариации одного или более компонентов) 1 М хлорида натрия, 218 мМ сахарозы и 11 мМ фосфатного буфера рН 7,0-7,4. Собранный элюированный вирус также называется в данной заявке как "очищенной вирусный элюат." Элюирование вирусов можно подвергать мониторингу путем наблюдения за поглощением ультрафиолетового излучения (UV), в частности, путем наблюдения поглощения при длине волны 280 нанометрах. В некоторых воплощениях кондиционированная вирусная загрузка подвергается очистке с помощью колоночной хроматографии, где наблюдают за элюированием вирусов и собирают специфические фракции, включающие вирусы. Такой подход может быть полезным, когда является желательным минимизировать объем элюированного вируса. В другом специфическом воплощении кондиционированную вирусную загрузку очищают с помощью хроматографии, как представлено в Примере, который обеспечивается в Разделе 8.6.
В некоторых воплощениях способ очистки вирусов (например, вирусов гриппа) включает обработку с помощью неспецифической эндонуклеазы (например, Бензоназы®). В некоторых воплощениях обработка неспецифической эндонуклеазой осуществляется на ранних этапах очистки вирусов. В одном воплощении обработка неспецифической эндонуклеазой осуществляется после этапа (а), но перед этапом (b). В другом воплощении обработка неспецифической эндонуклеазой осуществляется после этапа (b), но перед этапом (с). Альтернативно, вирус обрабатывается с помощью неспецифической эндонуклеазы во время этапа (с). Преимущества этого подхода являются представленными в Примере, который обеспечивается в Разделе 8.6. В специфическом воплощении кондиционированная вирусная загрузка связывается с аффинной средой и потом подвергается воздействию буфера, включающего неспецифическую эндонуклеазу. В некоторых воплощениях неспецифическая эндонуклеаза является представленной в буфере при концентрации от приблизительно 10 Ед./мл и приблизительно 100 Ед./мл. В других воплощениях неспецифическая эндонуклеаза является представленной в буфере при концентрации от приблизительно 40 Ед./мл до приблизительно 60 Ед./мл. В одном воплощении неспецифическая эндонуклеаза является представленной в буфере, включающем сахарозу. В специфическом воплощении неспецифическая эндонуклеаза является представленной в буфере, включающем 218 мМ сахарозы, 11 мМ фосфатного буфера рН 7,0-7,4. В другом специфическом воплощении присутствует специфическая эндонуклеаза при заключительной концентрации от приблизительно 40 Ед./мл до приблизительно 60 Ед./мл, в буфере, который сосоит из (в пределах 10% вариации одного или более компонентов) 218 мМ сахарозы, 11 мМ фосфатного буфера рН 7,0-7,4. В некоторых воплощениях загрузку и условия промывания доводят для обеспечения того, чтобы связанный вирус подвергался воздействию неспецифической эндонуклеазы в течение от приблизительно 10 минут до приблизительно 120 минут. В одном воплощении загрузку и условия промывания доводят для обеспечения того, чтобы связанный вирус подвергался воздействию неспецифической эндонуклеазы в течение от приблизительно 40 минут до приблизительно 80 минут. Еще в других воплощениях загрузку и условия промывания доводят для обеспечения того, чтобы связанный вирус подвергался воздействию неспецифической эндонуклеазы в течение, по крайней мере, 10 минут, или по крайней мере, 20 минут, или по крайней мере, 30 минут, или по крайней мере, 40 минут, или по крайней мере, 50 минут, или по крайней мере, 60 минут, или по крайней мере, 70 минут, или по крайней мере, 80 минут, или по крайней мере, 90 минут, или по крайней мере, 100 минут, или по крайней мере, минут, или по крайней мере, 110 минут, или по крайней мере, 120 минут. В некоторых аспектах в соответствии с изобретением доводят время воздействия неспецифической эндонуклеазы, концентрацию неспецифической эндонуклеазы и объем буфера, содержащего неспецифическую эндонуклеазу. Например, для минимизации времени, необходимого для расщепления ДНК контаминантов, концентрация неспецифической эндонуклеазы может быть увеличена; альтернативно, для минимизации количества используемой неспецифической эндонуклеазы время воздействия может быть увеличено. После обработки с помощью неспецифической эндонуклеазы может быть желательным промыть аффинную среду с помощью достаточного объема буфера, в котором вирусы будут оставаться связанными с аффинной средой (например, SP буфера) для удаления остатка контаминантов расщепленной ДНК. В соответствии с этим, в некоторых воплощениях аффинную смолу промывают так, как описывается ниже, перед и/или после обработки с помощью неспецифической эндонуклеазы. В другом специфическом воплощении неспецифическая эндонуклеаза представляет собой Бензоназу®. Еще в одном специфическом воплощении кондиционированная вирусная загрузка обрабатывается с помощью Бензоназы® одновременно с очисткой с помощью аффинной хроматографии, как представлено в Примере, который обеспечивается в Разделе 8.6.
В одном воплощении очищенные вирусы гриппа включают менее чем приблизительно 0,0060 нг, или менее чем приблизительно 0,0055 нг, или менее чем приблизительно 0,0050 нг, или менее чем приблизительно 0,0045 нг, или менее чем приблизительно 0,0040 нг, или менее чем приблизительно 0,0035 нг, или менее чем приблизительно 0,0030 нг, или менее чем приблизительно 0,0025 нг, или менее чем приблизительно 0,0020 нг, или менее чем приблизительно 0,0015 нг, или менее чем приблизительно 0,0010 нг, или менее неспецифической эндонуклеазы на 7,0±0,5 log10 БОЕ. В специфическом воплощении очищенные вирусы гриппа включают менее чем приблизительно 0,0040 нг, или менее чем приблизительно 0,0035 нг, или менее чем приблизительно 0,0030 нг, или менее чем приблизительно 0,0025 нг неспецифической эндонуклеазы на 7,0±0,5 log10 БОЕ. В другом специфическом воплощении неспецифическая эндонуклеаза представляет собой Бензоназу®. В некоторых аспектах в соответствии с изобретением после очистки путем хроматографии очищенный вирусный элюат концентрируется и/или буфер заменяется. Способы, полезные для концентрирования и/или замены буфера, были описаны выше. В некоторых воплощениях буфер очищенного вирусного элюата заменяют при использовании DF. В одном воплощении более, чем приблизительно 5 диаобъемов буфера заменяется с помощью DF, где диаобъем представляет собой общий объем буфера, введенного в процесс во время DF/объем ретентата. Преимущества замены более, чем приблизительно 5 диаобъемов подробно описываются в примере, который обеспечивается в Разделе 8.6. В другом воплощении приблизительно 6 диаобъемов, или приблизительно 7 диаобъемов, или приблизительно 8 диаобъемов, или приблизительно 9 диаобъемов или приблизительно 10 диаобъемов, или более диаобъемов буфера заменяется с помощью DF, где диаобъем представляет собой общий объем буфера, введенного в процесс во время DF/объем ретентата. В специфическом воплощении приблизительно 8 диаобъемов, или более диаобъемов буфера заменяется с помощью DF, где диаобъем представляет собой общий объем буфера, введенного в процесс во время DF/объем ретентата. В специфическом воплощении буфер обмена включает (в пределах 10% вариации одного или более компонентов) 200 мМ сахарозы, 100 мМ фосфатного буфера рН 7,0-7,4. В другом специфическом воплощении буфер обмена состоит из (в пределах 10% вариации одного или более компонентов) 200 мМ сахарозы, 100 мМ фосфатного буфера, рН 7,0-7,4. В некоторых воплощениях ретентат, включающий вирусы, собирают после того, как заменен желаемый объем буфера. После сбора ретентата некоторое количество вируса может оставаться слабо связанным с мембраной. В соответствии с этим, в некоторых воплощениях мембрану промывают с помощью дополнительного буфера обмена, который прибавляют к собранному ретентату. Собранный ретентат также называется в данной заявке как "рецептированная масса вируса" или как "#XDF," где "#" означает количество диаобъемов буфер, который заменяется в процессе DF, соответственно. В специфическом воплощении а мембрана с MWCO 500 кДа используется для концентрации и/или замены буфера. В некоторых воплощениях мембрана может очищаться после процесса и использоваться повторно. В других воплощениях новая мембрана используется для каждой партии очищенного вируса. В другом специфическом воплощении буфер очищенного вирусного элюата заменяют, как представлено в Примере, который обеспечивается в Разделе 8.6. Еще в других воплощениях осветленный вирус концентрируется с помощью UF и буфер заменяется с помощью DF, как описывается ниже. Введение этапа UF будет снижать объем полученной рецептированной массы вируса. В некоторых воплощениях вирусный элюат концентрируется приблизительно 2Х, или приблизительно 3Х, или приблизительно 4Х, или приблизительно 5Х, или более, где "X" является равным общему исходному объему, который прибавляется к рабочему/заключительному объему ретентата. В других воплощениях вирусный элюат концентрируется от 2Х до 4Х. В специфическом воплощении вирусный элюат концентрируется приблизительно 2Х, а потом буфер заменяется с помощью DF, как описывается ниже. В специфическом воплощении буфер очищенного вирусного элюата концентрируется и замена буфера осуществляется так, как приведено в Примере.
В одном воплощении рецептированная вирусная партия стерилизуется с помощью DFF и/или TFF. В другом воплощении рецептированная вирусная партия стерилизуется при использовании MF мембраны, которая имеет размер пор, достаточно большой для того, чтобы вирус проходил через нее, но достаточно малый для того, чтобы задерживать другие контаминантны. В одном воплощении рецептированная вирусная партия стерилизуется с помощью DFF и/или TFF через мембрану, имеющую размер пор, по крайней мере, приблизительно 0,45 микрометров. В некоторых воплощениях используются полипропиленовые и/или PVDF мембраны. В одном воплощении дополнительные компоненты прибавляют к рецептированной партии вируса перед стерилизацией. В некоторых воплощениях перед стерилизацией к рецептированной вирусной партия прибавляют, по крайней мере, один компонент, выбранный из группы, состоящей из аминокислотных наполнителей (например, глутамата, аргинина), гидролизатов белка (например, коллагена, желатина), хелатирующих агентов (например, ЭДТА) и консервантов. В специфическом воплощении глутамат, аргинин и желатин прибавляют к рецептированной вирусной партия перед стерилизацией. В другом специфическом воплощении cGAG (200 мМ сахарозы, 100 мМ фосфата, 12,1% вес./об. аргинина, 10% желатина и 54 мМ или 0,9% глутамата) прибавляют к очищенной партия вируса в соотношении 1:9 об/об.. В другом специфическом воплощении мононатрий глутамат, аргинин и желатин прибавляют к рецептированной вирусной партии перед при заключительной концентрации (в пределах 10% вариации) 5,4 мМ или 0,09%, 1,21% вес./об., и 1% вес./об., соответственно. Еще в одном специфическом воплощении рецептированная вирусная партия стерилизуется с помощью DFF, как приведено в Примере, который обеспечивается в Разделе 8.6.
В специфическом воплощении способ очистки вирусов гриппа от культуры клеток включает следующие этапы:
(а) осветление вирусного урожая путем фильтрации прямого потока (DFF) через, по крайней мере, одну мембрану, имеющую размер пор от приблизительно 1,2 микрометров до приблизительно 0,45 микрометров;
(b) концентрацию путем ультрафильтрации тангенциального потока (UF) и замену буфера путем диафильтрации (DF) после этапа (а) при использовании мембраны, которая имеет отсечение молекулярного веса (MWCO) 500 кДа;
(c) очистку путем аффинной колоночной хроматографии после этапа (b);
(d) замену буфера путем DF после этапа (с) при использовании мембраны, которая имеет отсечение молекулярного веса (MWCO) 500 кДа; и
(e) стерилизацию после этапа (d) путем DFF через, по крайней мере, одну мембрану, имеющую размер пор от приблизительно 0,45 микрометров до приблизительно 0,22 микрометров,
где показатель общего извлечения очищенных вирусов составляет, по крайней мере, 30%, и где очищенные вирусы включают менее чем 0,1 нг HCD и менее чем 0,3 мкг НСР на 7,0±0,5 log10 БОЕ вируса.
В некоторых воплощениях этап (с) дополнительно включает обработку с помощью неспецифической нуклеазы.
Дополнительные параметры, которые могут использоваться в способе очистки вирусов от культуры клеток, в частности вирусов гриппа, являются такими, как представлено в Примере, который обеспечивается в Разделе 8.6, приведенном ниже.
6.5.2 Очистка RSV
В специфическом воплощении вирусы, которые подвергают очистке, представляют собой респираторно-синцитиальные вирусы (RSV) (например, rА2ср248/404/1030ΔSН).
В одном воплощении способ очистки вирусов от культуры клеток включает следующие этапы:
(a) осветление вирусного урожая;
(b) стабилизация и/или замена буфера после этапа (а);
(c) концентрация и/или замена буфера после этапа (b);
(d) очистка путем хроматографии после этапа (с); и
(e) заключительное фильтрование после этапа (d).
В специфическом воплощении этап (а) включает множественные этапы фильтрования. В другом специфическом воплощении этап (а) дополнительно включает обработку с помощью неспецифической нуклеазы. В другом специфическом воплощении этапы (а) и (с) осуществляют путем фильтрации прямого потока. В другом специфическом воплощении этап (с) осуществляют путем фильтрации тангенциального потока. Еще в одном специфическом воплощении этап (с) включает как концентрацию путем фильтрации тангенциального потока, так и замену буфера путем диафильтрации. В одном специфическом воплощении этап (d) осуществляют путем ионообменной хроматографии (например, катионообменной). Еще в одном воплощении этап (с) включает только концентрирование. Дополнительные воплощения способа очистки вирусов (например, RSV) подробно приведены выше.
Способы очистки в соответствии с настоящим изобретением охватывают осветление вирусного урожая. Сырьевая среда из инфицированных культур может сначала осветляться путем центрифугирования, например, при 1000-2000 × g в течение периода времени, достаточного для удаления клеточного дебриса и других веществ в виде крупных частиц, например, в течение от 10 до 30 минут. Альтернативно, супернатант, содержащий вирус, фильтруют через ряд полупроницаемых мембран с определенным интервалом размера пор, достаточно большим для того, чтобы позволить вирусу проходить через нее, но в то же время задерживать интактные клетки и другие вещества в виде крупных частиц. Такой этап очистки в процессе очистки может включать обработку с помощью неспецифической эндонуклеазы (например, Бензоназы) для разрушения ДНК хозяйских клеток, где вирусный урожай подвергают а) фильтрованию путем фильтрации прямого потока (DFF); b) обрабатывают с помощью неспецифической эндонуклеазы; и с) снова фильтруют путем DFF.
В одном воплощении вирусный урожай осветляют с помощью DFF и/или TFF при использовании MF мембраны, которая имеет размер пор, достаточно большой для того, чтобы позволить вирусу проходить через нее, но в то же время задерживать интактные клетки и клеточный дебрис. В некоторых воплощениях вирусный урожай осветляют с помощью DFF в комбинации с обработкой неспецифической эндонуклеазой. В специфическом воплощении вирусный урожай фильтруют через, по крайней мере, одну мембрану, которая имеет размер пор приблизительно 10 микрометров или менее, после чего осуществляют обработку с помощью неспецифической эндонуклеазы и потом вновь фильтруют через, по крайней мере, одну мембрану, которая имеет размер пор приблизительно 3,0 микрометров или менее. В специфическом воплощении первый этап фильтрования в процессе осветления осуществляют через, по крайней мере, одну мембрану, которая имеет размер пор от приблизительно 5,0 микрометров до приблизительно 1,0 микрометров. В специфическом воплощении второй этап фильтрования в процессе осветления осуществляют через, по крайней мере, одну мембрану, которая имеет размер пор от приблизительно3,0 микрометров до приблизительно 0,45 микрометров. В некоторых воплощениях первый или второй этап фильтрования, отдельно или в комбинации, использует фильтр с двойной мембраной, где два фильтра, имеющие различные размеры, устанавливают один за другим для предотвращения засорения фильтра с меньшим размером пор. В одном воплощении такой двойной фильтр имеет размер пор приблизительно 3/0,8 микрометров, где фильтр с размером пор 3 микрометра действует как предварительный фильтр для удаления более крупного клеточного дебриса. В другом специфическом воплощении вирусный урожай осветляют с помощью DFF через первую мембрану, которая имеет размер пор приблизительно 3,0 микрометров, и вторую мембрану, которая имеет размер пор приблизительно 3/0,8 или приблизительно 0,65 микрометров.
В некоторых воплощениях способ очистки вирусов (например, RSV) включает обработку с помощью неспецифической эндонуклеазы (например, Бензоназы) для разрушения ДНК хозяйских клеток (HCD). В некоторых воплощениях обработку неспецифической эндонуклеазой осуществляют на ранних этапах очистки вирусов. В одном воплощении вирус обрабатывается с помощью неспецифической эндонуклеазы в ходе этапа (а). В специфическом воплощении отфильтрованный вирусный урожай смешивают с буфером, включающим неспецифическую эндонуклеазу. В некоторых воплощениях неспецифическая эндонуклеаза присутствует в буфере при концентрации от приблизительно 5 Ед./мл до приблизительно 100 Ед./мл. В других воплощениях неспецифическая эндонуклеаза присутствует в буфере при концентрации от приблизительно 40 Ед./мл до приблизительно 60 Ед./мл. В специфическом воплощении неспецифическая эндонуклеаза присутствует в буфере при концентрации приблизительно 50 Ед./мл. В одном воплощении неспецифическая эндонуклеаза присутствует в буфере, включающем приблизительно от 1,0 мМ до приблизительно 10 мМ MgCl. В специфическом воплощении буфер включает 50 Ед./мл неспецифической эндонуклеазы и 5 мМ MgCl. В другом специфическом воплощении MgCl присутствует при концентрации 2 мМ.
После первого этапа фильтрования в процессе осветления неспецифическую эндонуклеазу инкубируют с отфильтрованным вирусным урожаем в течение периода времени от приблизительно 1 часа до приблизительно 4 часов. В специфическом воплощении неспецифическую эндонуклеазу инкубируют с вирусным урожаем в течение приблизительно 3 часов. Еще в других воплощениях неспецифическую эндонуклеазу инкубируют при условиях, которые доводят для обеспечения того, чтобы вирус подвергался воздействию неспецифической эндонуклеазы в течение, по крайней мере, 10 минут, или по крайней мере, 20 минут, или по крайней мере, 30 минут, или по крайней мере, 40 минут, или по крайней мере, 50 минут, или по крайней мере, 60 минут, или по крайней мере, 70 минут, или по крайней мере, 80 минут, или по крайней мере, 90 минут, или по крайней мере, 100 минут, или по крайней мере, минут, или по крайней мере, 110 минут, или по крайней мере, 120 минут, или по крайней мере, 150 минут, или по крайней мере, 180 минут, или по крайней мере, 210 минут, или по крайней мере, 240 минут. В некоторых аспектах в соответствии с изобретением время воздействия неспецифической эндонуклеазы, концентрация неспецифической эндонуклеазы и объем буфера, содержащего неспецифическую эндонуклеазу, могут доводиться. Например, для минимизации времени, необходимого для расщепления ДНК контаминантов, концентрация неспецифической эндонуклеазы может быть повышена; альтернативно, для минимизации количества используемой неспецифической эндонуклеазы время воздействия может быть увеличено. В специфическом воплощении неспецифическая эндонуклеаза представляет собой Бензоназу®. После обработки с помощью неспецифической эндонуклеазы обработанный отфильтрованный вирусный урожай вновь фильтруют для удаления какого-либо остатка переваренных ДНК контаминантов и остатков дебриса хозяйских клеток.
В некоторых воплощениях осветленный вирусный урожай, обработанный Бензоназой, стабилизируют путем прибавления буфера на основе фосфата сахарозы (SP), трис сахарозы (TS) или сахароза фосфат глутамата (SPG). Эти буферы могут дополнительно содержать соль, такую, как хлорид натрия или хлорид калия. В одном воплощении TS буфер содержит от приблизительно 2,5 мМ до приблизительно 75 мМ, рН 7,2 Трис-Cl и от приблизительно 250 мМ до приблизительно 150 мМ сахарозы. В специфическом воплощении стабилизационный буфер содержит 50 мМ, рН 7,2 Трис-Cl и 218 мМ сахарозы. TS буферы могут дополнительно содержать, отдельно или в комбинации, NaCl, KCl, KН2РO4 или K2НРO4. В одном воплощении концентрация NaCl или KCl составляет от приблизительно 125 мМ до приблизительно 175 мМ. В специфическом воплощении стабилизационный буфер содержит 5 мМ, рН 7,2 Трис-Cl, 175 мМ сахарозы и 150 мМ NaCl или 150 мМ KCl. В другом специфическом воплощении стабилизационный буфер содержит 36 мМ рН 7,2 Трис-Cl, 214 мМ сахарозы и 150 мМ NaCl или KCl. В одном воплощении KH2PО4 или К2НРO4 присутствует при концентрации от приблизительно 10 мМ до приблизительно 2,5 мМ. В специфическом воплощении стабилизационный буфер содержит 5 мМ, рН 7,2 Трис-Cl, 175 мМ сахарозы, 150 мМ NaCl и 5 мМ KН2РO4. В другом воплощении стабилизационный буфер представляет собой SPG, где буфер содержит 218 мМ сахарозы, 3,8 мМ KН2РO4, 7,2 мМ K2НРO4 и 5 мМ глутамата натрия. Для специалиста в данной области техники будет понятным, что концентрации стабилизационных буферов могут изменяться в зависимости от вируса, вирусного урожая и условий очистки для получения наивысшего выхода стабилизированного вирусного урожая.
В некоторых воплощениях осветленный урожай концентрируется и/или буфер заменяется. В одном воплощении концентрацию и/или замену буфера осуществляют путем UF и DF. В другом воплощении TFF используется как для UF, так и DF. В некоторых воплощениях TFF осуществляют так, чтобы поддержать постоянной скорость вытекания фильтрата. В других воплощениях TFF осуществляют так, чтобы поддержать постоянным ТМР. В специфическом воплощении UF этап осуществляют при использовании 500 кДа картриджа с пористым волокном (GE Healthcare), где вирусный урожай концентрируется 5-кратно при использовании ТМР 15 фунтов на квадратный дюйм и скорости сдвига 12000 сек-1. Эти параметры могут изменяться в зависимости от вируса и условий очистки для максимизации окончательного выхода вируса для заключительной вакцинной композиции.
В некоторых воплощениях осветленный вирус сначала концентрируют с помощью UF, а потом буфер заменяют с помощью DF. Предполагается, что обменный буфер может быть таким же или отличаться от присутствующего в вирусном урожае. В дополнение, буфер обмена может быть таким же или отличаться от буфера заключительной композиции в зависимости от дополнительных этапов замены буфера. В одном воплощении буфер обмена представляет собой SP, TS или сахароза цитратный буфер при нейтральном значении рН. В специфическом воплощении буфер обмена включает приблизительно 7-25% вес./об. сахарозы, обеспечивая, таким образом, концентрацию сахарозы от низкой до высокой в пределах от приблизительно 100 мМ до приблизительно 800 мМ. В одном воплощении буфер обмена включает NaCl или КСl при концентрации от приблизительно 1 мМ до приблизительно 150 мМ. В другом воплощении буфер обмена включает Трис-Сl при концентрации от приблизительно 2,5 мМ до приблизительно 10 мМ. Еще в одном воплощении буфер обмена включает цитрат натрия или калия при концентрации от приблизительно 5,0 мМ до приблизительно 50 мМ. В одном воплощении буфер обмена включает фосфат калия при концентрации от приблизительно 50 мМ до приблизительно 150 мМ. Примеры специфических обменных буферов включают, но без ограничения, 5 мМ Трис-Cl; 7-25% вес./об. сахарозы; от 1 мМ до 150 мМ NaCl; 20 мМ цитрата натрия или калия, 7-25% вес./об. сахарозы, 150 мМ NaCl или KСl; и 100 мМ фосфата калия, 7-25% вес./об. сахарозы, 150 мМ KСl. В специфическом воплощении буфер обмена включает 25% вес./об. сахарозы, приблизительно 100 мМ калий фосфатного буфера и приблизительно 150 мМ KСl, рН 7,2. В другом специфическом воплощении буфер обмена включает 25% вес./об. сахарозы, приблизительно 5 мМ Трис-Сl и приблизительно 150 мМ NaCl, рН 7,2. Компоненты буфера обмена могут подвергаться модификации в зависимости от вируса и условий очистки для максимизации выхода вируса на этапе хроматографии и этапе заключительного фильтрования.
В некоторых воплощениях стабилизированный вирусный урожай дополнительно очищают с помощью хроматографии, как описывается ниже. В некоторых воплощениях используется ионообменная хроматография (например, анионообменная или катионообменная хроматография). В специфическом воплощении после снижения объема путем UF и замены буфера путем диафильтрации обработанный осветленный вирусный урожай дополнительно очищают с помощью ионообменной хроматографии. Этот хроматографический этап или этап доочистки осуществляют в одном воплощении при использовании негативной хроматографии. В этом воплощении поверхность (например, полимерные гранулы) подвергают дериватизации для связывания HCD или НСР при исключении связывания частиц вируса, позволяя, таким образом, вирусу проходить мимо поверхности. Эта концепция может быть также применена к другим поверхностям так, что буфер, включающий частицы вируса, может проходить через или мимо дериватизованной поверхности. Полный процесс хроматографии является свободным от добавок и легко масштабируется для применения в получении вируса в большом объеме для вакцинной композиции. Предполагается, что хроматография может осуществляться в периодическом процессе или, альтернативно, при использовании колоночного процесса. В некоторых воплощениях кондиционированную вирусную загрузку очищают с помощью колоночной хроматографии.
Либо после этапа хроматографии, если он осуществляется, либо после замены буфера, концентрированный вирусный урожай подвергают этапу стерилизации. В одном воплощении этап стерилизации представляет собой этап заключительного фильтрования. В одном воплощении заключительное фильтрование представляет собой DFF, по крайней мере, через одну мембрану, которая имеет размер пор 3 микрометра или менее. В специфическом воплощении фильтр представляет собой двойную мембрану с размером пор 3/0,8 микрометра. В другом специфическом воплощении фильтр является таким с размером пор приблизительно 1 мМ или менее. В одном аспекте фильтр представляет собой мембрану 0,8, 0,65 или 0,45 микрометра.
В специфическом воплощении способ очистки респираторно-синцитиального вируса из клеток, инфицированных вирусом, включает следующие этапы:
а. осветление вирусного урожая, включающее;
i. фильтрование вирусного урожая путем фильтрации прямого потока (DFF), по крайней мере, через один фильтр для осветления, который имеет размер пор от приблизительно 10 микрометров до приблизительно 3 микрометров;
ii. обработку вирусного урожая с помощью неспецифической эндонуклеазы;
iii. фильтрование вирусного урожая путем DFF, по крайней мере, через один фильтр для осветления, который имеет размер пор от приблизительно 3 микрометров до приблизительно 0,45 микрометра;
b. стабилизацию осветленного вирусного урожая при использовании сахарозного, фосфатного или Трис буфера с солью (NaCl или KСl);
с. концентрированно стабилизированного вирусного урожая путем фильтрации тангенциального потока (TFF) и осуществления замены буфера путем диафильтрации (DF) при использовании картриджа с пористым волокном с отсечением молекулярного веса (MWCO) от 500 кДадо 0,1 мкм;
d. фильтрование концентрированного вирусного урожая с помощью DFF, по крайней мере, через один фильтр для осветления, который имеет размер пор от приблизительно 0,8 микрометров до приблизительно 0,45 микрометров; посредством чего респираторно-синцитиальный вирус очищается от инфицированных вирусом клеток и имеет заключительный титр вирусной инфективности, по крайней мере, 5,7 log10 БОЕ/мл.
В другом специфическом воплощении способ очистки включает этап очистки с помощью катионообменной хроматографии после концентрирования вирусного урожая и замены буфера.
6.6 Вакцинные композиции и способы применения
Изобретение также относится к вирусам (например, гриппа или RSV), которые получают с помощью способа в соответствии с изобретением. Такие вирусы могут быть рецептированы с помощью известных способов для обеспечения вакцины для введения людям или животным. Вирусы могут быть представлены интактными вирусными частицами (например, живыми аттенуированными вирусами) или находиться в виде инактивированного/дезинтегрированного вируса (например, обработанного с помощью детергентов на основе формальдегида). Необязательно, определенный вирусный компонент (например, белок) может быть изолирован из вирусов с помощью способов, известных специалисту в данной области техники, и использоваться в получении вакцины. Способы получения и рецептирования инактивированных / дезинтегрированных вирусных частиц для вакцинных композиций являются хорошо известными в уровне техники и используются на протяжении более 40 лет.
6.6.1 Вакцина вируса гриппа
Композиция интактных вирусных частиц (например, живых аттенуированных вирусов) может включать буферы, аминокислотные наполнители (например, глутамат, аргинин), белковые гидролизаты (например, коллаген, желатина), хелатирующие агенты (например, ЭДТА) и консерванты. Буферы, полезные для такой композиции, могут содержать 200 мМ сахарозного, фосфатного или гистидинового буфера с рН 7,0-7,4. В некоторых воплощениях композиция интактных вирусных частиц включает аминокислотные наполнители, такие, как глутамат и аргинин. В некоторых других воплощениях композиция интактных вирусных частиц включает стабилизационные белковые гидролизаты такие, как коллаген или желатин (например, свиной, рыбный или птичий желатин). В некоторых воплощениях композиция интактных вирусных частиц может включать живые вирусы, которые являются стабильными в жидкой форме в течение периода времени, достаточного для того, позволить осуществлять "хранение на месте" (например, в случае продажи или коммерциализации при замораживании при 2-8°С, 4°С, 5°С и т.д.) на протяжении сезона вакцинации от гриппа (например, типично от приблизительно сентября до марта в северном полушарии). Таким образом, вирусные/вакцинные композиции являются желательными для сохранения их эффективности или для потери их эффективности при приемлемой скорости в течение периода хранения. В других воплощениях такие растворы/вакцины являются стабильными в жидкой форме при температуре хранения от приблизительно 2°С до приблизительно 8°С, например, при температуре холодильной камеры. Например, способы и композиции для рецептирования стабильной при низкой температуре аттенуированных вакцин вируса гриппа являются описанными в патентной публикации РСТ № WO/2006/041819; также смотри публикацию РСТ WO/2005/014862.
Таким образом, в некоторых воплощениях изобретение обеспечивает стабильную при хранении при пониженных температурах композицию, включающую один или более из следующих компонентов (в пределах 10% вариации одного или более компонентов) в заключительных композициях: 1-5% аргинина; 1-4% желатина; 5-10% сахарозы (необязательно в фосфатном буфере); 0,01-0,1% глутаминовой кислоты (мононатрий, моногидрат); 10-150 мМ фосфата натрия и 80-150 мМ гистидина.
В одном специфическом воплощении вакцинная композиция включает один или более из следующих компонентов (в пределах 10% вариации одного или более компонентов); 1-2% аргинина; 2% желатина; 7-10% сахарозы (необязательно в фосфатном буфере); и 100 мМ гистидина. В другом специфическом воплощении вакцинная композиция включает один или более из следующих компонентов (в пределах 10% вариации одного или более компонентов): 0,01-0,1% глутаминовой кислоты (мононатрий, моногидрат); 1-2% аргинина; 1% желатина; и 7-10% сахарозы в фосфатном буфере.
В некоторых других воплощениях изобретение обеспечивает стабильную при хранении при пониженных температурах композицию, включающую один или более из следующих компонентов в заключительных композициях: сахароза: 6-8% вес/объем (вес./об.); аргинин моногидрохлорид 1-2% вес./об.; глутаминовая кислота, мононатрий моногидрат 0,05-0,1% вес./об.; желатиновый гидролизат, свиной типа А (или другого происхождения, такой, как рыбный или птичий) 0,5-2% вес./об.; фосфат калия двуосновный 1-2%; и фосфат калия моноосновный 0,25-1% вес./об.
В одном специфическом воплощении вакцинная композиция включает один или более из следующих компонентов: сахароза: 6,84% вес/объем (вес./об.); аргинин монохлорид 1,21% вес./об.; глутаминовая кислота, мононатрий моногидрат 0,094 вес./об.; желатиновый гидролизат, свиной типа А (или другого происхождения) 1% вес./об.; фосфат калия двуосновный 1,13%; и фосфат калия моноосновный 0,48% вес./об. В другом специфическом воплощении вакцинная композиция включает все компоненты из следующих: сахароза: 6,84% вес/объем (вес./об.); аргинин монохлорид 1,21% вес./об.; глутаминовая кислота, мононатрий моногидрат 0,094% вес./об.; желатиновый гидролизат, свиной типа А (или другого происхождения) 1% вес./об.; фосфат калия двуосновный 1,13%; и фосфат калия моноосновный 0,48% вес./об.
В другом специфическом воплощении вакцинная композиция включает все компоненты из следующих (в пределах 10% вариации одного или более компонентов): сахароза: 6,84% вес/объем (вес./об.); аргинин монохлорид 1,21% вес./об.; глутаминовая кислота, мононатрий моногидрат 0,094% вес./об.; желатиновый гидролизат, свиной типа А (или другого происхождения) 1% вес./об.; фосфат калия двуосновный 1,13%; и фосфат калия моноосновный 0,48% вес./об. В другом специфическом воплощении вакцинная композиция включает все компоненты из следующих (в пределах 10% вариации одного или более компонентов): сахароза: 6,84% вес/объем (вес./об.); аргинин монохлорид 1,21% вес./об.; желатиновый гидролизат, свиной типа А (или другого происхождения) 1% вес./об. В таких воплощениях композиции содержатся в буфере (например, в буфере на основе фосфата калия (рН 7,0-7,2)). В другом специфическом воплощении вакцинные композиции включают все компоненты из следующих (в пределах 20% вариации одного или более компонентов): сахароза: 6,84% вес/объем (вес./об.); аргинин монохлорид 1,21% вес./об.; глутаминовая кислота, мононатрий моногидрат 0,094% вес./об.; желатиновый гидролизат, свиной типа А (или другого происхождения) 1% вес./об.; фосфат калия двуосновный 1,13%; и фосфат калия моноосновный 0,48% вес./об.
Еще в одном специфическом воплощении вакцинная композиция включает все компоненты из следующих (в пределах 30% вариации одного или более компонентов): сахароза: 6,84% вес/объем (вес./об.); аргинин монохлорид 1,21% вес./об.; глутаминовая кислота, мононатрий моногидрат 0,094% вес./об.; желатиновый гидролизат, свиной типа А (или другого происхождения) 1% вес./об.; фосфат калия двуосновный 1,13%; и фосфат калия моноосновный 0,48% вес./об. Еще в одном специфическом воплощении вакцинная композиция включает все компоненты из следующих (в пределах 40% вариации одного или более компонентов): сахароза: 6,84% вес/объем (вес./об.); аргинин монохлорид 1,21% вес./об.; глутаминовая кислота, мононатрий моногидрат 0,094% вес./об.; желатиновый гидролизат, свиной типа А (или другого происхождения) 1% вес./об.; фосфат калия двуосновный 1,13%; и фосфат калия моноосновный 0,48% вес./об.
В другом специфическом воплощении вакцинная композиция включает все компоненты из следующих (в пределах 1% вариации одного или более компонентов): сахароза: 6,84% вес/объем (вес./об.); аргинин монохлорид 1,21% вес./об.; глутаминовая кислота, мононатрий моногидрат 0,094% вес./об.; желатиновый гидролизат, свиной типа А (или другого происхождения) 1% вес./об.; фосфат калия двуосновный 1,13%; и фосфат калия моноосновный 0,48% вес./об. В другом специфическом воплощении вакцинная композиция включает все компоненты из следующих (в пределах 3% вариации одного или более компонентов): сахароза: 6,84% вес/объем (вес./об.); аргинин монохлорид 1,21% вес./об.; глутаминовая кислота, мононатрий моногидрат 0,094% вес./об.; желатиновый гидролизат, свиной типа А (или другого происхождения) 1% вес./об.; фосфат калия двуосновный 1,13%; и фосфат калия моноосновный 0,48% вес./об. В специфическом воплощении вакцинная композиция может содержать, например, фосфат калия (например, по крайней мере, 50 мМ, или по крайней мере, 100 мМ, или по крайней мере, 200 мМ, или по крайней мере, 250 мМ) как буфер или, альтернативно, гистидин (например, по крайней мере, 50 мМ, или по крайней мере, 100 мМ, или по крайней мере, 200 мМ, или по крайней мере, 250 мМ).
Необязательно, высушивание распылением, быстрый процесс высушивания, посредством которого порция жидкой композиции атомизируется с помощью распыления с образованием мелких капель под потоком сухого нагретого газа, может использоваться для продления времени хранения вакцинной композиции. Испарение мелких капель приводит к образованию сухих порошков, которые состоят из растворенных веществ (смотри, например, публикацию патентной заявки США 2004/0042972).
В общем случае, вирус или вирусные компоненты могут вводиться с профилактической целью в приемлемом носителе или наполнителе для стимуляции иммунного ответа, специфического для одного или более штаммов вируса. Типично, носитель или наполнитель представляет собой фармацевтически приемлемый носитель или наполнитель, такой как стерильная вода, водный солевой раствор, водные забуференные солевые растворы, водные растворы декстрозы, водные растворы глицерина, этанола или их комбинации. Получение таких растворов, обеспечивающих стерильность, рН, изотоничность и стабильность достигается в соответствии с прописями, принятыми в области техники. В общем случае, носитель или наполнитель выбирают для минимизации аллергических или других нежелательных эффектов и для того, чтобы он был приемлемым для конкретного способа введения, например подкожного, внутримышечного, интраназального и т.д.
Необязательно, композиция для профилактического введения вирусов или их компонентов также содержит один или более адьювантов для повышения иммунного ответа на антигены вируса гриппа. Приемлемые адъюванты включают: сапонин, минеральные гели, такие, как гидроокись алюминия, поверхностно-активные вещества, такие, как лизолецитин, полиолы плюроника, полианионы, пептиды, эмульсии на основе масла или углеводорода, бациллу Кальмета-Герена (BCG), Corynebacterium parvum и синтетические адъюванты QS-21 и MF59.
В общем случае вакцинные композиции вводятся в количестве, достаточном для стимуляции иммунного ответа, специфического для одного или более штаммов вируса гриппа. Предпочтительно, когда введение вирусов вызывает протективный иммунный ответ. Дозировки и способы индукции протективного иммунного ответа против одного или более вирусных штаммов являются известными специалисту в данной области техники. Например, инактивированные вирусы гриппа обеспечиваются в интервале приблизительно 1-1000 НID50 (инфекционная доза для человека), то есть приблизительно 105-108 БОЕ (бляшкообразующих единиц) на вводимую дозу. Альтернативно, приблизительно 10-50 мкг, например, приблизительно 15 мкг НА вводится без адьюванта, с меньшими дозами, которые вводятся с адьювантом. Типично, доза будет доводиться в пределах этого интервала на основе, например, возраста, физического состояния, веса тела, пола, диеты, времени введения и других клинических факторов. Профилактическая вакцинная композиция вводится системно, например, путем подкожной или внутримышечной инъекции при использовании иголки и шприца или с помощью безыгольного инъектора. Альтернативно, вакцинная композиция вводится интраназально, либо с помощью капель, аэрозоля с частицами больших размеров (большими, чем приблизительно 10 микрометров), либо путем распыления в верхнюю часть респираторного тракта. Несмотря на то, что любой из упомянутых выше путей доставки приводит к протективному иммунному ответу, интраназальное введение обеспечивает дополнительное преимущество стимуляции иммунитета в слизистой оболочке в сайте введения вируса гриппа. Для интраназального введения аттенуированная живая вирусная вакцин часто является предпочтительной, например, аттенуированный, адаптированный к холоду и/или чувствительный к температуре рекомбинантный или реассортантный вирус гриппа. Несмотря на то, что стимуляция протективного вирусного ответа с помощью одной дозы является предпочтительной, могут вводиться дополнительные дозировки, тем же или другим путем, для достижения желаемого профилактического эффекта. Эти способы могут быть адаптированы для любого вируса, включая но без ограничения, ортомиксовирусы (включая штаммы вируса гриппа А и В), парамиксовирусы (включая RSV, метапневмовирус человека и парагрипп), вирусы бешенства и флавовирусы.
6.6.2 RSV вакцины
Одно воплощение, представленное в данной заявке, представляет собой способы стимуляции иммунного ответа у субъекта, включающие введение субъекту, который в этом нуждается, эффективного количества иммуногенной композиции, описанной в данной заявке, которая включает живой аттенуированный очищенной вирус (например, RSV). В некоторых воплощениях аттенуированный вирус представляет собой химерный вирус.
Одно воплощение, представленное в данной заявке, представляет собой способы стимуляции иммунного ответа у млекопитающего (например, у человека), включающие введение млекопитающему, который в этом нуждается, эффективного количества иммуногенной композиции, описанной в данной заявке, которая включает аттенуированный RSV. В частном воплощении аттенуированный RSV представляет собой rA2cp248/404/1030ΔSH.
Иммуногенные композиции, описанные в данной заявке, которые включают живой аттенуированный очищенной вирус, могут применяться в активной иммунизации субъекта. Одно воплощение, представленное в данной заявке, представляет собой способы предотвращения вирусной инфекции, включающие введение субъекту эффективного количества иммуногенной композиции, описанной в данной заявке, которая включает живой аттенуированный очищенной вирус, то есть вакцины. В некоторых воплощениях живой аттенуированный вирус представляет собой химерный вирус.
Одно воплощение, представленное в данной заявке, представляет собой способы предотвращения RSV инфекции, включающие введение млекопитающему (например, человеку) эффективного количества иммуногенной композиции, описанной в данной заявке, которая включает живой аттенуированный очищенный RSV, то есть вакцины. В частном воплощении живой аттенуированный RSV пpeдcтaвляeт собой rA2cp248/404/1030ΔSH.
Иммуногенные композиции, описанные в данной заявке, которые включают живой аттенуированный очищенной вирус, могут использоваться в ингибировании вирусных инфекций. Одно воплощение, представленное в данной заявке, представляет собой способы ингибирования вирусной инфекции, включающие введение субъекту, который в этом нуждается, эффективного количества иммуногенной композиции, описанной в данной заявке, которая включает живой аттенуированный очищенный вирус. В некоторых воплощениях аттенуированный вирус представляет собой химерный вирус. В специфическом воплощении данной заявки представляются способы для ингибирования RSV инфекции, включающие введение млекопитающему (например, человеку) эффективного количества иммуногенной композиции, описанной в данной заявке, которая включает живой аттенуированный очищенный RSV. В частном воплощении аттенуированный RSV представляет собой rA2cp248/404/1030ΔSH.
Иммуногенные композиции, описанные в данной заявке, которые включают живой аттенуированный очищенной вирус, могут использоваться для индукции иммунного ответа, что приводит к снижению титра вируса у субъекта. Одно воплощение, представленное в данной заявке, представляет собой способы для снижения титра вируса у субъекта, включающие введение иммуногенной композиции, описанной в данной заявке, которая включает живой, аттенуированный, ассоциированный с клеткой вирус. В некоторых воплощениях аттенуированный вирус представляет собой химерный вирус. Одно специфическое воплощение, представленное в данной заявке, представляет собой способы для снижения титра RSV, включающие введение млекопитающему (например, человеку) эффективного количества иммуногенной композиции, описанной в данной заявке, которая включает живой аттенуированный RSV. В частном воплощении аттенуированный RSV представляет собой rA2cp248/404/1030ΔSH.
В некоторых воплощениях эффективное количество иммуногенной композиции, описанной в данной заявке, снижает титр вируса приблизительно в 2 раза, предпочтительно приблизительно в 5 раз или более, приблизительно в 10 раз или более, или приблизительно в 20 раз или более у субъекта, которому был введен вирус, по сравнению с субъектом, не подвергнутым обработке. В некоторых воплощениях эффективное количество иммуногенной композиции, описанной в данной заявке, снижает длительность и/или тяжесть одного или более симптомов, связанных с ассоциированной с клеткой вирусной инфекцией, у субъектов, последовательно инфицированных ассоциированным с клеткой вирусом, по сравнению с субъектами, не подвергнутыми обработке. В некоторых воплощениях эффективное количество иммуногенной композиции, описанной в данной заявке, повышает выживание субъектов, последовательно инфицированных с помощью очищенного вируса, по сравнению с субъектами, не подвергнутыми обработке.
Иммуногенные композиции, описанные в данной заявке, которые включают живой аттенуированный очищенной вирус, могут вводиться субъекту, который ранее не подвергался обработке, то есть субъекту, который не был и не является в настоящее время инфицированным вирусом, который представляет интерес. В одном воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный ассоциированный с клеткой вирус, может вводиться субъекту, который ранее не подвергался обработке и который имеет риск развития вирусной инфекции. В специфическом воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный RSV, может вводиться субъекту, который ранее не подвергался обработке и который имеет риск развития RSV инфекции. В частном воплощении аттенуированный RSV представляет собой rA2cp248/404/1030ΔSH.
Иммуногенные композиции, описанные в данной заявке, которые включают живой аттенуированный очищенной вирус, могут вводиться субъекту, который ранее был инфицирован различными группами, подгруппами или штаммами вируса, который представляет интерес. В одном воплощении иммуногенная композиция вводится субъекту, который ранее был инфицирован различными группами, подгруппами или штаммами вируса, который представляет интерес, и имеет риск развития инфекции, вызванной вирусом, который представляет интерес.
В одном воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный RSV (например, rA2cp248/404/1030ΔSH) вводится младенцу или младенцу, родившемуся преждевременно. В другом воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный RSV (например, rA2cp248/404/1030ΔSH), вводится человеку с муковисцидозом, бронхо-легочной дисплазией, врожденным заболеванием сердца, врожденным иммунодефицитом или приобретенным иммунодефицитом. В другом воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный RSV (например, rА2ср248/404/1030ΔSН), вводится ребенку ясельного возраста. В другом воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный RSV (например, rA2cp248/404/1030ΔSH), вводится ребенку. В другом воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный RSV (например, rA2cp248/404/1030ΔSH), вводится ребенку школьного возраста.
В специфическом воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный RSV (например, rA2cp248/404/1030ΔSH), вводится человеку в возрасте от 1 до 24 месяцев. В другом воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный RSV (например, rА2ср248/404/1030ΔSН), вводится человеку в возрасте от 1 до 3 месяцев. В другом воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный RSV (например, rA2cp248/404/1030ΔSH), вводится человеку в возрасте от 6 до 24 месяцев.
В другом воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный RSV (например, rA2cp248/404/1030ΔSH), вводится человеку, который имеет трансплантат костного мозга. В другом воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный RSV (например, rA2cp248/404/1030ΔSH), вводится пожилому человеку. В другом воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный RSV (например, rA2cp248/404/1030ΔSH), вводится человеку в лечебно-реабилитационном центре для престарелых. В другом воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный RSV (например, rA2cp248/404/1030ΔSH), вводится человеку, который живет в групповом доме (то есть доме, в котором живут 15 или более субъектов).
В специфическом воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный RSV (например, rA2cp248/404/1030ΔSH), вводится субъекту, который представляет собой человека (в специфическом воплощении такой субъект представляет собой младенца, преждевременно рожденного младенца или ребенка ясельного возраста), перед началом сезона RSV, типично от ноября до апреля в северном полушарии. В другом воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный RSV (например, rA2cp248/404/1030ΔSH), вводится субъекту, который представляет собой человека (в специфическом воплощении такой субъект представляет собой младенца, преждевременно рожденного младенца или ребенка ясельного возраста) во время сезона RSV, типично от ноября до апреля в северном полушарии. В другом воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный RSV (например, rA2cp248/404/1030ΔSH), вводится субъекту, который представляет собой человека (в специфическом воплощении такой субъект представляет собой младенца, преждевременно рожденного младенца или ребенка ясельного возраста), перед и во время сезона RSV, типично от ноября до апреля в северном полушарии.
В некоторых воплощениях иммуногенная композиция, описанная в данной заявке, которая включает живой аттенуированный RSV, не приводит к полной защите от вирусной инфекции, но приводит к более низкому титру вируса по сравнению с неподвергнутым обработке субъектом при заражении вирусом. В некоторых воплощениях введение иммуногенной композиции, описанной в данной заявке, которая включает живой аттенуированный RSV, приводит к 0,5-кратному, 1-кратному, 2-кратному, 4-кратному, 6-кратному, 8-кратному, 15-кратному, 25-кратному, 50-кратному или более снижению титра вируса по сравнению с неподвергнутым обработке субъектом при заражении вирусом. В некоторых воплощениях введение иммуногенной композиции, описанной в данной заявке, которая включает живой аттенуированный RSV, приводит к 10%, предпочтительно 25%, 50%, 75% или более снижению титра вируса по сравнению с неподвергнутым обработке субъектом при заражении вирусом. Преимущества снижения титра вируса включают, но без ограничения, менее тяжелые симптомы вирусной инфекции, более слабые симптомы вирусной инфекции и снижение длительности течения вирусной инфекции.
Иммуногенные композиции, описанные в данной заявке и включающие живой аттенуированный химерный ассоциированный с клеткой вирус, могут использоваться для индукции иммунного ответа на невирусный антиген. Иммуногенная композиция, описанная в данной заявке, включающая живой аттенуированный химерный ассоциированный с клеткой вирус, может использоваться для доставки белка, полипептида или пептида, представляющего интерес, субъекту для предотвращения и/или лечения заболевания.
Для введения иммуногенных композиций может использоваться множество способов, например, вакцинные композиции, описанные в данной заявке, которые включают, но без ограничения, интраназальные, интратрахеальные, пероральные, легочные, интрадермальные, интраперитонеальные и парентеральные (например, внутримышечные, внутривенные и подкожные) пути введения. В некоторых воплощениях иммуногенная композиция, описанная в данной заявке, которая включает живой, аттенуированный, ассоциированный с клеткой вирус, вводится естественным путем инфекции вируса. В специфическом воплощении иммуногенная композиция, описанная в данной заявке, которая включает живой, аттенуированный RSV (например, rА2ср248/404/1030ΔSН), вводится интраназально.
В процедурах иммунизации используемое количество иммуногенной композиции и расписание иммунизации будет определяться квалифицированным врачом, работающим в данной области, и будет вводиться с учетом иммунного ответа и титра антител у субъекта. В специфическом воплощении младенцу, преждевременно рожденному младенцу или ребенку ясельного возраста вводится доза иммуногенной композиции, описанной в данной заявке, которая включает живой аттенуированный RSV (например, rA2cp248/404/1030ΔSH), где доза иммуногенной композиции включает приблизительно от 125 до 200 БОЕ аттенуированного RSV. В другом воплощении младенцу, преждевременно рожденному младенцу или ребенку ясельного возраста вводится доза иммуногенной композиции, описанной в данной заявке, которая включает живой аттенуированный RSV (например, rA2cp248/404/1030ΔSH), где доза иммуногенной композиции включает приблизительно 125 БОЕ, приблизительно 150 БОЕ, приблизительно 175 БОЕ или приблизительно 200 БОЕ аттенуированного RSV.
В некоторых воплощениях 2-6 доз иммуногенной композиции, включающей приблизительно от 125 до 200 БОЕ живого аттенуированного RSV (например, rA2cp248/404/1030ΔSH), вводятся младенцу, преждевременно рожденному младенцу или ребенку ясельного возраста. В некоторых воплощениях дозы иммуногенной композиции вводятся с интервалом от 1 до 6 месяцев или с интервалом от 2 до 12 месяцев. В специфическом воплощении 3 дозы иммуногенной композиции, включающей приблизительно от 125 до 200 БОЕ живого аттенуированного RSV (например, rA2cp248/404/1030ΔSH), вводятся младенцу, преждевременно рожденному младенцу или ребенку ясельного возраста с интервалом 2 месяца. Например, первая доза иммуногенной композиции, включающая 150 БОЕ живого аттенуированного RSV (например, rA2cp248/404/1030ΔSH), вводится младенцу в возрасте менее чем 1 месяц, вторая доза иммуногенной композиции, включающая 150 БОЕ живого аттенуированного RSV (например, rA2cp248/404/1030ΔSH), вводится младенцу в возрасте приблизительно 2 месяцев, и третья доза иммуногенной композиции, включающая 150 БОЕ живой аттенуированный RSV (например, rA2cp248/404/1030ΔSH), вводится младенцу в возрасте приблизительно 4 месяцев.
6.7 Вирусы
Ассоциированный с клеткой вирус может представлять собой существующий в природе вирус, мутантный вирус (например, вирус, подвергнутый мутации при УФ облучении, мутагенезе и/или пассировании), реассортантный (для ассоциированных с клеткой вирусов с сегментированньми геномами), и/или генетически сконструированный вирус. Неограничивающие примеры ассоциированных с клеткой РНК-содержащих вирусов включают респираторно-синцитиальный вирус (RSV), вирус коревой краснухи, вирус гриппа, вирус пенистости человека, ретровирусы, такие как HTLV, лентивирусы такие, как HIV и SIV, и реовирусы. Альтернативно, ассоциированный с клеткой вирус представляет собой содержащий ДНК вирус, такой как вирус герпеса. Неограничивающие примеры ассоциированных с клеткой РНК-содержащих вирусов включают вирус герпеса, EBV, CMV и вирус болезни Марека. В некоторых воплощениях ассоциированный с клеткой вирус, очищенный с помощью процесса, описанного в данной заявке, и/или содержащийся в иммуногенной композиции, описанной в данной заявке, является дефектным по репликации. В специфическом воплощении одна или более функций, существенных для репликации вирусного генома и/или синтеза, являются дефектными в дефектном по репликации ассоциированном с клеткой вирусе. В другом воплощении одна или более функций, существенных для сборки вирусных частиц, являются дефектными в дефектном по репликации ассоциированном с клеткой вирусе. В другом воплощении одна или более функций, существенных для репликации вирусного генома или синтеза и сборки вирусных частиц, являются дефектными в дефектном по репликации ассоциированном с клеткой вирусе.
В специфическом воплощении ассоциированный с клеткой вирус, очищенный с помощью процесса, описанного в данной заявке и/или содержащийся в иммуногенной композиции, описанной в данной заявке, является аттенуированным вирусом. В частном воплощении ассоциированный с клеткой вирус представляет собой живой аттенуированный вирус. Аттенуированный ассоциированный с клеткой вирус может иметь, например, сниженную способность к репликации своего вирусного генома, сниженную способность к репликации, сниженную способность к сборке инфекционных вирусных частиц, и/или сниженную способность к инфицированию хозяйской клетки по сравнению с ассоциированным с клеткой вирусом дикого типа. Аттенуирование ассоциированных с клеткой вирусов может подвергаться исследованию с помощью любого способа, известного специалисту в данной области техники. Смотри, например, патентную заявку США №10/831,780, 23 апреля, 2004 (опубликована 27 января, 2005 как публикация патентной заявки США №2005/0019891) и, в частности, раздел 5.7 под названием "Аттенуирование рекомбинантных вирусов". В некоторых воплощениях аттенуированный вирус получают при использовании хорошо известных методик мутагенеза, таких, как холодовое пассирование вируса или воздействие УФ облучения и/или мутагенов. В других воплощениях аттенуированный вирус является генетически сконструированным.
Ассоциированный с клеткой вирус может представлять собой химерный вирус. В специфическом воплощении химерный вирус представляет собой вирус, дефектный по репликации. В частном воплощении химерный вирус является аттенуированным вирусом.
6.7.1 Вирус гриппа
Культуральная среда, способы, процессы и композиции, описанные в данной заявке, являются особенно полезыми для получения и очистки вирусов гриппа для вакцин. Вирусы гриппа состоят из внутреннего рибопротеинового ядра, содержащего сегментированный геном на основе одноцепочечной РНК и внешнюю липопротеиновую оболочку с матриксным белком. Вирусы гриппа А и гриппа В каждый содержит восемь сегментов негативной одноцепочечной смысловой РНК. Геном вируса гриппа А кодирует одиннадцать полипептидов. Сегменты 1-3 кодируют три полипептида, составляющие РНК-зависимую РНК полимеразу. Сегмент 1 кодирует комплексный белок полимеразы РВ2. Остальные белки полимеразы РВ1 и РА кодируются сегментом 2 и сегментом 3, соответственно. В дополнение, сегмент 1 некоторых штаммов вируса гриппа кодирует малый белок, PB1-F2, получаемый из альтернативной рамки считывания в пределах участка, кодирующего РВ1. Сегмент 4 кодирует гемагглютинин (НА), поверхностный гликопротеин, который является вовлеченным в присоединение к клетке и поступление в клетку во время инфекции. Сегмент 5 кодирует полипептид нуклеокапсидного нуклеопротеина (NP), основного структурного компонента, ассоциированного с вирусной РНК. Сегмент 6 кодирует нейраминидазу (NA), оболочечный гликопротеин. Сегмент 7 кодирует два матриксных белка, которые обозначаются как M1 и М2, которые транслируются из дифференциально сплайсированных мРНК. Сегмент 8 кодирует NS1 и NS2, два неструктурных белка, которые транслируются из альтернативно сплайсированных вариантов мРНК.
Восемь геномных сегментов вируса гриппа В кодируют 11 белков. Три самых больших гена кодируют компоненты РНК полимеразы, РВ1, РВ2 и РА. Сегмент 4 кодирует NA белок. Сегмент 5 кодирует NP. Сегмент 6 кодирует NA белок и NB белок. Оба белка, NB и NA, транслируются из перекрывающихся рамок считывания бисцистронной мРНК. Сегмент 7 вируса гриппа В также кодирует два белка: M1 и М2. Самый маленький сегмент кодирует два продукта, NS1, который транслируется из полноразмерной РНК, и NS2, который транслируется из сплайсированного варианта мРНК.
Реассортантные вирусы получают для встраивания выбранных антигенов гемагглютинина и/или нейраминидазы из клинических изолятов с учетом одобренного главного штамма, который также называют главным донорным вирусом (MDV). FluMist®, например, использует одобренный адаптированный к холоду, аттенуированный, чувствительный к температуре MDV штамм (например, са А/Анн-Арбор/6/60 и са В/Анн-Арбор/1/66). Другие штаммы, которые могут использоваться в качестве основного донорного вируса, включают, но без ограничения, са А/Анн-Арбор/6/60, са В/Анн-Арбор/1/66, са А/Ленинград/13 4/17/57, А/Пуэрто Рико/8/34 (PR8), са В/Анн-Арбор/1/94, В/Ленинград/14/17/55, B/USSR/60/69 и В/Ленинград/179/86.
Ряд способов является полезным для получения реассортантных вирусов, включая способы при использовании куриных эмбрионов и более современные способы культуры клеток. Смотри, например, публикацию РСТ WO 03/091401; WO 05/062820 и патенты США №№6,544,785; 6,649,372; 6,951,75, а также публикации патентных заявок США №№11/455,818, 11/455,73, и 11/501,067. Предполагается, что среда и способы в соответствии с изобретением являются полезными для получения вирусов гриппа, включая, но без ограничения, штаммы вируса гриппа, раскрытые в данной заявке, и реассортантные вирусы, включающие гены основного донорного вируса (например, са А/Анн-Арбор/6/60, са В/Анн-Арбор/1/66, PR8, и т.д.). Дополнительно предполагается, что среда и способы в соответствии с изобретением являются полезными для получения вирусов гриппа, включая реассортантные вирусы, имеющие один или более из следующих компонентов, чувствительных к температуре, адаптированных к холоду, аттенуированных фенотипов. Реассортанты могут быть получены с помощью классических реассортантных методик, например, путем способов совместной инфекции или, необязательно, с помощью методик плазмидной "помощи" (смотри, например, публикации РСТ WO 03/091401 и WO 05/062820; патенты США №№6,544,785, 6,649,372, 6,951,754, 6,887,699, 6,001,634, 5,854,037, 5,824,536, 5,840,520, 5,820,871, 5,786,199 и 5,166,057; публикации патентных заявок США №№20060019350, 20050158342, 20050037487, 20050266026, 20050186563, 20050221489, 20050032043, 20040142003, 20030035814 и 20020164770; и Neumann и др. (1999) Generation of influenza A virus entirely from cloned cDNAs. Proc Nati Acad Sci USA. 96: 9345-9350; Fodor и др. (1999) Rescue of influenza A virus from recombinant DNA. J. Virol 73: 9679-9682; Hoffmann и др. (2000) A DNA transfection system for generation of influenza A virus from eight plasmids Proc Nati Acad Sci USA 97: 6108-6113; WO 01/83794; Hoffmann и Webster (2000), Unidirectional RNA polymerase I-polymerase II transcription system for the generation of influenza A virus from eight plasmids, 81: 2843-2847; и Hoffmann и др. (2002), Rescue of influenza В viruses from 8 plasmids, 99(17): 11411-11416. Недавно были получены реассортанты путем плазмидной помощи в MDCK. клетках (смотри, например, публикацию РСТ WO 2007/124327; Wang и Duke; 2007 Oct. 23, J. Virol., 4: 102).
6.7.2 Респираторно-синцитиальный вирус
Способы, процессы и композиции, описанные в данной заявке, являются особенно полезными для получения и очистки RSV для вакцин. Любая группа, подгруппа или штамм RSV (например, группа А или группа В) могут очищаться с помощью процесса, описанного в данной заявке, и/или содержаться в иммуногенной композиции, описанной в данной заявке. Смотри, например, Sato и др., 2005, Journal of Clinical Microbiology 43: 36-40 для обсуждения групп и подгрупп RSV. В одном воплощении RSV принадлежит к группе А. В другом воплощении RSV принадлежит к группе В.
RSV, очищенный с помощью процесса, описанного в данной заявке, и/или содержащийся в иммуногенной композиции, описанной в данной заявке, может представлять собой существующий в природе штамм RSV, подвергнутый мутагенезу RSV (например, вирус, подвергнутый мутации при использовании УФ облучения, мутагенов и/или пассирования), и/или генетически сконструированный RSV. В одном воплощении RSV геном включает одну или более мутаций в одном или более вирусных генах, таких, как F, G, NS1, NS2, M1 (открытая рамка считывания ("ORF")1), M2(ORF2), SH2, N, Р или L гены. В некоторых воплощениях комбинация замен, делеций и/или инсерций вводится в RSV геном. В некоторых воплощениях RSV геном включает одну или более миссенс-мутаций (мутации с изменением смысла) в одном или более вирусных генах, таких, как F, G, NS1, NS2, M1 (ORF1), M2 (ORF2), SH2, N, Р или L гены. В некоторых воплощениях RSV геном включает делецию одного или более, всего или части одного или более вирусных генов, таких, как NS1, NS2, M1 (ORF1), M2 (ORF2), SH2, N, Р или L гены.
В одном воплощении RSV, который может быть очищен с помощью процесса, описанного в данной заявке, и/или содержаться в иммуногенной композиции, описанной в данной заявке, является дефектным по репликации. В специфическом воплощении RSV, который может быть очищен с помощью процесса, описанного в данной заявке, и/или содержаться в иммуногенной композиции, описанной в данной заявке, является аттенуированным. Для нелимитирующих мутаций, которые могут быть введены в геном RSV с целью аттенуирования вируса, смотри, например, патентную заявку США №10/831,780,23 апреля 2004 (опубликована 27 января 2005 как публикация заявки США №2005/0019891) и патентную заявку США №11/389,618, поданную 24 марта 2006 (опубликована 20 июля 2006 как публикация заявки США №2006/0160130). Аттенуированные RSV включают, но без ограничения, пассированные на холоду (ср) мутанты (например, cpRSV описанный у Kirn и др., 1971, Pediatrics 48: 745-755, который введен в данную заявку в качестве ссылки в своей целостности), чувствительные к температуре (ts) мутанты (например, RSV ts-1, RSV ts-2, ts\A, ts\9A, и ts\C, описанные, например, у Crowe и др., 1993, Vaccine 11: 1395-1404; Crowe и др., 1995, Vaccine 13: 847-855; Mills и др., 1971, J Immunol. 107: 123-130; и Pringle и др., Vaccine 1993 11:473-478), пассированные на холоду чувствительные к температуре (cpts) мутанты (например, срts248/404, срts248/255, cpts248/955 и cpts530/1009; смотри, например, Karron и др., 1997, J Infect Dis. 176: 1428-1436), и генетически сконструированные мутанты (например, rA2cp248/404ΔSH, rA2cp248/404/1030ΔSH, rΔNS1, rΔNS2-2 и r248ΔNS2, описанные, например, у Karron и др., J. of Infect. Diseases 191: 1093-1140; Whitehead и др., 1999, J. Virol. 73: 3438-3442; и Collins и др., 2005, Proc. Am. Thorac. Soc. 2: 166-173).
В специфическом воплощении RSV, который может быть очищен с помощью процесса, описанного в данной заявке, и/или содержаться в иммуногенной композиции, описанной в данной заявке, представляет собой rA2cp248/404/1030ΔSH. Этот аттенуированный RSV содержит множество аттенуирующих генетических элементов, которые отвечают за их температурную чувствительность и характеристики аттенуации, включая: (i) набор из 5 миссенс-мутаций в N, F и L белках, которые аттенуируют пассированный на холоду RSV; (ii) 248 из 1030 модификаций, которые представляют собой отдельные миссенс-мутации в L белке, которые снижают рестриктивную температуру, обеспечивают чувствительный к температуре фенотип и аттенуируют вирус; (iii) 404 модификаций, которые являются комбинацией нуклеотидной замены в стартовом транскрипционном сигнале М2 гена и миссенс-мутации в L белке, которые вместе придают дополнительную чувствительность к температуре; и (iv) ASH, который представляет собой делецию цельного гена SH, которая обеспечивает аттенуированный фенотип. Смотри Таблицу, приведенную ниже для положений аминокислотных замен, которые вводятся в RSV геном.
|
В некоторых воплощениях RSV, который может быть очищен с помощью процесса, описанного в данной заявке, и/или содержаться в иммуногенной композиции, описанной в данной заявке, конструируется для экспрессии одной или более гетерологичных последовательностей (то есть RSV представляет собой химерный вирус). Гетерологичные последовательности могут быть введены, например, в кодирующие последовательности F, G, NS1, NS1, M1 (ORF1), M2(ORF2), N, P, SH2 и/или L. Неограничивающие примеры гетерологичных последовательностей, для экспрессии которых может быть сконструирован RSV, включают антигены (например, вирусные антигены, бактериальные антигены, опухолевые антигены (такие как те, что описаны Robbins и Kawakawi, 1996, Curr. Opin. Immunol. 8: 628-636), грибковые антигены и паразитарные антигены), маркер или метку (например, flag метку и His метку), химерные белки (например, гибрид G белков RSV из двух различных штаммов RSV), а также белки, полипептиды или пептиды, обладающие желательным биологическим свойством или активностью (например, цитокины, такие как интерферон (IFN)-α IFN-β, IFN-γ, IL-2, IL-7, IL-9, IL-15, и IL-22). В специфическом воплощении химерный RSV является аттенуированным. Для неограничивающих примеров химерных RSV смотри, например, патентную заявку США №10/831,780, поданную 23 апреля 2004 года (опубликована 27 января 2005 года как публикация заявки США №2005/0019891), и патентную заявку США №11/389,618, поданную 24 марта 2006 года (опубликована 20 июля 2006 года как публикация заявки США №2006/0160130).
В одном воплощении RSV конструируют для экспрессии одного или более вирусных антигенов из вируса, который принадлежит к группе, подгруппе или штамму RSV, отличному от RSV вектора. Например, но без ограничения, RSV вектор может быть получен из группы В RSV, а гетрологичная последовательность может иметь происхождение от группы А RSV.
В другом воплощении RSV конструируют для экспрессии одного или более вирусных антигенов, которые получают или которые имеют происхождение от вируса, отличного от RSV. Неограничивающие примеры вирусных антигенов включают антигены из аденовирусов (например, мастаденовируса и авиаденовируса), вирусов герпеса (например, вируса простого герпеса 1, вируса простого герпеса 2, вируса простого герпеса 5, вируса простого герпеса 6, вируса Эпштейна-Барра, HHV6-HHV8 и цитомегаловируса), левивирусов (например, левивируса, энтеробактериальная фаза MS2, аллолевируса), вирусов оспы (например, подсемейство хордопоксвируса, парапоксвируса, авипоксвируса, каприпоксвируса, лепориипоксвируса, свипоксвируса, моллюскипоксвируса и энтеропоксивируса), паповавирусов (например, полиомавируса и папилломавируса), парамиксовирусов (например, парамиксовируса, вируса парагриппа 1, морбилливируса (например, вируса коревой краснухи), рубулавируса (например, вируса эпидемического паротита), пневмовирусов (например, пневмовируса, респираторно-синцитиального вируса человека), респираторно-синцитиального вируса человека и метапневмовируса (например, птичьего пневмовируса и метапневмовируса человека)), пикорнавирусов (например, энтеровируса, риновируса, гепатовируса (например, вируса гепатита А человека), кардиовируса и аптовируса), реовирусов (например, ортореовируса, орбивируса, ротавируса, циповируса, фидживируса, фитореовируса и оризавируса), ретровирусов (например, ретровирусов типа В млекопитающих, ретровирусов типа С млекопитающих, ретровирусов типа С птиц, группы ретровирусов типа D, BLV-HTLV ретровирусов, лентивирусов (например, вируса иммунодефицита человека типа 1 и вируса иммунодефицита человека типа 2 (например, HIV gp 160), спумавируса), флавивирусов (например, вируса гепатита С, вируса лихорадки Денге, вируса лихорадки Западного Нила), гепаднавирусов (например, вируса гепатита В), тогавирусов (например, альфавируса (например, вируса Синдбис) и рубивирусов (например, вирус краснухи)), рабдовирусов (например, везикуловируса, лиссавируса, эфемеровируса, циторабдовируса и нуклеорабдовируса), аренавирусов (например, аренавируса, вируса лимфоцитарного хориоменингита, Ippy вируса и лассавируса) и коронавирусов (например, коронавируса и торовируса). В специфическом воплощении вирусный антиген имеет происхождения от вируса, который приводит к возникновению респираторного заболевания, такой, как антигены вируса гриппа (например, гемагглютинины Н5 и Н7), антигены метапневмовируса, антигены вируса парагриппа, антигены вируса болезни Ньюкасла, антигены вируса Сендай и антигены вируса инфекционного ларинготрахеита (ILV). В некоторых воплощениях вирусный антиген имеет происхождения от вируса парагриппа человека типа 1, вируса парагриппа человека типа 2, вируса парагриппа человека типа 3, или от вируса Сендай. В другом воплощении вирусный антиген представляет собой HIV gp 120, HIV nef, нейраминидазу вируса гриппа, гемагглютинин вируса гриппа, HTLV tax, гликопротеин вируса простого герпеса (например, gB, gC, gD, и gE) или поверхностный антиген вируса гепатита В, Е белок вируса гепатита С или стержневой белок коронавируса.
В другом воплощении RSV конструируют для экспрессии одного или более бактериальных антигенов (например, бактериального поверхностного белка или протективного антигена, ассоциированного с бактериями). Нелимитирующие примеры бактериальных антигенов включают антигены, которые имеют происхождение от бактерий ponaAquaspirillum, рода Azospirillum, poaaAzotobacteraceae, рода Bacteroidaceae, видов Bartonella, рода Bdellovibrio, видов Campylobacter, видов Chlamydia (например, Chlamydia pneumoniae), рода Enterobacteriaceae (например, видов С itrobacter, Edwardsiella, Enterobacter aerogenes, видов Erwinia, Escherichia со/г, видов Hafnia, видов Klebsiella, видов Morganella, Proteus vulgaris, Providencia, видов Salmonella, Serratia marcescens и Shigellaflexneri), рода Gardmella, Haemophilus influenzae, рода Halobacteriaceae, рода Helicobacter, рода Legionallaceae, видов Listeria, рода Methylococcaceae, микобактерий (например, Mycobacterium tuberculosis), рода Neisseriaceae, рода Oceanospirillum, рода Pasteurellaceae, видов Pneumococcus, видов Pseudomonas, рода Rhizobiaceae, рода Spirillum, рода Spirosomaceae, Staphylococcus (например, устойчивый к метициллину Staphylococcus aureus и Staphylococcus pyrogenes), Streptococcus (например, Streptococcus enteritidis, Streptococcus fasciae и Streptococcus pneumoniae), рода Helicobacter, рода Yersinia, Bacillus antracis и рода Vampirovibrio. В специфическом воплощении бактериальный антиген имеет происхождение от бактерии, которая вызывает или является ассоциированной с респираторным заболеванием, такой как виды Pneumococcus, Haemophilus influenzae, Streptococcus и Chlamydia pneumoniae.
В другом воплощении RSV конструируют для экспрессии одного или более грибковых антигенов, которые получают или которые имеют происхождение от патогенных грибков. Нелимитирующие примеры грибковых антигенов включают антигены, которые имеют происхождение от Cryptococcus neoformans; Blastomyces dermatitidis; Aiellomyces dermatitidis; Histoplasma capsulatum; Coccidioides immitis; видов Candida, включая С. albicans, С. tropicalis, С. parapsilosis, С. guilliermondii и С. krusei, видов Aspergillus, включая A. fumigatus, A. flavus и A. niger, видов Rhizopus; видов Rhizomucor; видов Cunninghammella; видов Apophysomyces, включая А. saksenaea, A. mucor и A. absidia; Sporothrix schenckii, Paracoccidioides brasiliensis; Pseudallescheria boydii, Torulopsis glabrata; видов Trichophyton, видов Microsporum и видов Dermatophyres. В специфическом воплощении грибковый антиген имеет происхождение от патогенных грибков, которые вызывают или являются ассоциированными с респираторным заболеванием.
В другом воплощении RSV конструируют для экспрессии одного или более паразитарных антигенов. Нелимитирующие примеры паразитарных антигенов включают антигены, имеющие происхождение от членов типа Apicomplexa, таких, как, например, Babesia, Toxoplasma, Plasmodium, Eimeria, Isospora, Atoxoplasma, Cystoisospora, Hammondia, Besniotia, Sarcocystis, Frenkelia, Haemoproteus, Leucocytozoon, Theileria, Perkinsus и Gregarina spp.; Pneumocystis carinii; членов типа Microspora, таких как, например, Nosema, Enterocytozoon, Encephalitozoon, Septata, Mrazekia, Amblyospora, Ameson, Glugea, Pleistophora и Microsporidium spp.; и членов Ascetospora типа, таких, как, например, Haplosporidium spp., а также видов, включая Plasmodium falciparum, P. vivax, P. ovale, P. malaria; Toxoplasma gondii; Leishmania mexicana, L. tropica, L. major, L. aethiopica, L. donovani, Trypanosoma cruzi, T. brucei, Schistosoma mansoni, S. haematobium, S.japonium; Trichinella spiralis; Wuchereria bancrofti; Brugia malayli; Entamoeba histolytica; Enterobius vermiculoarus; Taenia solium, Т. saginata, Trichomonas vaginatis, Т. hominis, Т. tenax; Giardia lamblia; Cryptosporidium parvum; Pneumocytis carinii, Babesia bovis, B. divergens, B. microti, Isospora belli, L hominis; Dientamoebafragilis; Onchocerca volvulus; Ascaris lumbricoides; Necator americanis; Ancylostoma duodenale; Strongyloides stercoralis; Capillariaphilippmensis; Angiostrongylus cantonensis; Hymenolepis папа; Diphyllobothrium latum; Echinococcus granulosus, E. multilocularis; Paragonimus westermani, P. caliensis; Chlonorchis sinensis; Opisthorchis felineas, G. Viverini, Fasciola hepatica, Sarcoptes scabiei, Pediculus humanus; Phthirlus pubis; и Dermatobia hominis.
7. СПЕЦИФИЧЕСКИЕ ВОПЛОЩЕНИЯ
1. Способ получения вирусов гриппа в культуре клеток до значения log10 ТСID50/мл, по крайней мере, приблизительно 8,0 и/или до значения log10 БОЕ/мл, по крайней мере, приблизительно 8,0, включающий:
(a) размножение MDCK клеток в свободной от сыворотки культуральной среде при поддержании одного или более условий культивирования, выбранных из группы, состоящей из: скорости перемешивания от приблизительно 100 до 200 об/мин; значения рН от приблизительно 6,0 до приблизительно 7,8; температуры от приблизительно 33°С до приблизительно 42°С; и количества растворенного кислорода (DO) от приблизительно 35% до приблизительно 100%;
(b) инфицирование размноженных MDCK клеток вирусом гриппа без замены культуральной среды; и
(c) инкубацию инфицированных размноженных MDCK клеток при условиях, которые позволяют осуществлять репликацию вируса гриппа.
2. Способ воплощения 1, где культуральная среда представляет собой MediV SFM 110.
3. Способ воплощения 1 или 2, где MediV SFM 110 включает 9 г/л глюкозы.
4. Способ в соответствии с любым из предыдущих воплощений, где MDCK клетки размножают как адгезивные клетки на микроносителях.
5. Способ воплощения 4, где концентрация микроносителей составляет от 1 до 3 г/л.
6. Способ воплощения 4 или 5, где MDCK клетки высевают на микроносители при плотности от 10 до 40 клеток/микроноситель и размножают в течение от 2 до 5 дней.
7. Способ в соответствии с любым из предыдущих воплощений, где скорость перемешивания поддерживается на уровне от приблизительно 100 до 200 об/мин; значение рН поддерживается на уровне от приблизительно 6,0 до приблизительно 7,8; температура поддерживается от приблизительно 33°С до приблизительно 42°С; и количество растворенного кислорода (DO) поддерживается от приблизительно 35% до приблизительно 100%.
8. Способ в соответствии с любым из предыдущих воплощений, где MDCK клетки размножают при скорости перемешивания от 150 об/мин до 200 об/мин
9. Способ в соответствии с любым из предыдущих воплощений, где MDCK клетки размножают при значении рН от 7,0 до 7,8.
10. Способ воплощения 9, где значение рН составляет 7,4±0,2.
11. Способ в соответствии с любым из предыдущих воплощений, где MDCK клетки размножают при температуре 37±2°C.
12. Способ в соответствии с любым из предыдущих воплощений, где MDCK клетки являются депонированными в АТСС с номерами депонирования РТА-7909 или РТА-7910.
13. Способ в соответствии с любым из предыдущих воплощений, где MDCK клетки размножают до плотности клеток от 5×105 до 3×106 клеток/мл.
14. Способ в соответствии с любым из предыдущих воплощений, где этап (b) осуществляют при использовании вирусного внесения от 0,01×103 БОЕ/мл до 0,1×103 БОЕ/мл.
15. Способ воплощения 14, где этап (b) осуществляют при использовании вирусного внесения от 0,01×103 БОЕ/мл до 0,05 БОЕ/мл.
16. Способ в соответствии с любым из предыдущих воплощений, где этап (b) осуществляют при использовании внесения вируса в количестве от 0,00001 БОЕ/клетка до 0,0001 БОЕ/клетка.
17. Способ воплощения 16, где этап (b) осуществляют при использовании внесения вируса в количестве от 0,00001 БОЕ/клетка до 0,00005 БОЕ/клетка.
18. Способ в соответствии с любым из предыдущих воплощений, где вирусы гриппа являются адаптированными к холоду.
19. Способ воплощения 18, где вирусы гриппа являются также аттенуированными и чувствительными к температуре.
20. Способ в соответствии с любым из предыдущих воплощений, где вирус гриппа представляет собой вирус гриппа А.
21. Способ в соответствии с любым из предыдущих воплощений, где вирус гриппа представляет собой вирус гриппа В.
22. Способ воплощения 20, где вирус гриппа А включает один или более генных сегментов вируса гриппа штамма са А/Анн-Арбор/6/60.
23. Способ в соответствии с воплощением 21, где вирус гриппа В включает один или более генных сегментов вируса гриппа штамма са В/Анн-Арбор/1/66.
24. Способ в соответствии с любым из предыдущих воплощений, где MDCK клетки инкубируют при температуре от 30°С до 35°С во время репликации вируса гриппа на этапе (с).
25. Способ воплощения 24, где MDCK клетки инкубируют при температуре 33±2°C во время репликации вируса гриппа на этапе (с).
26. Способ в соответствии с любым из предыдущих воплощений, где MDCK клетки инкубируют при скорости перемешивания от 150 об/мин до 200 об/мин во время репликации вируса гриппа на этапе (с).
27. Способ в соответствии с любым из предыдущих воплощений, где MDCK клетки инкубируют при значении рН от приблизительно 7,0 до приблизительно 7,8 во время репликации вируса гриппа на этапе (с).
28. Способ воплощения 27, где рН составляет 7,4±0,2.
29. Способ в соответствии с любым из предыдущих воплощений, где протеаза присутствует на этапе (с).
30. Способ воплощения 29, где протеаза представляет собой серинпротеазу.
31. Способ воплощения 29 или 30, где протеаза представляет собой рекомбинантную свободную от животных контаминантов протеазу.
32. Способ воплощения 31, где протеаза является присутствующей при заключительной концентрации 0,03Х.
33. Способ в соответствии с любым из предыдущих воплощений, который дополнительное включает этап сбора культуральной среды после инфекции.
34. Способ воплощения 33, где культуральную среду собирают через 48-72 часа после инфекции.
35. Способ осуществления переноса с гранулы на гранулу клеток в культуре клеток, выращенной на микроносителях, включающий:
(а) этап первого промывания, в котором всю или часть ростовой среды заменяют промывочной средой, включающей хелатирующий агент;
(b) инкубацию культуры клеток в промывочной среде с перемешиванием или без него;
(c) прибавление протеазы к культуре клеток в промывочной среде;
(d) инкубацию культуры клеток с протеазой при перемешивании или без перемешивания; и
(e) перенос в новую емкость для роста.
36. Способ воплощения 35, который дополнительно включает второй этап промывания между этапами (b) и (с) с помощью промывочной среды, включающей хелатирующий агент.
37. Способ воплощения 35 или 36, где свежая ростовая среда и/или дополнительные микроносители прибавляют после этапа (d).
38. Способ в соответствии с любым из воплощений 35-37, где свежую ростовую среду и/или дополнительные микроносители прибавляют перед, во время или после этапа (е).
39. Способ в соответствии с любым из воплощений 35-38, где концентрация хелатирующего агента составляет от 0,4 мМ до 0,6 мМ.
40. Способ в соответствии с любым из воплощений 35-39, где значение рН промывочной среды составляет от 7,8 до 8,2.
41. Способ в соответствии с любым из воплощений 35-40, где протеаза представляет собой рекомбинантную, свободную от животных контаминантов протеазу.
42. Способ воплощения 41, где протеазу прибавляют до получения заключительной концентрации от 0,04Х до 0,06Х.
43. Способ в соответствии с любым из воплощений 35-42, где культуру клеток перемешивают во время этапа (b).
44. Способ в соответствии с любым из воплощений 35-43, где культуру клеток перемешивают во время этапа (d).
45. Способ воплощения 43 или 44, где культуру клеток перемешивают при скорости от 175 об/мин до 275 об/мин
46. Способ воплощения 45, где культуру клеток перемешивают при скорости 230±25 об/мин
47. Способ в соответствии с любым из воплощений 35-46, где культуру клеток инкубируют на этапах (b) и (d) в течение 15-60 минут.
48. Способ в соответствии с любым из воплощений 35-47, где ингибитор протеазы прибавляют после этапа (d).
49. Способ осуществления переноса с гранулы на гранулу клеток в культуре клеток, выращенных на микроносителях, включающий:
(a) прибавление хелатирующего агента к культуре клеток без промывания клеток;
(b) инкубирование культуры клеток в присутствии хелатирующего агента с перемешиванием или без него;
(c) прибавление протеазы к культуре клеток в присутствии хелатирующего агента;
(d) инкубацию культуры клеток с протеазой с перемешиванием или без него;
и
(e) прибавление дополнительной свежей среды и пополнение культуры клеток одним или более компонентами среды.
50. Способ воплощения 49, где один или более компонентов среды являются выбранными из группы, состоящей из CaCl2, MgCl2, MgSO4, микроэлементов А, микроэлементов В и микроэлементов С.
51. Способ воплощения 49 или 50, где один или более компонентов среды составляют от 1,25 мМ до 1,5 мМ СаСl2, от 0,1 мМ до 0,2 мМ MgCl2 и от 0,1 до 0,8 мМ MgSO4, 2Х микроэлементов А, 2Х микроэлементов В, и 2Х микроэлементов С.
52. Способ в соответствии с любым из воплощений 49-51, где культуру клеток переносят в новую емкость для роста до, во время или после этапа (е).
53. Способ в соответствии с любым из воплощений 49-52, где концентрация хелатирующего агента составляет от 0,5 мМ до 5 мМ.
54. Способ воплощения 53, где концентрация хелатирующего агента составляет приблизительно 2 мМ.
55. Способ в соответствии с любым из воплощений 49-54, где значение рН культуры клеток доводят, в случае необходимости, до значения от 7,8 до 8,2 перед или во время этапа (с).
56. Способ в соответствии с любым из воплощений 49-55, где протеаза представляет собой рекомбинантную, свободную от животных компонентов протеазу.
57. Способ в соответствии с любым из воплощений 49-56, где протеазу прибавляют до получения заключительной концентрации от 0,04Х до 0,06Х.
58. Способ в соответствии с любым из воплощений 49-57, где культуру клеток перемешивают во время этапа (b).
59. Способ в соответствии с любым из воплощений 49-58, где культуру клеток перемешивают во время этапа (d).
60. Способ воплощения 58 или 59, где культуру клеток перемешивают при скорости от 175 об/мин до 275 об/мин
61. Способ в соответствии с любым из воплощений 49-60, где культуру клеток инкубируют на этапах (b) и (d) в течение 15-90 минут.
62. Способ в соответствии с любым из воплощений 49-61, где ингибитор протеазы прибавляют после этапа (d).
63. Способ очистки вирусов гриппа от культуры клеток, включающий:
(a) осветление вирусного урожая путем фильтрации прямого потока (DFF), по крайней мере, через одну мембрану, которая имеет размер пор от приблизительно 1,2 микрометров до приблизительно 0,45 микрометров;
(b) концентрацию путем ультрафильтрации тангенциального потока (UF) и замену буфера путем диафильтрации (DF) после этапа (а) при использовании мембраны, обладающей отсечением молекулярного веса (MWCO) 500 кДа;
(c) очистку путем аффинной колоночной хроматографии после этапа (b);
(d) концентрацию с помощью ультрафильтрации и/или замены буфера с помощью диафильтрации после этапа (с) при использовании мембраны, обладающей отсечением молекулярного веса (MWCO) 500 кДа; и
(e) стерилизацию после этапа (d) путем DFF, по крайней мере, через одну мембрану, которая имеет размер пор от приблизительно 0,45 микрометров до приблизительно 0,22 микрометров, где общее извлечение очищенных вирусов составляет, по крайней мере, 30%, и где очищенные вирусы включают менее чем 0,1 нг HCD, и менее чем 0,3 мкг НСР на 7,0±0,5 log10 БОЕ вируса.
64. Способ воплощения 63, где сахарозу и фосфатный буфер прибавляют к вирусному урожаю до получения заключительной концентрации, в пределах 10% вариации, 218 мМ сахарозы, 11 мМ фосфатного буфера рН 7,0-7,4, перед этапом (а).
65. Способ воплощения 63 или 64, где этапы (а) и (b) объединены.
66. Способ в соответствии с любым из воплощений 63-65, где этап (b) осуществляют при трансмембранном давлении (ТМР) от приблизительно 10 фунтов на квадратный дюйм до приблизительно 20 фунтов на квадратный дюйм.
67. Способ в соответствии с любым из воплощений 63-66, где этап (b) осуществляют при скорости истечения от приблизительно 35 литров на метр в час (LMH) до приблизительно 50 LMH.
68. Способ в соответствии с любым из воплощений 63-67, где этап (b) осуществляют при скорости сдвига от приблизительно 12000 с-1 до приблизительно 16000 с-1.
69. Способ в соответствии с любым из воплощений 63-68, где этап (b) приводит к получению 5Х концентрации и к замене, по крайней мере, 5 диаобъемов буфера.
70. Способ в соответствии с любым из воплощений 63-69, где буфер обмена в этап (b) включает, в пределах 10% вариации, 218 мМ сахарозы, 11 мМ фосфатного буфера рН 7,0-7,4.
71. Способ в соответствии с любым из воплощений 63-70, где буфер заменяют путем диафильтрации, которую осуществляют на этапе (d).
72. Способ в соответствии с любым из воплощений 63-70, где концентрацию с помощью ультрафильтрации и замену буфера путем диафильтрации осуществляют на этапе (d).
73. Способ в соответствии с любым из воплощений 63-70 или 72, где этап (d) приводит к получению, по крайней мере, 2Х концентрации.
74. Способ в соответствии с любым из воплощений 63-73, где минимально 8 диаобъемов буфера заменяют на этапе (d).
75. Способ в соответствии с любым из воплощений 63-74, где буфер обмена на этапе (d) включает, в пределах 10% вариации, 200 мМ сахарозы, 100 мМ фосфатного буфера рН 7,0-7,4.
76. Способ в соответствии с любым из воплощений 63-75, где от 8,0 log10 БОЕ до 11 log10 БОЕ вирусов гриппа загружают на мл аффинной среды.
77. Способ воплощения 76, где от 9,0 log10 БОЕ до 10,0 log10 БОЕ вирусов гриппа загружают на мл аффинной среды.
78. Способ воплощения 76, где от 9,2 log10 БОЕ до 9,8 log10 БОЕ вирусов гриппа загружают на мл аффинной среды.
79. Способ в соответствии с любым из воплощений 63-78, где после загрузки вируса аффинную среду промывают с помощью буфера, включающего, в пределах 10% вариации, 218 мМ сахарозы, 11 мМ фосфатного буфера рН 7,0-7,4.
80. Способ в соответствии с любым из воплощений 63-79, где этап (с) дополнительно включает воздействие буфера, включающего неспецифическую эндонуклеазу.
81. Способ воплощения 80, где длительность воздействия буфера, включающего неспецифическую нуклеазу, составляет от 30 до 90 минут.
82. Способ воплощения 81, где длительность воздействия буфера, включающего неспецифическую нуклеазу, составляет 50±10 минут.
83. Способ в соответствии с любым из воплощений 80-82, где неспецифическая эндонуклеаза представляет собой Бензоназу™.
84. Способ в соответствии с любым из воплощений 80-83, где буфер, включающий неспецифическую эндонуклеазу, включает, в пределах 10% вариации, 218 мМ сахарозы, 11 мМ фосфатного буфера рН 7,0-7,4 и неспецифическую эндонуклеазу при заключительной концентрации от 40 Ед./мл до 60 Ед./мл.
85. Способ в соответствии с любым из воплощений 80-84, где после обработки с помощью буфера, включающего неспецифическую эндонуклеазу, аффинную среду промывают с помощью буфера, включающего, в пределах 10% вариации, 218 мМ сахарозы, 11 мМ фосфатного буфера рН 7,0-7,4.
86. Способ в соответствии с любым из воплощений 80-85, где очищенные вирусы включают менее чем 0,0050 нг неспецифической эндонуклеазы на 7,0±0,5 log10 БОЕ вируса.
87. Способ в соответствии с любым из воплощений 63-86, где аффинная среда является выбранной из группы, состоящей из Целлуфина™ сульфата и FluSelect™.
88. Способ в соответствии с любым из воплощений 63-87, где вирусы гриппа элюируют из аффинной среды с помощью буфера, включающего, в пределах 10% вариации, 1 М хлорида натрия, 218 мМ сахарозы и 11 мМ фосфатного буфера рН 7.0-7,4.
89. Вирусы гриппа, полученные с помощью способа в соответствии с любым из воплощений 1-34 или 63-88.
90. Очищенные вирусы гриппа, включающие менее чем 0,1 нг HCD и менее чем 0,3 мкг НСР на 7,0±0,5 log10 БОЕ вируса, где вирусы гриппа очищают из культуры клеток млекопитающих.
91. Очищенные вирусы гриппа воплощения 90, где клетки млекопитающих являются выбранными из группы, состоящей из диплоидных клеток человеческих фибробластов, клеток ретинобластомы человека, клеток почки человека, клеток легких резусного эмбриона, клеток почки африканской зеленой мартышки и клеток почки собаки.
92. Очищенные вирусы гриппа воплощения 90, где клетки млекопитающих представляют собой MDCK клетки.
93. Очищенные вирусы гриппа воплощения 90, где клетки млекопитающих представляют собой культуру клеток VERO.
94. Иммуногенная композиция, включающая полипептиды вирусов гриппа в соответствии с любым из воплощений 89-93.
8. ПРИМЕРЫ
Изобретение далее будет описанным со ссылкой на следующие примеры. Эти примеры обеспечиваются только с целью иллюстрации, и изобретение никоим образом не может трактоваться как такое, которое будет ограничиваться этими примерами, вместо этого будет предназначаться для того, чтобы охватывать все вариации, которые станут очевидными в результате описания идей, которые обеспечиваются в данной заявке. Конечно, будет оценено, что специфические списки и описания используемого частного оборудования и реагентов, размеров, производителей и т.д., не будут считаться такими, которые ограничивают настоящее изобретение, если это не является специально указанным. Кроме того, будет оценено, что другое оборудование и реагенты, которые ведут себя подобным образом, могут легко заменять описанное.
8.1 Среда и процессы культуры клеток
Композиции свободной от сыворотки среды (например, MediV SFM 107, MediV SFM 105), полезные для размножения MDCK клеток, в частности, неканцерогенных MDCK клеток, были описаны ранее (смотри, например, FL410US и G-FL414US). Однако работа при использовании этих композиций свободной от сыворотки среды с неканцерогенными MDCK клетками, адаптированными к свободной от сыворотки среде (например, депозитный номер АТСС РТА-7909 или РТА-7910), выявила, что несмотря на то, что целесообразный пик вирусных титров (обычно измеряется как log10 БОЕ/мл) реассортантного вируса гриппа может быть получен без замены среды, пик титров все еще остается ниже того, который получают при использовании замены среды, когда часть (например, ~67%) ростовой среды удаляется и заменяется инфекционной средой после размножения клеток и перед (или в одно и то же время) инфицированием. Кроме того, требуется прибавление протеазы (TrypLE) для получения таких пиковых титров. Для преодоления необходимости замены среды и/или требования прибавления протеазы разрабатывали усиленную среду, MediV SFM 110. MediV SFM 110 включает 5х концентрацию витаминов, линолевую кислоту, липоевую кислоту, нуклеозиды, путресцин и почти все аминокислоты, которые присутствуют в описанных ранее средах. Применение MediV SFM 110 не улучшало плотности клеток по сравнению с таким, полученными при использовании MediV SFM 105 +ТЕ (данные не представлены). Однако использование MediV SFM 110,0% и 67% замены среды продемонстрировало подобные вирусные титры.
Осуществление двенадцати прогонов при использовании процесса без замены среды (MX) и клеток, полученных путем переноса с гранулы на гранулу (смотри Пример, который обеспечивается в Разделе 8.2, приведенном ниже) из четырех посевных реакторов и выращенных в среде MediV SFM 110, описывается ниже. Три адаптированных к холоду (со), чувствительных к температуре (ts), аттенуированных (att) реассортантных штамма вируса гриппа, включающих НА и NA из штаммов дикого типа А/Уругвай/716/2007, А/Южная Дакота/6/2007 и В/Флорида/4/2006 (со ссылкой на штамм дикого типа с помощью предшествующего идентификатору "са"), получали в объеме 2 л и все три штамма вирусов получали при титре, по крайней мере, 8,4 log10 БОЕ/мл. Собственное отделение клеток в посевных реакторах и присоединение клеток в реакторах для заключительного получения (FPR) наблюдали после переноса с гранулы на гранулу при использовании 1 х DPBS промывания и трипсинизации при использовании TrypLE select и ЭДТА при значении рН 8,0. После инфицирования периодически отбирали образцы клеток для определения оптимального времени сбора. Было обнаружено, что пик титров вируса наблюдали через 3 дня после инфицирования (dpi) для всех типов вирусов. Осуществляли четыре прогона каждого из этих штаммов для подтверждения воспроизводимости результатов, и данные находились в соответствии друг с другом, са А/Уругвай/716/2007 обеспечивал получение самого высокого титра при 8,7±0,05 log10 БОЕ/мл через 3 дня после инфицирования (dpi), в то время как пики титров для са А/Южная Дакота/6/2007 и са В/Флорида/4/2006 составляли 8,8±0,0 log10 БОЕ/мл и 8,45±0,25 log10 БОЕ/мл соответственно через 3 дня после инокуляции.
Воспроизводимость данных этих прогонов свидетельствовала о том, что процесс при отсутствии замены среды представляет собой эффективный процесс. Таким образом, усиленная среда поддерживала продуктивность при отсутствии либо замены, либо прибавления среды или ее компонентов. В соответствии с этим разработка и применение усиленной среды преодолевало одну из наиболее затруднительных операционных проблем в получении вакцины против гриппа на основе культуры клеток необходимость замены/пополнения среды.
8.1.1 Материалы и способы
Материалы, реагенты и оборудование: другие материалы, оборудование и реагенты, которые ведут себя подобным образом, могут с легкостью быть использованы для их замены.
1. Модифицированная Дюльбекко среда Игла (DMEM) / Ham F12 (Gibco, Grand Island, NY, кат. номер МЕ 080012)
2. MilliQ или WFI вода
3. MediV SFM 110 основной порошок (Gibco, Grand Island, NY, кат. номер ME 080045)
4. Глюкоза (Invitrogen, Carlsbad, California, кат. номер 15023-021)
5. Селенит натрия (Sigma, St. Louis, МО, кат. номер 6607-31)
6. L-глутамин (Gibco, Grand Island, NY, кат. номер 25030-081)
7. CD липиды (100Х) (Gibco, Grand Island, NY, кат. номер 11905-031)
8. Пшеничный пептон (Organotechnie, SAS, La Coumeuve, France, кат. номер 19559)
9. Инсулин (Serological, Norcross, GA, кат. номер 4506)
10. Т3 (Sigma, St. Louis, МО, кат. номер Т5516)
11. Гидрокортизон (Mallinckrodt, Phillipsburg, NY, кат. номер 8830(-05))
12. Простагландин El (Sigma, St. Louis, МО, кат. номер Р7527)
13. EGF (Sigma, St. Louis, МО, кат. номер Е9644)
14. Двойная соль лимоннокислого железа (J Т Baker, Phillipsburg, NJ, кат. номер 1980-01)
15. Трополон (Sigma, St. Louis, МО, кат. номер T89702-5G)
16. Микроэлементы A (Cellgro/Mediatech, Manassas, VA, кат. номер 99-182-cl)
17. Микроэлементы В (Cellgro/Mediatech, Manassas, VA, кат. номер 99-175-cl)
18. Микроэлементы С (Cellgro/Mediatech, Manassas, VA, кат. номер 99-176-cl)
19. Биокарбонат натрия (Invitrogen, Carlsbad, California, кат. номер 91425/87-5067)
20. Забуференный фосфатом физиологический раствор Дюльбекко (DPBS) рН-7,4 (Invitrogen, Carlsbad, California, кат. номер 14190-367)
21. Пакет раствором ЭДТА - DPBS (Gibco кат. номер 14190-367)
22. 0,5 М ЭДТА рН8 (Gibco, Grand Island, NY, кат. номер 15575-038)
23. 0,2 мкм стерильный фильтр (Millipore, Bedford, MA, кат. номер SCGPU05RE)
24. TrypLE Select (Gibco, Grand Island, NY, кат. номер 12563)
25. Ингибитор трипсина из лимской фасоли (Worthington, Lakewood, NJ, кат. номер LS002829)
26. Цитодекс 3 (Amersham Biosciences, Piscataway, NJ, кат. номер 17-0485-03)
27. Фосфат чахарозы (Hyclone, Logan, UT, кат. номер SH3A1578-01)
28. Стерильный резервуар на 10-20 л (SAFC Biosciences JRH, Lenexa, Kansas, 1329B)
29. Роллерные флаконы (Coming, Coming, NY, кат. номер 3907)
30. 1 М раствор NaOH (EMD, Darmstadt, Germany, кат. номер 1071)
31. 0,2 мкм стерильный фильтр (Coming, Coming, NY, кат. номер 430320,430767)
32. Пипетки на 1 мл, 5 мл, 10 мл, 25 мл, 50 мл (VWR, Brisbane, CA, кат. номера 53284-700, 53283-704, 708,710, соответственно)
33. Пипетки на 5 мл для отсасывания (VWR, Brisbane, CA, кат. номер 53392-044)
34. Пробирки Эппендорфа на 1,8 мл (USA Scientific, Ocala FL, кат. номер 1415-5510)
35. Наконечники для микропипеток (Art Molecular Bioproducts, San Diego CA, кат. номер 20Е, 200E и 1000Е)
36. Фосфат сахарозы, Юх (Hyclone, Logan, UT, кат. номер SH3A1578-01)
37. Блоки командоаппарата Applikon (Applikon Biotechnology, Foster City, CA модели: ADI 1010, ADI 1025)
38. Стеклянная емкость на 3 л с крышкой (Biotechnology, Foster City, CA)
39. 2,5" A310 мешалки (Lightnin, Rochester, NY)
40. 60 мм marine мешалка (Applikon Biotechnology, Foster City, CA).
41. 45 мм marine мешалки (Applikon Biotechnology, Foster City, CA).
42. Перистальтический насос (Watson Marlow Bredel Pump, Wilmington, MA, модель 520S/R)
43. Камера биологической безопасности (The Baker Company, Sanford, ME, SG-600)
44. Термостат для роллерных флаконов (Belico Biotechnology, Vineland, NJ, модель 7630-80589)
45. Водяная баня (Boekel Grant, West Chester, PA, PB-1400)
46. Счетчик клеток Nucleocounter (Newe Brunswick Scientific, Edison, NJ, M1293-0000)
47. Bioprofile 400 (Nova Biomedical, Waltham, MA, Bioprofile 400)
48. Микроскоп (Zeiss, Thomwood, NY, Axiovert 25)
49. Цифровая камера (Nikon, Melville, NY, модель Е5400)
50. Микропипетки (Labsystem, Boston, MA, Model No. P2-20, P100. P200, P1000)
51. Устройство для пипетирования (Drwnmond, Broomall, PA, кат. номер 4-000-100)
52. COz термостат для встряхиваемых колб (ATR Biotech, Laurel, MD, модель АJ 118).
Источник получения клеток: Свободный от сыворотки клон MDCK клеток ID 9В9-1Е4 (АТСС депозитный номер РТА-7910, смотри WO 08/105931), полученный из Process Development Bank (PDB), культивировали в роллерных флаконах при использовании MediV SFM105 с микроэлементами А, В и С или MediV SFM1094. Состав MediV SFM 105 с микроэлементами А, В и С является подобным среде MediV SFM 109, за исключением того, что MediV SFM 105 представляет собой жидкость, а MediV SFM109 представляет собой порошок. Клетки пассировали обычным способом каждые 3-4 дня после высевания при SOP D02005, за исключением того, что не осуществляли промывания 2х DPBS.
Посевной материал вируса:
Этот процесс совершенствовали при использовании сезонного штамма 2008/2009 FluMist®: са А/У ругвай/716/2007 (партия # nb3903pg94, 141900675A), са А/Южная Дакота/6/2007 (партия # 141900666), и са В/Флорида/4/2006 (141900641А). Все эти препараты для инокуляции получали на куриных эмбрионах. Подобные результаты были получены для посевного материала вирусов, полученных в культуре клеток при использовании способов "спасения" плазмиды (смотри, например, Wang и Duke; 2007 23 октября, J. Virol. 4: 102; Hoffmann, и др., 2000, PNAS, 97(11): 6108-13; и Hoffmann и др., 2002, PNAS, 99(17): 11411-6).
Культуральная среда: для этих прогонов использовали среду MediV SFM 105 с 1X растворами микроэлементов А, В и С с общим содержанием D-глюкозы 4,5 г/л или MediV SFM 109 с общим содержанием D-глюкозы 4,5 или 9,0 г/л при обычном пассировании клеток для роллерных флаконов и прогонов в посевных реакторах (SRs), соответственно. Использовали MediV SFM 110 среду с общим содержанием D-глюкозы 9,0 г/л для прогонов реакторов заключительного получения (FPR). В зависимости от условий посева и предполагаемых концентраций содержание D-глюкозы может доводиться до значения от приблизительно 4,5 до приблизительно 9,0 г/л. Состав каждой культуральной среды подробно приведен в Таблице.
|
|
|
|
|
|
|
Условия биореактора и способы: Для всех экспериментов FPR инокулировали при использовании разведения содержания из посевного реактора 1:8 (SR) и инфицировали с помощью реассортантов сезонных вирусов 2008/2009, са А/Уругвай, са А/Южная Дакота и са В/Флорида. Несколько FPR прогоняли при идентичных условиях для обеспечения эксплуатационной надежности процесса и записи вариабельности. Первые три эксперимента осуществляли для сравнения процессов с заменой среды (MX) и такового без замены среды (No-MX), проводимых одновременно при использовании одного вируса 2008/2009 для каждого эксперимента. Каждый из первых трех экспериментов 2×2 л FPR осуществляли в нескольких повторностях при идентичных условиях, где процесс при отсутствии замены среды осуществляли во время инфицирования и реакторы инфицировали тем же штаммом вируса для записи процесса вариабельности. Таким образом, в общей сложности 6×2л биореакторов инокулировали с помощью разведения содержания 1:8 культура клеток из SR и инфицировали с помощью всех трех сезонных штаммов вируса 2008/2009 при использовании процесса без замены среды.
Последние два эксперимента осуществляли для получения большего количества данных для проведения процесса без замены среды для 08/09 штамма. Для четвертого эксперимента 3×2 л FPR инокулировали из 1×2 л SR и инфицировали с помощью трех сезонных реассортантных типов вирусов. Эксперимент 5 был повтором эксперимента 4 при использовании идентичных условий. Эксперимент повторяли для того, чтобы осуществить запись процесса вариабельности для оценки возможности осуществления процесса без замены среды.
Штамм вируса, используемый для инфицирования, и используемый источник клеток для инокуляции FPR в каждом эксперименте являются описанными в Таблице.
|
Посевные реакторы (SR): Для всех экспериментов клетки выращивали в посевных биореакторах в объеме либо 2 л, либо 5 л при использовании 2 г/л Cytodex 3 микроносителей в MediV SFM 105 среде, содержащей растворы микроэлементов А, В и С (MediV SFM 105 + ТЕ), или MediV SFM 109 среде. Состав среды MediV SFM 105 с микроэлементами А, В и С был почти идентичным таковому среды MediV SFM 109, за исключением того, что MediV SFM 105 представляла собой жидкость, а MediV SFM 109 представляла собой порошок и содержала меньше селенита натрия. Концентрации глюкозы и глутамина составляли 9,0 г/л и 4 мМ, соответственно. Флаконы инокулировали при плотности 1,35×105 клеток/мл для экспериментов 1-3 и 1,8×105 клеток/мл для экспериментов 4 и 5. Содержание растворенного кислорода (D.O.) в SR поддерживали на уровне 50% при использовании комбинации чистого кислорода и N2 при постоянной скорости потока 0,02 vvm. Контроль значения рН был двусторонним и осуществлялся как при использовании СO2, так и 1N NaOH для всех SR. Рабочий объем SR для эксперимента 1 и эксперимента 2 составлял 2 л и 5 л, соответственно. Оба реактора были оснащены лопастью для перемешивания и перемешивание осуществляли при 175 об/мин Рабочий объем SR для экспериментов 3 и 4 составлял 2 л. Оба реактора были оснащены 2 Lightnin мешалкой для перемешивания и перемешивание осуществляли при 175 об/мин Влиянием лопасти для перемешивания и рабочего объема на рост клеток и метаболизм пренебрегали для исследования. Для первых 3 экспериментов SR инокулировали с помощью 22,5 клеток/МС. Для того чтобы достичь лучшего роста клеток, SR для экспериментов 4 и 5 инокулировали с помощью 30 клеток/МС. Экспериментальная модель, описывающая каждый FPR с его соответствующим SR, является представленной в Таблице, а условия процесса являются описанными в Таблице для каждого SR. На 4 день после посева отключали контроль устройства для перемешивания, поток газа и D.O. и температурный контроль SR для оседания микроносителей, клетки промывали и трипсинизировали с помощью половины рабочего раствора биореактора с прибавлением 10 × TrypLE и значением рН8, существенно так, как подробно представлено ниже в Примере, который обеспечивается в Разделе 8.2, представленном ниже. Содержимое SR подвергали трипсинизации при использовании В2В прописи переноса, как указано в Таблице.
Реакторы заключительной продукции (FPR): Содержимое засеянных реакторов потом закачивали в порционные емкости и 125 мл этого клеточного инокулята использовали для инокуляции FPR при разведении 1:8. Клетки в FPR выращивали в MediV SFM 110 среде, содержащей глюкозу при концентрации 9,0 г/л. Стеклянные резервуары FPR на 2 л были оснащены 2 Lightnin мешалками и перемешивание осуществляли при 175 об/мин D.O. контролировали при 50% насыщении воздуха, что находилось под контролем стратегии суммарного потока при 0,02 vvm, где постоянный суммарный поток на уровне 40 мл/мин поддерживали, когда снабжение газообразным N2 подсчитывали из содержания O2 и CO2 газов (N2=40-O2-CO2). Контроль значения рН был двусторонним как при использовании СО2, так и 1N NaOH, для всех FPR. Температуру во время фазы роста и инфицирования поддерживали на уровне 37°С и 33°С, соответственно. Штаммы вирусов для FPR являются приведенными в 0, а условия процесса во время фазы роста и инфицирования для FPR являются приведенными в 0.
|
|
|
|
Среда, содержащая клетки, концентрируется 2Х во время процесса переноса с гранулы на гранулу. В соответствии с этим 125 мл продукта переноса с гранулы на гранулу является эквивалентным 250 мл продукта до переноса.
Аналитические процедуры: Осуществляли ежедневное взятие образцов из флаконов. Клетки подсчитывали при использовании устройства для подсчета клеток Nucleocounter, и фотографии делали при использовании микроскопа при 10х увеличении для проверки морфологии клеток. рН, pO2, рСО2 и концентрации глюкозы, лактата, глутамина и аммония подвергали мониторингу ежедневно при использовании анализатора Nova Bioprofile 400. Поверку рН биореактора осуществляли тогда, когда различие между онлайновыми и офлайновыми значениями было выше чем 0,03 единицы рН. Инфицированные образцы стабилизировали с помощью 10х фосфата сахарозы (SP) и замораживали при -80°С до проведения анализа. Процесс размножения вируса подвергали анализу путем измерения вирусной инфективности с помощью фокального флуоресцентного анализа (FFA) существенно так, как описано ниже.
Фокальный флуоресцентный анализ CFFA): MDCK клетки выращивали в планшетах на 96 ячеек в MEM/EBSS+ IX неэссенциальных аминокислот + 2 мМ глутамина + пенициллин/стрептавидин (VGM) при 36±1°C, 5±2% CO2, до достижения конфлуэнтности (~4 дня). VGM потом удаляли и клетки промывали с помощью свежей VGM, после чего инфицировали с помощью 100 мкл вирусного инокулята (например, са А/Уругвай, са А/Южная Дакота и са В/Флорида) то есть серийно разводили (например, 10-1, 10-2 … 10-7) в VGM и инкубировали в течение приблизительно 19-20 часов при 33±1°С, 5±2% СО2. Каждым разведением вируса инокулировали клетки в трехкратной повторности. После инкубации в течение приблизительно 19-20 часов при 33±1°С, 5±2% СO2 клетки подвергали иммуноокрашиванию с помощью антигриппозных антител для определения титра вируса образцов в соответствии со следующей процедурой. Среду для культуры клеток, содержащую вирусы, удаляли из каждого планшета, и планшеты промывали с помощью 200 мкл/ячейка DPBS, после чего фиксировали при использовании 100 мкл холодного 4% параформальдегида в течение 15±3 минут при комнатной температуре. Потом планшет дважды промывали с помощью 250 мкл/ячейка 1X забуференным фосфатом физиологическим раствором + 0,05% Твин 20 (TPBS), после чего инкубировали клетки с первичным антителом, специфическим либо к А штамму, либо к В штамму. Первичные антитела разводили до желаемого разведения в 0,1% сапонине, 1% BS, и 0,1% азиде натрия в 1X PBS (SBSA). После инкубации в течение 60±5 минут при 37±1°С первичное антитело удаляли, клетки трижды промывали с помощью 250 мкл TPBS, и вторичное антитело, конъюгированное с флуоресцентным красителем (например, кроличье анти-баранье антитело, меченное с помощью FITC), полученное до желаемого разведения в SBSA, прибавляли к ячейкам. После инкубации в течение 60±5 минут при 37±1°С удаляли вторичное антитело и планшеты дважды промывали так, как описано выше, и дважды с помощью нановоды, после чего высушивали при использовании бумажных полотенец. Планшеты потом высушивали на воздухе при снятой крышке в темноте при комнатной температуре в течение, крайней мере, 10 минут. Визуализировали флуоресцентные сигналы при использовании инвертированного флуоресцентного микроскопа при 100х общем увеличении. Изображения создавали при использовании программного обеспечения для создания изображений, такого, как программа SPOT. В общем случае исследовали центральную полосу каждой ячейки и подсчитывали все бляшки и учитывали только те ячейки, которые имели значение от 8 до 120 бляшек, log10 БОЕ/мл подсчитывали для всех учтенных ячеек, после чего вычисляли среднее значение и стандартное отклонение трех ячеек.
8.1.2 Результаты и обсуждение
Клетки инокулировали при использовании 22,5 и 30 клеток/микроноситель (МС) для посевных биореакторов для первых 3 экспериментов и последних 2 экспериментов, соответственно. Фигура 1 представляет график плотности жизнеспособных клеток (VCD) и жизнеспособность клеток (V%) для SR для всех экспериментов. На 4 dps плотности клеток для посевных реакторов колебались от 0,94 до 1,14 миллионов клеток/мл. Отличие плотности клеток потенциально возникало по причине различия в концентрации клеток, используемой для инокуляции - 22,5 и 30 клеток/МС. Плотность клеток на 4 день после высевания (dps) в SR, инокулированных при использовании 22,5 и 30 клеток/МС, составляла 0,95±0,01 и 1,12±0,024 миллион клеток/мл, соответственно. Клеточная жизнеспособность для всех биореакторов была выше 90%. После 4 дней культивирования перенос с гранулы на гранулу при использовании промывания 1×0,5 мМ ЭДТА - DPBS и 10 × TrypLE Select осуществляли в посевных реакторах для трипсинизации клеток. Трипсинизация длилась 30 +/- 10 минут, периодически отбирали образцы для того, чтобы наблюдать за отделением клеток под микроскопом. Через приблизительно 30-40 минут трипсинизации приблизительно 90% клеток отделялись от МС, они представляли собой одиночные клетки, как показано на Фигуре 2. Трипсинизированные клетки использовали для инокуляции биореакторов заключительной продукции при разведении 1:8 для всех экспериментов. График роста для всех FPR построен на Фигуре 3. Поскольку VCD для всех FPR в эксперименте 2 составляли менее чем 0,6×106 клеток/мл на 4 dps, и культура клеток в этих FPR демонстрировала более длительную lag фазу, эти клетки инфицировали на 5 dps вместо 4 dps. В дополнение, данные, полученные после инфицирования VCD, не были доступными для FPR в эксперименте 4. В завершении, несмотря на низкое значение VCD, которое составляло менее чем 0,5×106 клеток/мл, FPR инфицировали на 4 dps в эксперименте 5. Жизнеспособность была выше 90% для FPR во время фазы роста клеток.
Плотность клеток на момент инфицирования для всех FPR указана в Таблице. Наблюдали большие вариации в плотности жизнеспособных клеток. Это значение колебалось от 0,44 до 1,12×106 клеток/мл. Это различие было связано с ошибкой при подсчете клеток. Среднее значение VCD как для SR, так и для FPR является представленным в Таблице. На 4 dps среднее значение VCD для SR и FPR составляло приблизительно 1,12×106 клеток/мл и 0,73×106 клеток/мл, соответственно.
|
|
После трипсинизации клетки в FPR прикреплялись к гранулам микроносителя на 0 dps и потом начинали размножаться на поверхности гранул микроносителя. Большая часть микроносителей была покрыта клетками и только некоторые гранулы оставались пустыми (ни одной клетки, покрывающей гранулу) через 4 dps. Морфология клеток была подобной во всех экспериментах. Фотографии, которые демонстрируют типичную морфологию клеток через 3 dps и 4 dpi, являются представленными на Фигуре 4 и Фигуре 5, соответственно.
Через 4 или 5 dps FPR в экспериментах 1, 2 и 3 инфицировали с помощью са А/Уругвай, са А/Южная Дакота и са В/Флорида, соответственно. Перед инфицированием к среде культуры клеток прибавляли 0,03×10 × TrpLE select. В экспериментах 4 и 5 индивидуальные FPR инфицировали с помощью одного из трех сезонных штаммов са А/Уругвай, са А/Южная Дакота и са В/Флорида при дозе 20 БОЕ/мл. Фигура 6 показывает, что пик титра вируса достигался в период от 68 до 74 часов после инфекции (hpi). Кроме того, титр вируса оставался высоким после этого до 92 hpi.
Среднее значение титров вируса для каждого типа вирусного штамма является подытоженным в Таблице. Эти значения составляли 8,7, 8,8 и 8,45 log10 БОЕ/мл для са А/Уругвай, са А/Южная Дакота и са В/Флорида, соответственно. Это находилось в соответствии или было выше, чем то, которое наблюдали для этих вирусов, когда осуществляли 67% замену среды.
Осуществляли дополнительные эксперименты для сравнения титров вирусов для четырех штаммов (са А/Висконсин/67/05, А са А/Уругвай, са А/Южная Дакота и са В/Флорида), полученных при использовании процесса 67% замены среды (осуществляли существенно так, как описано в международной патентной публикации WO 08/105931, смотри Пример 12), с процессом без замены среды (осуществляли существенно так, как описано выше). Осуществляли, по крайней мере, два прогона для каждого процесса и штамма. Как можно видеть из Фигуры 7, пики титров вирусов для каждого штамма являются сравнимыми для процесса с 67% заменой среды и процесса без замены среды.
|
Замена среды представляет собой основной операционный этап в современном процессе производства вакцины против гриппа на основе культуры клеток. Много попыток было сделано для того, чтобы устранить замену среды перед инфицированием, поскольку без замены среды вероятность контаминации микроорганизмами будет снижаться и могут использоваться более операционно благоприятные процессы. Посредством осуществления серий двенадцати прогонов биореактора без замены среды осуществляли сбор данных по осуществлению процесса, в частности, относительно отделения/прикрепления клеток, клеточного роста и титров вируса, для оценки вариабельности нового процесса для получения вакцины и осуществимости инокуляции FPR с помощью клеток, непосредственно взятых из SR, при использовании новой процедуры переноса с гранулы на гранулу. Каждый из трех вирусных штаммов, в частности, са А/Уругвай, са А/Южная Дакота и са В/Флорида, получали четыре раза без замены среды перед инфицированием. Было подтверждено, что VCD может достигать значения вплоть до 1×106 клеток/мл через 4 dps в SR, и В2В перенос при использовании 1x DPBS, TrypLE Select и ЭДТА может успешно осуществляться с эффективным (>90%) отделением клеток в посевных реакторах через 30-40 минут после трипсинизации. Клетки в FPR размножаются на поверхности гранул микроносителя и среднее значение VCD составляет приблизительно 0,73×106 клеток/мл на момент инфицирования. Пики титров вируса для са А/Уругвай, са А/Южная Дакота и са В/Флорида для всех прогонов FPR при отсутствии MX процесса составляли 8,7±0,05, 8,8±0,0 и 8,45±0,25 log10 БОЕ/мл, соответственно через 3 dpi. Это было лучше, чем или соответствовало таковому, которое обычно наблюдается для вирусного штамма с 67% заменой среды (смотри Фигуру 8). Пик титров вируса для всех типов вируса был большим чем 8,4 log10 БОЕ/мл. Эти результаты отчетливо демонстрируют, что В2В перенос и отсутствие MX процесса, описанные в данной заявке, представляют весьма надежный процесс. Они минимизируют применение дорогих реагентов среды и могут снизить вероятность контаминации.
8.2 Процесс попеременного тангенциального потока (ATF)
Для того чтобы способствовать in situ замене жидкости в биореакторах, мы разработали процессы производства на основе культуры клеток при использовании ATF для: а) промывки микроносителей in situ); b) замены среды для культивирования клеток в емкостях для культивирования; и с) отделения продукционных клеток от биологических веществ, которые получают в культуре клеток, вакцин и других материалов, и сбор продуктов в больших масштабах более эффективным и контролируемым образом. Как показано на Фигуре 18, никаких микроносителей не содержится в пакете для отходов после стерилизации микроносителя или после замены среды. Кроме того, как показано в Таблице, применение ATF в сочетании с фильтрацией прямого потока во время сбора вирусного урожая не приводит к какому-либо увеличению содержания белка хозяйских клеток или ДНК хозяйских клеток, присутствующих в урожае или в заключительном очищенном продукте.
|
Этот Пример описывает процессы и параметры, используемые для нескольких экспериментальных прогонов, которые применяют ATF, и контрольных прогонов, которые не используют такового. Типичное оборудование и реагенты, которые могут использоваться в процессе, подробно указаны в Таблицах. Несомненно, другое оборудование и реагенты, которые действуют подобным образом, могут необязательно заменять те, что описаны в данной заявке, и специфическое упоминание определенных брендов или типов оборудования и реагентов не должно трактоваться как ограничивающее, если специально не указано таковое. ATF система обеспечивает эффективное средство для фракционирования смеси или суспензии клеток, молекул и других частиц. ATF процесс обеспечивает средства получения быстрого тангенциального потока с низким сдвигом. ATF система обеспечивает средства для ограничения процесса. Поскольку полный процесс является закрытым, то ATF система может использоваться для предварительной и завершающей стерилизации промывочных растворов для гранул микроносителя, заменяющей среды перед инфицированием и во время процесса сбора урожая.
Система фильтрования состоит из корпуса, который может включать модуль для фильтрования при использовании пористого волокна или просеивающий модуль для фракционирования более крупных частиц, таких как микроносители. Используемый корпус размещается между емкостью процесса или биореактором, с одной стороны, и диафрагменным насосом, с другой стороны. Емкость служит в качестве контейнера для хранения фильтруемого содержимого. Насос для фильтрата используется для контролируемого удаления фильтрованного потока. Неотфильтрованный материал остается в системе. ATF представляет собой пульсирующий, двусторонний поток жидкости, туда и обратно, между емкостью, в которой осуществляется процесс, и диафрагменным насосом. Насос разделяется на две камеры с помощью гибкой диафрагмы. Одна из камер насоса служит в качестве резервуара жидкости, который регистрирует в технологическом аппарате при прохождении через просеивающий модуль. Вторая камера насоса представляет собой воздушную камеру, которая регистрирует в контрольной системе насоса потока. Типично, контролируемое прибавление сжатого воздуха в воздушную камеру повышает давление в этой камере по отношению к технологическому аппарату. Это расширяет воздушную камеру, обратно пропорционально уменьшая объем в камере жидкости, в процессе направления жидкого содержимого от насоса к технологическому аппарату через просеивающий модуль. Поток, проходящий через полости просеивающего модуля, генерирует тангенциальный поток в одном направлении. Напротив, с помощью слабого давления в технологическом аппарате или путем присоединения воздушной камеры к откачивающему устройству или вакууму давление в воздушной камере снижают по сравнению с технологическим аппаратом, и поток жидкости будет направляться от технологического аппарата к жидкостной камере насоса, генерируя, таким образом, тангенциальный поток в другом направлении. Цикл является повторяемым.
|
|
|
|
Приготовления к предварительному посеву: ATF может использоваться для любого процесса, в котором удаляют и/или заменяют жидкость из биореактора. Например, ATF система может использоваться для удаления DPBS промывочного раствора после гидратирования гранул микроносителя перед стерилизацией флаконов и/или после этапов автоклавирования, ATF система может использоваться для удаления DPBS промывочного раствора и замены его полной средой роста. Таблица показывает контрольные установки ATF, которые используются во время замены жидкости при получении в экспериментальных прогонах 1-3.
1. Готовили микроноситель Cytodex 3 и отвешивали желаемое количество Cytodex 3 (4 г для биореактора на 2 л и 10 г для биореактора на 5 л), переносили его в очищенный стерильный биореактор и подвергали гидратации в 50~100 мл 1X PBS на грамм гранул не менее чем 3 часа или в течение ночи и промывали с помощью свежего PBS. Этапы промывания могут осуществляться при использовании ATF установки, как подробно представлено в Таблице.
2. Присоединяли трубки и фильтры ко всем свободным портам.
3. Присоединяли зонд DO на ночь перед калибровкой для того, чтобы осуществить поляризацию (Примечание: минимум 6 часов).
4. Калибровали зонды рН и DO в соответствии с инструкциями производителя и присоединяли к собранному биореактору, удостоверившись, что кончик зонда является погруженным в DPBS, которая уже присутствует в технологическом реакторе. Прибавляли дополнительное количество DPBS к реактору, в случае необходимости.
5. Автоклавировали цельный блок при 121°С в течение 30 минут при давлении 15 фунтов на квадратный дюйм в жидком цикле.
6. После автоклавирования и охлаждения присоединяли зонд для DO, зонд для определения рН и мотор для мешалки.
7. Аликвоту 1N NaOH в маленьком подающем резервуаре соединяли с основной линией и соответствующими резервуарами реактора.
8. Среда, используемая за день до инокуляции (посев).
а. Нагревали желаемое количество среды для роста клеток (CGM), MediV 105 SFM, в водяной бане при 37°С.
b. Изымали DPBS из биореактора через порт для отведения жидкости. Альтернативно, использовали ATF систему изъятия DPBS промывочного раствора и заменяли CGM при использовании установок, подробно описанных в Таблице.
c. Промывали гранулы один раз свежей, теплой CGM в соответствии со следующими этапами:
i) Прибавляли желаемое количество CGM после изъятия DPBS.
ii) Включали контроль перемешивания при 120 об/мин в течение 10 минут.
iii) Выключали перемешивание и позволяли гранулам осесть, после чего изымали супернатант.
d. Прибавляли желаемый объем CGM к биореактору.
9. Включали аэрирование, контроль температуры и перемешивание. Заданные значения для размножения клеток были следующими: рН=7,4, температура = 37°С, DO=50% насыщение воздуха, и перемешивание = от приблизительно 135 до приблизительно 175 об/мин (обычно быстрее для меньшего биореактора).
10. Прибавляли глюкозу до получения конечной концентрации 9 г/л.
11. Изымали образцы и осуществляли измерение с помощью NOVA, проводили DO калибрование и коррекцию значения рН (в случае необходимости).
12. Включали контрольное устройство биореактора и осуществляли прогон при скорости потока от 40 до 320 мл/мин, (для рабочих объемов от 2 до 16 л).
|
|
Посев и выращивание: Подсчитывали среднее количество жизнеспособных клеток на роллерный флакон или посевной реактор и переносили приемлемое количество клеток во флакон для выращивания со свежей, нагретой средой. Для переноса с гранулы на гранулу может использоваться разведение точно 1:8, или альтернативно, может использоваться плотность посева от приблизительно 1×105 до приблизительно 1,5×105. Примечание: клетки могут подвергаться разведению при использовании любого способа переноса с гранулы на гранулу, описанного в Примерах 8.3 и других, представленных ниже. Данные, представленные на Фигуре 17, были получены при разведении клеток при использовании прописи ЭДТА/трипсин (Пример, который обеспечивается в Разделе 8.3). Позже изымали образец пост-инокуляции с помощью устройства Nova и ежедневно подсчитывали клетки. Как только количество клеток достигало величины желаемой плотности в период 3~4 дней после культивирования, осуществляли инфицирование вирусом. Заданные параметры для размножения клеток были следующими: рН=7,4, температура=37°С, DO=50% насыщение воздуха, и перемешивание = от приблизительно 135 до приблизительно 175 об/мин (для рабочих объемов от 2 до 16 л).
Инфицирование: Перед инфицированием приблизительно 66% CGM удаляли и заменяли полной инфекционной средой (CIM, DMEM/F-12,45% глюкозы, 200 мМ L-глутамина, 1:330 разведение 10Х TrypLE), как описано далее: выключали все контрольные системы и позволяли осесть гранулам микроносителя. Желаемое количество среды, эквивалентное 66%, удаляли из биореактора и заменяли свежей, нагретой средой CIM. Заданные параметры подвергали доводке и вновь включали контрольные приборы. Заданные параметры для инфицирования были следующими: рН=7,4, температура = 33°С, DO=50% насыщение воздуха, и перемешивание = от приблизительно 135 до приблизительно 175 об/мин (для рабочих объемов от 2 до 16 л). Таблица показывает контрольные установки ATF, используемые в процессе замены среды в экспериментальных продукционных прогонах 1-3. При использовании заданных установок, описанных в Таблице, желаемое количество среды, эквивалентное 66%, удаляли при использовании ATF системы с перемешиванием и не позволяя гранулам микроносителя осесть из биореактора и заменяли равным объемом свежей, нагретой среды СIМ. Как только достигали заданных параметров, прибавляли желаемое количество вируса. Если является желательным, то подсчет количества клеток осуществляли перед инфицированием и подсчитывали количество вируса, необходимое для инфицирование биореактора, например, можно использовать 20-200 MOI (БОЕ/мл) для сезонного штамма или 2000 MOI (БОЕ/мл) для пандемического штамма. Альтернативно, заданное количество вируса при известной концентрации (БОЕ/мл) прибавляли, основываясь на рабочем объеме реактора. Смотри, например, WO 08/105931 (Пример 12, в частности).
Сбор урожая: в желаемый момент времени (обычно через 48-72 часов после инфекции) контрольные приборы выключали и позволяли осесть гранулам микроносителя. Приемлемый стерильный контейнер присоединяли к порту выхода биореактора и вирусный урожай удаляли с помощью перистальтического насоса или ATF устройства. Тогда, когда использовали перистальтический насос, заботились о том, чтобы в него не попали гранулы микроносителя. Когда сбор урожая закончен, можно прибавить 10Х SP буфер (2,18 М сахароза и 110 мМ фосфата калия, рН 7) к резервуару для получения заключительной концентрация 1X. Когда используется ATF, то этап сбора урожая может быть непосредственно соединен с этапом фильтрования прямого потока, как описано в Примере, который обеспечивается в Разделе , представленном ниже, который показывает заданные установки ATF, которые используются во время сбора урожая при экспериментальных продукционных прогонах 1-4.
8.3 Быстрый процесс переноса с гранулы на гранулу при использовании низких концентраций протеазы.
Этот Пример описывает процессы и параметры для быстрого и эффективного переноса с гранулы на гранулу MDCK клеток при использовании DPBS/0,5 мМ ЭДТА рН8 промывочного раствора и низкой концентрации протеазы (например, 0,05Х TrypLE) во вращающейся колбе, флаконе для встряхивания или смесительном чане биореактора. Обзор схемы технологического процесса обеспечивается на Фигуре 8А. Типичное оборудование и реагенты, которые могут использоваться в процессе, подробно представлены в Таблицах. Несомненно, другое оборудование и реагенты, которые действуют подобным образом, могут необязательно заменять те, что описаны в данной заявке, и специфическое упоминание определенных брендов или типов оборудования и реагентов не должно трактоваться как ограничивающее, если специально не указано таковое.
Этот процесс был использован в двенадцати прогонах, описанных выше. Как отмечалось ранее, собственное отделение клеток в посевных реакторах и присоединение клеток в FPR наблюдали при использовании прописи переноса с гранулы на гранулу при использовании 1x DPBS промывки с помощью ЭДТА и трипсинизации при использовании TrypLE select при значении рН8. Таким образом, процесс переноса с гранулы на гранулу является быстрым, эффективным и надежным.
|
|
|
Получение 1X жидкой среды DPBS из 10X DPBS порошка: прибавляли среду в виде порошка к воде комнатной температуры при осторожном перемешивании (воду не нагревать). Споласкивали контейнер изнутри для удаления остатков порошка. Разводили до желаемого объема водой. Перемешивали до растворения (без чрезмерного перемешивания). Доводили значение рН среды до 7,8±0,1 (заключительное рабочее значение рН составляло 8,0). Значение рН будет обычно подниматься на 0,1-0,3 при фильтровании. После доведения значения рН держали резервуар закрытым до фильтрования среды. Подвергали стерилизации немедленно при использовании мембраны 0,1 мкм.
Приготовление 0,5 М маточного раствора ЭДТА: Прибавляли 186,1 г ЭДТА (динатрий, дигидрат) к 800 мл деионизированной воды. Прибавляли приблизительно 20 г гранул NaOH или 10N NaOH при перемешивании до получения значения рН 8,0. Примечание: последние несколько грамм прибавляли медленно для того, чтобы избежать чрезмерного повышения значения рН. ЭДТА не может раствориться до тех пор, пока рН не будет в пределах 8. Доводили объем до 1 л при использовании деионизированной воды. Фильтровали при использовании фильтра 0,1 мкм. Переносили аликвоту в меньшие объемы (каждый флакон на 200 мл) и хранили при комнатной температуре.
Получение раствора DPBS/0,5 М маточный ЭДТА: прибавляли 1 мл 0,5 М маточного раствора ЭДТА рН8 к каждому литру DPBS. Доводили значение рН среды до 7,8±0,1 (заключительное рабочее значение рН составляло 8,0), в случае необходимости. Примечание: значение рН будет обычно подниматься на 0,1-0,3 при фильтровании. Фильтровали при использовании фильтра 0,1 мкм.
Процедуры промывания 1X DPBS/0,5 мМ ЭДТА - рН8,0: прекращали перемешивание, контроль значений рН, DO, температуры, в случае надобности. Оставляли гранулы микроносителя для осаждения в течение 15±5 минут. Удаляли через порт откачи 80±10% истощенной ростовой среды. Смотри Таблицу. Примечание: эта процедура может осуществляться при использовании попеременного тангенциального потока (ATF). Заменяли равным количеством промывочного раствора 1X DPBS/0,5 мМ ЭДТА - рН8,0 в емкости для культивирования. Смотри Таблицу. Начинали перемешивание при исходных заданных параметрах и промывали клетки в течение 25±5 минут. Прекращали перемешивание и оставляли гранулы микроносителя для оседания на 15±5 минут. Удаляли через порт откачки 80±10% промывочного раствора. Смотри Таблицу. Примечание: эту процедуру можно осуществлять при использовании ATF системы. Прибавляли 1X DPBS/0,5 мМ ЭДТА - рН8,0 промывочный раствор к емкости до 50% рабочего культурального раствора. Смотри Таблицу. Устанавливали скорость перемешивания до желаемого значения об/мин Смотри Таблицу. Включали мешалку, аппаратуру контроля рН, DO и температуры. Доводили значения рН до 8,0. Смотри Таблицу.
|
|
Процедура отделения клеток: когда значение рН культуры достигало 8±0,1, прибавляли рассчитанный объем 10Х TrypLE до получения заключительной концентрации 0,05Х через порт для введения или через порт для среды. Смотри Таблицу. Примечание: Можно также осуществлять разведение 1:200 10Х TrypLE по отношению к желаемому рабочему объему. Через порт для взятия образцов брали образцы аликвот каждые 15±2 минут до полного отделения. Примечание: Отделение клеток должно быть окончено в течение < 60 минут. Прибавляли основную среду к исходному рабочему объему емкости для культивирования. Останавливали все контрольные приборы за исключением перемешивания и контроля рН.
Процедура переноса с гранулы на гранулу: Переносили желаемый объем отделенных клеток в реактор для заключительной продукции.
|
|
8.4 Процесс переноса с гранулы на гранулу при отсутствии протеазы и применение ATF
Одна из основных проблем получения вакцин, рекомбинантных белков и других биологических лекарственных средств заключается в воспроизводимом отделении адгезивных продукционных клеток от культуральных емкостей и потом повторное прикрепление их к новым емкостям для культивирования, процесс, который обычно является известным как субкультивирование клеток. Эта задача становится особенно сложной для продукционного процесса на основе микроносителей при крупномасштабном производстве. Для обеспечения должного процесса субкультивирования клеток обычно используются реагенты на основе трипсина или подобных трипсину веществ (например, TrypLE). Однако процесс трипсинизации может быть сложным для контроля, и риск чрезмерной или недостаточной трипсинизации может иметь негативное воздействие на надежность процессов производства и даже вызывать снижение продуктивности. В данной заявке мы описываем новый способ, который позволяет серийно пассировать клетки млекопитающих, в частности высокоадгезивные MDCK клетки, при отсутствии использования трипсина или подобных трипсину реагентов. Этот способ использует ЭДТА для замены трипсина или подобных трипсину реагентов. Это способ может дополнительно сочетаться с использованием устройства для попеременного тангенциального потока (ATF) для того, чтобы способствовать in situ замене жидкости в биореакторах.
С помощью нового разработанного процесса при отсутствии использования протеазы мы успешно пассировали MDCK клетки более чем 5 раз, последовательно и постоянно достигая высокой жизнеспособности клеток (> 90%) и высокой плотности клеток (>1X 106 клеток/мл) (смотри Фигуру 15). Мы также использовали клетки, полученные с помощью этого способа, для получения высокого титра вирусов, включая адаптированные к холоду живые аттенуированные вирусы гриппа нескольких различных подтипов. Титр вируса составлял, по крайней мере, 8 log10 БОЕ/мл для каждого из трех характерных штаммов вируса, которые входят в состав сезонных вакцин (A/H1, A/H3 и В штаммы) (Фигура 16 и непредставленные данные). Этот процесс может использоваться как для вакцин, так и для продукции биологических веществ на основе культуры клеток (моноклональное антитело, рекомбинантный белок и т.д.) в малом и большом объемах.
Этот Пример описывает процессы и параметры для быстрого и эффективного переноса с гранулы на гранулу MDCK клеток путем промывания клеток и инкубации клеток с ЭДТА рН 8 во вращающемся флаконе, флаконе для встряхивания или биореакторе с чаном для перемешивания при отсутствии какой-либо протеазы. Типичное оборудование и реагенты, которые могут использоваться в процессе, подробно представлены в Таблицах, приведенных выше. Несомненно, другое оборудование и реагенты, которые действуют подобным образом, могут необязательно заменять те, что описаны в данной заявке, и специфическое упоминание определенных брендов или типов оборудования и реагентов не должно трактоваться как ограничивающее, если специально не указано таковое.
Процедуры промывания и инкубации при использовании 1X DPBS/0,5 мМ ЭДТА - рН 8,0: Прекращали перемешивание, контроль значений рН, DO, температуры, в случае надобности. 1) Оставляли гранулы микроносителя для осаждения, период 15±5 минут в общем случае является достаточным, и удаляли ~70-80% или более истощенной ростовой среды. Примечание: Эта процедура может осуществляться при использовании попеременного тангенциального потока (ATF). 2) Заменяли желаемый объем 1X DPBS промывочного раствора в емкости для культивирования. В общем случае равный объем промывочного буфера предполагается для осуществления эффективного промывания. 3) Повторяли этапы (1) и (2), если это является желательным, обычно предполагается использование в общей сложности трех промываний. 4) Удаляли промывочный раствор, в случае необходимости, для сохранения желаемого объема (например, ~50% от исходного объема). Примечание: эта процедура может осуществляться при использовании ATF. 5) Прибавляли 0,5 мМ ЭДТА - рН 8,0 до получения заключительной концентрация 0,5 мМ. 6) Начинали перемешивание, а также контроль рН, DO и температуры, если это является применимым. Перемешивание в общем случае будет происходить при 100-250 об/мин в зависимости от рабочего раствора и/или мешалки. Скорость перемешивания 100 об/мин используется для переноса в малом масштабе в пределах нескольких сотен миллилитров или менее. Также смотри, например, Таблицу для скоростей перемешивания, которые могут использоваться для больших рабочих объемов. 7) Осуществляли инкубацию при перемешивании в течение 60±10 минут. Образцы аликвот могут быть взяты для проверки на полное отделение клеток. Таблица подробно представляет условия, которые используются для переноса с гранулы на гранулу в малом масштабе.
После того как клетки отделяют, они готовы для получения разведения. В общем случае, ростовую среду прибавляют до получения желаемого рабочего объема (например, исходного объема), и желаемый объем отделенных клеток переносят в новую емкость. Альтернативно, дополнительное количество ростовой среды и/или микроносителей прибавляют к исходной емкости. Для процесса в производственном масштабе разведение от 1:5 до 1:8 было определено как полезное. Таблица обеспечивает подробности в отношении разведения 1:8 для нескольких заключительных рабочих объемов. Необязательно, исходный флакон промывают с помощью ростовой среды и соединяют с перенесенным материалом, этот объем будет учитываться при осуществлении процессов в большом масштабе с тем, чтобы не разводить клетки очень сильно. 8) Инкубируют новые флаконы при приемлемой температуре (в данном случае используют 37°С) без какого-либо перемешивания в течение 40-60 минут. 9) Начинают перемешивание, а также контролируют значения рН, DO и температуры, если это является необходимым для роста клеток. 10) Повторяют этапы (1)-(9) в случае необходимости для серийного размножения и разведения для инфицирования.
Параллельные культуры серийно размножали на протяжении (5) пассажей при использовании способа при отсутствии протеазы (ЭДТА из коммерческих или приготовленных на фирме препаратов) существенно так, как подробно описано в Таблице, или ЭДТА/TrypLE существенно так, как подробно описано в Примере, который обеспечивается в Разделе 8.2. Для контроля клеток новые клетки подвергают трипсинизации (клетки промывают и инкубируют с IX TrypLE в течение 15-20 мин, прибавляют свежую ростовую среду, клетки центрифугируют в течение 10 мин при 1000 об/мин и ресуспендируют в свежей ростовой среде) и используют для засевания вращающихся флаконов для сравнения клеточного роста/жизнеспособности и титра каждого пассажа. Количество клеток и жизнеспособность во время культивирования являются представленными на Фигуре 15. Как можно увидеть из графиков, количество клеток и жизнеспособность культур, размноженных при использовании только ЭДТА (при отсутствии протеазы) и ЭДТА/TrypLE, являются сравнимыми. Кроме того, оба этих способа были в общем случае рассмотрены для получения культуры с более высокой плотностью, по сравнению с контрольным способом. Клетки из каждого пассажа параллельных культур также использовали для получения вируса гриппа. Полученные титры вирусов для са A/Висконсин/67/07 и са B/Малайзия/2506/04 (Фигура 16, верхняя и нижняя панели, соответственно) были подобными, несмотря на используемый способ размножения.
|
8.5 Быстрый процесс переноса с гранулы на гранулу без промывания
Присутствие дивалентных катионов в ростовой среде может ингибировать действие протеазы, используемой для отделения клеток от микроносителей. Как показано выше, ЭДТА может использоваться для хелатирования таких катионов, способствуя отделению клеток. Осуществляли серии экспериментов для исследования влияния концентраций ЭДТА на морфологию клеток и отделение. Фигура 23А показывает необработанные клетки. Они имеют уплощенную морфологию и являются крепко прикрепленными к микроносителям. Фигуры 23B-F показывают изменения в морфологии, которые видны через 60 минут воздействия с помощью увеличивающихся концентраций ЭДТА: 0,5, 1, 2, 5 и 10 мМ, соответственно. Некоторое округление клеток наблюдается при использовании обработки с помощью концентраций 0,5 и 1 мМ. Обработка с помощью 2 мМ и выше приводила к дополнительному округлению и отделению. Почти все клетки отделялись от микроносителей при самых высоких концентрациях ЭДТА. На основе этих наблюдений можно сказать, что 1-2 мМ ЭДТА может способствовать округлению клеток.
Вторые серии экспериментов осуществляли для проверки влияния концентраций TrypLE в присутствии 1 или 2 мМ ЭДТА. После предварительной обработки с помощью 1 или 2 мМ ЭДТА TrypLE прибавляли к культуре клеток при заключительной концентрации 0,0125Х, 0,025Х и 0,05Х и наблюдали за отделением. Фигура 24 показывает отделение, которое наблюдали для клеток, предварительно обработанных с помощью 2 мМ ЭДТА при использовании различных концентраций TrypLE в динамике по времени. В момент времени 0 после прибавления TrypLE клетки показали округлую морфологию (Фигуры 24А, В и С, 0,0125Х, 0,025Х и 0,05Х TrypLE, соответственно) с невысоким отделением. Через 60 минут после прибавления TrypLE все культуры показали некоторое отделение. При более низких концентрациях TrypLE (0,0125Х и 0,025Х) не все клетки отделялись и наблюдали некоторую агрегацию (Фигуры 24Е и Е, соответственно). При концентрации 0,05Х TrypLE почти все клетки отделялись и наблюдали незначительную агрегацию (Фигура 24F). Однако тогда, когда эти клетки переносили в новую емкость для продукции, содержащую свежую ростовую среду, они повторно не прикреплялись к старым и новым микроносителям, вероятно, по причине хелатирования дивалентных катионов в свежей ростовой среде.
Исследовали влияние прибавления раствора CaCl2, MgCl2, MgSO4 и микроэлементов А, В и С к ростовой среде на способность преодолевать влияние хелатирования на прикрепление и рост. Таблица показывает процент повторного прикрепления клеток и размножения через 4 дня после посева с добавлением раствора различных концентраций CaCl2, MgCl2, MgSO4 к MediV 105 SFM ростовой среде. Таблица показывает количество клеток через 4 дня после посева с прибавлением раствора различных концентраций СаСl2, MgCl2, MgSO4 и микроэлементов А, В и С к MediV 105 SFM ростовой среде. Как показано в Таблице, MDCK клетки достигали значения свыше 1Е6 клеток/мл и свыше 90% жизнеспособности клеток через 4 дня после переноса с гранулы на гранулу, когда среду MediV 105 SFM дополняли 1,5 мМ CaCl2, 0,15 мМ MgCl2, 0,4 мМ MgSO4, и 2Х раствора микроэлементов А, В и С. На основе этих исследований могут быть проведены дополнительные эксперименты для дальнейшей оптимизации этих факторов, например для определения оптимальных условий роста для дополнительных типов клеток (например, клеток VERO) и/или для того, чтобы сделать этот процесс надежным при любом масштабе производства вируса.
Изучение концентрации ЭДТА: MDCK клетки, выращенные в роллерных флаконах на 850 см2, засевали в посевной биореактор на 2 л (MediV 105SFM, 2 г микроносителя/л) при плотности 1,8×105 клеток/мл. Параметры посевного реактора устанавливали на значении рН 7,4, которое контролировалось с помощью CO2 и 1N NaOH; 50% насыщения воздуха с постоянным значением скорости потока воздуха 20 мл/мин; температура 37°С; и перемешивание 175 об/мин Через 4 дня, когда достигали полной конфлюэнтности (1,2-1,6Е6 клеток/мл), 25 мл культуры микроносителя переносили в флаконы 6×100 мл, а потом прибавляли ЭДТА к каждому флакону для получения различных заключительных концентраций 0,5, 1, 2, 5, 10, 20 мМ. Последовательно флаконы инкубировали в орбитальном встряхивающем устройстве при 37°С, 5% СO2, 200 об/мин в течение 1 часа. Осуществляли периодическое микроскопическое исследование всех флаконов в течение периода инкубации для проверки степени процесса, когда клетки становились сферическими по форме (округление), при различных концентрациях ЭДТА.
Концентрация TrypLE Select в комбинации с оптимизированными концентрациями ЭДТА: MDCK клетки, выращенные в роллерных флаконах на 850 см2, засевали в 2×2 л посевных биореактора (MediV 105SFM, 2 г микроносителя/л) при плотности 1,8×105 клеток/мл в соответствии с TR #348. Посевные реакторы разгоняли в течение 4 дней с теми же параметрами биореактора, что описаны выше. Через 4 дня к одному биореактору прибавляли 1 мМ ЭДТА, а к другому прибавляли 2 мМ ЭДТА. Оба реактора подвергали перемешиванию в течение 1 часа при 175 об/мин Потом значение рН обоих биореакторов доводили до 8 перед переносом клеточной суспензии из каждого биореактора в 3×500 мл флакона для встряхивания. Из каждого набора культуры 10Х TrypLE Select прибавляли к каждому флакону для получения заключительных концентраций 0,05Х, 0,025Х и 0,0125Х и инкубировали при 37°С, 5% СO2, 150 об/мин в орбитальном встряхивающем устройстве в течение 30 минут. Во время процесса инкубации периодически брали образцы из каждого набора для осуществления периодического микроскопического исследования для проверки степени отделения от микроносителей. В соответствии с микроскопическими наблюдениями, когда > 90% клеток отделялось от микроносителей, прибавляли равный объем ингибитора трипсина (LBTI) для остановки активности трипсина.
|
|
8.6 Процесс очистки для культуры клеток, продуцирующей вирус гриппа
Разработка надежного крупномасштабного процесса очистки для вируса гриппа, вырабатываемого в культуре клеток, требует интенсивного исследования. Процесс ранней стадии разрабатывали тогда, когда вирусный урожай (через 60-65 часов после инфицирования) закачивали в резервуар и прибавляли 10Х буфера на основе фосфата сахарозы (SP) к резервуару с вирусным урожаем (VH) при 1/10 (об/об.) разведении для стабилизации вируса. Стабилизированный вирусный урожай (SVH) сначала обрабатывали с помощью бензоназы при концентрации 50 единиц/мл с 2 мМ MgCl2 при 32°С в течение 3 часов для удаления ДНК MDCK хозяйских клеток (HCD) и реакцию останавливали путем прибавления 5 мМ ЭДТА. Бензоназа представляет собой сконструированную рекомбинантную эндонуклеазу, которая расщепляет ДНК на олигонуклеотиды в присутствии ионов магния. Обработанный бензоназой урожай вируса потом осветляли с помощью капсульных фильтров на основе 1,2 мкм полипропилена (РР) и 0,45 мкм PVDF. Осветленный урожай вируса подвергали кондиционированию с помощью 5-кратной (5Х) ультрафильтрации и 5-кратной диафильтрации при использовании SP буфера с применением картриджа на основе пористого волокна с отсечением молекулярного веса 500 кДа. Вирусные частицы будут оставаться со стороны ретентата, в то время как белок хозяйских клеток (НСР), ДНК хозяйских клеток (HCD) и бензоназа будут диаотфильтровываться на стороне пермеата пористого волокна. Концентрированный и диаотфильтрованный вирус очищают при использовании хроматографии с колонкой из Целлуфин сульфата (CS) для дальнейшего удаления загрязняющих остатков HCD, НСР и бензоназы. CS представляет собой аффинную смолу, которая связывает вирус на колонке, и связанный вирус элюируется при использовании SP буфера с высоким содержанием соли. Очищенный вирус из элюата колонки будет подвергаться диафильтрации при использовании пяти диаобъемов SP100 (200 мМ сахарозы и 100 мМ фосфата калия, рН 7,2) буфера картриджа на основе пористого волокна с отсечением молекулярного веса 500 кДа для удаления буфера с высоким содержанием соли и рецептирования очищенного вируса. Вирусный продукт диафильтрации потом стабилизируют путем прибавления cGAG в разведении 1/9 (об/об.) и подвергают стерилизации путем фильтрования при использовании фильтра 0,22 мкм для получения массы заключительного продукта.
Существенные изменения были применены к исходному процессу, что способствовало масштабируемости, эффективности процесса и повышению качества заключительного продукта. Изменения, внесенные в процесс, основывались на оценке извлечения и уровня загрязняющих веществ (HCD, НСР и бензоназы) и внедрялись в исходно принятый процесс. В общей сложности было внедрено пять этапов процесса, направленных на масштабируемость и повышение эффективности процесса, а также качество заключительного продукта. Прежде всего, сбор вируса осуществляется через 48 часов после инфицирования для клеток, инфицированных при использовании вирусного внесения в количестве 2000 БОЕ/мл, это время соответствует пику титра вируса. Во-вторых, этап удаления HCD заменяли с периодического режима обработки бензоназой обработкой бензоназой на колонке. Эти два этапа, взятые вместе, улучшают качество заключительного продукта путем значительного снижения уровня HCD исходного материала и заключительной массы. В-третьих, концентрация загрузки CS смолы была повышена от 9,0 log10 БОЕ/мл до 9,5 log10 БОЕ/мл, это снижает размер продукционной колонки с 4 л до 1,4 л и повышает эффективность процесса. В-четвертых, вторая замена объема буфера была увеличена с 5 до 8 диаобъемов для улучшения очистки от бензоназы. В-пятых, поток через заключительный фильтр был снижен наполовину до средней величины 25 л/м2 для того, чтобы избежать какого-либо засорения фильтра во время осуществления заключительной фильтрации в процессе СТМ прогонов. Заключительный способ (подробно описан ниже) обеспечивает процесс, который дает среднее значение общего извлечения 43,4%, с 0,72 нг/доза (с помощью PicoGreen) и 0,1 нг/доза (с помощью PCR) HCD, 0,21 мкг/доза НСР и 0,0035 нг/доза бензоназы, которые все являются более низкими, чем характеристики, которые требуются органами государственного регулирования. Фигура 10 обеспечивает общий обзор исходного и усовершенствованного процессов очистки.
8.6.1 Материалы и способы
Материалы, реагенты и оборудование: другие материалы, оборудование и реагенты, которые ведут себя подобным образом, могут заменять приведенные ниже.
1. 1,2 мкм фильтр Polygard CN Opticap XL5 (Millipore Corporation, Billerica, MA, кат. номер KN12A05HH1)
2. 0,45 мкм фильтр Durapore Opticap XL4 (Millipore Corporation, Billerica, MA, кат. номер KPHLA04HH3)
3. 50 л контейнер (Hyclone, Ltd, Logan, UT, кат. номер SH30712,04)
4. 10 л контейнер (Hyclone, Ltd, Logan, UT, кат. номер SH30712,12)
5. Пористое волокно, 500 кДа, 4,800 см2 (GE Healthcare, Uppsala, Sweden, кат. номер UFP-500-C-6A)
6. Пористое волокно, 500 кДа, 290 см2 (GE Healthcare, Uppsala, Sweden, кат. номер UFP-500-C-3X2MA)
7. Смола Целлуфин сульфата (Chisso Corporation, Tokyo, Japan, кат. номер 19847)
8. Прижимная планка уплотнительного кольца (GE Healthcare, Uppsala, Sweden, кат. номер 18-8494-01)
9. Соединительный элемент уплотнительного кольца (GE Healthcare, Uppsala, Sweden, кат. номер 18-8475-01)
10. Держатель щупа, 23 мкм, наконечник (GE Healthcare, Uppsala, Sweden, кат. номер 18-9252-01)
11. Держатель щупа, 23 мкм, соединительный элемент (GE Healthcare, Uppsala, Sweden, кат. номер 18-1103-08)
12. Прокладки 25 мм, внутренний диаметр мм, EPDM (GE Healthcare, Uppsala, Sweden, кат. номер 18-0019-27)
13. Клапаны двухканального порта (GE Healthcare, Uppsala, Sweden, кат. номер 18-5757-01)
14. Фильтровальная капсула Sartopore2 300, 0,45 мкм/ 0,22 мкм, 300 см2 (Satorius, МА, кат. номер 5441307Н5-00-В)
15. Фильтровальная капсула Sartopore2 150, 0,45 мкм/ 0,22 мкм, 150 см2 (Satorius, МА, кат. номер 5441307Н4-00-В)
16. 1 л PETG флаконы (Nalgene, Rochester, NYU, кат. номер 2019-1000)
17. 2 л PETG флаконы (Nalgene, Rochester, NYU, кат. номер 2019-2000)
18. Вулканизированные платиной силиконовые трубки MasterFlex L/S размер 24 (Cole Farmer, Vemon Hills, IL, кат. номер 96410-24)
19. Вулканизированные платиной силиконовые трубки MasterFlex L/S размер 36 (Cole Parmer, Vemon Hills, IL, кат. номер 96410-36)
20. IX буфер на основе фосфата сахарозы (Нуclone, Ltd, Logan, UT, кат. номер SH3A1577) - буфер 218 мМ сахарозы и 11 мМ фосфата калия, рН 7
21. 1XSP/1M NaCI буфер (Hyclone, Ltd, Logan, UT, кат. номер SH3A2034)
22. SP100 буфер (Hyclone, Ltd, Logan, UT, кат. номер SH3A1796) - буфер 200 мМ сахарозы и 100 мМ фосфата калия, рН 7,2
23. cGAG буфер (Hyclone, Ltd, Logan, UT, кат. номер SH3A1795)
24. Бензоназа (EMD, Darmstadt, Germany, кат. номер 1,01697,0002)
25. 1 M MgCl2 (Sigma, St. Louis, Missouri, кат. номер М1028, серия 085К8920)
26. Наборы двухцепочечной ДНК Quant-iT PicoGreen (Invitrogen, Eugene, Oregon, кат. номер PI 1496, серия №22987)
27. 0,5 N NaOH, разведенный из 10 N NaOH (VWR, West Chester, Pennsylvania, кат. номер VW3247-7)
28. Перистальтический насос (Watson Marlow Inc., Wilmington, МА, модели 520U, 520S и 520Di)
29. Волновой смеситель Wavemixer (GE Healthcare, Uppsala, Sweden, кат. номер Mixer20/50EH)
30. Регулировочный узел для АКТА хроматографического процесса (GE Healthcare, Uppsala, Sweden, кат. номер 28409334)
31. Регулировочный узел для фильтрования Uniflux10 (GE Healthcare, Uppsala, Sweden, кат. номер 28920799)
32. Хроматографическая колонка BPG 100 (GE Healthcare, Uppsala, Sweden, кат. номер 18-1103-01)
33. Хроматографическая колонка BPG 200 (GE Healthcare, Uppsala, Sweden, кат. номер 18-1103-11)
34. Flexstand (GE Healthcare, Uppsala, Sweden, кат. номер 56-4107-54).
|
Культура клеток для сбора вируса (VH): Подробные сведения о росте MDCK клеток и продукции вируса являются представленными в международной патентной публикации WO 08/105931 (смотри, в частности. Пример 12). Все прогоны продукции вируса осуществляли в биореакторе однократного применения (SUB) с процессом ~67% замены среды, и клетки инфицировали при использовании введения вируса в количестве 2000 БОЕ/мл. Вирус собирали через приблизительно 60-65 часов (прогоны 1-7) или 48 часов (прогоны 8-9) после инфицирования MDCK клеток. Микроносители в SUB оставляли для осаждения в течение не менее чем 45 минут перед сбором вируса(VН). Приблизительно 18 л вируса закачивали в 50 л контейнер при скорости приблизительно 0,2 л/мин, и 2 л 10Х SP буфера закачивали в тот же контейнер для стабилизации вирусного урожая (SVH). После смешивания отбирали образцы на этапах SVH для исследования инфективности вируса с помощью FFA, HCD и НСР анализов.
Следующий процесс может использоваться для непосредственного сочетания этапа сбора вирусного урожая с этапом фильтрации прямого потока. Приемлемый объем 10Х SP буфера прибавляют к биореактору для получения стабилизированного вирусного урожая (SVH), буфер включает заключительную концентрацию приблизительно 1X SP, микроносители можно оставлять для осаждения и сбор вирусного урожая соединяют с DFF и TFF этапами при использовании ATF. Например, в сочетанном ATF/DFF/TFF исследовании SVH непосредственно накачивали из биореактора в ATF систему с помощью подающего насоса. Фильтрат ATF потом пропускали через линейно встроенные DFF капсулы и, в завершение, в чан для Uniflux процесса. Работа ATF системы подробно описывается в инструкции по эксплуатации ATF. Заданные параметры ATF системы при давлении и циклах откачки, специфические для высоты и давления на выходе биореактора, составляли 3 л/мин и 1,8 л/мин, соответственно для 10 л и 20 л биореакторов. Скорость потока Uniflux подающего насоса (скорость потока ATF фильтрата) устанавливали для выравнивания специфического потока TFF фильтрата для каждого эксперимента. 5XUF5XDF процесс является подробно описанным ниже. Все 5XUF5XDF материалы дополнительно очищали вплоть до CS хроматографического этапа, как подробно описано ниже.
Фильтрование 1 прямого потока (DFF1): Готовили и автоклавировали фильтровальное оборудование за день до сбора вирусного урожая. Фильтровальное оборудование, содержащее полипропиленовую фильтровальную капсулу 1,2 мкм Polygard CN и фильтровальную капсулу 0,45 мкм Durapore PVDF, подробно представлено на Фигуре 9А, верхняя панель. Приблизительно 20 л SVH прокачивали через закрытое оборудование при скорости 1,5 литра за минуту (LPM), и фильтры обрабатывали тогда, когда SVH проходил через них. Общая площадь поверхности мембраны составляла 1800 см2 для полипропиленовой фильтровальной капсулы 1,2 мкм Polygard CN и 1900 см2 для фильтровальной капсулы 0,45 мкм Durapore PVDF. При скорости потока фильтрации 1,5 LPM поток для 1,2 мкм и 0,45 мкм фильтров составлял 500 литров на м2 площади за час (LMH) и 474 LMH, соответственно. Фактическая нагрузка для 1,2 мкм и 0,45 мкм фильтров составляла 111 и 105 л/м2, соответственно. Осветленный фильтрат собирали как DFF1 в 20 л контейнер. Брали образцы DFF1 фильтрата и анализировали на инфективность с помощью FFA и на остаточные количества HCD и НСР.
Фильтрация 1 тангенциального потока, 5Х ультрацентрифугирование (UF)/5Х диафильтраиия (DF) (TFF1): Трубковую оснастку Uniflux готовили и автоклавировали за день до сбора вирусного урожая. Все рисунки трубковой оснастки являются подробно представленными на Фигуре 9А, нижняя панель. Uniflux™ агрегат использовали для осуществления TFF1 этапа с применением следующих операционных параметров. Uniflux агрегат представляет собой фильтровальную систему на основе мембранного разделения, скомпонованную для эксплуатации картриджей на основе пористого волокна. Использовали пористое волокно с отсечением молекулярного веса 500 кДа (MWCO) с размером пор 0,5 мМ и общей площадью поверхности мембраны 4800 см2 и 60 см толщины слоя. Этот процесс обеспечивал получение заключительной DFF1 загрузки 41,7 л/м2 площади поверхности мембраны, которая находится в оптимальном интервале 40-150 л/м2 для TFF1 процесса, как было оценено предварительно. Для прогонов 1-6 тот же картридж из пористого волокна очищали после процесса и использовали повторно. Для прогонов 7-9 готовили новое пористое волокно и использовали его для каждого прогона. Новые картриджи на основе пористого волокна готовили путем промывания с помощью деионизированной (DI) воды в течение 90 минут для удаления глицеринового консерванта, подвергали санитарной обработке с помощью 0,5 N NaOH в течение 1 часа и уравновешивали с помощью 1X SP буфера до достижения значения рН 7,0 перед каждым прогоном. Полный 5XUF/5XDF процесс осуществлялти при использовании Uniflux агрегата, запрограммированного при постоянной скорости сдвига 16000 сек-1 и постоянном значении ТМР 20 фунтов на кв. дюйм.
Полный объем DFF1 пропускали через Uniflux агрегат. Приблизительно 5 л DFF1 сначала закачивали в чан для Uniflux процесса. Канал для фильтрата сначала закрывали для установления скорости рециркуляционного потока (ретентата) 8,6 л/мин, что является эквивалентным скорости сдвига 16000 сек-1. Через 5 минут рециркуляции 5XUF процесс останавливали. Канал фильтрата открывали для того, чтобы позволить загрязняющим веществам, меньшим 500 кДа, таким как НСР и ДНК, проходить через мембрану, в то время как контрольный клапан ретентата постепенно закрывали для достижения заданного параметра трансмембранного давления (ТМР) 1,4 бара (20,3 фунта на кв. дюйм). Оставшийся DFF1 фильтрат непрерывно закачивали в технологический резервуар для поддержания постоянного уровня в резервуаре 5±0,1 л до тех пор, пока полный объем DFF1 не поступал в резервуар. После того как поступал весь DFF1 материал, нагнетательный насос останавливали и продолжали концентрировать ретентат до достижения собранного заключительного объема ретентата 4 л или 16 л фильтрата. 4 л ретентата (5XUF) подвергали диафильтрации путем замены буфера 5Х диаобъемами 1X SP буфера (20 л), и процесс осуществляли при той же скорости сдвига и ТМР, как описано выше. Канал для буфера диафильтрации открывали и вновь включали нагнетательный насос накачивания в 1X SP буфер. 5XDF процесс заканчивали после того, как собирали 20 л диафильтрационного фильтрата. В конце 5XDF клапан контроля ретентата полностью открывали и канал фильтрата закрывали снова для того, чтобы позволить системе рециркуляции унести какой-либо восстановленный вирус, который был слабо связан с поверхностью мембраны из пористого волокна во время осуществления процесса. Ретентат, который содержит концентрированный и подвергнутый диафильтрации вирусный продукт, высушивали и собирали в 10 л резервуар для продукта. Для двух последних прогонов очистки (8 и 9) вводили этап дополнительного промывания буфером после сбора ретентата Приблизительно 1,5 л 1X SP закачивали в резервуар для осуществления процесса и подвергали рециркуляции в течение 5 минут с закрытым каналом фильтрата. Этот промывочный буфер также собирали в тот же 10 л резрвуар для продукта и резервуар обозначали как 5XUF 5XDF TFF1 продукт, при этом общий объем составлял приблизительно 5,5 л. Отбирали образцы TFF1 продукта для исследования инфективности с помощью FFA, HCD и НСР. Картридж из пористого волокна и Uniflux систему очищали после каждого прогона процесса с помощью 0,5 N NaOH в течение 1 часа при использовании скорости рециркуляционного потока 8,6 л/мин
Упаковка колонки BPG 100/200 Целлуфин сульфата (CS), исследование колонки:
CS смолу хранили в 20% этаноле в виде приблизительно 50% глинистой суспензии. Количество смолы, которое требуется для упаковки BPG 100 или BPG 200 колонки, подсчитывали при использовании коэффициента уплотнения 1,1. Как BPG100, так и BPG200 колонку упаковывали до целевой толщины слоя поглощающего материала 17,5 см или целевого объема слоя 1,37 л и 5,50 л, соответственно. Подсчитанное количество смолы готовили для осуществления двукратной замены буфера на 1X SP буфер, после чего осуществляли однократную замену буфера на 1X SP/1M NaC1 буфер.
BPG 100 и BPG 200 колонки объединяли в соответствии с инструкциями производителя. Готовили пустую колонку, подвергали ее санитарной обработке с помощью 0,5 N NaOH и промывали при использовании DI воды перед использованием. 1X SP буфер использовали для упаковки "флоу-пак" CS смолы в BPG 100 колонку при скорости 500 см/час для получения толщины слоя поглощающего материала колонки 15-20 см (целевое значение 17,5 см) при использовании AKTAprocess™ агрегата. AKTAprocess представляет собой автоматизированную жидкостную хроматографическую систему.
Приготовленную глинистую суспензию смолы в 1X SP/1M NaCl буфере наливали вдоль боковой стенки пустой колонки и любое остаточное количество смолы, оставшееся на стенке, смывали с помощью воды в опрыскивателе. Оставляли смолу для осаждения с целью получения толщины слоя смолы, по крайней мере, 10 см ниже уровня жидкости. Сверху в колонку вставляли соединительное устройство без разрушения слоя смолы и потом закрепляли с помощью оставшихся винтов/резьбовых муфт. 4-портовый 2-канальный клапан (4-2 клапан) инсталлировали на входе колонки. Четыре различных порта соединяли так, как описано далее:
1 - AKTAprocess система на входе колонки
2 - Ручной очиститель колонки (соединенный со спускным каналом или рециркуляционным каналом)
3 - Скоба технологического разъема (обжимающая блокировка, которая используется для введения растворов с высоким содержанием соли для НЕТР анализа)
4 - BPG 100 /200 вход в колонку.
Нижнее разгрузочное отверстие BPG 100 колонки потом соединяли с АКТА системой разгрузочного отверстия колонки. Перед погружением соединительного элемента колонки проверяли соединения для 4-2 клапана, портов 3 и 4. Верхний соединительный элемент медленно погружали в поглощающий слой смолы и небольшой объем буфера удаляли из порта 3 4-2 клапана. Это обеспечивало то, что входное отверстие верхнего соединительного элемента освобождалось от буфера.
Потом 4-2 клапан переключали для связи портов 1 и 2. 1X SP буфер соединяли с входящим отверстием АКТА системы, устанавливали скорость потока 500 см/час. Сначала блокировали колонку при этой точке посредством продувочного отверстия колонки (порт 2 на 4-2 клапане). Когда скорость потока достигала значения 500 см/час на измерителе расхода жидкости, 4-2 клапан быстро регулировали так, чтобы порты 1 и 4 были соединены. Когда слой смолы достигал желаемой толщины, замыкатель соединительного элемента опускали в слой смолы. Эти этапы повторяли до тех пор, пока не происходило никакого изменения в толщине слоя смолы и соединительный элемент не достигал слоя смолы. Соединительный элемент дополнительно опускали на 1-3 мм с целью уплотнения слоя смолы для того, чтобы избежать какого-либо зазора между соединительным элементом и слоем смолы.
Перед оценкой упаковывания CS колонку уравновешивали с помощью 1X SP для установления стабильной базовой линии проводимости. Спаковывание колонки оценивали путем введения 1X SP/1M NaC1 при концентрации 2% от объема колонки (CV) при использовании скобы технологического разъема (порт 3-4 на 4-2 клапане). Колонку уравновешивали с помощью 1X SP при скорости потока 50 см/час, (порт 1-4 на 4-2 клапане). Пик проводимости возникал при значении приблизительно ½ CV. Полученный пик проводимости на программном обеспечении Unicorn использовали для оценки высоты тарелки колонки (НЕТР) и ассиметрии пика. Как только достигали желаемого значения НЕТР колонки, колонку подвергали санитарной обработке и хранили в 0,5 N NaOH перед использованием.
Хроматография при использовании Целлуфин сульфата (CS): Уплотнительные элементы для агрегата AKTAProcess готовили и автоклавировали за день до сбора вирусного урожая. Рисунки всех уплотнительных элементов подробно приведены на Фигуре 9В, верхняя панель. Полный процесс хроматографии был автоматизирован при использовании запрограммированного способа.
Все направления потоков AKTAProcess агрегата вручную уравновешивали с помощью 1X SP перед каждым прогоном. Перед началом процесса колонку сначала уравновешивали с помощью 3 объемов колонки (CV) 1X SP при линейной скорости истечения 150 см/час. Потом загружали полный объем 5XUF 5XDF TFF1 на колонку и несвязанный материал собирали в виде потока, прошедшего через нее. После загрузки колонку промывали с помощью 1 CV 1X SP при скорости 150 см/час, после этого с помощью 2,5 CV 1X SP, содержащего 50 ед./мл бензоназы и 2 мМ MgCl2 (1X SPB), при скорости 50 см/час для обработки бензоназой на колонке. Снижали скорость линейного потока и подсчитывали 1X SPB промывочный объем, который позволяет смоле колонки иметь контакт с бензоназой в течение 50 минут. Потом колонку промывали с помощью 1 CV 1X SP при скорости 50 см/час для замены последнего CV 1X SPB обработки бензоназой на колонке и дополнительно 1 CV 1X SP при скорости 150 см/час. Связанный вирус элюировали из колонки с помощью 3 CV 1X SP/1M NaCl буфера. CS элюат собирали с 10 л резервуар и сбор пика элюирования основывался на поглощении УФ (A280 считывание от 50 единиц оптической плотности до 50 ед. опт. плотности (от 0,1 O.D. до 0,1 O.D.) при использовании длины пути 5 мм УФ проточной кюветы). Объем CS элюирования из BPG 100 колонки составлял приблизительно от 0,6 до 0,9 л. Колонку и AKTAprocess систему подвергали санитарной обработке с помощью 0,5 N NaOH после каждого прогона процесса. Загрузку колонки, поток, прошедший через нее, брали образцы промывочного раствора и элюата для анализа инфективности с помощью FFA, бензоназы, HCD и НСР.
Фильтрация 2 тангенциального потока, 8XDF (TFF2): Установку и использование Flexstand осуществляли в соответствии с инструкциями производителя. Использовали пористое волокно 500 кДа MWCO с размером пор 0,5 мм, толщиной слоя 60 см и общей площадью поверхности мембраны 290 см2. С таким размером площади мембраны и объемом CS элюата, как описано выше, заключительная загрузка находилась в интервале 20-50 л/м2 площади поверхности мембраны, что является оптимальным интервалом для TFF2 процесса, как было оценено предварительно. Новое пористое волокно устанавливали на Flexstand за день до сбора вирусного урожая. Пористое волокно промывали с помощью DI воды в течение 90 минут для удаления глицеринового консерванта, подвергали санитарной обработке при использовании 0,5 N NaOH в течение 1 часа и уравновешивали с помощью SP 100 буфера до достижения значения рН 7,2.
Весь объем CS элюата подвергали обработке при использовании Flexstand системы. Канал фильтрата сначала закрывали для того, чтобы позволить осуществить рециркуляцию CS элюата при подающей скорости потока 0,5 л/мин для получения скорости сдвига 16,000 сек-1. После рециркуляции в течение 5 минут канал фильтрата открывали для начала диафильтрации. В то же время прокачивали SP100 буфер через канал диафильтрации и клапан контроля ретентата постепенно закрывали для получения трансмембранного давления (ТМР) на уровне 20-21 фунта на кв. дюйм. Объем резервуара ретентата поддерживали постоянным при объеме, равном CS объему элюирования (интервал от 0,4-0,8 л), для всего процесса путем контроля скорости потока насоса канала SP100 диафильтрации. Перед прогоном 8 CS элюат подвергали диафильтрации при использовании 5Х диаобъемов SP 100 буфера. CS элюат подвергали замене буфера с помощью 8Х диаобъемов SP100 буфера для прогонов очистки 8-9. В конце диафильтрации клапан ретентата полностью открывали и канал фильтрата снова закрывали для того, чтобы позволить системе осуществить рециркуляцию в течение 5 минут перед извлечением продукта. Диафильтрованный продукт высушивали в 10 л резервуаре для продукта. Брали образцы диафильтрованного продукта для анализа инфективности с помощью FFA, содержания бензоназы, HCD и НСР. Картридж из пористого волокна и систему очищали с помощью 0,5 N NaOH в течение 1 часа при скорости потока рециркуляции 0,5 л/мин
Фильтрация 2 прямого потока (DFF2): Готовили и автоклавировали фильтровальное оборудование за день перед сбором вирусного урожая. Рисунки фильтровального оборудования подробно приведены на Фигуре 9В, нижняя панель. Используемая мембранная капсула 0,22 мкм из полиэтерсульфона имела общую площадь поверхности 150 см2 для прогонов 1-5 и 300 см2 для прогонов 6-9. Этап заключительного стерильного фильтрования DFF2 осуществляли в камере биобезопасности.
Концентрированный глутамат аргинин желатин (cGAG) прибавляли к 8XDF продукту в разведении 1:9 (об/об.) для получения заключительной композиции очищенного вируса. Рецептированный вирус прокачивали через закрытое оборудование при приблизительно 0,38 LPM для капсулы 300 см2 и фильтр заправляли при использовании заключительного продукта. Собирали фильтрат в стерильные 2 л флаконы в качестве заключительного продукта. При скорости потока фильтрации 0,38 LPM поток для 300 см2 фильтров составлял 760 LMH. Рецептированная масса, загруженная на площадь мембраны, находилась в интервале 20-150 л/м. Брали образцы отфильтрованного через мембрану 0,22 мкм заключительного продукта для анализа на инфективность с помощью уровней FFA, содержания бензоназы, HCD и НСР. Заключительный нерасфасованный продукт разделяли на аликвоты в виде нескольких 1-, 10- и 100-мл аликвот, быстро замораживали и хранили при -80°С.
Анализ образцов и подсчеты: Все образцы, отправленные на анализ, быстро замораживали и хранились при -80°С. НСР анализы осуществляли существенно так, как описано ниже. HCD анализ осуществляли при использовании PicoGreen и способов ПЦР существенно так, как описано ниже. Распределение размеров HCD анализировали с помощью метода прямой метки псорален-биотина (blot) и непосредственного окрашивания агарозных гелей. Анализ количественной оценки бензоназы осуществляли существенно так, как описано ниже. Все значения, которые являются подсчитанными как нг или мкг на дозу, основываются на титре 7 log10 БОЕ на дозу (одна доза также обычно упоминается как 107 БОЕ).
Определение остаточной ДНК хозяйских клеток: Остаточную ДНК хозяйских клеток MDCK определяли количественно при использовании способа ПЦР в реальном времени в формате микроячеек. Мишенью анализа была уникальная последовательность для гена субъединицы I цитохромоксидазы (Сох I) собак. При использовании набора оптимизированных олигонуклеотидных праймеров MDCK Сох I специфический продукт ПЦР получали из матрицы и определяли с помощью SYBR® Green красителя. Формат микроячеек обеспечивает ДНК калибровку в пределах широкого динамического интервала (от 1000 до 0,1 нг/мл). Приемлемые позитивные и негативные контроли включались в каждый анализ. Исследуемый образец ДНК получали при использовании набора для экстракции ДНК. Образец ДНК, количественно оцененный выше нижней границы количественной оценки 0,1 нг/мл, будет высчитываться из стандартной кривой. Точность будет в пределах от 75 до 125% на основе извлечения максимума контроля. Полученные результаты будут представлять собой среднее значение количества ДНК образца экстракции, что обеспечивает значения пика выхода от 50 до 150%. Эти анализы могут осуществляться при использовании коммерчески доступных наборов, таких как набор Quant-iT PicoGreen (Invitrogen, Eugene, Oregon, кат. номер PI 1496), в соответствии с процедурой, описанной в наборе.
Определение остаточного белка хозяйских клеток: Остаточный белок хозяйских клеток (MDCK) (НСР) определяли с помощью твердофазного иммуноферментного анализа (ELISA) при использовании первично биотинилированных антител кроля, полученных против НСР (из инфицированной культуры MDCK) и конъюгата стрептавидин-пероксидаза хрена (HRPO). Антитела против лизата MDCK клеток абсорбировали на полистироловом микропланшете. Блокирующий раствор, содержащий коровий сывороточный альбумин, прибавляли до обеспечения избытка сайтов связывания. Когда разведение образца продукта прибавляли к покрытому планшету, MDCK НСР, в случае присутствия, связывался с антителами покрытия. Первичное, меченное антителом биотином антитело против MDCK лизата, полученное у кроликов, прибавляли к планшету, после чего прибавляли меченный пероксидазой хрена (HRPO) стрептавидиновый конъюгат. В завершение прибавляли HRPO субстрат и использовали считывающее устройство для ELISA для измерения интенсивности образовавшегося окрашенного конечного продукта. Интенсивность развития окрашивания является пропорциональной количеству MDCK НСР, присутствующего в исследуемом образце. Стандартную кривую получали из калибрования известных белковых концентраций лизата MDCK клеток. Из стандартной кривой определяли концентрацию белка лизата MDCK клеток.
Определение остаточной бензоназы: Активность бензоназы определяли с помощью ее способности расщеплять ДНК спермы сельди. Исследуемый образец в двукратной повторности сравнивали со стандартной кривой бензоназы, при котором результаты измеряют с помощью спектрофотометра при длине волны 260 нм. Процент степени извлечения (активность бензоназы) подсчитывали для определения точного значения в ед./мл. Точная активность извлеченной бензоназы в соответствии со стандартным извлечением составляла 1,1-1,9 ед./мл, коэффициент корреляции должен быть ≥0,995, активность разведения образца без разведения будет составлять ≥0,7 ед./мл для активности, которая подвергается количественной оценке, и процент степени извлечения будет составлять от 80 до 120%.
8.6.2 Результаты и обсуждение
Все SUB прогоны продемонстрировали титр сбора в интервале от 8,0 до 8,6 log10 БОЕ/мл. Извлечение, HCD и НСР результаты, используемые для оценки поведения каждого прогона очистки, подытожены в Таблицах. Приведенные ниже Разделы будут подытоживать и обсуждать изменения, которые осуществляли для совершенствования эффективности процесса и качества конечного продукта. Усовершенствования процесса для исходной и конечной схем очистки подытожены на Фигуре 10, которая показывает основные изменения от прогонов ранней очистки до прогонов завершающей очистки.
|
|
|
|
|
SVH - изменение в обработке бензоназой от SVH до обработки бензоназой на колонке: Исходный процесс обработки бензоназой осуществляли на SVH этапе для удаления ДНК хозяйских клеток. Этап этого процесса вовлекает смешивание 20 л SVH с 50 ед./мл бензоназы в течение трех часов при 32°С перед осуществлением DFF1 этапа. В прогонах очистки 1-4 бензоназу прибавляли на SVH этапе в прогонах очистки 5-9, обработка бензоназой удалялась из этапа SVH и осуществлялась как процесс обработки бензоназой на колонке во время этапа CS хроматографии при использовании хроматографического буфера, который содержал 50 ед./мл бензоназы, контакт со смолой составлял 50 минут. Как показано в Таблице, прогоны очистки 2-4, уровень HCD не снижался значительно в единицах нг на дозу между SVH и DFF1; однако в прогонах очистки 5-9 уровень HCD заметно снижался после этапа CS хроматографии на колонке с бензоназой. Уровень HCD заключительного нерасфасованного продукта, который анализировали как с помощью ПЦР, так и PicoGreen, был обнаружен как более низкий для прогонов очистки 5-9 (0,84-1,42 нг/доза) по отношению к прогонам очистки 1-4 (3,25-40,49 нг/доза). Это изменение не только улучшало качество заключительного продукта путем снижения заключительного содержания HCD до уровня, который является меньшим или равным 1 нг/доза, но также повышало эффективность процесса путем снижения времени обработки бензоназой и общего количества требуемой бензоназы. Влияние обработки бензоназой на колонке будет далее обсуждаться в Разделе CS хроматография.
DFF1: Как показано в Таблице, DFF1 этап продемонстрировал хорошее извлечение (78,3-154,6%) за исключением прогона 4 (52,7%). DFF1 этап удалял клетки и клеточный дебрис и обычно не демонстрировал снижения титра. Этот этап также удалял некоторое количество HCD, но не НСР. Площадь мембраны для обоих фильтров (1,2 и 0,45 мкм), используемых для фильтрования 20 л SVH, основывалась на способности обоих фильтров и была заранее определена из исследования пропорционального снижения Vмакс./Pмакс. при использовании квалификационного коэффициента 2,6 и 1,5, соответственно. Для фильтрования скорость потока 1,5 LPM, поток для фильтров 1,2 мкм и 0,45 мкм составляли 500 LMH и 474 LMH, соответственно. Фактическая SVH нагрузка для фильтров 1,2 мкм и 0,45 мкм составляла 111 и 105 м/м2, соответственно.
TFF1 - изменения в установках и способе извлечения для совершенствования этапа извлечения TFF1: Первые 6 прогонов очистки показали постепенное снижение эффективности извлечения на TFF1 этапе для каждого прогона с 107,2% до 30,3% (см.Таблицу). Для прогонов очистки 1-6 TFF1 пористое волокно картриджа очищали с помощью 0,5 N NaOH и повторно использовали после процесса. Является неизвестным, является ли эффективность очистки картриджа с пористым волокном достаточной для полного удаления слоев геля после каждого прогона и это может приводить к снижению извлечения вируса после этого этапа процесса. Для получения более соответствующего этапа извлечения осуществляли три основных изменения существующей прописи, начиная с прогона очистки 7. Во-первых, использовали новое пористое волокно для каждого прогона для устранения возможности недостаточной очистки пористого волокна. Во-вторых, концентрированный ретентат подвергали повторной циркуляции в картридже на основе пористого волокна в течение 5 минут с открытым клапаном ретентата, а клапан закрывали перед сбором TFF1 продукта. Это устраняет любой потенциальный слой геля, который может образовываться на поверхности мембраны во время процесса концентрации и диафильтрации, и позволяет осуществлять извлечение. В-третьих, этап дополнительного промывания буфером осуществляли при той же скорости потока рециркуляции и при том же времени (5 минут) для извлечения оставшегося в пористом волокне картриджа вируса, и промывочный буфер собирали вместе с продуктом. После таких внесенных изменений этап извлечения TFF1 оставался последовательно высоким со значениями приблизительно 75-80% для прогонов очистки 7-9 (см.Таблицу). Фигура 11 показывает типичную кривую истечения для TFF1 процесса в отличие такового, который осуществлялся при скорости сдвига 16000 сек-1 и постоянном ТМР 20 фунтов на кв. дюйм (прогон очистки 8). Поток снижался по мере того, как раствор вируса становился более концентрированным (5XUF), он продолжал снижаться, когда начинали этап диафильтрации, и слабо повышался к концу этапа диафильтрации (5XDF). Параметры потока колебались в пределах 70-100 LMH для всех прогонов очистки и оказывались связанными с вирусным титром и мутностью DFF1 фильтрата. Слабое повышение параметров потока в конце этапа диафильтрации, вероятно, происходило благодаря дополнительному удалению НСР и HCD загрязняющих веществ в конце 5XDF. Как показано в Таблице, основная часть (80-90%) НСР загрязняющих веществ удалялась на первом этапе TFF (TFF1), поскольку любой НСР, меньший 500 кДа, должен быть удален в фильтрат. Завершение замены буфера вирусного урожая до IX SP было продемонстрировано с помощью снижения следовой электропроводности от 12,5 мСм/см до 1 мСм/см, в конце 5XDF процесса (Фигура 11).
Обработка бензоназой на CS колонке для повышения удаления HCD: Исходные эксперименты осуществляли при использовании CS колонки небольшого размера с толщиной слоя 10 см и с загрузочной концентрацией вируса приблизительно 9,0 log10 БОЕ на мл смолы. Поскольку процесс был усовершенствован, загрузочную концентрацию вируса на мл смолы, скорость линейного потока и толщину слоя колонки линейно масштабировали. При загрузочном титре 9,0 log10 БОЕ/мл смолы, 4 л объема слоя CS будет необходимым для процесса на 20 л стабилизированного вирусного урожая с титром урожая 8,3 log10 БОЕ/мл. В улучшенных прогонах 1-5, 4 л CS смолы упаковывали в BPG 200 колонку (20 см внутренний диаметр (i.d.)) до получения заключительной толщины слоя 12,5 см. В процессе упаковки BPG 200 колонки при скорости 200 см/час встречное давление превышало рекомендованное давление упаковки 2,5 бара (Фигура 12). Осуществляли изучение способности динамического связывания, которое показало, что CS может фактически связывать вплоть до приблизительно 9,7 log10 БОЕ/мл смолы при условиях упаковывания, описанных выше. В связи с этим при вирусной загрузке 9,5 log10 БОЕ/мл смолы только 1,3 л CS смолы будет необходимым для осуществления процесса на 20 л стабилизированного вирусного урожая с титром вирусного урожая 8,3 log10 БОЕ/мл.
BPG 200 колонка, упакованная при использовании 1,3 л CS смолы, приводила к образованию толщины слоя колонки 4,5 см. Значительное уменьшение толщины слоя колонки обеспечивало более низкое значение разделения по сравнению с колонкой, упакованной с толщиной слоя 15-20 см (типично для крупномасштабных процессов). Начиная от прогона очистки 6, BPG 100 колонку упаковывали с образованием толщины слоя 17,5 см +/- 2,5 см для получения объема CS колонки 1,4 л. Для BPG 100 колонки использовали скорость упаковывания 500 см/час, и окончательное давление для упаковывания не превышало рекомендованный предел давления упаковывания смолы, который отличается от давления упаковывания для BPG 200 колонки (Фигура 12).
При сравнении прогонов очистки 6-9 (BPG 100) с прогонами очистки 2-5 (BPG 200) были обнаружены подобные значения для CS элюата этапа извлечения, которые составляли 54% и 59%, соответственно, когда фактическая загрузка увеличивалась от 8,4 до 8,9 log10 БОЕ/мл смолы (BPG 200 колонка) и от 9 до 9,3 log10 БОЕ/мл смолы (BPG 100 колонка) (см. Таблицу). Касательно поведения колонки в отношении удаления HCD, как осуществляли при использовании обработки бензоназой на колонке, прогоны очистки 6-9 (BPG 100) продемонстрировали сравнимые уровни HCD CS элюата(0,3-1,5 нг/доза), что и уровень HCD CS элюата (1,2 нг/доза) в прогоне очистки 5 (BPG 200) (0). Несмотря на то что поведение колонки было подобным, уменьшение размера колонки повышало эффективность процесса путем снижения объема CS элюата и буфера, что будет важным при переходе к крупномасштабному производству. Фигура 13 показывает типичную хроматограмму для единственного пика вируса, который элюировали из CS BPG 100 колонки (прогон 9).
Как показано в Таблице, общее очищение от HCD для обработки бензоназой на колонке (прогоны 5-9) было лучше, чем обработка бензоназой при периодическом режиме (прогоны 2-4). Процент остаточного количества HCD после очистки вируса для обработки бензоназой в периодическом режиме колебался в пределах 0,15-3,4% (прогоны 2-4), процент остаточного количества HCD после очистки вируса для обработки бензоназой на колонке колебался в пределах 0,02-0,15% (прогоны 5-9). Обработка бензоназой на колонке на CS этапе была продемонстрирована как такая, которая обладала более высоким значением общего удаления HCD, чем обработка бензоназой в периодическом режиме на SVH этапе, что таким образом приводило к более низкому уровню ДНК в заключительной массе.
Существовало несколько преимуществ при использовании обработки бензоназой на колонке по сравнению с обработкой бензоназой в периодическом режиме. Во-первых, эффективность процесса повышалась путем соединения двух этапов процесса в один и замены 3 часов для обработки бензоназой на SVH этапе 1 часом обработки бензоназой для этапа осуществления на CS колонке. Во-вторых, общее количество бензоназы, которое является необходимым в процессе очистки, снижается. Периодический режим обработки бензоназой требует одного миллиона единиц бензоназы для 20 л вирусного урожая, в то время как обработка бензоназой на колонке требует только двухсот тысяч единиц бензоназы. Таким образом, обработка бензоназой на колонке снижает общее количество необходимой бензоназы в пять раз.
TFF2 повышение объема диафильтрации на этапе TFF2 для повышения очистки от бензоназы: Как показано в Таблице, этап извлечения на TFF2 для всех девяти прогонов очистки был последовательно выше 64% (64-150,8%). В прогоне 3 CS объем элюирования составлял 3,2 л. При использовании 290 см2 пористого волокна загрузка CS элюата на мембрану пористого волокна повышалась до 110 л/м2 и общее время процесса составляло 6 часов. Мембрану 1400 см2 пористого волокна использовали в следующих двух последовательных прогонах для того, чтобы избежать длительного времени процесса и поддержать загрузочную концентрацию на уровне приблизительно 20-50 л/м2, как установлено в исследованиях малого масштаба. Однако, начиная с прогона 6, размер колонки изменяли с 4 л до 1,4 л, и объем элюирования также снижали до не более чем 0,9 л. Снижение объема элюата было прямо пропорциональным размеру колонки. В прогонах 6-9 использовали 290 см2 картридж из пористого волокна для поддержания загрузочной концентрации CS элюата на уровне 20-50 л/м2. Фигура 14 показывает типичную кривую потока TFF2 процесса для очистки прогона 8, который осуществляли при скорости сдвига 16000 сек-1 и постоянном значении ТМР на уровне 21 фунта на кв. дюйм. TFF2 поток был целесообразно стабильным в процессе диафильтрации, что свидетельствует о том, что операционные условия не вызывали какого-либо неправильного срабатывания. Расход колебался в пределах 80-110 LMH для всех прогонов очистки.
TFF2 объем замены буфера также повышали с 5 диаобъемов до 8 диаобъемов для того, чтобы способствовать очищению от бензоназы. Как показано в Таблице, когда процесс меняли на этап обработки бензоназой на колонке (прогон 5), уровень бензоназы CS элюата составлял >75 нг/мл, что свидетельствовало о том, что бензоназа связывается с CS колонкой и элюируется совместно с вирусным продуктом. Связывание бензоназы с CS колонкой также подтверждали путем оценки образцов, прошедших через колонку 1 CV - 4 CV после обработки IX SPB. Образцы, которые прошли через колонку, были продемонстрированы как такие, которые содержат низкие уровни бензоназы (см. Таблицу). Таким образом, TFF2 объем замены буфера увеличивали с 5 диаобъемов до 8 диаобъемов в прогонах очистка 8 и 9 для повышения очистки от бензоназы до уровня, который был ниже границы определения (LOD). В результате этого уровень бензоназы снижался дополнительно 4-5-кратно с помощью повышения объемов диафильтрации с 5XDF до 8XDF. Это изменение снижало уровень бензоназы в заключительной массе до такого, который был ниже границы определения, что составляло менее чем 0,1 нг/доза (см. Таблицу).
DFF2 - увеличение размера фильтра для финальной стерильной фильтрации заключительной массы: Как показано в Таблице, среднее значение этапа извлечения при использовании размера 0,22 мкм заключительного фильтра 150 см2 и 300 см2 составляло 88,3-111,1% и 65,8-108%, соответственно. Размер фильтра 300 см2 был выбран в качестве размера заключительного фильтра для того, чтобы избежать какого-либо засорения потока поступающего материала при заключительной стерильной фильтрации в СТМ рабочих прогонах. Площадь мембраны, используемой для фильтрования 0,6-1 л заключительной массы, основывалась на мелкосерийных исследованиях, которыми ранее была установлена загрузка в пределах от 20 до 150 л/м. Скорость потока фильтрования составляла 0,38 LPM для 300 см2 фильтров, а поток для этих фильтров составлял 760 LMH. Фактическая загрузка для этих фильтров составляла 20-33 л/м, что находилось в пределах интервала, определенного из мелкосерийных исследований.
Изменение времени вышерасположенного (SUB) процесса сбора с 3 dpi на 2 dpi:
Начиная с прогона очистки 8, время сбора вирусного урожая изменяли с 3 dpi (сбор через 60-65 часов) на 2 dpi (сбор через 48 часов). Пик вирусного титра наблюдали через 48 часов dpi, когда использовали внесение вируса на уровне 0,001-0,003 БОЕ/клетка. Изменение времени сбора приводило к снижению исходных уровней HCD и НСР, как показано на SVH этапе для прогонов очистки 8 и 9 (см. Таблицы). Это изменение также приводило к более низкому уровню загрязнения HCD и НСР в заключительном массовом продукте (см. Таблицы) и, таким образом, улучшало качество конечного продукта.
Реализованный процесс очистки обеспечивал хорошее извлечение вируса и чистоту: Полностью реализованный процесс был продемонстрирован в прогонах очистки 8 и 9. Среднее значение общего титра извлечения этих двух прогонов составляло 43,4%, со средним значение уровня HCD загрязнения 0,72 нг/доза (определенный с помощью PicoGreen) и 0,1 нг/доза (определенный с помощью ПЦР), уровня НСР загрязнения 0,21 мкг/доза и уровня загрязнения бензоназой 0,0035 нг/доза, которые все были ниже технических требований к очищенной массе.
Таким образом, некоторые изменения были сделаны по отношению к исходному процессу очистки для улучшения эффективности процесса и качества конечного продукта, включая 1) время сбора вирусного урожая изменяли с 3 dpi на 2 dpi для получения более низких уровней HCD и НСР загрязнения в SVH, 2) этап обработки HCD изменяли с периодического режима обработки бензоназой при SVH на обработку бензоназой на CS колонке для улучшения деградации и удаления общего HCD, 3) целевая концентрация загрузки CS смолы была увеличена с 9,0 log10FFA/мл на 9,5 log10FFA/мл, что снижало размер колонки с 4 л до 1,4 л, 4) замененный объем буфера в заключительной композиции для TFF2 повышался от 5 диаобъемов до 8 диаобъемов для улучшения удаления бензоназы, и 5) загрузку заключительного стерильного фильтрования снижали наполовину до среднего значения 25 л/м2 для того, чтобы устранить какое-либо засорение в процессе заключительной фильтрации в СТМ прогонах.
Процесс заключительной очистки показан на Фигуре 10, и данные для всех прогонов очистки подытожены в Таблице. Среднее значение общего извлечения вируса, основанное на титрах для улучшенного процесса очистки, составляло 43,4%, со средним значением уровня загрязнения 0,0035 нг/доза для бензоназы, 0,72 нг/доза (PicoGreen) и 0,1 нг/доза (ПЦР) для HCD и 0,19 мкг/доза для НСР. Эти уровни загрязнения были ниже технических требований, которые предъявляются к продукту. Заключительные массы для прогонов очистки 6-9 подвергали анализу с помощью анализа размера ДНК при использовании блот-анализа прямой метки (псорален-биотин) и способа непосредственного окрашивания (агарозный гель). Преобладающий сигнал в этих анализах показал распределение размера ДНК ≤500 п.о. (данные не представлены).
Модифицированный процесс очистки для культуры клеток, продуцирующей вирус гриппа
Дополнительные модификации, которые могут быть сделаны для надежного крупномасштабного процесса очистки, описанные в Примере, который обеспечивается в Разделе 8.6, представлены на Фигуре 10b и подробно описаны ниже. В частности, этапы сбора, осветления и TFF1 могут быть соединены для того, чтобы избежать необходимости в чане для сбора урожая, снизить количество манипуляций и улучшить общее время обработки. Для бесперебойного сочетания операций TFF1 процесс может быть изменен с постоянного значения ТМР на постоянный приток. Дополнительно, или альтернативно, более низкое значение ТМР используется (ниже чем 20 фунтов на кв. дюйм, например от приблизительно 10 фунтов на кв. дюйм (12000 S-1) до приблизительно 14,5 фунта на кв. дюйм (16,000 S-1)). 2Х UF этап может прибавляться к TFF2 этапу для снижения объема получаемого продукта. Необязательно 10XUF используется в TFF1 для потенциального удвоения загрузки на всех последующих этапах очистки.
Таблица подытоживает изменения параметров, извлечения и HCD для нескольких прогонов очистки. Эти прогоны используют вирус, полученный в MediV SFM 110 без замены среды, существенно так, как описывается выше (смотри Пример, который обеспечивается в Разделе 8.1). Все прогоны очистки осуществляли существенно так, как описано для процесса 1b (смотри Пример, который обеспечивается в Разделе 8.6) за исключение того, что описано ниже. Прогоны #25, #27 и #30 осуществляли путем соединения этапов сбора, DFF и TFF1. Для этих прогонов TFF1 осуществляли при постоянном притоке (50 LMH, скорость сдвига 12000 сек-1). Прогоны #24, #26 и #31 осуществляли без сочетания этапов сбора, DFF и TFF1. Для этих прогонов TFF1 осуществляли при более низком значении ТМР (10 фунтов на кв. дюйм, скорость сдвига 16000 сек-1). Кондиционную вирусную загрузку разделяли для CS этапа и подвергали обработке либо при использовании 2 мМ MgCl2, либо при 10 мМ MgCl2.
Анализ ДНК показал, что повышение концентрации MgCl2 не снижало размер ДНК (данные не представлены). Однако в одном случае выход был сниженным (смотри Таблицу).
Таблица подытоживает изменения параметров, извлечения и HCD для нескольких прогонов очистки вируса, полученного в MediV SFM 105 с заменой среды. Эти прогоны используют вирус, полученный существенно так, как описано в публикации международной патентной заявки WO 08/105931 (смотри, в частности, Пример 12). Все прогоны очистки осуществляли существенно так, как описано для 1b процесса (смотри Пример, который обеспечивается в Разделе 8.6) за исключение того, что описано ниже. Прогоны #40, #41 и #42 осуществляли путем соединения этапов сбора, DFF и TFF1. Для этих прогонов TFF1 осуществляли либо при постоянном притоке (35 LMH, скорость сдвига 12000 сек-1), либо при постоянном ТМР (10 фунтов на кв. дюйм, скорость сдвига 12000 сек-1). Прогоны с постоянньм притоком осуществляли в мелкосерийном масштабе и подвергали обработке только на CS этапе. Прогон #43 осуществляли без соединения этапов сбора, DFF и TFF1.
Взятые вместе эти исследования свидетельствуют о том, что MediV SFM 110 (без MX) и MediV SFM 105 (с MX) процесс продемонстрировал подобный Flux/TMP характеристики. Применение более низкого сдвига (12000 сек-1), более низкого значения ТМР (10 фунтов на кв. дюйм) и более низкого притока (35 LMH) приводило к более длительному этапу TFF процесса, однако общее время осуществления процесса может быть снижено при использовании соединения этапов сбора, DFF и TFF1. Заключительная концентрация HCD для этих прогонов очистки была продемонстрирована, как такая, которая составляет 0,01-0,6 нг/доза, что является сравнимой с таковой, которая была получена в 1b процессе, описанном выше. Общий выход в общем случае составлял свыше 30%.
|
|
8.7 Оценка смол для очистки вируса гриппа
Целлуфин сульфат (CS) представляет собой аффинный гель, который связывается с вирусом, и этот вирус элюируют из колонки при использовании буфера на основе фосфата сахарозы (SP) с высоким содержанием соли. Как описано выше, гель Целлуфин сульфата может использоваться в колонке хроматографического этапа для дополнительного удаления загрязнений ДНК хозяйских клеток (HCD), белка хозяйских клеток (НСР) и контаминанта Бензоназы®, которая вводится на этапе промывания колонки (обработка бензоназой на колонке) для разрушения ДНК хозяйских клеток в процессе производства вакцинных материалов, приемлемых для клинических испытаний. Связывающая способность для CS геля составляет 9,72 log10 БОЕ на мл геля, определенная при помощи исследования способности к динамическому связыванию с использованием вирусного штамма са В/Малайзия/2506/04 (данные не представлены). Основываясь на связывающей способности геля, подсчитанные объемы колонки для 400 л и 1600 л с целью получения тривалентных вакцин на основе культур клеток составляли 25 л (40 см × 20 см) и 100 л (80 см × 20 см), соответственно. С учетом 20-30% общей потери инфекционных частиц на этапе первой фильтрации прямого потока (DFF1) и этапе фильтрации тангенциального потока (TFF1) перед загрузкой CS колонки, размер каждой целевой колонки при каждом объеме процесса будет позволять осуществлять очистку вирусного урожая до титра вплоть до 8,7 log10 БОЕ/мл без превышения способности CS геля. Однако идентификация альтернативного хроматографического геля с более высокой способностью связывания вируса будет обеспечивать повышение общей продукционной способности без необходимости дополнительной очистки в увеличенном масштабе.
Приведенный ниже Пример подробно описывает оценку шести дополнительных аффинных смол (обозначаются как Смолы A-F) при использовании процесса очистки существенно так, как описано выше (смотри Пример, который обеспечивается в Разделе 8.6). Кратко, при использовании са В/Малайзия 2506/04 в качестве модельного штамма вирусный урожай, стабилизированный (VH) с помощью буфера на основе фосфата сахарозы (SP), осветляли с помощью капсульных фильтров 1,2 мкм полипропилена (РР) и 0,45 мкм поливинилидендифторида (PVDF). Осветленный VH кондиционировали с помощью 5-кратной (5Х) ультрафильтрации (UF) и 5-кратной (5Х) диафильтрации (DF) при использовании буфера на основе фосфата сахарозы (SP) и картриджа из пористого волокна с отсечением молекулярного веса 500 кДа. Концентрированный и подвергнутый диафильтрации вирус потом очищали с помощью хроматографических колонок для дополнительного удаления загрязнения ДНК хозяйских клеток (HCD), белка хозяйских клеток (НСР) и контаминанта Бензоназы®, которая вводится на этапе промывания колонки (обработка бензоназой на колонке) для разрушения ДНК хозяйских клеток. Также осуществляли непосредственное сравнение высокоэффективных новых смол и CS геля, который в настоящее время используется. Кратко, различные партии вирусного урожая использовали для оценки осуществления очистки исследуемых смол С и D по сравнению с Целлуфин сульфатом. Оценка включала исследование выхода, связывающей способности и уровня загрязняющих веществ (например, HCD, НСР и Бензоназы®). При использовании этого типа оценки можно эффективно оценивать поведение новых смол.
8.7.1 Материалы и способы
Материалы, реагенты и оборудование: Указанные материалы, оборудование и реагенты могут быть легко заменены на те, которые ведут себя подобным образом.
1. Серии вирусного урожая (са В/Малайзия 2506/04, са A/Висконсин 67/05, са A/Соломоновы острова 03/06, са A/Висконсин 67/05, са A/Южная Дакота/6/2007), которые использовались в этих исследованиях, собирали через 48-68 часов после инфицирования, титры вирусного урожая составляли около 8,7-8,9 log10 БОЕ/мл. Осветленный вирусный урожай подвергали обработке при использовании 5Х ультрафильтрации (UF) и 5Х диафильтрации (DF) путем фильтрации тангенциального потока (TFF1), которые осуществляли существенно так, как описано подробно в Разделе 8.6, приведенном выше, с заключительными титрами 8,6-9,4 log10 БОЕ/мл в качестве загрузки колонки.
2. Наборы Quant-iT PicoGreen дцДНК (Invitrogen, Eugene, Oregon, кат. номер P11496)
3. 1X SP буфер, рН 7,0 (Hyclone, Ltd. Logan, UT, кат. номер SH3A1577,03) или полученный при использовании 6,5 мМ фосфата калия двуосновного, 4,5 мМ фосфата калия моноосновного и 218 мМ сахарозы. Для 1 л 1X SP смешивали раствор 6,5 мл 1 М фосфата калия двуосновного, раствор 4,5 мл 1 М фосфата калия моноосновного, 74,62 г сахарозы и растворяли в Н2O до получения заключительного объема 1 л. Значение рН доводили до 7,0 с помощью 1 N Н3РO4 или 1 N КОН, в случае необходимости.
4. 1X SP, 1 М NaCl буфер получали при использовании 9,5 мМ фосфата калия двуосновного, 1,5 мМ фосфата калия моноосновного, 218 мМ сахарозы и 1 М NaCl. Для 1 л 1X SP, 1 М NaCl буфер, 9,5 мл раствора 1 М фосфата калия двуосновного, 1,5 мл раствора 1 М фосфата калия моноосновного, 74,62 г сахарозы и 58,44 г хлорида натрия (NaCl) смешивали и растворяли в H2O до получения заключительного объема 1 л. Значение рН доводили до 7,0 с помощью 1 N Н3РO4 или 1 N КОН, в случае необходимости.
5. 1X SPB раствор содержит 2 мМ MgCl2 и 50 ед./мл Бензоназы. Для приготовления 50 мл 1X SPB прибавляли 100 мкл 1 М MgCl2 и 7,65 мкл бензоназы (327 ед./мл) в 49,9 мл 1X SP
6. Фосфат калия двуосновного, K2НРO4 (Sigma, St. Louis, Missouri, кат. номер Р3786)
7. Фосфат калия моноосновного, KН2РO4 (Sigma, St. Louis, Missouri, кат. номер Р5379)
8. 1 М К2НРO4 фосфата калия двуосновного (174,18 г) растворяли в Н2O до получения заключительного объема 1 л.
9. 1 М KH2PO4 фосфата калия моноосновного (136,09 г) растворяли в Н2О до получения заключительного объема 1 л.
10. Сахароза (EMD, Gibbstown, Новые Jersey, кат. номер 1,07653,9012)
11. NaCl (EMD, Gibbstown, New Jersey, кат. номер 7760)
12. 1 М MgCl2 (Sigma, St. Louis, Missouri, кат. номер M1028)
13. Бензоназа® (EMD, Darmstadt, Germany, кат. номер 1,07653,9012, 353 ед./мкл)
14. 0,5 N NaOH, разведенный из 10 N NaOH (VWR, West Chester, Pennsylvania, кат. номер VW3247-7)
15. Фильтры 0,22 мкм (Millipore, Billerica, Massachusetts, кат. номер SCGPU11RE)
16. Флаконы из модифицированного полиэтилен терефталатгликоля (PETG) (Nalgene, Rochester, New York): 1 л (кат. номер 2019-1000); 2 л (кат. номер 2019-2000); 125 мл (кат. номер 2019-0125); 250 мл (кат. номер 2019-0250)
17. Конические колбы (Coming, Coming, New York): 15 мл (кат. номер 430052); 50 мл (кат. номер 630829);
18. 1,2 мкм Polygard CN Opticap XL5 фильтр (Millipore Corporation, Billerica, Massachusetts, кат. номер KN12A05HH1)
19. 0,45 мкм Durapore Opticap XL4 фильтр (Millipore Corporation, Billerica, Massachusetts, кат. номер KPHLA04HH3)
20. 20 л резервуар (Hyclone, Ltd, Logan, UT, кат. номер SH30712.03)
21. 50 л резервуар (Hyclone, Ltd, Logan, UT, кат. номер SH30712,04)
22. Пористое волокно, 500 кДа, 4,800 см2 (GE Healthcare, Uppsala, Sweden, модель № UFP-500-C-6A)
23. Пористое волокно, 500 кДа, 1,400 см2 (GE Healthcare, Uppsala, Sweden, модель № UFP-500-C-3×2 MA)
24. Omnifit колонки (0,66 см × 20 см и 1 см × 20 см) (Bio-Chem Valve Inc. Coldhams Lane, Cambridge)
25. XK-16 колонка 16 мм × 20 см (GE Healthcare, Uppsala, Sweden)
26. Akta Explorer 100 (GE Healthcare, Uppsala, Sweden)
27. SpectraMax GEMINI ЕМ считывающее устройство для микропланшетов (Molecular Devices, Sunnyvale, California)
28. Thermo Orion рН-метр (Thermo Scientific, Waltham, Massachusetts)
29. CDM210 измеритель электропроводности (Radiometer Analytical, Lyon, France).
Получение исследуемых смол: Смолы хранили в 20% этаноле. Желаемое количество (например, 42 мл) 50% глинистой суспензии смолы пипеткой вводили в 50 мл коническую колбу и центрифугировали при 1000 об/мин в течение 10 минут. Удаляли жидкость и смолы повторно суспендировали в 21 мл буфера для упаковки (1X SP+1 M NaCl, pH 7,0). Замену смолы на буфер для упаковки повторяли три раза.
Получение ХK-16 (16 мм × 10 см) для исследования или CS смолы для колонки: Все части пустой колонки очищали с помощью воды и высушивали перед упаковкой. Колонку собирали в соответствии с инструкциями производителя. Соединительный элемент колонки вставляли в дно колонки и трубку соединительного элемента соединяли со шприцом на 30 мл. Колонку размещали вертикально и закрепляли зажимами. 10 мл буфера для упаковки вводили в колонку и шприцом, выходящим из дна, вытягивали жидкость, пока не оставалось 2 см буфера в колонке. Приготовленные исследуемые смолы выливали в колонку без введения пузырьков воздуха и осаждали под собственным весом. После того как смола осаждалась, колонку заполняли буфером для упаковки. Верхнюю часть соединительного элемента осторожно вводили в колонку без внесения пузырьков воздуха. Потом колонку соединяли с АКТА Explorer системой и упаковывали при скорости 500 см/час (16,7 мл/мин) в течение приблизительно 20 минут при использовании буфера для упаковки до тех пор, пока толщина слоя колонки не изменялась. Верхнюю часть соединительного элемента вводили на 1-2 мм ниже вершины геля. Толщина слоя полученной упакованной колонки составляла 10 см, что было равно 20 мл объема колонки. Колонку Omnifit меньшего размера (0,66 см × 17 см), что было равно 5,8 мл геля при упаковке, использовали для изучения способности к динамическому связыванию с помощью исследуемых смол и CS гелей. Упакованные колонки с исследуемыми смолами подвергали санитарной обработке при использовании 1 N NaOH в течение 1 часа и повторно уравновешивали с помощью 1X SP рН 7,0 буфера. Упакованную CS колонку подвергали санитарной обработке при использовании 0,5 N NaOH в течение 1 часа и повторно уравновешивали с помощью 1Х SP рН 7,0 буфера.
Получение кондиционированной вирусной загрузки для 5Х ультрафилыпрации и 5Х диафильтрации (5XUF/ 5XDF) с использованием колонок исследуемой смолы и Целлуфин сульфата: 15 или 20 л 1X SP стабилизированного вирусного урожая из 15 л биореактора или 30 л SUB биореактора (подробности в отношении роста и продукции вируса MDCK клетками являются описанными в публикации международной патентной заявки WO 08/105931, смотри, в частности, Пример 12) фильтровали через капсулу 1800 см2 1,2 мкм предварительного фильтра и капсулу 1900 см2 0,45 мкм фильтра при скорости потока 1,5 л/мин и собирали в 20 л резервуар от Hyclone. Фильтрат, полученный в результате фильтрования прямого потока (DFF1), потом очищали при использовании фильтрования тангенциального потока (TFF1) с 5-кратной ультрафильтрацией (5Х UF) и 5-кратной диафильтрацией (5Х DF) с помощью 1X SP буфера при использовании Flexstand системы, существенно так, как описано в усовершенствованном процессе, описанном выше (смотри Пример, который обеспечивается в Разделе 8.6). TFF1 этап осуществляли при постоянной скорости сдвига 16000 сек1 и ТМР при значении 20 фунтов на кв. дюйм при использовании картриджа с пористьм волокном 1400 см2 или 4800 см2 с отсечением молекулярного веса 500 кДа для большинства партий. Сбор урожая вируса са В/Малайзия партии #1 осуществляли при постоянной скорости сдвига 12000 сек-1 и ТМР при 14,5 фунта на кв. дюйм, а сбор урожая вируса са В/Малайзия партии #2 осуществляли при постоянной скорости сдвига 12000 сек-1 и постоянном потоке 70 LMH. 5X UF/5X DF раствор вируса разделяли на аликвоты 100 мл на флакон. Все флаконы замораживали на сухом льду и хранили при -80°C как материал загрузки для исследуемых смол и CS колонки.
Условия прогонов колонок на основе исследуемых смол и Целлуфин сульфата: Опреационные параметры для прогонов колонок с исследуемыми смолами (16 мм × 10 см) были существенно такими, как подробно описано выше, для BPG 100 колонки. Кратко, колонку сначала уравновешивали с помощью 3 объемов колонки (CV) 1X SP и желаемое количество 5X UF/5X DF вирусного раствора загружали на колонку при скорости потока 150 см/час (5 мл/мин, для 1,6 см × 10 см ХK-16 колонки и 0,85 мл/мин для 0,66 см × 17 см Omnifit колонки). После промывания с помощью 1 CV 1X SP буфера 1X SPB загружали на колонку при скорости 50 см/час (85 мл 1X SPB со скоростью 1,7 мл/мин, для 1,6 см × 10 см XK-16 колонки и 15 мл 1X SPB со скоростью 0,3 мл/мин, для 0,66 см × 17 см Omnifit колонки) для обработки бензоназой на колонке при использовании времени контакта 50 минут. Потом колонку промывали сначала с помощью 1 CV 1X SP при скорости 50 см/час и второй раз с помощью 1 CV 1X SP при скорости линейного потока 150 см/час. Связанный вирус элюировали с помощью 3 CV 1X SP, содержащего 1 М NaCl, pH 7,0 буфера, при скорости линейного потока 150 см/час. Пик элюирования собирали от 20 mAU (единиц оптической плотности) до 20 mAU (от 0,1 O.D. до 0,1 O.D.) при длине волны A280 нм. Собирали фракции для загрузки исследуемых смол, потока, который прошел через колонку, промывочного раствора с бензоназой и элюата. Все образцы разделяли на аликвоты, замораживали на сухом льду и хранили при температуре -80°C для анализа инфективности с помощью FFA (флуоресцентного анализа бляшкообразования) и ДНК анализа с помощью PicoGreen.
Оценка очистки при использовании колонок с исследуемыми смолами: Упакованные колонки с исследуемыми смолами (16 мм × 10 см) индивидуально загружали при использовании материалом вирусного штамма са В/Малайзия 5XUF/ 5XDF TFF1 при концентрации загрузки 9,0 log10 БОЕ/мл. Для того чтобы избежать загрузки малым объемом 5XUF/ 5XDF, вирусный загрузочный раствор предварительно 2,5-кратно разводили с помощью 1X SP буфера от титра 9,4 log10 БОЕ/мл до 9,0 log10 БОЕ/мл перед загрузкой. 50 мл вирусного раствора загружали при титре 9,4 log10 БОЕ/мл геля для каждого прогона колонки. Вычисления основывались на кратности загрузочного титра вируса в загрузочном объеме, разделенном на CS объем колонки, log (10^(9,0 БОЕ/мл) × 50 мл / 20 мл объем колонки) = 9,4 log10 БОЕ/мл геля. Для исследуемых смол собирали фракции загрузки, потока, который прошел через колонку, промывочного раствора с бензоназой и элюата для каждого прогона. Все образцы разделяли на аликвоты, замораживали на сухом льду и хранили при температуре -80°C для анализа инфективности с помощью FFA и для количественного анализа HCD, НСР и бензоназы.
Исследование связывающей способности колонок с исследуемыми смолами: Колонки с исследуемыми смолами (16 мм × 10 см) загружали с помощью материала вирусного штамма са В/Малайзия 5XUF/ 5XDF TFF1 при загрузочной концентрации 9,0 log10 БОЕ/мл. Раствор 5XUF/ 5XDF вирусной загрузки предварительно разводили с помощью 1X SP буфера от титра 9,4 log10 БОЕ/мл до 9,0 log10 БОЕ/мл перед загрузкой. Четыре различных общих загрузки вируса, которые колебались на уровне концентраций 9,4, 9,9, 10,2 и 10,5 log10 БОЕ/мл геля, проводили для исследования связывающей способности исследуемых смол. Для каждого прогона собирали образцы вирусной загрузки, потока, который прошел через колонку, и элюата и анализировали на титры инфективности с помощью флуоресцентного анализа бляшкообразования (FFA) существенно так, как описано выше (смотри Пример, который обеспечивается в Разделе 8.1), и на ДНК хозяйских клеток (HCD) при использовании Quant-iT PicoGreen набора существенно в соответствии с процедурой, описанной в наборе. Уровень HCD элюата колонки в нг на 107 титр дозы подсчитывали как HCD (нг/мл)/10^(титр CS элюата log10 БОЕ/мл - 7,0 log10 БОЕ/доза)) = HCD (нг/доза). Уровень белка хозяйских клеток (НСР) и бензоназы™ также определяли существенно так, как описано выше (смотри Пример, который обеспечивается в Разделе 8.6).
Исследование способности к динамическому связыванию Целлуфин сульфата и исследуемых смол: TFF1 (5Х UF/5X DF) материал для различных партий штаммов са B/Малайзия и са A/Висконсин использовали для осуществления исследований связывающей способности колонки для оценки материала партии на показатели работы и способность к связыванию исследуемых смол по сравнению с CS гелем. TFF1 (5Х UF/5X DF) вирусный раствор загружали на колонки с CS и исследуемыми смолами при скорости 150 см/час. Количество вирусной загрузки определяли как такое на уровне от 10,5 до 10,7 log10 БОЕ/мл геля. Вычисления основывались на кратности загрузочного титра вируса в загрузочном объеме, разделенном на CS объем колонки, log10 (TFF1 загрузочного титра (log10 БОЕ/мл)) × загрузочный объем (мл) / объем колонки (мл)) = целевая загрузка при log10 БОЕ/мл геля. Поток, прошедший через колонку, собирали как 1 объем колонки (CV) в каждой фракционной колбе. Фракции, которые прошли через колонку, оценивали на титр с помощью FFA. Кривую "проскока" CS геля выстраивали как объем потока, прошедшего через колонку, против процента концентрации вирусного титра в потоке, прошедшем через колонку, по отношению к концентрации загрузочного титра. Способность к динамическому связыванию определяли как максимальное количество вируса, которое может связываться с гелем до достижения 10% загрузочной концентрации вируса в потоке, прошедшем через колонку. Объем (X) при 10% "проскоке" вируса потом использовали для подсчета способности к связыванию (Y) геля, что представляет собой кратность загрузочного титра вируса в объеме 10% "проскока", и разделяли на объем колонки, log (10^(загрузочного титра (log10 БОЕ/мл)) × (мл)/ объем колонки (мл)) = Y log10 БОЕ/мл геля.
Исследования загрузочного интервала: Три различных партии материала са В/Малайзия TFF1 (5Х UF/5X DF) использовали для осуществления исследований загрузочного интервала для сравнения влияния материала партии на поведение исследуемых смол С и D по сравнению с CS гелем. Интервалы целевой загрузки для каждой индивидуальной партии и для каждого геля колонки являются приведенными в Таблице 34. Собирали и анализировали фракции загрузки колонки, потока, который прошел через колонку, и элюата колонки для каждого прогона при использовании FFA и HCD анализов.
Выходы этапа очистки: Выход этапа очистки при использовании колонки рассчитывали из кратности титра элюированного вируса для объема колонки, поделенного на загруженный титр вируса и загруженный объем, 10^ титр CS элюата БОЕ/мл) × объем элюирования / (10^(титр CS загрузки БОЕ/мл) × объем загрузки).
|
8.7.2 Результаты и обсуждение
Для исследования прогонов очистки на исследуемых смолах A-D каждую колонку загружали 5XUF/ 5XDF TFF1 материалом вирусного штамма са В/Малайзия при концентрации загрузки 9,0 log10 БОЕ/мл. Целевое количество вирусной загрузки составляло 9,4 log10 БОЕ/мл геля для каждого прогона. Вирус элюировали из колонки при использовании трех объемов колонки (CV) SP буфера с 1 М NaCl. Хроматограмма элюирования для исследуемых смол A-D прогонов колонки показана на Фигуре 19, панели A-D, соответственно. Как показано в Фигуре 19, исследуемые смолы А и В оказались такими, которые демонстрируют разделенные множественные пики элюирования, в то время как исследуемые смолы С и D показали единственный пик с "плечами" пика и гетерогенными характеристиками.
Таблица подытоживает результаты для четырех прогонов очистки для сравнения выхода этапа, уровня загрязнений HCD, НСР и контаминанта бензоназы в колоночном элюате. Исследуемые смолы С и D имели более высокие значения выхода этапа (103,5% и 76,5%) по сравнению с исследуемыми смолами А и В и исследуемой смолой В, которая давала самые низкие значения выхода этапа (14,5%). В отношении уровней загрязнения HCD следует сказать, что очищенный с помощью исследуемых смол С и D штамм са В/Малайзия имел самые низкие уровни HCD (0,07 и 0,08 нг/доза) по сравнению с исследуемыми смолами А и В (0,14 и 0,67 нг/доза). Уровни НСР для са В/Малайзия, очищенного с помощью исследуемой смолы С (0,27 нг/доза) и исследуемой смолы D (0,21 нг/доза), были подобными таковым для исследуемой смолы А (0,26 нг/доза), но ниже, чем для исследуемой смолы В (0,87 нг/доза). Уровни бензоназы для штамма са В/Малайзия, очищенного с помощью исследуемых смол С и D (0,25 и 0,31 нг/доза), были ниже, чем при использовании исследуемых смол А и В (1,78 и 2,60 нг/доза).
|
В Таблице показано, что титр вируса в потоке, прошедшем через колонку, для прогонов четырех исследуемых смол был продемонстрирован либо как очень низкий (2,2% от общего количества инфекционных частиц по отношению к загрузке исследуемой смолы С), либо на уровне границы определения (LOD), что свидетельствует о том, что вирус был в основном связан с гелем при загрузке 9,4 log10 БOE/мл геля. Исследуемая смола С имела самое высокое количество вируса в потоке, прошедшем через колонку, что дает возможность предположить, что исследуемая смола С может иметь более низкую способность к связываю по сравнению с тремя другими исследуемыми смолами. Фракция промывки от бензоназы для этих четырех прогонов также продемонстрировала либо неопределяемое количество вируса, либо очень низкий процент вируса (1,2% для исследуемой смолы С и 0,9% для исследуемой смолы D). Результаты начального скрининга для четырех прогонов очистки при использовании исследуемых смол свидетельствуют о том, что исследуемые смолы С и D обладали лучшими характеристиками по сравнению с другими двумя гелями в отношении выхода этапа и уровней загрязнения и контаминанта элюата.
|
Результаты скрининга исследуемых смол A-D при загрузке 9,4 log10 БОЕ/мл геля показали, что вирус в основном был связан, таким образом более высокое количество вирусной загрузки при уровнях загрузки 9,4, 9,9, 10,2 и 10,5 log10 БОЕ/мл геля было выбрано для оценки способности к связыванию этих смол. В дополнение, исследуемые смолы Е и F также подвергали оценке. Влияние на выход этапа и уровни загрязнения HCD при этих уровнях загрузки также подвергали оценке. Результаты исследования способности к связыванию подытожены ниже. Таблица приводит результаты определения способности к связыванию исследуемых смол С и D. Таблица приводит результаты определения способности к связыванию исследуемых смол А, В, Е и F.
|
|
В Таблице результаты прогона при загрузке 9,4 log10 БОЕ/мл геля для исследуемых смол С и D сравнивали с элюированием SP буфером 1 М NaCl и 2 М NaCl, соответственно. Элюирование 2 М NaCl осуществляли для оценки, будут ли пики элюирования исследуемых смол С и D приводить к получению единственного пика по отношению к пикам, которые наблюдали при элюировании с помощью 1 М NaCl. Как показано в Фигуре 20, пик элюирования заострялся при использовании 2 М NaCl элюирования для обоих гелей без признаков гетерогенности (сравни Фиг.19В с 20А и Фиг.19D с 20В). Как показано в Таблице, 2 М NaCl элюирование существенно не влияло на выход этапа для обоих исследуемых смол С и D, принимая во внимание извлечение на основе титров от 103,5 до 90,2% для исследуемой смолы С и от 76,5 до 59,7% для исследуемой смолы D. Уровни HCD элюата в нг на дозу были слабо повышены для обоих гелей, когда осуществляли элюирование с помощью 2 М NaCl; повышались от 0,07 до 0,2 нг/доза для исследуемой смолы С и от 0,08 до 0,11 нг/доза для исследуемой смолы D. Для оценки влияния на уровень BCD при более высоком количестве вирусной загрузки, поскольку количество загрузки увеличивали с 9,4 до 9,9 log10 БОЕ/мл геля, уровень HCD элюата для исследуемой смолы С повышали от 0,2 до 1,26 нг/доза, но это не влияло на выход этапа (90,2% против 94,4%). Дальнейшее повышение загрузки до 10,2 log10 БОЕ/мл геля продемонстрировало повышение количества "проскока" вируса (14,4%) в потоке, прошедшем через колонку, что таким образом приводило к снижению выхода (79,4%) и повышению HCD уровня в элюате (2,19 нг/доза) для исследуемой смолы С. Поскольку кривую "проскока" не оценивали для каждого геля, способность к связыванию оценивали тогда, когда не более чем 2% вируса появлялось в потоке, прошедшем через колонку, для соответствующего количества вирусной загрузки. Таким образом, 9,9 log10 БОЕ/мл геля представляло собой оцененную способность к связыванию для смолы С. Как показано в Таблице, для исследуемой смолы D повышение загрузки вируса от 9,5 до 10,2 log10 БОЕ/мл геля приводило к повышению уровня HCD от 0,11 нг/доза до 0,98 нг/доза, но не оказывало значительного эффекта на выход этапа (от 59,7% до 79,7%). Это происходило потому, что малый процент вируса определяли в потоке, прошедшем через колонку (1,4%) даже при загрузке 10,2 log10 БОЕ/мл геля. Таким образом, 10,2 log10 БОЕ/мл геля оценивали на способность к связыванию исследуемой смолы D.
Вкратце, оцененные способности к связыванию для исследуемых смол С и D составляли 9,9 и 10,2 log10 БОЕ/мл геля, соответственно. Исследуемая смола D обладала приблизительно в два раза более высокой способностью к связыванию, чем исследуемая смола С в этом наборе исследований со штаммом са В/Малайзия. Когда увеличивали количество вирусной загрузки, уровни HCD элюата для обоих исследуемых смол С и D также повышались. При сравнении гелей при таком же уровне загрузки 10,2 log10 БОЕ/мл геля было установлено, что значение HCD на дозу для исследуемой смолы С (2,19 нг/доза) было выше, чем для исследуемой смолы D (0,98 нг/доза), что свидетельствует о том, что влияние на уровень HCD для исследуемой смолы С было более выраженным, чем для исследуемой смолы D при более высокой вирусной загрузке. В отношении выхода этапа при сравнении различных количеств вирусной загрузки было установлено, что исследуемая смола С дает несколько более высокие значения выхода этапа, чем исследуемая смола D.
Результаты начального скрининга свидетельствуют о том, что исследуемые смолы С и D давали лучшие результаты очистки по сравнению с исследуемыми смолами А и В, когда исследования осуществляли при загрузке 9,4 log10 БОЕ/мл геля. Для того чтобы оценить, могут ли исследуемые смолы А и В, а также две дополнительных исследуемых смолы (Е и F) давать даже более высокие способности к связыванию, чем исследуемые смолы С и D, осуществляли исследования способности к связыванию с исследуемыми смолами А, В, Е и F и оценивали выходы этапа. Результаты подытожены в Таблице. В этом наборе прогонов очистки связанный вирус элюировали с помощью SP буфера 1 М NaCl, который представляет собой буфер условий элюирования, используемых для CS хроматографического этапа, описанного в Примере, который обеспечивается в Разделе 8.6.
Как показано в Таблице, оцененная способность к связыванию для исследуемой смолы Е составляла от 9,9 до 10,2 log10 БОЕ/мл геля, поскольку при этих двух интервалах загрузки процентное содержание вируса в потоке, прошедшем через колонку, повышалось от неопределяемого до 8,3%. Для исследуемой смолы А оцененная способность к связыванию составляла от 10,2 до 10,5 log10 БОЕ/мл геля, поскольку процентное содержание вируса в потоке, прошедшем через колонку, повышалось от неопределяемого до 6,3% при этих двух интервалах загрузки. Способности к связыванию для обоих исследуемых смол В и Е оценивали как такие, которые составляют, по крайней мере, ≥9,9 log10 БОЕ/мл геля, поскольку не осуществляли прогонов при более высоких интервалах загрузки.
При оценке влияния уровней HCD при более высоких количествах вирусной загрузки уровни HCD для исследуемых смол А, В, Е и F повышались тогда, когда вирусная загрузка увеличивалась от 9,4 до 9,9 log10 БОЕ/мл геля. Даже более высокие уровни HCD наблюдали для исследуемых смол А и Е, когда вирусная загрузка увеличивалась вплоть до 10,2 и 10,5 log10 БОЕ/мл геля. При том же количестве вирусной загрузки (9,9 log10 БОЕ/мл геля) с исследуемыми смолами С и D наблюдали более высокие уровни HCD во фракции элюирования для некоторых исследуемых смол (3,43 нг/доза для исследуемой смолы А, 2,9 нг/доза для исследуемой смолы В, 5,31 нг/доза для исследуемой смолы Е и 1,24 нг/доза для исследуемой смолы F) (см. Таблицу). Таким образом, влияние на уровни HCD для исследуемых смол А, В, Е и F с более высокой вирусной загрузкой было более значительным, чем для исследуемых смол С и D.
Выход этапа снижался от 82% до 47,8% для исследуемой смолы Е, когда вирусная загрузка увеличивалась от 9,4 до 10,2 log10 БОЕ/мл геля (см. Таблицу). Для исследуемой смолы А выход этапа также снижался (69,4% to 51,5%), когда вирусная загрузка увеличивалась от 9,4 до 10,5 log10 БОЕ/мл геля. Обе исследуемые смолы В и F продемонстрировали относительно низкие выходы этапа (11,7% и 34,9%) по сравнению с исследуемыми смолами Е и А (52,0% и 61,5%) с тем же количеством вирусной загрузки (9,9 log10 БОЕ/мл геля). Ту же тенденцию наблюдали при вирусной загрузке 9,4 log10 БОЕ/мл геля с более высокими выходами этапа для исследуемой смолы Е (82%) и исследуемой смолы А (69,4%) по сравнению с исследуемой смолой В (14,5%). При сравнении исследуемых смол было обнаружено, что исследуемые смолы С и D давали более высокие выходы этапа, чем исследуемые смолы А, В, Е и F при различных интервалах вирусной загрузки. Исследуемые смолы С и D дополнительно оценивали при использовании различных вирусных штаммов и партий сбора для сравнения характеристик с существующим CS гелем.
Исследуемую смолу С использовали для оценки очистки других вирусных штаммов. Фигуры 21А и В показывают хроматограмму пика элюирования прогонов очистки са А/Висконсин и са А/Соломоновы острова, соответственно, при использовании колонки с исследуемой смолой С. Пики профилей были весьма подобными и последовательньми с прогонами очистки для штамма са В/Малайзия (Фигура 21C). Таблица приводит выходы этапа и уровни HCD в элюате для очистки штаммов са В/Малайзия, са А/Соломоновы острова и са А/Висконсин. Весь вирус, связанный на колонке, и менее чем 1% общего количества частиц инфекционного вируса по отношению к загрузке наблюдали в потоке, прошедшем через колонку, при условиях загрузки от 9,4 до 10,0 БОЕ/мл геля. Выходы этапа для трех штаммов колебались от 78,9 до 112,5%, были относительно сравнимыми для всех трех штаммов и были сравнимыми с предыдущими высокими выходами, полученными для исследуемого геля смолы С. Уровни ДНК хозяйских клеток были низкими, когда загрузка составляла менее 9,8 log10 БОЕ/мл геля, однако уровень ДНК в элюате повышался до значения 1,34 нг/доза, когда использовали высокое количество вирусной загрузки (при 10 log10 БОЕ/мл геля). Подобное повышение уровня HCD наблюдали для изучения способности к связыванию при использовании исследуемого геля смолы С со штаммом са В/Малайзия, используемым в предыдущем исследовании. Результаты свидетельствуют о том, что исследуемые смолы дают подобные характеристики, когда использовались для очистки различных штаммов.
|
Очистку штаммов са А/Висконсин и са В/Малайзия оценивали при использовании геля исследуемой смолы D. Фигуры 22А и В показывают хроматограмму пика элюирования для элюированного вируса. Профили пиков элюирования являются подобными для двух штаммов и очистка извлечения для этого этапа была выше с ожидаемым интервалом (<2 нг/доза) уровней HCD для фракции элюата для обоих штаммов (см. Таблицу).
|
Исследование динамической способности к связыванию осуществляли с TFF 1 (5XUF 5XDF) материалом для штамма са В/Малайзия и са А/Висконсин и тремя различными партиями са В/Малайзия с общей целевой загрузкой вируса от 10,5 до 10,7 log10 БОЕ/мл геля. В начале записи значения A280 нм вирусная загрузка является относительно слабой. После загрузки определенного объема значение A280 значительно повышалось и постепенно достигало плато, что свидетельствовало о том, что колонка превысила свою способность, позволяя, таким образом, вирусу осуществлять "проскок". Процентное содержание вируса в потоке, прошедшем через колонку, подсчитывали путем деления титра вируса каждой фракции потока, прошедшего через колонку, на загрузочный титр и умножения на 100. Кривую "проскока" выстраивали при использовании процентного значения концентрации вируса в потоке, прошедшем через колонку, против загруженного объема. Динамическую способность геля к связыванию определяли как способность к связыванию на мл геля, когда фракция потока, прошедшего через колонку, достигала 10% "проскока" вирусной концентрации по отношению к загрузочной концентрации.
Для CS колонки, когда загружали 18 мл вируса, 5% вируса появлялось во фракции потока, прошедшего через колонку. Когда достигали способности к связыванию при 10% "проскоке", загружали приблизительно 19 мл раствора вируса. Это представляет загрузку 9,8 log10 БОЕ на мл геля (log10(10^(9,3) × 19 мл/5,8 мл) = 9,8 log10 БОЕ на мл геля). Таким образом, 9,72 log10 БОЕ/мл геля определяли как динамическую способность к связыванию для CS геля со штаммом са В/Малайзия/2506/04 партия # 1. Подобно этому, когда загружали 27 мл вируса на колонку с исследуемой смолой С, а 24 мл вируса загружали на колонку с исследуемой смолой D, 10% вируса появлялось во фракциях потока, прошедшего через колонку. Динамическую способность к связыванию исследуемых смол С и D определяли как 9,96 и 9,92 log10 БОЕ/мл геля, соответственно, с той же партией штамма вируса са B/Малайзия. Динамические способости к связыванию для исследуемых смол С, D и CS колонки для нескольких партий штамма са B/Малайзия подытожены в Таблице. Как показано в Таблице, динамическая способность к связыванию варьировала и оказалась зависимой от уровней HCD и НСР в материале загрузки. Динамическая способность к связыванию колонок с CS и исследуемыми смолами С и D подвергается влиянию со стороны уровня HCD для загруженного материала: чем более высокий уровень HCD материала загрузки, тем ниже динамическая способность к связыванию геля. Динамическая способность к связыванию геля оказалась менее подверженной влиянию со стороны уровня НСР материала загрузки. Было выдвинуто предположение, что некоторое количество ДНК хозяйских клеток связывается с вирусом, препятствуя, таким образом, кинетическому связыванию вируса с гелевой поверхностью лиганда, что приводит к более низкой способности к связыванию, наблюдаемой для партий вируса с более высокими уровнями ДНК. Среди четырех партий, показанных в Таблице, динамическая способность к связыванию CS геля варьировала от 9,7 до 10,4 log10 БОЕ/мл геля, способность к связыванию для исследуемой смолы С колебалась в интервале от 9,9 до 10,7 log10 БОЕ/мл смолы, а способность к связыванию для исследуемой смолы D колебалась от 9,9 до свыше 10,7 log10 БОЕ/мл геля. В общем случае, динамическая способность к связыванию исследуемых гелей смол С и D была выше (~2-кратно) по сравнению с CS гелем при оцененных условиях. Динамическая способность к связыванию геля исследуемой смолы D была иногда выше в некоторых партиях и, по крайней мере, сравнимой с исследуемым гелем смолы С.
|
После сравнения динамической способности к связыванию CS с исследуемыми смолами С и D осуществляли индивидуальные прогоны при использовании трех партий са В/Малайзия для оценки выхода этапа и удаления HCD для CS и исследуемых смол при использовании тех же загрузочных условий. Интервалы целевого загрузочного титра для каждой партии выбирали для изучения в соответствии с динамической способностью к связыванию партии. Таблица подытоживает выход этапа очистки и уровни HCD при различных интервалах вирусной загрузки для колонки очистки с использованием CS, исследуемой смолы С и исследуемой смолы D с использованием партии 1 са В/Малайзия. Оцененные способности к связыванию для исследуемых смол С и D составляли 9,9 и 10,2 log10 БОЕ/мл геля, соответственно. Исследуемая смола D обладала приблизительно в два раза более высокой способностью к связыванию, чем исследуемая смола С, в этих исследованиях. Способность к связыванию для CS составляла 9,7 log10 БОЕ/мл геля3 при использовании той же партии материала. Обе исследуемые смолы С и D обладали более высокой (в 2- и 4 раза) способностью к связыванию, чем CS. Когда увеличивали количество загруженного вируса, то уровни HCD элюата для обеих исследуемых смол С и D также повышались. При сравнении гелей при том же уровне загрузки 10,2 log10 БОЕ/мл геля было установлено, что уровень HCD на дозу для исследуемой смолы С (2,19 нг/доза) был выше, чем для исследуемой смолы D (0,98 нг/доза). Таким образом, повышение уровня HCD в элюате было подобным для исследуемой смолы D и CS геля, когда повышалась загрузка вируса. Однако для исследуемого геля смолы С повышение уровня HCD было более примечательным по сравнению с CS гелем. Выход этапа с различными количествами загруженного вируса был сравнимым или мало отличался для исследуемой смолы С по сравнению с исследуемой смолой D. По сравнению с CS колонкой колонки с исследуемыми смолами С и D давали более высокие выходы этапа, когда очистку вируса осуществляли при условиях более высокой вирусной нагрузки. В общем случае, исследуемая смола D обладала более высокой способностью к связыванию и лучшими характеристиками очистки по сравнению с CS и исследуемой смолой С.
|
Таблица подытоживает интервалы выходов этапа очистки и уровни HCD при различных вирусных загрузках для колоночной очистки са В/Малайзия партии 2 при использовании CS, исследуемой смолы С и исследуемой смолы D. Способности к связыванию для исследуемых смол С и D, а также CS составляли 9,96, 9,92 и 9,80 log10 БОЕ/мл геля, соответственно. Исследуемые смолы С и D имели немного более высокую способность к связыванию, чем CS гель. Когда загрузка вируса была близкой к способности динамического связывания, 9,8-9,9 log10 БОЕ/мл геля, выходы этапа для всех трех гелей были сравнимыми при значении 47,5% - 62,8%. При более высокой вирусной загрузке, 10,1 log10 БОЕ/мл геля выходы этапа для CS колонки значительно снижались до 25,2%, а для исследуемой смолы С снижались до 50,2%, в то время как выход для исследуемой смолы D оставался на уровне 63,2%. Когда загрузка повышалась до значения 10,4 log10 БОЕ/мл геля, выход этапа для CS далее снижался до значения 12,6%, в то время как выход для исследуемых смол С и D снижался до 49,8 и 39,5%, соответственно. Выходы этапа для исследуемых смол С и D были значительно выше, чем для CS геля.
|
Когда количество вирусной загрузки повышалось, уровни HCD элюата для CS, гелей исследуемых смол С и D также повышались. Сравнение гелей при том же количестве вирусной загрузки от 9,8 до 10,4 log10 БОЕ/мл геля, показало, что уровень HCD на дозу для исследуемой смолы С (0,97, 2,51, 2,93 нг/доза) был выше, чем для CS (0,5,1,91,2,43 нг/доза), а значение HCD для исследуемой смолы D было самым низким (ГО, 1,67,1,21 нг/доза). Повышение уровня HCD в вирусе, очищенном при использовании исследуемой смолы С, было большим, чем для CS геля. Повышение уровня HCD в элюате было подобным для исследуемой смолы D и CS геля, хотя и меньшим для исследуемой смолы D. В целом, исследуемая смола D обладала более высокой способностью к связыванию и лучшими характеристиками очистки (выход этапа и уровень HCD) по сравнению с CS и исследуемой смолой С, в частности, когда оценивалось при условии более высокой загрузки вируса.
После оценки общей характеристики очистки исследуемых смол С и D по сравнению с CS колонкой для предыдущих двух партий са В/Малайзия, исследуемая смола D была выбрана для исследований очистки для дальнейшего сравнения CS геля при использовании партии #3 са В/Малайзия. Результаты подытожены в Таблице. Для этой партии динамическая способность к связыванию CS и исследуемой смолы D были сравнимыми при значениях 10,2 log10 БОЕ/мл геля для CS и 10,1 log10 БОЕ/мл геля для исследуемой смолы D. При сравнении характеристик при различных количествах вирусной загрузки уровни HCD были сравнимыми между CS и гелем исследуемой смолой D (все менее чем 1,1 нг/доза). Для выходов этапа, в частности при высокой вирусной загрузке на уровне 10,2 и 10,5 log10 БОЕ/мл геля, исследуемая смола D давала немного лучший выход этапа (52,8 и 65,8%), чем CS гель (46,2 и 55,2%).
|
Для оценки масштабируемости очистки гель исследуемой смолы D упаковывали в ХK-50 колонку (5 см × 17 см) приблизительно с 25-кратным расширением масштаба. Вирусный урожай 10 л биореактора, TVCC-2 партию #32 са штамма А/Южная Дакота подвергали обработке после SP стабилизации, DFF1 и TFF1 (5Х UF и 5Х DF), как описывается в способах для колоночной загрузки материала. TFF1 (5XUF 5XDF) материал загружали на колонку с исследуемой смолой D и CS ХK-50 (5 см × 17 см), соответственно. Условия прогонки колонки и операционные параметры, включая этап загрузки и скорость промывания при использовании линейного потока, этап обработки бензоназой на колонке и этапы элюирования, были такими же, как и в TVCC-1 процессе (масштаб 20 л) и мелкосерийном прогоне, описанном в способах Раздела. Фигура 22С показывает хроматограммы пика элюирования исследуемой смолы D при масштабе ХK-50 колонки. Пики элюирования показали небольшой предварительный пик в начале элюирования, после которого наступал основной единственный пик при отсутствии множества характеристик пика элюирования, как наблюдали на хроматограмме мелкосерийного элюирования (Фигуры 22А и В). Таблица подытоживает выходы этапа очистки и уровни HCD элюата для прогонов исследуемой смолы D и CS колонки. Общая вирусная загрузка 10,0 log10 БОЕ/ мл геля вспомогательного мелкосерийного прогона очистки при использовании исследуемой смолы D давала сравнимый выход этапа (75,6%) и низкие уровни HCD (0,15 нг/доза), демонстрируя масштабируемость геля исследуемой смолы D. Эти результаты при сравнении с прогоном CS колонки ХK-50 прогона продемонстрировали, что уровень HCD элюата для колонки исследуемой смолы D был в два раза меньше, чем для элюата CS колонки.
|
В общей сложности шесть исследуемых смол для очистки вируса подвергали скринингу и оценке. Оценка включала изучение выхода этапа, способность к связыванию и уровень загрязнения. Исследуемые смолы С и D обладали лучшими способностями к связыванию, более высокими выходами этапа и более низкими уровнями загрязнения HCD по сравнению с четырьмя другими смолами. Выходы этапа для исследуемых смол В и F были достаточно низкими для того, чтобы рассматриваться как такие для препаратов в коммерческих масштабах. Способности к связыванию исследуемых смол А и Е были несколько выше или сравнимыми с таковыми для исследуемых смол С и D; однако выходы этапа были не столь высокими, а загрязнение HCD повышалось до достаточно высоких уровней при высоких количествах вирусной загрузки. При сравнении исследуемых смол С и D, несмотря на немного более высокие выходы этапа, которые наблюдали для исследуемой смолы С, исследуемая смола D оказалась такой, которая имела более высокую способность к связыванию и обладала меньшим воздействием на уровень HCD при загрузке более высокого количества вируса. Это предполагает то, что исследуемые смолы С и D представляют собой хроматографические гели, которые могут рассматриваться для применения в очистке коммерческого масштаба. Дополнительная оценка характеристик, включая способность к связыванию, выходы этапа и уровень ДНК хозяйских клеток в элюате колонки, исследуемых смол С и D по сравнению с гелями на основе Целлуфин сульфата показала, что гель исследуемой смолы D является лучшим, чем гель смолы С, который, таким образом, был выбран в качестве альтернативы CS для дальнейшей крупномасштабной оценки. При оценке четырех различных партий вируса было установлено, что динамическая способность к связыванию исследуемых смол С и D была приблизительно в два раза выше (в некоторых партиях) или, по крайней мере, сравнимой с таковой для Целлуфин сульфата. Исследуемая смола D обладала подобной или более высокой способностью к связыванию, чем исследуемая смола С. В отношении выхода этапа и уровней ДНК хозяйских клеток исследуемая смола D обладала подобным выходом по сравнению с исследуемой смолой С, но имела более высокий выход, чем CS при условии более высокой вирусной загрузки. При повышении вирусной загрузки влияние на повышение уровня HCD в элюате было подобным для исследуемой смолы D и CS геля, но влияние на повышение уровня HCD в элюате было более заметным для исследуемой смолы С. Уровень HCD элюата исследуемой смолы D был сравнимым с CS для всех оцененных партий. В завершение, пилотная оценка масштабируемости исследуемой смолы D на прогоне ХK-50 колонки показала выход очистки, низкий уровень хозяйской ДНК в элюате, демонстрируя масштабируемость и потенциал для использования в качестве альтернативы хроматографического геля для процесса производства вируса гриппа на основе культуры клеток.
8.8 Очистка RSV
Фильтры и картриджи
1) 8-мкм Sartopure PP2 номинальный фильтр
2) 3-мкм Sartopure PP2 номинальный фильтр
3) 0,65-мкм Sartopure PP2 номинальный фильтр
4) 3,0/0,8-мкм Sartoclean CA мембранный фильтр
5) 0,45-мкм Millipak 100 PVDF фильтр
6) Картридж из UF/DF пористого волокна, размер пор мембраны 500 кДа, внутренний просвет (внутренний диаметр) может быть либо 0,5 мм, либо 1,0 мм, толщина слоя может варьировать от 30 до 60 см.
Химические вещества
1) Сахароза
2) Трис Сl
3) KСl
4) KН2РO4
5) K2HPO4
6) NaCl
7) KCl
8) ЭДТА
9) Трегалоза
10) SFM4MegaVir
11) Цитрат натрия
12) Цитрат калия
13) Бензоназа
14) NaOH
15) NaOCl.
Оборудование
1) Wavemixer с нагревательным элементом (Wave Biotech модель # 20/50ЕН)
2) 10 л Stedim резервуары (кат. номер FBP 10381)
3) Крупногабаритная стеклянная тара
4) Пипетки
5) Флаконы (250 мл, 1 л Nalgene)
6) GE гибкая подставка
7) Насосы (Watson Marlow 520 S, 620Di)
8) Весы (Sartorius, модель # EB60EDE-1; Sartorius модель # CP4202S).
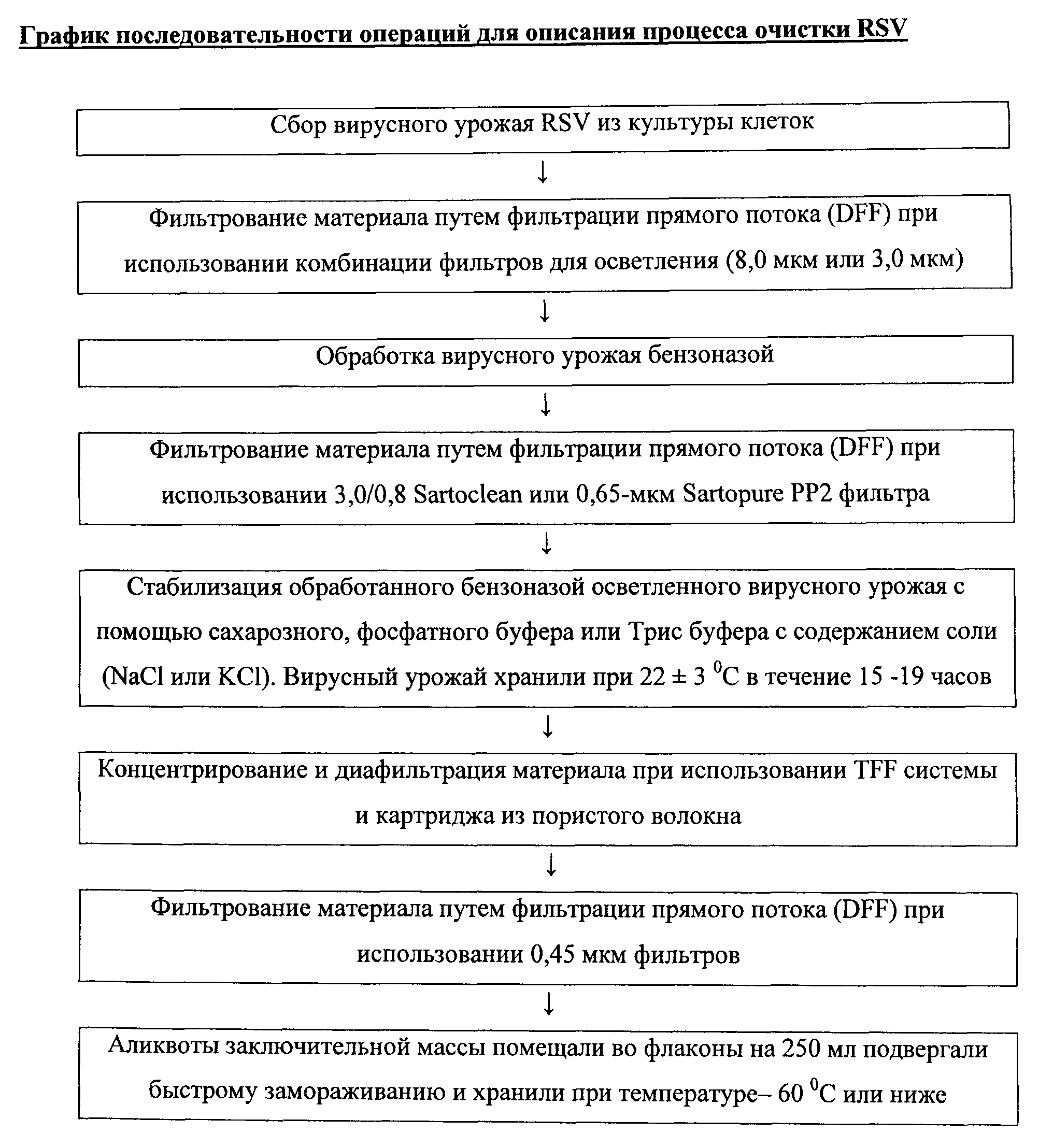
Методология
1) RSV (например, rА2ср248/404/1030ΔSН) вирус выращивают в клетках Vero. Современная эксплуатационная платформа использует 10 л биореактор. Вирусный урожай (VH) содержит инфекционную среду SFM4MegaVir (Hyclone).
2) Вирусный урожай разделяли на пулы в 10 л Stedim резервуаре и фильтровали через 8- или 3-мкм фильтр при подаваемом давлении 15 фунтов на кв. дюйм и с загрузкой 4-5 мл VH/см2 эффективной фильтрационной поверхности (EFA) для 3-мкм фильтра или 27 мл VH/см2 EFA для 8-мкм фильтра. Фильтрат собирали, взвешивали в 10 л Stedim резервуаре.
3) Осветленный вирусный урожай обрабатывали с помощью 50 ед./мл бензоназы при 32±3°С в течение 3 часов. Урожай обрабатывали в качалке при 30 качаний/мин (об/мин) и при 3° угле.
4) Осветленный, обработанный бензоназой VH фильтровали через 0,65-мкм Sartorius Sartopure PP2 фильтр с загрузкой 16-18 мл осветленного, обработанного бензоназой VH /см2 EFA для фильтра.
а. 0,65-мкм фильтрат потом стабилизировали с помощью стабилизационного буфера, включающего 36 мМ Трис-Cl, 214 мМ сахарозы и 150 мМ NaCl или KСl.
5) Стабилизированный фильтрат хранили в течение ночи (16±3 часа) и использовали в качестве вносимого материала для этапа ультрафильтрации (концентрации).
6) Этап ультрафильтрации осуществляли при использовании картриджа из пористого волокна 500 кДа от GE Healthcare с просветом внутреннего диаметра 0,5-1 мм. Стабилизированный 0,65-мкм фильтрат загружали на картридж из расчета 10 мл на см2 поверхности мембрны. Вносимый материал концентрировали 5-кратно при использовании операционного трансмембранного давления (ТМР) 15 фунтов на кв. дюйм и скорости сдвига 12000 сек-1.
7) Концентрированный материал подвергали диафильтрации при использовании буфера диафильтрации (8-10-кратная замена буфера на основе объема концентрата). Буфер обмена включал Трис (5 мМ); сахарозу (25% вес./об.); NaCl (150 мM); pH 7,2.
8) Подвергнутый диафильтрации материал пропускали через конечный фильтр (0,45-мкм фильтр Millipak) с загрузкой 4-5 мл/см2. Фильтрат представлял собой заключительную массу (лекарственное вещество), его разделяли на аликвоты во флаконы. Все аликвоты RSV вирусного лекарственного вещества были подвергнуты либо быстрой заморозке в бане метанол-сухой лед, либо при использовании морозильной камеры с контролем скорости замораживания.
Хотя вышеупомянутое изобретение было подробно описано с целью ясности и понимания, является понятным, что специалист в данной области техники из прочтения данного раскрытия может осуществить различные изменения форм и деталей без отступления от истинного объема в соответствии с изобретением. Например, все методики и приборы, описанные выше, могут использоваться в различных комбинациях. Все публикации, патенты, патентные заявки или другие документы, которые цитируются в данной заявке и являются введенными в нее в качестве ссылки в своей целостности для всех целей до такой степени, как если бы каждая индивидуальная публикация, патент, патентная заявка или другой документ были индивидуально указаны для введения в качестве ссылки для всех целей. В дополнение, следующие временные патентные заявки США: 60/845,121, поданная 16 сентября 2006 года; 60/871,721, поданная 22 декабря 2006 года; 60/917,008, поданная 09 мая 2007 года; 60/951,813, поданная 25 июля 2007 года; 61/099,749, поданная 24 сентября 2008 года; 61/104,933, поданная 13 октября 2008 года; 61/122,456, поданная 15 декабря 2008 года; 61/187721, поданная J 17 июня 2009 года, и патентная заявка США 11/855,769, поданная 14 сентября 2007 года, являются введенными в качестве ссылки в своей целостности.