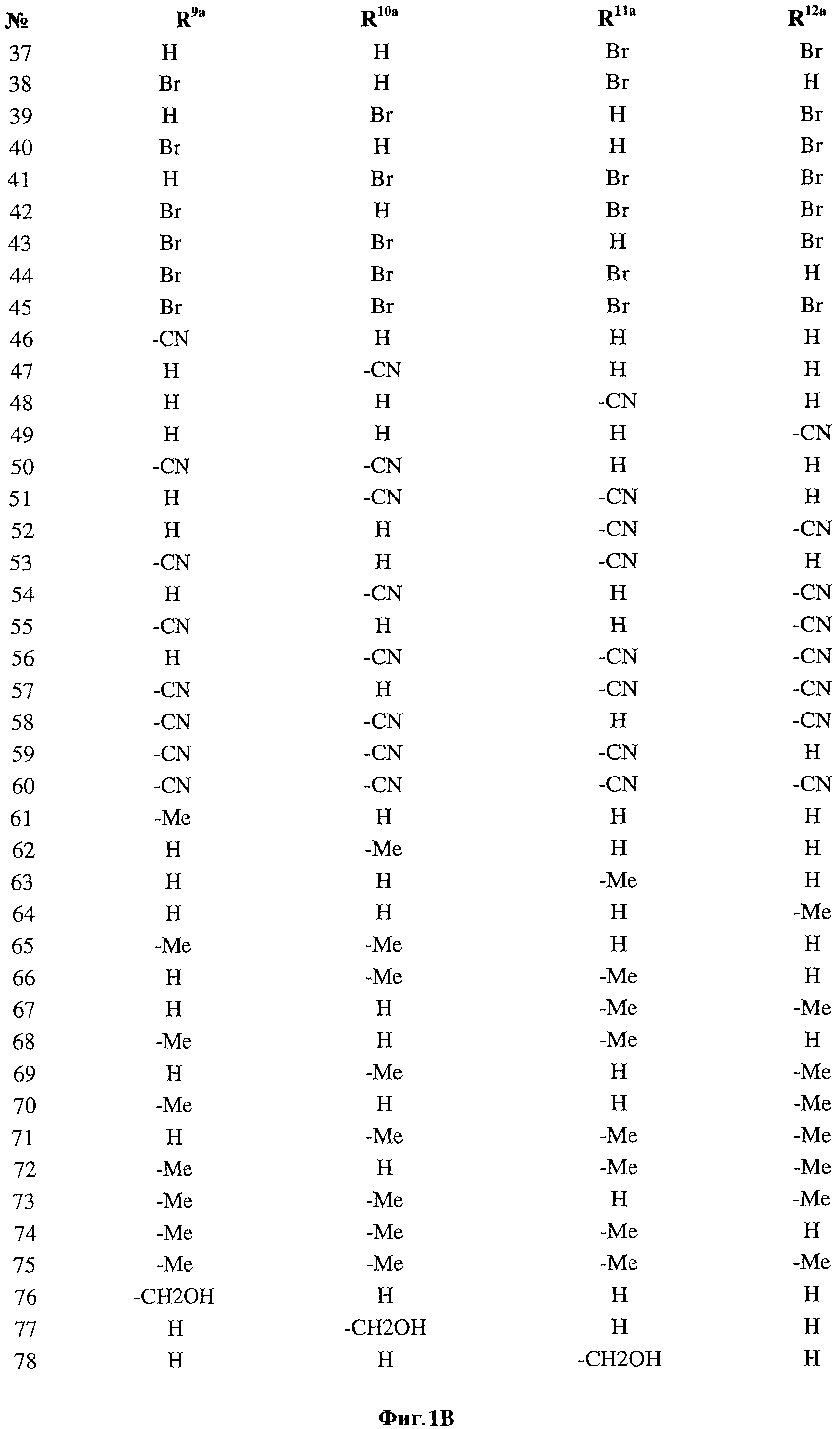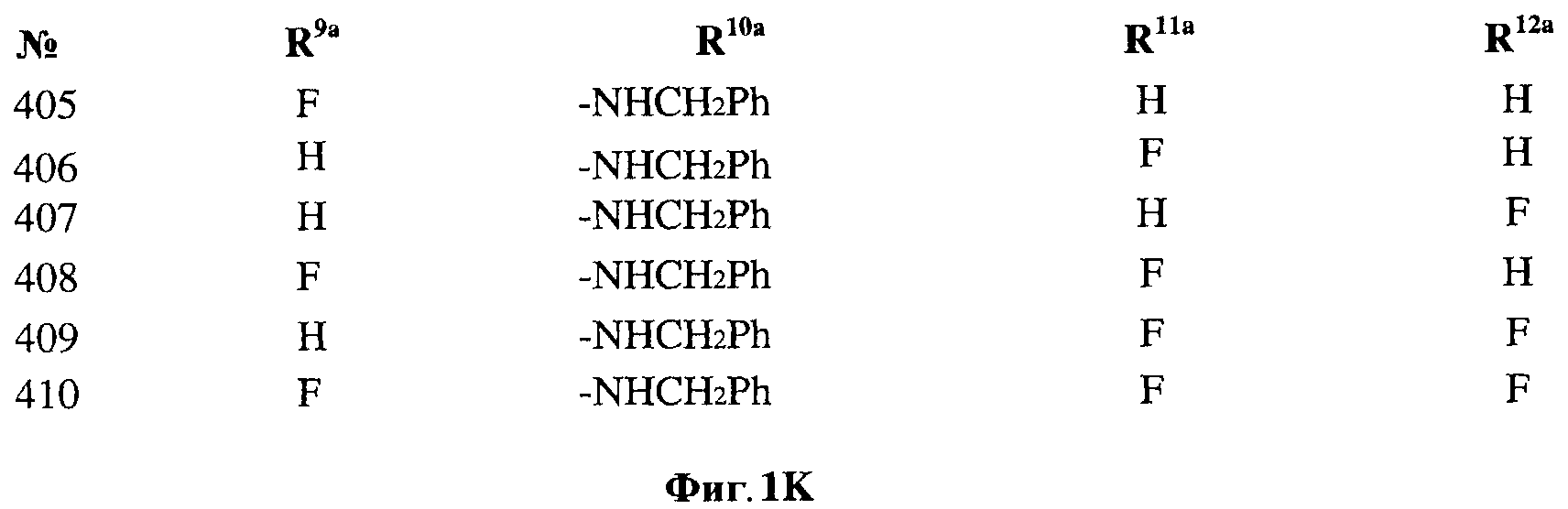БОРСОДЕРЖАЩИЕ МАЛЫЕ МОЛЕКУЛЫ В КАЧЕСТВЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ АГЕНТОВ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США №61/034371, поданной 6 марта 2008, предварительной заявке на патент США №61/052637, поданной 12 мая 2008, предварительной заявке на патент США №61/094406, поданной 4 сентября 2008, предварительной заявке на патент США №61/105990, поданной 16 октября 2008, предварительной заявке на патент США №61/110903, поданной 3 ноября 2008, предварительной заявке на патент США №61/143700, поданной 9 января 2009, и предварительной заявке на патент США №61/148731, поданной 30 января 2009, содержание каждой из которых полностью включено в настоящее описание посредством ссылки для любых целей.
УРОВЕНЬ ТЕХНИКИ
[0002] Атипичное воспаление представляет собой значительную составную часть обширного ряда заболеваний у людей. В крови у людей, страдающих дегенеративными расстройствами, часто наблюдаются избыточные уровни провоспалительных регуляторов. Одним из типов указанных провоспалительных регуляторов являются цитокины, включая ИЛ-1α, β, ИЛ-2, ИЛ-3, ИЛ-6, ИЛ-7, ИЛ-9, ИЛ-12, ИЛ-17, ИЛ-18, ИЛ-23, ФНО-α, ЛТ, ФИЛ, Онкостатин и ИФНс1α, β, γ.
[0003] Неограничивающий список распространенных медицинских проблем, непосредственно вызываемых воспалительными цитокинами, включает: артрит, при котором воспалительные цитокины могут приводить к повреждениям синовиальной мембраны и к разрушению суставного хряща и кости; почечную недостаточность, при которой воспалительные цитокины ограничивают кровообращение и повреждают нефроны; волчанку, при которой воспалительные цитокины усиливают отложение иммунных комплексов и повреждение; астму, при которой воспалительные цитокины перекрывают дыхательные пути; псориаз, при котором воспалительные цитокины вызывают дерматит; панкреатит, при котором воспалительные цитокины вызывают повреждение клеток поджелудочной железы; аллергию, при которой воспалительные цитокины вызывают проницаемость кровеносных сосудов и гиперемию; фиброз, при котором воспалительные цитокины поражают травмированную ткань; хирургические осложнения, при которых воспалительные цитокины препятствуют излечению; анемию, при которой воспалительные цитокины нарушают выработку эритропоэтина; и фибромиалгию, при которой у пациентов, страдающих фибромиалгией, повышены уровни воспалительных цитокинов.
[0004] Другие заболевания, связанные с хроническим воспалением, включают рак; сердечный приступ, при котором хроническое воспаление способствует коронарному атеросклерозу; болезнь Альцгеймера, при которой хроническое воспаление разрушает клетки мозга; застойную сердечную недостаточность, при которой хроническое воспаление вызывает истощение сердечной мышцы; инсульт, при котором хроническое воспаление провоцирует тромбоэмболические события; и стеноз клапана аорты, при котором хроническое воспаление повреждает клапаны сердца. Артериосклероз, остеопороз, болезнь Паркинсона, инфекция, воспалительное заболевание кишечника, включая болезнь Крона и язвенный колит, а также рассеянный склероз (типичное аутоиммунное заболевание, связанное с воспалением) также связаны с воспалением (Bebo, В.F., Jr., J Neurosci Res, 45: 340-348, (1996); Mennicken, F., TRends Pharmacol Sci, 20: 73-78, (1999); Watanabe, T, Int J Cardiol, 66 Suppl 1: S45-53; discussion S55, (1998); Sullivan, G.W., JLeukoc Biol, 67: 591-602, (2000); Franceschi, C, Ann N Y Acad Sci, 908: 244-254, (2000); Rogers, J, Ann N Y Acad Sci, 924: 132-135, (2000); Li, Y.J., Hum Mol Genet, 12: 3259-3267, (2003); Maccarrone, M., Curr Drug Targets Inflamm Allergy, 1: 53-63, (2002); Lindsberg, P.J., Stroke, 34: 2518-2532, (2003); DeGraba, T.J., Adv Neurol, 92: 29-42, (2003); Ito, H., Curr Drug Targets Inflamm Allergy, 2: 125-130, (2003); von der Thusen, J.H., Pharmacol Rev, 55: 133-166, (2003); Schmidt, M.I.,. Clin Chem Lab Med, 41: 1120-1130, (2003); Virdis, A., Curr Opin Nephrol Hypertens, 12: 181-187, (2003); Tracy, R.P., Int J Clin Pract, Suppl 10-17, (2003); Haugeberg, G., Curr Opin Rheumatol, 15: 469-475, (2003); Tanaka, Y., J Bone Miner Metab, 21: 61-66, (2003); Williams, J.D., Clin Exp Dermatol, 27: 585-590, (2002)). Некоторые заболевания на поздних стадиях могут представлять угрозу для жизни. Для лечения указанных воспалительных заболеваний существует несколько методик, результаты которых, однако, как правило, неудовлетворительные, что является следствием недостаточной эффективности и побочных эффектов лекарственных средств, относящихся к указанным методикам.
Воспалительное заболевание кишечника
[0005] Воспалительное заболевание кишечника (ВЗК) включает болезнь Крона (БК) и язвенный колит (ЯК), оба из которых представляют собой идиопатические хронические заболевания, наблюдаемые с возрастающей частотой во многих частях мира. В Соединенных Штатах каждый год заболевает более 600000 человек. ВЗК может поражать либо тонкую кишку, либо толстую кишку, либо обе указанных кишки. БК может поражать любую часть желудочно-кишечного тракта, но чаще всего поражает дистальный отдел тонкой кишки и толстую кишку. Указанная болезнь или не затрагивает прямую кишку, или вызывает воспаление или инфекцию с дренажем вокруг прямой кишки. ЯК обычно вызывает язвы в нижнем отделе толстого кишечника, часто начиная с прямой кишки. Пациенты, страдающие ВЗК, обладают дефектной барьерной функцией кишечного эпителия, что делает возможной бактериальную колонизацию эпителия. В результате бактериальные продукты и про-воспалительные цитокины (ФНО-α, ИЛ-1 и ИЛ-6) вызывают постоянную стимуляцию воспаления. Бактериальные антигены проникают в иммунную систему при помощи дендритных клеток слизистой оболочки и макрофагов. В ответ на это кишечные фагоциты (преимущественно моноциты и нейтрофилы) пролиферируют и увеличивают экспрессию и секрецию про-воспалительных цитокинов. Симптомы различны, но могут включать диарею, лихорадку и боль.
Пациенты с длительным ЯК обладают повышенным риском развития рака толстой кишки. В настоящее время не существует удовлетворительного лечения, поскольку причина ВЗК остается неясной, хотя предполагают инфекционные и иммунологические механизмы. Целью лечения ВЗК является контроль воспалительных симптомов, обычно при помощи кортикостероидов, аминосалицилатов и стандартных иммунодепрессивных агентов, таких как азатиоприн (azathioprine) (6-меркаптопурин), метотрексат (methotRexate) и циклоспорин (ciclosporine). Среди них единственными влияющими на заболевание терапевтическими агентами являются иммунодепрессивные агенты азатиоприн и метотрексат, каждый из которых отличается медленным началом действия и только умеренной эффективностью. Долгосрочная терапия может вызвать повреждение печени (фиброз или цирроз) и подавление деятельности костного мозга. Также пациенты часто становятся нечувствительными к указанному лечению. Другие терапевтические схемы направлены только на симптомы (Rutgeerts, Р. A, J Gastroenterol Hepatol, 17 Suppl: S176-185 (2002); Rutgeerts, P., Aliment Pharmacol Ther, 17: 185-192 (2003)).
Псориаз
[0006] Псориаз представляет собой одно из наиболее широко распространенных иммуноопосредованных хронических заболеваний кожи, существующее в различных формах и с различными степенями тяжести, поражая приблизительно 2% населения, или более 4,5 миллионов человек, в Соединенных Штатах, из которых, как полагают, 1,5 миллиона страдают указанным заболеванием в степени от умеренной до тяжелой. У десяти-тридцати процентов пациентов, страдающих псориазом, также развивается одна из форм артрита - псориатический артрит, повреждающий кость и соединительные ткани вокруг суставов. Псориаз проявляется в виде бляшек выпуклой красной кожи, покрытых хлопьевидными белыми образованиями. Он также может иметь вид прыщей (пустулезный псориаз) или ожогов (зритродермический). Псориаз также может вызывать интенсивный зуд и жжение. Пациенты страдают как физически, так и психологически. В настоящее время для лечения псориаза существует несколько способов воздействия, включая топическое лечение, фототерапию и системное воздействие. Однако все они в целом считаются только подавляющими заболевание и изменяющими его течение, при этом ни один из них не излечивает заболевание. Более того, многие виды лечения косметически нежелательны, не подходят для длительного применения или связаны со значительной токсичностью.
[0007] Существует несколько разновидностей псориаза. Бляшечный псориаз {psoriasis vulgaris) представляет собой наиболее распространенную форму псориаза. Он поражает от 80 до 90% всех больных псориазом. Бляшечный псориаз обычно выглядит как выпуклые участки воспаленной кожи, покрытые серебристо-белой чешуйчатой кожей. Эти участки называются бляшками. Псориаз сгибательных поверхностей (обратный псориаз) выглядит как скользкие участки воспаленной кожи. Он наблюдается в складках кожи, особенно вокруг гениталий (между бедер и в паху), в подмышках, под животом при излишнем весе (pannus), и под грудями (складка под молочной железой). Заболевание усугубляют трение и пот, при этом повышена восприимчивость к грибковым инфекциям. Каплевидный псориаз характеризуется многочисленными маленькими овальными
(каплевидными) пятнами. Указанные многочисленные пятна псориаза занимают большие области тела, такие как туловище, конечности и череп.Каплевидный псориаз связан со стрептококковой инфекцией горла. Пустулезный псориаз выглядит как выпуклые наросты, заполненные неинфекционным гноем (пустулы). Кожа под и вокруг пустул красная и болезненная. Пустулезный псориаз может быть локализован, обычно на кистях и стопах (palmoplantar pustulosis), или генерализован с широко распространенными участками, расположенными на любой части тела. Ногтевой псориаз приводит к различным изменениям во внешнем виде ногтей рук и ног. Указанные изменения включают обесцвечивание под ногтевой пластиной, рубцевание ногтей, линии, пересекающие ноготь, утолщение кожи под ногтями, а также утрату ногтя (онихолиз) и растрескивание ногтя. Псориатический артрит включает воспаление сустава и соединительной ткани. Псориатический артрит может поражать любой сустав, но чаще всего поражает суставы пальцев рук и ног. Он может приводить к колбасовидному опуханию пальцев рук и ног, известному как дактилит. Псориатический артрит также может поражать бедра, колени и позвоночник (спондилит). Около 10-15% людей, страдающих псориазом, страдают также и псориатическим артритом. Эритродермический псориаз вызывает широко распространенное воспаление и шелушение кожи почти на всей поверхности тела. Он может сопровождаться тяжелым зудом, опуханием и болью. Он часто является результатом осложнения нестабильного бляшечного псориаза, особенно вследствие внезапного прекращения системного лечения. Указанная форма псориаза может быть смертельной по причине крайнего воспаления и шелушения, нарушающих способность организма регулировать температуру и способность кожи выполнять барьерную функцию.
[0008] С улучшением понимания биологических свойств псориаза за последние два десятилетия стали доступны биологические виды терапии, направленные на активность Т-лимфоцитов и цитокинов, ответственных за воспалительную природу указанного заболевания. В настоящее время лекарственные средства, назначаемые при псориазе, включают ингибиторы ФНО-α, первоначально применяемые для лечения ревматоидного артрита (РА), ENBReL® (etanercept), ReMICADE® (infliximab) и HUMIRA® (adalimumab), и ингибитор Т-клеток AMEVIVE® (alefacept) от Biogen, утвержденный в 2002, и RAPTIVA® (efalizumab) от Genentech/Xoma, утвержденный в 2003 (Weinberg, J.М., J Drugs Dermatol, 1: 303-310, (2002)). AMEVIVE® (alefacept) представляет собой слитый с иммуноглобулином белок, состоящий из первого внеклеточного домена LFA-3 человека, слитого с шарнирным, С(Н)2 и С(Н)3 доменами IgG(l) человека. Он ингибирует пролиферацию Т-клеток через NK-клетки (Cooper, J. С, Eur J Immunol, 33: 666-675, (2003)). RAPTIVA®, также известный как анти-CD11a, представляет собой гуманизированное моноклональное антитело, нацеленное на адгезионную молекулу Т-клеток, антиген, ассоциированный с функцией лимфоцитов-1 (LFA-1). Предотвращение связывания LFA-1 с его лигандом (ICAM-1, молекула межклеточной адгезии-1) ингибирует активацию и миграцию лимфоцитов, приводя к пониженной инфильтрации лимфоцитов, таким образом ограничивая каскад событий, в конечном итоге приводящих к признакам и симптомам псориаза (Cather, J.С., Expert Opin Biol Ther, 3: 361-370, (2003)). Потенциальные побочные эффекты известных в настоящее время из уровня техники ингибиторов ФНО-α, тем не менее, являются тяжелыми, включая развитие лимфомы (Brown, S.L., Arthritis Rheum, 46: 3151-3158, (2002)), ухудшение застойной сердечной недостаточности, приводящее к серьезной инфекции и сепсису, и обострение рассеянного склероза и проблем с центральной нервной системой (Weisman, М.Н.,. J Rheumatol Suppl, 65: 33-38, (2002); Antoni, С., Clin Exp Rheumatol, 20: S152-157, (2002)). Несмотря на то, что побочные эффекты ингибитора Т-клеток AMEVIVE®/RAPTIVA® при лечении псориаза могут быть более переносимыми, RAPTIVA® представляет собой иммунодепрессивный агент. Иммунодепрессивные агенты обладают потенциалом увеличивать риск инфекции, реактивировать скрытые хронические инфекции или увеличивать риск развития рака.
[0009] Несмотря на то, что за последние два десятилетия было сделано много усилий к пониманию биологических свойств псориаза, и стали доступны нетрадиционные виды лечения псориаза, как описано выше, большинство страдающих псориазом до сих пор не получают адекватного лечения. Анкетирование более 40000 американских пациентов, страдающих псориазом, проведенное Национальным фондом псориаза в 1998 показало, что 79% более молодых пациентов разочарованы неэффективностью их лечения. Среди пациентов, страдающих тяжелой формой заболевания, 32% считали свое лечение недостаточно интенсивным (Mendonca, С.О., Pharmacol Ther, 99: 133-147, (2003); Schon, М.P., J Invest Dermatol, 112: 405-410, (1999)).
Ревматоидный артрит
[0010] Ревматоидный артрит (РА) представляет собой другой пример мучительных воспалительных нарушений. РА представляет собой широко распространенное хроническое заболевание, связанное с воспалением, характеризующееся хроническим воспалением мембранной выстилки (синовиума) суставов и/или других внутренних органов. Воспалительные клетки также могут внедряться и повреждать кость и хрящ. Пораженный болезнью сустав может потерять форму и правильное положение, что приводит к потере подвижности. У пациентов, страдающих РА, наблюдаются боль, ригидность, ощущение тепла, покраснение и опухание сустава, и другие системные симптомы, такие как лихорадка, усталость и анемия. В настоящее время поражены приблизительно 1% населения или 2,1 миллиона человек в США, среди которых больше женщин (1,5 миллиона), чем мужчин (0,6 миллиона). Патология РА понятна не до конца, хотя в качестве механизма предполагают каскад несоответствующих иммунологических реакций. Общепринятое-лечение при РА, к сожалению, неэффективно (Bessis, N., J Gene Med, 4: 581-591, (2002)) (29). Заболевание не вполне чувствительно к симптоматическому лечению, включая кортикостероиды и нестероидные противовоспалительные препараты (НСПВП), применяемые с 1950-х годов. Также указанное лечение несет риск серьезных побочных действий. Терапевтические эффекты противоревматических препаратов, оказывающих влияние на заболевание (disease-modifying antirheumatic drugs, DMARDs), таких как метотрексат (MethotRexate, МТХ), часто неустойчивы и кратковременны.
[0011] Роль цитокиновой сети в опосредовании воспаления и разрушения сустава при РА широко исследовали в последние годы. В дополнение к ФНО-α, ИЛ-1 играет основную роль в патогенезе и клинических проявлениях РА (54). Способность ИЛ-1 вызывать воспаление и разрушение сустава и ингибировать процессы восстановления тканей четко установлена в системах in vitro и в моделях на животных, при этом облегчение воспалительных симптомов у пациентов с РА достигалось блокированием ИЛ-1 (BResnihan, В., Arthritis Rheum, 41: 2196-2204, (1998)). ИЛ-6 представляет собой многофункциональный цитокин, регулирующий иммунный ответ, кроветворение, острофазовую реакцию и воспаление. Нарушение регуляции выработки ИЛ-6 вовлечено в патологию нескольких заболеваний, включая РА. Терапевтический подход к блокированию сигнала ИЛ-6 осуществляли при помощи гуманизированного антитела к ИЛ-6P, включая, среди прочих-заболеваний, и PA (Ito, Н., Curr Drug Targets Inflamm Allergy, 2: 125-130, (2003); Ishihara, К Cytokine Growth Factor Rev, 13: 357-368, (2002)). ИЛ-10 представляет собой противовоспалительный цитокин. Показано, что экспрессия ИЛ-10 предотвращает артрит или облегчает заболевание в моделях на животных (57, 58). Хотя очевидно, что такие цитокины, как ФНО-α, ИЛ-1, ИЛ-6 и ИЛ-10 играют независимые роли, они действуют сообща, опосредуя определенные патофизиологические процессы при РА. Обнаружение класса молекул, описанных в настоящем изобретении, которые способны модулировать указанные различные цитокины, приведет к заметному терапевтическому прогрессу в лечении РА.
[0012] Новый класс биологических противо-ревматических препаратов, оказывающих влияние на заболевание (DMARDs), для лечения РА был разработан недавно на основании понимания роли цитокинов, ФНО-α и ИЛ-1, в воспалительном процессе. Управление по контролю за продуктами и лекарствами (FDA) одобрило некоторые такие DMARDs, включая ENBReL® (etanercept) от Immunex/Amgen Inc. в 1998, REMICADE® (infliximab) от Centocor/Johnson & Johnson, HUMIRA® (adalimumab) от Abbott Laboratories Inc. в 2002, и KINERET® (anakinra) от Amgen в 2001. ENBReL® представляет собой рекомбинантный белок растворимого рецептора ФНО (ФНОР). REMICADE® представляет собой гуманизированное (химерное) моноклональное антитело мыши к ФНО-α. HUMIRA® представляет собой полностью человеческое моноклональное антитело к ФНО, созданное при помощи технологии фагового дисплея, получая в результате антитело с полученными от человека вариабельными областями тяжелой и легкой цепей и константными областями IgGl: к человека. Все 3 указанных белковых лекарственных средства нацелены на ФНО-α и связывают его, блокируя действие ФНО-α. KINERET® представляет собой рекомбинантный антагонист рецептора ИЛ-1, который похож на природный ИЛ-1Ра человека, за исключением добавления единственного остатка метионина на амино-конце. KINERET® блокирует биологическое действие ИЛ-1 путем конкурентного ингибирования связывания ИЛ-1 с рецептором ИЛ-1 типа I (ИЛ-1Р1) и последовательного уменьшения про-воспалительного действия ИЛ-1.
Рассеянный склероз
[0013] Рассеянный склероз (PC) представляет собой аутоиммунное заболевание, диагностируемое в США у от 350000 до 500000 человек. Признаками болезни являются множественные области воспаления и потери миелина в головном мозге и спинном мозге. У пациентов, страдающих PC, наблюдаются различные степени неврологических нарушений, в зависимости от локализации и степени потери миелина. Известно, что экспрессия хемокинов (членов семейства ИЛ-8) при аутоиммунном воспалении ЦНС регулируется некоторыми воспалительными цитокинами, такими как ФИО (Glabinski, A.R., Scand J Immunol, 58: 81-88, (2003)). Роли других про-/противовоспалительных цитокинов, таких как ИЛ-1-бета, ИЛ-6 и ИЛ-10, также подтверждены в моделях на животных ЭАЭ (Diab, А., J Neuropathol Exp Neurol, 56: 641-650, (1997); Samoilova, E.В., J Immunol, 161: 6480-6486, (1998); Robertson, J., J Cell Biol, 155: 217-226, (2001)), а также у человека (de Jong, В.A., J Neuroimmunol, 126: 172-179, (2002)). ИЛ-1β присутствует в поражениях, обусловленных PC. Антагонист рецептора ИЛ-1 (ИЛ-1Ра) ослабляет индукцию экспериментального аутоиммунного энцефаломиелита (ЭАЭ). Повышенный риск PC отмечен у индивидуумов с высоким соотношением выработки ИЛ-1β к ИЛ-1Рα и высоким соотношением выработки ФИО к ИЛ-10 (de Jong, В.A., J Neuroimmunol, 126: 172-179, (2002)). Общие симптомы PC включают усталость, слабость, спастичность, проблемы с равновесием, проблемы с мочевым пузырем и кишечником, нечувствительность, потерю зрения, тремор и депрессию. В настоящее время лечение PC только облегчает симптомы и замедляет развитие инвалидности, а некоторые новые виды лечения PC, включая трансплантацию стволовых клеток и генотерапию, являются консервативными (Fassas, А., Blood Rev, 17: 233-240, (2003); Furlan, R., Curr Pharm Des, 9: 2002-2008, (2003)). Несмотря на то, что антитела к ФНО, как показано, обладают защитным действием при экспериментальном аутоиммунном энцефаломиелите (ЭАЭ), они утяжеляют течение заболевания у пациентов с PC, что позволяет предположить, что ингибирования только ФНО-α недостаточно (Ghezzi, P., Neuroimmunomodulation, 9: 178-182, (2001)).
Нейродегенеративные нарушения
[0014] Болезнь Альцгеймера (БА) и болезнь Паркинсона (БП) представляют собой два наиболее широко распространенных нейродегенеративных нарушения. БА серьезно поражает способность человека к осуществлению повседневной деятельности. Она влияет на части мозга, контролирующие мышление, память и речь. Около 4 миллионов американцев, обычно старше 60 лет, по оценкам, страдают от БА.
[0015] БП представляет собой прогрессирующее нарушение центральной нервной системы, поражающее свыше 1,5 миллиона человек в Соединенных Штатах. Клинически указанное заболевание
характеризуется снижением произвольных движений, трудностями с походкой, постуральной неустойчивостью, ригидностью и тремором. БП обусловлена дегенерацией пигментированных нейронов в substantia nigra головного мозга, что приводит к пониженной доступности дофамина. Причины указанных нейродегенеративных нарушений неизвестны, и в настоящее время способов лечения указанного заболевания не существует.
[0016] Таким образом, необходимы новые подходы к лечению вышеуказанных и других связанных с воспалением заболеваний. Хотя механизмы связанных с воспалением заболеваний остаются неясными и часто варьируются от одного заболевания к другому, показано, что дисфункция иммунной системы, вызванная нарушением регуляции цитокинов, играет важную роль в возникновении и развитии воспаления (Schon, М.P., J Invest Dermatol, 112: 405-410, (1999); AndReakos, E.Т., Cytokine Growth Factor Rev, 13: 299-313, (2002); Najarian, D.J., J Am Acad Dermatol, 48: 805-821, (2003)).
Воспаление, связанное с последствиями радиотерапии:
[0017] Воспалительные заболевания прямой и сигмовидной кишок, связанные с радиационным повреждением, представляют собой наиболее распространенные осложнения радиационной терапии рака в тазовой области, который включает рак шейки матки, матки, простаты, мочевого пузыря и яичек. Радиационный проктосигмоидит представляет собой наиболее распространенную клинически выраженную форму повреждения кишечника после облучения тазовой области, с заболеваемостью от 5% до 20%. У пациентов обычно встречаются симптомы тенезмов, кровотечения, малообъемный понос и боль в прямой кишке. Реже могут развиваться слабо выраженная непроходимость или свищевые ходы в прилежащие органы.
[0018] Цитокины можно в целом подразделить на 3 типа: провоспалительные (ИЛ-1α, (3, ИЛ-2, ИЛ-3, ИЛ-6, ИЛ-7, ИЛ-9, ИЛ-12, ИЛ-17, ИЛ-18, ИЛ-23, ФНО-α, ЛТ, ФИЛ, онкостатин и ИФНс1α, β, γ); противовоспалительные (ИЛ-4, ИЛ-10, ИЛ-11, W-13 и ТРФ-(3); и хемокины (ИЛ-8, Gro-α, МВБ-1, МХБ-1, ENA-78 и RANTES).
[0019] Фактор некроза опухолей α (ФНО-α) и интерлейкин-1 (ИЛ-1) представляют собой провоспалительные цитокины, которые опосредуют воспалительные реакции, связанные с инфекционными агентами и другими клеточными стрессами. Повышенная выработка таких цитокинов, как ИЛ-1 и ФНО-α, как полагают, лежит в основе развития многих воспалительных заболеваний, включая, среди прочего, ревматоидный артрит (РА), болезнь Крона, воспалительное заболевание кишечника, рассеянный склероз, эндотоксический шок, остеопороз, болезнь Альцгеймера, застойную сердечную недостаточность и псориаз (DinaRello, С.A. et al., Rev. Infect. Diseases 1984, 6:51; Salituro et al., Curr. Med. Chem. 1999, 6:807-823; Henry et al., Drugs Fut. 1999, 24: 1345-1354). Принятым терапевтическим подходом к потенциальному применению лекарств при указанных состояниях является уменьшение провоспалительных цитокинов, таких как ФНО-α (также называемый ФНОа) и интерлейкин-1β (ИЛ-1b).
Фосфодиэстераза 4
[0020] Фосфодиэстеразы (ФДЭ), специфические к циклическим нуклеотидам, представляют собой группу ферментов, катализирующих гидролиз различных циклических нуклеозидмонофосфатов (включая цАМФ и цГМФ). Указанные циклические нуклеотиды действуют как вторичные переносчики информации в клетках и как переносчики информации, передающие импульсы от рецепторов на поверхности клеток, связывающих различные гормоны и нейротрансмиттеры. Действие ФДЭ заключается в регуляции уровеня циклических нуклеотидов в клетках и поддержании гомеостаза циклических нуклеотидов за счет распада указанных циклических нуклеотидов, что приводит к прекращению осуществления их роли переносчиков информации.
[0021] Ферменты ФДЭ сгруппированы в одиннадцать семейств в соответствии с их специфичностью к гидролизу цАМФ или цГМФ, их чувствительностью к регуляции кальцием, кальмодулином или цГМФ, и их селективным ингибированием различными соединениями. Например, ФДЭ1 стимулируется Са2+/калмодулином. ФДЭ2 является цГМФ-зависимой и обнаружена в сердце и надпочечниках. ФДЭ3 является цГМФ-зависимой, при этом ингибирование указанного фермента создает положительное ионотропное действие. ФДЭ4 является цАМФ-специфической, а ее ингибирование вызывает расслабление дыхательных путей, противовоспалительное и антидепрессантное действие. ФДЭ5, вероятно, важна для регуляции содержания цГМФ в гладкой мускулатуре сосудов, и поэтому ингибиторы ФДЭ5 могут обладать сердечно-сосудистым действием. Поскольку ФДЭ обладают индивидуальными биохимическими свойствами, возможно, что они являются субъектами множества различных форм регуляции.
[0022] ФДЭ4 распознают по различным кинетическим свойствам, включая низкую константу Михаэлиса для цАМФ и чувствительность к некоторым лекарственным средствам. Семейство ферментов ФДЭ4 состоит из четырех генов, которые образуют четыре изоформы фермента ФДЭ4, обозначаемые ФДЭ4А, ФДЭ4 В, ФДЭ4С, и ФДЭ4 D [См.: Wang et al., ExpRession, Purification, and Characterization of human cAMP-Specific Phosphodiesterase (PDE4) Subtypes А, В, C, and D, Biochem. Biophys. Res. Comm., 234, 320 324 (1997)]. Кроме того, были идентифицированы различные сплайсированные варианты каждой из изоформ ФДЭ4.
[0023] Изоферменты ФДЭ4 локализованы в цитозоле клеток и не связаны ни с какими известными мембранными структурами. Изоферменты ФДЭ4 специфически инактивируют цАМФ путем катализа его гидролиза до аденозин-5'-монофосфата (АМФ). Регуляция активности цАМФ важна для многих биологических процессов, включая воспаление и память. Ингибиторы изоферментов ФДЭ4, такие как ролипрам (rolipram), пикламиласт (piclamilast), CDP-840 и арифло (ariflo) являются мощными противовоспалительными агентами и поэтому могут применяться для лечения заболеваний, обусловленных воспалением, таких как астма и артрит. Дополнительно, ролипрам улучшает когнитивные способности у крыс и мышей в парадигмах обучения.
[0024] Соединения, способные ингибировать вышеописанные биологические молекулы или лечить заболевания, в которых участвуют указанные биологические молекулы, могут являться значительным достижением в данной области техники.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
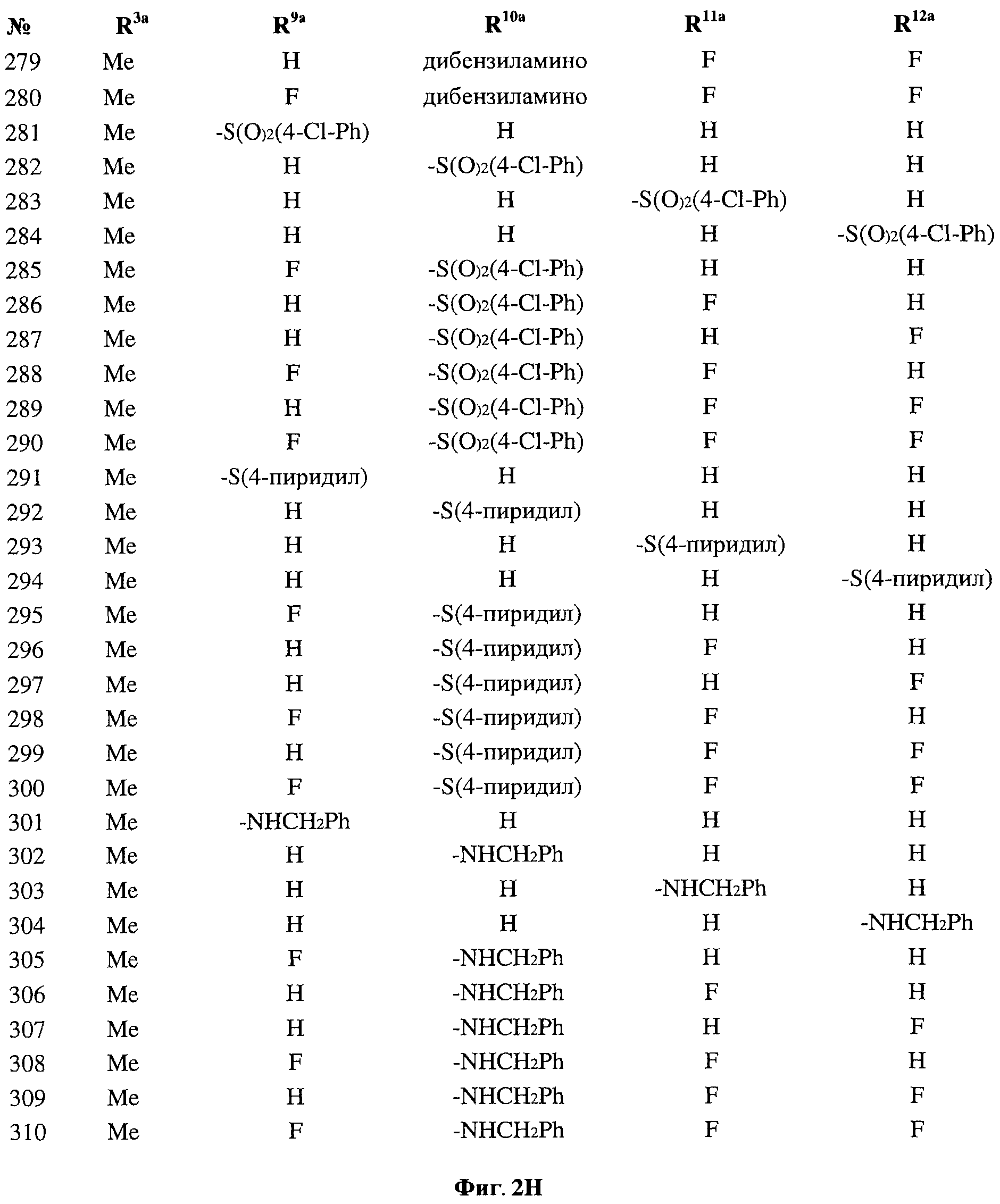
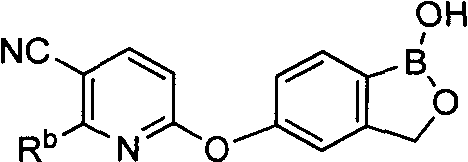
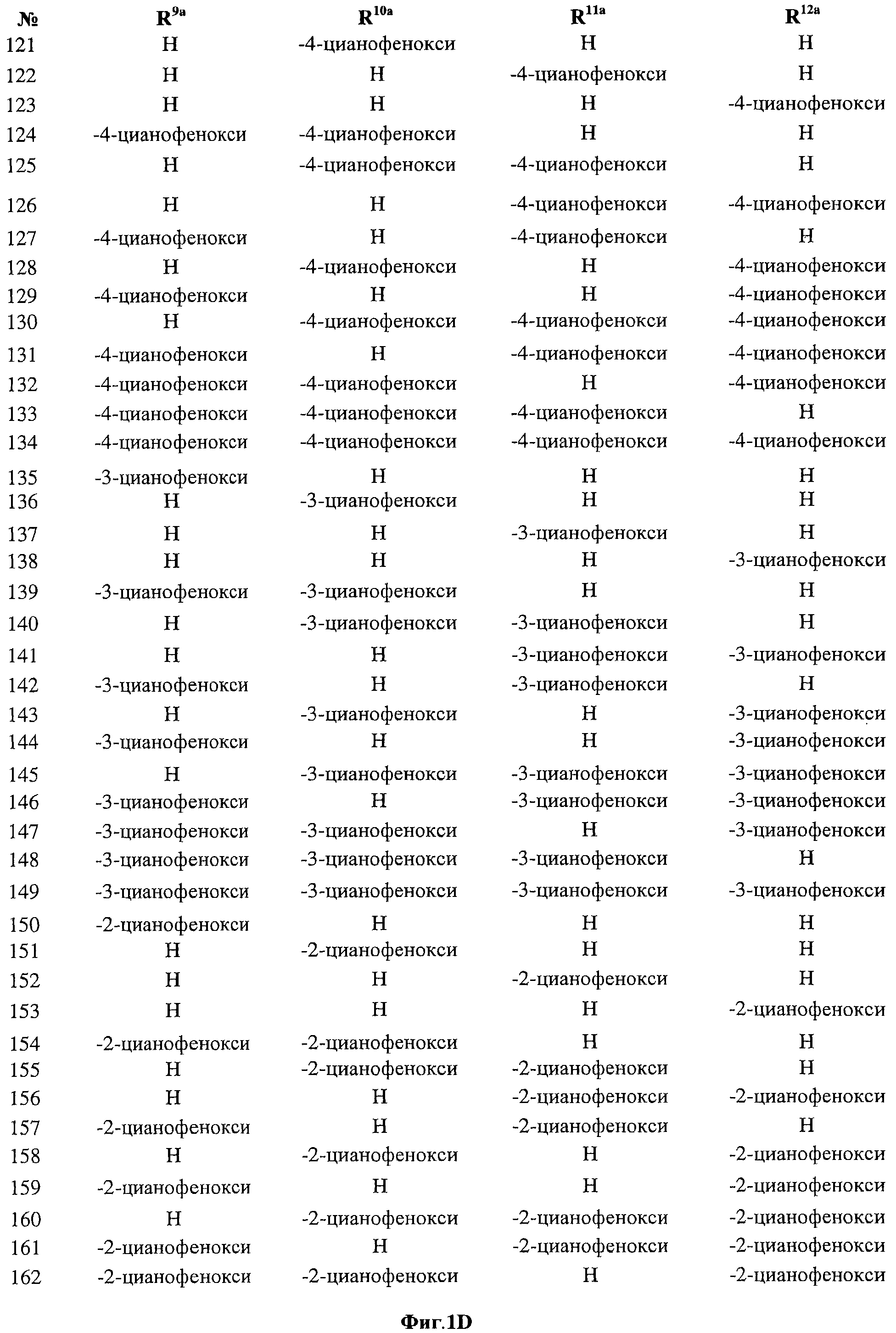
[0025] Согласно первому аспекту настоящего изобретения, предложено соединение согласно настоящему изобретению. Согласно примеру реализации, указанное соединение описано в настоящей заявке или представляет собой фармацевтически приемлемую соль описанного соединения. Согласно примеру реализации, указанное соединение соответствует формуле, приведенной в настоящем описании. Согласно примеру реализации, указанное соединение выбрано из D1, D2, D3, D4, D5, D6, D7, D8, D9, D10, D11, D12, D13, D14, D15, D16, D17, D18, D19, D20, D21, D22, D23, D24, D25, D26, D27, D28, D29, D30, D31, D32, D33, D34, D35, D36, D37, D38, D39, D40, D41, D42, D43, D44, D45, D46, D47, D48, D49, D50, D51, D52, D53, D54, D55, D56, D57, D58, D59, D60, D61, D62, D63, D64, D65, D66, D67, D68, D69, D70, D71, D72, D73, D74, D75, D76, D77, D78, D79, D80, D81, D82, D83, D84, D85, D86, D87, D88, D89, D90, D91, D92, D93, D94, D95, D96, D97, D98, D99, D100, D101, D102, D103, D104, D105, D106, D107, D108, D109, DUO, Dill, D112, D113, D114, D115, D116, D117, D118, D119, D120, D121, D122, D123, D124, D125, D126, D127, D128, D129, D130, D131, D132, D133, D134, D135, D136, D137, D138, D139, D140, D141, D142, D143, D144, D145, D146, D147, D148, D149, D150, D151, D152, D153, D154, D155, D156, D157, D158, D159, D160, D161, D162, D163, D164, D165, D166, D167, D168, D169, D170, D171, D172, D173, D174, D175, D176, D177, D178, D179, D180, D181, D182, D183, D184, D185, D186, D187, D188, D189, D190, D191, D192, D193, D194, D195, D196, D197, D198, D199, D200, D201, D202, D203, D204, D205, D206, D207, D208, D209, D210, D211, D212, D213, D214, D215, D216, D217, D218, D219, D220, D221, D222, D223, D224, D225, D226, D227, D228 и D229.
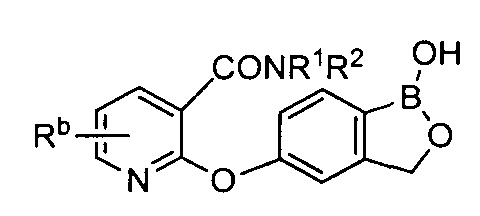
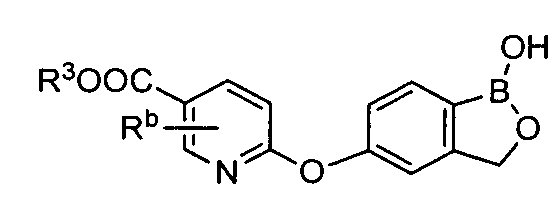
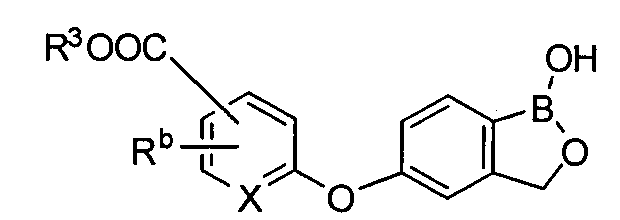
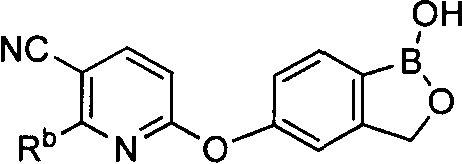
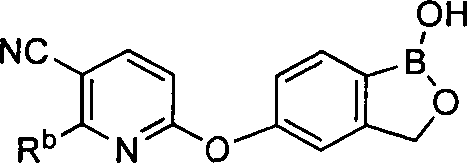
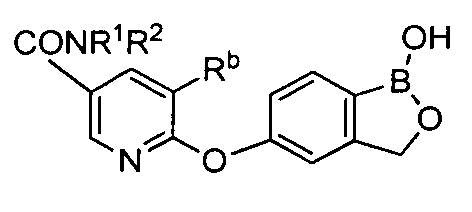
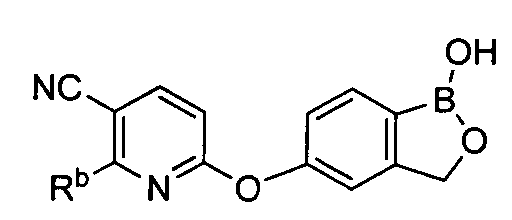
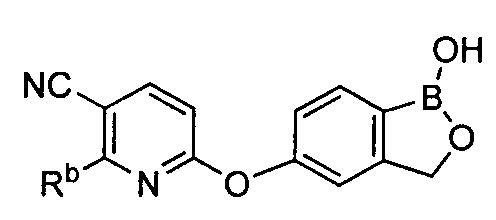
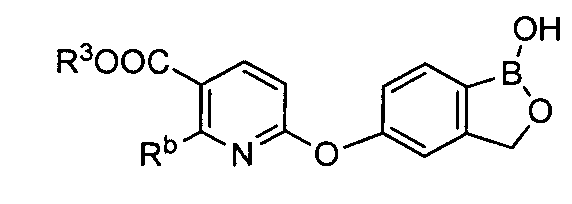
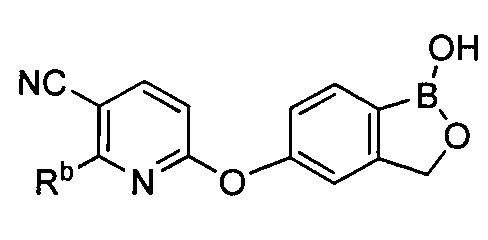
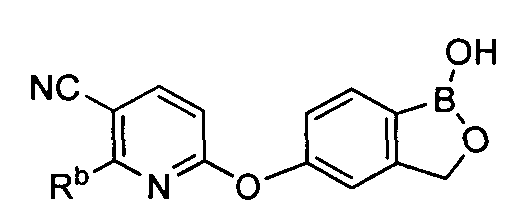
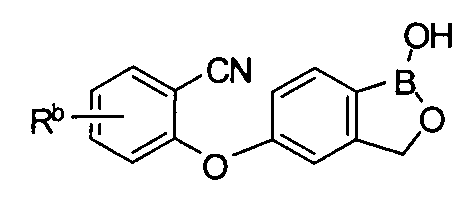
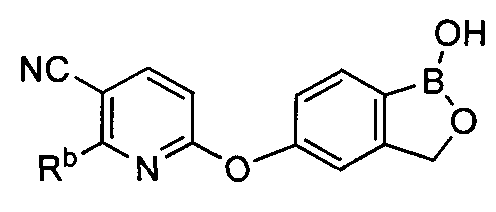
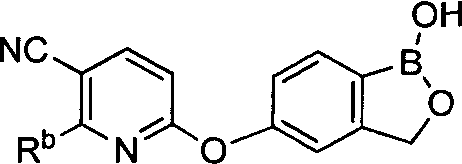
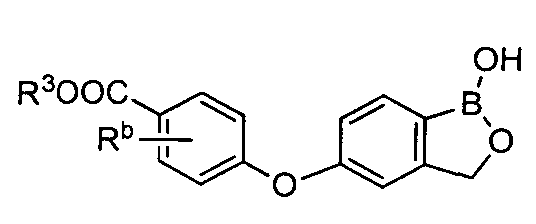
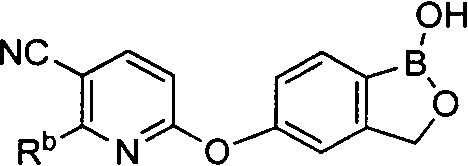
[0026] Согласно второму аспекту настоящего изобретения, предложено соединение и соли указанного соединения, обладающие структурой согласно формуле:
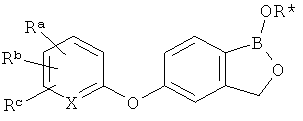
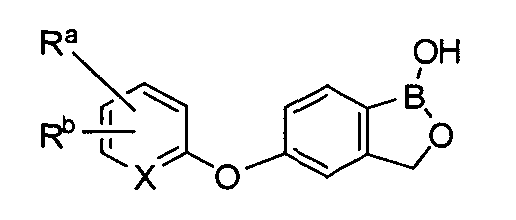
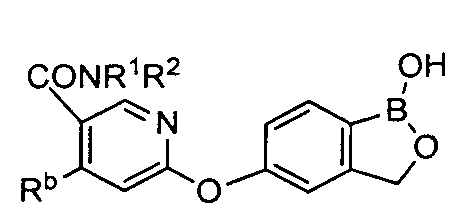
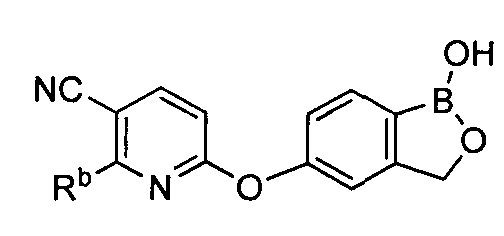
где R* представляет собой член, выбранный из Н, отрицательного заряда и положительно заряженного противоиона. X представляет собой член, выбранный из CRa, CRb и N. Ra представляет собой член, выбранный из CN, -C(O)NR1R2, и -С (О)OR3. Rb и Rc представляют собой члены, независимо выбранные из Н, OR4, NR4R5, SR4, -S(O)R4, -S(O)2R4, -S(O)2NR4R5, -С(O)R4, -C(O)OR4, -C(O)NR4R5, нитро, галогена, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила, причем каждый из R1, R2, R4 и R5 представляют собой члены, независимо выбранные из Н, нитро, галогена, циано, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила. R3 представляет собой член, выбранный из Н и замещенного или незамещенного алкила. Существует условие, что R1 и R2, вместе с атомами, к которым они присоединены, возможно, объединены с образованием 5-7-членного замещенного или незамещенного гетероциклоалкильного кольца. Существует условие, что R4 и R5, вместе с атомами, к которым они присоединены, возможно, объединены с образованием 5-7-членного замещенного или незамещенного гетероциклоалкильного кольца. Существует условие, что Rb и Rc не могут одновременно представлять собой Н. Существует условие, что Ra и Rb возможно соединены с образованием 5-8-членного кольца, содержащего две оксогруппы.
[0027] Согласно настоящему изобретению также предложены фармацевтические составы и способы получения и применения соединений согласно настоящему описанию.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
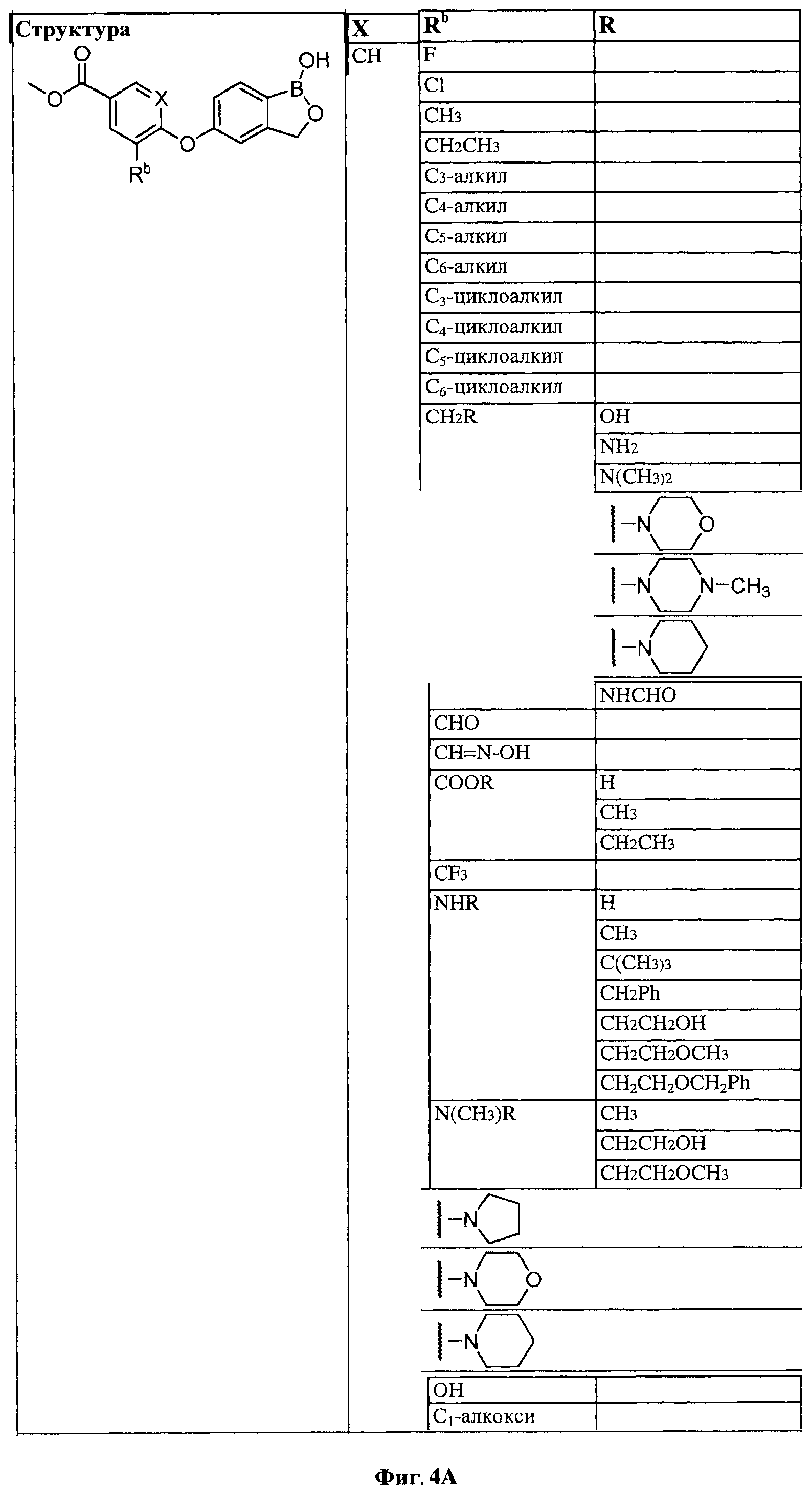
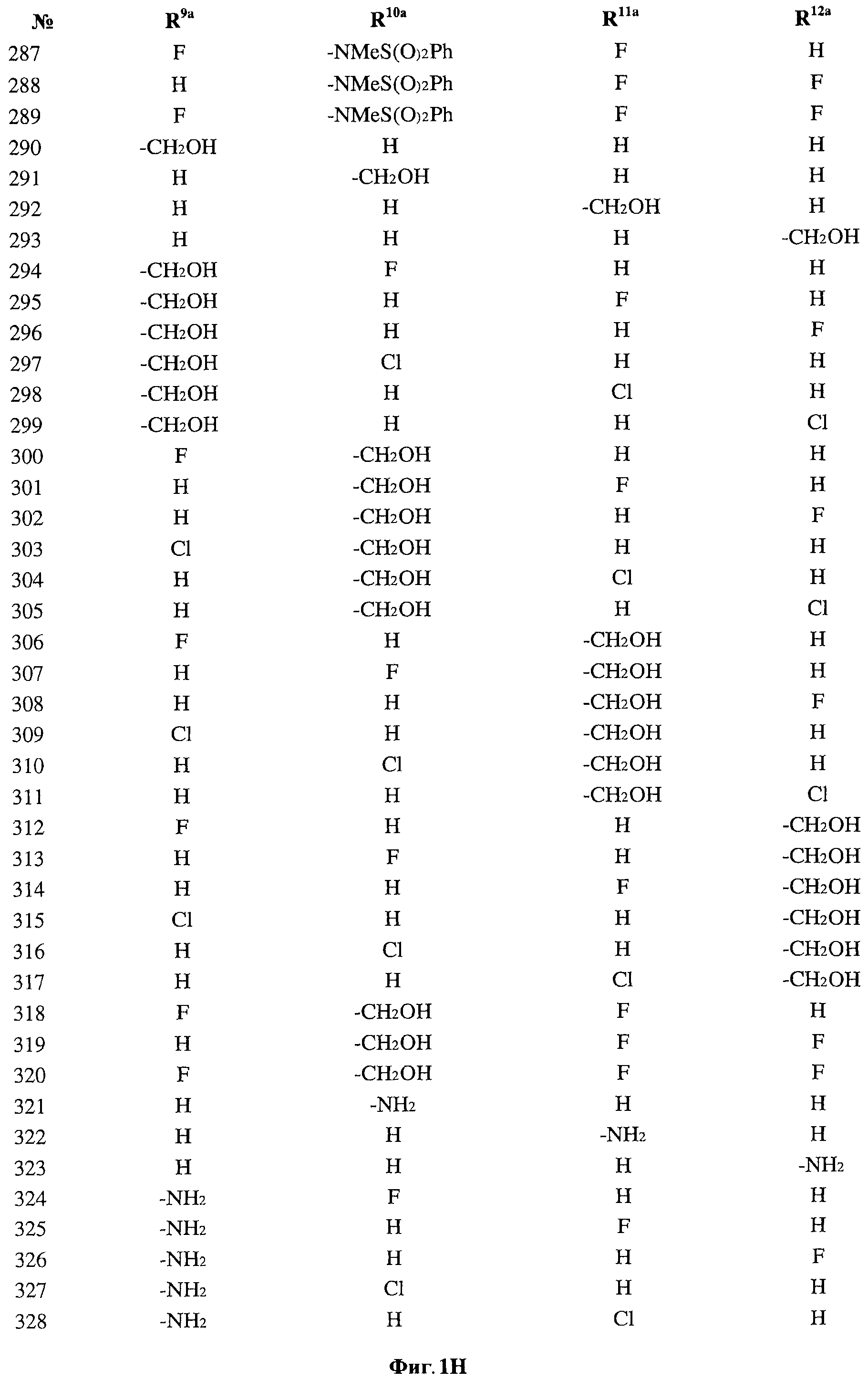
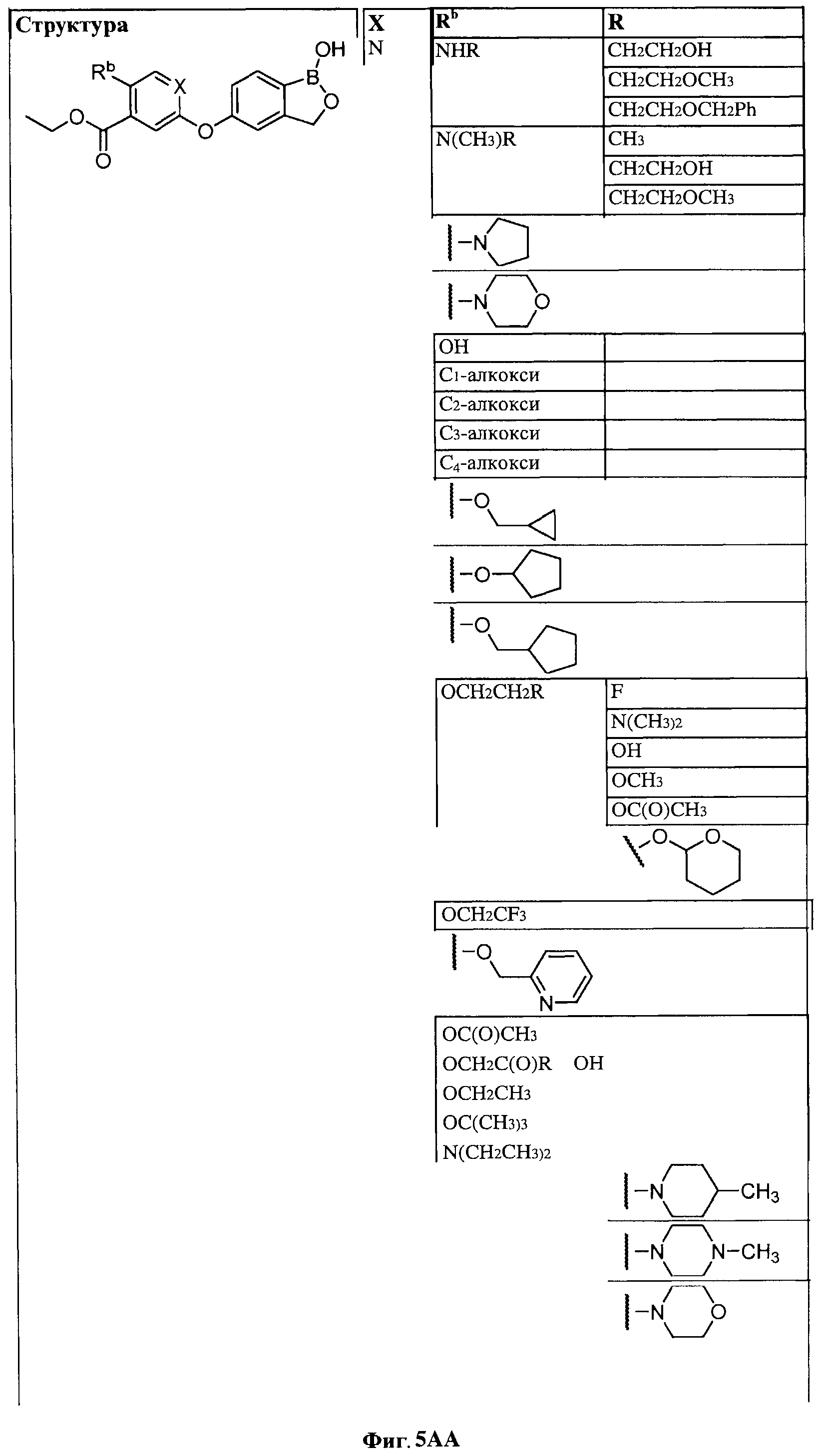
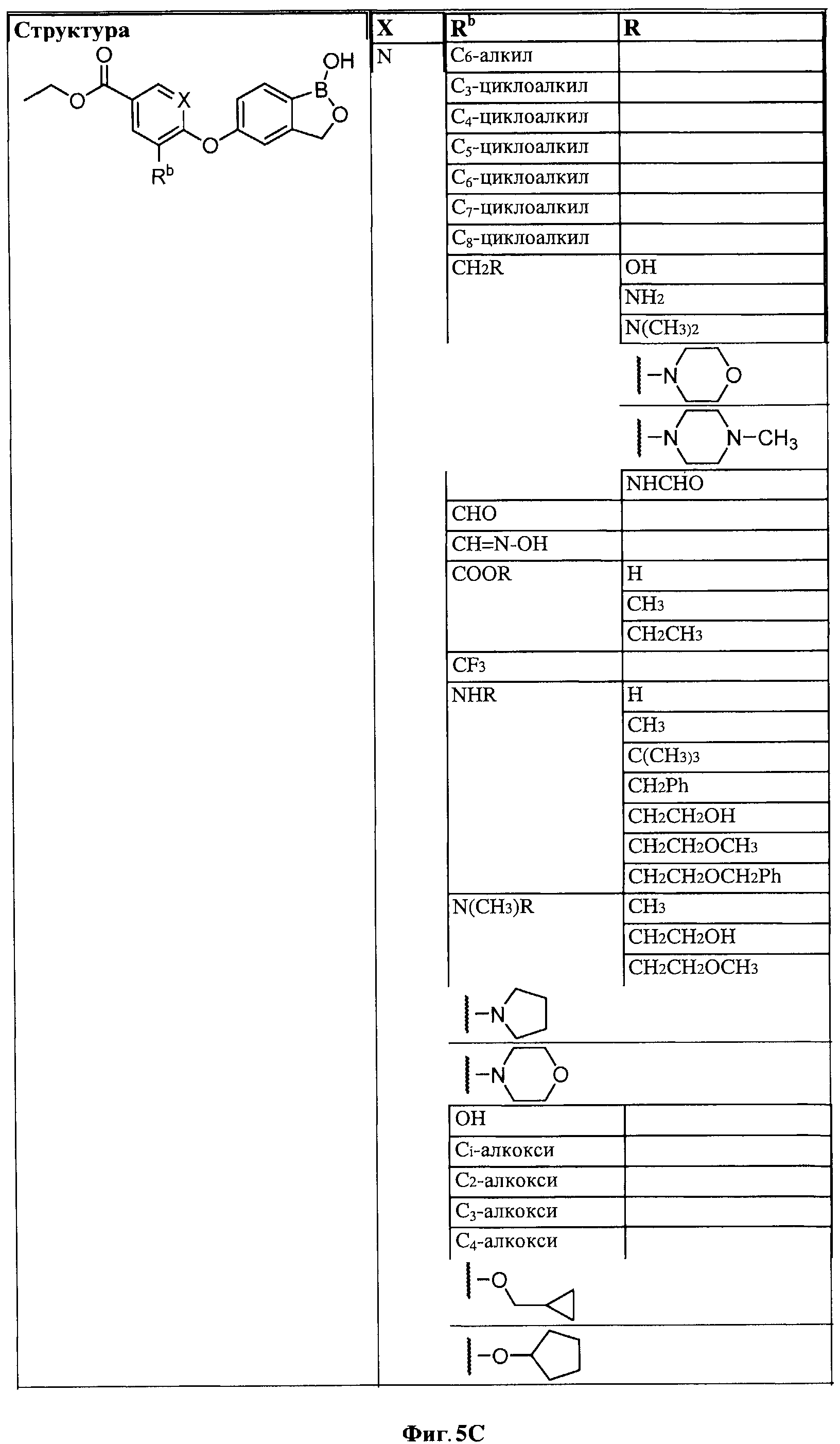
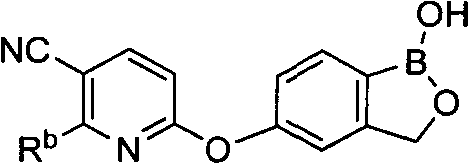
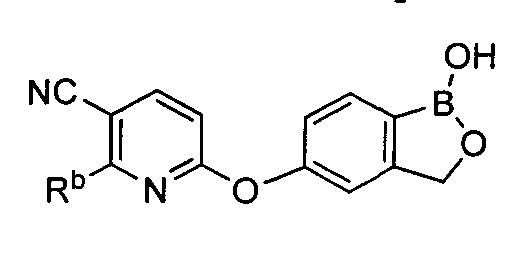
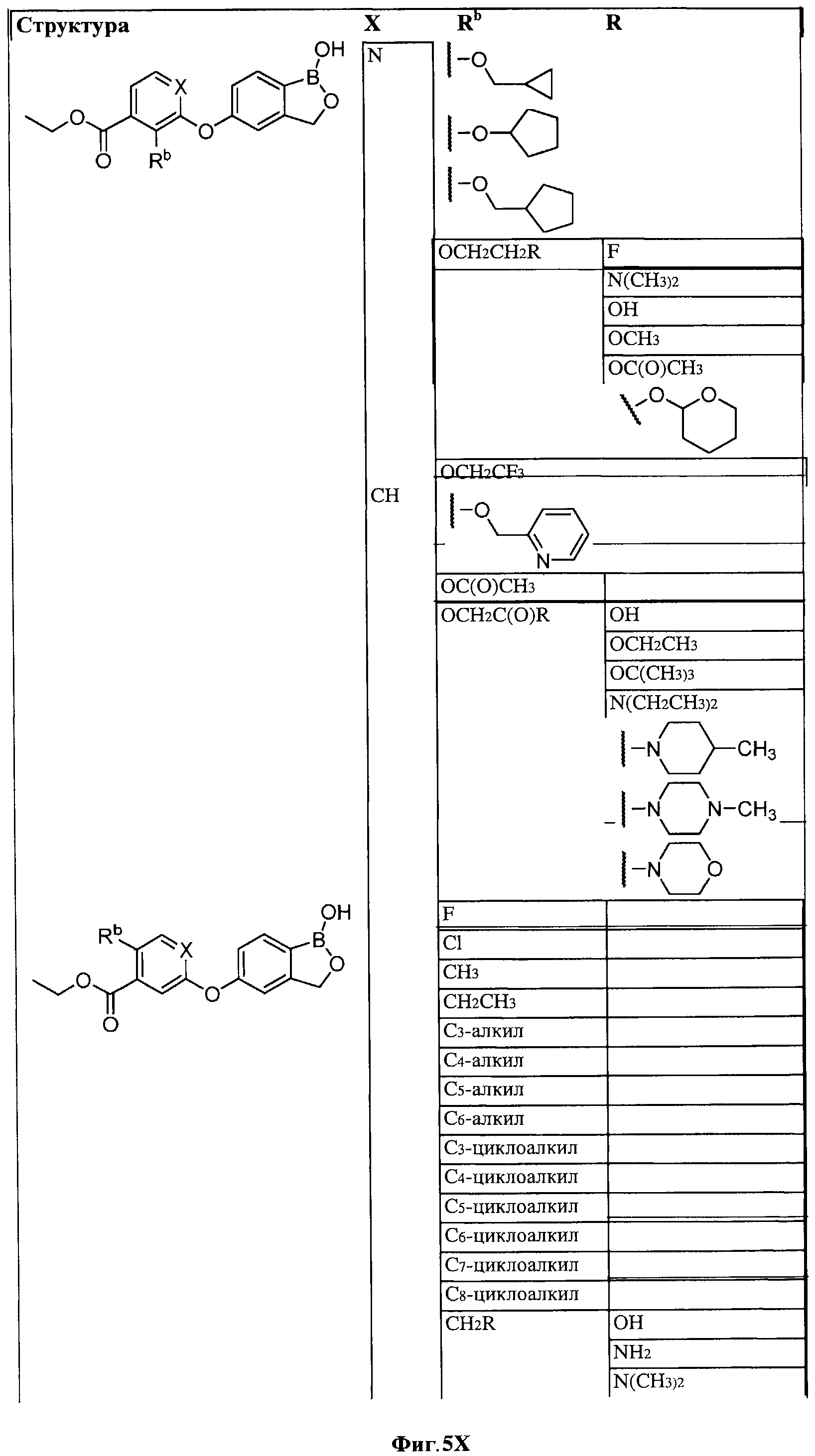
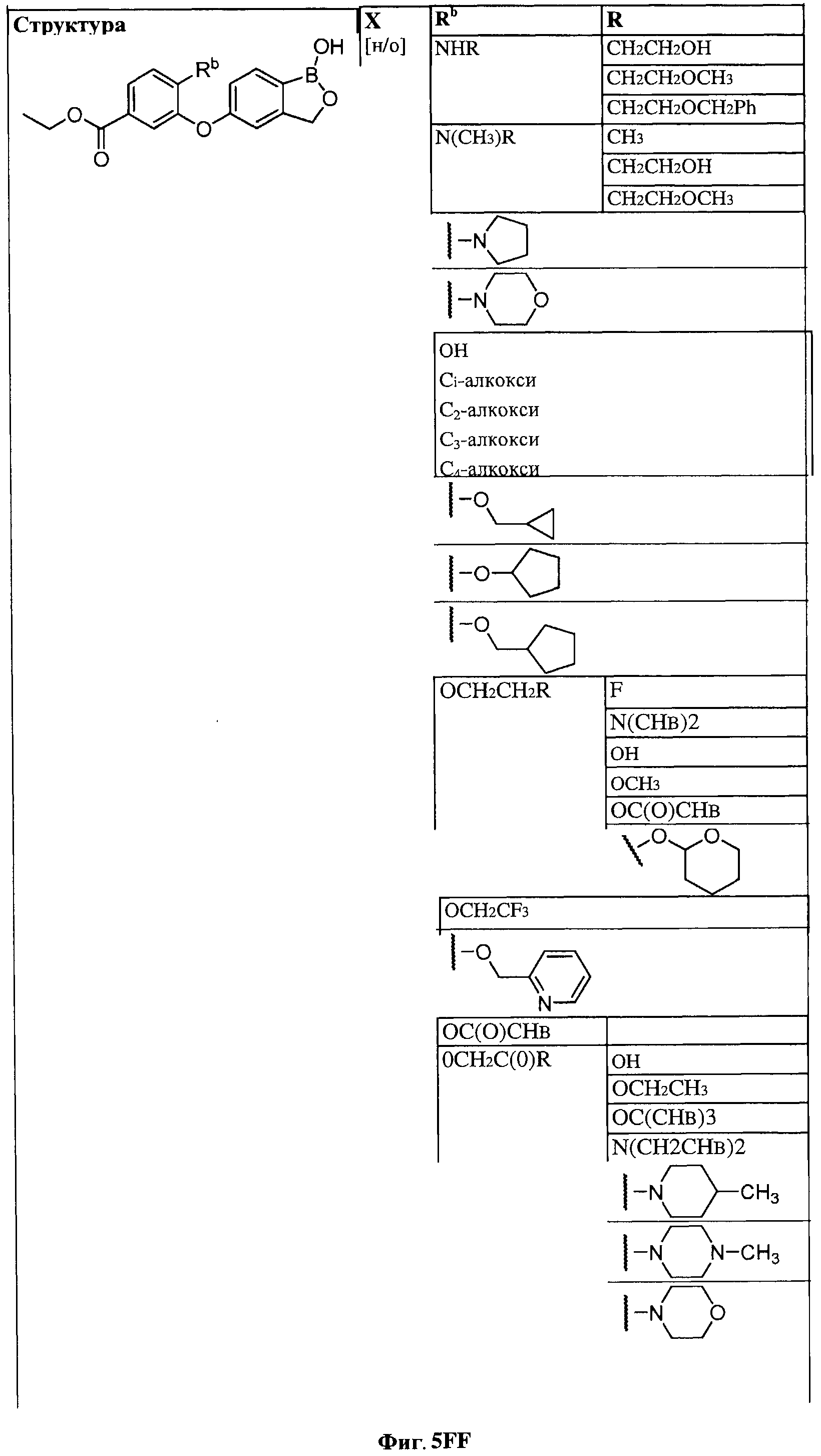
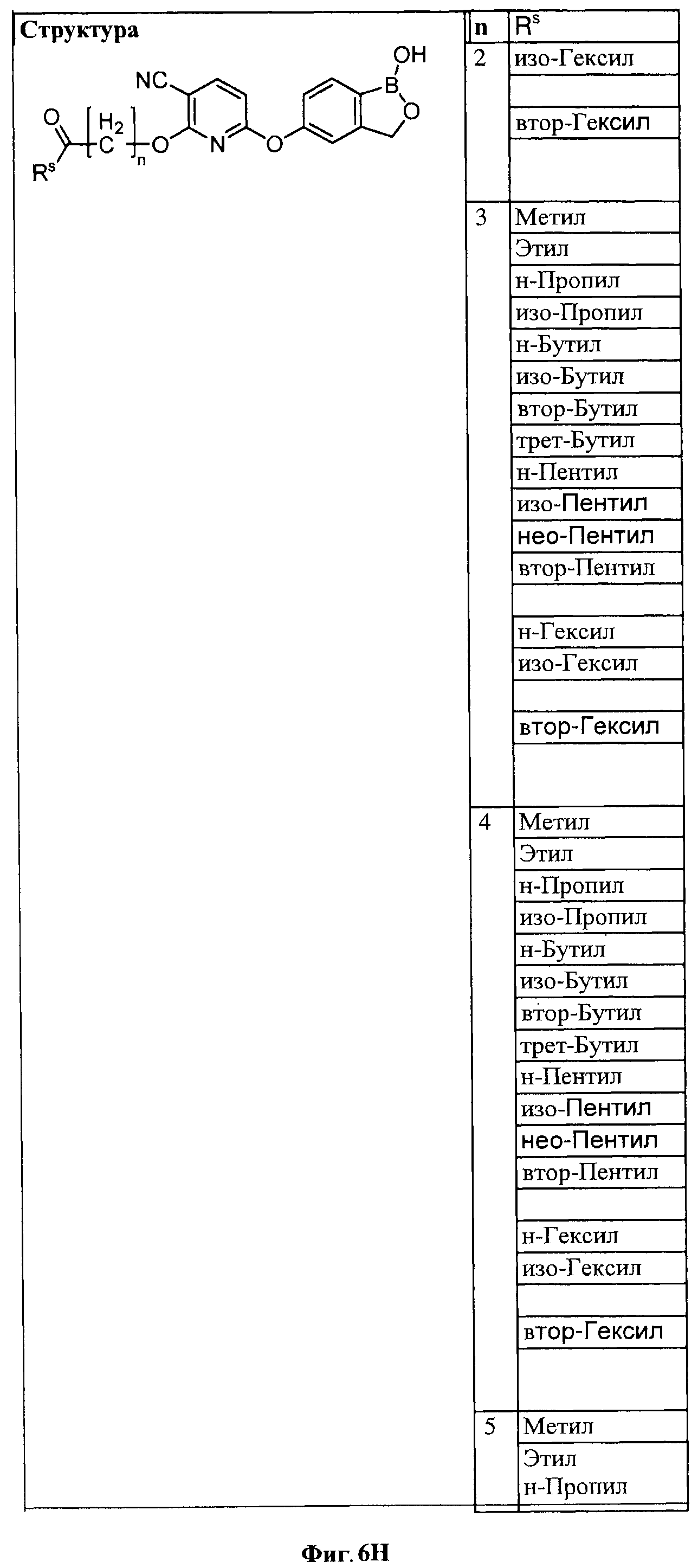
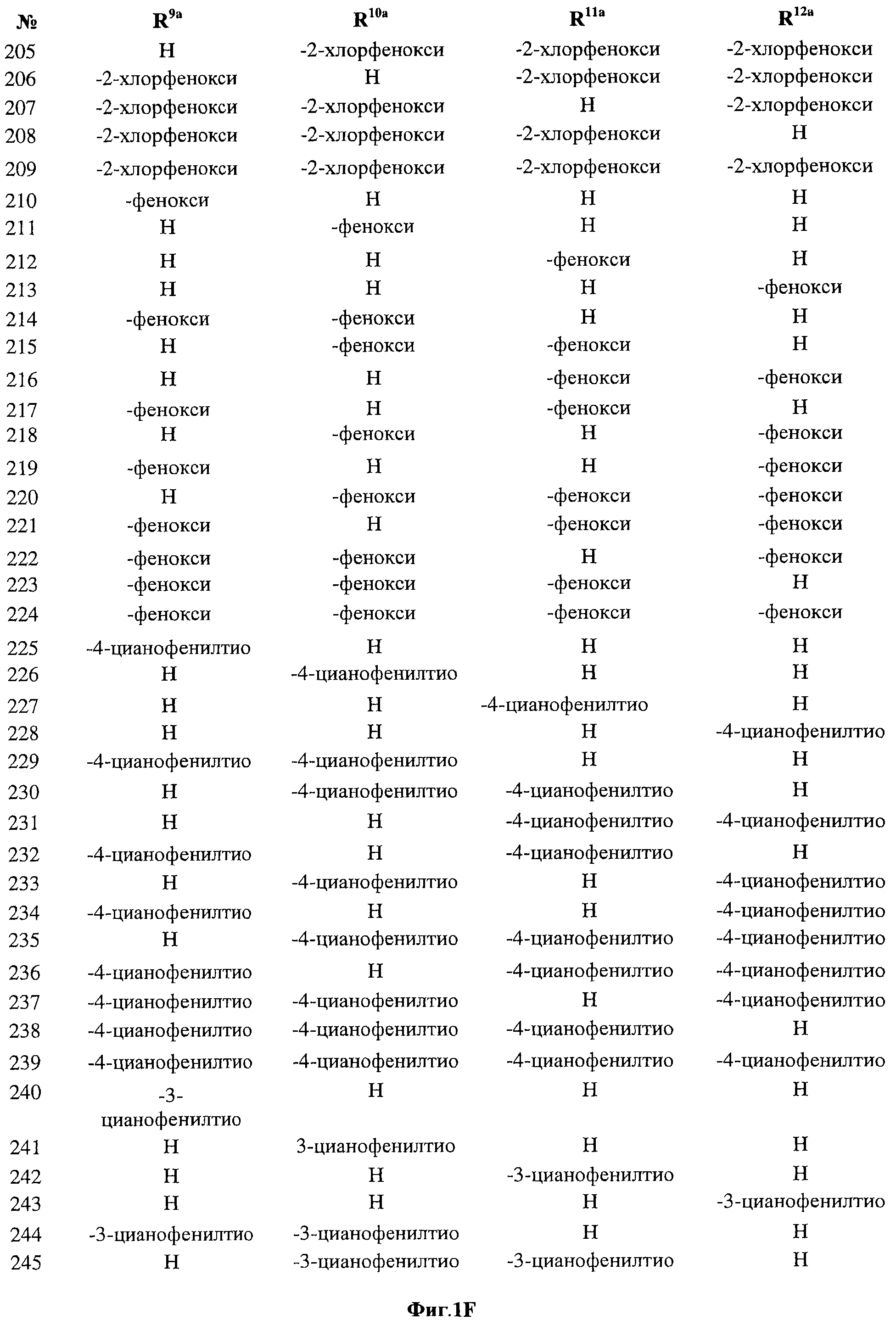
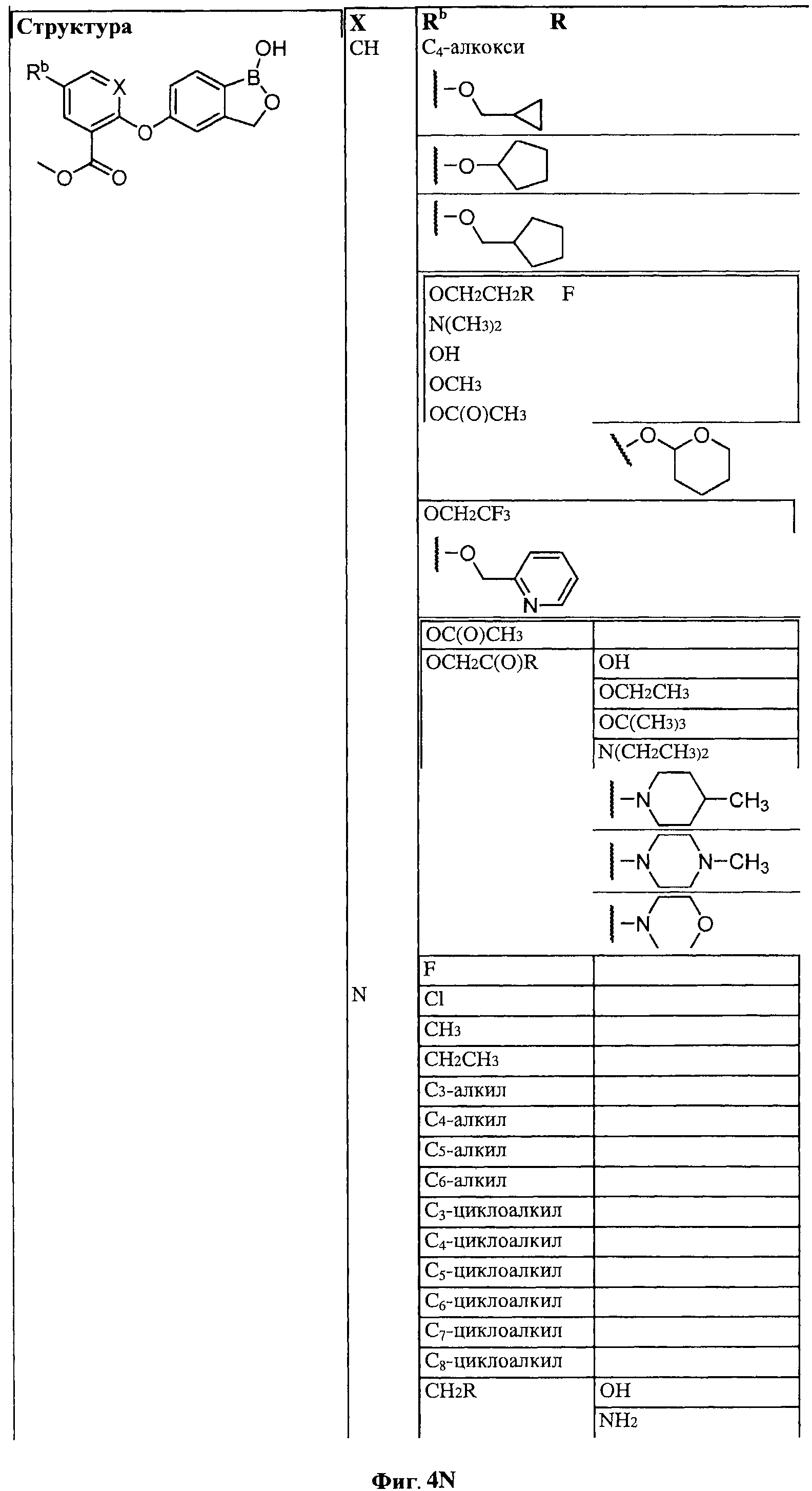
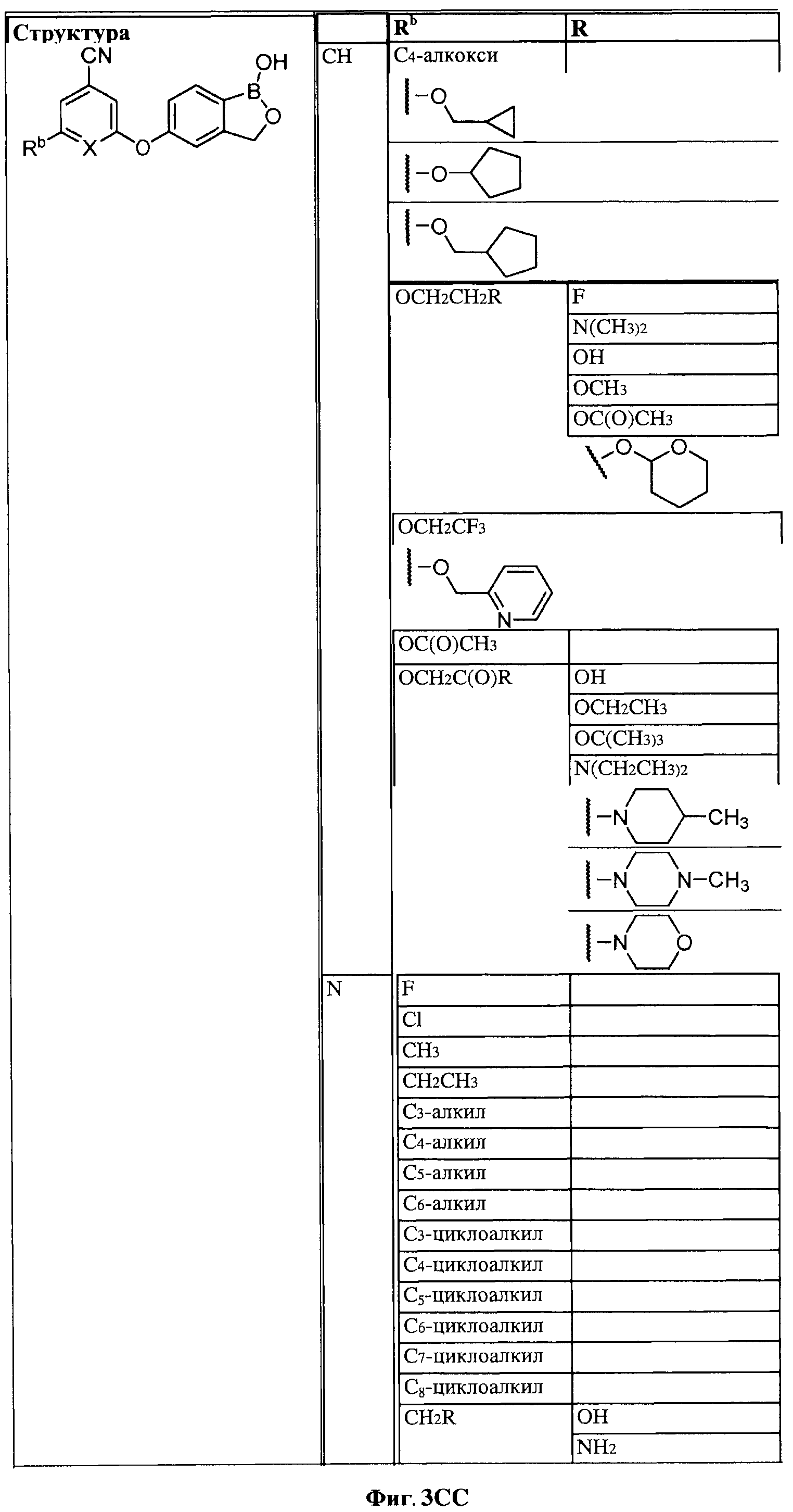
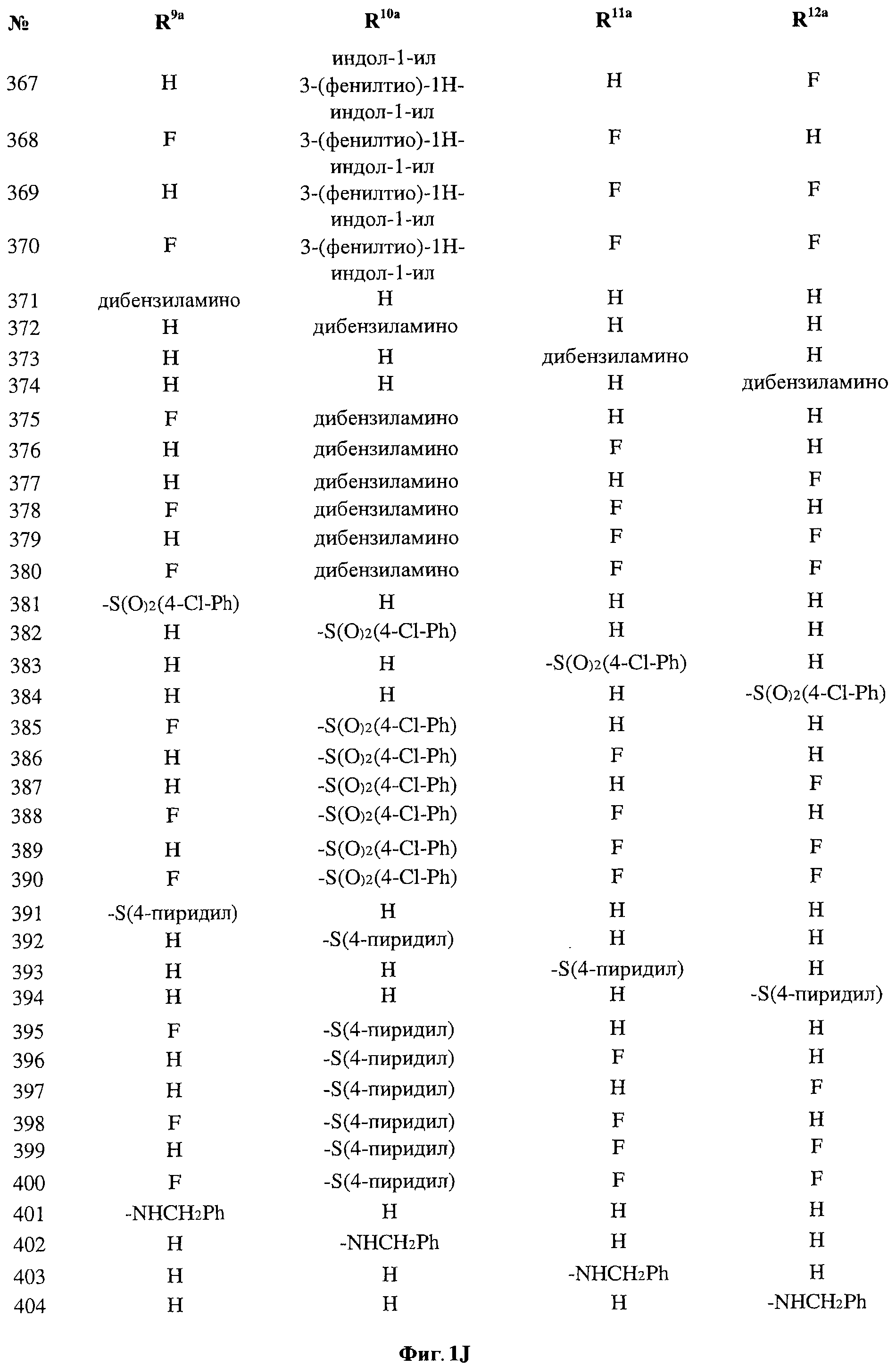
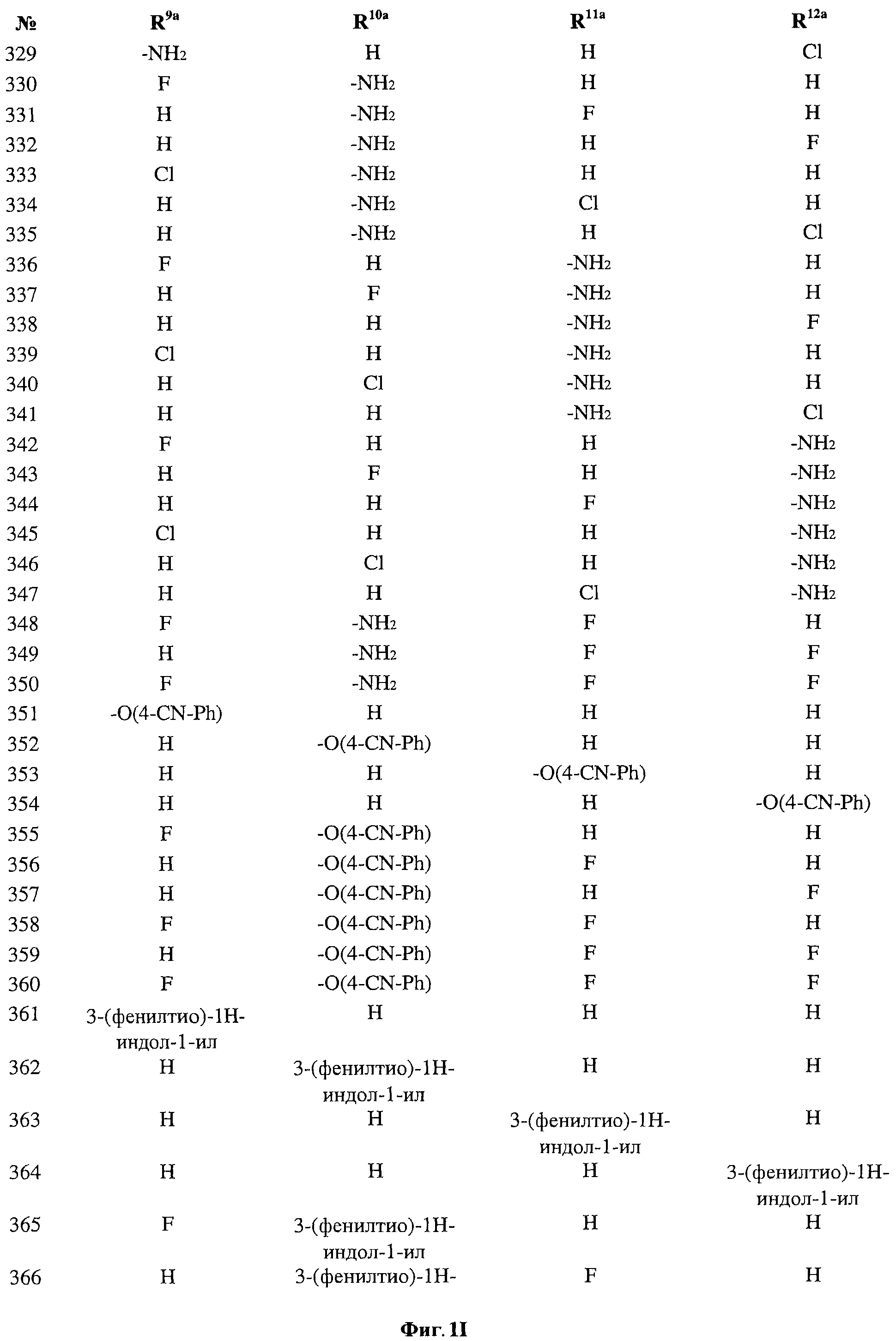
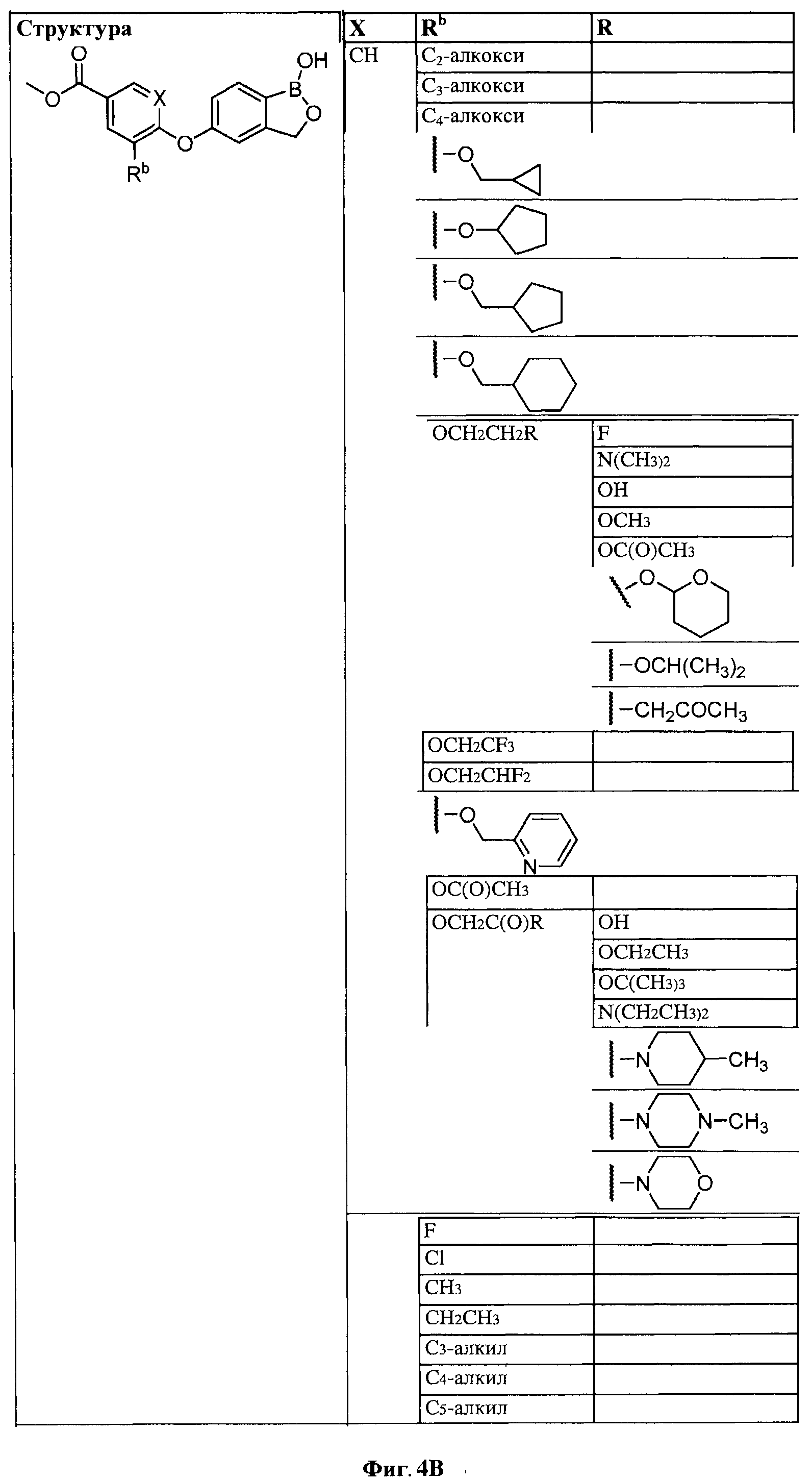
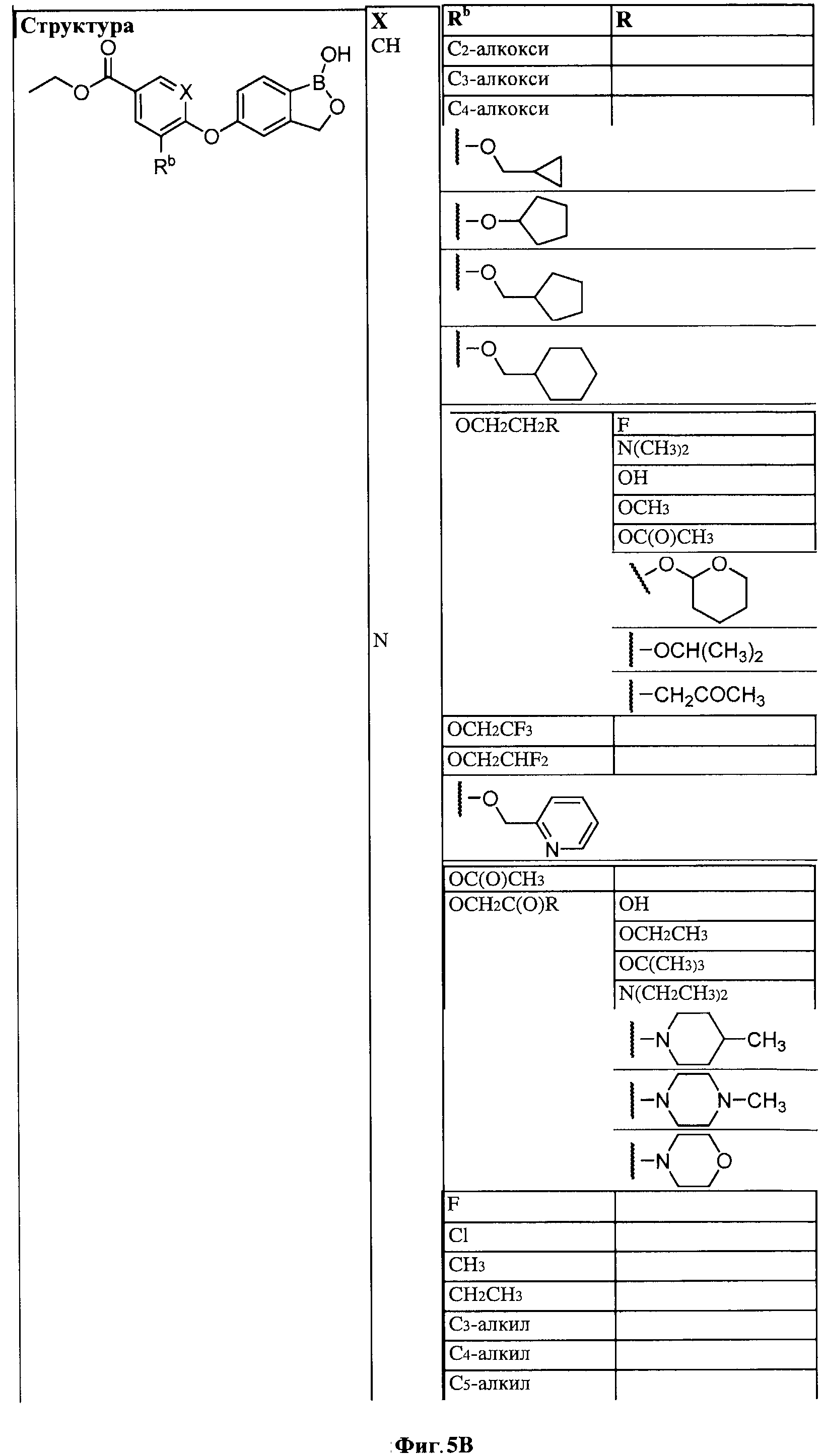
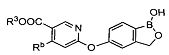
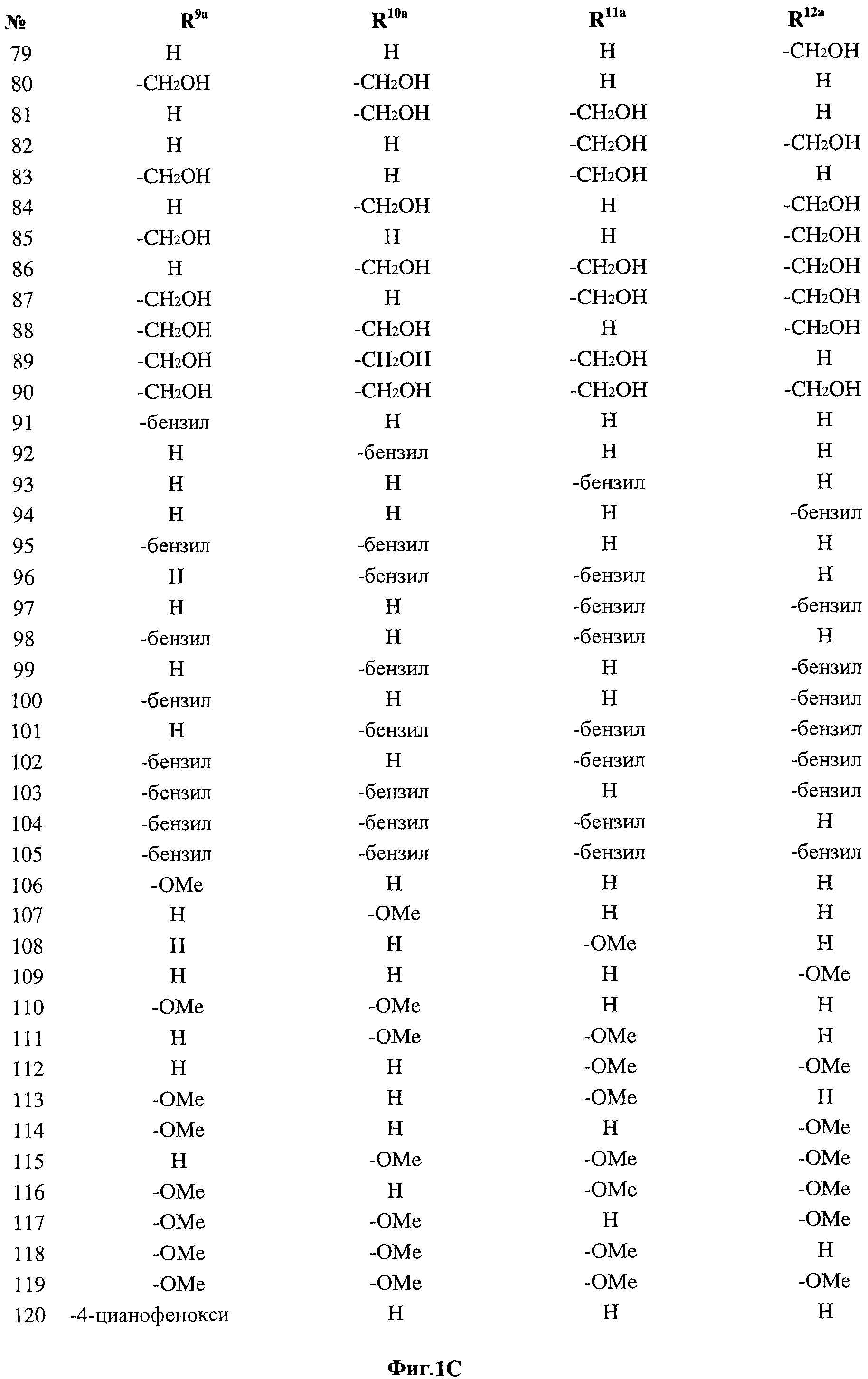
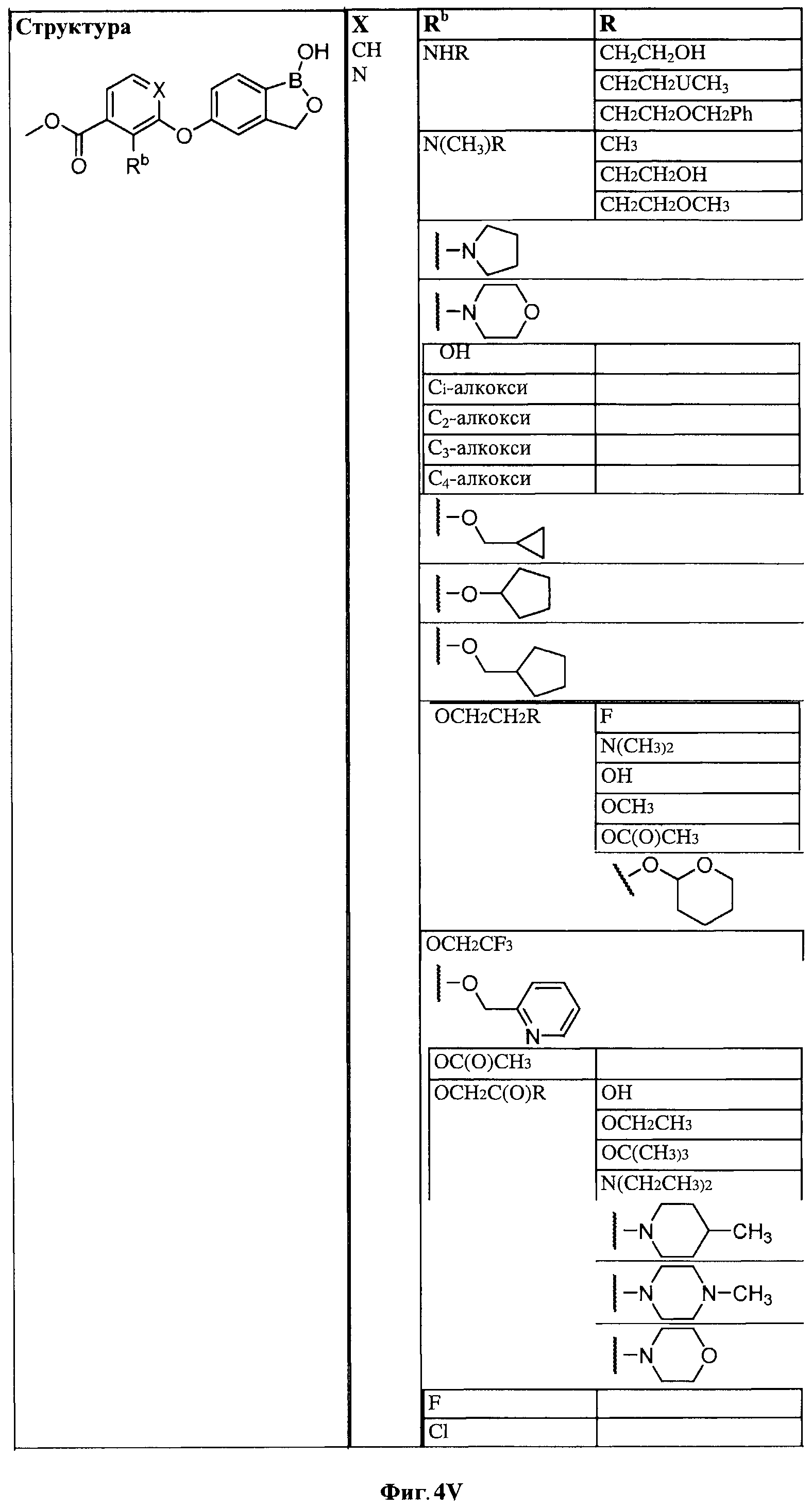
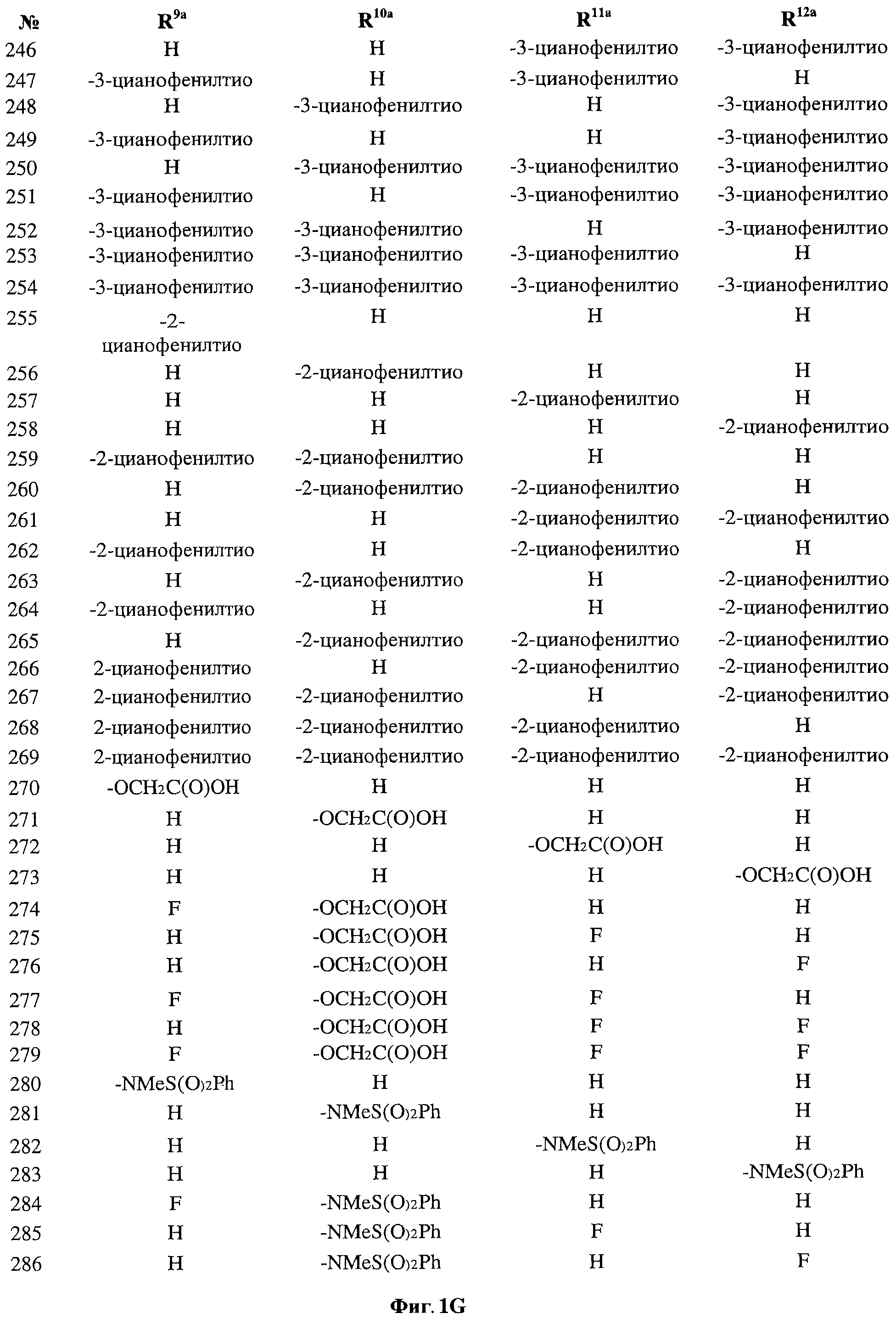
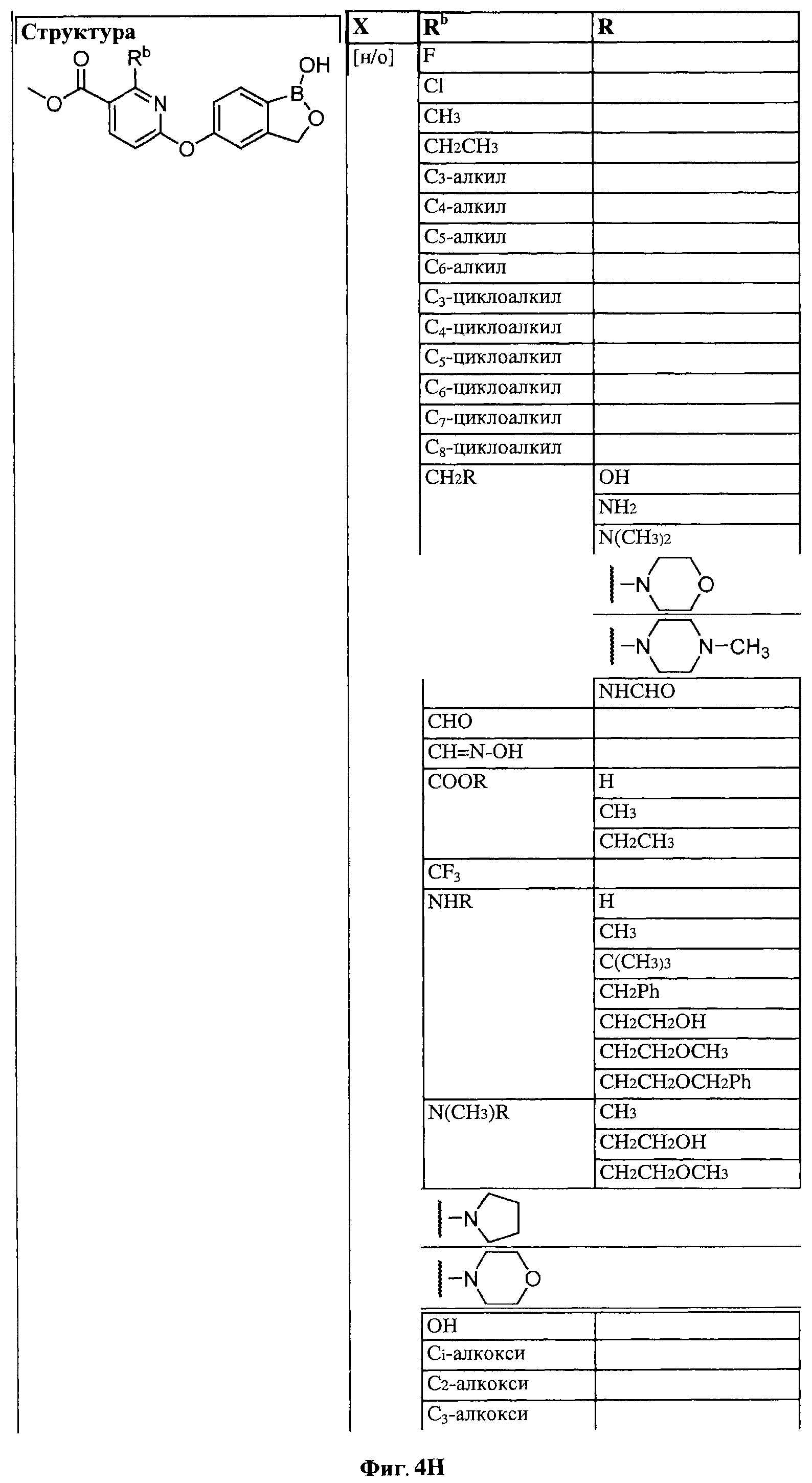
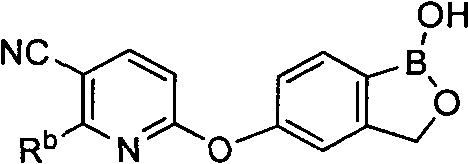
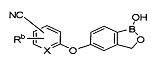
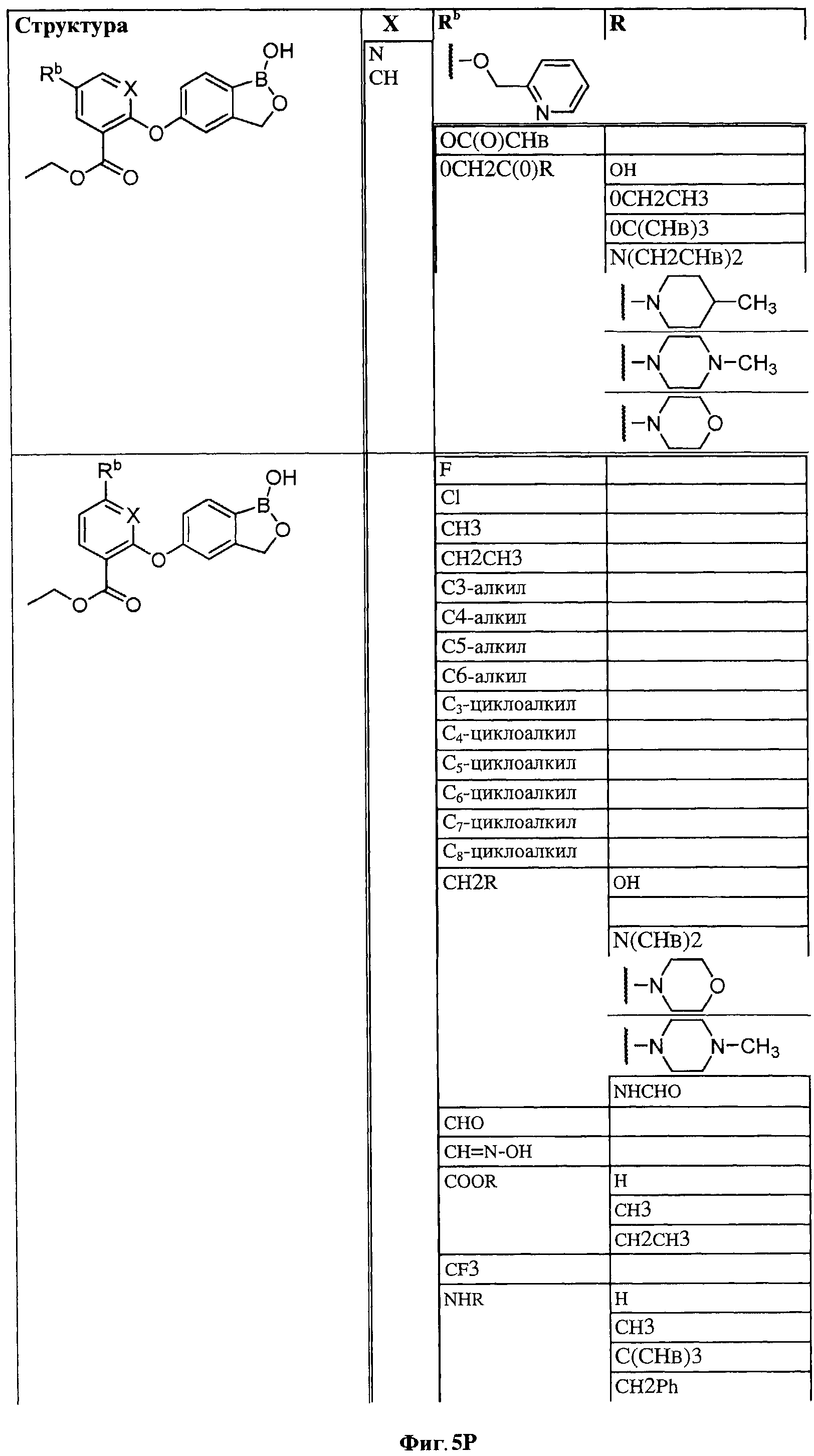
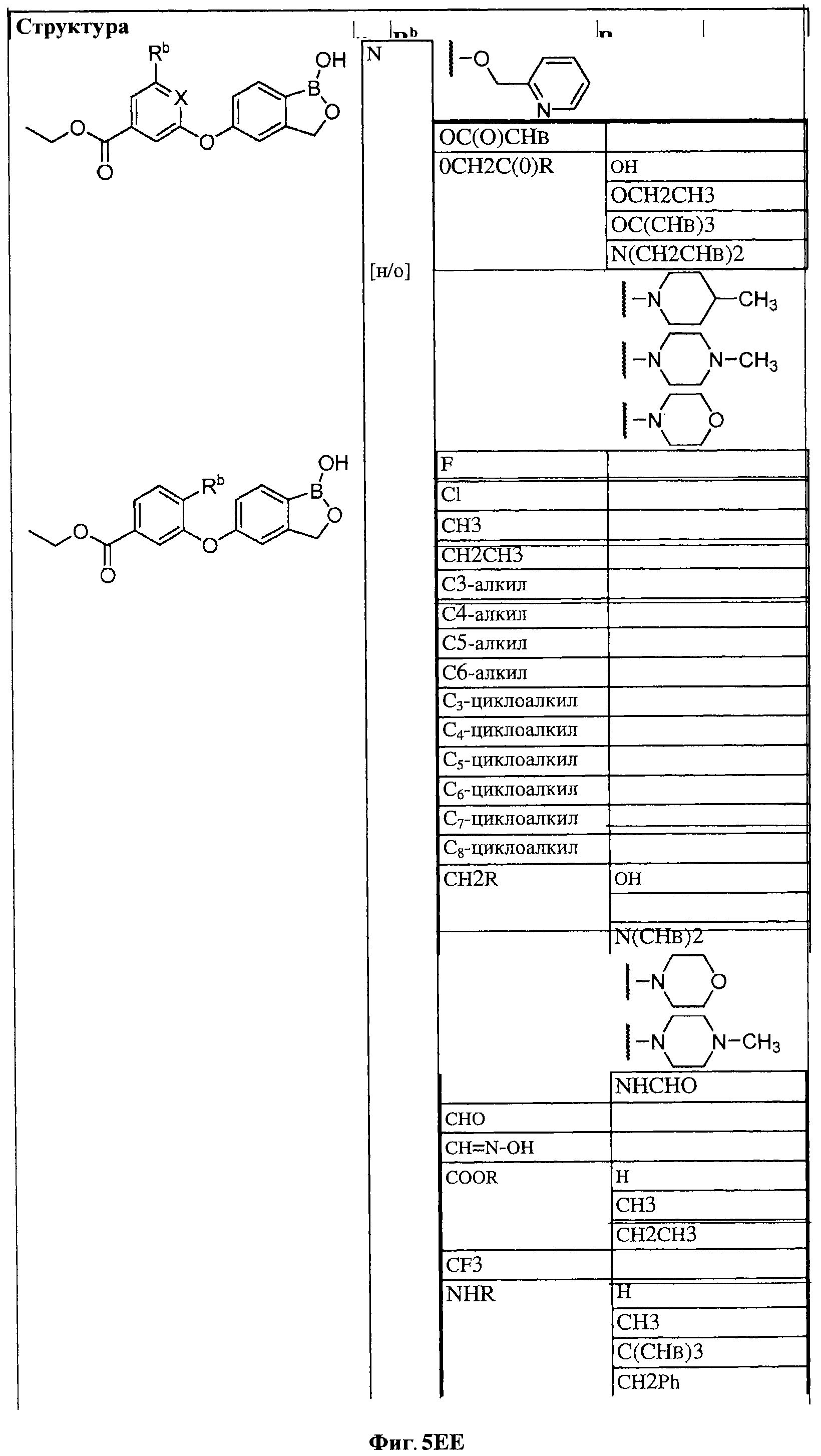
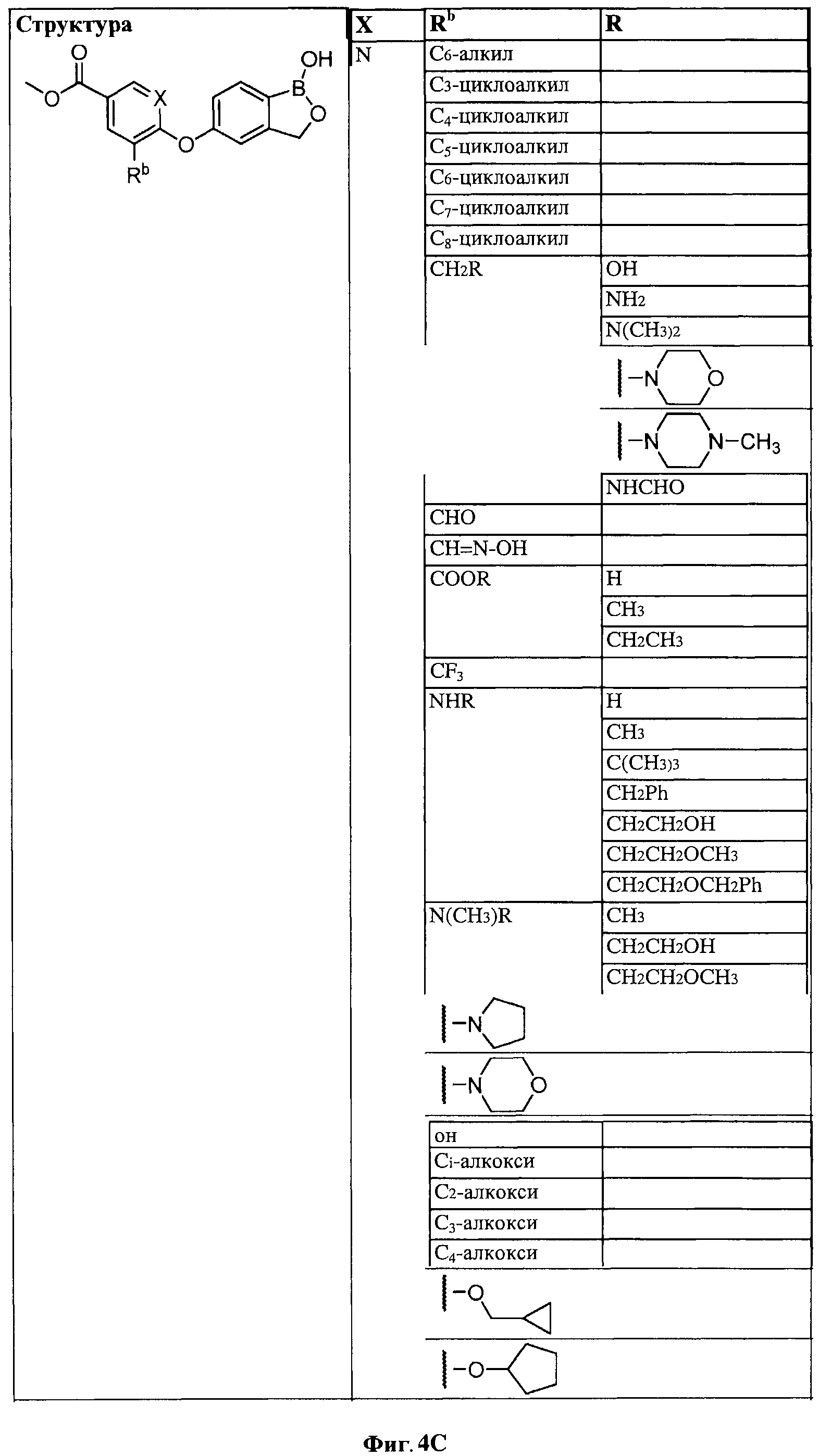
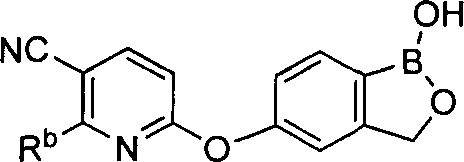
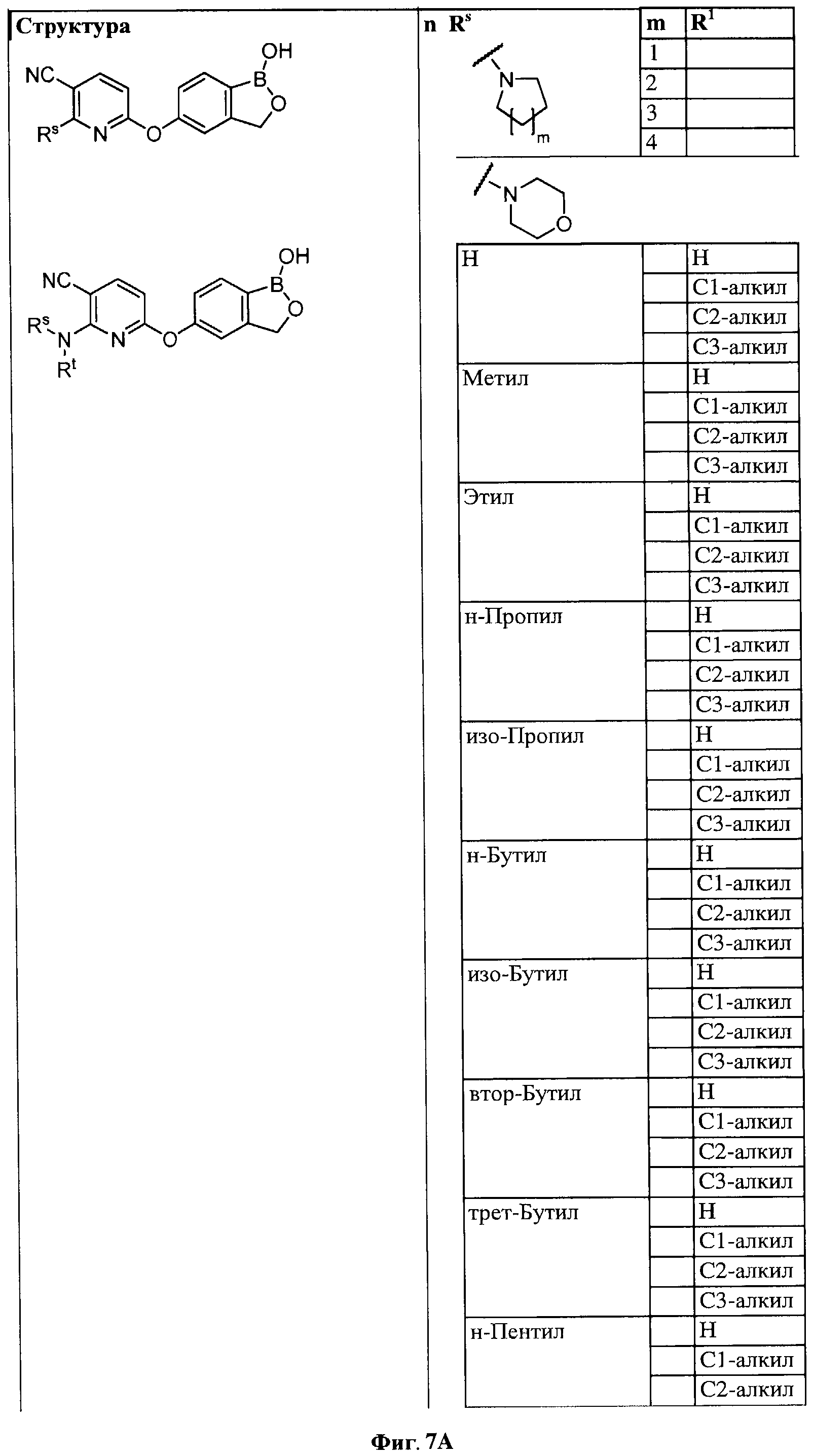
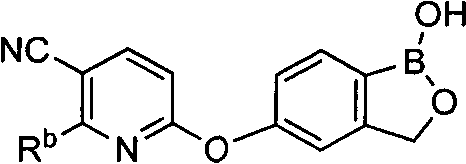
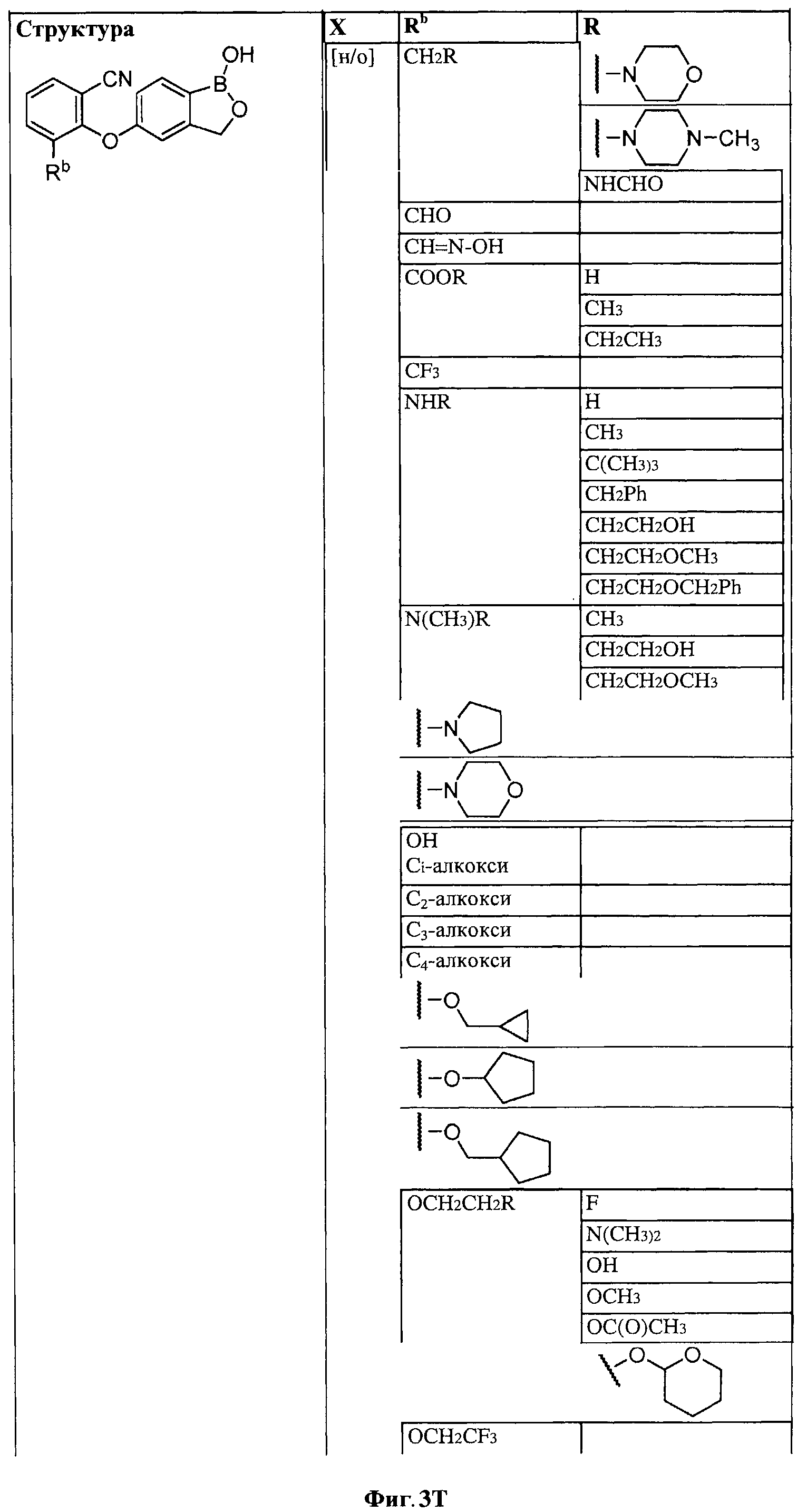
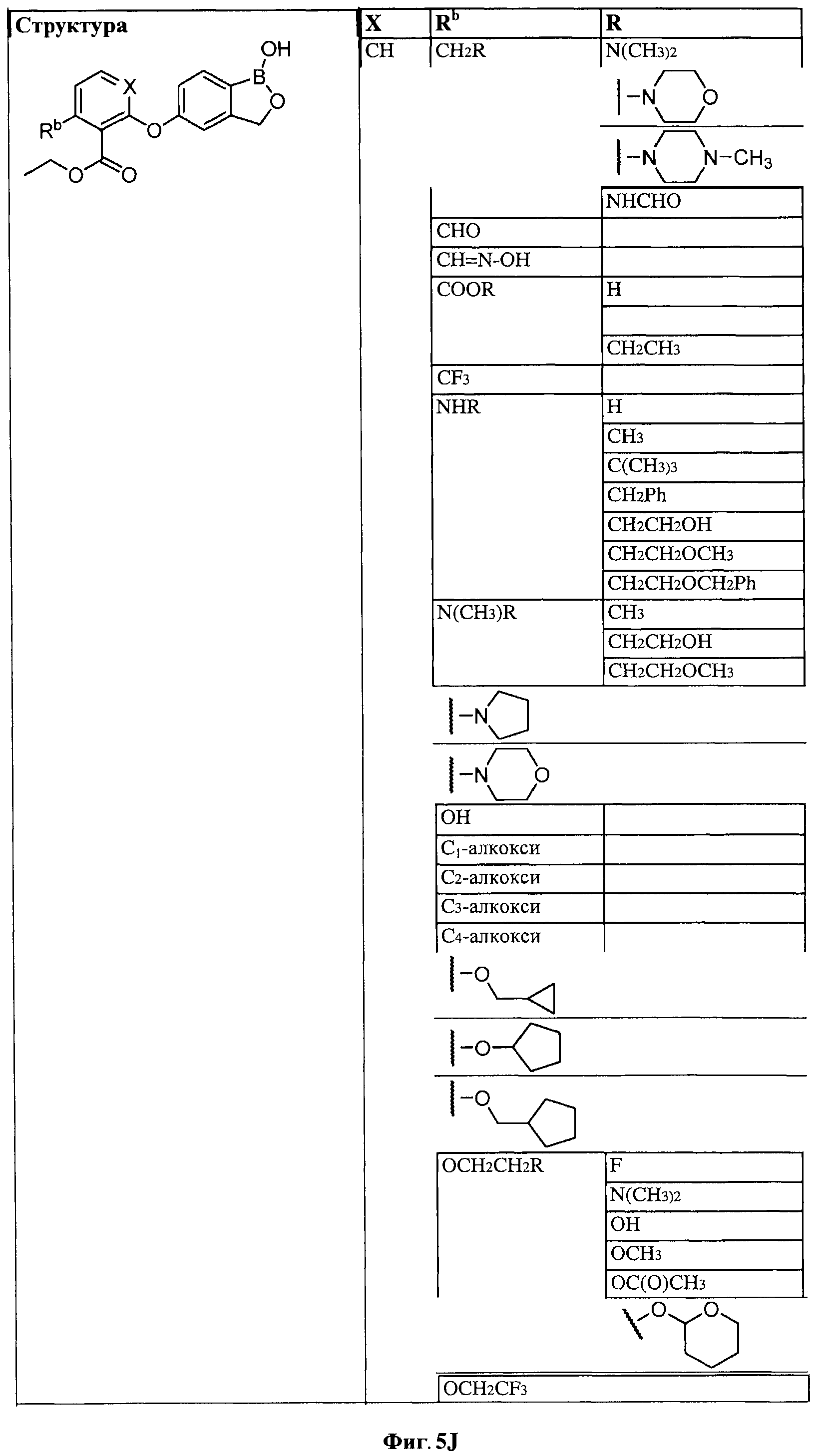
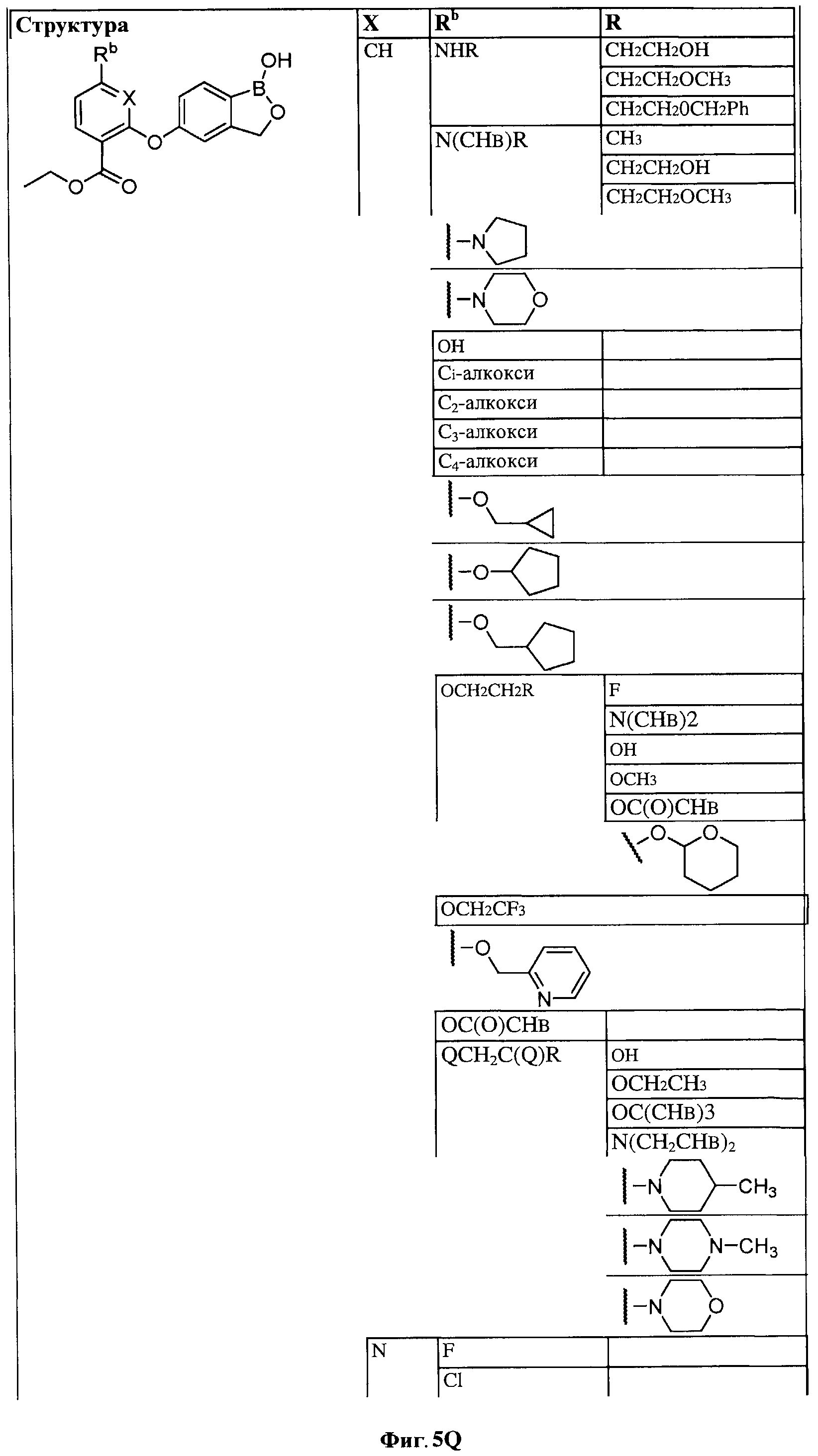
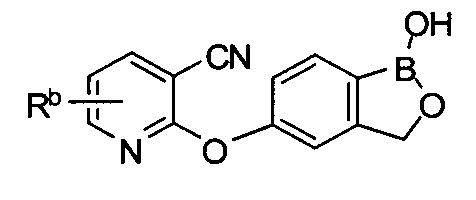
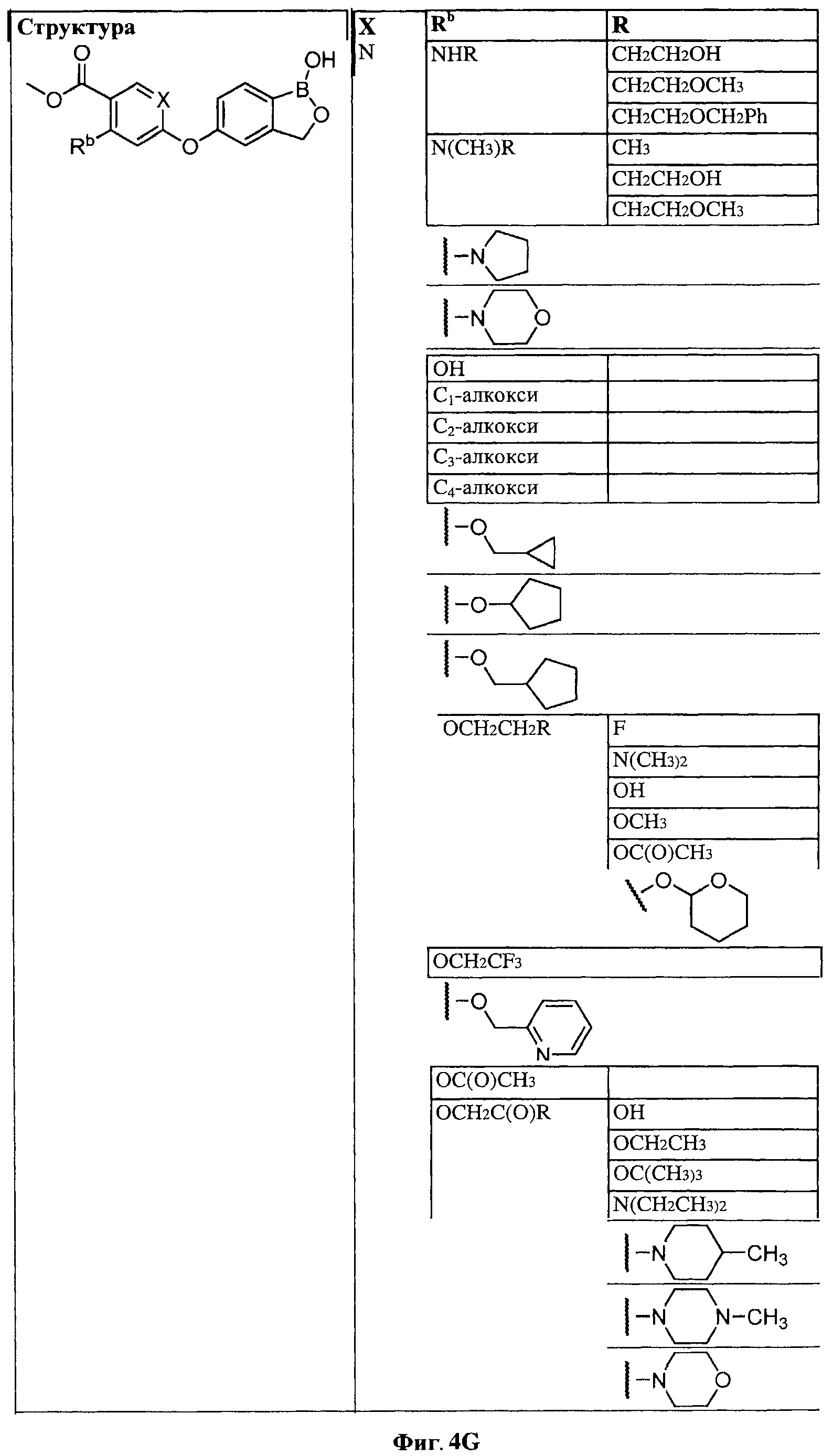
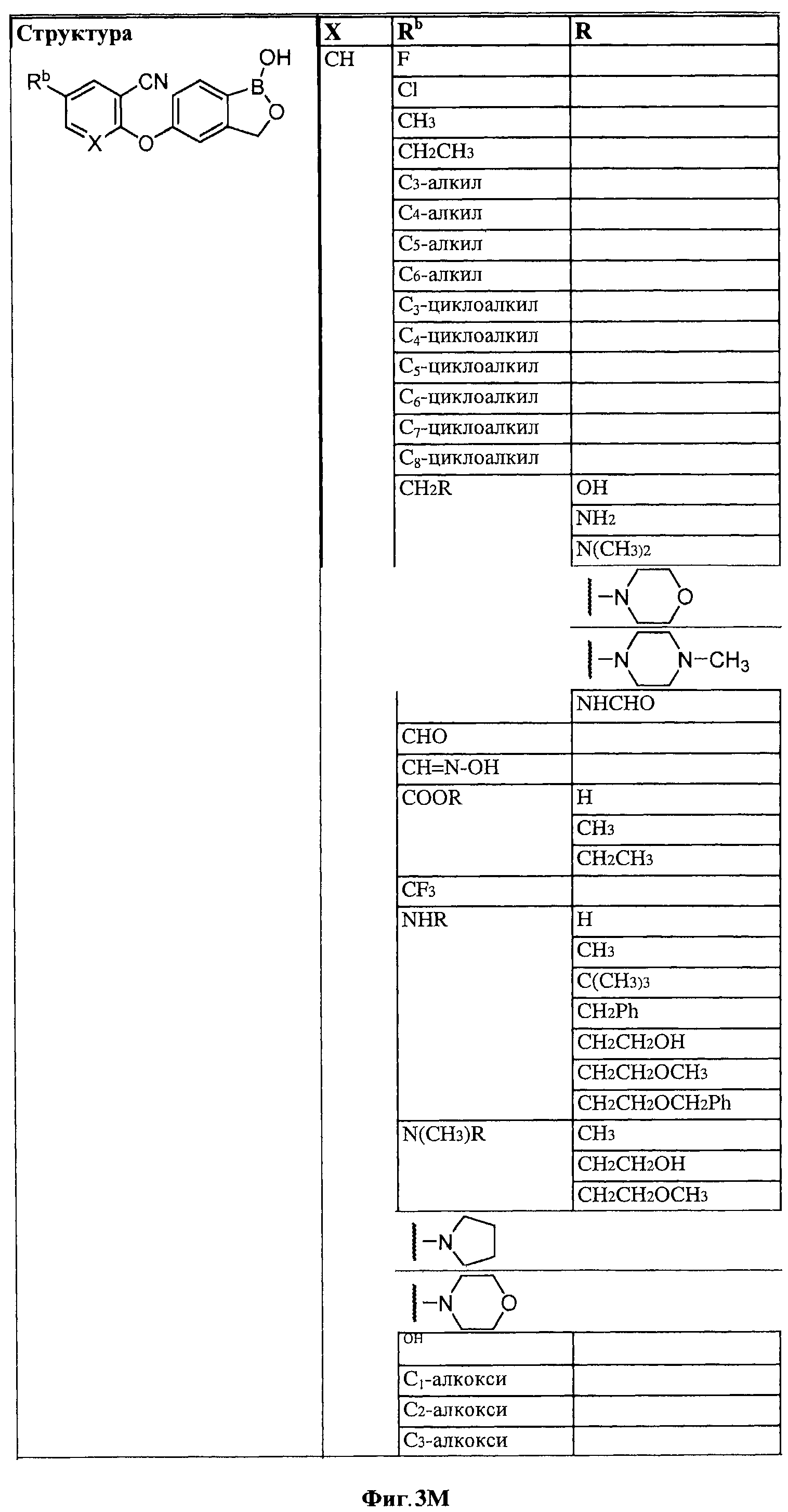
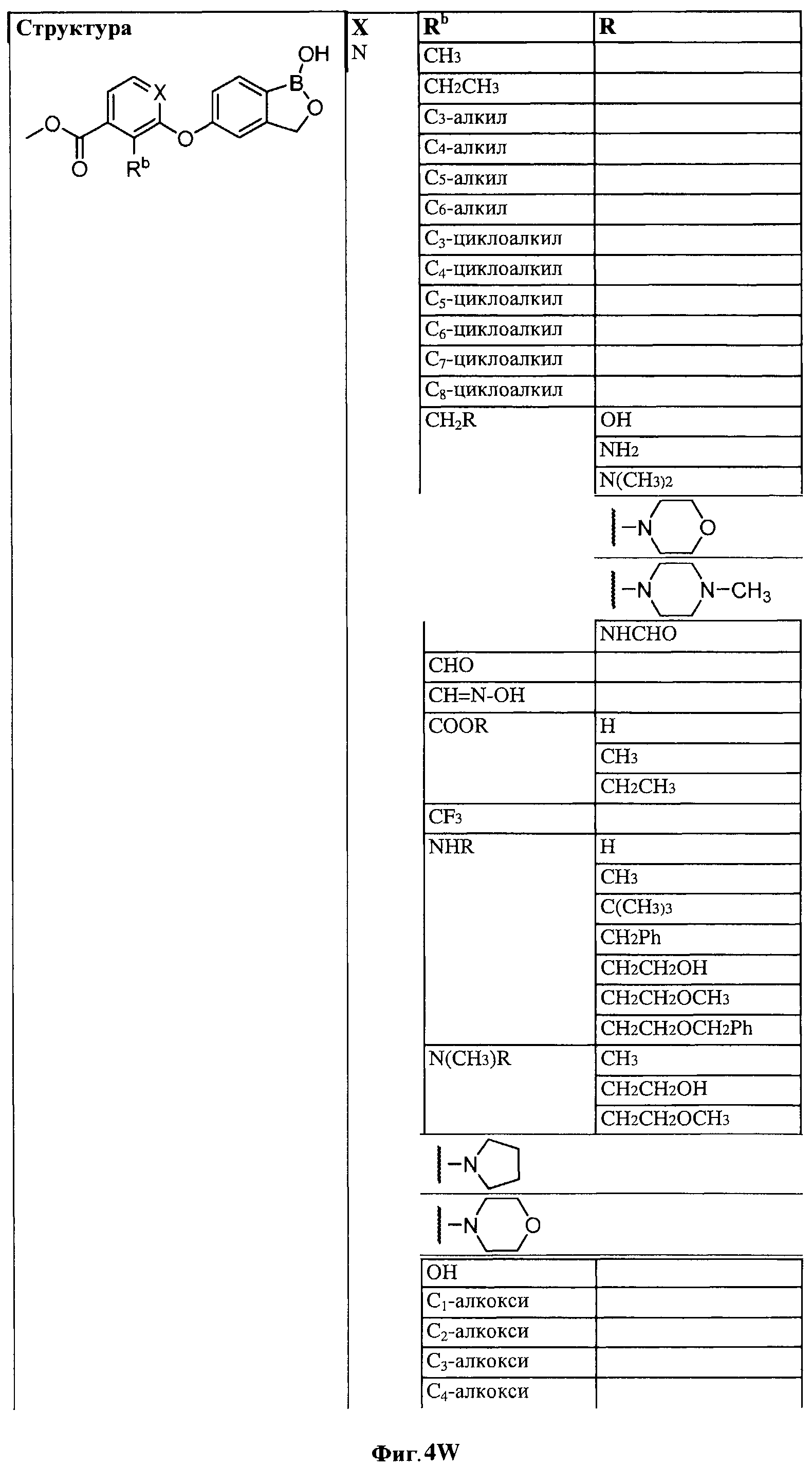
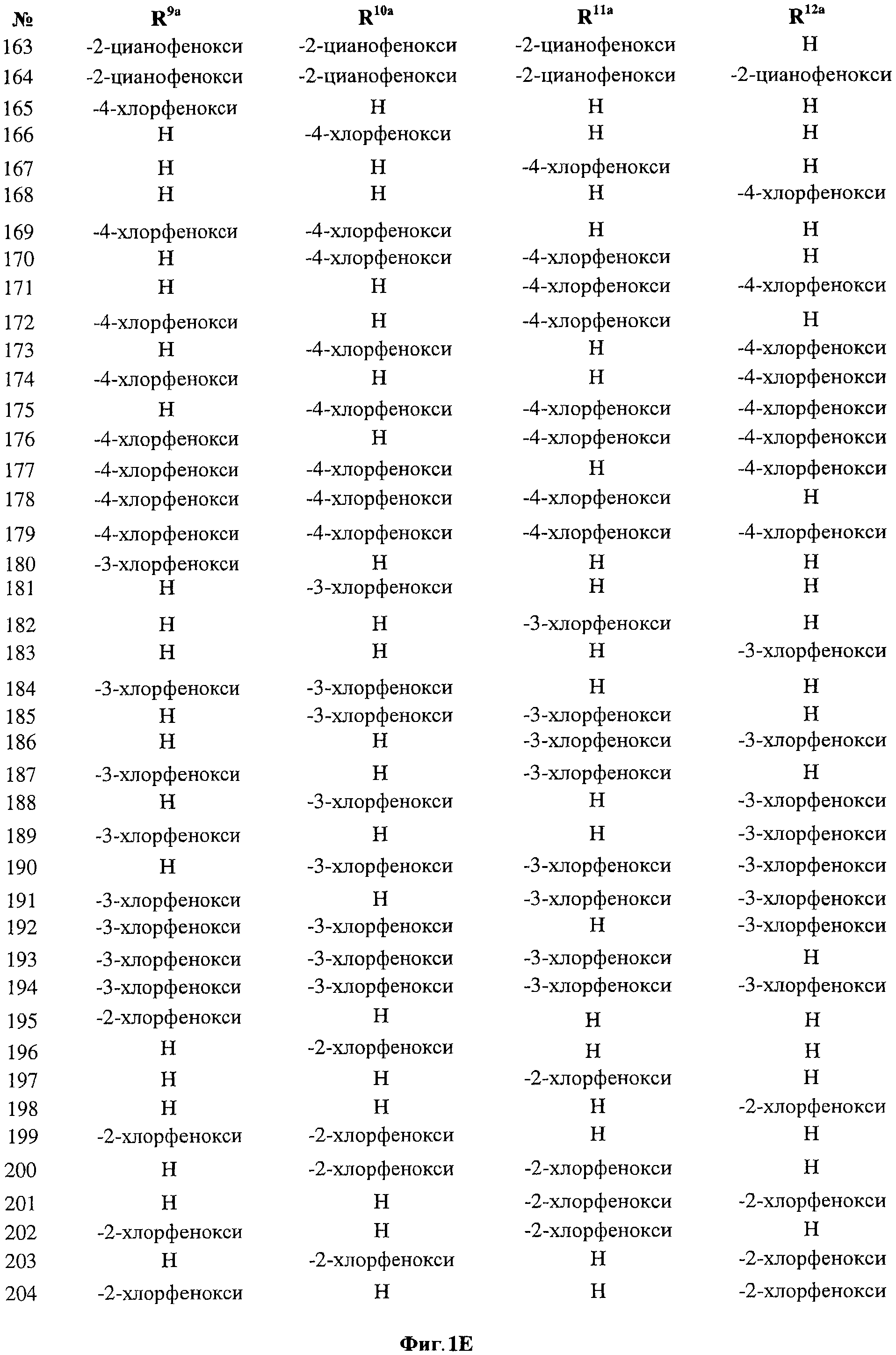
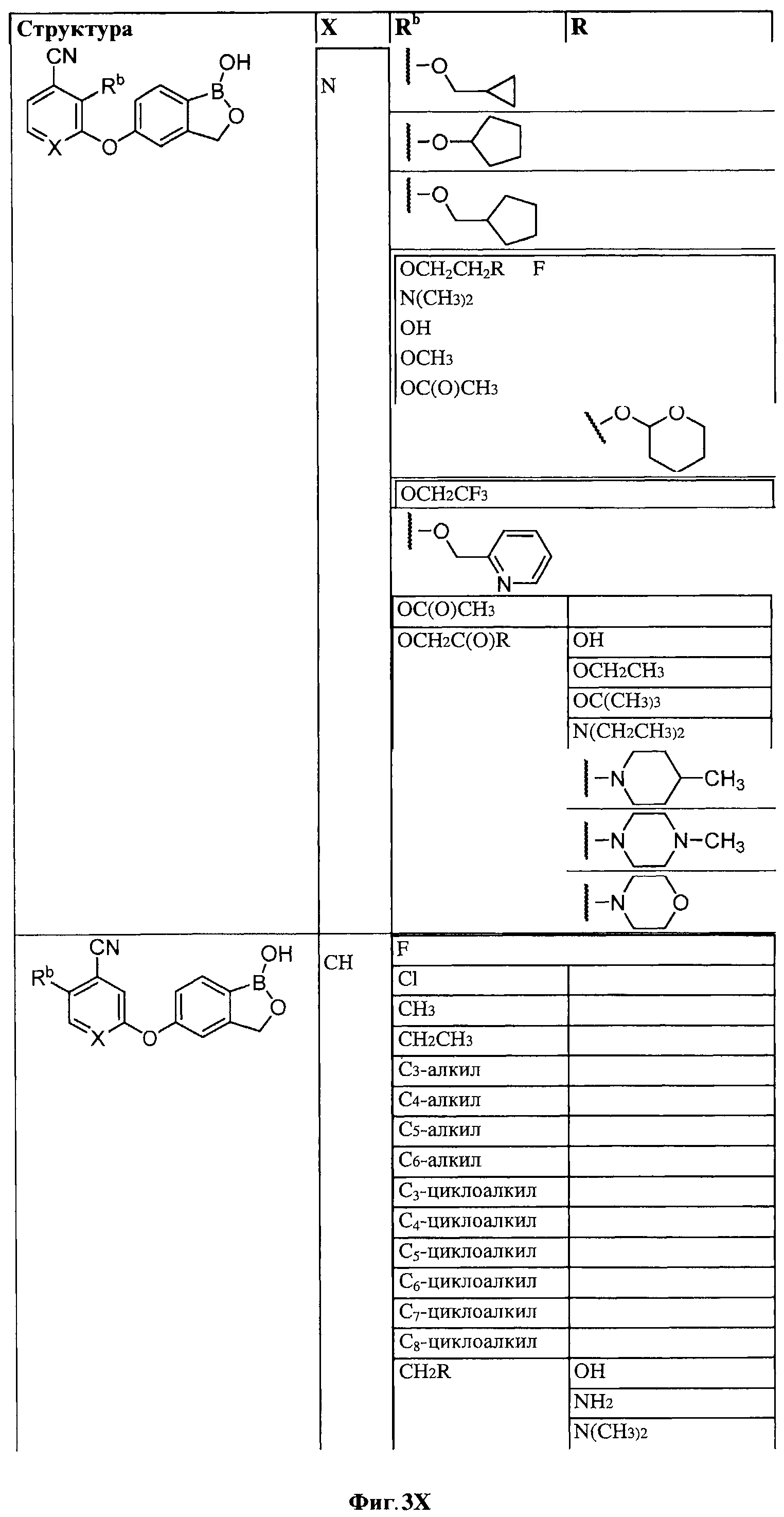
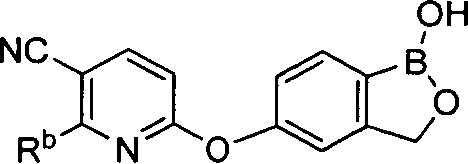
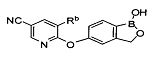
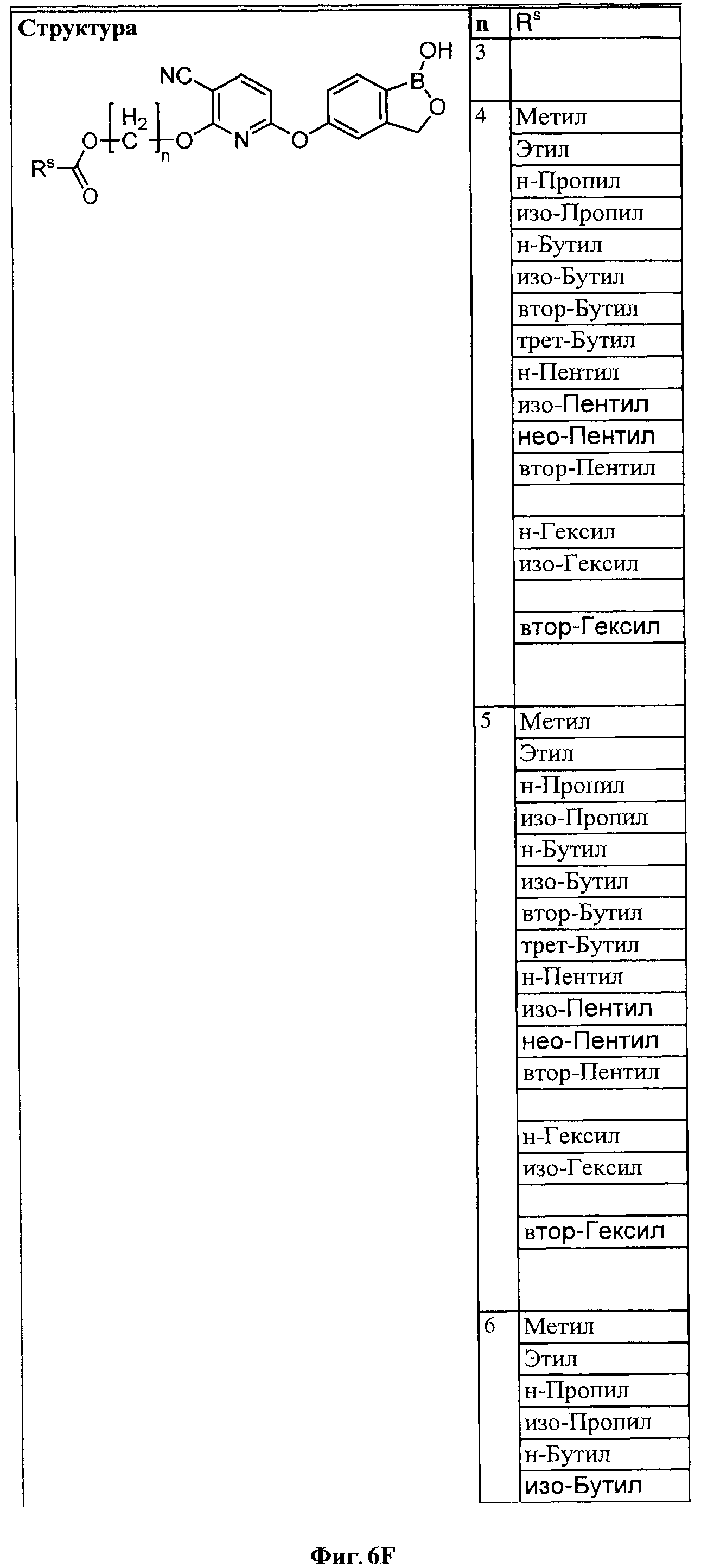
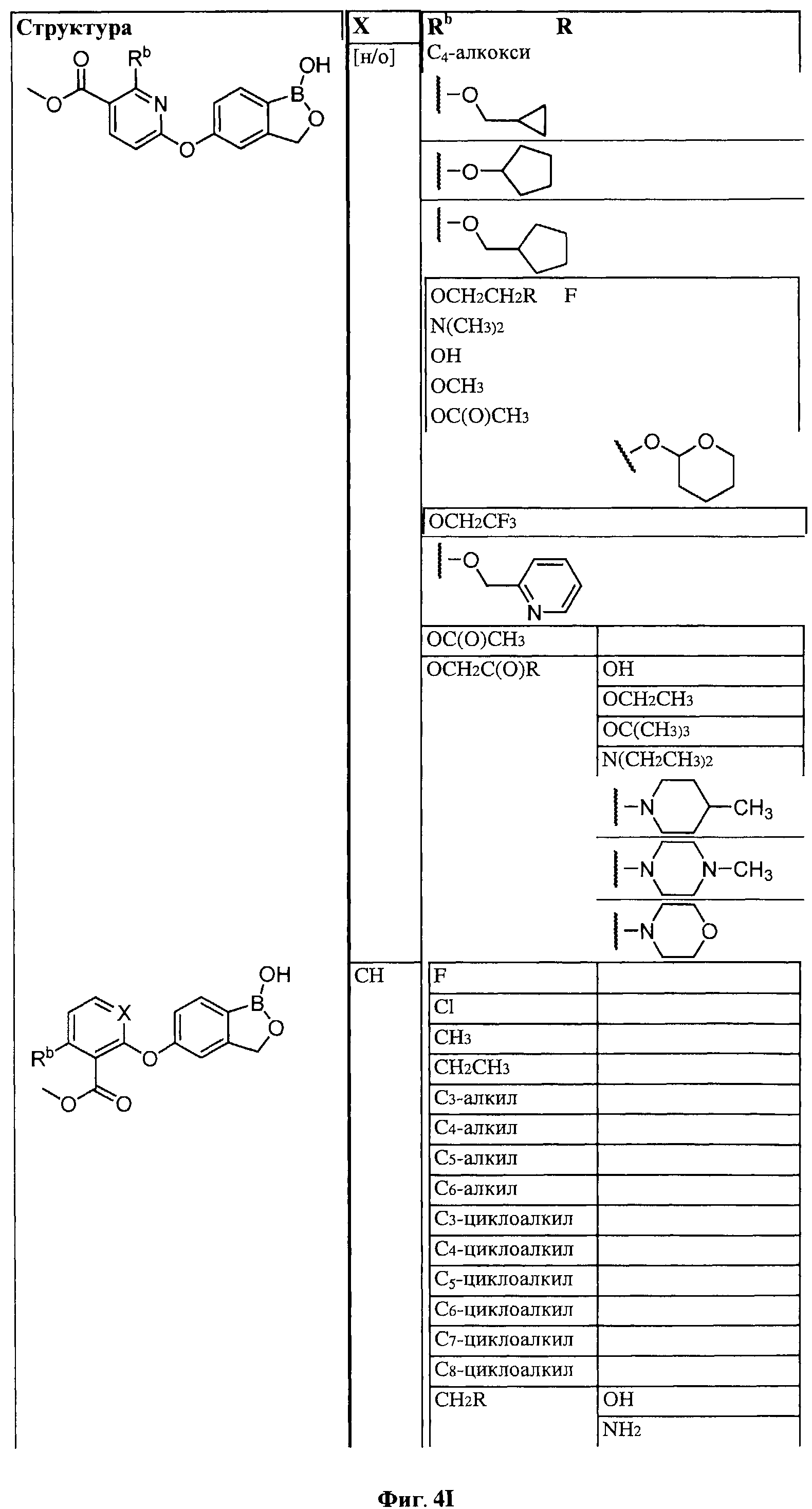
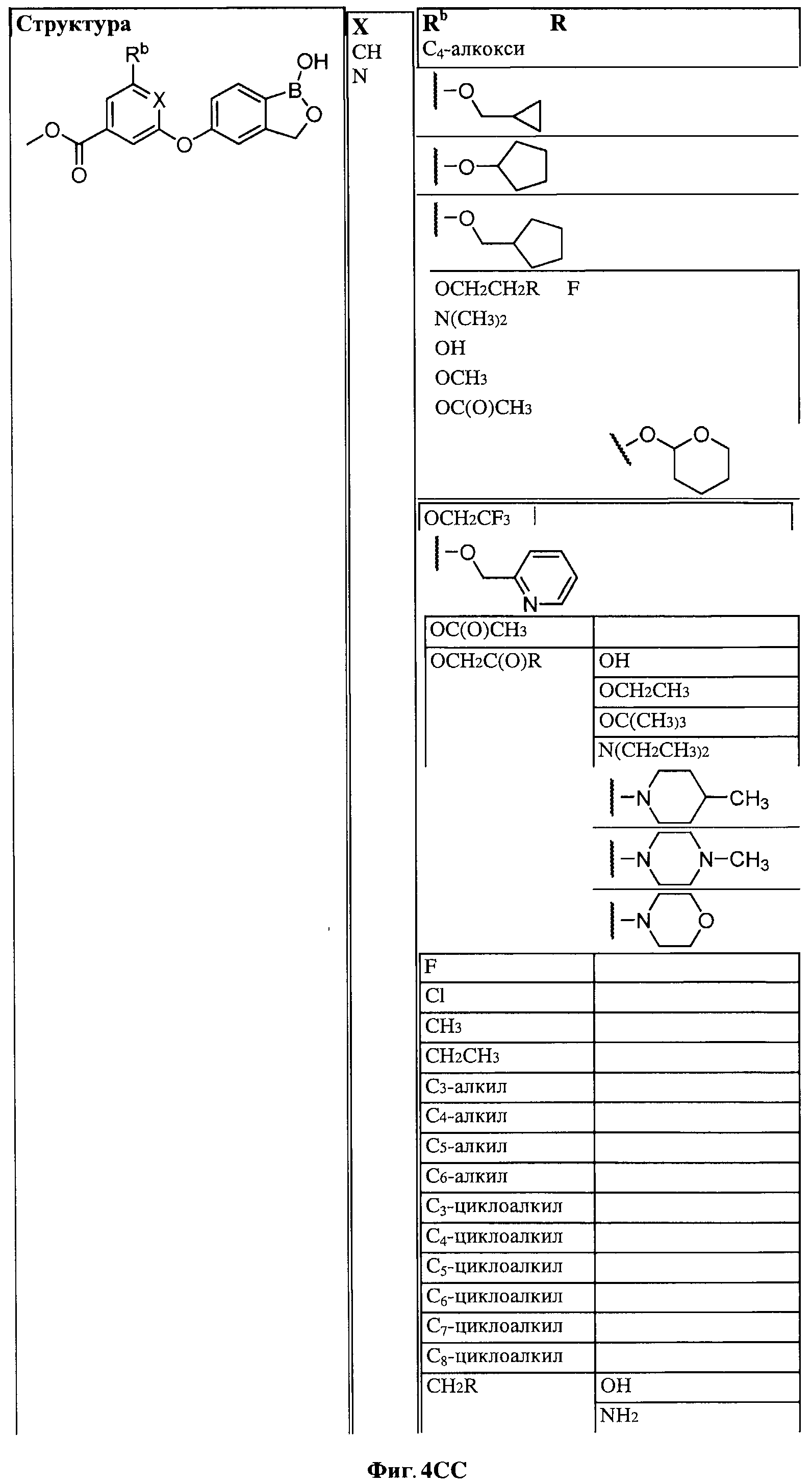
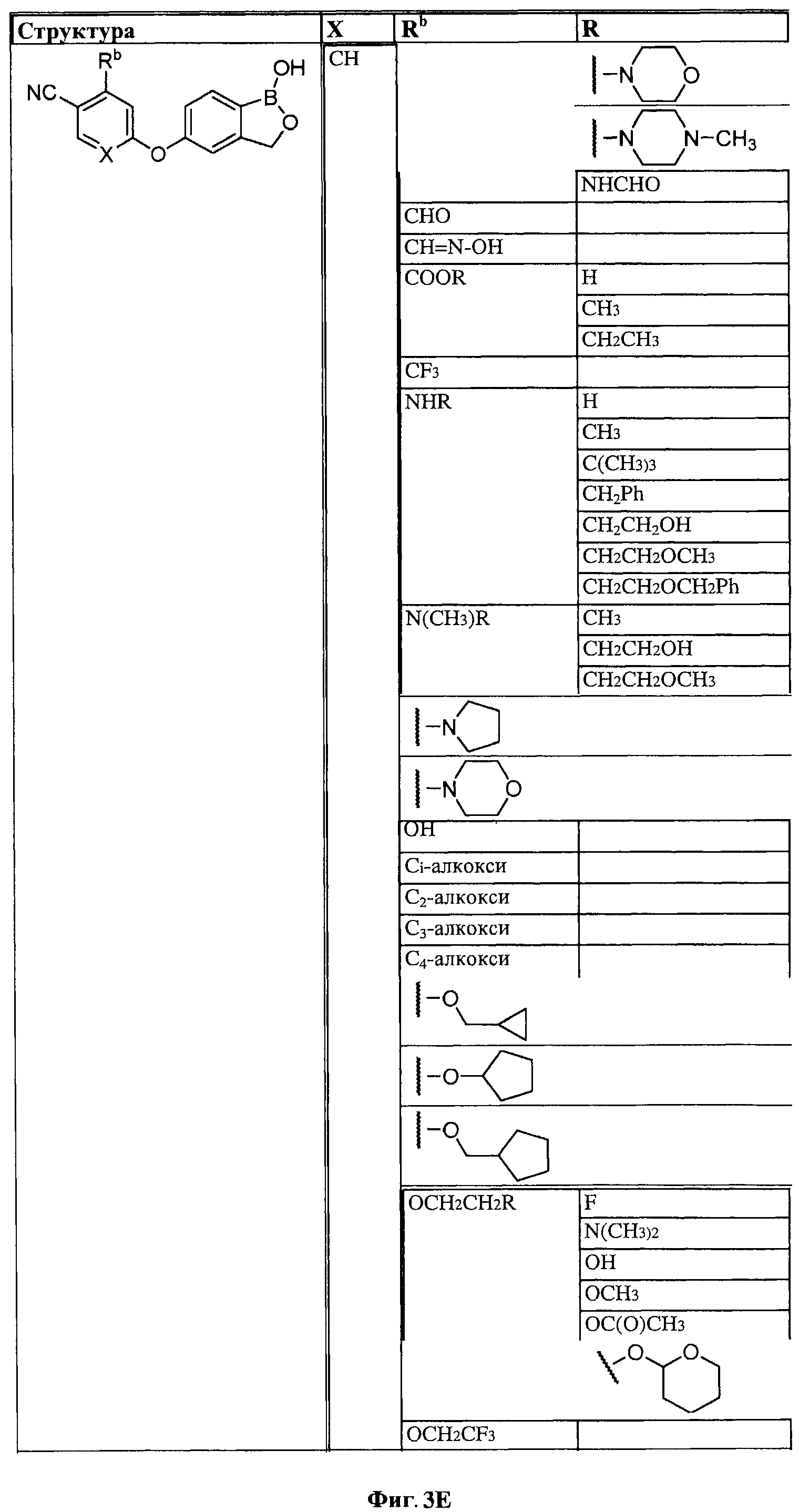
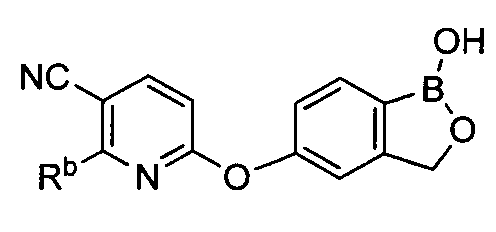
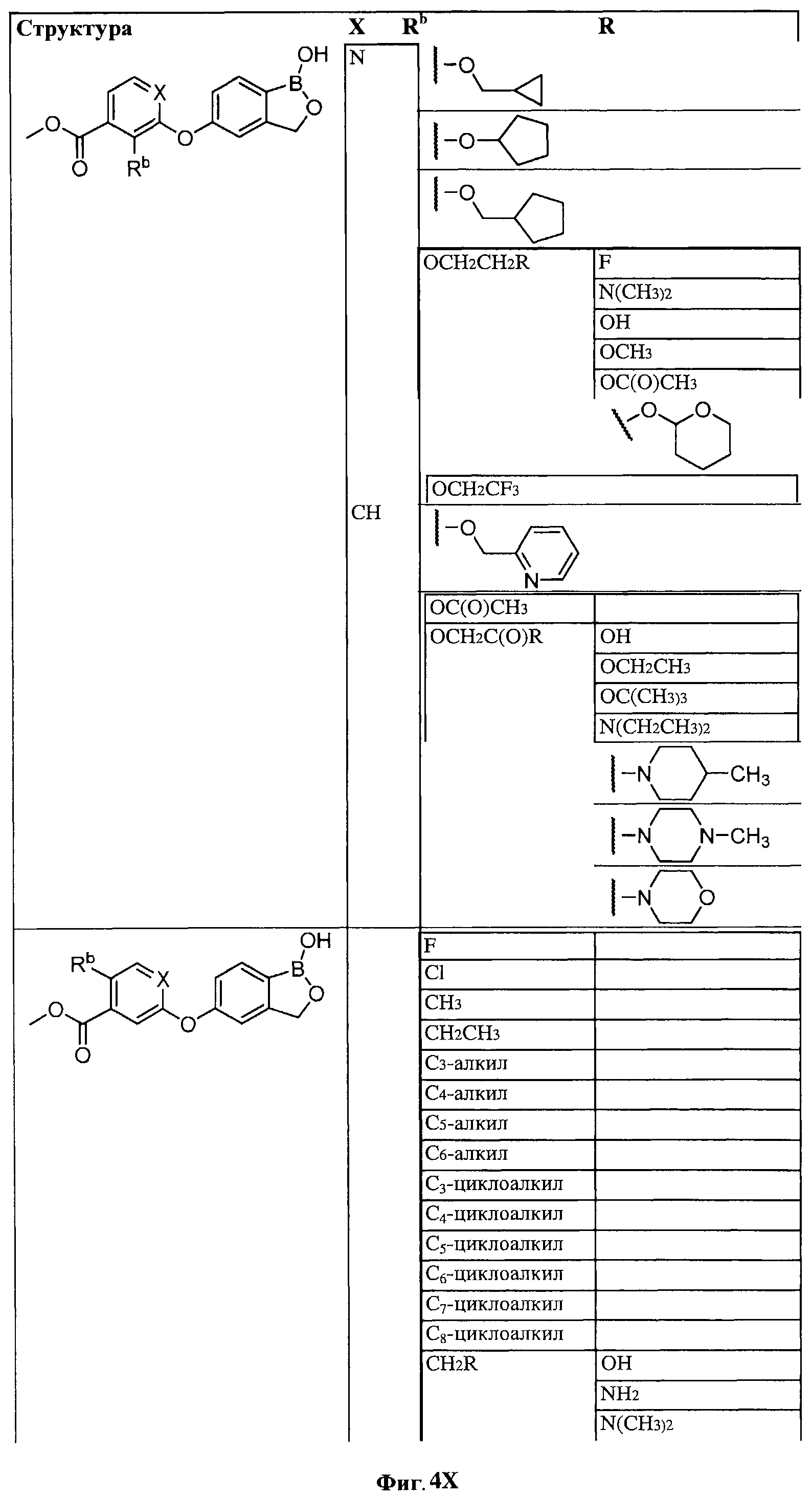
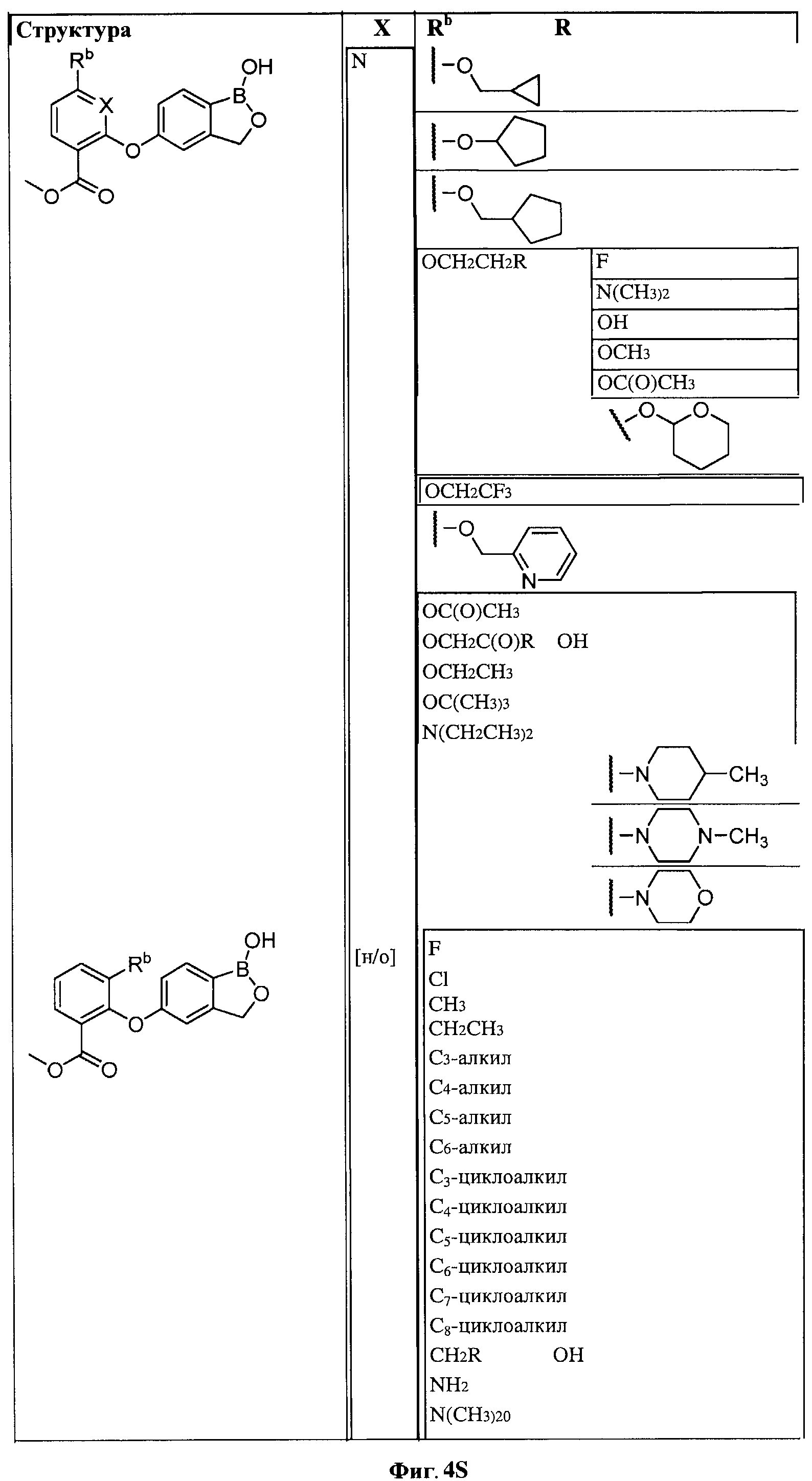
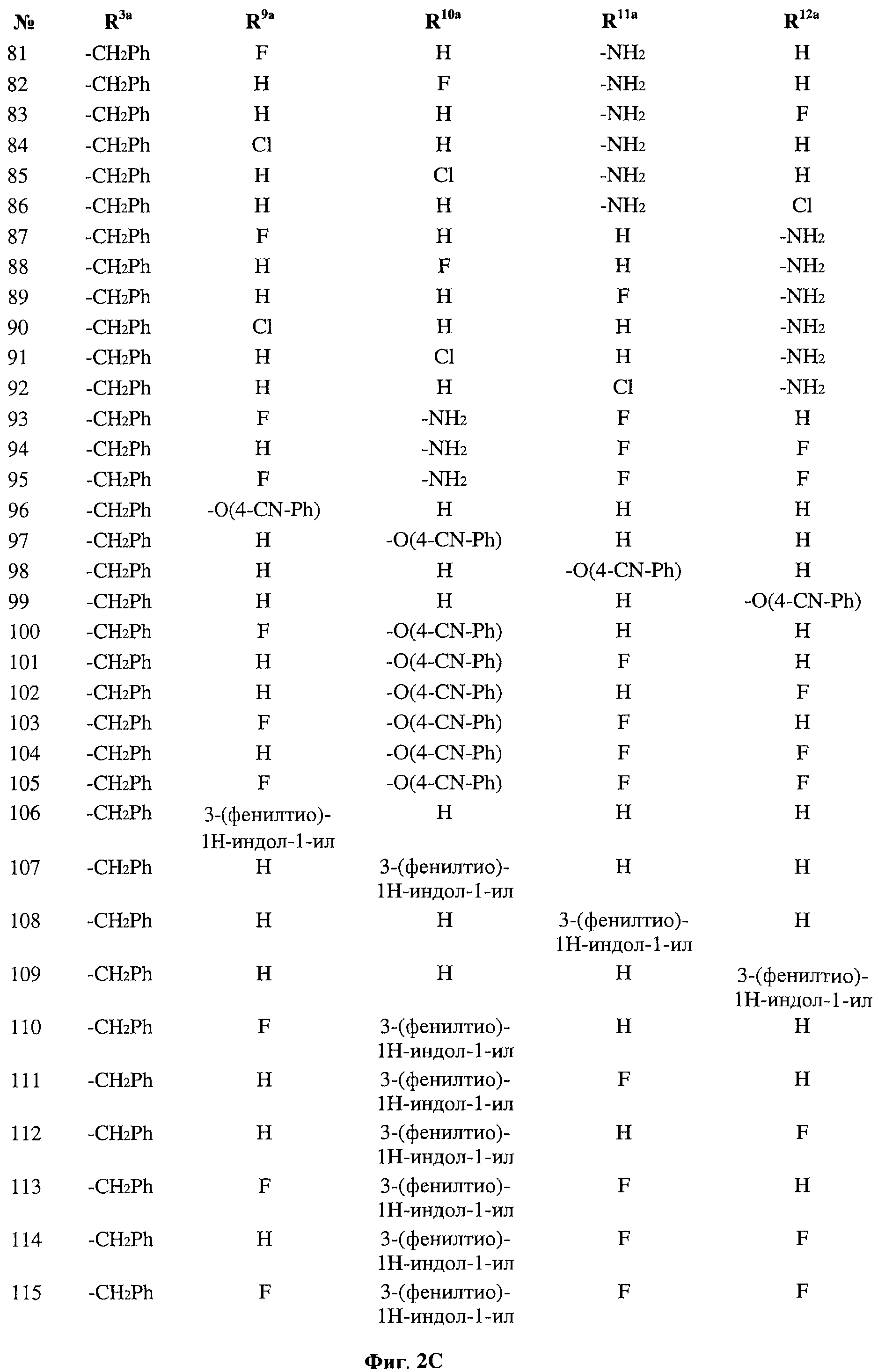
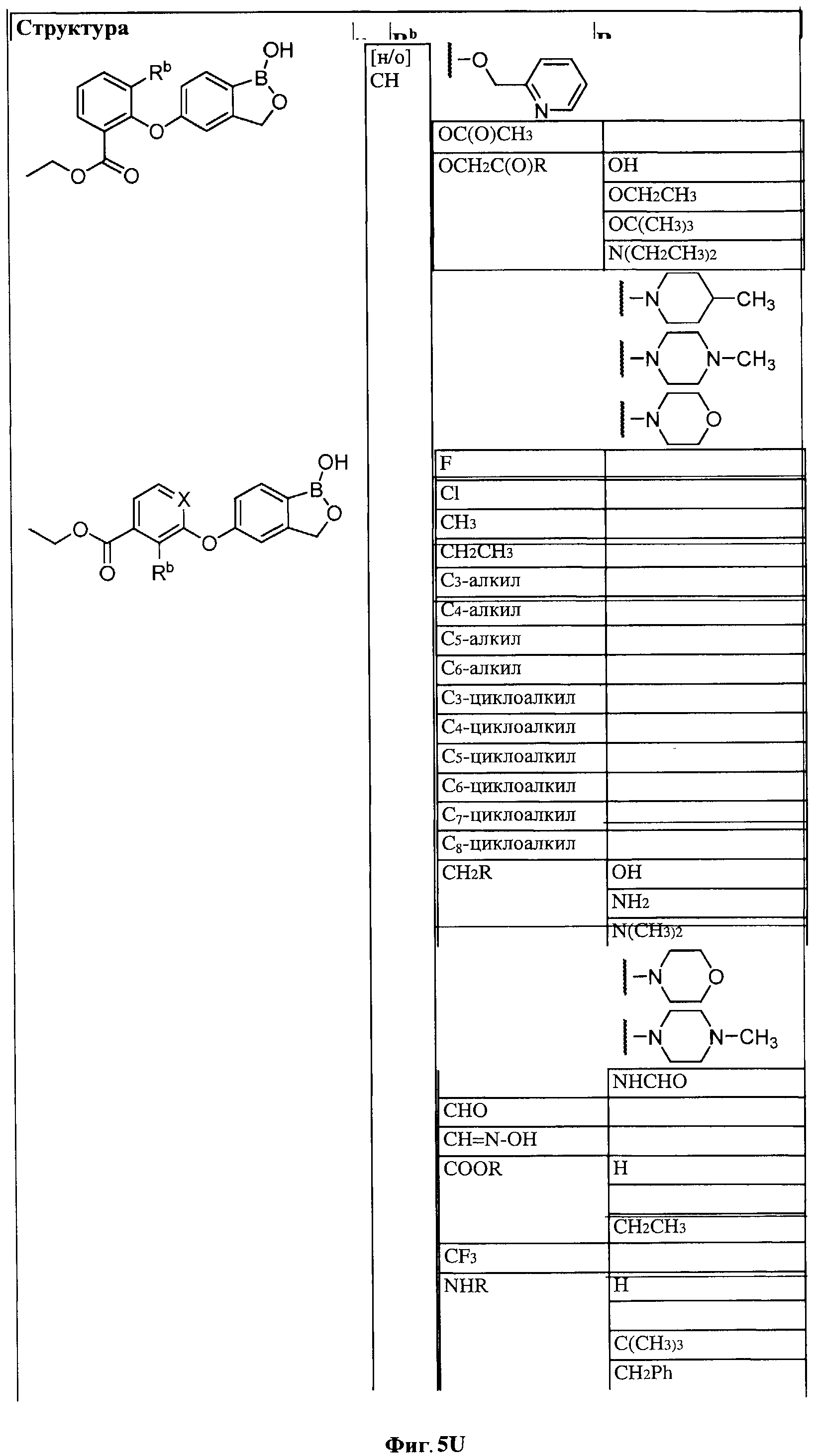
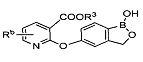
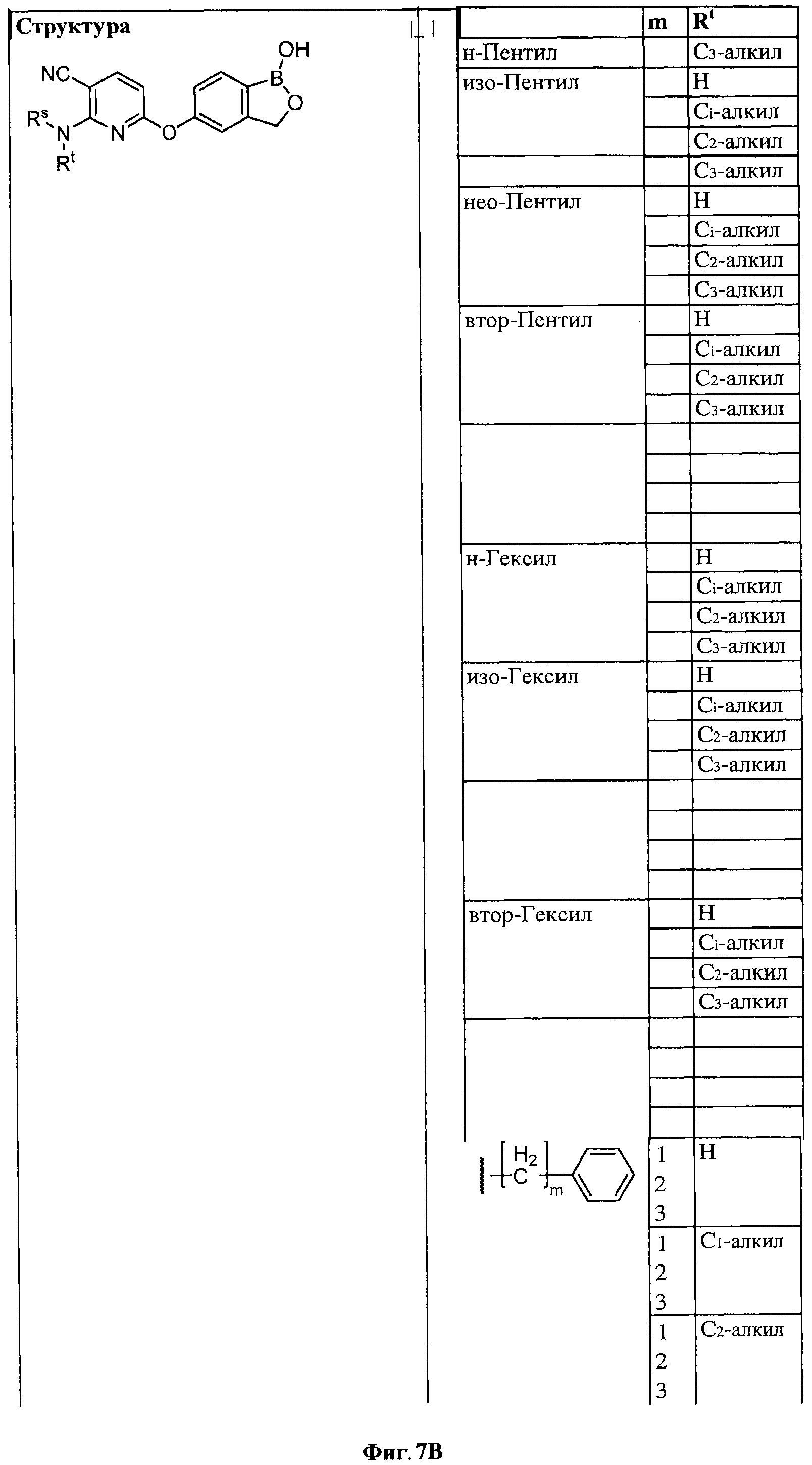
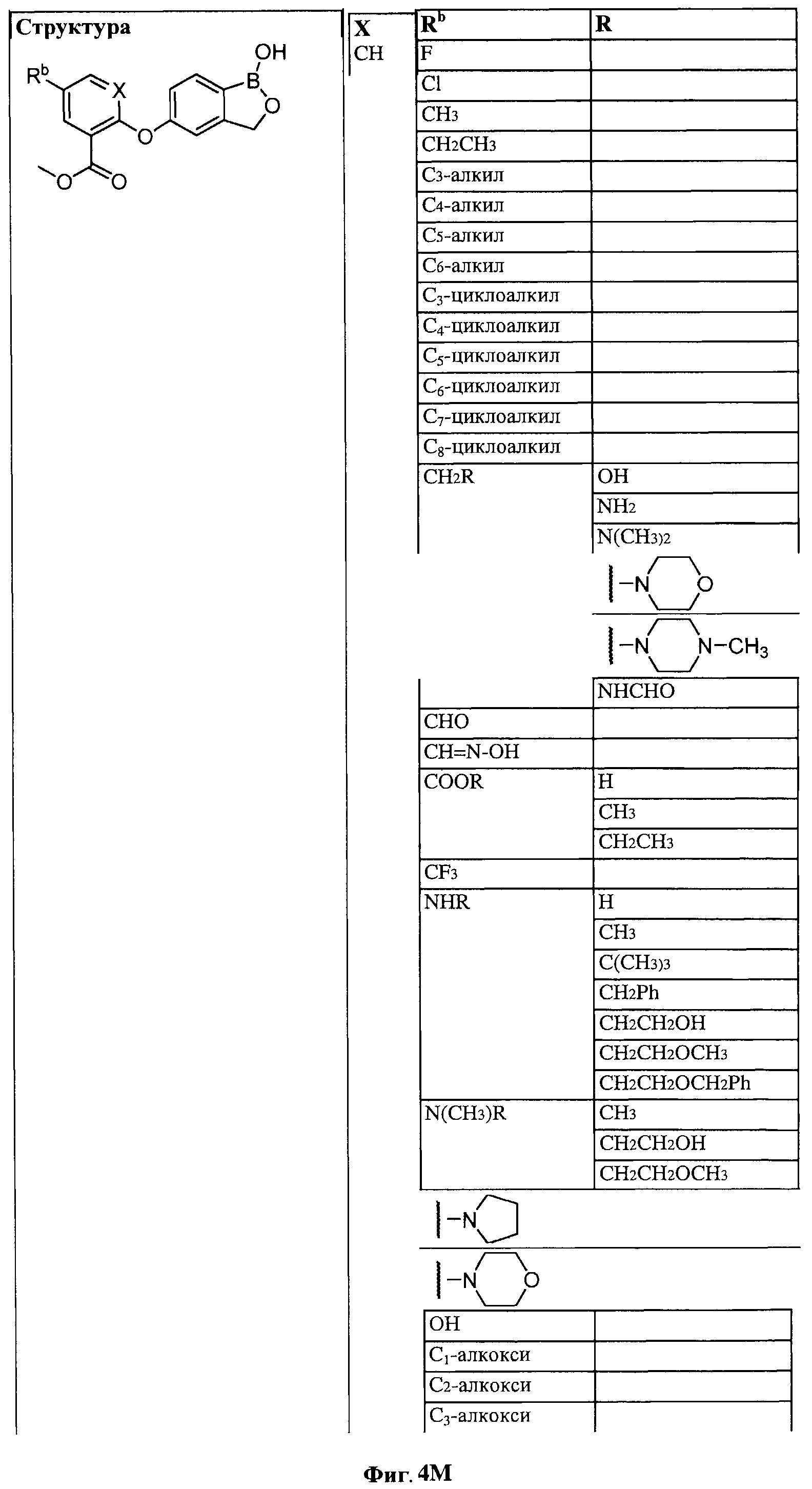
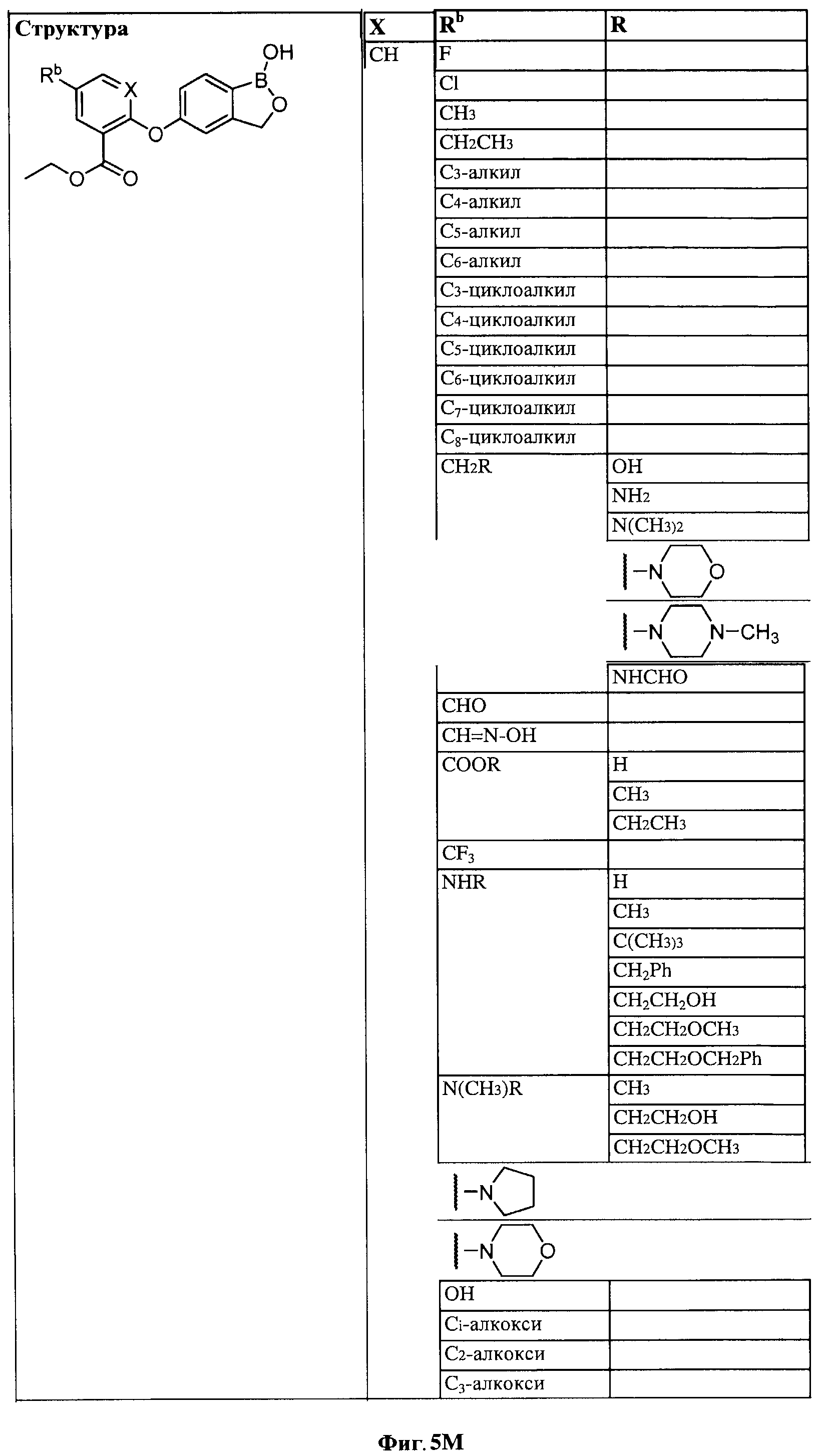
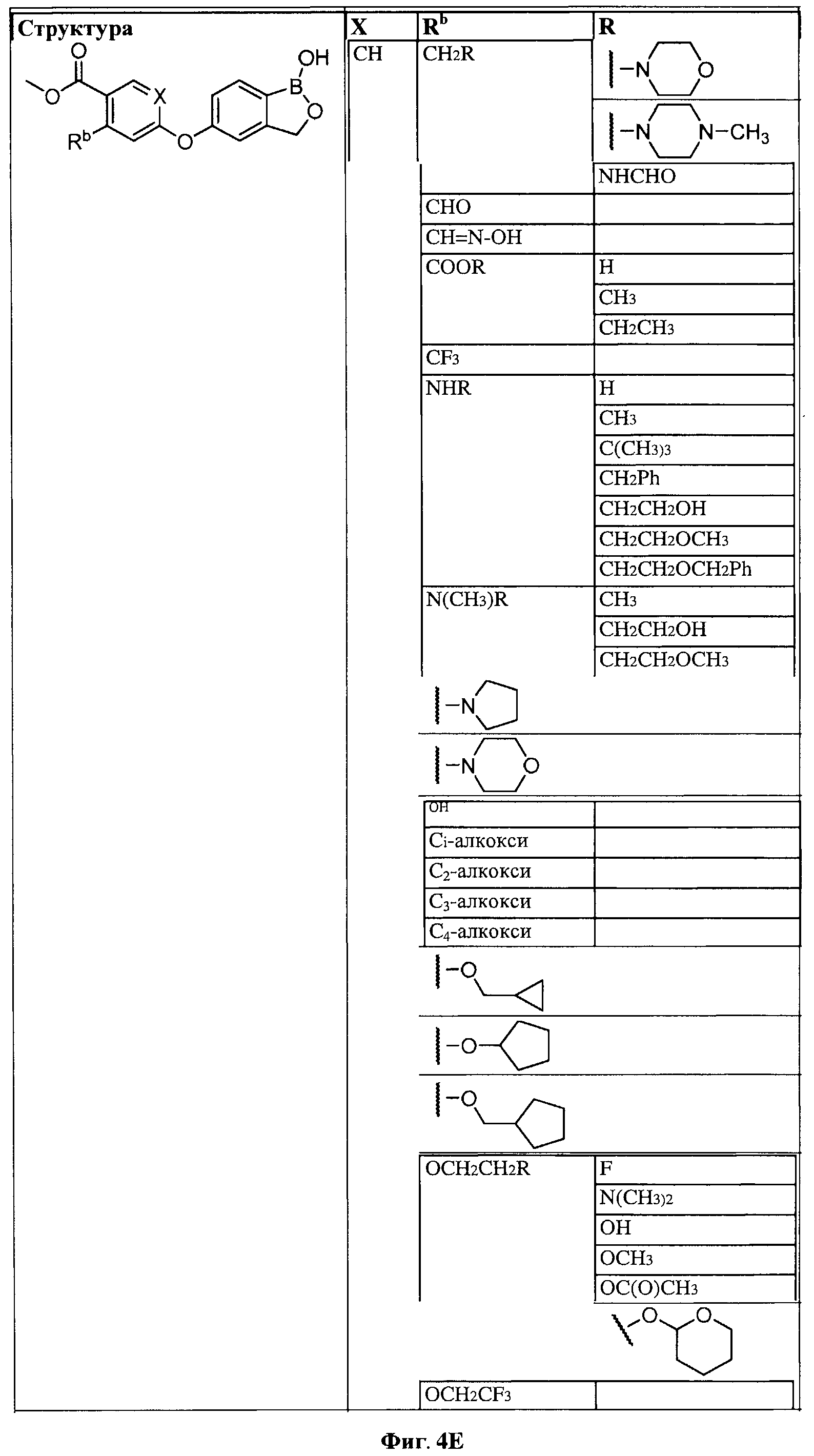
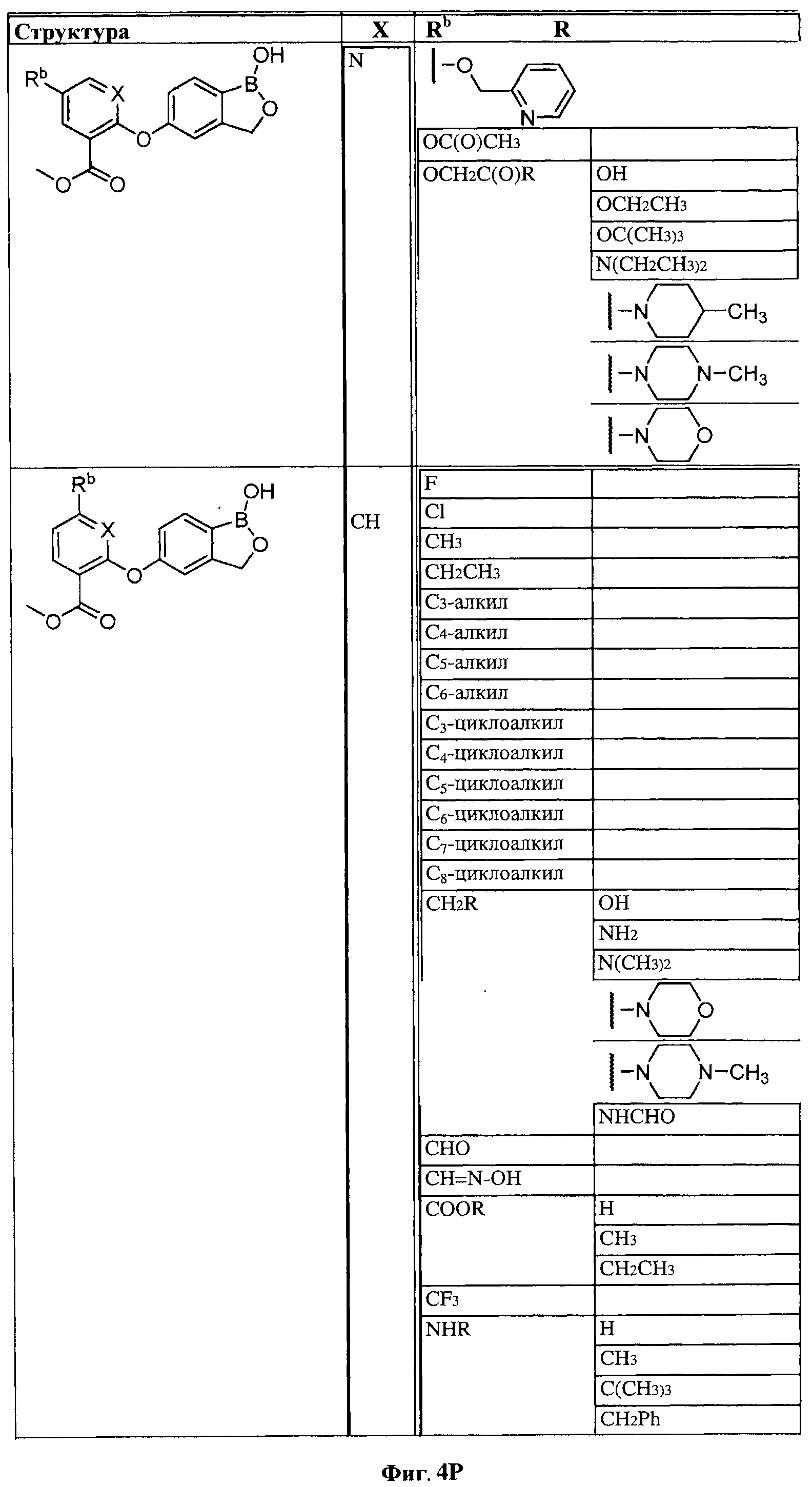
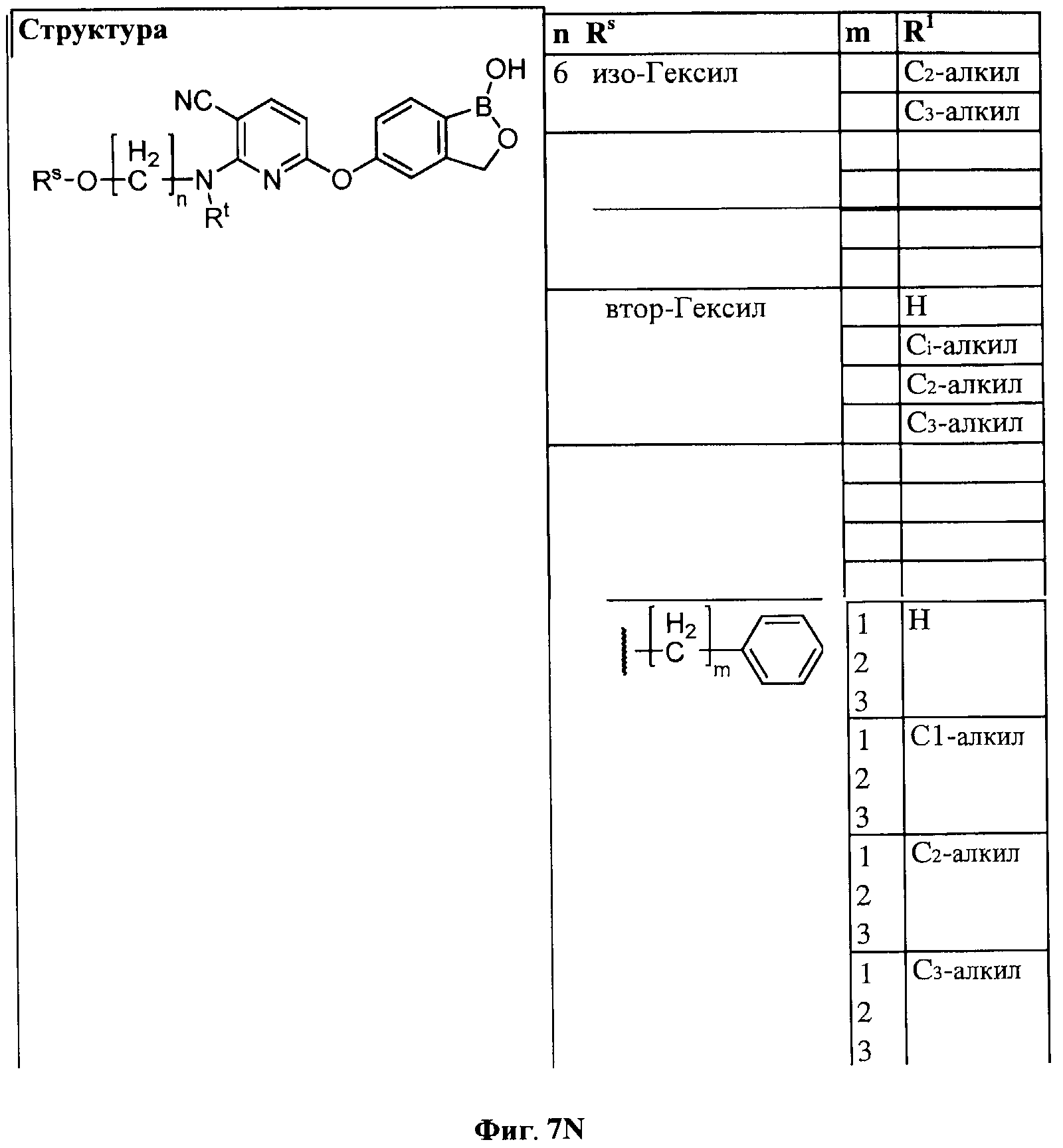
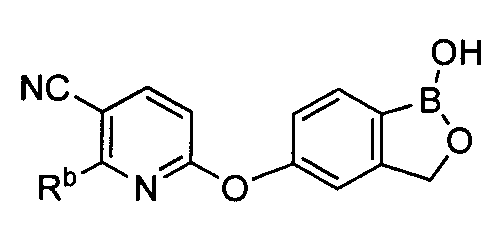
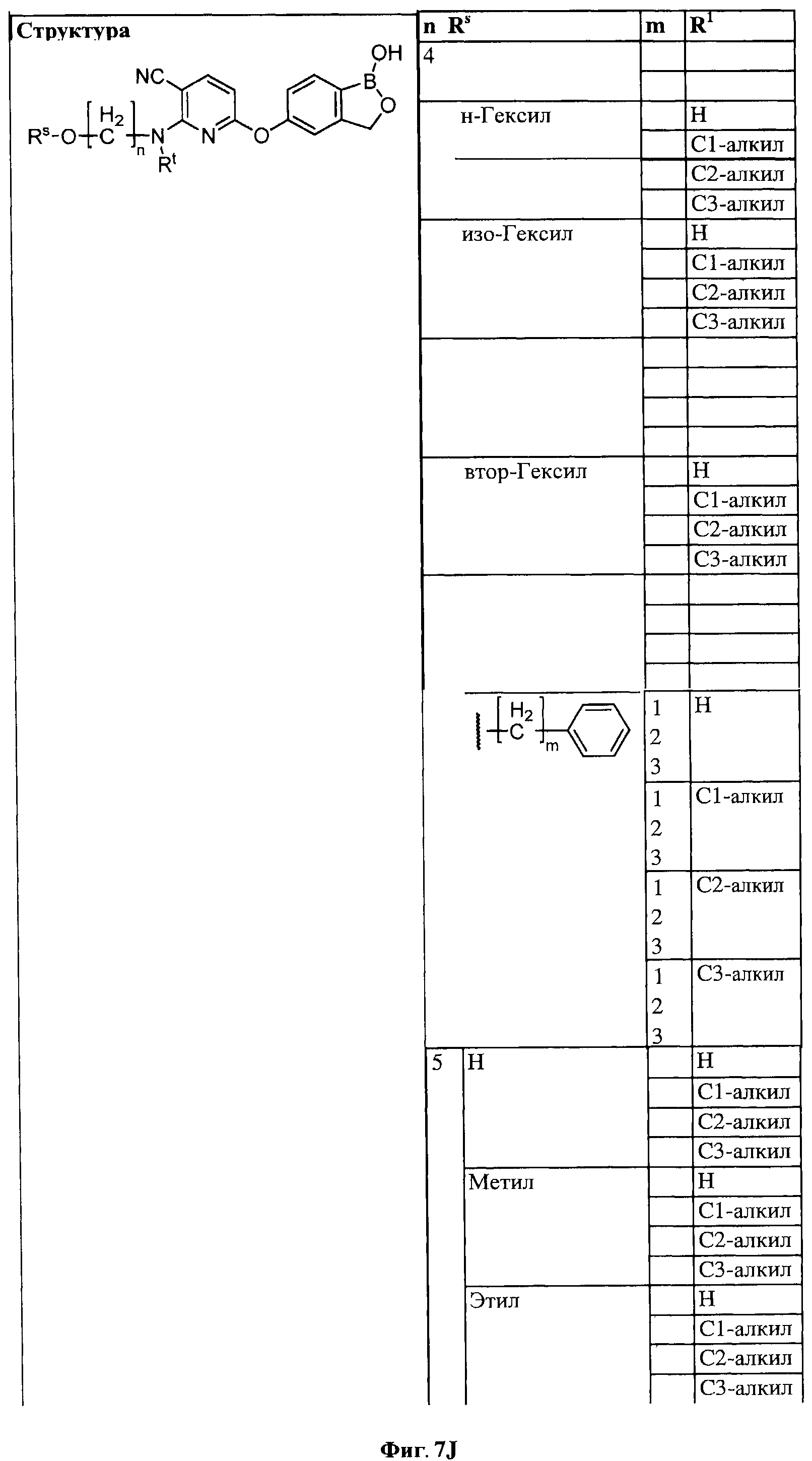
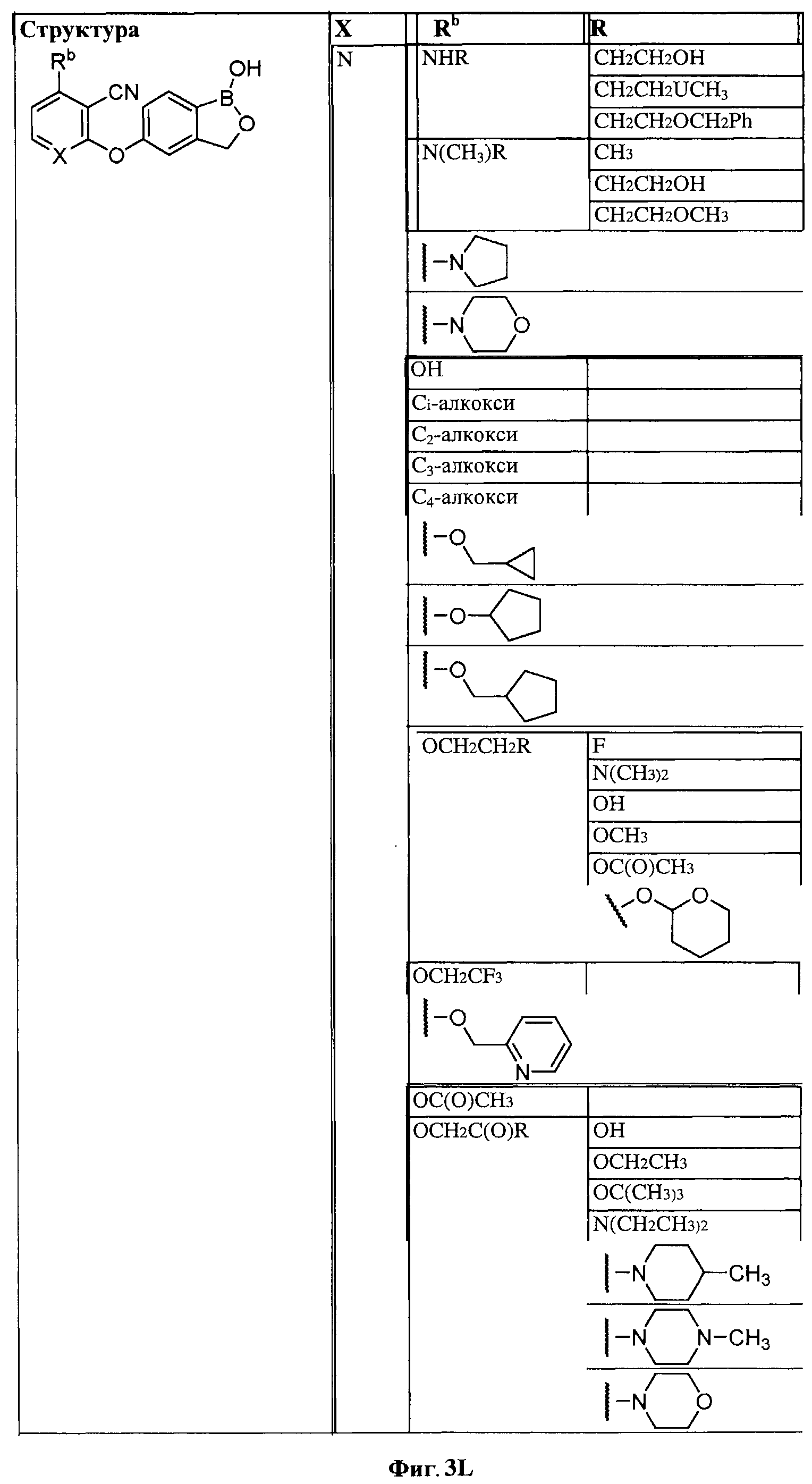
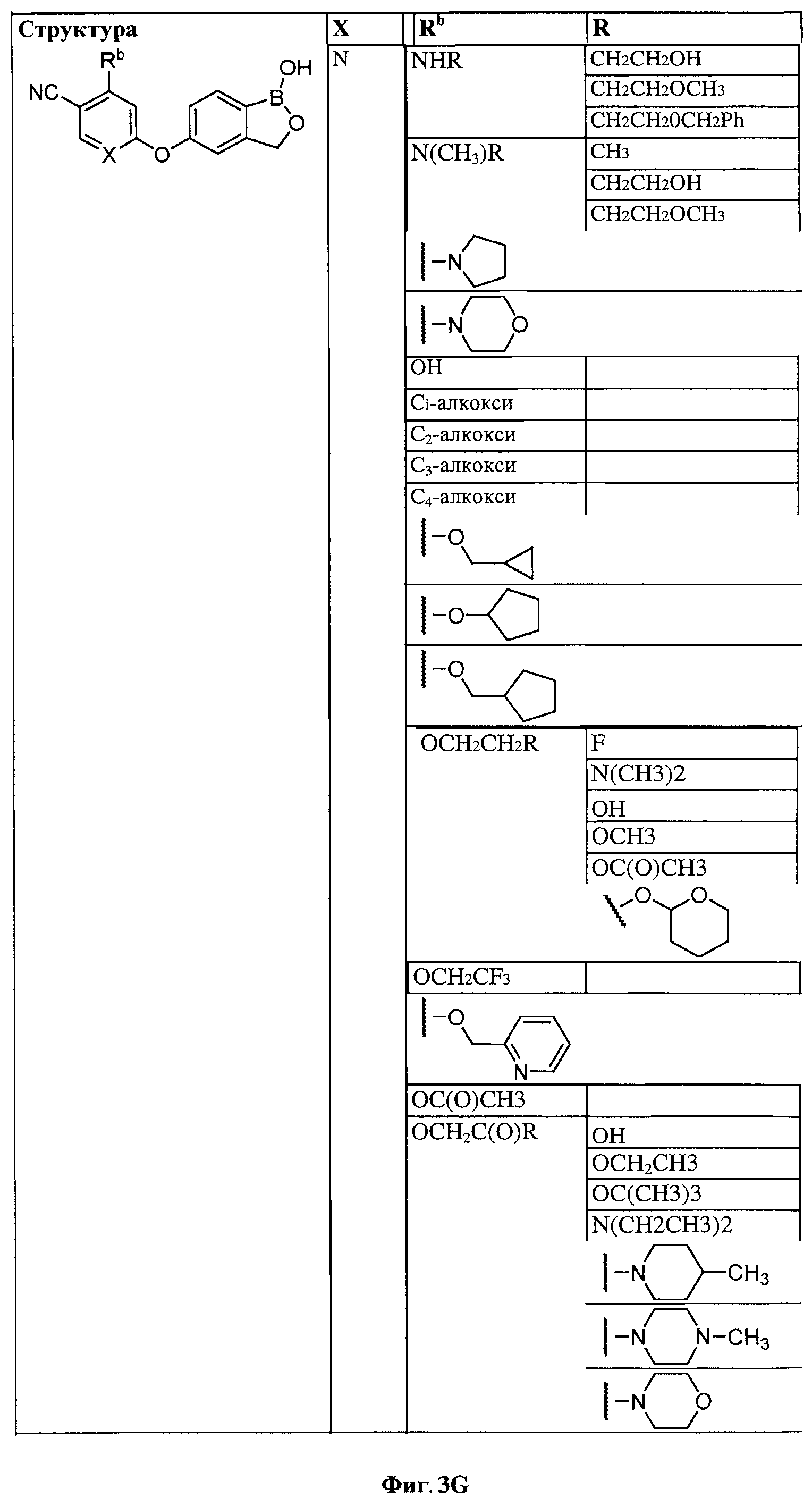
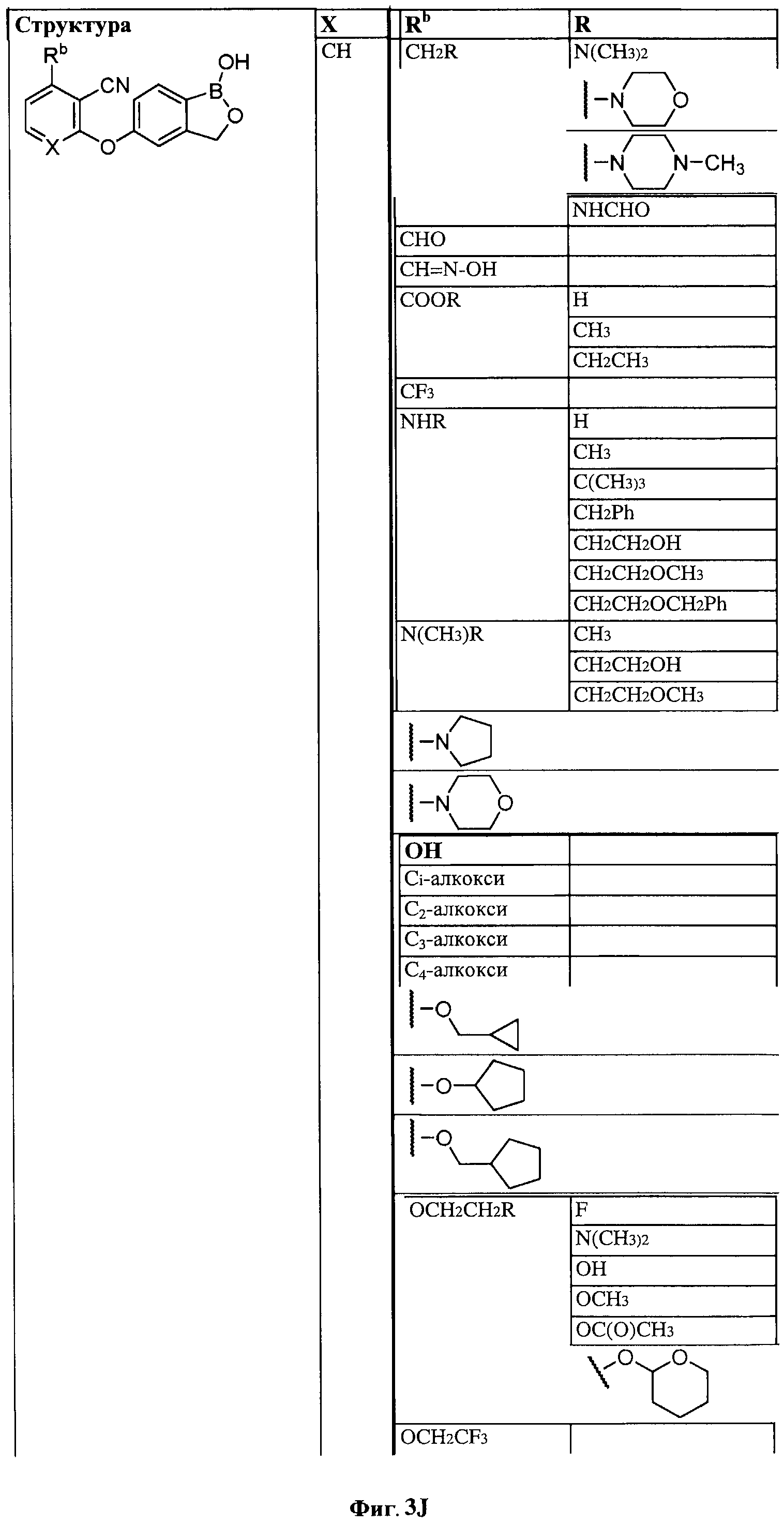
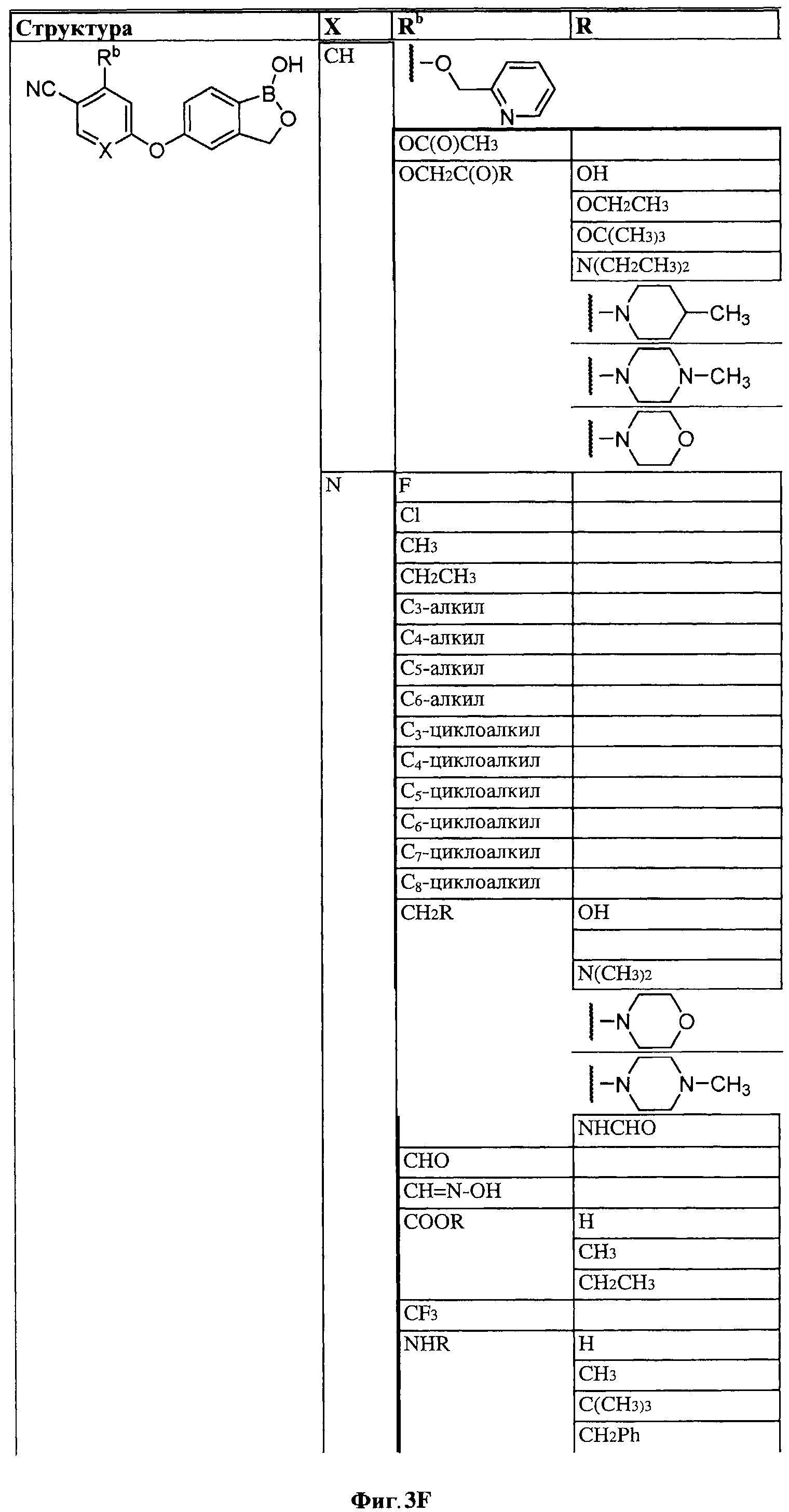
[0028] На ФИГ.1 показаны примеры соединений согласно настоящему изобретению.
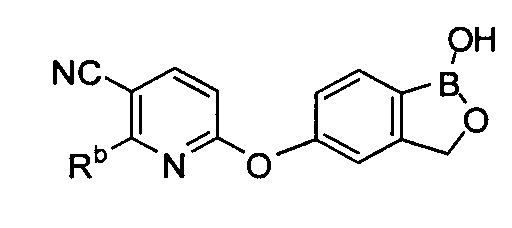
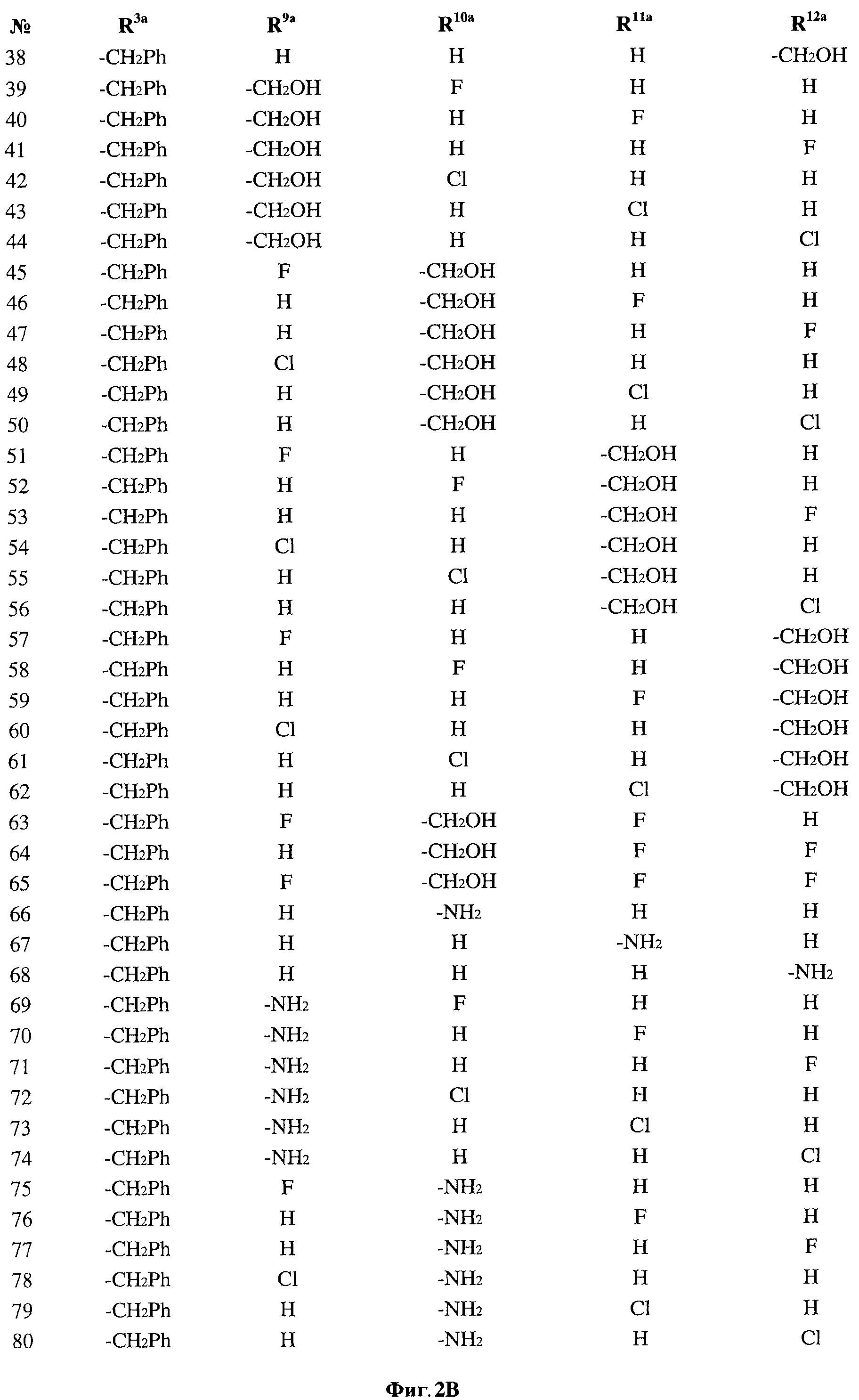
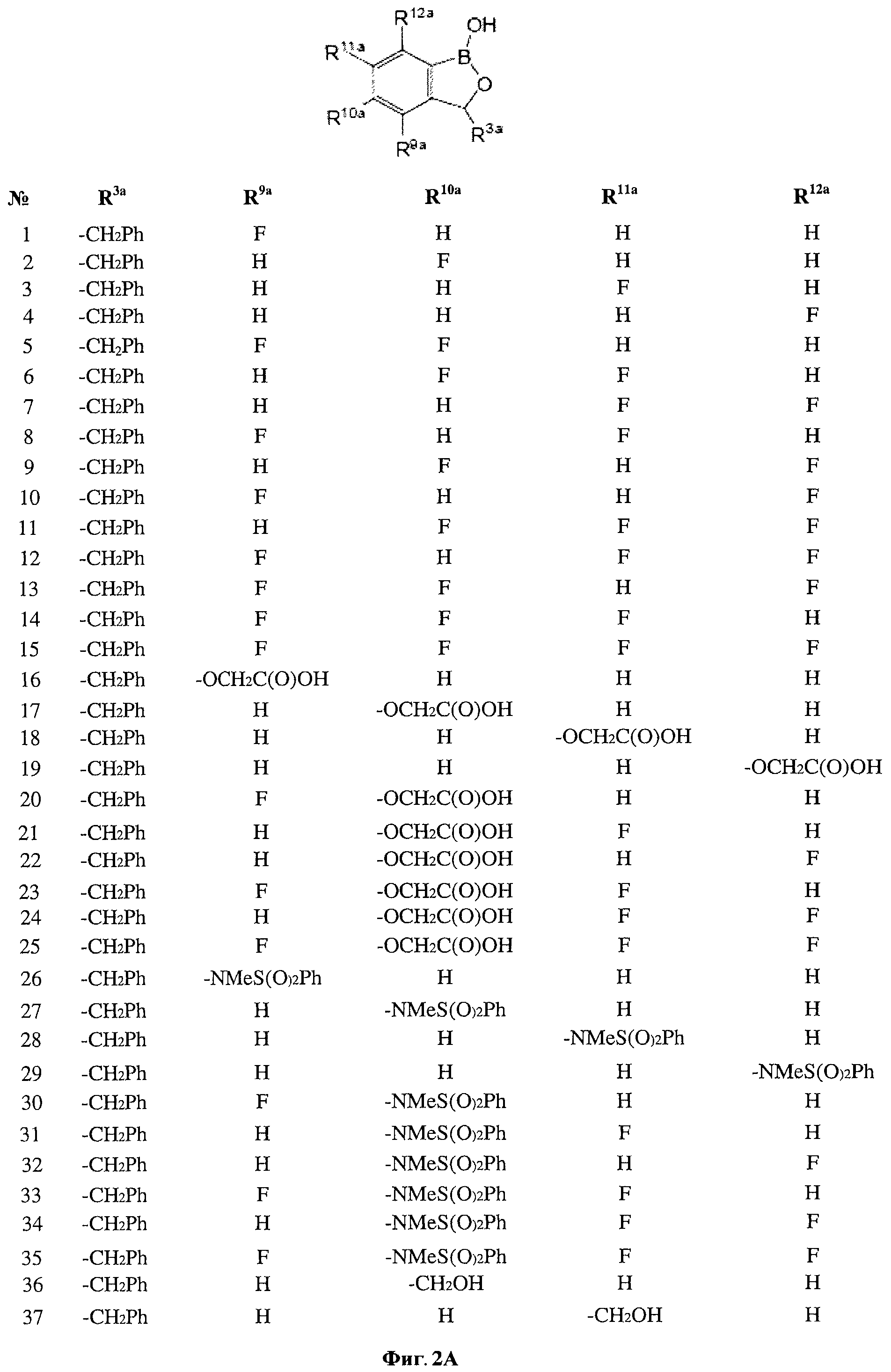
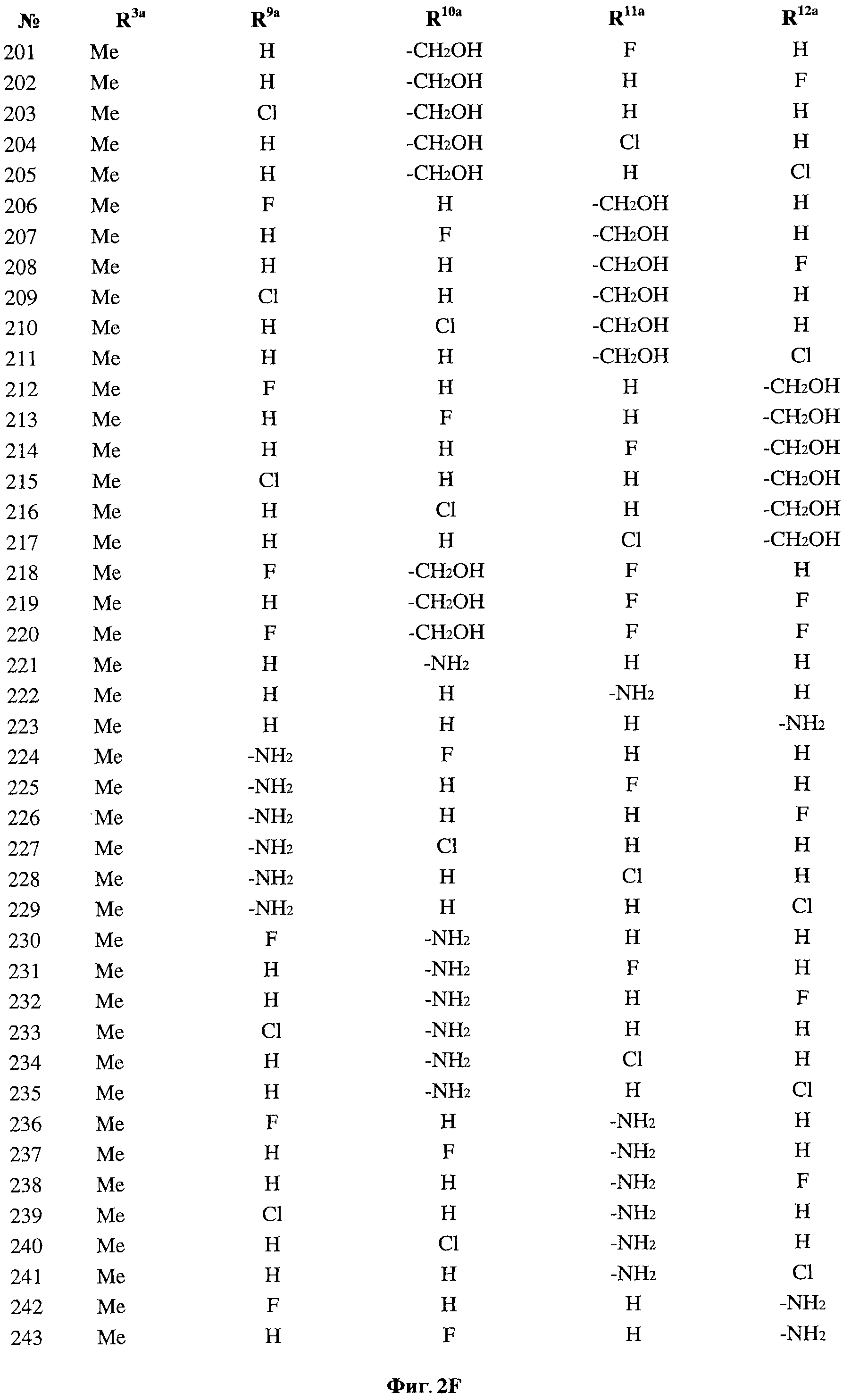
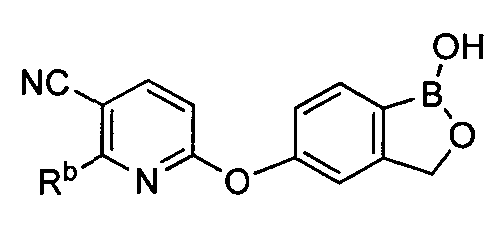
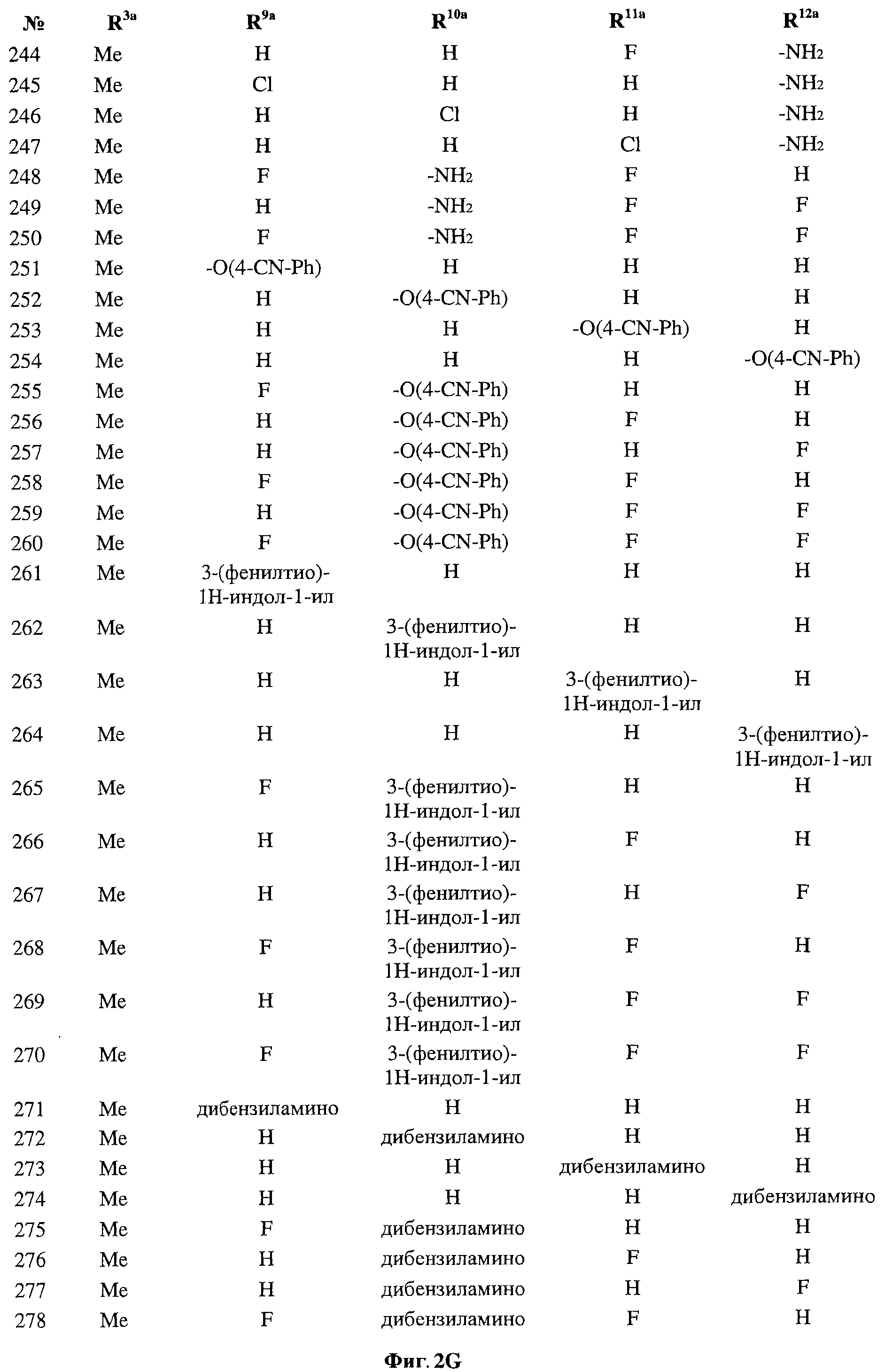
[0029] На ФИГ.2 показаны примеры соединений согласно настоящему изобретению.
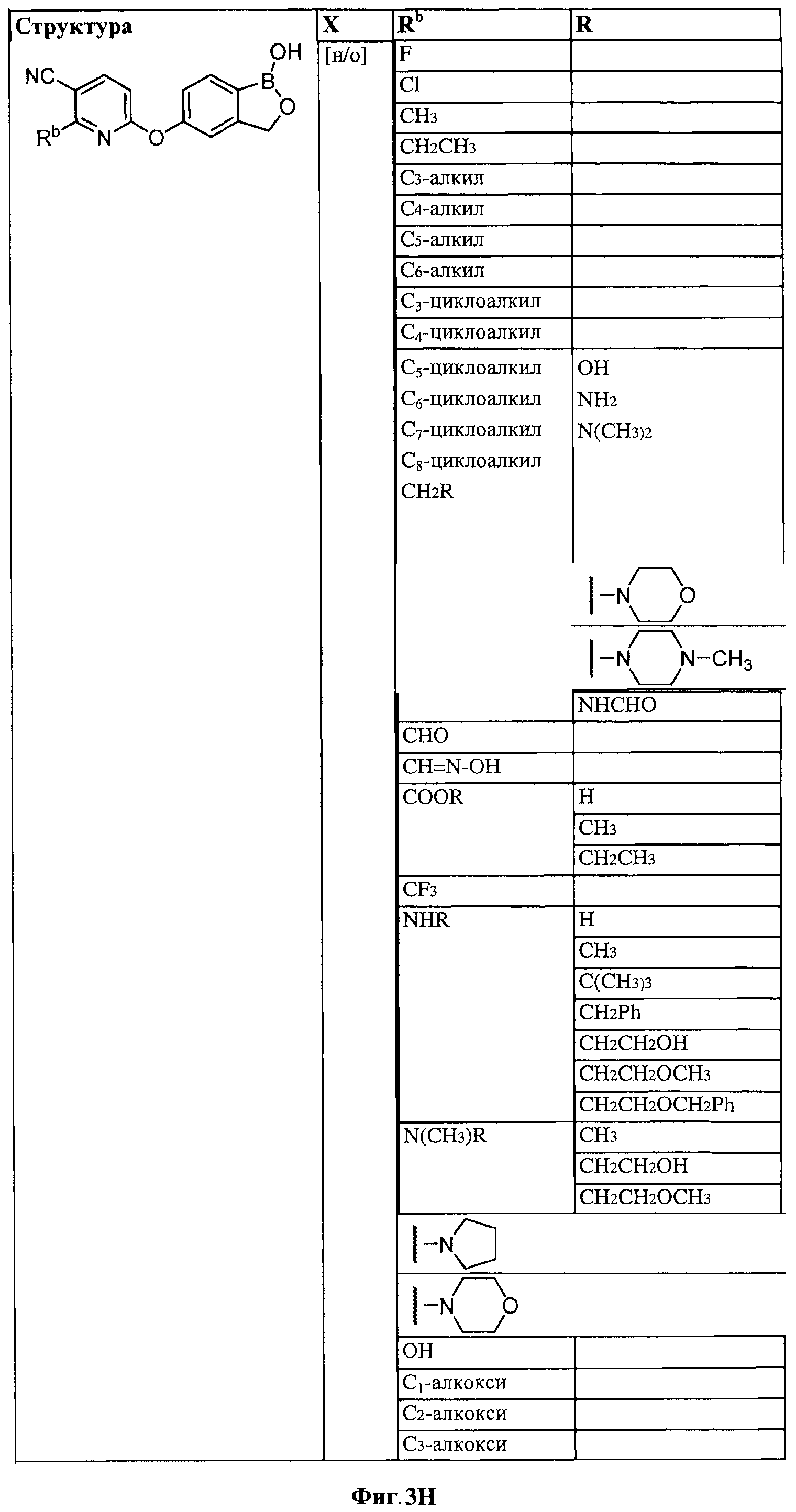
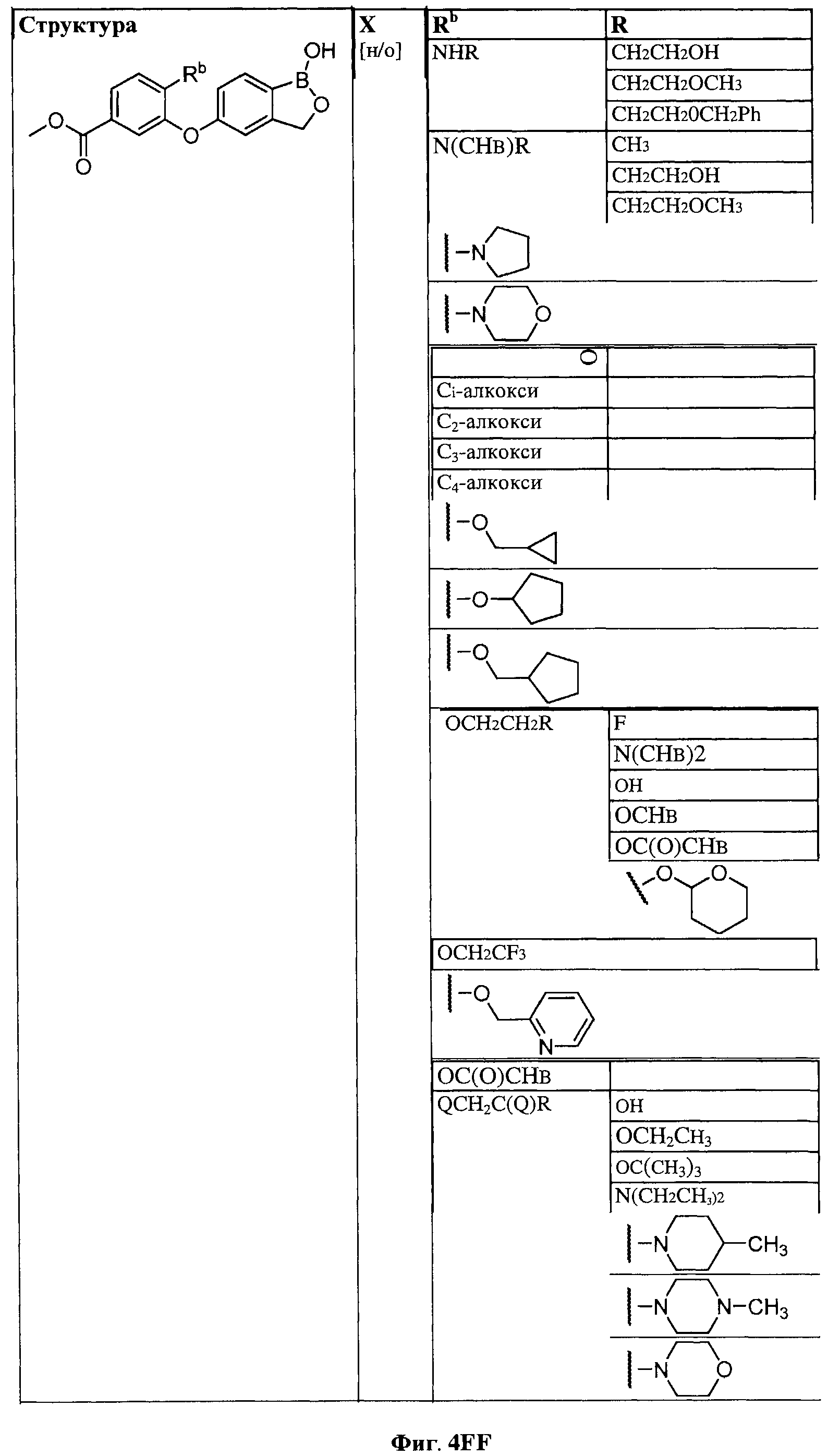
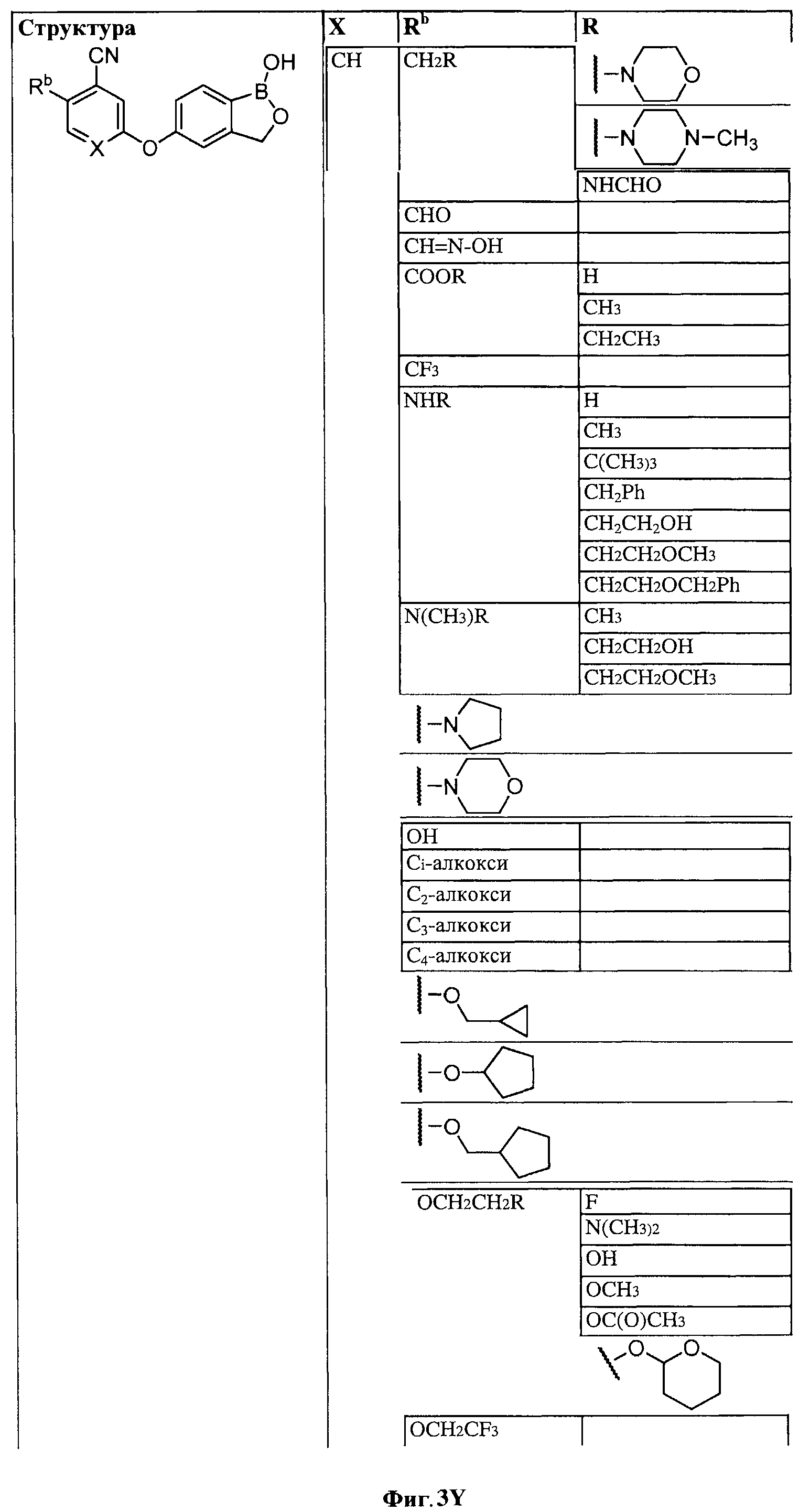
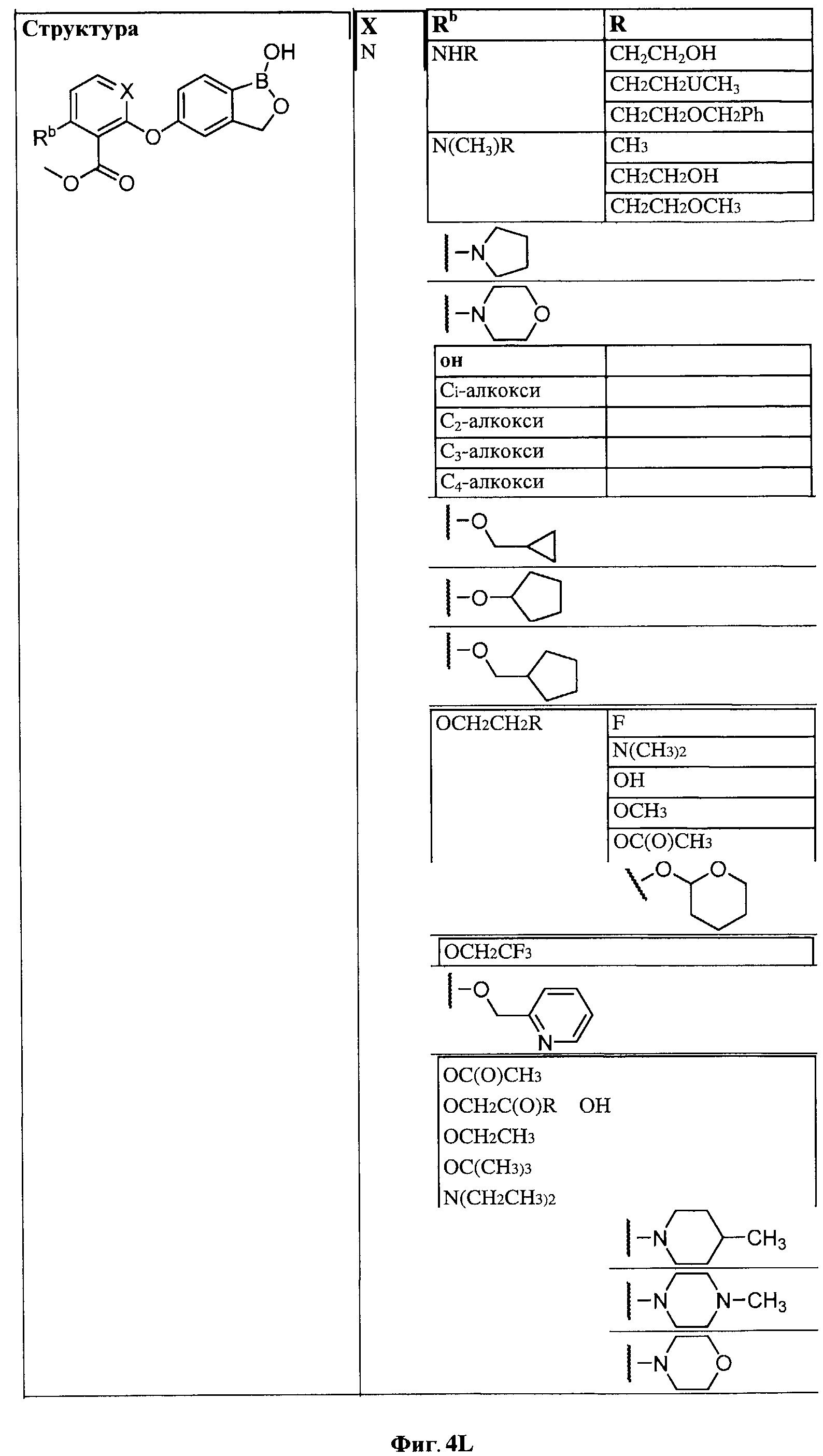
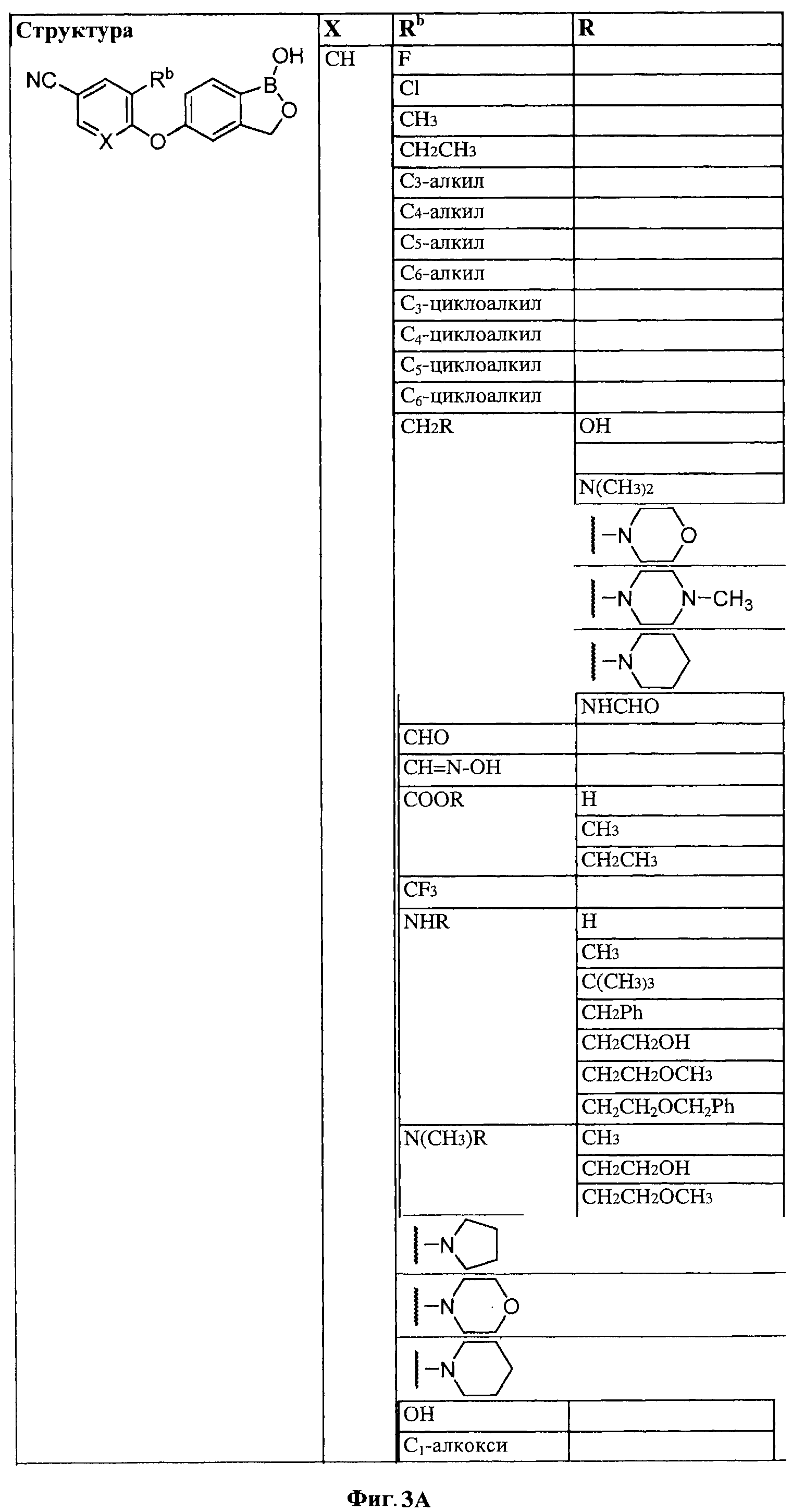
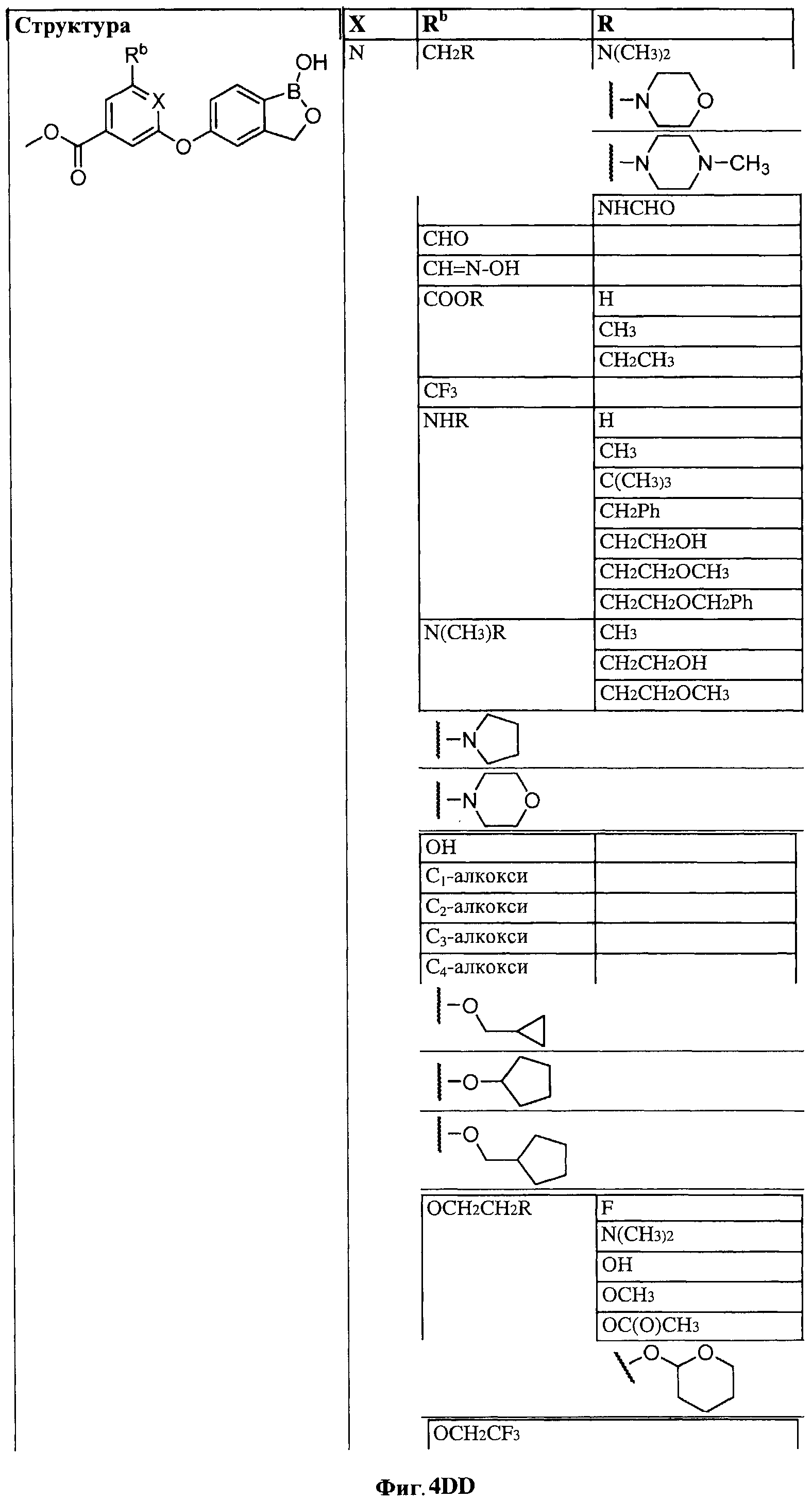
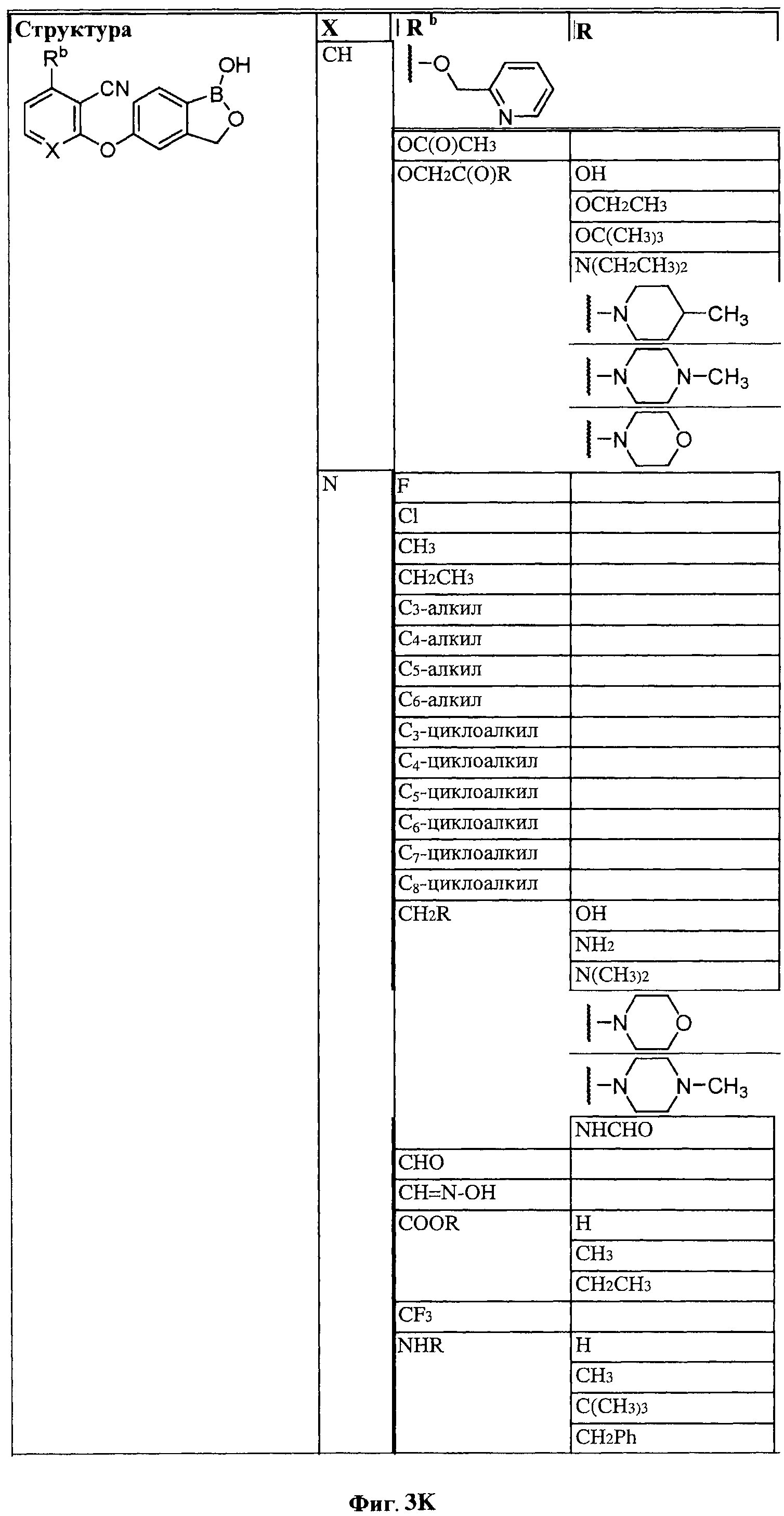
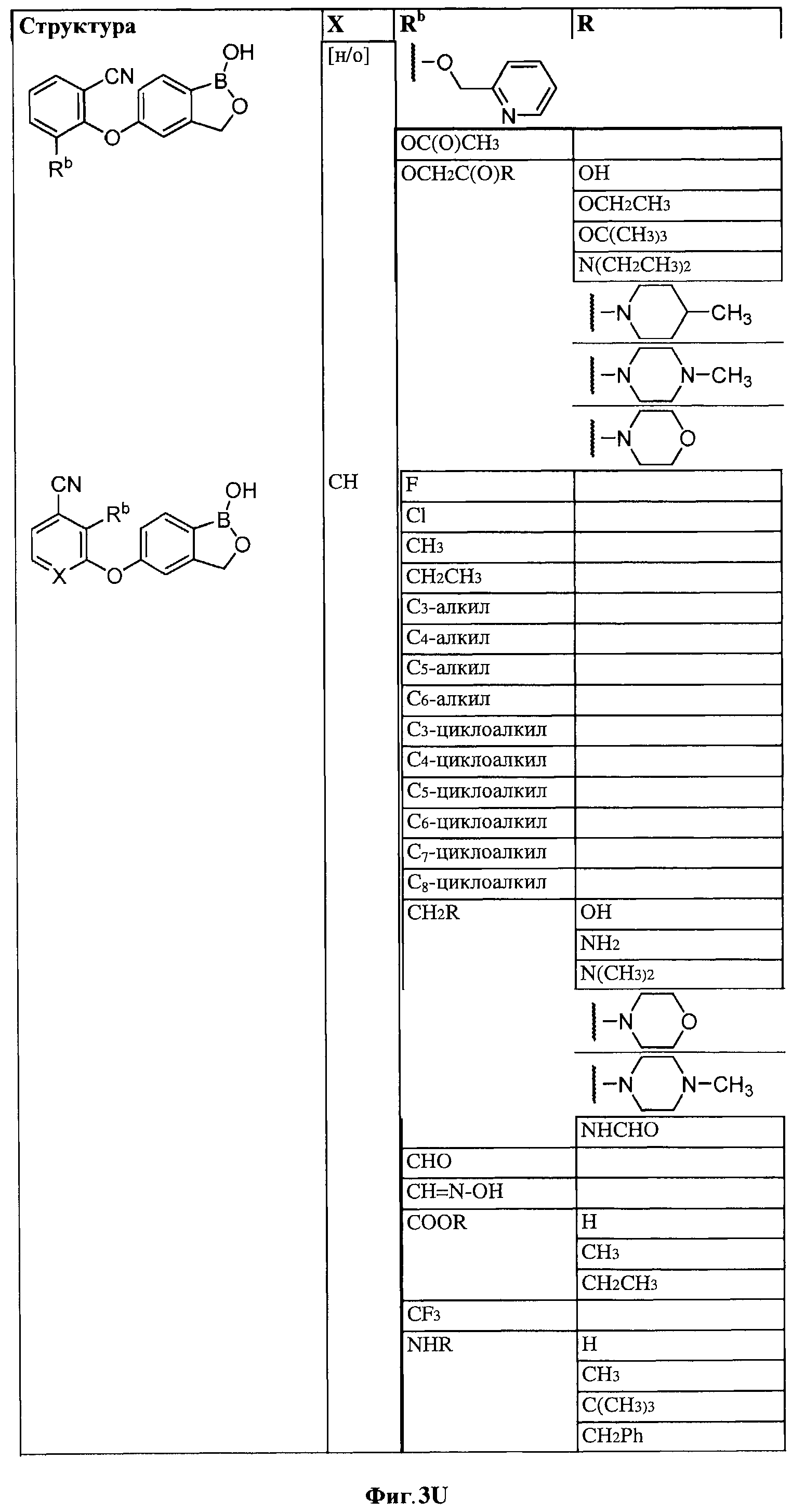
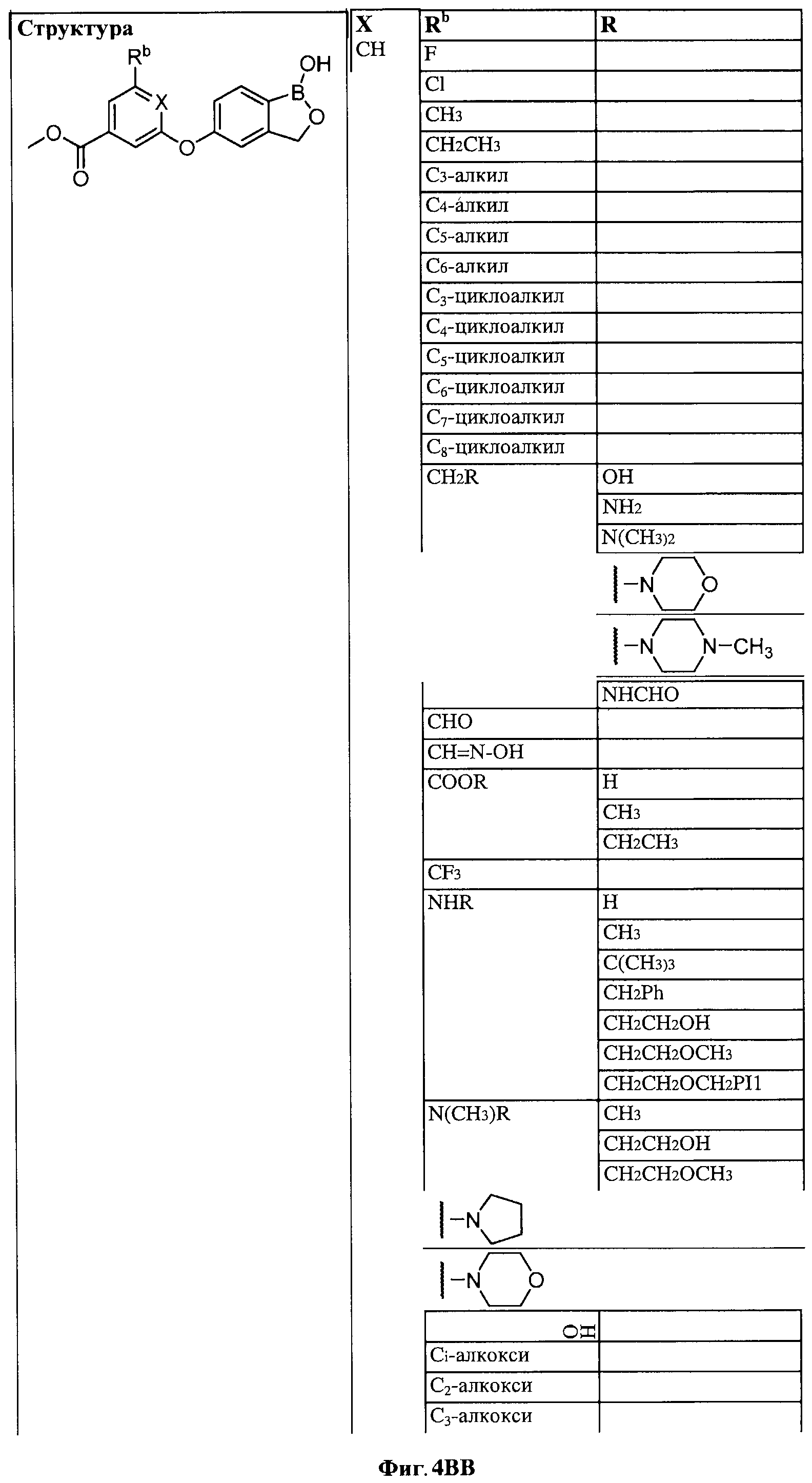
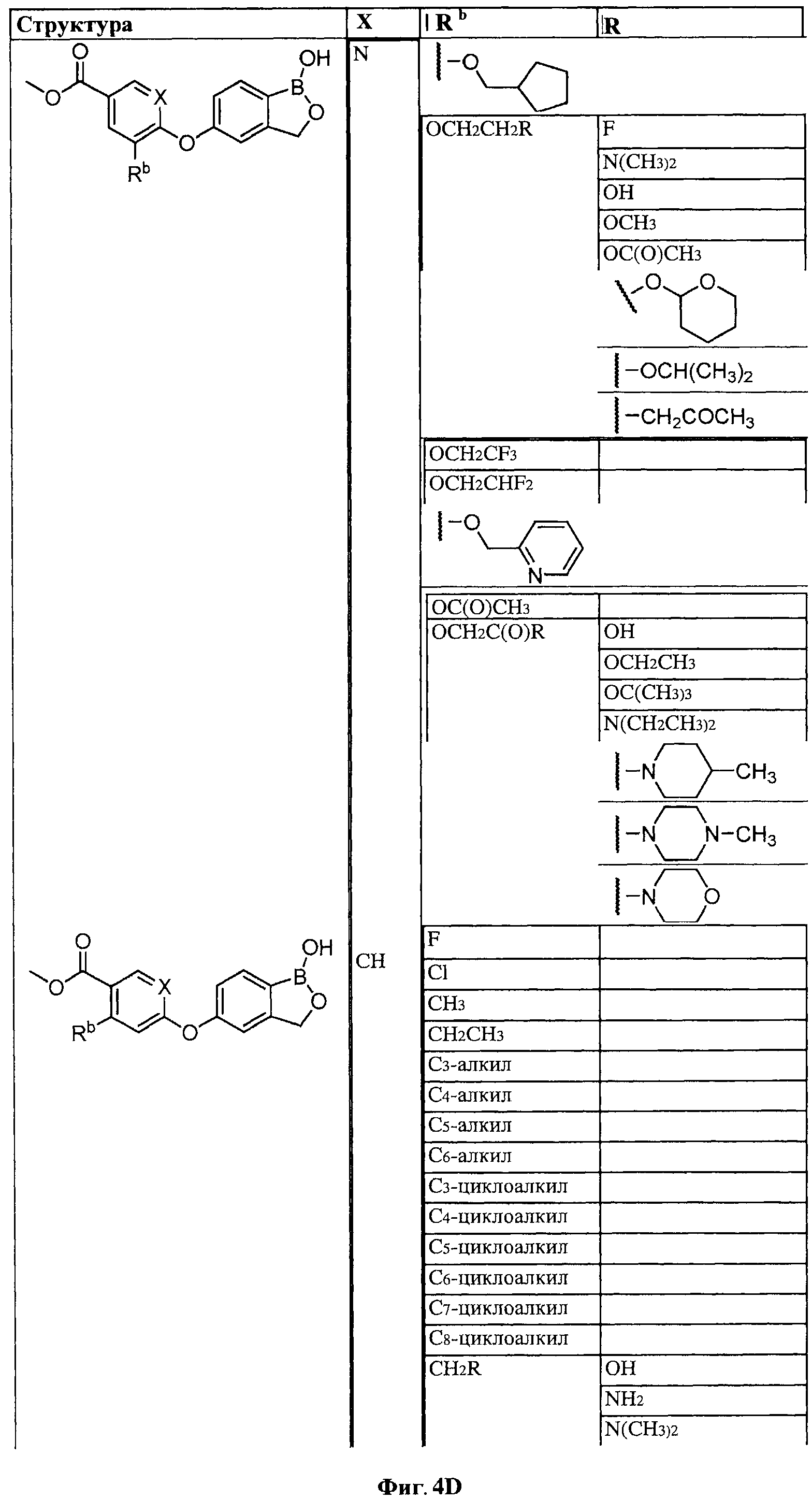
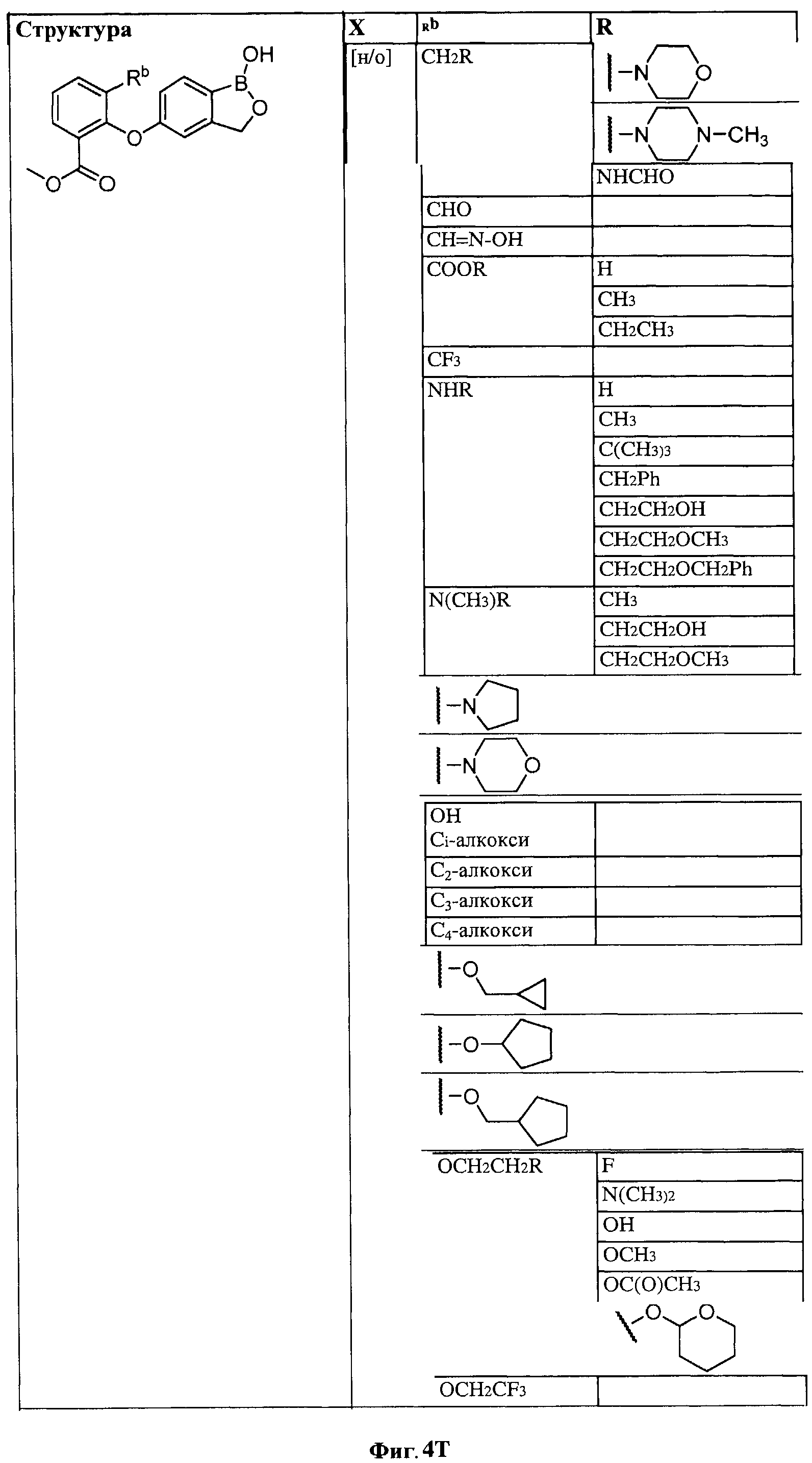
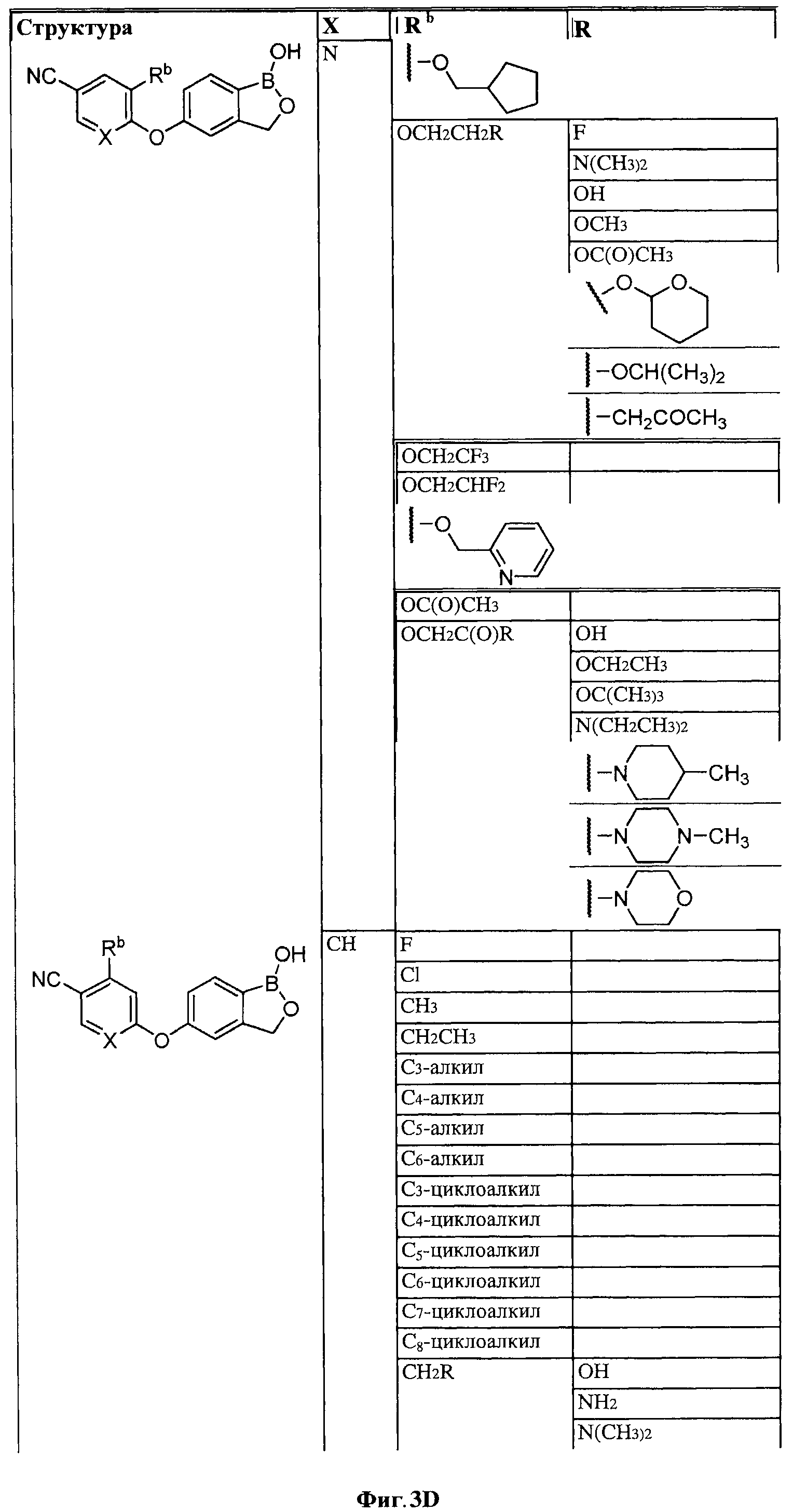
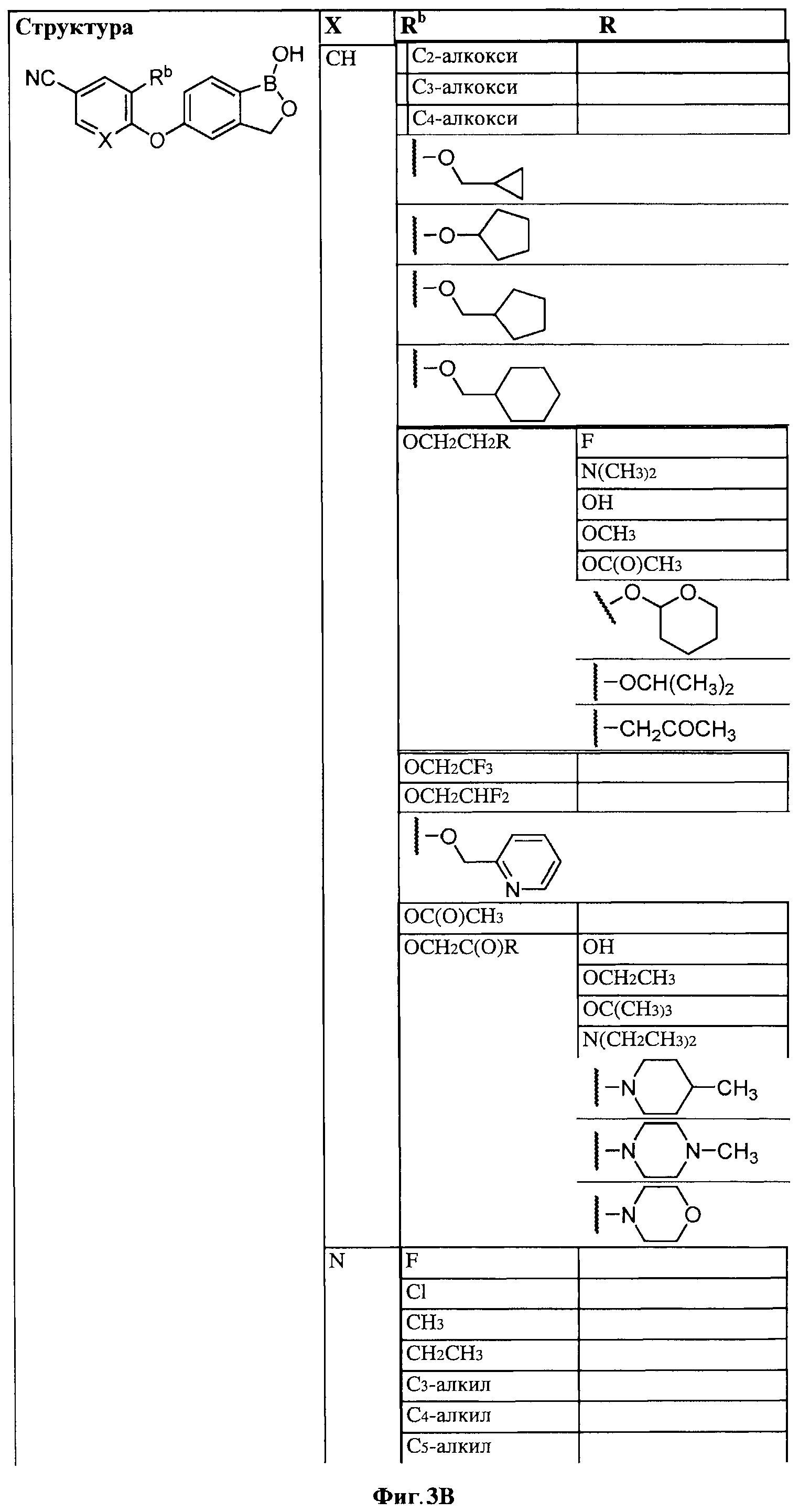
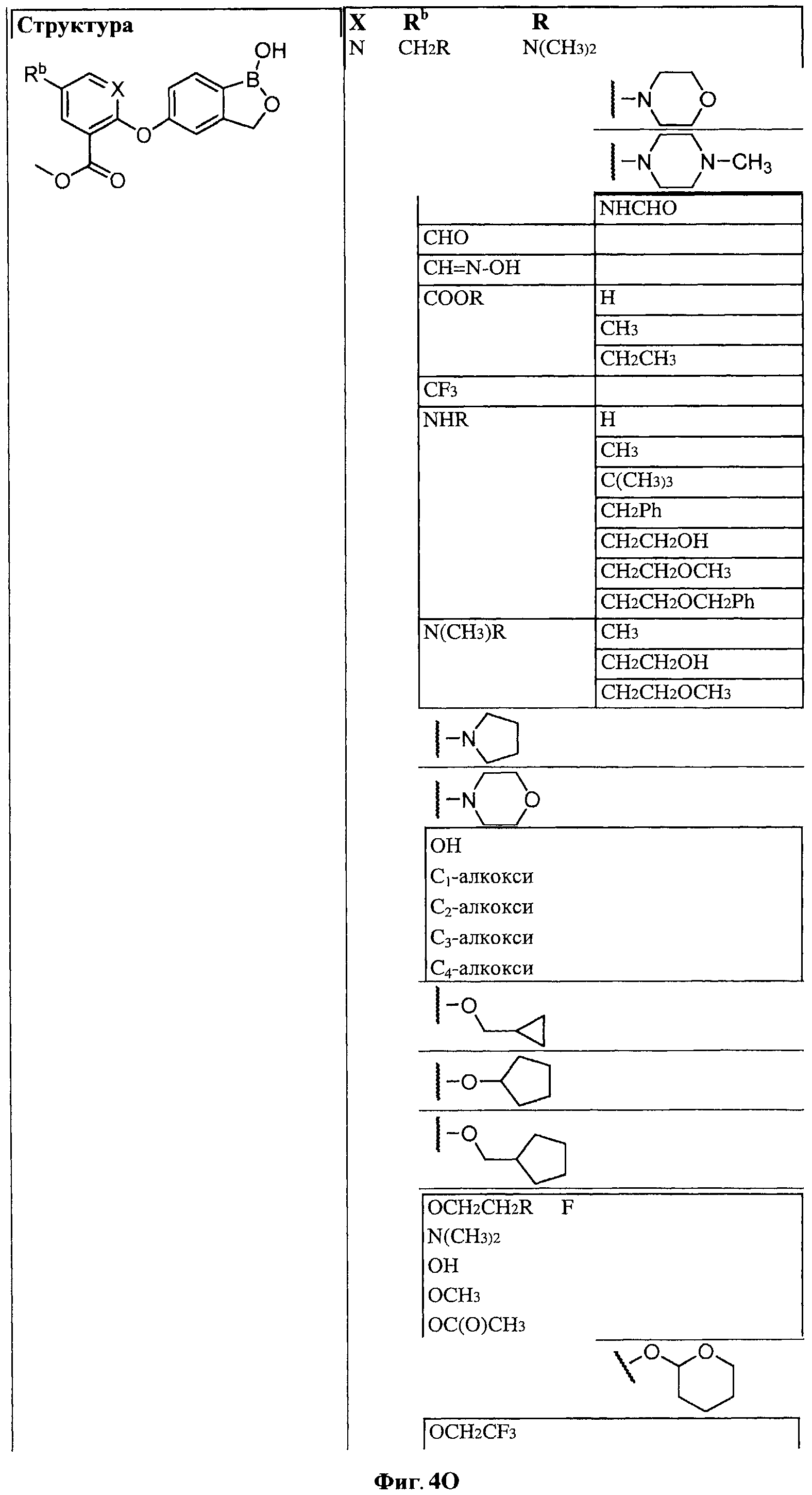
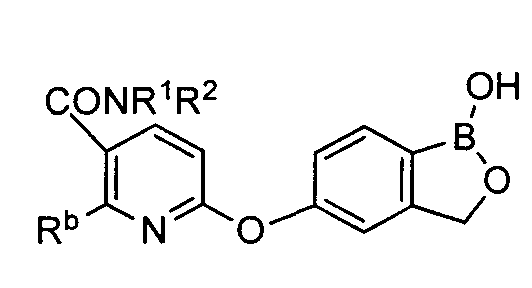
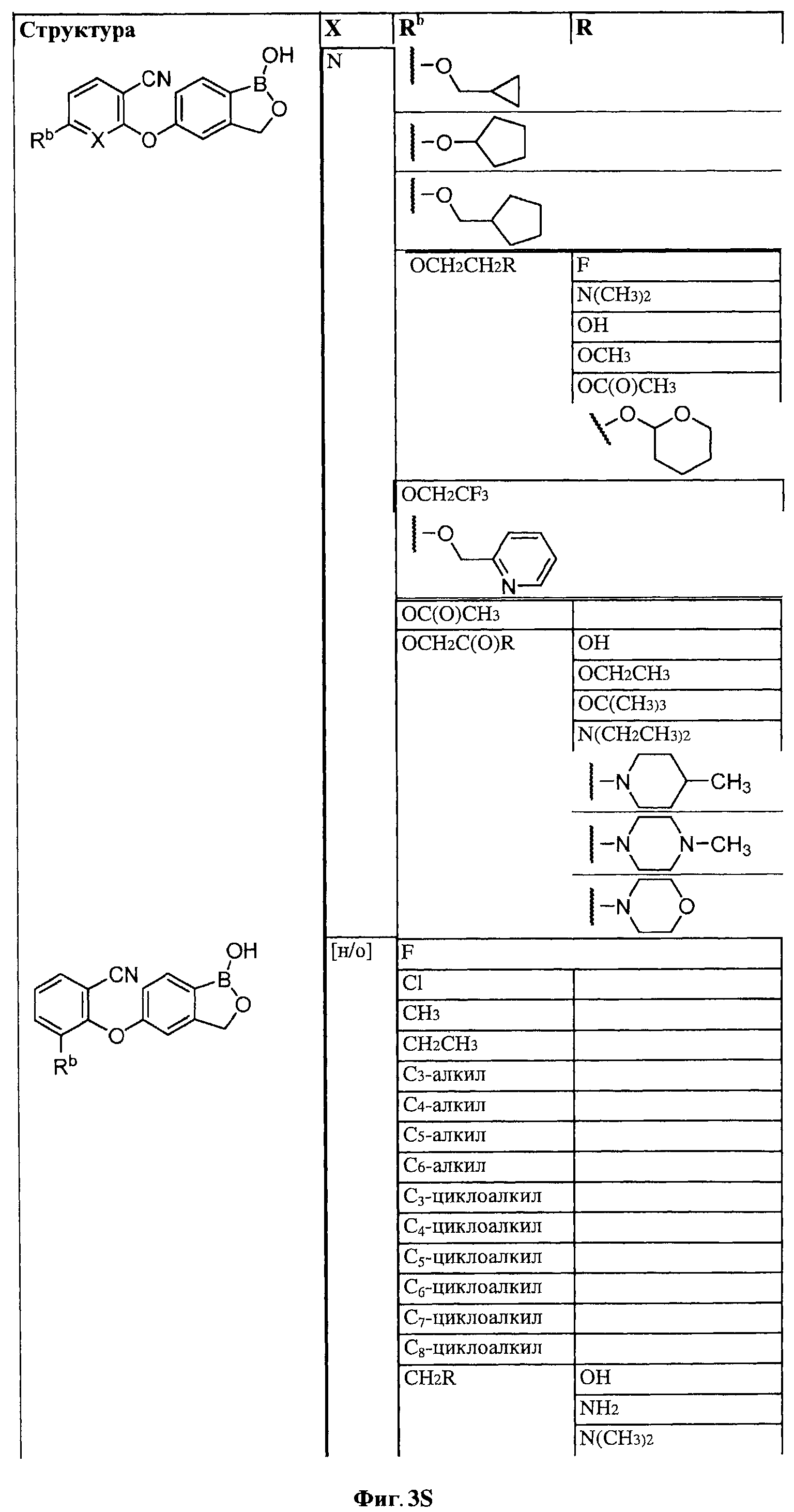
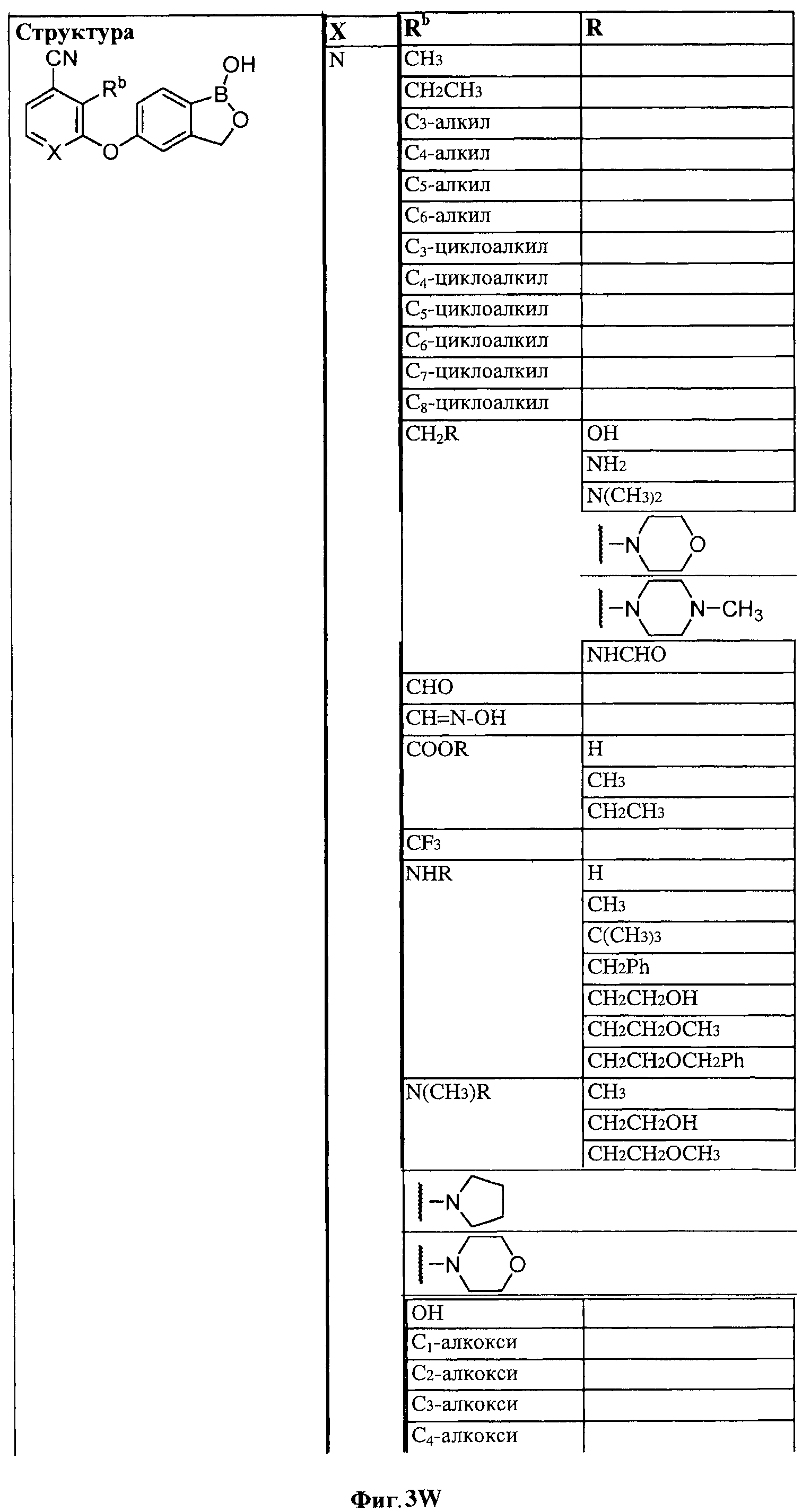
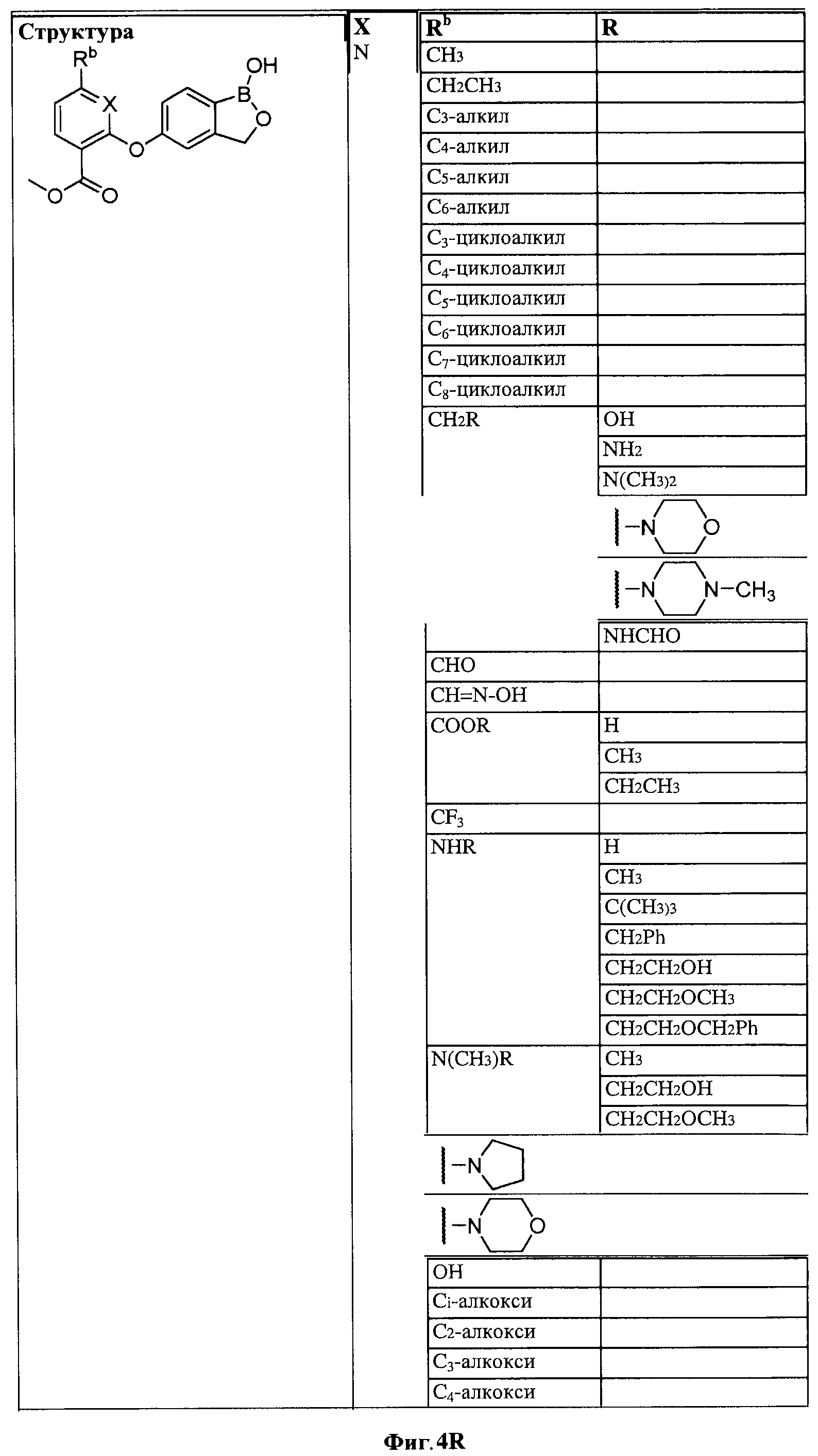
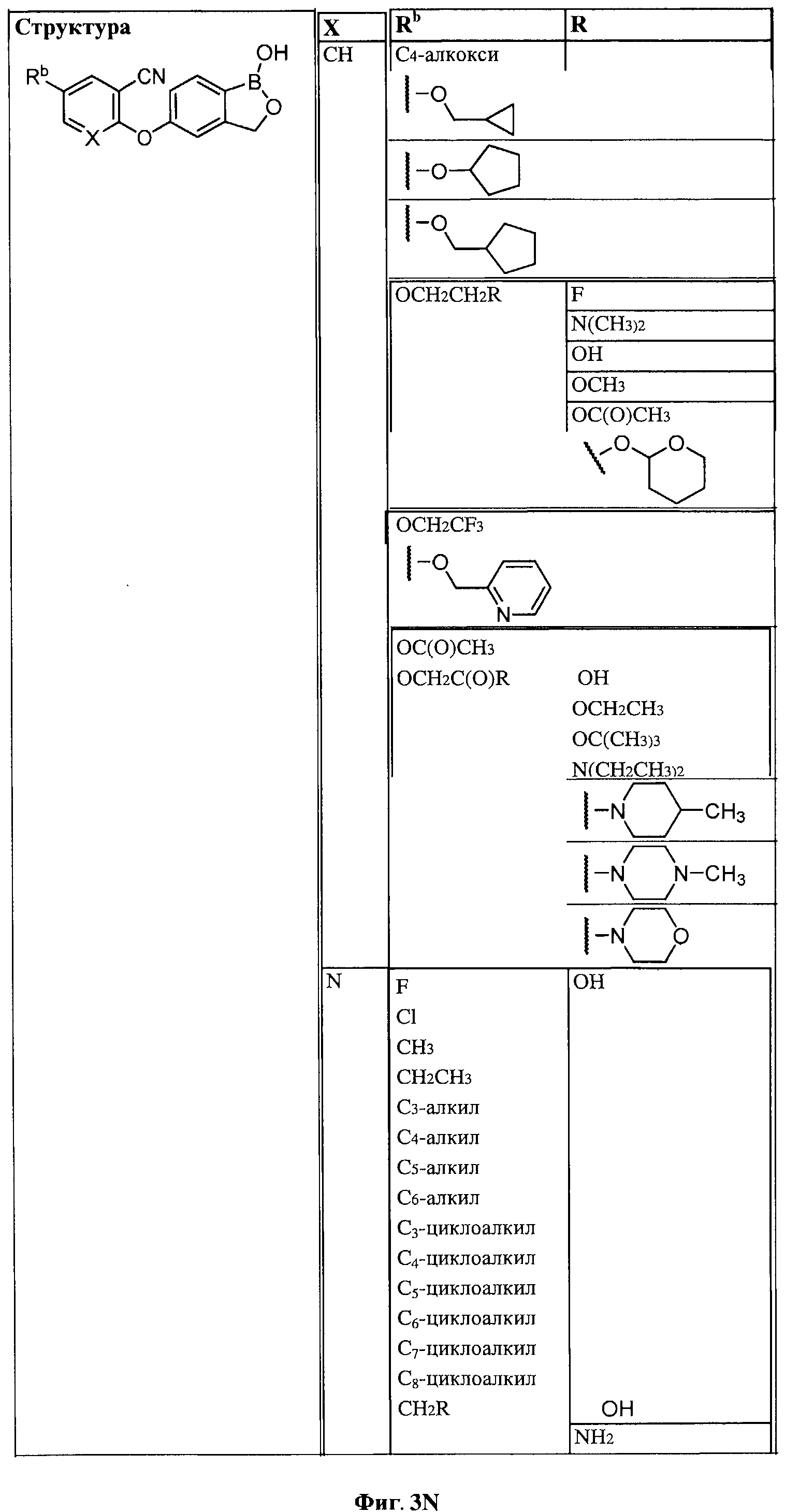
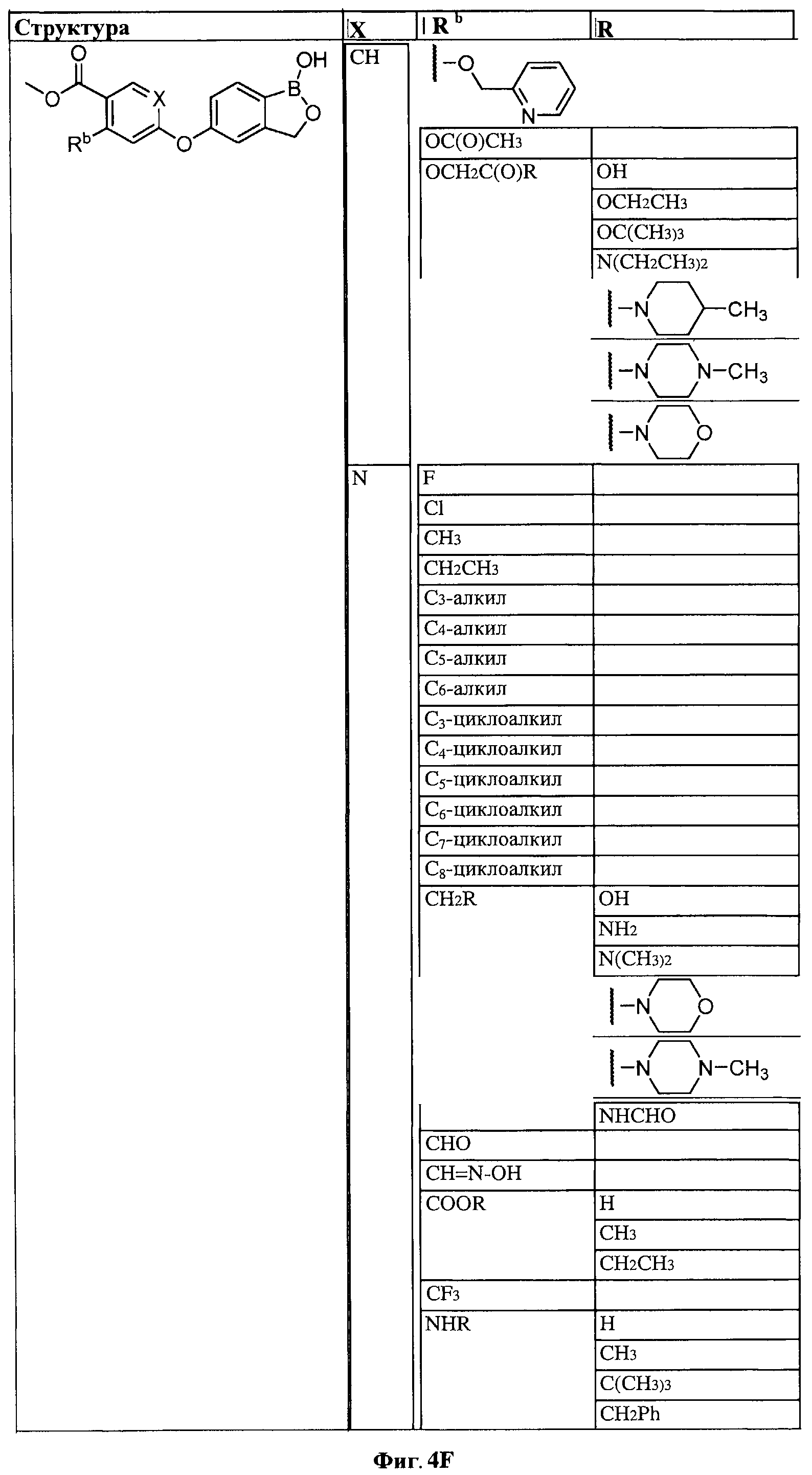
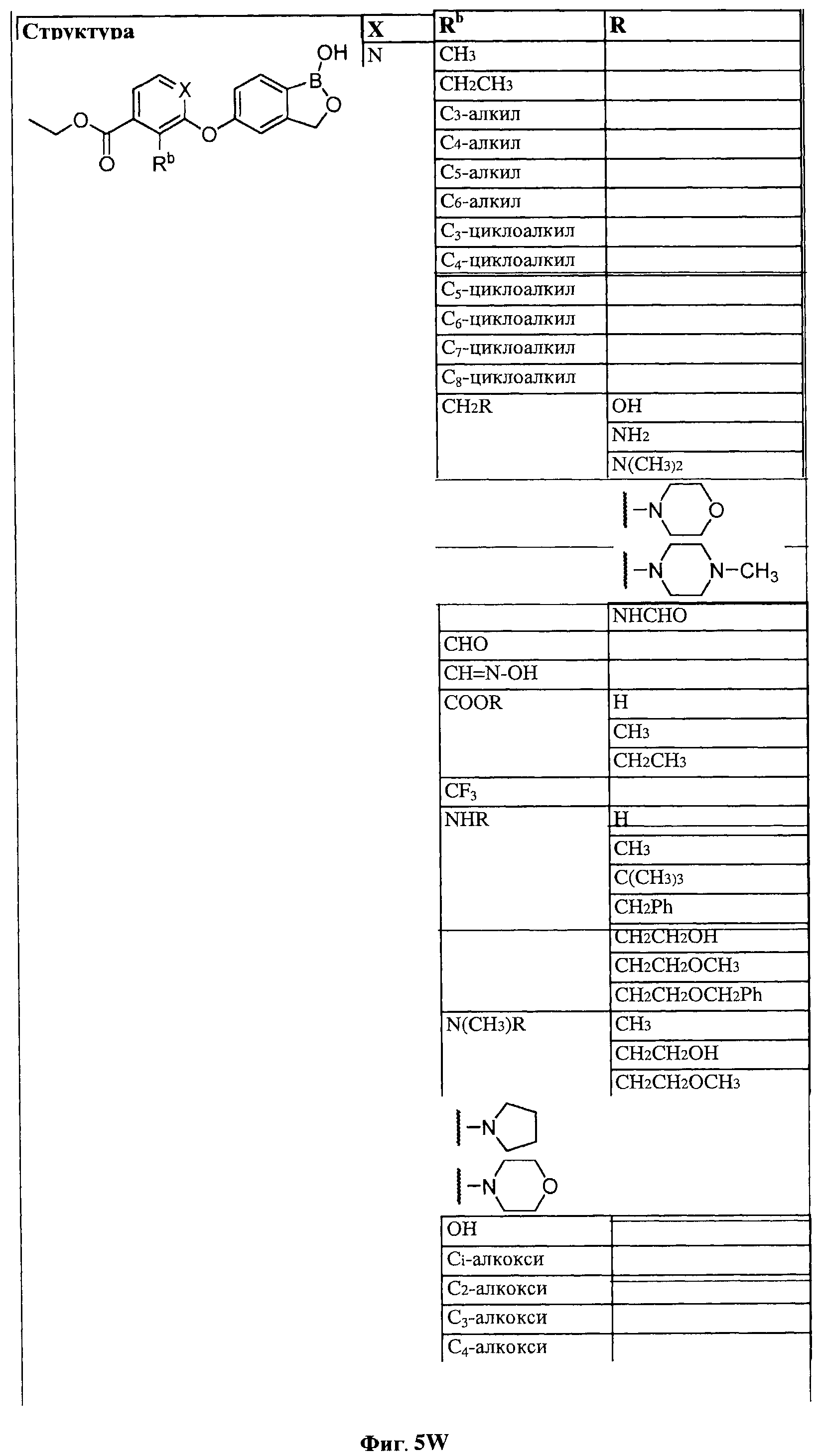
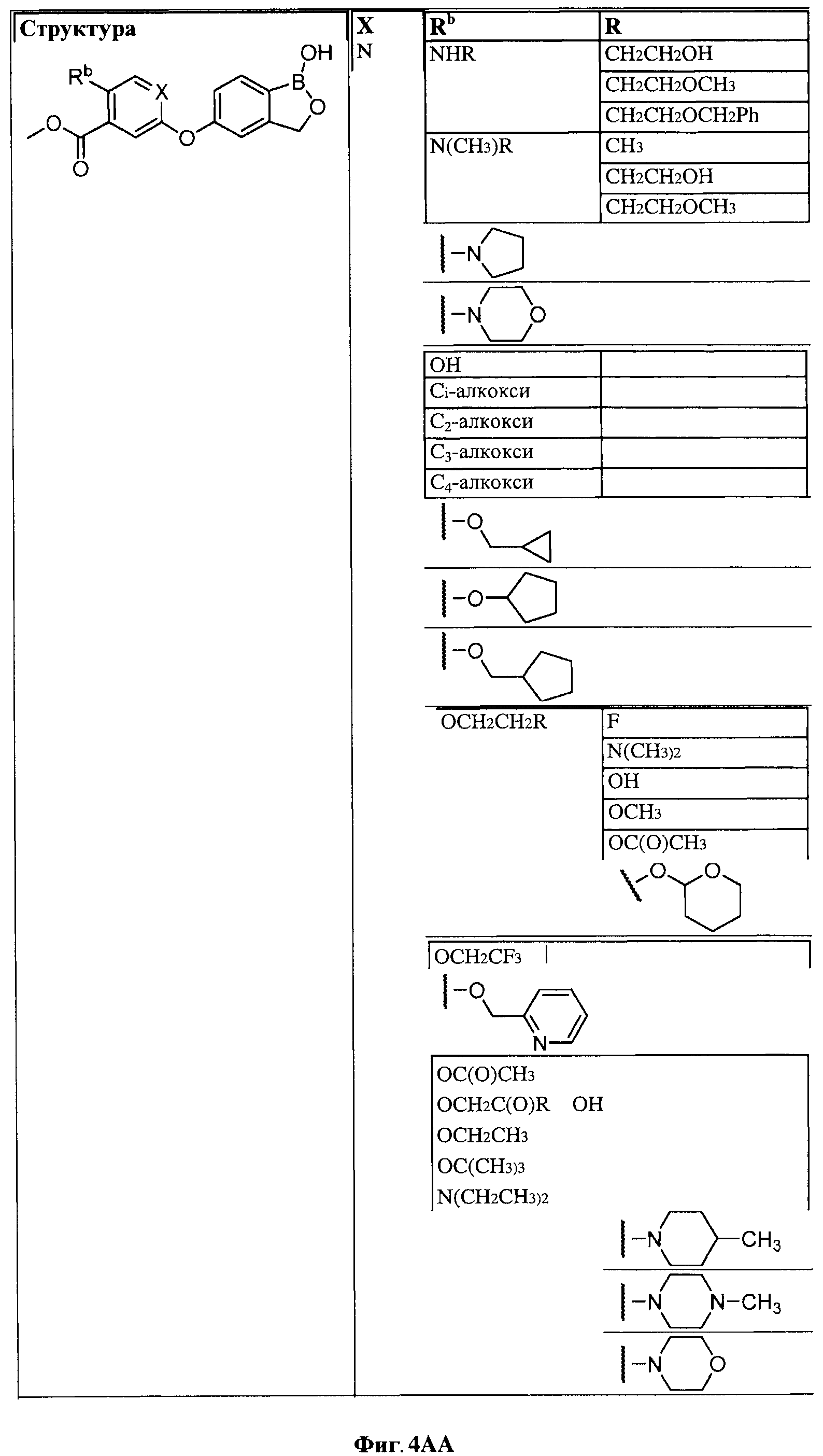
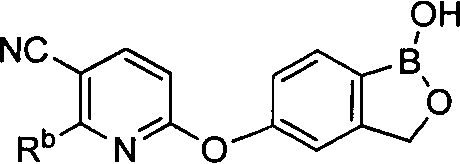
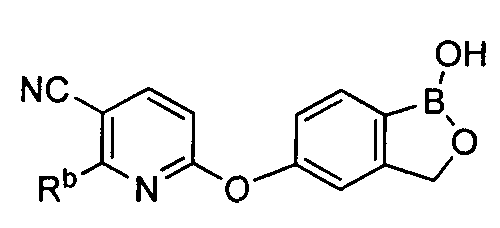
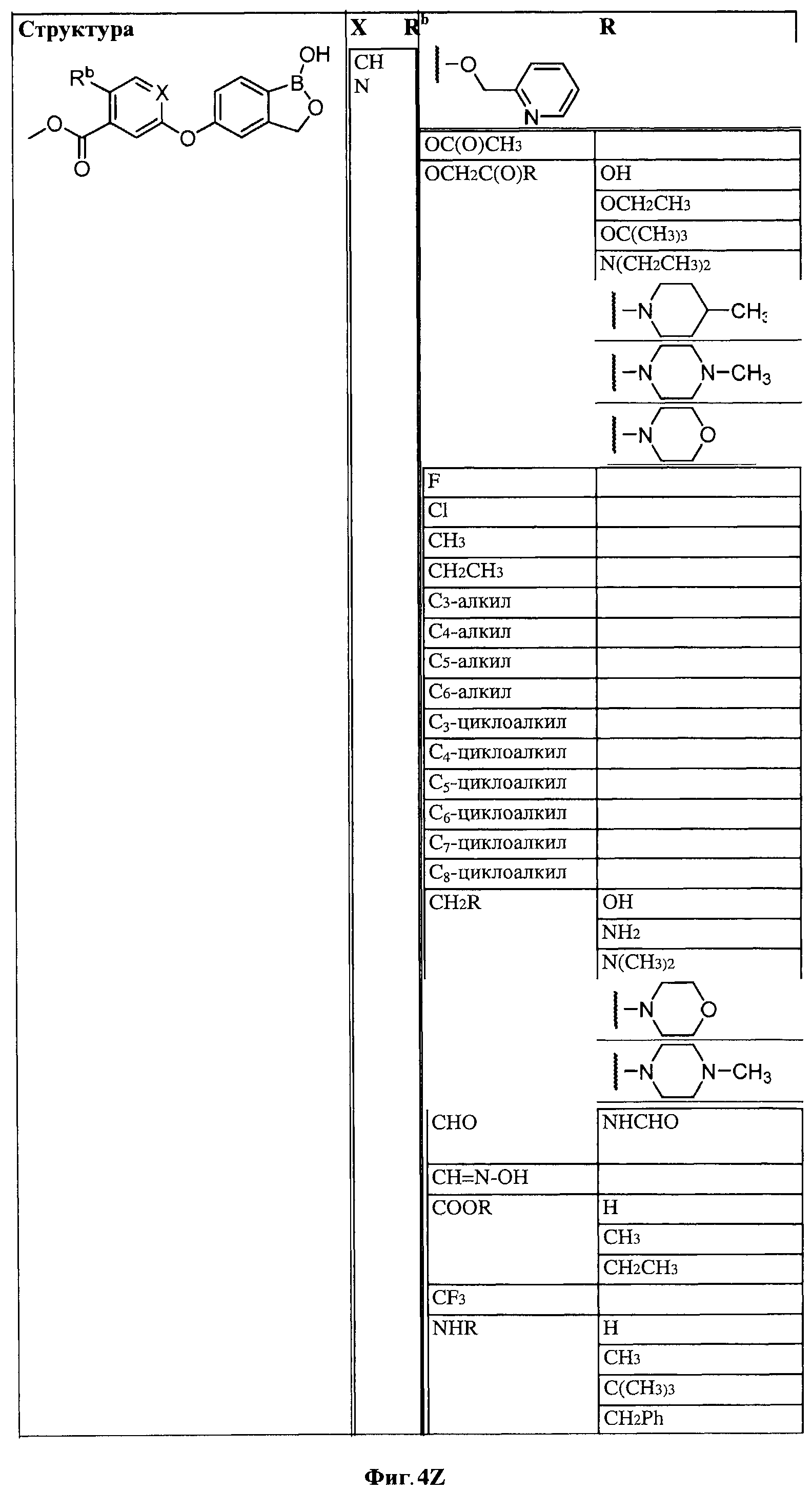
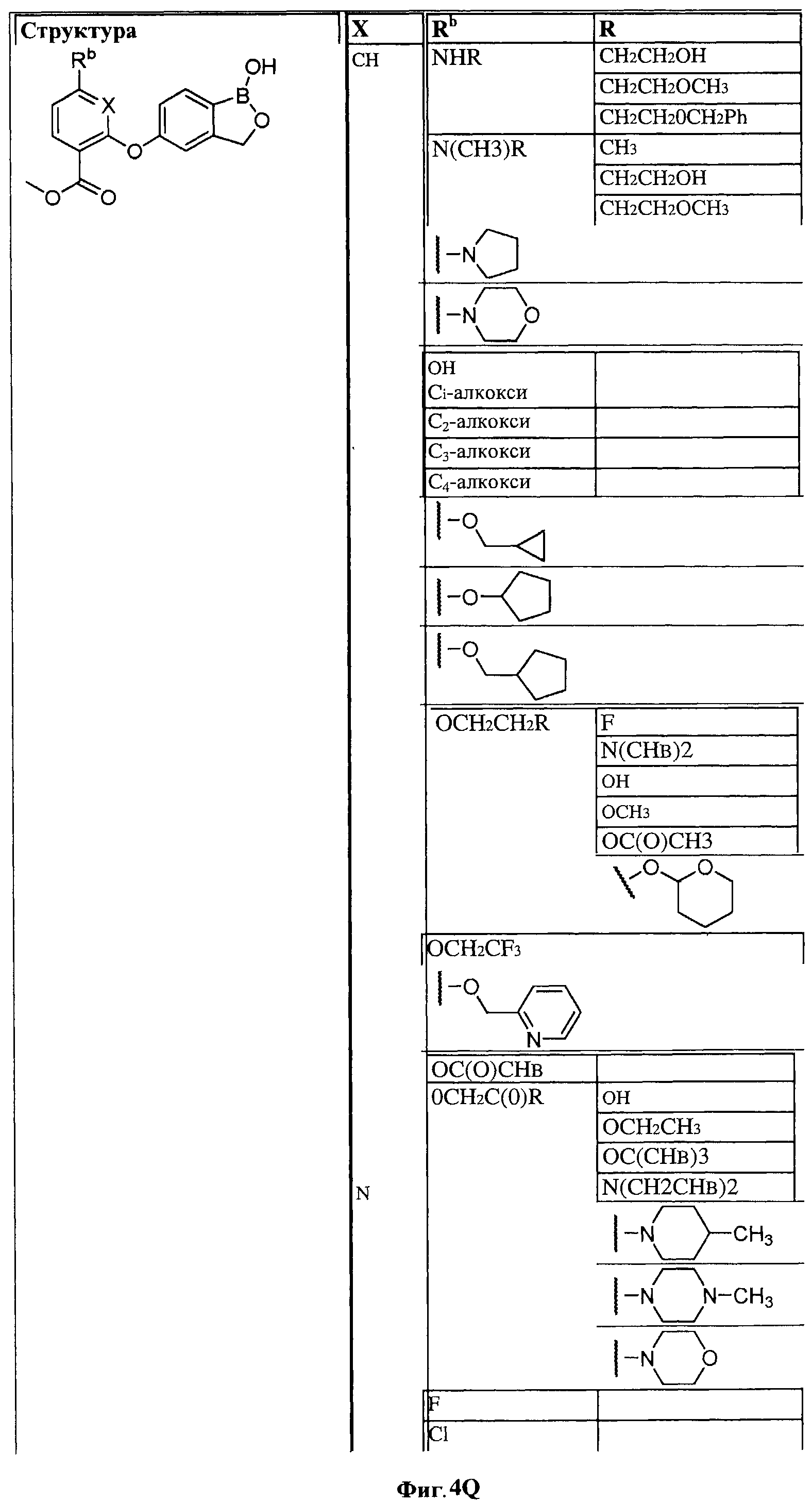
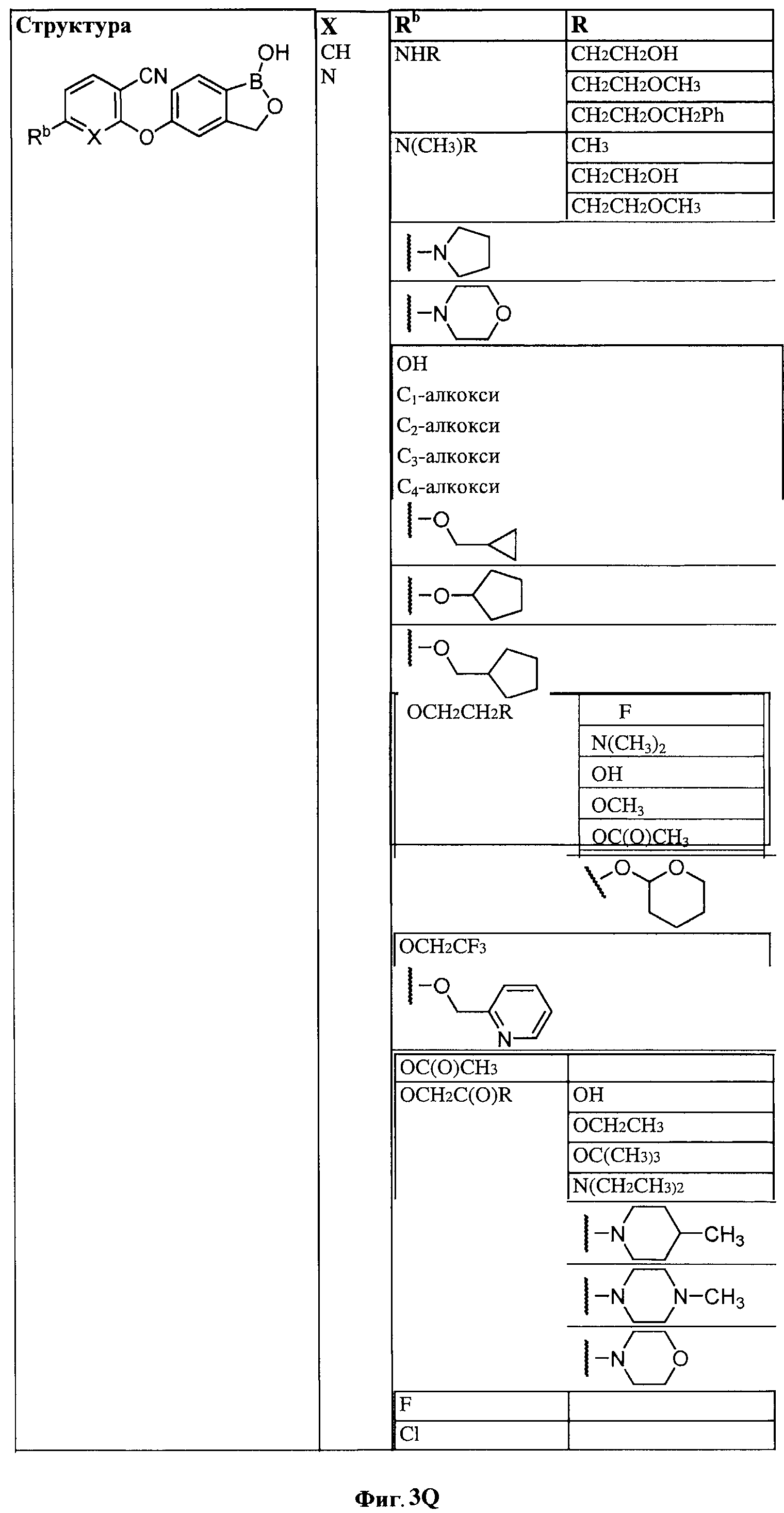
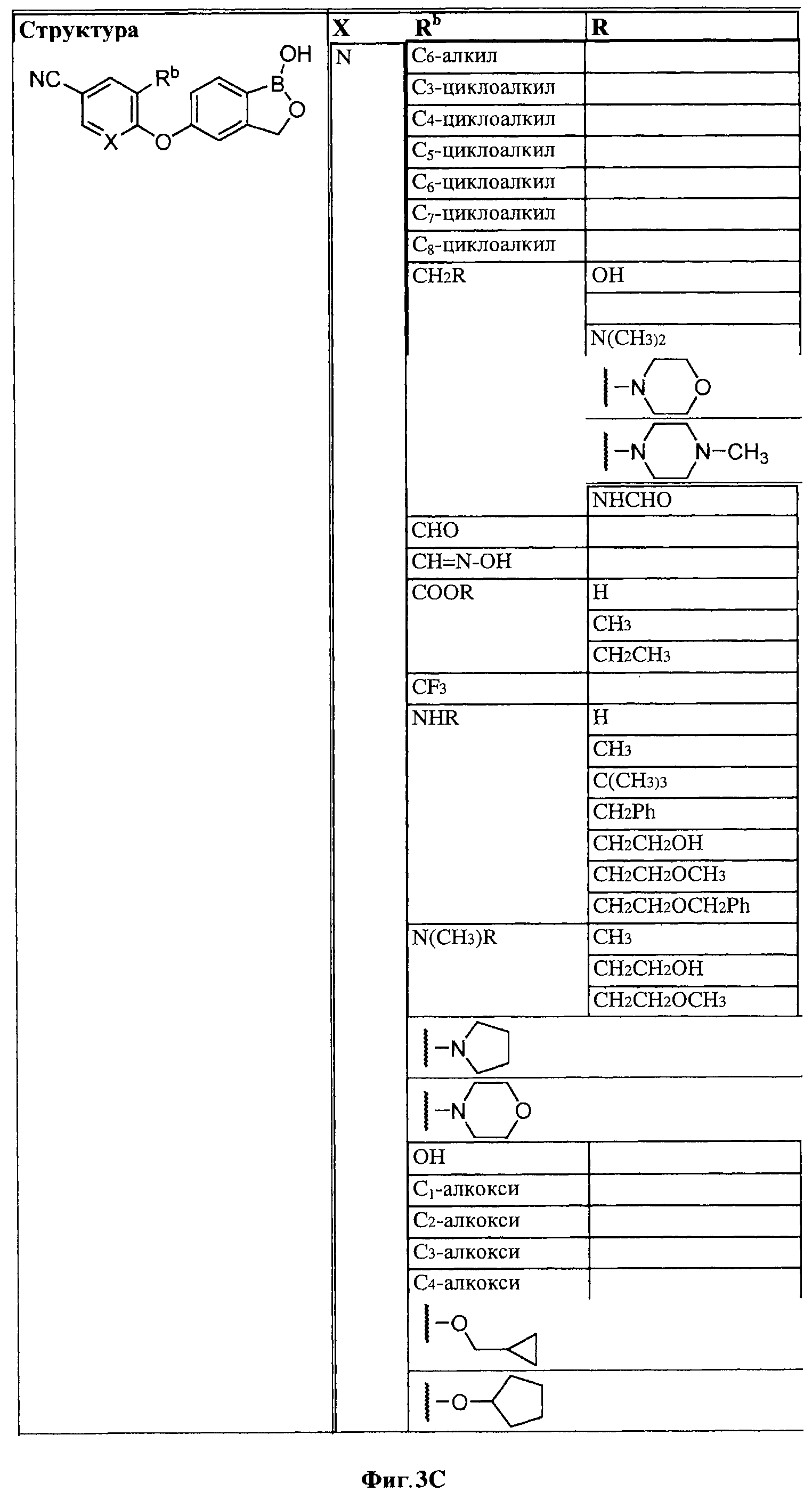
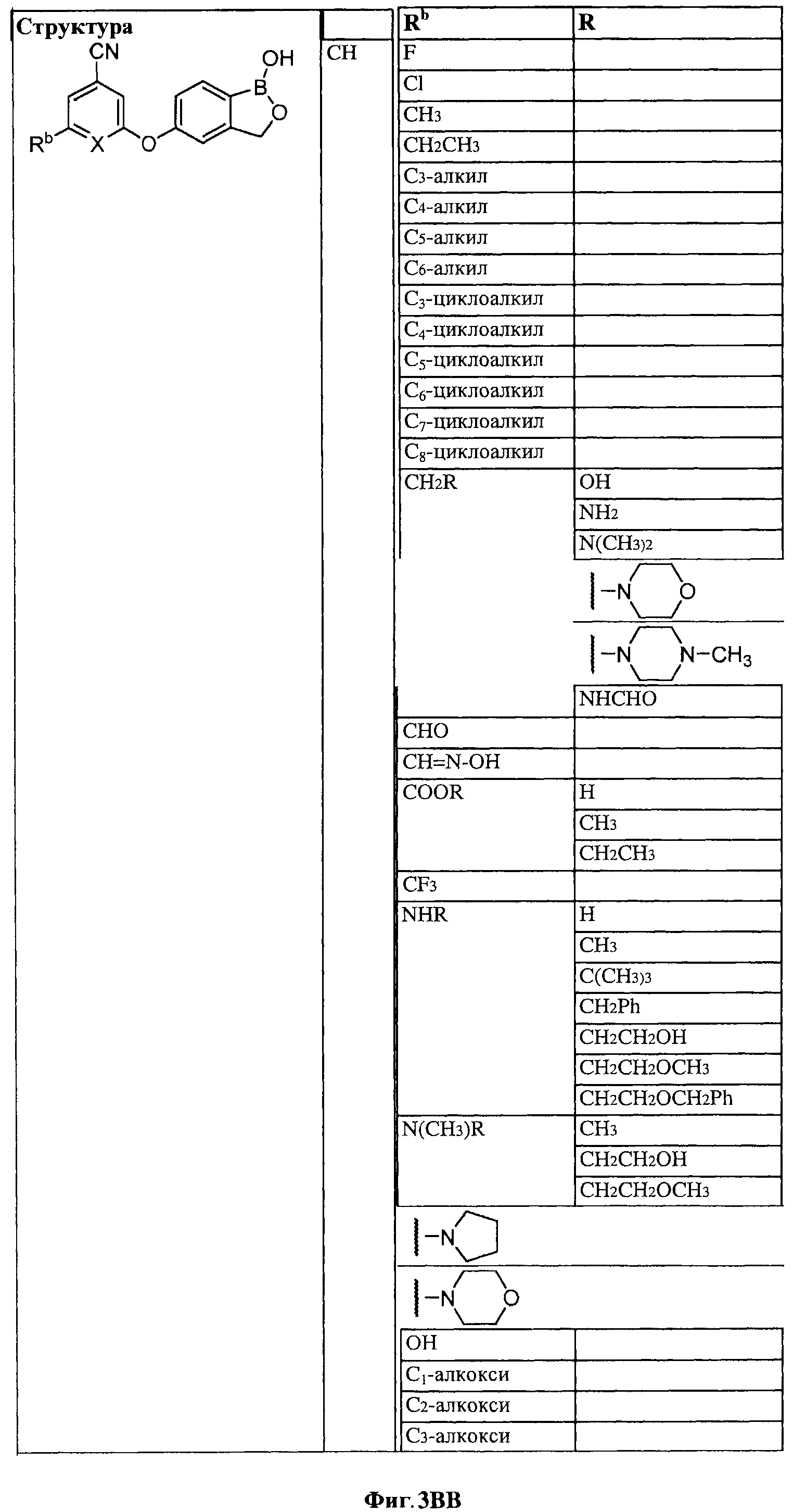
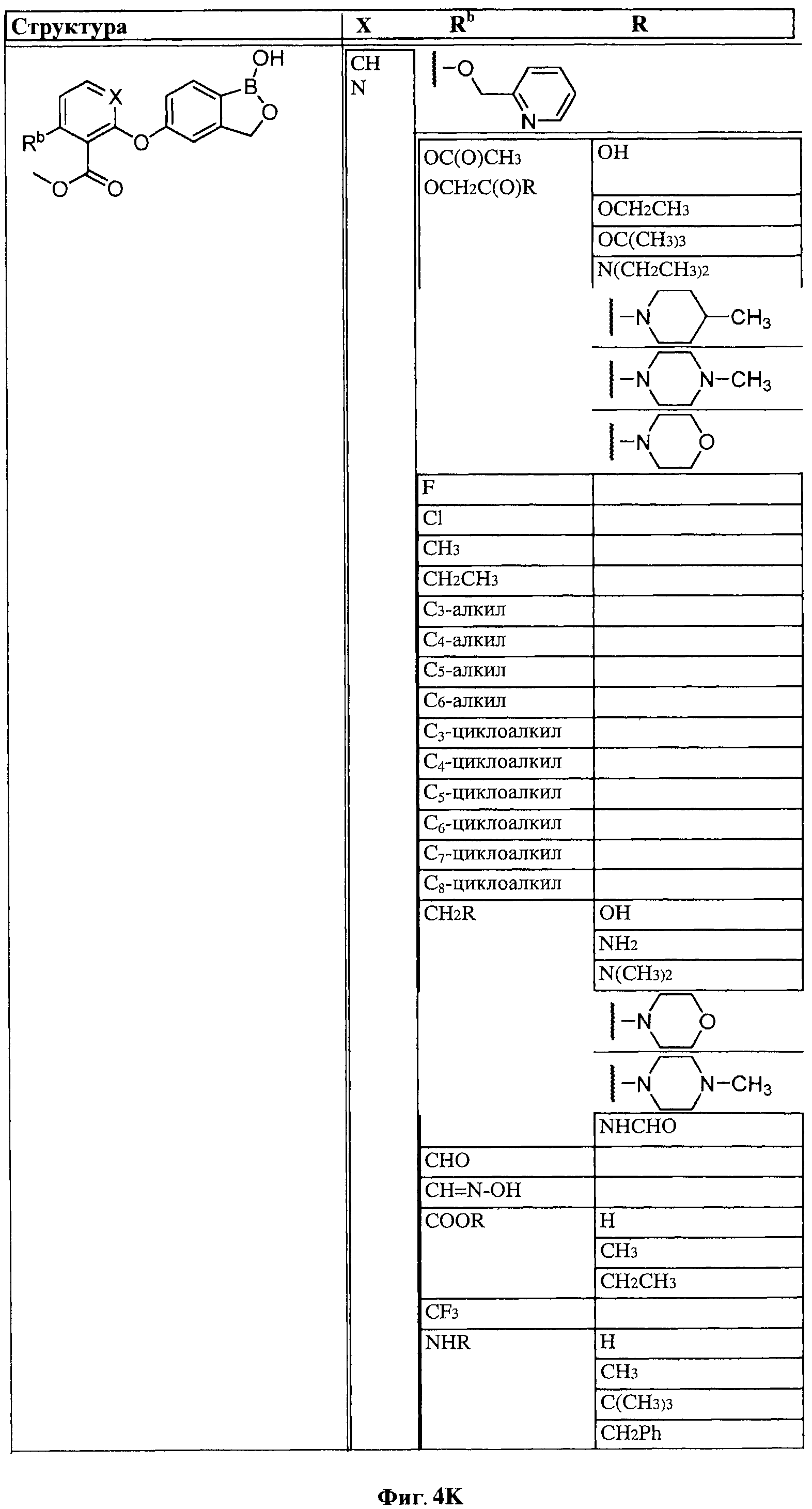
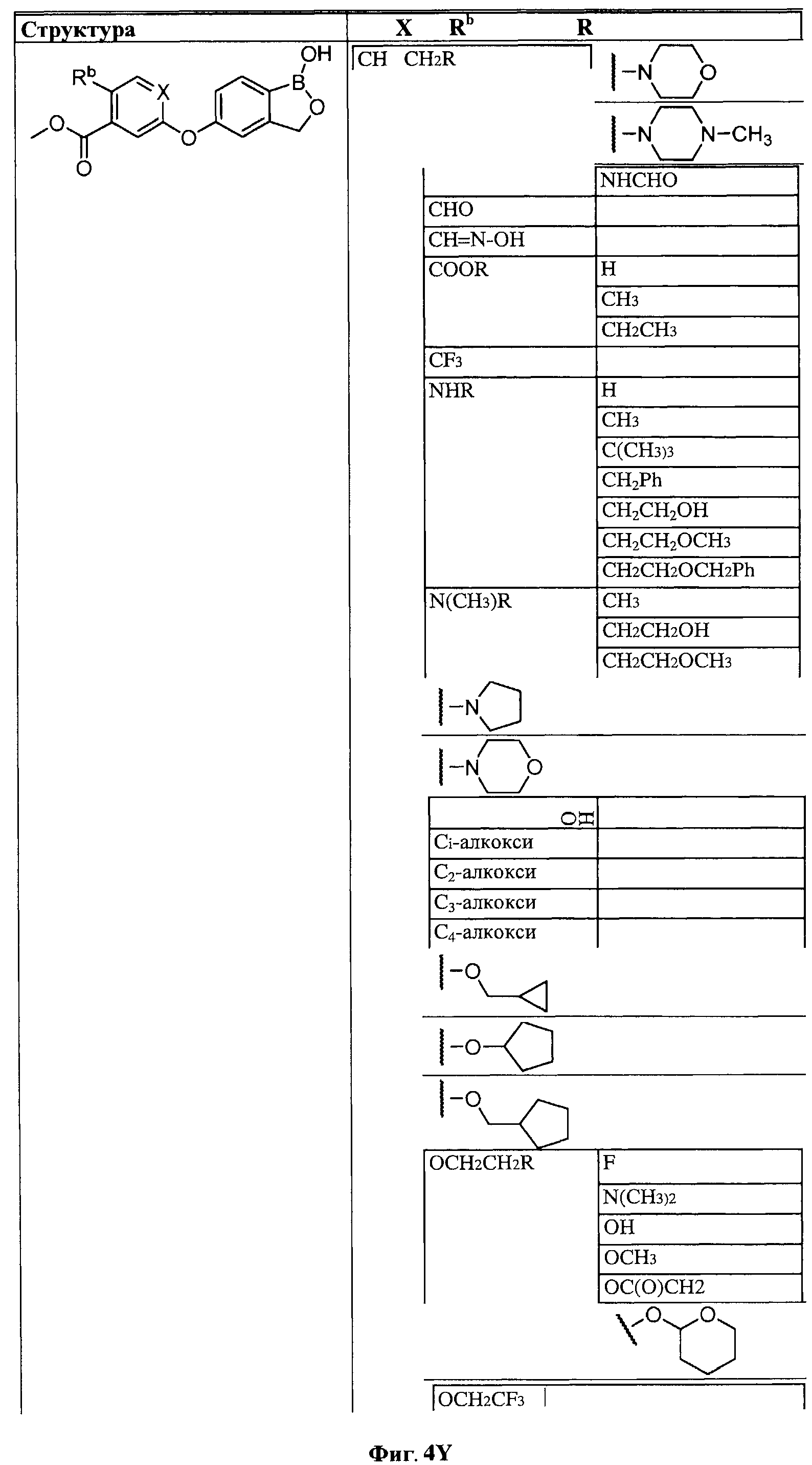
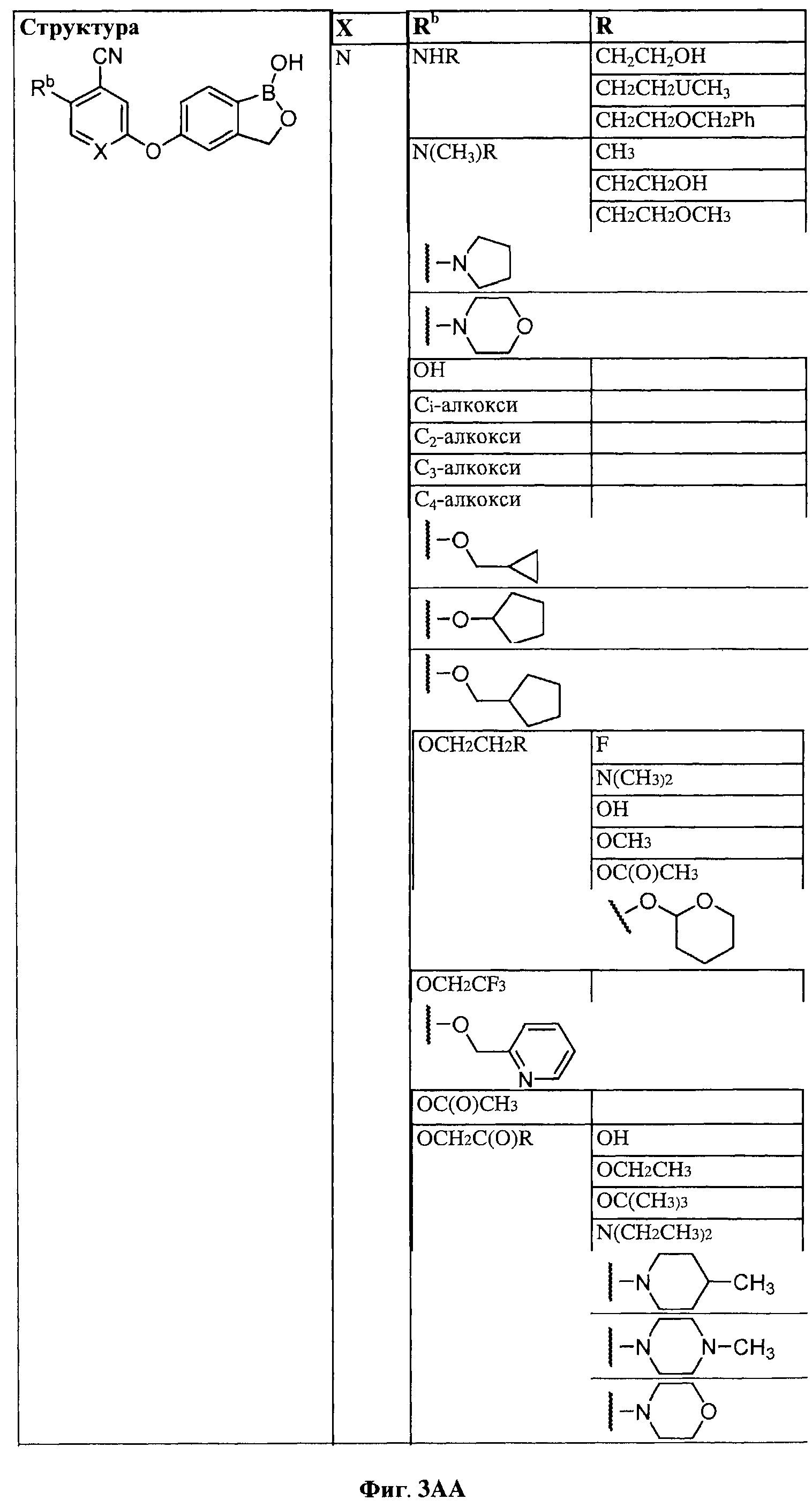
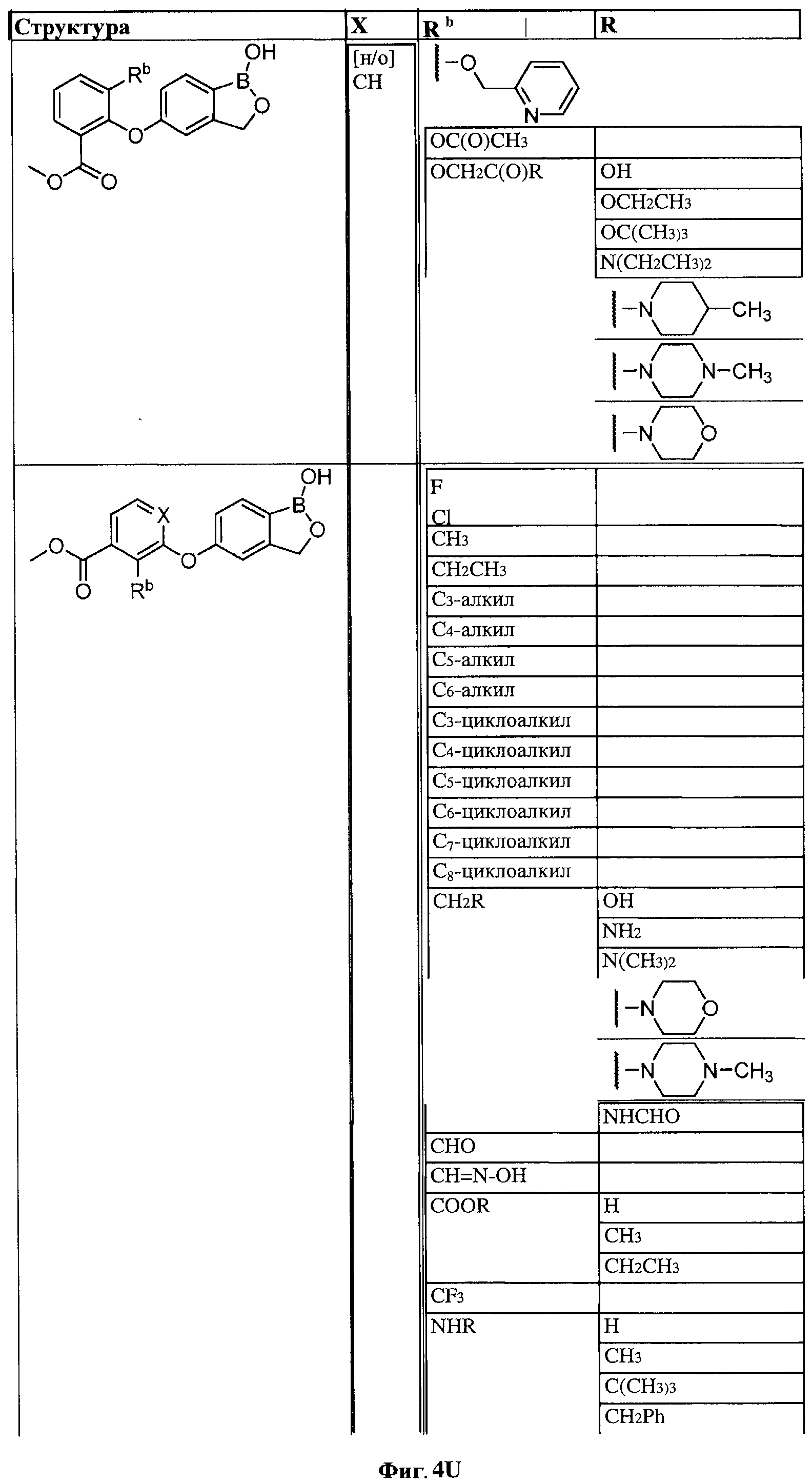
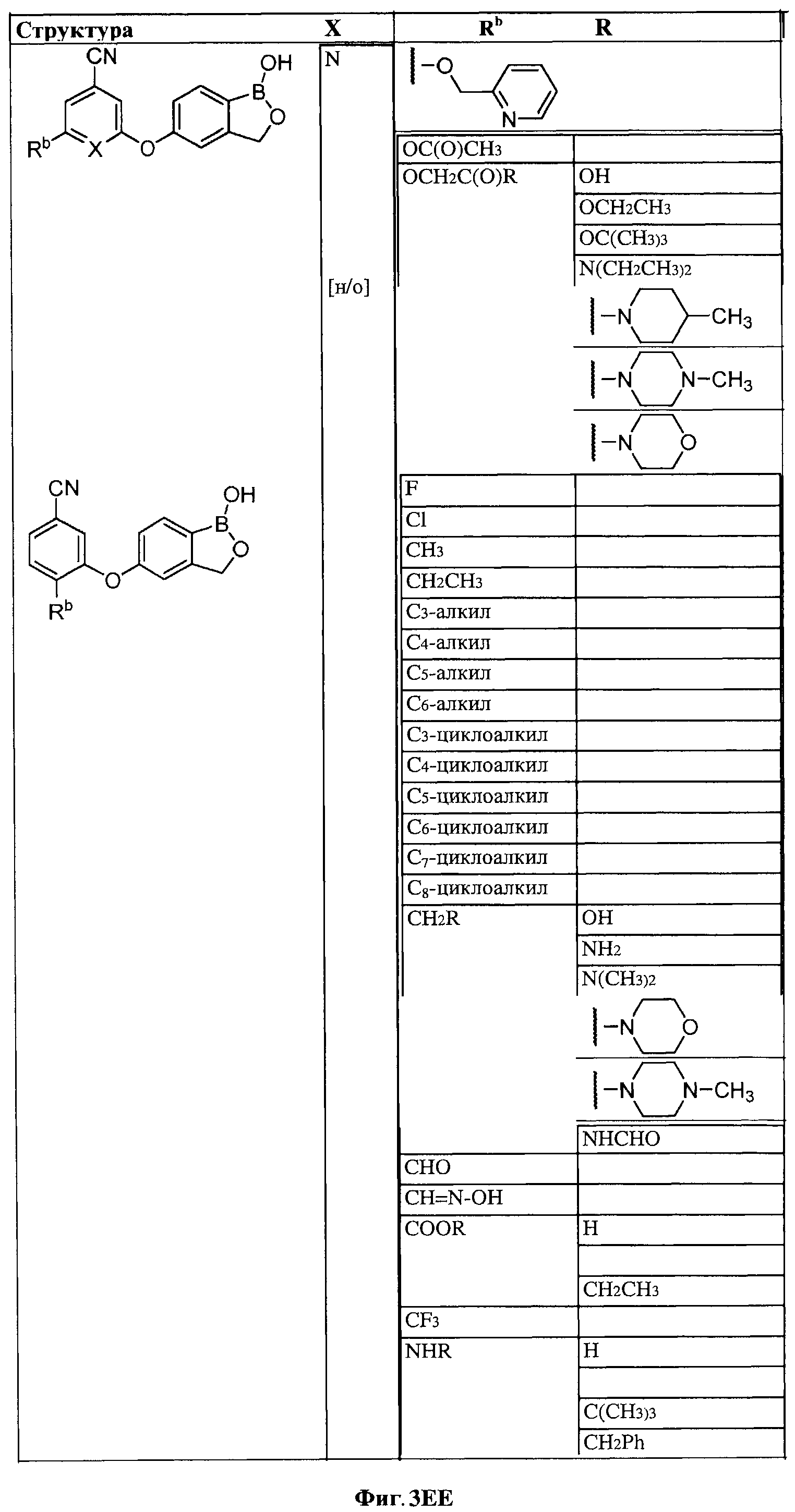
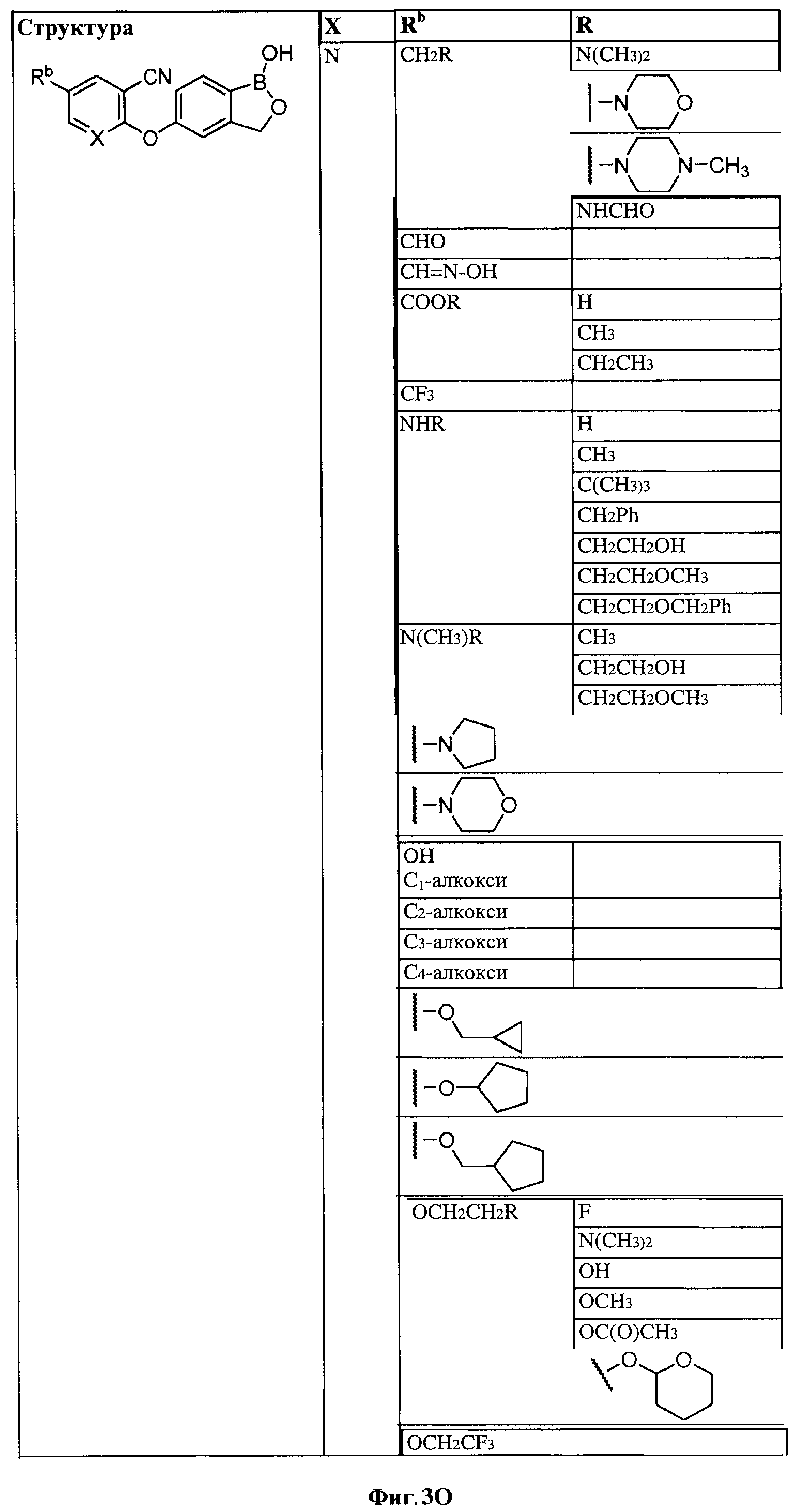
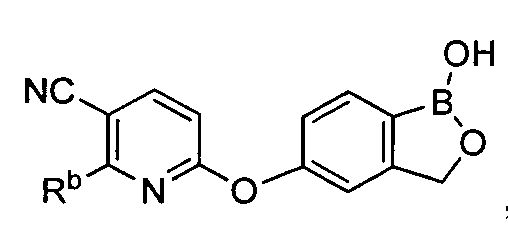
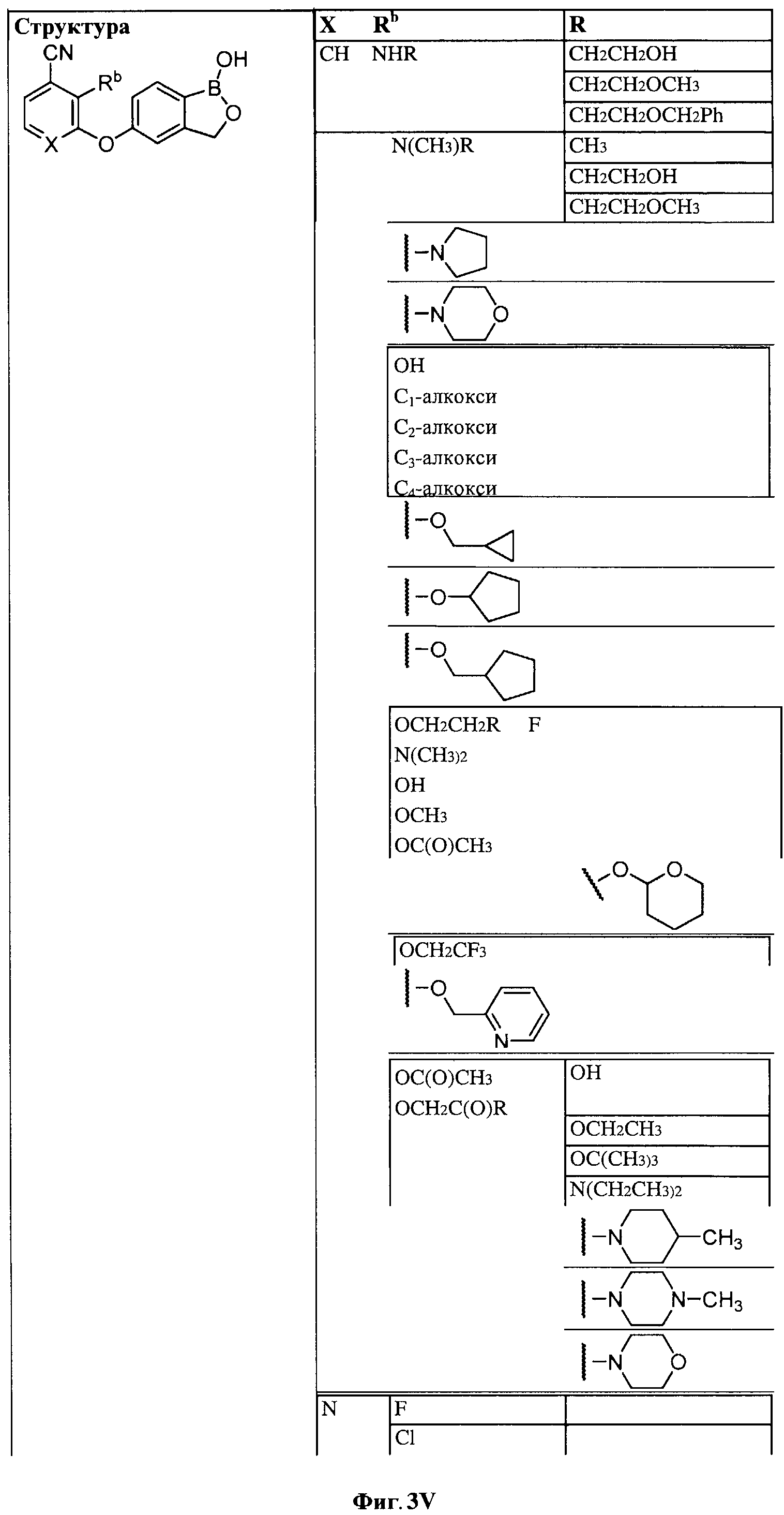
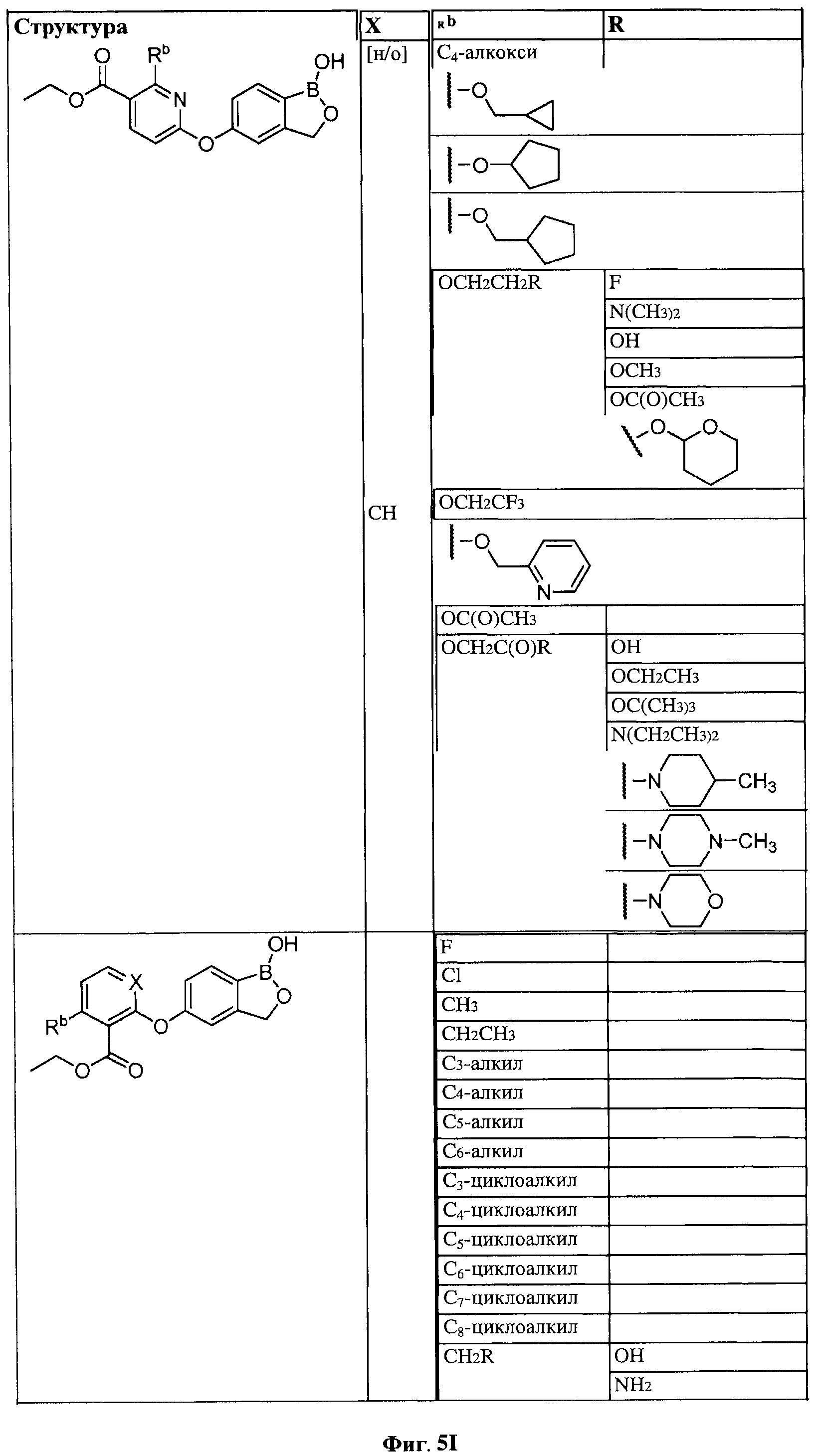
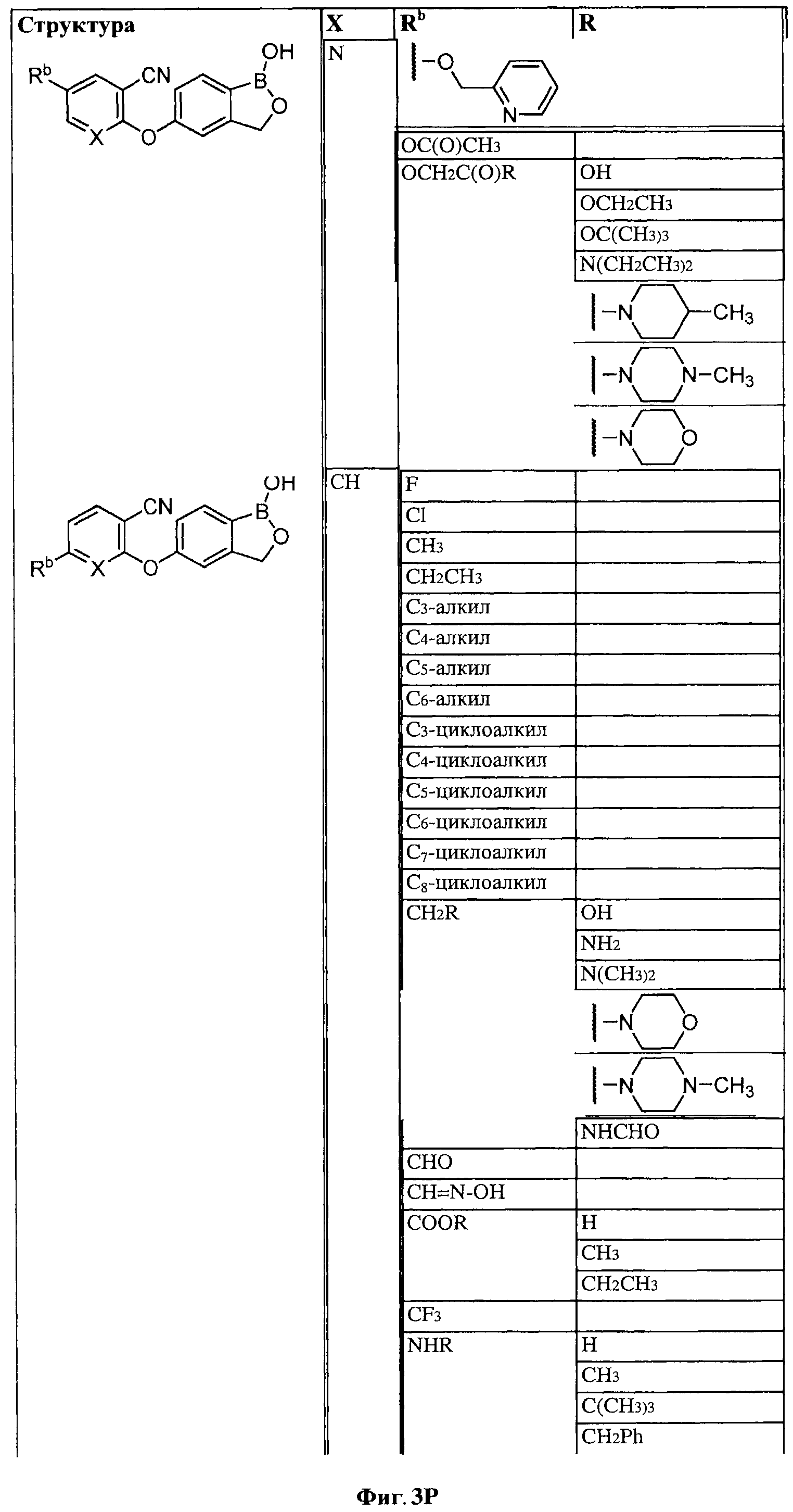
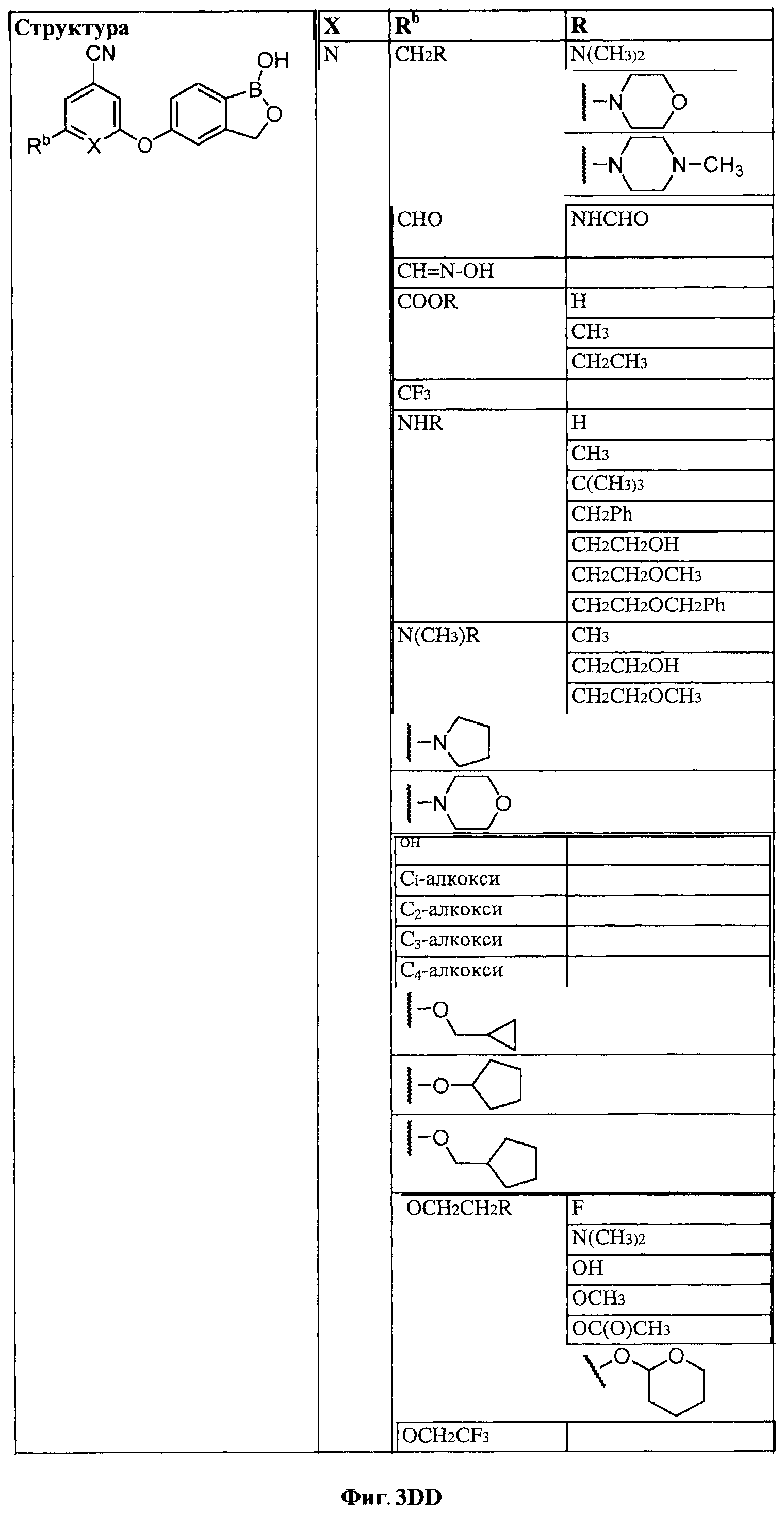
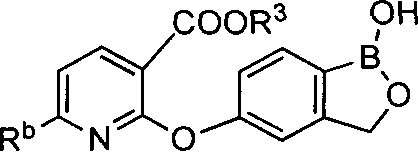
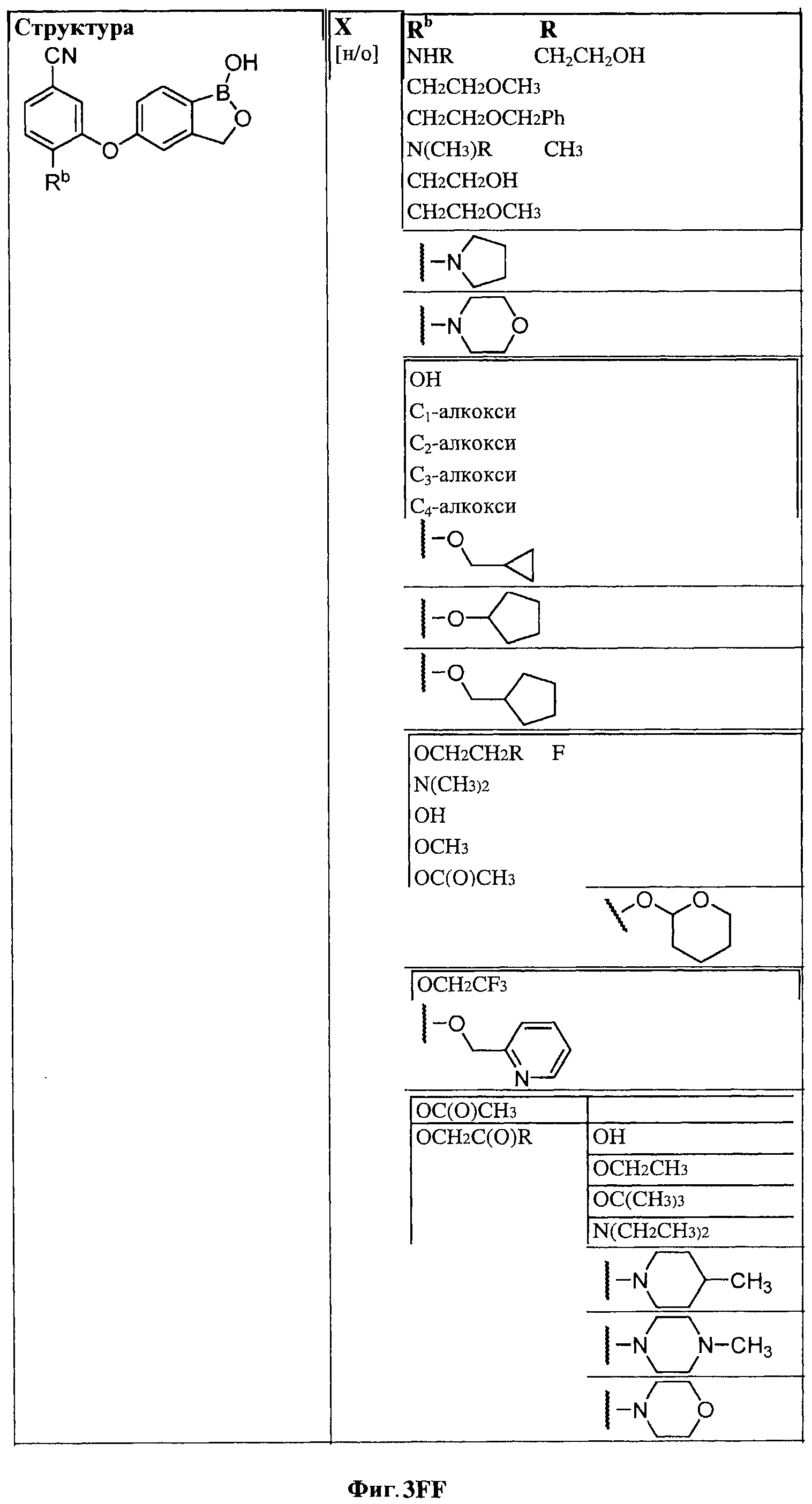
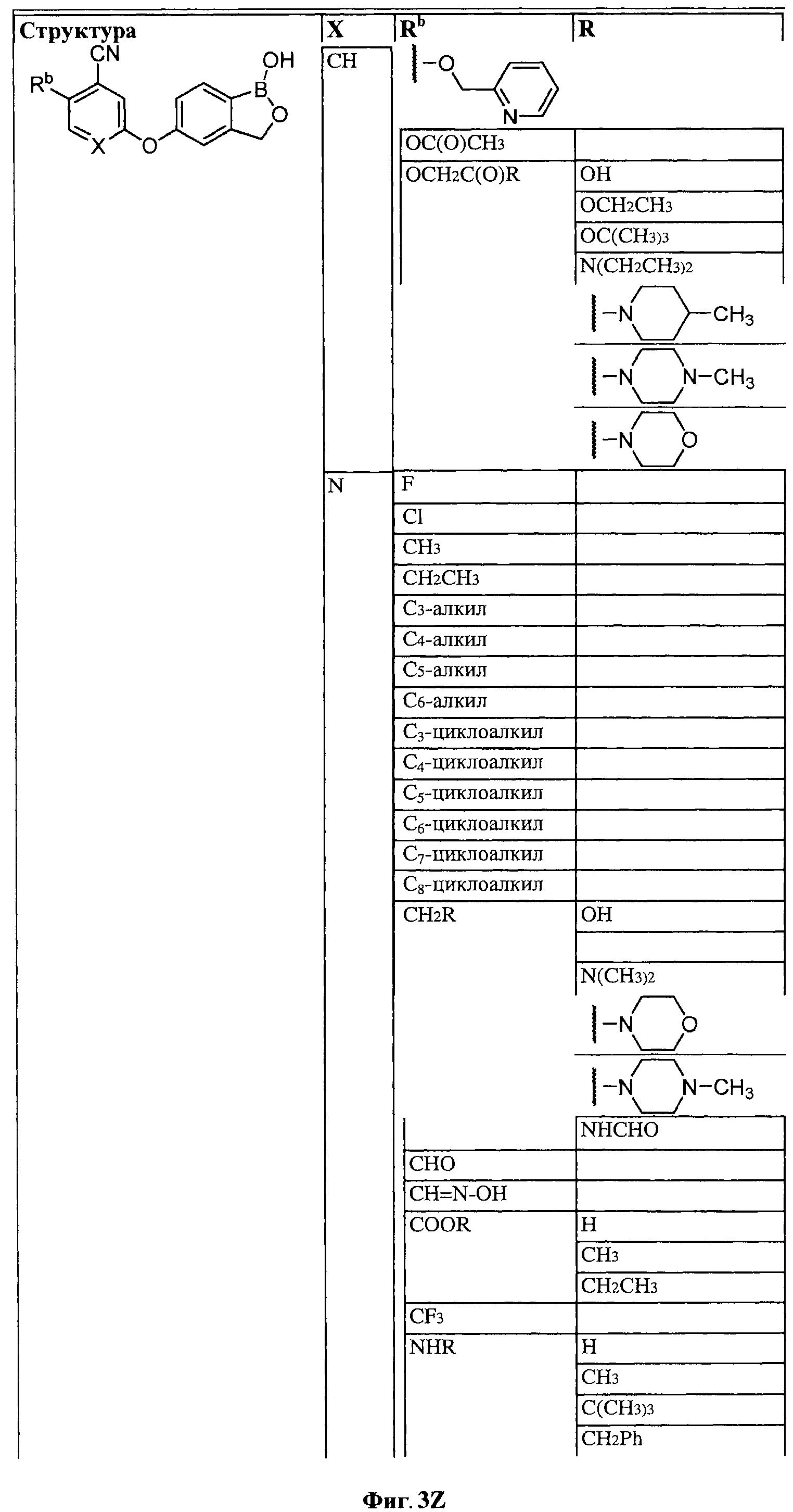
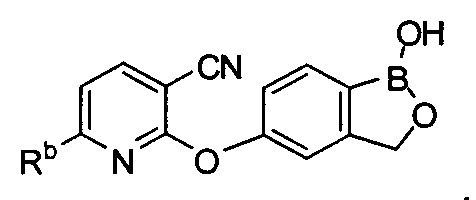
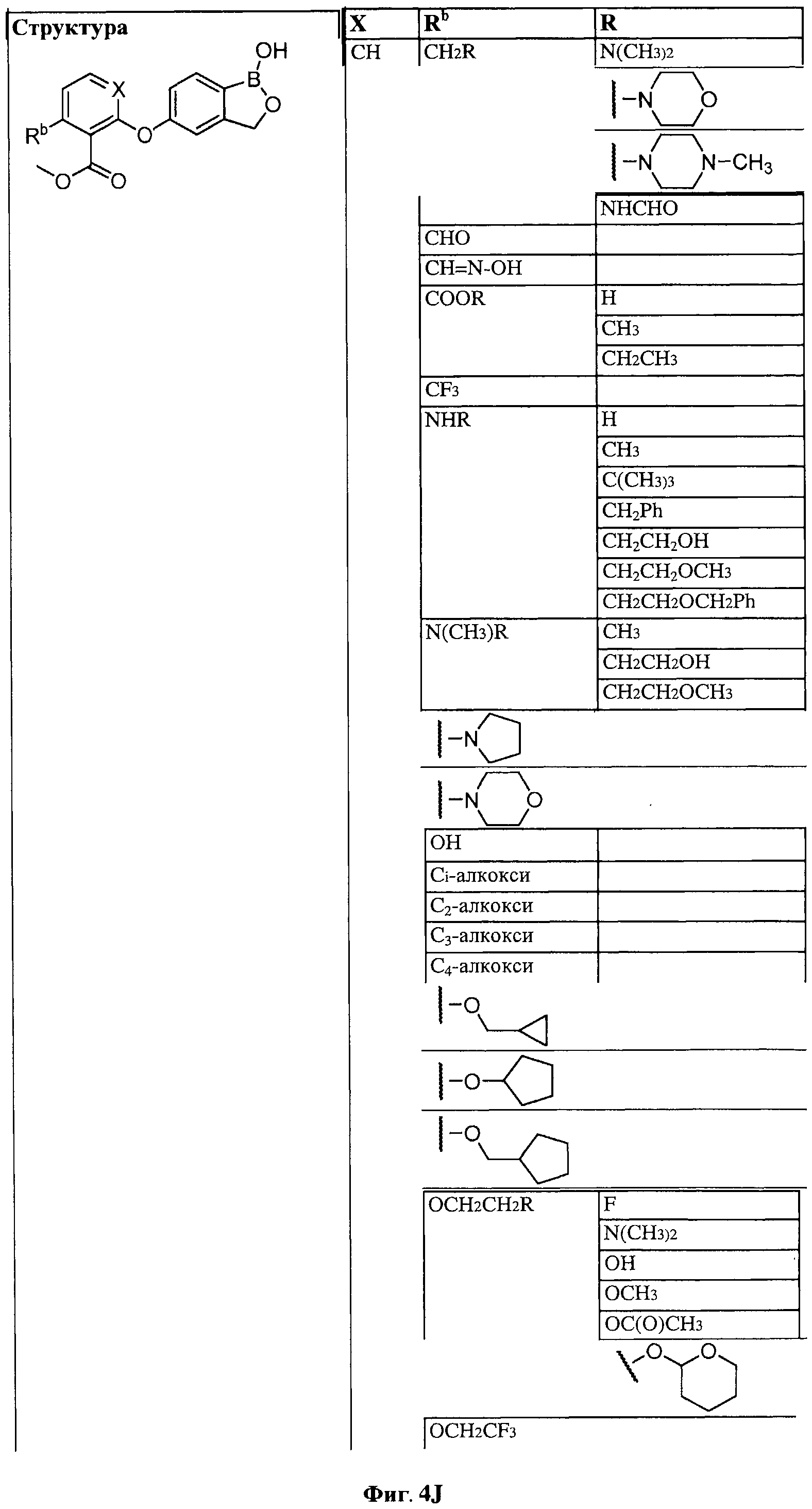
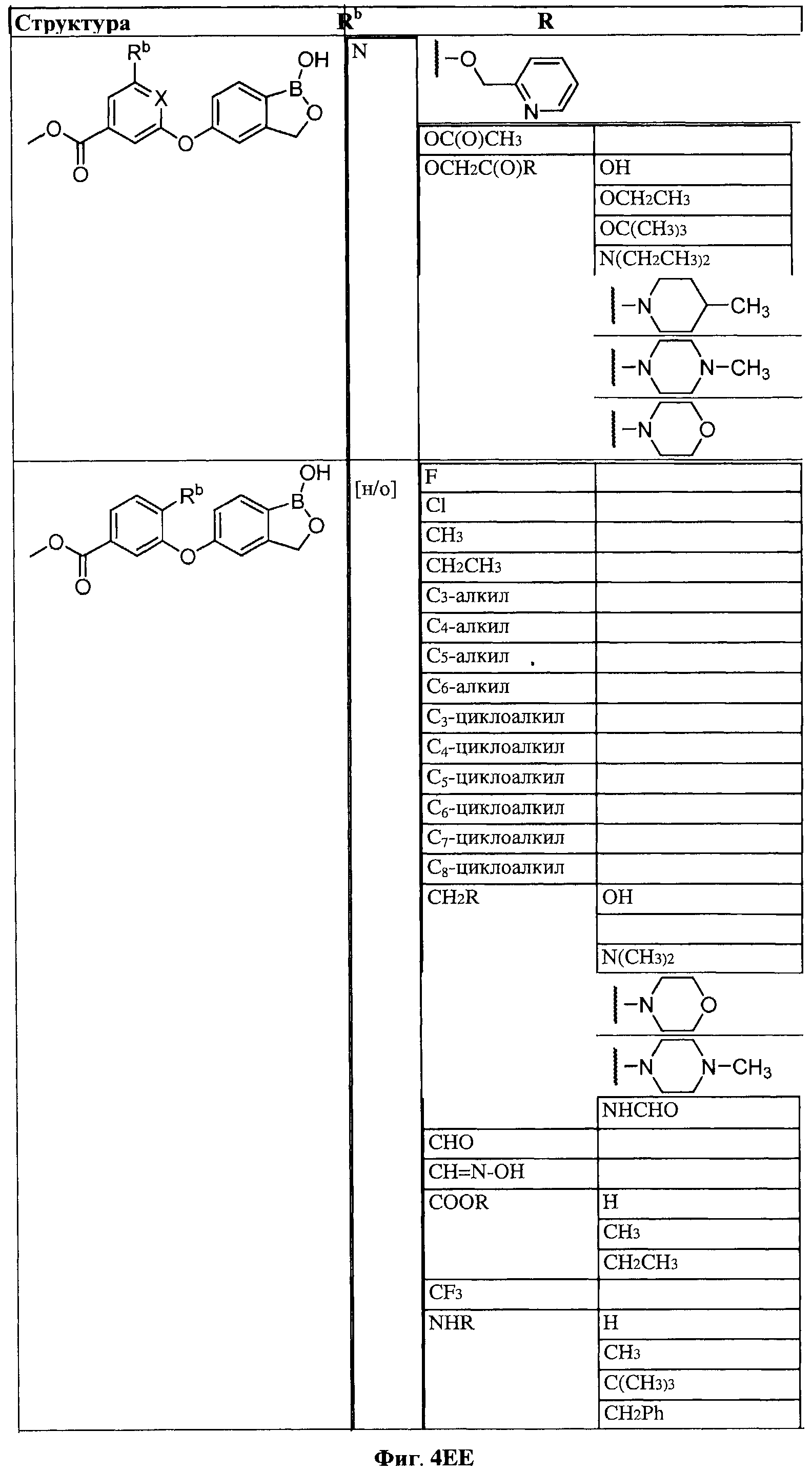
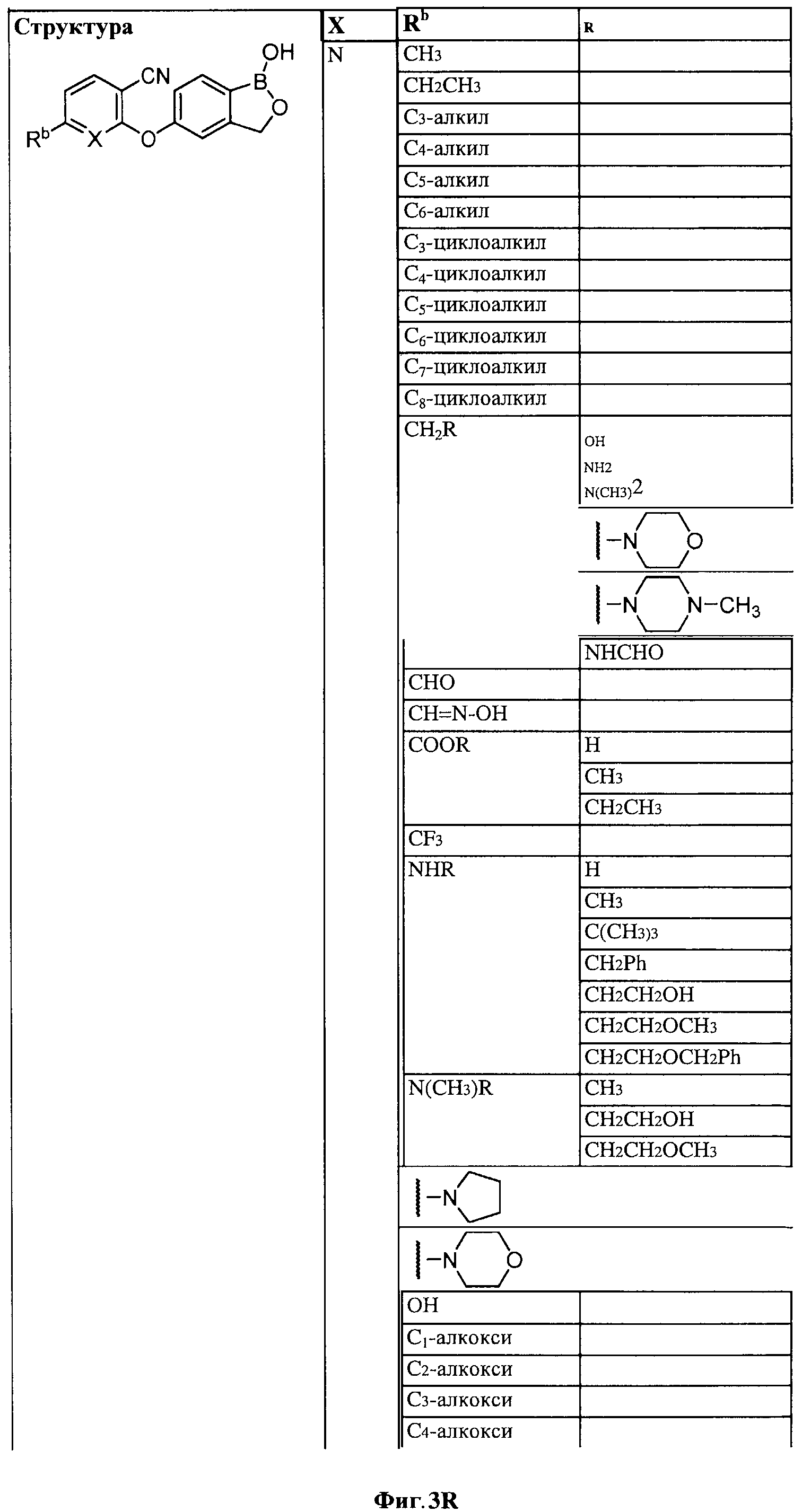
[0030] На ФИГ.3 и 4 показаны примеры соединений согласно настоящему изобретению.
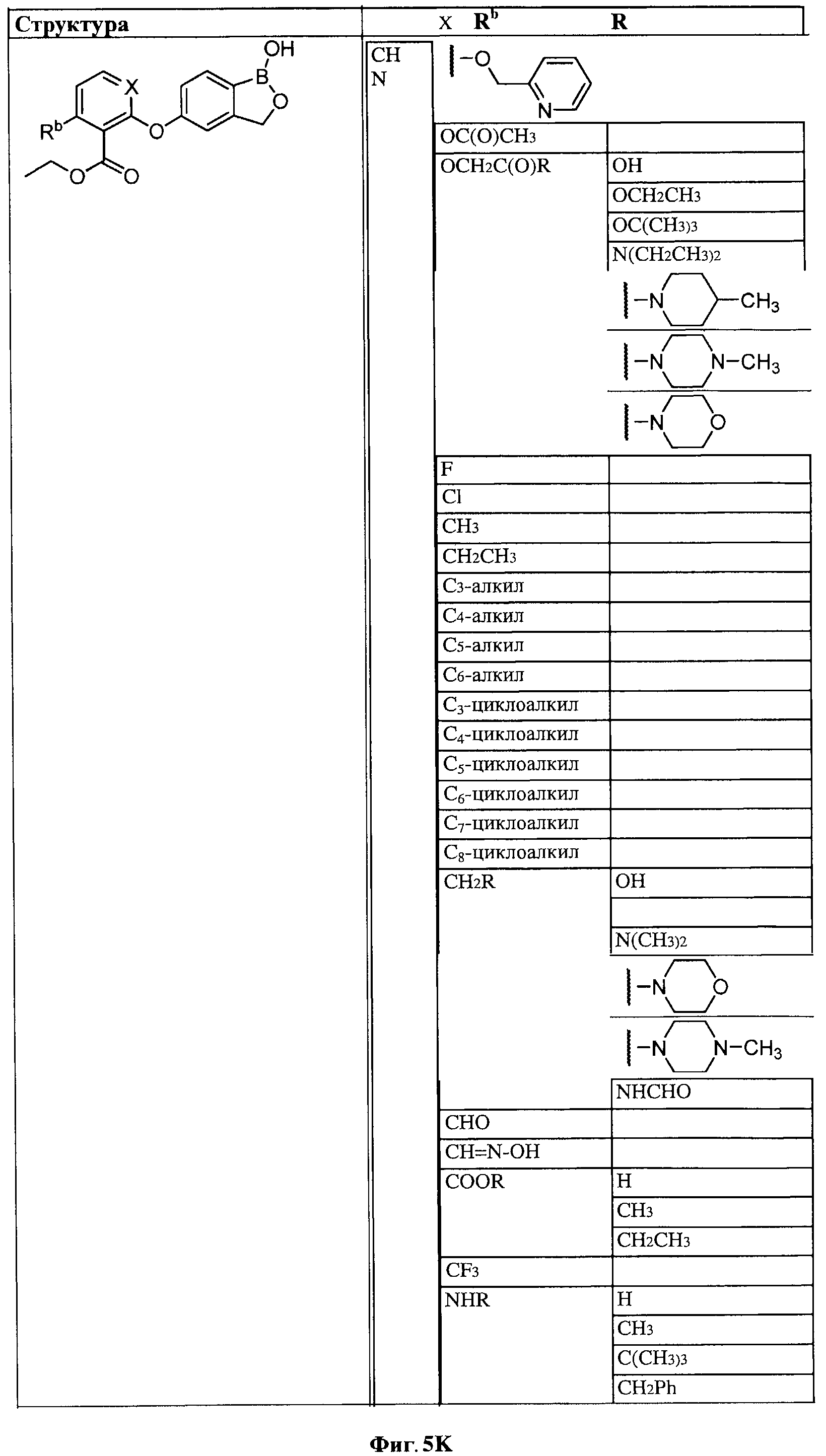
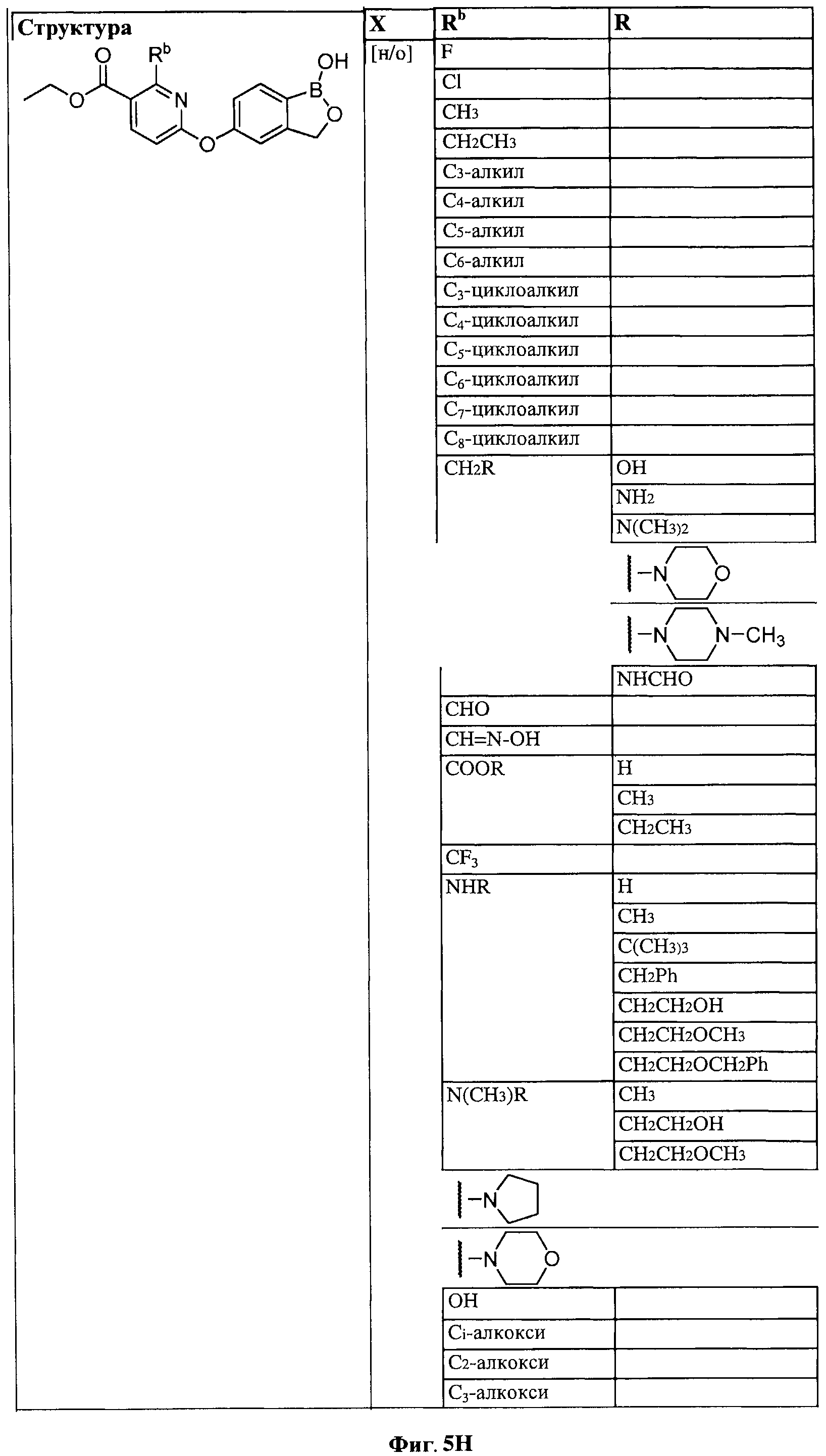
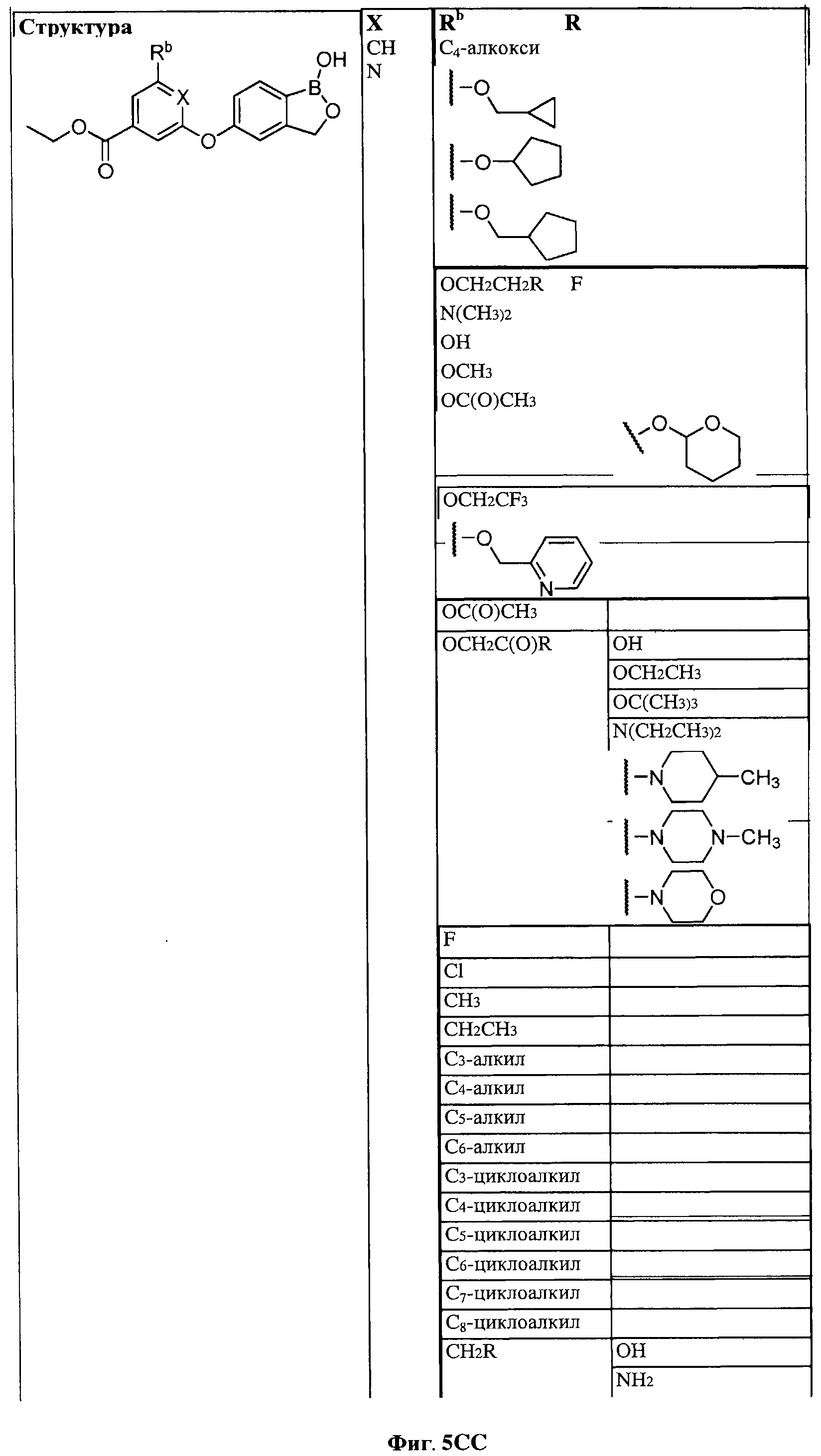
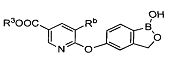
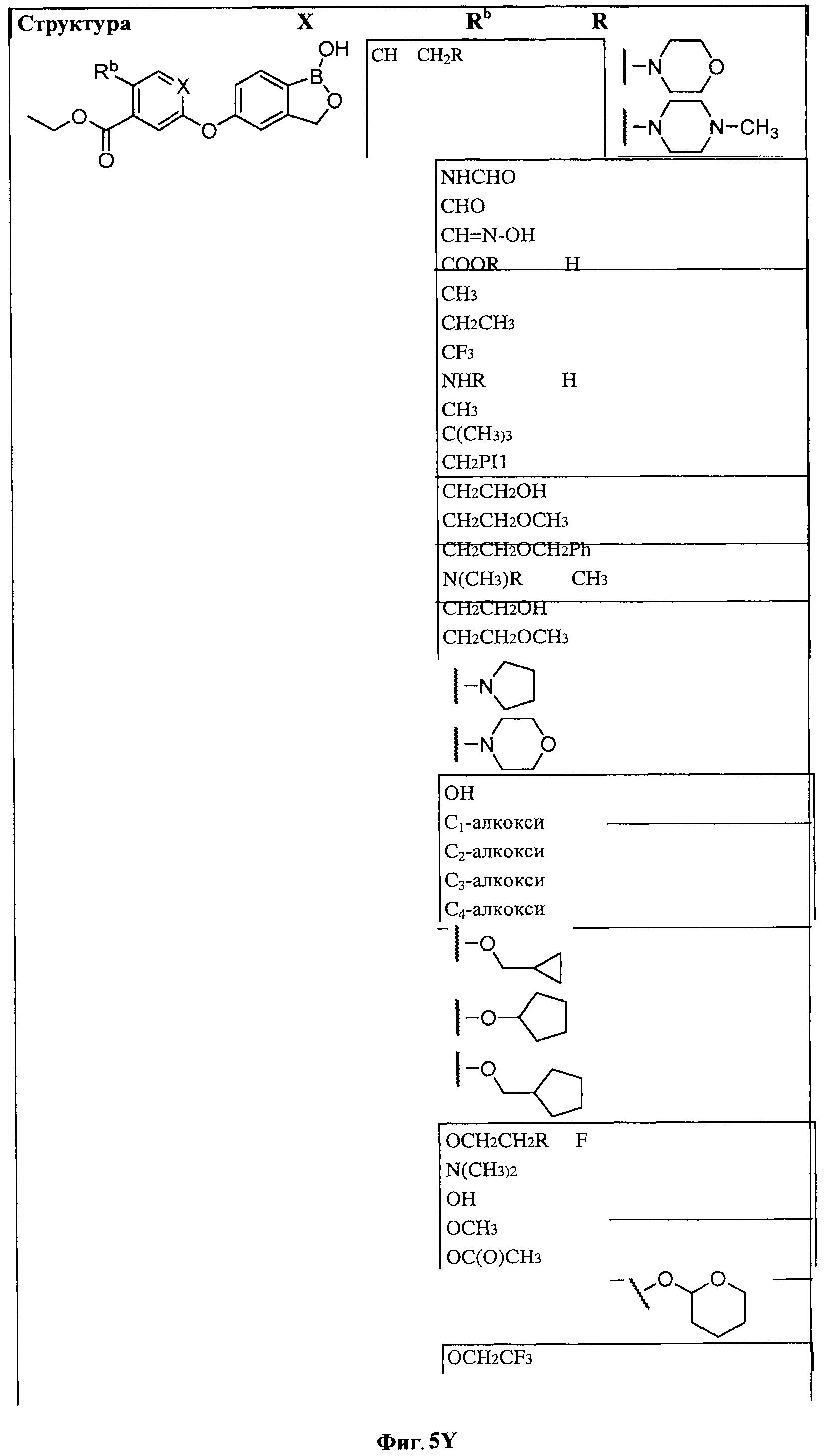
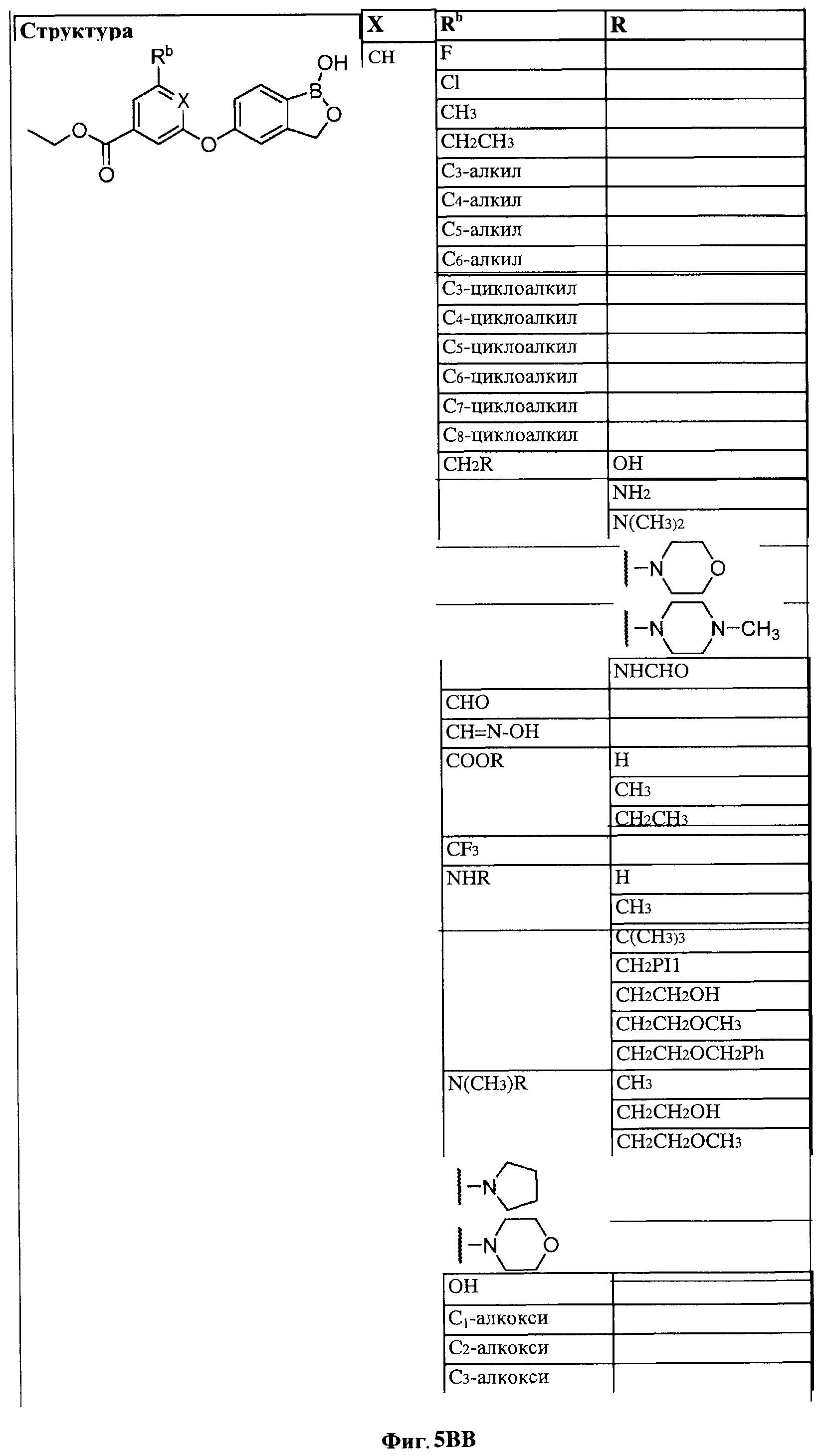
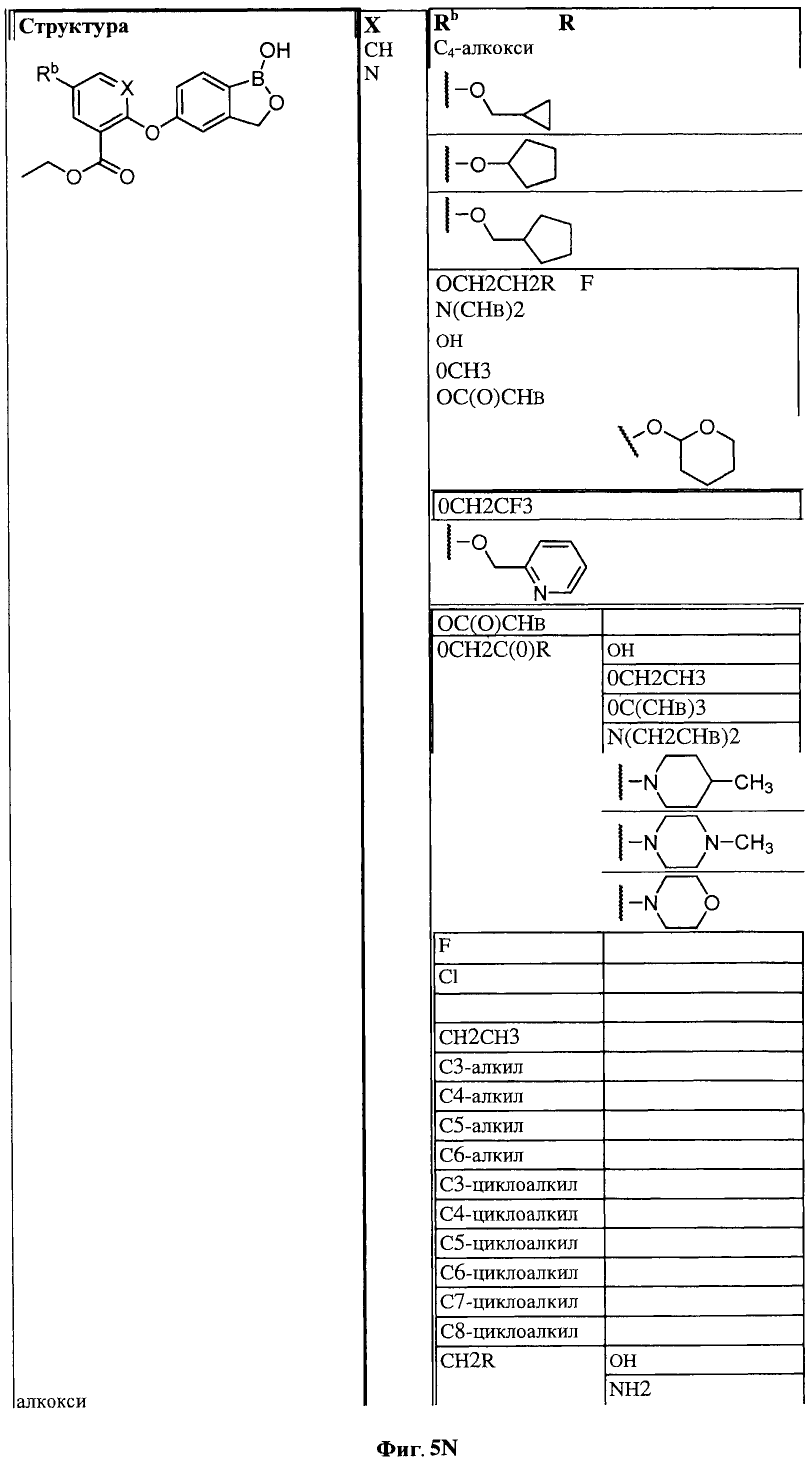
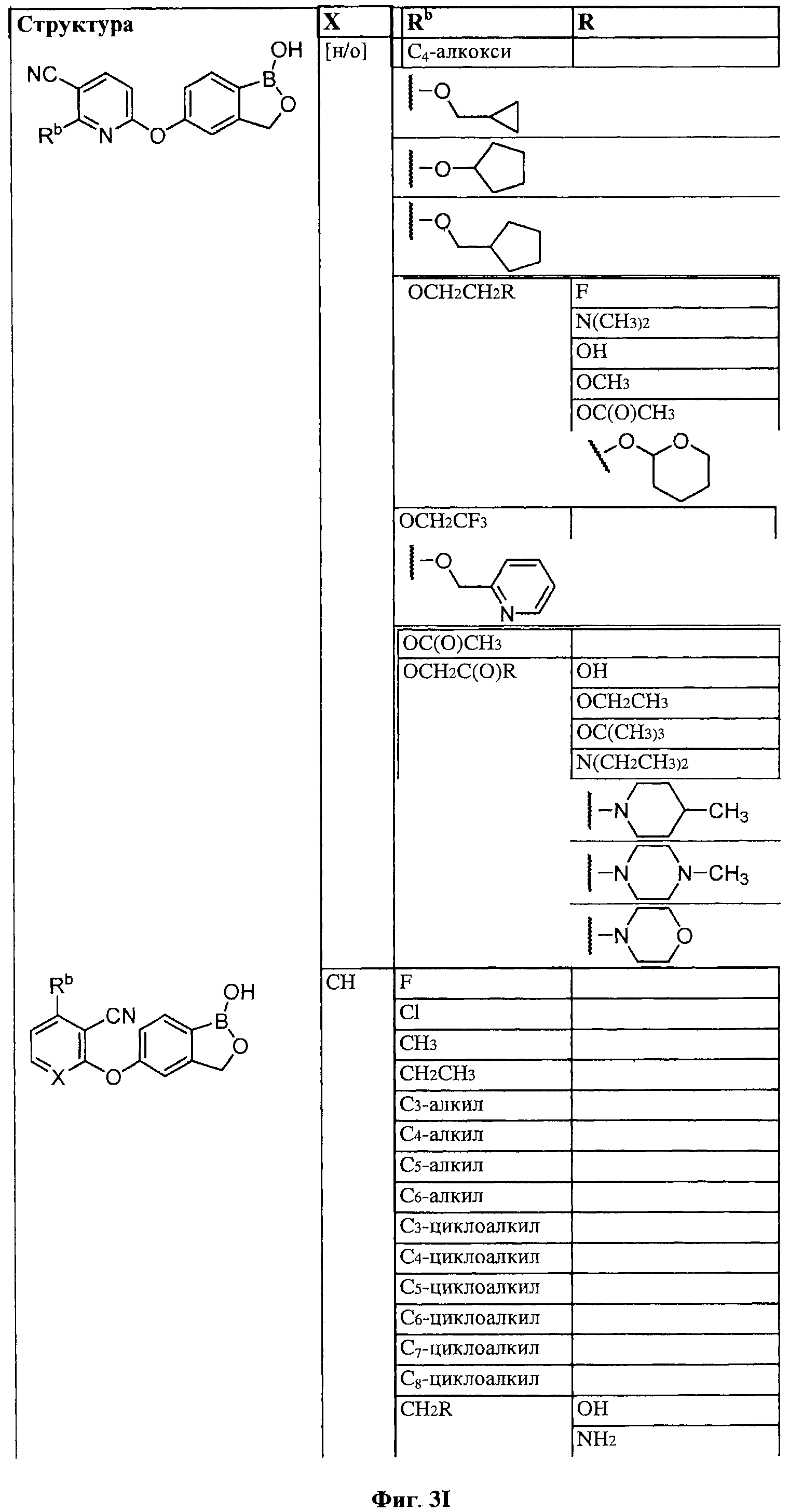
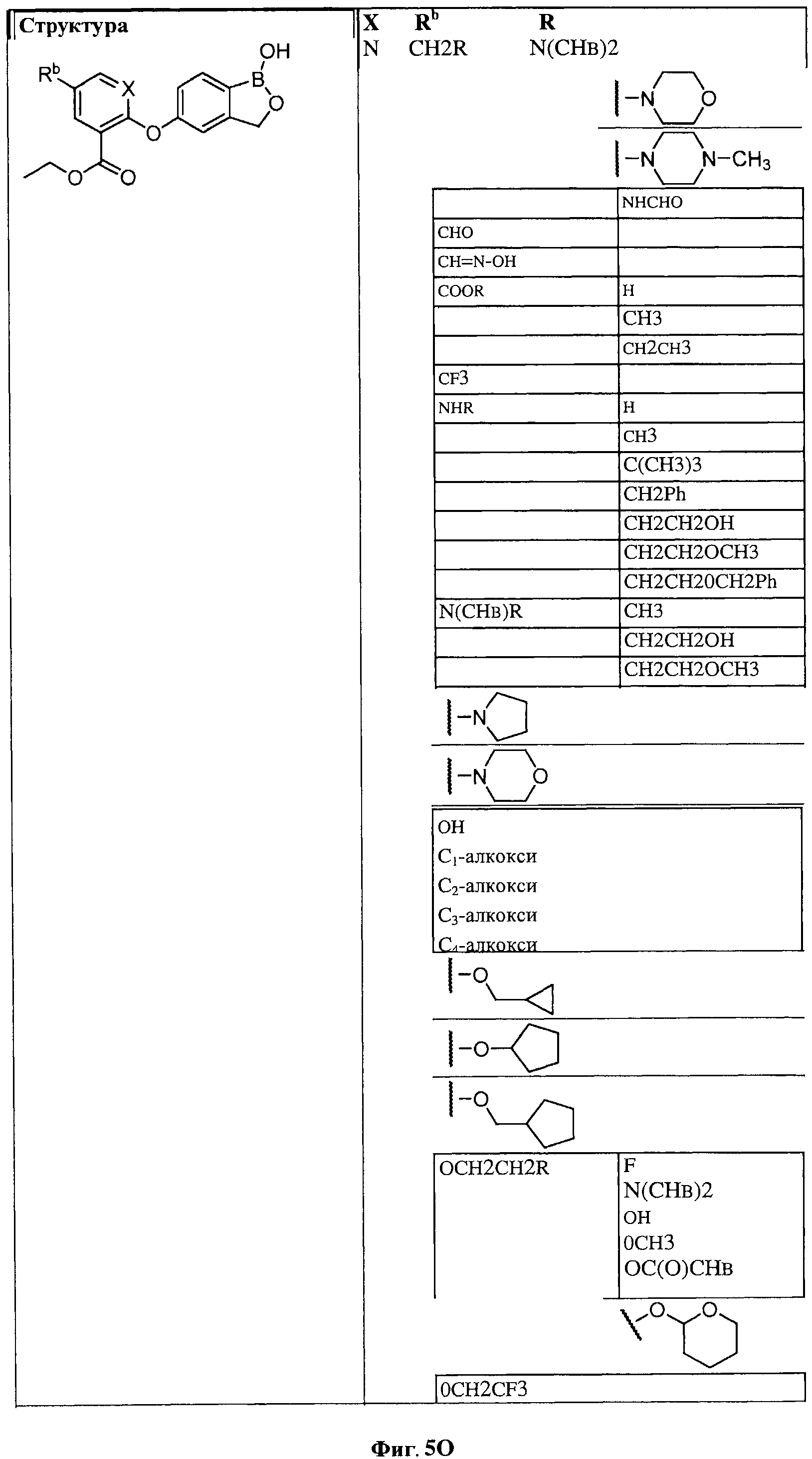
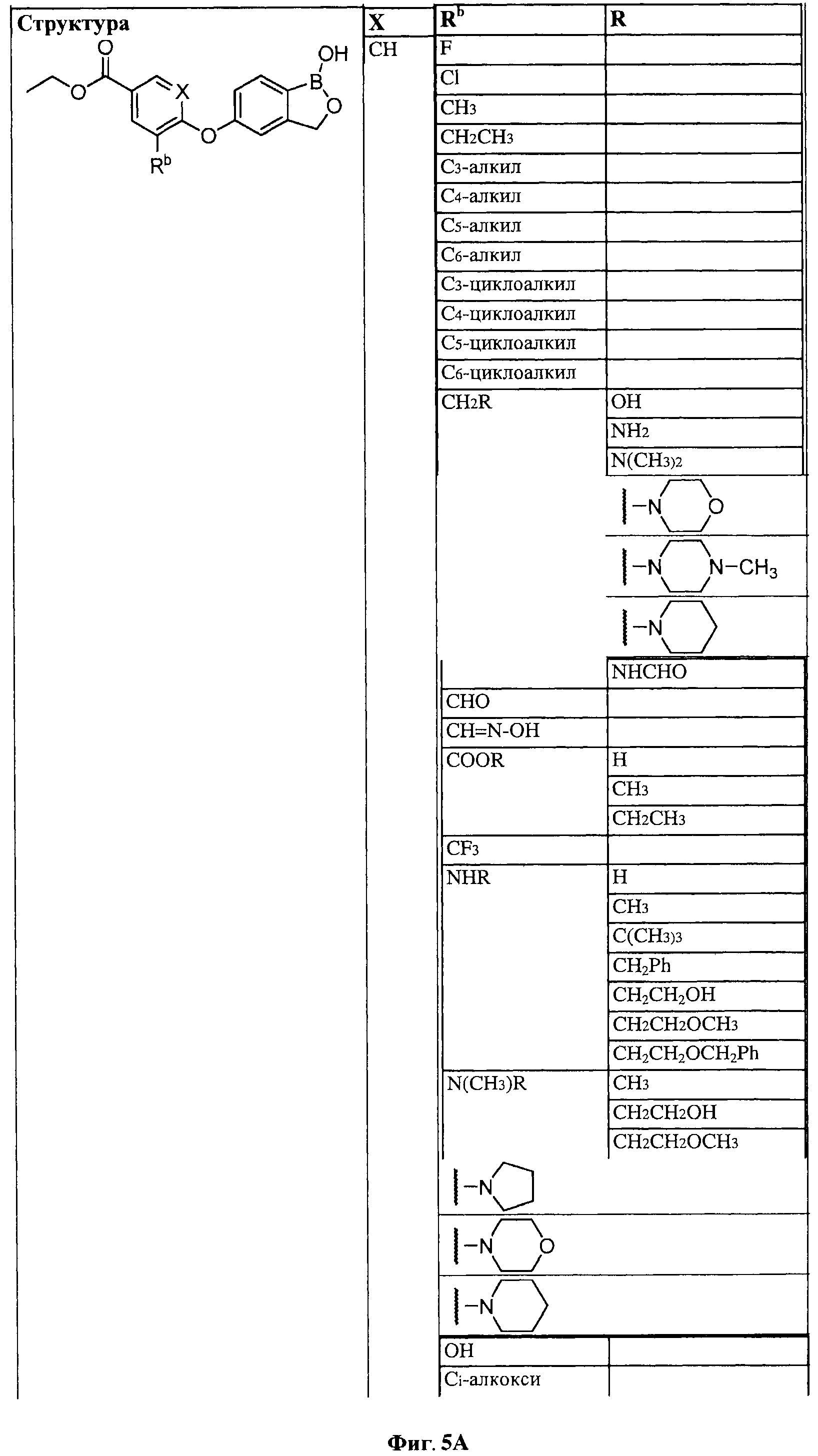
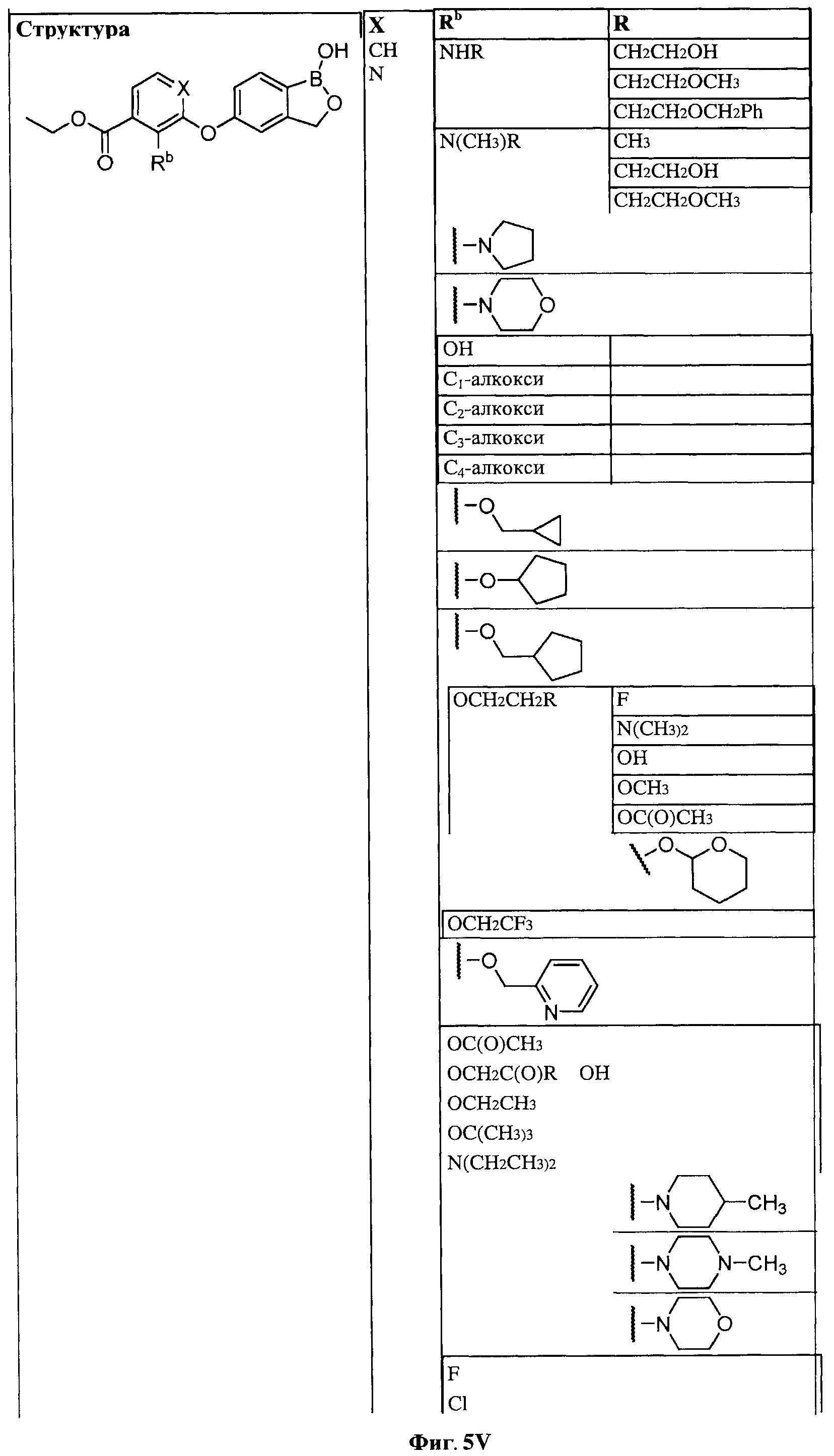
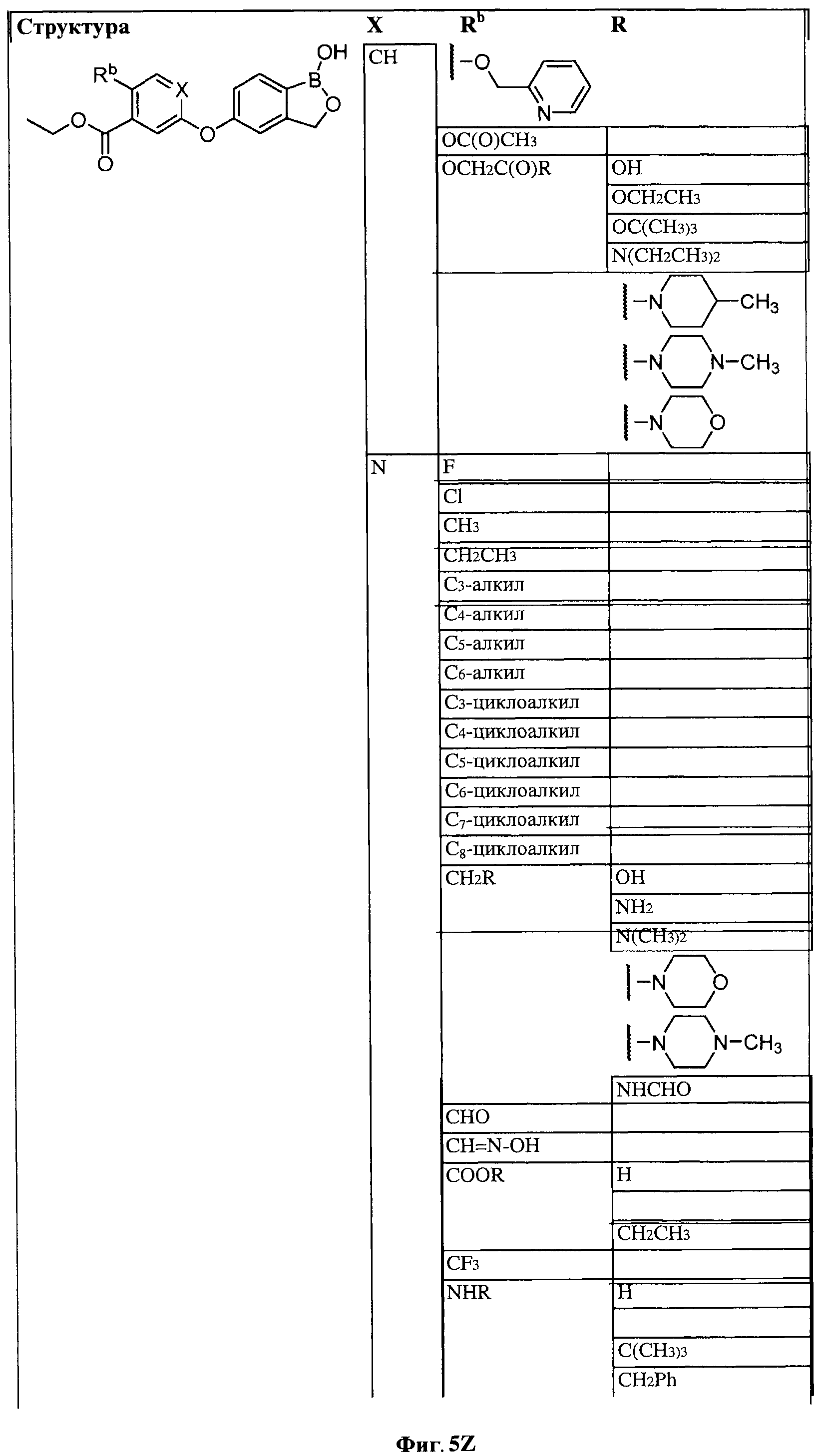
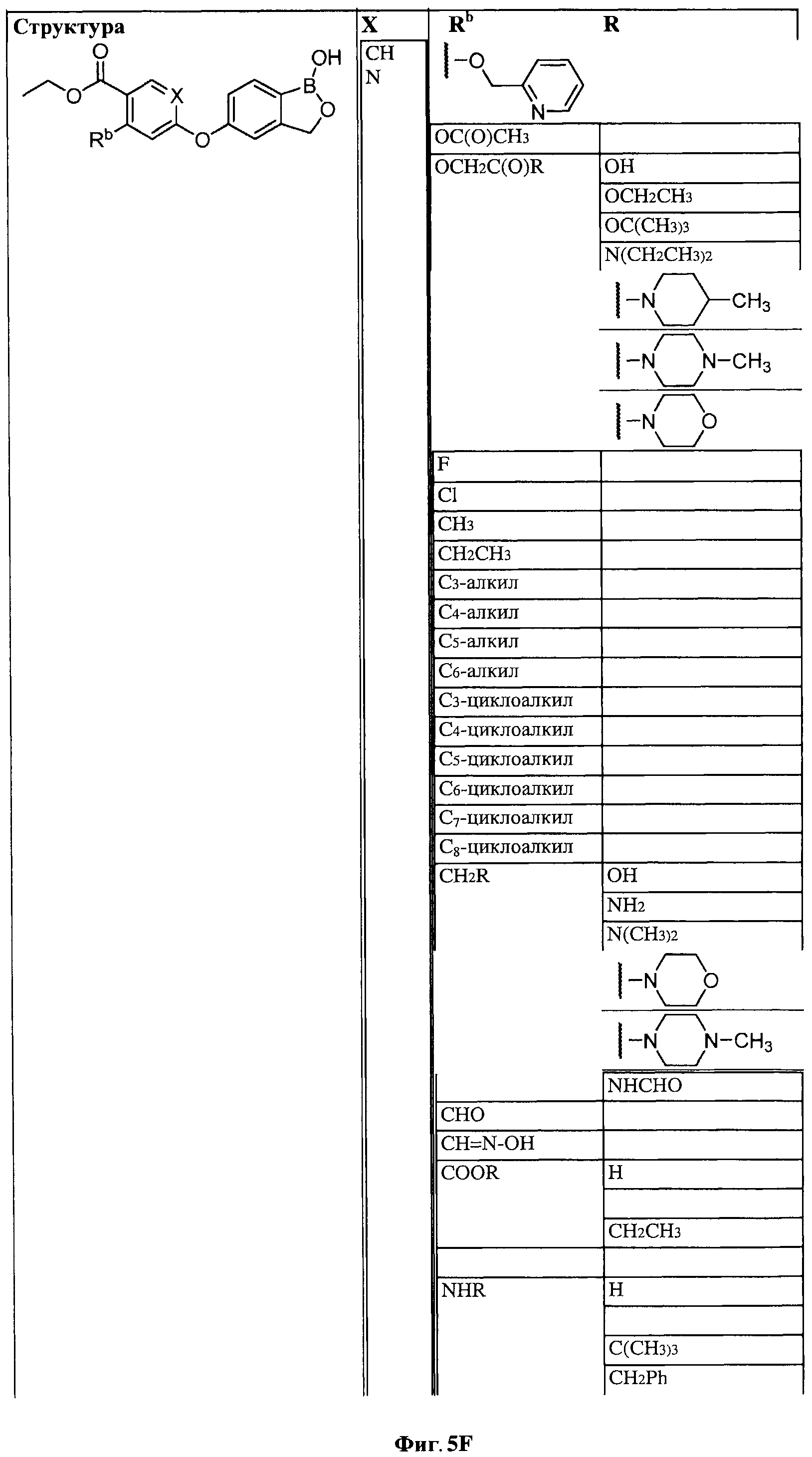
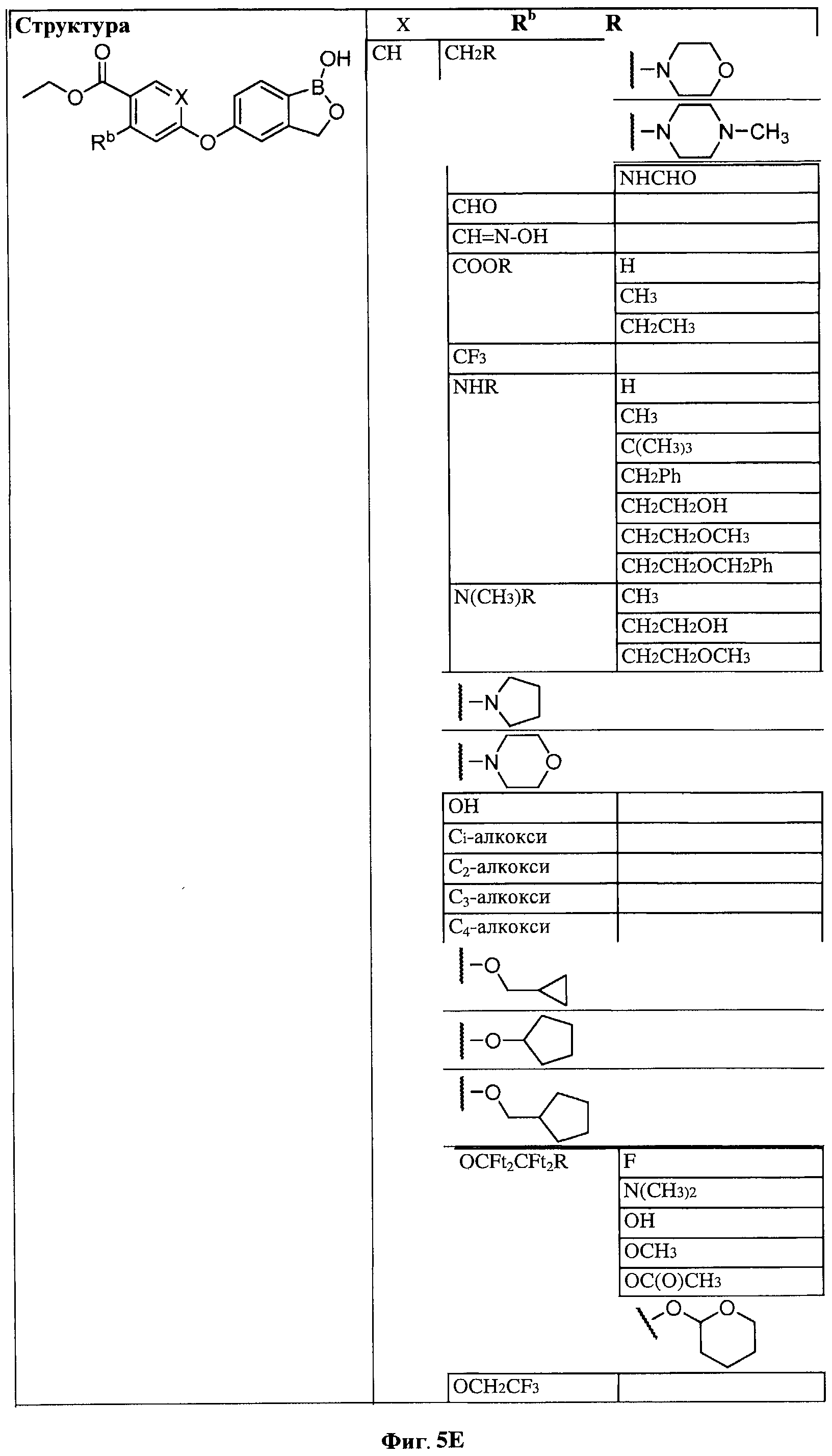
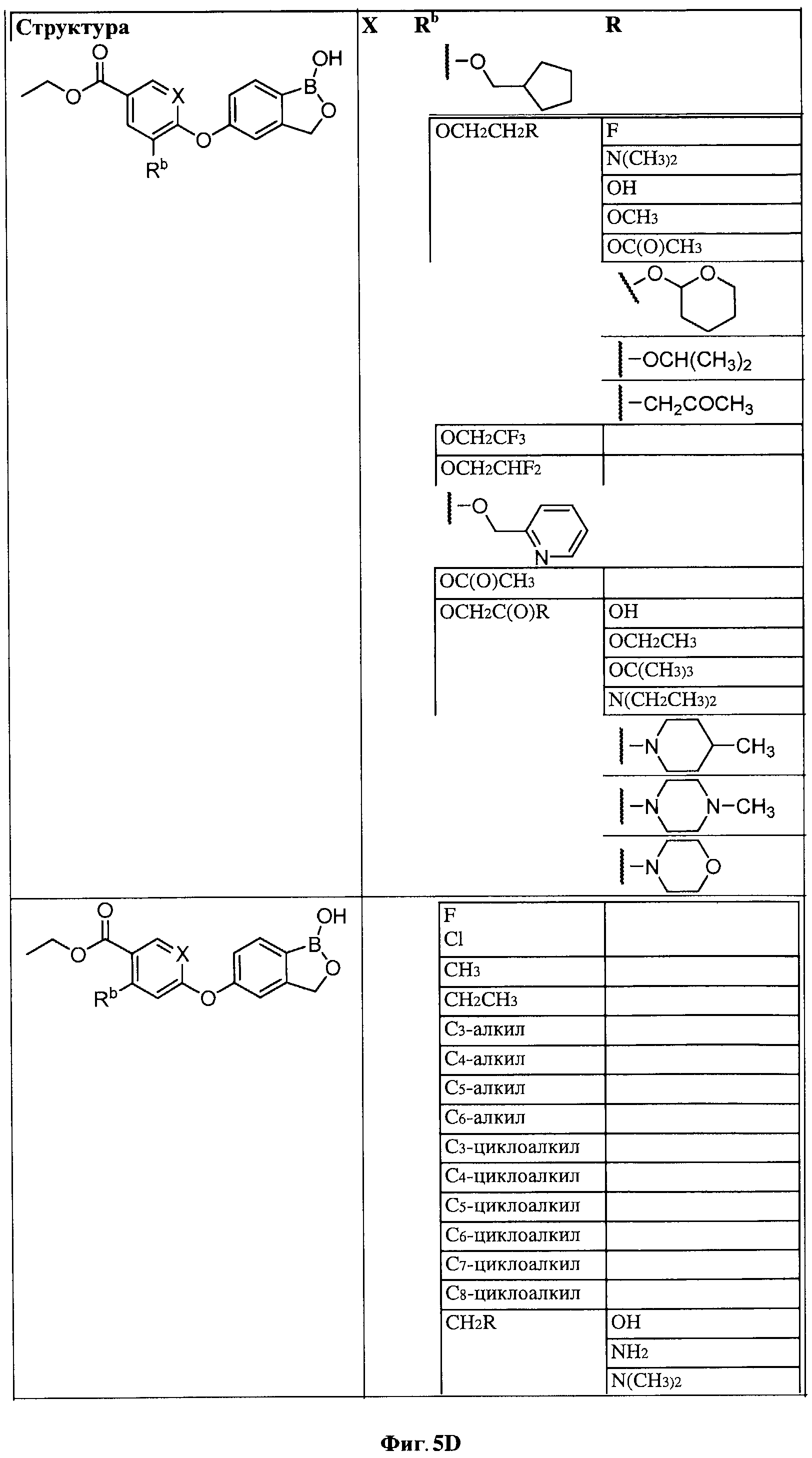
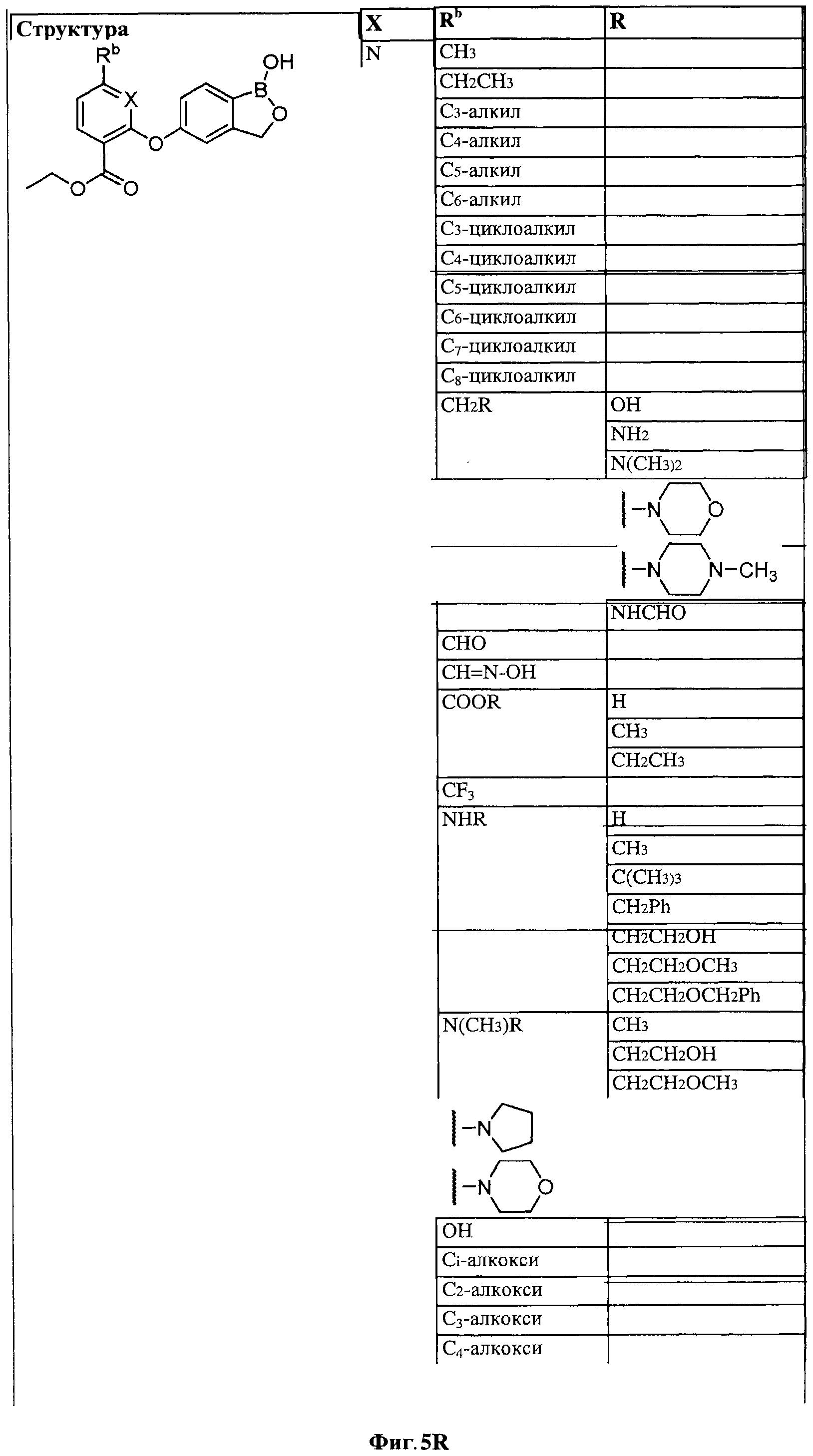
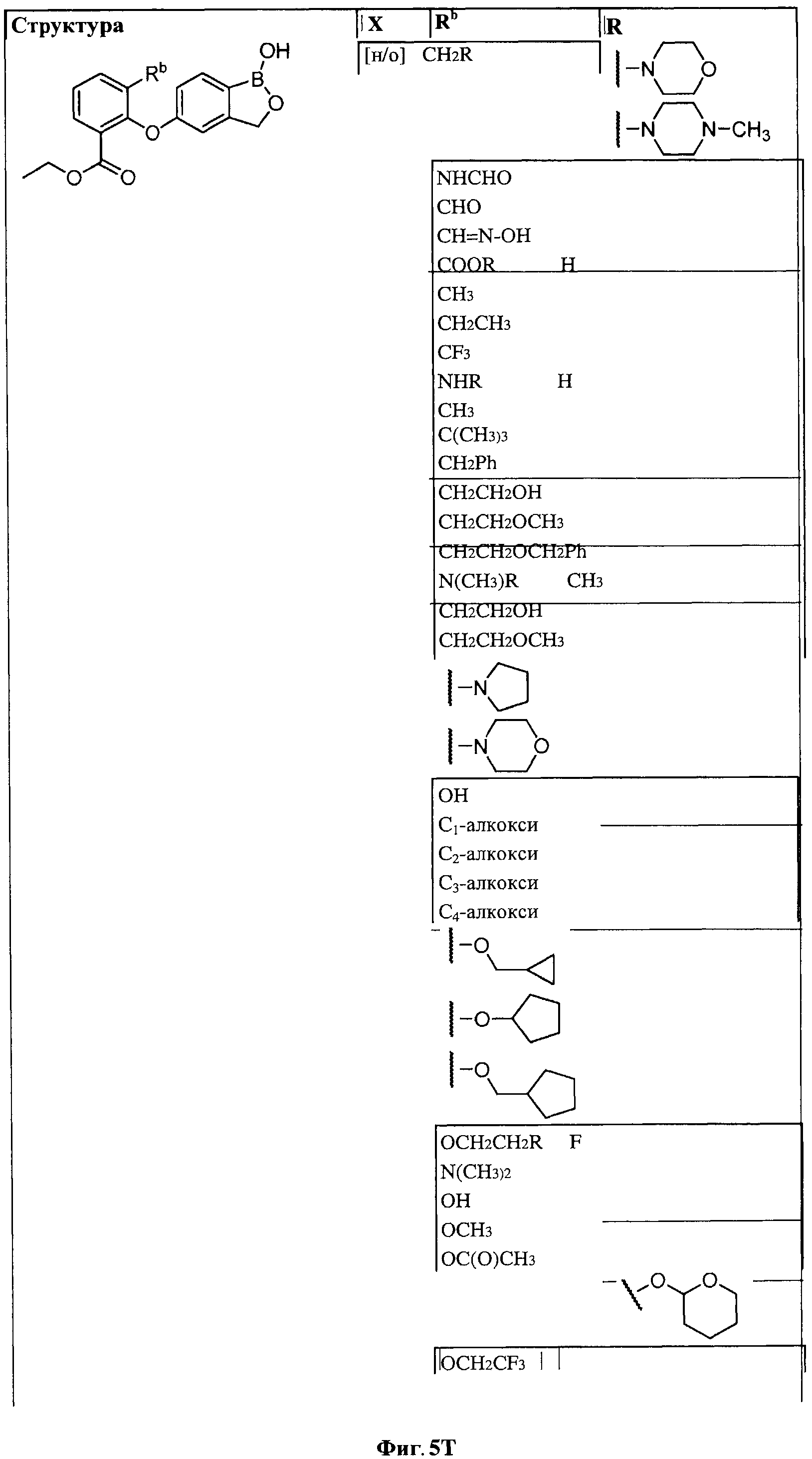
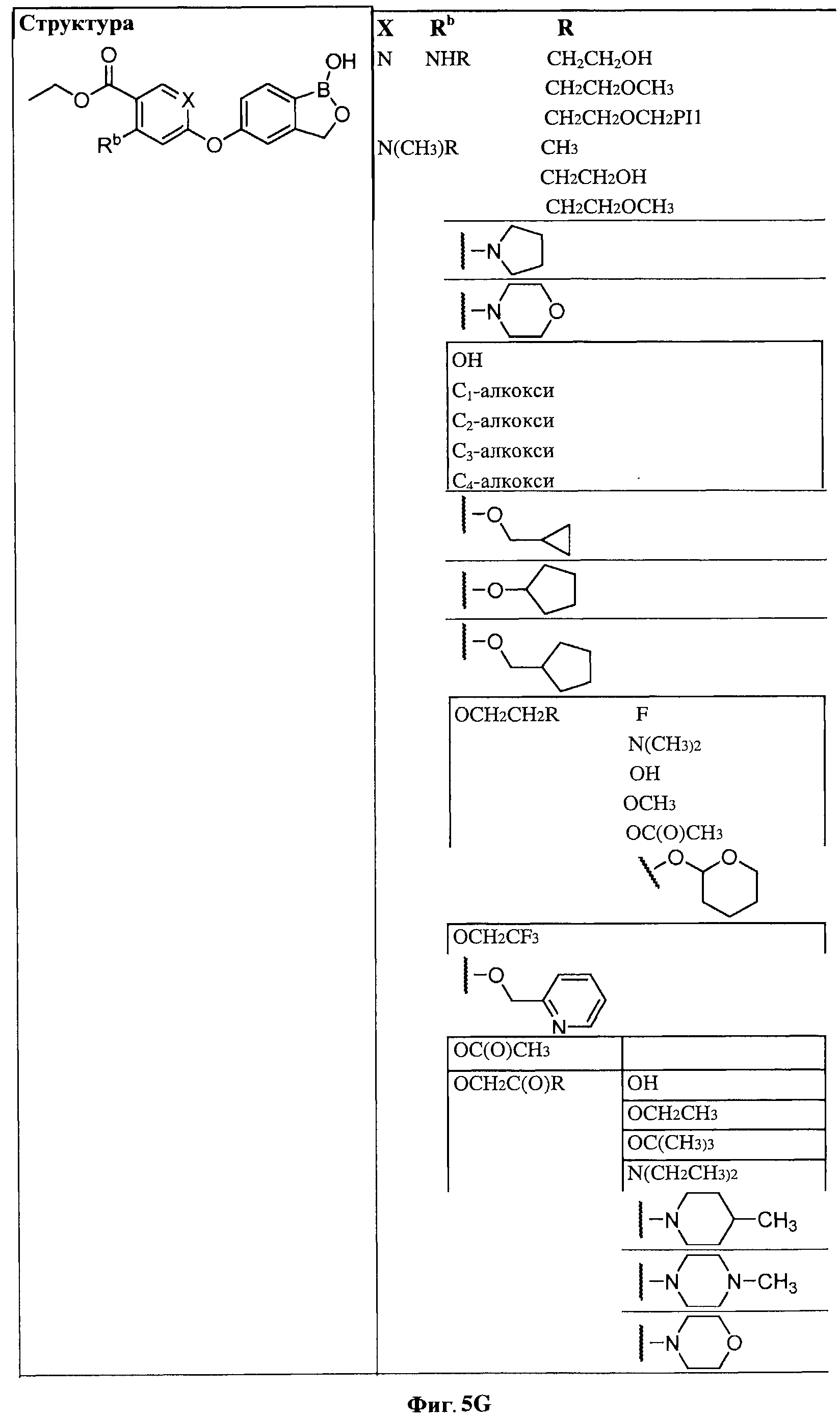
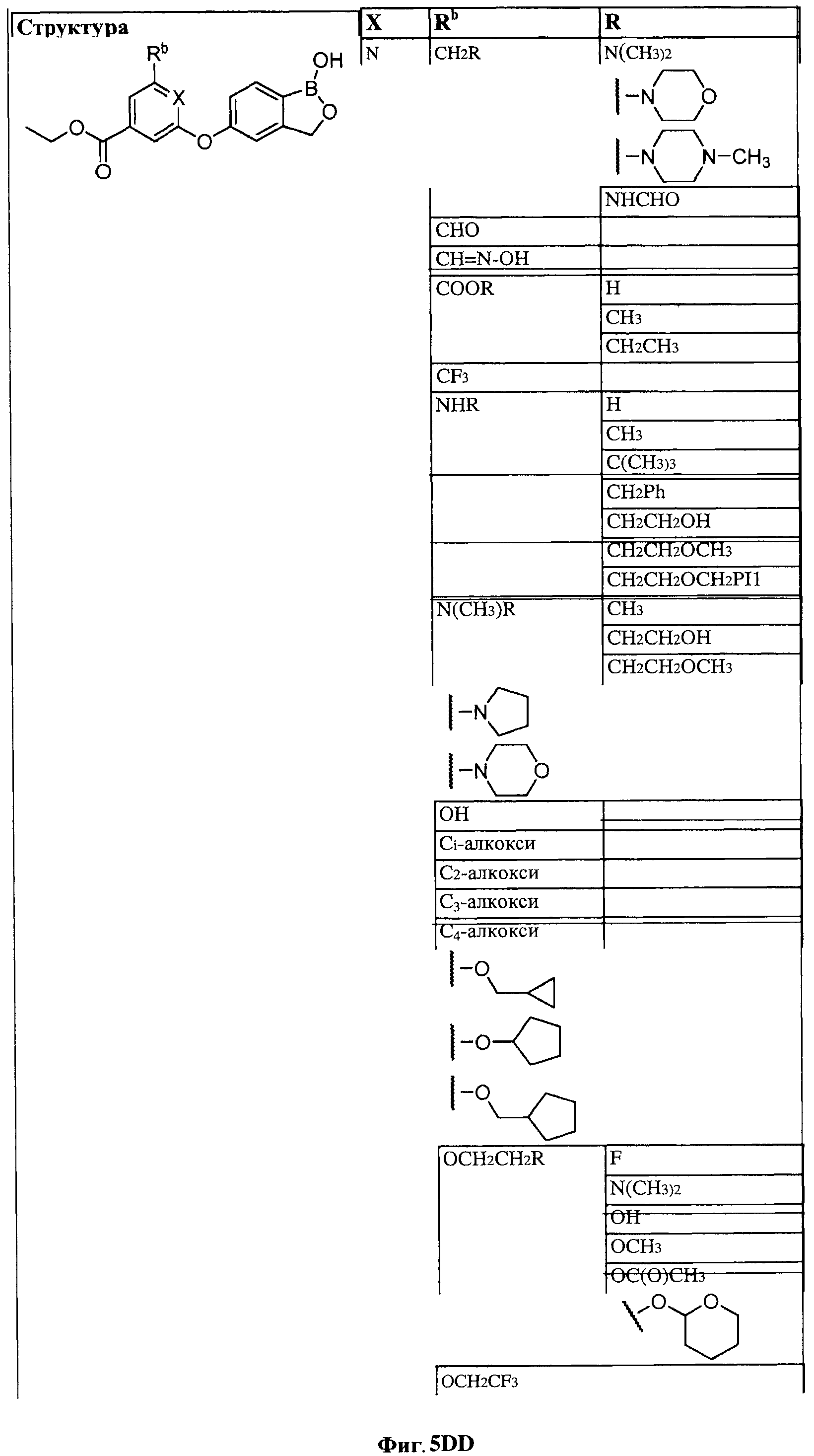
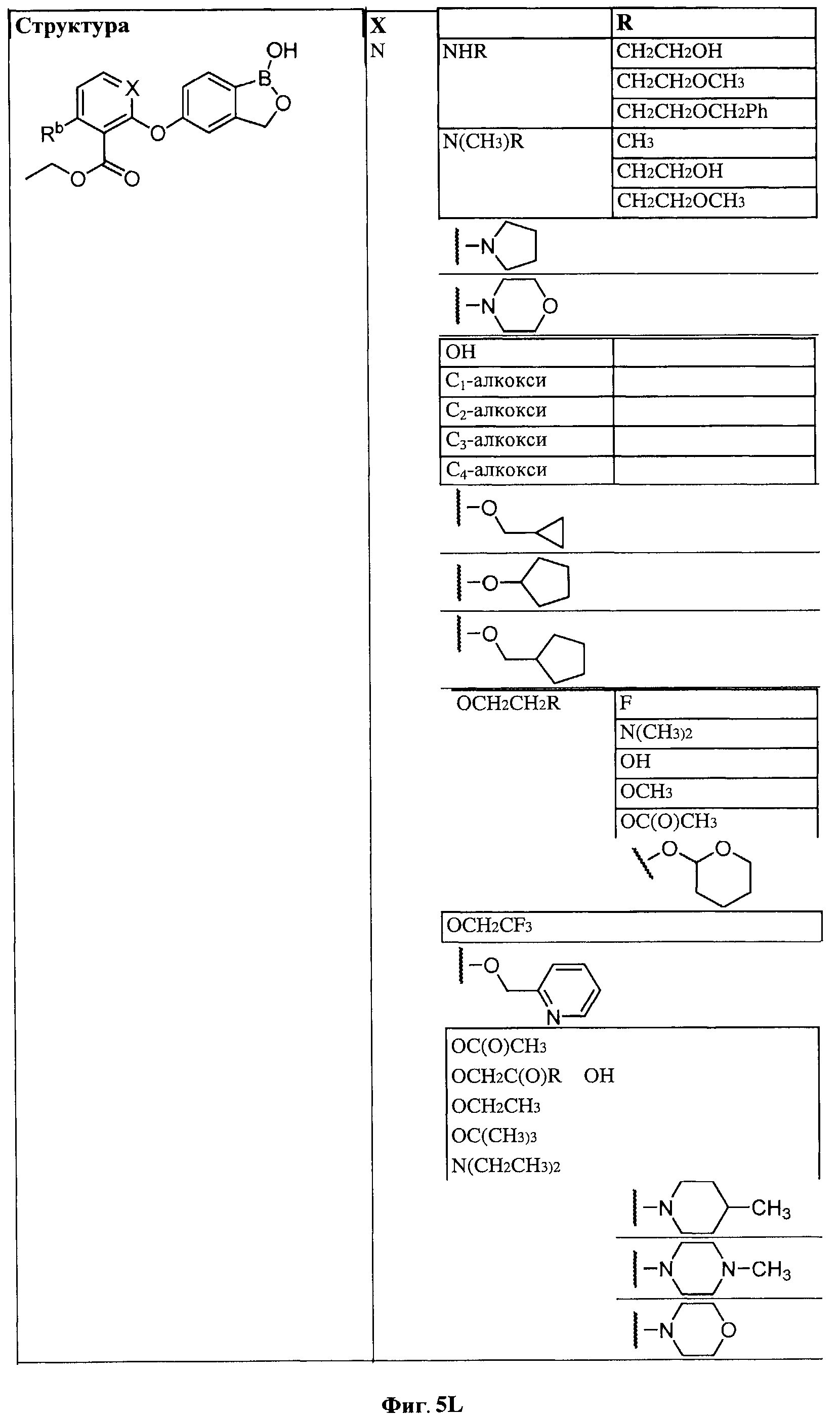
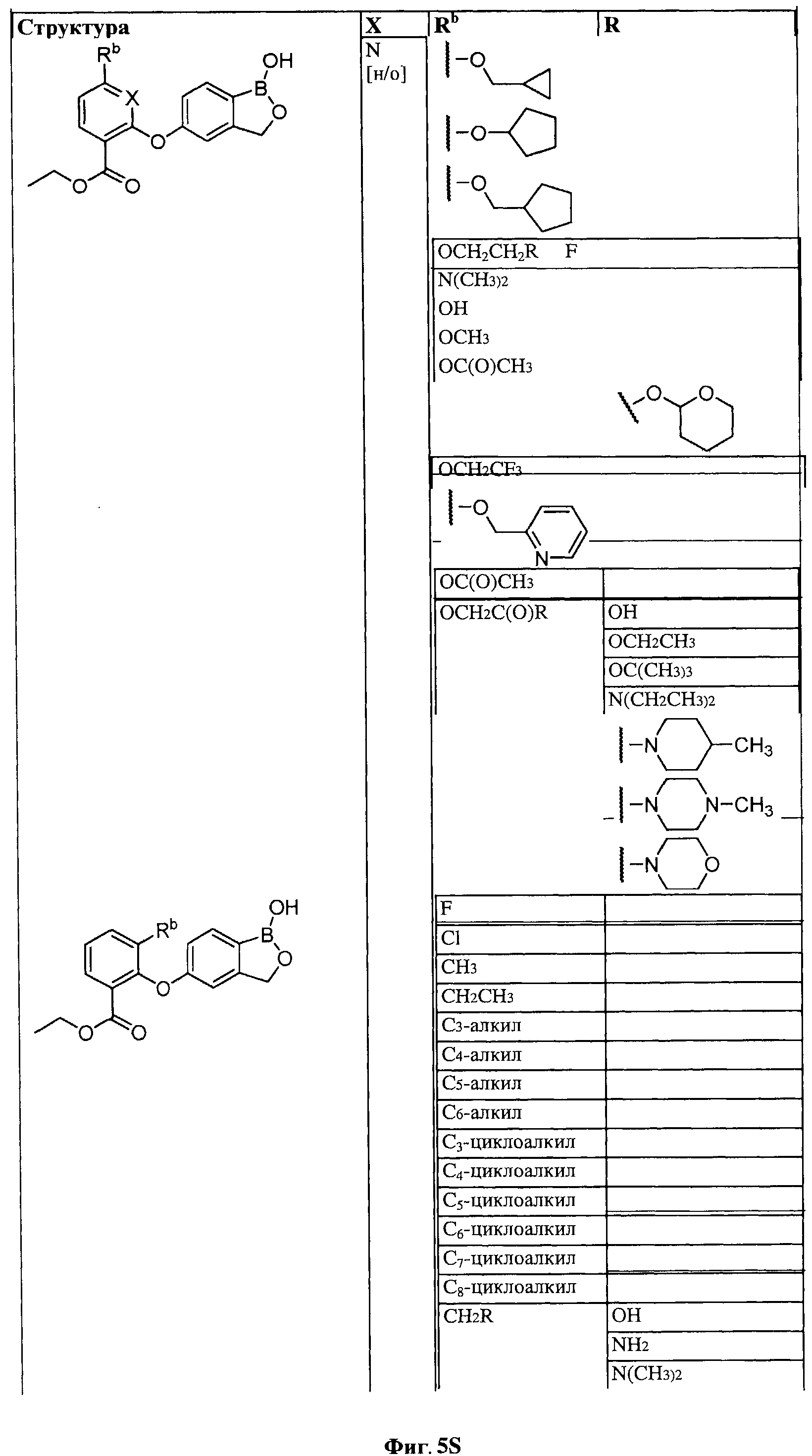
[0031] На ФИГ.5 показаны примеры соединений согласно настоящему изобретению.
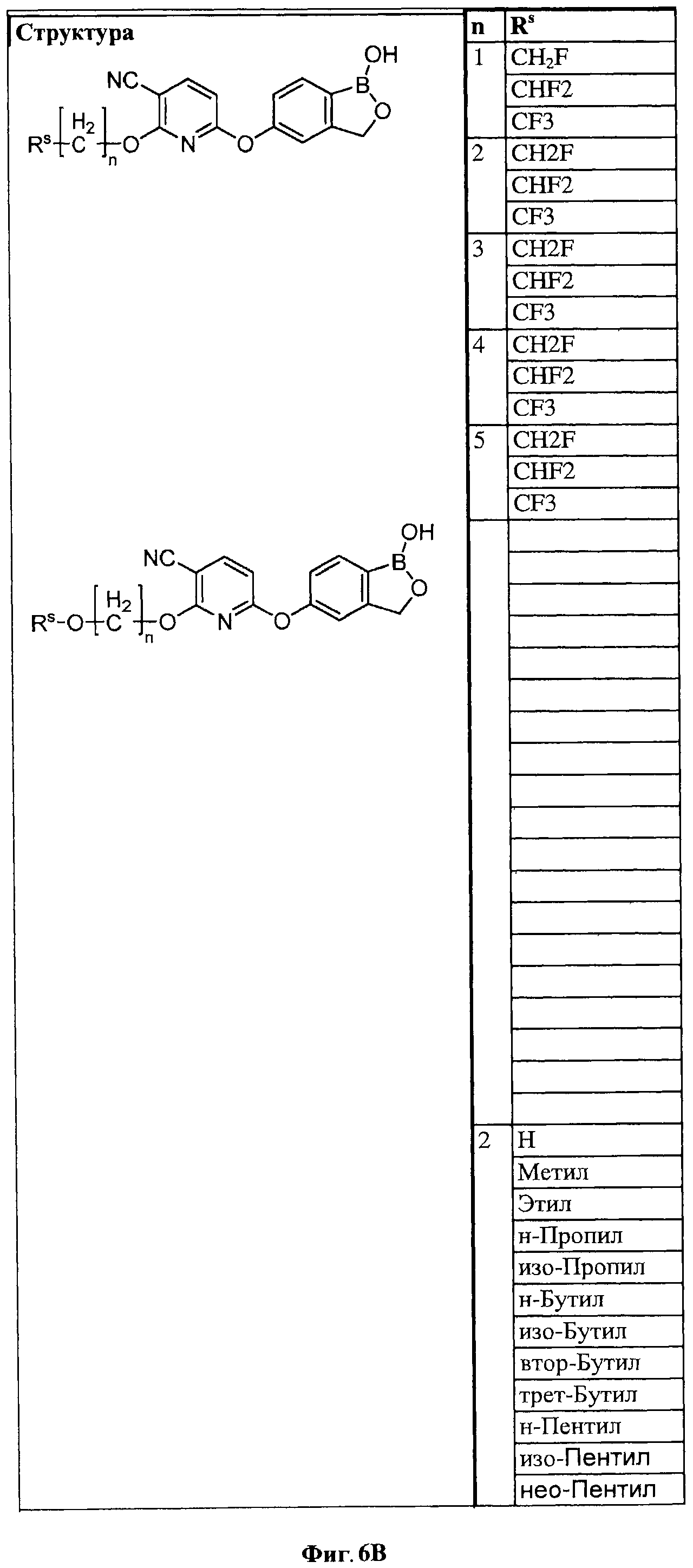
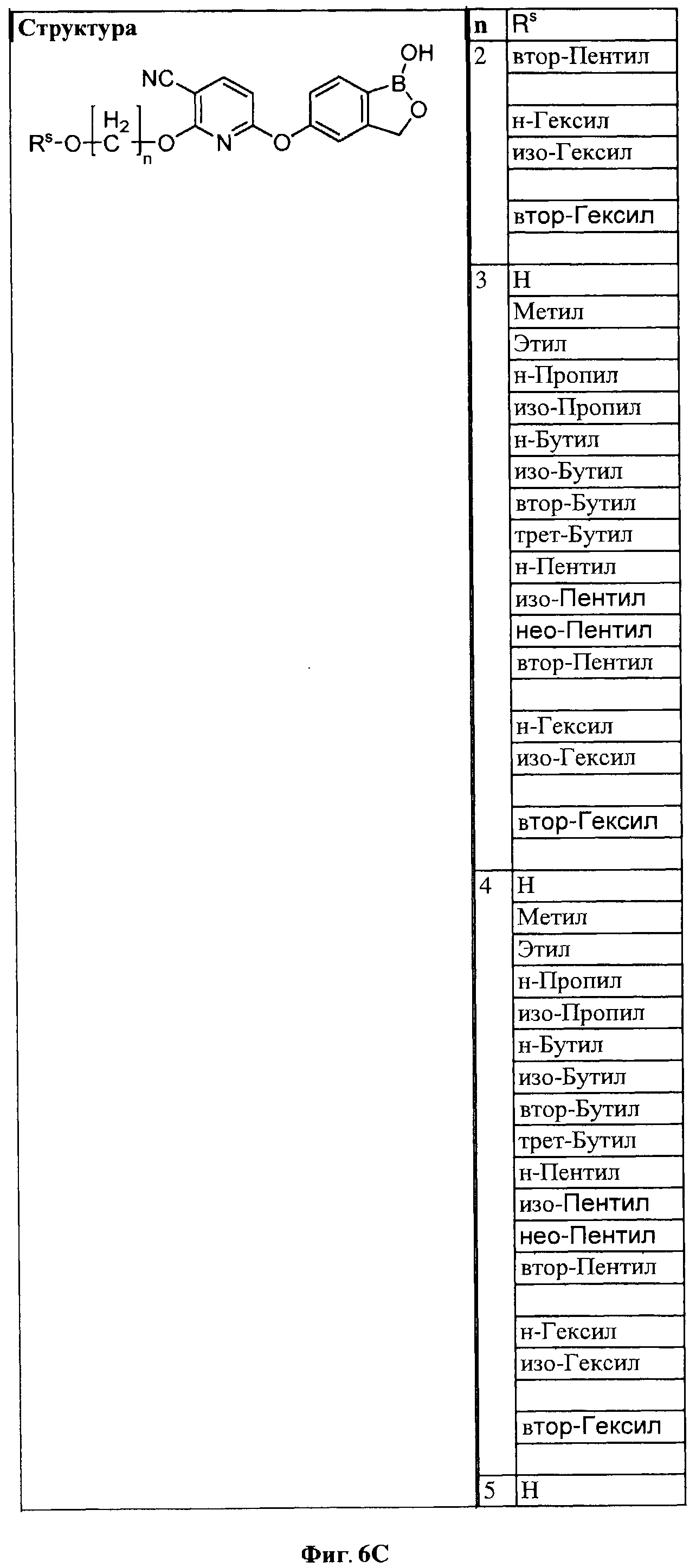
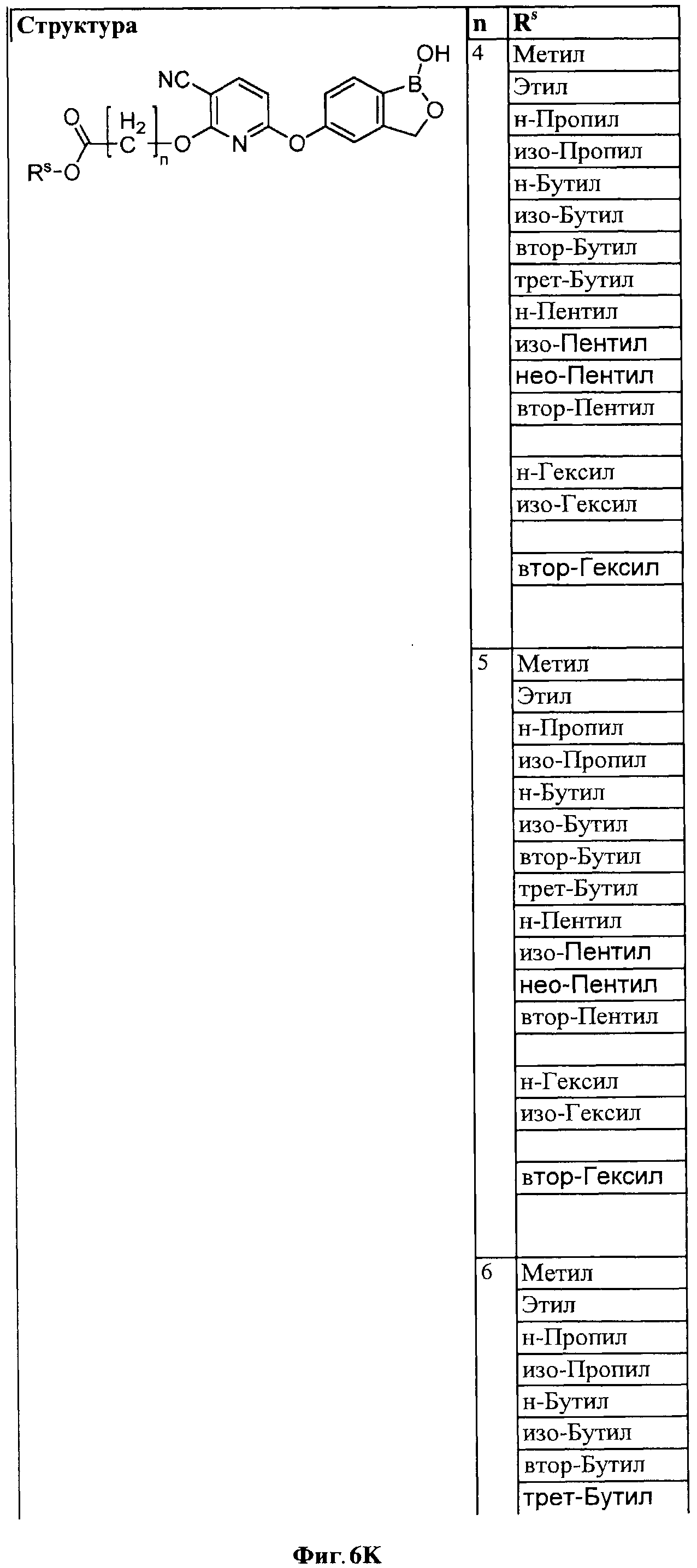
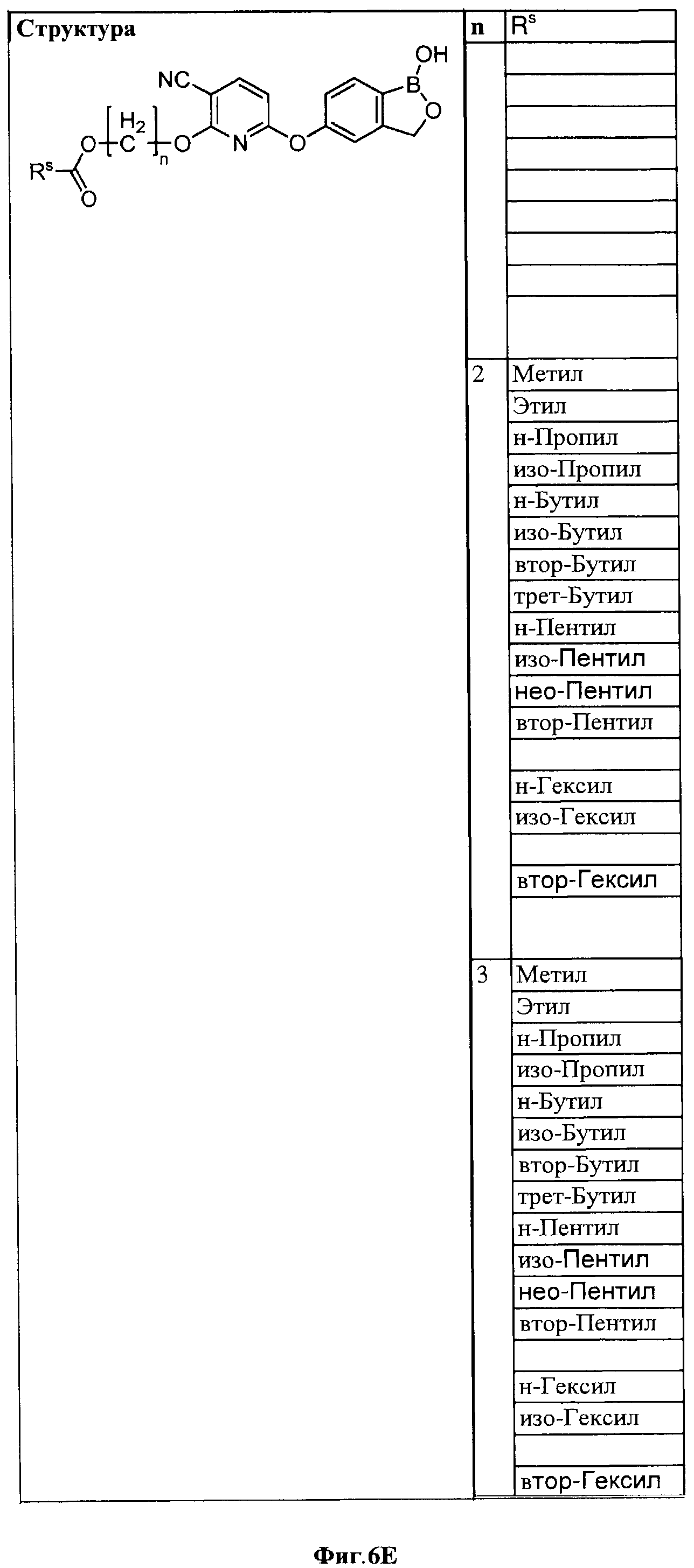
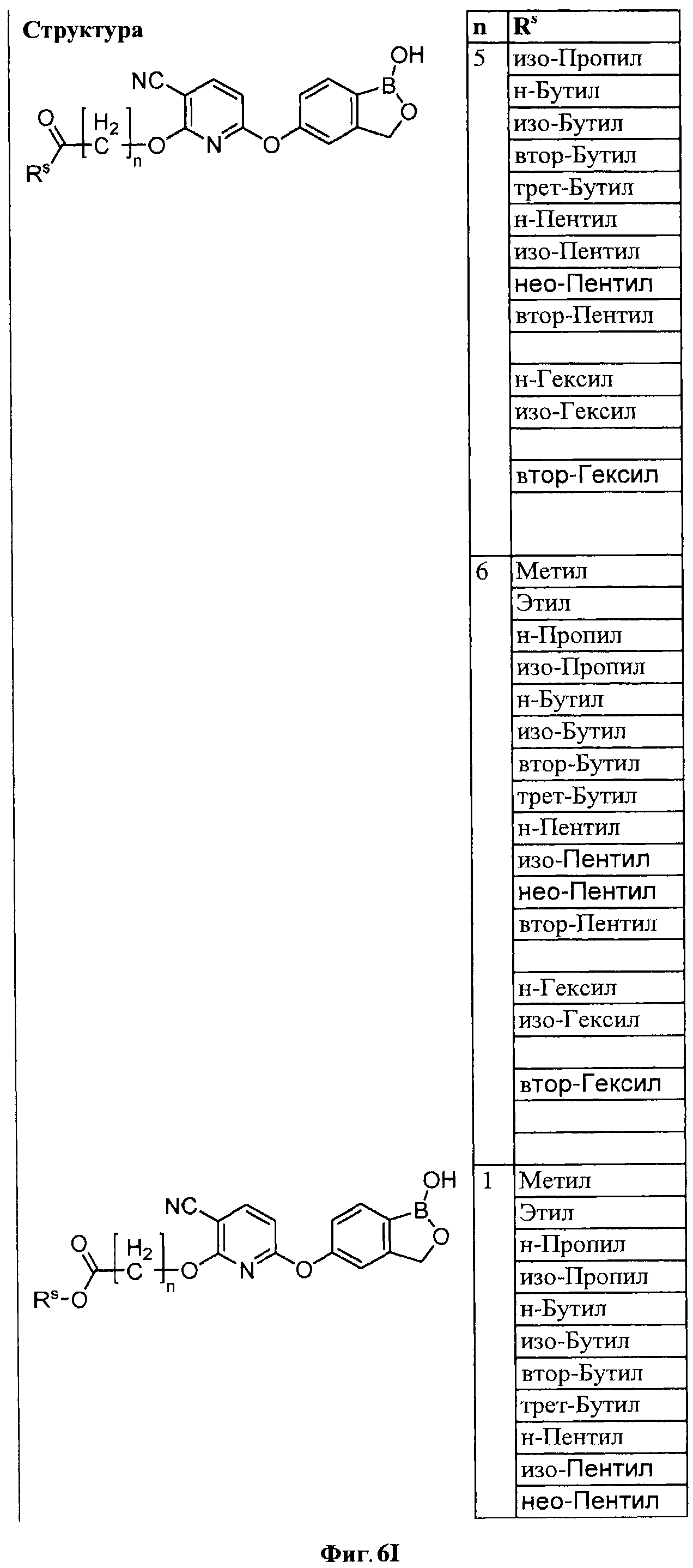
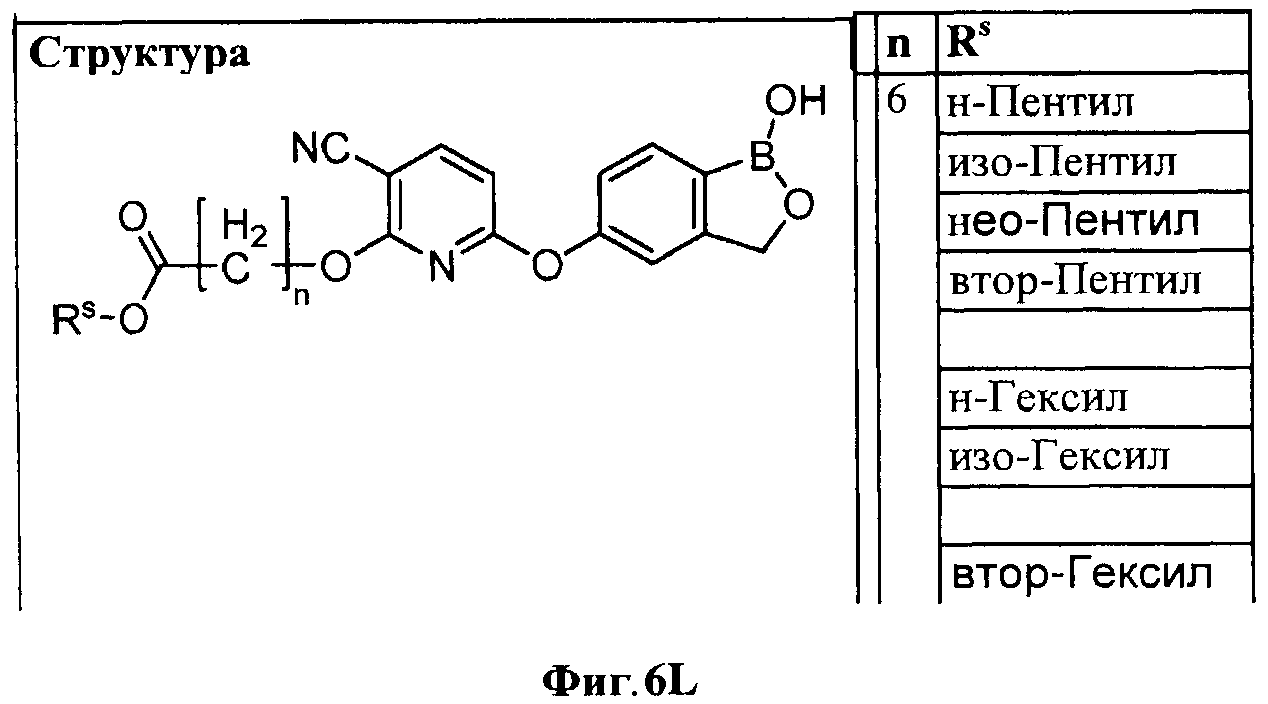
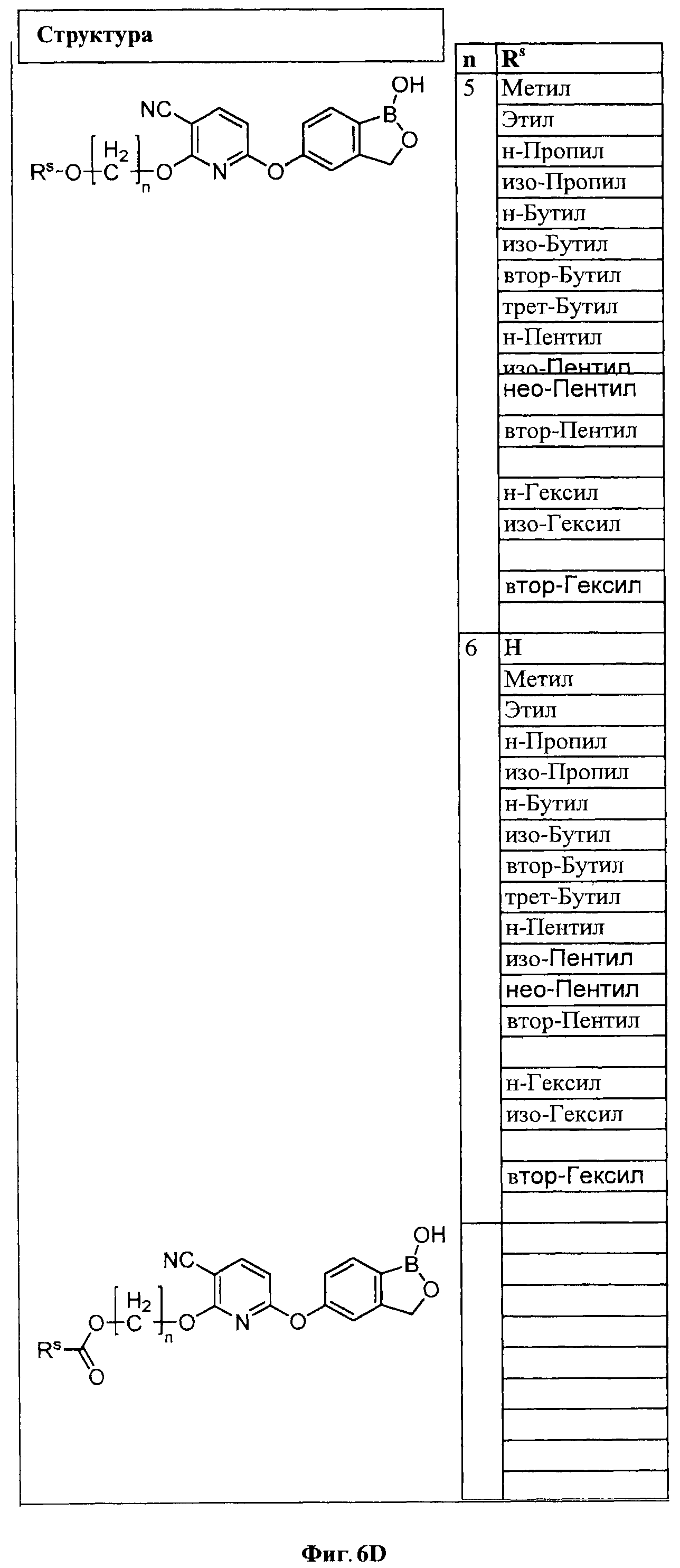
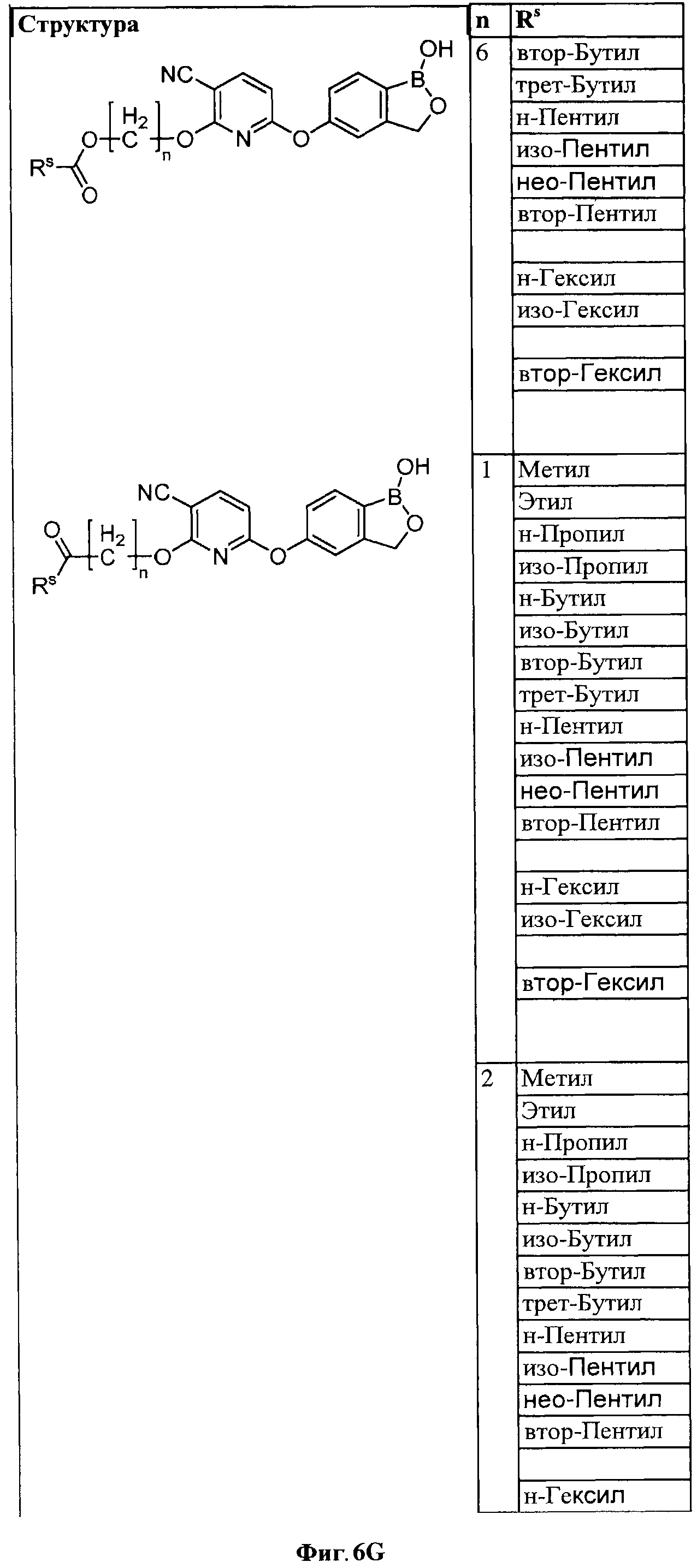
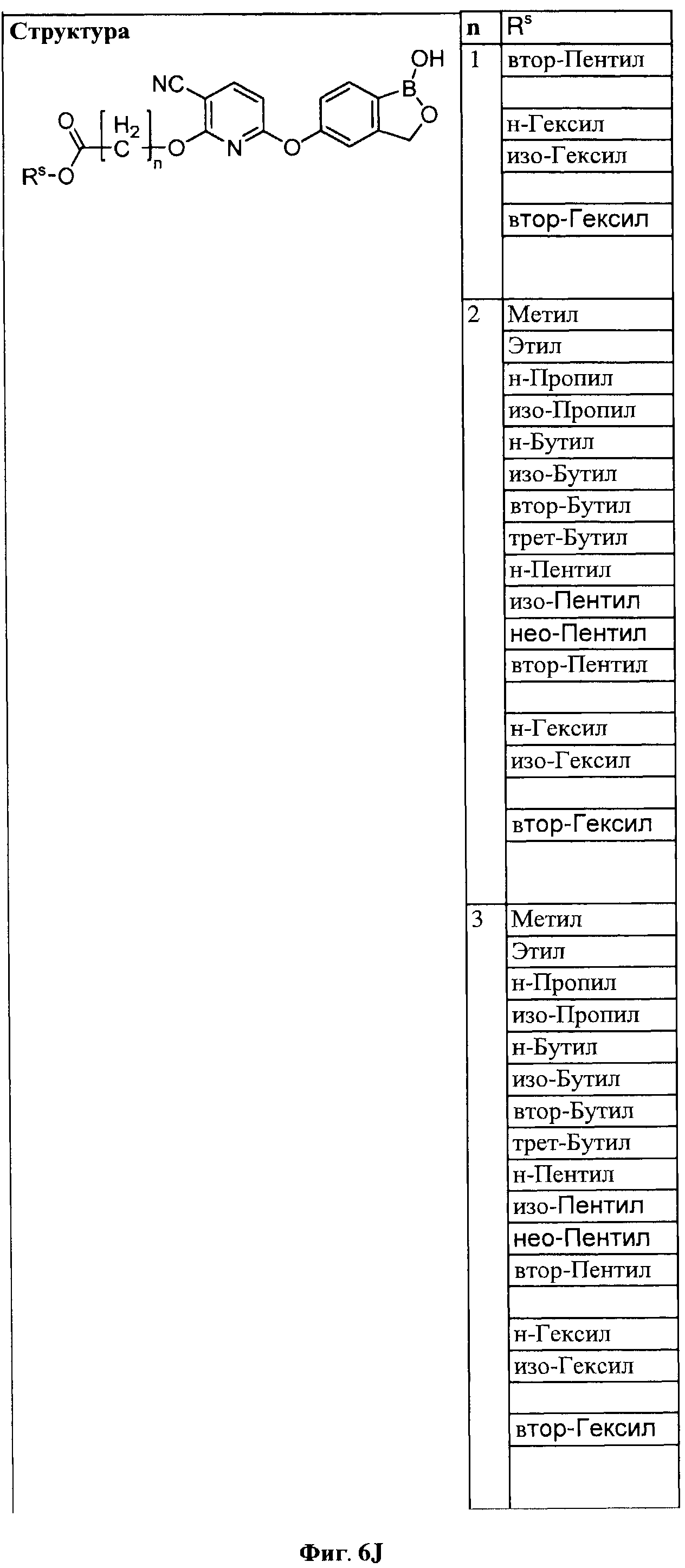
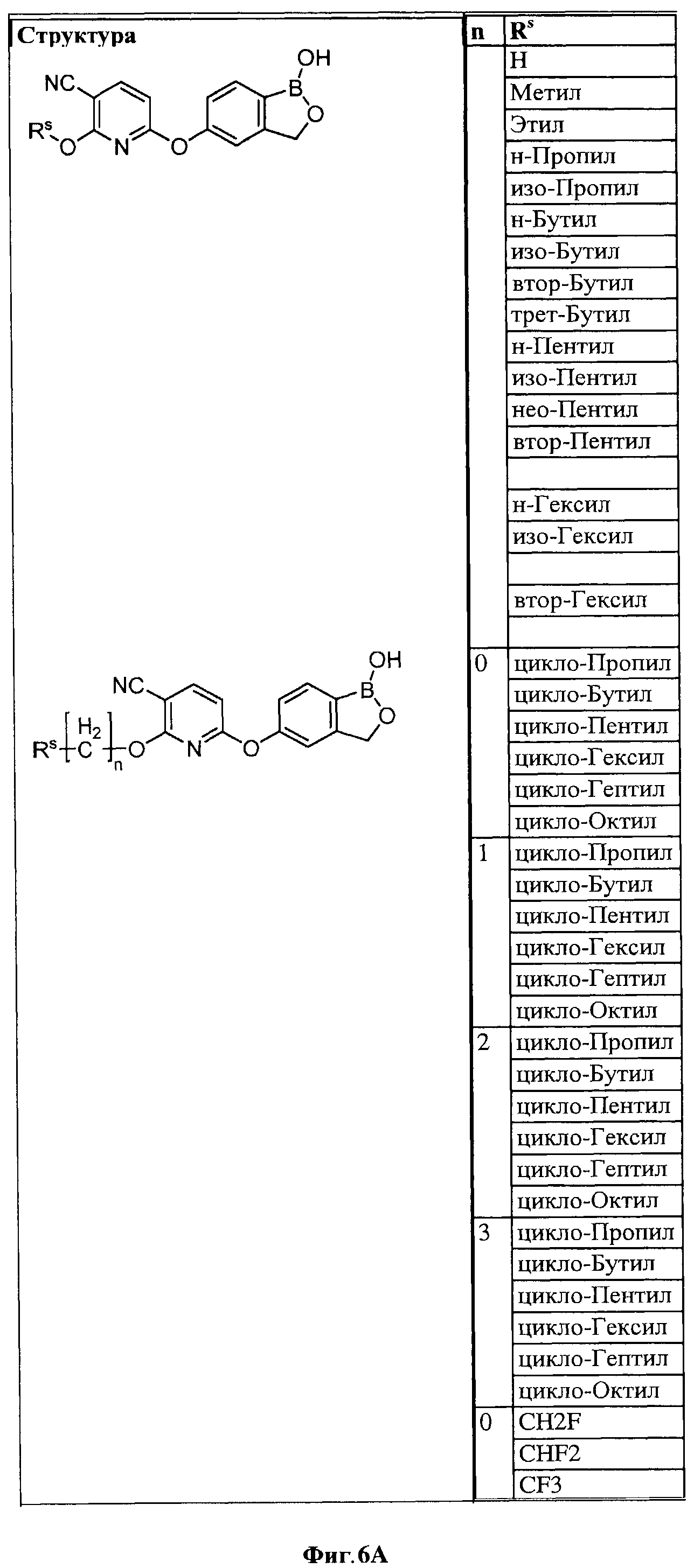
[0032] На ФИГ.6 показаны примеры соединений согласно настоящему изобретению.
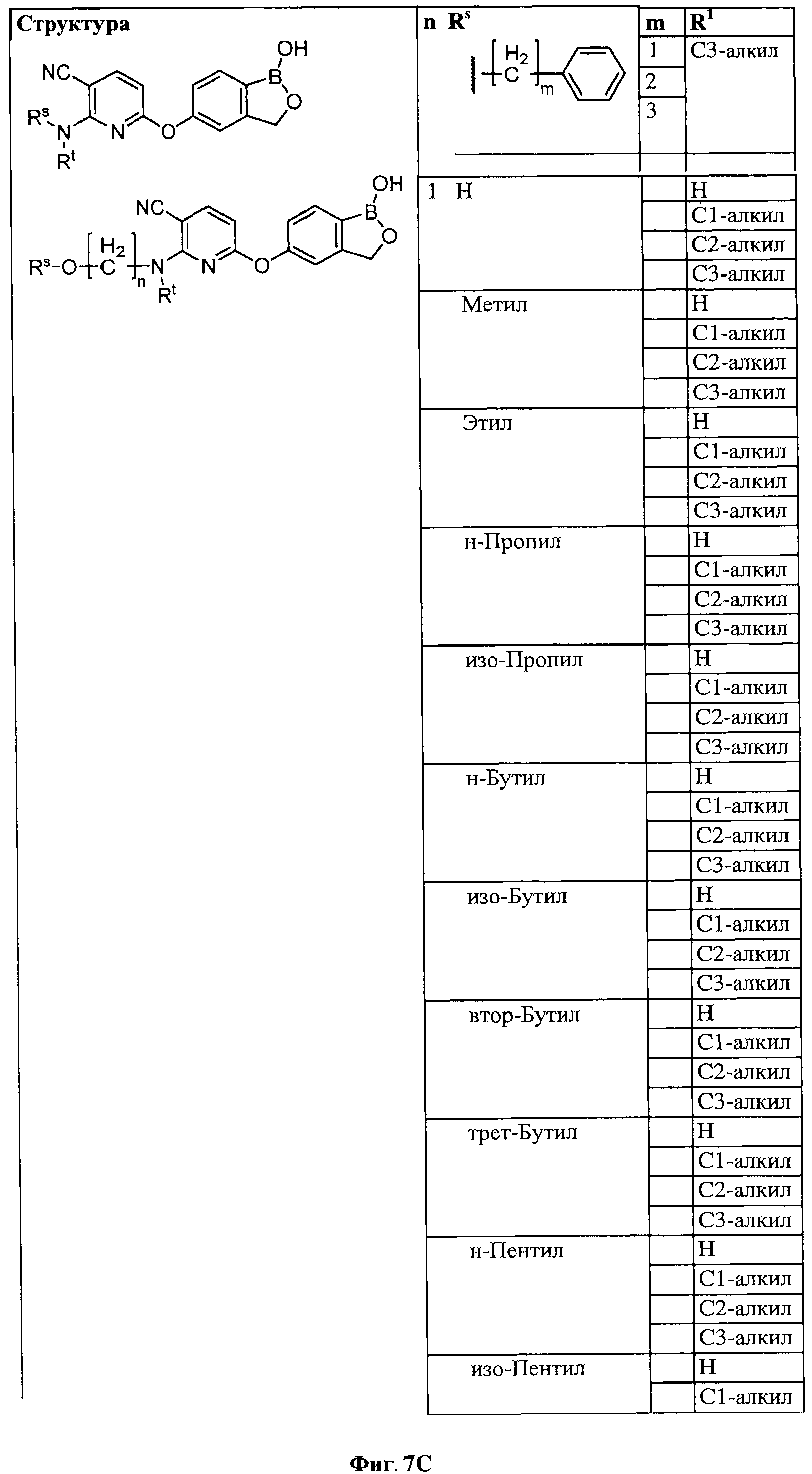
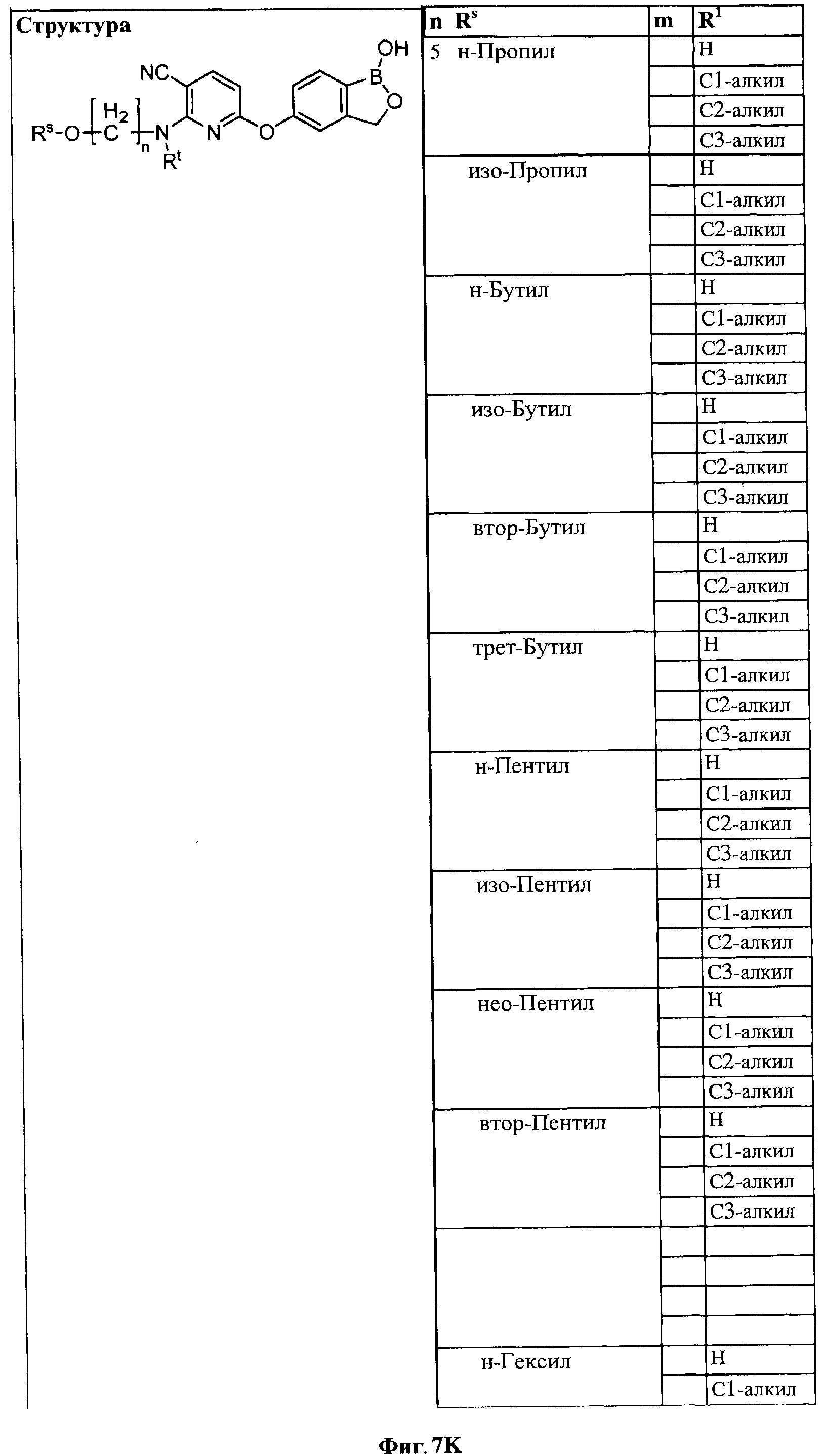
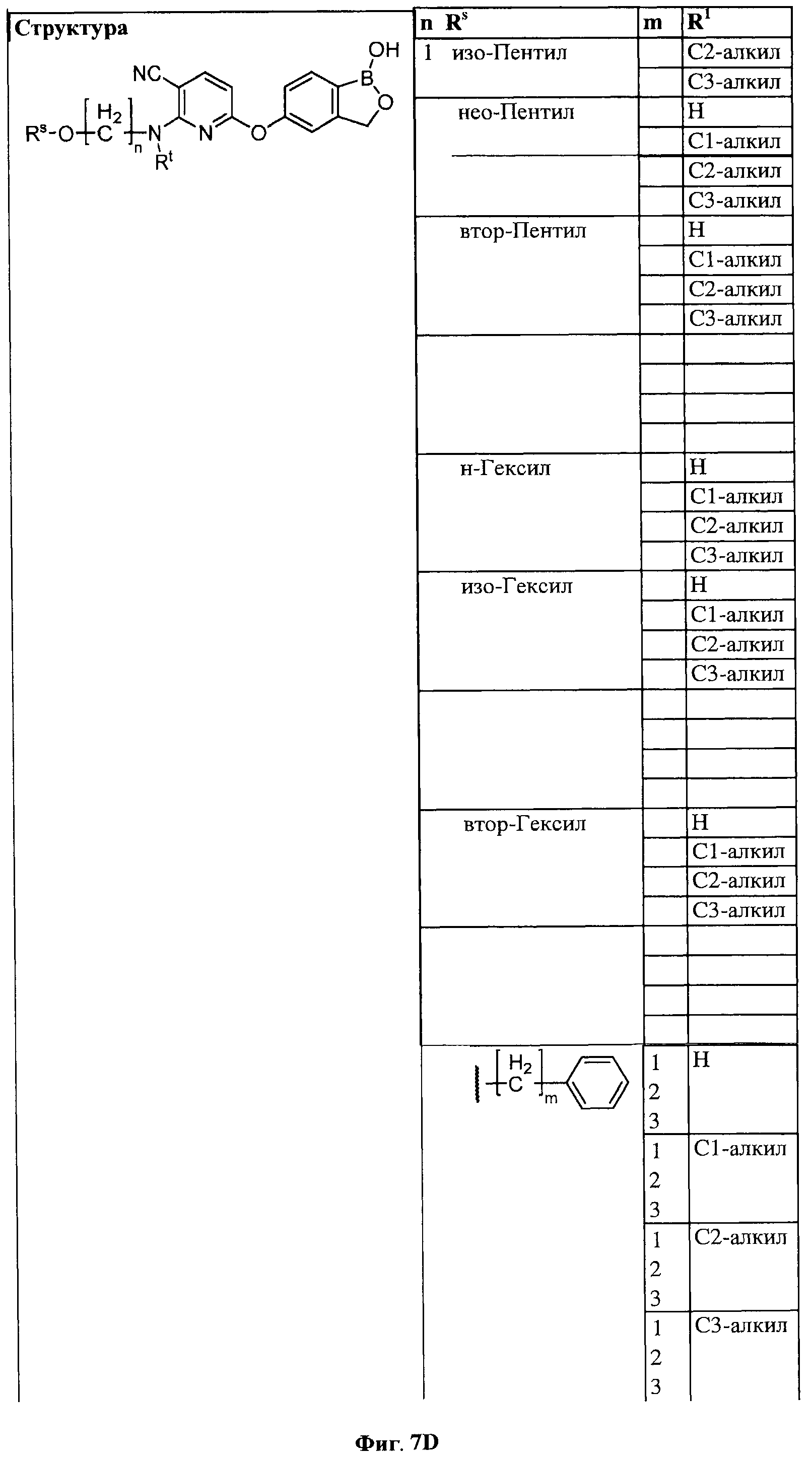
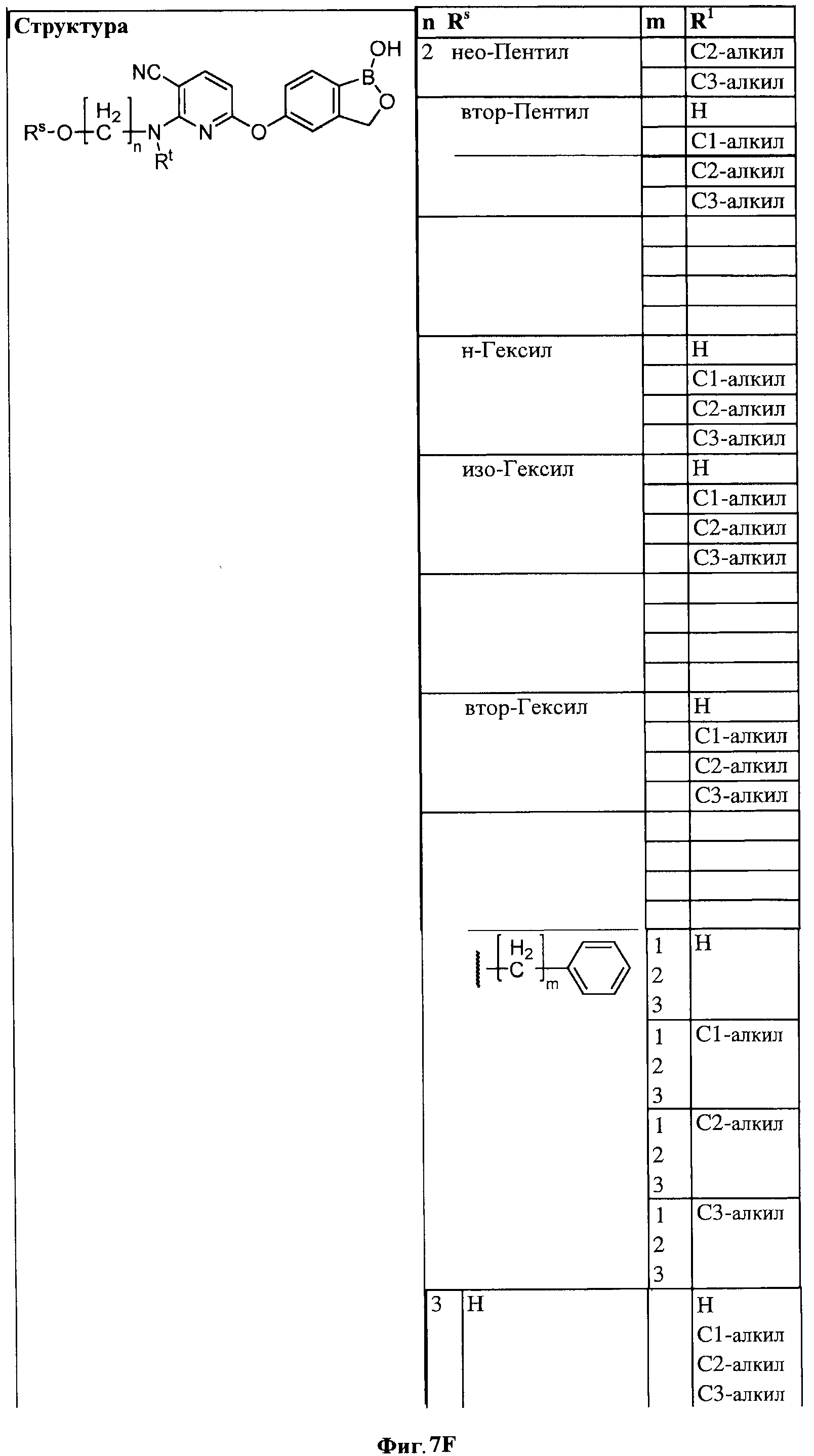
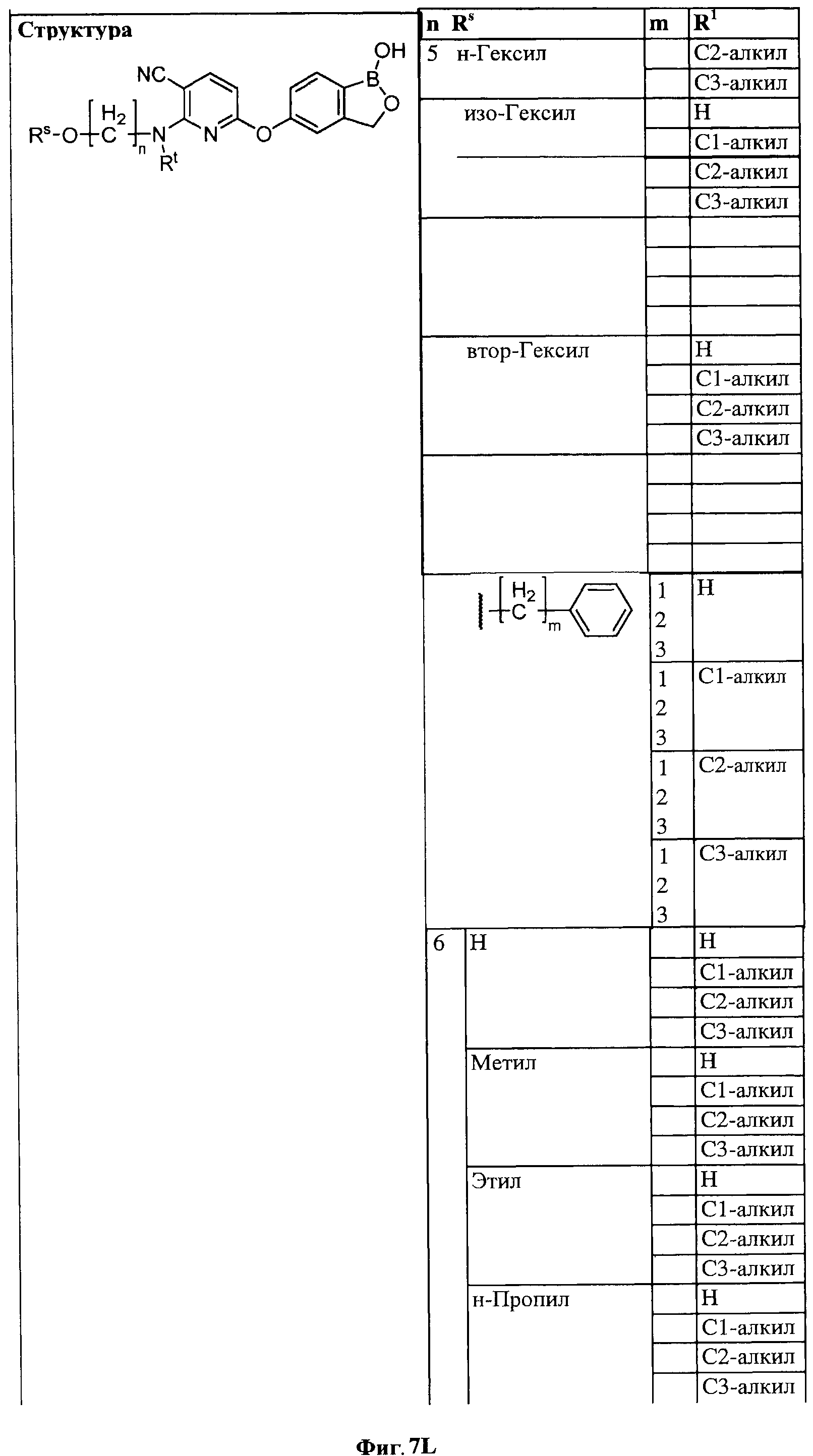
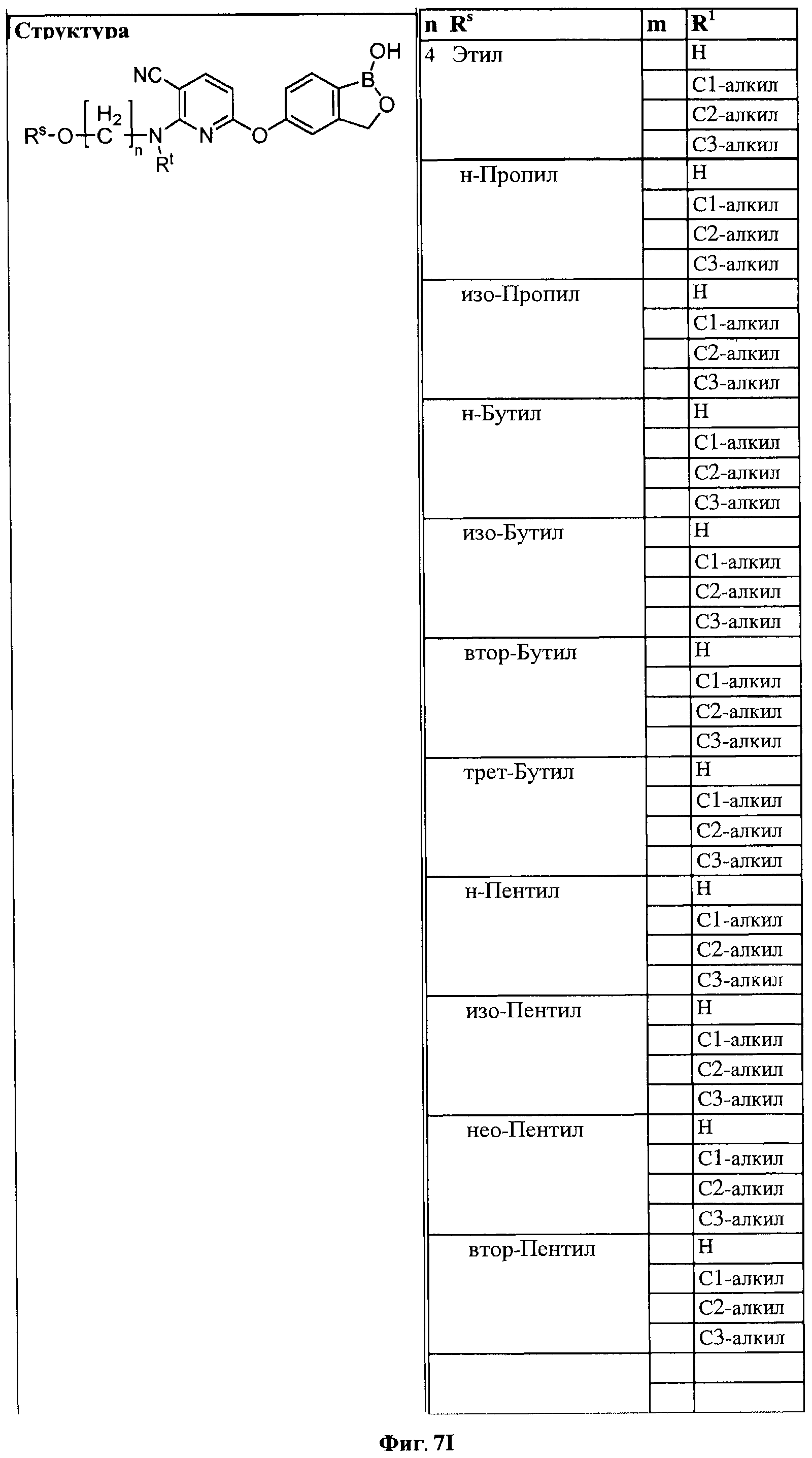
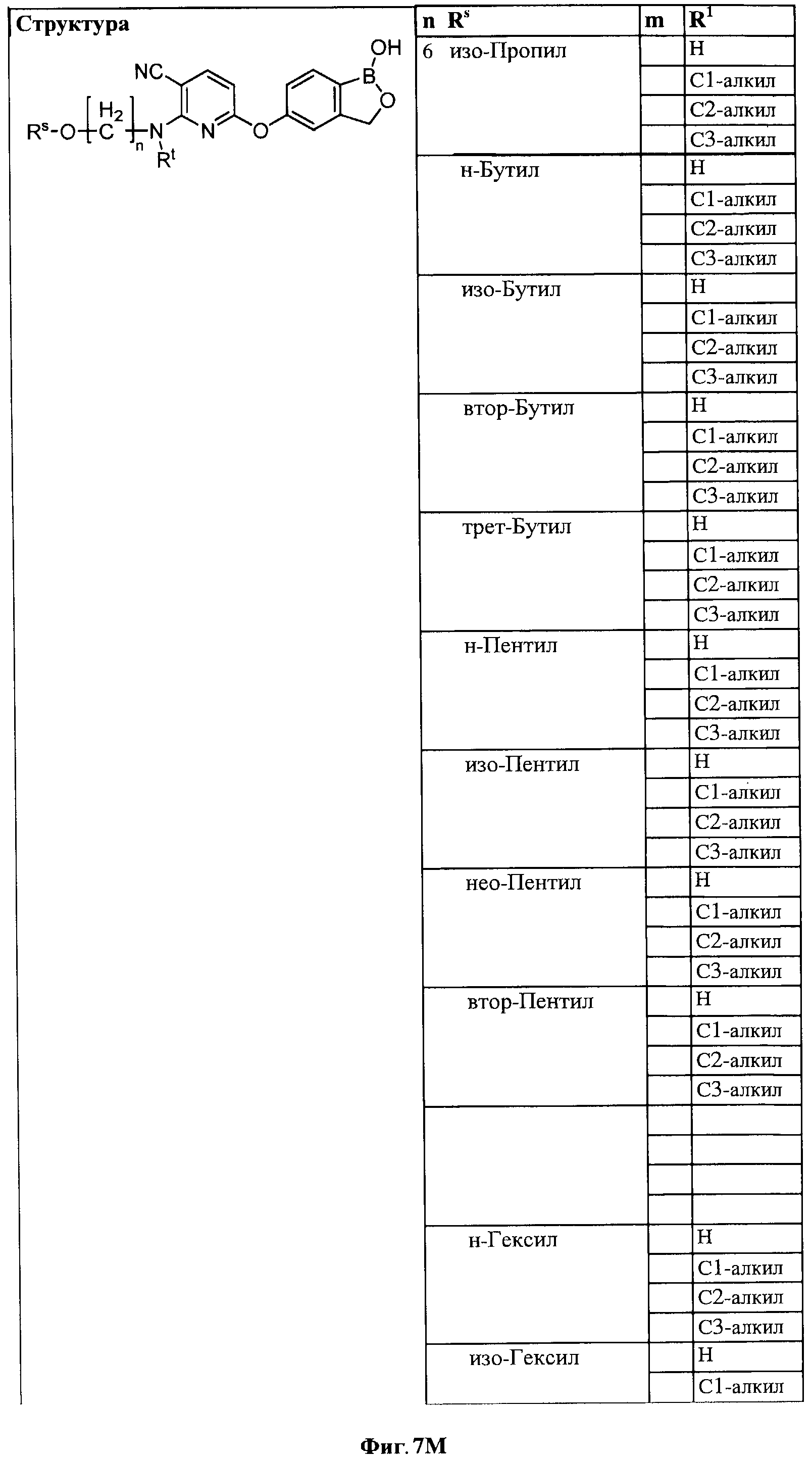
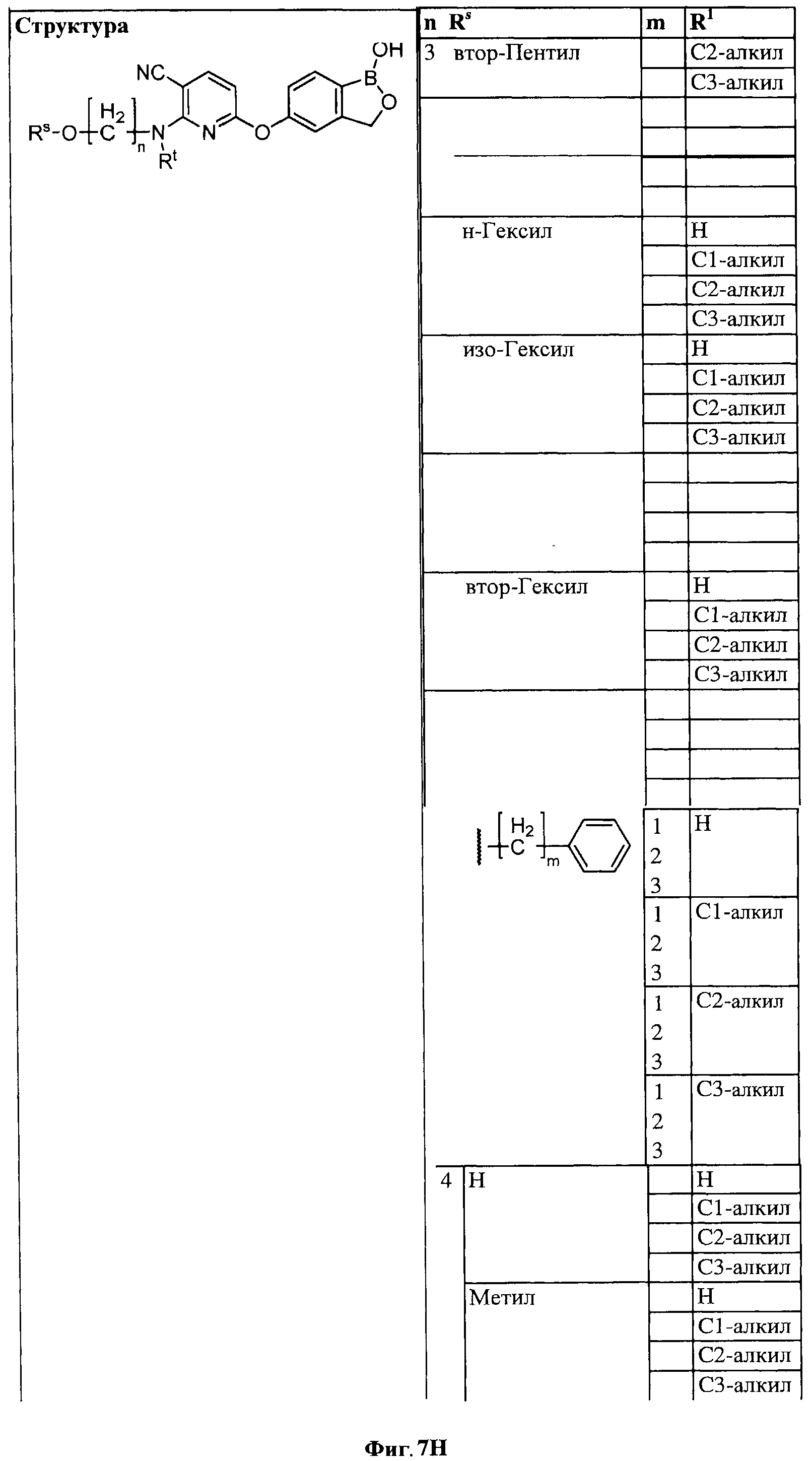
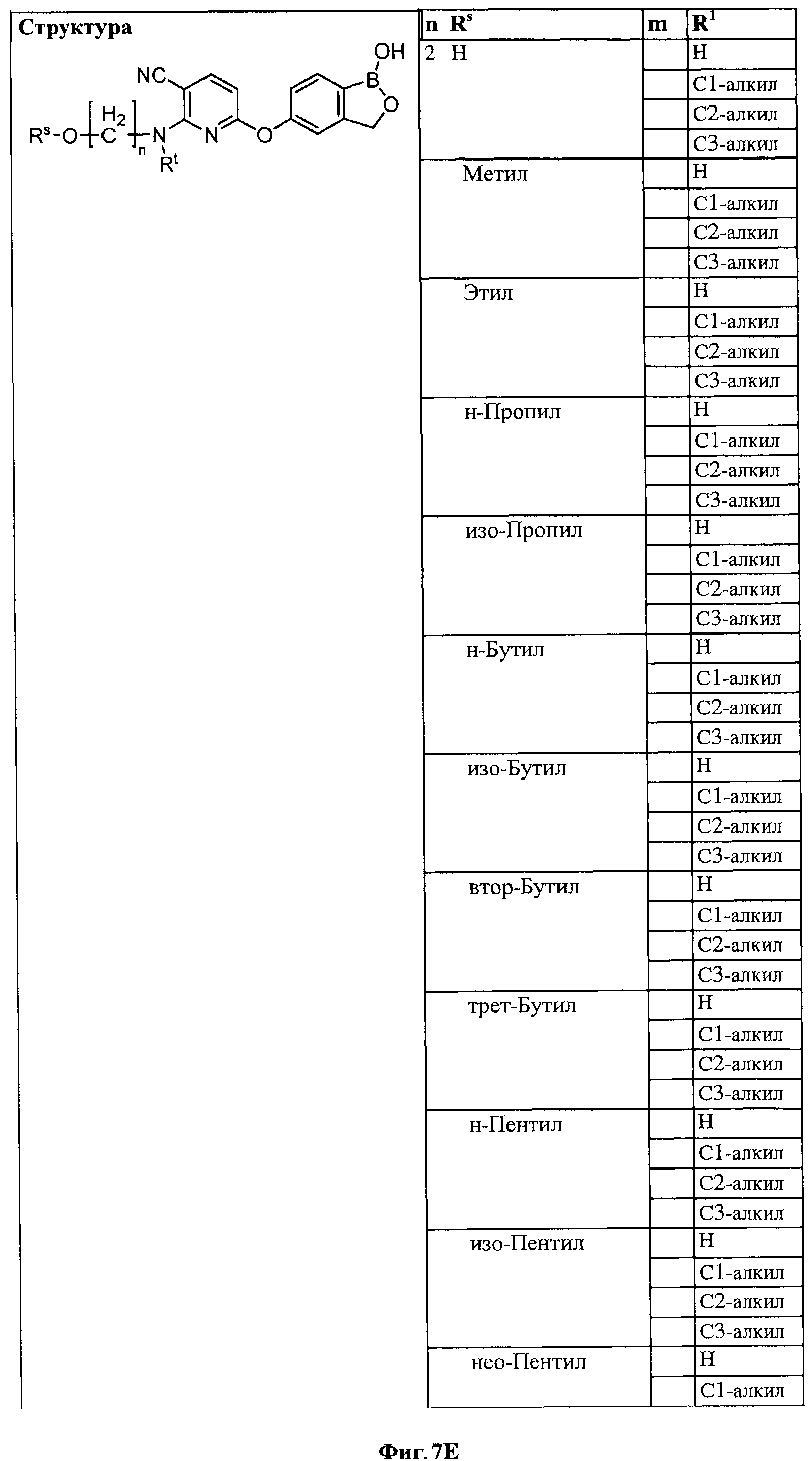
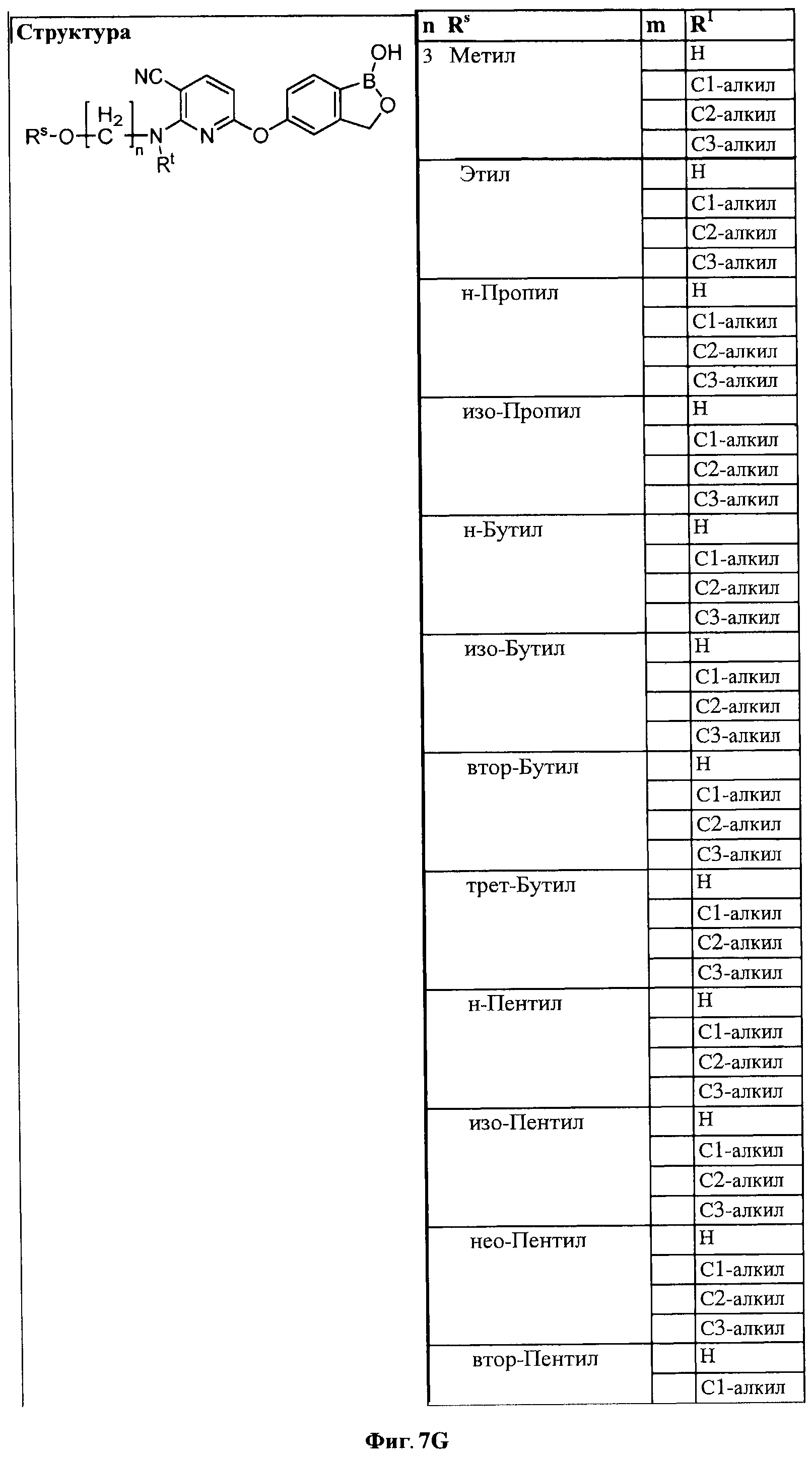
[0033] На ФИГ.7 показаны примеры соединений согласно настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Определения и сокращения
[0034] В настоящем описании формы единственного числа включают указание на множественное число, если иное явно не предписано контекстом. Например, ссылка на «активный агент» включает как единственный активный агент, так и два или несколько различных активных агентов в комбинации. Следует понимать, что настоящее описание не ограничено конкретными дозированными формами, носителями, или тому подобное, указанными в настоящем описании, и как таковое может быть изменено.
[0035] Сокращения, применяемые в настоящем описании, в общем случае соответствуют своим общепринятым значениям в химической и биологической областях.
[0036] Использовали следующие сокращения: водн. - водный; HATU - О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат; EDCI - N-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорид; мета-СРВА - 3-хлорпероксибензойная кислота; экв. - эквивалент; DIAD - диизопропилазодикарбоксилат; ДМФА - N,N-диметилформамид; ДМСО - диметилсульфоксид; АсОН - уксусная кислота; NaCNBH3 - цианоборогидрид натрия; к.т. - комнатная температура; ТГФ - тетрагидрофуран; Вос2O - ди-грет-бутил дикарбонат; МеОН - метанол; EtOH - этанол; ТФУК - трифторуксусная кислота; DIPEA - N,N-диизопропилэтиламин; РrОН - 1-пропанол; 1-РrОН - 2-пропанол; т.пл. - температура плавления; НММ - N-метилморфолин; B2pin2 - бис(пинаколато)диборон; O/N - в течение ночи; BzOOH - бензоилпероксид; ТГП - тетрагидропиранил; Ас - ацетил; ПТСК - пара-толуолсульфоновая кислота; Руr. - пиридин; Cbz - бензилоксикарбонил; ПМБ - п-метоксибензил; ДГП - дигидропиран; КСК - камфорсульфоновая кислота; ЦТАБ - цетилтриметиламмонийбромид; насыщ. - насыщенный; Сy - циклогексил; Рh - фенил; Аr - арил.
[0037] «Соединение согласно настоящему изобретению» в настоящем описании относится к соединениям, рассматриваемым в настоящем описании, солям (таким как фармацевтически приемлемые соли), пролекарствам, сольватам и гидратам указанных соединений.
[0038] «Ингибирование» и «блокирование», употребляемые в настоящем описании взаимозаменяемо, относятся к частичной или полной блокаде экспрессии воспалительного цитокина при помощи способа согласно настоящему изобретению, что приводит к уменьшению количества указанного цитокина в организме животного.
[0039] Если замещающие группы определены их традиционными химическими формулами, написанными слева направо, они равным образом включают химически идентичные заместители, которые могут быть получены при написании указанной структуры справа налево, например, -СН2О- следует понимать как включающий также и -ОСН2-.
[0040] Термин «поли» в настоящем описании означает по меньшей, мере 2. Например, ион поливалентного металла представляет собой ион металла, обладающий валентностью по меньшей мере 2.
[0041] «Группа» относится к радикалу молекулы, который присоединен к другой группе.
[0042] Символ  , используемый в качестве связи или изображенный перпендикулярно связи, указывает на точку, в которой показанный остаток присоединен к остальной части молекулы.
, используемый в качестве связи или изображенный перпендикулярно связи, указывает на точку, в которой показанный остаток присоединен к остальной части молекулы.
[0043] Термин «алкил», отдельно или как часть другого заместителя, обозначает, если не указано иное, линейную или разветвленную цепь, или циклический углеводородный радикал, или комбинацию указанных радикалов, который может быть полностью насыщенным, моно- или полиненасыщенным, и может включать двух- и многовалентные радикалы, имеющие указанное число атомов углерода (т.е., C1-С10 обозначает от одного до десяти атомов углерода). Согласно некоторым из вариантов реализации, термин «алкил» обозначает линейную или разветвленную цепь, или комбинацию указанных цепей, которая может быть полностью насыщенной, моно- или полиненасыщенной, и может включать двух- и многовалентные радикалы. Примеры насыщенных углеводородных радикалов включают, без ограничения, такие группы как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, циклогексил, (циклогексил)метил, циклопропилметил, гомологи и изомеры, например, н-пентила, я-гексила, н-гептила, н-октила, и тому подобное. Ненасыщенная алкильная группа представляет собой такую группу, которая содержит одну или несколько двойных связей или тройных связей. Примеры ненасыщенных алкильных групп включают, без ограничения, винил, 2-пропенил, кротил, 2-изопентенил, 2-(бутадиенил), 2,4-пентадиенил, 3-(1,4-пентадиенил), этинил, 1- и 3-пропинил, 3-бутинил, и более высокие гомологи и изомеры.
[0044] Термин «незамещенный алкил» включает линейные или разветвленные насыщенные углеводородные радикалы. Примеры насыщенных углеводородных радикалов включают, без ограничения, такие группы как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, вгор-бутил, н-пентил.
[0045] Термин «алкилен» отдельно или как часть другого заместителя обозначает двухвалентный радикал, полученный из алкана, в качестве примера, без ограничения, -СН2СН2СН2СН2-, и дополнительно включает группы, описанные ниже как «гетероалкилен». Обычно алкильная (или алкиленовая) группа может содержать от 1 до 2 4 атомов углерода, причем группы, содержащие 10 или менее атомов углерода, согласно настоящему изобретению являются предпочтительными. «Низший алкил» или «низший алкилен» представляет собой алкильную или алкиленовую группу с более короткой цепью, как правило, содержащую восемь или менее атомов углерода.
[0046] Термины «алкокси», «алкиламино» и «алкилтио» (или тиоалкокси) в настоящем описании использованы в их общепринятом смысле, и относятся к алкильным группам, присоединенным к остальной части молекулы через атом кислорода, аминогруппу или атом серы, соответственно.
[0047] Термин «гетероалкил», отдельно или в комбинации с другим термином, обозначает, если не указано иное, стабильно линейный или с разветвленной цепью или циклический углеводородный радикал, или комбинацию указанных радикалов, содержащий указанное число атомов углерода и, по меньшей мере, один гетероатом. Согласно некоторым из вариантов реализации, термин «гетероалкил», отдельно или в комбинации с другим термином, обозначает стабильную линейную или разветвленную цепь, или комбинацию указанных цепей, содержащую указанное число атомов углерода и по меньшей мере один гетероатом. Согласно примеру реализации, гетероатомы можно выбрать из группы, состоящей из В, О, N и S, причем атомы азота и серы могут, возможно, быть окисленными, а гетероатом азота может, возможно, быть кватернизованным. Гетероатом(ы) В, О, N и S могут занимать любе внутреннее положение в гетероалкильной группе, или занимать такое положение, через которое алкильная группа присоединена к оставшейся части молекулы. Примеры включают, без ограничения, -СН2-СН2-О-СН3, -CH2-CH2-NH-CH3, -CH2-CH2-N(СН3)-СН3, -CH2-S-CH2-CH3, -СН2-СН2, -S(O)-CH3, -CH2-CH2-S(О)2-СН3, -CH=CH-O-CH3, -CH2-CH=N-OCH3, и -CH=CH-N(СН3)-СН3. Последовательно может располагаться до двух гетероатомов, как, например, -CH2-NH-OCH3. Аналогично, термин «гетероалкилен», отдельно или как часть другого заместителя, обозначает двухвалентный радикал, полученный из гетероалкила, например, без ограничения, -CH2-CH2-S-CH2-CH2- и -CH2-S-CH2-CH2-NH-СН2-. В случае гетероалкиленовых групп, гетероатомы также могут занимать один или оба конца цепи (например, алкиленокси, алкилендиокси, алкиленамино, алкилендиамино, и тому подобное). Кроме того, в случае алкиленовых и гетероалкиленовых соединительных групп, ориентация соединительной группы не определяется направлением, в котором написана формула соединительной группы. Например, формула -C(O)2R'- обозначает как -C(O)2R'-, так и -R'С(О)2-.
[0048] Термины «циклоалкил» и «гетероциклоалкил» отдельно или в комбинации с другими терминами, обозначают, если не указано иное, циклические варианты «алкила» и «гетероалкила», соответственно. Кроме того, в случае гетероциклоалкила, гетероатом может занимать положение, через которое гетероцикл присоединен к остальной части молекулы. Примеры циклоалкилов включают, без ограничения, циклопентил, циклогексил, 1-циклогексенил, 3-циклогексенил, циклогептил, и тому подобное. Примеры гетероциклоалкилов включают, без ограничения, 1-(1,2,5,6-тетрагидропиридил), 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-морфолинил, 3-морфолинил, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидротиен-2-ил, тетрагидротиен-3-ил, 1-пиперазинил, 2-пиперазинил, и тому подобное.
[0049] Термины «гало» или «галоген», отдельно или как часть другого заместителя, обозначают, если не указано иное, атом фтора, хлора, брома или йода. Кроме того, подразумевают, что такие термины, как «галоалкил», включают моногалоалкил или полигалоалкил. Например, термин «гало(С1-С4)алкил» понимают как включающий, без ограничения, трифторметил, 2,2,2-трифторэтил, 4-хлорбутил, 3-бромпропил, и тому подобное.
[0050] Термин «арил» означает, если не указано иное, полиненасыщенный ароматический заместитель, который может представлять собой единственное кольцо или многочисленные кольца (предпочтительно от 1 до 3 колец), конденсированные между собой или связанные ковалентно. Термин «гетероарил» относится к арильным группам (или кольцам), содержащим от одного до четырех гетероатомов. Согласно примеру реализации, гетероатом выбирают из В, N, О, и S, причем атомы азота и серы, возможно, окислены, а атом(ы) азота, возможно, являются четвертичными. Гетероарильная группа может быть присоединена к остальной части молекулы через гетероатом. Неограничивающие примеры арильных и гетероарильных групп включают фенил, 1-нафтил, 2-нафтил, 4-бифенил, 1-пирролил, 2-пирролил, 3-пирролил, 3-пиразолил, 2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 2-фенил-4-оксазолил, 5-оксазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5-бензотиазолил, пуринил, 2-бензимидазолил, 5-индолил, 1-изохинолил, 5-изохинолил, 2-хиноксалинил, 5-хиноксалинил, 3-хинолил, 6-хинолил, диоксаборолан, диоксаборинан и диоксаборепан. Заместители для каждой из перечисленных выше арильных и гетероарильных кольцевых систем выбирают из группы приемлемых заместителей, описанных ниже.
[0051] Для краткости, термин «арил», применяемый в комбинации с другими терминами (например, арилокси, арилтио, арилалкил), включает такие радикалы, в которых арильная группа присоединена через следующий остаток к остальной части молекулы. Так, термин «арилалкил» понимают как включающий такие радикалы, в которых арильная группа присоединена к алкильной группе (например, бензил, 1-(3-нитрофенил)этил, и тому подобное). Заместитель, такой как бензил или 1-(3-нитрофенил)этил, может также быть обозначен как «замещенный алкил», где этильный радикал несет в качестве заместителя 3-нитрофенильную группу. Термин «арилокси» предназначен включать такие радикалы, в которых арильная группа присоединена к атому кислорода. Термин «арилоксиалкил» предназначен включать такие радикалы, в которых арильная группа присоединена к атому кислорода, который, в свою очередь, присоединен к алкильной группе (например, феноксиметил, 3-(1-нафтилокси)пропил, и тому подобное).
[0052] Для краткости, термин «гетероарил», используемый в комбинации с другими терминами (например, гетероарилокси, гетероарилтиокси, гетероарилалкил), включает такие радикалы, в которых гетероарильная группа присоединена через следующую группу к остальной части молекулы. Так, термин «гетероарилалкил» предназначен включать такие радикалы, в которых гетероарильная группа присоединена к алкильной группе (например, пиридометил и тому подобное). Термин «гетероарилокси» предназначен включать такие радикалы, в которых гетероарильная группа присоединена к атому кислорода. Термин «гетероарилоксиалкил» предназначен включать такие радикалы, в которых арильная группа присоединена к атому кислорода, который, в свою очередь, присоединен к алкильной группе (например, 2-пиридилоксиметил и тому подобное).
[0053] Предполагается, что каждый из вышеуказанных терминов (например, «алкил», «гетероалкил», «арил» и «гетероарил») включает как насыщенные, так и ненасыщенные формы указанных радикалов. Предпочтительные заместители для каждого типа радикалов представлены ниже.
[0054] Заместители для алкильных и гетероалкильных радикалов (включая группы, часто упоминаемые как алкилен, алкенил, гетероалкилен, гетероалкенил, алкинил, циклоалкил, гетероциклоалкил, циклоалкенил и гетероциклоалкенил) в общем упоминаются как «заместители при алкильной группе» и могут представлять собой одну или несколько из множества групп, выбранных из, без ограничения: -R', -OR',=O, =NR',=N-OR', NR'R'', -SR', -галоген, -SiR'R''R''', -OC(O)R', -C(O)R', -CO2R', -CONR'R'', -ОС(O)NR'R'', -NR''C(O)R', -NR'-C(O)NR''R''', -NR''C(O)2R', -NR''''-C(NR'R''R''')=NR'''', -NR''''-C(NR'R'')=NR''', -S(O)R', -S(O)2R', -S(O)2NR'R'', -NR''SO2R', -CN, -NO2, -N3, -CH(Ph)2, фтор (C1-C4) алкокси и фтор (C1-C4) алкил, в количестве от нуля до (2m'+1), где m' представляет собой общее число атомов углерода в указанном радикале. R', R'', R''', R'''' и R''''' каждый предпочтительно независимо относится к водороду, замещенному или незамещенному гетероалкилу, замещенному или незамещенному арилу, например, арилу, содержащему в качестве заместителей 1-3 галогена, замещенной или незамещенной алкильной, алкокси или тиоалкоксигруппе, или арилалкильным группам. Если соединение согласно настоящему изобретению содержит более одной группы R, например, каждая из указанных групп R независимо выбрана так, чтобы каждая из них представляла собой группы R', R'', R''', R'''' и R''''', если присутствует более одной из указанных групп. Если R' и R'' присоединены к одному и тому же атому азота, они могут быть объединены с указанным атомом азота, образуя 5-, 6- или 7-членное кольцо. Например, -NR'R'' включает, без ограничения, 1-пирролидинил и 4-морфолинил. Из приведенного выше обсуждения заместителей любому квалифицированному специалисту в данной области техники понятно, что термин «алкил» включает группы, содержащие атомы углерода, связанные с группами, отличными от атомов водорода, такими как галоалкил (например, -CF3 и -CH2CF3) и ацил (например, -C(O)CH3, -C(O)CF3, -С(О)СН2ОСН3, и тому подобное).
[0055] Аналогично заместителям, описанным для алкильного радикала, заместители для арильных и гетероарильных групп в целом обозначают как «заместители при арильной группе». Указанные заместители выбирают, например, из: -R', -OR', =O, =NR',=N-OR', -NR'R'', -SR', -галогена, -SiR'R''R''', -OC(O)R', -C(O)R', -CO2R', -CONR'R'', ОС(O)NR'R'', -NR''C(O)R', -NR'-C(O)NR''R''', -NR''C(O)2R', -NR'''''-C(NR'R''R''')=NR'''', -NR''''-C(NR'R'')=NR''', -S(O)R', -S(O)2R', S(O)2NR'R'', -NR''SO2R', -CN, -NO2, -N3, -CH(Ph)2, фтор (C1-C4) алкокси и фтор (C1-C4) алкила, в количестве от нуля до общего числа открытых валентностей ароматической кольцевой системы; и при этом R', R'', R''', R'''' и R''''' предпочтительно независимо выбраны из водорода, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного арила и замещенного или незамещенного гетероарила. Если соединение согласно настоящему изобретению содержит более одной группы R, например, каждую из указанных групп R независимо выбирают так, как будто каждая из них представляет собой группы R', R'', R''', R'''' и R''''', если присутствует более одной из указанных групп.
[0056] Два заместителя при соседних атомах в арильном или гетероарильном кольце можно заменить на заместитель формулы -Т-С(O)-(CRR')q-U-, где Т и U независимо представляют собой -NR-, -O-, -CRR'- или простую связь, a q представляет собой целое число от О до 3. Альтернативно, два заместителя при соседних атомах в арильном или гетероарильном кольце могут быть заменены на заместитель формулы -А-(СН2)r-В-, где А и В независимо представляют собой -CRR'-, -O-, -NR-, -S-, -S(O)-, -S(O)2-, -S(O)2NR'- или простую связь, а r представляет собой целое число от 1 до 4. Одну из одинарных связей в новом кольце, полученном указанным образом, можно заменить на двойную связь. Альтернативно, два заместителя при соседних атомах в арильном или гетероарильном кольце можно заменить на заместитель формулы -(CRR')s-X-(CR''R''')d-, где s и d независимо представляют собой целые числа от 0 до 3, а X представляет собой -O-, -NR'-, -S-, -S(O)-, -S(O)2-, или -S(O)2NR'-. Заместители R, R', R'' и R''' предпочтительно независимо выбирают из водорода или замещенного или незамещенного (C1-C6)алкила.
[0057] «Кольцо» в настоящем описании обозначает замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Кольцо включает конденсированные кольцевые группы. Число атомов в кольце обычно определяют по числу членов в кольце. Например, «5-7-членное кольцо» означает, что кольцевая конфигурация образована 5-7 атомами. Если не указано иное, кольцо, возможно, содержит гетероатом. Так, термин «5-7-членное кольцо» включает, например, фенил, пиридинил и пиперидинил. Термин «5-7-членное гетероциклоалкильное кольцо», с другой стороны, включало бы пиридинил и пиперидинил, но не фенил. Термин «кольцо» дополнительно включает кольцевую систему, содержащую более одного «кольца», причем каждое «кольцо» независимо такое, как определено выше.
[0058] В настоящем описании термин «гетероатом» включает атомы кроме углерода (С) и водорода (Н). Примеры включают кислород (О), азот (N), серу (S), кремний (Si), германий (Ge), алюминий (Аl) и бор (В).
[0059] Символ «R» представляет собой общее сокращение, представляющее замещающую группу, которую выбирают из групп замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, замещенного или незамещенного циклоалкила и замещенного или незамещенного гетероциклоалкила.
[0060] Под «эффективным» количеством лекарственного средства, состава или проникающего вещества понимают количество активного агента, достаточное для достижения желаемого локального или системного действия. «Топически эффективное», «косметически эффективное», «фармацевтически эффективное» или «терапевтически эффективное» количество относится к количеству лекарственного средства, необходимому для достижения желаемого терапевтического результата.
[0061] «Топически эффективный» относится к материалу, который при нанесении на кожу, ноготь, волосы, коготь или копыто обеспечивает желаемый фармакологический результат или локально в месте применения, или системно в результате трансдермального проникновения активного ингредиента указанного материала.
[0062] «Косметически эффективный» относится к материалу, который при нанесении на кожу, ноготь, волосы, коготь или копыто оказывает необходимый косметический результат в месте нанесения активного ингредиента указанного материала.
[0063] Термины «фармацевтически приемлемые соли» или «соли указанного соединения» предусматривают включение солей соединений согласно настоящему изобретению, полученных с использованием относительно нетоксичных кислот или оснований, в зависимости от конкретных заместителей, содержащихся в соединениях согласно настоящему описанию. Если соединения согласно настоящему изобретению содержат относительно кислотные функциональные группы, можно получить соли присоединения основания, путем приведения в контакт нейтральной формы указанных соединений с достаточным количеством выбранного основания, или в чистом виде, или в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения основания включают соли натрия, калия, кальция, аммония, органических аминов или магния, или подобные соли. Если соединения согласно настоящему изобретению содержат относительно основные функциональные группы, можно получить соли присоединения кислоты, путем приведения в контакт нейтральной формы указанных соединений с достаточным количеством выбранной кислоты, или в чистом виде, или в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения кислот включают соли, полученные с применением неорганических кислот, таких как соляная, бромоводородная, азотная, угольная, одноосновная угольная, фосфорная, одноосновная фосфорная, двухосновная фосфорная, серная, одноосновная серная, йодоводородная или фосфористая кислоты, и тому подобное, а также соли, полученные с применением относительно нетоксичных органических кислот, таких как уксусная, пропионовая, изобутановая, малеиновая, малоновая, бензойная, янтарная, пробковая, фумаровая, молочная, миндальная, фталевая, бензолсульфоновая, п-толуолсульфоновая, лимонная, винная, метансульфоновая, и тому подобное. Также включены соли аминокислот, такие как аргинат и тому подобное, и соли органических кислот, таких как глюкуроновая или галактуроновая кислоты, и тому подобное (см., например, Berge et al., "Pharmaceutical Salts", Journal of Pharmaceutical Science 66: 1-19 (1977)). Некоторые конкретные соединения согласно настоящему изобретению содержат как основные, так и кислотные функциональные группы, что позволяет превратить указанные соединения либо в соли присоединения кислот, либо в соли присоединения оснований.
[0064] Нейтральные формы соединения предпочтительно восстанавливают, приводя в контакт указанную соль с основанием или кислотой и выделяя исходное соединение обычным способом. Исходная форма соединений отличается от различных солевых форм по некоторым физическим свойствам, таким как растворимость в полярных растворителях.
[0065] Кроме солевых форм, согласно настоящему изобретению предложены соединения, находящиеся в форме пролекарств. Пролекарства соединений или комплексов согласно настоящему описанию легко подвергаются изменениям в физиологических условиях с образованием соединений согласно настоящему изобретению. Кроме того, пролекарства можно превратить в соединения согласно настоящему изобретению при помощи химических или биохимических способов в среде ex vivo.
[0066] Некоторые соединения согласно настоящему изобретению могут существовать как в несольватированной, так и в сольватированной формах, включая гидратированные формы. В целом, сольватированные формы эквивалентны несольватированным формам и включены в объем настоящего изобретения. Некоторые соединения согласно настоящему изобретению могут существовать во множестве кристаллических или аморфных форм. В целом, все физические формы эквивалентны для применений, рассматриваемых в настоящем изобретении, и рассматриваются как входящие в объем настоящего изобретения.
[0067] Некоторые соединения согласно настоящему изобретению содержат асимметрические атомы углерода (оптические центры) или двойные связи; рацематы, диастереомеры, геометрические изомеры и индивидуальные изомеры входят в объем настоящего изобретения. Графическое представление рацемических, амбискалемических и скалемических или энантиомерно чистых соединений, использованное в настоящем описании, взято из Maehr, J. Chem. Ed. 1985, 62: 114-120. Сплошные и пунктирные клинья применяют для обозначения абсолютной конфигурации стереоцентра, если не указано иное. Если соединения согласно настоящему описанию содержат олефиновые двойные связи или другие центры геометрической асимметрии и не указано иное, предполагают, что указанные соединения включают оба Е и Z геометрических изомера. Аналогично, включены все таутомерные формы.
[0068] Соединения согласно настоящему изобретению могут существовать в конкретных геометрических или стереоизомерных формах. Настоящее изобретение включает все указанные соединения, включая цис- и транс-изомеры, (-)- и (+)-энантиомеры, (R)- и (S)-энантиомеры, диастереомеры, (D)-изомеры, (L)-изомеры, рацемические смеси изомеров и другие смеси изомеров, такие как энантиомерно или диастереомерно обогащенные смеси, входящие в объем настоящего изобретения. Дополнительные асимметрические атомы углерода могут присутствовать в заместителе, таком как алкильная группа. Указанные изомеры, также как и смеси указанных изомеров, рассматривают так входящие в объем настоящего изобретения.
[0069] Оптически активные (-R) - и (S)-изомеры и d и 1 изомеры можно получить при помощи хиральных синтонов или хиральных реактивов, или разделения при помощи общепринятых методик. Если, например, выбран конкретный энантиомер соединения согласно настоящему изобретению, указанный энантиомер можно получить путем асимметрического синтеза или путем получения производного с использованием хирального вспомогательного соединения, причем полученную смесь диастереомеров разделяют и отщепляют вспомогательную группу, получая чистый выбранный энантиомер. Альтернативно, если указанная молекула содержит основную функциональную группу, такую как аминогруппа, или кислотную функциональную группу, такую как карбоксильная группа, можно получить диастереомерные соли с соответствующим оптически активным основанием или кислотой, с последующим разделением полученных указанным образом диастереомеров дробной кристаллизацией или хроматографическими средствами, известными в данной области, и последующим выделением чистых энантиомеров. Кроме того, разделение энантиомеров и диастереомеров часто осуществляют при помощи применяемых в хроматографии хиральных неподвижных фаз, возможно, в сочетании с образованием химических производных (например, образованием карбаматов из аминов).
[0070] Соединения согласно настоящему изобретению также могут содержать неприродные соотношения изотопов атомов в одном или более атомах, входящих в состав указанных соединений. Например, соединения могут включать радиоактивные метки такими радиоактивными изотопами, как, например, тритий (3Н), иод-125 (125I) или углерод-14 (14С). Все изотопные варианты соединений согласно настоящему изобретению, радиоактивные или нет, рассматривают как включенные в объем настоящего изобретения.
[0071] Термин «фармацевтически приемлемый носитель» или «фармацевтически приемлемая среда» относятся к любому составу или несущей среде, обеспечивающей соответствующую доставку эффективного количества активного агента согласно настоящему описанию, не влияющей на эффективность биологической активности активного агента, и достаточно нетоксичной для хозяина или пациента. Типичные носители включают воду, масла, как растительные, так и минеральные, основы кремов, основы лосьонов, основы мазей, и тому подобное. Указанные основы включают суспендирующие агенты, загустители, улучшители проникновения, и тому подобное. Составы указанных основ хорошо известны в областях косметики и топических фармацевтических препаратов. Дополнительную информацию, касающуюся носителей, можно найти в Remington: The Science and Practice of Pharmacy, 21st Ed., Lippincott, Williams & Wilkins (2005), включенном в настоящее описание посредством ссылки.
[0072] Термин «фармацевтически приемлемый носитель» или «фармацевтически приемлемая среда» относятся к любому составу или несущей среде, обеспечивающей соответствующую доставку эффективного количества активного агента согласно настоящему описанию, не влияющей на эффективность биологической активности активного агента, и достаточно нетоксичной для хозяина или пациента. Типичные носители включают воду, масла, как растительные, так и минеральные, основы кремов, основы лосьонов, основы мазей, и тому подобное. Указанные основы включают суспендирующие агенты, загустители, улучшители проникновения, и тому подобное. Составы указанных основ хорошо известны в областях косметики и топических фармацевтических препаратов. Дополнительную информацию, касающуюся носителей, можно найти в Remington: The Science and Practice of Pharmacy, 21st Ed., Lippincott, Williams & Wilkins (2005), включенном в настоящее описание посредством ссылки.
[0073] «Фармацевтически приемлемый топический носитель» и эквивалентные термины относятся к фармацевтически приемлемым носителям, как описано выше, подходящим для топического (местного) применения. Неактивная жидкая или кремообразная среда, способная суспендировать или растворять активный агент(ы) и обладающая свойствами не быть токсичной и не вызывать воспаления при нанесении на кожу, ноготь, волосы, коготь или копыто, представляет собой пример фармацевтически приемлемого топического носителя. Указанный термин также отдельно предназначен включать материалы-носители, одобренные для применения в топических косметических продуктах.
[0074] Термин «фармацевтически приемлемая добавка» относится к консервантам, антиокислителям, отдушкам, эмульгаторам, красителям и наполнителям, известным или применяемым в области составления рецептур лекарственных препаратов и не влияющих ненадлежащим образом на эффективность биологической активности активного агента, и достаточно нетоксичных для хозяина или пациента. Добавки для топических составов широко известны в данной области, и могут быть добавлены к топической композиции, поскольку они фармацевтически приемлемы и не опасны для эпителиальных клеток или функции указанных клеток. Кроме того, они не должны вредно влиять на стабильность композиции. Например, инертные наполнители, средства против раздражения, агенты, придающие клейкость, формообразующие, отдушки, замутнители, антиокислители, желирующие агенты, стабилизаторы, поверхностно-активные вещества, эмоленты, красящие агенты, консерванты, буферные агенты, другие усилители проникновения, и другие традиционные компоненты составов для топической или трансдермальной доставки широко известны в данной области техники.
[0075] Термины «улучшение», «усиление проникновения» или «улучшение проницаемости» относятся к увеличению проницаемости кожи, ногтя, волос, когтя или копыта для лекарственного средства, для того чтобы увеличить скорость, с которой лекарственное средство проникает через кожу, ноготь, волосы, коготь или копыто. Улучшенное проникновение, достигаемое путем применения указанных усилителей, можно наблюдать, например, при помощи измерения скорости диффузии лекарственного средства через кожу, ноготь, волосы, коготь или копыто животного при помощи аппарата диффузионной ячейки. Диффузионная ячейка описана Merritt et al. Diffusion Apparatus for Skin Penetration, J of Controlled Release, 1 (1984) pp.161-162. Термин «усилитель проникновения» или «усилитель проницаемости» обозначает агент или смесь агентов, которые, отдельно или в комбинации, повышают проницаемость кожи, ногтя, волос, когтя или копыта для лекарственного средства.
[0076] Термин «наполнители», как известно, обычно означает носители, разбавители и/или среды, применяемые при составлении рецептур композиций лекарственных средств, эффективных для выбранного применения.
[0077] Термины «эффективное количество» и «терапевтически эффективное количество» лекарственного средства или фармакологически активного агента относятся к нетоксичному, но достаточному количеству лекарственного средства или агента, обеспечивающему выбранный эффект. В пероральных дозированных формах согласно настоящему описанию «эффективное количество» одного из активных агентов в комбинации представляет собой такое количество указанного активного средства, которое эффективно для достижения выбранного эффекта при применении в комбинации с другим активным средством указанной комбинации. Количество, которое является «эффективным», может меняться от субъекта к субъекту, в зависимости от возраста и общего состояния здоровья индивидуума, конкретного активного агенте или агентов, и соответствующее «эффективное» количество в каждом отдельном случае может определить средний специалист в данной области при помощи стандартных экспериментов.
[0078] Выражения «активный ингредиент», «терапевтический агент», «действующее вещество» или «активный агент» обозначают химическое вещество, которое может быть эффективным при лечении рассматриваемого заболевания, нарушения или состояния.
[0079] Выражение «фармацевтически приемлемый» обозначает остатки или соединения, которые, с точки зрения медицинской оценки, подходят для применения у человека, не вызывая нежелательных биологических эффектов, например, таких как избыточная токсичность, раздражение, аллергическая реакция, и тому подобное.
[0080] Выражение «пероральная дозированная форма» обозначает любую фармацевтическую композицию, вводимую субъекту через полость рта, в которой один или несколько антитромбоцитарных агентов и один или более кислотных ингибиторов вводят одновременно в комбинации, возможно, с одним или несколькими дополнительными лекарственными средствами. Типичные пероральные дозированные формы включают таблетки, капсулы, пленки, порошки, саше, гранулы, растворы, твердые вещества, суспензии, или в виде нескольких различных единиц (например, гранулы, таблетки и/или капсулы, содержащие различные активные средства), упакованные вместе для совместного введения, и другие составы, известные в данной области. Пероральная дозированная форма может состоять из одной, двух, трех, четырех, пяти или шести единиц. Если пероральная дозированная форма содержит многочисленные единицы, все указанные единицы находятся в единственной упаковке (например, бутылке или другой форме упаковки, такой как блистерная упаковка). Если пероральная дозированная форма представляет собой единственную единицу, она может находиться или не находиться в единственной упаковке. Согласно предпочтительному варианту реализации, пероральная дозированная форма состоит из одной, двух или трех единиц. Согласно особенно предпочтительному варианту реализации, пероральная дозированная форма представляет собой единственную единицу.
[0081] Выражение «единица» в настоящем описании относится к числу отдельных объектов для введения, составляющих дозированную форму. Согласно некоторым из вариантов реализации, дозированная форма содержит соединение согласно настоящему изобретению в одной капсуле. Это единственная единица. Согласно некоторым из вариантов реализации, дозированная форма содержит соединение согласно настоящему изобретению как часть терапевтически эффективной дозировки крема или мази. Это также единственная единица. Согласно некоторым из вариантов реализации, дозированная форма содержит соединение согласно настоящему изобретению и другой активный ингредиент, содержащиеся в одной капсуле, или как часть терапевтически эффективной дозировки крема или мази или лосьона. Это единственная единица, вне зависимости от того, включает ли содержимое капсулы многочисленные отдельные гранулы активного ингредиента. Согласно некоторым из вариантов реализации, дозированная форма содержит соединение согласно настоящему изобретению в одной капсуле, а активный ингредиент во второй капсуле. Это дозированная форма из двух единиц, такая как две капсулы или таблетки, и поэтому указанные единицы содержатся в единственной упаковке. Поэтому термин «единица» относится к объекту, который вводят животному, а не к внутренним компонентам указанного объекта.
[0082] Термин «пролекарство» в настоящем описании представляет собой биологически неактивное производное исходной молекулы лекарственного средства, которое оказывает свое фармакологическое действие только после химического и/или ферментативного превращения в свою активную форму in vivo. Пролекарства включают пролекарства, разработанные для того, чтобы обойти проблемы, связанные с доставкой исходного лекарственного средства. Указанные проблемы могут быть вызваны плохими физико-химическими свойствами, такими как плохая химическая стабильность или низкая растворимость в воде, а могут также быть обусловлены плохими фармакокинетическими свойствами, такими как плохая биодоступность или плохой период полувыведения. Так, некоторые преимущества пролекарств могут включать улучшенную химическую стабильность, абсорбцию и/иди ФК свойства исходных карбоновых кислот. Пролекарства также можно применять для того чтобы сделать лекарства более «дружественными к пациенту», путем минимизации частоты (например, один раз в сутки) или пути введения (например, перорально), или для улучшения вкуса или запаха при пероральном приеме, или для минимизации боли при парентеральном приеме.
[0083]Согласно некоторым из вариантов реализации, пролекарство обеспечивает эффект «медленного высвобождения» активного лекарственного средства, таким образом изменяя увеличение концентрации D-серина со временем так, что улучшается эффективность исходного соединения. Например, соединения согласно настоящему изобретению, продлевающие увеличение концентрации D-серина, демонстрируют улучшенную эффективность в моделях на животных когнитивной функции (например, Contextual Fear Conditioning или Novel Object Recognition).
[0084] Согласно некоторым из вариантов реализации, пролекарства более стабильны химически, чем активное лекарственное средство, что улучшает изготовление состава и доставку исходного лекарственного средства по сравнению с исходным лекарственным средством в отдельности.
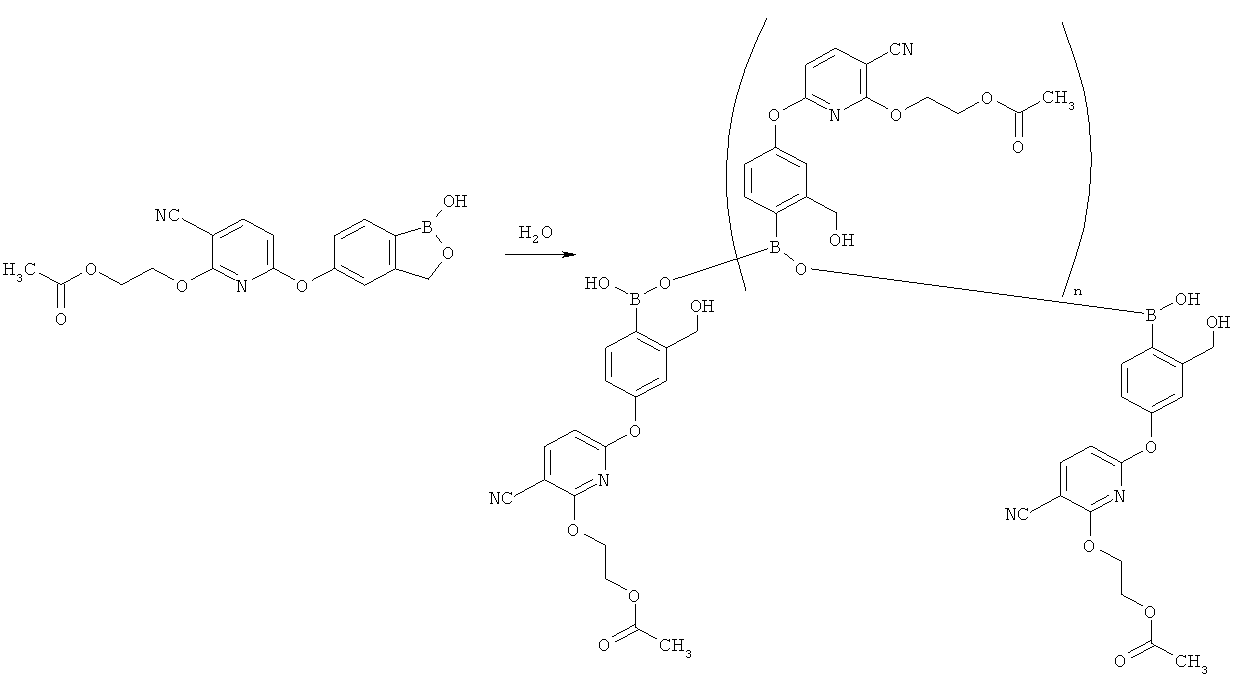
[0085] Пролекарства для аналогов карбоновых кислот согласно настоящему изобретению могут включать широкий ассортимент сложных эфиров. Согласно примеру реализации, фармацевтические композиции согласно настоящему изобретению содержат сложный эфир карбоновой кислоты. Согласно примеру реализации, пролекарство подходит для лечения/предотвращения тех заболеваний и состояний, которые требуют, чтобы молекула лекарственного средства преодолевала гематоэнцефалический барьер. Согласно примеру реализации, пролекарство проникает в головной мозг, где оно превращается в активную форму молекулы лекарственного средства. Согласно одному из вариантов реализации, пролекарство применяют для придания молекуле активного лекарственного средства способности проникать внутрь глаза после местного нанесения пролекарства на глаз. Кроме того, пролекарство можно превратить в его исходное соединение химическими или биохимическими способами в среде ex vivo. Например, пролекарство можно медленно превратить в его исходное соединение при помещении в трансдермальный пластырь-резервуар с соответствующим ферментом или химическим реактивом.
[0086] Термин «субстраты» обозначает фармацевтически приемлемые дисперсные материалы, такие как шарики, крупинки, гранулы, пеллеты и тому подобное, в составе пероральной дозированной формы.
[0087] Термин «по существу, не содержащий» в настоящем описании относится к композиции, не содержащей указанного вещества или содержащей менее терапевтически эффективного количества указанного вещества для любых известных целей, для которых предназначена указанная композиция.
[0088] Термин «местное применение» относится к нанесению фармацевтического агента на наружную поверхность кожи, ногтя, волос, когтя или копыта, так что указанный агент пересекает наружную поверхность кожи, ногтя, волос, когтя или копыта и проникает в нижележащие ткани. Местное применение включает нанесение состава на неповрежденную кожу, ноготь, волосы, коготь или копыто, или на поврежденную, раненую или имеющую открытое повреждение кожу, ноготь, волосы, коготь или копыто. Местное применение фармацевтического агента может приводить к ограниченному распределению агента в коже и окружающих тканях или, если агент выносится из обработанной области с током крови, может привести к системному распределению агента.
[0089] Термин «трансдермальная доставка» относится к диффузии агента через барьер кожи, ногтя, волос, когтя или копыта в результате топического введения или другого применения композиции. Роговой слой действует как барьер и немногие фармацевтические агенты способны проникать через неповрежденную кожу. Напротив, эпидермис и дерма проницаемы для многих растворенных веществ, и благодаря этому абсорбция лекарственных средств легче происходит через кожу, ноготь, волосы, коготь или копыто, которые сошлифованы или иным образом лишены рогового слоя, чтобы обнажить эпидермис. Трансдермальная доставка включает инъекцию или другую доставку через любую часть кожи, ногтя, волос, когтя или копыта, или слизистой оболочки, и абсорбцию или проникновение через оставшуюся часть. Абсорбцию через неповрежденную кожу, ноготь, волосы, коготь или копыто можно улучшить, помещая активный агент в соответствующую фармацевтически приемлемую среду пред нанесением на кожу, ноготь, волосы, коготь или копыто. Пассивное топическое введение может состоять из нанесения активного агента непосредственно на место лечения в комбинации с эмолентами или улучшителями проницаемости. В настоящем описании подразумевают, что трансдермальная доставка включает доставку посредством проникновения через наружный покров, т.е. кожу, ноготь, волосы, коготь или копыто.
[0090] Термин «субстраты» обозначает фармацевтически приемлемые дисперсные материалы, такие как шарики, крупинки, гранулы, пеллеты и тому подобное, в составе пероральной дозированной формы.
[0091] Термин «по существу, не содержащий» в настоящем описании относится к композиции, не содержащей указанного вещества или содержащей менее терапевтически эффективного количества указанного вещества для любых известных целей, для которых предназначена указанная композиция.
[0092] Термин «микробная инфекция» относится к любой инфекции тканей хозяина инфекционным агентом, включающим, без ограничения, вирусы, бактерии, микобактерии, грибы и паразиты (см., например, Harrison's Principles of Internal Medicine, pp.93-98 (Wilson et al., eds., 12th ed. 1991); Williams et al., J. of Medicinal Chem. 42:1481-1485 (1999), полностью включенный в настоящую заявку посредством ссылки.
[0093] «Биологическая среда» в настоящей заявке относится как к in vitro, так и к in vivo биологическому окружению. Типичная «биологическая среда» in vitro включает, без ограничения, культуру клеток, культуру тканей, гомогенизаты, плазму и кровь. Применения in vivo в общем осуществляют на млекопитающих, предпочтительно на людях.
[0094] «Единица ногтя человека» в настоящей заявке может представлять собой ногтевую пластинку, ногтевое ложе, проксимальную ногтевую складку, латеральную ногтевую складку и комбинацию указанных объектов.
[0095] Термин «уходящая группа» обозначает функциональную группу или атом, который может быть вытеснен другой функциональной группой или атомом в реакции замещения, такой как реакция нуклеофильного замещения. В качестве примера, типичные уходящие группы включают группы трифлат, хлор, бром и йод; группы сульфониловых сложных эфиров, такие как мезилат, тозилат, брозилат, нозилат и тому подобное; и ацилоксигруппы, такие как ацетокси, трифторацетокси, и тому подобное.
[0096] Термин «аминозащитная группа» обозначает защитную группу, подходящую для предотвращения нежелательных реакций по аминному азоту. Типичные аминозащитные группы включают, без ограничения, формил; ацильные группы, например, алканоильные группы, такие как ацетил, трихлорацетил или трифторацетил; алкоксикарбонильные группы, такие как трет-бутоксикарбонил (Воc); арилметоксикарбонильные группы, такие как бензилоксикарбонил (Cbz) и 9-флуоренилметоксикарбонил (Fmoc); арилметильные группы, такие как бензил (Вn), тритил (Тr), и 1,1-ди-(4'-метоксифенил)метил; силильные группы, такие как триметилсилил (TMS) и трет-бутилдиметилсилил (TBS); и тому подобное.
[0097] Термин «гидроксизащитная группа» обозначает защитную группу, подходящую для предотвращения нежелательных реакций по гидроксигруппе. Типичные гидроксизащитные группы включают, без ограничения, алкильные группы, такие как метил, этил и грет-бутил; ацильные группы, например, алканоильные группы, такие как ацетил; арилметильные группы, такие как бензил (Вn), п-метоксибензил (РМВ), 9-флуоренилметил (Fm), и дифенилметил (бензгидрил, DPM); силильные группы, такие как триметилсилил (TMS) и трет-бутилдиметилсилил (TBS); и тому подобное.
[0098] Бор способен образовывать донорно-акцепторные связи (или координационные связи) с кислородом, серой или азотом в некоторых обстоятельствах согласно настоящему изобретению. Донорно-акцепторные связи обычно слабее ковалентных связей. В тех ситуациях, когда атом бора ковалентно связан по меньшей мере с одним атомом кислорода, серы или азота, и в то же время связан донорно-акцепторной связью с кислородом, серой или азотом, соответственно, дативная связь и ковалентная связь между бором и двумя идентичными гетероатомами может взаимопревращаться или существовать в форме резонансного гибрида. Относительно точной природы и протяженности электронного распределения в указанных ситуациях существует статистическая неопределенность. Приведенные структуры не предназначены включать любой и все возможные сценарии связи между бором и атомом, с которым он связан. Неограничивающие примеры указанных связей следующие:
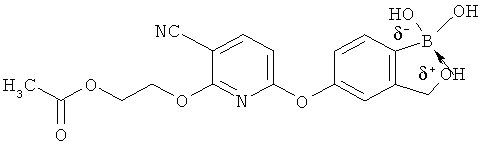
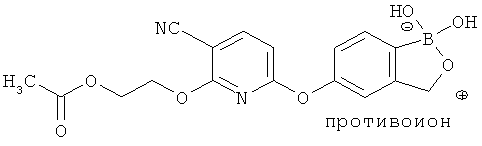
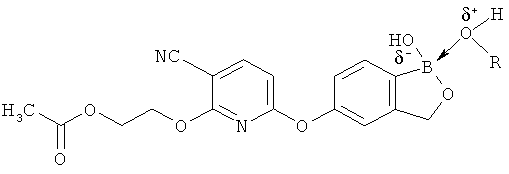
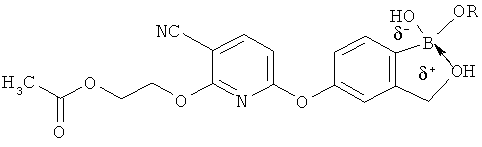
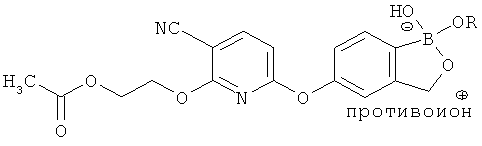
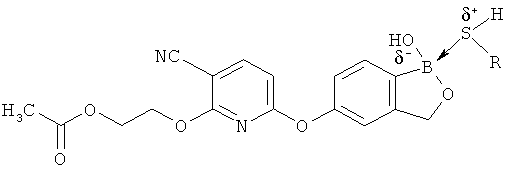
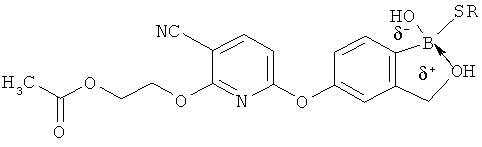
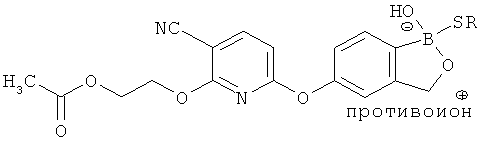
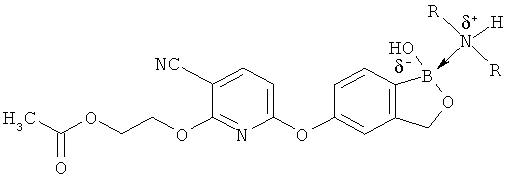
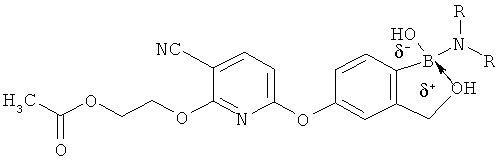
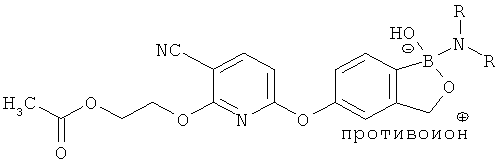
[0099] «Противоион соли» в настоящем описании относится к положительно заряженным ионам, ассоциированным с соединением согласно настоящему изобретению, если бор является полностью или частично отрицательно заряженным. Примеры противоионов соли включают Н+, Н3О+, аммоний, калий, кальций, магний и натрий.
[0100] Соединения, содержащие бор, связанный с углеродом и тремя гетероатомами (такими как три кислорода, описанные в настоящем разделе), может, возможно, содержать полностью отрицательно заряженный бор или частично отрицательно заряженный бор, что обусловлено природой дативной связи между бором и кислородами. Из-за отрицательного заряда с указанным соединением может быть ассоциирован положительно заряженный противоион, таким образом, образуя соль. Примеры положительно заряженных противоионов включают Н+, Н3O+, кальций, натрий, аммоний, калий. Соли указанных соединений полностью входят в описания указанных соединений.
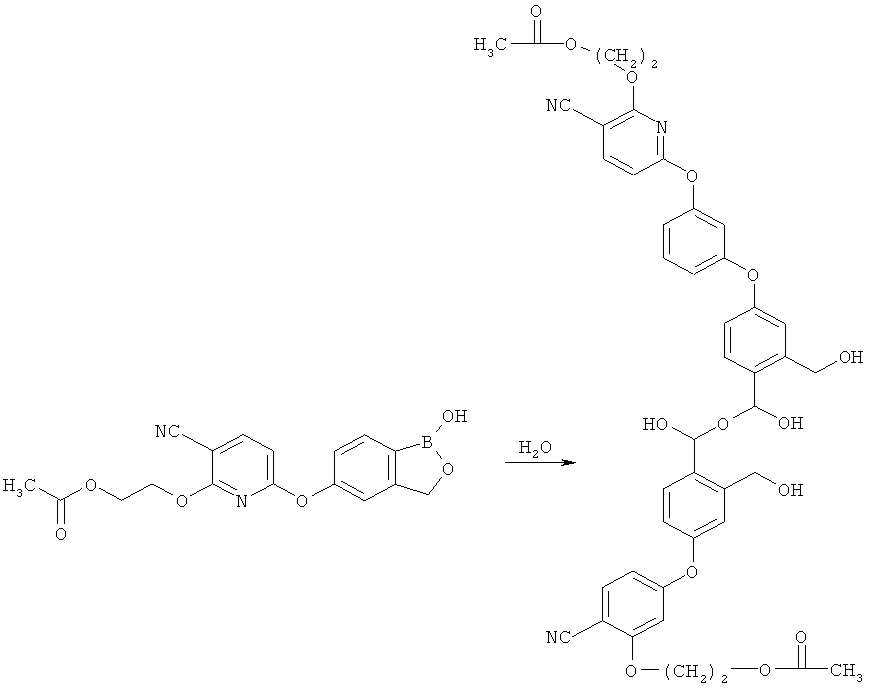
[0101] Настоящее изобретение также включает соединения, представляющие собой поли- или мультивалентные разновидности, включая, например, такие разновидности, как димеры, тримеры, тетрамеры и более высокие гомологи соединений, применяемых в настоящем изобретении или реакционноспособных аналогов указанных соединений. Например, димеры оксаборолов могут образовываться в следующих условиях:
[0102] Настоящее изобретение также включает соединения, представляющие собой ангидриды циклических борсодержащих сложных эфиров, синтезированные путем помещения указанных соединений в дегидратирующие условия. Примеры указанных ангидридов приведены ниже:
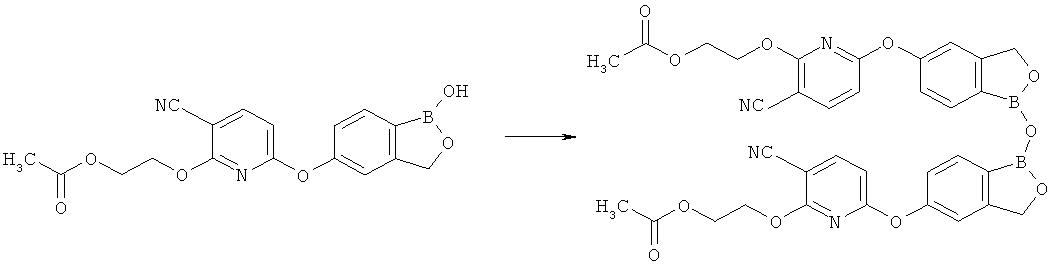 .
.
[0103] Также получены тримеры соединений согласно настоящему изобретению. Например, тримеры ациклических боросодержащих сложных эфиров можно получить следующим образом:
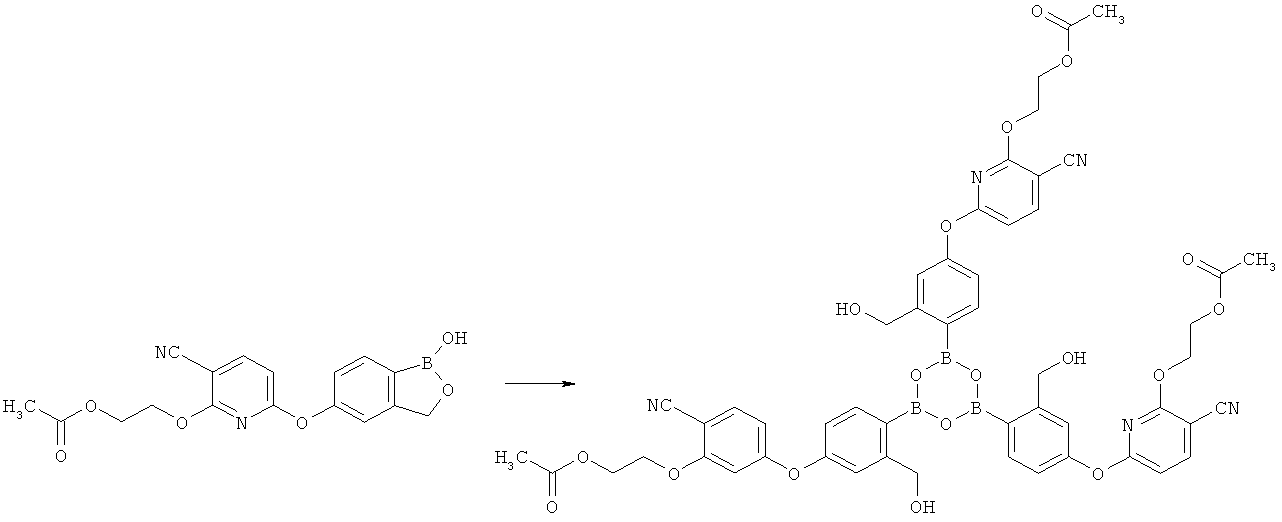
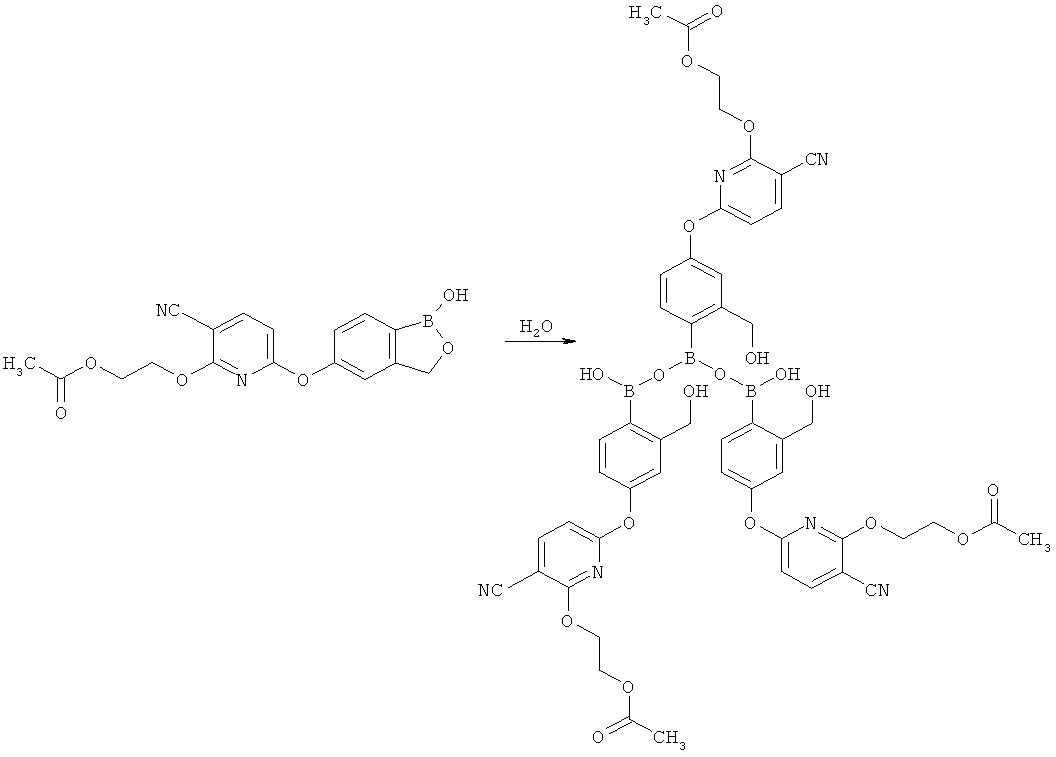
[0104] Полимеры соединений согласно настоящему изобретению также можно получить путем отщепления некоторых защитных групп под действием сильной кислоты. Например, тримеры ациклических боросодержащих сложных эфиров можно получить следующим образом:
[0105] Также в настоящем изобретении применяют соединения, представляющие собой поли- или мультивалентные разновидности, включая, например, такие разновидности, как димеры, тримеры, тетрамеры и более высокие гомологи соединений согласно настоящему изобретению или реакционноспособные аналоги указанных соединений. Поли- и мультивалентные разновидности можно получить из единственной разновидности или нескольких разновидностей соединений согласно настоящему изобретению. Например, димерная конструкция может быть «гомодимерной» или «гетеродимерной». Кроме того, поли- и мультивалентные конструкции, в которых соединение согласно настоящему изобретению или реакционноспособный аналог указанного соединения, присоединено к олигомерной или полимерной основе (например, полилизин, декстран, гидроксиэтилкрахмал, и тому подобное), попадают в объем настоящего изобретения. Основа предпочтительно является полифункциональной (т.е., содержащей множество реакционноспособных центров для присоединения соединений, применяемых в настоящем изобретении). Кроме того, в основу в качестве производных можно включить единственное соединение согласно настоящему изобретению или несколько соединений согласно настоящему изобретению.
[0106] Кроме того, настоящее изобретение включает применение соединений с фрагментом, определенным в формулах, входящих в настоящее описание, в которые введены функциональные группы для получения соединений, обладающих растворимостью в воде, улучшенной по сравнению с аналогичными соединениями, в которые не были введены подобные функциональные группы. Так, любой заместитель, указанный в настоящем описании, можно заменить на аналогичные радикалы, обладающие улучшенной растворимостью в воде. Например, в объем настоящего изобретения входит замена гидроксильной группы на диол, или амина на четвертичный амин, гидроксиамин или подобный более растворимый в воде остаток. Согласно предпочтительному варианту реализации, дополнительную растворимость в воде придают путем замещения в центре, не существенном для активности по отношению к «редактируемому» домену соединений согласно настоящему описанию, остатком, улучшающим растворимость в воде исходных соединений. Способы улучшения растворимости в воде органических соединений известны в данной области. Указанные способы включают, без ограничения, введение в органическое ядро функциональной группы с постоянно заряженным остатком, например, четвертичного иона аммония, или группы, которая заряжена при физиологически значимом pH, например, карбоновой кислоты, амина. Другие способы включают добавление к органическому ядру гидроксил- или амин-содержащих групп, например, спиртов, полиолов, поли простых эфиров, и тому подобное. Типичные примеры включают, без ограничения, полилизин, полиэтиленимин, поли(этиленгликоль) и поли(пропиленгликоль). Подходящие варианты химической природы функциональных групп и стратегий для указанных соединений известны в данной области. См., например, Dunn, R.L., et al., Eds. POLYMERIC DRUGS AND DRUG DELIVERY SYSTEMS, ACS Symposium Series Vol.469, American Chemical Society, Washington, D.C. 1991.
II. Введение
[0107] Настоящее изобретение имеет много аспектов. Указанные аспекты включают изобретения, относящиеся к соединениям, фармацевтическим составам, способам лечения состояния, улучшения эффекта, увеличения выработки цитокина и/или хемокина, уменьшения выработки цитокина и/или хемокина, увеличения высвобождения цитокина и/или хемокина, уменьшения высвобождения цитокина и/или хемокина, или ингибирования фосфодиэстеразы.
III. Соединения
IIIa.
[0108] Согласно первому из аспектов, настоящее изобретение представляет собой соединение согласно изобретению. Согласно примеру реализации, настоящее изобретение представляет собой соединение, описанное в настоящей заявке. Согласно примеру реализации, указанное соединение соответствует формуле, описанной в данной заявке. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D2, D3, D4, D5, D6, D7, D8, D9, D10, D11, D12, D13, D14, D15, D16, D17, D18, D19, D20, D21, D22, D23, D24, D25, D26, D27, D28, D29, D30, D31, D32, D33, D34, D35, D36, D37, D38, D39, D40, D41, D42, D43, D44, D45, D46, D47, D48, D49, D50, D51, D52, D53, D54, D55, D56, D57, D58, D59, D60, D61, D62, D63, D64, D65, D66, D67, D68, D69, D70, D71, D72, D73, D74, D75, D76, D77, D78, D79, D80, D81, D83, D84, D85, D86, D87, D88, D89, D90, D91, D92, D93, D94, D95, D96, D97, D98, D99, D100, D101, D102, D103, D104, D105, D106, D107, D108, D109, D110, D111, D112, D113, D114, D115, D116, D117, D118, D119, D120, D121, D122, D123, D124, D125, D126, D127, D128, D129, D130, D131, D132, D133, D134, D135, D136, D137, D138, D139, D140, D141, D142, D143, D144, D145, D146, D147, D148, D149, D150, D151, D152, D153, D154, D155, D156, D157, D158, D159, D160, D161, D162, D163, D164, D165, D166, D167, D168, D169, D170, D171, D172, D173, D174, D175, D176, D177, D178, D179, D180, D181, D182, D183, D184, D185, D186, D187, D188, D189, D190, D191, D192, D193, D194, D195, D196, D197, D198, D199, D200, D201, D202, D203, D204, D205, D206, D207, D208, D209, D210, D211, D212, D213, D214, D215, D216, D217, D218, D219, D220, D221, D222, D223, D224, D225, D228 и D229. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из
[0109] Согласно второму аспекту настоящего изобретения, предложено соединение, имеющее структуру, соответствующую формуле:

где R* представляет собой член, выбранный из Н, отрицательного заряда и положительно заряженного противоиона. X представляет собой член, выбранный из CRa, CRb и N. Ra представляет собой член, выбранный из CN, -C(O)NR1R2, и -С(О)OR3. Rb и Rc представляют собой члены, независимо выбранные из Н, OR4, NR4R5, SR4, -S(O)R4, -S(O)2R4, -S(O)2NR4R5, -C(O)R4, -C(O)OR4, -C(O)NR4R5, нитро, галогена, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила, где каждый из R1, R2, R4 и R5 представляют собой члены, независимо выбранные из Н, нитро, галогена, циано, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила. R3 представляет собой член, выбранный из Н и замещенного или незамещенного алкила. Существует условие, что R1 и R2, вместе с тем атомом, к которому они присоединены, возможно, объединены с образованием 5-7-членного замещенного или незамещенного гетероциклоалкильного кольца. Существует условие, что R4 и R5, вместе с тем атомом, к которому они присоединены, возможно, объединены с образованием 5-7-членного замещенного или незамещенного гетероциклоалкильного кольца. Существует условие, что Rb и Rc не могут оба представлять собой Н. Существует условие, что Ra и Rb, возможно, соединены с образованием 5-8-членного кольца, содержащего две оксогруппы.
[0110] Согласно примеру реализации, X представляет собой N. Согласно примеру реализации, X представляет собой СН. Согласно примеру реализации, X представляет собой CRb.
[0111] Согласно примеру реализации, R* представляет собой Н.
[0112] Согласно примеру реализации, по меньшей мере один из Rb и Rc представляет собой член, выбранный из F и Сl. Согласно примеру реализации, по меньшей мере один из Rb и Rc представляет собой замещенный или незамещенный алкил, который представляет собой член, выбранный из незамещенного алкила, гидроксиалкила, галоалкила, тригалоалкила, замещенного или незамещенного аминоалкила, -CH2C(O)OR6, -CH2NHC(О)R6, -CH2NR6R7, где каждый из R6 и R7 представляет собой член, выбранный из Н, замещенного или незамещенного алкила, замещенного или незамещенного циклоалкила и замещенного или незамещенного гетероарила, при условии, что R6 и R7, вместе с теми атомами, к которым они присоединены, возможно, объединены с образованием 5-7-членного замещенного или незамещенного гетероциклоалкильного кольца.
[0113] Согласно примеру реализации, Rb представляет собой Н. Согласно примеру реализации, Rc представляет собой Н. Согласно примеру реализации, Rc представляет собой Н, a Rb представляет собой член, выбранный из галогена, незамещенного алкила, галогензамещенного алкила, незамещенного алкокси. Согласно примеру реализации, Rc представляет собой Н, a Rb представляет собой член, выбранный из метила и этила. Согласно примеру реализации, Rc представляет собой Н, a Rb представляет собой член, выбранный из незамещенного С3 алкила, незамещенного С4 алкила, незамещенного С5 алкила и незамещенного С6 алкила. Согласно примеру реализации, Rb представляет собой Н, a Rc представляет собой трифторметил. Согласно примеру реализации, Rc представляет собой Н, a Rb представляет собой член, выбранный из метокси, этокси, незамещенного С3 алкокси, незамещенного С4 алкокси, незамещенного С5 алкокси и незамещенного С6 алкокси.
[0114] Согласно примеру реализации, по меньшей мере один из Rb и Rc представляет собой член, выбранный из -CH2C(O)OR6, -CH2NHC(О)R6, CH2NR6R7, где каждый из R6 и R7 представляет собой член, независимо выбранный из Н, метила, трифторметила, этила, пропила, бутила, т-бутила, -С(O)Н, где R6 и R7, вместе с атомом азота, к которому они присоединены, возможно, образуют кольцо, выбранное из 4-метилпиперазинила, пиперидинила, морфолина и пирролидинила. Согласно примеру реализации, по меньшей мере один из Rb и Rc представляет собой метил, трифторметил, -СН2OН, -СН2N(СН3)2,
 ,
,  ,
,  ,
,  ,
, 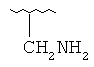 и
и 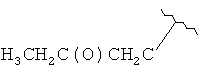
[0115] Согласно примеру реализации, по меньшей мере один из Rb и Rc представляет собой член, выбранный из -OR4, -C(O)R4, -С(О)OR4 и -C(O)NR4R5, где каждый R4 и R5 представляет собой член, независимо выбранный из Н, метила, этила, метоксиэтила, циклопропила, CH2C(O)OR8, СН2С(О)NR8R9, 2-(диметиламино) этила, 2-пиридинметила, 2-(4-циано) пиридинила, с условием, что R8 и R9, вместе с теми атомами, к которым они присоединены, возможно, образуют 5-7-членное замещенное или незамещенное гетероциклоалкильное кольцо.
[0116] Согласно примеру реализации, по меньшей мере один из Rb и Rc представляет собой член, выбранный из -ОН, -ОСН3, -ОСН2СН3, -ОСН2СН2ОСН3, -ОСН2С(O)ОН, -ОСН2С(О)ОСН2СН3, -ОСН2С(О)ОС(СН3)3, -С(О)ОСН3, -С(О)ОН, -С(O)Н, -ОСН2С(О)N(СН2СН3)2, 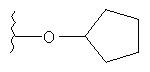 ,
, 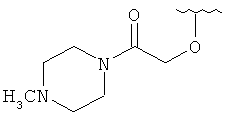 ,
, 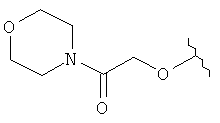 ,
, 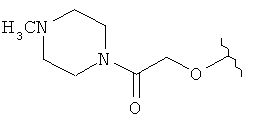 ,
, 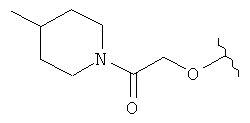 ,
, 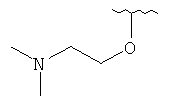 ,
,  и
и  .
.
[0117] Согласно примеру реализации, по меньшей мере один из Rb и Rc представляет собой член, выбранный из F, Сl, метила, трифторметила, -СН2ОН, -CH2N(CH3)2, -ОН, -OСН3, -ОСН2СН3, ОСН2СН2ОСН3, -ОСН2С(O)ОН, -ОСН2С(О)ОСН2СН3, -ОСН2С(О)ОС(СН3)3, С(О)ОСН3, -С(О)ОН, -C(O)H, -OCH2C(O)N(CH2CH3)2,  ,
,  ,
,  ,
,  ,
,  и
и  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ,
, 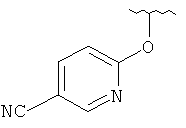 и
и 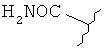 .
.
[0118] Согласно примеру реализации, указанное соединение имеет структуру, соответствующую формуле

где X, R*, Rb и Rc такие, как описано в настоящей заявке.
[0119] Согласно примеру реализации, по меньшей мере один из Rb и Rc представляет собой член, выбранный из галогена, галоалкила, C(O)R4, -С(О)OR4, -C(O)NR4R5, -CH2C(O)OR4, -CH2NHC(O)R4 и OR4, где R4 и R5 представляют собой члены, независимо выбранные из Н и замещенного или незамещенного алкила.
[0120] Согласно примеру реализации, по меньшей мере один из Rb и Rc представляет собой член, выбранный из F, Сl, метила, трифторметила, -СН2OН, -CH2N(CH3)2, -ОН, -OСН3, -ОСН2СН3, OСН2СН2OСН3, -OСН2С(О)ОН, -OСН2С(О)ОСН2СН3, -OСН2С(О)ОС(СН3)3, С(O)OСН3, -С(О)ОН, -С(O)Н, -ОСН2С(О)N(СН2СН3)2, 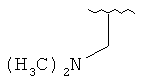 ,
,  ,
,  ,
,  ,
,  и
и 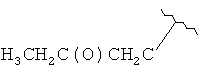 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ,
,  и
и 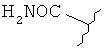 .
.
[0121] Согласно примеру реализации, указанное соединение имеет структуру, соответствующую формуле:
 ,
,
где X, R*, Rb и Rc такие, как описано в настоящей заявке.
[0122] Согласно примеру реализации, по меньшей мере, один из Rb и Rc представляет собой член, выбранный из F, Сl, метила, трифторметила, -СН2OН, -CH2N(CH3)2, -ОН, -OСН3, -ОСН2СН3, OСН2С(O)OН, -ОСН2СН2ОСН3, -OСН2С(О)ОСН2СН3, -OСН2С(О)ОС(СН3)3, С(O)ОСН3, -С(О)ОН, -C(O)H, -OCH2C(O)N(CH2CH3)2, 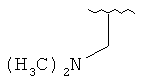 ,
,  ,
,  ,
,  ,
,  и
и 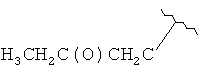 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ,
,  и
и 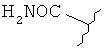 .
.
[0123] Согласно примеру реализации, Rc представляет собой Н, a Rb представляет собой член, выбранный из F, Сl, метила, трифторметила, -СН2OН, -CH2N(CH3)2, -ОН, -OСН3, -ОСН2СН3, OСН2С(O)OН, -ОСН2СН2ОСН3, -OСН2С(О)ОСН2СН3, -OСН2С(О)ОС(СН3)3, С(O)ОСН3, -С(O)OН, -C(O)H, -OCH2C(O)N(CH2CH3)2,
 ,
,  ,
,  ,
,  ,
,  и
и  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ,
,  и
и  .
.
[0124] Согласно примеру реализации, указанное соединение имеет структуру, соответствующую формуле:
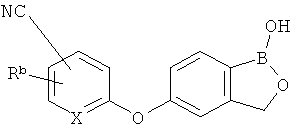
где X представляет собой N или СН или CRb, Rb представляет собой член, выбранный из галогена и замещенного или незамещенного алкила, C(O)R4, С(О)OR4, OR4, NR4R5, где R4 и R5 представляют собой члены, независимо выбранные из Н, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила, при условии, что R4 и R5, вместе с тем атомом, к которому они присоединены, возможно, объединены с образованием 5-7-членного замещенного или незамещенного гетероциклоалкильного кольца, и соли указанных соединений. Согласно примеру реализации, Rb представляет собой член, выбранный из OR4 и NR4R5, где R4 и R5 представляют собой члены, независимо выбранные из Н, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, аи замещенного или незамещенного гетероарила, с условием, что R4 и R5, вместе с тем атомом, к которому они присоединены, возможно, объединены с образованием 5-7-членного замещенного или незамещенного гетероциклоалкильного кольца.
[0125] Согласно примеру реализации, Rb представляет собой алкил, возможно, содержащий в качестве заместителя член, выбранный из галогена, OR4a, С(О)OR4a, NR4aR4b, замещенного или незамещенного гетероциклоалкила или незамещенного гетероарила, где R4a и R4b независимо выбирают из Н, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила. Согласно примеру реализации, R4a представляет собой Н или незамещенный алкил. Согласно примеру реализации, R4b представляет собой Н или незамещенный алкил или С(O)Н. Согласно примеру реализации, Rb представляет собой фтор. Согласно примеру реализации, Rb представляет собой хлор.
[0126] Согласно примеру реализации, Rb представляет собой ОН. Согласно примеру реализации, Rb представляет собой OR4, где R4 представляет собой алкил, возможно, содержащий в качестве заместителя, по меньшей мере, один галоген, гидроксил, простую эфирную, карбоксильную или сложноэфирную группу.
[0127] Согласно примеру реализации, Rb представляет собой OR4, где R4 представляет собой незамещенный алкил. Согласно примеру реализации, Rb представляет собой OR4, где R4 представляет собой незамещенный C1 или С2 или С3алкил. Согласно примеру реализации, Rb представляет собой OR4, где R4 представляет собой незамещенный С4 или С5 или С6 алкил. Согласно примеру реализации, Rb представляет собой OR4, где R4 представляет собой метил или этил или пропил или изопропил или изобутил.
[0128] Согласно примеру реализации, Rb представляет собой OR4, где R4 представляет собой алкил, содержащий в качестве заместителя по меньшей мере один галоген. Согласно примеру реализации, Rb представляет собой OR4, где R4 представляет собой алкил, содержащий в качестве заместителя один или два или три галогена. Согласно примеру реализации, Rb представляет собой О (СН2)m1R31, где m1 равно 1 или 2 или 3 или 4 или 5 или 6, a R31 представляет собой метильный остаток, в котором по меньшей мере один из атомов водорода замещен на галоген. Согласно примеру реализации, указанный галоген представляет собой хлор. Согласно примеру реализации, указанный галоген представляет собой фтор. Согласно примеру реализации, R31 представляет собой -CF3. Согласно примеру реализации, R31 представляет собой -CHF2. Согласно примеру реализации, m1 равно 1 или 2 или 3. Согласно примеру реализации, Rb представляет собой -OCH2CF3. Согласно примеру реализации, Rb представляет собой OCH2CHF2.
[0129] Согласно примеру реализации, Rb представляет собой -О (СН2)m1OC(О)R4d, где m1 представляет собой число, выбранное из 1 или 2 или 3 или 4 или 5 или 6, a R4d представляет собой незамещенный алкил. Согласно примеру реализации, m1 равно 1 или 2 или 3. Согласно примеру реализации, m1 равно 2. Согласно примеру реализации, R4d представляет собой незамещенный C1 или С2 или С3 алкил. Согласно примеру реализации, R4d представляет собой незамещенный С4 или С5 или С6 алкил. Согласно примеру реализации, R4d представляет собой метил. Согласно примеру реализации, Rb представляет собой -О(СН2)2OС(О)СН3.
[0130] Согласно примеру реализации, Rb представляет собой -О(СН2)m1C(О)R4d, где m1 представляет собой число, выбранное из 1 или 2 или 3 или 4 или 5 или 6, a R4d представляет собой незамещенный алкил. Согласно примеру реализации, m1 равно 2 или 3 или 4. Согласно примеру реализации, m1 равно 3. Согласно примеру реализации, R4d представляет собой незамещенный C1 или С2 или С3 алкил. Согласно примеру реализации, R4d представляет собой незамещенный С4 или С5 или С6 алкил. Согласно примеру реализации, R4d представляет собой метил. Согласно примеру реализации, Rb представляет собой -О(СН2)3С (О)СН3.
[0131] Согласно примеру реализации, Rb представляет собой -О (СН2)m1С(О)OR4d, где m1 представляет собой число, выбранное из 1 или 2 или 3 или 4 или 5 или 6, a R4d представляет собой Н или незамещенный алкил. Согласно примеру реализации, Rb представляет собой -OСН2С(О)OR4d, где R4d такой, как описано в настоящей заявке. Согласно примеру реализации, R4d представляет собой Н или метил или этил или трет-бутил. Согласно примеру реализации, Rb представляет собой -О (СН2)С(О)ОСН2СН3 или -О(СН2)С(О)ОН или -О(СН2)С(О)ОС(СН3)3.
[0132] Согласно примеру реализации, Rb представляет собой OR4, где R4 представляет собой алкил, содержащий в качестве заместителя замещенную или незамещенную аминогруппу. Согласно примеру реализации, Rb представляет собой -О(СН2)m2С(О)NR4eR4f, где m2 представляет собой число, выбранное из 1 или 2 или 3 или 4 или 5 или 6, a R4e и R4f независимо выбраны из Н или незамещенного алкила, или R4e и R4f, вместе с атомом азота, к которому они присоединены, возможно, соединены с образованием замещенного или незамещенного 4-8-членного кольца.
[0133] Согласно примеру реализации, Rb представляет собой -OСН2С(О)NR4eR4f, где R4e и R4f такие, как описано в настоящей заявке. Согласно примеру реализации, R4e и R4f одинаковые и представляют собой независимо выбранный незамещенный алкил. Согласно примеру реализации, R4e и R4f различны, и их независимо выбирают из незамещенного алкила. Согласно примеру реализации, R4e представляет собой Н. Согласно примеру реализации, R4f представляет собой Н. Согласно примеру реализации, R4e и R4f представляют собой этил. Согласно примеру реализации, R4e и R4f, вместе с атомом азота, к которому они присоединены, соединены с образованием пиперазинила, незамещенного или замещенного незамещенным алкилом при атоме азота в положении 4. Согласно примеру реализации, R4e и R4f, вместе с атомом азота, к которому они присоединены, соединены с образованием N-метилпиперазинила. Согласно примеру реализации, R4e и R4f, вместе с атомом азота, к которому они присоединены, соединены с образованием пиперидинила, незамещенного или замещенного незамещенным алкилом. Согласно примеру реализации, R4e и R4f, вместе с атомом азота, к которому они присоединены, образуют 4-метилпиперидинил. Согласно примеру реализации, R4e и R4f, вместе с атомом азота, к которому они присоединены, образуют незамещенный морфолинил.
[0134] Согласно примеру реализации, Rb представляет собой OR4, где R4 представляет собой незамещенный алкил. Согласно примеру реализации, R4 представляет собой C1 или С2 или С3 или С4 или С5 или С6алкил. Согласно примеру реализации, R4 представляет собой C1 алкил. Согласно примеру реализации, Rb представляет собой OR4, где R4 представляет собой алкил, содержащий в качестве заместителя незамещенный пиридинил. Согласно примеру реализации, Rb представляет собой 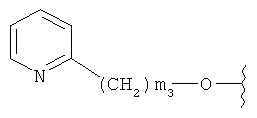 , где m3 равно 1 или 2 или 3 или 4 или 5 или 6. Согласно примеру реализации, m3 равно 1.
, где m3 равно 1 или 2 или 3 или 4 или 5 или 6. Согласно примеру реализации, m3 равно 1.
[0135] Согласно примеру реализации, Rb представляет собой OR4, где R4 представляет собой замещенный или незамещенный циклоалкил. Согласно примеру реализации, Rb представляет собой OR4, где R4 представляет собой незамещенный циклоалкил. Согласно примеру реализации, Rb представляет собой OR4, где R4 представляет собой циклопентил. Согласно примеру реализации, R4 представляет собой незамещенный циклогексил.
[0136] Согласно примеру реализации, Rb представляет собой OR4, где R4 представляет собой алкил, содержащий в качестве заместителя незамещенный алкокси. Согласно примеру реализации, Rb представляет собой -О(СН2)m5OR30, где т5 равно 1 или 2 или 3 или 4 или 5 или 6, а R30 представляет собой Н или незамещенный алкил или незамещенный тетрагидропиран. Согласно примеру реализации, R30 представляет собой C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, т5 равно 1 или 2 или 3. In Согласно примеру реализации, m5 равно 2. Согласно примеру реализации, R30 представляет собой C1 или С2 или С3 алкил. Согласно примеру реализации, R30 представляет собой С4 или С5 или С6 алкил. Согласно примеру реализации, R30 представляет собой Н. Согласно примеру реализации, R30 представляет собой метил или изопропил. Согласно примеру реализации, R30 представляет собой 2-тетрагидропиран. Согласно примеру реализации, Rb представляет собой -О(СН2)2OС(СН3)2 или -O(СН2)2ОН или -O(СН2)2O-ТГП (тетрагидропиран).
[0137] Согласно примеру реализации, Rb представляет собой OR4, где R4 представляет собой алкил, содержащий в качестве заместителя незамещенный циклоалкил. Согласно примеру реализации, Rb представляет собой -О(СН2)m5OR30, где m5 равно 1 или 2 или 3 или 4 или 5 или 6, a R30 представляет собой 3-8-членный циклоалкил. Согласно примеру реализации, R30 представляет собой 3-6-членный циклоалкил. Согласно примеру реализации, R30 представляет собой член, выбранный из циклопропила и циклопентила. Согласно примеру реализации, m5 равно 1 или 2 или 3. Согласно примеру реализации, m5 равно 1.
[0138] Согласно примеру реализации, Rb представляет собой C(O)R4, где R4 представляет собой незамещенный алкил. Согласно примеру реализации, R4 представляет собой C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, R4 представляет собой C1 алкил. Согласно примеру реализации, Rb представляет собой С(O)Н. Согласно примеру реализации, Rb представляет собой C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, Rb представляет собой C1 алкил. Согласно примеру реализации, Rb представляет собой алкил, содержащий в качестве заместителя галоген. Согласно примеру реализации, Rb представляет собой алкил, содержащий в качестве заместителя по меньшей мере один галоген. Согласно примеру реализации, Rb представляет собой алкил, содержащий в качестве заместителя по меньшей мере один фтор. Согласно примеру реализации, Rb представляет собой CF3.
[0139] Согласно примеру реализации, Rb представляет собой алкил, содержащий в качестве заместителя гидрокси. Согласно примеру реализации, Rb представляет собой -(СН2)m4OН, где m4 представляет собой число, выбранное из 1 или 2 или 3 или 4 или 5 или 6. Согласно примеру реализации, m4 равно 1.
[0140] Согласно примеру реализации, Rb представляет собой алкил, содержащий в качестве заместителя карбокси или сложный эфир. Согласно примеру реализации, Rb представляет собой - (СН2)m1С(О)OR4a, где m1 представляет собой число, выбранное из 1 или 2 или 3 или 4 или 5 или 6 a R4a представляет собой Н или незамещенный алкил.
[0141] Согласно примеру реализации, Rb представляет собой CH2C(O)OR4a, где R4a такой, как описано в настоящей заявке. Согласно примеру реализации, R4a представляет собой Н или метил или этил или трет-бутил.
[0142] Согласно примеру реализации, Rb представляет собой алкил, содержащий в качестве заместителя аминогруппу. Согласно примеру реализации, Rb представляет собой - (СН2)m7NR4aR4b, где m7 представляет собой число, выбранное из 1 или 2 или 3 или 4 или 5 или 6, a R4a и R4b представляют собой члены, независимо выбранные из Н и незамещенного алкила и формила, или R4a и R4b, вместе с атомом азота, к которому они присоединены, возможно, соединены с образованием замещенного или незамещенного 4-8-членного кольца. Согласно примеру реализации, R4b такой, как описано в настоящей заявке, R4a представляет собой Н. Согласно примеру реализации, R4a такой, как описано в настоящей заявке, R4b представляет собой Н. Согласно примеру реализации, R4b такой, как описано в настоящей заявке, R4a представляет собой метил. Согласно примеру реализации, R4a такой, как описано в настоящей заявке, R4b представляет собой метил. Согласно примеру реализации, m7 равно 1. Согласно примеру реализации, R4a и R4b, вместе с атомом азота, к которому они присоединены, соединены с образованием пиперазинила, незамещенного или замещенного незамещенным алкилом при атоме азота в положении 4. Согласно примеру реализации, R4a и R4b, вместе с атомом азота, к которому они присоединены, соединены с образованием N-метилпиперазинила. Согласно примеру реализации, R4a и R4b, вместе с атомом азота, к которому они присоединены, соединены с образованием пиперидинила, незамещенного или замещенного незамещенным алкилом. Согласно примеру реализации, R4a и R4b, вместе с атомом азота, к которому они присоединены, соединены с образованием 4-метилпиперидинила. Согласно примеру реализации, R4a и R4b, вместе с атомом азота, к которому они присоединены, образуют незамещенный морфолинил.
[0143] Согласно примеру реализации, Rb представляет собой NH2. Согласно примеру реализации, Rb представляет собой NR4R5 где R4 представляет собой член, выбранный из Н и незамещенного алкила, а R5 представляет собой член, выбранный из замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила. Согласно примеру реализации, Rb представляет собой NR4R5, R4 такой, как описано в настоящей заявке, R5 представляет собой незамещенный алкил. Согласно примеру реализации, Rb представляет собой NR4R5, где R4 представляет собой Н, R5 такой, как описано в настоящей заявке. Согласно примеру реализации, Rb представляет собой NR4R5, где R4 представляет собой незамещенный алкил, R5 такой, как описано в настоящей заявке. Согласно примеру реализации, Rb представляет собой NR4R5, где R5 такой, как описано в настоящей заявке, R4 представляет собой незамещенный C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, Rb представляет собой NR4R5, где R4 представляет собой незамещенный C1 или С2 или С3 алкил a R5 такой, как указано в настоящем описании. Согласно примеру реализации, Rb представляет собой NR4R5, где R4 представляет собой метил, a R5 такой, как указано в настоящем описании. Согласно примеру реализации, Rb представляет собой NR4R5, где R4 такой, как указано в настоящем описании, a R5 представляет собой незамещенный C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, Rb представляет собой NR4R5, где R5 представляет собой член, выбранный из метила и трет-бутила, a R4 такой, как указано в настоящем описании.
[0144] Согласно примеру реализации, Rb представляет собой NR4R5, где R4 такой, как описано в настоящей заявке, R5 представляет собой алкил, содержащий в качестве заместителя член, выбранный из ОН, незамещенного арилалкокси, незамещенного алкокси и незамещенного арила. Согласно примеру реализации, Rb представляет собой NR4R5, где R5 представляет собой -(CH2)m8Ph.
[0145] Согласно примеру реализации, Rb представляет собой NR4R5, где R5 представляет собой - (СН2)m8OR26, где m8 представляет собой число, выбранное из 1 или 2 или 3 или 4 или 5 или 6 a R26 представляет собой член, выбранный из Н, незамещенного или арилзамещенного C1 или С2 или С3 или С4 или С5 или С6 алкила. Согласно примеру реализации, m8 равно 1 или 2 или 3. Согласно примеру реализации, m8 равно 2. Согласно примеру реализации, R26 представляет собой незамещенный C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, R26 представляет собой метил. Согласно примеру реализации, R26 представляет собой бензил. Согласно примеру реализации, Rb представляет собой NR4R5, где R4 такой, как описано в настоящей заявке, R5 представляет собой - (СН2)m8O(СН2)m9Рh, где m8 и m9 каждое независимо выбирают из 1 или 2 или 3 или 4 или 5 или 6. Согласно примеру реализации, Rb представляет собой NR4R5, где R4 такой, как указано в настоящем описании, R5 представляет собой -(СН2)m8O(СН2)m9Ph, где m8 и m9 каждое независимо выбирают из 1 или 2 или 3. Согласно примеру реализации, Rb представляет собой NR4R5, где R4 такой, как описаноуказано в настоящем описании, R5 представляет собой -(СН2)m8O(СН2)Ph. Согласно примеру реализации, Rb представляет собой NR4R5, где R4 такой, как описано в настоящей заявке, R5 представляет собой - (СН2)2O(СН2)m9Ph. Согласно примеру реализации, Rb представляет собой NR4R5, где R4 такой, как описано в настоящей заявке, R5 представляет собой -(СН2)2O(СН2)Ph.
[0146] Согласно примеру реализации, Rb представляет собой член, выбранный из -NH(CH2)2OH, -NH(СН2)2ОСН3, -NHCH3, -NHC(CH3)3, -NH(CH2)Ph, -NH (СН2)2O(СН2)Ph.
[0147] Согласно примеру реализации, Rb представляет собой член, выбранный из -N(CH3)2, -N(СН3)(СН2)2OН, -N(СН3)(СН2)2ОСН3, -NHCH3, -NHC(CH3)3, -NH(CH2)Ph, -NH(СН2)2O(СН2)Ph.
[0148] Согласно примеру реализации, Rb представляет собой -NR4R5, где R4 и R5, вместе с атомом азота, к которому они присоединены, соединены с образованием замещенного или незамещенного 4-8-членного кольца. Согласно примеру реализации, единственный отличающийся от углерода атом, который образует кольцо, представляет собой атом азота, к которому присоединены R4 и R5. Согласно примеру реализации, Rb представляет собой -NR4R5, где R4 и R5, вместе с атомом азота, к которому они присоединены, соединены с образованием члена, выбранного из замещенного или незамещенного пирролидинила и замещенного или незамещенного пиперидинила. Согласно примеру реализации, Rb представляет собой -NR4R5, где R4 и R5, вместе с атомом азота, к которому они присоединены, соединены с образованием члена, выбранного из незамещенного пирролидинила и незамещенного пиперидинила. Согласно примеру реализации, единственным неуглеродным атомом, образующим кольцо, является азот. Согласно примеру реализации, указанное кольцо содержит один атом азота и один атом кислорода. Согласно примеру реализации, Rb представляет собой -NR4R5, где R4 и R5, вместе с атомом азота, к которому они присоединены, соединены с образованием замещенного или незамещенного морфолинила. Согласно примеру реализации, Rb представляет собой -NR4R5, где R4 и R5, вместе с атомом азота, к которому они присоединены, соединены с образованием незамещенного морфолинила.
[0149] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
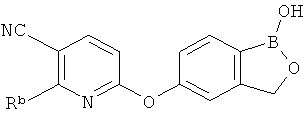 ,
,
и соли указанного соединения, где Rb такой, как описано в настоящей заявке.
[0150] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
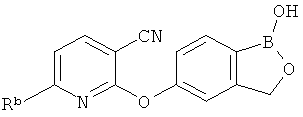 ,
,
и соли указанного соединения, где Rb такой, как описано в настоящей заявке.
[0151] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
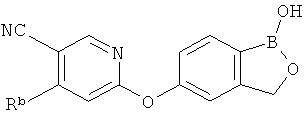 ,
,
и соли указанного соединения, где Rb такой, как описано в настоящей заявке.
[0152] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
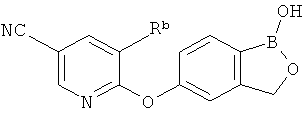 ,
,
и соли указанного соединения, где Rb такой, как описано в настоящей заявке.
[0153] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
 ,
,
и соли указанного соединения, где Rb такой, как описано в настоящей заявке.
[0154] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
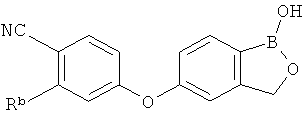 ,
,
и соли указанного соединения, где Rb такой, как описано в настоящей заявке.
[0155] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
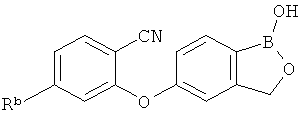 ,
,
и соли указанного соединения, где Rb такой, как описано в настоящей заявке.
[0156] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
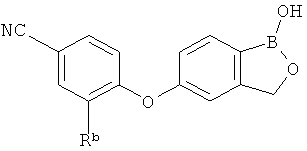
и соли указанного соединения, где Rb такой, как описано в настоящей заявке.
[0157] Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D46, D86, D99, D100, D107, D108, D114, D122, D125, D126, D127, D128, D131, D140 и D141, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D95, D96, D97, D102, D110, D111, D113, D115, D121, D129, D130, D132, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D47, D109, D116, D118, D119, D120, D123, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D98, D101, D106, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D11, D12, D37, D38, D39, D40, D41, D42, D43, D124, D142, D143, D146, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D14, D15, D16, D17, D28, D29, D30, D31, D133, D134, D135, D144, D145, D147, и солей указанных соединений.
[0158] Согласно примеру реализации, указанное соединение имеет структуру, представляющую собой член, выбранный из:
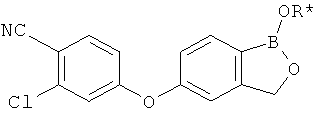 ,
, 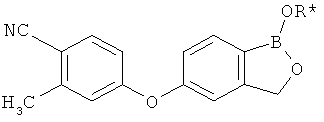 ,
, 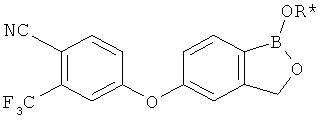 ,
,
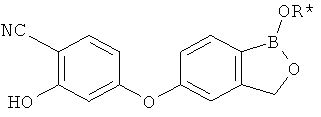 ,
, 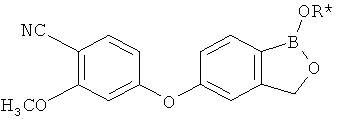 ,
, 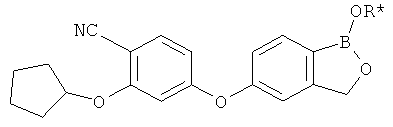 ,
,
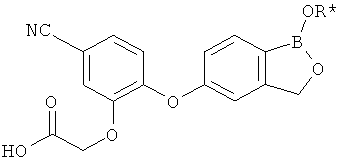 ,
, 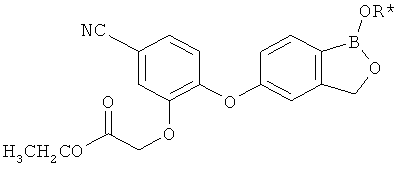 ,
, 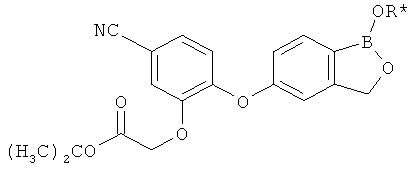 ,
,
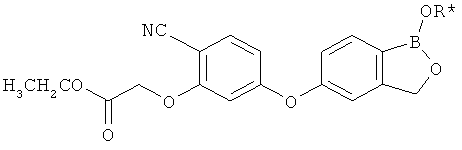 ,
, 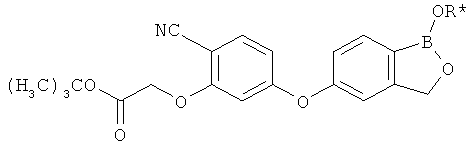 ,
,
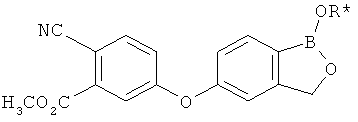 ,
, 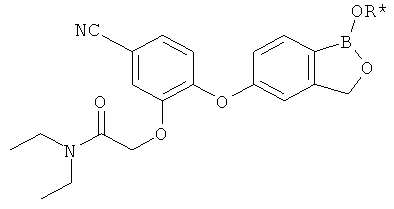 ,
, 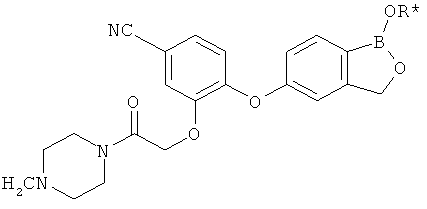 ,
,
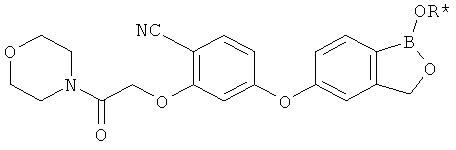 ,
, 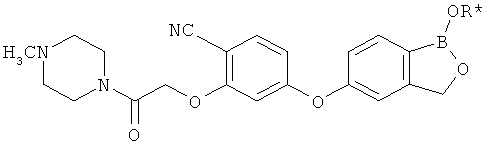 ,
,
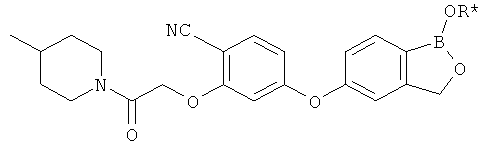 ,
, 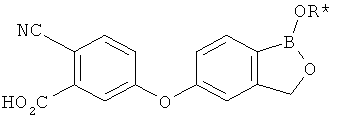 ,
, 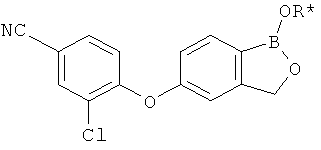 ,
,
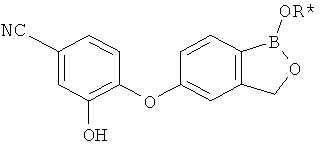 ,
, 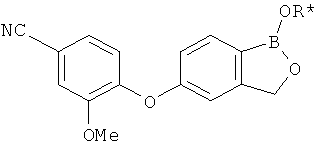 ,
, 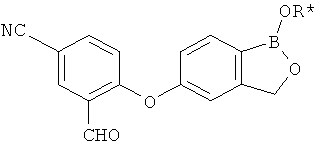 ,
,
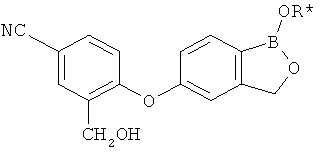 ,
, 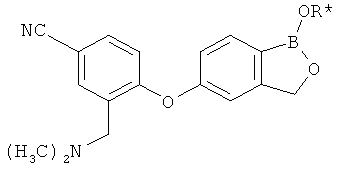 ,
, 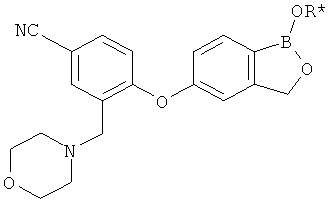 ,
,
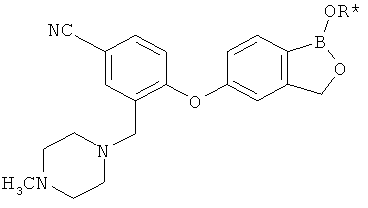 ,
, 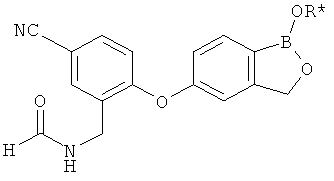 ,
, 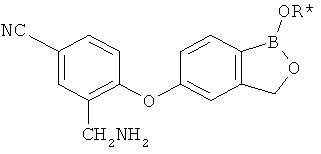 ,
,
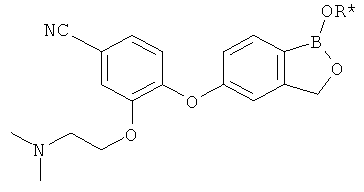 ,
, 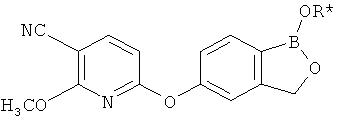 ,
, 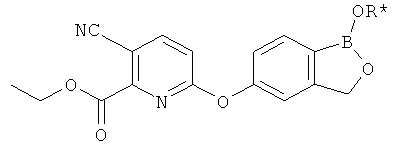 ,
,
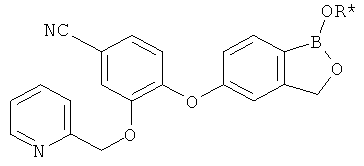 ,
, 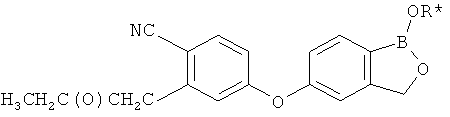 и
и 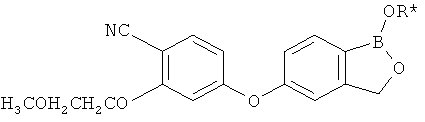 ,
,
где R* такой, как определено в настоящей заявке.
[0159] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
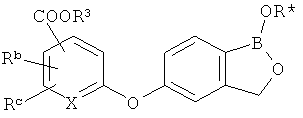 ,
,
где R3, X, R*, Rb и Rc такие, как описано в настоящей заявке.
[0160] Согласно примеру реализации, R3 представляет собой Н. Согласно примеру реализации, R3 представляет собой незамещенный алкил. Согласно примеру реализации, R3 представляет собой метил. Согласно примеру реализации, R3 представляет собой С2 алкил. Согласно примеру реализации, R3 представляет собой С3 алкил. Согласно примеру реализации, R3 представляет собой С4 алкил. Согласно примеру реализации, R3 представляет собой С5 алкил. Согласно примеру реализации, R3 представляет собой С6 алкил.
[0161] Согласно примеру реализации, по меньшей мере один из Rb и Rc представляет собой член, выбранный из -C(O)NR4R5, -С(О)OR4, CH2C(O)OR4, -CH2NHC(О)R4 и OR4, где каждый из R4 и R5 представляет собой член, независимо выбранный из Н, замещенного или незамещенного алкила, замещенного или незамещенного циклоалкила и замещенного или незамещенного гетероарила.
[0162] Согласно примеру реализации, по меньшей мере один из Rb и Rc представляет собой член, выбранный из F, Сl, метила, трифторметила, -СН2OН, -CH2N(CH3)2, -ОН, -OСН3, -ОСН2СН3, OСН2С(O)OН, -OСН2С(О)ОСН2СН3, -OСН2С(О)ОС(СН3)3, -С(O)OСН3, -С(О)ОН, -C(O)H, -OСН2С(O)N(СН2СН3)2,
 ,
,  ,
,  ,
,  ,
,  и
и 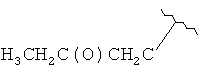 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ,
,  и
и 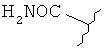 .
.
[0163] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
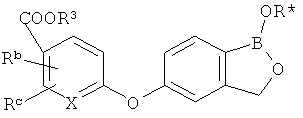 ,
,
где R3, X, R*, Rb и Rc такие, как описано в настоящей заявке.
[0164] Согласно примеру реализации, по меньшей мере один из Rb и Rc представляет собой член, выбранный из -C(O)NH2, -ОН, -OСН3, циклопропилокси и 4-цианопиридин-2-илокси.
[0165] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:

где R3, X, R* такие, как описано в настоящей заявке, и по меньшей мере один из Rb и Rc представляет собой член, выбранный из F, Сl, метила, трифторметила, -СН2ОН, -CH2N(CH3)2, -ОН, -OСН3, -ОСН2СН3, -OСН2С(O)OН, -OСН2С(О)ОСН2СН3, -ОСН2С(О)ОС(СН3)3, -С(O)ОСН3, -С(О)ОН, -С(O)Н, -OСН2С(O)N(СН2СН3)2,
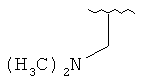 ,
,  ,
,  ,
,  ,
,  и
и 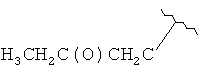 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ,
,  и
и 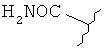 .
.
[0166] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
 ,
,
где R3, X и R* такие, как описано в настоящей заявке, и по меньшей мере один из Rb и Rc представляет собой член, выбранный из C(O)NR4R5, -С(О)OR4, -CH2C(O)OR4, -CH2NHC(O)R4 и OR4, где каждый R4 и R5 представляет собой член, независимо выбранный из Н, замещенного или незамещенного алкила, замещенного или незамещенного циклоалкила и замещенного или незамещенного гетероарила.
[0167] Согласно примеру реализации, указанное соединение имеет формулу, представляющую собой член, выбранный из:
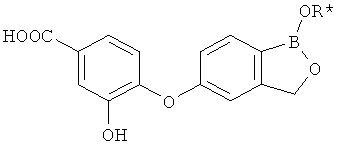 ,
, 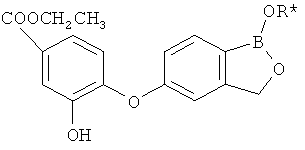 ,
, 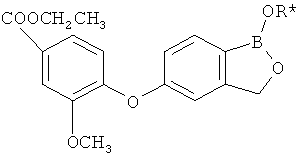 ,
, 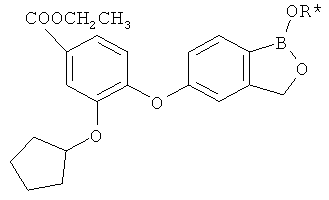 ,
,
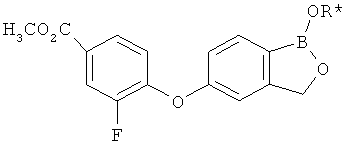 ,
, 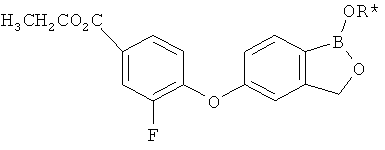 ,
, 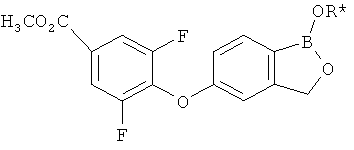 ,
,
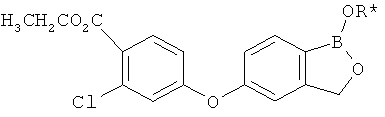 ,
,  ,
, 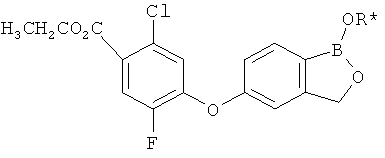 ,
,
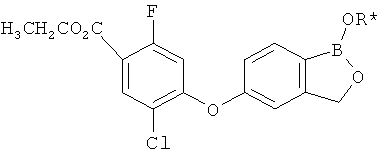 ,
, 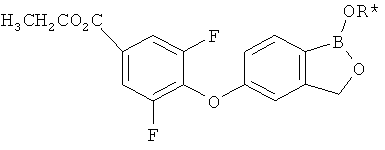 ,
, 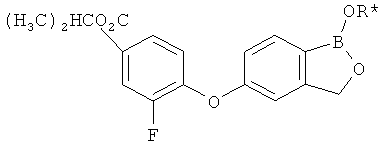 ,
,
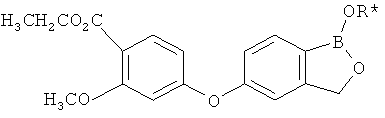 ,
, 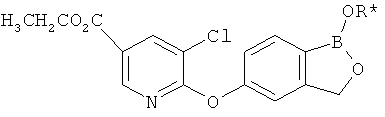 ,
, 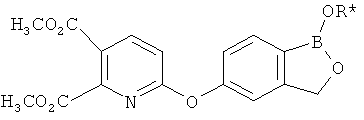 ,
,
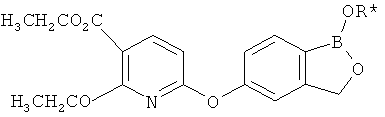 ,
, 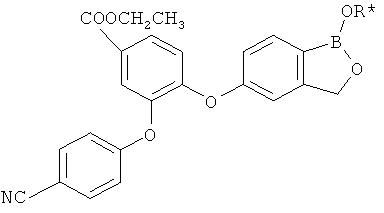 ,
, 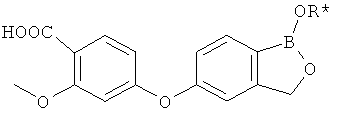 и
и
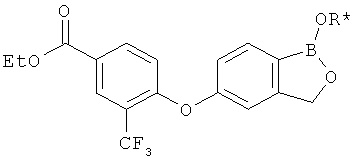 ,
,
где R* такой, как определено в настоящей заявке.
[0168] Согласно примеру реализации, указанное соединение имеет формулу, представляющую собой член, выбранный из
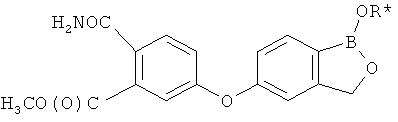 и
и 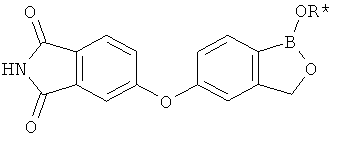 ,
,
где R* такое, как описано в настоящей заявке.
IIIb. Мягкие лекарственные средства
[0169] Мягкие лекарственные средства (или долекарства (ante-drugs)) представляют собой терапевтические агенты, подвергающиеся предсказуемому метаболизму до неактивных метаболитов после оказания их терапевтического действия. Следовательно, их получают путем встраивания в молекулу, в дополнение к активности, наиболее желательный путь, по которому указанная молекула подвергается деактивации и детоксикации.
[0170] Согласно третьему аспекту настоящего изобретения, предложен оксаборол, содержащий сложный эфир, присоединенный к положению 5 указанной группы. Такие замещенные по положению 5 сложные эфиры оксаборола являются метаболически стабильными при местном применении (таком как на кожу или ноготь) и оказывают свое терапевтическое действие. Затем замещенные по положению 5 сложные эфиры оксаборола гидролизуются под действием эстеразы. Эстеразы в общем разделяют на холинэстеразы (включая ацетилхолинэстеразы), карбоксилэстеразы и арилэстеразы. Задействованный механизм соответствует общей формуле:

Крайне изменчивая активность эстеразы присутствует в широком спектре органов, тканей и жидкостей организма. После гидролиза замещенный по положению 5 сложный эфир оксаборола превращается в замещенную по положению 5 оксабороловую кислоту, которая в основном неактивна и нетоксична, если какие-либо лекарственные средства проникают через кожу и попадают в системный кровоток. Указанный так называемый подход мягкого лекарства улучшает терапевтический индекс биоактивных соединений замещенных по положению 5 оксаборолов.
[0171] Согласно третьему аспекту настоящего изобретения, предложено соединение, имеющее структуру согласно следующей формуле:
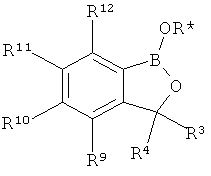
где R* представляет собой член, выбранный из Н, отрицательного заряда и положительно заряженного противоиона. R3 и R4 представляют собой члены, независимо выбранные из Н, циано, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила. R9, R10, R11 и R12 представляют собой члены, независимо выбранные из Н, OR20, NR20R21, SR20, -S(O)R20, -S(O)2R20, -S(O)2NR20R21, нитро, галогена, циано, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила. Каждый R20 и R21 представляет собой член, независимо выбранный из Н, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила. R3 и R4, вместе с атомами, к которым они присоединены, возможно, соединены с образованием 4-7-членного кольца. R9 и R10, вместе с атомами, к которым они присоединены, возможно, соединены с образованием 4-7-членного кольца. R10 и R11, вместе с атомами, к которым они присоединены, возможно, соединены с образованием 4-7-членного кольца. R11 и R12, вместе с атомами, к которым они присоединены, возможно, соединены с образованием 4-7-членного кольца. R20 и R21, вместе с атомами, к которым они присоединены, возможно, соединены с образованием 4-7-членного кольца. Существует условие, что R10 содержит остаток, имеющий структуру согласно следующей формуле:
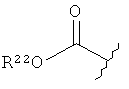
где R22 представляет собой член, выбранный из Н, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила.
[0172] Согласно примеру реализации, существует условие, что указанное соединение не представляет собой 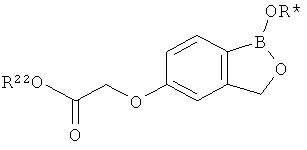 .
.
Согласно примеру реализации, существует условие, что указанное соединение не представляет собой 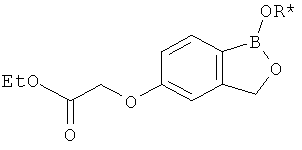 .
.
[0173] Согласно примеру реализации, R22 представляет собой Н. Согласно примеру реализации, R22 представляет собой член, выбранный из замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила. Согласно примеру реализации, R22 представляет собой член, выбранный из замещенного или незамещенного алкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила.
[0174] Согласно примеру реализации, существует условие, что по меньшей мере одн член, выбранный из R10 и R11, должен содержать группу, имеющую структуру согласно формуле:
 .
.
Согласно примеру реализации, R22 представляет собой член, выбранный из замещенного или незамещенного метила, замещенного или незамещенного этила, замещенного или незамещенного пропила, замещенного или незамещенного изопропила, замещенного или незамещенного бутила.
[0175] Согласно примеру реализации, указанное соединение имеет структуру, представляющую собой член, выбранный из:
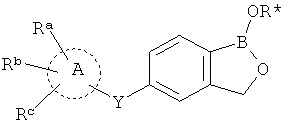
где Y представляет собой член, выбранный из S и О; А представляет собой член, выбранный из замещенного или незамещенного арила и замещенного или незамещенного гетероарила; Ra, Rb и Rc представляют собой члены, независимо выбранные из Н, OR20, NR20R21, SR20, -S(O)R20, -S(O)2R20, -S(O)2NR20R21, -C(O)R20, -C(O)NR20R21, -C(O)OR22, нитро, галогена, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила, где каждый R20 и R21 представляет собой член, независимо выбранный из Н, нитро, галогена, циано, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного, арила, и замещенного или незамещенного гетероарила, при условии, что R20 и R21, вместе с атомами, к которым они присоединены, возможно, объединены с образованием 5-7-членного замещенного или незамещенного гетероциклоалкильного кольца, при условии, что по меньшей мере один из членов, выбранных из Ra, Rb, Rc содержит -С(О)OR22.
[0176] Согласно примеру реализации, указанное соединение представляет собой член, обладающий структурой согласно следующей формуле:
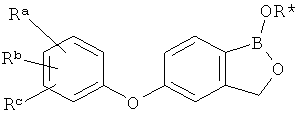 и
и 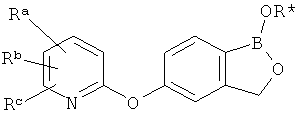 ,
,
где R*, Ra, Rb и Rc такие, как описано в настоящей заявке.
[0177] Согласно примеру реализации, указанное соединение имеет структуру, представляющую собой член, выбранный из:
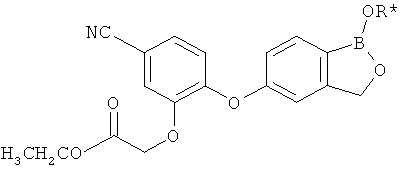 ,
, 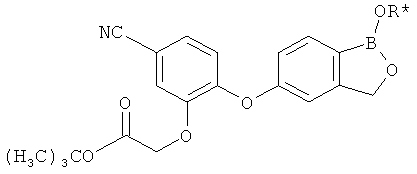 ,
, 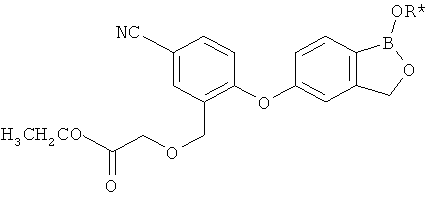 ,
,
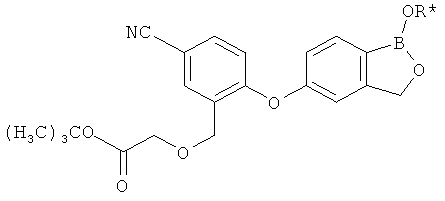 ,
,
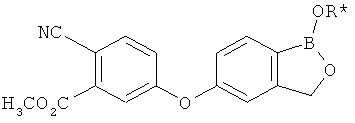 ,
, 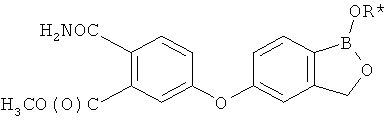 ,
, 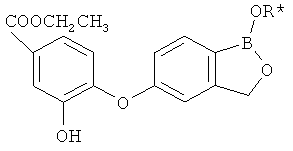 ,
,
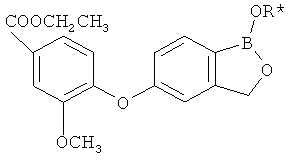 ,
, 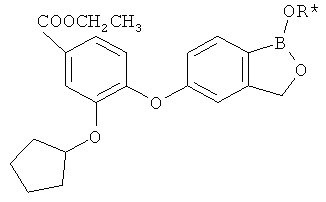 ,
, 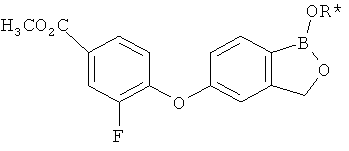 ,
,
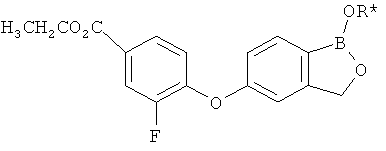 ,
, 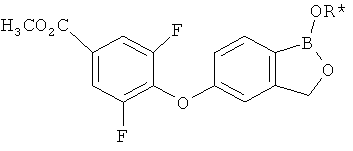 ,
, 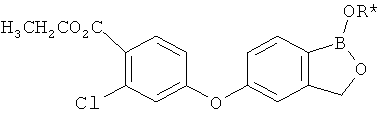 ,
,
 ,
, 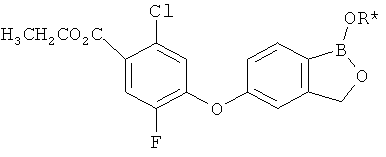 ,
, 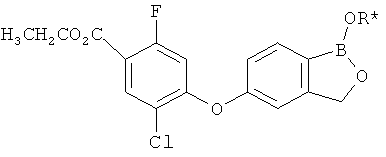 ,
,
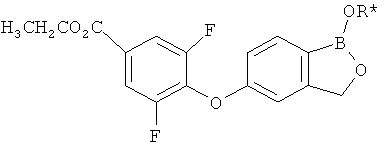 ,
, 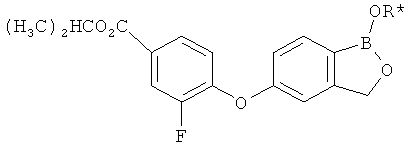 ,
, 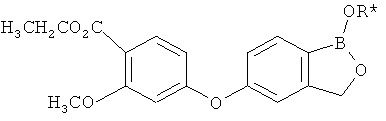 ,
,
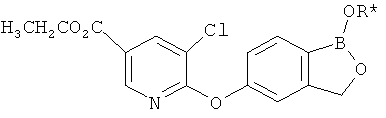 ,
, 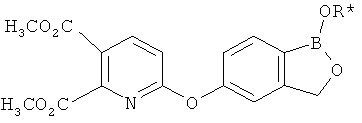 ,
, 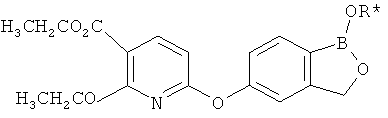 ,
,
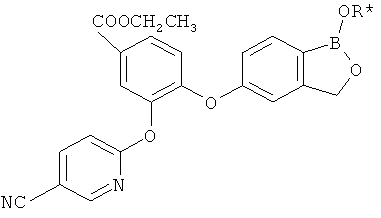
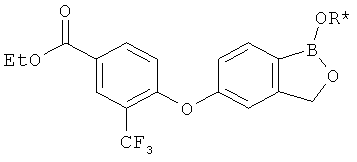 ,
,
где R* такое, как определено в настоящей заявке.
[0178] Согласно примеру реализации, указанное соединение имеет структуру согласно формуле
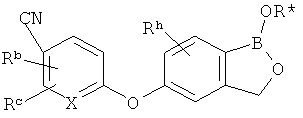
где X, R*, Rb и Rc такие, как описано в настоящей заявке, и где Rh представляет собой галоген. Согласно другому примеру реализации, Rh представляет собой фтор. Согласно другому примеру реализации, Rh представляет собой хлор. Согласно другому примеру реализации, указанное соединение имеет структуру, представляющую собой член, выбранный из:
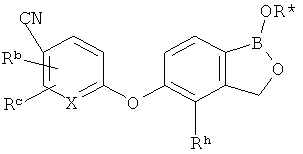 или
или 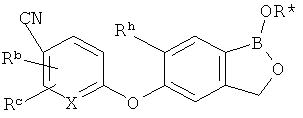 ,
,
где X, R*, Rb, Rc и Rh такие, как описано в настоящей заявке. Согласно другому примеру реализации, указанное соединение имеет структуру, представляющую собой член, выбранный из:
 или
или  ,
,
где X, R*, Rb, Rc и Rh такие, как описано в настоящей заявке.
[0179] Согласно примеру реализации, указанное соединение имеет структуру, представляющую собой член, выбранный из:
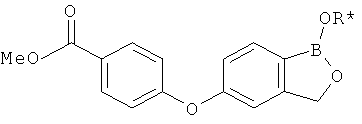 ,
, 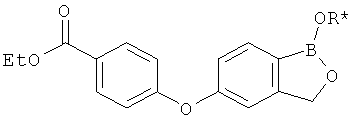 ,
, 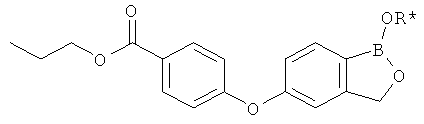 ,
,
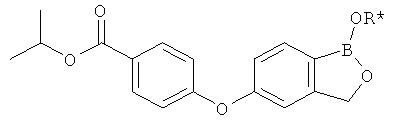 ,
, 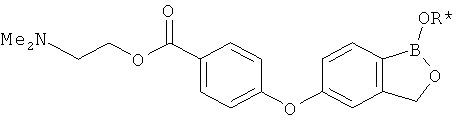 ,
, 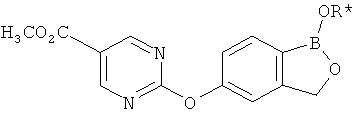 ,
,
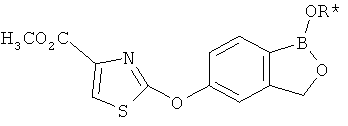 ,
, 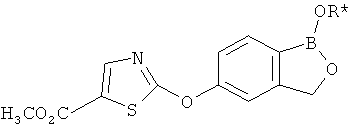 и
и 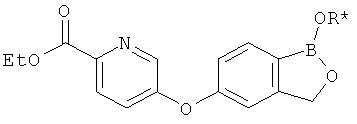 ,
,
где R* такое, как определено в настоящей заявке.
IIIc.
[0180] Согласно четвертому аспекту настоящего изобретения, предложено соединение, имеющее структуру согласно следующей формуле:
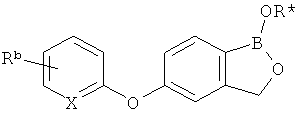
где R* представляет собой член, выбранный из Н, отрицательного заряда и положительно заряженного противоиона, X представляет собой СН или N, и Rd представляет собой аминозамещенный алкил.
[0181] Согласно примеру реализации, Rd представляет собой - (CR10R11)11NR12R13, где n представляет собой член, выбранный из 1-10, a R10, R11, R12 и R13 представляют собой члены, независимо выбранные из Н, OR14, NR14R15, SR14, -S(O)R14, -S(O)2R14, -S(O)2NR14R15, -C(O)R14, -C(O)OR14, -C(O)NR14R15, нитро, галогена, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила, где каждый R14 и R15 представляет собой член, независимо выбранный из Н, нитро, галогена, циано, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила.
[0182] Согласно примеру реализации, R10 и R11 представляют собой Н. Согласно примеру реализации, R12 и R13 представляют собой Н. Согласно примеру реализации, n представляет собой член, выбранный из от 1 до 5. Согласно примеру реализации, n представляет собой член, выбранный из от 1 до 3. Согласно примеру реализации, n равно 1.
[0183] Согласно примеру реализации, Rd представляет собой -(CH2)nNHR13 где n представляет собой член, выбранный из 1-10, a R13 представляет собой член, выбранный из Н, OR14, NR14R15, SR14, -S(O)R14, -S(O)2R14, -S(O)2NR14R15, -C(O)R14, -C(O)OR14, -C(O)NR14R15, где каждый R14 и R15 представляет собой член, независимо выбранный из Н, нитро, галогена, циано, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила.
[0184] Согласно примеру реализации, Rd представляет собой -(CH2)nNHR13 где n представляет собой член, выбранный из 1-10, a R13 представляет собой -S(O)2R14, где R14 представляет собой член, выбранный из Н, незамещенного алкила и замещенного или незамещенного арила.
[0185] Согласно примеру реализации, Rd представляет собой -(CH2)nNHR13 где n представляет собой член, выбранный из 1-10, a R13 представляет собой -S(O)2R14, где R14 представляет собой незамещенный алкил или замещенный или незамещенный арил. Согласно примеру реализации, R14 представляет собой незамещенный C1 или С2 или С3 алкил. Согласно примеру реализации, R14 представляет собой незамещенный С4 или С5 или С6 алкил. Согласно примеру реализации, R14 представляет собой C1 алкил.
[0186] Согласно примеру реализации, Rd представляет собой -(CH2)nNHR13 где n представляет собой член, выбранный из 1-10, a R13 представляет собой -S(O)2R14, где R14 представляет собой замещенный или незамещенный арил. Согласно примеру реализации, R14 представляет собой замещенный или незамещенный фенил. Согласно примеру реализации, R14 представляет собой незамещенный фенил. Согласно примеру реализации, R14 представляет собой фенил, содержащий в качестве заместителя по меньшей мере один галоген и/или по меньшей мере один незамещенный алкил. Согласно примеру реализации, Rd имеет структуру, представляющую собой член, выбранный из
 , где R14 представляет собой хлор или фтор или незамещенный C1 или С2 или С3 или С4 алкил. Согласно примеру реализации, R14 представляет собой хлор или метил. Согласно примеру реализации, n равно 1 или 2 или 3. Согласно примеру реализации, n равно 1.
, где R14 представляет собой хлор или фтор или незамещенный C1 или С2 или С3 или С4 алкил. Согласно примеру реализации, R14 представляет собой хлор или метил. Согласно примеру реализации, n равно 1 или 2 или 3. Согласно примеру реализации, n равно 1.
[0187] Согласно примеру реализации, Rd имеет структуру, представляющую собой член, выбранный из
 ;
;  ; или
; или  .
.
[0188] Согласно примеру реализации, Rd представляет собой -(CH2)nNH2 где n представляет собой член, выбранный из 1-10. Согласно примеру реализации, n равно 1 или 2 или 3 или 4 или 5. Согласно примеру реализации, n равно 1 или 2 или 3. Согласно примеру реализации, Rd представляет собой -CH2NH2.
[0189] Согласно примеру реализации, Rd представляет собой -(CH2)nNHR13 где n представляет собой член, выбранный из 1-10, a R13 представляет собой незамещенный циклоалкил. Согласно примеру реализации, R13 представляет собой незамещенный С3-C8 циклоалкил. Согласно примеру реализации, R13 представляет собой циклопентил или циклогексил или циклогептил. Согласно примеру реализации, n равно 1 или 2 или 3. Согласно примеру реализации, n равно 1. Согласно примеру реализации, n равно 1, a R13 представляет собой циклогексил.
[0190] Согласно примеру реализации, Rd представляет собой -(CH2)nNHR13 где n представляет собой член, выбранный из 1-10, a R13 представляет собой незамещенный алкил. Согласно примеру реализации, R13 представляет собой C1 или С2 или С3 алкил. Согласно примеру реализации, R13 представляет собой С4 или С5 или С6 алкил. Согласно примеру реализации, n равно 1 или 2 или 3. Согласно примеру реализации, n равно 1. Согласно примеру реализации, Rd представляет собой -(СН2)nNHCH3. Согласно примеру реализации, Rd представляет собой -(CH2)NHCH3.
[0191] Согласно примеру реализации, Rd представляет собой -(СН2)nNR13aR13 где n представляет собой член, выбранный из 1-10, а R13 и R13a каждый представляют собой члены, независимо выбранные из незамещенного алкила. Согласно примеру реализации, R13 и R13a каждый представляют собой члены, независимо выбранные из незамещенного алкила. Согласно примеру реализации, R13 и R13a каждый представляют собой члены, независимо выбранные из C1 или С2 или С3 или С4 или С5 или С6 алкила. Согласно примеру реализации, R13 и R13a каждый представляют собой члены, независимо выбранные из C1 или С2 или С3 алкила. Согласно примеру реализации, Rd представляет собой -(СН2) NR13aR13, где R13 и R13a каждый представляют собой члены, независимо выбранные из C1 или С2 или С3 алкила. Согласно примеру реализации, Rd представляет собой - (СН2)N(СН3)2.
[0192] Согласно примеру реализации, Rd представляет собой - (СН2)nNH(СН2)n1R16 где n представляет собой член, выбранный из 1-10, n1 представляет собой член, выбранный из 1-10, a R16 представляет собой замещенный или незамещенный арил. Согласно примеру реализации, n1 равно 1 или 2 или 3 или 4 или 5. Согласно примеру реализации, n1 равно 1. Согласно примеру реализации, R16 представляет собой незамещенный фенил. Согласно примеру реализации, R16 представляет собой фенил, возможно, содержащий в качестве заместителя по меньшей мере один галоген. Согласно примеру реализации, R16 представляет собой фенил, возможно, содержащий в качестве заместителя по меньшей мере один хлор или фтор или бром. Согласно примеру реализации, R16 представляет собой орто-бромфенил или мета-бромфенил или пара-бромфенил. Согласно примеру реализации, Rd представляет собой -CH2NHCH2R16, где R16 представляет собой фенил или орто-бромфенил или мета-бромфенил.
[0193] Согласно примеру реализации, R16 представляет собой фенил, содержащий в качестве заместителя нитро или циано или незамещенный алкокси или незамещенный алкил. Согласно примеру реализации, R16 представляет собой орто-цианофенил или мета-цианофенил или пара-цианофенил. Согласно примеру реализации, R16 представляет собой орто-нитрофенил или мета-нитрофенил или пара-нитрофенил. Согласно примеру реализации, Rd представляет собой -CH2NHCH2R16, где R16 представляет собой орто-цианофенил или мета-цианофенил или пара-цианофенил или орто-нитрофенил или мега-нитрофенил или пара-нитрофенил.
[0194] Согласно примеру реализации, R16 представляет собой фенил, содержащий в качестве заместителя незамещенный C1 или С2 или Сз или С4 или С5 или С6 алкил. Согласно примеру реализации, R16 представляет собой орто-метилфенил или мега-метилфенил или пара-метилфенил. Согласно примеру реализации, Rd представляет собой -CH2NHCH2R16, где R16 представляет собой орто-метилфенил или мета-метилфенил или пара-метилфенил.
[0195] Согласно примеру реализации, R16 представляет собой фенил, содержащий в качестве заместителя незамещенный C1 или С2 или С3 или С4 или С5 или С6 алкилокси. Согласно примеру реализации, R16 представляет собой орто-метоксифенил или мета-метоксифенил или пара-метоксифенил. Согласно примеру реализации, Rd представляет собой -CH2NHCH2R16, где R16 представляет собой орто-метоксифенил или мета-метоксифенил или пара-метоксифенил.
[0196] Согласно примеру реализации, R16 представляет собой незамещенный С3 или С4 или С5 или C6 или С7 или С8 циклоалкил. Согласно примеру реализации, R16 представляет собой незамещенный циклогексил. Согласно примеру реализации, Rd представляет собой -CH2NHCH2R16, где R16 представляет собой циклогексил.
[0197] Согласно примеру реализации, R16 представляет собой незамещенный гетероарил. Согласно примеру реализации, R16 представляет собой незамещенный пиррол. Согласно примеру реализации, R16 представляет собой незамещенный 2-пиррол. Согласно примеру реализации, Rd представляет собой -CH2NHCH2R16, где R16 представляет собой 2-пиррол.
[0198] Согласно примеру реализации, R16 представляет собой незамещенный C1 или С2 или С3 алкил. Согласно примеру реализации, R16 представляет собой незамещенный С4 или С5 или С6 алкил. Согласно примеру реализации, Rd представляет собой -CH2NHC(СН3)2.
[0199] Согласно примеру реализации, R16 представляет собой фенил, содержащий в качестве заместителя -NHC(O)-R34, где R34 представляет собой незамещенный C1 или С2 или С3 или С4 или С5 или C6 алкил. Согласно примеру реализации, R16 представляет собой фенил, содержащий в качестве заместителя -NНС(O)СН3. Согласно примеру реализации, Rd представляет собой -CH2NHCH2R16, где R16 представляет собой орто-(СН3С(О)NH-) фенил или мета-(СН3С(О)NH-) фенил или пара-(СН3С(O)NH-)фенил.
[0200] Согласно примеру реализации, Rd представляет собой - (СН2)nNHC(О)R14, где n представляет собой член, выбранный из 1-10, где R14 представляет собой незамещенный алкил. Согласно примеру реализации, R14 представляет собой незамещенный C1 или С2 или С3 алкил. Согласно примеру реализации, R14 представляет собой незамещенный С4 или С5 или С6 алкил. Согласно примеру реализации, R14 представляет собой метил или этил или изопропил или т-бутил. Согласно примеру реализации, R14 представляет собой C1 алкил. Согласно примеру реализации, Rd представляет собой - (СН2)NHC(О)СН3 или - (СН2)NHC(О)СН2СН3 или - (СН2)NHC(О)СН(СН3)2 или (CH2)NHC(O)C(CH3)3.
[0201] Согласно примеру реализации, Rd представляет собой -(СН2) nNHC(О)R14, где n представляет собой член, выбранный из 1-10, где R14 представляет собой замещенный или незамещенный арил. Согласно примеру реализации, R14 представляет собой незамещенный фенил. Согласно примеру реализации, R14 представляет собой фенил, содержащий в качестве заместителя нитро или циано или незамещенный алкокси или незамещенный алкил. Согласно примеру реализации, R14 представляет собой орто-цианофенил или мета-цианофенил или пара-цианофенил. Согласно примеру реализации, R14 представляет собой орто-нитрофенил или мета-нитрофенил или пара-нитрофенил. Согласно примеру реализации, Rd представляет собой -CH2NHC(О)R14, где R14 представляет собой орто-цианофенил или мета-цианофенил или пара-цианофенил или орто-нитрофенил или мета-нитрофенил или пара-нитрофенил.
[0202] Согласно примеру реализации, R14 представляет собой фенил, содержащий в качестве заместителя незамещенный C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, R14 представляет собой орто-метилфенил или мета-метилфенил или пара-метилфенил. Согласно примеру реализации, Rd представляет собой - CH2NHC(О)R14, где R14 представляет собой орто-метилфенил или мета-метилфенил или пара-метилфенил.
[0203] Согласно примеру реализации, R14 представляет собой фенил, содержащий в качестве заместителя незамещенный C1 или С2 или С3 или или С5 или С6 алкилокси. Согласно примеру реализации, R14 представляет собой орто-метоксифенил или мета-метоксифенил или пара-метоксифенил. Согласно примеру реализации, Rd представляет собой -CH2NHC(О)R14, где R14 представляет собой орто-метоксифенил или мета-метоксифенил или пара-метоксифенил.
[0204] Согласно примеру реализации, R14 представляет собой фенил, содержащий в качестве заместителя галоген. Согласно примеру реализации, R14 представляет собой хлор или фтор. Согласно примеру реализации, Rd представляет собой -CH2NHC(О)R14, где R14 представляет собой орто-фторфенил или мета-фторфенил или пара-фторфенил.
[0205] Согласно примеру реализации, R14 представляет собой фенил, содержащий в качестве заместителя галоалкил. Согласно примеру реализации, указанный галоген представляет собой хлор или фтор. Согласно примеру реализации, R14 представляет собой фенил, содержащий в качестве заместителя алкил, содержащий в качестве заместителя два фтора. Согласно примеру реализации, R14 представляет собой орто(трифторметил)фенил или мета(трифторметил)фенил или пара(трифторметил)фенил. Согласно примеру реализации, Rd представляет собой -CH2NHC(О)R14, где R14 представляет собой орто(трифторметил)фенил или мета (трифторметил) фенил или пара (трифторметил) фенил..
[0206] Согласно примеру реализации, Rd представляет собой -(CH2)nNHC(О)(CR40R41)n9OC(О)R42, где n представляет собой член, выбранный из 1-10, где R40 представляет собой незамещенный алкил, R41 представляет собой незамещенный алкил, R42 представляет собой незамещенный алкил. Согласно примеру реализации, R40 или R41 или R42 каждый независимо выбирают из C1 или С2 или С3 или С4 или С5 или С6 алкила. Согласно примеру реализации, R40 или R41 или R42 каждый представляет собой метил. Согласно примеру реализации, n9 равно 1. Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)(С(СН3)(СН3))ОС(О)R42, где R42 представляет собой C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, Rd представляет собой - (СН2)nNHC(О)(С(СН3)(СН3))ОС(О)СН3.
[0207] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)R14, где n представляет собой член, выбранный из 1-10, где R14 представляет собой незамещенный циклоалкил. Согласно примеру реализации, R14 представляет собой незамещенный С3 или С4 или С5 или С6 или С7 или С8 циклоалкил. Согласно примеру реализации, R14 представляет собой незамещенный циклопентил или циклогексил.
[0208] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)R14, где n представляет собой член, выбранный из 1-10, где R14 представляет собой незамещенный гетероарил. Согласно примеру реализации, R14 представляет собой незамещенный фуран. Согласно примеру реализации, R14 представляет собой незамещенный 2-фуран.
[0209] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)OR14, где n представляет собой член, выбранный из 1-10, где R14 представляет собой незамещенный алкил. Согласно примеру реализации, R14 представляет собой C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, R14 представляет собой С4 алкил. Согласно примеру реализации, R14 представляет собой член, выбранный из н-бутила, изобутила, втор-бутила и трет-бутила. Согласно примеру реализации, Rd представляет собой - (СН2)NHC(О)OR14, где R14 представляет собой C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(O)ОС(СН3)3.
[0210] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)NR43R44, где n представляет собой целое число, выбранное из 1-10, где R43 и R44 независимо выбраны из Н, замещенного или незамещенного алкила,, замещенного или незамещенного циклоалкила и замещенного или незамещенного арила. Согласно примеру реализации, R43 и R44, вместе с атомом азота, к которому они присоединены, соединены с образованием 3-8-членного кольца. Согласно примеру реализации, R43 и R44, вместе с атомом азота, к которому они присоединены, соединены с образованием 4-7-членного кольца. Согласно примеру реализации, R43 и R44, вместе с атомом азота, к которому они присоединены, соединены с образованием 5-6-членного кольца. Согласно примеру реализации, n равно 1 или 2 или 3. Согласно примеру реализации, представляет собой
 и
и  .
.
[0211] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)NHR44, где n представляет собой целое число, выбранное из 1-10, где R44 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный циклоалкил и замещенный или незамещенный арил. Согласно примеру реализации, R44 представляет собой незамещенный арил. Согласно примеру реализации, R44 представляет собой незамещенный фенил. Согласно примеру реализации, R44 представляет собой арил, содержащий в качестве заместителя незамещенный алкил. Согласно примеру реализации, R44 представляет собой арил, содержащий в качестве заместителя незамещенный C1 или С2 или С3 алкил. Согласно примеру реализации, R44 представляет собой арил, содержащий в качестве заместителя незамещенный С4 или С5 или С6 алкил. Согласно примеру реализации, R44 представляет собой фенил, содержащий в качестве заместителя незамещенный C1 или С2 или С3 алкил. Согласно примеру реализации, R44 представляет собой орто-метилфенил или мета-метилфенил или пара-метилфенил. Согласно примеру реализации, Rd представляет собой -СН2)NHC(О)NHR44, где R44 представляет собой пара-метилфенил.
[0212] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)NHR44, где n представляет собой целое число, выбранное из 1-10, где R44 представляет собой арил, содержащий в качестве заместителя незамещенный алкиламино. Согласно примеру реализации, R44 представляет собой арил, содержащий в качестве заместителя NR50R51, где каждый R50 и R51 независимо выбраны из Н и незамещенного алкила. Согласно примеру реализации, R44 представляет собой фенил, содержащий в качестве заместителя NR50R51, где R50 и R51 каждый независимо выбраны из C1 или С2 или С3 или С4 или С5 или С6 алкила. Согласно примеру реализации, R44 Представляет собой фенил, содержащий в качестве заместителя NR50R51, где R50 и R51 каждый независимо выбраны из C1 или С2 или С3 алкила. Согласно примеру реализации, R44 представляет собой орто-(NR50R51) фенил или мета-(NR50R51) фенил или пара -(NR50R51) фенил. Согласно примеру реализации, R50 представляет собой C1 или С2 или С3 алкил. Согласно примеру реализации, R51 представляет собой C1 или С2 или С3 алкил. Согласно примеру реализации, R50 представляет собой C1 или С2 или С3 алкил. Согласно примеру реализации, R44 представляет собой фенил, содержащий в качестве заместителя N(СН3)2. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)NHR44, где R44 представляет собой пара-(N(СН3)2)фенил.
[0213] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)(СН2)n10NR43R44, где n представляет собой целое число, выбранное из 1-10, п10 представляет собой целое число, выбранное из 1-10, где R43 и R44 независимо выбирают из Н, замещенного или незамещенного алкила, замещенного или незамещенного циклоалкила и замещенного или незамещенного арила. Согласно примеру реализации, R43 и R44, вместе с атомом азота, к которому они присоединены, соединены с образованием 3-8-членного кольца. Согласно примеру реализации, R43 и R44, вместе с атомом азота, к которому они присоединены, соединены с образованием 4-7-членного кольца. Согласно примеру реализации, R43 и R44, вместе с атомом азота, к которому они присоединены, соединены с образованием 5-6-членного кольца. Согласно примеру реализации, n равно 1 или 2 или 3. Согласно примеру реализации, n10 равно 1 или 2 или 3. Согласно примеру реализации, Rd представляет собой -(CH2NHC(O)(СН2)n10NR43R44.
[0214] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)NHR44, где n представляет собой целое число, выбранное из 1-10, где R44 представляет собой арил, содержащий в качестве заместителя галоген. Согласно примеру реализации, R44 представляет собой фенил, содержащий в качестве заместителя галоген. Согласно примеру реализации, R44 представляет собой орто-(галоген)фенил или мета-(галоген)фенил или пара-(галоген)фенил. Согласно примеру реализации, R44 представляет собой орто-(хлор)фенил или мета-(хлор)фенил или пара-(хлор)фенил. Согласно примеру реализации, R44 представляет собой орто-(фтор)фенил или мета-(фтор)фенил или пара-(фтор)фенил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)NHR44, где R44 представляет собой пара-(хлор)фенил.
[0215] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)NHR44, где n представляет собой целое число, выбранное из 1-10, где R44 представляет собой незамещенный арил. Согласно примеру реализации, R44 представляет собой незамещенный фенил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)NHR44, где R44 представляет собой незамещенный фенил.
[0216] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)NHR44, где n представляет собой целое число, выбранное из 1-10, где R44 представляет собой незамещенный алкил. Согласно примеру реализации, R44 представляет собой C1 или С2 или С3 алкил. Согласно примеру реализации, Rd представляет собой -(CH2)NHC(O)NHR44, где R44 представляет собой С4 или С5 или С6 алкил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)NHR44, где R44 представляет собой этил.
[0217] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)(CR52R53)n11NR54R55, где n представляет собой целое число, выбранное из 1-10, n11 представляет собой целое число, выбранное из 1-10, где R52 и R53 независимо выбраны из Н и алкила, возможно, замещенного арилом, и где R54 и R55 независимо выбирают из Н, незамещенного алкила, и -С(О)OR56, где R56 представляет собой незамещенный алкил.
[0218] Согласно примеру реализации, Rd представляет собой -(CH2)NHC(O)(СН2)n11NR54R55, где n11 представляет собой целое число, выбранное из 1-10, и где R54 и R55 независимо выбраны из Н, незамещенного алкила и -С(О)OR56, где R56 представляет собой незамещенный алкил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)(СН2)NHR55 и где R55 представляет собой -С(О)OR56, где R56 представляет собой незамещенный алкил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)(СН2)NHR55 и где R55 представляет собой -С(О)OR56, где R56 представляет собой C1 или С2 или С3 алкил. Согласно примеру реализации, Rd представляет собой -(CH2)NHC(O)(СН2)NHR55 и где R55 представляет собой -С(О)OR56, где R56 представляет собой С4 или С5 или С6 алкил.
[0219] Согласно примеру реализации, Rd представляет собой -(CH2)NHC(O)(CH2)NR54R55 и где R54 представляет собой незамещенный алкил, и R55 представляет собой -С(О)OR56, где R56 представляет собой незамещенный алкил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)(СН2)NR54R55 и где R54 представляет собой C1 или С2 или С3 или С4 или С5 или С6 алкил, R55 представляет собой -С(О)OR56, где R56 представляет собой C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)(СН2)NR54R55 и где R54 представляет собой С2 алкил, R55 представляет собой -С(О)OR56, где R56 представляет собой C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)(СН2)NR54R55 и где R54 представляет собой C1 или С2 или С3 алкил, R55 представляет собой -С(О)OR56, где R56 представляет собой С3 или С4 или С5 алкил. Согласно примеру реализации, Rd представляет собой - (СН2)NHC(О)(СН2)NR54R55 и где R54 представляет собой C1 алкил, R55 представляет собой -С(О)OR56, где R56 представляет собой С4 алкил.
[0220] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)(СН2)n11NR54R55, где n представляет собой целое число, выбранное из 1-10, n11 представляет собой целое число, выбранное из 1-10, и где R54 и R55 независимо выбраны из Н и незамещенного алкила. Согласно примеру реализации, Rd представляет собой -(CH2)nNHC(O)(CH2)n11NH2. Согласно примеру реализации, n равно 1 или 2 или 3. Согласно примеру реализации, n11 равно 1 или 2 или 3. Согласно примеру реализации, Rd представляет собой -(CH2)NHC(O)(CH2)NH2. Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)(СН2)n11NHR55, где n представляет собой целое число, выбранное из 1-10, n11 представляет собой целое число, выбранное из 1-10, и где R55 представляет собой незамещенный алкил. Согласно примеру реализации, Rd представляет собой -(CH2)NHC(O)(CH2)NHR55, где R55 представляет собой незамещенный алкил. Согласно примеру реализации, Rd представляет собой -(CH2)NHC(O)(СН2)NHR55 где R55 представляет собой С1 или С2 или С3 алкил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)(CH2)NHR55 где R55 представляет собой С4 или С5 или С6 алкил. Согласно примеру реализации, Rd представляет собой -(CH2)NHC(O)(CH2)NHCH3.
[0221] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)(СН2)n11NR54R55 где n представляет собой целое число, выбранное из 1-10, n11 представляет собой целое число, выбранное из 1-10, и где R54 и R55 представляют собой независимо выбранные незамещенные алкилы. Согласно примеру реализации, R54 и R55 каждый представляет собой член, независимо выбранный из C1 или С2 или С3 или С4 или С5 или С6 алкила. Согласно примеру реализации, R54 и R55 каждый представляет собой член, независимо выбранный из C1 или С2 или С3 алкила. Согласно примеру реализации, Rd представляет собой -(CH2)NHC(О)(CH2)NR54R55, где R54 и R55 каждый представляет собой член, независимо выбранный из C1 или С2 или С3 алкила. Согласно примеру реализации, Rd представляет собой -(CH2)NHC(O)(СН2)N(СН3)2.
[0222] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)(CHR53)n11NR54R55, где n представляет собой целое число, выбранное из 1-10, n11 представляет собой целое число, выбранное из 1-10, где R53 представляет собой алкил, и где R54 и R55 независимо выбираны из Н, незамещенного алкила, и -С(О)OR56, где R56 представляет собой незамещенный алкил. Согласно примеру реализации, n равно 1 или 2 или 3 и n11 равно 1 или 2 или 3. Согласно примеру реализации, n равно 1 и n11 равно 1. Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)(CHR53)n11NH2, где n представляет собой целое число, выбранное из 1-10, n11 представляет собой целое число, выбранное из 1-10, где R53 представляет собой алкил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)СН(R53)(NH2), где R53 представляет собой алкил. Согласно примеру реализации, R53 представляет собой C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, R53 представляет собой C1 или С2 или С3 алкил. Согласно примеру реализации, Rd представляет собой -(СН2) NHC(О)СН(R53)(NH2), где R53 представляет собой C1 или С2 или С3 или С4 алкил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)СН(R53)(NH2), где R53 представляет собой С4 алкил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)СН(СН3)(NH2). Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)СН(NH2)(СН2СН(СН3)2).
[0223] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)(CHR53)n11NR54R55, где n представляет собой целое число, выбранное из 1-10, n11 представляет собой целое число, выбранное из 1-10, где R53 представляет собой алкил, содержащий в качестве заместителя арил, и где R54 и R55 представляют собой независимо выбранные незамещенные алкилы. Согласно примеру реализации, n равно 1 или 2 или 3 и n11 равно 1 или 2 или 3. Согласно примеру реализации, n равно 1 и n11 равно 1. Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)(CHR53)n11NR54R55, где n представляет собой целое число, выбранное из 1-10, n11 представляет собой целое число, выбранное из 1-10, где R53 представляет собой алкил, содержащий в качестве заместителя арил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)СН(R53)(NR54R55) где R53 представляет собой алкил, содержащий в качестве заместителя арил. Согласно примеру реализации, R53 представляет собой (CH2)n12-Ph, где n12 представляет собой целое число, выбранное из 1-10. Согласно примеру реализации, n равно 1 или 2 или 3, n11 равно 1 или 2 или 3 и n12 равно 1 или 2 или 3. Согласно примеру реализации, n равно 1, n11 равно 1 и n12 равно 1. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)СН(CH2-Ph)(NR54R55), где R54 или R55 представляет собой d или С2 или С3 или С4 алкил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)СН((СН2)n12-Ph)(N(СН3)2). Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)СН(СН2-Ph)(N(CH3)2).
[0224] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)R58, где n представляет собой целое число, выбранное из 1-10, и R58 представляет собой член, выбранный из
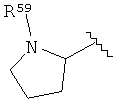 и
и 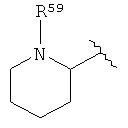 , где R59 представляет собой Н или незамещенный алкил или С(О)OR56, где R56 представляет собой незамещенный алкил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)R58, где R58 представляет собой
, где R59 представляет собой Н или незамещенный алкил или С(О)OR56, где R56 представляет собой незамещенный алкил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)R58, где R58 представляет собой  или
или  или
или  . Согласно примеру реализации, Rd представляет собой - (СН2)NHC(О)R58, где R58 представляет собой
. Согласно примеру реализации, Rd представляет собой - (СН2)NHC(О)R58, где R58 представляет собой  или
или  или
или  .
.
[0225] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)(CHR53)n11NHR55, где n представляет собой целое число, выбранное из 1-10, n11 представляет собой целое число, выбранное из 1-10, где R53 представляет собой алкил, и где R55 представляет собой -С(О)OR56, где R56 представляет собой незамещенный алкил. Согласно примеру реализации, n равно 1 или 2 или 3 и n11 равно 1 или 2 или 3. Согласно примеру реализации, n равно 1 и n11 равно 1. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)СН(R53)(NHC(О)OR56), где R53 представляет собой C1 или С2 или С3 или С4 или С5 или С6 алкил и R56 представляет собой C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, R53 представляет собой C1 или С2 или С3 алкил. Согласно примеру реализации, R56 представляет собой С4 или С5 или С6 алкил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)СН(СН2СН(СН3)2)(NHC(О)OR56). Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)СН(R53)(NHC(О)ОС(СН3)3). Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)СН(СН2СН(СН3)2)(NHC(О)ОС(СН3)3).
[0226] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)(CHR53)n11NH2, где n представляет собой целое число, выбранное из 1-10, n11 представляет собой целое число, выбранное из 1-10, где R53 представляет собой незамещенный алкил, возможно, содержащий в качестве заместителя арил. Согласно примеру реализации, n равно 1 или 2 или 3 и n11 равно 1 или 2 или 3. Согласно примеру реализации, n равно 1 и n11 равно 1. Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)(CHR53)n11NH2, где n представляет собой целое число, выбранное из 1-10, n11 представляет собой целое число, выбранное из 1-10, где R53 представляет собой (CH2)n12-Ph, где n12 представляет собой целое число, выбранное из 1-10. Согласно примеру реализации, n равно 1 или 2 или 3, n11 равно 1 или 2 или 3 и n12 равно 1 или 2 или 3. Согласно примеру реализации, n равно 1, n11 равно 1 и n12 равно 1. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)СН[(СН2)-Ph])(NH2).
[0227] Согласно примеру реализации, Rd представляет собой -(СН2)nNHC(О)(CHR53)n11NH(С(О)OR56), где n представляет собой целое число, выбранное из 1-10, n11 представляет собой целое число, выбранное из 1-10, где R56 представляет собой C1 или С2 или С3 или С4 или С5 или С6 алкил, и R53 представляет собой незамещенный алкил. Согласно примеру реализации, n равно 1 или 2 или 3 и n11 равно 1 или 2 или 3. Согласно примеру реализации, n равно 1 и n11 равно 1. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)(CHR53)NH(С(О)OR56), где R56 представляет собой С4 алкил, и R53 представляет собой C1 или С2 или С3 или С4 алкил. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)СН(СН3)(NH(С(О)OR56)). Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)СН(R53)(NH(С(О)ОС(СН3)3)). Согласно примеру реализации, Rd представляет собой -(CH2)NHC(O)CH(CH3))NH(C(O)OC(CH3)3).
[0228] Согласно примеру реализации, Rd представляет собой -СН2)nNHC(О)(CHR53)n11NH(С(О)OR56) где n представляет собой целое число, выбранное из 1-10, n11 представляет собой целое число, выбранное из 1-10, где R56 представляет собой C1 или С2 или С3 или С4 или С5 или С6 алкил, и R53 представляет собой алкил, содержащий в качестве заместителя арил. Согласно примеру реализации, n равно 1 или 2 или 3 и n11 равно 1 или 2 или 3. Согласно примеру реализации, n равно 1 и n11 равно 1. Согласно примеру реализации, Rd представляет собой -(СН2)NHC(О)(CHR53)NH(С(О)OR56), где R56 представляет собой С4 алкил, и R53 представляет собой (CH2)n12-Ph, где n12 представляет собой целое число, выбранное из 1-10. Согласно примеру реализации, Rd представляет собой -(CH2)NHC(О)СН((СН2)-Ph)(NH(С(О)OR56)). Согласно примеру реализации, Rd представляет собой - (СН2)NHC(О)СН(R53)(NH(С(О)ОС(СН3)3)). Согласно примеру реализации, Rd представляет собой -(CH2)NHC(O)CH((CH2)-Ph)) (NH(C(O)OC(CH3)3)).
[0229] Согласно примеру реализации, указанное соединение имеет структуру согласно формуле:
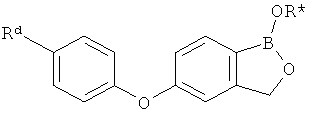 или
или 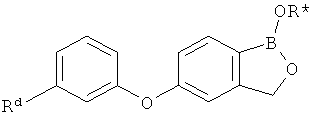 или
или 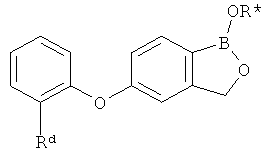 или
или
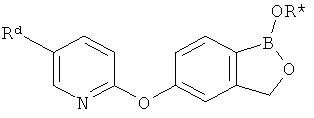 или
или 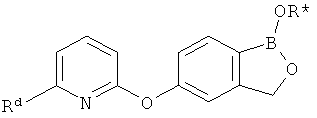 или
или 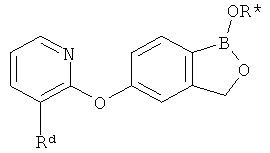
где Rd такой, как определено в настоящей заявке.
[0230] Согласно примеру реализации, указанное соединение имеет структуру согласно формуле:
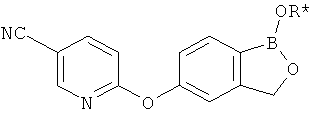 или
или 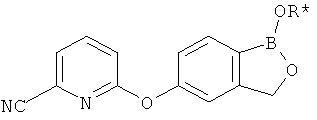 или
или 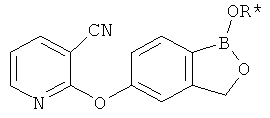 или
или
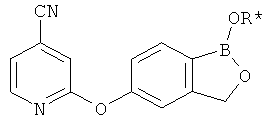 .
.
[0231] Согласно примеру реализации, указанное соединение имеет структуру согласно формуле:
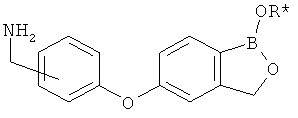 ,
,
где R* такой, как определено в настоящей заявке.
Согласно примеру реализации, указанное соединение имеет структуру, представляющую собой член, выбранный из:
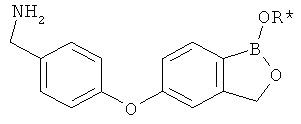 и
и 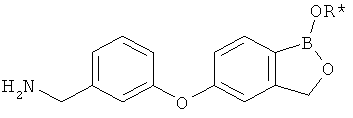 ,
,
где R* такой, как определено в настоящей заявке.
Согласно примеру реализации, указанное соединение имеет структуру согласно формуле:
 ,
,
где R* такой, как определено в настоящей заявке.
IIId.
[0232] Согласно пятому аспекту настоящего изобретения, предложено соединение, имеющее структуру согласно формуле:
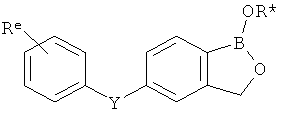 и
и 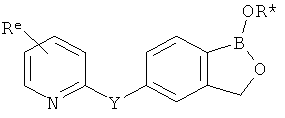
где Y представляет собой член, выбранный из S и О; R* представляет собой член, выбранный из Н, отрицательного заряда и положительно заряженного противоиона; Re представляет собой член, выбранный из замещенного или незамещенного гидроксиалкила, -С(O)Н и -С(О)NR20R21. Каждый из R20 и R21 представляют собой члены, независимо выбранные из Н, нитро, галогена, циано, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила. Существует условие, что R20 и R21 вместе с атомами, к которым они присоединены, возможно, объединены с образованием 5-7-членного замещенного или незамещенного гетероциклоалкильного кольца.
[0233] Согласно примеру реализации, указанное соединение имеет структуру согласно формуле:
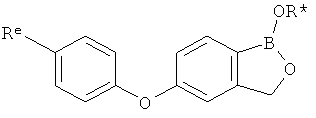 или
или 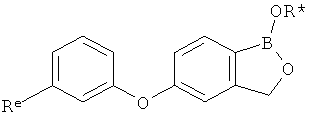 или
или 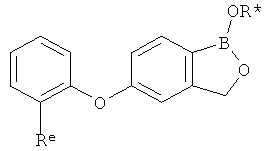 или
или
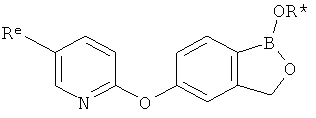 или
или 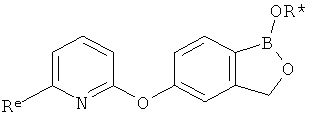 или
или 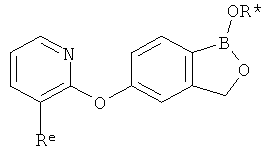
где Re такой, как определено в настоящей заявке.
[0234] Согласно примеру реализации, указанное соединение имеет структуру согласно формуле:
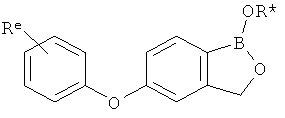
где R* такой, как определено в настоящей заявке, a Re представляет собой замещенный или незамещенный гидроксиалкил. Согласно примеру реализации, Re представляет собой незамещенный гидроксиалкил. Согласно примеру реализации, Re представляет собой незамещенный C1-С6 гидроксиалкил. Согласно примеру реализации, Re представляет собой незамещенный C1 или С2 или С3 или С4 или С5 или С6 гидроксиалкил. Согласно примеру реализации, указанное соединение имеет структуру согласно формуле
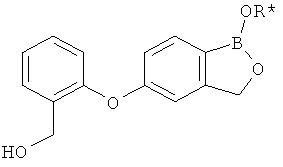 или
или 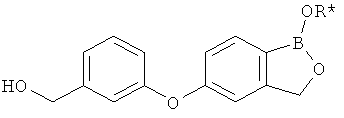 или
или 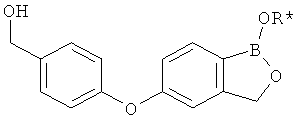 ,
,
где R* такой, как определено в настоящей заявке.
[0235] Согласно примеру реализации, указанное соединение имеет структуру согласно формуле:

где R* такой, как определено в настоящей заявке, a Re представляет собой С(O)Н. Согласно примеру реализации, указанное соединение имеет структуру, которая представляет собой
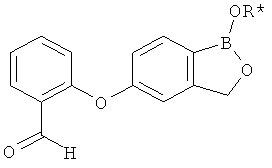 или
или 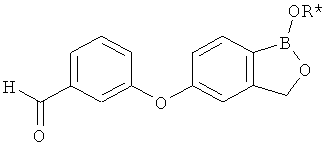 или
или 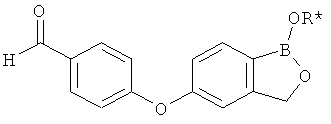 , где R* такой, как описано в настоящей заявке.
, где R* такой, как описано в настоящей заявке.
[0236] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
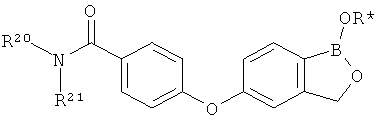
где R* такой, как определено в настоящей заявке, и при условии, что оба вместе R20 и R21 не представляют собой члены, выбранные из замещенного или незамещенного алкила, и при условии, что R20 и R21, вместе с атомами, к которым они присоединены, не являются возможно объединенными с образованием замещенного или незамещенного морфолинового кольца. Согласно примеру реализации, существует условие, что оба вместе R20 и R21 не представляют собой члены, выбранные из незамещенного алкила. Согласно примеру реализации, существует условие, что оба вместе R20 и R21 не представляют собой этил.
[0237] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
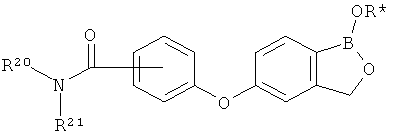
где R* такой, как определено в настоящей заявке, R20 и R21 представляют собой независимо выбранный незамещенный алкил. Согласно примеру реализации, существует условие, что каждый R20 и R21 не представляет собой незамещенный С4-С6 алкил. Согласно примеру реализации, существует условие, что каждый R20 и R21 не представляет собой незамещенный C1-С3 алкил. Согласно примеру реализации, существует условие, что оба R20 и R21 не представляют собой метил. Согласно примеру реализации, существует условие, что оба R20 и R21 не представляют собой этил. Согласно примеру реализации, существует условие, что оба R20 и R21 не представляют собой н-пропил. Согласно примеру реализации, указанное соединение представляет собой
 , где каждый R20 и R21 представляет собой незамещенный С4-С6 алкил. Согласно примеру реализации, существует условие, что указанное соединение не представляет собой
, где каждый R20 и R21 представляет собой незамещенный С4-С6 алкил. Согласно примеру реализации, существует условие, что указанное соединение не представляет собой  , где каждый R20 и R21 представляет собой незамещенный С1-С3алкил. Согласно примеру реализации, существует условие, что указанное соединение не представляет собой
, где каждый R20 и R21 представляет собой незамещенный С1-С3алкил. Согласно примеру реализации, существует условие, что указанное соединение не представляет собой
 , где оба R20 и R21 представляют собой метил.
, где оба R20 и R21 представляют собой метил.
Согласно примеру реализации, существует условие, что указанное соединение не представляет собой
 , где оба R20 и R21 представляют собой этил.
, где оба R20 и R21 представляют собой этил.
Согласно примеру реализации, существует условие, что указанное соединение не представляет собой
 , где оба R20 и R21 представляют собой н-пропил.
, где оба R20 и R21 представляют собой н-пропил.
[0238] Согласно примеру реализации, указанное соединение имеет структуру согласно:
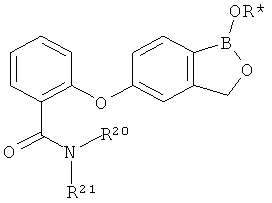 или
или 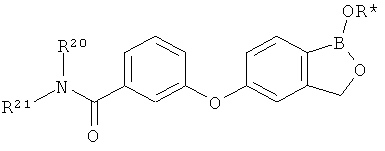 или
или  где R*, R20 и R21 такие, как описано в настоящей заявке.
где R*, R20 и R21 такие, как описано в настоящей заявке.
[0239] Согласно примеру реализации, указанное соединение представляет собой:
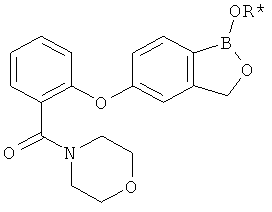 , где R* такой, как описано в настоящей заявке. Согласно примеру реализации, указанное соединение представляет собой:
, где R* такой, как описано в настоящей заявке. Согласно примеру реализации, указанное соединение представляет собой:
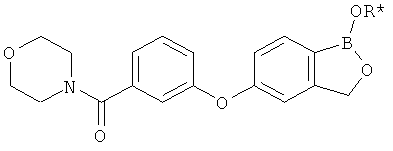 , где R* такой, как описано в настоящей заявке. Согласно примеру реализации, указанное соединение представляет собой:
, где R* такой, как описано в настоящей заявке. Согласно примеру реализации, указанное соединение представляет собой: 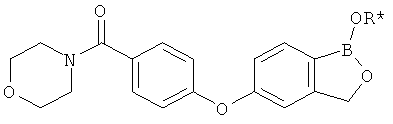 где R* такой, как описано в настоящей заявке.
где R* такой, как описано в настоящей заявке.
[0240] Согласно примеру реализации, указанное соединение не имеет структуру согласно формуле:

где R* такой, как описано в настоящей заявке.
[0241] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
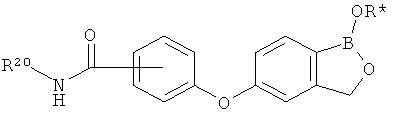
где R* такой, как определено в настоящей заявке, R20 представляет собой NH2. Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
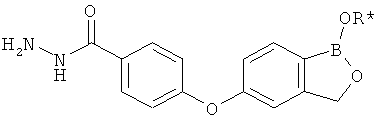
где R* такой, как определено в настоящей заявке.
[0242] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
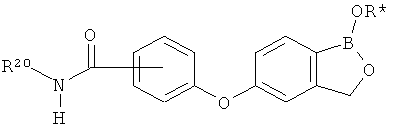
где R* такое, как определено в настоящей заявке, R20 представляет собой тетрагидрофуран-2-илметил. Согласно примеру реализации, указанное соединение имеет структуру согласно:
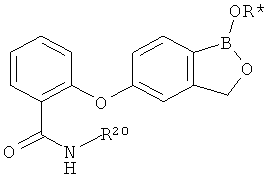 или
или 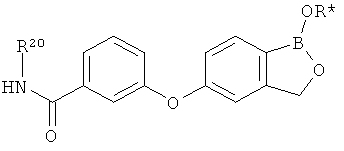 или
или 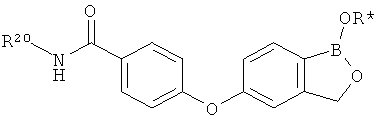
где R20 представляет собой тетрагидрофуран-2-илметил.
[0243] Согласно примеру реализации, указанное соединение имеет структуру согласно формуле:

где R* такое, как определено в настоящей заявке, R20 представляет собой -NC(O)OR56, где R56 представляет собой незамещенный алкил. Согласно примеру реализации, R56 представляет собой член, выбранный из C1 или С2 или С3 или С4 или С5 или С6 алкила. Согласно примеру реализации, указанное соединение имеет структуру согласно:
 или
или  или
или 
где R20 представляет собой NC(O)OR56. Согласно примеру реализации, R56 представляет собой трет-бутил.
[0244] Согласно примеру реализации, указанное соединение имеет структуру согласно формуле:
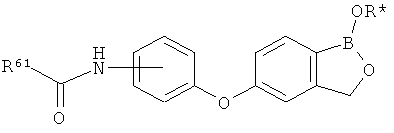
где R* такое, как определено в настоящей заявке, R61 представляет собой незамещенный алкил. Согласно примеру реализации, R61 представляет собой C1 или С2 или С3 алкил. Согласно примеру реализации, указанное соединение имеет структуру согласно:
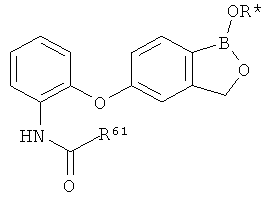 или
или 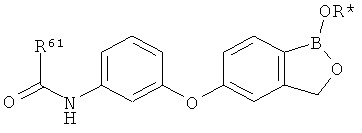 или
или 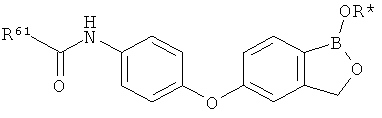
где R61 такой, как описано в настоящей заявке. Согласно примеру реализации, R61 представляет собой метил.
[0245] Согласно примеру реализации, указанное соединение имеет структуру согласно формуле:
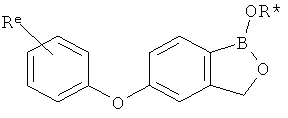
где R* такой, как определено в настоящей заявке, и Re представляет собой замещенный или незамещенный алкилокси. Согласно примеру реализации, Re представляет собой незамещенный алкилокси. Согласно примеру реализации, Re представляет собой незамещенный C1-С6 алкилокси. Согласно примеру реализации, Re представляет собой незамещенный C1 или С2 или С3 или С4 или С5 или С6 алкилокси. Согласно примеру реализации, указанное соединение имеет структуру, которая представляет собой
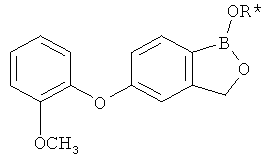 или
или 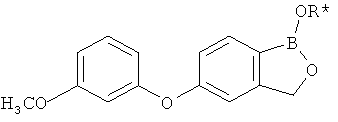 или
или 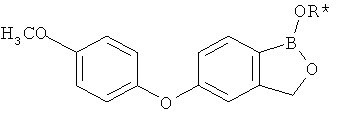 ,
,
где R* такой, как определено в настоящей заявке.
[0246] Согласно примеру реализации, указанное соединение имеет структуру согласно формуле:

где R* такой, как определено в настоящей заявке, и Re представляет собой NO2. Согласно примеру реализации, указанное соединение имеет структуру, которая представляет собой
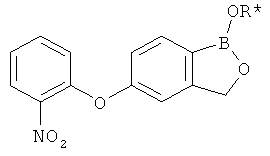 или
или 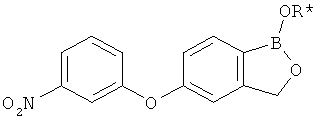 или
или 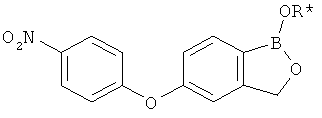 ,
,
где R* такой, как определено в настоящей заявке.
[0247] Согласно примеру реализации, указанное соединение имеет структуру согласно формуле:

где R* такое, как определено в настоящей заявке, и Re представляет собой NH2. Согласно примеру реализации, указанное соединение имеет структуру, которая представляет собой
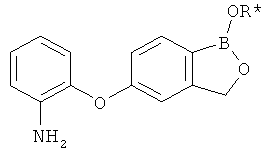 или
или 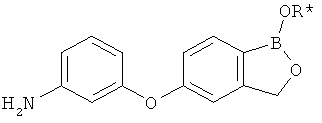 или
или 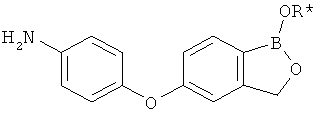 ,
,
где R* такой, как определено в настоящей заявке.
[0248] Согласно примеру реализации, указанное соединение имеет структуру согласно формуле:

где R* такое, как определено в настоящей заявке, и Re представляет собой R60S(O)2NH-, где R60 представляет собой незамещенный алкил. Согласно примеру реализации, R60 представляет собой метил. Согласно примеру реализации, указанное соединение имеет структуру, которая представляет собой
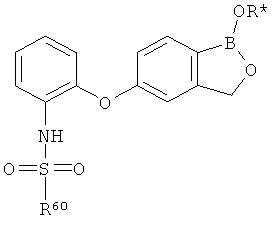 или
или 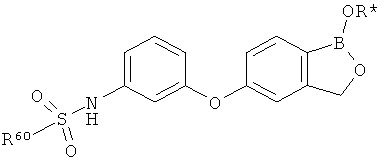 или
или 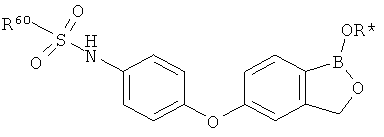 ,
,
где R* такой, как определено в настоящей заявке.
[0249] Согласно примеру реализации, указанное соединение имеет структуру согласно формуле:
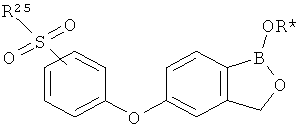
где R* такой, как определено в настоящей заявке, и Rf представляет собой замещенный или незамещенный алкил. Согласно примеру реализации, Rf представляет собой незамещенный алкил. Согласно примеру реализации, Rf представляет собой незамещенный C1-С6 алкил. Согласно примеру реализации, Rf представляет собой незамещенный C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, Rf представляет собой незамещенный C1 или С2 или С3 алкил. Согласно примеру реализации, Rf представляет собой метил или этил или изопропил. Согласно примеру реализации, указанное соединение имеет структуру, которая представляет собой
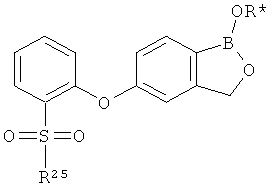 или
или 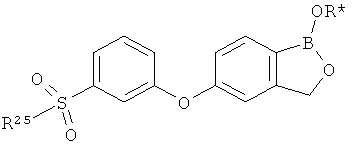 или
или 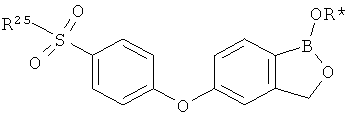 ,
,
где R* такой, как определено в настоящей заявке.
[0250] Согласно примеру реализации, указанное соединение имеет структуру, представляющую собой член, выбранный из:
 и
и 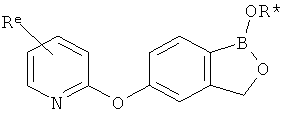
где R* и Re такие, как описано в настоящей заявке.
Согласно примеру реализации, указанное соединение имеет структуру, представляющую собой член, выбранный из:
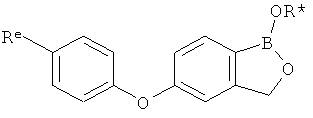 и
и 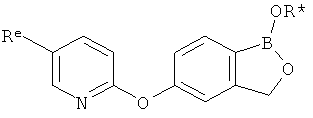 ,
,
где R* и Re такие, как определено в настоящей заявке.
[0251] Согласно примеру реализации, Re представляет собой
С(О)NR20R21, где каждый R20 и R21 представляет собой член, выбранный из Н, гидроксиалкила, замещенного или незамещенного аминоалкила, замещенного или незамещенного арилалкила, замещенного или незамещенного гетероарилалкила, или R20 и R21, вместе с атомом азота, к которому они присоединены, возможно, соединены с образованием замещенного или незамещенного пиперазинильного кольца. Согласно примеру реализации, R20 представляет собой Н. Согласно примеру реализации, R21 представляет собой член, выбранный из незамещенного гидроксиалкила, замещенного или незамещенного аминоалкила, незамещенного фенилалкила, N-замещенного аминоалкила. Согласно примеру реализации, R20 представляет собой Н, и R21 представляет собой незамещенный алкил. Согласно примеру реализации, R20 представляет собой Н, и R21 представляет собой незамещенный C1-C6 алкил. Согласно примеру реализации, R20 представляет собой Н, и R21 представляет собой C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, R20 и R21, вместе с атомом азота, к которому они присоединены, соединены с образованием незамещенного пиперазинильного кольца. Согласно примеру реализации, R20 и R21, вместе с атомом азота, к которому они присоединены, соединены с образованием N-замещенного пиперазинильного кольца. Согласно примеру реализации, указанное N-замещенное пиперазинильное кольцо содержит в качестве заместителя незамещенный C1-С6 алкил и незамещенный C1-C6 алкилкарбонил. Согласно примеру реализации, R20 представляет собой Н, и R21 представляет собой член, выбранный из орто-незамещенного алкилбензила или мета-незамещенного алкилбензила или пара-незамещенного алкилбензила. Согласно примеру реализации, R20 представляет собой Н, и R21 представляет собой пара-метилбензил. Согласно примеру реализации, R20 представляет собой Н, и R21 представляет собой член, выбранный из орто-алкоксибензила или мета-алкоксибензила или пара-алкоксибензила. Согласно примеру реализации, R20 представляет собой Н, и R21 представляет собой член, выбранный из орто-метоксибензила или мета-метоксибензила или пара-метоксибензила. Согласно примеру реализации, R20 представляет собой Н, и R21 представляет собой пара-метоксибензил. Согласно примеру реализации, R20 представляет собой Н, и R21 представляет собой фенил. Согласно примеру реализации, R20 представляет собой Н, и R21 представляет собой циклоалкил. Согласно примеру реализации, R20 представляет собой Н, и R21 представляет собой циклопропил. Согласно примеру реализации, R20 представляет собой Н, и R21 представляет собой циклобутил. Согласно примеру реализации, R20 представляет собой Н, и R21 представляет собой циклопентил. Согласно примеру реализации, R20 представляет собой Н, и R21 представляет собой циклогексил. Согласно примеру реализации, R20 представляет собой Н, и R21 представляет собой СН3. Согласно примеру реализации, R20 представляет собой СН3, и R21 представляет собой СН3.
[0252] Согласно примеру реализации, Re представляет собой член, выбранный из
 ,
,  ,
,  ,
, 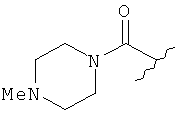 ,
, 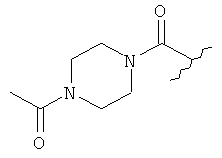 ,
,
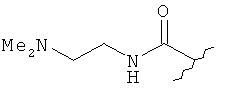 ,
, 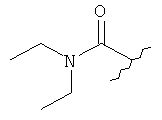 и
и 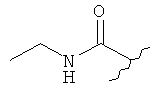 .
.
[0253] Согласно примеру реализации, указанное соединение представляет собой член, выбранный из N-бензил-4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензамида,
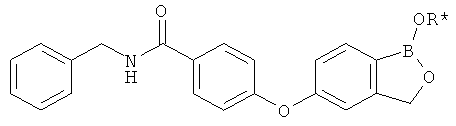 , 4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-N-(2-гидрокси-этил)-бензамида
, 4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-N-(2-гидрокси-этил)-бензамида
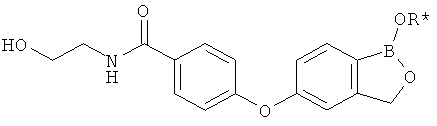 , 4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-N-пиридин-2-илметилбензамида
, 4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-N-пиридин-2-илметилбензамида
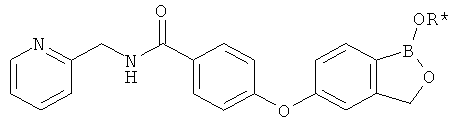 , [4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-фенил]-(4-метилпиперазин-1-ил)-метанона
, [4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-фенил]-(4-метилпиперазин-1-ил)-метанона 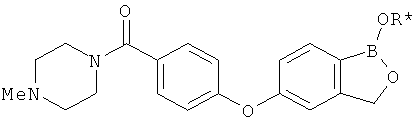 ,
,
1-{4-[4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензоил]-пиперазин-1-ил}-этанона 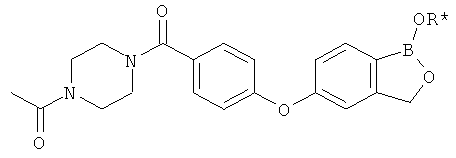 , N-(2-диметиламиноэтил)-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензамида
, N-(2-диметиламиноэтил)-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензамида 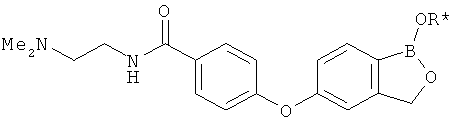 , N,N-диэтил-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинамида
, N,N-диэтил-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинамида 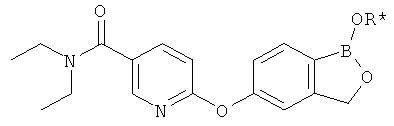 , N-этил-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинамида
, N-этил-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинамида
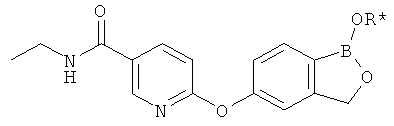 , 5-(5-(гидроксиметил)пиридин-2-илокси)бензо[с][1,2]оксаборол-1(3Н)-ола
, 5-(5-(гидроксиметил)пиридин-2-илокси)бензо[с][1,2]оксаборол-1(3Н)-ола 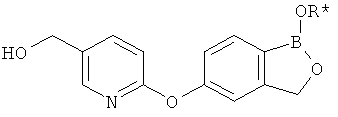 , 6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинальдегида
, 6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинальдегида 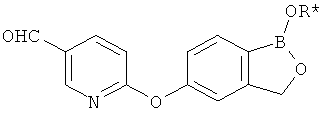 и (Z)-N-((6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)пиридин-3-ил)метилен)-2-метилпропан-2-аминоксида
и (Z)-N-((6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)пиридин-3-ил)метилен)-2-метилпропан-2-аминоксида 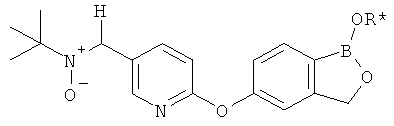 .
.
[0254] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
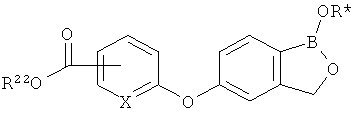
где X представляет собой член, выбранный из N, СН или C(O)R22, R22 представляет собой член, выбранный из алкила, возможно, содержащего в качестве заместителя диалкиламино, и R* такое, как описано в настоящей заявке. Согласно примеру реализации, указанное соединение имеет структуру согласно:
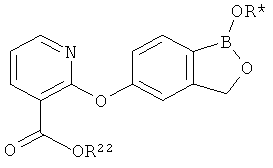 или
или 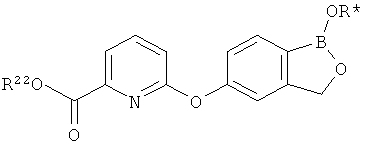 или
или 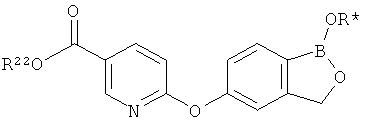
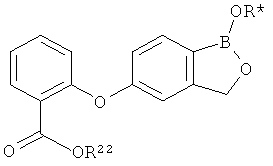 или
или 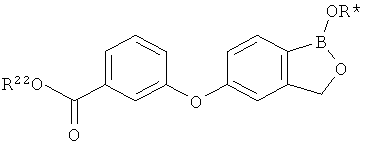 или
или 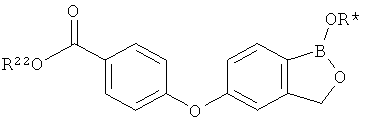 ,
,
где R22 представляет собой незамещенный алкил, и R* такой, как описано в настоящей заявке. Согласно примеру реализации, R22 представляет собой незамещенный С1-С6 алкил. Согласно примеру реализации, R22 представляет собой незамещенный C1 или С2 или С3 или C4 или С5 или С6 алкил. Согласно примеру реализации, R22 представляет собой незамещенный C1 алкил. Согласно примеру реализации, R22 представляет собой незамещенный С2 алкил. Согласно примеру реализации, R22 представляет собой незамещенный С3 алкил. Согласно примеру реализации, R22 представляет собой изопропил. Согласно примеру реализации, R22 представляет собой диалкиламиноалкил. Согласно примеру реализации, R22 представляет собой диалкиламиноэтил. Согласно примеру реализации, R22 представляет собой диметиламиноалкил. Согласно примеру реализации, R22 представляет собой диметиламиноэтил.
[0255] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
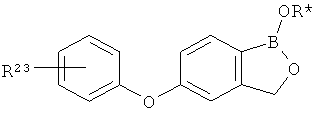
где R23 представляет собой галоген, и R* такой, как описано в настоящей заявке. Согласно примеру реализации, указанное соединение имеет структуру согласно:
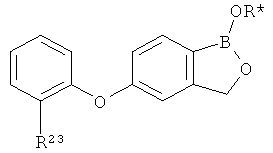 или
или 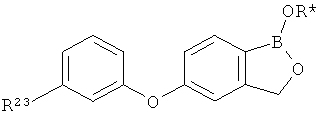 или
или 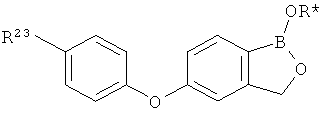
где R23 представляет собой галоген, и R* такое, как описано в настоящей заявке. Согласно примеру реализации, R23 представляет собой фтор или хлор.
[0256] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
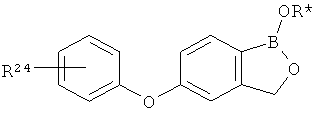
где R24 представляет собой незамещенный алкил или галогензамещенный алкил, и R* такой, как описано в настоящей заявке. Согласно примеру реализации, указанное соединение имеет структуру согласно:
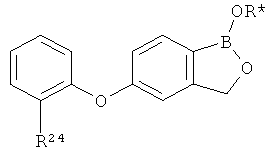 или
или 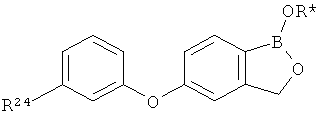 или
или 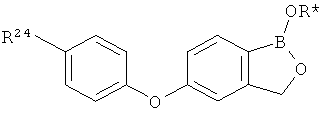
где R24 представляет собой незамещенный алкил или галогензамещенный алкил, и R* такой, как описано в настоящей заявке. Согласно примеру реализации, R24 представляет собой незамещенный C1-С6 алкил или галогензамещенный C1-С6 алкил. Согласно примеру реализации, R24 представляет собой незамещенный C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, R24 представляет собой галогензамещенный C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, R24 представляет собой фторзамещенный C1 или С2 или С3 или С4 или С5 или С6 алкил. Согласно примеру реализации, R24 представляет собой трифторметил. Согласно примеру реализации, R24 представляет собой метил.
[0257] Согласно примеру реализации, указанное соединение представляет собой
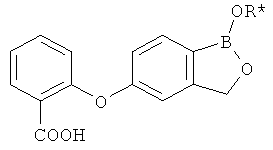 , где R* такой, как описано в настоящей заявке.
, где R* такой, как описано в настоящей заявке.
Согласно примеру реализации, указанное соединение представляет собой
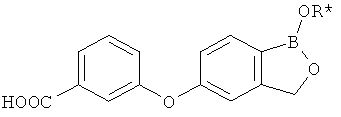 , где R* такое, как описано в настоящей заявке.
, где R* такое, как описано в настоящей заявке.
[0258] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
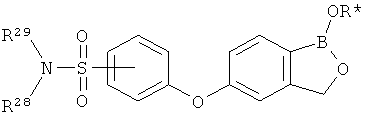
где R28 или R29 независимо выбраны из незамещенного алкила, и R* такой, как описано в настоящей заявке. Согласно примеру реализации, указанное соединение имеет структуру, представляющую собой член, выбранный из: 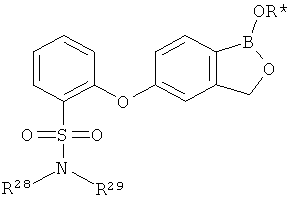 или
или 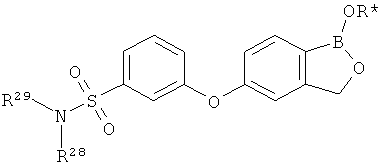
или 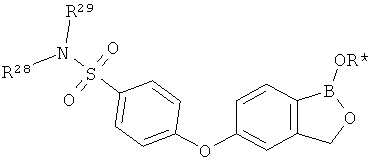 .
.
Согласно примеру реализации, R28 представляет собой этил. Согласно примеру реализации, R29 представляет собой этил.
[0259] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
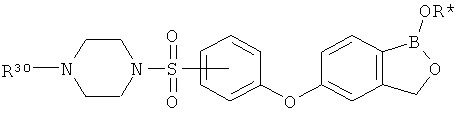
где R30 представляет собой Н и незамещенный алкил, и R* такой, как описано в настоящей заявке. Согласно примеру реализации, указанное соединение имеет структуру согласно:
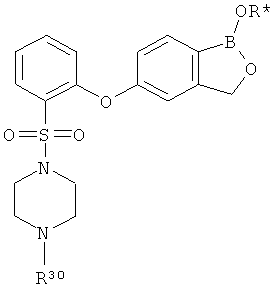 или
или 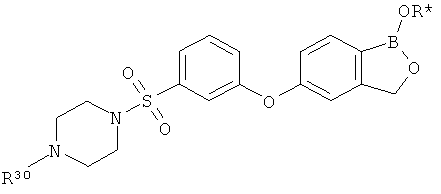 или
или 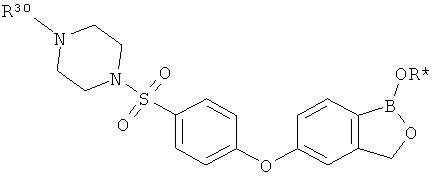 ,
,
где R30 представляет собой незамещенный алкил, и R* такое, как описано в настоящей заявке. Согласно примеру реализации, R30 представляет собой метил.
[0260] Согласно примеру реализации, указанное соединение имеет структуру согласно следующей формуле:
[0261] Согласно примеру реализации, указанное соединение имеет структуру, перечисленную на ФИГ.1, или представляет собой соль указанного соединения. Согласно примеру реализации, указанное соединение имеет структуру, перечисленную на ФИГ.2, или представляет собой соль указанного соединения. Согласно примеру реализации, указанное соединение имеет структуру, перечисленную на ФИГ.3, или представляет собой соль указанного соединения. Согласно примеру реализации, указанное соединение имеет структуру, перечисленную на ФИГ.4, или представляет собой соль указанного соединения. Согласно примеру реализации, указанное соединение имеет структуру, перечисленную на ФИГ.5, или представляет собой соль указанного соединения. Согласно примеру реализации, указанное соединение имеет структуру, перечисленную на ФИГ.6, или представляет собой соль указанного соединения. Согласно примеру реализации, указанное соединение имеет структуру, перечисленную на ФИГ.7, или представляет собой соль указанного соединения.
[0262] Согласно примеру реализации, в соединении согласно любой из формул, приведенных в настоящей заявке, R* представляет собой Н.
[0263] Согласно другому примеру реализации настоящего изобретения, предложены поли- или мультивалентные варианты соединений согласно настоящему описанию. Согласно примеру реализации настоящего изобретения, предложен димер соединений согласно настоящему описанию. Согласно примеру реализации настоящего изобретения, предложен димер соединения, представляющего собой член, выбранный из D1, D2, D3, D4, D5, D6, D7, D8, D9, D10, D11, D12, D13, D14, D15, D16, D17, D18, D19, D20, D21, D22, D23, D24, D25, D26, D27, D28, D29, D30, D31, D32, D33, D34, D35, D36, D37, D38, D39, D40, D41, D42, D43, D44, D45, D46, D47, D48, D49, D50, D51, D52, D53, D54, D55, D56, D57, D58, D59, D60, D61, D62, D63, D64, D65, D66, D67, D68, D69, D70, D71, D72, D73, D74, D75, D76, D77, D78, D79, D80, D81, D82, D83, D84, D85, D86, D87, D88, D89, D90, D91, D92, D93, D94, D95, D96, D97, D98, D99, D100, D101, D102, D103, D104, D105, D106, D107, D108, D109, D110, D111, D112, D113, D114, D115, D116, D117, D118, D119, D120, D121, D122, D123, D124, D125, D126, D127, D128, D129, D130, D131, D132, D133, D134, D135, D136, D137, D138, D139, D140, D141, D142, D143, D144, D145, D146, D147, D148, D149, D150, D151, D152, D153, D154, D155, D156, D157, D158, D159, D160, D161, D162, D163, D164, D165, D166, D167, D168, D169, D170, D171, D172, D173, D174, D175, D176, D177, D178, D179, D180, D181, D182, D183, D184, D185, D186, D187, D188, D189, D190, D191, D192, D193, D194, D195, D196, D197, D198, D199, D200, D201, D202, D203, D204, D205, D206, D207, D208, D209, D210, D211, D212, D213, D214, D215, D216, D217, D218, D219, D220, D221, D222, D223, D224, D225, D226, D227, D228 и D229.
[0264] Согласно примеру реализации настоящего изобретения, предложен ангидрид соединений согласно настоящему описанию. Согласно примеру реализации настоящего изобретения, предложен ангидрид соединения, представляющего собой член, выбранный из D1, D2, D3, D4, D5, D6, D7, D8, D9, D10, D11, D12, D13, D14, D15, D16, D17, D18, D19, D20, D21, D22, D23, D24, D25, D26, D27, D28, D29, D30, D31, D32, D33, D34, D35, D36, D37, D38, D39, D40, D41, D42, D43, D44, D45, D46, D47, D48, D49, D50, D51, D52, D53, D54, D55, D56, D57, D58, D59, D60, D61, D62, D63, D64, D65, D66, D67, D68, D69, D70, D71, D72, D73, D74, D75, D76, D77, D78, D79, D80, D81, D82, D83, D84, D85, D86, D87, D88, D89, D90, D91, D92, D93, D94, D95, D96, D97, D98, D99, D100, D101, D102, D103, D104, D105, D106, D107, D108, D109, DUO, Dill, D112, D113, D114, D115, D116, D117, D118, D119, D120, D121, D122, D123, D124, D125, D126, D127, D128, D129, D130, D131, D132, D133, D134, D135, D136, D137, D138, D139, D140, D141, D142, D143, D144, D145, D146, D147, D148, D149, D150, D151, D152, D153, D154, D155, D156, D157, D158, D159, D160, D161, D162, D163, D164, D165, D166, D167, D168, D169, D170, D171, D172, D173, D174, D175, D176, D177, D178, D179, D180, D181, D182, D183, D184, D185, D186, D187, D188, D189, D190, D191, D192, D193, D194, D195, D196, D197, D198, D199, D200, D201, D202, D203, D204, D205, D206, D207, D208, D209, D210, D211, D212, D213, D214, D215, D216, D217, D218, D219, D220, D221, D222, D223, D224, D225, D226, D227, D228 и D229.
[0265] Согласно примеру реализации настоящего изобретения, предложен тример соединений согласно настоящему описанию. Согласно примеру реализации настоящего изобретения, предложен тример соединения, представляющего собой член, выбранный из D1, D2, D3, D4, D5, D6, D7, D8, D9, D10, D11, D12, D13, D14, D15, D16, D17, D18, D19, D20, D21, D22, D23, D24, D25, D26, D27, D28, D29, D30, D31, D32, D33, D34, D35, D36, D37, D38, D39, D40, D41, D42, D43, D44, D45, D46, D47, D48, D49, D50, D51, D52, D53, D54, D55, D56, D57, D58, D59, D60, D61, D62, D63, D64, D65, D66, D67, D68, D69, D70, D71, D72, D73, D74, D75, D76, D77, D78, D79, D80, D81, D82, D83, D84, D85, D86, D87, D88, D89, D90, D91, D92, D93, D94, D95, D96, D97, D98, D99, D100, D101, D102, D103, D104, D105, D106, D107, D108, D109, D110, D111, D112, D113, D114, D115, D116, D117, D118, D119, D120, D121, D122, D123, D124, D125, D126, D127, D128, D129, D130, D131, D132, D133, D134, D135, D136, D137, D138, D139, D140, D141, D142, D143, D144, D145, D146, D147, D148, D149, D150, D151, D152, D153, D154, D155, D156, D157, D158, D159, D160, D161, D162, D163, D164, D165, D166, D167, D168, D169, D170, D171, D172, D173, D174, D175, D176, D177, D178, D179, D180, D181, D182, D183, D184, D185, D186, D187, D188, D189, D190, D191, D192, D193, D194, D195, D196, D197, D198, D199, D200, D201, D202, D203, D204, D205, D206, D207, D208, D209, D210, D211, D212, D213, D214, D215, D216, D217, D218, D219, D220, D221, D222, D223, D224, D225, D226, D227, D228 и D229.
[0266] Согласно примеру реализации настоящего изобретения, предложено соединение, описанное в настоящей заявке, или соль, гидрат или сольват указанного соединения, или комбинация указанных форм. Согласно примеру реализации настоящего изобретения, предложено соединение, описанное в настоящей заявке, или соль, гидрат или сольват указанного соединения. Согласно примеру реализации настоящего изобретения, предложено соединение, описанное в настоящей заявке, или соль указанного соединения. Согласно примеру реализации, указанная соль представляет собой фармацевтически приемлемую соль. Согласно примеру реализации настоящего изобретения, предложено соединение, описанное в настоящей заявке, или гидрат указанного соединения. Согласно примеру реализации настоящего изобретения, предложено соединение, описанное в настоящей заявке, или сольват указанного соединения. Согласно примеру реализации настоящего изобретения, предложено соединение, описанное в настоящей заявке, или пролекарство указанного соединения. Согласно примеру реализации настоящего изобретения, предложена соль соединения, описанного в настоящей заявке. Согласно примеру реализации настоящего изобретения, предложена фармацевтически приемлемая соль соединения, описанного в настоящей заявке. Согласно примеру реализации настоящего изобретения, предложен гидрат соединения, описанного в настоящей заявке. Согласно примеру реализации настоящего изобретения, предложен сольват соединения, описанного в настоящей заявке. Согласно примеру реализации настоящего изобретения, предложено пролекарство соединения, описанного в настоящей заявке.
[0267] Согласно примеру реализации, алкил представляет собой член, выбранный из линейного алкила и разветвленного алкила. Согласно другому примеру реализации, гетероалкил представляет собой член, выбранный из линейного гетероалкила и разветвленного гетероалкила.
[0268] Дополнительные соединения, применяемые в способах согласно настоящему изобретению, описаны в Предварительной заявке на патент США №60/654060; поданной 16 февраля 2005 (Attorney Docket No. 064507-5014PR); Заявке на патент США №11/357687, поданной 16 февраля 2006 (Attorney Docket No. 064507-5014US); Заявке на патент США №11/505591, поданной 16 августа 2006 (Attorney Docket No. 064507-5014US01), Предварительной заявке на патент США №60/823888 поданной 29 августа 2006, и 60/774532 поданной 16 февраля 2006 (Attorney Docket No. 064507-5016PR и 064507-5016PR01, соответственно); Заявке на патент США №11/676120, поданной 16 февраля 2007 (Attorney Docket No. 064507-5016US), которые полностью включены в настоящую заявку посредством ссылок во всех отношениях. Способы получения соединений согласно настоящему изобретению также описаны в указанных заявках на патенты.
IIIе. Способы получения соединений
[0269] Следующие приведенные в качестве примеров схемы иллюстрируют способы получения борсодержащих молекул согласно настоящему изобретению. Данные способы не ограничены получением показанных соединений, а могут быть применены для получения множества молекул, таких как соединения и комплексы, описанные в настоящей заявке. Соединения согласно настоящему изобретению также можно синтезировать при помощи способов не исключительно показанных на схемах, но также и хорошо известных специалистам в данной области. Указанные соединения можно получить с использованием легко доступных веществ известных промежуточных соединений.
[0270] Соединения согласно настоящему изобретению можно получить согласно методикам, описанным в настоящей заявке. Алгоритм А описан ниже для получения 5-дизамещенных производных фенокси(галогензамещенного)бензоксаборола:
Методика А:
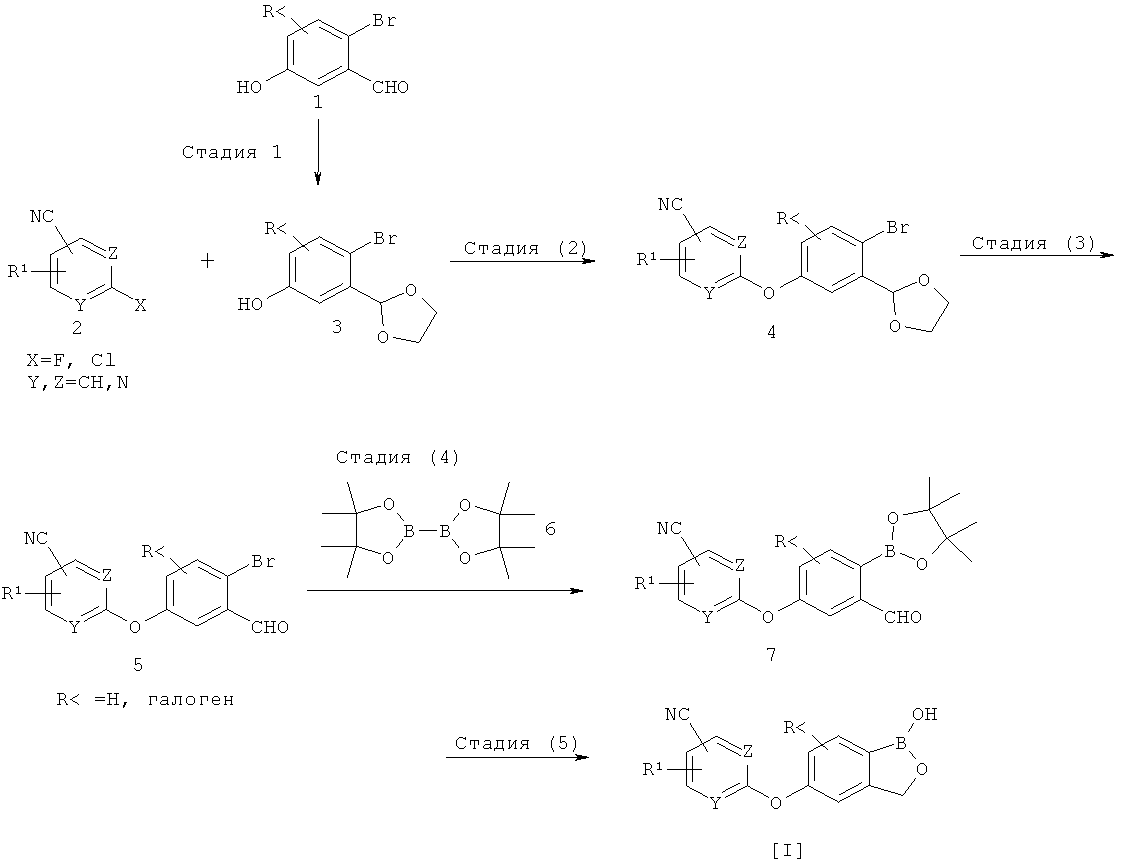
[0271] Стадия 1: Формильную группу соединения 1 защищали в виде этиленацеталя при помощи этиленгликоля в присутствии кислотного катализатора. Этиленгликоль использовали в избытке, обычно примерно от 2 до 10 эквивалентов по отношению к соединению 1. В качестве кислотных катализаторов применяли сульфоновые кислоты, такие как пара-толуолсульфоновая кислота или метансульфоновая кислота, хлорид водорода, бромид водорода, и тому подобное, примерно от 1 до 10 молярных %. В качестве растворителя применяли толуол, бензол, ксилол. Реакцию проводили в условиях отгонки азеотропа при кипячении с обратным холодильником с насадкой Дина-Старка. Обычно реакцию завершали в течение примерно 1-2 4 часов. Указанная стадия может не потребоваться в зависимости от реакционной способности соединения 2.
[0272] Стадия 2: Соединения 2 и 3 подвергали реакции сочетания в присутствии основания, получая соединение 4. В качестве основания применяли карбонаты, такие как карбонат калия, карбонат цезия и карбонат натрия, гидрид натрия, трет-бутоксид калия, и тому подобное. Количество основания составляло примерно от 1 до 5 эквивалентов. Подходящие растворители включали N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, ацетонитрил, и тому подобное. Реакцию проводили при температуре примерно от 70 до 150°С, и завершали в течение от примерно 1 до примерно 24 часов.
[0273] Стадия 3: На соединение 4 действовали кислотой, чтобы гидролизовать ацеталь. Подходящие кислоты включали хлороводородную кислоту, бромоводородную кислоту, пара-толуолсульфоновую кислоту, метансульфоновую кислоту, уксусную кислоту, и тому подобное, в количестве примерно от 1 до 50 эквивалентов. Подходящие растворители включали метанол, этанол, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, и тому подобное. Реакцию проводили при температуре от комнатной до температуры кипения растворителя. Реакция завершалась в течение от примерно 1 до примерно 2 4 часов.
[0274] Стадия 4: Соединение 5 подвергали сочетанию по Судзуки-Мияура (Miyaura coupling) для введения атома бора. Смесь соединений 5, 6, комплекса [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (II) с дихлорметаном, и карбоната калия, в растворителе, перемешивали при температуре примерно от 50°С до температуры кипения растворителя. Растворитель выбирали из 1,4-диоксана, 1,2-диметоксиэтана, тетрагидрофурана, диметилсульфоксида, диметилформамида, толуола, и тому подобное. Палладиевый катализатор применяли в количестве от примерно 1 до примерно 5 молярных %, а основание применяли в количестве примерно от 2 до 5 эквивалентов. Реакцию проводили в течение примерно 1-24 часов.
[0275] Стадия 5: На соединение 7 воздействовали восстановительным агентом, таким как боргидрид натрия и алюмогидрид лития, в инертном растворителе. Восстановительный агент применяли в количестве примерно от 0,5 до 2 эквивалентов. Инертный растворитель представлял собой метанол, этанол, тетрагидрофуран, эфир, и тому подобное. Реакцию проводили при температуре от 0°С до комнатной, и завершали в течение от примерно 1 до примерно 12 часов. Пинакол удаляли путем промывания водным раствором борной кислоты в процессе экстрагирования, обработки неочищенного продукта водой или при сублимационной сушке после очистки.
[0276] Некоторые 2-алкокси-6-хлорникотинонитрилы (2а) получали следующим образом:
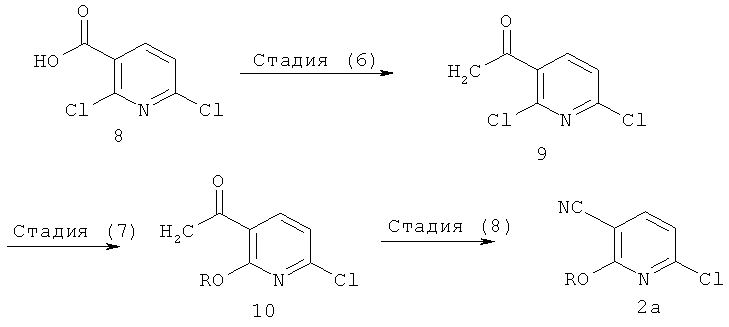
[0277] Стадия 6: 2,6-дихлорникотиновую кислоту (8) превращали в хлорид соответствующей кислоты при помощи оксалилхлорида или тионилхлорида в инертном растворителе. В качестве растворителя применяли дихлорметан, 1,2-дихлорэтан, тетрагидрофуран. Реакцию проводили при температуре от 0°С до комнатной, и завершали в течение от примерно 1 до примерно 2 4 часов. Для ускорения реакции можно добавить небольшое количество N,N-диметилформамида. Образовавшийся хлорид кислоты обрабатывали аммиаком, получая соединение 8.
[0278] Стадия 7: Соединение 10 получали, воздействуя на соединение 8 соответствующим алкоксидом. В качестве алкоксида можно применять имеющиеся в продаже метоксид натрия или этоксид натрия. В другом варианте, алкоксид получали in situ из спирта (ROH) и основания, такого как натрий, гидрид натрия, гидрид калия, бутиллитий и тому подобное. В качестве растворителя применяли тетрагидрофуран, 1,4-диоксан, N,N-диметилформамид, 1,2-диметоксиэтан, толуол, и тому подобное. Реакцию проводили при температуре от 0°С до комнатной, в течение примерно 1-24 часов.
[0279] Стадия 8: На соединение 10 воздействовали оксихлоридом фосфора и пиридином, получая соединение 2а. Оксихлорид фосфора и пиридин применяли в количествах примерно от примерно 3 до примерно 6 эквивалентов. Растворитель выбирали из ацетонитрила, тетрагидрофурана, толуола, и тому подобное. Реакцию проводили при температуре от комнатной до температуры кипения растворителя, и завершали в течение примерно 1-24 часов.
[0280] Некоторые 2-алкокси-6-хлорникотинонитрилы (2а) и 6-алкокси-2-хлорникотинонитрилы (2b) альтернативно получали следующим образом:
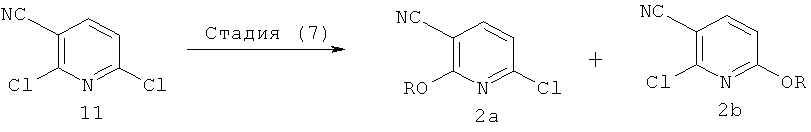
[0281] Соединения 2а и 2b получали в тех же условиях, которые описаны выше для стадии 7, из 2,6-дихлорникотинонитрила (11). Полученную смесь можно разделять при помощи колоночной хроматографии на силикагеле, препаративной тонкослойной хроматографии или высокоэффективной жидкостной хроматографии.
[0282] Некоторые производные 2-амино-6-хлорникотинонитрила (2 с) и производные 6-амино-2-хлорникотинонитрила (2d) альтернативно получали следующим образом:
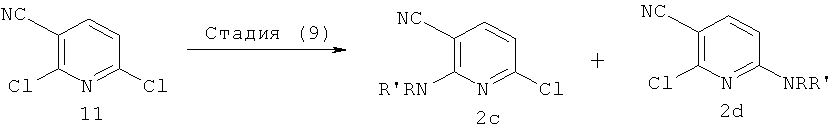
[0283] Стадия 9: Соединения 2 с и 2d получали при воздействии на соединение 11 соответствующими аминами в присутствии основания или без него. Амин использовали в количестве примерно от 1 до 10 эквивалентов. Указанные основания включают карбонат калия, карбонат натрия, карбонат цезия, гидрид натрия, гидрид калия, бутиллитий, и тому подобное. В качестве растворителя применяли тетрагидрофуран, 1,4-диоксан, N,N-диметилформамид, 1,2-диметоксиэтан, толуол, и тому подобное. Реакцию проводили при температуре от 0°С до температуры кипения растворителя, в течение от примерно 1 до примерно 24 часов. Полученную смесь можно разделять при помощи колоночной хроматографии на силикагеле, препаративной тонкослойной хроматографии или высокоэффективной жидкостной хроматографии.
[0284] Соединения 1а и 1b получали следующим образом.


[0285] Стадия 10: (а) На соединение 12 или 13 воздействовали трибромидом бора в дихлорметане. Трибромид бора применяли в количестве примерно от 1 до 3 эквивалентов. Реакцию проводили при температуре примерно от -78°С до комнатной, и она завершалась в течение примерно 1-24 часов. (b) Альтернативно, на соединения 12 или 13 воздействовали 48% бромоводородной кислотой в уксусной кислоте при температуре примерно от 30 до 100°С в течение от примерно 6 до примерно 72 часов.
[0286] Методика В описана ниже для получения моно- или дизамещенных 5-феноксипроизводных:
Методика В:
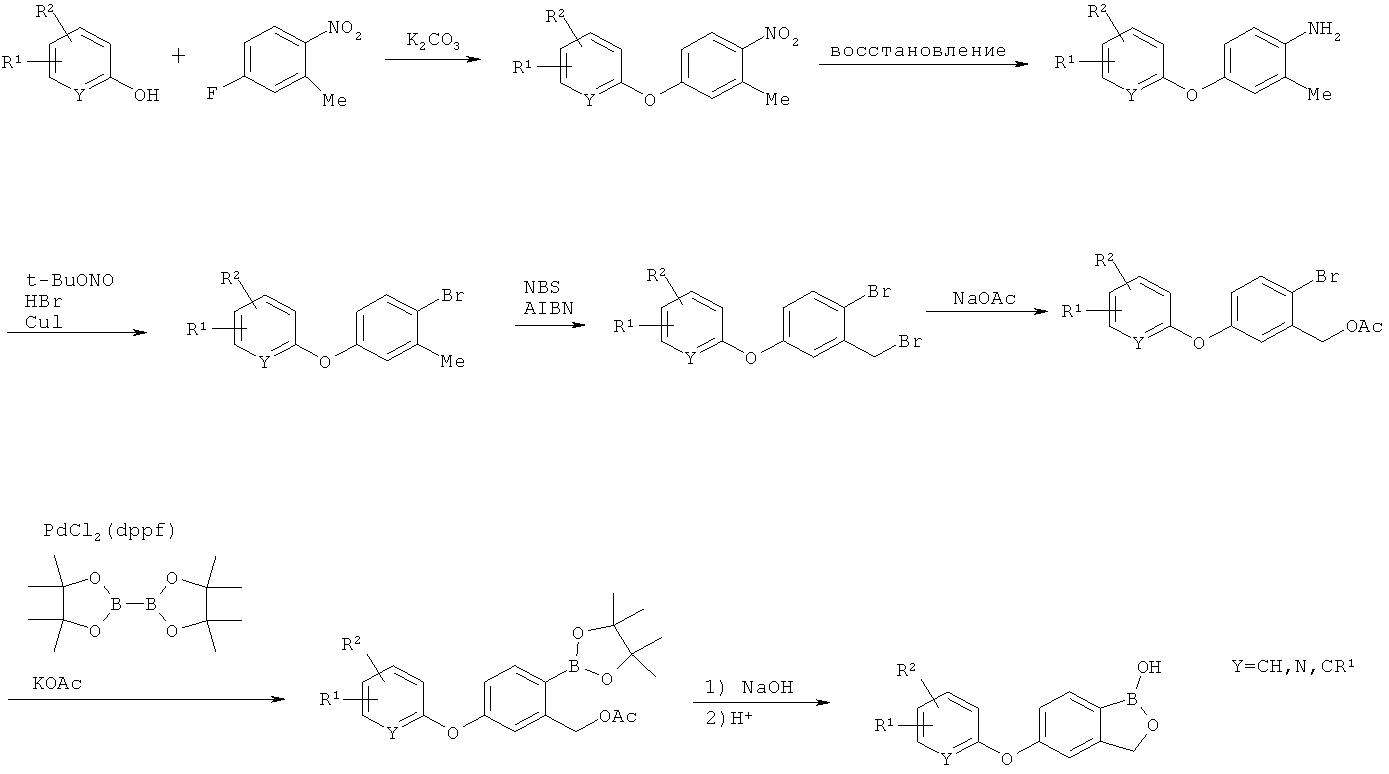
[0287] Методика С описана ниже для получения 5-феноксипроизводных:
Методика С:
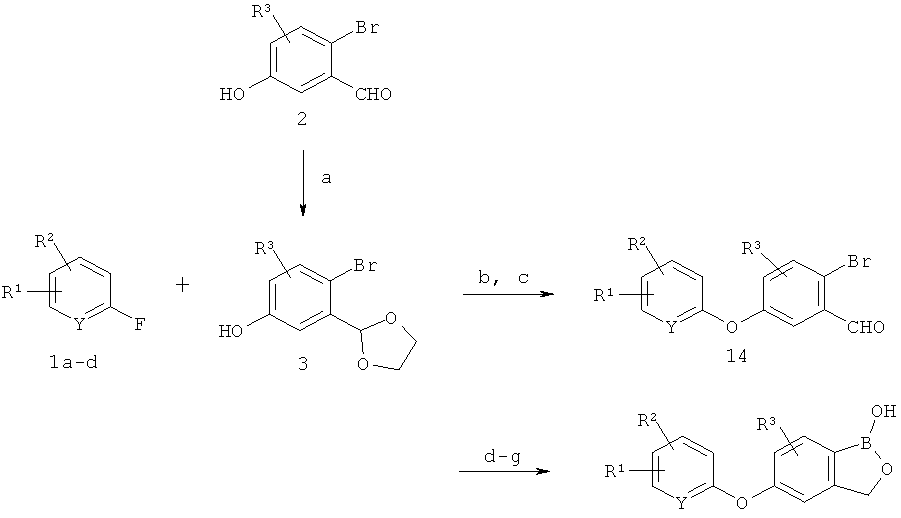
[0288] Реактивы и условия: (а) этиленгликоль, p-TsOH, толуол, кипячение с обратным холодильником, 6 ч; (b) К2СO3, ДМФА, 100°С, в течение ночи; (с) 3 М НСl, ТГФ, кипячение с обратным холодильником, 2 ч; (d) NaBH4, МеОН, к.т., 1 ч; (е) 3, 4-дигидро-2H-пиран, камфорсульфоновая кислота, СН2Сl2, к.т., 2 ч; (f) (i-PrO)3B, n-BuLi, ТГФ, от -78°С до к.т., 3 ч; (g) 6 М НСl, ТГФ, к.т., 3 ч; (h) 6 М NaOH, МеОН, 1,4-диоксан, кипячение с обратным холодильником, 6 суток; (i) EDCI, HOBt, DMAP, ДМФА, к.т., в течение ночи.
[0289] Производные 5-феноксибензоксаборола синтезировали как описано выше. Каркас диарилового эфира получали путем реакции нуклеофильного ароматического замещения. Формильную группу соединения 2 защищали в виде ацеталя чтобы избежать самоконденсации соединения 2. Формильную группу соединения 4 восстанавливали до спирта и защищали в виде простого эфира ТГП. Затем вводили атом бора при помощи обмена галогена на металл с использованием n-BuLi в присутствии триизопропилбората, известного как методика остановки реакции in-situ (Li, W., et al. J. Org. Chem. 2002, 61, 5394-5397. После снятия защиты группы ТГП при помощи НСl, полученная гидроксиметильная группа самопроизвольно циклизовалась, давая желаемый оксаборол.
[0290] Методика D описана ниже для получения карбоксимонозамещенных 5-фенокси производных:
Методика D:
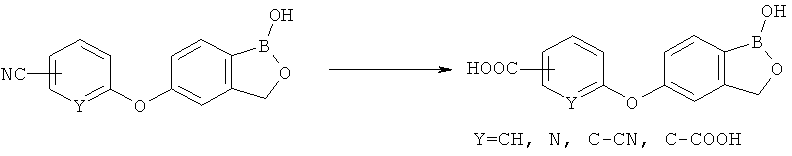
Реактивы и условия: 6 М NaOH, МеОН, 1,4-диоксан, кипячение с обратным холодильником, 6 суток. Карбоксипроизводные получали путем основного гидролиза соответствующего цианосоединения.
[0291] Методика Е описана ниже для получения амидных монозамещенных 5-феноксипроизводных:
Методика Е:
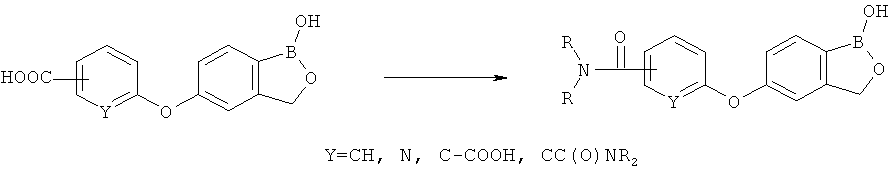
Реактивы и условия: EDCI, HOBt, DMAP, ДМФА, к.т., в течение ночи. Амидные производные синтезировали из карбоксипроизводных с использованием обычных условий EDCI/HOBt.
[0292] Методика F описан ниже для получения сложноэфирных монозамещенных 5-феноксипроизводных:
Методика F:
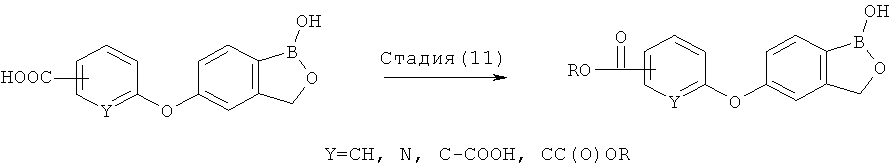
Стадия 11: Реактивы и условия: (a) ROH, серная кислота (от 1 до 10 молярных %), кипячение с обратным холодильником в течение от 1 до 24 часов, или (b) RX (X=CI, Br, I), основание (карбонат калия, карбонат натрия, гидрид натрия, и тому подобное), растворитель (ацетон, тетрагидрофуран, N,N-диметилформамид, и тому подобное), от 0°С до кипения, от 1 до 24 часов.
[0293] Различные 4-цианофенокси производные синтезировали как показано в Методике G аналогичными путями, получая соединения [1].
Методика G:
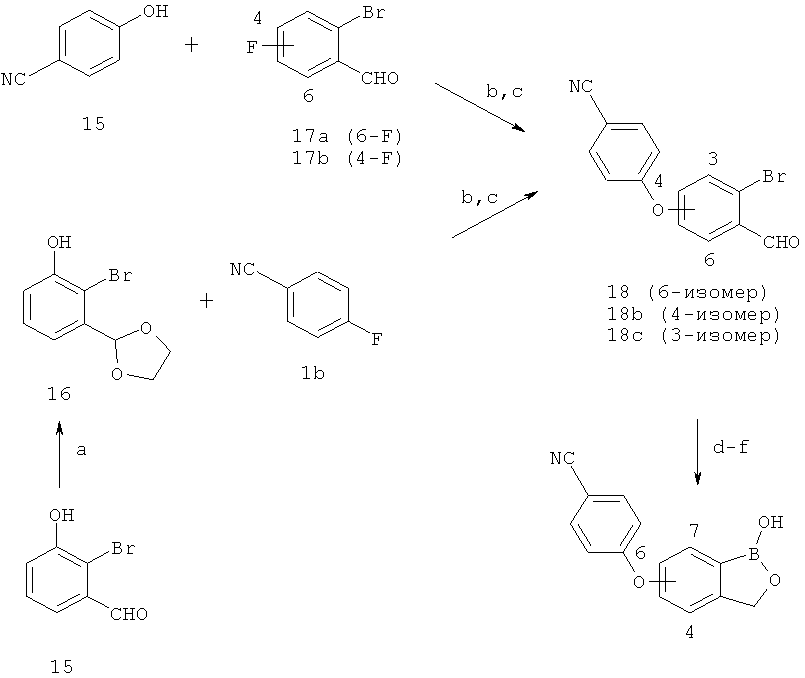
Реактивы и условия: (а) этиленгликоль, p-TsOH, толуол, кипячение с обратным холодильником, 6 ч; (b) К2СO3, ДМФА, 100°С, в течение ночи; (с) 3 М НСl, ТГФ, кипячение с обратным холодильником, 2 ч; (d) NaBH4, МеОН, к.т., 1 ч; (е) 3,4-дигидро-2H-пиран, камфорсульфоновая кислота, СН2Сl2, к.т., 2 ч; (f) (i-PrO)3B, n-BuLi, ТГФ, от -78°С до к.т., 3 ч.
[0294] Карбамоилзамещенные производные получали следующим образом:
Методика H
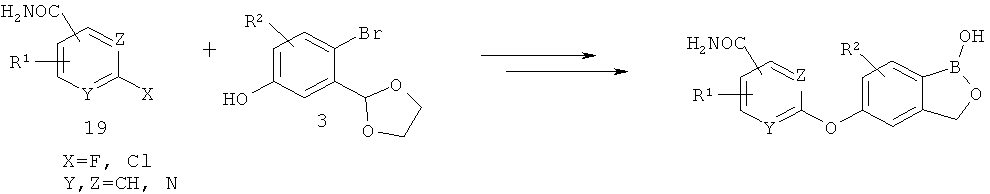
[0295] Указанные соединения получали из соединений 19 и 3 способом, аналогичным Методике А.
[0296] Аминометилзамещенные производные получали следующим образом:
Методика I
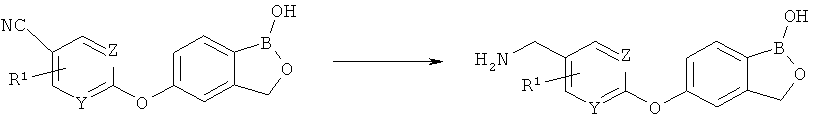
[0297] Указанные соединения получали гидрированием соответствующих цианопроизводных. Обычно применяли условия с палладием на угле (от 5 до 10%) в этаноле, метаноле, этилацетате и тому подобное, при температуре от комнатной до температуры кипения растворителя, при давлении от атмосферного до примерно 50 фунтов на кв. дюйм в течение примерно от 1 до 72 часов. Альтернативно, указанные соединения получали путем восстановления алюмогидридом лития в эфире или тетрагидрофуране при температуре от 0°С до температуры кипения растворителя, в течение от примерно 1 до примерно 2 4 часов.
Алкиламинометильные производные получали следующим образом:
Методика J
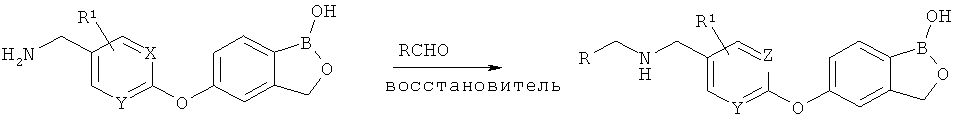
[0031] Указанные соединения получали обычным восстановительным алкилированием. В качестве восстановителя обычно применяли борогидрид натрия или цианоборогидрид натрия. В качестве растворителя применяли метанол, этанол, тетрагидрофуран, 1,4-диоксан, и тому подобное. Реакцию проводили при температуре примерно от 0 до 50°С до комнатной, и завершали в течение примерно 1-24 часов.
[0032] Сульфониламинометильные производные получали следующим образом:
Методика К
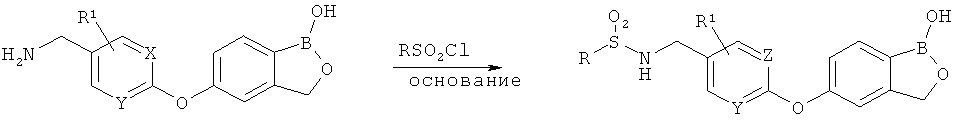
[0033] Указанные соединения получали обычным сульфонированием. На амин воздействовали от 1 до 10 эквивалентами сульфонилхлорида. В качестве основания применяли триэтиламин, диизопропилэтиламин, ДБУ, пиридин, 4-N,N-диметиламинопиридин, гидрид натрия, бутиллитий, и тому подобное. В качестве растворителей применяли дихлорметан, 1,2-дихлорэтан, тетрагидрофуран, ацетонитрил, N,N-диметилформамид, и тому подобное. Реакцию проводили при температуре от 0 до 50°С, и завершали в течение примерно через примерно от 1 до примерно 2 4 часов.
[0034] Алканоиламинометильные производные получали следующим образом:
Методика L
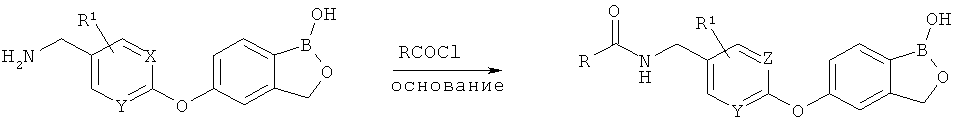
[0035] Указанные соединения получали способом, аналогичным Методике К, применяя хлорид кислоты вместо сульфонилхлорида.
[0036] Производные мочевины получали следующим образом:
Методика М
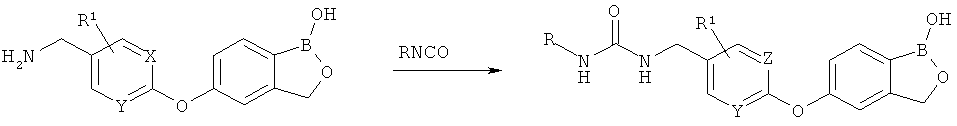
[0037] Указанные соединения получали, воздействуя на амин от 1 до 10 эквивалентами соответствующего изоцианата. В качестве растворителя применяли дихлорметан, 1,2-дихлорэтан, тетрагидрофуран, ацетонитрил, N,N-диметилформамид, и тому подобное. Реакцию проводили при температуре примерно от 0 до 80°С, и завершали в течение от примерно 1 до примерно 24 часов.
[0038] Альтернативно, производные мочевины получали следующим образом:
Методика N
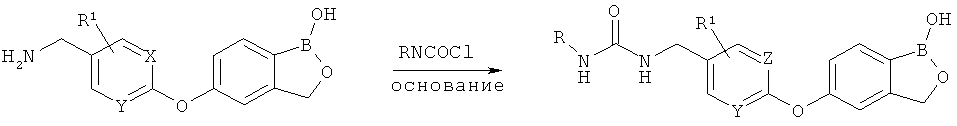
[0298] Указанные соединения получали способом, аналогичным Методике К, применяя карбамоилхлорид вместо сульфонилхлорида.
[0299] 5-Алкоксипроизводные получали следующим образом:
Методика Р
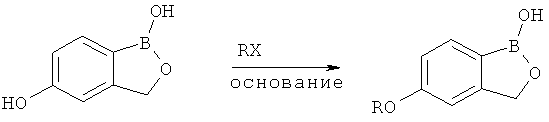
Указанные соединения получали из 5-гидроксипроизводных при помощи обычного алкилирования примерно от 1 до примерно 10 эквивалентами алкилгалогенида (RX) и основанием. В качестве основания применяли карбонат калия, карбонат натрия, карбонат цезия, гидрид натрия, трет-бутоксид калия, и тому подобное. В качестве растворителя применяли ацетон, ацетонитрил, тетрагидрофуран, дихлорметан, N,N-диметилформамид, и тому подобное. Реакцию проводили при температуре примерно от 0 до 100°С, и завершали в течение примерно 1-24 часов.
[0300] 5-алканоилокси и 5-арилокси производные получали следующим образом:
Методика Q
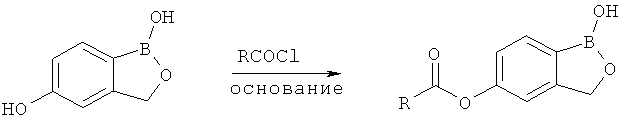
[0301] Указанные соединения получали способом, аналогичным Методике L.
[0302] Соединения согласно настоящему изобретению можно превратить в гидраты и сольваты способами, аналогичными приведенным в настоящем описании.
III.f) Комбинации, содержащие дополнительные терапевтические агенты
[0303] Соединения согласно настоящему изобретению можно также применять в комбинации с дополнительными терапевтическими агентами. Таким образом, согласно настоящему изобретению предложена, в виде следующего аспекта, комбинация, содержащая соединение согласно настоящему описанию или фармацевтически приемлемую соль указанного соединения, совместно, по меньшей мере, с одним дополнительным терапевтическим агентом. Согласно примеру реализации, дополнительный терапевтический агент представляет собой соединение согласно настоящему изобретению. Согласно примеру реализации, дополнительный терапевтический агент содержит атом бора. Согласно примеру реализации, дополнительный терапевтический агент не содержит атома бора. Согласно примеру реализации, дополнительный терапевтический агент представляет собой соединение, описанное в разделах III а)-е).
[0304] Если соединение согласно настоящему изобретению применяют в комбинации со вторым терапевтическим агентом, действующим на то же самое болезненное состояние, доза каждого из соединений может отличаться от дозы при применении указанного соединения отдельно. Соответствующие дозы легко могут быть определены специалистом в данной области. Следует учитывать, что количество соединения согласно настоящему изобретению, необходимое для применения при лечении, может меняться в зависимости от природы состояния, лечение которого проводят, и от возраста и состояния здоровья пациента, и остается в конечном счете на усмотрение лечащего терапевта или ветеринара. Согласно примеру реализации, дополнительный терапевтический агент представляет собой противовоспалительное средство. Согласно примеру реализации, дополнительный терапевтический агент представляет собой стероид или циклоспорин или псорален или UVA или ретиноид или метотрексат или аналог витамина D3. Согласно примеру реализации, указанный стероид представляет собой системный стероид или топический стероид. Согласно примеру реализации, дополнительный терапевтический агент представляет собой топический стероид или антигистаминное средство или ингибитор кальциневрина. Согласно примеру реализации, дополнительный терапевтический агент представляет собой СС-10004 или AWD-12-281. Согласно примеру реализации, дополнительный терапевтический агент представляет собой кортикостероид или НСПВП (нестероидное противовоспалительный препарат). Согласно примеру реализации, дополнительный терапевтический агент представляет собой ингибитор ФДЭ4. Согласно примеру реализации, дополнительный терапевтический агент представляет собой ролипрам (rolipram) или рофлумиласт (roflumilast).
[0305] Отдельные компоненты указанных комбинаций можно вводить одновременно или последовательно в единичной дозированной форме. Единичная дозированная форма может представлять собой отдельную или множественно-единичную дозированную форму. Согласно примеру реализации настоящего изобретения, предложена комбинация в виде отдельной единичной дозированной формы. Примером отдельной единичной дозированной формы является капсула, в которой как соединение согласно настоящему изобретению, так и дополнительный терапевтический агент содержатся в одной и той же капсуле. Согласно примеру реализации настоящего изобретения, предложена комбинация в виде двухединичных дозированных форм. Примером двухединичных дозированных форм является первая капсула, содержащая соединение согласно настоящему изобретению, и вторая капсула, содержащая дополнительный терапевтический агент. Следовательно, термин «отдельная единичная» или «двухединичная» или «множественноединичная» относится к объекту, который проглатывает пациент, а не к внутреннему содержимому указанного объекта. Соответствующие дозы известных терапевтических агентов легко может определить квалифицированный специалист в данной области.
[0306] Упоминаемые в настоящем описании комбинации удобно можно предложить для применения в форме фармацевтического состава. Следовательно, примером реализации настоящего изобретения является фармацевтический состав, содержащий а) соединение согласно настоящему изобретению; b) дополнительный терапевтический агент и с) фармацевтически приемлемый наполнитель. Согласно примеру реализации, фармацевтический состав представляет собой единичную дозированную форму. Согласно примеру реализации, фармацевтический состав представляет собой отдельную единичную дозированную форму. Согласно примеру реализации, фармацевтический состав представляет собой двухединичную дозированную форму. Согласно примеру реализации, фармацевтический состав представляет собой двухединичную дозированную форму, включающую первую единичную дозированную форму и вторую единичную дозированную форму, причем первая единичная дозированная форма содержит а) соединение согласно настоящему изобретению и Ь) первый фармацевтически приемлемый наполнитель; и вторая единичная дозированная форма содержит с) дополнительный терапевтический агент и d) второй фармацевтически приемлемый наполнитель.
IV. Способы
а) Уменьшение выработки цитокина и/или хемокина
[0307] Согласно другому аспекту настоящего изобретения, предложен способ уменьшения выработки цитокина и/или хемокина, причем указанный способ включает: обеспечение контакта клетки с соединением согласно настоящему изобретению, при котором выработка указанной клеткой цитокина и/или хемокина уменьшается. Согласно другому аспекту настоящего изобретения, предложен способ уменьшения выработки цитокина и/или хемокина, причем указанный способ включает: обеспечение контакта клетки с соединением согласно настоящему описанию или с фармацевтически приемлемой солью указанного соединения, при котором выработка указанной клеткой цитокина и/или хемокина уменьшается. Согласно примеру реализации, соединение согласно настоящему изобретению представляет собой соединение согласно настоящему описанию или фармацевтически приемлемую соль указанного соединения. Согласно примеру реализации, соединение согласно настоящему изобретению представляет собой соединение согласно настоящему описанию. Согласно примеру реализации, указанную клетку приводят в контакт с терапевтически эффективным количеством указанного соединения. Согласно примеру реализации, указанное соединение соответствует формуле согласно настоящему описанию. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из C1, С2, С3, С4, С5, С6, С7, С8, С9, С10, С11, С12, С13, С14, С15, С16, С17, С18, С19, С20, С21, С22, С23, С24, С25, С26, С27, С28, С29, С30, С31, С32, С33, С34, С35, С36, С37, С38, С39, С40, С41, С42, С43, С44, С45, С46, С47, С48, С49, С50, С51, С52, С53, С54, С55, С56, С57, С58, С59, С60, С61, С62, С63, С64, С65, С66, С67, С68, С69, С70, С71, С72, С73, С74, С75, С76, С77, С78, С79, С80, С81, С82, С83, С84, С85, С8б, С87, С88, С89, С90, С91, С92, С93, С94, С95, С96, С97, С98, С99 и С100. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D1, D2, D3, D4, D5, D6, D7, D8, D9, D10, D11, D12, D13, D14, D15, D16, D17, D18, D19, D20, D21, D22, D23, D24, D25, D26, D27, D28, D29, D30, D31, D32, D33, D34, D35, D36, D37, D38, D39, D40, D41, D42, D43, D44, D45, D46, D47, D48, D49, D50, D51, D52, D53, D54, D55, D56, D57, D58, D59, D60, D61, D62, D63, D64, D65, D66, D67, D68, D69, D70, D71, D72, D73, D74, D75, D76, D77, D78, D79, D80, D81, D82, D83, D84, D85, D86, D87, D88, D89, D90, D91, D92, D93, D94, D95, D96, D97, D98, D99, D100, D101, D102, D103, D104, D105, D106, D107, D108, D109, D110, D111, D112, D113, D114, D115, D116, D117, D118, D119, D120, D121, D122, D123, D124, D125, D126, D127, D128, D129, D130, D131, D132, D133, D134, D135, D136, D137, D138, D139, D140, D141, D142, D143, D144, D145, D146, D147, D148, D149, D150, D151, D152, D153, D154, D155, D156, D157, D158, D159, D160, D161, D162, D163, D164, D165, D166, D167, D168, D169, D170, D171, D172, D173, D174, D175, D176, D177, D178, D179, D180, D181, D182, D183, D184, D185, D186, D187, D188, D189, D190, D191, D192, D193, D194, D195, D196, D197, D198, D199, D200, D201, D202, D203, D204, D205, D206, D207, D208, D209, D210, D211, D212, D213, D214, D215, D216, D217, D218, D219, D220, D221, D222, D223, D224, D225, D226, D227, D228 и D229. Согласно примеру реализации, указанное соединение представляет собой С17. Согласно другому примеру реализации, указанное соединение представляет собой С27. Согласно другому примеру реализации, указанное соединение представляет собой С23 или С24. Согласно другому примеру реализации, указанное соединение представляет собой С25. Согласно другому примеру реализации, указанное соединение представляет собой С26. Согласно другому примеру реализации, указанное соединение представляет собой С37. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D46, D86, D99, D100, D107, D108, D114, D122, D125, D126, D127, D128, D131, D140 и D141, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D95, D96, D97, D102, D110, D111, D113, D115, D121, D129, D130, D132, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D47, D109, D116, D118, D119, D120, D123, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D98, D101, D106, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D11, D12, D37, D38, D39, D40, D41, D42, D43, D124, D142, D143, D146, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D14, D15, D16, D17, D28, D29, D30, D31, D133, D134, D135, D144, D145, D147 и солей указанных соединений
[0308] Согласно примеру реализации, указанный способ представляет собой способ уменьшения выработки цитокина, такого как цитокин ТН1. Согласно примеру реализации, цитокин ТН1 представляет собой член, выбранный из ИФН-γ и ИЛ-2.
[0309] Согласно примеру реализации, указанный способ предназначен для уменьшения выработки цитокина, такого как цитокин ТН2. Согласно примеру реализации, цитокин ТН2 представляет собой член, выбранный из ИЛ-4, ИЛ-5 и ИЛ-10.
[0310] Согласно примеру реализации, указанный способ предназначен для уменьшения выработки цитокина, представляющего собой член, выбранный из ИЛ-1α, ИЛ-1β, ИЛ-2, ИЛ-3, ИЛ-6, ИЛ-7, ИЛ-9, ИЛ-12, ИЛ-17, ИЛ-18, ИЛ-23, ФНО-α, ЛТ, ФИЛ, Онкостатин, ИФНα, ИФН-β и ИФН-γ. Согласно другому примеру реализации, указанный цитокин представляет собой член, выбранный из ИЛ-1β, ИЛ-2, ИЛ-3, ИЛ-6, ИЛ-7, ИЛ-9, ИЛ-12, ИЛ-23, ФНО-α, ЛТ, ФИЛ, Онкостатин, и ИФН-γ. Согласно другому примеру реализации, указанный цитокин представляет собой член, выбранный из ИЛ-1β, ИЛ-2, ИЛ-23, ФНО-α и ИФН-γ. Согласно другому примеру реализации, указанный цитокин представляет собой ФНО-α.
[0311] Согласно примеру реализации, указанный способ предназначен для уменьшения выработки цитокина, представляющего собой член, выбранный из ИЛ-1β, ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, ИЛ-23, ФНО-α и ИФН-γ.
[0312] Согласно примеру реализации, указанный способ предназначен для уменьшения выработки цитокина, представляющего собой член, выбранный из ИЛ-4, ИЛ-10, ИЛ-11, W-13 и ТРФ-β.
[0313] Согласно примеру реализации, указанный способ предназначен для уменьшения выработки хемокина, представляющего собой член, выбранный из ИЛ-8, Gro-α, МВБ-1, МХБ-1, ПГЕ2, ENA-78 и RANTES. Согласно примеру реализации, указанный хемокин представляет собой член, выбранный из МХБ-1 и ПГЕ2.
[0314] Согласно примеру реализации, в любом из способов согласно настоящему описанию, соединение согласно настоящему изобретению присутствует в таком количестве, которое будет ингибировать выработку цитокина и/или хемокина на по меньшей мере от примерно 5 до примерно 100% или по меньшей мере от примерно 30 до примерно 100%, или по меньшей мере от примерно 40 до примерно 100%, или по меньшей мере от примерно 50 до примерно 100%, или по меньшей мере от примерно 60 до примерно 100%, или по меньшей мере от примерно 70 до примерно 100%, или по меньшей мере от примерно 80 до примерно 100%, или по меньшей мере от примерно 90 до примерно 100%, или по меньшей мере от примерно до примерно 30 до примерно 70%, или по меньшей мере от примерно 40 до примерно 90%, или по меньшей мере от примерно 45 до примерно 80%, или по меньшей мере от примерно 55 до примерно 75%, или по меньшей мере от примерно 75 до примерно 98%, или по меньшей мере от примерно 55 до примерно 99%, или по меньшей мере от примерно 5 до примерно 20%, или по меньшей мере от примерно 10 до примерно 25%. Согласно примеру реализации, соединение согласно настоящему изобретению представляет собой соединение, описанное в данной заявке.
б) Увеличение выработки цитокина и/или хемокина
[0315] Согласно другому аспекту настоящего изобретения, предложен способ увеличения выработки цитокина и/или хемокина, причем указанный способ включает: обеспечение контакта клетки с соединением согласно настоящему изобретению, при котором выработка указанной клеткой цитокина и/или хемокина увеличивается. Согласно примеру реализации, указанное соединение представляет собой соединение, описанное в настоящей заявке, или фармацевтически приемлемую соль указанного соединения. Согласно примеру реализации, соединение согласно настоящему изобретению представляет собой соединение, описанное в настоящей заявке. Согласно примеру реализации, указанная клетка контактирует с терапевтически эффективным количеством указанного соединения. Согласно примеру реализации, указанное соединение соответствует формуле, описанной в настоящей заявке. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из C1, С2, С3, С4, С5, С6, С7, С8, С9, С10, С11, С12, С13, С14, С15, С16, С17, С18, С19, С20, С21, С22, С23, С24, С25, С26, С27, С28, С29, С30, С31, С32, С33, С34, С35, С36, С37, С38, С39, С40, С41, С42, С43, С44, С45, С46, С47, С48, С49, С50, С51, С52, С53, С54, С55, С56, С57, С58, С59, С60, С61, С62, С63, С64, С65, С66, С67, С68, С69, С70, С71, С72, С73, С74, С75, С76, С77, С78, С79, С80, С81, С82, С83, С84, С85, С86, С87, С88, С89, С90, С91, С92, С93, С94, С95, С96, С97, С98, С99 и С100. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D1, D2, D3, D4, D5, D6, D7, D8, D9, D10, D11, D12, D13, D14, D15, D16, D17, D18, D19, D20, D21, D22, D23, D24, D25, D26, D27, D28, D29, D30, D31, D32, D33, D34, D35, D36, D37, D38, D39, D40, D41, D42, D43, D44, D45, D46, D47, D48, D49, D50, D51, D52, D53, D54, D55, D56, D57, D58, D59, D60, D61, D62, D63, D64, D65, D66, D67, D68, D69, D70, D71, D72, D73, D74, D75, D76, D77, D78, D79, D80, D81, D82, D83, D84, D85, D86, D87, D88, D89, D90, D91, D92, D93, D94, D95, D96, D97, D98, D99, D100, D101, D102, D103, D104, D105, D106, D107, D108, D109, D110, D111, D112, D113, D114, D115, D116, D117, D118, D119, D120, D121, D122, D123, D124, D125, D126, D127, D128, D129, D130, D131, D132, D133, D134, D135, D136, D137, D138, D139, D140, D141, D142, D143, D144, D145, D146, D147, D148, D149, D150, D151, D152, D153, D154, D155, D156, D157, D158, D159, D160, D161, D162, D163, D164, D165, D166, D167, D168, D169, D170, D171, D172, D173, D174, D175, D176, D177, D178, D179, D180, D181, D182, D183, D184, D185, D186, D187, D188, D189, D190, D191, D192, D193, D194, D195, D196, D197, D198, D199, D200, D201, D202, D203, D204, D205, D206, D207, D208, D209, D210, D211, D212, D213, D214, D215, D216, D217, D218, D219, D220, D221, D222, D223, D224, D225, D226, D227, D228 и D229. Согласно примеру реализации, указанное соединение представляет собой С17. Согласно другому примеру реализации, указанное соединение представляет собой С27. Согласно другому примеру реализации, указанное соединение представляет собой С23 или С24. Согласно другому примеру реализации, указанное соединение представляет собой С26.
[0316] Согласно примеру реализации, указанный способ предназначен для увеличения выработки цитокина, такого как цитокин ТН1. Согласно примеру реализации, цитокин ТН1 представляет собой член, выбранный из ИФН-у и ИЛ-2.
[0317] Согласно примеру реализации, указанный способ предназначен для увеличения выработки цитокина, такого как цитокин ТН2. Согласно примеру реализации, цитокин ТН2 представляет собой член, выбранный из ИЛ-4, ИЛ-5 и ИЛ-10.
[0318] Согласно примеру реализации, указанный способ предназначен для увеличения выработки цитокина, представляющего собой член, выбранный из ИЛ-4, ИЛ-10, ИЛ-11, W-13 и ТРФ-р.
[0319] Согласно примеру реализации, указанный способ предназначен для увеличения выработки хемокина, представляющего собой член, выбранный из ИЛ-8, Gro-a, МВБ-1, МХБ-1, ПГЕ2, ENA-78, и RANTES. Согласно примеру реализации, указанный хемокин представляет собой член, выбранный из МХБ-1 и ПГЕ2.
[0320] Согласно примеру реализации, в любом из способов согласно настоящему описанию, соединение согласно настоящему изобретению присутствует в таком количестве, которое будет увеличивать выработку цитокина и/или хемокина на, по меньшей мере, от примерно 5 до примерно 100% или по меньшей мере от примерно 30 до примерно 100%, или по меньшей мере от примерно 40 до примерно 100%, или по меньшей мере от примерно 50 до примерно 100%, или по меньшей мере от примерно 60 до примерно 100%, или по меньшей мере от примерно 7 0 до примерно 100%, или по меньшей мере от примерно 80 до примерно 100%, или по меньшей мере от примерно 90 до примерно 100%, или по меньшей мере от примерно 30 до примерно 7 0%, или по меньшей мере от примерно 40 до примерно 90%, или по меньшей мере
от примерно 45 до примерно 80%, или по меньшей мере от примерно 55 до примерно 75%, или по меньшей мере от примерно 75 до примерно 98%, или по меньшей мере от примерно 55 до примерно 99%, или по меньшей мере от примерно 5 до примерно 20%, или по меньшей мере от примерно 10 до примерно 25%. Согласно примеру реализации, соединение согласно настоящему изобретению представляет собой соединение, описанное в настоящей заявке.
в) Уменьшение высвобождения цитокина и/или хемокина.
[0321] Согласно другому аспекту настоящего изобретения, предложен способ уменьшения высвобождения цитокина и/или хемокина, причем указанный способ включает: обеспечение контакта клетки с соединением согласно настоящему изобретению, при котором высвобождение указанной клеткой цитокина и/или хемокина уменьшается. Согласно примеру реализации, соединение согласно настоящему изобретению представляет собой соединение согласно настоящему описанию или фармацевтически приемлемую соль указанного соединения. Соединение согласно настоящему изобретению
представляет собой соединение согласно настоящему описанию. Согласно примеру реализации, указанная клетка контактирует с терапевтически эффективным количеством указанного соединения. Согласно примеру реализации, указанное соединение соответствует формуле согласно настоящему описанию. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из C1, С2, С3, С4, С5, С6, С7, С8, С9, С10, С11, С12, С13, С14, С15, С16, С17, С18, С19, С20, С21, С22, С23, С24, С25, С26, С27, С28, С29, С30, С31, С32, С33, С34, С35, С36, С37, С38, С39, С40, С41, С42, С43, С44, С45, С46, С47, С48, С49, С50, С51, С52, С53, С54, С55, С56, С57, С58, С59, С60, С61, С62, С63, С64, С65, С66, С67, С68, С69, С70, С71, С72, С73, С74, С75, С76, С77, С78, С79, С80, С81, С82, С83, С84, С85, С86, С87, С88, С89, С90, С91, С92, С93, С94, С95, С96, С97, С98, С99 и С100. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D1, D2, D3, D4, D5, D6, D7, D8, D9, D10, D11, D12, D13, D14, D15, D16, D17, D18, D19, D20, D21, D22, D23, D24, D25, D26, D27, D28, D29, D30, D31, D32, D33, D34, D35, D36, D37, D38, D39, D40, D41, D42, D43, D44, D45, D46, D47, D48, D49, D50, D51, D52, D53, D54, D55, D56, D57, D58, D59, D60, D61, D62, D63, D64, D65, D66, D67, D68, D69, D70, D71, D72, D73, D74, D75, D76, D77, D78, D79, D80, D81, D82, D83, D84, D85, D86, D87, D88, D89, D90, D91, D92, D93, D94, D95, D96, D97, D98, D99, D100, D101, D102, D103, D104, D105, D106, D107, D108, D109, DUO, Dill, D112, D113, D114, D115, D116, D117, D118, D119, D120, D121, D122, D123, D124, D125, D126, D127, D128, D129, D130, D131, D132, D133, D134, D135, D136, D137, D138, D139, D140, D141, D142, D143, D144, D145, D146, D147, D148, D149, D150, D151, D152, D153, D154, D155, D156, D157, D158, D159, D160, D161, D162, D163, D164, D165, D166, D167, D168, D169, D170, D171, D172, D173, D174, D175, D176, D177, D178, D179, D180, D181, D182, D183, D184, D185, D186, D187, D188, D189, D190, D191, D192, D193, D194, D195, D196, D197, D198, D199, D200, D201, D202, D203, D204, D205, D206, D207, D208, D209, D210, D211, D212, D213, D214, D215, D216, D217, D218, D219, D220, D221, D222, D223, D224, D225, D226, D227, D228 и D229. Согласно примеру реализации, указанное соединение представляет собой С17. Согласно другому примеру реализации, указанное соединение представляет собой С27. Согласно другому примеру реализации, указанное соединение представляет собой С23 или С24. Согласно другому примеру реализации, указанное соединение представляет собой С25. Согласно другому примеру реализации, указанное соединение представляет собой С26. Согласно другому примеру реализации, указанное соединение представляет собой С37. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D46, D86, D99, D100, D107, D108, D114, D122, D125, D126, D127, D128, D131, D140 и D141, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D95, D96, D97, D102, D110, D111, D113, D115, D121, D129, D130, D132, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D47, D109, D116, D118, D119, D120, D123, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D98, D101, D106, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D11, D12, D37, D38, D39, D40, D41, D42, D43, D124, D142, D143, D146, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D14, D15, D16, D17, D28, D29, D30, D31, D133, D134, D135, D144, D145, D147 и солей указанных соединений.
[0322] Согласно примеру реализации, указанный способ предназначен для уменьшения высвобождения цитокина, такого как цитокин ТН1. Согласно примеру реализации, цитокин ТН1 представляет собой член, выбранный из ИФН-γ и ИЛ-2.
[0323] Согласно примеру реализации, указанный способ предназначен для уменьшения высвобождения цитокина, такого как цитокин ТН2. Согласно примеру реализации, цитокин ТН2 представляет собой член, выбранный из ИЛ-4, ИЛ-5 и ИЛ-10.
[0324] Согласно примеру реализации, указанный способ предназначен для уменьшения высвобождения цитокина, представляющего собой член, выбранный из ИЛ-1α, ИЛ-1β, ИЛ-2, ИЛ-3, ИЛ-6, ИЛ-7, ИЛ-9, ИЛ-12, ИЛ-17, ИЛ-18, ИЛ-23, ФНО-α, ЛТ, ФИЛ, Онкостатин, ИФНа, ИФН-β и ИФН-γ. Согласно другому примеру реализации, указанный цитокин представляет собой член, выбранный из ИЛ-1β, ИЛ-2, ИЛ-3, ИЛ-6, ИЛ-7, ИЛ-9, ИЛ-12, ИЛ-23, ФНО-α, ЛТ, ФИЛ, Онкостатин, и ИФН-γ. Согласно другому примеру реализации, указанный цитокин представляет собой член, выбранный из ИЛ-1β, ИЛ-2, ИЛ-23, ФНО-α и ИФН-γ. Согласно другому примеру реализации, указанный цитокин представляет собой ФНО-α. Согласно другому примеру реализации, указанный цитокин представляет собой ИФН-γ.
[0325] Согласно примеру реализации, указанный способ предназначен для уменьшения высвобождения цитокина, представляющего собой член, выбранный из ИЛ-1β, ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, ИЛ-23, ФНО-α и ИФН-γ.
[0326] Согласно примеру реализации, соединение согласно настоящему изобретению уменьшает высвобождение ИЛ-1β, ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, ИЛ-23, ФНО-β и ИФН-γ. Согласно примеру реализации, указанное соединение представляет собой С17.
[0327] Согласно примеру реализации, указанный способ предназначен для уменьшения высвобождения цитокина, представляющего собой член, выбранный из ИЛ-4, ИЛ-10, ИЛ-11, W-13 и ТРФ-β.
[0328] Согласно примеру реализации, указанный способ предназначен для уменьшения высвобождения хемокина, представляющего собой член, выбранный из ИЛ-8, Gro-α, МВБ-1, МХБ-1, ПГЕ2, ENA-78, и RANTES. Согласно примеру реализации, указанный хемокин представляет собой член, выбранный из МХБ-1 и ПГЕ2. Согласно примеру реализации, указанное соединение представляет собой С17, и указанный хемокин представляет собой член, выбранный из МХБ-1 и ПГЕ2.
[0329] Согласно примеру реализации, соединение согласно настоящему изобретению уменьшает высвобождение ФНО-α, ИЛ-2, ИФНγ, ИЛ-5 и ИЛ-10. Согласно примеру реализации, указанное соединение, по существу, не уменьшает высвобождение ИЛ-1β, ИЛ-6 и ИЛ-8. Согласно примеру реализации, указанное соединение, по существу, не уменьшает высвобождения ИЛ-1β. Согласно примеру реализации, указанное соединение, по существу, не уменьшает высвобождения ИЛ-4. Согласно примеру реализации, соединение согласно настоящему изобретению уменьшает высвобождение ИЛ-12 и ИЛ-23. Согласно примеру реализации, указанное соединение представляет собой С27.
[0330] Согласно примеру реализации, в любом из способов согласно настоящему описанию, соединение согласно настоящему изобретению присутствует в таком количестве, которое будет уменьшать высвобождение цитокина и/или хемокина на, по меньшей мере, от примерно 5 до примерно 100% или по меньшей мере от примерно 30 до примерно 100%, или по меньшей мере от примерно 40 до примерно 100%, или по меньшей мере от примерно 50 до примерно 100%, или по меньшей мере от примерно 60 до примерно 100%, или по меньшей мере от примерно 7 0 до примерно 100% или по меньшей мере от примерно 80 до примерно 100%, или по меньшей мере от примерно 90 до примерно 100%, или по меньшей мере от примерно 30 до примерно 70%, или по меньшей мере от примерно 40 до примерно 90%, или по меньшей мере от примерно 45 до примерно 80%, или по меньшей мере от примерно 55 до примерно 75%, или по меньшей мере от примерно 75 до примерно 98%, или по меньшей мере от примерно 55 до примерно 99%, или по меньшей мере от примерно 5% до примерно 20%, или по меньшей мере от примерно 10% до примерно 25%. Согласно другому примеру реализации, соединение согласно настоящему изобретению представляет собой соединение, описанное в настоящей заявке, или фармацевтически приемлемую соль указанного соединения.
г) Увеличение высвобождения цитокина и/или хемокина
[0331] Согласно другому аспекту настоящего изобретения, предложен способ увеличения высвобождения цитокина и/или хемокина, причем указанный способ включает: обеспечение контакта клетки с соединением согласно настоящему изобретению, при котором высвобождение указанной клеткой цитокина и/или хемокина увеличивается. Согласно примеру реализации, указанное соединение представляет собой соединение согласно настоящему описанию или фармацевтически приемлемую соль указанного соединения. Согласно примеру реализации, указанное соединение представляет собой соединение согласно настоящему описанию. In Согласно примеру реализации, указанная клетка контактирует с терапевтически эффективным количеством указанного соединения. Согласно примеру реализации, указанное соединение соответствует формуле согласно настоящему описанию. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из C1, С2, С3, С4, С5, С6, С7, С8, С9, С10, С11, С12, С13, С14, С15, С16, С17, С18, С19, С20, С21, С22, С23, С24, С25, С26, С27, С28, С29, С30, С31, С32, СЗЗ, С34, С35, С36, С37, С38, С39, С40, С41, С42, С43, С44, С45, С46, С47, С48, С49, С50, С51, С52, С53, С54, С55, С56, С57, С58, С59, С60, С61, С62, С63, С64, С65, С66, С67, С68, С69, С70, С71, С72, С73, С74, С75, С76, С77, С78, С79, С80, С81, С82, С83, С84, С85, С86, С87, С88, С89, С90, С91, С92, С93, С94, С95 и С96. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D1, D2, D3, D4, D5, D6, D7, D8, D9, D10, D11, D12, D13, D14, D15, D16, D17, D18, D19, D20, D21, D22, D23, D24, D25, D26, D27, D28, D29, D30, D31, D32, D33, D34, D35, D36, D37, D38, D39, D40, D41, D42, D43, D44, D45, D46, D47, D48, D49, D50, D51, D52, D53, D54, D55, D56, D57, D58, D59, D60, D61, D62, D63, D64, D65, D66, D67, D68, D69, D70, D71, D72, D73, D74, D75, D76, D77, D78, D79, D80, D81, D82, D83, D84, D85, D86, D87, D88, D89, D90, D91, D92, D93, D94, D95, D96, D97, D98, D99, D100, D101, D102, D103, D104, D105, D106, D107, D108, D109, D110, D111, D112, D113, D114, D115, D116, D117, D118, D119, D120, D121, D122, D123, D124, D125, D126, D127, D128, D129, D130, D131, D132, D133, D134, D135, D136, D137, D138, D139, D140, D141, D142, D143, D144, D145, D146, D147, D148, D149, D150, D151, D152, D153, D154, D155, D156, D157, D158, D159, D160, D161, D162, D163, D164, D165, D166, D167, D168, D169, D170, D171, D172, D173, D174, D175, D176, D177, D178, D179, D180, D181, D182, D183, D184, D185, D186, D187, D188, D189, D190, D191, D192, D193, D194, D195, D196, D197, D198, D199, D200, D201, D202, D203, D204, D205, D206, D207, D208, D209, D210, D211, D212, D213, D214, D215, D216, D217, D218, D219, D220, D221, D222, D223, D224, D225, D226, D227, D228 и D229. Согласно примеру реализации, указанное соединение представляет собой С17. Согласно другому примеру реализации, указанное соединение представляет собой С27. Согласно другому примеру реализации, указанное соединение представляет собой С23 или С24. Согласно другому примеру реализации, указанное соединение представляет собой С26.
[0332] Согласно примеру реализации, указанный способ предназначен для увеличения высвобождения цитокина, такого как цитокин ТН1. Согласно примеру реализации, цитокин ТН1 представляет собой член, выбранный из ИФН-γ и ИЛ-2.
[0333] Согласно примеру реализации, указанный способ предназначен для увеличения высвобождения цитокина, такого как цитокин ТН2. Согласно примеру реализации, цитокин ТН2 представляет собой член, выбранный из ИЛ-4, ИЛ-5 и ИЛ-10.
[0334] Согласно примеру реализации, указанный способ представляет собой способ увеличения высвобождения цитокина, представляющего собой член, выбранный из ИЛ-4, ИЛ-10, ИЛ-11, W-13 и ТРФ-β.
[0335] Согласно примеру реализации, указанный способ представляет собой способ увеличения высвобождения хемокина, представляющего собой член, выбранный из ИЛ-8, Gro-α, МВБ-1, МХБ-1, ПГЕ2, ENA-78, и RANTES. Согласно примеру реализации, указанный хемокин представляет собой член, выбранный из МХБ-1 и ПГЕ2.
[0336] Согласно примеру реализации, в любом из способов согласно настоящему описанию, соединение согласно настоящему изобретению присутствует в таком количестве, которое будет увеличивать высвобождение цитокина и/или хемокина на, по меньшей мере, от примерно 5 до примерно 100% или по меньшей мере от примерно 30 до примерно 100%, или по меньшей мере от примерно 40 до примерно 100%, или по меньшей мере от примерно 50 до примерно 100%, или по меньшей мере от примерно 60 до примерно 100%, или по меньшей мере от примерно 70 до примерно 100%, или по меньшей мере от примерно на 80 до примерно 100%, или по меньшей мере от примерно 90 до примерно 100%, или по меньшей мере от примерно 30 до примерно 70%, или по меньшей мере от примерно 40 до примерно 90%, или по меньшей мере от примерно 45 до примерно 80%, или по меньшей мере от примерно 55 до примерно 75%, или по меньшей мере от примерно 75 до примерно 98%, или по меньшей мере от примерно 55 до примерно 99%, или по меньшей мере от примерно 5% до примерно 20%, или по меньшей мере от примерно 10% до примерно 25%. Согласно примеру реализации, соединение согласно настоящему изобретению представляет собой соединение, описанное в настоящей заявке, или фармацевтически приемлемую соль указанного соединения.
д) Иигибирование фосфодиэстеразы
[0337] Согласно другому аспекту настоящего изобретения, предложен способ ингибирования фосфодиэстеразы (ФДЭ), причем указанный способ включает: обеспечение контакта фосфодиэстеразы с соединением согласно настоящему изобретению, при котором фосфодиэстераза ингибируется. Согласно примеру реализации, соединение согласно настоящему изобретению представляет собой соединение согласно настоящему описанию или фармацевтически приемлемую соль указанного соединения. Согласно примеру реализации, соединение согласно настоящему изобретению представляет собой соединение согласно настоящему описанию. Согласно примеру реализации, количество указанного соединения представляет собой терапевтически эффективное количество. Согласно примеру реализации, указанное соединение соответствует формуле согласно настоящему описанию. Согласно примеру реализации, указанное соединение соответствует следующей формуле:
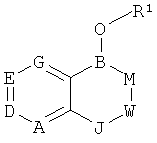
где В представляет собой бор. R1 представляет собой член, выбранный из отрицательного заряда, противоиона соли, Н, циано, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила. М представляет собой член, выбранный из кислорода, серы и NR2. R2 представляет собой член, выбранный из Н, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила. J представляет собой член, выбранный из (CR3R4)n1 и CR5. R3, R4, и R5 представляют собой члены, независимо выбранные из Н, циано, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила. n1 представляет собой целое число, выбранное из 0-2. W представляет собой член, выбранный из С=0 (карбонил), (CR6R7)m1 и CR8. R6, R7, и R8 представляют собой члены, независимо выбранные из Н, циано, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила. m1 представляет собой целое число, выбранное из 0 и 1. А представляет собой член, выбранный из CR9 и N. D представляет собой член, выбранный из CR10 и N. Е представляет собой член, выбранный из CR11 и N.G представляет собой член, выбранный из CR12 и N. R9, R10, R11 и R12 представляют собой члены, независимо выбранные из Н, OR*, NR*R**, SR*, -S(O)R*, -S(O)2R*, -S(O)2NR*R**, -C(O)R*, -C(O)OR*, -C(O)NR*R**, нитро, галогена, циано, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила, где каждый R* и R** представляют собой члены, независимо выбранные из Н, нитро, галогена, циано, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила. Комбинация атомов азота (А+D+Е+G) представляет собой целое число, выбранное из 0-3. Член, выбранный из R3, R4 и R5 и член, выбранный из R6, R7 и R8, вместе с атомами, к которым они присоединены, возможно, соединены с образованием 4-7-членного кольца. R3 и R4, вместе с атомами, к которым они присоединены, возможно, соединены с образованием 4-7-членного кольца. R6 и R7, вместе с атомами, к которым они присоединены, возможно, соединены с образованием 4-7-членного кольца. R9 и R10, вместе с атомами, к которым они присоединены, возможно, соединены с образованием 4-7-членного кольца. R10 и R11, вместе с атомами, к которым они присоединены, возможно, соединены с образованием 4-7-членного кольца. R11 и R12, вместе с атомами, к которым они присоединены, возможно, соединены с образованием 4-7-членного кольца.
[0338] Согласно примеру реализации, указанное соединение представляет собой член, выбранный из C1, С2, С3, С4, С5, С6, С7, С8, С9, С10, С11, С12, С13, С14, С15, С16, С17, С18, С19, С20, С21, С22, С23, С24, С25, С26, С27, С28, С29, С30, С31, С32, С33, С34, С35, С36, С37, С38, С39, С40, С41, С42, С43, С44, С45, С46, С47, С48, С49, С50, С51, С52, С53, С54, С55, С56, С57, С58, С59, С60, С61, С62, С63, С64, С65, С66, С67, С68, С69, С70, С71, С72, С73, С74, С75, С76, С77, С78, С79, С80, С81, С82, С83, С84, С85, С86, С87, С88, С89, С90, С91, С92, С93, С94, С95 и С96, или фармацевтически приемлемых солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D1, D2, D3, D4, D5, D6, D7, D8, D9, D10, D11, D12, D13, D14, D15, D16, D17, D18, D19, D20, D21, D22, D23, D24, D25, D26, D27, D28, D29, D30, D31, D32, D33, D34, D35, D36, D37, D38, D39, D40, D41, D42, D43, D44, D45, D46, D47, D48, D49, D50, D51, D52, D53, D54, D55, D56, D57, D58, D59, D60, D61, D62, D63, D64, D65, D66, D67, D68, D69, D70, D71, D72, D73, D74, D75, D76, D77, D78, D79, D80, D81, D82, D83, D84, D85, D86, D87, D88, D89, D90, D91, D92, D93, D94, D95, D96, D97, D98, D99, D100, D101, D102, D103, D104, D105, D106, D107, D108, D109, DUO, D111, D112, D113, D114, D115, D116, D117, D118, D119, D120, D121, D122, D123, D124, D125, D126, D127, D128, D129, D130, D131, D132, D133, D134, D135, D136, D137, D138, D139, D140, D141, D142, D143, D144, D145, D146, D147, D148, D149, D150, D151, D152, D153, D154, D155, D156, D157, D158, D159, D160, D161, D162, D163, D164, D165, D166, D167, D168, D169, D170, D171, D172, D173, D174, D175, D176, D177, D178, D179, D180, D181, D182, D183, D184, D185, D186, D187, D188, D189, D190, D191, D192, D193, D194, D195, D196, D197, D198, D199, D200, D201, D202, D203, D204, D205, D206, D207, D208, D209, D210, D211, D212, D213, D214, D215, D216, D217, D218, D219, D220, D221, D222, D223, D224, D225, D226, D227, D228 и D229. Согласно примеру реализации, указанное соединение представляет собой С17. Согласно другому примеру реализации, указанное соединение представляет собой С27. Согласно другому примеру реализации, указанное соединение представляет собой С23. Согласно другому примеру реализации, указанное соединение представляет собой С24. Согласно другому примеру реализации, указанное соединение представляет собой С25. Согласно другому примеру реализации, указанное соединение представляет собой С26. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D46, D86, D99, D100, D107, D108, D114, D122, D125, D126, D127, D128, D131, D140 и D141, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D95, D96, D97, D102, D110, D111, D113, D115, D121, D129, D130, D132, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D47, D109, D116, D118, D119, D120, D123, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D98, D101, D106, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D11, D12, D37, D38, D39, D40, D41, D42, D43, D124, D142, D143, D146, и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D14, D15, D16, D17, D28, D29, D30, D31, D133, D134, D135, D144, D145, D147, и солей указанных соединений.
[0339] Согласно примеру реализации, указанное соединение представляет собой член, выбранный из 5-(4-цианофенокси)-1-гидрокси-2,1-бензоксаборола; 1,3-дигидро-1-гидрокси-5-фенокси-2, 1-бензоксаборола  ; 5-(2-цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола
; 5-(2-цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола  ; 5-[4-(N,N-диэтилкарбамоил)фенокси]-1,3-дигидро-1-гидрокси-2,1-бензоксаборола
; 5-[4-(N,N-диэтилкарбамоил)фенокси]-1,3-дигидро-1-гидрокси-2,1-бензоксаборола 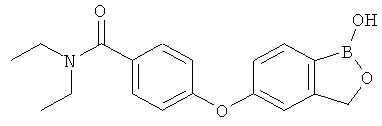 ; 1,3-дигидро-1-гидрокси-5-[4-(морфолинокарбонил)фенокси]-2,1-бензоксаборола
; 1,3-дигидро-1-гидрокси-5-[4-(морфолинокарбонил)фенокси]-2,1-бензоксаборола 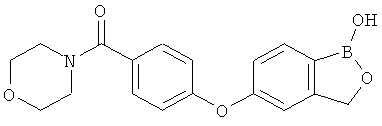 ; 5-(3,4-дицианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола
; 5-(3,4-дицианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола 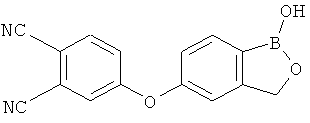 ; 1,3-дигидро-1-гидрокси-5-(3-цианофенокси)-2,1-бензоксаборола
; 1,3-дигидро-1-гидрокси-5-(3-цианофенокси)-2,1-бензоксаборола 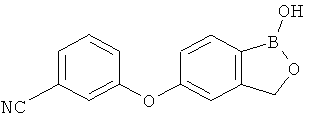 ; 5-(4-карбоксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола
; 5-(4-карбоксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола 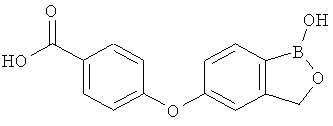 ; 5-(5-цианопиридин-2-илокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола
; 5-(5-цианопиридин-2-илокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола 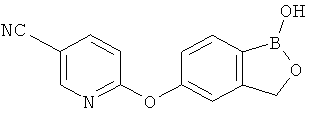 ; 5-(4-цианобензилокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола
; 5-(4-цианобензилокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола 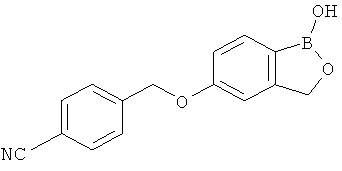 ; метилового эфира 4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты
; метилового эфира 4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты 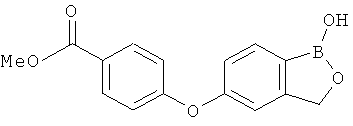 ; метилового эфира 4-(1-гидрокси-1,3-дигидро-бензо [с][1,2]оксаборол-5-илокси)-бензойной кислоты
; метилового эфира 4-(1-гидрокси-1,3-дигидро-бензо [с][1,2]оксаборол-5-илокси)-бензойной кислоты  ; этилового эфира 4-(1-гидрокси-1,3-дигидро-бензо [с][1,2]оксаборол-5-илокси)-бензойной кислоты
; этилового эфира 4-(1-гидрокси-1,3-дигидро-бензо [с][1,2]оксаборол-5-илокси)-бензойной кислоты
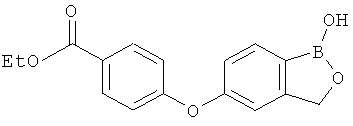 ; пропилового эфира 4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты
; пропилового эфира 4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты
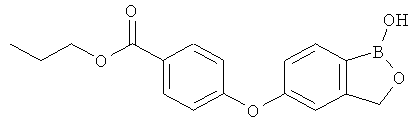 ; изопропилового эфира 4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты
; изопропилового эфира 4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты
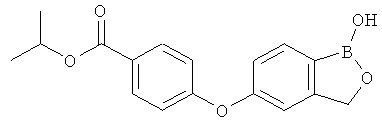 ; 2-диметиламино-этилового эфира 4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты
; 2-диметиламино-этилового эфира 4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты
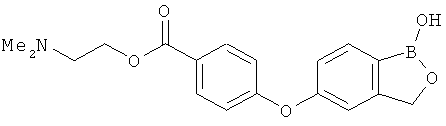 ; N-бензил-4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензамида
; N-бензил-4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензамида 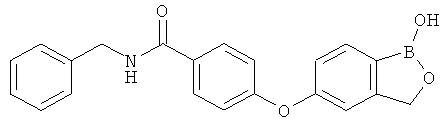 ; 4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-N-(2-гидрокси-этил)-бензамида
; 4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-N-(2-гидрокси-этил)-бензамида 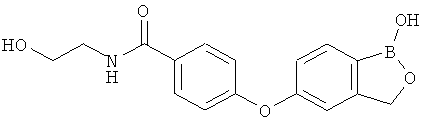 ; 4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-N-пиридин-2-илметил-бензамида
; 4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-N-пиридин-2-илметил-бензамида 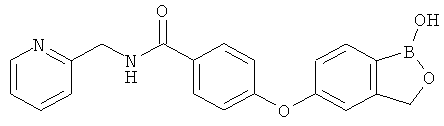 ; [4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-фенил]-(4-метил-пиперазин-1-ил)-метанона
; [4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-фенил]-(4-метил-пиперазин-1-ил)-метанона 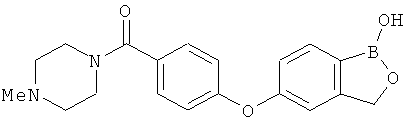 ; 1-{4-[4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензоил]-пиперазин-1-ил}-этанона
; 1-{4-[4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензоил]-пиперазин-1-ил}-этанона
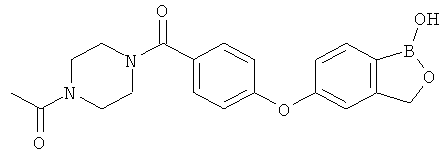 ; N-(2-диметиламино-этил)-4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензамида
; N-(2-диметиламино-этил)-4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензамида
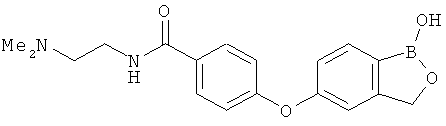 ; метилового эфира 2-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-пиримидин-5-карбоновой кислоты
; метилового эфира 2-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-пиримидин-5-карбоновой кислоты
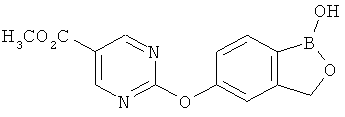 ; метилового эфира 2-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-тиазол-4-карбоновой кислоты
; метилового эфира 2-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-тиазол-4-карбоновой кислоты
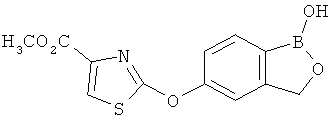 ; метилового эфира 2-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-тиазол-5-карбоновой кислоты
; метилового эфира 2-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-тиазол-5-карбоновой кислоты
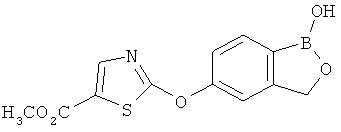 ; этилового эфира 5-(1-гидрокси-1,3-дигидро-бензо [с][1,2]оксаборол-5-илокси)-пиридин-2-карбоновой кислоты
; этилового эфира 5-(1-гидрокси-1,3-дигидро-бензо [с][1,2]оксаборол-5-илокси)-пиридин-2-карбоновой кислоты
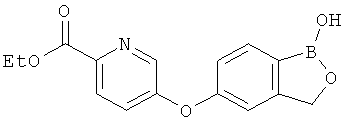 .
.
[0340] Согласно примеру реализации, указанная фосфодиэстераза представляет собой член, выбранный из ФДЭ1, ФДЭ2, ФДЭ3, ФДЭ4, ФДЭ5, ФДЭ6, ФДЭ7, ФДЭ8, ФДЭ9, ФДЭ10 и ФДЭ11. Согласно примеру реализации, указанная фосфодиэстераза представляет собой ФДЭ4. Согласно примеру реализации, ФДЭ4 представляет собой член, выбранный из ФДЭ4А, ФДЭ4 В, ФДЭ4С и ФДЭ40. Согласно примеру реализации, ФДЭ4 представляет собой ФДЭ4 В. Согласно примеру реализации, указанная фосфодиэстераза представляет собой ФДЭ7.
[0341] Согласно примеру реализации, настоящего изобретения предложен способ ингибирования фосфодиэстеразы4 (ФДЭ4), но без значительного ингибирования, по меньшей мере, одной ФДЭ, представляющей собой член, выбранный из ФДЭ1, ФДЭ2, ФДЭ3, ФДЭ5 и ФДЭ6, включающий обеспечение контакта клетки с соединением согласно настоящему изобретению, благодаря чему осуществляется указанное ингибирование. Согласно примеру реализации, указанное соединение представляет собой С27.
[0342] Согласно другому примеру реализации настоящего изобретения, предложен способ ингибирования фосфодиэстеразы4 (ФДЭ4), причем указанный способ включает: обеспечение контакта указанной фосфодиэстеразы с соединением С17, или с фармацевтически приемлемой солью указанного соединения, при котором ингибируется фосфодиэстераза4 (ФДЭ4). Согласно другому примеру реализации настоящего изобретения, предложен способ ингибирования фосфодиэстеразы7 (ФДЭ7), причем указанный способ включает: обеспечение контакта указанной фосфодиэстеразы с соединением С17, или с фармацевтически приемлемой солью указанного соединения, при котором ингибируется фосфодиэстераза7 (ФДЭ7). Согласно другому примеру реализации настоящего изобретения, предложен способ ингибирования фосфодиэстеразы4 (ФДЭ4), причем указанный способ включает: обеспечение контакта указанной фосфодиэстеразы с соединением С27, или с фармацевтически приемлемой солью указанного соединения, при котором ингибируется фосфодиэстераза4 (ФДЭ4). Согласно другому примеру реализации настоящего изобретения, предложен способ ингибирования фосфодиэстеразы7 (ФДЭ7), причем указанный способ включает: обеспечение контакта указанной фосфодиэстеразы с соединением С27, или с фармацевтически приемлемой солью указанного соединения, при котором ингибируется фосфодиэстераза7 (ФДЭ7). Согласно примеру реализации, количество указанного соединения представляет собой терапевтически эффективное количество.
[0343] Согласно другому примеру реализации настоящего изобретения, предложен способ ингибирования фосфодиэстеразы4 (ФДЭ4), причем указанный способ включает: обеспечение контакта указанной фосфодиэстеразы с соединением С23 или С24 или С25, или с фармацевтически приемлемой солью указанного соединения, при котором ингибируется фосфодиэстераза4 (ФДЭ4).
[0344] Согласно другому примеру реализации настоящего изобретения, предложен способ ингибирования фосфодиэстеразы4 (ФДЭ4), причем указанный способ включает: обеспечение контакта указанной фосфодиэстеразы с соединением D46 или D86 или D99 или D100 или D107 или D108 или D114 или D122 или D125 или D126 или D127 или D128 или D131 или D140 и D141, или с фармацевтически приемлемой солью указанного соединения, при котором ингибируется фосфодиэстераза4 (ФДЭ4).
[0345] Согласно другому примеру реализации настоящего изобретения, предложен способ ингибирования фосфодиэстеразы4 (ФДЭ4), причем указанный способ включает: обеспечение контакта указанной фосфодиэстеразы с соединением D95 или D96 или D97 или D102 или D110 или D111 или D113 или D115 или D121 или D129 или D130 или D132, или с фармацевтически приемлемой солью указанного соединения, при котором ингибируется фосфодиэстераза4 (ФДЭ4).
[0346] Согласно другому примеру реализации настоящего изобретения, предложен способ ингибирования фосфодиэстеразы4 (ФДЭ4), причем указанный способ включает: обеспечение контакта указанной фосфодиэстеразы с соединением D47 или D109 или D116 или D118 или D119 или D120 или D123, или с фармацевтически приемлемой солью указанного соединения, при котором ингибируется фосфодиэстераза 4 (ФДЭ4).
[0347] Согласно другому примеру реализации настоящего изобретения, предложен способ ингибирования фосфодиэстеразы4 (ФДЭ4), причем указанный способ включает: обеспечение контакта указанной фосфодиэстеразы с соединением D98 или D101 или D106, или с фармацевтически приемлемой солью указанного соединения, при котором ингибируется фосфодиэстераза 4 (ФДЭ4).
[0348] Согласно другому примеру реализации настоящего изобретения, предложен способ ингибирования фосфодиэстеразы4 (ФДЭ4), причем указанный способ включает: обеспечение контакта указанной фосфодиэстеразы с соединением D11 или D12 или D37 или D38 или D39 или D40 или D41 или D42 или D43 или D124 или D142 или D143 или D146, или с фармацевтически приемлемой солью указанного соединения, при котором ингибируется фосфодиэстераза4 (ФДЭ4).
[0349] Согласно другому примеру реализации настоящего изобретения, предложен способ ингибирования фосфодиэстеразы4 (ФДЭ4), причем указанный способ включает: обеспечение контакта указанной фосфодиэстеразы с соединением D14 или D15 или D16 или D17 или D28 или D29 или D30 или D31 или D133 или D134 или D135 или D144 или D145 или D147, или с фармацевтически приемлемой солью указанного соединения, при котором ингибируется фосфодиэстераза4 (ФДЭ4).
[0350] Согласно примеру реализации, в любом из способов согласно настоящему описанию, соединение согласно настоящему изобретению присутствует в таком количестве, которое будет ингибировать фосфодиэстеразу согласно настоящему описанию на, по меньшей мере, от примерно 5 до примерно 100% или по меньшей мере от примерно 30 до примерно 100%, или по меньшей мере от примерно 40 до примерно 100%, или по меньшей мере от примерно 50 до примерно 100%, или по меньшей мере от примерно 60 до примерно 100%, или по меньшей мере от примерно 70 до примерно 100%, или по меньшей мере от примерно 80 до примерно 100%, или по меньшей мере от примерно 90 до примерно 100%, или по меньшей мере от примерно 30 до примерно 7 0%, или по меньшей мере от примерно 40 до примерно 90%, или по меньшей мере от примерно 45 до примерно 80%, или по меньшей мере от примерно 55 до примерно 75%, или по меньшей мере от примерно 75 до примерно 98%, или по меньшей мере от примерно 55 до примерно 9 9%, или по меньшей мере от примерно 5% до примерно 2 0%, или по меньшей мере от примерно 10% до примерно 25%. Согласно примеру реализации, соединение согласно настоящему изобретению представляет собой соединение, описанное в настоящей заявке, или фармацевтически приемлемую соль указанного соединения.
е) Состояния и действие
[0351] Согласно другому аспекту настоящего изобретения, предложен способ лечения и/или предотвращения состояния, и/или усиления действия, у животного, причем указанный способ включает введение указанному животному эффективного количества соединения согласно настоящему изобретению, благодаря чему осуществляется лечение и/или предотвращение состояния. Согласно примеру реализации, соединение согласно настоящему изобретению представляет собой соединение, описанное в настоящей заявке. Согласно примеру реализации, соединение согласно настоящему изобретению представляет собой фармацевтически приемлемую соль соединения, описанного в настоящей заявке. Согласно примеру реализации, эффективное количество представляет собой количество, эффективное для лечения состояния. Согласно примеру реализации, эффективное количество представляет собой количество, эффективное для предотвращения состояния. Согласно примеру реализации, указанное животное не иное как нуждающееся в лечении при помощи соединения согласно настоящему изобретению. Согласно примеру реализации, указанное соединение соответствует формуле согласно настоящему описанию. Согласно другому аспекту настоящего изобретения, предложен способ лечения состояния у животного, нуждающегося в указанном лечении, причем указанный способ включает введение указанному животному некоторого количества соединения согласно настоящему изобретению, благодаря чему осуществляется лечение состояния. Согласно другому аспекту настоящего изобретения, предложен способ лечения состояния у животного, нуждающегося в указанном лечении, причем указанный способ включает введение указанному животному терапевтически эффективного количества соединения согласно настоящему изобретению, благодаря чему осуществляется лечение состояния. Согласно другому аспекту настоящего изобретения, предложен способ предотвращения состояния у животного, причем указанный способ включает введение указанному животному некоторого количества соединения согласно настоящему изобретению, благодаря чему осуществляется предотвращение состояния. Согласно другому аспекту настоящего изобретения, предложен способ улучшения действия, у животного, причем указанный способ включает введение указанному животному эффективного количества соединения согласно настоящему изобретению, благодаря чему осуществляется улучшение действия. Согласно примеру реализации, указанное соединение соответствует формуле, описанной в разделе, озаглавленном «ингибирование фосфодиэстеразы». Согласно примеру реализации, указанное соединение представляет собой член, выбранный из C1, С2, С3, С4, С5, С6, С7, С8, С9, С10, С11, С12, С13, С14, С15, С16, С17, С18, С19, С20, С21, С22, С23, С24, С25, С26, С27, С28, С29, С30, С31, С32, С33, С34, С35, С36, С37, С38, С39, С40, С41, С42, С43, С44, С45, С46, С47, С48, С49, С50, С51, С52, С53, С54, С55, С56, С57, С58, С59, С60, С61, С62, С63, С64, С65, С66, С67, С68, С69, С70, С71, С72, С73, С74, С75, С76, С77, С78, С79, С80, С81, С82, С83, С84, С85, С86, С87, С88, С89, С90, С91, С92, С93, С94, С95, С96, С97, С98, С99 и СЮО. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D1, D2, D3, D4, D5, D6, D7, D8, D9, D10, D11, D12, D13, D14, D15, D16, D17, D18, D19, D20, D21, D22, D23, D24, D25, D26, D27, D28, D29, D30, D31, D32, D33, D34, D35, D36, D37, D38, D39, D40, D41, D42, D43, D44, D45, D46, D47, D48, D49, D50, D51, D52, D53, D54, D55, D56, D57, D58, D59, D60, D61, D62, D63, D64, D65, D66, D67, D68, D69, D70, D71, D72, D73, D74, D75, D76, D77, D78, D79, D80, D81, D82, D83, D84, D85, D86, D87, D88, D89, D90, D91, D92, D93, D94, D95, D96, D97, D98, D99, D100, D101, D102, D103, D104, D105, D106, D107, D108, D109, D110, D111, D112, D113, D114, D115, D116, D117, D118, D119, D120, D121, D122, D123, D124, D125, D126, D127, D128, D129, D130, D131, D132, D133, D134, D135, D136, D137, D138, D139, D140, D141, D142, D143, D144, D145, D146, D147, D148, D149, D150, D151, D152, D153, D154, D155, D156, D157, D158, D159, D160, D161, D162, D163, D164, D165, D166, D167, D168, D169, D170, D171, D172, D173, D174, D175, D176, D177, D178, D179, D180, D181, D182, D183, D184, D185, D186, D187, D188, D189, D190, D191, D192, D193, D194, D195, D196, D197, D198, D199, D200, D201, D202, D203, D204, D205, D206, D207, D208, D209, D210, D211, D212, D213, D214, D215, D216, D217, D218, D219, D220, D221, D222, D223, D224, D225, D226, D227, D228 и D229. Согласно примеру реализации, указанное соединение представляет собой С17 или фармацевтически приемлемую соль указанного соединения. Согласно примеру реализации, указанное соединение представляет собой С27 или фармацевтически приемлемую соль указанного соединения. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D46, D86, D99, D100, D107, D108, D114, D122, D125, D126, D127, D128, D131, D140 и D141 и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D95, D96, D97, D102, D110, D111, D113, D115, D121, D129, D130, D132 и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D47, D109, D116, D118, D119, D120, D123 и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D98, D101, D106 и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D11, D12, D37, D38, D39, D40, D41, D42, D43, D124, D142, D143, D146 и солей указанных соединений. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D14, D15, D16, D17, D28, D29, D30, D31, D133, D134, D135, D144, D145, D147 и солей указанных соединений.
[0352] Согласно примеру реализации, указанное состояние представляет собой заболевание. Согласно примеру реализации, указанное состояние представляет собой состояние, связанное с воспалением. Согласно примеру реализации, указанное состояние включает увеличение выработки цитокина и/или хемокина. Согласно примеру реализации, указанное состояние включает уменьшение выработки цитокина и/или хемокина. Согласно примеру реализации, указанное состояние включает увеличение высвобождения цитокина и/или хемокина. Согласно примеру реализации, указанное состояние включает уменьшение высвобождения цитокина и/или хемокина. Согласно примеру реализации, указанное состояние включает ингибирование фосфодиэстеразы. Согласно примеру реализации, указанное соединение находится в количестве, достаточном для лечения заболевания, связанного с воспалением, путем ингибирования экспрессии провоспалительного цитокина или путем стимуляции экспрессии противовоспалительного цитокина, но указанное количество недостаточно для существенного ингибирования циклин-зависимых киназ. Согласно примеру реализации, указанное состояние опосредуется цитокином. Согласно примеру реализации, указанное состояние опосредуется хемокином. Согласно примеру реализации, указанное состояние опосредуется нейтрофилом. Согласно примеру реализации, указанное состояние опосредуется фосфодиэстеразой. Согласно примеру реализации, указанное состояние опосредуется фосфодиэстеразой-4. Согласно примеру реализации, указанное состояние опосредуется фосфодиэстеразой-7.
[0353] Согласно примеру реализации, указанное состояние представляет собой член, выбранный из периодонтита, сухого кератоконъюнктивита, ревматоидного артрита, остеоартрита, болезни Крона, язвенного колита, псориатического артрита, травматического артрита, краснушного артрита, воспалительного заболевания кишечника, рассеянного склероза, псориаза, реакции трансплантат-против-хозяина, системной красной волчанки, кожной красной волчанки, синдрома токсического шока, синдрома раздраженного кишечника, мышечной дегенерации, отторжения аллотрансплантата, панкреатита, инсулинита, гломерулонефрита, диабетической нефропатии, почечного фиброза, хронической почечной недостаточности, подагры, проказы, острого синовита, синдрома Рейтера, подагрического артрита, болезни Бехчета, спондилита, эндометриоза, несуставных воспалительных состояний, таких как состояния синдрома межпозвоночного диска, бурсита, тендинита, теносиновита или фибромиалгический синдром; и острой или хронической боли, включая, без ограничения, неврологическую боль, нейропатии, полинейропатии, диабетические полинейропатии, травму, мигрень, тензионную и кластерную головную боль, синдром Хортона, варикозные язвы, невралгии, мышечноскелетную боль, остеотравматическую боль, переломы, альгодистрофию, спондилоартрит, фибромиалгию, фантомные боли, боль в спине, боль в позвоночнике, боль после хирургического вмешательства, ишиалгию, вызванную грыжей межпозвоночного диска, боль, связанную с раком, сосудистую боль, боль в животе, роды, или боль, связанную с ВИЧ. Другими цитокин-опосредуемыми заболеваниями являются аллергия; метаболическое заболевание; осложнения, связанные с химиотерапией/радиацией; диабет типа I; диабет типа II; заболевание печени; желудочно-кишечное заболевание; офтальмологическое заболевание; аллергический конъюнктивит; диабетическая ретинопатия; синдром Шегрена; увеит; легочное нарушение; заболевание почек; дерматит; ВИЧ-ассоциированная кахексия; церебральная малярия; анкилозирующий спондилит; проказа; анемия; фибромиалгия; почечная недостаточность; инсульт; хроническая сердечная недостаточность; эндотоксикоз, реперфузионное повреждение, ишемия/реперфузия, ишемия миокарда, рестеноз, тромбоз, ангиогенез, коронарная болезнь сердца, болезнь коронарных артерий, острый коронарный синдром, артериит Такаясу, порок сердца, такой как сердечная недостаточность, стеноз устья аорты, кардиомиопатия, миокардит, васкулит, сосудистый рестеноз, клапанный порок или аорто-коронарный шунт; гиперхолестеринемия; заболевания или состояния, связанные со свертыванием крови или фибринолизом, такие как, например, острый венозный тромбоз, легочная эмболия, тромбоз во время беременности, геморрагический некроз кожа, острое или хроническое диссеминированное внутрисосудистое свертывание (ДВС), образование тромба из-за хирургического вмешательства, длительный постельный режим или длительный период неподвижности, венозный тромбоз, молниеносная менингококкемия, острые тромботические инсульты, острая коронарная окклюзия, острая окклюзия периферической артерии, массивная легочная эмболия, тромбоз подмышечной вены, массивный тромбоз подвздошно-бедренной вены, закупорка артериальной или венозной канюли, кардиомиопатия, веноокклюзионная болезнь печени, гипотония, сниженный сердечный выброс, сниженное сосудистое сопротивление, легочная гипертония, уменьшенная растяжимость легких, лейкопения или тромбоцитопения; или атеросклероз.
[0354] Согласно примеру реализации, указанное состояние представляет собой член, выбранный из аллергического конъюнктивита, увеита, глаукомы, неврита зрительного нерва, ретинальной ишемии, диабетической ретинопатии, вызванного лазером повреждения глаз, или хирургической или травматической пролиферативной витреоретинопатии.
[0355] Согласно примеру реализации, указанное состояние представляет собой член, выбранный из аллергического ринита, астмы, респираторного дистресс-синдрома у взрослых, хронического воспаления легких, хронической обструктивной болезни легких, эмфиземы, бронхита, гиперсекреции слизи, силикоза, инфекции ТОРС и воспаления дыхательных путей.
[0356] Согласно примеру реализации, указанное состояние представляет собой член, выбранный из псориаза, экземы, атопического дерматита, контактного дерматита, воспалительной алопеции или акне.
[0357] Согласно примеру реализации, указанное состояние представляет собой член, выбранный из синдрома Гийена-Барре, болезни Паркинсона, болезни Хантингтона, болезни Альцгеймера, бокового амиотрофического склероза, рассеянного склероза и других демиелинизирующих заболеваний, вирусных и бактериальных менингитов, травмы ЦНС, повреждения спинного мозга, судорог, конвульсий, оливомостомозжечковой атрофии, СПИД-дементного комплекса, синдромов MERRF и MELAS, болезни Лебера, энцефалопатии Вернике, синдрома Ретта, гомоцистеинурии, гиперпролинемии, гипергомоцистеинемии, некетотической гиперглицинемии, гидроксимасляной аминоацидурии, недостаточности сульфитоксидазы, комбинированного системного заболевания, свинцовой энцефалопатии, синдрома Туретта, печеночной энцефалопатии, привыкания к лекарственному препарату, устойчивости к лекарственному препарату, зависимости от лекарственного препарата, депрессии, синдрома дефицита внимания (СДВ), тревожности и шизофрении, аневризмы или эпилепсии.
[0358] Согласно примеру реализации, указанное состояние представляет собой член, выбранный из заболеваний, сопровождающихся резорбцией кости, остеопетроза, остеопороза или остеоартрита.
[0359] Согласно примеру реализации, указанное состояние представляет собой член, выбранный из диабета, общего истощения, истощения на фоне инфекции или злокачественной опухоли, истощения на фоне синдрома приобретенного иммунодефицита (СПИД), ожирения, анорексии или нервной булимии. Согласно примеру реализации, указанное состояние представляет собой член, выбранный из сепсиса, ВИЧ, вируса гепатита С, малярии, инфекционного артрита, лейшманиоза, болезни Лайма, рака, включая, без ограничения, рак груди, рак толстой кишки, рак легкого, рак простаты, множественную миелому, острую миелогенную лейкемию, миелодиспластический синдром, неходжкинскую лимфому или фолликулярную лимфому, болезнь Кастлемена или лекарственную устойчивость.
[0360] Согласно примеру реализации, указанное состояние представляет собой член, выбранный из бронхиальной астмы, ринита, гриппа, инсульта, инфаркта миокарда, термического повреждения, респираторного дистресс-синдрома взрослых (РДСВ), множественного повреждения органов на фоне травмы, острого гломерулонефрита, дерматоза с острыми воспалительными компонентами, острого гнойного менингита, гемодиализа, лейкоцитофереза, синдромов связанных с трансфузией гранулоцитов, или некротизирующего энтероколита.
[0361] Согласно примеру реализации, указанное состояние представляет собой член, выбранный из воспалительного заболевания кишечника (ВЗК), псориаза, ревматоидного артрита (РА), рассеянного склероза (МС), нейродегенеративного нарушения, сердечнососудистого заболевания (ССЗ) и атеросклероза, и метаболического заболевания (метаболический синдром и диабет), а также воспаления, связанного с инфекцией. Согласно примеру реализации, указанное состояние представляет собой нейродегенеративное расстройство, представляющее собой член, выбранный из болезни Альцгеймера и болезни Паркинсона. Согласно примеру реализации, указанное состояние представляет собой воспалительное заболевание кишечника, выбранное из группы, состоящей из: болезни Крона или язвенного колита. Согласно примеру реализации, указанное состояние представляет желудочно-кишечное осложнение. Согласно примеру реализации, указанное состояние представляет собой диарею. Согласно примеру реализации, указанное состояние представляет собой член, выбранный из целиакии и неспецифического колита. Согласно примеру реализации, указанное состояние представляет собой заболевание печени. Согласно примеру реализации, указанное состояние представляет собой член, выбранный из аутоиммунного гепатита, гепатита С, первичного билиарного цирроза, первичного склерозирующего холангита или молниеносной печеночной недостаточности. Согласно примеру реализации, указанное состояние представляет собой заболевание костей. Согласно примеру, реализации, указанное состояние представляет собой остеопороз. Согласно примеру реализации, указанное состояние представляет собой заболевание легких. Согласно примеру реализации, указанное состояние представляет собой член, выбранный из: аллергического ринита, астмы, хронической обструктивной болезни легких, хронического гранулематозного воспаления, кистозного фиброза и саркоидоза. Согласно примеру реализации, указанное состояние представляет собой сердечно-сосудистое заболевание. Согласно примеру реализации, указанное сердечно-сосудистое заболевание представляет собой член, выбранный из атеросклеротической болезни сердца, застойной сердечной недостаточности и рестеноза. Согласно примеру реализации, указанное состояние представляет собой заболевание почек. Согласно примеру реализации, указанное состояние представляет собой член, выбранный из гломерулонефрита и васкулита. Согласно примеру реализации, указанное состояние представляет собой член, выбранный из заболевания, связанного с последствиями радиотерапии, или атеросклероза. Согласно еще одному примеру реализации, указанное состояние представляет собой атопический дерматит. Согласно еще одному примеру реализации, указанное состояние представляет собой старческий кератоз.
[0362] Согласно примеру реализации, указанное состояние представляет собой член, выбранный из псориаза, воспалительного артрита, ревматоидного артрита, астмы, хронического бронхита, воспалительного заболевания кишечника (ВЗК), хронической обструктивной болезни легких (ХОБЛ), атопического дерматита, крапивницы, аллергического ринита, аллергического конъюнктивита, весеннего конъюнктивита, колита, эозинофильной гранулемы, септического шока, реперфузионного повреждения миокарда, реперфузионного повреждения головного мозга, хронического гломерулонефрита, эндотоксического шока, респираторного дистресс-синдрома взрослых, кистозного фиброза, артериального рестеноза, атеросклероза, кератоза, ревматоидного спондилита, остеоартрита, лихорадки, сахарного диабета, пневмокониоза, хронической обструктивной болезни дыхательных путей, токсической контактной экземы, аллергической контактной экземы, атопической экземы, себорейной экземы, простого лишая, солнечного ожога, зуда в аногенитальной области, очаговой алопеции, гипертрофированных шрамов, дискоидной красной волчанки, системной красной волчанки, фолликулярных пиодермии, обширных пиодермии, эндогенного акне, экзогенного акне, розацеа, болезни Бехчета, нефрита при анафилактоидной пурпуре, лейкемии, рассеянного склероза, желудочно-кишечного заболевания и аутоиммунного заболевания. Согласно примеру реализации, колит представляет собой член, выбранный из язвенного колита, болезни Крона, воспаления в отключенной кишке, ишемического колита, инфекционного колита, молниеносного колита, химического колита, микроскопического колита, лимфоцитарного колита и атипического колита. Согласно примеру реализации, колит представляет собой член, выбранный из язвенного колита и болезни Крона. Согласно примеру реализации, указанное состояние представляет собой солнечный ожог. Согласно примеру реализации, указанное состояние представляет собой воспаление, вызванное солнечным ожогом.
[0363] Согласно примеру реализации, указанное состояние представляет собой псориаз. Согласно примеру реализации, псориаз представляет собой член, выбранный из бляшечного псориаза, псориаза сгибательных поверхностей (обратного псориаза), каплевидного псориаза, пустулезного псориаза, ногтевого псориаза, псориатического артрита и эритродермического псориаза. Согласно примеру реализации, псориаз представляет собой член, выбранный из бляшечного псориаза и ногтевого псориаза. Согласно примеру реализации, указанное состояние представляет собой псориаз, а указанное соединение представляет собой С17. Согласно примеру реализации, указанное состояние представляет собой псориаз, а указанное соединение представляет собой С27. Согласно примеру реализации, указанное состояние представляет собой бляшечный псориаз или ногтевой псориаз, а указанное соединение представляет собой С17. Согласно примеру реализации, указанное состояние представляет собой бляшечный псориаз или ногтевой псориаз, а указанное соединение представляет собой С27.
[0364] Согласно примеру реализации, указанное нарушение представляет собой член, выбранный из когнитивного нарушения или ухудшения, и нарушения памяти. Согласно примеру реализации, указанное нарушение памяти вызвано деменцией. Согласно примеру реализации, пациент страдает нарушением памяти, вызванным болезнью Альцгеймера, шизофренией, болезнью Паркинсона, болезнью Хантингтона, болезнью Пика, болезнью Крейтцфельдта-Якоба, депрессией, старением, травмой головы, инсультом, гипоксией ЦНС, старением мозга, мультиинфарктной деменцией, острым нейрональным заболеванием, возрастным когнитивным ухудшением, ВИЧ или сердечнососудистым заболеванием.
[0365] Согласно примеру реализации, ингибирование ФДЭ4 усиливает эффект, причем усиливаемый эффект представляет собой познавательные способности или память.
[0366] Согласно примеру реализации настоящего изобретения, предложен способ стимуляции роста фолликула яичника у самки, включающий введение указанной самке лекарственного средства, содержащего соединение согласно настоящему изобретению, благодаря чему стимулируется рост фолликула яичника у самки. Согласно примеру реализации, соединение согласно настоящему изобретению представляет собой соединение, описанное в настоящей заявке, или фармацевтически приемлемую соль указанного соединения. Согласно примеру реализации/ у указанной самки вызывают овуляцию. Согласно примеру реализации, у указанной самки проводят контролируемую гиперстимуляцию яичников. Согласно примеру реализации, указанное лекарственное средство вводят одновременно, раздельно или последовательно, с фолликулостимулирующим гормоном (ФСГ) или с агентом, обладающим активностью ФСГ, или с агентом, стимулирующим высвобождение эндогенного ФСГ.
[0367] Согласно настоящему изобретению, также предложен способ лечения воспалительного заболевания, связанного с уровнями экспрессии цитокина, причем указанный способ включает введение животному, нуждающемуся в указанном лечении, соединения согласно настоящему изобретению. Согласно примеру реализации, указанное соединение соответствует формуле согласно настоящему описанию. Согласно примеру реализации, соединение согласно настоящему изобретению представляет собой соединение согласно настоящему описанию или фармацевтически приемлемую соль указанного соединения.
[0368] Согласно примеру реализации настоящего изобретения, предложен способ лечения или предотвращения связанного с воспалением заболевания у животного, причем указанный способ включает введение указанному животному терапевтически эффективного количества соединения согласно настоящему изобретению, причем указанное соединение находится в количестве, достаточном для лечения связанного с воспалением заболевания путем ингибирования экспрессии воспалительного цитокина или путем стимуляции экспрессии противовоспалительного цитокина, но указанное количество недостаточно для существенного ингибирования циклинзависимых киназ. Согласно примеру реализации, соединение согласно настоящему изобретению представляет собой соединение, описанное в настоящей заявке, или фармацевтически приемлемую соль указанного соединения.
[0369] Согласно примеру реализации настоящего изобретения, предложен способ ингибирования выработки воспалительного цитокина клетками, способными к производству воспалительного цитокина, причем указанный способ включает обеспечение контакта указанной клетки с терапевтическим количеством соединения согласно настоящему изобретению, при котором ингибируется выработка воспалительного цитокина клетками. Согласно примеру реализации, терапевтическое количество достаточно для ингибирования выработки белка воспалительного цитокина на примерно от 50% до примерно 99%.
[0370] Согласно примеру реализации настоящего изобретения, предложен способ ингибирования воспалительной реакции у животного, причем указанный способ включает: обеспечение контакта указанного животного с терапевтическим количеством соединения согласно настоящему изобретению, при этом ингибируется воспалительная реакция.
[0371] Согласно примеру реализации, для любого из способов согласно настоящему описанию, указанное животное представляет собой член, выбранный из человека, крупного рогатого скота, оленя, северного оленя, козы, медоносной пчелы, свиньи, овцы, лошади, коровы, быка, собаки, морской свинки, песчанки, кролика, кошки, верблюда, яка, слона, страуса, выдры, курицы, утки, гуся, цесарки, голубя, лебедя и индейки. Согласно другому примеру реализации, для любого из способов согласно настоящему описанию, указанное животное выбрано из человека, крупного рогатого скота, козы, свиньи, овцы, лошади, коровы, быка, собаки, морской свинки, песчанки, кролика, кошки, курицы и индейки. Согласно другому примеру реализации, для любого из способов согласно настоящему описанию, указанное животное представляет собой человека.
[0372] Согласно примеру реализации, для любого из способов согласно настоящему описанию можно применять соединение согласно настоящему изобретению и/или фармацевтический состав согласно настоящему описанию.
[0373] Согласно другому примеру реализации, для любого из способов лечения/предотвращения состояния или усиления эффекта согласно настоящему описанию, животное, которому вводят соединение согласно настоящему изобретению, не иное как нуждающееся в лечении при помощи соединения согласно настоящему изобретению. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из C1, С2, С3, С4, С5, С6, С7, С8, С9, С10, С11, С12, С13, С14, С15, С16, С17, С18, С19, С20, С21, С22, С23, С24, С25, С26, С27, С28, С29, С30, С31, С32, С33, С34, С35, С36, С37, С38, С39, С40, С41, С42, С43, С44, С45, С46, С47, С48, С49, С50, С51, С52, С53, С54, С55, С56, С57, С58, С59, С60, С61, С62, С63, С64, С65, С66, С67, С68, С69, С70, С71, С72, С73, С74, С75, С76, С77, С78, С79, С80, С81, С82, С83, С84, С85, С86, С87, С88, С89, С90, С91, С92, С93, С94, С95, С96, С97, С98, С99 и С100. Согласно примеру реализации, указанное соединение представляет собой С17. Согласно примеру реализации, указанное соединение представляет собой С27. Согласно примеру реализации, указанное соединение представляет собой D1. Согласно примеру реализации, указанное соединение представляет собой D82. Согласно примеру реализации, указанное соединение представляет собой D226. Согласно примеру реализации, указанное соединение представляет собой D227.
[0374] Согласно другому примеру реализации, указанный способ относится к лечению псориаза путем введения соединения согласно настоящему изобретению животному, иначе не нуждающемуся в лечении при помощи соединений согласно настоящему изобретению.
[0375] Согласно другому примеру реализации, указанный способ относится к лечению атопического дерматита путем введения соединения согласно настоящему изобретению животному, иначе не нуждающемуся в лечении при помощи соединений согласно настоящему изобретению.
V. Фармацевтические составы
[0376] Согласно другому аспекту настоящего изобретения, предложен фармацевтический состав, содержащий: (а) соединение согласно настоящему изобретению и (б) фармацевтически приемлемый наполнитель. Согласно примеру реализации, соединение согласно настоящему изобретению представляет собой соединение согласно настоящему описанию или фармацевтически приемлемую соль указанного соединения. Согласно примеру реализации, указанное соединение соответствует формуле согласно настоящему описанию. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из C1, С2, С3, С4, С5, С6, С7, С8, С9, С10, С11, С12, С13, С14, С15, С16, С17, С18, С19, С20, С21, С22, С23, С24, С25, С26, С27, С28, С29, С30, С31, С32, С33, С34, С35, С36, С37, С38, С39, С40, С41, С42, С43, С44, С45, С46, С47, С48, С49, С50, С51, С52, С53, С54, С55, С56, С57, С58, С59, С60, С61, С62, С63, С64, С65, С66, С67, С68, С69, С70, С71, С72, С73, С74, С75, С76, С77, С78, С79, С80, С81, С82, С83, С84, С85, С86, С87, С88, С89, С90, С91, С92, С93, С94, С95, С96, С97, С98, С99 и С100. Согласно примеру реализации, указанное соединение представляет собой член, выбранный из D1, D2, D3, D4, D5, D6, D7, D8, D9, D10, D11, D12, D13, D14, D15, D16, D17, D18, D19, D20, D21, D22, D23, D24, D25, D26, D27, D28, D29, D30, D31, D32, D33, D34, D35, D36, D37, D38, D39, D40, D41, D42, D43, D44, D45, D46, D47, D48, D49, D50, D51, D52, D53, D54, D55, D56, D57, D58, D59, D60, D61, D62, D63, D64, D65, D66, D67, D68, D69, D70, D71, D72, D73, D74, D75, D76, D77, D78, D79, D80, D81, D82, D83, D84, D85, D86, D87, D88, D89, D90, D91, D92, D93, D94, D95, D96, D97, D98, D99, D100, D101, D102, D103, D104, D105, D106, D107, D108, D109, D110, D111, D112, D113, D114, D115, D116, D117, D118, D119, D120, D121, D122, D123, D124, D125, D126, D127, D128, D129, D130, D131, D132, D133, D134, D135, D136, D137, D138, D139, D140, D141, D142, D143, D144, D145, D146, D147, D148, D149, D150, D151, D152, D153, D154, D155, D156, D157, D158, D159, D160, D161, D162, D163, D164, D165, D166, D167, D168, D169, D170, D171, D172, D173, D174, D175, D176, D177, D178, D179, D180, D181, D182, D183, D184, D185, D186, D187, D188, D189, D190, D191, D192, D193, D194, D195, D196, D197, D198, D199, D200, D201, D202, D203, D204, D205, D206, D207, D208, D209, D210, D211, D212, D213, D214, D215, D216, D217, D218, D219, D220, D221, D222, D223, D224, D225, D226, D227, D228 и D229. Согласно примеру реализации, указанное соединение представляет собой С17. Согласно примеру реализации, указанное соединение представляет собой С27. Согласно примеру реализации, указанный состав представляет собой единичную дозированную форму. Согласно примеру реализации, указанный состав представляет собой член, выбранный из пероральной единичной дозированной формы и единичной дозированной формы для местного применения. Согласно примеру реализации, единичная дозированная форма для местного применения представляет собой член, выбранный из лосьона, мази и крема. Согласно примеру реализации, указанный состав предназначен для местного применения.
[0377] Согласно примеру реализации, соединение согласно настоящему изобретению присутствует в фармацевтическом составе в количестве в диапазоне от примерно 0, 0001% до примерно 60% (масс.). Согласно примеру реализации, указанное количество находится в диапазоне от примерно 0,05% до примерно 0,2% (масс.). Согласно примеру реализации, указанное количество находится в диапазоне от примерно 0, 075% до примерно 0,15% (масс). Согласно примеру реализации, указанное количество находится в диапазоне от примерно 0,01% до примерно 10% (масс). Согласно примеру реализации, указанное количество находится в диапазоне от примерно 0,1% до примерно 10% (масс). Согласно примеру реализации, указанное количество находится в диапазоне от примерно 0,25% до примерно 6% (масс.). Согласно примеру реализации, указанное количество находится в диапазоне от примерно 0,5% до 5% (масс.). Согласно примеру реализации, указанное количество находится в диапазоне от примерно 0,1% до 1,0% (масс.). Согласно примеру реализации, указанное количество находится в диапазоне от примерно от 0,25% до 0,75% (масс). Согласно примеру реализации, указанное количество находится в диапазоне от примерно 0,4% до примерно 0,6% (масс.). Согласно примеру реализации, указанное количество находится в диапазоне от примерно 1,0% до примерно 2,0% (масс.). Согласно примеру реализации, указанное количество находится в диапазоне от примерно 1,3% до примерно 1,7% (масс.). Согласно примеру реализации, указанное количество находится в диапазоне от примерно 2,0% до примерно 3,0% (масс.). Согласно примеру реализации, указанное количество находится в диапазоне от примерно 3,0% до примерно 4,0% (масс.). Согласно примеру реализации, указанное количество находится в диапазоне от примерно 4,0% до примерно 5,0% (масс.). Согласно примеру реализации, указанное количество находится в диапазоне от примерно 4,5% до примерно 5,5% (масс.). Согласно примеру реализации, указанное количество находится в диапазоне от примерно 10% до примерно 20% (масс.). Согласно примеру реализации, указанное количество находится в диапазоне от примерно 13% до примерно 17% (масс.). Согласно примеру реализации, указанное количество находится в диапазоне от примерно 14% до примерно 16% (масс.). Согласно примеру реализации, указанное количество представляет собой член, выбранный из примерно 0,1%, 0,3%, 0,5%, 1,0%, 1,5%, 2,0%, 5,0%, 10% и 15% (масс.).
[0378] Фармацевтические составы согласно настоящему изобретению могут принимать множество форм, приспособленных к выбранному пути введения. Специалист в данной области распознает различные методики синтеза, которые можно применить для приготовления нетоксичных фармацевтических составов, включающих соединения согласно настоящему описанию. Специалист в данной области распознает широкий диапазон нетоксичных фармацевтически приемлемых растворителей, которые можно применить для приготовления сольватов соединений согласно настоящему изобретению, таких как вода, этанол, пропиленгликоль, минеральное масло, растительное масло и диметилсульфоксид (ДМСО).
[0379] Фармацевтические составы согласно настоящему изобретению можно вводить перорально, местно, окулярно (в глаз), парентерально, при помощи ингаляции или спрея, или ректально, в виде единичных дозированных составов, содержащих общеупотребительные нетоксичные фармацевтически приемлемые носители, адъюванты и среды. Кроме того, следует понимать, что наилучший способ введения может представлять собой комбинацию способов. Особенно предпочтительно пероральное введение в форме пилюли, капсулы, эликсира, сиропа, леденца, пастилки, или тому подобного. Термин парентеральный в настоящем описании включает подкожные инъекции, внутрикожную, внутрисосудистую (например, внутривенную), внутримышечную, спинальную, интратекальную инъекцию, или подобные инъекционные или инфузионные методики.
[0380] Фармацевтические составы, содержащие соединения согласно настоящему изобретению предпочтительно находятся в форме, подходящей для перорального применения, например, такой как таблетки, пастилки, леденцы, водные или масляные суспензии, диспергируемые порошки или гранулы, эмульсии, твердые или мягкие капсулы, или сиропы или эликсиры.
[0381] Фармацевтические составы, предназначенные для перорального применения, можно приготовить любым способом, известным в области производства фармацевтических составов, и указанные композиции могут содержать один или несколько агентов, выбранных из группы, включающей подсластители, ароматизаторы, красители и консерванты, с целью получения фармацевтически превосходных и вкусных препаратов. Таблетки могут содержать активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми наполнителями, которые подходят для производства таблеток. Указанные наполнители могут представлять собой, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и диспергирующие агенты, например, кукурузный крахмал или альгиновую кислоту; связующие агенты, например, крахмал, желатин или гуммиарабик; смазывающие агенты, например, стеарат магния, стеариновую кислоту или тальк; и наполнители и агенты, увеличивающие объем, такие как микрокристаллическая целлюлоза. Таблетки могут быть без покрытия или с покрытием, нанесенным по любым известным методикам для задержки распада и всасывания в желудочно-кишечном тракте, и обеспечения, таким образом, замедленного действия в течение более длительного периода. Например, можно применять обеспечивающий замедление материал, такой как глицерилмоностеарат или глицерилдистеарат.
[0382] Составы для перорального применения могут также быть представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водной или масляной средой, например, арахисовым маслом, жидким парафином или оливковым маслом.
[0383] Водные суспензии содержат активные вещества в смеси с наполнителями, подходящими для производства водных суспензий. Указанные наполнители представляют собой суспендирующие агенты, например, карбоксиметилцеллюлозу натрия, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую камедь и гуммиарабик; и диспергирующие или смачивающие агенты, которые могут представлять собой природные фосфатиды, например, лецитин, или продукты конденсации алкиленоксида и жирных кислот, например, полиоксиэтиленстеарат, или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например, гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и гекситов, такими как полиоксиэтилен сорбит моноолеат, или продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и ангидридов гекситов, например, полиоксиэтилена сорбитанмоноолеат. Водные суспензии также могут содержать один или несколько консервантов, например, этил- или н-пропил-п-гидроксибензоат, один или более красителей, одну или несколько вкусоароматических добавок, и один или более подсластителей, таких как сахароза или сахарин.
[0384] Масляные суспензии можно приготовить путем суспендирования активных ингредиентов в растительном масле, например, арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загустители, такие как, например, пчелиный воск, твердый парафин или цетиловый спирт. Для получения вкусных пероральных препаратов можно добавить подсластители, такие как перечисленные выше, и вкусоароматические добавки. Указанные составы можно законсервировать путем добавления антиокислителя, такого как аскорбиновая кислота.
[0385] Диспергируемые порошки и гранулы, подходящие для приготовления водной суспензии путем добавления воды, содержат активный ингредиент в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и одним или более консервантами. Примеры подходящих диспергирующих или смачивающих агентов и суспендирующих агентов уже приведены выше. Другие диспергирующие агенты включают гидрофильные полимеры, электролиты, Твин® 60 или 80, ПЭГ, поливинилпирролидон (ПВП, известный в продаже как Plasdone®), и диспергирующие агенты на углеводной основе, такие как, например, гидроксипропилцеллюлоза и простые эфиры гидроксипропилцеллюлозы (например, НРС, HPC-SL и HPC-L), гидроксипропилметилцеллюлоза и простые эфиры гидроксипропилметилцеллюлозы (например, НРМС К100, НРМС К4М, НРМС К15М, и НРМС К100М), карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксиэтилцеллюлоза, фталат гидроксипропилметилцеллюлозы, ацетат-стеарат гидроксипропилметилцеллюлозы, некристаллическая целлюлоза, алюмосиликат магния, триэтаноламин, поливиниловый спирт (ПВС), сополимер поливинилпирролидона/винилацетата (Plasdone®, например, S-630), полимер 4-(1,1,3,3-тетраметилбутил)-фенола с этиленоксидом и формальдегидом (также известный как тилоксапол), полоксамеры (например, Pluronics F68®, F88®, и F108®, которые представляют собой блок-сополимеры этиленоксида и пропиленоксида); и полоксамины (например, Tetronic 9080, также известный как Полоксамин 9080, который представляет собой четырехфункциональный блок-сополимер, полученный последовательным добавлением пропиленоксида и этиленоксида к этилендиамину (BASF Corporation, Parsippany, N.J.)) - Также могут присутствовать дополнительные наполнители, например, подсластители, вкусоароматические добавки и красители.
[0386] Фармацевтические составы согласно настоящему изобретению также могут быть представлены в форме эмульсий масло-в-воде и эмульсий вода-в-масле. Масляная фаза может представлять собой растительное масло, например, оливковое масло или арахисовое масло, или минеральное масло, например, жидкий парафин, или смесь указанных масел. Подходящие эмульгаторы могут представлять собой природные камеди, например, гуммиарабик или трагакантовую камедь; природные фосфатиды, например, соевый лецитин, и сложные эфиры или неполные сложные эфиры, полученные из жирных кислот и ангидридов гекситов, например, сорбитанмоноолеат; и продукты конденсации указанных неполных сложных эфиров с этиленоксидом, например, полиоксиэтилена сорбитанмоноолеат. Эмульсии также могут содержать подсластители и вкусоароматические агенты.
[0387] В состав сиропов и эликсиров могут входить подсластители, например, глицерин, пропиленгликоль, сорбит или сахароза. Указанные составы также могут содержать смягчающее средство, консервант, и вкусоароматические добавки и красители. Фармацевтические составы могут быть в форме стерильных водных иди масляных суспензий для инъекций. Рецептуру указанной суспензии можно составить в соответствии с известным уровнем техники с использованием указанных выше подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильные препараты для инъекций также могут представлять собой стерильный раствор или суспензию для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых сред и растворителей, которые можно применять - вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды широко применяют стерильные жирные масла. Для указанной цели можно применять любые безвкусные жирные масла, включая синтетические моно- и диглицериды. Кроме того, в препаратах для инъекций находят применение жирные кислоты, такие как олеиновая кислота.
[0388] Фармацевтические составы также можно вводить в форме суппозиториев, например, для ректального введения лекарственного средства. Указанные композиции можно приготовить путем смешивания лекарственного средства с подходящим нераздражающим наполнителем, твердым при обычных температурах, но жидким при ректальной температуре, который будет, следовательно, плавиться в прямой кишке, высвобождая лекарственное средство. Такими материалами являются кокосовое масло и полиэтиленгликоли.
[0389] Альтернативно, фармацевтические составы можно вводить парентерально в стерильной среде. Лекарственное средство, в зависимости от применяемых среды и концентрации, может быть суспендировано или растворено в среде. Благоприятно, что такие адъюванты, как местные анестетики, консерванты и буферные агенты, могут быть растворены в указанной среде.
[0390] Согласно некоторым из вариантов реализации, фармацевтические составы можно вводить в глаз. Согласно некоторым из вариантов реализации, глазные составы содержат жидкую среду. Соединение, в зависимости от применяемых среды и концентрации, может быть суспендировано или растворено в среде. Такие глазные составы можно затем вводить в глаз в форме капель. Подходящие среды и возможные компоненты для замены слез известны в данной области.
[0391] Для введения животным кроме человека, композицию, содержащую терапевтическое соединение, можно добавлять животным в корм или в питьевую воду. Также легко будет составить рецептуру продуктов корма и питьевой воды для животных, так чтобы животное получало соответствующее количество указанного соединения с питанием. Дополнительно, указанное соединение может быть легко обеспечено в виде добавки для добавления в пищу или в питьевую воду. Указанную композицию также можно добавлять в пищевые или питьевые добавки для человека.
[0392] Для лечения вышеуказанных состояний применяют уровни дозировки порядка примерно от 5 мг до 250 мг на килограмм массы тела в сутки, и более предпочтительно примерно от 25 мг до 150 мг на килограмм массы тела в сутки. Количество активного ингредиента, которое можно объединять с веществами-носителями для получения отдельной единичной дозированной формы, может изменяться в зависимости от состояния, которое лечат, и от конкретного пути введения. Дозированные формы могут в общем случае содержать примерно от 1 мг до примерно 500 мг активного ингредиента.
[0393] Частоту дозирования также можно менять в зависимости от применяемого соединения и конкретного заболевания, которое лечат. Однако для лечения большинства расстройств предпочтительна схема дозирования 4 раза в сутки или реже. Однако следует понимать, что конкретный уровень дозировки для любого конкретного пациента будет зависеть от множества факторов, включая активность конкретного применяемого соединения, возраста, массы тела, общего состояния здоровья, пола, питания, времени введения, пути введения и скорости выведения, комбинации лекарственных средств и тяжести конкретного заболевания, подвергающегося лечению.
[0394] Предпочтительные соединения согласно настоящему изобретению будут обладать желаемыми фармакологическими свойствами, которые включают, без ограничения, биодоступность при пероральном приеме, низкую токсичность, низкое связывание с белками сыворотки и желаемые периоды полураспада in vitro и in vivo. Проникновение через гематоэнцефалический барьер необходимо для соединений, применяемых для лечения заболеваний ЦНС, тогда как для соединений, применяемых для лечения периферических заболеваний, предпочтительны низкие концентрации в головном мозге.
[0395] Для предсказания желаемых фармакологических свойств можно применять тесты. Тесты, применяемые для предсказания биодоступности, включают транспорт через монослои клеток кишечника человека, включая монослои клеток Сасо-2. Токсичность для культивируемых гепатоцитов можно применять для предсказания токсичности соединения. Проникновение соединения через гематоэнцефалический барьер человека можно предсказать на основании концентрации в головном мозге у животных, получавших соединение внутривенно.
[0396] Связывание с белками сыворотки можно предсказать исходя из тестов на связывание с альбумином. Указанные тесты описаны в обзоре Oravcova, et al. (Journal of Chromatography В (1996) volume 677, pages 1-27).
[0397] Период полураспада соединения обратно пропорционален частоте дозирование соединения. Периоды полураспада соединений in vitro можно предсказать исходя из тестов на микросомальный период полураспада, описанных Kuhnz и Gieschen (Drug Metabolism and Disposition, (1998) volume 26, pages 1120-1127).
[0398] Количество композиции, необходимое для применения для лечения, может меняться в зависимости не только от конкретного соединения, но также и от пути введения, природы состояния, лечение которого проводят, и возраста и состояния здоровья пациента, и будет в конечном итоге оставаться на усмотрение лечащего терапевта или клинициста.
[0399] Согласно примеру реализации, фармацевтическая композиция согласно настоящему описанию содержит дополнительный активный ингредиент. Согласно другому примеру реализации, указанный дополнительный активный ингредиент представляет собой иммуносупрессивный агент. Согласно другому примеру реализации, указанный дополнительный активный ингредиент представляет собой член, выбранный из кортикостероидов, аминосалицилатов, азатиоприна (6-меркаптопурина), метотрексата и циклоспорина, этанерцепта (etanercept), инфликсимаба (infliximab), адалимумаба (adalimumab), алефацепта (alefacept), эфализумаба (efalizumab) и анакинра (anakinra).
[0400] Согласно другому примеру реализации, указанный дополнительный активный ингредиент представляет собой член, выбранный из цилостазола (cilostazol), ролипрама (rolipram), рофлумиласта (roflumilast), пикламиласта (piclamilast), CDP-840 и арифло (ariflo).
[0401] Согласно другому примеру реализации, указанный дополнительный активный ингредиент представляет собой член, выбранный из бетаметазона (betamethasone), такролимуса (tacrolimus) и пимекролимуса (pimecrolimus). Согласно другому примеру реализации, указанный дополнительный активный ингредиент представляет собой член, выбранный из аналога активированного витамина D и аротиноида (ароматического аналога ретиноевой кислоты). Согласно другому примеру реализации, указанный дополнительный активный ингредиент представляет собой член, выбранный из кальципотриола, такого как Tazorac (tazarotene).
V.а.) Топические составы (составы для местного применения)
[0402] Согласно предпочтительному варианту реализации, способы согласно настоящему изобретению можно применять посредством местного применения соединений, описанных в настоящей заявке. Местное нанесение включает, например, чресслизистый, чрескожный, ногтевой и чрезногтевой пути введения.
[0403] Композиции согласно настоящему изобретению содержат жидкие или полутвердые среды, которые могут включать, без ограничения, полимеры, загустители, буферные вещества, нейтрализаторы, хелатообразующие агенты, консерванты, поверхностно-активные вещества или эмульгаторы, антиокислители, воски или масла, эмоленты, солнцезащитные вещества, и растворитель или смешанную систему растворителей. Растворитель или смешанная система растворителей важны для состава, поскольку они в первую очередь отвечают за растворение лекарственного средства. Наилучшие растворители или смешанные системы растворителей также способны поддерживать клинически необходимые концентрации лекарственного средства в растворе, несмотря на добавление к составу плохого растворителя. Топические композиции, применяемые в настоящем изобретении, также можно изготовить в виде широкого спектра типов продуктов. Указанные продукты, среди прочего, включают, без ограничения, лосьоны, кремы, гели, карандаши, спреи, мази, пасты, пены, муссы, маски, глазные мази, глазные или ушные капли, пропитанные повязки, салфетки, очистители, включая мыла, составы для мытья тела и шампуни, и продукты для макияжа, такие как основы, румяна, помады и тени для век. Указанные типы продуктов могут содержать различные типы систем носителей, включая, без ограничения, частицы, наночастицы и липосомы. При желании, можно добавить дезинтегрирующие агенты, такие как сшитый поливинилпирролидон, агар-агар, или альгиновую кислоту или ее соли, такие как альгинат натрия. Методики приготовления составов и введения можно найти в Remington: The Science and Practice of Pharmacy, выше. Состав можно выбирать для максимизации доставки в выбранный целевой участок организма. Составы также могут содержать различные общеупотребительные красители, отдушки, загустители, консерванты, увлажнители, эмоленты, смягчители, солюбилизирующие наполнители, диспергаторы, улучшители проницаемости, пластификаторы, консерванты, стабилизаторы, деэмульгаторы, смачивающие агенты, солнцезащитные вещества, эмульгаторы, увлажнители, вяжущие агенты, дезодоранты, и тому подобное, которые можно добавлять для получения дополнительных преимуществ, таких как, например, улучшения ощущения при нанесении и/или внешнего вида топического препарата.
[0404] Лосьоны, которые представляют собой препараты, наносимые на поверхность кожи, ногтя, волос, когтя или копыта без втирания, обычно представляют собой жидкие или полутвердые препараты, в которых диспергированы мелкодисперсное твердое вещество, воскоподобное вещество или жидкость. Лосьоны обычно будут содержать суспендирующие агенты для получения лучших дисперсий, а также соединения, подходящие для нанесения и удержания активного агента в контакте с кожей, ногтем, волосами, когтем или копытом, например, метилцеллюлозу, карбоксиметилцеллюлозу натрия, или тому подобное.
[0405] Кремы, содержащие активный агент для доставки согласно настоящему изобретению представляют собой вязкие жидкие или полутвердые эмульсии, типов масло-в-воде или вода-в-масле. Основы кремов смываются водой и содержат масляную фазу, эмульгатор и водную фазу. Масляная фаза в общем случае состоит из вазелина или жирного спирта, такого как цетиловый или стеариловый спирт; водная фаза обычно, хотя и не обязательно, превышает по объему масляную фазу и в общем содержит увлажнитель. Эмульгатор в составе крема, как указано в Remington: The Science and Practice of Pharmacy выше, в общем случае представляет собой неионогенное, анионное, катионное или амфотерное поверхностно-активное вещество.
[0406] Лосьон или крем могут содержать относительно большое количество водной фазы и относительно малое количество масляной фазы. Кроме того, лосьоны и кремы согласно настоящему изобретению могут содержать активное соединение, «полностью растворенное» в масляной фазе, так что активное соединение по существу не кристаллизуется при комнатной температуре. Согласно одному из вариантов реализации, лосьон или крем может содержать двухфазную систему, то есть систему, в которой часть (примерно от 30 до примерно 75% по массе) активного соединения растворено в масляной фазе, а оставшаяся часть суспендирована в водной фазе.
[0407] Согласно настоящему изобретению также можно применять гелевые составы. Как понятно специалистам в области приготовления лекарственных средств для местного применения, гели являются полутвердыми. Однофазные гели содержат органические макромолекулы, распределенные по существу равномерно в объеме несущей жидкости, которая обычно является водной, но также может представлять собой растворитель или смесь растворителей. Согласно различным вариантам реализации, можно применять общеупотребительные гелеобразующие агенты. Согласно примеру реализации, применяют целлюлозу или ее производные. Согласно примеру реализации, применяют гидроксипропилметилцеллюлозу, такую как Methocel Е4М. Другие гелеобразующие агенты включают метилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, ацетат целлюлозы, этилцеллюлозу, метилгидроксиэтилцеллюлозу, гидроксиэтилцеллюлозу, и целлюлозную камедь. Гелеобразующие агенты на основе целлюлозы, в частности, гидроксиметилцеллюлозу и гидроксипропилметилцеллюлозу, также применяют согласно некоторым из вариантов реализации. Согласно некоторым вариантам реализации, можно применять поперечно сшитые акриловые полимеры, включая Carbopol.
[0408] Согласно одному из вариантов реализации, состав согласно настоящему изобретению достаточно вязкий для образования плотного геля. Согласно одному из вариантов реализации, вязкость находится в диапазоне 25000-300000 сП (сантипуаз) или 75000-200000 сП, при измерении по Брукфильду (LV).
[0409] Для облегчения приготовления может быть удобно приготовить первую гелевую композицию, называемую в данной заявке спид-гелем, которую можно применять для добавления к другим компонентам при приготовлении конечной композиции для местного нанесения. Существует несколько возможных составов спид-геля. Например, спид-гель можно приготовить, смешивая лецитиновый органогель (Л.О.), то есть смесь 1:1 (масс.) лецитина и изопропилмиристата, с маслом LID (смесь 1:1 [масс] Л.О. и докузата натрия), растворяя дополнительный порошок докузата натрия в указанной смеси, а затем добавляя водный раствор мочевины.
[0410] Мази, представляющие собой полутвердые препараты, обычно готовят на основе вазелина или других нефтепродуктов. Как понятно среднему специалисту, конкретная мазевая основа, которую следует применять, представляют собой такую основу, которая обеспечивает оптимальную доставку активного агента для данного состава, и, предпочтительно, обеспечивает также другие желаемые характеристики, например, смягчение или тому подобное. Как и другие среды или носители, мазевая основа должна быть инертной, стабильной, не раздражающей и не сенсибилизирующей. Как указано в Remington: The Science and Practice of Pharmacy, 19th Ed. (Easton, Pa.: Mack Publishing Co., 1995), на страницах 1399-1404, мазевые основы можно сгруппировать в четыре класса: масляные основы; эмульгируемые основы; эмульсионные основы и водорастворимые основы. Масляные мазевые основы включают, например, растительные масла, жиры животного происхождения и полутвердые углеводороды, полученные из нефти. Примеры масляных мазевых основ включают белую мазь USP, желтую мазь NF, олеиновую кислоту USP, оливковое масло USP, парафин USP, вазелин NF, белый вазелин USP, спермацетовый воск USP, синтетический спермацет NF, глицероль NF, белый воск USP, и желтый воск USP. Эмульгируемые мазевые основы, также известные как абсорбирующие мазевые основы, содержат мало воды или не содержат воды, и включают, например, гидроксистеарина сульфат, безводный ланолин и гидрофильный вазелин. Эмульсионные мазевые основы представляют собой или эмульсии вода-в-масле (В/М), или эмульсии масло-в-воде (М/В), и содержат, например, цетиловый спирт, глицерилмоностеарат, ланолин и стеариновую кислоту. Предпочтительные водорастворимые мазевые основы получают из полиэтиленгликолей различной молекулярной массы; и снова можно сослаться на Remington: The Science and Practice of Pharmacy выше, для дополнительной информации.
[0411] Подходящие составы согласно настоящему изобретению также включают спреи и аэрозоли. Спреи в общем случае предусматривают нахождение активного агента в водном и/или спиртовом растворе, который можно распылить для доставки на кожу, ноготь, волосы, коготь или копыто. Указанные спреи включают такие спреи, состав которых разработан для обеспечения концентрации раствора активного агента в месте введения после доставки; например, раствор для спрея может в первую очередь состоять из спирта или другой подобной летучей жидкости, в которой можно растворить лекарственное средство или активный агент. После доставки на кожу, ноготь, волосы, коготь или копыто носитель испаряется, оставляя концентрированный активный агент в месте введения. Примеры аэрозольной технологии описаны в патентах США №№6682716; 6716415; 6716417; 6783753; 7029658; и 7033575.
[0412] Топические фармацевтические композиции могут также содержать подходящие твердые или гелевые носители. Примеры таких носителей включают, без ограничения, карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы, желатин и полимеры, такие как полиэтиленгликоли.
[0413] Топические фармацевтические композиции также могут содержать подходящий эмульгатор, то есть агент, улучшающий или облегчающий смешивание и образование суспензий масло-в-воде или вода-в-масле. Эмульгатор согласно настоящему описанию может состоять из единственного эмульгатора или может представлять собой неионогенное, анионное, катионное или амфотерное поверхностно-активное вещество или смесь двух или нескольких таких поверхностно-активных веществ; предпочтительны для применения согласно настоящему изобретению неионогенные или анионные эмульгаторы. Такие поверхностно-активные - агенты описаны в "McCutcheon's Detergent and Emulsifiers," North American Edition, 1980 Annual published by the McCutcheon Division, MC Publishing Company, 175 Rock Road, Glen Rock, N.J. 07452, USA.
[0414] Примеры подходящих ионогенных поверхностно-активных веществ включают капроат натрия, каприлат натрия, капрат натрия, лаурат натрия, миристат натрия, миристолеат натрия, пальмитат натрия, пальмитолеат натрия, олеат натрия, рицинолеат натрия, линолеат натрия, линоленат натрия, стеарат натрия, лаурилсульфат натрия (додецил), тетрадецилсульфат натрия, лаурилсаркозинат натрия, диоктилсульфосукцинат натрия, холат натрия, таурохолат натрия, гликохолат натрия, дезоксихолат натрия, тауродезоксихолат натрия, гликодезоксихолат натрия, урсодезоксихолат натрия, хенодезоксихолат натрия, таурохенодезоксихолат натрия, гликохенодезоксихолат натрия, холилсаркозинат натрия, N-метилтаурохолат натрия, фосфатиды яичного желтка, гидрогенизированный соевый лецитин, димиристоиллецитин, лецитин, гидроксилированный лецитин, лизофосфатидилхолин, кардиолипин, сфингомиелин, фосфатидилхолин, фосфатидилэтаноламин, фосфатидная кислота, фосфатидилглицерин, фосфатидилсерин, диэтаноламин, фосфолипиды, фосфат олеилового эфира полиоксиэтилена-10, продукты этерификации жирных спиртов или этоксилированных жирных спиртов фосфорной кислотой или ангидридом, эфиркарбоксилаты (путем окисления концевой группы ОН в этоксилированных жирных спиртах), сукцинилированные моноглицериды, стеарилфумарат натрия, стеароилпропиленгликоля кислый сукцинат, моно/диацетилированные сложные эфиры винной кислоты и моно- и диглицеридов, сложные эфиры лимонной кислоты и моно- и диглицеридов, глицериллакто сложные эфиры жирных кислот, ацил лактилаты, лактиловые сложные эфиры жирных кислот, стеароил-2-лактилат натрия, стеароиллактилат натрия, соли альгиновой кислоты, пропиленгликольальгинат, этоксилированные алкилсульфаты, алкилбензолсульфоны, альфа-олефинсульфонаты, ацилизэтионаты, ацилтаураты, сульфонаты алкилглицериловых простых эфиров, октилсульфосукцинат натрия, ундециленамидо-МЕА-сульфосукцинат натрия, гексадецилтриаммонийбромид, децилтриметиламмонийбромид, цетилтриметиламмонийбромид, додециламмонийхлорид, соли алкилбензилдиметиламмония, соли диизобутилфеноксиэтоксидиметилбензиламмония, соли алкилпиридиния, бетаины (триалкилглицин), лаурилбетаин (N-лаурил-N,N-диметилглицин) и этоксилированные амины (полиоксиэтилен-15 кокосовый амин). Для простоты, типичные противоионы приведены выше. Специалисту понятно, однако, что можно применять любой биологически приемлемый противоион. Например, хотя жирные кислоты показаны в виде натриевых солей, также можно применять другие катионные противоионы, такие как, например, катионы щелочных металлов или аммония. Составы согласно настоящему изобретению могут содержать один или несколько из вышеуказанных ионогенных поверхностно-активных веществ.
[0415] Предпочтительными для применения согласно настоящему описанию являются спирты с большой молекулярной массой, такие как цетеариловый спирт, цетиловый спирт, стеариловый спирт, эмульгирующий воск, глицерилмоностеарат и олеиловый спирт. Другими примерами являются этиленгликоля дистеарат, сорбитана тристеарат, пропиленгликоля моностеарат, сорбитана моноолеат, сорбитана моностеарат (SPAN 60), диэтиленгликоля монолаурат, сорбитана монопальмитат, сахарозы диолеат, сахарозы стеарат (CRODESTA F-160), полиоксиэтилена лауриловый простой эфир (BRIJ 30), полиоксиэтилена (2) стеариловый простой эфир (BRIJ 72), полиоксиэтилена (21) стеариловый простой эфир (BRIJ 721), полиоксиэтилена моностеарат (Myrj 45), полиоксиэтилена (20) сорбитанмонолаурат (TWEEN 20, полисорбат 20), полиоксиэтилена (20) сорбитанмонопальмитат (TWEEN 40, полисорбат 40), полиоксиэтилена (20) сорбитанмоностеарат (TWEEN 60, полисорбат 60), полиоксиэтилена (20) сорбитанмоноолеат (TWEEN 80, полисорбат 80), другие неионные полиоксиалкиленовые производные неполных эфиров ангидридов гекситов и длинноцепочечных жирных кислот, и олеат натрия. Согласно примеру реализации, эмульгатор представляют собой октилдодеканол. Согласно примеру реализации, применяют ксантановую камедь или смесь ксантановых камедей. Холестерин и производные холестерина также можно применять в эмульсиях для наружного применения и для создания эмульсий в/м.
[0416] Особенно подходящими неионогенными эмульгаторами являются эмульгаторы с гидрофильно-липофильным балансом (ГЛБ) примерно от 3 до 6 для системы в/м и от 8 до 18 для системы м/в, при измерении способом, описанным Paul L. Lindner в "Emulsions and Emulsion", под редакцией Kenneth Lissant, изданном Dekker, New York, N.Y., 1974, страницы 188-190. более предпочтительными для применения согласно настоящему изобретению являются одно или несколько неионогенных поверхностно-активных веществ, обеспечивающих систему, обладающую ГЛБ примерно от 8 до примерно 18.
[0417] Примеры таких неионогенных эмульгаторов включают, без ограничения, «BRIJ 72», торговое наименование стеарилового простого эфира полиоксиэтилена (2), обладающего ГЛБ равным 4,9; «BRIJ 721», торговое наименование стеарилового простого эфира полиоксиэтилена (21), обладающего ГЛБ равным 15,5, «Brij 30», торговое наименование лаурилового простого эфира полиоксиэтилена, обладающего ГЛБ равным 9,7; «Polawax», торговое наименование эмульгирующего воска, обладающего ГЛБ равным 8,0; «Span 60», торговое наименование моностеарата сорбитана, обладающего ГЛБ равным 4,7; «Crodesta F-160», торговое наименование стеарата сахарозы, обладающего ГЛБ равным 14,5. Все указанные вещества поставляют в продажу Ruger Chemicals Inc.; Croda; ICI Americas, Inc.; Spectrum Chemicals; и BASF. Если топические составы согласно настоящему изобретению содержат, по меньшей мере, один эмульгатор, каждый из эмульгаторов присутствует в количестве примерно от 0,5 до 2,5% масс, предпочтительно от 0,5 до 2,0% масс., более предпочтительно от 1,0 до 1,8%. Предпочтительно, эмульгатор содержит смесь стеарета-21 (примерно 1,8%) и стеарета-2 (примерно 1,0%).
[0418] Топические фармацевтические композиции также могут содержать подходящие эмоленты. Эмоленты представляют собой вещества, применяемые для предотвращения или смягчения сухости, а также для защиты кожи, ногтя, волос, когтя или копыта. Подходящие эмоленты включают, без ограничения, углеводородные масла, воски, силикон, цетиловый спирт, изопропилмиристат, стеариловый спирт, олеиловый спирт, октилгидроксистеарат, глицерин, другие жирные спирты, включая жирные спирты с короткой или средней цепью, обладающие длиной углеродной цепи до 18 атомов, триглицериды жирных кислот с короткой или средней цепью, сложные эфиры, такие как сложные эфиры жирных кислот, лецитины и родственные им полярные соединения, такие как фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозит, фосфатидная кислота, лизофосфатидилхолин, лизофосфатидилэтаноламин и сфингомиелин, и тому подобное. Другие подходящие эмоленты включают триглицеридные масла, такие как растительные масла, такие как масло зародышей пшеницы, кукурузное, подсолнечное, каритэ, касторовое, сладкого миндаля, макадамии, абрикосовое, соевых бобов, хлопковое, люцерны, мака, тыквенное, кунжутное, огуречное, рапсовое, авокадо, лесного ореха, виноградной косточки, семян черной смородины, энотеры, проса, ячменя, кинвы, оливковое, ржи, сафлора, тунговое, соевое, пальмовое, пассифлоры или мускусной розы; триглицериды каприловой/каприновой кислоты, такие как поступающие в продажу под торговыми наименованиями MIGLYOL® (Condea Chemie, Germany) и CRODAMOL (Croda, Inc., Edison, N.J.); жирные спирты, такие как каприловый спирт, лауриловый спирт, миристиловый спирт, цетиловый спирт и стеариловый спирт; и жирные сложные эфиры, такие как олеилацетат, изотридецилбензоат, диизооктилсебацинат, изопропилмиристат, цетилоктаноат, изопропилпальмитат, бутилстеарат, гексиллаурат, миристилмиристат, децилолеат, гексилдецилдиметилоктаноат, цетиллактат, миристиллактат, ланолинацетат, изоцетилстеарат, изоцетилизостеарат, холестерил-12-гидроксистеарат, сложный эфир дипентаэритрита и жирной кислоты и изостеарилмалат. Известно и подходит для применения обширное множество подходящих эмолентов. См, например, Sagarin, Cosmetics, Science and Technology, 2nd Edition, Vol.1, pp.32-43 (1972), и патент США №4919934, выданный на имя Deckner et al., выданный 24 апреля 1990, содержание каждого из которых полностью включено в настоящее описание посредством ссылок. Указанные вещества выпускает в продажу Ruger Chemical Со, (Irvington, NJ).
[0419] Если топические составы согласно настоящему изобретению содержат по меньшей мере один эмолент, каждый из эмолентов присутствует в количестве примерно от 0,1 до 15%, предпочтительно от 0,1 до 3,0, более предпочтительно 0,5, 1,0 или 2,5% масс. Предпочтительно, эмолент представляет собой смесь цетилового спирта, изопропилмиристата и стеарилового спирта в соотношении 1/5/2. Эмолент также может представлять собой смесь цетилового спирта и стеарилового спирта в соотношении 1/2.
[0420] Топические фармацевтические композиции также могут содержать подходящие антиокислители, т.е. вещества, как известно, замедляющие окисление. Антиокислители, подходящие для применения согласно настоящему изобретению, включают, без ограничения, бутилированный гидрокситолуол, аскорбиновую кислоту, аскорбат натрия, аскорбат кальция, аскорбилпальмитат, бутилированный гидроксианизол, 2,4,5-тригидроксибутирофенон, 4-гидроксиметил-2,6-ди-трет-бутилфенол, эриторбиновую кислоту, гваяковую смолу, пропилгаллат, тиодипропионовую кислоту, дилаурилтиодипропионат, трет-бутилгидрохинон и токоферолы, такие как витамин Е, и тому подобное, включая фармацевтически приемлемые соли и сложные эфиры указанных соединений. Предпочтительно, антиокислитель представляет собой бутилированный гидрокситолуол, бутилированный гидроксианизол, пропилгаллат, аскорбиновую кислоту, фармацевтически приемлемые соли или сложные эфиры указанных соединений, или смеси указанных веществ. Наиболее предпочтительно, антиокислитель представляет собой бутилированный гидрокситолуол. Указанные вещества поставляет в продажу Ruger Chemical Со, (Irvington, NJ). Антиокислители, которые можно включать в составы согласно настоящему изобретению, включают природные антиокислители, полученные из растительных экстрактов, таких как экстракты алоэ вера; авокадо; ромашки; эхинацеи; гинкго билоба; женьшеня; зеленого чая; вереска; жожоба; лаванды; лимонного сорго; солодки; мальвы; овса; перечной мяты; зверобоя; ивы; грушанки; пшеницы; дикого ямса; экстракты морских растений; и смеси указанных экстрактов.
[0421] Если топические составы согласно настоящему изобретению содержат по меньшей мере один антиокислитель, общее количество присутствующего антиокислителя составляет примерно от 0,001 до 0,5% масс., предпочтительно от 0,05 до примерно 0,5% масс, наиболее предпочтительно 0,1%.
[0422] Топические фармацевтические композиции могут также содержать подходящие консерванты. Консерванты представляют собой соединения, добавляемые к фармацевтическому составу, чтобы оказывать антимикробное действие. Среди известных в данной области консервантов эффективными и приемлемыми для парентеральных составов являются хлорид бензалкония, бензетоний, хлоргексидин, фенол, мета-крезол, бензиловый спирт, метилпарабен, пропилпарабен и другие парабены, хлорбутанол, о-крезол, п-крезол, хлоркрезол, нитрат фенилртути, тимеросал, бензойная кислота, и различные смеси указанных веществ. См., например, Wallhausser, К.-Н., Develop. Biol. Standard, 24:9-28 (1974) (S. Krager, Basel). Предпочтительно, консервант выбирают из метилпарабена, пропилпарабена и их смесей. Указанные вещества поставляют в продажу Inolex Chemical Со (Philadelphia, РА) или Spectrum Chemicals.
[0423] Если топические составы согласно настоящему изобретению содержат по меньшей мере один консервант, общее количество присутствующего консерванта составляет примерно от 0,01 до примерно 0,5% масс, предпочтительно от примерно 0,1 до 0,5%, более предпочтительно примерно от примерно 0,03 до примерно 0,15%. Предпочтительно, консервант представляют собой смесь метилпарабена и пропилпарабена в соотношении 5/1. Если в качестве консерванта применяют спирт, его количество обычно составляет от 15 до 20%.
[0424] Топические фармацевтические композиции могут также содержать подходящие хелатирующие агенты для образования комплексов с катионами металлов, которые не пересекают липидный бислой. Примеры подходящих хелатирующих агентов включают этилендиаминтетрауксусную кислоту (ЭДТА), этиленгликоль-бис(бета-аминоэтиловый простой эфир)-N,N,N',N'-тетрауксусную кислоту (ЭГТА) и тетракалиевую соль 8-амино-2-[(2-амино-5-метилфенокси)метил]-6-метоксихинолин-N,N,N',N'-тетрауксусной кислоты (QUIN-2). Предпочтительно, хелатирующими агентами являются ЭДТА и лимонная кислота. Хелатирующий агент может содержать соли вышеуказанных соединений, такие как, например, эдетат динатрия. Указанные вещества поставляет в продажу Spectrum Chemicals.
[0425] Если топические составы согласно настоящему изобретению содержат, по меньшей мере, один хелатирующий агент, общее количество присутствующего хелатирующего агента составляет примерно от 0,005% до 2,0% по массе, предпочтительно примерно от 0,05% до примерно 0,5% масс., более предпочтительно примерно 0,1% по массе.
[0426] Топические фармацевтические композиции могут также содержать подходящие нейтрализующие агенты, применяемые для установления величины pH состава в пределах фармацевтически приемлемого диапазона. Примеры нейтрализующих агентов включают, без ограничения, троламин, трометамин, гидроксид натрия, соляную кислоту, карбонат натрия, лимонную кислоту, уксусную кислоту и соответствующие кислоты или основания указанных соединений. Указанные вещества поставляет в продажу Spectrum Chemicals (Gardena, СА).
[0427] Если топические составы согласно настоящему изобретению содержат, по меньшей мере, один нейтрализующий агент, общее количество присутствующего нейтрализующего агента составляет примерно от 0,1% масс, до примерно 10% масс., предпочтительно от 0,1% масс. до примерно 5,0% масс., и более предпочтительно примерно 1,0% масс. Нейтрализующий агент в общем добавляют в таком количестве, которое необходимо для придания составу необходимого pH. Согласно одному из вариантов реализации, pH составляет примерно от 6,0 до примерно 8,0. Согласно одному из вариантов реализации, pH составляет примерно от 3,0 до примерно 4,0.
[0428] Топические фармацевтические композиции могут также содержать подходящие загустители или агенты, увеличивающие вязкость. Указанные компоненты представляют собой диффундирующие соединения, способные увеличивать вязкость полимерсодержащего раствора при помощи взаимодействия указанного агента с полимером. Например, в качестве агента, увеличивающего вязкость, можно применять CARBOPOL ULTReZ 10, полиметилметакрилат (ПММА) и коллоидную двуокись кремния. Указанные вещества выпускает в продажу Noveon Chemicals, Cleveland, ОН. Другие примеры загустителей включают моноглицериды и жирные спирты, сложные эфиры жирных кислот и спиртов, содержащих от 3 до 16 атомов углерода. Примерами подходящих моноглицеридов являются глицерилмоностеарат и глицерилмонопальмитат. Примерами жирных спиртов являются цетиловый спирт и стеариловый спирт. Примерами подходящих сложных эфиров являются миристилстеарат и цетилстеарат. Моноглицериды также действуют как вспомогательный эмульгатор. Другие эмоленты или маслянистые вещества, которые можно применять, включают вазелин, глицерилмоноолеат, миристиловый спирт, и изопропилпальмитат. Согласно одному из вариантов реализации, загуститель применяют в комбинации с эмульгатором.
[0429] Если топические составы согласно настоящему изобретению содержат по меньшей мере один агент, увеличивающий вязкость, общее количество присутствующего агента, увеличивающего вязкость, составляет примерно от 0,25% до примерно 5, 0% по массе, предпочтительно от 0,25% до примерно 0,1% масс., и более предпочтительно от примерно 0,4% до примерно 0,6% по массе.
[0430] Топические фармацевтические композиции могут также содержать дезинтегрирующие агенты, включая крахмал, например, природный крахмал, такой как кукурузный крахмал или картофельный крахмал, прежелатинизированный крахмал, такой как National 1551 или Amijele®, или натрия крахмала гликолят, такой как Promogel® или Explotab®; целлюлозу, такую как древесный продукт, микрокристаллическую целлюлозу, например, Avicel®, Avicel® РН101, Avicel® PH102, Avicel® PH105, Elcema® P100, Emcocel®, Vivacel®, Ming Tia®, и Solka-Floc®, метилцеллюлозу, кроскармеллозу, или поперечносшитую целлюлозу, такую как поперечносшитую карбоксиметилцеллюлозу натрия (Ac-Di-Sol®), сшитую карбоксиметилцеллюлозу, или сшитую кроскармеллозу; сшитый крахмал, такой как натрия крахмала гликолят; сшитый полимер, такой как кросповидон; сшитый поливинилпирролидон; альгинат, такой как альгиновая кислота или соль альгиновой кислоты, такая как альгинат натрия; глину, такую как Veegum® HV (алюмосиликат магния); камедь, такую как агар-агар, гуаровая смола, камедь рожкового дерева, камедь карайи, пектин или трагакант; натрия крахмала гликолят; бентонит; природную губку; поверхностно-активное вещество; смолу, такую как катионообменная смола; цитрусовую пульпу; лаурилсульфат натрия; лаурилсульфат натрия в комбинации с крахмалом; и тому подобное.
[0431] Топические фармацевтические композиции могут также содержать подходящие усилители проницаемости ногтей. Примеры усилителей проницаемости ногтей включают меркаптановые соединения, сульфиты и бисульфиты, кератолитические агенты и поверхностно-активные вещества. Усилители проницаемости ногтей, подходящие для применения согласно настоящему изобретению, более подробно описаны в работе Malhotra et al., J. Pharm. Sci., 91:2, 312-323 (2002), содержание которой полностью включено в настоящее описание посредством ссылки.
[0432] Топические фармацевтические композиции могут также содержать подходящие антивспенивающие и препятствующие побелению агенты, которые улучшают внешний вид крема или лосьона и ингибируют образование белого мылоподобного вида при втирании крема или лосьона в кожу. Пример указанного вещества включает жидкий силикон. Другие антивспенивающие агенты включают симетикон, полигликоль и сорбитансесквиолеат.
[0433] Топические фармацевтические композиции могут также содержать «вспенивающийся после нанесения» агент, «вспенивающийся после нанесения» относится к гелю, который остается гелем, когда его выпускают из контейнера, но вспенивается после того, как его распределят по коже. Вспенивающиеся после нанесения агенты включают насыщенные алифатические углеводороды, содержащие 4-6 атомов углерода, такие как бутан, пентан и гексан (в частности, пентан и изобутен). Другие подходящие вспенивающиеся после нанесения агенты включают частично или полностью галогенированные углеводороды, такие как трихлорфторэтан. Также можно применять смеси алифатических и галогенированных углеводородных пропеллентов или вспенивающихся после нанесения агентов. В общем подходящие вспенивающиеся после нанесения агенты представляют собой вещества, которые обладают малой растворимостью в воде, например, менее 20 см3 газа на 100 граммов воды при атмосферном давлении и 20°С.
[0434] Топические фармацевтические композиции могут также содержать один или несколько подходящих растворителей. Способность любого твердого вещества (растворенного вещества) растворяться в любом жидком веществе (растворителе) зависит от физических свойств растворенного вещества и растворителя. Если растворенные вещества и растворители обладают сходными физическими свойствами, растворимость растворенного вещества в растворителе будет наибольшей. Отсюда берет начало традиционное условие, что «подобное растворяется в подобном». Растворители можно определить в одном крайнем случае как неполярные липофильные масла, тогда как другой крайний случай представляют полярные гидрофильные растворители. Маслянистые растворители растворяют другие неполярные вещества благодаря взаимодействиям Ван-дер-Ваальса, тогда как вода и другие полярные растворители растворяют полярные вещества при помощи ионных, дипольных или взаимодействий посредством водородной связи. Все растворители можно расположить в ряд от наименее полярного, например, углеводородов, таких как декан, до наиболее полярного растворителя, которым является вода. Растворенное вещество будет проявлять свою наивысшую растворимость в растворителях, обладающих равной по величине полярностью. Следовательно, лекарственные средства, обладающие минимальной растворимостью в воде, покажут улучшенную растворимость в менее полярных растворителях, при этом растворитель, обладающий полярностью, почти равной полярности растворенного вещества, обеспечит максимальную растворимость. Большинство лекарственных средств имеет промежуточной полярностью и, следовательно, демонстрируют максимальную растворимость в таких растворителях, как пропиленгликоль или этанол, которые значительно менее полярны, чем вода. Если лекарственное средство более растворимо в пропиленгликоле (например, 8% (масс.)), чем в воде (например, 0,1% (масс.)), то добавление воды к пропиленгликолю должно уменьшить максимальное количество лекарственного средства, растворимого в указанной смеси растворителей, по сравнению с чистым пропиленгликолем. Добавление плохого растворителя к превосходному растворителю будет уменьшать максимальную растворимость для полученной смеси по сравнению с максимальной растворимостью в превосходном растворителе.
[0435] Если соединения входят в топические составы, концентрация активного ингредиента в составе может быть ограничена растворимостью активного ингредиента в выбранном растворителе и/или носителе. Нелипофильные лекарственные средства обычно демонстрируют очень низкую растворимость в фармацевтически приемлемых растворителях и/или носителях. Например, растворимость некоторых соединений согласно настоящему изобретению в воде менее 0,00025% масс. Растворимость тех же соединений согласно настоящему изобретению в пропиленгликоле или изопропилмиристате может составлять менее 2% масс.
[0436] Примеры солюбилизирующих наполнителей включают полиэтоксилированные жирные кислоты, диэфиры ПЭГ-жирных кислот, смеси моноэфиров и диэфиров ПЭГ-жирных кислот, сложные эфиры жирных кислот полиэтиленгликоля и глицерина, продукты переэтерификации спирт-масло, полиглицериновые производные жирных кислот, сложные эфиры пропиленгликоля и жирных кислот, смеси сложных эфиров пропиленгликоля и глицерина, моно- и диглицериды, стерол и производные стерола, сложные эфиры полиэтиленгликоля сорбитана и жирных кислот, полиэтиленгликольалкиловые простые эфиры, сложные эфиры Сахаров, полиэтиленгликоля алкилфенолы, блок-сополимеры полиоксиэтилен-полиоксипропилен, сложные эфиры сорбитана и жирных кислот, сложные эфиры низших спиртов и жирных кислот, ионогенные поверхностно-активные вещества, сложные эфиры токоферола и сложные эфиры стерола. Согласно одному из вариантов реализации настоящего изобретения, этилгексилгидроксистеарат представляет собой растворитель, применяемый для растворения соединений, описанных в настоящей заявке. Согласно одному из вариантов реализации настоящего изобретения, моноэтиловый простой эфир диэтиленгликоля (ДЭГМЭ) представляет собой растворитель, применяемый для растворения соединений, описанных в настоящей заявке. Согласно одному из вариантов реализации настоящего изобретения, моноэтиловый простой эфир диэтиленгликоля (ДЭГМЭ) представляет собой растворитель, применяемый для растворения соединения согласно настоящему изобретению. Соединения согласно настоящему изобретению, применяемые в настоящем составе, как полагают, обладают растворимостью в ДЭГМЭ примерно от 10% масс, до примерно 25% масс. Согласно другому варианту реализации, для растворения соединений согласно настоящему описанию применяют систему сорастворителей ДЭГМЭ-вода. Согласно другому варианту реализации, для растворения соединения согласно настоящему изобретению применяют систему сорастворителей ДЭГМЭ-вода. Растворяющая способность ДЭГМЭ падает при добавлении воды; однако можно разработать систему сорастворителей ДЭГМЭ/вода для поддержания выбранной концентрации активного ингредиента примерно от 0,1% до примерно 5% масс. Предпочтительно активный ингредиент присутствует в применяемых топических составах в количестве примерно от 0,5% до примерно 3% масс и более предпочтительно примерно 1% масс. Поскольку ДЭГМЭ менее летуч, чем вода, когда топический состав испаряется после нанесения, активный агент становится более растворимым в составе крема. Таким образом, повышенная растворимость уменьшает вероятность сниженной биодоступности, вызываемой выпадением в осадок лекарственного средства на поверхности кожи, ногтя, волос, когтя или копыта.
[0437] Согласно одному из вариантов реализации, среда является липофильной. Липофильные материалы включают маслянистый материал, такой как вазелин, минеральное масло, загущенное или желированное полиэтиленом, парафиновые воски с большой молекулярной массой и диглицериды жирных кислот, желированные жирными кислотами с большой молекулярной массой или полиамидным комплексом гидроксистеарата, пропиленгликольизостеарат или изостеариловый спирт, желированные жирными кислотами с большой молекулярной массой или смеси указанных веществ.
[0438] Жидкие формы, такие как лосьоны, подходящие для топического введения или подходящие для косметического применения, могут содержать подходящие водные или неводные среды с буферными, суспендирующими и распределяющими агентами, загустителями, улучшителями проницаемости, и тому подобное. Твердые формы, такие как кремы или пасты или тому подобное, могут содержать, например, любой из следующих ингредиентов, воду, масло, спирт или жир, в качестве субстрата с поверхностно-активным веществом, полимерами, такими как полиэтиленгликоль, загустителями, твердыми веществами, и тому подобное. Жидкие или твердые составы могут содержать улучшенные технологии доставки, такие как липосомы, микросомы, микрогубки, и тому подобное. Липосомные составы, которые способствуют проникновению соединения в кожу, описаны в патентах США 5169637; 5000958; 5049388; 4975282; 5194266; 5023087; 5688525; 5874104; 5409704; 5552155; 5356633; 5032582; 4994213; и публикация РСТ №W096/40061.
[0439] Кроме того, соединения можно доставлять при помощи системы с замедленным высвобождением, такой как полупроницаемые основы из твердых гидрофобных полимеров, содержащие терапевтический агент. Различные материалы с замедленным высвобождением установлены и хорошо известны специалистам в данной области техники. Так, по меньшей мере две различных дозированных лекарственных формы, каждая из которых содержит соединение согласно настоящему изобретению, можно разработать для местного применения путем включения такой дозированной лекарственной формы в эмульсию масло-в-воде или в эмульсию вода-в-масле. В таком составе дозированная форма с отсроченным высвобождением находятся в непрерывной фазе, а дозированная форма с отсроченным замедленным высвобождением находится в дисперсной фазе. Состав можно также получить таким образом, чтобы вводить три дозированных формы, как описано выше. Например, можно обеспечить эмульсию масло-в-воде-в-масле, в которой масло является непрерывной фазой, содержащей третий компонент с отсроченным замедленным высвобождением, вода, диспергированная в масле, содержит первую дозированную форму с отсроченным высвобождением, а масло, диспергированное в воде, содержит вторую дозированную форму с отсроченным высвобождением.
[0440] Схемы местного лечения согласно реализации настоящего изобретения включают нанесение композиции непосредственно на кожу, ноготь, волосы, коготь или копыто в месте нанесения, от одного до нескольких раз в сутки.
[0441] Составы согласно настоящему изобретению можно применять для лечения, облегчения или предотвращения состояний или симптомов, связанных с бактериальными инфекциями, акне, воспалением, и тому подобное.
[0442] Согласно примеру реализации, фармацевтический состав содержит простой раствор. Согласно примеру реализации, простой раствор содержит полиэфир. Согласно примеру реализации, полиэфир представляет собой полиэтиленгликоль или полипропиленгликоль. Согласно примеру реализации, простой раствор содержит спирт. Согласно примеру реализации, спирт представляют собой метанол, этанол, пропанол, изопропанол или бутанол. Согласно примеру реализации, простой раствор содержит полиэфир и спирт. Согласно другому примеру реализации, простой раствор содержит пропиленгликоль и этанол. Согласно другому примеру реализации, простой раствор представляют собой член, выбранный из раствора, содержащего примерно 10% пропиленгликоля и примерно 90% этанола; примерно 2 0% пропиленгликоля и примерно 80% этанола; примерно 30% пропиленгликоля и примерно 70% этанола; примерно 40% пропиленгликоля и примерно 60% этанола; примерно 50% пропиленгликоля и примерно 50% этанола; примерно 60% пропиленгликоля и примерно 40% этанола; примерно 70% пропиленгликоля и примерно 30% этанола; примерно 80% пропиленгликоля и примерно 2 0% этанола; примерно 90% пропиленгликоля и примерно 10% этанола.
[0443] Согласно примеру реализации, простой раствор содержит ацетон. Согласно примеру реализации, простой раствор содержит ацетон и спирт. Согласно примеру реализации, простой раствор содержит ацетон и член, выбранный из метанола, этанола, пропанола, изопропанола или бутанола. Согласно примеру реализации, простой раствор содержит ацетон, спирт и полиэфир. Согласно другому примеру реализации, простой раствор содержит ацетон, спирт и член, выбранный из полиэтиленгликоля и полипропиленгликоля. Согласно примеру реализации, простой раствор содержит ацетон и этанол. Согласно другому примеру реализации, простой раствор представляют собой член, выбранный из раствора, содержащего примерно 10% ацетона и примерно 90% этанола; примерно 20% ацетона и примерно 80% этанола; примерно 30% ацетона и примерно 70% этанола; примерно 40% ацетона и примерно 60% этанола; примерно 50% ацетона и примерно 50% этанола; примерно 60% ацетона и примерно 40% этанола; примерно 70% ацетона и примерно 30% этанола; примерно 80% ацетона и примерно 20% этанола; примерно 90% ацетона и примерно 10% этанола.
[0444] Согласно примеру реализации, фармацевтический состав представляет собой лак.
V. б) Дополнительные активные агенты
[0445] Далее приведены примеры косметических и фармацевтических агентов, которые можно добавлять к топическим фармацевтическим составам согласно настоящему изобретению. Следующие агенты представляют собой известные соединения и легко доступны в продаже.
[0446] Противовоспалительные агенты включают, без ограничения, бисаболол, ментолатум, дапсон, алоэ, гидрокортизон, и тому подобное.
[0447] Витамины включают, без ограничения, витамин В, витамин Е, витамин А, витамин D, и тому подобное, и производные витаминов, такие как тазаротен, кальципротен, третиноин, адапален, и тому подобное.
[0448] Агенты против старения включают, без ограничения, ниацинамид, ретинол и ретиноидные производные, АГК (альфагидроксикислоты), аскорбиновую кислоту, липоевую кислоту, кофермент Q 10, бетагидроксикислоты, салициловую кислоту, пептиды, связывающие медь, диметилэтиламин (ДМЭА), и тому подобное.
[0449] Солнцезащитные или облегчающие солнечный ожог агенты включают, без ограничения, ПАБК, жожоба, алоэ, падимат-О, метоксициннаматы, проксамин НСl, лидокаин, и тому подобное. Агенты для загара без солнца включают, без ограничения, дигидроксиацетон (ДГА). Блокаторы ультрафиолетового (УФ) излучения включают, например, аминобензойные кислоты, бензофеноны, камфоры, циннаматы, дибензоилметаны, салицилаты, оксиды металлов, и смеси указанных соединений.
[0450] Агенты для лечения псориаза и/или агенты для лечения акне включают, без ограничения, салициловую кислоту, бензоилпероксид, каменноугольную смолу, сульфид селена, оксид цинка, пиритион (цинка и/или натрия), тазаротен, кальципротен, третиноин, адапален и тому подобное.
[0451] Агенты, эффективные для контроля или коррекции кератинизации, включают, без ограничения: третиноин, тазаротен и адапален.
[0452] Композиции, содержащие соединение/активный агент согласно настоящему описанию, и, возможно, по меньшей мере, один из указанных дополнительных агентов, предназначены для топического введения. При основном применении результатом является то, что соединения согласно настоящему изобретению и любой другой активный агент воздействует и лечит кожу, ноготь, волосы, коготь или копыто. Альтернативно, любой из нанесенных топически активных агентов может также быть доставлен системно посредством трансдермальных путей.
[0453] В таких композициях дополнительный косметически или фармацевтически эффективный агент, такой как противовоспалительный агент, витамин, агент против старения, солнцезащитный агент и/или агент, лечащий акне, например, обычно представляет собой второстепенный компонент (примерно от 0,001% до примерно 20% по массе или предпочтительно примерно от 0,01% до примерно 10% по массе), а остальное составляют различные среды или носители и технологические добавки, полезные для образования желаемой дозированной лекарственной формы.
V. в) Исследование
[0454] Предпочтительные соединения для применения в топических составах согласно настоящему изобретению должны обладать определенными фармакологическими свойствами. Такие свойства включают, без ограничения, низкую токсичность, низкое связывание с белками сыворотки и желаемое время полувыведения in vitro и in vivo. Для предсказания этих желаемых фармакологических свойств можно применять тесты. Тесты, применяемые для предсказания биодоступности, включают транспорт через монослои клеток кишечника человека, включая монослои клеток Сасо-2. Связывание с белками сыворотки можно предсказать по тестам на связывание альбумина. Такие тесты описаны в обзоре Oravcova et al. (1996, J. Chromat. B677: 1-27). Время полувыведения соединения обратно пропорционально частоте дозирования соединения. Время полувыведения соединений in vitro можно предсказать по тестам на микросомальное время полувыведения, как описывают Kuhnz и Gleschen (Drug Metabolism and Disposition, (1998) volume 26, pages 1120-1127).
[0455] Токсичность и терапевтическую эффективность указанных соединений можно определить по обычным фармацевтическим методикам на культурах клеток или на экспериментальных животных, например, определение LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной для 50% популяции). Дозовое отношение между терапевтическим и токсическим действиями представляет собой терапевтический индекс и может быть выражено как отношение между LD50 и ED50. Предпочтительными являются соединения с высокими терапевтическими индексами. Данные, полученные из этих тестов на культурах клеток и на экспериментальных животных, можно применять при определении диапазона дозировок для человека. Дозировка указанных соединений находится предпочтительно в диапазоне концентраций в кровотоке, которые включают ED50 с малой токсичностью или отсутствием токсичности. Дозировку можно менять в пределах указанного диапазона в зависимости от применяемой дозированной формы и используемого пути введения. Точный состав, путь введения и дозировку может выбирать конкретный терапевт в зависимости от состояния пациента (см., например, Fingl et al., 1975, in "The Pharmacological Basis of Therapeutics", Ch.1, p.1).
V. г) Введение
[0456] Для любого соединения, применяемого в способе согласно настоящему изобретению, первоначально можно определить эффективную дозу в тестах на культуре клеток, согласно настоящему описанию. Например, дозу можно установить в моделях на животных, чтобы получить диапазон концентраций в кровотоке, который включает ЕС50 (эффективную дозу для увеличения на 50%), определенную на культуре клеток, т.е., такую концентрацию исследуемого соединения, при которой достигается половинное от максимального ингибирование роста клеток. Такую информацию можно применять для более точного определения подходящих доз для человека.
[0457] В общем, соединения, полученные при помощи способов и промежуточных соединений согласно настоящему описанию, можно вводить в терапевтически или косметически эффективном количестве любыми путями введения, приемлемыми для агентов, применяемых для сходных целей. Однако следует понимать, что конкретный уровень дозировки для каждого отдельного пациента будет зависеть от множества факторов, включая активность конкретного применяемого соединения, возраст, массу тела, общее состояние здоровья, пол, питание, время введения, путь введения, скорость выведения, комбинацию лекарственных средств, тяжесть конкретного заболевания, лечение которого проводят, и усмотрение лечащего терапевта. Лекарственное средство можно вводить от одного раза в сутки до двух раз, или 3 или 4 раз в сутки.
[0458] Дозовое количество и интервал устанавливают индивидуально для достижения таких концентраций активной молекулы в плазме, которые достаточны для обеспечения ингибирующего действия на рост бактериальных клеток. Обычно дозировки для пациентов при системном введении варьируют от 0,1 до 1000 мг/сутки, предпочтительно 1-500 мг/сутки, более предпочтительно 10-200 мг/сутки, еще более предпочтительно 100-200 мг/сутки. Выраженные в единицах площади поверхности тела пациента, дозировки варьируют от 50 до 91 мг/м2/сутки
[0459] Количество соединения в составе может варьироваться во всем диапазоне, применяемом специалистами. Обычно состав может содержать, в массовых процентах (масс.%), примерно 0,01 10 масс.% лекарственного средства от общей массы состава, а остальную часть составляет один или более подходящих фармацевтических наполнителей. Предпочтительно, соединение присутствует в концентрации примерно 0,1-3,0 масс.%, более предпочтительно примерно 1,0 масс.%.
[0460] Согласно примеру реализации, фармацевтический состав представляет собой мазь и содержит соединение согласно настоящему изобретению. Согласно примеру реализации, фармацевтический состав представляет собой мазь, содержащую С17. Согласно примеру реализации, фармацевтический состав представляет собой мазь, содержащую С27.
[0461] Согласно другому примеру реализации, фармацевтический состав содержит С17 и по меньшей мере одно поверхностно-активное вещество согласно настоящему описанию. Согласно другому примеру реализации, фармацевтический состав содержит С27 и по меньшей мере одно поверхностно-активное вещество, описанное настоящей заявке. Согласно другому примеру реализации, фармацевтический состав содержит гидроксистеарат. Согласно другому примеру реализации, гидроксистеарат представляет собой член, выбранный из глицерилмоностеарата, этилгексилгидроксистеарата и октилгидроксистеарата.
[0462] Согласно другому примеру реализации, фармацевтический состав содержит С17 и спирт. Согласно другому примеру реализации, фармацевтический состав содержит С27 и спирт. Согласно другому примеру реализации, спирт представляет собой длинноцепочечный спирт или жирный спирт. Согласно другому примеру реализации, спирт представляет собой член, выбранный из бензилового спирта, октилдодеканола, стеарилового спирта, цетилового спирта, олеилового спирта. Согласно примеру реализации, состав содержит член, выбранный их бензилового спирта, октил содержит по меньшей мере одно соединение, представляющее собой член, выбранный из углеводородных масел, восков, силикона, цетилового спирта, изопропилмиристата, стеарилового спирта, олеилового спирта, этилгексилгидроксистеарата, оксилгидроксистеарата, глицерина, гидроксистеаратов других жирных спиртов.
[0463] Согласно другому примеру реализации, фармацевтический состав содержит соединение согласно настоящему изобретению и по меньшей мере один эмолент, описанный в настоящей заявке.
[0464] Согласно другому примеру реализации, фармацевтический состав содержит соединение согласно настоящему изобретению и вазелин.
[0465] Согласно примеру реализации, фармацевтический состав содержит С17 и вазелин. Согласно примеру реализации, фармацевтический состав содержит С27 и вазелин. Согласно примеру реализации, фармацевтический состав содержит С17 и член, выбранный из углеводородных масел, восков, силикона, цетилового спирта, изопропилмиристата, стеарилового спирта, олеилового спирта, этилгексилгидроксистеарата, оксилгидроксистеарата, глицерина, гидроксистеаратов других жирных спиртов. Согласно примеру реализации, фармацевтический состав содержит С27 и член, выбранный из углеводородных масел, восков, силикона, цетилового спирта, изопропилмиристата, стеарилового спирта, олеилового спирта, этилгексилгидроксистеарата, оксилгидроксистеарата, глицерина, гидроксистеаратов других жирных спиртов. Согласно примеру реализации, фармацевтический состав содержит С17 и этилгексилгидроксистеарат и/или октилгидроксистеарат. Согласно примеру реализации, фармацевтический состав содержит С27 и этилгексилгидроксистеарат и/или октилгидроксистеарат. Согласно примеру реализации, фармацевтический состав содержит С17, вазелин и член, выбранный из углеводородных масел, восков, силикона, цетилового спирта, изопропилмиристата, стеарилового спирта, олеилового спирта, этилгексилгидроксистеарата, оксилгидроксистеарата, глицерина, гидроксистеаратов других жирных спиртов. Согласно примеру реализации, фармацевтический состав содержит С27, вазелин и член, выбранный из углеводородных масел, восков, силикона, цетилового спирта, изопропилмиристата, стеарилового спирта, олеилового спирта, этилгексилгидроксистеарата, оксилгидроксистеарата, глицерина, гидроксистеаратов других жирных спиртов. Согласно примеру реализации, фармацевтический состав содержит С17, вазелин, олеиловый спирт и этилгексилгидроксистеарат. Согласно примеру реализации, фармацевтический состав содержит С27, вазелин, олеиловый спирт и этилгексилгидроксистеарат.
[0466] Согласно примеру реализации, фармацевтический состав представляет собой крем и содержит соединение согласно настоящему изобретению. Согласно примеру реализации, соединение представляет собой С17. Согласно примеру реализации, соединение представляет собой С27.
[0467] Согласно другому примеру реализации, фармацевтический состав содержит соединение согласно настоящему изобретению и консервант. Согласно примеру реализации, консервант представляет собой член, выбранный из хлорида бензалкония, бензетония, хлоргексидина, фенола, м-крезола, бензилового спирта, метилпарабена, пропилпарабена и других парабенов, хлорбутанола, о-крезола, п-крезола, хлоркрезола, нитрата фенилртути, тимеросала, бензойной кислоты, и различных смесей указанных соединений. Согласно примеру реализации, соединение представляет собой С17. Согласно примеру реализации, соединение представляет собой С27. Согласно примеру реализации, консервант представляют собой парабен. Согласно примеру реализации, консервант представляет собой член, выбранный из метилпарабена и пропилпарабена.
[0468] Согласно другому примеру реализации, фармацевтический состав содержит соединение согласно настоящему изобретению и хедатирующий агент. Согласно другому примеру реализации, фармацевтический состав содержит С17 и хелатирующий агент. Согласно другому примеру реализации, фармацевтический состав содержит С27 и хелатирующий агент. Согласно примеру реализации, хелатирующий агент представляет собой эдетат натрия.
[0469] Ниже приведены примеры реализации.
[0470] Согласно примеру реализации настоящего изобретения, предложено соединение, обладающее структурой согласно формуле:
где Ra представляет собой член, выбранный из CN, C(O)NR1R2, С(О)OR3; где R3 представляет собой член, выбранный из Н и замещенного или незамещенного алкила, X представляет собой член, выбранный из N, СН и CRb, Rb представляет собой член, выбранный из галогена и замещенного или незамещенного алкила, C(O)R4, С(О)OR4, OR4, NR4R5, где R1, R2, R4 и R5 представляют собой члены, независимо выбранные из Н, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила, при условии, что R1 и R2, вместе с атомами, к которым они присоединены, возможно, объединены с образованием 4-8-членного замещенного или незамещенного гетероциклоалкильного кольца; при условии, что R4 и R5, вместе с атомами, к которым они присоединены, возможно, объединены с образованием 4-8-членного замещенного или незамещенного гетероциклоалкильного кольца, и соли указанных соединений.
[0471] Согласно примеру реализации, в соответствии с приведенным выше абзацем, R3 представляет собой член, выбранный из Н и незамещенного алкила.
[0472] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, соединение имеет структуру согласно формуле:
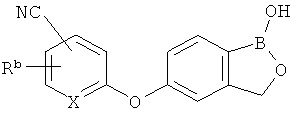 .
.
[0473] Согласно примеру реализации соответствии с любым из приведенных выше абзацев, соединение имеет формулу, представляющую собой член, выбранный из:
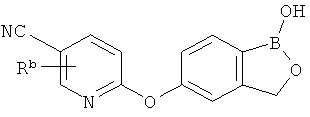 и
и 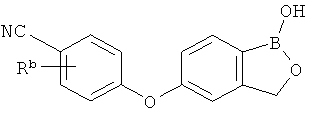 .
.
[0474] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, соединение имеет формулу, представляющую собой член, выбранный из:
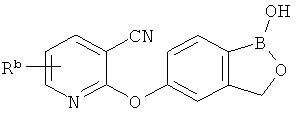 и
и 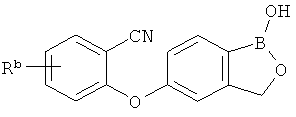 .
.
[0475] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, соединение имеет формулу, представляющую собой член, выбранный из:
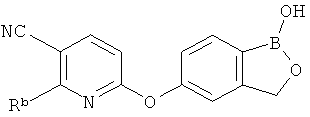 и
и 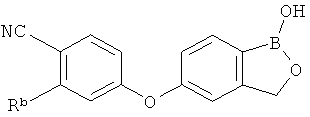 .
.
[0476] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, соединение имеет формулу, представляющую собой член, выбранный из:
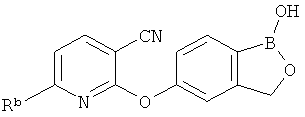
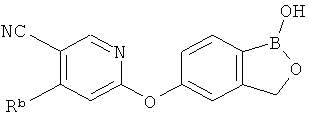
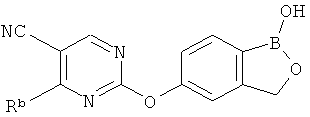
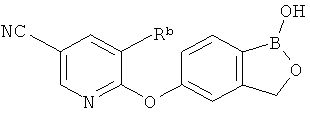 и
и 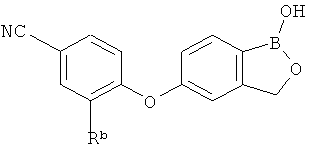 .
.
[0477] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, соединение имеет структуру согласно формуле:
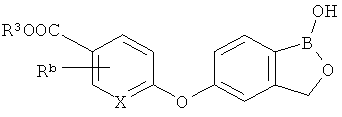 .
.
[0478] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, соединение имеет формулу, представляющую собой член, выбранный из:
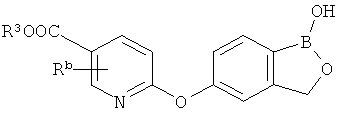 и
и 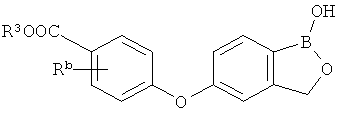
[0479] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, соединение имеет формулу, представляющую собой член, выбранный из:
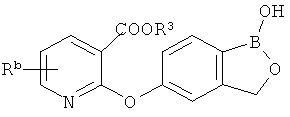 и
и 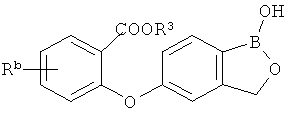
[0480] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, соединение имеет формулу, представляющую собой член, выбранный из:
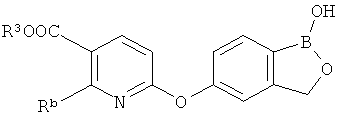 и
и 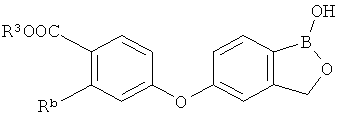
[0481] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, соединение имеет формулу, представляющую собой член, выбранный из:
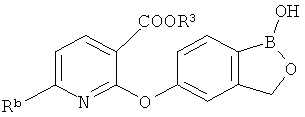
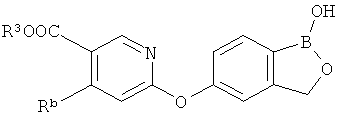
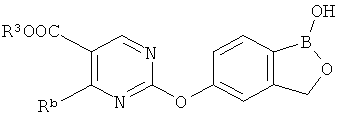
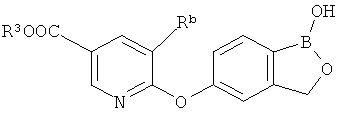 и
и 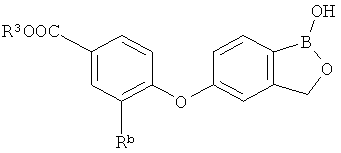
[0482] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, соединение имеет структуру согласно формуле:
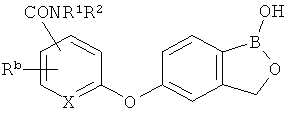
соединение имеет формулу, представляющую собой член, выбранный из:
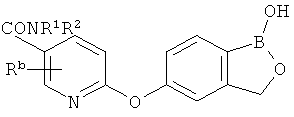 и
и 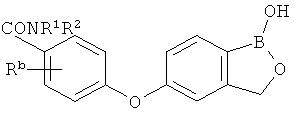
[0483] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, соединение имеет формулу, представляющую собой член, выбранный из:
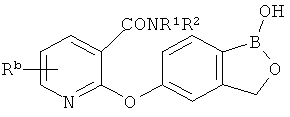 и
и 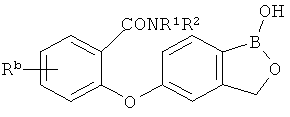
[0484] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, соединение имеет формулу, представляющую собой член, выбранный из:
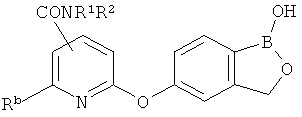 и
и 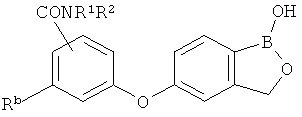
[0485] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, соединение имеет формулу, представляющую собой член, выбранный из:
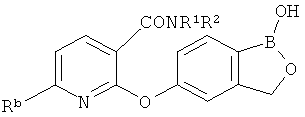
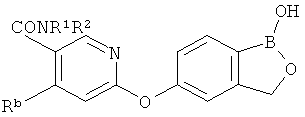
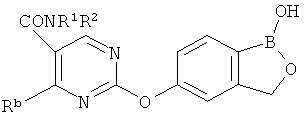
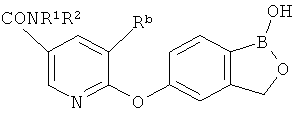 и
и 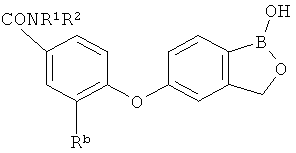
[0486] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой член, выбранный из фтора и хлора.
[0487] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой член, выбранный из OR4 и NR4R5.
[0488] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой OR4, и R4 представляет собой член, выбранный из Н, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила.
[0489] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой OR4, и R4 представляет собой член, выбранный из Н, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила и замещенного или незамещенного циклоалкила.
[0490] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой OR4, и R4 представляет собой незамещенный C1-С6 алкил.
[0491] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой OR4, и R4 представляет собой незамещенный циклоалкил.
[0492] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой OR4, и R4 представляет собой алкил, содержащий в качестве заместителя член, выбранный из замещенного или незамещенного С1-С6 алкокси.
[0493] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой OR4, и R4 представляет собой алкил, содержащий в качестве заместителя, по меньшей мере, один галоген.
[0494] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой OR4, и R4 представляет собой алкил, содержащий в качестве заместителя, по меньшей мере, одну оксогруппу.
[0495] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой OR4, и R4 представляет собой член, выбранный из -СН3, -СН2СН3, -(СН2)2СН3, -СН(СН3)2, -CH2CF3, -CH2CHF2, -СН2СН2(ОН), -СН2СН2(OСН3), СН2СН2(ОС(СН3)2), -С(O)СН3, -СН2СН2OС(О)СН3, -СН2С(О)ОСН2СН3, СН2С(О)ОС(СН3)3, -(СН2)3С(О)СН3, -СН2С(О)ОС(СН3)3, циклопентила, циклогексила
 ;
;  и
и  .
.
[0496] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой OR4, где R4 представляет собой алкил, возможно, содержащий в качестве заместителя по меньшей мере один галоген, гидроксил, простую эфирную, карбокси или сложноэфирную группу.
[0497] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой OR4, где R4 представляет собой незамещенный алкил.
[0498] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой OR4, где R4 представляет собой незамещенный C1 или С2 или С3 алкил.
[0499] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой OR4, где R4 представляет собой незамещенный С4 или С5 или С6 алкил.
[0500] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой OR4, где R4 представляет собой метил или этил или пропил или изопропил или изобутил.
[0501] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой -О(СН2)m1OC(О)R4d, где m1 представляет собой число, выбранное из 1 или 2 или 3 или 4 или 5 или 6 и R4d представляет собой незамещенный алкил. Согласно примеру реализации, m1 равно 1 или 2 или 3. Согласно примеру реализации, m1 равно 2. Согласно примеру реализации, R4d представляет собой незамещенный C1 или С2 или С3 алкил. Согласно примеру реализации, R4d представляет собой незамещенный С4 или С5 или С6 алкил. Согласно примеру реализации, R4d представляет собой метил. Согласно примеру реализации, Rb представляет собой -О(СН2)2OС(О)СН3.
[0502] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой -О(СН2)m1C(О)R4d, где m1 представляет собой число, выбранное из 1 или 2 или 3 или 4 или 5 или 6 и R4d представляет собой незамещенный алкил. Согласно примеру реализации, m1 равно 2 или 3 или 4. Согласно примеру реализации, m1 равно 3. Согласно примеру реализации, R4d представляет собой незамещенный C1 или С2 или С3 алкил. Согласно примеру реализации, R4d представляет собой незамещенный С4 или С5 или С6 алкил. Согласно примеру реализации, R4d представляет собой метил. Согласно примеру реализации, Rb представляет собой -O(СН2)3С(O)СН3.
[0503] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой -О(СН2)m1С(О)OR4d, где m1 представляет собой число, выбранное из 1 или 2 или 3 или 4 или 5 или 6, и R4d представляет собой Н или незамещенный алкил.
[0504] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой -OСН2С(О)OR4d, где R4d такое, как описано в настоящей заявке.
[0505] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, R4d представляет собой Н или метил или этил или трет-бутил.
[0506] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой -О(СН2)С(О)ОСН2СН3 или -О(СН2)С(О)ОН или -О(СН2)С(О)ОС(СН3)3.
[0507] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой OR4, где R4 представляет собой алкил, содержащий в качестве заместителя замещенную или незамещенную амино.
[0508] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой -О(СН2)m2С(О)NR4eR4f, где m2 представляет собой число, выбранное из 1 или 2 или 3 или 4 или 5 или 6, и R4e и R4f независимо выбирают из Н или незамещенного алкила, или R4e и R4f, вместе с атомами, к которым они присоединены, возможно, соединены с образованием замещенного или незамещенного 4-8-членного кольца.
[0509] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой OR4, где R4 представляет собой замещенный или незамещенный циклоалкил.
[0510] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой OR4, где R4 представляет собой незамещенный циклоалкил.
[0511] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой -О(СН2)m5OR30, где m5 равно 1 или 2 или 3 или 4 или 5 или 6, и R30 представляет собой Н или незамещенный алкил или незамещенный тетрагидропиран.
[0512] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, X представляет собой N.
[0513] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, X представляет собой СН.
[0514] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, X представляет собой CRb.
[0515] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой NR4R5, где R4 и R5 представляют собой члены, независимо выбранные из Н, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила, и замещенного или незамещенного гетероарила.
[0516] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой NR4R5, где R4 представляет собой Н или незамещенный алкил; и R5 представляет собой незамещенный алкил или алкил, содержащий в качестве заместителя член, выбранный из гидроксила, фенила, незамещенного алкокси и алкокси, замещенного фенилом.
[0517] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой NR4R5.
[0518] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, R4 представляет собой член, выбранный из Н или СН3.
[0519] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой NR4R5 где R4 и R5 представляют собой члены, независимо выбранные из замещенного или незамещенного алкила.
[0520] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой NR4R5, где R5 представляет собой алкил, содержащий в качестве заместителя член, выбранный из ОН, незамещенного арилалкокси, незамещенного алкоксила, и незамещенного арила. Согласно примеру реализации, Rb представляет собой NR4R5, где R5 представляет собой - (СН2)m8Ph.
[0521] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой NR4R5, где R5 представляет собой -(СН2)m8OR26, где m8 представляет собой число, выбранное из 1 или 2 или 3 или 4 или 5 или 6, и R26 представляет собой член, выбранный из Н, незамещенного или арилзамещенного C1 или С2 или С3 или С4 или С5 или С6 алкила.
[0522] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой NR4R5, где R5 представляет собой -(СН2)m8O(СН2)m9Ph, где каждый m8 и m9 независимо выбирают из 1 или 2 или 3.
[0523] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой NR4R5, где R4 представляет собой незамещенный алкил; и R5 представляет собой замещенный или незамещенный алкил.
[0524] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой NR4R5, где R4 представляет собой незамещенный алкил; и R5 представляет собой алкил, содержащий в качестве заместителя член, выбранный из замещенного или незамещенного алкокси и гидроксила.
[0525] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой NR4R5, где R4 представляет собой незамещенный алкил; и R5 представляет собой алкил, содержащий в качестве заместителя незамещенный алкокси.
[0526] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой член, выбранный из N(CH3)2, N(СН3)(СН2СН2(ОСН3)), N(CH3)(СН2СН2ОН), NH2, NHCH3, NH(СН2СН2(ОСН3)), NH(СН2СН2(OCH2Ph), NH(CH2Ph), NH(C(CH3)3) и NH(CH2CH2OH).
[0527] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, R^b представляет собой NR^4 R^5, где R^4 и R^5, вместе с атомом азота, к которому они присоединены, объединены с образованием 4-8-членного замещенного или незамещенного гетероциклоалкильного кольца.
[0528] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой NR4R5, где R4 и R5, вместе с атомом азота, к которому они присоединены, объединены с образованием замещенного или незамещенного 5-6-членного гетероциклоалкильного кольца.
[0529] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, Rb представляет собой член, выбранный из:
 ;
;  и
и 
[0530] Согласно примеру реализации настоящего изобретения, предложен фармацевтический состав, содержащий: (а) соединение согласно любому из приведенных выше абзацев; и (б) фармацевтически приемлемый наполнитель.
[0531] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, состав представляет собой единичную дозированную форму.
[0532] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, состав предназначен для перорального или местного применения.
[0533] Согласно примеру реализации настоящего изобретения предложен уменьшения выработки цитокина или хемокина, причем указанный способ включает: обеспечение контакта клетки с соединением согласно любому из приведенных выше абзацев или с фармацевтически приемлемой солью указанного соединения, при котором выработка указанной клеткой цитокина и/или хемокина уменьшается.
[0534] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, цитокин представляет собой член, выбранный из ИЛ-α, ИЛ-1β, ИЛ-2, ИЛ-3, ИЛ-6, ИЛ-7, ИЛ-9, ИЛ-12, ИЛ-17, ИЛ-18, ИЛ-23, ФНО-α, ЛТ, ФИЛ, Онкостатин, ИФНα, ИФНβ и ИФН-γ.
[0535] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, цитокин представляет собой член, выбранный из ИЛ-β, ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, ИЛ-23, ФНО-α и ИФН-γ.
[0536] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, цитокин представляет собой член, выбранный из ИЛ-2, ИЛ-5, ИЛ-10, ИЛ-12, ИЛ-23, ФНО-α и ИФН-γ.
[0537] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, хемокин представляет собой член, выбранный из ИЛ-8, Gro-α, МВБ-1, МХБ-1, ПГЕ2, ENA-78, и RANTES.
[0538] Согласно примеру реализации настоящего изобретения предложен способ лечения состояния, у животного, включающий введение указанному животному эффективного количества соединения согласно любому из приведенных выше абзацев, благодаря чему осуществляется лечение состояния.
[0539] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, состояние представляет собой член, выбранный из артрита, ревматоидного артрита, воспалительного заболевания кишечника, псориаза, легочного заболевания, рассеянного склероза, нейродегенеративного нарушения, застойной сердечной недостаточности, инсульта, стеноза устья аорты, почечной недостаточности, волчанки, панкреатита, аллергии, фиброза, анемии, атеросклероза, метаболического заболевания, заболевания костей, сердечно-сосудистого заболевания, осложнения, связанного с химиотерапией/радиацией, диабета типа I, диабета типа II, заболевания печени, желудочно-кишечного нарушения, офтальмологического заболевания, аллергического конъюнктивита, диабетической ретинопатии, синдрома Шегрена, увеита, легочного нарушения, заболевания почек, дерматита, кахексии, связанной с ВИЧ, церебральной малярии, анкилозирующего спондилита, проказы, анемии и фибромиалгии.
[0540] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, состояние представляет собой член, выбранный из псориаза, атопического дерматита, ревматоидного артрита, воспалительного заболевания кишечника, астмы и хронической обструктивной болезни легких.
[0541] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, состояние представляет собой псориаз, причем указанный псориаз представляет собой член, выбранный из бляшечного псориаза, псориаза сгибательных поверхностей, каплевидного псориаза, пустулезного псориаза, ногтевого псориаза и эритродермического псориаза.
[0542] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, псориаз представляет собой член, выбранный из бляшечного псориаза и ногтевого псориаза.
[0543] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, животное представляет собой человека.
[0544] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, животное нуждается в лечении.
[0545] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, животное представляет собой человека.
[0546] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, животное еще не нуждается в лечении соединением.
[0547] Согласно примеру реализации настоящего изобретения предложен способ ингибирования фосфодиэстеразы (ФДЭ), причем указанный способ включает: обеспечение контакта фосфодиэстеразы с соединением согласно любому из приведенных выше абзацев или с фармацевтически приемлемой солью указанного соединения, при этом фосфодиэстераза ингибируется.
[0548] Согласно примеру реализации, в соответствии с любым из приведенных выше абзацев, фосфодиэстераза представляет собой член, выбранный из фосфодиэстеразы4 (ФДЭ4) и фосфодиэстеразы7 (ФДЭ7).
[0549] Далее настоящее изобретение проиллюстрировано следующими Примерами. Приведенные Примеры не предназначены определять или ограничивать объем настоящего изобретения.
ПРИМЕРЫ
[0550] Спектры протонного ЯМР получены на спектрометрах Varian AS 300 (300 МГц) или AS 400 (400 МГц), химические сдвиги отображали в 5-шкале (м.д.) в слабом поле относительно тетраметилсилана. Масс-спектры получены на масс-спектрометре Agilent 1200 series plus 6120 Quadrupole LC/MS, Micromass Quattro II или Waters MS, состоящем из Alliance 2795 (ЖХ) и детектора Waters Micromass ZQ. Масс-спектрометр оснащен источником ионизации в электроспрее (ES), работающим в режиме положительных и отрицательных ионов.
[0551] Использованы следующие сокращения:
вод. означает водный;
HATU означает О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат;
EDCI означает N-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорид; мета-СРВА означает 3-хлорпероксибензойная кислота; экв. означает эквивалент;
DIAD означает диизопропилазодикарбоксилат;
ДМФА означает N,N-диметилформамид;
ДМСО означает диметилсульфоксид;
НОАс означает уксусная кислота;
NaCNBH3 означает цианоборгидрид натрия;
к.т.означает комнатная температура;
O/N означает в течение ночи;
ТГФ означает тетрагидрофуран;
Вос2O означает ди-трет-бутилдикарбонат;
МеОН означает метанол;
EtOH означает этанол;
ТФУ означает трифторуксусная кислота;
DIPEA означает диизопропилэтиламин;
РrОН означает 1-пропанол;
iPrOH означает 2-пропанол; и
Т.пл. означает температура плавления.
[0552] Все использованные растворители имеются в продаже. Данные растворители использовали без дополнительной очистки. Реакции обычно проводили в безводных растворителях в инертной атмосфере азота.
[0553] Названия соединений даны либо вручную, либо с использованием программы ChemDraw, либо приведены согласно каталогу, если соединения имеются в продаже.
[0554] ВЭЖХ-анализ выполняли с использованием системы Water 600 Controller, оснащенной Waters 717 Plus Autosampler и Waters 2996 Photodiode Array Detector. Использовали колонку АСЕ C18 (5 мкм, 4,6X150 мм). Условия элюирования: линейный градиент, начиная с 95% А (А: 0,1% Н3РO4 в воде) и заканчивая 90% В (В: MeCN) в течение 6 мин. и затем поддерживали на 90% В до отметки в 10 минут. Затем колонку повторно уравновешивали в течение 3 мин до 95:5; общее время хроматографии: 20 мин. Температуру колонки поддерживали при температуре окружающей среды, скорость потока: 1,0 мл/мин. Диапозон сканирования диодно-матричного детектора: 200-400 нм.
[0555] Тонкослойную хроматографию (ТСХ) выполняли на Alugram® (силикагель, 60 F254) от Mancherey-Nagel, для проявления пятен обычно использовали ультрафиолет. В некоторых случаях использовали другие методики проявления. В этих случаях для проявления соединения ТСХ-пластину проявляли йодом (смешивали приблизительно 1 г I2 с 10 г силикагеля, и тщательно перемешивали), ванилином (данный краситель готовили путем растворения приблизительно 1 г ванилина в 100 мл 10% H2SO4), нингидрином (имеется в продаже, Aldrich) или Magic Stain (готовили путем тщательного перемешиванмя 25 г (NH4)6Мо7O24·4Н2O, 5 г (NH4)2Се (IV) (NO3) 6 в 450 мл воды и 50 мл концентрированной H2SO4). Флэш-хроматографиювыполняли с использованием, как правило, силикагеля 40-63 мкм (230-400 меш) из Silicycle в соответствии с методиками, аналогиными методикам, описанным в Still W.C., Kahn М. and Mitra М. Journal of Organic Chemistry, 1978, 43, 2923-2925. В качестве растворителей для флэш-хроматографии или тонкослойной хроматографии обычно использовали смеси хлороформ/метанол, дихлорметан/метанол, этилацетат/метанол или гексан/этилацетат. Обращеннофазную колоночную хроматографию выполняли на Biotage®, используя С18 картриджи (Biotage) и элюирование градиентом вода/метанол (элюирование обычно от 5% МеОН/Н2O до 90% МеОН/Н2O).
[0556] Препаративную хроматографию выполняли либо на Waters Prep LC 4000 System с использованием детектора Waters 2487 Diode Array, либо на Waters LC Module 1 plus. Использовали колонку Waters XTerra Prep C18 (5 мкм, 30×100 мм) или Phenomenex Luna C18 (5 мкм, 21, 6×250 мм) или Phenomenex Gemini C18 (5 мкм, 100×30 мм). Для элюирования соединения при скорости потока приблизительно 20 мл/мин и общего времени хроматографии в пределах 20-30 мин использовали узкие градиенты ацетонитрил/вода, где вода содержит либо 0,1% трифторуксусной кислоты, либо 0,1% уксусной кислоты.
ПРИМЕР 1
Получение соединения 3 из соединения 1
1.1. Восстановление карбоновой кислоты
[0557] К раствору соединения 1 (23,3 ммоль) в безводном ТГФ (70 мл) в атмосфере азота добавляли по каплям ВИЗ (1,0 М раствор в ТГФ, 55 мл, 55 ммоль) при 0°С, и данную реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем смесь снова охлаждали с помощью ледяной бани, и добавляли по каплям МеОН (20 мл) для разложения избытка ВН3. Полученную смесь перемешивали, пока не прекращалось выделение пузырьков газа, и затем добавляли 10% NaOH (10 мл). Смесь концентрировали, остаток смешивали с водой (200 мл) и экстрагировали EtOAc. Остаток, полученный после упаривания на роторном испарителе, очищали путем колоночной флэш-хроматографии на силикагеле с выходом соединения 320,7 ммоль.
1.2. Результаты
[0558] Типичные соединения структурной формулы 3, полученные с использованием описанной выше методики, включают 1.2.а 2-бром-5-хлорбензиловый спирт; 1.2.b 2-бром-5-метоксибензиловый спирт.
ПРИМЕР 2
Получение соединения 3 из соединения 2
2.1. Восстановление альдегида
[0559] К раствору соединения 2 (Z=Н, 10,7 ммоль) в метаноле (30 мл) добавляли боргидрид натрия (5,40 моль), и данную смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 9,9 ммоль соединения 3.
[0560] Типичные соединения структурной формулы 3, полученные с использованием данной методики, включают 2.2.а 2-бром-5-(4-цианофенокси)бензиловый спирт; 2.2.b 2-бром-4-(4-цианофенокси) бензиловый спирт; 2.2.с 5-(4-цианофенокси)-1-инданол; 2.2.d 2-бром-5-(трет-бутилдиметилсилокси)бензиловый спирт.
[0561] Дополнительные примеры соединений, которые могут быть получены с использованием данной методики, включают 2-бром-4-(3-цианофенокси)бензиловый спирт; 2-бром-4-(4-хлорфенокси)бензиловый спирт; 2-бром-4-феноксибензиловый спирт; 2-бром-5-(3,4-дицианофенокси)бензиловый спирт; 2-(2-бром-5-фторфенил)этиловый спирт; 2-бром-5-фторбензиловый спирт и 1-бром-2-нафталинметанол.
ПРИМЕР 3
Получение соединения 4 из соединения 3
3.1. Защитное алкилирование
[0562] Соединение 3 (20,7 ммоль) растворяли в СН2Сl2 (150 мл) и охлаждали до 0°С в ледяной бане. К данному раствору в атмосфере азота добавляли последовательно N,N-диизопропилэтиламин (5,4 мл, 31,02 ммоль, 1,5 экв.) и хлорметилметиловый эфир (2 мл, 25,85 ммоль, 1,25 экв.). Реакционную смесь перемешивали в течение ночи при комнатной температуре и промывали насыщенным водным раствором NaHCO3 и затем насыщенным водным раствором NaCl. Остаток, полученный после упаривания на роторном испарителе, очищали путем колоночной флэш-хроматографии на силикагеле с получением 17,6 ммоль соединения 4.
3.2. Результаты
[0563] Типичные соединения структурной формулы 4, полученные с I использованием описанной выше методики, включают 3.2.а 2-бром-5-хлор-1-(метоксиметоксиметил)бензол; 3.2.b 2-бром-5-фтор-1-[1-(метоксиметокси)этил]бензол; 3.2.с 2-бром-5-фтор-1-[2-(метоксиметокси)этил]бензол; 3.2.d 2-бром-4,5-дифтор-1-(метоксиметоксиметил)бензол; 3.2.е 2-бром-5-циано-1-(метоксиметоксиметил)бензол; 3.2.f 2-бром-5-метокси-1-(метоксиметоксиметил)бензол; 3.2.g 1-бензил-1-(2-бромфенил)-1-(метоксиметокси)этан; 3.2.h 2-бром-6-фтор-1-(метоксиметоксиметил)бензол; 3.2.1 2-бром-4-(4-цианофенокси)-1-(метоксиметоксиметил)бензол; 3.2.j 2-бром-5-(трет-) бутилдиметилсилокси)-1-(метоксиметоксиметил)бензол; 3.2.k 2-бром-5-(2-цианофенокси)-1-(метоксиметоксиметил)бензол; 3.2.l 2-бром-5-фенокси-1-(метоксиметоксиметил) бензол.
[0564] Дополнительные примеры соединений, которые могут быть получены с использованием данной методики, включают 2-бром-1-(метоксиметоксиметил)бензол; 2-бром-5-метил-1-(метоксиметоксиметил)бензол; 2-бром-5-(метоксиметоксиметил)-1-(метоксиметоксиметил)бензол; 2-бром-5-фтор-1-(метоксиметоксиметил)бензол; 1-бром-2-(метоксиметоксиметил)нафталин; 2-бром-4-фтор-1-(метоксиметоксиметил)бензол; 2-фенил-1-(2-бромфенил)-1-(метоксиметокси)этан; 2-бром-5-(4-цианофенокси)-1-(метоксиметоксиметил)бензол; 2-бром-4-(3-цианофенокси)-1-(метоксиметоксиметил)бензол; 2-бром-4-(4-хлорфенокси)-1-(метоксиметоксиметил)бензол; 2-бром-4-фенокси-1-(метоксиметоксиметил)бензол; 2-бром-5-(3,4-дицианофенокси)-1-(метоксиметоксиметил)бензол.
ПРИМЕР 4
Получение соединения I из соединения 4 через соединение 5
4.1. Металлирование и борилирование
[0565] К раствору соединения 4 (17,3 ммоль) в безводном ТГФ (80 мл) при -78°С в атмосфере азота добавляли по каплям трет-BuLi или H-BuLi (11,7 мл), и раствор становился коричневым. Затем добавляли за один прием В(0Ме)3 (1,93 мл, 17,3 ммоль), и удаляли охлаждающую баню. Смесь постепенно нагревали при перемешивании в течение 30 мин и затем перемешивали на водяной бане в течение 2 ч. После добавления 6 н. НСl (6 мл) смесь перемешивали в течение ночи при комнатной температуре, и согласно ТСХ-анализу имел место приблизительно 50% гидролиз. Раствор упаривали на роторном испарителе, и остаток растворяли в МеОН (50 мл) и 6 н. НСl (4 мл). Полученный раствор подвергали кипячению с обратным холодильником в течение 1 ч, и согласно ТСХ-анализу гидролиз был завершен. Остаток, полученный после упаривания на роторном испарителе, растворяли в EtOAc, промывали водой, сушили и затем упаривали. Полученный неочищенный продукт очищали путем колоночной флэш-хроматографии на силикагеле с получением твердого вещества (чистота 80%). Данное твердое вещество дополнительно очищали путем промывания гексаном с получением 7,2 ммоль соединения I.
4.2 Результаты
[0566] Результаты анализа для типичных соединений структуры I, полученных с использованием описанной выше методики, включают 4.2.а 5-хлор-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С1); 4.2.b 1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С2); 4.2.с 5-фтор-1,3-дигидро-1-гидрокси-3-метил-2,1-бензоксаборол (С3); 4.2.d. 6-фтор-1-гидрокси-1,2,3,4-тетрагидро-2,1-бензоксаборин (С4); 4.2.е 5,6-дифтор-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С5); 4.2.f 5-циано-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С6); 4.2.g 1,3-дигидро-1-гидрокси-5-метокси-2,1-бензоксаборол (С7); 4.2.h 1,3-дигидро-1-гидрокси-5-метил-2,1-бензоксаборол (С8); 4.2.i 1,3-дигидро-1-гидрокси-5-гидроксиметил-2,1-бензоксаборол (С9); 4.2.k 1,3-дигидро-2-окса-1-циклопента[α]нафталин (С11); 4.2.l 7-гидрокси-2,1-оксаборолано[5,4-с]пиридин (С12); 4.2.m 1,3-дигидро-6-фтор-1-гидрокси-2,1-бензоксаборол (С13); 4.2.n 3-бензил-1,3-дигидро-1-гидрокси-3-метил-2,1-бензоксаборол (С14); 4.2.о 3-бензил-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С15); 4.2.р 1,3-дигидро-4-фтор-1-гидрокси-2,1-бензоксаборол (С16); 4.2.q 5-(4-цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С17); 4.2.t 6-(4-цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С18); 4.2.s 6-(3-цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С19); 4.2.t 6-(4-хлорфенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С20); 4.2.u 6-фенокси-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С21); 4.2.v 5-(4-цианобензилокси)-1, 3-дигидро-1-гидрокси-2,1-бензоксаборол (С22); 4.2.w 5-(2-цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С23); 4.2.x 5-фенокси-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С24); 4.2.у 5-[4-(N,N-диэтилкарбамоил)фенокси]-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С25); 4.2.z 1,3-дигидро-1-гидрокси-5-[4-(морфолинокарбонил)фенокси]-2,1-бензоксаборол (С26); 4.2.аа 5-(3,4-дицианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С27); 4.2.ab 6-фенилтио-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С28); 4.2.ас 6-(4-трифторметоксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С29); 4.2.ad 5-(N-метил-N-фенилсульфониламино)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С30); 4.2.ае 6-(4-метоксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С31); 4.2.af 6-(4-метоксифенилтио)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С32); 4.2.аg 6-(4-метоксифенилсульфонил)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С33); 4.2.ah 6-(4-метоксифенилсульфинил)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С34); 4.2.ах 5-трифторметил-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С35) и 4,2.aj 4-(4-цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С36).
[0567] Реакцию сочетания между 4-фторбензонитрилом и замещенным фенолом с получением исходного вещества 2 можно найти в Igarashi, S. et al. Chemical & Pharmaceutical Bulletin (2000), 48(11), 1689-1697.
7-(4-Цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С100)
[0568] Реакцию сочетания между 4-фторбензонитрилом и замещенным фенолом с получением исходного вещества 2 можно найти в Igarashi, S. et al. Chemical&Pharmaceutical Bulletin (2000), 48(11), 1689-1697.
4.2.ak 5-(3-Цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (С37)
[0569] Реакцию сочетания между 3-фторбензонитрилом и замещеным фенолом с получением исходного вещества 2 можно найти в Li, F. et al., Organic Letters (2003), 5(12), 2169-2171.
4.2.al 5-(4-Карбоксифенокси)-1-гидрокси-2,1-бензоксаборол (C38)
[0570] К раствору 5-(4-цианофенокси)-1-гидрокси-2, 1-бензоксаборола (430 мг, 1,71 ммоль), полученнного при синтезе соединения С17, в этаноле (10 мл) добавляли гидроксид натрия (6 моль/л, 2 мл), и данную смесь подвергали кипячению с обратным холодильником в течение 3 часов. Добавляли соляную кислоту (6 моль/л, 3 мл), и полученную смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем колоночной хроматографии на силикагеле (этилацетат) с последующим растиранием с диизопропиловым эфиром с получением целевого соединения (37 мг, 8%).
4.2.am 1-Гидрокси-5-[4-(тетразол-1-ил)фенокси]-2,1-бензоксаборол (С39)
[0571] Смесь 5-(4-цианофенокси)-1-гидрокси-2,1-бензоксаборола (200 мг, 0,7 97 ммоль), азида натрия (103 мг, 1,59 ммоль) и хлорида аммония (85 мг, 1,6 ммоль) в N,N-диметилформамиде (5 мл) перемешивали в течение двух суток при 80°С. Добавляли воду и экстрагировали смесь этилацетатом. Органический слой промывали водой и солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем колоночной хроматографии на силикагеле (этилацетат) и последующего растирания с этилацетатом с получением целевого соединения (55 мг, 23%).
ПРИМЕР 5
Получение соединения I из соединения 2 через соединение 6
5.1. Каталитическое боронилирование, восстановление и циклизация
[0572] Смесь соединения 2 (10,0 ммоль), бис(пинаколато)дибора (2,79 г, 11,0 ммоль), PdCl2 (dppf) (250 мг, 3 молярных %) и ацетата калия (2,94 г, 30,0 ммоль) в 1, 4-диоксане (40 мл) перемешивали в течение ночи при 80°С. Добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Полученный неочищенный продукт растворяли в тетрагидрофуране (80 мл), затем добавляли периодат натрия (5,56 г, 2 6,0 ммоль). После перемешивания при комнатной температуре в течение 30 мин добавляли 2 н. НСl (10 мл), и данную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток обрабатывали диэтиловым эфиром с получением 6,3 ммоль соответствующей бороновой кислоты. К раствору полученной бороновой кислоты (0,595 ммоль) в метаноле (5 мл) добавляли боргидрид натрия (11 мг, 0,30 ммоль), и данную смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли воду и экстрагировали смесь этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем колоночной хроматографии на силикагеле с получением 0,217 ммоль соединения I.
ПРИМЕР 6
Получение соединения I из соединения 3
6.1. Однореакторное боронилирование и циклизация
[0573] К раствору соединения 3 (4,88 ммоль) и триизопропилбората (1,35 мл, 5,86 ммоль) в тетрагидрофуране (10 мл) добавляли по каплям в течение 15 мин при -78°С в атмосфере азота н-бутиллитий (1,6 моль/л в гексане; 6,7 мл, 10,7 ммоль), и данную смесь перемешивали в течение 2 ч, пока смесь не нагревалась до комнатной температуры. Реакцию прекращали путем добавления 2 н. НСl и экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем колоночной хроматографии на силикагеле и обрабатывали пентаном с получением соединения I (0,41 ммоль).
ПРИМЕР 7
Получение соединения I из соединения 3
7.1. Однореакторное борилирование и циклизация с отгонкой
[0574] К раствору соединения 3 (4,88 ммоль) в толуоле (20 мл) добавляли триизопропилборат (2,2 мл, 9,8 ммоль), и данную смесь нагревали при температуре кипения в течение 1 ч. Растворитель, образовавшийся изопропиловый спирт и избыток триизопропилбората удаляли при пониженном давлении. Остаток растворяли в тетрагидрофуране (10 мл) и охлаждали до -78°С. Добавляли по каплям в течение 10 мин н-бутиллитий (3,2 мл, 5,1 ммоль), и данную смесь перемешивали в течение 1 ч, пока смесь не нагревалась до комнатной температуры. Реакцию прекращали путем добавления 2 н. НСl и экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем колоночной хроматографии на силикагеле с получением 1,54 ммоль соединения I.
ПРИМЕР 8
Получение соединения 8 из соединения 7
8.1. Бромирование
[0575] К раствору соединения 7 (49,5 ммоль) в четыреххлористом углероде (200 мл) добавляли N-бромсукцинимид (8,81 г, 49,5 ммоль) и N,N-азоизобутилонитрил (414 мг, 5 молярных %), и данную смесь нагревали при температуре кипения в течение 3 ч. Добавляли воду, и смесь экстрагировали хлороформом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением неочищенного метилбромированного промежуточного соединения 8.
ПРИМЕР 9
Получение соединения 3 из соединения 8
9.1. Гидроксилирование
[0576] К неочищенному соединению 8 (49,5 ммоль) добавляли диметилформамид (150 мл) и ацетат натрия (20,5 г, 250 ммоль), и данную смесь перемешивали в течение ночи при 80°С. Добавляли воду, и смесь экстрагировали диэтиловым эфиром. Органический слой промывали водой и солевым раствором, и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. К остатку добавляли метанол (150 мл) и 1 н. гидроксид натрия (50
мл), и данную смесь перемешивали при комнатной температуре в течение 1 ч.Реакционную смесь концентрировали при пониженном давлении до приблизительно 1/3 исходного объема. Добавляли воду и соляную кислоту, и полученную смесь экстрагировали этилацетатом. Органический слой промывали водой и солевым раствором, и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем колоночной хроматографии на силикагеле и последующего растирания с дихлорметаном с получением 21,8 ммоль соединения 3. 9.2. Результаты
[0577] Типичные соединения структуры 3, полученные с использованием описанной выше методики, включают 9.2.а 2-бром-5-цианобензиловый спирт.
[0578] Дополнительные примеры соединений, которые могут быть получены с использованием данной методики, включают 2-бром-5-(4-цианофенокси)бензиловый спирт.
ПРИМЕР 10
Получение соединения 9 из соединения 2
10.1. Реакция
[0579] Смесь соединения 2 (20,0 ммоль), хлорида
(метоксиметил)трифенилфосфония (8,49 г, 24,0 ммоль) и трет-бутоксида калия (2,83 г, 24,0 моль) в N,N-диметилформамиде (50 мл) перемешивали в при комнатной температуре течение ночи. Реакцию гасили путем добавления 6 н. НСl, затем смесь экстрагировали этилацетатом. Органический слой промывали водой (х 2) и солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. К остатку добавляли тетрагидрофуран (60 мл) и 6 н. НСl, и данную смесь нагревали при температуре кипения в течение 8 ч. Добавляли воду и экстрагировали смесь диэтиловым эфиром. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением соединения 16,6 ммоль 9.
ПРИМЕР 11 Методика, используемая на. стадии 13
11.1. Реакция
[0580] Раствор соединения I в подходящем спиртовом растворителе (Rx-0H) нагревали при температуре кипения в атмосфере азота, и
затем спирт удаляли путем отгонки с получением соответствующего
сложного эфира.
ПРИМЕР 12
Получение соединения 1b из соединения 1а
12.1. Реакция
[0581] К раствору соединения 1а в толуоле добавляли аминоспирт, и собирали выпавшее в осадок твердое вещество с получением соединения lb.
12.2. Результаты
[0582] (500 мг, 3,3 ммоль) растворяли в толуоле (37 мл) при 80°С, и добавляли этаноламин (0,20 мл, 3,3 ммоль). Данную смесь охлаждали до комнатной температуры, затем в ледяной бане и фильтровали с получением соединения С38 в виде белого порошка (600, 5 мг, 94%).
ПРИМЕР 13
5-(4-Карбоксифенокси)-1-гидрокси-2,1-бензоксаборол (С38)
[0583] К раствору 5-(4-цианофенокси)-1-гидрокси-2,1-бензоксаборола (430 мг, 1,71 ммоль), полученного при синтезе соединения С17, в этаноле (10 мл) добавляли гидроксид натрия (6 моль/л, 2 мл), и данную смесь подвергали кипячению с обратным холодильником в течение 3 часов. Добавляли соляную кислоту (6 моль/л, 3 мл), и полученную смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем колоночной хроматографии на силикагеле (этилацетат) и последующего растирания с диизопропиловым эфиром с получением целевого соединения (37 мг, 8%).
ПРИМЕР 14
1-Гидрокси-5-[4-(тетразол-1-ил)фенокси]-2,1-бензоксаборол (С39)
[0584] Смесь 5-(4-цианофенокси)-1-гидрокси-2,1-бензоксаборола (200 мг, 0,797 ммоль), азида натрия (103 мг, 1,59 ммоль) и хлорида аммония (85 мг, 1,6 ммоль) в N,N-диметилформамиде (5 мл) перемешивали в течение двух суток при 80°С. Добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали водой и солевым раствором, и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем колоночной хроматографии на силикагеле (этилацетат) и последующего растирания с этилацетатом с получением целевого соединения (55 мг, 23%).
ПРИМЕР 15
4-(4-Цианофенокси) фенилбороновая кислота (С97)
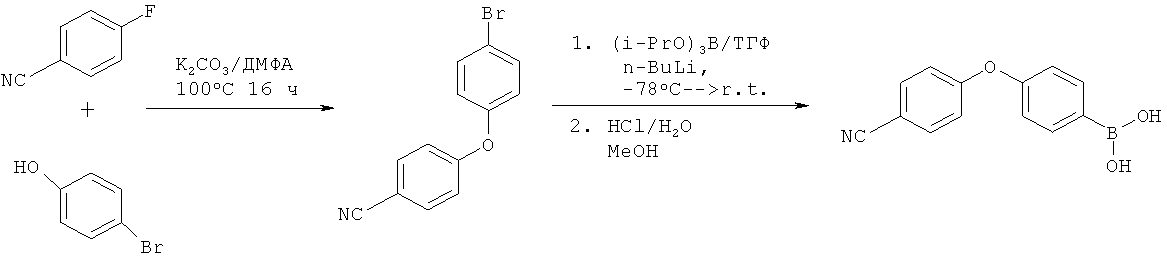
[0585] (а) (4-Цианофенил) (4-бромфенил)овый эфир. Смесь 4-фторбензонитрила (7,35 г, 60,68 ммоль), 4-бромфенола (10 г, 57,8 ммоль) и карбоната калия (12 г, 1,5 экв.) в ДМФА (100 мл) в атмосфере азота перемешивали в течение 16 ч при 100°С и затем фильтровали. Остаток, полученный после упаривания на роторном испарителе, растворяли в этилацетате и промывали 1 н. раствором NaOH для удаления непрореагировавшего фенола. Затем органический раствор сушили и пропускали через короткую колонку силикагеля для удаления окраски и незначительных следов фенола. Полученный раствор упаривали с выходом (4-цианофенил)(4-бромфенил)ового эфира (13,82 г, 87,2%) в виде белого твердого вещества. 1Н ЯМР (300 МГц, ДМСО-d6): δ 7,83 (d, 2Н), 7,63 (d, 2Н), 7,13 (d, 2Н) и 7,10 (d, 2Н) м.д.
[0586] (b) 4-(4-Цианофенокси)фенилбороновая кислота. Для синтеза 4-(4-цианофенокси)фенилбороновой кислоты из (4-цианофенил) (4-бромфенил)ового эфира в качестве исходного вещества, использовали методику, описанную в Примере 2d. Указанное в заголовке соединение получали в виде белого твердого вещества. Т.пл.: 194-198°С. Масс-спектр: m/z=239 (М+), 240 (М+1) (ИЭР+) и m/z=238 (М-1) (ИЭР-). Чистота (ВЭЖХ): 95,3% при 254 нм и 92,1% при 220 нм. 1Н ЯМР (300 МГц, ДMCO-d6+D2O): δ 7,83-7,76 (m, 4Н), 7,07 (d, 2Н) и 7,04 (d, 2Н) м.д.
ПРИМЕР 16
3-(4-Цианофенокси) фенилбороновая кислота (С98)
[0587] В соответствии с методиками, использованными для синтеза соединения С21, синтезировали указанное в заголовке соединение из (4-цианофенил)(3-бромфенил)ового эфира (который получали, используя в качестве исходных веществ 3-бромфенол и 4-фторбензонитрил). Продукт получали в виде белого твердого вещества.
ПРИМЕР 17
4-(4-Цианофенокси)-2-Метилфенилбороновая кислота (С99)
[0588] В соответствии с методиками, использованными для синтеза соединения С21, синтезировали указанное в заголовке соединение синтезировали из (4-цианофенил)(4-бром-3-метилфенил)ового эфира (который получали, используя в качестве исходных веществ 4-бром-3-метилфенол и 4-фторбензонитрил). Продукт получали в виде кремового твердого вещества.
ПРИМЕР 18
Циклические бороновые эфира
[0589] С помощью методик, приведенных в данном описании, могут быть получены дополнительные соединения. При выборе соответствующего исходного вещества, такого как соединение 1 или 3, методики, приведенные в данном описании, могут быть использованы для получения следующих соединений..
[0590] Получены типичные соединения структуры I: 18а этил 2-(1-гидрокси-1,3-дигидробензо[с][1,2] оксаборол-5-илокси)ацетат (С41); 18b 2-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)уксусную кислоту (С42); 18 с 6-(тиофен-2-илтио)бензо[с][1,2]оксаборол-1(3Н)-ол (С43); 18d 6-(4-фторфенилтио)бензо[с][1,2]оксаборол-1(3Н)-ол (С44); 18е 1-(3-((1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)метил)фенил)пентан-1-он (С45); 18f 2-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-1-(пиперидин-1-ил)этанон (С46); 18g 2-(1-гидрокси-1,3-дигидробензо[с][1,2] оксаборол-5-илокси)-1-(4-(пиримидин-2-ил)пиперазин-1-ил)этанон (С47); 18h 6-(4-(пиридин-2-ил)пиперазин-1-ил)бензо[с][1,2]оксаборол-1(3Н)-ол (С48); 18i 6-нитробензо[с][1,2]оксаборол-1(3Н)-ол (С49); 18j 6-аминобензо[с][1,2]оксаборол-1(3Н)-ол (С50); 18k 6-(диметиламино)бензо[с][1,2]оксаборол-1(3Н)-ол (С51); 181 N-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-6-ил)бензамид (С52); 18m 6-(4-фенилпиперазин-1-ил)бензо[с][1,2]оксаборол-1(3Н)-ол (С53); 18n 6-(1Н-индол-1-ил)бензо[с][1,2]оксаборол-1(3Н)-ол (С55); 18о 6-морфолинобензо[с][1,2]оксаборол-1(3Н)-ол (С56); 18р 6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинонитрил (С57); 18q 5-фтор-6-нитробензо[с][1,2]оксаборол-1(3Н)-ол (С58); 18r 5-бром-6-(гидроксиметил)бензо[с][1,2]оксаборол-1(3Н)-ол (С59); 18s 3,1-дигидро-1,5-дигидрокси-1Н, 3Н-бензо[1,2-е: 4,5-с']бис[1,2]оксаборол (С60); 18t 1-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-6-ил)-3-фенилмочевину (С61); 18u N-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-6-ил)бензолсульфонамид (С62); 18v N-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-6-ил)ацетамид (С63); 18w 7-(гидроксиметил)бензо[с][1,2]оксаборол-1(3Н)-ол (С64); 18х 7-метилбензо[с][1,2]оксаборол-1(3Н)-ол (С65); 18у 6-(3-(фенилтио)-1Н-индол-1-ил)бензо[с][1,2]оксаборол-1(3Н)-ол (С66); 18z 3-(1-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-6-ил)-1Н-индол-3-илтио)пропаннитрил (С67); 18аа 6-(5-метокси-1Н-индол-1-ил)бензо[с][1,2]оксаборол-1(3Н)-ол (С68); 18ab 5,6-метилендиоксибензо[с][1,2]оксаборол-1(3Н)-ол. (С69); 18ас 6-амино-5-фторбензо[с][1,2]оксаборол-1(3Н)-ол (С70); 18ad 6-(бензиламино)-5-фторбензо[с][1,2]оксаборол-1(3Н)-ол (С71); 18ае 6-(5-метокси-3-(фенилтио)-1Н-индол-1-ил)бензо[с][1,2]оксаборол-1(3Н)-ол (С72); 18аf 3-(1-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-6-ил)-5-метокси-1Н-индол-3-илтио)пропаннитрил (С73); 18аg 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-1-илокси)бензонитрил (С74); 18ah 6-(5-хлор-1Н-индол-1-ил)бензо[с][1,2]оксаборол-1(3Н)-ол (С75); 18ai 3-(5-хлор-1-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-6-ил)-1H-индол-3-илтио)пропаннитрил (С76); 18aj 6-(бензиламино)бензо[с][1,2]оксаборол-1(3Н)-ол (С77); 18аk 6-(дибензиламино)бензо[с][1,2]оксаборол-1(3Н)-ол (С78); 18аl 7-(4-(1Н-тетразол-5-ил)фенокси)бензо[с][1,2]оксаборол-1(3Н)-ол (С79); 18am 6-(5-хлор-3-(фенилтио)-1Н-индол-1-ил)бензо[с][1,2]оксаборол-1(3Н)-ол (С80); 18аn 6-(4-(пиримидин-2-ил)пиперазин-1-ил)бензо[с][1,2]оксаборол-1(3Н)-ол (С82); 18ао 7-(бензилокси)бензо[с][1,2]оксаборол-1(3Н)-ол (С83); 18ар 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-6-илтио)пиридинияхлорид (С84); 18aq 6-(пиридин-2-илтио)бензо[с][1,2]оксаборол-1(3Н)-ол (С85); 18аr 7-фторбензо[с][1,2]оксаборол-1(3Н)-ол (С86); 18аs 6-(4-(трифторметил)фенокси)бензо[с][1,2]оксаборол-1(3Н)-ол (С87); 18at 6-(4-хлорфенилтио)бензо[с][1,2]оксаборол-1(3Н)-ол (С88); 18аu 6-(4-хлорфенилсулъфинил)бензо[с][1,2]оксаборол-1(3Н)-ол (С89); 18av 6-(4-хлорфенилсульфонил)бензо[с][1,2]оксаборол-1(3Н)-ол (С90); 18aw N-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-ил)-N-(фенилсульфонил)бензолсульфонамид (С91); 18ах 6-(4-(трифторметил)фенилтио)бензо[с][1,2]оксаборол-1(3Н)-ол (С92); 18ау 6-(4-(трифторметил)фенилсульфинил)бензо[с][1,2]оксаборол-1(3Н)-ол (С93); 18az 6-(4-(метилтио)фенилтио)бензо[с][1,2]оксаборол-1(3Н)-ол (С94); 18bа 6-(пара-толилтио)бензо[с][1,2]оксаборол-1(3Н)-ол (С95); 18bb 3-((1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)метил) бензонитрил (С96).
ПРИМЕР 19
19а 5-(4-Цианобензилокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D1)
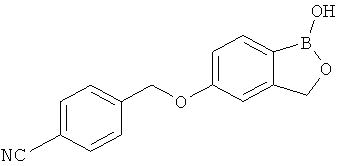
[0591] Смесь 4-бром-3-формилфенола (25,2 г, 125 ммоль), трет-бутилдиметилхлорсилана (21,4 г, 138 ммоль) и имидазола (9,63 г, 14 0 ммоль) в дихлорметане (30 0 мл) перемешивали при комнатной температуре в течение 3 часов. Добавляли воду, и данную смесь экстрагировали хлороформом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением неочищенного силилового эфира (40,9 г, количественный выход). К раствору неочищенного силилового эфира (36,8 г, 117 ммоль) в метаноле (300 мл) добавляли порциями боргидрид натрия (2,22 г, 58,4 ммоль) при 0°С, и данную смесь перемешивали в течение 1 часа при комнатной температуре. Медленно добавляли воду, и удаляли при пониженном давлении растворитель до приблизительно 1/3 исходного объема. Смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 2-бром-5-трет-бутилдиметилсилоксибензилового спирта (36,9 г, количественный выход).
[0592] 1Н-ЯМР (300 МГц, CDCl3) δ (м.д.) 0,20 (s, 6Н), 0,98 (s, 9Н), 4,67 (br s, 1H), 6,65 (dd, J=8,2, 2,6 Гц, 1Н), 6,98 (d, J=2,9 Гц, 1H), 7,36 (d, J=8,8 Гц, 1H).
[0593] К раствору 2-бром-5-трет-бутилдиметилсилоксибензилового спирта (36,9 г, 116 ммоль) и диизопропилэтиламина (26,0 мл, 150 ммоль) в дихлорметане (30 0 мл) добавляли хлорметилметиловый эфир (11,0 мл, 145 ммоль), и данную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду, и смесь экстрагировали хлороформом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем колоночной хроматографии на силикагеле (гексан/этилацетат, 96:4) с получением 1-бром-4-трет-бутилдиметилсилокси-2-метоксиметоксиметилбензола (39,3 г, 94%).
[0594] 1H-ЯМР (300 МГц, CDCl3) δ (м.д.) 0,19 (s, 6Н), 0,98 (s, 9Н), 3,43 (s, 3Н), 4,59 (s, 2Н), 4,75 (s, 2Н), 6,64 (dd, J=8,5, 2,9 Гц, 1Н), 6,98 (d, J=2,9 Гц, 1Н), 7,36 (d, J=8,5 Гц, 1Н).
[0595] К раствору 1-бром-4-трет-бутилдиметилсилокси-2-метоксиметоксиметилбензола (34,2 г, 94,8 ммоль) в тетрагидрофуране (100 мл) добавляли фторид тетрабутиламмония (1 моль/л в тетрагидрофуране, 5 0 мл), и данную смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем колоночной хроматографии на силикагеле (гексан/этилацетат, 2:1) с получением 4-бром-3-(метоксиметоксиметил)фенола (25,9 г, количественный выход).
[0596] 1Н-ЯМР (300 МГц, CDCl3) δ (м.д.)3, 44 (s, 3Н), 4,61 (s, 2Н), 4,77 (s, 2Н), 6,66 (dd, J=8,5, 2,9 Гц, 1Н), 7,00 (d, J=2,9 Гц, 1Н), 7, 37 (d, J=8,5 Гц, 1Н).
[0597] Смесь 4-бром-3-(метоксиметоксиметил)фенола (2,47 г, 10,0 ммоль), 4-цианобензилбромида (1,88 г, 9,50 ммоль) и карбоната калия (1,66 г, 12,0 ммоль) в N,N-диметилформамиде (20 мл) перемешивали в течение ночи при 70°С. Добавляли воду и экстрагировали смесь этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 4-[4-бром-3-(метоксиметоксиметил)феноксиметил]бензонитрила (1,88 г, 95%).
[0598] Соединение, полученное на предыдущей стадии, превращали в целевое соединение аналогично Примеру 4.2.q (С17).
[0599] 1Н-ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 4,90 (s, 2Н), 5,25 (s, 2Н), 6,98 (dd, J=7,9, 2,1 Гц, 1Н), 7,03 (d, J=1,8 Гц, 1Н), 7,62 (d, J=7,9 Гц, 1Н), 7,64 (d, J=8,5 Гц, 2Н), 7,86 (d, J=8,5 Гц, 1Н), 9,01 (s, 1Н).
19b 5-(3-Хлор-4-цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D2)
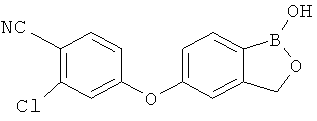
[0600] Смесь 2-бром-5-гидроксибензальдегида (60,0 г, 299 ммоль), этиленгликоля (56 мл, 1,00 моль) и пара-толуолсульфоновой кислоты (1,14 г, 5,98 ммоль) в толуоле (450 мл) в течение ночи подвергали кипячению с обратным холодильником с использованием насадки Дина-Старка. Добавляли карбонат калия (3 г), и данную смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 4-бром-3-(1,3-диоксолан-2-ил)фенола (66,1 г, 90%).
[0601] 1Н-ЯМР (300 МГц, ДMCO-d6) δ (м.д.)3, 9-4,1 (m, 4Н), 5,81 (s, 1Н), 6,71 (dd, J=8,5, 2,9 Гц, 1Н), 6,96 (d, J=2,9 Гц, 1Н), 7,36 (d, J=7,9 Гц, 1Н), 9,81 (brs, 1Н).
[0602] Смесь 2-хлор-4-фторбензонитрила (4,43 г, 28,4 ммоль), 4-бром-3-(1,3-диоксолан-2-ил)фенола (6,96 г, 28,4 ммоль) и карбоната калия (4,70 г, 34,1 ммоль) в N, N-диметилформамиде (60 мл) перемешивали в течение ночи при 100°С в атмосфере азота. Данную смесь вливали в смесь этилацетат /вода. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением неочищенного 4-(4-бром-3-(1, 3-диоксолан-2-ил)фенокси)-3-хлорбензонитрила (10,8 г), который использовали без очистки на следующей стадии.
[0603] Полученное на предыдущей стадии соединение (10,8 г) растворяли в тетрагидрофуране (40 мл), добавляли 3 М НСl (20 мл), и данную смесь подвергали кипячению с обратным холодильником в течение 2 ч. Добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 4-(4-бром-3-формилфенокси)-3-хлорбензонитрила (9,76 г, количественный выход.).
[0604] 1Н-ЯМР (300 МГц, CDCl3) δ (м.д.) 6,94 (dd, J=8,5, 2,3 Гц, 1Н), 7,06 (d, J=2,3 Гц, 1Н), 7,21 (dd, J=8,5, 2,9 Гц, 1Н), 7,59 (d, J=2,9 Гц, 1Н), 7,64 (d, J=8,5 Гц, 1Н), 7,73 (d, J=8,5 Гц, 1Н), 10,2 (s, 1Н).
[0605] К раствору 4-(4-бром-3-формилфенокси)-3-хлорбензонитрила (9,25 г, 27,4 ммоль) в метаноле (80 мл) добавляли порциями при 0°С боргидрид натрия (522 мг, 13,7 ммоль), и данную смесь перемешивали в течение 1 ч при комнатной температуре Растворитель удаляли до приблизительно половины исходного объема, добавляли 1 М НСl, и данную смесь вливали в смесь этилацетат/вода. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем хроматографии на силикагеле (гексан/этилацетат, 8:2-7:3) с получением 4-(4-бром-3-(гидроксиметил)фенокси)-3-хлорбензонитрила (8,19 г, выход за 3 стадии 85%).
[0606] 1Н-ЯМР (300 МГц, CDCl3) δ (м.д.) 1,87 (brs, 1H), 4,75 (s, 2H), 6,89 (dd, J=8,5, 2,9 Гц, 1H), 6,92 (dd, J=8,8, 2,6 Гц, 1H), 7,03 (d, J=2,6 Гц, 1H), 7,27 (d, J=2,9 Гц, 1H), 7,58 (d, J=8,8 Гц, 1H), 7,61 (d, J=8,8 Гц, 1H).
[0607] К раствору 4-(4-бром-3-(гидроксиметил)фенокси)-3-хлорбензонитрила (4,08 г, 12 ммоль) в толуоле (160 мл) добавляли триизопропилборат (4,15 мл, 18,0 ммоль), растворитель отгоняли через насадку Дина-Старка, пока объем не уменьшался до приблизительно 3 мл. Добавляли тетрагидрофуран (3 мл), и данную смесь охлаждали до -78°С. Затем добавляли по каплям н-бутиллитий (1,6 М раствор в гексане, 7,5 мл, 12 ммоль), и данную смесь оставляли нагреваться до комнатной температуры. Реакцию прекращали путем добавления 1 М раствора НСl, и затем смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем хроматографии на силикагеле (гексан/этилацетат, 70:30-55:45) и последующего растирания с изопропиловым эфиром с получением 5-(3-хлор-4-)цианофенокси)-1-гидрокси-2,1-бензоксаборола (1,64 г, 39%).
[0608] 1H-ЯМР (300 МГц, ДMCO-d6) δ (м.д.) 4,97 (s, 2Н), 7,08 (dd, J=8,9, 2,3 Гц, 1Н), 7,13 (dd, J=7,9, 2,1 Гц, 1Н), 7,20 (d, J=2,1 Гц, 1Н), 7,36 (d, J=2,3 Гц, 1Н), 7,80 (d, J=7,9 Гц, 1Н), 7,96 (d, J=8,8 Гц, 1Н), 9,25 (s, 1Н).
19с 5-(4-Циано-3-метилфенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D3)
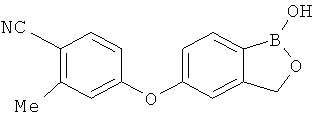
[0609] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19b (D2), из 4-фтор-2-метилбензонитрила и 4-бром-3-(1,3-диоксолан-2-ил)фенола.
[0610] 1Н-ЯМР (300 МГц, ДМСО-d6) δ (м.д.)2, 43 (s, 3Н), 4,95 (s, 2Н), 6,94 (dd, J=8,5, 2,6 Гц, 1Н), 7,06 (dd, J=7,9, 2,3 Гц, 1Н), 7,08 (d, J=2,3 Гц, 1Н), 7,12 (d, J=2,1 Гц, 1Н), 7,77 (d, J=8,5 Гц, 2Н), 9,21 (s, 1Н).
19d 5-(2-Хлор-4-цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D4)
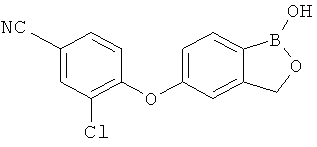
[0611] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19b (D2), из 3-хлор-4-фторбензонитрила и 4-бром-3-(1,3-диоксолан-2-ил)фенола.
[0612] 1H-ЯМР (300 МГц,ДMCO-d6) δ (м.д.) 4,94 (s, 2Н), 7,07 (d, J=8,2 Гц, 1Н), 7,11 (d, J=0,9 Гц, 1Н), 7,12 (dd, J=8,8, 1,2 Гц, 1Н), 7,7-7,9 (m, 2Н), 8,24 (d, J=2,1 Гц, 1Н), 9,23 (s, 1Н).
19е 5-(4-Циано-3-трифторметилфенокси) -1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D5)
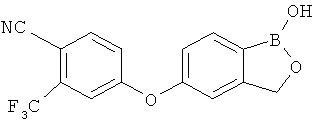
[0613] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19b (D2), из 4-фтор-2-трифторметилбензонитрила и 4-бром-3-(1,3-диоксолан-2-ил)фенола.
[0614] 1Н-ЯМР (300 МГц, ДMCO-d6) δ (м.д.) 4,97 (s, 2Н), 7,16 (dd, J=7,0, 2,1 Гц, 1Н), 7,24 (d, J=2,1 Гц, 1Н), 7,35 (dd, J=8,5, 2,3 Гц, 1Н), 7,60 (d, J=2,6 Гц, 1Н), 7,81 (d, J=8,2 Гц, 1Н), 8,14 (d, J=8,5 Гц, 1Н), 9,27 (s, 1Н).
19f 5-(4-Циано-3-метоксикарбонилфенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол, (D6)
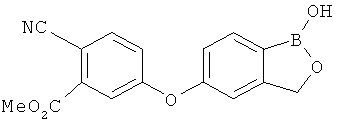
[0615] Смесь метил 2-циано-5-фторбензоата (4,48 г, 25,0 ммоль), 2-бром-5-гидроксибензальдегида (5,03 г, 25,0 ммоль) и карбоната калия (4,14 г, 30.0 ммоль) в N,N-диметилформамиде (50 мл) перемешивали при 80°С в течение ночи. Добавляли воду и экстрагировали смесь этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем хроматографии на силикагеле (хлороформ) с получением метил 5-(4-бром-3-формилфенокси)-2-цианобензоата (5,35 г, 71%).
[0616] 1Н-ЯМР (300 МГц, CDCl3) δ (м.д.)3, 98 (s, 3Н), 7,18-7,24 (m, 2Н), 7,58 (d, J=2,9 Гц, 1Н), 7,66 (d, J=2,6 Гц, 1Н), 7,72 (d, J=8,8 Гц, 1Н), 7,78 (d, J=8,5 Гц, 1Н), 10,3 (s, 1Н).
[0617] Смесь метил 5-(4-бром-3-формилфенокси)-2-цианобензоата (11,9 г, 33,1 ммоль), бис(пинаколато)дибора (8,89 г, 35,0 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (II) (678 мг, 0,828 ммоль) и ацетата калия (9,75 г, 99,0 ммоль) в 1,4-диоксане (160 мл) перемешивали в течение ночи при 80°С в атмосфере азота. Затем смесь фильтровали через подушку целита, и удаляли при пониженном давлении растворитель. В результате хроматографии на колонке силикагеля (гексан/этилацетат, 65:35) получали метил 2-циано-5-(3-формил-4-(4,4,5, 5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)бензоат (15,7 г).
[0618] К раствору метил 2-циано-5-(3-формил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)бензоата (15,7 г) в метаноле (150 мл) добавляли порциями при 0°С боргидрид натрия (646 мг, 17,0 ммоль). Данную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь подкисляли путем добавления 6 М НСl и экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем хроматографии на силикагеле (гексан/этилацетат, 6:4-4:6) и последующей перекристаллизации из смеси метанол/вода с получением 5-(4-циано-3-метоксикарбонилфенокси)-1-гидрокси-2,1-бензоксаборола (6, 34 г, 62%).
[0619] 1Н-ЯМР (300 МГц, ДMCO-d6) δ (м.д.)3,86 (s, 3Н), 7,13 (dd, J=7,9, 2,1 Гц, 1Н), 7,20 (d, J=2,1 Гц, 1Н), 7,39 (dd, J=8,6, 2,6 Гц, 1Н), 7,55 (d, J=2,6 Гц, 1Н), 7,80 (d, J=7,9 Гц, 1Н), 8,01 (d, J=8,8 Гц, 1Н), 9,25 (s, 1Н).
19g 5-(4-Карбамоил-3-метоксикарбонилфенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D7)
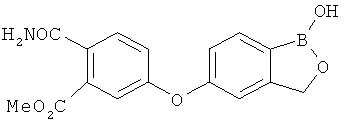
[0620] Смесь 5-(4-Циано-3-метоксикарбонилфенокси)-1-гидрокси-2,1-бензоксаборола (5,25 г, 17,0 ммоль) и 1 М NaOH (50 мл) в метаноле (150 мл) перемешивали в течение 1 ч при комнатной температуре. Затем смесь подкисляли путем добавления 6 М НСl и экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем хроматографии на силикагеле (этилацетат) и последующего растирания с диизопропиловым эфиром с получением 5-(4-карбамоил-3-метоксикарбонилфенокси)-1-гидрокси-2,1-бензоксаборола (1,09 г, 19%).
[0621] 1H-ЯМР (300 МГц, ДМСО-d6) δ (м.д.)3, 70 (s, 3Н), 4,94 (s, 2Н), 7,0-7,1 (m, 2Н), 7,15-7,25 (m, 2Н), 7,40 (br s, 1Н), 7,61 (d, J=8,8 Гц, 1Н), 7,75 (d, J=7,9 Гц, 1Н), 7,90 (br s, 1Н), 9,19 (s, 1H).
19h 5-(3-Карбокси-4-цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D8)
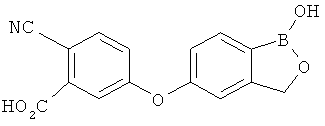
[0622] Смесь 5-(4-циано-3-метоксикарбонилфенокси)-1-гидрокси-2,1-бензоксаборола (5,25 г, 17,0 ммоль) и 1 М NaOH (50 мл) в метаноле (150 мл) перемешивали в течение 1 ч при комнатной температуре. Затем смесь подкисляли путем добавления 6 М НСl и экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем хроматографии на силикагеле (этилацетат - хлороформ/метанол, 3:1) и последующего растирания с этилацетатом с получением 5-(3-карбокси-4-цианофенокси)-1-гидрокси-2,1-бензоксаборола (810 мг, 16%).
[0623] 1Н-ЯМР (300 МГц, ДMCO-d6) δ (м.д.) 4,95 (s, 2Н), 7,04-7,16 (m, 3Н), 7,43 (d, J=2,3 Гц, 1Н), 7,71 (d, J=8,5 Гц, 1Н), 7,78 (d, J=8,0 Гц, 1Н), 9,27 (br s, 1Н).
19i 5-(1,3-Дигидро-1-гидрокси-2,1-бензоксаборол-5-илокси)изоиндолин-1,3-дион (D9)
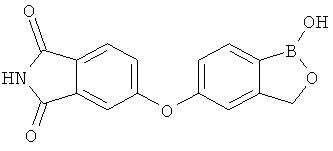
[0624] Смесь 5-(4-карбамоил-3-метоксикарбонилфенокси)-1-гидрокси-2,1-бензоксаборола (560 мг, 1,71 ммоль) и 1 М NaOH (5 мл) в метаноле (15 мл) перемешивали при комнатной температуре в течение 10 мин. Затем смесь подкисляли путем добавления 6 М НСl и экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток растирали с этилацетатом с получением 5-(1,3-дигидро-1-гидрокси-2,1-бензоксаборол-5-илокси)изоиндолин-1,3-диона (380 мг, 75%).
[0625] 1Н-ЯМР (300 МГц, ДMCO-d6) δ (м.д.) 4,96 (s, 2Н), 7,11 (dd, J=7,9, 1,5 Гц, 1Н), 7,17 (s, 1Н), 7,25 (d, J=2,3 Гц, 1Н), 7,38 (dd, J=8,2, 2,3 Гц, 1H), 7,82 (d, J=8,2 Гц, 1H), 7,83 (d, J=8,2 Гц, 1H), 9,23 (s, 1H), 11,3 (br s, 1H).
19j 5-(4-Циано-3-гидроксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D10)
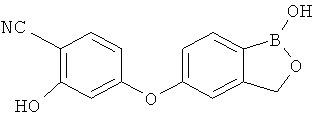
[0626] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19n (D14), из 4-фтор-3-гидроксибензонитрила и 4-бром-3-(1,3-диоксолан-2-ил)фенола.
[0627] 1Н-ЯМР (300 МГц, ДMCO-d6) δ (м.д.) 4,96 (s, 2Н), 6,49 (d, J=2,3 Гц, 1Н), 6,55 (dd, J=8,8, 2,3 Гц, 1Н), 7,08 (dd, J=7,9, 2,1 Гц, 1Н), 7,15 (d, J=1,8 Гц, 1Н), 7,60 (d, J=8,5 Гц, 1Н), 7,78 (d, J=8,2 Гц, 1Н), 9,23 (s, 1Н), 11,2 (s, 1Н).
19k 5-(4-Циано-3-ацетоксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D11)
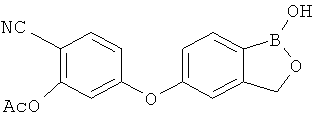
[0628] Смесь 5-(4-циано-3-гидроксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (900 мг, 3,37 ммоль), уксусного ангидрида (1,7 мл, 18 ммоль), триэтиламина (1,4 мл, 10 мл) в N,N-диметилформамиде (10 мл) перемешивали при комнатной температуре в течение ночи. Затем смесь подкисляли путем добавления 1 М НСl и экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем хроматографии на силикагеле (гексан/этилацетат, 1:1) с получением 5-(4-циано-3-ацетоксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (818 мг, 79%).
[0629] 1Н-ЯМР (300 МГц, ДMCO-d6) δ (м.д.)2,31 (s, 3Н), 4,96 (s, 2Н), 7,04 (dd, J=8,5, 2,6 Гц, 1Н), 7,07 (d, J=2,3 Гц, 1Н), 7,12 (dd, J=7,9, 2,1 Гц, 1Н), 7,20 (d, J=2,0 Гц, 1Н), 7,80 (d, J=7,9 Гц, 1Н), 7,91 (d, J=8,6 Гц, 1Н), 9,25 (s, 1Н).
19l 5-(4-Циано-3-метоксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D12)
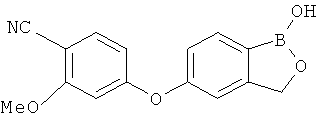
[0630] К раствору 5-(4-циано-3-гидроксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (100 мг, 0,375 ммоль) и иодметана (0,07 0 мл. 1,1 ммоль) в N,N-диметилформамиде (10 мл) добавляли гидрид натрия (60% дисперсия в масле, 45 мг, 1,1 ммоль) при 0°С в атмосфере азота, и данную смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли воду и 1 М НСl, и данную смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток обрабатывали смесью гексан/диизопропиловый эфир с получением 5-(4-циано-3-метоксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (92 мг, 87%).
[0631] 1Н-ЯМР (300 МГц, ДMCO-d6) δ (м.д.) 3,86 (s, 3Н), 4,96 (s, 2Н), 6,56 (dd, J=8,5, 2,1 Гц, 1Н), 6,93 (d, J=2,3 Гц, 1Н), 7,09 (dd, J=8,2, 2,1 Гц, 1Н), 7,14 (s, 1Н), 7,70 (d, J=8,5 Гц, 1Н), 7,77 (d, J=7,9 Гц, 1Н), 9,22 (s, 1Н).
19m 5-(3-Хлор-2-цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D13)
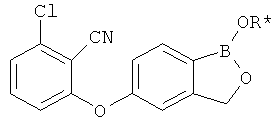
[0632] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19b (D2), из 2-хлор-6-фторбензонитрила и 4-бром-3-(1,3-диоксолан-2-ил)фенола.
[0633] 1H-HMP (300 МГц, ДМСО-d6) δ (м.д.) 4,96 (s, 2Н), 6,97 (d, J=8,5 Гц, 1Н), 7,16 (dd, J=7,9, 2,1 Гц, 1Н), 7,21 (d, J=2,1 Гц, 1Н), 7,49 (d, J=8,2 Гц, 1Н), 7,66 (t, J=8,2 Гц, 1Н), 7,79 (d, J=8,2 Гц, 1Н), 9,25 (s, 1Н).
19n 5-(4-Циано-2-гидроксифвнокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D14)
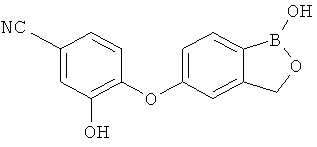
[0634] К раствору 4-фтор-3-гидроксибензонитрила (25,0 г, 182 ммоль), диизопропилэтиламина (47,7 мл, 273 ммоль) в дихлорметане (530 мл) добавляли по каплям хлорметилметиловый эфир (16,6 мл, 219 ммоль) при 0°С, и данную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду и экстрагировали смесь дихлорметаном. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 4-фтор-3-метоксиметоксибензонитрила (33,0 г, количественный выход.), который использовали без очистки на следующей стадии.
[0635] Смесь 4-фтор-3-метоксиметоксибензонитрила (33,0 г, 182 ммоль), 4-бром-3-(1,3-диоксолан-2-ил)фенола (44,6 г, 182 ммоль), и карбоната калия (30,1 г, 218 ммоль) в N,N-диметилформамиде (370 мл) перемешивали в течение ночи при 100°С в атмосфере азота. Данную смесь вливали в смесь этилацетат/вода. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, остаток пропускали через короткую колонку с силикагелем (гексан/этилацетат, 3:1) и затем растирали со смесью гексан/этилацетат с получением 4-(4-бром-3-(1,3-диоксолан-2-ил)фенокси)-3-метоксиметоксибензонитрила (32,6 г, 44%).
[0636] 1H-HMP (300 МГц, CDCl3) δ (м.д.)3, 46 (s, 3Н), 4,0-4,2 (m, 4Н), 5,20 (s, 2Н), 6,03 (s, 1Н), 6,86 (dd, J=8,5, 2,9 Гц, 1Н), 6,93 (d, J=8,5 Гц, 1Н), 7, 24-7, 30 (m, 2Н), 7,54 (d, J=8,8 Гц, 1Н), 7, 54 (d, J=2, 1 Гц, 1Н).
[0637] К раствору 4-(4-бром-3-(1,3-диоксолан-2-ил)фенокси)-3-метоксиметоксибензонитрила (32,2 г, 79,3 ммоль) в тетрагидрофуране
(300 мл) добавляли 3 М НСl (100 мл), и данную смесь подвергали кипячению с обратным холодильником в течение 2 ч. Добавляли воду и экстрагировали смесь этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 4-(4-бром-3-формилфенокси)-3-гидроксибензонитрила (25,8 г, количественный выход).
[0638] Смесь 4-(4-бром-3-формилфенокси)-3-гидроксибензонитрила (20,5 г, 64,5 ммоль), бис(пинаколато)дибора (17,2 г, 67,7 ммоль), [1,11-бис(дифенилфосфино)ферроцен]дихлорпалладия (II) (1,32 г, 1,61 ммоль) и ацетата калия (19,1 г, 194 ммоль) в 1,4-диоксане (260 мл) перемешивали в течение ночи при 80°С в атмосфере азота. Затем смесь фильтровали через слой целита и удаляли растворитель при пониженном давлении. В результате хроматографии на колонке силикагеля (этилацетат) получали метил 4-(3-формил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)-3-гидроксибензонитрил (25,1 г).
[0639] К раствору метил 4-(3-формил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил) фенокси)-3-гидроксибензонитрила (25,1 г) в метаноле (300 мл) добавляли порциями боргидрид натрия (2,45 г, 64,5 ммоль) при 0°С. Данную смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель удаляли при пониженном давлении до приблизительно 1/3 исходного объема. Смесь подкисляли путем добавления 6 М НСl и экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, остаток очищали путем хроматографии на силикагеле (гексан/ацетон, 7:3-6:4) и последующей перекристаллизации из смеси ацетон/вода и растирали с этилацетатом с получением 5-(4-циано-2-гидроксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (10,9 г, 63%).
[0640] 1H-ЯМР (300 МГц, ДMCO-d6) δ (м.д.) 4,90 (s, 2Н), 6,90-6,95 (m, 2Н), 7,09 (d, J=7,9 Гц, 1Н), 7, 26-7, 33 (m, 2Н), 7,69 (d, J=7,9 Гц, 1Н), 9,12 (s, 1Н), 10,4 (br s, 1Н).
19о 5-(4-Циано-2-метоксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D15)
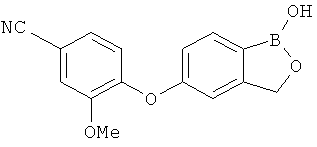
[0641] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 271 (D12), из 5-(4-циано-2-гидроксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (D14) и иодметана.
[0642] 1Н-ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 3, 80 (s, 3Н), 4,90 (s, 2Н), 6,90-6, 96 (m, 2Н), 7,12 (d, J=8,2 Гц, 1Н), 7,44 (dd, J=8,2, 2,1 Гц, 1Н), 7,67 (d, J=1,8 Гц, 1Н), 7,69 (d, J=8,8 Гц, 1Н), 9,13 (s, 1Н).
19р 5-[4-Циано-2-(этоксикарбонилметокси)фенокси]-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D16)
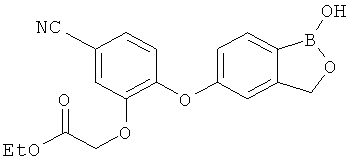
[0643] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 191 (D12), из 5-(4-циано-2-гидроксифенокси)-1, 3-дигидро-1-гидрокси-2,1-бензоксаборола (D14) и этил бромацетата.
[0644] 1Н-ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 1,17 (t, J=7,0 Гц, 3Н), 4,12 (q, J=7,0 Гц, 2Н), 4,91 (s, 4Н), 6, 94-6, 99 (m, 2Н), 7,13 (d, J=8,5 Гц, 1Н), 7,47 (dd, J=8,5, 1,8 Гц, 1Н), 7,66 (d, J=1,8 Гц, 1Н), 7,70 (d, J=8,5 Гц, 1Н), 9,14 (s, 1Н).
19q 5-[2-(Карбоксиметокси)-4-цианофенокси]-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D17)
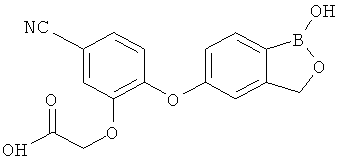
[0645] Смесь 5-[4-циано-2-(этоксикарбонилметокси)фенокси]-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (D16) (216 мг, 0,612 ммоль) и 1 М NaOH (2 мл) в метаноле (8 мл) перемешивали при комнатной температуре в течение 1 ч. Затем смесь подкисляли путем добавления 1 М НСl и экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток обрабатывали гексаном с получением 5-[2-(карбоксиметокси)-4-цианофенокси]-1,3-дигидро-1-гидрокси-2, 1-бензоксаборола (82 мг, 41%).
[0646] 1Н-ЯМР (300 МГц, ДMCO-d6) δ (м.д.) 4,82 (s, 2Н), 4,90 (s, 2Н), 6, 94-7, 00 (m, 2Н), 7,11 (d, J=8,2 Гц, 1Н), 7,45 (dd, J=8,5, 1,8 Гц, 1Н), 7,62 (s, 1Н), 7,70 (d, J=8,5 Гц, 1Н), 9,14 (s, 1Н), 13,1 (br s, 1Н).
19 г 5-(4-Карбокси-2-гидроксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D18)
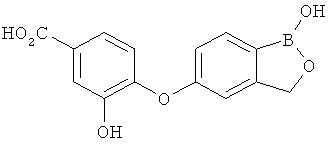
[0647] Смесь 5-(4-циано-2-гидроксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (D14) (4,00 г, 15,0 ммоль) и 6 М NaOH (30 мл) в метаноле (60 мл) и 1,4-диоксане (60 мл) подвергали кипячению с обратным холодильником в течение 5 суток. Затем смесь охлаждали в ледяной бане и подкисляли путем добавления 6 М НСl и экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток перекристаллизовывали из этилацетата с получением 5-(4-карбокси-2-гидроксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (1,29 г, 30%). Фильтрат наносили на колонку с силикагелем. В результате хроматографирования (гексан/этилацетат, 3:7-2:8) и последующего растирания с этилацетатом получали еще 1,00 г указанного в заголовке соединения (23%).
[0648] 1Н-ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 4,89 (s, 2Н), 6,85 (d, J=1,5 Гц, 1Н), 6,90 (dd, J=7,9, 2,1 Гц, 1Н), 7,03 (d, J=8,5 Гц, 1Н), 7,41 (dd, J=8,2, 2,1 Гц, 1Н), 7,54 (d, J=2,1 Гц, 1Н), 7,66 (d, J=7,9 Гц, 1Н), 9,08 (s, 1Н), 9,98 (s, 1Н), 12,8 (br s, 1Н).
19s 5-(4-Этоксикарбонил-2-гидроксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D19)
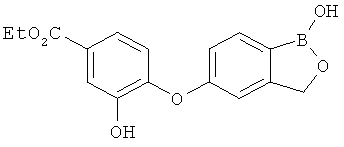
[0649] Смесь 5-(4-карбокси-2-гидроксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (1,95 г, 6,82 ммоль) и серной кислоты (1,5 мл) в этаноле (75 мл) подвергали кипячению с обратным холодильником в течение 6 ч. Добавляли воду, и данную смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. В результате очистки путем колоночной хроматографии на силикагеле (гексан/ацетон, 6:4-5:5) и последующей перекристаллизации из диизопропилового эфира получали 5- (4-этоксикарбонил-2-гидроксифенокси)-1,3-дигидро-1-гидрокси-2, 1-бензоксаборол (1,65 г, 77%).
[0650] 1Н-ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 1,29 (t, J=7,0 Гц, 3Н), 4,27 (q, J=7,0 Гц, 1Н), 4,89 (s, 2Н), 6,86 (s, 1Н), 6,91 (d, J=8,2 Гц, 1Н), 7,05 (d, J=8,2 Гц, 1Н), 7,43 (dd, J=8,5, 2,1 Гц, 1Н), 7,56 (s, 1Н), 7,67 (d, J=8,2 Гц, 1Н), 9,09 (s, 1Н), 10,1 (s, 1Н).
19t 5-(4-Этоксикарбонил-2-метоксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D20)
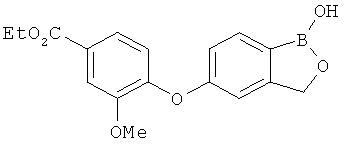
[0651] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 191 (D12), из 5-(4-этоксикарбонил-2-гидроксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (D19) и подметана.
[0652] 1H-ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 1,31 (t, J=7,0 Гц, 3Н), 3,80 (s, 3Н), 4,31 (q, J=7,0 Гц, 2Н), 4,89 (s, 3Н), 6,86-6,94 (m, 2Н), 7,11 (d, J=8,5 Гц, 1Н), 7,59 (dd, J=8,2, 1,8 Гц, 1Н), 7,63 (d, J=2,1 Гц, 1Н), 7,68 (d, J=7,9 Гц, 1Н), 9,11 (s, 1Н).
19u 5-[4-Этоксикарбонил-2-(циклопентилокси)фенокси]-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D21)
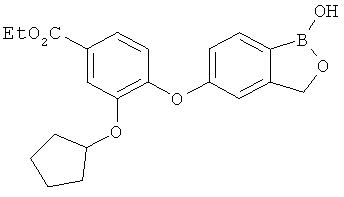
[0653] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 191 (D12), из 5-(4-этоксикарбонил-2-гидроксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (D19) и циклопентилиодида.
[0654] 1Н-ЯМР (300 МГц, ДМСО-d6) δ (м.д.): 1,2-1,6 (m, 6Н), 1,30 (t, J=7,0 Гц, 3Н), 1,7-1,9 (m, 2Н), 4,30 (q, J=7,0 Гц, 2Н), 4,87 (s, 2Н), 4,87 (m, 1Н), 6,84 (s, 1Н), 6,88 (d, J=7,9 Гц, 1Н), 7,17 (d, J=7,9 Гц, 1Н), 7,55-7,61 (m, 2Н), 7,65 (d, J=7,9 Гц, 1Н), 9,09 (s, 1Н).
19v 5-[4-Этоксикарбонил-2-(4-цианопиридин-2-илокси)фенокси]-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D22)
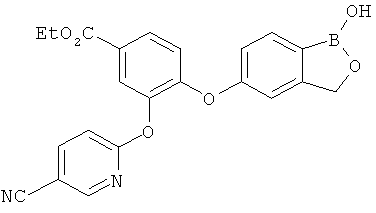
[0655] Смесь 5-(4-этоксикарбонил-2-гидроксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (D19) (200 мг, 0,637 ммоль), 2-хлор-5-пиридин-5-карбонитрила (106 мг, 0,764 ммоль) и карбоната калия (264 мг, 1,90 ммоль) в N, N-диметилформамиде (4 мл) перемешивали в течение 2 ч при 70°С в атмосфере азота. Затем данную смесь вливали в смесь этилацетат/разбавленная НСl. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем колоночной хроматографии на силикагеле (гексан/ацетон, 6:4) и затем путем препаративной ТСХ (гексан/ацетон, 5:5) с получением 5-[4-этоксикарбонил-2-(4-цианопиридин-2-илокси)фенокси]-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (133 мг, 50%).
[0656] 1H-ЯМР (300 МГц, ДMCO-d6) δ (м.д.) 1,29 (t, J=7,0 Гц, 1Н), 4,29 (q, J=7,0 Гц, 2Н), 4,88 (s, 2Н), 6,91 (dd, J=8,2, 2,3 Гц, 1Н), 6,95 (d, J=2,1 Гц, 1Н), 7,13 (d, J=8,8 Гц, 1Н), 7,24 (d, J=8,8 Гц, 1Н), 7,67 (d, J=7,9 Гц, 1Н), 7, 84-7, 90 (m, 2Н), 8,28 (dd, J=8,8, 2,3 Гц, 1Н), 8,62 (d, J=2,3 Гц, 1Н), 9,16 (s, 1Н).
19w 5-(4-Циано-2-формилфенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D23)
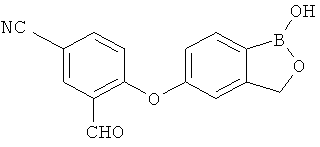
[0657] К раствору 4-бром-3-формилфенола (20,1 г, 100 ммоль) в метаноле (20 0 мл) добавляли порциями боргидрид натрия (1,90 г, 50,0 ммоль) при 0°С, и данную смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель удаляли при пониженном давлении до половины объема, добавляли 6 М НСl (50 мл), и данную смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 4-бром-3-гидроксиметилфенола (19,4 г, 96%).
[0658] 1H-HMP (300 МГц, ДMCO-d6) δ (м.д.) 4,39 (d, J=5,9 Гц, 2Н), 5,35 (t, J=5,9 Гц, 1Н), 6,56 (dd, J=8,5, 2,9 Гц, 1Н), 6,97 (d, J=2,9 Гц, 1Н), 7,28 (d, J=8,5 Гц, 1Н), 9,61 (s, 1Н).
[0659] Смесь 4-фтор-3-формилбензонитрила (14,2 г, 96,0 ммоль), 4-бром-3-гидроксиметилфенола (19,4 г, 96 ммоль) и карбоната калия (15,2 г, 110 ммоль) в N,N-диметилформамиде (200 мл) перемешивали в течение 2 ч при 7 0°С в атмосфере азота. Затем данную смесь вливали в смесь этилацетат/вода. Органический слой дважды промывали водой и солевым раствором и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем колоночной хроматографии на силикагеле (гексан/этилацетат, 3:1-7:3) с получением 4-[4-бром-3-(гидроксиметил)фенокси]-3-формилбензонитрила (26,0 г, 82%).
[0660] Смесь 4-[4-бром-3-(гидроксиметил)фенокси]-3-формилбензонитрила (25,5 г, 76,8 ммоль), 3, 4-дигидро-2Н-пирана (10,4 мл, 115 ммоль) и dl-10-камфорсульфоновой кислоты (356 мг, 2 молярных %) в дихлорметане (30 0 мл) перемешивали в течение 2 ч при комнатной температуре. Добавляли карбонат натрия (3 г), и данную смесь вливали в смесь вода/хлороформ. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем колоночной хроматографии на силикагеле (гексан/этилацетат, 85:15) с получением 4-[4-бром-3-(2-тетрагидропиранилоксиметил)фенокси]-3-формилбензонитрила (28,0 г, 88%).
[0661] Смесь 4-[4-бром-3-(2-тетрагидропиранилоксиметил)фенокси]-3-формилбензонитрила (28,0 г, 67,3 ммоль), бис(пинаколато)дибора (18,8 г, 74,0 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (II) (1,37 г, 2,5 молярных %) и ацетата калия (19,8 г, 202 ммоль) в 1,4-диоксане (270 мл) перемешивали в течение ночи при 80°С в атмосфере азота. Смесь фильтровали через подушку целита, и удаляли при пониженном давлении растворитель. Остаток растворяли в тетрагидрофуране (250 мл), добавляли 6 М НСl (30 мл), и данную смесь перемешивали в течение 2 ч при комнатной температуре. Затем данную смесь вливали в смесь этилацетат/вода. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем колоночной хроматографии на силикагеле (гексан/этилацетат, 5:5-3:7) и последующей перекристаллизации из смеси этилацетат/гексан с получением 5-(4-циано-2-формилфенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (6,61 г, 35%).
[0662] 1Н-ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 4,98 (s, 2Н), 7,03 (d, J=8,5 Гц, 1Н), 7,21 (d, J=8,2 Гц, IE), 7,27 (s, 1Н), 7,82 (d, J=7,9 Гц, 1H), 8,04 (dd, J=8,8, 2,3 Гц, 1H), 8,24 (d, J=2,3 Гц, 1H), 9,27 (s, 1H), 10,4 (s, 1H).
19x 5-[4-Циано-2-(гидроксиметил) фенокси]-1, 3-дигидро-1-гидрокси-2,1-бензоксаборол (D24)
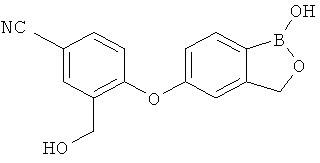
[0663] К раствору 5-(4-циано-2-формилфенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (3,00 г, 10,8 ммоль) в метаноле (100 мл) добавляли порциями боргидрид натрия (400 мг, 10,8 ммоль) при 0°С, и данную смесь перемешивали в течение 1 ч при комнатной температуре Растворитель удаляли при пониженном давлении до половины исходного объема, добавляли 1 М НСl (50 мл), и данную смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток обрабатывали смесью этилацетат/гексан с получением 5-[4-циано-2-(гидроксиметил)фенокси]-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (1,83 г, 60%).
[0664] 1Н-ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 4,58 (d, J=5,6 Гц, 2Н), 4,93 (s, 2Н), 5,44 (t, J=5,6 Гц, 1Н), 6,91 (d, J=8,5 Гц, 1Н), 7,03 (dd, J=8,2, 1,2 Гц, 1Н), 7,05 (s, 1Н), 7,71 (dd, J=8,5, 2,3 Гц, 1Н), 7,75 (d, J=7,9 Гц, 1Н), 7,88 (d, J=1,2 Гц, 1Н), 9,20 (s, 1Н).
19y 5-[4-Циано-2-(формиламинометил)фенокси]-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D25)
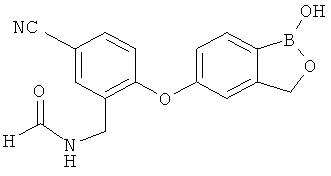
[0665] К раствору 4-[4-бром-3-(2-тетрагидропиранилоксиметил)фенокси]-3-формилбензонитрила (14,6 г, 34,9 ммоль), полученного в Примере 19w (D23), в метаноле (100 мл) добавляли порциями боргидрид натрия (664 мг, 17,5 ммоль) при 0°С, и данную смесь перемешивали в течение 1 ч при комнатной температуре Растворитель удаляли при пониженном давлении до половины исходного объема, и данную смесь вливали в смесь этилацетат/вода. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 4-[4-бром-3-(2-тетрагидропиранилоксиметил)фенокси]-3-(гидроксиметил)бензонитрила (14,6 г, 100%).
[0666] 1Н-ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 1,3-1,8 (m, 6Н), 3,47 (m, 1Н), 3,72 (m, 1Н), 4,4-4,8 (m, 4Н), 5,44 (t, J=5,9 Гц, 1Н), 6,92 (d, J=8,5 Гц, 1Н), 6, 96 (dd, J=8,5, 2,9 Гц, 1Н), 7,17 (d, J=2,9 Гц, 1Н), 7,65 (d, J=8,5 Гц, 1Н), 7,71 (dd, J=8,5, 1,8 Гц, 1Н), 7,87 (d, J=1,2 Гц, 1Н).
[0667] К раствору 4-[4-бром-3-(2-тетрагидропиранилоксиметил)фенокси]-3-(гидроксиметил)бензонитрила (12,1 г, 28,9 ммоль) в дихлорметане (100 мл) добавляли триэтиламин (8,0 мл, 58 ммоль) и метансульфохлорид (2,5 мл, 32 ммоль) при 0°С, и данную смесь перемешивали при комнатной температуре в течение 1 ч. Затем смесь промывали водой и солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Остаток растворяли в N,N-диметилформамиде (100 мл), добавляли диформилимид натрия (3,29 г, 34,7 ммоль), и данную смесь перемешивали в течение 2 ч при 50°С. Затем данную смесь вливали в смесь этилацетат/вода. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Остаток растворяли в 1,4-диоксане (80 мл), добавляли 3 М NaOH (10 мл), и данную смесь перемешивали в течение 1 ч при комнатной температуре Затем данную смесь вливали в смесь этилацетат /вода. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (гексан/этилацетат, 5:5-4:6) с получением 4-[4-бром-3-(2-тетрагидропиранилоксиметил)фенокси]-3-(формиламинометил)бензонитрила (8,77 г, 68%).
[0668] 1Н-ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 1,4-1,8 (m, 6Н), 3,46 (m, 1Н), 3,73 (m, 1Н), 4,37 (d, J=5,9 Гц, 2Н), 4,47 (d, J=13,8 Гц, 1Н), 4,67 (d, J=13,8 Гц, 1Н), 4,72 (br s, 1Н), 6,92 (d, J=8,5 Гц, 1Н), 7,00 (d, J=8,5 Гц, 1Н), 7,21 (s, 1Н), 7,67 (dd, J=8,8, 1,8 Гц, 1Н), 7,72 (d, J=8,5 Гц, 1Н), 7,76 (s, 1Н), 8,14 (s, 1Н), 8,53 (br t, 1Н).
[0669] Смесь 4-[4-бром-3-(2-тетрагидропиранилоксиметил)фенокси]-3-(формиламинометил)бензонитрила (1,44 г, 3,24 ммоль), бис(пинаколато)дибора (905 мг, 3,56 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (II) (87 мг, 3 молярных %) и ацетата калия (1,01 г, 10,3 ммоль) в 1,4-диоксане (25 мл) перемешивали в течение ночи при 80°С в атмосфере азота. Смесь фильтровали через подушку целита, и удаляли при пониженном давлении растворитель. Остаток пропускали через короткую колонку силикагеля (гексан/этилацетат, 4:6). Полученный неочищенный продукт растворяли в тетрагидрофуране (20 мл), добавляли 6 М НСl (2 мл), и данную смесь перемешивали в течение ночи при комнатной температуре. Данную смесь вливали в смесь этилацетат /вода. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем колоночной хроматографии на силикагеле (гексан/этилацетат (4:6)-этилацетат-этилацетат /метанол (2:1)) и последующего растирания с водой с получением 5-[4-циано-2-(формиламинометил)фенокси]-1,3-дигидро-1-гидрокси-2, 1-бензоксаборола (685 мг, 68%).
[0670] 1Н-ЯМР (300 МГц, ДMCО-d6) δ (м.д.) 4,40 (d, J=5,9 Гц, 1Н), 4,95 (s, 1Н), 6,92 (d, J=8,5 Гц, 1Н), 7,07 (dd, J=7,9, 1,8 Гц, 1Н), 7,11 (s, 1Н), 7,72 (dd, J=8,5, 2,1 Гц, 1Н), 7,77 (d, J=8,2 Гц, 1Н), 8,15 (s, 1Н), 8,53 (br t, 1Н), 9,21 (s, 1H).
19z 5-(2-Аминометил-4-цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол гидрохлорид (D26)
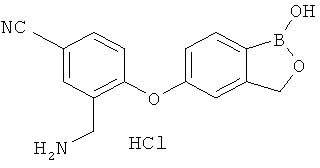
[0671] К раствору 5-[4-циано-2-(формиламинометил)фенокси]-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (250 мг, 0,812 ммоль) в этаноле (16 мл) добавляли 6 М НСl (4 мл), и данную смесь подвергали кипячению с обратным холодильником в течение 2 ч. Растворитель удаляли при пониженном давлении, и остаток обрабатывали диэтиловым эфиром с получением 5-(2-аминометил-4-цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола гидрохлорида (24 7 мг, 98%).
[0672] 1Н-ЯМР (300 МГц, ДMCO-d6) δ (м.д.) 4,14 (br s, 2Н), 4,97 (s, 2Н), 6,88 (d, J=8,8 Гц, 1Н), 7,16 (dd, J=7,9, 2,1 Гц, 1H), 7,21 (s, 1H), 7, 78-7, 86 (m, 2H), 8,08 (d, J=1,8 Гц, 1H), 8,54 (br s, 3H), 9,29 (s, 1H).
19aa Этил-2-этокси-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинат (D27)
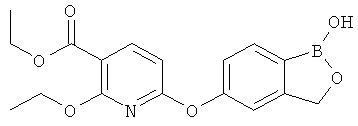
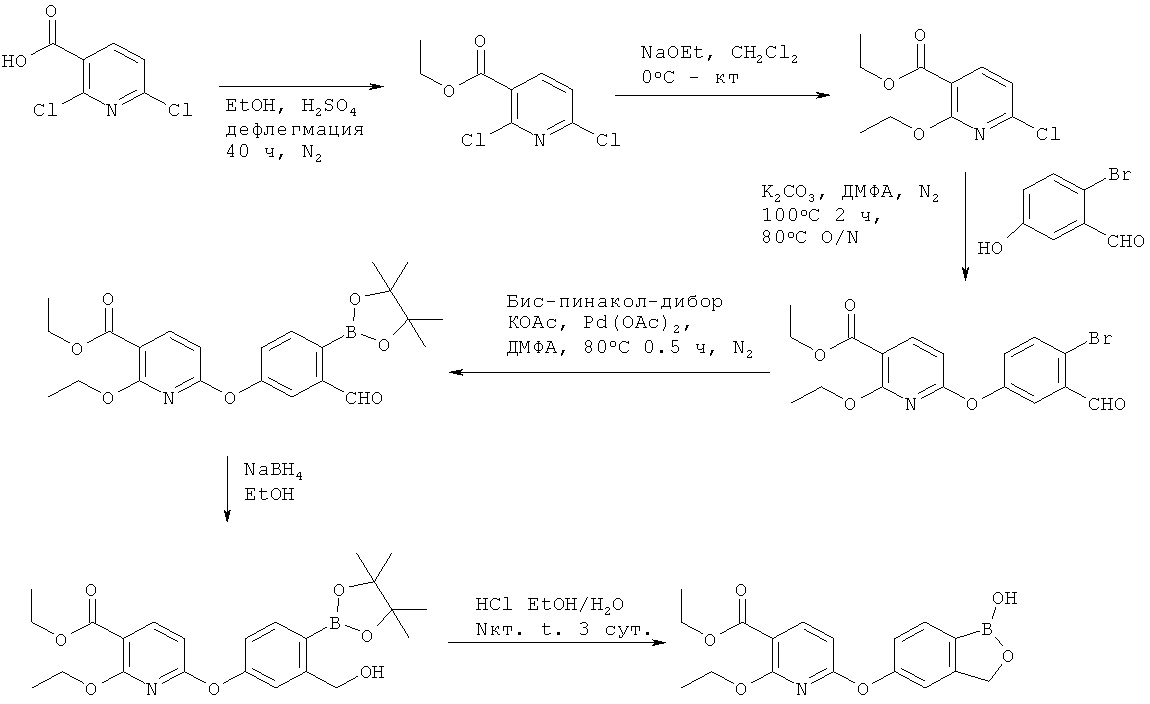
[0673] 2,6-Дихлорникотиновую кислоту (25,5 г, 0,1328 ммоль) этерифицировали в EtOH (200 крепости (200 proof), 200 мл) в присутствии 96% H2SO4 (1,7 г), в качестве катализатора, при температуре кипения в течение 40 ч в атмосфере N2 с получением желаемого этил 2,6-дихлорникотината, полученный продукт выделяли, используя стандартные методики очистки, в виде серого твердого вещества (24,89 г, 0,1131 ммоль, выход 85,2%).
[0674] 1H ЯМР (300 МГц, ДМСО-d6): δ 8, 30 (d, J=8,1 Гц, 1Н), 7,71 (d, J=8,1 Гц, 1Н), 4,33 (q, J=7,2 Гц, 2Н) и 1,30 (t, J=7,2 Гц, 3Н) м.д.
[0675] Замещение NaOEt (5,8 г, 1,5 экв.) этил-2,6-дихлорникотинатом (12,5 г, 5 6,8 ммоль) в СН2Сl2 (ссылка: США 2005/0288299А1) проводили путем медленного добавления основания в виде твердого вещества к раствору бис-хлорэфира при 0°С и перемешивания в течение 3 ч с охлаждением, затем в течение ночи смесь нагревали от 0°С до комнатной температуры. Добавляли дополнительное количество СН2Сl2 и воды, фазы разделяли, сушили, и упаривали с получением жидкости (11,62 г), которая медленно кристаллизовалась в течение ночи. Полученное твердое вещество перекристаллизовывали из пентана, используя для охлаждения сухой лед, с выходом желаемого этил-6-хлор-2-этоксиникотината в виде белых кристаллов (9,45 г, 41,15 ммоль, выход 7 2,4%).
[0676] Т.пл.: 33-35°С. 1Н ЯМР (300 МГц, ДMCO-d6): δ 8,13 (d, J=8,1 Гц, 1Н), 8,16 (d, J=8,1 Гц, 1H), 4,34 (q, J=7,2 Гц, 2H), 4,24 (q, J=7,2 Гц, 2H), 1,31 (t, J=7,2 Гц, 3Н) и 1,27 (t, J=7,2 Гц, 3Н) м.д.
[0677] Реакцию сочетания этил-6-хлор-2-этоксиникотината (9,45 г, 41,15 ммоль) с 2-бром-5-гидроксибензальдегидом (8,27 г, 41,15 ммоль) выполняли в присутствии К2СО3 (8,53 г, 1,5 экв.) в ДМФА (100 мл) в течение 2 ч при 100°С и затем в течение ночи при 80°С в атмосфере N2 с получением неочищенного остатка после фильтрования и выпаривания. Данный остаток очищали посредством колоночной хроматографии на силикагеле (гексан:EtOAc=7:1, об./об.) и перекристаллизации из гексана и пентана с получением желаемого этил 6-(4-бром-3-формилфенокси)-2-этоксиникотината в виде белого твердого вещества (8,35 г, 21,15 ммоль, выход 51,4%).
[0678] 1Н ЯМР (300 МГц, ДMCO-d6): δ 10,17 (s, 1Н), 8,21 (d, J=8,4 Гц, 1H), 7,85 (d, J=8,4 Гц, 1H), 7,67 (d, J=3,3 Гц, 1H), 7,54 (dd, J=8,4 & 2,8 Гц, 1H), 6,68 (d, J=8,4 Гц, 1H), 4,21 (q, J=7,5 Гц, 2H), 4,05 (q, J=7,2 Гц, 2H), 1,26 (t, J=7,2 Гц, 3Н) и 1,14 (t, J=7,l Гц, 3Н) м.д.
[0679] Каталитическим борилированием этил-6-(4-бром-3-формилфенокси)-2-этоксиникотината (8,35 г, 21,15 ммоль) бис-пинакол-дибором (6,5 г, 25,38 ммоль), КОАс (6,2 г, 63,45 ммоль) и Pd(OAc)2 (0,25 г) в ДМФА (100 мл) при 80°С в течение 30 мин в атмосфере N2 получали единственный продукт реакции (согласно ТСХ-анализу), однако выдерживание реакционной смеси в течение ночи при комнатной температуре приводило к появлению еще одного соединения. После выделения продуктов реакции с использованием стандартных методик получали неочищенное масло (13,5 г), содержащее необходимый этил-2-этокси-6-(3-формил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)никотинат, которое использовали в следующей реакции.
[0680] Восстановление неочищенного масла (13,5 г), содержащего этил-2-этокси-6-(3-формил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)никотината с использованием NaBH4 (2,3 г) в EtOH (200 proof, 250 мл) при 0°С, согласно ТСХ-анализу, завершалось за 30 мин. Добавляли 6 н. НСl, затем реакционную смесь упаривали, остаток растворяли в EtOAc, промывали водой и очищали путем колоночной хроматографии на силикагеле (гексан:EtOAc=2:1). Согласно 1Н ЯМР полученное масло представляло собой фактически нециклизированный этил-2-этокси-6-(3-(гидроксиметил)-4-(4,4,5, 5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)никотинат.
[0681] Циклизацию этил-2-этокси-6-(3-(гидроксиметил)-4-(4,4,5,5-тетраметил-1,3,2-диокса-боролан-2-ил)фенокси)никотината, полученного на предыдущей стадии, быстро выполняли в EtOH и 6 н. НСl, затем реакционную смесь упаривали. К остатку добавляли воду, и затем, обрабатывая смесь ультразвуком, медленно добавляли ацетон с получением кристаллов, которые отфильтровывали и промывали водой и гексаном. Твердое вещество сушили в условиях глубокого вакуума в течение ночи с получением необходимого соединения, указанного в заголовке, этил-2-этокси-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотината (2,287 г, 6,66 ммоль).
[0682] 1Н ЯМР (300 МГц, ДМСО-d6): δ 9,22 (s, 1Н), 8,18 (d, J=8,1 Гц, 1Н), 7,76 (d, J=7,8 Гц, 1Н), 7,24 (s, 1Н), 7,16 (dd, J=7,8 & 1,8 Гц, 1Н), 6,57 (d, J=8,1 Гц, 1Н), 4,97 (s, 2Н), 4,21 (q, J=7, 5 Гц, 2Н), 4,09 (q, J=7,2 Гц, 2Н), 1,25 (t, J=7,2 Гц, 3Н) и 1,16 (t, J=7,2 Гц, 3Н) м.д. Чистота (ВЭЖХ): 100% при 220 нм и 254 нм. Масс-спектр: m/z=342 (М-1, ИЭР(-)).
19аb 2-(5-Циано-2-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)фенокси)-N,N-диэтилацетамид (D28)
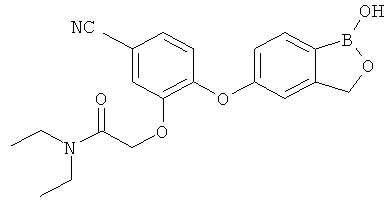
[0683] Смесь 5-[2-(карбоксиметокси)-4-цианофенокси]-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (D17) (1,00 г, 3,08 ммоль), EDCI (1,77 г, 9,24 ммоль), НОВТ (1-гидроксибензотриазола) (1,25 г, 9,24 ммоль), диэтиламина (0,96 мл, 9,24 ммоль) и 4-диметиламинопиридина (75 мг, 0,62 ммоль) в ДМФА (20 мл) перемешивали в течение ночи при комнатной температуре. Добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем хроматографии на силикагеле (хлороформ/метанол, 9:1). Фракции, содержащие желаемый продукт, объединяли, удаляли при пониженном давлении растворитель, и затем промывали водой и толуолом. Снова удаляли при пониженном давлении растворитель. Проводили дополнительную хроматографию на колонке с силикагелем (ацетон:гексан, 5:5). Фракции, содержащие желаемый продукт, объединяли, и удаляли при пониженном давлении растворитель. Остаток перекристаллизовывали с использованием смеси гексана и диизопропилового эфира с получением чистого 2-(5-циано-2-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)фенокси)-N,N-диэтилацетамида (0,662 г, 57%).
[0684] 1H-ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 1,00 (t, J=6,75 Гц, 3Н), 1,09 (t, J=7,03, 3Н), 3,2-3,3 (m, 4Н), 4,9 (d, J=9,01 Гц, 1Н), 6,9-7,0 (m, 2H), 71,-7,2 (dd, J=8, 36, 1, 03 Гц, 1H), 7,42 (m, 1H), 7,54 (s, 1H), 7,69 (m, 1H), 9,12 (d, J=1,17 Гц, 1H).
19aс 4-(2-(5-циано-2-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)фенокси)ацетил)-1-метилпиперазина гидрохлорид (D29)
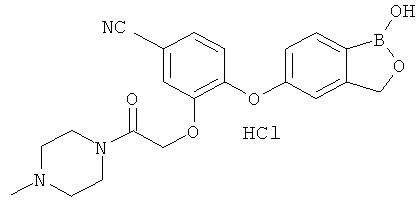
[0685] Данное соединение получали в соответствии с методикой, аналогичной методике получения соединения D28.
[0686] 1Н-ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 2,73 (s, 3 Н), 2.9-3.1 (m, 4 Н), 3.3-3.5 (m, 2 Н), 3.8-3.9 (m, 1Н), 4.3-4.4 (m, 1Н), 4.90 (s, 2 Н), 5.02 (d, J=8.2 Гц, 2 Н), 6.96 (m, 2 Н), 7.14 (d, J=8.2 Гц, 1Н), 7.45 (d, J=8.2 Гц, 1Н), 7.62 (s, 1Н), 7.71 (d, J=8.8 Гц, 1Н), 9.15 (s, 1Н), 10.91 (s, 1Н).
19ad 5-[4-Циано-2-(трет-бутоксикарбонилметокси) фенокси]-1, 3-дигидро-1-гидрокси-2,1-бензоксаборол (D30)
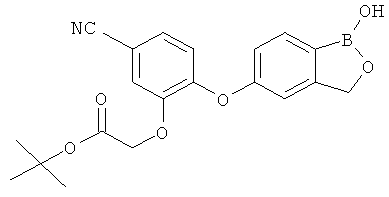
[0687] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 191 (D12), из 5-(4-циано-2-гидроксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (D14) и трет-бутил-бромацетата.
[0688] 1Н-ЯМР (300 МГц, ДMCO-d6) δ (м.д.) 1,38 (s, 9 Н), 4,79 (s, 2 Н), 4,90 (s, 2 Н), 6,96 (m, 2 Н), 7,14 (d, J=8,5 Гц, 1Н), 7,46 (dd, J=1,8, 8,5 Гц, 1Н), 7,59 (d, J=1,0 Гц, 1Н), 7,65 (m, 1Н), 9,13 (s, 1Н).
19ае 2-((5-Циано-2-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)фенокси)метил)пиридина гидрохлорид (D31)
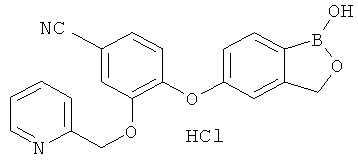
[0689] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 191 (D12), из 5-(4-циано-2-гидроксифенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (D14) и 2-хлорметилпиридина гидрохлорида.
[0690] 1Н-ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 4,89 (s, 2 Н), 5,32 (s, 2 Н), 6,70 (m, 2 Н), 7,20 (d, J=8,2 Гц, 1Н), 7,26 (d, J=7,9 Гц, 1Н), 7,4-7,6 (m, 2 Н), 7,70 (d, J=8,8 Гц, 1Н), 7,81 (s, 1Н), 7,88 (t, J=7,9 Гц, 1Н), 8,60 (d, J=5,0, 1Н).
19af 4-(5-Циано-2-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)бензил)морфолина гидрохлорид (D32)
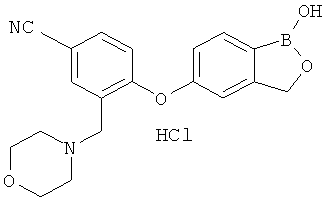
[0691] Смесь 5-(4-Циано-2-формилфенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (D23) (0,400 г, 1,43 ммоль), морфолина (0,375 мл, 4,2 9 ммоль) и уксусной кислоты (0,24 6 мл, 4,2 9 ммоль) в метаноле (10 мл) перемешивали в течение пяти минут при комнатной температуре в атмосфере азота. Добавляли цианоборогидрид (0,270 г, 4,2 9 ммоль), и данную смесь перемешивали в течение двух часов при комнатной температуре в атмосфере азота. Добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали путем хроматографии на силикагеле (этилацетат/гексан (5:5)-дихлорметан/метанол (4:1)). Фракции, содержащие желаемый продукт, объединяли, и удаляли при пониженном давлении растворитель. Добавляли воду и толуол, затем их удаляли при пониженном давлении с получением чистого 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-3-(морфолинометил)бензонитрила (0,399 г, 80%).
[0692] 1Н-ЯМР (300 МГц, ДMCO-d6) δ (м.д.) 2,35 (m, 4 Н), 3,53 (m, 6 Н), 4,93 (s, 2 Н), 7,00 (m, 3 Н), 7,73 (dd, J=8, 07, 2, 50 Гц, 2 Н), 7,90 (d, 2,35 Гц, 1Н), 9,18 (s, 1Н).
[0693] Смесь 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-3-(морфолинометил)бензонитрила (0,391 г, 1,12 ммоль), 4 М НСl в диоксане (0,335 мл, 1,34 ммоль), диэтилового эфира (10 мл) и ТГФ (3 мл) перемешивали в течение пяти минут при комнатной температуре. Осадок отфильтровывали и сушили при пониженном давлении. Полученное твердое вещество промывали в ТГФ, твердое вещество снова отфильтровывали и сушили при пониженном давлении с получением желаемого соединения (0, 258 г, 60%).
[0694] 1Н-ЯМР (300 МГц, ДMCO-d6) δ (м.д.) 3,2-3,3 (m, 3 Н), 3,7-4,0 (m, 5 Н), 4,47 (s, 2 Н), 4,98 (s, 2 Н), 6,90 (d, J=8,8 Гц, 1Н), 7,20 (d, J=7,9 Гц, 1Н), 7,27 (s, 1Н), 7,8-7,9 (m, 2 Н), 8,28 (s, 1Н), 9,29 (br s, 1Н), 11,09 (br s, 1Н).
19аg 1-(5-Циано-2-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)бензил)-4-метилпиперазин-1,4-диий (D33)
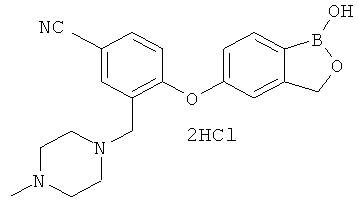
[0695] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19af (D32), из 5-(4-циано-2-формилфенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (D23) и 1-метилпиперазина.
[0696] 1Н-ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 2,77 (s, 3 Н), 3,0-4,2 (m, 10 Н), 4,96 (s, 2 Н), 6,92 (d, J=8,8 Гц, 1Н), 7,15 (d, J=7,6 Гц, 1Н), 7,20 (s, 1Н), 7,83 (m, 2 Н), 8,15 (s, 1Н), 9,2 (br s, 1 H), 11,1 (br s, 1H).
19ah 1-(5-Циано-2-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)фенил)-N,N-диметилметанаминий (D34)
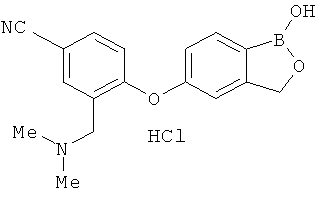
[0697] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19af (D32), из 5-(4-циано-2-формилфенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола (D23) и диметиламина.
[0698] 1Н-ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 2,77 (s, 6 Н), 4,41 (s, 2 Н), 4,97 (s,.2 Н), 6,90 (d, J=8,5 Гц, 1Н), 7,19 (dd, J=8,05, 1,86 Гц, 1Н), 7,26 (s, 1Н), 7,84 (d, J=8,2, 1Н), 7,88 (d, J=2,4, 1Н), 8,25 (d, J=2,1, 1 H), 9,32 (br s, 1 H).
19ai Синтез 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-метокси-бензойной кислоты этилового эфира (D35)

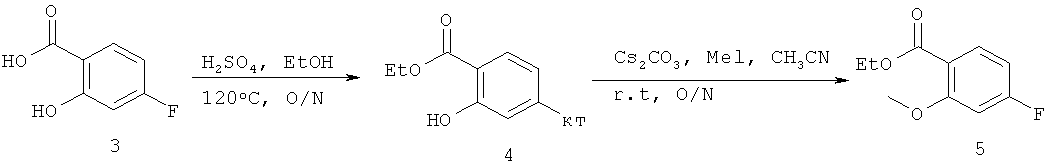
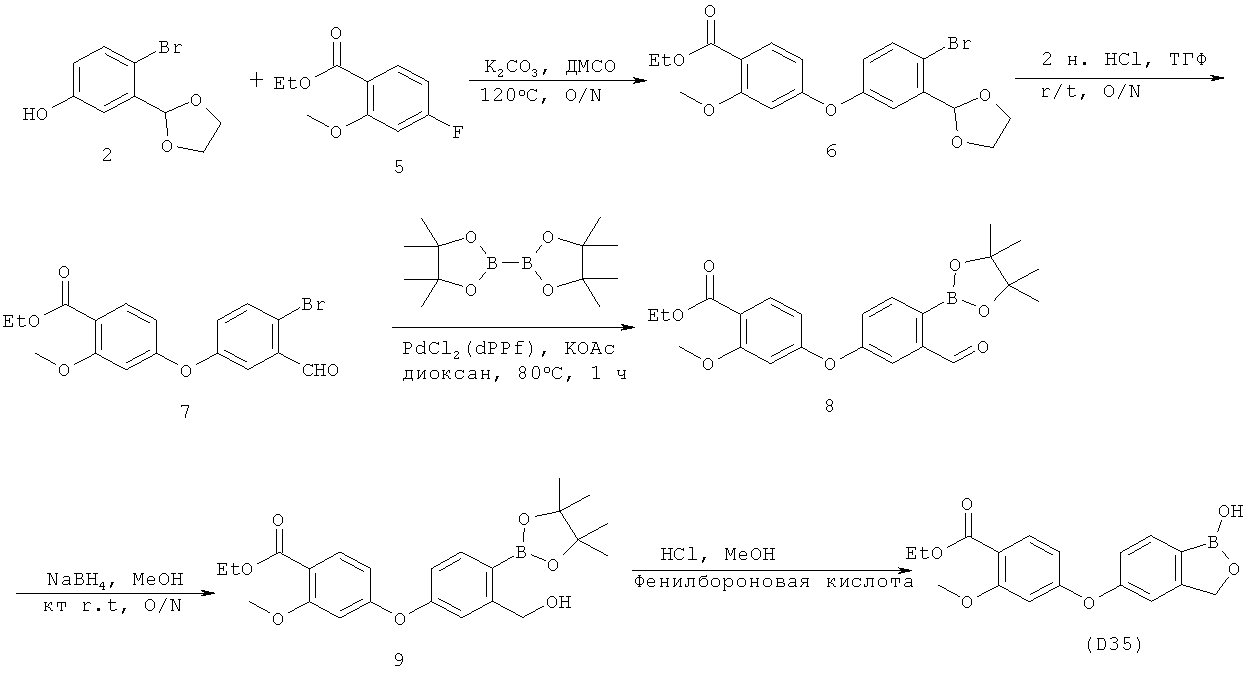
4-Бром-3-[1,3]диоксолан-2-ил-фенол (2)
[0699] К раствору 2-бром-5-гидрокси-бензальдегида (1) (15,0 г, 74,62 ммоль) в толуоле (100 мл) добавляли этиленгликоль (12,5 мл, 223,86 ммоль) и пара-TSA (пара-толуолсульфоновую кислоту) (1,42 г, 7,4 6 ммоль). Растворитель удаляли при пониженном давлении с получением неочищенного продукта 2 (20,0 г неочищенного вещества), который использовали на следующей стадии без дополнительной очистки. 1Н ЯМР (400 МГц, CDCl3) δ: 7,38 (d, J=8,6 Гц, 1Н), 7,01 (d, J=2,7 Гц, 1H), 6,62 (d, J=8,2, 2,3 Гц, 1H), 6,01 (s, 1H), 4,20-4,01 (m, 4H). Этиловый эфир 4-фтор-2-гидроксибензойной кислоты (4)
[0700] К раствору 4-фтор-2-гидроксибензойной кислоты (соединение 3) (20,0 г, 128,11 ммоль) в этаноле (100 мл) добавляли концентрированную серную кислоту (10 мл). Полученную смесь нагревали в течение ночи в масляной бане (120°С). Растворитель удаляли при пониженном давлении с получением неочищенного продукта, который очищали путем колоночной хроматографии (силикагель, 10% EtOAc в гексане) с получением указанного в заголовке соединения 4 (19,9 г, 85%) в виде бесцветного твердого вещества. 1Н ЯМР (400 МГц, CDCl3) δ: 11,15 (s, 1Н), 7,83 (d, J=6,6 Гц, 1H), 7,81 (d, J=6,6 Гц, 1H), 6,62 (dd, J=10,1, 2,3 Гц, 1H), 6,61 (dd, J=7,0, 2,0 Гц, 1H), 4,41 (q, J=7,0 Гц, 2H), 1,42 (t, J=7,0 Гц, 3Н). Масс-спектр (ИЭР) m/z: 185 (М+1)+.
Этиловый эфир 4-фтор-2-метоксибензойной кислоты (5)
[0701] К раствору соединения 4 (19,9 г, 0,109 моль) в ацетонитриле (200 мл) добавляли карбонат цезия (42,0 г, 0,129 моль). Полученную смесь перемешивали в течение 30 мин при комнатной температуре, и затем добавляли метилиодид (13,5 мл, 0,218 моль). Полученную смесь перемешивали в течение ночи при комнатной температуре и фильтровали через Celite®. Растворитель удаляли при пониженном давлении с получением неочищенного продукта 5 (20,0 г, 93%), который использовали на следующей стадии без дополнительной очистки. 1Н ЯМР (400 МГц, CDCl3) δ: 7,81-7,78 (m, 1Н), 6,60-6,58 (m, 2H), 4,38 (q, J=7,0 Гц, 2H), 3,82 (s, 3Н), 1,39 (t, J=7,0 Гц, 3Н). Масс-спектр (ИЭР) m/z: 199 (М+1)+.
Этиловый эфир 4-(4-Бром-3-[1, 3]диоксолан-2-ил-фенокси)-2-метоксибензойной кислоты (6)
[0702] К раствору соединения 2 (9,27 г, 37,83 ммоль) в ДМСО (50 мл) добавляли карбонат калия (15,68 г, 113,48 ммоль). Полученную смесь перемешивали в течение 30 мин при комнатной температуре, и затем добавляли соединение 5 (8,99 г, 45,39 ммоль). Полученную смесь нагревали в течение ночи при 12 0°С. Реакционную смесь разбавляли EtOAc (100 мл) и промывали водой (50 мл). Органический слой сушили над Na2SO4 и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали путем колоночной хроматографии (силикагель, 10% EtOAc в гексане) с получением указанного в заголовке соединения 6 (5,6 г, 35%) в виде бледно-желтого твердого вещества. 1Н ЯМР (400 МГц, CDCl3) S: 7,81 (d, J=9,0 Гц, 1Н), 7,59 (d, J=8,6 Гц, 1H), 7,35 (s, 1H), 6,97 (dd, J=8,6, 2,7 Гц, 1H), 6,60 (d, J=2,3 Гц, 1H), 6,49 (dd, J=8,6, 2,4 Гц, 1H), 6,01 (s, 1H), 4,39 (q, J=7,4 Гц, 2H), 4,20-4,01 (m, 4H), 3,81 (s, 3H), 1,40 (t, J=7,4 Гц, 3Н). Масс-спектр (ИЭР) m/z: 423 (М+1)+, 425 (М+3)+.
Этиловый эфир 4-(4-бром-3-формил-фенокси)-2-метоксибензойной кислоты (7)
[0703] К раствору соединения 6 (5,6 г, 13,23 ммоль) в ТГФ (50 мл) при 0°С добавляли 2 н. НСl (50 мл). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли EtOAc (100 мл) и промывали водой (50 мл). Органический слой сушили над Na2SO4 и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали путем колоночной хроматографии (силикагель, 10% EtOAc в гексане) с получением указанного в заголовке соединения 7 (3,0 г, 60%) в виде бледно-желтого твердого вещества. 1Н ЯМР (400 МГц, CDCl3) δ: 10,35 (s, 1Н), 7,82 (d, J=8,6 Гц, 1H), 7,60 (d, J=8,6 Гц, 1H), 7,58 (d, J=2,7 Гц, 1H), 7,19 (dd, J=8,6, 3,1 Гц, 1H), 6,60 (d, J=2,0 Гц, 1H), 6,51 (dd, J=8,6, 2,3 Гц, 1H), 4,39 (q, J=7,0 Гц, 2H), 3,81 (s, 3H), 1,40 (t, J=7,0 Гц, 3Н), Масс-спектр (ИЭР) m/z: 379 (М+1)+, 381 (М+3)+.
Этиловый эфир 4-[3-формил-4-(4,4,5,5-тетраметил-[1, 3,2]диоксаборолан-2-ил)-фенокси]-2-метоксибензойной кислоты (8) [0704] К раствору соединения 7 (3,0 г, 7,91 ммоль) в 1,4-диоксане (20 мл) добавляли бис(пинаколато)дибор (2,41 г, 9,49 ммоль), ацетат калия (2,33 г, 23,73 ммоль) и хлорид [1,1'-бис(дифенилфосфино)ферроцен]палладия (II) (0,3 г, 0,40 ммоль). В течение 10 минут данную смесь продували газообразным азотом, и полученную суспензию нагревали в течение 1 ч при 80°С. Данную смесь пропускали через Celite® и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали путем колоночной хроматографии (силикагель, 10% EtOAc в гексане) с получением указанного в заголовке соединения 8 (3,22 г, 96%) в виде бесцветного масла. 1Н ЯМР (400 МГц, CDCl3) δ: 10,61 (s, 1Н), 7,98 (d, J=8,2 Гц, 1H), 7,81 (d, J=8,6 Гц, 1H), 7,60 (d, J=2,3 Гц, 1H), 7,35 (d, J=5,5 Гц, 2H), 6,62 (d, J=2,0 Гц, 1H), 6,58 (d, J=8,6 Гц, 1H), 4,39 (q, J=7,0 Гц, 2H), 3,81 (s, 3H), 1,42 (s, 12H), 1,20 (t, J=7,0 Гц, 3Н).
Этиловый эфир 4-[3-гидроксиметил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-метоксибензойной кислоты (9)
[0705] К раствору соединения 8 (3,22 г, 7,55 ммоль) в метаноле (40 мл) добавляли боргидрид натрия (0,373 г, 9,82 ммоль) при 0°С. Полученную смесь перемешивали в течение 30 мин при комнатной температуре. Растворитель удаляли при пониженном давлении, остаток разбавляли водой (50 мл) и экстрагировали EtOAc (2×50 мл). Объединенный органический слой сушили над Na2SO4 и концентрировали при пониженном давлении с получением неочищенного продукта, который использовали на следующей стадии без дополнительной очистки. 1Н ЯМР (400 МГц, CDCl3) δ: 7,91 (d, J=8,2 Гц, 1Н), 7,82 (d, J=8,6 Гц, 1H), 7,01 (s, 1H), 6,98 (d, J=8,2 Гц, 1H), 6,60 (s, 1H), 6,67 (d, J=8,6 Гц, 1H), 4,65 (s, 2H), 4,39 (q, J=7,0 Гц, 2H), 3,81 (s, 3H), 1,42 (s, 12H), 1,20 (t, J=7,0 Гц, 3Н).
19ai Этиловый эфир 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-метоксибензойной кислоты (D35)
[0706] К раствору соединения 9 (2,0 г, 4,67 ммоль) в метаноле (50 мл) добавляли 6 н. НСl (10 мл) и фенилбороновую кислоту (2,85 г, 2 3,36 ммоль). Полученную смесь перемешивали в течение ночи при комнатной температуре. Растворитель удаляли при пониженном давлении с получением неочищенного продукта, который очищали путем обращеннофазной препаративной ВЭЖХ, используя в качестве элюента CH3CN/H2O (0,1% раствор уксусной кислоты), и затем лиофилизировали с выходом указанного в заголовке соединения D35 (0,66 г, 39%) в виде белого твердого вещества. Т.пл.: 64, 9-65, 2°С. 1Н ЯМР (400 МГц, ДМСO-d6) δ: 9,20 (s, 1Н), 7,80 (d, J=8,2 Гц, 1Н), 7,72 (d, J=8,6 Гц, 1Н), 7,18 (s, 1Н), 7,16 (dd, J=8,2, 2,0 Гц, 1Н), 6,80 (s, 1Н), 6,60 (dd, J=8,6, 2,3 Гц, 1Н), 4,98 (s, 2Н), 4,21 (q, J=7,0 Гц, 2Н), 3,81 (s, 3Н), 1,20 (t, J=7,0 Гц, 3Н). Масс-спектр (ИЭР) m/z: 329 (М+1)+; чистота согласно ВЭЖХ: 99, 46% (220 нм), 100% (254 нм).
19аj 4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-метоксибензойная кислота (D36)
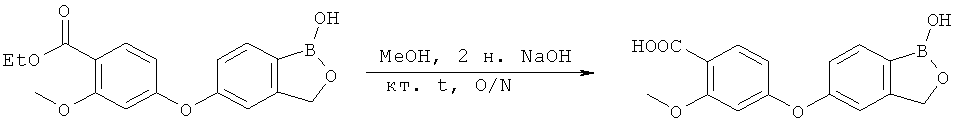
[0707] К раствору соединения D35 (0,1 г, 0,31 ммоль) в метаноле (2 мл) добавляли 2 н. NaOH (1 мл). Полученную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при' пониженном давлении с получением неочищенного продукта, который растворяли в Н2O (1 мл) и подкисляли с использованием 1 н. НСl. Полученное твердое вещество отфильтровывали и промывали диэтиловым эфиром (10 мл) с выходом указанного в заголовке соединения D36 (78 мг, 86%) в виде белого твердого вещества. Т.пл.: 109,6-110,1°С. 1H ЯМР (400 МГц, ДМСО-d6) δ: 9,20 (s, 1Н), 7,80 (d, J=8,2 Гц, 1Н), 7,75 (d, J=8,6 Гц, 1Н), 7,18 (s, 1Н), 7,15 (d, J=9,4 Гц, 1H), 6,80 (s, 1H), 6,60 (d, J=8,6 Гц, 1H), 4,98 (s, 2H), 3,81 (s, 3Н). Масс-спектр (ИЭР) m/z: 301 (M+1)+; чистота согласно ВЭЖХ: 100% (220 нм), 99,79% (254 нм).
19ak 2-Циклопентилокси-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензонитрил (D37)
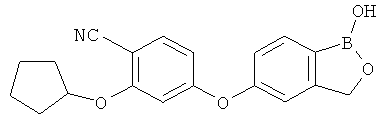
[0708] К раствору 2-гидрокси-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензонитрила (D10) (200 мг, 0,7 5 ммоль) в ТГФ (50 мл) и ДМФА (20 мл) добавляли порциями NaH (47 мг, 95%, 1,87 ммоль). Данную смесь перемешивали в течение 5 минут при комнатной температуре, и затем медленно добавляли циклопентилиодид (0,26 мл, 2,25 ммоль). Реакционную смесь перемешивали в течение 2 4 часов при комнатной температуре. После завершения реакции все летучие компоненты выпаривали под вакуумом. Остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования смесь 25% EtOAc/гексан, с получением 36 мг указанного в заголовке соединения с выходом 12,6%. 1Н ЯМР (400 МГц, (ДMCO-d6) δ: 9,23 (s, 1Н), 7,78 (d, J=7,8 Гц, 1Н) 7,69 (d, J=8,6 Гц, 1Н), 7,17 (s, 1Н), 7,10 (dd, J=2,0, 8,2 Гц, 1Н), 6,90 (d, J=2,3 Гц, 1Н), 6,56 (dd, J=1,9, 8,6 Гц, 1Н), 4,96 (s, 2Н), 4,95 (t, J=5,8 Гц, 1Н), 1, 95-1, 55 (m, 8Н). Масс-спектр (ИЭР) m/z: 336 (М+Н)+; чистота согласно ВЭЖХ: 99,15% (220 нм), 99, 62% (MaxPlot).
19al Этиловый эфир [2-циано-5-(1-гидрокси-1,3-дигидробензо [с][1,2] оксаборол-5-илокси)-фенокси]-уксусной кислоты (D38)
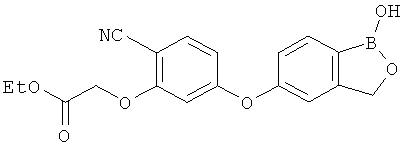
[0709] К раствору 2-гидрокси-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензонитрила (D10) (300 мг, 1,12 ммоль) в ТГФ (50 мл) добавляли порциями NaH (95 мг, 60%, 2,3 6 ммоль). Данную смесь перемешивали в течение 5 минут при комнатной температуре, и затем медленно добавляли этилбромацетат (0,262 мл, 2,36 ммоль). Реакционную смесь нагревали в течение ночи при 7 0°С. После охлаждения до комнатной температуры реакционную смесь фильтровали. Фильтрат упаривали под вакуумом. Остаток очищали путем обращеннофазной хроматографии, используя для элюирования градиент 5% МеOН/Н2О-90% МеОН/Н2O, с получением 320 мг указанного в заголовке соединения с выходом 81%. 1Н ЯМР (400 МГц, ДМСO-d6) δ: 9,25 (s 1Н), 7,78 (d, J=8,0 Гц, 1Н), 7,75 (d, J=8,4 Гц, 1Н), 7,14 (d, J=1,6 Гц, 1Н), 7,08 (dd, J=1,6, 7,6 Гц, 1Н), 6,86 (d, J-2,0 Гц, 1Н), 6,64 (dd, J=2,4, 8,8 Гц, 1Н), 5,00 (s, 2Н), 4,97 (s, 2Н), 4,13 (q, J=6,8 Гц, 2Н), 1,16 (t, 6,8 Гц, 3Н). Масс-спектр (ИЭР) m/z: 354 (М+Н)+; чистота согласно ВЭЖХ: 99,11% (220 нм), 99,14% (254 нм).
19am [2-Циано-5-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-фенокси]-уксусная кислота (D39)
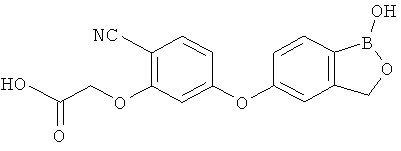
[0710] К прозрачному раствору этилового эфира [2-циано-5-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-фенокси]-уксусной кислоты (D38) (90 мг, 0,25 ммоль) в ТГФ (20 мл) добавляли LiOH (15,3 мг, 0,76 ммоль) и воду (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Затем медленно добавляли 1 н. НСl до pH 2. Смесь упаривали под вакуумом. Остаток очищали путем обращеннофазной хроматографии, используя для элюирования градиент 5% МеОН/Н2O - 90% МеОН/Н2O, с получением 48 мг указанного в заголовке соединения с выходом 58%. 1Н ЯМР (400 МГц, CD3OD) δ: 7,70 (d, J=7,8 Гц, 1Н), 7,59 (d, J=8,6 Гц, 1Н), 7,09 (s, 1Н), 7,05 (dd, J=1,9, 8,21 Гц, 1Н), 6,66 (d, J=1,9 Гц, 1Н), 6,63 (dd, J=1,9, 8,6 Гц, 1Н), 5,06 (s, 2Н), 4,78 (s, 2Н). Масс-спектр (ИЭР) m/z: 326 (М+Н)+; чистота согласно ВЭЖХ: 96,33% (220 нм), 96,44% (254 нм).
19аn Трет-бутиловый эфир [2-циано-5-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-фенокси]-уксусной кислоты (D40)
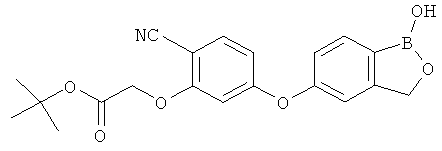
[0711] К раствору 2-гидрокси-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензонитрила (D10) (200 мг, 0,75 ммоль) в ТГФ (50 мл) добавляли порциями NaH (43 мг, 95%, 1,81 ммоль). Данную смесь перемешивали в течение 5 минут при комнатной температуре, и затем медленно добавляли трет-бутилбромацетат (0,25 мл, 1,65 ммоль). Реакционную смесь нагревали в течение 2 4 часов при 7 0°С. После охлажения до комнатной температуры реакционную смесь фильтровали. Полученный фильтрат упаривали под вакуумом. Остаток очищали путем обращеннофазной хроматографии, используя для элюирования градиент 5% МеОН/Н2O - 90% МеOН/Н2O, с получением 36 мг указанного в заголовке соединения с выходом 12,6%. 1Н ЯМР (400 МГц, ДМСO-d6) S: 9,26 (s, 1Н), 7,78 (d, J=8,2 Гц, 1Н), 7,75 (d, J=8,6 Гц, 1Н), 7,14 (s, 1Н), 7,09 (dd, J=2,3, 8,2 Гц, 1Н), 6,74 (d, J=2,3 Гц, 1Н), 6,68 (dd, J=2,0, 8,6 Гц, 1H), 4,96 (s, 2H), 4,86 (s, 2H), 1,37 (s, 9H). Масс-спектр (ИЭР) m/z: 380 (M-H)~; чистота согласно ВЭЖХ: 99,11% (220 нм), 98,48% (254 нм).
Общая методика синтеза амида посредством реакции сочетания
[0712] К раствору [2-циано-5-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-фенокси]-уксусной кислоты (D39) (150 мг, 0,4 6 ммоль) в ДМФА (4 мл) при комнатной температуре добавляли HATU (353 мг, 0,93 ммоль) и диизопропилэтиламин (0,32 мл, 1,8 6 ммоль), и перемешивали в течение 1 минуты. Добавляли соответствующий амин (0,93 ммоль), и реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь разбавляли дистиллированной водой (300 мл) и экстрагировали этилацетатом (4×400 мл). Органические экстракты объединяли, сушили над Na2SO4 и концентрировали с получением неочищенного масла. Все неочищенное вещество очищали путем обращеннофазной ВЭЖХ с использованием для градиентного элюирования двухфазной системы растворителей: 0,1% водного раствора АсОН и ацетонитрила. Фракции, содержащие чистый продукт, объединяли и лиофилизировали с получением конечного продукта хорошей чистоты.
19ао 4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-(2-морфолин-4-ил-2-оксоэтокси)-бензонитрил (D41)
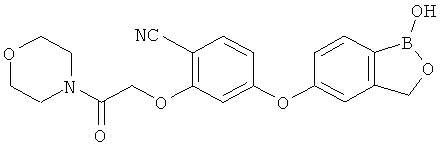
[0713] В соответствии с общей методикой, морфолин (80 мкл, 0,93 ммоль) подвергали реакции сочетания с [2-циано-5-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-фенокси]-уксусной кислотой (D39) (150 мг, 0,46 ммоль) с получением неочищенного масла, содержащего D41. В результате очистки путем обращеннофазной ВЭЖХ и последующей лиофилизации получали соединение D41 (38 мг, 21%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ДMCO-d6) δ: 9,32 (br s, 1Н), 7,86 (d, J=8,5 Гц, 1Н), 7,78 (d, J=8,5 Гц, 1Н), 7,21 (br s, 1Н), 7,15 (dd, J=9,0, 1,5 Гц, 1Н), 6,90 (d, J=1,5 Гц, 1Н), 6,65 (dd, J=8,5, 1,5 Гц, 1Н), 5,17 (s, 2Н), 5,03 (s, 2Н), 3, 65-3, 55 (m, 4Н), 3,49-3,40 (m, 4Н). Масс-спектр (ИЭР) m/z: 395 (М+Н)+; чистота согласно ВЭЖХ: 96,02% (Maxplot), 97,64% (220 нм) и 97,18% (254 нм).
19ар 4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-[2-(4-метил-пиперидин-1-ил)-2-оксоэтокси]-бензонитрил (D42)
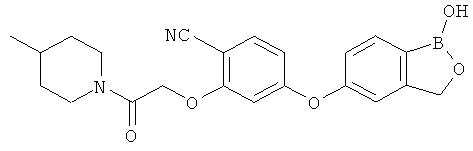
[0714] В соответствии с общей методикой, 4-метилпиперидин (110 мкл, 0,90 ммоль) подвергали реакции сочетания с циано-5-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-фенокси]-уксусной кислотой (D39) (97 мг, 0,30 ммоль) с получением неочищенного масла, содержащего D42. В результате очистки путем обращеннофазной ВЭЖХ и последующей лиофилизации получали соединение D42 в виде белого твердого веществ (42 мг, 35%). 1Н ЯМР (400 МГц, ДМСO-d6) δ: 9,25 (br s, 1Н), 7,78 (d, J=7,0 Гц, 1H), 7,73 (d, J=7,0 Гц, 1H), 7,13 (br s, 1H), 7,08 (dd, J=7,5, 2,0 Гц, 1H), 6,74 (d, J=2,0 Гц, 1H), 6,62 (dd, J=7,5, 2,0 Гц, 1H), 5,08 (d, J=10,0 Гц, 1H), 5,02 (d, J=10,0 Гц, 1H), 4,95 (s, 2H), 4,22 (br d, J=10,5 Гц, 1H), 3,65 (br d, J=10,5 Гц), 2,93 (br t, J=10,5 Гц, 1H), 2,52 (br t, J=10,5 Гц, 1H), 1,63-1,50 (m, 3H), 1, 08-0, 96 (m, 1H), 0,88 (d, J=7,0 Гц, 3Н), 0,90-0,80 (m, 1H). Масс-спектр (ИЭР) m/z: 407 (M+H)+; чистота согласно ВЭЖХ: 99,51% (Maxplot), 99,12% (220 нм) и 98,77% (254 нм).
19aq 4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-[2-(4-метил-пиперазин-1-ил)-2-оксо-этокси]-бензонитрила гексафторфосфат (D43)
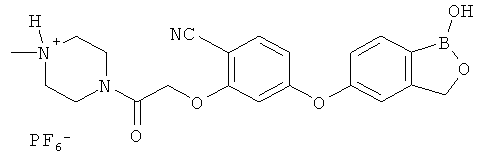
[0715] В соответствии с общей методикой, 4-метилпиперазин (150 мкл, 0,90 ммоль) подвергали реакции сочетания с циано-5-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-фенокси]-уксусной кислотой (D39) (150 мг, 0,46 ммоль) с получением неочищенного масла, содержащего соединение (D43). В результате очистки путем обращеннофазной ВЭЖХ и последующей лиофилизации получали соединение (D43) в виде гексафторфосфатной соли белого цвета (40 мг, чистота 16%). 1Н ЯМР (400 МГц, ДMCO-d6) δ: 9,65 (br s, 1Н), 9,23 (s, 1H), 7,80 (d, J=8,0 Гц, 1H), 7,73 (d, J=8,0 Гц, 1H), 7,13 (s, 1H), 7,08 (d, J=8,0 Гц, 1H), 6,97 (s, 1H), 6,55 (d, J=8,0 Гц, 1H), 5,17 (s, 2H), 4,97 (s, 2H), 3,50-2,76 (br m, 5H), 3,35 (br s, 3H), 2,70 (br s, 3H); 19F ЯМР (376 МГц, ДMCO-d6) -70,6 (d, J=714 Гц, 6F) м.д.; Масс-спектр (ИЭР) m/z: 408 (М+Н)+; чистота согласно ВЭЖХ: 94,56% (Maxplot), 95,06% (220 нм) и 95,77% (254 нм).
19аr Диметиловый эфир 6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-пиридин-2,3-дикарбоновой кислоты (D44)
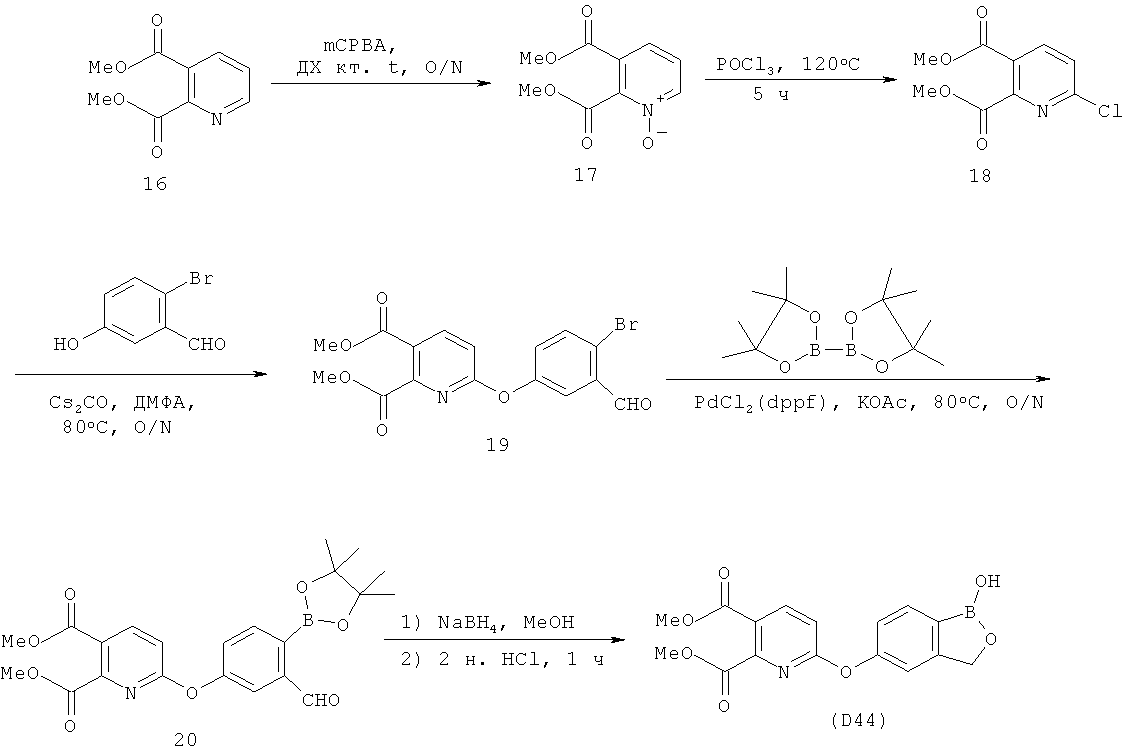
Диметиловый эфир 1-оксипиридин-2,3-дикарбоновой кислоты (17)
[0716] Смесь диметилового эфира пиридин-2,3-дикарбоновой кислоты (16) (2,0 г, 10,24 ммоль) и мета-хлорпербензойной кислоты (чистота 75%, 2,12 г, 12,28 ммоль) в хлороформе (50 мл) перемешивали при комнатной температуре в течение 16 ч. Твердое вещество отфильтровали, и полученный фильтрат промывали насыщенным водным раствором NаНСО3 (2×50 мл), сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта (2,3 г, количественный выход) в виде желтого твердого вещества, которое использовали без очистки на следующей стадии. 1Н ЯМР (4 00 МГц, ДМСO-d6) δ: 8,65 (d, J=6,6 Гц, 1Н), 7,90 (d, J=7,8 Гц, IE), 7,66 (dd, J=7,8, 6,6 Гц, 1H), 3,91 (s, 6H). Масс-спектр (ИЭР) m/z: 212 (M+1)+.
Диметиловый эфир 6-хлорпиридин-2,3-дикарбоновой кислоты (18)
[0717] Раствор диметилового эфира 1-оксипиридин-2,3-дикарбоновой кислоты (17) (4,0 г, 18,94 ммоль) в оксихлориде фосфора (30 мл) нагревали в течение 3 ч при 115°С. После охлажденния смесь обрабатывали ледяной водой (50 мл) и хлороформом (3×50 мл), подщелачивали путем добавления насыщенного водного раствора NаНСО3 (3×50 мл), и разделяли слои. Органический слой сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта (4,0 г) в виде коричневого масла, который использовали без очистки на следующей стадии. 1Н ЯМР 400 МГц, (ДМСО-d6) δ: 8,32 (d, J=8,2 Гц, 1Н), 7,83 (d, J=8,2 Гц, 1Н), 3,85 (s, 6Н), Масс-спектр (ИЭР) m/z: 230 (М+1)+, 232 (М+3)+.
Диметиловый эфир 6-(4-бром-3-формилфенокси)-пиридин-2,3-дикарбоновой кислоты (19)
[0718] К раствору диметилового эфира 6-хлорпиридин-2,3-дикарбоновой кислоты (18) (4,0 г, 17,42 ммоль) и 2-бром-5-гидроксибензальдегида (3,5 г, 17,42 ммоль) в ДМФА (30 мл) добавляли карбонат цезия (11,35 г, 34,84 ммоль). Полученную смесь нагревали в течение ночи при 80°С. ДМФА удаляли при пониженном давлении, разбавляли EtOAc (100 мл), промывали водой (2×25 мл) и солевым раствором (50 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта, который очищали путем колоночной хроматографии (силикагель, 20% EtOAc в гексане) с получением указанного в заголовке соединения 19 (1,14 г, 15%) в виде светло-желтого масла. 1Н ЯМР (400 МГц, ДMCO-d6) δ: 10,18 (s, 1Н), 8,38 (d, J=8,6 Гц, 1H), 7,90 (d, J=8,5 Гц, 1H), 7,66 (s, 1H), 7, 55-7, 52 (m, 1H), 7,36 (d, J=8,6 Гц, 1H), 3,86 (s, 3H), 3,84 (s, 3Н). Масс-спектр (ИЭР) m/z: 394 (M+1)+, 396 (M+3)+.
Диметиловый эфир 6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-пиридин-2,3-дикарбоновой кислоты (20)
[0719] К раствору диметилового эфира 6-(4-бром-3-формилфенокси)-пиридин-2,3-дикарбоновой кислоты (19) (1,14 г, 2,89 ммоль) в 1,4-диоксане (10 мл), дегазированному азотом (30 мин), добавляли бис(пинаколато)дибор (1,10 г, 4,33 ммоль), ацетат калия (0,85 г, 8,67 ммоль) и хлорид [1,11-бис(дифенилфосфино)ферроцен]палладия (II) (0,16 г, 0,23 ммоль). Данную суспензию снова дегазировали азотом (10 мин) и нагревали в течение ночи при 90°С. Полученную смесь пропускали через Celite® и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали путем колоночной хроматографии (силикагель, 20% EtOAc в гексане) с выходом указанного в заголовке соединения 20 (0,85 г, 70%) в виде бесцветного масла. 1Н ЯМР (400 МГц, ДМСО-d6) δ: 10,39 (s, 1Н), 8,39 (d, J=8,6 Гц, 1Н), 7,85 (d, J=7,8 Гц, 1Н), 7,69 (s, 1Н), 7,56-7,53 (m, 1Н), 7,36 (d, J=8,6 Гц, 1Н), 3,84 (s, 3Н), 3,79 (s, 3Н), 1,35 (s, 12Н).
19аr Диметиловый эфир 6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-пиридин-2,3-дикарбоновой кислоты (D44)
[0720] К раствору диметилового эфира 6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-пиридин-2,3-дикарбоновой кислоты (20) (0,77 г, 1,74 ммоль) в чистом этаноле (10 мл) добавляли боргидрид натрия (0,08 г, 2,09 ммоль) при 0°С. Данную смесь выдерживали в течение на 1 ч при 0°С, затем pH смеси доводили до 2-3 путем добавления 2 М НСl. Растворитель удаляли при пониженном давлении с получением неочищенного продукта, который очищали путем обращеннофазной препаративной ВЭЖХ, используя в качестве элюента CH3CN/H2O (нейтральный pH), и лиофилизировали с выходом указанного в заголовке соединения D44 (0,18 г, 30%) в виде белого твердого вещества. Т.пл.: 67,5-69,2°С. 1Н ЯМР (400 МГц, ДMCO-d6) δ: 9,24 (s, 1Н), 8,33 (d, J=8,6 Гц, 1Н), 7,77 (d, J=7,8 Гц, 1H), 7,25-7, 22 (m, 2H), 7,15 (d, J=7,8 Гц, 1H), 4,98 (s, 2H), 3,81 (s, 3H), 3,77 (s, 3H).
Масс-спектр (ИЭР) m/z: 344 (M+1)+; чистота согласно ВЭЖХ: 99,42% (Maxplot), 99,03% (220 нм), 99, 95% (254 нм).
19as Этиловым эфир 3-циано-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5'-илокси)-пиридин-2-карбоновой кислоты (D45)
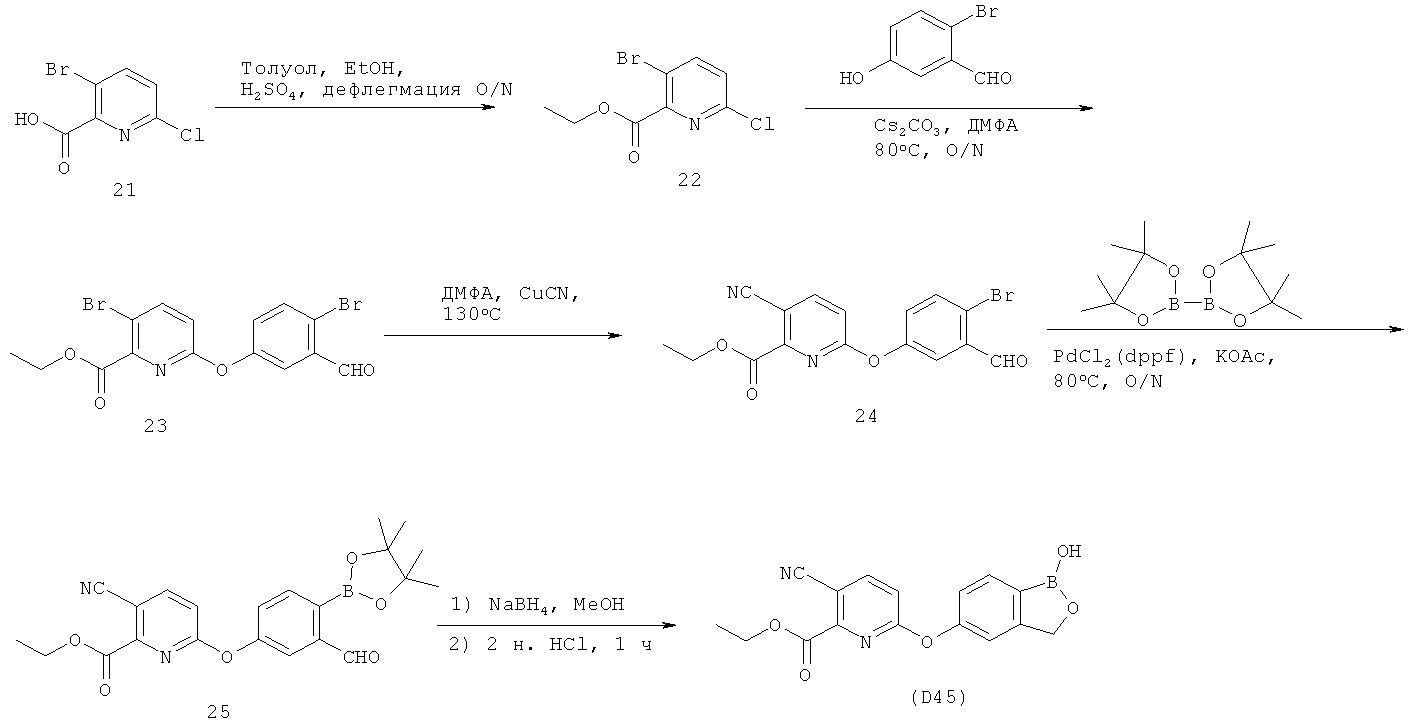
Этиловый эфир 3-бром-6-хлорпиридин-2-карбоновой кислоты (22)
[0721] К раствору 3-бром-6-хлорпиколиновой кислоты (21) (8,0 г, 33, 83 ммоль) в смеси толуола (80 мл) и этанола (40 мл) добавляли серную кислоту (0,66 мл, 6,76 ммоль). Данную реакционную смесь подвергали кипячению с обратным холодильником в течение 16 ч, затем оставляли охлаждаться и распределяли между СНСl3 (200 мл) и насыщенным водным раствором NаНСО3 (250 мл). Водный слой экстрагировали CHCl3 (2×100 мл), объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта, который очищали путем колоночной хроматографии (силикагель, 10% EtOAc в гексане) с выходом указанного в заголовке соединения 22 (9,0 г, количественный выход) в виде прозрачного масла. 1Н ЯМР (400 МГц, ДМСО-d6) δ: 8,31 (d, J=8,6 Гц, 1Н), 7,68 (d, 1H, J=8,2 Гц), 4,39 (q, J=7,0 Гц, 2H), 1,33 (t, J=7,2 Гц, 3Н).
Этиловый эфир 3-бром-6-(4-бром-3-формилфенокси)-пиридин-2-карбоновой кислоты (23)
[0722] К раствору этилового эфира 3-бром-6-хлорпиридин-2-карбоновой кислоты (22) (8,0 г, 30,24 ммоль) и 2-бром-5-гидрокси-бензальдегида (7,29 г, 36,29 ммоль) в ДМФА (100 мл) добавляли карбонат цезия (22,6 г, 69,55 ммоль). Полученную смесь нагревали в течение ночи при 80°С. ДМФА удаляли при пониженном давлении, остаток разбавляли EtOAc (200 мл), промывали водой (2×50 мл) и солевым раствором (50 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта, который очищали путем колоночной хроматографии (силикагель, 20% EtOAc в гексане) с выходом указанного в заголовке соединения 23 (4,0 г, 31%) в виде прозрачного масла. 1Н ЯМР (400 МГц, ДMCO-d6) δ: 10,18 (s, 1Н), 8,27 (d, J=8,6 Гц, 1Н), 7,87 (d, J=7,6 Гц, 1Н), 7,65 (s, 1Н), 7,51 (dd, J=8,7, 2,9 Гц, 1Н), 7,26 (d, J=8,9 Гц, 1Н), 4,29 (q, J=7,1 Гц, 2Н), 1,25 (t, J=7,0 Гц, 3Н). Масс-спектр (ИЭР) m/z: 430 (М+1)+.
Этиловый эфир 6-(4-бром-3-формилфенокси)-3-цианопиридин-2-карбоновой кислоты (24)
[0723] К раствору этилового эфира 3-бром-6-(4-бром-3-формилфенокси)-пиридин-2-карбоновой кислоты (23) (1,8 г, 4,19 ммоль) в ДМФА (6 мл) добавляли порциями CuCN (0,75 г, 8,38 ммоль) при 130°С, и нагревали в течение 4 ч. Данную смесь охлаждали до комнатной температуры, и добавляли этилацетат (100 мл). Смесь перемешивали в течение 10 минут, фильтровали и промывали этилацетатом (2×50 мл). Полученный фильтрат промывали водой (2×50 мл) и солевым раствором (50 мл), сушили над безводным сульфатом натрия, фильтровали и упаривали под вакуумом. Остаток очищали путем колоночной хроматографии (25% этилацетат/гексаны) с получением соединения 24 (0,3 г, 19%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ДMCO-d6) δ: 10,20 (s, 1Н), 8,51 (d, J=8.6 Гц, 1H), 7,91(d, J=8,9 Гц, 1H), 7,76 (s, 1H), 7,59 (d, J=2.7 Гц, 1H), 7,55 (dd, J=8,5, 2,7 Гц, 1H), 4,32 (q, J=7,1 Гц, 2H), 1,26 (t, J=7,0 Гц, 3Н). Масс-спектр (ИЭР) m/z: 377 (М+1)+.
Этиловый эфир 3-циано-6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-пиридин-2-карбоновой кислоты (25)
[0724] К раствору 6-(4-бром-3-формил-фенокси)-3-циано-пиридин-2-карбоновой кислоты этилового эфира (24) (0,30 г, 0,79 ммоль) в 1,4-диоксане (6 мл), дегазированному азотом (30 мин), добавляли бис(пинаколато)дибор (0,30 г, 1,19 ммоль), ацетат калия (0,23 г, 2,39 ммоль) и хлорид [1,1'-бис(дифенилфосфино)ферроцен]палладия (II) (0,03 г, 0,03 ммоль). Данную суспензию снова дегазировали азотом (10 мин) и нагревали в течение ночи при 80°С. Полученную смесь пропускали через Celite® и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали путем колоночной хроматографии (силикагель, 25% EtOAc в гексане) с выходом указанного в заголовке соединения 25 (0,11 г, 29%) в виде бесцветного масла. ХН ЯМР (400 МГц, ДMCO-d6) δ: 10,38 (s, 1Н), 8,51 (d, J=8,9 Гц, 1H), 7,83 (d, J=8,2 Гц, 1H), 7,76 (s, 1H), 7,51 (d, J=2,7 Гц, 1H), 7,49 (d, J=8,5 Гц, 1H), 4,32 (q, J=7,1 Гц, 2H), 1,39 (s, 12H), 1,21 (t, J=7,0 Гц, 3Н).
19as Этиловый эфир 3-циано-6-(1-гидрокси-1,3-дигидробензо[с] [1,2]оксаборол-5-илокси)-пиридин-2-карбоновой кислоты (D45)
[0725] К раствору этилового эфира 3-циано-6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-пиридин-2-карбоновой кислоты (25) (0,11 г, 0,23 ммоль) в метаноле (5 мл) добавляли боргидрид натрия (0,01 г, 0,27 ммоль) при 0°С. Данную смесь выдерживали в течение 1 ч при 0°С, затем добавляли 2 М НСl достижения pH смеси значения 2-3. Растворитель удаляли при пониженном давлении с получением неочищенного продукта, который очищали путем обращеннофазной препаративной ВЭЖХ, используя в качестве элюента CH3CN/H2O (0,1% АсОН), с получением после лиофилизации указанного в заголовке соединения D45 (0,08 г, 20%) в виде белого твердого вещества. Т.пл.: 204-206°С. 1Н ЯМР (400 МГц, ДMCO-d6) δ: 9,26 (s, 1Н), 8,47 (d, J=9,0 Гц, 1Н), 7,80 (d, J=9,4 Гц, 1Н), 7,39 (d, J=8,6 Гц, 1Н), 7,32 (s, 1Н), 7,24-7,19 (m, 1Н), 4,99 (s, 2Н), 4,32-4,23 (m, 2Н), 1,39-1,20 (m, 3Н). Масс-спектр (ИЭР) m/z: 325 (М+1)+; чистота согласно ВЭЖХ: 96,01% (Maxplot), 98,13% (220 нм), 97, 47% (254 нм).
19at 6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-метокси-никотинонитрил (D46) и 19аu 2-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-6-метокси-никотинонитрил (D47)
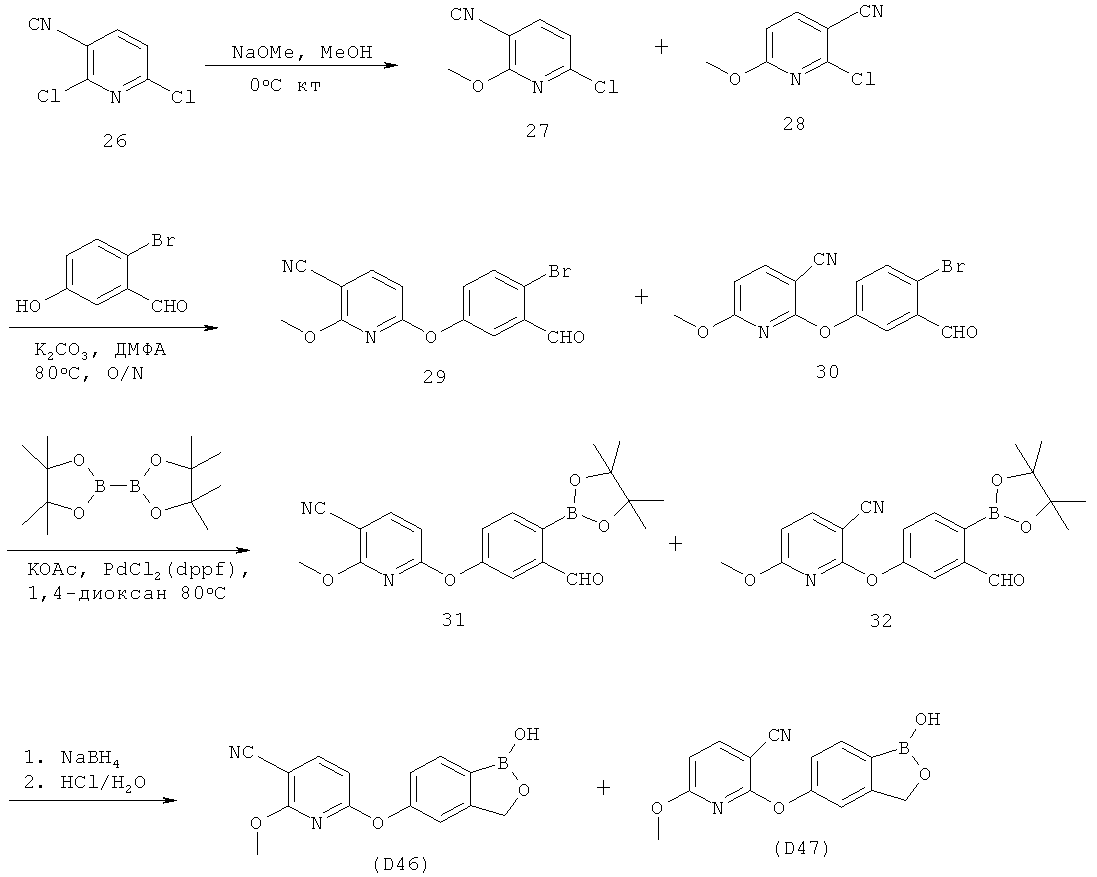
6-Хлор-2-метокси-никотинонитрил и 2-хлор-6-метокси-никотинонитрил (27 и 28)
[0726] К раствору 2,6-дихлорникотинонитрила (26) (5,0 г, 28,90 ммоль) в метаноле (25 мл) медленно добавляли метоксид натрия (25% раствор в метаноле, 6,24 мл, 28,90 ммоль) при 0°С, и перемешивали в течение 16 ч при комнатной температуре. Метанол отгоняли, и остаток разбавляли EtOAc (150 мл), промывали водой (2×50 мл) и солевым раствором (50 мл), сушили над Na2SO4, фильтровали и концентрировали с получением неочищенной смеси, которую перекристаллизовывали из диэтилового эфира с выходом неразделяемой смеси соединений 27 и 28 в соотношении 1:2 (4,8 г, количественный выход) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ДМСО-d6) δ: 8,30 (d, J=8,2 Гц, 1Н), 8,27 (d, J=8,6 Гц, 1Н), 7,31 (d, J=7,7 Гц, 1Н), 7,00 (d, J=8,6 Гц, 1Н), 3,98 (s, 3Н), 3,92 (s, 3Н).
6-(4-Бром-3-формил-фенокси)-2-метоксиникотинонитрил и 2-(4-бром-3-формил-фенокси)-6-метоксиникотинонитрил (29 и 30)
[0727] К смеси 6-хлор-2-метокси-никотинонитрила и 2-хлор-6~ метокси-никотинонитрила (соединения 27 и 28) (5,0 г, 29,65 ммоль) и 2-бром-5-гидрокси-бензальдегида (5,96 г, 29,65 ммоль) в ДМФА (100 мл) добавляли карбонат калия (6,14 г, 44,47 ммоль). Полученную смесь нагревали в течение ночи при 80°С. ДМФА удаляли при пониженном давлении, остаток растворяли в EtOAc (150 мл), промывали водой (2×50 мл) и солевым раствором (50 мл), сушили над Na2SO4, фильтровали и концентрировали с получением коричневого масла, которое перекристаллизовывали из диэтилового эфира (50 мл) с выходом неразделяемой смеси соединений 29 и 30 в соотношении 1:2 (5,8 г, 60%) в виде белого твердого вещества. 1Н ЯМР (4 00 МГц, ДMCO-d6) δ: 10,17 (s, 2Н), 8, 28-8, 23 (m, 2Н), 7,87 (dd, J=8,5, 2,7 Гц, 2Н), 7,75 (d, J=2,7 Гц, 1Н), 7,71 (d, J=3,1 Гц, 1Н), 7,62-7,55 (m, 2Н), 6,79 (d, J=8,2 Гц, 1Н), 6,73 (d, J=8,6 Гц, 1Н,), 3,71(s, 3Н), 3,61 (s, 3Н). Масс-спектр (ИЭР) m/z: 335 (М+1)+.
6-[3-Формил-4-(4,4, 5,5-тетраметил-[1,3,2]диоксаборолан-2~ил)-фенокси]-2-метоксиникотинонитрил и 2-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-6-метоксиникотинонитрил (31 и 32)
[0728] К раствору 6-(4-бром-3-формил-фенокси)-2-метокси-никотинонитрила и 2-(4-бром-3-формил-фенокси)-6-метокси-никотинонитрила (29 и 30) (4,80 г, 14,40 ммоль) в 1,4-диоксане (70 мл), дегазированному азотом (30 мин), добавляли бис(пинаколато)дибор (5,48 г, 21,61 ммоль), ацетат калия (4,24 г, 43, 20 ммоль) и хлорид [1,1'-бис(дифенилфосфино)ферроцен]палладия (II) (0,54 г, 0,72 ммоль). Данную суспензию снова дегазировали азотом (10 мин) и нагревали в течение ночи при 90°С. Полученную смесь пропускали через целит и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали путем колоночной хроматографии (силикагель, 25% EtOAc в гексане) с выходом указанных в заголовке соединений 31 и 32 в соотношении 1:1,5 (4,60 г, 85%) в виде бесцветного масла. 1Н ЯМР (400 МГц, ДMCO-d6) δ: 10,37 (s, 2Н), 8, 28-8,24 (m, 2Н), 7, 83-7, 57 (m, 4Н), 7, 64-7, 57 (m, 2Н), 6, 80-6, 73 (m, 2Н), 3,71 (s, 3Н), 3,61 (s, 3Н), 1,39 (s, 24Н).
19at 6-(1-Гидрокси-1, 3-дигидробензо [с] [1,2]оксаборол-5-илокси)-2-метоксиникотинонитрил (D46) и
19аu 2-(1-Гидрокси-1,3-дигидробензо [с] [1,2] оксаборол-5-илокси)-6-метоксиникотинонитрил (D47)
[0729] К раствору 6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-метоксиникотинонитрила и 2-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-6-метоксиникотинонитрила (31 и 32) (2,6 г, 6,83 ммоль) в метаноле (15 мл) добавляли боргидрид натрия (0,31 г, 8,19 ммоль) при 0°С, и выдерживали при этой же температуре в течение на 1 ч. Затем pH смеси доводили до 2-3 путем добавления 2 М НСl. Растворитель удаляли при пониженном давлении с получением смеси региоизомеров, которую разделяли на хиральной колонке (Chiralcel_OJ 10 мк 4-6×250 мм), элюируя смесью гексан/iPrOH/EtOH (90:5:5), с получением указанных в заголовке соединений D46 (1,70 г, 58%) и D47 (0, 40 г, 23%) в виде белого твердого вещества после лиофилизации.
19at 6-(1-Гидрокси-1, 3-дигидробензо [с] [1,2] оксаборол-5-илокси)-2-метоксиникотинонитрил (D46)
[0730] 1Н ЯМР (400 МГц, ДМСO-d6) δ: 9,24 (s, 1Н), 8,21 (d, J=8,2 Гц, 1Н), 7,77 (d, J=7,8 Гц, 1Н), 7,29 (s, 1Н), 7,19 (d, J=8,6 Гц, 1Н), 6,64 (d, J=8,2 Гц, 1Н), 4,97 (s, 2Н), 3,74 (s, 3Н). Масс-спектр (ИЭР) m/z: 283 (М+1)+; чистота согласно ВЭЖХ: 99,77% (Maxplot), 99,27% (220 нм), 99,77% (254 нм).
19аu 2-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-6-метоксиникотинонитрил (D47)
[0731] 1Н ЯМР (400 МГц, ДMCO-d6) δ: 9,24 (s, 1Н), 8,25 (d, J=7,2 Гц, 1H), 7,78 (d, J=7,8 Гц, 1H), 7,32 (s, 1H), 7,25-7, 23 (m, 1H), 6,73 (d, J=8,6 Гц, 1H), 5,00 (s, 2H), 3,63 (s, 3Н). Масс-спектр (ИЭР) m/z: 283 (M+1)+; чистота согласно ВЭЖХ: 100% (Maxplot), 98,76% (200 нм), 99,59% (254 нм).
19av Этил-5-хлор-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинат-(D48)
[0732] Указанное в заголовке соединение получали с помощью методики, аналогичной описаной ниже методике для D60. [0733] Т.пл.: 149-153°С. 1Н ЯМР (300 МГц, ДМСО-d6): δ 9, 24 (s, 1Н), 8,57 (d, J=1,8 Гц, 1Н), 8,42 (dd, J=2,1 & 0,6 Гц, 1Н), 7,77 (d, J=8,1 Гц, 1Н), 7,25 (d, 1Н), 7,17 (dd, J=7,8 & 2,1 Гц, 1Н), 4,97 (s, 2Н), 4,31 (q, J=7,2 Гц, 2Н) и 1,30 (t, J=7,2 Гц, 3Н) м.д. Чистота (ВЭЖХ): 95% при 220 нм и 95% при 254 нм. Масс-спектр: m/z=334 (М+1, ИЭР(+)) и m/z=332 (М-1, ИЭР(-)).
19aw 5-Хлор-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотиновая кислота (D49)
[0734] Гидролиз этил-5-хлор-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотината (0,9 г, 2,7 ммоль) 1 н. NaOH (11 мл) в МеОН (50 мл) в течение ночи при комнатной температуре с последующим подкислением путем добавления 6 н. НСl, выделением и перекристаллизацией из смеси EtOAc и гексана с выходом указанной в заголовке карбоновой кислоты в виде желтоватого твердого вещества (0,76 г, 2,49 ммоль, выход 92%).
[0735] Т.пл.: 185-190°С (разл.). 1H ЯМР (300 МГц, ДMCO-d6): δ 13,50 (s, 1Н), 9,23 (s, 1Н), 8,54 (d, J=2,1 Гц, 1Н), 8,37 (d, J=2,1 Гц, 1Н), 7,77 (d, J=7,8 Гц, 1Н), 7,25 (d, J=l,5 Гц, 1Н), 7,16 (dd, J=7,8 & 1,5 Гц, 1Н) и 4,97 (s, 2Н) м.д. Чистота (ВЭЖХ): >95% при 254 нм. Масс-спектр: m/z=306 (М+1, ИЭР(+)) и m/z=260 (М-45, ИЭР(-)).
19ах 5-(2-Фтор-4~метоксикарбонилфенокси)-1-гидрокси-2,1-бензоксаборол (D50)
[0736] Смесь 4-бром-3-(1,3-диоксолан-2-ил)фенола (7,1 г, 2 9 ммоль, 1 экв.), метил-3,4-дифторбензоата (5 г, 29 ммоль, 1 зкв.), карбоната калия (6 г, 43,5 ммоль, 1,5 экв.) в ДМФА (29 мл) перемешивали в течение ночи при 100°С. Согласно ТСХ-анализу реакция была завершена. После охлаждения до комнатной температуры осадок удаляли путем фильтрования. Остаток промывали EtOAc. Органические фракции объединяли и концентрировали на роторном испарителе. Остаток переносили в смесь EtOAc и воды. Органический слой отделяли и промывали солевым раствором и сушили над безводным сульфатом натрия. Фильтровали и концентрировали с получением неочищенного метил-4-(4-бром-3-(1,3-диоксолан-2-ил)фенокси)-3-фторбензоата в виде светло-коричневого масла, которое использовали без очистки на следующей стадии.
[0737] К раствору метил-4-(4-бром-3-(1,3-диоксолан-2-ил)фенокси)-3-фторбензоата в ТГФ (30 мл) добавляли 20 мл 3 М НСl (полученной из 6 М НСl и воды в соотношении 1:1), данную смесь подвергали кипячению с обратным холодильником в течение 2 часов. ТСХ-анализ показывал отсутствие SM (гексан/EtOAc, 7:3). Реакционную смесь охлаждали до комнатной температуры. Добавляли 1 н. NaOH (60 мл). Половину растворителя выпаривали на роторном испарителе, остаток экстрагировали EtOAc. Органическую фазу промывали водой, солевым раствором, сушили над Na2SO4, фильтровали и концентрировали с получением светло-коричневого масла, которое оставляли на на 2,5 суток. Образовавшееся твердое вещество отфильтровывали и промывали смесью гексан/EtOAc с получением метил-4-(4-бром-3-формилфенокси)-3-фторбензоата в виде желтоватого порошка (10,2 г, 100%).
[0738] К раствору метил-4-(4-бром-3-формилфенокси)-3-фторбензоата (10 г, 28,3 ммоль), КОАс (8,33 г, 84,9 ммоль), бис(пинаколато)дибора (8,63 г, 34 ммоль) в безводном 1,4-диоксане (120 мл) добавляли PdCl2 (dppf)2 (578 мг, 2,5 молярных % CAS №72287-26-4, Aldrich catalog №379670). Данную реакционную смесь дегазировали с использованием N2 и затем нагревали при 80°С с перемешиванием на магнитной мешалке. Ход реакции контролировали посредством анализа ТСХ, реакция была завершена в течение ночи. Смесь охлаждали до комнатной температуры, фильтровали через целит, промывали этилацетатом и затем упаривали. Остаток растворяли в минимальном объеме EtOAc и для удаления темной окраски наносили на очень короткую и широкую колонку силикагеля, которую элюировал смешанным растворителем гексан/EtOAc (3:1, об./об.) с получением светло-желтого масла. Снова выполняли хроматографирование на силикагеле (гексан/EtOAc, 7:3). Первая фракция (белое вещество) согласно ЯМР (отсутствие ароматических сигналов) представляла собой бис(пинаколато)дибор. Фракции, содержащие желаемый продукт, собирали и концентрировали с получением метил-3-фтор-4-(3-формил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)бензоата в виде бесцветного масла (9.5 г, 84%).
[0739] 1Н ЯМР (ДМСO-d6, 300 МГц): δ=10,38 (s, 1Н), 7,91 (dd, J=2,1, 13,2 Гц, 1Н), 7,82 (d, J=7,8 Гц, 2Н), 7,42 (d, J=2,7 Гц, 2Н), 7,32 (d, J=8,4 Гц, 1Н), 3,85 (s, 3Н), и 1,32 (s, 12Н) м.д.
[0740] К раствору метил-3-фтор-4-(3-формил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)бензоата (5 г, 12,5 ммоль) в МеОН (125 мл) добавляли порциями NaBH4 (709 мг, 18,75 ммоль) при 0°С на ледяной бане в атмосфере N2. Данную реакционную смесь перемешивали, поддерживая температуру в диапазоне от 0°С до комнатной температуры. Ход реакции контролировали посредством анализа ТСХ, реакция была завершена в течение ночи. Смесь охлаждали до комнатной температуры. Растворитель выпаривали на роторном испарителе до половины от исходного объема. Затем данную смесь охлаждали до 0°С и прекращали реакцию путем добавления воды (12 мл) и последующего добавления 6 н. НСl (12 мл). Перемешивали при комнатной температуре в течение 30 мин, выпавшее в осадок белое твердое вещество отфильтровывали. Полученное смолистое твердое вещество суспендировали в воде в течение 1 ч с использованием ультразвука. Фильтровали, промывали большим количеством воды. Фильтровали и сушили с получением целевого соединения в виде белого твердого вещества (2,1 г, 56%).
[0741] 1H ЯМР (ДМСО-d6, 300 МГц): δ=9,19 (s, 1Н), 7,88 (dd, J=1,8, 11,1 Гц, 1Н), 7,80 (d, J=8,4 Гц, 1Н), 7,75 (d, J=8,1 Гц, 1Н), 7,21 (d, J=8,4 Гц, 1Н), 7,07 (d, J=8,4 Гц, 2Н), 4,93 (s, 2Н), и 3,84 (s, 3Н).
19ay 5-(2-Фтор-4-этоксикарбонилфенокси)-1-гидрокси-2,1-бензоксаборол (D51)
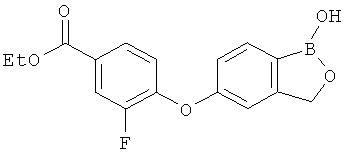
[0742] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19ах (D50), из этил-3,4-дифторбензоата и 4-бром-3-формилфенола.
[0743] Масс-спектр (ИЭР) m/z: 315 (М-Н).
19az 5-{2,6-Дифтор-4-метоксикарбонилфенокси)-1-гидрокси-2,1-бензоксаборол (D52)
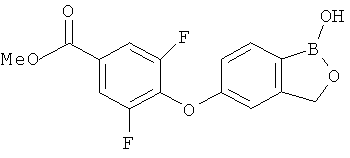
[0744] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19ах (D50), из метил-3,4,5-трифторбензоата и 4-бром-3-формилфенола.
[0745] Масс-спектр (ИЭР) m/z: 319 (М-Н)-.
19bа 5-(5-Хлор-2-фтор-4-этоксикарбонилфенокси)-1-гидрокси-2,1-бензоксаборол (D53)
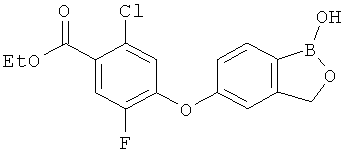
[0746] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19ах (D50), из этил-2-хлор-4,5-дифторбензоата и 4-бром-3-формилфенола.
[0747] Масс-спектр (ИЭР) m/z: 349 (М-Н)-.
19bb 5-(4-Этоксикарбонил-2-трифторметилфенокси)-1-гидрокси-2,1-бензоксаборол (D54)
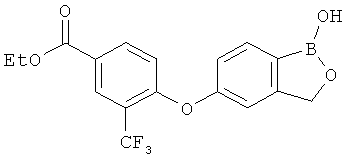
[0748] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19ах (D50), из этил-4-фтор-3-трифторметилбензоата и 4-бром-3-формилфенола. [0749] Масс-спектр (ИЭР) m/z: 365 (М-Н)-.
19bс 5-(2-Фтор-4-изопропилоксикарбонилфенокси)-1-гидрокси-2,1-бензоксаборол (D55)
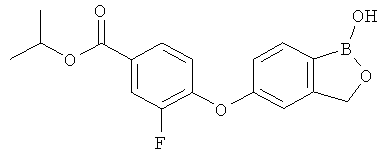
[0750] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19ах (D50), из изопропил-3,4-дифторбензоата и 4-бром-3-формилфенола.
[0751] Масс-спектр (ИЭР) m/z: 329 (М-Н)-.
19bd 5-(2, 6-Дифтор-4-этоксикарбонилфенокси)-1-гидрокси-2,1-бензоксаборол (D56)
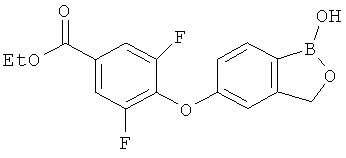
[0752] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19ах (D50), из этил-3,4,5-трифторбензоата и 4-бром-3-формилфенола.
[0753] Масс-спектр (ИЭР) m/z: 333 (М-Н)-.
19bе 5-(3-Хлор-4-этоксикарбонилфенокси)-1-гидрокси-2,1-бензоксаборол (D57)
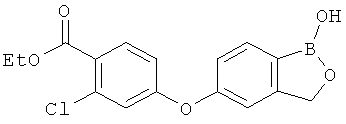
[0754] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19ах (D50), из этил-2-хлор-4-фторбензоата и 4-бром-3-формилфенола.
[0755] Масс-спектр (ИЭР) m/z: 331 (М-Н)-.
19bf 5-(2-Хлор-5-фтор-4-этоксикарбонилфенокси)-1-гидрокси-2,1-бензоксаборол (D58)
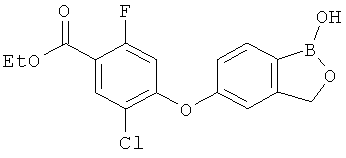
[0756] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19ах (D50), из этил-5-хлор-2,4-дифторбензоата и 4-бром-3-формилфенола.
[0757] Масс-спектр (ИЭР) m/z: 349 (М-Н)-.
19bi (4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)фенил)метанаминия хлорид (D59)
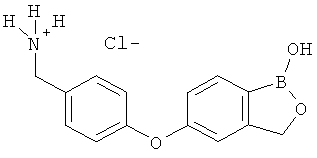
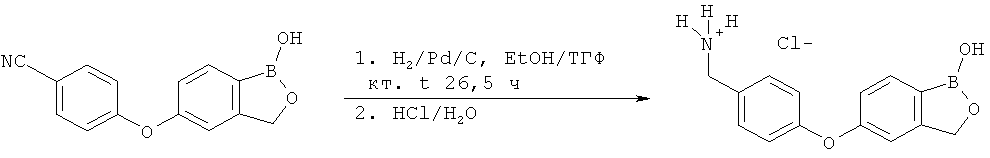
[0758] Указанное в заголовке соединение синтезировали в соответствии с той же методикой, которая описана выше для получения его региоизомера. Выход 66,7%.
[0759] Т.пл.: >250°С. 1H ЯМР (ДМСО-d6, 300 МГц): δ 9,18 (s, 1Н), 8,43 (br, s, 3Н), 7,74 (d, J=8,1 Гц, 2Н), 7,52 (d, J=8,7 Гц, 2Н), 7,08 (d, J=8,7 Гц, 1Н), 6, 98-6, 94 (m, 2Н), 4,91 (s, 2Н) и 3,99 (br, q, J=4,8 Гц, 2Н) м.д. Чистота (ВЭЖХ): 92,2% при 220 нм и 94,9% при 254 нм. Масс-спектр: m/z=256 (М+1, ИЭР(+)) и m/z=255 (М-, ИЭР(-)).
19bj Этил 6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинат (D60)
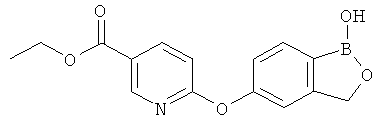
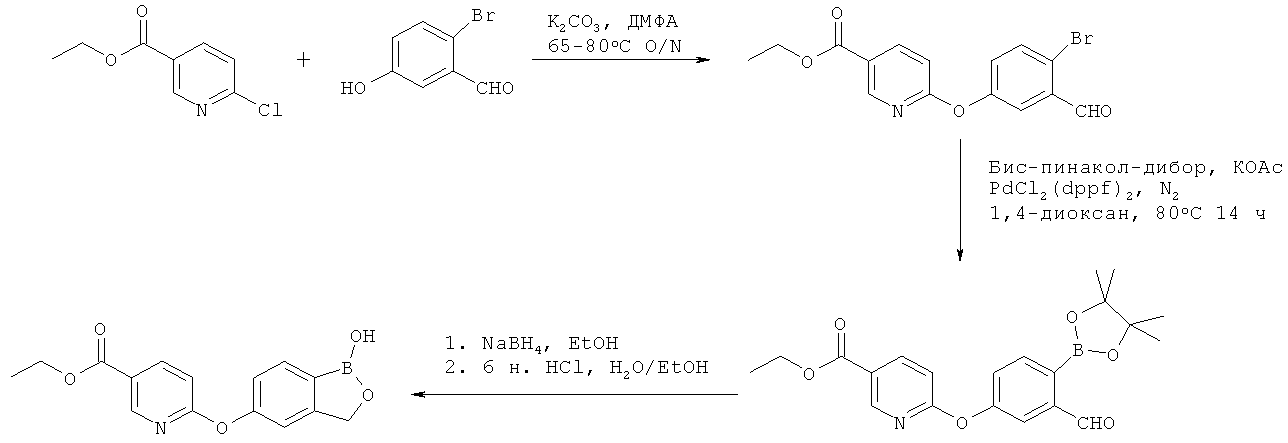
[0760] К смеси этил-6-хлорникотината (18,6 г, 0,1 моль) и 2-бром-5-гидроксибензальдегида (20,1 г, 0,1 моль) в сухом ДМФА (200 мл) добавляли в атмосфере азота К2СO3 (20,8 г, 1,5 экв.), и данную смесь перемешивали при 65-80°С в течение 30,5 ч. После охлаждения до комнатной температуры смесь фильтровали, упаривали и обрабатывали под разрежением в течение ночи с получением коричневого масла (38,26 г) с превращением в реакции сочетания 81,5% исходных веществ в этил-6-(4-бром-3-формилфенокси) никотинат, по данным ЯМР.
[0761] 1H ЯМР (300 МГц, ДМСО-d6): δ 10,17 (s, 1Н), 8,66-8,65 (m, 1Н), 8,33 (dd, J=8,7&2,4 Гц, 1Н), 7,86 (d, J=8,7 Гц, 1Н), 7,60 (d, J=2,7 Гц, 1Н), 7,50 (dd, J=8,4&2,7 Гц, 1Н), 7,23 (dd, J=8,7& 0,6 Гц, 1Н), 4,30 (q, J=7,2 Гц, 2Н) и 1,29 (t, J=7,2 Гц, 3Н) м.д.
[0762] К раствору масла, полученного на предыдущей стадии, в 1,4-диоксане (450 мл) добавляли бис-пинаколдибор (30,5 г, 0,12 моль), КОАс (29,5 г, 0,3 моль) и PdCl2(dppf)2 (1,95 г, 2,5 молярных %), и данную смесь дегазировали с использованием N2 и нагревали в течение 14 ч при 80°С с перемешиванием. Полученную темную смесь фильтровали и упаривали. Остаток растворяли в минимальном объеме EtOAc и для удаления темной окраски наносили на короткую колонку силикагеля, которую элюировали смесью гексан/EtOAc (2:1) с получением коричневого масла (46,4 г), содержащего в основном этил-6-(3-формил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)никотинат.
[0763] 1H ЯМР (300 МГц, ДMCO-d6): δ 10,39 (s, 1Н), 8, 67-8, 65 (m, 1Н), 8,35-8,31 (m, 1H), 7,83 (d, J=8,1 Гц, 1H), 7,64 (d, J=2,7 Гц, 1H), 7,50 (dd, J=7,8 & 2,7 Гц, 1H), 7,24 (d, J=8,1 Гц, 1H), 4,30 (q, J=7,2 Гц, 2H), 1,34 (s, 12H) и 1,29 (t, J=7,2 Гц, 3Н) м.д.
[0764] К раствору полученного выше пинаколборного альдегида (46,4 г) в EtOH (450 мл, 200 крепости (200 proof)) при 0°С добавляли порциями NaBH4 (5 г), и данную смесь перемешивали в течение ночи, медленно повышая температуру смеси до комнатной температуры. Смесь снова охлаждали с помощью ледяной бани, добавляли воду (50 мл), и затем медленно добавляли 6 н. НСl (50 мл). После перемешивания в течение 30 мин данную смесь упаривали для удаления EtOH, затем добавляли воду (2 00 мл) и нейтрализовали насыщенным водным раствором NаНСО3. Данную смесь экстрагировали EtOAc, концентрировали, и для удаления темной примеси остаток наносили на короткую и широкую колонку силикагеля, которую элюировали смесью гексан/EtOAc (2:1, об./об.). Полученое масло содержало примесь пинакола, что усложняло спектр протоннного ЯМР. Масло растворяли в минимальном объеме ацетона, и затем медленно добавляли воду, обрабатывая смесь ультроазвуком, чтобы отделить твердый продукт. Твердое вещество собирали путем фильтрования, промывали пентаном и гексаном и сушили в течение ночи в условиях глубокого вакуума с получением этил 6-(1-гидрокси-1,3-дигидробензо[с][1, 2]оксаборол-5-илокси)никотината в виде кремового твердого вещества (17,8 4 г). Общий выход за 3 стадии: 5 9,6%.
[0765] Т.пл.: 110-113°С. 1H ЯМР (300 МГц, ДМСO-d6): δ 9,21 (s, 1Н), 8,68 (d, J=2,4 Гц, 1Н), 8,30 (dd, J=8,4 & 2,1 Гц, 1Н), 7,76 (d, J=8,1 Гц, 1Н), 7,21 (d, J=l,5 Гц, 1Н), 7,15 (d, J=8,7 Гц, 1Н), 7,12 (dd, J=7,8 & 2,1 Гц, 1Н), 4,97 (s, 2Н), 4,30 (q, J=7,5 Гц, 2Н) и 1,29 (t, J=7,5 Гц, 3Н) м.д. Чистота (ВЭЖХ): 95,3% при 220 нм и 95,4% при 254 нм. Масс-спектр: m/z=300 (М+1, ИЭР(+)) и m/z=298 (М-1, ИЭР(-)).
19bk 6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотиновая кислота-: (D61)
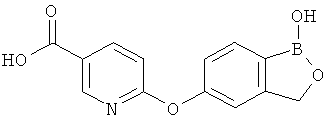
[0766] Указнное в заголовке бис-кислотное соединение получали путем гидролиза соответствующего этилового эфира карбоновой кислоты. Этил-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинат (2,99 г, 10 ммоль) растворяли в только что открытом ТГФ (100 мл), и добавляли 1 н. NaOH (38 мл). Данную смесь перемешивали в течение ночи при комнатной температуре в атмосфере N2. Затем добавляли 6 н. НСl (6,5 мл), ТГФ удаляли путем выпаривания на роторном испарителе, фильтровали и промывали водой и затем гексаном. Полученное твердое вещество сушили в течение ночи в условиях глубокого вакуума с выходом указанного в заголовке бис-кислотного соединения (2,57 г, 9,48 ммоль, выход 94,8%) в виде коричневатого твердого вещества.
[0767] Т.пл.: >200°С. 1Н ЯМР (300 МГц, ДМСО-d6): δ 13,21 (s, 1Н), 9,21 (s, 1Н), 8,65 (d, J=2,1 Гц, 1Н), 8,28 (dd, J=8,4 & 2,4 Гц, 1Н), 7,76 (d, J=7,8 Гц, 1H), 7,21 (d, J=l,5 Гц, 1H), 7,14-7,11 (m, 2H) и 4,97 (s, 2H) м.д. Чистота (ВЭЖХ): 97,2% при 220 нм и 97,8% при 254 нм. Масс-спектр: m/z=272 (М+1, ИЭР(+)) и m/z=270 (М-1, ИЭР (-)).
19bl N,N-диэтил-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинамид (D62)
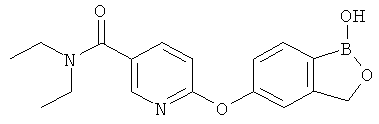
[0768] К раствору 6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотиновой кислоты (0,813 г, 3 ммоль) в безводном ДМФА (70 мл) добавляли диэтиламин (3,2 мл, 30 ммоль) и DIPEA (1,6 мл, 9 ммоль) в атмосфере N2. Данную смесь охлаждали с помощью ледяной бани, и добавляли сшивающий агент PyCloP (Aldrich №26564, 1,4 г, 3,3 ммоль). Реакционную смесь перемешивали в течение 10 мин при 0°С и в течение ночи при комнатной температуре, затем упаривали на роторном испарителе. Остаток растворяли в EtOAc, промывали водой, упаривали и очищали путем колоночной флэш-хроматографии на силикагеле, используя для элюирования EtOAc, с получением указанного в заголовке амидного соединения в виде белого твердого вещества (0,92 г, 2,82 ммоль, выход 94%).
[0769] Т.пл.: 85-95°С. 1Н ЯМР (300 МГц, ДMCO-d6): δ 9,18 (s, 1Н), 8,15 (dd, J=2,4 & 0,6 Гц, 1H), 7,86 (dd, J=8,7 & 2,4 Гц, 1H), 7,75 (d, J=8,1 Гц, 1H), 7,19 (dd, J=2,1 & 0,6 Гц, 1H), 7,13-7,07 (m, 2H) и 4,96 (s, 2H), 3,48-3,12 (широкий m, 4H) и 1,16-1,02 (широкий s, 6H) м.д. Чистота (ВЭЖХ): 97,0% при 220 нм и 96,9% при 254 нм. Масс-спектр: m/z=327 (М+1, ИЭР(+)) и m/z=325 (М-1, ИЭР(-)).
19bm N-Этил-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинамид (D63)
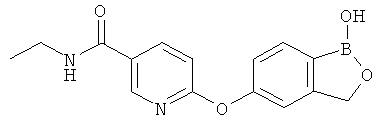
[0770] Указанное в заголовке соединение синтезировали из соответствующей карбоновой кислоты с использованием описанной выше методики синтеза аналога диэтиламида. Выход 78,3%.
[0771] Т.пл.: 100-120°С (гигроскопичное вещество). 1Н ЯМР (300 МГц, ДМСО-d6): δ 9, 20 (s, 1Н), 8,57 (d, J=2, 1 Гц, 1Н), 8,54 (широкий t, J=5,4 Гц, 1Н), 8,23 (dd, J=8,4 & 2,4 Гц, 1Н), 7,75 (d, J=7,8 Гц, 1Н), 7,17 (d, J=1,8 Гц, 1Н), 7,12-7,08 (m, 2Н), 4,96 (s, 2Н), 3, 32-3, 22 (m, 2Н) и 1,10 (t, J=7,2 Гц, 3Н) м.д. Чистота (ВЭЖХ): 97,2% при 220 нм и 98,1% при 254 нм. Масс-спектр: m/z=299 (М+1, ИЭР(+)) и m/z=297 (М-1, ИЭР(-)).
19bn 5-(5-(Гидроксиметил)пиридин-2-илокси)бензо[с][1,2]оксаборол-1(3Н)-ол (D64)
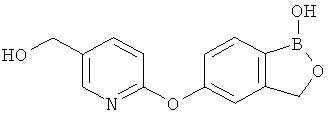
[0772] Восстановление этил-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотината (2 г, 6,68 ммоль) в ТГФ (130 мл) проводили с использованием супергидрида (LiEt3BH, 1 М раствор в ТГФ, 26,7 мл), в течение ночи, поддерживая температуру в диапазоне от 0°С до комнатной температуры, со стандартной очисткой, что позволило получить указанный в заголовке спирт в виде белого твердого вещества (1,03 г, выход 60%).
[0773] Т.пл.: 210-212°С. 1H ЯМР (300 МГц, ДMCO-d6): δ 9,18 (s, 1Н), 8,, 08-8, 07 (m, 1H), 7,81-7,78 (m, 1H), 7,72 (d, J=7, 8 Гц, 1H), 7,09 (s, 1H), 7,05-7,01 (m, 2H), 5,28 (широкий s, 1H), 4,94 (s, 2H) и 4,46 (s, 2H) м.д. Чистота (ВЭЖХ): 96,5% при 220 нм и 98,3% при 254 нм. Масс-спектр: m/z=258 (М+1, ИЭР+) и m/z=256 (М-1, ИЭР-).
19bo Метил-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинат (D65)
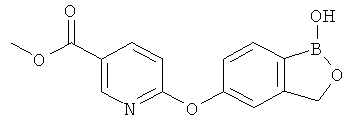
[0774] Смесь соответствующей карбоновой кислоты (0,8 г, 2,95 ммоль) и 96% H2SO4 (1 г) в МеОН (130 мл) подвергали кипячению с обратным холодильником в течение ночи в атмосфере N2. Полученный продукт выделяли, используя стандартные методики очистки и флэш-хроматографию на колонке с силикагелем (элюирование: гексан: EtOAc, 1:1 об./об.), с выходом указанного в заголовке сложного метилового эфира в виде белого твердого вещества (0,127 г, выход 15,1%).
[0775] Т.пл.: 156-158°С. 1Н ЯМР (300 МГц, ДМСО-d6): δ 9, 22 (s, 1Н), 8,68 (dd, J=2,4 & 0,6 Гц, 1Н), 8,31 (dd, J=8,7 & 2,4 Гц, 1Н), 7,76 (d, J=7,8 Гц, 1Н), 7,22 (d, J=1,2 Гц, 1Н), 7,17-7,11 (m, 2Н), 4,97 (s, 2Н) и 3,84 (s, 3Н) м.д. Чистота (ВЭЖХ): 98,0% при 220 нм и 100% при 254 нм. Масс-спектр: m/z=286 (М+1, ИЭР(+)) и m/z=284 (М-1, ИЭР(-)).
19bр н-Пропил-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинат-(D66)
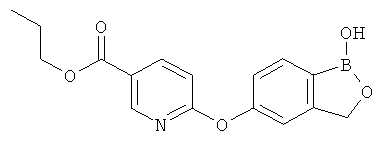
[0776] Смесь соответствующей карбоновой кислоты (0,5 г, 1,84 ммоль) и агента для сочетания CDI (N,N'-карбонилдиимидазола) (0,66 г, 4,0 6 ммоль, 2,2 экв.) в смешанном растворителе, состоящем из СН2Сl2а (50 мл), ТГФ (30 мл) и ДМФА (40 мл), перемешивали в течение ночи при комнатной температуре в атмосфере N2. Затем в смесь добавляли безводный н-РrОН (30 мл) и каталитическое количество NaH (60%, 10 мг). Смесь подвергали кипячению с обратным холодильником в течение 2 ч в атмосфере N2 и затем упаривали. Остаток растворяли в EtOAc, промывали сначала 0,5 н. НСl, затем раствором NaHCO3 (pH=8), сушили и упаривали. Полученное липкое твердое вещество растворяли в минимальном объеме ацетона, затем добавляли гексан, обрабатывая смесь ультразвуком, и охлаждали с получением указанного в заголовке сложного н-пропилового эфира в виде желтоватого твердого вещества (0,354 г, 1,13 ммоль, выход 61,3%).
[0777] Т.пл. 89-94°С. 1Н ЯМР (300 МГц, ДМСO-d6): δ 9, 22 (s, 1Н), 8,69 (d, J=2,4 Гц, 1Н), 8,31 (dd, J=8,7 & 2,7 Гц, 1Н), 7,76 (d, J=7,8 Гц, 1Н), 7,22 (s, 1Н), 7,17-7,12 (m, 2Н), 4,97 (s, 2Н), 4,22 (t, J=6,3 Гц, 2Н), 1,70 (секстет, J=6, 9 Гц, 2Н) и 0,94 (t, J=7,2 Гц, 3Н) м.д. Чистота (ВЭЖХ): 98,3% при 220 нм и 98,3% при 254 нм. Масс-спектр: m/z=314 (М+1, ИЭР(+)) и m/z=312 (М-1, ИЭР(-)).
19bq Изопропил-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинат-(D67)
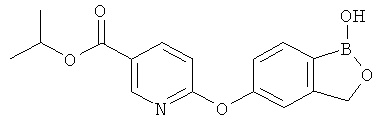
[0778] Указанный в заголовке сложный изопропиловый эфир получали с использованием адаптированной для данного синтеза описанной выше методики получения сложного н-пропилового эфира, с увеличением времени кипячения до 4 ч. Выход 71,8%.
[0779] Т.пл.: 95-101°С. 1Н ЯМР (300 МГц, ДMCO-d6): δ 9,21 (s, 1Н), 8,66 (d, J=2,4 Гц, 1H), 8,29 (dd, J=8,7 & 2,1 Гц, 1H), 7,76 (d, J=7,8 Гц, 1H), 7,21 (d, J=1,8 Гц, 1H), 7,16-7,11 (m, 2H), 5,12 (септет, J=6,0 Гц, 1H), 4,97 (s, 2H) и 1,30 (d, J=6,3 Гц, 6H) м.д. Чистота (ВЭЖХ): 98,2% при 220 нм и 96,6% при 254 нм. Масс-спектр: m/z=314 (М+1, ИЭР(+)) и m/z=312 (М-1, ИЭР(-)).
19br н-Бутил-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинат (D68)
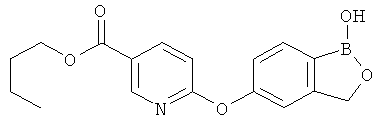
[0780] Указанный в заголовке сложный н-бутиловый эфир, получали с использованием адаптированной для данного синтеза описанной выше методики получения сложного н-пропилового эфира, с увеличением времени кипячения до 4 ч. Выход 68,5%.
[0781] Т.пл.: 75-80°С. 1Н ЯМР (300 МГц, ДМСО-d6): δ 9,22 (s, 1Н), 8, 68-8, 67 (m, 1Н), 8, 32-8,29 (dm, Jd=8,7 Гц, 1Н), 7,76 (d, J=7,5 Гц, 1Н), 7,22 (s, 1Н), 7,17-7,12 (m, 2Н), 4,97 (s, 2Н), 4,26 (t, J=6,3 Гц, 2Н), 1,66 (пентет, J=7,5 Гц, 2Н), 1,39 (секстет, J=7, 5 Гц, 2Н) и 0,90 (t, J=7,5 Гц, 3Н) м.д. Чистота (ВЭЖХ): 100% при 220 нм и 100% при 254 нм. Масс-спектр: m/z=328 (М+1, ИЭР(+)).
19bs 6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинальдегид (D69)
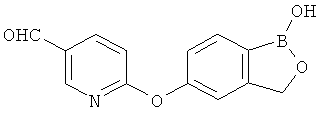
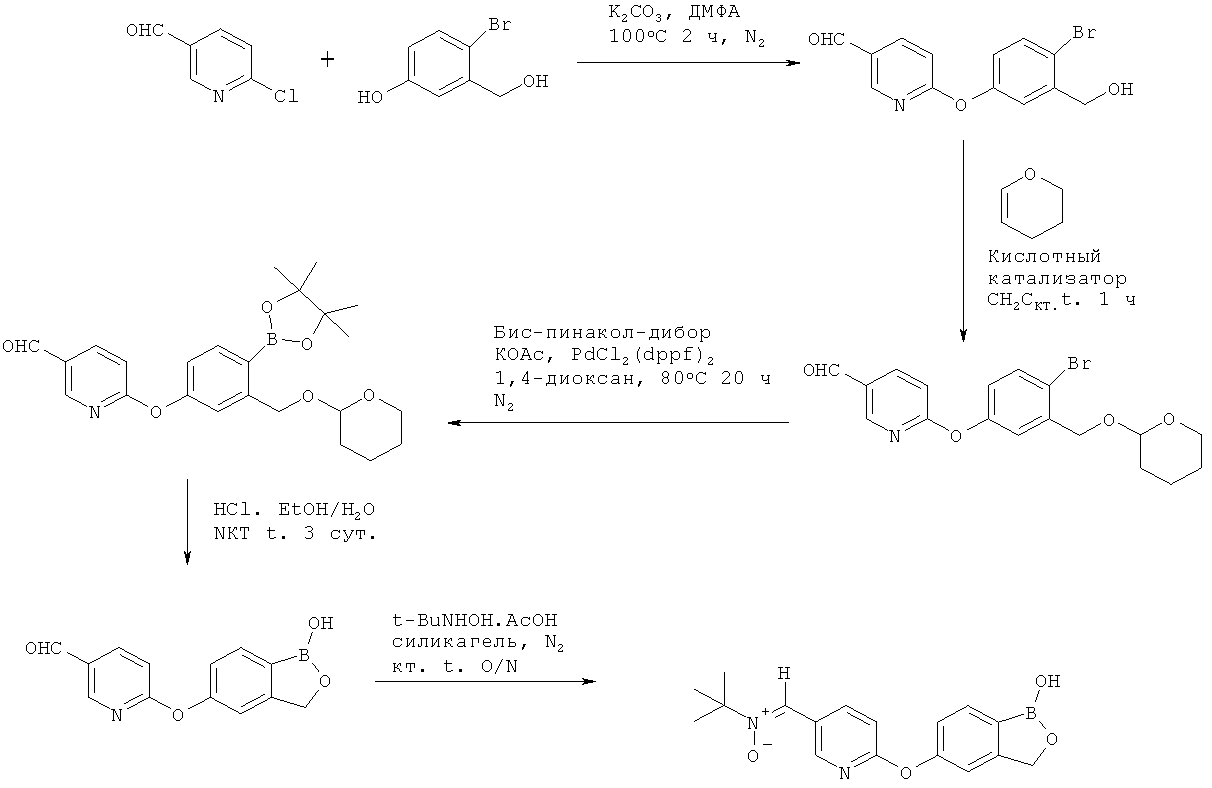
[0782] Реакцию сочетания 6-хлорникотинальдегида (5,4 г, 38,15 ммоль) с 4-бром-3-(гидроксиметил)фенолом (8,15 г, 38,15 ммоль) выполняли в присутствии К2СO3 (8,5 г, 1,5 экв.) в ДМФА (100 мл) в течение 2 ч при 100°С в атмосфере N2. Реакционную смесь очищали путем колоночной хроматографии на силикагеле (гексан:EtOAc=3:1, об./об.) с получением желаемого 6-(4-бром-3-(гидроксиметил)фенокси)никотинальдегида (8,03 г, 26,1 ммоль, выход 68,3%) в виде белого твердого вещества.
[0783] 1Н ЯМР (300 МГц, ДМСО-d6): δ 9, 98 (s, 1Н), 8,68 (d, J=2,4 Гц, 1Н), 8,27 (ddd, J=8,7 & 2,4 & 0,6 Гц, 1Н), 7,63 (d, J=7,8 Гц, 1Н), 7,29 (d, J=2,4 Гц, 1Н), 7,24 (d, J=8,7 Гц, 1Н), 7,07 (dd, J=8,1 & 2,4 Гц, 1Н), 5,54 (t, J=5,4 Гц, 1Н) и 4,50 (d, J=5,4 Гц, 2Н) м.д.
[0784] Тетрагидропиранильную (ТНР) защитную группу 6-(4-бром-3-(гидроксиметил)фенокси)никотинальдегида (2,4 г, 7,78 ммоль) 3,4-дигидро-2H-пираномом (2,2 мл) осуществляли, используя в качестве каталиатора (15)-(+)-10-камфорсульфоновую кислоту в CH2Cl2 (80 мл) при комнатной температуре в течение 1 ч, что позволило получить после очистки путем колоночной хроматографии на силикагеле (гексан:EtOAc=3:1, об./об.) необходимый 6-(4-бром-3-((тетрагидро-2H-пиран-2-илокси)метил)фенокси)никотинальдегид в виде бесцветного масла (3,07 г, 7,8 ммоль, выход 100%).
[0785] 1Н ЯМР (300 МГц, ДMCO-d6): δ 9, 98 (s, 1Н), 8,68 (d, J=2,4 Гц, 1H), 8,27 (ddd, J=8,4 & 2,4 & 0,6 Гц, 1H), 7,68 (dd, J=8,4 & 0,6 Гц, 1H), 7,31 (d, J=2,4 Гц, 1H), 7,25 (d, J=8,1 Гц, 1H), 7,12 (dd, J=8,4 & 3,0 Гц, 1H), 4, 75-4, 74 (m, 1H), 4,70 (d, J=13,5 Гц, 1H), 4,48 (d, J=13,5 Гц, 1H), 3, 80-3,72 (m, 1H), 3, 50-3, 44 (m, 1H) и 1,80-1,40 (m, 6H) м.д.
[0786] Каталитическое борилирование 6-(4-бром-3-((тетрагидро-2Я-пиран-2-илокси)метил)фенокси)никотинальдегида (3,07 г, 7,83 ммоль) бис-пинакол-дибором (3,05 г, 12 ммоль) выполняли в присутствии КОАс (2,3 г, 2 3,5 ммоль) и PdCl2(dppf)2 (0,163 г, 2,5% ммоль) в 1,4-диоксане (100 мл) при 80°С в течение ночи в атмосфере N2. Реакционную смесь очищали путем колоночной хроматографии на силикагеле (гексан:EtOAc=3:1, об./об.) с получением необходимого 6-(3-((тетрагидро-2Н-пиран-2-илокси)метил)-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)никотинальдегида в виде масла (3 г, 6,83 ммоль, выход 87,2%).
[0787] 1Н ЯМР (300 МГц, ДМСО-d6): δ 9, 98 (s, 1Н), 8,68 (d, J=2,4 Гц, 1Н), 8,27 (dd, J=8,7 & 2,4 Гц, 1Н), 7,73 (d, J=8,4 Гц, 1Н), 7,24-7,21 (m, 2Н), 7,10 (dd, J=8,4 & 2,4 Гц, 1Н), 4,82 (d, J=12,9 Гц, 1Н), 4, 70-4, 66 (m, 2Н), 3,79-3, 72 (m, 1Н), 3, 47-3, 40 (m, 1Н), 1,75-1,43 (m, 6Н) и 1,29 (s, 12Н) м.д.
[0788] Гидролиз и одновременную циклизацию 6-(3-((тетрагидро-2Н-пиран-2-илокси)метил)-4-(4,4,5, 5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)никотинальдегида (3 г, 6,83 ммоль) выполняли с использованием кислоты в водном EtOH в атмосфере N2 в течение 3,5 суток. Полученный продукт выделяли, используя стандартные методики очистки (без колоночной хроматографии), с выходом желаемого альдегида циклической бороновой кислоты, 6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинальдегида, в виде белого твердого вещества (1,12 г, 4,39 ммоль, выход 64,3%).
[0789] Т.пл. 179-182°С. ХН ЯМР (300 МГц, ДМСО-d6): δ 9, 98 (s, 1Н), 9,23 (s, 1H), 8,69 (d, J=2,4 Гц, 1H), 8,26 (ddd, J=8,4 & 2,4 & 0,9 Гц, 1H), 7,77 (d, J=8, 1 Гц, 1H), 7,24-7,21 (m, 2H), 7,15 (dd, J=8,1 & 1,2 Гц, 1H) и 4,98 (s, 2H) м.д. Чистота (ВЭЖХ): 95% при 220 нм и 95% при 254 нм. Масс-спектр: m/z=256 (М+1, ИЭР(+)) и m/z=254 (М-1, ИЭР(-)).
19bt Оксид (Z)-N-((6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)пиридин-3-ил)метилен)-2-метилпропан-2-амина (D70)
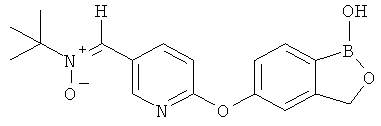
[0790] Путем реакции альдегида циклической бороновой кислоты, 6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинальдегид (0,18 г, 0,7 ммоль), с солью трет-BuNHOH АсОН, (0,25 г, 2 экв.) и силикагелем (0,5 г) в EtOH (30 мл) в течение ночи при комнатной температуре в атмосфере N2 после фильтрования, упаривания и перекристаллизации из EtOAc и гексана, обрабатывая смесь ультразвуком, получали необходимое указанное в заголовке соединение нитронильного производного циклической бороновой кислоты в виде белого твердого вещества (0,1985 г, 0,608 5 ммоль, выход 8 6,9%).
[0791] Т.пл.: 156-164°С. 1Н ЯМР (300 МГц, ДМСО-d6): δ 9,18 (s, 1Н), 9,02 (d, J=2,1 Гц, 1Н), 8,90 (dd, J=8,7 & 2,1 Гц, 1Н), 7,92 (s, 1Н), 7,75 (d, J=8,1 Гц, 1Н), 7,15 (d, J=2,1 Гц, 1Н), 7,11-7,06 (m, 2Н), 4,96 (s, 2Н) и 1,48 (s, 12Н) м.д. Чистота (ВЭЖХ): >95% при 220 нм и >95% при 254 нм. Масс-спектр: m/z=327 (М+1, ИЭР(+)).
Общая методика получения сложного эфира из карбоновой кислоты
[0792] К раствору 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты (С38) (800 мг, 2,96 ммоль) в подходящем спирте (50 мл) добавляли 4 капли концентрированной H2SO4. Полученный раствор нагревали до температуры кипения, пока не завершалась реакция. Весь органический растворитель выпаривали под вакуумом. Остаток растворяли в EtOAc (30 мл) и промывали насыщенным раствором NаНСО3 (30 мл). Затем смесь подкисляли до pH 3 путем добавления 1 М НСl. Органический слой сушили над MgSO4, фильтровали и упаривали под вакуумом. Полученный продукт очищали путем колоночной хроматографии на силикагеле.
19bu Метиловый эфир 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензойной-кислоты (D71)
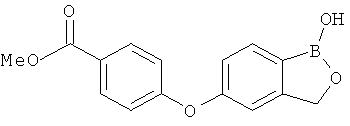
[0793] Применение общей методики получения сложных эфиров с использованием МеОН и очистки на силикагеле (элюирование: 10% EtOAc/гексаны) позволило получить 630 мг указанного в заголовке соединение с выходом 75%. 1Н ЯМР (400 МГц, ДMCO-d6) δ: 9,22 (s, 1Н), 7,98 (d, J=9,0 Гц, 2H), 7,78 (d, J=7,8 Гц, 1H), 7,30-7,10 (m, 4H), 4,97 (s, 2H), 3,83 (s, 3Н). Масс-спектр (ИЭР) m/z: 285 (М+Н)+; чистота согласно ВЭЖХ: 96,21% (220 нм), 96, 22% (254 нм).
19bv Этиловый эфир 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты (D72)
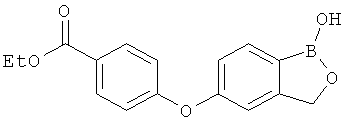
[0794] Применение общей методики получения сложных эфиров с использованием EtOH и очистки на силикагеле (элюирование: 10% EtOAc/гексаны) позволило получить 350 мг указанного в заголовке соединение с выходом 39%. 1Н ЯМР (400 МГц, ДМСО-d6) δ: 9,21 (s 1Н), 7,98 (d, J=9,0 Гц, 2Н), 7,78 (d, J=8,2 Гц, 1Н), 7,107-7,03 (m, 4Н), 4,96 (s, 2Н), 4,30 (q, J=7,4 Гц, 2Н), 1,31 (t, J=7,0 Гц, 3Н). Масс-спектр (ИЭР) m/z: 299 (М+Н)+; чистота согласно ВЭЖХ: 97,7% (220 нм), 99,5% (254 нм).
19bw Пропиловый эфир 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты (D73)
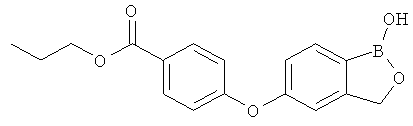
[0795] Применение общей методики получения сложных эфиров с использованием РrОН и очистки на силикагеле (элюирование: 10% EtOAc/гексаны) позволило получить 3 60 мг указанного в заголовке соединения с выходом 39%. 1Н ЯМР (400 МГц, ДМСО-d6) δ: 9,21 (s, 1Н), 7,99 (d, J=9,0 Гц, 2Н), 7,78 (d, J=7,8 Гц, 1Н), 7,16-7,05 (m, 4Н), 4,96 (s, 2Н), 4,22 (t, J=6,7 Гц, 2Н), 1, 76-1, 65 (m, 2Н), 0,96 (t, 7,41 Гц, 3Н). Масс-спектр (ИЭР) m/z: 313 (М+Н)+; чистота согласно ВЭЖХ: 96,5% (220 нм), 97,6% (254 нм).
19bх Изопропиловый эфир 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты (D74)
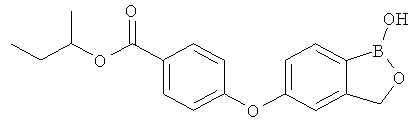
[0796] Применение общей методики получения сложных эфиров с использованием iPrOH и очистки на силикагеле (элюирование: 10% EtOAc/гексаны) позволило получить 550 мг указанного в заголовке соединения с выходом 60%. 1H ЯМР (400 МГц, ДМСО-d6) δ: 9,22 (s, 1Н), 7,98 (d, 2H), 7,78 (d, 1H), 7,13-7,05 (m, 4H), 5,16-5,08 (m, 1H), 4,96 (s, 2H), 1,33 (d, 6H). Масс-спектр (ИЭР) m/z: 313 (M+H)+; чистота согласно ВЭЖХ: 97,39% (220 нм), 98,23% (254 нм).
19by 2-Диметиламиноэтиловый эфир 4-(1-гидрокси-1,3-дигидробензо [с][1,2]оксаборол-5-илокси)-бензойной кислоты (D75)
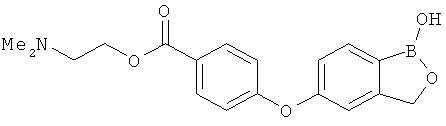
[0797] К прозрачному раствору 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты (С38) (0,5 г, 1,7 5 ммоль) в ДМФА (20 мл) добавляли N,N-диметиламиноэтанол (0,37 мл, 3,7 ммоль) и EDCI (0,71 г, 3,7 ммоль). Данную реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем ДМФА выпаривали под вакуумом. Остаток очищали путем хроматографии на силикагеле, используя для элюирования смесь 5% МеОН/ДХМ (дихлорметан), с получением указанного в заголовке соединения (0,35 г, выход 56%). 1Н ЯМР (400 МГц, ДMCO-d6) δ: 7,97 (d, J=8,9 Гц, 2Н), 7,76 (d, J=7,8 Гц, 1Н), 7,15-7,07 (m, 4H), 4,95 (s, 2H), 4,33 (t, J=5,5 Гц, 2H), 2,58 (t, J=5,9 Гц, 2H), 2,20 (s, 6H). Масс-спектр (ИЭР) m/z: 342 (M+H)+; чистота согласно ВЭЖХ: 91,90% (220 нм), 94,99% (254 нм).
Аналоги амидов
Общая методика получения амида из карбоновой кислоты
[0798] К раствору 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты (С38) (1 г, 3,70 ммоль) и амина (3,70 ммоль) добавляли HATU (1,67 г, 4,44 ммоль) и DIPEA (1,55 мл, 8,88 ммоль) в ДМФА (20 мл). Данную реакционную смесь перемешивали в течение ночи при комнатной температуре. Весь органический растворитель выпаривали. Остаток растворяли в EtOAc (50 мл) и промывали водой (3×30 мл). Органический слой упаривали под вакуумом.
19bz N-Бензил-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензамид (D76)
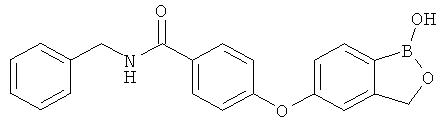
[0799] Применение общей методики получения амида с использованием бензиламина (0,396 г, 3,70 ммоль) и очистки посредством колоночной хроматографии на силикагеле (25% EtOAc/гексаны) позволило получить 0,8 г указанного в заголовке соединения с выходом 60%. 1Н ЯМР (400 МГц, ДMCO-d6) δ: 9,08 (s, 1Н), 9,00 (t, 1Н), 7,97 (d, 2Н), 7,78 (d, 1Н), 7,40-7, 23 (m, 4Н), 7,12-7,02 (m, 4Н), 4,97 (s, 2Н), 4,48 (d, 2Н). Масс-спектр (ИЭР) m/z: 360 (М+Н)+; чистота согласно ВЭЖХ: 96,5% (220 нм), 99,4% (254 нм).
19са 4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-N-(2-гидрокси-этил)-бензамид (D77)
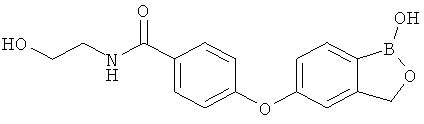
[0800] Применение общей методики получения амида с использованием 2-аминоэтанола (0,23 г, 3,70 ммоль) и очистки посредством обращенно-фазовой хроматографии с элюированием градиентом 5% МеОН/H2O - 90% МеОН/H2O позволило получить 0,57 г указанного в заголовке соединения с выходом 49%. 1Н ЯМР (400 МГц, ДМСО-d6) δ: 9,16 (s, 1Н), 8,38 (t, J=5,5 Гц, 1Н), 7,90 (d, J=7,0 Гц, 2Н), 7,75 (d, J=8,2 Гц, 1Н), 7,08 (m, 4Н), 4,95 (s, 2Н), 4,72 (t, J=5,5 Гц, 1Н), 3,49 (q, J=6,2 Гц, 2Н). Масс-спектр (ИЭР) m/z: 314 (М+Н)+; чистота согласно ВЭЖХ: 94,6% (220 нм), 95,4% (254 нм).
19cb 4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-N-пиридин-2-илметилбензамид (D78)
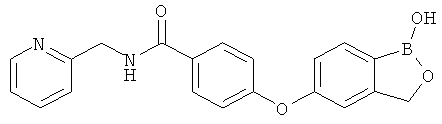
[0801] Применение общей методики получения амида с использованием 2-аминометилпиридина (0,4 г, 3,70 ммоль) и очистки посредством обращенно-фазовой хроматографии с элюированием с градиентом 5% МеОН/H2O - 90% МеОН/H2O позволило получить 0,55 г указанного в заголовке соединения с выходом 41%. 1Н ЯМР (400 МГц, ДМСО-d6) δ: 9,20 (s, 1Н), 9,10 (t, J=5,8 Гц, 1H), 8,51 (d, J=4,7 Гц, 1H), 7,97 (d, J=8,6 Гц, 2H), 7,79-7,73 (m, 2H), 7,31 (d, J=7,8 Гц, 1H), 7, 29-7, 25 (m, 1H), 7,12 (d, J=8,6 Гц, 1H), 7, 09-7, 03 (m, 1H), 4,95 (s, 2H), 4,56 (d, 6,24 Гц, - 2H);. Масс-спектр (ИЭР) m/z: 361 (M+H)+; чистота согласно ВЭЖХ: 98,4% (220 нм), 99,5% (254 нм).
19сс [4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-фенил]-(4-метилпиперазин-1-ил)-метанон (D79)
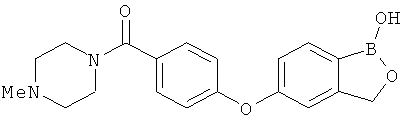
[0802] Применение общей методики получения амида с использованием 1-метилпиперазина (0,41 г, 3,70 ммоль) и очистки посредством обращеннофазной хроматографии с элюированием с градиентом 5% МеОН/H2O - 90% МеОН/H2O позволило получить 0,23 г указанного в заголовке соединения с выходом 18%. 1Н ЯМР (400 МГц, ДМСО-d6) δ: 9,20 (s, IE), 7,78 (d, 1Н), 7,42 (d, 2H), 7,14-7,06 (m, 4H), 4,96 (s, 2H), 3,58 (br, 4H), 2,32 (br, 4H), 2,20 (s, 3H). Масс-спектр (ИЭР) m/z: 353 (M+H)+; чистота согласно ВЭЖХ: 96, 24% (220 нм), 97, 00% (254 нм).
19cd 1-{4-[4-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензоил]-пиперазин-1-ил}-этанон (D80)
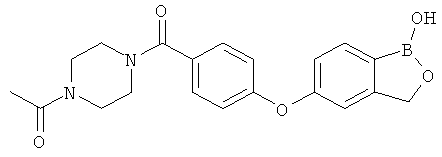
[0803] Применение общей методики получения амида с использованием 1-ацетилпиперазина (0,474 г, 3,70 ммоль) и очистки посредством обращеннофазной хроматографии с элюированием с градиентом 5% МеОН/H2O- 90% МеОН/H2O позволило получить 0, 98 г указанного в заголовке соединения с выходом 70%. 1Н ЯМР (400 МГц, ДМСО-d6) δ: 9,19 (s, 1Н), 7,75 (d, J=7,8 Гц, 1H), 7,47 (d, J=7,3 Гц, 2H), 7,12-7,02 (m, 4H), 4,96 (s, 2H), 2,02 (s, 3H), 3,46 (br, 8H). Масс-спектр (ИЭР) m/z: 381 (M+H)+; чистота согласно ВЭЖХ: 97,17% (220 нм), 99,67% (254 нм).
19се N-(2-Диметиламиноэтил)-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензамид (D81)
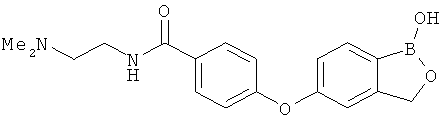
[0804] Применение общей методики получения амида с использованием 2-амино-1-диметиламиноэтана (0,4 г, 3,70 ммоль) и очистки посредством обращеннофазной хроматографии с элюированием с градиентом 5% МеОН/H2O-90% МеОН/H2O позволило получить 0,55 г указанного в заголовке соединения с выходом 41%. 1Н ЯМР (400 МГц, ДМСО-d6) δ: 9,21 (s, 1Н), 8,65 (t, 1Н), 7,92 (d, 2Н), 7,78 (d, 1Н), 7,16 (d, 2Н), 7,06-7,01 (m, 2Н), 4,98 (s, 2Н), 3,59 (q, 2Н), 3,26-3,20 (га, 2Н), 2,82 (s, 6Н). Масс-спектр (ИЭР) m/z: 341 (М+Н)+; чистота согласно ВЭЖХ: 96,13% (220 нм), 98,38% (254 нм).
19cj 6-(1Ггидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинонитрил (D82)
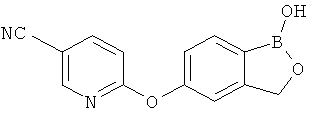
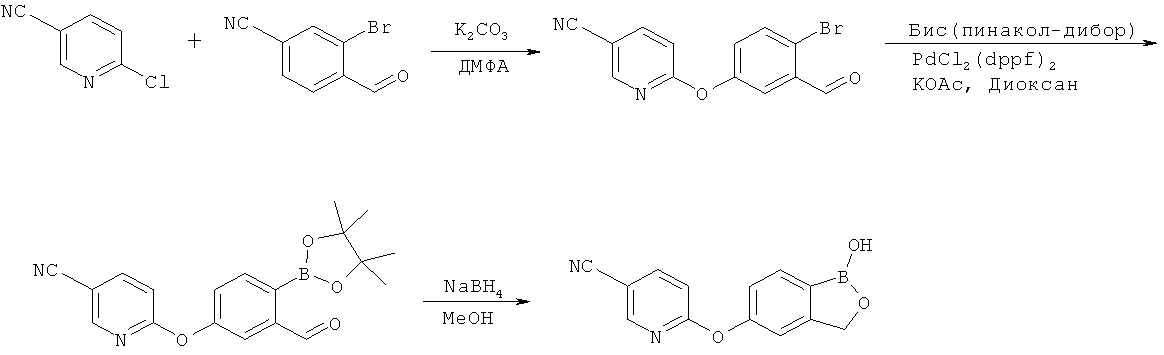
[0805] К раствору 6-хлорникотинонитрила (3,5 г, 25,0 ммоль, 1,0 экв.), 2-бром-5-гидроксибензальдегида (5,0 г, 25,0 ммоль, 1,0 экв.) в ДМФА (40,0 мл) добавляли в атмосфере азота К2СO3 (4,1 г, 30,0 ммоль, 1,2 экв.)-Данную смесь нагревали в течение ночи при 80°С. После охлаждения до комнатной температуры смесь вливали в EtOAc (30 мл) и H2O (30 мл). Слои разделяли, и водную фазу экстрагировали EtOAc (3×20 мл). Объединенные органические экстракты промывали солевым раствором (30 мл), сушили над MgSO4, фильтровали, и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя для элюирования МеОН/ДХМ (0:100-10:90), с получением 6-(4-бром-3-формил-фенокси)-никотинонитрила в виде белого твердого вещества. 1Н ЯМР (ХЛОРОФОРМ-d) δ: 10,35 (s, 1Н), 8,43 (dd, J=2,3, 0,6 Гц, 1Н), 7,98 (dd, J=8,6, 2,3 Гц, IE), 7, 69-7, 77 (m, 2Н), 7,30 (dd, J=8,6, 3,0 Гц, 1H), 7,12 (dd, J=8,6, 0,8 Гц, 1H). Получено 5,92 г, выход 78%.
[0806] К раствору 6-(4-бром-3-формилфенокси)-никотинонитрила (4,16 г, 13,7 ммоль, 1,0 экв.) в 1,4-диоксане (120 мл) добавляли бис-пинакол-дибор (3,83 г, 15,1 ммоль, 1,1 экв.), КОАс (4,03 г, 41,1 ммоль, 3,0 экв.) и PdCl2(dppf)2 (300 мг, 0,4 ммоль, 0,03 экв.). Данную смесь дегазировали с использованием N2 и нагревали в течение ночи при 80°С. После охлаждения до комнатной температуры смесь фильтровали через короткий картридж с целитом, и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя для элюирования EtOAc/гептан (0:100-70:30), с получением 6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрила в виде желтого твердого вещества. 1H ЯМР (ХЛОРОФОРМ-d) δ: 10,67-10,69 (m, 1Н), 8, 42-8, 45 (m, 1Н), 8,01-8,05 (m, 1Н), 7, 94-7, 98 (m, 1Н), 7,74-7,77 (m, 1Н), 7,36-7,41 (m, 1Н), 7,07-7,11 (m, 1Н), 1,38-1,40 (m, 12Н). Получено 4,1 г, выход 85,4%.
[0807] К суспензии 6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрила (1,67 г, 4,8 ммоль, 1,0 экв.) в EtOH (30 мл) при 0°С добавляли небольшими порциями NaBH4 (180,4 мг, 4,76 ммоль, 1,0 экв.). Данную смесь перемешивали в течение 20 минут при 0°С и оставляли нагреваться до комнатной температуры еще в течение 1 ч. После охлаждения до 0°С прозрачный раствор осторожно обрабатывали H2O (1 мл), и затем медленно добавляли 3 н. НСl (10 мл). Полученную желтую суспензию оставляли постепенно нагреваться до комнатной температуры и перемешивали в течение 2 ч. Затем pH смеси доводили до 7, добавляя по каплям насыщенный NaHCO3. Образовавшийся осадок собирали путем фильтрования и промывали H2O с получением 6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-никотинонитрила в виде белого твердого вещества. ЖХ/МС m/z: 253 (М+Н); 1H ЯМР (ДМСО-d6) δ: 9,19 (s, 1Н), 8, 60-8, 66 (m, 1Н), 8,31 (dd, J=8,7, 2,4 Гц, 1Н), 7,76 (d, J=8,0 Гц, 1Н), 7, 20-7,28 (m, 2Н), 7,13 (dd, J=8,0, 2,0 Гц, 1Н), 4,96 (s, 2Н). Получено 1,1 г, выход 92,4%.
19сk Бутиловый эфир 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты (D83)
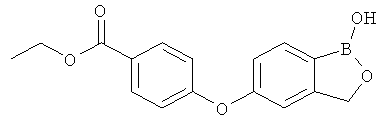
[0808] Применение общей методики синтеза сложных эфиров с использованием ВuОН и очистка на силикагеле.
19cl 3-Фтор-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси) бензонитрил:, (D84)
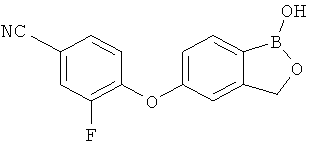
[0809] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19b (D2), из 3,4-дифторбензонитрила и 4-бром-3-(1,3-диоксолан-2-ил)фенола.
19cm 3-Метил-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)бензонитрил (D85)
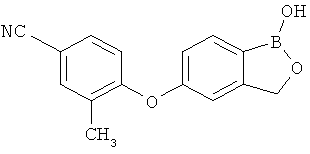
[0810] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19b (D2), из 4-фтор-3-метилбензонитрила и 4-бром-3-(1,3-диоксолан-2-ил)фенола.
19сn 4-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-2-(2-метоксиэтокси)-бензонитрил (D86)
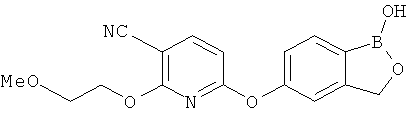
[0811] Данное соединение получали в соответствии с методикой, аналогичной методике, описанной в Примере 19at (D46), с использованием 2-метоксиэтанола и гидрида натрия вместо метилата натрия.
[0812] 1Н ЯМР (400 МГц, ДМСО-d6) δ 3, 22 (s, 3Н), 3,53 (t, J=4,7 Гц, 2Н), 4,24 (t, J=4,7 Гц, 2Н), 4,99 (s, 2Н), 6,71 (d, J=8,2 Гц, 1Н), 7,21 (d, J=7,8 Гц, 1Н), 7,30 (s, 1Н), 7,79 (d, J=8,2 Гц, 1Н), 8,25 (d, J=8,6 Гц, 1Н), 9,26 (s, 1Н). Масс-спектр: 327 [М+Н+].
19со 5-(4-Фторфенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D87)
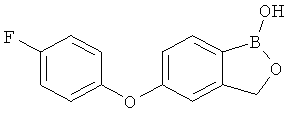
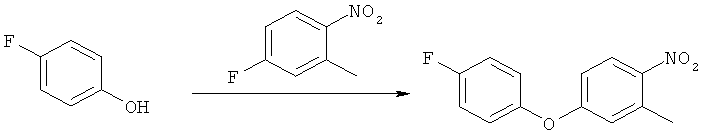
[0813] К раствору соединения А (7,22 г) и К2СO3(17,8 г) в ДМФА (200 мл) в атмосфере Аr добавляли 5-фтор-2-нитротолуол (10 г). Данную реакционную смесь перемешивали при 80°С в течение ночи, фильтровали, экстрагировали диэтиловым эфиром. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения В (16 г, 99%). ЖХ/МС: 248 (М+Н)+.
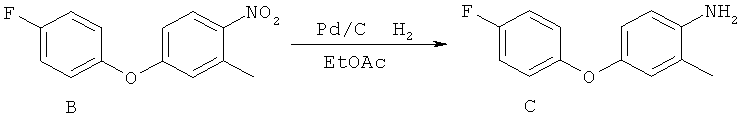
[0814] К раствору соединения В (16 г) в EtOAc (200 мл) добавляли Pd/C (2 г). Данную реакционную смесь перемешивали при комнатной температуре в течение ночи в атмосфере Н2, фильтровали, и выпаривали растворитель с получением соединения С (13 г, 99%). ЖХ/МС: 218 (М+Н)+.

[0815] К раствору CuBr2 (16 г) в MeCN (140 мл) добавляли трет-ВuONO (10 мл) при -10°С. Через 0,5 ч к реакционной смеси добавляли соединение С (16 г) в MeCN (10 мл). Реакционную смесь перемешивали в течение ночи при -10°С, фильтровали, растворитель выпаривали, и остаток очищали путем хроматографии с получением соединения D (2,4 г, 15%). ГХ/МС: 281.

[0816] К раствору соединения D (2,4 г) и NBS (N-бромсукцинимида) (1,6 г) в ССl4 (25 мл) добавляли перекись бензоила (200 мг). Данную реакционную смесь перемешивали в течение ночи при 70°С, фильтровали и промывали водой. Органический слой сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения Е (2,7 г, 99%).
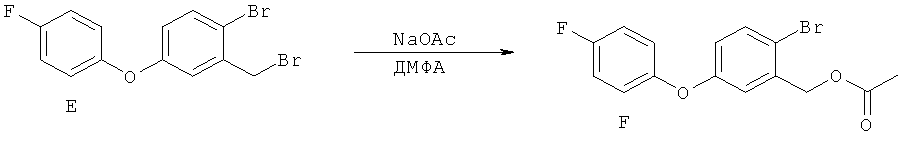
[0817] К раствору соединения Е (2,7 г) в ДМФА (50 мл) добавляли NaOAc (4 г). Данную реакционную смесь перемешивали при 70°С в течение 5 ч, фильтровали и экстрагировали диэтиловым эфиром. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения F (2 г, 99%).
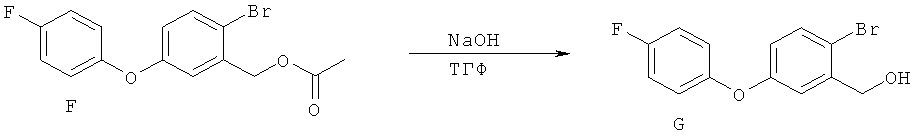
[0818] К раствору соединения F (2 г) в ТГФ (20 мл) добавляли NaOH/H2O (10%; 20 мл). Данную реакционную смесь перемешивали в течение ночи при комнатной температуре, добавляли 4 М НСl/H2O до приблизительно pH 7, и данную смесь экстрагировали EtOAc. Органический слой сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения G (1,5 г, 88%). ЖХ/МС: 297 (М+Н)+.
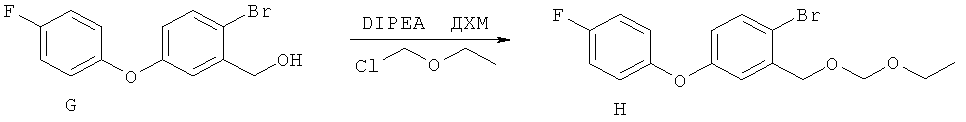
[0819] К раствору соединения G (1,5 г) и DIPEA (0,97 г) в ДХМ (20 мл) добавляли (хлорметокси)этан (0,7 г). Данную реакционную смесь перемешивали в течение ночи при комнатной температуре и упаривали. Остаток очищали путем хроматографии с получением соединения Н (1 г, 58%). ЖХ/МС: 356(М+Н)+.
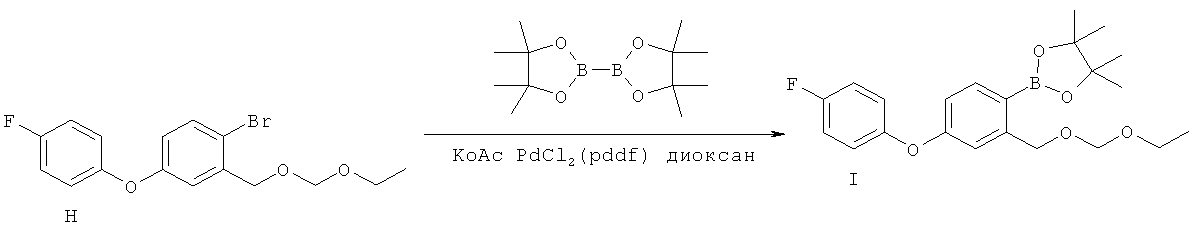
[0820] К раствору соединения Н (1 г), КОАс (0,8 г) и PdCl2 (dppf) (0,12 г) в диоксане (5 мл) добавляли в атмосфере Аr бис(пинаколато)дибор (1 г). Данную реакционную смесь перемешивали в течение ночи при 70°С, промывали водой, экстрагировали ДХМ, и органический слой упаривали. Остаток очищали путем ВЭЖХ с получением соединения I (800 мг, 70%).
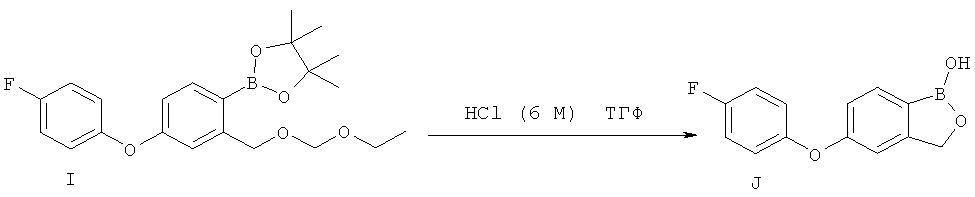
[0821] К раствору соединения I (800 мг) в ТГФ (20 мл) добавляли НСl/H2O (6 М, 20 мл). Данную реакционную смесь перемешивали в течение ночи при комнатной температуре и экстрагировали ДХМ. Органический слой сушили и упаривали. Остаток очищали путем ВЭЖХ с получением необходимого соединения (300 мг,60%). ЖХ/МС: 245(М+Н)+.
19ср 5-(4-Хлорфенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D88)
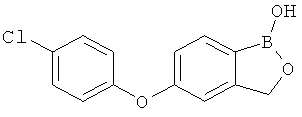
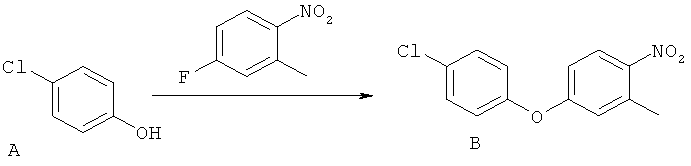
[0822] К раствору соединения А (18 г) и К2СO3 (36 г) в ДМФА (200 мл) добавляли в атмосфере Аr 5-фтор-2-нитротолуол (20 г). Данную реакционную смесь перемешивали в течение ночи при 70°С, фильтровали, разбавляли водой и экстрагировали диэтиловым эфиром. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения В (36 г, 99%). ЖХ/МС: 264 (М+Н).
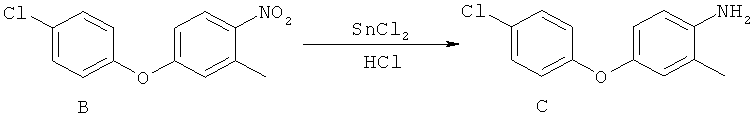
[0823] К раствору соединения В (36 г) в НСl (150 мл) добавляли SnCl2 (116 г). Данную реакционную смесь перемешивали в течение 1 ч при комнатной температуре, фильтровали, экстрагировали EtOAc, и выпаривали растворитель с получением соединения С (30 г, 97%). ЖХ/МС: 234 (М+Н)+.
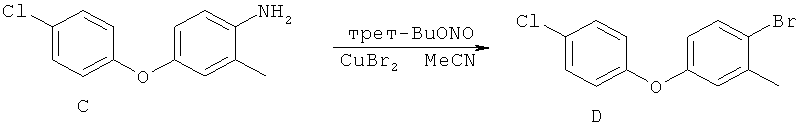
[0824] К раствору CuBr2 (42 г) в MeCN (500 мл) добавляли трет-BuONO (22 мл) при -10°С. Через 0,5 ч к реакционной смеси добавляли ANA-РО4209-3А-3 (30 г) в MeCN (10 мл). Реакционную смесь перемешивали при -10°С в течение ночи, фильтровали, и выпаривали растворитель. Остаток очищали путем хроматографии с получением соединения ANA-РО4209-3А-4 (8,4 г, 22%). ГХ/МС: 297.

[0825] К раствору соединения D (8,4 г) и NBS (5,5 г) в ССl4 (200 мл) добавляли перекись бензоила (800 мг). Данную реакционную смесь перемешивали в течение ночи при 70°С, фильтровали и промывали водой. Органический слой сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения Е (10 г, 99%).
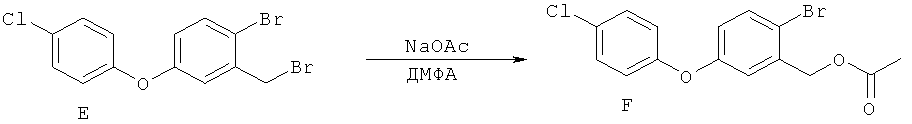
[0826] К раствору соединения Е (10 г) в ДМФА (250 мл) добавляли NaOAc (15 г). Данную реакционную смесь перемешивали при 70°С в течение 5 ч, фильтровали, разбавляли водой и экстрагировали диэтиловым эфиром. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения F (9,6 г, 99%).
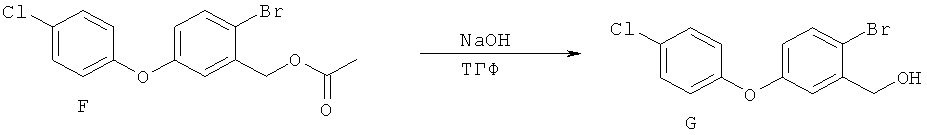
[0827] К раствору соединения F (9,6 г) в ТГФ (50 мл) добавляли NaOH/H2O (10%; 50 мл). Данную реакционную смесь перемешивали в течение ночи при комнатной температуре, добавляли НСl/H2O (4 М) приблизительно до pH 7, и полученную смесь экстрагировали EtOAc. Органический слой сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения G (7,5 г, 89%). ЖХ/МС: 313 (М+Н)+.
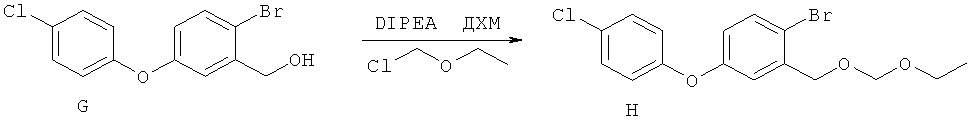
[0828] К раствору соединения G (7,5 г) и DIPEA (3,87 г) в ДХМ (200 мл) добавляли (хлорметокси)этан (2,9 г). Данную реакционную смесь перемешивали в течение ночи при комнатной температуре, упаривали и очищали путем хроматографии с получением соединения Н (9 г, 99%). ЖХ/МС: 372(М+Н)+.
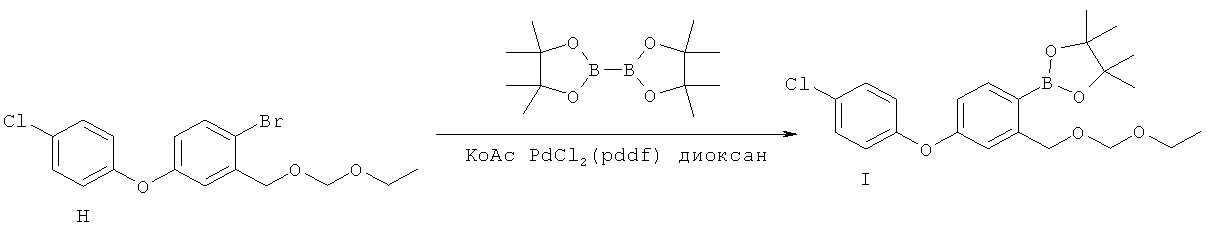
[0829] К раствору соединения Н (9 г), КОАс (7 г) и PdCl2(dppf) (0,98 г) в диоксане (100 мл) добавляли в атмосфере Аr бис(пинаколато)дибор (9,1 г). Данную реакционную смесь перемешивали в течение ночи при 70°С, разбавляли водой, экстрагировали ДХМ, органический слой упаривали и очищали путем ВЭЖХ с получением соединения I (8 г, 80%).
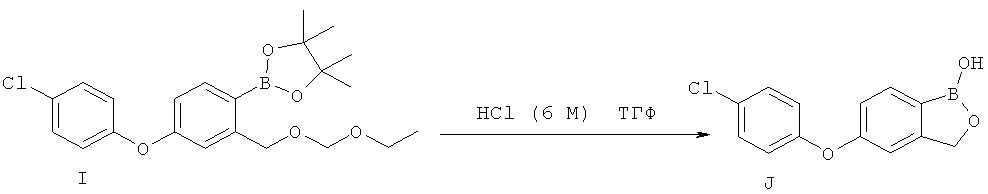
[0830] К раствору соединения I (8 г) в ТГФ (80 мл) добавляли НСl/H2O (6 М; 80 мл). Данную реакционную смесь перемешивали в течение ночи при комнатной температуре, экстрагировали ДХМ и упаривали. Остаток очищали путем ВЭЖХ с получением необходимого соединения (2 г, 40%). ЖХ/МС: 261 (М+Н)+.
19cq 5-(4-Метилфенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D89)
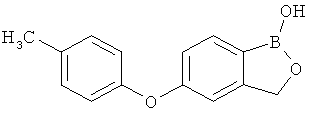
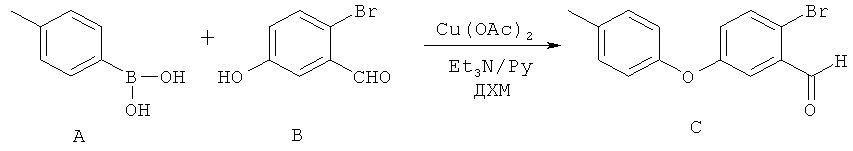
[0831] Соединение А (8 г, 58,8 ммоль), соединение В (8 г, 3 9„ 8 ммоль), Сu(ОАс)2 (8,4 г, 4 7,8 ммоль) и 4А MS (11 г) суспендировали в сухом ДХМ (100 мл), добавляли Et3N (11,2 мл) и пиридин (33,6 мл), и данную реакционную смесь перемешивали при комнатной температуре в течение 48 ч в атмосфере Аr, фильтровали, промывали 1 М НСl, органические слои объединяли и сушили над MgSO4. Неочищенный продукт очищали путем хроматографии, используя РЕ/ЕА (20:1), с получением соединения С (4,2 г, 30%). ГХ/МС: 290 (M+H)+; 1H ЯМР (400 МГц, CDCl3) 5 10, 299 (s, 1Н), 7, 589 (d, J=8,8 Гц, 1Н), 7,458 (d, J=2,8 Гц, 1Н),7,195 (d, J=8,0 Гц, 2Н), 7,107 (dd, J=2,8 Гц, J=8,4 Гц, 1Н), 6,936 (d, J=8,4 Гц, 2Н), 2, 366 (s, 1Н).
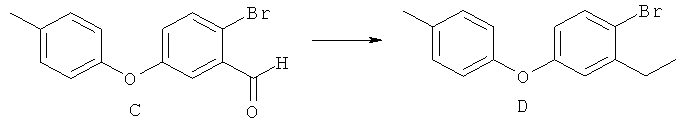
[0832] Смесь соединения С (5 г, 17,2 ммоль) и NaBH4 (320 мг, 8,6 ммоль) в МеОН (50 мл) перемешивали в течение 1 ч при температуре окружающей среды и упаривали. Остаток очищали путем хроматографии, используя РЕ/ЕА (6:1), с получением соединения D (5 г, 100%). ГХ/МС: 292 (М+Я)+;1Я ЯМР (400 МГц, CDCl3) 5 7, 465 (d, J=8,0 Гц, 1Н), 7, 272 (d, J=8,0 Гц, 2Н),7,171-7, 133 (m, 1Н), 6,931 (d, J=8,4 Гц, 2Н), 6,811 (d, J=8,0 Гц, 1Н), 4,701 (s, 2Н), 2,351 (s, 3Н).
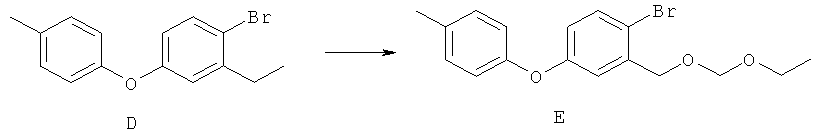
[0833] Смесь соединения D (1,6 г, 5,5 ммоль) и NaH (217 мг, 9,0 ммоль) в ДМФА (20 мл) перемешивали в течение 30 мин при 0°С.
Добавляли ЕOМ-Сl (800 мг, 8,5 ммоль), данную смесь перемешивали в течение 1 ч при температуре окружающей среды и упаривали. Остаток очищали путем хроматографии, используя РЕ/ЕА (10:1), с получением соединения Е (1,6 г, 84%). 1Н ЯМР (400 МГц, CDCl3) 5 7, 470 (d, J=9,2 Гц, 1Н), 7, 168-7, 146 (m, 3Н), 6,929(d, J=8,4 Гц, 2H), 6,811 (d, J=9,2 Гц, 1H), 4, 803 (s, 2H), 4,636 (s, 2H), 3,661-3, 645 (m, 2H), 2, 352 (s, 3H), 1,255-1, 220 (m, 3H).
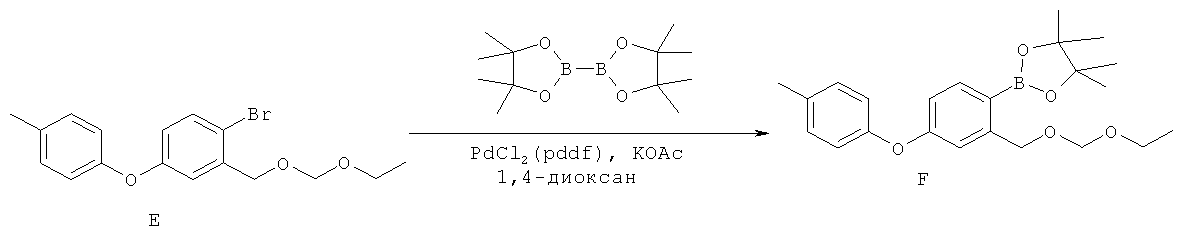
[0834] Смесь соединения E (1,6 г, 4,6 ммоль),
бис(пинаколато)дибора (1,7 г, 7,1 ммоль), PdCl2(dppf) (98 мг) и КОАс (1,3 г, 13,2 ммоль) в 1,4-диоксане (20 мл) перемешивали в течение ночи при 80°С в атмосфере Аr. Растворитель выпаривали. Остаток очищали путем хроматографии, используя РЕ/ЕА (10:1), с получением соединения F (1,6 г, 89%). 1Н ЯМР(400 МГц, CDCl3) 5 7, 778 (d, J=8,0 Гц, 1Н), 7,159 (d, J=8,8 Гц,2Н), 6, 942 (d, J=8,0 Гц, 2H), 6,856 (m, 1H), 4, 854 (s, 2H), 4,797 (s, 2H), 3, 659-3, 606 (m, 2H), 2,349 (s, 3H), 1,333 (s, 12H), 1, 240-1, 206 (m, 3H).
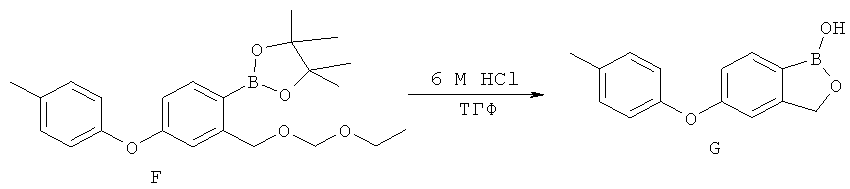
[0835] Смесь соединения F (1,6 г, 4,0 ммоль), 6 M НСl (8 мл) и ТГФ (8 мл) перемешивали в течение ночи при температуре окружающей среды и упаривали. Остаток очищали путем препаративной ВЭЖХ с получением желаемого соединения (600 мг, 63%). ЖХ/МС: 241 (М+H)+; 1H ЯМР (400 МГц, CDCl3) δ 7, 684 (d, J=8,4 Гц, 1Н), 7,197 (d, J=7,6 Гц,2Н), 7,007-6, 956(га, 3Н), 6, 875 (s, 1Н), 5,026 (s, 2H), 2,368 (s, 3Н).
19cr 5-(4-Трифторметил)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D90)
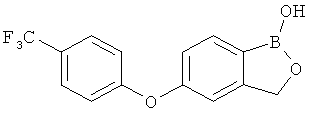
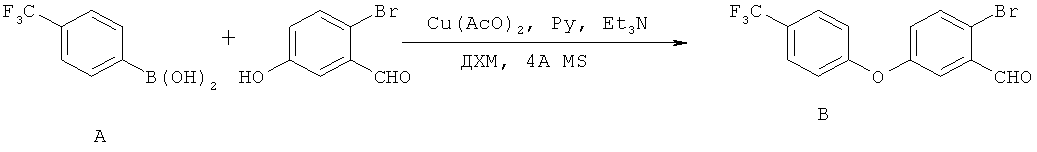
[0836] К раствору соединения А (10,1 г, 53,3 ммоль), 2-бром-5-гидроксибензальдегида (6,7 г, 33,3 ммоль), 4А MS (25 г) и Сu(ОАс)2
(7,84 г, 43,3 ммоль) в сухом CH2Cl2 (150 мл) добавляли в атмосфере Аr пиридин (4,74 г, 59,9 ммоль) и Et3N (8,4 мл, 59,9 ммоль). Данную реакционную смесь перемешивали в течение ночи при температуре окружающей среды, фильтровали, промывали 2 н. НСl, экстрагировали CH2Cl2. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 25:1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения В (3,49 г, 30%). 1Н ЯМР (CDCl3) δ 7,07 (2Н, d, J=8,8 Гц), 7,18 (1Н, dd, J=2,8, 8,4 Гц), 7,55 (1Н, d, J=2,8 Гц), 7,61-7,67 (3Н, m), 10,32 (1Н, s).
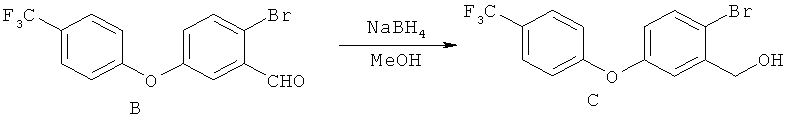
[0837] К раствору соединения В (3,49 г, 10,1 ммоль) в МеОН (40 мл) добавляли NaBH4 (192 мг, 5,06 ммоль). Данную реакционную смесь перемешивали в течение 0,5 ч при температуре окружающей среды Растворитель выпаривали. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейн эфир/EtOAc, 15:1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения С (3,25 г, 93%). 1Н ЯМР (CDCl3) δ 1,79 (1Н, s), 4,73 (2Н, s), 6,87 (1Н, dd, J=2,4, 8,8 Гц), 7,05 (2Н, d, J=8,4 Гц), 7,23 (1Н, d, J=2 Гц), 7,53 (1Н, d, J=9,2 Гц), 7,59 (2Н, d, J=8,8 Гц).
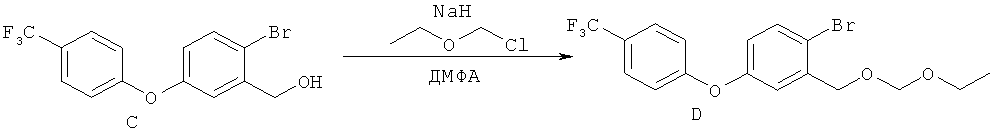
[0838] К раствору соединения С (3,7 г, 10,6 ммоль) в сухом ДМФА (20 мл) добавляли в атмосфере Аr NaH (462 мг, 10,6 ммоль, 55%). Данную реакционную смесь перемешивали в течение 0,5 ч при 0°С, затем добавляли (хлорметокси)этан (1,3 г, 13,8 ммоль). Реакционную смесь перемешивали в течение 1 ч при температуре окружающей среды и гасили путем добавления изо-PrOH. Растворитель выпаривали в условиях глубокого вакуума. Остаток растворяли в EtOAc, промывали водой. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 100:1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения D (3,1 г, 76%). 1Н ЯМР (CDCl3) δ 1,22 (3Н, t, J=6,8 Гц), 3,61-3,66 (2Н, m), 4,64 (2Н, s), 4,80 (2Н, s), 6,85 (1Н, dd, J=2,8, 8,8 Гц), 7,04 (2Н, d, J=8,8 Гц), 7,23 (1Н, d, J=2,8 Гц), 7,53 (1Н, d, J=8,8 Гц), 7,58 (2Н, d, J=9,2 Гц).
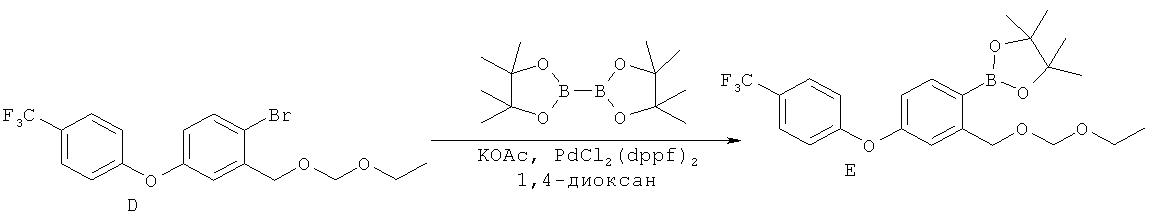
[0839] Смесь соединения D (3,1 г, 7,7 ммоль), бис(пинаколато)дибора (5,87 г, 23,1 ммоль), PdCl2 (dppf) 2 (186 мг, 0,2 3 ммоль) и КОАс (2,26 г, 23,1 ммоль) в 1,4-диоксане (40 мл) перемешивали в течение ночи при 80°С в атмосфере Аr. Органический слой удаляли. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения Е (2,6 г, 75%). 1H ЯМР (CDCl3) δ 1,21 (3Н, t, J=6, 8 Гц), 1,33 (12Н, s), 3,59-3, 64 (2Н, m), 4,79 (2Н, s), 4,86 (2Н, s), 6,92 (1Н, dd, J=2,8, 7,6 Гц), 7,05 (2Н, d, J=8,4 Гц), 7,19 (1Н, d, J=1,6 Гц), 7,56 (2Н, d, J=8,0 Гц), 7,83 (1Н, d, J=7,6 Гц).
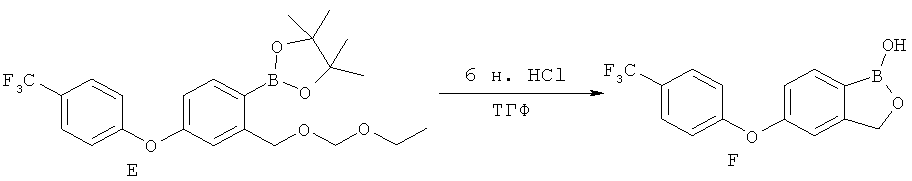
[0840] Смесь соединения Е (2,6 г, 5,75 ммоль), 6 М НСl (26 мл) и ТГФ (2 6 мл) перемешивали в течение ночи при температуре окружающей среды. Растворители удаляли. Остаток очищали путем препаративной ВЭЖХ с получением желаемого соединения (370 мг, 22%). 1Н ЯМР (ДМСО-d6) δ 4, 96 (2Н, s), 7,08 (1Н, m), 7,13 (1Н, s), 7,20 (2Н, d, J=8,5 Гц), 7,77 (3H,m), 9,21 (1Н, s).
19cs 5-(4-(4-Метилпиперазин-1-илсульфонил)фенокси)бензо[с][1,2]оксаборол-1(3Н)-ол (D91)
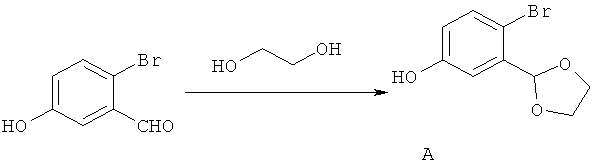
[0841] К раствору 2-бром-5-гидроксибензальдегида (14 г) и пара-толуолсульфоновой кислоты (1,4 г) в толуоле (400 мл) добавляли этан-1,2-диол (6,5 г). Данную реакционную смесь нагревали с использованием насадки Дина-Старка в течение ночи и охлаждали до комнатной температуры. Реакционную смесь упаривали при пониженном давлении, растворяли в ДХМ, фильтровали, и выпаривали растворитель с получением соединения А (15 г, 88%). ЖХ/МС: 246 (М+Н)+.
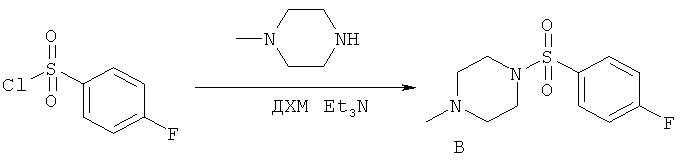
[0842] К раствору 1-метилпиперазина (5,5 г) в ДХМ (200 мл) добавляли Et3N (10,5 г) при 0°С. После перемешивания в течение 0,5 ч к реакционной смеси добавляли по каплям 4-фторбензол-1-сульфонил (10 г). Реакционную смесь перемешивали в течение 2 ч при 0°С, затем перемешивали в течение ночи при комнатной температуре и промывали водой. Органический слой сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения В (13 г, 97%). ЖХ/МС: 259 (М+Н)+.
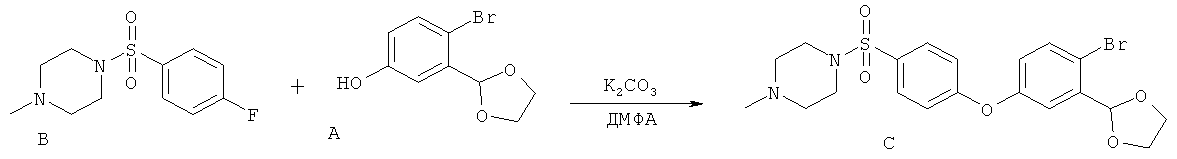
[0843] К раствору соединения В (8 г) и К2СO3 (8,3 г) в ДМФА (250 мл) добавляли в атмосфере Аr соединение А (8,3 г). Данную реакционную смесь перемешивали в течение 3 ч при 150°С, фильтровали, разбавляли диэтиловым эфиром и промывали водой. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения С (14 г, 96%). ЖХ/МС: 484 (М+Н)+.
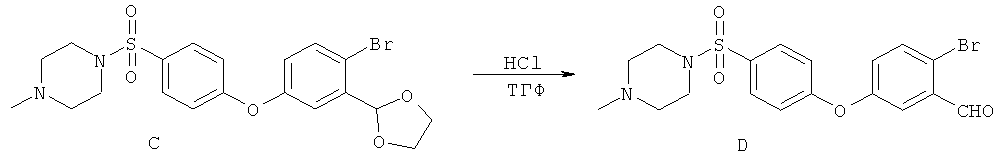
[0844] К раствору соединения С (14 г) в ТГФ (100 мл) добавляли НСl (12 М; 100 мл). Данную реакционную смесь перемешивали в течение ночи при комнатной температуре и экстрагировали ДХМ. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения D (12 г, 94%). ЖХ/МС: 440 (М+Н)+.
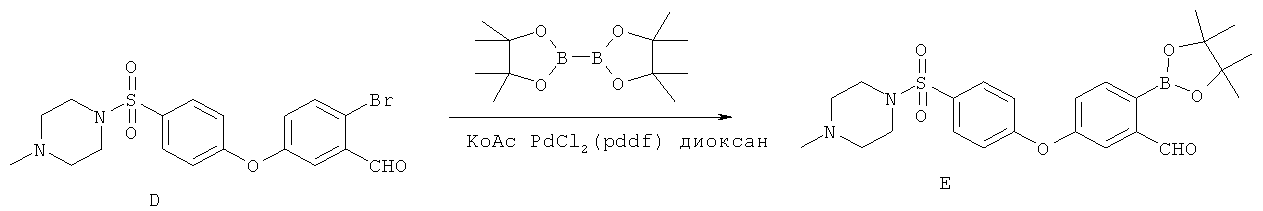
[0845] К раствору соединения D (12 г), КОАс (7,9 г) и PdCl2 (dppf) (1,1 г) в диоксане (80 мл) добавляли в атмосфере Аr бис(пинаколато)дибор (10,4 г). Данную реакционную смесь перемешивали в течение ночи при 70°С, разбавляли водой и экстрагировали ДХМ. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения Е (5 г, 37%).
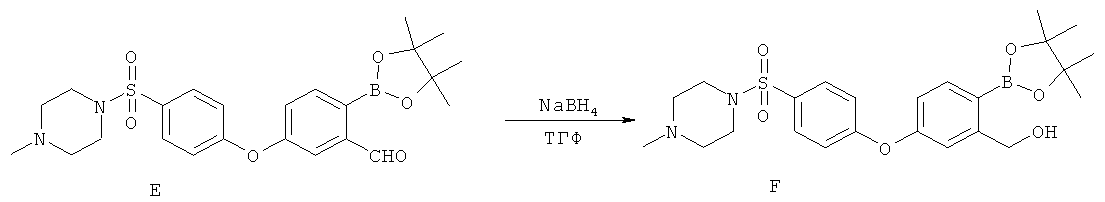
[0846] К раствору соединения Е (5 г) в ТГФ (40 мл) добавляли NaBH4 (1 г). Данную реакционную смесь перемешивали в течение ночи при комнатной температуре, добавляли НСl/H2O (4 М), и полученную смесь экстрагировали EtOAc. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения F (800 мг, 16%). ЖХ/МС: 489(М+Н)+.
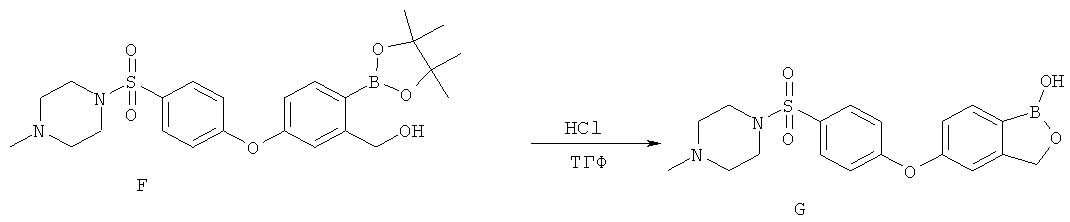
[0847] К раствору соединения F (800 мг) в ТГФ (20 мл) добавляли НСl/H2O (6 М, 20 мл). Данную реакционную смесь перемешивали в течение ночи при комнатной температуре и экстрагировали ДХМ. Органический слой упаривали, и остаток очищали путем ВЭЖХ с получением необходимого соединения (100 мг, 16%). ЖХ/МС: 389 (М+Н)+.
19ct N,N-Диэтил-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)бензолсульфонамид (D92)
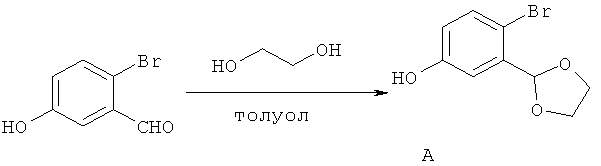
[0848] К раствору 2-бром-5-гидроксибензальдегида (5 г) и толуолсульфоновой кислоты (0,13 г) в толуоле (200 мл) добавляли этан-1,2-диол (3,8 г). Данную реакционную смесь нагревали в условиях по Дину-Старку в течение ночи и охлаждали до комнатной температуры. Реакционную смесь упаривали при пониженном давлении, добавляли ДХМ, смесь фильтровали, и выпаривали растворитель с получением соединения А (5 г, 83%). ЖХ/МС: 246 (М+Н)+.
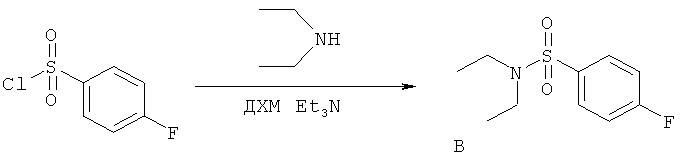
[0849] К раствору диэтиламина (1 г) в ДХМ (50 мл) добавляли Et3N (2,8 г) при 0°С. После перемешивания в течение 0,5 ч к реакционной смеси добавляли по каплям 4-фторбензол-1-сульфонил (2,9 г). Реакционную смесь перемешивали в течение 2 ч при 0°С, затем перемешивали в течение ночи при комнатной температуре и промывали водой. Органический слой сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения В (2,5 г, 78%). ЖХ/МС: 232 (М+Н)+.
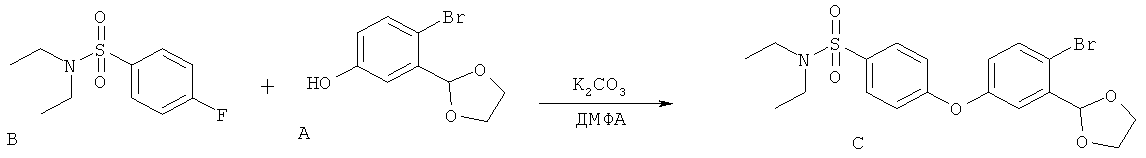
[0850] К раствору соединения В (2,5 г) и К2СO3 (2,7 г) в ДМФА (100 мл) добавляли в атмосфере Аr2 соединение А (2,5 г). Данную реакционную смесь перемешивали в течение 3 ч при 150°С, фильтровали и экстрагировали диэтиловым эфиром. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения С (5 г, 100%). ЖХ/МС: 458 (М+Н)+.
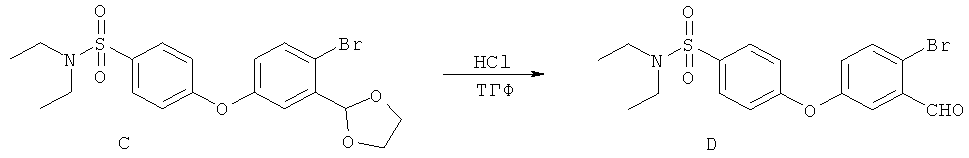
[0851] К раствору соединения С (5 г) в ТГФ (40 мл) добавляли 12 М НСl (40 мл). Данную реакционную смесь перемешивали в течение ночи при комнатной температуре и экстрагировали ДХМ. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения D (4,1 г, 100%). ЖХ/МС: 414 (М+Н)+.
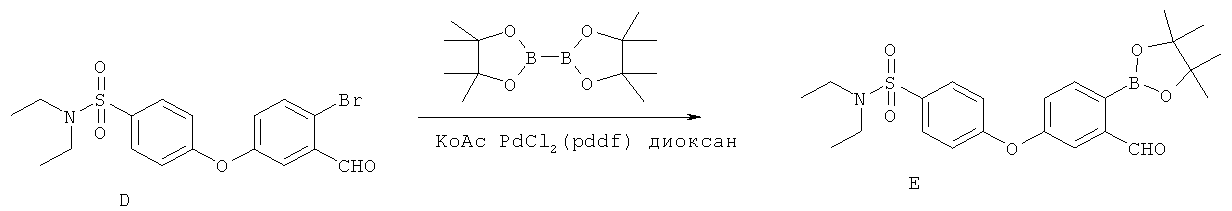
[0852] К раствору соединения D (4,1 г), КОАс (2,9 г) и PdCl2 (dppf) (0,4 г) в диоксане (80 мл) добавляли в атмосфере Аr бис(пинаколато)дибор (3,8 г). Данную реакционную смесь перемешивали в течение ночи при 70°С, разбавляли водой и экстрагировали ДХМ. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения Е (3 г, 66%).
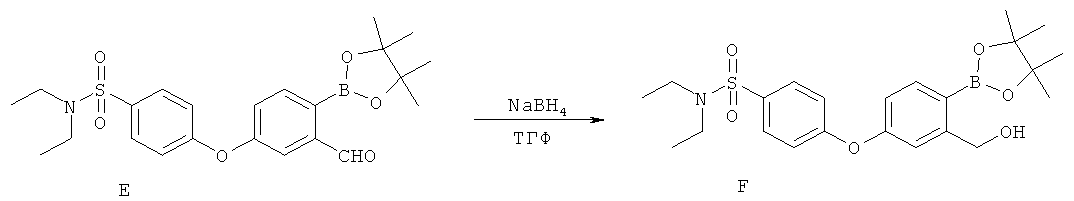
[0853] К раствору соединения Е (3 г) в ТГФ (40 мл) добавляли NaBH4 (1 г). Данную реакционную смесь перемешивали в течение ночи при комнатной температуре, и добавляли 4 М НСl/H2O, экстрагировали EtOAc. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель с получением соединения F (1,3 г, 43%). ЖХ/МС: 462 (М+Н)+.
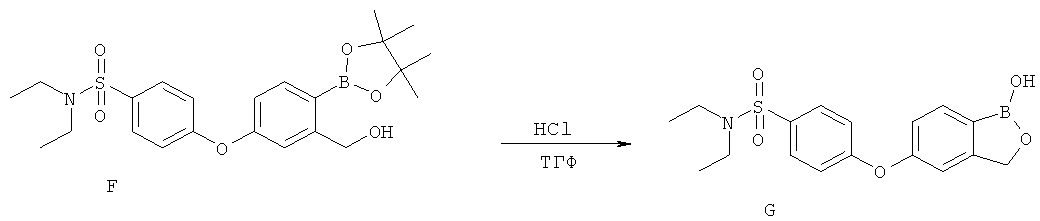
[0854] К раствору соединения F (1,3 г) в ТГФ (30 мл) добавляли 6 М НСl/H2O (30 мл). Данную реакционную смесь перемешивали в течение ночи при комнатной температуре, экстрагировали ДХМ, упаривали и очищали путем ВЭЖХ с получением желаемого соединения (300 мг, 30%). ЖХ/МС: 362 (М+Н)+.
19сu 5-(4-Метоксифенокси)бензо[с][1,2]оксаборол-1(3Н)-ол (D93)
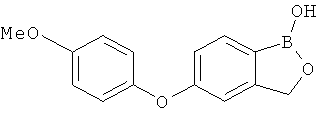
Получение соединения В
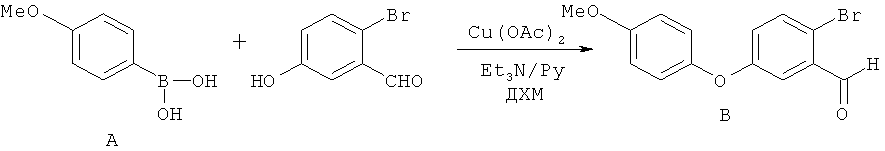
[0855] Соединение А (11 г, 5,97 моль), 2-бром-5-гидроксибензальдегид (9 г, 45 ммоль), Сu(ОАс)2 (9,8 г, 54 ммоль) и 4A MS (20 г) суспендировали в сухом ДХМ (100 мл), добавляли Et3N (12,6 мл) и пиридин (37,8 мл), и данную реакционную смесь перемешивали в течение 48 ч при комнатной температуре в атмосфере Аr. Смесь фильтровали и экстрагировали 1 М НСl. Органические слои объединяли и сушили над MgSO4. Неочищенный продукт очищали путем хроматографии, используя РЕ/ЕА (20:1), с получением соединения В (2,2 г, 15%). ГХ/МС: 308 (М+Н)+.
Получение соединения С
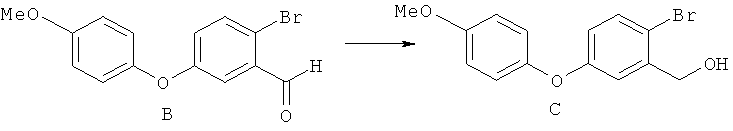
[0856] Смесь соединения В (80 мг, 0,26 ммоль) и NaBH4 (5 мг, 0,13 ммоль) в МеОН (3 мл) перемешивали в течение 1 ч при температуре окружающей среды. Растворитель удаляли. Остаток очищали путем хроматографии, используя РЕ/ЕА (6:1), с получением соединения С (70 мг, 88%). 1Н ЯМР(400 МГц, CDCl3) δ 7, 447 (d, J=8,4 Гц, 1Н), 7,100 (d, J=2,1 Гц, 1H), 6,993 (d, J=9,2 Гц, 2H), 6, 909 (d, J=9,2 Гц, 2Н), 6, 768 (dd, J=2, 4 Гц, J=8,0 Гц, 1Н), 4, 688 (s, 2H), 3,820 (s, 3Н).
Получение соединения D
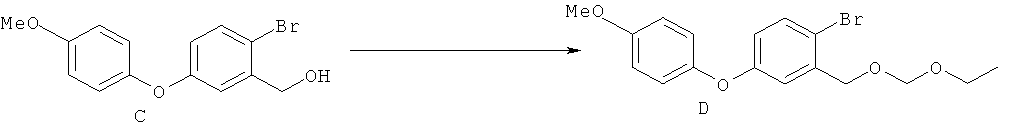
[0857] Смесь соединения С (1,45 г, 4,7 ммоль) и NaH (187 мг, 7,8 ммоль) в ДМФА (20 мл) перемешивали в течение 30 мин при 0°С. Добавляли Е0М-С1 (689 мг, 7,3 ммоль), и данную смесь перемешивали в течение 1 ч при температуре окружающей среды. Растворитель удаляли. Остаток очищали путем хроматографии, используя РЕ/ЕА (10:1), с получением соединения D (1,4 г, 82%). 1Н ЯМР (400 МГц, CDCl3) δ 7, 449 (d, J=9,2 Гц, 1Н), 7,128 (d, J=3,6 Гц, 1Н), 6,987 (d, J=8,4 Гц, 2Н), 6,904 (d, J=9, 6 Гц, 1Н), 6, 747 (dd, J=3,2 Гц, J=8,4 Гц, 1Н), 4,797 (s, 2Н), 4,622 (s, 2Н),3,819 (s, 3Н), 3,674-3, 622 (m, 2Н),1,251-1,215 (m, 3Н).
Получение соединения Е
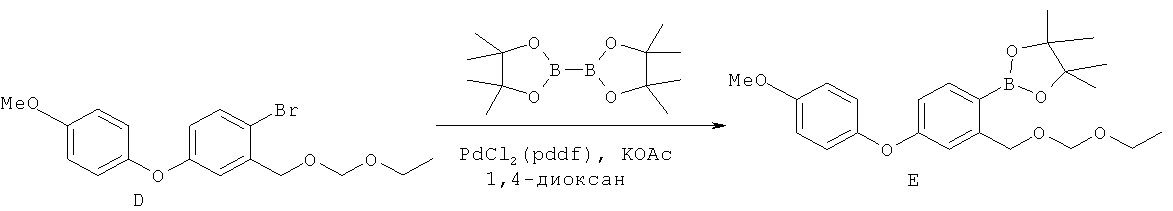
[0858] Смесь соединения D (700 мг, 1,9 ммоль), бис (пинаколато) дибора (741 мг, 3,0 ммоль), PdCl2(dppf) (42 мг) и КОАс (570 мг, 5,5 ммоль) в 1,4-диоксане (10 мл) перемешивали в течение ночи при 80°С в атмосфере Аr. Растворитель удаляли. Остаток очищали путем хроматографии, используя РЕ/ЕА (10:1), с получением соединения Е (700 мг, 89%). 1Н ЯМР (400 МГц, CDCl3) δ 7, 767 (d, J=8,4 Гц, 1Н), 7, 092 (s, 1Н), 7,001 (d, J=8,8 Гц, 2Н), 6,903 (d, J=9,2 Гц, 2Н), 6,814 (dd, J=l,6 Гц, J=8,0 Гц, 1Н), 4,840 (s, 2H), 4, 795 (s, 2H), 3, 659-3, 606 (m, 2H), 3,819 (s, 3Н), 3,659-3,607 (m, 2H), 1,330 (s, 12H), 1,242-1,207 (m, 3Н).
Получение соединения D93
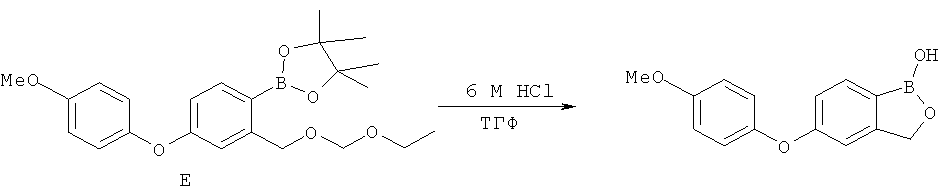
[0859] Смесь соединения Е (700 мг, 1,7 ммоль) в 6 М НСl (4 мл) и ТГФ (4 мл) перемешивали в течение ночи при температуре окружающей среды. Растворители удаляли. Остаток очищали путем препаративной ВЭЖХ с получением желаемого соединения (300 мг, 69%). ЖХ/МС: 257 (М+Н)+; 1Н ЯМР (400 МГц, CDCl3) δ 7, 665 (d, J=8,0 Гц, 1Н), 7,026 (d, J=9,2 Гц,2Н), 6, 976 (dd, J=2,0 Гц, J=8,0 Гц, 1H), 6, 926 (d, J=9,2 Гц, 2H), 6, 826 (d, J=l,6 Гц, 1H), 5,014 (s, 2H), 3, 823 (s, 3H).
19cv 5-(3,4-Диметоксифенокси)бензо[с][1,2]оксаборол-1(3Н)-ол (D94)
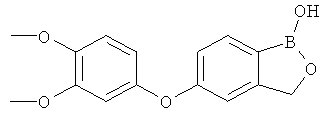
Получение соединения В
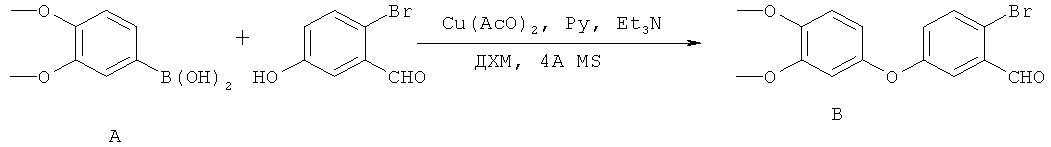
[0860] К раствору соединения А (14,6 г, 80,2 ммоль), 2-бром-5-гидроксибензальдегида (10,08 г, 50,2 ммоль), 4А MS (30 г) и Сu(ОАс)2 (10,88 г, 60,2 ммоль) в сухом СН2Сl2 (200 мл) добавляли в атмосфере Аr пиридин (7,12 г, 90,2 ммоль) и Et3N (12,7 мл, 90,2 ммоль). Данную реакционную смесь перемешивали в течение ночи при температуре окружающей среды, фильтровали, промывали 2 н. НСl и экстрагировали СН2Сl2. Органические слои объединяли, сушили (Nа2SO4), фильтровали, и выпаривали растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 15:1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения В (1,84 г, 11%). 1Н ЯМР (CDCl3) δ 3, 84 (3Н, s), 3,89 (3Н, s), 6, 56-6, 62 (2Н, m), 6,84 (1Н, d, J=8,8 Гц), 7,10 (1Н, dd, J=2,8, 8,4 Гц), 7,43 (1Н, d, J=2,8 Гц), 7,56 (1Н, d, J=9,2 Гц), 10,29 (1Н, s).
Получение соединения С
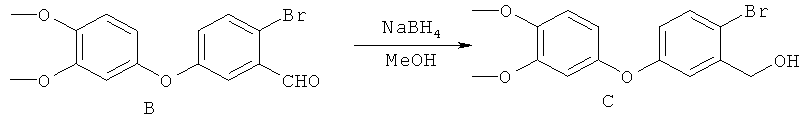
[0861] К раствору соединения В (2,16 г, 6,42 ммоль) в МеОН (150 мл) добавляли NaBH4 (120 мг, 3,15 ммоль). Данную реакционную смесь перемешивали в течение 0,5 ч при температуре окружающей среды Растворитель выпаривали. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 3:1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения С (2,2 г, 99%). 1Н ЯМР (CDCl3) δ 1,57 (1Н, s), 3,83 (3Н, s), 3,87 (3Н, s), 4,69 (2Н, d, J=6,0 Гц), 6,56 (1Н, dd, J=2,4, 8,8 Гц), 6,62 (1Н, d, J=2,4 Гц), 6,76 (1Н, dd, J=2,4, 8,8 Гц), 6,82 (1Н, d, J=9,2 Гц), 7,11 (1Н, d, J=2,4 Гц), 7,43 (1Н, d, J=8,4 Гц).
Получение соединения D
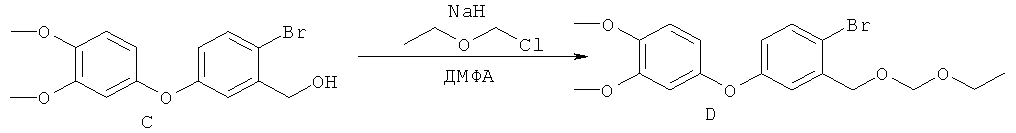
[0862] К раствору соединения С (2,2 г, 6,4 ммоль) в сухом ДМФА (25 мл) добавляли в атмосфере Аr NaH (279 мг, 6,4 ммоль, 55%). Данную реакционную смесь перемешивали в течение 0,5 ч при 0°С, и затем добавляли (хлорметокси)этан (782 мг, 8,32 ммоль). Реакционную смесь перемешивали в течение 1 ч при температуре окружающей среды и гасили путем добавления изо-PrOH. Растворитель выпаривали в условиях глубокого вакуума. Остаток растворяли в EtOAc и промывали водой. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 10:1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения D (1,8 г, 71%). 1Н ЯМР (CDCl3) δ 1,22 (3Н, t, J=8,0 Гц), 3,61-3,66 (2Н, m), 3,83 (3Н, s), 3,88 (3Н, s), 4,61 (2Н, s), 4,79 (2Н, s), 6,55 (1Н, dd, J=2, 8, 8,4 Гц), 6,62 (1Н, d, J=2,0 Гц), 6,74 (1Н, dd, J=2, 4, 9,2 Гц), 6,82 (1Н, d, J=8,4 Гц), 7,12 (1Н, d, J=2,4 Гц), 7,44 (1Н, d, J=8,4 Гц).
Получение соединения Е
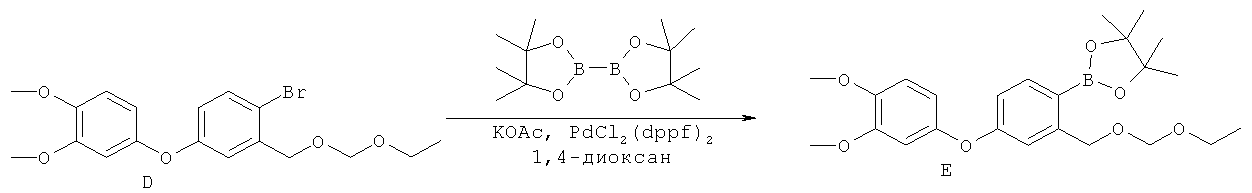
[0863] Смесь соединения D (1,8 г, 4,53 ммоль), бис(пинаколато)дибора (3,45 г, 13,6 ммоль), PdCl2(dppf)2 (109 мг, 0,13 ммоль) и КОАс (1,33 г, 13,6 ммоль) в 1,4-диоксане (20 мл) перемешивали в течение ночи при 80°С в атмосфере Аr. Органический слой удаляли. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 15:1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения Е (1,84 г, 82%). 1H ЯМР (CDCl3) δ 1,21 (3Н, t, J=6,8 Гц), 1,32 (12Н, s), 3,60-3,65 (2Н, m), 3,81 (3Н, s), 3,88 (3Н, s), 4,79 (2Н, s), 4,83 (2Н, s), 6,59 (1Н, dd, J=2,4, 8,4 Гц), 6,64 (1Н, d, J=2,8 Гц), 6, 80-6, 83 (2Н, m), 7,10 (1Н, d, J=2,0 Гц), 7,75 (1Н, d, J=8,4 Гц).
Получение соединения D94
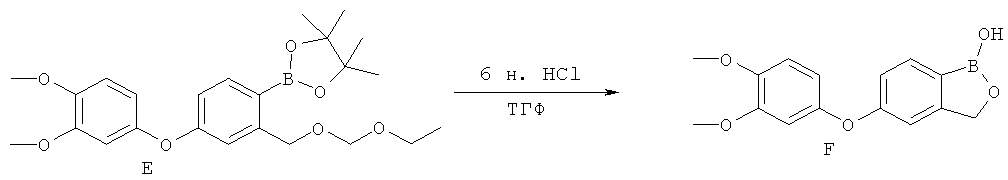
[0864] Смесь соединения Е (1,84 г, 4,14 ммоль), 6 М НСl (40 мл) и ТГФ (60 мл) перемешивали в течение ночи при температуре окружающей среды. Растворители удаляли. Остаток очищали путем препаративной ВЭЖХ с получением желаемого соединения (615 мг, 52%). 1Н ЯМР (ДМСО-d6) δ 3, 73 (3Н, s), 3,76 (3Н, s), 4,91 (2Н, s), 6,59 (1Н, dd, J=2,5, 9,0 Гц), 6,77 (1Н, d, J=2,5 Гц), 6,89 (1Н, s), 6,94 (1Н, dd, J=l,5, 8,0 Гц), 6,97 (1Н, d, J=8,5 Гц), 7,69 (1Н, d, J=8,0 Гц), 9,11 (1Н, s).
19cw 2-Диметиламино-6-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D95)
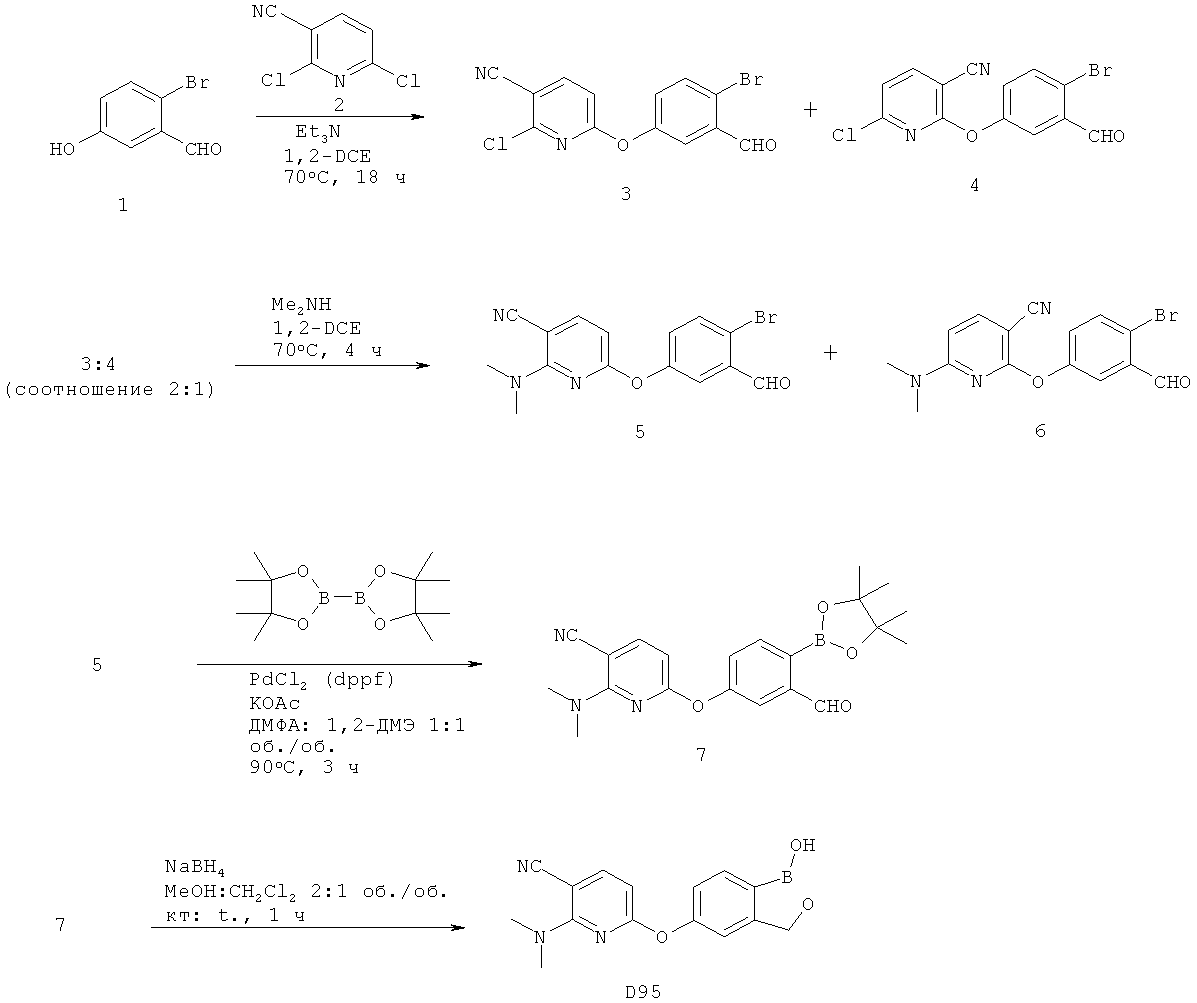
6-(4-Бром-3-формилфенокси)-2-хлорникотинониатрил (3)
[0865] В герметично закрываемый реакционный сосуд, содержащий раствор 2-бром-5-гидроксибензальдегида (1) (7,84 г, 39,0 ммоль) и 2,6-дихлорникотинонитрила (2) (7,42 г, 42,9 ммоль), добавляли триэтиламин (11,0 мл, 78,0 ммоль). Реакционный сосуд герметично закрывали тефлоновой крышкой и нагревали при 70°С в течение 18 ч. Реакционную смесь оставляли охлаждаться до комнатной температуры и концентрировали с получением оранжевого масла (18,0 г). Масло разбавляли СН2Сl2 (200 мл), затем добавляли силикагель (70 г, 230-400 меш), и концентрировали досуха. Полученную смесь наносили на колонку с силикагелем (70 г, 230-400 меш), и элюировали градиентом 5-40% EtOAc/гексаны. Выделяли 5,80 г смеси 6-(4-бром-3-формилфенокси)-2-хлорникотинонитрила (3) и 2-(4-бром-3-формилфенокси)-6-хлорникотинонитрила (4) в соотношении 2:1, соответственно, в виде прозрачного масла, которое со временем затвердевало, превращаясь в белое твердое вещество. Данную смесь использовали на следующей стадии после дополнительной очистки.
[0866] 6-(4-Бром-3-формилфенокси)-2-хлорникотинонитрил (3): 1Н ЯМР (400 МГц, CDCl3) δ 10,35 (s, 1Н), 7,99 (d, J=8,6 Гц, 1Н), 7,73 (d, J=8,6 Гц, 1Н), 7,69 (d, J=2,7 Гц, 1Н), 7,30 м,д, (dd, J=8,6, 2,7 Гц, 1Н), 7,02 (d, J=8,6 Гц, 1Н).
[0867] 2-(4-Бром-3-формилфенокси)-6-хлорникотинонитрил (4): 1Н ЯМР (400 МГц, CDCl3) δ 10,35 (s, 1Н), 7,97 (d, J=7,8 Гц, 1Н), 7,75 (d, J=7,8 Гц, 1Н), 7,73 (d, J=2,3 Гц, 1Н), 7,34 (dd, J=7,8, 2,3 Гц, 1Н), 7,17 (d, J=7,8 Гц, 1Н).
6-(4-Бром-3-формилфенокси)-2-диметиламиноникотинонитрил (5)
[0868] Смесь 6-(4-бром-3-формилфенокси)-2-хлорникотинонитрила (3) и 2-(4-бром-3-формилфенокси)-6-хлорникотинонитрила (4) в соотношении 2:1, соответственно, (2,47 г, 7,34 ммоль) растворяли в 1,2-дихлорэтане (40 мл) в герметично закрываемом реакционном сосуде. Затем добавляли диметиламин (18,3 мл, 36,7 ммоль), и реакционный сосуд герметично закрывали тефлоновой крышкой. Реакционную смесь нагревали при 70°С в течение 4 ч [Примечание: со временем формировался белый осадок]. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали с получением оранжевого твердого вещества, которое содержало смесь 6-(4-бром-3-формилфенокси)-2-диметиламиноникотинонитрила (5) и 2-(4-бром-3-формилфенокси)-6-диметиламиноникотинонитрила (6) в соотношении 2:1, соответственно, (2,80 г). Полученное твердое вещество растворяли в СН2Сl2 (200 мл), затем добавляли силикагель (50 г, 230-400 меш), и концентрировали досуха. Полученную смесь наносили на колонку с силикагелем (100 г, 230-400 меш), и элюировали градиентом 5-10% EtOAc/гексаны. Фракции, содержащие чистый продукт, объединяли и концентрировали с получением указанного в заголовке соединения 5 в виде белого твердого вещества (1,10 г, фактический выход 43%).
[0869] 6-(4-Бром-3-формилфенокси)-2-диметиламиноникотинонитрил (5): 1Н ЯМР (400 МГц, CDCl3) δ 10,34 (s, 1Н), 7,78 (d, J=2,7 Гц, 1H), 7,72 (d, J=8,2 Гц, 1H), 7,66 (d, J=8,6 Гц, 1H), 7,27 (dd, J=8,6, 2,7 Гц, 1H), 6,24 (d, J=8,2 Гц, 1H), 3,11 (s, 6H). [0870] 2-(4-Бром-3-формил-фенокси)-6-диметиламино-никотинонитрил (6): 1H ЯМР (400 МГц, CDCl3) δ 10,35 (s, 1Н), 7,85 (d, J=2,7 Гц, 1H), 7,66 (d, J=8,6 Гц, 1H), 7,64 (d, J=8,6 Гц, 1H), 7,32 (dd, J=8,6, 2,7 Гц, 1H), 6,19 (d, J=8,6 Гц, 1H), 2,95 (s, 6H).
2-Диметиламино-6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрил (7) [0871] 6-(4-Бром-3-формилфенокси)-2-диметиламиноникотинонитрил (5) (1,10 г, 3,18 ммоль), бис (пинаколато)дибор (1,21 г, 4,77 ммоль) и ацетат калия (624 мг, 6,3 6 ммоль) в смеси диметилформамид/1,2-диметоксиэтан (20 мл: 20 мл) нагревали в течение 5 мин при 90°С в герметично закрытом реакционном сосуде. Затем добавляли PdCl2(dppf) (233 мг, 0,32 ммоль), тефлоновую крышку снимали, и реакционную смесь нагревали в течение 3 ч при 90°С. Реакционную смесь оставляли охлаждаться до комнатной температуры, затем разбавляли бензолом (600 мл) и концентрировали с получением черного масла (3,0 г). Масло разбавляли СН2Сl2 (300 мл), затем добавляли силикагель (30 г, 230-400 меш), и концентрировали досуха. Полученную смесь наносили на колонку с силикагелем (60 г, 230-400 меш), и элюировали градиентом 10-4 0% EtOAc/гексаны. Фракции содержащие чистый продукт, объединяли и концентрировали с получением указанного в заголовке соединения 7 в виде масла, которое со временем затвердевало с образованием белого твердого вещества (530 мг, фактический выход 42%). 1H ЯМР (400 МГц, СОСl3) δ 10,61 (s, 1Н), 7,92 (d, J=8,2 Гц, 1Н), 7,78 (d, J=2,3 Гц, 1Н), 7,68 (d, J=8,2 Гц, 1Н), 7,35 (dd, J=8,2, 2,3 Гц, 1Н), 6,20 (d, J=8,2 Гц, 1Н), 3,08 (s, 6Н), 1,28 (s, 12Н).
19сх 2-Диметиламино-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D95)
[0872] Раствор 2-диметиламино-6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрила (7) (370 мг, 0,94 ммоль) в СН2Сl2 (5 мл) добавляли к смеси NaBH4 (26 мг, 0,66 ммоль) в безводном метаноле (10 мл) при комнатной температуре. Затем порциями в течение 10 минут добавляли дополнительное количество твердого NaBH4 (82 мг, 2,2 ммоль). Далее реакционную смесь перемешивали еще в течение 1 ч при комнатной температуре. Реакцию прекращали путем добавления раствора ледяной уксусной кислоты (0,2 мл) и дистиллированной воды (0,2 мл) и затем перемешивали в течение 10 минут. Реакционную смесь концентрировали с получением масла (~550 мг). Масло растворяли в смеси уксусная кислота /метанол/СН2Сl2 (1/2/100 об./об./об., 100 мл), затем добавляли силикагель (5 г, 230-400 меш), и концентрировали досуха с получением сыпучего импрегнированного силикагеля. Данную смесь наносили на колонку с силикагелем (10 г, 230-400 меш), и элюировали смесью уксусная кислота /метанол/СН2Сl2 (1/2/100 об./об./об.). Фракции, содержащие соединение D95, собирали и концентрировали с получением светло-желтого масла. Полученное масло лиофилизировали следующим образом: сначала масло разбавляли смесью МеОН/СН2Сl2 (1/1 об. /об., 15 мл), затем добавляли деионизованную воду (200 мл), полученную белую суспензию замораживали в бане со смесью сухого льда и ацетона и помещали на ночь в лиофилизатор. Получали соединение D95 в виде белого твердого вещества, (70 мг, фактический выход 25%). 1Н ЯМР (400 МГц, ДМСО-d6) δ 9, 23 (s, 1Н), 7,95 (d, J=8,6 Гц, 1Н), 7,77 (d, J=7,8 Гц, 1Н), 7,23 (d, J=0,5 Гц, 1Н), 7,16 (dd, J=7,8, 0,5 Гц, IE), 6,31 (d, J=8,6 Гц, 1H), 4,98 (s, 2H), 3,14 (s, 6H). Масс-спектр: [M+H+]=296. Чистота согласно ВЭЖХ: 95,04% (Maxplot), 94, 63% (220 нм), 92,41% (254 нм).
19су 6-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-2-[(2-метокси-этил)-метиламино]-никотиконитрил (D96)
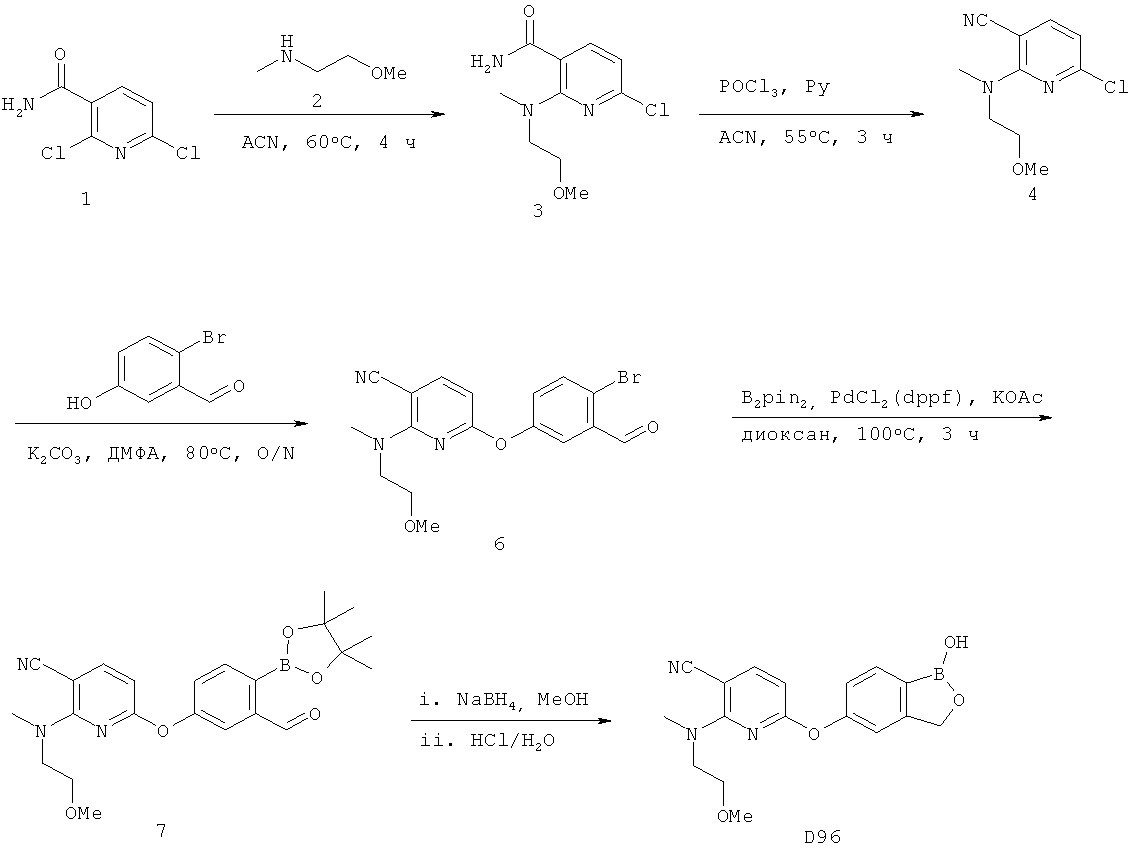
6-Хлор-2-[(2-мешоксиэтил)-метиламино]-никотинамид (3)
[0873] К раствору 2,6-дихлорникотинамида (1) (10 г, 52,9 ммоль) в безводном ацетонитриле (200 мл) добавляли (2-метоксиэтил)-метиламин (2) (18,8 г, 212 ммоль). Данную реакционную смесь нагревали при 60°С в течение 1,5 часа. Медленно добавляли 5% раствор NaOH (1000 мл). Затем полученный раствор экстрагировали EtOAc (3×250 мл). Объединенный органический слой сушили над MgSO4, фильтровали и упаривали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 5-30% EtOAc/гексаны, с получением указанного в заголовке соединения (11,66 г, выход 91%). 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 8,07 (d, J=8,6 Гц, 1Н), 7,76 (br, s,, 1Н), 6,93 (d, J=8,2 Гц, 1Н), 5,66 (br, s,, 1Н), 3,66-3,51 (m, 4Н), 3,32 (s, 3Н), 2, 93 (s, 3Н).
6-Хлор-2-[(2-метоксиэтил)-метиламино]-никотинонитрил (4)
[0874] К раствору 6-хлор-2-[(2-метокси-этил)-метил-амино]-никотинамида (3) (14 г, 58 ммоль) в безводном ацетонитриле (360 мл) добавляли пиридин (37,5 мл, 463,8 ммоль) и РОСl3 (21,2 мл, 232 ммоль). Данную реакционную смесь нагревали при 55°С в течение 3 часов. После охлаждения до комнатной температуры pH смеси доводили до 9, медленно добавляя 10% водный раствор NaOH. Затем раствор экстрагировали EtOAc (3×200 мл). Объединенный органический слой сушили над MgSO4, фильтровали и упаривали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 5-3 0% EtOAc/гексаны, с получением желаемого продукта (11,6 г, выход 90%). 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,61 (d, J=7,4 Гц, 1Н), 6,58 (d, J=7,8 Гц, 1Н), 3,87 (t, J=5,3 Гц, 2Н), 3,64 (t, J=5,3 Гц, 2Н), 3,38 (s, 3Н), 3,36 (s, 3Н).
6-(4-Бром-3-формилфенокси)-2-[(2-метоксиэтил)-метиламино]-никотинонитрил (6)
[0875] К раствору 6-хлор-2-[(2-метокси-этил)-метил-амино]-никотинонитрила (4) (11,6 г, 51,9 ммоль) в безводном ДМФА (300 мл) добавляли 2-бром-5-гидрокси-бензальдегид (10,4 г, 51,9 ммоль) и К2СО3 (14,3 г, 103,8 ммоль). Данную реакционную смесь нагревали в течение 16 часов при 80°С. ДМФА выпаривали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент EtOAc (5-30%), с получением указанного в заголовке соединения (15 г, выход 75%). 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 10,34 (s, 1Н), 7, 75-7, 69 (m, 2Н), 7,67 (d, J=8,6 Гц, 1Н), 7, 28-7, 23 (m, 1Н), 6,26 (d, J=8,6 Гц, 1Н), 3,56 (t, J=5,5 Гц, 2Н), 3,36 (t, J=5,5 Гц, 2Н), 3,25 (s, 3Н), 3,24 (s, 3Н).
6-[3-Формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-[(2-метокси-этил)-метил-амино]-никотинонитрил (7)
[0876] К раствору 6-(4-бром-3-формилфенокси)-2-[(2-метоксиэтил)-метиламино]-никотинонитрила (6) (15 г, 38,5 ммоль) в безводном 1,4-диоксане (360 мл) добавляли биспинаколатодибор (11,7 г, 4 6,2 ммоль), PdCl2(dppf) (2,8 г, 3,85 ммоль) и КОАс (11,3 г, 115,3 ммоль). Раствор перемешивали в течение 30 минут при комнатной температуре, используя барботирование азотом (N2). Затем реакционную смесь нагревали в течение 3 часов при 100°С. После завершения реакции раствор фильтровали и концентрировали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 2,5-20% EtOAc/гексан, с получением указанного в заголовке соединения (15 г, выход 89%). 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 10,64 (s, 1Н), 7,94 (d, J=7, 8 Гц, 1Н), 7,76 (d, J=2,3 Гц, 1Н), 7, 72-7, 69 (m, 1Н), 7,35 (dd, J=8,0, 2,5 Гц, 1Н), 6,25 (d, J=8,6 Гц, 1Н), 3,56 (t, J=5,5 Гц, 2Н), 3,36 (t, J=5,5 Гц, 2Н), 3,25 (s, 3Н), 3,22 (s, 3Н), 1,40 (s, 12Н).
6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-[(2-метоксиэтил)-метиламино]-никотинонитрил (D96)
[0877] К прозрачному раствору 6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-[(2-метоксиэтил)-метиламино]-никотинонитрила (7) (15 г, 343 ммоль) в безводном МеОН (300 мл) медленно добавляли NaBH4 (7,83 г, 206 ммоль). Данную реакционную смесь перемешивали в течение 4 часов при комнатной температуре, затем добавляли 1 М раствор НСl (200 мл). Перемешивание продолжали в течение ночи при комнатной температуре. Затем раствор медленно упаривали под вакуумом. Очистку выполняли путем обращенно-фазовой хроматографии (Biotage), используя для элюирования градиент 10-100% МеОН/H2O, с получением указанного в заголовке соединения (3 г, выход 2 6%). 1Н ЯМР (400 МГц, ХЛОРОФОРМОМ) δ м.д. 7,74 (d, J=8,6 Гц, 1Н), 7,70 (d, J=8,2 Гц, 1Н), 7,13-7,09 (m, 2Н), 6,23 (d, J=8,2 Гц, 1Н), 5,08 (s, 2Н), 4,78 (s, 1Н), 3,56 (t, J=5,7 Гц, 2Н), 3,36 (t, J=5,7 Гц, 2Н), 3,27 (s, 3Н), 3,23 (s, 3Н). Масс-спектр (ИЭР) m/z: 340 (М+Н)+; ВЭЖХ: 99,38% (220 нм), 98,1% (MaxPlot).
19cz 6-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-2-пирролидин-1-ил-никотинонитрил (D97)
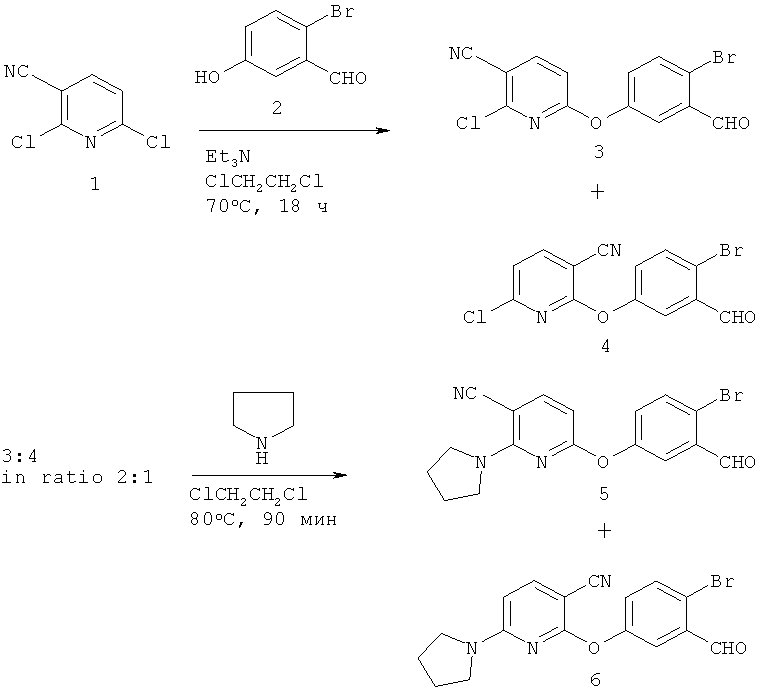
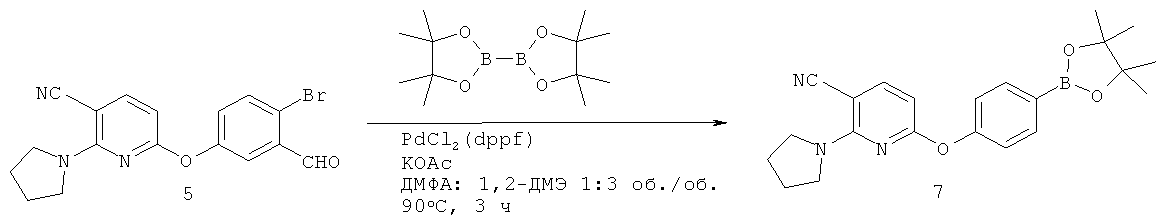
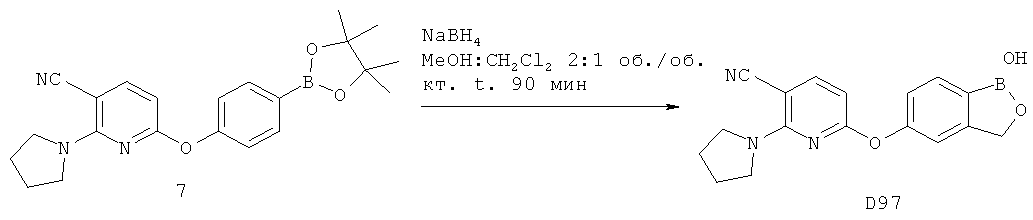
6-(4-Бром-3-формилфенокси)-2-хлорникотинонитрил (3)
[0878] 2,6-Дихлорникотинонитрил (7,42 г, 42,9 ммоль), 2-бром-5-гидроксибензальдегид (7,84 г, 39,0 ммоль) и триэтиламин (7,89 г, 11,0 мл, 78,0 ммоль) в 1,2-дихлорэтане (50 мл) нагревали до 70°С в течение 18 ч в герметично закрытом реакционном сосуде. Реакционную смесь охлаждали до комнатной температуры и концентрировали с получением смеси 6-(4-бром-3-формилфенокси)-2-хлорникотинонитрила (3) и 2-(4-бром-3-формил-фенокси)-6-хлор-никотинонитрила (4) в соотношении 1,8:1, соответственно, (18 г). ТСХ-анализ соединения 3 показал Rf=0,4 и для соединения 4Rf=0,35 (элюирование: 25% EtOAc/гексаны; проявление УФ-лампой). Смесь соединениий фракционировали путем хроматографии на "сухой" колонке следующим образом. Масло разбавляли СН2Сl2 (200 мл), затем добавляли силикагель (70 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (70 г, 230-400 меш), и элюировали градиентом 5-40% EtOAc/гексаны. Собирали три основные фракции, фракция 1 с 3:4 в соотношении 1:1,5 (3,40 г), фракция 2 с 3:4 в соотношении 1,8:1 (3,70 г), и фракция 3 с 3:4 в соотношении 2,0:1 (2,10 г). Фракцию 3 (наиболее обогащенную необходимым соединением 3) использовали на следующей стадии без дополнительной очистки.
[0879] Соединение 3: 1Н ЯМР (400 МГц, CDCl3) δ 10,34 (s, 1Н), 7,99 (d, J=8,6 Гц, 1H), 7,73 (d, J=8,6 Гц, 1H), 7,69 (d, J=2,7 Гц, 1H), 7,30 (dd, J=8, 9, 2,3 Гц, 1H), 7,02 (d, J=8,6 Гц, 1H). [0880] Соединение 4: гН ЯМР (400 МГц, CDCl3) δ 10,34 (s, 1H), 7,97 (d, J=7,8 Гц, 1H), 7,75 (d, J=10,5 Гц, 1H), 7,73 (d, J=2,3 Гц, 1H), 7,3 4 (dd, J=9,0, 3, 1 Гц, 1H), 7,17 (d, J=7,8 Гц, 1H).
6-(4-Бром-3-формилфенокси)-2-пирролидин-1-ил-никотинонитрил (5) [0881] Смесь 6-(4-бром-3-формилфенокси)-2-хлорникотинонитрила (3) и 2-(4-бром-3-формилфенокси)-6-хлорникотинонитрила (4) в соотношении 2,0:1 (1,14 г, 3,39 ммоль) и пирролидина (72 3 мг, 0,8 5 мл, 10,2 ммоль) в 1,2-дихлорэтане (30 мл) нагревали до 80°С в течение 90 мин в герметично закрытом реакционном сосуде. Реакционную смесь охлаждали до комнатной температуры и концентрировали с получением смеси 6-(4-бром-3-формилфенокси)-2-пирролидин-1-ил-никотинонитрила (5) и 2-(4-бром-3-формилфенокси)-6-пирролидин-1-ил-никотинонитрила (6) в соотношении 2:1 (2,10 г). ТСХ-анализ 6-(4-бром-3-формилфенокси)-2-пирролидин-1-ил-никотинонитрила (5) показал Rf=0,6 и для 2-(4-бром-3-формилфенокси)-6-пирролидин-1-ил-никотинонитрила (6) показал Rf=0,4 (элюирование: 25% EtOAc/гексаны; проявление УФ-лампой или раствором фосфорномолибденовой кислоты в этаноле). Смесь соединений фракционировали путем хроматографии на "сухой" колонке следующим образом. Масло разбавляли 10% МеОН/СН2Сl2 (100 мл), затем добавляли силикагель (10 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (30 г, 230-400 меш), и элюировали смесью 10% EtOAc/гексаны. После разделения смеси соединений получали соединение 5 в виде белого твердого вещества (550 м, выход 43%) и соединение 6 в виде белого твердого вещества (120 мг, выход 10%).
[0882] Соединение 5: 1Н ЯМР (400 МГц, CDCl3) δ 10,34 (s, 1Н), 7,79 (d, J=3,1 Гц, 1H), 7,69 (d, J=8,2 Гц, 1H), 7,65 (d, J=8,6 Гц, 1H), 7,28 (dd, J=9,0, 3,1 Гц, 1H), 6,18 (d, J=8,2 Гц, 1H), 3,60-3,52 (4H), 1,93-1,87 (4H).
[0883] Соединение 6: 1Н ЯМР (400 МГц, CDCl3) δ 10,35 (s, 1H), 7,88 (d, J=2,7 Гц, 1H), 7,66 (d, J=8,6 Гц, 1H), 7,60 (d, J=8,6 Гц, 1H), 7,33 (dd, J=8,2, 2,7 Гц, 1H), 6,05 (d, J=8,6 Гц, 1H), 3,40-3,20 (4H), 2,13-1,81 (4H).
6-[3-Формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-пирролидин-1-ил-никотинонитрил (7)
[0884] 6-(4-Бром-3-формилфенокси)-2-пирролидин-1-ил-никотинонитрил (5) (505 мг, 1,36 ммоль), биспинаколатодибор (689 мг, 2,71 ммоль) и КОАс (33 3 мг, 3,3 9 ммоль) в смеси ДМФА (5 мл) и 1,2-диметоксиэтана (15 мл) нагревали до 90°С в течение 5 мин в герметично закрытом реакционном сосуде Затем добавляли PdCl2(dppf) (99 мг, 0,13 ммоль), и реакционную смесь интенсивно перемешивали в течение 3 ч при 90°С. Реакционную смесь охлаждали до комнатной температуры, разбавляли бензолом (300 мл) и концентрировали с получением черного твердого вещества, которое содержало соединение 7 (1,70 г) [Примечание: допускается добавление бензола с последующим выпариванием для азеотропного удаления ДМФА]. ТСХ-анализ соединения 7 показал Rf=0,4 (элюирование: 25% EtOAc/гексаны; проявление УФ-лампой или раствором фосфорномолибденовой кислоты в этаноле). Неочищенное черное твердое вещество фракционировали путем хроматографии на "сухой" колонке следующим образом. Твердое вещество растворяли в 10% МеОН/СН2Сl2 (200 мл), затем добавляли силикагель (10 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (30 г, 230-400 меш), и элюировали смесью 10% EtOAc/гексан. Соединение 7 выделяли в виде белого твердого вещества (308 мг, 54%). 1H ЯМР (400 МГц, CDCl3) δ 10,62 (s, 1Н), 7,93 (d, J-8,2 Гц, 1H), 7,82 (d, J=2,3 Гц, 1H), 7,68 (d, J=8,6 Гц, 1H), 7,38 (dd, J=8,2, 2,3 Гц, 1H), 6,17 (d, J=8,2 Гц, 1H), 3,60-3,51 (4H), 1,93-1, 83 (4H), 1,41 (s, 12H).
6-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-2-пирролидин-1-ил-никотинонитрил (D97)
[0885] Раствор NaBH4 (35 мг, 0,93 ммоль) в МеОН (5 мл) добавляли к раствору 6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-пирролидин-1-ил-никотинонитрила (7) (250 мг, 0,60 ммоль) в CH2Cl2 (2,5 мл) при комнатной температуре, и данную реакционную смесь перемешивали в течение 5 минут. Дополнительное количество твердого NaBH4 (100 мг, 2,64 ммоль) добавляли порциями в течение 25 минут, и реакционную смесь перемешивали еще в течение 60 минут при комнатной температуре. Добавляли раствор ледяной уксусной кислоты (0,2 мл) в дистиллированной воде (0,2 мл), и реакционную смесь перемешивали в течение 15 минут при комнатной температуре. Реакционную смесь концентрировали досуха и сушили в условиях глубокого вакуума с получением 450 мг белого твердого вещества. Полученное белое твердое вещество фракционировали путем хроматографии на "сухой" колонке следующим образом. Твердое вещество растворяли в смеси АсОН/МеОН/СН2Сl2 (1:1:100, 200 мл), затем добавляли силикагель (10 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (20 г, 230-400 меш), и элюировали смесью АсОН/МеОН/СН2Сl2 (1:1:100). Соединение D97 выделяли в виде белого липкого твердого вещества (110 мг). Полученное липкое твердое вещества растворяли в смеси 30% МеОН/СН2Сl2 (30 мл), затем добавляли дистиллированную воду (300 мл), и лиофилизировали с получением соединения D97 в виде белого сыпучего твердого вещества (90 мг, выход 47%). 1Н ЯМР (400 МГц, CDCl3) δ 9,19 (s, 1Н), 7,89 (d, J=8,6 Гц, 1H), 7,73 (d, J=8,2 Гц, 1H), 7,20 (br s, 1H), 7,13 (br d, J=7,8 Гц, 1H), 6,22 (d, J=8,6 Гц, 1H), 4,96 (s, 2H), 3, 48-3, 40 (4H), 1, 86-1, 77 (4H); Масс-спектр: (M+H)+=322; чистота согласно ВЭЖХ: 96, 73% (Maxplot), 97, 50% (220 нм), 97, 63% (254 нм).
19da 2-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-6-[(2-гидроксиэтил)-метиламино]-никотинонитрил (D98)
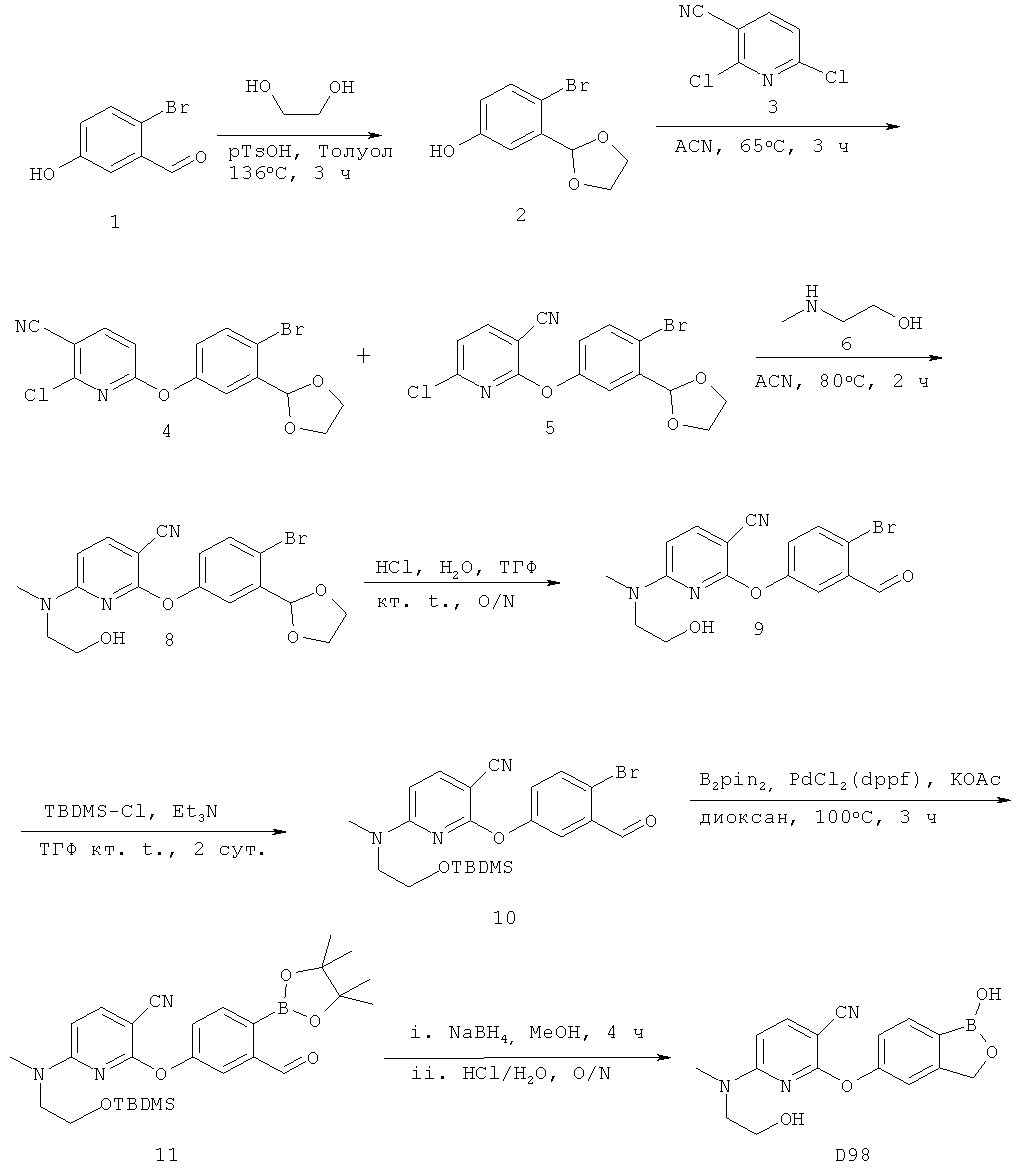
4-Бром-3-[1,3]диоксолан-2-ил-фенол (2)
[0886] К раствору 2-бром-5-гидроксибензальдегида (1) (10 г, 49,8 ммоль) в толуоле (200 мл) добавляли этиленгликоль (9,25 г, 149,3 ммоль) и каталитическое количество napa-TsQH (200 мг). Устанавливали насадку Дина-Старка, и реакционную смесь нагревали в течение 3 часов при 136°С. Затем раствор охлаждали до комнатной температуры и промывали насыщенным NaHCO3 (200 мл). Органический слой сушили над Na2SO4, фильтровали и упаривали под вакуумом с получением указанного в заголовке соединения (11,6 г, выход 95%). 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,40 (d, J=8,6 Гц, 1Н), 7,09 (d, J=3,1 Гц, 1Н), 6,72 (dd, J=8,6, 3,1 Гц, 1Н), 6,04 (s, 1Н), 4,18-4,04 (m, 4Н).
6-(4-Бром-3-[1,3]диоксолан-2-ил-фенокси)-2-хлорникотинонитрил+2-(4-бром-3-[1,3]диоксолан-2-ил-фенокси)-6-хлорнихотинонитрил (4+5) [0887] К раствору 2,6-дихлорникотинонитрила (3) (7,06 г, 40,8 ммоль) в безводномом ацетонитриле (300 мл) добавляли 4-бром-3-[1,3] диоксолан-2-ил-фенол (2) (10 г, 40,8 ммоль) и К2СО3 (5,63 г, 4 0,8 ммоль). Данную реакционную смесь нагревали в течение 3 часов при 65°С. Затем раствор фильтровали и упаривали под вакуумом с получением 15,6 г целевой смеси. 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,94 (d, J=9,0 Гц, 2Н), 7,62 (d, J=8,6 Гц, 2Н), 7,46 (d, J=3,1 Гц, 1Н), 7,41 (d, J=3,1 Гц, 1Н), 7,18-7,08 (m, 2Н), 7,05 (dd, J=8,8, 2,93 Гц, 1Н), 6,93 (d, J=8,2 Гц, 1Н), 6,11 (s, 1Н), 6,09 (s, 1Н), 4,19-3,99 (m, 8Н).
2-(4-Бром-3-[1,3]диоксолан-2-ил-фенокси)-6-[(2-гидрокси-этил)-метиламино]-никотинониотрил (8)
[0888] К раствору смеси 6-(4-бром-3-[1,3]диоксолан-2-ил-фенокси)-2-хлорникотинонитрила и 2-(4-бром-3-[1,3]диоксолан-2-ил-фенокси)-6-хлорникотинонитрила (4+5) (1 г, 2,6 ммоль) в ацетонитриле (безводном, 30 мл) добавляли 2-метиламиноэтанол (6) (2,1 мл, 26 ммоль). Данную реакционную смесь нагревали в течение 2 часов при 80°С. После завершения реакции все летучие компоненты выпаривали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 10-80% EtOAc/гексан, с получением указанного в заголовке соединения (400 мг, выход 36%). 1H ЯМР (400 МГц, CDCl3) δ 7, 62 (d, J=8,6 Гц, 1Н), 7,59 (d, J=8,6 Гц, 1Н), 7,47 (d, J=3,1 Гц, 1Н), 7,06 (dd, J=8,6 Гц, 3,1 Гц, 1Н), 6,18 (d, J=8,6 Гц, 1Н), 6,08 (s, 1Н), 4, 20-4, 02 (m, 4Н), 3,55 (t, J=3,2 Гц, 2Н), 3,42 (t, J=3,2 Гц, 2Н), 3,02 (s, 3Н).
2-(4-Бром-3-формилфенокси)-6-[(2-гидроксиэтил)-метиламино]-никотинонитрил (9)
[0889] К раствору 2-(4-бром-3-[1,3]диоксолан-2-ил-фенокси)-6-[(2-гидрокси-этил)-метил-амино]-никотинонитрила (8) (400 мг, 0,95 ммоль) в ТГФ (30 мл) добавляли 1 М раствор НСl (10 мл). Данную реакционную смесь перемешивали в течение ночи при комнатной температуре. После завершения реакции весь ТГФ выпаривали под вакуумом. Водный раствор экстрагировали EtOAc (2×50 мл). Органический слой промывали водой (3×50 мл). Органический слой сушили над MgSO4, фильтровали и упаривали под вакуумом с получением желаемого продукта (320 мг, выход 89%), который использовали без дополнительной очистки. 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 10,35 (s, 1Н), 7,91 (d, J=2,7 Гц, 1Н), 7,67 (t, J=9,2 Гц, 2Н), 7,32 (dd, J=8,6, 2,7 Гц, 1Н), 6,24 (d, J=8,6 Гц, 1Н), 3, 70-3, 62 (m, 2Н), 3, 56-3,49 (m, 2Н), 3,04 (s, 3Н).
2-(4-Бром-3-формилфенокси)-6-{[2-(трет-бутилдиметилсиланилокси)-этил]-метиламино}-никотинонитрил (10)
[0890] К раствору 2-(4-бром-3-формилфенокси)-6-[(2-гидроксиэтил)-метиламино]-никотинонитрила (9) (400 мг, 1,06 ммоль) в ТГФ (безводном, 30 мл) добавляли TBDMS-C1 (трет-бутилхлордиметилсилан) (193 мг, 1,28 ммоль) и Et3N (0,178 мл, 1,28 ммоль). Раствор перемешивали при комнатной температуре в течение 2 суток. Затем раствор фильтровали и концентрировали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 2,5-20% EtOAc/гексаны, с получением 420 мг (выход 81%) указанного в заголовке соединения. 1Н ЯМР (400 МГц, CDCl3) δ 10,4 (s, 1Н), 7,83 (s, 1Н), 7, 76-7, 68 (m, 2Н), 7,40-7,33 (m, 1Н), 6,30 (br s, 1Н), 3,62 (br s, 2Н), 3,48 (s, 2Н), 3,02 (s, 3Н), 0,89 (s, 9Н), 0,02 (s, 6Н).
6-{[2-(трет-Бутилдиметилсиланилокси)-этил]-метиламино}-2-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрил (11)
[0891] К раствору 2-(4-бром-3-формилфенокси)-6-{[2-(трет-бутилдиметил-силанилокси)-этил]-метиламино}-никотинонитрила (10) (520 мг, 1,06 ммоль) в безводном 1,4-диоксане (60 мл) добавляли биспинаколатодибор (323 мг, 1,27 ммоль), PdCl2 (dppf) (78 мг, 0,106 ммоль) и КОАс (312 мг, 3,18 ммоль). Раствор перемешивали в течение 30 минут при комнатной температуре, используя барботирование азотом (N2). Затем реакционную смесь нагревали в течение 3 часов при 100°С. Раствор фильтровали и концентрировали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 2,5-20% EtOAc/гексаны, с получением 485 мг (выход 85%) указанного в заголовке соединения. 1Н ЯМР (400 МГц, CDCl3) δ 10,6 (s, 1Н), 7,93 (d, J=8,6 Гц, 1Н), 7,82 (s, 1Н), 7,60 (d, J=8,6 Гц, 1Н), 7,39 (d, J=8,6 Гц, 1Н), 6,20 (br s, 1Н), 3,52 (br s, 2H), 3,39 (s, 2H), 2,98 (s, 3H), 1,37 (s, 12H), 0,79 (s, 9H),-0,09 (s, 6H). 2-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-6-[(2-гидрокси-этил)-метиламино]-никотинонитрил: (D98)
[0892] К прозрачному раствору 6-{[2-{трет-бутилдиметилсиланилокси)-этил]-метиламино}-2-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрила (11) (485 мг, 0,903 ммоль) в безводном МеОН (100 мл) медленно добавляли NaBH4 (101 мг, 2,65 ммоль). Данную реакционную смесь перемешивали в течение 4 часов при комнатной температуре, затем добавляли 1 М раствор НСl (60 мл). Перемешивание продолжали в течение ночи при комнатной температуре. Затем раствор медленно упаривали под вакуумом. Очистку выполняли путем обращенно-фазовой хроматографии (Biotage), используя для элюирования градиент 10-100% МеОН/H2O, с получением желаемого продукта (51 мг, выход 13,8%). 1Н ЯМР (400 МГц, ДMCO-d6) δ м.д. 9,22 (s, 1Н), 7,92 (d, J=8,6 Гц, 1Н), 7,75 (d, J=8,2 Гц, 1Н), 7,24 (s, 1Н), 7,16 (dd, J=7,8, 2,0 Гц, 1H), 6,43 (br. s., 1H), 4,98 (s, 2H), 3,90 (br. s., 1H), 3,47 (br. s., 2H), 3,39 (s, 2H, masked), 2,95 (br. s., 3 H); ВЭЖХ: 98,18% (220 нм), 99,15% (254 нм), 99,16 (MaxPlot).
19db 6-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-2-(2-гидрокси-этокси)-никотинонитрил (D99)
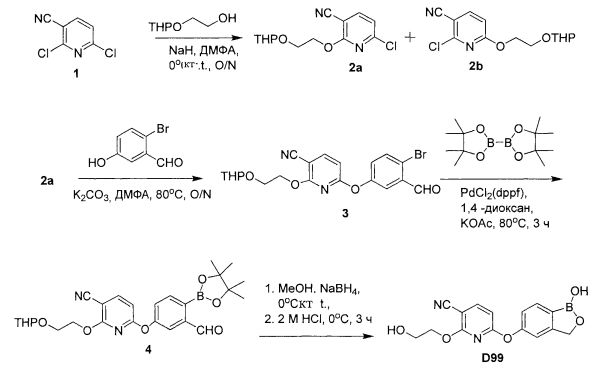

6-Хлор-2-[2-(тетрагидропиран-2-илокси)-этокси]-никотинонитрил (2а)
[0893] К раствору 2-(тетрагидропиран-2-илокси)-этанола (12,65 мл, 8 6, 70 ммоль) в ДМФА (50 мл) при 0°С добавляли порциями 95% гидрид натрия в минеральном масле (2,19 г, 86,70 ммоль). После выдерживания в течение 1 ч при комнатной температуре данную смесь медленно добавляли к раствору 2,6-дихлор-никотинонитрила (10,0 г, 57, 80 ммоль) в ДМФА (30 мл) при 0°С. Оставляли на ночь, ДМФА удаляли при пониженном давлении, полученную смесь разбавляли EtOAc (200 мл), промывали водой (2×25 мл) и солевым раствором (2×25 мл), сушили над безводным Na2SO4, фильтровали и концентрировали с получением смеси региоизомеров 2а и 2b в виде масла. Очистку выполняли путем флэш-хроматографии на силикагеле, используя градиент 2-25% EtOAc/гексаны, с получением указанного в заголовке соединения (4,0 г, 26%) в виде прозрачного масла. 1Н ЯМР (400 МГц, CDCl3) δ м.д. 7, 89-7, 75 (m, 1Н), 7,08-6, 96 (m, 1Н), 4,74 (br. s., 1Н), 4,63 (t, J=4,9 Гц, 2Н), 4,19-4,00 (m, 1Н), 3,98-3,74 (m, 2Н), 3, 62-3, 43 (m, 1Н), 1,63-1,91 (m, 2Н), 1, 68-1, 47 (m, 4Н).
6-(4-Бром-3-формилфенокси)-2-[2-(тетрагидропиран-2-илокси)-этокси]-никотинонитрил (3)
[0894] К смеси 6-хлор-2-[2-(тетрагидропиран-2-илокси)-этокси]-никотинонитрила (2,4 г, 8,48 ммоль) и 2-бром-5-гидроксибензальдегида (1,87 г, 9,33 ммоль) в ДМФА (25 мл) добавляли карбонат калия (1,75 г, 12,69 ммоль). Полученную смесь нагревали в течение ночи при 80°С. ДМФА удаляли при пониженном давлении, остаток разбавляли EtOAc (200 мл), промывали водой (20 мл) и солевым раствором (3×20 мл), сушили над Na2SO4, фильтровали и концентрировали с получением белого твердого вещества. Очистку выполняли путем флэш-хроматографии на силикагеле, используя градиентное элюирование (5-25% EtOAc/гексаны), с получением указанного в заголовке соединения (2,7 г, 71%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ м.д. 10,35 (s, 1Н), 7,88 (d, J=8,2 Гц, 1Н), 7,75 (d, J=2,7 Гц, 1Н), 7,70 (d, J=8,2 Гц, 1Н), 7,28 (dd, J=8,6, 3,5 Гц, 1Н), 6,60 (d, J=8,2 Гц, 1Н), 4,64 (s, 1Н), 4,28 (t, J=4,9 Гц, 2Н), 3, 97-3, 80 (m, 2Н), 3,72-3,60 (m, 1Н), 3,55-3,42 (m, 1Н), 1, 84-1, 64 (m, 2Н), 1,61-1,49 (m, 4Н).
6-[3-Формил-4-(4,4,5,5-теграметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-[2-(тетрагидропиран-2-илокси)-этокси]-никотинонитрил (4)
[0895] К дегазированному раствору 6-(4-бром-3-формил-фенокси)-2-[2-(тетрагидропиран-2-илокси)-этокси]-никотинонитрила (2,7 г, 6,03 ммоль) в 1,4-диоксане (25 мл) добавляли бис(пинаколато)дибор (1,76 г, 6,94 ммоль), ацетат калия (1,77 г, 18,0 ммоль) и хлорид [1,1'-бис(дифенилфосфино)ферроцен]палладия (II) (0,22 г, 0,30 ммоль). Полученную суспензию дегазировали, используя продувание N2, и нагревали в течение 3 ч при 80°С. Затем смесь охлаждали до комнатной температуры, пропускали через Celite® и разбавляли EtOAc (150 мл), органический слой промывали водой (20 мл) и солевым раствором (20 мл), сушили над Na2SO4, фильтровали и концентрировали. Очистку выполняли путем флэш-хроматографии на силикагеле, применяя градиентное элюирование (5-25% EtOAc/гексаны), с получением указанного в заголовке соединения (2,10 г, 72%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ДMCО-d6) δ м.д. 10,37 (s, 1Н), 8,28 (d, J=8,6 Гц, 1Н), 7,82 (d, J=8,2 Гц, 1Н), 7,71 (s, 1Н), 7,57 (d, J=8,2 Гц, 1Н), 6,81 (d, J=8,2 Гц, 1Н), 4,51 (s, 1Н), 4,29-4,10 (m, 2Н), 3, 85-3, 60 (m, 2Н), 3, 60-3, 50 (m, 1Н), 3, 46-3, 36 (m, 1Н), 1, 75-1, 48 (m, 2Н), 1,50-1,33 (m, 4Н), 1,33 (s, 12Н).
6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-(2-гидроксиэтокси)-никотинониотрил (D99)
[0896] К раствору 6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-[2-(тетрагидропиран-2-илокси)-этокси]-никотинонитрила (2,5 г, 5,15 ммоль) в метаноле (15 мл) при 0°С добавляли боргидрид натрия (0,38 г, 10,32 ммоль). После выдерживания в течение 1 ч при комнатной температуре раствор охлаждали в ледяной бане, и pH доводили до 3-4 путем добавления 2 М НСl. Полученную смесь перемешивали в течение 2 ч при 0°С и затем в течение 30 мин при комнатной температуре. Растворитель удаляли при пониженном давлении, очистку выполняли путем обращенно-фазовой препаративной ВЭЖХ, используя в качестве элюента смесь CH3CN/H2O (0,1.% АсОН), с получением указанного в заголовке соединения D99 (1,0 г, 40%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,23 (s, 1Н), 8,22 (d, J=8,2 Гц, 1Н), 7,77 (d, J=8,2 Гц, 1Н), 7,27 (s, 1Н), 7,18 (d, J=8,2 Гц, 1Н), 6,66 (d, J=8,6 Гц, 1Н), 4,97 (s, 2Н), 4,82 (t, 1Н), 4,12 (t, J=4,9 Гц, 2Н), 3,73-3,50 (m, 2Н). Масс-спектр (ИЭР) m/z: 313 (М+1)+; чистота согласно ВЭЖХ: 98,78% (Maxplot), 98,58% (220 нм).
19dc 2-Циклопентилокси-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D100)
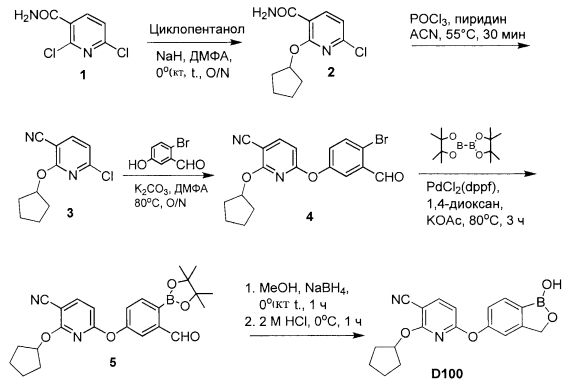

6-Хлор-2-циклопентилокси-никотинамид (2)
[0897] К раствору циклопентанола (1,42 мл, 15,70 ммоль) в ДМФА (5 мл) при 0°С добавляли порциями гидрид натрия (95% в минеральном масле, 0,39 г, 15,70 ммоль), и перемешивали в течение 1 ч при комнатной температуре. Данную смесь медленно добавляли к раствору 2, 6-дихлорникотинамида (2,0 г, 10,47 ммоль) в ДМФА (10 мл) при 0°С. Реакционную смесь перемешивали в течение ночи при комнатной температуре. ДМФА удаляли при пониженном давлении, и полученную смесь разбавляли EtOAc (100 мл), промывали водой (2×25 мл) и солевым раствором (2×25 мл), сушили над безводным Na2SO4, Н), 7,03 (d, J=8,2 Гц, 1H), 5,74 (br. s., 1H), 5, 70-5, 57 (m, 1H), 2, 25-1, 95 (m, 2H), 1,90-1, 66 (m, 6 H).
6-Хлор-2-циклопентилоксиникотинонитрил (3)
[0898] К раствору 6-хлор-2-циклопентилоксиникотинамида (1,56 г, 6,48 ммоль) и пиридина (3,14 мл, 38,88 ммоль) в ацетонитриле (30 мл) в течение 5 мин добавляли оксихлорид фосфора (1,77 мл, 19,44 ммоль). Данную реакционную смесь перемешивали в течение 1 ч при 55°С. Ацетонитрил выпаривали под вакуумом, и полученный остаток нейтрализовали путем добавления 1 н. NaOH при 0°С, пока pH смеси не достигал ~7. Реакционную смесь, экстрагировали EtOAc (100 мл). Органический слой отделяли, и водный слой дополнительно экстрагировали EtOAc (3×50 мл). Все органические экстракты объединяли, промывали солевым раствором (2×25 мл), сушили над безводном Na2SO4, фильтровали и концентрировали с получением указанного в заголовке соединения (1,63 г, 94%) в виде желтого масла, которое использовали на следующей стадии без дополнительной очистки. 1Н ЯМР (400 МГц, ДМСО-d6) δ 8,26 (d, J=7,8 Гц, 1Н), 7,26 (d, J=7,8 Гц, 1Н), 5,49-5,42 (m, 1Н), 2,25-1,78 (m, 2Н), 1, 80-1, 64 (m, 4Н), 1,60 (t, J=6,8 Гц, 2Н).
6-(4-Бром-3-формилфенокси)-2-циклопентилоксиникотинонитрил (4)
[0899] К смеси 6-хлор-2-циклопентилоксиникотинонитрила (1,32 г, 5,92 ммоль) и 2-бром-5-гидроксибензальдегида (1,43 г, 7,10 ммоль) в ДМФА (10 мл) добавляли карбонат калия (1,22 г, 8,88 ммоль). Полученную смесь нагревали в течение ночи при 69°С. ДМФА удаляли при пониженном давлении, остаток разбавляли EtOAc (100 мл), промывали водой (30 мл) и солевым раствором (30 мл), сушили над Na2SO4, фильтровали и концентрировали с получением белого твердого вещества, которое очищали путем флэш-хроматографии на силикагеле, используя в качестве элюентат 10-25% EtOAc/гексаны, с выходом указанного в заголовке соединения (2,30 г, количественный выход) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ДМСО-d6) δ 10,19 (s, 1Н), 8,24 (d, J=8,2 Гц, 1Н), 7,88 (d, J=8,6 Гц, 1Н), 7,70 (s, 1H), 7, 60-7, 46 (m, 1H), 6,79 (d, J=8,2 Гц, 1H), 4,95 (br. s., 1H), 1,87-1, 50 (m, 6 H), 1, 52-1,30 (m, 2H).
2-Циклопентилокси-6-[3-формил-4-(4,4,5, 5-тегграметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрил (5)
[0900] К дегазированному раствору 6-(4-бром-3-формил-фенокси)-2-циклопентилоксиникотинонитрила (2,20 г, 5,68 ммоль) в 1,4-диоксане (25 мл) добавляли бис(пинаколато)дибор (1,73 г, 6,81 ммоль), ацетат калия (1,67 г, 17,04 ммоль), и хлорид [1,1'-бис(дифенилфосфино)ферроцен]палладия (II) (0,20 г, 0,28 ммоль). Полученную суспензию дегазировали, используя продувание N2, и нагревали в течение ночи при 80°С. Затем смесь пропускали через Celite®, промывали EtOAc (100 мл), органический слой промывали водой (30 мл) и солевым раствором (30 мл), сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта, который очищали путем флэш-хроматографии на силикагеле, используя в качестве элюента 10-25% EtOAc/гексаны, с выходом указанного в заголовке соединения (2,0 г, 83%) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-dg) δ 10,38 (s, 1Н), 8,24 (d, J=8,2 Гц, 1Н), 7,82 (d, J=8,2 Гц, 1Н), 7,74 (s, 1Н), 7,56 (d, J=8,2 Гц, 1Н), 6,78 (d, J=8,2 Гц, 1Н), 4,96 (br. s., 1Н), 1, 80-1, 54 (m, 6Н), 1, 50-1, 40 (m, 2Н), 1,34 (s, 12Н).
2-Циклопентилокси-6-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D100)
[0901] К раствору 2-циклопентилокси-6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрила (2,0 г, 4,60 ммоль) в метаноле (15 мл) при 0°С добавляли боргидрид натрия (0,26 г, 6,90 ммоль). После выдерживания в течение 1 ч при комнатной температуре pH смеси доводили до 3~4 путем добавления 2 М НСl при 0°С. Полученную смесь перемешивали при 0°С в течение 30 мин и затем обрабатывали ультразвуком с получением белого твердого вещества, которое отфильтровывали и лиофилизировали с получением соединения D100 (0,85 г, 56%) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 9, 24 (s, 1Н), 8,20 (d, J=8,2 Гц, 1Н), 7,77 (d, J=7,8 Гц, 1Н), 7,27 (d, J=1,2 Гц, 1Н), 7,18 (dd, J=8,2, 1,9 Гц, 1Н), 6,69 (d, J=8,2 Гц, 1Н), 4,97 (br. s., 3Н), 1, 75-1, 54 (m, 6Н), 1,52-1,33 (m, 2Н). Масс-спектр (ИЭР) m/z: 337 (М+1)+; чистота согласно ВЭЖХ: 99,36% (Maxplot), 99, 35% (220 нм); Элементный анализ C18H17BN2CM-0,25 H2O. Рассчитано: С, 63, 46%; Н, 5,18%; N, 8,22%. Найдено: С, 63,34%; Н, 5,17%; N, 8,34%.
19dd 2-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-6-(2-метоксиэтиламино)-никотинонитрил (D101)
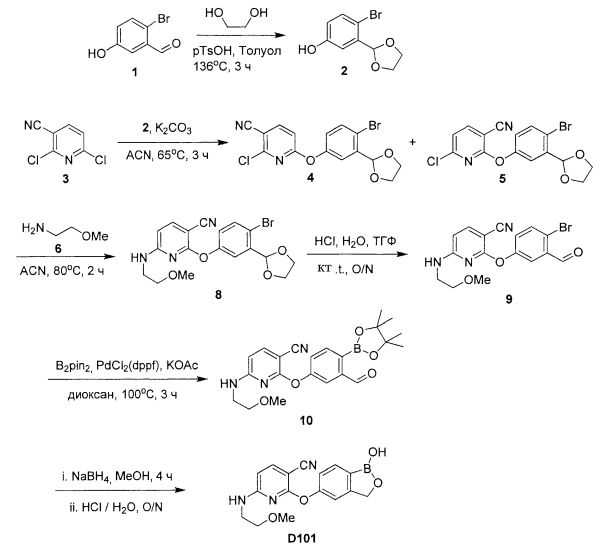

4-Бром-3-[1,3]диоксолан-2-ил-фенол (2)
[0902] К раствору 2-бром-5-гидрокси-бензальдегида (1) (10 г, 49,8 ммоль) в толуоле (200 мл) добавляли этиленгликоль (9,25 г, 14 9,3 ммоль) и каталитическое количество пара-TsOH (200 мг). Устанавливали насадку Дина-Старка, и реакционную смесь нагревали в течение 3 часов при 136°С. Звтем раствор охлаждали до комнатной температуры и промывали насыщеннымым NaHCO3 (200 мл). Органический слой сушили над Na2SO4, фильтровали и упаривали под вакуумом с получением указанного в заголовке соединения (11,6 г, выход 95%). 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,40 (d, J=8,6 Гц, 1Н), 7,09 (d, J=3,1 Гц, 1Н), 6,72 (dd, J=8,6, 3,1 Гц, 1Н), 6,04 (s, 1Н), 4,18-4,04 (m, 4Н).
6-(4-Бром-3-[1,3]диоксолан-2-ил-фенокси)-2-хлорникотинонитрил+2-(4-бром-3-[1,3]диоксолан-2-ил-фенокси)-6-хлорникотинонитрил (4+5)
[0903] К раствору 2,6-дихлорникотинонитрила (3) (7,06 г, 40,8 ммоль) в безводном ацетонитриле (300 мл) добавляли 4-бром-3-[1,3] диоксолан-2-ил-фенол (2) (10 г, 40,8 ммоль) и К2СO3 (5, 63 г, 40,8 ммоль). Данную реакционную смесь нагревали при 65°С в течение 3 часов. Затем раствор фильтровали и упаривали под вакуумом с получением смеси указанных в заголовке соединений (15,6 г). 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,94 (d, J=9,0 Гц, 2Н), 7,62 (d, J=8,6 Гц, 2Н), 7,46 (d, J=3,1 Гц, 1Н), 7,41 (d, J=3,1 Гц, 1Н), 7,18-7,08 (m, 2Н), 7,05 (dd, J=8,8, 2,93 Гц, 1Н), 6,93 (d, J=8,2 Гц, 1Н), 6,11 (s, 1Н), 6,09 (s, 1Н), 4,19-3,99 (m, 8Н).
2-(4-Бром-3-[1,3]диоксолан-2-ил-фенокси)-6-(2-метоксиэтиламино)-никотинонитрил (8)
[0904] К раствору смеси 6-(4-бром-3-[1,3]диоксолан-2-ил-фенокси)-2-хлор-никотинонитрила и 2-(4-бром-3-[1,3]диоксолан-2-ил-фенокси)-6-хлор-никотинонитрила (4+5) (2,5 г, 6,6 ммоль) в безводном ацетонитриле (50 мл) добавляли 2-метоксиэтиламин (5,7 мл, 66 ммоль). Данную реакционную смесь нагревали в течение 2 часов при 80°С. После завершения реакции все летучие компоненты выпаривали под вакуумом. Остаток очищали путем хроматографии на силикагеле, используя для элюирования градиент 10-80% EtOAc/гексаны, с получением указанного в заголовке соединения (1,0 г, выход 36%). 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,58-7,47 (ш, 2Н), 7,41 (d, J=3,1 Гц, 1Н), 7,04 (dd, J=8,6, 2,7 Гц, 1Н), 6, 09-6,03 (m, 2Н), 5,37 (t, J=5,1 Гц, 1Н), 4,14-3,99 (m, 4Н), 3,37 (t, J=5,1 Гц, 2Н), 3,31-3,23 (m, 5 Н).
2-(4-Бром-3-формил-фенокси)-6-(2-метокси-эшиламино)-никотинонитрил (9)
[0905] К раствору 2-(4-бром-3-[1,3]диоксолан-2-ил-фенокси)-6-(2-метокси-этиламино)-никотинонитрила (8) (1,0 г, 2,38 ммоль) в ТГФ (50 мл) добавляли 1 М раствор НСl в H2O (20 мл). Оставляли на ночь, ТГФ выпаривали под вакуумом. Водный раствор экстрагировали EtOAc (2×50 мл). Органический слой промывали водой (3×50 мл), сушили над MgSO4, фильтровали и упаривали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 25-100% EtOAc/гексаны, с получением желаемого продукта (780 мг, выход 87%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 10,34 (s, 1Н), 7,80 (d, J=2,7 Гц, 1Н), 7,67 (d, J=8,6 Гц, 1Н), 7,60 (d, J=8,2 Гц, 1Н), 7,30 (dd, J=8,8, 2,9 Гц, 1Н), 6,13 (d, J=8,2 Гц, 1Н), 5,24 (br. s., 1Н), 3,42 (t, J=4,9 Гц, 2Н), 3,35-3,27 (m, 5 Н).
2-[3-Формил-4-(4,4,5,5-тетрамети.л-[1,3, 2] дхокса.боролан-2-лл)-фенокси]-6-(2-метоксиэтиламино)-нхкотхнонлтрлл (10)
[0906] К раствору 2-(4-бром-3-формилфенокси)-6-(2-
метоксиэтиламино)-никотинонитрила (9) (780 мг, 2,0 ммоль) в безводном 1,4-диоксане (100 мл) добавляли биспинаколатодибор (630 мг, 2,5 ммоль), PdCl2(dppf) (150 мг, 0,2 ммоль) и КОАс (610 мг, 6,2 ммоль). Раствор перемешивали в течение 30 минут при комнатной температуре, используя барботирование азотом (N2). Затем реакционную смесь нагревали в течение 3 часов при 100°С. После охлаждения до комнатной температуры раствор фильтровали и концентрировали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 25-100% EtOAc/гексаны, с получением 440 мг указанного в заголовке соединения (выход 50%). 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d)) δ м.д. 10,62 (s, 1Н), 7,94 (d, J=7,8 Гц, 1Н), 7,82 (d, J=2,0 Гц, 1Н), 7,59 (d, J=8,6 Гц, 1Н), 7,40 (dd, J=8,2, 2,3 Гц, 1Н), 6,12 (d, J=8,6 Гц, 1Н), 5,37 (t, J=4,9 Гц, 1Н), 3,40 (t, J=4,9 Гц, 2Н), 3, 33-3, 25 (m, 5 Н), 1,40 (s, 12Н).
2-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-6-(2-метокси-этиламино)-никотинонитрил (D101)
[0907] К прозрачному раствору 2-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-6-(2-метоксиэтиламино)-никотинонитрила (10) (440 мг, 1,04 ммоль) в безводном МеОН (100 мл) медленно добавляли NaBH4 (120 мг, 3,12 ммоль). Данную реакционную смесь перемешивали в течение 4 часов при комнатной температуре, затем добавляли 1 М раствора НСl (50 мл). Перемешивание продолжали в течение ночи при комнатной температуре. Затем раствор медленно концентрировали под вакуумом. Очистку выполняли путем препаративной ВЭЖХ с получением указанного в заголовке соединения (108 мг, выход 32%) в виде белого лиофилизата. 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,23 (br, s,, 1Н), 7,86 (br. s., 1Н), 7, 79-7,68 (m, 2Н), 7,24 (s, 1Н), 7,18-7,13 (m, 1Н), 6,30 (d, J=8,6 Гц, 1H), 4,98 (s, 2Н), 3,20 (d, J=l,6 Гц, 2H), 3,17-3,06 (m, 5 Н). Масс-спектр (ИЭР) m/z: 326 (М+Н)+; ВЭЖХ: 99,39% (220 нм), 99,24% (MaxPlot).
19de 6-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-2-морфолин-4-ил-никотинонитрил (D102)
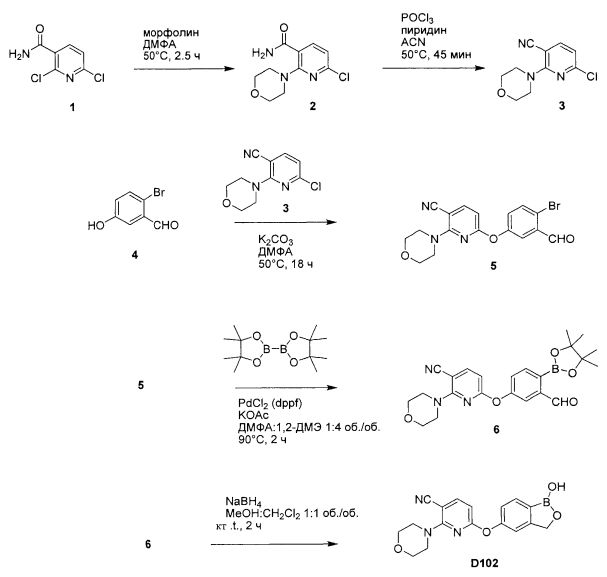

6-Хлор-2-морфолин-4-ил-никотинаиид (2)
[0908] Получение 2, 6-дихлор-никотинамида (1) описано в методике синтеза соединения D46. Герметично закрытый реакционный сосуд, содержащий 2,6-дихлор-никотинамид (1) (1,85 г, 9,70 ммоль) и морфолин (1,69 мл, 19,4 ммоль) в безводном диметилформамиде (20 мл) нагревали до 50°С в течение 2,5 ч. Затем реакционную смесь охлаждали до комнатной температуры и разбавляли 0,1 М NaOH (600 мл) и экстрагировали этилацетатом (3×500 мл). Все органические экстракты объединяли, сушили над Na2SO4, фильтровали и концентрировали с получением указанного в заголовке соединения (2,49 г) в виде оранжевого масла, которое со временем затвердевало. 6-Хлор-2-морфолин-4-ил-никотинамид (2) использовали в следующих реакциях без дополнительной очистки. 1Н ЯМР 400 МГц (ДМСО-d6) δ 7, 89 (br s, 1Н), 7,67 (d, J=7,8 Гц, 1H), 7,56 (br s, 1H), 6,88 (d, J=7,8 Гц, 1H), 3,67 (br t, J=4,7 Гц, 4H), 3,31 (br t, J=4,7 Гц, 4H).
6-Хлор-2-морфолин-4-ил-никотинонитрил (3)
[0909] Синтез 6-хлор-2-морфолин-4-ил-никотинонитрила (3) выполняли в соответствии с описанной выше экспериментальной методикой синтеза соединения D46. В результате взаимодействия 6-хлор-2-морфолин-4-ил-никотинамида (2) (2,49 г) с оксихлоридом фосфора (2,7 мл, 2 9 ммоль) и пиридином (4,7 мл, 58 ммоль) в ацетонитриле (60 мл) и последующего выделения продукта реакции получали неочищенное черное масло. Полученное черное масло фракционировали путем хроматографии на "сухой" колонке следующим образом: масло разбавляли CH2Cl2 (300 мл), затем добавляли силикагель (20 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (60 г, 230-400 меш), и элюировали смесью 10% EtOAc/гексаны. Фракции, содержащие чистый продукт, объединяли и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества (1,97 г; фактический выход за 2 стадии относительно 1,85 г соединения 1 составлял 91%). Согласно ТСХ-анализу (элюирование: 50% EtOAc/гексаны; проявление УФ-лампой) Rf=0,8; 1H ЯМР (400 МГц, CDCl3) δ 7,69 (d, J=8,2 Гц, 1Н), 6,75 (d, J=7,8 Гц, 1Н), 3,85-3,77 (8Н).
6-(4'-Бром-3'-формилфенокси)-2-морфолин-4-ил-никотинонитрил (5)
[0910] Синтез 6-(4'-бром-3'-формилфенокси)-2-морфолин-4-ил-никотинонитрила (5) выполняли в соответствии с описанной выше экспериментальной методикой синтеза соединения D46 за тем исключением, что реакционную смесь нагревали при 50°С в течение 18 ч. В результате взаимодействия 6-хлор-2-морфолин-4-ил-никотинонитрила (3) (1,58 г, 7,06 ммоль), 2-бром-5-гидрокси-бензальдегида (4) (2,13 г, 10,6 ммоль) и К2СO3 (1, 95 г, 14,1 ммоль) в ДМФА (30 мл) и последующего выделения продукта реакции получали неочищенное масло. Полученное масло фракционировали путем хроматографии на "сухой" колонке следующим образом: масло разбавляли СН2Сl2 (300 мл), затем добавляли силикагель (40 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (80 г, 230-400 меш), и элюировали градиентом 10-20% EtOAc/гексаны. Фракции, содержащие чистый продукт, объединяли и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества (1,69 г, фактический выход 61%).
[0911] Согласно ТСХ-анализу (элюирование: 25% EtOAc/гексаны; проявление УФ-лампой или раствором фосфорномолибденовой кислоты) Rf=0,4; 1Н ЯМР (400 МГц, CDCl3) δ 10,34 (s, 1Н), 7,77 (d, J=8,6 Гц, 1H), 7,76 (d, J=3,1, 1H), 7,68 (d, J=9,0 Гц, 1H), 7,25 (dd, J=8,6, 3,1 Гц, 1H), 6,38 (d, J=8,2 Гц, 1H), 3,71 (br t, J=4,3 Гц, 4H), 3,59 (br t, J=4,3 Гц, 4H).
6-[3-Формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-морфолин-4-ил-никотинонитрил (6)
[0912] Синтез 6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-морфолин-4-ил-никотинонитрила (6) выполняли в соответствии с описанной выше экспериментальной методикой синтеза соединения (D46). В результате взаимодействия соединения 5 (1,69 г, 4,37 ммоль), бис(пинаколато)дибора (3,32 г, 13,1 ммоль) и ацетата калия (1,28 г, 13,1 ммоль) в смеси растворителей диметилформамид (10 мл) и 1,2-диметоксиэтан (40 мл) получали коричневое масло. Полученное коричневое масло фракционировали путем хроматографии на "сухой" колонке следующим образом: масло разбавляли СН2Сl2 (400 мл), затем добавляли силикагель (40 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (80 г, 230-400 меш), и элюировали градиентом 10-20% EtOAc/гексаны. Фракции, содержащие чистый продукт, объединяли и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества (1,24 г, фактический выход 65%). Согласно ТСХ-анализу (двойное элюирование: 25% EtOAc/гексаны; проявление УФ-лампой) Rf=0,3; 1Н ЯМР (400 МГц, CDCl3) δ 10,64 (s, 1Н), 7,95 (d, J=8,2 Гц, 1H), 7,79 (d, J=2,3 Гц, 1H), 7,76 (d, J=8,6 Гц, 1H), 7,36 (dd, J=8,2, 2,3 Гц, 1H), 6,39 (d, J=8,2 Гц, 1H), 3,71 (br t, J=5,1 Гц, 4H), 3,59 (br t, J=5,1 Гц, 4H), 1,40 (s, 12H).
6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-морфолин-4-ил-никотинонитрил (D102)
[0913] Синтез 6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-морфолин-4-ил-никотинонитрила (D102) выполняли в соответствии с описанной выше экспериментальной методикой синтеза соединения D46. В результате взаимодействия 6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-морфолин-4-ил-никотинонитрила (6) (1,20 г, 2,76 ммоль) с ЫаВЩ (417 мг, 11,0 ммоль) и последующего выделения продукта реакции получали оранжевое масло, содержащее соединение D102. Полученное масло фракционировали путем хроматографии на "сухой" колонке следующим образом: масло разбавляли 30% МеОН/СН2Сl2 (400 мл), затем добавляли силикагель (40 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (120 г, 230-400 меш), и элюировали смесью уксусная кислота/МеОН/СН2Сl2 (1:1:100). Фракции, содержащие соединение D102, собирали и концентрировали с получением светло-желтого масла. Полученное масло лиофилизировали следующим образом: сначала масло разбавляли ацетонитрилом (40 мл), затем добавляли деионизованную воду (400 мл), полученную белую суспензию замораживали в бане со смесью сухого льда и ацетона и помещали на ночь в лиофилизатор. Соединение D102 получали в виде белого твердого вещества (740 мг, чистота согласно ВЭЖХ 94%). Соединение D102 дополнительно очищали путем колоночной хроматографии и лиофилизации, используя описанные выше условия, с получением соединения D102 в виде белого твердого вещества (405 мг, чистота согласно ВЭЖХ 98%, фактический выход 44%). Согласно ТСХ-анализу (элюирование: уксусная кислота/МеОН/СН2Сl2 (1:2:100); проявление УФ-лампой) Rf=0,5; 1Н ЯМР (400 МГц, ДМСО-d6) δ 9, 23 (s, 1Н), 8,06 (d, J=8,6 Гц, 1Н), 7,77 (d, J=8,2 Гц, 1Н), 7,25 (d, J=1,9 Гц, 1Н), 7,16 (dd, J=8,2, 1,9 Гц, 1Н), 6,46 (d, J=8,6 Гц, 1Н), 4,98 (s, 2Н), 3,61 (br t, J=4,5 Гц, 4Н), 3,49 (br t, J=4,5 Гц, 4H). Масс-спектр: [М+Н]+=338; чистота (ВЭЖХ): 96,50% (Maxplot), 98, 28% (220 нм), 97,23 (254 нм).
19df 5-(4-(Метилсульфонил)фенокси)бензо[с][1,2]оксаборол-1(3Н)-ол (D103)
Получение соединения В
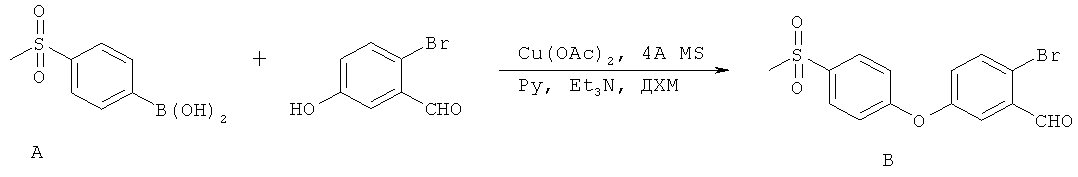
[0914] К раствору соединения А (15,4 г, 77 ммоль), 2-бром-5-гидроксибензальдегида (9,67 г, 48 ммоль), 4А MS (35 г) и Сu(ОАс)2 (11,32 г, 62,6 ммоль) в сухом СН2Сl2 (250 мл) добавляли в атмосфере Аr пиридин (6,84 г, 86,6 ммоль) и Et3N (12,2 мл, 86,6 ммоль). Данную реакционную смесь перемешивали в течение ночи при температуре окружающей среды и фильтровали, промывали 2 н. НСl, и экстрагировали СН2Сl2. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 10/1-4/1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения В (2,9 г, 7,8%). 1Н ЯМР (ДМСО, 500 МГц): δ 10,17 (1Н, S), 7,95 (2Н, d, J=8,5 Гц), 7,89 (1Н, d, J=8,5 Гц), 7,49 (1Н, d, J=2 Гц), 7,45 (1Н, dd, J=2,0, 8,5 Гц), 7,27 (2Н, d, J=8,5 Гц), 3,22 (3Н, s).
Получение соединения С
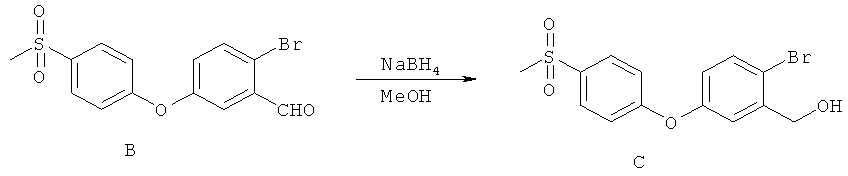
[0915] К раствору соединения В (4,0 г, 11,3 ммоль) в МеОН (250 мл) добавляли NaBH4 (214 мг, 5,65 ммоль). Данную реакционную смесь перемешивали в течение 0,5 ч при температуре окружающей среды Растворитель выпаривали. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 2/1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения С (3,25 г, 93%). 1Н ЯМР (ДМСО, 500 МГц): δ 3,20 (3Н, s), 4,50 (2Н, d, J=5,5 Гц), 5,55 (1Н, t, J=5,5 Гц), 7,02 (1Н, dd, J=3,0, 8,5 Гц), 7,20 (2Н, m), 7,24 (1Н, d, J=2,5 Гц), 7,65 (1Н, d, J=8,5 Гц), 7,93 (2Н, m).
Получение соединения D
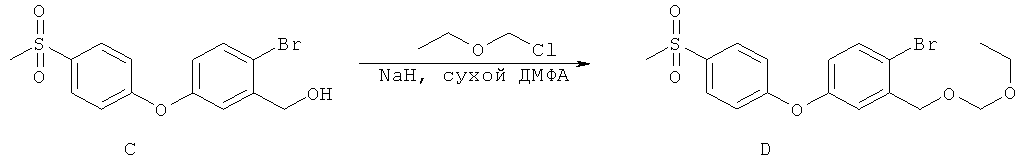
[0916] К раствору соединения С (400 мг, 1,12 ммоль) в сухом ДМФА (6 мл) добавляли NaH (49 мг, 1,12 ммоль, 55%) в атмосфере Аr. Данную реакционную смесь перемешивали при 0°С в течение 0,5 ч, затем добавляли (хлорметокси)этан (137 мг, 1,46 ммоль). Реакционную смесь перемешивали в течение 1 ч при температуре окружающей среды и реакцию гасили путем добавления i-PrOH. Растворитель выпаривали в условиях глубокого вакуума. Остаток растворяли в EtOAc, промывали водой. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 5/1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения D (350 мг, 75%). 1Н ЯМР (CDCl3, 400 МГц): δ 1,22 (3Н, m), 3,05 (3Н, s), 3,64 (2Н, m), 4,65 (2Н, s), 4,80 (2Н, s), 6,88 (1Н, dd, J=3,2, 8,8 Гц), 7,08 (2H, m), 7,25 (1H, d, J=3,2 Гц), 7,57 (1H, d, J=8,8 Гц), 7,89 (2H, m).
Получение соединения E
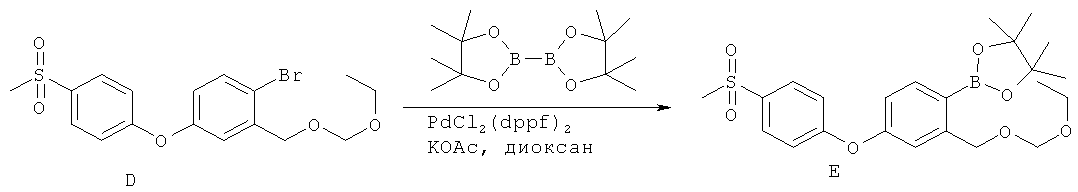
[0917] Смесь соединения D (340 мг, а 0,82 ммоль), бис (пинаколато) дибора (625 мг, 2,46 ммоль), PdCl2(dppf)2 (19,8 мг, 0,0246 ммоль) и КОАс (241 мг, 2,46 ммоль) в 1,4-диоксане (5 мл) перемешивали при 80°С в течение ночи в атмосфере Аr. Органический слой удаляли. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 5/1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения Е (360 мг, 95%). 1Н ЯМР (CDCl3, 500 МГц): δ 1,20 (3Н, t, J=4,5 Гц), 1,32 (12Н, s), 3,05 (3Н, s), 3,63 (2Н, m), 4,80 (2Н, s), 4,87 (2Н, s), 6,96 (1Н, dd, J=2,5, 10 Гц), 7,09 (2H, dd, J=2,5, 9,0 Гц), 7,20 (1H, d, J=3,0 Гц), 7,86 (3Н, m).
Получение соединения D103
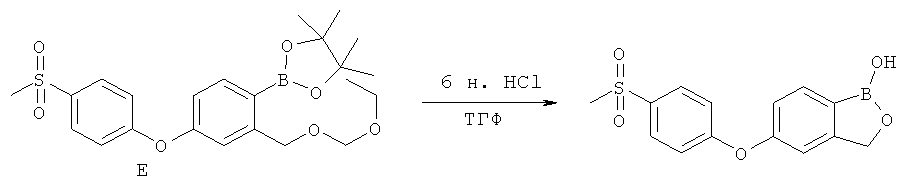
[0918] Смесь соединения Е (300 мг, 0,66 ммоль) в 6 н. НСl (6 мл) и ТГФ (9 мл) перемешивали в течение ночи при температуре окружающей среды. Растворители удаляли. Остаток очищали путем препаративной ВЭЖХ с получением необходимого соединения (100 мг, 50%). 1Н ЯМР (ДМСО-d6, 500 МГц): δ 3, 20 (3Н, s), 4,97 (2Н, s), 7,11 (1Н, dd, J=2,0, 8,0 Гц), 7,16 (1H, d, J=1,5 Гц), 7,21 (2H, m), 7,80 (1H, d, J=8,0 Гц), 7,93 (2H, m), 9,23 (1H, s).
19dg 5-(4-(Изопропилсульфонил) фенокси)бензо[с][1,2]оксаборол-1(3Н)-ол (D104)
Получение соединения В
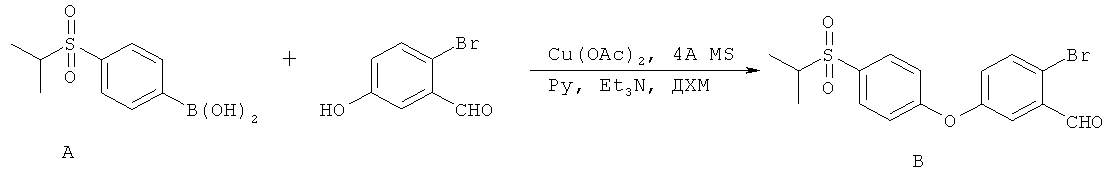
[0919] К раствору соединения А (15,0 г, 65,8 ммоль), 2-бром-5-гидроксибензальдегида (8,26 г, 41,1 ммоль), 4А MS (35 г) и Сu(ОАс)2 (9,68 г, 53,4 ммоль) в сухом СН2Сl2 (250 мл) добавляли в атмосфере Аr пиридин (5,85 г, 74 ммоль) и Et3N (10,4 мл, 74 ммоль). Данную реакционную смесь перемешивали в течение ночи при температуре окружающей среды и фильтровали, промывали 2 н. НСl, и экстрагировали СН2Сl2. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 10/1-5/1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения В (2,2 г, 14%). 1Н ЯМР (ДМСО, 500 МГц): 5 10,33 (1Н, S), 7,86 (1Н, m), 7,85 (1Н, га), 7,70 (1Н, d, J=8,5 Гц), 7,61 (1Н, d, J=3,0 Гц), 7,21 (1Н, dd, J=3,0 8,5 Гц), 7,11 (1Н, m), 7,09 (1Н, m), 3,19 (1Н, га), 1,32 (3Н, s), 1,31 (3Н, s).
Получение соединения С
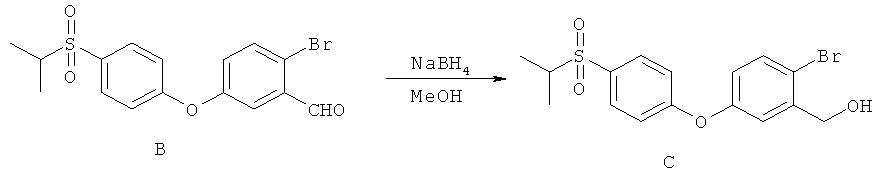
[0920] К раствору соединения В (2,9 г, 7,6 ммоль) в МеОН (150 мл) добавляли NaBH4 (144 мг, 3,8 ммоль). Данную реакционную смесь перемешивали в течение 0,5 ч при температуре окружающей среды Растворитель выпаривали. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 3/1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения С (2,6 г, 89%). 1Н ЯМР (ДМСО, 500 МГц): δ 1,14 (3Н, s), 1,15 (3Н, s), 3,36 (1Н, m), 4,50 (2Н, d, J=5,0 Гц), 5,57 (1Н, t, J=6,0 Гц), 7,03 (1Н, dd, J=3,5, 8,5 Гц), 7,20 (2Н, d, J=9,0 Гц), 7,26 (1Н, d, J=3,0 Гц), 7,64 (1Н, d, J=8,5 Гц), 7,84 (2Н, d, J=8,5 Гц).
Получение соединения D
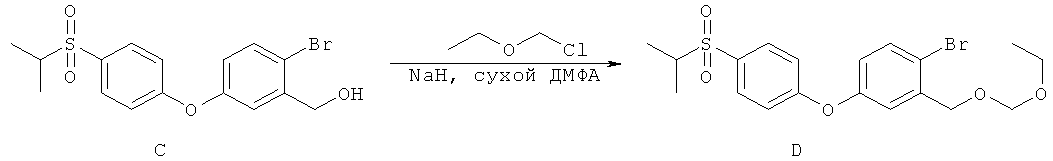
[0921] К раствору соединения С (2,7 г, 7,0 ммоль) в сухом ДМФА (50 мл) добавляли NaH (305 мг, 7,0 ммоль, 55%) в атмосфере Аr. Данную реакционную смесь перемешивали при 0°С в течение 0,5 ч, затем добавляли (хлорметокси)этан (861 мг, 9,1 ммоль). Реакционную смесь перемешивали в течение 1 ч при температуре окружающей среды и прекращали реакцию путем добавления i-PrOH. Растворитель выпаривали в условиях глубокого вакуума. Остаток растворяли в EtOAc, промывали водой. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 5/1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения D (2,5 г, 81%).
Получение соединения Е
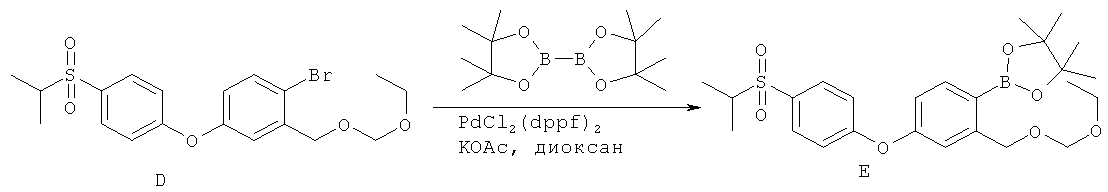
Смесь соединения D (2,5 г, 5,64 ммоль), бис(пинаколато)дибора (4,3 г, 16,9 ммоль), PdCl2(dppf)2 (184 мг, 0, 226 ммоль) и КОАс (1,65 г, 16,9 ммоль) в 1,4-диоксане (50 мл) перемешивали при 80°С в течение ночи в атмосфере Аr. Органический слой удаляли. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 5/1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения Е (2,7 г, 99%).
Получение соединения D104
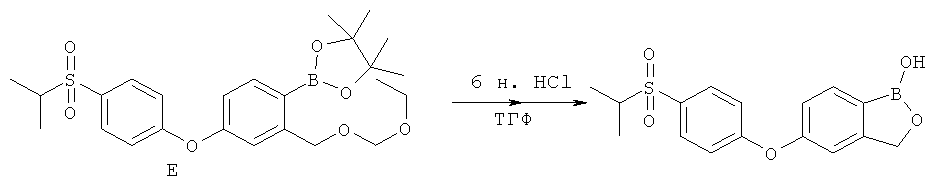
[0922] Смесь соединения Е (2,7 г, 5,6 ммоль) в 6 н. НСl (20 мл) и ТГФ (30 мл) перемешивали в течение ночи при температуре окружающей среды. Растворители удаляли. Остаток очищали путем препаративной ВЭЖХ с получением желаемого соединения (1,3 г, 70%). 1Н ЯМР (ДМСО-d6, 500 МГц): δ 1,15 (3Н, s), 1,16 (3Н, s), 3,38 (1Н, m), 4,97 (2Н, s), 7,13 (1Н, dd, J=2,0, 8,0 Гц), 7,20 (1Н, d, J=5 Гц), 7,22 (2Н, m), 7,80 (1Н, d, J=8,0 Гц), 7,85 (2Н, m), 9,23 (1Н, s).
19dh 5-(4-(Этилсульфонил) фенокси) бензо[с][1,2]оксаборол-1(3Н)-ол (D105)
Получение соединения В
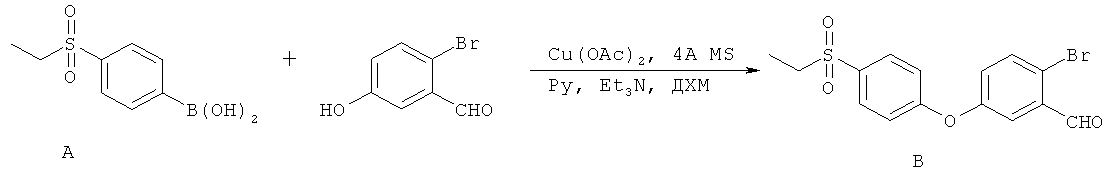
[0923] К раствору соединения А (10,3 г, 48,1 ммоль), 2-бром-5-гидроксибензальдегида (6,0 г, 30 ммоль), 4А MS (25 г) и Сu(ОАс)2 (7,0 г, 39 ммоль) в сухом СН2Сl2 (200 мл) добавляли пиридин (4,22 г, 54 ммоль) и Et3N (7,5 мл, 54 ммоль) в атмосфере Аr. Данную реакционную смесь перемешивали в течение ночи при температуре окружающей среды и фильтровали, промывали 2 н. НСl, и экстрагировали СН2Сl2. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 10/1-4/1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения В (3,9 г, 35%). 1Н ЯМР (ДМСО, 500 МГц): 5 10,18 (1Н, S), 7,90 (3Н, m), 7,51 (1Н, d, J=3,5 Гц), 7,46 (1Н, dd, J=3,0 9,0 Гц), 7,27 (2Н, d, J=8,5 Гц), 3,28 (2Н, m), 1,11 (3Н, t, J=7,5 Гц).
Получение соединения С
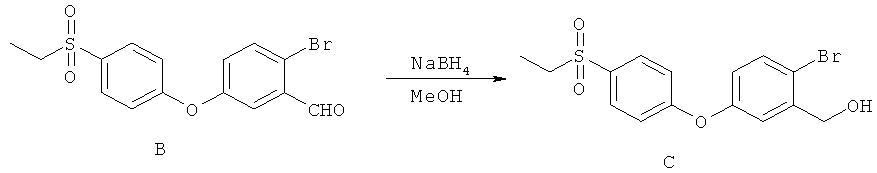
[0924] К раствору соединения В (3,9 г, 10,6 ммоль) в МеОН (250 мл) добавляли NaBH4 (200 мг, 5,3 ммоль). Данную реакционную смесь перемешивали в течение 0,5 ч при температуре окружающей среды Растворитель выпаривали. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 3/1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения С (3,66 г, 93,4%). 1Н ЯМР (ДМСО, 500 МГц): 5 1,10 (3Н, t, J=8,0 Гц), 3,26 (2Н, m), 4,50 (2Н, d, J=5,5 Гц), 5,54 (1Н, t, J=6,0 Гц), 7,03 (1Н, dd, J=3,0, 9,0 Гц), 7,20 (2Н, m), 7,26 (1Н, d, J=3,0 Гц), 7,65 (1Н, d, J=8,5 Гц), 7,88 (2Н, m).
Получение соединения D
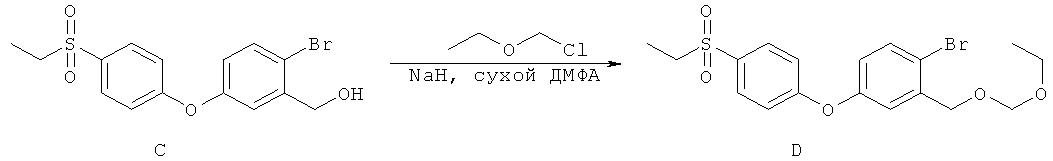
[0925] К раствору соединения С (3,66 г, 9,9 ммоль) в сухом ДМФА (50 мл) добавляли NaH (432 мг, 9,9 ммоль, 55%) в атмосфере Аr. Данную реакционную смесь перемешивали при 0°С в течение 0,5 ч, затем добавляли (хлорметокси)этан (1,22 г, 13 ммоль). Реакционную смесь перемешивали в течение 1 ч при температуре окружающей среды и прекращали реакцию путем добавления i-PrOH. Растворитель выпаривали в условиях глубокого вакуума. Остаток растворяли в EtOAc, промывали водой. Органический слой отделяли, сушили (Na2SO4), фильтровали, и выпаривали растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 5/1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения D (2,84 г, 67%). 1Н ЯМР (CDCl3, 500 МГц): δ 1,22 (3Н, t, J=7,0 Гц), 1,29 (3Н, t, J=7,0 Гц), 3,11 (2Н, m), 3,64 (2Н, m), 4,65 (2Н, s), 4,81 (2Н, s), 6,89 (1Н, d, J=8,5 Гц), 7,08 (2Н, d, J=8,0 Гц), 7,25 (1Н, s), 7,57 (1Н, d, J=8,5 Гц), 7,85 (2Н, d, J=8,0 Гц).
Получение соединения Е
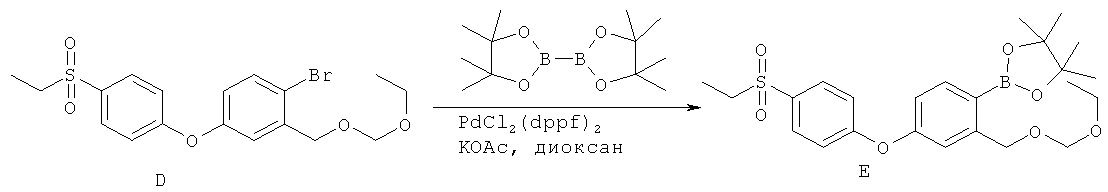
[0926] Смесь соединения D (2,84 г, 6,64 ммоль), бис (пинаколато) дибора (5,08 г, 20 ммоль), PdCl2(dppf)2 (161 мг, 0,2 ммоль) и КОАс (1,96 г, 20 ммоль) в 1,4-диоксане (50 мл) перемешивали при 80°С в течение ночи в атмосфере Аr. Органический слой удаляли. Остаток очищали путем колоночной хроматографии на силикагеле (элюент: петролейный эфир/EtOAc, 5/1). Фракции, содержащие чистый продукт, собирали, и выпаривали растворитель с получением соединения Е (2,83 г, 90%).
Получение соединения D105
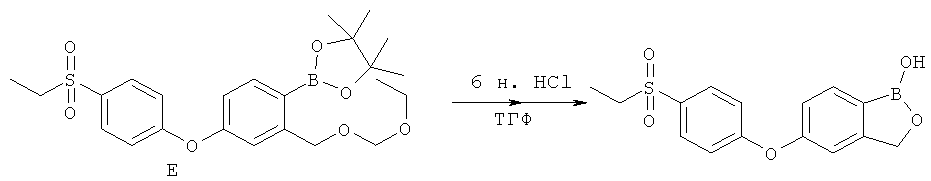
[0927] Смесь соединения Е (2,83 г, 5,94 ммоль) в 6 н. НСl (40 мл) и ТГФ (60 мл) перемешивали в течение ночи при температуре окружающей среды. Растворители удаляли. Остаток очищали путем препаративной ВЭЖХ с получением желаемого соединения (1,0 г, 53%). 1Н ЯМР (CDCl3, 500 МГц): δ 1,30 (3Н, m), 3,12 (2Н, m), 5,08 (2Н, s), 7,02 (1Н, d, J=l,5 Гц), 7,07 (1Н, dd, J=2,0, 7,5 Гц), 7,12 (2Н, m), 7,78 (1Н, d, J=7,5 Гц), 7,87 (2Н, m).
19di 2-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-6-(2-гидрокси-этиламино)-никотинонитрил (D106)
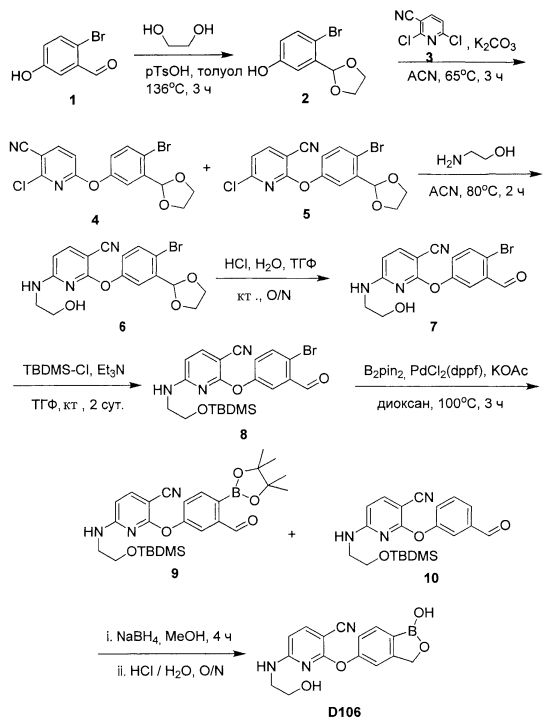

4-Бром-3-[1,3]диоксолан-2-ил-фенол (2)
[0928] К раствору 2-бром-5-гидроксибензальдегида (1) (10 г, 49,8 ммоль) в толуоле (200 мл) добавляли этиленгликоль (9,25 г, 149,3 ммоль) и каталитическое количество пapa-TsOH (200 мг). Устанавливали насадку Дина-Старка, и реакционную смесь нагревали в масляной бане с температурой 136°С в течение 3 часов. Полученный раствор охлаждали до комнатной температуры и затем промывали насыщенным раствором NaHCO3 (200 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали под вакуумом с получением 11,6 г (выход 95%) указанного в заголовке соединения. 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,40 (d, J=8,6 Гц, 1Н), 7,09 (d, J=3,1 Гц, 1Н), 6,72 (dd, J=8,6, 3,1 Гц, 1Н), 6,04 (s, 1Н), 4,18-4,04 (m, 4Н).
6-(4-Бром-3-[1,3]диоксолан-2-ил-фенокси)-2-хлорникотинонитрил+2-(4-бром-3-[1,3]диоксолан-2-ил-фенокси)-6-хлорникотинонитрил (4+5)
[0929] К раствору 2,6-дихлорникотинонитрила (3) (7,06 г, 40,8 ммоль) в безводном ацетонитриле (300 мл) добавляли 4-бром-3-[1,3] диоксолан-2-ил-фенол (2) (10 г, 40,8 ммоль) и К2СO3 (5, 63 г, 40,8 ммоль). Данную реакционную смесь нагревали при 65°С в течение 3 часов. Затем раствор фильтровали и концентрировали под вакуумом с получением 15,6 г целевой смеси (). 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,94 (d, J=9,0 Гц, 2Н), 7,62 (d, J=8,6 Гц, 2Н), 7,46 (d, J=3,1 Гц, 1Н), 7,41 (d, J=3,1 Гц, 1Н), 7,18-7,08 (m, 2Н), 7,05 (dd, J=8,8, 2,9 Гц, 1Н), 6,93 (d, J=8,2 Гц, 1Н), 6,11 (s, 1Н), 6,09 (s, 1Н), 4,19-3,99 (m, 8Н).
2-(4-Бром-3-[1,3]диоксолан-2-ил-фенокси)-6-(2-гидрокси-этиламино)-никотинонитрил (6)
[0930] К раствору 6-(4-бром-3-[1,3]диоксолан-2-ил-фенокси)-2-хлор-никотинонитрила и 2-(4-бром-3-[1,3]диоксолан-2-ил-фенокси)-6-хлор-никотинонитрила (4+5, 2,5 г, 6,6 ммоль) в ацетонитриле (безводном, 50 мл) добавляли 2-аминоэтанол (2) (3,96 г, 66 ммоль). Данную реакционную смесь нагревали при 80°С в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, и затем все летучие компоненты удаляли под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 25-100% EtOAc/гексан, с получением указанного в заголовке соединения (1,1 г, выход 41%).
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,57 (d, J=8,6 Гц, 2Н), 7,45 (d, J=2,7 Гц, 1Н), 7,06 (dd, J=8,8, 2,9 Гц, 1Н), 6,09 (d, J=8,6 Гц, 1Н), 6,08 (s, 1Н), 5,34 (br, s,, 1Н), 4,04-4,18 (m, 4Н), 3,60 (t, J=5,3 Гц, 2Н), 3,28 (q, J=5,4 Гц, 2Н).
2-(4-Бром-3-формилфенокси)-6-[(2-гидроксиэтил)-метиламино]-никотинонитрил (7)
[0931] К раствору (2-(4-бром-3-[1,3]диоксолан-2-ил-фенокси)-6-(2-гидрокси-этиламино)-никотинонитрила (6) (1,1 г, 2,7 ммоль) в ТГФ (200 мл) добавляли раствор НСl (1 М, 100 мл). Данную реакционную смесь перемешивали в течение ночи при комнатной температуре. ТГФ выпаривали под вакуумом. Образовавшееся белое твердое вещество отфильтровывали и сушили на воздухе с получением 0,94 г (выход за две стадии 55%) указанного в заголовке соединения.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,19 (s, 1Н), 7,88 (br, s, 1Н), 7,85 (d, J=8,6 Гц, 1H), 7,72 (br, s,, 1H), 7,65 (d, J=2,3 Гц, 1H), 7,52 (dd, J=8,8, 2,3 Гц, 1H), 6,34 (d, J=8,6 Гц, 1H), 4,61 (br. s., 1H), 3,40 (br. s, 2H), 3,05 (br. s, 2H).
2-(4-Бром-3-формилфенокси)-6-[2-(трет-бутилдиметилсиланилокси)-этиламино]-никотинонитрил (8)
[0932] К раствору 2-(4-бром-3-формилфенокси)-6-[(2-гидроксиэтил)-метиламино]-никотинонитрила (7) (0,94 г, 2,59 ммоль) в безводном ТГФ (100 мл) добавляли трег-бутилхлордиметилсилан (0,86 г, 5,7 ммоль), Et3N (0,8 мл, 5,7 ммоль) и каталитическое количество DMAP (4-диметиламинопиридина). Данный раствор перемешивали в течение ночи при комнатной температуре. Затем раствор фильтровали и концентрировали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 5-50% EtOAc/гексаны, с получением 1,1 г (выход 89%) указанного в заголовке соединения.
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 10,34 (s, 1Н), 7,79 (d, J=2,7 Гц, 1Н), 7,66 (d, J=8,6 Гц, 1Н), 7,60 (d, J=8,6 Гц, 1Н), 7,30 (dd, J=8,6, 2,7 Гц, 1Н), 6,14 (d, J=8,6 Гц, 1Н), 5,23 (br. s., 1Н), 3,64 (t, J=4,9 Гц, 2Н), 3,25 (q, J=5,4 Гц, 2Н), 0,86 (s, 9Н), 0,02 (s, 6Н).
6-[2-(трет-Бутилдиметилсиланилокси)-этиламино]-2-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрил (9)
[0933] К раствору 2-(4-бром-3-формилфенокси)-6-[2-(трет-бутилдиметил-силанилокси)-этиламино]-никотинонитрила (8) (1,1 г, 2,3 ммоль) в безводном 1,4-диоксане (150 мл) добавляли биспинаколатодибор (0,71 г, 2,77 ммоль), PdCl2 (dppf) (0,17 г, 0,23 ммоль) и КОАс (0,68 г, 6,9 ммоль). Данный раствор перемешивали при комнатной температуре в течение 30 минут, используя барботирование азотом (N2). Затем реакционную смесь нагревали при 100°С в течение 3 часов. Полученный раствор фильтровали и концентрировали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 5-25% EtOAc/гексаны, с получением смеси указанного в заголовке соединения 9 и дебромированного соединения, 6-[2-(трет-бутил-диметил-силанилокси)-этиламино]-2-(3-формил-фенокси)-никотинонитрила (10). Данное вещество использовали на следующей стадии без дополнительной очистки.
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 10,62 (s, 1Н), 10,02 (s, 1Н), 7,94 (d, J=8,20 Гц, 1Н), 7,82 (d, J=l,95 Гц, 1Н), 7,70-7,77 (m, 2Н), 7,53-7,64 (m, 4Н), 7,37-7,50 (m, 3Н), 6,12-6,19 (m, 2Н), 5, 27-5, 37 (m, 2Н), 3, 55-3, 69 (m, 4Н), 3,23 (m, 4Н), 0,82-0,88 (m, 18Н), 0, 00 (d, 12Н).
2-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-6-(2-гидроксиэтиламино)-никотинонитрил (D106)
[0934] К прозрачному раствору смеси соединений 9 и 10 (6-[2-(трет-бутилдиметилсиланилокси)-этиламино]-2-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрила и 6-[2-(грет-бутилдиметилсиланилокси)-этиламино]-2-(3-формилфенокси)-никотинонитрила) в МеОН (безводном, 200 мл) медленно добавляли NaBH4 (0,26 г, 6,9 ммоль). Данную реакционную смесь перемешивали при комнатной температуре в течение 4 часов, и затем добавляли 1 М раствор НСl (30 мл). Оставляли на ночь при комнатной температуре, полученный раствор медленно упаривали под вакуумом. Очистку выполняли путем обращеннофазной хроматографии (Biotage), используя для элюирования градиент 5-100% МеОН/H2O, с получением 120 мг (выход 2 9%) указанного в заголовке соединения в виде белого твердого вещества.
1Н ЯМР (400 МГц, flMC0-d6) δ м.д. 9,23 (s, 1Н), 7, 86-7, 80 (m, 1Н), 7,75 (d, J=8,2 Гц, 1Н), 7,70 (br, s,, 1Н), 7,22 (s, 1Н), 7,14 (dd, J=8,0, 2,1 Гц, 1Н), 6,31 (d, J=8,6 Гц, 1Н), 4,98 (s, 2Н), 4,64 (br. s, 1Н), 3,43 (br. s, 2H), 3,07 (br. s, 2H). Масс-спектр (ИЭР) m/z: 312 (M+H)+; ВЭЖХ: 97,41% (220 нм), 97,24 (MaxPlot).
19dj 2-Этокси-6-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D107)
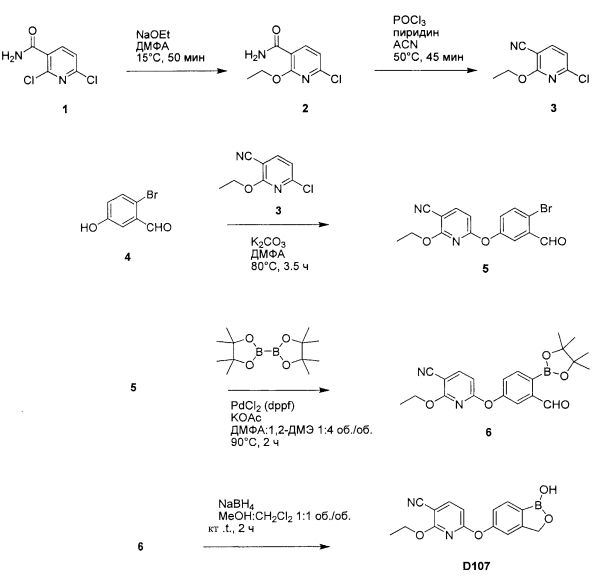

6-Хлор-2-этоксиникотинамид (2)
[0935] Получение 2, 6-дихлорникотинамида (1) описано в методике синтеза соединения D46. К раствору соединения 1 (5,01 г, 26,2 ммоль) в диметилформамиде (30 мл) при 15°С медленно (в течение 10 мин) добавляли свежеприготовленный раствор этилата натрия в этаноле (12,1 мл 2,17 М раствора, 26,2 ммоль) [Примечание: для поддерживания температуры реакционной смеси на уровне 14-16°С использовали водяную баню; этилат натрия получали путем взаимодействия твердого Na (1,50 г, 65,2 ммоль) с безводным EtOH (30,0 мл)]. После завершения добавления этоксида натрия реакционную смесь перемешивали в течение 40 мин при 14-16°С. [Примечание: аликвоту (0,3 мл) реакционной смеси концентрировали. Спектр 1Н-ЯМР аликвоты снятый в ДМСО-d6, показывал ~98% превращение исходных веществ в необходимое соединение 2]. Реакционную смесь вливали в воду (500 мл) и экстрагировали EtOAc (3×400 мл). Все органические экстракты объединяли, сушили над Na2SO4, фильтровали и концентрировали с получением указанного в заголовке соединения в виде светло-серого твердого вещества (5,20 г, чистота согласно 1Н-ЯМР 95%). Указанное в заголовке соединение использовали на следующей стадии без дополнительной очистки. 1Н ЯМР (400 МГц, ДМСО-d6) δ 8,16 (d, J=8,2 Гц, 1Н), 7,76 (br s, 1H), 7,57 (br s, 1H), 7,17 (d, J=7,8 Гц, 1H), 4,41 (q, J=7,0 Гц, 2H), 1,35 (t, J=7,0 Гц, 3Н).
6-Хлор-2-этоксиникотинонитрил (3)
[0936] Синтез 6-хлор-2-этоксиникотинонитрила (3) выполняли в соответствии с описанной выше экспериментальной методикой синтеза соединения D46. В результате взаимодействия 6-хлор-2-морфолин-4-ил-никотинамида (2) (5,20 г, 25,9 ммоль) с оксихлоридом фосфора (7,2 мл, 78 ммоль) и пиридином (12,6 мл, 156 ммоль) в ацетонитриле (120 мл) и последующего выделения продукта реакции получали неочищенное черное масло. Полученное черное масло фракционировали путем хроматографии на "сухой" колонке следующим образом: масло разбавляли СН2Сl2 (300 мл). затем добавляли силикагель (40 г, 230-400 меш), и концентрировали досуха. Данную смесь помещали на колонку с силикагелем (120 г, 230-400 меш), и элюировали смесью 5% EtOAc/гексан. Фракции, содержащие чистый продукт, объединяли и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества (4,20 г, фактический выход 87%). Согласно ТСХ-анализу (элюирование: 25% EtOAc/гексаны; проявление УФ-лампой) Rf=0,8; гН ЯМР (400 МГц, (CDCl3) δ 7, 80 (d, J=7,8 Гц, 1Н), 6,99 (d, J=8,2 Гц, 1H), 4,51 (q, J=7,0 Гц, 2H), 1,45 (t, J=7,0 Гц, 3Н).
6-(4'-Бром-3'-формил-фенокси)-2-этоксиникотинонитрил (5)
[0937] Синтез 6-(4'-бром-3'-формилфенокси)-2-этоксиникотинонитрила (5) выполняли в соответствии с описанной выше экспериментальной методикой синтеза соединения D46 за тем исключением, что реакционную смесь нагревали при 80°С в течение 3,5 ч. В результате взаимодействия 6-хлор-2-этоксиникотинонитрила (3) (3,52 г, 19,3 ммоль), 2-бром-5-гидроксибензальдегида (4) (2,58 г, 12,9 ммоль) и К2СО3 (3,55 г, 25,7 ммоль) в ДМФА (40 мл) и последующего выделения продукта реакции получали неочищенное масло. Полученное масло фракционировали путем хроматографии на "сухой" колонке следующим образом: масло разбавляли CH2Cl2 (500 мл), затем добавляли силикагель (80 г, 230-400 меш), и концентрировали досуха. Данную смесь помещали на колонку с силикагелем (120 г, 230-400 меш), и элюировали градиентом 10-30% EtOAc/гексаны. Фракции, содержащие чистый продукт, объединяли и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества (3,71 г, фактический выход 61%). Согласно ТСХ-анализу (двойное элюирование: 25% EtOAc/гексан; проявление УФ-лампой) Rf=0,5; 1Н ЯМР (400 МГц, CDCl3) δ 10,35 (s, 1Н), 7,87 (d, J=8,6 Гц, 1Н), 7,76 (d, J=3,1 Гц, 1Н), 7,70 (d, J=8,6 Гц, 1Н), 7,29 (dd, J=8,6, 3,1 Гц), 6,57 (d, J=8,2 Гц, 1Н), 4,17 (q, J=7,0 Гц, 2H), 1,29 (t, J=7,0 Гц, 3Н).
2-Этокси-6-[3-формил-4-(4,4,5, 5-тетраметил-[1,3,2] диоксаборолан-2-ил)-фенокси]-никотинонитрил (6)
[0938] Синтез 2-этокси-6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрила (6) выполняли в соответствии с описанной выше экспериментальной методикой синтеза соединения D46. В результате взаимодействия соединения 6 (3,62 г, 10,5 ммоль), бис(пинаколато)дибора (7,97 г, 31,4 ммоль) и ацетата калия (3,08 г, 31,4 ммоль) в смеси растворителей диметилформамид (20 мл) и 1,2-диметоксиэтан (80 мл) и последующего выделения продукта реакции получали коричневое масло. Полученное масло фракционировали путем хроматографии на "сухой" колонке следующим образом: масло разбавляли СН2Сl2 (400 мл), затем добавляли силикагель (80 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (80 г, 230-400 меш), и элюировали градиентом 10-20% EtOAc/гексаны. Фракции, содержащие чистый продукт, объединяли и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества (2,71 г, фактический выход 74%). Согласно ТСХ-анализу (элюирование: 25% EtOAc/гексаны; проявление УФ-лампой) Rf=0,4; 1Н ЯМР (400 МГц, CDCl3) δ 10,64 (s, 1Н), 7,97 (d, J=8,2 Гц, 1H), 7,86 (d, J=8,6 Гц, 1H), 7,79 (d, J=2,0 Гц, 1H), 7,38 (dd, J=8,2, 2,3 Гц, 1H), 6,54 (d, J=8,2 Гц, 1H), 4,17 (q, J=7,0 Гц, 2H), 1,41 (s, 12H), 1,28 (t, J=7,0 Гц, 3Н).
2-Этокси-6-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D107)
[0939] Экспериментальная методика синтеза 6-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-2-морфолин-4-ил-никотинонитрила (D107) аналогична описанной для соединения D46. В результате взаимодействия 2-этокси-6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрила (б) (2,71 г, 7,81 ммоль) с NaBH4 (886 мг, 23,4 ммоль) и последующего выделения продукта реакции получали оранжевое масло, содержащее соединения D107. Полученное масло фракционировали путем хроматографии на "сухой" колонке следующим образом: масло разбавляли 30% МеОН/СН2Сl2 (400 мл), затем добавляли силикагель (80 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (160 г, 230-400 меш), и элюировали смесью уксусная кислота/МеОН/СН2Сl2 (1:1:100). Фракции, содержащие D107, собирали и концентрировали с получением светло-желтого масла. Полученное масло лиофилизировали следующим образом: сначала масло разбавляли метанолом (30 мл), затем добавляли деионизованную воду (400 мл), полученную белую суспензию замораживали в бане со смесью сухого льда и ацетона и помещали на ночь в лиофилизатор. Соединение D107 получали в виде белого твердого вещества (1,82 г), которое согласно 1Н-ЯМР содержало 30 молярных % пинаколдиола. Соединение D107 дополнительно очищали путем колоночной хроматографии и лиофилизации, используя описанные выше условия, с получением D107 (4 02 мг, фактический выход 17%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ДМСО-d6) δ 9, 25 (s, 1Н), 8,24 (d, J=8,2 Гц, 1Н), 7,79 (d, J=7,8 Гц, 1Н), 7,29 (d, J=2,0 Гц, 1Н), 7,20 (dd, J=7,8, 2,0 Гц, 1Н), 6,69 (d, J=8,2 Гц, 1Н), 4,99 (s, 2Н), 4,17 (q, J=7,0 Гц, 2Н), 1,21 (t, J=7,0 Гц, 3Н). Масс-спектр: [М+Н+]=297; чистота согласно ВЭЖХ: 97,18% (Maxplot), 97,65% (220 нм).
19dk 2-Гидрокси-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинонитрил (D108)
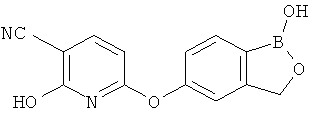
[0940] К раствору 48% НВr (2 мл) и уксусной кислоты (4 мл) добавляли 6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-метоксиникотинонитрил (D46) (0, 300 мг, 1,06 ммоль). Данную реакционную смесь перемешивали в течение 24 часов при 50°С. Добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали водой,-солевым раствором, сушили над безводным сульфатом натрия и затем фильтровали. Растворитель удаляли при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле (7:3-9:1 этилацетат/гексан). Полученное вещество дополнительно очищали путем обращеннофазной ВЭЖХ с получением 2-гидрокси-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)никотинонитрила (0, 027 г, выход 10%). Масс-спектр (ИЭР(-)) m/z: 267 (М-Н)-; 1Н ЯМР (300 МГц, ДMCO-d6) δ м.д. 4,97 (s, 2Н), 6,4 (br s, 1Н), 7,15 (d, J=7,9 Гц, 1Н), 7,25 (s, 1Н), 7,77 (d, J=7,9 Гц, 1Н), 8,09 (d, J=7,9 Гц, 1Н), 9,24 (s, 1Н), 12,7 (br s, 1Н).
19dl 6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-4-метокси-никотинонитрил (D109)
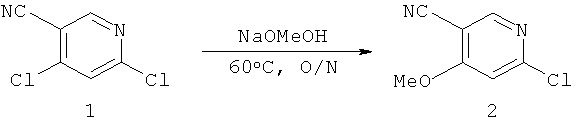
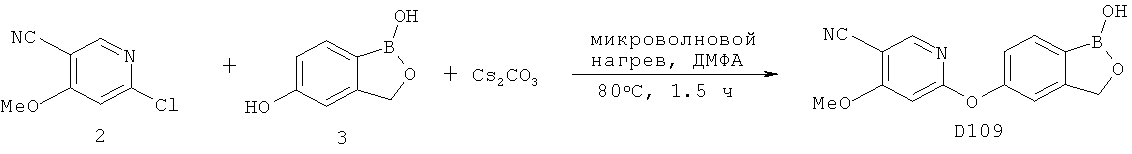
6-Хлор-4-метоксиникошинонитрил (2)
[0941] К раствору 4,6-дихлорникотинонитрила (1) (200 мг, 1,06 ммоль) в безводном метаноле (10 мл) добавляли раствор метоксида натрия (0,5 М/МеОН, 2,12 мл, 1,06 ммоль). Данную реакционную смесь нагревали при 60°С в течение ночи. Реакционный раствор охлаждали до комнатной температуры, и добавляли НСl (1 М, 8 мл). Летучие компоненты выпаривали под вакуумом. Очистку выполняли, используя Biotage (градиентное элюирование: 10-50% EtOAc/гексан) с получением указанного в заголовке соединения (150 мг, выход 77%). 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 8,48 (s, 1Н), 6,98 (s, 1Н), 4,03 (s, 3Н).
6-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-4-метокси-никотинонитрил (D109)
[0942] К прозрачному раствору 6-хлор-4-метоксиникотинонитрила (2) (200 мг, 1,2 ммоль) в безводном ДМФА (15 мл) добавляли 3Н-бензо[с][1,2]оксаборол-1,5-диол (3) (90 мг, 0,6 ммоль) и CS2CO3 (390 мг, 1,2 ммоль). Данную реакционную смесь нагревали при 80°С в течение 1,5 часа в микроволновой печи. pH смеси доводили до 2 путем добавления НСl (1 М). Все летучие компоненты удаляли под вакуумом. Очистку выполняли путем обращенно-фазовой хроматографии (Biotage), используя для элюирования градиент 5-100% МеОН/H2O, с получением указанного в заголовке соединения (100 мг, выход 30%). 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,32 (s, 1Н), 8,40 (s, 1Н), 7,75 (d, J=7,8 Гц, 1Н), 7,19 (s, 1Н), 7,12-7,08 (m, 1Н), 6,93 (s, 1 Н), 4,96 (s, 2Н), 3,99 (s, 3Н). Масс-спектр (ИЭР) m/z: 283 (М+Н)+; ВЭЖХ: 95,75% (220 нм), 95,81% (MaxPlot).
19dm 6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-метиламиноникотинонитрил (D110)
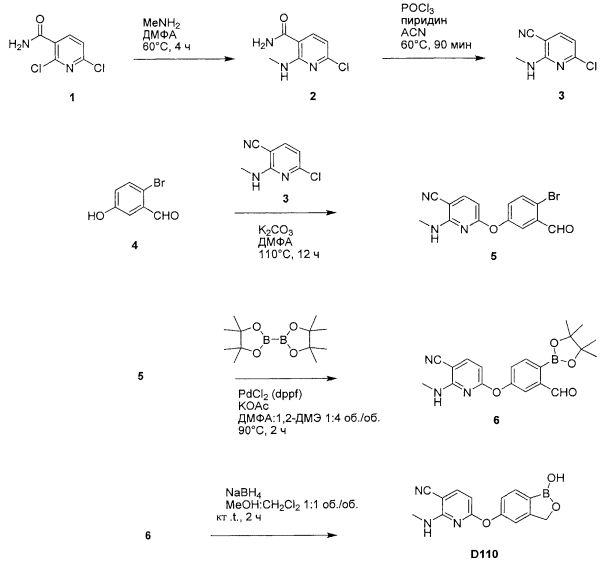

6-Хлор-2-метиламиноникотинамид (2)
[0943] Получение 2,6-дихлорникотинамида (1) описано в методике синтеза соединения D46. Герметично закрытый реакционный сосуд, содержащий 2,6-дихлорникотинамид (1) (6,23 г, 32,6 ммоль) и метиламин (98 мл 2 М раствора в ТГФ, 196 ммоль) в безводном диметилформамиде (60 мл) нагревали до 60°С в течение 4 ч. Затем реакционную смесь охлаждали до комнатной температуры, разбавляли водой (800 мл) и экстрагировали этилацетатом (4×600 мл). Все органические экстракты объединяли, сушили над Na2SO4, фильтровали и концентрировали с получением светло-оранжевого масла (7,10 г). Полученное масло разбавляли СН2Сl2 (300 мл), затем добавляли силикагель (50 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (200 г, 230-400 меш), и элюировали с градиентом 30-50% EtOAc/гексаны. Фракции, содержащие чистый продукт, объединяли и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества (4,73 г, фактический выход 78%). Согласно ТСХ-анализу (элюирование: 50% EtOAc/гексаны; проявление УФ-лампой) Rf=0,5; 1Н ЯМР (400 МГц, CDCl3) δ 7, 47 (d, J=8,5 Гц, 1Н), 7,90 (d, J=7,9 Гц, 1Н), 1,48 (s, 3Н).
6-Хлор-2-метиламиноникотинонитрил (3)
[0944] Экспериментальная методика синтеза 6-хлор-2-метиламиноникотинонитрила (3) аналогична описанной методике для синтеза D46. Реакция 6-хлор-2-метиламиноникотинамида (2) (4,70 г, 25,54 ммоль) с оксихлоридом фосфора (7,0 мл, 76,6 ммоль) и пиридином (12,3 мл, 152 ммоль) в ацетонитриле (60 мл) при 60°С в течение 90 мин позволила получить неочищенное черное масло. Полученное черное масло фракционировали путем хроматографии на "сухой" колонке следующим образом: масло разбавляли СН2Сl2 (300 мл), затем добавляли силикагель (50 г, 230-400 меш), и концентрировали досуха. Данную смесь помещали на колонку с силикагелем (100 г, 230-400 меш), и элюировали смесью 20% EtOAc/гексан. Фракции, содержащие чистый продукт, объединяли и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества (2,91 г, фактический выход 69%). Согласно ТСХ-анализу (элюирование: 10% EtOAc/гексаны; проявление УФ-лампой) Rf=0,4; 1Н ЯМР (400 МГц, ДМСО-d6) δ 7,91 (d, J=7,8 Гц, 1Н), 7,52 (br q, J=4,7 Гц, 1H), 6,67 (d, J=7,8 Гц, 1H), 2,80 (d, J=4,7 Гц, 3Н).
6-(4'-Бром-3'-формилфенокси)-2-метиламиноникотинонитрил (5)
[0945] Экспериментальная методика для синтеза 6-(4'-бром-3'-формилфенокси)-2-метиламиноникотинонитрила (5) аналогична описанной для синтеза D46 за тем исключением, что реакционную смесь нагревали при 110°С в течение 12 ч. В результате взаимодействия 6-хлор-2-метиламиноникотинонитрила (3) (1,90 г, 11,3 ммоль), 2-бром-5-гидроксибензальдегида (4) (1,52 г, 7,56 ммоль) и К2СО3 (2,09 г, 15,1 ммоль) в ДМФА (45 мл) и последующего выделения продукта реакции получали неочищенное масло. Полученное масло фракционировали путем хроматографии на "сухой" колонке следующим образом: масло разбавляли CH2Cl2 (400 мл), затем добавляли силикагель (50 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (200 г, 230-400 меш), и элюировали градиентом 10-30% EtOAc/гексаны. Фракции, содержащие чистый продукт, объединяли и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества (1,42 г, фактический выход 57%). Согласно ТСХ-анализу (элюирование: 10% EtOAc/гексаны/ проявление УФ-лампой) Rf=0,2; 1Н ЯМР (400 МГц, CDCl3) δ 10,35 (s, 1Н), 7,80 (d, J=2,7 Гц, 1Н), 7,67 (d, J=8,6 Гц, 1Н), 7,64 (d, J=8,2 Гц, 1Н), 7,30 (dd, J=8,6, 3,1 Гц, 1Н), 6,20 (d, J=8,2 Гц, 1Н), 5,20 (br s, 1Н), 2,80 (d, J=4,7 Гц, 1H).
6-[3-Формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-метиламино-никотинонитрил (6)
[0946] Экспериментальная методика синтеза 6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-метиламиноникотинонитрила (6) аналогична описанной для синтеза D46. В результате взаимодействия соединения 6 (1,40 г, 4,21 ммоль), бис(пинаколато)дибора (3,21 г, 12,6 ммоль) и ацетата калия (1,24 г, 12,6 ммоль) в смеси растворителей диметилформамид (15 мл) и 1,2-диметоксиэтан (45 мл) и последующего выделения продукта реакции получали черное масло. Полученное черное масло фракционировали путем хроматографии на "сухой" колонке следующим образом: масло разбавляли СН2Сl2 (400 мл), затем добавляли силикагель (50 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (100 г, 230-400 меш), и элюировали градиентом 10-4 0% EtOAc/гексаны. Фракции, содержащие чистый продукт, объединяли и концентрировали с получением указанного в заголовке соединения в виде светло-серого твердого вещества (510 мг, фактический выход 33%). Согласно ТСХ-анализу (двойное элюирование: 25% EtOAc/гексаны; проявление УФ-лампой) Rf=0,3; 1Н ЯМР (400 МГц, ДМСО-d6) δ 10,40 (s, 1Н), 7,94 (d, J=8,2 Гц, 1Н), 7,82 (d, J=8,2 Гц, 1Н), 7,71 (d, J=2,3 Гц, 1Н), 7,54 (dd, J=8,2, 2,3 Гц, 1Н), 7,32 (br q, J=4,3 Гц, 1Н), 6,26 (d, J=8,6 Гц, 1H), 2,58 (d, J=4,3 Гц, 3Н), 1,35 (s, 12H).
6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-метиламиноникотинонитрил (D110)
[0947] Экспериментальная методика для синтеза 6-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-2-метиламино-никотинонитрила (D110) аналогична описанной для синтеза D46. Реакция 6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-метиламино-никотинонитрила (6) (4 90 мг, 1,35 ммоль) с NaBH4 (102 мг, 2,69 ммоль) и последующее выделение продукта реакции позволило получить оранжевое масло, содержащее соединение D110. Полученное масло фракционировали путем хроматографии на "сухой" колонке следующим образом: масло разбавляли СН2Сl2 (300 мл), затем добавляли силикагель (30 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (150 г, 230-400 меш), и элюировали смесью уксусная кислота/МеОН/СН2Сl2 (0,5:0,5:100). Фракции, содержащие соединение D110, собирали и концентрировали с получением светло-желтого масла. Полученное масло лиофилизировали следующим образом: сначала масло разбавляли метанолом (50 мл), затем добавляли деионизованную воду (300 мл), полученную белую суспензию замораживали в бане со смесью сухого льда и ацетона и помещали на ночь в лиофилизатор.
Соединение D110 получали в виде белого твердого вещества (243 мг, фактический выход 64%). 1Н ЯМР (400 МГц, ДМСО-d6) δ 9, 20 (s, 1Н), 7,88 (d, J=8,2 Гц, 1Н), 7,76 (d, J=8,2 Гц, 1Н), 7,25 (br s, 1Н), 7,24 (s, 1H), 7,15 (d, J=8,2 Гц, 1H), 6,13 (d, J=8,2 Гц, 1H), 4,98 (s, 2H), 2,61 (d, J=4,3 Гц, 3Н). Масс-спектр: [M+H]+=282; чистота согласно ВЭЖХ: 94, 93% (Maxplot), 93, 43% (220 нм).
19dn 6-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-2-(2-метокси-этиламино)-никотинонитрил (D111)
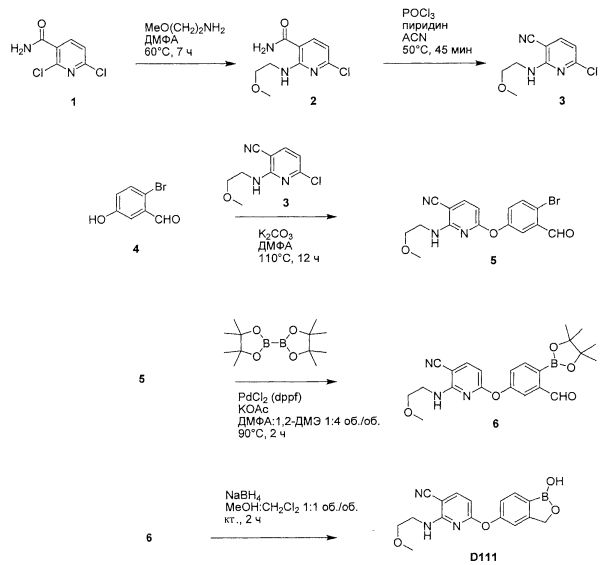

6-Хлор-2-(2-метокси-этиламино)-никотинамид (2)
[0948] Получение 2,6-дихлор-никотинамида (1) описано в методике синтеза соединения D46. Герметично закрытый реакционный сосуд, содержащий 2,6-дихлор-никотинамид (1) (8,66 г, 45,3 ммоль) и 2-метокси-этиламин (15,6 мл, 181 ммоль) в безводном диметилформамиде (40 мл) нагревали до 60°С в течение 7 ч. Затем реакционную смесь охлаждали до комнатной температуры. Диметилформамид удаляли путем азеотропного выпаривания с толуолом (6×700 мл) на роторном испарителе с водяной баней при 70°С с получением оранжевого масла (12,2 г). Полученное масло фракционировали путем хроматографии на "сухой" колонке следующим образом: масло разбавляли СН2Сl2 (400 мл), затем добавляли силикагель (100 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (200 г, 230-400 меш), и элюировали смесью 50% EtOAc/гексаны. Фракции, содержащие чистый продукт, объединяли и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества (5,37 г, фактический выход 64%). 1Н ЯМР (400 МГц, ДМСО-d6) δ 7, 79 (d, J=7,8 Гц, 1Н), 7,30 (s, 1Н), 6,76 (d, J=7,8 Гц, 1Н), 6,52 (s, 1Н), 4,04 (br t, J=4,7 Гц, 1Н), 3,80 (td, J=5,5, 4,7 Гц, 2H), 3,63 (t, J=5,5 Гц, 2H), 2, 94 (s, 3Н).
6-Хлор-2-(2-мешоксиэшламино)-никотинонитрил (3)
[0949] Экспериментальная методика для синтеза 6-хлор-2-(2-метокси-этиламино)-никотинонитрила (3) аналогична описанной для синтеза D46. В результате взаимодействия 6-хлор-2-(2-метокси-этиламино)-никотинамида (2) (6,85 г, 36,9 ммоль) с оксихлоридом фосфора (10,1 мл, 111 ммоль) и пиридином (17,9 мл, 221 ммоль) в ацетонитриле (90 мл) и последующего выделения продукта реакции получали черное масло, содержащее указанное в заголовке соединение (6,97 г, 98% превращение). Указанное в заголовке соединение использовали на следующей стадии без дополнительной очистки. 1Н ЯМР (400 МГц, ДМСО-d6) δ 7, 94 (d, J=7,8 Гц, 1Н), 7,50 (br s, 1H), 6,71 (d, J=8,2 Гц, 1H), 3,54-3,43 (m, 4H), 3,26 (s, 3H).
6-(4'-Бром-3'-формилфенокси)-2-(2-метоксиэтиламино)-никотинонитрил (5)
[0950] Экспериментальная методика для синтеза 6-(4'-бром-3'-формил-фенокси)-2-(2-метокси-этиламино)-никотинонитрила (5) аналогична описанной для синтеза D46 за тем исключением, что реакционную смесь нагревали при 110°С в течение 12 ч. В результате взаимодействия 6-хлор-2-(2-метокси-этиламино)-никотинонитрила (3) (5,13 г, 24,2 ммоль), 2-бром-5-гидрокси-бензальдегида (4) (3,25 г, 16,2 ммоль) и К2СО3 (4,47 г, 32,3 ммоль) в ДМФА (45 мл) и последующего выделения продукта реакции получали неочищенное масло, содержащее соединение 5. Полученное масло фракционировали путем хроматографии на "сухой" колонке следующим образом: масло разбавляли 10% МеОН/СН2Сl2 (300 мл), затем добавляли силикагель (70 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (140 г, 230-400 меш), и элюировали градиентом 10-40% EtOAc/гексаны. Фракции, содержащие чистый продукт, объединяли и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества я3356] (4,71 г, фактический выход 52%). Согласно ТСХ-анализу (элюирование: 25% EtOAc/гексаны; проявление УФ-лампой) Rf=0,3; 1Н ЯМР (400 МГц, CDCl3) δ 10,29 (s, 1Н), 7,70 (d, J=3,0 Гц, 1Н), 7,63 (d, J=8,6 Гц, 1Н), 7,61 (d, J=8,2 Гц, 1Н), 7,23 (dd, J=8,6, 3,0 Гц, 1Н), 6,17 (d, J=8,2 Гц, 1Н), 5,57 (br s, 1Н), 3,37-3,27 (4Н), 3,26 (s, 3Н).
6-[3-Формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-(2-метоксиэтиламино)-никотинонитрил (6)
[0951] Экспериментальная методика для синтеза 6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-(2-метокси-этиламино)-никотинонитрила (6) аналогична описанной для синтеза соединения D46. В результате взаимодействия соединения 5 (4,70 г, 12,5 ммоль), бис(пинаколато)дибора (6,35 г, 25,0 ммоль) и ацетата калия (2,45 г, 25,0 ммоль) в 1,2-диметоксиэтане (120 мл) получали коричневое масло. Полученное коричневое масло фракционировали путем хроматографии на "сухой" колонке следующим образом: масло разбавляли СН2Сl2 (400 мл), затем добавляли силикагель (70 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (140 г, 230-400 меш), и элюировали градиентом 10-20% EtOAc/гексаны. Фракции, содержащие чистый продукт, объединяли и концентрировали с получением указанного в заголовке соединения в виде светло-желтого твердого вещества (4,24 г, фактический выход 80%). 1Н ЯМР (400 МГц, ДМСО-d6) δ 10,38 (s, 1Н), 7,93 (d, J=8,2 Гц, 1H), 7,80 (d, J=8,2 Гц, 1H), 7,66 (d, J=2,3 Гц, 1H), 7,50 (dd, J=8,2, 2,3 Гц, 1H), 7,29 (br s, 1H), 6,29 (d, J=8,2 Гц, 1H), 3,32 (s, 3H), 3,17-3,13 (4H), 1,33 (s, 12H).
6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-(2-метоксиэтиламино)-никотинонитрил (D111)
[0952] Экспериментальная методика для синтеза 6-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-2-(2-метокси-этиламино)-никотинонитрила (D111) аналогична описанной для синтеза соединения D46. В результате взаимодействия 6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-(2-метоксиэтиламино)-никотинонитрила (6) (4,20 г, 9,92 ммоль) с NaBH4 (750 мг, 19,8 ммоль) и последующего выделения продукта реакции получали оранжевое масло, содержащее соединение D111. Полученное масло фракционировали путем хроматографии на "сухой" колонке следующим образом: масло разбавляли 10% МеОН/СН2Сl2 (400 мл), затем добавляли силикагель (70 г, 230-400 меш), и концентрировали досуха. Данную смесь наносили на колонку с силикагелем (210 г, 230-400 меш), и элюировали смесью уксусная кислота/МеОН/СН2Сl2 (1:1:100). Фракции, содержащие соединение D111, собирали и концентрировали с получением светло-желтого масла. Полученное масло лиофилизировали следующим образом: сначала масло разбавляли ацетонитрилом (40 мл), затем добавляли деионизованную воду (400 мл), полученную белую суспензию замораживали в бане со смесью сухого льда и ацетона и помещали на ночь в лиофилизатор. Соединение D111 получали в виде белого твердого вещества (1,70 г), которое согласно 1Н-ЯМР содержало 30 молярных % пинаколдиола.
Соединение D111 дополнительно очищали путем колоночной хроматографии и лиофилизации, используя описанные выше условия, с получением соединения D111 в виде белого твердого вещества (972 мг, фактический выход 30%). 1Н ЯМР (400 МГц, ДМСО-d6) δ 9,21 (s, 1Н), 7,90 (d, J=8,2 Гц, 1Н), 7,76 (d, J=7,8 Гц, 1Н), 7,25 (br t, J=4,7 Гц, 1Н), 7,24 (d, J=1,5 Гц, 1H), 7,14 (dd, J=7,8, 1,5 Гц, 1H), 6,22 (d, J=8,6 Гц, 1H), 4,97 (s, 2H), 3,33 (s, 3H), 3,25-3,15 (m, 4H). Масс-спектр: [M+H]+=324; чистота согласно ВЭЖХ: 97,36% (Maxplot), 97,21% (220 нм), 96,44% (254 нм).
19do 6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-метоксиникотинамид. (D112)
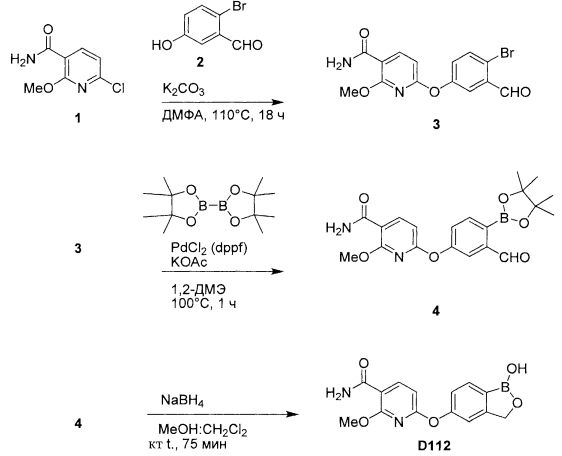

6-(4-Бром-3-формилфенокси)-2-метоксиникошинамид (3)
[0953] Смесь 6-хлор-2-метоксиникотинамида (7,15 г, 38,3 ммоль), 2-бром-5-гидрокси-бензальдегида (11,5 г, 57,5 ммоль) и К2СO3 (15,9 г, 115 ммоль) в диметилформамиде (60 мл) нагревали до 110°С в течение 18 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли H2O (800 мл) и экстрагировали этилацетатом (6×400 мл). Органические экстракты объединяли, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали путем колоночной флэш-хроматографии на силикагеле (50-80% этилацетат/гексаны) с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества (5,19 г, выход 39%).
1Н ЯМР (400 МГц, ДМСО-d6) δ 10,18 (s, 1Н), 8,28 (d, J=8,2 Гц, 1Н), 7,85 (d, J=8,6 Гц, 1Н), 7,68 (d, J=2,7 Гц, 1Н), 7,59 (br s, 1Н), 7,53 (dd, J=8,6, 2,7 Гц, 1Н), 7,53 (br s, 1Н), 6,72 (d, J=8,2 Гц, 1H), 3,71 (s, 3H).
6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-метоксиникотинамид (4)
[0954] Суспензию 6-(4-бром-3-формил-фенокси)-2-метокси-никотинамида (4,05 г, 11,5 ммоль) в 1,2-диметоксиэтане (240 мл) нагревали до 100°С в течение 20 минут, пока растворилось все твердое вещество. Добавляли биспинаколатодибор (5,86 г, 23,1 ммоль) и КОАс (2,26 г, 23,1 ммоль), и данную реакционную смесь перемешивали при 100°С дополнительно в течение 10 минут. Добавляли PdCl2 (dppf) (0,84 г, 1,2 ммоль), и реакционную смесь перемешивали при 100°С в течение 70 минут. Смесь очищали путем колоночной флэш-хроматографии на силикагеле (50-80% этилацетат /гексаны) с получением указанного в заголовке соединения в виде белого твердого вещества (3,21 г, выход 69%).
1H ЯМР (400 МГц, ДМСО-d6) δ 10,39 (s, 1Н), 8,28 (d, J=8,2 Гц, 1Н), 7,82 (d, J=8,2 Гц, 1Н), 7,71 (d, J 2,3 Гц, 1Н), 7,60 (br s, 1Н), 7,53 (dd, J=8,2, 2,3 Гц, 1H), 7,53 (br s, 1H), 6,71 (d, J=8,2 Гц, 1H), 3,72 (s, 3H), 1,33 (s, 12H).
6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-метоксиникотинамид (D112)
[0955] К раствору 6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-2-метокси-никотинамида (2,51 г, 6,30 ммоль) в CH2Cl2 (40 мл) добавляли раствор NaBH4 (0, 077 г, 2,0 ммоль) в безводном метаноле (10 мл), и перемешивали при комнатной температуре в течение 5 минут. Затем добавляли порциями в течение 45 минут при комнатной температуре твердый NaBH4 (0,400 г, 10,6 ммоль). Данную реакционную смесь перемешивали дополнительно в течение 30 минут, затем прекращали реакцию путем добавления 50% водного раствора уксусной кислоты (1 мл). Перемешивали еще в течение 30 минут при комнатной температуре, и затем раствор концентрировали под вакуумом. Остаток очищали путем колоночной флэш-хроматографии на силикагеле (АсОН/МеОН/СН2Сl2, 1:3:100 об./об./об.) с получением указанного в заголовке соединения в виде белого рыхлого твердого вещества (0,220 г, выход 12%).
1Н ЯМР (400 МГц, ДMCO-d6) δ 9, 20 (s, 1Н), 8,25 (d, J=8,2 Гц, 1Н), 7,76 (d, J=7,8 Гц, 1Н), 7,58 (br s, 1Н), 7,53 (br s, 1H), 7,25 (br s, 1H), 7,16 (br d, J=7,8 Гц, 1H), 6,58 (d, J=8,2 Гц, 1H), 4,97 (s, 2H), 3,75 (s, 3H). Масс-спектр: [M+H+]=301.
Чистота согласно ВЭЖХ: 94, 05% (Maxplot), 94, 02% (220 нм), 92,23% (254 нм).
19dp 2-(2-Бензилоксиэтиламино)-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D113)
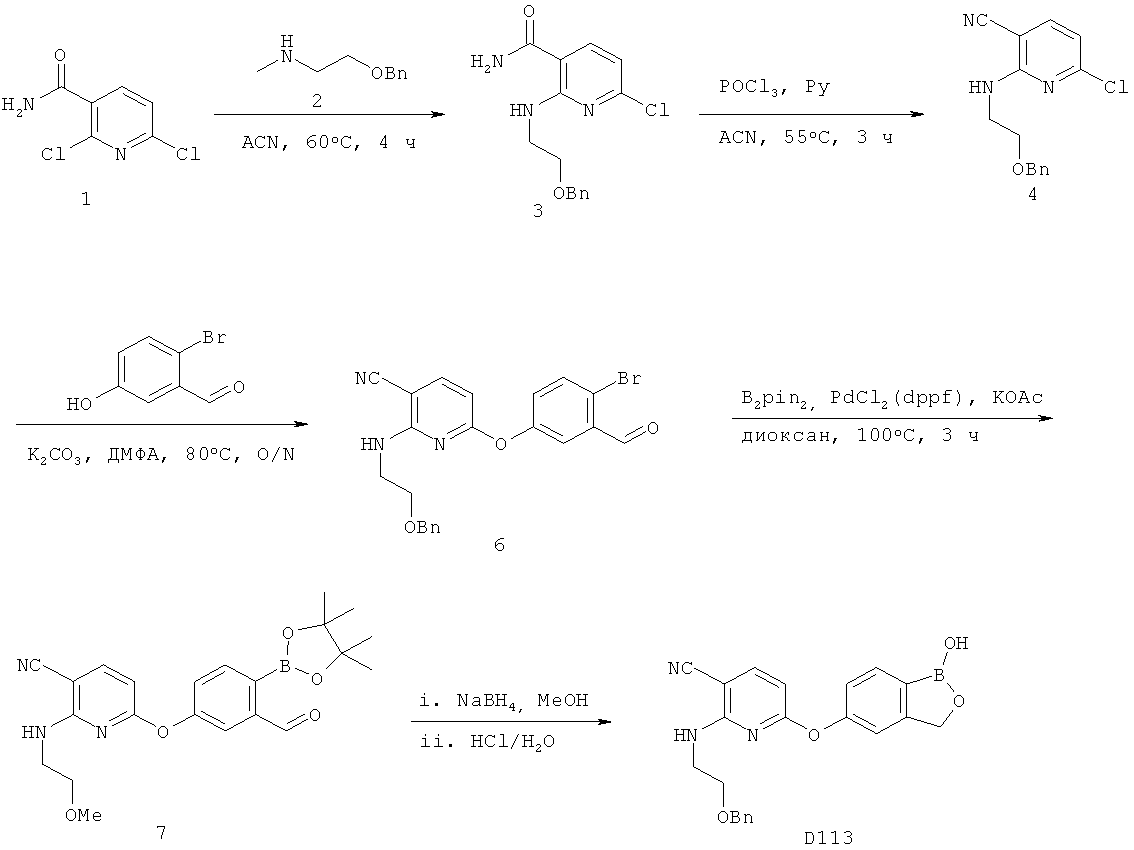
2-(2-Бензилоксиэшиламино)-6-хлорникотинамид (3)
[0956] К раствору 2,6-дихлорникотинамида (1) (12,6 г, 66,1 ммоль) в безводном ацетонитриле (200 мл) добавляли 2-бензилоксиэтиламин (2) (10 г, 66,1 ммоль) и триэтиламин (11 мл, 7 9,3 ммоль). Данную реакционную смесь нагревали при 60°С в течение 2 суток. Раствор охлаждали до комнатной температуры, и полученную суспензию фильтровали. Фильтрат упаривали под вакуумом. Остаток очищали, используя Biotage (25-100% EtOAc/гексаны), с получением 15,8 г (выход 78,3%) указанного в заголовке соединения.
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 8,70 (br. s., 1Н), 7,46 (d, J=8,2 Гц, 1Н), 7, 40-7, 23 (m, 5 Н), 6,44 (d, J=8,2 Гц, 1Н), 5,97 (br. s., 2Н), 4,58 (s, 2Н), 3, 75-3, 66 (m, 4Н).
2-(2-Бензилоксиэтиламино)-6-хлорникотинонитрил (4)
[0957] К раствору 2-(2-бензилоксиэтиламино)-6-хлорникотинамида (3) (15,8 г, 51,7 ммоль) в безводном ацетонитриле (200 мл) добавляли пиридин (33,4 мл, 413 ммоль) и РOСl3 (18,9 мл, 207 ммоль). Данную реакционную смесь нагревали при 55°С в течение 3 часов. После охлаждения до комнатной температуры pH смеси доводили до 9, медленно добавляя 10% водный раствор NaOH. Добавляли EtOAc (200 мл), и слои разделяли. Водный слой экстрагировали EtOAc (этилацетатом) (2×200 мл). Объединенный органический слой сушили над MgSO4, фильтровали и упаривали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 2-20% EtOAc/гексаны, с получением указанного в заголовке соединения (10 г, выход 67%).
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,56 (d, J=7,8 Гц, 1Н), 7,41-7,27 (m, 5 Н), 6,60 (d, J=7,8 Гц, 1Н), 5,68 (br, s,, 1Н), 4,57 (s, 2Н), 3,76-3,63 (га, 4Н).
2-(2-Бензилоксиэтиламино)-6-(4-бром-3-формилфенокси)-никотинонитрил (6)
[0958] К раствору 2-(2-бензилоксиэтиламино)-6-(4-бром-3-формилфенокси)-никотинонитрила (4) (10 г, 34,7 ммоль) в безводном ДМФА (300 мл) добавляли 2-бром-5-гидрокси-бензальдегид (7 г, 34,7 ммоль) и К2СО3 (9,6 г, 69,4 ммоль). Данную реакционную смесь нагревали при 80°С в течение 16 часов. ДМФА выпаривали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 2,5-20% EtOAc/гексаны, с получением указанного в заголовке соединения (10 г, выход 64%). 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 10,34 (s, 1Н), 7,75-7,60 (m, 3Н), 7,39-7,20 (m, 6Н), 6,20 (d, J=6,6 Гц, 1Н), 5,59 (br s, 1Н), 4,43 (s, 2Н), 3, 50-3, 36 (m, 4Н).
2-(2-Бензилоксиэтиламино)-6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрил (7)
[0959] К раствору 2-(2-бензилоксиэтиламино)-6-(4-бром-3-формилфенокси)-никотинонитрила (6) (10 г, 22,1 ммоль) в безводном 1,4-диоксане (360 мл) добавляли биспинаколатодибор (6,74 г, 2 6,5 ммоль), PdCl2(dppf) (1,62 г, 2,21 ммоль) и КОАс (6,5 г, 66,3 ммоль). Раствор перемешивали при комнатной температуре в течение 30 минут, используя барботирование азотом (N2). Затем реакционную смесь нагревали при 100°С в течение 3 часов. После завершения реакции раствор фильтровали и концентрировали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 2,5-20% EtOAc/гексаны, с получением 9 г (выход 8 2%) указанного в заголовке соединения.
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 10,63 (s, 1Н), 7,93 (d, J=8,2 Гц, 1Н), 7,77 (s, 1Н), 7, 66-7, 62 (m, 1Н), 7, 38-7,25 (m, 6Н), 6,18 (d, J=8,2 Гц, 1Н), 5,56 (br s, 1Н), 4,48 (s, 2Н), 3,47 (t, J=5,3 Гц, 2Н), 3,39 (q, J=5,4 Гц, 2Н), 1,39 (s, 12Н).
2-(2-Бензилоксиэтиламино)-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D113) [0960] К прозрачному раствору 2-(2-бензилокси-этиламино)-6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрила (7) (9 г, 18 ммоль) в безводном МеОН (200 мл) медленно добавляли NaBH4 (4,11 г, 108 ммоль). Данную реакционную смесь перемешивали при комнатной температуре в течение 4 часов, затем добавляли 1 М раствор НСl (200 мл). Перемешивание продолжали в течение ночи при комнатной температуре. Затем раствор медленно упаривали под вакуумом. Образовавшееся твердое вещество отфильтровывали, промывали водой и сушили на воздухе с получением 3,3 г (выход 45,6%) указанного в заголовке соединения в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,91 (d, J=8,6 Гц, 2Н), 7,76 (d, J=8,2 Гц, 2Н), 7,35-7,18 (m, 5 Н), 7,15 (s, 1Н), 7,08 (dd, J=8,2, 2,0 Гц, 1Н), 6,23 (d, J=8,6 Гц, 1Н), 4,94 (s, 2Н), 4,29 (s, 2Н), 3,34-3,21 (m, 4Н). Масс-спектр (ИЭР) m/z: 402 (М+Н)+; ВЭЖХ: 92,59% (220 нм), 93,22% (MaxPlot).
19dq 6-(4-Фтор-1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-метоксиникотинонитрил (D114)
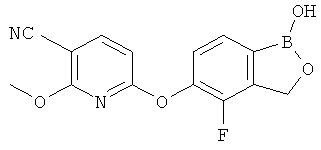
[0961] Раствор безводного тетрагидрофурана (50 мл) и диизопропиламина (11 мл) охлаждали до 0°С, и добавляли по каплям в атмосфере N2 (используя баллон с азотом) 1,6 М раствор н-бутиллития в гексане (47 мл). Данную смесь перемешивали в течение 10 минут при 0°С и затем охлаждали до-78°С в бане со смесью сухого льда и ацетона. К реакционной смеси добавляли по каплям в атмосфере N2 (используя баллон с азотом) смесь 4-бром-2-фтор-1-метоксибензола (7,9 мл, 61 ммоль) и безводного тетрагидрофурана (50 мл). Затем полученную смесь оставляли перемешиваться в течение 30 минут при -78°С. Добавляли по каплям при -78°С в атмосфере N2 (используя баллон с азотом) N,N-диметилформамид (7,5 мл). Реакционную смесь перемешивали в течение 1 часа при комнатной температуре в атмосфере N2 (используя баллон с азотом). Половину растворителя удаляли из раствора при пониженном давлении, и оставшийся раствор экстрагировали с использованием этилацетата, воды (300 мл) и 1 М НСl (65 мл). Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении. Остаток кристаллизовали путем промывания гексаном. Образовавшееся твердое вещество собирали путем фильтрования и сушили при пониженном давлении с получением 6-бром-2-фтор-3-метокоибонзальдегида (8,21 г, выход 58%).
[0962] Раствор 6-бром-2-фтор-3-метоксибензальдегида (2 г, 8,58 ммоль) в дихлорметане (43 мл) охлаждали до-78°С в в бане со смесью сухого льда и ацетона в атмосфере N2 (используя баллон с азотом). Добавляли по каплям в атмосфере N2 (используя баллон с азотом) 1 М раствор бромида бора в дихлорметане (9,5 мл). Данную реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь помещали на баню с ледяной водой, и избыток бромида бора гасили путем добавления ледяной крошки. Добавляли воду, и данный раствор экстрагировали дихлорметаном. Водный слой экстрагировали еще два раза дихлорметаном. Органические слои объединяли, промывали солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении с получением 6-бром-2-фтор-3-гидроксибензальдегида (1,61 г, выход 86%).
[0963] Раствор 6-бром-2-фтор-3-гидроксибензальдегида (1,61 г, 7,35 ммоль), этиленгликоля (2 мл, 36,8 ммоль), пара-толуолсульфоновой кислоты {0Г21 г, 0,147 ммоль) и толуола (150 мл) подвергали кипячению с обратным холодильником, используя насадку Дина-Старка, в течение 16 часов. Добавляли водный раствор бикарбоната натрия, и полученный раствор экстрагировали этилацетатом. Водный слой экстрагировали еще пять раз этилацетатом. Органические слои объединяли и промывали солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении с получением 4-бром-3-(1,3-диоксолан-2-ил)-2-фторфенола (1,81 г, выход 94%).
[0964] Раствор 6-хлор-2-метоксиникотинонитрила (1,16 г, 6,88 ммоль), 4-бром-3-(1,3-диоксолан-2-ил)-2-фторфенола (1,81 г, 6,88 ммоль), карбоната калия (1,14 г, 8,26 ммоль) и N,N-диметилформамида (35 мл) перемешивали в течение ночи при 80°С. Добавляли воду, и затем раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении, и остаток очищали на колонке силикагеля, используя Combiflash, с получением 6-(4-бром-3-(1,3-диоксолан-2-ил)-2-фторфенокси)-2-метоксиникотинонитрила (2,31 г, выход 85%).
[0965] К раствору 6-(4-бром-3-(1,3-диоксолан-2-ил)-2-фторфенокси)-2-метоксиникотинонитрила (2,31 г, 5,85 ммоль) в 1,4-диоксане (30 мл) добавляли ацетат калия, бис(пинаколато)дибор (1,64 г, 6,44 ммоль) и 1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий (II) (0,119 г, 0,146 ммоль). Данную реакционную смесь перемешивали в течение ночи в атмосфере N2 (используя баллон с азотом) при 80°С. Реакционную смесь охлаждали до комнатной температуры и фильтровали через целит с использованием этилацетата. Растворитель удаляли при пониженном давлении. Остаток очищали на колонке силикагеля, используя Combiflash, с получением 6-(3-(1,3-диоксолан-2-ил)-2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)-2-метоксиникотинонитрила (2,18 г, выход 85%).
[0966] К раствору 6-(3-(1,3-диоксолан-2-ил)-2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)-2-метоксиникотинонитрила (2,18 г, 4,93 ммоль) в тетрагидрофуране (6 мл) добавляли 3 М НСl (3 мл). Данный раствор подвергали кипячению с обратным холодильником в течение четырех часов. Затем раствор охлаждали до комнатной температуры, и добавляли воду. Данный раствор экстрагировали этилацетатом. Органический слой промывали водой, затем промывали солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении с получением 6-(2-фтор-3-формил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)-2-метоксиникотинонитрила (1,45 г, выход 74%).
[0967] Раствор 6-(2-фтор-3-формил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)-2-метоксиникотинонитрила (1,45 г, 3,64 ммоль) в метаноле (15 мл) помещали в баню с ледяной водой. Добавляли порциями борогидрид натрия. Данную реакционную смесь перемешивали при О°С в течение пяти минут и затем перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь снова охлаждали до О°С в бане с ледяной водой, и добавляли боргидрид натрия (0,034 г, 0,91 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь снова охлаждали до 0°С, и добавляли еще одну порцию боргидрида натрия (0,034 г, 0,91 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение одного часа. Реакционную смесь нейтрализовали до pH 6-7 с использованием 1 М НСl. Затем данный раствор экстрагировали с использованием этилацетата и 0,5 М раствора борной кислоты в воде. Органический слой промывали еще два раза 0,5 М раствором броной кислоты, затем промывали солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении. Остаток очищали на колонке силикагеля, используя Combiflash, с получением 6-(4-фтор-1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-метоксиникотинонитрила (0,220 г, выход 20%). Масс-спектр (ИЭР(-)) m/z: 300 (М-Н)-; 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 3,67 (s, 3Н), 5,11 (s, 2Н), 6,82 (d, J=8,2 Гц, 1Н), 7,39 (t, J=6,8, J=7,5 Гц, 1Н), 7,60 (d, J=7,8 Гц, 1Н), 8,28 (d, J=8,2 Гц, 1Н), 9,47 (s, 1Н).
19dr 6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-[(2-гидроксиэтил)-метиламино]-никотинонитрил (D115)
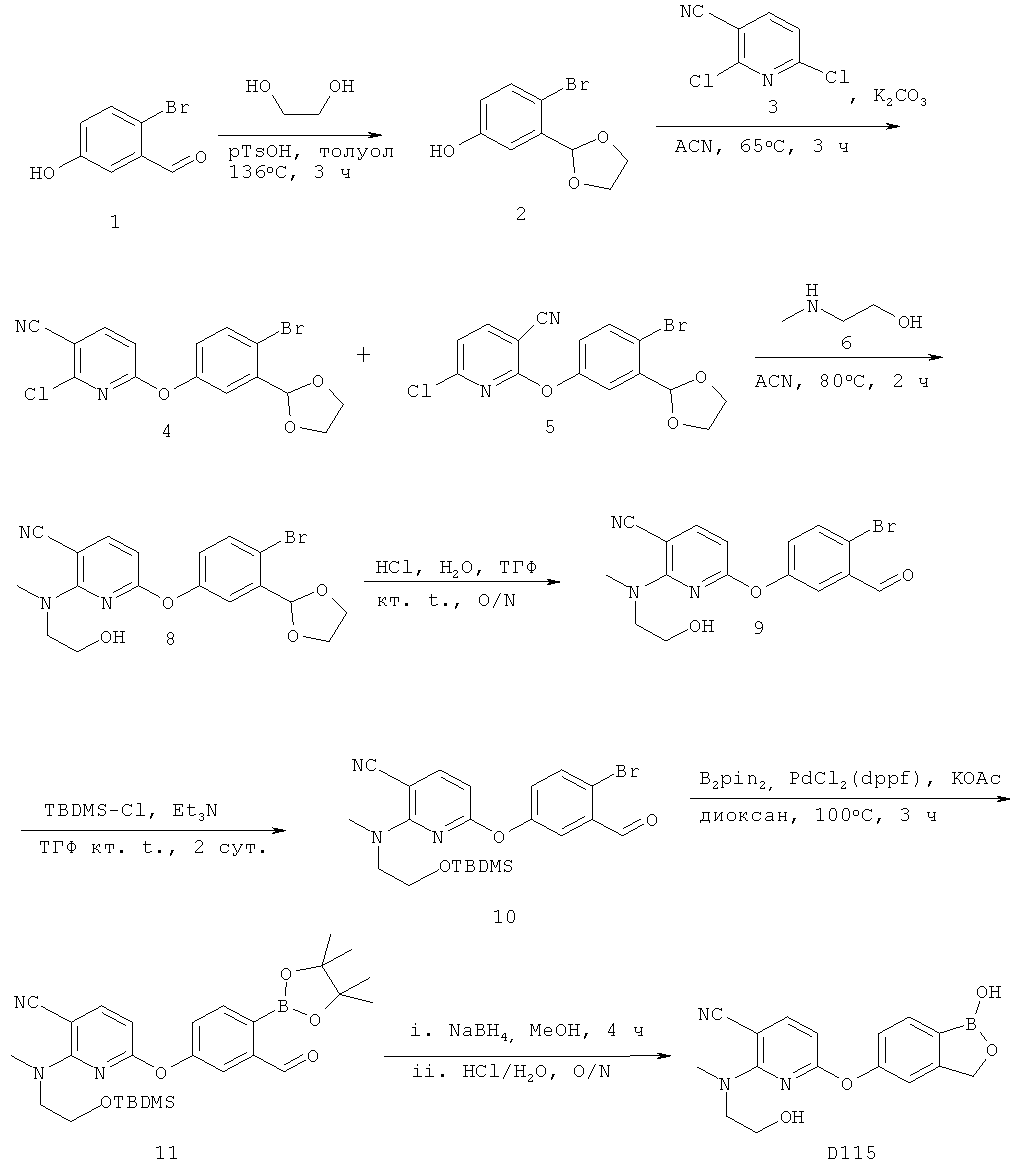
4-Бром-3-[1,3]диоксолан-2-ил-фенол (2)
[0968] К раствору 2-бром-5-гидроксибензальдегида (1) (10 г, 49,8 ммоль) в толуоле (200 мл) добавляли этиленгликоль (9,25 г, 149,3 ммоль) и каталитическое количество пapa-TsOH (200 мг). Устанавливали насадку Дина-Старка, и реакционную смесь нагревали при 136°С в течение 3 часов. Затем раствор охлаждали до комнатной температуры и промывали насыщенным раствором NаНСО3 (200 мл). Органический слой сушили над Na2SO4, фильтровали и упаривали под вакуумом с получением указанного в заголовке соединения (11,6 г, выход 95%). 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,40 (d, J=8,6 Гц, 1Н), 7,09 (d, J=3,1 Гц, 1Н), 6,72 (dd, J=8,6, 3,1 Гц, 1Н), 6,04 (s, 1Н), 4,18-4,04 (m, 4Н).
6-(4-Бром-3-[1,3]диоксолан-2-ил-фенокси)-2-хлор-никотинонитрил+2-(4-бром-3-[1,3]диоксолан-2-ил-фенокси)-6-хлор-никотинонитрил (4+5)
[0969] К раствору 2,6-дихлор-никотинонитрила (3) (7,06 г, 40,8 ммоль) в безводном ацетонитриле (300 мл) добавляли 4-бром-3-[1,3] диоксолан-2-ил-фенол (2) (10 г, 40,8 ммоль) и К2СO3 (5, 63 г, 4 0,8 ммоль). Данную реакционную смесь нагревали при 65°С в течение 3 часов. Затем раствор фильтровали и упаривали под вакуумом с получением 15,6 г целевой смеси. 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,94 (d, J=9,0 Гц, 2Н), 7,62 (d, J=8,6 Гц, 2Н), 7,46 (d, J=3,1 Гц, 1Н), 7,41 (d, J=3,1 Гц, 1Н), 7,18-7,08 (m, 2Н), 7,05 (dd, J=8,8, 2,93 Гц, 1Н), 6,93 (d, J=8,2 Гц, 1Н), 6,11 (s, 1Н), 6,09 (s, 1Н), 4,19-3,99 (m, 8Н).
6-(4-Бром-3-[1,3]диоксолан-2-ил-фенокси)-2-[(2-гидрокси-этил)-метиламино]-никотинонитрил (8)
[0970] К раствору смеси 6-(4-бром-3-[1,3]диоксолан-2-ил-фенокси)-2-хлор-никотинонитрила и 2-(4-бром-3-[1,3]диоксолан-2-ил-фенокси)-6-хлор-никотинонитрила (4+5) (1 г, 2,6 ммоль) в безводном ацетонитриле (30 мл) добавляли 2-метиламино-этанол (6) (2,1 мл, 26 ммоль). Данную реакционную смесь нагревали при 80°С в течение 2 часов. После завершения реакции все летучие компоненты выпаривали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 10-80% EtOAc/гексан, с получением указанного в заголовке соединения (400 мг, выход 36%). 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,71-7,68 (m, 1Н), 7,59 (d, J=8,6 Гц, 1Н), 7,42 (d, J=2,7 Гц, 1Н), 7,00 (dd, J=8,6, 3,0 Гц, 1Н), 6,25 (d, J=8,6 Гц, 1Н), 6,06 (s, 1Н), 4,19-4,04 (m, 4Н), 3, 60-3, 43 (m, 4Н), 3, 35-3, 30 (m, 3Н).
2-(4-Бром-3-формилфенокси)-6-[(2-гидроксиэтил)-метиламино]-никотинонитрил (9)
[0971] К раствору 6-(4-бром-3-[1,3]диоксолан-2-ил-фенокси)-2-[(2-гидроксиэтил)-метиламино]-никотинонитрила (8) (7,6 г, 18,1 ммоль) в ТГФ (100 мл) добавляли раствор НСl (1 М, 100 мл). Данную реакционную смесь перемешивали в течение ночи при 50°С. После завершения реакции весь ТГФ выпаривали под вакуумом. Водный раствор экстрагировали EtOAc (этилацетатом) (2×50 мл). Органический слой промывали водой (3×50 мл), сушили над MgSO4, фильтровали и упаривали под вакуумом с получением 6,8 г (выход 100%) необходимого продукта.
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 10,34 (s, 1Н), 7,80-7, 65 (m, 3Н), 7,26-7, 22 (m, 1Н), 6,28 (d, J=8,6 Гц, 1Н), 3,71-3,64 (m, 2Н), 3,58 (t, J=5,7 Гц, 2Н), 3,29 (s, 3Н), 2,03 (s, 1Н).
6-(4-Бром-3-формилфенокси)-2-{[2-(трет-бутилдиметилсиланилокси)-этил]-метиламино}-никотинонитрил (10)
[0972] К раствору 2-(4-бром-3-формил-фенокси)-6-[(2-гидроксиэтил)-метил-амино]-никотинонитрила (9) (8 г, 21,3 ммоль) в безводном ТГФ (100 мл) добавляли TBDMS-Cl (3,21 г, 21,3 ммоль) и Et3N (3 мл, 21,3 ммоль). Данный раствор перемешивали при комнатной температуре в течение 2 суток. Затем раствор фильтровали и концентрировали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 5-50% EtOAc/гексан, с получением 10 г (выход 85%) указанного в заголовке соединения.
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 10,37 (s, 1Н), 7,78-7,73 (m, 2Н), 7,69 (d, J=8,6 Гц, 1Н), 7, 30-7,26 (m, 1Н), 6,28 (d, J=8,6 Гц, 1Н), 3,66-3,57 (m, 4Н), 3,28 (s, 3Н), 0,87 (s, 9Н), 0,00 (s, 6Н).
2-{[2-(трет-Бутилдиметилсиланилокси)-этил]-метиламино}-6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрил (11)
[0973] К раствору 6-(4-бром-3-формилфенокси)-2-{ [2-(трет-бутилдиметилсиланилокси)-этил]-метиламино}-никотинонитрила (10) (5 г, 10,2 ммоль) в безводном 1,4-диоксане (150 мл) добавляли биспинаколатодибор (3,11 г, 12,2 ммоль), PdCl2(dppf) (0,75 г, 1,02 ммоль) и КОАс (3 г, 30,6 ммоль). Данный раствор перемешивали при комнатной температуре в течение 30 минут, используя барботирование азотом (N2). Затем реакционную смесь нагревали при 100°С в течение 3 часов. Затем раствор фильтровали и концентрировали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 5-10% EtOAc/гексан с получением 5,2 г (выход 95%) указанного в заголовке соединения.
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 10,70 (s, 1Н), 7,98 (d, J=8,2 Гц, 1Н), 7,81 (d, J=2,3 Гц, 1Н), 7,77-7, 73 (m, 1Н), 7,39 (dd, J=8,2, 2,3 Гц, 1Н), 6,28 (d, J=8,2 Гц, 1Н), 3,71-3,51 (m, 4Н), 3,29 (s, 3Н), 1,44 (s, 12Н), 0,87 (s, 9Н), 0,00 (s, 6Н).
6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-[(2-гидроксиэтил)-метиламино]-никотинонитрил (D115)
[0974] К прозрачному раствору соединения (11) (5,2 г, 9,7 ммоль) в безводном МеОН (150 мл) медленно добавляли NaBH4 (2,2 г, 58 ммоль). Данную реакционную смесь перемешивали при комнатной температуре в течение 4 часов, затем добавляли раствор НСl (1 М, 150 мл). Перемешивание продолжали в течение ночи при комнатной температуре. Затем раствор медленно упаривали под вакуумом. Очистку выполняли путем обращеннофазной хроматографии (Biotage), используя для элюирования градиент 5-100% МеОН/H2O, с получением 786 мг желаемого продукта (выход 25%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,22 (s, 1Н), 7,93 (d, J=8,6 Гц, 1Н), 7,75 (d, J=8,2 Гц, 1Н), 7,22 (s, 1Н), 7,13 (dd, J=7,8, 2,0 Гц, 1Н), 6,31 (d, J=8,6 Гц, 1Н), 4,98 (s, 2Н), 4,66 (t, J=5,1 Гц, 1Н), 3, 48-3, 44 (m, 2Н), 3,41 (t, J=5,1 Гц, 2Н), 3,16 (s, 3Н). Масс-спектр (ИЭР) m/z: 326 (М+Н)+; ВЭЖХ: 99,0% (220 нм), 98,21% (MaxPlot).
19ds 2-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-4-метокси-пиримидин-5-карбонитрил (D116)
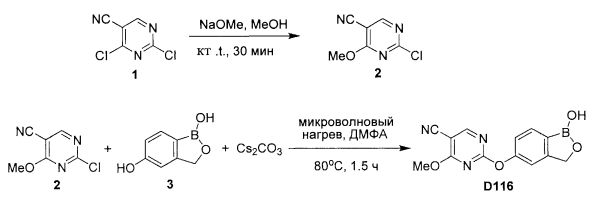

2-Хлор-4-метоксипиримидин-5-карбонитрил (2)
[0975] К раствору 2,4-дихлорпиримидин-5-карбонитрила (1) (300 мг, 1,72 ммоль) в безводном ТГФ (20 мл) добавляли раствор метоксид натрия (0,5 М/МеОН, 3,45 мл, 1,72 ммоль). Данную реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Летучие компоненты удаляли под вакуумом. Очистку выполняли путем хроматографии на силикагеле (Biotage), используя для элюирования градиент 2-30% EtOAc/гексан, с получением указанного в заголовке соединения (130 мг, выход 45%). 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 8,62 (s, 1Н), 4,18 (s, 3Н).
2-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-4-метокси-пиримидин-5-карбонитрил
[0976] К прозрачному раствору 2-хлор-4-метокси-пиримидин-5-карбонитрила (2) (500 мг, 2,95 ммоль) в безводном ДМФА (30 мл) добавляли 3Н-бензо[с][1,2]оксаборол-1,5-диол (3) (221 мг, 1,47 ммоль) и CS2CO3 (1054 мг, 3,24 ммоль). Данную реакционную смесь нагревали при 80°С в течение 2 ч в микроволновой печи. pH смеси доводили до 2 путем добавления НСl (1 М). Все летучие компонент компоненты удаляли под вакуумом. Очистку выполняли путем обращеннофазной хроматографии (Biotage), используя для элюирования градиент 5-100% МеОН/Н2O, с получением указанного в заголовке соединения (125 мг, выход 30%) в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДMCO-d6) δ м.д. 9,26 (s, 1Н), 8,88 (s, 1Н), 7,80 (d, J=8,0 Гц, 1Н), 7,31 (s, 1Н), 7,23 (dd, J=8,0, 1,8 Гц, 1Н), 5,01 (s, 2Н), 4,00 (s, 3Н). Масс-спектр (ИЭР) m/z: 284 (М+Н)+; ВЭЖХ: 92,78% (220 нм), 94,74% (MaxPlot).
19dt 5-[5-Аминометил-6-(2-бензилокси-этиламино)-пиридин-2-илокси]-3Н-бензо[с][1,2]оксаборол-1-ол (D117)
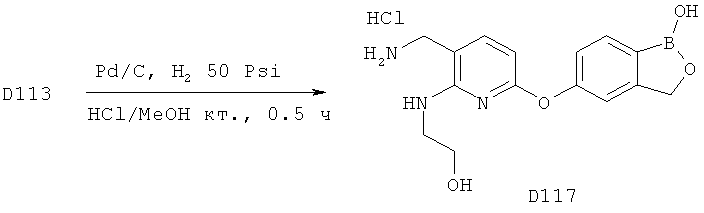
[0977] К раствору соединения D113 (2,5 г, 6,23 ммоль) в безводном МеОН (50 0 мл) добавляли Pd/C (100 мг). Гидрирование выполняли при комнатной температуре, в атмосфере Н2 (50 Psi (344,75·103 Па)) в течение 30 минут. Затем полученную суспензию фильтровали. Фильтрат концентрировали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 5-20% МеОН/ДХМ, с получением 1,95 г (выход 99%) указанного в заголовке соединения в виде белого твердого вещества.
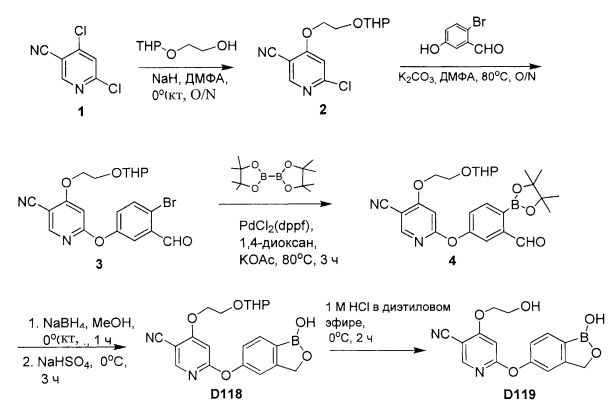

6-Хлор-4-[2-(театрагидропиран-2-илокси)-этокси]-никошинонитрил (2) [0978] К раствору 2-(тетрагидропиран-2-илокси)-этанола (6,32 г, 4 3, 30 ммоль) в ДМФА (15 мл) при 0°С добавляли порциями 95% гидрид натрия в минеральном масле (1,09 г, 43,30 ммоль). После выдерживания в течение 1 ч при комнатной температуре данную смесь медленно добавляли к раствору 4,6-дихлор-никотинонитрила (5,0 г, 28, 90 ммоль) в ДМФА (25 мл) при 0°С. Оставляли на ночь, ДМФА удаляли при пониженном давлении, и полученную смесь разбавляли EtOAc (50 мл). Органический слой промывали водой (20 мл) и солевым раствором (3×20 мл), сушили над безводным Na2SO4, фильтровали и концентрировали. Очистку выполняли путем флэш-хроматографии на силикагеле, применяя градиентное элюирование (5-25% EtOAc/гексан), с получением указанного в заголовке соединения (4,9 г, 60%) в виде прозрачного масла. 1Н ЯМР (400 МГц, CDCl3) δ м.д. 8,47 (s, 1Н), 7,10 (s, 1Н), 4,70 (t, J=3,3 Гц, 1Н), 4,32-4,45 (m, 2Н), 4,19-4,08 (m, 1Н), 3,91-3,80 (m, 2Н), 3, 59-3, 50 (m, 1Н), 1, 83-1, 68 (m, 2Н), 1, 65-1,50 (m, 4Н).
[0979] К смеси 6-хлор-4-[2-(тетрагидропиран-2-илокси)-этокси]-никотинонитрила (4,8 г, 16,62 ммоль) и 2-бром-5-гидроксибензальдегида (4,01 г, 19,94 ммоль) в ДМФА (30 мл) добавляли карбонат калия (3,44 г, 24,93 ммоль). Полученную смесь нагревали при 80°С в течение ночи. ДМФА удаляли при пониженном давлении, и остаток разбавляли EtOAc (200 мл). Органический слой промывали водой (20 мл) и солевым раствором (3×20 мл), сушили над Na2SO4, фильтровали и концентрировали с получением белого твердого вещества. Очистку выполняли путем флэш-хроматографии на силикагеле, используя градиентное злюирование (2-25% EtOAc/гексан), с получением указанного в заголовке соединения (4,8 г, 64%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,19 (s, 1Н), 8,46 (s, 1Н), 7,88 (d, J=8,6 Гц, 1Н), 7,60 (d, J=2,7 Гц, 1Н), 7,49 (dd, J=8,6, 2,7 Гц, 1Н), 7,09 (s, 1Н), 4, 75-4, 67 (m, 1Н), 4, 49-4,45 (m, 2Н), 4, 00-3, 89 (m, 1Н), 3, 85-3, 74 (m, 2Н), 3,49-3,41 (m, 1Н), 1, 78-1, 53 (m, 2Н), 1,39-1,53 (m, 4Н).
6-[3-Формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-4-[2-(тетрагидро-пиран-2-илокси)-этокси]-никотинонитрил (4)
[0980] К дегазированному раствору 6-(4-бром-3-формил-фенокси)-4-[2-(тетрагидро-пиран-2-илокси)-этокси]-никотинонитрила (4,9 г, 10,09 ммоль) в 1,4-диоксане (35 мл) добавляли бис(пинаколато)дибор (3,18 г, 12,54 ммоль), ацетат калия (3,21 г, 37,7 ммоль) и хлорид [1,1'-бис(дифенилфосфино)ферроцен]палладия (II) (0,38 г, 0,52 ммоль). Полученную суспензию дегазировали, используя продувание N2, и нагревали при 80°С в течение 3 ч. Затем смесь охлаждали до комнатной температуры, пропускали через Celite® и разбавляли EtOAc (150 мл). Органический слой промывали водой (20 мл) и солевым раствором (20 мл), сушили над Na2SO4, фильтровали и концентрировали. Очистку выполняли путем флэш-хроматографии на силикагеле, используя градиентное элюирование (5-25% EtOAc/гексан), с получением указанного в заголовке соединения (3,8 г, 64%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,39 (s, 1Н), 8,44 (s, 1Н), 7,83 (d, J=7,8 Гц, 1Н), 7,62 (d, J=2,3 Гц, 1Н), 7,49 (dd, J=8,2, 2,3 Гц, 1Н), 7,06 (s, 1Н), 4,69 (s, 1Н), 4, 47-4, 39 (m, 2Н), 4, 02-3, 92 (m, 1Н), 3,80-3,70 (m, 2Н), 3, 49-3, 38 (m, 1Н), 1,72-1, 58 (m, 2Н), 1,50-1,42 (m, 4Н), 1,33 (s, 12Н).
6-(1-Гидрокси-1,3-дигидро-бензо[с] [1,2]оксаборол-5-илокси)-4-[2-(тетрагидро-пиран-2-илокси)-эшокси]-никотинонитрил (D118)
[0981] К раствору 6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-4-[2-(тетрагидропиран-2-илокси)-этокси]-никотинонитрила (0,5 г, 1,02 ммоль) в метаноле (3 мл) при 0°С добавляли боргидрид натрия (0,07 г, 2,04 ммоль). После выдерживания в течение 1 ч при комнатной температуре раствор охлаждали в ледяной бане, и pH доводили до 4-5 путем добавления 1 М NaHSO4 (2,6 мл, 2,6 ммоль). Полученную смесь обрабатывали ультразвуком и перемешивали при 0°С в течение 1 ч. Выпавшее в осадок белое твердое вещество отфильтровывали, промывали МеОН, и лиофилизировали с получением указанного в заголовке соединения D118 (0,1 г, 25%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ДMCО-d6) δ м.д. 9,22 (s, 1Н), 8,46 (s, 1Н), 7,77 (d, J=7,8 Гц, 1Н), 7,21 (d, J=l,6 Гц, 1Н), 7,15-7,09 (га, 1Н), 7,02 (s, 1Н), 4,99 (s, 2Н), 4,71 (s, 1Н), 4, 49-4, 40 (m, 2Н), 4,02-3,91 (m, 1Н), 3,84-3,73 (m, 2Н), 3,49-3,41 (m, 1Н), 1,72-1,58 (m, 2Н), 1,55-1,41 (m, 4Н). Масс-спектр (ИЭР) m/z: 397 (М+1)+; чистота согласно ВЭЖХ: 97,55% (Maxplot), 97,65% (220 нм).
6-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-4-(2-гидроксиэшокси)-никошинонитрил (D119)
[0982] К суспензии 6-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-4-[2-(тетрагидропиран-2-илокси)-этокси]-никотинонитрила (1,8 г, 4,54 ммоль) в метаноле (15 мл) при 0°С добавляли 1 М НСl в диэтиловом эфире (5,45 мл, 5,45 ммоль), и оставляли при этой же температуре на 2 ч. Образовавшееся твердое вещество собирали путем фильтрования, растворяли в минимальном объеме смеси 10% МеОН/СНСl3, и пропускали через короткую колонку. Выпаривали растворитель с получением указанного в заголовке соединения D119 (0,28 г, 20%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,23 (s, 1Н), 8,45 (s, 1Н), 7,77 (d, J=7,8 Гц, 1Н), 7,22 (s, 1Н), 7,15-7,09 (m, 1Н), 7,01 (s, 1Н), 5,04 (t, J=5,3 Гц, 1Н), 4,99 (s, 2Н), 4,30 (t, J=4,5 Гц, 2Н), 3, 79-3, 76 (m, 2Н). Масс-спектр (ИЭР) m/z: 313 (М+1)+; чистота согласно ВЭЖХ: 99,27% (Maxplot), 99, 66% (220 нм). Элементный анализ C15H13BN2O5. Рассчитано: С, 57,73; Н, 4,20; N, 8,98. Найдено: С, 57,53; Н, 4,31; N, 8,95.
19dw 4-Этокси-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D120)
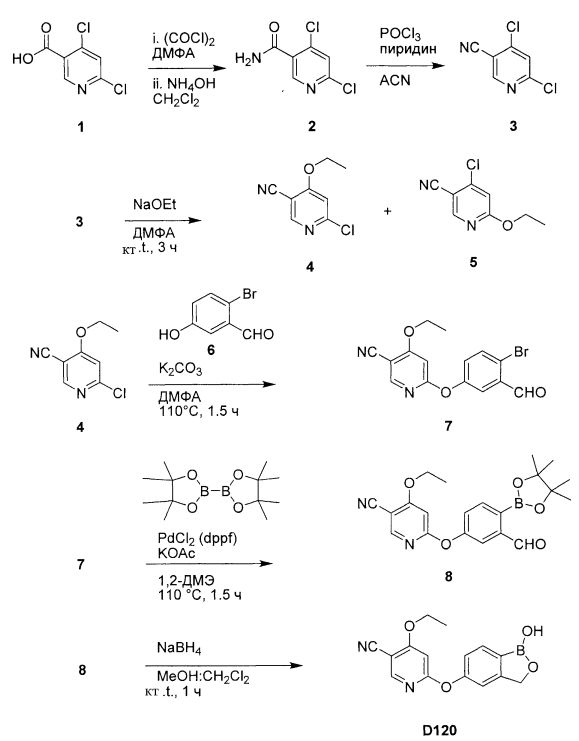

4,6-Дихлорникотинамид (2)
[0983] К суспензии 4,6-дихлорникотиновой кислоты (8,47 г, 44,1 ммоль) в диметилформамиде (200 мл) при комнатной температуре добавляли в течение 1 часа оксалилхлорид (7,70 мл, 88,3 ммоль). Реакционную смесь дополнительно перемешивали в течение 3 часов при комнатной температуре, затем концентрировали под вакуумом. Остаток растворяли в СН2Сl2 (200 мл), и затем по каплям в течение 30 минут добавляли NH4OH (8,3 мл, 130 ммоль) [Примечание: добавление NH4OH сопровождалось выделением тепла, поэтому приходилось контролировать скорость добавления, чтобы температура реакционной смеси не превышала 25°С]. Реакционную смесь дополнительно перемешивали в течение 1 часа при комнатной температуре, затем разбавляли водой (600 мл) и экстрагировали EtOAc (этилацетатом) (4×600 мл). Органические экстракты объединяли, сушили над Na2SO4, фильтровали и концентрировали с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества (8,05 г, выход 95%), которое использовали на следующей стадии без дополнительной очистки.
1Н ЯМР (400 МГц, ДМСО-d6) δ 8, 48 (s, 1Н), 8,10 (br s, 1Н), 7,87 (Ьг s, 2Н).
4,6-Дихлорникотинонитрил (3)
[0984] К суспензии 4,б-дихлорникотинамида (8,00 г, 41,9 ммоль) в ацетонитриле (180 мл) при комнатной температуре добавляли пиридин (20,3 мл, 250 ммоль), затем добавляли в течение 3 минут при комнатной температуре POCl3 (11,7 мл, 126 ммоль). Данную реакционную смесь нагревали при 60°С в течение 1,5 часа. Реакционный раствор охлаждали до комнатной температуры и вливали в 0,8 М водный раствор NaOH (600 мл), и затем экстрагировали EtOAc (этилацетатом) (6 * 400 мл). Органические экстракты объединяли, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали путем колоночной флэш-хроматографии на силикагеле (30% этилацетат/гексан) с получением указанного в заголовке соединения в виде светло-оранжевого твердого вещества (6,41 г, 88%). 1Н ЯМР (400 МГц, CDCl3) δ 8, 67 (s, 1Н), 7,58 (s, 1Н).
6-Хлор-4-этоксиникотинонитрил (4)
[0985] К раствору 4,6-дихлорникотинонитрила (6,29 г, 36,3 ммоль) в диметилформамиде (60 мл) при комнатной температуре добавляли в течение 10 минут 1,93 М раствор NaOEt в этаноле (18,8 мл, 36,3 ммоль). Данную реакционную смесь перемешивали в течение 3 часов, разбавляли водой (600 мл) и экстрагировали EtOAc (этилацетатом) (4×400 мл). Органические экстракты объединяли, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали путем колоночной флэш-хроматографии на силикагеле (20% этилацетат/гексан) с получением указанного в заголовке соединения в виде белого твердого вещества (3,8'2 г, 58%) и 4-хлор-6-этоксиникотинонитрила (0,41 г, 6,0%) в виде белого твердого вещества.
6-Хлор-4-этоксиникотинонитрил (4): гЕ ЯМР (400 МГц, CDCl3) δ 8,47 (s, 1Н), 6,93 (s, 1H), 4,24 (q, J=7,0 Гц, 2H), 1,54 (t, J=7,0 Гц, 3H).
4-Хлор-6-этоксиникотинонитрил (5): 1H ЯМР (400 МГц, CDCl3) δ 8,43 (s, 1Н), 6,87 (s, 1H), 4,44 (q, J=7,0 Гц, 2H), 1,40 (t, J=7,0 Гц, 3H).
6-(4-Бром-3-формилфенокси)-4-этоксиникотинонитрил (7)
[0986] Смесь 6-хлор-4-этоксиникотинонитрила (3,80 г, 20,8 ммоль), 2-бром-5-гидроксибензальдегида (4,60 г, 22,9 ммоль) и К2СO3 (4,31 г, 31,2 ммоль) в диметилформамиде (30 мл) нагревали до 110°С в течение 5 часов. Реакционную смесь разбавляли Н2O (400 мл) и экстрагировали этилацетатом (8×400 мл). Органические экстракты объединяли, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали путем колоночной флэш-хроматографии на силикагеле (15-50% этилацетат /гексан) с получением указанного в заголовке соединения в виде белого твердого вещества (5,31 г, 73%). 1Н ЯМР (400 МГц, CDCl3) δ 10,34 (s, 1Н), 8,22 (s, 1Н), 7,71 (d, J=8,6 Гц, 1Н), 7,68 (d, J=3,1 Гц, 1Н), 7,27 (dd, J=8,6, 3,1 Гц, 1Н), 6,50 (s, 1Н), 4,24 (q, J=7,0 Гц, 2Н), 1,55 (t, J=7,0 Гц, 3Н).
4-Этокси-6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрил (8)
[0987] Смесь 6-(4-бром-3-формилфенокси)-4-этоксиникотинонитрила (5,30 г, 15,3 ммоль), биспинаколатодибора (7,75 г, 30,5 ммоль) и КОАс (3,00 г, 30,5 ммоль) в 1,2-диметоксиэтане (180 мл) нагревали до 110°С в течение 10 минут. Добавляли PdCl2 (dppf) (0,56 г, 0,76 ммоль), и реакционную смесь интенсивно перемешивали при 110°С в течение 1,5 часа. Данную смесь очищали путем колоночной флэш-хроматографии на силикагеле (20-40% этилацетат/гексан) с получением указанного в заголовке соединения в виде белого твердого вещества (3,53 г, выход 59%).
1Н ЯМР (400 МГц, CDCl3) δ 10,68 (s, 1Н), 8,23 (s, 1Н), 8,01 (d, J=8,2 Гц, 1Н), 7,73 (d, J=2,3 Гц, 1Н), 7,36 (dd, J=8,2, 2,3 Гц, 1Н), 6,49 (s, 1Н), 4,23 (q, J=7,0 Гц, 2Н), 1,54 (t, J=7,0 Гц, 3Н), 1,39 (s, 12Н).
4-Этокси-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D120)
[0988] К раствору 4-этокси-6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрила (3,53 г, 8,95 ммоль) в СН2Сl2 (80 мл) добавляли раствор NaBH4 (0,10 г, 2,6 ммоль) в безводном метаноле (20 мл), и перемешивали при комнатной температуре в течение 5 минут. Затем добавляли порциями в течение 30 минут при комнатной температуре твердый NaBH4 (0,58 г, 15,3 ммоль). Реакционную смесь дополнительно перемешивали в течение 30 минут, гасили путем добавления 7 0% водного раствора уксусной кислоты (3 мл) и затем перемешивали дополнительно в течение 1 часа при комнатной температуре. Реакционную смесь концентрировали, и остаток очищали путем колоночной флэш-хроматографии на силикагеле (АсОН/МеОН/СН2Сl2 1:1:100 об./об./об.) с получением указанного в заголовке соединения в виде вязкого масла. Масло лиофилизировали с получением белого твердого вещества (0,781 г, выход 29%). 1Н ЯМР (400 МГц, ДМСО-d6) δ 9,24 (s, 1Н), 8,45 (s, 1Н), 7,77 (d, J=8,2 Гц, 1Н), 7,22 (s, 1Н), 7,13 (dd, J=7,8, 1,6 Гц, 1Н), 6,97 (s, 1Н), 4,99 (s, 2Н), 4,32 (q, J=7,0 Гц, 2Н), 1,40 (t, J=7,0 Гц, 3Н).
Масс-спектр: [М+Н+]=297.
Чистота согласно ВЭЖХ: 96, 58% (Maxplot), 98,13% (220 нм), 97, 49% (254Нм).
19dx 2-Бензиламино-6-(1-гидрокси-1,3-дигидробензо[с] [1,2]оксаборол-5-илокси)-никотинонитрил (D121)
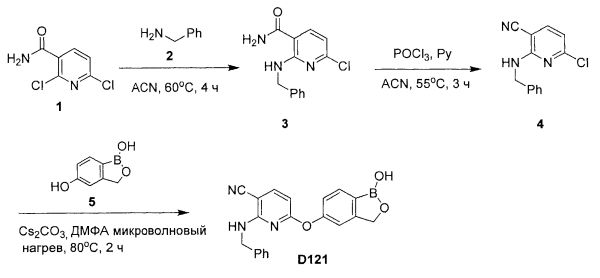

2-Бензиламино-6-хлорникоггинамид (3)
[0989] К раствору 2,6-дихлорникотинамида (1) (2,3 г, 12,2 ммоль) в безводном ацетонитриле (100 мл) добавляли 2-бензиламин (2) (1,3 г, 12,2 ммоль) и триэтиламин (1,7 мл, 12,2 ммоль). Данную реакционную смесь нагревали при 60°С в течение 4 часов. Затем раствор охлаждали до комнатной температуры и фильтровали. Полученный фильтрат упаривали под вакуумом. Остаток очищали путем хроматографии на силикагеле (Biotage), используя для элюирования градиент 5-50% EtOAc/гексан, с получением указанного в заголовке соединения (1,71 г, выход 54%).
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 8,82 (br. s., 1Н), 7,52 (d, J=8,2 Гц, 1Н), 7,40-7,23 (m, 6 Н), 6,50 (d, J=8,2 Гц, 1Н), 5,66 (br. s., 2Н), 4,70 (d, J=5,5 Гц, 2Н).
2-Бензиламино-6-хлорникотинонитрил (4)
[0990] К раствору 2-бензиламино-6-хлорникотинамида (3) (1,71 г, 6,6 ммоль) в безводном ацетонитриле (80 мл) добавляли пиридин (4,26 мл, 52,7 ммоль) и РOСl3 (2,41 мл, 264 ммоль). Данную реакционную смесь нагревали при 55°С в течение 3 часов. После охлаждения до комнатной температуры pH смеси доводили до 9, медленно добавляя 10% водный раствор NaOH (30 мл). Добавляли EtOAc (200 мл), слои разделяли. Водный слой экстрагировали EtOAc (этилацетатом) (2×200 мл). Объединенный органический слой сушили над MgSO4, фильтровали и упаривали под вакуумом. Очистку выполняли путем хроматографии на силикагеле, используя для элюирования градиент 2-20% EtOAc/гексан, с получением указанного в заголовке соединения (0,66 г, выход 42%).
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,58 (d, J=8,2 Гц, 1Н), 7,39-7,29 (m, 5 Н), 6,65 (d, J=7,8 Гц, 1Н), 5,55 (br. s., 1Н), 4,69 (d, J=5,5 Гц, 2Н).
2-Бензиламино-6-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D121)
[0991] К прозрачному раствору 2-бензиламино-6-хлорникотинонитрила (4) (660 мг, 2,73 ммоль) в безводном ДМФА (30 мл) добавляли 3Н-бензо[с][1,2]оксаборол-1,5-диол (3) (205 мг, 1,37 ммоль) и CS2CO3 (880 мг, 2,7 3 ммоль). Данную реакционную смесь нагревали при (m,°С в течение 1,5 часа в микроволновой печи. pH смеси доводили до 2 путем добавления НСl (1 М). Все летучие компоненты удаляли под вакуумом. Очистку выполняли путем обращеннофа3Ной хроматографии (Biotage), используя для элюирования градиент 10-90% МеОН/Н2O, с получением указанного в заголовке соединения (480 мг, выход 49,5%) в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,25 (s, 1Н), 8, 00-7, 95 (m, 1Н), 7,91 (d, J=8,2 Гц, 1Н), 7,76 (d, J=7,8 Гц, 1Н), 7,20-7,05 (m, 5 Н), 6,87 (dd, J=7,4, 1,9 Гц, 1Н), 6,25 (d, J=8,6 Гц, 1Н), 4,93 (s, 2Н), 4,17 (d, J=5,8 Гц, 2Н), 3,32 (s, 1Н). Масс-спектр (ИЭР) m/z: 358 (М+Н)+; ВЭЖХ: 97,8% (220 нм), 97,61% (MaxPlot).
19dy 6-(6-Фтор-1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-метоксиникотинонитрил (D122)
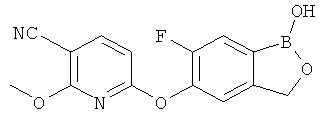
[0992] Раствор, приготовленный из 4-фтор-3-метоксибензальдегида (4,3 г, 27,9 ммоль), бромида калия (16,6 г, 139,5 ммоль), брома (3,6 мл, 69,8 ммоль) и воды (45 мл), перемешивали при комнатной температуре в течение 24 часов. Добавляли еще одну порцию брома (1,43 мл, 27,9 ммоль), и реакционную смесь перемешивали в течение ночи при комнатной температуре. Образовавшийся осадок собирали путем фильтрования и сушили при пониженном давлении с получением 2-бром-4-фтор-5-метоксибензальдегида (6,01 г, выход 92%).
[0993] Раствор 2-бром-4-фтор-5-метоксибензальдегида (1,19 г, 8,20 ммоль), 48% НВr (57 мл) и ледяной уксусной кислоты (57 мл) подвергали кипячению с обратным холодильником при 130°С в течение 5 часов. Ледяную уксусную кислоту удаляли при пониженном давлении. Раствор нейтрализовали с использованием карбоната натрия. Добавляли воду, и данную смесь экстрагировали с использованием этилацетата. Органический слой промывали солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении. Остаток очищали на колонке с силикагелем (Combiflash) с получением 2-бром-4-фтор-5-гидроксибензальдегида (1,15 г, выход 64%).
[0994] Остальные стадии идентичны соответствующим стадиям синтеза 6-(4-фтор-1-гидрокси-1, 3-дигидробензо[с] [1, 2]оксаборол-5-илокси)-2-метоксиникотинонитрила. 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 3,67 (s, 3Н), 4,98 (s, 2Н), 6,82 (d, J=8,4 Гц, 1Н), 7,48 (d, J=6,6 Гц, 1Н), 7,62 (d, J=9,8 Гц, 1Н), 8,27 (d, J=8,4 Гц, 1Н), 9, 35 (s, 1Н).
19dz 5-Гидрокси-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D123)
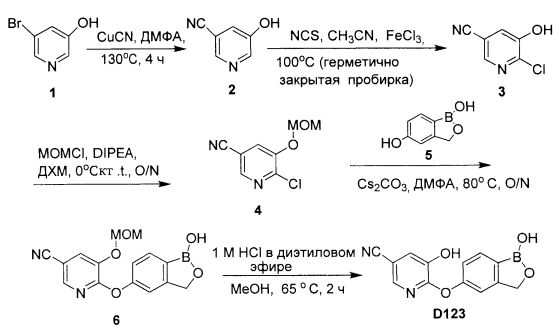

5-Гидрокси-никотинониотрил (2)
[0995] Смесь 5-бромпиридин-3-ола (9,94 мл, 54,0 ммоль) и CuCN (7,4 г, 82,62 ммоль) в ДМФА (20 мл) нагревали при 135°С в течение 5 часов. ДМФА удаляли при пониженном давлении, остаток разбавляли NH40H (10 мл) при 0°С. Данную смесь барботировали газообра3Ным аммиаком в течение 1 часа, охлаждали до 0°С и подкисляли концентрированной НСl (35 мл), пока pH смеси не достигал 3Начения 4. Полученную смесь экстрагировали EtOAc (5×100 мл). Органический слой промывали водой (2×100 мл) и солевым раствором (2×100 мл), сушили над безводным Na2SO4, фильтровали и концентрировали с получением желтого твердого вещества. Очистку выполняли путем флэш-хроматографии на силикагеле, используя градиентное элюирование (5-25% EtOAc/гексан), с получением указанного в заголовке соединения (2,5 г, 39%) в виде желтого твердого вещества. гН ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,78 (s, 1Н), 8,46 (d, J=2,0 Гц, 1Н), 8,41 (d, J=2,7 Гц, 1Н), 7,61-7,57 (m, 1Н).
6-Хлор-5-гидроксиникотинонитрил (3)
[0996] Смесь 5-гидроксиникотинонитрила (2,0 г, 16,66 ммоль) и N-хлорсукцинимида (3,3 г, 25,0 ммоль) в ацетонитриле (33 мл) нагревали в герметично закрытой пробирке при 107°С в течение ночи. Ацетонитрил удаляли при пониженном давлении, остаток разбавляли EtOAc (100 мл). Органический слой промывали водой (10 мл) и солевым раствором (2×10 мл), сушили над Na2SO4, фильтровали и концентрировали с получением коричневого масла. Очистку выполняли путем флэш-хроматографии на силикагеле, используя градиентное элюирование (20-80% EtOAc/гексан), с получением указанного в заголовке соединения (0,55 г, 36%) в виде желтого твердого вещества. 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,70 (s, 1Н), 8,35 (d, J=2,0 Гц, 1Н), 7,67 (d, J=2,0 Гц, 1Н). Масс-спектр (ИЭР) m/z: 153 (М-1)+.
6-Хлор-5-метоксимешоксиникотинонитрил (4)
[0997] К раствору 6-хлор-5-гидроксиникотинонитрила (1,12 г, 7,24 ммоль) в ДХМ (15 мл) добавляли N,N-диизопропилэтиламин (1,57 мл, 9,05 ммоль), и затем при 0°С медленно добавляли хлор-метилметиловый эфир (0,66 мл, 8,69 ммоль). Данную реакционную смесь оставляли на ночь при комнатной температуре, затем промывали насыщенным раствором NаНСО3 (10 мл) и солевым раствором (10 мл), сушили над Na2SO4, фильтровали и концентрировали с получением желтого масла. Очистку выполняли путем флэш-хроматографии на силикагеле, используя градиентное элюирование (5-25% EtOAc/гексан), с получением указанного в заголовке соединения (0,68 г, 50%) в виде прозрачного масла. 1H ЯМР (400 МГц, ДMCO-d6) δ м.д. 8,53 (d, J=2,0 Гц, 1Н), 8,14 (d, J=2,0 Гц, 1Н), 5,42 (s, 2Н), 3,40 (s, 3Н), Масс-спектр (ИЭР) m/z: 199 (М+1)+.
6-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-5-метоксимешокси-никотинонитрил (6)
[0998] К смеси 6-хлор-5-метоксиметоксиникотинонитрила (0,68 г, 3,42 ммоль) и 3Н-бензо[с][1,2]оксаборол-1,5-диола (0,56 г, 3,76 ммоль) в ДМФА (10 мл) добавляли карбонат цезия (2,45 г, 7,52 ммоль). Полученную суспензию нагревали при 80°С в течение ночи. ДМФА удаляли при пониженном давлении, остаток разбавляли EtOAc (50 мл), промывали водой (10 мл) и солевым раствором (10 мл), сушили над Na2SO4, фильтровали и концентрировали с получением коричневого масла. Очистку выполняли путем флэш-хроматографии на силикагеле, применяя градиентное элюирование (1-100% MeOH/EtOAc), с получением указанного в заголовке соединения (0,40 г, 40%) в виде прозрачного масла. 1H ЯМР (400 МГц, ДМС0-d6) δ м.д. 9,23 (s, 1Н), 8,24 (s, 1Н), 8,03 (s, 1Н), 7,77 (d, J=8,6 Гц, 1Н), 7,23 (s, 1Н), 7,14 (d, J=7,4 Гц, 1Н), 5,40 (s, 2Н), 4,98 (s, 2Н), 3,45 (s, 3Н). Масс-спектр (ИЭР) m/z: 313 (М+1)+.
5-Гидрокси-6-(1-гидрокси-1,3-дигидробензо[с] [1,2]оксаборол-5-илокси)-никотинонитрил (D123)
[0999] К суспензии 6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-5-метоксиметоксиникотинонитрила (0,28 г, 0,89 ммоль) в метаноле (4 мл) добавляли 1 М НСl в диэтиловом эфире (1,79 мл, 1,79 ммоль) при 0°С. Данную реакционную смесь нагревали при 65°С в течение 2 часов. Метанол удаляли при пониженном давлении, и полученный продукт очищали путем препаративной обращеннофа3Ной ВЭЖХ, используя в качестве элюента CH3CN/H2O (0,1% АсОН), с получением указанного в заголовке соединения (0,10 г, 41%) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДMCO-d6) δ м.д. 9,22 (s, 1Н), 8,02 (s, 1Н), 7,76 (d, J-7,8 Гц, 1Н), 7,57 (s, 1Н), 7,19 (s, 1Н), 7,15-7,09 (m, 1Н), 4,98 (s, 2Н). Масс-спектр (ИЭР) m/z: 267 (М-1)-; чистота согласно ВЭЖХ: 92,91% (Maxplot), 92,41% (220 нм).
19еа 2-Этокси-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)бензонитрил (D124)
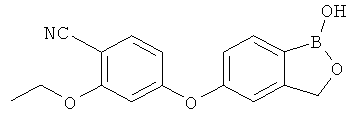
[1000] Раствор 2-гидрокси-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)бензонитрила (0,200 г, 0, 749 ммоль), иодэтан (0,182 мл, 2,25 ммоль) и N, N-диметилформамид (10 мл), в атмосфере N2 (баллон с азотом) помещали в баню с ледяной водой. Добавляли гидрид натрия (0,090 г, 2,25 ммоль), и данную смесь перемешивали в атмосфере N2 (используя баллон с азотом) при 0°С в течение 15 минут. Затем реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Избыток гидрида натрия гасили путем добавления воды, и затем смесь нейтрализовали с использованием 1 М НСl. Добавляли воду, и данный раствор экстрагировали с использованием этилацетата. Органический слой промывали водой, солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении. Остаток отверждали путем добавления изопропилового эфира. Осадок отфильтровывали и сушили при пониженном давлении с получением 2-этокси-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)бензонитрила (0,131 г, выход 59%). Масс-спектр (ИЭР(-)) m/z: 294 (М-Н)-; 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,33 (t, J=6,9 Гц, 3Н), 4,13 (q, J=7,0 Гц, 2Н), 4,95 (s, 2Н), 6,56 (dd, J=8,6, 1,9 Гц, 1Н), 6,89 (d, J=1,9 Гц, 1Н), 7,08 (dd, J=8,1, 1,6 Гц, 1Н), 7,14 (s, 1Н), 7,69 (d, J=8,6 Гц, 1Н), 7,77 (d, J=7,8 Гц, 1Н), 9,19 (s, 1Н).
19еb 6-(1-Гидрокси-1,3-дигидробензо[с][1,2] оксаборол-5-илокси)-2-(2,2,2-трифторэтокси)-никотинонитрил (D125)
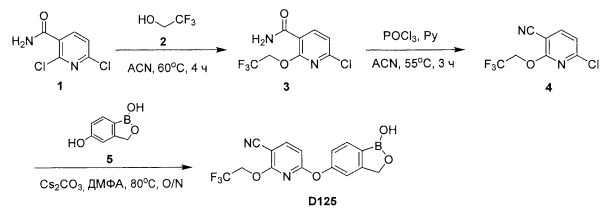

6-Хлор-2-(2,2,2-трифторэтокси)-никотинамид (3)
[1001] К раствору 2,2,2-трифторэтанола (2) (4,8 мл, 67,8 ммоль) добавляли натрий (0,52 г, 22,6 ммоль). Реакцию проводили в течение ночи. Затем к реакционному раствору добавляли 2,6-дихлорникотинамид (1) (4,32 г, 22,6 ммоль) в ДМФА (30 мл). Температуру реакционной смеси поддерживали на уровне комнатной температуры в течение 3 ч. Полученную суспензию фильтровали. Фильтрат концентрировали под вакуумом. Очистку выполняли путем хроматографии на силикагеле (Biotage), используя для элюирования градиент 10-60% EtOAc/гексан, с получением 4,68 г (выход 81%) указанного в заголовке соединения.
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 8,54 (d, J=7,8 Гц, 1Н), 7,29 (br. s., 1Н), 7,21 (d, J=7,8 Гц, 1Н), 5,91 (br. s., 1Н), 4,93-4,89 (m, 2Н).
6-Хлор-2-(2,2,2-трифаюрэа?окси)-никотинонитрил (4)
[1002] К раствору 6-хлор-2-(2,2,2-трифторэтокси)-никотинамида (3) (4,68 г, 18,3 ммоль) в безводном ацетонитриле (100 мл) добавляли пиридин (11,86 мл, 146,8 ммоль) и РОС13 (6,72 мл, 73,4 ммоль). Данную реакционную смесь нагревали при 55 0С в течение 3 часов. После охлаждения до комнатной температуры pH смеси доводили до 9, медленно добавляя 10% водный раствор NaOH. Добавляли EtOAc (2 00 мл), слои разделяли. Водный слой экстрагировали EtOAc (этилацетатом) (2×2 00 мл). Объединенный органический слой сушили над MgSO4, фильтровали и концентрировали под вакуумом. Очистку выполняли путем хроматографирования на силикагеле, используя для элюирования градиент 2-20% EtOAc/гексан, с получением 4 г (выход 92%) указанного в заголовке соединения.
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,92 (d, J=7,9 Гц, 1Н), 7,17 (d, J=7,9 Гц, 1Н), 4, 92-4, 84 (m, 2Н).
6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-(2,2,2-шрифторэтокси)-никотаинониотрил (D125)
[1003] К раствору 6-хлор-2-(2,2,2-трифторэтокси)-никотинонитрила (4) (1,26 г, 5,33 ммоль) в безводном ДМФА (30 мл) добавляли 3Н-бензо[с][1,2] оксаборол-1,5-диол (400 мг, 2,67 ммоль) и Cs2CO3 (1,91 г, 5,8 7 ммоль). Данную реакционную смесь нагревали при 80°С в течение 2 ч в микроволновой печи. Реакционную смесь охлаждали до комнатной температуры, и затем добавляли 1 М НСl (20 мл). Летучие компоненты удаляли под вакуумом. Очистку выполняли путем препаративной ВЭЖХ, используя для элюирования градиент 5-90% ACN/вода, с получением 380 мг (выход 41%) указанного в заголовке соединения в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,28 (s, 1Н), 8,36 (d, J=8,2 Гц, 1Н), 7,81 (d, J=7,8 Гц, 1Н), 7,31 (s, 1Н), 7,23 (dd, J=8,2, 2,0 Гц, 1Н), 6,83 (d, J=8,2 Гц, 1Н), 5,00 (s, 2Н), 4, 90-4, 83 (m, 2Н); 1H ЯМР (376 МГц, ДMCO-d6) м.д. - 72,84. Масс-спектр (ИЭР) m/z: 351 (М+Н)+; ВЭЖХ: 96,35% (220 нм), 97,02% (MaxPlot). Элементный анализ C15H10BF3N2O4. Рассчитано: С, 51,47%; Н, 2,88%; N, 8,00%. Найдено: С, 51,44%; Н, 2,86%; N, 8,30%.
19ес 2-[3-Циано-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-пиридин-2-илокси]-этилацетат (D126)
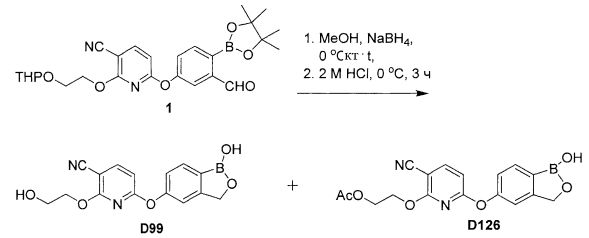

2-[3-Циано-6-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-пиридин-2-илокси]-этиловый эфир уксусной кислоты (D126)
[1004] Получение соединения D126 описано выше в методике синтеза соединения D99, где соединение D126 выделяли в качестве побочного продукта при очистке соединения D99 путем обращеннофа3Ной препаративной ВЭЖХ, используя в качестве элюента градиент CH3CN/H2O (0,1% АсОН). Соединение D126 получали в виде белого твердого вещества (0,25 г, 20%). 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,24 (s, 1Н), 8,24 (d, J=8,2 Гц, 1Н), 7,77 (d, J=8,2 Гц, 1Н), 7,26 (s, 1Н), 7,18 (d, J=7,8 Гц, 1Н), 6,71 (d, J=8,2 Гц, 1Н), 4,98 (s, 2Н), 4,35-4, 26 (m, 2Н), 4,22-4,13 (m, 2Н), 1,98 (s, 3Н); 13С ЯМР (400 МГц, ДMCO-d6) δ м.д. 170,86, 164, 58, 163,75, 156, 71, 155,37, 147,67, 132,62, 120,87, 115,95, 114,86, 104,43, 89,54, 70,34, 65,92, 62,27, 21,22 (бор-замещенный атом С не обнаружен). Масс-спектр (ИЭР) m/z: 355 (М+1)+; чистота согласно ВЭЖХ: 96, 66% (Maxplot), 97, 43% (220 нм). Элементный анализ CI7H15BN2O6. Рассчитано: С, 57,66%; Н, 4,27%; N, 7,91%. Найдено: С, 57,58%; Н, 4,41%; N, 7,71%.
19ed 2-(2,2-Дифторэтокси)-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D127)
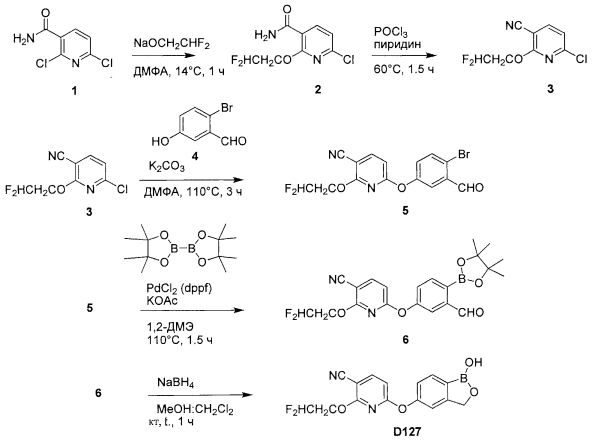

6-Хлор-2-(2,2-дифторэтокси)-никотинамид (2)
[1005] К суспензии NaH (2,22 г; 60% (масса/массу) дисперсия в масле) в 1,2-диметоксиэтане (40,0 мл) при 14°С добавляли по каплям в течение 30 минут 2,2-дифторэтанол (3,51 мл, 55,5 ммоль) и перемешивали в течение 1 часа. Порцию данного раствора (25 мл, 35 ммоль) добавляли по каплям в течение 10 минут к раствору 2,6-дихлор-никотинамида (5,30 г, 27,7 ммоль) в диметилформамиде (40 мл) при 14°С. Полученную суспензию перемешивали дополнительно в течение 1 часа при 14°С, разбавляли водой (600 мл) и экстрагировали EtOAc (этилацетатом) (3×400 мл). Органические экстракты объединяли, сушили над Na2SO4, фильтровали и концентрировали с получением указанного в заголовке соединения в виде светло-оранжевого твердого вещества (6,39 г, 97%), которое использовали без дополнительной очистки.
гН ЯМР (400 МГц, ДMCO-de) 5 8,19 (d, J=7,8 Гц, 1Н), 7,87 (br s, 1Н), 7,53 (br s, 1H), 7,28 (d, J=7,8 Гц, 1H), 6,47 (tt, J=54,7, 3,5 Гц, 1H), 4,66 (td, J=11,3, 3,5 Гц, 2H).
6-Хлор-2-(2,2-дифторэтокси)-никотинонитрил (3)
[1006] К раствору 6-хлор-2-(2,2-дифторэтокси)-никотинамида (6,39 г, 27,0 ммоль) в ацетонитриле (100 мл) при 14°С в течение 5 минут добавляли РОСl3 (7,5 мл, 81 ммоль). Данную реакционную смесь нагревали до 60°С в течение 1,5 часа и затем охлаждали до комнатной температуры. Смесь вливали в охлажденный до 0°С 0,6 М водный раствор NaOH (800 мл), и экстрагировали EtOAc (этилацетатом) (4×800 мл). Органические экстракты объединяли, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали путем колоночной флэш-хроматографии на силикагеле (20% этилацетат/гексан) с получением указанного в заголовке соединения в виде светло-желтого масла, которое со временем затвердевало (5,10 г, 86%).
1Н ЯМР (400 МГц, CDCl3) δ 7, 89 (d, J=8,2 Гц, 1Н), 7,12 (d, J=8,2 Гц, 1Н), 6,17 (tt, J=55,1, 3,5 Гц, 1Н), 4,66 (td, J=13,3, 3,5 Гц, 2Н).
6-(4-Бром-3-формилфенокси)-2-(2,2-дифторэтокси)-никотинонитрил (5)
[1007] Смесь 6-хлор-2-(2,2-дифторэтокси)-никотинонитрила (5,01 г, 22,9 ммоль), 2-бром-5-гидроксибензальдегида (3,84 г, 19,1 ммоль) и К2СО3 (5,3 г, 38 ммоль) в диметилформамиде (30 мл) нагревали до 110°С в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли Н2О (800 мл) и экстрагировали этилацетатом (4×800 мл). Органические экстракты объединяли, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали путем колоночной флэш-хроматографии на силикагеле (20% этилацетат/гексан) с получением указанного в заголовке соединения в виде белого твердого вещества (6,62 г, 90%)
1Н ЯМР (400 МГц, CDCl3) δ 10,36 (s, 1Н), 7,94 (d, J=8,2 Гц, 1Н), 7,74 (d, J=3,1 Гц, 1Н), 7,73 (d, J=8,6 Гц, 1Н), 7,28 (dd, J=8,6, 3,1 Гц, 1Н), 6,70 (d, J=8,2 Гц, 1Н), 5,97 (tt, J=54,7, 4,3 Гц, 1Н), 4,31 (td, J=13,3, 4,3 Гц, 2Н).
2-(2,2-Дифторэтокси)-6-[3-формил-4-(4,4,5, 5-тетраметил-[1,3, 2] диоксаборолан-2-ил)-фенокси]-никотинонитрил (6) [1008] Смесь 6-(4-бром-3-формилфенокси)-2-(2,2-дифтор-этокси)-никотинонитрила (6,60 г, 17,2 ммоль), биспинаколатодибоора (8,75 г, 34,5 ммоль) и КОАс (3,38 г, 34,5 ммоль) в 1,2-диметоксиэтане (180 мл) нагревали до 110°С в течение 10 минут. Добавляли PdCl2 (dppf) (0, 630 г, 0,86 ммоль), и данную реакционную смесь перемешивали при 110°С в течение 2 часов. Смесь очищали путем колоночной флэш-хроматографии на силикагеле (10-4 0% этилацетат/гексан) с получением указанного в заголовке соединения в виде светло-серого твердого вещества (5,22 г, выход 70%). 1H ЯМР (400 МГц, ДМСО-d6) δ 10,39 (s, 1Н), 8,37 (d, J=8,6 Гц, 1Н), 7,84 (d, J=8,2 Гц, 1Н), 7,77 (d, J=2,7 Гц, 1Н), 7,61 (dd, J=8,2, 2,3 Гц, 1Н), 6,93 (d, J=8,2 Гц, 1Н), 6,27 (tt, 54,3, 3,5 Гц, 1Н), 4,39 (td, J=14,9, 3,5 Гц, 2Н), 1,36 (s, 12Н).
2-(2,2-Дифторэтокси)-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D127)
[1009] Раствор NaBH4 (0,100 г, 2,6 ммоль) в безводном метаноле (20 мл) добавляли к раствору 2-(2,2-дифторэтокси)-6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрила (5,20 г, 12,1 ммоль) в CH2Cl2 (80 мл) и перемешивали при комнатной температуре в течение 5 минут. Затем к реакционной смеси при комнатной температуре добавляли порциями в течение 30 минут твердый NaBH4 (0,815 г, 21,5 ммоль), и затем реакционную смесь перемешивали дополнительно в течение 30 минут. Реакционную смесь гасили путем добавления 60% водного раствора уксусной кислоты (5 мл), перемешивали в течение 30 минут при комнатной температуре и затем концентрировали под вакуумом. Остаток очищали путем колоночной флэш-хроматографии на силикагеле (АсОН)/МеОН/СН2Сl2 1:1:100 об./об./об.) с получением указанного в заголовке соединения в виде вязкого масла, которое лиофилизировали с получением белого твердого вещества (1,92 г, выход 48%). 1Н ЯМР (400 МГц, ДMCO-d6) δ 9, 27 (s, 1Н), 8,31 (d, J=8,2 Гц, 1Н), 7,78 (d, J=7,9 Гц, 1Н), 7,29 (d, J=1,5 Гц, 1Н), 7,20 (dd, J=7,9, 1,5 Гц, 1Н), 6,79 (d, J=8,2 Гц, 1Н), 6,25 (tt, J=54,5, 3,5 Гц, 1Н), 4,97 (s, 2Н), 4,40 (td, J=11,4, 3,5 Гц, 2Н). Масс-спектр: 333 [М+Н+].
Чистота согласно ВЭЖХ: 98,15% (Maxplot), 97, 48% (220 нм), 97,44% (254Нм).
19ее 6-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-2-изопропоксиникотинонитрил (D128)
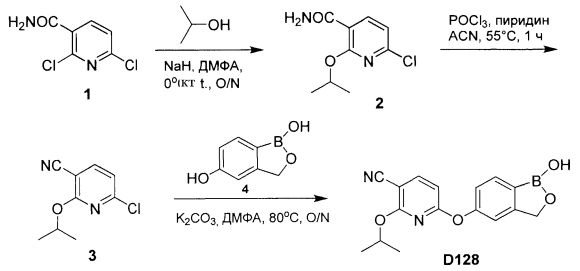

6-Хлор-2-изопропоксиникотинамид (2)
[1010] К раствору пропан-2-ола (2,94 мл, 39,26 ммоль) в ДМФА (15 мл) при 0°С добавляли порциями 95% гидрид натрия в минеральном масле (0,94 г, 39,26 ммоль), и перемешивали в течение 1 ч при комнатной температуре. Данную смесь медленно добавляли к раствору 2, 6-дихлор-никотинамида (5,0 г, 26,17 ммоль) в ДМФА (25 мл) при 0°С. Реакционную смесь перемешивали в течение ночи при комнатной температуре. ДМФА удаляли при пониженном давлении, и полученную смесь разбавляли EtOAc (50 мл), промывали водой (2×2 0 мл) и солевым раствором (2×10 мл), сушили над безводным Nа2SО4, фильтровали и концентрировали с получением желтого масла. Очистку выполняли путем флэш-хроматографии на силикагеле, используя градиентное элюирование (5-50% EtOAc/гексан), с выходом указанного в заголовке соединения (2,94 г, 64%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, CDCl3) δ м.д. 8,45 (d, J=8,2 Гц, 1Н), 7,73 (br, s,, 1Н), 7,03 (d, J=7, 8 Гц, 1Н), 5,84 (br, s,, 1Н), 5,64-5,47 (m, 1Н), 1,45 (d, J=6,3 Гц, 6 Н).
6-Хлор-2-изопропокси-никотинонитрил (3)
[1011] К раствору 6-хлор-2-изопропоксиникотинамида (2,87 г, 13,37 ммоль) и пиридина (6,48 мл, 80,22 ммоль) в ацетонитриле (25 мл) добавляли в течение 5 мин оксихлорид фосфора (3,68 мл, 40,13 ммоль). Данную реакционную смесь перемешивали при 55°С в течение 1 ч. Ацетонитрил выпаривали под вакуумом, и полученный остаток нейтрализовали путем добавления 1 н. NaOH при 0°С, пока pH смеси не достигал ~7. Реакционную смесь экстрагировали EtOAc (100 мл). Органический слой отделяли, и водный слой дополнительно экстрагировали EtOAc (этилацетатом) (3×50 мл). Все органические экстракты объединяли, промывали солевым раствором (2×25 мл), сушили над безводным Na2SO4, фильтровали и концентрировали с получением желтого масла. Очистку выполняли путем флэш-хроматографии на силикагеле, используя градиентное элюирование (5-25% EtOAc/гексан), с получением указанного в заголовке соединения (2,1 г, 81%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,28 (d, J=8,2 Гц, 1Н), 7,27 (d, J=8,2 Гц, 1Н), 5, 34-5, 20 (m, 1Н), 1,33 (d, J=6,2 Гц, 6 Н).
6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-изопропоксиникотинонитрил (D128)
[1012] К смеси 6-хлор-2-изопропоксиникотинонитрила (0,73 г, 4,0 ммоль) и 3Н-бензо[с][1,2]оксаборол-1,5-диола (0,40 г, 2,66 ммоль) в ДМФА (10 мл) добавляли карбонат калия (1,10 г, 7,98 ммоль). Полученную суспензию нагревали при 80°С в течение ночи. ДМФА удаляли при пониженном давлении, остаток разбавляли EtOAc (50 мл), промывали водой (10 мл) и солевым раствором (2×10 мл), сушили над Na2SO4, фильтровали и концентрировали с получением коричневого масла. Очистку выполняли путем обращенно-фазовой препаративной ВЭЖХ, используя в качестве элюента МеОН/Н2O (0,1% АсОН), с получением указанного в заголовке соединения (0,21 г, 21%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,27 (s, 1Н), 8,23 (d, J=8,6 Гц, 1Н), 7,79 (d, J=7,8 Гц, 1Н), 7,29 (s, 1Н), 7,22-7,14 (ш, 1Н), 6,70 (d, J=8,2 Гц, 1Н), 4,99 (s, 2Н), 4,85 (sept,, J=6,3 Гц, 1Н), 1,19 (d, J=6,3 Гц, 6 Н). Масс-спектр (ИЭР) m/z: 311 (М+1)+; чистота согласно ВЭЖХ: 98,44% (Maxplot), 97,99% (220 нм).
19ef 2-трет-Бутиламино-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D129) и
19еg 2-Амино-6-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D130)
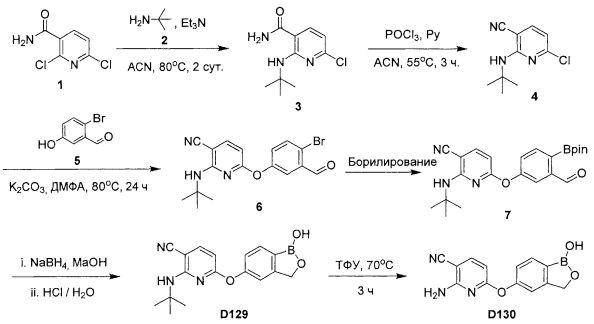

2-трет-Бутиламино-6-хлорникотинамид (3)
[1013] К раствору 2,6-дихлорникотинамида (1) (4 г, 20,9 ммоль) в безводном ацетонитриле (60 мл) добавляли трет-бутиламин (2) (13,28 мл, 12,6 ммоль) и триэтиламин (15,7 мл, 12,6 ммоль). Данную реакционную смесь нагревали при 80°С в течение 2 суток. Затем раствор охлаждали до комнатной температуры, и полученную суспензию фильтровали. Фильтрат концентрировали под вакуумом. Остаток очищали путем хроматографирования на силикагеле (Biotage), используя градиентное элюирование (20-100% EtOAc/гексан), с получением указанного в заголовке соединения (850 мг, выход 18%). 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 8,51 (br. s., 1Н), 7,47 (d, J=7,8 Гц, 1Н), 6,42 (d, J=7,8 Гц, 1Н), 5,65 (br. s., 2Н), 1,48 (s, 9 Н).
2-трет-Бутиламино-6-хлорникотинонитрил (4)
[1014] К раствору 2-трет-бутиламино-6-хлорникотинамида (3) (850 мг, 3,73 ммоль) в безводном ацетонитриле (40 мл) добавляли пиридин (2,42 мл, 29,9 ммоль) и POCl3 (1,37 мл, 14,9 ммоль). Данную реакционную смесь нагревали при 55°С в течение 3 часов. После охлаждения до комнатной температуры pH смеси доводили до 9, медленно добавляя 10% водный раствор NaOH. Затем раствор экстрагировали EtOAc (этилацетатом) (3×50 мл). Объединенный органический слой сушили над MgSO4, фильтровали и концентрировали под вакуумом. Очистку выполняли путем хроматографирования на силикагеле (Biotage), используя для элюирования градиент 2-30% EtOAc/гексан, с получением указанного в заголовке соединения (630 мг, выход 80%).
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,52 (d, J=7,9 Гц, 1Н), 6,56 (d, J=7,9 Гц, 1Н), 5,15 (br. s., 1Н), 1,49 (s, 9 Н).
6-(4-Бром-3-формил-фенокси)-2-трет-бутиламино-никотинонитрил (6)
[1015] К раствору 2-трет-бутиламино-6-хлорникотинонитрила (4) (630 мг, 3 ммоль) в ДМФА (100 мл) добавляли 2-бром-5-гидроксибензальдегид (603 мг, 3 ммоль) и К2СО3 (828 мг, 6 ммоль).
Данную реакционную смесь нагревали при 80°С в течение 24 ч. После охлаждения до комнатной температуры ДМФА удаляли под вакуумом. Очистку выполняли путем хроматографирования на силикагеле (Biotage), используя для элюирования градиент 2,5-10% EtOAc/гексан, с получением указанного в заголовке соединения (950 мг, выход 85%).
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 10,34 (s, 1Н), 7,71-7,67 (m, 2Н), 7,62 (d, J=8,2 Гц, 1Н), 7,24 (dd, J=8,6, 2,8 Гц, 1Н), 6,24 (d, J=8,2 Гц, 1Н), 5,04 (s, 1Н), 1,.12 (s, 9 Н).
2-трет-Бутиламино-6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрил (7)
[1016] К раствору 6-(4-бром-3-формилфенокси)-2-трет-бутиламиноникотинонитрила (6) (950 мг, 2,54 ммоль) в безводном 1,4-диоксане (100 мл) добавляли биспинаколатодибор (0,775 г, 3,05 ммоль), PdCl2(dppf) (0,19 г, 0,25 ммоль) и КОАс (0,75 г, 7,62 ммоль). Раствор перемешивали в течение 3 0 минут при комнатной температуре, используя барботирование азотом (N2), и затем нагревали при 100°С в течение 3 часов. Затем раствор фильтровали и концентрировали под вакуумом. Очистку выполняли путем хроматографирования на силикагеле, используя для элюирования градиент 5-30% EtOAc/гексан, с получением указанного в заголовке соединения 7 (1 г, 93,5%).
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 10,63 (s, 1Н), 7,96 (d, J=8,2 Гц, 1Н), 7,74 (d, J=2,2 Гц, 1Н), 7, 63-7, 60 (m, 1Н), 7,34 (dd, J=8,1, 2,1 Гц, 1Н), 6,22 (d, J=8,2 Гц, 1Н), 5,03 (br. s., 1Н), 1,40 (s, 12Н), 1,17 (s, 9Н).
2-трет-Бутиламино-6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D129)
[1017] К раствору 2-трет-бутиламино-6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрила (7) (1 г, 2,38 ммоль) в безводном ДМФА (100 мл) добавляли NaBH4 (0,55 г, 14,25 ммоль). Температуру реакционной смеси поддерживали на уровне комнатной температуры в течение 4 ч, затем добавляли 1 М НСl (30 мл). Реакцию проводили в течение ночи. Все летучие компоненты удаляли под вакуумом. Очистку выполняли путем препаративной ВЭЖХ, используя для элюирования градиент 5-80% ACN/вода, с получением указанного в заголовке соединения (430 мг, выход 56%) в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,21 (s, 1Н), 7,88 (d, J=8,2 Гц, 1Н), 7,74 (d, J=8,2 Гц, 1Н), 7,19 (s, 1Н), 7,09 (dd, J=7,8, 1,9 Гц, 1Н), 6,31 (d, J=8,2 Гц, 1Н), 5,94 (s, 1Н), 4,93 (s, 2Н), 1,03 (s, 9 Н). Масс-спектр (ИЭР) m/z: 324 (М+Н)+; ВЭЖХ: 96, 97% (220 нм), 96,71% (MaxPlot).
2-Амино-6-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D130)
[1018] Раствор соединения D129 (400 мг, 1,23 ммоль) в ТФУ (25 мл) нагревали в течение 3 ч при 70°С. Все летучие компоненты удаляли под вакуумом. Очистку выполняли путем препаративной ВЭЖХ, используя для элюирования градиент 5-90% ACN/вода, с получением указанного в заголовке соединения (78 мг, выход 24%).
1Н ЯМР (400 МГц, ДMCO-d6) δ м.д. 9,23 (s, 1Н), 7,88 (d, J=8,6 Гц, 1Н), 7,76 (d, J=8,2 Гц, 1Н), 7,21 (d, J=1,6 Гц, 1Н), 7,12-7,09 (m, 1Н), 6,98 (s, 2Н), 6,19 (d, J=8,2 Гц, 1Н), 4,98 (s, 2 Н).
Масс-спектр (ИЭР) m/z: 268 (М+Н)+; ВЭЖХ: 96, 36% (220 нм), 97,08% (MaxPlot).
19eh 6-(1-Гидрокси-1-3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-2-пропокси-никотинонитрил (D131)
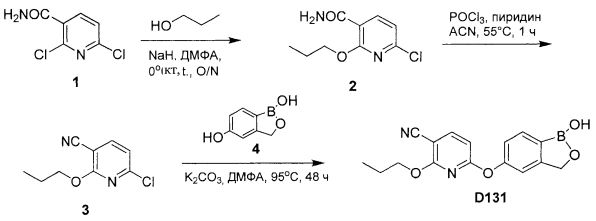

6-Хлор-2-пропоксиникотинамид (2)
[1019] К раствору пропан-1-ола (2,94 мл, 39,26 ммоль) в ДМФА (15 мл) при 0°С добавляли порциями 95% гидрид натрия в минеральном масле (0,94 г, 39,26 ммоль), и перемешивали в течение 1 ч при комнатной температуре. Данную смесь медленно добавляли к раствору 2, 6-дихлорникотинамида (5,0 г, 26,17 ммоль) в ДМФА (25 мл) при 0°С. Данную реакционную смесь перемешивали в течение ночи при комнатной температуре. ДМФА удаляли при пониженном давлении, и полученную смесь разбавляли EtOAc (60 мл), промывали водой (2×20 мл) и солевым раствором (2×10 мл), сушили над безводным Na2SO4, фильтровали и концентрировали с получением желтого масла. Очистку выполняли путем флэш-хроматографии на силикагеле, используя градиентное элюирование (5-60% EtOAc/гексан), с получением указанного в заголовке соединения (3,8 г, 68%) в виде прозрачного масла. 1H ЯМР (400 МГц, CDCl3) δ м.д. 8,46 (d, J=8,2 Гц, 1Н), 7,69 (br. s., 1 H), 7,06 (d, J=8,2 Гц, 1 H), 5,86 (br. s., 1 H), 4,48 (t, J=6,6 Гц, 2 H), 1,99-1, 79 (m, 2 H), 1,07 (t, J=7,4 Гц, 3 H).
6-Хлор-2-пропоксиникотинонитрил (3)
[1020] К раствору 6-хлор-2-пропоксиникотинамида (3,80 г, 17,71 ммоль) и пиридина (8,50 мл, 106,21 ммоль) в ацетонитриле (25 мл) в течение 5 мин добавляли оксихлорид фосфора (4,81 мл, 53,13 ммоль). Данную реакционную смесь перемешивали в течение 1 ч при 55°С. Ацетонитрил выпаривали под вакуумом, и полученный остаток нейтрализовали путем добавления 1Н. NaOH при 0°С, пока pH смеси не достигал ~7. Реакционную смесь экстрагировали EtOAc (100 мл). Органический слой отделяли, и водный слой дополнительно экстрагировали EtOAc (этилацетатом) (3×50 мл). Все органические экстракты объединяли, промывали солевым раствором (2×25 мл), сушили над безводным Na2SO4, фильтровали и концентрировали с получением желтого масла. Очистку выполняли путем флэш-хроматографирования на силикагеле, используя градиентное элюирование (5-25% EtOAc/гексан), с получением указанного в заголовке соединения (3,4 г, 98%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ДMCO-d6) δ м.д. 8,29 (d, J=7,9 Гц, 1Н), 7,29 (d, J=7,9 Гц, 1Н), 4,31 (t, J=6,5 Гц, 2Н), 1, 79-1, 66 (га, 2Н), 0,96 (t, J=7,5 Гц, 3Н).
6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-изопропокси-никотинонитрил (D131)
[1021] К смеси 6-хлор-2-пропоксиникотинонитрила (0,54 г, 3,0 ммоль) и 3Н-бензо[с][1,2]оксаборол-1,5-диола (0,40 г, 2,0 ммоль) в ДМФА (10 мл) добавляли карбонат калия (0,83 г, 6,0 ммоль). Полученную суспензию нагревали в течение 48 ч при 95°С. ДМФА удаляли при пониженном давлении, остаток разбавляли EtOAc (50 мл), промывали водой (10 мл) и солевым раствором (2×10 мл), сушили над Na2SO4, фильтровали и концентрировали с получением коричневого масла. Очистку выполняли путем обращенно-фазовой препаративной ВЭЖХ, используя в качестве элюента МеОН/Н2O (0,1% АсОН), с получением указанного в заголовке соединения (0,25 г, 26%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,25 (s, 1Н), 8,24 (d, J=8,2 Гц, 1Н), 7,79 (d, J=7,8 Гц, 1Н), 7,29 (s, 1Н), 7,17-7,22 (m, 1Н), 6,69 (d, J=8,6 Гц, 1Н), 4,99 (s, 2Н), 4,07 (t, J=6,8 Гц, 2Н), 1,65-1,55 (m, 2Н), 0,81 (t, J=7,4 Гц, 3Н). Масс-спектр (ИЭР) m/z: 311 (М+1)+; чистота согласно ВЭЖХ: 98,36% (Maxplot), 97,66% (220 нм).
19ei 6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-(2-гидроксиэтиламино)-никотинонитрил (D132)
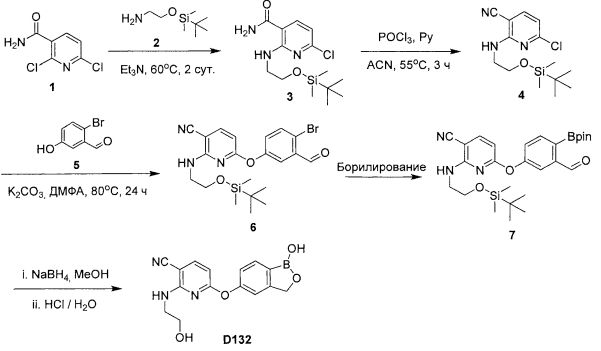

2-[2-(трет-Бутилдиметилсиланилокси)-этиламино]-6-хлорникошинамид (3)
[1022] К раствору 2, 6-дихлорникотинамида (1) (3 г, 15,7 ммоль) в безводном ацетонитриле (50 мл) добавляли 22-(трет-бутилдиметилсиланилокси)-этиламин (2) (2,75 г, 15,7 ммоль) и триэтиламин (2,2 мл, 15,7 ммоль). Данную реакционную смесь нагревали в течение 2 суток при 60°С. Затем раствор охлаждали до комнатной температуры и фильтровали. Полученный фильтрат концентрировали под вакуумом. Очистку выполняли путем хроматографирования на силикагеле (Biotage), используя для элюирования 10-100% EtOAc/гексан, с получением указанного в заголовке соединения (2 г, 40,6%).
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 8,64 (br. s., 1Н), 7,51 (d, J=8,2 Гц, 1Н), 6,47 (d, J=7,8 Гц, 1Н), 5,66 (br. s., 2Н), 3,79 (t, J=5,5 Гц, 2H), 3,62 (q, J=5,5 Гц, 2H), 0,91 (s, 9Н), 0,07 (s, 6Н).
2-[2-(трет-Бутилдиметилсиланилокси)-этиламино]-6-хлорникотинонитрил (4)
[1023] К раствору 2-[2-(трет-бутилдиметилсиланилокси)-этиламино]-6-хлорникотинамида (3) (300 мг, 0,96 ммоль) в безводном ацетонитриле (50 мл) добавляли пиридин (0,62 мл, 7,65 ммоль) и РОСl3 (0,35 мл, 382 ммоль). Данную реакционную смесь нагревали в течение 1 часа при 60°С. После охлаждения до комнатной температуры pH смеси доводили до 9, медленно добавляя 10% водный раствор NaOH. Добавляли EtOAc (200 мл), слои разделяли. Водный слой экстрагировали EtOAc (этилацетатом) (2×200 мл). Объединенный органический слой сушили над MgS04, фильтровали и концентрировали под вакуумом. Очистку выполняли путем хроматографирования на силикагеле, используя для элюирования градиент 1-20% EtOAc/гексан, с получением указанного в заголовке соединения (22 0 мг, выход 78%).
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,48 (d, J=7,9 Гц, 1Н), 6,51 (d, J=7,9 Гц, 1Н), 5,62 (br, s,, 1Н), 3,71 (t, J=5,2 Гц, 2Н), 3,54 (q, J=5,3 Гц, 2Н), 0,83 (s, 9 Н), 0,00 (s, 6 Н).
6-(4-Бром-3-формилфенокси)-2-[2-(трет-бутилдиметилсиланилокси)-этиламино]-никотинонитрил (6)
[1024] К раствору 2-[2-(арет-бутилдиметилсиланилокси)-этиламино]-6-хлорникотинонитрила (4) (1,1 г, 3,5 ммоль) в ДМФА (80 мл) добавляли 2-бром-5-гидроксибензальдегид (5, 0,75 г, 3,7 ммоль) и К2СО3 (0,97 г, 7,05 ммоль). Данную реакционную смесь нагревали в течение 24 ч при 80°С. ДМФА удаляли под вакуумом. Очистку выполняли путем хроматографирования на силикагеле (Biotage), используя для элюирования градиент 1-3% EtOAc/гексан, с получением 1,26 г (выход 75%) указанного в заголовке соединения,. 1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 10,31 (s, 1Н), 7,72 (d, J=2,8 Гц, 1Н), 7,62 (dd, J=8,6, 3,8 Гц, 2Н), 7,21-7,26 (m, 1Н), 6,17 (d, J=8,3 Гц, 1Н), 5,55 (t, J=4,9 Гц, 1Н), 3,59 (t, J=5,3 Гц, 2Н), 3,27 (q, J=5,2 Гц, 2Н), 0,85 (s, 9Н), 0,00 (s, 6Н).
2-[2-(арет-Бутилдиметилсиланилокси)-этиламино]-6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрил (7)
[1025] К раствору 6-(4-бром-3-формилфенокси)-2-[2-(трет-бутилдиметил-силанилокси)-этиламино]-никотинонитрила (6) (1,26 г, 2,65 ммоль) в безводном 1,4-диоксане (150 мл) добавляли биспинаколатодибор (0,807 г, 3,18 ммоль), PdCl2 (dppf) (0,19 г, 0,26 ммоль) и КОАс (0,78 г, 7,95 ммоль). Раствор перемешивали в течение 30 минут при комнатной температуре, используя барботирование азотом (N2), затем нагревали в течение 3 часов при 100°С. Затем раствор фильтровали и концентрировали под вакуумом. Очистку выполняли путем хроматографирования на силикагеле, используя для элюирования градиент 5-25% EtOAc/гексан, с получением указанного в заголовке соединения (1,11 г, выход 80%).
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 10,63 (s, 1Н), 7,94 (d, J=8,2 Гц, 1Н), 7,78 (d, J=l,9 Гц, 1Н), 7,64 (d, J=8,2 Гц, 1Н), 7,37 (dd, J=8,1, 2,1 Гц, 1Н), 6,17 (d, J=8,2 Гц, 1Н), 5,57 (br. s., 1Н), 3,62 (t, J=5,1 Гц, 2Н), 3,32 (q, J=5,1 Гц, 2Н), 1,40 (s, 12Н), 0,88 (s, 9 Н), 0,03 (s, 6 Н).
6-(1-Гидрокси-1,3-дигидробензо[с] [1,2]оксаборол-5-илокси)-2-(2-гидрокси-этиламино)-никотинонитрил (D132)
[1026] К раствору 2-[2-(трет-бутилдиметилсиланилокси)-этиламино]-6-[3-формил-4-(4,4,5, 5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрила (7) (1,11 г, 2,12 ммоль) в безводном МеОН (60 мл) добавляли NaBH4 (0,48 г, 12,7 ммоль). Данную реакционную смесь перемешивали в течение 4 ч при комнатной температуре, затем добавляли 1 М НСl (20 мл). Перемешивали в течение ночи, затем все летучие компоненты удаляли. Очистку выполняли путем препаративной ВЭЖХ, используя для элюирования градиент 5%-90% ACN/вода, с получением 86,3 мг (выход 13%) указанного в заголовке соединения в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДMCO-d6) δ м.д. 9,20 (s, 1Н), 7,87 (d, J=8,6 Гц, 1Н), 7,73 (d, J=8,2 Гц, 1Н), 7,21 (s, 1Н), 7,13-7,08 (m, 2Н), 6,14 (d, J=8,2 Гц, 1Н), 4,96 (s, 2Н), 4, 59-4, 55 (m, 1Н), 3,32-3,29 (m, 2Н), 3,16-3,10 (m, 2Н). Масс-спектр (ИЭР) m/z: 268 (М+Н)+; ВЭЖХ: 98,95% (220 нм), 98,66% (MaxPlot).
19ej 3-(Циклопентилокси)-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)бензонитрил (D133)
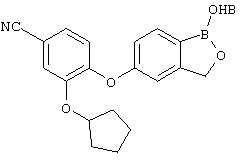
[1027] Раствор 3-гидрокси-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)бензонитрила (0,500 г, 1,87 ммоль), циклопентилиодида (0,65 мл, 5,61 ммоль) и N,N-диметилформамида (30 мл) охлаждали в атмосфере N2 (используя баллон с азотом) до 0°С в бане с ледяной водой. Добавляли гидрид натрия (0,224 г, 5,61 ммоль), и затем реакционную смесь перемешивали в течение 5 минут в бане с ледяной водой. Затем реакционную смесь перемешивали в течение 2 часов при комнатной температуре. Добавляли еще одну порцию циклопентилиодида (0,22 мл, 1,87 ммоль), и реакционную смесь охлаждали до 0°С в бане с ледяной водой. Добавляли гидрид натрия (0,075 г, 1,87 ммоль), и реакционную смесь перемешивали в течение 5 минут при 0°С. Затем реакционную смесь перемешивали еще в течение 2 часов при комнатной температуре. Избыток гидрида натрия гасили путем добавления воды, и затем реакционную смесь нейтрализовали с использованием 1 М НСl. Добавляли воду, и данный раствор экстрагировали с использованием этилацетата. Органический слой промывали водой, солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении. Остаток очищали на колонке с силикагелем (Combiflash) с получением 3-(циклопентилокси)-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)бензонитрила (0,396 г, выход 63%). 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,25 (m, 2Н), 1,38 (m, 2Н), 1,50 (m, 2Н), 1,73 (m, 2Н), 4,86 (m, 2Н), 6,84 (s, 1Н), 6,87 (d, J=8,2 Гц, 1Н), 7,18 (d, J=8,2 Гц, 1Н), 7,40 (d, J=8,4 Гц, 1Н), 7,58 (s, 1Н), 7,64 (d, J=8,0 Гц, 1Н), 9,06 (s, 1Н).
19еk 3-(Циклопропилметокси)-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)бензонитрил (D134)
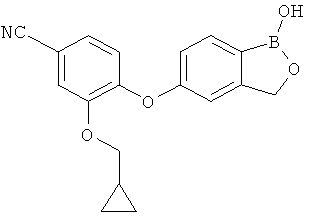
[1028] Раствор бромметилциклопропана (0,544 мл, 5,61 ммоль), иодида натрия (4,20 г, 28,05 ммоль) и N,N-диметилформамида (30 мл) перемешивали в атмосфере N2 (используя баллон с азотом) при 70°С в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, и добавляли 3-гидрокси-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)бензонитрил (0,500 г, 1,87 ммоль) и еще одну порцию N,N-диметилформамида (30 мл). Реакционную смесь охлаждали до 0°С в бане с ледяной водой, и добавляли гидрид натрия (0,224 г, 5,61 ммоль). Реакционную смесь перемешивали в атмосфере N2 (используя баллон с азотом) в течение 5 минут при 0°С и затем в течение ночи при комнатной температуре. Избыток гидрида натрия гасили путем добавления воды, и затем раствор нейтрализовали с использованием 1 М НСl. Добавляли воду, и данный раствор экстрагировали с использованием этилацетата. Органический слой промывали водой, солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении. Остаток очищали на колонке с силикагелем (Combiflash) с получением 3-(циклопропилметокси)-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)бензонитрила (0,225 г, выход 37%). 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,15 (d, J=4,5 Гц, 2Н), 0,43 (d, J=7,6 Гц, 2Н), 1,06 (septet, J=6,7 Гц, 1Н), 3,90, (d, J=6,9 Гц, 1Н), 4,91 (s, 2Н), 6,95 (m, 2Н), 7,13 (d, J=8,2 Гц, 1Н), 7,42 (d, J=8,4 Гц, 1Н), 7,62 (s, 1Н), 7,70 (d, J=8,6 Гц, 1Н), 9,12 (s, 1Н).
19еl 3-(Циклопентилметокси)-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)бензонитрил (D135)
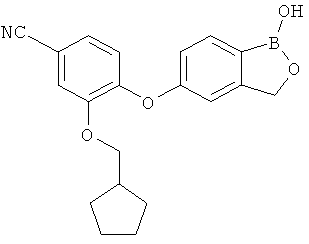
[1029] Данное соединение получали в соответствии с методикой, аналогичной методике получения соединения D133.
Масс-спектр (ИЭР(-)) m/z: 348 (М-Н)-; 1Н ЯМР (400 МГц, ДMCO-d6) δ м.д. 1,05 (m, 2Н), 1,37 (m, 4Н), 1,47 (m, 2Н), 2,07 (септет, J=7,2 Гц, 1Н), 3,88 (d, J=6,4 Гц, 2Н), 4,88 (s, 2Н), 6,88 (s, 1Н), 6,90 (dd, J=8,1, 2,2 Гц, 1Н), 7,21 (d, J=8,4 Гц, 1Н), 7,45 (dd, J=8,2, 2,0 Гц, 1Н), 7,66 (щ, 2Н), 9,08 (s, 1Н).
19еm 6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-изобутоксиникотинонитрил (D136)


6-Хлор-2-изобутокси-никотинамид (3)
[1030] К раствору 2,6-дихлор-никотинамида (1) (3 г, 15,7 ммоль) в безводном ацетонитриле (30 мл) добавляли 2-метилпропан-1-ол (2) (1,22 г, 16,5 ммоль) и NaH (0,42 г, 16,5 ммоль). Температуру реакционной смеси в течение ночи поддерживали на уровне комнатной температуры. Полученную суспензию фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали путем хроматографии на силикагеле (Biotage), используя градиентное элюирование (10%-80% EtOAc/гексан), с получением указанного в заголовке соединения (2,39 г, выход 66%).
1Н ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 8,46 (d, J=7,8 Гц, 1Н), 7,70 (br. s., 1Н), 7,06 (d, J=7,8 Гц, 1Н), 6,09 (br. s., 1Н), 4,30 (d, J=6,6 Гц, 2Н), 2,25-2,11 (m, 1Н), 1,07 (d, J=6,6 Гц, 6 Н).
6-Хлор-2-изобутиламиноникотинонитрил (4)
[1031] К раствору 6-хлор-2-изобутоксиникотинамида (3) (2,39 г, 10,4 ммоль) в безводном ацетонитриле (150 мл) добавляли пиридин (6,75 мл, 83,5 ммоль) и РОСl3 (3,82 мл, 41,7 ммоль). Данную реакционную смесь нагревали в течение 3 часов при 55°С. После охлаждения до комнатной температуры pH смеси доводили до 9, медленно добавляя 10% водный раствор NaOH. Добавляли EtOAc (60 мл), слои разделяли. Водный слой экстрагировали EtOAc (этилацетатом) (2×60 мл). Объединенный органический слой сушили над MgSO4, фильтровали и концентрировали под вакуумом. Очистку выполняли путем хроматографирования на силикагеле, используя для элюирования градиент 2%-30% EtOAc/гексан, с получением 2 г (выход 91%) указанного в заголовке соединения.
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,80 (d, J=8,0 Гц, 1Н), 6,99 (d, J=8,0 Гц, 1Н), 4,20 (d, 3=6, 6 Гц, 2Н), 2,21-2,09 (m, 1Н), 1, 05 (d, J=6,6 Гц, 6Н).
6-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-2-изобуаюксиникотинонитрил (D136)
[1032] К раствору 6-хлор-2-изобутиламиноникотинонитрила (4) (1,12 г, 5,33 ммоль) в безводном ДМФА (30 мл) добавляли 3Н-бензо[с][1,2]оксаборол-1,5-диол (400 мг, 2,67 ммоль) и Cs2CO3 (1,91 г, 5,87 ммоль). Данную реакционную смесь нагревали в течение 2 ч при 80°С в микроволновой печи. Затем ДМФА выпаривали под вакуумом. Очистку выполняли путем препаративной ВЭЖХ, используя для элюирования градиент 5%-90% ACN/вода, с получением указанного в заголовке соединения (250 мг, выход 29%) в виде белого твердого вещества.
1Н ЯМР (400 МГц, ДMCO-d6) δ м.д. 9,23 (br s, 1Н), 8,20 (d, J=8,2 Гц, 1Н), 7,77 (d, J=7,9 Гц, 1Н), 7,17 (d, J=8,0 Гц, 1Н), 6,66 (d, J=8,6 Гц, 1Н), 4,97 (s, 2Н), 3,89 (d, J=6, 6 Гц, 2Н), 1,95-1,80 (m, 1Н), 0,80 (d, J=6,6 Гц, 6 Н). Масс-спектр (ИЭР) m/z: 323 (М-Н)-; ВЭЖХ: 99, 25% (220 нм), 99, 43% (MaxPlot).
19еn 5-[2-Циано-4-(формиламинометил) фенокси]-1,3-дигидро-1-гидрокси-2,1-бензоксаборол (D137)
[1033] Данное соединение получали из 2-фтор-5-формилбензонитрила и 4-бром-3-гидроксиметилфенола в соответствии с методикой, аналогичной методике получения соединения D25.
1Н ЯМР (300 МГц, ДМСО-d6) м.д. 4,30 (d, J=6,2 Гц, 2Н), 4,94 (s, 2Н), 7,0-7,1 (m, 3Н), 7,56 (dd, J=8,8, 1,2 Гц, 1Н), 7,7-7,8 (m, 2Н), 8,13 (s, 1Н), 8,56 (br s, 1Н), 9,21 (s, 1H).
19ео 5-(2-Аминометил-4-цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборола гидрохлорид (D138)
[1034] Данное соединение получали из соединения D137 в соответствии с методикой, аналогичной методике получения соединения D26.
1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 4,04 (br s, 2Н), 4,96 (s, 2Н), 7,06-7,16 (m, 3Н), 8,05 (d, J=2,3 Гц, 1Н), 8,45 (br s, 3H), 9,27 (s, 1H).
19ep Метил 4-(1,3-дигидро-1-гидрокси-2,1-бензоксаборол-5-илокси)-3-фторбензоат (D139)
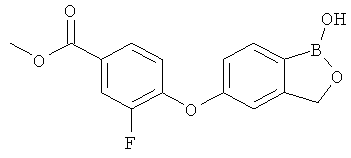
Стадия 1
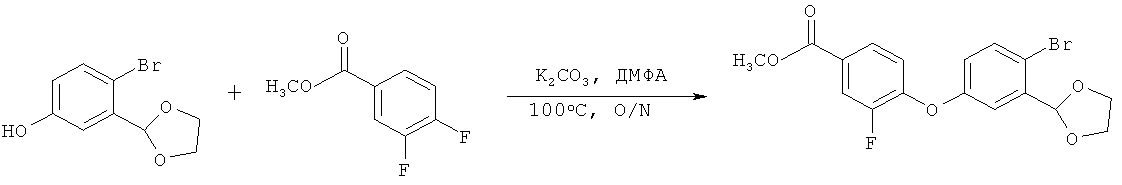
[1035] Смесь 4-бром-3-(1,3-диоксолан-2-ил)фенола (7,1 г, 29 ммоль, 1 экв.), 3,4-дифторметилбензоата (5 г, 2 9 ммоль, 1 экв.), карбоната калия (6 г, 4 3,5 ммоль, 1,5 экв.) в ДМФА (2 9 мл) перемешивали в течение ночи при 100°С. Согласно ТСХ-анализу, реакция была завершена. После охлаждения до комнатной температуры осадок удаляли путем фильтрования. Остаток промывали EtOAc. Органические фракции объединяли и концентрировали на роторном испарителе. Остаток переносили в смесь EtOAc и воды. Органический слой отделяли, промывали солевым раствором и сушили над безводным сульфатом натрия. Фильтровали, и концентрировали с получением указанного в заголовке соединения в виде светло-коричневого масла, которое использовали без очистки на следующей стадии.
Стадия 2

[1036] К раствору метил 4-(4-бром-3-(1,3-диоксолан-2-ил)фенокси)-3-фторбензоата в ТГФ (30 мл) добавляли 20 мл 3 М НСl (полученной из 6 М НСl и воды в соотношении 1:1), данную смесь подвергали кипячению с обратным холодильником в течение 2 часов. ТСХ-анализ показывал отсутствие SM (гексан/EtOAc, 7:3). Реакционную смесь охлаждали до комнатной температуры. Добавляли 1Н. NaOH (60 мл). Половину растворителя выпаривали на роторном испарителе, остаток экстрагировали EtOAc. Органическую фракцию промывали водой, солевым раствором, сушили над Na2SO4, фильтровали и концентрировали с получением светло-коричневого масла, которое оставляли на 2,5 суток. Образовавшееся твердое вещество отфильтровывали и промывали смесью гексан/EtOAc с получением желтоватого порошка (10,2 г, выход 99,6% за две стадии).
Стадия 3
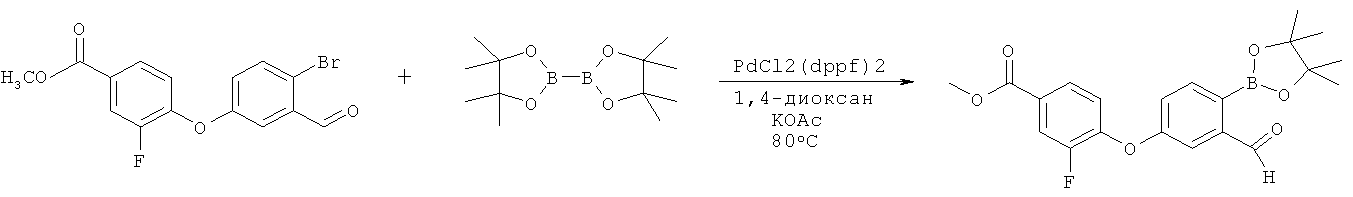
[1037] К раствору метил 4-(4-бром-3-формилфенокси)-3-фторбензоата (10 г, 28,3 ммоль), КОАс (8,33 г, 84,9 ммоль), бис(пинаколато)дибора (8,63 г, 34 ммоль) в безводном 1,4-диоксане (120 мл) добавляли PdCl2 (dppf) 2 (578 мг, 2,5 молярных %, CAS №72287-26-4, Aldrich catalog №379670). Данную реакционную смесь дегазировали с использованием N2 и затем нагревали при 80°С с перемешиванием на магнитной мешалке. Реакцию проводили в течение ночи, согласно ТСХ-анализу реакция была завершена. Смесь охлаждали до комнатной температуры, фильтровали через целит, промывали этилацетатом и затем упаривали. Остаток растворяли в минимальном объеме EtOAc и пропускали через очень короткую и широкую колонку силикагеля (для удаления темной окраски), используя для элюирования смешанный растворитель гексан/EtOAc (3:1, об./об.), с получением светло-желтого масла. Снова проводили хроматографию на силикагеле (гексан/EtOAc, 7:3). Первая фракция (белое вещество) согласно ЯМР (отсутствие ароматических сигналов) представляла собой бис(пинаколато)дибор. Фракции, содержащие желаемый продукт, собирали и концентрировали с получением метил 3-фтор-4-(3-формил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)бензоата в виде бесцветного масла (9,5 г, выход 84%). 1Н ЯМР (ДМСО-d6, 300 МГц): δ=10,38 (s, 1Н), 7,91 (dd, J=2,1, 13,2 Гц, 1Н), 7,82 (d, J=7,8 Гц, 2Н), 7,42 (d, J=2,7 Гц, 2Н), 7,32 (d, J=8,4 Гц, 1Н), 3,85 (s, 3Н) и 1,32 (s, 12Н) м.д.
Стадия 4
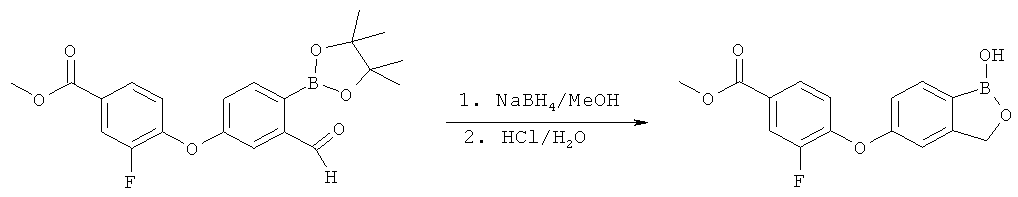
[1038] К раствору метил-3-фтор-4-(3-формил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)бензоата (5 г, 12,5 ммоль) в МеОН (125 мл) добавляли порциями NaBH4 (709 мг, 18,75 ммоль) при 0°С, в ледяной бане, в атмосфере N2. Данную реакционную смесь перемешивали, поддерживая температуру в диапазоне от 0°С до комнатной температуры. Ход реакции контролировали посредством ТСХ-анализа, и в течение ночи реакция была завершена. Смесь охлаждали до комнатной температуры. Половину растворителя выпаривали на роторном испарителе. Затем данную смесь охлаждали до 0°С и гасили путем добавления воды (12 мл) и последующего добавления 6 н. НСl (12 мл). Перемешивали в течение 30 мин при комнатной температуре, выпавшее в осадок белое твердое вещество отфильтровывали. Полученное смолистое твердое вещество суспендировали в воде в течение 1 ч с использованием ультразвука. Фильтровали, промывали большим количеством воды. Фильтровали, и сушили с получением соединения D139 (2,1 г, выход 55,7%) в виде белого твердого вещества. Т.пл.: 149-152°С. Масс-спектр (ИЭР) m/z: 303 (М+1, положительный) и 301 (М-1, отрицательный). Чистота согласно ВЭЖХ: 97, 27% (220 нм), 97, 29% (254 Нм). 1H ЯМР (ДМСО-d6, 300 МГц): δ=9,19 (s, 1Н), 7,88 (dd, J=1,8, 11,1 Гц, 1Н), 7,80 (d, J=8,4 Гц, 1Н), 7,75 (d, J=8,1 Гц, IE), 7,21 (d, J=8,4 Гц, 1H), 7,07 (d, J=8,4 Гц, 2H), 4,93 (s, 2H), и 3,84 (s, 3H).
19eq D140
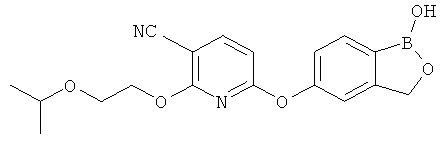
[1039] Данное соединение получали аналогично соединению D130, используя 2-изопропоксиэтанол вместо пропанола.
19er D141
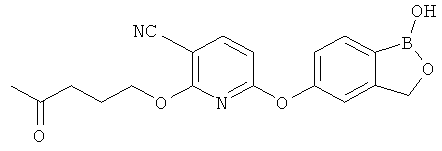
[1040] Данное соединение получали аналогично соединению D130, используя 3-ацетилпропанол вместо пропанола.
13es D142
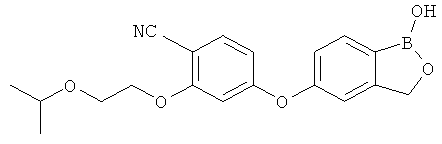
[1041] Данное соединение получали из соединения D10 и 2-изопропоксиэтанола посредством реакции Мицунобу.
19et D143
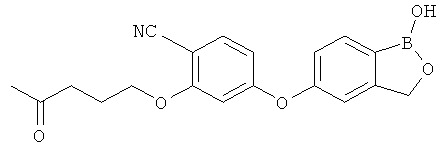
[1042] Данное соединение получали из соединения D10 и 3-ацетилпропанола посредством реакции Мицунобу.
19еu D144
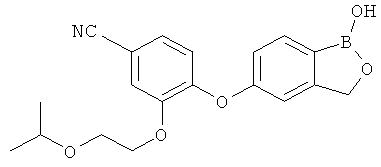
[1043] Данное соединение получали из соединения D14 и 2-изопропоксиэтанола посредством реакции Мицунобу.
19ev D145
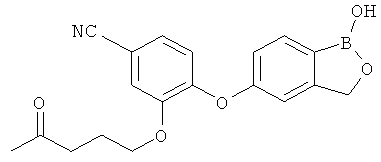
[1044] Данное соединение получали из соединения D14 и 3-ацетилпропанола посредством реакции Мицунобу.
19ew D146
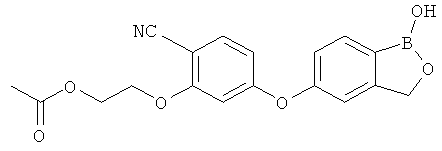
[1045] Данное соединение получали из соединения D10 и 2-гидроксиэтилацетата посредством реакции Мицунобу.
19ех D147
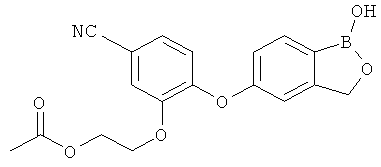
[1046] Данное соединение получали из соединения D14 и 2-гидроксиэтилацетата посредством реакции Мицунобу.
N-[4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-4-метилбензолсульфонамид (D148)
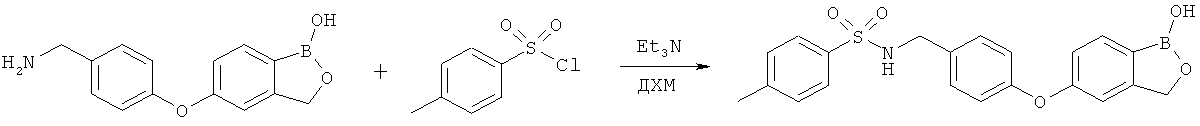
[1047] В сцинтилляционную пробирку объемом 20 мл, содержащую 5-(4-аминометил-фенокси)-3Н-бензо[с][1,2]оксаборол-1-ол (144 мг, 0,56 ммоль, 1,1 экв.), 4-метил-бензолсульфонилхлорид (118,4 мг, 0,62 ммоль, 1,1 экв.) в ДХМ (10,0 мл), добавляли по каплям EtsN (160 мкл, 1,12 ммоль, 2,0 экв.). Данную смесь перемешивали в течение ночи при комнатной температуре. Смесь осторожно обрабатывали водным NH4Сl (10 мл), слои разделяли. Водный слой экстрагировали ДХМ (дихлорметаном) (2×5 мл), объединенные органические фазы промывали Н2O (10 мл), солевым раствором (10 мл), сушили над MgSO4, фильтровали, и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя для элюирования EtOAc/гептан (0:100-80:20), с получением N-[4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензил]-4-метилбензолсульфонамида в виде белого твердого вещества. ЖХ/МС m/z: 432 (М+23); 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 1H ЯМР (ДMCО-d6) δ: 9,11 (s, 1Н), 8,08 (t, J=6,3 Гц, 1Н), 7,65-7,74 (ш, 3Н), 7,38 (d, J=8,0 Гц, 2Н), 7,23-7,31 (m, J=8,6 Гц, 2Н), 6,95-7,00 (m, 2Н), 6, 89-6, 95 (m, 2Н), 4,92 (s, 2Н), 3,95 (d, J=6,3 Гц, 2Н), 2,38 (s, 3Н).
3-Хлор-N-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-бензолсульфонамид (D149)
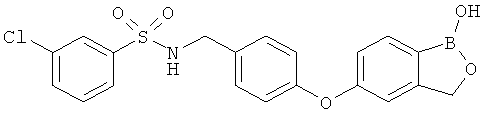
[1048] Соединение D149 получали с использованием методики, аналогичной методике получения соединения D148. ЖХ/МС m/z: 452 (М+23); 1Н ЯМР (ДMCO-d6) δ: 9,11 (s, 1Н), 8,36 (t, J=6,3 Гц, 1Н), 7,66-7, 77 (m, 4Н), 7,59 (t, J=8,1 Гц, 1Н), 7,25 (d, J=8,6 Гц, 2Н), 6, 87-6, 98 (m, 4Н), 4,93 (s, 2Н), 4,05 (d, J=6,3 Гц, 2Н).
2-Хлор-N-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-бензолсульфонамид (D150)
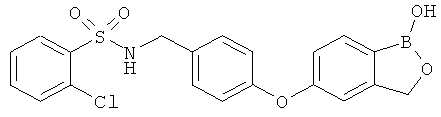
[1049] Соединение D150 получали с использованием методики, аналогичной методике получения соединения D148. ЖХ/МС m/z: 452 (М+23); 1Н ЯМР (ДМСО-d6) δ: 9,11 (s, 1Н), 8,45 (t, J=6,2 Гц, 1Н), 7, 88-7, 93 (m, 1Н), 7,71 (d, J=8,0 Гц, 1H), 7,57-7,61 (m, 2H), 7,44-7,51 (m, 1H), 7,23 (d, J=8,6 Гц, 2H), 6, 84-6, 92 (m, 4H), 4,94 (s, 2H), 4,11 (d, J=6,2 Гц, 2H).
N-[4-(1-Гидрокси-1r3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-метансульфонамид (D151)
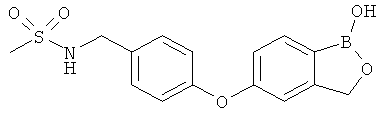
[1050] Соединение D151 получали с использованием методики, аналогичной методике получения соединения D148. ЖХ/МС m/z: 356 (М+23); 1Н ЯМР (ДMCO-d6) δ: 9,08 (s, 1Н), 7,69 (d, J=7,9 Гц, 1Н), 7,52 (t, J=6,3 Гц, 1Н), 7,33-7,39 (m, J=8,6 Гц, 2Н), 7,00-7,07 (m, 2Н), 6, 90-6, 97 (m, 2Н), 4,90 (s, 2Н), 4,13 (d, J=6,3 Гц, 2Н), 2,85 (s, 3Н).
5-(5-Аминометилпиридин-2-илокси)-3Н-бензо[с][1,2]оксаборол-1-ол (D152)
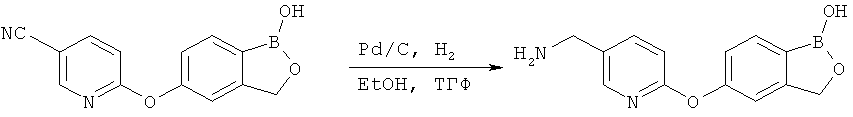
[1051] В круглодонную колбу объемом 50 мл, оснащенную магнитной мешалкой, добавляли сначала 6-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (1,0 г, 4,0 ммоль, 1,0 экв.) и затем EtOH (40 мл) и ТГФ (15 мл). Колбу откачивали и заполняли N2, повторяя эту процедуру два раза. К полученному раствору при перемешивании добавляли 5% Pd/C (300 мг), колбу откачивали и заполняли Н2, повторяя эту процедуру три раза. Полученную суспензию перемешивали в атмосфере Н2 (используя баллон с водородом) при комнатной температуре в течение 3 суток. Смесь фильтровали через короткий картридж с целитом и промывали EtOH (3×25 мл). Объединенный фильтрат концентрировали при пониженном давлении, остаток очищали путем хроматографии на силикагеле, используя для элюирования МеОН/ДХМ (0:100-10:90), с получением белого твердого вещества. Полученное твердое вещество растворяли в минимальном количестве МеОН и осторожно обрабатывали НСl в Et2O. Образовавшийся осадок собирали путем фильтрования и промывали Et2O с получением 5-(5-аминометилпиридин-2-илокси)-3Н-бензо[с][1,2]оксаборол-1-ола гидрохлорида в виде белого твердого вещества. 1Н ЯМР (ДMCO-d6) δ: 9,95 (br. s., 1Н), 8,28 (d, J=2,2 Гц, 1H), 8,11 (dd, J=8,5, 2,4 Гц, 1H), 7,75 (d, J=8,0 Гц, 1H), 7,07-7,14 (m, 2H), 7,05 (dd, J=7,9, 2,0 Гц, 1H), 4,94 (s, 2H), 4,14 (t, J=5,6 Гц, 2H).
5-{4-[(Циклогексилметиламино)-метил]-фенокси}-3Н-бензо[с][1,2]оксаборол-1-ол (D153)
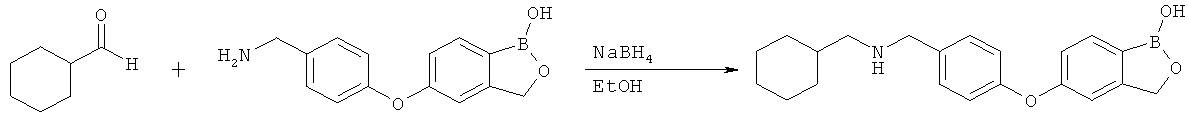
[1052] К раствору 5-(4-аминометилфенокси)-3Н-бензо[с][1,2]оксаборол-1-ола (150 мг, 0,59 ммоль, 1,0 экв.) в EtOH (5,0 мл) добавляли циклогексанкарбальдегид (280 мкл, 2,36 ммоль, 4,0 экв.). Данную смесь перемешивали в течение 30 минут при комнатной температуре. После охлаждения до 0 "С добавляли порциями NaBH4 (89 мг, 0,36 ммоль, 4,0 экв.), смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 2 ч. Затем смесь осторожно обрабатывали разбавленной НСl (5 мл), водную фазу экстрагировали EtOAc (3×10 мл). Объединенные органические экстракты промывали солевым растворомом (10 мл), сушили над MgS04, фильтровали, и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя для элюирования МеОН/ДХМ (0:100-10:90), с получением 5-{4-[(циклогексилметиламино)-метил]-фенокси}-3Н-бензо[с][1,2]оксаборол-1-ола в виде белого твердого вещества. ЖХ/МС m/z: 352 (М+Н); 1Н ЯМР (ДМСО-d6) δ: 9,08 (s, 1Н), 7,68 (d, J=8,0 Гц, 1Н), 7, 30-7, 37 (m, J=8,5 Гц, 2Н), 6, 95-7, 02 (m, 2Н), 6, 88-6, 95 (m, 2Н), 4,89 (s, 2Н), 3,64 (s, 2Н), 2,31 (d, J=6,6 Гц, 2Н), 1, 67-1,77 (m, 2Н), 1, 56-1, 66 (m, 3Н), 1, 30-1, 44 (m, 1Н), 1, 02-1, 23 (m, 3Н), 0,77-0,91 (m, 2Н).
5-(4-Циклогексиламинометил-фенокси)-3Н-бензо[с][1,2]оксаборол-1-ол (D154)
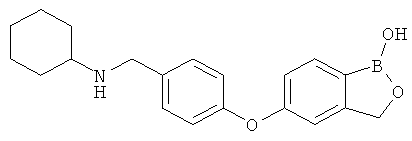
[1053] Соединение D154 получали с использованием методики, аналогичной методике получения соединения D153. ЖХ/МС m/z: 338 (М+Н); 1Н ЯМР (ДMCO-d6) δ: 9,08 (br. s., 1Н), 7,68 (d, J=8,0 Гц, 1H), 7,31-7,38 (m, J=8,5 Гц, 2H), 6, 95-7, 00 (m, 2H), 6,89-6,95 (m, 2H), 4,89 (s, 2H), 3,68 (s, 2H), 2,35 (tt, J=9,9, 3,7 Гц, 1H), 1, 78-1, 88 (m, 2H), 1, 59-1, 70 (m, 2H), 1,47-1, 56 (m, 1H), 0,97-1,22 (m, 5H).
5-(4-{[(1Н-Пиррол-2-илметил)-амино]-метил}-фенокси)-3Н-бензо[с][1,2]оксаборол-1-ол. D155)
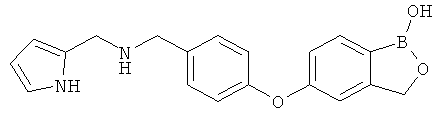
[1054] Соединение D155 получали с использованием методики, аналогичной методике получения соединения D153. ЖХ/МС m/z: 335 (М+Н); 1Н ЯМР (ДМСО-d6) δ: 9,08 (br. s., 1Н), 7,68 (d, J=7,9 Гц, 1H), 7, 32-7, 38 (m, J=8,5 Гц, 2H), 6, 96-7, 02 (m, 2H), 6,89-6,96 (m, 2H), 6,61 (td, J=2,6, 1,6 Гц, 1H), 5,89 (q, J=2,6 Гц, 1H), 5, 83-5, 87 (m, 1H), 4,90 (s, 2H), 4,07 (br. s., 1H), 3,63 (s, 2H), 3,60 (s, 2H), 3,31 (br. s., 1H).
5-(4-[(2-Бромбензиламино)-метил]-фенокси}-3Н-бензо[с][1,2]оксаборол-1-ол (D156)
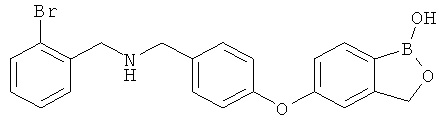
[1055] Соединение D156 получали с использованием методики, аналогичной методике получения соединения D153. ЖХ/МС m/z: 42 4 (М+); 1Н ЯМР (ХЛОРОФОРМ-d) δ: 7,71 (br. s., 1Н), 7,55 (d, J=7,9 Гц, 1H), 7,41 (dd, J=7,6, 1,5 Гц, 1H), 7,36 (d, J=8,4 Гц, 2H), 7,26-7,32 (m, 1H), 7,10-7,19 (m, 2H), 7,01 (d, J=8,5 Гц, 3Н), 6,96 (br. s., 1H), 6,89 (s, 1H), 5,29 (br. s., 1H), 5,04 (br. s., 2H), 3,92 (s, 2H), 3,81 (s, 2H).
5-{ 4-[(3-Bp омбензил амино)-метил]-фенокси]-3Н-бензо[с][1,2]оксаборол-1-ол (D157)
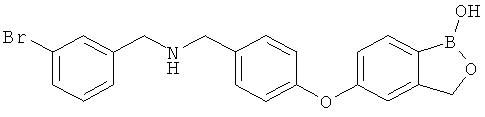
[1056] Соединение D157 получали с использованием методики, аналогичной методике получения соединения D153. ЖХ/МС m/z: 424 (М+); 1H ЯМР (ХЛОРОФОРМ-d) δ: 7,68 (br. s., 1H), 7,52 (s, 1H), 7,38 (dt, J=7,9, 1,4 Гц, 1H), 7,33 (d, J=8,5 Гц, 2H), 7, 26-7, 29 (m, 1H), 7,19 (t, J=7,7 Гц, 1H), 6, 96-7, 03 (m, 1H), 7,01 (d, J=8,5 Гц, 2H), 6,89 (s, 1H), 5,02 (br. s., 2H), 3,80 (d, J=5,5 Гц, 4H), 2,17 (s, 1H).
5-{4-[(2-Метоксибензиламино)-метил]-фенокси}-3Н-бензо[с][1,2]оксаборол-1-ол (D158)
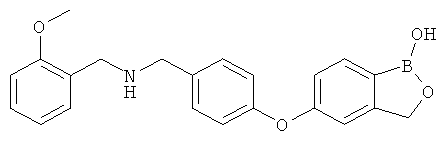
[1057] Соединение D158 получали с использованием методики, аналогичной методике получения соединения D153. ЖХ/МС m/z: 37 6 (М+Н); 1Н ЯМР (ХЛОРОФОРМ-d) δ: 7,64 (s, 1Н), 7,34 (d, J=8,4 Гц, 2Н), 7,27 (s, 1Н), 7,24 (br, s,, 1Н), 6, 85-7, 02 (m, 6H), 5,00 (s, 2H), 3,85 (s, 2H), 3,83 (s, 3Н), 3,78 (s, 2H), 2,16 (s, 1H).
5-[4-(Бензиламинометил)-фенокси]-3Н-бензо[с][1,2]оксаборол-1-ол (D159)
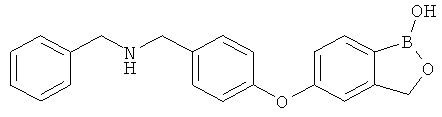
[1058] Соединение D159 получали с использованием методики, аналогичной методике получения соединения D153. ЖХ/МС m/z: 34 6 (М+Н); 1H ЯМР (ХЛОРОФОРМ-d) δ: 7,66 (br. s., 1Н), 7,31-7,38 (m, 6H), 7,28 (d, J=2,5 Гц, ОН), 6,99 (s, 3Н), 6,88 (br. s., 1H), 5,01 (s, 2H), 3,88 (s, 1H), 3,84 (s, 2H), 3,81 (s, 2H).
5-{4-[(2-Метилбензиламино)-метил]-фенокси}-3Н-бензо[с][1,2]оксаборол-1-ол (D160)
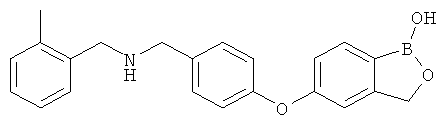
[1059] Соединение D160 получали с использованием методики, аналогичной методике получения соединения D153. ЖХ/МС m/z: 3 60 (М+Н); 1Н ЯМР (ХЛОРОФОРМ-d) δ: 7, 64-7,72 (m, 1Н), 7,32-7, 39 (m, 3Н), 7,18 (dd, J=5,3, 3,4 Гц, 2Н), 7,14-7,21 (m, 1Н), 6,98 (d, J=8,5 Гц, 3Н), 6,87 (s, 1Н), 4,99 (s, 2Н), 3,94 (d, J=1,4 Гц, 4Н), 2,30 (s, 3Н).
5-[4-(Изопропиламинометил)-фенокси]-3Н-бензо[с][1,2]оксаборол-1-ол (D161)
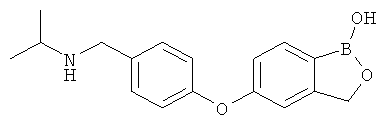
[1060] Соединение D161 получали с использованием методики, аналогичной методике получения соединения D153. ЖХ/МС m/z: 2 98 (М+Н); 1Н ЯМР (ХЛОРОФОРМ-d) δ: 7,61 (d, J=8,4 Гц, 3Н), 6,99 (d, J=8,1 Гц, 2Н), 6,85 (br. s., 2Н), 5,00 (s, 2Н), 3,98 (s, 2Н), 2,15 (s, 1Н), 1,42 (d, J=6,5 Гц, 6Н).
3-{[4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензиламино]-метил}-бензонитрил (D162)
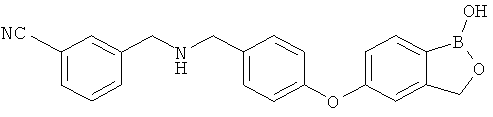
[1061] Соединение D162 получали с использованием методики, аналогичной методике получения соединения D153. ЖХ/МС m/z: 239 (М-131); 1Н ЯМР (ДMCO-d6) δ: 9,86 (br. s., 1Н), 9,15 (br. s., 1H), 8,06 (s, 1H), 7,83-7,93 (m, 2H), 7,65-7,75 (m, 1H), 7,58-7,65 (m, 3H), 7,07 (d, J=8,6 Гц, 1H), 7,04-7,10 (m, 1H), 6,93-6, 99 (m, 2H), 4,91 (s, 2H), 4,14 (br. s., 4H).
4-{[4-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензиламино]-метил}-бензонитрил (D163)
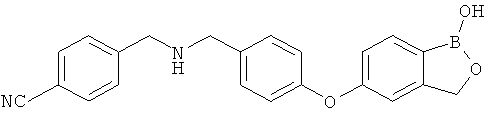
[1062] Соединение D163 получали с использованием методики, аналогичной методике получения соединения D153. ЖХ/МС m/z: 239 (М-131); 1Н ЯМР (ДMCО-d6) δ: 9, 46-9, 73 (m, 1Н), 9,13 (s, 1Н), 7,90 (d, J=8,3 Гц, 2Н), 7,72 (d, J=8,6 Гц, 3Н), 7,52-7, 56 (m, J=8,6 Гц, 2Н), 7,06-7,10 (m, J=8,6 Гц, 2Н), 6,96 (s, 1Н), 6,95 (d, J=0,5 Гц, 1Н), 4,91 (s, 2Н), 4,22 (s, 2Н), 4,09-4,17 (m, 2Н).
5-{4-[(4-Нитро-бензиламино)-метил]-фенокси}-3Н-бензо[с][1,2]оксаборол-1-ол (D164)
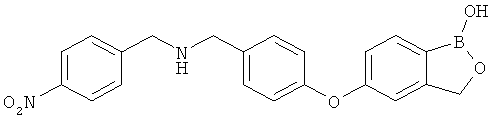
[1063] Соединение D164 получали с использованием методики, аналогичной методике получения соединения D153. ЖХ/МС m/z: 23 9 (М-151); 1Н ЯМР (ДМСО-d6) δ: 9,11 (s, 1Н), 8, 22-8, 27 (m, J=8,7 Гц, 2Н), 7,70 (d, J=8,9 Гц, 3Н), 7,47 (s, 2Н), 7,04-7,08 (m, J=8,5 Гц, 2Н), 6, 93-6, 97 (m, 2Н), 4,90 (s, 2Н), 4, 09-4,23 (m, 2Н), 3,94-4,05 (m, 2Н).
N-(4-([4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензиламино]-метил}-фенил)-ацетамид (D165)
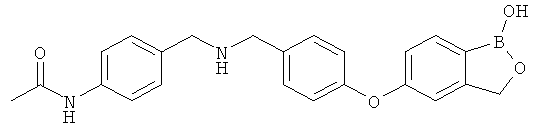
[1064] Соединение D165 получали с использованием методики, аналогичной методике получения соединения D153. ЖХ/МС m/z: 403 (М+Н); 1Н ЯМР (ДМСО-d6) δ: 10,18 (s, 1Н), 9,66 (br. s., 1Н), 9,16 (br. s., 1H), 7,74 (d, J=8,7 Гц, 1H), 7,59 (dd, J=16,0, 8,6 Гц, 4H), 7,45 (d, J=8,6 Гц, 2H), 7,06 (d, J=8,6 Гц, 2H), 6,95 (s, 1H), 6,96 (d, J=3,8 Гц, 1H), 4,91 (s, 2H), 4,04 (br. s., 4H), 2,03 (s, 3H).
N-[4-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензил]-ацетамид (D166)
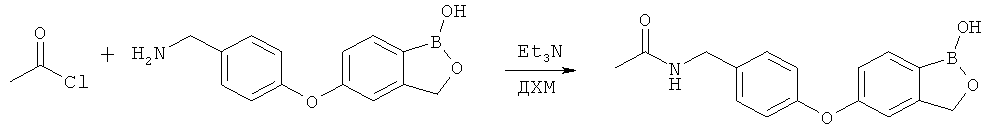
[1065] В сцинтилляционную пробирку объемом 20 мл, содержащую 5-(4-аминометилфенокси)-3Н-бензо[с][1,2]оксаборол-1-ол (150 мг, 0,59 ммоль, 1,0 экв.) в ДХМ (5,0 мл), добавляли Et3N (1(m, мкл, 1,3 ммоль, 2,2 экв.) и затем ацетилхлорид (84 мкл, 1,2 ммоль, 2,0 экв.). Данную смесь перемешивали в течение ночи при комнатной температуре. Затем смесь концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя для элюирования МеОН/ДХМ (0:100-10:90), с получением N-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-фенил]-ацетамида в виде белого твердого вещества. ЖХ/МС m/z: 298 (М+Н); 1Н ЯМР (ХЛОРОФОРМ-d) δ: 7,55 (d, J=8,0 Гц, 1Н), 7,11 (d, J=8,6 Гц, 2Н), 6, 74-6, 83 (m, 3Н), 6,68 (d, J=1,4 Гц, 1Н), 4,79 (s, 2Н), 4,21 (d, J=5,8 Гц, 2Н), 1,84 (s, 3Н). Получено 165 мг, выход 94,3%.
N-[4-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензил]-4-метил-бензамид (D167)
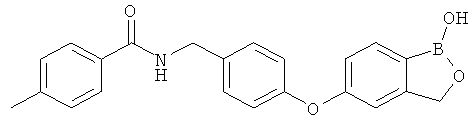
[1066] Соединение D167 получали с использованием методики, аналогичной методике получения соединения D166. ЖХ/МС m/z: 396 (М+23); ХЯ ЯМР (ХЛОРОФОРМ-d) δ: 7,69 (d, J=8,2 Гц, 2Н), 7,35 (d, J=6,8 Гц, 2Н), 7,23 (d, J=7,9 Гц, 2Н), 6, 95-7, 04 (m, 3Н), 6,88 (br. s., 1H), 6,83-6, 93 (m, 1H), 6,38 (br. s., 1H), 5,02 (s, 2H), 4,63 (d, J=5,7 Гц, 2H), 2,39 (s, 3H).
N-[4-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензил]-3-метил-бензамид (D168)
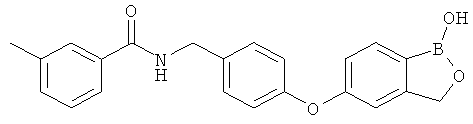
[1067] Соединение D168 получали с использованием методики, аналогичной методике получения соединения D166. ЖХ/МС m/z: 374 (М+Н); 1Н ЯМР (ХЛОРОФОРМ-d) δ: 7,68 (d, J=8,2 Гц, 1Н), 7,63 (s, 1Н), 7, 52-7, 60 (m, 1Н), 7, 30-7,38 (m, 4Н), 7,02 (dd, J=8,6, 2,7 Гц, 3Н), 6,89 (br. s., 1Н), 6,39 (br. s., 1Н), 5,02 (s, 2H), 4,64 (d, J=5,7 Гц, 2H), 3,88 (s, 1H), 2,39 (s, 3H).
N-[4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-2-метил-бензамид. (D169)
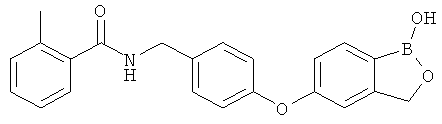
[1068] Соединение D169 получали с использованием методики, аналогичной методике получения соединения D166. ЖХ/МС m/z: 37 4 (М+Н); 1Н ЯМР (ДМСО-dg) 5: 9,08 (s, 1Н), 8,76 (s, 1Н), 7,68 (d, J=8,0 Гц, 1Н), 7, 28-7,38 (m, 4Н), 7,22 (d, J=7,4 Гц, 2Н), 7,00-7,05 (m, 2Н), 6,91-6,96 (m, 2Н), 4,89 (s, 2Н), 4,41 (d, J=6,1 Гц, 2Н), 2,31 (s, 3Н).
N-[4-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензил]-4-нитро-бензамид (D170)
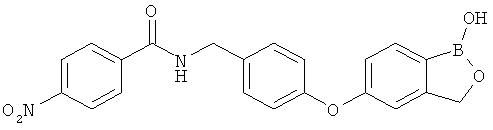
[1069] Соединение D170 получали с использованием методики, аналогичной методике получения соединения D166. ЖХ/МС m/z: 37 4 (М-30); 1Н ЯМР (ДМСО-d6) δ: 9,36 (s, 1Н), 9,08 (s, 1Н), 8, 28-8, 32 (m, 2Н), 8,08-8,12 (m, 2Н), 7,68 (d, J=8,0 Гц, 1Н), 7, 34-7, 38 (m, J=8,6 Гц, 2Н), 6,99-7, 04 (m, 2Н), 6, 89-6, 95 (га, 2Н), 4,89 (s, 2Н), 4,48 (d, J=5,9 Гц, 2Н).
4-Циано-N-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-бензамид (D171)
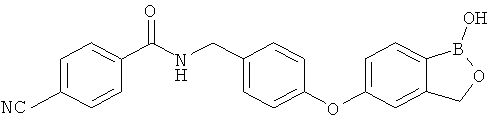
[1070] Соединение D171 получали с использованием методики, аналогичной методике получения соединения D166. ЖХ/МС m/z: 407 (М+23); 1Н ЯМР (ДMCO-d6) δ: 9,28 (s, 1Н), 9,08 (s, 1Н), 8,00-8,05 (m, 2Н), 7, 93-7,97 (m, 2Н), 7,68 (d, J=8,0 Гц, 1Н), 7,32-7,37 (m, J=8,6 Гц, 2Н), 6, 99-7, 04 (m, 2Н), 6, 89-6, 95 (m, 2Н), 4,88 (s, 2Н), 4,47 (d, J=5,9 Гц, 2Н).
N-[4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-4-метокси-бензамид (D172)
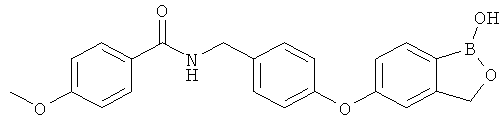
[1071] Соединение D172 получали с использованием методики, аналогичной методике получения соединения D166. ЖХ/МС m/z: 390 (М+Н); 1Н ЯМР (ХЛОРОФОРМ-d) δ: 7, 74-7, 78 (m, 1Н), 7,76 (d, J=8,8 Гц, 2Н), 7,31 (dd, J=8,4, 1,9 Гц, 2Н), 6,97 (s, 1Н), 6,95 (d, J=0,7 Гц, 1Н), 6,92 (dd, J=8,1, 0,6 Гц, 1Н), 6, 85-6,89 (m, 2Н), 6,81-6,84 (m, 1Н), 4,97 (s, 1Н), 4,94 (s, 1Н), 4,57 (d, J=5,2 Гц, 2Н), 3,80 (d, J=1,0 Гц, 3Н).
4-Фтор-N-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-бензамид (D173)
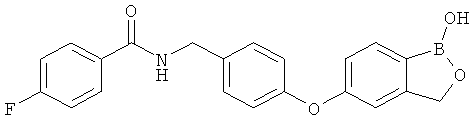
[1072] Соединение D173 получали с использованием методики, аналогичной методике получения соединения D166. ЖХ/МС m/z: 4 00 (М+23); 1Н ЯМР (ХЛОРОФОРМ-d) δ: 7,82 (dd, J=8,8, 5,3 Гц, 2Н), 7, 55-7, 72 (m, 1Н), 7,30 (dd, J=8,7, 2,3 Гц, 2Н), 7,01-7,09 (m, 3Н), 6,96 (d, J=8,5 Гц, 2Н), 6,91 (dt, J=8,1, 2,3 Гц, 1Н), 6,83 (d, J=2,0 Гц, 1Н), 4,95 (d, J=12,8 Гц, 2Н), 4,56 (d, J=5,7 Гц, 2Н).
N-[4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-4-трифторметилбензамид (D174)
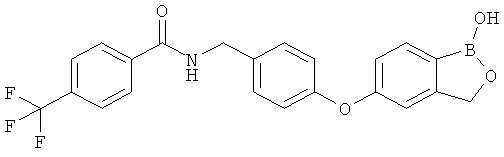
[1073] Соединение D174 получали с использованием методики, аналогичной методике получения соединения D166. ЖХ/МС m/z: 450 (М+23); гЕ ЯМР (ХЛОРОФОРМ-d) δ: 8,20 (s, 1Н), 7, 8 9-7, 94 (m, J=8,2 Гц, 2Н), 7,79 (br. s., 1Н), 7,64 (d, J=8,1 Гц, 1Н), 7,56-7,62 (m, J=8,2 Гц, 2Н), 7,27 (d, J=8,6 Гц, 2Н), 6, 88-6, 93 (m, 2Н), 6,85 (dd, J=8,1, 2,0 Гц, 1Н), 6,78 (s, 1Н), 4,88 (s, 2Н), 4,52 (d, J=5,8 Гц, 2Н).
1-[4-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензилкарбамоил]-1-метил-этиловый эфир уксусной кислоты (D175)
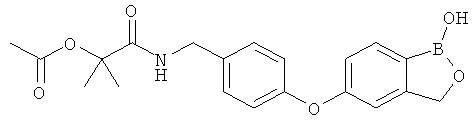
[1074] Соединение D175 получали с использованием методики, аналогичной методике получения соединения D166. ЖХ/МС m/z: 4 06 (М+23); 1Н ЯМР (ХЛОРОФОРМ-d) δ: 7,68 (br. s., 1Н), 7,23-7,28 (m, 2H), 6, 95-7,02 (m, 3Н), 6,88 (s, 1H), 6,40 (br. s., 1H), 5,01 (s, 2H), 4,46 (d, J=5,9 Гц, 2H), 2,06 (s, 3H), 2,03 (s, 1H), 1,66 (s, 6H).
N-[4-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензил]-изобутирамид. (D176)
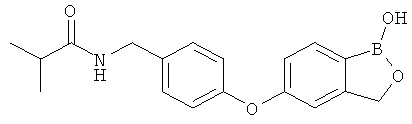
[1075] Соединение D176 получали с использованием методики, аналогичной методике получения соединения D166. ЖХ/МС m/z: 32 6 (М+Н); 1Н ЯМР (ХЛОРОФОРМ-d) δ: 7,68 (br. s., 1Н), 7, 24-7,28 (m, 2H), 6, 96-7, 02 (m, 3Н), 6,84-6, 92 (m, 1H), 5,77 (br. s., 1H), 5,02 (s, 2H), 4,43 (d, J=5,8 Гц, 2H), 1,19 (d, J=6,9 Гц, 6H).
N-[4-(1-Гидрокси-1, 3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-2,2-диметилпропионамид (D177)
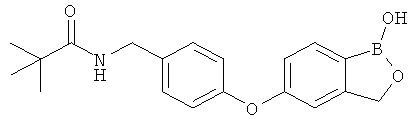
[1076] Соединение D177 получали с использованием методики, аналогичной методике получения соединения D166. ЖХ/МС m/z: 340 (М+Н); 1Я ЯМР (ХЛОРОФОРМ-d) δ: 7,66 (br. s., 1Н), 7,21-7,26 (m, 2H), 6,99 (d, J=8,5 Гц, 2H), 6, 94-7, 00 (m, 1H), 6,88 (s, 1H), 6,02 (br. s., 1H), 5,01 (s, 2H), 4,42 (d, J=5,7 Гц, 2H), 3,82 (br. s., 1H), 1,23 (s, 9H).
N-[4-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензил]-пропионамид (D178)
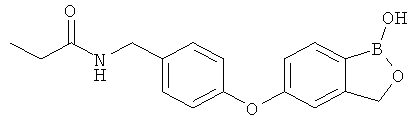
[1077] Соединение D178 получали с использованием методики, аналогичной методике получения соединения D166. ЖХ/МС m/z: 312 (М+Н); 1Н ЯМР (ДМСО-d6) δ: 9,08 (br. s., 1Н), 8,24 (br. s., 1H), 7,68 (d, J=8,0 Гц, 1H), 7,23-7, 29 (m, J=8,5 Гц, 2H), 6,97-7,03 (m, 2H), 6,93 (dd, J=8,0, 2,1 Гц, 1H), 6,90 (s, 1H), 4,89 (s, 2H), 4,23 (d, J=6,0 Гц, 2H), 2,12 (q, J=7,6 Гц, 2H), 1,00 (t, J=7,6 Гц, 3Н).
4-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензиламид циклопентанкарбоновой кислоты (D179)
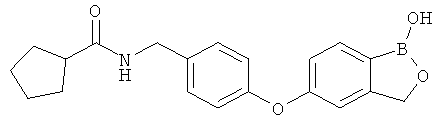
[1078] Соединение D179 получали с использованием методики, аналогичной методике получения соединения D166. ЖХ/МС m/z: 352 (М+Н); 1Н ЯМР (ХЛОРОФОРМ-d) δ: 7,66 (d, J=8,1 Гц, 1Н), 7,19 (d, J=8,5 Гц, 2Н), 6,85-6, 93 (m, 3Н), 6,79 (s, 1Н), 6,31 (br. s., 1Н), 4,91 (s, 2H), 4,34 (d, J=5,8 Гц, 2H), 1, 64-1,83 (га, 6Н), 1,45-1,54 (m, 2Н).
4-(1-Тидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензиламид-циклогексанкарбоновой кислоты (D180)
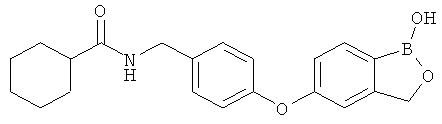
[1079] Соединение D180 получали с использованием методики, аналогичной методике получения соединения D166. ЖХ/МС m/z: 366 (М+Н); 1Н ЯМР (ХЛОРОФОРМ-d) δ: 7,71 (br. s., 1Н), 7,24 (d, J=8,5 Гц, 2H), 6,97 (d, J=8,4 Гц, 3Н), 6,87 (s, 1H), 5,96 (br. s., 1H), 5,01 (br. s., 2H), 4,42 (d, J=5,7 Гц, 2H), 1,88 (d, J=13,2 Гц, 2Н), 1,77 (d, J=9,8 Гц, 2Н), 1,66 (d, J=5,7 Гц, 1Н), 1,46 (d, J=12,3 Гц, 2H), 1,16-1,31 (m, 3Н).
4-(1-Гидрокси-1,3-дигидро-бензо[с] [1,2] оксаборол-5-илокси)-бензиламид фуран-2-карбоновой кислоты (D181)
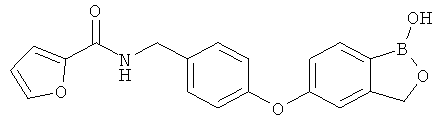
[1080] Соединение D181 получали с использованием методики, аналогичной методике получения соединения D166. ЖХ/МС m/z: 350 (М+Н); 1H ЯМР (ХЛОРОФОРМ-d) δ: 8,01 (s, 1Н), 7,67 (d, J=8,0 Гц, 1Н), 7,38 (d, J=0,9 Гц, 1Н), 7,24-7,31 (m, 2Н), 7,08 (d, J=3,5 Гц, 1Н), 6, 87-6,96 (m, 4Н), 6,81 (s, 1Н), 6,44 (dd, J=3,4, 1,7 Гц, 1Н), 4,92 (s, 2Н), 4,53 (d, J=6,0 Гц, 2Н).
4-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензиламидпирролидин-1-карбоновой кислоты (D182)
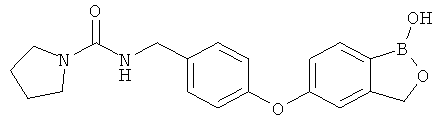
[1081] Соединение D182 получали с использованием методики, аналогичной методике получения соединения D166. ЖХ/МС m/z: 3 53 (М+Н); 1Н ЯМР (ХЛОРОФОРМ-d) δ: 7,71 (d, J=8,1 Гц, 1Н), 7,30 (d, J=8,4 Гц, 2Н), 6,90-7, 02 (m, 3Н), 6,86 (d, J=1,1 Гц, 1Н), 6,61 (br. s., 1Н), 4,96-5, 02 (m, 2Н), 4,57 (br. s., 1Н), 4,43 (d, J=5,7 Гц, 2H), 3,36 (t, J=6,5 Гц, 4H), 1,90 (t, J=3,0 Гц, 3Н), 1, 90 (d, J=13,4 Гц, 1H).
Трет-бутиловый эфир [4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-карбаминовой кислоты (D183)
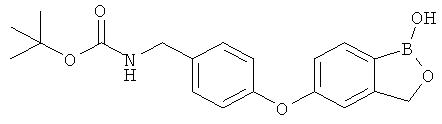
[1082] Соединение D183 получали с использованием методики, аналогичной методике получения соединения D166. ЖХ/МС m/z: 353 (М+Н); 1Н ЯМР (ХЛОРОФОРМ-d) δ: 7,68 (d, J=8,1 Гц, 1Н), 7,27 (d, J=8,5 Гц, 2Н), 6, 96-7, 03 (m, 1Н), 7,00 (d, J=8,5 Гц, 2Н), 6,87 (s, 1Н), 5,00 (s, 2Н), 4,30 (br. s., 2Н), 1,46 (s, 9Н).
1-[4-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензил]-3-фенил-мочевина (D184)
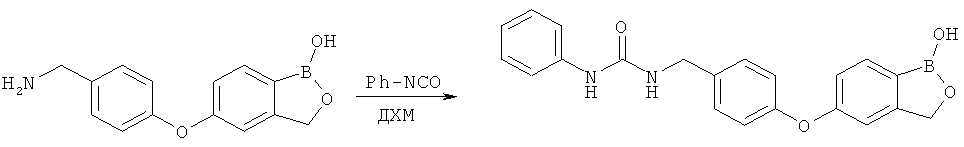
[1083] В сцинтилляционную пробирку объемом 20 мл, содержащую 5-(4-аминометил-фенокси)-3Н-бензо[с][1,2]оксаборол-1-ол (150 мг, 0,59 ммоль, 1,0 экв.) в ДХМ (5,0 мл), добавляли фенилизоцианат (71 мкл, 0,65 ммоль, 1,1 экв.). Данную смесь перемешивали в течение ночи при комнатной температуре. Затем смесь обрабатывали Н2O (5 мл). Осадок собирали путем фильтрования и промывали Н2O с получением, 1-
[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-3-фенилмочевины в виде белого твердого вещества. ЖХ/МС m/z: 375 (М+Н); 1Н ЯМР (ДMCO-d6) δ: 9,07 (s, 1Н), 8,51 (s, 1H), 7,67 (d, J=8,0 Гц, 1H), 7,37 (dd, J=8,6, 1,0 Гц, 2H), 7,30-7,35 (m, J=8,6 Гц, 2H), 7,19 (t, J=8,0 Гц, 2H), 6, 99-7, 04 (m, 2H), 6, 88-6, 95 (m, 3H), 6,58 (s, 1H), 4,89 (s, 2H), 4,27 (d, J=5,9 Гц, 2H).
1-Этил-3-[4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензил]-мочевина (D185)
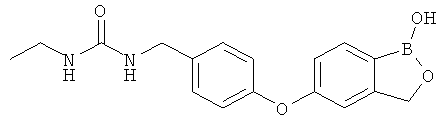
[1084] Соединение D185 получали с использованием методики, аналогичной методике получения соединения D184. ЖХ/МС m/z: 327 (М+Н); 1Н ЯМР (ДMCO-d6) δ: 9,07 (s, 1Н), 7,67 (d, J=8,0 Гц, 1H), 7, 23-7, 28 (m, J=8,6 Гц, 2H), 6, 97-7, 02 (m, 2H), 6, 87-6, 94 (m, 2H), 6,27 (s, 1H), 5,85 (s, 1H), 4,88 (s, 2H), 4,16 (d, J=6,0 Гц, 2H), 3,00 (dd, J=7,1, 5,7 Гц, 2H), 0,97 (t, J=7,2 Гц, 3Н).
1-[4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-3-пара-толил-мочевина (D186)
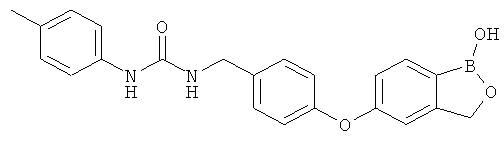
[1085] Соединение D186 получали с использованием методики, аналогичной методике получения соединения D184. ЖХ/МС m/z: 38 9 (М+Н); 1Н ЯМР (ДMCO-d6) δ: 9,07 (s, 1Н), 8,40 (s, 1Н), 7,68 (d, J=8,0 Гц, 1Н), 7, 24-7, 35 (m, 4Н), 6, 98-7, 05 (m, 4Н), 6, 89-6, 96 (m, 2Н), 6,53 (s, 1Н), 4,89 (s, 2Н), 4,26 (d, J=5,9 Гц, 2Н), 2,19 (s, 3Н).
1-Циклогексил-3-[4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензил]-мочевина (D187)
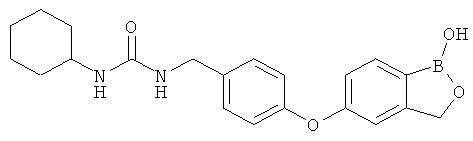
[1086] Соединение D187 получали с использованием методики, аналогичной методике получения соединения D184. ЖХ/МС m/z: 381 (М+Н); 1Н ЯМР (ДМСО-d6) δ: 9,07 (s, 1Н), 7,68 (d, J=8,0 Гц, 1Н), 7,26 (d, J=8,6 Гц, 2Н), 7,00 (d, J=8,5 Гц, 1Н), 6, 97-7, 03 (m, 1Н), 6,88-6,95 (m, 2Н), 6,16 (s, 1Н), 5,80 (d, J=8,0 Гц, IE), 4,89 (s, 2Н), 4,17 (d, J=6,0 Гц, 2H), 1,71 (br. s., 2H), 1,60 (br. s., 2H), 1, 44-1, 55 (m, 1H), 1,23 (br. s., 2H), 1,08 (br. s., 3H).
1-(4-Хлорфенил)-3-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-мочевина (D188)
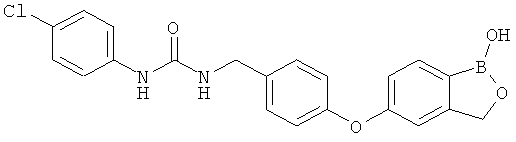
[1087] Соединение D188 получали с использованием методики, аналогичной методике получения соединения D184. ЖХ/МС m/z: 409 (М+Н); 1Н ЯМР (ДMCO-d6) δ: 9,08 (br. s., 1Н), 8,70 (s, 1H), 7,68 (d, J=8,0 Гц, 1H), 7,42 (d, J=8,9 Гц, 1H), 7,42 (q, J=5,2 Гц, 1H), 7, 30-7, 38 (m, 2H), 7,24 (d, J=8,9 Гц, 1H), 7,24 (q, J=5,1 Гц, 1H), 6, 96-7, 05 (m, 1H), 7,02 (d, J=8,5 Гц, 1H), 6,88-6,96 (m, 2H), 6,66 (s, 1H), 4,89 (s, 2H), 4,27 (d, J=5,9 Гц, 2H).
1-(4-Диметиламинофенил)-3-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-мочевина (D189)
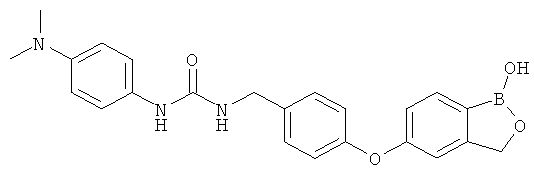
[1088] Соединение D189 получали с использованием методики, аналогичной методике получения соединения D184. ЖХ/МС m/z: 418 (М+Н); 1H ЯМР (ДMCO-d6) δ: 9,07 (s, 1Н), 8,13 (s, 1Н), 7,67 (s, 1Н), 7,31 (s, 2Н), 7,18 (d, J=9,1 Гц, 2Н), 7,02 (d, J=8,6 Гц, 2Н), 6,90 (s, 2Н), 6,63 (d, J=9,1 Гц, 2Н), 6,41 (s, 1Н), 4,89 (s, 2Н), 4,26 (s, 2Н), 2,78 (s, 6Н).
Трет-бутиловый эфир {1-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензилкарбамоил]-этил}-карбаминовой кислоты (D190)
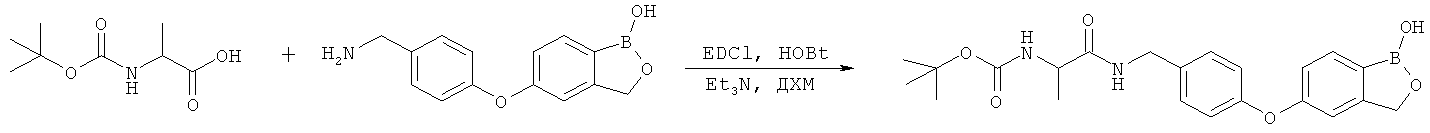
[1089] В сцинтилляционную пробирку объемом 40 мл, содержащую 5-(4-аминометилфенокси)-3Н-бензо[с][1, 2]оксаборол-1-ол (350 мг, 1,37 ммоль, 1,0 экв.), EDCl (314,4 мг, 1,64 ммоль, 1,2 экв.), HOBt (221,6 мг, 1,64 ммоль, 1,2 экв.) и Et3N (0,46 мл mg, 3,29 ммоль, 2,4 экв.) в ДХМ (15,0 мл), добавляли по каплям 2-трет-бутоксикарбониламинопропионовую кислоту (311,1 мг, 1,64 ммоль, 1,2 экв.). Данную смесь перемешивали в течение ночи при комнатной температуре. Затем смесь обрабатывали Н2O (10 мл), слои разделяли. Водный слой экстрагировали ДХМ (2×10 мл), объединенные органические фазы промывали солевым раствором (10 мл), сушили над MgSO4, фильтровали, и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя для элюирования МеОН/ДХМ (0:100-10:90), с получением трет-бутилового эфира {1-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензилкарбамоил]-этил}-карбаминовой кислоты в виде белого твердого вещества. ЖХ/МС m/z: 449 (М+23); 1Н ЯМР (ДМСО-d) δ: 9,08 (s, 1Н), 8,26 (t, J=5,7 Гц, 1Н), 7,68 (d, J=8,0 Гц, IE), 7,22-7,31 (m, J=8,4 Гц, 2H), 6,96-7,01 (m, J=8,5 Гц, 2H), 6, 88-6, 95 (m, 3Н), 4,89 (s, 2Н), 4,21-4,30 (m, 2Н), 3, 88-4, 02 (m, 1Н), 1,35 (s, 9H), 1,18 (d, J=7,1 Гц, 3Н).
Трет-бутиловый эфир {1-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензилкарбамоил]-2-фенилэтил}-карбаминовой кислоты (D191)
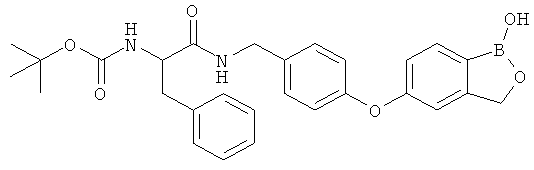
[1090] Соединение D191 получали с использованием методики, аналогичной методике получения соединения D190. ЖХ/МС m/z: 525 (М+23); 1Н ЯМР (ДМСО-d6) δ: 9,08 (s, 1Н), 8,39 (t, J=5,7 Гц, 1Н), 7,68 (d, J=8,0 Гц, 1Н), 7,18-7,27 (m, 8Н), 6, 89-6, 99 (m, 4Н), 4,89 (s, 2Н), 4,26 (d, J=5,9 Гц, 2Н), 4,11-4,21 (m, 1Н), 2,89-3,03 (m, 1Н), 2,71-2,86 (m, 1Н), 1,29 (s, 9Н).
Трет-бутиловый эфир {[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензилкарбамоил]-метил}-карбаминовой кислоты (D192)
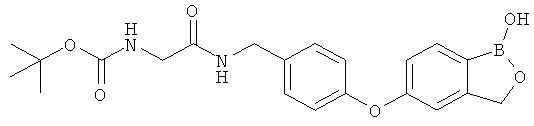
[1091] Соединение D192 получали с использованием методики, аналогичной методике получения соединения D190. ЖХ/МС m/z: 4 35 (М+23); 1H ЯМР (ХЛОРОФОРМ-d) δ: 7,66 (br. s., 1Н), 7,24 (d, J=6,2 Гц, 1H), 7,26 (s, 1H), 6, 93-6, 98 (m, 3H), 6,85 (s, 1H), 6,73 (br. s., 1H), 4,98 (br. s., 2H), 4,44 (d, J=5,9 Гц, 2H), 3,83 (d, J=6,1 Гц, 2H), 2,16 (s, 1H), 2,07 (s, 1H), 1,41 (s, 9H).
Трет-бутиловый эфир {1-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензилкарбамоил]-3-метилбутил}-карбаминовой кислоты (D193)
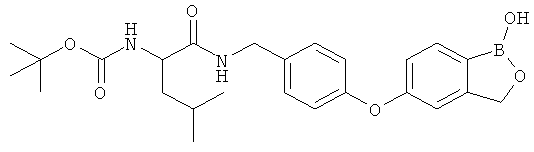
[1092] Соединение D193 получали с использованием методики, аналогичной методике получения соединения D190. ЖХ/МС m/z: 4 91 (М+23); 1Н ЯМР (ДMCO-d6) δ: 9,08 (s, 1Н), 8,30 (t, J=5, 9 Гц, 1Н), 7,68 (d, J=8,0 Гц, 1Н), 7,26 (d, J=8,5 Гц, 2Н), 6,98 (d, J=8,5 Гц, 2Н), 6, 85-6, 94 (ш, 3Н), 4,89 (s, 2Н), 4,24 (d, J=5,9 Гц, 2Н), 3,92-4,01 (m, 1Н), 1, 39-1, 48 (m, 1Н), 1,35 (s, 9Н), 1,26-1,32 (m, 1Н), 0,84 (dd, J=10,5, 6,6 Гц, 7Н).
Трет-бутиловый эфир {[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензилкарбамоил]-метил}-метилкарбаминовой кислоты (D194)
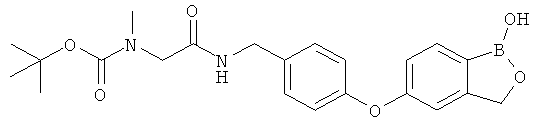
[1093] Соединение D194 получали с использованием методики, аналогичной методике получения соединения D190. ЖХ/МС m/z: 449 (М+23); 1H ЯМР (ДMCО-d6) δ: 9,08 (s, 1Н), 8,35 (t, J=5,5 Гц, IE), 7,68 (d, J=8,0 Гц, 1H), 7,29 (d, J=7,8 Гц, 2H), 6, 97-7, 04 (m, 2H), 6, 86-6, 96 (m, 2H), 4,89 (s, 2H), 4,26 (d, J=6,0 Гц, 2H), 3, 74-3,83 (m, 2H), 2,80 (br. s., 3H), 1,38 (s, 4H), 1,29 (s, 5H).
2-Диметиламино-N-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-ацетамид (D195)
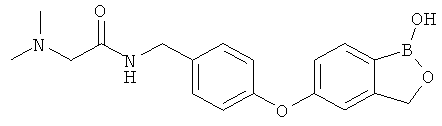
[1094] Соединение D195 получали с использованием методики, аналогичной методике получения соединения D190. ЖХ/МС m/z: 341 (М+Н); 1H ЯМР (ДMCO-d6) δ: 9,08 (s, 1Н), 8,26 (t, J=6,2 Гц, 1Н), 7,68 (d, J=8,1 Гц, 1H), 7,25-7,31 (m, 2H), 6, 97-7, 02 (m, 2H), 6, 88-6, 95 (m, 2H), 4,89 (s, 2H), 4,26 (d, J=6,2 Гц, 2H), 2,89 (s, 2H), 2,19 (s, 6H).
4-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензиламид 1-метилпирролидин-2-карбоновой кислоты (D196)
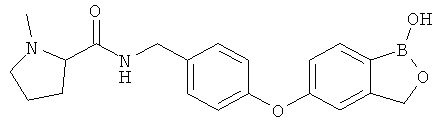
[1095] Соединение D196 получали с использованием методики, аналогичной методике получения соединения D190. ЖХ/МС m/z: 367 (М+Н); 1Н ЯМР (ДМСО-d6) δ: 9,08 (s, 1Н), 8,25 (t, J=6,2 Гц, 1Н), 7,68 (d, J=8,0 Гц, 1H), 7,22-7,29 (m, J=8,6 Гц, 2H), 6,96-7,03 (m, 2H), 6, 89-6, 96 (га, 2H), 4,89 (s, 2H), 4,19-4,31 (m, 2H), 2,97-3,04 (m, 1H), 2,74 (dd, J=9,4, 5,8 Гц, 1H), 2,26 (s, 3H), 2,19-2,24 (m, 1H), 2,01-2,12 (m, 1H), 1,62-1,75 (m, 3H).
2-Диметиламино-Ы-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-3-фенил-пропионамид (D197)
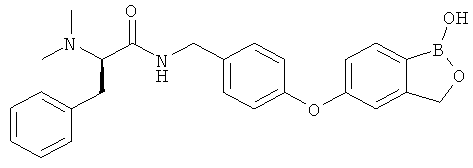
[1096] Соединение D197 получали с использованием методики, аналогичной методике получения соединения D190. ЖХ/МС m/z: 4 31 (М+Н); 1Н ЯМР (ДМСО-d6) δ: 9,08 (s, 1Н), 8,24 (t, J=5, 9 Гц, 1Н), 7,68 (d, J=8,0 Гц, 1Н), 7,12-7,24 (m, 5Н), 7,03 (d, J=8,6 Гц, 2Н), 6,87-6, 93 (m, 4Н), 4,90 (s, 2Н), 4, 25-4, 32 (m, 1Н), 4,10 (dd, J=14,7, 5,2 Гц, 1Н), 3,27 (dd, J=9,5, 5,1 Гц, 1Н), 2,96 (dd, J=13,1, 9,5 Гц, 1Н), 2,76 (dd, J=13,1, 5,1 Гц, 1Н), 2,25 (s, 6Н).
Трет-бутиловый эфир (2-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензилкарбамоил]-пирролидин-1-карбоновой кислоты (D198)
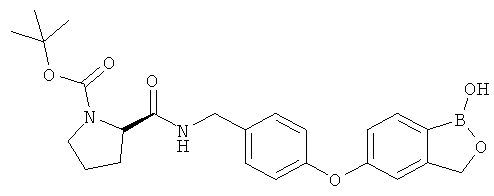
[1097] Соединение D198 получали с использованием методики, аналогичной методике получения соединения D190. ЖХ/МС m/z: 475 (М+23); 1H ЯМР (ДMCO-d6) δ: 9,08 (s, 1Н), 8, 29-8, 40 (m, 1Н), 7,68 (d, J=8,0 Гц, 1Н), 7, 25-7, 34 (m, 2Н), 6, 95-7, 03 (m, 2Н), 6,87-6,95 (m, 2Н), 4,89 (s, 2Н), 4, 26-4, 35 (m, 1Н), 4,01-4,25 (m, 2Н), 3,33-3,43 (m, 1H), 3,22-3,30 (m, 2H), 1,66-1,87 (m, 3H), 1,38 (s, 3H), 1,25 (s, 6H).
Трет-бутиловый эфир 2-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензилкарбамоил]-пиперидин-1-карбоновой кислоты (D199)

[1098] Соединение D199 получали с использованием методики, аналогичной методике получения соединения D190. ЖХ/МС m/z: 48 9 (М+23); 1Н ЯМР (ДМСО-de) 5: 9,08 (s, 4Н), 7,68 (d, J=7,5 Гц, 3Н), 7,67 (d, J=0,2 Гц, 1Н), 7,27 (d, J=8,6 Гц, 7Н), 6, 97-7,02 (m, 7Н), 4,89 (s, 7Н), 3,29 (s, 5Н), 2,48 (dt, J=3,7, 1,8 Гц, 17Н), 2,48 (d, J=7,6 Гц, 17Н).
2-Амино-N-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-3-фенил-пропионамид (D200)
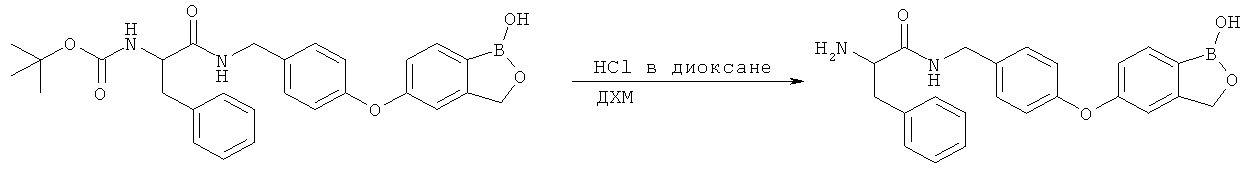
[1099] В сцинтилляционную пробирку объемом 20 мл, содержащую трет-бутиловый эфир {1-[4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензилкарбамоил]-2-фенилэтил}-карбаминовой кислоты (190 мг, 0,38 ммоль, 1,0 экв.) в ДХМ (5,0 мл), добавляли 4,0 М НСl в 1,4-диоксане (5,0 мл), и данную смесь перемешивали в течение ночи при комнатной температуре. Затем смесь концентрировали при пониженном давлении с получением 2-амино-N-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-3-фенил-пропионамида в виде светло-желтого стеклообра3Ного твердого вещества. ЖХ/МС m/z: 403 (М+Н); 1H ЯМР (ДМСО-d6) δ: 8,91 (br. s., 1Н), 8,32 (br. s., 3H), 7,70 (d, J=8,0 Гц, 1H), 7, 23-7, 33 (m, 4H), 7,19-7,23 (m, 2H), 7,11 (d, J=8,6 Гц, 2H), 6, 88-6, 99 (m, 4H), 4,90 (s, 2H), 4,27-4,35 (m, 1H), 4,15-4,24 (m, 1H), 3,98-4,06 (m, 1H), 3,0 4 (d, J=7,2 Гц, 2H).
2-Амино-N-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-пропионамид (D201)
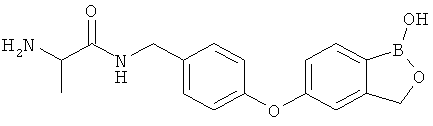
[1100] Соединение D201 получали с использованием методики, аналогичной методике получения соединения D200. ЖХ/МС m/z: 327 (М+Н); гН ЯМР (ДМСО-dg) 5: 8,88 (s, 1Н), 8,14 (br. s., 3Н), 7,69 (d, J=8,0 Гц, 1Н), 7,30 (d, J=8,6 Гц, 2H), 6, 99-7, 05 (m, 2H), 6, 89-6, 96 (m, 2H), 4,89 (s, 2H), 4,32 (t, J=5,3 Гц, 2H), 3,82-3,91 (m, 1H), 1,36 (d, J=7,0 Гц, 3Н).
4-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензиламид 2-амино-4-метилпентановой кислоты (D202)
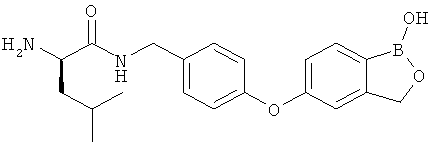
[1101] Соединение D202 получали с использованием методики, аналогичной методике получения соединения D200. ЖХ/МС m/z: 369 (М+Н); 1Н ЯМР (ДМСО-d6) δ: 9,07-9,15 (m, 2Н), 8,29 (br. s., 3Н), 7,71 (d, J=8,0 Гц, 1Н), 7, 29-7, 36 (m, J=8,6 Гц, 2H), 6,99-7,06 (m, 2H), 6, 88-6, 96 (m, 2H), 4,90 (s, 2H), 4, 26-4,36 (m, 2H), 3,72-3,83 (m, 1H), 1,53-1, 66 (m, 3H), 0,87 (dd, J=7,6, 6,2 Гц, 6H).
N-[4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-2-метиламиноацетамид (D203)
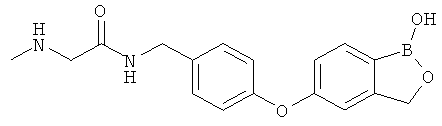
[1102] Соединение D203 получали с использованием методики, аналогичной методике получения соединения D200. ЖХ/МС m/z: 327 (М+Н); 1Н ЯМР (ДМСО-d6) δ: 7, 70 (d, J=8,0 Гц, 1Н), 7,32 (d, J=8,4 Гц, 2Н), 7,03 (d, J=8,6 Гц, 2Н), 6, 89-6, 96 (m, 2Н), 4,90 (s, 2Н), 4,33 (d, J=5,9 Гц, 2Н), 3,74 (t, J=5,7 Гц, 2Н), 2,55 (dd, 3Н).
4-(1-Гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензиламид пирролидин-2-карбоновой кислоты (D204)
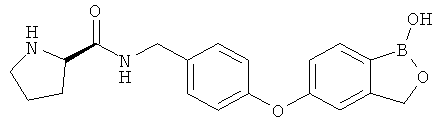
[1103] Соединение D204 получали с использованием методики, аналогичной методике получения соединения D200. ЖХ/МС m/z: 353 (М+Н); 1Н ЯМР (ДMCO-d6) δ: 9,11 (br. s., 1Н), 9,06 (t, J=5,8 Гц, 1H), 7,70 (d, J=8,0 Гц, 1H), 7,31 (d, J=8,6 Гц, 2H), 7,03 (d, J=8,6 Гц, 1H), 7,03 (q, J=4,9 Гц, 1H), 6, 89-6, 97 (m, 2H), 4,90 (s, 2H), 4,33 (d, J=5,8 Гц, 2H), 4,18 (br. s., 1H), 3,17-3,26 (m, 2H), 2, 23-2,35 (m, 1H), 1, 79-1, 94 (m, 3H).
4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензиламид пиперидин-2-карбоновой кислоты (D205)
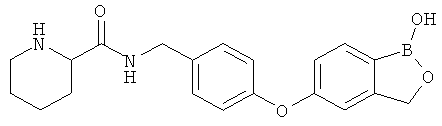
[1104] Соединение D205 получали с использованием методики, аналогичной методике получения соединения D200. ЖХ/МС m/z: 3 67 (М+Н); 1Н ЯМР (ДМСО-d6) δ: 9,12 (br. s., 1Н), 9,03 (t, J=5,8 Гц, 1H), 8, 62-8, 72 (m, 1H), 7,71 (d, J=8,0 Гц, 1H), 7,30 (d, J=8,6 Гц, 2H), 6, 99-7,05 (m, 2H), 6, 89-6, 96 (m, 2H), 4,90 (s, 2H), 4,32 (dd, J=5,6, 3,2 Гц, 2H), 3,73-3, 82 (m, 1H), 3, 25-3, 40 (m, 2H), 3,20 (d, J=12,5 Гц, 1H), 2, 86-2, 95 (m, OH), 2,12 (d, J=12,0 Гц, 1H), 1,44-1,79 (m, 3H).
Гидразид 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты (D206)
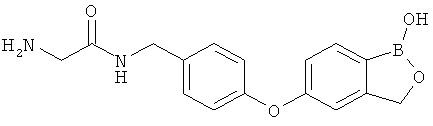
[1105] Соединение D206 получали с использованием методики, аналогичной методике получения соединения D200. ЖХ/МС m/z: 285 (М+Н); 1Н ЯМР (ДМСО-d6) δ: 11,68 (s, 1Н), 7, 92-8, 04 (m, 2Н), 7,79 (d, J=8,0 Гц, 1Н), 7,08-7,15 (m, 3Н), 7,06 (dd, J=8,0, 2,1 Гц, 1Н), 4,94 (s, 2Н).
2-Амино-N-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензил]-ацетамид (D207)
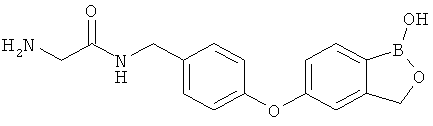
[1106] Соединение D207 получали с использованием методики, аналогичной методике получения соединения D200. ЖХ/МС m/z: 313 (М+23); 1Н ЯМР (ДMCO-d6) δ: 8,95 (br. s., 1Н), 8,16 (br. s., 2H), 7,71 (d, J=8,0 Гц, 1Н), 7,29-7, 36 (m, 2H), 6, 98-7, 06 (m, 2H), 6, 88-6, 97 (m, 2H), 4,90 (s, 2H), 4,32 (d, J=5,9 Гц, 2H), 3,47-3, 67 (m, 2H).
6-(1-Гидрокси-3-метил-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-никотинонитрил (D208)
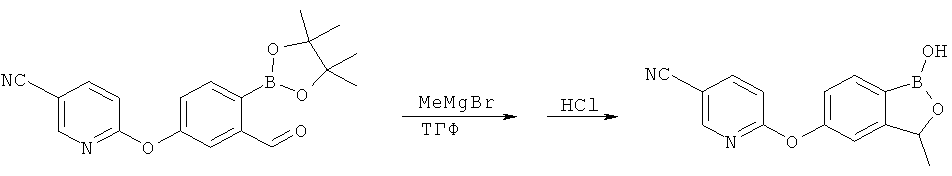
[1107] К суспензии 6-[3-формил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-никотинонитрила (105 мг, 0,3 ммоль, 1,0 экв.) в ТГФ (5,0 мл) при 0°С добавляли по каплям MeMgBr (0,15 мл, 0,45 ммоль, 1,5 экв.). Данную смесь перемешивали в течение 20 минут при 0°С и затем оставляли нагреваться до комнатной температуры в течение 1 ч. После охлаждения до 0°С полученный прозрачный раствор осторожно обрабатывали Н2O (1 мл), и затем медленно добавляли 3Н. НСl (10 мл). Полученную желтую суспензию оставляли медленно нагреваться до комнатной температуры и перемешивали в течение 2 ч. Затем pH смеси доводили до 7, добавляя по каплям насыщенный раствор NaHCO3, и данную смесь экстрагировали EtOAc (3×10 мл). Объединенные органические экстракты промывали солевым раствором (10 мл), сушили над MgSO4, фильтровали, и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя для элюирования МеОН/ДХМ (0:100-10:90), с получением 6-(1-гидрокси-3-метил-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-никотинонитрила в виде белого твердого вещества. ЖХ/МС m/z: 2 67 (М+Н); 1H ЯМР (ДMCO-d6) δ: 9,19 (s, 1Н), 8,71 (dd, J=2,3, 0,6 Гц, 1Н), 8,38 (dd, J=8,7, 2,4 Гц, IE), 7,80 (d, J=7,9 Гц, 1H), 7, 28-7, 35 (m, 2H), 7,20 (dd, J=7,9, 2,0 Гц, 1H), 5,26 (q, J=6,5 Гц, 1H), 1,45 (d, J=6,6 Гц, 3Н).
4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензальдегид (D209)
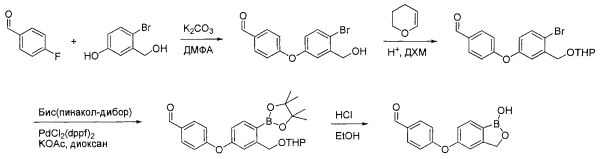

[1108] К раствору 4-фторбензальдегида (5,4 мл, 50,0 ммоль, 1,0 экв.), 4-бром-3-гидроксиметилфенола (10,6 г, 50,0 ммоль, 1,0 экв.) в ДМФА (140,0 мл) в атмосфере азота добавляли К2СO3 (8,3 г, 60,0 ммоль, 1,2 экв.). Данную смесьь нагревали в течение ночи при 80°С. После охлаждения до комнатной температуры смесь вливали в EtOAc (10 мл), и добавляли Н2O (100 мл). Слои разделяли, и водную фазу экстрагировали EtOAc (3×100 мл). Объединенные органические экстракты промывали солевым раствором (100 мл), сушили над MgSO4 фильтровали, и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя для элюирования МеОН/ДХМ (0:100-10:90), с получением 4-(4-бром-3-гидроксиметил-фенокси)-бензальдегида в виде желтого масла. 1Н ЯМР (ХЛОРОФОРМ-d) δ: 9,93 (s, 1Н), 7, 80-7, 89 (m, 2Н), 7,55 (d, J=8,6 Гц, 1Н), 7,27 (d, J=3,1 Гц, 1Н), 7,06 (d, J=8,7 Гц, 2Н), 6,89 (dd, J=8,6, 2,9 Гц, 1Н), 4,74 (s, 2Н). Получено 15,2 г, выход 99%.
[1109] К суспензии 44-(4-бром-3-гидроксиметилфенокси)-бензальдегида (15,2 г, 49,5 ммоль, 1,0 экв.) в ДХМ (250 мл) добавляли 3,4-дигидро-2Н-пиран (6,7 мл, 74,2 ммоль, 1,5 экв.) и затем камфорсульфоновую кислоту (300 мг). Данную смесь перемешивали в течение 2 ч при комнатной температуре Добавляли К2СО3 (1 г), смесь промывали Н2O (150 мл), солевым раствором (150 мл). Органическую фазу сушили над MgSO4, фильтровали, и полученный фильтрат концентрировали при пониженном давлении. Маслянистый остаток очищали путем хроматографии на силикагеле используя для элюирования градиент EtOAc/гептан (0:100-50:50), с получением 4-[4-бром-3-(тетрагидропиран-2-илоксиметил)-фенокси]-бензальдегида в виде светло-желтого масла. 1H ЯМР (ХЛОРОФОРМ-d) δ: 9,93 (s, 1Н), 7,81-7,89 (m, 2Н), 7,54 (d, J=8,6 Гц, 1Н), 7,29 (d, J=2,9 Гц, 1Н), 7,04-7,11 (m, 2Н), 6,87 (dd, J=8,6, 2,9 Гц, 1Н), 4,81 (d, J=14,0 Гц, 1Н), 4,76 (t, J=3,4 Гц, IE), 4,55 (d, J=14,0 Гц, 1H), 3,88 (ddd, J=11,3, 8,6, 3,1 Гц, 1H), 3,51-3,61 (m, 1H), 1,71-1,88 (m, 6H).
[1110] К раствору 4-[4-бром-3-(тетрагидропиран-2-илоксиметил)-фенокси]-бензальдегида (1,17 г, 3,0 ммоль, 1,0 экв.) в 1,4-диоксане (20 мл) добавляли бис-пинакол-дибор (838 мг, 3,3 ммоль, 1,1 экв.), КОАс (883 мг, 9,0 ммоль, 3,0 экв.) и PdCl2 (dppf) 2 (65,8 мг, 0,0 9 ммоль, 0,0 3 экв.). Данную смесь дегазировали с использованием N2 и нагревали в течение ночи при 80°С. После охлаждения до комнатной температуры смесь фильтровали через короткий картридж с целитом, и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя для элюирования градиент EtOAc/гептан (0:100-70:30), с получением 4-[3-(тетрагидропиран-2-илоксиметил)-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-бензальдегида в виде прозрачного масла. 1Н ЯМР (ХЛОРОФОРМ-d) δ: 9,93 (s, 1Н), 7,84 (d, J=8,8 Гц, 2Н), 7,26 (s, 1Н), 7,05-7,11 (m, 2Н), 6,95 (dd, J=8,2, 2,4 Гц, 1Н), 4,95 (d, J=13,2 Гц, 1Н), 4,84 (d, J=13,3 Гц, 1Н), 4,75 (t, J=3,5 Гц, 1Н), 3,89 (ddd, J=11,3, 8,4, 3,0 Гц, 1Н), 3, 48-3, 59 (m, 1Н), 1, 55-1, 75 (m, 6Н), 1, 34 (s, 12Н).
[1111] К суспензии 4-[3-(тетрагидропиран-2-илоксиметил)-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-бензальдегида (1,4 г, 3,2 ммоль, 1,0 экв.) в EtOH (15 мл) при 0°С добавляли НСl (15 мл, 3Н.). Данную смесь перемешивали при 0°С в течение 20 минут и затем оставляли нагреваться до комнатной температуры в течение 1 ч. Затем pH смеси доводили до 7, добавляя по каплям насыщенный раствор NaHCO3. Осадок собирали путем фильтрования и промывали Н2O с получением 4-(1-гидрокси-1,3-дигидро-бензо[с] [1, 2]оксаборол-5-илокси)-бензальдегида в виде белого твердого вещества. ЖХ/МС m/z: 255 (М+Н); 1Н ЯМР (ДMCO-d6) δ: 9,92 (s, 1Н), 9,19 (s, 1Н), 7,92 (d, J=8,8 Гц, 1Н), 7,92 (q, J=4,6 Гц, 1Н), 7,78 (d, J=8,0 Гц, 1Н), 7,16 (d, J=8,7 Гц, 2Н), 7,12-7,19 (m, 1Н), 7,09 (dd, J=8,0, 2,1 Гц, 1Н), 4,95 (s, 2Н).
5-(4-Метиламинометилфенокси)-3Н-бензо[с][1,2]оксаборол-1-ол (D210)
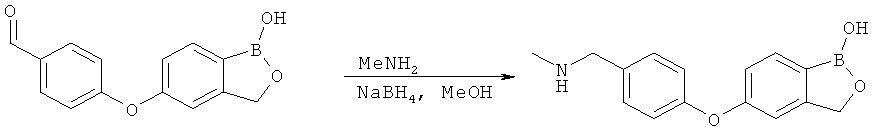
[1112] К раствору 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензалдегида (76,2 мг, 0,3 ммоль, 1,0 экв.) в МеОН (3,0 мл) добавляли диметиламин (170 мкл, 0,33 ммоль, 1,1 экв.). Данную смесь перемешивали в течение 30 минут при комнатной температуре. После охлаждения до 0°С добавляли порциями NaBH4 (11,3 мг, 0,3 ммоль, 1,0 экв.), и затем смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 2 ч. Смесь осторожно обрабатывали разбавленной НСl (5 мл), и водную фазу экстрагировали EtOAc (3×10 мл). Объединенные органические экстракты промывали солевым раствором (10 мл), сушили над MgSO4, фильтровали, и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя для элюирования МеОН/ДХМ (0:100-10:90), с получением 5-(4-метиламинометилфенокси)-3Н-бензо[с][1,2]оксаборол-1-ола в виде белого твердого вещества. ЖХ/МС m/z: 270 (М+Н); 1Н ЯМР (ДМСО-d6) δ: 7, 67-7, 74 (m, 1Н), 7,41-7,46 (m, J=8,5 Гц, 2Н), 7, 00-7, 07 (m, 2Н), 6,91-6,98 (m, 2Н), 4,91 (s, 2Н), 4,53 (s, 3Н), 3,85 (s, 2Н).
5-(4-Диметиламинометилфенокси)-3Н-бензо[с][1,2]оксаборол-1-ол (D211)
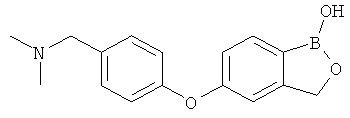
[1113] Соединение D211 получали с использованием методики, аналогичной методике получения соединения D210. ЖХ/МС m/z: 28 4 (М+Н); 1Н ЯМР (ДМСО-d6) δ: 9,09 (br. s., 1Н), 7, 67-7, 73 (m, 1H), 7,29-7,35 (m, J=8,5 Гц, 2H), 6, 97-7, 03 (m, 2H), 6, 92-6, 97 (m, 2H), 4,90 (s, 2H), 4,54 (s, 6H), 3,45 (s, 2H).
4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-N-(4-метилбензил)-бензамид (D212)
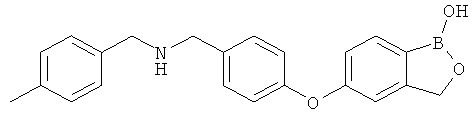
[1114] Соединение D212 получали с использованием методики, аналогичной методике получения соединения D229. ЖХ/МС m/z: 374 (М+Н); 1Н ЯМР (ДМСO-d6) δ: 9,16 (s, 1Н), 8,96 (t, J=5,9 Гц, 1Н), 7, 90-7, 98 (ш, 2Н), 7,75 (d, J=7,9 Гц, 1Н), 7,17-7,22 (m, 2Н), 7,07-7,15 (m, 4Н), 7, 02-7, 07 (m, 2Н), 4,95 (s, 2Н), 4,43 (d, J=6,0 Гц, 2Н), 2,27 (s, 3Н).
4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-N-(4-метоксибензил)-бензамид (D213)
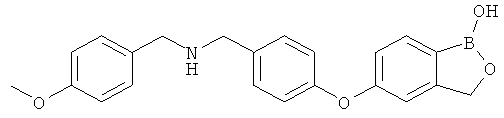
[1115] Соединение D213 получали с использованием методики, аналогичной методике получения соединения D229. ЖХ/МС m/z: 412 (М+23); 1Н ЯМР (ДМСО-d6) δ: 9,16 (s, 1Н), 8,93 (t, J=6,0 Гц, 1Н), 7, 89-7, 98 (m, 2Н), 7,75 (d, J=7,9 Гц, 1Н), 7, 20-7, 27 (m, 2Н), 7,07-7,12 (m, 2Н), 7,02-7, 07 (m, 2Н), 6,86-6,91 (m, 2Н), 4,94 (s, 2Н), 4,4 0 (d, J=6,0 Гц, 2Н), 3,72 (s, 3Н).
4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-N-фенилбензамид (D214)
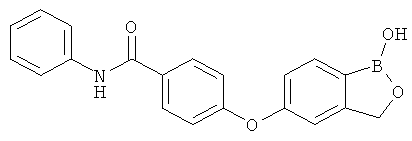
[1116] Соединение D214 получали с использованием методики, аналогичной методике получения соединения D229. ЖХ/МС m/z: 368 (М+23); 1Н ЯМР (ДMCO-d6) δ: 10,17 (s, 1Н), 7,99 (d, J=8,6 Гц, 2Н), 7,74 (dd, J=7,8, 4,7 Гц, 3Н), 7,32 (t, J=7,8 Гц, 2H), 7,13 (d, J=8,6 Гц, 2H), 7,01-7,09 (m, 3Н), 4,93 (s, 2Н).
N-Циклопропил-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензамид (D215)
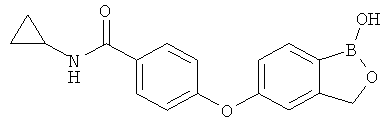
[1117] Соединение D215 получали с использованием методики, аналогичной методике получения соединения D229. ЖХ/МС m/z: 310 (М+Н); 1Н ЯМР (ДMCO-d6) δ: 9,13 (s, 1Н), 8,36 (d, J=4,0 Гц, 1Н), 7,83 (d, J=8,8 Гц, 2Н), 7, 66-7, 77 (m, 1Н), 6,98-7,11 (m, 4Н), 4,92 (s, 2Н), 2,81 (td, J=7,3, 3,7 Гц, 1Н), 0, 62-0, 70 (m, 2Н), 0,49-0,57 (m, 2Н).
4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-N-(тетрагидрофуран-2-илметил)-бензамид (D216)
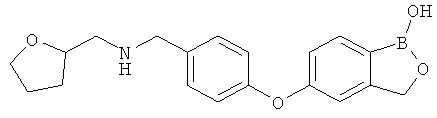
[1118] Соединение D216 получали с использованием методики, аналогичной методике получения соединения D229. ЖХ/МС m/z: 37 6 (М+23); 1Н ЯМР (METHANOL-d4) 5: 8,38 (br, s,, 1Н), 7,81-7,88 (m, 2H), 7,66 (d, J=7,9 Гц, 1H), 6, 99-7, 07 (m, 4H), 5,02 (s, 2H), 4,10 (qd, J=6,8, 4,8 Гц, 1H), 3,89 (dt, J=8,1, 6,7 Гц, 1H), 3,72-3,79 (m, 1H), 3,46-3,54 (m, 1H), 3,37-3,45 (m, 1H), 1,84-2,07 (m, 3H), 1,61-1,70 (m, 1H).
4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-N-метилбензамид (D217)
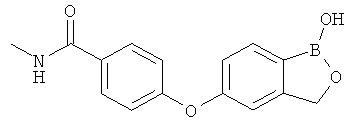
[1119] Соединение D217 получали с использованием методики, аналогичной методике получения соединения D229. ЖХ/МС m/z: 28' (М+Н); гН ЯМР (ДМСО-de) 5: 9,13 (s, 1Н), 8,36 (d, J=4,5 Гц, 1Н), 7, 82-7,87 (m, 2Н), 7,73 (d, J=7,9 Гц, 1Н), 6, 99-7,08 (m, 4Н). 4,92 (s, 2Н), 2,75 (d, J=4,5 Гц, 3Н).
4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-N', N-диметил-бензамид (D218)
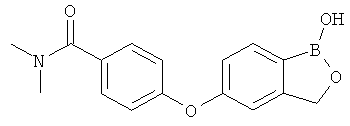
[1120] Соединение D218 получали с использованием методики, аналогичной методике получения соединения D229. ЖХ/МС m/z: 2 98 (М+Н); 1Н ЯМР (ДMCO-d6) δ: 9,29 (s, 1Н), 7,71 (d, J=8,0 Гц, 1Н), 7,38-7, 45 (m, 2Н), 6, 97-7, 05 (m, 4Н), 4,91 (s, 2Н), 2,92 (br. s., 6Н).
Трет-бутиловый эфир N'-[4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензоил]-гидразинкарбоновой кислоты (D219)
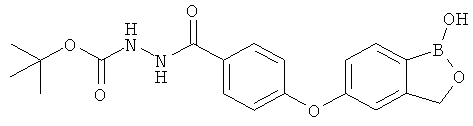
[1121] Соединение D219 получали с использованием методики, аналогичной методике получения соединения D229. ЖХ/МС m/z: 407 (М+23); 1Н ЯМР (ДМСО-d6) δ: 10,13 (s, 1Н), 9,15 (s, 1Н), 8,87 (s, 1Н), 7,88 (d, J=8,6 Гц, 2Н), 7,75 (d, J=8,0 Гц, 1Н), 7,02-7,10 (m, 4Н), 4,93 (s, 2Н), 1,41 (s, 9Н).
4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензамид (D220)
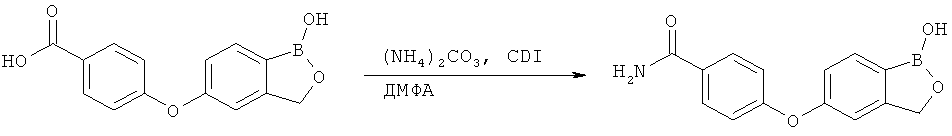
[1122] В сцинтилляционную пробирку объемом 40 мл, содержащую 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензойную кислоту (77 мг, 0,28 ммоль, 1,0 экв.) и CDI (101,3 мг, 0,62 ммоль), 2,5 экв.) в ДМФА (3,0 мл), добавляли карбонат аммония (123,3 мг, 1,28 ммоль, 4,5 экв.). Данную смесь перемешивали в течение ночи при комнатной температуре. Смесь обрабатывали Н2O (5 мл), слои разделяли. Водный слой экстрагировали EtOAc (2×5 мл), объединенные органические фазы промывали солевым раствором (10 мл), сушили над MgS04, фильтровали, и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя для элюирования МеОН/ДХМ (0:100-10:90), с получением 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензамида в виде белого твердого вещества. ЖХ/МС m/z: 270 (М+Н); 1H ЯМР (ДMCO-d6) δ: 9,14 (s, 1Н), 7, 87-7, 92 (m, 2H), 7,73 (d, J=7,8 Гц, 1H), 7,05 (d, J=8,8 Гц, 4H), 4,93 (s, 2H).
5-(4-Гидроксиметилфенокси)-3Н-бензо[с][1,2]оксаборол-1-ол (D221)
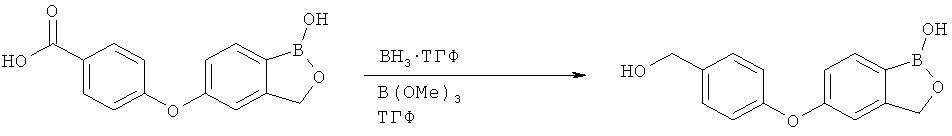
[1123] К раствору 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты (200 мг, 0,74 ммоль, 1,0 экв.) и триметилбората (0,5 мл, 4,4 ммоль, 6,0 экв.) в ТГФ (7,0 мл) добавляли по каплям в атмосфере азота 1,0 М раствор комплекса боргидридтетрагидрофуран в ТГФ (1,5 мл, 1,5 ммоль, 2,0 экв.). Данную смесь перемешивали в течение ночи при комнатной температуре. Затем смесь осторожно обрабатывали МеОН (2 мл) и вливали в EtOAc (10 мл) и насыщенный NаНСО3 (10 мл). Слои разделяли, и водную фазу экстрагировали EtOAc (3×10 мл). Объединенные органические экстракты промывали солевым раствором (10 мл), сушили над MgS04, фильтровали, и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя для элюирования МеОН/ДХМ (0:100-10:90), с получением 5-(4-гидроксиметилфенокси)-3Н-бензо[с][1,2]оксаборол-1-ола в виде белого твердого вещества. ЖХ/МС m/z: 279 (М+23); 1Н ЯМР (ДМСО-d6) δ: 9,09 (s, 1Н), 7,70 (d, J=8,0 Гц, 1Н), 7, 34-7, 38 (m, J=8,7 Гц, 2Н), 7,01-7,05 (m, 2Н), 6,96 (dd, J=8,0, 2,1 Гц, 1Н), 6,91-6,93 (m, 1Н), 5,18 (t, J=5,7 Гц, 1Н), 4,91 (s, 2Н), 4,49 (d, J=5,7 Гц, 2Н).
5-(4-Нитрофенокси)-3Н-бензо[с][1,2]оксаборол-1-ол (D222)
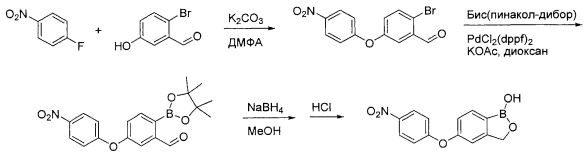

[1124] К раствору 1-фтор-4-нитробензола (1,1 мл, 10,0 ммоль, 1,0 экв.), 2-бром-5-гидроксибензальдегида (2,0 г, 10,0 ммоль, 1,0 экв.) в ДМФА (30,0 мл) добавляли К2СО3 (1,7 г, 12,0 ммоль, 1,2 экв.) в атмосфере азота. Данную смесь нагревали в течение ночи при 100°С. После охлаждения до комнатной температуры смесь вливали в EtOAc (30 мл), и добавляли Н2O (30 мл). Слои разделяли, и водную фазу экстрагировали EtOAc (3×2 0 мл). Объединенные органические экстракты промывали солевым раствором (30 мл), сушили над MgS04, фильтровали, и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя для элюирования градиент EtOAc/гептан (0:100-100:0), с получением 2-бром-5-(4-нитро-фенокси)-бензальдегида в виде желтого тонкоизмельченного порошка. 1Н ЯМР (ХЛОРОФОРМ-d) δ: 10,31-10,37 (m, ЮН), 8,26 (dd, J=9,0, 0,3 Гц, 15Н), 8,21-8,28 (m, 13Н), 7,73 (d, J=8,6 Гц, 3Н), 7,73 (dt, J=8,7, 0,5 Гц, 7Н), 7,62 (dd, J=3,1, 0,3 Гц, 10Н), 7, 20-7, 29 (m, 19Н), 7,00-7,10 (m, 23Н). Получено 2,6 г; выход 80,7%.
[1125] К раствору 2-бром-5-(4-нитрофенокси)-бензальдегида (966 мг, 3,0 ммоль, 1,0 экв.) в 1,4-диоксане (25 мл) добавляли бис-пинакол-дибор (838 мг, 3,3 ммоль, 1,1 экв.), КОАс (883 мг, 9,0 ммоль, 3,0 экв.) и PdCl2 (dppf) 2 (66 мг, 0,09 ммоль, 0,03 экв.). Данную смесь дегазировали с использованием N2 и нагревали в течение ночи при 80°С. После охлаждения до комнатной температуры смесь фильтровали через короткий картридж с целитом, и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя для элюирования градиент EtOAc/гептан (0:100-100:0), с получением 5-(4-нитрофенокси)-2-(4,4,5-триметил-[1,3,2]диоксаборолан-2-ил)-бензальдегида в виде желтого твердого вещества. 1Н ЯМР (ХЛОРОФОРМ-d) δ: 10,65 (s, 1Н), 8,19-8,29 (m, J=9,3 Гц, 2Н), 8,01 (d, J=8,2 Гц, 1Н), 7,66 (d, J=2,5 Гц, 1Н), 7,32 (dd, J=8,2, 2,5 Гц, 1Н), 7,04-7,10 (m, 2Н), 1,41 (s, 12Н). Получено 724 мг; выход 65,3%.
[1126] К суспензии 5-(4-нитрофенокси)-2-(4,4,5-триметил-[1,3,2]диоксаборолан-2-ил)-бензальдегида (721 мг, 1,9 ммоль, 1,0 экв.) в EtOH (15 мл) при 0°С добавляли небольшими порциями NaBH4 (73,8 мг, 1,9 ммоль, 1,0 экв.). Данную смесь перемешивали при 0°С в течение 20 минут и затем оставляли нагреваться до комнатной температуры в течение 1 ч. После охлаждения до 0°С полученный прозрачный раствор осторожно обрабатывали Н2O (1 мл), и затем медленно добавляли 3Н. НСl (5 мл). Полученную желтую суспензию оставляли постепенно нагреваться до комнатной температуры и перемешивали в течение 2 ч. Затем pH смеси доводили до 7, добавляя по каплям насыщенный раствор NaHCO3. Осадок собирали путем фильтрования и промывали Н2O с получением 5-(4-нитро-фенокси)-3Н-бензо[с][1,2]оксаборол-1-ола в виде белого порошка. ЖХ/МС m/z: 294 (М+23); 1Н ЯМР (ДМСО-d6) δ: 7,26 (d, J=8,6 Гц, 1Н), 6,93 (d, J=3,0 Гц, 1Н), 6,56 (dd, J=8,5, 3,0 Гц, 1H), 4,37 (s, 2H). Получено 510 мг: выход 9 6,4%.
5-(4-Амино-фенокси)-3Н-бензо[с][1,2]оксаборол-1-ол (D223)
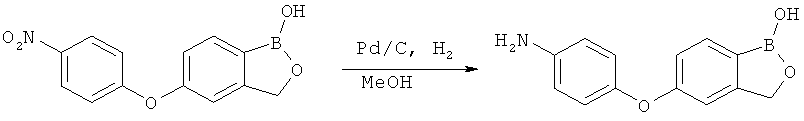
[1127] В круглодонную колбу объемом 25 мл, оснащенную магнитной мешалкой, добавляли сначала 5-(4-нитрофенокси)-3Н-бензо[с][1,2]оксаборол-1-ол (310 мг, 1,1 ммоль, 1,0 экв.) и затем МеОН (10 мл). Колбу откачивали и заполняли N2, повторяя эту 10 процедуру два раза. К полученному раствору при перемешивании добавляли 5% Pd/C (60 мг), колбу откачивали и заполняли Н2, повторяя эту процедуру три раза. Полученную суспензию перемешивали в атмосфере Н2 (используя баллон с водородом) в течение ночи при комнатной температуре. Смесь фильтровали через короткий картридж с 15 целитом и промывали МеОН (3×10 мл). Объединенный фильтрат концентрировали при пониженном давлении с получением светло-желтого масла. Полученное масло растворяли в минимальном количестве МеОН и осторожно обрабатывали конценрированной НСl. Образовавшийся осадок собирали путем фильтрования и промывали 20 гептанами с получением гидрохлоридной соли 5-(4-аминофенокси)-3Н-бензо[с][1,2]оксаборол-1-ола в виде белого твердого вещества ЖХ/МС m/z: 242 (М+Н); 1Н ЯМР (ДМСО-d6) δ: 9,03 (br. s., 1Н), 7,64 (d, J=8,0 Гц, 1H), 6, 77-6, 89 (m, 4H), 6, 64-6, 77 (га, 2H), 4,86 (s, 2H), 3,30 (br. s., 2H).
N-[4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-фенил]-ацетамид (D224)
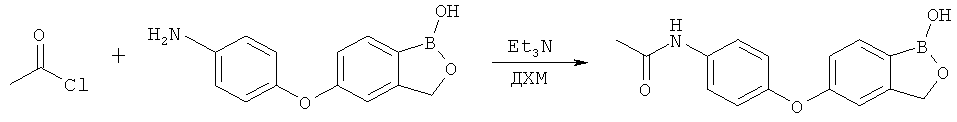
[1128] В сцинтилляционную пробирку объемом 20 мл, содержащую 5-(4-амино-фенокси)-3Н-бензо[с][1,2]оксаборол-1-ол (68 мг, 0,28 ммоль, 1,0 экв.) в ДХМ (3,0 мл), добавляли начала Et3N (47 мкл, 0,33 ммоль, 1,2 экв.) и затем ацетилхлорид (22 мкл, 0,31 ммоль, 1,1 экв.). Данную смесь перемешивали в течение ночи при комнатной температуре. Затем смесь концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя для элюирования МеОН/ДХМ (0:100-10:90), с получением N-[4-(l-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-фенил]-ацетамида в виде белого твердого вещества. ЖХ/МС m/z: 284 (М+Н); 1Н ЯМР (ДМСO-d6) δ: 10,17 (s, 1Н), 7,68 (d, J=8,1 Гц, 1Н), 7,58-7,63 (m, 2Н), 6, 94-6,99 (m, 2Н), 6,88 (dd, J=8,0, 2,1 Гц, 1Н), 6,84 (d, J=1,5 Гц, 1Н), 4,85 (s, 2Н), 3,12 (s, 1Н), 2,00 (s, 3Н).
N-[4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-фенил]-метансульфонамид (D225)
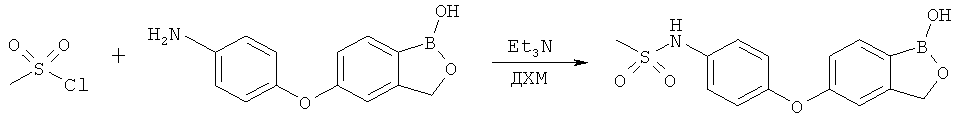
[1129] В сцинтилляционную пробирку объемом 20 мл, содержащую 5-(4-аминофенокси)-3Н-бензо[с][1,2]оксаборол-1-ол (50 мг, 0,21 ммоль,
1.0 экв.) в ДХМ (3,0 мл), добавляли сначала Et3N (35 мкл, 0,25 ммоль, 1,2 экв.) и затем метансульфохлорид (18 мкл, 0,31 ммоль, 1.1 экв.). Данную смесь перемешивали в течение ночи при комнатной температуре. Затем смесь концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя для элюирования МеОН/ДХМ (0:100-10:90), с получением N-[4-(l-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-фенил]-метансульфонамида в виде белого твердого вещества. ЖХ/МС m/z: 342 (М+23); 1Н ЯМР (ДMCO-d6) δ: 9,72 (s, 1Н), 7, 65-7, 79 (m, 1Н), 7,21-7,26 (m, 2Н), 7,01-7,05 (m, 2Н), 6,91-6,94 (m, 1Н), 6,89-6,91 (m, 1Н), 4,88 (s, 2Н), 2,94 (s, 3Н).
4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензойная кислота (D226)
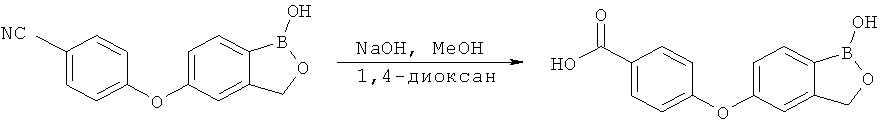
[1130] В круглодонную колбу объемом 250 мл, оснащенную магнитной мешалкой, содержащую 4-(1-гидрокси-1,3-дигидро-бензо [с] [1,2]оксаборол-5-илокси)-бензонитрил (5,0 г, 20,0 ммоль, 1,0 экв.), МеОН (90 мл) и 1,4-диоксан (50 мл), медленно добавляли NaOH (6 н., 20 мл). На колбу устанавливали воздушный холодильник, и нагревали в течение 2 суток в заранее нагретой до 90°С масляной бане. Затем колбу помещали в ледяную баню, и pH раствора доводили до 2, осторожно добавляя 1Н. НСl. Затем смесь экстрагировали EtOAc (3×150 мл). Объединенные органические экстракты промывали H2O (200 мл) и солевым раствором (200 мл), сушили над MgSO4, фильтровали, и фильтрат концентрировали при пониженном давлении с получением 4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензойной кислоты в виде белого твердого вещества. ЖХ/МС m/z: 271 (М+Н); 1Н ЯМР (ДМСО-d6) δ: 12,80 (br. s., 1Н), 9,16 (s, 1H), 7,94 (d, J=8,6 Гц, 2H), 7,76 (d, J=8,0 Гц, 1H), 7,01-7,15 (m, 4H), 4,94 (s, 2H). Получено 4,7 г, выход 87,0%.
[4-(1-Гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-фенил]-морфолин-4-ил-метанон (D227)
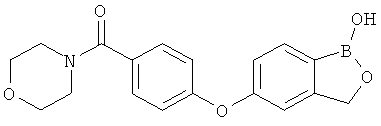
[1131] Соединение D227 получали с использованием методики, аналогичной методике получения соединения D229. ЖХ/МС m/z: 701 (2М+23); 1Н ЯМР (ДМСО-d6) δ: 9,15 (s, 1Н), 7,75 (d, J=7,9 Гц, 1Н), 7, 42-7, 49 (m, 2Н), 7,06-7,10 (га, 3Н), 7,02-7, 06 (m, 1Н), 4,95 (s, 2Н), 3, 40-3, 65 (m, 8Н).
N-Циклопентил-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензамид (D228)
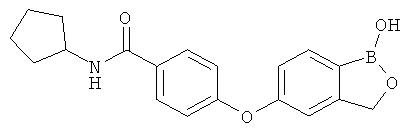
[1132] Соединение D228 получали с использованием методики, аналогичной методике получения соединения D229. ЖХ/МС m/z: 352 (М+Н); 1Н ЯМР (ДMCO-d6) δ: 9,15 (s, 1Н), 8,15 (d, J=7,9 Гц, 1Н), 7,86-7,2 (m, 2Н), 7,75 (d, J=8,5 Гц, 1Н), 7,05-7,11 (m, 2Н), 7, 00-7, 05 (m, 2Н), 4,94 (s, 2Н), 3,69-3,81 (m, 1Н), 1, 77-1, 86 (m, 2Н), 1, 67-1, 77 (m, 2Н), 1, 56-1,65 (m, 1Н), 1, 22-1, 37 (m, 4Н), 1,04-1,20 (m, 1Н).
N-Бензил-4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензамид (D229)
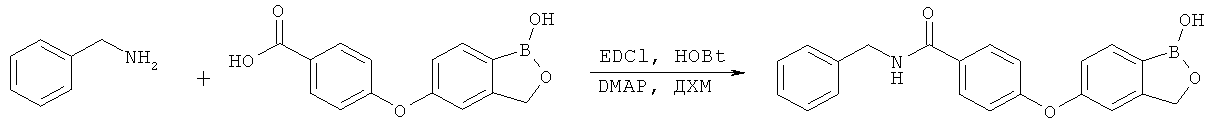
[1133] В сцинтилляционную пробирку объемом 40 мл, содержащую 4-(1-гидрокси-1,3-дигидробензо[с][1,2]оксаборол-5-илокси)-бензойную кислоту (150 мг, 0,55 ммоль, 1,0 экв.), EDCI (157,2 мг, 0,82 ммоль, 1,5 экв.), HOBt (111,5 мг, 0,82 ммоль, 1,5 экв.) и ОМАР (12 мг, 0,1 ммоль, 0,2 экв.) в ДХМ (10,0 мл), добавляли по каплям бензиламин (24 мкл, 2,2 ммоль, 4,0 экв.). Данную смесь перемешивали в течение ночи при комнатной температуре. Затем смесь обрабатывали Н2O (10 мл), слои разделяли. Водный слой экстрагировали ДХМ (2×5 мл), объединенные органические фазы промывали солевым раствором (10 мл), сушили над MgS04, фильтровали, и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя для элюирования МеОН/ДХМ (0:100 до 10:90), с получением N-бензил-4-(1-гидрокси-1,3-дигидро-бензо[с][1,2]оксаборол-5-илокси)-бензамида в виде белого твердого вещества. ЖХ/МС m/z: 360 (М+Н); 1Н ЯМР (ДМСО-d6) δ: 9,01 (t, J=6,0 Гц, 1Н), 7,91-8,00 (m, 2H), 7,76 (d, J=7,9 Гц, 1Н), 7,29-7, 36 (m, 5H), 7,21-7,27 (m, 1H), 7,08-7,13 (m, 2H), 7,02-7, 07 (m, 2H), 4,95 (s, 2H), 4,48 (d, J=6,0 Гц, 2H).
ПРИМЕР 20 ТЕСТЫ IN VITRO
[0550] Исследовали способность соединений согласно настоящему-описанию ингибировать провоспалительные цитокины или фосфодиэстеразы.
Цитокиновые тесты
[0551] Замороженные моноядерные клетки периферической крови (МНПК) человека оттаивали и центрифугировали. Со сгустка клеток отсасывали среду криоконсервации и ресуспендировали клетки в свежей культуральной среде (КС), содержащей RPMI 164 0 и 10% ФБС, в планшетах на 96 ячеек. Исследуемое вещество растворяли в ДМСО, получая 10 мМ образец (ДМСО, 100%). 10 мМ образец разбавляли до 100 мкМ в КС (ДМСО, 1%), а затем разбавляли дополнительно до 10, 1, 0,1, 0,01 мкМ в 200 мкл КС (n=3). Индуктор (1 мкг/мл ЛПС для ФНО-α и ИЛ-1β [и ИЛ-6] или 20 мкг/мл ФГА для ИФНγ, ИЛ-2, ИЛ-4, ИЛ-5 и ИЛ-10. ИЛ-23 индуцировали 100 нг/мл ИФН-g+1 нг/мл ЛПС, с использованием клеток ТНР-1. Для контроля указанных экспериментов применяли среду (1% ДМСО). Среду без индуктора применяли в качестве отрицательного контроля. Клетки инкубировали при 37°С, 5% СO2. Надклеточные жидкости отбирали через 24 часа (для ФНО-α, ИЛ-β, ИЛ-2, ИЛ-6 и ИФНγ) и 48 часов (для ИЛ-4, ИЛ-5, ИЛ-10 и ИЛ-23), и хранили при-20°С. Надклеточные жидкости оттаивали и анализировали на экспрессию цитокина при помощи меченых флуорохромом цитокин-специфических гранул BD FACSArray™. ИЛ-23 анализировали при помощи имеющегося в продаже комплекта ELISA (R&D Systems).
IC50 (мкМ) или % ингибирования при 10 мкМ
|
|
|
|
Анализ спектра изоформ ФДЭ
[0552] Рекомбинантные ферменты ФДЭ человека экспрессировали в бакуловирусной системе. Анализ представляет собой модификацию 2-стадийного способа Thompson & Appleman (Biochem. 10:311-316, 1971), адаптированного для планшета на 96 ячеек. Исходные растворы готовили в концентрации 40 мМ в 100% ДМСО. Конечная концентрация ДМСО составляла 5%. Каждое соединение исследовали, выполняя серийные разведения 1 в 4 с исходной концентрацией 100 мМ. Каждую концентрацию исследовали в двух повторениях. 3Начения IC50 получали из 11-точечных кривых и анализировали при помощи программного обеспечения Prism (GraphPad Inc.). Исследованные изоформы ФДЭ включали PDE1A3 (цАМФ), PDE1A3 (цГМФ), PDE2A3, PDE3Cat, PDE4Cat, PDE4A4, PDE4B2, PDE4C2, PDE4D3, PDE5Cat, PDE6AB, PDE7A1, PDE8A1, PDE9A1, PDE10A1 (цАМФ), PDE10A1 (цГМФ), PDE11A1 (цАМФ) и PDE11A1 (цГМФ).
Тест с ФДЭ4
[0553] Применяли частично очищенную ФДЭ4 из клеток миелоидной лейкемии человека U-937. исследуемое соединение и/или среду инкубировали с 0,2 мг фермента и 1 мМ цАМФ, содержащим 0,01 мМ [3Н]цАМФ в буферном растворе Трис pH 7,5 в течение 20 минут при 25 °С. Реакцию прекращали кипячением в течение 2 минут и превращали полученный АМФ в аденозин добавлением 10 мг/мл нуклеотидазы змеиного яда и последующей инкубации при 37°С в течение 10 минут. Негидролизованный цАМФ связывали смолой AG1-X2, а оставшийся [3Н]аденозин в водной фазе анализировали количественно путем сцинтилляционного измерения. Исследуемые соединения тестировали в концентрациях 10, 3, 1, 0,3, 0,1, 0,03, 0,01, 0, 003 и 0,001 мкМ для определения IС50.
|
|
ПРИМЕР 21
ТЕСТЫ IN VIVO
1. Противовоспалительная активность in vivo в модели индуцированной форболовым эфиром эдемы уха у мышей
[0554] Форбол-12-миристат-13-ацетат (ФМА, 5 мкг в 20 мкл ацетона) наносили топически на переднюю и заднюю поверхности правого уха в восьми группах самцов мышей CD-1 (Crl.) по 5 животных в группе (массой (22±2) г). Исследуемые вещества и среду (ацетон:этанол 1:1, 20 мкл/ухо) наносили топически на оба уха за 3 0 минут до и через 15 минут после воздействия ФМА. В качестве положительного контроля применяли дексаметазон (1 мг/ухо×2), который наносили исследуемым животным топически по той же схеме нанесения. Затем в качестве показателя воспаления измеряли опухание уха при помощи микрометра модели Dyer через 6 часов после нанесения ФМА. Процент ингибирования вычисляли согласно формуле: [(Ic-It)/1 с]×100%, где 1 с и It относятся к увеличению толщины уха (мм) у контрольных и обработанных мышей, соответственно. Процент ингибирования 30 процентов или более по опуханию уха считали 3Начимой противовоспалительной активностью.
|
|
|
|
2. Противовоспалительная активность in vivo в модели индуцированной оксазолоном эдемы уха у мышей [0555] Использовали группы по 5 самцов мышей BALB/c массой (23±2) г.Предварительно вымытые брюшки подопытных животных сенсибилизировали нанесением 100 мкл 1,5% раствора оксазолона в ацетоне. Через семь дней после первичной сенсибилизации вводили исследуемые вещества и среду (ацетон/этанол 1:1, 20 мкл/ухо) топически на переднюю и заднюю поверхности правого уха за 3 0 минут до и через 15 минут после воздействия вторым применением оксазолона (1% в ацетоне, 2 0 мкл/ухо) топическим путем. В качестве положительного контроля применяли индометацин (0,3 мг/ухо×2), наносимый топически по той же схеме лечения, что и для исследуемых соединений. Через двадцать четыре часа после второго нанесения оксазолона измеряли толщину уха каждой мыши при помощи микрометра модели Dyer. 30 процентов или более ингибирования опухания уха по сравнению с контролем по среде считалось 3Начимым и указывало на возможную противовоспалительную активность.
|
|
|
ПРИМЕР 22
Доклиническая токсикология С17, нового оксаборола на стадии разработки для местного лечения псориаза
[0556] С17 (5-(4-цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол) представляет собой новое оксабороловое соединение, обладающее противовоспалительной активностью. Данные по доклинической токсичности доступны для исследований in vitro и исследований in vivo после системного и местного применения землеройкам, хорькам, крысам и мышам. С17 (1 мкМ) классифицирован как малоактивный блокатор hERG-канала, минимизирующий проблемы в отношении сердечно-сосудистой безопасности. С17 (до 5000 мкг на планшет) показал отсутствие мутагенной активности в присутствии или в отсутствии Aroclor-induced S9 печеночной фракции по отношению к штаммам Salmonella typhimurium ТА98, ТА100, ТА1535, и ТА1537 и штамму Escherichia coli WP2 uvrA. С17 (до 500 мкг/мл) показал отсутствие кластогенной активности в тесте In Vitro на аберрацию хромосом млекопитающих в присутствии или отсутствии Aroclor-induced S9 с использованием лимфоцитов периферической крови человека. После перорального введения 10, 30, и 100 мг/кг землеройкам {Suncus murinus), наблюдалось дозо-зависимое рвотное действие. Уровень максимальной недействующей дозы (МНД (no observed effect level NOEL)) составлял 10 мг/кг, и был связан со значительным содержанием в плазме. После перорального введения 10, 30, и 100 мг/кг хорькам рвотного действия не наблюдалось ни в одной из дозовых групп.После перорального введения 30, 100 и 300 мг/кг/сутки самцам и самкам крыс Sprague-Dawley в течение 14 последовательных дней, МНД был определен как 300 мг/кг/сутки. Ни в одной из дозовых групп не наблюдалось смертности, нежелательных действий на клиническую патологию, или микроскопических или макроскопических изменений. Составы с С17 готовили в виде 1%, 5% и 10% раствора в ацетоне/этаноле (50:50, об/об) и исследовали в тесте на региональном лимфатическом узле на способность вызывать реакцию гиперчувствительности. Местное лечение С17 самок мышей СBА/J не дало индекса стимуляции 3 или выше, и поэтому С17 считают не обладающим сенсибилизирующим действием на кожу. С17 представляет собой новое соединение в стадии разработки для топического лечения псориаза, и, как показано в различных доклинических исследованиях токсичности, является безопасным.
ПРИМЕР 23
Активность in vitro и механизм действия СП, нового оксаборола на стадии разработки длялечения псориаза
[0557] С17 (5-(4-цианофенокси)-1,3-дигидро-1-гидрокси-2,1-бензоксаборол) представляет собой противовоспалительное соединение широкого спектра действия, находящееся в настоящее время в стадии разработки для местного лечения бляшечного псориаза. С17 ингибирует секрецию ФНО-□ моноядерными клетками периферической крови (МНПК), стимулируемую липополисахаридом (ЛПС), и секрецию ИЛ-2 и ИФН-□ после стимуляции фитогемагглютинином (ФГА) в наномолярных концентрациях. С17 ингибирует секрецию ФНО-П с IC50 770 нМ; однако на воспалительные цитокины ИЛ-1 и ИЛ-6 С17 не действует. ИЛ-2 и ИФН-П ингибируются с IС50 4 60 нМ и 270 нМ соответственно. ИЛ-5 и ИЛ-10 ингибируются С17 в низших микромолярных концентрациях. Одним из механизмов ингибирующего действия С17 на широкий спектр цитокинов может являться ингибирование фосфодиэстеразы4 (ФДЭ4). С17 ингибирует активность фермента ФДЭ4 в клетках U937 человека с IС50 0,49 мкМ, ингибируя все четыре изоформы ФДЭ4 одинаково. Показано, что С17 является конкурентным ингибитором субстрата цАМФ, как показал ферментный кинетический анализ. С17 также ингибирует ФДЭ7 с IC50 0,7 3 мкМ, но не ингибирует 3Начительно ФДЭ1, 2, 3, или 5. В отличие от классических ингибиторов ФДЭ4, например, ролипрама (Rolipram), С17 ингибирует выработку ИЛ-23 макрофагами ТНР-1 человека с IС50 2,25 мкМ. Указанное действие, а также ингибирование цитокинов ФНО-□ и ТН1, позволяет предположить потенциал С17 для лечения псориаза.
|
|
ПРИМЕР 24
Активность in vivo C17, нового оксаборола на стадии разработки длялечения псориаза
[0558] С17 представляет собой новое боросодержащее оксабороловое лекарственное средство, обладающее противовоспалительным действием, основанным на ингибировании высвобождения провоспалительных цитокинов, включая ФНО-α, ИФН-γ, ИЛ-β, ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, и ИЛ-23. С17 также ингибирует высвобождение хемокина МХБ-1 и ПГЕ2. Указанное действие частично объясняют ингибированием фосфодиэстеразы-4 (ФДЭ-4).
[0559] Для оценки антипсориатической активности С17 проводили одноцентровое, рандомизированное, с контролем по среде, слепое исследование с участием 12 субъектов, страдающих псориазом. У каждого субъекта проводили обработку шести исследуемых областей (два активных состава: С17 мазь, 5%, С17 крем, 5%, две среды и два препарата сравнения).
[0560] Исследуемый препарат 1 представлял собой С17 мазь (препарат согласно настоящему описанию), с местным нанесением примерно 200 мкл мази на исследуемую область (1,1 см2) один раз в сутки на протяжении 12 дней (10 обработок). Дозировка составляла примерно 10 мг активного ингредиента/сутки, с общей дозировкой примерно 100 мг активного ингредиента.
[0561] Исследуемый препарат 2 представлял собой С17 крем (препарат согласно настоящему описанию), с местным нанесением примерно 200 мкл крема на исследуемую область (1,1 см2) один раз в сутки на протяжении 12 дней (10 обработок). Дозировка составляла примерно 10 мг активного ингредиента/сутки, с общей дозировкой примерно 100 мг активного ингредиента.
[0562] Исследуемый препарат 3 представлял собой среду исследуемого препарата 1 (без С17), с местным нанесением примерно 200 мкл мази на исследуемую область (1,1 см2) один раз в сутки на протяжении 12 дней (10 обработок).
[0563] Исследуемый препарат 4 представлял собой среду исследуемого препарата 2 (без С17), с местным нанесением примерно 2 00 мкл крема на исследуемую область (1,1 см2) один раз в сутки на протяжении 12 дней (10 обработок)..
[0564] Препарат сравнения 1 состоял из крема Betnesol®-V 0,1%, с местным нанесением примерно 2 00 мкл крема на исследуемую область (1,1 см2) один раз в сутки на протяжении 12 дней (10 обработок). Дозировка составляла примерно 0,2 мг бетаметазона/сутки, с общей дозировкой примерно 2 мг бетаметазона.
[0565] Препарат сравнения 2 состоял из мази Protopic® 0,1%, с местным нанесением примерно 200 мкл мази на исследуемую область (1,1 см2) один раз в сутки на протяжении 12 дней (10 обработок). Дозировка составляла примерно 0,2 мг такролимуса/сутки, с общей дозировкой примерно 2 мг такролимуса.
[0566] Исследуемые препараты были произведены Dow Pharmaceutical Sciences, 1330A Redwood Way, Petaluma, CA 94954, USA. Соединение сравнения крем Betnesol®-V 0,1% было произведено GlaxoWellcome GmbH & Со. Соединение сравнения Protopic 0,1% было произведено Astellas Pharma GmbH, Neumarkter Str. 61, 81673 Munich, Germany. Введение меток в исследуемые препараты осуществлялось Апасог Pharmaceuticals, 1060 East Meadow Circle, Palo Alto, CA 94303-4230, USA.
[0567] На исследуемые области наносили за одно применение 200 мкл каждого из исследуемых препаратов. Исследуемые препараты наносили под камеры Дюринга (12 мм внутренний 0,14 мм наружный 0), установленные в отверстиях, проколотых в гидроколлоидной повязке (Varihesive®, Bristol-Myers Squibb Gruppe, Munich, Germany). Указанное количество полностью заполняло камеры. Камеры закрепляли на месте при помощи адгезивных пластырей (Fixomull, BSN, Hamburg, Germany). В предыдущих исследованиях было показано, что гидроколлоидная повязка хорошо переносится. Отсутствие терапевтического влияния повязки на псориаз было подтверждено определением толщины инфильтрата до и после нанесения. Расстояние между камерами составляло не менее 1,5 см. указанное расстояние было достаточным для исключения взаимодействий между соседними областями. Все области обрабатывали в условиях окклюзии 10 раз на протяжении 12 дней. Перед каждым новым нанесением оставшийся остаток препарата удаляли осторожной очисткой каждой исследуемой области отдельным кусочком мягкой ткани. Обработки проводили в течение 10 дней за время исследования (дни 1-6 и 8-11). Гидроколлоидная повязка оставалась на месте максимум в течение 7 дней, обновление повязки проводили в 8 день исследования.
[0568] Экспериментальные исследования включали сонографию, фотодокументацию и клиническую оценку со сравнением вариантов лечения для одного индивидуума.
[0569] В первый день исследования контур бляшки наносили на лист прозрачного пластика. Планируемые области исследования наносили на лист, предусматривая расстояние между указанными местами не менее 1,5 см. Исследуемые области нумеровали от 1 до 6. Листы пластика присоединяли к индивидуальной регистрационной карте (ИРК). Проводили сонографическое исследование и фотодокументацию исходного состояния. Клиническая оценка перед лечением по определению равнялась 0 во всех тестовых полях. Присоединяли гидроколлоидную повязку и проводили первую обработку как описано выше.
[0570] В дни исследования с 2 по 6 и с 8 по 11 один раз в сутки удаляли окклюзионные камеры и обновляли лечебные препараты. В день исследования 7 повязку и камеры оставляли на месте до дня исследования 8. В дни исследования 8 и 12 также удаляли гидроколлоидную повязку и после удаления остатков препаратов проводили сонографию, клиническую оценку и фотодокументацию. В последний день исследования проводили окончательное клиническое исследование, включая лабораторное исследование безопасности (гематология, клиническая химия и анализ мочи).
[0571] Сонографические измерения проводили при помощи 20 МГц высокочастотного сонографа (DUB 20S, Taberna pro Medicum, Lueneburg). Серии А-сканированных изображений объединяли и представляли на мониторе в виде разреза кожи. Было возможно латеральное разрешение примерно 200 мкм и аксиальное разрешение 80 мкм. В зависимости от зхоструктур, были представлены компоненты эпидермиса, дермы и подкожного слоя. Благодаря этому было возможно точное измерение толщины кожи. Воспалительный псориатический инфильтрат был виден как легко определяемая эхопрозрачная полоса ниже входящего эхо. Определяли и документировали толщину эхопрозрачной псориатической полосы. Толщину измеряли в мкм и обозначали как Т.
[0572] Клиническую оценку (общую оценку) исследуемых областей проводили по 5-балльной шкале: - 1 = ухудшение; 0 = без изменения (отсутствие эффекта); 1 = слабое улучшение; 2 = явное улучшение, но не полное излечение; 3 = полное излечение. Сравнение проводили с необработанной бляшкой под гидроколлоидной повязкой. В описанную общую оценку вносили свой вклад клинически ясные различия в эритеме и инфильтрации.
[0573] Толщина инфильтратов показала, что лечение С17 приводит к значимому и явному улучшению. Средний процент уменьшения толщины инфильтрата для обоих составов с С17 составил 54% по сравнению с отсутствием изменений средней толщины инфильтратов для сред. Статистические сравнения показали, что С17,5% показал значительно большее уменьшение (р<0,025) толщины инфильтратов, чем соответствующие среды. Для препарата сравнения мази Protopic™ 0,1% средний процент уменьшения толщины инфильтратов (48%) был ниже. Более высокое уменьшение средней толщины инфильтратов (72%) было отмечено для препарата сравнения крема Betnesol™-V, 0,1%. Не было обнаружено значительных различий между мазью С17, 5% и кремом Betnesol™-V 0,1% на 12 день исследования. Во всех других сравнениях крем Betnesol™-V 0,1% показал значительно более высокое уменьшение толщины инфильтратов. Клинические оценки и другие дополнительные критерии эффективности соответствовали данным сонографических измерений.
ПРИМЕР 25
С27, новое оксабороловое соединение, обладающее противовоспалительной активностью: результаты исследований эффективности in vivo и доклинических исследований безопасности
[0574] С27 представляет собой второй представитель ряда новых оксабороловых соединений, которое уменьшает высвобождение ФНО□ посредством мощного ингибирования фосфодиэстеразы-4 (ФДЭ4). Указанное новое лекарственное средство в настоящее время находится в стадии доклинической разработки для лечения псориаза и атопического дерматита. С27 проявляет значительную активность in vivo в модели острого раздражения кожи. В среде ацетон/этанол, 5% С27 ингибирует индуцированный ФМА отек уха в большей степени, чем 15% дексаметазон (82% ингибирования по сравнению с 73%, соответственно, р<0,01) и активно в указанной модели в мазевой среде в таких низких концентрациях, как 0,01%. При местном применении С27 также значительно ингибирует индуцированное оксазолоном опухание уха (модель аллергического контактного дерматита). Скрининг in vitro показал, что С27 не проявляет значительного ингибирования hERG или фермента р450. Фармакокинетический анализ на крысах после перорального введения в дозе 100 мг/кг показал относительно низкую биодоступность (7%) и, после внутривенного введения в дозе 20 мг/кг среднее время удержания в плазме 0,64 ч. С27 показал свою безопасность в 14-дневном исследовании на крысах в повторных пероральных дозах 10, 100 и 300 мг/кг/сутки; во всех дозах не наблюдалось никакого воздействия на клиническую химию или гематологию. Также показано меньшее рвотное действие, чем у ролипрама. Безэффектная максимальная концентрация в плазме Сmах для С27 в тесте на рвоту у землероек составила 12,4 мкг/мл. Накожное нанесение 5% мази или крема С27 на более 15% поверхности тела геттингенской карликовой свиньи не дало обнаружимых уровней соединения в плазме (LLOQ (нижний предел количественного определения) = 0,01 мкг/мл), и через 24 часа воздействия не наблюдалось раздражения кожи. Указанные ранние исследования позволяют предположить, что С27 обладает необходимой биологической активностью in vivo и хорошим периферическим профилем безопасности для допущения его к клиническим испытаниям.
ПРИМЕР 26
Исследования структура-активность для С17 и С27, новых оксабороловых соединений, обладающих противовоспалительной активностью
[0575] Исследовали взаимосвязь структура-активность новых боросодержащих противовоспалительных агентов. С17 (5-(4-цианофенокси)-1-гидрокси-1,3-дигидро-2,1-бензоксаборол) представляет собой противовоспалительное соединение широкого спектра действия, находящееся в настоящее время в стадии разработки для местного лечения бляшечного псориаза. С17 ингибирует высвобождение ФНО-альфа из моноядерных клеток периферической крови (МНПК), стимулируемое липополисахаридом (ЛПС). Обнаружено, что С17 ингибирует фермент фосфодиэстеразу4 (ФДЭ4), полученный из клеток человека U937. Поскольку ингибирование ФДЭ4, как полагают, является частью механизма действия указанного соединения по ингибированию высвобождения ФНО-альфа, проводили изучение взаимосвязи структура-активность для близких соединений с целью идентификации более мощного ингибитора ФДЭ4/ФНО-альфа.
[0576] Проводили скрининг соединений при помощи биохимического теста на фермент ФДЭ4 и клеточного теста на высвобождение цитокина с использованием МНПК, стимулируемых ЛПС или фитогемагглютинином (ФГА). Полученные результаты показали, что электронно-акцепторные группы, такие как циано и N,N-диалкилкарбамоил, в пара-положении к атому кислорода, важны для активности. Сложноэфирные и пиридиновые аналоги также показали мощную активность. Однако карбоксильные производные утратили большую часть своей активности в обоих тестах. С27 продемонстрировал мощное ингибирование ФДЭ4 (IC50 60 нМ), тогда как IC50 С17 и ролипрама составили 490 нМ и 860 нМ, соответственно. Региоизомеры по цианогруппе были менее активными. С27 также ингибировал высвобождение цитокинов, таких как ФНО-альфа (IC50 160 нМ), ИЛ-2 (IC50 180 нМ), и интерферон-гамма (IC50 220 нМ). С27 не показал цитотоксичности в отношении линий клеток L929 и HepG2 в концентрациях вплоть до 100 микроМ.
ПРИМЕР 27
Мазевые составы для С17 или С27
[0577] В производственный резервуар помещали необходимое количество белого вазелина и нагревали до плавления при (65±5)°С. В резервуар из нержавеющей стали добавляли С17 или С27, олеиловый спирт и октилгидроксистеарат, и перемешивали пропеллерной мешалкой при нагревании при (65±5)°С до получения прозрачного раствора (суспензии в случае 5% С17). Поддерживали указанную температуру. Добавляли смесь С17 или С27 в перерабатывающий резервуар, перемешивая при помощи гомогенизатора. Гомогенизировали при (65±5)°С минимум в течение 5 минут. Убирали нагреватель и начинали охлаждение. Продолжали перемешивание до образования однородной мази.
[0578] Состав мази С17 представлен ниже. Количественный состав мази С17, 0,5%, 2% и 5%.
|
|
[0579] Состав мази С27 представлен ниже.
Количественный состав мази С27, 0,01%, 0,1%, 1% и 2%
|
ПРИМЕР 28
Составы кремов для С17
Состав крема А для С17
[0580] В резервуар 1 из нержавеющей стали (НС) добавляли очищенную воду и глицерин для приготовления смеси с ксантановой камедью. При перемешивании пропеллерной мешалкой добавляли ксантановую камедь и перемешивали до получения гладкого однородного геля. В резервуар 2 из нержавеющей стали добавляли очищенную воду и гидроксид натрия и смешивали при помощи магнитной мешалки до получения прозрачного 10% раствора гидроксида натрия. В резервуар 3 из нержавеющей стали добавляли С17, олеиловый спирт, этилгексилгидроксистеарат, глицерилмоностеарат SE, холестерин и бутилированный гидрокситолуол. Перемешивали пропеллерной мешалкой и нагревали при (80±5)°С до получения прозрачного раствора. Поддерживали указанную температуру. В производственный резервуар добавляли раствор из НС резервуара 3, перемешивая при помощи гомогенизатора. Гомогенизировали при (80±5)°С минимум в течение 5 минут. Убирали нагреватель и начинали охлаждение. Продолжали перемешивание пропеллерной мешалкой до образования жидкого крема, что достигалось при 30-35°С. Перемешивая при помощи гомогенизатора, добавляли смесь с ксантановой камедью из НС резервуара 1. Продолжали гомогенизацию, пока крем не станет гуще, гладким и однородным. Доводили pH крема или 10% раствором гидроксида натрия, или разбавленной соляной кислотой до pH 6,0±0,3. Доводили объем партии до 100% оставшимся количеством очищенной воды. Перемешивали пропеллерной мешалкой до получения гладкого и однородного крема.
[0581] Состав крема С17 представлен ниже. Состав крема А для С17, 5%
|
|
Состав крема В для С17
[0582] В резервуар из нержавеющей стали добавляли олеиловый спирт, бензиловый спирт, диизопропиладипат, глицерилмоностеарат SE, октилдодеканол, бутилированный гидрокситолуол и С17. Перемешивали пропеллерной мешалкой при нагревании до (60±5)°С до получения прозрачного раствора. Поддерживали указанную температуру. При непрерывном перемешивании пропеллерной мешалкой добавляли пемулен TR-2. Перемешивали, пока маслянистые компоненты не станут визуально однородными. Поддерживали указанную температуру. В производственный резервуар добавляли очищенную воду, метилпарабен, пропилпарабен, пропиленгликоль и эдетат динатрия. Перемешивали пропеллерной мешалкой при нагревании до (60±5)°С до получения прозрачного раствора.. Поддерживали указанную температуру.
[0583] При непрерывном перемешивании пропеллерной мешалкой добавляли карбопол ультрез 10. Перемешивали, пока водная фаза не станет визуально однородной. Поддерживали указанную температуру. При перемешивании гомогенизатором добавляли масляную фазу к водной фазе в производственном резервуаре. Гомогенизировали при (60±5)°С минимум в течение 5 минут. Убирали нагреватель и начинали охлаждение. Продолжали перемешивание пропеллерной мешалкой, добавляли 25% троламин и перемешивали, пока крем не станет гуще, однородным и комнатной температуры.
[0584] Состав другого крема С17 представлен ниже. Состав крема В для С17, 0,3-2%
|
|
25% раствор троламина
|
ПРИМЕР 2 9
Состав крема для С27
[0585] В резервуар из нержавеющей стали добавляли бензиловый спирт, октилдодеканол, С27, стеариловый спирт, цетиловый спирт, БГТ и глицерилмоностеарат. Перемешивали пропеллерной мешалкой при нагревании до (65±5)°С до расплавления твердых веществ и получения прозрачного раствора. Поддерживали указанную температуру. В производственный резервуар добавляли очищенную воду, полисорбат 60, пропиленгликоль, метилпарабен, пропилпарабен и эдетат натрия. Нагревали до (65±5)°С при перемешивании до получения прозрачного раствора. Поддерживали указанную температуру. Перемешивая при помощи гомогенизатора, добавляли компоненты масляной фазы С27 к водной фазе в производственном резервуаре. Гомогенизировали при (65±5)°С минимум в течение 5 минут. Убирали нагреватель и начинали охлаждение. Продолжали перемешивание пропеллерной мешалкой, пока крем не станет гуще, гладким и комнатной температуры.
[0586] Состав крема С27 представлен ниже.
|
[0587] Следует понимать, что примеры и варианты реализации согласно настоящему описанию приведены только с целью иллюстрации, и специалист в данной области, учитывая их, может предложить различные модификации или изменения, которые должны быть включены в сущность и область действия настоящей заявки и в объем прилагаемой формулы изобретения. Все публикации, патенты и заявки на патенты, цитируемые в настоящей заявке, полностью включены в настоящую заявку посредством ссылок во всех отношениях.