Результат интеллектуальной деятельности: N-[2-(АДАМАНТ-2-ИЛ)АМИНОКАРБОНИЛМЕТИЛ]-N'-(ДИАЛКИЛАМИНО)АЛКИЛНИТРОБЕНЗАМИДЫ, ОБЛАДАЮЩИЕ АНТИАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
Изобретение относится к области химии и касается новых биологически активных соединений, обладающих антиаритмической активностью, общей формулы I:
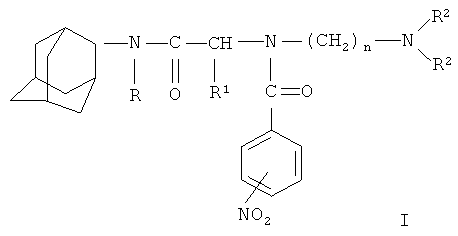
где R - водород, алкил (C1-C6) или циклоалкил; R1 может быть водородом или алифатическим остатком (C1-C2); R2 может быть алкилом (C1-C2) или вместе с азотом насыщенным гетероциклом с одним или двумя гетероатомами, такими, как, например, морфолин, пирролидин, пиперидин; "n" может иметь значение 2 или 3; нитрогруппа в бензамиде может находиться в любом (о-, м-, n-) положении цикла и их физиологически приемлемые соли с минеральными и органическими кислотами, предпочтительно в виде гидрохлоридов формулы 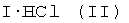 .
.
Заявляемые соединения проявляют высокую антиаритмическую активность.
Одной из актуальных проблем фармакологии остается поиск и изучение механизма действия эффективных антиаритмических средств. Это обусловлено тем, что аритмии нередко служат причиной внезапной смерти и вызывают опасные осложнения со стороны различных систем организма. Несмотря на то, что в последние годы для лечения аритмий предложены хирургические методы, имплантация пейсмекеров, применение дефибрилляторов, фармакологическая коррекция остается основным подходом в лечении и профилактике аритмий, а также возникающих при этом осложнений. Следует подчеркнуть, что в клинической практике при терапии нарушений ритма сердца чаще всего используют комбинированную терапию, включающую антиаритмики различных классов [Недоступ А.В., Благова О.В. Принципы комбинированной антиаритмической терапии. Русский мед. журнал, 2005, №11, с.767-774; Недоступ А.В. Вопросы стратегии терапии аритмий сердца. Русский мед. журнал, Кардиология, 2008, т.16, №6, с.431-435].
Лечение аритмий является весьма сложной задачей, зачастую не имеющей однозначного решения. Существующие антиаритмические препараты часто обладают ограниченной эффективностью и серьезным побочным действием, включая проаритмогенное, представляющее особую опасность для пациентов с имеющейся сердечной патологией. Нормализующее влияние на нарушенный ритм сердечных сокращений оказывают вещества, относящиеся к различным классам химических соединений и различным фармакологическим группам.
Многочисленные исследования последних лет показали, что в ряде случаев действенными препаратами при определенных типах аритмий, таких как фибрилляция предсердий, являются препараты III класса по классификации E.Vaughan-Williams. В настоящее время проводятся развернутые клинические исследования по ниферидилу-антиаритмику III класса - структурному аналогу нибентана [Глушков Р.Г., Южаков С.Д., Львов А.И. и др., Химико-фармацевтический журнал, 2011, т.45, №2, с.3-12; Миронов Н.Ю., Голицын С.П., Соколов С.Ф. и др. Электрофизиологические эффекты и противоаритмическая активность нового отечественного антиаритмического препарата III класса ниферидила у больных пароксизмальными наджелудочковыми тахикардиями. Эксперим. и клин. фармакол., 2012, т.75, №10, с.78-83; Savelieva I. J. Camm. Europace, 2008, v.10, №6, p.646-665; Wulf H., Castle N.A., Pardo L.A. et al. Rev. Drug Discov., 2009, v.8, №12, 982-1001].
Однако существующие препараты этого класса, такие как соталол, амиодарон, нибентан имеют ряд отрицательных эффектов, в том числе и проаритмогенный [Машковский М.Д. Лекарственные средства, Москва, Изд-во «Новая волна», 2000; Pollard С.Е. et al. Br.J.Pharmacol., 2010, v. 159, N1, p.12-21]. Кроме того, антиаритмические препараты III класса в той или иной степени обладают свойствами антиаритмиков I, II и IV классов [Резник А.В., Федоров В.В., Розенштраух Л.В., Кокоз Ю.М. и др. Ионные механизмы кардиотропного действия препарата III класса РГ-2. Кардиология, 2003, №10, с.76-81; Миронов Н.Ю., Голицын С.П., Соколов С.Ф. и др. Электрофизиологические эффекты и противоаритмическая активность нового отечественного антиаритмического препарата III класса ниферидила у больных пароксизмальными наджелудочковыми тахикардиями. Эксперим. и клин. фармакол., 2012, т.75, №10, с.78-83; Моисеева И.Я., Котляров А.А., Родина О.П., Кустинова И.Н. Основы клинической фармакологии противоаритмических и соавт., 2006; Галенко-Ярошевский П.А., Шейх-Заде Ю.Р., Михин В.П., Богус С.К. Антиаритмические средства. Нарушение ритма сердца. «Просвещение-Юг», 2012 г., с.17-42].
Поэтому поиск новых химических соединений, проявляющих антиаритмические свойства, весьма актуален. Ближайшим аналогом заявляемых соединений по структуре и действию является N,N-(2-дициклогексил)аминокарбонилметил-N'-[3-(диэтиламино)-пропил]-4-нитро-бензамида гидрохлорид (прототип), проявляющий свойства антиаритмиков III класса [Зауер В., Шиндлер Р., Рюгер К., Каверина Н.В., Середенин С.Б. и др. Амиды аминокарбоновых кислот, способ их получения и фармацевтическая композиция. Пат. РФ №2134683 (1994). Бюлл.1999, №23]. Прототип также обладает свойствами антиаритмических препаратов I и IV классов [Каверина Н.В., Лысковцев В.В. и др. Новый антиаритмический препарат III класса среди дициклогексиламидов аминокарбоновых кислот. Вестник РАМНД998, №11, с.42-46; Каверина Н.В., Лысковцев В.В., Соколов С.Ф. и соавт. Ал-275, новый антиаритмический препарат III класса. Фармакологические свойства и особенности механизма действия. Кардиология, 2000, №7, с.42-47]. Кроме того, названное соединение также обладает рядом побочных эффектов и по этой причине не получило практического применения. Известно, что введение в молекулу биологически активного соединения адамантильного заместителя модифицирует его фармакологическое действие и снижает токсичность [Ковалев И.Е. Биологическая активность адамантансодержащих веществ. Хим. фарм. журн., 1977, т.11, №3, с.19-27; Pandeya S.N. Indian J. Pharm., 1971, v33, р.1].
Цель изобретения - синтез новых соединений, обладающих высокой антиаритмической активностью, низкой токсичностью и большой широтой терапевтического действия, которая достигается получением N-[2-(адамант-2-ил) аминокарбонилметил]-N'-(диалкиламино)алкилнитробензамидов общей формулы I.
Заявляемые соединения формулы I настоящего изобретения в специальной и патентной литературе не описаны.
Примерами соединений формулы I настоящего изобретения могут быть следующие соединения:
N-[2-(адамантан-2-ил)аминокарбонилметил]-N'-[2-(диэтиламино)этил]-4-нитробензамид;
N-[2-(адамант-2-ил)аминокарбонилметил]-N'-[3-(диэтиламино)пропил]-4-нитробензамид;
N,N-[2-(адамант-2-ил)-2-циклогексиламинокарбонилметил]-N'-[2-(диэтиламино)этил]-4-нитробензамид;
N,N-[2-(адамант-2-ил)-2-циклогексиламинокарбонилметил]-N'-[3-(диэтиламино)пропил]-4-нитробензамид;
N-[2-(адамант-2-ил)аминокарбонилметил]-N'-[3-(морфолино)пропил]-4-нитробензамид.
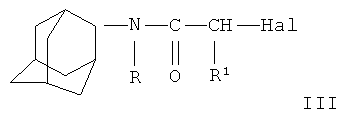
Поставленная цель достигается согласно способу получения соединений формулы I, заключающемуся в том, что N-(адамант-2-ил) галогенацетамиды формулы III
подвергают действию диаминов общей формулы IV
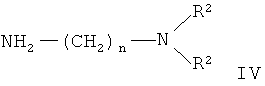
где R, R1, n, R2 имеют вышеуказанные значения, Hal - хлор или бром.
Реакцию проводят в среде инертных растворителей, таких как ароматические углеводороды, спирты, эфиры, полярные апротонные растворители (диметилформамид, диметилсульфоксид) или в избытке исходного диамина. Процесс проводят в присутствии акцепторов галогенводородов, в качестве которых могут быть использованы карбонаты щелочных металлов, третичные амины или исходный диамин, при температуре от комнатной до температуры кипения исходного диамина с получением диаминоамидов общей формулы V:
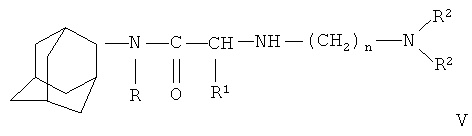
Соединение общей формулы V ацилируют соответствующим нитробензоилгалогенидом, в котором нитрогруппа может находиться в любом положении фенильного кольца. Реакцию проводят в инертных растворителях или в двухфазной системе, например, органический растворитель-вода, в присутствии акцепторов галогенводородов, с выделением заявляемых соединений общей формулы I. В качестве растворителей могут применяться толуол, ксилол, бензол, хлороформ и др., а в качестве акцепторов галогеноводородов применимы третичные амины (триэтиламин, этилморфолин, пиридин и др.), карбонаты (гидрокарбонаты) калия, натрия или их водные растворы.
Амиды нитробензойных кислот формулы I превращают в физиологически приемлемые соли формулы II
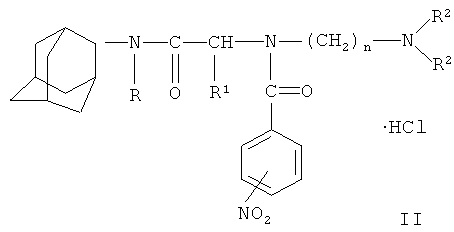
действием минеральных или органических кислот, предпочтительно хлористоводородной кислотой. В качестве растворителей для получения солей общей формулы II могут быть применены ароматические углеводороды, спирты, эфиры, ацетон, хлороформ, четыреххлористый углерод.
Соединения формулы I представляют собой кристаллические вещества, нерастворимые в воде, растворимые в большинстве органических растворителей.
Гидрохлориды формулы II - белые или почти белые кристаллические вещества, хорошо растворимые в воде, в спиртах, практически не растворимые в эфире, ацетоне, ароматических углеводородах.
Строение и чистота заявляемых соединений подтверждаются результатами элементного анализа и спектрами ЯМР 1H.
Изобретение иллюстрируется следующими примерами.
Пример 1.Смесь 4,1 г (0,018 моль) N-(адамант-2-ил)хлорацетамида, 5 г (6,1 мл; 0,043 моль) 2-диэтиламиноэтиламина в 25 мл толуола нагревают с обратным холодильником до кипения и выдерживают в этих условиях 4-5 часов. По окончании реакции к охлажденной реакционной массе прибавляют 15 мл толуола и полученный толуольный раствор промывают 2×20 мл водой, толуол упаривают и получают 4,25 г (81% от теории) неочищенного N-(адамант-2-ил)амида N'-(2-диэтиламино)этиламиноуксусной кислоты.
К раствору 4,2 г (0,013 моль) N-(адамант-2-ил)амида N'-(2-диэтиламино) этиламиноуксуной кислоты в 50 мл бензола прибавляют 3,2 г (0,03 моль) углекислого натрия и 20 мл воды. К полученной смеси порциями прибавляют 3,2 г (0,0167 моль) хлорангидрида n-нитробензойной кислоты. Смесь перемешивают при 20-25°C 2 часа, а затем прибавляют 40 мл воды и температуру в реакционной массе поднимают до 50-55°C. Перемешивание продолжают еще 2 часа. Охлаждают, бензольный слой отделяют, водный - дополнительно экстрагируют бензолом. Объединенный бензольный раствор промывают водой, затем растворитель отгоняют, а остаток кристаллизуют из водного этанола. Полученный продукт представляет собой белый с кремовым оттенком кристаллический порошок с т.пл. 155-157°C. Выход N-[2-(адамант-2-ил)аминокарбонилметил]-N'-[2-(диэтиламино)этил]-n-нитробензамида (Ia) 3,9 г (71% от теории).
Найдено, %: C 65,81; H 7,95; N12,52; C25H36 N4O4.
Вычислено, %: C 65,77; H 7,95; N 12,27.
К раствору 3,65 г (0,008 моль) N-[2-(адамант-2-ил)аминокарбонилметил]-N'-[2-(диэтиламино)этил]-n-нитробензамида в 50 мл сухого толуола при перемешивании прибавляют спиртовый раствой хлористого водорода до pH 2-3. Смесь оставляют для полной кристаллизации на 5-6-часов. Осадок гидрохлорида N-[2-(адамант-2-ил)аминокарбонилметил]-N'-[2-диэтиламино)-этил]-n-нитробензамида (IIa) отфильтровывают, промывают ацетоном, высушивают, затем кристаллизуют из пропанола-2. Белый кристаллический порошок с т.пл. 222-224°C. Выход 3,4 г (81%)
Найдено, %: C 61,20; H 7,68; C17,14; N 11,24. C25H37 Cl N4O4.
Вычислено, %: C 60,90; H 7,56; Cl 7,19; N11,36.
Спектр ЯМР 1H (DMSO d6, δ, м.д.):
1,25 (6 H, t, N (CH2CH3)2); 1,31-1,88 (14 Н, м, AdH);
3,21 (4 H, кв, N (CH2CH3)2); 3,20 (2Н, т, CH2 CH2 N); 3,78 (1H, д, AdH-2); 3,84 (2Н, т, CONCH2 СН2); 4,07 (2H, с, -CH3-CO-); 7,64 и 8,25 (4H, м, n-ArH); 7,94 (1H, д, -NH-).
Пример 2. К смеси 5,7 г (0,025 моль) N-(адамант-2-ил)хлорацетамида и 15 мл толуола прибавляют 15 мл (12,3 г; 0,094 моль) 3-диэтиламинопропиламина. Реакционную массу кипятят 2 часа. Охлаждают, добавляют 30 мл воды и 15 мл толуола, органический слой отделяют, водный слой дополнительно экстрагируют толуолом. Объединенный толуольный раствор промывают водой, а затем упаривают досуха. Получают 6,82 г (85%) технического N-(адамант-2-ил)амида-N'-(3-(диэтиламино)пропиламиноуксусной кислоты. Продукт хроматографически чистый.
К перемешиваемой смеси 6,0 г (0,0187 моль) N-(адамант-2-ил) амида 3-диэтиламинопропиламиноуксусной кислоты и 4,2 г углекислого калия в 50 мл толуола и 20 мл воды прибавляют 3,5 г (0,0245 моль) 4-нитробензоилхлорида с такой скоростью, чтобы температура в реакционной смеси не превышала 25°C. Перемешивают еще 1,5 часа, а затем прибавляют 50 мл воды, нагревают до 50-60°C и выдерживают при перемешивании 2 часа. Охлаждают, органический слой отделяют, а водный - дополнительно экстрагируют 25 мл толуола. Объединенный толуольный раствор промывают 25 мл 10% раствора аммиака, а затем водой. Растворитель отгоняют в вакууме. Получают 7,5 г неочищенного продукта, который кристаллизуют из 70% водного этанола. Светло-кремовые кристаллы с т.пл. 119-121°C. Выход N-[2-(адамант-2-ил)аминокарбонилметил]-N'-[3-(диэтиламино)пропил]-4-нитробензамида (Iб) 5,9 г (78% от теории).
Найдено, %: C 66,48; H 8,26; N 11,87. C26H38N4O4.
Вычислено, %: C 66,36; H 8,14; N 11,90.
К раствору 5,75 г основания 16 в 50 мл ацетона при перемешивании прибавляют 25% спиртовой раствор хлористого водорода до pH 2-3. Выдерживают при 5-10°C 2 часа, выпавший осадок целевого продукта отфильтровывают, промывают сухим ацетоном. Белый кристаллический порошок с т.пл. 199-200°C (изо-пропанол). Выход гидрохлорида N-[2-(адамант-2-ил)аминокарбонилметил]-N'-[3-(диэтиламино)пропил]-4-нитробензамида (IIб) составляет 5,72 г (81%).
Найдено, %: C 61,34; H 7,68; Cl 7,14; N 10,94. С26Н39 Cl N4O4.
Вычислено, %: C 61,56; H 7,75; Cl 6,99; N 11,05.
Спектр ЯМР 1H (DMSO d6, δ, м.д.): 1,14 и 1,23 (6H, т, N-(CH2CH3)2; 1,30-1,86 (14Н, м, AdH); 2,00 (2Н, м, -CH2 СН2 N); 3,00 и 3,11 (6H, м, -CH2CH3)2 и
- (CH2 CH2N); 3,52 (2Н, т, СО NCH2, СН2-); 3,77 и 3,89 (1Н, д, AdH-2); 3,98 и 4,19 (2Н, с, CH2CO); 7,62 и 8,24; 7,67 и 8,31 (4Н, м, n-Ar-H); 7,87 и 8,04 (1Н, Д, -NH).
Пример 3. Раствор 6,2 г (0,02 моль) N-(адамант-2-ил)-N-цикло-гексилхлорацетамида и 7,79 г (9,5 мл; 0,067 моль) диэтиламиноэтиламина в 15 мл толуола нагревают до 145°C и выдерживают 4 часа. Избыток амина и толуол отгоняют на роторном испарителе. К остатку прибавляют 25 мл толуола, 20 мл воды. Слои разделяют. Толуольный раствор промывают водой. Растворитель отгоняют и получают 7,25 г (92,9% от теории) неочищенного N-(адамант-2-ил)-N-циклогексиламида N'-(2-диэтиламино)этиламиноуксусной кислоты.
К перемешиваемой смеси 7,22 г (0,018 моль) N-(адамант-2-ил)-N-циклогексиламида-N'-(2-диэтиламино)этиламиноуксусной кислоты, 4,0 г (0,029 моль) карбоната калия и 30 мл воды в 65 мл толуола, порциями прибавляют 4,12 г (0,022 моль) 4-нитробензоилхлорида. Реакционную массу перемешивают при комнатной температуре 1,5 часа, затем прибавляют 40 мл воды и температуру в массе поднимают до 60°C. Выдерживают в этих условиях 1 час. Охлаждают, слои разделяют, водный - дополнительно экстрагируют 20 мл толуола. Промывают водой толуольный раствор и растворитель отгоняют, а остаток 8,1 г кристаллизуют из пропанола-2. Получают 5,25 г (65%) N,N-[2-(адамант-2-ил)-2-циклогексиламинокарбонил-метил]-N-[2-(диэтиламино)этил]-4-нитробензамида (IIв). Светло-кремовые кристаллы с т.пл. 198-199°C.
Найдено, %: C 68,90; H 8,90; N 10,56; C31H46N4O4.
Вычислено, %: C 69,11; H 8,61; N 10,40.
К раствору 5,1 г (0,01 моль) основания Iв в 50 мл сухого ацетона при перемешивании прибавляют раствор хлористого водорода в этаноле до pH 2-3. Выделившийся осадок отфильтровывают, промывают ацетоном, высушивают и кристаллизуют из абсолютного этанола. Получают 4,35 г (81,6%) гидрохлорида N,N-[2-(адамант-2-ил)-2-циклогексиламинокарбонилметил]-N'-[2-(диэтиламино)этил]-4-нитробензамида (IIв). Т.пл. 222-224°C (разл.).
Найдено, %: C 64,91; H 8,24; Cl 6,38; N 9,52. C31H47 Cl N4O4.
Вычислено, %: C 64,73; H 8,24; Cl 6,16; N 9,74.
Спектр ЯМР 1H (DMSO d6, δ, м.д.): 1,25 (6H, т, -N-(CH2CH3)2); 1,10-2,30 (24H, м, 14Н AdH и 10H циклогексила); 3,24 (5H, м, 4H-N(CH2CH3)2 и 1H циклогексила); 3,39 (3H, м, 2H, CH2CH2 N и 1H Ad H-2); 3,83 (2H, т, CONCH2CH2); 4,08 (2H, с,- COCH2 N-); 7,56 и 8,24 (4Н, м, n-ArH).
Пример 4. Смесь 6,2 г (0,02 моль) N-(адамант-2-ил)-N-циклогексил-хлорацетамида и 7,8 г (9,6 мл; 0,06 моль) 3-диэтиламинопропиламина в 20 мл o-ксилола нагревают до кипения и выдерживают 2 часа. Избыток диамина и ксилол отгоняют в вакууме. К остатку прибавляют 40 мл бензола. Полученный раствор промывают водой, затем растворитель отгоняют. Получают с количественным выходом (8,1 г) хроматографически чистый N-(адамант-2-ил)-N-циклогексиламид-N'-(3-диэтиламино)пропиламиноуксусной кислоты, который используют на следующей стадии.
К перемешиваемой смеси 8,0 г (0,02 моль) N-(адамант-2-ил)-N-циклогексиламида-N'-(3-диэтиламино)пропиламиноуксусной кислоты, 3,65 г (0,035 моль) углекислого натрия в 75 мл толуола и 30 мл воды медленно прибавляют 5,15 г (0,028 моль) n-нитробензоилхлорида. Перемешивают реакционную массу при комнатной температуре 2 часа, затем прибавляют 45 мл воды, нагревают до 50-55°C и выдерживают в этих условиях 2 часа. Массу охлаждают, толуольный слой отделяют, промывают водой и растворитель отгоняют в вакууме. Получают 9,75 г (89%) N,N-[2-(адамант-2-ил)-2-циклогексиламинокарбонилметил]-N'-[3-(диэтиламино)пропил]-4-нитробензамида (1 г) (в виде масла), которое используется на следующей стадии.
К раствору 9,5 г основания 1 г в 75 мл сухого ацетона при перемешивании и охлаждении прибавляют эфирный раствор хлористого водорода до pH 2-3. Смесь оставляют для кристаллизации при 0+5°C на 2-3 часа. Осадок отфильтровывают, высушивают и кристаллизуют из абсолютного этанола. Получают 8,8 г (79,65%) гидрохлорида N,N-[2-(адамант-2-ил)-2-циклогексиламинокарбонилметил]-N'-[3-(диэтиламино)-пропил]-n-нитробензамида (IIг). Белый кристаллический порошок с т.пл. 177-178°C.
Найдено, %: C 65,01; H 8,46; Cl 6,31; N 9,76. C32H49 Cl N4O4.
Вычислено, %: C 65,23; H 8,38; Cl 6,02, N 9,51.
Спектр ЯМР 1H (DMSOd6 - CF3 COOD, δ, м, д): 1,24 (6Н, т, -N(CH2CH3)2; 1,10-2,30 (26Н, м, 14Н AdH, 10H циклогексила и 2H - CH2CH2 N-); 3,11 (5Н, м, 4Н -N(CH2CH3)2 и 1Н-циклогексила); 3,14 (2Н, т, CH2CH2 N), 3,36 (1Н, м, Ad H-2); 3,53 (2H, т, - CONCH2CH2); 4,04 (2Н, с, - COCH2 N-); 7,55 и 8,24 (4Н, м, n-ArH).
Пример 5. Смесь 4,1 г (0,018 моль) N-(адамант-2-ил) хлорацетамида и 15 мл (14,8 г; 0,1 моль) 3-морфолинпропиламина нагревают с обратным холодильником при 145-150°C в течение 1 часа. Избыток морфолинопропиламина отгоняют в вакууме, остаток растворяют в 30 мл толуола. Полученный раствор промывают водой, а затем толуол отгоняют. Получают 4,7 г (77%) неочищенного N-(адамант-2-ил)амида-N'-(3-морфолино)пропиламиноуксусной кислоты.
К перемешиваемой смеси 4,7 г (0,014 моль) N-(адамант-2-ил) амида N'-(3-морфолино)пропиламиноуксусной кислоты, 4,4 г (0,031 моль) углекислого калия в 50 мл толуола и 20 мл воды порциями прибавляют 3,7 г (0,020 моль) n-нитробензоилхлорида. По окончании прибавления смесь перемешивают при комнатной температуре 2 часа, затем добавляют 25 мл воды, нагревают до 60°C и выдерживают еще 1 час. Массу охлаждают, толуольный слой отделяют, водный - дополнительно экстрагируют 20 мл толуола. Объединенный толуольный раствор промывают 10% раствором аммиака и водой. Растворитель отгоняют и получают 5,8 г (85,8%) некристаллизованного N-[2-(адамант-2-ил)аминокарбонилметил]-N'-[3-(морфолино)пропил]-n-нитробензамида (Iд), который передают без очистки на следующую стадию.
В раствор 5,8 г основания Iд в 50 мл ацетона прибавляют диэтиловый эфир, насыщенный хлористым водородом до pH 2-3. Смесь оставляют для полной кристаллизации при +5°C на 2 часа. Выпавший осадок отфильтровывают, промывают эфиром. Получают 4,75 г (76%) гидрохлорида N-[2-(адамант-2-ил)аминокарбонилметил]-N'-[3-(морфолино)пропил]-n-нитробензамида (IIд). Белые кристаллы с т.пл. 215-216°C (из абс. этанола).
Найдено, %: C 59,92; H 7,25; Cl 7,15; N 10,91. C26H37 ClN4O4.
Вычислено, %: C 59,93; H 7,16; Cl 6,80; N 10,75.
Спектр ЯМР 1H (DMSOd6, δ, м.д.): 1,30-2,10 (14H, м, AdH); 2,05; 3,18 и 3,50 (6H, три м, -CH2CH2CH2-); 2,80-3,90 (8Н, м, -морфолин); 3,90 и 4,13 (1H, м, AdH-2); 3,96 и 4,19 (2H, с, -N-CH2CO-); 7,67; 8,24; 8,31 (4H, м, n-ArH); 7,88; 8,04 (1H, д, -NH-).
Изучение антаритмической активности N-[(адамант-2-ил) аминокарбонилметил]-N'-(диалкиламино) алкилнитробензамидов
Проводился поиск новых антиаритмических лекарственных средств в ряду N-[(адаман-2-ил)аминокарбонилметил]-N'-(3-диалкиламино) алкилнитробензамидов с использованием хлоридкальциевой и аконитиновой моделей аритмии, а также изучение острой токсичности исследуемых соединений в соответствии с методическими рекомендациями по доклиническому изучению лекарственных средств [Галенко-Ярошевский П.А., Каверина Н.В., Камкин А.Г., Турилова А.И., Богус С.К., Шейх-Заде Ю.Р. Методические рекомендации по доклиническому изучению антиаритмических лекарственных средств. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. - М.,: Гриф и К, 2012б, с.385-387 и соавт., 2012 г.].
Методы исследования
Опыты проводили на белых нелинейных бодрствующих крысах-самцах массой 200 г, содержащихся в стандартных условиях вивария. Животных получали из питомника: филиал «Столбовая» ФГБУ «НЦБМТ» РАМН.
В работе были использованы две модели аритмии: аконитиновая и хлоридкальциевая. Аконитиновую аритмию вызывали с помощью внутривенного введения аконитина-гидрохлорида в дозах 30-40 мкг/кг. Через 1-3 минуты после введения аконитина развивались нарушения сердечного ритма смешанного предсердно-желудочкового типа, которые носили разнообразный характер. В экспериментах использовали дозу аконитина, которая вызывала нарушения сердечного ритма средней тяжести (политопная экстрасистолия). ЭКГ регистрировали во II стандартном отведении с помощью Полиспектра -8/B и компьютерной программы через 3, 5, 10, 15 и 20 минут после введения аконитина. Критерием положительного эффекта соединения служило отсутствие аритмии, вызванной аконитином. Эффективную дозу ЭД50 и доверительные границы вычисляли по методу Миллера и Тейнтера при уровне вероятности p=0,05. О терапевтической широте препарата судили по величине антиаритмического индекса (АИ), представляющего собой отношение летальной дозы ЛД50 к эффективной ЭД50.
Хлоридкальциевую аритмию вызывали высокими дозами 10% раствора хлорида кальция (250-390 мг/кг). Через 1-2 минуты после введения хлорида кальция возникает фибрилляция желудочков сердца. Вначале эксперимента подбирали дозу 10% раствора хлорида кальция, вызывающую летальную фибрилляцию желудочков. Исследуемые соединения вводили за 1-2 минуты до введения хлорида кальция. ЭКГ регистрировали во II стандартном отведении каждые 5 минут с помощью Полиспектра -8/B и компьютерной программы. Антиаритмический эффект оценивали по уменьшению количества случаев летальной фибрилляции желудочков сердца. Значимость данных оценивали с помощью критерия Фишера.
Острая токсичность заявляемых соединений
Исследование было начато с изучения острой токсичности этих веществ на нелинейных бодрствующих крысах-самцах массой 200 г при внутривенном введении. В качестве растворителя использовали апирогенную воду для инъекций. Изучение острой токсичности проводили на 6-8 животных с использованием трех и более доз. Результаты оценивали через 2 недели после введения соединений. Эффективную дозу - ЭД50 и летальную дозу - LD50 с доверительными границами вычисляли по методу Миллера и Тейнтера при уровне вероятности p=0,05. Результаты экспериментов представлены в таблице 1. В качестве вещества сравнения использовали прототип - соединение N,N-(2-дициклогексил)аминокарбонилметил-N'-[3-(диэтиламино)-пропил]-4-нитро-бензамида гидрохлорид. Проведенные исследования показали, что наименее токсичным оказалось соединение IIб, у которого токсичность была в 2 раза меньше прототипа (табл.1).
|
Изучение антиаритмической активности исследуемых соединений в условиях хлоридкальциевой модели аритмии
Исследование каждого соединения проводилось на 3-6 группах животных в зависимости от количества исследуемых доз. В контроле было 6 групп по 10 животных. Опытные группы - 11 групп по 6 животных; 6 групп по 8 животных; 1 группа - 5 животных.
Проведенные опыты показали, что в контроле при внутривенном введении 10% раствора хлорида кальция (250-390 мг/кг) погибло 10 животных из 10. Защитный эффект исследуемых соединений проявлялся в дозах 0,25-0,5-1,0 мг/кг при их внутривенном введении до введения хлорида кальция (табл.2, 3, 4, 5, 6, 7).
|
|
|
|
|
|
Сводные данные о выживаемости животных под влиянием исследуемых соединений в условиях хлоридкальциевой модели аритмии представлены в табл.8, 9.
|
|
Все изученные соединения в условиях хлоридкальциевой модели аритмии проявляли антиаритмическую активность. Соединение IIб оказалось наименее токсичным по сравнению с прототипом и соединениями изучаемого ряда. При определении антиаритмического индекса заявляемых соединений и препаратов сравнения было установлено, что соединение IIб обладает наибольшей широтой терапевтического действия по сравнению с прототипом, другими соединениями этого ряда и препаратами сравнения - лидокаином и верапамилом (табл.10).
|
Изучение антиаритмической активности исследуемых соединений в условиях аконитиновой модели аритмии
В условиях аконитиновой модели аритмии все соединения обладают антиаритмической активностью. Наиболее выраженный антиаритмический индекс выявлен у соединения IIб. Это соединение по антиаритмической активности в условиях аконитиновой модели аритмии превосходит препараты сравнения - лидокаин и новокаинамид (табл.11).
|
Таким образом, заявляемые соединения проявляют антиаритмическую активность при изучении в условиях хлоридкальциевой и аконитиновой моделей аритмии. Соединение IIб обладает выраженной антиаритмической активностью, наименьшей токсичностью и имеет наибольший антиаритмический индекс, превосходящий в 1,6 раза прототип.
![N-[2-(АДАМАНТ-2-ИЛ)АМИНОКАРБОНИЛМЕТИЛ]-N'-(ДИАЛКИЛАМИНО)АЛКИЛНИТРОБЕНЗАМИДЫ, ОБЛАДАЮЩИЕ АНТИАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ](https://fips.edrid.ru/images/rid/a3/ce/49/6420d2a3d04355dfb70fbdc4bac160de.png)
![N-[2-(АДАМАНТ-2-ИЛ)АМИНОКАРБОНИЛМЕТИЛ]-N'-(ДИАЛКИЛАМИНО)АЛКИЛНИТРОБЕНЗАМИДЫ, ОБЛАДАЮЩИЕ АНТИАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ](https://fips.edrid.ru/images/rid/a3/ce/49/dce6a6286066d5a40dc85dd97483487d.png)
![N-[2-(АДАМАНТ-2-ИЛ)АМИНОКАРБОНИЛМЕТИЛ]-N'-(ДИАЛКИЛАМИНО)АЛКИЛНИТРОБЕНЗАМИДЫ, ОБЛАДАЮЩИЕ АНТИАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ](https://fips.edrid.ru/images/rid/a3/ce/49/9809deb21420a145f620fafe128967a2.png)
![N-[2-(АДАМАНТ-2-ИЛ)АМИНОКАРБОНИЛМЕТИЛ]-N'-(ДИАЛКИЛАМИНО)АЛКИЛНИТРОБЕНЗАМИДЫ, ОБЛАДАЮЩИЕ АНТИАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ](https://fips.edrid.ru/images/rid/a3/ce/49/cbab18a7fc6e2cb980499cae54dfc544.png)

