Результат интеллектуальной деятельности: СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ГИБРИДНОГО БЕЛКА Е7-HSP70 (ВАРИАНТЫ)
Вид РИД
Изобретение
Изобретение относится к области биотехнологии и биофармакологии и касается способа микробиологического синтеза гибридного белка E7-HSP70, в частности, E7(6)HSP70 или E7(11)-HSP70 или E7(16)-HSP70 или E7(18)-HSP70. Эти гибридные белки состоят из аминокислотных последовательностей онкобелка Е7 вируса папилломы человека (ВПЧ) 6, 11, 16 или 18 типов соответственно, слитых с аминокислотной последовательностью белка теплового шока с молекулярной массой 70 кДа (HSP70) бактерий Mycobacterium tuberculosis, 16 С-концевых аминокислотных остатков которого заменены на искусственную последовательность, включающую 6 остатков гистидина.
Вирус папилломы человека (ВПЧ) 6 и/или 11 типа является возбудителем таких заболеваний, как аногенитальный кондиломатоз и рецидивирующий респираторный папилломатоз (РРП), а (ВПЧ) 16 и/или 18 типа - возбудителем опухолевых заболеваний аногенитальной области.
Аногенитальный кондиломатоз - возникновение кондилом (бородавок) в аногенитальной области у мужчин и женщин - является одним из наиболее распространенных вирусных заболеваний, передающихся половым путем, и распространенной формой проявления инфекции ВПЧ. Примерно за 90% случаев этого заболевания ответственны ВПЧ 6 и 11 типа, за оставшиеся 10% случаев - ВПЧ 42 и 54 типов [А.В. Миченко, 2010; Баткаев, Э.А., 2001].
Несмотря на отсутствие летальных случаев, аногенитальные кондиломы наносят существенный вред здоровью, снижают качество жизни пациентов, требуют длительного лечения и часто рецидивируют независимо от типа лечения. В литературных источниках есть сведения, что кондиломы нередко способствуют развитию рака гениталий [Беляева Т.Л. и соавт., 1989; Васильева, В.В. 1999; Козлова В.И. и соавт., 2000; Кулаков В.И., 2003; Djurdjewic С. et al., 1999; Zielinski G.D. et al., 1999].
Особой формой ВПЧ-инфекции является рецидивирующий папилломатоз респираторного тракта (РРП).
Проблема РРП привлекает пристальное внимание исследователей. Это, прежде всего, связано с тяжестью патологии (рост папиллом в самом узком участке дыхательных путей приводит к выраженному стенозу гортани, вплоть до асфиксии), потенциально возможной малигнизацией папиллом (у взрослых РРП расценивают как облигатное предраковое состояние), а также длительностью заболевания и его клинической непредсказуемостью [Ю.Л. Солдатский Адъювантная терапия …, 2006; В.В. Барышев, В.Г. 2009].
Рак шейки матки - злокачественная опухоль, которая по данным медицинской статистики среди онкологических заболеваний у женщин занимает четвертое место (после рака желудка, кожи и молочных желез). Источником раковой опухоли шейки матки служат нормальные клетки, покрывающие шейку матки. Ежегодно эту опухоль выявляют более чем у 600 тысяч пациенток. За 70% случаев рака шейки матки ответственны папилломавирусы человека 16 и 18 типов.
Белок Е7, входящий в состав гибридного белка E7-HSP70, играет ключевую роль в репликации ВПЧ и способен влиять на дифференциацию инфицированных клеток. Белок Е7 нарушает регуляцию контроля клеточного цикла, образуя стабильный неактивный комплекс с серией регулирующих клеточный цикл белков, инициирует репликацию вирусных генов и нарушает регуляцию пролиферации инфицированных клеток [Сахарова О.В., М.И. Нечушкин, 1999; De Villiers Е.-М., 1994].
Белок Е7 является белком исключительно вирусного происхождения, постоянно присутствует в инфицированных клетках и отсутствует в неинфицированных, поэтому он является подходящей мишенью для высокоспецифичной иммунотерапии для предотвращения и лечения папилломатоза. Иммунотерапия может быть как терапевтической, нацеленной на активацию Т-клеточного иммунного ответа против антигенов ВПЧ, экспрессируемых в инфицированных клетках, так и профилактической, индуцирующей выработку нейтрализующих антител [Kanodia et al., 2008].
Иммуногенность белка Е7 в составе терапевтических вакцин может быть увеличена за счет присоединения к нему белка-носителя, который стимулирует Т-клеточный ответ. Таким белком является белок теплового шока HSP70 Mycobacterium tuberculosis. Иммунные системы животных способны распознавать многочисленные В и Τ клеточные эпитопы, которые присутствуют в составе этого белка, что позволяет ему выполнять функцию мощного неспецифического стимулятора иммунной системы [Qian et al, 2006].
Белки теплового шока (Heat shock protein - HSP) относятся к семейству стрессовых белков и представляют собой полифункциональные белки, метаболизм которых в клетках изменяется в ответ на воздействие неблагоприятных условий. Важнейшими свойствами белков HSP являются их способность к улучшению презентации антигена на поверхности дендритных клеток и макрофагов, а также способность выступать в роли носителей иммуногенных пептидов [Gaston J.S.H., Clin. Exp. Immunol. 127: 1-3, 2002; Khlebodarova T.M., Genetika 38: 437-452, 2002; Lussow A.R. et al., Eur. J. Immunol. 21: 2297-2302, 1991., а также патент РФ 2229307].
Одними из наиболее важных представителей белков HSP являются белки семейства HSP70. В настоящее время известно более 10 представителей HSP70 эукариот [Bernelli-Zazzera A. et al., Ann. N.Y. Acad. Sci. 663: 120-124, 1992.]. В отличие от большинства других стрессовых белков HSP функционируют в виде мономеров и обладают способностью к связыванию крупных пептидных фрагментов. В качестве основного компонента новых препаратов наиболее предпочтительным является использование HSP70 из Mycobacterium tuberculosis, поскольку этот белок вызывает наиболее мощную стимуляцию клеточного иммунологического ответа к связанным с ним антигенным пептидам.
Российская компания ООО «Аванген» разработала способ получения препарата на основе гибридного белка E7-HSP70, состоящего из онкобелка Е7 ВПЧ 11 типа и белка HSP70 Mycobacterium tuberculosis [RU 2290204]. В способе, разработанном ООО «Аванген», биосинтез целевого белка осуществляют в клетках Escherichia coli, трансформированных плазмидой pQE30-E711-dnaK. Белок получают в виде телец включения. После разрушения клеток бактерий тельца включения отмывают и проводят денатурацию-ренатурацию целевого белка. Исходя из описания [RU 2290204], можно предположить, что отсутствие в процессе получения белка E7-HSP70 специфических стадий очистки препарата от комплекса липополисахаридов (ЛПС) будет приводить к тому, что препараты белка E7-HSP70, получаемые согласно описанной процедуре, будут содержать значительное и варьирующее от образца к образцу количество бактериального ЛПС, обладающего токсичным и пирогенным действием. Тем самым применение в лечебных целях белка E7-HSP70, синтезированного в клетках E. coli, будет затруднено.
В качестве ближайшего аналога заявляемого способа рассмотрим способ получения белка E7-HSP70, содержащего аминокислотную последовательность белка Е7 ВПЧ 11 типа (RU 2489481), в котором описано использование дрожжей Saccharomyces cerevisiae в качестве альтернативных продуцентов белка E7-HSP70. Эти дрожжи, входящие в список микроорганизмов, безопасных для человека, не содержат токсичный и пирогенный бактериальный ЛПС [Gordonova et al., 2002]. В настоящее время их используют для производства 28 разрешенных к применению в медицине белков, включая вакцины [Ferrer-Miralles et al., 2009].
В ближайшем аналоге приводится способ получения рекомбинантного гибридного белка E7-HSP70, состоящего из аминокислотной последовательности онкобелка Е7 вируса папилломы человека 11 типа, слитой с аминокислотной последовательностью белка теплового шока с молекулярной массой 70 кДа (HSP70) бактерий Mycobacterium tuberculosis. Штамм S. cerevisiae SCR-702-E7-HSP70 продуцент E7-HSP70 получают путем трансформации лабораторного штамма S. cerevisiae D702 экспрессионным вектором pPDX3-E7-HSP70. Способ получения рекомбинантного гибридного белка заключается в культивировании штамма-продуцента в ферментере объемом 3 л. 50 мл посевного материала используют для засева 3-литрового ферментера Anglicon, содержащего 950 мл среды YPD. Ферментацию проводят при температуре 28°С, аэрации 1 л/мин и скорости перемешивания 1000 об/мин. Через 24 часа после засева ферментера начинают подпитку среды культивирования 50%-м раствором глюкозы со скоростью 2 мл/ч и устанавливают рН-статирование культуры на уровне рН 6.8±0.1, используя для подтитровки растворы 10% серной кислоты и 10% NaOH. Общее время ферментации составляет 72 часа.
По данным электрофоретического анализа уровень продукции рекомбинантного белка E7-HSP70 составляет 100 мг/л среды (3).
Способ - ближайший аналог характеризуется недостаточно высоким уровнем микробиологического синтеза при значительной продолжительности времени культивирования.
Задача заявляемого изобретения: расширение арсенала способов микробиологического синтеза гибридного белка E7-HSP70.
Задача решена путем:
- разработки способа микробиологического синтеза гибридного белка E7(6)-HSP70 путем культивирования дрожжей Saccharomyces cerevisiae ВКПМ Y-3919, продуцирующих такой белок, в подходящих условиях на среде, содержащей в качестве источника углерода сахарозу, а процесс культивирования проводят в две фазы: первую из которых осуществляют при температуре 25-26°С и начальной концентрации сахарозы 25-30 г/л, а по достижении концентрации сахарозы в среде 15 мг/л для проведения второй фазы процесса культивирования температуру снижают и поддерживают на уровне не более 23°С, значение рН поддерживают на уровне 5,7-5,9, а концентрацию сахарозы поддерживают на уровне 15 мг/л путем экспоненциальной подпитки;
- разработки способа микробиологического синтеза гибридного белка E7(11)-HSP70 путем культивирования дрожжей Saccharomyces cerevisiae ВКПМ Y-3853, продуцирующих такой белок, в подходящих условиях на среде, содержащей в качестве источника углерода сахарозу, а процесс культивирования проводят в две фазы: первую из которых осуществляют при температуре 25-26°С и начальной концентрации сахарозы 25-30 г/л, а по достижении концентрации сахарозы в среде 15 мг/л для проведения второй фазы процесса культивирования температуру снижают и поддерживают на уровне не более 23°С, значение рН поддерживают на уровне 5,7-5,9, а концентрацию сахарозы поддерживают на уровне 15 мг/л путем экспоненциальной подпитки;
- разработки способа микробиологического синтеза гибридного белка E7(16)-HSP70 путем культивирования дрожжей Saccharomyces cerevisiae ВКПМ Y-4057, продуцирующих такой белок, в подходящих условиях на среде, содержащей в качестве источника углерода сахарозу, а процесс культивирования проводят в две фазы: первую из которых осуществляют при температуре 25-26°С и начальной концентрации сахарозы 25-30 г/л, а по достижении концентрации сахарозы в среде 15 мг/л для проведения второй фазы процесса культивирования температуру снижают и поддерживают на уровне не более 23°С, значение рН поддерживают на уровне 5,7-5,9, а концентрацию сахарозы поддерживают на уровне 15 мг/л путем экспоненциальной подпитки;
- разработки способа микробиологического синтеза гибридного белка E7(18)-HSP70 путем культивирования дрожжей Saccharomyces cerevisiae ВКПМ Y-4058, продуцирующих такой белок, в подходящих условиях на среде, содержащей в качестве источника углерода сахарозу, а процесс культивирования проводят в две фазы: первую из которых осуществляют при температуре 25-26°С и начальной концентрации сахарозы 25-30 г/л, а по достижении концентрации сахарозы в среде 15 мг/л для проведения второй фазы процесса культивирования температуру снижают и поддерживают на уровне не более 23°С, значение рН поддерживают на уровне 5,7-5,9, а концентрацию сахарозы поддерживают на уровне 15 мг/л путем экспоненциальной подпитки.
Способ в общем виде
Инокулят одного из штаммов-продуцентов выращивают в колбах Эрленмейера с питательной стерильной средой А, содержащей в мас. %: пептон - 2, дрожжевой экстракт - 2, KH2PO4 - 0,01, (NH4)2SO4 - 0,5, вода - остальное.
Для получения инокулята в каждую колбу вносят раствор сахарозы до концентрации 25-30 г/л и по 1 мл стока рабочей культуры в 15% глицерине. Колбы инкубируют при встряхивании (200 об/мин) при температуре 25-26°С и до конечной оптической плотности не менее 10 о.е.
В ферментере подготавливают питательную среду А и стерилизуют ее при 116°С в течение 40 мин. В остывшую среду вносят раствор сахарозы до концентрации 25-30 г/л. Инокулят переносят в ферментер, при этом посевная доза составляет 4-7% от объема среды А.
Процесс культивирования делится на два этапа - фаза накопления биомассы и фаза биосинтеза целевого продукта. Целью первого этапа является максимальное накопление пула клеток, необходимых для производства продукта. Для этого на первом этапе культивирования созданы оптимальные условия для активного роста культуры.
В течение первого этапа клетки активно растут благодаря повышенной температуре 25-26°С, обогащенной культуральной среде и стартовому субстрату - сахарозе. В течение первой фазы культивирования в процессе отсутствует рН-статирование, с начала второй фазы культивирования рН поддерживают на уровне 5,7-5,9.
С 22-24 часа культивирования по достижении концентрации сахарозы в среде 15 мг/л проводят биосинтез гибридного белка. Для повышения уровня экспрессии температуру роста снижают до уровня не более 23°С и проводят подпитку сахарозой, поддерживая ее концентрацию на уровне 15 мг/л.
Культивирование проводят в течение 60-65 ч.
Уровень биосинтеза целевого белка в результате культивирования штамма S. cerevisiae SCR-702-E7(6)-HSP70 или S. cerevisiae SCR-702-E7(11)-HSP70 или S. cerevisiae SCR-702-E7(16)-HSP70 или S. cerevisiae SCR-702-E7(18)-HSP70 в ферментере составляет не менее 550 мг/л культуральной жидкости.
Заявляемое изобретение проиллюстрировано следующими фигурами:
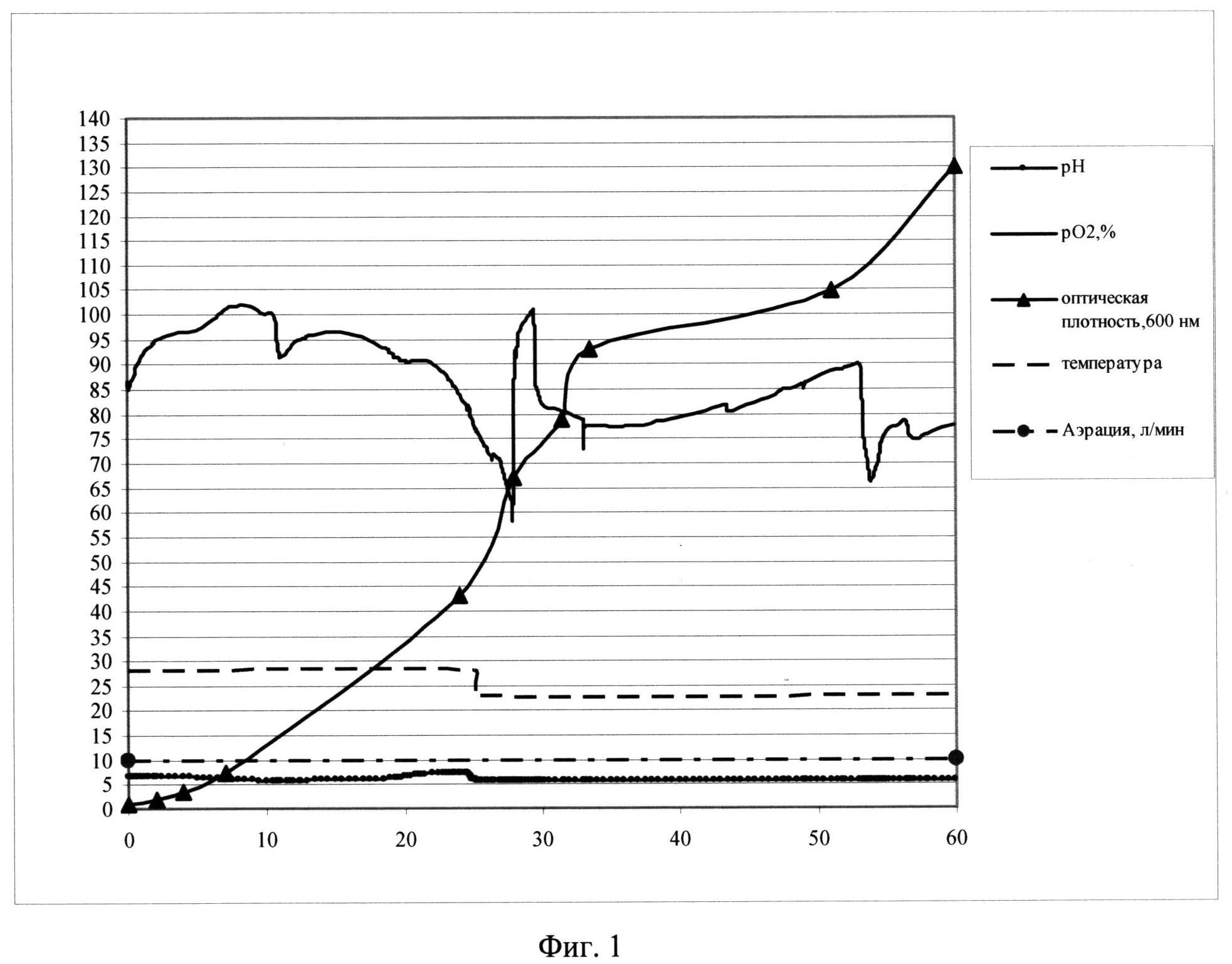
Фиг. 1. Параметры культивирования штамма-продуцента S. cerevisiae SCR-702-E7(6)-HSP70 в объеме 10 л по предлагаемой схеме. По оси абсцисс - часы культивирования, по оси ординат - значения параметров культивирования.
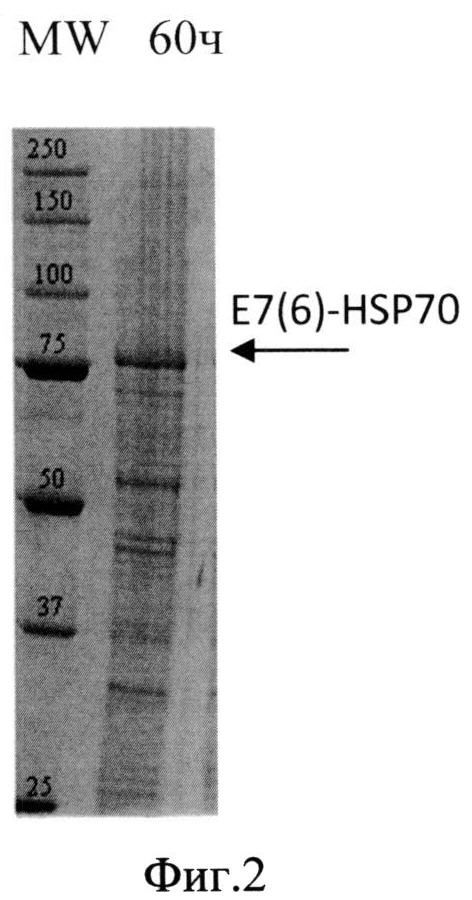
Фиг. 2. Анализ содержания белка в лизате биомассы штамма-продуцента S. cerevisiae SCR-702-E7(6)-HSP70 методом электрофореза в ПААГ, полученной в ходе процесса культивирования по предлагаемой схеме. Стрелкой показано положение полноразмерного белка E7(6)-HSP70.
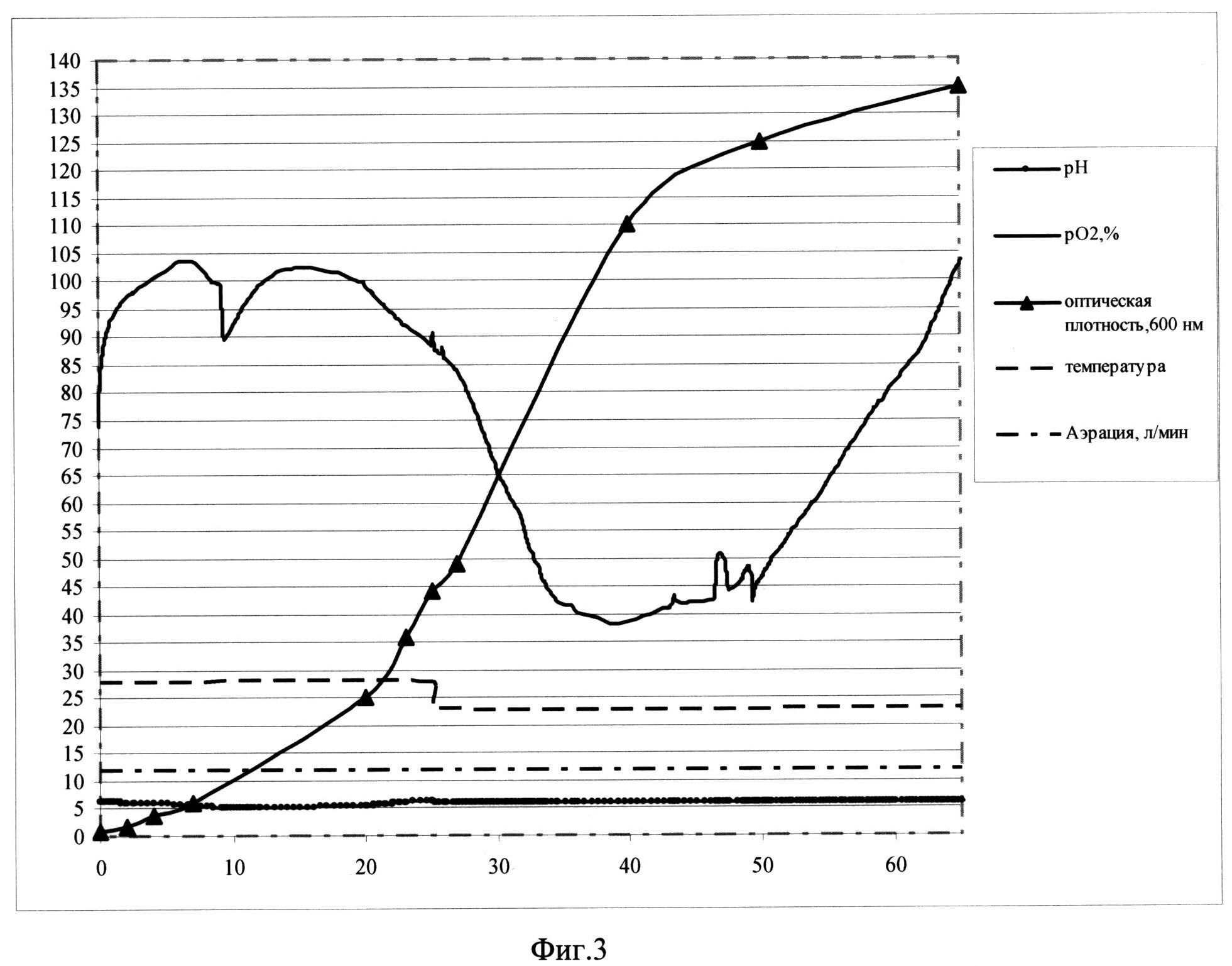
Фиг. 3. Параметры культивирования штамма-продуцента S. cerevisiae SCR-702-E7(11)-HSP70 в объеме 12 л по предлагаемой схеме. По оси абсцисс - часы культивирования, по оси ординат - значения параметров культивирования.
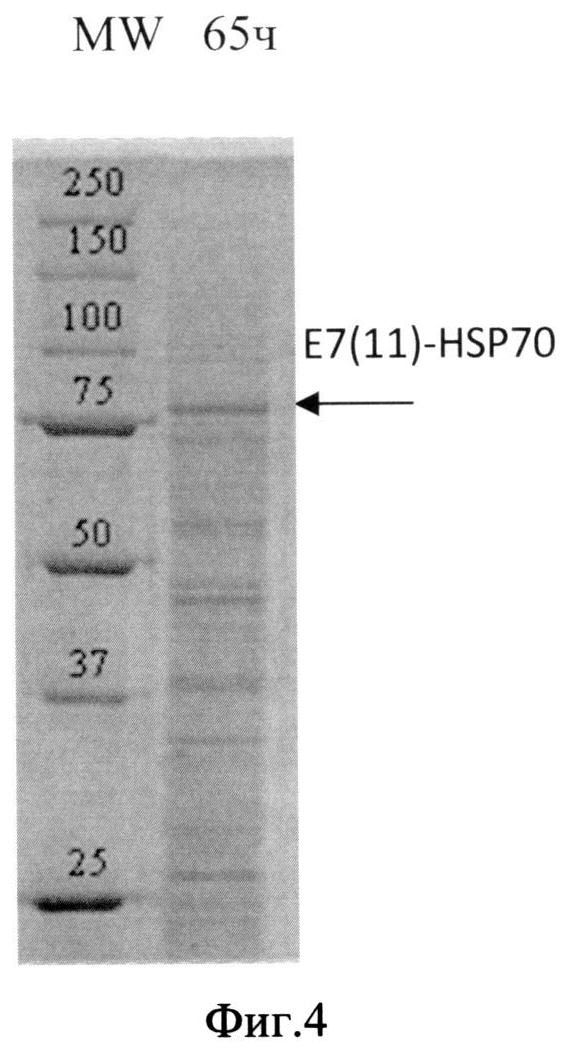
Фиг. 4. Анализ содержания белка в лизате биомассы штамма-продуцента S. cerevisiae SCR-702-E7(11)-HSP70 методом электрофореза в ПААГ, полученной в ходе процесса культивирования по предлагаемой схеме. Стрелкой показано положение полноразмерного белка E7(11)-HSP70.
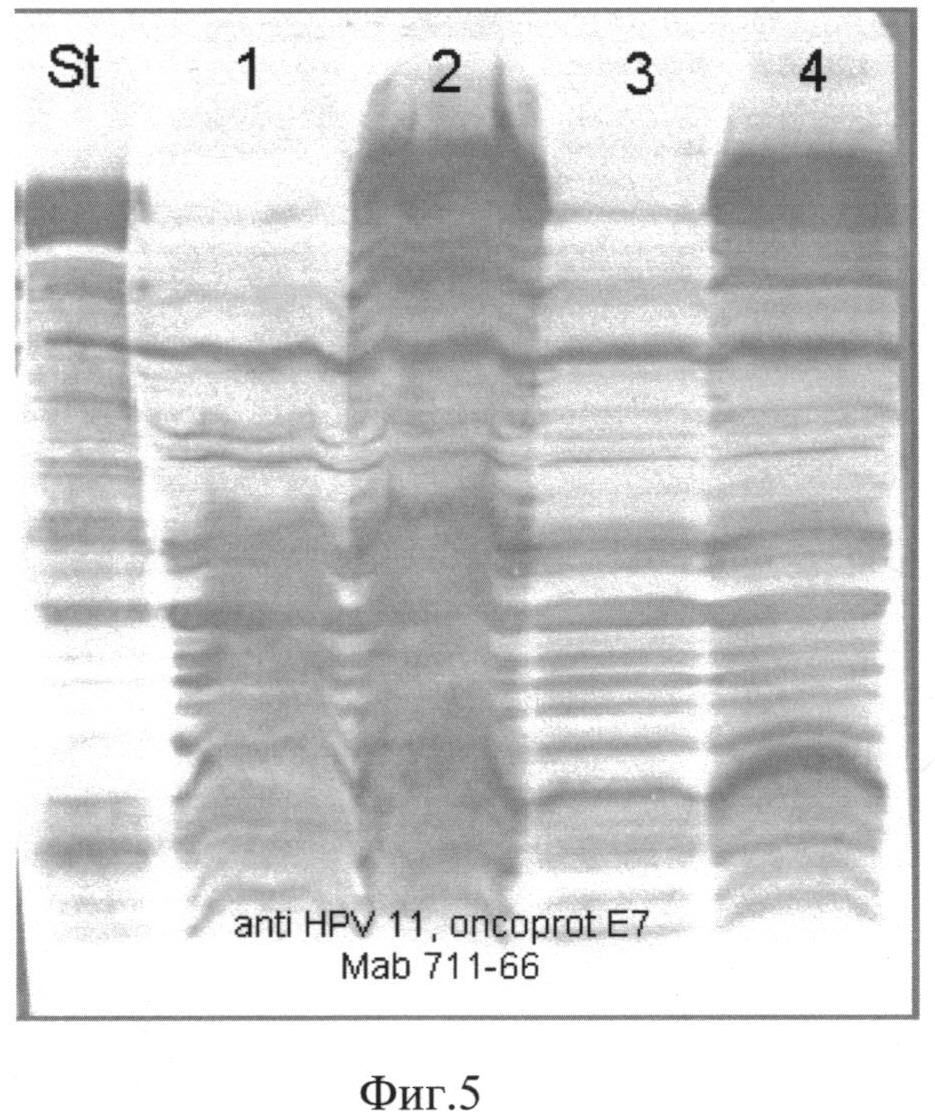
Фиг. 5. Western-анализ лизатов биомассы штаммов-продуцентов S. cerevisiae SCR-702-E7(6)-HSP70 и S. cerevisiae SCR-702-E7(11)-HSP70. Для Western-анализа использовали антитела anti-HPV 11, oncoprotein Е7 Mab 711-66, специфичные к белку Е7 11 типа. St-внутренний стандарт белка E7(11)HSP70; 1,3-лизаты биомассы штамма S. cerevisiae SCR-702-E7(6)-HSP70; 2,4-лизаты биомассы штамма S. cerevisiae SCR-702-E7(11)-HSP70.
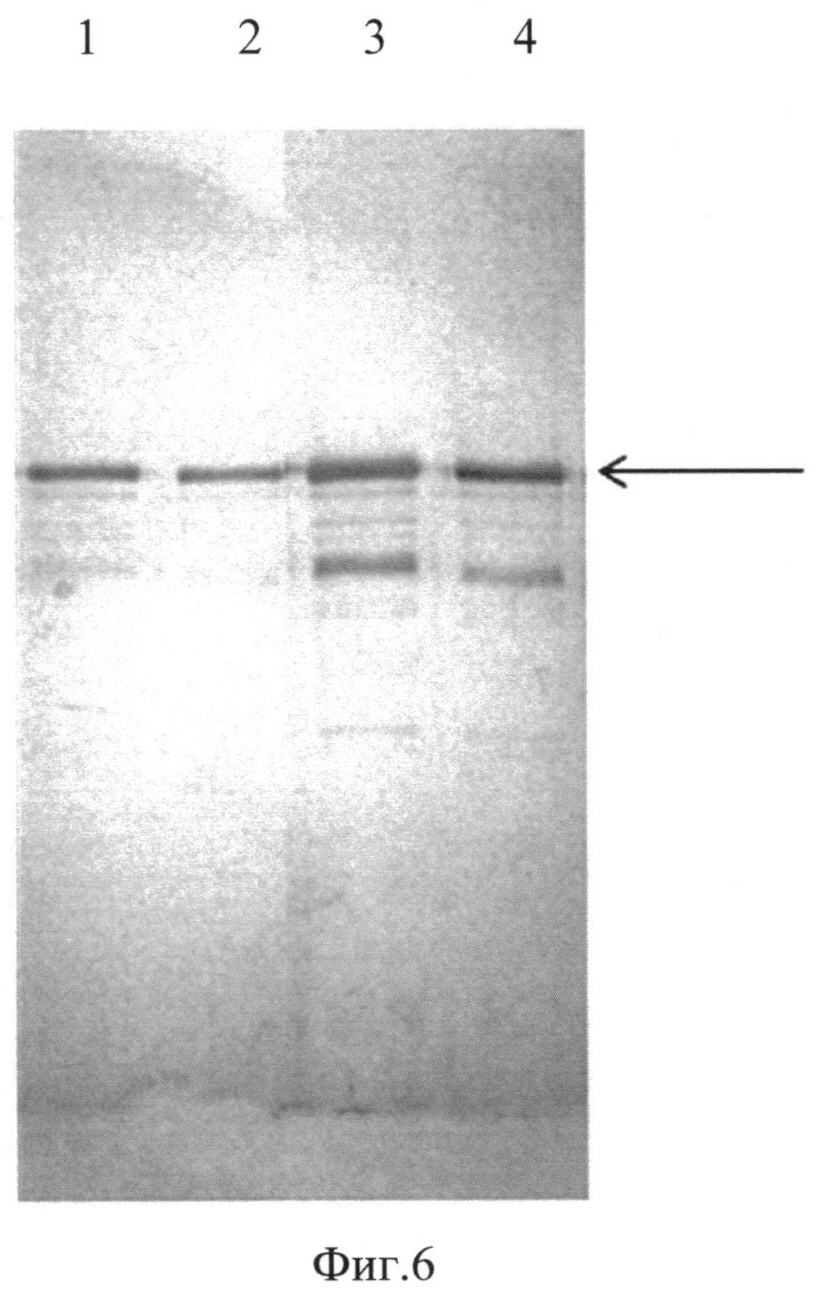
Фиг. 6. Western-анализ образцов субстанций белков E7(6)-HSP70, E7(11)-HSP70, Е7(16)-HSP70 и E7(18)-HSP70. Для Western-анализа использовали антитела anti-HSP70 Mab TS29, специфичные к белку HSP70. 1, 2, 3, 4 - образцы субстанций белков E7(6)-HSP70, E7(11)-HSP70, E7(16)-HSP70 и E7(18)-HSP70 соответственно.
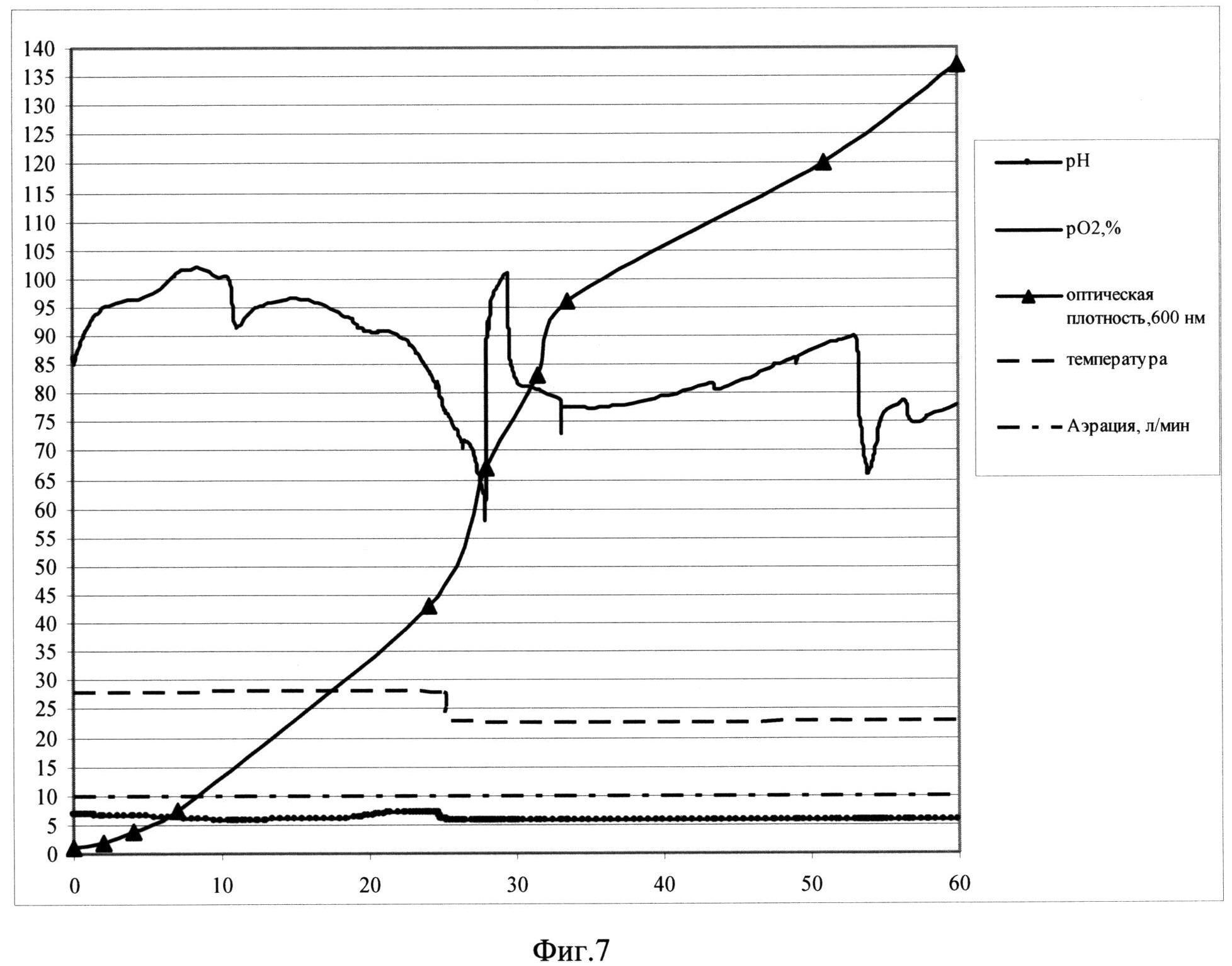
Фиг. 7. Параметры культивирования штамма-продуцента S. cerevisiae SCR-702-E7(16)-HSP70 в объеме 10 л по предлагаемой схеме. По оси абсцисс - часы культивирования, по оси ординат - значения параметров культивирования.
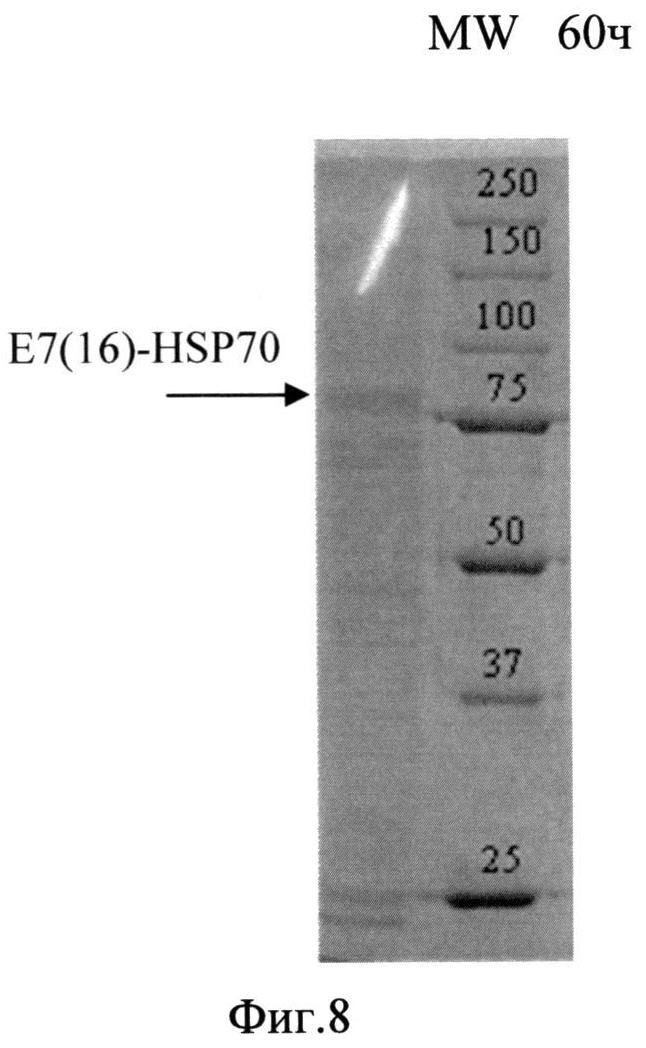
Фиг. 8. Анализ содержания белка в лизате биомассы штамма-продуцента S. cerevisiae SCR-702-E7(16)-HSP70 методом электрофореза в ПААГ, полученной в ходе процесса культивирования по предлагаемой схеме. Стрелкой показано положение полноразмерного белка E7(16)-HSP70.
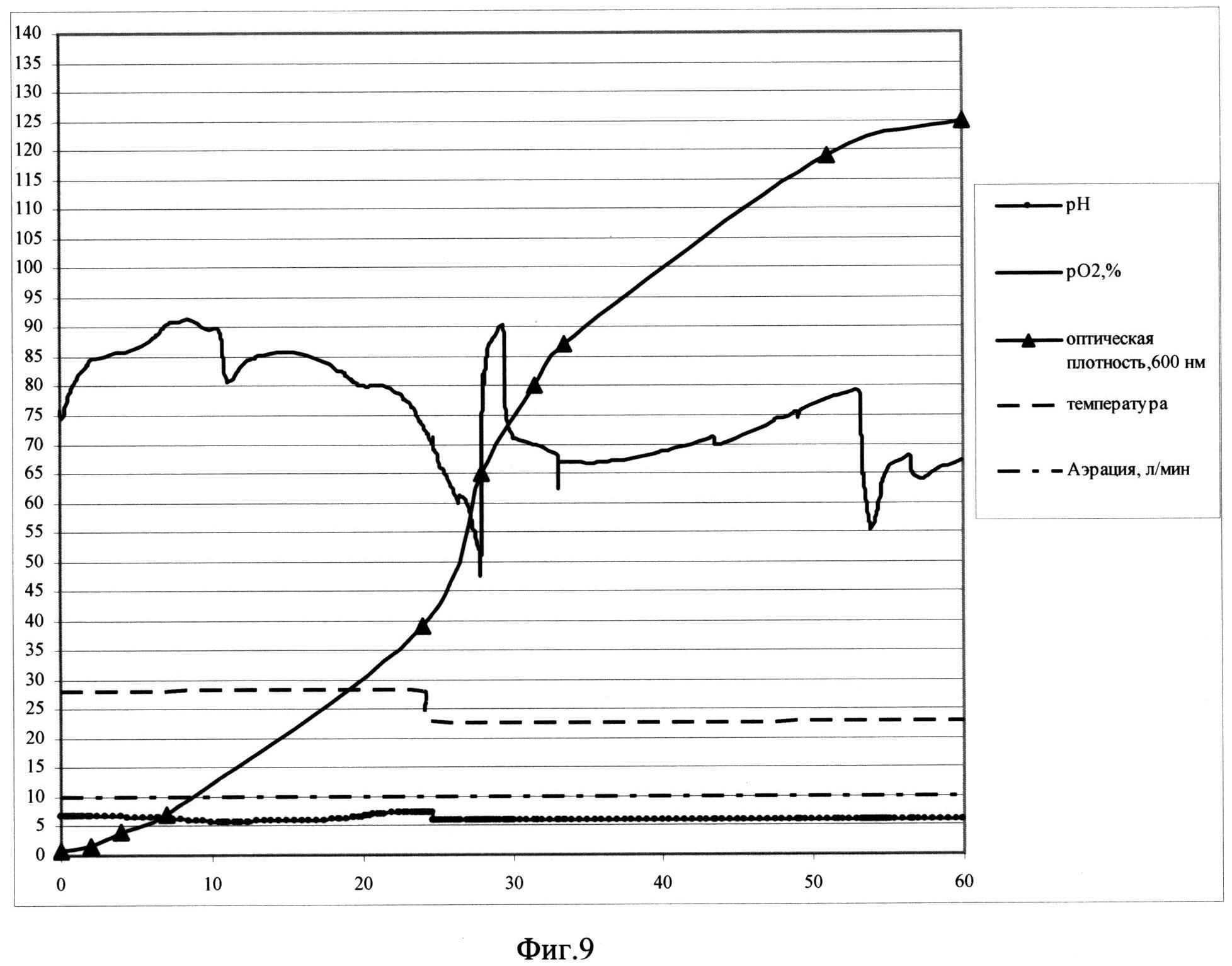
Фиг. 9. Параметры культивирования штамма-продуцента S. cerevisiae SCR-702-E7(18)-HSP70 в объеме 10 л по предлагаемой схеме. По оси абсцисс - часы культивирования, по оси ординат - значения параметров культивирования.
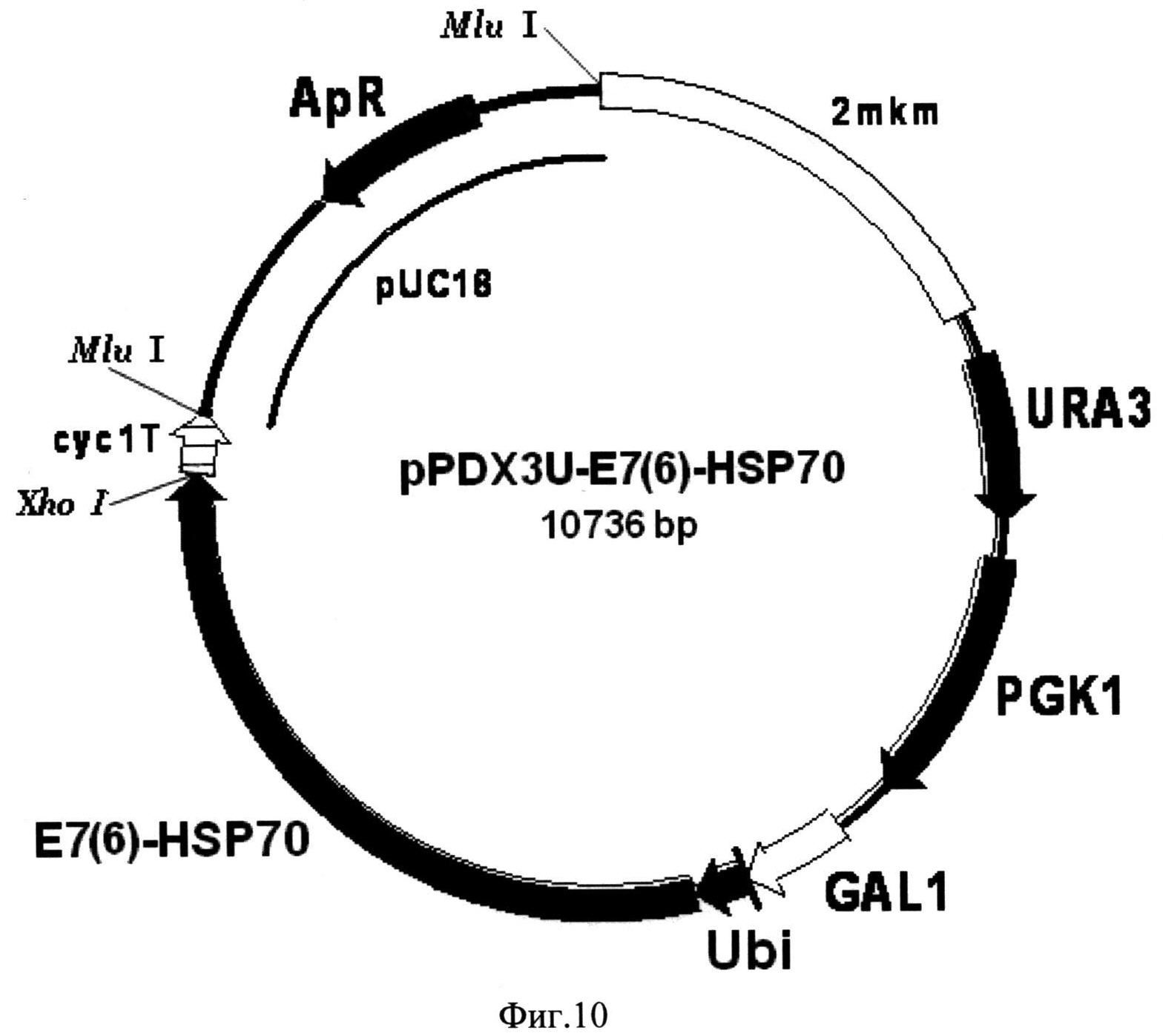
Фиг. 10. Карта экспрессионной плазмиды pPDX3U-E7(6)-HSP70. Бирепликонная плазмида pPDX3U-E7(6)-HSP70 содержит структурный ген рекомбинантного белка E7(6)-HSP70 (E7(6)-HSP70), включающего в свой состав последовательности онкобелка Е7 вируса папилломы человека серотипа-6 и белка теплового шока HSP70 Mycobacterium tuberculosis, 16 С-концевых аминокислотных остатков которого замещены на искусственную последовательность, включающую 6 остатков гистидина, слитый в одной рамке считывания с последовательностью, кодирующей убиквитин (Ubi) дрожжей S. cerevisiae, под контролем промотора GAL1 (GAL1). В состав вектора входят последовательности ДНК, кодирующие селективные маркеры URA3 (URA3) и PGK1 (PGK1) дрожжей S. cerevisiae, последовательность терминатора транскрипции гена CYC1 дрожжей S. cerevisiae (cyc1T), обеспечивающая терминацию транскрипции гена слитого белка, а также фрагмент 2-микронной эндогенной плазмиды дрожжей S. cerevisiae (2 mkm), обеспечивающий репликацию плазмиды pPDX3U-E7(6)-HSP70 в клетках дрожжей S. cerevisiae, и фрагмент плазмиды pUC18 (pUC18), содержащий ген бета-лактамазы (ApR) и ориджин репликации, и обеспечивающий селективную амплификацию вектора в клетках E. coli.
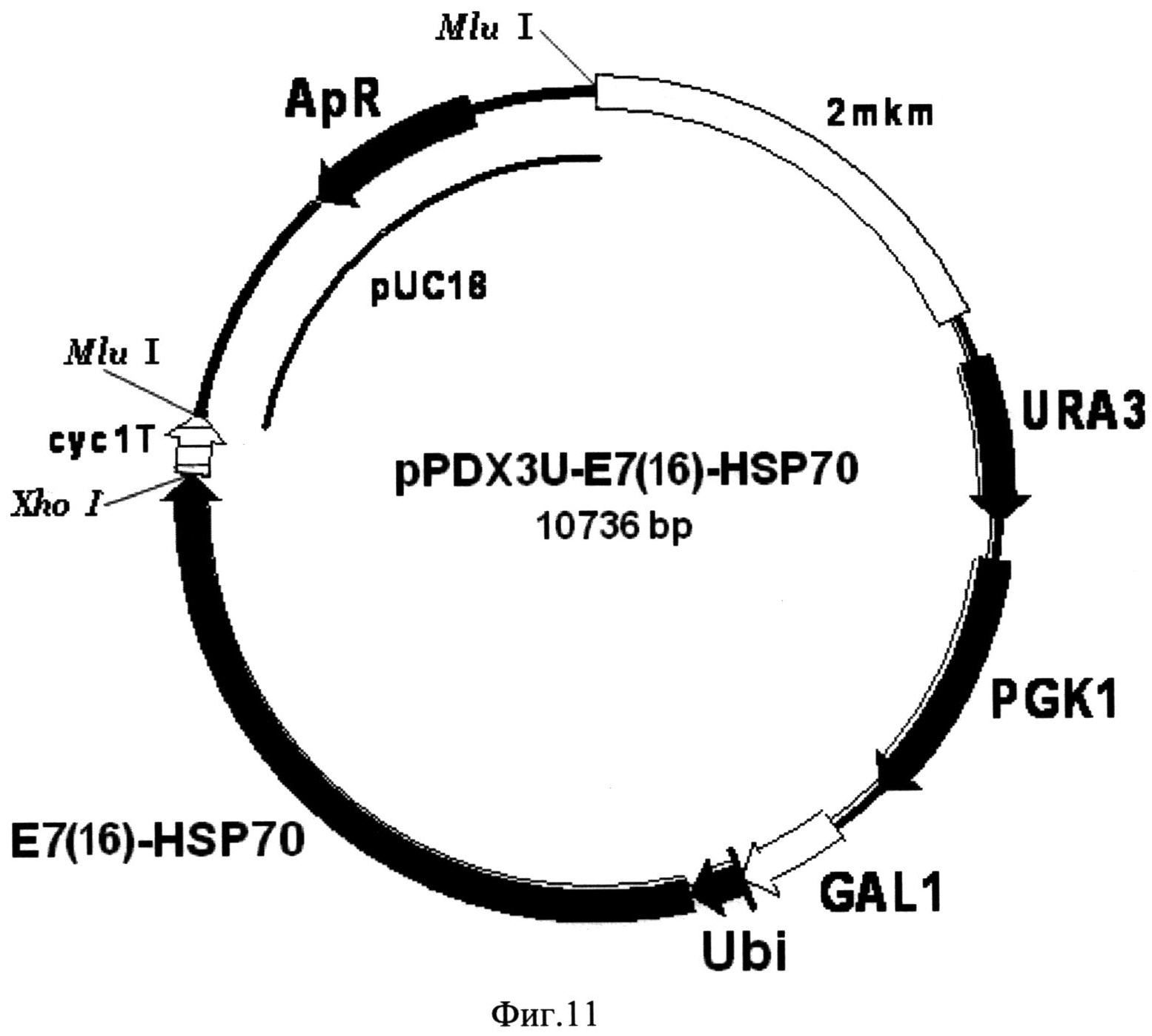
Фиг. 11. Карта экспрессионной плазмиды pPDX3U-E7(16)-HSP70. Бирепликонная плазмида pPDX3U-E7(16)-HSP70 содержит структурный ген рекомбинантного белка E7(16)-HSP70 (E7(16)-HSP70), включающего в свой состав последовательности онкобелка Е7 вируса папилломы человека серотипа-16 и белка теплового шока Hsp70 Mycobacterium tuberculosis, 16 С-концевых аминокислотных остатков которого замещены на искусственную последовательность, включающую 6 остатков гистидина, слитый в одной рамке считывания с последовательностью, кодирующей убиквитин (Ubi) дрожжей S. cerevisiae, под контролем промотора GAL1 (GAL1). В состав вектора входят последовательности ДНК, кодирующие селективные маркеры URA3 (URA3) и PGK1 (PGK1) дрожжей S. cerevisiae, последовательность терминатора транскрипции гена CYC1 дрожжей S. cerevisiae (cyc1T), обеспечивающая терминацию транскрипции гена слитого белка, а также фрагмент 2-микронной эндогенной плазмиды дрожжей S. cerevisiae (2 mkm), обеспечивающий репликацию плазмиды pPDX3U-E7(16)-HSP70 в клетках дрожжей S. cerevisiae, и фрагмент плазмиды pUC18 (pUC18), содержащий ген бета-лактамазы (ApR) и ориджин репликации, и обеспечивающий селективную амплификацию вектора в клетках E. coli.
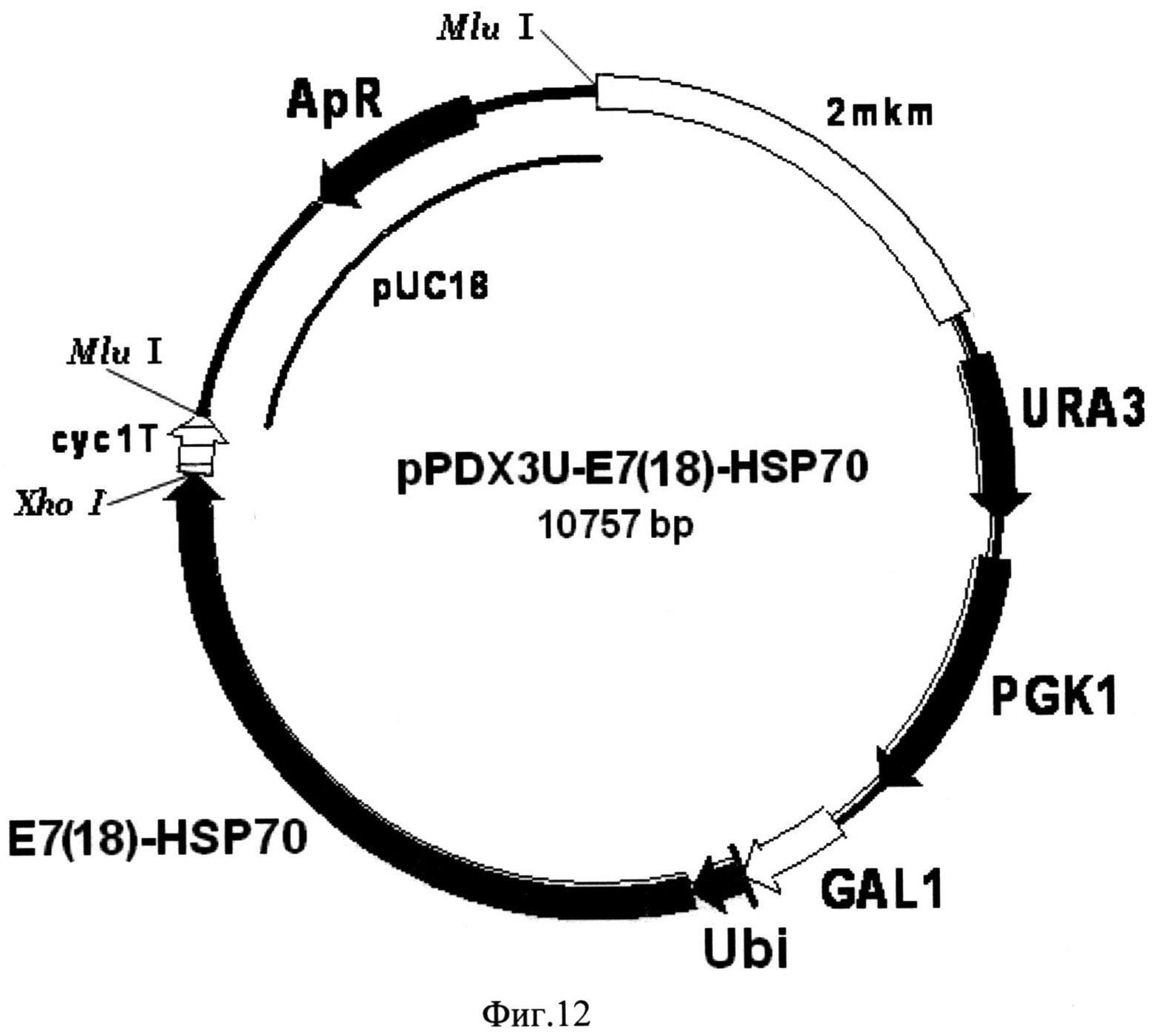
Фиг. 12. Карта экспрессионной плазмиды pPDX3U-E7(18)-HSP70. Бирепликонная плазмида pPDX3U-E7(18)-HSP70 содержит структурный ген рекомбинантного белка E7(18)-HSP70 (E7(18)-HSP70), включающего в свой состав последовательности онкобелка Е7 вируса папилломы человека серотипа-18 и белка теплового шока Hsp70 Mycobacterium tuberculosis, 16 С-концевых аминокислотных остатков которого замещены на искусственную последовательность, включающую 6 остатков гистидина, слитый в одной рамке считывания с последовательностью, кодирующей убиквитин (Ubi) дрожжей S. cerevisiae, под контролем промотора GAL1 (GAL1). В состав вектора входят последовательности ДНК, кодирующие селективные маркеры URA3 (URA3) и PGK1 (PGK1) дрожжей S. cerevisiae, последовательность терминатора транскрипции гена CYC1 дрожжей S. cerevisiae (cyc1T), обеспечивающая терминацию транскрипции гена слитого белка, а также фрагмент 2-микронной эндогенной плазмиды дрожжей S. cerevisiae (2 mkm), обеспечивающий репликацию плазмиды pPDX3U-E7(18)-HSP70 в клетках дрожжей S. cerevisiae, и фрагмент плазмиды pUC18 (pUC18), содержащий ген бета-лактамазы (ApR) и ориджин репликации, и обеспечивающий селективную амплификацию вектора в клетках E. coli.
Пример 1. Способ микробиологического синтеза гибридного белка E7(6)-HSP70
Разработка структуры синтетического гена и синтез гена белка Е7 серотипа 6.
Синтетический ген кодирует белок, идентичный прототипу белка Е7 вируса папилломы человека серотипа 6 (GenBank, Р06464). В структуре гена используются кодоны, наиболее часто используемые в высокоэкспрессируемых генах дрожжей Saccharomyces cerevisiae и Pichia pastoris. Для облегчения последующих стадий
клонирования в составе вектора экспрессии структурный ген белка Е7(6) фланкирован сайтами рестрикции BglII и BamHI.
Конструирование фрагмента ДНК, кодирующего белок E7-Hsp70 типа 6
ДНК ранее сконструированной плазмиды pUC19MX-E7-HSP70 [RU 2489481] расщепляют по уникальным концевым сайтам BglII и BamH1. Уникальный BglII/BamH1 фрагмент ДНК, заключающий последовательность структурного гена белка Е7 ВПЧ-11 вируса папилломы человека серотипа 11, замещают на синтетический BglII/BamH1 фрагмент ДНК, заключающий последовательность структурного гена белка Е7 ВПЧ-6 папилломы человека серотипа 6. В результате получают плазмиду pUC19MX-E7(6)-HSP70. Полученная плазмида pUC19MX-E7(6)-HSP70 содержит ген рекомбинантного белка E7(6)-HSP70, состоящего из онкобелка Е7 ВПЧ 6-ого типа и белка теплового шока Hsp70 из М. tuberculosis, содержащего на С-конце взамен 16 С-концевых аминокислотных остатков природного белка Hsp70 аминокислотную последовательность, включающую 6 остатков гистидина.
Конструирование экспрессионного вектора рРDХ3-GAL1U
Конструирование проводят с использованием лабораторного вектора pPDX3. Вектор pPDX3 отличается от вектора pPDX2 [RU 2010123696] тем, что включает вариант структурного гена URA3, содержащий мутацию в последовательности сайта Ncol (ccatgg изменен на ccatga), не приводящую к инактивации гена URA3. Конструирование проводят следующим образом.
Структурный ген убиквитина дрожжей амплифицируют в реакции ПЦР с использованием в качестве матрицы хромосомной ДНК лабораторного штамма S. cerevisiae Y618(1), выделяемой по методу Сидорука(2). Праймерами для ПЦР-амплификации служат N513-A (5′-ggagaaaaaactaccatgcagatcttcgtcaag) и N514 (5′-actggatccacctcttagccttagcacaac). Амплифицируют фрагмент ДНК плазмиды pUC18x-GAL1, заключающий нуклеотидную последовательность промотора гена GALl дрожжей S.cerevisiae. Праймерами для ПЦР-амплификации служат N168 (5′-gccagggttttcccagtcacga) и N513-B (5′-cttgacgaagatctgcatggtagttttttctcc). Амплифицированные фрагменты ДНК смешивают и лигируют в реакции ПЦР с использованием праймеров N168 и N514. Результирующий фрагмент ДНК элюируют из агарозного геля с использованием кита Qiagen (Qiagen, cat-No 28706), обрабатывают рестриктазами HindIII и XhoI и клонируют в расщепленном по тем же сайтам лабораторном векторе pPDX3.
В результате клонирования получают экспрессионный вектор pPDX3-GAL1U, ДНК которого содержит нуклеотидную последовательность, кодирующую убиквитин дрожжей S.cerevisiae, слитую с нуклеотидной последовательностью промоторной области гена GAL1 дрожжей S.cerevisiae.
Конструирование экспрессионного вектора pPDX3U-E7(6)-HSP70
BglII/XhoI фрагмент ДНК плазмиды pUC19MX-E7(6)-HSP70, заключающий
структурный ген белка E7(6)-HSP70, включающего аминокислотные последовательности онкобелка Е7 ВПЧ 6-ого типа и белка теплового шока Hsp70 М. tuberculosis, содержащего на С-конце последовательность, включающую 6 остатков гистидина, лигируют с ДНК экспрессионного вектора pPDX3-GAL1U, расщепленного по сайтам BamHI и XhoI.
В результате клонирования получают экспрессионный вектор pPDX3U-E7(6)-HSP70 (Фиг. 10), включающий последовательность структурного гена рекомбинантного белка E7(6)-HSP70, слитую с последовательностью гена убиквитина дрожжей S. cerevisiae под контролем промотора гена GAL1 дрожжей S.cerevisiae.
Конструирование штамма S.cerevisiae ВКПМ Y-3919
Штамм ВКПМ Y-3919, продуцент белка E7(6)-HSP70 получают в результате трансформации лабораторного штамма D702 [RU 2489481] экспрессионным вектором pPDX3U-E7(6)-HSP70. Для трансформации клетки штамма D702 подращивают в течение 18-24 часов при температуре 28°С на агаризованной среде YPGE, следующего состава в мас. %: бактопептон - 2, дрожжевой экстракт - 1, бактоагар - 2, этанол - 2, глицерин - 3, вода - остальное. Трансформацию выращенных клеток штамма D702 проводят по методу Ito (3). Трансформанты отбирают по способности расти на среде YPD следующего состава, в масс. %: бактопептон - 2, дрожжевой экстракт - 1, глюкоза - 2, бактоагар - 2, вода - остальное. Один из полученных трансформантов называют штаммом S.cerevisiae ВКПМ Y-3919.
Микробиологический синтез белка E7(6)-HSP70
Заявляемый способ реализован для штамма-продуцента S. cerevisiae SCR-702-E7 (6)-HSP70 (ВКПМ Y-3919) при культивировании в ферментере (Sartorius Biostat С30-3, Германия) в объеме среды 10 л. Культивирование ведут при температуре 26°С в ходе первой фазы и при температуре 21°С в ходе второй фазы, при концентрации растворенного кислорода 50-100% при скорости перемешивания 800 об/мин, уровне аэрации 10 л/мин. Во второй фазе культивирования рН поддерживают на уровне 5,7 титрованием 20%-ным раствором фосфорной кислоты и 12,5%-ным раствором аммиака. Инокулят в объеме 0,5 л выращивают до оптической плотности 15 о.е. (оптических единиц) и вносят в ферментер со стерильной питательной средой. В качестве стартового субстрата в среду вносят сахарозу до концентрации 30 г/л. После внесения инокулята в биореактор и установки значений контроллера производят мониторинг основных параметров роста культуры: ОД600, рН, морфология клеток, уровень растворенного кислорода, концентрация сахарозы в культуральной жидкости. Первые 10 часов роста клетки утилизируют сахарозу с образованием спирта (процесс брожения). Значение рН при этом снижается. Затем культуру клеток переключают на потребление спирта, рН растет. В этот же момент резко падает уровень рО2, идет процесс дыхания. Кривая рН принимает характерную S-образную форму. На выходе на плато, на 25 часу роста с началом второй фазы культивирования начинают рН-статирование на уровне 5,9, снижают температуру до значения 23°С и проводят экспоненциальную подпитку 50%-ным раствором сахарозы. Подпитку ведут так, чтобы концентрация сахарозы в культуральной жидкости не превышала 15 мг/л, при этом в культуре идет процесс дыхания, происходит автоиндукция экспрессии, но рост культуры не тормозится. На 59 часу роста оптическая плотность составляет 130 о.е., при этом скорость роста культуры падает до 0,01. На 60 час культивирование остановлено.
Для анализа уровня накопления растворимого гибридного белка E7(6)HSP70 биомассу штамма-продуцента суспендируют в лизирующем буфере с ингибиторами протеаз (1 мМ EDTA и 2 мМ PMSF) и разрушают путем дезинтеграции в гомогенизаторе Bullet Blender (Next Advance, США) с использованием стеклянных шариков диаметром 500 мкм при 12000 об/мин в течение 5 мин при +4°C. Лизаты дрожжевых клеток анализируют методом электрофореза в 8% ПААГ в присутствии додецилсульфата натрия по Лэммли. Анализ интенсивности полос на электрофореграммах проводят с использованием программного обеспечения Gene Tools (Syngene, Англия).
Продуктивность штамма S. cerevisiae SCR-702-E7(6)-HSP70 при культивировании составила 580 мг/л культуральной жидкости.
Пример 2. Способ микробиологического синтеза гибридного белка E7(11)-HSP70
Заявляемый способ реализован для штамма-продуцента & cerevisiae SCR-702-E7 (11)-HSP70 (ВКПМ Y-3853) при культивировании в ферментере (Sartorius Biostat С30-3, Германия) в объеме среды 12 л. Культивирование ведут при температуре 25°С в ходе первой фазы и при температуре 20°С в ходе второй фазы, при концентрации растворенного кислорода 40-100% при скорости перемешивания 800 об/мин, уровне аэрации 12 л/мин. Во второй фазе культивирования рН поддерживают на уровне 5,9 титрованием 20%-ным раствором фосфорной кислоты и 12,5%-ным раствором аммиака. Инокулят в объеме 0,6 л выращен до оптической плотности 15 о.е. и внесен в ферментер со стерильной питательной средой.
В качестве стартового субстрата в среду вносят сахарозу до концентрации 25 г/л. После внесения инокулята в биореактор и установки значений контроллера производят мониторинг основных параметров роста культуры: ОД600, рН, морфология клеток, уровень растворенного кислорода, концентрация сахарозы в культуральной жидкости. Первые 9,5 часов роста клетки утилизируют сахарозу до спирта в процессе брожения. Значение рН при этом падает. Затем культуру клеток переключают на потребление спирта, рН растет. В этот же момент резко падает уровень рO2, идет процесс дыхания. Кривая рН принимает характерную S-образную форму. На выходе на плато, на 24,5 часу роста с началом второй фазы культивирования, при этом проводят рН-статирование на уровне 5,7, снижают температуру до значения 23°С и начинают экспоненциальную подпитку 50%-ным раствором сахарозы. Подпитку ведут так, что концентрация сахарозы в культуральной жидкости не превышает 15 мг/л, в культуре идет процесс дыхания, происходит автоиндукция экспрессии, но рост культуры не тормозится. На 64 час роста оптическая плотность составляет 133 о.е., при этом скорость роста культуры - 0,01. На 65 часу процесс культивирования останавливают.
Для анализа уровня накопления растворимого гибридного белка E7(11)HSP70 биомассу штамма-продуцента суспендируют в лизирующем буфере с ингибиторами протеаз (1 мМ EDTA и 2 мМ PMSF), разрушают путем дезинтеграции в гомогенизаторе Bullet Blender (Next Advance, США) с использованием стеклянных шариков диаметром 500 мкм при 12000 об/мин в течение 5 мин при +4°C. Лизаты дрожжевых клеток анализируют методом электрофореза в 8% ПААГ в присутствии додецилсульфата натрия по Лэммли. Анализ интенсивности полос на электрофореграммах проводят с использованием программного обеспечения Gene Tools (Syngene, Англия).
В результате продуктивность штамма S. cerevisiae SCR-702-E7(11)-HSP70 составляет 630 мг/л культуральной жидкости.
Пример 3. Способ микробиологического синтеза гибридного белка E7(16)-HSP70
Разработка структуры синтетического гена и синтез гена белка Е7 серотипа 16.
Синтетический ген кодирует белок, идентичный прототипу белка Е7 вируса папилломы человека серотипа 16 (GenBank, Р03129). В структуре гена используются кодоны, наиболее часто используемые в высокоэкспрессируемых генах дрожжей Saccharomyces cerevisiae и Pichia pastoris. Для облегчения последующих стадий клонирования в составе вектора экспрессии структурный ген белка Е7(16) фланкирован сайтами рестрикции BglII и BamHI.
Конструирование фрагмента ДНК, кодирующего белок E7-Hsp70 типа 16
ДНК ранее сконструированной плазмиды pUC19MX-E7-HSP70 [RU 2489481] расщепляют по уникальным концевым сайтам BglII и BamHI. Уникальный BglII/BamHl фрагмент ДНК, заключающий последовательность структурного гена белка Е7 ВПЧ-11 вируса папилломы человека серотипа 11, замещают на синтетический BglII/BamH1 фрагмент ДНК, заключающий последовательность структурного гена белка Е7 ВПЧ-16 папилломы человека серотипа 16.
В результате получают плазмиду pUC19MX-E7(16)-HSP70.
Полученная плазмида pUC19MX-E7(16)-HSP70 содержит ген рекомбинантного белка E7(16)-HSP70, состоящего из онкобелка Е7 ВПЧ 16-ого типа и белка теплового шока Hsp70 из M.tuberculosis, содержащего на С-конце взамен 16 С-концевых аминокислотных остатков природного белка Hsp70 аминокислотную последовательность, включающую 6 остатков гистидина.
Конструирование экспрессионного вектора рРDХ3-GAL1U
Конструирование осуществляют таким же образом, как в Примере 1.
Конструирование экспрессионного вектора pPDX3U-E7(16)-HSP70
BglII/XhoI фрагмент ДНК плазмиды pUC19MX-E7(16)-HSP70, заключающий структурный ген белка E7(16)-HSP70, включающего аминокислотные последовательности онкобелка Е7 ВПЧ 16-ого типа и белка теплового шока Hsp70 M.tuberculosis, содержащего на С-конце последовательность, включающую 6 остатков гистидина, лигируют с ДНК экспрессионного вектора pPDX3-GAL1U, расщепленного по сайтам BamHI и XhoI.
В результате клонирования получают экспрессионный вектор pPDX3U-E7(16)-HSP70
(Фиг. 11), включающий последовательность структурного гена рекомбинантного белка E7(16)-HSP70, слитую с последовательностью гена убиквитина дрожжей S. cerevisiae под контролем промотора гена GAL1 дрожжей S. cerevisiae.
Конструирование штамма S.cerevisiae ВКПМ Y-4057
Штамм ВКПМ Y-4057, продуцент белка E7(16)-HSP70 получают в результате трансформации лабораторного штамма D702 [RU 2489481] экспрессионным вектором pPDX3U-E7(16)-HSP70. Для трансформации клетки штамма D702 подращивают в течение 18-24 часов при температуре 28°С на агаризованной среде YPGE, следующего состава в мас. %: бактопептон - 2, дрожжевой экстракт - 1, бактоагар - 2, этанол - 2, глицерин - 3, вода - остальное. Трансформацию выращенных клеток штамма D702 проводят по методу Ito (3). Трансформанты отбирают по способности расти на среде YPD следующего состава, в мас.%: бактопептон - 2, дрожжевой экстракт - 1, глюкоза - 2, бактоагар - 2, вода - остальное. Один из полученных трансформантов называют штаммом S.cerevisiae ВКПМ Y-4057.
Микробиологический синтез белка E7(16)-HSP70
Заявляемый способ реализован для штамма-продуцента S. cerevisiae SCR-702-E7 (16)-HSP70 (ВКПМ Y-4057) при культивировании в ферментере (Sartorius Biostat С30-3, Германия) в объеме среды 10 л. Культивирование ведут при температуре 26°С в ходе первой фазы и при температуре 21°С в ходе второй фазы, при концентрации растворенного кислорода 50-100% при скорости перемешивания 800 об/мин, уровне аэрации 10 л/мин. Во второй фазе культивирования рН поддерживают на уровне 5,9 титрованием 20%-ным раствором фосфорной кислоты и 12,5%-ным раствором аммиака. Инокулят в объеме 0,5 л выращен до оптической плотности 13,5 о.е. и внесен в ферментер со стерильной питательной средой. В качестве стартового субстрата в среду внесят сахарозу до концентрации 27 г/л. После внесения инокулята в биореактор и установки значений контроллера производят мониторинг основных параметров роста культуры: ОД600, рН, морфология клеток, уровень растворенного кислорода, концентрация сахарозы в культуральной жидкости. Первые 10 часов роста клетки утилизируют сахарозу до спирта (процесс брожения). Уровень рН падает. Затем культуру клеток переключают на потребление спирта, уровень рН растет. В этот же момент происходит резкое падение уровня рO2, (начало процесса дыхания). Кривая рН принимает характерную S-образную форму. На выходе на плато, с 25 часа роста идет вторая фаза культивирования, при этом проводят рН-статирование на уровне 5,9, снижают температуру до значения 23°С и начинают экспоненциальную подпитку 50%-ным раствором сахарозы так, чтобы концентрация сахарозы в культуральной жидкости не превышала 15 мг/л. При таких условиях в культуре идет процесс дыхания, происходит автоиндукция экспрессии, а рост культуры не тормозится. На 58 час роста оптическая плотность составляет 135 о.е., а скорость роста культуры - 0,01. На 60 часу культивирование остановливают.
Для анализа уровня накопления растворимого гибридного белка E7(16)HSP70 биомассу штамма-продуцента суспендируют в лизирующем буфере с ингибиторами протеаз (1 мМ EDTA и 2 мМ PMSF), разрушают путем дезинтеграции в гомогенизаторе Bullet Blender (Next Advance, США) с использованием стеклянных шариков диаметром 500 мкм при 12000 об/мин в течение 5 мин при +4°C. Лизаты дрожжевых клеток анализируют методом электрофореза в 8% ПААГ в присутствии додецилсульфата натрия по Лэммли. Анализ интенсивности полос на электрофореграммах проводят с использованием программного обеспечения Gene Tools (Syngene, Англия).
Продуктивность штамма S.cerevisiae SCR-702-E7(16)-HSP70 при культивировании составляет 645 мг/л культуральной жидкости.
Пример 4. Способ микробиологического синтеза гибридного белка E7(18)-HSP70
Разработка структуры синтетического гена и синтез гена белка Е7 серотипа 18.
Синтетический ген кодирует белок, идентичный прототипу белка Е7 вируса папилломы человека серотипа 18 (GenBank, P06788). В структуре гена используются кодоны, наиболее часто используемые в высокоэкспрессируемых генах дрожжей Saccharomyces cerevisiae и Pichia pastoris. Для облегчения последующих стадий клонирования в составе вектора экспрессии структурный ген белка Е7(18) фланкирован сайтами рестрикции BglII и BamHI.
Конструирование фрагмента ДНК, кодирующего белок E7-Hsp70 типа 18
ДНК ранее сконструированной плазмиды pUC19MX-E7-HSP70 [RU 2489481] расщепляют по уникальным концевым сайтам BglII и BamHI. Уникальный BglII/BamHI фрагмент ДНК, заключающий последовательность структурного гена белка Е7 ВПЧ-11 вируса папилломы человека серотипа 11, замещают на синтетический BglII/BamHI фрагмент ДНК, заключающий последовательность структурного гена белка Е7 ВПЧ-18 папилломы человека серотипа 18.
В результате получают плазмиду рUС19МХ-Е7(18)-Н8Р70.
Полученная плазмида pUC19MX-E7(18)-HSP70 содержит ген рекомбинантного белка E7(18)-HSP70, состоящего из онкобелка Е7 ВПЧ 18-ого типа и белка теплового шока Hsp70 из М. tuberculosis, содержащего на С-конце взамен 16 С-концевых аминокислотных остатков природного белка Hsp70 аминокислотную последовательность, включающую 6 остатков гистидина.
Конструирование экспрессионного вектора рРDХ3-GALlU
Конструирование осуществляют таким же образом, как в Примере 1.
Конструирование экспрессионного вектора pPDX3U-E7(18)-HSP70
BglII/XhoI фрагмент ДНК плазмиды pUC19MX-E7(18)-HSP70, заключающий структурный ген белка E7(18)-HSP70, включающего аминокислотные последовательности онкобелка Е7 ВПЧ 18-ого типа и белка теплового шока Hsp70 М. tuberculosis, содержащего на С-конце последовательность, включающую 6 остатков гистидина, лигируют с ДНК экспрессионного вектора pPDX3-GAL1U, расщепленного по сайтам BamHI и XhoI.
В результате клонирования получают экспрессионный вектор pPDX3U-E7(18)-HSP70
(Фиг. 12), включающий последовательность структурного гена рекомбинантного белка E7(18)-HSP70, слитую с последовательностью гена убиквитина дрожжей S.cerevisiae под контролем промотора гена GAL1 дрожжей S.cerevisiae.
Конструирование штамма S.cerevisiae ВКПМ Y-4058
Штамм ВКПМ Y-4058, продуцент белка E7(18)-HSP70 получают в результате трансформации лабораторного штамма D702 [RU 2489481] экспрессионным вектором pPDX3U-E7(18)-HSP70. Для трансформации клетки штамма D702 подращивают в течение 18-24 часов при температуре 28°С на агаризованной среде YPGE, следующего состава в мас. %: бактопептон - 2, дрожжевой экстракт - 1, бактоагар - 2, этанол - 2, глицерин - 3, вода - остальное. Трансформацию выращенных клеток штамма D702 проводят по методу Ito (3). Трансформанты отбирают по способности расти на среде YPD следующего состава, в мас. %: бактопептон - 2, дрожжевой экстракт - 1, глюкоза - 2, бактоагар - 2, вода - остальное. Один из полученных трансформантов называют штаммом S.cerevisiae ВКПМ Y-4058.
Микробиологический синтез белка E7(18)-HSP70
Заявляемый способ реализован для штамма-продуцента S.cerevisiae SCR-702-E7 (18)-HSP70 (ВКПМ Y-4058) при культивировании в ферментере (Sartorius Biostat С30-3, Германия) в объеме среды 10 л. Культивирование ведут при температуре 26°С в ходе первой фазы и при температуре 20°С в ходе второй фазы, при концентрации растворенного кислорода 50-100% при скорости перемешивания 1000 об/мин, уровне аэрации 10 л/мин. Во второй фазе культивирования рН поддерживают на уровне 5,7 титрованием 20%-ным раствором фосфорной кислоты и 12,5%-ным раствором аммиака. Инокулят в объеме 0,5 л выращен до оптической плотности 13 о.е. и внесен в ферментер со стерильной питательной средой.
В качестве стартового субстрата в среду вносят сахарозу до концентрации 30 г/л. После внесения инокулята в биореактор и установки значений контроллера производят мониторинг основных параметров роста культуры: ОД600, рН, морфология клеток, уровень растворенного кислорода, концентрация сахарозы в культуральной жидкости. Первые 10 часов роста клетки утилизируют сахарозу до спирта (процесс брожения). Значение рН падает. Затем культуру переключают на потребление спирта, рН растет. В этот же момент происходит резкое падение уровня рO2, идет процесс дыхания. Кривая рН принимает характерную S-образную форму. На выходе на плато, с 24,5 часа роста идет вторая фаза культивирования, при этом проводят рН-статирование на уровне 5,8, снижают температуру до значения 23°С и начинают экспоненциальную подпитку 50%-ным раствором сахарозы так, чтобы концентрация сахарозы в культуральной жидкости не превышала 15 мг/л. При таких условиях в культуре идет процесс дыхания, происходит автоиндукция экспрессии, но рост культуры не тормозится. На 58 час роста оптическая плотность составляет 126,5 о.е., а скорость роста культуры - 0,01. На 60 часу культивирование остановливают.
Для анализа уровня накопления растворимого гибридного белка E7(18)HSP70 биомассу штамма-продуцента суспендируют в лизирующем буфере с ингибиторами протеаз (1 мМ EDTA и 2 мМ PMSF), разрушают дезинтеграцией в гомогенизаторе Bullet Blender (Next Advance, США) с использованием стеклянных шариков диаметром 500 мкм при 12000 об/мин в течение 5 мин при +4°C. Лизаты дрожжевых клеток анализируют методом электрофореза в 8% ПААГ в присутствии додецилсульфата натрия по Лэммли. Анализ интенсивности полос на электрофореграммах проводят с использованием программного обеспечения Gene Tools (Syngene, Англия).
Продуктивность штамма S.cerevisiae SCR-702-E7(18)-HSP70 составляет 550 мг/л культуральной жидкости.
Таким образом, заявляемый способ микробиологического синтеза гибридного белка белка E7(6)-HSP70 или E7(l 1)-HSP70 или E716)-HSP70 или E7(18)-HSP70:
- позволяет синтезировать гибридные белки E7(6)-HSP70, E7(11)-HSP70, E7(16)-HSP70 и E7(18)-HSP70 в количестве не менее 550 мг/л, что превосходит уровень синтеза гибридного белка E7(11)-HSP70 в ближайшем аналоге более, чем в 5 раз;
- позволяет осуществить процесс микробиологического синтеза гибридных белков E7(6)-HSP70, E7(11)-HSP70, E7(16)-HSP70 или E7(18)-HSP70 в течение не более 65 часов, что на 7 часов меньше, чем время необходимое для синтеза гибридного белка Е7(11)-HSP70 в ближайшем аналоге.
Источники научно-технической информации
1. Kartashova N.N., Kuchin S.V., Benevolensky S.V. (1996). Genetic aspects of carbon catabolite repression of the STA2 glucoamylase gene in Saccharomyces cerevisiae. Yeast 12: 1297-13.
2. Сидорук К.В., Левитан Е.И. (2008). Универсальный метод выделения высокомолекулярной ДНК из микроорганизмов, основанный на предварительной обработке биомассы раствором ацетата аммония. Сборник тезисов и докладов "Актуальные вопросы генетики, радиобиологии и радиоэкологии: вторые чтения, посвященные памяти В.И. Корогодина и В.А. Шевченко", Дубна: ОИЯИ, 2008, стр.100.
3. Ito, H., et al., Transformation of intact cells treated with alkali cations. J. Bacteriol., 153, 163-8(1983).