Результат интеллектуальной деятельности: СПОСОБ ДИАГНОСТИКИ АПОПТОЗА ЛИМФОЦИТОВ
Вид РИД
Изобретение
Известны способы диагностики апоптоза лимфоцитов при активации прооксидантной и антиоксидантной активности путем определения роста общего содержания SH-групп белков [Microtubule dynamics and glutathione metabolism in phagocytizing human polymorphonuclear leukocytes / B.R. Burchill, J.M. Oliver, С.B. Pearson et al. // J. of Cell Biology. - 1978. - Vol.76, №2. - P. 439-447.], но данная методика не позволяет оценить уровень восстановленного глутатиона, а следовательно, оценить эффективность диагностики апоптоза. Известен также способ косвенного определения содержания восстановленного глутатиона по активности глутатионпероксидазы [Медицинские лабораторные технологии: В 2-х томах/ Под ред. А.И. Карпищенко - Т. 2 / А.И. Карпищенко. - СПб.: Интермедика. - 1999. - 656 с.], однако активность этого фермента зависит от конформации активного центра фермента. При изменении конформации активного центра фермента его активность меняется, что не позволяет с высокой точностью оценить уровень восстановленного глутатиона, а, следовательно, диагностировать апоптоз. Известен также способ косвенного определения концентрации восстановленного глутатиона по активности глутатионредуктазы [Медицинские лабораторные технологии: В 2-х томах/ Под ред. А.И. Карпищенко - Т. 2 / А.И. Карпищенко. - СПб.: Интермедика. - 1999. - 656 с.], однако активность этого фермента зависит от конформации активного центра фермента. При изменении конформации активного центра фермента его активность меняется, что не позволяет достоверно в любой ситуации оценить с высокой точностью уровень восстановленного глутатиона, а следовательно, диагностировать апоптоз.
Известен также способ диагностики функционирования лимфоцитов в норме и при апоптозе по содержанию восстановленного глутатиона, предложенный М.Е. Anderson (1985) в модификации S. Kojima et al. (2004) [Low dose gamma-rays activate immune functions via induction of glutathione and delay tumor growth / S. Kojima, K. Nakayama, H. Ishida // J. Radiat. Res. - 2004. - Vol.45, №1. - P. 33-39.], основаный на взаимодействии восстановленного глутатиона (GSH) с 5,5′-дитио-бис(2-нитробензойной) кислотой (ДТНБ). При этом образуется окисленный глутатион (GSSG), который затем восстанавливается и вновь взаимодействует с ДТНБ. Данный способ является наиболее близким к предлагаемому по технической сущности и достигаемому результату и выбран в качестве прототипа.
Целью предлагаемого изобретения является повышение эффективности и точности способа.
Указанная цель достигается путем выделения клеток, инкубации клеток 48 часов при температуре 37°C и 5% содержании СО2 с добавлением индуктора апоптоза дексаметазона в концентрации 10-4 моль/мл, количественным определением жизнеспособности лимфоцитов по включению трипанового синего, обработки клеток 0,5 мМ перекисью водорода и биохимическим определением концентрации белок-связанного, восстановленного и окисленного глутатиона в лизате лимфоцитов. Новым в данном способе является внесение в инкубационную среду 0,5 мМ гидроксида водорода, без которого невозможна стимуляция антиоксидантной активности и последующая диагностика апоптоза.
Следовательно, только комплексная модернизация способа-прототипа позволяет получить желаемый результат. Только комплексное определение трех форм глутатиона позволяет диагностировать апоптоз, а именно диагностировать апоптоз при росте уровня белково-связанного глутатиона на 5% и менее, восстановленного глутатиона на 7% и менее и окисленного глутатиона на 18% и более.
Антиоксидантная система направлена на эффективную нейтрализацию гидроксирадикалов и снижение токсичной для организма гидроперекиси. Гидроксильный радикал (·ОН) участвует в микробицидном и цитотоксическом действии нейтрофилов, моноцитов и Т-лимфоцитов и других клеток [Окислительный стресс. Прооксиданты и антиоксиданты / Е.Б. Меньщикова, В.З. Ланкин, Н.К. Зенков и соавт. - М.: Слово. -2006. - 556 с.]. Есть два основных механизма синтеза ·OH нейтрофилами: первый - образование из пероксида водорода в присутствии металлов переменной валентности в так называемой «реакции Фентона»: Fe2++Н2О2→Fe3++·ОН+ОН- [Лущак В.И. Окислительный стресс и механизмы защиты от него у бактерий / В.И. Лущак // Биохимия. - 2001. - Т. 66, вып. 5. - С.592-609.], второй - в ходе ряда реакций с участием гипогалоидов: 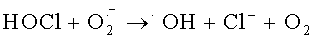 или взаимодействие гипохлорита с ионами Fe2+[Spin trapping evidence for myeloperoxidase-dependent hydroxyl radical formation by human neutrophils and monocytes // C.L. Ramos, S. Pou, В.E. Britigan et al. // J. Biol. Chem. - 1992. - Vol.267. - P. 8307-8312; Candeias, L.P. Formation of hydroxyl radicals on reaction of hypochlorous acid with ferrocyanide, a model iron (II) complex / L.P. Candeias, M.R.L. Stratford, P. Wardman // Free Radical Res. - 1994. - Vol.20. - P. 241-249.]. Следовательно, если в клетке нет металлов переменной валентности в свободном состоянии, для нее реакция Фентона и подобные реакции не будут опасными.
или взаимодействие гипохлорита с ионами Fe2+[Spin trapping evidence for myeloperoxidase-dependent hydroxyl radical formation by human neutrophils and monocytes // C.L. Ramos, S. Pou, В.E. Britigan et al. // J. Biol. Chem. - 1992. - Vol.267. - P. 8307-8312; Candeias, L.P. Formation of hydroxyl radicals on reaction of hypochlorous acid with ferrocyanide, a model iron (II) complex / L.P. Candeias, M.R.L. Stratford, P. Wardman // Free Radical Res. - 1994. - Vol.20. - P. 241-249.]. Следовательно, если в клетке нет металлов переменной валентности в свободном состоянии, для нее реакция Фентона и подобные реакции не будут опасными.
В клетках предусмотрен ряд защитных реакций по блокированию свободных ионов Fe2+ и Cu+. Например, активированные клетки синтезируют лактоферрин, связывающий свободное железо и переводящий его в каталитически неактивную форму, а также продуцируют высокие концентрации таурина, конъюгирующего с гипохлоритом и защищающего клетку от его токсичных эффектов [Taurine chloramines, a product of activated netrophils, inhibits in vitro the genetation of nitric oxide and other macrofage inflammatory mediators / J. Marcinkiewiez, A. Grabowska, J. Bereta et al. // J. Leukocyte Biol. - 1995. - Vol.58. - P.667-674.].
Образование •ОН показано в ходе микросомального окисления, окисления арахидоновой кислоты, в реакциях с флавиновыми ферментами, убихиноном, пероксинитритом. В ряде исследований клеток in vitro получены свидетельства продукции •ОН данными клетками [Hydroxylation of salicylate by activated neutrophils / W.B. Davis, B.S. Mohammed, D.C. Mays et al. // Biochem Pharmacol. - 1989. - Vol.38. - P.4013-4019.]. Однако изучение этих реакций зачастую основывалось на использовании ингибиторов и измерении уровня вторичных продуктов. Следовательно, реакции, приписанные •ОН, могли быть вызваны другими оксидантами, в частности O2 •- или гипохлорной кислотой [Do human neutrophils form hydroxyl radical. Evaluation of an unresolved controversy / M.S. Cohen, B.E. Britigan, D.J. Hassett et al. // Free Radic Biol Med. - 1988. - Vol.5. - P.81-90.]. Ряд авторов считает, что in vitro за счет реакции Фентона клетки производят незначительные количества •ОН [Rosen, G.M. Free radicals and phagocytic cells / G.M. Rosen, S. Pou, C.L. Ramos // FASEB J. - 1995. - Vol.9. - P.200-211.].
Генерация •ОН стимулированными клетками в очаге воспаления может существенно лимитироваться отсутствием в среде ионов железа. Исследование реакции Фентона в клетках выявило, что блокирование ионов железа лактоферрином ингибирует непосредственно саму реакцию [Rosen, G.M. Free radicals and phagocytic cells / G.M. Rosen, S. Pou, C.L. Ramos // FASEB J. - 1995. - Vol.9. - P.200-211.], а утилизация H2O2 миелопероксидазой ограничивает реакцию, даже если железо доступно [Winterboum, С.С. Myeloperoxidase as an effective inhibitor of hydroxyl radical production: Implications for the oxidative reactions of neutrophils / C.C. Winterboum // J. Clin. Invest. - 1986. - Vol.78. - P.545-557.]. Хотя большинство биологических форм железа каталитически неактивно, показана способность клеток к продукции •ОН в присутствии трансферрина, подверженного протеолитической деградации [Phagocyte-derived free radicals stimulated by ingestion of ironrich Staphylococcus aureus: Aspin-trapping study / M.S. Cohen, B.E. Britigan, Y.S. Chai et al. // J. Infect Dis. - 1991. - Vol.163. - 819-826.], или железа в составе Pseudomonas aeruginosa, содержащего сидерофор пиохелин [Possible role of bacterial siderophores in inflammation-Iron bound to the pseudomonas siderophore pyochelin can function as a hydroxyl radical catalyst / T.J. Coffman, C.D. Cox, B.L. Edeker et al. / J. Clin. Invest. - 1990. - Vol.86. - P.1030-1038.]. Однако M.S. Cohen и соавторы обнаружили, что внутриклеточное железо не всегда доступно: в их экспериментах повышенного образования радикала •ОН не отмечалось, даже если клетки поглощали Staphylococcus aureus, который был преинкубирован с Fe2+ [Phagocyte-derived free radicals stimulated by ingestion of ironrich Staphylococcus aureus: Aspin-trapping study / M.S. Cohen, B.E. Britigan, Y.S. Chai et al. // J. Infect Dis. - 1991. - Vol.163. - 819-826.].
С помощью чувствительных спиновых меток обнаружена наработка гидроксил-радикала клетки in vitro в результате реакции HOCl и O2 •-, причем преобразованию в •ОН подверглась очень небольшая часть использованного клетками кислорода [Free hydroxyl radicals are formed on reaction between the neutrophilderived species superoxide and hypochlorous acid / L.P. Candeias, K.B. Patel, M.R. L. Stratford et al. // FEBS Lett. - 1993. - Vol.333. - P.151-159.]. Вопрос о том, достаточно ли такого количества •ОН, чтобы играть существенную роль в цитотоксичности, до сих пор остается открытым. Здесь необходимо учитывать, что гораздо большей бактерицидной способностью •ОН обладает в присутствии Cl [Radiation induced generation of chlorine derivatives in N2O-saturated phosphate buffered saline: Toxic effects on Escherichia coli cells / G. Czapski, S. Goldstein, N. Andom et al. // Free Radic. Biol. Med. - 1992. - Vol.12. - P.353-361.], вероятно, вследствие реакции между ними с образованием гипохлорита [Bactericidal potency of hydroxyl radical in physiological environments / R.G. Wolcott, B.S. Franks, D.M. Hannum et al. // J. Biol. Chem. - 1994. - Vol.269. - P.9721-9734.].
Гидроксильный радикал представляет собой один из наиболее реакционно-способных окислителей и может взаимодействовать почти с любой молекулой клетки. Он модифицирует дезоксирибозу и азотистые основания ДНК, окисляет молекулы белков, углеводов и липидов. Особенно активно •ОН в ходе реакций перекисного окисления липидов атакует фосфолипиды, содержащие в жирнокислотных радикалах ненасыщенные связи, что ведет к образованию гидроперекисей [Дубинина, E.E. Продукты метаболизма кислорода в функциональной активности клеток (жизнь и смерть, созидание и разрушение). Физиологические и клинико-биохимические аспекты / E.E. Дубинина. - СПб.: Медицинская пресса, 2006. - 400 с; Окислительный стресс. Прооксиданты и антиоксиданты / E.Б. Меньщикова, В.З. Ланкин, Н.К. Зенков и соавт. - M.: Слово. - 2006. - 556 с.]. Основным компонентом антиокидантной системы является восстановленная форма глутатиона.
Глутатион - трипептид (L-γ-глутамил-L-цистеилглицин) с молекулярной массой 307 Da занимает особое место среди SH-содержащих соединений. Наличие γ-глутамильной связи защищает трипептид от ферментативной деградации. В организме глутатион присутствует в двух формах: окисленной - GSSG и восстановленной - GSH, причем содержание GSH в клетках на несколько порядков выше, чем GSSG [Колесниченко Л.С., 1989; Wu G. et al., 2004; Смирнова Г.В., Октябрьский О.Н., 2005; Марри Р. и соавт., 2009]. По данным Р. Pietarinen-Runtti et al. (2000), концентрация GSH в клетках составляет около 5 нмоль/мг белка. Содержание глутатиона в сыворотке крови здоровых людей незначительно, поэтому клетки основную потребность в GSH обеспечивают путем нематричного синтеза [Wu G. et al., 2004] в ходе двух последовательных реакций, катализируемых γ-глутамилцистеин-синтетазой (КФ 6.3.2.2) и глутатион-синтетазой (КФ 6.3.2.3) [Кулинский В.И., 1990; Смирнова Г.В., Октябрьский О.Н., 2005; Марри Р. и соавт., 2009]. Лимитирующим звеном синтеза является образование γ-глутамилцистеина, зависящее от наличия L-цистеина и его способности окисляться в L-цистин [Зенков Н.К. и соавт., 2001]. В то же время недостаточность глутатион-синтетазы способствует развитию окислительных повреждений в нейтрофилах [Spielberg S.P. et al., 1979].
Глутатион при физиологических значениях pH имеет две анионные карбокси-группы, положительно заряженную аминогруппу и SH-группу цистеинового остатка, которая придает GSH свойства восстановителя и способность быстро обезвреживать свободные радикалы и АФК [Day R.M., 2005; Zhu Y., 2007; Circu C.L. et al., 2009]. Глутатин является типичным тиолом и, участвуя в одноэлектронных восстановительных реакциях, становится GS•, который димеризуется до GSSG, легко реагирующего со свободными SH-группами. Второй тип окислительно-восстановительных превращений с участием GSH - это реакции тиолдисульфидного обмена, которые известны как основной путь образования смешанных дисульфидов глутатиона с белками (белок-SSG) и играют роль в регуляции биологических процессов [Chai Y.C. et al., 1994]. В реакциях третьего типа происходит двухэлектронное окисление глутатиона с образованием интермедиата, который реагирует со второй молекулой GSH (получение GSSG) или иной молекулой (синтез смешанного дисульфида) [Смирнова Г.В., Октябрьский О.Н., 2005].
GSH является стабилизатором мембран [Биленко М.В, 1989; Udupi V., 1992; Trudel S. et al., 2009]. Он защищает клеточные структуры от высокотоксичного OCI - [Carr A.C., Winterboum С.С., 1997], при этом GSH превращается в глутатион-сульфонамид и дегидроглутатион [Harwood D.T. et al., 2006]. Связывая NO, глутатион образует токсичные для клетки нитрозильные комплексы. Моно-нитрозоглутатион может активировать апоптоз [Turpaev K.T. et al., 1997].
Не всегда восстановительного потенциала GSH достаточно для полной нейтрализации прооксидантов. Существует мнение, что взаимодействие GSH с органическими радикалами эффективно только в условиях удаления O2 •-, поэтому глутатион образует с супероксиддисмутазой своеобразную антиоксидантную систему, ибо в противном случае развиваются реакции образования H2O2 и GS• [Ланкин В.З. и соавт., 1997; Меньщикова Е.Б. и соавт., 2006]. В сочетании с витамином B12 глутатион, а также N-ацетилцистеин могут потенцировать прооксидантное и цитотоксическое действие на клетку [Соловьева М.Е. и соавт., 2007].
Основной антиоксидантный эффект GSH реализует посредством участия в работе ферментов. Глутатион выступает донором водорода при восстановлении H2O2 и перекисей липидов глутатион-пероксидазами и глутатион-S-трансферазами (ГТ) [Hirayama К., 1989; Sies H. et al., 1997; Кулинский В.И., 1990; Hayes J.D. et al., 2005; Зенков Н.К. и соавт., 2009; Liu G. et al., 2010]. Высокая активность глутатион-редуктазы и накопление GSH оказывает протекторный эффект в отношении альвеолярных макрофагов, инкубируемых с прооксидантами in vitro [Pietarinen P.К. 1995] и других клеток.
С изменением окислительно-восстановительного баланса сопряжено большое количество реакций, поэтому поддержание оптимального редокс-состояния цитозоля выступает важным условием нормальной жизнедеятельности клеток. Высокая концентрация глутатиона в цитоплазме, его редокс-активность и возможность поддержания в восстановленном состоянии делают систему GSH/GSSG важнейшим внутриклеточным редокс-буфером [Reed M.C. et al., 2008]. Концентрация GSH в клетке в 500-1000 раз превышает уровень НАДФН и других внутриклеточных редокс-систем, поэтому изменения соотношения GSH/GSSG прямо отражают изменения редокс-статуса клетки [Кулинский В.И., 2007; Asian M., Canatan D., 2008; Reed M.C., 2008]. Считают, что буферная емкость системы глутатиона защищает репликативную систему клетки, а дефицит GSH приводит к снижению синтеза ДНК и белков [Poot M., 1991; Ланкин В.З., 1997; Day R.M., Suzuki Y.J., 2005; Liu G. et al., 2010], а затем и к апоптозу. Следовательно, только комплексная оценка всех форм глутаиона позволяет диагностировать апоптоз.
Стимуляцию процессов перекисного окисления в клетках для последующей диагностики апоптоза проводили с помощью 0,5 мМ гидроксида водорода.
|
Для оценки клеточного ответа на воздействие пероксида водорода в изучаемых концентрациях проводили определение: содержания внутриклеточных активных форм кислорода (АФК) - методом проточной цитофлуориметрии, с помощью красителя с заблокированной флуоресценцией дихлорфлюоресцеина диацетата. Дихлорфлюоренцеин диацетат, изначально не флюоресцирующий, пассивно проникает внутрь клетки и под действием эстераз переходит в полярное соединение, неспособное диффундировать обратно из клетки. После реакции с H2O2 он превращается во флуоресцирующий метаболит. Количество аннексин-положительных клеток оценивается методом проточной цитофлуориметрии по способности аннексина V специфически связываться с фосфатидилсерином, экспрессированным на внешней стороне цитоплазматической мембраны апоптозных клеток, и количеству пропидий иодид-положительных клеток, оцениваемых по способности пропидия йодида (PI) проникать в поврежденные клетки и интерколировать с дефрагментированной ДНК при некрозе клетки.
Поддержание внутри клетки содержания на определенном уровне АФК важно для регуляции жизнедеятельности. Активные формы кислорода участвуют в реализации танатогенной программы посредством изменения редокс-регуляции экспрессии генов и проапоптотических белков.
Каждый вновь введенный в формулу изобретения признак выполняет функцию повышения точности и эффективности способа: дополнительная обработка 0,5 мМ гидроксидом водорода с последующим определением белково-связанного, восстановленного и окисленного глутатиона.
Роль антиоксидантной системы клетки заключается в снижении токсического эффекта свободных радикалов, в том числе и гидроперекисей липидов.
Антиоксидантную защиту обеспечивает широкий круг веществ, различных по происхождению, физико-химической природе и механизмам действия. Общим их свойством, по определению J.M. Gutteridge (1992), является способность, присутствуя в низких по сравнению с окисляемым субстратом концентрациях, существенно задерживать или ингибировать его окисление. Постоянное образование прооксидантов должно быть уравновешено их инактивацией, поэтому для поддержания гомеостаза необходима адекватная ситуации непрерывная регенерация антиоксидантной способности клеток [Зенков Н.К. и соавт., 2001; Blokhina О. et al., 2003].
Общепринятой номенклатуры антиоксидантов в настоящее время не существует, хотя ряд авторов [Dimascio Р., 1990; Kaira V. et al., 2001; Зайцев В.Г. и соавт., 2003] выделяет два класса: превентивные, снижающие скорость инициации цепной реакции окисления, и гасящие (прерывающие цепь), препятствующие развитию цепной реакции. К превентивным относят каталазу и пероксидазы, разрушающие ROOH, а также агенты, образующие хелатные комплексы с металлами переменной валентности, к прерывающим цепь - фенолы, ароматические амины. В условиях in vivo главными гасящими антиоксидантами являются: витамин Е, нейтрализующий ROO• в липидной фазе мембран [Jore D. et al., 1990; Hong J.H. et al., 2004], фермент СОД, улавливающий О2 •- в водной фазе клетки [Fridovich I., 1989; Dimascio Р., 1990; Ciurea D., 1992], и церулоплазмин - белок острой фазы, выполняющий антирадикальную функцию в крови [Maridund S.L., 1987; Atanasiu R-L. et al., 1998].
Более известно деление антиоксидантов на ферменты и соединения неферментативной природы. Последние в определенных концентрациях всегда присутствуют в липидной фазе мембран и водных средах организма и расходуются первыми при устранении проявлений окислительного стресса [Droge W., 2002; Blokhina 0., 2003]. Ферменты наиболее активно присоединяются к антиоксидантной защите (АОЗ) после включения механизмов индукции [Лущак В. И., 2001]. При возникновении окислительного стресса (ОС) расход антиоксидантов возрастает и меняется экспрессия генов, кодирующих белковые компоненты АОЗ [Дубинина Е.Е., 2006]. Между ферментами и неферментативными элементами АОЗ существует равновесие, причем последние при ряде патологических состояний организма могут выступать в качестве прооксидантов [Зенков Н.К. и др., 2001].
Главную роль среди неферментавных антиоксидантных систем защиты отводят глутатиону.
Функционирование клеток связано с уровнем белково-связанного глутатиона. Определение белково-связанного глутатиона основано на способности боргидрата натрия (NaBH4) высвобождать из связи с белками глутатион, который при взаимодействии с ДТНБ образует окрашенное соединение, а именно тио-2-нитробензойную кислоту, водный раствор которой имеет максимум поглощения при длине волны 412 нм [Burchill, B.R. Microtubule dynamics and glutathione metabolism in phagocytizing human polymorphonuclear leukocytes [Text] / B.R. Burchill, J.M. Oliver, C.B. Pearson et al. // J. of Cell Biology. - 1978. - Vol.76, №2. - P.439-447.].
В настоящее время крайне важно определить уровень белково-связанного, восстановленного и окисленного глутатиона для диагностики апоптоза.
Содержание восстановленного глутатиона определяют методом, предложенным М.Е. Anderson (1985) в модификации S. Kojima et al. (2004) [Kojima, S. Low dose gamma-rays activate immune functions via induction of glutathione and delay tumor growth / S. Kojima, K. Nakayama, H. Ishida // J. Radiat. Res. - 2004. - Vol.45, №1. - P.33-39.]. Принцип метода основан на взаимодействии GSH с 5,5'-дитио-бис(2-нитробензойной) кислотой (ДТНБ) с образованием тио-2-нитробензойной кислоты, водный раствор которой имеет максимум поглощения при длине волны 412 нм. При этом образуется GSSG, который восстанавливается глутатионредуктазой до GSH и вновь взаимодействует с ДТНБ. Скорость образования окрашенного продукта пропорциональна содержанию общего глутатиона. Для определения содержания GSSG пробы прединкубируются с блокатором SH-групп 2-винилпиридином («Wako», Япония), который необратимо связывает GSH, и, следовательно, скорость образования окрашенного продукта пропорциональна содержанию GSSG.
Лизат клеток готовят на 5% сульфосалициловой кислоте, которая осаждает белки, но не ингибирует активность глутатионредуктазы.
Концентрацию белка в клетках определяют методом [A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding / M.M. Bradford // Analyt. Biochem. - 1976. - Vol.7, №1, 2. - P.248-254.], основанным на взаимодействии Кумасси голубого G-250 с остатками аргинина и лизина в белках. Свободный краситель красного цвета (максимум поглощения 495 нм) при образовании комплекса с белком переходит в синюю форму (максимум поглощения 595 нм).
К 0,1 мл лизата клеток добавляют 1,0 мл раствора Кумасси голубого (100 мг красителя, 50 мл 96° этанола, 100 мл 85% H3PO4, H2O до 1,0 л), перемешивают, инкубируют 3 мин при комнатной температуре и измеряют оптическую плотность проб (длина волны 595 нм) против контроля, содержащего 0,1 мл воды и 1,0 мл раствора Кумасси голубого. Содержание белка рассчитывают по калибровочной кривой, построенной по разведениям стандартного раствора альбумина (1,0 мг/мл) и выражают в мг/мл.
Диагностика апоптоза с оценкой трех форм глутатиона необходима для анализа жизнеспособности клеток и тканей при их пересадке.
Все сказанное свидетельствует о крайней важности разработки способа диагностики апоптоза, а также для оценки токсического действия активных форм кислорода на культуру клеток.
Популярность указанного выше способа обоснована его высокой чувствительностью, простотой осуществления и достаточной адекватностью получаемых результатов, лежащих в основе определения концентрации трех форм глутатиона в среде инкубации клеток.
Существенные признаки, характеризующие изобретение, проявили в заявленной совокупности новые свойства, явным образом не вытекающие из уровня техники в данной области, и не являются очевидными для специалиста.
Идентичной совокупности признаков не обнаружено при изучении патентной и научной медицинской литературы.
Данное изобретение может быть использовано в медицинской практике для повышения эффективности и точности оценки диагностики апоптоза при различных заболеваниях. Таким образом, следует считать предлагаемое изобретение соответствующим условиям патентоспособности: «новизна», «изобретательский уровень», «промышленная применимость».
Метод основан на определении концентрации белок-связанного, восстановленного и окисленного глутатиона.
Способ осуществляется следующим образом поэтапно:
1. Выделение культуры клеток линии Jurkat.
Культивирование и исследование клеток на апоптоз проводилось в луночных планшетах (2,0×104 клеток на лунку) в питательной среде RPMI-1640 при инкубации 48 часов, температуре 37°С и 5% содержанием CO2 с добавлением минимальной концентрации индуктора апоптоза - синтетического глюкокортикоида дексаметазона ("KRCA", Словения), составлявшем 10-4 моль/мл. Затем проводилась оценка количества апоптотических клеток с использованием FITC - меченного аннексина V и пропидиума йодида (PI) методом проточной лазерной цитометрии, а также проводилось определение жизнеспособности клеток по включению трипанового синего. В контроле количество клеток в апоптозе составило 7,06 (6,00-8,71)%, а после инкубации 28,2 (25,1-31,4)% (четырехкратное увеличение)
2. Количественное определение численности жизнеспособных клеток с помощью окраски трипановым синим («Serva»,CLUA) микроскопическим методом.
Клетки ресуспендируют в 1 мл клеточной взвеси. Отбирают 100 мкл ресуспендированной клеточной суспензии и добавляют 100 мкл 0,1% раствора трипанового синего на физ. растворе, хорошо перемешивают и заполняют камеру Горяева. Предварительно к камере притирают покровное стекло так, чтобы появлялись радужные, ньютоновые кольца (только при этих условиях соблюдался правильный объем камеры). Каплю клеточной взвеси с красителем вносят под притертое покровное стекло. Подсчет клеток производят в 5-ти больших квадратах по диагонали камеры Горяеева. Расчет жизнеспособных клеток по содержанию «мертвых» клеток, окрашенных в синий цвет, производят по формуле:
А×106=(число клеток)/4
где, А - клеточность лимфоцитов крови.
Далее проводят обработку клеток 0,5 мМ гидроксида водорода (H2O2).
3. Биохимическое исследование белково-связанного, восстановленного и окисленного глутатиона.
Лизат лимфоцитов готовят на 5% сульфосалициловой кислоте, которая осаждает белки, но не ингибирует активность глутатионредуктазы. Количество общего глутатиона (GSH и GSSG) определяют в пробе, содержащей 0,1 М Na-фосфатный буфер (pH=7,5) с 1 мМ ЭДТА, 0,4 мМ НАДФН2, 0,3 мМ ДТНБ и 1 U/мл глутатионредуктазы («Wako», Япония). Окисленный глутатион определяют аналогичным способом в клеточном лизате после предварительной инкубации пробы в течение 30 мин с 10 мМ 2-винилпиридином. Расчет содержания общего и окисленного глутатиона производят с помощью калибровочных графиков, для построения которых используют растворы GSH и GSSG («MP», США) в концентрации от 3 до 100 мкМ, обработанные аналогично опытным пробам. Концентрацию GSH рассчитывают как разницу между концентрацией общего глутатиона и GSSG, выражая результат в нмоль/мг белка.
Определение белково-связанного глутатиона.
После инкубации клетки центрифугируют 5 минут при 4°C и 1500 об/мин для их осаждения. Удаляют супернатант. Добавляют 1 мл охлажденного PBS (рН 7,4). Ресуспендируют на вортексе. Центрифугируют 5 минут при 4°C и 1500 об/мин. Удаляют супернатант. Осадок клеток ресуспендируют в 1 мл 5% сульфосалициловой кислоты для получения клеточного лизата. Центрифугируют при 3000 об/мин 10 мин, 1,0 мл осадка белка инкубируют 1 ч при 50°C с 1,0 мл 1% NaBH4. Далее оставшийся белок осаждают добавлением 0,4 мл 30% ТХУ. Пробу инкубируют 15 мин при 50°C. Затем пробу охлаждают 5 мин (0°C). Центрифугируют 10 мин при 3000 об/мин. Супернатант смешивают с 2,5 мл PBS (рН 7,4) и добавляют 2,0 мл ацетона для полного окисления NaBH4. Перемешивают. Центрифугировают 10 мин при 3000 об/мин. Удаляют верхнюю фазу. К нижней фазе добавляют равный объем диэтилового эфира (для удаления ТХУ). Перемешивают. Центрифугируют 10 мин при 3000 об/мин. Затем снова удаляют верхнюю фазу. Далее процедуру отмывки пробы от ТХУ с помощью диэтилового эфира производят 4-кратно. Затем отбирают 0,1 мл жидкости (из нижней фазы) и смешивают с 0,4 мл 0,01 М фосфатного буфера (рН=7,0). В пробу добавляют 0,1 мл 0,4 мг/мл ДТНБ. Пробу спектрофотометрируют при 412 нм против контроля, содержащего воду вместо раствора осажденного белка.
Расчет производят с учетом коэффициента молярной экстинкции 13·103 М-1 см-1. Результаты определения концентрации белково-связанного глутатиона выражают в нмоль/мг белка.
Оценка способа диагностики апоптоза лимфоцитов по способу-прототипу и предлагаемому способу выполнялось 40 раз. Результаты исследования обработаны статистически с использованием пакета программ Stat Soft Statistica 6.0.
При проведении исследования по способу-прототипу уровень восстановленного глутатиона в среде инкубации лимфоцитов в норме составил 2.11±0.17 нмоль/мг белка, белково-связанного глутатиона 2.8±0.26 нмоль/мг белка, окисленного глутатиона 0.16±0.2 нмоль/мг белка, а при оценке по предлагаемому способу в случае эффективной диагностики апоптоза лимфоцитов уровень восстановленного глутатиона составил 1.96±0.2 нмоль/мг белка, белково-связанного глутатиона 2.5±0.21 нмоль/мг белка, окисленного глутатиона 0.21±0.4 нмоль/мг белка. При отсутствии апоптоза лимфоцитов уровен восстановленного глутатиона составил 2.6±0,2 нмоль/мг белка, белково-связанного глутатиона 3.4±0.3 нмоль/мг белка, окисленного глутатина 0.18±0.02 нмоль/мг белка (табл.2).
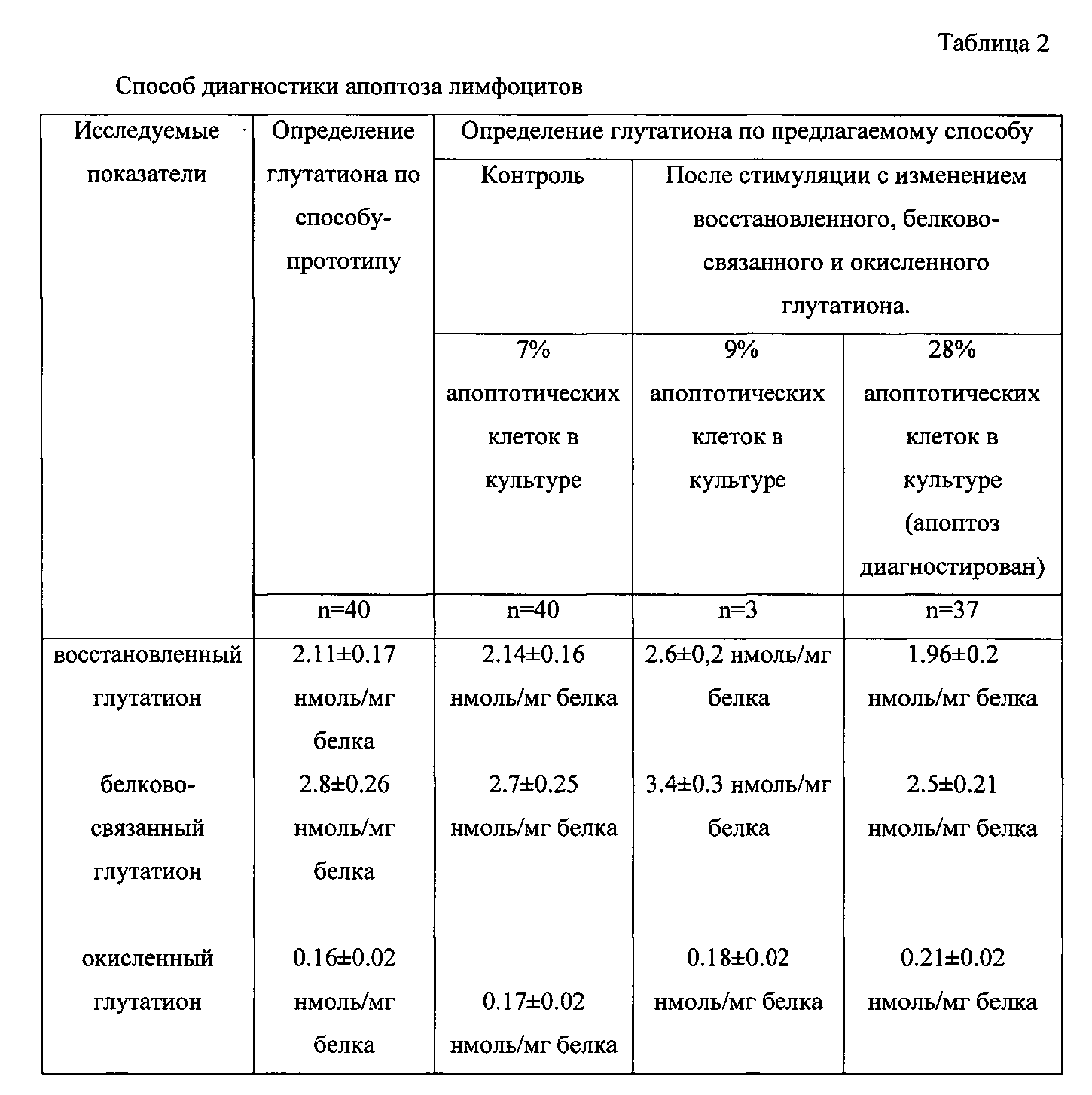
То есть при эффективной диагностике апоптоза лимфоцитов уровень восстановленного глутатиона возрастает на 7% и менее, белково-связанного глутатиона на 5% и менее, окисленного глутатиона на 18% и более. При отсутствии диагностики апоптоза лимфоцитов уровень восстановленного глутатиона увеличивается на 17% и более, белково-связаного глутатиона на 18% и более, окисленного глутатиона на 4% и менее.
Полученные результаты уровня глутатиона в среде инкубации лимфоцитов соответствуют данным литературы [Смирнова Г.В., Октябрьский О.Н., 2005].
Итак, при применении способа-прототипа был получен недостаточно точный результат, не позволивший диагностировать апоптоз лимфоцитов, что связано с отсутствием биохимической стимуляции процесса, а наиболее эффективным и точным был предлагаемый способ.
При этом предлагаемый способ прост в исполнении и интерпретации полученных результатов.
Способ диагностики апоптоза лимфоцитов, включающий этапы выделения клеток, инкубацию клеток 48 часов при температуре 37°С и с 5% содержанием СО, с добавлением индуктора апоптоза дексаметазона в концентрации 10 моль/мл, количественное определение жизнеспособности лимфоцитов по включению трипанового синего, обработку клеток 0,5 мМ перекисью водорода и биохимическое определение концентрации белок-связанного, восстановленного и окисленного глутатионов в лизате лимфоцитов и при росте концентрации белок-связанного глутатиона на 5% и менее, восстановленного глутатиона на 7% и менее и окисленного глутатиона на 18% и более диагностируют апоптоз лимфоцитов
