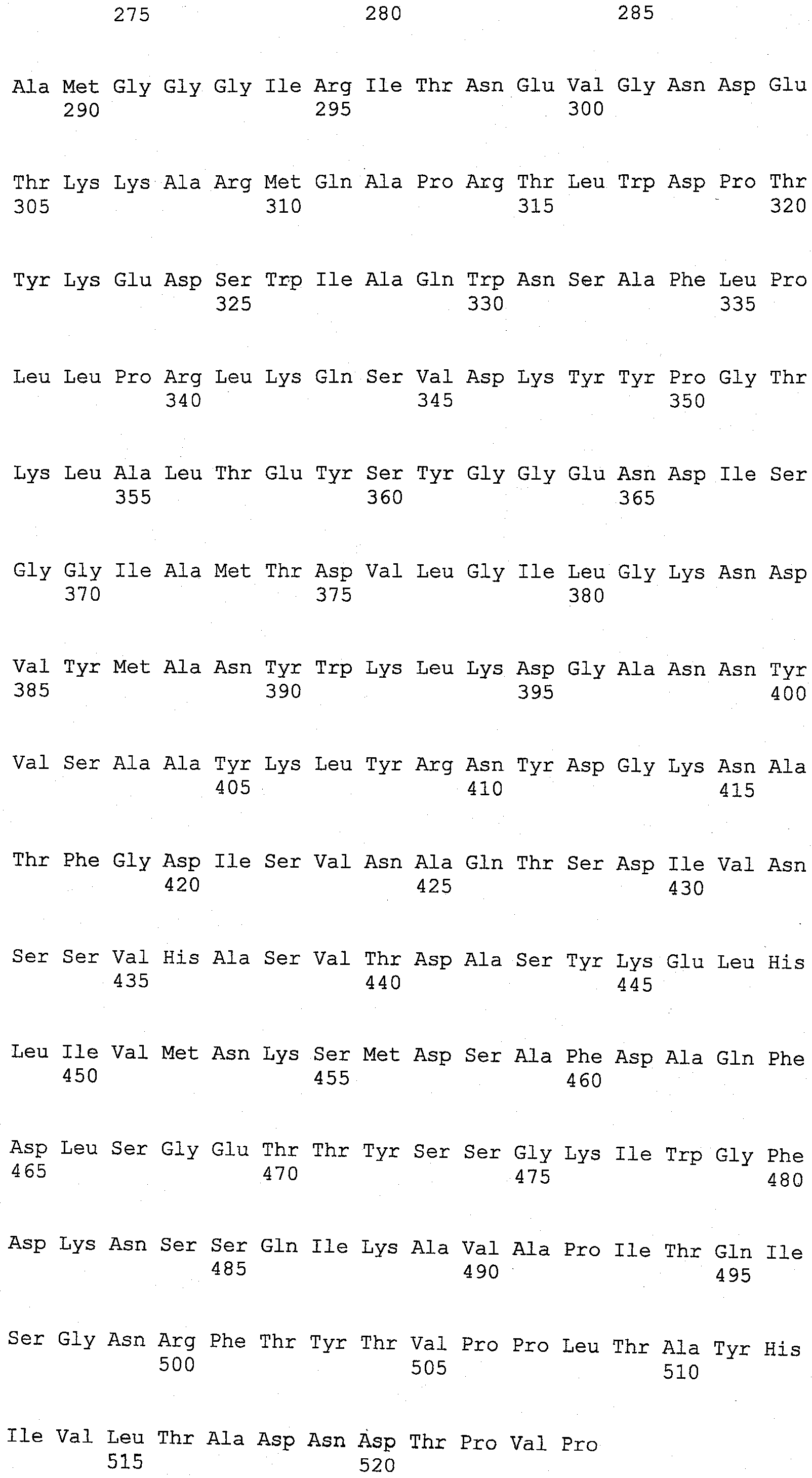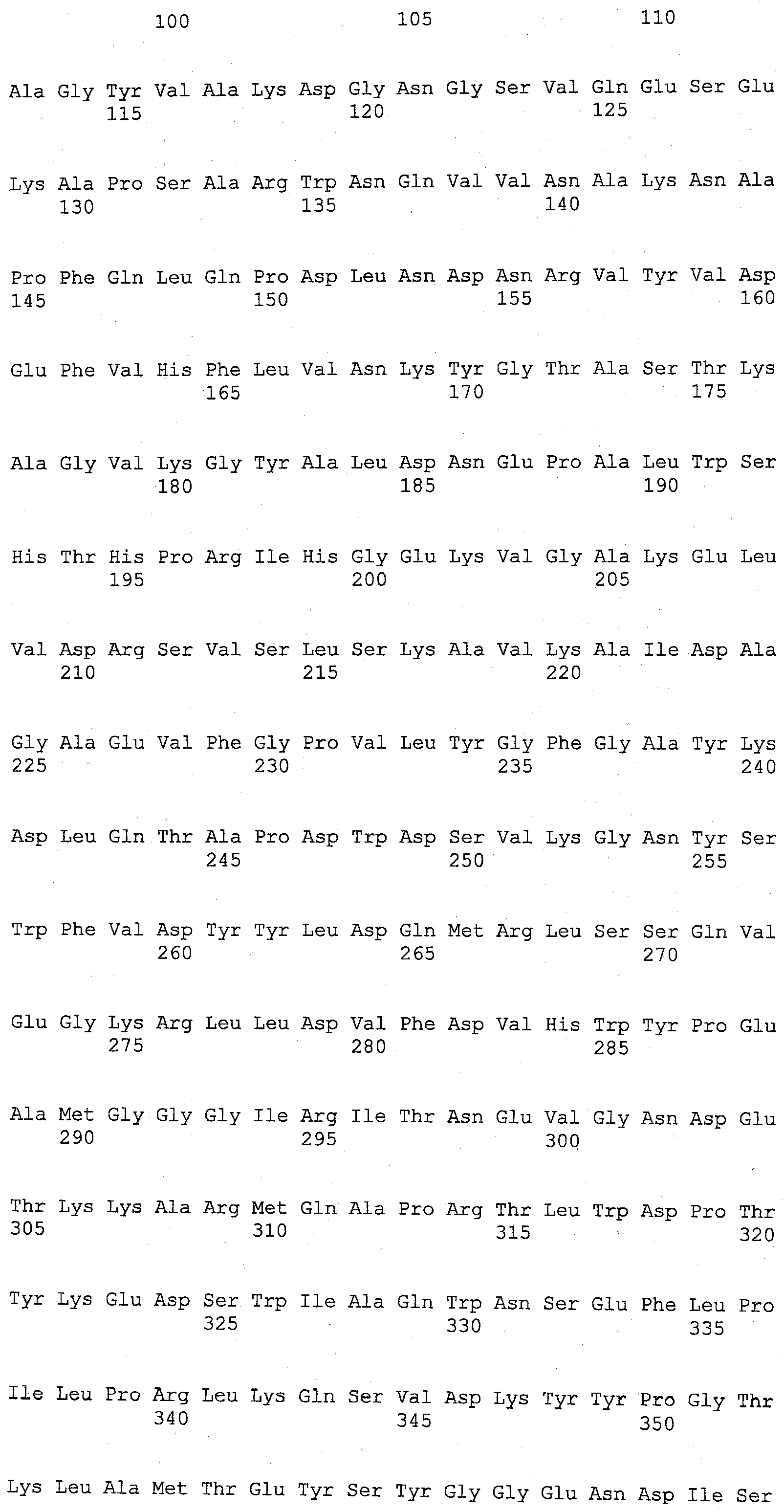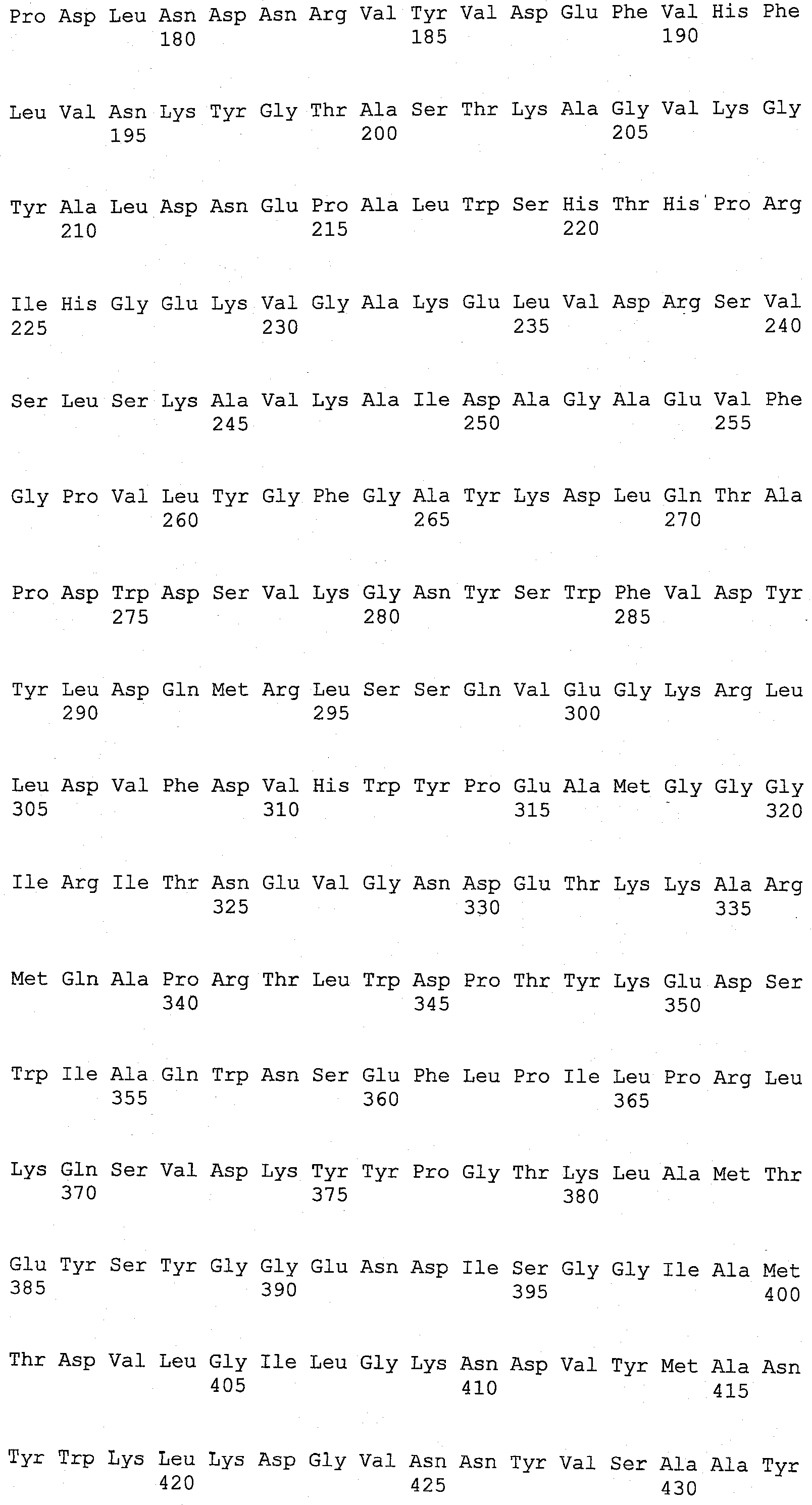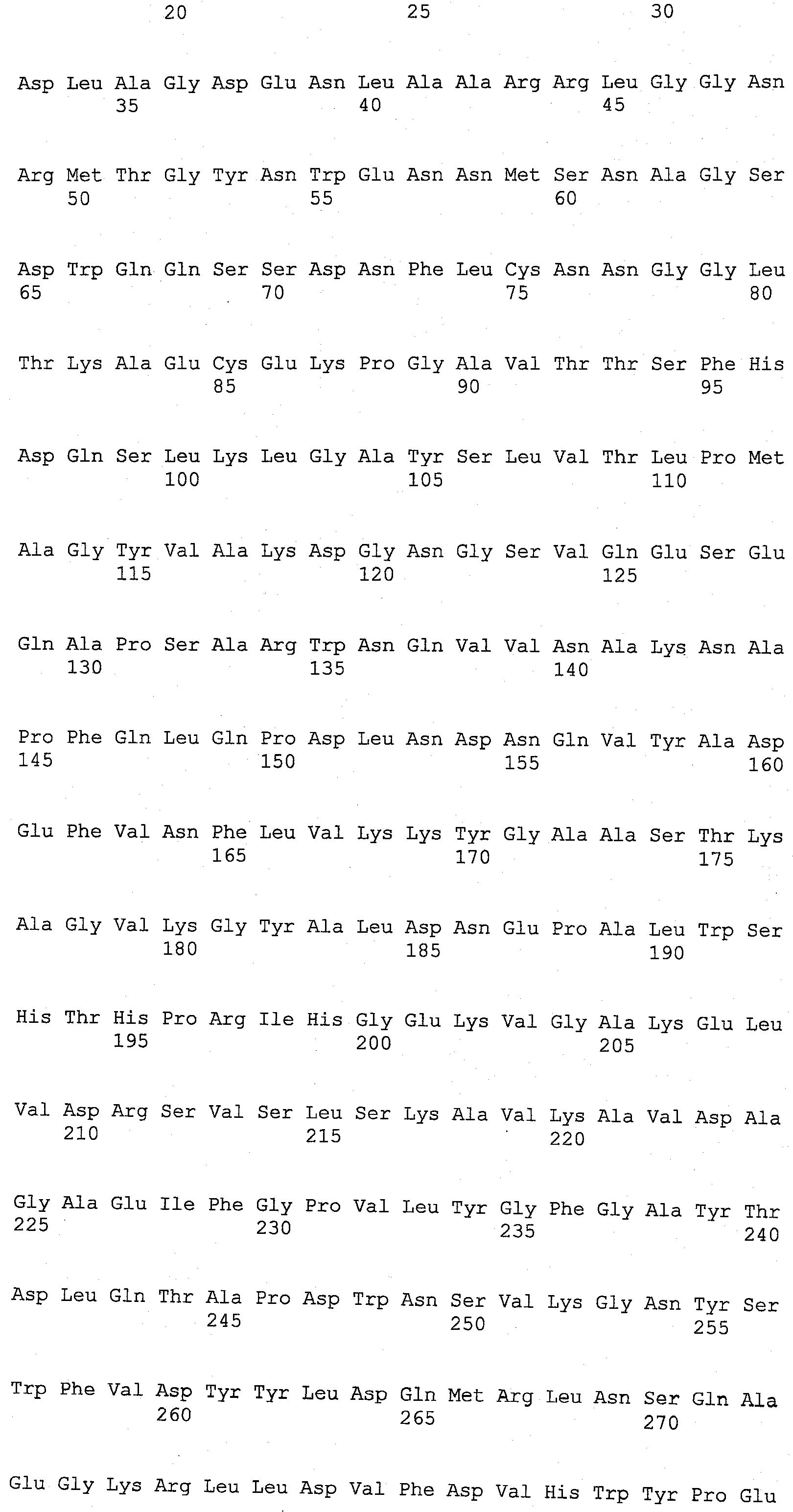Результат интеллектуальной деятельности: ВАРИАНТЫ СЕМЕЙСТВА, СОСТОЯЩЕГО ИЗ 44 КСИЛОГЛЮКАНАЗ
Вид РИД
Изобретение
Ссылка на список последовательностей
Настоящая заявка содержит список последовательностей в машиночитаемой форме. Машиночитаемая форма этого списка включена в настоящее описание посредством ссылки.
Область, к которой относится изобретения
Настоящее изобретение относится к вариантам ксилоглюканазы, принадлежащей к семейству, состоящему из 44 гликозилгидролаз, а также к полинуклеотидам, кодирующим эти варианты, и к способам получения этих вариантов.
Предшествующий уровень техники
Ксилоглюкан представляет собой основной структурный полисахарид, присутствующий в стенке первичных (растущих) клеток растений. По своей структуре ксилоглюканы состоят из целлюлозоподобного бета-1,4-связанного глюкозного остова, который, в большинстве случаев, бывает замещен различными боковыми цепями. Очевидно, что ксилоглюкан функционирует в стенке первичных клеток растений посредством перекрестно связывающихся микроволокон целлюлозы, образуя целлюлозо-ксилоглюкановую сетчатую структуру.
Ксилоглюканазы обладают способностью катализировать солюбилизацию ксилоглюкана с образованием ксилоглюкановых олигосахаридов. Некоторые ксилоглюканазы обладают только ксилоглюканазной активностью, а другие ксилоглюканазы обладают ксилоглюканазной и целлюлазной активностью. Ксилоглюканазам могут быть присвоены классификационные номера EC 3.2.1.4 или EC. 3.2.1.151. Ферменты с ксилоглюканазной активностью описаны, например, в работе Vincken et al. (1997) Carbohydrate Research 298(4):299-310, в которой охарактеризованы три различных эндоглюканазы Endol, EndoV и EndoVI Trichoderma viride (а также T. reesei). Эндоглюканазы Endol, EndoV и EndoVI принадлежат к семейству, состоящему из 5, 7 и 12 гликозилгидролаз соответственно, см. Henrissat B. (1991) Biochem. J. 280: 309-316, и Henrissat B. and Bairoch A. (1993) Biochem. J. 293: 781-788. В заявке WO 94/14953 описано семейство из 12 ксилоглюканаз (EG II), клонированных из грибов Aspergillus aculeatus. В заявке WO 99/02663 описано семейство, состоящее из 12 ксилоглюканаз, и семейство, состоящее из 5 ксилоглюканаз, клонированных из Bacillus licheniformis и Bacillus agaradhaerens соответственно. В заявке WO 01/062903 описано семейство из 44 ксилоглюканаз.
В частности, в заявках WO 99/02663 и WO 01/062903 высказывается предположение, что ксилоглюканазы могут быть использованы в детергентах.
Целью настоящего изобретения является получение вариантов ксилоглюканаз, принадлежащих к семейству из 44 гликозилгидролаз, которые, по сравнению с родительским ферментом, обладают улучшенными свойствами.
Описание сущности изобретения
Настоящее изобретение относится к выделенным вариантам родительской ксилоглюканазы, включающим модификации в одном или нескольких положениях, выбранных из группы, состоящей из положений 68, 123, 156, 118, 200, 129, 137, 193, 92, 83, 149, 34, 340, 332, 9, 76, 331, 310, 324, 498, 395, 366, 1, 374, 7, 140, 8, 14, 21, 211, 37, 45, 13, 78, 87, 436, 101, 104, 111, 306, 117, 119, 414, 139, 268, 142, 159, 164, 102, 168, 176, 180, 482, 183, 202, 206, 217, 4, 222, 19, 224, 228, 232, 2, 240, 244, 5, 247, 249, 328, 252, 259, 406, 267, 269, 275, 179, 166, 278, 281, 288, 298, 301, 18, 302, 165, 80, 303, 316, 169, 322, 120, 146, 342, 348, 147, 353, 380, 468, 382, 383, 38, 384, 389, 391, 10, 392, 396, 177, 397, 399, 409, 237, 413, 253, 415, 418, 40, 443, 445, 148, 449, 225, 450, 454, 3, 455, 456, 299, 461, 470, 204, 476, 488, 347 и 507, которые соответствуют положениям в аминокислотной последовательности SEQ ID NO:3, где указанная(ые) модификация(ии) независимо представляет(ют) собой
i) инсерцию аминокислоты, расположенной ниже аминокислоты, которая занимает указанное положение,
ii) делецию аминокислоты, которая занимает указанное положение, или
iii) замену аминокислоты, которая занимает указанное положение, другой аминокислотой; и
где родительская ксилоглюканаза принадлежит к семейству из 44 ксилоглюканаз, а указанный вариант обладает ксилоглюканазной активностью.
Настоящее изобретение также относится к выделенным полинуклеотидам, кодирующим варианты ксилоглюканаз или полипептидов, обладающих ксилоглюканазной активностью; к конструкциям нуклеиновых кислот; к векторам и к клеткам-хозяевам, содержащим указанные полинуклеотиды; а также к способам получения варианта родительской ксилоглюканазы или полипептида, обладающего ксилоглюканазной активностью.
Подробное описание изобретения
Настоящее изобретение относится к вариантам родительского фермента, принадлежащего к семейству из 44 ксилоглюканаз и содержащего модификацию, предпочтительно, в виде замены, и/или инсерции, и/или делеции в одном или нескольких положениях, где нумерация положения соответствует нумерации положений в SEQ ID NO: 3. Варианты согласно изобретению обладают ксилоглюканазной активностью и могут также обладать целлюлолитической активностью. Варианты согласно изобретению, в отличие от родительской ксилоглюканазы, обладают улучшенными свойствами. В одном из аспектов изобретения, указанные варианты обладают повышенной стабильностью в жидких детергентах, а, в частности в жидких моющих композициях для стирки.
Определения
Ксилоглюканазная активность: Термин «ксилоглюканазная активность» определяется в настоящем документе как фермент, катализирующий гидролиз ксилоглюкана. Эта реакция включает эндогидролиз 1,4-бета-D-глюкозидных связей в ксилоглюкане. В соответствии с настоящим изобретением, ксилоглюканазную активность определяют с использованием AZCL-ксилоглюкана (от Megazyme), который служит в качестве субстрата в ферментативной реакции. Такой анализ может быть проведен несколькими способами, например, как описано в примере 2 настоящей заявки или как описано в заявке WO 01/62903. Одна единица ксилоглюканазной активности (XyloU) определена с помощью аналитического метода, описанного в заявке WO 01/62903, на странице 60, строки 3-17.
Целлюлазная активность: Термин «целлюлазная активность» определяется в настоящем документе как фермент, катализирующий гидролиз 1,4-бета-D-глюкозидных связей в бета-1,4-глюкане (целлюлозе). В соответствии с настоящим изобретением, целлюлазную активность определяют с использованием AZCL-НЕ-целлюлозы (от Megazyme), которая служит в качестве субстрата в ферментативной реакции.
Вариант: Термин «вариант» определен в настоящем документе как полипептид, обладающий ксилоглюканазной активностью и включающий модификацию, такую как замена, инсерция и/или делеция одного или нескольких аминокислотных остатков в одном или нескольких конкретных положениях, соответствующих положениям аминокислот в SEQ ID NO: 3. Варианты согласно изобретению могут также обладать целлюлазной активностью. Модифицированный полипептид (вариант) получают вмешательством человека путем модификации полинуклеотидной последовательности, кодирующей родительский фермент. Родительский фермент может кодироваться последовательностями SEQ ID NO: 1, SEQ ID NO: 4 или SEQ ID NO: 6, или последовательностью, которая по меньшей мере на 65%, более предпочтительно, по меньшей мере на 70%, еще более предпочтительно, по меньшей мере на 75%, еще более предпочтительно, по меньшей мере на 80%, еще более предпочтительно, по меньшей мере на 85%, еще более предпочтительно, по меньшей мере на 90%, а наиболее предпочтительно, по меньшей мере на 95% идентична одной из этих последовательностей, и которая кодирует активный полипептид. Последовательностью полипептидного варианта, предпочтительно, является последовательность, которая не была обнаружена в природе.
Фермент дикого типа: Термин ксилоглюканаза «дикого типа» означает ксилоглюканазу, экспрессируемую природным микроорганизмом, таким как бактерии, дрожжи или нитчатые грибы, встречающиеся в природе. Термин «дикого типа» может употребляться как синоним термина «природный».
Родительский фермент: Используемый здесь термин ксилоглюканаза-«родитель» или «родительская» ксилоглюканаза означает ксилоглюканазу, в которую были внесены модификации, например, замена(ы), инсерция(и), делеция(и) и/или усечение(я), с получением вариантов фермента согласно изобретению. Этот термин также означает полипептид, с которым сравнивают данный вариант, и сопоставляют этот вариант путем выравнивания. Указанным родителем может быть природный (дикого типа) полипептид, такой как фермент SEQ ID NO: 2, или SEQ ID NO: 3, или SEQ ID NO: 5, или SEQ ID NO: 7, или полипептид, имеющий последовательность, которая по меньшей мере на 65%, более предпочтительно, по меньшей мере на 70%, еще более предпочтительно, по меньшей мере на 75%, еще более предпочтительно, по меньшей мере на 80%, еще более предпочтительно, по меньшей мере на 85%, еще более предпочтительно, по меньшей мере на 90%, а наиболее предпочтительно, по меньшей мере на 95% идентична одной из этих последовательностей. Родительским полипептидом может быть также вариант природного полипептида, аминокислотная последовательность которого была модифицирована или изменена. Родительским полипептидом может быть также аллельный вариант, который представляет собой полипептид, кодируемый любой из двух или более альтернативных форм гена, занимающего тот же самый локус в хромосоме.
Выделенный вариант или полипептид: Используемый здесь термин «выделенный вариант» или «выделенный полипептид» означает вариант или полипептид, который выделен из источника, например, из клетки-хозяина, в которой он экспрессируется, или из ферментного комплекса, который обычно присутствует в данной клетке. Предпочтительно, полипептид имеет чистоту, составляющую по меньшей мере 40%, более предпочтительно, по меньшей мере 60%, еще более предпочтительно, по меньшей мере 80%, наиболее предпочтительно, по меньшей мере 90%, а еще более предпочтительно, по меньшей мере 95%, как было определено с помощью электрофореза в ДСН-ПААГ.
По существу, чистый вариант или полипептид: Используемый здесь термин «по существу, чистый вариант или по существу, чистый полипептид» означает полипептидный препарат, содержащий максимум 10 мас.%, предпочтительно, максимум 8 мас.%, более предпочтительно, максимум 6 мас.%, еще более предпочтительно, максимум 5 мас.%, еще более предпочтительно, максимум 4 мас.%, еще более предпочтительно, максимум 3 мас.%, еще более предпочтительно, максимум 2 мас.%, еще более предпочтительно, максимум 1 мас.%, а наиболее предпочтительно, максимум 0,5 мас.% другого полипептидного материала, с которым он ассоциируется в природе или в рекомбинантном препарате. Поэтому, по существу, чистый вариант или полипептид имеет чистоту, предпочтительно, составляющую по меньшей мере 92%, более предпочтительно, по меньшей мере 94%, еще более предпочтительно, по меньшей мере 95%, еще более предпочтительно, по меньшей мере 96%, еще более предпочтительно, по меньшей мере 97%, еще более предпочтительно, по меньшей мере 98%, еще более предпочтительно, по меньшей мере 99%, еще более предпочтительно, по меньшей мере 99,5%, а наиболее предпочтительно, 100% по массе всего полипептидного материала, присутствующего в данном препарате. Варианты и полипептиды согласно изобретению, предпочтительно, присутствуют, по существу, в чистой форме. Это может быть достигнуто, например, путем получения указанного варианта или полипептида хорошо известными рекомбинантными методами или классическими методами очистки.
Зрелый полипептид: Термин «зрелый полипептид» определен здесь как полипептид, обладающий ксилоглюканазной активностью, конечная форма которого образуется после трансляции и любых посттрансляционных модификаций, таких как N-концевой процессинг, C-концевое усечение, гликозилирование, фосфорилирование и т.п. Для полипептида, определенного в SEQ ID NO: 2, зрелая ксилоглюканазная последовательность теоретически может начинаться в положении 28 последовательности SEQ ID NO: 2. Зрелая последовательность заканчивается в положении 551 SEQ ID NO: 2. Теоретическая зрелая последовательность ксилоглюканазы представлена в SEQ ID NO: 3. В зависимости от экспрессионной системы, фактическая длина зрелого полипептида может варьироваться от 1 до 10 аминокислот теоретической последовательности зрелого полипептида. Зрелый полипептид, например, может начинаться в положении 33 последовательности SEQ ID NO: 2 и заканчиваться в положении 551 последовательности SEQ ID NO: 2. Последовательность, кодирующая зрелый полипептид: Термин «последовательность, кодирующая зрелый полипептид» определен здесь как нуклеотидная последовательность, кодирующая зрелый полипептид, обладающий ксилоглюканазной активностью. В одном из аспектов изобретения, последовательностью, кодирующей зрелый полипептид, является последовательность, состоящая из нуклеотидов 82-1653 SEQ ID NO: 1. Последовательность, кодирующая зрелый полипептид, может иметь длину, варьирующуюся от 3 до 30 нуклеотидов, в зависимости от экспрессионной системы. Последовательность, кодирующая зрелый полипептид, может, например, соответствовать нуклеотидам 97-1653 SEQ ID NO: 1.
Идентичность: Сходство между двумя аминокислотными последовательностями или между двумя нуклеотидными последовательностями определяется параметром «идентичность».
В соответствии с настоящим изобретением, степень идентичности двух аминокислотных последовательностей определяют с использованием алгоритма Нидлмана-Вюнша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), включенного в программу Needle, входящую в пакет программ EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends in Genetics 16: 276-277; http://emboss.org), предпочтительно, версии 3.0.0 или более поздней. Необязательными используемыми параметрами являются штраф на пробел-пропуск 10, штраф на пробел-удлинение 0,5 и матрица замен EBLOSUM62 (EMBOSS версии BLOSUM62). Выходные данные программы Needle, обозначенные как «идентичность самых длинных последовательностей» (получаемые с использованием опции - nobrief), выражены как процент идентичности и вычисляются следующим образом:
(Идентичные остатки × 100)/(Длина выравниваемых последовательностей - Общее число пробелов, используемых при выравнивании).
В соответствии с настоящим изобретением, степень идентичности между двумя дезоксирибонуклеотидными последовательностями определяют с использованием алгоритма Нидлмана-Вюнша (Needleman and Wunsch, 1970, см. выше), включенного в программу Needle, входящую в пакет программ EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, см. выше; http://emboss.org), предпочтительно, версии 3.0.0 или более поздней. Необязательными используемыми параметрами являются штраф на пробел-пропуск 10, штраф на пробел-удлинение 0,5 и матрица замен EDNAFULL (EMBOSS версии NCBI NUC4.4). Выходные данные программы Needle, обозначенные как «идентичность самых длинных последовательностей» (получаемые с использованием опции - nobrief), выражены как процент идентичности и вычисляются следующим образом:
(Идентичные дезоксирибонуклеотиды × 100)/(Длина выравниваемых последовательностей - Общее число пробелов, используемых при выравнивании).
Функциональный фрагмент: Термин «функциональный фрагмент полипептида» используется для описания полипептида, который происходит от более длинного полипептида, например зрелого полипептида, и имеет усечение либо в N-концевой области, либо в С-концевой области, либо в обеих областях, в результате чего образуется фрагмент родительского полипептида. Для того чтобы полипептид был функциональным, необходимо, чтобы его фрагмент сохранял по меньшей мере 20%, предпочтительно, по меньшей мере 40%, более предпочтительно, по меньшей мере 50%, еще более предпочтительно, по меньшей мере 60%, еще более предпочтительно, по меньшей мере 70%, еще более предпочтительно, по меньшей мере 80%, еще более предпочтительно, по меньшей мере 90%, еще более предпочтительно, по меньшей мере 95%, а наиболее предпочтительно, по меньшей мере 100% ксилоглюканазной активности полноразмерного/зрелого полипептида.
Аллельный вариант: Используемый здесь термин «аллельный вариант» означает любые две или более альтернативных форм гена, занимающих тот же самый локус в хромосоме. Аллельные варианты обычно возникают в результате мутации и могут приводить к полиморфизму внутри популяций. Генные мутации могут быть молчащими (не изменяют кодируемый полипептид) или могут кодировать полипептиды, имеющие модифицированные аминокислотные последовательности. Аллельным вариантом полипептида является полипептид, кодируемый аллельным вариантом гена.
Выделенный полинуклеотид: Используемый здесь термин «выделенный полинуклеотид» означает полинуклеотид, выделенный из источника. В одном из аспектов изобретения, выделенный полинуклеотид имеет чистоту, составляющую по меньшей мере 40%, более предпочтительно, по меньшей мере 60%, еще более предпочтительно, по меньшей мере 80%, наиболее предпочтительно, по меньшей мере 90%, а еще более предпочтительно, по меньшей мере 95%, как было определено с помощью электрофореза в агарозном геле.
По существу, чистый полинуклеотид: Используемый здесь термин «по существу, чистый полинуклеотид» означает полинуклеотидный препарат, не содержащий других чужеродных или нежелательных нуклеотидов и имеющий форму, подходящую для его использования в генетически сконструированных системах продуцирования полипептидов. Таким образом, по существу, чистый полинуклеотид содержит максимум 10 мас.%, предпочтительно, максимум 8 мас.%, более предпочтительно, максимум 6 мас.%, еще более предпочтительно, максимум 5 мас.%, еще более предпочтительно, максимум 4 мас.%, еще более предпочтительно, максимум 3 мас.%, еще более предпочтительно, максимум 2 мас.%, еще более предпочтительно, максимум 1 мас.%, а наиболее предпочтительно, максимум 0,5 мас.% другого полинуклеотидного материала, с которым он ассоциируется в природе или в рекомбинантном препарате. Однако, по существу, чистый полинуклеотид может включать природные 5'- и 3'-нетранслируемые области, такие как промоторы и терминаторы. По существу, чистый полинуклеотид имеет чистоту, предпочтительно, составляющую по меньшей мере 90%, более предпочтительно, по меньшей мере 92%, еще более предпочтительно, по меньшей мере 94%, еще более предпочтительно, по меньшей мере 95%, еще более предпочтительно, по меньшей мере 96%, еще более предпочтительно, по меньшей мере 97%, еще более предпочтительно, по меньшей мере 98%, еще более предпочтительно, по меньшей мере 99%, а наиболее предпочтительно, по меньшей мере 99,5% по массе. Полинуклеотиды согласно изобретению, предпочтительно, имеют, по существу, чистую форму, то есть указанный полинуклеотидный препарат, по существу, не содержит другого полинуклеотидного материала, с которым он ассоциируется в природе или в рекомбинантном препарате. Полинуклеотиды могут представлять собой геномные ДНК, кДНК, РНК, а также полусинтетические полинуклеотиды, синтетические полинуклеотиды или любые их комбинации.
Кодирующая последовательность: Используемый здесь термин «кодирующая последовательность» означает полинуклеотид, который непосредственно определяет аминокислотную последовательность его полипептидного продукта. Границы кодирующей последовательности, в основном, определяются открытой рамкой считывания, которая обычно начинается со старт-кодона ATG или альтернативных старт-кодонов, таких как GTG и TTG, и заканчивается стоп-кодоном, таким как TAA, TAG и TGA. Кодирующей последовательностью может быть ДНК, кДНК, синтетический полинуклеотид или рекомбинантный полинуклеотид.
Функционально связанный: Используемый здесь термин «функционально связанный» означает конфигурацию, в которой регуляторная последовательность находится в соответствующем положении по отношению к кодирующей последовательности полинуклеотидной последовательности, что позволяет указанной регуляторной последовательности управлять экспрессией кодирующей последовательности полипептида.
Клетка-хозяин: Используемый здесь термин «клетка-хозяин» включает любую клетку, которая является компетентной в отношении переноса в нее конструкции нуклеиновой кислоты или вектора, содержащих полинуклеотид согласно изобретению, ее трансфекции такой конструкцией или вектором и трансдукции указанной конструкции или вектора и т.п. Термин «клетка-хозяин» включает любое потомство родительской клетки, которое не является идентичным родительской клетке, что обусловлено мутациями, происходящими в процессе репликации.
Повышенная химическая стабильность: Термин «повышенная химическая стабильность» определяют здесь как вариант фермента, сохраняющего ферментативную активность после инкубирования в присутствии химического вещества или химических веществ, либо природных, либо синтетических, которые снижают ферментативную активность родительского фермента. Повышенная химическая стабильность может также способствовать образованию вариантов, обладающих лучшей способностью катилизировать реакцию в присутствии таких химических веществ. В конкретном аспекте изобретения, повышенной химической стабильностью является повышенная стабильность в детергенте, в частности в жидком детергенте. Повышенной стабильностью к детергенту является, в частности, повышенная стабильность ксилоглюканазной активности при смешивании ксилоглюканазного варианта согласно изобретению с получением жидкой композиции детергента и с ее последующим хранением при температуре от 15 до 50°С.
В настоящем изобретении жидкими детергентами являются детергенты, особенно подходящие для их использования в качестве жидких моющих средств для стирки.
Соглашения по обозначению вариантов
В соответствии с настоящим изобретением, аминокислотную последовательность ксилоглюканазы, описанную в SEQ ID NO: 3, используют для определения соответствующего аминокислотного остатка в другой ксилоглюканазе. Аминокислотную последовательность другой ксилоглюканазы выравнивают с аминокислотной последовательностью ксилоглюканазы, описанной в SEQ ID NO: 3, и исходя из такого выравнивания может быть определено число положений аминокислот, соответствующих любому аминокислотному остатку в аминокислотной последовательности ксилоглюканазы, описанной в SEQ ID NO: 3.
Выравнивание полипептидных последовательностей может быть осуществлено, например, с использованием программы «ClustalW» (Thompson J.D., Higgins D.G. and Gibson T.J., 1994, CLUSTAL W: Improving the sensitivity of progressive multiple sequence alignment through sequence weighting, positions-specific gap penalties and weight matrix choice, Nucleic Acids Research 22: 4673-4680). Выравнивание последовательностей ДНК может быть осуществлено с использованием ДНК данного полипептида в качестве матрицы, в которой была сделана замена кодона данных аминокислот соответствующим кодоном последовательности ДНК.
При описании различных вариантов ксилоглюканаз согласно изобретению, номенклатура, описанная ниже, была адаптирована для простоты ее идентификации. Во всех случаях, используется принятая ИЮПАК (IUPAC) однобуквенная или трехбуквенная аббревиатура аминокислот.
Замены: Для замены аминокислот используется следующая номенклатура: исходная аминокислота/положение/замененная аминокислота. В соответствии с этим, замена треонина аланином в положении 226 обозначается «Thr226Ala» или «T226A». Множественные мутации разделены значком «плюс» («+»), так, например, «G205R + S411F» означает мутации в положениях 205 и 411, где глицин (G) заменен аргинином (R), а серин (S) заменен фенилаланином (F), соответственно. Если исходная аминокислота может быть заменена аминокислотой, выбранной из группы аминокислот, то такая замена обозначается «K129R,S,A,I,F,Q», где лизин (K) в положении 129 заменен аминокислотой, выбранной из группы, состоящей из аргинина (R), серина (S), аланина (A), изолейцина (I), фенилаланина (F) и глутамина (Q). Альтернативно, «K129R,S,A,I,F,Q» может записываться как K129R, или K129S, или K129A, или K129I, или K129F, или K129Q.
Делеции. Для делеции аминокислот используется следующая номенклатура: исходная аминокислота/положение/звездочка (*). В соответствии с этим, делеция глицина в положении 195 обозначается «Gly195*» или «G195*». Множественные делеции разделены значком «плюс» («+»), например, «G195* + S411*».
Инсерции. Для инсерции аминокислот используется нижеследующая номенклатура: звездочка(*)/положение/строчная буква/встроенная аминокислота, где строчная буква означает добавление аминокислоты ниже данного положения. В соответствии с этим, инсерция глутаминовой кислоты (E) за положением 10 обозначается «*10aE». Если ниже положения 10 за глутаминовой кислотой (E) встраивается вторая аминокислота, например, валин (V), то такая инсерция обозначается «*10аЕ + *10bV». Добавление полипептидов к N-концу обозначается 0 (ноль). Добавление глутаминовой кислоты (E) и валина (V) к N-концевой аминокислоте полипептида обозначается «*0aE+*0bV». Инсерция аминокислоты, «добавляемой ниже», может быть также определена как добавление одной или нескольких аминокислот между названным положением и положением, следующим непосредственно за названным положением, например, инсерция ниже положения 195 приводит к добавлению одной или нескольких аминокислот между положениями 195 и 196, в результате чего образуются новые положения, *195a, *195b и т.п.
Родительские ксилоглюканазы
В настоящем изобретении, родительской ксилоглюканазой является либо (a) ксилоглюканаза, принадлежащая к семейству из 44 гликозилгидролаз, также называемому семейством из 44 ксилоглюканаз; либо (b) полипептид, выбранный из группы, состоящей из SEQ ID NO:3, SEQ ID NO: 5 и SEQ ID NO: 7; либо (c) полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 75% идентична последовательности зрелого полипептида SEQ ID NO: 3; либо (d) полипептид, кодируемый полинуклеотидом, который гибридизуется в условиях по меньшей мере умеренной жесткости с (i) последовательностью, кодирующей зрелый полипептид, SEQ ID NO: 1, или SEQ ID NO: 4, или SEQ ID NO: 6; (ii) геномной последовательностью ДНК, включающей последовательность, кодирующую зрелый полипептид, SEQ ID NO:1, SEQ ID NO: 4 или SEQ ID NO: 6; или (iii) полноразмерной комплементарной цепью (i) или (ii); либо (e) полипептид, кодируемый полинуклеотидом, включающим нуклеотидную последовательность, которая по меньшей мере на 70% идентична последовательности, кодирующей зрелый полипептид, SEQ ID NO: 1.
В первом аспекте изобретения, родительская ксилоглюканаза содержит аминокислотную последовательность, которая имеет степень идентичности со зрелым полипептидом SEQ ID NO: 3, составляющую, предпочтительно, по меньшей мере 70%, более предпочтительно, по меньшей мере 75%, более предпочтительно, по меньшей мере 80%, еще более предпочтительно, по меньшей мере 85%, еще более предпочтительно, по меньшей мере 90%, еще более предпочтительно, по меньшей мере 95%, еще более предпочтительно, по меньшей мере 96%, еще более предпочтительно, по меньшей мере 97%, еще более предпочтительно, по меньшей мере 98%, а наиболее предпочтительно, по меньшей мере 99%, и которая обладает ксилоглюканазной активностью (далее называемая «гомологичными полипептидами»). В одном из аспектов изобретения, гомологичные полипептиды имеют аминокислотную последовательность, которая отличается от зрелого полипептида SEQ ID NO:3 на десять, предпочтительно, на девять, более предпочтительно, на восемь, еще более предпочтительно, на семь, еще более предпочтительно, на шесть, еще более предпочтительно, на пять аминокислот, еще более предпочтительно, на четыре, еще более предпочтительно, на три, еще более предпочтительно, на две аминокислоты, и наиболее предпочтительно, на одну аминокислоту.
По существу, гомологичные родительские ксилоглюканазы могут иметь одну или несколько аминокислотных модификаций, таких как замены, делеции и/или инсерции. Эти модификации, по своей природе, предпочтительно, играют незначительную роль, то есть представляют собой консервативные аминокислотные замены и другие замены, которые не оказывают заметного влияния на трехмерную укладку или активность белка или полипептида; небольшие делеции, обычно от одной до примерно 9 аминокислот, предпочтительно, от одной до примерно 15 аминокислот, а наиболее предпочтительно, от одной до примерно 30 аминокислот; и небольшие амино- или карбокси-концевые удлинения, такие как добавление амино-концевого метионинового остатка, небольшого линкерного пептида, имеющего примерно до 5-10 остатков, предпочтительно, от 10 до 15 остатков, а наиболее предпочтительно, от 20 до 25 остатков, или небольшое удлинение, облегчающее очистку (присоединение аффинной метки), такое как присоединение полигистидиновой метки или белка А (Nilsson et al., 1985, EMBO J. 4: 1075; Nilsson et al., 1991, Methods Enzymol. 198: 3. В общих чертах, см. также Ford et al., 1991, Protein Expression and Purification 2: 95-107.
Хотя вышеописанные модификации, по своей природе, предпочтительно, не оказывают значительного влияния, однако, иногда они могут играть определенную роль, то есть могут приводить к образованию гибрида из более крупных полипептидов длиной до 300 аминокислот или более и могут представлять собой амино- или карбокси-концевые удлинения.
Примерами консервативных замен являются замены между аминокислотами группы основных аминокислот (аргинина, лизина и гистидина), кислотных аминокислот (глутаминовой кислоты и аспарагиновой кислоты), полярных аминокислот (глутамина и аспарагина), гидрофобных аминокислот (лейцина, изолейцина и валина), ароматических аминокислот (фенилаланина, триптофана и тирозина) и небольших аминокислот (глицина, аланина, серина, треонина и метионина). Аминокислотные замены, которые, по существу, не приводят к изменению удельной активности, известны специалистам и описаны, например, в публикации Neurath & Hill, 1979, In, The Proteins, Academic Press, New York. Наиболее часто встречающимися заменами являются Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Tyr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu и Asp/Gly.
Незаменимые аминокислоты в ксилоглюканазных полипептидах согласно изобретению могут быть идентифицированы в соответствии с процедурами, известными специалистам, такими как сайт-направленный мутагенез или аланин-сканирующий мутагенез (Cunningham and Wells, Science 244: 1081-1085, 1989). В последнем методе, одиночные аланиновые мутации вводят в каждый остаток молекулы, и полученные мутантные молекулы тестируют на биологическая активность (то есть ксилоглюканазную активность) для идентификации аминокислотных остатков, играющих важную роль в активности молекулы. См. также Hilton et al., J. Biol. Chem. 271:4699-4708, 1996. Активный центр фермента или другие области, участвующие в биологических взаимодействиях, могут быть также определены с помощью физического анализа структуры, как было определено такими методами, как ядерный магнитный резонанс, кристаллография, электронная дифракция или фотоаффинное мечение, в комбинации с мутацией предполагаемого сайта контактирования аминокислот. См., например, de Vos et al., Science 255:306-312, 1992; Smith et al., J. Mol. Biol. 224:899-904, 1992; Wlodaver et al., FEBS Lett. 309:59-64, 1992. Идентичность незаменимых аминокислот может быть также определена исходя из анализа их гомологии с полипептидами, которые являются родственными полипептиду согласно изобретению. Кристаллическая структура фермента, принадлежащего к семейству, состоящему из 44 гликозилгидролаз, была описана Kitago et al, J. Biol. Chem. Vol. 282:35703-35711, 2007. На основании этой структуры можно генерировать трехмерную структуру родительской ксилоглюканазы (SEQ ID NO: 3) in silico. Путем сравнения с опубликованной структурой, нижеследующие остатки в SEQ ID NO: 3 были идентифицированы как остатки, осуществляющие важную ферментативную функцию, а именно остаток E187 (каталитическая аминокислота/каталитическое основание), остаток E358 (каталитический нуклеофил), остаток E56 (карбоксилатная группа, координирующая Ca2+) и остаток D154 (карбоксилатная группа, координирующая Ca2+). Поэтому, такие положения, предпочтительно, не должны быть мутированы в родительском ферменте.
Родительская ксилоглюканаза, предпочтительно, содержит аминокислотную последовательность SEQ ID NO: 3 или ее аллельный вариант или фрагмент, обладающий ксилоглюканазной активностью. В одном из аспектов изобретения, родительская ксилоглюканаза содержит аминокислотную последовательность SEQ ID NO: 2. В другом аспекте изобретения, родительская ксилоглюканаза содержит зрелый полипептид SEQ ID NO: 2. В другом аспекте изобретения, родительская ксилоглюканаза состоит из аминокислотной последовательности SEQ ID NO: 3 или ее аллельного варианта или фрагмента, обладающего ксилоглюканазной активностью. В другом аспекте изобретения, родительская ксилоглюканаза содержит аминокислотную последовательность SEQ ID NO: 5 или ее аллельный вариант или фрагмент, обладающий ксилоглюканазной активностью. В другом аспекте изобретения, родительская ксилоглюканаза содержит аминокислотную последовательность SEQ ID NO: 7 или ее аллельный вариант или фрагмент, обладающий ксилоглюканазной активностью. В другом аспекте изобретения, родительская ксилоглюканаза содержит аминокислотную последовательность, которая по меньшей мере на 65%, более предпочтительно, по меньшей мере на 70%, еще более предпочтительно, по меньшей мере на 75%, еще более предпочтительно, по меньшей мере на 80%, еще более предпочтительно, по меньшей мере на 85%, еще более предпочтительно, по меньшей мере на 90%, а наиболее предпочтительно, по меньшей мере на 95% идентична последовательности SEQ ID NO: 2 или SEQ ID NO: 3, или SEQ ID NO: 5. Фрагментом зрелого полипептида SEQ ID NO: 3 является полипептид, который имеет одну или несколько аминокислот, делетированных у амино- и/или карбоксиконца этой аминокислотной последовательности, и сохраняет ксилоглюканазную активность.
Во втором аспекте изобретения, родительские ксилоглюканазы кодируются полинкулеотидами, которые гибридизуются в условиях очень низкой жесткости, предпочтительно, в условиях низкой жесткости, более предпочтительно, в условиях умеренной жесткости, более предпочтительно, в условиях умеренной-высокой жесткости, еще более предпочтительно, в условиях высокой жесткости, а наиболее предпочтительно, в условиях очень высокой жесткости, (i) с последовательностью, кодирующей зрелый полипептид, SEQ ID NO: 1 или SEQ ID NO: 4, или SEQ ID NO: 6, (ii) с последовательностью геномной ДНК, включаеющей последовательность, кодирующую зрелый полипептид, SEQ ID NO: 1 или SEQ ID NO: 4, или SEQ ID NO: 6, (iii) с подпоследовательностью (i) или (ii); или (iv) с полноразмерной комплементарной цепью (i), (ii) или (iii) (J. Sambrook, E.F. Fritsch and T. Maniatis, 1989, Molecular Cloning, A Laboratory Manual, 2d edition, Cold Spring Harbor, New York). Такая подпоследовательность может кодировать полипептидный фрагмент, обладающий ксилоглюканазной активностью. В одном из аспектов изобретения, комплементарной цепью является полноразмерная комплементарная цепь последовательности, кодирующей зрелый полипептид, SEQ ID NO: 1 или SEQ ID NO: 4, или SEQ ID NO: 6.
Подпоследовательностью последовательности, кодирующей зрелый полипептид, SEQ ID NO: 1 или SEQ ID NO: 4, или SEQ ID NO: 6, или ее гомологом является нуклеотидная последовательность, в которой один или несколько нуклеотидов делетированы у 5'- и/или 3'-конца, где указанный полипептид, кодируемый указанной подпоследовательностью, обладает ксилоглюканазной активностью.
Родительскими ферментами могут быть также аллельные варианты полипептидов, обладающих ксилоглюканазной активностью.
Полинуклеотид SEQ ID NO: 1 или SEQ ID NO: 4, или SEQ ID NO: 6 или его подпоследовательность, а также аминокислотная последовательность SEQ ID NO: 3 или SEQ ID NO: 5, или SEQ ID NO: 7, или ее фрагмент, могут быть использованы для конструирования зондов нуклеиновой кислоты, применяемых для идентификации и клонирования ДНК, кодирующей родительские ксилоглюканазы, происходящие от штаммов различного рода или вида, где такую идентификации и клонирование осуществляют методами, хорошо известными специалистам. В частности, такие зонды могут быть использованы для гибридизации с геномной ДНК или с кДНК представляющего интерес рода или вида после проведения стандартных процедур саузерн-блот-анализа, осуществляемого в целях идентификации и выделения соответствующего гена, описанного в настоящей заявке. Такие зонды могут быть значительно короче полноразмерной последовательности, но их длина должна составлять по меньшей мере 14, предпочтительно, по меньшей мере 25, более предпочтительно, по меньшей мере 35, а наиболее предпочтительно, по меньшей мере 70 нуклеотидов. Однако, предпочтительно, чтобы такой зонд нуклеиновой кислоты имел длину по меньшей мере 100 нуклеотидов. Так, например, зонд нуклеиновой кислоты может иметь длину по меньшей мере 200 нуклеотидов, предпочтительно, по меньшей мере 300 нуклеотидов, более предпочтительно, по меньшей мере 400 нуклеотидов, а наиболее предпочтительно, по меньшей мере 500 нуклеотидов. Могут быть использованы даже еще более длинные зонды, например, зонды нуклеиновой кислоты, которые, предпочтительно, имеют длину по меньшей мере 600 нуклеотидов, более предпочтительно, по меньшей мере 700 нуклеотидов, еще более предпочтительно, по меньшей мере 800 нуклеотидов, еще более предпочтительно, по меньшей мере 900 нуклеотидов, еще более предпочтительно, по меньшей мере 1000 нуклеотидов, еще более предпочтительно, по меньшей мере 1100 нуклеотидов, еще более предпочтительно, по меньшей мере 1200 нуклеотидов, еще более предпочтительно, по меньшей мере 1300 нуклеотидов, еще более предпочтительно, по меньшей мере 1400 нуклеотидов, еще более предпочтительно, по меньшей мере 1500 нуклеотидов, а наиболее предпочтительно, по меньшей мере 1600 нуклеотидов. Могут быть использованы как ДНК-, так и РНК-зонды. Эти зонды обычно метят для детектирования соответствующего гена (например, 32P, 3H, 35S, биотином или авидином). Такие зонды входят в объем настоящего изобретения.
Библиотека геномных ДНК, полученная от других организмов, может быть скринирована на ДНК, которая гибридизуется с описанными выше зондами и кодирует родительскую ксилоглюканазу. Геномная ДНК или другая ДНК от других организмов может быть разделена с помощью электрофореза в агарозном или полиакриламидном геле или другими методами разделения. ДНК из указанных библиотек или выделенная ДНК может быть перенесена на нитроцеллюлозу или другой подходящий материал-носитель и иммобилизована на этой нитроцеллюлозе или на этом материале-носителе. В саузерн-блот-анализе, для идентификации клона или ДНК, которые гомологичны последовательности SEQ ID NO: 1 или ее подпоследовательности, используют материал-носитель. В соответствии с настоящим изобретением, термин «гибридизация» означает, что данный полинуклеотид гибридизуется с меченным нуклеотидным зондом, соответствующим полинуклеотиду, представленному в SEQ ID NO: 1, его комплементарной цепи или подпоследовательности в условиях от низкой до очень высокой жесткости. Молекулы, с которыми гибридизуется данный зонд, могут быть детектированы с использованием, например, рентгеновской пленки или с применением любых других детектирующих средств, известных специалистам.
В одном из аспектов изобретения, зондом нуклеиновой кислоты является последовательность, кодирующая зрелый полипептид, SEQ ID NO:1. В другом аспекте изобретения, зондом нуклеиновой кислоты являются нуклеотиды 82-1653 SEQ ID NO: 1 или нуклеотиды 97-1653 SEQ ID NO:1. В другом аспекте изобретения, зондом нуклеиновой кислоты является полинуклеотидная последовательность, кодирующая полипептид SEQ ID NO:2, или ее подпоследовательность. В другом аспекте изобретения, указанным зондом нуклеиновой кислоты является SEQ ID NO: 1.
Для длинных зондов, имеющих длину по меньшей мере 100 нуклеотидов, условия от очень низкой до очень высокой жесткости определены как предварительная гибридизация и гибридизация при 42°C в 5X SSPE, 0,3% ДСН, 200 микрограммов/мл фрагментированной и денатурированной ДНК спермы лосося, и либо 25% формамид, используемый в условиях очень низкой и низкой жесткости, либо 35% формамид, используемый в условиях умеренной и умеренно-высокой жесткости, либо 50% формамид, используемый в условиях высокой и очень высокой жесткости, где указанную предварительную гибридизацию и гибридизацию проводят в соответствии со стандартными процедурами саузерн-блот-анализа, оптимальное время которого составляет 12-24 часа.
Для длинных зондов длиной по меньшей мере в 100 нуклеотидов, материал-носитель подвергают конечной промывке три раза, каждую из которых проводят в течение 15 минут с использованием 2× SSC, 0,2% ДСН, предпочтительно, при 45°С (в условиях очень низкой жесткости), более предпочтительно, при 50°С (в условиях низкой жесткости), более предпочтительно, при 55°С (в условиях умеренной жесткости), еще более предпочтительно, при 60°С (в условиях умеренно-высокой жесткости), еще более предпочтительно, при 65°С (в условиях высокой жесткости), а наиболее предпочтительно, при 70°С (в условиях очень высокой жесткости).
Для коротких зондов, длина которых составляет примерно от 15 до 70 нуклеотидов, условия жесткости определяют как предварительную гибридизацию, гибридизацию и промывку после гибридизации при температуре примерно на 5-10°С ниже Tm, вычисленной по Болтону и Маккарти (1962, Proceedings of the National Academy of Sciences USA 48:1390) в 0,9 M NaCl, 0,09 M трис-HCl, pH 7,6, 6 мМ EDTA, 0,5% NP-40, 1× растворе Денхардта, 1 мМ пирофосфата натрия, 1 мМ моноосновного фосфата натрия, 0,1 мМ ATP и 0,2 мг дрожжевой РНК на мл в соответствии со стандартными процедурами саузерн-блот-анализа, оптимальное время которого составляет 12-24 часа.
Для коротких зондов длиной примерно от 15 до 70 нуклеотидов, материал-носитель промывают один раз в 6× SCC плюс 0,1% ДСН в течение 15 минут и два раза (каждый) в течение 15 минут с использованием 6× SCC при температуре примерно на 5-10°С ниже вычисленной Tm.
В третьем аспекте изобретения, родительская ксилоглюканаза кодируется полинуклеотидом, включающим нуклеотидную последовательность, или состоящим из нее, где указанная последовательность, предпочтительно, по меньшей мере на 65%, более предпочтительно, по меньшей мере на 70%, более предпочтительно, по меньшей мере на 75%, еще более предпочтительно, по меньшей мере на 80%, еще более предпочтительно, по меньшей мере на 85%, еще более предпочтительно, по меньшей мере на 90%, еще более предпочтительно, по меньшей мере на 95%, а наиболее предпочтительно на 96%, 97%, 98% или 99% идентична последовательности, кодирующей зрелый полипептид, SEQ ID NO: 1, и которая кодирует активный полипептид. В одном из аспектов изобретения, последовательностью, кодирующей зрелый полипептид, является последовательность нуклеотидов 82-1653 SEQ ID NO:1 или последовательность нуклеотидов 97-1653 SEQ ID NO:1.
Родительская ксилоглюканаза может быть получена из микроорганизмов любого рода. В одном из аспектов изобретения, родительская ксилоглюканаза секретируется во внеклеточное пространство.
В другом аспекте изобретения, родительской ксилоглюканазой может быть бактериальная ксилоглюканаза. Так, например, ксилоглюканазой может быть полипептид грамположительных бактерий, таких как Bacillus, предпочтительно, бактерий подразделения Bacillus/Lactobacillus, более предпочтительно, бактерий видов, происходящих от рода Paenibacillus, а в частности, Paenibacillus polymyxa, например, Paenibacillus polymyxa, ATCC 832, а предпочтительной ксилоглюканазой является ксилоглюканаза, принадлежащая к семейству из 44 ксилоглюканаз, например, описанных в WO 01/62903, более предпочтительно, ксилоглюканаза SEQ ID NO: 5, еще более предпочтительно, ксилоглюканаза SEQ ID NO: 7, а наиболее предпочтительно, ксилоглюканаза SEQ ID NO: 2 или ее зрелый полипептид.
Получение вариантов
Варианты родительской ксилоглюканазы могут быть получены любым методом мутагенеза, известным специалистам, таким как неспецифический и/или сайт-направленный мутагенез, конструирование синтетических генов, конструирование полусинтетических генов, неспецифический мутагенез, перестановка генов и т.п.
Конструирование синтетического гена включает in vitro синтез нужной полинуклеотидной молекулы, которая кодирует представляющую интерес полипептидную молекулу. Синтез гена может быть осуществлен с применением ряда методов, таких как технология на основе мультиплексных микрочипов, описанная Tian, et al. (Tian et al., Nature 432:1050-1054), и аналогичные технологии, в которых олигонуклеотиды подвергают синтезу и сборке на фотопрограммируемых микрофлюидизационных чипах.
Конструирование полусинтетического гена осуществляют путем комбинирования технологий конструирования синтетического гена, и/или сайт-направленного мутагенеза, и/или неспецифического мутагенеза, и/или перестановки генов. Конструирование полусинтетического гена осуществляют с использованием полинуклеотидных фрагментов, которые синтезируют в комбинации с ПЦР-технологиями. Таким образом, определенные области генов могут быть синтезированы de novo, некоторые области могут быть амплифицированы с использованием праймеров, мутированных методом сайт-направленного мутагенеза, а другие области могут быть подвергнуты ПЦР с вероятностью ошибки или точной ПЦР-амплификации. Затем полинуклеотидные фрагменты могут быть подвергнуты перестановке.
Сайт-направленный мутагенез представляет собой метод, который позволяет вносить одну или несколько мутаций в определенном сайте полинуклеотидной молекулы, кодирующей родительскую ксилоглюканазу. Этот способ может быть осуществлен in vitro или in vivo.
Сайт-направленный мутагенез может быть осуществлен in vitro с помощью реакции ПЦР, предусматривающей использование олигонуклеотидных праймеров, содержащих желаемую мутацию. Сайт-направленный мутагенез может быть также осуществлен in vitro с помощью кластерного мутагенеза, заключающегося в расщеплении рестриктирующим ферментом в сайте плазмиды, содержащей полинуклеотид, кодирующий родительскую ксилоглюканазу, с последующим лигированием олигонуклеотида, имеющего мутацию, в данный полинуклеотид. Обычно, рестриктирующим ферментом, который расщепляет и плазмиду, и олигонуклеотид, является один и тот же фермент, что позволяет создавать у плазмиды и у вставки липкие концы и лигировать их друг с другом. Дополнительное описание подходящих методов можно найти в руководствах Sambrook et al. (1989), Molecular cloning: A laboratory manual, Cold Spring Harbor lab., Cold Spring Harbor, NY; Ausubel F.M. et al. (eds.) «Current protocols in Molecular Biology». John Wiley and Sons, 1995; Harwood C.R. and Cutting S.M. (eds.) «Molecular Biological Methods for Bacillus». John Wiley and Sons, 1990), в заявке WO 96/34946; и в публикации Scherer and Davis, 1979, Proc. Natl. Acad. Sci. USA 76: 4949-4955; и Barton et al., 1990, Nucleic Acids Research 18: 7349-4966.
После лигазной реакции смесь для лигирования может быть использована для трансформации клеток-хозяев, а в целях клонирования часто используют клетки E.coli, как описано в руководстве Ausubel F. M. et al. Трансформированные клетки E.coli могут быть размножены в планшетах с жидкой средой или с твердым агаром, а плазмиды могут быть выделены из трансформированных клеток и использованы для трансформации клеток B. subtilis. Подходящие компетентные клетки Bacillus, такие как MB1510, 168-производное (например, поставляемое фирмой BGSC с регистрационным номером № 1A1 168 trpC2), могут быть трансформированы как описано в WO 03/095658. Кластер для интеграции плазмиды в E.coli, используемый для конструирования библиотеки, может быть применен для трансформации Bacillus. Этот метод подробно описан в заявке WO 03/095658. Альтернативно, может быть использован in vitro амплифицированный ПЦР-SOE-продукт (Melnikov and Youngman, Nucleic Acid Research 27, 1056).
Сайт-направленный мутагенез может быть осуществлен in vivo методами, известными специалистам. См., например, публикацию заявки на патент США 2004/0171154; Storici et al., 2001, Nature Biotechnology 19: 773-776; Kren et al., 1998, Nat. Med. 4: 285-290; и Calissano and Macino, 1996, Fungal Genet. Newslett. 43: 15-16.
В настоящем изобретении может быть использован любой метод сайт-направленного мутагенеза. Существует множество коммерчески доступных наборов, которые могут быть использованы для получения вариантов родительских ксилоглюканаз.
Одна или множество аминокислотных замен, делеций и/или инсерций могут быть введены и протестированы известными методами мутагенеза, рекомбинации и/или перестановки с последующим проведением соответствующей процедуры скрининга, например, описанной в публикации Reidhaar-Olson and Sauer, 1988, Science 241 : 53-57; Bowie and Sauer, 1989, Proc. Natl. Acad. Sci. USA 86: 2152-2156; в заявке WO 95/17413; или в заявке WO 95/22625. Другими методами, которые могут быть применены, являются ПЦР с вероятностью ошибки, фаговое представление (например, Lowman et al., 1991, Biochem. 30:10832-10837; патент США №5223409; заявка WO 92/06204) и область-направленный мутагенез (Derbyshire et al., 1986, Gene 46:145; Ner et al., 1988, DNA 7:127).
Описанные выше методы мутагенеза/перестановки могут быть объединены с высокоэффективными методами автоматического скрининга для детектирования активности клонированных мутагенных полипептидов, экспрессируемых клетками-хозяевами, например Bacillus, как описано выше. Мутагенные молекулы ДНК, кодирующие полипептиды, обладающие ксилоглюканазной активностью, могут быть выделены из клеток-хозяев и быстро секвенированы стандартными методами, известными специалистам.
Варианты
В настоящем изобретении, выделенные варианты родительской ксилоглюканазы содержат модификацию в одном или нескольких положениях, выбранных из группы, состоящей из положений 68, 123, 156, 118, 200, 129, 137, 193, 92, 83, 149, 34, 340, 332, 9, 76, 331, 310, 324, 498, 395, 366, 1, 374, 7, 140, 8, 14, 21, 211, 37, 45, 13, 78, 87, 436, 101, 104, 111, 306, 117, 119, 414, 139, 268, 142, 159, 164, 102, 168, 176, 180, 482, 183, 202, 206, 217, 4, 222, 19, 224, 228, 232, 2, 240, 244, 5, 247, 249, 328, 252, 259, 406, 267, 269, 275, 179, 166, 278, 281, 288, 298, 301, 18, 302, 165, 80, 303, 316, 169, 322, 120, 146, 342, 348, 147, 353, 380, 468, 382, 383, 38, 384, 389, 391, 10, 392, 396, 177, 397, 399, 409, 237, 413, 253, 415, 418, 40, 443, 445, 148, 449, 225, 450, 454, 3, 455, 456, 299, 461, 470, 204, 476, 488, 347 и 507, где указанный вариант, обладающий ксилоглюканазной активностью, содержит аминокислотную последовательность, которая по меньшей мере на 70%, более предпочтительно, по меньшей мере на 75%, еще более предпочтительно, по меньшей мере на 80%, еще более предпочтительно, по меньшей мере на 85%, еще более предпочтительно, по меньшей мере на 90%, еще более предпочтительно, по меньшей мере на 95%, еще более предпочтительно по меньшей мере на 97%, еще более предпочтительно, по меньшей мере на 98%, а наиболее предпочтительно, на 99% идентична аминокислотной последовательности родительской ксилоглюканазы. Нумерация положений соответствует нумерации аминокислотной последовательности SEQ ID NO: 3. Предпочтительно, указанные варианты, содержащие модификации в одном или нескольких положениях, идентифицированных выше, обладают повышенной стабильностью к детергенту, а предпочтительно, в жидком детергенте, по сравнению с активностью родительской ксилоглюканазы.
В предпочтительном варианте изобретения, указанный вариант содержит одну или несколько нижеследующих комбинаций модификаций:
|
|
|
|
|
|
|
|
|
В одном из аспектов изобретения, общее число аминокислотных модификаций в вариантах согласно изобретению составляет, предпочтительно, 55, более предпочтительно, 52, еще более предпочтительно, 50, еще более предпочтительно, 40, еще более предпочтительно, 30, еще более предпочтительно, 20, еще более предпочтительно, 15, еще более предпочтительно, десять, еще более предпочтительно, девять, еще более предпочтительно, восемь, еще более предпочтительно, семь, еще более предпочтительно, шесть, еще более предпочтительно, пять, еще более предпочтительно, четыре, еще более предпочтительно, три, еще более предпочтительно две модификации, а наиболее предпочтительно, одну модификацию. В другом аспекте изобретения, общее число модификаций составляет одну, предпочтительно, две, более предпочтительно, три, еще более предпочтительно, четыре, еще более предпочтительно, пять, еще более предпочтительно, шесть, еще более предпочтительно, семь, еще более предпочтительно, восемь, еще более предпочтительно, девять, а наиболее предпочтительно, десять модификаций. Модификация может присутствовать в форме i) инсерции аминокислоты, которую вводят ниже аминокислоты, занимающей данное положение; ii) делеции аминокислоты, занимающей данное положение, или iii) замены аминокислоты, занимащей данное положение, другой аминокислотой. Эти модификации могут быть внесены независимо друг от друга; так, например, в отличие от родительской ксилоглюканазы, в этих вариантах, в одном положении может присутствовать инсерция, во втором положении - замена, а в третьем положении - делеция. В предпочтительном варианте изобретения, указанный вариант содержит только замены.
В одном из аспектов изобретения, мутируемые положения идентифицируют с помощью анализа консенсусной последовательности. Этот анализ осуществляют путем выравнивания последовательности SEQ ID NO: 3 с SEQ ID NO: 5 и SEQ ID NO: 7, а также с другими последовательностями, взятыми из базы данных Uniprot, которые на 30% идентичны области последовательностей SEQ ID NO: 3 ферментов, принадлежащих к семейству, состоящему из 44 гликозилгидролаз. Полученные консенсусные последовательности представлены на фиг.1. Консенсусной последовательностью 1 является последовательность, включающая аминокислоту, наиболее часто встречающуюся в данном положении, как было определено путем выравнивания, а консенсусной последовательностью 2 является последовательность, включающая 2-ю аминокислоту, наиболее часто встречающуюся в данном положении, и т.п. В одном из аспектов изобретения, один или более (несколько) остатков SEQ ID NO: 3 заменены соответствующим остатком консенсусной последовательности 1 или консенсусной последовательности 2, или консенсусной последовательности 3, или консенсусной последовательности 4. В одном из аспектов изобретения, указанные варианты содержат модификацию в одном или более (нескольких) положениях, выбранных из группы, состоящей из 52 положений, идентифицированных с помощью анализа консенсусной последовательности и состоящих из положений 10, 19, 68, 80, 89, 104, 111, 117, 123, 129, 137, 139, 140, 147, 156, 159, 164, 165, 177, 179, 183, 200, 204, 211, 222, 224, 225, 228, 232, 259, 267, 268, 269, 281, 328, 345, 366, 374, 380, 383, 384, 406, 415, 436, 443, 445, 449, 450, 455, 456, 488 и 507. В предпочтительном варианте изобретения, указанной модификацией является замена или несколько замен, выбранных из группы, состоящей из: I10V, D19E, Q68H, L80V, G89A, T104A, P111Q, A117S, S123P, K129T, Q137E, V139K, N140F, Q147S, R156Y, V159M, H164N, F165Y, A177T, V179I, A183S, G200P, G204T, R211K, I222V, A224P, G225S, V228I, V232A, V259I, R267K, L268K, S269A, F281L, A328G, V345I, D366H, T374A, L380F, N383Y, D384G, K406N, N415G, H436Y, S443D, K445S, L449I, V450I, S455N, M456Y, K488T и P507A.
В другом аспекте изобретения, указанный вариант получают из родительского пептида путем замены аминокислот, имеющих положительные заряды и расположенных в пределах 20 Å от иона кальция, на нейтрально заряженные или отрицательно заряженные аминокислоты. Предпочтительными вариантами согласно изобретению являются варианты, в которых суммарный заряд в пределах 20 Å от иона кальция имеет высокое отрицательное значение. В таких вариантах, положительно заряженные аминокислоты могут быть заменены аминокислотами с нейтральным или отрицательным зарядом в зависимости от условий их применения. В соответствии с этим, предпочтительные варианты могут иметь аминокислотный остаток, который является частично или полностью положительно заряженным в зависимости от «химической стабильности» или от условий их применения, то есть остаток Lys, Arg или His может быть заменен отрицательно заряженной или нейтральной аминокислотой. Предпочтительными замененными аминокислотами могут быть отрицательно заряженные аминокислоты, такие как Asp и Glu, или нейтральные аминокислоты, такие как Ala, Asn, Gln, Tyr, Trp и Phe. Предпочтительный вариант согласно изобретению содержит модификацию в одном или нескольких положениях, выбранных из группы, состоящей из положений 49, 87, 118, 129, 134, 142, 156, 169 и 197. В предпочтительном варианте изобретения указанными модификациями являются замены в одном или нескольких положениях, выбранных из группы, состоящей из положений 87, 118, 129, 134, 142, 156 и 169. В предпочтительном варианте изобретения, указанная замена выбрана из группы, состоящей из K87A; K129A,S,F,I; K118A; K142A,Q, R156Y,F,V,I,K,W,L,M и K169Q,A.
В одном из аспектов изобретения, вариант родительской ксилоглюканазы содержит модификацию в одном или более (нескольких) положениях, соответствующих положениям 68, или 123, или 156, или 118, или 200, или 129, или 137, или 193, или 92, или 76, или 331. Предпочтительный вариант имеет замену в положении 68 и одну или несколько замен в одном или нескольких дополнительных положениях, выбранных из группы, состоящей из положений 123, 156, 118, 200, 129, 137, 193, 92, 83, 149, 34, 340, 332, 9, 76, 331, 310, 324, 498, 395 и 366.
В другом аспекте изобретения, вариант имеет замену в положении 156 и одну или несколько замен в одном или нескольких дополнительных положениях, выбранных из группы, состоящей из положений 10, 13, 14, 19, 37, 68, 78, 92, 118, 123, 129, 137, 139, 140, 147, 159, 164, 165, 169, 176, 177, 179, 183, 200, 204, 211, 222, 224, 244, 247, 249, 259, 267, 268, 269, 275, 288, 299, 301, 302, 303, 310, 324, 328, 331, 366, 380, 383, 384, 389, 406, 409, 415, 436, 443, 445, 449, 450, 454, 455, 456, 461, 470 и 507.
В другом аспекте изобретения, вариант родительской ксилоглюканазы включает модификации в двух или более (нескольких) положениях, соответствующих положениям 68, или 123, или 156, или 118, или 200, или 129, или 137, или 193, или 92, или 76, или 331. Предпочтительный вариант имеет замену в положении 68, или 123, или 156, или 118, или 200, или 129. Еще более предпочтительный вариант имеет замены в положениях 129 и 156.
В другом аспекте изобретения, вариант родительской ксилоглюканазы имеет модификации в трех или более (нескольких) положениях, соответствующих положениям 68, или 123, или 156, или 118, или 200, или 129, или 137, или 193, или 92, или 76, или 331.
В другом аспекте изобретения, вариант родительской ксилоглюканазы имеет модификации в четырех или более (нескольких) положениях, соответствующих положениям 68, или 123, или 156, или 118, или 200, или 129, или 137, или 193, или 92, или 76, или 331.
В другом аспекте изобретения, вариант родительской ксилоглюканазы имеет модификации в пяти или более (нескольких) положениях, соответствующих положениям 68 или 123, или 156, или 118, или 200, или 129, или 137, или 193, или 92, или 76, или 331.
В другом аспекте изобретения, вариант родительской ксилоглюканазы имеет модификации в шести или более (нескольких) положениях, соответствующих положениям 68, или 123, или 156, или 118, или 200, или 129, или 137, или 193, или 92. или 76, или 331.
В другом аспекте изобретения, вариант родительской ксилоглюканазы имеет модификации в семи или более (нескольких) положениях, соответствующих положениям 68 или 123, или 156, или 118, или 200, или 129, или 137, или 193, или 92, или 76, или 331.
В другом аспекте изобретения, вариант родительской ксилоглюканазы имеет модификации в положениях, соответствующих положениям 129, и 156, и 331, и 200, и 118.
В другом аспекте изобретения, вариант родительской ксилоглюканазы имеет модификации в положениях, соответствующих положениям 68, и 129, и 156, и 331, и 200, и 118.
В другом аспекте изобретения, вариант родительской ксилоглюканазы имеет модификации в положениях, соответствующих положениям 68, и 92, и 129, и 156, и 331, и 200, и 118.
В другом аспекте изобретения, вариант содержит одну или более (несколько) замен, выбранных из группы, состоящей из Q68H,N,L; S123P,T; R156Y,F,V,I,K,W,L,M; K118A,R; G200P,E,S,D; K129T,A,S; Q137E; H193T,S,D; T92V,I,A,S; A83E; Q149E; L34F,I,V; R340T,N; S332P; T9D; S76W,V,I,K,R,T; N331F,C; M310I,V,L; D324N; G498A,D; D395G и D366H. Предпочтительные замены выбраны из группы, состоящей из Q68H; S123P; R156Y,F; K118A; G200P,E; K129T,A; Q137E; H193T; T92V и N331F. Более предпочтительные замены выбраны из группы, состоящей из Q68H; S123P; R156Y,F; K118A; G200P,E; K129T,A; Q137E; T92V и N331F. Более предпочтительно, указанный вариант содержит замену в девяти или восьми, в семи, или в шести, или в пяти, или в четырех, или в трех, или в двух, или в одном положении, где указанные замены выбраны из группы, состоящей из Q68H; S123P; R156Y,F; K118A; G200P,E; K129T,A; Q137E; T92V и N331F.
В другом аспекте изобретения, вариант содержит одну или более (несколько) нижеследующих комбинаций замен:
|
В предпочтительном варианте изобретения, все варианты, описанные выше, представляют собой варианты родительской ксилоглюканазы, принадлежащей к семейству из 44 гликозилгидролаз, где более предпочтительная родительская ксилоглюканаза выбрана из ксилоглюканазы, имеющей последовательность, которая по меньшей мере на 65%, более предпочтительно, по меньшей мере на 70%, более предпочтительно, по меньшей мере на 75%, еще более предпочтительно, по меньшей мере на 80%, еще более предпочтительно, по меньшей мере на 85%, еще более предпочтительно, по меньшей мере на 90%, а наиболее предпочтительно, по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO:3, при этом более предпочтительная родительская ксилоглюканаза выбрана из группы, состоящей из SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 5 и SEQ ID NO: 7, а наиболее предпочтительная родительская ксилоглюканаза состоит из SEQ ID NO: 3.
Полинуклеотиды
Настоящее изобретение также относится к выделенным полинуклеотидам, кодирующим варианты родительской ксилоглюканазы согласно изобретению. В частности, полинуклеотиды, кодирующие вариант ксилоглюканазы, описаны выше в разделе «Вариант» и входят в объем настоящего изобретения. Полинуклеотиды согласно изобретению гибридизуются с денатурированным двухцепочечным ДНК-зондом, содержащим полноразмерную последовательность варианта, соответствующую положениям 82-1653 SEQ ID NO: 1 или положениям 97-1653 SEQ ID NO: 1, где нужные модификации последовательности соответствуют фактическим аминокислотным модификациям в данном варианте или в любом зонде, включающем подпоследовательность варианта, имеющую длину по меньшей мере примерно 100 пар оснований, по меньшей мере в условиях умеренной жесткости, а предпочтительно, в условиях высокой жесткости. Вариант полинуклеотидов согласно изобретению может также содержать молчащие мутации, а также мутации, приводящие к образованию аминокислотных модификаций, описанных выше в разделе «Вариант». Молчащими мутациями являются мутации в кодоне, которые не приводят к замене аминокислоты, например, при замене кодона GTT на кодон GAT, которые оба кодируют валин.
Полинуклеотиды, кодирующие варианты ксилоглюканазы согласно изобретению, включают ДНК и РНК. Методы выделения ДНК и РНК хорошо известны специалистам. ДНК и РНК, имеющие представляющие интерес гены, могут быть клонированы в банках генов или в библиотеках ДНК методами, известными специалистам. Затем полинуклеотиды, кодирующие полипептиды, обладающие ксилоглюканазной активностью согласно изобретению, идентифицируют и выделяют, например, путем гибридизации или с помощью ПЦР.
Экспрессионные векторы
Настоящее изобретение также относится к экспрессионным векторам, а, в частности к рекомбинантным экспрессионным векторам, содержащим конструкцию нуклеиновой кислоты согласно изобретению. Конструкции нуклеиновой кислоты согласно изобретению включают выделенный полинуклеотид, кодирующий вариант ксилоглюканазы согласно изобретению, предпочтительно, функционально связанный с одной или несколькими регуляторными последовательностями, которые регулируют экспрессию кодирующей последовательности в подходящей клетке-хозяине в условиях, подходящих для таких регуляторных последовательностей. При создании экспрессионного вектора кодирующая последовательность должна быть расположена в векторе так, чтобы она была функционально связана с соответствующими регуляторными последовательностями для экспрессии. Регуляторные последовательности могут присутствовать либо в векторах, либо в конструкциях нуклеиновой кислоты, встроенных в данный вектор.
Регуляторной последовательностью может быть соответствующая промоторная последовательность, то есть нуклеотидная последовательность, распознаваемая клеткой-хозяином, экспрессирующей полинуклеотид, кодирующий полипептид согласно изобретению. Промотором может быть любая нуклеотидная последовательность, обладающая транскрипционной активностью в выбранной клетке-хозяине, включая мутантные, усеченные и гибридные промоторы, и такой промотор может быть получен из генов, кодирующих внеклеточные или внутриклеточные полипептиды, которые являются либо гомологичными, либо гетерологичными для данной клетки-хозяина. Такие промоторы хорошо известны специалистам. Регуляторной последовательностью может быть также подходящая последовательность терминации транскрипции, то есть последовательность, распознаваемая клеткой-хозяином для терминации транскрипции. Последовательность терминации транскрипции функционально связана с 3'-концом нуклеотидной последовательности, кодирующей полипептид. В настоящем изобретении может быть использован любой терминатор, который является функциональным в выбранной клетке-хозяине, и такие терминаторы хорошо известны специалистам. Регуляторной последовательностью может быть также подходящая лидерная последовательность, то есть нетранслируемая область мРНК, которая играет важную роль в трансляции последовательности в клетке-хозяине. Лидерная последовательность функционально связана с 5'-концом нуклеотидной последовательности, кодирующей полипептид. В настоящем изобретении может быть использована любая лидерная последовательность, которая является функциональной в выбранной клетке-хозяине, и такие лидерные последовательности хорошо известны специалистам. Регуляторной последовательностью может быть также область, кодирующая сигнальный пептид, где указанная область кодирует аминокислотную последовательность, присоединенную к аминоконцу полипептида, и направляет кодируемый полипептид по клеточному секреторному пути. 5'-конец кодирующей нуклеотидной последовательности, по своей природе, может содержать область, кодирующую сигнальный пептид и обычно присоединенную, в транслируемой открытой рамке считывания, к сегменту области, кодирующей секретируемый полипептид. Альтернативно, 5'-конец кодирующей последовательности может содержать область, кодирующую сигнальный пептид, которая является чужеродной для кодирующей последовательности. Такая чужеродная область, кодирующая сигнальный пептид, может быть необходимой в том случае, когда кодирующая последовательность, по своей природе, не содержит область, кодирующую сигнальный пептид. Альтернативно, чужеродная область, кодирующая сигнальный пептид, может быть просто заменена природной областью, кодирующей сигнальный пептид, что будет приводить к повышению уровня секреции полипептида. Однако в настоящем изобретении может быть использована любая область, кодирующая сигнальный пептид, которая будет направлять экспрессируемый полипептид по секреторному пути выбранной клетки-хозяина. Регуляторной последовательностью может быть также последовательность полиаденилирования, которая функционально связана с 3'-концом нуклеотидной последовательности, и которая, при ее транскрипции, будет распознаваться клеткой-хозяином как сигнал к присоединению полиаденозиновых остатков к транскрибируемой мРНК. В настоящем изобретении может быть использована любая последовательность полиаденилирования, которая является функциональной в выбранной клетке-хозяине. Может также оказаться желательным присоединение регуляторных последовательностей, которые осуществляют регуляцию экспрессии полипептида, ассоциированного с ростом клетки-хозяина. Примерами регуляторных систем являются системы, индуцирующие экспрессию гена, включающегося или выключающегося в ответ на действие химических или физических факторов, включая присутствие регуляторного соединения.
Выделенный полинуклеотид, кодирующий вариант ксилоглюканазы согласно изобретению, может быть модифицирован различными способами для сообщения ему способности экспрессировать данный полипептид. Модификация полинуклеотидной последовательности перед ее встраиванием в вектор может оказаться желательной или необходимой в зависимости от экспрессионного вектора. Методы модификации полинуклеотидных последовательностей с применением техники рекомбинантных ДНК хорошо известны специалистам. Кроме того, к данному полипептиду могут быть присоединены метки, которые могут облегчать очистку или иммобилизацию полипептида. Такой меткой может быть, например, полигистидиновая метка (His-метка). Предпочтительно, эта метка расположена у N- или C-конца полипептида и может кодироваться вектором. Альтернативно, данная метка может быть расположена внутри полипептида при условии, что она не будет влиять на функциональные свойства полипептида.
Рекомбинантным экспрессионным вектором может быть любой вектор (например, плазмида, фагмида, фаг или вирус), который может быть подвергнут стандартным процедурам в соответствии с техникой рекомбинантных ДНК и может индуцировать экспрессию нуклеотидной последовательности. Выбор вектора обычно зависит от совместимости данного вектора с клеткой-хозяином, в которую встраивают данный вектор.
Векторами могут быть линейные или замкнутые кольцевые плазмиды. Таким вектором может быть автономно реплицирующийся вектор, то есть вектор, присутствующий во внехромосомной молекуле, репликация которой не зависит от хромосомной репликации, например, в плазмиде, во внехромосомном элементе, в минихромосоме или в искусственной хромосоме.
Вектор может содержать любые элементы, обеспечивающие саморепликацию. Альтернативно, вектором может быть такой вектор, который, при его встраивании в клетку-хозяина, интегрируется в геном клетки-хозяина и реплицируется вместе с хромосомой(ами), в которую(ые) он интегрирован. Кроме того, могут быть использованы один вектор или одна плазмида, либо два или более векторов, или две или более плазмид, которые имеют общую ДНК, встраиваемую в геном клетки-хозяина или транспозон.
Векторы согласно изобретению, предпочтительно, содержат один или несколько селективных маркеров, облегчающих отбор трансформированных клеток. Селективный маркер представляет собой ген, продукт которого сообщает резистентность к биоцидам или вирусам, резистентность к тяжелым металлам, прототрофам или ауксотрофам и т.п. Примерами бактериальных селективных маркеров являются гены dal, происходящие от Bacillus subtilis или Bacillus licheniformis, или маркеры, сообщающие резистентность к антибиотикам, таким как ампициллин, канамицин, хлорамфеникол или тетрациклин. Подходящими маркерами для дрожжевых клеток-хозяев являются ADE2, HIS3, LEU2, LYS2, MET3, TRP1 и URA3. Селективными маркерами, используемыми в клетках-хозяевах нитчатых грибов, являются, но не ограничиваются ими, amdS (ацетамидаза), argB (орнитин-карбамоилтрансфераза), bar (фосфинотрицин-ацетилтрансфераза), hygB (гигромицинфосфотрансфераза), niaD (нитратредуктаза), pyrG (оротидин-5'-фосфатдекарбоксилаза), sC (сульфат-аденилтрансфераза), trpC (антранилатсинтаза), а также их эквиваленты. Генами, предпочтительными для использования в клетках Aspergillus, являются гены amdS и pyrG Aspergillus nidulans или Aspergillus oryzae, и ген bar Streptomyces hygroscopicus.
Векторы согласно изобретению могут содержать элемент(ы), позволяющий(ие) осуществлять стабильную интеграцию вектора в геном клетки-хозяина или автономную репликацию вектора в клетке независимо от генома.
Для повышения уровня продуцирования генного продукта, в клетку-хозяина могут быть встроены более чем одна копия нуклеотидной последовательности согласно изобретению. Увеличение числа копий нуклеотидной последовательности может быть достигнуто путем интергации по меньшей мере одной дополнительной копии последовательности в геном клетки-хозяина или путем включения амплифицируемого селективного маркерного гена с указанной нуклеотидной последовательностью, где клетки, содержащие амплифицированные копии селективного маркерного гена и, тем самым, дополнительные копии нуклеотидной последовательности, могут быть отобраны путем их культивирования в присутствии соответствующего селективного агента.
Методы, применяемые для лигирования описанных выше элементов в целях конструирования рекомбинантных экспрессионных векторов согласно изобретению, хорошо известны специалистам в данной области (см., например, Sambrook et al., 1989, см. выше).
В одном из вариантов изобретения, плазмидный вектор может содержать следующие элементы:
i) область, кодирующую сигнальный пептид (например, область, полученную от генов мальтогенной амилазы штамма NCIB 11837 Bacillus, альфа-амилазы Bacillus stearothermophilus, субтилизина Bacillus licheniformis, альфа-амилазы Bacillus licheniformis, нейтральной протеазы Bacillus stearothermophilus (nprT, nprS, nprM), и prsA Bacillus subtilis), за которой следует полинуклеотидная последовательность, кодирующая зрелый вариант ксилоглюканазы. За указанной последовательностью могут следовать функционально связанные с ней элементы:
ii) последовательность ДНК, включающую мРНК-стабилизирующй сегмент (например, происходящий от гена Cryllla, как указано в заявке WO 99/043835);
iii) маркерный ген (например, ген резистентности к хлорамфениколу); и
iv) геномная ДНК от Bacillus subtilis в виде 5'- и 3'-фланкирующих сегментов, расположенных выше и ниже указанного полинуклеотида соответственно, что позволяет осуществлять геномную интеграцию посредством гомологичной рекомбинации между фланкирующими сегментами и геномом Bacillus.
Описанные выше векторы могут быть использованы для получения и скрининга вариантов с применением вышеописанных методов мутагенеза.
Клетки-хозяева
Настоящее изобретение также относится к рекомбинантным клеткам-хозяевам, содержащим полинуклеотид, кодирующий вариант ксилоглюканазы согласно изобретению, который преимущественно используется при рекомбинантном продуцировании полипептидов. Вектор, включающий полинуклеотидную последовательность согласно изобретению, вводят в клетки-хозяева так, чтобы указанный вектор присутствовал в виде хромосомного интегранта, либо в виде самореплицирующегося внехромосомного вектора, описанного выше.
Указанной клеткой-хозяином могут быть прокариотические клетки, такие как бактериальные клетки, архебактерии или эукариотические клетки, такие как клетки грибов, клетки растений, клетки насекомых или клетки млекопитающих.
Используемыми прокариотами являются клетки бактерий, такие как клетки грамположительных бактерий, включая, но не ограничиваясь ими, клетки Bacillus, например, Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus brevis, Bacillus circulans, Bacillus clausii, Bacillus coagulans, Bacillus halodurans, Bacillus lautus, Bacillus lentus, Bacillus licheniformis, Bacillus megaterium, Bacillus stearothermophilus, Bacillus subtilis и Bacillus thuringiensis; или клетки Streptomyces, например Streptomyces lividans или Streptomyces murinus, либо клетки грамотрицательных бактерий, такие как клетки E.coli и Pseudomonas sp. В предпочтительном варианте изобретения, бактериальной клеткой-хозяином является клетка Bacillus lentus, Bacillus licheniformis, Bacillus stearothermophilus или Bacillus subtilis. В другом предпочтительном варианте изобретения, клеткой Bacillus является клетка алкалофильной Bacillus.
Введение вектора в бактериальную клетку-хозяина может быть осуществлено, например, путем трансформации протопластов (см., например, Chang and Cohen, 1979, Molecular General Genetics 168: 111-115), с использованием компетентных клеток (см., например, Young and Spizizin, 1961, Journal of Bacteriology 81: 823-829, или Dubnau and Davidoff-Abelson, 1971, Journal of Molecular Biology 56: 209-221), путем электропорации (см., например, Shigekawa and Dower, 1988, Biotechniques 6: 742-751), или путем конъюгирования (см., например, Koehler and Thome, 1987, Journal of Bacteriology 169: 5771-5278).
В предпочтительном варианте изобретения, клеткой-хозяином является клетка грибов. Используемый здесь термин «грибы» включает грибы типа Ascomycota, Basidiomycota, Chytridiomycota и Zygomycota (определенные в публикации Hawksworth et al., Ainsworth and Bisby's Dictionary of The Fungi, 8th edition, 1995, CAB International, University Press, Cambridge, UK), а также Oomycota (упоминаемые в публикации Hawksworth et al., Ainsworth and Bisby's Dictionary of The Fungi, 8th edition, 1995, CAB International, University Press, Cambridge, UK, page 171) и все митоспоровые грибы (Hawksworth et al., In, Ainsworth and Bisby's Dictionary of The Fungi, 8th edition, 1995, CAB International, University Press, Cambridge, UK). В более предпочтительном варианте изобретения, грибковой клеткой-хозяином является дрожжевая клетка. Используемый здесь термин «дрожжи» включает аскоспорогенные дрожжи (Endomycetales), базидиоспорогенные дрожжи и дрожжи, принадлежащие к несовершенным грибам (Blastomycetes). Поскольку в будущем классификация дрожжей может изменяться, то в соответствии с настоящим изобретением, дрожжи должны быть определены как описано в публикации Biology and Activities of Yeast (Skinner, Passmore and Davenport, eds, Soc. App. Bacteriol. Symposium Series N9, 1980).
В еще более предпочтительном варианте изобретения, дрожжевой клеткой-хозяином является клетка Candida, Hansenula, Kluyveromyces, Pichia, Saccharomyces, Schizosaccharomyces или Yarrowia. В наиболее предпочтительном варианте изобретения, дрожжевой клеткой-хозяином является клетка Saccharomyces carlsbergensis, Saccharomyces cerevisiae, Saccharomyces diastaticus, Saccharomyces douglasii, Saccharomyces kluyveri, Saccharomyces norbensis или Saccharomyces oviformis. В другом наиболее предпочтительном варианте изобретения, дрожжевой клеткой-хозяином является клетка Kluyveromyces lactis. В другом наиболее предпочтительном варианте изобретения, дрожжевой клеткой-хозяином является клетка Yarrowia lipolytica.
В другом более предпочтительном варианте изобретения, грибковой клеткой-хозяином является клетка нитчатых грибов. Термин «нитчатые грибы» включает все формы нитчатых грибов подразделения Eumycota и Oomycota (определенного Hawksworth et ai, в Ainsworth and Bisby's Dictionary of The Fungi, 8th edition, 1995, CAB International, University Press, Cambridge, UK). Нитчатые грибы характеризуются тем, что стенки их мицелия состоят из хитина, целлюлозы, глюкана, хитозана, маннана и других комплексных полисахаридов. Вегетативный рост происходит за счет удлинения гифов, а катаболизм углерода является облигатно аэробным. В противоположность этому, вегетативный рост дрожжей, таких как Saccharomyces cerevisiae, происходит за счет почкования одноклеточного таллома, а катаболизм углерода может быть ферментативным. В еще более предпочтительном варианте изобретения, клеткой-хозяином нитчатых грибов является клетка грибов, принадлежащих к виду, который включает, но не ограничивается ими, Acremonium, Aspergillus, Fusarium, Humicola, Mucor, Myceliophthora, Neurospora, Penicillium, Thielavia, Tolypocladium или Trichoderma. В наиболее предпочтительном варианте изобретения, клеткой-хозяином нитчатых грибов является клетка Aspergillus awamori, Aspergillus foetidus, Aspergillus japonicus, Aspergillus nidulans, Aspergillus niger или Aspergillus oryzae. В другом наиболее предпочтительном варианте изобретения, клеткой-хозяином нитчатых грибов является клетка Fusarium bactridioides, Fusarium cerealis, Fusarium crookwellense, Fusarium culmorum, Fusarium graminearum, Fusarium graminum, Fusarium heterosporum, Fusarium negundi, Fusarium oxysporum, Fusarium reticulatum, Fusarium roseum, Fusarium sambucinum, Fusarium sarcochroum, Fusarium sporotrichioides, Fusarium sulphureum, Fusarium torulosum, Fusarium trichothecioides или Fusarium venenatum. В наиболее предпочтительном варианте изобретения, родительской клеткой нитчатых грибов является клетка Fusarium venenatum (Nirenberg sp. nov.). В другом наиболее предпочтительном варианте изобретения, клеткой-хозяином нитчатых грибов является клетка Humicola insolens, Humicola lanuginosa, Mucor miehei, Myceliophthora thermophila, Neurospora crassa, Penicillium purpurogenum, Thielavia terrestris, Trichoderma harzianum, Trichoderma koningii, Trichoderma longibrachiatum, Trichoderma reesei или Trichoderma viride.
Клетки грибов могут быть трансформированы способом, включающим образование протопластов, трансформацию протопластов и регенерацию клеточной стенки по механизму, известному per se. Подходящие способы трансформации клеток-хозяев Aspergillus описаны в EP 238023 и в публикации Yelton et al., 1984, Proceedings of the National Academy of Sciences USA 81:1470-1474. Подходящие методы трансформации вида Fusarium описаны в публикации Malardier et al., 1989, Gene 78: 147-156 и в WO 96/00787. Дрожжи могут быть трансформированы методами, описанными Becker and Guarente в издании Abelson and Simon, Guide to Yeast Genetics and Molecular Biology, Methods in Enzymology 194: 182-187, Academic Press, Inc., New York; Ito et al., 1983, Journal of Bacteriology 153:163; и Hinnen et ai, 1978, Proceedings of the National Academy of Sciences USA 75: 1920.
Конкретным вариантом настоящего изобретения является рекомбинантная клетка-хозяин, трансформированная полинуклеотидом, кодирующим вариант ксилоглюканазы согласно изобретению. Предпочтительно, такая клетка-хозяин не содержит природного гена, кодирующего ксилоглюканазу, либо такой ген является дезинтегрированным. Поэтому рекомбинантный вариант ксилоглюканазы представляет собой лишь ксилоглюканазу, продуцированную рекомбинантной клеткой-хозяином согласно изобретению.
Способы получения
Настоящее изобретение также относится к способам получения варианта ксилоглюканазы, включающим: (a) культивирование клетки-хозяина согласно изобретению в условиях, подходящих для экспрессии данного варианта; и (b) выделение данного варианта из культуральной среды.
В способах получения согласно изобретению, клетки-хозяева культивируют в питательной среде, подходящей для продуцирования варианта ксилоглюканазы с применением методов, известных специалистам. Так, например, клетки могут быть выращены путем культивирования в шейкерных колбах или путем лабораторной или крупномасштабной ферментации (включая, непрерывную ферментацию, периодическую ферментацию, периодическую ферментацию с подпиткой или объемную ферментацию) в лабораторных или в промышленных ферментерах, осуществляемой в подходящей среде и в условиях, обеспечивающих экспрессию и/или выделение данного полипептида. Культивирование проводят в подходящей питательной среде, содержащей углерод, источники азота и неорганические соли, в соответствии с процедурами, известными специалистам. Подходящие среды закупают у коммерческих поставщиков, либо они могут быть получены в соответствии с известной рецептурой (имеющейся, например, в каталогах Американской коллекции типовых культур). Если полипептид секретируется в питательную среду, то такой полипептид может быть непосредственно выделен из этой среды. Если данный полипептид не секретируется в среду, то он может быть выделен из клеточных лизатов.
Одним из вариантов настоящего изобретения является способ получения варианта родительской ксилоглюканазы, где указанный вариант обладает ксилоглюканазной активностью, и где указанный способ включает: a) культивирование клеток в условиях, подходящих для экспрессии данного варианта, где указанные клетки содержат полинуклеотидную последовательность, кодирующую вариант родительской ксилоглюканазы, где указанный вариант модифицирован в одном или более (нескольких) положениях аминокислот, выбранных из группы, состоящей из положений 68, 123, 156, 118, 200, 129, 137, 193, 92, 83, 149, 34, 340, 332, 9, 76, 331, 310, 324, 498, 395, 366, 1, 374, 7, 140, 8, 14, 21, 211, 37, 45, 13, 78, 87, 436, 101, 104, 111, 306, 117, 119, 414, 139, 268, 142, 159, 164, 102, 168, 176, 180, 482, 183, 202, 206, 217, 4, 222, 19, 224, 228, 232, 2, 240, 244, 5, 247, 249, 328, 252, 259, 406, 267, 269, 275, 179, 166, 278, 281, 288, 298, 301, 18, 302, 165, 80, 303, 316, 169, 322, 120, 146, 342, 348, 147, 353, 380, 468, 382, 383, 38, 384, 389, 391, 10, 392, 396, 177, 397, 399, 409, 237, 413, 253, 415, 418, 40, 443, 445, 148, 449, 225, 450, 454, 3, 455, 456, 299, 461, 470, 204, 476, 488, 347 и 507, и где указанную полинуклеотидную последовательность получают путем мутагенеза родительской полинуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 4 и SEQ ID NO: 6, или родительской полинуклеотидной последовательности, которая по меньшей мере на 65%, более предпочтительно, по меньшей мере на 70%, более предпочтительно, по меньшей мере на 75%, еще более предпочтительно, по меньшей мере на 80%, еще более предпочтительно, по меньшей мере на 85%, еще более предпочтительно, по меньшей мере на 90%, а наиболее предпочтительно, по меньшей мере на 95% идентична нуклеотидной последовательности SEQ ID NO:1; и b) выделение указанного варианта ксилоглюканазы из культуральной среды.
В альтернативном аспекте изобретения, вариант ксилоглюканазы не выделяют, а в качестве источника данного варианта используют клетку-хозяина согласно изобретению, экспрессирующую такой вариант.
Вариант ксилоглюканазы может быть детектирован известными методами, которые являются специфичными для экспрессируемых полипептидов. Такие методы детектирования могут включать использование специфических антител, оценку образования ферментного продукта или определение исчезновения субстрата фермента. Так, например, ферментный анализ может быть использован для определения активности варианта ксилоглюканазы, описанного в примерах, представленных в настоящей заявке.
Полученный вариант ксилоглюканазы может быть выделен методами, известными специалистам. Так, например, полипептид может быть выделен из питательной среды стандартными методами, включая, но не ограничиваясь ими, сбор, центрифугирование, фильтрацию, экстракцию, сушку распылением, выпаривание или осаждение.
Вариант ксилоглюканазы согласно изобретению может быть очищен различными методами, известными специалистам, включая, но не ограничиваясь ими, хроматографию (например, ионообменную хроматографию, аффинную хроматографию, гидрофобную хроматографию, хроматофокусирование и эксклюзионную хроматографию), электрофорез (например, препаративное изоэлектрическое фокусирование), дифференциальное растворение (например, преципитацию сульфатом аммония), электрофорез в ДСН-ПААГ или экстракцию (см., например, Protein Purification, J.-C. Janson and Lars Ryden, editors, VCH Publishers, New York, 1989) с получением, по существу, чистых вариантов ксилоглюканазы.
Композиции
Настоящее изобретение также относится к композициям, включающим вариант ксилоглюканазы или полипептид, обладающие ксилоглюканазной активностью согласно изобретению. Указанные композиции, предпочтительно, обогащены таким вариантом или полипептидом. Термин «обогащенный» означает, что ксилоглюканазная активность композиции повышается, например, в 1,1 или более раз. Указанные композиции, предпочтительно, приготавливают так, чтобы они обладали желаемыми свойствами, то есть почти не имели окраску, почти не имели запаха и обладали приемлемой стабильностью при хранении.
Указанная композиция может содержать вариант или полипептид согласно изобретению в качестве основного ферментного компонента; так, например, данная композиция может состоять из одного компонента. Альтернативно, такая композиция может обладать ферментативной активностью, например, она может включать аминопептидазу, амилазу, карбогидразу, карбоксипептидазу, каталазу, целлюлазу, хитиназу, кутиназу, циклодекстрин-гликозилтрансферазу, дезоксирибонуклеазу, эстеразу, альфа-галактозидазу, бета-галактозидазу, глюкоамилазу, альфа-глюкозидазу, бета-глюкозидазу, галопероксидазу, инвертазу, лакказу, липазу, маннозидазу, оксидазу, пектинолитический фермент, пептидоглутаминазу, пероксидазу, фитазу, полифенолоксидазу, протеолитический фермент, рибонуклеазу, трансглутаминазу или ксиланазу.
Полипептидные композиции могут быть получены методами, известными специалистам, и могут представлять собой жидкий или сухой препарат. Так, например, полипептид может быть получен в форме гранулята или микрогранулята. Вариант или полипептид, включенные в данную композицию, могут быть стабилизированы методами, известными специалистам. В предпочтительном варианте изобретения вариант ксилоглюканазы получают в виде жидкой композиции.
Применение
Настоящее изобретение также относится к способам применения вариантов ксилоглюканазы.
Варианты ксилоглюканазы, предпочтительно, вводят в моющие композиции и/или используют вместе с моющими композициями, такими как, например, моющие композиции для стирки, например, моющие композиции для стирки в домашних условиях, а, в частности, жидкие моющие композиции для стирки. Моющая композиция обычно содержит стандартные ингредиенты детергентов, такие как поверхностно-активные вещества (анионные, катионные, неионные, цвиттерионные, амфотерные), модифицирующие добавки, отбеливатели, полимеры и другие ферменты и другие ингредиенты, описанные, например, в заявках WO 2007/130562 и WO 2007/149806, которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
Моющая композиция может быть получена в любой форме, такой как твердое вещество, жидкость, гель или любая их комбинация, при этом предпочтительной композицией является жидкая композиция, а более предпочтительно, жидкая моющая композиция для стирки.
Одним из аспектов изобретения является применение варианта ксилоглюканазы или композиции варианта ксилоглюканазы согласно изобретению вместе с моющей композицией для предотвращения пиллинга ткани, и/или для придания ткани мягкости, и/или для сохранения ее окраски, и/или для удаления пятен, и/или для предупреждения переосаждения загрязнений на ткань, и/или для ингибирования переноса красителя на ткань в целях улучшения качества ткани или одежды.
Кроме того, настоящее изобретение относится к способу стирки тканей, включающему обработку тканей моющим раствором, содержащим моющую композицию и вариант ксилоглюканазы или композицию варианта ксилоглюканазы согласно изобретению. Такая стирка может быть осуществлена, например, на стиральной машине или вручную. Моющим раствором может быть, например, водный моющий раствор, содержащий моющую композицию и имеющий рН в пределах 3-12.
В процессе стирки и носки, поверхность тканей или одежды загрязняется фрагментами разорванных или разрыхленных волокон, которые придают ткани линялый и изношенный вид. Удаление этих волокон с поверхности ткани позволяет частично сохранить ее первоначальный цвет и вид, придает ей более яркую окраску и улучшает ее внешний вид. Вариант ксилоглюканазы или композиция варианта ксилоглюканазы могут быть использованы для сохранения цвета ткани и/или для улучшения ее внешнего вида при проведении одного цикла или нескольких (повторных) циклов полоскания.
Кроме того, микроволокна, выступающие на поверхность текстильного изделия, могут собираться в небольшие комочки, так называемые пилли или ворсинки, которые прилипают к поверхности ткани и портят ее внешний вид. Вариант ксилоглюканазы или композиция варианта ксилоглюканазы согласно изобретению могут быть использованы для удаления таких комочков (пиллей), то есть для достижения эффекта, который называется предотвращением пиллинга.
Сохранение окраски и предотвращение пиллинга могут быть оценены визуально группой специалистов. Эти эффекты могут быть измерены по отражению света или путем определения ворсистости хлопчатобумажной ткани методом оптических измерений. Эти методы, в основном, известны специалистам и кратко описаны в публикации Enzymes in Detergency, 1997, опубликованной Marcel Dekker, стр. 139-140.
В частности, с увеличением циклов полоскания, на поверхности текстильного волокна образуется осадок, который может включать пятна грязи, содержащие крупные частицы; растворимые пятна грязи; красители; пигменты и нерастворимые соли. Это может приводить к видимому ухудшению кажущейся чистоты изделия после стирки, например, придавать ткани сероватый или желтоватый оттенок. Для предупреждения этого, в циклах полоскания может быть использован вариант ксилоглюканазы или композиция варианта ксилоглюканазы. Этот эффект называется «предотвращение переосаждения загрязнений на ткань» или «ингибированием переноса красителя на ткань» или «удалением пятен» и может быть оценен методами оптических измерений.
Частички грязи или нерастворимой соли, захватываемые на поверхности ткани и застревающие между волокнами, могут сообщать ткани жесткость. При использовании в циклах стирки вариантов ксилоглюканазы или композиции варианта ксилоглюканазы согласно изобретению можно придать данной ткани большую мягкость.
Ткани, обрабатываемые способами согласно изобретению, могут быть подвергнуты обычной стирке, например стирке в домашних условиях. При этом большинство вещей, пригодных для стирки, представляет собой одежду и ткани, включая вязанные изделия, тканые изделия, изделия из хлопчато-бумажной ткани «деним», изделия из пряжи и полотенечной ткани, изделия, изготовленные из хлопка, из смешанной ткани, включающей хлопковое волокно, или натуральное, или синтетическое целлюлозное волокно (например, полученное из древесной целлюлозы), или их смеси. Примерами смешанных тканей являются смеси хлопчато-бумажной ткани или исскуственного шелка/вискозы с одним или несколькими сопутствующими материалами, такими как шерсть, синтетическое волокно (например, полиамидное волокно, акриловое волокно, полиэфирное волокно, волокно из поливинилового спирта, поливинилхлоридное волокно, полиуретановое волокно, волокно из полимочевины, арамидное волокно) и волокно, содержащее целлюлозу (например, искусственный шелк/вискоза, волокно рами, лен/льняное полотно, джут, волокно из ацетата целлюлозы, лиоцель).
Известно, что обработка тканей или одежды моющим раствором, содержащим вариант ксилоглюканазы или композицию варианта ксилоглюканазы согласно изобретению может быть особенно полезной, например, при изготовлении нового волокна, и/или новой ткани, и/или новой одежды, а также при стирке используемой ткани и/или одежды, например, в домашних или в промышленных условиях.
Доза варианта ксилоглюканазы или композиции варианта ксилоглюканазы согласно изобретению и другие условия, в которых используется такая композиция, включая состав и концентрацию моющего раствора, могут быть определены методами, известными специалистам.
Настоящее изобретение более подробно описано в нижеследующих примерах, которые не должны рассматриваться как ограничение объема изобретения.
Ксилоглюканазы могут быть использованы в композициях согласно изобретению для эффективного удаления пятен, содержащих производные целлюлозы или гемицеллюлозы, для более эффективного ингибирования переосаждения загрязнений на ткань и для облегчения удаления пятен. Ксилоглюканазы могут быть также использованы в данных композициях для облегчения удаления пятен из хлопчато-бумажной ткани в процессе последующей стирки. Такой эффект удаления пятен может наблюдаться на хлопчато-бумажной ткани и на тканях всех типов, имеющих высокое содержание хлопка, таких как ткани, изготовленные из смеси хлопкового и синтетического волокна (например, полиэстера, полиамида, такого как найлонТМ, и эластана).
Примеры
Пример 1 - Получение и очистка вариантов ксилоглюканазы
Варианты ксилоглюканазы согласно изобретению были получены стандартными методами, а именно, путем введения неспецифических и/или сайт-направленных мутаций в ген; трансформации клеток-хозяев Bacillus subtilis мутированными генами; ферментации трансформированных клеток-хозяев и получения варианта ксилоглюканазы из ферментационного бульона. Эталонную ксилоглюканазу (SEQ ID NO: 3) продуцировали в рекомбинантной Bacillus subtilis аналогичным образом.
Ферментацию осуществляли в культурах в шейкерных колбах при 37°C и при встряхивании в течение 4 дней со 100 мл среды PS-1, содержащей одну таблетку CaCO3 (0,5 г), в 500-миллилитровой колбе Эрленмейера с перегородкой. Среда PS-1 содержит 100 г/л сахарозы, 40 г/л соевой муки, 10 г/л Na2HPO4·12H2O, 0,1 мл/л Dowfax 63N10 и 6 мкг/мл антибиотика хлорамфеникола.
После ферментации бульон с культурой собирали путем центрифугирования (26000 × g, 20 минут). Небольшой объем супернатанта подвергали стерильной фильтрации через фильтр 0,45 мкм и хранили в замороженном виде. Непосредственно перед проведением анализов на стабильность, описанных ниже, образцы сразу оттаивали.
В некоторых случаях, образцы ферментов очищали непосредственно перед их использованием в тесте на стабильность.
Для очистки ферментов супернатанты фильтровали через фильтр NALGENE 0,2 мкм (номер по каталогу № 569-0020) в целях удаления остатка клеток-хозяев. 0,2 мкм-фильтрата доводили до pH 5,0 добавлением 20% CH3COOH и фильтрат наносили на колонку с белком А (ProA) XpressLine (UpFront chromatography A/S), уравновешенную в 50 мМ янтарной кислоты/NaOH, 1 мМ CaCl2, pH 5,0. После интенсивной промывки колонки XpressLine ProA уравновешивающим буфером, ксилоглюканазу постадийно элюировали 50 мМ триса/HCl, pH 9,0. Фракции собирали в процессе элюирования. Фракции с колонки анализировали на ксилоглюканазную активность (пример 2) и фракции, обладающие такой активностью, объединяли. pH данного пула доводили до 9,0 с использованием 3M основания Трис, и этот пул разводили деминерализованной водой до достижения такой же проводимости, которой обладает 50 мМ Трис/HCl, pH 9,0 (или более низкой проводимости). Скорректированный по рН раствор наносили на колонку SOURCE Q (GE Healthcare), уравновешенную в 50 мМ Трис/HCl, pH 9,0. После интенсивной промывки колонки SOURCE Q уравновешивающим буфером, фермент элюировали линейным градиентом NaCl (0 → 0,5M) в том же самом буфере в объеме выше пяти колоночных объемов. Фракции с колонки снова анализировали на ксилоглюканазную активность, и активные фракции дополнительно анализировали с помощью электрофореза в ДСН-ПААГ. Фракции, которые давали только одну полосу, обнаруживаемую на окрашенном кумасси ПААГ с ДСН, объединяли и получали очищенный препарат.
Пример 2 - Анализ на ксилоглюканазу
Ксилоглюканазную активность ферментных образцов, например, взятых после очистки, оценивали с помощью анализа на AZCL-ксилоглюкан.
AZCL-ксилоглюкан (Megazyme) инкубировали с ксилоглюканазой, и спонтанное появление синей окраски оценивали на длине волны 650 нм. Ксилоглюканазную активность вычисляли как увеличение интенсивности синей окраски в процессе инкубирования после вычитания собственного фонового значения.
Субстрат AZCL-ксилоглюкан: 4 мг/мл AZCL-ксилоглюкана (Megazyme), гомогенно суспендированного в 0,01% тритоне X-100 путем перемешивания.
Температура при проведении анализа: 37°C.
Аналитический буфер: 50 мМ янтарной кислоты/NaOH, 0,01% тритона X-100, pH 5,0.
500 мкл суспензии субстрата AZCL-ксилоглюкана помещали на лед в пробирку Эппендорфа. Затем добавляли 500 мкл аналитического буфера, и смесь оставляли для охлаждения на льду. После этого добавляли 20 мкл образца фермента (разведенного в 0,01% тритона X-100). Анализ начинали путем переноса пробирки Эппендорфа в термомиксер Эппендорфа, который был установлен на температуру проведения анализа. Эту пробирку инкубировали в течение 15 минут на термомиксере Эппендорфа при самой высокой скорости встряхивания (1400 об/мин). Инкубирование завершали путем переноса пробирки обратно на ледяную баню. После охлаждения пробирки на льду, ее быстро центрифугировали в охлажденной льдом центрифуге для осаждения непрореагировавшего субстрата. 200 мкл супернатанта переносили в микротитрационный планшет и считывали величину оптической плотности A650. В этот анализ был включен контрольный буфер (20 мкл 0,01% тритона X-100, вместо фермента), и различия в A650 для образца фермента и контрольного буфера оценивали как показатель ксилоглюканазной активности.
Пример 3 - Стабильность вариантов ксилоглюканазы
Стабильность к детергенту, содержащему варианты ксилоглюканазы согласно изобретению, оценивали путем измерения активности вариантов после их инкубирования в жидком детергенте.
Тест на стабильность осуществляли путем добавления образца фермента в жидкий детергент и хранения при повышенной температуре, например, при 35°C или 40°C. После хранения в течение заранее определенного периода времени определяли ферментативную активность и эту активность сравнивали с активностью эквивалентного образца, который хранили приблизительно при -18°C в течение того же самого периода времени. Результатом теста на стабильность является активность образца, который хранили при повышенной температуре, где указанную активность выражали как % от активности, обнаруживаемой в образце, который хранили в условиях холода.
Результаты для вариантов ксилоглюканазы сравнивали с результатами для родительской ксилоглюканазы (SEQ ID NO:3), протестированной в тех же самых условиях. Отношение результатов этих двух стабильностей представляет собой коэффицинт повышения стабильности (SIF).
Варианты, имеющие SIF>1, являются более стабильными в тестируемых условиях, чем родительская ксилоглюканаза. Предпочтительными вариантами являются варианты, имеющие высокие значения SIF в данном тесте.
Детергент
Жидкий детергент, используемый в тестах на стабильность, имеет следующий состав:
|
Тест на хранение
Перед проведением теста на стабильность при хранении, образцы фермента, полученные как описано в примере 1, сразу оттаивали.
Образцы фермента разводили до концентрации приблизительно 0,25 мг раствора фермента на мл.
Жидкий детергент закапывали в стеклянные бутыли объемом приблизительно 12 мл, в результате чего в каждой стеклянной бутыли содержалось 1,0±0,05 грамма детергента.
Для каждого образца фермента приготавливали две бутыли с двумя дубликатами. В эти бутыли добавляли 50 мкл разведенного фермента и помещали небольшую магнитную стержневую мешалку, а затем их плотно закрывали (для предотвращения выпаривания во время хранения). Содержимое перемешивали стержневой магнитной мешалкой в течение примерно 5 минут. Одну бутыль из этой пары помещали в морозильную камеру при температуре приблизительно -18°C. Другую бутыль помещали в подходящую печь-инкубатор при заранее определенной повышенной температуре тестирования, например, при 35°C или 40°C. После хранения в течение предварительно определенного периода времени бутыли, находящиеся в печи-инкубаторе, переносили в морозильную камеру.
Анализ на активность
Активность образцов фермента после их хранения в детергенте оценивали методами, описанными ниже.
Материалы и реагенты:
1 M фосфатный буфер, pH 7:
138 граммов NaH2PO4·H2O растворяли примерно в 750 мл воды. Затем добавляли 4 н. NaOH для доведения pH до 7,0. После этого конечный объем доводили до 1000 мл.
Аналитический буфер (50 мМ фосфат, pH 7):
Смешивали 950 мл воды, 50 мл 1 M фосфатного буфера, pH 7 и 5 мл Berol 537 (неионного поверхностно-активного вещества, поставляемого Akzo Nobel). Конечный pH доводили до 7,00±0,02.
Субстрат:
Таблетки целлазима C поставлялись компанией Megazyme International Ireland Ltd, номер по каталогу T-CCZ. Эти таблетки содержали структурированную HE-целлюлозу, окрашенную красителем.
Процедура
Примерно за 30 минут до начала анализа бутыли, находящиеся в морозильной камере, переносили в холодильник, приблизительно при 4°С. Непосредственно перед началом анализа бутыли вынимали из холодильника, помещали на лабораторный столик и открывали.
В каждую открытую бутыль добавляли 10 мл аналитического буфера (при комнатной температуре). Затем бутыли переносили в водяную баню при 30°C, снабженную многофункциональной магнитной мешалкой, погруженной вовнутрь бани. Содержимое осторожно помешивали примерно 5 мин.
В каждую бутыль добавляли одну таблетку целлазима C. Затем содержимое перемешивали мешалкой, скорость которой была достаточной лишь для поддержания частиц субстрата в движении и для предотвращения осаждения. Через 30 минут после добавления таблетки бутыли вынимали из водяной бани и оставляли на 15 минут при комнатной температуре без перемешивания.
Из верхней части каждой бутыли пипеткой брали приблизительно 1 мл практически прозрачного супернатанта и переносили в кювету полумикроспектрофотометра. Затем измеряли оптическую плотность на 590 нм на подходящем спектрофотометре. Все измерения завершали через 15 минут.
В анализ были включены контрольные образцы, то есть эквивалентные образцы детергента, в которые не добавляли фермент ксилоглюканазу.
Вычисление
Для каждого образца фермента проводили два измерения A590:
- A590f, представляющего собой величину оптической плотности (А) A590 для образца, который хранили при -18°C,
- A590w, представляющего собой величину A590 для образца, который хранили при повышенной температуре.
Величину, полученную для контроля, (A590b) вычитали из A590f (с получением A590f-A590b) и из A590w (с получением A590w-A590b).
Стабильность вычисляли по формуле:
% стабильности=((A590w-A590b)/(A590f-A590b))×100%.
Результаты (A590f - A590b) для каждого фермента должны составлять в пределах величин 0,1-1,2. Если эти величины выходят за пределы данного интервала, то результаты для этого фермента должны быть интерпретированы как недостоверные, и тест необходимо повторить с использованием другого разведения указанного образца фермента.
И наконец, коэффициент повышения стабильности (SIF) для каждого варианта фермента вычисляли следующим образом:
SIF = % стабильности образца фермента/% стабильности родительского фермента (SEQ ID NO: 3).
Результаты
Ниже представлены результаты стабильности вариантов ксилоглюканазы, тестируемых в различных условиях.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пример 4 - Стабильность вариантов ксилоглюканазы
Стабильность к детергенту, содержащему варианты ксилоглюканазы согласно изобретению, оценивали путем измерения активности вариантов после их инкубирования в жидком детергенте.
Тест на стабильность осуществляли путем добавления образца фермента в жидкий детергент и хранения при повышенной температуре, например, при 35°C или 46°C. После хранения в течение предварительно установленного периода времени определяли ферментативную активность, и эту активность сравнивали с активностью идентичного образца, который хранили на холоде приблизительно при +5°C в течение того же самого периода времени. Результатом теста на стабильность является активность образца, который хранили при повышенной температуре (образец в условиях стресса), где указанную активность выражали как % активности, обнаруживаемой в эквивалентном образце, который хранили в условиях холода (образец, не подвергаемый стрессу).
Результаты для вариантов ксилоглюканазы сравнивали с результатами для родительской ксилоглюканазы (SEQ ID NO:3), протестированной в тех же самых условиях.
Детергент
Жидкий детергент, используемый в тестах на стабильность, имеет следующий состав:
|
|
Тест на хранение
Перед проведением теста на стабильность при хранении, образцы фермента, полученные как описано в примере 1, сразу оттаивали.
Образцы фермента использовали без дополнительного разведения.
Жидкий детергент закапывали в полистироловый микротитрационный 96-луночный планшет с круглодонными лунками (планшет 1) с получением 190 мкл детергента на лунку.
В каждую лунку добавляли десять микролитров образца фермента и вставляли небольшую магнитную стержневую мешалку, а затем планшет плотно закрывали (для предотвращения выпаривания) крышкой из адгезивной алюминиевой фольги (Beckman Coulter). Содержимое перемешивали магнитной стержневой мешалкой в течение примерно 30 минут.
Из каждой лунки планшета 1 брали 20 мкл смеси детергента-фермента, а затем переносили в новый пустой идентичный планшет (планшет 2). После этого оба планшета герметично закрывали.
Исходный планшет (планшет 1) помещали в подходящую печь-инкубатор при заранее определенной повышенной температуре тестирования, например, при 35°C или 46°C. Другой планшет (планшет 2) помещали в холодильник приблизительно при 5°С.
После инкубирования в течение предварительно определенного периода времени планшеты вынимали из холодильника и из печи-инкубатора. Планшеты оставляли на лабораторном столике по меньшей мере на 0,5 часа для охлаждения всех лунок до комнатной температуры.
Затем 20 мкл образца, взятого из каждой лунки планшета 1, переносили в новый пустой 96-луночный планшет с круглодонными лунками (планшет 1а).
Итак, планшет 1а содержал 20 мкл образцов в условиях стресса, а планшет 2 содержал 20 мкл образцов, не подвергнутых стрессу.
Анализ на активность
Активность образцов фермента после хранения их в детергенте оценивали описанными ниже методами при комнатной температуре.
Схема проведения анализа:
Пара-нитрофенол-1-бета-D-целлотетраозид (pNP-бета-D-целлотетраозид) представляет собой синтетический субстрат, который гидролизуется благодаря каталитическому действию некоторых ксилоглюканазных ферментов.
Сам субстрат является бесцветным, однако, после гидролиза гликозидной связи по восстанавливающим концам, высвобождается паранитрофенол, который имеет желтую окраску в буфере при рН 8, что обусловлено выской оптической плотностью при 405 нм.
Сам pNP-бета-D-целлотетраозид является в высокой степени стабильным в условиях проведения данного анализа. Таким образом, увеличение оптической плотности при длине волны 405 нм является показателем ферментативной активности.
Авторами настоящего изобретения было обнаружено, что родительская ксилоглюканаза (SEQ ID NO:3) присоединяет pNP-бета-D-целлотетраозид в качестве субстрата, о чем свидетельствует значительное увеличение оптической плотности при 405 нм.
Материалы и реагенты:
Аналитический буфер: 100 мМ EPPS; 0,01% твина-20; pH 8,0.
pNP-бета-D-целлотетраозид (CAS-#: 129411-62-7; Toronto Research Chemicals; Canada)
Раствор субстрата: 1 мМ pNP-бета-D-целлотетраозида в аналитическом буфере.
Процедура:
Планшет 1а содержит 20 мкл образцов в условиях стресса, а планшет 2 содержит 20 мкл образцов, не подвергнутых стрессу.
Образцы разводили путем добавления 50 мкл аналитического буфера во все лунки в планшете 1a и в планшете 2, и перемешивали в течение одного часа с помощью шейкера, встроенного в микротитрационный планшет. Затем во все лунки добавляли еще 50 мкл аналитического буфера, и встряхивание продолжали еще 10 минут.
20 мкл 6-кратно разведенных образцов переносили в 384-луночный полистироловый микротитрационный планшет с прозрачными лунками, и во все лунки добавляли 20 мкл раствора субстрата. Образцы смешивали путем быстрого встряхивания микротитрационного планшета. Измерение кинетики ферментативной активности инициировали сразу после наблюдения скорости увеличения оптической плотности при 405 нм на 384-луночном спектрофотометрическом планшет-ридере.
Была определена начальная скорость (оптическая плотность (А)/мин) реакции. Начальная скорость реакции является показателем ферментативной активности в образце, как было подтверждено путем построения линейной страндартной кривой при соответствующих концентрациях фермента.
Вычисления:
% остаточной активности вычисляли как ферментативную активность образца в условиях стресса, деленную на ферментативную активность в идентичном образце, не подвергнутом стрессу.
% остаточной активности = «A/мин (образца в условиях стресса)»/«A/мин (образца, не подвергнутого стрессу)» ×100%.
Результаты
Ниже представлены результаты стабильности вариантов ксилоглюканазы, тестируемых в различных условиях.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|