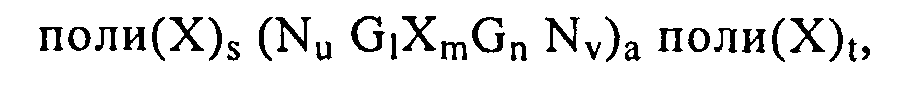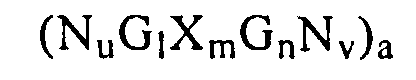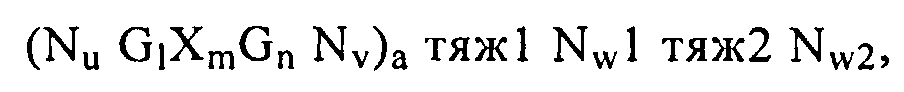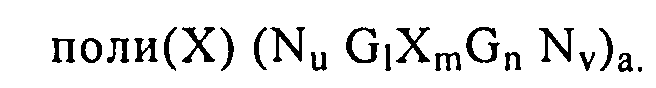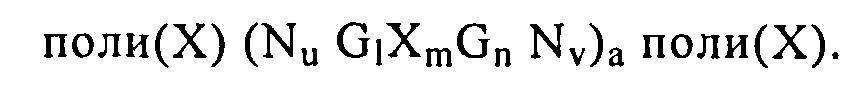Результат интеллектуальной деятельности: НУКЛЕИНОВЫЕ КИСЛОТЫ ФОРМУЛЫ (I) (NuGlXmGnNv)a И ИХ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИММУННОСТИМУЛИРУЮЩИХ АГЕНТОВ/АДЪЮВАНТОВ
Вид РИД
Изобретение
Настоящее изобретение относится к нуклеиновым кислотам общей формулы (I) (NuGlXmGnNv) и их производным в качестве иммуностимулирующих агентов/адьювантов, а также к содержащим их композициям, необязательно включающим дополнительный адъювант. Кроме того, настоящее изобретение относится к фармацевтической композиции или вакцине, каждая из которых содержит нуклеиновые кислоты формулы (I) и/или их производные в качестве иммуностимулирующего агента и необязательно по крайней мере один дополнительный фармацевтически активный компонент, например, антигенный агент. Настоящее изобретение также относится к применению фармацевтической композиции или вакцины для лечения раковых заболеваний, инфекционных заболеваний, аллергических заболеваний, аутоиммунных заболеваний и т.п. Кроме того, в настоящем изобретении предлагается применение нуклеиновых кислот общей формулы (I) (NuGlXmGnNv) и/или их производных для получения фармацевтической композиции, предназначенной для лечения указанных заболеваний.
При проведении стандартной и генетической вакцинации часто возникает проблема незначительного и следовательно в большинстве случаев неадекватного иммунного ответа в организме, который требуется лечить или вакцинировать. Для решения указанной проблемы в вакцины или фармацевтически активные компоненты добавляют так называемые адъюванты, т.е. вещества или композиции, способные увеличивать и/или направленно влиять на иммунный ответ, например, в ответ на антиген. Например, установлено, что эффективность некоторых вводимых активных медикаментозных ингредиентов можно значительно улучшить при смешивании активного ингредиента с адъювантом, влияющим на высвобождение активного ингредиента в клеточную систему организма реципиента и необязательно на его захват клетками организма реципиента. С использованием указанного способа можно обеспечить эффект, сопоставимый с периодическим введением большого числа низких доз с регулярными интервалами. Термин «адъювант», использованный в данном контексте, обозначает соединение или композицию, которые служат в качестве носителя или вспомогательного агента для иммуногена и/или других фармацевтически активных соединений. Обычно термин «адъювант» рассматривают в широком смысле, и он обозначает целый ряд соединений или стратагермов, способных повышать иммуногенность антигенов, включенных в состав или вводимых одновременно с адъювантом. Адъюванты подразделяются, но, не ограничиваясь только ими, на иммунно-потенциирующие средства, системы доставки антигенов или их комбинации.
В предшествующем уровне техники описан ряд соединений и композиций, предназначенных для применения в качестве адьювантов, например, адьювант Фрейнда, оксиды металлов (гидроксид алюминия и т.п.), квасцы, неорганические хелатные соединения или их соли, различные парафиновые масла, синтетические смолы, альгинаты, мукоиды, соединения полисахаридов, казеинаты, а также соединения, выделенные из крови и/или сгустков крови, такие как, например, производные фибрина и т.п. Однако в большинстве случаев при применении указанных адьювантов наблюдаются нежелательные побочные эффекты, например, раздражение и воспаление кожи на участке введения. В некоторых случаях наблюдаются даже токсичные побочные эффекты, прежде всего некроз тканей. К сожалению, в большинстве случаев применение указанных адьювантов приводит к неадекватной стимуляции клеточного иммунного ответа только за счет активации В-клеток.
Соединения, которые выделяют из организмов животных, такие как, например, желатин, в основном являются не пригодными для применения в качестве адьювантов, предназначенных для иммуностимуляции. Не смотря на то, что указанные соединения обычно не вызывают отрицательного действия на организм хозяина или клетки организма хозяина, они в большинстве случаев слишком быстро мигрируют от участка введения в организм хозяина или в клетки организма хозяина, что значительно ухудшает их свойства, требующиеся для адъюванта, такие как, например, замедленное высвобождение активного ингредиента, необязательно вводимого в комбинации с адъювантом, и т.п. Указанное быстрое распространение можно, в некоторых случаях, замедлить с использованием таннинов или других (неорганических) соединений. Однако к настоящему времени метаболизм указанных дополнительных соединений и участки их накопления в организме полностью не изучены. Таким образом, в данном случае можно предположить, что указанные соединения накапливаются в виде инородных веществ, значительно влияя на механизмы фильтрации, например, клеток почки, печени и/или селезенки. Кроме того, способность желатина к набуханию при парентеральном введении может привести к нежелательным побочным эффектам в условиях in vivo, таким как, например, набухание, прежде всего, в участке введения и к болезненным ощущениям.
При введении соединений, выделенных из крови и/или сгустков крови, таких как, например, производные фибрина и т.п., обычно наблюдаются иммуностимулирующие эффекты. Однако, большинство указанных соединений при введении в качестве адьювантов оказываются непригодными для данной цели, т.к. наблюдается побочное действие на иммунную систему (которое проявляется одновременно с требуемыми иммуногенными свойствами). Например, многие из указанных соединений относятся к аллергенам и в некоторых случаях вызывают избыточный ответ иммунной системы, значительно превышающий требуемый уровень. Таким образом указанные соединения являются непригодными для применения в качестве адьювантов для иммуностимуляции по упомянутым выше причинам.
Соответственно, в первом объекте настоящего изобретения предлагаются иммуностимулирующие агенты, действующие в качестве адьювантов и стимулирующие врожденный иммунитет, предпочтительно при введении в комбинации с другими биологически активными соединениями, прежде всего при введении в комбинации с иммуномодулирующими соединениями, более предпочтительно в комбинации с соединениями, которые специфично стимулируют приобретенный иммунитет, такими как антигены.
В данном контексте известно, что (неспецифичные) иммуностимулирующие эффекты можно также получить при непосредственном применении нуклеиновых кислот для индукции неспецифичного (т.е. врожденного) иммунного ответа, например, с использованием последовательностей бактериальной CpG-ДНК, предназначенной не только для передачи генетической информации. Например, известно, что ДНК играет центральную роль в продуцировании неспецифичных иммунных ответов. Например, известно, что бактериальная ДНК выполняет роль сигнала «опасности» для предупреждения иммунных клеток, таких как макрофаги и дендритные клетки, и ускорения защитного иммунного ответа поляризованных Т клеток, ответа Тh1. Иммуностимулирующее действие предположительно возникает в результате присутствия неметилированных мотивов, CG (нуклеиновой кислоты), и в связи с этим можно предположить, что указанная CpG-ДНК является сама по себе иммуностимулирующим агентом (см., например, патент US № 5663153). CpG-ДНК напрямую вызывает активацию компонентов врожденной иммунной системы, что приводит к регуляции с повышением активности совместно стимулирующих молекул и провоспалительных цитокинов. Такое иммуностимулирующее свойство ДНК характерно также для олигонуклеотидов ДНК, стабилизированных за счет модификации фосфоротиоатом (см., например, патент US № 6239116). Указанную иммуностимулирующую ДНК можно также комбинировать с другими иммуностимулирующими соединениями. Например, в патенте US №6406705 описаны иммуностимулирующие композиции, содержащие синергетическую комбинацию олигодезоксирибонуклеотида CpG и другого соединения, в отличие от нуклеиновой кислоты, которые оказывают стимулирующий эффект на врожденную иммунную систему.
Однако, применение ДНК для индукции неспецифичного иммунного ответа характеризуется рядом недостатков. ДНК разрушается in vivo только относительно медленно, и таким образом при применении иммуностимулирующей (чужеродной) ДНК может вызвать образование антител против ДНК, что было подтверждено на модели мышей (Gilkeson и др., J. Clin. INvest., т. 95, сс.1398-1402 (1995)). Преобладающее присутствие (чужеродной) ДНК в организме, таким образом, может привести к избыточной активации иммунной системы, что, как показано на мышах, приводит к спленомегалии (Montheith и др., Anticancer Drug Res., т.12, № 5, сс.421-432 (1997)). Кроме того, (чужеродная) ДНК может взаимодействовать с геномом организма-хозяина и приводить к мутациям, прежде всего за счет встраивания в геном организма-хозяина. Например, может произойти встраивание введенной (чужеродной) ДНК в интактный ген, что представляет собой мутацию, которая может снизить или даже полностью подавлять функцию эндогенного гена. В результате указанной интеграции могут разрушиться ферментативные системы, жизненно важные для клеток. Кроме того, существует риск изменения клетки в такой степени, что клетка трансформируется в дегенеративное состояние. Указанная трансформация может произойти, например, при интеграции (чужеродной) ДНК в ген, который участвует в регуляции роста клеток. Таким образом, как описано ранее, при использовании (чужеродной) ДНК в качестве иммуностимулирующего агента нельзя исключить возможный риск развития ракового заболевания.
Таким образом, более предпочтительным является применение специфических РНК в качестве соединения для индукции (неспецифичного) ответа врожденной иммунной системы. Термин «врожденная иммунная система, являющаяся частью иммунной системы», использованный в данном контексте, обозначает основную систему защиты большинства организмов и включает защитные барьеры, такие как гуморальный и химический барьеры, включающие, например, воспаление, систему комплементов и клеточные барьеры. Кроме того, врожденная иммунная система включает небольшое число рецепторов, называемых образраспознающими рецепторами или рецепторами патоген-ассоциированных молекулярных образов (рецепторы ПАМО), таких как члены семейства Toll-подобных рецепторов (TLR, см., например, статью Trinchieri и Sher, Nature reviews, Immunology, т.7, (март 2007)). Такие рецепторы TLR представляют собой трансмембранные белки, которые распознают лиганды внеклеточной среды или эндосомальных просветов. После связывания с лигандами они передают сигнал через цитоплазматические адапторные белки, который индуцирует защитный ответ организма-хозяина и связанное с ним продуцирование противомикробных пептидов, провоспалительных хемокинов и цитокинов, противовирусных цитокинов и т.п. (см., например, статью Meylan E., J. Tschopp, и др., «Intracellular pattern recognition receptors in the host response», Nature, т.442, № 7098, сс.39-44 (2006)).
В настоящее время идентифицировано 10 рецепторов Toll (TLR) человека и 13 рецепторов мыши, для которых только частично изучен механизм их действия. Указанные Toll-подобные рецепторы человека (TLR) включают TLR1-TLR2 (известный лиганд: триациллипопептид), TLR1-TLR6 (известный лиганд: диациллипопептид), TLR2 (известный лиганд: пептидогликан), TLR3 (известный лиганд: дцРНК), TLR4 (известный лиганд: ЛПС (липополисахарид) грамотрицательных бактерий)), TLR5 (известный лиганд: бактериальный флагеллин(ы)), TLR7/8 (известные лиганды: имидазохинолины, аналоги гуанозина (гуанина) и оцДНК), TLR9 (известные лиганды: бактериальная ДНК CpG, вирусы, простейшие и малярийный пигмент гемозоин (продукт гидролиза гемоглобина) и TLR10. После распознавания микробных патогенов указанные TLR обычно индуцируют внеклеточные сигнальные пути, которые в свою очередь приводят к индуцированию воспалительных цитокинов (например, ФНО-α, ИЛ-6, ИЛ-1-β и ИЛ-12), интерферон типа I (ИФ-β и различные ИФ-α) и хемокины (Kawai Т. и S. Akira, «TLR signaling». Cell Death Differ, т.13, №5, сс.816-825 (2006)).
В данном контексте применение РНК является предпочтительным по нескольким причинам. Например, как известно в настоящее время и указано выше, оцРНК связывается с рецепторами TLR-7/-8, а дцРНК связывается с рецепторами TLR, и, таким образом, оказывает иммуностимулирующий эффект. Кроме того, РНК в качестве иммуностимулирующего агента обычно характеризуется значительно более коротким периодом полураспада in vivo по сравнению с ДНК, при этом исключаются недостатки, описанные выше для ДНК. Тем не менее, применение таких специфических РНК, известных в качестве иммуностимулирующих агентов, также в некоторой степени ограничено. Например, определенные последовательности РНК, описанные в предшествующем уровне техники, оказывают лишь ограниченное иммуностимулирующее действие in vivo. Для иммуностимуляции могут требоваться повышенные количества РНК, которые, без учета повышенной стоимости в связи с необходимостью введения большого количества РНК, приводят к риску развития нежелательных побочных эффектов, в основном описанных выше, например, раздражение и воспаление в участке введения, даже в случае введения в ограниченный период времени. Кроме того, токсичные побочные эффекты нельзя исключить при введении большого количества иммуностимулирующего агента.
Другим ограничением является низкий уровень индукции интерферонов типа I (например, ИФ-α и ИФ-β) известными иммуностимулирующими РНК, которые в основном являются индукторами противовирусной и противопролиферативной активности и цитолитической активности в лимфоцитах, природных клетках-киллерах и макрофагах.
Известные иммуностимулирующие дцРНК включают, например, поли A:U и поли I:С. Однако недостатком таких иммуностимулирующих молекул дцРНК является их неопределенная длина, что может привести к непредсказуемым молекулярным структурам и, как следствие, к агрегации. Указанные агрегаты могут, в свою очередь, привести к нежелательным побочным эффектам, таким как закупорка кровеносных сосудов или избыточная иммуностимуляция в участке инъекции. Кроме того, указанные непредсказуемые молекулярные структуры представляют проблему при проведении стандартных лабораторных исследований или на практике в промышленном производстве, т.к. проблема заключается в невозможности проведения соответствующего контроля качества вследствие переменных свойств продукта. Таким образом, в фармацевтике предпочтительно использовать нуклеиновую кислоту с определенной длиной и структурой, пригодную для применения в качестве адъюванта.
Несмотря на определенный успех применения РНК, существует постоянно возрастающая необходимость в улучшенных иммуностимулирующих агентах, которые сами по себе вызывают иммунный ответ врожденной иммунной системы пациента. Соответственно, во втором объекте настоящего изобретения предлагаются иммуностимулирующие агенты, вызывающие неспецифический иммунный ответ при активации врожденной иммунной системы пациента.
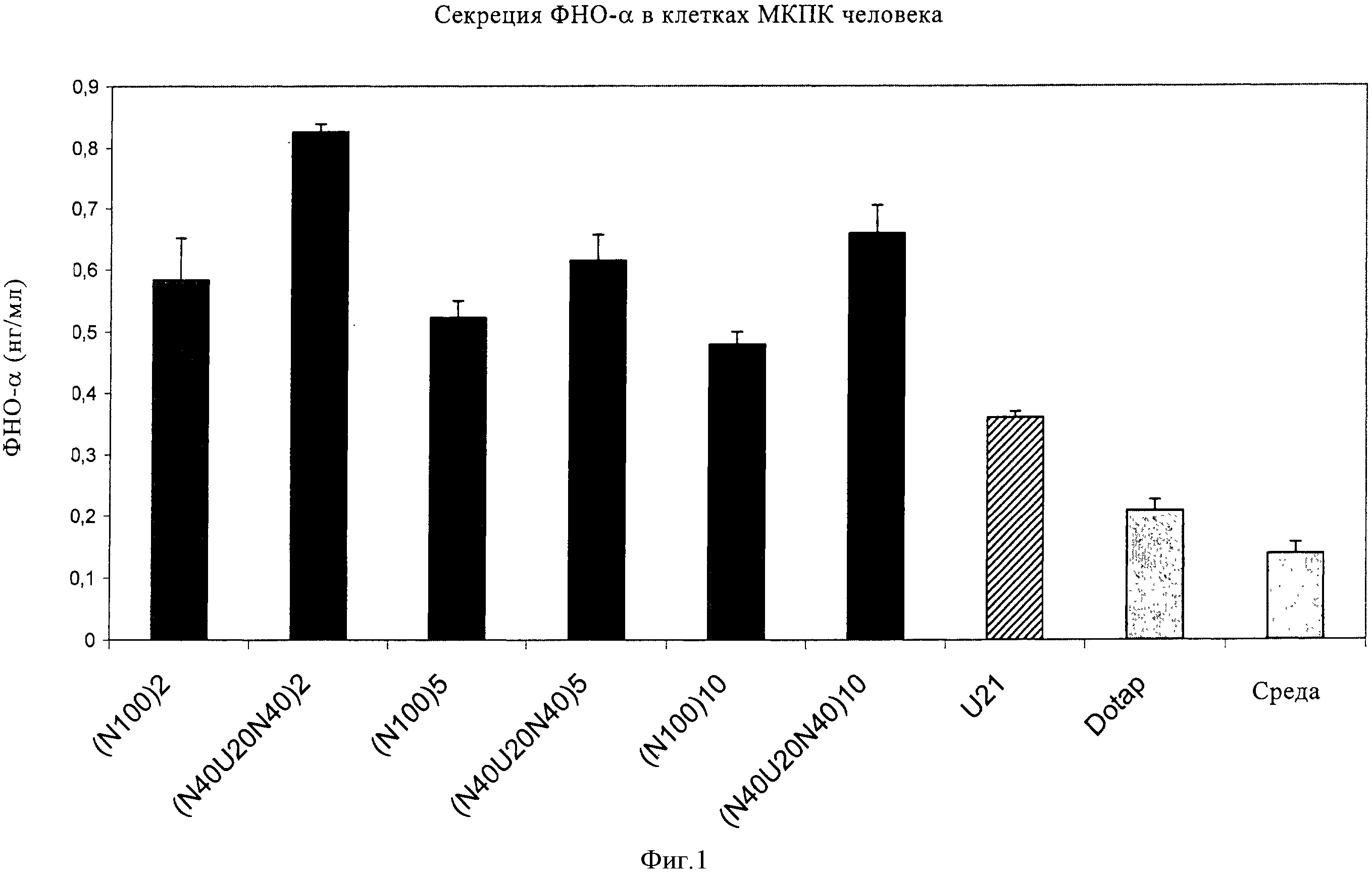
В обоих объектах настоящего изобретения предлагаются нуклеиновые кислоты общей формулы (I). Указанные нуклеиновые кислоты по настоящему изобретению активируют врожденную иммунную систему, вызывая, таким образом, неспецифический иммунный ответ. Используемые в качестве адьювантов (например, в качестве компонента вакцины), они могут дополнительно поддерживать иммуностимулирующую активность второго соединения, специфично активирующего приобретенную иммунную систему.
В настоящем изобретении предлагается нуклеиновая кислота формулы (I):
(NuGlXmGnNv)a
где
G обозначает гуанозин (гуанин), уридин (урацил) или аналог гуанозина (гуанина) или уридина (урацила), предпочтительно гуанозин (гуанин) или их аналоги,
Х обозначает гуанозин (гуанин), уридин (урацил), аденозин (аденин), тимидин (тимин), цитидин (цитозин) или аналоги указанных нуклеотидов (нуклеозидов), предпочтительно уридин (урацил) или его аналоги,
N обозначает последовательность нуклеиновой кислоты, длина которой составляет приблизительно от 4 до 50, предпочтительно приблизительно от 4 до 40, более предпочтительно приблизительно от 4 до 30 или от 4 до 20 нуклеотидов, при этом каждый N независимо выбирают из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозина) или аналогов указанных нуклеотидов (нуклеозидов),
а равно целому числу от 1 до 20, предпочтительно от 1 до 15, наиболее предпочтительно от 1 до 10,
1 равно целому числу от 1 до 40,
где если l=1, то G обозначает гуанозин (гуанин) или его аналог,
если l>1, то по крайней мере 50% указанных нуклеотидов (нуклеозидов) обозначают гуанозин (гуанин) или его аналог,
m равно целому числу и по крайней мере равно 3,
где если m=3, то X обозначает уридин (урацил) или его аналог, и
если m>3, то присутствует по крайней мере 3 последовательных уридина (урацила) или его аналогов,
n равно целому числу от 1 до 40,
где если n=1, то G обозначает гуанозин (гуанин) или его аналог,
если n>1, то по крайней мере 50% указанных нуклеотидов (нуклеозидов) обозначают гуанозин (гуанин) или его аналог,
u, v могут независимо друг от друга обозначать целое число от 0 до 50,
предпочтительно если и равно 0, то v≥1, или
если v равно 0, то u≥1,
причем длина нуклеиновой кислоты формулы (I) по настоящему изобретению составляет по крайней мере 50 нуклеотидов, предпочтительно по крайней мере 100 нуклеотидов, более предпочтительно по крайней мере 150 нуклеотидов, еще более предпочтительно по крайней мере 200 нуклеотидов и наиболее предпочтительно по крайней мере 250 нуклеотидов.
Молекула (NuGlXmGnNv)a формулы (I) по настоящему изобретению представляет собой обычную нуклеиновую кислоту в форме любой ДНК или РНК, предпочтительно, но, не ограничиваясь только ими, циклической или линейной ДНК, одно- или двухцепочечной ДНК или РНК (которые также можно рассматривать как ДНК или РНК за счет нековалентной ассоциации двух одноцепочечных ДНК или РНК) или частично двухцепочечных ДНК или РНК (которые обычно состоят из более длиной и по крайней мере одной более короткой одноцепочечной ДНК или РНК, приблизительно одинаковых по длине, где одна или более одноцепочечных молекул ДНК или РНК являются частично комплементарными одной или более другим одноцепочечным молекулам ДНК или РНК, образуя, таким образом, двухцепочечную РНК на данном участке), например, (частично) одноцепочечная ДНК или РНК в комбинации с участками (частично) двухцепочечной ДНК или РНК. Предпочтительно, нуклеиновая кислота формулы (I) по настоящему изобретению является одно- или двухцепочечной ДНК или РНК, более предпочтительно частично двухцепочечной ДНК или РНК. Предпочтительной также является нуклеиновая кислота формулы (I) по настоящему изобретению в виде смеси одноцепочечной и двухцепочечной ДНК или РНК.
Прежде всего предпочтительно нуклеиновая кислота по настоящему изобретению (NuGlXmGnNv)a формулы (I) является частично двухцепочечной нуклеиновой кислотой, т.к. указанная (частично двухцепочечная) нуклеиновая кислота по настоящему изобретению формулы (I) (или формулы (Iа), (II) (IIа), (IIb), (IIIa) и/или (IIIb), как описано ниже, может положительно стимулировать врожденную иммунную систему пациента, который нуждается в курсе лечения и за счет направленного действия на рецепторы ПАМО для РНК (TLR-7 и TLR-8) или для двухцепочечной РНК (TLR-3, RIG-I и MDA-5). Рецепторы TLR-3, TLR-7 и TLR-8 расположены в эндосоме и активируются с помощью РНК, захваченной эндосомой. Напротив, RIG-I и MDA-5 являются цитоплазматическими рецепторами, которые активируются с помощью РНК, которая непосредственно захватывается в цитоплазме или которая высвобождается из эндосом (высвобождение или удаление из эндосом). Соответственно, любая частично двухцепочечная нуклеиновая кислота (NuGlXmGnNv)a по настоящему изобретению формулы (I) (или (частично двухцепочечная) нуклеиновая кислота по настоящему изобретению формулы (I) (и (Iа), (II) (IIа), (IIb), (IIIa) и (IIIb), как описано ниже) может активировать каскады различных сигналов иммуностимуляции, активируя таким образом ответ врожденной иммунной системы или значительно увеличивая его.
Структура (NuG1XmGnNv)a формулы (I) по настоящему изобретению включает элемент GlXmGn в качестве основного фрагмента и элементы Nu и/или Nv в качестве разграничивающих элементов, причем вся последовательность NuGlXmGnNv может повторяться, т.е. присутствует по крайней мере 1 раз, что определяется целым числом а. В настоящем изобретении было неожиданно установлено, что молекула формулы (I) по настоящему изобретению, т.е. характеризующаяся структурой (NuGlXmGnNv)a, как описано выше, приводит к значительному увеличению ответа врожденной иммунной системы пациента, на что прежде всего указывает увеличение высвобождения интерферона-α по сравнению во введением только основного фрагмента GlXmGn. Кроме того, молекула, включающая описанный выше основной фрагмент GlXmGn, может амплифицироваться в организме бактерий с более высоким выходом, если указанный фрагмент отделен повторяющимися элементами Nu и/или Nv, как указано в формуле (I). Указанная структура молекулы является прежде всего предпочтительной при получении структуры (NuGlXmGnNv)a формулы (I), как описано выше, с использованием методов транскрипции in vitro вместо стандартного твердофазного синтеза, который в значительной степени ограничен определенным размером нуклеиновых кислот.
Основной фрагмент GlXmGn формулы (I) по настоящему изобретению более подробно описан ниже.
G в составе нуклеиновой кислоты формулы (I) по настоящему изобретению обозначает нуклеотид или дезоксинуклеотид или включает нуклеозид, причем нуклеотидом (нуклеозидом) является гуанозин (гуанин) или уридин (урацил) или их аналог, более предпочтительно гуанозин (гуанин) или его аналог. Термин «аналоги нуклеотида (нуклеозида), гуанозина (гуанина) или уридина (урацила)», использованный в данном контексте, обозначает неприродные варианты природных нуклеотидов (нуклеозидов) гуанозина (гуанина) и уридина (урацила). Соответственно, аналогами гунозина (гуанина) или уридина (урацила) обычно являются нуклеотиды (нуклеозиды), химически модифицированные неприродными функциональными группами или компонентами, которые предпочтительно вводят в состав НК, т.е. осуществляют вставку, модификацию или делецию природного нуклеотида гуанозина (гуанина) или уридина (урацила) или на которые заменяют природные функциональные группы или компоненты природного нуклеотида гуанозина (гуанина) или уридина (урацила). Соответственно, каждую функциональную группу или компонент природного нуклеотида гуанозина (гуанина) или уридина (урацила) можно модифицировать или удалять из структуры, а именно основание, сахарид (рибозу), любую природную функциональную боковую группу и/или фосфатный остаток, образующие цепь олигонуклеотида. Фосфатные группы можно заменить, например, на фосфороамидаты, фосфоротиоаты, нуклеотиды пептидов, метилфосфонаты и т.п., однако в настоящем изобретении предпочтительными являются природные фосфодиэфирные цепи. Кроме того, сахаридный (рибозный) компонент выбирают из дезоксирибозы, прежде всего нуклеиновой кислоты, РНК, как описано выше, в которой сахаридный (рибозный) компонент выбирают из дезоксирибозы.
Соответственно, аналоги гуанозина (гуанина) или уридина (урацила), но, не ограничиваясь только ими, включают любой природный или неприродный гуанозин (гуанин) или уридин (урацил), модифицированный химическим способом, например, при ацетилированиия, метилировании, гидроксилировании и т.п., включая, например, 1-метилгуанозин (гуанин), 2-метилгуанозин (гуанин), 2,2-диметилгуанозин (гуанин), 7-метилгуанозин (гуанин), дигидроуридин (урацил), 4-тиоуридин (урацил), 5-карбоксиметиламинометил-2-тиоуридин (урацил), 5-(карбоксигидроксиметил)уридин (урацил), 5-фторуридин (урацил), 5-бромуридин (урацил), 5-карбоксиметиламинометилуридин (урацил), 5-метил-2-тиоуридин (урацил), метиловый эфир N-уридин(урацил)-5-оксиуксусной кислоты, 5-метиламинометилуридин (урацил), 5-метоксиаминометил-2-тиоуридин (урацил), 5'-метоксикарбонилметилуридин (урацил), 5-метоксиуридин (урацил), метиловый эфир уридин(урацил)-5-оксиуксусной кислоты, уридин(урацил)-5-оксиуксусная кислота (v). Получение указанных аналогов известно специалистам в данной области техники и описано, например, в патентах US №№4373071, 4401796, 4415732, 4458066, 4500707, 4668777, 4973679, 5047524, 5132418, 5153319, 5262530 и 5700642, содержание которых полностью включено в настоящее описание в качестве ссылки. Согласно настоящему изобретению предпочтительными являются те аналоги, которые увеличивают иммуногенность нуклеиновой кислоты формулы (I) по настоящему изобретению и/или не препятствует дополнительной модификации. По крайней мере один гуанозин (гуанин) или уридин (урацил) или их аналог может означать элементы основного фрагмента Cl и/или Gn, и не обязательно по крайней мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% 90% или даже 100% нуклеотидов-элементов основного фрагмента Cl и/или Gn являются природным гуанозином (гуанином), природным уридином (урацилом) и/или их аналогом и/или проявляют свойства их аналога, как описано выше. Предпочтительно элемент основного фрагмента Gl и/или Gn содержит по крайней мере всего один аналог природного гуанозина (гуанина) и/или природного уридина (урацила). Наиболее предпочтительно все нуклеотиды (нуклеозиды) в составе указанных элементов Gl и/или Gn являются аналогами, которые могут являться в наиболее предпочтительном варианте идентичными аналогами нуклеотидов (нуклеозидов) одного и того же типа (например, все гуанозиновые (гуаниновые) нуклеотиды являются 1-метилгуанозином (гуанином), или они могут различаться (например, по крайней мере два различных аналога гуанозина заменяют природный нуклеотид гуанозин).
Число нуклеотидов (нуклеозидов) элемента основного фрагмента G (Gl и/или Gn) в составе нуклеиновой кислоты формулы (I) по настоящему изобретению определяется индексами l и n. Индексы l и n независимо друг от друга равны целому числу от 1 до 100, 1 до 90, 1 до 80, 1 до 70, 1 до 60, предпочтительно от 1 до 50, еще более предпочтительно от 1 до 40, и наиболее предпочтительно от 1 до 30, где нижний предел равен 1, но в другом варианте равен 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или даже более. Предпочтительно для каждого целого числа если 1 и/или n=1, то G обозначает гуанозин (гуанин) или его аналог, а если 1 или n>1, то по крайней мере 50%, более предпочтительно по крайней мере 50%, 60%, 70%, 80%, 90% или даже 100% нуклеотидов (нуклеозидов) в составе элемента основного фрагмента G (Gl и/или Gn) обозначают гуанозин (гуанин) или его аналог. Например, но, не ограничиваясь только ими, если 1 или n=4, то Gl и/или Gn могут обозначать, например, GUGU, GGUU, UGUG, UUGG, GUUG, GGGU, GGUG, GUGG, UGGG или GGGG и т.п., если l или n=5, то Gl и/или Gn могут обозначать, например GGGUU, GGUGU, GUGGU, UGGGU, UGGUG, UGUGG, UUGGG, GUGUG, GGGGU, GGGUG, GGUGG, GUGGG, UGGGG или GGGGG и т.п., и т.п. Нуклеотид (нуклеозид) в составе элемента основного структурного фрагмента Gl и/или Gn, соседних с элементом Хm в составе нуклеиновой кислоты формулы (I) по настоящему изобретению, предпочтительно не обозначает уридин (урацил) или его аналог. Более предпочтительно нуклеотиды (нуклеозиды) в составе элемента основного структурного фрагмента Gl и/или Gn, соседних с элементом Хm в составе нуклеиновой кислоты формулы (I) по настоящему изобретению, обозначают по крайней мере один гуанозин (гуанин) или его аналог, более предпочтительно последовательность 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или даже 20 или более гуанозинов (гуанинов) или его аналогов. Кроме того, нуклеотид в составе элемента основного структурного фрагмента Gl и/или Gn, соседних с элементом N, например, Nu, и/или Nv (или Nw1 или Nw2, как описано ниже), в составе нуклеиновой кислоты формулы (I) по настоящему изобретению, предпочтительно не обозначает уридин (урацил) или его аналог. Более предпочтительно нуклеотиды (нуклеозиды) в составе элемента основного структурного фрагмента Gl и/или Gn, соседних с элементом N, например, Nu, и/или Nv (или Nw1 или Nw2, как описано ниже), в составе нуклеиновой кислоты формулы (I) по настоящему изобретению, обозначают по крайней мере один гуанозин (гуанин) или его аналог, более предпочтительно последовательность 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или даже 20 или более гуанозинов (гуанинов) или его аналогов.
Термин «гомология», использованный в данном контексте, обозначает, что последовательности сравнивают с контрольной последовательностью и определяют степень их гомологии (идентичности) в процентах. Например, для определения гомологии двух последовательностей нуклеиновых кислот в процентах сначала их совмещают относительно друг друга таким образом, чтобы последовательно сравнивать нуклеотидные последовательности. Для этого, например, в последовательность первой нуклеиновой кислоты можно вводить пробелы и нуклеотиды можно сравнивать с соответствующим положением второй последовательности нуклеиновой кислоты. Когда в одном положении первой последовательности нуклеиновой кислоты расположен нуклеотид, идентичный нуклеотиду во второй последовательности нуклеиновой кислоты, то в этом положении две последовательности являются идентичными (гомологичными). Гомология двух последовательностей в процентах является функцией числа идентичных положений в последовательностях. Если, например, определенная гомология последовательности определена для конкретной нуклеиновой кислоты по сравнению с контрольной нуклеиновой кислотой определенной длины, то такая гомология последовательности определена по сравнению с контрольной нуклеиновой кислотой. Следовательно, если, например, гомология последовательности нуклеиновой кислоты по сравнению с контрольной нуклеиновой кислотой длиной 100 нуклеотидов составляет 50%, то указанная нуклеиновая кислота может содержать 50 нуклеотидов, полностью идентичных фрагменту контрольной нуклеиновой кислоты длиной 50 нуклеотидов. Однако указанная нуклеиновая кислота может также представлять собой последовательность нуклеиновой кислоты длиной 100 нуклеотидов, гомология которой составляет 50%, другими словами, в данном случае 50% идентичных нуклеиновых кислот по сравнению с контрольной последовательностью нуклеиновой кислоты расположены во всей цепи нуклеиновой кислоты. В другом варианте, последовательностью нуклеиновой кислоты может являться последовательность нуклеиновой кислоты длиной 200 нуклеотидов, которая во фрагменте нуклеиновой кислоты длиной 100 нуклеотидов является полностью идентичной с контрольной последовательностью нуклеиновой кислоты длиной 100 нуклеотидов. Разумеется, другие последовательности нуклеиновых кислот полностью удовлетворяют указанному критерию.
Определение гомологии двух последовательностей в процентах можно осуществить с использованием математического алгоритма. Предпочтительным, но, не ограничиваясь только ими, примером математического алгоритма, который можно использовать для сравнения двух последовательностей, является алгоритм, описанный в статье Karlin и др., PNAS USA, т.90, cc.5873-5877 (1993). Указанный алгоритм включен в программу NBLAST, с помощью которой можно сравнивать последовательности с требуемой гомологией с последовательностями по настоящему изобретению. Для сравнения последовательностей, содержащих пробелы (гэпы), можно использовать программу Gapped BLAST, описанную в статье Altschul и др.. Nucleic Acids Res, т.25, cc.3389-3402 (1997). При использовании программ BLAST и Gapped BLAST можно использовать параметры по умолчанию одной из программ (например, NBLAST). Кроме того, последовательности можно сравнивать с использованием версии 9 программы GAP (основной программы сравнения) фирмы Genetic Computing Group с использованием матрицы по умолчанию (BLOSUM62, величины от -4 до +11), при этом величина штрафа за открытый гэп составляет -12 (для первого нуля гэпа), а величина штрафа за расширение гэпа составляет -4 (для каждого дополнительного удачного нуля в гэпе). После сравнения гомологию в процентах рассчитывают по числу совпадений в процентах контрольной последовательности с последовательностью по настоящему изобретению. Указанные способы определения гомологии последовательностей двух нуклеиновых кислот можно также использовать для сравнения соответствующих аминокислотных последовательностей с использованием соответствующих программ.
Аналогичным образом для формулы (I) предпочтительно, если 1 или n>1, то по крайней мере 60%, 70%, 80%, 90% или даже 100% нуклеотидов (нуклеозидов) элементов в основном структурном фрагменте Gl и/или Gn являются гуанозином (гуанином) или его аналогами, как описано выше. Остальные нуклеотиды (нуклеозиды) элементов основного структурного фрагмента Gl и/или Gn (если гуанозин (гуанин) составляет менее 100% указанных нуклеотидов (нуклеозидов)) могут являться уридином (урацилом) или его аналогами, как описано выше.
Элемент X, прежде всего Хm, в нуклеиновой кислоте формулы (I) по настоящему изобретению также является элементом основного структурного фрагмента и является нуклеотидом или дезоксинуклеотидом или включает нуклеозид, причем нуклеозид (нуклеотид) обычно выбирают из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (питозина) или их аналогов, предпочтительно уридина (урацила) или их аналогов. Термин «аналоги нуклеотида (нуклеозида)» обозначает неприродные варианты природных нуклеотидов (нуклеозидов). Соответственно, аналогами являются химические производные нуклеотидов (нуклеозидов), содержащие неприродные функциональные группы, которые предпочтительно включают в природные нуклеотиды (нуклеозиды), удаляют из них или которыми заменяют природные функциональные группы нуклеотида (нуклеозида). Таким образом, каждый компонент природного нуклеотида можно модифицировать, а именно, основание, сахаридный остаток (рибозу или дезоксирибозу) и/или фосфат, образующие нуклеотидную цепь. Фосфатные группы можно заменять, например, на фосфорамидаты, фосфоротиоаты, пептидные нуклеотиды, метилфосфонаты и т.п., однако предпочтительной является природная фосфодиэфирная цепь. Предпочтительно по крайней мере 10%, более предпочтительно по крайней мере 20%, более предпочтительно по крайней мере 50%, более предпочтительно по крайней мере 70% и даже еще более предпочтительно по крайней мере 90% всех нуклеотидов «X» проявляют свойства аналога, как определено выше, если нуклеиновая кислота по настоящему изобретению содержит по крайней мере всего один аналог. Аналоги, на которые заменен определенный нуклеотид в составе элемента основного структурного фрагмента «Хm», являются идентичными, например, все цитидиновые (цитозиновые) нуклеотиды (нуклеозиды) в составе элемента основного структурного фрагмента «Хm» представляют собой определенный цитидиновый (цитозиновый) аналог, например, 2-тиоцитидин (цитозин) или они могут отличаться от определенного нуклеотида (нуклеозида), например, элемент «Хm» включает по крайней мере два различных цитидиновых (цитозиновых) аналога.
Аналоги гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозина), включают, но, не ограничиваясь только ими, любые природные или неприродные гуанозин (гуанин), уридин (урацил), аденозин (аденин), тимидин (тимин), цитидин (цитозин, модифицированные химическими методами, например, при ацелировании, метилировании, гидроксилировании и т.п., и включают 1-метиладенозин (аденин), 2-метиладенозин (аденин), 2-метилтио-N6-изопентениладенозин (аденин), N6-метиладенозин (аденин), N6-изoпeнтeнилaдeнoзин (аденин), 2-тиоцитидин (цитозин), 3-метилцитидин (цитозин), 4-ацетилцитидин (цитозин), 2,6-диаминопурин, 1-метилгуанозин (гуанин), 2-метилгуанозин (гуанин), 2,2-диметилгуанозин (гуанин), 7-метилгуанозин (гуанин), инозин, 1-метилинозин, дигидроуридин (урацил), 4-тиоуридин (урацил), 5-карбоксиметиламинометил-2-тиоуридин (урацил), 5-(карбоксигидроксиметил)уридин (урацил), 5-фторуридин (урацил), 5-бромуридин (урацил), 5-карбоксиметиламинометилуридин (урацил), 5-метил-2-тиоуридин (урацил), метиловый эфир N-уридин(урацил)-5-оксиуксусной кислоты, 5-метиламинометилуридин (урацил), 5-метоксиаминометил-2-тиоуридин (урацил), 5'-метоксикарбонилметилуридин (урацил), 5-метоксиуридин (урацил), метиловый эфир уридин(урацил)-5-оксиуксусной кислоты, уридин(урацил)-5-оксиуксусная кислота (v), квеозин, β-D-маннозилквеозин, вибутоксозин и инозин. Получение указанных аналогов описано, например, в следующих патентах US 4373071, US 4401796, US 4415732, US 4458066, US 4500707, US 4668777, US 4973679, US 5047524, US 5132418, US 5153319, US 5262530 и US 5700642. Наиболее предпочтительными аналогами по настоящему изобретению, как описано выше, являются аналоги нуклеотидов (нуклеозидов), которые увеличивают иммуногенность нуклеиновой кислоты формулы (I) по настоящему изобретению и/или которые не препятствуют дальнейшей модификации.
Число элементов Х основного структурного фрагмента в составе нуклеиновой кислоты формулы (I) по настоящему изобретению определяется индексом m. Индекс m равен целому числу и обычно равен по крайней мере 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, от 20 до 30, от 30 до 40, от 40 до 50, от 50 до 60, от 60 до 70, от 70 до 80, от 80 до 90, от 90 до 100, от 100 до 150, от 150 до 200 или даже более, причем если m равно 3, то Х обозначает уридин (урацил) или его аналог, и если m>3, то по крайней мере 3 или более последовательных уридинов (урацилов) или их аналогов включены в состав элемента Х формулы (I), как описано выше. Указанную последовательность 3 или более уридинов (урацилов) в данном контексте называют монотонной последовательностью уридинов (урацилов). Длина монотонной последовательности уридинов (урацилов) обычно составляет по крайней мере 3, 4, 5, 6, 7, 8, 9 или 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, от 20 до 30, от 30 до 40, от 40 до 50, от 50 до 60, от 60 до 70, от 70 до 80, от 80 до 90, от 90 до 100, от 100 до 150, от 150 до 200 уридинов (урацилов) или необязательно аналогов уридинов (урацилов), как описано выше. Указанная монотонная последовательность уридинов (урацилов) присутствует по крайней мере один раз в элементе Х основного структурного фрагмента нуклеиновой кислоты формулы (I) по настоящему изобретению. Следовательно, возможным является присутствие, например, 1, 2, 3, 4, 5 или более монотонных последовательностей уридина (урацила), содержащих 3 или более уридинов (урацилов) или их аналогов, при этом монотонные последовательности уридинов (урацилов) могут прерываться в элементе Х основного структурного фрагмента по крайней мере одним гуанозином (гуанином), аденозином (аденином), тимидином (тимином) цитидином (цитозином) или их аналогами, предпочтительно 2, 3, 4, 5 или более. Например, если m равно 3, то Хm обозначает UUU. Если m равно 4, то Хm может, например, означать, но, не ограничиваясь только ими, UUUA, UUUG, UUUC, UUUU, AUUU, GUUU или CUUU и т.п. Если n равно 10, то Хm может обозначать, но, не ограничиваясь только ими, UUUAAUUUUC, UUUUGUUUUA, UUUGUUUGUU, UUGUUUUGUU, UUUUUUUUUU и т.п. Нуклеотиды Хm, соседние с Gl или Gn нуклеиновой кислоты формулы (I) по настоящему изобретению предпочтительно включают уридин (урацил) или их аналоги. Если m>3, то обычно по крайней мере 50%, предпочтительно по крайней мере 60%, 70%, 80%, 90% или даже 100% нуклеотидов в составе Хm являются уридином (урацилом) или их аналогами, как описано выше. Остальные нуклеотиды в составе Хm до 100% (в случае, если в последовательность Хm включено менее 100% уридинов (урацилов))) являются гуанозином (гуанином), уридином (урацилом), аденозином (аденином), тимидином (тимином), цитидином (цитозином) или их аналогами, как описано выше.
Нуклеиновая кислота формулы (I) включает также граничный элемент N. Граничным элементом N обычно является нуклеиновая последовательность, длина которой составляет приблизительно от 4 до 50, предпочтительно приблизительно от 4 до 40, более предпочтительно от 4 до 30 нуклеотидов (нуклеозидов), еще более предпочтительно приблизительно от 4 до 20 нуклеотидов (нуклеозидов), при этом нижний предел составляет в других вариантах также 5, 6, 7, 8, 9, 10 или более. Предпочтительно нуклеотиды (нуклеозиды) в составе каждого N независимо выбирают из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозинам) и/или их аналогов. Другими словами, граничным элементом N в составе нуклеиновой кислоты формулы (I) по настоящему изобретению может являться последовательность, состоящая из любой (статистической) последовательности, известной в данной области техники, при этом каждый N независимо выбирают из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозинам) и/или их аналогов или из гомополимера указанных нуклеотидов (нуклеозидов), в каждом случае при условии, что длина указанной последовательности составляет приблизительно от 4 до 50, предпочтительно приблизительно от 4 до 40, более предпочтительно от 4 до 30 или от 4 до 20 нуклеотидов (нуклеозидов), как описано выше.
Согласно одному варианту N может представлять собой последовательность нуклеиновой кислоты, как описано в данном контексте, которая обычно включает не более двух одинаковых нуклеотидов (нуклеозидов), как описано выше, в соседних положениях, т.е. последовательность обычно не содержит фрагментов из более двух одинаковых нуклеотидов (нуклеозидов), которые выбирают из аденозина (аденина), цитидина (цитозина), уридина (урацила), гуанодина (гуанина) и/или их аналогов (т.е. участков «аа», «ее», «uu», «gg» и/или их аналогов), более предпочтительно не содержит указанных участков, т.е. одинаковые нуклеотиды (нуклеозиды), как описано в данном контексте, в соседних положениях отсутствуют. Кроме того или в другом варианте N может обозначать последовательность нуклеиновой кислоты, как описано в данном контексте, которая обычно содержит аденозин (аденин) или его аналог в количестве приблизительно от 0 до 50%, от 5 до 45%, или от 10 до 40%, более предпочтительно приблизительно от 15 до 35%, еще более предпочтительно приблизительно от 20 до 30% и наиболее предпочтительно приблизительно 25%, уридин (урацил) или его аналог в количестве приблизительно от 0 до 50%, от 5 до 45%, или от 10 до 40%, более предпочтительно приблизительно от 15 до 35%, еще более предпочтительно приблизительно от 20 до 30% и наиболее предпочтительно приблизительно 25%, цитидин (питозин) или его аналог в количестве приблизительно от 0 до 50%, от 5 до 45%, или от 10 до 40%, более предпочтительно приблизительно от 15 до 35%, еще более предпочтительно приблизительно от 20 до 30% и наиболее предпочтительно приблизительно 25%, гуанозин (гуанин) или его аналог в количестве приблизительно от 0 до 50%, от 5 до 45%, или от 10 до 40%, более предпочтительно приблизительно от 15 до 35%, еще более предпочтительно приблизительно от 20 до 30% и наиболее предпочтительно приблизительно 25%. Наиболее предпочтительно N представляет собой последовательность нуклеиновой кислоты, как определено в данном контексте, обычно содержащей приблизительно 25% аденозина (аденина), гуанозина (гуанина), цитидина (цитозина) и уридина (урацила). Примеры указанных последовательностей N включают, например, agcu, ague, augc, acgu, gcua, gcau, gacu, guca, cuag, caug, cagu, cgau,uagc, uacg, ucga, ucag, agcugcua, gcaucaug, caguucga и т.п.
Число граничных элементов N в составе нуклеиновой кислоты формулы (I) по настоящему изобретению, т.е. число его повторов, определяется целым числом и и/или v. Таким образом элемент N в составе нуклеиновой кислоты формулы (I) по настоящему изобретению может присутствовать в виде (повторяющегося) Nu и/или Nv, где и и/или v равны независимо друг от друга целому числу от 0 или 1 до 100, более предпочтительно от 0 или 1 до 50, еще более предпочтительно от 0 или 1 до 40 и наиболее предпочтительно от 0 или 1 до 30, например, от 0 или 1 до 5, 10, 20, 25 или 30, или от 5 до 10, от 10 до 15, от 15 до 20, от 20 до 25 или от 25 до 30. Более предпочтительно в состав формулы (I) включен по крайней мере один (повторяющийся) граничный элемент Nu и/или Nv, т.е. либо и либо v не равны 0, более предпочтительно присутствуют оба (повторяющихся) граничных элемента Nu и/или Nv.
Кроме того, комбинация элементов основного структурного фрагмента и граничных элементов в составе элемента NuGlXmGnNv может присутствовать в виде повторяющихся элементов молекулы (I), (NuGkXmGnNv)a по настоящему изобретению, как описано выше, при этом число повторов объединенного элемента формулы (I), (NuGlXmGnNv)a, определяется целым числом а. Предпочтительно а равно целому числу приблизительно от 1 до 100, от 1 до 50, от 1 до 20, более предпочтительно целому числу приблизительно от 1 до 15, наиболее предпочтительно целому числу от 1 до 10. В данном контексте повторяющиеся элементы NuGlXmGnNv могут являться одинаковыми или различными.
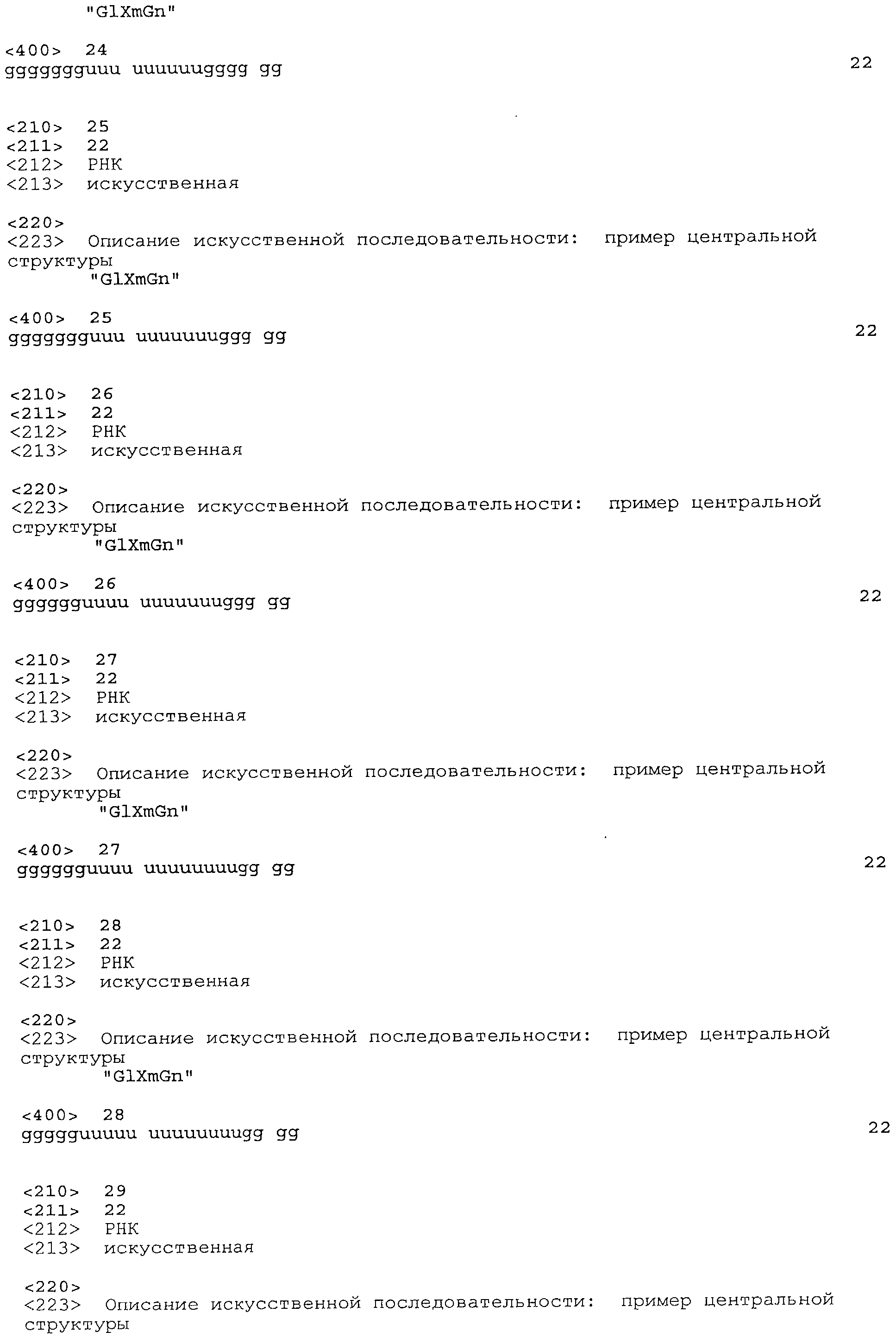
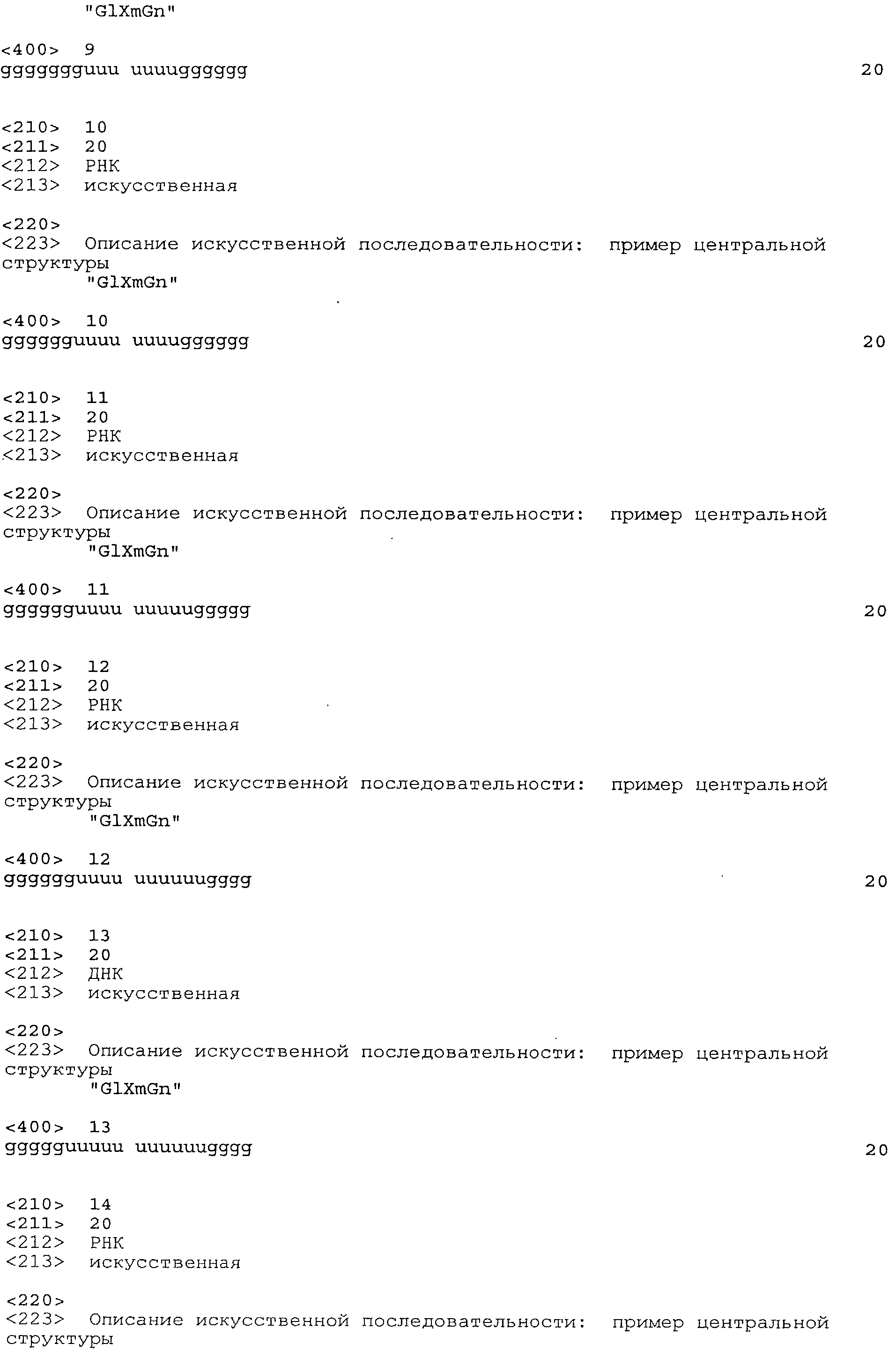
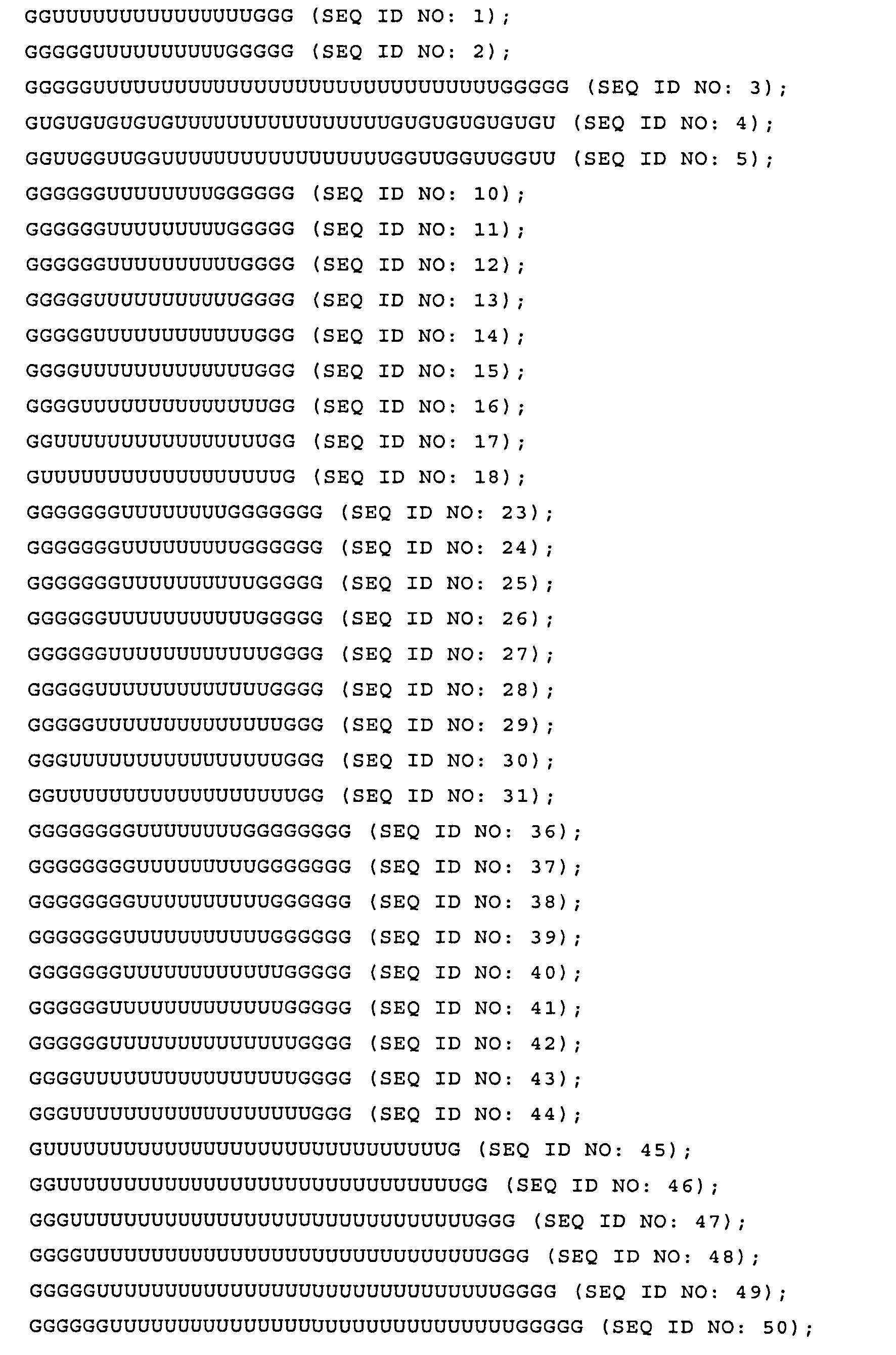
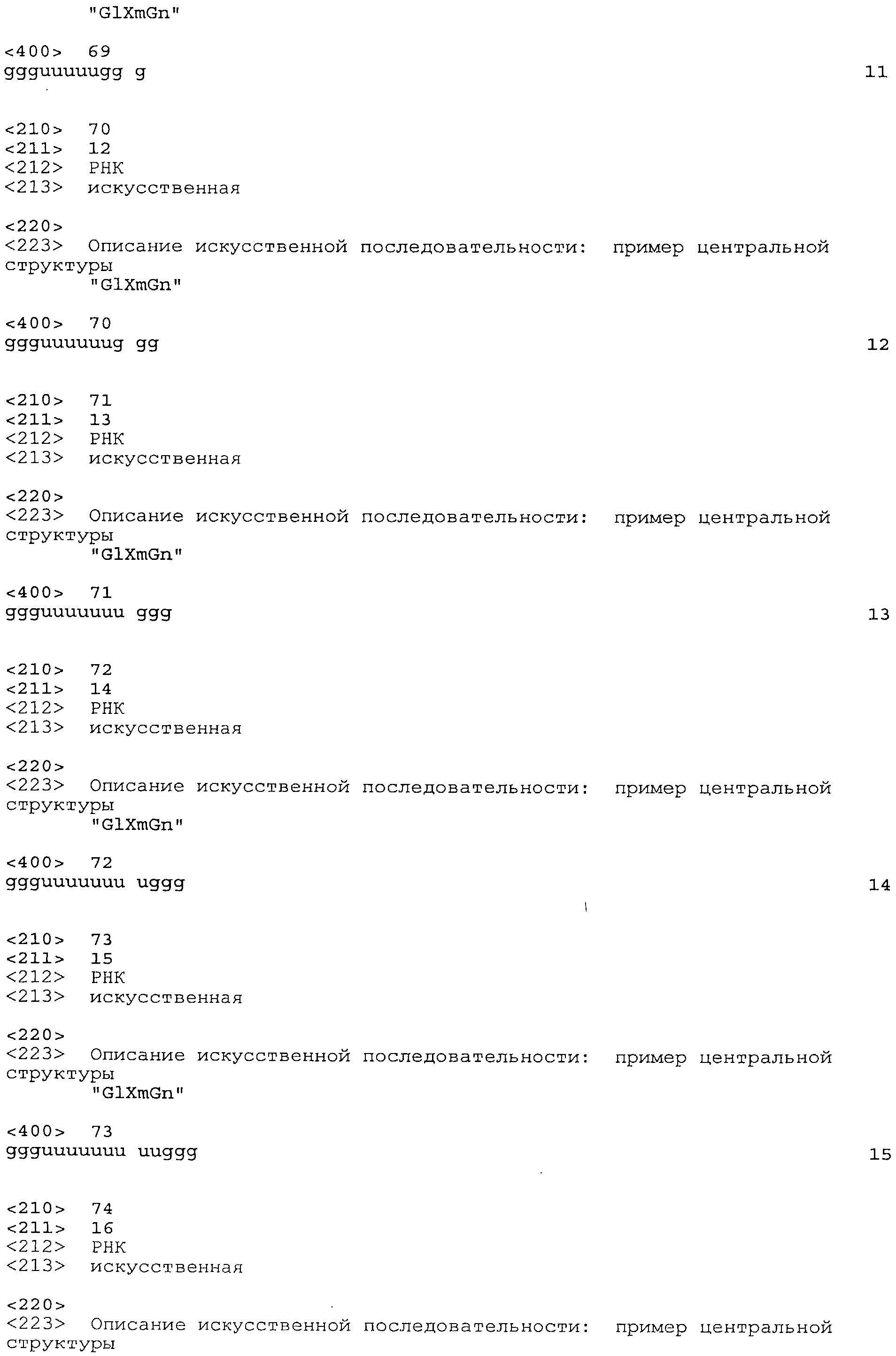
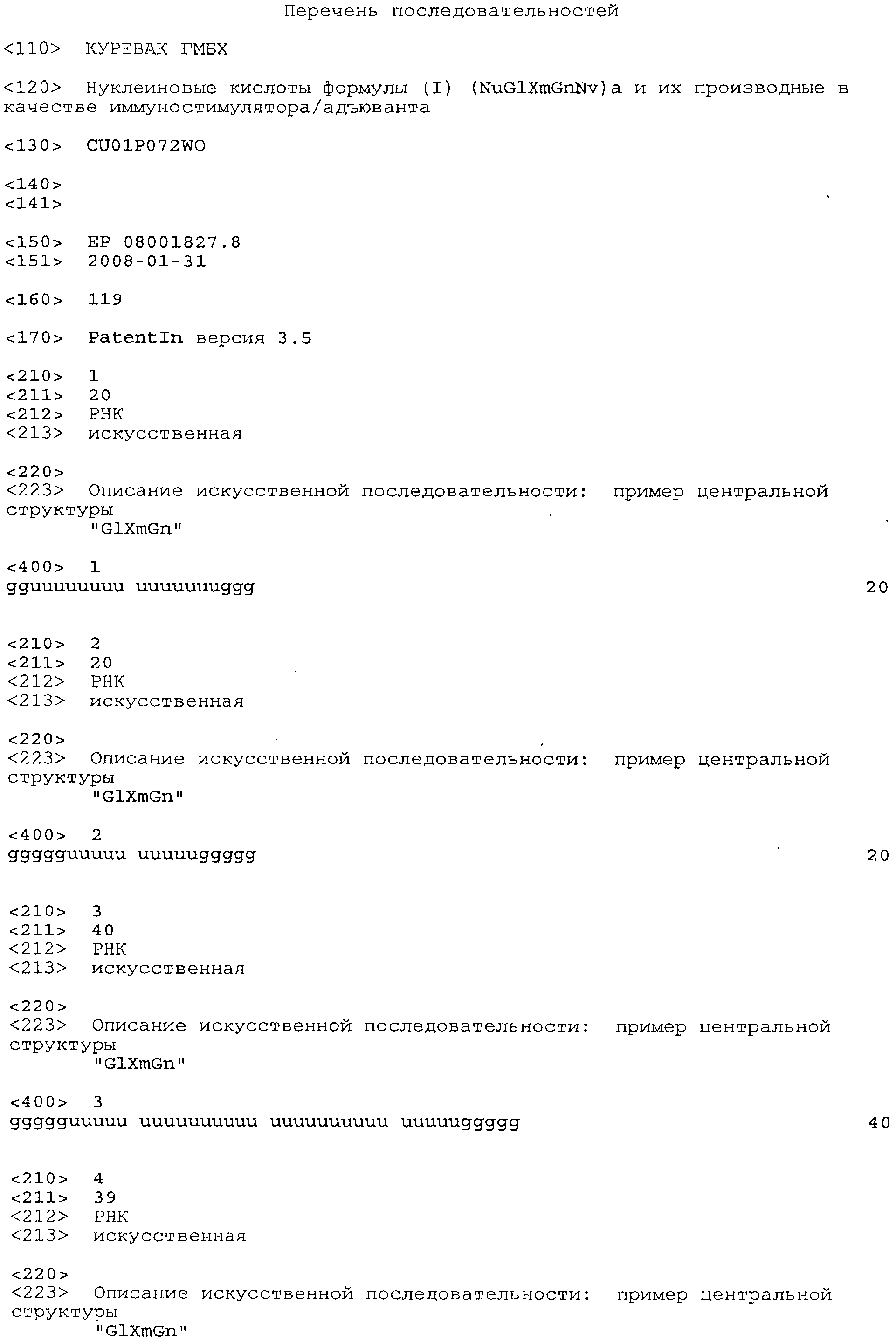
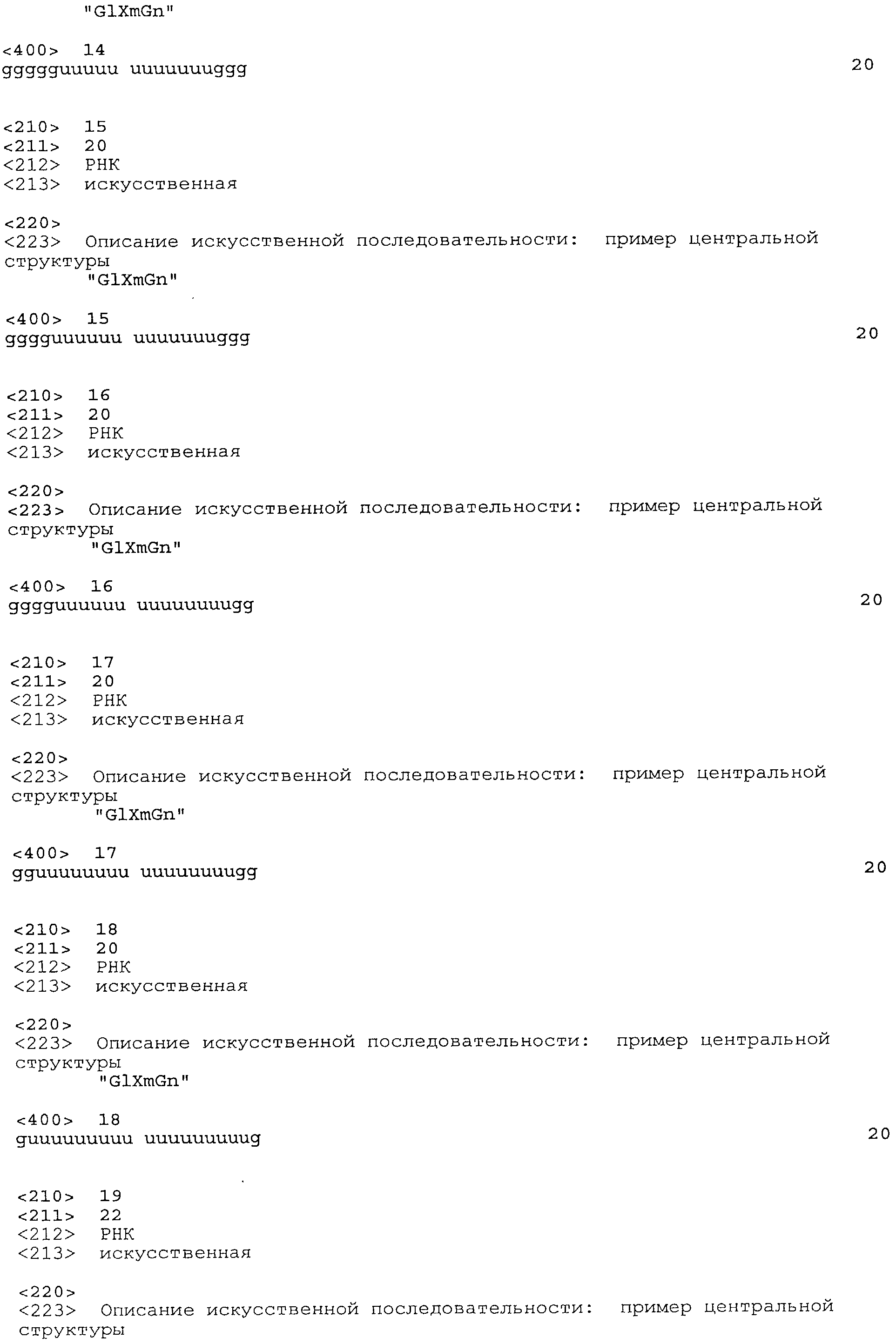
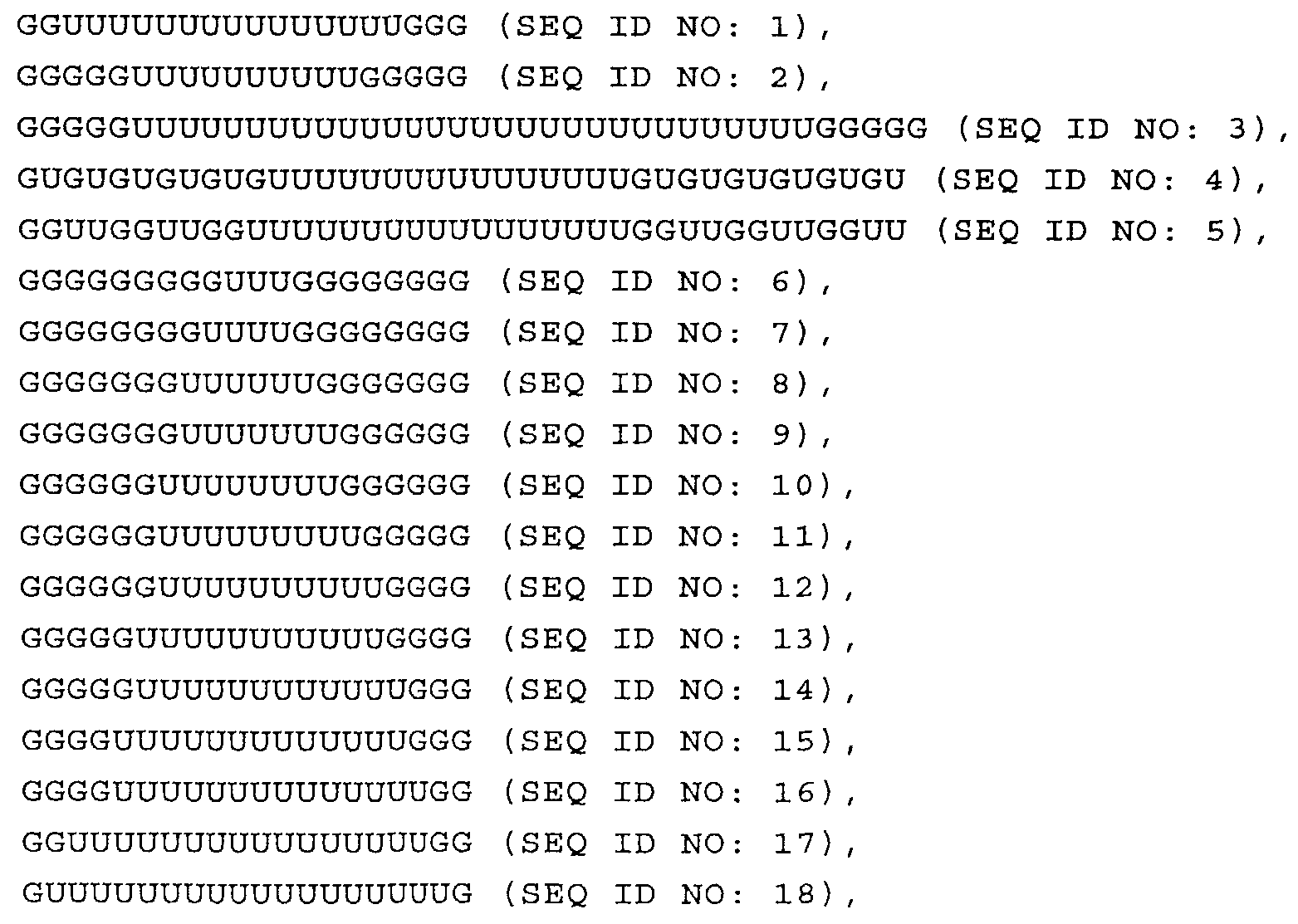
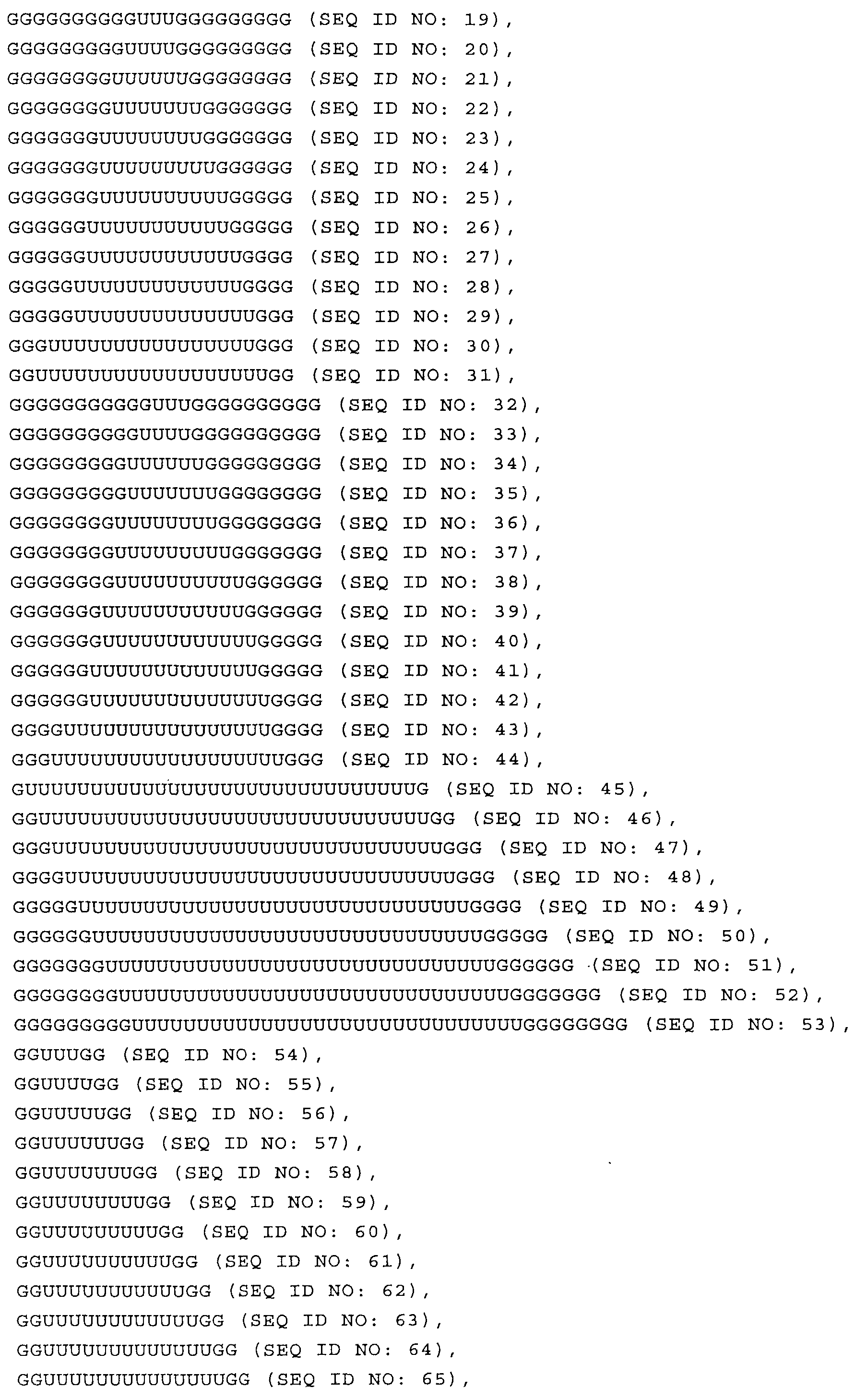
Согласно наиболее предпочтительному варианту нуклеиновая кислота формулы (I) (NuGlXmGnNv)a по настоящему изобретению, как описано выше, содержит центральную структуру GlXmGn, который предпочтительно выбирают из одной из следующих последовательностей SEQ ID NO:1-80:

Согласно другому предпочтительному варианту объектом настоящего изобретения является альтернативная нуклеиновая кислота формулы (Iа):
(NuGlXmGnNv)a
где
С обозначает цитидин (цитозин), уридин (урацил) или аналог цитидина (цитозина) или уридина (урацила), предпочтительно цитидина (цитозина) или их аналоги,
Х обозначает гуанозин (гуанин), уридин (урацил), аденозин (аденин), тимидин (тимин), цитидин (цитозин) или аналоги указанных нуклеотидов (нуклеозидов), предпочтительно уридин (урацил) или его аналоги,
каждый N обозначает последовательность нуклеиновой кислоты, длина которой независимо друг от друга составляет приблизительно от 4 до 50, предпочтительно приблизительно от 4 до 40, более предпочтительно приблизительно от 4 до 30 или от 4 до 20 нуклеотидов, при этом каждый N независимо выбирают из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозина) или аналогов указанных нуклеотидов (нуклеозидов),
а равно целому числу от 1 до 20, предпочтительно от 1 до 15, наиболее предпочтительно от 1 до 10,
1 равно целому числу от 1 до 40,
где если l=1, то С обозначает цитидин (цитозин) или его аналог,
если l>1, то по крайней мере 50% указанных нуклеотидов (нуклеозидов) обозначают цитидин (цитозин) или его аналог,
m равно целому числу и по крайней мере равно 3,
где если m=3, то Х обозначает уридин (урацил) или его аналог, и
если m>3, то присутствует по крайней мере 3 последовательных уридина (урацила) или его аналогов,
n равно целому числу от 1 до 40,
где если N=1, то С обозначает цитидин (цитозин) или его аналог,
если n>1, то по крайней мере 50% указанных нулеотидов (нуклеозидов) обозначают цитидин (цитозин) или его аналог,
u, v могут независимо друг от друга равны целому числу от 0 до 50,
предпочтительно если u=0, то v≥1, или
если n v равно 0, то u≥1,
где длина молекулы нуклеиновой кислоты формулы (Iа) по настоящему изобретению составляет по крайней мере 50 нуклеотидов, предпочтительно по крайней мере 100 нуклеотидов, более предпочтительно по крайней мере 150 нуклеотидов, еще более предпочтительно по крайней мере 200 нуклеотидов и наиболее предпочтительно по крайней мере 250 нуклеотидов.
Все приведенные выше определения элементов N (т.е. Nu и Nv) и Х (Хm), прежде всего основного фрагмента, как описано выше, а также целых чисел а, l, m, n, u и v, соответствуют элементам формулы (Iа), при этом в формуле (Iа) основной фрагмент обозначает ClXmCn. Определения граничных элементов Nu и Nv идентичны определениям Nu и Nv, приведенным выше.
Более предпочтительно, С в составе молекулы нуклеиновой кислоты формулы (Iа) по настоящему изобретению обозначает нуклеотид или дезоксинуклеотид или включает нуклеозид, причем нуклеотидом (нуклеозидом) является цитидин (цитозин) или уридин (урацил) или их аналог. Термин «аналоги цитидина (цитозина) или уридина (урацила)», использованный в данном контексте, обозначает неприродные варианты природных нуклеотидов (нуклеозидов) цитидина (цитозина) и уридина (урацила). Соответственно, аналогами цитидина (цитозина) или уридина (урацила) обычно являются нуклеотиды (нуклеозиды), модифицированные химическим способом неприродными функциональными группами или компонентами, при включении в природный нуклеотид цитидин (цитозин) или уридин (урацил) или удалении из них или на которые заменяют природные функциональные группы или компоненты природного нуклеотида цитидина (цитозина) или уридина (урацила). Соответственно, каждую функциональную группу или компонент природного нуклеотида цитидина (цитозина) или уридина (урацила) можно модифицировать, а именно по остатку основания, сахарида (рибозы) и/или фосфата, образующих цепь олигонуклеотида. Фосфатные группы можно заменить, например, на фосфорамидаты, фосфоротиоаты, нуклеотиды пептидов, метилфосфонаты и т.п., однако в настоящем изобретении предпочтительными являются природные фосфодиэфирные цепи.
Соответственно, аналоги цитидина (цитозина) или уридина (урацила), но, не ограничиваясь только ими, включают любой природный или неприродный цитидин (цитозин) или уридин (урацил), модифицированный химическим способом, например, при ацетилировании, метилировании, гидроксилировании и т.п., включая, например, 2-тиоцитидин (цитозин), 3-метилцитидин (цитозин), 4-ацетилцитидин (цитозин), дигидроуридин (урацил), 4-тиоуридин (урацил), 5-карбоксиметиламинометил-2-тиоуридин (урацил), 5-(карбоксигидроксиметил)уридин (урацил), 5-фторуридин (урацил), 5-бромуридин (урацил), 5-карбоксиметиламинометилуридин (урацил), 5-метил-2-тиоуридин (урацил), метиловый эфир N-уридин(урацил)-5-оксиуксусной кислоты, 5-метиламинометилуридин (урацил), 5-метоксиаминометил-2-тиоуридин (урацил), 5'-метоксикарбонилметилуридин (урацил), 5-метоксиуридин (урацил), метиловый эфир уридин(урацил)-5-оксиуксусной кислоты, уридин (урацил)-5-оксиуксусная кислота (v). Получение указанных аналогов известно специалистам в данной области техники и описано, например, в патентах US №№4373071, 4401796, 4415732, 4458066, 4500707, 4668777, 4973679, 5047524, 5132418, 5153319, 5262530 и 5700642, содержание которых в полном объеме включено в настоящее описание в качестве ссылки. Согласно настоящему изобретению предпочтительными являются те аналоги, которые увеличивают иммуногенность молекулы нуклеиновой кислоты формулы (Iа) по настоящему изобретению и/или не препятствует дополнительной модификации. По крайней мере один цитидин (цитозин) или уридин (урацил) или их аналог включен в состав элементов основного структурного фрагмента Сl и/или Сn, и не обязательно по крайней мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% 90% или даже 100% нуклеотидов в составе элементов основного структурного фрагмента Сl и/или Сn являются природным цитидином (цитозином), природным уридином (урацилом) и/или их аналогом и/или проявляют свойства их аналога, как описано выше. Предпочтительно основной структурный фрагмент Сl и/или Сn содержит по крайней мере один аналог природного цитидина(цитозина) и/или природного уридина (урацила). Наиболее предпочтительно все нуклеотиды (нуклеозиды) в составе указанных элементов Сl и/или Сn являются аналогами, которые могут являться в наиболее предпочтительном варианте одинаковыми аналогами одного и того же типа нуклеотидов (нуклеозидов) (например, все цитидиновые (цитозиновые) нуклеотиды являются 2-тиоцитидином (цитозином) или они могут различаться (например, по крайней мере двумя различными аналогами цитидина (цитозина) заменяют природный нуклеотид цитидин (цитозин)).
Число нуклеотидов (нуклеозидов) основного структурного фрагмента С (Cl и/или Сn) в составе нуклеиновой кислоты формулы (Iа) по настоящему изобретению определяется индексами l и n. Индексы 1 и п независимо друг от друга равны целому числу от 1 до 90, 1 до 80, 1 до 70, 1 до 60, предпочтительно от 1 до 50, еще более предпочтительно от 1 до 40, и наиболее предпочтительно от 1 до 30, где нижний предел равен 1, но в другом варианте равен 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или даже более. Предпочтительно для каждого целого числа если l и/или n равно 1, то С обозначает цитидин (цитозин) или их аналог, а если l или n>1, то по крайней мере 50%, более предпочтительно по крайней мере 50%, 60%, 70%, 80%, 90% или даже 100% нуклеотидов (нуклеозидов) в составе элемента основного структурного фрагмента С (Cl и/или Сn) обозначают цитидин (цитозин) или их аналог. Например, но, не ограничиваясь только ими, если 1 или n равно 4, то Cl и/или Сn могут обозначать, например, CUCU, CCUU, UCUC, UUCC, CUUC, CCCU, CCUC, CUCC, UCCC или СССС и т.п., если 1 или n равно 5, то Cl и/или Сn могут обозначать, например CCCUU, CCUCU, CUCCU, UCCCU, UCCUC, UCUCC, UUCCC, CUCUC, CCCCU, CCCUC, CCUCC, CUCCC, UCCCC или ССССС и т.п., и т.п. Нуклеотид (нуклеозид) в составе элементов Cl и/или Сn, соседних с элементом Хm в составе нуклеиновой кислоты формулы (Iа) по настоящему изобретению предпочтительно не обозначает уридин (урацил) или его аналог. Более предпочтительно нуклеотиды (нуклеозиды) в составе элементов основного структурного фрагмента Cl и/или Сn, соседних с элементом Хm в составе нуклеиновой кислоты формулы (I) по настоящему изобретению, обозначают по крайней мере один цитидин (цитозин) или его аналог, более предпочтительно последовательность 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или даже 20 или более цитидинов (цитозинов) или их аналогов. Кроме того, нуклеотид (нуклеозид) в составе элементов Cl и/или Сn, соседних с элементом N, например, Nu, и/или Nv (или Nw1 или Nw2, как описано ниже), в составе нуклеиновой кислоты формулы (Iа) по настоящему изобретению предпочтительно не обозначает уридин (урацил) или его аналог. Более предпочтительно нуклеотиды (нуклеозиды) в составе элементов Сl и/или Сn, соседних с элементом N, например, Nu, и/или Nv (или Nw1 или Nw2, как описано ниже), в составе нуклеиновой кислоты формулы (Iа) по настоящему изобретению, обозначают по крайней мере один гуанозин (гуанин) или его аналог, более предпочтительно последовательность 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или даже 20 или более гуанозинов (гуанинов) или их аналогов. Аналогичным образом, предпочтительна формула (Iа), в которой если 1 или n>1, то по крайней мере 60%, 70%, 80%, 90% или даже 100% нуклеотидов элементов Сl и/или Сn являются цитидином (цитозином) или их аналогами, как описано выше. Остальные нуклеотиды (нуклеозиды) элементов Сl и/или Сn (если цитидин (цитозин) составляет менее 100% указанных нуклеотидов (нуклеозидов)) могут являться уридином (урацилом) или их аналогами, как описано выше.
Элемент X, прежде всего элемент Хm, является предпочтительным, как определено выше для формулы (I), в качестве другого элемента основного структурного фрагмента в составе нуклеиновой кислоты по настоящему изобретению формулы (Iа). Число элементов Х в составе нуклеиновой кислоты формулы (Iа) по настоящему изобретению определяется индексом m. Индекс m равен целому числу обычно по крайней мере 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, от 20 до 30, от 30 до 40, от 40 до 50, от 50 до 60, от 60 до 70, от 70 до 80, от 80 до 90, от 90 до 100, от 100 до 150, от 150 до 200, или даже более, где если m=3, то элемент Х обозначает уридин (урацил) или его аналог, а если m>3, то по крайней мере 3 или более последовательных уридинов (урацилов) или их аналогов присутствуют в составе элемента Х формулы (Iа), как описано выше. Указанную последовательность по крайней мере 3 или более последовательных уридинов (урацилов) в данном контексте обозначают термином «монотонная последовательность уридинов (урацилов)». Монотонная последовательность уридинов (урацилов) обычно включает по крайней мере 3, 4, 5, 6, 7, 8, 9 or 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, от 20 до 30, от 30 до 40, от 40 до 50, от 50 до 60, от 60 до 70, от 70 до 80, от 80 до 90, от 90 до 100, от 100 до 150, от 150 до 200, уридинов (урацилов) или необязательно их аналогов, как описано выше. Указанная монотонная последовательность уридинов (урацилов) встречается по крайней мере один раз в составе элемента Х нуклеиновой кислоты формулы (Iа) по настоящему изобретению. Таким образом, например, 1, 2, 3, 4, 5 или более монотонных последовательностей уридинов (урацилов) или их аналогов могут прерываться по крайней мере одним гуанозином (гуанином), аденозином (аденином), тимидином (тимином), цитидином (цитозином) или их аналогами, предпочтительно 2, 3, 4, 5 или более. Например, если m=3, то Хm обозначает UUU. Если m=4, то Хm может обозначать, но, не ограничиваясь только ими UUUA, UUUG, UUUC, UUUU, AUUU, GUUU или CUUU, и т.п. Если n=10, то Хm может обозначать, но не ограничиваясь только ими UUUAAUUUUC, UUUUGUUUUA, UUUGUUUGUU, UUGUUUUGUU, UUUUUUUUUU, и т.п. Нуклеотиды (нуклеозиды) в составе элемента Хm, соседнего с элементами Cl или Сn нуклеиновой кислоты формулы (Iа) по настоящему изобретению предпочтительно включают уридин (урацил) или его аналоги. Если m>3, то обычно по крайней мере 50%, предпочтительно по крайней мере 60%, 70%, 80%, 90% или даже 100% нуклеотидов в составе элемента Хm являются уридинами (урацилами) или их аналогами, как описано выше. Остальными нуклеотидами (нуклеозидами) в составе элемента Хm (если последовательность элемента Хm содержит менее 100% уридинов (урацилов)) могут являться гуанозин (гуанидин), уридин (урацил), аденозин (аденин), тимидин (тимин), цитидин (цитозин) или их аналоги, как описано выше.
Аналогичным образом, нуклеиновая кислота по настоящему изобретению формулы (Iа), как описано выше, содержит граничный элемент N, прежде всего Nu и/или Nv, где N, прежде всего Nu и/или Nv, а также целые числа х и у имеют значения, определенные выше.
Элемент NuClXmCnNv может присутствовать в виде повторяющегося элемента нуклеиновой кислоты по настоящему изобретению формулы (Iа) (NuClXmCnNv)a, как описано выше, при этом число повторов указанного элемента формулы (Ia) (NuClXmCnNv)a определяется целым числом а. Предпочтительно индекс а равен целому числу приблизительно от 1 до 100, от 1 до 50, от 1 до 20, более предпочтительно целому числу приблизительно от 1 до 15, наиболее предпочтительно целому числу приблизительно от 1 до 10, в данном случае повторяющиеся элементы NnClXmCnNv могут являться одинаковыми или различными.
Согласно наиболее предпочтительному варианту нуклеиновая кислота по настоящему изобретению формулы (Ia) (NuClXmCnNv)a; как описано выше, включает основной фрагмент ClXmCn, который предпочтительно выбирают из следующих последовательностей SEQ ID NOs:81-83:
CCCUUUUUUUUUUUUUUUCCCUUUUUUUUUUUUUUUCCCUUUUUUUUUUUUUUUCCC (SEQ ID NO:81)
CCCUUUCCCUUUCCCUUUCCCUUUCCCUUUCCCUUUCCCUUUCCCUUUCCC (SEQ ID NO:82)
CCCUUUUUUUUUUUUUUUCCCCCCUUUUUUUUUUUUUUUCCC (SEQ ID NO:83)
Нуклеиновая кислота по настоящему изобретению формулы (I) (или (Iа)), прежде всего каждый отдельный повторяющийся элемент NuGlXmCnNv (или NuClXmCnNv) в ее составе, могут являться одноцепочечной, двухцепочечной или частично двухцепочечной и т.п., как в основном описано для формулы (I).
Если нуклеиновая кислота по настоящему изобретению формулы (I) (или (Iа)) является одноцепочечной нуклеиновой кислотой, то последовательность обычно является одноцепочечной на протяжении всей длины.
Если нуклеиновая кислота по настоящему изобретению формулы (I) (или (Iа)) является двухцепочечной нуклеиновой кислотой, то она представляет собой обычно двухцепочечную структуру вдоль всей длины.
Если нуклеиновая кислота по настоящему изобретению формулы (I) (или (Iа)) является частично двухцепочечной нуклеиновой кислотой, то нуклеиновая кислота формулы (I) (или (Ia)) может представлять собой одноцепочечную структуру за пределами основного структурного фрагмента GlXmCn (или СlХmСn) и двухцепочечную структуру в области указанного основного структурного фрагмента GlХmGn (или ClXmCn), которые предпочтительно выбирают по крайней мере из одной описанных выше последовательностей SEQ ID NOs:1-83. Еще более предпочтительно основной структурный фрагмент GlXmGn (или ClXmCn) формулы (I) (или (Iа)) представляет двухцепочечную структуру в области указанного основного структурного фрагмента, в котором присутствуют последовательности из уридинов (урацилов), наиболее предпочтительно расположенные на всей длине цепи или по крайней мере в 60%, 70%, 80%, 90%, 95%, 98% или 99% цепи.
В другом варианте, если нуклеиновая кислота по настоящему изобретению формулы (I) (или (Iа)) является частично двухцепочечной нуклеиновой кислотой, другие участки (в отличие от основного структурного фрагмента GlXmGn) нуклеиновой кислоты по настоящему изобретению формулы (I) или (Iа), как описано выше, могут являться двухцепочечными. Например, последовательность нуклеиновой кислоты формулы (I) или (Iа) может представлять собой двухцепочечную структуру за пределами основного структурного фрагмента GlXmGn (или ClXmCn), например, в граничных элементах Nu и/или Nv, и одноцепочечную структуру указанного основного структурного фрагмента GlXmGn (или ClXmCn), которую предпочтительно выбирают по крайней мере из одной описанных выше последовательностей SEQ ID NOs:1-83. Например, по крайней мере один Nu и/или Nv может представлять собой двухцепочечную структуру, в то время как остальные элементы формулы (I) или (Iа), например, основной структурный фрагмент GlXmGn и/или другие элементы представляют собой одноцепочечные структуры.
В другом варианте нуклеиновую кислоту по настоящему изобретению формулы (I) можно выбирать из смеси одноцепочечной нуклеиновой кислоты формулы (I) или (Iа) и (частично) двухцепочечной нуклеиновой кислоты формулы (I) (или (Iа)), предпочтительно в соотношении приблизительно от 1:10 до 10:1, более предпочтительно в соотношении от 1:3 до 3:1.
Согласно наиболее предпочтительному варианту нуклеиновую кислоту по настоящему изобретению формулы (I) можно выбирать из следующих последовательностей:


Согласно наиболее предпочтительному варианту нуклеиновую кислоту по настоящему изобретению формулы (Iа) можно выбирать из следующих последовательностей:
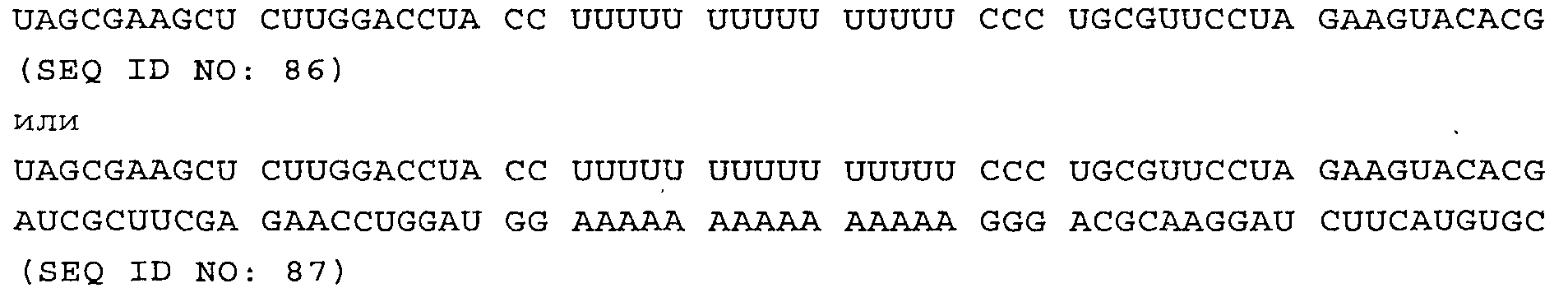
Согласно одному предпочтительному варианту нуклеиновую кислоту по настоящему изобретению формулы (I) (или (Iа)), как описано в данном контексте, можно модифицировать последовательностью поли(Х) (модифицирующий элемент). Указанная нуклеиновая кислота может включать, например, нуклеиновую кислоту формулы (II):
поли(Х)s(NuGlXmGnNv)aполи(Х)t,
где длина молекулы нуклеиновой кислоты формулы (II) по настоящему изобретению составляет по крайней мере 50 нуклеотидов, предпочтительно по крайней мере 100 нуклеотидов, более предпочтительно по крайней мере 150 нуклеотидов, еще более предпочтительно по крайней мере 200 нуклеотидов и наиболее предпочтительно по крайней мере 250 нуклеотидов.
Элементы G, Х и N, прежде всего основной структурный фрагмент GlXmGn и элементы Nu и Nv, а также целые числа а, l, m, n, u и v в составе нуклеиновой кислоты формулы (II) имеют значения, как определено выше для формулы (I). В данном контексте модифицирующий элемент поли(Х), прежде всего(Х)s и/или поли(Х)t, в составе нуклеиновой кислоты по настоящему изобретению формулы (II) обычно представляет собой одноцепочечную, двухцепочечную или частично двухцепочечную структуру нуклеиновой кислоты, например, последовательность ДНК или РНК, как описано выше. Предпочтительно модифицирующий элемент(Х), прежде всего (X)s и/или поли(Х)t, является гомополимерным фрагментом нуклеиновых кислот, где Х может являться любым нуклеотидом или дезоксинуклеотидом, как описано выше для Х в составе нуклеиновой кислоты по настоящему изобретению формулы (I) или (Iа). Предпочтительно Х выбирают независимо для каждого поли(Х), прежде всего поли(Х)s и/или поли(Х)t, из нуклеотида или дезоксинуклеотида, или Х включает нуклеозид, причем нуклеотид (нуклеозид) выбирают из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозина), инозина или их аналогов, например, из одноцепочечных фрагментов цитидина (цитозина) (поли(С)), гуанозина (гуанина), (поли(G)), аденозина (аденина), (поли(А)), уридина (урацила), (поли(U)), инозина (поли(1)) и т.п., или из гомополимерных двухцепочечных фрагментов инозина и цитидина (цитозина) (поли(I:С)), аденозина (аденина) и уридина (урацила) (поли(А:U)) и т.п., при этом гомополимерную последовательность, прежде всего поли(I:С) и/или поли(А:U), и Х можно присоединять к последовательности (NuGlXmGnNv)a нуклеиновой кислоты формулы (II) через любые из их цепей, например, с использованием последовательностей поли-С, поли-1, поли-А или поли-U. Длина модифицирующего элемента поли(Х), прежде всего поли(Х)s и/или поли(Х)t, в составе нуклеиновой кислоты по настоящему изобретению формулы (II) определяется целыми числами s и/или t, где s и/или t, независимо друг от друга могут составлять приблизительно от 5 до 100, предпочтительно приблизительно от 5 до 70, более предпочтительно приблизительно от 5 до 50, еще более предпочтительно приблизительно от 5 до 30 и наиболее предпочтительно приблизительно от 5 до 20.
Согласно предпочтительному варианту осуществления настоящего изобретения нуклеиновая кислота формулы (II), как описано выше, может включать, например, нуклеиновую кислоту формулы (IIа),
поли(Х)(NuGlXmGnNv)a
или нуклеиновую кислоту формулы (IIb),
поли(Х)(NuGlXmGnNv)a поли(Х),
где длина указанных нуклеиновых кислот формул (IIа) или (IIb) по настоящему изобретению составляет по крайней мере 50 нуклеотидов, предпочтительно по крайней мере 100 нуклеотидов, более предпочтительно по крайней мере 150 нуклеотидов, еще более предпочтительно по крайней мере 200 нуклеотидов и наиболее предпочтительно по крайней мере 250 нуклеотидов. Значения элементов и индексов в указанных формулах имеют значения, приведенные для формул (II) или (I) выше. Кроме того, указанные формулы (II), (IIа) и (IIb) можно определить на основе формулы (Ib), т.е. с использованием основного структурного фрагмента ClXmCn.
Более предпочтительно поли(Х) в составе нуклеиновой кислоты по настоящему изобретению формулы (II), (IIа) и/или (IIb) можно выбирать из поли(Х), как описано выше, более предпочтительно из поли(I:С) и/или поли(А:U). Указанные модифицирующие элементы поли(Х), прежде всего (I:С) и/или (A:U), можно присоединять к последовательности формулы (II), (IIа) и/или (IIb) с использованием их любых цепей, например, с использованием последовательностей поли-С, поли-G, поли-I, поли-А или поли-U.
Аналогично тому, как описано выше для формул (I) или (Iа), нуклеиновая кислота по настоящему изобретению формулы (II), (IIа) и/или (IIb) может представлять собой одноцепочечную, двухцепочечную или частично двухцепочечную структуру нуклеиновой кислоты, как описано выше.
Если нуклеиновая кислота по настоящему изобретению формулы (II), (IIа) и/или (IIb) является одноцепочечной нуклеиновой кислотой, то последовательность обычно является одноцепочечной вдоль всей длины.
Аналогичным образом, если нуклеиновая кислота по настоящему изобретению формулы (II), (IIа) и/или (IIb) является двухцепочечной нуклеиновой кислотой, то последовательность обычно является двухцепочечной вдоль всей длины.
Если нуклеиновая кислота по настоящему изобретению формулы (II), (IIа) и/или (IIb) является частично двухцепочечной нуклеиновой кислотой, то последовательность нуклеиновой кислоты формулы (II), (IIа) и/или (IIb) может являться одноцепочечной за пределами основного структурного фрагмента GlXmGn) и двухцепочечной в области основного структурного фрагмента GlXmGn, которые предпочтительно выбирают по крайней мере из одной описанных выше последовательностей SEQ ID NO:1-80 или 81-83. Еще более предпочтительно основной структурный фрагмент GlXmGn (или ClXmCn) формулы (II), (IIа) и/или (IIb) может являться двухцепочечной структурой в указанной области основного структурного фрагмента, в которой присутствуют последовательности уридина (урацила), наиболее предпочтительно расположенной вдоль всей цепи уридинов (урацилов) или по крайней мере в 60%, 70%, 80%, 90%, 95%, 98% или 99% цепи.
В другом или дополнительном варианте, если нуклеиновая кислота по настоящему изобретению формулы (II), (IIа) и/или (IIb) является частично двухцепочечной нуклеиновой кислотой, другие участки (в отличие от основного структурного фрагмента GlXmGn) нуклеиновой кислоты по настоящему изобретению формулы (II), (IIа) и/или (IIb), как описано выше, могут являться двухцепочечными. Например, последовательность нуклеиновой кислоты формулы (II), (IIа) и/или (IIb) может являться двухцепочечной структурой за пределами основного структурного фрагмента GlXmGn, например, в граничных элементах Nv и/или Nv, и/или в модифицирующем элементе поли(Х), например, поли(Х)s и/или поли(Х)t (таком как, например, последовательность поли(I:С) или поли(А:U)), и одноцепочечной структурой указанного основного структурного фрагмента GlXmGn, который предпочтительно выбирают по крайней мере из одной описанных выше последовательностей SEQ ID NO:1-83. Например, по крайней мере один Nv и/или Nv и/или по крайней мере один модифицирующий элемент поли(Х), например, поли(Х)s и/или поли(Х)t, может являться двухцепочечной структурой, в то время как остальные элементы формулы (II), (IIа) и/или (IIb), например, основной структурный фрагмент GlXmGn и/или другие элементы могут являться одноцепочечными.
В другом или дополнительном варианте смесь по настоящему изобретению можно выбирать из одноцепочечной нуклеиновой кислоты формулы (II), (IIа) и/или (IIb) и (частично) двухцепочечной нуклеиновой кислоты формулы (II), (IIа) и/или (IIb), предпочтительно характеризующейся соотношением приблизительно от 1:10 до 10:1, более предпочтительно соотношением от 1:3 до 3:1.
Согласно наиболее предпочтительному варианту нуклеиновую кислоту по настоящему изобретению формулы (II), (IIа) и/или (IIb) можно выбирать, например, из следующих последовательностей:

В другом предпочтительном варианте нуклеиновую кислоту по настоящему изобретению формулы (I) (или (Iа)), как описано выше, можно модифицировать при введении структур типа тяж или тяж-петля, при этом получают нуклеиновую кислоту формулы (IIIa),
(Nu тяж1 GlXmGn тяж2 Nv)a,
или нуклеиновую кислоту формулы (IIIb),
(Nu GlXmGnNv)a тяж1 Nw1 тяж2 Nw2,
где длина нуклеиновой кислоты формулы (IIIa) и/или (IIIb) по настоящему изобретению составляет по крайней мере 100 нуклеотидов, более предпочтительно по крайней мере 150 нуклеотидов, еще более предпочтительно по крайней мере 200 нуклеотидов и наиболее предпочтительно по крайней мере 250 нуклеотидов. Указанные формулы (IIIa) и (IIIb) можно определять на основе формулы (Ib), т.е. введением основного структурного фрагмента ClXmCn.
Прежде всего нуклеиновые кислоты по настоящему изобретению формулы (IIIa) и/или (IIIb) представляют собой вариант формулы (I), как описано выше. В составе нуклеиновой кислоты формулы (IIIa) и/или (IIIb) граничные элементы N, т.е. Nu и/или Nv, граничащие с основным структурным фрагментом GlXmGn, содержат по крайней мере одну структуру типа тяж или тяж-петля, предпочтительно включающем элементы тяж 1 и тяж 2 в одной структуре типа тяж-петля. Элементы G, Х и N, прежде всего основной структурный фрагмент GlXmGn и элементы Nu и Nv, а также целые числа а, 1, m, n, u и v в составе нуклеиновой кислоты формулы (IIIa) и/или (IIIb) имеют значения, определенные выше. Более предпочтительно целое число а равно 1. Необязательно u и/или v могут равняться 0. Кроме того, элементы Nw1 и Nw2, соседние с элементами тяж1 и тяж2 в структуре типа тяж-петля, являются дополнительными граничными элементами, значения которых аналогичны значениям Nu и/или Nv, как описано выше. Прежде всего, граничный элемент N имеет значение, описанное выше для N в формуле (I), а целые числа w1 и w2 выбирают независимо друг от друга из простых чисел u и/или v, как описано выше для формулы (I).
Термин «структура типа тяж или тяж-петля», использованный в данном контексте, обозначает внутримолекулярное образование комплементарных пар нуклеотидов, которое может происходить в одноцепочечной ДНК или чаще в РНК. Данная структура известна также под названием шпилька или петля-шпилька. Такая структура образуется за счет комплементарности оснований из двух фрагментов одной и той же молекулы, например, элементов тяж1 и тяж2 в структуре тяж-петля, обычно элементы палиндромной последовательности нуклеиновой кислоты образуют двухцепочечный тяж (двойную спираль) и неспаренную петлю. Таким образом, неспаренная петля обычно обозначает участок нуклеиновой кислоты, который характеризуется отсутствием или практически полным отсутствием гомологии с последовательностью элемента тяж1 или тяж2 и, таким образом, такая неспаренная петля не способна образовывать комплементарные пары с любым из указанных элементов структуры тяж-петля. Полученная лепестковая структура является основным строительным блоком вторичных структур многих РНК. Таким образом, образование лепестковой структуры зависит от стабильности образующихся спиральных и петельных участков, при этом первым обязательным условием обычно является присутствие последовательности, которая может сворачиваться и образовывать двойную спираль из пар оснований. Стабильность спаренных элементов типа тяж-петля определяется длиной, числом ошибочных спариваний оснований или выступов, которые содержатся в структуре (небольшое количество ошибочных спариваний оснований обычно является допустимым, особенно в длинных спиралях), а также составом оснований на спаренном участке. Например, спаривание между гуанозином (гуанином) и цитидином (цитозином) может являться предпочтительным в указанных последовательностях, поскольку они содержат три водородные связи и являются более стабильными по сравнению с парами аденозин (аденин) - уридин (урацил), которые содержат только две водородные связи. В составе РНК предпочтительным являются две водородные связи гуанозин (гуанин) - уридин (урацил). Стабильность петли влияет на образование структуры тяж-петля. «Петли» (т.е. только петля, не содержащая элементов петли тяж1 и тяж2), которые содержат менее трех оснований, являются стерически менее предпочтительными. Однако могут присутствовать тяжи, т.е. структуры, не содержащие (отчетливо выраженных) петель, а только неспаренный участок между тяжем1 и тяжем2. В контексте настоящего изобретения оптимальная длина петли составляет приблизительно от 4 до 100 оснований, более предпочтительно от 4 до 50 оснований или даже от 4 до 30 или от 4 до 20 оснований.
Следовательно, в случае нуклеиновой кислоты формулы (IIIa) и/или (IIIb), элементы тяж-петля тяж1 и тяж2 обычно представляют собой участки одной структуры типа тяж или тяж-петля, причем эти структуры образуются из элементов тяж1 и тяж2, а петля образуется из последовательности, которая расположена между этими элементами структуры типа тяж-петля. Структуры тяж или тяж-петля могут образовать спираль из спаренных оснований. Каждый элемент структуры тяж-петля тяж1 и тяж2 предпочтительно представляют собой нуклеиновую кислоту, как описано выше, более предпочтительно РНК, наиболее предпочтительно оцРНК, где любые нуклеотиды (нуклеозиды) или их аналоги как описано выше, в составе элемента основного структурного фрагмента Х можно использовать в качестве нуклеотидов (нуклеозидов) для тяжа1 и/или тяжа2. Кроме того, элемент структуры тяж-петля тяж1 представляет собой палиндромную последовательность в отношении элемента тяж2. Таким образом, обе последовательности способны образовывать пары оснований из каждой другой последовательности и образовывать структуру-основу для тяжа или тяжа-петли.
Таким образом, элементы структуры тяж-петля тяж1 и тяж2 можно выбирать из комплементарных последовательностей любых нуклеиновых кислот, при условии, что элементы тяжа-петли тяж1 или тяж2 являются палиндромными по отношению друг к другу, т.е. одна последовательность идентична другой (т.е. является комплементарной) в обратном направлении, или характеризуются гомологией с указанной последовательностью по крайней мере на 90%, более предпочтительно по крайней мере на 95% и наиболее предпочтительно на 99% в обратном направлении. Каждая из указанных палиндромных последовательностей тяж1 и тяж2 может образовываться из последовательности любой нуклеиновой кислоты, длина которой составляет приблизительно от 5 до 50, более предпочтительно приблизительно от 5 до 40 и наиболее предпочтительно приблизительно от 5 до 30 оснований, которые выбирают из аденозина (аденина), гуанозина (гуанина), цитидина (цитозина), уридина (урацила), тимидина (тимина) или их аналогов, как описано в данном контексте.
Примеры последовательностей элементов структуры тяж-петля тяж1 и тяж2 могут включать, например:
а) для тяжа1:
UAGCGAAGCUCUUGGACCUA (SEQ ID NO:95)
для тяжа2:
UAGGUCCAAGAGCUUCGCUA (SEQ ID NO:96)
б) для тяжа1:
UAGGUCCAAGAGCUUCGCUA (SEQ ID NO:96)
для тяжа2:
UAGCGAAGCUCUUGGACCUA (SEQ ID NO:95)
в) для тяжа1:
GCCGCGGGCCG (SEQ ID NO:97)
для тяжа2:
CGGCCCGCGGC (SEQ ID NO:98)
г) для тяжа1:
CGGCCCGCGGC (SEQ ID NO:98)
для тяжа2:
GCCGCGGGCCG (SEQ ID NO:97)
д) для тяжа1:
GACACGGUGC (SEQ ID NO:99)
для тяжа2:
GCACCGUGCA (SEQ ID NO:100)
e) для тяжа1:
GCACCGUGCA (SEQ ID NO:100)
для тяжа2:
GACACGGUGC (SEQ ID NO:99)
ж) для тяжа1:
ACCUAGGU (SEQ ID NO:101)
для тяжа2:
ACCUAGGU (SEQ ID NO:101)
з) для тяжа1:
UGGAUCCA (SEQ ID NO:102)
для тяжа2:
UGGAUCCA (SEQ ID NO:102)
и) для тяжа1:
CCUGC (SEQ ID NO:103)
для тяжа2:
GCAGG (SEQ ID NO:104)
к) для тяжа1:
GCAGG (SEQ ID NO:105)
для тяжа2:
CCUGC (SEQ ID NO:106) И Т.П.
В одном варианте основной структурный фрагмент GlXmGn может располагаться внутри структуры тяж-петля, т.е. основной структурный фрагмент GlXmGn может располагаться межу элементами структуры тяж-петли тяж1 и тяж2, предпочтительно образуя петлю. Указанная нуклеиновая кислота характеризуется формулой (IIIa), состав которой (элементы Nu, тяж1, GlXmGn, тяж, Nv) описан выше. Если и и/или v равно 0, и а равно 1, то формула (IIIa) представляет собой особую нуклеиновую кислоту «тяж1 GlXmGn тяж2», также включенную в настоящее изобретение.
В другом варианте основной структурный фрагмент GlXmGn может располагаться за пределами структуры тяж-петля, где, соответственно, элементы структуры тяж-петля, тяж1 и тяж2, могут разделяться друг от друга последовательностью, предпочтительно граничным элементом N, например, Nw1 или Nw2, которые затем могут образовывать структуру петли при спаривании оснований в элементах тяж1 и тяж2. Кроме того, элементы структуры тяж-петля 1 и/или элемент 1, соседний с основным структурным фрагментом GlXmGn, могут отделяться от основного структурного фрагмента GlXmGn дополнительным граничным элементом, например, Nw1 или Nw2. Согласно настоящему изобретению указанная нуклеиновая кислота характеризуется формулой (IIIb) состава (NuGlXmGnNv)a тяж1 Nw1 тяж2 Nw2, как описано выше.
Нуклеиновая кислота по настоящему изобретению формулы (IIIa) и/или (IIIb) может являться одноцепочечной или частично двухцепочечной нуклеиновой кислотой.
Если нуклеиновая кислота по настоящему изобретению формулы (IIIa) и/или (IIIb) является одноцепочечной нуклеиновой кислотой, то последовательность обычно является одноцепочечной вдоль всей длины.
Если нуклеиновая кислота по настоящему изобретению формулы (IIIa) и/или (IIIb) является частично двухцепочечной нуклеиновой кислотой, то нуклеиновая кислота формулы (IIIa) и/или (IIIb) предпочтительно является одноцепочечной на участке элементов структуры тяж-петля, тяж1 и тяж2, и на участках петли, образованной основным структурным элементом GlXmGn или любым другим элементом, например, Nw1 или Nw2. Элементы, расположенные за пределами элементов структуры тяж-петля, тяж1 и тяж2, и на участках петли, образованной либо основным структурным фрагментом GlXmGn или любым другим элементом, например, Nw1 или Nw2, могут являться независимо друг от друга, одноцепочечными или двухцепочечными.
В другом или дополнительном варианте смеси одноцепочечной или частично двухцепочечной нуклеиновой кислоты формулы (IIIa) и/или (IIIb) и (частично) двухцепочечной нуклеиновой кислоты формулы (IIIa) и/или (IIIb), предпочтительно характеризуются соотношением приблизительно от 1:10 до 10:1, более предпочтительно соотношением от 1:3 до 3:1.
Согласно наиболее предпочтительному варианту нуклеиновую кислоту по настоящему изобретению формулы (IIIa) и/или (IIIb) можно выбирать, например, из следующих последовательностей:
UAGCGAAGCU CUUGGACCUA GG OTJOTJU UUUUU UUUUU GGG UAGGUCCAAG AGCUUCGCUA (SEQ ID NO:107)
UAGCGAAGCU CUUGGACCUA GG UUUUU UUUUU UUUUU GGG UGCGUUCCUA GAAGUACACG GCCGCGGGCCG UGCGUUCCUA GAAGUACACG CGGCCCGCGGC UGCGUUCCUA GAAGUACACG
(элементы тяж1 и тяж2 подчеркнуты, а центральный элемент GlXmGn выделен жирным шрифтом)
Нуклеиновые кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, можно получить любым стандартным методом, включая синтетические методы, такие как твердофазный синтез, и методами in vitro, такими как реакции транскрипции in vitro. Для получения нуклеиновых кислот по настоящему изобретению предпочтительно используют транскрипцию in vitro. Неожиданно было установлено, что нуклеиновые кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, полученные транскрипцией in vitro с использованием их 5'-фосфата, характеризуются улучшенной стимуляцией врожденного иммунитета по сравнению с нуклеиновыми кислотами формулы (I), (Iа), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, полученными синтетическими методами. Не ссылаясь на какую-либо теорию, можно отметить, что указанная стимуляция врожденного иммунитета связана с активацией рецептора RIG-1. Соответственно, нуклеиновые кислоты формулы (I), (Iа), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, полученные транскрипцией in vitro, являются предпочтительными.
Нуклеиновые кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, обычно предлагаются в форме «стабилизированного олигонуклеотида», т.е. олигорибонуклеотида или олигодезоксирибонуклеотида, устойчивого к деградации in vivo (например, экзо-или эндонуклеазами). Указанную стабилизацию можно осуществлять, например, с использованием модифицированной фосфатной цепи нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше. Предпочтительно используемые нуклеотиды содержат модифицированную фосфоротиоатом фосфатную цепь, в которой предпочтительно по крайней мере один атом кислорода фосфатной группы в составе фосфатной цепи заменен на атом серы. Другие стабилизированные олигонуклеотиды включают, например: неионые аналоги, такие как например, алкил- и арилфосфонаты, в которых заряженный атом кислорода в составе фосфоната заменен на алкильную или арильную группу, или фосфодиэфиры или алкилфосфотриэфиры, в которых заряженный кислородный остаток присутствует в алкилированной форме. Однако предпочтительными являются природные фосфодиэфирные цепи.
Нуклеиновые кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, можно стабилизировать. Как описано выше, любую нуклеиновую кислоту, например, ДНК или РНК, в принципе можно использовать в качестве нуклеиновой кислоты формулы (I), (Iа), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как описано выше. Однако с точки зрения безопасности предпочтительным является использование РНК в качестве указанной нуклеиновой кислоты. Прежде всего, применение РНК исключает риск стабильной интеграции в геном трансформированной клетки. Кроме того, РНК деградирует с более высокой скоростью in vivo. Аналогичным образом в настоящее время не детектированы антитела анти-РНК, предположительно вследствие относительно короткого периода полураспада РНК in vivo по сравнению с ДНК. По сравнению с ДНК, РНК намного менее стабильна в растворе, что вызвано, в том числе, в основном действием РНК-деградирующих ферментов, так называемых РНКаз (рибонуклеаз). Даже в присутствии незначительных примесей рибонуклеазы наблюдается полная деградация РНК в растворе. Указанные примеси РНКаз можно удалить только при специальной обработке, прежде всего диэтилпирокарбонатом (ДЭПК). Соответственно, природная деградация мРНК в клеточной цитоплазме строго регулируется. В связи с этим в литературе описан ряд механизмов. Таким образом, концевая структура является принципиально важной для мРНК in vivo. В 5'-концевом фрагменте природных м-РНК присутствует так называемая «кэп-сруктура» (модифицированный гуанозин (гуанин) и в 3'-концевом фрагменте последовательность, содержащая до 200 аденозинов (аденинов) (так называемый полиА-концевой фрагмент).
Нуклеиновые кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) no настоящему изобретению, как описано выше, прежде всего предлагаются в виде (м)РНК, и, следовательно, их можно стабилизировать в отношении деградации РНКазами при введении так называемой структуры «5'-кэп». Наиболее предпочтительной в качестве структуры «5'-кэп» является m7G(5')ppp (5'(A,G(5')ppp(5')A или G(5')ppp(5')G. Однако указанную модификацию проводят, только если еще не проводили модификацию, например, модификацию липидами в 5'-концевом фрагменте нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, или если модификация не влияет на иммуногенные свойства (немодифицированной или химическим методом модифицированной) нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше.
В другом варианте 3'-концевой фрагмент нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, прежде всего если указанная нуклеиновая кислота представляет собой РНК, можно модифицировать при включении последовательности, содержащей по крайней мере 50 аденозиновых рибонуклеотидов, предпочтительно по крайней мере 70 аденозиновых рибонуклеотидов, более предпочтительно по крайней мере 100 аденозиновых рибонуклеотидов, наиболее предпочтительно по крайней мере 200 аденозиновых (адениновых) рибонуклеотидов, (так называемый полиА-концевой фрагмент). Прежде всего, нуклеиновая кислота формулы (I), (Iа), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, может содержать, прежде всего если РНК представляет собой мРНК, полиА-концевой фрагмент в 3'-концевом фрагменте, содержащий приблизительно от 10 до 100 аденозиновых нуклеотидов, прежде всего приблизительно от 10 до 200 аденозиновых нуклеотидов, более предпочтительно приблизительно от 10 до 100 аденозиновых нуклеотидов, более предпочтительно приблизительно от 20 до 100 аденозиновых нуклеотидов или еще более предпочтительно приблизительно от 40 до 80 аденозиновых нуклеотидов.
Кроме того, 3'-концевой фрагмент нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, прежде всего если нуклеиновая кислота представляет собой РНК, можно модифицировать при включении последовательности, содержащей по крайней мере 50 цитидиновых рибонуклеотидов, предпочтительно по крайней мере 70 цитидиновых рибонуклеотидов, более предпочтительно по крайней мере 100 цитидиновых рибонуклеотидов, наиболее предпочтительно по крайней мере 200 цитидиновых рибонуклеотидов, (так называемый полиС-концевой фрагмент). Прежде всего, нуклеиновая кислота формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, может содержать, прежде всего если РНК представляет собой мРНК, полиС-концевой фрагмент в 3'-концевом фрагменте, содержащий приблизительно от 10 до 200 цитидиновых нуклеотидов, прежде всего приблизительно от 10 до 200 цитидиновых нуклеотидов, предпочтительно приблизительно от 10 до 100 цитидиновых нуклеотидов, более предпочтительно приблизительно от 20 до 70 цитидиновых нуклеотидов или еще более предпочтительно приблизительно от 20 до 60 или даже от 10 до 40 цитидиновых нуклеотидов.
Аналогичным образом, указанную модификацию (полиА-концевой или полиС-концевой фрагмент) можно вводить, только если не проводили модификацию, например, модификацию липидами, в 3'-концевом фрагменте нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, или если модификация не влияет на иммуногенные свойства (немодифицированной или химическим способом модифицированной) нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше.
Указанные выше модификации, т.е. введение структуры «5'-кэп» или введение «полиА-концевого фрагмента» или «полиС-концевого фрагмента» в 3'-концевой участок, предотвращают преждевременную деградацию нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, in vivo и соответственно стабилизируют нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, in vivo.
Нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (П1а) и/или (IIIb) по настоящему изобретению, как описано выше, можно модифицировать липидами. Указанная липидно-модифицированная нуклеиновая кислота по настоящему изобретению обычно содержит нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как описано выше, по крайней мере одну линкерную группу, ковалентно связанную с нуклеиновой кислотой по настоящему изобретению, и по крайней мере один липид, ковалентно связанный с соответствующей линкерной группой. В другом варианте липидно-модифицированная нуклеиновая кислота по настоящему изобретению обычно содержит (по крайней мере одну) нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как описано выше, по крайней мере один (бифункциональный) липид, ковалентно связанный (в отсутствии линкерной группы) с указанной нуклеиновой кислотой по настоящему изобретению. В третьем варианте указанная липидно-модифицированная нуклеиновая кислота по настоящему изобретению обычно содержит нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как описано выше, по крайней мере одну линкерную группу, ковалентно связанную с нуклеиновой кислотой по настоящему изобретению, и по крайней мере один липид, ковалентно связанный с соответствующей линкерной группой, и кроме того по крайней мере один (бифункциональный) липид, ковалентно связанный (в отсутствии линкерной группы) с указанной нуклеиновой кислотой по настоящему изобретению.
Липидом, включенным в модифицированную липидом нуклеиновую кислоту по настоящему изобретению, обычно является липид или липофильный остаток, который предпочтительно является биологически активным. Указанные липиды предпочтительно включают природные вещества и соединения, такие как, например, витамины, например, α-токоферол (витамин Е), включая RRR-a-токоферол (старое название D-α-токоферол), L-α-токоферол, рацемат D,L-α-токоферола, сукцинат витамина Е (СВЕ) или витамин А и его производные, например, ретиноевая кислота, ретинол, витамин D и его производные, например, витамин D и также его эргостерольные предшественники, витамин Е и его производные, витамин К и его производные, например, витамин К и родственные соединения хинона и фитола, или стероиды, такие как желчные кислоты, например, холевая кислота, дезоксихолевая кислота, дегидрохолевая кислота, кортизон, дигоксигенин, тестостерон, холестерол или тиохолестерол. Другие липиды или липофильные остатки по настоящему изобретению включают, но, не ограничиваясь только ими, полиалкиленгликоли (см. статью Oberhauser и др., Nucl. Acids Res., т.20, с.533 (1992)), алифатические группы, такие как например, С1-С20алканы, С1-С20алкены или С1-С20алканольные соединения и т.п., такие как, например, додекандиол, гексадеканол или ундецильные остатки (Saison-Behmoaras и др., EMBO J., т.10, с.111 (1991), Kabanov и др., FEBS Lett., т.259, с.327 (1990), Svinarchuk и др.. Biochimie, т.75, с.49 (1993)), фосфолипиды, такие как, фосфатидилглицерин, диацилфосфатидилглицерин, фосфатидилхолин, дипальмитоилфосфатидилхолин, дистеароилфосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин, дигексадецил-рац-глицерин, сфинголипиды, цереброзиды, ганглиозиды или 1,2-ди-О-гексадецил-рац-глицеро-3-Н-фосфонат триэтиламмония (Manoharan и др., Tetrahedron Lett., т.36, с.3651 (1995), Shea и др., Nucl. Acids Res., т.18, с.3777 (1990)), полиамины или полиалкиленгликоли, такие как, например, полиэтиленгликоль (ПЭГ) (Manoharan и др., Nucleosides & Nucleotides, т.14, с.969 (1995)), гексаэтиленгликоль (ГЭГ), пальмитин или пальмитиновые остатки (Mishra и др., Biochim. Biophys. Acta, т.1264, с.229 (1995)), октадециламины или гексиламинокарбонилоксихолестерольные остатки (Crooke и др., J. Pharmacol. Exp. Ther., т.277, с.923 (1996)), а также воски, терпены, алициклические углеводороды, насыщенные и моно- или полиненасыщенные остатки жирных кислот и т.п.
Связь между липидом и нуклеиновой кислотой формулы (I), (Iа), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, в принципе может образовываться по любому нуклеотиду, основанию или сахаридному компоненту любого нуклеотида нуклеиновой кислоты по настоящему изобретению, в 3'- и/или 5'-концевом фрагменте, и/или по фосфатной цепи нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше. Прежде всего предпочтительной по настоящему изобретению является концевая липидная модификация нуклеиновой кислоты по настоящему изобретению в 3'- и/или 5'-концевом фрагменте. Концевая модификация характеризуется рядом преимуществ по сравнению с модификацией в центре последовательности. С одной стороны, модификации в центре последовательности могут влиять на свойства гибридизации, что может оказывать отрицательный эффект в случае стерически заторможенных остатков. С другой стороны, в случае синтеза липидно-модифицированной нуклеиновой кислоты по настоящему изобретению, модифицированной только в концевых фрагментах, синтез нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, можно проводить с использованием коммерческих мономеров, которые можно приобрести в большом количестве, и можно использовать стандартные методики синтеза.
Согласно первому предпочтительному варианту связывание нуклеиновой кислоты по настоящему изобретению и по крайней мере одного липида осуществляют через линкерную группу (ковалентно связанную с нуклеиновой кислотой формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше). Линкерные группы по настоящему изобретению обычно содержат по крайней мере две или не обязательно 3, 4, 5, 6, 7, 8, 9, 10, 10-20, 20-30 или более реакционноспособных групп, которые выбирают, например, из гидроксигруппы, аминогруппы, алкоксигруппы и т.п. Одна реакционноспособная группа предпочтительно предназначена для связывания описанной выше нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, например, олигонуклеотида РНК. Указанная реакционноспособная группа может присутствовать в защищенном виде, например, с использованием защитных групп, таких ДМТ (диметокситритилхлорид), Fmoc, MMT (монометокситритил), ТФУ (трифторуксусная кислота). Кроме того, серосодержащие группы можно защищать дисульфидами, например, алкилтиолами, такими как, например, 3-тиопропанол, или активированными компонентами, такими как 2-тиопиридин. Одна или более реакционноспособных групп по настоящему изобретению предназначена для ковалентного связывания одного или более липидов. В первом варианте нуклеиновая кислота формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, может связываться через ковалентно связанную линкерную группу предпочтительно по крайней мере с одним липидом, например, с 1, 2, 3, 4, 5, 5-10, 10-20, 20-30 или более липидом(ами) в расчете на одну молекулу нуклеиновой кислоты, прежде всего предпочтительно по крайней мере с 3-8 или более липидов (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше. Связанные липиды можно присоединять независимо друг от друга в различных положениях последовательности нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, или они могут присутствовать в виде комплекса в одном или более положениях нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше. Дополнительную реакционноспособную группу связующей группы можно использовать для прямого или косвенного (отщепляемого) связывания с материалом носителя, например, с твердой фазой. Предпочтительные линкерные группы по настоящему изобретению включают, например, гликоль, глицерин и производные глицерина, производные 2-аминобутил-1,3-пропандиола и 2-аминобутил-1,3-пропандиола, пирролидиновые связующие группы и пирролидинсодержащие органические молекулы (прежде всего для модификации в 3'-концевом фрагменте) и т.п. В качестве прежде всего предпочтительных по настоящему изобретению линкерных групп являются глицерин или производные глицерина (якорная группа С3) или 2-аминобутил-1,3-пропандиола (якорная группа С7). Производное глицерина (якорная группа С3) в качестве линкерной группы является наиболее предпочтительным в случае, когда липидную модификацию проводят через простую эфирную связь. Если липидную модификацию проводят через амидную или уретановую связь, то предпочтительным является, например, 2-аминобутил-1,3-пропандиол (якорная группа С7). В этой связи природа связи, образующейся между линкерной группой и нуклеиновой кислотой формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, является предпочтительно совместимой с условиями и реагентами для получения амидатов, т.е. связь не должна расщепляться ни в кислотных, ни в основных средах. Предпочтительными являются связи, быстро образующиеся в условиях синтеза и не гидролизующиеся в присутствии аммиака в процессе синтеза нуклеиновой кислоты. Пригодными связями являются все соответствующие пригодные связи, предпочтительно сложно-эфирные связи, амидные связи, уретановые и просто-эфирные связи. Кроме достаточно высокой совместимости с исходными материалами (несколько стадий синтеза), прежде всего предпочтительными являются просто-эфирные связи за счет их относительно высокой биологической стабильности в условиях ферментативного гидролиза.
Во втором предпочтительном варианте (по крайней мере одна) нуклеиновая кислота формулы (I), (Ia), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как описано выше, связана напрямую по крайней мере с одним (бифункциональным) липидом, как описано выше, т.е. в отсутствии линкерной группы, как описано выше. В данном случае (бифункциональный) липид по настоящему изобретению предпочтительно содержит по крайней мере 2 реакционноспособные группы или необязательно 3, 4, 5, 6, 7, 8, 9, 10 или более реакционноспособных групп, предназначенных для связывания липида напрямую или косвенно с материалом носителя, как описано в данном контексте, и по крайней мере одну дополнительную реакционноспособную группу, предназначенную для связывания с нуклеиновой кислотой формулы (I), (Iа), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как описано выше. Во втором варианте, нуклеиновая кислота формулы (I), (Ia), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как описано выше, может предпочтительно связываться по крайней мере с одним дипидом (напрямую в отсутствии линкерной группы), например, с 1, 2, 3, 4, 5, 5-10, 10-20, 20-30 или более липидом(ами), прежде всего предпочтительно по крайней мере с 3-8 или более липидом(ами) в расчете на одну молекулу нуклеиновой кислоты формулы (I), (Iа), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше. Связанные липиды могут разделяться друг от друга в различных положениях нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, или они могут присутствовать в виде комплекса в одном или более положений нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше. В другом варианте по крайней мере одна нуклеиновая кислота формулы (I), (Ia), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как описано выше, например, необязательно 3, 4, 5, 6, 7, 8, 9, 10, 10-20, 20-30 или более нуклеиновых кислот формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, можно присоединять, согласно второму варианту, к липиду, как описано выше, с использованием их реакционноспособных групп. Липиды, пригодные для использования согласно второму варианту, прежде всего предпочтительно включают такие (бифункциональные) липиды, которые обеспечивают связывание (предпочтительно по их концевым группам или необязательно во внутримолекулярных фрагментах), такие как, например, полиэтиленгликоль (ПЭГ) и его производные, гексаэтиленгликоль (ГЭГ) и его производные, алкандиолы, аминоалканы, тиоалканолы и т.п. Природа связи между (бифункциональным) липидом и нуклеиновой кислотой формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, предпочтительно определена при описании первого предпочтительного варианта.
В третьем варианте связывание между нуклеиновой кислотой формулы (I), (Iа), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как описано выше, и по крайней мере одним липидом, как описано выше, можно осуществлять согласно обоим описанным выше вариантам одновременно. Например, нуклеиновая кислота формулы (I), (Iа), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как описано выше, может связываться в одном положении нуклеиновой кислоты по крайней мере с одним липидом через линкерную группу (аналогично первому варианту) и в другом положении нуклеиновой кислоты формулы (I), (Iа), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, напрямую по крайней мере с одним липидом в отсутствие линкерной группы (аналогично второму варианту). Например, в 3'-концевом фрагменте нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, по крайней мере один липид, как описано выше, может ковалентно связываться с нуклеиновой кислотой через линкерную группу, а в 5'-концевом фрагменте нуклеиновой кислоты по настоящему изобретению липид, как описано выше, может ковалентно связываться с нуклеиновой кислотой в отсутствие линкерной группы. В другом варианте в 5'-концевом фрагменте нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, по крайней мере один липид, как описано выше, может ковалентно связываться с нуклеиновой кислотой через линкерную группу, и в 3'-концевом фрагменте нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, липид, как описано выше, может ковалентно связываться с нуклеиновой кислотой в отсутствие линкерной группы. Аналогичным образом, ковалентное связывание может происходить не только в концевых фрагментах нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как описано выше, но и в центральном фрагменте, как описано выше, например, в 3'-концевом и центральном фрагментах, в 5'-концевом и центральном фрагментах, в 3'- и 5'-концевых и центральном фрагментах, только в центральном фрагментах и т.п.
Модифицированную липидом нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как описано выше, предпочтительно получают различными способами. Модификацию липидом в принципе, как описано выше, можно проводить в любом участке нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, например, в 3'- и/или 5'-концевых фрагментах или в фосфатной цепи нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как описано выше и/или в любом основании или сахариде в любом нуклеотиде в составе нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как описано выше. В настоящем изобретении предпочтительными являются концевые липидные модификации в 3'- и/или 5'-концевых фрагментах нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) no настоящему изобретению, как описано выше. С использованием указанной концевой химической модификации по настоящему изобретению можно получать множество различных производных нуклеиновых кислот. Способ получения указанных модифицированных липидом нуклеиновых кислот формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, предпочтительно выбирают в зависимости от положения, в котором необходимо проводить липидную модификацию.
Если, например, модификацию липидом проводят в 3'-концевом фрагменте нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, то модификацию липидом обычно проводят до или после получения нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше. Получение нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, можно проводить прямым синтезом нуклеиновой кислоты или необязательно при добавлении готовой синтезированной нуклеиновой кислоты или нуклеиновой кислоты из образцов, выделенных из других источников.
Согласно первому варианту нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, синтезируют напрямую перед введением липида, обычно по стандартным методикам. В данном случае, исходный нуклеотид (нуклеозид) предпочтительно присоединяют к твердой фазе, например, через связывающую группу, например, через сукцинильный остаток, и затем нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как описано выше, синтезируют, например, с использованием амидитного метода. Линкерную группу, как описано в данном контексте, затем ковалентно присоединяют, предпочтительно через первую реакционноспособную группу линкера к 3'-концевому фрагменту нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как описано выше. Затем липид, как описано выше, можно ковалентно присоединить к линкерной группе через вторую реакционноспособную группу линкера. В другом варианте линкерную группу присоединяют к липиду перед связыванием с 3'-концевым фрагментом нуклеиновой кислоты формулы (I), (Iа), (II), (IIа), (IIb), (IIIa) и/или (IIIb) no настоящему изобретению, как описано выше. В таком случае необходимо только присоединить первую реакционноспособную группу линкера к 3'-концевому фрагменту нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше. После синтеза нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как описано выше, или после связывания с липидом, нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как описано выше, можно отделить от твердой фазы и удалить защитные группы. Если синтез проводят в растворе, то стадии промывки и очистки для удаления непрореагировавших реагентов, растворителей и нежелательных вторичных продуктов можно проводить после синтеза модифицированной липидом нуклеиновой кислоты по настоящему изобретению (и необязательно перед отделением от материала носителя).
Согласно следующему варианту, модифицированную липидом по 3'-фрагменту нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как определено выше, получают после введения липида в реакционноспособную группу линкера, или присоединяют липид к реакционноспособной группе линкера в составе синтезированной нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше. Например, первую реакционноспособную группу линкера, как описано выше, вводят в реакцию с липидом, как описано выше. Затем, предпочтительно на второй стадии, во вторую реакционноспособную группу линкера вводят кислотоустойчивую защитную группу, например, ДМТ, Fmoc и т.п., чтобы обеспечить последующее присоединение нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, к указанной реакционноспособной группе. Затем линкер присоединяют к твердой фазе напрямую или косвенным способом через третью реакционноспособную группу линкера. Косвенное связывание можно осуществить, например, через (конденсирующую) молекулу, которая ковалентно присоединена к линкеру и к твердой фазе. Указанной (конденсирующей) молекулой является, например, сукцинильная группа и т.п., как описано выше. Затем защитную группу в составе третьей реакционноспособной группы линкера удаляют и обычно проводят конденсацию или синтез нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, с использованием реакционноспособной группы, которая в данный момент является свободной. Наконец, модифицированную липидом нуклеиновую кислоту по настоящему изобретению обычно отщепляют от материала носителя (и необязательно удаляют защитные группы в нуклеиновой кислоте). Кроме того, можно также присоединить следующий липид по концевому 3'-фрагменту конденсированной нуклеиновой кислоты по настоящему изобретению формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb), предпочтительно согласно одной описанной выше стадии.
Согласно подварианту указанного упомянутого выше варианта, линкер, как описано выше, можно присоединить напрямую или косвенным способом к твердой фазе через первую реакционноспособную группу. Затем кислотоустойчивую защитную группу сначала присоединяют ко второй реакционноспособной группе линкера. После связывания защитной группы со второй реакционноспособной группой, липид, как описано выше, сначала можно присоединить к третьей реакционноспособной группе линкера. Затем аналогичным образом предпочтительно удаляют защитную группу третьей реакционноспособной группы линкера и проводят присоединение или синтез нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, с использованием реакционноспособной группы, которая в данный момент является свободной, и отщепляют модифицированную липидом нуклеиновую кислоту по настоящему изобретению от материала носителя (и необязательно удаляют защитные группы в нуклеиновой кислоте).
Согласно, прежде всего, предпочтительному варианту, модифицированную липидом по 3'-фрагменту нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, такую как модифицированная липидом нуклеиновая кислота по настоящему изобретению, получают через линкер, содержащий три реакционноспособные группы (трифункциональное якорное соединение) на основе глицерина (якорная группа С3) и включающий монофункциональный липид, такой как, например, остаток пальмитиновой кислоты, холестерина или токоферола. В данном случае в качестве исходного соединения для получения линкера можно использовать, например, а,(3-изопропилиденглицерин (глицерин, содержащий кетальзащитную группу), который сначала предпочтительно превращают в присутствии гидрида натрия в алкоголят и вводят в реакцию Вильямсона с гексадецилбромидом и липидом, при этом получают соответствующий простой эфир. В другом варианте, на первой стадии эфирную связь вводят другим способом, например, при образовании тозилата α,β-изопропилиденглицерина и взаимодействии тозилата с реакционноспособной группой липида, например, с кислотным протоном, при этом получают соответствующий простой эфир. На второй стадии кетальзащитную группу удаляют в присутствии кислоты, например, уксусной кислоты, разбавленной соляной кислоты и т.п. и затем первичную гидроксильную группу в составе диола селективно защищают диметокситритилхлоридом (ДМТ-Сl). На последней стадии полученный на предыдущей стадии продукт предпочтительно вводят в реакцию с янтарным ангидридом в присутствии DMAP в качестве катализатора, при этом получают сукцинат. Указанный линкер, прежде всего, можно использовать, например, для присоединения остатков пальмитиновой кислоты или токоферола в качестве липида.
Согласно другому варианту, модифицированную липидом по 3'-фрагменту нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, получают с использованием (бифункционального) липида, такого как, например, полиэтиленгликоль (ПЭГ) или гексаэтиленгликоль (ГЭГ) в отсутствии линкера, как описано выше. Указанные бифункциональные липиды обычно содержат две функциональные группы, как описано выше, при этом один концевой фрагмент бифункционального липида предпочтительно присоединяют к материалу носителя через (конденсирующую) молекулу, например, через отщепляемую в щелочных средах сукцинильную якорную группу и т.п., как описано выше, а нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, синтезируют с использованием другого концевого фрагмента бифункционального липида (Ваyer Е., Maier М., Bleicher К., Gaus H.-J., Z.Naturforsch., 50b, c.671 (1995)). Метод получения указанной модифицированной липидом нуклеиновой кислоты по настоящему изобретению соответственно упрощается при отсутствии третьей функциональной группы и линкера, как описано выше. С этой целью бифункциональный липид, используемый по настоящему изобретению, например, полиэтиленгликоль, сначала обычно монозамещают защитной группой, например, ДМТ. На второй стадии обычно проводят этерификацию защищенного липида в присутствии янтарного ангидрида по реакционноспособной группе в присутствии катализатора DMAP, при этом получают сукцинат. Затем на третьей стадии бифункциональный липид можно конденсировать с материалом носителя и удалить защитные группы, и на четвертой стадии синтезируют нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, согласно описанному выше способу. Затем в полученной нуклеиновой кислоте формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, необязательно удаляют защитные группы и отщепляют модифицированную липидом нуклеиновую кислоту от материала носителя.
Согласно другому предпочтительному варианту, модификацию липидом нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, можно проводить по концевому 5'-фрагменту нуклеиновой кислоты. В связи с этим, модификацию липидом обычно проводят с использованием готовой нуклеиновой кислоты или после синтеза нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше. Нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, можно получить, как определено выше, прямым синтезом нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, или использовать уже готовую нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как определено выше. Синтез нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, предпочтительно проводят аналогично тому, как описано выше, по известной методике синтеза нуклеиновых кислот, более предпочтительно, фосфорамидитным методом.
Согласно, прежде всего, предпочтительному варианту модификацию липидом нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, можно проводить по концевому 5'-фрагменту нуклеиновой кислоты по настоящему изобретению с использованием специфически модифицированных фосфорамидитов по фосфорамидитному способу получения нуклеиновой кислоты. Указанные амидиты, которые получают известным достаточно простым методом, обычно конденсируют в качестве последнего мономера с коммерческой нуклеиновой кислотой или предварительно синтезированной нуклеиновой кислотой. Указанные реакции отличаются чрезвычайно быстрой кинетикой и чрезвычайно высокими выходами. Получение модифицированных амидитов предпочтительно проводят при взаимодействии фосфорамидита, например, р-цианоэтилмонохлорфосфорамидита (хлорангидрида-диизопропиламида моно(2-цианоэтилового эфира) фосфорной кислоты) с алкоголятом липида, как определено выше, растворенным в пригодном растворителе, например, в абсолютном дихлорметане, например, с алкоголятом токоферола, холестерина, гексадеканола, ДМТ-ПЭГ и т.п. Аналогичным образом, предпочтительно в реакционную смесь добавляют DIPEA в качестве кислотного акцептора.
Указанные фосфорамидиты, используемые для получения модифицированной липидом по 5'-фрагменту нуклеиновой кислоты по настоящему изобретению, относительно устойчивы к гидролизу, и их можно очищать (перед синтезом) хроматографией на силикагеле. В этом случае в элюент обычно добавляют небольшое количество слабого основания, такого как, например, триэтиламин, чтобы исключить разложение амидита. Важно отметить, что требуется полностью удалить указанное основание из продукта, чтобы исключить снижение выхода конденсации. Указанное удаление можно проводить, например, при высушивании в вакууме, но, предпочтительно, при очистке фосфорамидитов осаждением из трет-бутилметилового эфира с использованием пентана. Если используемые модифицированные липидом амидиты характеризуются чрезвычайно высокой вязкостью, например, присутствуют в форме вязкого масла, также проводят экспресс-хроматографию (на колонке), при которой не требуется добавлять триэтиламин в качестве основания. Однако указанную очистку обычно не проводят в случае амидитов, модифицированных ПЭГ, поскольку они содержат отщепляемую в кислых средах защитную группу ДМТ.
В реакции конденсации модифицированных липидом фосфорамидитов по концевому 5'-фрагменту нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, предпочтительно используют растворители, в которых амидиты характеризуются достаточно высокой растворимостью. Например, благодаря высокой липофильности амидитов по настоящему изобретению их растворимость в ацетонитриле может снижаться. В связи с этим, в качестве растворителя, который обычно используется для реакции конденсации, вместо ацетонитрила предпочтительно используют раствор в хлорированных углеводородах, например, 0,1 М раствор в (абсолютном) дихлорметане. Однако при использовании дихлорметана требуется некоторая модификация стандартной методики циклов синтеза. Например, чтобы исключить осаждение амидита в шлангах автоматического синтезатора и на материале носителя, все краны и шланги, которые контактируют с амидитом, до и после текущей стадии конденсации промывают (абсолютным) дихлорметаном и сушат при продувке.
При использовании модифицированных липидом амидитов обычно достигаются высокие выходы конденсации, которые сопоставимы с выходом конденсации амидитов в стандартных условиях, как описано в предшествующем уровне техники. Реакции модифицированных липидом амидитов характеризуются более медленной кинетикой. В связи с этим, при использовании модифицированных липидом амидитов продолжительность конденсации предпочтительно (значительно) увеличивают по сравнению со стандартными методиками. Указанное время конденсации может определить специалист в данной области техники. Поскольку стадию кэппирования после конденсации можно исключить, то аналогичным образом при необходимости повышения общего выхода реакции можно проводить следующий цикл синтеза с использованием одного и того же модифицированного липидом амидита. В этом случае стадию удаления тритильных защитных групп обычно не проводят, например, в случае липидов, модифицированных ДМТ, таких как ДМТ-ПЭГ.
При получении модифицированной липидом по концевому 5'-фрагменту нуклеиновой кислоты по настоящему изобретению триэфир фосфита, через который липид присоединен к нуклеиновой кислоте формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, окисляют сульфирующим агентом. В этом случае предпочтительно используют сульфирующий агент, который обеспечивает максимально полное окисление фосфотриэфира. В другом случае, реакция сульфирования, например, из-за стерических ограничений, может происходить с чрезвычайно низким выходом, и после отщепления в аммиаке и удаления защитной группы MON образуется только незначительное количество продукта, или он совсем не образуется. Указанное явление зависит от типа модификации, использованного сульфирующего агента и условий сульфирования. Следовательно, окисление предпочтительно проводить в присутствии иода. В результате, несмотря на введение сложной фосфодиэфирной связи, из-за близости липидного остатка не следует ожидать, что указанная связь будет распознаваться нуклеазами в качестве субстрата.
При модификации липидом линкеры или (бифункциональные) липиды, присутствующие в нуклеиновой кислоте формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, или необязательно нуклеиновую кислоту саму по себе формулы (I), (Ia), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как определено выше, можно конденсировать напрямую или косвенно с материалом носителя. Прямую конденсацию предпочтительно проводят непосредственно с материалом носителя, в то время как косвенную конденсацию с материалом носителя обычно проводят с использованием дополнительного (конденсирующего) агента. Связь с материалом носителя, образующаяся при конденсации, предпочтительно является ковалентной (отщепляемой) связью с линкером или бифункциональным липидом и/или ковалентной (отщепляемой) связью с твердой фазой. Соединения, пригодные в качестве (конденсирующего) агента, включают, например, дикарбоновые кислоты, например, остатки янтарной кислоты (сукцинильные якорные группы), остатки щавелевой кислоты (оксалильные якорные группы) и т.п. Линкеры, (бифункциональные) липиды или необязательно нуклеиновые кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, которые аналогично, например, аминоалкильным группам (например, аминопропильным или аминогексанильным группам) содержат свободную функциональную аминогруппу, можно присоединять к материалу носителя через фталимидный линкер. Тиол-содержащие линкеры, (бифункциональные) липиды или необязательно нуклеиновые кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, можно присоединять к материалу носителя в форме дисульфида. Пригодные материалы носителя по настоящему изобретению включают, прежде всего, твердые фазы, такие как макропористые стекла CPG, Tentagel®, содержащий аминогруппы ПС-ПЭГ (Tentagel® S NH2) и т.п., предпочтительно CPG Tentagel® или содержащий аминогруппы ПС-ПЭГ (Tentagel® S NH2). Согласно прежде всего предпочтительному варианту для конденсации с материалом носителя можно, например, конденсировать сукцинаты описанных линкеров или бифункциональных липидов по настоящему изобретению предпочтительно с содержащим аминогруппы ПС-ПЭГ (Tentagel® S NH2) в присутствии в качестве конденсирующего агента TBTU/NMM (1H-бензотриазол-1-ил-1,1,3,3-тетраметилурониятетрафторборат/N-метилморфолин). В случае материалов носителя на основе ПС-ПЭГ, которые обычно используют для синтеза продуктов на уровне 1 мкмоль, наилучшие результаты обычно получают при содержании функциональных групп в интервале от 50 до 100 мкмоль/г (Bayer E., Bleicher К., Maier M., Z. Naturforsch., 50b, с. 1096 (1995)). Однако, если необходимо получить нуклеотиды по настоящему изобретению в более препаративном масштабе, материалы носителя предпочтительно содержат максимально возможное количество функциональных групп (≥100 мкмоль). Согласно настоящему изобретению указанный способ обеспечивает высокие выходы конденсации (Gerster M., Maier M., Clausen N., Schewitz J., Bayer E., Z. Naturforsch., 52b, c.110 (1997)). Например, высокие выходы можно обеспечивать при использовании материалов носителя, таких как, например, смолы, содержащие вплоть до 138 мкмоль/г функциональных групп или необязательно с более высоким содержанием функциональных групп. В связи с тем, что выходы конденсации с использованием описанных выше линкеров или бифункциональных липидов составляют приблизительно 100%, содержание функциональных групп в материале носителя можно относительно точно подбирать с учетом стехиометрического соотношения указанных соединений. Содержание функциональных групп предпочтительно регистрируют спектроскопическим методом по количеству отщепленной защитной группы ДМТ (см. экспериментальную часть). Остаточные аминогруппы, все еще присутствующие в материале носителя, блокируют (кэппируют) уксусным ангидридом. Указанное кэппирование обычно проводят после модификации материала носителя, но указанную реакцию также можно проводить непосредственно в ходе синтеза нуклеиновой кислоты, например, в ДНК-синтезаторе. Для получения модифицированных липидом нуклеиновых кислот, иммобилизованных на материалах носителя на основе производных ПС-ПЭГ, предпочтительно используют циклы синтеза, специально разработанные для смолы Tentagel® с учетом специфических свойств материала (Ваyer Е., Maier M., Bleicher К., Gaus H.-J., Z. Naturforsch., 50b, с.671 (1995), Ваyer Е., Bleicher К., Maier M., Z. Naturforsch., 50b, c.1096 (1995)). Предпочтительные изменения указанной методики по сравнению со стандартной методикой включают:
- большую продолжительность стадий конденсации, кэппирования и окисления,
- увеличение числа стадий удаления тритильных защитных групп,
- большую продолжительность стадий промывки после каждой стадии,
- использование раствора для промывки (0,1 М раствора в смеси диоксан/вода, 9:1), содержащего аскорбиновую кислоту, после стадии окисления, которая обычно требуется (для окисления триэфира фосфита) при амидитном способе для удаления следов иода.
Следует отметить, что природа модификации оказывает влияние на отдельные стадии цикла синтеза. Например, в случае материалов носителя на основе производных ПЭГ1500 наблюдается значительное замедление кинетики реакций, что приводит к необходимости увеличения продолжительности стадий удаления тритильных защитных групп и, кроме того, увеличения времени конденсации. Указанные изменения и модификации может определить специалист в данной области техники, и их можно использовать в любое время, указанное в описании настоящего изобретения. В ходе модифицированных таким образом циклов реакции можно получить как модифицированные липидом сложные фосфордиэфиры, так и фосфортиоаты. Липидные остатки не влияют на выход конденсации амидитов с линкерами или бифункциональными липидами по настоящему изобретению, который соответствует стандартным значениям (97-99%). При использовании указанных модификаций по концевому 3'-фрагменту сохраняется возможность получения производных по концевому 5'-фрагменту и проведения других модификаций, например, по остаткам основания, сахара или фосфата основной цепи.
Нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) no настоящему изобретению, как определено выше, в виде химически немодифицированной нуклеиновой кислоты или в виде (химически) модифицированной нуклеиновой кислоты, например, в виде модифицированной липидом нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, можно также стабилизировать за счет образования комплекса нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, например, но, не ограничиваясь только ими, с катионным полимером, катионными пептидами или полипептидами, предпочтительно с поликатионным полимером, таким как полилизин или полиаргинин или, в другом варианте, с катионными липидами или липофектантами, с гистоном, нуклеолином, протамином, олигофектамином, спермином или спермидином, а также с катионными полисахаридами, прежде всего, с хитозаном, TDM, MDP, мурамилдипептидом, с плюрониками и/или с производным указанных соединений и т.п. Гистоны и протамины являются катионными белками, которые принимают участие в природной компактизации ДНК. Таким образом, они принимают участие in vivo в процессе конденсации не-транскрибированной ДНК и ДНК определенных вирусов. В отношении гистонов, которые можно использовать в настоящем изобретении для получения комплекса с нуклеиновой кислотой формулы (I), (Ia), (II), (IIа), (IIb), (HIa) и/или (IIIb) по настоящему изобретению, как определено выше, в качестве более предпочтительных следует упомянуть гистоны H1, Н2а, Н3 и Н4. Однако, прежде всего, предпочтительным является протамин (протамин Р1 или Р2) или катионные частичные последовательности протамина. Согласно настоящему изобретению соединение предпочтительно представляет собой пептидную последовательность протамина Р1 или Р2, и, более точно, соответствующую (катионной) последовательности (SRSRYYRQRQRSRRRRRR (SEQ ID NO:109) или RRRLHRIHRRQHRSCRRRKRR (SEQ ID NO:110). Другие соединения, пригодные для получения комплекса нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, выбирают из адъювантов, как определено в данном контексте, но, не ограничиваясь только ими.
Использованный в данном контексте термин «образование комплекса» обозначает, что нуклеиновая кислота формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, связана со стабилизирующим соединением, как определено выше, например, с катионным полимером, катионными пептидами или полипептидами и т.п. за счет образования нековалентного комплекса нуклеиновой кислоты и стабилизирующего соединения. Использованный в данном контексте термин «нековалентный» обозначает обратимую ассоциацию нуклеиновой кислоты и стабилизирующего соединения за счет нековалентных взаимодействий указанных соединений, при этом молекулы ассоциированы за счет определенного типа электронного взаимодействия в отличие от ковалентной связи, например, за счет Ван-дер-Ваальсовых связей, т.е. слабого электростатического притяжения в связи с неспецифической силой притяжения двух молекул. Ассоциация нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, и стабилизирующего соединения находится в равновесии с диссоциацией указанного комплекса. Без учета какой-либо теории предполагается, что внутри клеток равновесие смещается в сторону диссоциации комплекса нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, и стабилизирующего соединения.
В одном варианте нуклеиновой кислотой формулы (I), (Ia), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как определено выше, является иммуностимулятор, если его вводят в отсутствие любого другого фармацевтического активного компонента, или указанную нуклеиновую кислоту используют в качестве адъюванта при введении в смеси с фармацевтическим активным компонентом, например, в виде композиции, содержащей фармацевтический активный компонент и адъювант (например, композиции вакцины, включающей специфический антиген и нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, в качестве адъюванта).
Нуклеиновая кислота формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, в качестве «иммуностимулятора» предпочтительно может инициировать неантигенную иммунную реакцию (обеспечивается врожденным иммунитетом), предпочтительно по иммуностимулирующему механизму. Обычно иммунная реакция вызывается различными способами. Важным фактором для соответствующей иммунной ответной реакции является стимуляция различных субпопуляций Т-клеток. Обычно Т-лимфоциты дифференцируют на две субпопуляции, клеточные Т-хелперы 1 (Th1) и клеточные Т-хелперы 2 (Th2), с помощью которых иммунная система разрушает внутриклеточные (Th1) и внеклеточные (Th2) патогены (например, антигены). Две популяции клеток Th различаются по спектру продуцируемых ими белков-эффекторов (цитокинов). Таким образом, клетки Th1 ускоряют клеточную иммунную ответную реакцию за счет активации макрофагов и цитотоксических Т-клеток. С другой стороны, клетки Th2 ускоряют гуморальную иммунную ответную реакцию за счет стимуляции превращения В-клеток в плазматические клетки и образования антител (например, против антигенов). В связи с этим, соотношение Th1/Th2 играет значительную роль в развитии иммунной ответной реакции. Согласно настоящему изобретению соотношение Th1/Th2 иммунной ответной реакции предпочтительно смещается под действием иммуностимулятора, а именно под действием нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, в сторону клеточной ответной реакции, то есть ответной реакции Th1, и таким образом предпочтительно индуцируется клеточная иммунная ответная реакция. Как определено выше, нуклеиновая кислота по настоящему изобретению сама по себе вызывает неспецифическую иммунную ответную реакцию, что позволяет использовать нуклеиновую кислоту отдельно (без добавления другого фармацевтического активного компонента) в качестве иммуностимулятора. При введении в смеси с другим фармацевтическим активным компонентом, предпочтительно со специфическим иммуностимулятором, нуклеиновая кислота по настоящему изобретению служит в качестве адъюванта, который поддерживает специфическую иммунную ответную реакцию, вызванную другим фармацевтическим активным компонентом.
Настоящее изобретение относится также к фармацевтическим композициям, включающим по крайней мере одну нуклеиновую кислоту по настоящему изобретению формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, и необязательно фармацевтически приемлемый (совместимый) носитель и/или другие вспомогательные вещества и добавки и/или адъюванты (первый вариант композиции по настоящему изобретению). Кроме того, настоящее изобретение относится к фармацевтическим композициям, включающим по крайней мере одну нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, например, одну, две, три, четыре, шесть, семь или более указанных нуклеиновых кислот, фармацевтический активный компонент и необязательно фармацевтически приемлемый носитель и/или другие вспомогательные вещества и добавки и/или адъюванты (второй вариант композиции по настоящему изобретению).
Фармацевтические композиции по настоящему изобретению обычно включают безопасное и эффективное количество по крайней мере одной нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, или одной, двух, трех, четырех, шести, семи или более указанных нуклеиновых кислот. Использованный в данном контексте термин «безопасное и эффективное количество» обозначает количество каждой или всех нуклеиновых кислот формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, в композиции, которое является достаточным для значительного и положительного влияния на состояние, подлежащее лечению, например, опухолевые, аутоиммунные заболевания, аллергию или инфекционное заболевание и т.п. Однако, в то же время, «безопасное и эффективное количество» является достаточно малым, чтобы исключить серьезные побочные действия, т.е. чтобы обеспечить целесообразное соотношение польза-риск. Указанные пределы обычно определяет медицинский персонал. В отношении нуклеиновой кислоты формулы (I), (Iа), (II), (IIа), (IIb), (IIIa) и/или (IIIb) no настоящему изобретению, как определено выше, термин «безопасное и эффективное количество» предпочтительно обозначает количество, достаточное для стимуляции иммунной системы, но при этом не наблюдается избыточная или приносящая вред иммунная реакция, а также предпочтительно не наблюдаются иммунные реакции ниже определяемого предела измерения. «Безопасное и эффективное количество» нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, изменяется в зависимости от конкретного состояния, подлежащего лечению, а также от возраста и физического состояния пациента, подлежащего лечению, тяжести состояния, продолжительности лечения, типа сопутствующего курса лечения, конкретного используемого фармацевтически приемлемого носителя и аналогичных факторов, известных лечащему врачу. Фармацевтические композиции по настоящему изобретению можно использовать в медицине, а также в ветеринарии.
Согласно первому варианту описанная выше нуклеиновая кислота формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, сама по себе является иммуностимулятором (без добавления любых других фармацевтических активных компонентов), прежде всего, при условии, что нуклеиновая кислота формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, модифицирована липидом. Липид может дополнительно повышать иммуностимулирующие свойства нуклеиновых кислот по настоящему изобретению или может представлять собой терапевтически активную молекулу, такую как, например, витамин или стероид, как описано выше, например, α-токоферол (витамин Б), D-α-токоферол, L-α-токоферол, D,L-α-токоферол, сукцинат витамина Е (СВЕ), витамин А и его производные, витамин D и его производные, витамин К и его производные и т.п.
Фармацевтические композиции согласно второму варианту осуществления настоящего изобретения могут содержать (кроме по крайней мере одной нуклеиновой кислоты формулы (I), (Iа), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как определено выше) по крайней мере один дополнительный фармацевтический активный компонент. В связи с этим, фармацевтический активный компонент обозначает соединение, которое оказывает терапевтическое действие в отношении конкретного показания, предпочтительно онкологических заболеваний, аутоиммунного заболевания, аллергии или инфекционных заболеваний. Указанные соединения включают, но, не ограничиваясь только ими, пептиды, белки, нуклеиновые кислоты, низкомолекулярные (молекулярная масса менее 5000, предпочтительно менее 1000) органические или неорганические (терапевтически активные) соединения, сахара, антигены или антитела, терапевтические агенты, известные в предшествующем уровне техники, антигенные клетки, антигенные клеточные фрагменты, клеточные фракции, модифицированные, аттенуированные или дезактивированные (например, химическим или радиационным методом) патогены (вирусы, бактерии и т.п.) и т.п.
Согласно первому подварианту второго варианта (композиции по настоящему изобретению) фармацевтическим активным компонентом, включенным в фармацевтическую композицию, является иммуномодулятор, предпочтительно иммуностимулятор. Наиболее предпочтительно, фармацевтическим активным компонентом является антиген или иммуноген. Следует понимать, что термины «антиген» и «иммуноген» обозначают любую структуру, которая стимулирует образование антител и/или активацию клеточной иммунной ответной реакции, то есть специфическую (а не адъювантную) иммунную ответную реакцию. В связи с этим, согласно настоящему изобретению термины «антиген» и «иммуноген» являются синонимами. Примеры антигенов включают пептиды, полипептиды, то есть так называемые белки, клетки, клеточные экстракты, полисахариды, конъюгаты полисахаридов, липиды, гликолипиды и углеводы. Примеры антигенов включают, например, опухолевые антигены, антигены животного, растительного, вирусного, бактериального, грибкового и протозойного происхождения, аутоиммунные антигены или аллергены. Предпочтительными являются поверхностные антигены опухолевых клеток и поверхностные антигены, прежде всего, секретируемые формы вирусных, бактериальных, грибковых или протозойных патогенов. Антиген представлен, например, в виде вакцины по настоящему изобретению, а также в виде гаптена, иммобилизованного на пригодном носителе. Можно также использовать другие антигенные компоненты, например, дезактивированные или аттенуированные патогены (как описано выше).
Антигенные полипетиды включают все известные антигенные пептиды, например, опухолевые антигены и т.п. Конкретные примеры опухолевых антигенов включают, но, не ограничиваясь только ими, опухоль-специфичные поверхностные антигены (TSSA), например, 5Т4, 707-АР, 9D7, AFP, AlbZIP HPG1, α-5-β-1-интегрин, α-5-β-6-интегрин, α-актинин-4/m, α-метилацилкоэнзим-А-рацемазу, ART-4, ARTC1/m, В7Н4, BAGE-1, BCL-2, bcr/ab1, β-катенин/m, BING-4, BRCA1/m, BRCA2/m, CA 15-3/CA 27-29, CA 19-9, CA72-4, CA125, калретикулин, CAMEL, CASP-8/m, катепсин В, катепсин L, CD19, CD20, CD22, CD25, CDE30, CD33, CD4, CD52, CD55, CD56, CD80, CDC27/m, CDK4/m, CDKN2A/m, CEA, CLCA2, CML28, CML66, COA-1/m, CLP (коактозино-подобный белок), комбинацию XXIII, COX-2, CT-9/BRD6, Cten, циклин B1, циклин D1, cyp-B, CYPB1, DAM-10, DAM-6, DEK-CAN, EFTUD2/m, EGFR, ELF2/m, EMMPRIN, EpCam, EphA2, EphA3, ЕrbВ3, ETV6-AML1, EZH2, FGF-5, FN, Frau-1, G250, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE7b, GAGE-8, GDEP, GnT-V, gp100, GPC3, GPNMB/m, HAGE, HAST-2, гепсин, Her2/neu, HERV-K-MEL, HLA-A*0201-R17I, HLA-A11/m, HLA-A2/m, HNE, гомеобокс NKX3.1, HOM-TES-14/SCP-1, HOM-TES-85, HPV-E6, HPV-E7, HSP70-2M, HST-2, hTERT, iCE, IGF-1R, IL-13Ra2, IL-2R, IL-5, незрелый ламининовый рецептор, калликреин-2, калликреин-4, Ki67, KIAA0205, KIAA0205/m, KK-LC-1, K-Ras/m, LAGE-A1, LDLR-FUT, MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-A10, MAGE-A12, MAGE-B1, MAGE-B2, MAGE-B3, MAGE-B4, MAGE-B5, MAGE-B6, MAGE-B10, MAGE-B16, MAGE-B17, MAGE-C1, MAGE-C2, MAGE-C3, MAGE-D1, MAGE-D2, MAGE-D4, MAGE-E1, MAGE-E2, MAGE-F1, MAGE-H1, MAGEL2, маммаглобин А, MART-1/мелан-А, MART-2, MART-2/m, матриксный белок 22, MC1R, M-CSF, ME1/m, мезотелин, MG50/PXDN, MMP11, MN/CA IX-антиген, MRP-3, MUC-1, MUC-2, MUM-l/m, MUM-2/m, MUM-3/m, миозин класса I/m, NA88-A, N-ацетилгликозаминилтрансферазу-V, Neo-PAP, Neo-PAP/m, NFYC/m, NGEP, NMP22, NPM/ALK, N-Ras/m, NSE, NY-ESO-1, NY-ESO-B, OA1, OFA-iLRP, OGT, OGT/m, OS-9, OS-9/m, остеокальцин, остеопонтин, р15, р190 минорный bcr-ab1, p53, p53/m, PAGE-4, PAI-1, PAI-2, PART-1, PATE, PDEF, Pim-1-киназу, Pin-1, Pm1/PARα, POTE, FRAME, PRDX5/m, простеин, протеиназу-3, PSA, PSCA, PSGR, PSM, PSMA, PTPRK/m, RAGE-1, RBAF600/m, RHAMM/CD168, RU1, RU2, S-100, SAGE, SART-1, SART-2, SART-3, SCC, SIRT2/m, Sp17, SSX-1, SSX-2/HOM-MEL-40, SSX-4, STAMP-1, STEAP, сурвивин, сурвивин-2В, SYT-SSX-1, SYT-SSX-2, TA-90, TAG-72, TARP, TEL-AML1, TGFβ, TGFβRII, TGM-4, TPI/m, TRAG-3, TRG, TRP-1, TRP-2/6b, TRP/INT2, TRP-p8, тирозиназу, UPA, VEGF, VEGFR-2/FLK-1 и WT1. В настоящем изобретении можно использовать любой класс опухолевых антигенов, например, известно, что опухолевые антигены принимают участие в образовании новых сосудов, воздействуя на внеклеточную матриксную структуру и т.п. Опухолевые антигены можно включать в фармацевтическую композицию в виде белкового или пептидного антигена или в виде мРНК или ДНК, кодирующих опухолевые антигены или эпитопы, предпочтительно указанные выше опухолевые антигены.
Во втором подварианте второго варианта (для композиции по настоящему изобретению, включающей нуклеиновую кислоту по настоящему изобретению (в качестве адъюванта) и дополнительный фармацевтический активный компонент) фармацевтическим активным компонентом является антитело. В связи с этим, можно использовать любое терапевтически пригодное антитело. Согласно настоящему изобретению, прежде всего, предпочтительными являются антитела против антигенов, белков или нуклеиновых кислот, которые играют важную роль в развитии онкологических заболеваний или инфекционных заболеваний, например, клеточные поверхностные белки, гены-суппрессоры опухолей или их ингибиторы, факторы роста и элонгации, относящиеся к апоптозу белки, опухолевые антигены или антигены, как описано выше, и т.п.
Согласно третьему подварианту второго варианта фармацевтическим активным компонентом, содержащимся в фармацевтической композиции по настоящему изобретению, является нуклеиновая кислота. Указанная нуклеиновая кислота является одноцепочечной или двухцепочечной и присутствует в форме гомо- или гетеродуплекса, а также в линейной или циклической форме. Нуклеиновая кислота, содержащаяся в качестве фармацевтического активного компонента в фармацевтической композиции, не ограничивается по длине цепи и включает последовательность любой нуклеиновой кислоты природного происхождения или ее комплементарную последовательность или фрагмент. Аналогичным образом, нуклеиновая кислота, используемая в этой связи, является частично или полностью синтетической. Например, термин «нуклеиновая кислота» включает нуклеиновую кислоту, которая кодирует белок (терапевтически соответствующий) и/или которая способна индуцировать иммунную реакцию, например, антиген или нуклеиновую кислоту, кодирующую антиген. В данном контексте антиген предпочтительно обозначает антиген, как описано выше.
Предпочтительно, нуклеиновой кислотой, содержащейся в качестве фармацевтического активного компонента в фармацевтической композиции по настоящему изобретению, является мРНК. Указанную мРНК можно добавлять в фармацевтическую композицию по настоящему изобретению в нативной форме или в стабилизированной форме, которая снижает или даже предотвращает деградацию нуклеиновой кислоты in vivo, например, под действием экзо- и/или эндонуклеаз.
Например, мРНК, содержащуюся в качестве фармацевтического активного компонента в фармацевтической композиции по настоящему изобретению, можно стабилизировать, как определено выше, при включении структуры 5-кэп, а в другом варианте или дополнительном варианте при включении 3'-полиА-концевого фрагмента и/или 3'-полиС-концевого фрагмента, содержащего по крайней мере 50 нуклеотидов, предпочтительно по крайней мере 70 нуклеотидов, более предпочтительно по крайней мере 100 нуклеотидов, прежде всего, предпочтительно по крайней мере 200 нуклеотидов. Как упомянуто выше, структура концевого фрагмента играет важную роль in vivo. За счет указанных структур РНК распознается в качестве мРНК и при этом регулируется деградация. Тем не менее, дополнительно существуют другие процессы, которые стабилизируют или дестабилизируют РНК. Многие указанные процессы до настоящего времени еще не известны, но при этом взаимодействие между РНК и белками в большинстве случаев оказывает значительное влияние. Например, недавно описана «система контроля мРНК» (Hellerm и Parker, Ann. Rev. Genet., 33, cc.229-260 (1999)), которая распознает неполную или анти-смысловую мРНК по специфическому взаимодействию белков в цитозоле по типу обратной связи, и указанная РНК подвергается деградации, причем большинство из указанных процессов осуществляются с участием экзонуклеаз.
мРНК, содержащуюся в качестве фармацевтического активного компонента в фармацевтической композиции по настоящему изобретению, аналогичным образом можно стабилизировать за счет ассоциации или образования комплексов мРНК с катионным соединением, или связывания с ним, прежде всего, с поликатионным соединением, например, с поликатионным пептидом или белком. Прежде всего, эффективным является применение в качестве поликатионного (связывающегося с нуклеиновой кислотой) белка протамина, нуклеолина, спермина или спермидина. Кроме того, аналогичным образом можно использовать другие катионные пептиды или белки, такие как поли-L-лизин или гистоны. Указанная методика стабилизации мРНК описана в патенте ЕР-А-1083232, содержание которого в полном объеме включено в настоящее описание в качестве ссылки. Другие предпочтительные катионные соединения, которые можно использовать для стабилизации мРНК, присутствующей в качестве фармацевтического активного компонента, включают катионные соединения, как описано в данном контексте в связи с адъювантами, которые можно использовать для хранения и доставки нуклеиновой кислоты по настоящему изобретению, например, катионные полисахариды, например, хитозан, полибрен, полиэтиленимин (ПЭИ) или поли-L-лизин (ПLЛ) и т.п. В отличие от действия модифицированной липидом нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) в форме адъюванта с целью увеличения проницаемости клеток, которое уже является преимуществом, ассоциация или образование комплексов мРНК с катионными соединениями, например, катионными белками или катионными липидами, например, с олигофектамином в качестве комплексообразующего реагента на основе липида, предпочтительно ускоряет перенос мРНК, присутствующей в качестве фармацевтического активного компонента, в клетки, которые предназначены для такой обработки, или в организм, подлежащий лечению. Указанное также относится к способам стабилизации нуклеиновой кислоты, описанным в данном контексте, в которых можно использовать комплексообразование для стабилизации мРНК.
Другой подход к стабилизации мРНК в качестве фармацевтического активного компонента в фармацевтической композиции по настоящему изобретению заключается в направленном изменении последовательности мРНК при удалении или изменении так называемых дестабилизирующих элементов последовательности (ДЭП). Сигнальные белки могут связываться с указанными дестабилизирующими элементами последовательности (ДЭП), которые содержатся, прежде всего, в мРНК эукариотов, и регулируют ферментативную деградацию мРНК in vivo. Следовательно, для дополнительной стабилизации мРНК, присутствующей в качестве фармацевтического активного компонента, предпочтительно включают одно или более изменений в последовательность по сравнению с соответствующей областью мРНК дикого типа и таким образом удаляют ДЭП. Безусловно, согласно настоящему изобретению предпочтительно необязательно исключить такие ДЭП, которые присутствуют в не-транслируемых областях мРНК (3'- и/или 5'-UTR). Примеры указанных выше ДЭП включают обогащенные по AU последовательности, которые присутствуют в областях 3'-UTR множества нестабильных мРНК (Caput и др., Ргос. Natl. Acad. Sci. USA, 83, cc.1670-1674 (1986)). В связи с этим, мРНК, используемую в качестве фармацевтического активного компонента, предпочтительно модифицируют по сравнению с мРНК дикого типа и таким образом удаляют любые указанные дестабилизирующие последовательности. Указанное утверждение также справедливо для таких мотивов последовательностей, которые распознаются возможными эндонуклеазами, например, последовательность GAACAAG, которая содержится в сегменте 3'-UTR гена, кодирующего рецептор трансферрина (Binder и др., EMBO J., 13, cc.1969-1980 (1994)). Указанные мотивы последовательностей предпочтительно также исключать из модифицированной липидом нуклеиновой кислоты по настоящему изобретению.
Кроме того, мРНК, присутствующую в качестве фармацевтического активного компонента в фармацевтической композиции по настоящему изобретению, можно модифицировать, например, при необходимости для эффективной трансляции, то есть за счет эффективного связывания рибосом с рибосомальным участком связывания (последовательность Козака: GCCGCCACCAUGG (SEQ ID NO:111), AUG образует инициирующий кодон). В этой связи следует отметить, что повышенное содержание A/U вблизи с указанным положением обеспечивает более эффективное связывание рибосомы с мРНК.
Кроме того, в состав мРНК, используемой в качестве фармацевтического активного компонента, можно вводить один или более так называемых участков (последовательностей) внутренней посадки рибосомы (IRES). Таким образом, IRES может осуществлять функцию единственного рибосомального участка связывания, но также может обеспечивать образование мРНК, которая кодирует множество пептидов или полипептидов, которые транслируются рибосомами независимо друг от друга («мультицистронная мРНК»). Примеры последовательностей IRES, которые можно использовать согласно настоящему изобретению, включают последовательности РНК пикорнавируса (например, FMDV), вируса чумы (CFFV), вируса полиомиелита (PV), вируса энцефаломиокардита (ECMV), вируса ящура (FMDV), вируса гепатита С (HCV), вируса классической чумы свиней (CSFV), вируса мышиного лейкоза (MLV), обезьяньего вируса иммунодефицита (ВИЧ) или вируса паралича сверчка (CrPV).
мРНК, необязательно используемая в качестве фармацевтического активного компонента в фармацевтической композиции по настоящему изобретению, аналогичным образом может включать в нетранслируемых 5'-и/или 3'-областях стабилизирующие последовательности, которые увеличивают период полураспада мРНК в цитозоле. Указанные стабилизирующие последовательности характеризуются 100% гомологией по сравнению с природными последовательностями, которые содержатся в РНК вирусов, бактерий и эукариотов, а также указанные последовательности можно использовать в виде частично или полностью синтетических последовательностей. В качестве примеров стабилизирующих последовательностей, которые можно использовать согласно настоящему изобретению, следует упомянуть не-транслируемые последовательности (UTR) гена β-глобина, например, Homo sapiens или Xenopus laevis. Другой пример стабилизирующей последовательности характеризуется общей формулой (C/U)CCANxCCC(U/A)PyxUC(C/U)CC (SEQ ID NO:112), которая содержится в участке 3'-UTR чрезвычайно стабильной мРНК, которая кодирует α-глобин, α-(1)-коллаген, 15-липоксигеназу или тирозингидроксилазу (см. Holcik и др., Ргос. Natl. Acad. Sci. USA, 94, cc.2410-2414 (1997)). Безусловно, указанные стабилизирующие последовательности можно использовать в отдельности или в комбинации друг с другом, а также в комбинации с другими стабилизирующими последовательностями, известными специалисту в данной области техники.
Для дальнейшего повышения эффективности необходимой трансляции мРНК, используемую в качестве фармацевтического активного компонента, можно модифицировать по сравнению с соответствующей мРНК дикого типа, при этом модификации можно проводить в виде различных вариантов или в виде комбинации одного варианта с другим вариантом. С другой стороны, содержание G/C в области модифицированной мРНК, кодирующей пептид или полипептид, может превышать содержание G/C в кодирующей области мРНК дикого типа, кодирующей пептид или полипептид, причем кодируемая аминокислотная последовательность является немодифицированной по сравнению с диким типом. Указанная модификация определяется тем фактом, что для эффективной трансляции мРНК важным фактором является стабильность мРНК. В связи с этим, состав и последовательность различных нуклеотидов играет важную роль. Прежде всего, последовательности, характеризующиеся повышенным содержанием G(гуанозин (гуанин))/С(цитидин (цитозин)), являются более стабильными по сравнению с последовательностями, характеризующимися повышенным содержанием А(аденозин (аденин))/и(уридин (урацил)). В связи с этим, согласно настоящему изобретению при сохранении транслируемой аминокислотной последовательности кодоны изменяют по сравнению с мРНК дикого типа таким образом, чтобы они содержали большее количество нуклеотидов G/C. Так как несколько кодонов кодируют одну и ту же аминокислоту (вырожденность генетического кода), следует выявить кодоны, которые вносят вклад в стабильность (альтернативное использование кодонов). В зависимости от аминокислоты, кодируемой мРНК, можно использовать различные модификации последовательности мРНК по сравнению с последовательностью дикого типа. В случае аминокислот, кодируемых кодонами, которые включают только нуклеотиды G или С, модификации кодона не требуется. Соответственно, никаких изменений кодонов, кодирующих аминокислоты Pro (CCC или CCG), Arg (CGC или CGG), Ala (GCC или GCG) и Gly (GGC или GGG), не требуется, так как нуклеотиды А и U отсутствуют. В случае кодонов, которые содержат нуклеотиды А и/или U, их заменяют на другие кодоны, которые кодируют те же аминокислоты, но не содержат А и/или U. Примеры включают: замену кодонов CCU или ССА, кодирующих Pro, на ССС или CCG, замену кодонов CGU или CGA или AGA или AGG, кодирующих Arg, на CGC или CGG, замену кодонов GCU или GCA, кодирующих Ala, на GCC или GCG, замену кодонов GGU или GGA, кодирующих Gly, на GGC или GGG. В других случаях, хотя нуклеотиды А и U нельзя удалить из состава кодонов, содержание А и U можно снизить за счет использования кодонов, которые содержат меньшее количество нуклеотидов А и/или U. Например, кодон UUU, кодирующий Phe, заменяют на UUC, кодоны UUA, CUU или CUA, кодирующие Leu, заменяют на CUC или CUG, кодоны UCU или UCA или AGU, кодирующие Ser, заменяют на UCC, UCG или AGC, кодон UAU, кодирующий Тyr, заменяют на UAC, кодон UAA (терминирующий трансляцию) заменяют на UAG или UGA, кодон UGU, кодирующий Cys, заменяют на UGC, кодон CAU, кодирующий His, заменяют на САС, кодон САА, кодирующий Gln, заменяют на CAG, кодоны ALJU или AUA, кодирующие Не, заменяют на AUC, кодоны ACU или АСА, кодирующие Thr, заменяют на АСС или ACG, кодон AAU, кодирующий Asn, заменяют на ААС, кодон АА, кодирующий Lys, заменяют на AAG, кодоны GUU или GUA, кодирующие Val, заменяют на GUC или GUG, кодон GAU, кодирующий Asp, заменяют на GAC, кодон GAA, кодирующий Glu, заменяют на GAG. С другой стороны, в случае кодонов, кодирующих Met (AUG) и Trp (UGG), модификация последовательности является невозможной. Перечисленные выше замены, безусловно, можно осуществлять в отдельности, но следует использовать все возможные комбинации для увеличения содержания G/C в модифицированной мРНК по сравнению с исходной последовательностью. Так, например, все кодоны, кодирующие Thr, содержащиеся в исходной последовательности (дикого типа), можно заменить на АСС (или ACG). Однако, предпочтительно, использовать комбинации указанных выше замен, например: замену в исходной последовательности всех кодонов, кодирующих Thr, на АСС (или ACG) и замену всех кодонов, кодирующих Ser, на UCC (или UCG или AGC), замену в исходной последовательности всех кодонов, кодирующих Не, на AUC и замену всех кодонов, кодирующих Lys, на AAG, а также замену всех кодонов, кодирующих Туг, на UAC, замену в исходной последовательности всех кодонов, кодирующих Val, на GUC (или GUG) и замену всех кодонов, кодирующих Glu, на GAG, a также замену всех кодонов, кодирующих Аlа, на GCC (или GCG) и замену всех кодонов, кодирующих Arg, на CGC (или CGG), замену в исходной последовательности всех кодонов, кодирующих Val, на GUC (или GUG) и замену всех кодонов, кодирующих Glu, на GAG, а также замену всех кодонов, кодирующих Аlа, на GCC (или GCG) и замену всех кодонов, кодирующих Gly, на GGC (или GGG) и замену всех кодонов, кодирующих Asn, на ААС, замену в исходной последовательности всех кодонов, кодирующих Val, на GUC (или GUG) и замену всех кодонов, кодирующих Phe, на UUC и замену всех кодонов, кодирующих Cys, на UGC, а также замену всех кодонов, кодирующих Leu, на CUG (или CUC) и замену всех кодонов, кодирующих Gin, на CAG, а также замену всех кодонов, кодирующих Pro, на ССС (или CCG) и т.п. Предпочтительно, содержание G/C в области мРНК, которая кодирует пептид или полипептид, (или в каждом другом необязательно присутствующем фрагменте) повышают по крайней мере на 7%, более предпочтительно по крайней мере на 15%, прежде всего, предпочтительно по крайней мере на 20% по сравнению с содержанием G/C в кодирующей области мРНК дикого типа, кодирующей соответствующий пептид или полипептид, и, предпочтительно по крайней мере на 50%, более предпочтительно по крайней мере на 70% и наиболее предпочтительно по крайней мере на 90%. В связи с этим, прежде всего, предпочтительно повышать содержание G/C в модифицированной таким образом мРНК по сравнению с последовательностью дикого типа до максимально возможного уровня.
Другой предпочтительный тип модификации мРНК, используемой в качестве фармацевтического активного компонента в фармацевтической композиции, основан на полученных данных о том, что эффективность трансляции также определяется различной частотой распространения тРНК в клетках. Следовательно, если содержание так называемых «редких» кодонов в последовательности РНК повышается, то уровень трансляции соответствующей мРНК значительно снижается по сравнению со случаем, когда присутствуют кодоны, кодирующие относительно «часто встречающиеся» тРНК. В связи с этим, согласно настоящему изобретению кодирующую область мРНК, используемой в качестве фармацевтического активного компонента, модифицируют по сравнению с соответствующей областью мРНК дикого типа таким образом, чтобы по крайней мере один кодон последовательности дикого типа, который кодирует относительно мало распространенную в клетке тРНК, был заменен на кодон, который кодирует относительно часто встречающуюся в клетке тРНК, которая переносит ту же аминокислоту, что и относительно редкая тРНК. В результате указанной модификации последовательность РНК изменяют таким образом, что в последовательность включают кодоны, для которых доступны часто встречающиеся тРНК. Относительно часто встречающиеся в клетке тРНК и тРНК, которые, наоборот, встречаются относительно редко, известны специалисту в данной области, см., например, статью Akashi, Curr. Opin. Genet. Dev., 11 (6), cc.660-666 (2001). В результате указанной модификации согласно настоящему изобретению можно заменить все кодоны в последовательности дикого типа, которые кодируют относительно редко встречающуюся в клетке тРНК, на кодон, который кодирует относительно часто встречающуюся в клетке тРНК, которая переносит ту же аминокислоту, что и относительно редкая тРНК. Прежде всего, предпочтительно комбинировать повышенное, прежде всего, максимальное содержание G/C в последовательности мРНК, как описано выше, с «часто встречающимися» ко донами без изменения аминокислотной последовательности антигенного пептида или полипептида (одного или более), кодируемого кодирующей областью мРНК. Предпочтительные антигены, которые могут кодироваться мРНК, обогащенной по содержанию G/C, перечислены выше.
Согласно четвертому подварианту второго варианта (для композиции по настоящему изобретению) нуклеиновой кислотой, содержащейся в качестве фармацевтического активного компонента в фармацевтической композиции по настоящему изобретению, является двухцепочечная РНК (дцРНК), предпочтительно короткая интерферирующая РНК (киРНК). Прежде всего, дцРНК или киРНК представляет интерес в связи с явлением интерференции РНК. В настоящее время явлению интерференции РНК уделяется внимание в ходе иммунологических исследований. В последние годы был открыт основанный на РНК механизм защиты, который наблюдается в грибковых микроорганизмах, а также у растений и животных и действует в качестве «иммунной системы генома». Первоначально указанная система была выявлена у различных видов независимо друг от друга, впервые у микроорганизмов С. elegans, до того как были идентифицированы идентичные механизмы указанных процессов: РНК-опосредованная резистентность к вирусам у растений, посттранскрипционный сайленсинг генов (ПТСГ) у растений и интерференция РНК в эукариотах, соответственно, которые основаны на общей методике. Метод интерференции РНК (иРНК) in vitro основан на индукции двухцепочечными молекулами РНК (дцРНК) последовательность-специфичного подавления экспрессии генов (Zamore, Nat. Struct. Biol., 9, cc.746-750 (2001), Sharp, Genes Dev., 5, cc.485-490 (2001), Hannon, Nature, 41, cc.244-251(2002)). При трансфекции клеток млекопитающих, включающих длинные дцРНК, активация протеинкиназы R и RnaseL вызывает неспецифические эффекты, такие как, например, ответная реакция интерферонов (Stark и др., Annu. Rev. Biochem., 67, cc.227-264 (1998), Не и Katze, Viral ImmunoL, 15, cc.95-119 (2002)). Указанные неспецифические эффекты можно исключить при использовании более короткой, например, содержащей 21-23 остатка, так называемой короткой интерферирующей РНК (киРНК), так как неспецифические эффекты не индуцируются в присутствии киРНК, длина которой составляет менее 30 пар оснований (Elbashir и др.. Nature, 411, cc.494-498 (2001)). Недавно были использованы дцРНК in vivo (McCaffrey и др., Nature, 418, cc.38-39 (2002), Xia и др., Nature Biotech., 20, cc. 1006-1010 (2002), Brummelkamp и др., Cancer Cell, 2, cc.243-247 (2002)).
В связи с этим, двухцепочечная РНК (дцРНК), используемая в качестве фармацевтического активного компонента в фармацевтической композиции по настоящему изобретению, предпочтительно содержит последовательность, характеризующуюся общей структурой 5'-(N17-29)-3', где N обозначает любое основание и представляет собой нуклеотид. Общая структура включает дцРНК, макромолекула которой содержит рибонуклеотиды, рибонуклеотид включает пентозу (рибозу или дезоксирибозу), органическое основание и фосфат. Органическое основание в составе РНК включает пуриновые основания аденозин (аденин. А) и гуанозин (гуанин, G) и пиримидиновые основания цитидин (цитозин. С) и уридин (урацил, U). дцРНК, используемая в качестве фармацевтического активного компонента в фармацевтической композиции по настоящему изобретению, содержит указанные нуклеотиды или аналоги нуклеотидов, характеризующиеся ориентированной структурой. дцРНК, используемая в качестве фармацевтического активного компонента по настоящему изобретению, предпочтительно характеризуется общей структурой 5'-(N19-25)-3', более предпочтительно 5'-(N19-24)-3', еще более предпочтительно 5'-(N21-23)-3', где N обозначает любое основание. Предпочтительно по крайней мере 90%, более предпочтительно 95% и, прежде всего, 100% нуклеотидов в составе дцРНК, используемой в качестве фармацевтического активного компонента, являются комплементарными с фрагментом последовательности (м)РНК (терапевтически соответствующего) белка или антигена, описанного выше (в качестве фармацевтического активного компонента). 90% Комплементарность обозначает, что используемая в настоящем изобретении дцРНК, длина которой составляет, например, 20 нуклеотидов, содержит не более 2 нуклеотидов, которые не комплементарны с соответствующим фрагментом (м)РНК. Однако, последовательность дцРНК, необязательно используемой в фармацевтической композиции по настоящему изобретению, предпочтительно является полностью комплементарной по своей общей структуре с фрагментом (м)РНК белка или антигена, описанного выше в качестве фармацевтического активного компонента.
В основном, все фрагменты длиной от 17 до 29, предпочтительно от 19 до 25 пар оснований, которые присутствуют в кодирующей области (м)РНК, могут выполнять функцию последовательности-мишени для дцРНК, используемой в качестве фармацевтического активного компонента в фармацевтической композиции по настоящему изобретению. Аналогичным образом, для дцРНК, используемой в качестве фармацевтического активного компонента, мишенями являются нуклеотидные последовательности белка (терапевтически соответствующего) или антигена, описанного выше (в качестве фармацевтического активного компонента), которые расположены за пределами кодирующей области, прежде всего, например, в не кодирующей 5'-области (м)РНК, следовательно, для дцРНК мишенями являются не кодирующие области (м)РНК, проявляющие регуляторную функцию. В связи с этим, последовательность-мишень для дцРНК, используемой в качестве фармацевтического активного компонента, белка или описанного выше антигена, может располагаться в транслируемой и не-транслируемой области (м)РНК и/или в области регуляторных элементов. Последовательность-мишень для дцРНК, используемой в качестве фармацевтического активного компонента в фармацевтической композиции по настоящему изобретению, может располагаться также в перекрывающейся области не-транслируемой и транслируемой последовательности, прежде всего, последовательность-мишень может включать по крайней мере один нуклеотид, расположенный перед инициирующим триплетом кодирующей области (м)РНК.
Модифицированный нуклеотид предпочтительно может присутствовать в дцРНК, используемой в качестве фармацевтического активного компонента в фармацевтической композиции по настоящему изобретению. Термин «модифицированный нуклеотид» по настоящему изобретению обозначает, что указанный нуклеотид модифицируют химическим способом. Специалисту в данной области техники представляется очевидным, что термин «химическая модификация» обозначает изменение структуры природного нуклеотида за счет замены, включения или удаления одного или более атомов или групп атомов. По крайней мере, один модифицированный нуклеотид в составе дцРНК, используемой в настоящем изобретении, с одной стороны, обеспечивает стабильность, а с другой стороны предотвращает диссоциацию. Предпочтительно модифицируют от 2 до 10 и, более предпочтительно, от 2 до 5 нуклеотидов в составе дцРНК, используемой в настоящем изобретении. Рекомендуется заменить по крайней мере одну 2'-гидроксигруппу нуклеотидов в составе двухцепочечной структуры дцРНК на химическую группу, предпочтительно 2'-аминогруппу или 2'-метильную группу. По крайней мере, один нуклеотид по крайней мере в одной цепи двухцепочечной структуры также представляет собой так называемый «блокированный нуклеотид», включающий сахарный цикл, который химически модифицирован, предпочтительно по 2'-0, 4'-С-метиленовой мостиковой связи. Некоторые нуклеотиды в составе дцРНК, используемой в настоящем изобретении, предпочтительно являются блокированными нуклеотидами. Кроме того, за счет модификации основной цепи дцРНК, используемой в настоящем изобретении, можно исключить ее преждевременную деградацию. В связи с этим, прежде всего, предпочтительна модифицированная дцРНК в форме фосфортиоата, 2'-O-метил-РНК, блокированной нуклеиновой кислоты (БНК), олигомеров с пропусками БЫК/ДНК и т.п., которая в связи с этим, характеризуется более продолжительным периодом полураспада in vivo.
Концевые фрагменты двухцепочечной РНК (дцРНК), используемой в качестве фармацевтического активного компонента в фармацевтической композиции по настоящему изобретению, предпочтительно можно модифицировать, чтобы исключить деградацию в клетке или диссоциацию на отдельные цепи, прежде всего, чтобы исключить преждевременную деградацию под действием нуклеаз. Обычно нежелательная диссоциация дцРНК на отдельные цепи происходит, прежде всего, при низких концентрациях дцРНК или при использовании короткоцепных дцРНК. Прежде всего, для эффективного подавления диссоциации можно усилить когезию пар нуклеотидов в составе двухцепочечной структуры дцРНК по настоящему изобретению за счет по крайней мере одной, предпочтительно более одной химической связи(ей). дцРНК, используемая в качестве фармацевтического активного компонента в фармацевтической композиции по настоящему изобретению, диссоциация которой снижена, характеризуется более высокой стабильностью в отношении ферментативной и химической деградации в клетке или в организме (in vivo) или ех vivo и, в связи с этим, характеризуется более продолжительным периодом полураспада. Другая возможность предотвращения преждевременной диссоциации дцРНК по настоящему изобретению в клетке заключается в образовании петли(ель) типа шпильки в каждом концевом фрагменте цепей. В связи с этим, в предпочтительном варианте дцРНК, используемая в фармацевтической композиции по настоящему изобретению, характеризуется структурой типа шпильки, которая замедляет кинетику диссоциации. В указанной структуре петлеобразная структура образуется, предпочтительно, в концевом 5'- и/или 3'-фрагменте. Указанная петлеобразная структура не содержит водородных связей и, в связи с этим, обычно характеризуется отсутствием комплементарности между нуклеотидными основаниями. Обычно длина указанной петли составляет по крайней мере 5, предпочтительно по крайней мере 7 нуклеотидов, и указанная петля связывает две отдельные комплементарные цепи дцРНК по настоящему изобретению. Чтобы исключить диссоциацию цепей, нуклеотиды двух цепей дцРНК по настоящему изобретению предпочтительно можно модифицировать аналогичным образом, чтобы усилить водородную связь, например, за счет повышения энергии водородной связи между основаниями в составе необязательно модифицированных нуклеотидов. В результате повышается стабильность взаимодействия между цепями, и дцРНК защищается от действия РНКаз.
Согласно прежде всего предпочтительному варианту дцРНК, используемая в качестве фармацевтического активного компонента в фармацевтической композиции по настоящему изобретению, направлена против (м)РНК белка или антигена, как описано выше. Таким образом дцРНК предпочтительно подавляет трансляцию описанного выше белка или антигена в клетке по крайней мере на 50%, более предпочтительно на 60%, еще более предпочтительно на 70% и наиболее предпочтительно по крайней мере на 90%, то есть концентрация описанного выше белка или антигена в клетке предпочтительно составляет не более половины его концентрации в природных клетках (не обработанных дцРНК, используемой по настоящему изобретению). Подавление трансляции указанных белков или антигенов в клетках после добавления дцРНК, используемых по настоящему изобретению, основано на явлении интерференции РНК под действием таких молекул. Затем дцРНК, используемая по настоящему изобретению, превращается в так называемую киРНК, которая инициирует явление интерференции РНК и способна связываться с (м)РНК описанного выше белка или антигена. Степень подавления трансляции в клетках, индуцированного дцРНК, используемой по настоящему изобретению, оценивают методом нозерн-блоттинга, количественной ПЦР в режиме реального времени, или оценивают на уровне белков с использованием специфических антител против описанного выше белка или антигена. Образцы дцРНК, используемой в качестве фармацевтического активного компонента в фармацевтической композиции по настоящему изобретению, и соответствующую киРНК получают известными способами.
Фармацевтическая композиция (согласно первому или второму варианту) по настоящему изобретению обычно включает фармацевтически приемлемый (совместимый) носитель. Используемый в данном контексте термин «фармацевтически приемлемый (совместимый) носитель» предпочтительно включает жидкую или не жидкую основу композиции. Используемый в данном контексте термин «совместимый» обозначает, что компоненты фармацевтической композиции можно смешивать с фармацевтическим активным компонентом, то есть с нуклеиновой кислотой по настоящему изобретению в качестве иммуностимулирующего агента или в качестве адъюванта, а также с другим компонентом, и при этом в обычных условиях не происходит никакого взаимодействия, снижающего в значительной степени фармацевтическую эффективность композиции. Безусловно, фармацевтически приемлемые носители должны характеризоваться достаточно высокой степенью очистки и достаточно низкой токсичностью, то есть их можно использовать для введения субъекту, нуждающемуся в лечении.
Если композиция представлена в жидкой форме, фармацевтически приемлемый носитель обычно включает один или более фармацевтически приемлемых жидких (совместимых) носителей. Композиция включает в качестве фармацевтически приемлемых жидких (совместимых) носителей, например, апирогенную воду, изотонические солевые или буферные (водные) растворы, например, фосфатный, цитратный буферные растворы и т.п., растительные масла, такие как, например, арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло и масло какао, полиолы, такие как, например, полипропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль, альгиновую кислоту и т.п. Для получения инъекционной фармацевтической композиции по настоящему изобретению прежде всего можно использовать буферный раствор, предпочтительно водный буферный раствор, содержащий натриевую соль, предпочтительно по крайней мере 50 мМ раствор натриевой соли, кальциевую соль, предпочтительно по крайней мере 0,01 мМ раствор кальциевой соли и необязательно калиевую соль, предпочтительно по крайней мере 3 мМ раствор калиевой соли. Согласно предпочтительному варианту натриевая, кальциевая и необязательно калиевая соли представлены в форме галогенидов, например, хлоридов, иодидов, или бромидов, в форме гидроксидов, карбонатов, гидрокарбонатов, или сульфатов и т.п. Не ограничиваясь только ими, примеры натриевых солей включают, например, NaCl, NaI, NaBr, Nа2СО3, NaHCO3, Na2SO4, примеры необязательных калиевых солей включают, например, KСl, KI, KВr, K2СО3, KНСО3, K2SO4, а примеры кальциевых солей включают, например, CaCl2, CaI2, СаВr2, СаСОз, CaSO4, Са(ОН)2. Кроме того, в буферном растворе могут содержаться органические анионы упомянутых выше катионов. Согласно более предпочтительному варианту буферный раствор, пригодный для инъекции, как определено выше, может содержать соли, выбранные из хлорида натрия (NaCl), хлорида кальция (CaCl2) и необязательно хлорида калия (KСl), при этом кроме хлоридов могут присутствовать другие анионы. Обычно соли в буферном растворе для инъекции присутствуют при концентрации по крайней мере 50 мМ в случае хлорида натрия (NaCl) по крайней мере 3 мМ в случае хлорида калия (KСl) и по крайней мере 0,01 мМ в случае хлорида кальция (CaCl2). В качестве буферного раствора для инъекции можно использовать гипертонический, изотонический или гипотонический раствор со ссылкой на специфическую среду для сравнения, то есть буферный раствор характеризуется более высоким, равным или более низким содержанием соли относительно специфической среды для сравнения, при этом предпочтительно использовать такие концентрации упомянутых выше солей, которые не приводят к повреждению клеток за счет осмоса или других концентрационных эффектов. Среды для сравнения включают, например, для анализа «in vivo», биологические жидкости, такие как кровь, лимфа, цитозоль, или другие биологические жидкости, или, например, жидкости, которые используют в качестве сред для сравнения для анализа «in vitro», такие как стандартные буферные растворы или жидкости. Указанные стандартные буферные растворы или жидкости известны специалисту в данной области. В качестве жидкой основы, прежде всего, предпочтителен лактатный раствор Рингера.
Если композиция представлена в твердой форме, фармацевтически приемлемый носитель обычно включает один или более твердых фармацевтически приемлемых (совместимых) носителей. Композиция включает в качестве твердых фармацевтически приемлемых (совместимых) носителей, например, один или более совместимых твердых или жидких наполнителей или разбавителей, или можно также использовать инкапсулирующие соединения, которые пригодны для введения субъекту. Некоторые примеры указанных твердых фармацевтически приемлемых (совместимых) носителей включают, например, сахара, такие как, например, лактоза, глюкоза и сахароза, крахмалы, такие как, например, кукурузный крахмал или картофельный крахмал, целлюлозу и ее производные, такие как, например, натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза, ацетат целлюлозы, порошкообразный трагакант, солод, желатин, жир, твердые скользящие вещества, такие как, например, стеариновая кислота, стеарат магния, сульфат кальция и т.п.
Выбор фармацевтически приемлемого (совместимого) носителя в принципе зависит от способа введения фармацевтической композиции по настоящему изобретению. Фармацевтическую композицию по настоящему изобретению можно вводить, например, системным способом. Способы введения включают, например, пероральный, подкожный, внутривенный, внутримышечный, интраартикулярный, внутрисуставный, надчревный, подоболочечный, внутрипеченочный способы, введение внутрь пораженных тканей, внутричерепной, чрескожный, внутрикожный, внутрилегочный, внутрибрюшинный, внутрисердечный, внутриартериальный и подъязычный местный и/или интраназальный способы. Пригодное количество фармацевтической композиции, предназначенной для применения, определяют по данным стандартных экспериментов на моделях животных. Указанные модели включают, но, не ограничиваясь только ими, модели кролика, овцы, мыши, крысы, собаки и нечеловекообразных приматов. Предпочтительные стандартные лекарственные формы для инъекции включают стерильные водные растворы, стерильные физиологические солевые растворы или их смеси. Значение рН указанных растворов доводят приблизительно до 7,4. Пригодные носители для инъекции включают гидрогели, устройства для контролируемого или замедленного высвобождения, полимолочную кислоту и коллагеновые матрицы. Пригодные фармацевтические приемлемые носители для местного применения включают носители, которые пригодны для использования в лосьонах, кремах, гелях и т.п. Если соединение предназначено для перорального введения, предпочтительной стандартной лекарственной формой являются таблетки, капсулы и т.п. Фармацевтически приемлемые носители для получения стандартных лекарственных форм, которые можно использовать для перорального введения, известны в предшествующем уровне техники. Их выбор зависит от вторичных факторов, таких как вкус, стоимость и стабильность при хранении, которые не учитывались при создании настоящего изобретения, и такие носители может выбрать специалист в данной области техники.
Для дальнейшего повышения иммуногенности фармацевтическая композиция по настоящему изобретению может дополнительно включать одно или более вспомогательных веществ. Таким образом, предпочтительно достигается синергетическое действие нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, и вспомогательного вещества, необязательно дополнительно содержащегося в фармацевтической композиции (и в итоге фармацевтического активного компонента), как описано выше. В этом отношении в зависимости от различных типов вспомогательных веществ можно обсуждать различные механизмы. Например, в первый класс пригодных вспомогательных веществ включены соединения, которые обеспечивают созревание дендритных клеток (ДК), например, липосахариды, ФНО-а или лиганд CD40. В основном, в качестве вспомогательного вещества можно использовать любой агент, который действует на иммунную систему по механизму «сигнал об опасности» (LPS, GP96 и т.п.), или цитокины, такие как гранулоцитарно-макрофагеальный колониестимулирующий фактор (ГМ-КСФ), которые влияют на иммунный ответ, индуцированный иммуностимулирующим адъювантом по настоящему изобретению, или усиливают ее по механизму лиганд-мишень. Прежде всего, предпочтительными вспомогательными веществами являются цитокины, такие как монокины, лимфокины, интерлейкины или хемокины, которые ускоряют иммунный ответ, такие как ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-8, ИЛ-9, ИЛ-10, ИЛ-12, ИЛ-13, ИЛ-14, ИЛ-15, ИЛ-16, ИЛ-17, ИЛ-18, ИЛ-19, ИЛ-20, ИЛ-21, ИЛ-22, ИЛ-23, ИЛ-24, ИЛ-25, ИЛ-26, ИЛ-27, ИЛ-28, ИЛ-29, ИЛ-30, ИЛ-31, ИЛ-32, ИЛ-33, интерфероны: ИНФ-α, ИНФ-β, ИНФ-γ, ГМ-КСФ, Г-КСФ, М-КСФ, LT-P или ФНО-α, факторы роста, такие как гормоны роста человека.
Другие добавки, которые можно включать в фармацевтические композиции по настоящему изобретению, включают эмульгаторы, такие как, например, твин®, смачивающие агенты, такие как, например, лаурилсульфат натрия, красители, агенты для улучшения вкуса, фармацевтические носители, агенты для получения таблеток, стабилизаторы, антиоксиданты, консерванты.
Фармацевтическая композиция по настоящему изобретению в первом варианте (в отсутствие фармацевтического активного компонента) и втором варианте (в смеси с фармацевтическим активным компонентом) также дополнительно может включать адъювант. Соответственно, нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, в качестве иммуностимулирующего агента или в качестве адъюванта (во втором варианте фармацевтической композиции по настоящему изобретению) можно комбинировать с другими иммуностимулирующими агентами/адъювантами. В объем настоящего изобретения включены пригодные для указанных целей агенты/адъюванты, прежде всего, такие соединения, которые повышают (по одному или более механизмов) биологическое свойство/свойства (модифицированной или не модифицированной) нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, то есть, прежде всего соединения, которые усиливают иммунностимулирующее действие нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению. Примеры агентов/адъювантов, которые можно использовать в настоящем изобретении, включают, но, не ограничиваясь только ими, стабилизирующие катионные пептиды или полипептиды, как описано выше, такие как протамин, нуклеолин, спермин или спермидин, а также катионные полисахариды, прежде всего, хитозан, TDM, MDP, мурамилдипептид, плюроники, раствор алюмокалиевых квасцов, гидроксид алюминия, ADJUMER™ (полифосфазен), алюмофосфатный гель, глюканы из водорослей, альгамулин, гель гидроксида алюминия (квасцы), гель гидроксида алюминия с высокой степенью адсорбции белка, гель гидроксида алюминия с низкой вязкостью, AF или SPT (эмульсия, включающая 5% сквалан, 0,2% твин 80, 1,25% плюроник L121, фосфатно-солевой буферный раствор, рН 7,4), AVRIDINE™ (пропандиамин), BAY R1005™ (гидроацетат (N-(2-дезокси-2-L-лейциламино-β-D-глюкопиранозил)-N-октадецилдодеканоиламида), CALCITRIOL™ (1,25-дигидроксивитамин D3), кальцийфосфатный гель, САРТМ (кальцийфосфатные наночастицы), холерный голотоксин, гибридный белок холерный токсин-А1-белок-А-D-фрагмент, субъединицу В холерного токсина, CRL 1005 (блоксополимер Р1205), цитокин-содержащие липосомы, DDA (бромид диметилдиоктадециламмония), DHEA (дегидроэпиандростерон), DMPC (димиристоилфосфатидилхолин), DMPG (димиристоилфосфатидилглиперин), комплекс DOC/алюм (натриевая соль дезоксихолевой кислоты), полный адъювант Фрейнда, неполный адъювант Фрейнда, γ-инулин, адъювант Gerbu (смесь, включающая 1) N-ацетилглюкозаминил-(Р1-4)-N-ацетилмурамил-L-аланил-D-глютамин (GMDP), 2) хлорид диметилдиоктадециламмония (DDA), 3) комплекс цинковая соль L-пролина (ZnPro-8), ГМ-КСФ), GMDP (Н-ацетилглюкозаминил-(β1-4)-N-ацетилмурамил-L-аланил-D-изоглютамин), имиквимод (1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-4-амин), ImmTher™ (дипальмитат N-ацетилглюкозаминил-N-ацетилмурамил-L-Аlа-D-изоGlu-L-Аlа-глицерина), DRV (иммунолипосомы из везикул, полученных методом дегидратации-регидратации), интерферон-γ, интерлейкин-1β, интерлейкин-2, интерлейкин-7, интерлейкин-12, ISCOMS™ («иммуностимулирующие комплексы»), ISCOPREP 7.0.3.™, липосомы, LOXORIBINE™ (7-аллил-8-оксогуанозин (гуанин)), пероральный адъювант LT (лабильный энтеротоксин-протоксин из E.coli), микросферы и микрочастицы любого состава, MF59™ (сквален-водная эмульсия), MONTANIDE ISA 51™ (очищенный неполный адъювант Фрейнда), MONTANIDE ISA 720™ (метаболизируемый масляный адъювант), MPL™ (3-Q-дезацил-4'-монофосфориллипид А), липосомы МТР-РЕ и МТР-РЕ (мононатриевая соль (N-ацетил-L-аланил-D-изоглютаминил-L-аланин-2-(1,2-дипальмитоил-sn-глицеро-3-(гидроксифосфорилокси))этиламида), MURAMETIDE™ (Nac-Mur-L-Ala-D-Gln-ОСН3), мурамилпальмитин (MURAPALMITINE™) и D-мурамилпальмитин (D-MURAPALMITINE™) (Nac-Mur-L-Thr-D-изоGIn-sn-глицериндипальмитоил), NAGO (галактозоксидаза-нейраминидаза), наносферы или наночастицы любого состава, NISV (везикулы неионогенного ПАВ), PLEURAN™ (β-глюкан), PLGA, PGA и PLA (гомо- и сополимеры молочной кислоты и гликолевой кислоты, микро/наносферы), плюроник L121™, ПММА (полиметилметакрилат), PODDS™ (протеиноидные микросферы), производные полиэтиленкарбамата, поли-rА:поли-rU (комплекс полиадениловая кислота/полиуридиловая кислота), полисорбат 80 (твин 80), белковые кохлеаты (фирмы Avanti Polar Lipids, Inc., Alabaster, AL), STIMULON™ (QS-21), Quil-A (сапонин Quil-A), S-28463 (4-амино-оtес-диметил-2-этоксиметил-1Н-имидазо[4,5-с]хинолин-1-этанол), SAF-1™ (состав адъюванта «Syntex»), протеолипосомы вируса Сендай и липидные матрицы, содержащие белки вируса Сендай, Span-85 (триолеат сорбита), Specol (эмульсия, содержащая Marcol 52, Span 85 и твин 85), сквален или Robane® (2,6,10,15,19,23-гексаметилтетракозан и 2,6,10,15,19,23-гексаметил-2,6,10,14,18,22-тетракозагексан), стеарилтирозин (гидрохлорид октадецилтирозина), Theramid® (N-ацетилглюкозаминил-N-ацетилмурамил-L-Аlа-D-изоGlu-L-Аlа-дипальмитоксипропиламид), Theronyl-MDP (Termurtide™ или [thr 1]-MDP, N-ацетилмурамил-L-треонил-D-изоглютамин), частицы Тy (частицы Тy-VLP или вирусоподобные частицы), липосомы Уолтера-Рида (липосомы, содержащие липид А, абсорбированный на гидроксиде алюминия) и т.п. Можно также использовать липопептиды, такие как Pam3Cys, которые, прежде всего, пригодны для комбинирования с нуклеиновой кислотой по настоящему изобретению формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, в форме иммуностимулирующего адъюванта (см. статью Deres и др., Nature, 342, сс.561-564(1989)).
Адъюванты, упомянутые выше, можно разделить на несколько классов, включая адъюванты для систем пролонгированного действия и доставки, для совместной стимуляции, адъюванты в качестве антагонистов и т.п. Предпочтительные адъюванты для систем пролонгированного действия и доставки включают, например, соли алюминия, такие как Adju-phos, Alhydrogel, Rehydragel и т.п., эмульсии, такие как CFA, SAF, IFA, MF59, провакс (Provax), титермакс (TiterMax), монтанид (Montanide), ваксфектин (Vaxfectin) и т.п., сополимеры, такие как Optivax (CRL1005), L121, полоксамер 4010 и т.п., липосомы, такие как Stealth и т.п., кохлеаты, такие как BIORAL и т.п., адъюванты растительного происхождения, такие как QS21, Quil A, Iscomatrix, ISCOM и т.п. Предпочтительные адъюванты, пригодные для совместной стимуляции, включают, например, томатин (Tomatine), биополимеры, такие как PLG, РММ, инулин и т.п., микробные адъюванты, такие как ромуртид (Romurtide), детокс (DETOX), MPL, CWS, маннозу, CpG7909, ISS-1018, IC31, имидазохинолины, амплиген (Ampligen), Ribi529, имоксин (IMOxine), IRIV, VLP, холерный токсин, термолабильный токсин, Pam3Cys, флагеллин (Flagellin), якорный GPI, LNFPIII/Льюис X, противомикробные пептиды, UC-1V150, гибридный белок RSV, cdiGMP и т.п. Предпочтительные адъюванты, пригодные в качестве антагонистов, включают, например, нейропептид CGRP и т.п.
В качестве адъювантов, пригодных для систем пролонгированного действия и доставки, прежде всего, предпочтительными являются катионные или поликатионные соединения, включая протамин, нуклеолин, спермин или спермидин, или другие катионные пептиды или белки, такие как поли-L-лизин (П1Л), полиаргинин, основные полипетиды, проникающие в клетки пептиды (ПКП), включая ВИЧ-связывающие пептиды. Tat, HIV-1 Tat (ВИЧ), Tat-пептиды, пенетратин (Penetratin), VР22-пептиды или аналогичные пептиды, HSV VP22 (простой герпес), MAP, KALA или домены белковой трансдукции (ДБТ), РрТ620, обогащенные пролином пептиды, обогащенные аргинином пептиды, обогащенные лизином пептиды, МРG-пептид(ы), Рер-1, L-олигомеры, пептид(ы) кальцитонина, пептиды сложного локуса Antennapedia (прежде всего, из Drosophila antennapedia), pAntp, pisl, FGF, лактоферрин, транспортан, буфорин-2, Вас715-24, SynB, SynB(1), pVEC, hCT-пептиды, SAP, протамин, спермин, спермидин или гистоны. Кроме того, предпочтительные катионные или поликатионные белки или пептиды выбирают из следующих белков или пептидов следующей общей формулы: (Arg)1, (Lys)m, (His)n, (Orn)o, (Xaa)x, где l+m+n+o+x=8-15, a l, m, n или о независимо равны любому числу, выбранному из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, при условии, что общее содержание Arg, Lys, His и Оrn составляет по крайней мере 50% в расчете на все аминокислоты в составе олигопептида, а Хаа обозначает любую аминокислоту, выбранную из природных или неприродных аминокислот, за исключением Arg, Lys, His или Оrn, и х равен любому числу, выбранному из 0, 1, 2, 3 или 4, при условии, что общее содержание Хаа не превышает 50% в расчете на все аминокислоты в составе олигопептида. В данном контексте, прежде всего, предпочтительными олигопептидами аргинина являются, например, Arg7, Arg5, Arg9, Arg7, Н3К9, R9Н3, Н3R9Н3, YSSR-9SSY. (RKH)4, Y(RKH)2R и т.п. Другие предпочтительные катионные или поликатионные соединения, которые можно использовать в качестве адъюванта, включают катионные полисахариды, например, хитозан, полибрен, катионные полимеры, например, полиэтиленимин (ПЭИ), катионные липиды, например, DOTMA: хлорид [1-(2,3-сиолеилокси)пропил)]-N,N,N-триметиламмония, DMRIE, ди-С14-амидин, DOTIM, SAINT, DC-Chol, BGTC, СТАР, DOPC, DODAP, DOPE: диолеилфосфатидилэтаноламин, DOSPA, DODAB, DOIC, DMEPC, DOGS: диоктадециламидоглицилспермин, DIMRI: бромид димиристооксипропилдиметилгидроксиэтиламмония, DOTAP: диолеоилокси-3-(триметиламмоний)пропан, DC-6-14: хлорид O,O-дитетрадеканоил-N-(α-триметиламмонийацетил)диэтаноламина, CLIP1: хлорид рац[(2,3-диоктадецилоксипропил)(2-гидроксиэтил)]диметиламмония, CLIP6: рац[2(2,3-дигексадецилоксипропилоксиметилокси)этил]триметиламмоний, CLIP9: рац[2(2,3-дигексадецилоксипропилоксисукцинилокси)этил]триметиламмоний, олигофектамин, или катионные или поликатионные полимеры, например, модифицированные полиаминокислоты, такие как полимеры β-аминокислот или обращенные полиамиды и т.п., модифицированные полиэтилены, такие как ПВП (поли(N-этил-4-винилпириднийбромид)) и т.п., модифицированные акрилаты, такие как пДМАЭМА (поли(диметиламиноэтилметилакрилат)) и т.п., модифицированные амидоамины, такие как пАМАМ (поли(амидоамин)) и т.п., модифицированные сложные поли-β-аминоэфиры (ПБАЭ), такие как модифицированные в диаминоконцевом фрагменте сополимеры 1,4-бутандиолдиакрилата и 5-амино-1-пентанола и т.п., дендримеры, такие как дендримеры полипропиламина или дендримеры на основе пАМАМ и т.п., полимин(ы), такие как полиэтиленимин (ПЭИ), полипропиленимин и т.п., полиаллиламин, полимеры на основе сахаридов, такие как полимеры на основе циклодекстрина, полимеры на основе декстрана, хитозан и т.п., силановые полимеры, такие как сополимеры PMOXA-PDMS и т.п., блокполимеры, включающие комбинацию одного или более катионных блоков (например, выбранных из катионного полимера, как описано выше) и одного или более гидрофильных или гидрофобных блоков (например, полиэтиленгликоль) и т.п. Ассоциация или образование комплексов нуклеиновой кислоты по настоящему изобретению формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, с катионными или поликатионными соединениями предпочтительно придает нуклеиновой кислоте свойства адъюванта и оказывает стабилизирующее действие на нуклеиновую кислоту за счет комплексообразования. Методика стабилизации нуклеиновой кислоты в основном описана в патенте ЕР-А-1083232, описание которого включено в полном объеме в настоящее описание в качестве ссылки. В качестве катионных или поликатионных соединений, прежде всего, предпочтительны соединения, выбранные из группы, включающей протамин, нуклеолин, спермин, спермидин, олигопептиды аргинина, как определено выше, такие как Arg7, Arg8, Arg9, Arg7, Н3R9, R9Н3, Н3R9Н3, YSSR9SSY, (RKH)4, Y(RKH)2R и т.п.
Адъюванты, которые характеризуются совместным стимулирующим действием, включают нуклеиновые кислоты-формулы (IV); GlXmGn, гдe: G обозначает гуанозин (гуанин), уридин (урацил) или аналог гуанозина (гуанина) или уридина (урацила), Х обозначает гуанозин (гуанин), уридин (урацил), аденозин (аденин), тимидин (тимин), цитидин (цитозин) или аналог упомянутых выше нуклеотидов, индекс 1 равен целому числу от 1 до 40, причем, если 1 равен 1, G обозначает гуанозин (гуанин) или его аналог, если l>1 по крайней мере 50% нуклеотидов обозначают гуанозин (гуанин) или его аналог, m равен целому числу и по крайней мере равен 3, причем, если m равен 3, Х обозначает уридин (урацил) или его аналог, если m>3, то присутствуют по крайней мере 3 последовательных остатка уридина (урацила) или аналога уридина (урацила), n равен целому числу от 1 до 40, при этом, если n равен 1, G обозначает гуанозин (гуанин) или его аналог, если n>1 по крайней мере 50% нуклеотидов обозначают гуанозин (гуанин) или его аналог,
или нуклеиновые кислоты формулы (V): ClXmCn, где: С обозначает цитидин (цитозин), уридин (урацил) или аналог цитидина (цитозина) или уридина (урацила), Х обозначает гуанозин (гуанин), уридин (урацил), аденозин (аденин), тимидин (тимин), цитидин (цитозин) или аналог упомянутых выше нуклеотидов, 1 равен целому числу от 1 до 40, причем, если 1 равен 1, С обозначает цитидин (цитозин) или его аналог, если l>1 по крайней мере 50% нуклеотидов обозначают цитидин (цитозин) или его аналог, m равен целому числу и по крайней мере равен 3, причем, если m равен 3, Х обозначает уридин (урацил) или его аналог, если m>3, присутствуют по крайней мере 3 последовательных остатка уридина (урацила) или аналога уридина (урацила), n равен целому числу от 1 до 40, причем, если n равен 1, С обозначает цитидин (цитозин) или его аналог, если n>1 по крайней мере 50% нуклеотидов обозначают цитидин (цитозин) или его аналог.
Любое соединение, известное в качестве иммуностимулятора в связи с его связывающей аффинностью (в качестве лигандов) в отношении Toll-подобных рецепторов: TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13, можно использовать в качестве дополнительного компонента для дополнительной стимуляции иммунного ответа, индуцируемого нуклеиновыми кислотами по настоящему изобретению в составе фармацевтических композиций по настоящему изобретению.
Другим классом соединений, которые можно добавлять в фармацевтическую композицию по настоящему изобретению, являются нуклеиновые кислоты CpG, прежде всего, CpG-PHK или CpG-ДНК. CpG-PHK или CpG-ДНК является одноцепочечной CpG-ДНК (оцСрG-ДНК), двухцепочечной CpG-ДНК (дцДНК), одноцепочечной CpG-PHK (оцСрG-РНК) или двухцепочечной CpG-PHK (дцСрС-РНК). Нуклеиновая кислота CpG предпочтительно присутствует в форме CpG-PHK, более предпочтительно в форме одноцепочечной CpG-PHK (оцСрС-РНК). Нуклеиновая кислота CpG предпочтительно включает по крайней мере одну или более (митогенную) динуклеоидную последовательностей) цитидин (цитозин)/гуанин (мотив(ы) CpG). Согласно первому предпочтительному варианту по крайней мере один мотив CpG, включенный в указанные последовательности, т.е. С (цитидин (цитозин)) и G (гуанин) в составе мотива CpG, является неметилированным. Все остальные остатки цитидина (цитозина) или гуанина, необязательно содержащиеся в указанных последовательностях, являются метилированными или неметилированными. Однако в другом предпочтительном варианте С (цитидин (цитозин)) и G (гуанин) в мотиве CpG также могут присутствовать в метилированной форме.
Согласно, прежде всего, предпочтительному варианту фармацевтическую композицию по настоящему изобретению представляют также в виде вакцины. Вакцины по настоящему изобретению обычно включают фармацевтическую композицию по настоящему изобретению. Композиция указанных вакцин по настоящему изобретению характеризуется специфическим классом фармацевтических активных компонентов, включенных в композицию вакцины. Обычно фармацевтическое активное соединение является иммуностимулирующим соединением, которое вызывает специфический (приобретенный) иммунный ответ на определенный антиген(ы). В результате вызванного специфического (приобретенного) иммунного ответа у субъекта вырабатывается иммунитет (активный или пассивный иммунитет), например, на специфический патоген или специфическую опухоль.
Фармацевтическая композиция по настоящему изобретению и, прежде всего, вакцина по настоящему изобретению, прежде всего, характеризуется способом введения. Обычно фармацевтические композиции по настоящему изобретению, прежде всего, вакцины предпочтительно вводят системным способом. Способы введения указанной фармацевтической композиции/вакцины по настоящему изобретению обычно включают пероральный, подкожный, внутривенный, внутримышечный, интраартикулярный, внутрисуставный, надчревный, подоболочечный, внутрипеченочный способы, введение внутрь пораженных тканей, внутричерепной, чрескожный, внутрикожный, внутрилегочный, внутрибрюшинный, внутрисердечный, внутриартериальный и подъязычный местный и/или интраназальный способы. В другом варианте, вакцины или фармацевтическую композицию по настоящему изобретению можно вводить внутрикожным, подкожным, внутримышечным способом. В связи с этим, композиции/вакцины предпочтительно получают в твердой или жидкой форме, как в основном определено выше для фармацевтических композиций. Другие вспомогательные вещества (как определено выше), которые предпочтительно можно включать в вакцину по настоящему изобретению, дополнительно повышают иммуногенность, прежде всего, вакцины. Следует выбирать одно или более указанных вспомогательных веществ, как определено выше, в зависимости от иммуногенности и других свойств фармацевтического активного компонента в составе вакцины по настоящему изобретению.
Согласно другому предпочтительному объекту фармацевтическую композицию по настоящему изобретению, прежде всего, предпочтительно вакцину по настоящему изобретению, можно использовать для лечения упомянутых показаний, например, описанным ниже способом. Фармацевтическую композицию по настоящему изобретению, прежде всего, предпочтительно вакцину по настоящему изобретению, можно использовать для лечения, например, заболевания или состояния, которое связано с различными патологическими состояниями в результате отсутствия иммунного ответа, или при котором требуется иммунный ответ, предпочтительно усиленный иммунный ответ, в ходе лечения, например, опухоль-специфичных или патоген-специфичных заболеваний, инфекционных заболеваний и т.п., или заболеваний, которые можно лечить за счет смещения (избыточного) иммунного ответа в сторону иммунного ответа с доминирующим участием ТН1 и/или за счет десенсибилизации пациента, страдающего от избыточного иммунного ответа, например, от аллергии или аутоиммунных заболеваний. Продуцирование указанного иммунного ответа, или усиление уже существующего, но необязательно неадекватного иммунного ответа, с использованием фармацевтической композиции по настоящему изобретению в значительной степени основано на способности указанной композиции индуцировать неантигенный иммунный ответ. Важным фактором для соответствующего иммунного ответа является стимуляция различных субпопуляций Т-клеток. Обычно Т-лимфоциты дифференцируют на две субпопуляции, клеточные Т-хелперы 1 (Th1) и клеточные Т-хелперы 2 (Th2), с помощью которых иммунная система разрушает внутриклеточные (Th1) и внеклеточные (Th2) патогены (например, антигены). Две популяции Th клеток различаются по спектру продуцируемых ими белков-эффекторов (питокинов). Таким образом, клетки Th1 ускоряют клеточный иммунный ответ за счет активации макрофагов и цитотоксических Т-клеток. С другой стороны, клетки Th2 ускоряют гуморальный иммунный ответ за счет стимуляции превращения В-клеток в плазматические клетки и образования антител (например, против антигенов). В связи с этим, соотношение Th1/Th2 играет значительную роль в развитии иммунного ответа. В настоящем изобретении соотношение Th1/Th2 иммунного ответа предпочтительно смещается под действием фармацевтической композиции по настоящему изобретению, содержащей по крайней мере одну нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) no настоящему изобретению, как определено выше, например, одну, две, три, четыре, шесть, семь или более указанных нуклеиновых кислот, в сторону клеточного ответа, то есть таким образом индуцируется ответ Th1 и предпочтительно клеточный иммунный ответ. Только за счет указанного смещения и предпочтительного или даже исключительного действия иммунного ответа ТН1 можно эффективно лечить упомянутые выше показания. Следовательно, предпочтительно представленные фармацевтические композиции или вакцины по настоящему изобретению можно использовать для индукции опухоль-специфичных или патоген-специфичных иммунных ответов. Указанные фармацевтические композиции или вакцины по настоящему изобретению можно использовать, прежде всего, для усиления иммунного ответа антиген-презентирующих клеток (АПК). Аналогичным образом, прежде всего, фармацевтические композиции или вакцины по настоящему изобретению предпочтительно можно использовать для лечения рака или опухолевых заболеваний, предпочтительно выбранных из следующих заболеваний: карцинома ободочной кишки, меланома, почечно-клеточный рак, лимфома, острый миелоидный лейкоз (ОМЛ), острый лимфоидный лейкоз (ОЛЛ), хронический миелоидный лейкоз (ХМЛ), хронический лимфоцитарный лейкоз (ХЛЛ), опухоли желудочно-кишечного тракта, карцинома легких, глиома, опухоли щитовидной железы, карцинома молочной железы, опухоли предстательной железы, гепатомы, различные опухоли, индуцированные вирусом, такие как, например, карцинома, индуцированная вирусом папилломы (например, карцинома шейки матки), аденокарцинома, опухоли, индуцированные вирусом герпеса (например, лимфома Беркитта, индуцированная вирусом Эпштейна-Барр В-клеточная лимфома), опухоли, индуцированные гепатитом В (гепатоклеточная карцинома), индуцированные вирусом Т-клеточного лейкоза человека HTLV-1 и HTLV-2 лимфомы, акустическая нейрома/нейринома, рак шейки матки, рак легких, глоточный рак, анальная карцинома, глиобластома, лимфома, рак прямой кишки, астроцитомы, опухоли головного мозга, рак желудка, ретинобластомы, базалиомы, метастазы головного мозга, гранулобластомы, рак влагалища, рак поджелудочной железы, рак яичка, меланомы, карциномы щитовидной железы, рака мочевого пузыря, синдром Ходжкина, менингиомы, заболевание Шнеебергера, бронхиальная карцинома, опухоль гипофиза, грибовидный микоз, рак пищевода, рак молочной железы, карциноид, нейриномы, спиналиомы, лимфомы Беркитта, рак гортани, рак почек, тимомы, карциномы эндометрия, рак костной ткани, лимфомы не-Ходжкина, рак уретры, синдром CUP, опухоли головы/шеи, олигодендроглиомы, рак вульвы, рак кишечника, карциномы ободочной кишки, карциномы пищевода, бородавки, опухоли тонкой кишки, краниофарингиомы, карциномы яичников, опухоли/саркомы мягких тканей, рак яичников, рак печени, карциномы поджелудочной железы, карциномы шейки матки, карциномы эндометрия, метастазы печени, рак полового члена, рак языка, рак желчного пузыря, лейкоз, плазмоцитомы, рак матки, опухоль глазного века, рак предстательной железы и т.п. При использовании липида в составе модифицированной липидом нуклеиновой кислоты или в качестве фармацевтического активного компонента в композиции, прежде всего, предпочтителен α-токоферол (витамин Е), D-α-токофеорл, L-α-токоферол, D, L-α-токоферол или сукцинат витамина Е (СВЕ). α-Токоферол (витамин Е) не является высоко токсичным и характеризуется высокоэффективной противоопухолевой активностью (Bendich A., Machlin L. J., Am. J. Clin. Nutr., 48 с.612 (1988)) и, следовательно, указанное соединение является чрезвычайно перспективным агентом для лечения рака. Известно, что подавление пролиферации опухолевых клеток или цитотоксическую активность витамина Е можно объяснить двумя механизмами: с одной стороны, витамин Е является высокоэффективным антиоксидантом и достаточно эффективным акцептором радикалов (Borek С., Ann. NY Acad. Sci., 570, с.417 (1990)), с другой стороны, витамин Е предотвращает рост опухоли за счет стимуляции иммунного ответа (Shklar G., Schwartz J., Trickier D.P., Reid S., J. Oral Pathol. Med., 19, с.60 (1990)). Кроме того, в более поздних работах была выявлена связь между экспрессией гена-супрессора опухоли р53 в опухолевых клетках (плоско-клеточный рак полости рта) и лечением сукцинатом витамина Е (СВЕ) (Schwartz J., Shklar G., Trickier D., Oral Oncol. Europ. J. Cancer, 29B, c.313 (1993)). В связи с этим, можно наблюдать стимуляцию продуцирования р53 дикого типа, который действует в качестве супрессора опухоли, и восстановление мутированного р53, который проявляет онкогенную активность. Следует отметить, что биологическая активность СВЕ в отношении указанных опухолевых клеток является дозозависимой в двух случаях: при физиологических дозах (0,001-50 мкмоль/л) наблюдается повышение роста клеток, при фармакологических дозах (100-154 мкмоль/л) рост клеток подавляется. Указанное явление было обнаружено на культуре клеток (Elattar Т.М.A., Virji A.S., Anticancer Res., 19, с.365 (1999)). При обработке СВЕ также можно индуцировать апоптоз различных клеточных линий рака молочной железы (Yu W., Israel К., Liao Q.Y., Aldaz С.М., Sanders В.G., Kline К., Cancer Res., 59, с.953 (1999)). Апоптоз инициируется за счет взаимодействия лиганда Fas и рецептора Fas. Следует особо отметить, что до настоящего времени не было возможности наблюдать указанный механизм в соответствующих клеточных линиях. Существуют различные изомеры витамина Е, которые различаются числом и положением метальных групп в ароматическом кольце. В указанных работах использовали биологически наиболее активную форму природного витамина Е, α-токоферол. В свою очередь, указанный изомер присутствует в виде различных стереоизомеров, поскольку молекула содержит три оптически активных центра. Природной формой витамина Е является RRR-α-токоферол (ранее D-a-токоферол), но в настоящее время в основном используется рацемат (D,L-α-токоферол). Все упомянутые выше формы витамина Е аналогичным образом включены в качестве липида в объем настоящего изобретения.
Аналогичным образом, для лечения инфекционных заболеваний, прежде всего, предпочтительно используют по крайней мере одну нуклеиновую кислоту формулы (I), (Iа), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как определено выше, или фармацевтическую композицию по настоящему изобретению. Указанные инфекционные заболевания предпочтительно выбирают, но, не ограничиваясь только ими, из следующих заболеваний: вирус гриппа, малярия, атипичная пневмония (ОРС), желтая лихорадка, СПИД, боррелиоз Лайма, лейшманиоз, сибирская язва, менингит, вирусные инфекционные заболевания, такие как СПИД, остроконечная кондилома, вирусные папилломы, лихорадка Денге, москитная лихорадка, вирус Эбола, простуда, ранний летний менингоэнцефалит (РЛМЭ), грипп, опоясывающий лишай, гепатит, вирус простого герпеса типа I, вирус простого герпеса типа II, опоясывающий герпес, эпидемический грипп, японский энцефалит, лихорадка Ласса, лихорадка Марбург, корь, ящур, мононуклеоз, свинка, вирусная инфекция Норуолка, инфекционный мононуклеоз Пфейфера, оспа, полиомиелит (детская хромота), ложный круп, инфекционная эритема, бешенство, папилломы, лихорадка западного Нила, ветряная оспа, цитомегаловирус (ЦМВ), бактериальные вирусные заболевания, такие как выкидыш (воспаление предстательной железы), антракоз, аппендицит, боррелиоз, ботулизм, заболевания, вызванные Camphylobacter, Chlamydia trachomatis (воспаление уретры, конъюнктивиты), холера, дифтерия, донованоз, эпиглоттит, тифозная лихорадка, газовая гангрена, гонорея, туляремия, заболевания, вызванные Heliobacter pylori, коклюш, климатический бубон, остеомиелит, легионеллез, проказа, листериоз, пневмония, менингит, бактериальный менингит, сибирская язва, средний отит, заболевания, вызванные Mycoplasma hominis, неонатальный сепсис (хориоамнионит), нома, паратиф, чума, синдром Рейтера, пятнистая лихорадка Скалистых гор, паратиф сальмонеллы, тиф сальмонеллы, скарлатина, сифилис, столбняк, триппер, японская речная лихорадка, туберкулез, тиф, вагинит (кольпит), венерическая язва, а также инфекционные заболевания, вызванные паразитами, простейшими или грибами, такие как амебиаз, бильгарциоз, болезнь Чагаса, эпидермофития стопы, заболевания, вызванные дрожжевыми грибами, чесотка, малярия, онхоцеркоз (речная слепота), или грибковые заболевания, токсоплазмоз, трихомониаз, трипанозомоз (сонная болезнь), висцеральный лейшманиоз, пеленочный/подгузниковый дерматит, шистозоматоз, отравление рыбой (сигуатера), кандидоз, кожный лейшманиоз, лямблиоз (гиардиоз), или сонная болезнь, или инфекционные заболевания, вызванные эхинококком, широким лентецом, лисьим ленточным червем, собачьим ленточным червем, вшами, бычьим ленточным червем, свиным ленточным червем, миниатюрным ленточным червем.
Соответственно по крайней мере одну нуклеиновую кислоту по настоящему изобретению формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, или фармацевтическую композицию по настоящему изобретению можно использовать для получения лекарственного средства, предназначенного для лечения аллергического нарушения или заболевания. Аллергия является состоянием, которое обычно включает аномальную приобретенную иммунологическую гиперчувствительность к определенным чужеродным антигенам или аллергенам. При аллергии обычно наблюдается местный или системный воспалительный ответ на указанные антигены или аллергены, при этом в организме вырабатывается иммунитет против указанных аллергенов. В данном контексте аллергены включают, например, травы, пыльцу, плесень, лекарственные средства или многочисленные факторы окружающей среды и т.п. Не ссылаясь на какую-либо теорию можно предположить, что аллергия развивается по нескольким различным механизмам. Согласно классификационной схеме, предложенной Gell P. и Coombs R., термин «аллергия» ограничивается гиперчувствительностью типа I, которая вызывается иммуноглобулином IgE по классическому механизму. Гиперчувствительность типа I характеризуется избыточной активацией тучных клеток и базофилов под действием IgE, что приводит к системному воспалительному ответу и развитию симптомов, начиная от легкой степени ринореи до опасного для жизни анафилактического шока и летального исхода. Известные типы аллергии включают, но, не ограничиваясь только ими, аллергическую астму (приводящую к отеку слизистой оболочки носа), аллергический конъюнктивит (приводящий к покраснению и зуду конъюнктивы), аллергический ринит («сенную лихорадку»), анафилаксию, отек Квинке, атопический дерматит (экзему), крапивницу (круп), эозинофилию, дыхательные аллергии, аллергические реакции на укусы насекомых, кожные аллергии (приводящие к возникновению различных сыпей и включающих такие, как экзема, крапивница (аллергическая сыпь) и (контактный) дерматит), пищевые аллергии, аллергии на лекарственные средства и т.п. В настоящем изобретении предлагается, например, фармацевтическая композиция по настоящему изобретению или вакцина, которая включает аллерген (например, кошачий аллерген, пылевой аллерген, клещевой аллерген, растительный антиген (например, антиген березы) и т.п.) либо в виде белка, либо в виде мРНК (или ДНК), кодирующей указанный белковый аллерген, в комбинации с нуклеиновой кислотой по настоящему изобретению формулы (I), (Iа), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше. Фармацевтическая композиция по настоящему изобретению может смещать (избыточный) иммунный ответ в сторону более сильного ответа ТН1, таким образом, подавляется или ослабляется нежелательный ответ IgE.
Аналогичным образом по крайней мере одну нуклеиновую кислоту по настоящему изобретению формулы (I), (Iа), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, или фармацевтическую активную композицию по настоящему изобретению можно использовать для получения лекарственного средства, предназначенного для лечения аутоиммунных заболеваний. В широком смысле аутоиммунные заболевания можно разделить на системные и орган-специфичные или локализованные аутоиммунные нарушения в зависимости от основных клинико-патологических признаков каждого заболевания. Аутоиммунное заболевание подразделяют на категории системных синдромов, включая системную красную волчанку, синдром Шегрена, склеродермию, ревматоидный артрит и полимиозиты, или на категории локальных синдромов, включая эндокринологические (сахарный диабет типа 1, тиреоидит Хашимото, болезнь Аддисона и т.п.), дерматологические (обыкновенная пузырчатка), гематологические (аутоиммунная гематолитическая анемия), неврологические (рассеянный склероз), или аутоиммунное заболевание может затрагивать практически любую локализованную область ткани организма. Аутоиммунные заболевания, подлежащие лечению, выбирают из группы, включающей аутоиммунные заболевания типа I или аутоиммунные заболевания типа II или аутоиммунные заболевания типа III или аутоиммунные заболевания типа IV, такие как, например, рассеянный склероз, ревматоидный артрит, диабет, диабет типа I (сахарный диабет), системная красная волчанка, хронический полиартрит, Базедова болезнь, аутоиммунные формы хронического гепатита, язвенный колит, аллергические заболевания типа I, аллергические заболевания типа II, аллергические заболевания типа III, аллергические заболевания типа IV, фибромиалгия, алопеция, деформирующий спондилит, болезнь Крона, тяжелая псевдопаралитическая миастения, нейродермит, ревматическая полимиалгия, прогрессирующий системный склероз, псориаз, синдром Рейтера, ревматический артрит, васкулит и т.п., или диабет типа II. Хотя в настоящее время еще не выявлена причина, по которой в организме вырабатываются антитела против аутоантигенов, существуют некоторые данные по этиологии. Соответственно, аутореакция происходит в обход Т-клеточного пути. В нормальной иммунной системе для продуцирования В-клетками антител в значительных количествах требуется предварительная активация В-клеток Т-клетками. Указанная необходимость в Т-клетках в редких случаях исключается, например, при инфицировании организмами, продуцирующими суперантигены, которые инициируют поликлональную активацию В-клеток, или даже Т-клеток, за счет прямого неспецифического связывания с одной субъединицей рецепторов Т-клеток. Другое объяснение развития аутоиммунных заболеваний связано с молекулярной мимикрией. Экзогенный антиген может характеризоваться структурным сходством с определенными антигенами организма-хозяина, в связи с этим, любое антитело, продуцируемое против указанного антигена (который имитирует собственные антигены), теоретически также может связываться с антигенами клетки-хозяина и усиливать иммунный ответ. Наиболее поразительная форма молекулярной мимикрии наблюдается у β-гемолитических стрептококков группы А, которые характеризуются общими антигенами с миокардом человека и ответственны за нарушения функции сердца при ревматической атаке. В связи с этим, в настоящем изобретении предлагается также фармацевтическая композиция, содержащая аутоантиген (в виде белка, мРНК или ДНК, кодирующих белковый аутоантиген) и нуклеиновую кислоту по настоящему изобретению, которая обычно позволяет десенсибилизировать иммунную систему.
Настоящее изобретение относится также к применению по крайней мере одной нуклеиновой кислоты по настоящему изобретению формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, при получении фармацевтической композиции по настоящему изобретению или вакцины по настоящему изобретению, предназначенной для лечения описанных выше показаний, например, для лечения упомянутых опухолевых, аутоиммунных заболеваний, аллергии и инфекционных заболеваний. В другом варианте настоящее изобретение включает (терапевтическое) применение по крайней мере одной нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, для лечения опухолевых или инфекционных заболеваний, как описано выше.
Аналогичным образом, настоящее изобретение включает наборы, например наборы компонентов, причем каждый компонент включает по крайней мере одну нуклеиновую кислоту формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению и/или фармацевтическую композицию по настоящему изобретению и/или вакцину по настоящему изобретению, а также необязательно инструкции по применению, введению и дозировке по крайней мере одной нуклеиновой кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше и/или фармацевтической композиции по настоящему изобретению и/или вакцины по настоящему изобретению.
Способы лечения нарушения или заболевания, выбранного из группы, включающей раковые заболевания, инфекционные заболевания, аутоиммунные заболевания и аллергию, заключаются во введении пациенту, нуждающемуся в указанном лечении, фармацевтически эффективного количества нуклеиновой кислоты по настоящему изобретению.
Фигуры
Следующие фигуры представлены для иллюстрации настоящего изобретения и не ограничивают его объем.
На фиг. 1 показана способность РНК формулы (I), полученной в комбинации с DOTAP, индуцировать ФНО-α. Мононуклеарные клетки периферической крови (МКПК) высевали с плотностью 2-10 /лунка/200 мкл среды и стимулировали РНК (4 мкг/мл), полученной в комбинации с DOTAP (12 мкг/мл), в течение 20 ч. Затем проводили анализ ФНО-α методом ИФА с использованием супернатантов, не содержащих клеток. Как видно на фиг. 1, секреция ФНО-α в значительной степени индуцируется нуклеиновыми кислотами по настоящему изобретению формулы (I), прежде всего, последовательностями мРНК, соответствующими нуклеотидным последовательностям формулы (I) SEQ ID NO:114-119 по настоящему изобретению, как определено выше, т.е. последовательностям мРНК, соответствующим SEQ ID NO: 114-119 (SEQ ID NO:114 (R820/(N100)2), SEQ ID NO:115 (R719/(N100)5),SEQ ID NO:116 (R720/(N100)10), SEQ ID NO:117 (R821/(N40T20N40)2), SEQ ID NO:118 (R722/(N40T20N40)5) и SEQ ID NO:119 (R723/(N40T20N40)10)), по сравнению с контрольными последовательностями G2U20G20 (GGUUUUUUUUUUUUUUUUUUUUGG), Seq. U21: UUUUUUUUUUUUUUUUUUUUU (фосфодиэфир) и поли(U) (фирмы Sigma, 800-1000 кДа).
На фиг. 2 показана способность РНК формулы (I), полученной в комбинации с DOTAP, индуцировать ИНФ-α. Клетки МКПК высевали с плотностью 2·105 /лунка/200 мкл среды и стимулировали РНК (2 мкг/мл), полученной в комбинации с DOTAP (12 мкг/мл), в течение 20 ч. Затем проводили анализ ИНФ-α методом ИФА с использованием не содержащих клеток супернатантов. Как видно на фиг.2, секреция ИНФ-α в значительной степени индуцируется нуклеиновыми кислотами по настоящему изобретению формулы (I), прежде всего, последовательностями мРНК, соответствующими нуклеотидным последовательностям формулы (I) SEQ ID NO:114-119 по настоящему изобретению, как определено выше, т.е. последовательностям мРНК, соответствующим SEQ ID NO:114-119 (SEQ ID NO:114 (R820/(N100)2), SEQ ID NO:115 (R719/(N100)5), SEQ ID NO:116 (R720/(N100)10), SEQ ID NO:117 (R821/(N40T20N40)2), SEQ ID NO:118 (R722/(N40T20N40)5) и SEQ ID NO:119 (R723/(N40T20N40)10)), по сравнению с контрольными последовательностями G2U20G20 (GGUUUUUUUUUUUUUUUUUUUUGG), Seq. U21: UUUUUUUUUUUUUUUUUUUUU (фосфодиэфир) и поли(U) (фирмы Sigma, 800-1000 кДа).
Примеры
Следующие примеры представлены для иллюстрации настоящего изобретения и не ограничивают его объем.
1. Получение типичных нуклеиновых кислот формулы (I), (Iа), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению
Олигонуклеотиды РНК, в качестве примеров нуклеиновой кислоты общей формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, получали автоматическим твердофазным синтезом с использованием фосфорамидитов (включая последовательности, соответствующие SEQ ID NO:84-85 (формула (I)), SEQ ID NO:86-87 (формула (Ia)), SEQ ID NO:88-94 (формулы (II), (IIа) и (IIb)) и SEQ ID NO:107-108 (формулы (IIIa) и (IIIb))). В каждом случае РНК-специфичные 2'-гидроксильные группы нуклеотидов защищали группами TBDMS. При получении фосфортиоатов для окисления использовали реагент Бекаже. Материал носителя и неустойчивые в щелочной среде защитные группы отщепляли в присутствии метиламина, а защитные группы TBDMS отщепляли в присутствии гидрофторида триэтиламина.
Неочищенный продукт очищали методом ЖХВР с использованием ион-парной хроматографии, или ионообменной хроматографии, или комбинации двух указанных способов, обессоливали и высушивали. Чистоту продукта и нуклеотидный состав определяли методом масс-спектрометрии.
Согласно другому способу, указанные выше последовательности получали in vitro трансляцией с использованием векторов ДНК или олигонуклеотидных последовательностей, включающих последовательности по настоящему изобретению.
2. Иммуностимуляция in vitro с использованием типичных нуклеиновых кислот формулы (I), (Iа), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению
а) Для стимуляции клетки МКПК мыши (выделенные из дендритных клеток костного мозга), олигофектамин (3 мкл) смешивали со средой IMDM (30 мкл, фирмы BioWhittaker, номер по каталогу BE12-722F), не содержащей ЭТС, и инкубировали при комнатной температуре в течение 5 мин. Затем смешивали нуклеиновую кислоту (6 мкг) (SEQ ID NO:84-94 и 107-108 (каждый тип нуклеиновой кислоты использовали в одном эксперименте)) соответственно в форме РНК со средой IMDM (60 мкл), не содержащей ЭТС, смешивали со смесью олигофектамин/IMDM, затем инкубировали при комнатной температуре в течение 20 мин. Затем указанную смесь (33 мкл) добавляли в лунку 96-луночного микротитрационного планшета для культивирования, которая содержала 200000 клеток МКПК мыши в 200 мкл не содержащей ЭТС среды IMDM, и культивировали в течение ночи. Через 4 ч добавляли среду IMDM (100 мкл), содержащую 20% ЭТС, и снова инкубировали в течение 16 ч, супернатант удаляли и определяли содержание интерлейкина-6 (ИЛ-6) и интерлейкина-12 (ИЛ-12) методом ИФА (для цитокинов). Сравнительный анализ проводили аналогично тому, как описано для указанных выше последовательностей, с использованием иммуностимулирующего комплекса некэппированной мРНК β-галактозидазы (lacZ) дикого типа и протамина.
Полученные данные свидетельствуют о том, что нуклеиновые кислоты формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, присутствующие в форме РНК, прежде всего, последовательности по настоящему изобретению SEQ ID NO:84-94 и 107-108, характеризуются достаточно высокими иммуностимулирующими свойствами в отношении стимуляции естественного иммунитета.
б) Клетки МКПК человека получали в градиенте плотности фикола и культивировали в течение ночи в среде X-VIVO-15 (фирмы BioWhittaker, номер по каталогу BE04-418Q), которая содержала 1% глютамин и 1% пенициллин, в присутствии нуклеиновых кислот (10 мкг/мл) формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению в форме РНК, прежде всего, последовательностей по настоящему изобретению SEQ ID NO:84-94 и 107-108 (каждый тип нуклеиновой кислоты использовали в одном эксперименте).
Для стимуляции, олигофектамин (3 мкл) смешивали со средой X-VIVO-15 (30 мкл, фирмы BioWhittaker, номер по каталогу BE04-418Q) и инкубировали при комнатной температуре в течение 5 мин. Нуклеиновые кислоты (6 мкг) формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению в форме РНК, прежде всего, последовательности по настоящему изобретению SEQ ID NO:84-94 и 107-108 (каждый тип нуклеиновой кислоты использовали в одном эксперименте) соответственно смешивали со средой X-VIVO-15 (60 мкл, фирмы BioWhittaker, номер по каталогу BE04-418Q), затем смешивали со смесью олигофектамин/среда X-VIVO и инкубировали при комнатной температуре в течение 20 мин. Затем указанную смесь (33 мкл) добавляли в лунку 96-луночного микротитрационного планшета для культивирования, которая содержала 200000 клеток МКПК в 200 мкл среды X-VIVO-15 (фирмы BioWhittaker, номер по каталогу BE04-418Q), и культивировали в течение ночи. После инкубирования в течение еще 16 ч супернатант удаляли и определяли содержание интерлейкина-6 (ИЛ-6), интерлейкина-12 (ИЛ-12) и ФНО-α методом ИФА (для цитокинов). Сравнительный анализ проводили аналогично тому, как описано для последовательностей по настоящему изобретению (см. выше), с использованием иммуностимулирующей олигоРНК40 (5'-GCCCGUCUGUUGUGUGACUC-3', SEQ ID NO:113).
Полученные данные свидетельствуют о том, что нуклеиновые кислоты по настоящему изобретению в форме РНК, прежде всего, характеризующиеся последовательностями по настоящему изобретению формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению, как определено выше, характеризуются достаточно высокими иммуностимулирующими свойствами.
3. Иммуностимуляция in vivo с использованием в качестве адъюванта типичных нуклеиновых кислот формулы (I), (Iа), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению
Мышам BALB/c (5 особей в группе) вводили инъекцией β-галактозидазу в присутствии адъюванта (как определено в данном контексте) в день 0 и день 10. В день 20 мышей забивали и в сыворотке крови определяли антитела против β-галактозидазы методом ИФА и количественное содержание ИЛ-6, ИЛ-12 и ФНО-α аналогично тому, как описано выше для культур in vitro.
4. Стимуляция клеток человека адъювантом по настоящему изобретению в форме нуклеиновой кислоты формулы (I), (Iа), (II), (IIа), (IIb), (IIIa) и/или (IIIb)
а) Для определения иммуногенной активности нуклеиновых кислот формулы (I), (Iа), (II), (IIа), (IIb), (IIIа) и/или (IIIb) по настоящему изобретению, как определено выше, в качестве адъювантов, прежде всего нуклеиновые кислоты, содержащие последовательности SEQ ID NO:84-94 и 107-108 (каждый тип нуклеиновой кислоты использовали в одном эксперименте), инкубировали в присутствии клеток человека. Для этого клетки МКПК человека, например, инкубировали в смеси с РНК (10 мкг/мл, мРНК, кодирующая β-галактозидазу) и необязательно в присутствии протамина (10 мкг/мл) в течение 16 ч в среде X-VIVO-15 (фирмы BioWhittaker, номер по каталогу BE04-418Q), содержащей L-глютамин (2 мМ, фирмы BioWhittaker), пенициллин (10 Ед./мл, фирмы BioWhittaker) и стрептомицин (10 мкг/мл). Супернатанты удаляли и регистрировали высвобождение ИЛ-6 и ФНО-α методом ИФА.
б) В следующем эксперименте высвобождение ФНО-α клетками МКПК человека регистрировали после стимуляции нуклеиновыми кислотами по настоящему изобретению формулы (I), (Iа), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению (SEQ ID NO:84-94 и 107-108, каждый тип нуклеиновой кислоты использовали в одном эксперименте, см. выше), а также адъювантами, используемыми по настоящему изобретению.
Для этого клетки МКПК человека инкубировали в смеси с указанными нуклеиновыми кислотами (10 мкг/мл) в течение 16 ч в среде Х-VIVO 15 (фирмы BioWhittaker), содержащей L-глютамин (2 мМ, фирмы BioWhittaker), пенициллин (10 Ед./мл, фирмы BioWhittaker) и стрептомицин (10 мкг/мл). Супернатанты удаляли и анализировали методом ИФА.
5. Секреция ФНО-α и ИНФ-α в клетках МКПК человека
Для указанных экспериментов несколько нуклеиновых кислот по настоящему изобретению формулы (I), как определено выше, т.е. последовательности мРНК SEQ ID NO:114-119, получали в комбинации с DOTAP (фирмы Roche).
В указанном эксперименте использовали следующие последовательности нуклеиновых кислот по настоящему изобретению:
SEQ ID NO:114 (R820/(N 100)2),
SEQ ID NO:115 (R719/(N 100)5),
SEQ ID NO:116 (R720/(N100)10),
SEQ ID NO:117 (R821/(N40T20N40)2),
SEQ ID NO:118 (R722/(N40T20N40)5) и
SEQ ID NO:119 (R723/(N40T20N40)10).
Затем клетки МКПК человека стимулировали РНК (при концентрации 8 мкг/мл), полученной в комбинации с DOTAP (12 мкг/мл), в течение 20 ч. Затем в супернатантах регистрировали секрецию ФНО-α и ИНФ-α методом ИФА с критерием для связанных пар.
В указанном эксперименте клетки МКПК человека получали в градиенте плотности фикола и культивировали в присутствии указанных выше нуклеиновых кислот (2 мкг/мл или 4 мкг/мл) для стимуляции ИНФ-α или, соответственно, ФНО-α в течение 20 ч в среде X-VIVO-15 (фирмы BioWhittaker, номер по каталогу BE04-418Q), которая содержала глютамин (1%) и пенициллин (1%). Для получения комбинации и стимуляции, РНК (3 мкг или 6 мкг) в буферном растворе HBS переносили во флакон, содержащий 18 мкг метилсульфата N-[1-(2,3-диолеоилокси)пропил]-N,N,N-триметиламмония (DOTAP, фирмы Roche Diagnostics, номер по каталогу 11811177001) в буферном растворе HBS, и медленно перемешивали с использованием автоматической пипетки несколько раз. Смесь для трансфекции инкубировали при 15-25°С в течение 15 мин. Затем 1 объем смеси DOTAP/нуклеиновая кислота медленно разбавляли 7,3 объемами среды X-Vivo. Затем указанную смесь (100 мкл) добавляли в лунку 96-луночного микротитрационного планшета для культивирования, содержащего 2·105 клеток МКПК в 100 мкл среды X-VIVO-15 (фирмы BioWhittaker, номер по каталогу BE04-418Q), и культивировали в течение ночи. После инкубации в течение 20 ч супернатант удаляли и регистрировали содержание ИНФ-α и ФНО-α методом ИФА (для цитокинов). Сравнительный анализ проводили аналогично тому, как описано для последовательностей по настоящему изобретению (см. выше), с использованием иммуностимулирующего олигоG2U20G2 (модифицированный фосфотиоат), поли(U) (фирмы Sigma, Taufkirchen, Германия) и onnroUzi (фосфодиэфир).
Полученные результаты представлены на фиг.1 и фиг.2. На фиг.1 показана способность РНК, полученной в комбинации с DOTAP, индуцировать ФНО-α. Клетки МКПК высевали с плотностью 2·105/лунка/200 мкл среды и стимулировали РНК (4 мкг/мл), полученной в комбинации с DOTAP (12 мкг/мл), в течение 20 ч. Затем проводили анализ ФНО-α методом ИФА с использованием супернатантов, не содержащих клеток. На фиг. 2 показана способность РНК, полученной в комбинации с DOTAP, индуцировать ИНФ-α. Клетки МКПК высевали с плотностью 2·105/лунка/200 мкл среды и стимулировали РНК (2 мкг/мл), полученной в комбинации с DOTAP (12 мкг/мл), в течение 20 ч. Затем проводили анализ ИНФ-α методом ИФА с использованием супернатантов, не содержащих клеток.
Как видно на фиг. 1 и фиг. 2, секреция ФНО-α и ИНФ-α в значительной степени индуцируется нуклеиновыми кислотами по настоящему изобретению формулы (I), прежде всего, нуклеотидными последовательностями мРНК формулы (I) SEQ ID NO:114-119 по настоящему изобретению, как определено выше, т.е. последовательностями мРНК SEQ ID NO:114-119 (SEQ ID NO:114 (R820/(N100)2). SEQ ID NO:115 (R719/(N 100)5), SEQ ID NO:116 (R720/(N100)10), SEQ ID NO:117 (R821/(N40T20N40)2), SEQ ID NO:118 (R722/(N40T20N40)5) и SEQ ID NO:119 (R723/(N40T20N40)10)), по сравнению с контрольными последовательностями G2U20G2 (модифицированный фосфотиоат), поли(и) (фирмы Sigma, Taufkirchen, Германия) и олиго U21 (фосфодиэфир).
Преимущества настоящего изобретения
Нуклеиновую кислоту общей формулы (I), (Ia), (II), (IIа), (IIb), (IIIa) и/или (IIIb) по настоящему изобретению можно использовать в качестве иммуностимулирующего агента как таковую для стимуляции врожденного иммунитета у пациента, нуждающегося в лечении. Указанное иммуностимулирующее свойство можно в значительной степени усилить за счет добавления к нуклеиновым кислотам по настоящему изобретению других соединений, известных в данной области в качестве активных стимулирующих врожденный иммунитет на нуклеиновые кислоты по настоящему изобретению, например, за счет модификации липидами или добавления дополнительных адъювантов. Нуклеиновые кислоты по настоящему изобретению, как определено в данном контексте, прежде всего, нуклеиновые кислоты формулы (I), включающие структуру (NuGlXmGnNv)a, или производные указанных соединений, характеризуются в значительной степени улучшенной амплификацией в бактериях, например, Е. coli. Прежде всего, преимущество заключается в том, что нуклеиновая кислота по настоящему изобретению (NvGlXmGnNu)a формулы (I), или ее производные, представляет собой частично двухцепочечную нуклеиновую кислоту или смесь одноцепочечной и двухцепочечной нуклеиновых кислот, так как указанная (частично двухцепочечная) нуклеиновая кислота по настоящему изобретению формулы (I) (или формулы (Iа), (II) (IIа), (IIb), (IIIа) и/или (IIIb)) положительно стимулирует врожденный иммунитет у пациента, нуждающегося в лечении, взаимодействуя с рецепторами патоген-ассоциированного молекулярного паттерна (ПАМП) для одноцепочечной РНК (TLR-7 и TLR-8), а также с рецепторами ПАМП для двухцепочечной РНК (TLR-3, RIG-I и MDA-5). Рецепторы TLR-3, TLR-7 и TLR-8 расположены в эндосоме и активируются РНК, поглощенной эндосомой. И наоборот, RIG-I и MDA-5 являются цитоплазматическими рецепторами, которые активируются РНК, которая напрямую поглощается цитоплазмой или которая высвобождается из эндосомы (эндосомальное высвобождение или эндосомальный выход). Соответственно, частично двухцепочечная нуклеиновая кислота по настоящему изобретению (NnGlXmGnNv)a формулы (I) (или ее производные, например, (частично двухцепочечная) нуклеиновая кислота по настоящему изобретению формулы (Iа), (II) (IIа), (IIb), (IIIa) и (IIIb), как определено в данном контексте) активирует различные сигнальные каскады иммуностимуляции и, таким образом, вызывает усиление врожденного иммунитета или значительно повышает указанный ответ. Дополнительное преимущество настоящего изобретения заключается в высоко эффективной индукции противовирусного цитокина ИНФ-α, который является предпочтительным для стимуляции врожденного иммунитета. В большинстве случаев ограничение общепризнанных иммуностимулирующих нуклеиновых кислот (например, поли A:U и поли I:С) связано с их неопределенной структурой, которая приводит к регуляторным ограничениям.