Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ПРОГЕНИТОРНЫХ КЛЕТОК МИОКАРДА
Вид РИД
Изобретение
Изобретение относится к области биотехнологии, в частности к клеточной и тканевой инженерии, и может быть использовано в медицине и ветеринарии для лечения заболеваний сердца путем использования прогениторных клеток-предшественников кардиомиоцитов и клеток сосудов, а также изучения механизмов регенерации миокарда.
Динамика заболеваемости и смертности населения от ишемической болезни сердца и ее осложнений характеризуется неуклонным ростом на протяжении последних десятилетий. Несмотря на многочисленные исследования патогенеза ИБС, использование новых лекарственных препаратов, совершенствование методов хирургического лечения, проблема восстановления клеток миокарда и сократительной функции сердца остается до сих пор нерешенной. В связи с этим большие надежды для решения этой проблемы возложены на развитие регенеративной медицины, связанной с использованием стволовых клеток. Большинство проведенных клинических исследований по использованию стволовых клеток костного мозга, эндотелиальных клеток-предшественников, скелетных миобластов показали крайне ограниченную эффективность в восстановлении функции сердца и влиянию на прогноз заболевания. Причиной этого могло стать отсутствие способности этих клеток образовывать новые кардиомиоциты и клетки сосудов. Предполагается, что эффективность клеточной терапии заболеваний сердца может быть повышена путем использования определенных типов стволовых клеток, которые могут быть «коммитированы» в кардиомиоцитарном направлении in vitro перед трансплантацией. Этим типом клеток могут служить резидентные прогениторные клетки взрослого организма. Обнаружение резидентных прогениторных клеток сердца открывает новые перспективы для их использования в качестве «инструмента» для клеточной терапии. Прогениторные клетки миокарда обладают уникальными свойствами: они способны к самообновлению, образованию клонов из одной клетки и дифференцировке в эндотелиальные, гладкомышечные клетки и кардиомиоциты in vitro и in vivo (Beltrami, A.P., Barlucchi L., Torella D., et al. Adult cardiac stem cells are multipotent and support myocardial regeneration // Cell. - 2003. - V. 114. - P. 763-768; Linke, A., Mtiller P., Nurzynska D., et al. Stem cells in the dog heart are self-renewing, clonogenic, and multipotent and regenerate infarcted myocardium, improving cardiac function // Proc Natl Acad Sci USA. - 2005. - V. 102. - №25. - P. 8966-71; Urbanek, K., Quaini F., Tasca G., et al. Intense myocyte formation from cardiac stem cells in human cardiac hypertrophy // Proc. Natl. Acad. Sci. USA. - 2003. - V. 100. - P. 10440-10445; Urbanek, K., Torella D., Sheikh F., et al. Myocardial regeneration by activation of multipotent cardiac stem cells in ischemic heart failure // Proc Natl Acad Sci USA. - 2005. - V. 102. - №24. - P. 8692-7). В работах, проведенных на животных моделях с экспериментальной индукцией инфаркта миокарда, были получены доказательства участия прогениторных клеток в регенерации миокарда путем замены погибших кардиомиоцитов и клеток сосудов и поддержании сократительной функции сердца (Beltrami, А.Р., Barlucchi L., Torella D., et al. Adult cardiac stem cells are multipotent and support myocardial regeneration // Cell. - 2003. -V. 114. - P. 763-768; Dawn, В., Stein A.B., Urbanek K., et al. Cardiac stem cells delivered intravascularly traverse the vessel barrier, regenerate infarcted myocardium, and improve cardiac function // Proc Natl Acad Sci USA. - 2005. - V. 102. - P. 3766-71; Bearzi, C, Rota M., Hosoda Т., et al. Human cardiac stem cells // Proc Natl Acad Sci USA. - 2007. - V. 104. - №35. - P. 14068-73). Резидентные прогениторные клетки миокарда имеют ряд преимуществ перед другими типами клеток, используемых для трансплантации. СКС могут быть получены из биоптатов миокарда пациента (Dawn, В., Stein А.В., Urbanek К., et al. Cardiac stem cells delivered intravascularly traverse the vessel barrier, regenerate infarcted myocardium, and improve cardiac function // Proc Natl Acad Sci USA. - 2005. - V. 102. - P. 3766-71) или образцов миокарда, получаемых в ходе операции и после «наращивания» in vitro, трансплантированы в миокард того же пациента, что позволяет избежать применения иммуносупрессивной терапии. Кроме того, их способность к дифференцировке в кардиомиоциты и клетки сосудов позволяет их рассматривать в качестве единственного способа восстановления утраченных клеток миокарда. Несмотря на все перечисленные преимущества, получение культуры прогениторных клеток сердца является сложной задачей. Образцы миокарда человека можно получить лишь в малом количестве, что ограничивает возможность получения прогениторных клеток в количестве, достаточном для проведения аутотрансплантации. Большинство описанных методов получения прогениторных клеток основываются на ферментативной обработке кусочков миокарда с последующей иммуномагнитной селекцией на бусах с антителами к маркерам стволовых клеток [Beltrami, А.Р., Barlucchi L., Torella D., et al. Adult cardiac stem cells are multipotent and support myocardial regeneration // Cell. - 2003. - V. 114. - P. 763-768; Oh, H., Bradfute S.B., Gallardo T.D., et al. Cardiac progenitor cells from adult myocardium: homing, differentiation, and fusion after infarction // Proc Natl Acad Sci USA. - 2003. - V. 100. - P. 12313-8, патент №RU(11)2366706) или проведением градиентного центрифугирования (патент №ЕР2295541). Существенным ограничением этих методов является большой объем ткани миокарда, необходимый для выполнения протоколов. Кроме того, использование ферментативной обработки образцов миокарда может оказывать влияние на клеточные рецепторы, приводя к снижению эффективности иммуномагнитной селекции.
Наиболее близким к заявляемому изобретению является способ получения и экспансии в культуре ALDH+ прогениторных клеток сердца («Isolation of a new cardiac stem cell population» патент №EP2258833). В основе этого метода лежит использование образцов миокарда взрослого человека, полученных в результате проведения операции аортокоронарного шунтирования. В соответствии с описанием изобретения образцы миокарда измельчают, обрабатывают ферментами и в дальнейшем используются для проведения клеточного сортинга. Предложенный метод обеспечивает получение СКС с иммунофенотипом альдегид дегидрогеназа (ALDH)+ CD34+ C-kit- CD45- и характеризующиеся способностью к начальным этапам дифференцировки в кардиомиоциты.
Представленный способ выделения имеет ряд недостатков:
1) образцы миокарда перед культивированием подвергаются ферментативной обработке. Это приводит к частичной диссоциации образцов миокарда на отдельные клетки, которые не используются для дальнейшего выполнения протокола. Учитывая крайне маленький исходный объем образцов миокарда (от 10 до 200 мг) и низкое содержание стволовых клеток (1 стволовая клетка на 25000-40000 кардиомиоцитов) метод может обеспечить сохранение лишь части стволовых клеток от их исходного количества;
2) проведение ферментативной обработки вызывает изменение эпитопов на поверхности клеточной мембраны, что определяет дальнейшую выживаемость и способность к пролиферации стволовых клеток;
3) для получения (ALDH)+ CD34+ C-kit- CD45- клеток предлагается использовать клеточный сортинг, который способен оказывать повреждающее воздействие на клетки. Кроме того, использование строго определенных маркеров для селекции (в данном случае ALDH, CD34, C-kit, CD45) не позволяет сохранить другие типы стволовых клеток (например, Sca-1+, MDR+, C-kit+), которые являются ключевыми регуляторами регенераторных процессов в сердечной мышце;
4) увеличение количества (наращивание) прогениторных клеток проводится на заключительном этапе выделения (после проведения клеточного сортинга), что не позволяет сохранить взаимодействие с клетками-микроокружения, которые необходимы для осуществления самоподдержания СКС;
5) выполнение протокола обеспечивает получение (ALDH)+ CD34+ C-kit- CD45- клеток, рассматриваемых в качестве популяции прогениторных клеток сердца. Однако экспрессия маркера CD34 также характерна для стволовых клеток костного мозга, циркулирующих клеток-предшественников. Эти данные могут указывать на наличие гематопоэтических клеток в составе получаемой популяции;
6) дифференцировка прогениторных клеток ((ALDH)+ CD34+ C-kit- CD45-) наступает спонтанно и обеспечивает получение только клеток-предшественников с признаками начальных этапов дифференцировки в кардиомиоциты.
Задачей данного изобретения является разработка эффективного способа получения культуры прогениторных клеток из образцов миокарда млекопитающего, коммитированных к дифференцировке в направлении кардиомиоцитов и клеток сосудов.
Поставленная задача решается тем, что способ получения прогениторных клеток из образцов миокарда млекопитающего включает измельчение образцов, посадку их на культуральные чашки с покрытием, обеспечивающим их адгезию, и культивирование измельченных образцов в условиях гипоксии с образованием клеточной культуры, извлечение клеток из клеточной культуры посредством ее ферментативной обработки, культивирование извлеченных клеток до момента образования клеточных агрегатов с последующей ферментативной обработкой клеточных агрегатов для получения прогениторных клеток миокарда.
Измельчение образцов миокарда проводят до получения кусочков 1-10 мм3. В качестве покрытия культуральной чашки может быть использован коллаген, и/или фибронектин, и/или ламинин, и/или желатин, и/или фибрин в количестве 0,1-1000 мкг/см2.
Культивирование измельченных образцов миокарда проводят в условиях гипоксии при концентрации кислорода 0,1-15% в течение 6-36 часов в среде, содержащей IMDM и/или DMEM и/или DMEM-F12 и/или MEM и/или Myelocult и/или RPMI в концентрации 0,1-99,9% и 0,01-50% фетальной сыворотки теленка и/или лошади, при этом в процессе культивирования осуществляют смену 0,1-100% среды не реже одного раза в 10 дней. При этом среда дополнительно может содержать 0,01 - 3% пенициллина-стрептомицина, и/или 0,01-1 мМ 2-меркаптоэтанола, и/или 0,01-5% L-глутамина.
Культивирование извлеченных клеток до момента образования клеточных агрегатов осуществляют в среде, содержащей: 0,1-99,9% IMDM, и/или DMEM, и/или DMEM-F12, и/или MEM, и/или Myelocult, 0,01-50% фетальной сыворотки теленка и/или лошади, 0,01-3% пенициллина-стрептомицина, 0,01-1 mM 2-меркаптоэтанола, 0,01-10% В27, 0,1-5% L-глутамина, 0,01-1000 нг/мл основного фактора роста фибробластов, 0,01-1000 нг/мл эпидермального фактора роста, 0,01-1000 ед./мл тромбина, 0,01-1000 нг/мл кардиотрофина-1, при этом в процессе культивирования осуществляют смену 0,01-100% среды не реже чем 1 раз в 10 дней.
Культивирование измельченных образцов миокарда и извлеченных из клеточной культуры клеток проводят в течение 7-40 дней при 35-39°С в атмосфере 0,1-10% СО2. При этом культивирование образцов миокарда осуществляют до момента появления округлых клеток, а культивирование извлеченных клеток осуществляют на чашках с покрытием, обеспечивающим образование клеточных агрегатов. В качестве покрытия чашек может быть использован poly-D(L)-lysine и/или poly-ornithine в количестве 0,1-1000 мкг/см2. Посадку извлеченных клеток на культуральные чашки для образования клеточных агрегатов осуществляют в количестве 1-1000000 клеток/см2.
Для ферментативной обработки клеточной культуры и клеточных агрегатов используют раствор фермента, разрушающий связи между клетками. В качестве такого раствора фермента могут быть использованы 0,1-100% коллагеназа, или диспаза, или трипсин, или Accutase или их комбинация в версене, или фосфатно-солевом буфере, или среде культивирования, при этом обработку раствором фермента осуществляют в течение 0,1-30 минут.
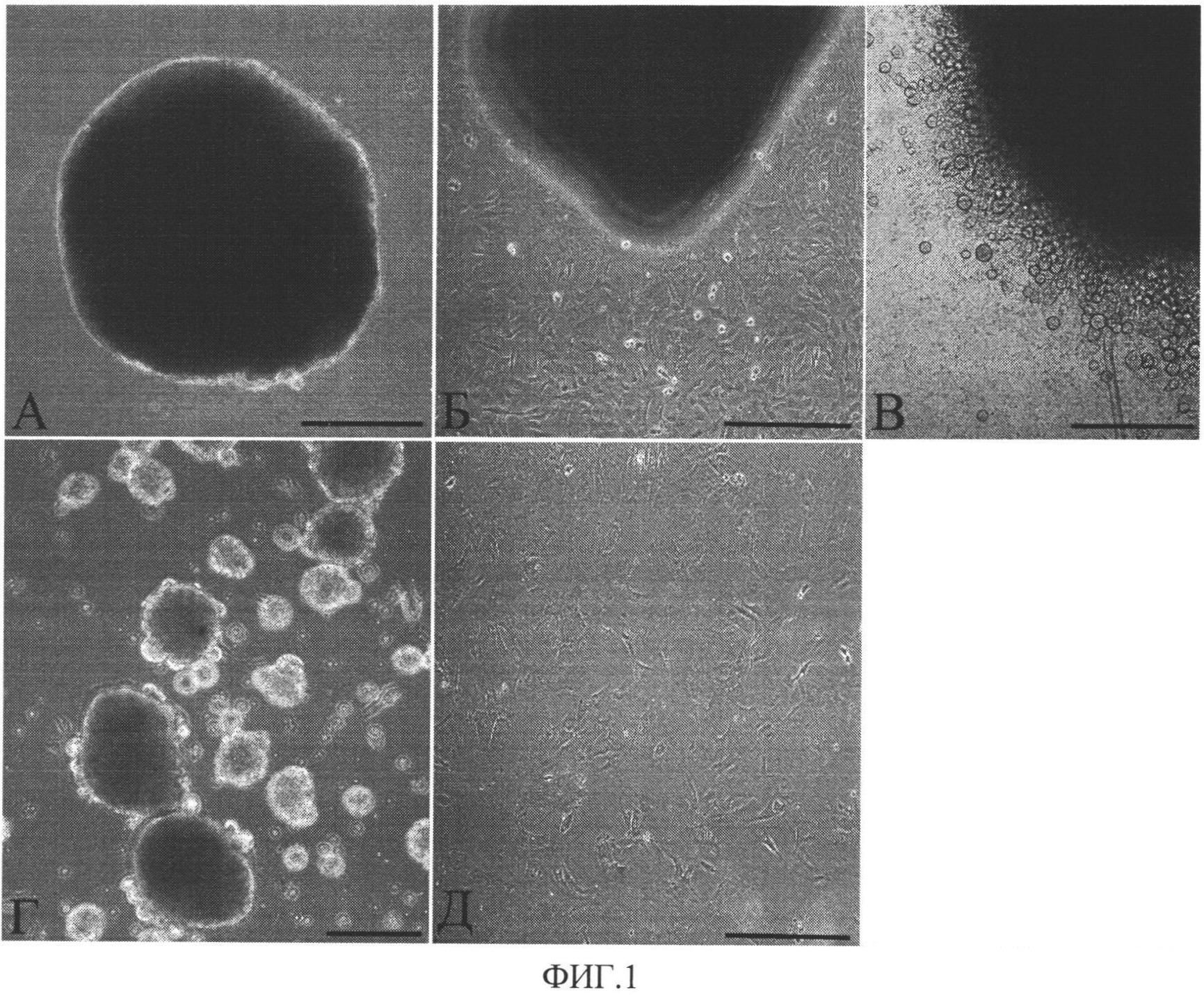
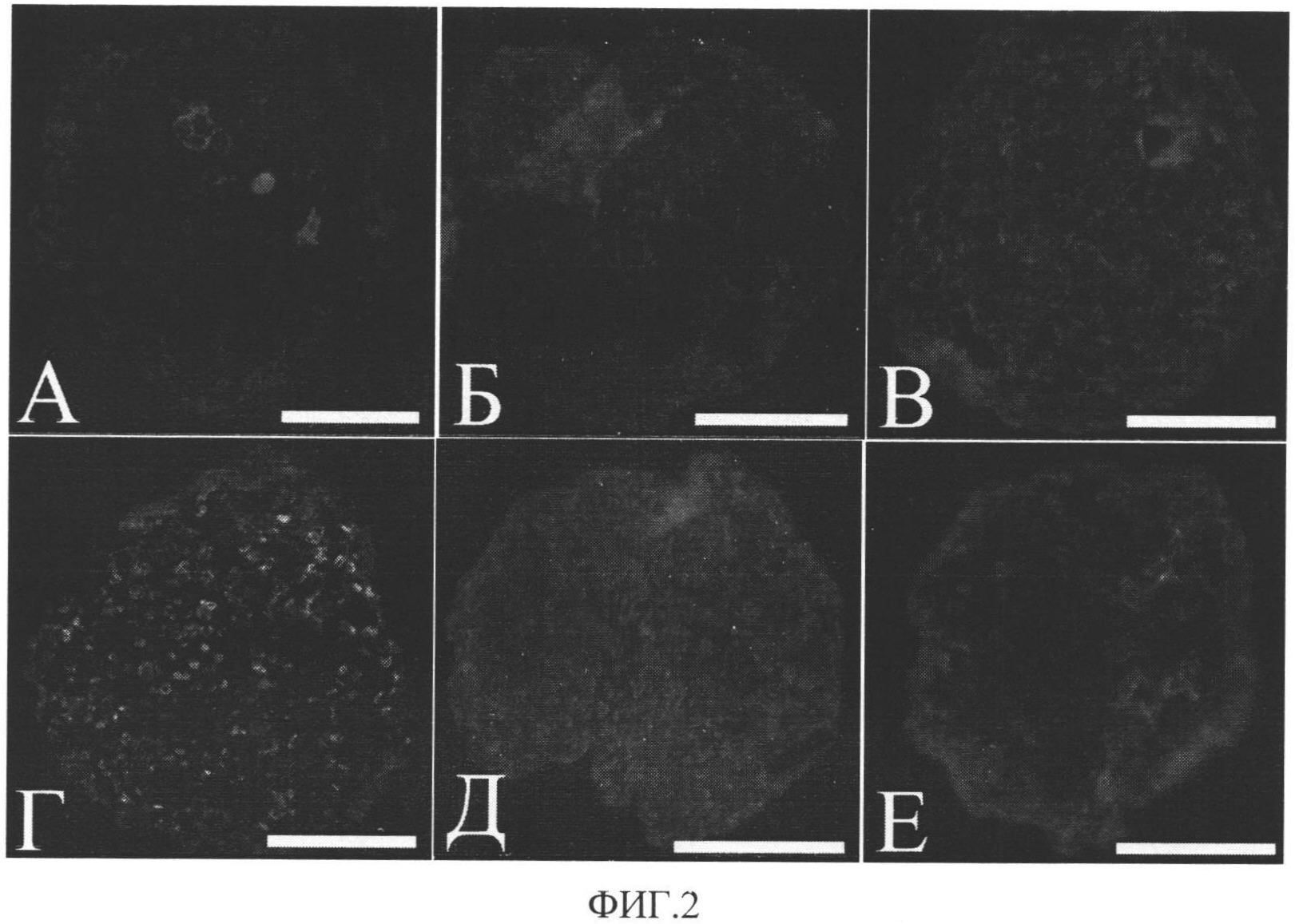
Изобретение поясняется чертежами, где на фиг.1 представлено поэтапное визуальное отображение способа получения прогениторных клеток из образцов миокарда, а на фиг.2 - результаты иммунофлуоресцентного окрашивания прогениторных клеток-предшественников кардиомиоцитов и клеток сосудов в составе клеточных агрегатов.
Заявляемый метод обладает следующими преимуществами.
1. Позволяет отказаться от использования ферментативной обработки, что сохраняет трехмерную структуру ткани, межклеточные взаимодействия, предотвращает повреждение прогениторных клеток и поддерживает их функциональную активность.
2. Культивирование кусочков миокарда в условиях гипоксии повышает их адгезионную способность к поверхности культуральной чашки, что обеспечивает образование эксплантной культуры прогениторных клеток.
3. Культивирование кусочков миокарда в условиях гипоксии снижает уровень апоптоза и повышает пролиферативную способность прогениторных клеток миокарда (внутри кусочков миокарда).
4. Культивирование кусочков миокарда в условиях гипоксии повышает миграционную способность клеток, что способствует образованию эксплантной культуры прогениторных клеток;
5. Использование покрытий (коллаген, и/или фибронектин, и/или ламинин, и/или желатин, и/или фибрин) обеспечивает повышение адгезионной способности прогениторных клеток миокарда к поверхности культуральной чашки, что является необходимым условием для образования эксплантной культуры прогениторных клеток.
6. Использование комбинации действий (измельчение образцов, культивирование в условиях гипоксии, использование покрытий для культуральных чашек и специальных сред) обеспечивает сокращение времени, необходимое для образования эксплантной культуры прогениторных клеток.
7. Использование культивирования в составе эксплантной культуры обеспечивает увеличение количества прогениторных клеток, снижает уровень апоптоза и повышает их способность к пролиферации in vitro.
8. Культивирование клеток в составе клеточных агрегатов позволяет индуцировать процесс дифференцировки прогениторных клеток в кардиомиоциты и клетки сосудов.
9. Предложенный способ позволяет использовать потенциал всех типов прогениторных клеток сердца (не только ((ALDH)+ CD34+ C-kit- CD45-) для образования предшественников клеток миокарда.
10. Предложенный способ обеспечивает получение прогениторных клеток-предшественников не только кардиомиоцитов, но и клеток сосудов.
Перечисленные преимущества достигаются за счет выполнения следующих последовательных взаимосвязанных действий. Образцы миокарда млекопитающего измельчают до размера кусочков 1-10 мм3, выкладывают на культуральные чашки, покрытые белками внеклеточного матрикса (коллаген, и/или фибронектин, и/или ламинин, и/или желатин, и/или фибрин) в количестве 0,1-1000 мкг/см2 или их комбинацией для их адгезии к поверхности и последующего культивирования. В качестве среды культивирования используют: 0,1-99,9% IMDM, и/или DMEM, и/или DMEM-F12, и/или MEM, и/или Myelocult, и/или RPMI, 0,01-50% фетальной сыворотки теленка и/или лошади, 0,01-3% пенициллина-стрептомицина, 0,01-1 mM 2-меркаптоэтанола, 0,01-5% L-глутамина. Культивирование проводят в условиях, соответствующих состоянию гипоксии (концентрация кислорода 0,1-15%) в течение 6-36 часов. Культивирование образцов в условиях гипоксии снижает уровень апоптоза и повышает пролиферативную способность прогениторных клеток, находящихся внутри кусочков миокарда. Культивирование в этих условиях способствует прикреплению образцов миокарда к поверхности культуральных чашек и стимулирует миграцию и пролиферацию клеток, появившихся из кусочков миокарда, что исключает необходимость ферментативной обработки. Использование покрытий (коллаген, и/или фибронектин, и/или ламинин, и/или желатин, и/или фибрин) обеспечивает повышение адгезионной способности прогениторных клеток миокарда к поверхности культуральных чашек, что является необходимым условием для образования эксплантной культуры прогениторных клеток. Повышение миграционной способности клеток способствует более быстрому образованию эксплантной культуры прогениторных клеток. В соответствии с этим, значительно увеличивается количество прогениторных клеток, которое можно получить из каждого образца миокарда. Кроме того, в культуре существенно увеличивается количество клеток, экспрессирующих маркер пролиферации Ki-67 и основополагающие маркеры стволовых клеток. В составе популяции присутствуют стволовые клетки, экспрессирующие основные маркеры СКС (с-kit, sca-1, MDR1), а также маркеры других типов прогениторных клеток (CD105, CD166, CD90, CD29, Tubulin, GFAP, Nestin, Gata 4, Nkx 2,5, Mef 2c, Ets 1, Erg 1, Gata 6, ALDH, Oct 4 и другие). Взаимное влияние клеток, мигрирующих (выползающих) из кусочков миокарда, осуществляемое за счет межклеточных взаимодействий и паракринных эффектов, обеспечивает условия, необходимые для поддержания жизнеспособности (подавление апоптоза, стимуляция пролиферации) и увеличения количества прогениторных клеток при культивировании in vitro. Предложенный метод позволяет в десятки раз повысить количество прогениторных клеток от их исходного количества в образце миокарда, что делает заявляемый метод особенно ценным для их получения даже из «самых небольших» образцов миокарда (биоптатов), что не обеспечивается методом, описанным в изобретении ЕР 2258833. После миграции прогениторных клеток из кусочков миокарда, они располагаются на поверхности монослоя клеток «фибробластоподобного» типа. Учитывая их слабую адгезионную способность прогениторные клетки можно легко получить с помощью непродолжительной «мягкой» обработки клеточной культуры 0,1-100% раствором фермента (коллагеназы, или диспазы, или трипсина, или Accutase, или др.) или их комбинацией в версене, или фосфатно-солевом буфере, или среде культивирования в течение 0,1-30 минут. Полученные клетки используются для индукции дифференцировки. Индукция дифференцировки достигается за счет культивирования полученных клеток в слабо адгезионных условиях, что обеспечивает образование клеточных агрегатов, состоящих из прогениторных клеток. Для их получения прогениторные клетки высаживают в количестве 1-1000000 клеток/см2 на культуральные чашки, покрытые poly-D(L)-lysine и/или poly-ornithine в количестве 0,1-1000 мкг/см2. Культивирование прогениторных клеток проводят в специальной среде, обеспечивающей образование клеточных агрегатов (0,1-99,9% IMDM, и/или DMEM, и/или DMEM-F12, и/или MEM, и/или Myelocult, и 0,01-50% фетальной сыворотки теленка и/или лошади, 0,01-3% пенициллина-стрептомицина, 0,01-1 mM 2-меркаптоэтанола, 0,01-10% В27, 0,01-5% L-глутамина, 0,01-1000 нг/мл основного фактора роста фибробластов, 0,01-1000 нг/мл эпидермального фактора роста, 0,01-1000 ед./мл тромбина, 0,01-1000 нг/мл кардиотрофина-1) при 35-39°С в атмосфере 0,1-10% СО2. Замену среды проводят каждые 3-5 дней. Культивирование в данных условиях способствует образованию клеточных агрегатов, которые представляют собой пространственную структуру, в центре которой находятся низкодифференцированные пролиферирующие прогениторные клетки, а по периферии - клетки, несущие маркеры кардиомиоцитарной (Nkx 2,5, Gata 4, МНС (тяжелые цепи миозина), саркомерный α-актин, саркомерный α-актинин и др.), эндотелиальной (Ets, Erg, фактор фон-Виллибранда, CD31 и др.), гладкомышечной (Gata 6, гладкомышечный α-актин и др.) дифференцировки. Клеточные агрегаты можно рассматривать как аналог «клеточной ниши» миокарда, в которой создаются условия, необходимые для образования прогениторных клеток-предшественников кардиомиоцитов и клеток сосудов. Получение конечного результата - прогениторных клеток миокарда, достигается путем обработки клеточных агрегатов раствором фермента(ов), вызывающего разрушение связей между клетками. В качестве такого ферментативного раствора может быть использована коллагеназа, диспаза, трипсин, Accutase или их комбинации в версене, или фосфатно-солевом буфере, или среде культивирования.
Таким образом, способ получения прогениторных клеток миокарда имеет преимущества перед другими ранее описанными методами, так как позволяет проводить получение прогениторных клеток без ферментативной обработки образцов миокарда млекопитающих и использовать для этого образцы миокарда практически любого размера. Предложенный способ обеспечивает поддержание жизнеспособности и увеличение количества всех популяций прогениторных клеток при культивировании in vitro. Предложенный способ позволяет использовать потенциал всех типов прогениторных клеток сердца для образования прогениторных клеток-предшественников кардиомиоцитов и клеток сосудов.
Изобретение поясняется следующими примерами:
Пример 1. Получение прогениторных клеток из сердца крысы
Для осуществления изобретения использовано сердце взрослой крысы линии Вистар возрастом 6 месяцев (масса 270 г). Животные содержались в стандартных условиях вивария. Работа с животными, их умерщвление проводилась строго в соответствии с рекомендациями о гуманном отношении к лабораторным животным, изложенными в Приказе МЗ СССР за №755 от 12 августа 1977 г. Сердце животного извлекалось из грудной клетки и помещалось в раствор фосфатно-солевого буфера без ионов Са++ и Mg++. Сердце животного измельчали с помощью ножниц/скальпеля до получения кусочков размером 1 мм3. Далее кусочки миокарда выкладывали на культуральные чашки, покрытые комбинацией белков внеклеточного матрикса (коллаген III (50 мкг/см2)+фибронектин (20 мкг/см2)), добавляли среду культивирования IMDM, содержащую 15% фетальной сыворотки теленка, 100 ед./мл пенициллина, 100 ед./мл стрептомицина, 2 мМ L-глутамина и культивировали в условиях гипоксии (5% О2) в течение 48 часов. По истечении 48 часов проводили частичную замену среды (50%) на новую среду культивирования. Культивирование проводили в течение 10 дней при 37°С в атмосфере 5% СО2, со сменой 50% среды каждые 3 дня до образования монослоя клеток вокруг кусочков миокарда, на поверхности которого располагались округлые клетки (стволовые клетки сердца). Для получения суспензии прогениторных клеток использовали обработку культуры клеток раствором фермента Accutase («ICT», США) в течение 2 минут. Далее клетки фильтровали через нейлоновые мембраны («BD Pharmingen», США) с размером пор 40 микрон и далее использовали для индукции дифференцировки. Для этого стволовые клетки высаживались в количестве 4000 клеток/см2 на культуральные чашки, покрытые комбинацией веществ (poly-L-lysine (2 мкг/см2) и poly-ornithine (10 мкг/см2)), в среду (35% среды IMDM/65% среды DMEM F12 («Invitrogen», США) с добавлением 2% В27, 10 нг/мл EGF, 20 нг/мл bFGF, 40 нМ кардиотрофина-1, 40 нМ тромбина, 100 ед./мл пенициллина, 100 ед./мл стрептомицина, 2 мМ L-глутамина) и культивировали при 37°С в атмосфере 5% СО2 в течение 10 дней. Спустя 48 часов наблюдалось образование объемных клеточных агрегатов, которые увеличивались в размерах по мере культивирования. Размер клеточных агрегатов варьировал в пределах 70-200 мкм. Появление прогениторных клеток-предшественников кардиомиоцитов и клеток сосудов подтверждено с помощью метода иммунофлуоресцентного окрашивания (пример 2, рисунок 2). Прогениторные клетки миокарда получали путем обработки клеточных агрегатов средой Accutase («ICT», США) в течение 3 минут.
Пример 2. Иммунофлуоресцентное окрашивание клеточных агрегатов
Криосрезы клеточных агрегатов (7 мкм) промывали в фосфатно-солевом буфере и фиксировали 4% формалином в течение 15 минут. Для снижения неспецифического связывания антител с клетками препараты инкубировали в блокирующем растворе (1% бычьего сывороточного альбумина/10% сыворотки донора вторых антител/фосфатно-солевой буфер) в течение 30 минут. После удаления излишка блокирующего раствора, клетки инкубировали в течение 60 мин с первичными антителами (в концентрациях, рекомендованных изготовителем) в растворе (1% бычий сывороточный альбумин/фосфатно-солевой буфер). Использовали первичные антитела против с-kit («Dako», США и «Biolegend», США), саркомерного α-актинина («Sigma», США), CD31 («BDPharmingen», США), α-гладкомышечного актина («Sigma», США), Nkx 2,5 («Abcam», США и «SantaCruz», США), Тропонина I («SantaCruz», США). Срезы отмывали от излишков антител 3 раза в фосфатно-солевом буфере. Затем инкубировали клетки в течение 60 минут с вторичными антителами Alexa Fluor («Invitrogen», США), меченными Texas Red или FITC в стандартном разведении 1:2000 в растворе (1% бычьего сывороточного альбумина/фосфатно-солевой буфер). Срезы отмывали от излишков антител в в фосфатно-солевом буфере 3 раза. Ядра клеток докрашивали DAPI. После отмывки в фосфатно-солевом буфере срезы клеточных агрегатов заключали в Aquapolymount («Polysciencesinc», США).
Полученные таким образом препараты анализировали с помощью флуоресцентного микроскопа Axiovert 200М («Zeiss», Германия). Документирование изображений производили с помощью цифровой видеокамеры Axiocam HRC («Zeiss», Германия) и обработки изображения в программах Axiovision 3.1 («Zeiss», Германия) и AdobePhotoShop («AdobeSystems», США).
На фиг.1 представлено визуальное отображение способа получения прогениторных клеток миокарда. А - фрагмент миокарда на чашке с коллагеном и фибронектином после посадки; Б - культура клеток через 4 дня после посадки образцов миокарда; В - появление прогениторных клеток сердца на поверхности монослоя фибробластов на 7 день культивирования; Г - сформированные клеточные агрегаты из прогениторных клеток сердца; Д - прогениторные клетки миокарда, полученные при ферментативном расщеплении клеточных агрегатов. Масштабный отрезок 100 мкм.
На фиг.2 представлены результаты иммунофлуоресцентного окрашивания агрегатов из стволовых клеток сердца. A - c-kit позитивные прогениторные клетки (красный); B - CD31 позитивные эндотелиальные клетки (красный); В - клетки, позитивные по гладкомышечному α-актину в составе клеточного агрегата; Г - прогениторные клетки-предшественники кардиомиоцитов, экспрессирующие Nkx 2,5 (зеленый), Д - прогениторные клетки-предшественники кардиомиоцитов, экспрессирующие саркомерный актинин (красный), Е - прогениторные клетки-предшественники кардиомиоцитов, экспрессирующие тропонин I (зеленый). Ядра клеток окрашены DAPI. Масштабный отрезок 50 мкм.