Результат интеллектуальной деятельности: СПОСОБЫ ПРИМЕНЕНИЯ ПРОИЗВОДНЫХ ТИАЗОЛА
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способам применения производных тиазола, в частности, тетомиласта в комбинации с агонистами бета2-адренергических рецепторов и/или противовоспалительными стероидами.
УРОВЕНЬ ТЕХНИКИ
Тетомиласт (2-(3,4-диэтоксифенил)-4-(2-карбокси-6-пиридил)тиазол; 6-[2-(3,4-диэтоксифенил)-1,3-тиазол-4-ил]пиридин-2-карбоновая кислота) представляет собой производное тиазола, применимое для лечения ряда заболеваний. Химическая структура тетомиласта отображается формулой 1 (смотрите также http://www.who.int/druginformation/vol18num2_2004/proplist91.pdf).

Тетомиласт вовлечен в несколько специфических функций в активированных нейтрофилах, как in vitro, так и in vivo, включая выработку супероксидов (например, патент США № 5643932 (RE 37 556), полностью включенный в заявку с помощью ссылки) и адгезию к эндотелию (например, патент США № 6291487, полностью включенный в заявку с помощью ссылки). Кроме того, было показано, что тетомиласт уменьшает сопротивление дыхательных путей прохождению воздуха, а также максимальный поток выдыхаемого воздуха у морских свинок, служащих моделями легочных заболеваний (например, патентная публикация США № 2004/0147563, полностью включенная в заявку с помощью ссылки). Помимо этого предварительная обработка тетомиластом приводила к дозозависимому подавлению индуцируемой липополисахаридами (LPS) выработки цитокинов (фактора некроза опухолей альфа [TNF-α], интерлейкина 1-бета [IL-1β] и интерлейкина-6 [IL-6]) в цельной человеческой крови здоровых добровольцев in vitro (например, патент США № 6291487), что предполагает возможное ингибирующее действие на активированные моноциты.
Тетомиласт был предложен для лечения хронической обструктивной болезни легких (COPD) и ряда других заболеваний, расстройств или состояний (например, в патентной публикации США 2004/0147563), но его взаимодействие с другими лекарственными средствами до сих пор не подвергалось анализу. Следовательно, тетомиласт не предлагался для применения или не применялся в комбинации с другими лекарственными средствами для лечения, например, респираторных заболеваний, расстройств или состояний.
Респираторные заболевания, расстройства или состояния характеризуются воспалением дыхательных путей, которое приводит либо к сжатию дыхательных путей (т.е. уменьшению функционального объема легких), либо к нарушению проходимости дыхательных путей (т.е. уменьшению скорости потока воздуха, входящего в легкие и выходящего из них). Респираторные заболевания в Америке стоят на третьем месте по частоте случаев смерти и являются основной причиной смерти детей в возрасте до года.
COPD характеризуется прогрессирующим развитием ограничения прохождения воздушного потока (нарушением проходимости дыхательных путей) (Pauwels R.A., et al.: Am. J. Respir. Crit. Care Med., 2001 (163), 1256-1276). COPD является одной из основных причин хронической заболеваемости и смертности во всем мире, и существует прогноз, согласно которому в Азиатско-Тихоокеанском регионе число пациентов с COPD будет быстро расти в течение следующих 20 лет вследствие увеличения числа людей старшего возраста и количества курящих.
Традиционные способы лечения респираторных заболеваний направлены на уменьшение воспаления дыхательных путей, что приводит к облегчению последствий сужения дыхательных путей. Один из таких известных в технике способов включает введение противовоспалительных средств, например, кортикостероидов, которые обладают мощным ингибирующим действием на выработку цитокинов. Однако наиболее обширные клинические исследования показали, что противовоспалительные стероиды не могут улучшить ситуацию с долговременным прогрессирующим ослаблением функции легких у пациентов с COPD, что ограничивает их применимость лишь временным облегчением симптомов респираторного заболевания (Pauwels R.A., et al.: N. Engl. J. Med., 1999(340), 1948-1953; Vestbo J. et al.: Lancet, 1999 (352), 1819-1823; Burge P.S., et al.: BMJ, 2000 (320), 1297-1303).
Второй известный в технике способ лечения воспаления дыхательных путей заключается в увеличении внутриклеточных уровней циклического аденозин 3',5'-монофосфата (cAMP). При респираторном заболевании основные клетки, вовлеченные в связанные с ним сужение бронхов и воспалительный процесс, подвергаются ингибирующему регулированию со стороны cAMP. Поэтому соединения, которые повышают уровни cAMP, часто вводят для лечения воспаления и сужения дыхательных путей, связанного с респираторными заболеваниями (Rabe K.F. et al.: Eur Respir J, 1995 (8), 637-642).
Первым известным путем повышения уровней cAMP в клетках дыхательных путей является введение бронхорасширяющих препаратов, например, агонистов бета2-адренергических рецепторов и им подобных. Эти препараты активируют рецепторы гладкой мускулатуры дыхательных путей. Будучи активированными, эти рецепторы стимулируют синтез cAMP аденилат циклазой. Таким образом, агонисты бета2-адренергических рецепторов, такие как альбутерол (наименование, рекомендованное Всемирной Организацией Здравоохранения, сальбутамол) и сальметерол, являются традиционными средствами лечения респираторных заболеваний. Однако, как и противовоспалительные стероиды, эти бронхорасширяющие средства также не могут улучшить долговременное ослабление функции легких у пациентов с респираторными заболеваниями, что ограничивает их применимость лишь временным облегчением симптомов этих заболеваний (Billah M.M. et al.: JPET, 2002 (302), 127-137).
Первым известным путем повышения уровней cAMP в клетках дыхательных путей является ингибирование расщепления cAMP путем блокирования фосфодиэстераз циклических нуклеотидов (PDEs). Существует, по крайней мере, одиннадцать ферментов семейства PDE, которые разрушают cAMP и/или cGMP. Среди различных форм PDE существует cAMP-специфичный изофермент PDE4, который является основным компонентом в гладкой мускулатуре дыхательных путей и в воспалительных и иммунокомпетентных клетках. Однако сообщалось, что эти лекарственные препараты обладают нежелательными побочными действиями, такими как, например, тошнота, рвота и повышение секреции кислоты в желудке (Barnes P.J.: N. Engl. J. Med., 2000 (343) No. 4, 269-280).
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу лечения пациента, включающему введение пациенту терапевтически эффективного количества тетомиласта. В одном из вариантов осуществления настоящего изобретения вместе с тетомиластом может быть введен хотя бы один агонист бета2-адренергических рецепторов. В другом варианте осуществления изобретения вместе с тетомиластом и как минимум одним агонистом бета2-адренергических рецепторов может также вводиться противовоспалительный стероид. Тетомиласт, агонист бета2-адренергических рецепторов и/или противовоспалительный стероид могут вводиться одновременно, раздельно или последовательно. Настоящее изобретение можно применять для лечения или профилактики респираторных заболеваний, расстройств или состояний, как, например, хронической обструктивной болезни легких (COPD).
Следует понимать, что как предшествующее общее описание, так и следующее далее по тексту подробное описание изобретения являются только иллюстративными и поясняющими и не ограничивают объем изобретения, определенный формулой изобретения.
Сопроводительные чертежи, которые включены в настоящее описание и составляют его часть, иллюстрируют несколько вариантов осуществления настоящего изобретения и совместно с описанием служат для объяснения основных идей настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА
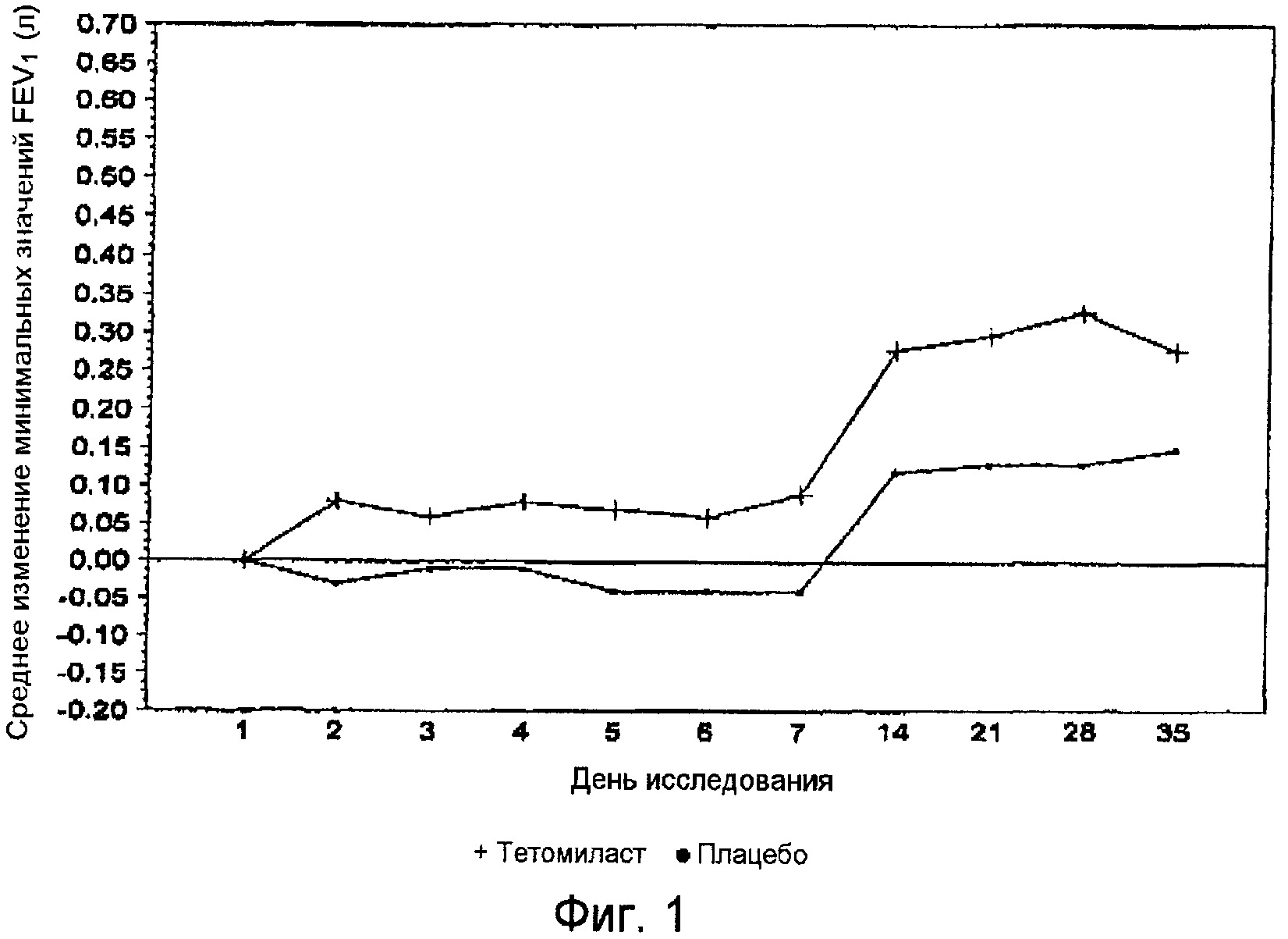
Фиг.1 представляет собой график, показывающий средние изменения минимальных значений FEV1 по отношению к исходному уровню (день, предшествующий введению препаратов) для групп, получавших тетомиласт и плацебо.
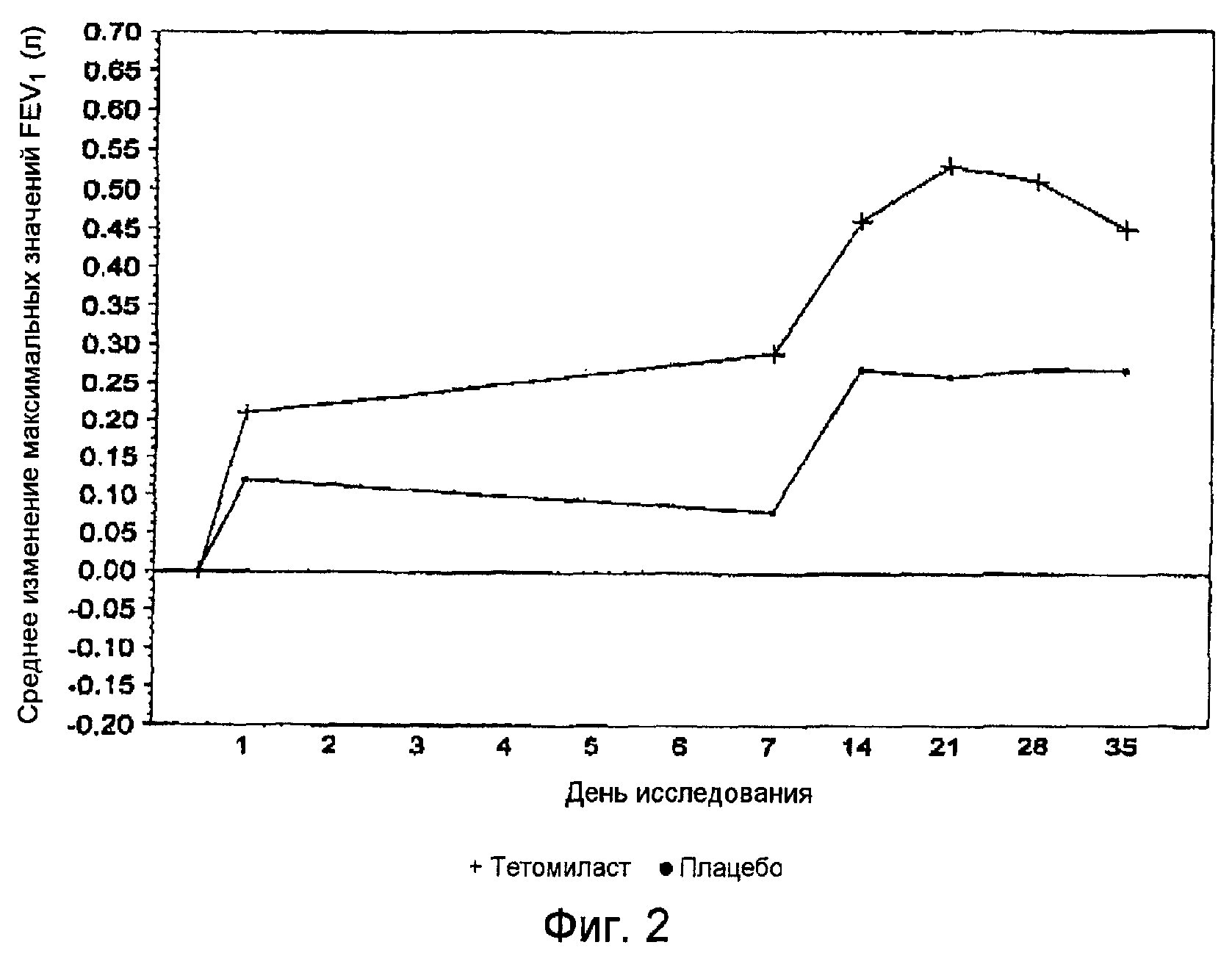
Фиг.2 представляет собой график, показывающий средние изменения максимальных значений FEV1 по отношению к исходному уровню (день, предшествующий введению препаратов) для групп, получавших тетомиласт и плацебо.
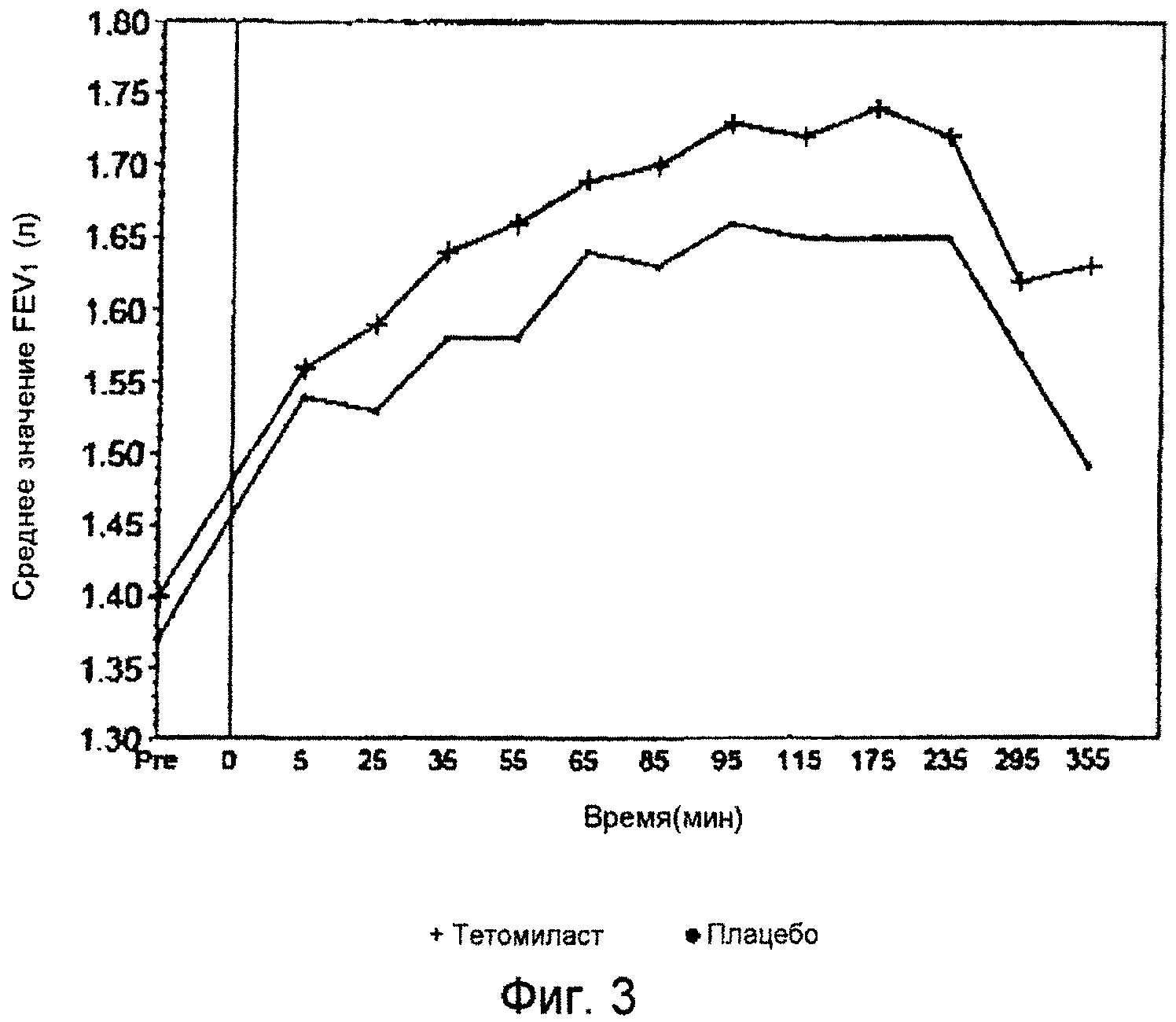
Фиг.3 представляет собой график, показывающий средние изменения значений FEV1 для групп, получавших тетомиласт и плацебо.
НАИЛУЧШИЙ СПОСОБ РЕАЛИЗАЦИИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Способы, рассматриваемые в настоящем изобретении, включают введение пациенту терапевтически эффективного количества тетомиласта, т.е. производного тиазола, описанного в патентной публикации США № 2004/0147563, которая полностью включена в настоящее описание с помощью ссылки. Варианты осуществления указанного способа включают дополнительное введение как минимум одного агониста бета2-адренергических рецепторов и, необязательно, как минимум одного противовоспалительного стероида.
Фраза «терапевтически эффективное количество» в настоящем описании относится к количеству действующего соединения, которое достаточно для стимулирования терапевтической, физиологической и фармакологической реакции у пациента. Предпочтительно эффективное количество действующего соединения стимулирует желаемые физиологические и фармакологические реакции, не вызывая нежелательных эффектов.
Пациент в настоящей заявке определяется как любой человек или животное, не являющееся человеком, имеющие потребность во введении тетомиласта или содержащих его комбинаций, или любой субъект, которому может быть полезно лечение тетомиластом или содержащими его комбинациями, включая людей и животных. Животные, которых предполагается подвергать лечению, включают всех одомашненных и диких позвоночных животных. Указанный пациент во время лечения может иметь стабильный уровень содержания в плазме любого из действующих соединений по настоящему изобретению.
Термин «лечение» в настоящей заявке относится как к профилактической, так и к симптоматической формам терапии.
Способ по настоящему изобретению может применяться для профилактики или лечения заболевания, расстройства или состояния, например, респираторного заболевания, расстройства или состояния. Респираторные заболевания, расстройства или состояния включают аллергические и воспалительные заболевания легких и верхних дыхательных путей. Типовые респираторные заболевания, расстройства или состояния включают, не ограничиваясь перечисленными, астматические состояния (например, аллергическую астму, бронхиальную астму, астму, вызванную физической нагрузкой, астму, вызванную загрязнением окружающей среды, и астму, вызванную действием холодного воздуха), острый синдром затруднения дыхания, хроническое или острое сужение бронхов, хроническую обструктивную болезнь легких (COPD), бронхит (например, острый бронхит, хронический бронхит, обструктивный бронхит, спастический бронхит, аллергический бронхит), эмфизему, пневмокониоз, незначительное нарушение проходимости дыхательных путей, синусит, бронхоэктаз и ринит (например, сезонный или круглогодичный ринит).
Один из вариантов осуществления настоящего изобретения включает способ профилактики или лечения хронической обструктивной болезни легких (COPD). COPD часто связана с прогрессирующим развитием ограничения воздушного потока (нарушения проходимости дыхательных путей), при котором воспалительные клетки, обнаруживаемые в бронхоальвеолярной промывной жидкости и мокроте пациентов, являются нейтрофилами.
В дополнение к различным заболеваниям, расстройствам или состояниям, раскрытым в патенте США № 5643932, патенте США № 6291487 и патентной публикации США № 2004/14563, другие типовые заболевания, расстройства или состояния, которые можно предотвращать или лечить тетомиластом, включают, не ограничиваясь перечисленным, гинекологические расстройства, остеоартрит, экзему, волчаночный нефрит, нефропатию трансплантата, врожденную обструктивную нефропатию, глютеиновую болезнь, болезнь Грейвса, тиреоидит, мышечную дистрофию, спинальную мышечную атрофию, димиелинизирующие заболевания центральной нервной системы (ЦНС), энцефаломиелит, миозит и болезнь «трансплантат против хозяина» (GvHD).
Тетомиласт
Тетомиласт (2-(3,4-диэтоксифенил)-4-(2-карбокси-6-пиридил)тиазол; 6-[2-(3,4-диэтоксифенил)-1,3-тиазол-4-ил]пиридин-2-карбоновая кислота) представляет собой производное тиазола, применимое для лечения ряда заболеваний и описанное в патентной публикации США № 2004/0147563. Химическая структура тетомиласта отображается формулой (1).

Под тетомиластом, отображенным в заявке формулой (1), в рамках настоящего изобретения понимаются также его пролекарства, конъюгаты или любые другие формы, которые обеспечивают присутствие активной формы тетомиласта. Кроме того, в заявке подразумевается, что термин «тетомиласт» включает солевые формы данного соединения (как кислотные, так и основные), сольваты, полиморфы и т.д.
Агонисты бета 2 -адренергических рецепторов
Фраза «агонисты бета2-адренергических рецепторов» в настоящем описании относится к соединениям, которые стимулируют бета2-адренергические рецепторы. Бета2-адренергические рецепторы являются преобладающими рецепторами в гладкой мускулатуре бронхов. Будучи активированным, бета2-адренергический рецептор стимулирует аденилат циклазу к синтезу cAMP. Эквивалентные фразы, применяемые в данной заявке и в технике, включают следующие: «бета2-агонист» и «β2 агонист». Агонисты бета2-адренергических рецепторов в настоящем описании включают их рацематы, стереоизомеры и смеси, пролекарства, конъюгаты или любые другие формы, которые способны обеспечить выделение активной формы агонистов бета2-адренергических рецепторов. Кроме того, имеется в виду, что любой из агонистов β2-адренергических рецепторов в настоящем описании включает его солевые формы (как кислотные, так и основные), сольваты, полиморфы и т.д.
Агонисты бета2-адренергических рецепторов включают, не ограничиваясь перечисленными, например альбутерол (сальбутамол), AR-C68397AA, арформотерол, бамбутерол, битолтерол, броксатерол, карбутерол, CHF-1035, кленбутерол, допексамин, фенотерол, формотерол, гексопреналин, HOKU-81, ибутерол, изоэтарин, изопреналин, KUL-1248, левосальбутамол, мабутерол, мелуадрин, метапротеренол, ноломирол, орципреналин, пирбутерол, прокатерол, репротерол, римитерол, ритодрин, сальмефамол, сальметерол, сибенадет, сотеренот, сульфонтерол, TA-2005, тербуталин, тиарамид, тулобутерол, эпинефрин, норэпинефрин, колтерол, этинорэпинефрин, изопротеренол, метапротеренол, эфедрин, GSK-597901, GSK-159797, GSK-678007, GSK-642444, GSK-159802, моногидрат гидрохлорида (-)-2-[7(S)-[2(R)-гидрокси-2-(4-гидроксифенил)этиламино]-5,6,7,8-тетрагидро-2-нафтилокси]-N,N-диметилацетамида, кармотерол, QAB-149 и 5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1H-хинолин-2-он, 4-гидрокси-7-[2-{[2-{[3-(2-фенилэтокси)пропил]сульфонил}этил]амино}этил]-2(3H)-бензотиазолон, 1-(2-фтор-4-гидроксифенил)-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[3-(4-метоксибензиламино)-4-гидроксифенил]-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[2H-5-гидрокси-3-оксо-4H-1,4-бензоксазин-8-ил]-2-[3-(4-N,N-диметиламинофенил)-2-метил-2-пропиламино]этанол, 1-[2H-5-гидрокси-3-оксо-4H-1,4-бензоксазин-8-ил]-2-[3-(4-метоксифенил)-2-метил-2-пропиламино]этанол, 1-[2H-5-гидрокси-3-оксо-4H-1,4-бензоксазин-8-ил]-2-[3-(4-н-бутилоксифенил)-2-метил-2-пропиламино]этанол, 1-[2H-5-гидрокси-3-оксо-4H-1,4-бензоксазин-8-ил]-2-{4-[3-(4-метоксифенил)-1,2,4-триазол-3-ил]-2-метил-2-бутиламино}этанол, 5-гидрокси-8-(1-гидрокси-2-изопропиламинобутил)-2H-1,4-бензоксазин-3-(4H)-он, 1-(4-амино-3-хлор-5-трифторметилфенил)-2-трет-бутиламино)этанол и 1-(4-этоксикарбониламино-3-циано-5-фторфенил)-2-(трет-бутиламино)этанол.
Агонисты бета2-адренергических рецепторов можно разделить на неселективные и селективные β2-агонисты. Наименование «неселективные β2-агонисты» относится к тем соединениям, которые действуют на все классы α- и β-адренергических рецепторов, и в число таких агонистов входят, не ограничиваясь перечисленными, эпинефрин, норэпинефрин, колтерол, этинорэпинефрин, изопротеренол, метапротеренол и эфедрин. Наименование «селективные β2-агонисты» относится к тем соединениям, которые специфично действуют на β2-адренергические рецепторы, и в число этих соединений входят, не ограничиваясь перечисленными, альбутерол (сальбутамол), AR-C68397AA, арформотерол, бамбутерол, битолтерол, броксатерол, карбутерол, CHF-1035, кленбутерол, допексамин, фенотерол, формотерол, гексопреналин, HOKU-81, ибутерол, изоэтарин, изопреналин, KUL-1248, левосальбутамол, мабутерол, мелуадрин, метапротеренол, ноломирол, орципреналин, пирбутерол, прокатерол, репротерол, римитерол, ритодрин, сальмефамол, сальметерол, сибенадет, сотеренот, сульфонтерол, TA-2005, тербуталин, тиарамид, тулобутерол, GSK-597901, GSK-159797, GSK-678007, GSK-642444, GSK-159802, моногидрат гидрохлорида (-)-2-[7(S)-[2(R)-гидрокси-2-(4-гидроксифенил)этиламино]-5,6,7,8-тетрагидро-2-нафтилокси]-N,N-диметилацетамида, кармотерол, QAB-149 и 5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1H-хинолин-2-он, 4-гидрокси-7-[2-{[2-{[3-(2-фенилэтокси)пропил]сульфонил}этил]амино}этил]-2(3H)-бензотиазолон, 1-(2-фтор-4-гидроксифенил)-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[3-(4-метоксибензиламино)-4-гидроксифенил]-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[2H-5-гидрокси-3-оксо-4H-1,4-бензоксазин-8-ил]-2-[3-(4-N,N-диметиламинофенил)-2-метил-2-пропиламино]этанол, 1-[2H-5-гидрокси-3-оксо-4H-1,4-бензоксазин-8-ил]-2-[3-(4-метоксифенил)-2-метил-2-пропиламино]этанол, 1-[2H-5-гидрокси-3-оксо-4H-1,4-бензоксазин-8-ил]-2-[3-(4-н-бутилоксифенил)-2-метил-2-пропиламино]этанол, 1-[2H-5-гидрокси-3-оксо-4H-1,4-бензоксазин-8-ил]-2-{4-[3-(4-метоксифенил)-1,2,4-триазол-3-ил]-2-метил-2-бутиламино}этанол, 5-гидрокси-8-(1-гидрокси-2-изопропиламинобутил)-2H-1,4-бензоксазин-3-(4H)-он, 1-(4-амино-3-хлор-5-трифторметилфенил)-2-трет-бутиламино)этанол и 1-(4-этоксикарбониламино-3-циано-5-фторфенил)-2-(трет-бутиламино)этанол.
Агонисты бета2-адренергических рецепторов можно также разделить на действующие в течение длительного времени или действующие в течение непродолжительного времени. Термин «действующие в течение длительного времени» относится к препаратам, которые оказывают воздействие на бронхи в течение примерно шести часов или более, и в некоторых случаях это действие может длиться до примерно двенадцати часов. Термин «действующие в течение непродолжительного времени» относится к препаратам, которые оказывают воздействие на бронхи в течение менее примерно шести часов.
Конкретные варианты агонистов бета2-адренергических рецепторов, рассматриваемые в настоящем изобретении, включают альбутерол или сальметерол. В еще одном варианте осуществления агонист бета2-адренергических рецепторов представляет собой сальметерола ксинафоат.
Противовоспалительные стероиды
Используемый в настоящем описании термин «противовоспалительный стероид» хорошо известен в технике и относится к соединениям, которые уменьшают или предотвращают воспаление, включая в себя стереоизомеры и смеси указанных стероидов, их сложные эфиры, пролекарства, конъюгаты или любые другие формы, которые способны обеспечить противовоспалительную активность. В настоящем описании имеется в виду, что противовоспалительные стероиды включают также их соли (как кислотные, так и основные), сольваты, полиморфы и т.д.
Примеры противовоспалительных стероидов включают, не ограничиваясь перечисленными, кортикостероиды, алколметазона дипропионат, беклометазон, будесонид, бутиксокорта пропионат, циклесонид, клокортолона пивалат, дефлазакорт, дексаметазон, дексаметазона пальмитат, дексаметазона натрия фосфат, депродона пропионат, фимексолон, флуоцинолона ацетонид, флуоцинонид, флунизолид, флутиказон, флутиказона пропионат, галобетазола пропионат, галопредона ацетат, галометазон, гидрокортизон, гидрокортизона ацепонат, гидрокортизона ацетат, гидрокортизона натрия сукцинат, гидрокортизона пробутат, лотепреднола этабонат, метилпреднизолон, метилпреднизолона ацепонат, метилпреднизолона сулептанат, мометазон, нафлокорт, преднизон, преднизолон, преднизолона фарнезилат, преднизолона натрия фосфат, предникарбат, римексолон, рофлепонид, триамцинолон (например, в виде ацетонида), трипредан, S-фторметиловый эфир 6α,9α-дифтор-17α-[(2-фуранилкарбонил)окси]-11β-гидрокси-16α-метил-3-оксо-андроста-1,4-диен-17b-карботионовой кислоты, S-(2-оксотетрагидрофуран-3S-ил)овый эфир 6α,9α-дифтор-11β-гидрокси-16α-метил-3-оксо-17α-пропионилокси-андроста-1,4-диен-17β-карботионовой кислоты, RPR-106541 и 5T-126 (SSP-Torii).
Метилпреднизолон и преднизон являются противовоспалительными кортикостероидами, пригодными для введения в форме инъекций и пероральных препаратов; они продаются многими фармацевтическими компаниями под фирменными и генерическими наименованиями. Беклометазона дипропионат продается в виде аэрозоля для ингаляции под наименованиями Beconase® и Beconase AQ® компанией GlaxoSmithKline. Флутиказона пропионат продается компанией GlaxoSmithKline под названием Flonase®. Триамцинолона ацетонид продается компанией Rhone-Poulenc Roher под названием Nasocort® в виде назального спрея и аэрозоля. Флунизолид продается в виде назального раствора под наименованием Nasalide® и NasarelTM компанией Roche Laboratories. Дексаметазон продается в виде натрий фосфатной соли компанией Medeva Pharmaceuticals Inc. под названием DexacortTM Phosphate. Мометазона фуроат продается в виде моногидрата в качестве назального препарата компанией Shering Corp под наименованием Nasonex®. Будесонид является еще одним кортикостероидом, применяемым в виде ингалируемого препарата для лечения легочных заболеваний. Будесонид поставляется на рынок компанией Astra Pharmaceuticals, L.P. в виде порошка в устройстве Turbuhaler® под названием Pulmicort Turbuhaler®. Все перечисленные лекарственные средства, назальные препараты, пероральные составы или составы для инъекций могут быть найдены в Physicians' Desk Reference® (PDR) 1999 года издания, опубликованной Medical Economics Corporation, Inc, of New Jersey, USA.
Конкретный вариант противовоспалительного стероида, рассматриваемый в настоящем изобретении, включает флутиказон. В еще одном варианте осуществления настоящего изобретения противовоспалительный стероид представляет собой флутиказона пропионат.
Различные формы действующих соединений
Как было указано выше, действующие соединения по настоящему изобретению могут применяться, например, в форме их солей и/или в виде сольватов (например, гидратов), и/или в форме N-оксидов и т.д.
Солевые формы действующих соединений включают их основные соли и кислотно-аддитивные соли. В одном из вариантов осуществления настоящего изобретения соль может являться «фармацевтически приемлемой солью», которая может придавать действующему соединению улучшенные фармакокинетические свойства по сравнению со свободной формой действующего соединения. Фармацевтически приемлемая солевая форма действующего соединения также может первоначально придавать действующему соединению желаемые фармакокинетические свойства, которыми оно не обладало ранее, и даже может положительно влиять на фармакодинамику действующего соединения в отношении его терапевтической активности в организме.
Фармакокинетические свойства активного соединения, которые предпочтительно могут подвергаться влиянию, включают, например, путь, которым действующее соединение переносится через клеточную оболочку, который, в свою очередь, может непосредственно и положительно влиять на поглощение, распределение, биотрансформацию и выделение действующего соединения.
Солевые формы действующих соединений по настоящему изобретению могут быть получены обычными способами. Если действующее соединение содержит кислотную группу, его подходящая соль может быть получена взаимодействием соединения с достаточным количеством подходящего основания с получением соответствующей основно-аддитивной соли. Примерами таких оснований являются гидроксиды щелочных металлов, в т.ч. гидроксид калия, гидроксид натрия и гидроксид лития; гидроксиды щелочноземельных металлов, например, гидроксид бария и гидроксид кальция; алкоксиды щелочных металлов (например, этанолат калия и пропанолат натрия); а также различные органические основания, например, пиперидин, диэтаноламин и N-метилглутамин. Кроме того, в число солей с основаниями входят алюминиевые соли действующих соединений по настоящему изобретению.
Соответственно, фармацевтически приемлемые основные соли действующих соединений включают, не ограничиваясь перечисленными, соли алюминия, аммония, кальция, меди, железа (III), железа (II), лития, магния, марганца (III), марганца (II), калия, натрия и цинка.
С другой стороны, кислотно-аддитивные соли могут быть образованы при обработке действующих соединений в форме свободных оснований достаточным количеством фармацевтически приемлемой органической или неорганической кислоты. Примеры таких солей включают, не ограничиваясь перечисленными, гидрогалогениды, например, гидрохлориды, гидробромиды, гидройодиды; другие минеральные кислоты и соответствующие им соли, например, сульфаты, нитраты, фосфаты и т.д.; алкил- и моноарилсульфонаты, например, этансульфонат, толуолсульфонат и бензолсульфонат; а также другие органические кислоты и соответствующие им соли, например, ацетаты, тартраты, малеаты, сукцинаты, цитраты, бензоаты, салициллаты, аскорбаты и т.д.
Соответственно, фармацевтически приемлемые кислотно-аддитивные соли действующих соединений по настоящему изобретению включают, не ограничиваясь перечисленными: ацетаты, адипаты, альгинаты, аргинаты, аспартаты, бензоаты, бензолсульфонаты (бесилаты), бисульфаты, бисульфиты, бромиды, бутираты, камфорцитраты, циклопентанпропионаты, диглюконаты, дигидрофосфаты, динитробензоаты, додецилсульфаты, этансульфонаты, фумараты, галактераты (производные слизевой кислоты), галактуронаты, глюкогептаноаты, глюконаты, глутаматы, глицерофосфаты, гемисукцинаты, гемисульфаты, гептаноаты, гексаноаты, гиппураты, гидрохлориды, гидробромиды, гидройодиды, 2-гидроксиэтансульфонаты, йодиды, изетионаты, изобутираты, лактаты, лактобионаты, малаты, малеаты, малонаты, манделаты, метафосфаты, метансульфонаты, метилбензоаты, моногидрофосфаты, 2-нафталинсульфонаты, никотинаты, нитраты, оксалаты, олеаты, памоаты, пектинаты, персульфаты, фенилацетаты, 3-фенилпропионаты, фосфаты, фосфонаты и фталаты.
Как было указано выше, действующие соединения по настоящему изобретению включают также их стереоизомеры. Термин «стереоизомер» относится к соединениям, которые имеют одну и ту же молекулярную формулу, причем атомы в молекулах соединены в одной и той же последовательности, но имеется различие в расположении атомов в пространстве. В число стереоизомеров входят энантиомеры (называемые также оптическими изомерами, молекулы которых являются зеркальными отражениями друг друга, причем изомеры имеют одинаковое, но противоположное по знаку удельное вращение) и диастереомеры (стереоизомеры, которые не являются зеркальными изображениями друг друга).
В число действующих соединений по настоящему изобретению входят также сложные эфиры соединений. Термин «сложный эфир» относится к действующему соединению, полученному в результате реакции этерификации, в которой карбоновая кислота взаимодействует со спиртом с образованием молекулы воды.
Фармацевтические композиции, составы и способы введения
Фармацевтические композиции по настоящему изобретению включают любое из описанных выше действующих соединений или несколько таких соединений. Фармацевтические композиции могут также включать фармацевтически приемлемый носитель, пригодный для введения пациенту по своим свойствам и ожидаемым характеристикам.
В настоящем описании термин «носитель» включает приемлемые разбавители, наполнители, вспомогательные вещества, носители, солюбилизирующие средства, модификаторы вязкости, консерванты и другие средства, служащие для придания необходимых свойств конечной фармацевтической композиции, которую предполагается вводить пациенту.
Более конкретно, носители, рассматриваемые в настоящем изобретении, включают: подкисляющие и подщелачивающие средства для получения желаемого или заранее определенного значения pH; противомикробные средства (включая антибактериальные, противогрибковые средства и средства против простейших); антиоксиданты для защиты ингредиентов фармацевтической композиции от повреждения или разрушения; буферные средства для поддержания желаемого значения pH; хелатирующие средства поддержания ионной силы; диспергирующие и суспендирующие средства; эмульгирующие средства; наполнители; консерванты; стабилизаторы; сахара и ПАВ. Терапевтически приемлемые примеры различных перечисленных классов носителей должны быть известны специалисту в данной области техники, и конкретные примеры обсуждаются ниже.
В одном из вариантов осуществления настоящего изобретения способ включает введение одной из следующих комбинаций: 1) тетомиласт и альбутерол; 2) тетомиласт и сальметерола ксинафоат; 3) тетомиласт, альбутерол и флутиказона пропионат; и 4) тетомиласт, сальметерола ксинафоат и флутиказона пропионат.
В настоящем описании имеется в виду, что комбинация действующих соединений может быть «более эффективной», если эта комбинация усиливает физиологическую и фармакологическую реакцию по сравнению с действующими соединениями, вводимыми по отдельности. В качестве альтернативы, комбинация действующих соединений может быть «более эффективной», если комбинация вызывает тот же уровень физиологической и фармакологической реакции, что и введенные по отдельности действующие соединения, но дозировка каждого из действующих соединений в комбинации ниже, чем дозировка, необходимая для достижения того же уровня реакции, если действующие соединения вводят по отдельности. Наконец, комбинация действующих соединений может быть более эффективной, если эта комбинация вызывает дополнительные физиологические и фармакологические реакции, по сравнению с действующими соединениями, введенными по отдельности.
Действующие соединения по настоящему изобретению могут вводиться любым подходящим путем в зависимости от природы заболевания, расстройства или состояния, подвергаемого лечению. Например, соединения могут вводиться перорально в виде сиропов, таблеток, капсул или ромбических таблеток и т.д., в составе препаратов с регулируемым, либо с немедленным высвобождением. В качестве альтернативы, соединения по настоящему изобретению могут вводиться с помощью ингаляции в виде сухого порошка, раствора, дисперсии и т.д. Соединения можно также вводить местно, в виде кремов, мазей, лосьонов, назальных спреев, аэрозолей и т.д. Наконец, в качестве альтернативы, соединения по настоящему изобретению можно применять для парентеральных, интрадермальных, подкожных, внутримышечных или внутривенных инъекций.
Описываемые фармацевтические составы могут быть получены любым из способов, известных в фармацевтической технике. В основном составы могут быть получены путем тщательного и однородного смешивания действующего соединения (соединений) с жидкими носителями и тонкоизмельченными твердыми носителями, либо носителями обоих типов и затем, при необходимости, придания продукту желаемой формы.
Составы по настоящему изобретению, пригодные для перорального введения, можно получать в форме дискретных единиц, таких как капсулы, крахмальные капсулы или таблетки, содержащие заранее определенное количество действующего соединения (соединений). Составы могут иметь форму порошков или гранул; раствора или суспензии в воде или неводной жидкой среде; или в жидкой эмульсии масло-в-воде или жидкой эмульсии вода-в-масле. Действующее соединение (соединения) может также входить в состав болюсов, электуария или пасты.
Пероральные композиции, как правило, включают инертный разбавитель или съедобный носитель. Действующее соединение (соединения) может быть смешано с наполнителями. Пероральные композиции также можно получать с использованием жидких носителей, для применения в качестве полосканий для рта, где действующее соединение в жидком носителе попадает в полость рта, используется для полоскания рта и выплевывается, либо проглатывается. В качестве составной части композиции могут быть включены фармацевтически совместимые связующие средства и/или вспомогательные вещества. В число связующих средств могут входить, например, микрокристаллическая целлюлоза, смола трагаканта или желатин. Носители могут включать, например, крахмал или лактозу. Также могут быть добавлены дезинтегрирующие средства, такие как альгиновая кислота или кукурузный крахмал. Кроме этого могут быть добавлены смазывающие средства, такие как стеарат магния или средства для скольжения, такие как коллоидный диоксид кремния. Наконец, в пероральные композиции можно добавлять вкусоароматические средства, такие как перечная мята, метилсалицилат или апельсин.
Если пероральная композиция имеет форму сиропа, состав, как правило, будет состоять из суспензии или раствора соединения, или его соли в жидком носителе. Примерами жидких носителей являются: этанол, арахисовое масло, оливковое масло, глицерин или вода.
Если композиция имеет форму таблеток, можно применять любой носитель, используемый в повседневной практике для получения твердого состава, в том числе: стеарат магния, каолин, тальк, желатин, гуммиарабик, стеариновую кислоту, крахмал, лактозу и сахарозу. Таблетки можно получать прессованием или формованием, необязательно с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки можно получать прессованием с помощью подходящего устройства действующего соединения в сыпучей форме, например, порошка или гранул, необязательно смешанных со связующим веществом, смазывающим веществом, инертным разбавителем, ПАВ или диспергирующим средством. Формованные таблетки можно получить путем формования в подходящем агрегате смеси порошкообразных соединений, увлажненных инертным жидким разбавителем. На эти таблетки необязательно можно нанести насечки или покрытие, и состав таблеток может быть таким, чтобы обеспечить медленное или регулируемое выделение ими действующего соединения.
Если композиция имеет форму капсулы, подходит любая методика инкапсулирования, например, применение капсул с твердой или мягкой желатиновой оболочкой.
В составах с регулируемым выделением могут применяться биоразрушаемые и/или биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота.
Типовые композиции для введения с помощью ингаляции имеют форму раствора суспензии или эмульсии, которые могут вводиться в виде сухого порошка или в форме аэрозоля с применением обычных пропеллентов, таких как фторированные углеводороды (например, трихлорфторметан). Композиции в форме сухого порошка могут содержать подходящую основу порошка (носитель), например, лактозу или крахмал, и могут быть заключены в различные виды упаковки (например, капсулы и картриджи или блистеры) для применения в ингаляторах или инсуффляторах.
Форма упаковки состава может быть предназначена для доставки одной дозы или большого числа доз. В случае доставки большого числа доз, состав может быть разделен на дозы предварительно, или же его необходимо делить на дозы при применении. Ингаляторы для сухих порошков подразделяются на три группы: 1) для введения одной дозы, 2) устройства для введения большого числа одиночных доз и 3) мультидозировочные устройства.
В случае ингаляторов, предназначенных для введения одной дозы, разовые дозы могут быть развешены производителем в небольшие контейнеры, которые, как правило, являются твердыми желатиновыми капсулами. Капсулу берут из отдельной коробки или контейнера и помещают в приемник ингалятора. Затем капсулу открывают или перфорируют с помощью иглы или режущего лезвия, чтобы дать возможность части вдыхаемого воздушного потока проходить через капсулу, захватывая порошок, либо чтобы дать возможность порошку высыпаться из капсулы через отверстия во время ингаляции. После завершения ингаляции пустую капсулу удаляют из ингалятора.
Некоторые капсульные ингаляторы снабжены загрузочным магазином, из которого индивидуальные капсулы могут переноситься в приемную камеру, в которой происходит перфорирование и отбор порошка из капсулы. Другие капсульные ингаляторы снабжены магазинами револьверного типа с капсульными камерами, которые можно помещать на одну линию с воздушной трубкой для подачи дозы порошка.
Блистерные ингаляторы обеспечивают лучшую защиту лекарственного средства от влаги по сравнению с капсульными ингаляторами. Доступ к порошку достигается путем перфорирования крышки, а также блистерной фольги, или отделением покрывающей фольги.
Мультидозировочные ингаляторы обычно не содержат заранее отмеренных количеств порошкообразного состава. Как правило, они состоят из контейнера и дозирующего элемента, который приводится в действие пациентом. Контейнер содержит большое число доз, которые выделяются из емкости индивидуально за счет объемного расширения. Применяются различные дозирующие элементы, в том числе поворотные мембраны или диски, поворотные цилиндры и поворотные усеченные конусы, причем все они имеют полости, которые должны заполняться порошком из контейнера. Другие типы мультидозирующих приспособлений снабжены мерными скользящими устройствами или мерными плунжерами с локальными или круговыми углублениями, для подачи определенного объема порошка из контейнера в камеру доставки или воздушную трубку.
Помимо введения с помощью ингаляторов для сухих порошков, композиции по настоящему изобретению можно вводить в виде водных растворов или суспензий, или в виде аэрозолей, подаваемых из упаковок под давлением. Аэрозольные композиции, подходящие для ингаляции, могут быть суспензиями либо растворами, и они, как правило, содержат действующий ингредиент (ингредиенты) и подходящий пропеллент, например, фтороуглерод или водородсодержащий хлорфтороуглерод или их смесь. Аэрозольные композиции могут не содержать наполнителей или могут необязательно содержать дополнительные наполнители (например, олеиновую кислоту или лецитин) и вспомогательные растворители (например, этанол). Аэрозольные составы, как правило, должны содержаться в баллончиках, закрытых клапанами, которые встроены в пусковое устройство, снабженное также мундштуком.
Желательно, чтобы лекарственные препараты, предназначенные для введения ингаляцией, имели контролируемый размер частиц. Оптимальный размер частиц, предназначенных для ингаляции в систему бронхов, составляет обычно 1-10 мкм, предпочтительно 2-5 мкм. Частицы, имеющие размер более 20 мкм, как правило, слишком велики, чтобы при ингалировании достичь малых проходов дыхательных путей. Чтобы добиться необходимого размера частиц, размер частицы действующего соединения (соединений) уменьшают обычными средствами, например, микроионизацией. Желаемая фракция может быть выделена пневмосепарацией или просеиванием. Частицы предпочтительно должны быть кристаллическими.
Композиции аэрозолей, как правило, должны быть помещены в баллончики, снабженные клапаном, в частности, дозирующим клапаном. Баллончики необязательно могут быть покрыты полимерным материалом (например, фторуглеродным полимером). Баллончики могут быть снабжены пусковыми устройствами, приспособленными для буккального введения препаратов.
Типовые композиции для назального введения включают упомянутые выше композиции для ингаляции и помимо этого включают неаэрозольные композиции в форме раствора или суспензии в инертном носителе, например, в воде, необязательно в комбинации с обычными наполнителями, такими как буферы, противомикробные средства, мукоадгезивные средства, средства, модифицирующие тоничность, и средства, модифицирующие вязкость, причем эти композиции можно вводить с помощью назального насоса.
Типовые дермальные и трансдермальные составы включают обычные водные и неводные носители. Например, носитель может иметь форму крема, мази, лосьона или пасты, или же он может быть в форме лечебного пластыря, повязки или мембраны.
Типовые композиции для парентерального, интрадермального или подкожного применения могут включать стерильный разбавитель, например, воду, физиологический раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители. Композиции такого типа могут включать также антибактериальные средства, например, бензиловый спирт или метилпарабены, антиоксиданты, например, аскорбиновую кислоту или бисульфит натрия, хелатирующие средства, например, этилендиаминтетрауксусную кислоту, и буферные средства, например, ацетаты, цитраты или фосфаты. Композиции могут включать также средства для регулирования тоничности, как, например, хлорид натрия или декстроза, и средства для регулирования pH, включая кислоты, например, хлористоводородную кислоту, и основания, например, гидроксид натрия. Композиция может быть помещена в ампулы, одноразовые шприцы или пузырьки, рассчитанные на большое число доз и изготовленные из стекла или пластмассы.
Фармацевтические композиции, применимые для инъекций, включают стерильные водные растворы или дисперсии и стерильные порошки, предназначенные для получения стерильных растворов или дисперсий для инъекции непосредственно перед применением. Подходящие для внутривенного введения носители включают физиологический солевой раствор, бактериостатическую воду или фосфатный буферный солевой раствор. Во всех случаях композиция должна быть стерильной и должна обладать достаточной текучестью, чтобы имелась возможность легко ввести ее с помощью шприца. Она должна быть стабильна в условиях производства и хранения и должна быть защищена от загрязнения микроорганизмами, такими как бактерии и грибки. Носитель может представлять собой растворитель или дисперсионную среду, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.д.), или их подходящую смесь. В случае дисперсий необходимая текучесть может поддерживаться, например, сохранением размеров частиц в необходимых пределах и применением покрытий, таких как лецитин, а также применением ПАВ. Предупреждение действия микроорганизмов может быть достигнуто с помощью различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и т.п. Во многих случаях композиция должна включать изотонические средства, например, сахара, многоатомные спирты, такие как маннит, сорбит или же хлорид натрия. Пролонгированная абсорбция композиций, предназначенных для инъекции, может быть достигнута включением в композицию средства, которое отсрочивает абсорбцию, например, моностеарата алюминия и желатина.
Стерильные растворы для инъекций могут быть получены введением действующего соединения (соединений) в требуемом количестве в подходящий растворитель, совместно с одним или несколькими из перечисленных выше ингредиентов, в случае необходимости их присутствия, с последующей стерилизацией фильтрованием. Дисперсии, как правило, получают введением действующего соединения (соединений) в стерильный носитель, который содержит основу дисперсионной среды и другие необходимые ингредиенты из числа перечисленных выше. Высушивание в вакууме и лиофилизация, которые приводят к получению порошка действующего ингредиента в комбинации с любыми другими желаемыми ингредиентами, из раствора, предварительно подвергнутого стерилизации фильтрованием, может применяться с целью получения стерильных порошков для приготовления стерильных растворов для инъекций.
Композиции по настоящему изобретению могут быть получены в виде дозированных лекарственных форм, например, таблеток, капсул или дозируемых аэрозолей, так, чтобы пациенту могла вводиться одна доза препарата.
Количество каждого из действующих соединений, которое необходимо для достижения желаемого терапевтического эффекта, будет, очевидно, меняться, в зависимости от конкретного соединения, пути введения, подвергаемого лечению субъекта и конкретного заболевания, расстройства или состояния, лечение которого осуществляется. В случае комбинированной терапии, благодаря тому, что индивидуальное действие активных соединений может взаимно положительно влиять и усиливать друг друга, при комбинированном введении может появиться возможность уменьшения соответствующих доз действующих соединений по сравнению с традиционной дозировкой, применяемой для индивидуальных соединений, вводимых по отдельности. Поэтому для выявления дополнительных терапевтически эффективных дозировок может быть проведено стандартное экспериментальное тестирование.
Как правило, каждая единица дозированной лекарственной формы, предназначенной для перорального введения, может содержать от примерно 0,3 мг до примерно 100 мг действующего соединения по настоящему изобретению. Каждая единица дозированной лекарственной формы для парентерального введения может содержать от примерно 0,1 мг до примерно 100 мг действующего соединения. Каждая единица дозировки для интраназального введения может содержать от примерно 1 мкг до примерно 400 мкг действующего соединения на одно приведение дозатора в действие. Доза сухого порошка для ингаляции может содержать от примерно 1 мкг до примерно 1000 мкг действующего соединения на единицу дозировки. Подходящим содержанием для составов местного применения является от примерно 0,001% до примерно 5% действующего соединения по настоящему изобретению.
В одном из вариантов осуществления настоящего изобретения тетомиласт можно вводить пациенту в количестве от примерно 25 мг до примерно 100 мг на одну дозу. В другом варианте осуществления тетомиласт можно вводить в количестве от примерно 25 мг до примерно 75 мг на одну дозу. В еще одном варианте осуществления тетомиласт можно вводить в количестве примерно 50 мг на одну дозу. В другом варианте осуществления тетомиласт можно вводить перорально.
Агонист бета2-адренергических рецепторов может вводиться в количестве от примерно 25 мкг до примерно 800 мкг на одну дозу. В одном из вариантов осуществления настоящего изобретения агонист бета2-адренергических рецепторов может вводиться в количестве от примерно 90 мкг до примерно 720 мкг на одну дозу. В другом варианте осуществления агонист бета2-адренергических рецепторов может вводиться в количестве примерно 720 мкг в течение примерно 90 минут. В еще одном варианте осуществления агонист бета2-адренергических рецепторов может вводиться в количестве от примерно 90 мкг на одну дозу. Агонист бета2-адренергических рецепторов может вводиться с помощью ингаляции. В конкретном варианте осуществления агонист бета2-адренергических рецепторов представляет собой альбутерол. В другом варианте осуществления агонист бета2-адренергических рецепторов представляет собой сальметерола ксинафоат. Сальметерола ксинафоат можно вводить в количестве от примерно 50 мкг до примерно 200 мкг на одну дозу. В еще одном варианте осуществления сальметерола ксинафоат можно вводить в количестве примерно 50 мкг на одну дозу.
Противовоспалительный стероид можно вводить в количестве от примерно 25 мкг до 2000 мкг на одну дозу. В одном из вариантов осуществления настоящего изобретения противовоспалительный стероид можно вводить в количестве от примерно 50 мкг до примерно 1000 мкг на одну дозу. В другом варианте осуществления противовоспалительный стероид можно вводить в количестве примерно 250 мкг на одну дозу. Противовоспалительный стероид можно вводить ингаляцией. В конкретном варианте осуществления противовоспалительный стероид может представлять собой флутиказона пропионат.
Действующее соединение может вводиться от одного до шести раз в день. В одном из вариантов осуществления настоящего изобретения действующие соединения вводят один или два раза в день.
Действующие соединения можно вводить совместно в виде индивидуальных, бинарных и тройных (или более) лекарственных форм, или их можно вводить в виде отдельных составов. Действующие соединения можно вводить одновременно, или же их можно вводить через небольшой или значительный промежуток времени, например, когда одно или два соединения вводят утром, и другое соединение (соединения) вводят вечером. Так, например, агонист бета2-адренергических рецепторов и противовоспалительный стероид по настоящему изобретению могут быть совместно включены в бинарную дозированную форму, и тетомиласт может быть включен в индивидуальную лекарственную форму, и две эти лекарственные формы могут вводиться одновременно, раздельно или последовательно. Данная комбинация может применяться в профилактических целях или же после появления симптомов заболевания. В некоторых случаях эта комбинация может применяться для предотвращения прогрессирования респираторного заболевания, расстройства или состояния или для задержки ослабления дыхательной функции.
В одном из вариантов осуществления настоящего изобретения все действующие соединения могут вводиться в одно и то же время или в очень близкие моменты времени.
Действующие соединения по настоящему изобретению могут вводиться в форме пероральных композиций или путем ингаляции с помощью ингаляторов, в частности, ингаляторов для сухих порошков. Например, тетомиласт можно вводить перорально, а агонист бета2-адренергических рецепторов и противовоспалительный стероид можно вводить путем ингаляции. Однако возможны и любые другие формы или применения.
ПРИМЕРЫ
Следующее далее по тексту описание примеров служит целям иллюстрации настоящего изобретения и не предназначено для создания каких-либо ограничений, явно выраженных или подразумеваемых, объема настоящего изобретения. Приложенная к тексту заявки формула изобретения служит цели повторного изложения настоящего изобретения, явного ограничения его подразумеваемого объема и указания на его отличительные особенности.
Методики
В описанных ниже исследованиях применяли следующие методики.
Отбор и анализ крови
Кровь отбирали для определения концентраций тетомиласта, альбутерола и флутиказона пропионата. Отбор крови для определения исходных уровней проводили перед введением препаратов. Образцы крови для фармакокинетических исследований (PK) отбирали до введения дозы и после введения дозы. У каждого субъекта в общей сложности отбирали приблизительно 70 мл крови для PK анализа.
Для определения концентраций тетомиласта и флутиказона пропионата образцы крови объемом 5 мл отбирали в пробирки Vacutainer® (содержащие гепариновый антикоагулянт) с зелеными крышками (тетомиласт) или лиловыми крышками (флутиказона пропионат). Каждую пробирку осторожно переворачивали 3-4 раза и помещали на ледяную баню не более чем на 15 минут. Каждую пробирку вращали в охлаждаемой центрифуге (4°C) в течение минимум 10 минут при скорости 2000-3000 оборотов в минуту (об/мин). Отделенную таким образом плазму разливали поровну в две полипропиленовые пробирки и хранили при температуре -20°C или ниже. Одну из пробирок использовали для анализа, а другую пробирку хранили при температуре -20°C или ниже до завершения исследования.
Для определения концентрации альбутерола отбирали образцы крови 5 мл в пробирки Vacutainer® с красной крышкой. Содержимому каждой пробирки давали свернуться при комнатной температуре в течение 30 минут. Каждую пробирку вращали в охлаждаемой центрифуге (4°C) в течение минимум 10 минут при скорости 2000-3000 об/мин. Отделенную сыворотку поровну разливали в две полипропиленовые пробирки и хранили при температуре -20°C или ниже. Одну из пробирок использовали для анализа, а другую пробирку хранили при температуре -20°C или ниже до завершения исследования.
Фармакодинамические исследования
Регистрировали электрокардиограмму (ЭКГ) в двенадцати отведениях у субъекта, находившегося в покое лежа на спине в течение ≥3 минут. Помимо регистрации ЭКГ при отборе и перед началом введения препаратов (день 0), ЭКГ также регистрировали в определенные моменты времени во время периода введения препаратов. Все 12-канальные ЭКГ мониторы, применявшиеся в этом исследовании, были калиброваны и нормированы. Документально фиксировались желудочковый ритм, интервал PR (время, прошедшее между началом волны P и началом интервала QRS на электрокардиограмме, соответствующее электрической активности в предсердии), интервал QRS (движение электрических импульсов через желудочки), интервал QT/QTc (интервал QT соответствует времени от начала волны Q до конца волны T в сердечном электрическом цикле; QTc является скорректированным интервалом QT, определяемым формулой Фредерика [QTcF] и формулой Базетта [QTcB]), а также общая интерпретация ЭКГ (нормальная или аномальная). Измерения регистрировались перед отбором любых образов крови, когда их можно было осуществить. Делалось как минимум три оригинальные копии каждой ЭКГ (по одной для учреждения, в котором проходило исследование, для спонсора и для провайдера ЭКГ). На каждой оригинальной ЭКГ исследователь ставил подпись и дату. ЭКГ повторно перечитывались eResearch Technologies, Inc. (Philadelphia, PA).
Отбирали образцы крови для определения уровней калия в сыворотке во время отбора участников исследования, перед началом введения препаратов (день 0) и в определенные моменты времени в период введения препаратов.
Основные показатели состояния организма (частота сердцебиений и систолическое кровяное давление) измеряли после того, как субъект находился в сидячем положении ≥3 минут. Помимо отбора участников исследования и исходного момента времени (день 0), основные показатели состояния организма регистрировали в определенные моменты времени в период введения препаратов. Измерения фиксировали перед отбором любых образцов крови, когда их можно было осуществить.
Тесты функции легких
Тесты функции легких проводили на протяжении всего исследования для наблюдения за состоянием дыхательной системы субъекта. Кривые объема воздушного потока строили на основе данных спирометрии. Препарат Combivent® (Boehringer Ingleheim Pharmaceuticals, Inc., Ridgefield CT), который на протяжении всего исследования применялся при необходимости для кратковременной нормализации дыхания, не применяли в течение 6 часов перед любым спирометрическим исследованием. Спирометрическое тестирование проводили во время отбора участников эксперимента, до начала введения препаратов (день 0) и в определенные моменты в период введения препаратов. Каждый субъект мог иметь до 5 регистраций результатов спирометрии в любой момент исследования. Регистрацию результатов спирометрии проводили с применением оборудования основного провайдера, а именно Quantum Research, Inc. (Louisville, CO). Все данные спирометрии регистрировали и направляли Quantum Research, Inc. для анализа.
При регистрации данных спирометрии наилучшую попытку для внесения в отчет выбирали следующим образом. Наибольшее значение объема форсированного выдоха за одну секунду (FEV1) выбирали в качестве «лучшего» данной тестовой сессии. Если два или более значения FEV1 одновременно являлись самыми высокими, для этих попыток использовали сумму FEV1 и форсированной жизненной емкости (FVC). Если обе величины оказывались равными для двух попыток, в отчет вносили величины для той попытки, которая являлась первой в хронологическом порядке, исходя из даты и времени попытки.
Пример 1: Совместное введение тетомиласта и альбутерола пациентам с хронической обструктивной болезнью легких (COPD).
В данном примере исследовался эффект введения комбинации тетомиласта и альбутерола. Описываемое исследование являлось многоцентровым, рандомизованным, перекрестным, амбулаторным, проводимым в условиях двойной анонимности, с контролем по плацебо для большого числа дозировок в группе из 27 пациентов с COPD. Все субъекты перед началом эксперимента проходили 28-дневный период очистки от ингалированных кортикостероидов и/или бронхорасширяющих средств длительного действия и/или непрерывной кислородной терапии (≥16 часов в день), и 7-дневный период очистки от пероральных бета2-агонистов и/или пероральных препаратов солей теофиллина. Рандомизованным субъектам осуществляли 8-дневное пероральное введение плацебо или тетомиласта в дозировке 50 мг (2 таблетки по 25 мг) один раз в день (QD). На восьмой день исследования с помощью ингаляции вводили четыре последовательных дозы альбутерола (за один цикл действия ингалятора вводилось 90 мкг альбутерола в форме основания) с применением дозирующего ингалятора (MDI) и приемной камеры (Ventolin®, GlaxoSmithKline, Research Triangle Park, NC), по одной дозе через каждые 30 минут на протяжении 90 минут в виде доз 90 мкг + 90 мкг + 180 мкг + 360 мкг для получения суммарной дозы 720 мкг (альбутерола в форме основания) или 8 циклов работы ингалятора.
После этого субъекты проходили 7-дневный период выведения препаратов (9-15 дни исследования), после чего их переводили в противоположную ветвь исследования (плацебо или тетомиласт пероральная доза 50 мг). На 23 день исследования повторяли введение нескольких доз альбутерола ингаляцией.
Субъектам давали инструкцию в дни 1-6 и 17-21 принимать участвующие в исследовании препараты (плацебо или тетомиласт 50 мг) QD с 8 унциями воды непосредственно перед завтраком. Субъекты, относящиеся к ветви плацебо, принимали две таблетки плацебо QD. В дни 7, 8, 16, 22 и 23 субъекты получали препараты для перорального приема (плацебо или тетомиласт 50 мг) в клинике в присутствии исследовательского персонала.
Для кратковременного восстановления дыхания во время исследования при наличии такой необходимости допускалось применение аэрозоля для ингаляции Combivent®, за исключением тех дней исследования, когда отбирались образцы для PK-анализа, дней, когда в условиях клиники с помощью ингаляции вводили несколько доз альбутерола, и/или дней, когда осуществляли спирометрическое тестирование. Во все дни исследования, когда происходил отбор образцов для PK, применение Combivent® прекращали за 6 часов до отбора образца. Кроме того, на 8 и 23 дни (когда в клинике с помощью ингаляции вводили несколько доз альбутерола) применение Combivent® прекращали за 6 часов до оценки фармакокинетики и на протяжении всего времени пребывания в клинике. Применение Combivent® прекращали за 6 часов до спирометрического тестирования. Рекомендованная доза аэрозоля для ингаляции Combivent® составляла по две ингаляции четыре раза в день. В данном исследовании субъектам при необходимости разрешалось проводить дополнительные ингаляции; однако общее число ингаляций не превышало 12 за 24 часа. Субъекты проводили трехкратные «пробные распыления» перед первым применением аэрозоля, если аэрозоль не использовали в течение более 24 часов.
Во время отбора участников исследования проводили пробу на обратимость действия альбутерола. Проба на обратимость действия альбутерола состояла из трех следующих стадий: (1) субъекты выполняли исходный спирометрический тест для измерения FEV1; (2) субъекты получали две дозы ингалированного альбутерола (два цикла действия ингалятора) на протяжении 3-5 минут; и (3) через 30 минут после получения второй дозы ингалированного альбутерола субъекты выполняли второй спирометрический тест для измерения FEV1.
В 8-й и 23-й дни исследования многократное введение альбутерола осуществляли в 0 часов (1 цикл действия ингалятора), 30 минут (1 цикл действия ингалятора), 1 час (2 цикла действия ингалятора) и 1,5 часа (4 цикла действия ингалятора). Тестирование функции легких и пульсовую оксиметрию проводили перед введением первой дозы, затем через 5 и 25 минут после введения каждой последующей дозы ингалированного альбутерола (т.е. 5, 25, 35, 55, 65, 85, 95 и 115 минут) и в моменты времени 175, 235, 295 и 355 минут. В дни 8 и 23 обратимость не оценивали, поскольку в указанные моменты времени получали данные для кривых объема воздушного потока.
Результаты тестов функции легких показали, что показатели состояния дыхательной системы пациента значительно выше в группе, принимавшей тетомиласт, по сравнению с группой, получавшей плацебо. Например, среднее изменение результатов измерения FEV1, полученных в дни 8/23 относительно устойчивого исходного уровня, находилось в пределах от 0,16 до 0,34 л в группе, получавшей тетомиласт, и от 0,13 до 0,29 л в группе, получавшей плацебо (таблица 1, фиг.3). Было показано, что это отличие является статистически значимым.
|
Аналогично среднее изменение измеренных величин FVC, полученных в дни 8/23 относительно исходного уровня, были существенно выше в группе, получавшей тетомиласт, по сравнению с группой, получавшей плацебо, во все моменты времени после первого введения альбутерола ингаляцией, за исключением момента через 5 минут после первого введения. Средние изменения FVC от устойчивого исходного уровня в дни 8/23 находились в пределах от 0,27 до 0,53 л в группе, получавшей тетомиласт, и от 0,15 до 0,43 л в группе, получавшей плацебо (таблица 2). Вновь было показано, что это отличие является статистически значимым.
|
Кроме того, хотя в исследовании не предполагалось определение различий в улучшении FEV1 или FVC, повторный анализ экспериментальных измерений показал, что, возможно, имеет место усиление действия введенного альбутерола при его сочетании с тетомиластом. Как следует из более высоких средних значений FEV1 и FVC во время введения альбутерола в 8/23 дни эксперимента, по-видимому, наблюдается более высокая эффективность и увеличенная продолжительность действия ингалированного альбутерола в комбинации с тетомиластом по сравнению с отдельно взятым альбутеролом (таблицы 3 и 4). Поскольку измерения для исследования функции легких продолжались только в течение 6 часов после введения альбутерола с помощью ингаляции, неизвестно, как долго мог бы продолжаться этот эффект. Эти расчеты дали основание предположить, что эффект от комбинированной терапии превышает аддитивный, и что действие ингалированного альбутерола усиливается при объединении с тетомиластом.
|
|
|
|
|
|
При параллельном пероральном приеме тетомиласта и плацебо наблюдалось отсутствие клинически значимых различий в случае введения с помощью ингаляции относительно высоких доз альбутерола по таким параметрам, как частота сердцебиений, систолическое кровяное давление, содержание калия в сыворотке или интервал QT. Кроме того, при параллельном пероральном приеме тетомиласта и плацебо наблюдалось отсутствие клинически значимых различий в случае введения с помощью ингаляции альбутерола в таких показателях, как нежелательные явления, химический состав сыворотки, состав крови или состав мочи. Эти результаты демонстрируют безопасность для пациента комбинированной терапии, включающей тетомиласт и альбутерол.
В совокупности результаты данного исследования показывают, что комбинация тетомиласта и альбутерола представляет собой безопасную и эффективную терапию для улучшения функции легких у пациентов с COPD. Кроме того, эти результаты дают возможность предположить, что при введении в качестве компонентов комбинированной терапии эти соединения являются более эффективными, чем в случае введения по отдельности. Таким образом, комбинация тетомиласта и альбутерола представляет собой перспективный способ лечения респираторных заболеваний, расстройств или состояний.
Пример 2: Совместное введение тетомиласта, сальметерола ксинафоата и флутиказона пропионата пациентам с COPD.
В этом примере исследовали эффект от введения комбинации тетомиласта, сальметерола ксинафоата и флутиказона пропионата.
Описываемое исследование являлось многоцентровым, рандомизованным, параллельным, амбулаторным, проводимым в условиях двойной анонимности исследованием фазы 1B препарата Advair Diskus® 250/50 (флутиказона пропионат и сальметерола ксинафоат, GlaxoSmithKline, Research Triangle Park, NC), вводимого пациентам с COPD параллельно с пероральным введением плацебо или 50 мг тетомиласта (2х25 мг таблетки). Все пациенты перед началом эксперимента проходили как минимум 28-дневный период очистки от ингалированных кортикостероидов непродолжительного действия, бронхорасширяющих средств длительного действия и/или непрерывной кислородной терапии (≥16 часов в день), а также минимум 7-дневный период очистки от бета2-агонистов и/или пероральных препаратов теофиллина. Пациентов случайным образом приписывали в одной из двух ветвей исследования (пероральное введение 50 мг тетомиласта или плацебо) перед началом введения препаратов в день 1, и распределяли по этим двум группам в соотношении 1:1 в соответствии с генерированным компьютером случайным кодом, предоставленным департаментом биостатистики Otsuka Maryland Research Institute (OMRI). Рандомизацию проводили с использованием центральной системы IVRS централизованно по всем исследовательским центрам.
Во время периода введения 1 в течение 7 дней субъектам давали пероральную дозу 50 мг тетомиласта или плацебо. Во время периода введения 2, т.е. в дни 8-35, к предыдущему режиму введения добавляли одновременное введение ингаляцией Advair Diskus® 250/50.
Субъектам давали инструкцию, во все дни исследования принимать участвующие в исследовании пероральные препараты (тетомиласт 50 мг или плацебо) QD с 8 унциями воды непосредственно перед завтраком. Субъекты, относящиеся к группе плацебо, принимали две таблетки плацебо QD. Субъекты, относящиеся к группе тетомиласта, принимали 2х25 мг таблетки тетомиласта QD. В дни 1-7, 14, 21, 28 и 35 субъекты принимали пероральные препараты (тетомиласт 50 мг или плацебо) в клинике в присутствии исследовательского персонала.
Препарат для ингаляции Advair Diskus® 250/50 на протяжении всех дней исследования 8-35 вводился субъектами самостоятельно, за исключением дней 14, 21, 28 и 35, когда это лекарственное средство вводили в клинике в присутствии исследовательского персонала. Advair Diskus® 250/50 вводился дважды в день (BID). Утреннее введение совпадало по времени с пероральным введением препаратов (тетомиласт 50 мг или плацебо). Вечернее введение осуществлялось на 12 часов позже. Время введения фиксировали в дневниках субъектов.
Во время исследования применяли предоставленный спонсором препарат Combivent® (Boehringer Ingleheim Pharmaceuticals, Inc., Ridgefield, CT) с целью кратковременного восстановления нормального дыхания. За 6 часов до любых PFT воздерживались от приема Combivent®. Combivent® поступал в дозирующих ингаляторах. При каждом приведении ингалятора в действие через клапан проходило 21 мкг ипратропия бромида и 120 мкг альбутерола сульфата и через мундштук в организм поступало 18 мкг ипратропия бромида и 103 мкг альбутерола сульфата. Дозировка Combivent® составляла четыре раза в день по две ингаляции. В данном исследовании субъектам разрешалось при необходимости проводить дополнительные ингаляции; однако общее количество ингаляций не превышало 12 в течение 24 часов. Если аэрозоль не использовали более 24 часов, при его первом применении после перерыва рекомендовалось три раза произвести «пробное распыление» содержимого ингалятора.
Результаты тестирования функции легких выявили, что параметры состояния дыхательной системы пациентов были значительно выше в группе, получавшей тетомиласт, по сравнению с группой плацебо. Например, при использовании в качестве исходного уровня параметров дня 1, уровни FEV1 в группе, получавшей тетомиласт, оказались значительно лучшими со статистической точки зрения по сравнению с плацебо группой. Минимальные значения FEV1 в группе, получавшей тетомиласт, оказались значительно лучшими со статистической точки зрения по сравнению с плацебо группой во все моменты времени до дня 7 (до начала совместного введения Advair Diskus® 250/50), за исключением дня 3, и во все моменты времени от дня 14 до дня 35 (после совместного введения Advair Diskus® 250/50) (фиг.1). Для максимальных и средних значений FEV1 улучшения в группе, получавшей тетомиласт, были статистически значимыми по сравнению с группой плацебо в дни 7, 21 и 28 и приближались к статистической значимости в день 14 и день 35 (фиг.2).
Кроме того, хотя в исследовании не предполагалось определение различий в улучшении FEV1, повторный анализ экспериментальных измерений показал, что, возможно, имеет место усиление действия ингалированной смеси флутиказона пропионата и сальметерола (Advair Diskus® 250/50) при ее сочетании с тетомиластом. Как следует из более высоких средних значений FEV1, во время совместного введения Adviar Diskus® 250/50 в 8-35 дни эксперимента, по-видимому, наблюдается более высокая эффективность и увеличенная продолжительность действия ингалированного Advair Diskus® 250/50 в комбинации с тетомиластом по сравнению с отдельно взятым Advair Diskus® 250/50 (таблицы 5 и 6). Эти расчеты дали очевидные основания для предположения, что эффект от комбинированной терапии превышает аддитивный, и что действие ингалированного сальметерола ксинафоата и флутиказона пропионата усиливается при объединении с тетомиластом. Кроме того, это исследование подтверждает и расширяет результаты примера 1, в котором было исследовано действие тетомиласта и нарастающих доз альбутерола.
|
|
|
При параллельном пероральном приеме тетомиласта и плацебо наблюдалось отсутствие клинически значимых различий в случае их введения в комбинации с Advair Diskus® 250/50 по таким параметрам, как частота сердцебиений, систолическое кровяное давление, содержание калия в сыворотке или интервал QT. Кроме того, при параллельном пероральном приеме тетомиласта и плацебо наблюдалось отсутствие клинически значимых различий в случае их введения в комбинации с ингаляционным введением Advair Diskus® 250/50 в таких показателях, как нежелательные явления, химический состав сыворотки, состав крови или состав мочи. Эти результаты демонстрируют безопасность для пациента комбинированной терапии, включающей тетомиласт, сальметерола ксинафоат и флутиказона пропионат.
В совокупности результаты данного исследования показывают, что комбинация тетомиласта, сальметерола ксинафоата и флутиказона пропионата представляет собой безопасную и эффективную терапию для улучшения реакции расширения бронхов у пациентов с COPD. Кроме того, эти результаты дают возможность предположить, что при введении в качестве компонентов комбинированной терапии эти соединения являются более эффективными, чем в случае введения по отдельности. Таким образом, комбинация тетомиласта, сальметерола и флутиказона представляет собой перспективный способ лечения респираторных заболеваний, расстройств или состояний.
Другие варианты осуществления настоящего изобретения должны быть ясны специалисту в данной области техники из рассмотрения описания и практического воплощения изобретения, раскрытого в настоящей заявке. Имеется в виду, что описание и примеры должны рассматриваться только как иллюстративные, причем истинные суть и объем настоящего изобретения показаны в следующей далее формуле изобретения.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Настоящее изобретение может найти применение для лечения или профилактики респираторных заболеваний, расстройств или состояний, как, например, хронической обструктивной болезни легких (COPD).