Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ГЛЮКАГОН-ПОДОБНЫЙ ПЕПТИД 1 (GLP-1)
Вид РИД
Изобретение
Перекрестная ссылка на родственные заявки
Настоящая заявка является частичным продолжением заявки на патент США № 10/632878, поданной 22 июля 2003; и в настоящей заявке, согласно статье 35, § 119 (е) Кодекса законов США, испрашивается преимущество предварительной заявки на патент США №. 60/744882, поданной 14 апреля 2006. Каждая из вышеупомянутых приоритетных заявок во всей своей полноте вводится в настоящее описание посредством ссылки.
Область, к которой относится изобретение
Настоящее изобретение относится к области разработки фармацевтических композиций. В настоящем изобретении описаны сухие порошкообразные препараты, содержащие частицы дикетопиперазина (DKP) в комбинации с глюкагон-подобным пептидом 1 (GLP-1). Настоящее изобретение относится к применению фармацевтического препарата для лечения заболеваний, таких как, но не ограничивающихся ими, диабет, рак и ожирение. Более конкретно, настоящее изобретение относится к применению фармацевтического препарата для внутрилегочной доставки.
Предшествующий уровень техники
Глюкагон-подобный пептид 1 (GLP-1), описанный в литературе, представляет собой инкретин длиной в 30 или 31 аминокислоту, высвобождаемый эндокринными L-клетками тонкого кишечника в ответ на поступление жира, углеводов и белка с пищей. Было обнаружено, что уровень секреции такого пептидного гормона снижается у индивидуума с сахарным диабетом типа 2, а поэтому указанный гормон является потенциальным кандидатом на средство для лечения этих и других родственных заболеваний.
В нормальном состоянии GLP-1 секретируется L-клетками тонкого кишечника в ответ на поступающие с пищей питательные вещества (в частности, сахар), которые стимулируют индуцируемое пищей высвобождение инсулина из поджелудочной железы, ингибируют высвобождения глюкагона из печени, а также оказывают другое воздействие на желудочно-кишечный тракт и головной мозг. Действие GLP-1 в поджелудочной железе зависит от глюкозы и минимизирует риск развития гипогликемии во время экзогенного введения пептида. GLP-1 также стимулирует все стадии биосинтеза инсулина и непосредственно стимулирует рост и выживаемость β-клеток, а также дифференцировку β-клеток. Комбинация этих эффектов приводит к увеличению массы β-клеток. Кроме того, рецептор GLP-1 передает сигнал, приводящий к снижению апоптоза β-клеток, что способствует увеличению массы β-клеток.
В желудочно-кишечном тракте GLP-1 ингибирует перистальтику желудочно-кишечного тракта, повышает секрецию инсулина в ответ на действие глюкозы и снижает секрецию глюкагона, что способствует замедлению метаболизма глюкозы. Было показано, что введение GLP-1 в центральную нервную систему подавляет потребление пищи грызунами, что позволяет предположить, что периферическое высвобождение GLP-1 может непосредственно влиять на функцию головного мозга. Это предположение является вполне обоснованным, так как было показано, что циркулирующий GLP-1 может быть доступным для GLP-1-рецепторов в некоторых областях головного мозга, а именно в субфорникальном органе и в области самого заднего поля (posttrema). Известно, что эти области головного мозга участвуют в регуляции аппетита и энергетического гомеостаза. Интересно отметить, что растяжение желудка активирует GLP-1-содержащие нейроны в хвостатом ядре одиночного пути и, вероятно, играют определенную роль в экспрессии GLP-1 в центральной нервной системе как вещества, подавляющего аппетит. Эти гипотезы были подтверждены исследованиями, проводимыми с использованием антагониста рецептора GLP-1, экзендина (9-39), где наблюдался противоположеный эффект. У человека введение GLP-1 приводило к эффекту насыщения (Verdich et al., 2001), а при непрерывном подкожном вливании в течение 6 недель у пациентов с диабетом наблюдалось снижение аппетита, что приводило к значительному снижению массы тела (Zander et al., 2002).
Было также показано, что GLP-1 является эффективным у пациентов с диабетом типа 2, а именно, при непрерывном внутривенном вливании он вызывает увеличение секреции инсулина и нормализует уровни глюкозы в крови натощак и после приема пищи (Nauck et al., 1993). Кроме того, было показано, что вливание GLP-1 приводит к снижению уровней глюкозы у пациентов, которые ранее подвергались лечению не-инсулиновыми пероральными лекарственными средствами, и у пациентов, которым требовалось лечение инсулином после неудачной терапии с использованием сульфонилмочевины (Nauck et al, 1993). Однако, как было описано в литературе и как обсуждается ниже, действие одной подкожной инъекции GLP-1 дало разочаровывающие результаты. Хотя были достигнуты высокие уровни иммунореактивного GLP-1 в плазме, однако секреция инсулина быстро возвращалась на уровни, наблюдаемые до проведения лечения, а концентрации глюкозы в крови не нормализовались (Nauck et al., 1996). Только после повторного подкожного введения влияние на уровни глюкозы в крови натощак было сравнимо с эффектом, наблюдаемым при внутривенном введении (Nauck et al., 1996). Было показано, что непрерывное подкожное введение в течение 6 недель приводило к снижению концентраций глюкозы в крови натощак и после приема пищи, и к снижению уровней HbA1c (Zander et al., 2002). Кратковременная эффективность одноразовых подкожных инъекций GLP-1 была ассоциирована с его нестабильностью в кровотоке. Было показано, что GLP-1 подвергается метаболизму в плазме in vitro, и что за такое разложение ответственен фермент дипептидил-петидаза-IV (DPP-IV (Mentlein et al., 1993).
Поскольку было продемонстрировано, что GLP-1 играет важную физиологическую роль при диабете, и что экзогенный GLP-1 быстро разлагается по амино-концу у здоровых индивидуумов и у индивидуумов с диабетом типа 2, то многие исследования были посвящены возможности повышения in vivo стабильности GLP-1, что можно рассматривать как новый подход к разработке противодиабетического средства для лечения диабета (Deacon et al., 2004). Было предложено два отдельных подхода: 1) получение аналогов, которые являются нечувствительными к ферментативному расщеплению и 2) применение селективных ингибиторов ферментов для предотвращения деградации GLP-1 in vivo и увеличение уровней интактных биологически активных пептидов. Были проведены клинические испытания аналогов GLP-1 длительного действия (например, лираглутида (Novo Nordisk, Copenhagen, Denmark)); экзенатида (экзендина-4; Byetta®) (Amylin Inc., San Diego, CA) и экзенатида-LAR (Eli Lilly, Indianapolis, IN)), которые являются резистентными к расщеплению и получили название «миметики инкретина». Ингибиторы дипептидил-пептидазы IV (например, вилдаглиптин (Galvus), разработанный Novartis, Basel, Switzerland), и ситаглиптин (Januvia), разработанный Merck, Whitehouse Station, New Jersey)), которые ингибируют фермент, ответственный за разложение инсулина, также находятся на стадии исследований (Deacon et al., 2004). Так, например, очевидно, что широкий спектр действия GLP-1 (например, повышение уровня высвобождения инсулина, замедление скорости опустошения желудка и повышение насыщаемости), наряду с его низкой предрасположенностью к развитию гипогликемии, делает этот препарат более предпочтительным для применения по сравнению с имеющимися в настоящее время терапевтическими средствами.
Однако, несмотря на имеющиеся в настоящее время методы/преимущества GLP-1-терапии, ни одно из лекарственных средств, применяемых в настоящее время для лечения диабета, не дают нужного терапевтического эффекта (снижения уровней HbA1c, снижения уровней глюкозы в крови натощак и улучшения метаболизма глюкозы), и у всех пациентов наблюдаются побочные эффекты, такие как токсикоз, гипогликемия, увеличение массы, тошнота и стресс от рвоты. Следовательно, необходимость в разработке стабильных препаратов GLP-1, обладающих длительной эффективностью и оптимальной абсорбцией при их введении в качестве фармацевтических препаратов, остается актуальной.
Описание сущности изобретения
В настоящее время не существует каких-либо стабильных и вводимых путем ингаляции препаратов, содержащих глюкагон-подобный пептид 1 (GLP-1) и применяемых в качестве фармацевтических средств. Для решения этой проблемы было разработано настоящее изобретение, которое относится к препаратам, содержащим GLP-1 в комбинации с частицами дикетопиперазина (DKP) и используемым в качестве фармацевтического средства.
Поэтому в своих конкретных вариантах изобретения настоящее изобретение относится к сухой порошкообразной композиции, содержащей молекулу GLP-1 и дикетопиперазин или их фармацевтически приемлемую соль. В других вариантах изобретения сухая порошкообразная композиция согласно изобретению содержит молекулу GLP-1, выбранную из группы, состоящей из нативного GLP-1, метаболита GLP-1, аналога GLP-1, производного GLP-1, GLP-1, защищенного от действия дипептидил-пептидазы IV (DPP-IV), GLP-1-миметика, экзендина, аналога пептида GLP-1 или биосинтетического аналога GLP-1. В еще одном варианте настоящего изобретения сухая порошкообразная композиция содержит дикетопиперазин, имеющий формулу 2,5-дикето-3,6-ди(4-X-аминобутил)пиперазин, где X выбран из группы, состоящей из сукцинила, глутарила, малеила и фумарила. В другом варианте изобретения сухая порошкообразная композиция содержит соль дикетопиперазина. В еще одном своем варианте настоящее изобретение относится к сухой порошкообразной композиции, где указанным дикетопиперазином является 2,5-дикето-3,6-ди(4-фумарил-аминобутил)пиперазин.
Кроме того, в настоящем изобретении рассматривается сухая порошкообразная композиция, где указанной молекулой GLP-1 является нативная или амидированная молекула GLP-1, где указанной амидированной молекулой GLP-1 является амид GLP-1 (7-36).
В еще одном своем конкретном варианте настоящее изобретение относится к способу получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, где указанный способ включает стадии получения раствора GLP-1, содержащего молекулу GLP-1; получения раствора дикетопиперазина, образующего частицы, или суспензии частиц дикетопиперазина; и объединения раствора GLP-1 с раствором или суспензией дикетопиперазина. В других конкретных вариантах изобретения способ получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, также включает удаление растворителя из раствора или суспензии путем лиофилизации, фильтрации или сушки распылением. В еще одном варианте изобретения частицы согласно изобретению образуются при удалении растворителя или перед удалением растворителя.
В одном из своих вариантов настоящее изобретение относится к способу получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, где указанная молекула GLP-1 выбрана из группы, состоящей из нативного GLP-1, аналога GLP-1, производного GLP-1, GLP-1, защищенного от действия дипептидил-пептидазы IV (DPP-IV), GLP-1-миметика, экзендина, аналога пептида GLP-1 или биосинтетического аналога GLP-1. В другом варианте изобретения способ получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, включает получение дикетопиперазина в виде суспензии частиц. В другом варианте изобретения дикетопиперазин получают в растворе, и такой способ включает коррекцию pH раствора для осаждения дикетопиперазина и образования частиц.
В других конкретных вариантах изобретения раствор GLP-1 имеет концентрацию, составляющую примерно 1 мкг/мл - 50 мг/мл, более предпочтительно, примерно 0,1 мг/мл - 10 мг/мл. В еще одном конкретном варианте изобретения раствор GLP-1 имеет концентрацию примерно 0,25 мг/мл.
Другой способ получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, также включает добавление агента в раствор, где указанный агент выбран из солей, поверхностно-активных веществ, ионов, осмолитов, хаотропов и лиотропов, кислоты, основания и органических растворителей. Такой агент стимулирует ассоциацию частиц GLP-1 и дикетопиперазина, а также повышает стабильность и/или улучшает фармакодинамику молекулы GLP-1. В некоторых вариантах изобретения указанным агентом является соль, такая как, но не ограничивающаяся ею, хлорид натрия. Также рассматривается, что указанным агентом может быть поверхностно-активное вещество, такое как, но не ограничивающееся ими, твин, тритон, плюроновая кислота, CHAPS, цетримид и Brij, H(CH2)7SO4Na. Таким агентом может быть ион, например, катион или анион. Указанным агентом может быть осмолит (стабилизатор), такой как, но не ограничивающийся ими, гексилен-гликоль (Hex-Gly), трегалоза, глицин, полиэтиленгликоль (ПЭГ), N-оксид триметиламина (TMAO), маннит и пролин. Указанным агентом может быть хаотроп или лиотроп, такой как, но не ограничивающийся ими, хлорид цезия, цитрат натрия и сульфат натрия. Указанным агентом может быть органический растворитель, например, спирт, выбранный из метанола (MeOH), этанола (EtOH), трифторэтанола (TFE) и гексафторизопропанола (HFIP).
В другом своем конкретном варианте настоящее изобретение относится к способу получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, где указанный способ включает доведение pH суспензии частиц до значения, составляющего примерно 4 или более. В других своих вариантах настоящее изобретение относится к способу получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, где указанная молекула GLP-1 в данных частицах имеет более высокую стабильность.
В настоящем изобретении также рассматривается способ введения эффективного количества молекулы GLP-1 индивидууму, нуждающемуся в этом, где указанный способ включает введение индивидууму частиц GLP-1/дикетопиперазина. Такими способами введения могут быть, но не ограничиваются ими, внутривенное, подкожное, пероральное, интраназальное, трансбуккальное, ректальное или внутрилегочное введение. В одном из вариантов изобретения указанным способом введения является внутрилегочное введение. В другом варианте изобретения указанный способ введения осуществляют для лечения состояния или заболевания, выбранного из группы, состоящей из диабета, ишемии, реперфузионного поражения ткани, дислипидемии, диабетической кардиомиопатии, инфаркта миокарда, острого коронарного синдрома, ожирения, катаболических изменений после хирургического вмешательства, гипергликемии, синдрома раздраженного кишечника, инсульта, нейродегенеративных расстройств, расстройства памяти и нарушения познавательных способностей и состояний, связанных с имплантацией островковых клеток и регенеративной терапией.
В другом варианте изобретения способ введения композиции частиц GLP-1/дикетопиперазина позволяет улучшить фармакокинетику, увеличить время полужизни и улучшить биологическую доступность GLP-1.
В еще одном своем конкретном варианте настоящее изобретение относится к способу получения сухой порошкообразной композиции с улучшенным фармакокинетическим профилем, где указанный способ включает стадии: получения раствора молекулы GLP-1; получения дикетопиперазина, образующего частицы; образования частиц; и объединения GLP-1 и дикетопиперазина; а затем удаления растворителя методом сушки с получением сухого порошка, где указанный сухой порошок имеет улучшенный фармакокинетический профиль. Термин «улучшенный фармакокинетический профиль» означает более длительное время полужизни GLP-1 и/или улучшенную биологическую доступность GLP-1. Такое более длительное время полужизни GLP-1 составляет 7,5 минут или более.
В одном из своих вариантов настоящее изобретение относится к получению сухой порошкообразной композиции, содержащей молекулу GLP-1 и дикетопиперазин или их фармацевтически приемлемую соль. В другом варианте изобретения молекула GLP-1 выбрана из группы, состоящей из нативных GLP-1; метаболитов GLP-1; аналогов GLP-1; производных GLP-1; GLP-1, защищенных от действия дипептидил-пептидазы IV (DPP-IV); GLP-1-миметиков; аналогов пептида GLP-1 или биосинтетических аналогов GLP-1.
В другом варианте изобретения указанный дикетопиперазин представляет собой дикетопиперазин, имеющий формулу 2,5-дикето-3,6-ди(4-X-аминобутил)пиперазин, где X выбран из группы, состоящей из сукцинила, глутарила, малеила и фумарила. В другом варианте изобретения указанным дикетопиперазином является соль дикетопиперазина. В другом варианте изобретения указанным дикетопиперазином является 2,5-дикето-3,6-ди-(4-фумарил-аминобутил)пиперазин.
В одном из вариантов изобретения молекула GLP-1 представляет собой нативный GLP-1. В другом варианте изобретения молекула GLP-1 представляет собой амидированную молекулу GLP-1. В другом варианте изобретения указанной амидированной молекулой GLP-1 является амид GLP-1 (7-36).
В одном из своих вариантов настоящее изобретение относится к способу получения частиц, содержащих молекулу GLP-1 и дикетопиперазин, где указанный способ включает стадии: получения молекулы GLP-1; получения дикетопиперазина в форме, выбранной из дикетопиперазина, образующего частицы, дикетопиперазиновых частиц и их комбинаций; и объединения молекулы GLP-1 и дикетопиперазина в форме сораствора, где образуются частицы, содержащие молекулу GLP-1 и дикетопиперазин.
В одном из вариантов изобретения указанный способ также включает удаление растворителя из указанного сораствора путем лиофилизации, фильтрации или сушки распылением. В другом варианте изобретения частицы, содержащие указанную молекулу GLP-1 и дикетопиперазин, образуются при удалении растворителя. В другом варианте изобретения частицы, содержащие указанную молекулу GLP-1 и дикетопиперазин, образуются перед удалением растворителя.
В другом варианте изобретения молекула GLP-1 выбрана из группы, состоящей из нативного GLP-1, аналога GLP-1, производного GLP-1, GLP-1, защищенного от действия дипептидил-пептидазы IV (DPP-IV), GLP-1-миметика, аналога пептида GLP-1 или биосинтетического аналога GLP-1. В другом варианте изобретения молекулу GLP-1 получают в виде раствора, содержащего GLP-1 в концентрации примерно 1 мкг/мл - 50 мг/мл. В другом варианте изобретения молекулу GLP-1 получают в виде раствора, содержащего GLP-1 в концентрации примерно 0,1 мг/мл - 10 мг/мл. В другом варианте изобретения молекулу GLP-1 получают в виде раствора, содержащего GLP-1 в концентрации примерно 0,25 мг/мл.
В другом варианте изобретения дикетопиперазин получают в форме суспензии дикетопиперазиновых частиц. В другом варианте изобретения дикетопиперазин получают в форме раствора, содержащего образующий частицы дикетопиперазин, где указанный способ также включает доведение рН раствора до значения, благоприятствующего образованию дикетопиперазиновых частиц. В другом варианте изобретения указанный способ также включает добавление агента в указанный раствор или суспензию, где указанный агент выбран из группы, состоящей из солей, поверхностно-активных веществ, ионов, осмолитов, хаотропов и лиотропов, кислот, оснований и органических растворителей. В другом варианте изобретения указанный агент стимулирует ассоциацию молекулы GLP-1 и дикетопиперазиновых частиц или дикетопиперазина, образующего частицы. В другом варианте изобретения указанный агент повышает стабильность или улучшает фармакодинамику молекулы GLP-1. В другом варианте изобретения указанным агентом является хлорид натрия.
В другом варианте изобретения указанный способ также включает коррекцию рН суспензии или раствора. В другом варианте изобретения указанный способ также включает доведение рН примерно до 4,0 или более. В еще одном варианте изобретения молекула GLP-1, присутствующая в частице, является более стабильной, чем нативный GLP-1.
В другом варианте изобретения указанный сораствор содержит GLP-1 в концентрации примерно 1 мкг/мл-50 мг/мл. В другом варианте изобретения указанный сораствор содержит GLP-1 в концентрации примерно 0,1 мг/мл - 10 мг/мл. В другом варианте изобретения указанный сораствор содержит молекулу GLP-1 в концентрации примерно 0,25 мг/мл.
В другом варианте изобретения указанный способ также включает добавление агента в сораствор, где указанный агент выбран из группы, состоящей из солей, поверхностно-активных веществ, ионов, осмолитов, хаотропов и лиотропов, кислот, оснований и органических растворителей. В другом варианте изобретения указанный агент стимулирует ассоциацию молекулы GLP-1 и дикетопиперазиновых частиц или дикетопиперазина, образующего частицы. В другом варианте изобретения указанный агент повышает стабильность или улучшает фармакодинамику молекулы GLP-1. В другом варианте изобретения указанным агентом является хлорид натрия.
В другом варианте изобретения указанный способ также включает коррекцию рН сораствора. В другом варианте изобретения указанный способ также включает доведение рН примерно до 4,0 или более.
В одном из своих вариантов настоящее изобретение относится к способу введения эффективного количества молекулы GLP-1 индивидууму, нуждающемуся в этом, где указанный способ включает введение указанному индивидууму частиц, содержащих GLP-1 и дикетопиперазин. В другом варианте изобретения указанный способ осуществляют путем внутривенного, подкожного, перорального, интраназального, трансбуккального, ректального или внутрилегочного введения. В другом варианте изобретения указанный способ осуществляют путем внутрилегочного введения.
В другом варианте изобретения указанный способ осуществляют для лечения состояния или заболевания, выбранного из группы, состоящей из диабета, ишемии, реперфузионного поражения ткани, дислипидемии, диабетической кардиомиопатии, инфаркта миокарда, острого коронарного синдрома, ожирения, катаболических изменений после хирургического вмешательства, гипергликемии, синдрома раздраженного кишечника, инсульта, нейродегенеративных расстройств, расстройства памяти и нарушения познавательных способностей и состояний, связанных с имплантацией островковых клеток и регенеративной терапией.
В другом варианте изобретения введение указанных частиц, по сравнению с введением нативного GLP-1, приводит к улучшению фармакокинетики, увеличению времени полужизни и улучшению биологической доступности GLP-1.
В одном из своих вариантов настоящее изобретение относится к способу получения порошкообразной композиции с улучшенным фармакокинетическим профилем GLP-1, где указанный способ включает стадии: получения молекулы GLP-1; получения дикетопиперазина, образующего частицы в растворе; образования частиц дикетопиперазина; объединения молекулы GLP-1 и раствора с образованием сораствора; и удаления растворителя из сораствора путем сушки распылением с получением порошка, имеющего улучшенный фармакокинетический профиль GLP-1.
В другом варианте изобретения указанный улучшенный фармакокинетический профиль GLP-1 включает более длительное время полужизни GLP-1. В другом варианте изобретения более длительное время полужизни GLP-1 составляет 7,5 минут или более. В другом варианте изобретения указанный улучшенный фармакокинетический профиль GLP-1 включает улучшенную биологическую доступность GLP-1 по сравнению с нативным GLP-1.
Краткое описание графического материала
Нижеследующий графический материал составляет часть описания настоящей заявки и включает некоторые другие аспекты настоящего изобретения. Настоящее изобретение будет более понятным из нижеследующего описания со ссылками на одну или несколько иллюстраций в сочетании с подробным описанием представленных здесь конкретных вариантов осуществления изобретения.
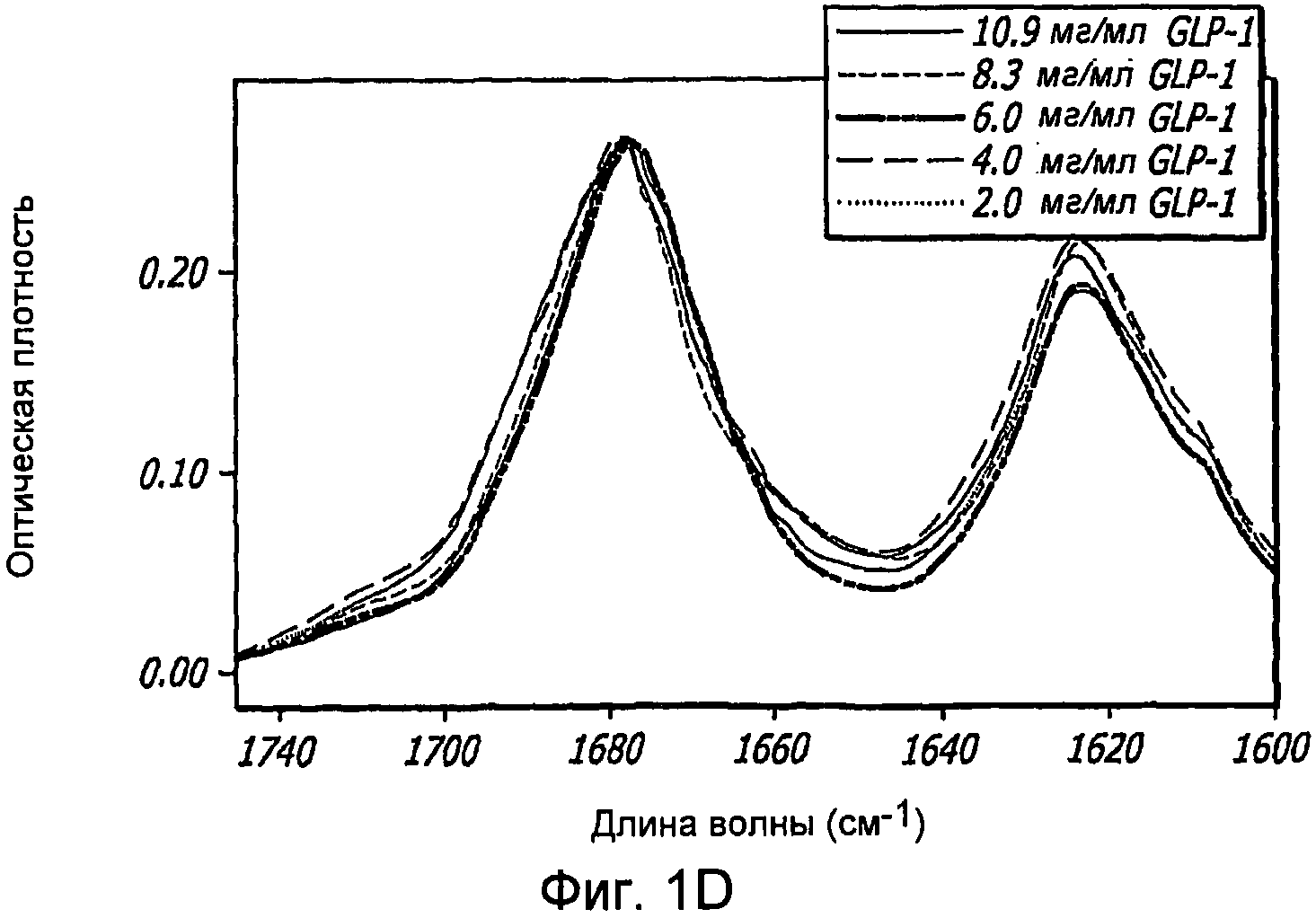
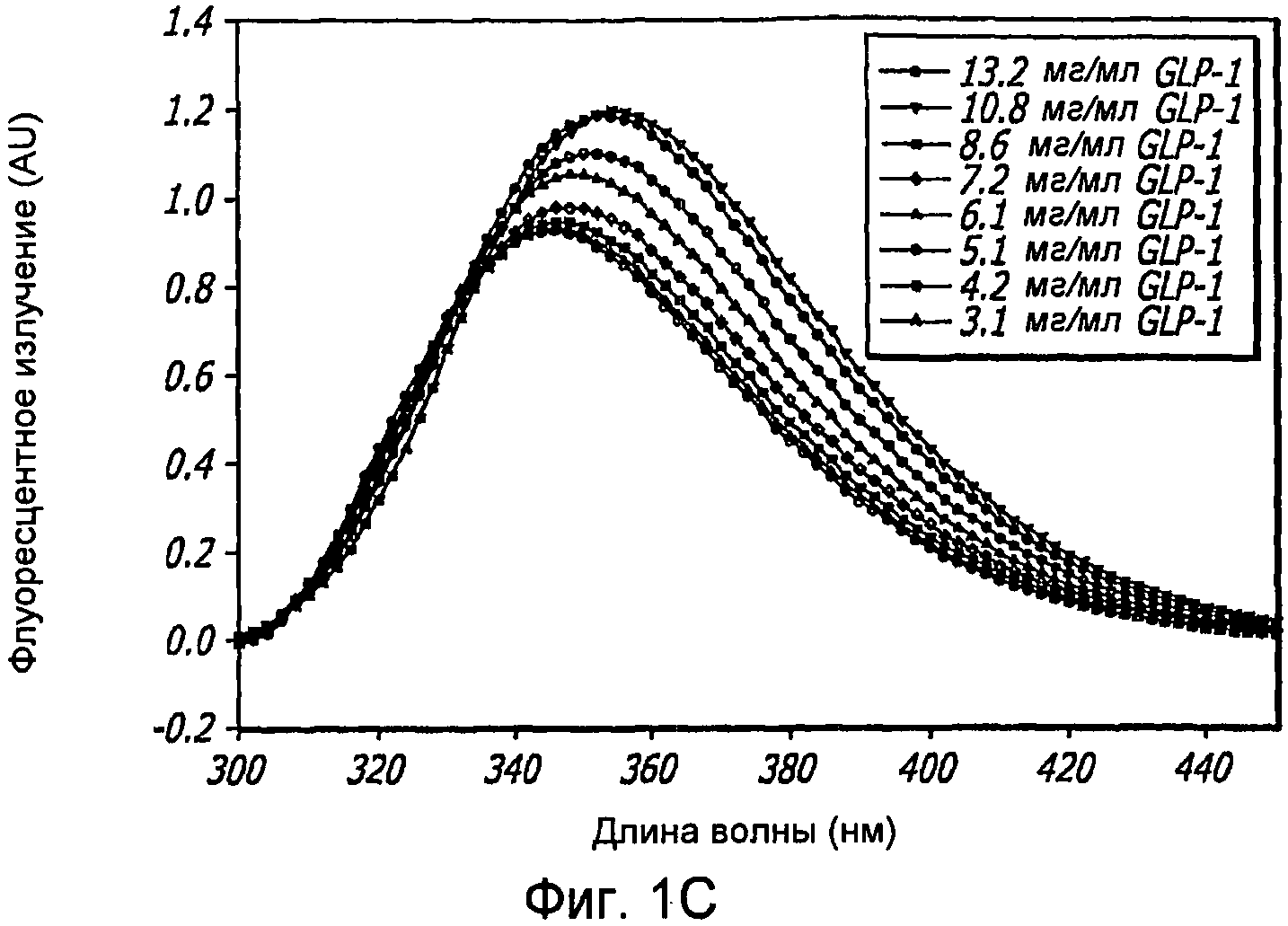
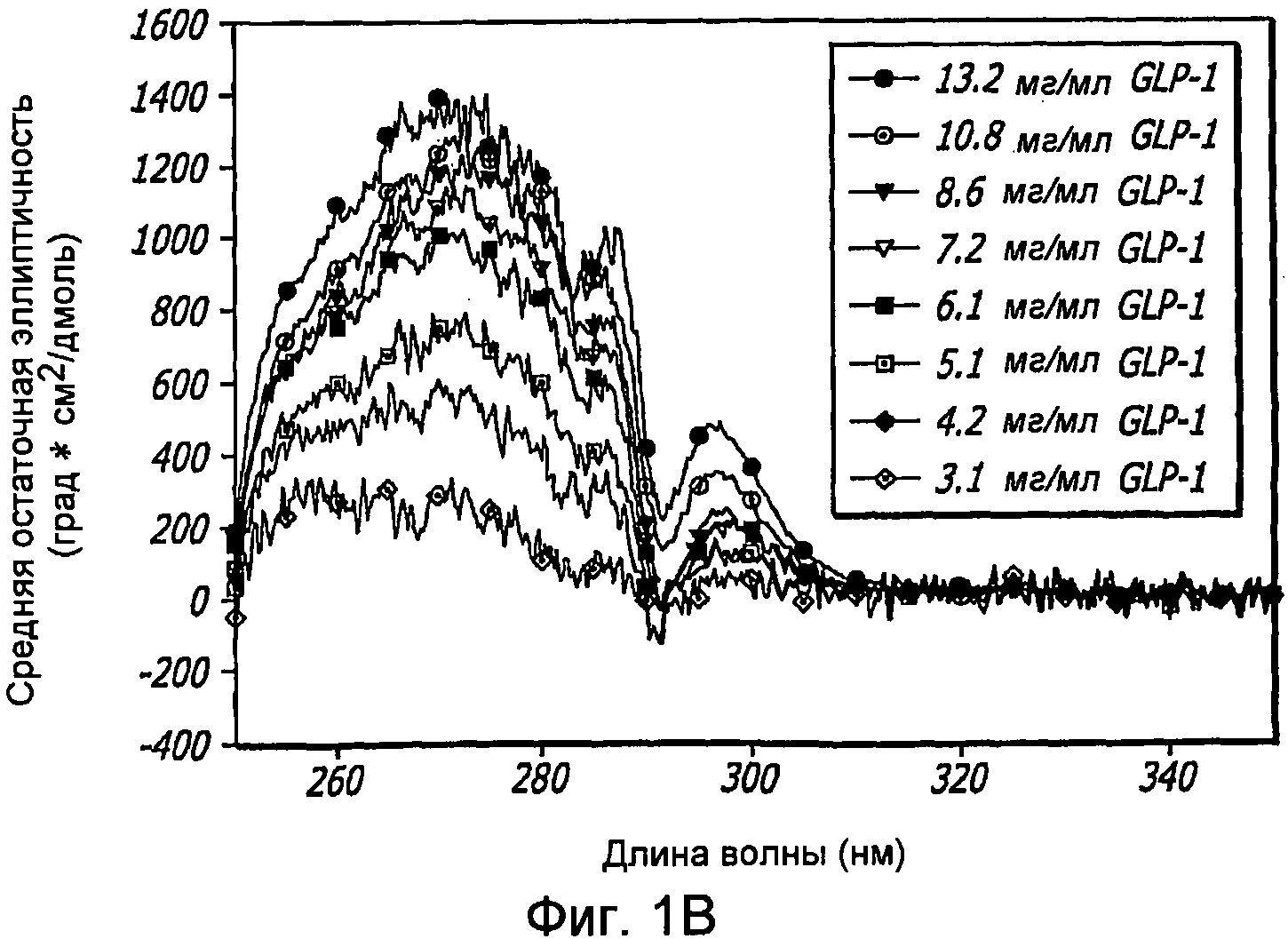
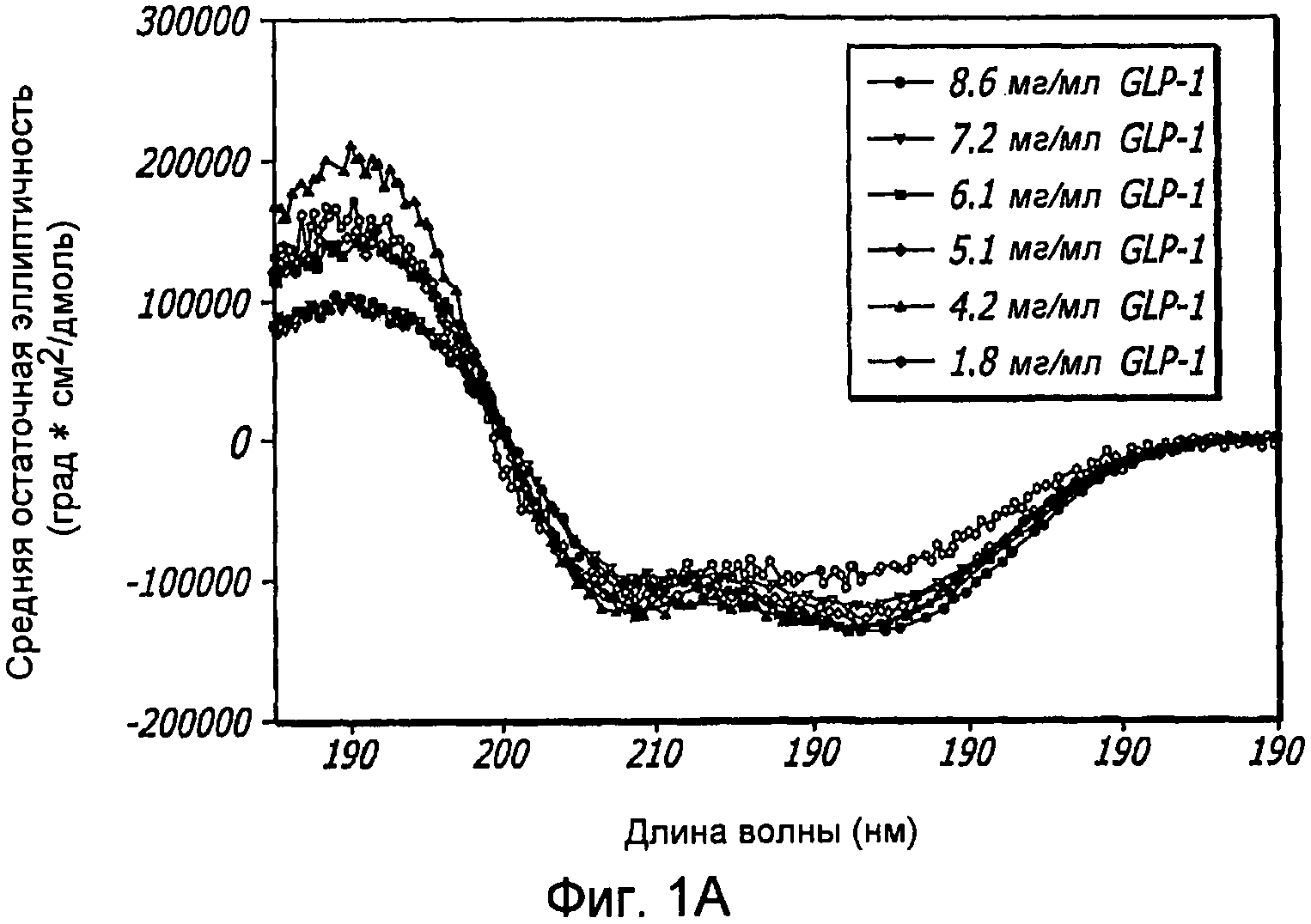
Фиг. 1A-1D. Структурный анализ GLP-1 при различных концентрациях (pH 4, 20°С). Фиг. 1A - Круговой дихроизм (КД) в далекой области УФ-излучения GLP-1 показал, что по мере увеличения концентрации вторичная структура пептида трансформируется, в основном, из неструктурированной конформации в спиральную конформацию. Фиг. 1B - КД в ближнем УФ показал, что степень третичной структуры увеличивается с увеличением концентрации пептида, что позволяет предположить, что GLP-1 подвергается самосборке. Фиг. 1С - Флуоресцентное излучение GLP-1 при различных концентрациях (pH 4, 20°С), возникающее в результате возбуждения триптофана на 280 нм. Фиг. 1D - Просвечивающая инфракрасная Фурье-спектроскопия (FTIR) GLP-1 при различных концентрациях (pH 4, 20°С). Полоса амида I при 1656 см-1 указывает на то, что GLP-1 имеет α-спиральную структуру при концентрациях ≥ 2 мг/мл.
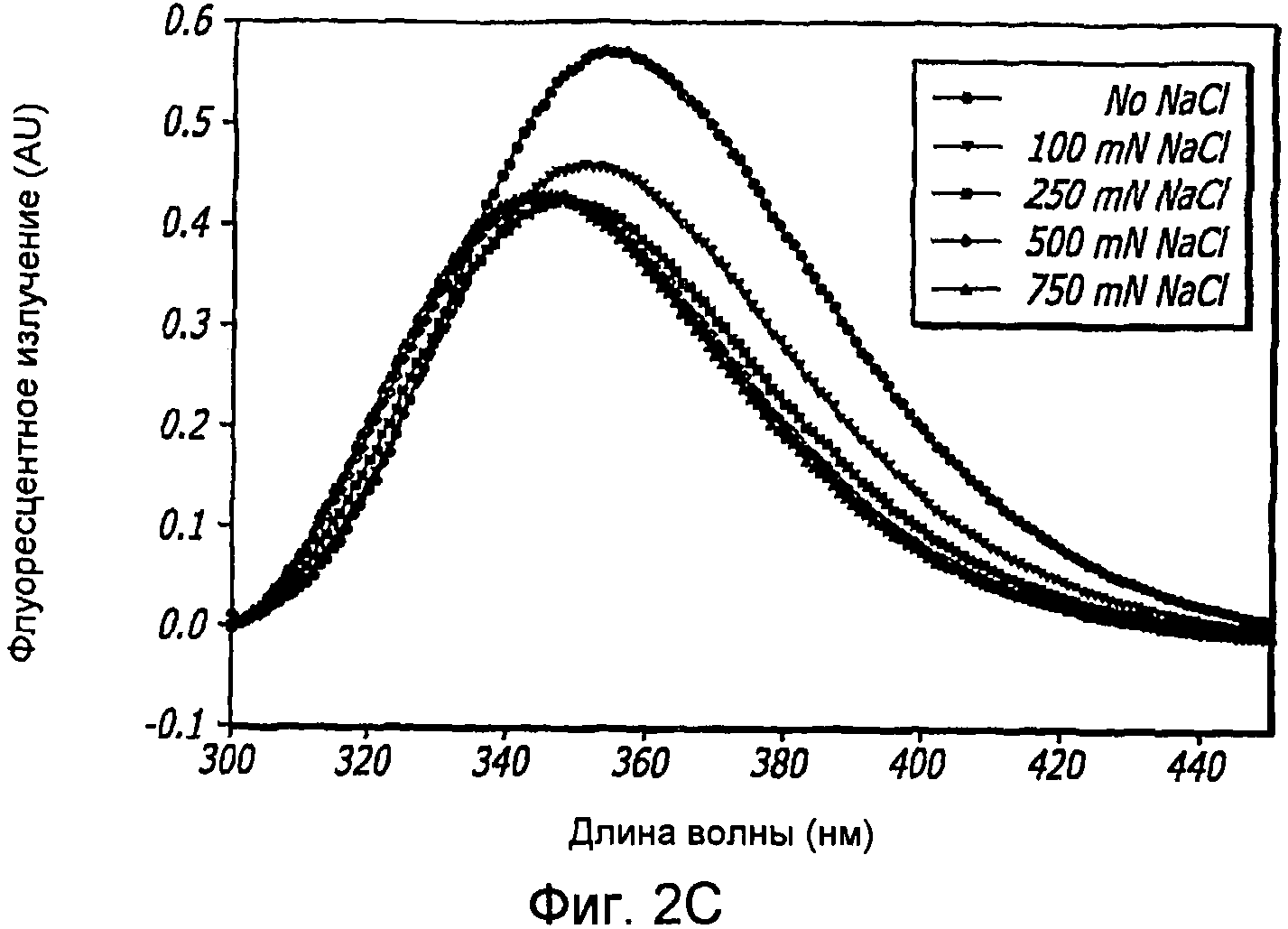
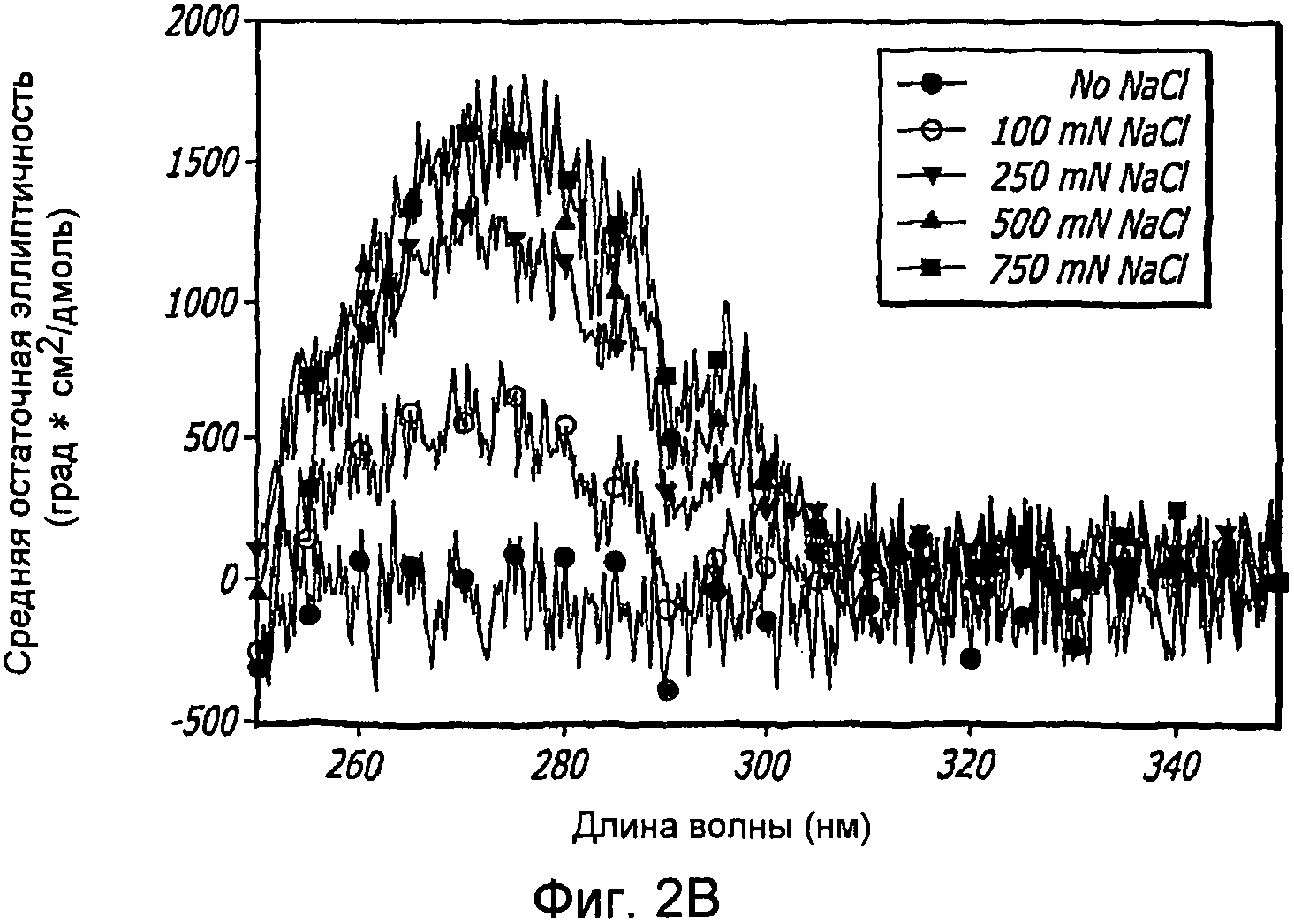
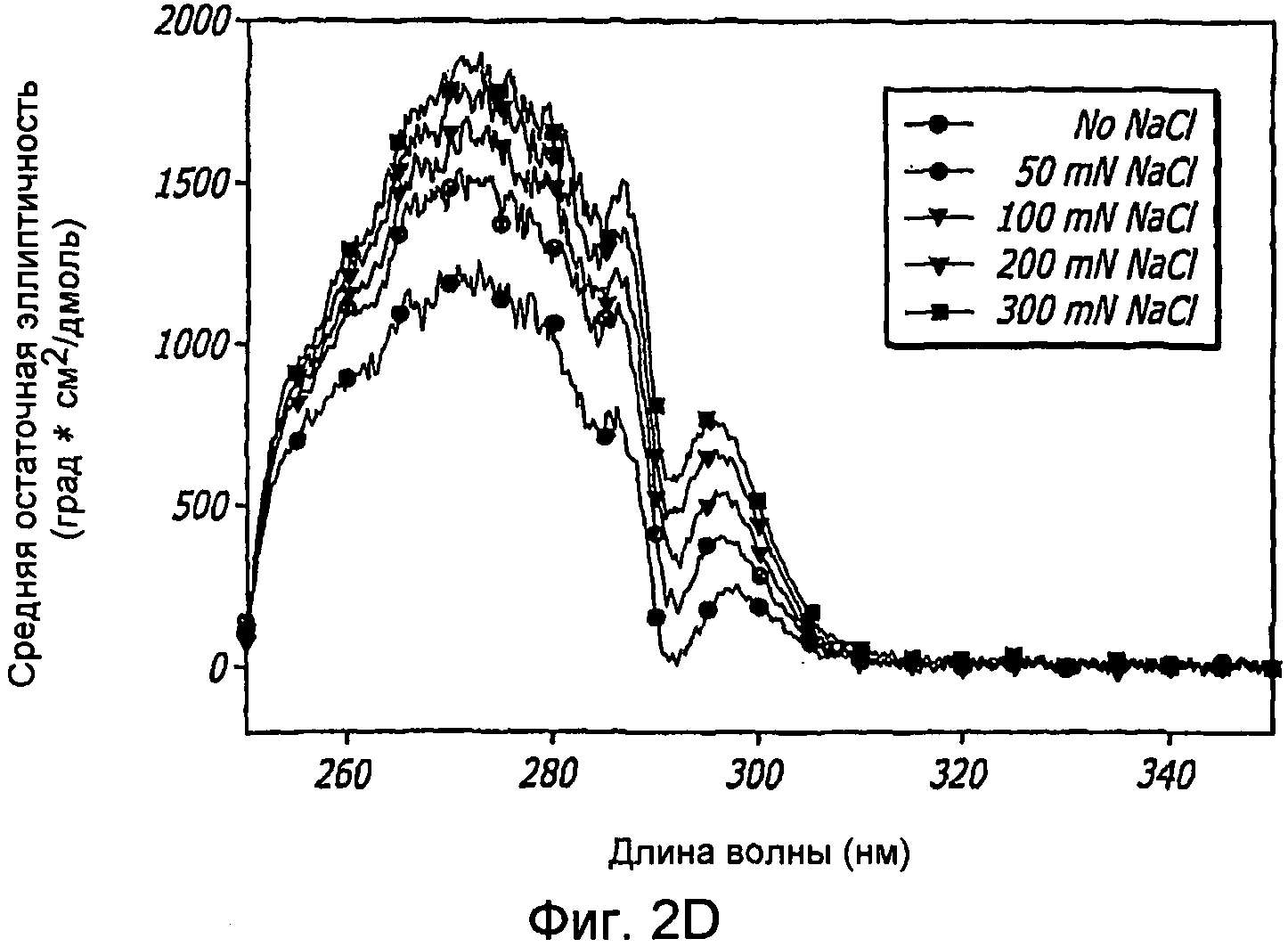
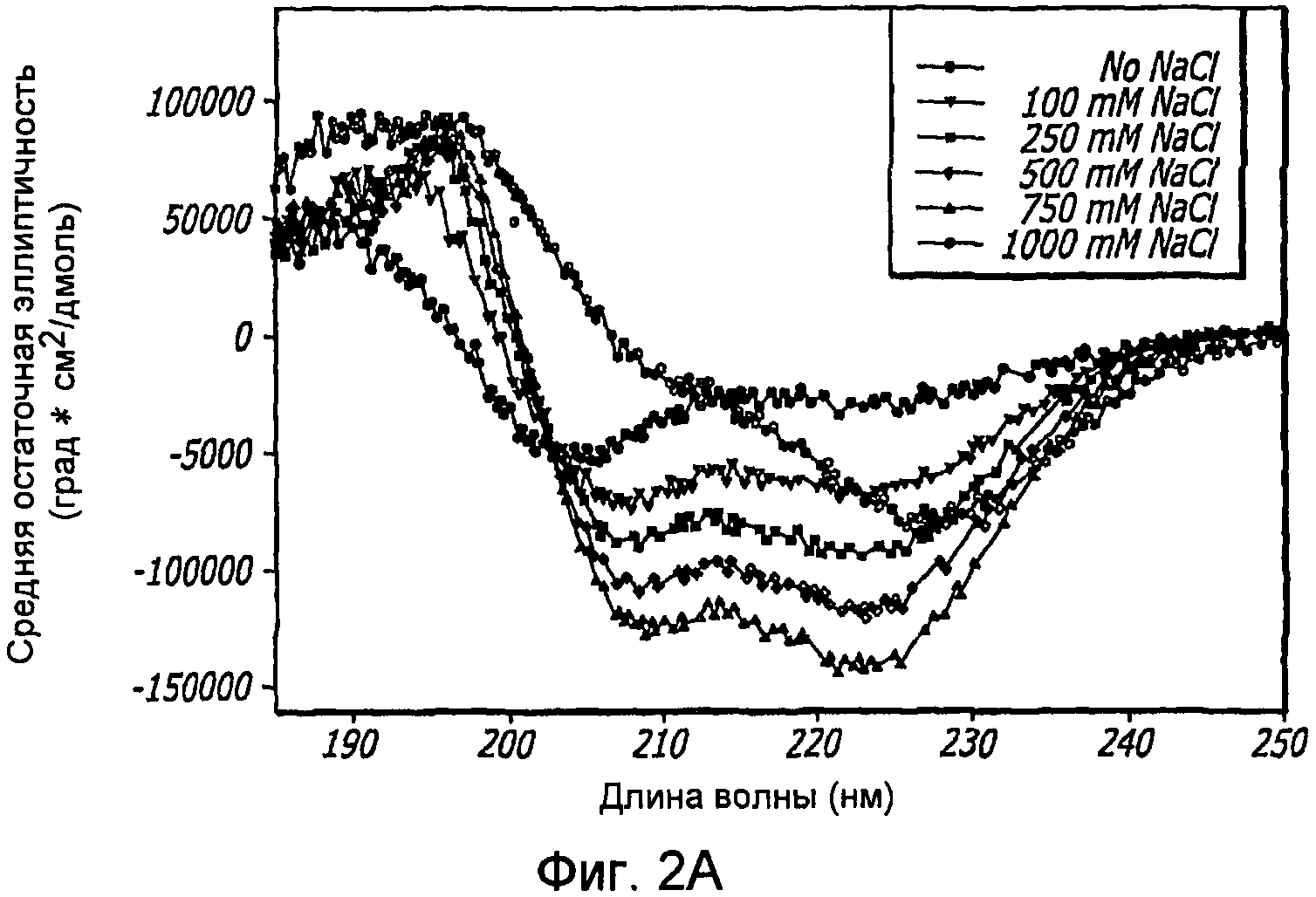
Фиг. 2A-2D. Структурный анализ GLP-1 при низких концентрациях и при варьирующейся ионной силе (pH 4, 20°С). Фиг. 2A - КД в далекой области УФ-излучения GLP-1 при 1,0 мг/мл показал, что при возрастании концентрации соли, неупорядоченная структура GLP-1 превращается в более упорядоченные α-спиральные структуры. Фиг. 2B - КД в ближней области УФ-излучения пептида при 1,0 мг/мл показал, что при возрастании концентрации NaCl также наблюдалась тенденция к увеличению степени третичной структуры GLP-1. Фиг. 2C - Собственное флуоресцентное излучение GLP-1 в концентрации 1,0 мг/мл при варьирующихся концентрациях NaCl (pH 4, 20°С) после возбуждения триптофана на 280 нм. При высоких концентрациях пептида максимальное значение интенсивности снижается и сдвигается в сторону более низкой длины волны, что указывает на присутствие хорошо определенной третичной структуры. Фиг. 2D - Анализ третичной структуры GLP-1 в концентрации 10 мг/мл при варьирующейся ионной силе (pH 4, 20°С). КД в ближней области спектра УФ-излучения показал, что с увеличением ионной силы увеличивается степень третичной структуры GLP-1, подвергаемого самосборке.
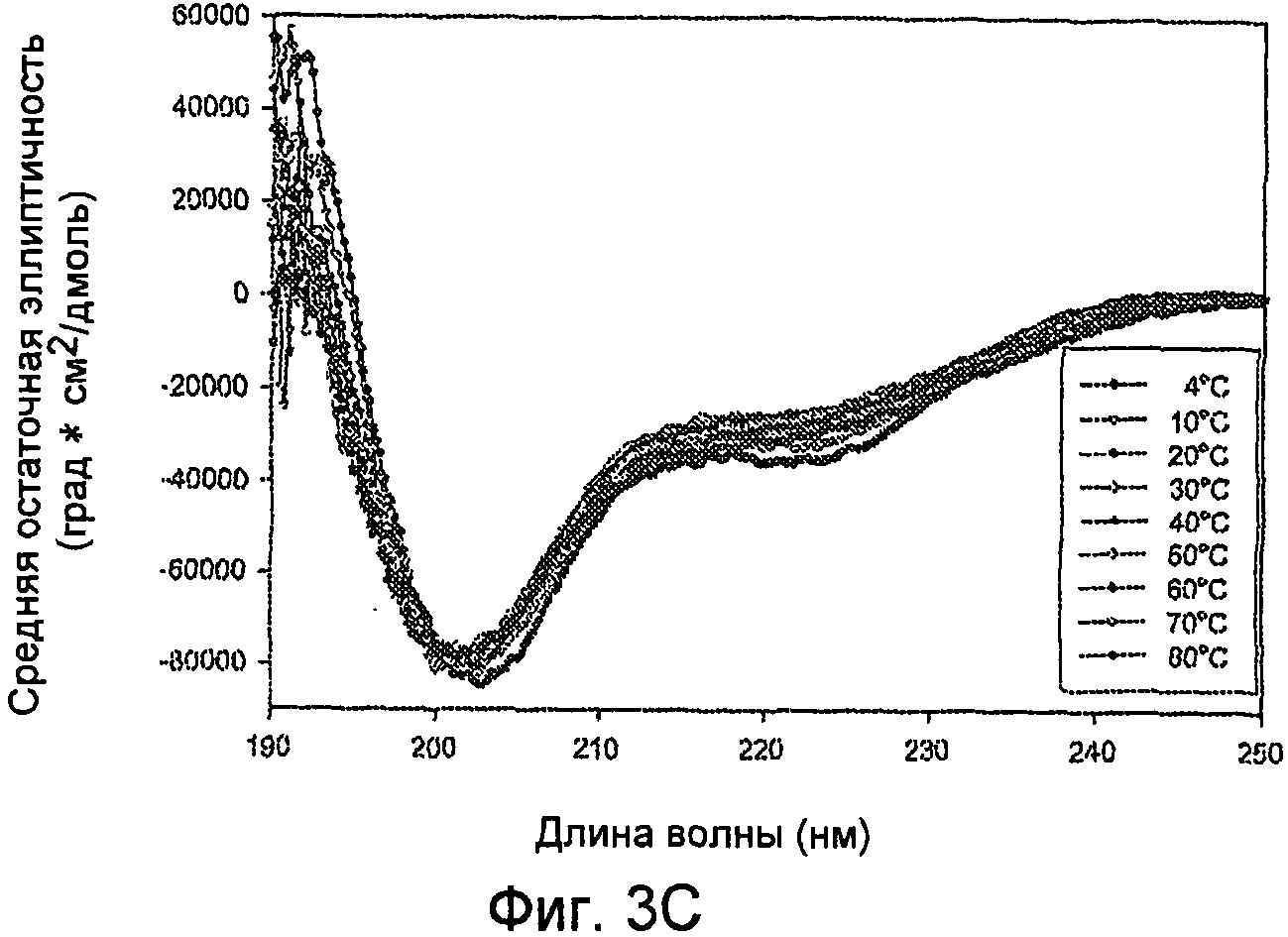
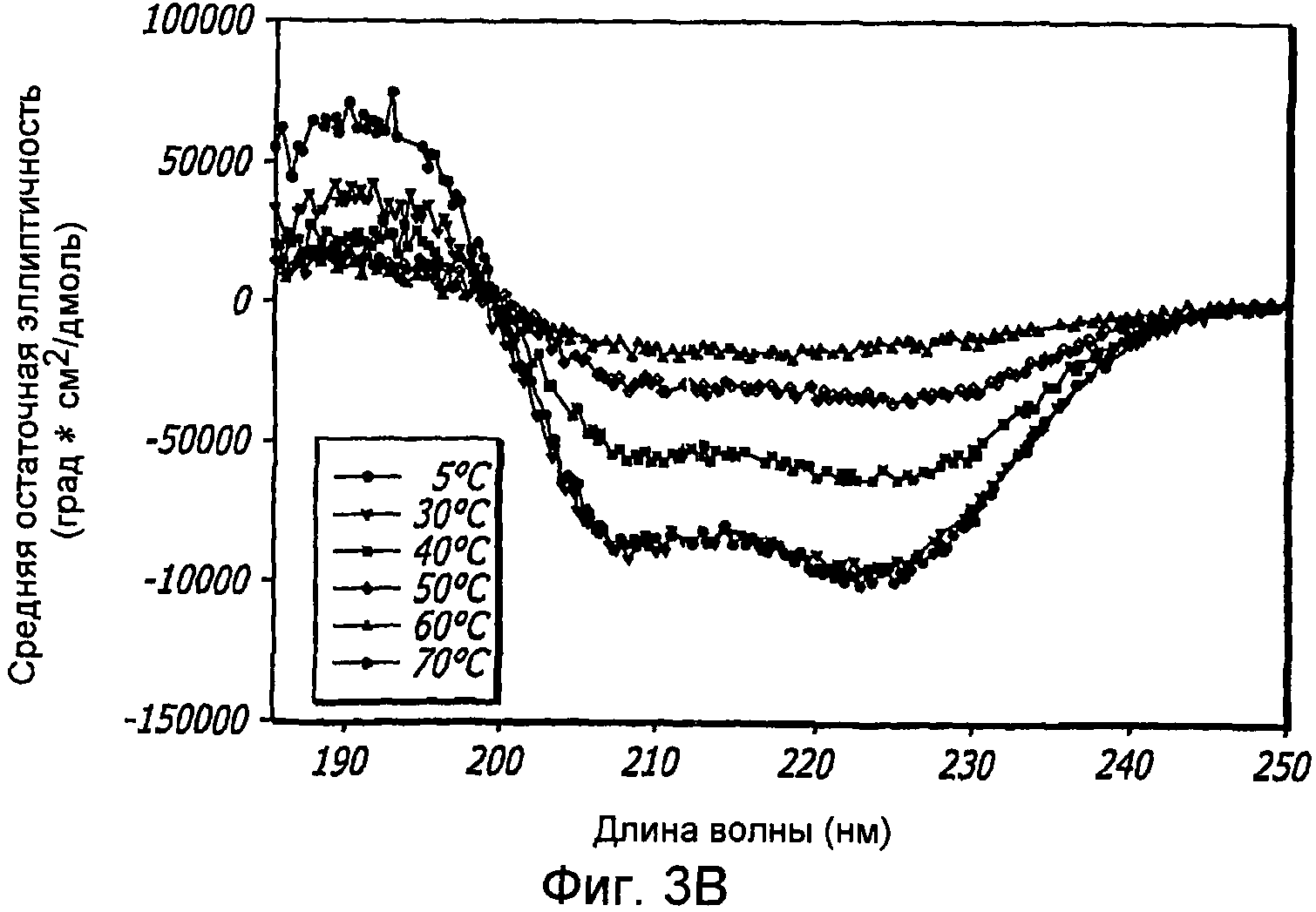
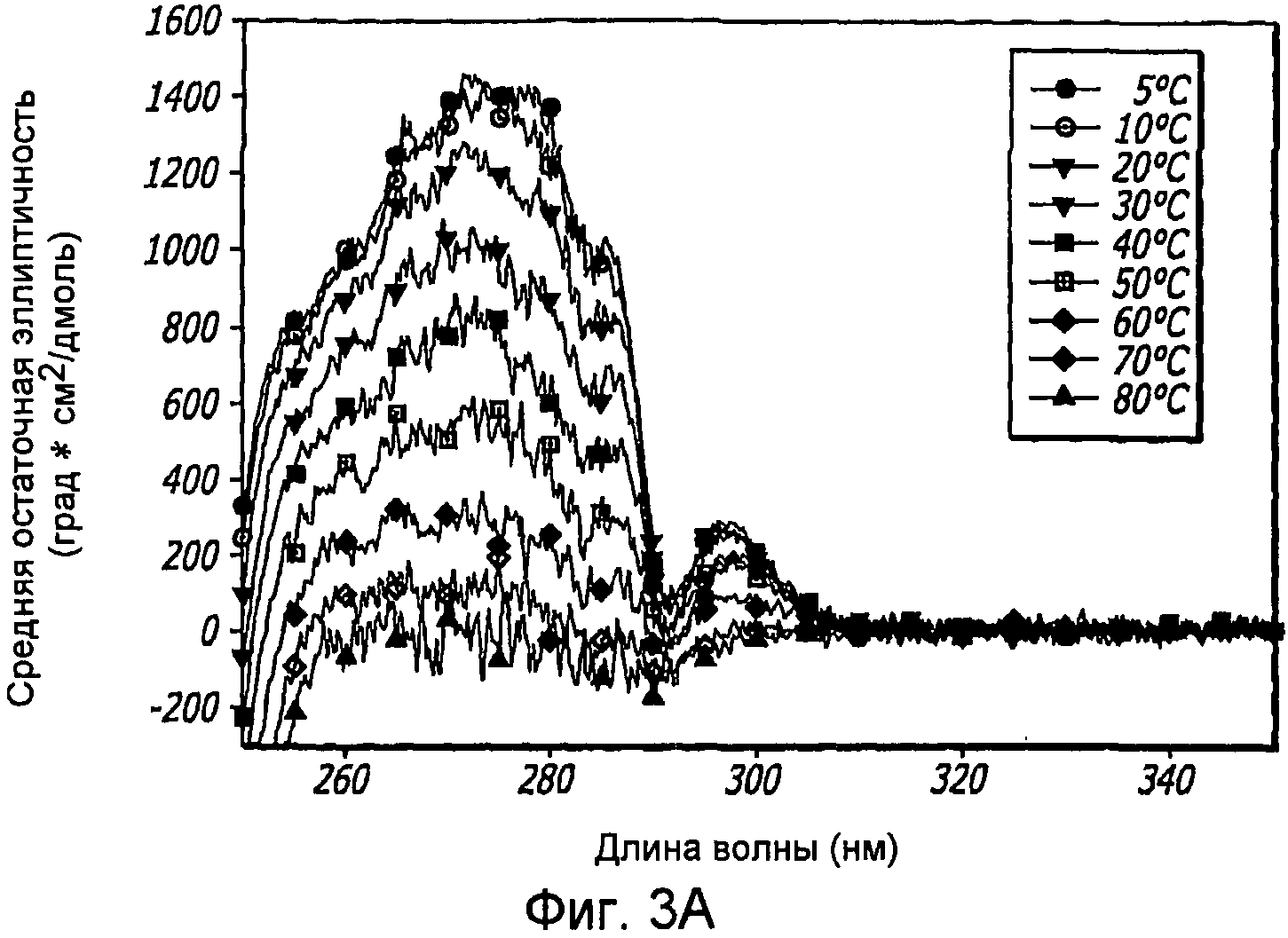
Фиг. 3A-3B. Структурный анализ 10 мг/мл GLP-1 при различных температурах (pH 4). Фиг. 3A - КД в ближнем УФ показал, что олигомеры GLP-1 диссоциируются с увеличением температуры. Фиг. 3B - Структурный анализ 10 мг/мл GLP-1 при различных температурах (pH 4). Фиг. 3C - Структурный анализ 0,05 мг/мл GLP-1 при различных температурах (pH 4). КД в далеком УФ показал, что данный пептид не чувствителен к изменению температуры.
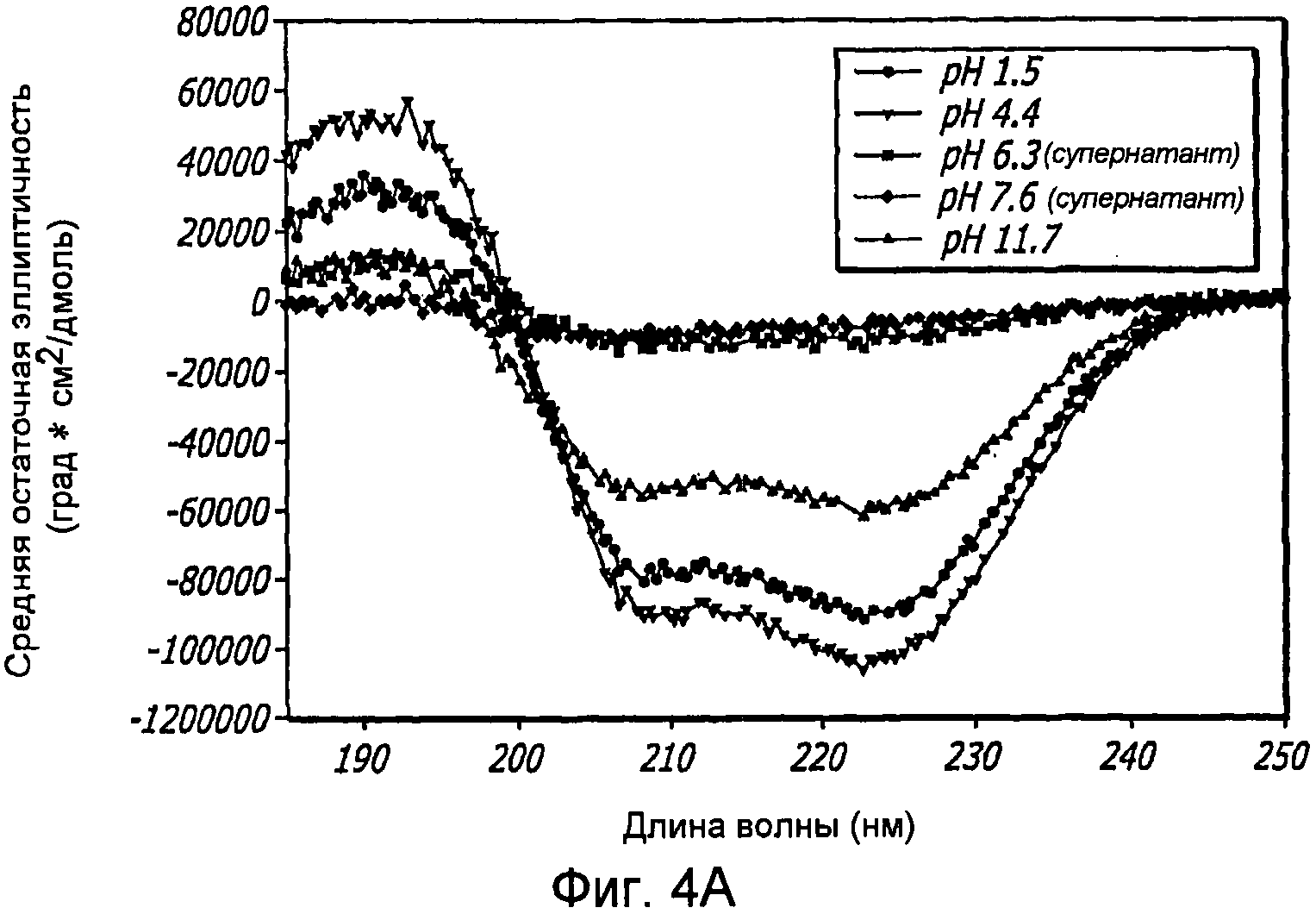
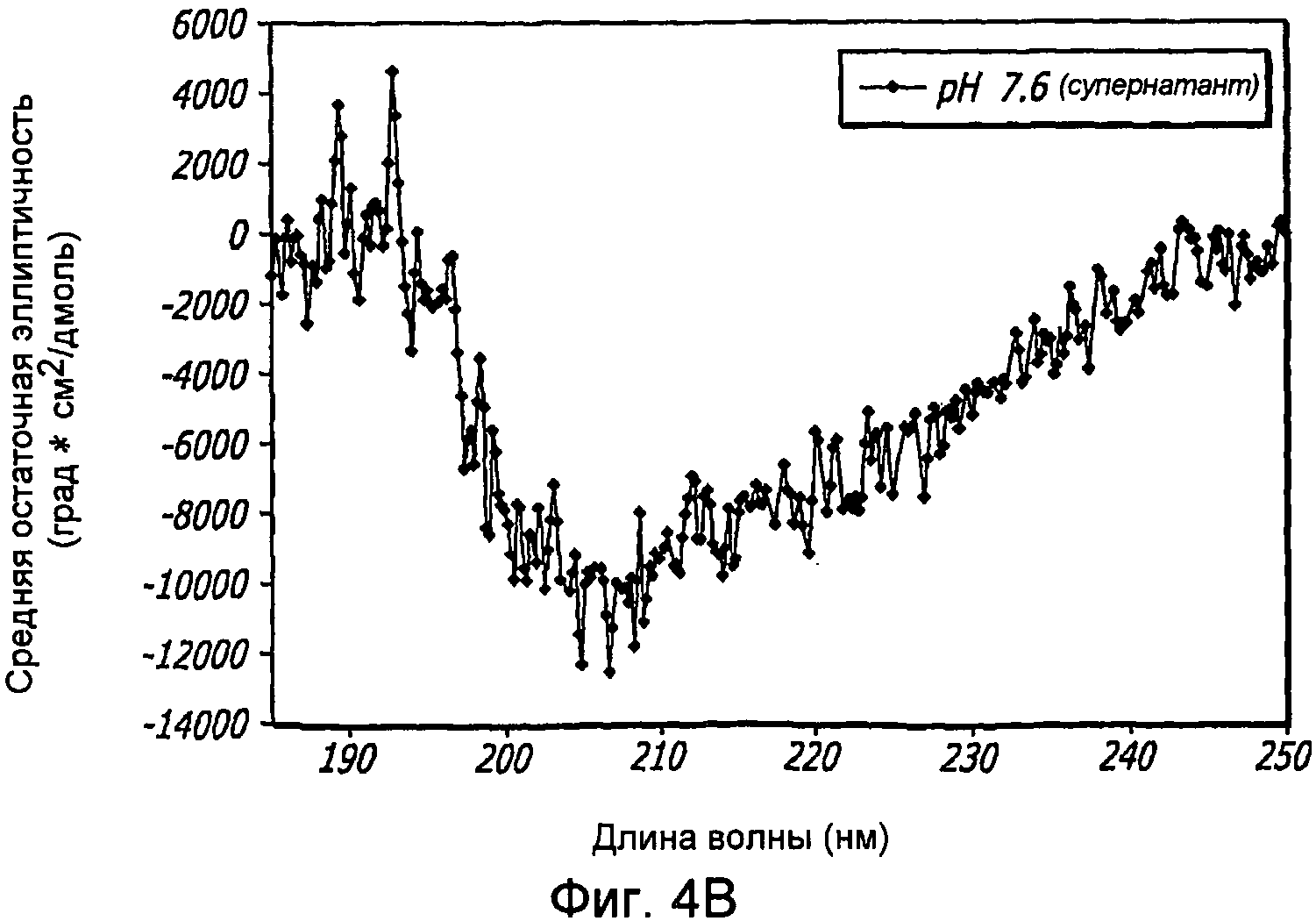
Фиг. 4A-4B. Структурный анализ GLP-1 при варьирующихся pH (20°С). Фиг. 4A - КД в далеком УФ GLP-1 в концентрации 10 мг/мл при варьирующихся pH (20°С). По мере увеличения pH GLP-1, подвергнутый самосборке, осаждается при pH 6,3-7,6, но сохраняет спиральную структуру при 1,5 и 11,7. Фиг. 4B - Уширение спектра при pH 7,6 показало, что при снижении концентрации вторичная структура GLP-1 становится неупорядоченной.
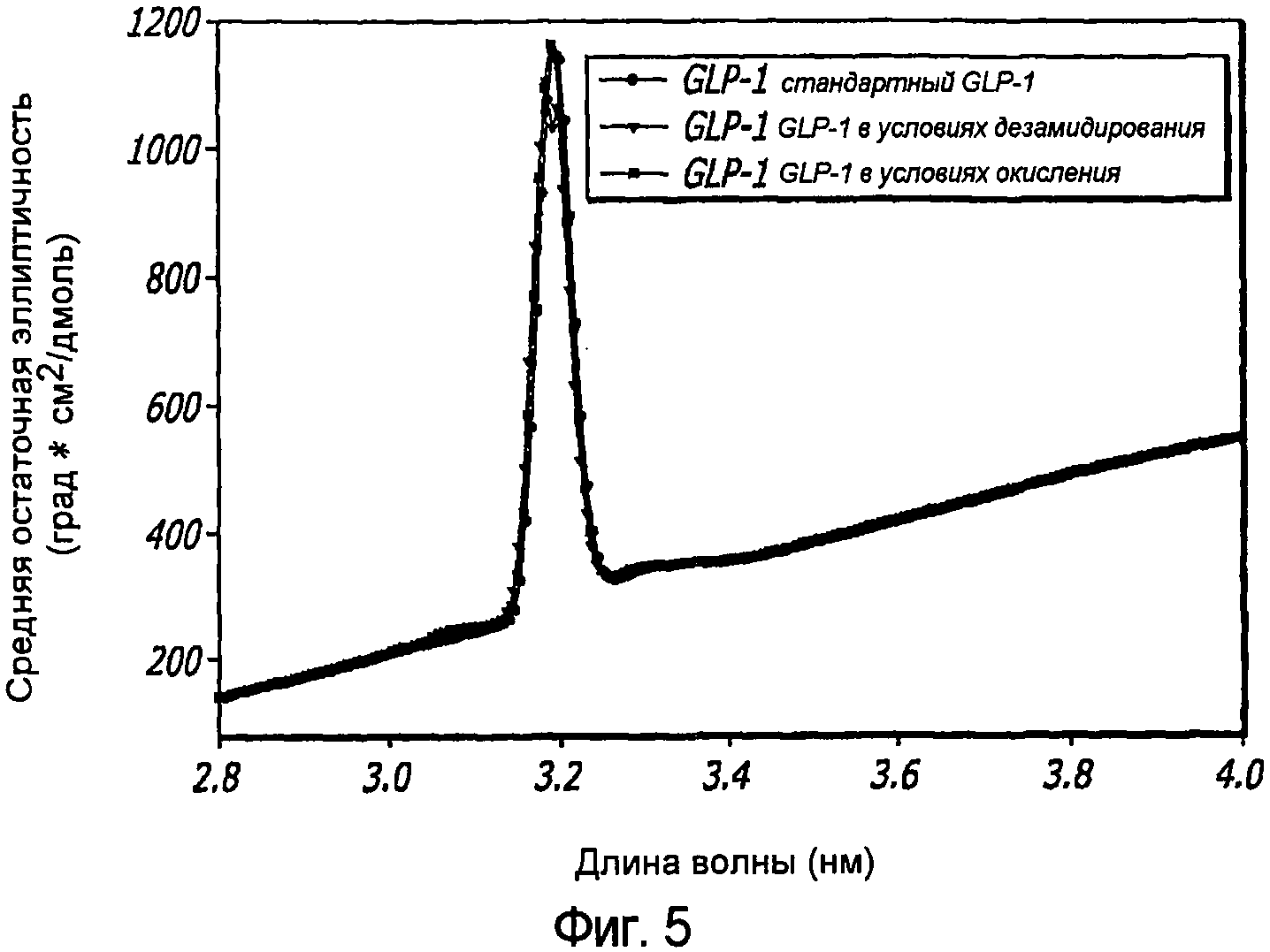
Фиг. 5. Резистентность GLP-1 в концентрации 1 мг/мл к дезамидированию и окислению была продемонстрирована с помощью ЖХВД. Условия дезамидирования были достигнуты путем инкубирования GLP-1 при pH 10,5 в течение 5 дней при 40°С. Окислительные условия были достигнуты путем инкубирования GLP-1 в 0,1 % H2O2 в течение 2 часов при комнатной температуре.
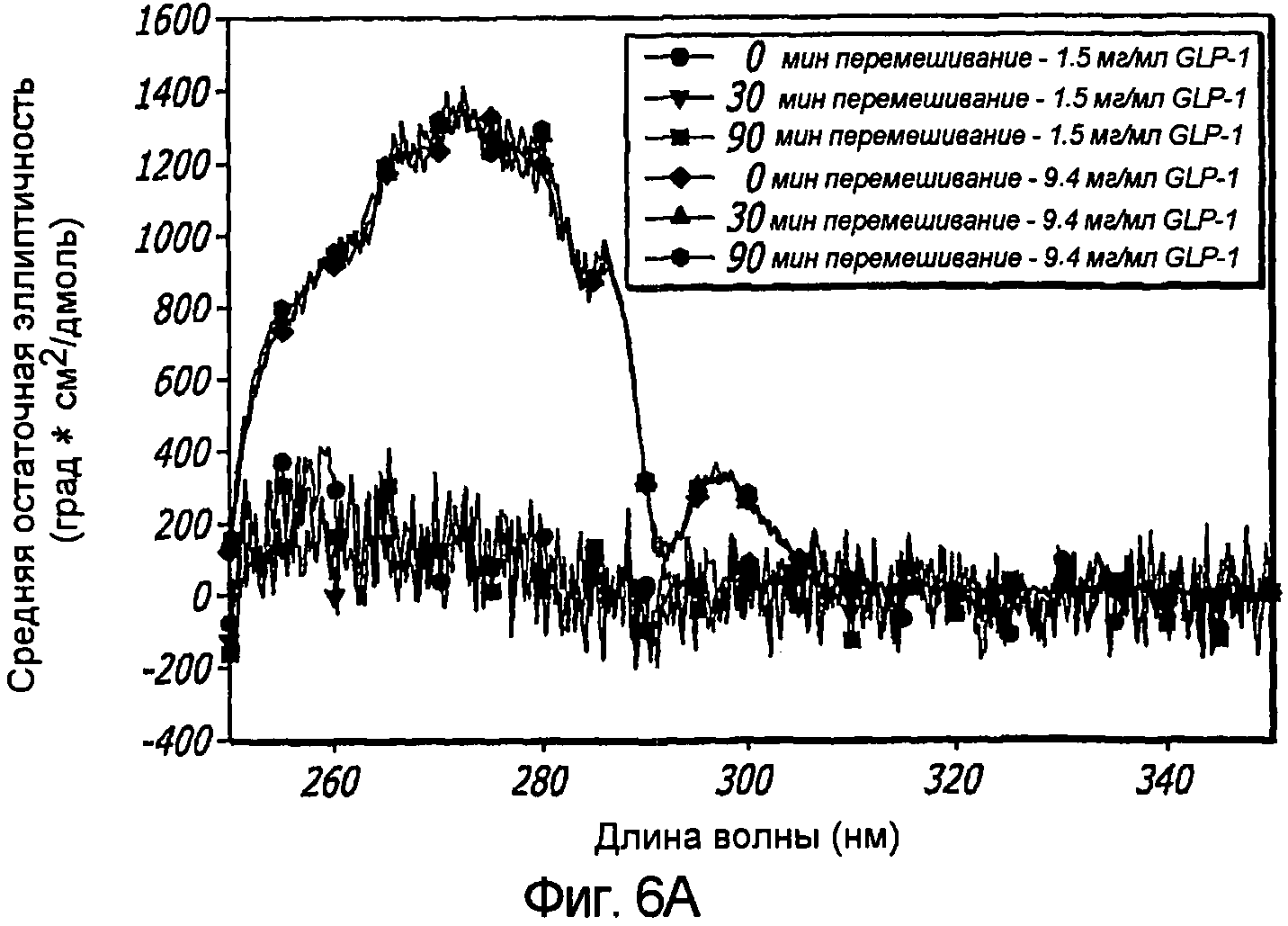
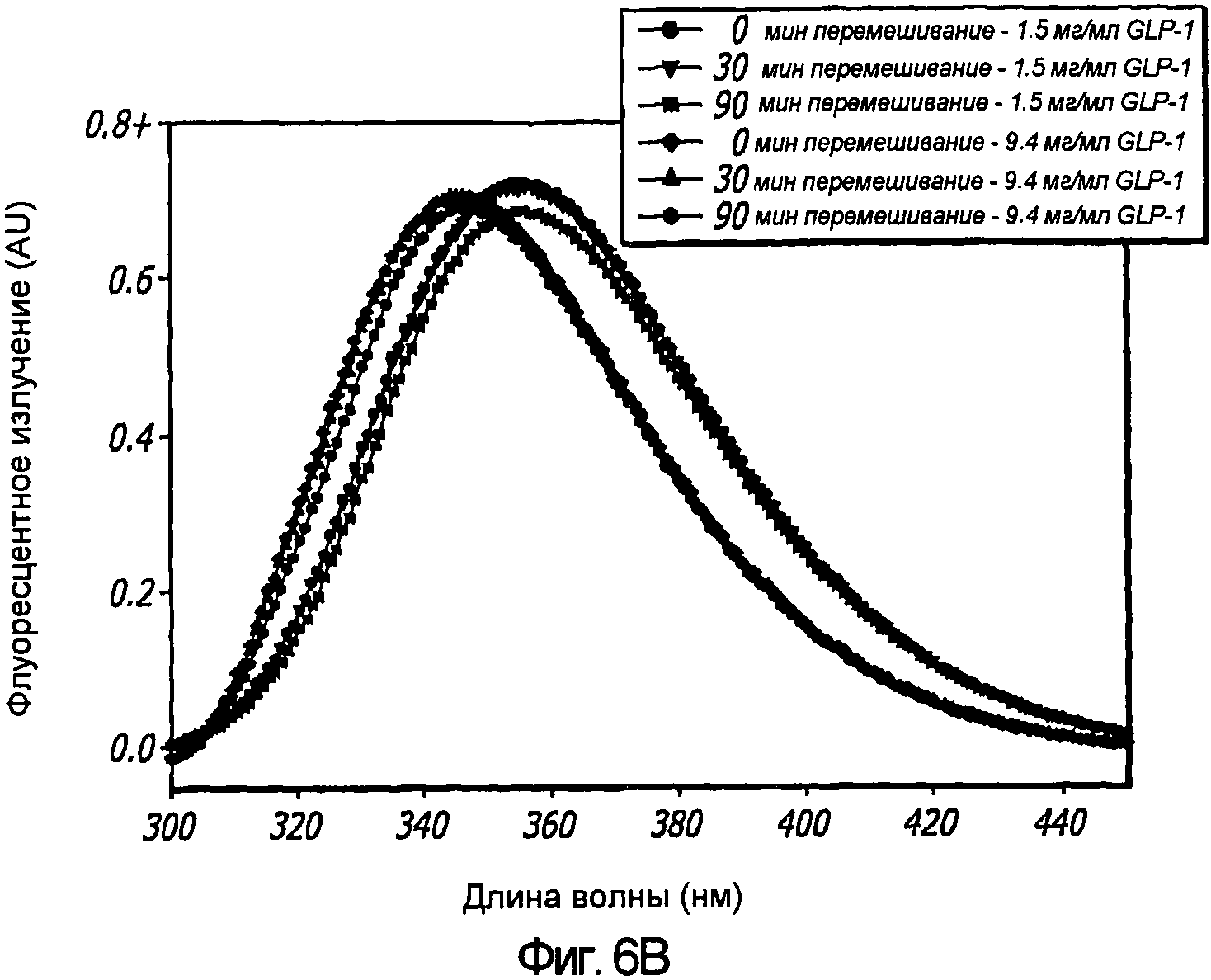
Фиг. 6A-6B. Влияние перемешивания на третичную структуру GLP-1 при концентрациях 1,5 и 9,4 мг/мл (pH 4). КД в ближнем УФ (Фиг. 6A) и флуоресцентное излучение GLP-1 (Фиг. 6B) показали, что третичная структура пептида GLP-1 не подвергается каким-либо значительным изменениям при перемешивании. Образцы перемешивали в течение 30 и 90 минут при комнатной температуре, и после возбуждения триптофана на 280 нм получали спектры флуоресцентного излучения.
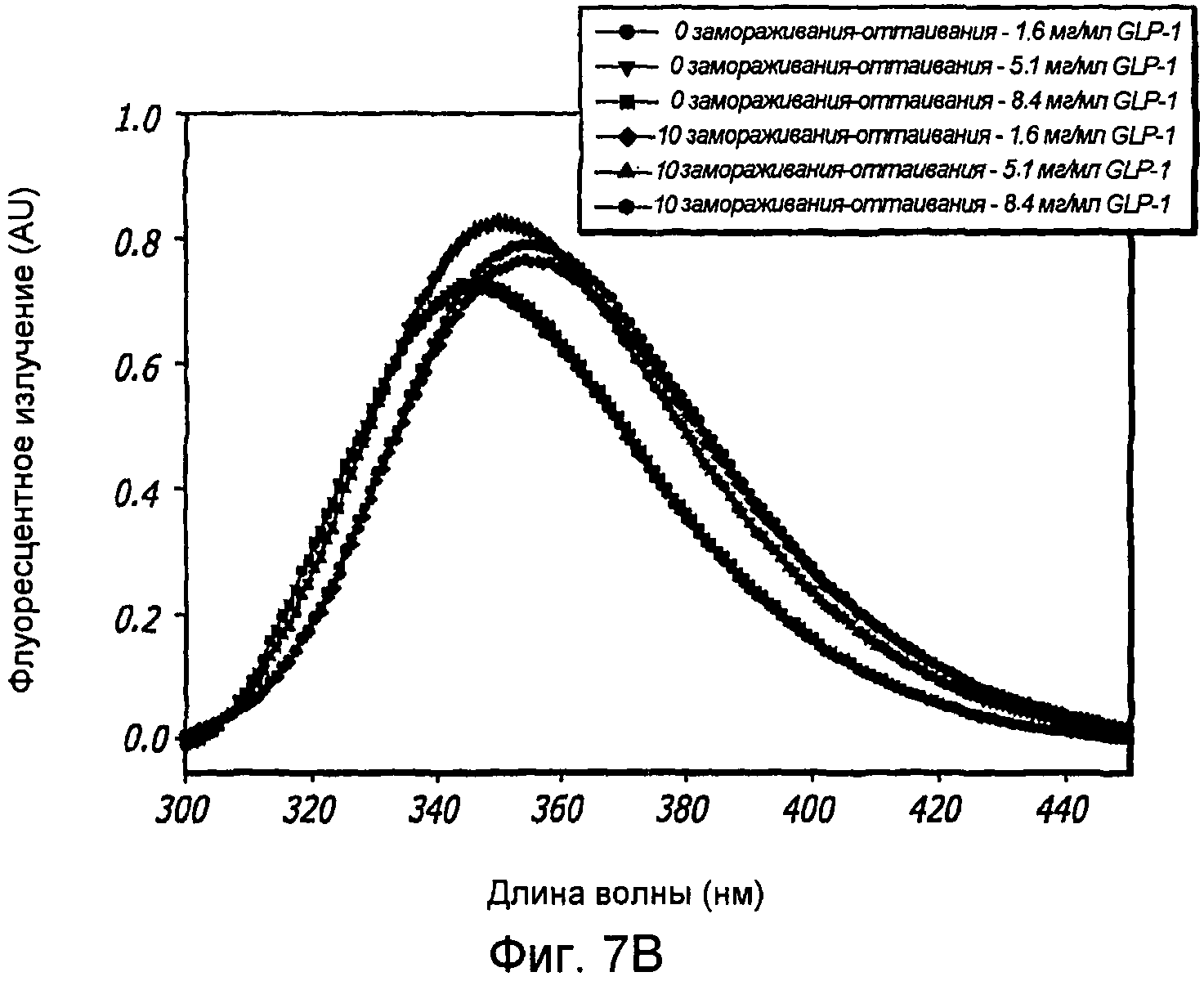
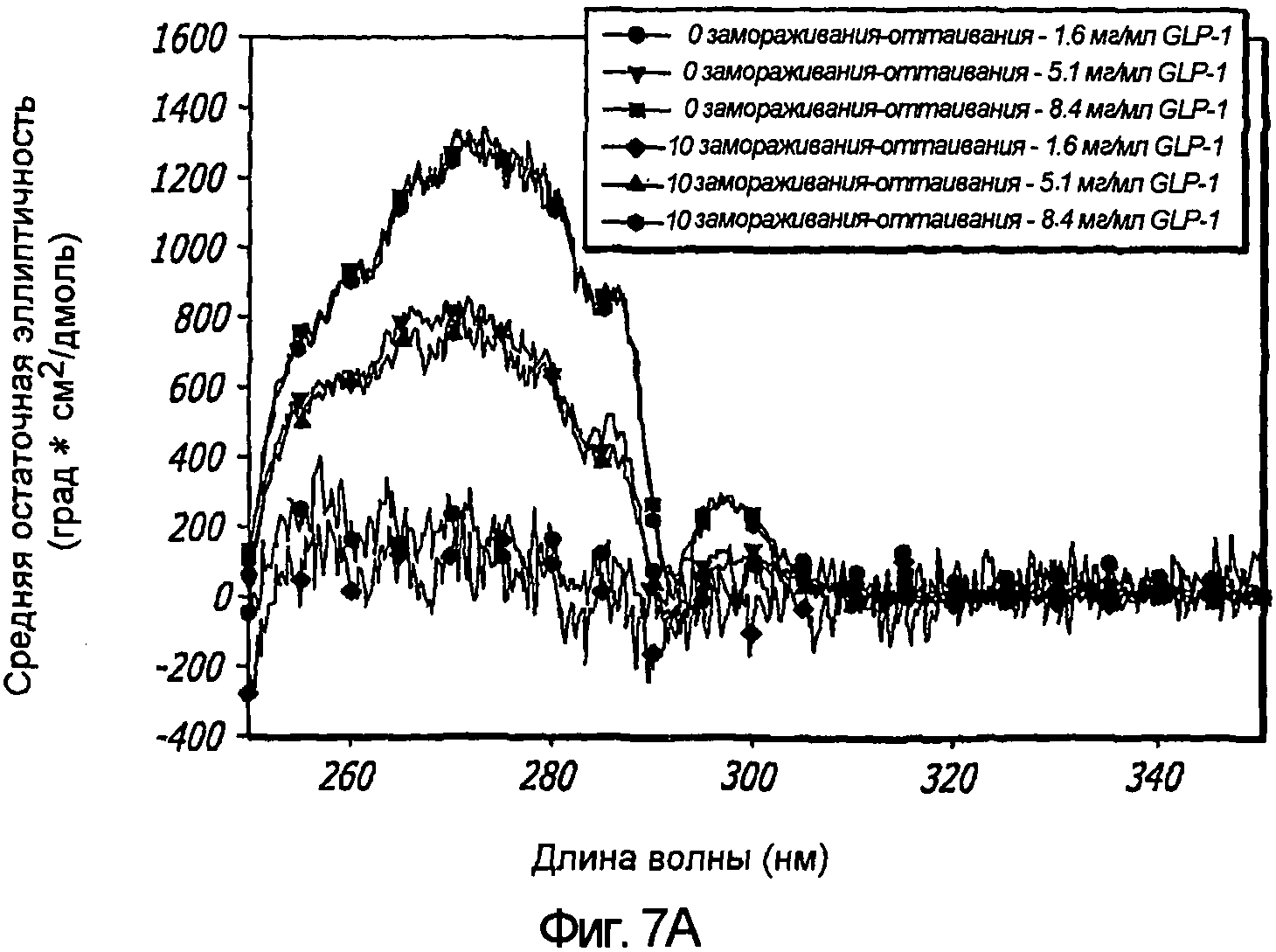
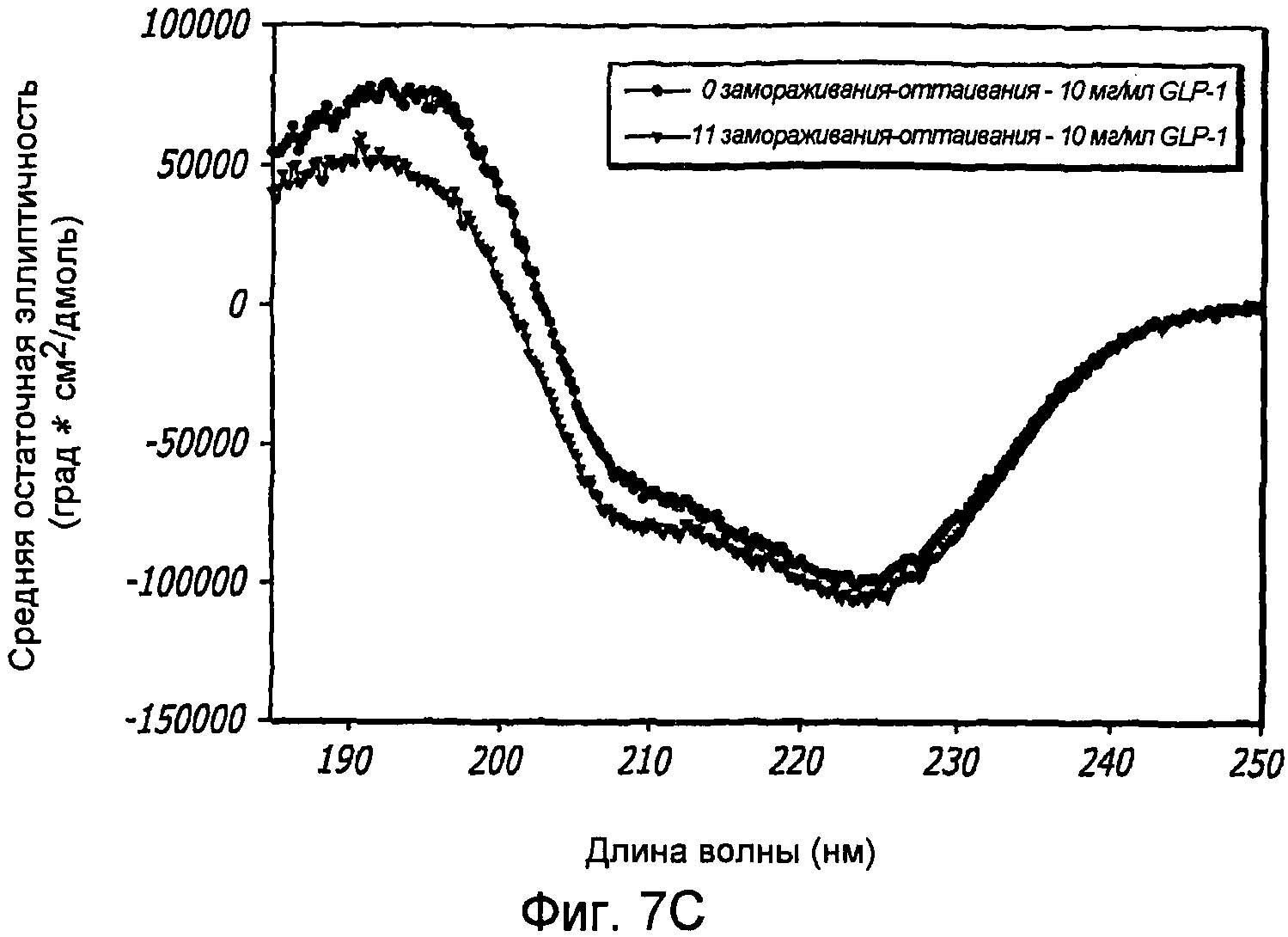
Фиг. 7A-7C. Влияние 10 циклов «замораживания - оттаивания» на третичную структуру GLP-1 при концентрациях 1,6, 5,1 и 8,4 мг/мл (pH 4). КД в ближнем УФ (Фиг. 7A) и флуоресцентное излучение GLP-1 (Фиг. 7B) показали, что третичная структура данного пептида не подвергается каким-либо значительным изменениям при проведении множества циклов «замораживания - оттаивания». Образцы замораживали при -20°С и размораживали при комнатной температуре. После возбуждения триптофана на 280 нм получали спектры флуоресцентного излучения. Аналогичные эксперименты по влиянию 11 циклов «замораживания - оттаивания» на вторичную структуру GLP-1 (рН4) при концентрации 10 мг/мл были проведены методом КД в далеком УФ (Фиг. 7C).
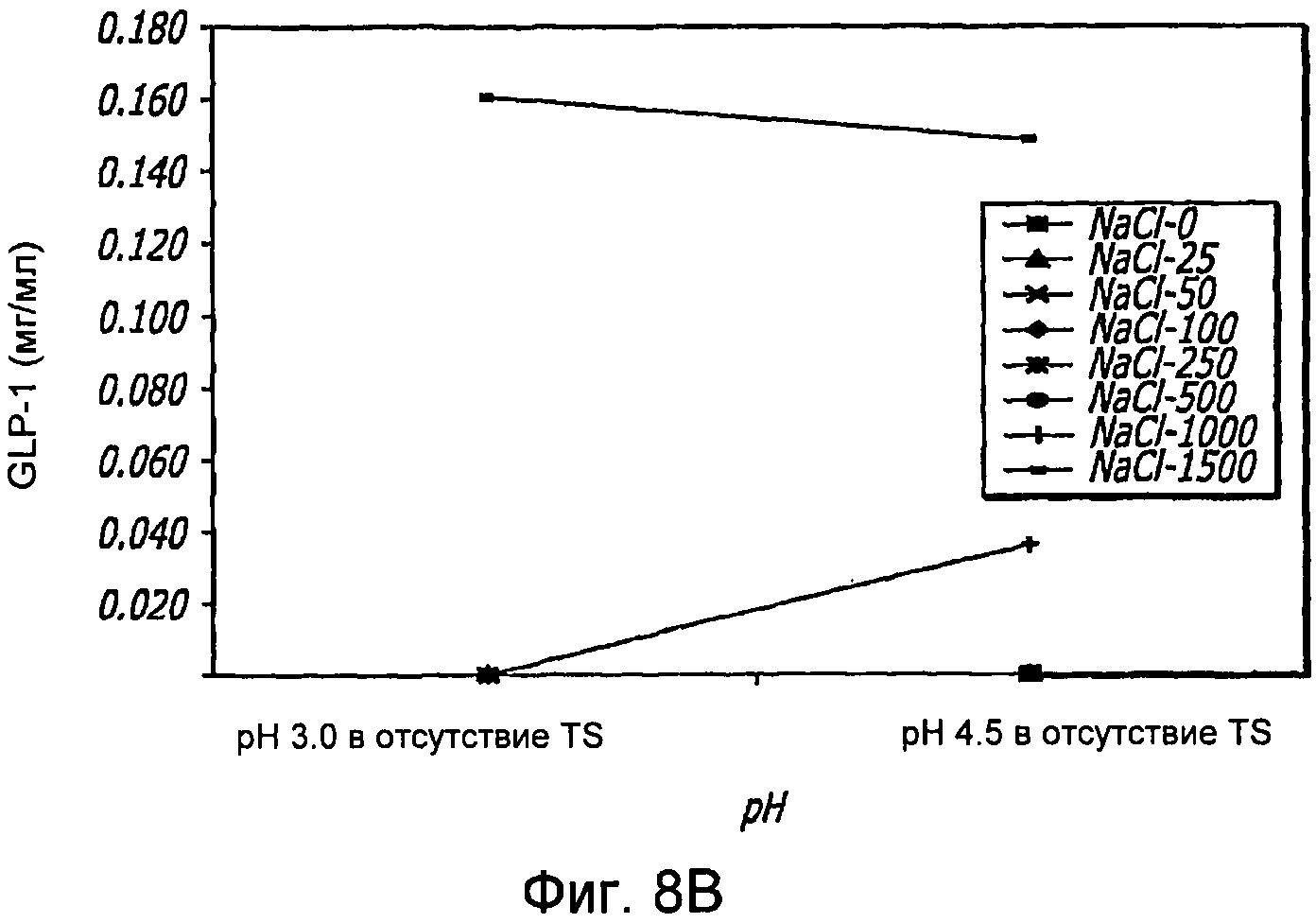
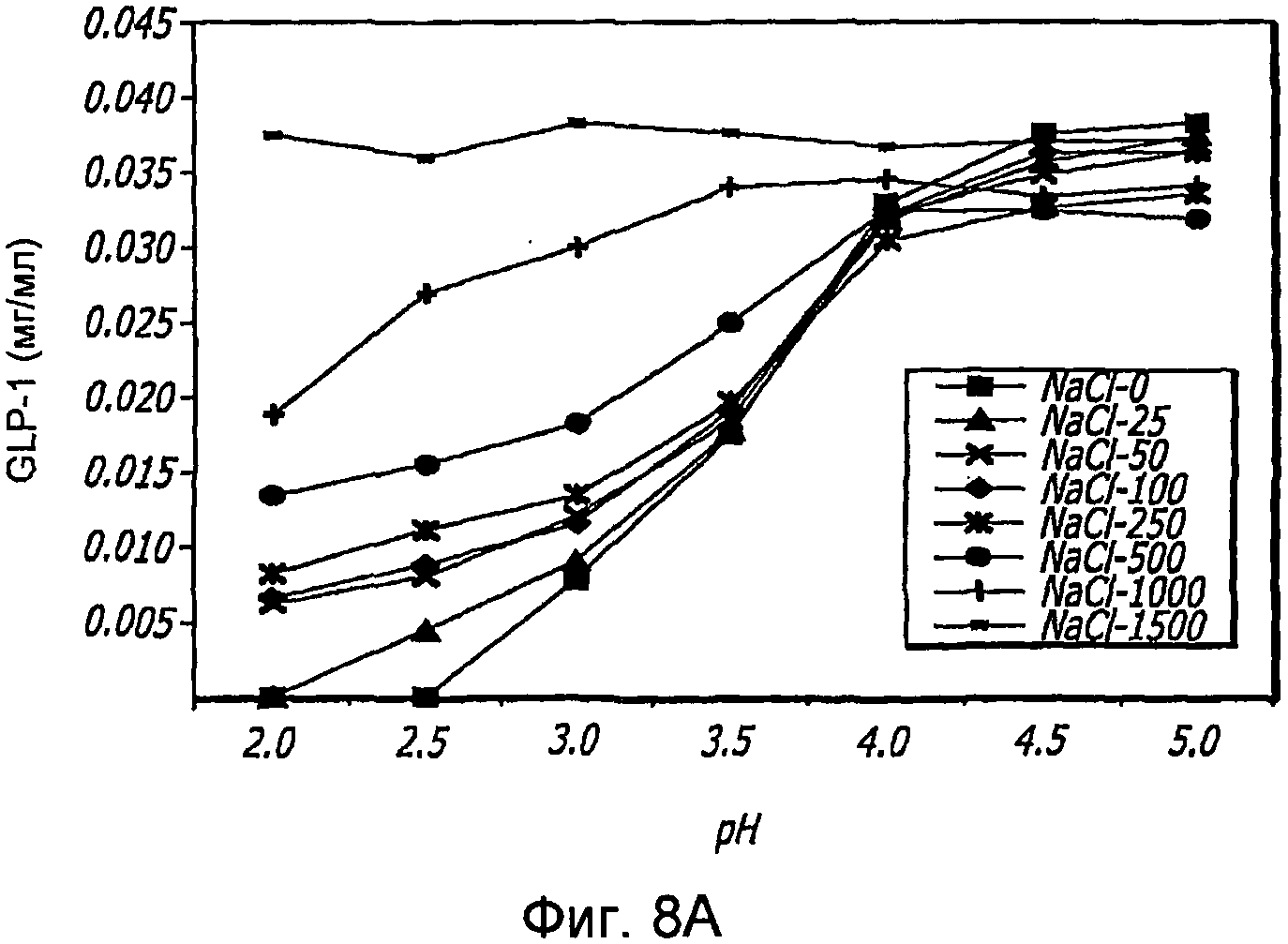
Фиг. 8A-8B. Исследование солей. Кривые загрузки GLP-1/FDKP в зависимости от pH и концентрации NaCl (Фиг. 8A). Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1. Концентрации NaCl выражали в мМ. Фиг. 8B - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH и концентрации NaCl.
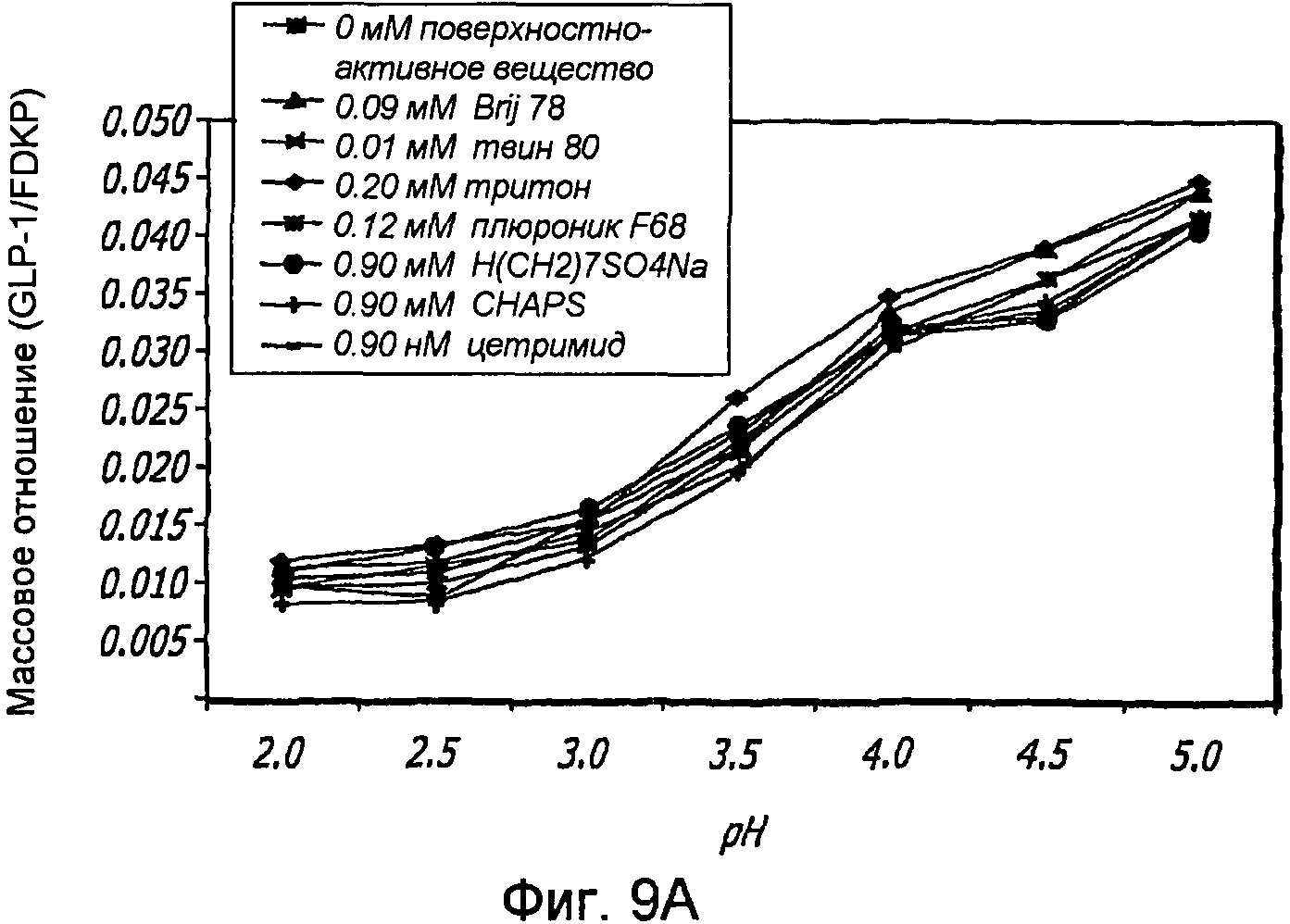
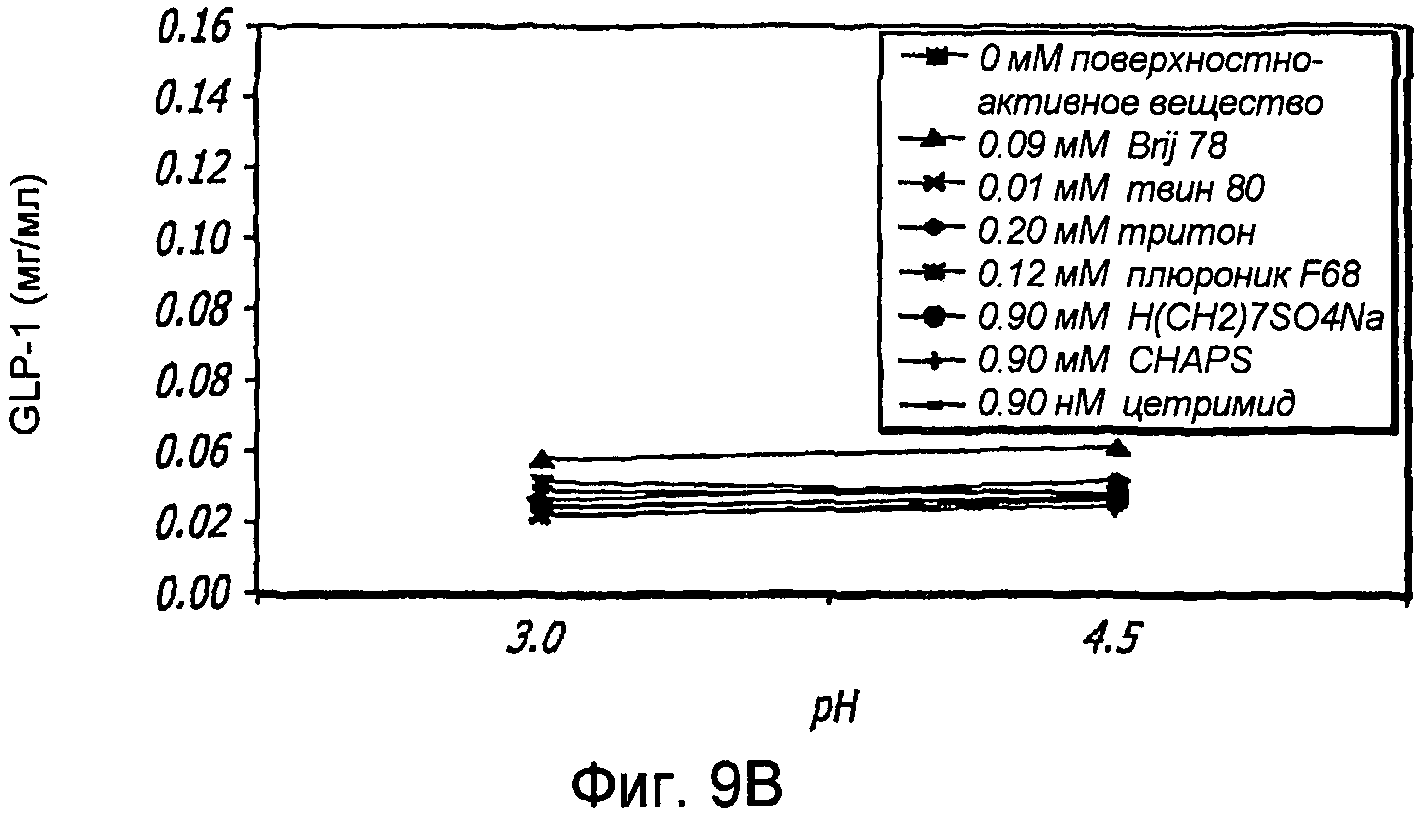
Фиг. 9A-9B. Исследование поверхностно-активных веществ. Кривые загрузки GLP-1/FDKP в зависимости от pH и поверхностно-активного вещества (Фиг. 9A). Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1. Фиг. 9B - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH и добавленного поверхностно-активного вещества.
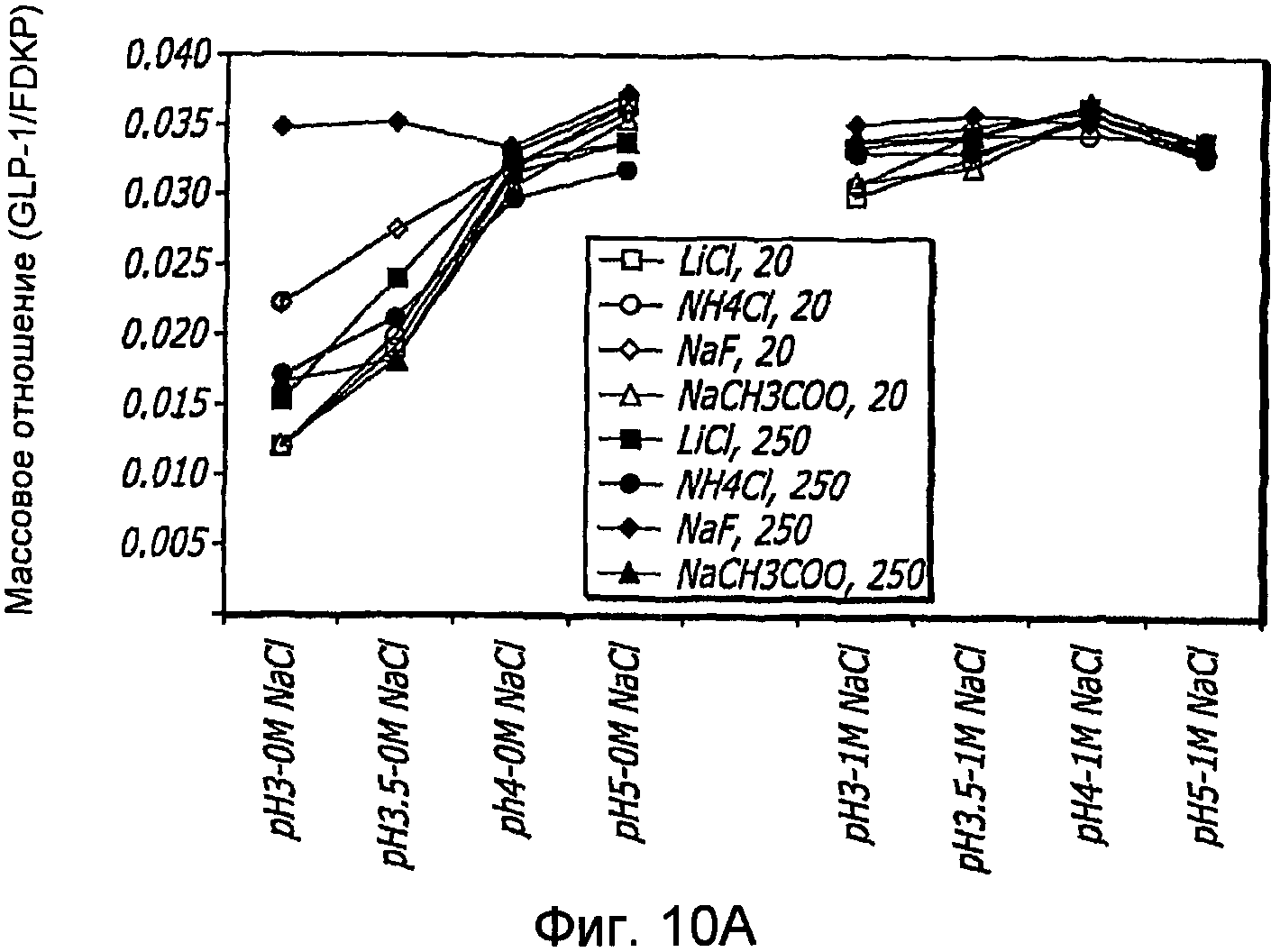
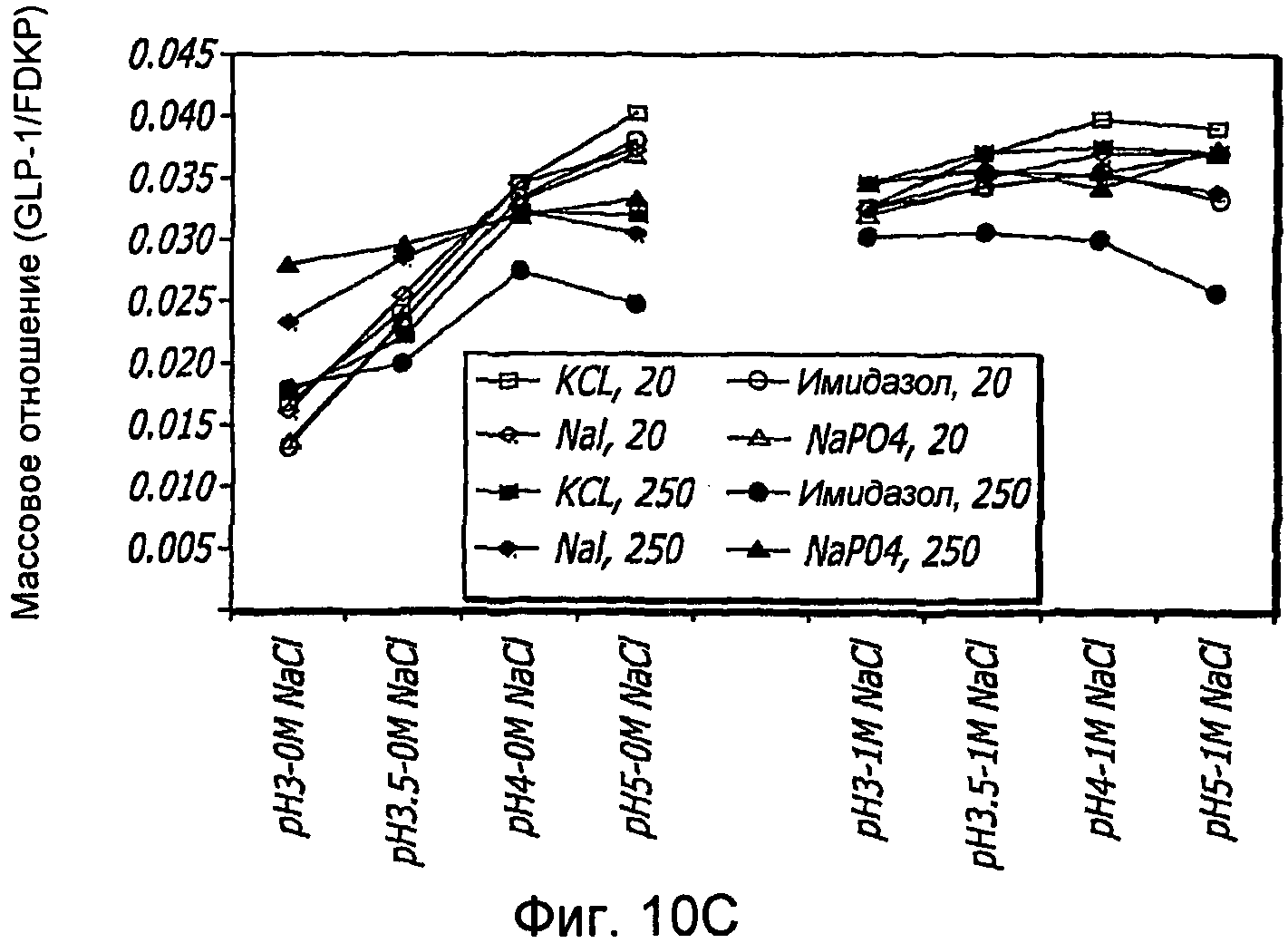
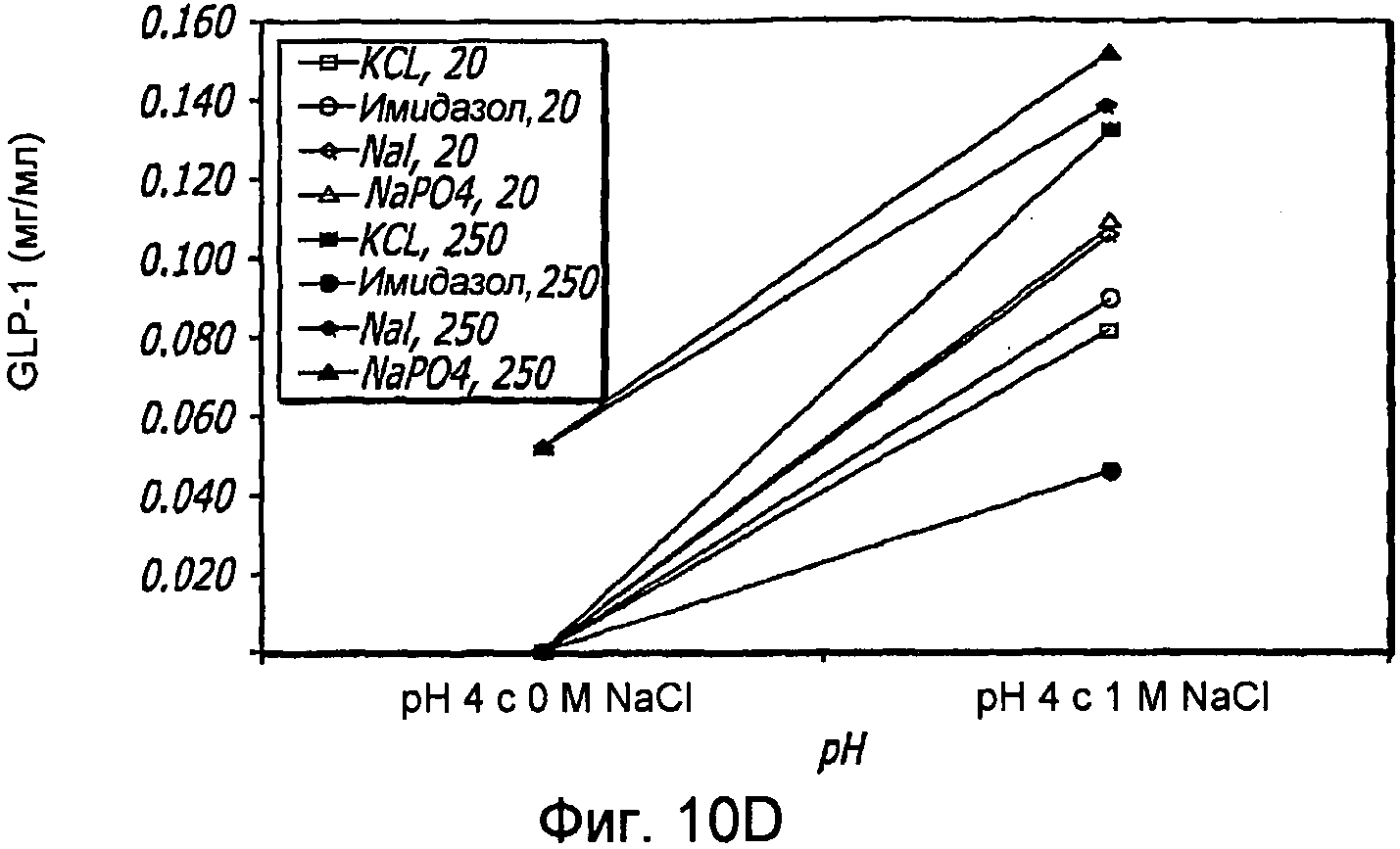
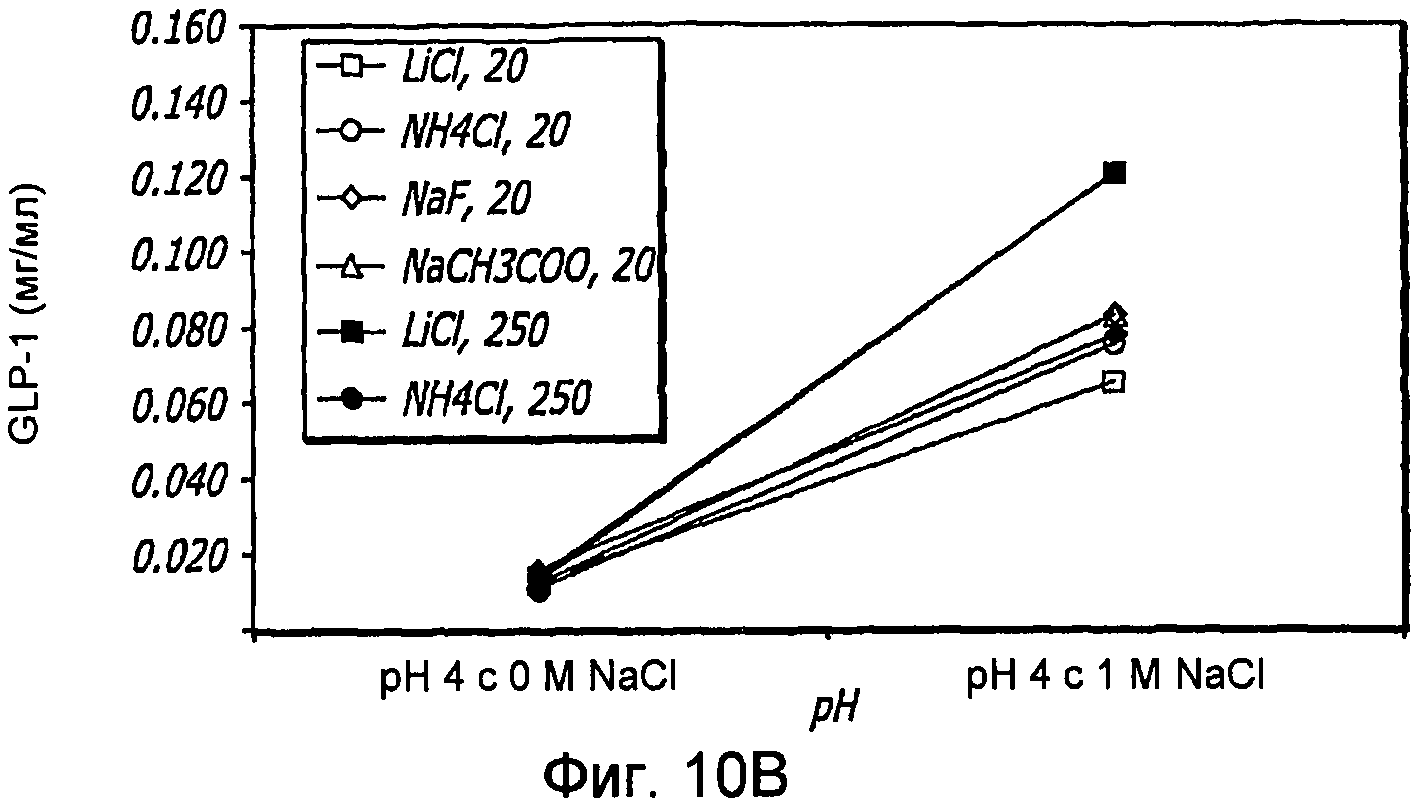
Фиг. 10A-10D. Исследование ионов. Кривые загрузки GLP-1/FDKP в зависимости от pH и ионов. Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1 (фиг.10А и 11С). Концентрации ионов указаны в надписях к графическому материалу (мМ). На кривых, расположенных справа, представлены результаты для 1М NaCl. Фиг. 10В и 10D - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH, ионов и 1М NaCl.
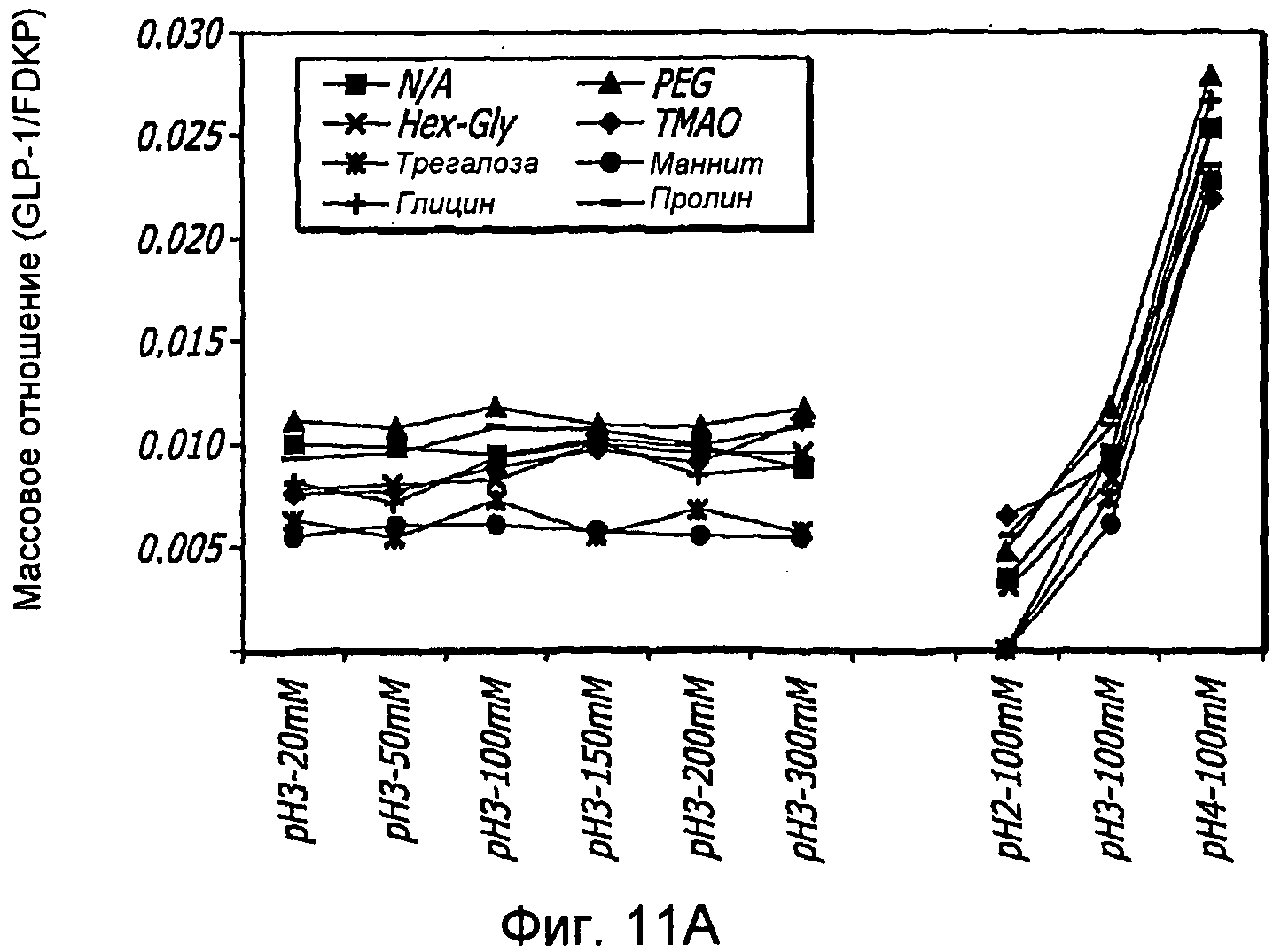
Фиг. 11-11В. Исследование осмолитов. Кривые загрузки GLP-1/FDKP в зависимости от pH и от присутствия общих стабилизаторов (осмолитов; фиг.11А). Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1. Фиг. 11В. - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH и осмолитов. «N/A» означает отсутствие осмолитов в образце.
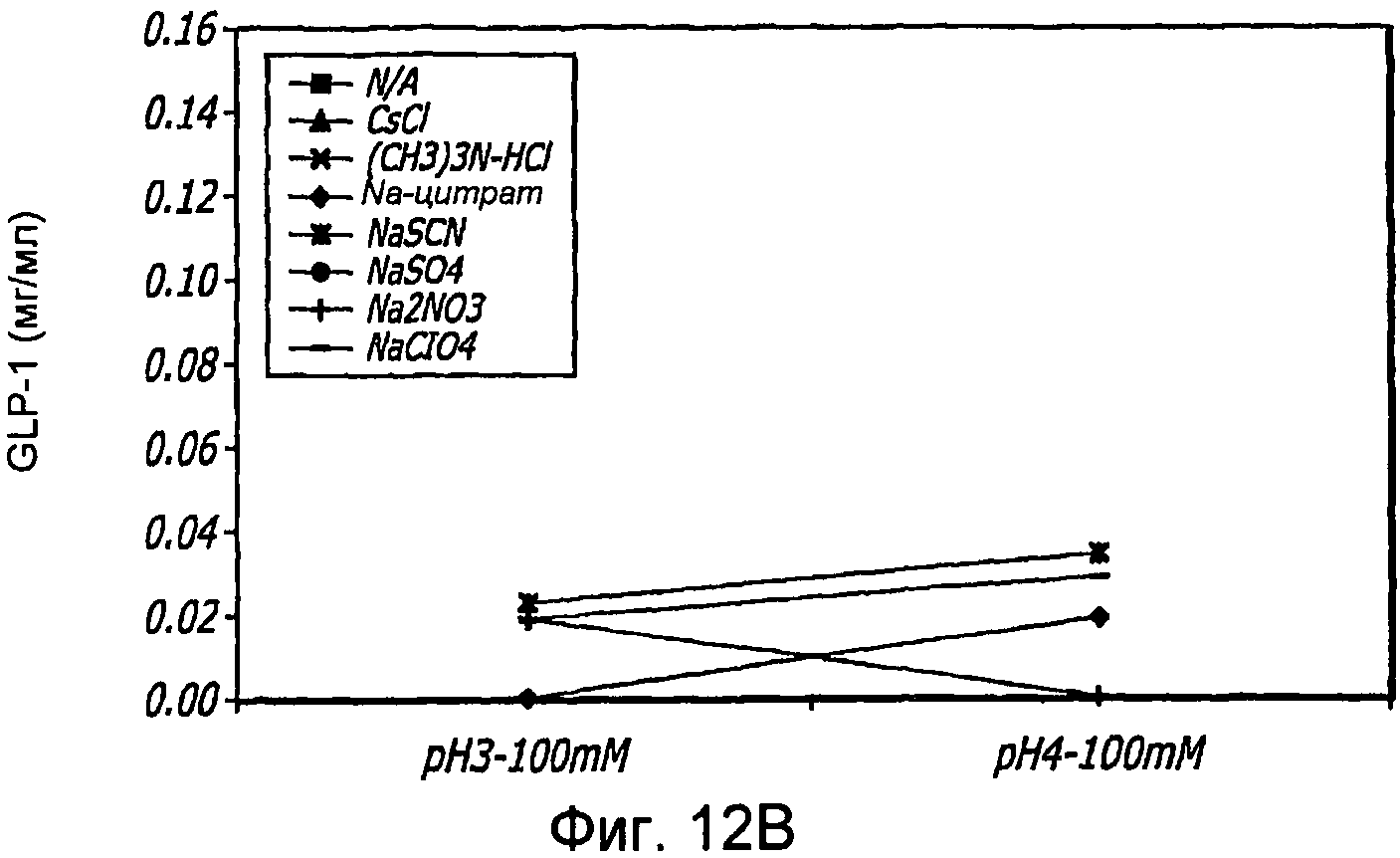
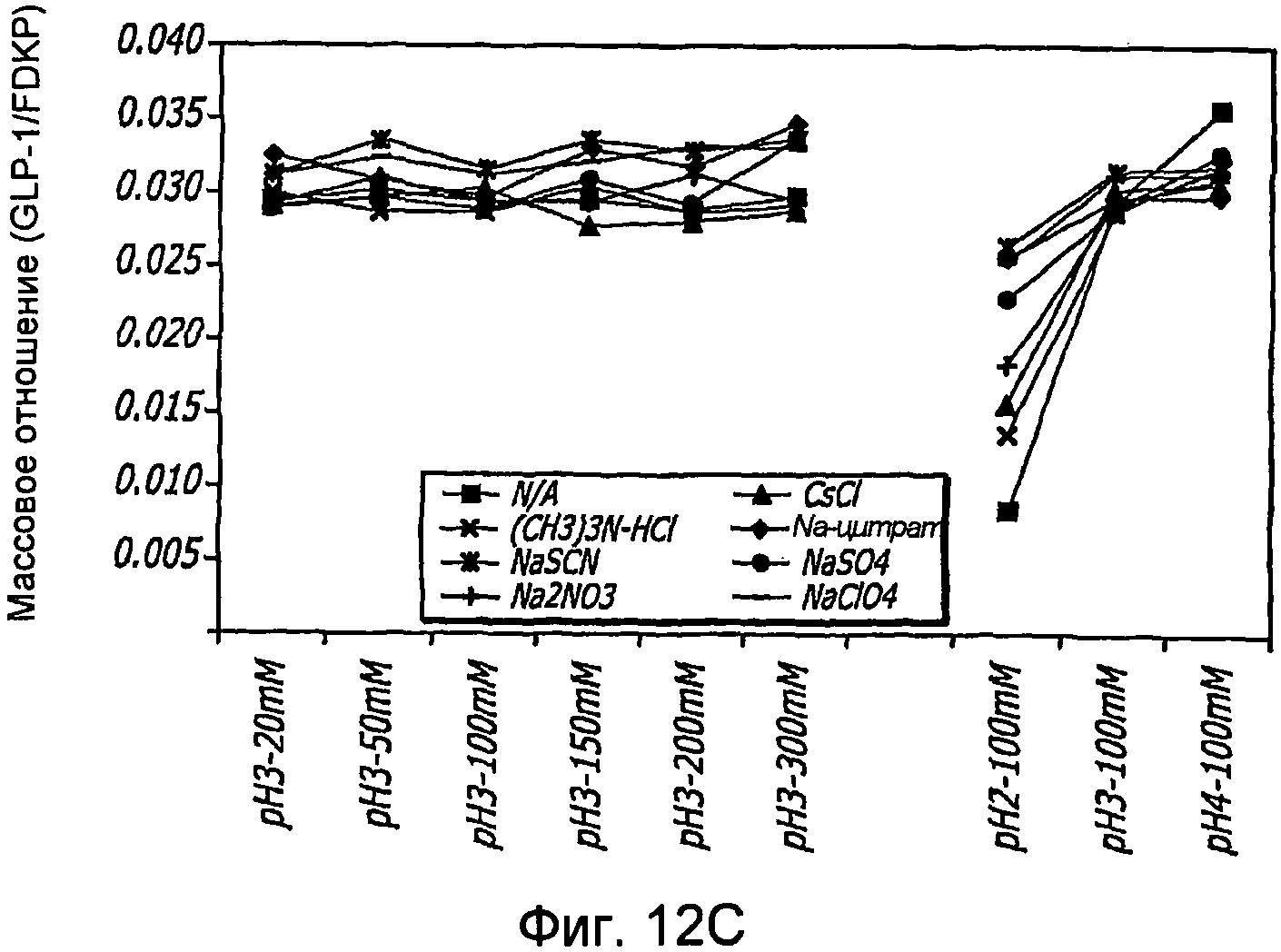
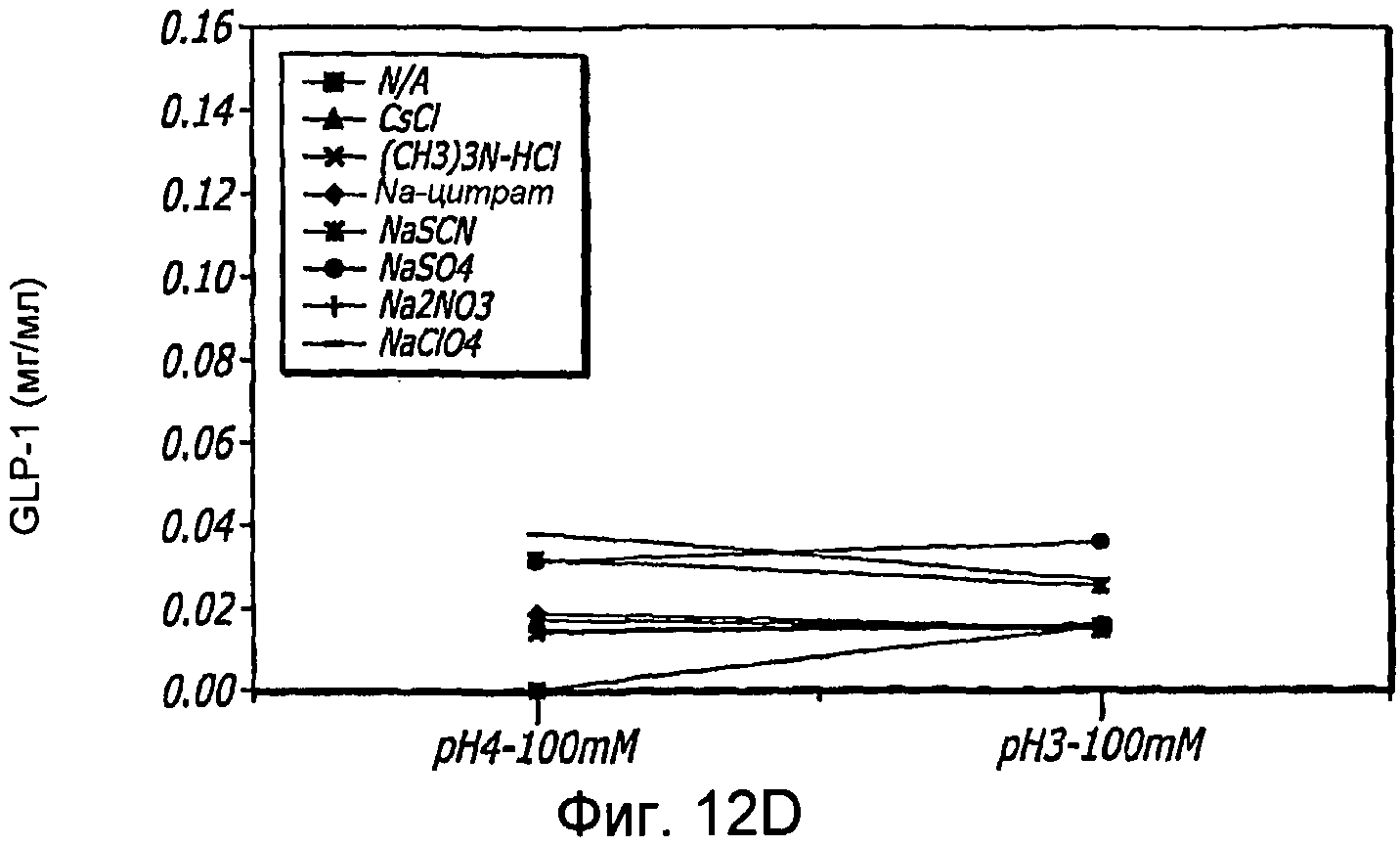
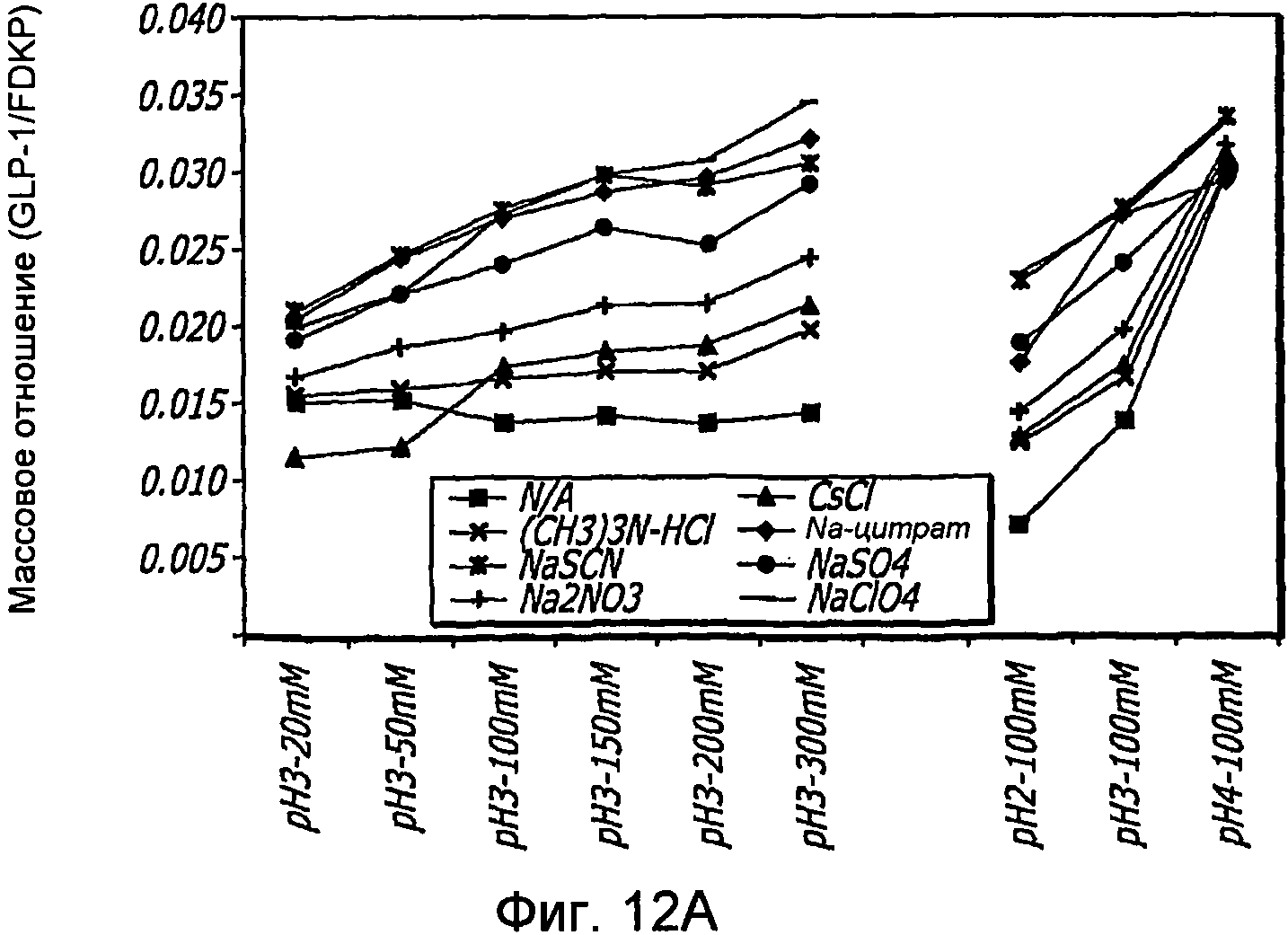
Фиг. 12A-12B. Исследование хаотропов/лиотропов. Кривые загрузки GLP-1/FDKP в зависимости от концентрации хаотропов или лиотропов при рН 3,0 (фиг.12А) и рН 4,0 (Фиг. 12C). Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1. Фиг. 12В и 12D. - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH в присутствии различных хаотропов или лиотропов. «N/A» означает отсутствие хаотропов или лиотропов в образце.
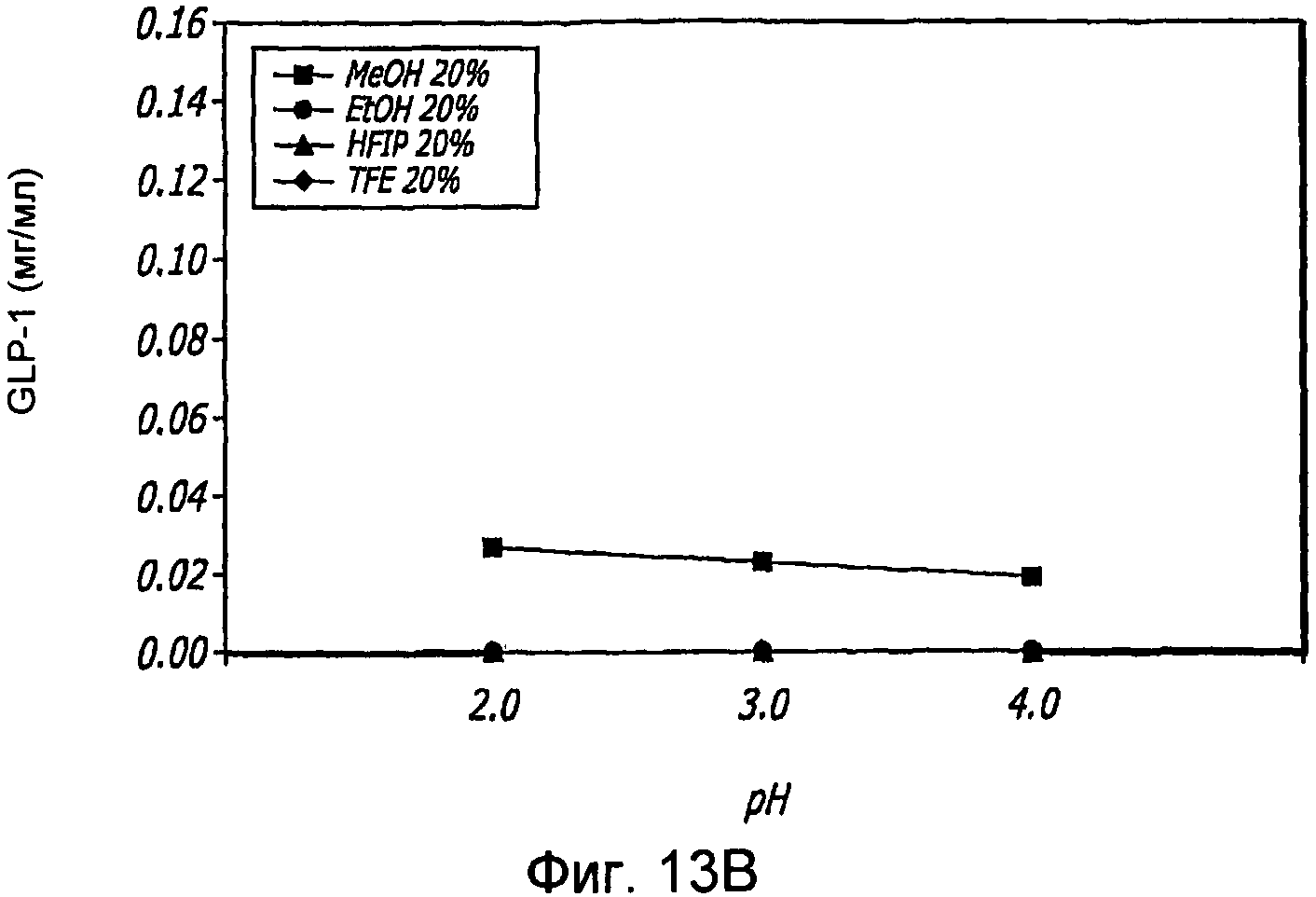
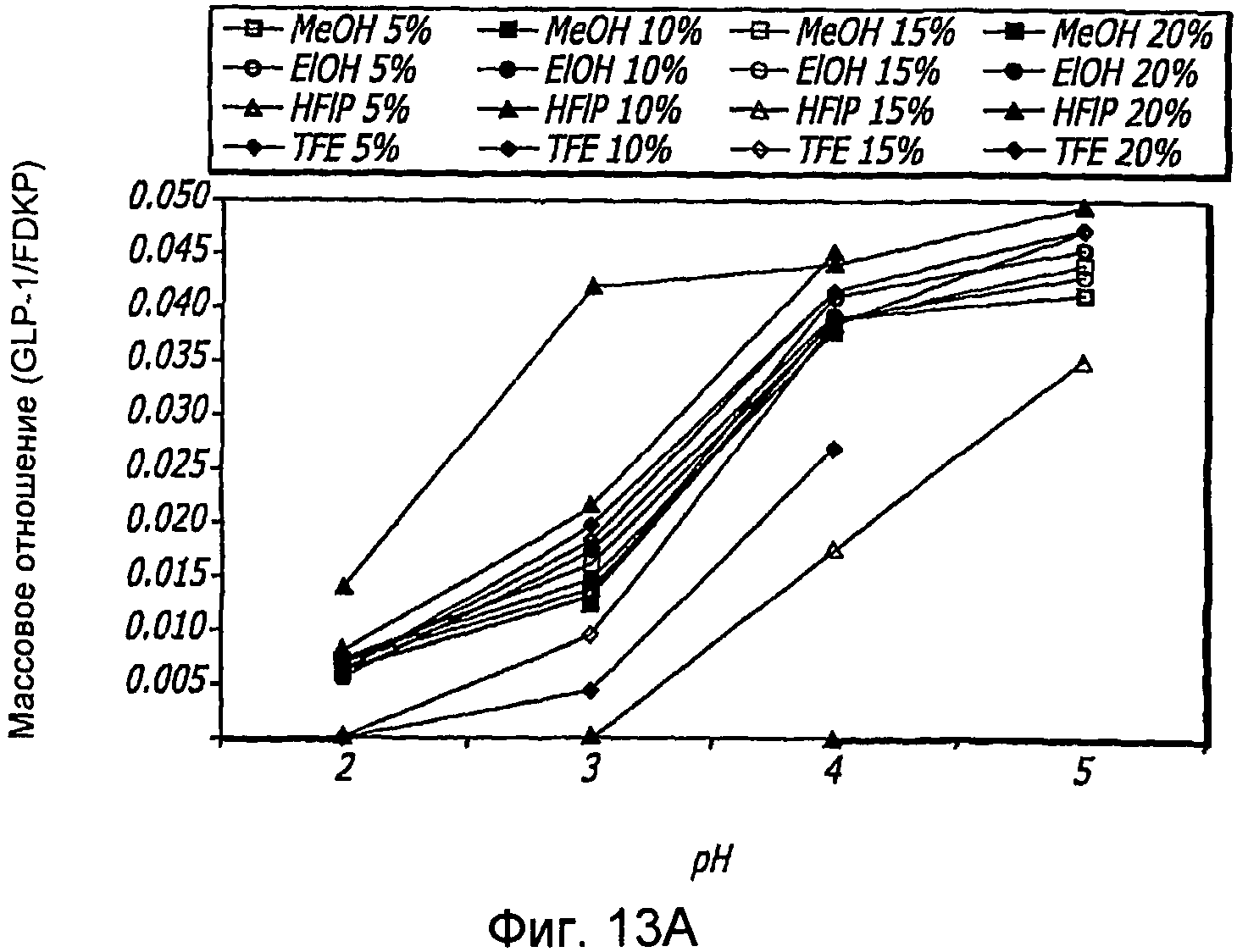
Фиг. 13A-13B. Исследование спиртов. Кривые загрузки GLP-1/FDKP в зависимости от pH и от спиртов. Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1. Были оценены четыре концентрации для каждого спирта, 5%, 10%, 15% и 20% об/об. (Фиг. 13A). TFE=трифторэтанол; HFIP=гексафторизопропанол. Фиг. 13B - Указано количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH и спирта (20%).
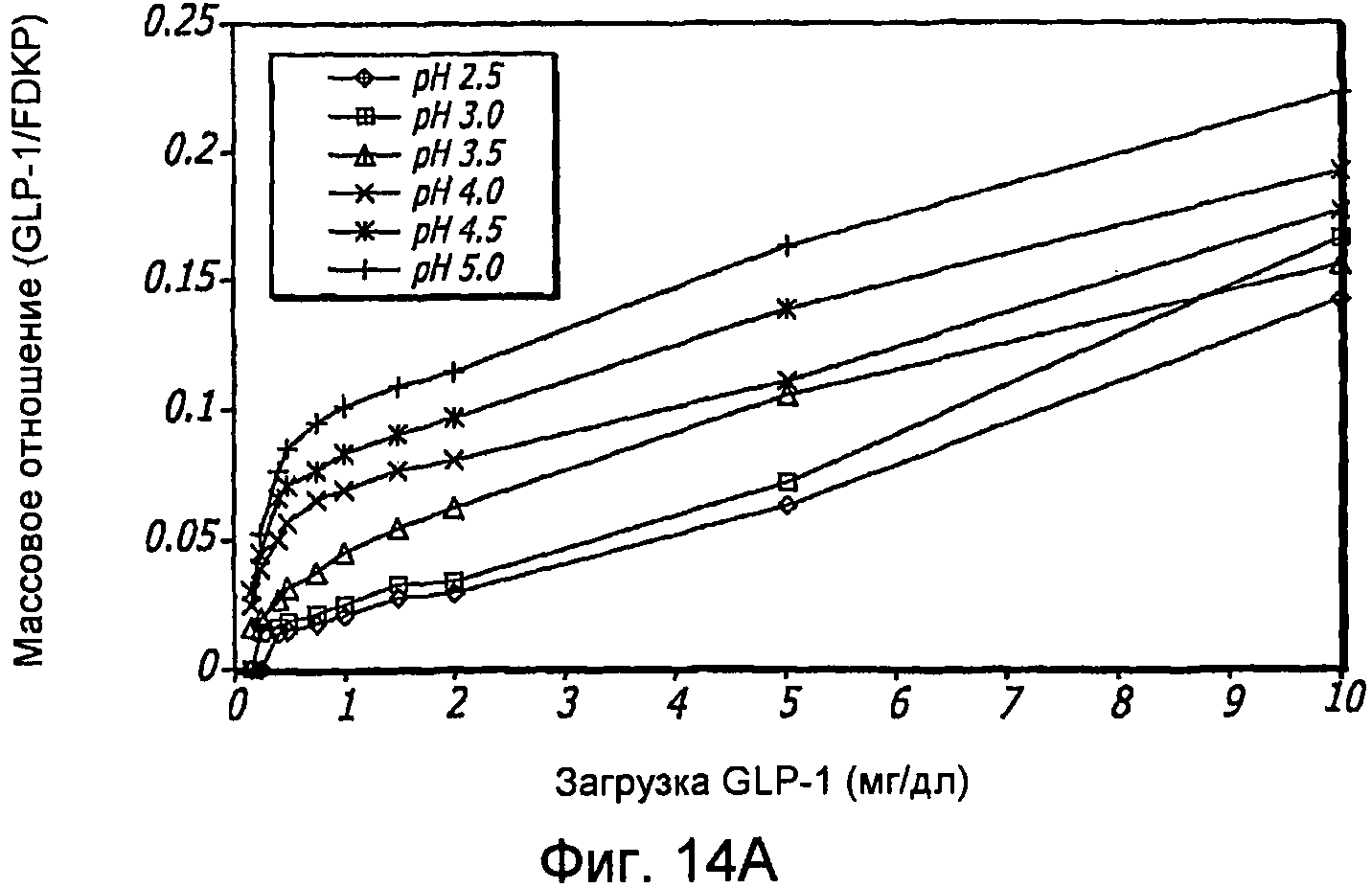
Фиг. 14A-14B. Исследование загрузки концентраций GLP-1/FDKP (Фиг. 14A). Загрузку осуществляли при 5 мг/мл FDKP, и анализируемую концентрацию GLP-1 откладывали по оси Х. Фиг. 14B - Изображения множества прапаратов GLP-1/FDKP, полученные с помощью сканирующей электронной микроскопии (СЭМ) (при увеличении 10000x), указывают на образование скоплений сферических и палочко-подобных GLP-1/FDKP-частиц, используемых в качестве препаратов. (Панель A) - 0,5 мг/мл GLP-1 и 2,5 мг/мл FDKP; (панель B) 0,5 мг/мл GLP-1 и 10 мг/мл FDKP; (панель C) 0,5 мг/мл GLP-1 и 10 мг/мл FDKP в 20 мМ хлорида натрия, 20 мМ ацетата калия и 20 мМ фосфата калия, pH 4,0; и (панель D) 10 мг/мл GLP-1 и 50 мг/мл FDKP в 20 мМ хлорида натрия, 20 мМ ацетата калия и 20 мМ фосфата калия, pH 4,0.
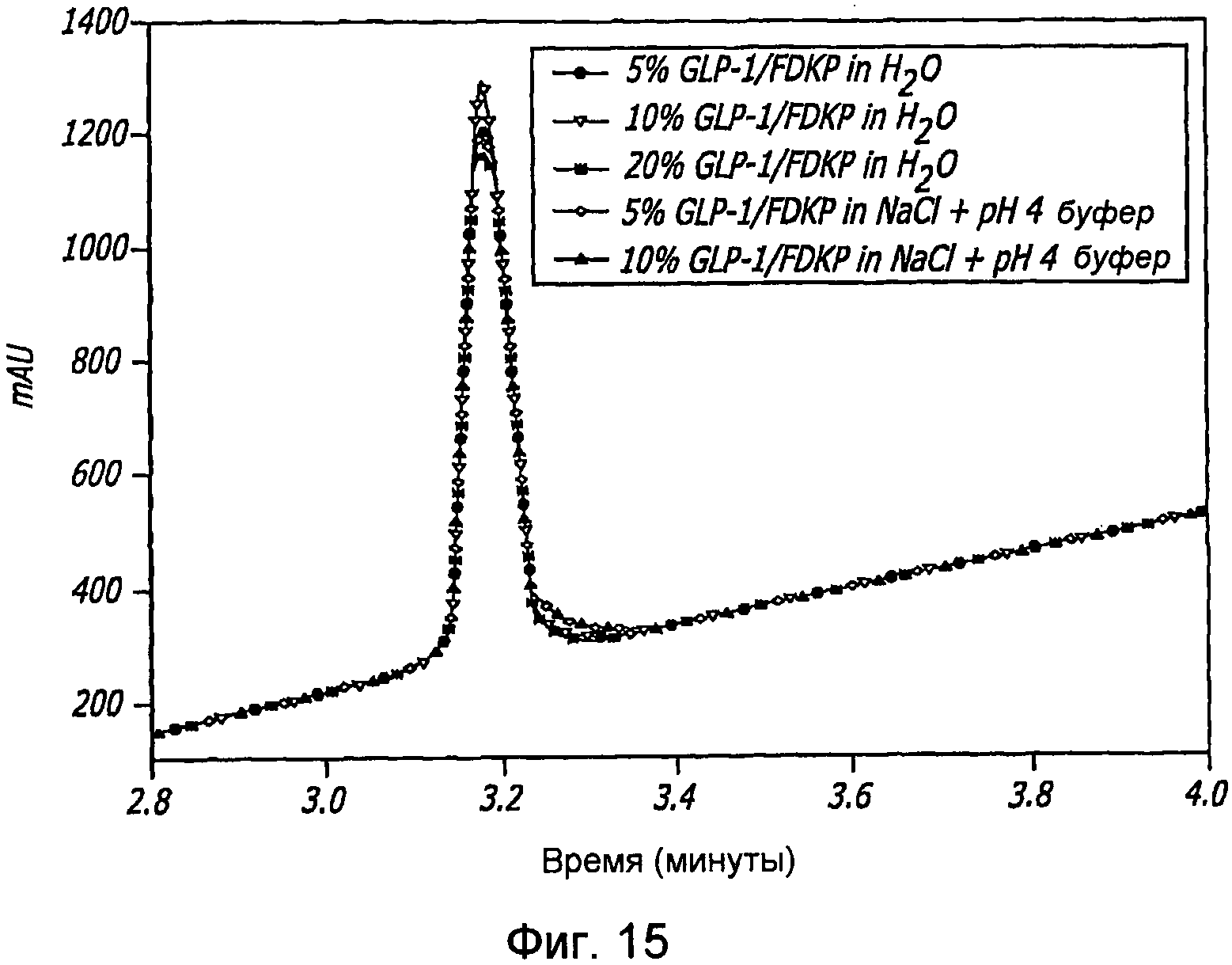
Фиг. 15. Показано влияние стресса на множество препаратов GLP-1/FDKP. Указано процентное содержание (по массе) GLP-1 по отношению к частицам FDKP и к другим компонентам, которые присутствовали в растворе до лиофилизации. Образцы инкубировали в течение 10 дней при 40°С.
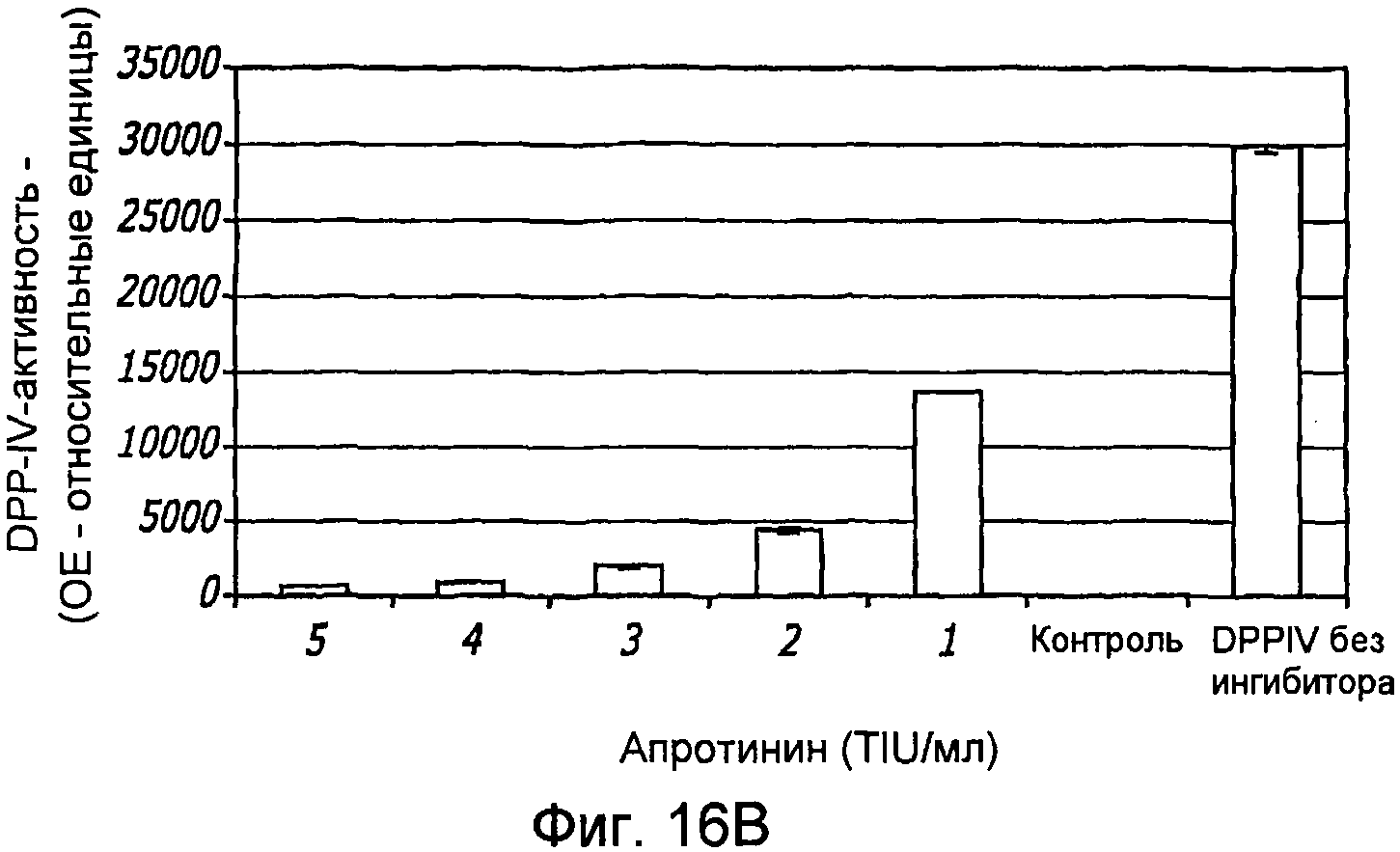
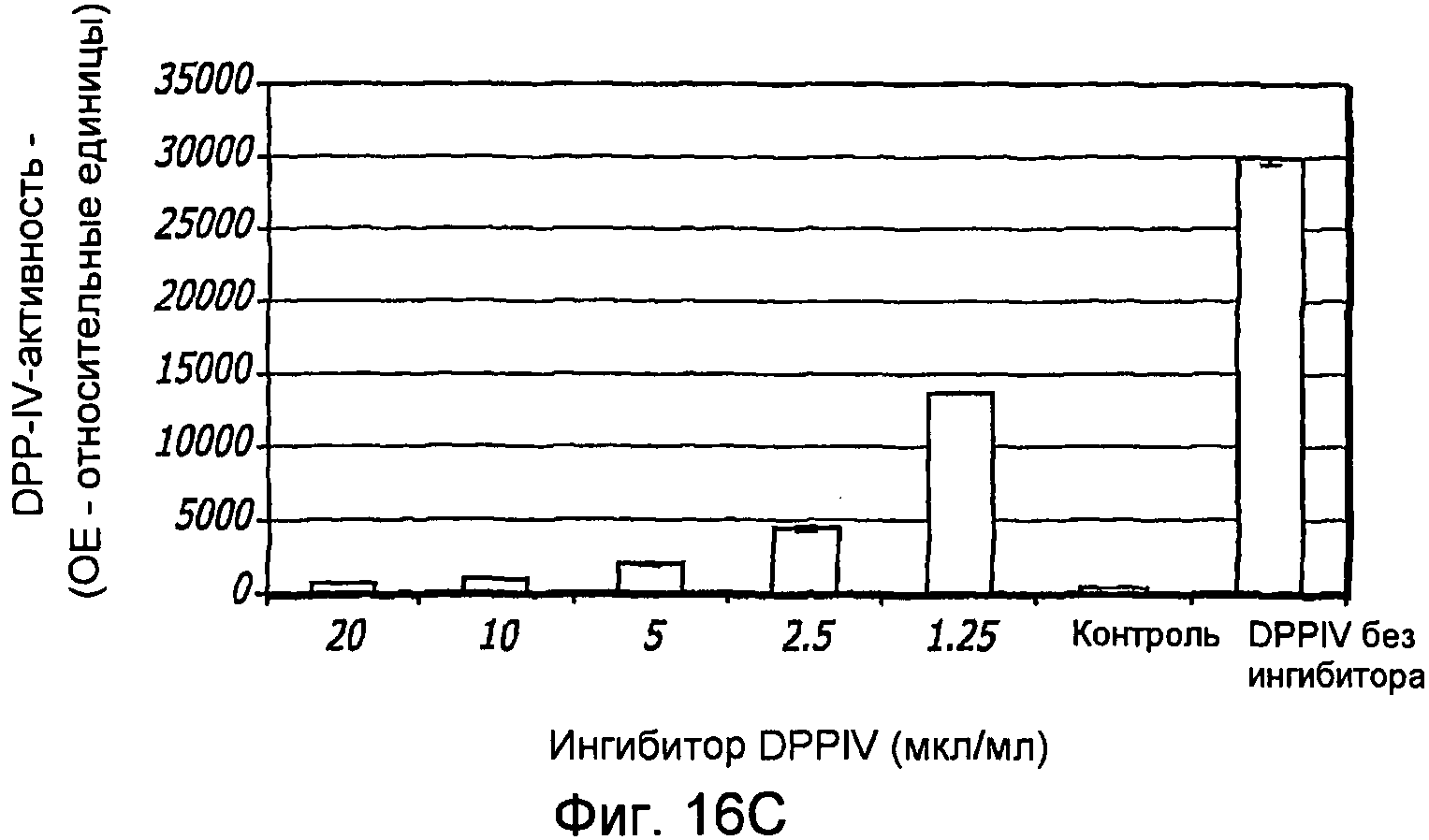
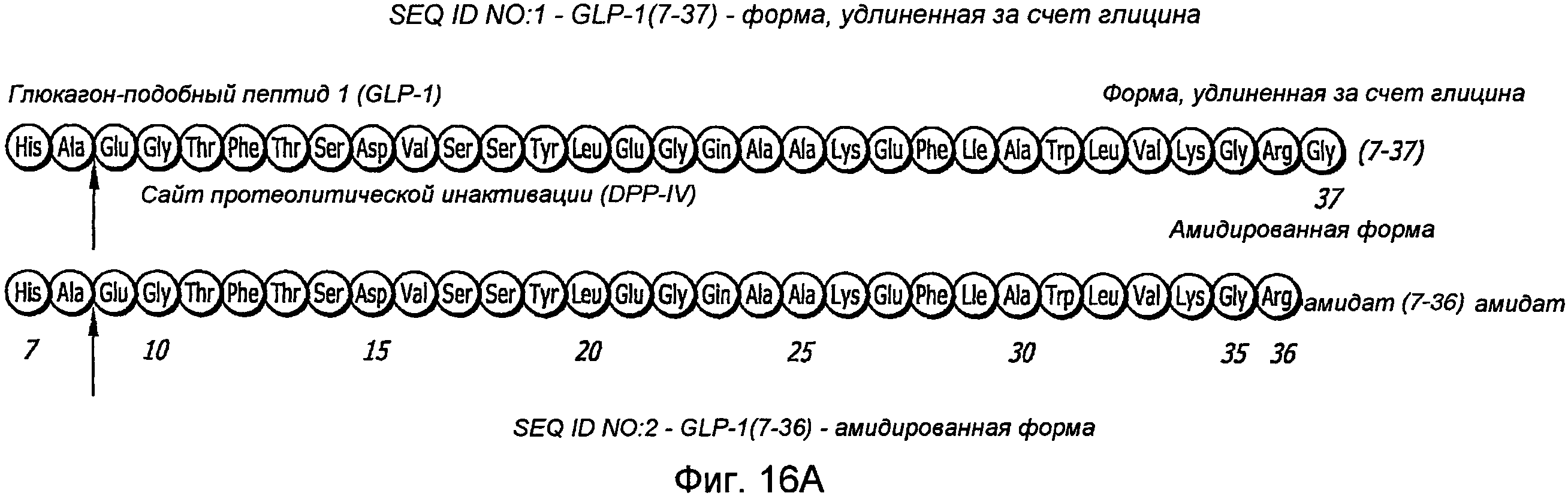
Фиг. 16A-16C. Структура GLP-1. Фиг. 16A - Показана удлиненная за счет глицина форма GLP-1 (SEQ ID NO.1) и амидированная форма (SEQ ID NO. 2). Фиг. 16B - Ингибирование DPP-IV-активности апротинином. Фиг. 16C - Ингибирование DPP-IV-активности ингибитором DPPIV.
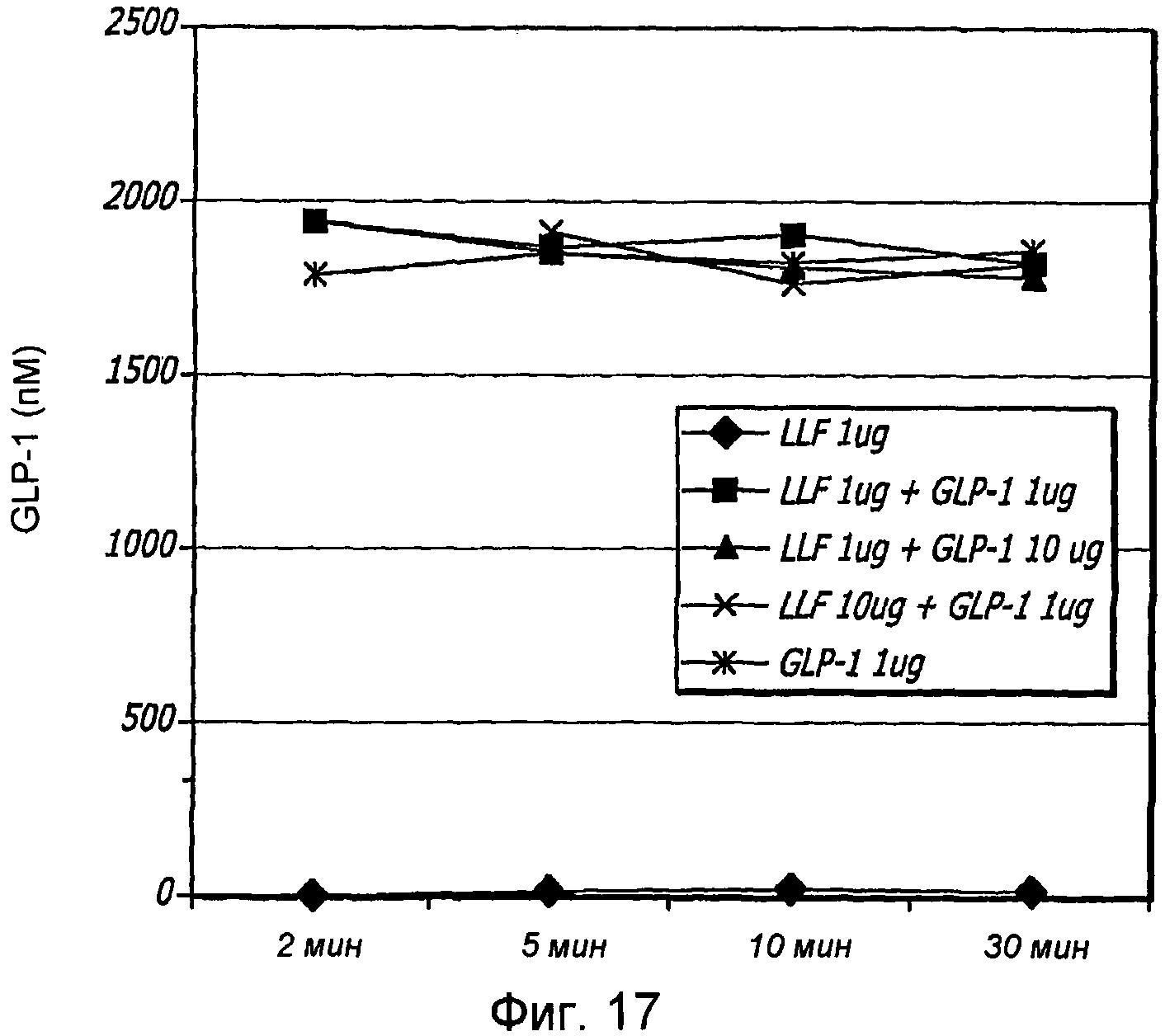
Фиг. 17. Обнаружение GLP-1 после инкубирования в легочном лаваже.
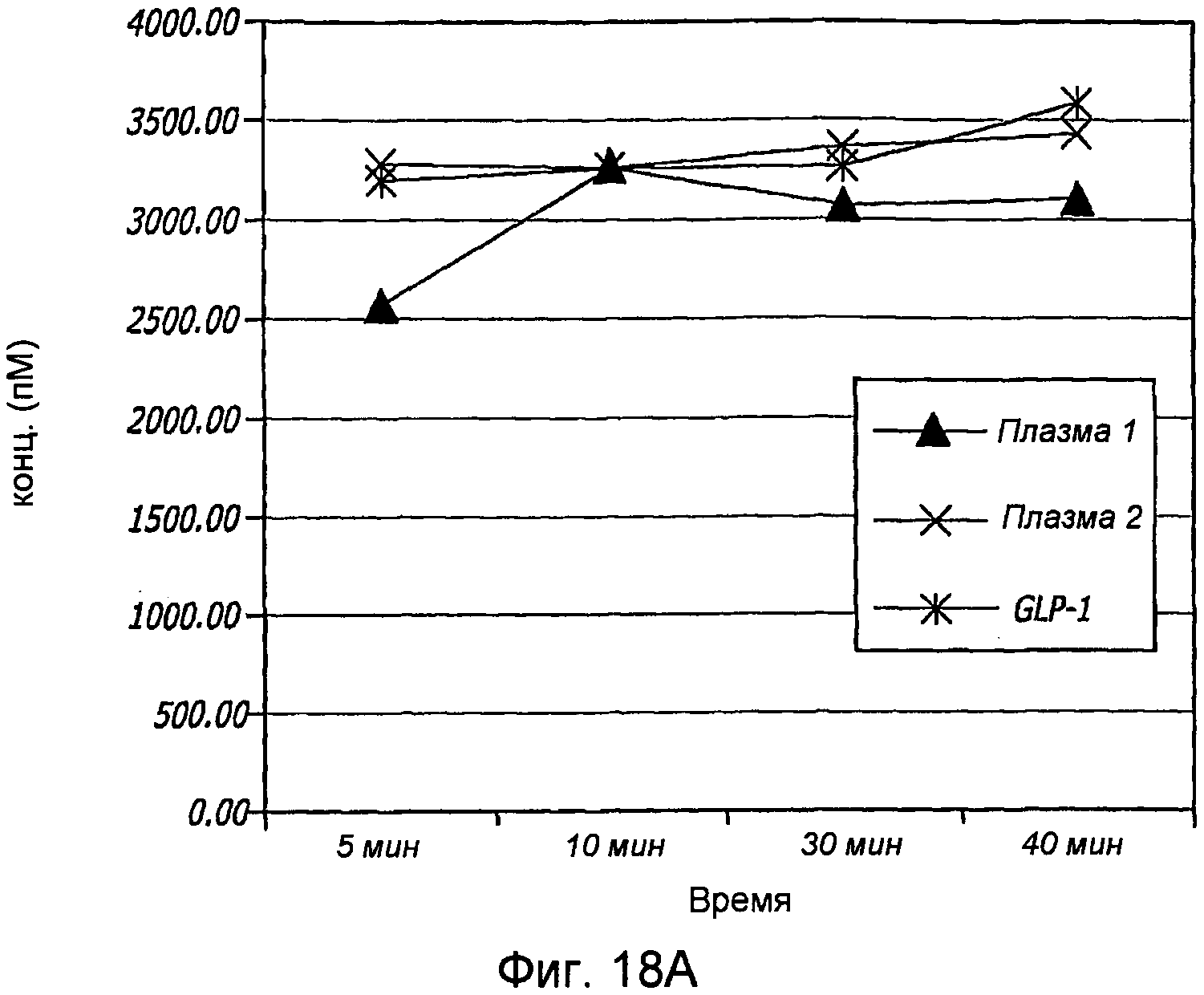
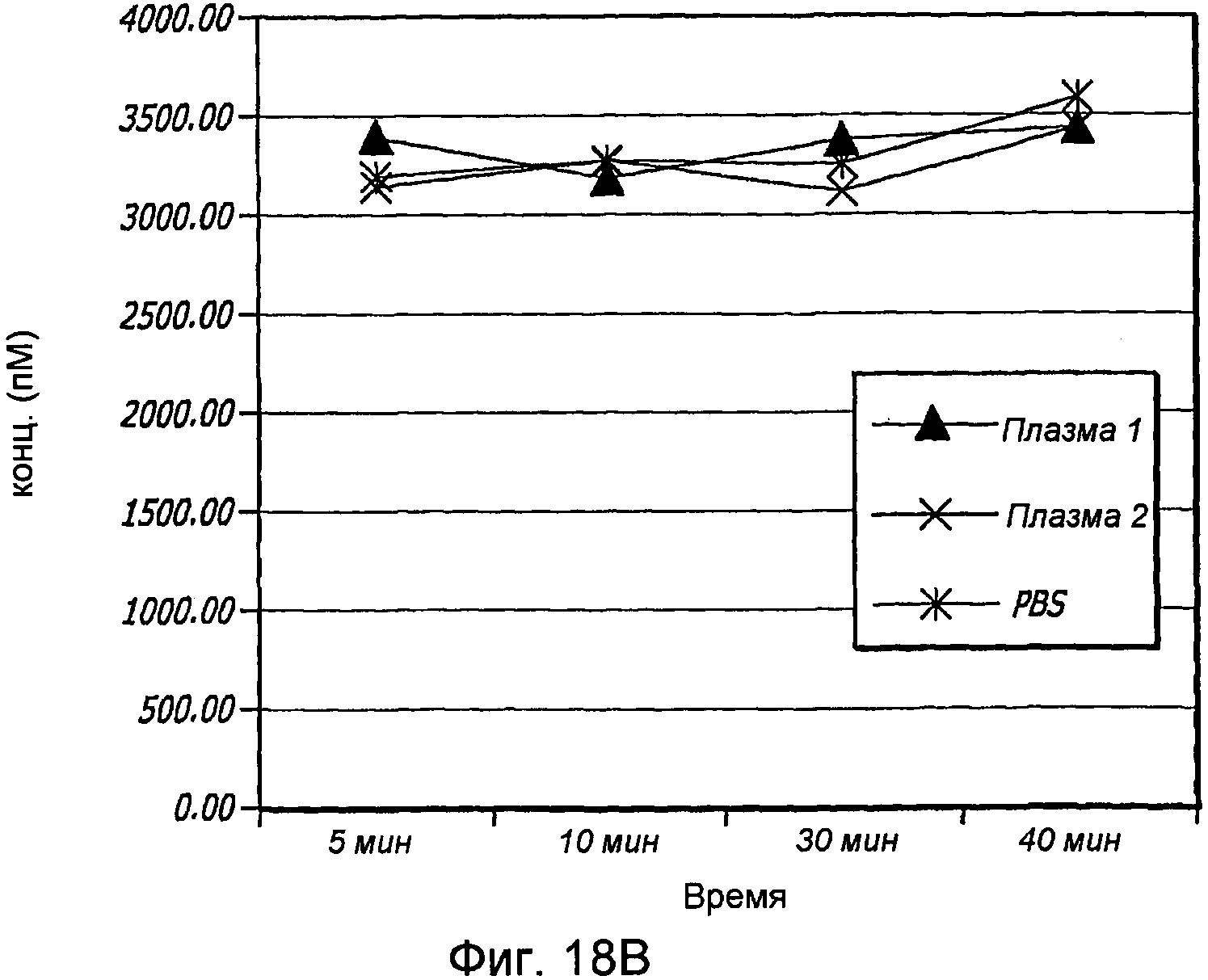
Фиг. 18A-18B. Проиллюстрирована количественная оценка GLP-1 в плазме. На фиг. 18A проиллюстрирована количественная оценка при разведении 1:2 в плазме. На фиг. 18B проиллюстрирована количественная оценка при разведении 1:10 в плазме.
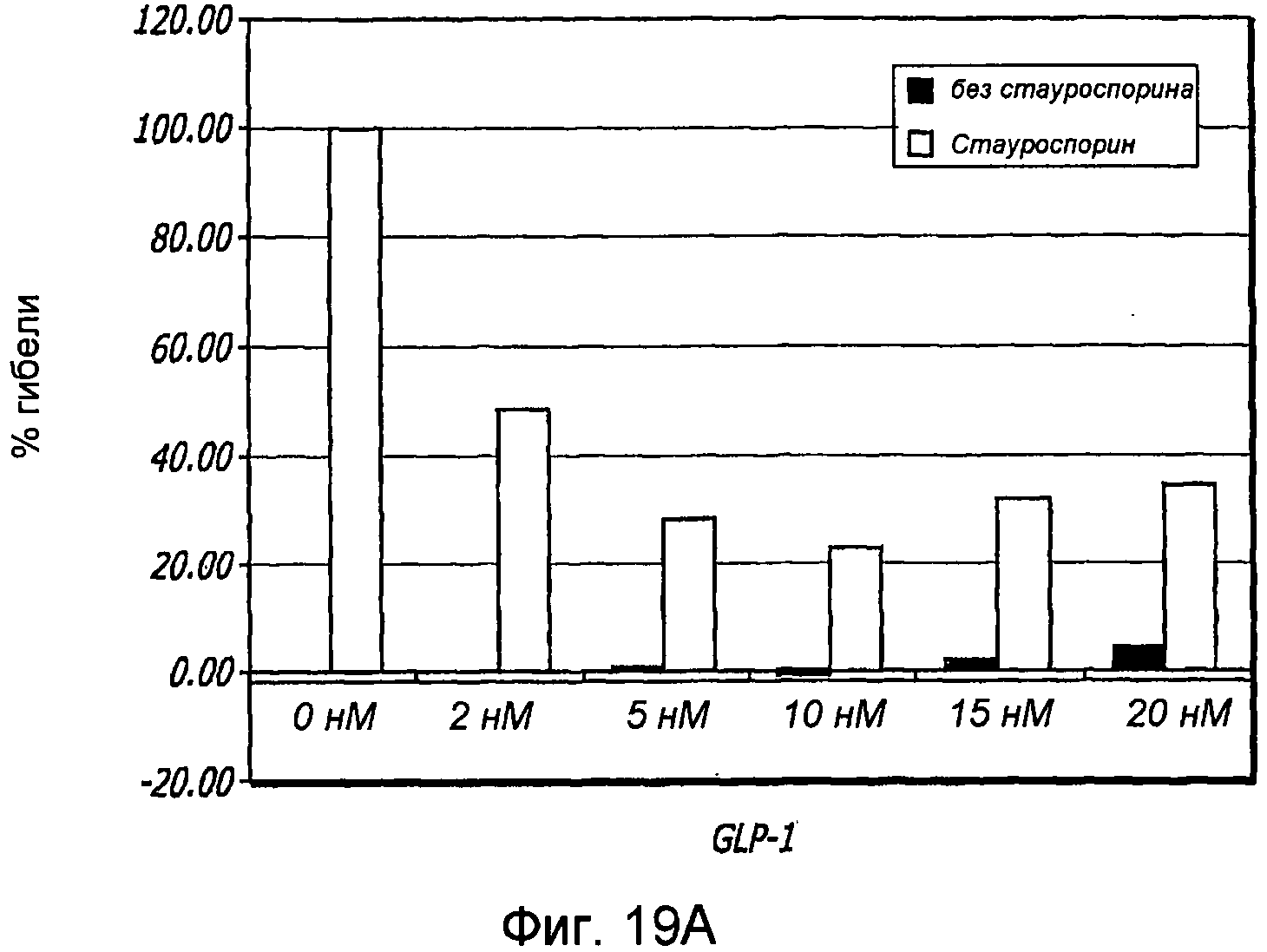
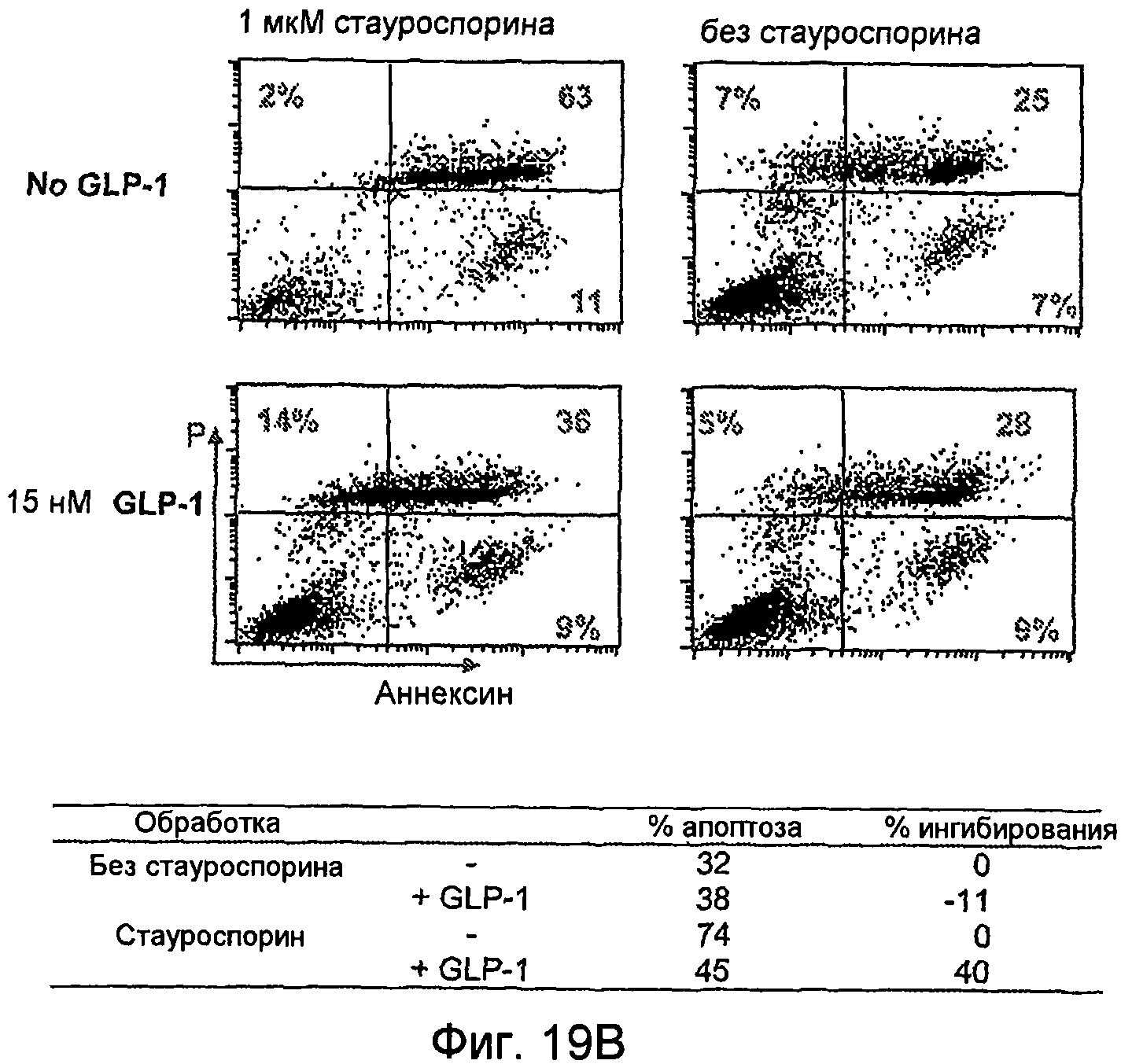
Фиг. 19A-19B. Влияние GLP-1 и аналогов GLP-1 на выживание клеток. Влияние GLP-1 на гибель эпителиальных клеток поджелудочной железы крыс (ARIP) (Фиг. 19A). Окрашивание аннексином V указывало на ингибирование апоптоза в присутствии GLP-1 и стауроспорина (Stau), используемых в качестве отдельных средств и в комбинации (Фиг. 19B). Концентрация GLP-1 составлет 15 нМ, а концентрация стауроспорина составляет 1 мкМ.
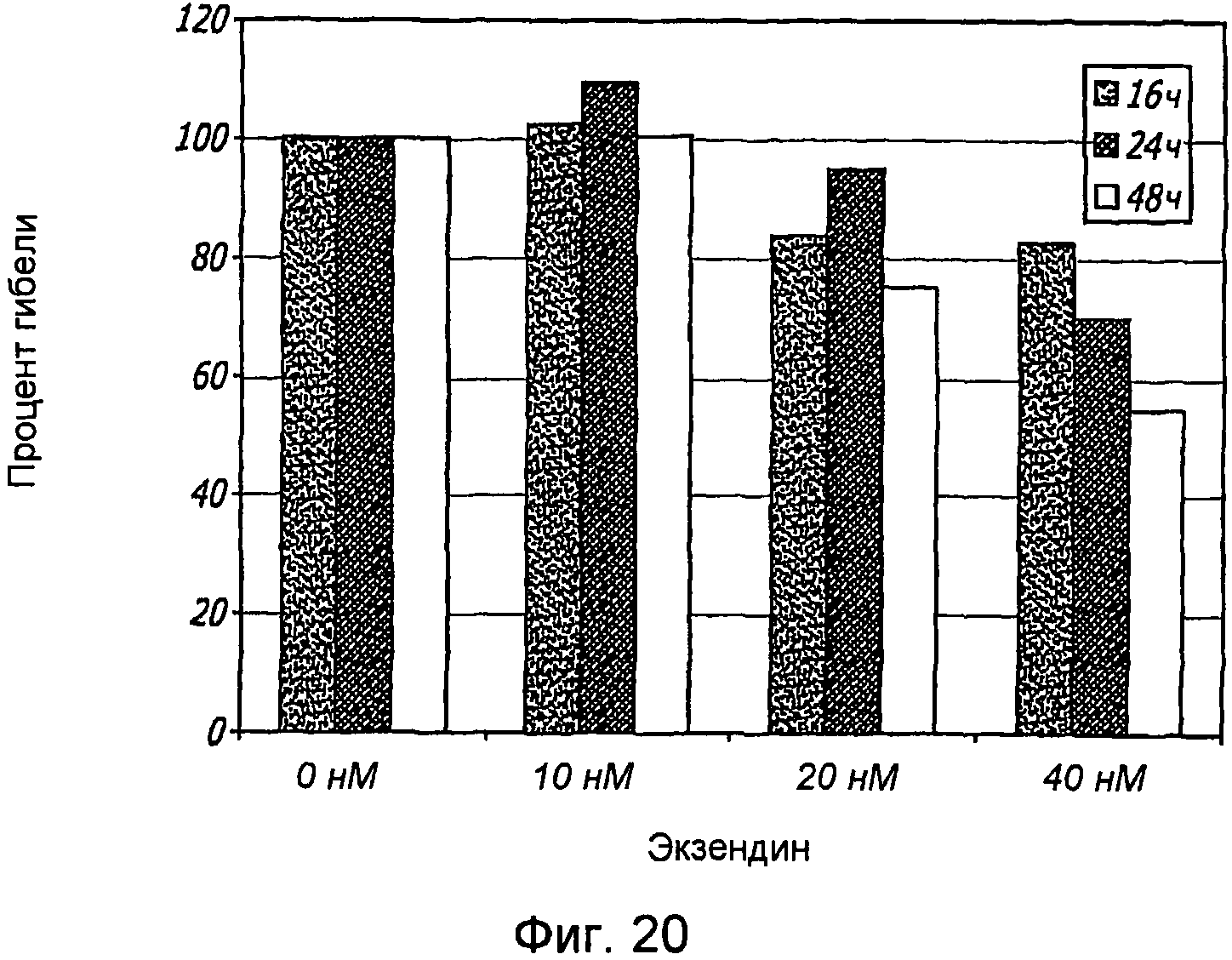
Фиг. 20. Влияние аналога GLP-1, экзендина-4, на жизнеспособность клеток. Клетки ARIP обрабатывали 0, 10, 20 и 40 нМ экзендина 4 в течение 16, 24 и 48 часов.
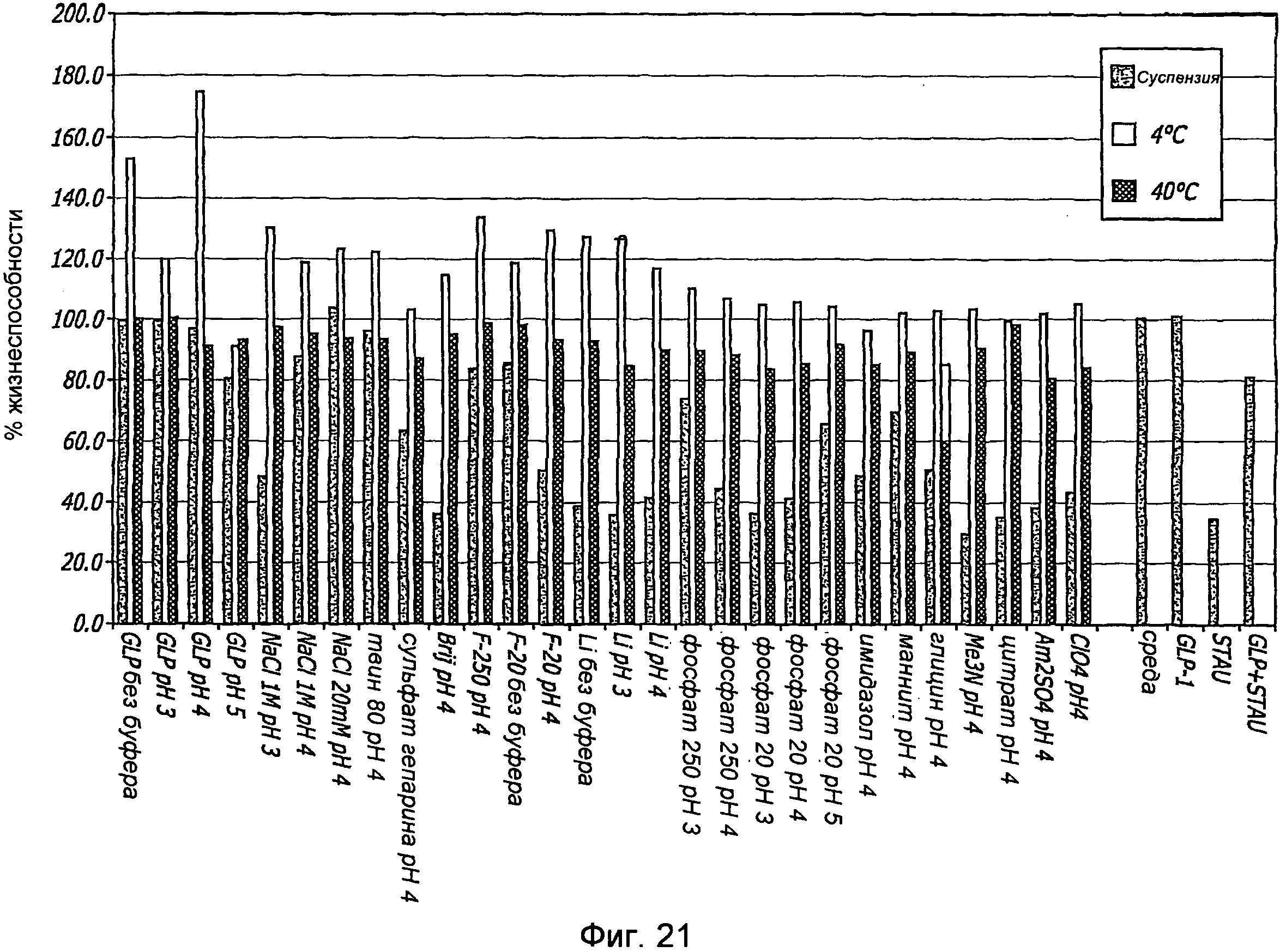
Фиг. 21. Влияние множества препаратов GLP-1/FDKP на индуцированную стауроспорином гибель клеток. Клетки ARIP, предварительно обработанные образцами GLP-1, подвергали воздействию 5 мкМ стауроспорина в течение 4 часов и анализировали с использованием реагента Cell Titer-GloTM на жизнеспособность клеток. Образцы помещали на 4 недели в условия стресса при 4°С и 40°С. Контрольные образцы, показанные справа (среда, GLP-1, STAU, GLP+STAU), иллюстрируют жизнеспособность клеток в среде (без GLP-1 или стауроспорина), в среде с GLP-1, в среде со стауроспорином и в среде с GLP-1 и стауроспорином (примечание: надписи на графике не относятся к контрольным образцам). Все результаты представлены как средние величины для трех экспериментов.
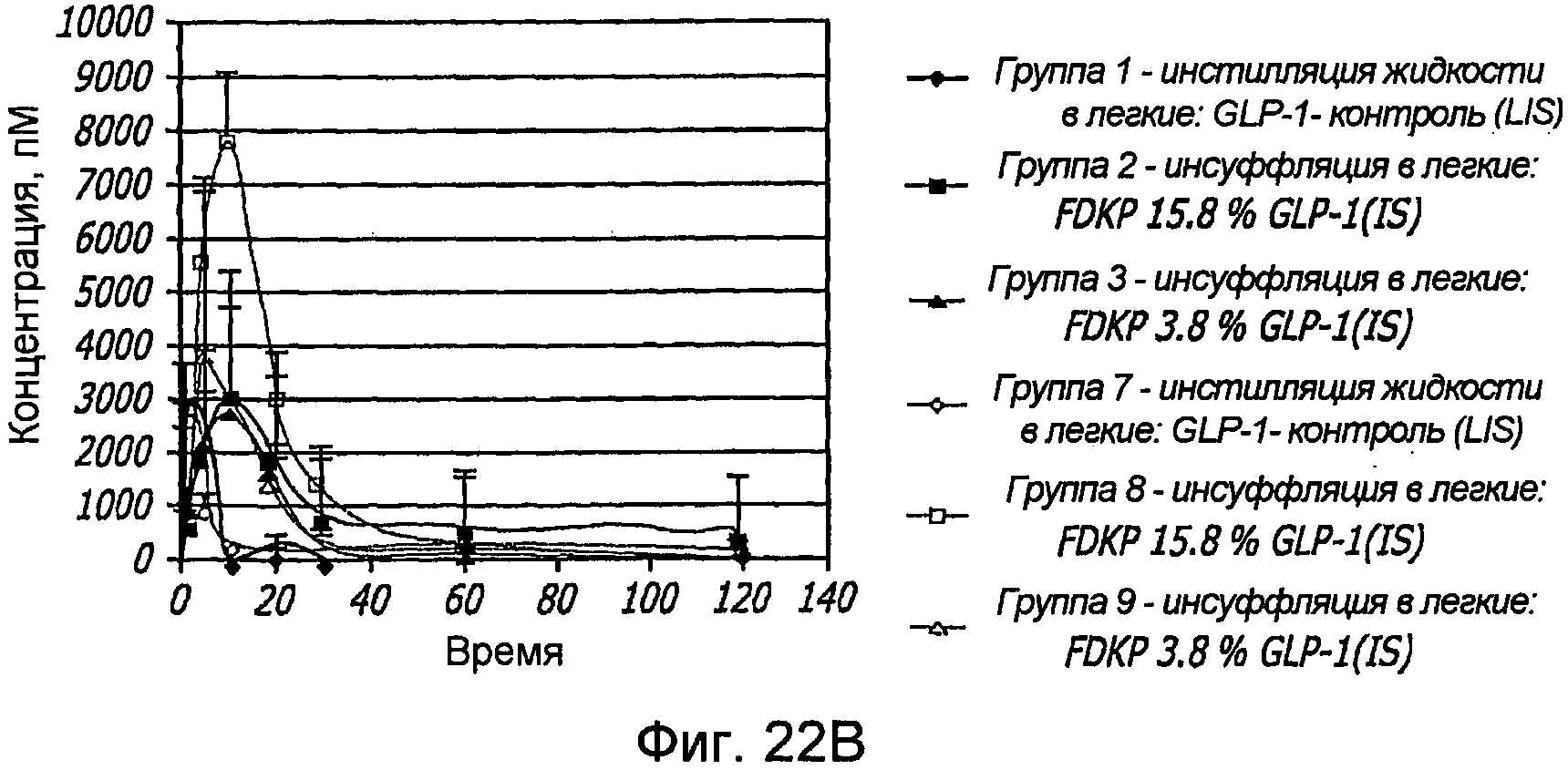
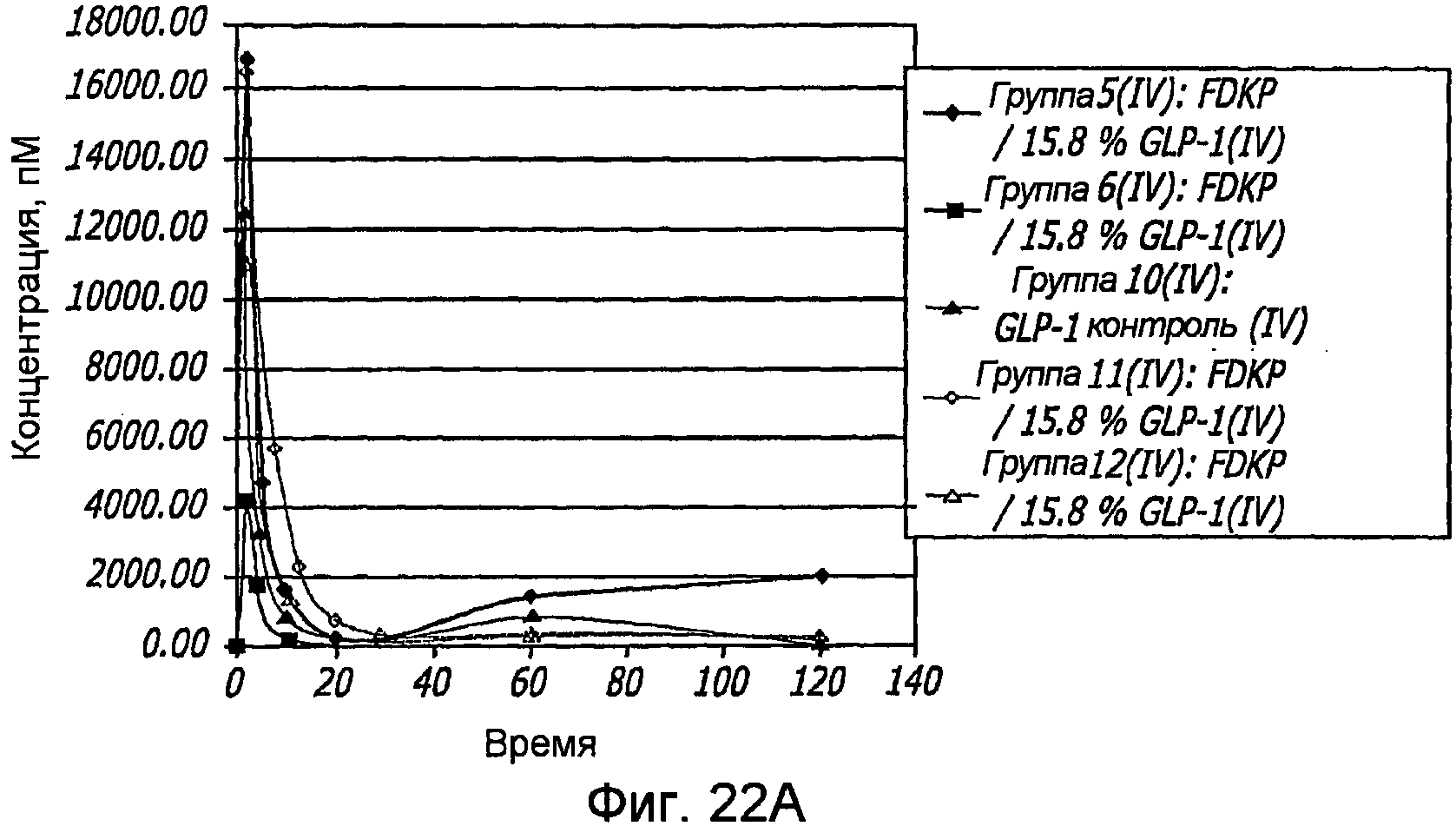
Фиг. 22A-22B. Фармакокинетические исследования, иллюстрирующие одну внутривенную инъекцию (i.v., фиг. 22A) и внутрилегочную инсуффляцию (i.s.; фиг. 22B) крысам с использованием различных концентраций препаратов GLP-1/FDKP. Указаны процентное содержание (по массе) GLP-1 по отношению к частицам FDKP для анализируемых препаратов.
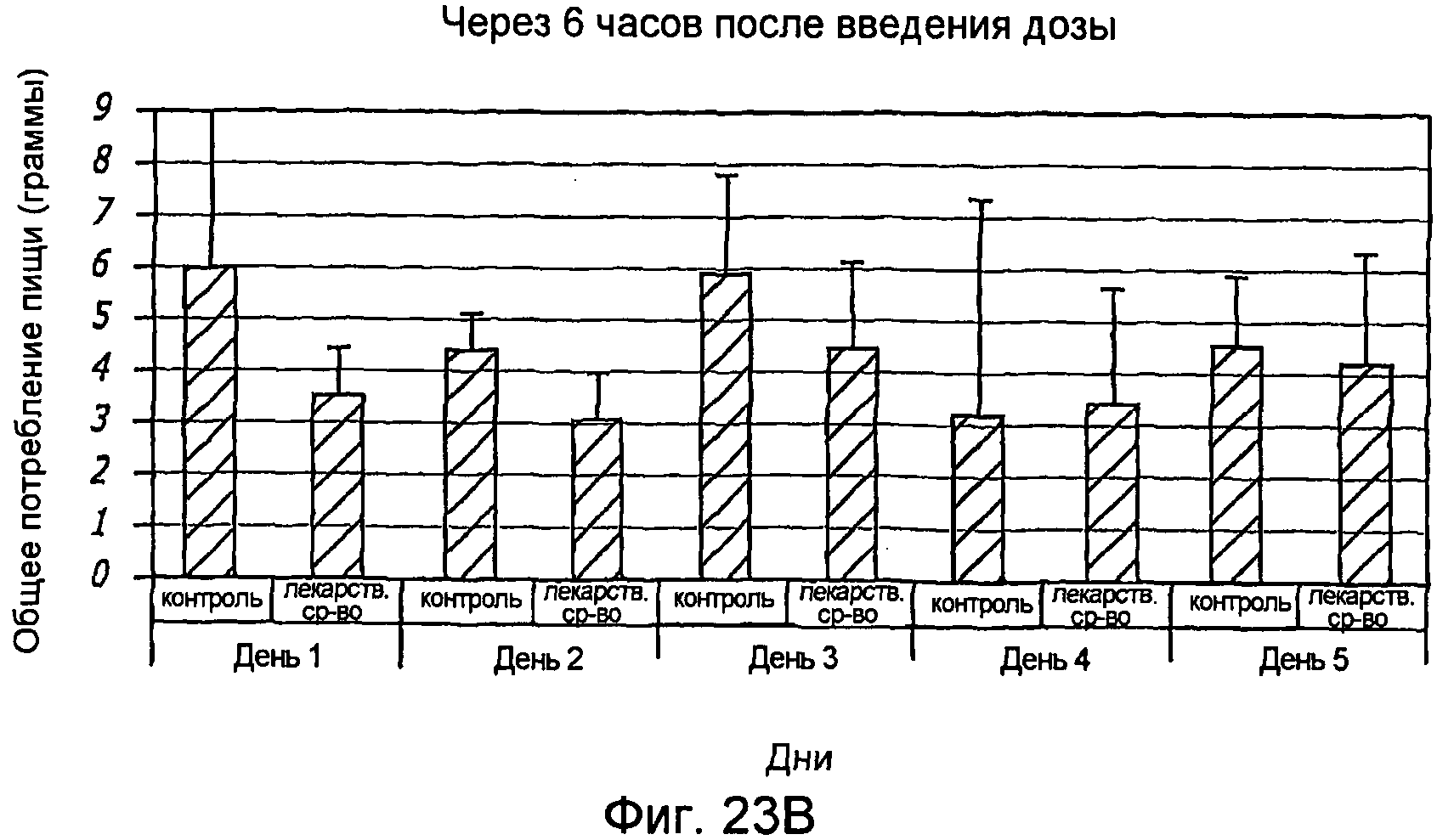
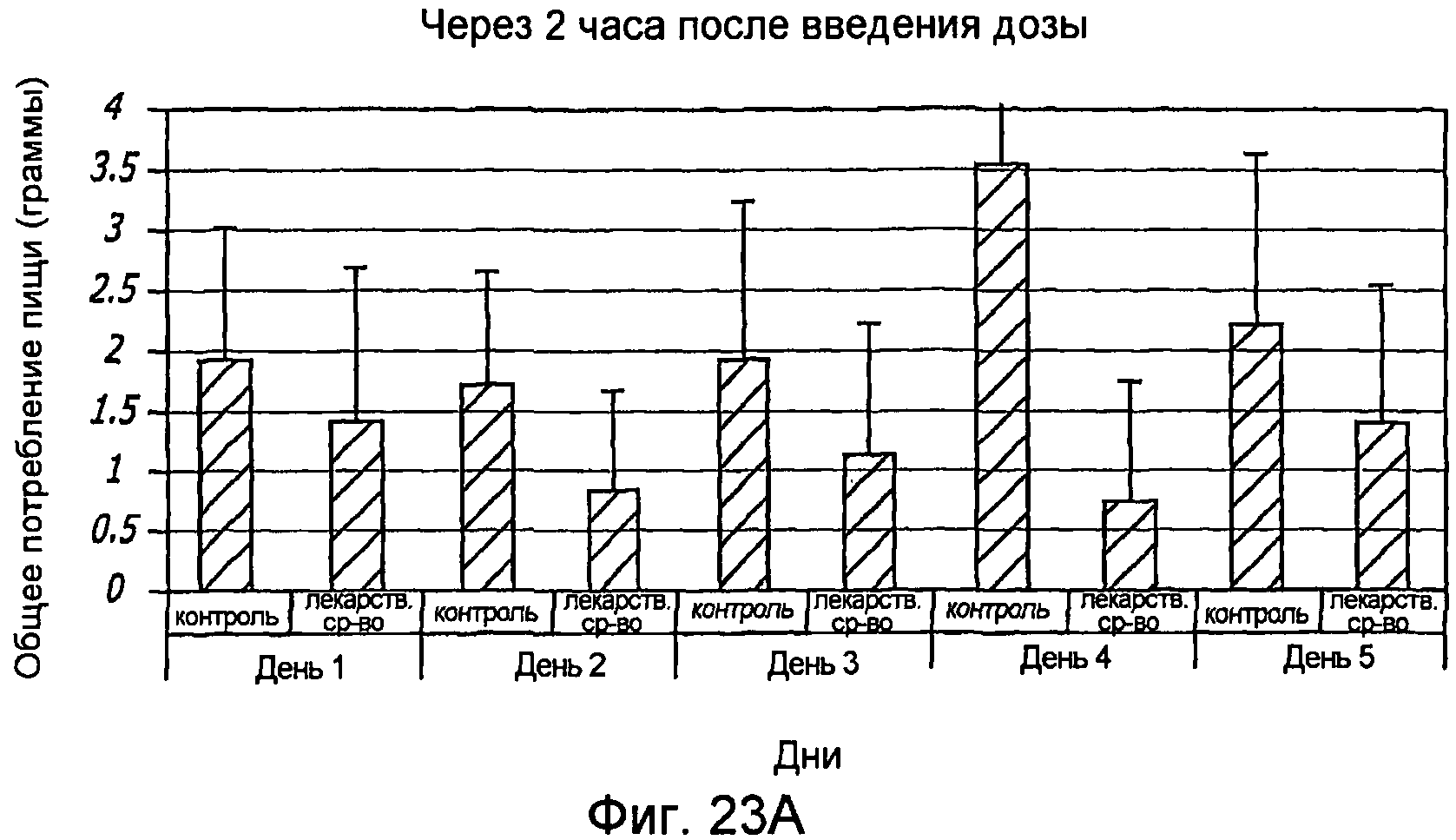
Фиг. 23A-23B. Снижение общего потребления пищи у крыс через 2 часа (фиг. 23A) и 6 часов (фиг. 23B) после введения им дозы препаратов GLP-1/FDKP.
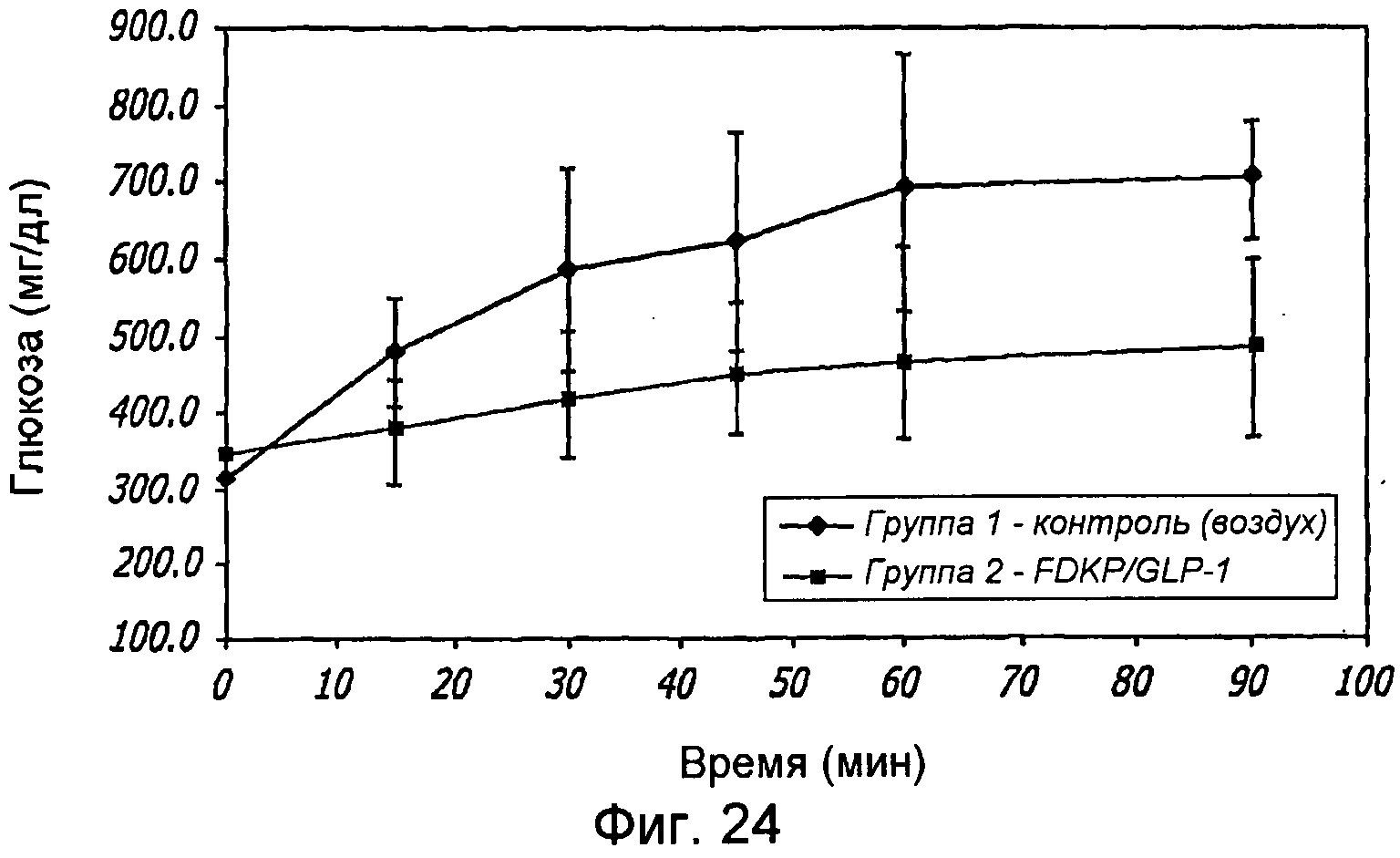
Фиг. 24. Фармакодинамические исследования GLP-1/FDKP, вводимого путем внутрилегочной инсуффляции самцам крыс, у которых было индуцировано ожирение в результате кормления их сахаром. Представлены данные измерения уровня глюкозы через 0, 15, 30, 45, 60 и 90 минут для контроля (воздух; группа 1) и для GLP-1/FDKP-обработанных животных (группа 2).
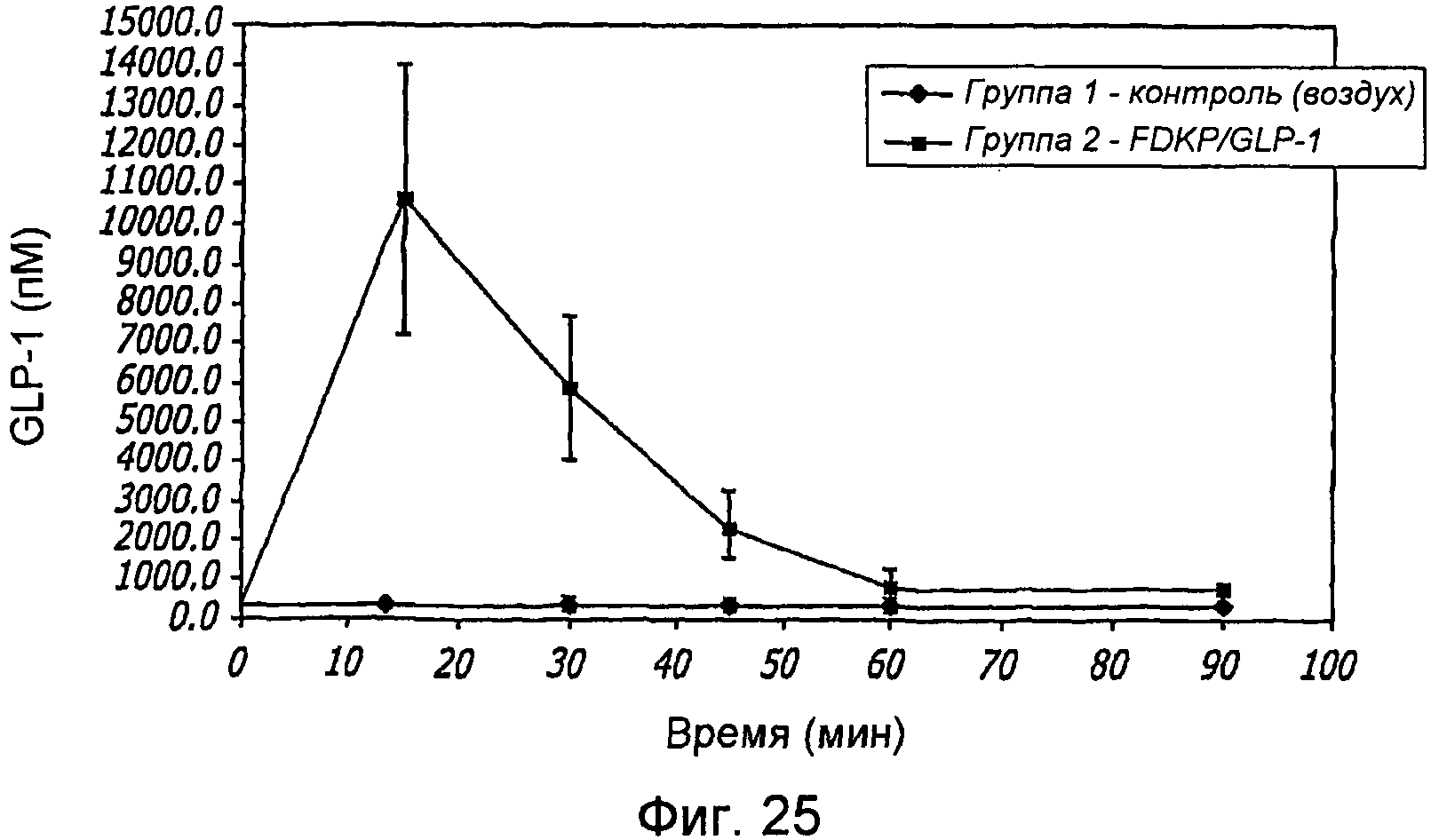
Фиг. 25. Фармакодинамические исследования GLP-1/FDKP, вводимого путем внутрилегочной инсуффляции самцам крыс, у которых было индуцировано ожирение в результате кормления их сахаром. Представлены данные измерения уровня GLP-1 через 0, 15, 30, 45, 60 и 90 минут для контроля (воздух; группа 1) и для GLP-1/FDKP-обработанных животных (группа 2).
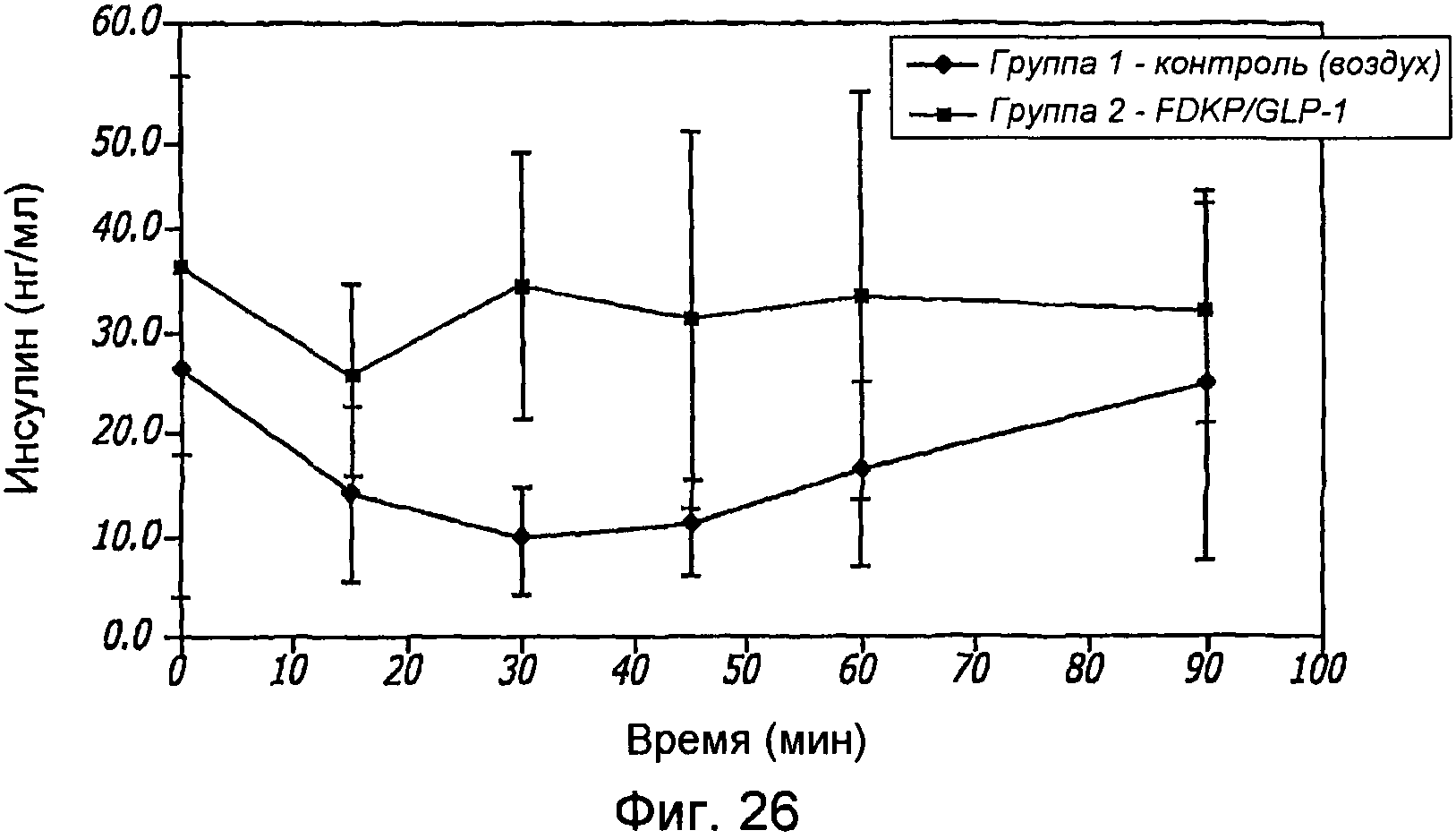
Фиг. 26. Фармакодинамические исследования GLP-1/FDKP, вводимого путем внутрилегочной инсуффляции самцам крыс, у которых было индуцировано ожирение в результате кормления их сахаром. Представлены данные измерения уровня инсулина через 0, 15, 30, 45, 60 и 90 минут для контроля (воздух; группа 1) и для GLP-1/FDKP-обработанных животных (группа 2).
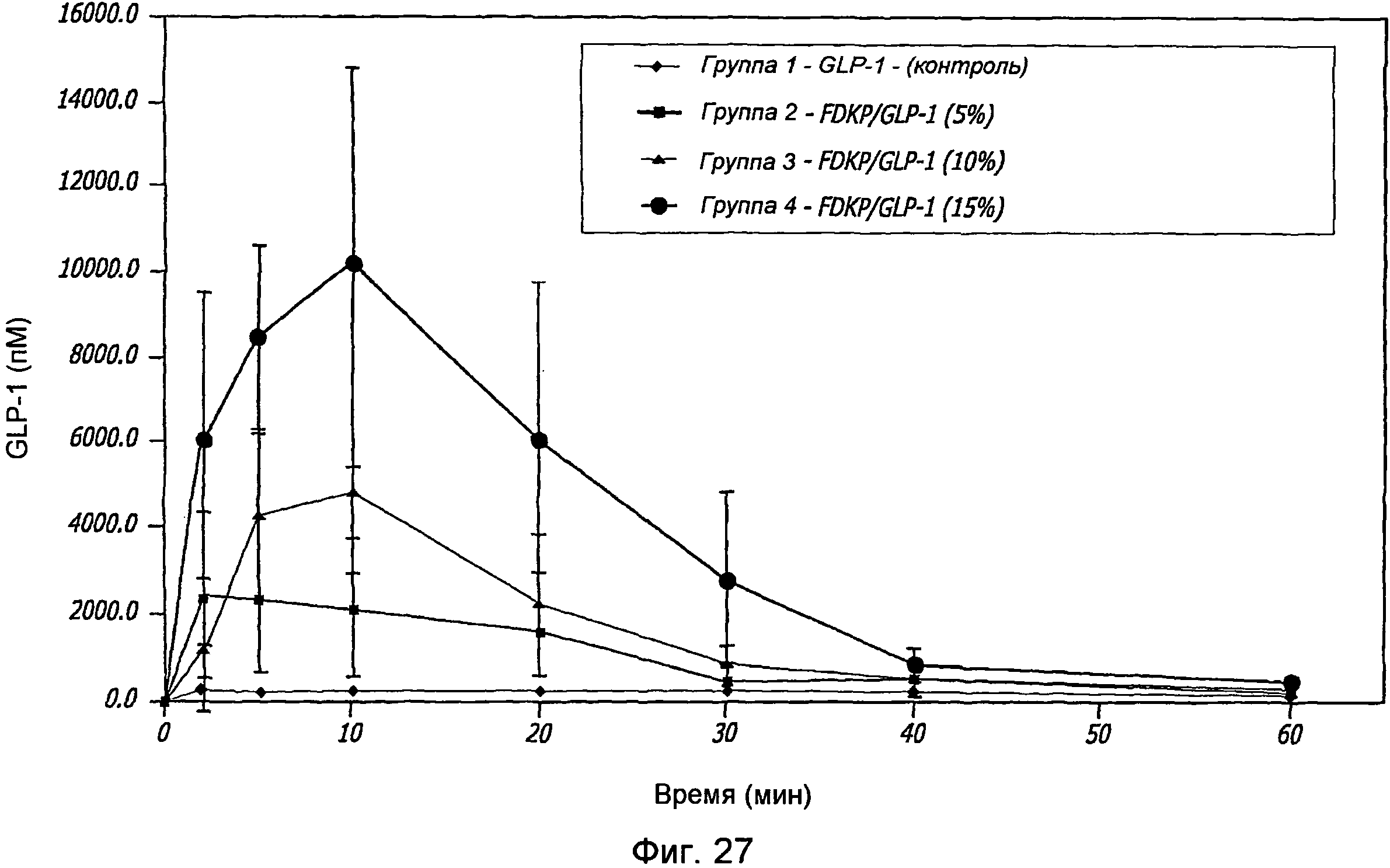
Фиг. 27. Фармакокинетические исследования GLP-1/FDKP различными концентрациями GLP-1, вводимыми самкам крыс путем внутрилегочной инсуффляции. Представлены данные измерения уровня GLP-1 через 0, 2, 5, 10, 20, 30, 40 и 60 минут для контроля (воздух; группа 1) и для GLP-1/FDKP-обработанных групп 2, 3 и 4, которым вводили 5%, 10% и 15% GLP-1, соответственно.
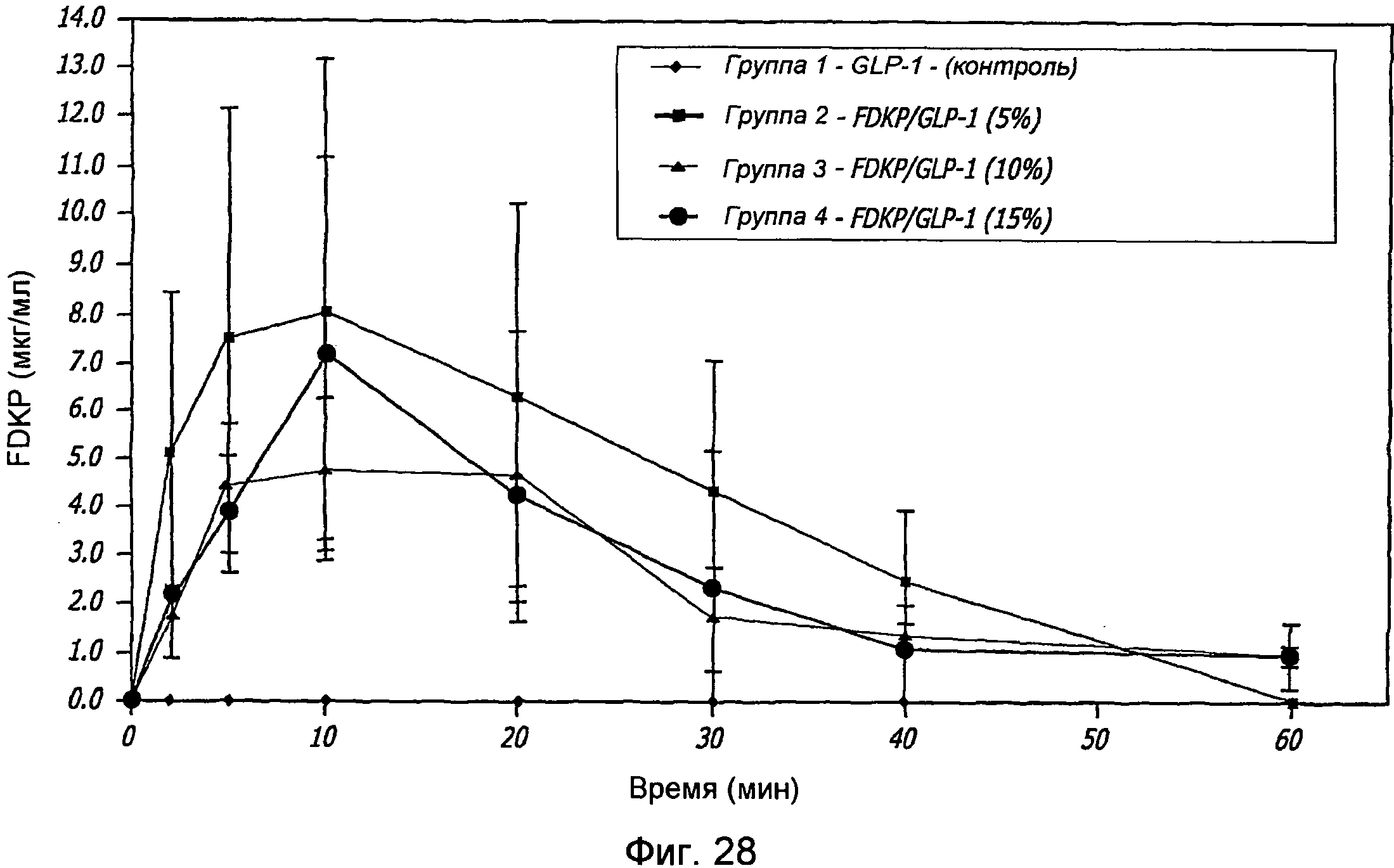
Фиг. 28. Фармакокинетические исследования GLP-1/FDKP с различными концентрациями GLP-1, вводимыми самкам крыс путем внутрилегочной инсуффляции. Данные измерения уровня FDKP через 0, 2, 5, 10, 20, 30, 40 и 60 минут для контроля (воздух; группа 1) и для GLP-1/FDKP-обработанных групп 2, 3 и 4, которым вводили 5%, 10% и 15% GLP-1, соответственно.
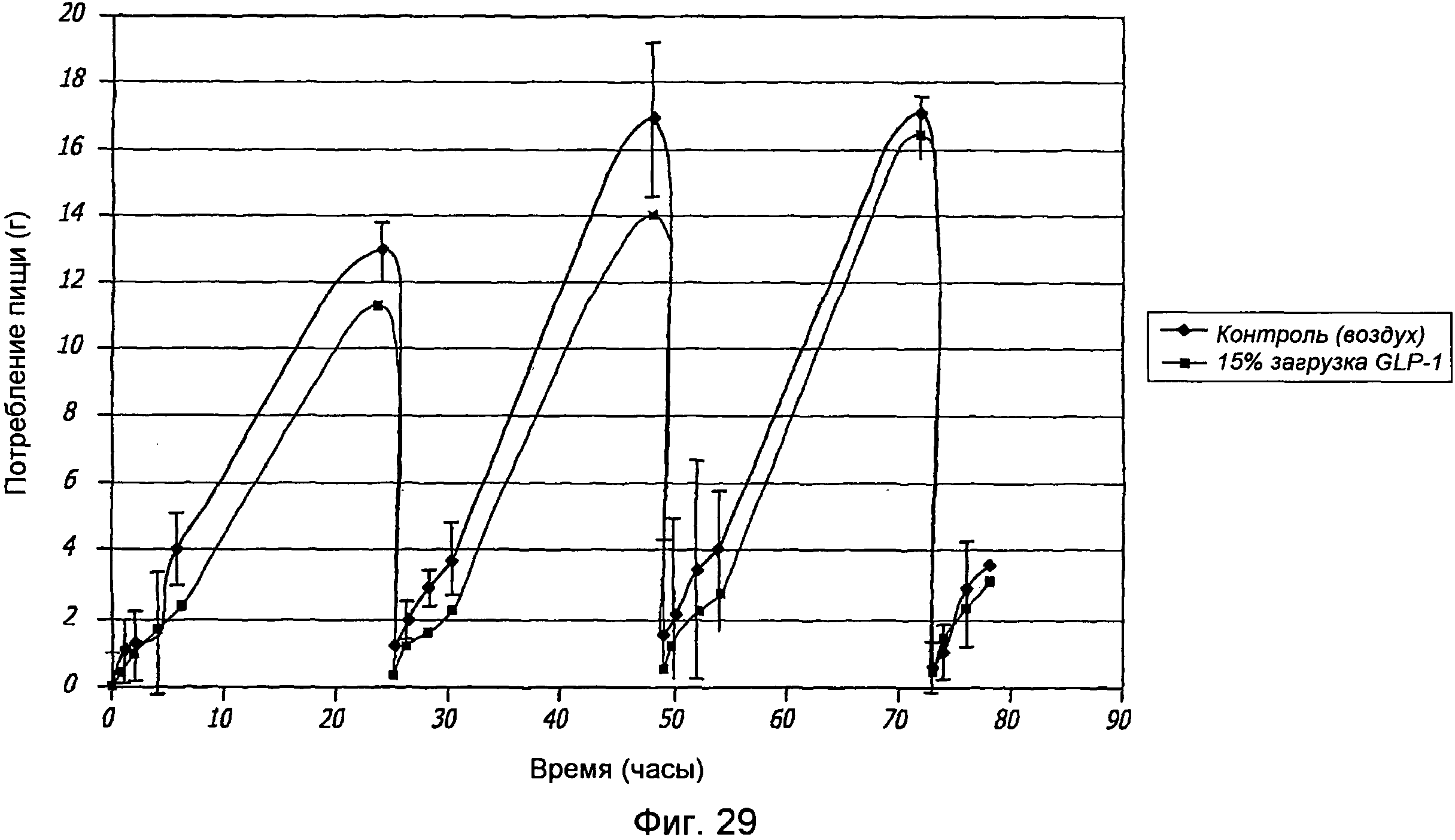
Фиг. 29. Фармакодинамические исследования GLP-1/FDKP у самок крыс, которым вводили GLP-1/FDKP, содержащий 15% GLP-1 (0,3 мг GLP-1), посредством внутрилегочной инсуффляции, проводимой один раз в день (n=10) 4 дня подряд. Полученные данные указывают на среднее потребление пищи, измеряемое перед введением дозы, и через 1, 2, 4 и 6 часов после введения дозы 4 дня подряд.
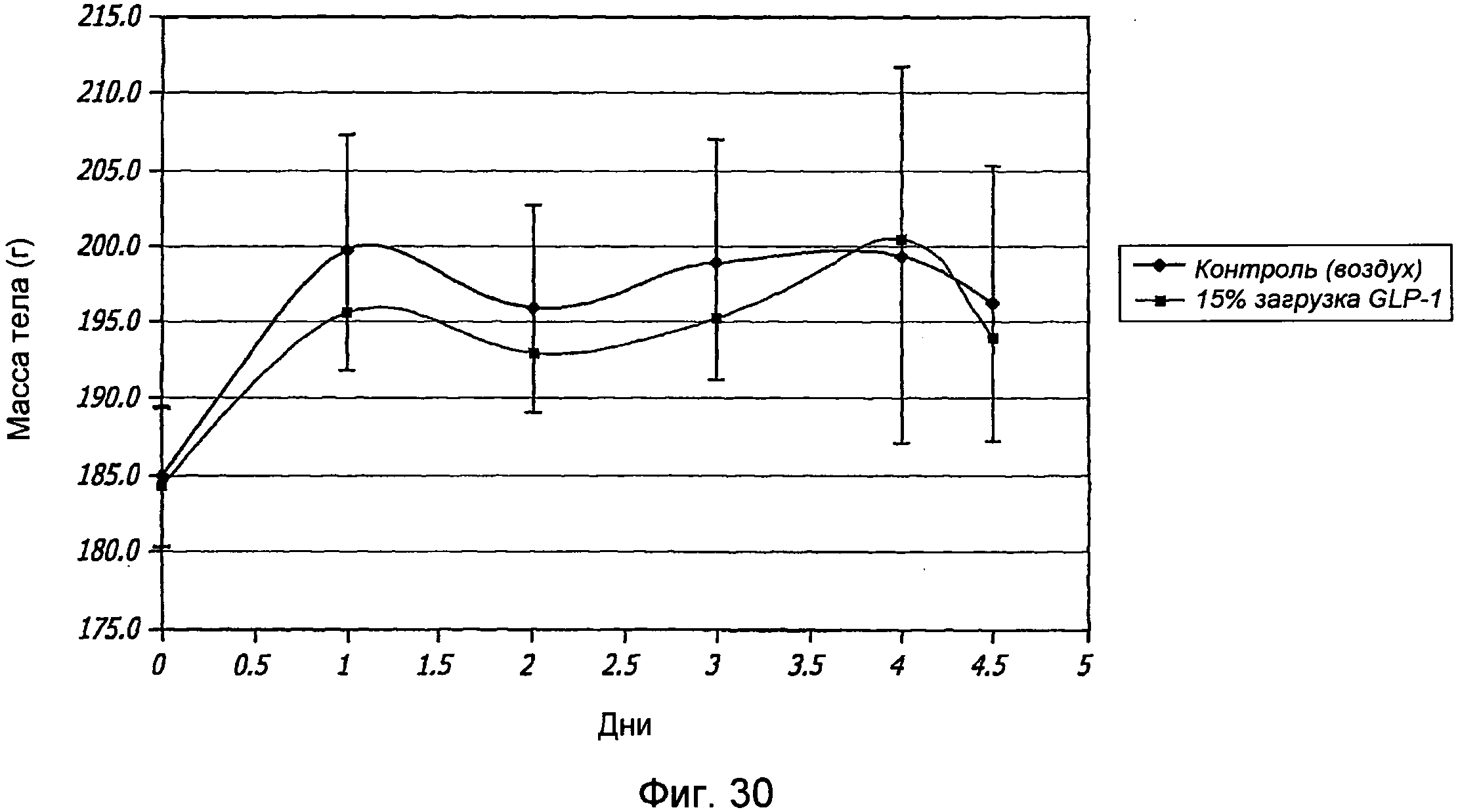
Фиг. 30. Фармакодинамические исследования GLP-1/FDKP у самок крыс, которым вводили GLP-1/FDKP, содержащий 15% GLP-1 (0,3 мг GLP-1), посредством внутрилегочной инсуффляции, проводимой один раз в день (n=10) 4 дня подряд. Полученные данные указывают на среднюю массу тела, измеряемую перед введением дозы, и через 1, 2, 4 и 6 часов после введения дозы 4 дня подряд.
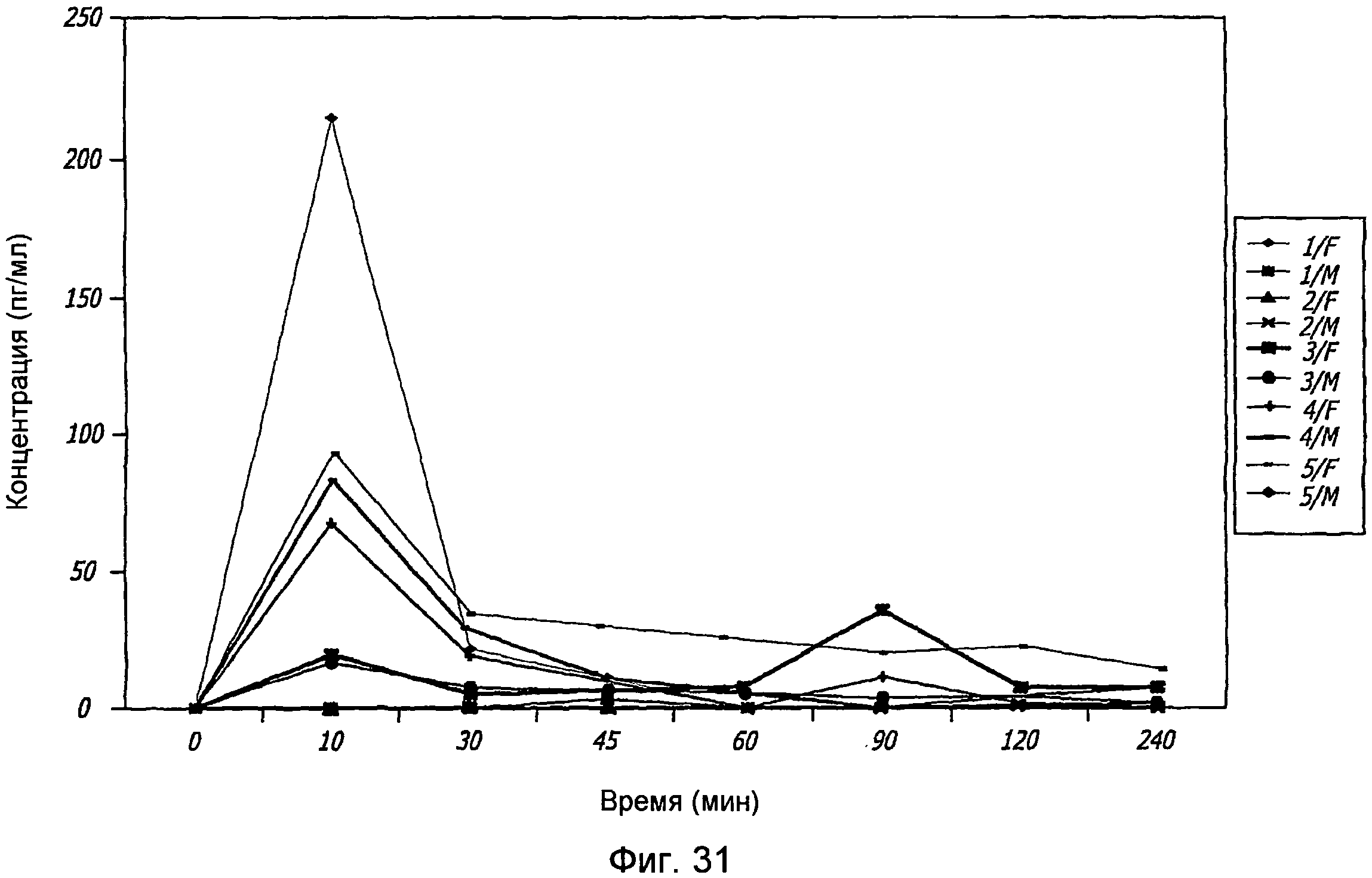
Фиг. 31. Токсикокинетические исследования GLP-1/FDKP у обезьян, которым ороназально вводили GLP-1/FDKP один раз в день (в течение 30 минут) 5 дней подряд. Полученные данные указывают на максимальные концентрации (Cmax) GLP-1 в плазме самцов и самок. Животным контрольной группы вводили воздух (группа 1), животным группы 2 вводили 2 мг/кг FDKP, а животным групп 3, 4 и 5 вводили 0,3, 1,0 или 2,0 мг/кг GLP-1/FDKP, соответственно.
Подробное описание предпочтительного варианта изобретения
В настоящее время не существует каких-либо стабильных и вводимых путем ингаляции препаратов, содержащих глюкагон-подобный пептид 1 (GLP-1) и применяемых в качестве фармацевтических средств. Это обусловлено нестабильностью пептида GLP-1 in vivo. Соединения GLP-1 могут сохраняться в растворе в различных условиях, но они имеют относительно непродолжительное время полужизни in vivo при их введении в виде раствора. Кроме того, было обнаружено, что в различных биологических жидкостях, таких как легочная жидкость и кровь, присутствует дипептидил-пептидаза IV (DPP-IV), которая значительно снижает биологическое время полужизни молекул GLP-1. Так, например, было показано, что биологическое время полужизни GLP-l(7-37) составляет 3-5 минут, см., патент США No. 5118666. Было также показано, что GLP-1 быстро абсорбируется in vivo после парентерального введения. Аналогичным образом, время полужизни амида GLP-1(7-36), при его подкожном введении, составляет примерно 50 минут, см. также патент США No. 5118666.
Быстрый клиренс и непродолжительное время полужизни композиций GLP-1, как известно специалистам, представляет определенную проблему, которая может быть решена в соответствии с настоящим изобретением. Проблема, рассматриваемая в настоящем изобретении, может быть решена путем получения оптимизированной композиции, содержащей нативный GLP-1/FDKP (фумарилдикетопиперазин) и особенно подходящей для внутрилегочного введения. В одном из своих конкретных аспектов настоящее изобретение относится к препаратам нативной молекулы GLP-1, которая может вырабатывать GLP-1-ответ in vivo. Рассматривается также применение вариантов нативного GLP-1 в таких препаратах.
Для решения вышеуказанных проблем, с которыми сталкиваются специалисты в данной области, было разработано настоящее изобретение, относящееся к препаратам GLP-1 в комбинации с дикетопиперазиновыми (DKP) частицами. В конкретных вариантах изобретения индивидууму вводят препараты GLP-1/DKP. В других конкретных вариантах изобретения препараты GLP-1/DKP содержат, но не ограничиваются ими, фумарилдикетопиперазин (FDKP) и могут включать другие DKP (асимметрические DKP, xDKP), такие как 2,5-дикето-3,6-ди(4-сукцинил-аминобутил)пиперазин (SDKP), асимметрические дикетопиперазины, включая дикетопиперазины, замещенные только в одном положении на кольце DKP (например, аналоги FDKP «с одним плечом»), и соли DKP. В других конкретных вариантах изобретения введение препарата GLP-1/FDKP осуществляют путем внутрилегочной доставки.
При разработке терапевтических препаратов молекул GLP-1 структурные свойства GLP-1 в растворе оценивали с применением различных биофизических и аналитических методов, которыми являются круговой дихроизм в далекой области УФ-излучения (КД в далеком УФ), круговой дихроизм в ближней области УФ-излучения (КД в ближнем УФ), собственная флуоресценция, инфракрасная Фурье-спектроскопия (FTIR), жидкостная хроматография высокого давления (ЖХВД) и масс-спектроскопия (МС). Метод кругового дихроизма (КД) представляет собой ценный инструмент, используемый для анализа структурных изменений белка в различных экспериментальных условиях и хорошо известный специалистам. Экспериментальными условиями, при которых были проведены данные анализы, являются: концентрация, ионная сила, температура, рН, оксилительный стресс, перемешивание и множество циклов «замораживания-оттаивания», влияющие на пептид GLP-1. Такие анализы были разработаны для характеризации основных путей разложения, а также для определения условий, которые влияют на структуру пептида GLP-1, в целях получения предпочтительных препаратов GLP-1/DKP, имеющих желательные фармакокинетические (ФК) и фармакодинамические (ФД) свойства.
Наблюдения показали, что по мере увеличения концентрации GLP-1 вторичная структура пептида трансформируется, в основном, из неструктурированной конформации в более упорядоченную спиральную конформацию. Увеличение ионной силы в растворе приводит к увеличению степени указанной структуры GLP-1 до его обратимого осаждения. Присутствие NaCl повышает степень третичной структуры GLP-1, на что указывает увеличение интенсивности полос КД в ближнем УФ, как показано на фиг. 2D. Это происходит даже при низких концентрациях пептида, при которых не обнаруживается самосборка. Увеличение ионной силы способствует быстрому превращению неструктурированного GLP-1 в альфа-спиральную форму, на что указывают сдвиги минимумов при КД в далеком УФ в сторону длин волн 208 нм и 222 нм (фиг. 2A), и самоассоциирующуюся конформацию, на что указывают сдвиги излучения триптофана в направлении более коротких длин волн по мере увеличения концентрации соли, и картины КД в ближнем УФ, как показано на фиг. 2B и 2D. Температура и pH различным образом влияют на конформацию GLP-1, при этом неупорядоченная структура GLP-1 не изменяется под действием любого из этих параметров. С другой стороны, было обнаружено, что самоассоциирующаяся конформация GLP-1 является чувствительной к тепловой денатурации, а его растворимость зависит от рН, как показано на фиг. 4A и 4B, где проиллюстрировано, что пептид GLP-1 подвергается обратимому осаждению при рН 6,3-7,6 и при концентрации 10 мг/мл. Было обнаружено, что различные конформации GLP-1, по существу, являются устойчивыми к перемешиванию и ко множеству циклов «замораживания-оттаивания». При этом какого-либо дезамидирования и окисления GLP-1 не наблюдалось.
Адсорбция GLP-1 на частицах FDKP также наблюдалась при различных условиях, которыми являются изменение рН, изменение концентрации GLP-1 и изменение концентрации различных поверхностно-активных веществ, солей, ионов, хаотропов и лиотропов, стабилизаторов и спиртов. Было обнаружено, что адсорбция GLP-1 на частицах FDKP в значительной степени зависит от рН, а в частности связывание происходит при pH примерно 4,0 или выше. Было обнаружено, что другие наполнители оказывают ограниченное влияние на абсорбцию GLP-1 на частицах FDKP.
При разработке препаратов GLP-1/DKP согласно изобретению был оценен ряд параметров, которые могут воздействовать или влиять на доставку и абсорбцию in vivo. Такими параметрами являются, например, структура пептида GLP-1, заряд на поверхности молекулы в некоторых условиях приготовления препарата, растворимость и стабильность при использовании такого пептида в качестве препарата, а также чувствительность к расщеплению сериновой протеазой и стабильность in vivo, где все вышеперечисленные параметры играют решающую роль в получении препарата, который может легко абсорбироваться и имеет более длительное биологическое время полужизни.
Стабильность полученных GLP-1/FDKP-препаратов тестировали в различных условиях in vitro и in vivo. Стабильность GLP-1 анализировали с помощью ЖХВД-анализа и клеточных анализов. Кроме того, стабильность GLP-1 оценивали в легочном лаваже (содержащем DPP-IV). Было также обнаружено, что стабильность нативного GLP-1 зависит от его концентрации в растворе.
In vitro исследования биологической активности GLP-1 также включают исследования загрузки GLP-1/FDKP и определение эффекта in vivo. Эта стратегия позволяет также разработать основные методы получения GLP-1/FDKP-препаратов. Кроме того, поскольку было обнаружено, что GLP-1 играет определенную роль в увеличении массы β-клеток посредством ингибирования апоптоза, стимуляции пролиферации β-клеток и неогенеза островковых клеток, то с помощью клеточного анализа была оценена пролиферативная и антиапоптотическая активность GLP-1/FDKP-препаратов согласно разложению.
Таким образом, настоящее изобретение относится к оптимизированным препаратам, содержащим нативный человеческий GLP-1 в комбинации с фумарилдикетопиперазином (FDKP), который является стабильным и резистентным к разложению.
II. Молекулы GLP-1
В своих конкретных вариантах настоящее изобретение относится к оптимизированным препаратам, содержащим нативный человеческий глюкагон-подобный пептид 1 (GLP-1) в комбинации с дикетопиперазином, таким как фумарилдикетопиперазин (FDKP). Такие GLP-1/FDKP-препараты согласно изобретению являются стабильными и резистентными к разложению.
Человеческий GLP-1 хорошо известен специалистам и происходит от полипептида препроглюкагона, синтезируемого в L-клетках дистальной подвздошной кишки, поджелудочной железы и головного мозга. GLP-1 представляет собой пептид из 30-31 аминокислоты, который существует в двух молекулярных формах, 7-36 и 7-37, причем доминирующей является форма 7-36. Процессинг препроглюкагона в амид GLP-1(7-36) и в удлиненную форму GLP-1(7-37) происходит, главным образом, в L-клетках. Было обнаружено, что уровни GLP-1 в плазме натощак составляют примерно 40 пг/мл. После приема пищи уровни GLP-1 в плазме быстро возрастают приблизительно до 50-165 пг/мл.
Используемый здесь термин «молекулы GLP-1» означает белки, пептиды, полипептиды, аналоги, миметики, производные, изоформы, фрагменты GLP-1 и т.п. Такими молекулами GLP-1 могут быть природные полипептиды GLP-1 (GLP-1(7-37)OH, GLP-1(7-36)NH2) и метаболиты GLP-1, такие как GLP-l(9-37). Таким образом, в конкретных вариантах изобретения молекулами GLP-1 являются: нативный GLP-1, аналог GLP-1, производное GLP-1, GLP-1, защищенный от действия дипептидил-пептидазы IV (DPP-IV), GLP-1-миметик, аналог пептида GLP-1 или биосинтетический аналог GLP-1.
Используемый здесь термин «аналог» включает соединения, которые по своей структуре аналогичны другому соединению. Так, например, противовирусное соединение ацикловир представляет собой нуклеозидный аналог, который по своей структуре аналогичен нуклеозиду гуанозину, происходящему от основания гуанина. Таким образом, ацикловир имитирует действие гуанозина (является его биологическим аналогом) и препятствует синтезу ДНК благодаря замене гуанозиновых остатков (или конкурентному связыванию с ними) в вирусной нуклеиновой кислоте и предотвращает ее трансляцию/транскрипцию. Таким образом, соединения, которые по своей структуре аналогичны другому соединению (родительскому соединению) и имитируют биологическую или химическую активность родительского соединения, называются аналогами. Для количественной оценки соединения, используемого в качестве аналога, необходимо, чтобы оно не содержало минимального или максимального числа элементных или функциональных групп-заместителей, при условии, что, в некоторых релевантных случаях, такой аналог будет обладать способностью имитировать родительское соединение, то есть, по своим биологическим или химическим свойствам, будет идентичным или комплементарным этому родительскому соединению или конкурировать с ним. Аналогами могут быть, и в большинстве случаев являются, производные родительского соединения (см. ниже определение термина «производное»). Аналоги описанных здесь соединений могут обладать активностью, аналогичной активности родительских соединений, либо меньшей, или большей активностью.
Используемый здесь термин «производное» означает соединение, полученное из (или происходящее от) природного родительского соединения, либо продуцированное из родительского соединения путем синтеза. Производное может представлять собой аналог (определение термина «аналог» см. выше), а поэтому может обладать аналогичной химической или биологической активностью. Однако, в отличие от аналога, производное необязательно должно имитировать биологическую или химическую активность родительского соединения. Для количественной оценки соединения, используемого в качестве производного, необходимо, чтобы оно не содержало минимального или максимального числа элементных или функциональных групп-заместителей. Так, например, хотя противовирусное соединение ганцикловир представляет собой производное ацикловира, однако ганцикловир имеет другой спектр противовирусной активности и обладает другими токсикологическими свойствами по сравнению с ацикловиром. Производные описанных здесь соединений могут обладать активностью, аналогичной активности родительских соединений, либо меньшей, или большей активностью, либо они могут вообще не обладать такой активностью.
Используемый здесь термин «метаболит» означает любое промежуточное соединение или продукт метаболизма и включает как крупные, так и небольшие молекулы. Определение используемого здесь термина, в соответствующих случаях, относится как к первичным, так и ко вторичным метаболитам. Первичный метаболит непосредственно участвует в нормальном росте, развитии и репродуцировании живых организмов. Вторичный метаболит не принимает непосредственного участия в этих процессах, но обычно несет важную экологическую функцию (например, действует как антибиотик).
Используемый здесь термин «биосинтетический» относится к любому продуцированию химического соединения живым организмом.
Используемый здесь термин «образующий частицы» относится к химическим, биосинтетическим или биологическим молекулам или соединениям, способным образовывать твердые частицы, обычно в жидкой среде. Образование частиц обычно происходит при создании определенного(ых) условия(й), благоприятствующих образованию для молекулы, частицы, такого(их) как, например, изменение pH, температуры, влажности и/или осмомолярности/осмомоляльности. Создание такого(их) условия(й) может приводить, например, к связыванию, коалесценции, отверждению и/или дегидратации и тем самым к образованию частиц. Одним из примеров процесса образования частиц является реакция осаждения.
Используемый здесь термин «сораствор» означает любую среду, состоящую по меньшей мере из двух химических, биологических и/или биосинтетических молекул. Так, например, сораствор может быть получен путем объединения жидкости, содержащей по меньшей мере одну химическую, биологическую и/или биосинтетическую молекулу, с твердым веществом, содержащим химическую, биологическую и/или биосинтетическую молекулу. В другом примере сораствор может быть получен путем объединения жидкости, содержащей по меньшей мере одну химическую, биологическую и/или биосинтетическую молекулу, с другой жидкостью, содержащей химическую, биологическую и/или биосинтетическую молекулу. В другом примере сораствор может быть получен путем добавления по меньшей мере двух твердых веществ, каждое из которых содержит по меньшей мере одну химическую, биологическую и/или биосинтетическую молекулу, в один раствор.
Нативный GLP-1, рассматриваемый в настоящем изобретении, представляет собой полипептид, имеющий аминокислотную последовательность SEQ ID NO. 1 или SEQ ID NO. 2. Нативный пептид GLP-1 подвергается быстрому расщеплению и инактивации в течение нескольких минут in vivo.
Аналогами GLP-1 согласно изобретению могут быть экзендины, то есть пептиды, которые, как было обнаружено, являются агонистами рецептора GLP-1, и такие аналоги могут также включать экзендины 1-4. Экзендины были обнаружены в яде змеи ядозуба и имеют примерно 53%-ную гомологию аминокислот с аминокислотами GLP-1 млекопитающего. Экзендины также обладают аналогичной аффинностью связывания с рецептором GLP-1. Сообщалось, что экзендин-3 и экзендин-4 стимулируют продуцирование cAMP в ацинарных клетках поджелудочной железы и высвобождение амилазы из этих клеток (Malhotra et al., 1992; Raufman et al., 1992; Singh et al., 1994). Ранее было предложено использовать экзендин-3 и экзендин-4 в качестве инсулинотропных средств для лечения сахарного диабета и для предупреждения гипергликемии (патент США No. 5424286).
Сообщалось, что карбокси-концевые фрагменты экзендина, такого как экзендин[9-39], карбоксиамидированная молекула и фрагменты 3-39 - 9-39 являются сильными и селективными антагонистами GLP-1 (Goke et al., 1993; Raufman et al., 1991; Schepp et al., 1994; Montrose-Rafizadeh et al., 1996). В литературе также было продемонстрировано, что экзендин[9-39] блокирует эндогенный GLP-1 in vivo, что приводит к снижению секреции инсулина (Wang et al., 1995; D'Alessio et al., 1996). Экзендин-4 сильно связывается с рецепторами GLP-1, присутствующими на инсулин-секретирующих β-ТС1-клетках, с диспергированными ацинарными клетками поджелудочной железы и с париетальными клетками желудка. Пептид зкзендин-4 также играет определенную роль в стимуляции высвобождения соматостатина и в ингибировании высвобождения гастрина в отдельных областях желудка (Goke et al., 1993; Schepp et al., 1994; Eissele et al., 1994). В клетках, трансфецированных клонированным рецептором GLP-1, экзендин-4 может вести себя как агонист, то есть он способствует повышению уровня cAMP, а экзендин[9-39] был идентифицирован как антагонист, то есть он блокирует стимулирующее действие экзендина-4 и GLP-1. Было также обнаружено, что экзендин является резистентным к разложению.
В другом варианте настоящего изобретения рассматривается использование пептидомиметиков. Пептидомиметиками, известными специалистам, являются пептиды, которые биологически имитируют активные детерминанты на гормонах, цитокинах, субстратах ферментов, вирусах или других биомолекулах и могут подавлять, стимулировать или как-либо иначе модулировать физиологическую активность природных лигандов. Пептидомиметики являются особенно ценными при разработке лекарственных средств. См., например, Johnson et al., "Peptide Turn Mimetics" in Biotechnology and pharmacy, Pezzuto et al., Eds., Chapman and Hall, New York (1993). Главным соображением, лежащим в основе применения пептидомиметиков, является ориентация боковых цепей пептидного остова белков, которая облегчает взаимодействие молекул. Предполагается, что пептидомиметики подвергаются молекулярным взаимодействиям, аналогичным взаимодействию природных молекул.
В других вариантах изобретения предусматривается, что молекулы GLP-1 согласно изобретению обладают по меньшей мере одной биологической активностью, присущей нативному GLP-1, а именно способностью связываться с рецептором GLP-1 и инициировать путь передачи сигнала, приводящий к индуцированию инсулинотропной активности. В других вариантах изобретения молекулой GLP-1 может быть пептид, полипептид, белок, аналог, миметик, производное, изоформа, фрагмент и т.п., которые сохраняют по меньшей мере одну биологическую активность природного GLP-1. Молекулами GLP-1 могут быть также фармацевтически приемлемые соли и пролекарства и соли пролекарств, полиморфы, гидраты, сольваты, биологически активные фрагменты, биологически активные варианты и стереоизомеры природного человеческого GLP-1, а также агонист, миметик и варианты антагонистов природного человеческого GLP-1, семейство экзендинов, включая экзендины 1-4 и их полипептидные гибриды. Молекулой GLP-1 согласно изобретению может быть также GLP-1, защищенный от действия дипептидил-пептидазы-IV (DPP-IV), который предотвращает или ингибирует разложение GLP-1.
Молекулами GLP-1 согласно изобретению являются пептиды, полипептиды, белки и их производные, которые содержат аминокислотные замены, улучшают растворимость, сообщают резистентность к окислению, повышают биологическую активность или увеличивают время полужизни в кровотоке. Таким образом, молекулы GLP-1, рассматриваемые в настоящем изобретении содержат аминокислотные замены, делеции или добавления, где аминокислоту, предназначенную для замены, делеции или добавления, выбирают из аминокислот, хорошо известных специалистам. N- или C-концы молекулы могут быть также модифицированы, например, путем ацилирования, ацетилирования, амидирования и т.п. Таким образом, в настоящем изобретении, термин «аминокислота» означает природные и не-природные аминокислоты, а также аминокислотные аналоги и миметики, функции которых аналогичны функциям природных аминокислот. Природными кодируемыми аминокислотами являются 20 незаменимых аминокислот (аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутамин, глутаминовая кислота, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин и валин), пиролизин и селеноцистеин. Термин «аминокислотный аналог» означает соединения, имеющие такую же основную химическую структуру, как и природная аминокислота, то есть в них α-углерод связан с водородом, с карбоксильной группой, аминогруппой и с группой R, например, такие соединения, как гомосерин, норлейцин, норваоин, сульфоксид метионина, метионинметилсульфоний, цитруллин, гидроксилглутаминовая кислота, гидроксипролин и пралин. Такие аналоги имеют модифицированные группы R (такие как норлейцин), но сохраняют основную химическую структуру, присущую природной аминокислоте. Аминокислотами, рассматриваемыми в настоящем изобретении, также являются β-аминокислоты, которые аналогичны α-аминокислотам с той точки зрения, что они также имеют амино-конец и карбокси-конец. Однако в β-аминокислотах эти функциональные концы разделены двумя атомами углерода. β-аминокислоты со специфической боковой цепью могут существовать в форме R- или S-изомеров в положении альфа-углерода (C2) или бета-углерода (C3). Это приводит к образованию всего четырех возможных диастереоизомеров для любой данной боковой цепи.
Молекулами GLP-1 согласно изобретению могут быть также гибридные белки GLP-1, слитые белки, олигомеры и мультимеры, гомологи, варианты гликозилирования различных типов и их мутеины, где указанная молекула GLP-1 сохраняет по меньшей мере одну биологическую активность нативной молекулы и, кроме того, такими молекулами, независимо от метода их синтеза или продуцирования, являются, но не ограничиваются ими, рекомбинантные молекулы (независимо от того, продуцированы ли они из кДНК, геномной ДНК, синтетической ДНК или другой формы нуклеиновой кислоты), синтетические молекулы и молекулы, полученные методами активации генов. Техника рекомбинантных ДНК хорошо известна среднему специалисту в данной области (см. Russell, D. W., et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, N.Y., 2001).
III. Дикетопиперазины
Дикетопиперазины хорошо известны специалистам по их способности образовывать микрочастицы, которые могут быть использованы для доставки и стабилизации лекарственного средства. В настоящем изобретении дикетопиперазины используются для облегчения абсорбции молекул GLP-1 и тем самым для получения стабильного препарата, резистентного к разложению.
При этом могут применяться различные методики, в которых дикетопиперазины могут быть образованы в виде частиц, включающих молекулы GLP-1, или частиц, на которых могут адсорбироваться молекулы GLP-1. Такая методика может включать смешивание растворов дикетопиперазина с растворами или суспензиями молекул GLP-1 с последующим осаждением и образованием частиц, содержащих дикетопиперазин и GLP-1. Альтернативно, дикетопиперазин может быть осажден с образованием частиц и последующим их смешиванием с раствором молекул GLP-1. Ассоциация между частицами дикетопиперазина и молекулой GLP-1 может быть инициирована удалением растворителя, либо, для стимуляции такой ассоциации, может быть осуществлена специфическая стадия, такая как коррекция рН, которая может быть проведена перед сушкой.
В предпочтительном варианте изобретения дикетопиперазинами согласно изобретению являются, но не ограничиваются ими, 3,6-ди(4-аминобутил)-2,5-дикетопиперазин, также известный как (E)-3,6-бис[4-(N-карбоксил-2-пропенил)амидобутил]-2,5-дикетопиперазин (который может также называться фумарилдикетопиперазином или FDKP).
Другими дикетопиперазинами, рассматриваемыми в настоящем изобретении, являются, но не ограничиваются ими, производные 3,6-ди(4-аминобутил)-2,5-дикетопиперазин, такие как: 3,6-ди(сукцинил-4-аминобутил)-2,5-дикетопиперазин (также называемый здесь 3,6-бис(4-карбоксипропил)амидобутил-2,5-дикетопиперазином; сукцинилдикетопиперазином или SDKP); 3,6-ди(малеил-4-аминобутил)-2,5-дикетопиперазин; 3,6-ди(цитраконил-4-аминобутил)-2-5-дикетопиперазин; 3,6-ди(глутарил-4-аминобутил)-2,5-дикетопиперазин; 3,6-ди(малонил-4-аминобутил)-2,5-дикетопиперазин; 3,6-ди(оксалил-4-аминобутил)-2,5-дикетопиперазин и их производные. В других вариантах настоящего изобретения рассматривается использование солей дикетопиперазина. Такими солями могут быть, например, любые фармацевтически приемлемые соли, такие как дикетопиперазиновые соли Na, K, Li, Mg, Ca, аммония или моно-, ди- или триалкиламмония (происходящие от триэтиламина, бутиламина, диэтаноламина, триэтаноламина или пиридинов и т.п.). Такой солью может быть моно-, ди- или смешанная соль. Рассматриваются также соли дикетопиперазинов высшего порядка, в которых группы R содержат более чем одну кислотную группу. В других аспектах изобретения основная форма агента может быть смешана с дикетопиперазином с получением лекарственного средства в виде соли дикетопиперазина, где указанное лекарственное средство является противокатионом дикетопиперазина. Неограничивающим примером рассматриваемой здесь соли является динатриевая соль (diNa) FDKP. Доставка лекарственного средства с использованием солей DKP описана в заявке на патент США No 11/210710, все разделы которой, относящиеся к солям DKP, вводятся в настоящее описание посредством ссылки.
Как указывается в настоящем описании, также рассматривается использование новых асимметрических аналогов FDKP, xDKP, таких как (Е)-3-(4-(3,6-диоксопиперазин-2-ил)бутилкарбамоил)-акриловая кислота; (E)-3-(3-(3,6-диоксопиперазин-2-ил)пропил-карбамоил)акриловая кислота; и (E)-3-(4-(5-изопропил-3,6-диоксопиперазин-2-ил)бутилкарбамоил) акриловая кислота и аналогов, описанных в предварительной заявке на патент США, озаглавленной «Асимметрические аналоги FDKP, используемые в качестве агентов для доставки лекарственных средств» ("Asymmetrical FDKP Analogs for Use as Drug Delivery Agents"), которая была подана одновременно с настоящей заявкой и во всей своей полноте вводится в настоящее описание (документ патентного поверенного No. 51300-00041).
Дикетопиперазины могут быть получены путем циклодимеризации производных сложного эфира аминокислоты, описанных Katchalski, et al. (J. Amer. Chem. Soc. 68:879-80; 1946), путем циклизации производных сложного эфира дипептида или путем тепловой дегидратации производных аминокислот в растворителях с высокой температурой кипения, рассматриваемых в работе Kopple, et al. (J. Org. Chem. 33:862-64;1968), описание которой вводится в настоящее описание.
Методы синтеза и получения дикетопиперазинов хорошо известны среднему специалисту в данной области и описаны в патентах США №№ 5352461; 5503852; 6071497; 6331318; 6428771 и в заявке на патент США No. 20060040953. В патентах США №№ 6444226 и 6652885 описано получение и синтез микрочастиц дикетопиперазинов в водной суспензии, к которой добавляют раствор активного агента для связывания активного агента с частицами. В этих патентах также описан способ удаления жидкой среды путем лиофилизации с получением микрочастиц, содержащих активный агент, и изменения состояния растворителя в такой суспензии для стимуляции связывания активного агента с частицами, как указывается в заявках на патенты США, №№ 60/717524 и 11/532063, озаглавленных «Способ получения лекарственного средства, исходя из увеличения аффинности активных агентов по отношению к поверхностям кристаллических микрочастиц» ("Method of Drug Formulation Based on Increasing the Affinity of Active Agents for Crystalline Microparticle Surfaces"); и 11/532065, озаглавленной «Способ получения лекарственного средства, исходя из увеличения аффинности активных агентов по отношению к поверхностям кристаллических микрочастиц» (Method of Drug Formulation Based on Increasing the Affinity of Active Agents for Crystalline Microparticle Surfaces. См. также патент США № 6440463 и заявку на патент США, No: 11/210709, поданную 23 августа 2005, и заявку на патент США № 11/208087). В некоторых случаях предусматривается, что нагруженные частицы дикетопиперазина согласно изобретению могут быть подвергнуты сушке методом сушки распылением, как описано, например, в заявке на патент США, № 11/678046, поданной 22 февраля, 2006 и озаглавленной «Способ улучшения фармацевтических свойств микрочастиц, содержащих дикетопиперазин и активный агент» («Method For Improving the Pharmaceutic Properties of Microparticles Comprising Diketopiperazine and an Active Agent»). Все указанные патенты и патентные заявки во всех разделах, относящихся к дикетопиперазинам, вводятся в настоящее описание посредством ссылки.
IV. Терапевтические препараты GLP-1/DKP-частиц
Настоящее изобретение также относится к GLP-1/FDKP-препарату для его введения индивидууму, нуждающемуся в лечении. Индивидуумом, рассматриваемым в настоящем изобретении, может быть животное-компаньон или человек. В некоторых вариантах изобретения рассматривается лечение диабета типа II, ожирения, рака или любых родственных заболеваний и/или состояний. Особенно предпочтительным индивидуумом является человек.
Другими заболеваниями или состояниями, рассматриваемыми в настоящем изобретении, являются, но не ограничиваются ими, синдром раздраженного кишечника, инфаркт миокарда, ишемия, реперфузионное поражение ткани, дислипидемия, диабетическая кардиомиопатия, острый коронарный синдром, метаболический синдром, катаболические изменения после хирургического вмешательства, нейродегенеративные расстройства, расстройство памяти и нарушение познавательных способностей, состояния, связанные с имплантацией островковых клеток и регенеративной терапией, или инсульт. Другими заболеваниями и/или состояниями, рассматриваемыми в настоящем изобретении, являются любые заболевания и/или состояния, включительно, которые ассоциируются с вышеперечисленными заболеваниями, и которые могут быть подвергнуты лечению путем введения индивидууму, нуждающемуся в этом, сухого порошкообразного GLP-1/FDKP-препарата. Указанный сухой порошкообразный GLP-1/FDKP-препарат согласно изобретению может быть также использован для предотвращения индуцирования дифференцировки человеческих бета-клеток при диабете типа II и гипергликемии.
В другом варианте настоящего изобретения предусматривается, что указанным индивидуумом может быть домашний питомец или животное-компаньон, включая крыс, кроликов, хомячков, морских свинок, песчанок, сурков, кошек, собак, овец, коз, свиней, коров, лошадей, обезьян и человекообразных обезьян (включая шимпанзе, гиббонов и павианов).
Кроме того, предусматривается, что препараты GLP-1/FDKP-частиц согласно изобретению могут быть введены в клинических или не-клинических целях различными способами, известными среднему специалисту в данной области. GLP-1/FDKP-композиции согласно изобретению могут быть введены в любую нужную биологическую мембрану, а предпочтительно, в слизистую оболочку индивидуума. Введение может быть осуществлено любым способом, включая, но не ограничиваясь ими, пероральное введение, интраназальное введение, трансбуккальное введение, системная внутривенная инъекция, подкожное введение, региональное введение путем доставки через кровь или лимфу, введение непосредственно в пораженный участок, или даже местное введение. В предпочтительных вариантах изобретения введение GLP-1/FDKP-композиции осуществляют путем внутрилегочной доставки.
Другими альтернативными способами введения, которые могут быть применены в настоящем изобретении, являются чрескожное введение, внутриартериальное введение, внутрибрюшинное введение, введение в пораженный участок, внутричерепное введение, внутрисуставное введение, введение в предстательную железу, интраплевральное введение, интратрахеальное введение, введение в стекловидное тело, интравагинальное введение, ректальное введение, введение в опухоль, внутримышечное введение, интравезикулярное введение, введение в слизистую, введение в область перикарда, местное введение в бронхи с помощью аэрозольного ингалятора, путем инъекции, вливания и непрерывного вливания, прямое промывание клеток-мишеней путем локализованной перфузии с использованием катетера и лаважа, местное введение с помощью кремов, жидких композиций (например, липосом) или другим способом, либо любой комбинации из вышеперечисленных методов, хорошо известных среднему специалисту в данной области (см., например, руководство Remington's Pharmaceutical Sciences, 1990, все разделы которого, относящиеся к методам доставки, вводятся в настоящее описание посредством ссылки).
Как и сухой порошкообразный препарат, частицы GLP-1/DKP согласно изобретению могут быть доставлены путем ингаляции в конкретные области дыхательной системы, в зависимости от их размера. Кроме того, частицы GLP-1/DKP могут иметь достаточно малый размер, который позволяет включать их в лекарственную форму в виде суспензии для внутривенного введения. Для пероральной доставки эти частицы могут быть включены в суспензию, таблетки или капсулы. GLP-1/DKP-композиция может быть доставлена с помощью ингалятора, такого как аэрозольный ингалятор, ингалятор с дозирующим клапаном, инсуффлятор и распылитель.
В других вариантах изобретения рассматривается введение «эффективного количества» GLP-1/DKP-препарата пациенту, нуждающемуся в этом. Термин «эффективное количество» сухого порошкообразного GLP-1/DKP-препарата, рассматриваемого в настоящем изобретении, означает количество соединения GLP-1, его аналога или пептидомиметика, или т.п., которое до некоторой степени ослабляет один или несколько симптомов заболевания, состояния или расстройства, подвергаемого лечению. В одном из вариантов изобретения «эффективное количество» сухого порошкообразного GLP-1/DKP-препарата может представлять собой количество молекул GLP-1, подходящее для лечения диабета посредством увеличения уровней инсулина в плазме, снижения или уменьшения уровней глюкозы в крови натощак и увеличения клеточной массы панкреатических бета-клеток по меньшей мере примерно на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50% или более и т.п. В другом своем предпочтительном варианте настоящее изобретение относится к лечению ожирения путем введения индивидууму, нуждающегося в таком лечении, фармацевтически эффективного количества молекулы GLP-1. В таких случаях «эффективным количеством» сухого порошкообразного GLP-1/DKP-препарата может быть количество молекул GLP-1, подходящее для лечения ожирения посредством снижения или уменьшения массы тела по меньшей мере примерно на 5, 10, 15, 20, 25, 30, 35, 40, 45, 50% или более и т.п. В настоящем изобретении также рассматривается введение «эффективного количества» сухого порошкообразного GLP-1/DKP-препарата для регуляции насыщения у индивидуума, нуждающемуся в таком лечении, где указанному индивидууму вводят фармацевтически эффективное количество молекулы GLP-1. Неограничивающим примером молекулы GLP-1 может быть молекула экзендина, такая как экзендин-1 или -4. В этих случаях «эффективным количеством» сухого порошкообразного GLP-1/DKP-препарата может быть количество молекул GLP-1, которое ослабляет ощущение голода и снижает потребление пищи (как было определено, например, по измерению массы или содержанию калорий) по меньшей мере примерно на 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50% или более и т.п. «Эффективное количество» сухого порошкообразного GLP-1/DKP-препарата может быть также определено как количество, достаточное для детектируемого и обнаруживаемого ослабления, снижения, минимизации или ограничения тяжести заболевания или состояния, или их симптомов. Прекращение развития, предотвращение или излечение данного заболевания или состояния может быть также осуществлено с использованием «эффективного количества» препарата согласно изобретению.
При введении GLP-1/FDKP-композиции согласно изобретению индивидууму, нуждающемуся в этом, конкретная доза данной композиции может быть определена, исходя из физических и физиологических факторов, таких как масса тела, тяжесть состояния, тип заболевания, подвергаемого лечению, ранее или одновременно проводимое терапевтическое лечение, наличие идиопатических заболеваний у пациента и способ введения. Средний специалист в данной области может самостоятельно определить конкретную дозу лекарственного средства в зависимости от одного или нескольких из указанных факторов.
GLP-1/DKP-препарат согласно изобретению может быть введен один или несколько раз в зависимости от заболевания или состояния, подвергаемого лечению. Введение GLP-1/DKP-препарата индивидууму может быть осуществлено через определенные интервалы времени, а именно через несколько минут, часов, дней, недель или месяцев. В некоторых случаях продолжительность терапевтического курса лечения может зависеть от времени полужизни молекулы GLP-1 после ее введения. В других вариантах изобретения для лечения конкретных заболеваний или состояний или комплекса заболеваний или состояний, таких как рак, может, например, оказаться желательным введение GLP-1/DKP-препарата согласно изобретению в сочетании с фармацевтическим наполнителем или агентом. В этих случаях курс лечения может быть назначен в зависимости от используемого фармацевтического наполнителя или агента.
V. Примеры
Нижеследующие примеры приводятся для иллюстрации некоторых вариантов изобретения. При этом следует отметить, что способы, описанные в этих примерах, являются репрезентативными способами, подходящими для осуществления настоящего изобретения. Однако следует отметить, что, исходя из данного описания, в конкретные варианты осуществления изобретения могут быть внесены различные изменения, которые дают такой же или аналогичный результат и не выходят за рамки существа и объема изобретения.
Пример 1
Анализы структуры GLP-1 с применением биофизических и аналитических методов
Анализы структуры и поведения GLP-1 были проведены с применением ряда биофизических и аналитических методов. Такими методами являются круговой дихроизм в далекой области УФ-излучения (КД в далеком УФ), круговой дихроизм в ближней области УФ-излучения (КД в ближнем УФ), собственная флуоресценция, инфракрасная Фурье-спектроскопия (FTIR), жидкостная хроматография высокого давления (ЖХВД) и масс-спектроскопия (МС), хорошо известные среднему специалисту в данной области. Исследования влияния концентрации, ионной силы, температуры, рН, окислительного стресса, перемешивания и множества циклов «замораживания-оттаивания» на пептид GLP-1 проводили в экспериментальных условиях широкого ряда, более подробно описанных ниже. Такие анализы были также проведены для характеризации основных путей разложения и определения условий, при которых может быть изменена пептидная структура GLP-1 в целях получения некоторых GLP-1/DKP-препаратов.
Экспериментальная процедура
GLP-1 закупали у American Peptide (Sunnyvale, CA) или AnaSpec (San Jose, CA), или получали в лаборатории (MannKind Corporation, Valencia, CA). Образцы водного раствора GLP-1 при различных концентрациях анализировали при pH 4,0 и 20°С (если это не оговорено особо). Перед проведением каждого эксперимента обычно получали свежие образцы, и эти образцы смешивали с соответствующей добавкой (например, с солью, рН-корректирующим буфером, Н2О2 и т.п., если это необходимо). Измерение вторичной структуры GLP-1 в различных условиях проводили методами КД в далеком УФ и просвечивающей инфракрасной Фурье-спектроскопии (FTIR). Кроме того, методы КД в ближнем УФ и собственной флуоресценции применяли для анализа третичной структуры GLP-1 путем мониторинга среды, окружающей его ароматические остатки, а именно, триптофан.
Структруры GLP-1 в зависимости от концентрации
Спектр кругового дихроизма (КД) был использован для анализа α-спирали, β-складчатого слоя, β-витков и случайной спирали, которые могут характеризовать такую молекулу, как белок или пептид. В частности, метод КД в далеком УФ был применен для определения типа вторичной структуры, например, чистой α-спирали, β-складчатого слоя и т.п., в белках и пептидах. С другой стороны, КД в ближнем УФ был использован для анализа третичных структур молекулы. Так, например, для определения влияния концентрации на структуры GLP-1 были применены методы КД в далеком и ближнем УФ.
КД в далеком УФ, продемонстрированный на фиг. 1A, показал, что GLP-1, используемый при концентрацях в широком диапазоне (например, 1,8; 4,2; 5,1; 6,1; 7,2 и 8,6 мг/мл), образует две отдельные структуры, включающие α-спирали и случайные спирали. При низких концентрациях (≤ 2 мг/мл) GLP-1 является, в основном, неструктурированным, как было определено по ярким одиночным минимумам на 205 нм. При возрастании концентрации данный пептид приобретает α-спиральную структуру, как было определено по двум минимумам на 208 нм и 224 нм (фиг. 1A).
Анализ третичной структуры позволяет предположить, что структуры GLP-1 при высоких концентрациях представляют собой самоассоциирующиеся конформации (то есть олигомеры). Данные, полученные методами КД в ближнем УФ и флуоресцентного излучения, подтвердили эту гипотезу. Позитивные полосы в области 250-300 нм при КД в ближнем УФ (фиг. IB) показали, что GLP-1 имеет определенную третичную структуру, компоненты которой увеличиваются при более высоких концентрациях. Более конкретно, эти полосы указывают на то, что ароматические остатки данного пептида являются в высокой степени иммобилизованными и находятся в хорошо определенном окружении.
Аналогичным образом, флуоресцентное излучение GLP-1 при различных концентрациях (pH 4,0, 20°С) показало, что ароматический остаток триптофан (который также представлен интенсивными полосами в КД-спектре в ближнем УФ) присутствует в хорошо определенной третичной структуре, на что указывают данные по возбуждению триптофана на 280 нм (Фиг. 1C). Максимум флуоресценции на 355 нм при низких концентрациях GLP-1 указывает на то, что триптофан подвержен воздействию растворителя и, в данном случае, GLP-1 не имеет четкой третичной структуры. При высоких концентрациях пептида интенсивность максимумов снижается, и эти максимумы смещаются в сторону более коротких длин волн, что указывает на более определенную третичную структуру.
Для уточнения предполагаемой вторичной структуры самоассоциирующейся конформации GLP-1 был проведен FTIR-анализ при различных концентрациях (pH 4,0, 20°С). Полоса амида 1 при 1656 см-1 явно указывает на то, что GLP-1 имеет α-спиральную структуру при концентрациях ≥ 2 мг/мл (фиг. 1D). Следовательно, GLP-1 не образует β-складчатых структур, и, более вероятно, что вместо этого данный пептид при высоких концентрациях образует спиральный пучок.
Кроме того, было экспериментально показано, что эти различные структуры GLP-1 не были генерированы путем обработки образца. После проведения сравнения разведений концентрированного маточного раствора с GLP-1, полученным путем прямого растворения пептида в буфере, были получены аналогичные спектры КД в далеком УФ, КД в ближнем УФ и флуоресцентного излучения.
Влияние ионной силы на GLP-1
Были также проведены исследования для определения влияния ионной силы на пептид GLP-1. На фиг. 2A (КД в далеком УФ) показано, что при возрастании концентрации соли (от 100 мМ до 1000 мМ), неупорядоченная структура GLP-1 превращается в α-спиральную конформацию, как было определено по минимумам на 208 и 224 нм. После повышения концентрации NaCl до 1 М из раствора осаждалось значительное количество пептида (при 1,0 мг/мл) (фиг. 2А). Тем не менее было показано, что осадок такого типа растворялся после разбавления водой, и тем самым было установлено, что при высокой ионной силе растворителя может происходить обратимое осаждение GLP-1.
Было показано, что соль также способствует образованию и улучшению третичной структуры GLP-1. Это проиллюстрировано на фиг. 2В (КД в ближнем УФ), где GLP-1 в концентрации 1,0 мг/мл не обнаруживал сигнала в отсутствие соли, но имел четкую третичную структуру, которая усиливалась с увеличением ионной силы. Эти результаты были подтверждены флуоресцентным излучением 1,0 мг/мл GLP-1 (фиг. 2C) при различных концентрациях NaCl (pH 4,0; 20°С) после возбуждения триптофана на 280 нм. Увеличение ионной силы приводило к сдвигу максимума интенсивности флуоресценции в сторону более коротких длин волн, что указывает на то, что в данном случае наблюдалось образование и усиления третичной структуры GLP-1 при концентрации 1,0 мг/мл.
Кроме того, анализ третичной структуры GLP-1 в концентрации 10 мг/мл при варьирующейся ионной силе (pH 4,0; 20°С), проводимый по спектру КД в ближнем УФ, показал, что с увеличением ионной силы также усиливается образование самоассоциирующейся конформации GLP-1 (фиг 2D).
Поэтому, полученные данные позволяют предположить, что ионная сила оказывает сильное влияние на структуру GLP-1, в результате чего этот белок приобретает α-спиральную конформацию и ассоциируется в олигомеры. Кроме того, увеличение ионной силы в растворе приводит к усилению олигомеризации GLP-1 до его обратимого осаждения. Это наблюдается при низких концентрациях пептида, при которых изначально отсутствовала третичная структура, а также при высоких концентрациях пептида, который уже имел достаточный уровень вторичной и третичной структуры. Таким образом, при увеличении ионной силы неструктурированный GLP-1 быстро превращается в α-спиральную и самоассоциирующуюся конформацию. Кроме того, полученные данные спектроскопии были сравнимы с полученными ранее данными анализов на влияние повышенных концентраций пептида.
Влияние температуры и рН на GLP-1
Были также проведены исследования для того, чтобы определить, является ли самоассоциирующаяся конформация GLP-1 чувствительной к изменениям температуры или pH. На фиг. 3A (КД в ближнем УФ) показано, что третичная структура GLP-1 при концентрации 10 мг/мл в значительной степени диссоциируется по мере увеличения температуры. С другой стороны, в анализе GLP-1 при различных температурах и pH 4,0 было установлено, что температура не оказывает влияния на GLP-1 при низких концентрациях (0,05 мг/мл); см. фиг. 3B и 3C (КД в далеком УФ). КД в далеком УФ показал, что данный пептид не является не чувствительным к температуре. Поэтому увеличение подвижности молекулы значительно затрудняет самосборку GLP-1.
И наоборот, на фиг. 4A (КД в далеком УФ) было продемонстрировано, что растворимость α-спиральной конформации GLP-1 зависит от pH. Хотя структура GLP-1 в концентрации 10 мг/мл является относительно однородной (то есть GLP-1 сохраняет спиральную структуру) при pH 4,4 и ниже, однако если рН повышается до нейтрального или близкого к нейтральному значения (pH 6,3-7,6), то некоторое осаждение все же происходит и образуется неупорядоченная структура, на что указывает спектр. Образцы, в которых наблюдалось осаждение, имели меньшую интенсивность, что обусловлено меньшей растворимостью GLP-1 в растворе. Такая неупорядоченная структура была определена по одному минимуму, наблюдаемому на 208 нм, как показано на фиг. 4А (КД в далеком УФ), и как показано на фиг. 4В (КД в ближнем УФ), что вероятно, является результатом снижения концентрации GLP-1 в растворе после осаждения. Такое осаждение может наблюдаться в том случае, если значения рН выше значения pI 5,5 для GLP-1. Однако, по мере увеличения значения рН от близкого к нейтральному до 11,7, большая часть осадка снова растворяется, что указывает на то, что такое осаждение является обратимым. Оставшийся нерастворимый осадок GLP-1 при pH 11,7 будет снижать количество пептида в растворе и тем самым снижать интенсивность спектра КД в далеком УФ, как показано на фиг. 4А. Также наблюдалось, что GLP-1 является в высокой степени нерастворимым в случае, когда лиофилизованный порошок GLP-1 смешивали с буфером, pH 9, до получения высокой концентрации GLP-1.
Стабильность GLP-1
Стабильность пептида GLP-1 оценивали путем определения его резистентности к дезамидированию и окислению, а также к влиянию перемешивания и циклов «замораживания-оттаивания».
GLP-1 (1 мг/мл) при pH 10,5 инкубировали в течение 5 дней при 40°С, после чего проводили анализы на дезамидирование и окисление с помощью обращенно-фазовой ЖХВД и масс-спектрометрии электрораспылением (МС). Оценку окисления также проводили на образцах GLP-1 (1 мг/мл), инкубированных в течение 2 часов в присутствии 0,1% Н2О2, с помощью ЖХВД и МС.
На фиг. 5 проиллюстрирована стабильность GLP-1 в условиях дезамидирования и оксиления. ЖХВД-хроматограммы показали, что GLP-1 элюируется при одном и том же времени удерживания, и пики разложения, образующиеся в анализируемых условиях дестабилизации, отсутствуют. Кроме того, МС-анализы давали аналогичные массы для всех образцов, 3297 г/моль, что указывало на то, что масса не изменялась. Полученные данные также показали, что эти пептиды остаются чистыми и интактными при их инкубировании в различных условиях. Таким образом, дезамидирования GLP-1 не наблюдалось. Было показано, что GLP-1 является резистентным к окислительному стрессу, как было обнаружено в присутствии 0,1% Н2О2, где чистота и масса GLP-1 оставались неизменными, на что указывали ЖХВД и МС, соответственно. Вообще говоря, каких-либо изменений времени удерживания или величин массы, а также пиков разложения, не обнаруживалось, что свидетельствует о том, что пептид GLP-1 является резистентным к дезамидированию и окислению.
Влияние перемешивания и последующего проведения циклов «замораживания-оттаивания» на GLP-1 при различных концентрациях анализировали с помощью КД в ближнем УФ и собственной флуоресценции. Перемешивание 9,4 и 1,5 мг/мл GLP-1 не приводило к каким-либо значительным изменениям в структуре пептида, на что указывали КД в ближнем УФ (фиг. 6А) и флуоресцентное излучение (Фиг. 6B). Образцы перемешивали в течение 30 и 90 минут при комнатной температуре, и после возбуждения триптофана на 280 нм получали спектры флуоресцентного излучения. В независимых исследованиях по «замораживанию-оттаиванию» растворы, содержащие GLP-1 (рН 4,0) при концентрациях 1,6, 5,1 и 8,4 мг/мл, замораживали при -20°С и оттаивали при комнатной температуре. Влияние 10 циклов «замораживания-оттаивания» на GLP-1 осуществляли и анализировали с помощью КД в ближнем УФ (фиг. 7A) и флуоресцентного излучения (фиг. 7B). После возбуждения триптофана на 280 нм получали спектры флуоресцентного излучения. Оба анализа показали, что при проведении множества циклов «замораживания - оттаивания» третичная структура данного пептида не подвергается каким-либо значительным изменениям. В аналогичных экспериментах анализировали влияние 11 циклов «замораживания - оттаивания» на вторичную структуру GLP-1 при концентрации 10 мг/мл (pH 4,0) (Фиг. 7C). КД в далеком УФ показал, что вторичная структура пептида не подвергалась какому-либо заметному изменению при проведении множества циклов «замораживания - оттаивания».
В целом, результаты биофизических анализов, проводимых в вышеописанных экспериментах, показали, что на структуру пептида GLP-1 значительно влияет его концентрация в растворе. По мере увеличения концентрации GLP-1 α-спиральные структуры становятся более явно выраженными. Кроме того, увеличение ионной силы приводит к усилению структуры GLP-1, а в некоторых случаях, к образованию третичных структур GLP-1.
Пример 2
Исследование адсорбции GLP-1/FDKP
Взаимодействие GLP-1 с частицами дикетопиперазина (DKP) в суспензии оценивали путем проведения исследований адсорбции. Исследования по изменению адсорбции проводили в целях изучения влияния электростатических свойств, водородных связей, водной структуры, гибкости структуры белка и специфических реакций присоединения солей на взаимодействие GLP-1/DKP. Кроме того, некоторые известные стабилизаторы белков были протестированы на блокирование адсорбции GLP-1 на поверхностях DKP.
С использованием ранее полученных частиц DKP-суспензии (то есть FDKP) были проанализированы условия, при которых GLP-1 адсорбируется на поверхностях ранее полученных DKP-частиц. Суспензию FDKP-частиц, которая уже содержала ранее образованные частицы FDKP, объединяли с 3X pH-корректирующим буфером и 3X раствором добавки или наполнителя. Конечный раствор содержал FDKP в концентрации 5 мг/мл и GLP-1 в концентрации 0,25 мг/мл (5% масс./масс.). Несвязанный GLP-1 в супернатанте отфильтровывали из суспензии. Частицы FDKP со связанным белком GLP-1 растворяли (разводили) 100 мМ бикарбоната аммония и фильтровали для отделения любого агрегированного белка GLP-1. Количество GLP-1 в супернатанте и в разведенных фракциях количественно оценивали с помощью ЖХВД. Была проведена серия экспериментов, в которых использовали добавки, такие как соли, поверхностно-активные вещества, ионы, осмолиты, хаотропы, органические вещества и различные концентрации GLP-1. Результаты этих исследований описаны ниже.
Исследования соли. Влияние соли на связывание GLP-1 с частицами FDKP оценивали с помощью ЖХВД-анализа. Загрузку GLP-1/ FDKP-частиц осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1 в присутствии 0, 25, 50, 100, 250, 500, 1000 и 1500 мМ NaCl (Фиг. 8A). Также оценивали количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH и концентрации NaCl (фиг. 8В). рН в данных наборах образцов корректировали смесью 20 мМ фосфата/20 мМ ацетата.
Как видно на фиг. 8A, оптимальное связывание (адсорбция) GLP-1 с частицами FDKP в высокой степени зависело от рН данной суспензии. При pH 4 и выше наблюдалось приблизительно 3,2% - 4% связывание GLP-1 с частицами FDKP, где отношение GLP-1/FDKP в растворе составляло 5% масс./масс. При pH 2,0 в присутствии 0 и 25 мМ NaCl адсорбции GLP-1 на частицах FDKP, в основном, не наблюдалось, однако при увеличении ионной силы наблюдалась явно заметная нагрузка. Осаждение GLP-1 наблюдалось в контрольных образцах, не содержащих FDKP, в присутствии ≥ 1M NaCl (Фиг. 8B). Такая заметная нагрузка при ≥ 1M NaCl является результатом обратимого осаждения (высаливания) пептида GLP-1 при высокой ионной силе. Контрольный образец GLP-1 с высоким содержанием соли в отсутствие частиц FDKP также обнаруживал высокие уровни GLP-1 в разведенных образцах, что указывает на то, что GLP-1 удерживался на фильтрах при сборе супернатанта. При концентрации NaCl ниже 1М какого-либо осаждения GLP-1 в отсутствие частиц FDKP не наблюдалось.
Исследование поверхностно-активных веществ. Влияние поверхностно-активных веществ на связывание GLP-1 с частицами FDKP оценивали с помощью ЖХВД-анализа. Загрузку осуществляли при 5 мг/мл FDKP и 0,25 мг/мл GLP-1 в присутствии поверхностно-активного вещества (фиг. 9А). Также оценивали количество GLP-1, обнаруженное в разведенных контрольных образцах, не содержащих FDKP, в зависимости от pH и концентрации поверхностно-активного вещества (фиг.9В). pH и условия контрольных образцов были такими же, как описано выше для исследования ионной силы. В данном исследовании использовали следующие поверхностно-активные вещества: Brij 78 при 0,09 мМ, твин 80 при 0,01 мМ, тритон X при 0,2 мМ, плюроник F68 при 0,12 мМ, H(CH2)7SO4Na при 0,9 мМ, CHAPS при 0,9 мМ, цетримид при 0,9 мМ. Кривые загрузки GLP-1 в присутствии каждого поверхностно-активного вещества были построены для GLP-1/FDKP в зависимости от pH.
Полученные данные показали, что на кривые адсорбции в зависимости от рН для GLP-1/FDKP-частиц не влияет присутствие поверхностно-активных веществ при концентрации, близкой к критической мицеллярной концентрации (CMC), то есть при концентрациях в небольшом интервале, разделенном границей, ниже которой агрегаты/мицеллы фактически не обнаруживаются и выше которой фактически все другие молекулы поверхностно-активных веществ образуют агрегаты. Поэтому можно также предположить, что любое из этих поверхностно-активных веществ может быть использовано для оптимизации стабильности и/или фармакокинетики (ФК), обсуждаемой ниже. Как было показано выше в описании исследований соли, взаимодействие GLP-1 с частицами FDKP зависит от pH данной суспензии.
Исследование ионов. В этом эксперименте проводили исследования двух различных ионов для определения влияния ионов на связывание GLP-1 с частицами FDKP. В обоих исследованиях Cl- представляет собой противоион для катионов, а Na+ представляет собой противоион для анионов. Загрузку GLP-1/FDKP-частиц осуществляли, как описано в предыдущих экспериментах. pH регулировали, как описано выше. Образцы получали с использованием рН-буфера = 3,0, 3,5, 4,0, или 5,0 в присутствии и в отсутствие NaCl (который был использован для более точной оценки в случае высокой ионной силы). В отдельные образцы были включены дополнительные ионы: LiCl при 20 или 250 мМ, NH4Cl при 20 или 250 мМ, NaF при 20 или 250 мМ, и NaCH3COO при 20 или 250 мМ.
Данные, полученные в первом исследовании ионов и приведенные на фиг. 10A, представлены в виде кривых загрузки GLP-1/FDKP в зависимости от pH и ионов. В отсутствие NaCl фторид при концентрации 20 или 250 мМ значительно влияет на адсорбцию (усиливает адсорбцию) при низком pH, а NaF при концентрации 250 мМ обнаруживает максимальное связывание независимо от рН. Такая картина наблюдается благодаря присутствию фторида, но не натрия, в данном растворе, поскольку бикарбонат натрия не дает одинаковых эффектов при 20 и 250 мМ. Кроме того, такие эффекты не являются результатом присутствия натрия в образце, поскольку соль в аналогичной концентрации, как показано на фиг.8, не дает такого эффекта. В присутствии 1M NaCl все ионы дают достаточно «заметную» нагрузку. Такая «заметная» нагрузка для образцов с 1M NaCl является результатом высаливания пептида GLP-1 из раствора в присутствии высокой ионной силы. Это также проиллюстрировано на фиг. 10B, где показано, что GLP-1 присутствует в разведенных контрольных образцах, не содержащих FDKP, но содержащих 1M NaCl. Количество детектируемого GLP-1 для этих контрольных образцов возрастало по мере увеличения концентрации ионов, поскольку они были добавлены к общему количеству ионов в данных образцах.
Во втором эксперименте по исследованию ионов (Фиг. 10C) получали образцы GLP-1/FDKP в присутствии KCl при 20 или 250 мМ, имидазола при 20 или 250 мМ, NaI при 20 или 250 мМ, или NaPO4 при 20 или 250 мМ. Эти данные показали, что имидазол при 250 мМ снижает нагрузку в присутствии 1М NaCl, а фосфат при 250 мМ и (?) при 250 мМ дают достаточно заметную нагрузку (фиг. 10C). Исходя из количества GLP-1, обнаруженного в разведенных контрольных образцах, не содержащих FDKP, при концентрациях 0M и 1M NaCl (фиг. 10D), можно сказать, что такой эффект обусловлен влиянием ионов на сам пептид GLP-1, а не на взаимодействие пептида с частицами FDKP. Присутствие фосфата натрия и иодида натрия приводит к некоторому высаливанию GLP-1 в отсутствие NaCl. Кроме того, имидазол стимулирует солюбилизацию GLP-1 в образцах с 1M NaCl и, таким образом, дает менее явную нагрузку. Осаждение также наблюдалось в контролях с 0М NaCl, содержащих 250 мМ фосфата и иодида.
Исследование осмолитов. Влияние осмолитов на связывание GLP-1 с частицами FDKP оценивали с помощью ЖХВД-анализа. На фиг. 11А представлены кривые загрузки GLP-1/FDKP в зависимости от pH в присутствии общих стабилизаторов (осмолитов). Загрузку GLP-1/ FDKP-частиц осуществляли, как описано в предыдущем эксперименте. Аналогичным образом, рН регулировали, как описано выше. Образцы получали при рН 3,0 и в присутствии 20, 50, 100, 150, 200 или 300 мМ осмолита (стабилизатора). Осмолиты представляют собой гексиленгликоль (Hex-Gly), трегалозу, глицин, ПЭГ, TMAO, маннит или пролин; а N/A означает отсутствие осмолита. В аналогичном эксперименте концентрация осмолита (стабилизатора) в образцах была постоянной при 100 мМ, а pH варьировался от 2,0 до 4,0.
Ни один из исследуемых осмолитов (стабилизаторов) не оказывал значительного влияния на адсорбцию GLP-1 на поверхности FDKP в случае, когда pH поддерживался на уровне pH 3,0, а концентрации осмолитов варьировались (фиг. 11A; кривые слева), или когда концентрация осмолитов поддерживалась при 100 мМ, а значения pH варьировались (фиг. 11A; кривые справа). Какого-либо осаждения GLP-1 в разведенных контрольных образцах, не содержащих FDKP, не обнаруживалось (фиг. 11B). Эти осмолиты могут быть использованы для оптимизации стабильности и/или улучшения фармакокинетических свойств.
Исследование хаотропов и лиотропов. Было проведено исследование ионов, которые влияют на структуру воды и белков (хаотропов и лиотропов), для определения роли этих факторов в адсорбции GLP-1 на FDKP. Загрузку GLP-1/FDKP-частиц осуществляли, как описано в предыдущих экспериментах. Аналогичным образом, рН регулировали, как описано выше. Образцы получали при рН 3,0 и в присутствии 0, 20, 50, 100, 150, 200 или 300 мМ нижеследующих хаотропов или лиотропов: NaSCN, CsCl, Na2SO4, (СН3)3N-HC1, Na2NO3, Na-цитрата и NaClO4. В аналогичном эксперименте концентрация хаотропа или лиотропа в образцах поддерживалась при 100 мМ, а pH варьировался от 2,0 до 4,0.
На фиг.12А представлены кривые загрузки для GLP-1/FDKP в зависимости от pH и хаотропа и/или лиотропа. При низком pH (≤ 3) для различных анализируемых хаотропов, а в частности, при более высоких концентрациях хаотропов наблюдались значительные изменения загрузки. Однако при pH 4 такие изменения не наблюдались (фиг. 12C). Таким образом, очевидно, что эти агенты стимулируют связывание GLP-1 с частицами FDKP при более низком pH, являющимся неблагоприятным для связывания, но при более высоких pH, которые являются благоприятными условиями для связывания, такое стимулирующее воздействие является незначительным. Данные, полученные для разведенных контрольных образцов, не содержащих FDKP, позволяют предположить, что изменения нагрузки, наблюдаемые при pH 3,0, частично вызваны присутствием специфических хаотропов, в различной степени влияющих на высаливание (осаждение) пептида GLP-1 (фиг. 12B и 12D). Такой эффект наблюдался для сильных хаотропов, таких как NaSCN и NaClO4.
Исследование органических соединений. Спирты, которые, как известно, индуцируют образование спиральной конформации в неструктурированных пептидах посредством увеличения силы водородных связей, оценивали для определения роли спиральной конформации в адсорбции GLP-1 на FDKP. Загрузку GLP-1/FDKP-частиц осуществляли, как описано в предыдущих экспериментах. Аналогичным образом, рН регулировали, как описано выше. Эффекты каждого из указанных спиртов наблюдали при рН 2,0, 3,0, 4,0 и 5,0. Были использованы следующие спирты: метанол (MeOH), этанол (EtOH), трифторэтанол (TFE) или гексафторизопропанол (HFIP). Каждый из этих спиртов оценивали при концентрации 5%, 10%, 15% и 20% об/об.
На фиг. 13А представлены кривые загрузки GLP-1/FDKP в зависимости от pH для каждого спирта в каждой концентрации. При pH 3,0, низкая концентрация HFIP (5%) дает высокий уровень адсорбции, на что указывает массовое отношение GLP-1 к частицам FDKP. Влиянием на адсорбцию в данных забуференных суспензиях обладали только спирты с наиболее прочными Н-связями (образующими спираль), HFIP. При более высоких концентрациях HFIP (20%) наблюдалось ингибирование адсорбции GLP-1 на FDKP. На фиг. 13B показано, что при 20% концентрации спирта какого-либо значительного осаждения GLP-1 в разведенных контрольных образцах, не содержащих FDKP, не наблюдалось.
Это позволяет предположить, что конформационная гибкость лекарственного средства (то есть энтропия и число контактов FDKP, которые могут образовываться) может играть определенную роль в адсорбции. Полученные данные позволяют предположить, что Н-связи могут играть определенную роль во взаимодействии GLP-1 с частицами FDKP в вышеописанных условиях. Исходя из этих данных, можно также сделать предположение, что если Н-связи служат в качестве доминирующей и обобщенной силы во взаимодействиях FDKP-GLP-1, то, очевидно, что должно наблюдаться большее число взаимодействий и более сильные воздействия.
Исследование концентраций. Было проведено исследование адсорбции GLP-1 на поверхности частиц FDKP при различных концентрациях GLP-1. На фиг. 14A показаны кривые загрузки GLP-1/FDKP в зависимости от концентрации GLP-1 при различных pH. Концентрации GLP-1 составляли 0,15, 0,25, 0,4, 0,5, 0,75, 1,0, 1,5, 2,0, 5,0 или 10 мг/мл. pH образцов составлял 2,5, 3,0, 3,5, 4,0, 4,5 или 5,0.
Увеличение загрузки GLP-1 на частицы FDKP наблюдалось в случае, когда концентрация FDKP поддерживалась при 5 мг/мл, а концентрация GLP-1 увеличивалась. Примерно 20% адсорбция GLP-1 на частицах FDKP наблюдалась в случае, когда концентрация GLP-1 составляла 10 мг/мл при pH 4. При этом неожиданностью явилось то, что какого-либо насыщения адсорбции GLP-1 на частицах FDKP при высоких концентрациях GLP-1 не наблюдалось. Такое наблюдение, вероятно, можно объяснить самосборокой GLP-1 в мультислои.
Анализ морфолигии препаратов GLP-1/FDKP с помощью сканирующей электронной микроскопии (СЭМ) показал, что GLP-1/FDKP-частицы присутствуют в виде кристаллических или пластинчатых структур, которые могут образовывать агрегаты, включающие несколько GLP-1/FDKP-частиц (фиг. 14B). Эти препараты получали путем лиофилизации раствора, содержащего: (панель A) 0,5 мг/мл GLP-1 и 2,5 мг/мл FDKP; (панель B) 0,5 мг/мл GLP-1 и 10 мг/мл FDKP; (панель C) 0,5 мг/мл GLP-1 и 10 мг/мл FDKP в 20 мМ хлорида натрия, 20 мМ ацетата калия и 20 мМ фосфата калия, pH 4,0; и (панель D) 10 мг/мл GLP-1 и 50 мг/мл FDKP в 20 мМ хлорида натрия, 20 мМ ацетата калия и 20 мМ фосфата калия при pH 4,0.
Краткое описание результатов
В общих чертах, исследования влияния адсорбции на взаимодействие GLP-1 с частицами FDKP показали, что связывание GLP-1 с поверхностями частиц DKP зависит от pH, при этом высокий уровень адсорбции наблюдается при pH 4 или выше. Было обнаружено, что адсорбция GLP-1 на поверхностях частиц DKP, главным образом, зависит от pH, причем при pH 2,0 адсорбция, в основном, не наблюдалась, а при pH ≥ 4,0 наблюдалось значительное взаимодействие. Как было обнаружено, ионы натрия и фторида усиливали адсорбцию при низком pH. Другие добавки, такие как поверхностно-активные вещества и известные стабилизаторы, оказывали лишь незначительное влияние на адсорбцию GLP-1 на поверхностях частиц FDKP.
Кроме того, на результаты этих экспериментов влияют свойства самого GLP-1. Было обнаружено, что поведение GLP-1 является нетипичным, и неожиданность такого поведения состоит в наблюдаемом отсутствии насыщения адсорбции, что может объясняться самосборкой GLP-1 при высоких концентрациях. Самосборка GLP-1 при высоких концентрациях может приводить к покрытию частиц DKP мультислоями пептида GLP-1 и тем самым к стимуляции повышения процента загрузки пептида GLP-1. Было подтверждено, что такая неожиданно обнаруженная способность GLP-1 к самосборке является благоприятной с точки зрения получения стабильных форм GLP-1, подходящих для введения. Кроме того, самоассоциирующаяся конформация GLP-1 может обеспечивать снижение степени разложения или замедление такого разложения GLP-1 в крови. Однако следует отметить, что при работе с ассоциированным GLP-1 необходимо принимать меры предосторожности, поскольку такой GLP-1 является чувствительным к изменениям температуры и к высоким рН.
Пример 3
Анализ на целостность препаратов GLP-1/FDKP
Исходя из результатов, описанных в экспериментах по примерам 1 и 2, для проведения анализа на жизнеспособность клеток, обсуждаемого в настоящей заявке, были отобраны серии препаратов GLP-1, обладающих свойствами, описанными в таблице 1. Большинство из таких препаратов содержало наполнители GRAS («в основном, известные как безопасные»), и некоторые из них были отобраны для проведения исследований на взаимосвязь стабильности и адсорбции.
|
Кроме того, исходя из результатов, полученных, как описано в примерах 1 и 2, были также выбраны серии препаратов для проведения исследований в фазе II на целостность GLP-1/FDKP. В нижеприведенной таблице 2 представлены шесть препаратов GLP-1, отобранных для проведения исследований в фазе II на целостность. После получения порошков они были смешаны с контрольным FDKP с получением одинаковых масс пептида GLP-1 и FDKP в каждом препарате.
|
Влияние стресса на препараты GLP-1/FDKP, описанные в таблице 2, анализировали с помощью ЖХВД (фиг. 15). Образцы, содержащие 5%, 10% или 20% GLP-1/FDKP, загруженные в Н2О, или 5% или 10% GLP-1/FDKP, загруженные в NaCl + буфер, pH 4,0, инкубировали в течение 10 дней при 40°С. ЖХВД-хроматограммы показали, что пептид GLP-1 элюируется при одном и том же времени удерживания, а пики разложения отсутствуют. Кроме того, МС-анализы давали аналогичные массы для всех образцов, 3297 г/моль, что указывало на то, что масса всех исследуемых образцов не изменялась. Полученные данные показали присутствие GLP-1 и частиц FDKP в определенном массовом отношении, а также других компонентов, имеющихся в растворе перед лиофилизацией. Было обнаружено, что GLP-1/FDKP-препараты, по существу, являются устойчивыми к стрессу.
Пример 4
Стабильность GLP-1, инкубированного в легочном лаваже
Принимая во внимание тот факт, что дипептидил-пептидаза IV (DPP-IV), обнаруживаемая в биологических жидкостях, расщепляет и инактивирует GLP-1, стабильность GLP-1 была проанализирована в биологических жидкостях, таких как легочная жидкость и кровь.
Дипептидил-пептидаза IV (DPP-IV) представляет собой внеклеточную мембраносвязанную сериновую протеазу, экспрессируемую на поверхности клеток некоторых типов, а в частности, на CD4+-Т-клетках. DPP-IV была также обнаружена в крови и в легочной жидкости. DPP-IV участвует в регуляции метаболизма глюкозы, поскольку ее субстратом является инсулинотропный гормон GLP-1, который инактивируется путем удаления его двух N-концевых аминокислот, см. фиг. 16A. DPP-IV расщепляет связь Ala-Glu в большинстве форм человеческого GLP-1 (GLP-1 (7-36)), циркулирующих в крови, что приводит к высвобождению N-концевых двух остатков. DPP-IV участвует в негативной регуляции выведения глюкозы путем разложения GLP-1, что приводит к снижению влияния инкретина на β-клетки поджелудочной железы.
Были проведены исследования для определения уровня ингибирования разложения GLP-1 в крови и в легочной жидкости крыс в присутствии апротинина или ингибитора DPP-IV. Апротинин, природный ингибитор сериновой протеазы, который, как известно, ингибирует разложение белка, добавляли к образцам после их сбора в концентрации 1, 2, 3, 4 и 5 единиц ингибитора трипсина на мл (TIU/мл). Затем измеряли DPP-IV-активность путем детектирования расщепления люминесцентного субстрата, содержащего DPP-IV-распознаваемую последовательность Gly-Pro. Бронхиальный лаваж инкубировали с пролюминесцентным субстратом в течение 30 минут, и продукт расщепления детектировали по интенсивности люминесценции.
Полученные данные указывали на усиление ингибирования DPP-IV-активности, как было установлено по ингибированию разложения пептида в различных биологических жидкостях (как обсуждается в настоящем описании) в присутствии возрастающих концентраций апротинина (фиг. 16B). Аналогичные результаты были получены с использованием ингибитора DPP-IV, добавленного в образцы после их сбора при 1,25, 2,5, 5, 10 и 20 мкл/мл (фиг. 16C). Добавление ингибиторов после сбора образцов позволяло проводить более точную оценку данных образцов.
Стабильность GLP-1 также оценивали в легочном лаваже с использованием mAb для ELISA с захватом антитела, которое распознает аминокислоты 7-9 GLP-1. GLP-1 инкубировали в легочном лаваже (LLF) в течение 2, 5, 20 и 30 минут. Инкубирование проводили в следующих условиях: 1 или 10 мкг (масс/масс) LLF и 1 или 10 мкг (масс/масс) GLP-1, как показано на фиг. 17. GLP-1 не детектировался лишь в одном LLF. При использовании комбинациии LLF и GLP-1 в различных концентрациях наблюдался высокий уровень GLP-1 по сравнению с уровнем GLP-1, используемого отдельно, что указывало на то, что GLP-1 является стабильным в легочном лаваже в течение всего периода времени (фиг. 17). Стабильность GLP-1 в неразведенном легочном лаваже была подтверждена в аналогичных исследованиях, при этом, через 20 минут, GLP-1 сохранял свою целостность на 70-72% (данные не приводятся).
Кроме того, была оценена стабильность GLP-1 в крысиной плазме. Плазму брали у различных крыс (плазма 1 и плазма 2, как указано в надписях на данном графике) и разводили 1:2 или 1:10 (об/об). Один микрограмм GLP-1 добавляли к 10 мкл плазмы или PBS. Образцы инкубировали при 37°С в течение 5, 10, 30 или 40 минут. Реакцию прекращали на льду и добавляли 0,1 ед. апротинина. Полученные данные показали высокую концентрацию GLP-1 в плазме при разведениях 1:2 и 1:10 в течение всех периодов времени проведения тестов (фиг. 18A и 18B). В целом, полученные данные неожиданно показали, что GLP-1 является стабильным в легочном лаваже и в плазме, в которых присутствует сериновая протеаза DPP-IV.
Пример 5
Влияние молекул GLP-1 на апоптоз и пролиферацию клеток
В целях детекции ингибирования апоптоза под действием GLP-1 был проведен скрининг-анализ для того, чтобы определить, влияет ли GLP-1 на ингибирование гибели β-клеток. Панкреатические эпителиальные клетки крыс (ARIP) (используемые в качестве модели панкреатических β-клеток и закупленные у ATCC, Manassas, VA) были преварительно обработаны GLP-1 при концентрациях 0, 2, 5, 10, 15 или 20 нМ в течение 10 минут. Затем, либо эти клетки не подвергали дальнейшей обработке, либо их обрабатывали 5 мкМ стауроспорина (индуктора апоптоза) в течение 4,5 часа. Жизнеспособность клеток оценивали с использованием реагента Cell Titer-GloTM (Promega, Madison, WI). С увеличением концентрации GLP-1 до 10 нМ в клетках, обработанных стауроспорином, наблюдалось снижение процента гибели клеток (фиг. 19A).
Дополнительную оценку влияния GLP-1 на апоптоз проводили с помощью FACS-анализа с окрашиванием аннексином V. Окрашивание аннексином V является ценным инструментом для детектирования апоптотических клеток и хорошо известно специалистам. Связывание аннексина V с клеточной мембраной позволяет проанализировать изменения асимметрии в фосфолипидах (ФЛ) перед проведением анализа на морфологические изменения, ассоциированные с апоптозом, и на утрату целостности мембраны. Таким образом, влияние GLP-1 на апоптоз определяли в клетках, обработанных 15 нМ GLP-1, l мкМ стауроспорина в течение 4 часов и 1 мкМ стауроспорина + 15 нМ GLP-1, или в клетках, не обработанных ни стауроспорином, ни GLP-1 (экспериментальный контроль). Полученные данные показали, что GLP-1 ингибирует индуцированный стауроспорином апоптоз примерно на 40% (фиг. 19B).
Аналогичные результаты анализа на ингибирование апоптоза были получены с использованием аналога GLP-1, экзендина-4, который связывается с рецептором GLP-1 так же, как и с самим GLP-1. Клетки ARIP обрабатывали 5 мкМ стауроспорина в присутствии 0, 10, 20 или 40 нМ экзендина в течение 16, 24 или 48 часов, соответственно. Полученные данные (фиг. 20) показали, что при 10 нМ экзендин был абсолютно неэффективным в ингибировании апоптоза, то есть наблюдалась 100% клеточная гибель. При концентрации 20 и 40 нМ экзендин ингибировал апоптоз лишь до определенной степени, причем примерно 50%-ное ингибирование наблюдалось через 48 часов в присутствии 40 нМ экзендина-4.
Пример 6
Влияние GLP-1/FDKP-композиций-кандидатов на клеточную гибель
Для оценки способности GLP-1/FDKP-препаратов ингибировать гибель клеток были проведены клеточные анализы (как описано в примере 3, см. выше таблицу 1). Эти препараты GLP-1/FDKP-частиц использовали либо в виде суспензии, либо в лиофилизованной форме. Полученные препараты анализировали на их способность ингибировать индуцированную стауроспорином гибель клеток ARIP. Клетки ARIP, предварительно обработанные GLP-1-образцами, подвергали воздействию 5 мкМ стауроспорина в течение 4 часов и анализировали с использованием реагента Cell Titer-GloTM (Promega, Madison, WI) для определения жизнеспособности клеток.
Образцы различных GLP-1/FDKP-препаратов либо не подвергали воздействию стресса, либо помещали на 4 недели в условия стресса при 4°С или 40°С. В клеточном анализе, проводимом для определения способности GLP-1/FDKP ингибировать индуцированную стауроспорином гибель клеток, каждый образец GLP-1/FDKP использовали в концентрации 45 нМ. Контрольные образцы, показанные справа, продемонстрировали жизнеспособность клеток только в одной среде, в среде лишь с одним GLP-1, в среде лишь с одним стауроспорином или в присутствии GLP-1 и стауроспорина (примечание: надписи на графике не относятся к контрольным образцам. Каждый столбик гистограммы представляет отдельный эксперимент с тремя повторностями). Все результаты представлены как среднее для экспериментов с тремя повторностями.
Полученные данные показали, что все подвергнутые стрессу лиофилизованные GLP-1/FDKP-препараты ингибировали индуцированную стауроспорином гибель клеток (фиг. 21). Однако гибель клеток не ингибировалась под действием многих GLP-1/FDKP-препаратов, используемых в форме суспензий.
Пример 7
Инсуффляция GLP-1/DKP-частиц в легкие
Для анализа фармакокинетики GLP-1/FDKP проводили оценку концентраций GLP-1 в плазме самок крыс Sprague Dawley, которым вводили различные препараты GLP-1/FDKP путем внутривенных инъекций или инсуффляции в легкие. В предварительных исследованиях, в препаратах GLP-1/FDKP-частиц, GLP-1 присутствовал в концентрации приблизительно 4% и 16% (масс/масс). Крыс произвольно разделяли на 12 групп, где группам 1, 4, 7 и 10 вводили раствор GLP-1 путем инстилляции жидкости в легкие или путем внутривенной (i.v.) инъекции. Группам 2, 5, 8 и 11 вводили GLP-1/FDKP-препарат в виде соли (как указано в таблице 2) путем инсуффляции в легкие или i.v.-инъекции. Группам 3, 6, 9 и 12 вводили смешанный GLP-1/FDKP-препарат в виде соли путем инсуффляции в легкие или i.v.-инъекции. GLP-1/DKP-препарат представлял собой препарат в виде соли с загрузкой приблизительно 16%. Для достижения загрузки приблизительно 4%, 16% препарат смешивали с DKP-частицами в отношении 3:1. При инсуффляции в легкие или внутривенной инъекции вводили 0,5 или 2,0 мг частиц (загрузка GLP-1 составляла 16% или 4%, соответственно), где суммарная доза GLP-1 составляла 0,08 мг.
Животным отдельной группы (группы 7-12) введение повторяли на день 2. Группам 1, 4, 7 и 10 вводили 80 мкг раствора GLP-1. Группам 2, 5, 8 и 11 вводили GLP-1/DKP-препарат в виде соли (загрузка GLP-1 составляла ~ 16%). Группам 3, 6, 9, 12 вводили смешанный GLP-1/DKP-препарат в виде соли (загрузка GLP-1 составляла ~ 4%).
Эксперимент проводили два раза с использованием одних и тех же препаратов, при этом введение дозы и забор крови осуществляли два дня подряд. Пробы крови для каждой группы брали в день введения дозы, перед введением дозы (время 0) и через 2, 5, 10, 20, 30, 60 и 120 минут после введения дозы. В кажый определенный момент времени из латеральной хвостовой вены брали приблизительно 150 мкл цельной крови в криогенную пробирку, содержащую приблизительно 3 ед/мл апротинина и 0,3% EDTA, а затем пробирку переворачивали и ставили на лед. Пробы крови центрифугировали при 4000 об/мин, и 40 мкл плазмы раскапывали с помощью пипетки по 96-луночным планшетам, а затем планшеты помещали на хранение при -80°С вплоть до их использования в ELISA-анализах на уровни GLP-1 в соответствии с инструкциями производителей (Linco Research, St Charles, MO). Было установлено, что оптимальными условиями являются условия, при которых аналитический буфер представляет собой GLP-1 в сочетании с одной сывороткой (5% FBS) без матрикса.
Внутривенное введение: Группам 5, 6, 10, 11 и 12 внутривенно (i.v.) вводили различные GLP-1/FDKP-препараты и раствор GLP-1; (фиг. 22A). Группам 5 и 6 вводили 15,8% GLP-1/FDKP, группам 11 и 12 вводили еще одну дозу 15,8% GLP-1/FDKP на следующий день, а группе 10 вводили раствор GLP-1 в качестве контроля. Концентрацию GLP-1/FDKP детектировали через 0, 2, 5, 10, 20, 40, 60, 80, 100 и 120 минут. У всех групп, после внутривенного введения, наблюдалось детектируемое увеличение уровней GLP-1 в плазме, при этом максимальные концентрации наблюдались через 2 минуты после обработки. Уровни активного GLP-1 у всех групп снижались до фоновых уровней через 20 минут после обработки. Какого-либо значимого различия в кинетике указанных различных препаратов GLP-1/FDKP и раствора GLP-1 при их внутривенной инъекции не наблюдалось. Было отмечено, что уровни GLP-1 в плазме снижались до фоновых уровней через 10-20 минут после введения дозы крысам, обработанным путем внутривенных инъекций, что дает основание предположить о наличии физиологической кинетики (то есть примерно 95 % GLP-1 элиминировалось через 10 минут).
Разовое введение путем инсуффляции: Из 12 групп группам 1, 2, 3, 7, 8 и 9 вводили различные GLP-1/FDKP-препараты или раствор GLP-1 путем инсуффляции в легкие (фиг. 22B). Группе 1 вводили 80 мкг контрольного GLP-1 путем инстилляции жидкости в легкие (LIS); группе 2 вводили 15,8% GLP-1/FDKP путем инсуффляции в легкие (IS); группе 3 вводили 3,8% GLP-1/FDKP путем инсуффляции в легкие (IS); группе 7 вводили 80 мкг контрольного GLP-1 путем инстилляции жидкости в легкие (LIS); группе 8 вводили 15,% GLP-1/FDKP путем инсуффляции в легкие (IS); а группе 9 вводили 3,8% GLP-1/FDKP путем инсуффляции в легкие (IS). Концентрации GLP-1/FDKP измеряли через 0, 2, 5, 10, 20, 40, 60, 80, 100 и 120 минут.
У всех групп, после внутрилегочного введения, наблюдалось детектируемое увеличение концентрации GLP-1 в плазме. Максимальные концентрации GLP-1 в плазме варьировались в зависимости от используемого препарата/композиции. У групп 2 и 8, через 10-20 минут после обработки, наблюдались максимальные уровни GLP-1 в плазме, на что указывала AUC, у групп 3 и 9 через 5-10 минут наблюдались значимые уровни активного GLP-1, а у групп 1 и 7 наблюдалось более быстрое и кратковременное увеличение уровней активного GLP-1 в плазме. У групп 2, 3, 7 и 8 через 60 минут после обработки, уровни активного GLP-1 в плазме снижались до фоновых уровней, а у групп 1 и 7 уровни GLP-1 достигали фоновых значений через 20 минут после обработки.
GLP-1 в концентрации 8 наномоль, очевидно, является эффективным у крыс с моделью диабета; доза GLP-1 составляла 80 мкг (которая в 3000 раз превышала сообщаемую эффективную дозу); уровни GLP-1 в плазме через 30 минут после введения дозы были в 10 раз выше при внутрилегочной доставке, чем после 3-часового вливания (Chelikani et al., 2005), а биологическая доступность GLP-1/FDKP, вводимого путем инсуффляции в легкие, составляла 71%. Полученные результаты представлены ниже в таблице 4. У большинства крыс, обработанных путем внутрилегочной доставки, уровни GLP-1 в плазме снижались до фоновых уровней через 30-60 минут после введения дозы. У всех крыс, за исключением 1 крысы в группе 2, после внутривенного введения или инсуффляции в легкие различных GLP-1/FDKP-препаратов наблюдалось увеличение концентраций GLP-1 в плазме.
Выводы: Фармакокинетические профили GLP-1/FDKP-препаратов отличались от фармакокинетических профилей раствора GLP-1. У крыс, обработанных путем инсуффляции GLP-1/FDKP-препаратов в легкие, по сравнению с крысами, обработанными раствором GLP-1, концентрации GLP-1 в плазме оставались неизменными в течение более длительного периода времени. У всех животных через 20-60 минут после введения дозы наблюдалось прогрессирующее снижение концентраций GLP-1 в плазме. 2 эксперимента, проводимые 2 дня подряд, дали относительно похожие результаты.
|
|
Пример 8
GLP-1/FDKP снижает потребление корма у крыс
Специалистам также известно, что в головном мозге GLP-1 стимулирует возникновение чувства насыщения и снижает потребление пищи. На основе такой роли GLP-1 в насыщении и снижении потребления пищи были проведены эксперименты для того, чтобы определить, являются ли GLP-1/FDKP-препараты согласно изобретению эффективными средствами для снижения потребления пищи и тем самым для предотвращения ожирения.
Двум группам самок крыс Sprague Dawley были введены дозы либо контроля (воздух), либо 15,8%-го GLP-1/FDKP-препарата в количестве 2 мг/день (0,32 мг GLP-1/дозу) путем инсуффляции в легкие. Контрольная группа состояла из пяти крыс, а тест-группа состояла из десяти крыс. Каждой крысе вводили одну дозу 5 дней подряд и через 2 и 6 часов после введения каждой дозы определяли уровень потребления пищи. Массу тела каждой крысы определяли ежедневно.
Предварительные данные показали, что через 2 и 6 часов после введения дозы у крыс, которым вводили GLP-1/FDKP-препараты, наблюдалось общее снижение потребления пищи (фиг. 23A и 23B). Такое снижение было еще более явным на 4-й день через 2 часа после введения дозы (p=0,01). Через 6 часов такое снижение было более выраженным на дни 1 и 2 (p<0,02). Через 24 часа после введения дозы, какого-либо воздействия на потребление пищи не наблюдалось.
Пример 9
Исследование токсичности
Исследования токсичности повторных доз проводили для оценки потенциальных токсических эффектов и токсикокинетического профиля GLP-1/DKP после неоднократных введений. Исследования на крысах проводили в течение 14 дней, а на обезьянах - в течение 28 дней. GLP-1/DKP вводили ежедневно путем ингаляции. В исследованиях, в которых животным вводили дозы в течение 28 дней, часть животных умерщвляли сразу после проведения курса обработки, а других животных оставляли на один месяц для восстановления, а затем умерщвляли. Всех животных оценивали на клинические признаки, различные физиологические параметры, включая уровни GLP-1, глюкозы и инсулина, массу органов, клинические патологии и гистопатологию различных органов.
Была проведена серия исследований на мутагенность GLP для оценки мутагенного потенциала дикетопиперазиновых частиц. Эти исследования включали тест Эймса in vitro и анализы на хромосомные аберрации, которые хорошо известны специалистам. Кроме того, был также проведен in vivo анализ мышиных микроядер, известный специалистам. Данные генотоксичности указывали на отсутствие какой-либо мутагенной активности или генетической токсичности частиц дикетопиперазина.
Были также проведены исследования для оценки влияния дикетопиперазиновых частиц на репродуктивную токсичность. Эти исследования включали анализы на плодовитость, внутриутробное развитие эмбрионов и постнатальное развитие детенышей крыс и кроликов. Дикетопиперазиновые частицы, вводимые путем подкожной инъекции, не оказывали какого-либо влияния на плодовитость или на имплантацию органов у крыс, а также не наблюдалось какой-либо тератогенности у крыс или кроликов. Дикетопиперазиновые частицы не оказывали какого-либо негативного воздействия на плодовитость и раннее развитие эмбриона, на внутриутробное развитие плода или на пренатальное или постнатальное развитие.
Принимая во внимание тот факт, что ряд фармацевтических средств был изъят из продаж на рынке фармацевтических препаратов из-за их способности индуцировать развитие LQT-синдрома (приобретенный LQTS или синдром удлинения Q-T является редким наследственным нарушением электрического сердечного ритма, которое может встречаться и у относительно здоровых людей), был проведен анализ на hERG для оценки фармакологических свойств дикетопиперазиновых частиц. Анализ на hERG проводили, исходя из того факта, что фармацевтические средства широкого ряда, вызывающие приобретенный LQTS, индуцируют этот синдром путем блокирования калиевого канала, кодируемого человеческим геном ether-a-go-go* (hERG), ответственным за реполяризацию потенциала желудочка сердца. Результаты анализа на hERG показали, что для дикетопиперазиновых частиц IC50 >100 мкМ. Кроме того, результаты неклинических исследований с использованием дикетопиперазиновых частиц показали, что эти частицы не оказывают какого-либо влияния на интервал QTc (интервал QT, корригированный с учетом частоты сердечных сокращений), поскольку его удлинение не наблюдалось у собак (9-месячные исследования или фармакологические исследования на безопасность для сердечно-сосудистой системы). Причем, при внутривенном введении дикетопиперазиновых частиц, какого-либо их влияния на ЦНС или сердечно-сосудистую систему не наблюдалось, как было оценено с помощью эталонного набора тестов на фармакологическую безопасность.
Пример 10
Влияние GLP-1 на массу β-клеток
Известно, что GLP-1 стимулирует все стадии биосинтеза инсулина и непосредственно стимулирует рост, выживаемость, а также дифференцировку β-клеток. Совокупность этих эффектов приводит к увеличению массы β-клеток. Кроме того, передача сигнала рецептора GLP-1 приводит к подавлению апоптоза β-клеток, что также играет определенную роль в увеличении β-клеточной массы. Известно, что GLP-1 модулирует массу β-клеток по трем возможным механизмам: усилению пролиферации β-клеток; ингибированию апоптоза β-клеток и дифференцировке предполагаемых стволовых клеток в эпителии протоков.
Для иллюстрации влияния GLP-1 на β-клеточную массу клетки обрабатывали GLP-1/FDKP на день 1, 3 и 5 и сравнивали с необработанными клетками. Введение активного GLP-1 приводило к 2-кратному увеличению массы β-клеток, как предполагалось ранее в литературе (Sturis et al., 2003). Кроме того, анализ влияния различных агонистов GLP-1-рецептора (GLP-1R) на развитие диабета продемонстрировал, что агонисты GLP-1R способствуют предупреждению либо замедлению возникновения или прогрессирования диабета.
Влияние GLP-1/FDKP на пролиферацию β-клеток и на уровни инсулина и глюкозы оценивали у самцов крыс с диабетическим ожирением, индуцированным сахаром/с ожирением (ZDF) (n=8/группу). Животным ежедневно 3 дня подряд вводили либо контроль (воздух), либо 2 мг GLP-1/FDKP, содержащий 15% (0,3 мг) GLP-1. Затем проводили тест на толерантность к глюкозе, вводимой внутрибрюшинно (i.р.), и брали пробы крови для проведения анализа на уровни GLP-1 и глюкозы в плазме перед введением дозы и через 15, 30, 45, 60 и 90 минут после введения дозы. Ткани поджелудочной железы брали для проведения иммуногистохимического анализа на уровни секреции инсулина, массу β-клеток и апоптоз.
Тест на толерантность к внутрибрюшинно (i.р.) вводимой глюкозе (IPGTT, фиг. 24) проводили на 4-й день после введения дозы. На 3-й день, после голодания в течение ночи, животным вводили ударную дозу глюкозы путем внутрибрюшинной инъекции, а затем сразу вводили контроль (воздух) или GLP-1/FDKP путем инсуффляции в легкие. Кровь брали до введения глюкозы и в различные периоды времени в течение 90 минут после введения дозы. Через 30 минут после введения дозы у животных группы 1 наблюдалось 47% увеличение уровней глюкозы по сравнению с уровнями глюкозы, наблюдаемыми до введения дозы, а у животных группы 2 (GLP-1/FDKP) наблюдалось 17%-увеличение уровней глюкозы по сравнению с уровнями глюкозы, наблюдаемыми до введения дозы. Во все периоды времени после проведения теста на толерантность к глюкозе уровни глюкозы у обработанных животных были значительно ниже уровней, наблюдаемых у контрольных животных (p<0,05).
Уровни GLP-1 также измеряли на 3-й день после введения дозы (фиг. 25). Через 15 минут после введения дозы максимальная концентрация GLP-1 в плазме у животных группы 2 составляла 10643 пМ.
Кроме того, на 3-й день после теста на толерантность к i.р.-вводимой глюкозе одновременно измеряли уровни инсулина и глюкозы в различные интервалы времени. Через 15 минут после введения дозы у контрольной группы 1 (воздух) и у группы 2 (GLP-/DKP) сначала наблюдалось снижение концентрации инсулина по сравнению с уровнем до введения дозы, на 46% и 30%, соответственно (Фиг. 26). Однако через 30 минут после введения дозы уровни инсулина у животных группы 2 снижались до фоновых, а уровни инсулина у животных группы 1 снижались на 64% по сравнению с уровнями до введения доз. У обработанных животных уровни инсулина через 45 минут, 60 минут и 90 минут были близки к уровням, наблюдаемым до введения доз с отклонениями менее чем 1,5%.
Для иммуноокрашивания на инсулин и оценки экспрессии инсулина под микроскопом были приготовлены предметные стекла. Количественная оценка экспрессии инсулина с помощью оптического микроскопа показала, что ассоциированное с обработкой увеличение уровней экспрессии инсулина в поджелудочной железе самцов крыс ZDF зависело от дозы, хотя оно не было статистически значимым (p=0,067), как было определено по процентному содержанию островковых β-клеток, экспрессирующих инсулин.
Был также проведен анализ на апоптоз в ткани поджелудочной железы крыс ZDF. Экзокринные и эндокринные панкреатические клетки оценивали с помощью анализа TUNEL (Tornusciolo D. R. et al., 1995). Было оценено приблизительно 10000 клеток в поджелудочной железе (экзокринных и эндокринных). Большинство TUNEL-позитивных клеток были экзокринными. Какого-либо отличия в индексах мечения апоптотических клеток у обработанных животных и у контрольных животных не наблюдалось.
Кроме того, в поджелудочной железе крыс с диабетическим ожирением, индуцированным сахаром, пролиферацию β-клеток оценивали путем ежедневного введения дозы контроля (воздух) или дозы GLP-1/FDKP путем инсуффляции один раз в день в течение 3 дней. Для определения совместной локализации инсулина и Ki67 (маркера пролиферации), проводимого с помощью иммуногистохимического анализа, приготавливали предметные стекла. Оценку пролиферации клеток под микроскопом проводили в инсулин-позитивных островковых клетках и в экзокринных клетках поджелудочной железы у всех 17 крыс ZDF. Количественная оценка пролиферации клеток указывала на отсутствие ассоциированного с обработкой влияния на пролиферацию островковых бета-клеток или экзокринных клеток поджелудочной железы самцов крыс ZDF.
В целом, эти исследования показали, что GLP-1/FDKP, вводимый в концентрации 2 мг или 0,3 мг GLP-1 путем инсуффляции в легкие, приводил к снижению уровней глюкозы в крови у крыс с диабетическим ожирением (модель диабета типа 2), как показал тест на толерантность к глюкозе, и к увеличению числа инсулин-секретирующих клеток на число островковых клеток.
Пример 11
Получение препаратов GLP-1/FDKP-частиц
Была также применена альтернативная методика получения препаратов GLP-1/FDKP-частиц. Препараты получали следующим образом: 10 масс.% маточного раствора GLP-1 получали путем добавления 1 части GLP-1 (по массе) к 9 частям деионизованной воды и добавления небольшого количества ледяной уксусной кислоты до образования прозрачного раствора. Маточную суспензию FDKP-частиц (приблизительно 10 масс.% частиц) разделяли на три части. К каждой суспензии добавляли соответствующее количество маточного раствора GLP-1 и получали нужные композиции, содержащие 5 и 15 масс.% GLP-1 в осушенном порошке. После добавления раствора белка pH суспензий составлял приблизительно 3,5. Затем рН суспензий доводили приблизительно до 4,4-4,5, после чего эти суспензии гранулировали в жидком азоте и лиофилизовали для удаления льда.
Аэродинамические свойства порошков характеризуются объемом дыхательной фракции на полный объем (ДФ на полный объем), то есть процентом (%) порошка дыхательной фракции, нормализованным по количеству порошка в картридже, который определяли следующим образом: пять картриджей вручную наполняли 5 мг порошка и этот порошок выпускали через ингалятор MannKind's MedTone® (описанный в заявке на патент США No. 10/655153).
Эта методика позволяла продуцировать препарат с хорошим показателем ДФ на полный объем. Порошок, содержащий 5 масс.% GLP-1, имел 48,8%, ДФ/полный объем, а порошок, содержащий 15 масс.% GLP-1, имел 32,2% ДФ/полный объем.
Пример 12
Фармакокинетические свойства GLP-1/FDKP при различных концентрациях GLP-1
Для оценки фармакокинетических свойств GLP-1/FDKP в различных концентрациях GLP-1 восемнадцать самок крыс Sprague Dawley весом 192,3-211,5 граммов разделяли на четыре группы обработки: контрольную группу, которой вводили GLP-1 (группа 1, n=3); и группы, которым вводили GLP-1/FDKP-препараты (группы 2-4, n=5/группу). Животным вводили один из нижеследующих тестируемых веществ: контроль (воздух) путем инстилляции в легкие; 2,42 мг GLP-1/FDKP, содержащего 5% GLP-1 (0,12 мг GLP-1); 1,85 мг GLP-1/FDKP, содержащего 10% GLP-1 (0,19 мг GLP-1), или 2,46 мг GLP-1/FDKP, содержащего 15% GLP-1 (0,37 мг GLP-1), путем инсуффляции в легкие. Затем брали пробы крови и анализировали на уровни FDKP в сыворотке и GLP-1 в плазме перед введением дозы и через различные интервалы времени (через 2, 5, 10, 20, 30, 40 и 60 минут) после введения дозы.
Максимальные концентрации GLP-1 в плазме (Cmax) после введения GLP-1/FDKP (5% препарат) составляли 2321 пМ при Tmax через 5 минут после введения дозы; 4887 пМ при Tmax через 10 минут после введения дозы (10% препарат); и 10207 пМ при Tmax через 10 минут после введения дозы (15% препарат). Как показано на фиг. 27, значимые уровни GLP-1 наблюдались в течение 30 минут после введения дозы. Уровни GLP-1, измеренные по площади под кривой (AUC), составляли 10622, 57101, 92606, 227873 пМ · мин для групп 1-4, соответственно. Оцениваемое время полужизни GLP-1 составляло 10 минут для GLP-1/FDKP при 10% или 15% нагрузке GLP-1.
Как показано на фиг. 28, максимальные концентрации FDKP составляли 8,5 мкг/мл (группа 2), 4,8 мкг/мл (группа 3) и 7,1 мкг/мл (группа 4) для GLP-1/FDKP-препаратов при 5%, 10% и 15% GLP-1, соответственно. Время до момента наблюдения максимальных концентраций (Tmax) составляло 10 минут. Эти данные показали, что FDKP и GLP-1 обладали аналогичной кинетикой абсорбции, и аналогичные количества FDKP абсорбировались независимо от загрузки GLP-1 на частицах.
В целом, исследования показали, что уровни GLP-1 в плазме детектировались на значимых уровнях после введения крысам Sprague Dawley разовой дозы GLP-1/FDKP путем инсуффляции в легкие. Дозозависимое увеличение уровней GLP-1 в плазме наблюдалось при максимальных концентрациях, достигаемых приблизительно через 10 минут после введения дозы, а наблюдаемые уровни GLP-1 обнаруживались через 40 минут после введения дозы. Все животные выживали до завершения исследования.
Пример 13
Фармакодинамические свойства GLP-1/FDKP, вводимого путем инсуффляции в легкие
Для оценки фармакодинамических свойств GLP-1/FDKP самок крыс Sprague Dawley разделяли на 2 группы обработки. Животным ежедневно 4 дня подряд вводили либо контроль (воздух; n=5), либо 2 мг GLP-1/FDKP, содержащего 15% GLP-1 (0,3 мг GLP-1), путем инсуффляции в легкие (n=10).
Потребление пищи оценивали в темное время суток перед введением дозы и через 1, 2, 4 и 6 часов после введения дозы 4 дня подряд (Фиг. 29). Уровень потребления пищи снижался на дни 1, 2 и 3 после ежедневного введения разовой дозы GLP-1/FDKP путем инсуффляции в легкие животным группы обработки, по сравнению с контрольной группой (воздух) (p<0,05). Статистически значимое снижение потребления пищи у животных группы обработки, по сравнению с контролем (воздух), наблюдалось на 1-й день, через 1 час и через 6 часов после введения дозы, на 2-й день через 4 и 6 часов после введения дозы, и перед введением дозы на 3-й день.
Массы тела (фиг. 30) измеряли ежедневно в течение 4 дней подряд перед введением дозы. Массы тела непосредственно перед введением дозы составляли примерно 180-209 граммов. Хотя статистической значимости при сравнении обработанных животных и контрольных животных (воздух) не достигалось, однако обработанные животные все же имели меньшую массу тела. Все животные выживали до проведения запланированного умерщвления.
Примеры 14-16
Токсикокинетические (TK) исследования
В нижеприведенных примерах 14-16 описаны исследования токсичности повторных доз, проводимые на крысах и обезьянах для оценки потенциального токсического действия и токсикокинетического профиля GLP-1/FDKP-порошка, вводимого путем ингаляции. Полученные данные показали, что GLP-1/FDKP-порошок, вводимый путем ингаляции, не обладает какой-либо явной токсичностью при дозах, в несколько раз превышающих дозы, допустимые для клинического применения. Кроме того, каких-либо различий между самцами и самками животных каждого вида не наблюдалось.
Пример 14
Токсикокинетические свойства GLP-1/FDKP, вводимого обезьянам в течение 5 дней путем инсуффляции в легкие
Были проведены исследования для определения токсичности и токсикокинетического профиля GLP-1/FDKP путем ороназального введения (предпочтительного для человека терапевтического способа введения) собакоподобным обезьянам (Macaca fascicularis) ежедневно (в течение 30 минут в день) 5 дней подряд. Ороназальное введение осуществляли путем надевания обезьянам маски на рот и нос и обеспечения вдыхания ими тестируемого препарата в течение 30 минут.
За четырнадцать дней до начала обработки животных подвергали механической фиксации для адаптации и вводили дозы. В начале эксперимента (день 1) животные самцы имели возраст от 30 месяцев до 56 месяцев и массу от 2,3 до 4,0 кг; а животные самки имели возраст от 31 месяца до 64 месяцев и массу от 1,6 до 3,4 кг. Десять (5 самцов и 5 самок) собакоподобных обезьян, ранее не участвующих в экспериментах, разделяли на 5 групп (по 2 животных на группу), как указано ниже в таблицах 5 и 6. Обезьяны, участвующие в экспериментах, представляют собой животных, живущих колониями, которым ранее вводили тестируемые препараты. Однако такие препараты имеют непродолжительное время полужизни, а поэтому маловероятно, что эти препараты могут присутствовать в организме обезьян или оказывать какое-либо влияние на обезьян во время проведения описанных здесь экспериментов по введению доз. Животным вводили контроль (воздух), 2 мг/кг FDKP или 0,3 (0,04 мг GLP-1), 1,0 (0,13 мг GLP-1) или 2,0 (0,26 мг GLP-1) мг/кг GLP-1/FDKP.
|
|
|
Пробы цельной крови (1,4 мл/пробу крови) брали на день 5 в нижеследующие моменты времени: перед введением дозы, через 10, 30, 45, 60, 90, 120 минут и 4 часа после введения дозы. Кровь брали из бедренной вены путем венопункции. Пробы крови разделяли на 2 аликвоты: одну брали для анализа на уровень GLP-1 в плазме (0,8 мл), а другую (0,6 мл) - для анализа на уровень FDKP в сыворотке. Для проведения анализа на уровень GLP-1 в плазме в каждый из указанных моментов времени собирали цельную кровь (0,8 мл) в 1,3-миллилитровые EDTA-пробирки (0,1% EDTA). Затем приблизительно через 5-10 секунд после забора крови в пробирки добавляли ингибитор DPP-IV (Millipore - Billerica, MA, 10 мкл/мл крови)(до достижения концентрации DPP-IV 100 мкМ). Пробирки несколько раз переворачивали и сразу помещали на влажный лед. Пробы цельной крови выдерживали на влажном льду, а затем центрифугировали (2-8°С) при 4000 об/мин приблизительно в течение 10 минут с получением плазмы. Пробы плазмы переносили в соответствующие сосуды и выдерживали на сухом льду, а затем хранили в холодильнике при -70(±10)°С. После этого определяли концентрации GLP-1 в плазме Cmax, Tmax, AUC и T1/2.
После введения GLP-1/FDKP путем ингаляции в течение четырех дней подряд во всех образцах, перед введением дозы, на 5-й день были обнаружены детектируемые уровни GLP-1. На 5-й день максимальные концентрации (Cmax) GLP-1 в плазме были достигнуты приблизительно через 10 минут после введения дозы (фиг. 31).
Увеличение Cmax и AUClast (площадь под кривой зависимости концентрации от времени в интервале времени от 0 до времени последней количественной оценки концентрации) для GLP-1 в зависимости от дозы наблюдалось у самцов и самок обезьян на 5-й день. Однако, во время исследования интервала доз, при увеличении доз как у самцов, так и у самок обезьян пропорционального увеличения величин AUClast для GLP-1 не наблюдалось, за исключением самцов при уровне дозы 1 мг/кг/день. 6,7-кратное увеличение дозы от 0,3 до 2,0 мг/кг/день приводило всего лишь к 2,9-кратному увеличению AUClast у самцов и к 1,1-кратному увеличению AUClast у самок.
Максимальная концентрация GLP-1 в среднем составляла 17,2, 93,1 и 214 пг/мл у самцов и 19,3, 67,9 и 82,8 пг/мл у самок при введении GLP-1/FDKP в дозах 0,3, 1,0 и 2,0 мг/кг/день, соответственно. Уровни GLP-1 в плазме быстро снижались с явным сокращением интервала времени полужизни от 4 минут до 24 минут.
Величины AUC для GLP-1 составляли 21,6, 105 и 62,3 пг · ч/мл у самцов и 33,4, 23,7 и 35,4 пг · ч/мл у самок при введении GLP-1/FDKP в дозах 0,3, 1,0 и 2,0 мг/кг/день, соответственно.
Каких-либо явных отличий у животных разных полов по параметрам TK GLP-1 при самой низкой дозе не наблюдалось. Однако у самцов обезьян величины AUClast были соответственно выше, чем величины AUClast у самок обезьян при средней и высокой исследуемой дозе. В некоторых образцах, взятых у контрольных обезьян, которым вводили наполнитель, и у контрольных обезьян, которым вводили воздух, наблюдались измеримые уровни GLP-1. Это может быть обусловлено загрязнением воздуха, вдыхаемого животными, или может указывать на присутствие эндогенного GLP-1 у конкретных обезьян. При этом следует отметить, что контрольные животные подвергались обработке не в тех помещениях, в которых содержались животные, обрабатываемые GLP-1/FDKP.
Поскольку биологическое время полужизни GLP-1 составляло менее чем 15 минут, то GLP-1 после введения GLP-1/FDKP должен быть полностью выведен через 24 часа. Поэтому эндогенные уровни GLP-1 могут служить возможным объяснением постоянству оцениваемых уровней GLP-1 в образцах на время 0, собранных на 5-й день у всех GLP-1/FDKP-обработанных животных. Вычитание величин, полученных на время 0, из величин наблюдаемых концентраций GLP-1 после введения дозы, должно отражать изменение GLP-1, обусловленное введением GLP-1/FDKP.
Для анализа на FDKP в сыворотке в каждый из указанных моментов времени брали цельную кровь (0,6 мл) в пробирки, не содержащие антикоагулянта, а затем кровь оставляли при комнатной температуре минимум на 30 минут для свертывания, после чего ее разделяли путем центрифугирования с получением сыворотки. Затем проводили анализ на FDKP и определяли его концентрации в сыворотке (Cmax), Tmax, AUC и T1/2). После введения GLP-1/FDKP путем ингаляции в течение четырех дней подряд, во всех образцах, перед введением дозы, на 5-й день были обнаружены детектируемые уровни FDKP. На 5-й день максимальные концентрации (Cmax) FDKP в плазме были достигнуты приблизительно через 10-30 минут после введения дозы.
Увеличение AUC∞ (площадь под кривой зависимости концентрации от времени, построенной в пределах от времени 0 и экстраполированной до бесконечности) FDKP в зависимости от дозы наблюдалось у самцов и самок обезьян на 5-й день. Однако у самок какого-либо различия в AUC∞ FDKP при дозе 0,3 и 1,0 мг/кг/день не наблюдалось, а при дозе 1-2 мг/кг/день наблюдалось дозозависимое увеличение. Во всех случаях, при которых наблюдалось увеличение, оно было все же не пропорциональным. 6,7-кратное увеличение дозы от 0,3 до 2,0 мг/кг/день приводило всего лишь к 2,7-кратному увеличению AUClast у самцов и к 3,0-кратному увеличению AUC∞ у самок. Максимальные концентрации (Cmax) FDKP в среднем составляли 200, 451 и 339 нг/мл у самцов и 134, 161 и 485 нг/мл у самок при введении GLP-1/FDKP в дозах 0,3, 1,0 и 2,0 мг/кг/день, соответственно. Величины AUC∞ для FDKP составляли 307, 578 и 817 нг · ч/мл у самцов и 268, 235 и 810 нг · ч/мл у самок, которым вводили GLP-1/FDKP в дозах 0,3, 1,0 и 2,0 мг/кг/день, соответственно. Величины AUC∞ и Cmax у животных, которым вводили только FDKP в дозе 2,1 мг/кг/день (группа 2), имели тот же порядок, что и величины для животных, которым вводили GLP-1/FDKP в дозе 2,13 мг/кг/день, за исключением того, что через 30-45 минут после введения дозы Tmax было немного более продолжительным.
В целом, GLP-1/FDKP хорошо переносился животными, и при этом не наблюдалось каких-либо клинических признаков или влияния на массу тела, потребление пищи, клинические параметры патологии и на макроскопическую или микроскопическую оценку. Следует также отметить, что введение GLP-1/FDKP путем ингаляции собакоподобным обезьянам при оцениваемых достигаемых дозах до 2,13 мг/кг/день (соответствующих дозе 0,26 мг/кг/день GLP-1), вводимых в течение 30 минут в день в течение 5 дней, не ассоциировалось с какой-либо дозоограничивающей токсичностью.
Пример 15
Токсикокинетика GLP-1/FDKP, вводимого в течение 14 дней путем инсуффляции в легкие крыс
В данном исследовании оценивали потенциальную токсичность GLP-1/FDKP после ежедневного введения путем инсуффляции в легкие в течение 14 дней подряд. Крысам ежедневно в течение 14 дней подряд вводили контроль (воздух), FDKP-частицы при 10 мг/кг или 1 (0,15 мг GLP-1), 3 (0,45 мг GLP-1) или 10 (1.5 мг GLP-1) мг/кг GLP-1/FDKP путем инсуффляции в легкие (n=24/пол/группу). Животных ежедневно оценивали на клинические признаки токсичности, а также регистрировали массу тела и потребление пищи.
На 1-й и 14-й дни Cmax GLP-1 достигалась примерно через 10-15 минут после введения дозы животным всех тест-групп. Максимальные концентрации GLP-1 при введении 10 мг/кг/день GLP-1/FDKP в среднем составляли 6714 и 6270 пг/мл на день 1 и 2979 и 5834 пг/мл на день 14 у самцов и самок, соответственно. Уровни GLP-1 в плазме быстро снижались со значительным сокращением интервала времени полужизни от 0,7 часа до 4,4 часа. Средние величины AUC для GLP-1 составляли 2187 пМ · ч у самцов и 2703 пМ · ч у самок при наивысшей дозе 10 мг/кг/день GLP-1/FDKP. При этом наблюдался минимальный уровень аккумуляции GLP-1, или такой аккумуляции GLP-1 вообще не наблюдалось, а также не наблюдалось какого-либо отличия в Cmax, времени полужизни и Tmax для обоих полов. Величины AUC GLP-1 были несколько выше у самок крыс, чем у самцов при всех вводимых дозах. Каких-либо значительных побочных эффектов (NOAEL) у крыс, которым вводили 10 мг/кг/день GLP-1/FDKP (1,5 мг/кг/день GLP-1) 14 дней подряд путем инсуффляции в легкие, не наблюдалось.
Примерно через 24 часа после введения последней дозы животных (12/пол/группу) умерщвляли и проводили оценку клинической патологии и макроскопический, и микроскопический анализы. Животных, участвующих в токсикокинетических (TK) исследованиях (12/пол/группу), умерщвляли на 14-й день после введения доз и конечного забора крови. Каких-либо случаев гибели или клинической патологии, ассоциированной с GLP-1/DKP, не наблюдалось. Какого-либо отличия в массах тела и в потреблении пищи у контрольных и обработанных животных также не наблюдалось. Лишь при введении самкам 10 мг/кг GLP-1/FDKP масса печени и отношение массы печени к общей массе тела были значительно ниже по сравнению с указанными параметрами у контрольной группы (воздух).
Каких-либо явных отличий в результатах гематологических тестов, анализов на свертывание крови, химических анализов, биохимических анализов мочи или химического анализа мочи у крыс, которым вводили наполнитель и воздух (контроль), не наблюдалось. Каких-либо явных или гистопатологических изменений в тканях, которые, как было определено, обладают потенциальной токсичностью в результате введения GLP-1/FDKP, не наблюдалось.
Пример 16
Токсикокинетика GLP-1/FDKP, вводимого обезьянам в течение 28 дней путем инсуффляции в легкие
В этом исследовании оценивали токсичность и токсикокинетические параметры GLP-1/FDKP, вводимого путем ингаляции ежедневно в течение по меньшей мере 4 недель. Для оценки обратимости, постоянства или замедления каких-либо эффектов животных оставляли на 4 недели для восстановления.
Животных разделяли на следующие группы обработки: группа 1: контроль (воздух); группа 2: 3,67 мг/кг/день FDKP-частиц; группа 3: 0,3 мг/кг/день GLP-1/FDKP (0,045 мг/кг/день GLP-1); группа 4: 1 мг/кг/день GLP-1/FDKP (0,15 мг/кг/день GLP-1) или группа 5: 2,6 мг/кг/день GLP-1/FDKP (0,39 мг/кг/день GLP-1). Сорок две собакоподобные обезьяны разделяли на 2 группы: группы для основного исследования (n = 3/пол/группа) и группы для восстановления (n= 2/пол/группа), а именно группы 1, 2 и 5. Группа 1: контроль (воздух), группа 2: FDKP (~4 мг/кг/день); группа 3: 0,3 мг/кг/день GLP-1/FDKP (низкая доза); группа 4: ?,0 мг/кг/день GLP-1/FDKP (средняя доза); группа 5: 2,6 мг/кг/день GLP-1/FDKP (высокая доза). Обычно, в этих исследованиях, на восстановление оценивали только обезьян, получавших высокие дозы, и контроль.
Мониторинг животных на смертность и заболеваемость проводили два раза в день, а мониторинг на патологии и признаки токсичности проводили, по меньшей мере, один раз в день через 30 минут после введения дозы. Массу тела регистрировали еженедельно и ежедневно проводили качественную оценку потребления пищи. Кровь брали на 1-й, 28-й и 56-й дни для проведения токсикокинетических исследований. Трех животных/пол/группу анестезировали, взвешивали, а затем у них брали кровь и подвергали аутопсии на 29-й день. Остальных животных групп 1, 2 и 5 (n=2/пол/группу) анестезировали, взвешивали, а затем у них брали кровь и подвергали аутопсии на 57-й день. После аутопсии отобранные органы взвешивали, и выбранные ткани собирали и помещали не хранение. Все ткани от каждого животного исследовали под микроскопом.
У животных всех групп иногда наблюдались отклонения в массах тела, однако какого-либо ассоциированного с обработкой влияния на массу тела не наблюдалось. Вообще говоря, во время всего исследования все животные сохраняли массу тела или слегка прибавляли в весе. При высоких дозах наблюдалось большая частота опорожнения кишечника или появления жидкого стула. Каких-либо заметных ассоциированных с обработкой изменений любых клинических биохимических параметров не наблюдалось, за исключением умеренного повышения уровня лактат-дегидрогеназы (LDH) и аспартат-аминотрансферазы (AST) при высокой дозе, вводимой самкам на 29-й день (в конце обработки), см. таблицу 7. Уровни LDH у самцов были также повышенными, но очень незначительно. Эти изменения были выявлены по окончании периода восстановления и не коррелировали с какими-либо данными микроскопического анализа печени. Изменения уровней AST у самок группы, которым вводили высокую дозу, обусловлены, главным образом, данными, полученными для одного из пяти животных.
|
|
Каких-либо ассоциированных с обработкой макроскопических или гистологических изменений при дозах до 2,6 мг/кг/день GLP-1/FDKP не наблюдалось. GLP-1/FDKP хорошо переносился животными, и при дозах, составляющих до 2,6 мг/кг/день GLP-1/FDKP (0,39 мг/кг/день GLP-1), при этом не наблюдалось каких-либо значимых проявлений клинических признаков или влияния на изменение массы тела, потребление пищи, данные гематологического анализа, биохимического анализа мочи, анализа на инсулин, офтальмоскопические данные, данные ЭКГ и макроскопические или микроскопические анализы. Введение FDKP путем ингаляции в оцениваемой достигаемой дозе 3,67 мг/кг/день в течение 28 дней по 30 минут в день также не ассоциировалось с какой-либо токсичностью.
Увеличение Cmax и AUClast для GLP-1 и FDKP в зависимости от дозы наблюдалось у самцов и самок обезьян на день 1. Во время проведения исследований, при различных интервалах доз, при увеличении доз на день 28 у самцов и самок обезьян наблюдалось непропорциональное увеличение Cmax GLP-1, но не AUClast. Максимальные концентрации GLP-1 при 2,6 мг/кг/день GLP-1/FDKP в среднем составляли 259 пг/мл у самцов и 164 пг/мл у самок. Уровни GLP-1 в плазме снижались со значительным сокращением интервала времени полужизни от 0,6 часов до 2,5 часа. Средние величины AUC для GLP-1 составляли 103 пг · ч/мл у самцов и 104 пг · ч/мл у самок при высокой дозе. При этом у самок обезьян наблюдались более высокие значения AUC и Cmax при низкой дозе по сравнению со значениями, наблюдаемыми у самцов. Максимальные концентрации FDKP при 2,6 мг/кг/день GLP-1/FDKP в среднем составляли 1800 нг/мл у самцов и 1900 пг/мл у самок.
В заключение следует отметить, что введение GLP-1/FDKP собакоподобным обезьянам путем ингаляции в оцениваемых достигаемых дозах, составляющих до 2,6 мг/кг/день GLP-1/FDKP или 0,39 мг/кг/день GLP-1, вводимого в течение 28 дней по 30 минут в день, хорошо переносилось с клинической точки зрения. При дозе 2,6 мг/кг/день GLP-1/FDKP (0,39 мг/кг/день GLP-1) каких-либо значительных побочных эффектов (NOAEL) не наблюдалось. Как описано ниже в примере 19, максимальная доза для человека в исследованиях фазы I составляла 1,5 мг GLP-1/FDKP в день или ~0,021 мг/кг GLP-1 (на массу тела человека приблизительно 70 кг). Дополнительные исследования проводили при дозе 3,0 мг GLP-1/FDKP в день или ~0,042 мг/кг GLP-1.
Пример 17
Получение препаратов экзендина/FDKP
Экзендин-4/FDKP получали путем объединения кислотного раствора пептида экзендина-4 (SEQ ID No. 3) с суспензией FDKP-частиц. Кислотный раствор пептида представляет собой 10% (масс/масс) пептид, растворенный в 2% уксусной кислоте. Суспензия FDKP содержит приблизительно 10% (масс/масс) FDKP-частиц. Кислотный раствор пептида экзендина-4 добавляли к суспензии FDKP-частиц при осторожном помешивании. Смесь экзендина-4/FDKP медленно титровали с 25% раствором аммиака до pH 4,50. Затем смесь гранулировали в жидком азоте и лиофилизовали.
% объема дыхательной фракции на полный объем (%ДФ на полный объем), который содержит порошок, включающий 15% экзендин- 4/FDKP, составляет 36%, при этом процент опустошения картриджа составлял 99%. Порошок, включающий 15% экзендин-4/FDKP, продуцированный в таком же масштабе, имел %ДФ на полный объем 34%, где процент опустошения картриджа составлял 100%.
Пример 18
Фармакокинетика экзендина/FDKP, вводимого путем инсуффляции в легкие
В настоящее время проводятся предварительные исследования токсичности повторных доз для оценки фармакодинамического и фармакокинетического профиля экзендина-4 (аналога GLP-1) в препарате экзендина-4/FDKP в различных концентрациях, а также оценки этого профиля после множества внутрилегочных введений.
Исследования проводили на крысах и обезьянах в течение двадцати восьми дней. Экзендин/FDKP вводили ежедневно путем ингаляции. В исследованиях, в которых животным вводили дозу в течение 28 дней, одну часть животных умерщвляли сразу после введения доз, а других животных оставляли на один месяц для восстановления, а затем умерщвляли. Всех животных оценивали на клинические признаки токсичности, различные физиологические параметры, включая уровни экзендина-4, глюкозы и инсулина в крови; массу органов и клиническую патологию и гистопатологию различных органов.
Группы для предварительного исследования состояли из пяти животных на группу и двух контрольных групп, которым внутривенно вводили воздух и экзендин. В исследованиях участвовали шесть групп, которым путем инсуффляции в легкие вводили приблизительно 2,0 мг доз экзендина/FDKP при 5%, 10%, 15%, 20%, 25% и 30% загрузке экзендина (масс/масс). Затем брали цельную кровь для анализа уровня глюкозы в крови и концентраций экзендина в течение периода времени, составляющего 8 часов.
Затем получали данные (Cmax, T1/2 и Tmax), которые показали, что препараты экзендина/FDKP по своим фармакокинетическим свойствам являются сравнимыми с GLP-1/FDKP или обладают лучшими фармакокинетическими свойствами, чем GLP-1/FDKP.
Пример 19
Фармакокинетика GLP-1/xDKP, вводимого крысам путем инсуффляции в легкие
Для того чтобы определить, могут ли различные DKP влиять на фармакокинетический профиль препаратов GLP-1/FDKP, были получены различные препараты GLP-1/xDKP, описанные в предварительной заявке на патент США, озаглавленной «Асимметрические аналоги FDKP, используемые в качестве агентов для доставки лекарственных средств» ("Asymmetrical Analogs FDKP for Use as Drug Delivery Agents"), которая была подана одновременно с настоящей заявкой и во всей своей полноте вводится в настоящее описание посредством ссылки (документ патентного поверенного No. 51300-00041).
Исследования проводили на крысах, которые были разделены на 6 групп обработки, состоящих из пяти животных на группу. Контрольной группе (n=3) вводили GLP-1 путем инстилляции жидкости. В качестве второго контроля также использовали GLP-1/FDKP (0,3 мг GLP-1), вводимый путем инсуффляции в легкие. Каждой из GLP-1/xDKP-обработанных групп вводили препараты GLP-1/xDKP путем инсуффляции в легкие в дозах ~2,0 мг xDKP, содержащего 10% и 15% GLP-1. В качестве xDKP использовали (E)-3-(4-(3,6-диоксопиперазин-2-ил)бутилкарбамоил)акриловую кислоту), (3,6-бис(4-карбоксипропил)амидобутил-2,5-дикетопиперазин) и динатриевую соль (E)-3,6-бис(4-(карбокси-2-пропенил)амидобутил)-2,5-дикетопиперазина. Цельную кровь брали для оценки концентраций GLP-1 через 5, 10, 20, 30, 45, 60 и 90 минут после введения дозы.
Пример 20
Испытания по введению порошка GLP-1/FDKP путем ингаляции взрослым здоровым мужчинам, проводимые в Фазе Ia с использованием одной дозы, открытой метки, возрастающих доз, контроля на безопасность и толерантность
Было показано, что GLP-1, при его внутривенном (i.v.) или подкожном (s.c.) вливании или при множестве подкожных инъекций, снижает повышенные уровни глюкозы в крови у человека. Поскольку этот гормон имеет очень короткое время полужизни, его необходимо вводить непрерывно путем подкожного вливания или множества ежедневных подкожных инъекций. На практике ни один из этих способов не является пригодным для длительного клинического применения. Эксперименты на животных показали, что при введении GLP-1 путем ингаляции могут быть достигнуты нужные терапевтические уровни.
Некоторые из функций GLP-1, включая снижение скорости опорожнения желудка, усиление чувства насыщения и подавление нерелевантной секреции глюкагона, очевидно, связаны с импульсным высвобождением GLP-1 после начала приема пищи. Благодаря такому раннему выбросу GLP-1 после ингаляции GLP-1/FDKP-порошка у животных с диабетом может вырабатываться фармакодинамический ответ. Кроме того, поздний выброс нативного GLP-1, ассоциированный с повышением секреции инсулина, может быть смоделирован путем ингаляции GLP-1/FDKP-порошка после приема пищи.
Клинические испытания Фазы Ia GLP-1/FDKP-порошка, вводимого путем ингаляции, были впервые разработаны для проведения теста на безопасность и переносимость выбранных доз нового вводимого путем ингаляции терапевтического продукта, регулирующего уровень глюкозы в крови у человека. Такое введение предусматривает применение ранее протестированного ингалятора MedTone®. Основной целью такого клинического испытания является идентификация интервалов доз GLP-1/FDKP-порошка, вводимого путем ингаляции в легкие, которые являются безопасными, хорошо переносятся пациентом и могут быть использованы в последующих клинических испытаниях на эффективность и безопасность. Дозы, выбранные для клинического испытания фазы Ia, были определены, исходя из результатов не-клинических испытаний на безопасность GLP-1/FDKP-порошка, вводимого путем ингаляции, и эти результаты были описаны выше в примерах для крыс и приматов.
Двадцать шесть (26) индивидуумов были включены в 5 групп, где каждая из групп 1 и 2 содержала до 4 обследуемых индивидуумов, а каждая из групп 3-5 содержала до 6 обследуемых индивидуумов, которые удовлетворяли критериям приемлемости, а затем было проведено клиническое испытание. Каждый индивидуум получал одну дозу глюкагон-подобного пептида-1 (GLP-1) в качестве GLP-1/FDKP-порошка для ингаляции при следующих уровнях доз: группа 1: 0,05 мг; группа 2: 0,45 мг; группа 3: 0,75 мг; группа 4: 1,05 мг и группа 5: 1,5 мг GLP-1. Других пациентов, вместо выбывших, не набирали. Дозы вводили с учетом массы тела в 70 кг. Средний специалист в данной области может самостоятельно определить и другие уровни доз, исходя из описанных выше исследований.
Целью данного испытания является определение безопасности и переносимости возрастающих доз GLP-1/FDKP-порошка, вводимого путем ингаляции здоровым взрослым мужчинам. Переносимость возрастающих доз GLP-1/FDKP-порошка для ингаляции оценивали путем мониторинга фармакологического или негативного воздействия на различные параметры, включая оценку сообщаемых ранее побочных эффектов (AE), оценку параметров жизненно важных функций, врачебное обследование, клинические лабораторные тесты и электрокардиограммы (ЭКГ).
Другими второстепенными целями является дополнительная оценка безопасности и фармакокинетических параметров. Такими параметрами являются дополнительные параметры безопасности, такие как случаи заболевания легких и другие AE, а также изменения функций легких между визитом 1 (скрининг) и визитом 3 (врачебное обследование); фармакокинетические (ФК) параметры GLP-1 в плазме и фумарилдикетопиперазина (FDKP) в сыворотке после введения дозы GLP-1/FDKP-порошка путем ингаляции, как было измерено по AUC0-120(мин) GLP-1 в плазме и AUC0-480(мин) FDKP в сыворотке; и дополнительные ФК-параметры GLP-1 в плазме, включая tmax GLP-1 в плазме; Cmax GLP-1 в плазме; и Т1/2 GLP-1 в плазме. Другими ФК-параметрами FDKP в сыворотке являются: Tmax FDKP в сыворотке; Cmax FDKP в сыворотке; и Т1/2 FDKP в сыворотке.
Конечной целью испытаний является сравнение нижеследующих фармакологических параметров и параметров безопасности, определенных для группы индивидуумов, участвующих в испытаниях. Главными конечными целями являются: конечный результат испытаний на безопасность с точки зрения частоты возникновения и тяжести сообщаемых AE, включая кашель и одышку, тошноту и/или рвоту, а также изменения, выявленные в результате скрининга параметров жизненно важных функций, проведения клинических лабораторных тестов и врачебного обследования. Другими целями являются определение фармакокинетических параметров GLP-1 в плазме и FDKP в сыворотке (AUC0-120(мин) GLP-1 в плазме и AUC0-480(мин) FDKP в сыворотке); дополнительных фармакокинетических свойств GLP-1 в плазме (Tmax GLP-1 в плазме; Cmax GLP-1 в плазме и Т1/2 GLP-1 в плазме; другие ФК-параметры FDKP в сыворотке (Tmax FDKP в сыворотке и Cmax FDKP в сыворотке) и дополнительных параметров безопасности (тесты на функции легких (PFT)) и ЭКГ.
Испытания в Фазе Ia с введением одной дозы включают стратегию, включающую использование открытой метки, схемы введения возрастающих доз, а также конструирование лекарственного средства, и указанные испытания проводят в соответствии с настоящим изобретением согласно статье 21 CFR (Свода федеральных правил) § 312 и Международных правил и принципов клинических исследований лекарственных средств (ВОЗ): Общим руководством (ICH-E6) и Руководством по общим правилам клинических исследований (ICH-E8) в целях определения безопасности и переносимости исследуемого медицинского продукта (IMP).
Клиническое испытание состоит из 3 визитов в клинику: 1) одного визита - для предварительного обследования (визит 1); 2) одного визита - для проведения лечения (визит 2); и 3) одного визита - для врачебного обследования (визит 3) через 8-14 дней после визита 2. Введение разовой дозы GLP-1/FDKP-порошка путем ингаляции проводят во время визита 2.
Целью данного клинического испытания является оценка параметров безопасности в каждой группе. Группе, которой была назначена соответствующая схема введения доз, не вводили дозу в более высокой концентрации до тех пор, пока от главного научного руководителя (PI) не поступила информация о безопасности и переносимости первой дозы или ранних вводимых доз. Для гарантии безопасности индивидуумам каждой группы дозы вводили с получасовым запаздыванием. Введение дозы может быть прекращено, если у 3 или более индивидуумов в группе наблюдается сильная тошнота и/или рвота, либо если уже была введена максимальная доза, либо по усмотрению главного научного руководителя (PI).
Было оценено пять доз GLP-1/FDKP-порошка для ингаляции (0,05, 0,45, 0,75, 1,05 и 1,5 мг GLP-1). Для приготовления всех доз полученный GLP-1/FDKP должен быть смешан с порошкообразным FDKP для ингаляции. Для приготовления нужной дозы GLP-1 (0,05 мг, 0,45 мг, 0,75 мг, 1,05 мг и 1,5 мг) были использованы картриджи с одноразовой дозой, содержащей 10 мг сухого порошка, состоящего из GLP-1/FDKP для ингаляции (15% масс/масс GLP-1/FDKP), взятого отдельно или смешанного с соответствующим количеством порошкообразного FDKP для ингаляций. Первые 2 самые низкие дозы оценивали для 2 групп, каждая из которых состояла из 4 индивидуумов, а 3 самые высокие дозы оценивали для 3 групп, каждая из которых состояла из 6 индивидуумов. Каждый индивидуум получал только 1 дозу из 5 оцениваемых доз. Помимо забора крови для анализа уровней GLP-1 (активного и общего) и измерения уровней FDKP, брали также пробы крови для определения уровней глюкагона, глюкозы, инсулина и С-пептида.
В настоящем описании приводятся различные ссылки на патенты и публикации. Каждая из этих цитируемых работ и публикаций во всей своей полноте вводится в настоящее описание посредством ссылки.
Термин «примерно», если это не оговорено особо, означает, что все числа, указывающие на количество ингредиентов, свойства, такие как молекулярная масса, условия проведения реакций и т.п., используемые в описании и в формуле изобретения, во всех случаях могут варьироваться. В соответствии с этим, если это не оговорено особо, численные параметры, представленные в данном описании и в прилагаемой формуле изобретения, являются приближенными и могут варьироваться в зависимости от свойств, которые необходимо получить при осуществлении настоящего изобретения. Без каких-либо преувеличений и попыток ограничить применение доктрины эквивалентов к заявленному объему авторы настоящего изобретения считают, что каждый численный параметр следует рассматривать по меньшей мере как ряд сообщаемых значимых величин и величин, вычисленных стандартными методами их округления. Несмотря на то что численные интервалы и параметры, представляющие широкий объем настоящего изобретения, являются приближенными, однако, как уже сообщалось, численные значения, приводящиеся в конкретных примерах, по возможности, указаны наиболее точно. При этом любые численные значения имеют присущие им погрешности, что обусловлено стандартными отклонениями, возникающими при соответствующих измерениях, проводимых в анализах.
Для каждого специалиста очевидно, что в настоящее изобретение могут быть внесены различные варианты и модификации, не выходящие за рамки существа и объема изобретения.
Артикли “а” и “an”, используемые в формуле и/или в описании изобретения в сочетании со словом “включающий”, могут относиться к «одному» объекту, а также к «одному или нескольким» объектам, «по меньшей мере к одному объекту» и «к одному или более чем одному» объекту.
Считается, что любые описанные здесь способы или композиции могут быть использованы для осуществления любых других описанных здесь способов или для приготовления любых других описанных здесь композиций.
Союз “или”, используемый в формуле изобретения, означает “и/или”, и, если это не оговорено особо, означает только альтернативные варианты, либо эти альтернативные варианты являются взаимоисключающими.
В настоящей заявке термин “примерно” используется для указания величины, которая включает стандартное отклонение ошибки для данного устройства или метода, используемых для определения этой величины.
Другие цели, отличительные признаки и преимущества настоящего изобретения будут очевидны из предшествующего описания и примеров, а также из формулы изобретения. Однако следует отметить, что подробное описание и конкретные примеры, в которых описаны конкретные варианты изобретения, приводятся лишь в целях иллюстрации, и различные изменения и модификации, которые будут очевидны для специалиста в данной области, исходя из подробного описания изобретения, также входят в объем и сущность настоящего изобретения.
Библиография
Помимо публикаций, приведенных выше, нижеследующие публикации, если они относятся к проведению репрезентативных процедур или к другим подробно описанным вариантам изобретения, вводятся в настоящее описание посредством ссылки.
Chelikani PK et al., Intravenous infusion of glucagon-like peptide-1 potently inhibits food intake, sham feeding, and gastric emptying in rats. Am J Physiol. Regul. Integr. Comp. Physiol, 288(6):R1695-706, 2005.
D'Alessio, et al., J. Clin. Invest., 97:133-38, 1996.
Deacon CF: Therapeutic strategies based on glucagon-like peptide 1. Diabetes. Sep;53(9):2181-9, 2004.
Eissele, et al., Life Sci, 55:629-34, 1994.
Goke, et al., J. Biol. Chem. 268:19650-55, 1993.
Johnson JD et al.: RyR2 and calpain-10 delineate a novel apoptosis pathway in pancreatic islets. J Biol Chem., 279(23):24794-802, 2004.
Malhotra, R., et al., Regulatory Peptides, 41:149-56, 1992.
Mentlein R, et al., Dipeptidyl peptidase IV hydrolyses gastric inhibitory polypeptide, glucagon-like peptide-1 (7-36) amide, peptide histidine methionine and is responsible for their degradation in human serum. Eur J Biochem., 214:829-835, 1993.
Montrose-Rafizadeh, et al., Diabetes, 45(Suppl. 2):152A, 1996.
Nauck MA, et al., Normalization of fasting hyperglycemia by exogenous GLP-I (7-36 amide) in type 2 diabetic patients. Diabetologia, 36:741-744, 1993.
Nauck MA, et al., Effects of subcutaneous glucagon-like peptide 1 (GLP-I [7-36 amide]) in patients with NIDDM. Diabetologia, 39:1546 -1553, 1996.
Nauck MA, et al., Effects of glucagon-like peptide 1 on counterregulatory hormone responses, cognitive functions, and insulin secretion during hyperinsulinemic, stepped hypoglycemic clamp experiments in healthy volunteers. J Clin Endocrinol Metab., 87:1239-1246, 2002.
Raufman, et al., J. Biol. Chem. 267:21432-37, 1992.
Raufman, et al., J. Biol. Chem. 266:2897-902, 1991.
Schepp, et al., Eur. J. Pharmacol, 69:183-91, 1994.
Singh, et al., Regul. Pept. 53:47-59, 1994.
Sturis J, et al., British Journal of Pharmacology, 140,123 .132, 2003.
Tornusciolo D.R. et al., Biotechniques 19(5):800-805, 1995. Simultaneous detection of TDT-mediated dUTP-biotin nick end-labeling (TUNEL)-positive cells and multiple immunohistochemical markers in single tissue sections.
Verdich C, et al., A meta-analysis of the effect of glucagon-like peptide-1 (7-36) amide on ad libitum energy intake in humans. J Clin Endocrinol Metab., 86:4382-4389, 2001.
Wang Q, et al., Glucagon-like peptide-1 regulates proliferation and apoptosis via activation of protein kinase B in pancreatic INS-I beta cells. Diabetologia, 47:478-487, 2004.
Wang, et al., J. Clin. Invest, 95:417-21, 1995.
Zander M, et al., Effect of 6-week course of glucagon-like peptide 1 on glycaemic control, insulin sensitivity, and beta-cell function in type 2 diabetes: a parallel-group study. Lancet, 359:824-830, 2002.