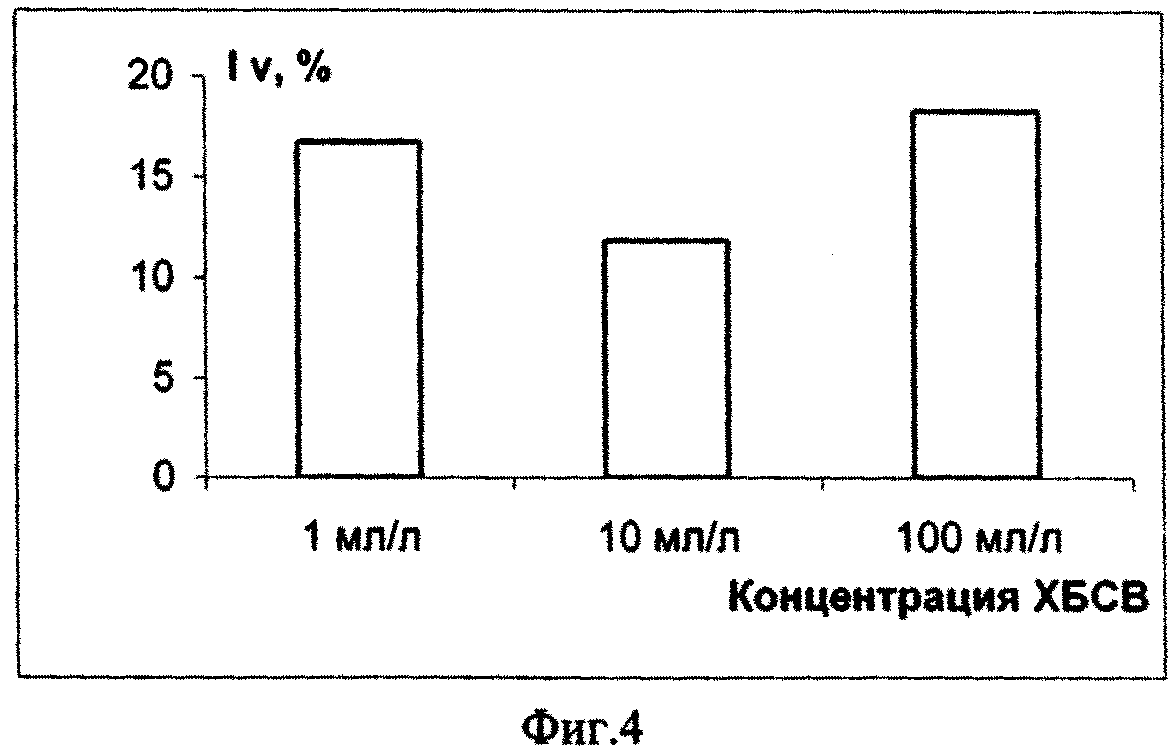Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ ВЛИЯНИЯ ТОКСИЧНОСТИ СТОЧНЫХ ВОД НА ВОДНЫЕ СОЛЕНЫЕ СРЕДЫ
Вид РИД
Изобретение
Предполагаемое изобретение относится к водной токсикологии и предназначено для оценки уровня токсичности морской среды, содержащей сточные воды.
В настоящее время проблема аварийных и запланированных сбросов сточных вод различного происхождения в водоемы Украины очень актуальна. В связи с этим, возникает проблема оценки токсичности сточных вод, как для водных экосистем, так и для здоровья человека, использующего водные ресурсы. Сточные воды населенных пунктов, представленные стоками домовых канализаций и скотных дворов, сливами от садово-огороднических хозяйств, отдельных больничных сооружений и различных предприятий легкой и тяжелой промышленности, в большинстве случаев, по своему химическому составу являются пресноводными. Попадая в пресноводные водоемы, такие отходы, безусловно, вызывают изменения в химическом составе воды. Для оценки токсичности среды, содержащей сточные воды, используются способы, основанные на определении воздействия острых (краткосрочных) токсичных концентраций стоков на пресноводных гидробионтов. В то же время, способы определения токсичности стоков для морских гидробионтов и гидробионтов, обитающих в водоемах с высокой соленостью весьма ограничены. Именно поэтому, сотрудники очистных сооружений и работники СЭС продолжают руководствоваться методиками, разработанными для пресноводной биоты, даже если сбросы сточных вод населенными пунктами осуществляются в море или соленые озера.
Известен (см. С.Е.Дятлов, А.Г.Петросян Phaeodactylum tricomutum Boil. (Chrysophyta) как тест-объект. Общие положения // Альгология.- 2001. - Т.11, №1. -С. 145-154) способ оценки токсичности морской среды, который положен в основу нормативного документа "Бiтестування морької води та стiчной, яка вiдводится в море. Методика", утвержденного Минэкобезопасности Украины №46 от 30.05.1995 г. (КНД, 1995). В известном способе биотестирование морских вод проводят с использованием морской одноклеточной водоросли Phaeodactylum tricomutum. Способ основан на определении показателей роста культуры морской одноклеточной водоросли Phaeodactylum tricomutum в тестируемой воде. Критерием токсичности является достоверное изменение численности клеток водоросли, экспонируемой в тестируемой среде, по сравнению с контролем, в течение 72 часов. Способ включает культивирование культуры морской одноклеточной водоросли Phaeodactylum tricomutum, процедуру биотестирования и обработку результатов. Процедура биотестирования состоит из отбора проб воды, внесения в контроль и в тестируемую среду инокулята культивируемой водоросли, подсчета численности клеток водоросли Phaeodactylum tricomutum на 24, 48 и 72 час экспозиции. Авторами предложена шкала токсичности тестируемой среды по ростовым показателям водоросли. Основным итогом таких работ является определение минимальной кратности разбавления (Кр min) - отношения тестируемой воды к контрольной. Кроме этого, авторы ссылаются на работы по определению минимально допустимой и медианальной эффективной (летальной) концентраций.
Известный способ определения влияния токсичности сточных вод на лабораторную культуру водорослей Phaeodactylum tricomutum обладает рядом недостатков:
- является кратковременным экспресс-тестом и не позволяет оценить различные фазы роста культуры, а именно периоды безразличия, начального нарушения функций клеток, период нормализации или даже стимуляции роста. Именно при хроническом (долгосрочном) эксперименте исследователь может получить полную информацию о токсичности тестируемой среды;
- не дает полной и достоверной информации при оценке опасности сбросов сточных вод различного происхождения для гиперсоленых водоемов.
В основу изобретения "Способ определения влияния токсичности сточных вод на водные соленые среды" поставлена задача путем проведения исследования влияния токсичности сточных вод на одноклеточные микроводоросли Platymonas viridis Rouch и Dunaliella salina Teod. в долгосрочном эксперименте, обеспечить исследователей более полной и достоверной информацией о степени токсичности различных концентраций сточных вод.
Поставленная цель достигается тем, что в способе путем определения показателей роста культуры морской одноклеточной водоросли в тестируемой воде, включающем культивирование культуры морской одноклеточной водоросли, процедуру биотестирования, состоящую из отбора проб воды, внесения в контроль и в тестируемую среду инокулята культивируемой водоросли, подсчета численности клеток водоросли, в качестве тест-объектов используют культуры одноклеточных морских микроводорослей Platymonas viridis Rouch и Dunaliella salina Teod и проводят долгосрочный эксперимент. Микроводоросль Platymonas viridis Rouch используют для оценки влияния токсичности стоков на морскую среду. Микроводоросль Dunaliella salina Teod. используют для оценки уровня опасности сбросов сточных вод различного происхождения для гиперсоленых водоемов.
Отличие предлагаемого способа от известного заключается в том, что автор предлагает проводить исследование токсичности сточных вод на одноклеточных микроводорослях в долгосрочном (15-суточном) эксперименте. Кроме этого, отличием предлагаемого способа от известного, является использование в качестве тест-объектов культуры Platymonas viridis Rouch -для оценки токсичности стоков на морскую среду и Dunaliella salina Teod - для оценки опасности сбросов сточных вод различного происхождения для гиперсоленых водоемов. Данные виды микроводорослей были выбраны в связи со следующим:
- простота культивирования и содержания в лабораторных условиях;
- возможность быстрого получения биомассы культур за короткий срок;
- высокая чувствительность к действию токсикантов;
- широкое применение в качестве тест-объектов в экотоксикологии;
- относительная устойчивость P. viridis и D. salina к действию некоторых токсикантов, в том числе сточных вод различного происхождения;
- доступность: водоросль P. viridis широко распространена в морских акваториях, a D. salina - типичный представитель водоемов с высокой степенью солености.
Способ реализуется следующим образом. Для биотестирования используют альгологически чистые культуры из музея культур микроводорослей Института биологии южных морей НАН Украины, г. Севастополь: Platymonas viridis (Rouch, 1970) - зеленая водоросль из сем. Chlamydomonadae (Chlorophyta, Volvociphyceae) - и зеленая одноклеточная жгутиковая галофильная водоросль Dunaliella salina (Teod, 1905) из сем. Chlamydomonadae, (Chlorophyta, Volvociphyceae). Для периодического биотестирования морской и гиперсоленой воды, содержащей сточные воды, микроводоросли культивируют в лабораторных условиях с использованием питательной среды Гольдберга (для водорослей Platymonas viridis и Dunalialla salina), среды Erd-Schreiber (Butcher, 1952) - для культивирования Platymonas viridis и среды Артари №1, №2 (1916) и Милько (1962) - для культивирования Dunalialla salina. Условия культивирования
Культуры водорослей выращивают в конических колбах емкостью 500 мл при температуре 18 - 25°С и естественном освещении. В качестве питательной среды используют среду Гольдберга. Морскую воду отбирают в условно чистой зоне моря, профильтровывают ее через двойной бумажный фильтр №6. Стерилизуют морскую воду путем троекратного нагревания в водяной бане до температуры 80°С.
Процедура биотестирования:
1. Проведение эксперимента:
- Последовательно вносят в морскую среду компоненты среды Гольдберга,
различные концентрации сточных вод, а также равное количество культуры микроводорослей.
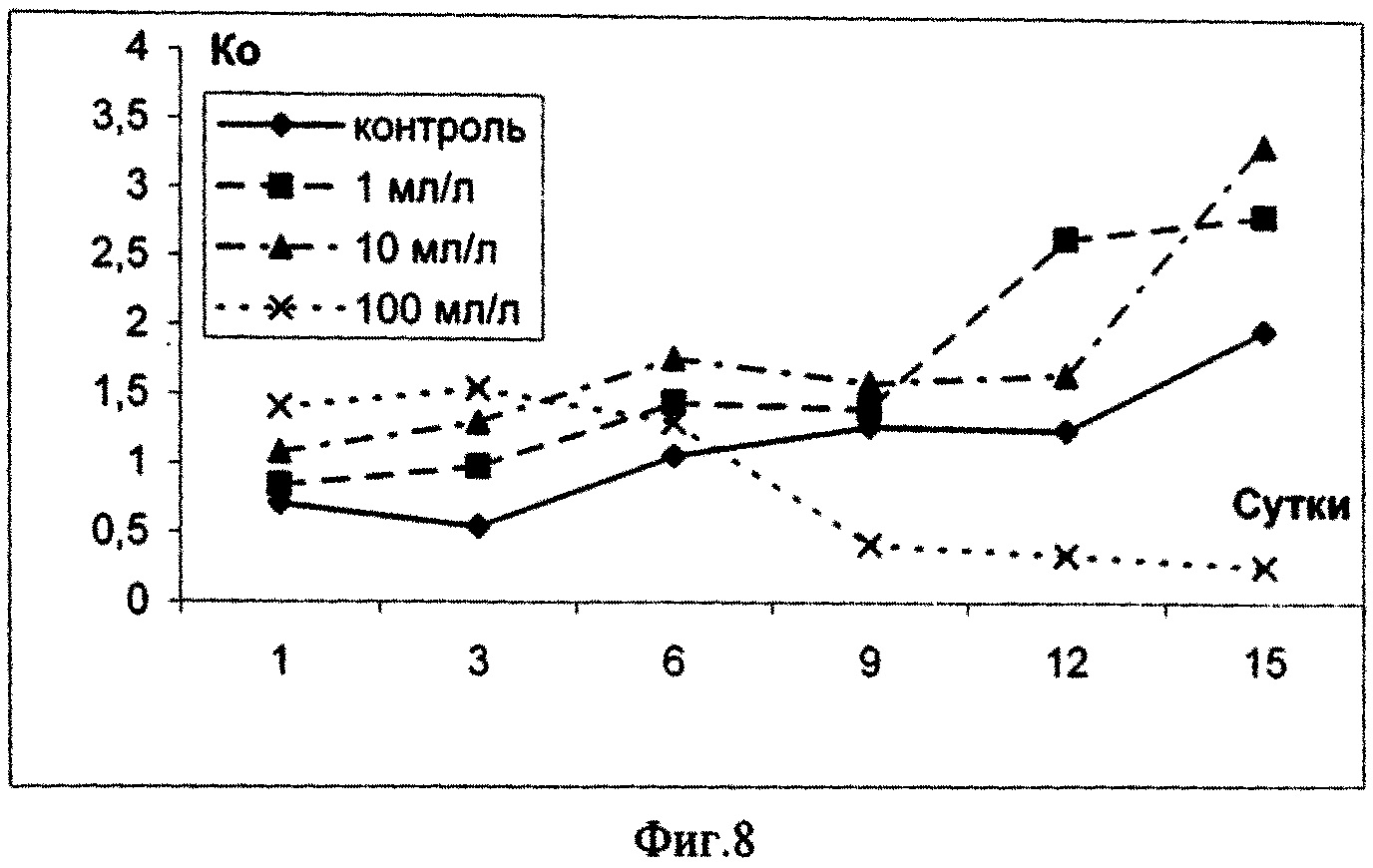
- Отбирают клеточный инокулят в начале опыта, затем на 1-е, 3-й, 6-е, 9-е, 12-е и 15-е сутки 15-суточного эксперимента и подсчитывают количество клеток для каждого варианта. Количество клеток подсчитывают во всем объеме камеры Горяева, движение микроводорослей фиксируют раствором Люголя с глицерином.
Эксперименты проводят в трех повторностях. Для каждого сосуда численность
клеток определяют также в трех повторностях.
2. Статистическая обработка результатов эксперимента. Результаты опытов обрабатывают статистически, используя t - критерий Стьюдента при сравнении параметра численности при уровне значимости р<0.05 (Лакин, 1973).
3. Определение наличия или отсутствия токсического эффекта различных концентраций сточной воды на культуру водорослей.
Показатели биотестирования
Основным показателем, с помощью которого оценивают уровень токсичности добавленных в среду сточных вод, является численность клеток водорослей. По результатам экспериментов составляют таблицу численности клеток во всех вариантах эксперимента в абсолютных единицах, а также значений численности клеток водорослей, выраженных в относительных единицах (% относительно контроля). Дополнительными показателями влияния токсичности среды на микроводоросли, могут служить процент ингибирования численности клеток, коэффициент относительного прироста культур, средняя скорость роста, процент снижения средней скорости роста, прирост и процент снижения прироста культуры.
На основании полученных результатов экспериментов делают вывод о минимальной кратности разбавления сточных вод морской водой или водой с высокой степенью солености, то есть устанавливают такое количество природной воды, при которой не будет наблюдаться токсический эффект нечистот. Для выявления токсичности различных концентраций сточных вод автор также предлагает руководствоваться «Шкалой токсичности тестируемой среды по показателям роста водорослей Phaeodactylum tricomutum Bohl» (Дятлов, Петросян, 2001), которая по проценту численности клеток в растворах определяет степень токсичности и характеристику среды, а также кратность разбавления. Ряд исследователей определяют также максимально допустимую (недействующую) концентрацию и летальную концентрацию (LC50, LC100), которые, в основном, используют при поверках культур по отношению к действию стандартного токсиканта.
Примеры реализации способа.
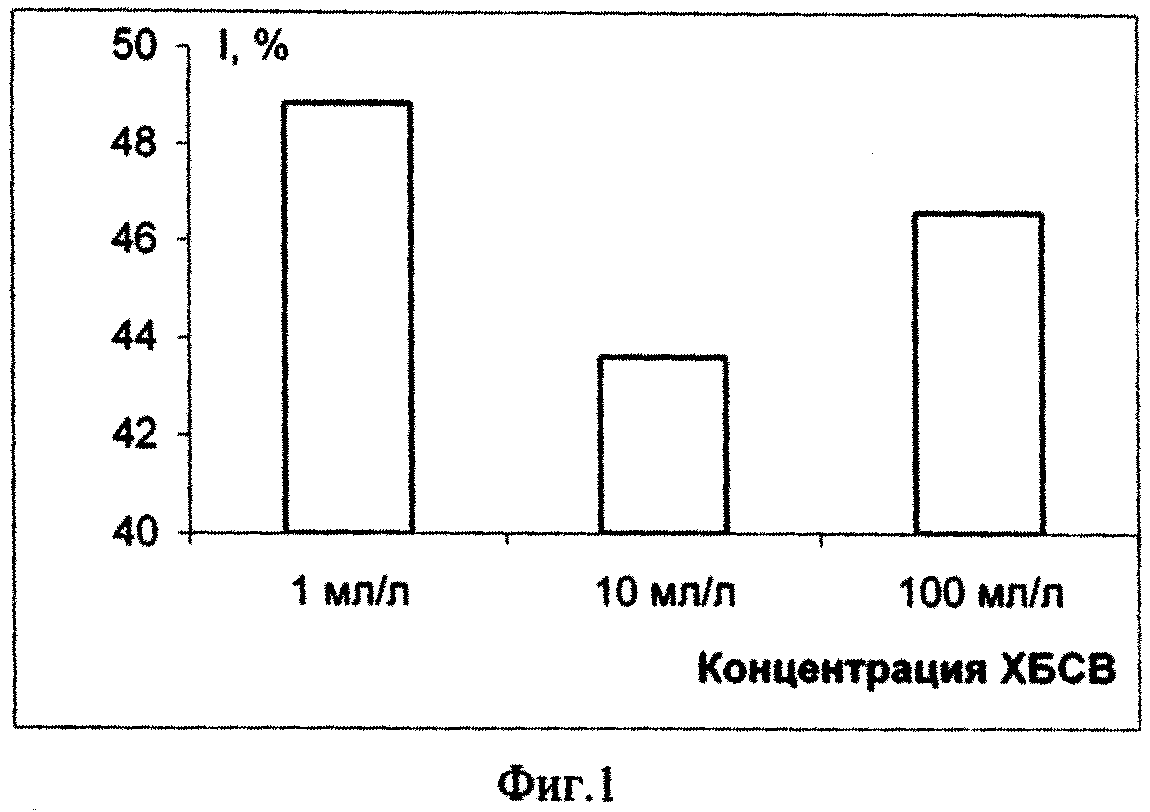
Пример 1. Оценивали уровень токсичности городских хозяйственно-бытовых сточных вод (ХБСВ) на морскую микроводоросль Platymonas viridis Rouch. Результаты эксперимента представлены в табл.1, а также на фиг. 1 - фиг. 6.
Таблица 1
Изменение численности клеток Platymonas viridis Rouch. при воздействии различных концентраций хозяйственно-бытовых сточных вод
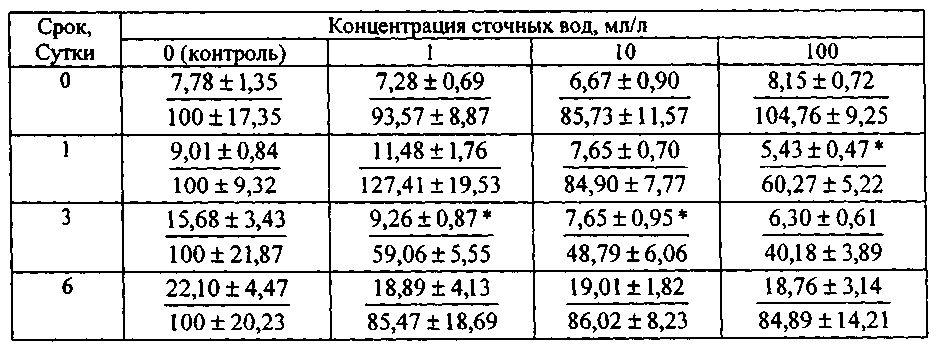
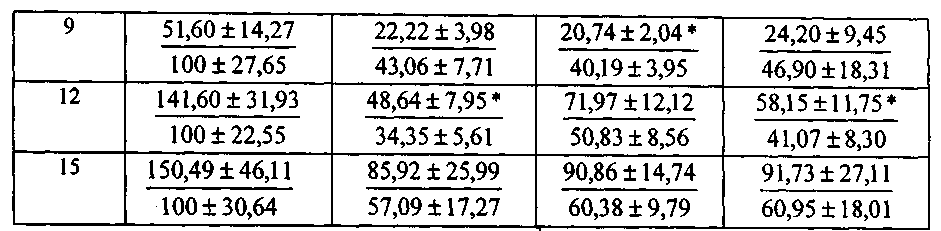
Примечание. В числителе - число клеток (X на 10) в мл, в знаменателе - то же по отношению к численности в контроле, принятом за 100%. Звездочкой обозначены значения численности клеток, достоверно отличающиеся от аналогичных значений в контрольных культурах (р≤0,05).
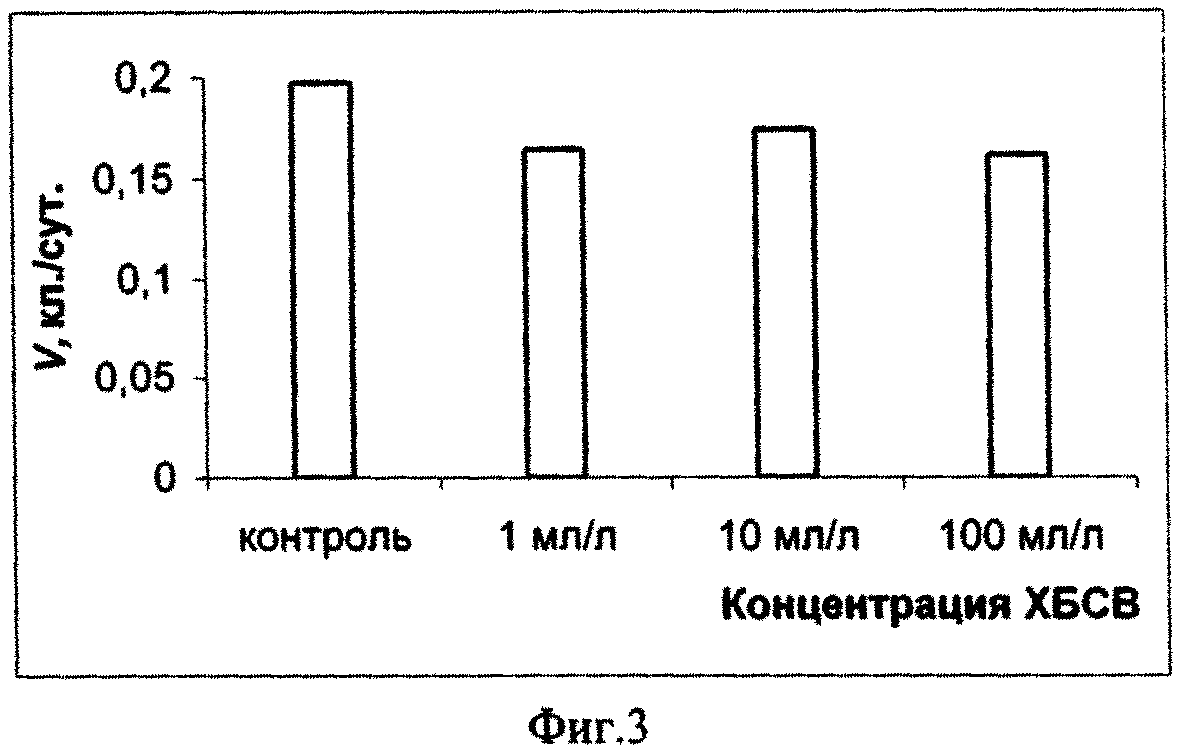
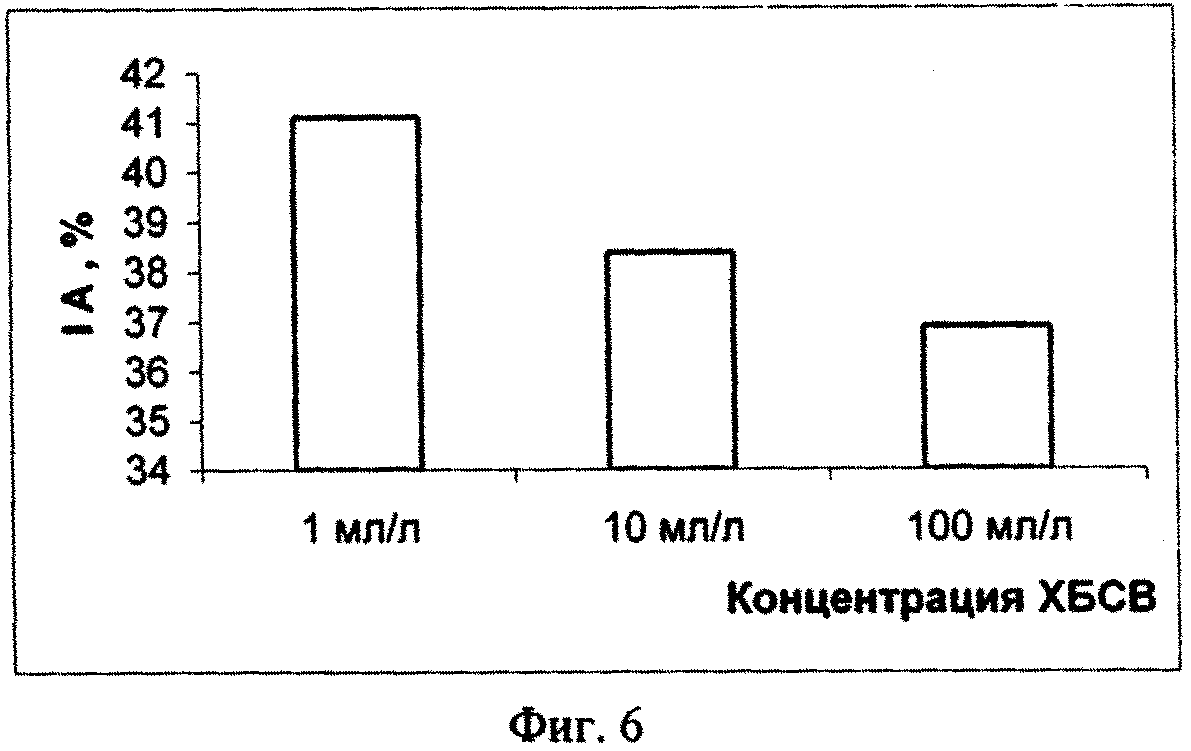
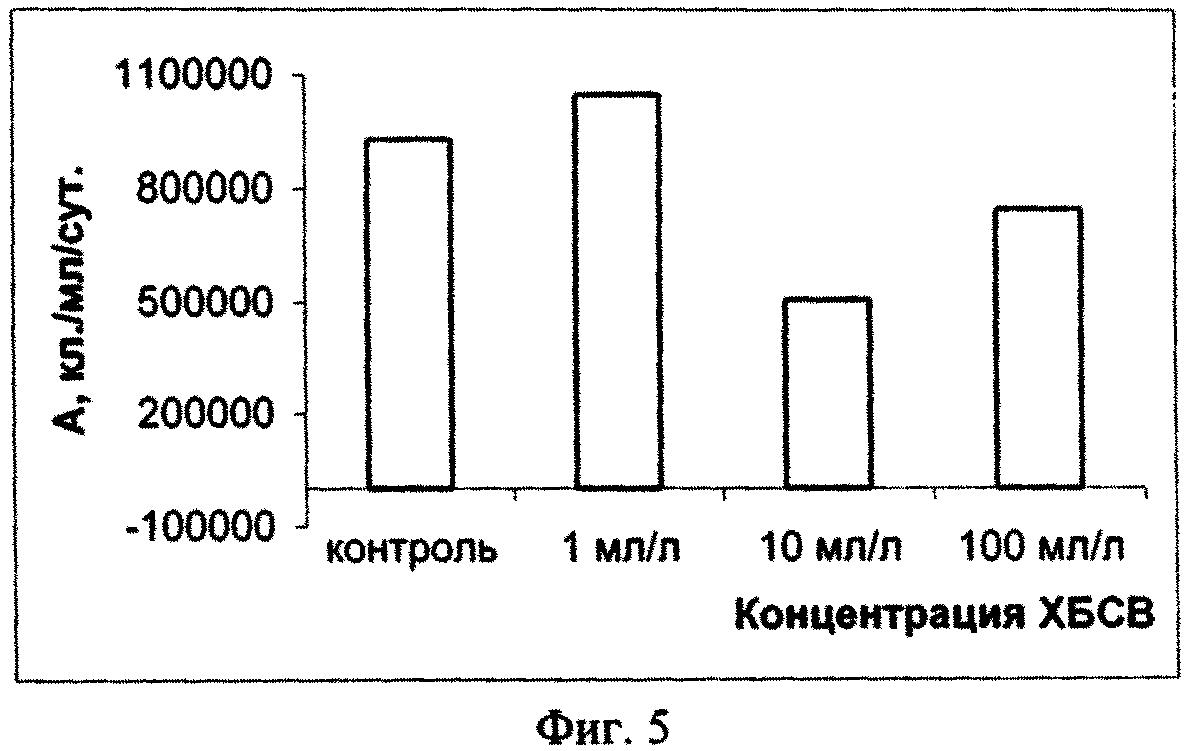
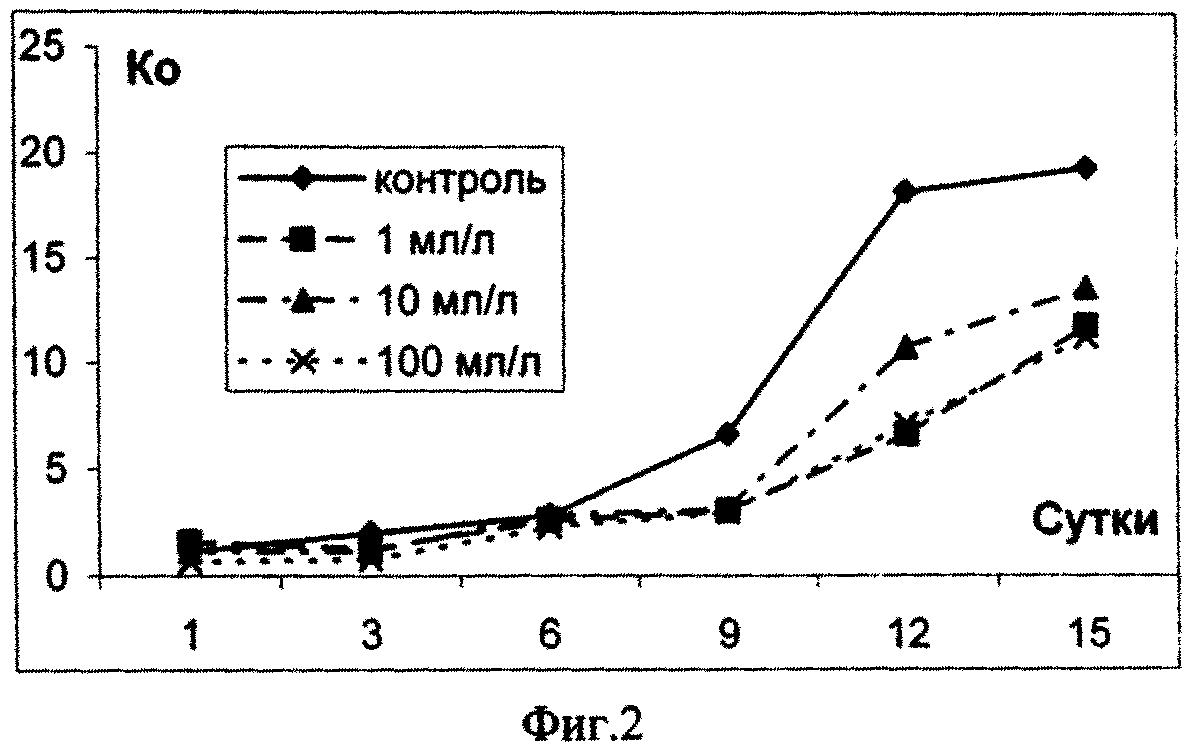
На основании полученных результатов можно сделать вывод о том, что в долгосрочном эксперименте ХБСВ в концентрациях 1, 10 и 100 мл/л не вызывали токсичности у морской флагелляты Platymonas viridis Rouch. Достоверное снижение более чем на 50 % по сравнению с контролем численности клеток на 9 - 12 сутки под влиянием сточных вод можно объяснить снижением средней скорости роста культуры (см. фиг. 3), причем процент снижения средней скорости роста численности микроводорослей выше при действии 1 и 100 мл/л сточных вод (см. фиг.4). В абсолютных значениях численность клеток P. viridis возрастала во всех вариантах в течение всего эксперимента. Однако, из табл. 1, фиг. 1 и фиг. 2 видно, что этот показатель был выше в контроле, чем в опытах. Следует отметить, что процент ингибирования численности был выше при наименьшей концентрации, а коэффициент относительного прироста соответственно был ниже в этом случае, а также при влиянии 100 мл/л сточных вод. Суточный прирост культуры P. viridis был выше в случае воздействия ХБСВ в концентрации 1 мл/л (см. фиг. 5). Снижение прироста увеличивалось с увеличением концентрации сточных вод (см. фиг. 6), что, безусловно, согласуется с данными табл. 1 и свидетельствует о том, что наибольший рост численности клеток происходит при увеличении содержания биогенов, присутствующих в стоках.
Из примера 1 следует, что во время экспоненциального периода роста культуры P. viridis сточные воды городского коллектора в концентрациях 1, 10 и 100 мл/л не вызывали необратимых нарушений в росте численности клеток исследованной культуры, хотя, почти в течение всего эксперимента исследованный показатель был ниже контрольного, что, вероятно, свидетельствует об избыточном количестве питательных и токсичных компонентов стоков.
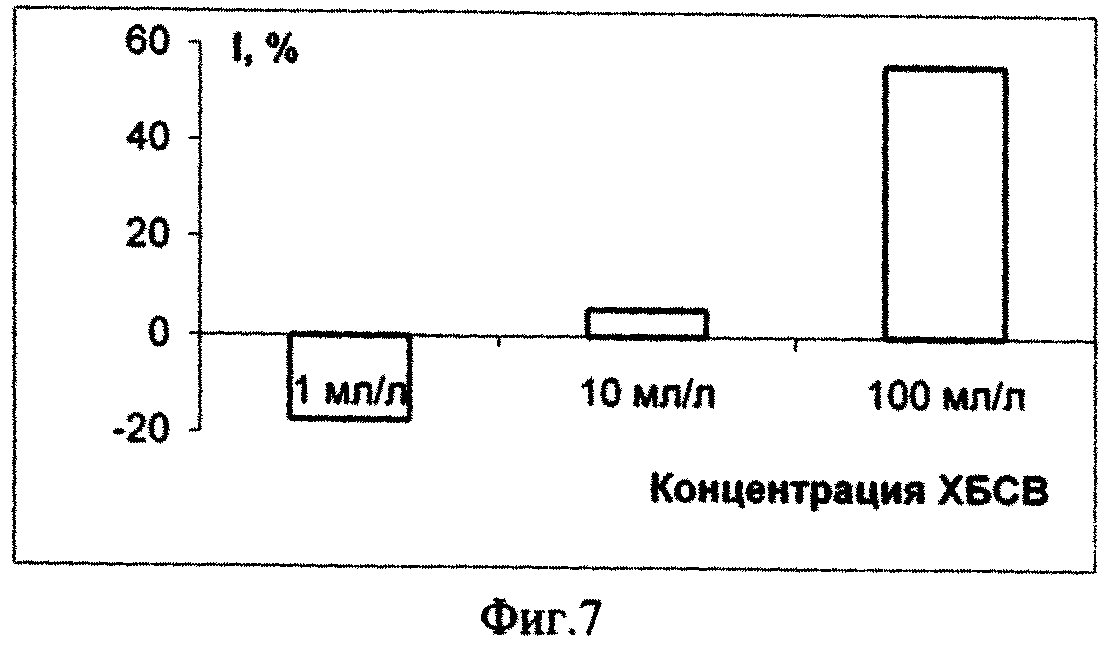
Пример 2. Оценивали уровень токсичности городских хозяйственно-бытовых сточных вод (ХБСВ) на галофильную микроводоросль Dunaliella salina Teod. Результаты эксперимента представлены в табл.2, а также на фиг.7 - фиг. 12.
Таблица 2
Изменение численности клеток Dunaliella salina Teod. при воздействии различных концентраций хозяйственно-бытовых сточных вод
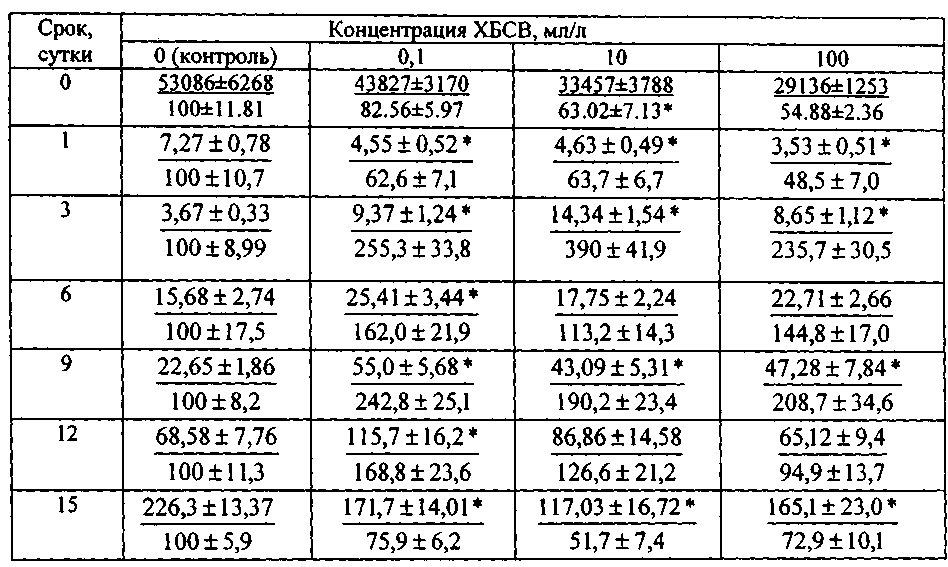
Примечание. В числителе - число клеток (X на 104) в мл, в знаменателе - то же по отношению к численности в контроле, принятом за 100 %. Звездочкой обозначены значения численности клеток, достоверно отличающиеся от аналогичных значений в контрольных культурах (р≤0,05).
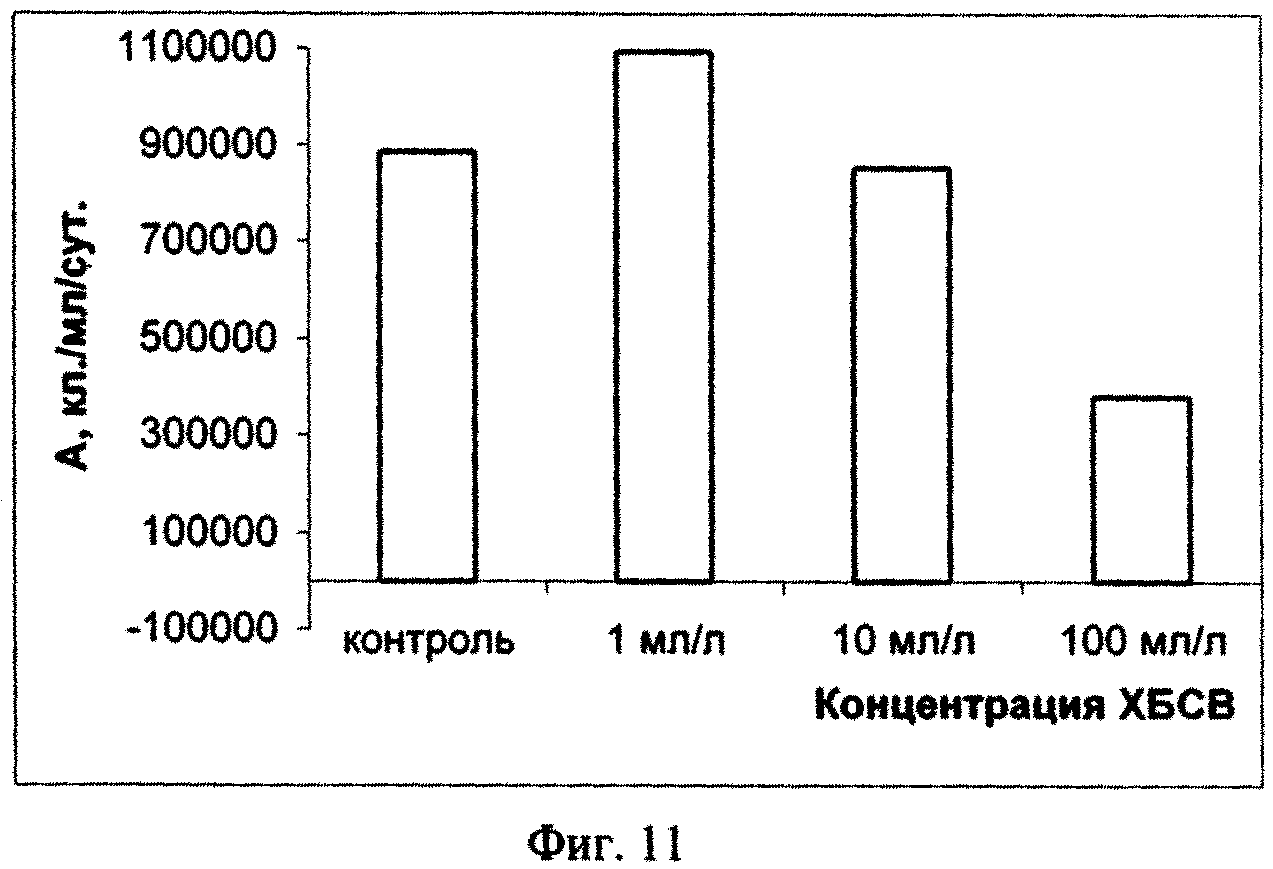
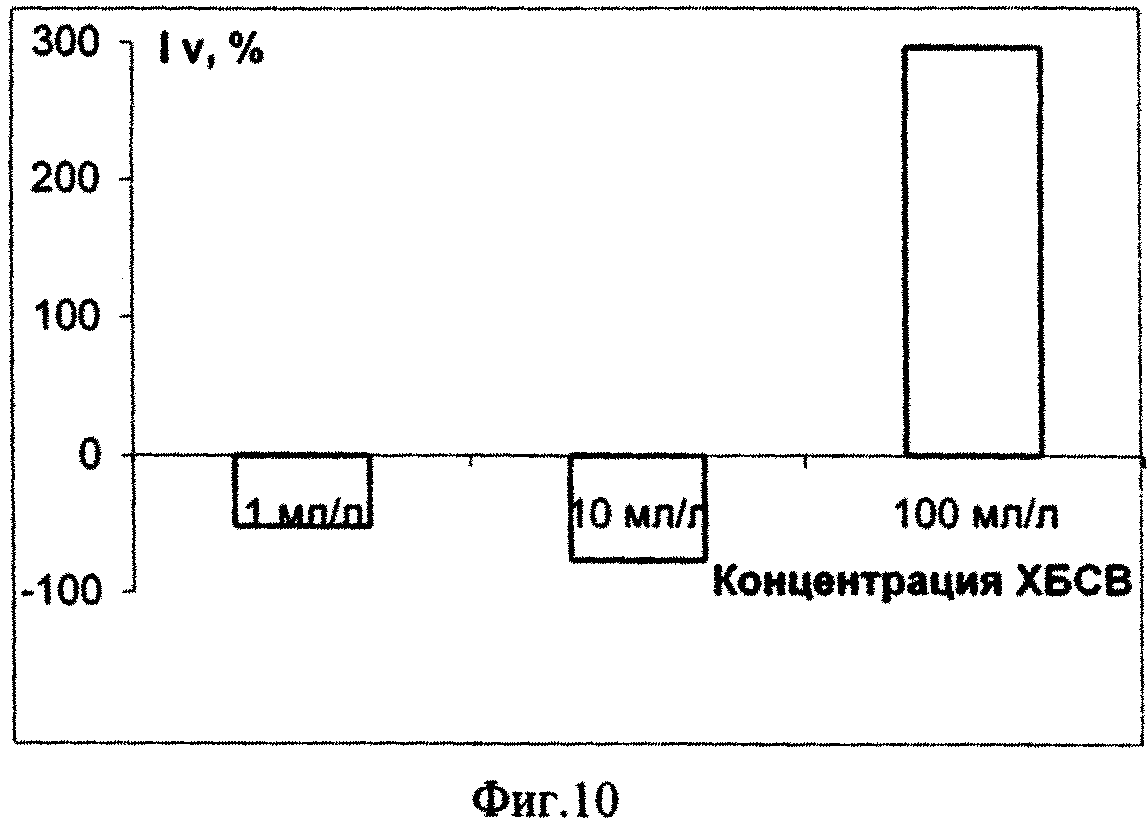
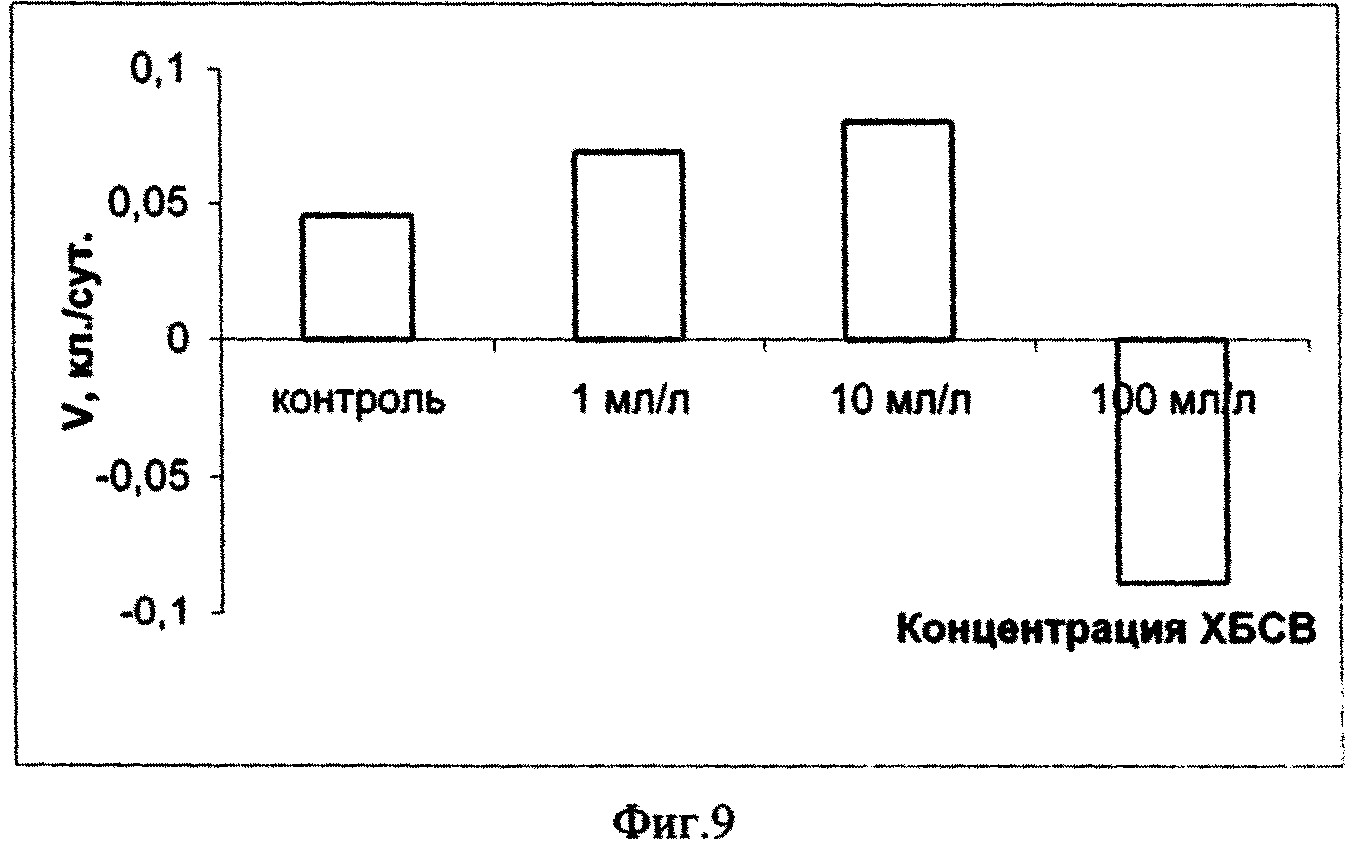
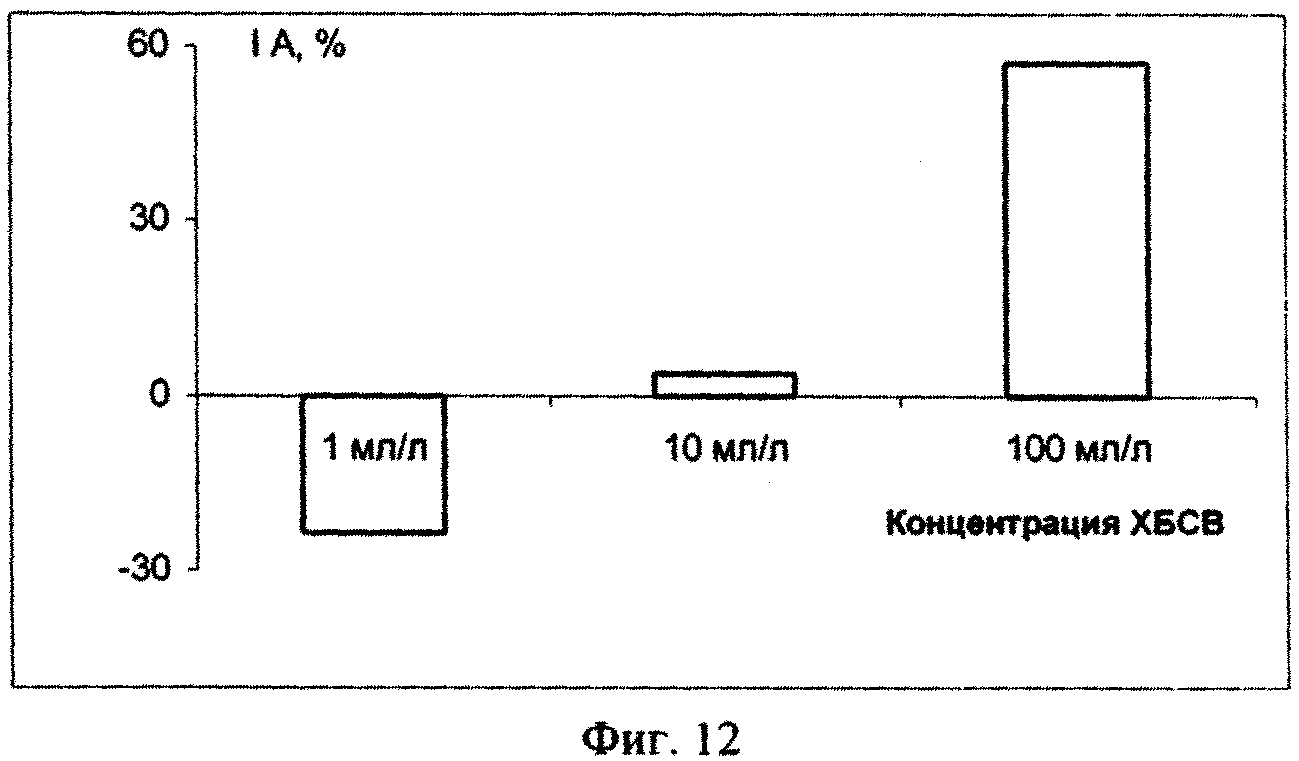
Исходя из полученных данных эксперимента по изучению влияния сточных вод на микроводоросль Dunaliella salina Teod (см. табл. 2) можно сделать вывод о безвредности тестируемых сточных вод в концентрации 1, 10 и 100 мл/л. Процент ингибирования численности клеток D. salina возрастал с увеличением концентрации ХБСВ (фиг. 7). С 6-х суток коэффициент относительного прироста культуры был наибольшим при действии 1 и 10 мл/л сточных вод, в то время как в контроле и, особенно, при влиянии сточных вод в концентрации 100 мл/л этот показатель был ниже. Такие же результаты показал расчет средней скорости роста культуры: при 1 и 10 мл/л скорость роста была максимальной, а при наибольшей концентрации - минимальной (фиг. 9). По сравнению с контролем процент снижения средней скорости роста числа клеток D. salina был наименьшим при воздействии 10 мл/л сточных вод (фиг. 10). Суточный прирост культуры исследованной микроводоросли был тем выше, чем ниже концентрация тестируемых ХБСВ (фиг. 11) и, соответственно, процент снижения прироста культуры был тем ниже, чем выше доза токсиканта (фиг. 12).
Таким образом, ХБСВ в концентрациях 1 и 10 мл/л вызвали в среднем большую стимуляцию роста числа клеток D. salina, чем при 100 мл/л. Стимуляция наблюдалась также в течение всего эксперимента, а максимальное, по сравнению с контролем, увеличение числа клеток пришлось на 3 - 12 сутки. В то же время, изучение действия сточных вод в концентрации 100 мл/л показало, что аналогичный период у культуры происходил с 3-х по 9-е сутки. Во всех вариантах увеличение числа клеток в абсолютных единицах происходило постепенно в ходе всего эксперимента (табл. 2).
Из приведенных примеров следует, что разбавление сточных вод городского коллектора морской водой в соотношениях 1:1000 (1 мл/л), 1:100 (10 мл/л) и 1:10 (100 мл/л) не вызывает необратимых изменений в росте числа клеток морской микроводоросли Platymonas viridis Rouch. и галофильной микроводоросли Dunaliella salina Teod.
Преимущества заявляемого способа по сравнению с известным заключаются в следующем:
- впервые производит оценку опасности сбросов сточных вод различного происхождения для гиперсоленых водоемов
- обеспечивает полной и достоверной оценкой о степени токсичности исследуемой среды, т.к. позволяет оценить различные фазы роста культуры: периоды безразличия и начального нарушения функций клеток, период нормализации или даже стимуляции роста, который вызван либо созданием в среде благоприятных условий, либо адаптационными способностями микроводорослей в ответ на воздействие токсиканта;
- благодаря проведению долгосрочного экспериментаы появляется возможность установления времени наиболее негативного проявления действия нечистот.