Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ 2-ГИДРОКСИЭТИЛ-1Н-ХИНОЛИН-2-ОНА И ИХ АЗАИЗОСТЕРИЧЕСКИЕ АНАЛОГИ С АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
Настоящее изобретение относится к производным 2-гидроксиэтил-1H-хинолин-2-она в качестве антибиотических соединений и их азаизостерическим аналогам, фармацевтической антибактериальной композиции, содержащей их, и применению этих соединений при производстве лекарственного средства для лечения инфекций (например, бактериальных инфекций). Эти соединения пригодны в качестве антимикробных агентов против различных патогенов человека и животных, включая среди прочих грамположительные и грамотрицательные аэробные и анаэробные бактерии и микобактерии.
Интенсивное применение антибиотиков оказывает селективное эволюционное воздействие на микроорганизмы, способствуя продуцированию в них генетически сформированных механизмов резистентности. Современное медицинское и социоэкономическое поведение обостряет проблему развития резистентности, создавая условия постепенного роста патогенных микроорганизмов, например, в искусственных суставах, и в условиях долговременной поддержки резервов хозяина, например, у иммунологически «скомпрометированных» пациентов.
В больничных условиях увеличивающееся число штаммов Staphylococcus aureus, Streptococcus pneumonia, Enterococcus spp. и Pseudomonas aeruginosa, главных источников инфекций, делает их резистентными в отношении множества лекарственных средств и вызывает трудности при лечении, вплоть до невозможности лечения вообще:
- S.aureus является резистентным по отношению к β-лактаму, хинолонам и теперь даже к ванкомицину;
- S.pneumoniae становится резистентным по отношению к пенициллиновым или хинолоновым антибиотикам и даже к новым макролидам;
- Enteroccocci является резистентным по отношению к хинолону и ванкомицину, а β-лактамные антибиотики не оказывают никакого эффективного воздействия на эти штаммы;
- Enterobacteriacea является резистентным по отношению к цефалоспорину и хинолону;
- P.aeruginosa является резистентным по отношению к β-лактаму и хинолону.
Кроме того, скорость распространения мультилекарственно-резистентных грамотрицательных штаммов таких, как Enterobacteriacea и Pseudomonas aeruginosa, равномерно увеличивается, вследствие чего вновь появляющиеся организмы, подобные таким организмам, как Acinetobacter spp.или Clostridium difficile, которые были выделены в процессе терапии с использованием применяемых в настоящее время антибиотиков, становятся реальной проблемой в больничных условиях. Поэтому в медицине существует большая потребность в новых антибактериальных агентах, способных преодолевать мультилекарственную резистентность грамотрицательных бактерий таких, как A.baumannii, ESBL-продуцирующие Е.coli и Klebsiella штаммы и Pseudomonas aeruginosa (Clinical Infectious Diseases (2006), 42, 657-68).
Помимо этого, микроорганизмы, вызывающие устойчивые инфекции, все более признаются в качестве являющихся причиной или сопутствующих факторов некоторых хронических болезней, подобных пептическим язвам или сердечным болезням.
В публикации WO 2006/134378 описаны преимущественно антибактериальные соединения формул (A1) и (A2)
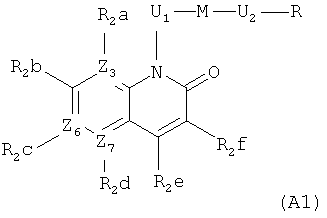
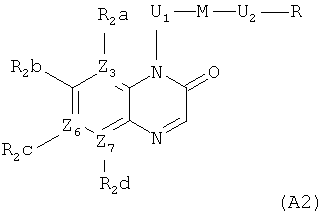
где
Z3, Z6 и Z7 представляют собой C или N при условии, что когда Z3, Z6 или Z7 представляют собой N, тогда R2a, R2c или R2d отсутствуют;
R2a, R2b, R2c и R2d каждый независимо друг от друга представляют собой (преимущественно) H, фтор, хлор или C1-6алкоксигруппу;
U1 представляет собой CRaRb-CRcRd, где Ra, Rb, Rc и Rd каждый независимо друг от друга представляют собой H или C1-6алкил;
M преимущественно представляет собой группу
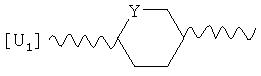 ,
,
где Y преимущественно представляет собой СН2 или O;
U2 преимущественно представляет собой NH-CH2;
R преимущественно представляет собой арил или гетероарил, который может быть необязательно замещенным при атоме углерода; и
любой из U1, M, U2 и R необязательно может быть замещенным при атоме углерода 1-3 заместителями, выбранными из (преимущественно) галогена, гидроксигруппы, оксогруппы или аминогруппы.
Однако WO 2006/134378 не раскрывает, в частности, каких-либо соединений, имеющих гидроксигруппу, присоединенную к U1 радикалу.
WO 2006/137485, WO 2007/138974, WO 2008/009700, WO 2008/071961, WO 2008/071962, WO 2008/071964, WO 2008/071981 и WO 2009/001126 описывают подобные антибактериальные соединения на основе 1H-хинолин-2-она, 1H-хиноксалин-2-она, 1H-[1,8]нафтиридин-2-она, 1H-[1,5]нафтиридин-2-она или 4H-пиридо[2,3-b]пиразин-3-она. Кроме того, соединения этого типа, имеющие гидроксигруппу, присоединенную к средней цепи, также не описаны в этих публикациях.
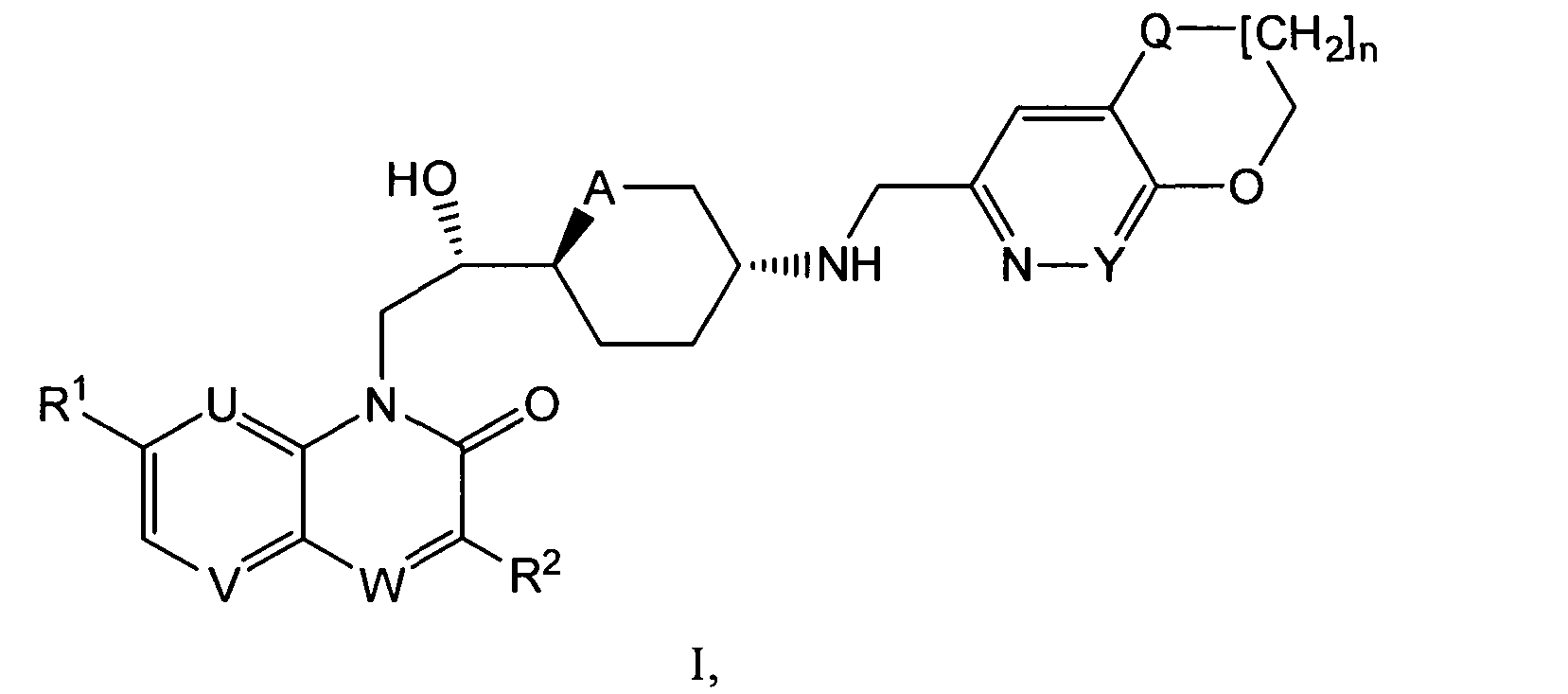
В настоящем изобретении предлагаются антибактериальные соединения на основе 1H-хинолин-2-она, 1H-хиноксалин-2-она, 1H-[1,8]нафтиридин-2-она или 4Я-пиридо[2,3-b]пиразин-3-она. При создании изобретения было установлено, что такие соединения обладают антибактериальными свойствами наряду с пониженным ингибированием hERG К+ канала, что делает менее вероятным пролонгирование ими QT интервала и способность вызывать желудочковую аритмию.
Различные варианты осуществления настоящего изобретения представлены далее:
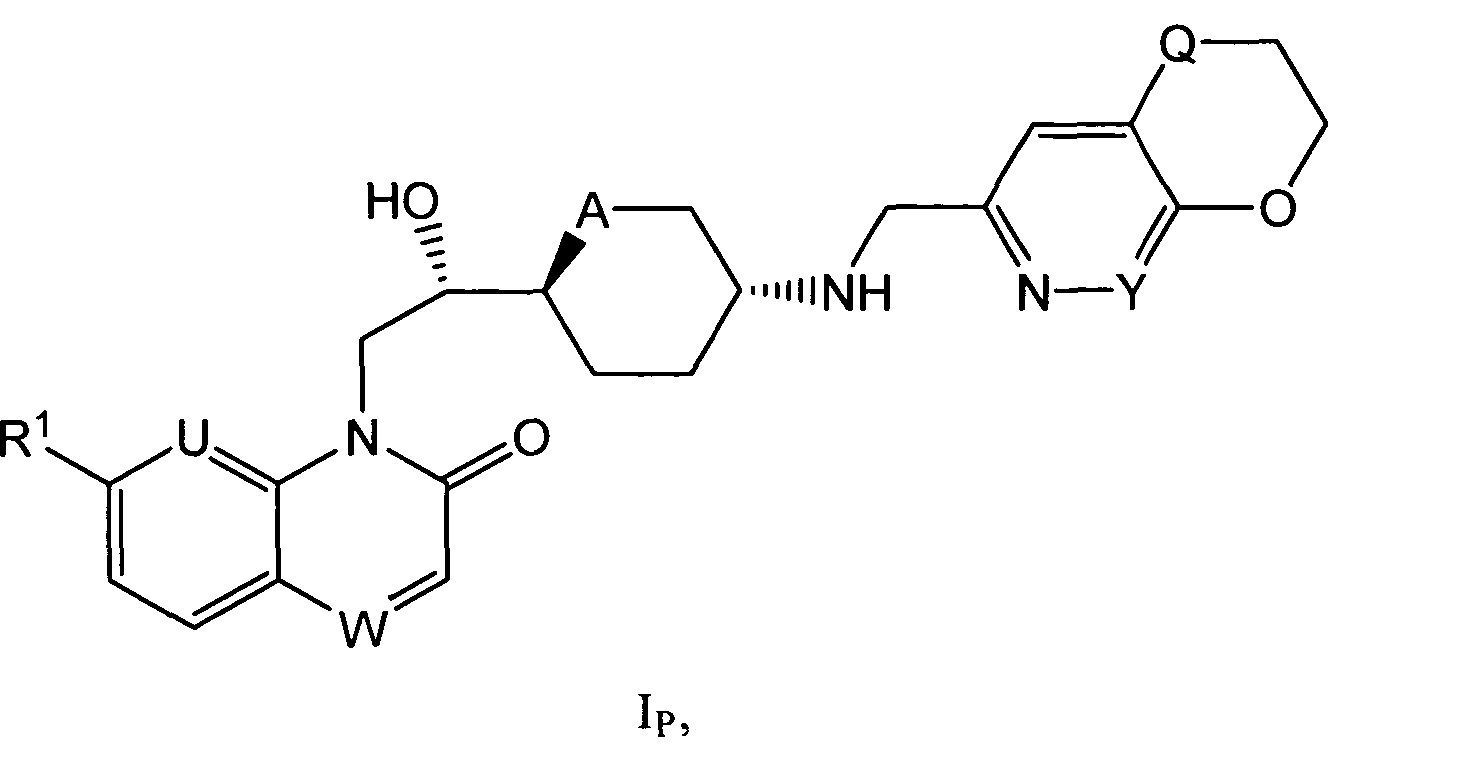
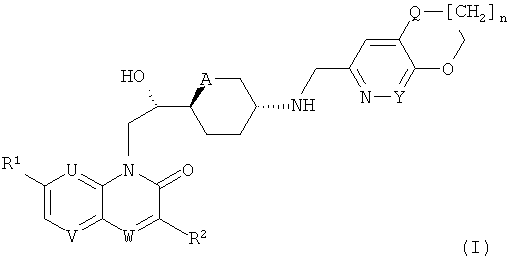
i) Изобретение, прежде всего, относится к соединениям формулы (I)
 ,
,
где
R1 представляет собой алкоксигруппу (преимущественно метоксигруппу); каждый из U и V представляет собой СН и W представляет собой СН или N, или
U представляет собой N, V представляет собой СН и W представляет собой СН или N (преимущественно N), или
каждый из U и V представляет собой N и W представляет собой СН;
R2 представляет собой водород или фтор, когда W представляет собой СН, или R2 представляет собой водород, когда W представляет собой N;
A представляет собой O или CH2;
Y представляет собой СН или N;
Q представляет собой O или S; и
n представляет собой O или 1;
и к солям (в особенности, фармацевтически приемлемым солям) соединений формулы (I).
В следующих параграфах представлены определения различных химических фрагментов для соединений согласно изобретению. Упомянутые определения предназначены для единообразного применения во всем описании и в формуле изобретения, если не указано иначе, и если определения не подлежат более широкому или, наоборот, более узкому толкованию.
Термин "алкил", используемый самостоятельно или в комбинации, относится к линейной или разветвленной алкильной группе, содержащей от одного до четырех атомов углерода. Термин "С1-халкил" (x представляет собой целое число) относится к линейной или разветвленной алкильной группе, содержащей от 1 до х атомов углерода. Например, C1-4алкильная группа содержит от одного до четырех атомов углерода. Типичные примеры алкильных группп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутип. Предпочтительными являются метил и этил. Наиболее предпочтительной является метальная группа.
Термин "алкоксигруппа", используемый самостоятельно или в комбинации, относится к линейной или разветвленной алкильной группе, содержащей от одного до четырех атомов углерода. Термин "Сx-yалкоксигруппа" (при этом x и y каждый является целым числом) относится к алкоксигруппе по определению, данному выше, содержащей от x до y атомов углерода. Например, С1-3алкоксигруппа содержит от одного до трех атомов углерода. Типичные примеры алкоксигрупп включают метоксигруппу, этоксигруппу, н-пропоксигруппу и изопропоксигруппу. Предпочтительными алкоксигруппами являются метоксигруппа и этоксигруппа. Наиболее предпочтительной является метоксигруппа.
Термин «галоген» относится к фтору, хлору, брому или йоду, предпочтительно к фтору или хлору.
Термин "фармацевтически приемлемые соли" относится к нетоксичным, аддитивным солям неорганической или органической кислоты и/или основания. Более подробные сведения могут быть найдены в публикации "Salt selection for basic drugs", Int. J. Pharm., (1986), 33, 201-217.
В этом тексте связь, прерванная волнистой линией, показывает точку присоединения изображенного радикала к остатку молекулы. Например, радикал, изображенный ниже
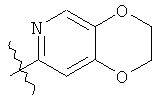 ,
,
представляет собой 2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-ил.
Кроме того, термин "комнатная температура", используемый в данном описании, относится к температуре 25°C.
Когда речь идет не о температурах, термин "приблизительно", расположенный перед численной величиной "X", относится в обычном применении к интервалу, составляющему от X минус 10% X до X плюс 10% X, и предпочтительно, к интервалу, составляющему от X минус 5% X до X плюс 5% X. В особом случае, касающемся температур, термин "приблизительно", расположенный перед температурой "Y" относится в обычном применении к температурному интервалу, составляющему от Y минус 10 C до Y плюс 10°C, и предпочтительно, к интервалу, составляющему от Y минус 5 C до Y плюс 5 C.
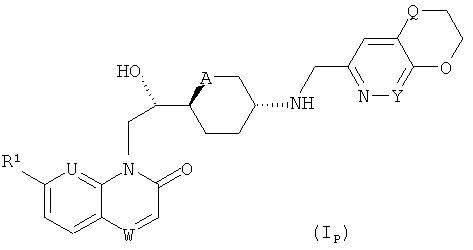
ii) Изобретение преимущественно относится к соединениям формулы (I), которые являются также соединениями формулы (IP).
 ,
,
где
R1 представляет собой алкоксигруппу (преимущественно метоксигруппу); U и W каждый независимо друг от друга представляет собой СН или N;
A представляет собой O или СН2;
Y представляет собой СН или N; и
Q представляет собой O или S;
и к солям (в особенности, фармацевтически приемлемым солям) соединений формулы (IP).
iii) Согласно одному главному варианту осуществления настоящего изобретения соединения формулы (I) согласно варианту i) или ii) должны быть такими, где Y представляет собой СН.
iv) Согласно другому главному варианту осуществления настоящего изобретения соединения формулы (I) согласно варианту i) или ii) должны быть такими, где Y представляет собой N.
v) Следующий вариант осуществления настоящего изобретения относится к соединениям формулы (I) согласно одному из вариантов i)-iv), где Q представляет собой O.
vi) Один подвариант варианта v) относится к соединениям формулы (I) согласно варианту i), где
Q представляет собой O;
R1 представляет собой метоксигруппу;
U представляет собой N и, или V представляет собой СН и W представляет собой N, или V представляет собой N и W представляет собой СН;
R2 представляет собой водород;
A представляет собой О или СН2 (предпочтительно, O);
Y представляет собой СН; и
n представляет собой 1.
vii) Следующий вариант осуществления настоящего изобретения относится к соединениям формулы (I) согласно одному из вариантов i)-iv), где Q представляет собой S.
viii) Один подвариант варианта vii) относится к соединениям формулы (I) согласно варианту i), где
Q представляет собой S;
R1 представляет собой метоксигруппу;
U представляет собой N и, или V представляет собой СН и W представляет собой N, или V представляет собой N и W представляет собой СН;
R2 представляет собой водород;
A представляет собой О или СН2 (предпочтительно, O);
Y представляет собой СН; и
n представляет собой 1.
ix) Изобретение относится, в особенности, к соединениям формулы (I) согласно одному из вариантов i)-viii), представленных выше, где V, если присутствует, представляет собой СН и U представляет собой N и W представляет собой СН, или U представляет собой СН и W представляет собой N, или также каждый из U и W представляет собой N.
x) Один подвариант варианта ix) относится к соединения формулы (I) согласно варианту vi), где U представляет собой N и W представляет собой СН.
xi) Другой подвариант варианта ix) относится к соединениям формулы (I) согласно варианту vi), где U представляет собой СН и W представляет собой N.
xii) Еще один подвариант варианта ix) относится к соединениям формулы (I) согласно варианту vi), где каждый из U и W представляет собой N.
xiii) Изобретение также относится к соединениям формулы (I) согласно варианту i) или варианту i) в комбинации с одним из вариантов iii)-viii),
представленных выше, где V представляет собой N, U представляет собой N и W представляет собой СН.
xiv) Согласно одному главному варианту осуществления настоящего изобретения соединения формулы (I) по одному из вариантов i)-xiii), представленных выше, должны быть такими, где A представляет собой O.
xv) Один подвариант варианта xiv) относится к соединениям формулы (I) согласно варианту i), где
А представляет собой О;
R1 представляет собой метоксигруппу;
U представляет собой N и, или V представляет собой СН и W представляет собой N, или V представляет собой N и W представляет собой СН;
R2 представляет собой водород;
Y представляет собой СН;
Q представляет собой О или S; и
n представляет собой 1.
xvi) Согласно другому главному варианту осуществления настоящего изобретения соединения формулы (I) по одному из вариантов i)-xiii), представленных выше, должны быть такими, где А представляет собой СН2.
xvii) Один подвариант варианта xvi) относится к соединениям формулы (I) согласно варианту i), где
А представляет собой СН2;
R1 представляет собой метоксигруппу;
U представляет собой N и, или V представляет собой СН и W представляет собой N, или V представляет собой N и W представляет собой СН;
R2 представляет собой водород;
Y представляет собой СН;
Q представляет собой O или S; и
n представляет собой 1.
xviii) Особый вариант осуществления настоящего изобретения относится к соединениям формулы (I) согласно одному из вариантов i)-xvii), представленных выше, где R1 представляет собой C1-3залкоксигруппу (в особенности, метоксигруппу).
xix) Другой особый вариант осуществления настоящего изобретения относится к соединения формулы (I) согласно варианту i), где
R1 представляет собой метоксигруппу;
U представляет собой N и, или V представляет собой СН и W представляет собой N, или V представляет собой N и W представляет собой СН;
R2 представляет собой водород;
А представляет собой О или CH2 (предпочтительно, O);
Y представляет собой СН;
Q представляет собой О или S; и
n представляет собой 1.
xx) Еще один особый вариант осуществления настоящего изобретения относится к соединениям формулы (I) согласно варианту i) или варианту i) совместно с одним из вариантов iii)-xix), представленных выше, где W представляет собой СН или N, и R2 представляет собой водород.
xxi) Еще один особый вариант осуществления настоящего изобретения относится к соединениям формулы (I) согласно варианту i) или варианту i) в комбинации с одним из вариантов iii)-v), vii), ix), х), xiii), xiv), xvi) и xviii), представленных выше, где W представляет собой СН и R2 представляет собой фтор.
xxii) Согласно другому варианту осуществления настоящего изобретения соединения формулы (I) по одному из вариантов i)-xxi), представленных выше, должны быть такими, где n представляет собой 0.
xxiii) Согласно еще одному другому варианту осуществления настоящего изобретения соединения формулы (I) по одному из вариантов i)-xxi), представленных выше, должны быть такими, где n представляет собой 1.
xxiv) Другой вариант осуществления настоящего изобретения относится к соединениям формулы (I) по одному из вариантов i)-xxiii) а также к меченным изотопами, в частности меченным 2H (дейтерием) соединениям формулы (I) согласно одному из варианты i)-xxiii), которые идентичны соединениям формулы (I) согласно одному из вариантов i)-xxiii), за исключением того, что один или более атомов имеет или каждый замещен атомом, имеющим тот же самый атомный номер, но атомную массу, отличную от атомной массы, обычно встрещающейся в природе. Меченные изотопом, особенно меченные 2H (дейтерием) соединения формулы (I) и их соли (в особенности, фармацевтически приемлемые соли), включены таким образом в объем настоящего изобретения.
Замещение водорода более тяжелым изотопом 2H (дейтерием) может привести к более высокой метаболической стабильности, приводящей, например, к увеличению в условиях in vivo полураспада или уменьшению требуемого дозирования, или может способствовать понижению ингибирования цитохром Р450 ферментов, приводящему, например, к улучшенному профилю безопасности. В другом варианте изобретения соединения формулы (I) не являются меченными изотопами или меченными только одним или более атомами дейтерия. Меченные изотопами соединения формулы (I) могут быть получены методами, аналогичными методам, описанным далее, но с использованием подходящих изотопных вариантов соответствующих реагентов или исходных материалов.
xxv) Особенно предпочтительными являются следующие соединения формулы (I) согласно варианту i) или ii):
1-((S)-2-{(2S,5R)-5-[(2,3-дигидро-4-окса-1-тиа-6-азанафталин-7-илметил)амино]тетрагидропиран-2-ил} -2-гидроксиэтил)-7-метокси-1H-[1,8]нафтиридин-2-он;
1-((2S)-2-{(2S,5R)-5-[(2,3-дигидро[1,4]диоксино[2,3-c]пиридин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-7-метокси-1H-[1,8]нафтиридин-2-он;
1-((2S)-2-{(2S,5R)-5-[(2,3-дигидро[1,4]диоксино[2,3-c]пиридин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-7-метокси-1H-хиноксалин-2-он;
4-((2S)-2-{(2S,5R)-5-[(2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-6-метокси-4H-пиридо[2,3-b]пиразин-3-он;
1-((2S)-2-{(2S)5R)-5-[(6,7-дигидро[1,4]диоксино[2,3-c]пиридазин-3-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-7-метокси-1H-[1,8]нафтиридин-2-он;
1-((2R)-2-{4-[(2,3-дигидро[1,4]диоксино[2,3-c]пиридин-7-илметил)амино]циклогексил}-2-гидроксиэтил)-7-метокси-1H-[1,8]нафтиридин-2-он;
1-((2R)-2-{4-[(2,3-дигидро[1,4]диоксино[2,3-c]пиридин-7-илметил)амино]циклогексил}-2-гидроксиэтил)-7-метокси-1H-хиноксалин-2-он;
1-((2S)-2-{(2S,5R)-5-[(6,7-дигидро-8-окса-5-тиа-1,2-диазанафталин-3-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-7-метокси-1H-[1,8]нафтиридин-2-он;
а также их соли (в особенности, фармацевтически приемлемые соли).
xxvi) Следующие соединения формулы (I) согласно варианту i) также являются особенно предпочтительными:
1-((2S)-2-гидрокси-2-{(2S,5R)-5-[(3-окса-1-тиа-5-азаиндан-6-илметил)амино]тетрагидропиран-2-ил}этил)-7-метокси-1H-[1,8]нафтиридин-2-он;
3-фтор-1-((2S)-2-гидрокси-2-{(2S,5R)-5-[(3-окса-1-тиа-5-азаиндан-6-илметил)амино]тетрагидропиран-2-ил}этил)-7-метокси-1H-[1,8]нафтиридин-2-он;
4-((2S)-2-{(2S,5R)-5-[(2,3-дигидро-4-окса-1-тиа-6-азанафталин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-6-метокси-4H-пиридо[2,3-b]пиразин-3-он;
4-((2S)-2-{(2S,5R)-5-[(6,7-дигидро-8-окса-5-тиа-1,2-диазанафталин-3-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-6-метокси-4H-пиридо[2,3-b]пиразин-3-он;
5-((2S)-2-{(2S,5R)-5-[(2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-3-метокси-5H-пиридо[2,3-b]пиразин-6-он;
5-((2S)-2-{(2S,5R)-5-[(2,3-дигидро-4-окса-1-тиа-6-азанафталин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-3-метокси-5Я-пиридо[2,3-b]пиразин-6-он;
5-((S)-2-{(2S,5R)-5-[(6,7-дигидро-8-окса-5-тиа-1,2-диазанафталин-3-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-3-метокси-5H-пиридо[2,3-b]пиразин-6-он;
а также их соли (в особенности, фармацевтически приемлемые соли).
xxvii) Изобретение далее относится к соединениям формулы (I) согласно варианту i), которые выбраны из группы, включающей соединения, указанные в варианте xxv), и соединения, указанные в варианте xxvi). В особенности это относится также к группам соединений формулы (I), выбранных из группы, включающей соединения, указанные в варианте xxv), и соединения, указанные в варианте xxvi), кроме того, к группам соединений, соответствующих одному из вариантов iii)-xxiii), а также к солям (в особенности фармацевтически приемлемым солям) таких соединений. Изобретение, кроме того, относится к любому отдельному соединению формулы (I), выбранному из группы, включающей соединения, указанные в варианте xxv), и соединения, указанные в варианте xxvi), и к солям (в особенности фармацевтически приемлемым солям) таких отдельных соединений.
Соединения формулы (I) согласно изобретению, то есть согласно одному из вариантов i)-xxvii), представленных выше, являются подходящими для применения в качестве химиотерапевтических активных соединений в медицине и ветеринарии и в качестве веществ для сохранения неорганических и органических материалов, в частности, всех типов органических материалов, например, полимеров, смазок, лакокрасочных материалов, волокон, кожи, бумаги и шерсти.
Соединения согласно настоящему изобретению особенно активны против "бактерий и бактериально-подобных организмов и поэтому являются особенно подходящими для человека, а также животных при профилактике и химиотерапии локальных и системных инфекций, вызываемых этими патогенными организмами, а также заболеваний, связанных с бактериальными инфекциями, включая пневмонию, воспаление среднего уха, синусит, бронхит, тонзиллит и мастоидит, связанные с инфекцией, вызываемой Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis, Staphylococcus aureus, Enterococcus faecalis, E.faecium, E.casseliflavus, S.epidermidis, S. haemolyticus или Peptostreptococcus spp.; фарингит, ревматическую лихорадку и гломерулонефрит, связанные с инфекцией, вызываемой Streptococcus pyogenes, группами С и G streptococci, Corynebacterium diphtheriae или Actinobacillus haemolyticum; инфекции верхних дыхательных путей, связанные с инфекцией, вызываемой Mycoplasma pneumoniae, Legionella pneumophila, Streptococcus pneumoniae, Haemophilus influenzae или Chlamydia pneumoniae; инфекции крови и тканей, включая эндокардит и остеомиелит, вызываемые S.aureus, S.haemolyticus, Е.faecalis, Е.faecium, Е.durans, включая наследственную резистентность к известным антибактериальным средствам, таким как, не лимитируя, β-лактамы, ванкомицин, аминогликозиды, хинолоны, хлорамфеникол, тетрациклины и макролиды; неосложненные инфекции кожи и мягких тканей, абсцессы и послеродовой сепсис, связанные с инфекцией, вызываемой Staphylococcus aureus, некоагулируемыми staphylococci (то-есть, S.epidermidis, S.haemolyticus и тому подобными), Streptococcus pyogenes, Streptococcus agalactiae, Streptococcal групп C-F (мельчайшая колония streptococci), viridans streptococci, Corynebacterium minutissimum, Clostridium spp. или Bartonella henselae; неосложненные острые инфекции мочевого тракта, связанные с инфекцией, вызываемой Staphylococcus aureus, некоагулируемыми видами стафилоккоков или Enterococcus spp.; уретрит и цервицит; болезни, передаваемые половым путем, связанные с инфекцией, вызываемой Chlamydia trachomatis, Haemophilus ducreyi, Treponema pallidum, Ureaplasma urealyticum или Neiserria gonorrhoeae; токсикозы, связанные с инфекцией, вызываемой S.aureus (пищевое отравление и токсический шок), или группами A, B и C streptococci; язвы, связанные с инфекцией, вызываемой Helicobacter pylori; системный лихорадочный синдром, связанный с инфекцией, вызываемой Borrelia recurrentis; болезнь Лайма, связанную с инфекцией, вызываемой Borrelia burgdorferi; конъюктивит, кератит и дакриоцистит, связанные с инфекцией, вызываемой Chlamydia trachomatis, Neisseria gonorrhoeae, S.aureus, S.pneumoniae, S.pyogenes, H.Influenzae или Listeria spp.; диссеминированный Mycobacterium avium комплекс (MAC), связанный с инфекцией, вызываемой Mycobacterium avium или Mycobacterium intracellulare; инфекции, вызываемые Mycobacterium tuberculosis, M.leprae, M.paratuberculosis, M.Kansasii или M.chelonei; гастроэнтерит, связанный с инфекцией, вызываемой Campylobacter jejuni; кишечные протозойные инфекции, связанные с инфекцией, вызываемой Cryptosporidium spp.; стоматологическую инфекцию, связанную с инфекцией, вызываемой viridans streptococci; стойкий кашель, связанный с инфекцией, вызываемой Bordetella pertussis; газовую гангрену, связанную с инфекцией, вызываемой Clostridium perfringens или Bacteroides spp.; и атеросклероз или сердечно-сосудистое заболевание, связанное с инфекцией, вызываемой Helicobacter pylori или Chlamydia pneumoniae.
Соединения формулы (I) согласно настоящему изобретению применяются, кроме того, для получения лекарственного средства для лечения инфекций, вызываемых такими бактериями, как Е.coli, Klebsiella pneumoniae и другими энтеробактериями, Acinetobacter spp., Stenothrophomonas maltophilia, Neisseria meningitidis, Bacillus cereus, Bacillus anthracis, Corynebacterium spp., Propionibacterium acnes и бактероидами spp.
Соединения формулы (I) согласно настоящему изобретению применяются, кроме того, для лечения протозойных инфекций, вызываемых Plasmodium malaria, Plasmodium falciparum, Toxoplasma gondii, Pneumocystis carinii, Trypanosoma brucei и Leishmania spp.
Представленный перечень патогенных микроорганизмов должен рассматриваться только в качестве примерного и никоим образом в качестве лимитирующего перечня.
Соединения формулы (I) по настоящему изобретению или их фармацевтически приемлемые соли могут быть применены для получения лекарственного средства для профилактики или лечения бактериальной инфекции.
Один аспект настоящего изобретения относится к применению соединения формулы (I) согласно одному из варианты i)-xxvii), или его фармацевтически приемлемой соли, для изготовления лекарственного средства для профилактики или лечения бактериальной инфекции. Другой аспект настоящего изобретения относится к соединению формулы (I) согласно одному из вариантов i)-xxvii), или его фармацевтически приемлемой соли для профилактики или лечения бактериальной инфекции.
Таким образом, соединения формулы (I) согласно одному из вариантов i)-xxvii), или их фармацевтически приемлемые соли, могут быть использованы для получение лекарственного средства, и являются пригодными для профилактики или лечения бактериальной инфекции, выбранной из группы, включающей инфекции дыхательных путей, отит, менингит, инфекции кожи и мягких тканей (осложненные или неосложненные), пневмонию (включая приобретенную госпитальную пневмонию), бактеремию, эндокардит, интраабдомиальные инфекции, желудочно-кишечные инфекции, Clostridium difficile инфекции, инфекции мочевых путей, инфекции, передаваемые половым путем, инфекции, вызываемые инородными телами, остеомиелит, болезнь Лайма, топические инфекции, офтальмологические инфекции, туберкулез и тропические заболевания (например, малярия), и, преимущественно, для профилактики или лечения бактериальной инфекции, выбранной из группы, включающей инфекции дыхательных путей, отит, менингит, инфекции кожи и мягких тканей (осложненные или неосложненные), пневмонию (включая приобретенную госпитальную пневмонию) и бактеремию.
Так же, как в медицине, бактериальные инфекции подлежат лечению с применением соединений формулы (I) (или их фармацевтически приемлемых солей) у других видов животных как, например, свиней, жвачных, лошадей, собак, кошек и домашней птицы.
Настоящее изобретение относится также к фармакологически приемлемым солям и к композициям и рецептурам на основе соединений формулы (I).
Любая ссылка на соединение формулы (I) подразумевает ссылку на соли (в частности, фармацевтически приемлемые соли) таких соединений, как уместную и целесообразную.
Фармацевтическая композиция согласно настоящему изобретению содержит, по крайней мере, одно соединение формулы (I) (или его фармацевтически приемлемую соль) в качестве активного агента и необязательно носители и/или разбавители и/или добавки, и может также дополнительно содержать известные антибиотики.
Соединения формулы (I) и их фармацевтически приемлемые соли могут быть использованы в качестве лекарственных средств, например, в форме фармацевтических композиций для энтерального и парентерального введения.
Изготовление фармацевтических композициий осуществляется методом, известным любому специалисту в области техники (см., например, Remington, The Science и Practice of Pharmacy, 21st Edition (2005), Part 5, "Pharmaceutical Manufacturing" [published by Lippincott Williams & Wilkins]) путем введения описанных соединений формулы (I) или их фармацевтически приемлемых солей, необязательно в комбинации с другими фармацевтически приемлемыми веществами, в лекарственную форму вместе с подходящими, нетоксичными, инертными, терапевтически совместимыми твердыми или жидкими носителями и, если необходимо, обычными фармацевтическими наполнителями.
Другой аспект по изобретению относится к способу лечения бактериальной инфекции у пациента, заключающему во введении названному пациенту фармацевтически активного количества соединения формулы (I) или его фармацевтически приемлемой соли.
Более того, соединения формулы (I) могут применяться для дезинфекции, например, для обработки хирургических инструментов с целью удаления патогенных микробов и бактерий или для асептической очистки помещения или поверхностей. Для этих целей соединения формулы (I) могут применяться в виде раствора или спрея.
Соединения формулы (I) в соответствии с настоящим изобретением могут быть получены с помощью методов, описанных ниже.
Получение соединений формулы (I)
Аббревиатуры:
В описании и примерах используются следующие аббревиатуры:
Ac - ацетил, АсОН - уксусная кислота, AD-смесь α-1,4-бмс(дигидрохинолин)фталазин, K3Fe(CN)6, К2СО3 и K2OsO4 2Н2О, AD-смесь β-1,4-бис(дигидрохинолин)фталазин, K3Fe(CN)6, К2СО3 и K2OsO4 2Н2О, Аллок - аллилоксикарбонил, Бок - трет-бутоксикарбонил, Bs - 4-бромбензолсульфонил (брозилат), Кбз - бензилоксикарбонил, КХ - колоночная хроматография на силикагеле, DAD - детектирование с помощью диодной матрицы, ДБУ - 1,8-диазабициклобицикло[5.4.0]ундецен-7-ен, ДХЭ - 1,2-дихлорэтан, ДХМ - дихлорметан, (DHQ)2PHAL - 1,4-бис(дигидрохинин)фталазин, (DHQD)2-Pyr-1,4-бис(дигидрохинидин)пиридин, ДИПЭА - N,N-диизопропилэтиламин, ДИБАГ - диизобутилалюминийгидрид, ДМАП - 4-диметиламинопиридин, ДМФ - N,N-диметилформамид, ДМСО - диметилсульфоксид, ЭА - этилацетат, ELSD - испарительное светорассеивающее детектирование, ЭСИ - ионизация электрораспылением, экв. - эквивалент, эфир - диэтиловый эфир, Et - этил, EtOH - этанол, Фмок - 9-флоренилметоксикарбонил, ВЭЖХ -высокоэффективная жидкостная хроматография, ЖХ - жидкостная хроматография, МХПБК - м-хлорпербензойная кислота, Me - метил, МеОН - метанол, мин - минута, МС - масс-спектроскопия, Ms - метансульфонил (мезил), NCS - N-хлорсукцинимид, Nf - нонафторбутансульфонил, Ns - 4-нитробензолсульфонил(нозилат), Pd/C - палладий на угле, Pd(OH)2/C - дигидроксид палладия на угле, РТТ - трибромид фенилтриметиламмония, Pyr - пиридин, рац. - рацемический, КТ - комнатная температура, tBu - трет-бутил, ТБМЭ - трет-бутилметиловый эфир, ТЭА - триэтиламин, Tf - трифторметансульфонил (трифлил), ТФК - трифторуксусная кислота, ТГФ - тетрагидрофуран, ТСХ - тонкослойная хроматография, ТМССl - триметилсилилхлорид, Ts - п-толуолсульфонил, wt% - вес.%.
Общие синтетические методы
Общий синтетический метод 1 (восстановление кетонов или альдегидов в спирты):
Альдегиды или кетоны могут быть восстановлены в соответствующие спирты с использованием различных восстановительных агентов, как описано в публикациях: Larock, R.C. in Comprehensive Organic Transformations A guide to Functional Group Preparations, 2ndEd., Wiley, New York, Chichester, Weinheim, Brisbane, Singapore, Toronto (1999), Section Alcohols and phenols; p.1075 to 1110. Наряду с другими, LiAlH4 и NaBH4 являются наиболее предпочтительными.
Общий синтетический метод 2 (восстановительное аминирование):
Реакцию между амином и альдегидом или кетоном проводят в растворителях, позволяющих удалять образующуюся воду посредством физических или химических методов (например, путем дистилляции азеотропной смеси растворитель-вода или с помощью осушающих агентов таких, как молекулярные сита, MgSO4 или Na2SO4). Обычно в качестве таких растворителей используют толуол, гексан, ТГФ, ДХМ или ДХЭ, или смесь растворителей такую, как ДХЭ/МеОН. Реакцию можно катализировать следами кислоты (обычно, АсОН). Промежуточный имин восстанавливают соответствующим восстановительным агентом (например, NaBH4, NaBHCN3 или NaBH(OAc)3), или путем гидрирования над катализатором из благородного металла, таким как Pd/C. Реакцию проводят в интервале температур от -10°C до 110°C, предпочтительно от 0°C до 60°C. Реакция может быть проведена в одном сосуде, а также в протонных растворителях типа МеОН или воды в присутствии пиколин-боранового комплекса (Tetrahedron (2004), 60, 7899-7906).
Общий синтетический метод 3 (активация спирта):
Спирт вводят в реакцию с MsCl, TfCl, NfCl, NsCl, BsCl или TsCl в присутствии органического основания, такого как триэтиламин, ДИПЭА или пиридин, в сухом апротонном растворителе, таком как ДХМ, ТГФ или пиридин, в температурном интервале от -10°C до комнатной температуры. Альтернативно, спирт может быть также восстановлен путем реакции с Ms2O или Tf2O. Активированное промежуточное соединение переводят далее в йод- или бромпроизводное реакцией активированного спирта с Nal или NaBr в растворителе таком, как ацетон.
Общий синтетический метод 4 (удаление аминозащитных групп):
Бензилкарбаматную группу удаляют посредством гидрирования над катализатором из благородного металла (например, Pd/C или Pd(OH)2/C). Бок-группу удаляют в кислых условиях, таких как HCl, в органическом растворителе, таком как метанол или диоксан, или ТФК (концентрированная или разбавленная), в растворителе, таком как ДХМ. Кроме того, общие методы удаления аминозащитных групп описаны в публикации: T.W.Greene, P.G.M.Wuts, Protecting Groups in Organic Synthesis, 3rd Ed (1999), 494-653 (Publisher: John Wiley and Sons, Inc., New York, N.Y.).
Общий синтетический метод 5 (защита аминогруппы):
Амины обычно защищают, переводя их в карбаматы с помощью таких групп, как Аллок, Кбз или Бок. При этом используют реакцию амина с аллилхлорформиатом или бензилхлорформиатом или ди-трет-бутилдикарбонатом в присутствии основания, такого как NaOH, ТЭА, ДМАП или имидазол. Они могут быть также защищены превращением в N-бензильные производные, полученные посредством реакции с бензилбромидом или бензилхлоридом в присутствии основания, такого как Na2CO3 или ТЭА. Альтернативно, N-бензильные производные могут быть получены посредством восстановительного аминирования в присутствии бензальдегида и боргидридного реагента, такого как NaBH4, NaB3CN или NaBH(OAc)3 в растворителе, таком как МеОН, ДХЭ или ТГФ. Кроме того, методы введения других аминозащитных групп описаны в публикации: T.W.Greene, P.G.M.Wuts, Protecting Groups in Organic Synthesis, 3rd Ed (1999), 494-653 (Publisher: John Wiley and Sons, Inc., New York, N.Y.).
Общий синтетический метод 6 (получение альдегидов и кетонов):
Спирты могут быть превращены в соответствующие кетоны или альдегиды путем окисления по Шверну (см.: D.Swern et al., J. Org. Chem. (1978), 43, 2480-2482) или Дессу-Мартину (см.: D.B. Dess and J.C.Martin, J. Org. Chem. (1983), 48, 4155) в соответствующих условиях. Альтернативно, альдегиды могут быть получены из соответствующих сложных эфиров посредством контролируемого восстановления с помощью гидридного реагента, такого как ДИБАГ.
Общий синтетический метод 7 (асимметрическое дигидроксилирование):
Хиральные диолы получают, используя AD-смесь α или AD-смесь β в смесях вода/2-метил-2-пропанол, по методу, описанному в публикации: Chem. Rev. (1994), 94, 2483. Ориентация индуцирования зависит от хирального лиганда, содержащегося в AD смеси: либо лиганда, основанного на дигидрохинине, в AD-смеси α, либо лиганда, основанного на дигидрохинидине, в AD-смеси β.
Общий синтетический метод 8 (асимметрическое восстановление):
Хиральные спирты могут быть получены из соответствующих прохиральных кетонов с использованием хирального восстанавливающего агента. Обычно при этом используются борсодержащие реагенты, такие как (R)-или (S)-тетрагидро-1-метил-3,3-дифенил-1H,3H-пирроло[1,2-с][1,3,2]оксаборол, в присутствии комплекса боргидридтетрагидрофуран (см. J. Am. Chem. Soc. (1987), 109, 5551) или В-хлордиизопинокамфеилборана (см. J. Org. Chem. (1989), 54, 1577). Альтернативно, могут быть использованы хиральные реагенты на основе алюминия. В таких реагентах комбинируют соль алюминия с хиральным промотером, такимкак (R)- или (S)-2,2′′-дигидрокси-1,1′-бинафтил (см. J. Am. Chem. Soc. (1984), 106, 6709). Каталитическое асимметрическое гидрирование прохиральных кетонов также является методом, который широко используется для получения хиральных спиртов. Для этих целей используются, например, хиральные рутениевые катализаторы (см. Acc. Chem. Res. (1997), 30, 97).
Общие экспериментальные методы:
Получение соединений формулы (I):
Соединения формулы (I) могут быть получены с помощью методов, приведенных ниже, методов, приведенных в примерах, или аналогичными методами. Оптимальные реакционные условия могут варьироваться в зависимости от особенностей используемых реагентов или растворителей, но такие условия могут быть подобраны специалистом в области техники путем оптимизации методик.
В разделах a) и b), представленных ниже, описаны общие методы получения соединений формулы (I). Если не указано иначе, общие группы R1, U, W, A, Y и Q имеют значения, приведенные для формулы (I). Общие синтетические методы, неоднократно используемые в приведенном ниже тексте, описаны выше в разделе, озаглавленном "Общие синтетические методы". Другие используемые аббревиатуры имеют значения, приведенные в эксперимертальной части. В некоторых примерах общие группы U, W, А и Y могут не совпадать с изображенными в примерах и на схемах, приведенных ниже, так как требуют применения защитных групп. Применение защитных групп хорошо известно из области техники (см., например, "Protective Groups in Organic Synthesis", T.W.Greene, P.G.M.Wuts, Wiley-Interscience, 1999).
a) Соединения формулы (I) могут быть получены реакцией соединений формулы (II)
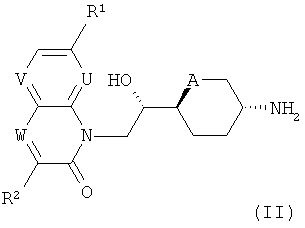
с соединениями формулы (III)
 ,
,
где G представляет собой группу
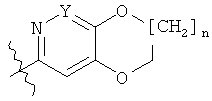
с использованием общего синтетического метода 2.
б) Соединения формулы (I) могут быть получены реакцией соединения формулы (IV)
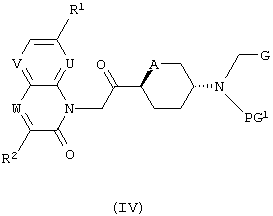


,
где PG1 представляет собой аминозащитную группу, такую как Кбз, Фмок или Бок, и G представляет собой группу
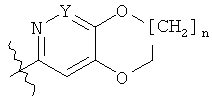
с использованием метода, описанного в общем синтетическом методе 8, с последующим удалением аминозащитной группы согласно общему синтетическому методу 4. В тех случаях, где A обозначает O, может быть использован общий синтетический метод 1.
Полученные таким образом соединения формулы (I) при необходимости могут быть превращены в их соли и преимущественно в их фармацевтически приемлемые соли.
Кроме того, всякий раз, когда соединения формулы (I) получают в виде смесей энантиомеров, энантиомеры могут быть разделены с помощью методов, известных любому специалисту в области техники, например, путем получения и разделения диастереомерных солей или с помощью ВЭЖХ на хиральной стационарной фазе такой, как Regis Whelk-01(R,R) (10 мкм) колонка, Daicel ChiralCel OD-H (5-10 мкм) колонка, или Daicel ChiralPak IA (10 мкм) колонка или AD-H (5 мкм) колонка. Типичные условия проведения хиральной ВЭЖХ включают применение изократной смеси элюента A (EtOH, в присутствии или отсутствии амина, такого как триэтиламин, диэтиламин) и элюента B (гексан), при скорости истечения от 0,8 до 150 мл/мин. Соединения формулы (I), полученные в виде смесей диастереомеров, могут быть разделены путем комбинации хроматографии на силикагеле, ВЭЖХ и методов кристаллизации. Получение синтетических промежуточных соединений: Соединения формулы (II) могут быть получены согласно описанию, представленному ниже на схеме 1.
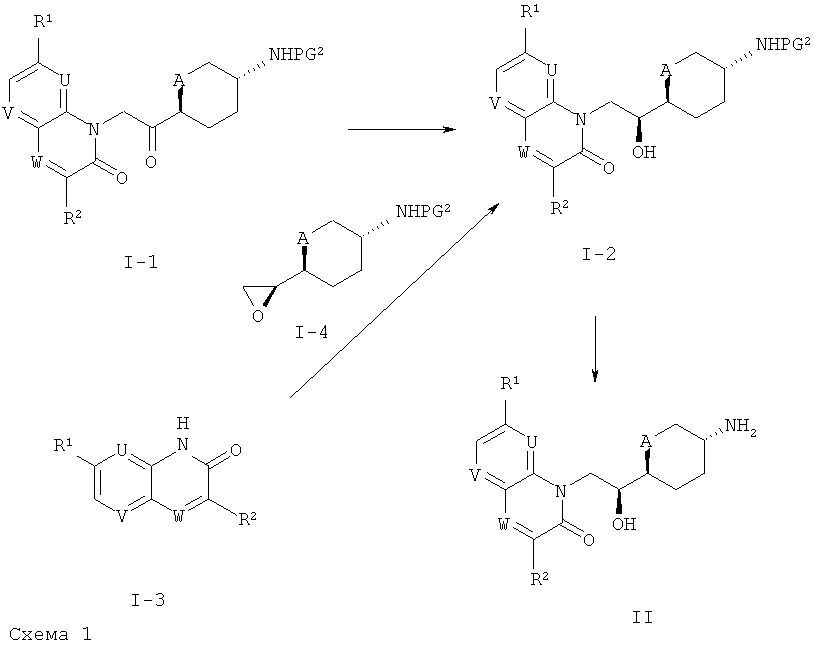
На схеме 1, PG2 представляет собой аминозащитную группу, такую как Кбз, Фмок или Бок.
В случаях, где A обозначает O, производные хирального кетона формулы (1-1) могут быть диастереоселективно восстановлены согласно общему синтетическому методу 1 или с использованием общего синтетического метода 8. В случаях, где A обозначает CH2, производные хирального спирта формулы (1-1) могут быть получены с использованием общего синтетического метода 8. Альтернативно, спирты формулы (1-2) могут быть получены посредством реакции производных формулы (1-3) с эпоксидами формулы (1-4) в присутствии неорганического основания, такого как CS2CO3. Соединения формулы (II) могут быть получены в результате удаления аминозащитной группы с использованием общего синтетического метода 4.
Альдегиды формулы (III) могут быть получены согласно публикациям: WO 2006/002047, WO 2008/009700, WO 2008/128942 и WO 2007/138974.
Соединения формул (1-1) и (IV) могут быть получены согласно описанию, представленному ниже на схеме 2.
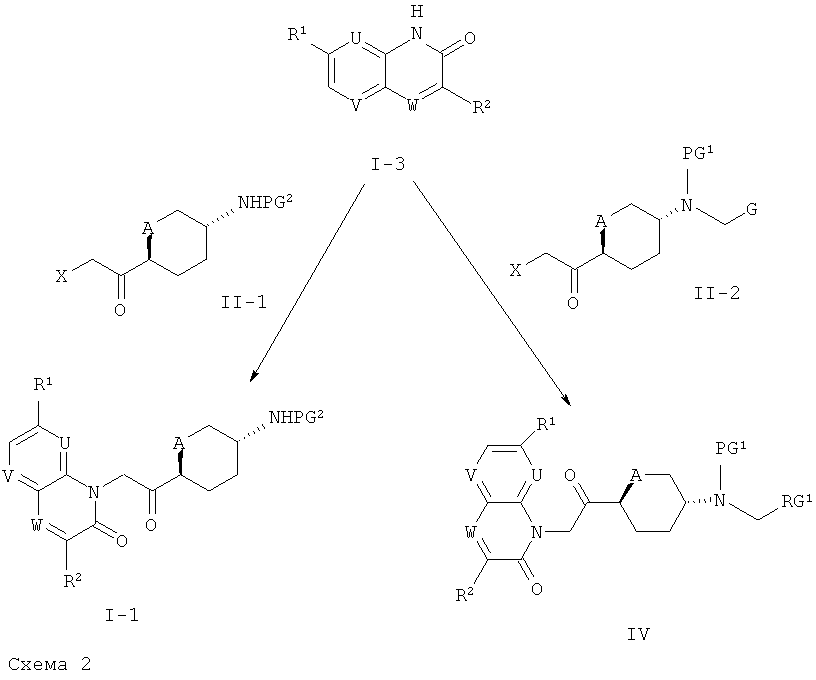
На схеме 2, X представляет собой галоген, такой как бром, PG1 и G имеют значения, приведенные для формулы (IV), и PG2 представляет собой аминозащитную группу, такую как Бок, Кбз или Фмок.
Таким образом, промежуточные соединения формулы (1-3) могут быть введены в реакцию с галогенметилкетонами формул (II-1) и (II-2) в присутствии основания, такого как К2СО3, в растворителе, таком как ТГФ или ДМФ, в температурном интервале от 40°C до 100°C, с получением соответствующих соединений формул (1-1) и (IV).
Получение исходных соединений:
Соединения формулы (1-3), где R1 обозначает МеО, или являются коммерческими продуктами (U=V=W=СН или U=V=N и W=СН), или могут быть получены согласно литературным источникам (U=СН, W=N: WO 2008/009700; U=N, W=СН: J. Heterocyclic Chem. (1986), 23(2), 501-504; U=V=N: WO 2006/134378). Соединение формулы (1-3), где R1 обозначает МеО, U обозначает N, R2 обозначает F и V и W обозначает каждый СН, могут быть получены, как описано на приведенной ниже схеме 2а.
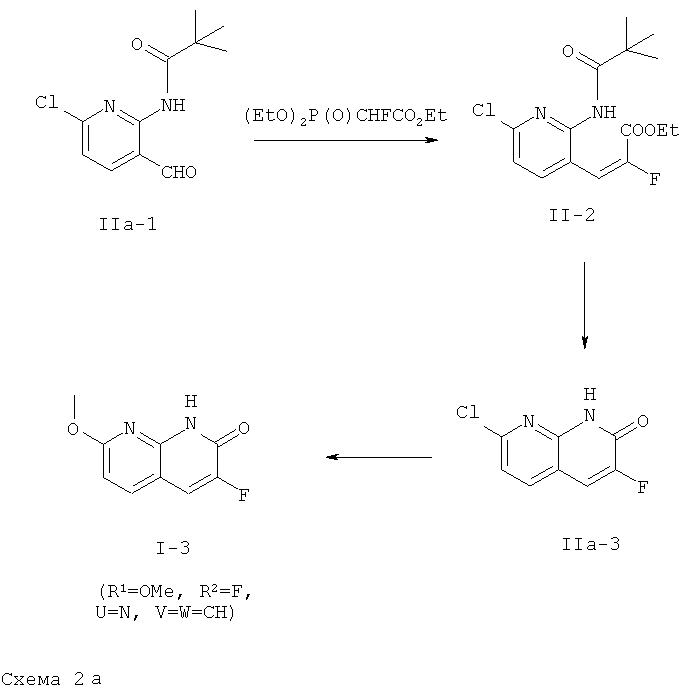
Таким образом, производное 3-формилпиридина формулы (IIa-1) (полученное согласно J. Org. Chem. (1990), 55, 4744) вводят в реакцию с триэтил 2-фтор-фосфонацетатом. Полученный акрилат формулы (IIa-2) циклизуют в термических условиях, получая производное формулы (IIa-3), которое вводят в реакцию с NaOMe, получая соединение формулы (1-3), где R1 обозначает MeO, U обозначает N, R обозначает F и V и W каждый обозначает СН.
Соединения формулы (1-4) могут быть получены согласно описанию, представленному ниже на схеме 3.
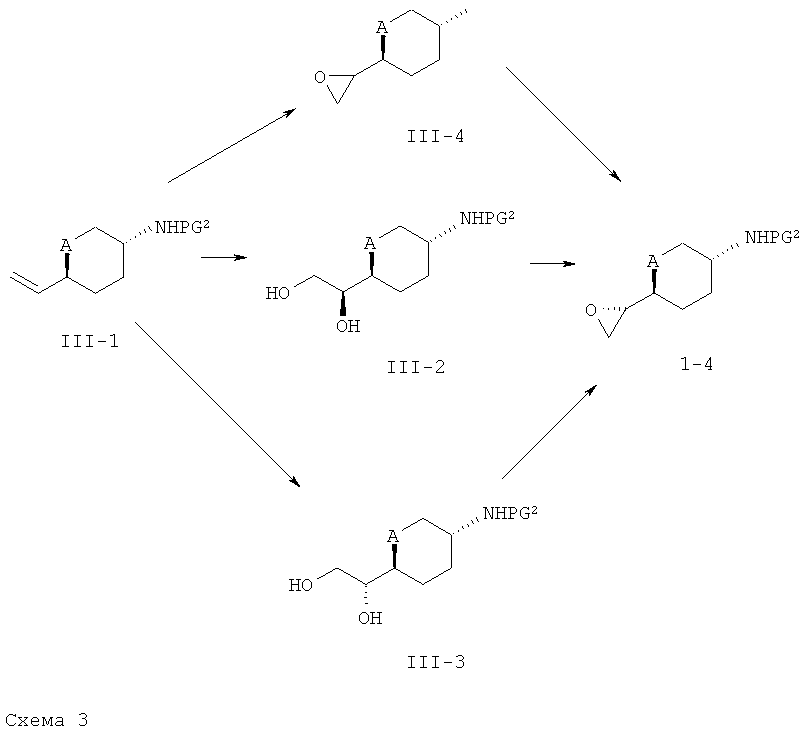
На схеме 3 PG2 представляет собой аминозащитную группу, такую как Бок, Кбз или Фмок.
Этиленовые производные формулы (III-1) (коммерческие продукты, например, когда А=СH2 и PG2=Бок, или полученные согласно WO 2006/032466, например, когда А=О и PG2=Бок) могут быть подвергнуты хиральному эпоксидированию с помощью м-ХПБК или перекиси водорода в присутствии металлического катализатора, такого как соль ванадия (III), с получением эпоксида формулы (III-4). В случаях, где A обозначает CH2, хиральные эпоксиды формулы (1-4) могут быть получены из алкенов формулы (III-1) посредством асимметрического дигидроксилирования с использованием хирального лиганда на основе дигидрохинидина (например, (DHDQ)2Pyr) согласно описанию, приведенному в общем синтетическом методе 7. Полученные диолы формулы (III-2) могут быть переведены в соответствующие эпоксиды формулы (1-4) или путем активации первичного спирта согласно общему синтетическому методу 3 с последующим образованием эпоксида в присутствии щелочно алкоксида, такого как метоксид натрия, или посредством реакции триметилортоацетата с последующей реакцией с ТМСС1 и образованием эпоксида в присутствии щелочного алкоголята (см. Tetrahedron (1992), 48, 10515). В тех случаях, когда А обозначает О, хиральные эпоксиды формулы (1-4) предпочтительно получают из хиральных диолов формулы III-3) исходя из алкенов формулы (III-1), посредством асимметрического дигидроксилирования, используя хиральный лиганд на основе хинидина (например, (DHQ)2PHAL). Полученные диолы формулы (III-3) могут быть переведены в соответствующие эпоксиды формулы (1-4) путем защиты первичной спиртовой группы переводом ее в сложноэфирную (предпочтительно, путем получения сложного эфира пивалиновой кислоты исходя из спирта формулы (Ш-З) и пивалоилхлорида в присутствии органического основания, такого как ТЭА), активации вторичного спирта согласно общему синтетическому методу 3, и циклизации с помощью щелочного алкоголята, такого как метоксид натрия. Альтернативно, эпоксиды формулы (1-4) могут быть получены посредством метода гидролитического кинетического разделения (ГКР), катализируемого хиральным комплексом (сален)-Со(III) (например, [(R,R)-N,N′-бис-(3,5-ди-трет-бутилсалицилиден)-1,2-циклогександиаминато(2-)]кобальт(III)-комплекс), рацемических эпоксидов согласно методикам, описанным в публикациях: Jacobsen et al. in J. Am. Chem. Soc. (2002), 124, 1307-1315 и Science (1997), 277, 936-938. Хиральные эпоксиды формулы (1-4) могут быть получены также путем хирального эпоксидирования алкенов формулы (III-1) по Ши с использованием хиральных кетонов согласно методу, описанному в Асе. Chem Res. (2004), 37, 488-496.
Соединения формулы (II-1), где A обозначает СНг и PG обозначает Бок или Кбз, являются коммерчески доступными. Другие соединения формулы (II-1) и соединения формулы (II-2) могут быть получены, например, согласно описанию, представленному ниже на схеме 4.
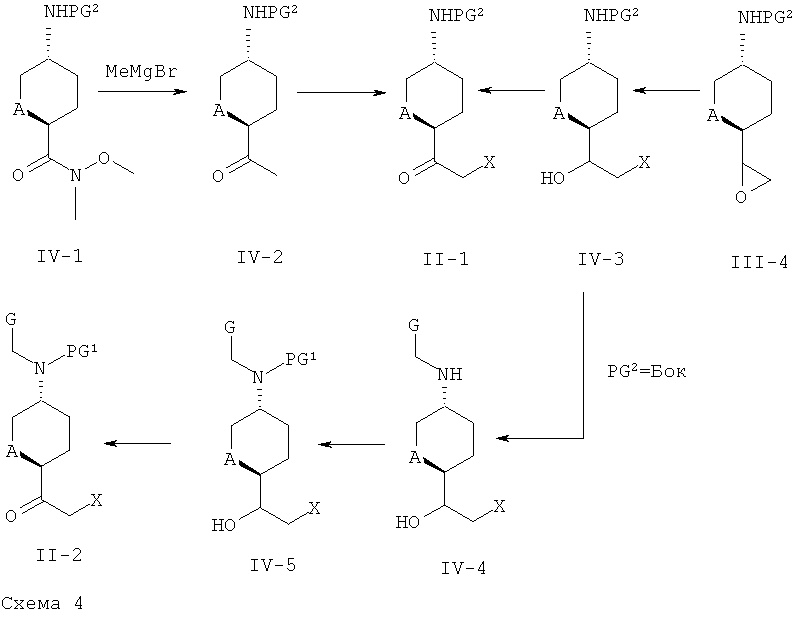
На схеме 4, X представляет собой галоген такой, как бром, PG1 и PG2 представляют собой независимо от каждой другой аминозащитные группы, такие как Кбз, Фмок или Бок.
Соединения формулы (II-1) могут быть получены реакцией производных гидроксаматов формулы (IV-1) (коммерчески доступны, когда А=CH2, или получены из 5-(трет-бутоксикарбониламино)тетрагидропиран-2-карбоновой кислоты (см. WO 2006/032466) и N,O-диметилгидроксиламина в присутствии ангидрида пропанфосфоновой кислоты и органического основания, такого как ДИПЭА) с метилмагнийбромидом. Кетоны формулы (IV-2) вводят в реакцию с LiНДМС и трибромидом фенилтриметиламмония или N-хлорсукцинимидом, получая производные галогенметилкетона формулы (II-1). Эти производные могут быть также получены раскрытием эпоксидов формулы (III-4) с помощью LiX (таких, как LiBr) или НХ (таких, как HCl), с последующим окислением соответствующих спиртовых производных формулы (IV-3) с использованием общего синтетического метода 6. Соединения формулы (II-2) могут быть получены удалением защитной группы с соединений формулы (IV-3) и последующим восстановительным аминированием соединений формулы G-CHO с использованием общего синтетического метода 2. Промежуточные соединения формулы (IV-4) могут быть защищены с использованием общего синтетического метода 5 с получением промежуточных соединений формулы (IV-5), которые могут быть затем окислены в соединения формулы (II-2) с использованием общего синтетического метода 6.
Особые варианты изобретения, описанные в следующих примерах, служат для более детального описания изобретения, никоим образом не лимитируя его объема.
Примеры
Все температуры приведены в °C. Соединения охарактеризованы с помощью 1H-ЯМР (300 МГц) (Varian Oxford) или 1H-ЯМР (400 МГц) (Bruker Advance 400); химические сдвиги приведены в м.д. относительно используемого растворителя; мультиплеты: s=синглет, d=дублет, t=триплет, q=квадраплет, р=пентет, гекс=гексет, гепт=гептет, m=мультиплет, константы взаимодействия приведены в Гц. Альтернативно, соединения охарактеризованы с помощью ЖХ-МС (Sciex API 2000 с Agilent 1100 Binary Pump, DAD и ELSD или Agilent quadrupole MS 6140 с Agilent 1200 Binary Pump, DAD и ELSD); с помощью TCX (ТСХ-пластины от фирмы Merck, силикагель 60 F254); или с помощью температуры плавления. Соединения очищают посредством хроматографии на силикагеле 60А. NH4OH, используемый для колоночной хроматографии, представляет собой 25%-ный водный раствор.
Эксперимент A: трет-бутиловый эфир (3R,6S)-[6-((2S)-оксиранил)тетрагидропиран-3-ил]карбаминовой кислоты
A.i. трет-бутшовый эфир (3R,6S)-(6-формилтетрагидропиран-3-ил)карбаминовой кислоты
К раствору трет-бутилового эфира (3R,6S)-(6-гидроксиметилтетрагидропиран-3-ил)карбаминовой кислоты (37,5 г, 162,13 ммолей) в ДХМ (310 мл), охлажденному до температуры -10°C, прибавляют ДИПЭА (84,75 мл, 495,06 ммолей), после чего медленно добавляют раствор Pyr-SO3-комплекса (50%-ный, 69,47 г, 218,25 ммолей) в ДМСО (225 мл), и реакционную смесь перемешивают в течение 2 ч при температуре 0°C. Затем
реакционную смесь распределяют между водой (150 мл) и ДХМ (220 мл), слои разделяют, и водный слой экстрагируют ДХМ (дважды по 150 мл). Объединенные органические слои высушивают над Na2SO4, фильтруют и концентрируют без досушивания. Остаток трижды выпаривают с толуолом и очищают, пропуская через слой силикагеля (ЭА/гептан в соотношении 2:1), получая при этом названный в заголовке альдегид в виде белого твердого вещества (33,58 г, 90%-ный выход).
МС (ЭСИ, m/z): 230,0 [М+Н+] для C11H19O4.
A.ii. трет-Бутиловый эфир (311,68)-(6-винилтетрагид.ропиран-3-ил)карбаминовой кислоты
tBuOK (31,74 г, 282,89 ммолей) прибавляют одной порцией к белой суспензии метилтрифенилфосфонийбромида (101,05 г, 282,89 ммолей) в ТГФ (340 мл) при комнатной температуре в атмосфере аргона. Полученную оранжевую суспензию перемешивают в течение 1 ч при комнатной температуре, после чего добавляют раствор промежуточного соединения (A.i) (32,43 г, 141,44 ммолей) в ТГФ (85 мл). Затем смесь перемешивают в течение 30 мин при комнатной температуре, добавляют 10%-ный водный раствор NaHSO4 (120 мл), и смесь разбавляют этилацетатом (200 мл). Оба слоя декантируют, и водный слой однократно экстрагируют этилацетатом (250 мл). Объединенные органические слои промывают рассолом, высушивают над Na2SO4, фильтруют и концентрируют без досушивания. Остаток быстро фильтруют (ЭА/гептан в соотношении от 1:2 до ЭА/гептан в соотношении 4:1), получая названное в заголовке соединение в виде белого твердого вещества (28,98 г, 90%-ный выход).
1H ЯМР (CDCl3) δ: 5,84 (ddd, J=5,6, 10,5, 17,3 Гц, 1Н); 5,24 (dt, J=1,5, 17,3 Гц, 1Н); 5,12 (dt, J=1,5, 10,5 Гц, 1Н); 4,26 (расширенный, s, 1Н); 4,10 (ddd, J=2,1, 4,7, 10,8 Гц, 1Н); 3,73 (m, 1Н); 3,61 (m, 1Н); 3,06 (t, J=10,5 Гц, 1Н); 2,10 (m, 1Н); 1,79 (m, 1Н); 1,25-1,60 (m, 2Н); 1,44 (s, 9Н).
МС (ЭСИ, m/z): 228,2 [М+Н+] для C12H21NO3.
A.iii. трет-Бутиловый эфир (3R,6S)-{6-[(2R)-l,2-дигидроксиэтил]тетрагидропиран-3-ил}карбаминовой кислоты
К смеси промежуточного соединения (А.и) (29,98 г, 131,9 ммолей) в 2-метил-2-пропаноле (575 мл), ЭА (92 мл) и воде (670 мл) прибавляют K3Fe(CN)6 (130,28 г, 395,68 ммолей, 3 экв.), К2СО3 (54,68 г, 395,68 ммолей, 3 экв.), (DHQ)2PHAL (0,72 г, 0,92 ммолей, 0,01 экв.) и K2OsO2(OH)2 (0,13 г, 0,36 ммолей, 0,003 экв.). Затем смесь перемешивают в течение ночи при температуре 0°C, при этой же температуре одной порцией прибавляют NaHSO3 (105 г), после чего реакция продолжается в течение 15 мин. Реакционную смесь затем экстрагируют водой и этилацетатом. Органический слой промывают рассолом, высушивают над Na2SO4, а затем фильтруют и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (ДХМ/МеОН в соотношении от 97:3 до 9:1), получая названный в заголовке диол в виде белого твердого вещества (27,84 г, 81%-ный выход). Соединение получают в виде смеси диастереомеров в соотношении 6:1.
1H ЯМР (CDCl3) основной диастереомер δ: 4,23 (расширенный s, 1Н); 4,09 (ddd, J=2,4, 5,1, 10,5 Гц, 1Н); 3,68-3,74 (m, 2Н); 3,52-3,66 (m, 2Н); 3,35 (ddd, J=2,4, 5,1, 11,4 Гц, 1Н); 2,98 (t, J=10,8 Гц, 1Н); 2,51 (расширенный d, J=6,0 Гц, 1Н); 2,09-2,21 (m, 2Н); 1,78 (m, 1Н); 1,54 (m, 1Н); 1,43 (s, 9Н); 1,22-1,36 (m, 1Н).
МС (ЭСИ, m/z): 262,4 [М+Н+] для C12H23NO5.
A.iv. (2R)-2-[(2S,5R)-(5-трет-Бутоксикарбониламинотетрагидропиран-2-ил]-2-гидроксиэтиловый эфир 2,2-диметилпропионовой кислоты
К раствору промежуточного соединения (A.iii) (27,84 г, 106,54 ммолей) и ДМАП (26,03 г, 213,08 ммолей, 2 экв.) в ДХМ (510 мл), охлажденному до температуры -15°C, прибавляют триметилацетилхлорид (17,06 мл, 138,5 ммолей, 1,3 экв.). Реакция продолжается в течение 1 ч, после чего к реакционной смеси прибавляют МеОН (28 мл), а затем насыщенный водный раствор NaHCO3 (250 мл). Два слоя разделяют, и водный слой экстрагируют этилацетатом (200 мл). Объединенные органические слои высушивают над Na2SO4, фильтруют и концентрируют без досушивания. После очистки масляного остатка с помощью колоночной хроматографии (гептан/ЭА в соотношении от 3:1 до 1:1), названное в заголовке соединение получают в виде белого твердого вещества (22,66 г, 62%-ный выход).
МС (ЭСИ, m/z): 346,1 [М+Н+] для C17H31NO6.
Бис-пивалат (13,1 г, 29%-ный выход), также выделенный из реакционной смеси, может быть снова превращен в промежуточное соединение (A.iii) с количественным выходом при обработке tBuOK в МеОН.
A.v. (2R)-2-[(2S,5R-5-трет-Бутоксикарбониламинотетрагидропиран-2-ил]-2-метансульфонилоксиэтиловый эфир 2,2-диметилпропионовой кислоты
К раствору промежуточного соединения (A.iv) (22,62 г, 65,48 ммолей) в ДХМ (328 мл), охлажденному до температуры 0°C, прибавляют триэтиламин (18,23 мл, 130,97 ммолей, 2 экв.) и MsCl (5,58 мл, 72,03 ммолей, 1,1 экв.). Реакционную смесь перемешивают при температуре 0°C в течение 45 мин, после чего добавляют насыщенный водный раствор NaHCO3 (250 мл) и ДХМ (200 мл). Слои декантируют, органический слой высушивают над Na2SO4, фильтруют и концентрируют без досушивания. Выделенное масло фильтруют через колонку с силикагелем (5,5×10 см, ЭА/гептан в соотношении 1:1), получая названное в заголовке соединение в виде белой пены (27,87 г, 100%-ный выход).
МС (ЭСИ, m/z): 424,3 [М+Н+] для C18H33NO8S.
A.vi. трет-Бутиловый эфир (3R,6S)-[6-((28)-оксиранил)тетрагидропиран-3-ил]карбаминовой кислоты
К раствору промежуточного соединения (A.v) (27,85 г, 65,76 ммолей) в ТГФ (340 мл) добавляют NaOMe (в 25%-ном растворе в МеОН, 30,1 мл, 2 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 20 мин, а затем распределяют между 10%-ным водным раствором NaHSO4 (220 мл) и этилацетатом (250 мл). Органический слой высушивают над Na2SO4, фильтруют и концентрируют при пониженном давлении. Выделенное масло очищают с помощью колоночной хроматографии (ЭА/гептан в соотношении 1:1), получая названный в заголовке эпоксид в виде белого твердого вещества (10,78 г). Соединение представляет собой смесь диастереомеров в соотношении 6:1.
1Н ЯМР (CDCl3) основной диастереомер δ: 4,22 (расширенный s, 1Н); 4,11 (m, 1Н); 3,60 (расширенный s, 1Н); 2,92-3,11 (m, 3H); 2,78 (m, 1Н); 2,64 (m, 1Н); 2,11 (m, 1Н); 1,54-1,78 (m, 2Н); 1,43 (s, 9Н); 1,27 (qd, J=4,2, 12,3 Гц, 1Н).
МС (ЭСИ, m/z): 244,3 [М+Н+] для C12H21NO4.
Эксперимент B 7-метокси-1H-[1,8]нафтиридин-2-он
К раствору 7-хлор-1H-[1,8]нафтиридин-2-она (получен по описанию в J. Org. Chem. (1990), 55, 4744; 5,36 г, 29,68 ммолей) в МеОН (98 мл) добавляют NaOMe (25%-ный раствор в МеОН, 161 мл). Полученный раствор перемешивают при нагревании с обратным холодильником в течение 15 ч, после чего растворитель удаляют в вакууме и добавляют воду (100 мл) и этилацетат (80 мл). Фазы разделяют, и водный слой экстрагируют этилацетатом (8 раз по 80 мл). Объединенные органические слои промывают рассолом (50 мл), высушивают над MgSO4, фильтруют и выпаривают при пониженном давлении. Названное в заголовке соединение получают в виде бежевого твердого вещества (5,22 г, 100%-ный выход).
1H ЯМР (ДМСОd6) δ: 11,96 (s, 1Н); 7,96 (d, J=8,5 Гц, 1H); 7,81 (d, J=9,4 Гц, 1Н); 6,63 (d, J=8,5 Гц, 1Н); 6,34 (d, J=9,4 Гц, 1H); 3,90 (s, 3H).
Эксперимент C: трет-бутиловый эфир транс-(R)-(4-оксиранилциклогексил)карбаминовой кислоты
C.i. трет-Бутиловый эфир транс-(4-винилциклогексил)карбаминовой кислоты
Исходя из трет-бутилового эфира транс-(4-гидроксиметилциклогексил)карбаминовой кислоты (22 г, 95,9 ммолей), названный в заголовке алкен, получают в виде белого твердого вещества (13,58 г), используя метод эксперимента A, стадии A.i и A.ii.
1H ЯМР (ДМСОd6) δ: 6,65 (m, 1Н); 5,73 (ddd, J=6,4, 10,2, 16,6 Гц, 1H); 4,95 (ddd, J=1,9, 2,1, 16,6 Гц, 1Н); 4,86 (ddd, J=1,2, 2,1, 10,2 Гц, 1Н); 3,12 (m, 1Н); 1,62-1,89 (m, 5Н); 1,35 (s, 9Н)„ 1,00-1,28 (m, 4Н).
МС (ЭСИ, m/z): 226,2 [М+Н+] для C13H23NO2.
C.ii. трет-Бутиловый эфир TpaHC-[4-(2R)-l,2-дигидроксиэтил)циклогексил]карбаминовой кислоты
К смеси промежуточного соединения (C.i) (21,65 г, 96,08 ммолей) в 2-метил-2-пропаноле (480 мл) и воде (480 мл) прибавляют K3Fe(CN)6 (94,9 г), К2СO3 (39,9 г), (DHQD)2Pyr (0,847 г) и K2OsO2(OH)2 (0,354 г), после чего смесь перемешивают при температуре 0°C в течение 30 ч. Затем реакцию осторожно останавливают с помощью водного раствора NaHSO3 (112 г). Слои затем декантируют, и водный слой однократно экстрагируют этилацетатом (400 мл). Объединенные органические слои высушивают над Na2SO4, фильтруют и концентрируют без досушивания. Остаток очищают с помощью колоночной хроматографии (ДХМ/МеОН в соотношении 9:1), получая названное в заголовке соединение в виде желтого твердого вещества (23,02 г, 92%-ный выход).
1H ЯМР (ДМСОd6) δ: 6,61 (m, 1Н); 4,32 (t, J=5,6 Гц, 1Н); 4,24 (d, J=5,0 Гц, 1Н); 3,21-3,36 (m, 2Н); 3,15 (m, 1Н); 3,074 (m, 1Н); 1,66-1,80 (m, 4Н); 1,53 (m, 1Н); 1,35 (s, 9Н), 1,00-1.26 (m, 4Н).
C.iii. трет-Бутиловый эфир транс-(R)-(4-оксиранилциклогексил)карбаминовой кислоты
К раствору промежуточного соединения (C.ii) (23,02 г, 88,762 ммолей) в ДХМ (240 мл) добавляют TsOH (0,795 г, 0,05 экв.) и триметилортоацетат (16,1 мл, 1,3 экв.), после чего реакция протекает при комнатной температуре в течение 30 мин. Растворители затем удаляют при пониженном давлении. Остаток переносят в смесь ДХМ (120 мл) и МеОН (0,03 мл) и добавляют ТМС-С1 (16,0 мл, 1,4 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, добавляют насыщенный водный раствор NaHCO3 (250 мл), и слои разделяют. Органический слой высушивают над Na2SO4, фильтруют и концентрируют без досушивания. Остаток переносят в смесь МеОН (150 мл) и добавляют NaOMe (25%-ный раствор в МеОН, 40,5 мл), после чего реакция продолжается при комнатной температуре в течение 1 ч. Реакционную смесь затем разбавляют ДХМ (300 мл) и водным раствором NaHSO4 (10%-ный, 120 мл). Водный слой экстрагируют смесью ДХМ/МеОН в соотношении 9:1 (трижды по 150 мл). Объединенные органические слои промывают рассолом (200 мл), высушивают над Na2SO4, фильтруют и концентрируют, получая желтое масло. После очистки остатка с помощью колоночной хроматографии (ЭА/гептан в соотношении 2:1), названное в заголовке соединение получают в виде белого твердого вещества (17,35 г, 81%-ный выход).
1H ЯМР (CDCl3) δ: 4,37 (расширенный s, 1Н); 3,39 (расширенный s, 1Н); 2,68-2,75 (m, 2Н); 2,52 (m, 1Н); 2,02-2,10 (m, 2Н); 1,96 (m, 1Н); 1,75 (m, 1Н); 1,45 (s, 9Н); 1,00-1,36 (m, 5Н).
Пример 1: 1-((S)-2-{(2S,5R)-5-[(2,3-дигидро-4-окса-1-тиа-6-азанафталин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-7-метокси-1H-[1,8]нафтиридин-2-он
1.i. трет-Бутиловый эфир {(3R,6S)-6-[(1S)-1-гидрокси-2-(7-метокси-2-оксо-2Н-[1,8]нафтиридин-1-ил)этил]тетрагидропиран-3-ил}карбаминовой кислоты
К раствору соединения эксперимента B (2,65 г, 15 ммолей) и соединения эксперимента A (3,65 г, 15 ммолей) в ДМФ (24 мл) добавляют CS2CO3 (5,23 г, 16,05 ммолей), после чего смесь нагревают при температуре 80°C в течение 7 ч. Растворитель удаляют при пониженном давлении, а остаток распределяют между водой (100 мл) и этилацетатом (100 мл). Водный слой еще раз экстрагируют этилацетатом (100 мл). Объединенные органические слои высушивают над Na2SO4, фильтруют и выпаривают при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (гептан/ЭА в соотношении от 1:4 до 0:1), получая названное в заголовке соединение в виде белого твердого вещества (3,50 г, 56%-ный выход).
1H ЯМР (ДМСОd6) δ: 8,01 (d, J=8,5 Гц, 1Н); 7,82 (d, J=9,4 Гц, 1H); 6,69 (d, J=8,5 Гц, 1H); 6,69 (перекрывающийся m, 1H); 6,47 (d, J=9,4 Гц, 1H); 4,65 (dd, J=8,8, 12,6 Гц, 1H); 4,43 (d, J=7,0 Гц, 1H); 4,32 (dd, J=4,1, 12,6 Гц, 1H); 3,96 (s, 3H); 3,91 (перекрывающийся m 1H); 3,80 (m, 1H), 3,30 (m, 1H); 3,13 (m, 1H); 2,90 (t, J=10,5 Гц, 1H); 1,86 (m, 1H); 1,53-1,63 (m, 2H), 1,34 (s, 9H); 1,33 (перекрывающийся m, 1H).
МС (ЭСИ, m/z): 420,3 [M+H+] для C21H29N3O6.
1.ii. 1-[(2S)-2-((2S,5R)-5-Аминотетрагидропиран-2-ил)-2-гидроксиэтил]-7-метокси-1Н-[1,8]нафтиридин-2-он
Раствор промежуточного соединения (1.i.) (3,5 г, 8,34 ммолей) в ТФК (11 мл) и ДХМ (5 мл) перемешивают при комнатной температуре в течение 20 мин. Летучую фракцию удаляют в вакууме, а остаток распределяют между насыщенным водным раствором NaHCO3 (20 мл) и смесью ДХМ/МеОН (в соотношении 9:1, 100 мл), после чего pH водного слоя доводят до 11, добавляя концентрированный раствор NaOH. Водный слой экстрагируют смесью ДХМ/МеОН (в соотношении 9:1, 6 раз по 75 мл). Объединенные органические экстракты промывают рассолом (50 мл), высушивают над Na2SO4, фильтруют и концентрируют без досушивания, получая названное в заголовке соединение в виде грязно-белой пены (2,0 г, 75%-ный выход).
1H ЯМР (ДМСОd6) δ: 8,01 (d, J=8,5 Гц, 1Н); 7,82 (d, J=9,4 Гц, 1Н); 6,69 (d, J=8,5 Гц, 1Н); 6,47 (d, J=9,4 Гц, 1H); 4,65 (dd, J=8,8, 12,9 Гц, 1H); 4,30-4,37 (m, 2Н); 3,94 (s, 3H); 3,92 (m, 1Н); 3,76 (m, 1Н); 3,12 (m, 1Н); 2,79 (t, J=10,3 Гц, 1Н); 2,53 (m, 1Н); 1,89 (m, 1Н); 1,50-1,59 (m, 2Н); 1,30 (расширенный s, 2Н); 1,13 (m, 1Н).
МС (ЭСИ, m/z): 320,3 [М+Н+] для C16H21N3O4.
`1.iii. 1-((S)-2-{(2S,5R)-5-[(2,3-дигидро-4-окса-1-тиа-6-азанафталин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-7-метокси-1Н-[1,8]нафтиридин-2-он
К раствору промежуточного соединения (1.ii) (0,112 г, 0,353 ммолей) в дихлорэтане (4,5 мл) и МеОН (1,5 мл) прибавляют 3Å молекулярные сита (1,1 г) и 2,3-дигидро-4-окса-1-тиа-6-аза-нафталин-7-карбальдегид (0,064 г, 0,357 ммолей), после чего смесь перемешивают в течение ночи при температуре 50°C, а после охлаждения добавляют NaBH4 (0,11 г). Реакция при этом протекает в течение 45 мин. Реакционную смесь разбавляют смесью ДХМ/МеОН (в соотношении 9:1, 100 мл). Твердые вещества отфильтровывают и промывают ДХМ (50 мл). Фильтрат промывают насыщенным водным раствором NaHCO3 (50 мл), высушивают над Na2SO4, фильтруют и концентрируют без досушивания. Остаток очищают с помощью колоночной хроматографии (смесь ДХМ/МеОН в соотношении 9:1, содержащая 1% водного раствора NH4OH), получая названное в заголовке соединение в виде белой пены (0,051 г, 30%-ный выход).
1H ЯМР (ДМСОd6) δ: 8,01 (d, J=8,5 Гц, 1Н); 7,95 (s, 1Н); 7,82 (d, J=9,4 Гц, 1Н); 7,13 (s, 1Н); 6,68 (d, J=8,5 Гц, 1Н); 6,46 (d, J=9,4 Гц, 1H); 4,64 (dd, J=8,8, 12,9 Гц, 1Н); 4,28-4,38 (m, 4Н); 3,87-3,96 (m, 2Н); 3,93 (s, 3H); 3,64 (АВ система, J=14,4 Гц, Δ=0,059 м.д., 2Н); 3,21-3,26 (m, 2Н); 3,17 (m, 1Н); 2,88 (t, J=10,3 Гц, 1Н); 2,43 (m, 1Н); 1,94-2,07 (m, 2Н); 1,42-1,62 (m 2Н); 1,18 (m, 1H).
МС (ЭСИ, m/z): 485,2 [М+Н+] для C24H28N4O5S.
Пример 2: 1-((2S)-2-{(2S,5R)-5-[(2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-7-метокси-1H-[1,8]нафтиридин-2-он.
Исходя из промежуточного соединения (1.ii) (0,1 г, 0,31 ммолей) и 2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-карбальдегида (0,052 г, 1,02 экв.) указанное в заголовке соединение получают в виде белой пены (0,088 г, 61%-ный выход), используя метод примера 1, стадия 1.iii. Сырой продукт очищают с помощью колоночной хроматографии (смесь ДХМ/МеОН в соотношении 93:7, содержащая 0,7% водного раствора NH4OH).
1H ЯМР (ДМСОd6) δ: 8,01 (d, J=8,5 Гц, 1Н); 7,99 (s, 1Н); 7,83 (d, J=9,4 Гц, 1Н); 6,91 (s, 1Н); 6,69 (d, J=8,5 Гц, 1Н); 6,47 (d, J=9,4 Гц, 1H); 4,65 (dd, J=8,8, 12,9 Гц, 1Н); 4,38 (d, J=6,4 Гц, 1Н); 4,24-435 (m, 5Н); 3,86-3,96 (m, 2Н); 3,94 (s, 3H); 3,61-3,71 (m, 2Н), 3,17 (m, 1Н); 2,89 (t, J=10,3 Гц, 1Н); 2,43 (m, 1H); 1,93-2,09 (m, 2Н); 1,45-1,62 (m, 2Н); 1,19 (m, 1Н).
МС (ЭСИ, m/z): 469,2 [М+Н+] для C24H28N4O6.
Пример 3: 1-((2S)-2-{(2S,5R)-5-[(2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-7-метокси-1H-хиноксалин-2-он
3.i. 4-[(2S)-2-((2S,5R)-5-Аминотетрагидропиран-2-ил)-2-гидроксиэтил]-6-метокси-4Н-пиридо[2,3-b]пиразин-3-он
Исходя из соединения эксперимента A (1,43 г, 5,90 ммолей) и 7-метокси-1H-хиноксалин-2-она (1,04 г, 5,9 ммолей) названное в заголовке соединение получают в виде желтоватой пены (0,168 г), используя методы примера 1, стадия 1.i (раскрытие эпоксида, 45%-ный выход) и стадия 1.ii (удаление Бок-защитной группы, 49%-ный выход, исходя из 0,45 г промежуточного соединения). Сырую реакционную смесь очищают с помощью колоночной хроматографии, используя соответствующую смесь растворителей.
МС (ЭСИ, m/z): 320,3 [М+Н+] для C16H21N3O4.
3.i. 1-((2S)-2-{(2S,5R)-5-[(2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-7-метокси-1Н-хиноксалин-2-он
Исходя из промежуточного соединения (3.i) (0,082 г, 0,257 ммолей) и 2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-карбальдегида (0,043 г, 1,002 экв.) и используя метод примера 1, стадия 1.iii (восстановительное аминирование) названное в заголовке соединение получают в виде грязно-белой пены (0,045 г, 37%-ный выход). Реакционную смесь очищают с помощью колоночной хроматографии (смесь ДХМ/МеОН в соотношении 93:7, содержащая 0,7% водного раствора NH4OH).
1H ЯМР (ДМСОd6) δ: 8,02 (s, 1Н); 8,00 (s, 1Н); 7,72 (d, J=8,8 Гц, 1Н); 7,09 (d, J=2,6 Гц, 1Н); 6,97 (dd, J=2,6, 8,8 Гц, 1Н); 6,92 (s, 1Н); 4,93 (d, J=6,4 Гц, 1Н); 4,23-4,36 (m, 5Н); 4,15 (dd, J=4,4, 12,6 Гц, 1Н); 3,98 (m, 1H); 3,86 (s, 3H); 3,78 (m, 1Н); 3,67 (АВ система, J=14,4 Гц, Δ=0,06 м.д., 2Н); 3,21 (m, 1Н); 2,92 (t, J=10,3 Гц, 1Н); 2,46 (m, 1Н); 2,13 (расширенный s, 1Н); 2,00 (m, 1Н); 1,46-1,63 (m, 2Н); 1,19 (m, 1Н).
МС (ЭСИ, m/z): 469,0 [М+Н+] для C24H28N4O6.
Пример 4: 4-((2S)-2-((2S,5R)-5-[(2,3-диидро[1,41диоксино[2.3-с]пиридин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-6-метокси-4H-пиридо[2,3-b]пиразин-3-он
4.i. 4-[(2S)-2-((2S,5R)-5-Аминотетрагидропиран-2-ил)-2-гидроксиэтил]-6-метокси-4Н-пиридо[2,3-b]пиразин-3-он
Исходя из 6-метокси-4H-пиридо[2,3-b]пиразин-3-она (0,425 г, 2,4 ммолей) и соединения эксперимента A (0,584 г, 2,4 ммолей) названный в заголовке амин получают в виде желтоватой пены, используя методы примера 1, стадия 1.i (раскрытие эпоксида, 37%-ный выход) и стадия 1.ii (удаление Бок-защитной группы, 100%-ный выход). При необходимости сырой продукт очищают с помощью колоночной хроматографии, используя соответствующую смесь растворителей.
МС (ЭСИ, m/z): 312,3 [М+Н+] для C5H20N4O4.
4.ii. 4-((2S)-2-{(2S,5R)-5-[(2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-6-метокси-4Н-пиридо[2,3-b]пиразин-3-он
Исходя из промежуточного соединения (4.i) (0,097 г, 0,304 ммолей) и 2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-карбальдегида (0,055 г, 1,1 экв.) названное в заголовке соединение получают в виде желтоватой пены (0,027 г, 19%-ный выход), используя метод примера 1, стадия 1.iii. Сырой продукт очищают с помощью колоночной хроматографии (смесь ДХМ/МеОН в соотношении 93:7, содержащая 0,7% водного раствора NH4OH).
1H ЯМР (ДМСОd6) δ: 8,09 (d, J=8,5 Гц, 1Н); 8,07 (s, 1Н); 7,98 (s, 1Н); 6,91 (s, 1Н); 6,79 (d, J=8,5 Гц, 1Н); 4,60 (перекрывающийся dd, J=8,8, 12,6 Гц, 1Н); 4,59 (d, J=6,8 Гц, 1Н); 4,30-4,34 (m, 2Н); 4,24-4,28 (m, 2Н); 4,20 (dd, J=3,8, 12,6 Гц, 1Н); 3,87-3,99 (m, 2Н); 3,94 (s, 3H); 3,65 (АВ система, J=14,4 Гц, Δ=0,06 м. д., 2Н); 3,20 (m, 1Н); 2,89 (t, J=10,5 Гц, 1Н); 2,46 (m, 1Н); 2,11 (расширенный s, 1Н); 1,99 (m, 1Н); 1,46-1,63 (m, 2Н); 1,19 (m, 1Н).
МС (ЭСИ, m/z): 470,2 [М+Н+] для C23H26N606.
Пример 5: 1-((2S)-2-{(2S,5R)-5-[(6,7-дигидро[1,4]диоксино[2,3-с]пиридазин-3-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-7-метокси-1H-[1,8]нафтиридин-2-он
Исходя из промежуточного соединения (1.ii) (0,1 г, 0,31 ммолей) и 6,7-дигидро[1,4]диоксино[2,3-с]пиридазин-3-карбальдегида (0,052 г, 1,02 экв.) названное в заголовке соединение получают в виде белой пены (0,039 г, 27%-ный выход), используя метод примера 1, стадия 1.iii. Сырой продукт очищают с помощью колоночной хроматографии (смесь ДХМ/МеОН в соотношении 93:7, содержащая 0,7% водного раствора NH4OH).
1H ЯМР (ДМСОd6) δ: 8,01 (d, J=8,5 Гц, 1Н); 7,83 (d, J=9,4 Гц, 1Н); 7,17 (s, 1Н); 6,69 (d, J=8,5 Гц, 1Н); 6,47 (d, J=9,4 Гц, 1H); 4,64 (dd, J=8,8, 12,6 Гц, 1Н); 4,47-4,52 (m, 2Н); 4,36-4,42 (m, 3H); 4,31 (dd, J=4,4, 12,6 Гц, 1Н); 3,88-3,94 (m, 2Н); 3,94 (s, 3H); 3,81-3,86 (m, 2Н), 3,17 (m, 1Н); 2,89 (t, J=10,3 Гц, 1Н); 2,41 (m, 1Н); 2,27 (m, 1Н); 1,99 (m, 1Н); 1,47-1,62 (m, 2Н); 1,19 (m, 1Н).
МС (ЭСИ, m/z): 470,2 [М+Н+] для C23H27N5O6.
Пример 6: 1-((2R)-2-{4-[(2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-илметил)амино]циклогексил}-2-гидроксиэтил)-7-метокси-1H-[1,8]нафтиридин-2-он
6.i. 1-[(2R)-2-транс-(4-Аминоциклогексил)-2-гидроксиэтил]-7-метокси-1Н-[1,8]нафтиридин-2-он
Исходя из соединения эксперимента С (1,17 г, 4,82 ммолей) и соединения эксперимента B (0,85 г, 4,82 ммолей) названное в заголовке соединение получают в виде белой пены (0,494 г), используя методы примера 1, стадия 1.i (раскрытие эпоксида, 39%-ный выход) и примера 1, стадия 1.ii (удаление Бок-защитной группы, 84%-ный выход). Сырой продукт очищают с помощью колоночной хроматографии, используя соответствующую смесь растворителей.
1H ЯМР (ДМССd6) δ: 8,01 (d, J=8,5 Гц, 1Н); 7,82 (d, J=9,4 Гц, 1Н); 6,69 (d, J=8,5 Гц, 1Н); 6,47 (d, J=9,4 Гц, 1H); 4,55 (dd, J=8,8, 12,6 Гц, 1Н); 4,33 (расширенный s, 1Н); 4,28 (dd, J=4,1, 12,6 Гц, 1Н); 3,94 (s, 3H); 3,78 (m, 1Н); 3,26 (расширенный s, 2Н); 2,42 (m, 1Н); 1,88 (m, 1Н), 1,81-1,71 (m, 2Н); 1,62 (m, 1Н); 1,08-1,30 (m, 3H); 0,85-1,02 (m, 2Н).
МС (ЭСИ, m/z): 318,2 [М+Н+] для C17H23N3O3.
6.ii. 1-((2R)-2-{4-[(2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-илметил)амино]циклогексил}-2-гидроксиэтил)-7-метокси-1Н-[1,8]нафтиридин-2-он
Исходя из промежуточного соединения (6.i) (0,1 г, 0,315 ммолей) и 2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-карбальдегида (0,053 г, 1,02 экв.) названное в заголовке соединение получают в виде белой пены (0,117 г, 80%-ный выход), используя метод примера 1, стадия 1.iii. Сырой продукт очищают с помощью колоночной хроматографии (смесь ДХМ/МеОН в соотношении 93:7, содержащая 0,7% водного раствора NH4OH).
1H ЯМР (ДМСОd6) δ: 8,01 (d, J=8,5 Гц, 1Н); 7,98 (s, 1H); 7,82 (d, J=9,4 Гц, 1H); 6,90 (s, 1H); 6,68 (d, J=8,5 Гц, 1H); 6,47 (d, J=9,4 Гц, 1H); 4,56 (dd, J=8,5, 12,3 Гц, 1H); 4,23-4,33 (m, 6H); 3,94 (s, 3H); 3,78 (m, 1H); 3,65 (s, 2H); 2,26 (m, 1H); 2,03 (расширенный s, 1H); 1,85-1,95 (m, 3H), 1,65 (m, 1H); 0,88-1,30 (m, 5H).
МС (ЭСИ, m/z): 467,2 [M+H+] для C25H30N4O5.
Пример 7: 1-((2R)-2-{4-[(2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-илметил)амино]циклогексил}-2-гидроксиэтил)-7-метокси-1H-хиноксалин-2-он
7.i. трет-Бутиловый эфир транс-{4-[(1R)-1-гидрокси-2-(7-метокси-2-оксо-2Н-хиноксалин-1-ил)этил]циклогексил} карбаминовой кислоты
К раствору соединения эксперимента C (1,58 г, 6,55 ммолей) в ДМФ (33 мл) добавляют 7-метокси-1H-хиноксалин-2-он (1,18 г, 1,02 экв.) и CS2CO3 (4,27 г, 2 экв.). Реакционную смесь перемешивают при температуре 80°С в течение 4 ч. Растворитель удаляют при пониженном давлении, а остаток распеределяют между водой (50 мл) и этилацетатом (50 мл), после чего водный слой повторно экстрагируют этилацетатом (50 мл). Органический слой высушивают над Na2SO4, фильтруют и выпаривают при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (смесь ДХМ/МеОН в соотношении 99:1, затем 95:5), получая названное в заголовке соединение в виде желтого твердого вещества (0,800 г, 29%-ный выход).
МС (ЭСИ, m/z): 418,1 [М+Н+] для C22H31N3O5.
7.Н. 1-[(2R)-2-транс-(4-Аминоциклогексил)-2-гидроксиэтил]-7-метокси-1Н-хиноксалин-2-он
Исходя из промежуточного соединения (7.i) (0,8 г, 1,91 ммолей) названное в заголовке соединение получают в виде желтоватой пены (0,175 г, 29%-ный выход), используя метод примера 1, стадия l.iii.
МС (ЭСИ, m/z): 318,1 [М+Н+] для C17H23N303.
7.iii. 1-((2R)-2-{4-[(2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-илметил)амино]циклогексил}-2-гидроксиэтил)-7-метокси-1Н-хиноксалин-2-он
Исходя из промежуточного соединения (7.и) (0,193 г, 0,608 ммолей) и 2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-карбальдегида (0,101 г, 1 экв.) названное в заголовке соединение получают в виде грязно-белой пены (0,178 г, 63%-ный выход), используя метод примера 1, стадия 1.iv. Сырой продукт очищают с помощью колоночной хроматографии (смесь ДХМ/МеОН в соотношении 93:7, содержащая 0,7% водного раствора NH4OH).
1H ЯМР (ДМСОd6) δ: 8,03 (s, 1Н); 8,01 (s, 1Н); 7,73 (d, J=8,8 Гц, 1Н); 7,08 (d, J=2,5 Гц, 1Н); 6,98 (dd, J=2,5, 8,8 Гц, 1Н); 4,76 (d, J=5,8 Гц, 1Н); 4,32-4,36 (m, 2Н); 4,28-4,30 (m, 2Н); 4,25 (частично перекрывающийся dd, J=3,5, 14,1 Гц, 1Н); 4,16 (dd, J=9,0, 14,1 Гц, 1Н); 3,89 (s, 3H); 3,69 (s, 2Н); 3,63 (m, 1Н); 2,32 (m, 1Н); 2,07 (расширенный s, 1Н); 1,88-1,99 (m, 4Н); 1,72 (m, 1Н); 1,41 (m, 1Н); 0,97-1,27 (m, 4Н).
МС (ЭСИ, m/z): 467,2 [М+Н+] для C25H30N405.
Пример 8: 1-((2S)-2-{(2S,5R)-5-[(6,7-дигидро-8-окса-5-тиа-1,2-диазанафталин-3-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-7-метокси-1H-[1,8]нафтиридин-2-он
Исходя из промежуточного соединения (1.ii) (0,1 г, 0,31 ммолей) и 6,7-дигидро-8-окса-5-тиа-1,2-диазанафталин-3-карбальдегида (0,057 г, 1 экв. получен согласно WO 2009/000745), названное в заголовке соединение получают в виде белой пены (0,020 г, 14%-ный выход), используя метод примера 1, стадия 1.iii. Сырой продукт очищают с помощью колоночной хроматографии (смесь ДХМ/МеОН в соотношении 93:7, содержащая 0,7% водного раствора NH4OH).
1H ЯМР (ДМСОd6) δ: 8,01 (d, J=8,5 Гц, 1Н); 7,82 (d, J=9,4 Гц, 1Н); 7,52 (s, 1Н); 6,68 (d, J=8,5 Гц, 1Н); 6,46 (d, J=9,4 Гц, 1H); 4,64 (dd, J=8,5, 12,6 Гц, 1Н); 4,53-4,59 (m, 2Н); 4,37 (d, J=6,7 Гц, 1Н); 4,31 (dd, J=3,8, 12,6 Гц, 1Н); 3,88-3,94 (m, 2Н); 3,93 (s, 3H); 3,78-3,83 (m, 2Н), 3,25-3,31 (m, 2Н); 3,17 (m, 1Н); 2,88 (t, J=10,3 Гц, 1Н); 2,43 (m, 1Н); 2,21 (m, 1Н); 1,99 (m, 1Н); 1,47-1,62 (m, 2Н); 1,17 (m, 1Н).
МС (ЭСИ, m/z): 486,4 [М+Н+] для C23H27N5O5S.
Пример 9: 1-((25)-2-Гидрокси-2-{(2S,5R)-5-[(3-окса-1-тиа-5-азаиндан-6-илметил)амино]тетрагидропиран-2-ил}этил)-7-метокси-1H-[1,8]нафтиридин-2-он
Исходя из промежуточного соединения (1.ii) (0,884 г, 2,77 ммолей) и [1,3]оксатиоло[5,4-с]пиридин-6-карбальдегида (получен по описанию в WO 2006/002047; 0,463 г, 1 экв.) названное в заголовке соединение получают в виде белой пены (0,5 г, 38%-ный выход), используя метод примера 1, стадия 1.iii. Сырой продукт очищают с помощью колоночной хроматографии (смесь ДХМ/МеОН в соотношении 93:7, содержащая 0,7% водного раствора NH4OH).
1H ЯМР (ДМСОd6) δ: 8,01 (d, J=8,5 Гц, 1Н); 7,96 (s, 1Н); 7,82 (d, J=9,4 Гц, 1Н); 7,40 (s, 1Н); 6,68 (d, J=8,5 Гц, 1Н); 6,46 (d, J=9,4 Гц, 1Н); 5,81 (s, 2Н); 4,65 (dd, J=9,1, 12,9 Гц, 1Н); 4,36 (d, J=6,7 Гц, 1Н); 4,31 (dd, J=4,4, 12,9 Гц, 1Н); 3,90-3,93 (m, 2Н); 3,93 (s, 3H); 3,63-3,74 (m, 2Н), 3,16 (m, 1Н); 2,88 (t, J=10,5 Гц, 1Н); 2,43 (m, 1Н); 1,95-2,08 (m, 2Н); 1,44-1,65 (m, 2Н); 1,19 (m, 1Н)
МС (ЭСИ, m/z): 471,3 [М+Н+] для C23H26N4O5S.
Пример 10: 3-Фтор-1-((2S)-2-гидрокси-2-{(2S,5R)-5-[(3-окса-1-тиа-5-азаиндан-6-илметил)амино]тетрагидропиран-2-ил}этил)-7-метокси-1H-[1,8]нафтиридин-2-он
10.i. 7-Хлор-3-фтор-1,8-нафтиридин-2(1Н)-он
К раствору N-(6-хлор-3-формилпиридин-2-ил)пиваламида (получен по описанию в J. Org. Chem. (1990), 55, 4744; 3,0 г, 12,64 ммолей) в MeCN (250 мл) добавляют триэтил-2-фторфосфоноацетат (4 г, 16,51 ммолей), хлорид лития (0,935 г) и ДБУ (2,8 мл, 18,7 ммолей), после чего смесь перемешивают при комнатной температуре в течение 4 ч. Растворитель выпаривают, а остаток распеределяют между 1-нормальным раствором HCl (100 мл) и эфиром (150 мл). Водный слой экстрагируют эфиром (100 мл) и объединенные эфирные экстракты высушивают над Na2SO4, фильтруют и концентрируют без досушивания. Остаток переносят в диоксан (15 мл) и добавляют 6-нормальный раствор HCl (50 мл), затем смесь нагревают с обратным холодильником в течение 90 мин, охлаждают до температуры 0°C и летучую фракцию удаляют в вакууме. Твердую часть отфильтровывают, промывают водой и высушивают в вакууме, получая названное в заголовке соединение в виде желтого твердого вещества (1,38 г, 56%-ный выход) с чистотой, составляющей только 70%.
МС (ЭСИ, m/z): 199,1 [М+Н+] для C8H4N2OClF.
10.ii. 3-Фтор-7-метокси-1,8-нафтиридин-2(1Н)-он
Раствор промежуточного соединения (10.i) (1,38 г, 6,95 ммолей) в растворе MeONa в МеОН (25%-ный, 40 мл) нагревают с обратным холодильником в течение 90 мин. Реакционную смесь затем охлаждают до температуры 0°C и добавляют к ней 2-нормальный раствор HCl (10 мл). Летучую фракцию удаляют в вакууме, а твердую часть отфильтровывают и высушивают в вакууме, получая названное в заголовке соединение в виде бежевого твердого вещества (1,0 г, 74%-ный выход) с чистотой, составляющей только 75%.
МС (ЭСИ, m/z): 195,2 [М+Н+] для C9H7N2O2F.
10.iii. 1-((2S)-2-((2S,5R)-5-Аминотетрагидро-2Н-пиран-2-ил)-2-гидроксиэтил)-3-фтор-7-метокси-1,8-нафтиридин-2(1Н)-он
Исходя из промежуточного соединения (10.и) (1,0 г) и соединения эксперимента A (1,51 г, 6,24 ммолей) названный в заголовке амин (0,13 г) получают в виде белого твердого вещества, используя методы примера 1, стадия 1.i (раскрытие эпоксида, 7%-ный выход) и стадии 1.ii (удаление Бок-защитной группы, 94%-ный выход). При необходимости сырой продукт очищают с помощью колоночной хроматографии, используя соответствующую смесь растворителей.
1H ЯМР (CDCl3) 5: 7,73 (d, J=8,5 Гц, 1Н); 7,35 (d, J=8,8 Гц, 1H); 6,69 (d, J=8,5 Гц, 1H); 4,90 (dd, J=9,0, 13,2 Гц, 1H); 4,67 (dd, J=4,2, 13,2 Гц, 1H); 3,93-4,03 (m, 2H); 4,01 (s, 3H); 3,38 (dt, J=2,9, 10,8 Гц, 1H); 3,04 (t, J=10,5 Гц, 1H); 2,82 (m, 1H); 2,09 (m, 1H); 1,65-1,86 (m, 2H); 1,36 (расширенный s, 3H); 1,27 (m, 1H).
МС (ЭСИ, m/z): 338,3 [M+H+] для C16H20N3O4F.
10.iv. 3-Фтор-1-((2S)-2-гидрокси-2-{(2S,5R)-5-[(3-окса-1-тиа-5-азаиндан-6-илметил)амино]тетрагидропиран-2-ил}этил)-7-метокси-1Н-[1,8]нафтиридин-2-он
Исходя из промежуточного соединения (10.iii) (0,130 г, 0,407 ммолей) и [1,3]оксатиоло[5,4-с]пиридин-6-карбальдегида (0,068 г, 1,0 экв.) названное в заголовке соединение получают в виде белой пены (0,03 г, 15%-ный выход), используя метод примера 1, стадия 1.iii. Сырой продукт очищают с помощью колоночной хроматографии (смесь ДХМ/МеОН в соотношении 93:7, содержащая 0,7% водного раствора NH4OH).
1H ЯМР (ДМСОd6) δ: 8,01 (d, J=8,5 Гц, 1Н); 7,97 (s, 1Н);,7,83 (d, J=10,0 Гц, 1H); 7,41 (s, 1Н); 6,76 (d, J=8,5 Гц 1H); 5,80 (s, 2Н); 4,72 (dd, J=9,0, 12,6 Гц, 1Н); 4,48 (d, J=6,4 Гц, 1Н); 4,31 (dd, J=4,1, 12,6 Гц, 1Н); 3,89-3,97 (m, 2Н); 3,93 (s, 3H); 3,64-3,74 (m, 2Н); 3,19 (m, 1Н); 2,90 (t, J=10,5 Гц, 1Н); 2,43 (перекрывающийся m, 1Н); 2,01 (m, 1Н); 1,90 (m, 1Н); 11,44-1,63 (m, 2Н); 1,18 (m, 1H).
МС (ЭСИ, m/z): 489,5 [М+Н+] для C23H25N4O5FS.
Пример 11: 4-{{2S)-2-{(2S,5Л)-5-[(2,3-дигидро-4-окса-1-тиа-6-азанафталин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-6-метокси-4H-пиридо[2,3-b]пиразин-3-он
11.i. 4-((2S)-2-((2S,5R)-5-Аминотетрагидро-2Н-пиран-2-ил)-2-гидроксиэтил)-6-метоксипиридо[2,3-b]пиразин-3(4Н)-он
Исходя из 6-метоксипиридо[2,3-b]пиразин-3(4H)-она (получен по описанию в WO 2008/128942; 1,58 г, 8,97 ммолей) и соединения эксперимента A (2,35 г, 9,68 ммолей) названный в заголовке амин получают в виде белого твердого вещества (2,41 г), используя методы примера 1, стадия 1.i (раскрытие эпоксида, 48%-ный выход) и стадия 1.ii (удаление Бок-защитной группы, 91%-ный выход). При необходимости сырой продукт очищают с помощью колоночной хроматографии, используя соответствующую смесь растворителей.
МС (ЭСИ, m/z): 321,3[М+Н+] для C15H20N4O4.
11.ii. 4-((2S)-2-((2S,5R)-5-[(2.3-Дигидро-4-окса-1-тиа-6-азанафталин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-6-метокси-4Н-пиридо[2,3-b]пиразин-3-он
Исходя из промежуточного соединения (11.i) (0,160 г, 0,5 ммолей) и 2,3-дигидро[1,4]оксатиино[2,3-с]пиридин-7-карбальдегида (0,092 г, 1,0 экв.) названное в заголовке соединение получают в виде желтого твердого вещества (0,035 г, 15%-ный выход), используя метод примера 1, стадия 1.iii. Сырой продукт очищают с помощью колоночной хроматографии (смесь ДХМ/МеОН в соотношении 93:7, содержащая 0,7% водного раствора NH4OH). Соединение затем тритурируют в ТБМЭ.
1H ЯМР (ДМСОd6) δ: 8,09 (d, J=8,5 Гц, 1Н); 8,07 (s, 1Н); 7,92 (s, 1Н); 7,13 (s, 1Н); 6,79 (d, J=8,5 Гц, 1Н); 4,59-4,63 (m, 2Н); 4,33-4,38 (m, 2Н); 4,21 (dd, J=3,8, 12,3 Гц, 1Н); 3,87-4,01 (m, 2Н); 3,95 (s, 3H); 3,59-3,70 (m, 2Н);,3,21-3,26 (m, 2Н); 3,21 (перекрывающийся m, 1Н); 2,89 (t, J=10,5 Гц, 1Н); 2,42 (m, 1Н); 1,95-2,07 (m, 2Н); 1,43-1,64 (m, 2Н); 1,18 (m, 1Н).
МС (ЭСИ, m/z): 486,4 [М+Н+] для C23H27N5O5S.
Пример 12: 4-((2S)-2-{(2S,5R)-5-[(6,7-Дигидро-8-окса-5-тиа-1,2-диазанафталин-3-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-6-метокси-4H-пиридо[2,3-b]пиразин-3-он
12.i. 4-((2S)-2-((2S,5R)-5-(((6,7-Дигидро[1,4]оксатиино[2,3-с]пиридазин-3-ил)метил)амино)тетрагидро-2Н-пиран-2-ил)-2-гидроксиэтил)-6-метокси-1,2-дигидропиридо[2,3-b]пиразин-3(4Н)-он
Исходя из промежуточного соединения (11.i) (0,205 г, 0,644 ммолей) и 6,7-дигидро-8-окса-5-тиа-1,2-диазанафталин-3-карбальдегида (0,119 г, 1,0 экв.) названное в заголовке соединение получают в виде желтого твердого вещества (0,120 г, 38%-ный выход), используя метод примера 1, стадия 1.iii. Сырой продукт очищают с помощью колоночной хроматографии (смесь ДХМ/МеОН в соотношении 93:7, содержащая 0,7% водного раствора NH4OH). Соединение затем тритурируют в ТБМЭ.
МС (ЭСИ, m/z): 489,6 [М+Н+] для C22H28N6O5S.
12.ii. 4-((2S)-2-{(2S,5R)-5-[(6,7-Дигидро-8-окса-5-тиа-1,2-диазанафталин-3-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-6-метокси-4Н-пиридо[2,3-b]пиразин-3-он
К раствору промежуточного соединения (12.i) (0,1 г, 0,226 ммолей) в ДХМ (2,5 мл) и МеОН (0,5 мл) добавляют MnO2 (0,039 г, 0,451 ммолей), после чего смесь перемешивают при комнатной температуре в течение 1,5 ч. Реакционную смесь затем фильтруют и фильтрат концентрируют без досушивания. Остаток очищают с помощью колоночной хроматографии (смесь ДХМ/МеОН в соотношении 93:7, содержащая 0,7% водного раствора NH4OH), получая названное в заголовке соединение в виде желтоватой пены (0,076 г, 70%-ный выход).
1H ЯМР (ДМСОD6) δ: 8,09 (d, J=8,5 Гц, 1Н); 8,07 (s, 1Н); 7,53 (s, 1Н); 6,79 (d, J=8,5 Гц, 1Н); 4,53-4,63 (m, 4Н); 4,21 (dd, J=4,1, 12,6 Гц, 1Н); 3,87-4,01 (m, 2Н); 3,95 (s, 3H); 3,76-3,86 (m, 2Н); 3,25-3,30 (m, 2Н); 3,21 (m, 1Н); 2,89 (t, J=10,3 Гц, 1Н); 2,42 (m, 1Н); 1,95-2,07 (m, 2Н); 1,43-1,64 (m, 2Н); 1,18 (m, 1Н).
МС (ЭСИ, m/z): 487,56 [М+Н+] для C22H26N6O5S.
Пример 13: 5-((2S)-2-{(2S,5R)-5-[(2,3-Дигидро[1,4]диоксино[2,3-с]пиридин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-3-метокси-5H-пиридо[2,3-b]пиразин-6-он
13.1. 5-((28S)-2-((2S,5R)-5-Аминотетрагидро-2Н-пиран-2-ил)-2-гидроксиэтил)-3-метоксипиридо[2,3-b]пиразин-6(5Н)-он
Исходя из 3-метоксипиридо[2,3-b]пиразин-6(5H)-она (получен по описанию в WO 2009/087153; 0,6 г, 3,40 ммолей) и соединения эксперимента A (0,83 г, 3,40 ммолей) названный в заголовке амин получают в виде желтоватой пены (0,173 г), используя методы примера 1, стадия 1.i (раскрытие эпоксида, 80%-ный выход) и стадия 1.ii (удаление Бок-защитной группы, 21%-ный выход). При необходимости сырой продукт очищают с помощью колоночной хроматографии, используя соответствующую смесь растворителей.
1H ЯМР (ДМСОD6) δ: 8,18 (s, 1H); 7,90 (d, J=9,7 Гц, 1Н); 6,68 (d, J=9,7 Гц, 1Н); 4,62 (dd, J=8,8, 12,9 Гц, 1Н); 4,48 (расширенный d, J=5,9 Гц, 1Н); 4,25 (dd, J=4,4, 12,9 Гц, 1Н); 4,01 (s, 3H); 3,91 (m, 1Н); 3,76 (m, 1Н); 3,14 (m, 1H); 2,80 (t, J=10,5 Гц, 1H); 2,55 (m, 1H); 1,89 (m, 1H); 1,50-1,68 (m, 4H); 1,14 (m, 1H).
МС (ЭСИ, m/z): 321,1 [M+H+] для C15H20N4O4.
13.ii. 5-((2S)-2-{(2S,5R)-5-[(2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-3-метокси-5Н-пиридо[2,3-b]пиразин-6-он
Исходя из промежуточного соединения (13.i) (0,084 г, 0,261 ммолей) и 2,3-дигидро[1,4]диоксино[2,3-с]пиридин-7-карбальдегида (0,043 г, 1,0 экв.) названное в заголовке соединение получают в виде желтоватой пены (0,057 г, 47%-ный выход), используя метод примера 1, стадия l.iii. Сырой продукт очищают с помощью колоночной хроматографии (смесь ДХМ/МеОН в соотношении 93:7, содержащая 0,7% водного раствора NH4OH).
1H ЯМР (ДМСОd6) δ: 8,17 (s, 1Н); 7,98 (s, 1Н); 7,90 (d, J=9,7 Гц, 1Н); 6,90 (s, 1H); 6,68 (d, J=9,7 Гц, 1H); 4,61 (dd, J=8,8, 12,6 Гц, 1Н); 4,48 (d, J=6,7 Гц, 1Н); 4,30-4,34 (m, 2Н); 4,24-4,28 (m, 2Н); 4,24 (dd, J=4,1, 12,6 Гц, 1Н); 3,99 (s, 3H); 3,93-3,85 (m, 2Н); 3,60-3,70 (m, 2Н); 3,18 (m, 1Н); 2,88 (t, J=10,5 Гц, 1Н); 2,41 (m, 1H); 2,06 (расширенный s, 1Н); 1,99 (m, 1Н); 1,44-1,62 (m, 2Н); 1,19 (m, 1Н).
МС (ЭСИ, m/z): 470,2 [М+Н+] для C23H27N5O6.
Пример 14: 5-((2S)-2-{(2S,5R)-5-[(2,3-дигидро-4-окса-1-тиа-6-азанафталин-7-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-3-метокси-5H-пиридо[2,3-b]пиразин-6-он
Исходя из промежуточного соединения (13.i) (0,096 г, 0,3 ммолей) и 2,3-дигидро[1,4]оксатиино[2,3-с]пиридин-7-карбальдегида (0,055 г, 1,0 экв.) названное в заголовке соединение получают в виде желтоватой пены (0,080 г, 55%-ный выход), используя метод примера 1, стадия 1.iii. Сырой продукт очищают с помощью колоночной хроматографии (смесь ДХМ/МеОН в соотношении 93:7, содержащая 0,7% водного раствора NH4OH).
МС (ЭСИ, m/z): 486,3 [М+Н+] для C23H27N5O5S.
Пример 15: 5-((S)-2-{(2S,5R)-5-[(6,7-Дигидро-8-окса-5-тиа-1,2-диазанафталин-3-илметил)амино]тетрагидропиран-2-ил}-2-гидроксиэтил)-3-метокси-5H-пиридо[2,3-b]пиразин-6-он
Исходя из промежуточного соединения (13.i) (0,115 г, 0,36 ммолей) и 6,7-дигидро[1,4]оксатиино[2,3-с]пиридазин-3-карбальдегида (0,066 г, 1,0 экв.) названное в заголовке соединение получают в виде желтоватой пены (0,056 г, 32%-ный выход), используя метод примера 1, стадия 1.iii. Сырой продукт очищают с помощью колоночной хроматографии (смесь ДХМ/МеОН в соотношении 93:7, содержащая 0,7% водного раствора NH4OH).
1H ЯМР (ДМСОd6) δ: 8,17 (s, 1Н); 7,90 (d, J=9,7 Гц, 1Н); 7,52 (s, 1Н); 6,68 (d, J=9,7 Гц, 1Н); 4,61 (перекрывающийся dd, J=8,8, 12,6 Гц, 1Н); 4,55-4,58 (m, 2Н); 4,49 (d, J=6,7 Гц, 1Н); 4,24 (dd, J=4,1, 12,6 Гц, 1Н); 3,99 (s, 3H); 3,85-3,94 (m, 2Н); 3,75-3,85 (m, 2Н); 3,25-3,31 (m, 2Н); 3,17 (m, 1Н); 2,87 (t, J=10,5 Гц, 1Н); 2,40 (m, 1Н); 2,21 (m, 1Н); 1,99 (m, 1Н); 1,45-1,61 (m, 2Н); 1,18 (m, 1Н).
МС (ЭСИ, m/z): 487,6 [М+Н+] для C22H26N6O5S.
Фармакологические свойства соединений по изобретению
Анализы методом in vitro
1) Минимальные концентрации ингибирования бактериального роста
Экспериментальные методы:
Минимальные концентрации ингибирования (MICs; мг/л) определялись в катион-регулируемой питательной среде Mueller-Hinton Broth (BBL) с использованием метода микроразбавления, описанного в "Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically", Approved Standard, 7th ed., Clinical and Laboratory Standards Institute (CLSI) Document M7-A7, Wayne, PA, USA, 2006.
Результаты:
Соединения всех примеров протестированы относительно воздействия на некоторые грамположительные и грамотрицательные бактерии.
Типичные результаты антибактериальных тестов представлены в нижеприведенной таблице (MIC в мг/л).
|
|
2) Блокирование hERG K+ каналов в условиях in vitro:
Принцип исследования
Индуцируемое лекарством пролонгирование QT интервала, вызывающее желудочковую аритмию, включая трепетание-мерцание желудочков, является вредным воздействием, которое наряду с применением других лекарственных средств, проявляется также и при использовании некоторых представителей различных классов противоинфекционных агентов. За последние годы имели место многочисленные случаи изъятия из торгового оборота, или приостановление на различных фазах клинических исследований антибактериальных средств именно благодаря их потенциальной способности проявлять угрожающую жизни токсичность. При этом противоинфекционные агенты заслуживают в этом отношении особого внимания, так как они используются в довольно высоких концентрациях, к чему часто добавляется усложненный лекарственный порядок их приема, когда полная информация относительно лекарственного режима отсутствует.
Некоторые противоинфекционные классы лекарственных средств, такие как макролиды и хинолоны, а также недавно открытый Viquidacin, который относится к тем же химических классам, что и соединения по настоящему изобретению, были вовлечены в исследование. В действительности, способность пролонгировать QT интервал часто варьируется среди представителей этих лекарственных классов, а потенциал для этого эффекта не может быть точно предсказуем при дизайне и разработке лекарственного средства. Наилучшим показателем является степень блокирования hERG К+канала. Хотя некоторые предсказующие модели hERG ингибирования были разработаны, в настоящее время нет ясной зависимости «структура-активность» для предсказания такого ингибирования. При создании изобретения было установлено, что комбинация двух особенностей настоящего изобретения приводит к соединениям с пониженной hERG склонностью при сохранении уровня антибактериальной активности.
Экспериментальные методы
hERG К+ каналы клонируют из человеческого сердца. Рекомбинантные каналы стабильно экспрессируют в СНО-К1 клетках (CHOhERG). Эти клетки были получены от bSys GmbH (СН-4052 Basel, Switzerland) и выращены в 150 мл колбах для клеточного культивирования при температуре 37°C в 5% CO2. Когда слияние клеток достигало ~100%, они расщеплялись 0,25%-ным трипсин-ЭДТК раствором и помещались в установку клеточного приготовления QPatch automated patch-clamp робота (фирма Sophion Bioscience A/S, 2750 Ballerup, Denmark). Потоки через hERG K+ каналы (IKhERG) выявлялись с помощью буферных растворов и протокола напряжения:
- экстрацеллюлярный раствор (в мМ): [NaCl]=150; [KCl]=4; [СаСl2]=1,2; [MgCl2]=1; [HEPES]=10; величина pH, доведенная до 7,4 с помощью NaOH;
- интрацеллюлярный раствор (в мМ): [KCl]=140; [NaCl]=10; [MgCl2]=1; [HEPES]=10; [EGTA]=5; [Mg-ATP]=5; [Na3-GTP]=0,1; величина pH, доведенная до 7,2 с помощью КОН;
- протокол напряжения: остаточный потенциал составлял -80 мV, а частота стимулирования равнялась 0,1 Гц. hERG К+ потоки измерялась в виде величины среднего потока в течение последних 20 мин 500-минутного импульса до -40 мV минус величина среднего потока в течение последних 20 мин 50-минутного импульса до -40 mV.
После стабилизации клеток в течение нескольких минут и устойчивости потоков амплитуда IKhERG регистрировалась в контрольных условиях. Затем с помощью QPatch робота испытывались тестируемые соединения в отношении воздействия на клетки при тестируемых концентрациях. После 4-минутного стимулирования амплитуда IKhERG регистрировалась в условиях тестирования. Соотношение двух амплитуд использовалось для определения фракционального блока, и средний блок на двух клетках использовался, чтобы оценить эффект данной концентрации (например, 10 мкМ). Если для данного тестируемого соединения было протестировано достаточное количество концентраций, рассчитывались очевидные значения IC50 для ингибирования IKhERG.
Результаты
Тестируемые соединения, имеющие формулу ICOMP, представленную ниже,
с использованием экспериментальных методов, описанных выше, для MIC относительно S.aureus А798 бактерии и для блокирования hERG К+ каналов в условиях in vitro, показали результаты, суммированные в приведенной ниже таблице 2.
|
Другие соединения примеров были также протестированы в условиях in vitro в отношении блокирования hERG К+ аналов. Результаты этих тестов представлены в приведенной ниже таблице 3.
|