Результат интеллектуальной деятельности: ЦИКЛИЧЕСКИЕ (АЗА) ИНДОЛИЗИНКАРБОКСАМИДЫ, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ
Вид РИД
Изобретение
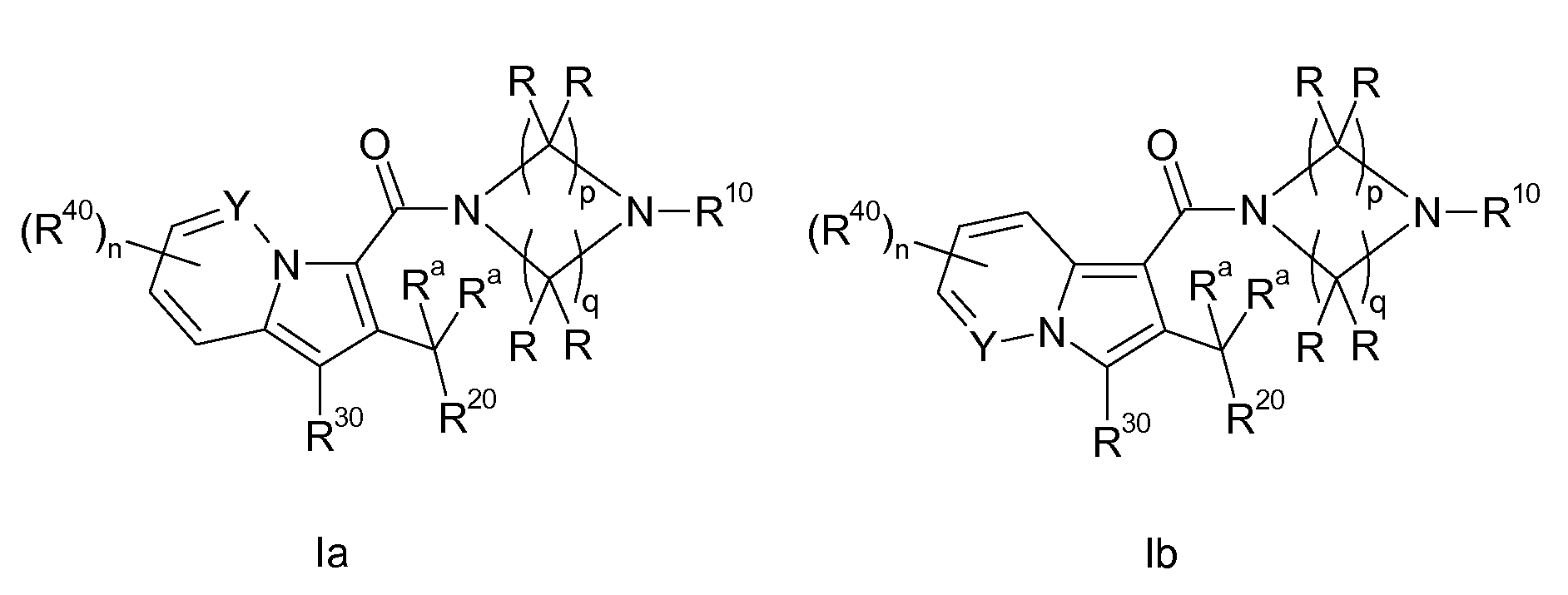
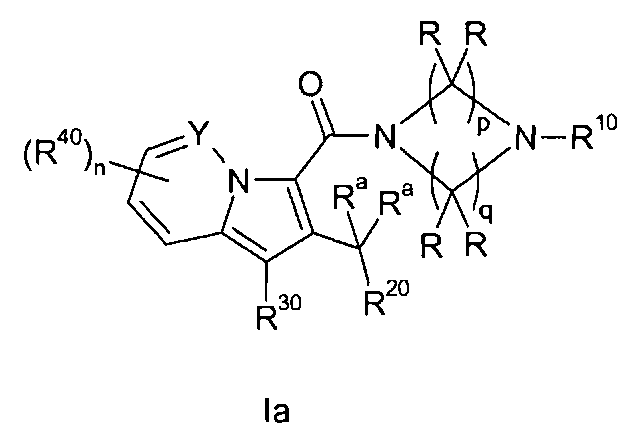
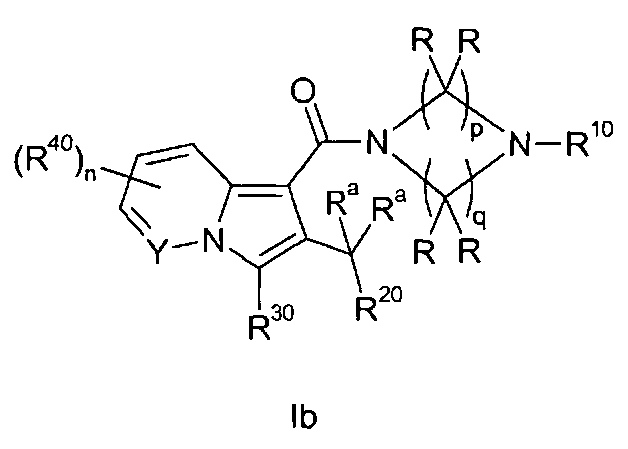
Настоящее изобретение относится к циклическим индолизинкарбоксамидам и азаиндолизинкарбоксамидам формулы Ia и Ib,
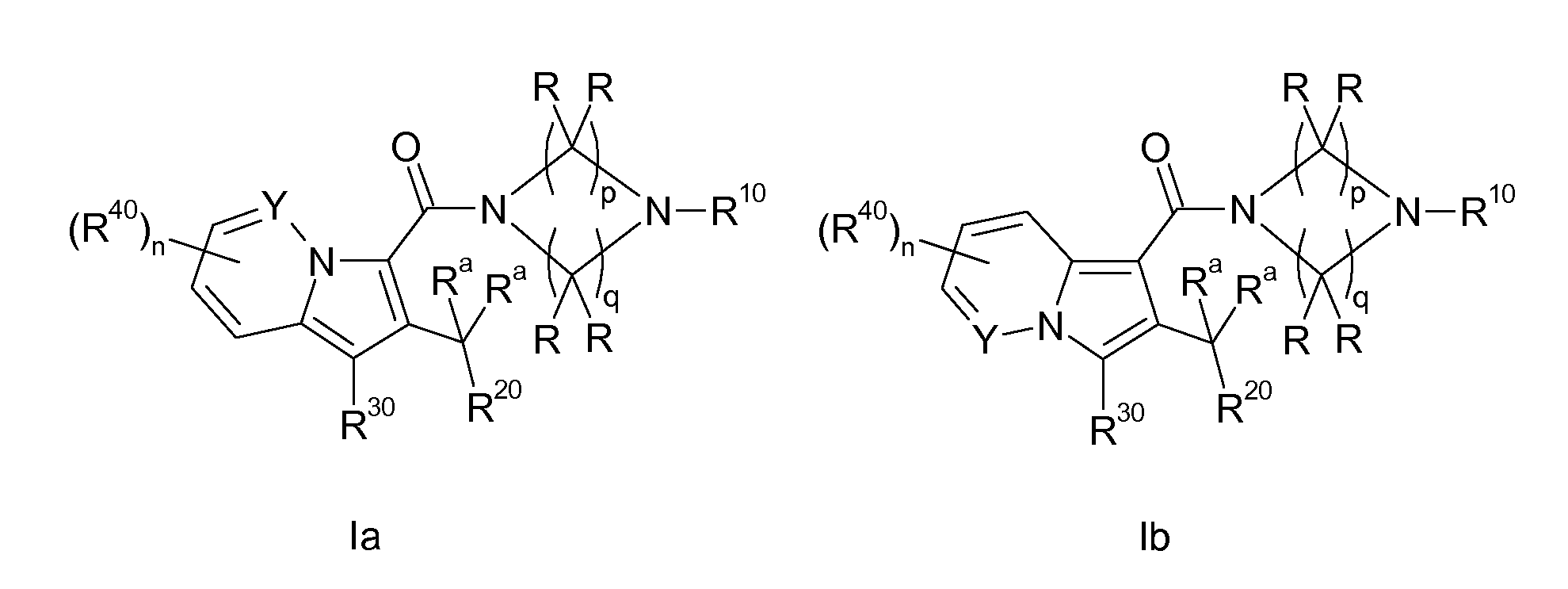
где R, Ra, R10, R20, R30, R40, Y, n, p и q имеют значения, указанные ниже, которые являются ценными фармацевтически активными соединениями. В частности, они ингибируют фермент ренин и модулируют активность системы ренин-ангиотензин и являются полезными для лечения заболеваний, таких как, например, гипертензия. Настоящее изобретение, кроме того, относится к способам получения соединений формул Ia и Ib, их применению и включающим их фармацевтическим композициям.
Система ренин-ангиотензин (RAS; также указываемая как ренин-ангиотензин альдостероновая система, RAAS) является ключевым регулятором сердечно-сосудистых функций, а также необходнима для баланса электролитов и для поддержания объема жидкостей организма и является определяющей для кровяного давления (см., например, E. Lonn, Can. J. Cardiol. 20 (Suppl. B) (2004), 83B; I. A. Reid, Am. J. Physiol.: Advances in Physiology Education 20 (1998), S236). Она действует через эффекты ангиотензина II, октапептидного гормона, который связывается с ангиотензиновыми рецепторами. Образование ангиотензина II включает две основные стадии. На первой стадии ренин (EC 3.4.23.15; ранее EC 3.4.99.19 и EC 3.4.4.15), состоящий из 340 аминокислот аспарагинпротеиназа, расщепляет ангиотензиноген с образованием биологически неактивного декапептида ангиотензина I. На второй стадии, ангиотензин I преобразуется в ангиотензин II под действием цинк-зависимой протеазы ангиотензин-превращающего фермента (ACE). Ренин продуцируется в юкстагломерулярных клетках почек, изначально в форме биологически неактивного проренина. Его выделение из почки и активация и последующая активация RAS у людей с нормальным артериальным давлением стимулируется натрием или уменьшением объема, или путем снижения кровяного давления.
Активность RAS является основным определяющим фактором некоторых патологических состояний, поскольку ангиотензин II, основная эффекторная молекула этой системы, повышает кровяное давление как непосредственно путем артериальной вазоконстрикции, так и опосредованно путем высвобождения натрий-сберегающего гормона - альдостерона - из надпочечников, сопровождаемое повышением объема внеклеточной жидкости, а также ускоряющими рост эффектами на сосудистую, сердечную и почечную ткани, что способствует конечному поражению органов.
Фармакологическая блокада RAS представляет собой общепринятый метод лечения различных заболеваний, например гипертензии (см., например, Handbook of Hypertension, W. H. Birkenhager et al. (ed.), Elsevier Science Publishers, Amsterdam (1986), vol. 8, 489). Однако терапевтический ответ, достигаемый используемыми в настоящее время типами блокаторов RAS, ингибиторами ACE и блокаторами ангиотензинового рецептора, хотя и является эффективным, тем не менее ограничен. Это может быть из-за повышения уровня ренина, индуцируемого этими средствами, и приводит к повышению уровня ангиотензина I, который может быть преобразован в ангиотензин II через другие пути, а не посредством ACE. Ингибирование ренина, который контролирует начальную и ограничивающую скорость стадию в RAS, катализируя расщепление Leu10-Val11 пептидной связи ангиотензиногена, приводящее к образованию пептидов ангиотензина, будет ингибировать всю систему RAS и, таким образом, будет более эффективным. Кроме того, поскольку ингибирование ACE также влияет на уровень других пептидов, которые расщепляются посредством ACE, таких как, например, брадикинин, что связано с побочными эффектами ингибиторов ACE, такими как кашель или ангионевротический отек, ренин является специфическим, поскольку ангиотензиноген является его единственным природным субстратом. Ингибирование ренина, таким образом, предлагает специфический и действенный путь снижения кровяного давления (см. M. Moser et al., J. Clin. Hypertension, 9 (2007), 701), а также обеспечения защиты органов, таких как сердце, почки и головной мозг и, кроме того, лечения гипертензии, таким образом, является полезным для лечения расстройств сердечно-сосудистой системы, таких как паралич сердца, сердечная слабость, сердечная недостаточность, инфаркт миокарда, гипертрофия сердца, сосудистая гипертрофия, левожелудочковая недостаточность, в частности левожелудочковая недостаточность после инфаркта миокарда, рестеноз и стенокардия; почечных заболеваний, таких как почечный фиброз, почечная недостаточность и почечная недостаточность; диабетических осложнений, таких как нефропатия и ретинопатия; глаукомы и церебральных нарушений, таких как внутримозговое кровоизлияние, например (что касается эффекта RAS на почечные заболевания и сердечные расстройства, см., например, U. C. Brewster, Am. J. Med. 116 (2004), 263; J. Gaedeke et al., Expert Opin. Pharmacother. 7 (2006), 377; B. Pilz et al., Hypertension 46 (2005), 569).
Большое количество пептидных и пептидомиметических ингибиторов человеческого ренина с различными стабильными аналогами переходного состояния расщепляемой пептидной связи было разработано начиная примерно с 1980 года, и они способствовали признанию ренина как терапевтической мишени (см., например, B. B. Scott et al., Curr. Protein Pept. Sci. 7 (2006), 241; J. Maibaum et al., Expert Opin. Ther. Patents 13 (2003), 589). Однако эти соединения, как правило, страдают недостатками, такими как недостаточная биодоступность (см. H. D. Kleinert, Cardiovasc. Drugs Therapy 9 (1985), 645), или продолжительность действия, или высокая стоимость их производства. Недавно поступил на рынок перорально активный ингибитор ренина алискирен (см. Drugs Fut. 26 (2001), 1139; J. Wood et al., J. Hypertens. 23 (2005), 417; M. Azizi et al., J. Hypertens. 24 (2006), 243). Но профиль свойств алискерина все же не идеальный, например, что касается его пероральной биодоступности, и особенным недостатком алискирена является его сложная молекулярная структура с четырьмя хиральными центрами и его многостадийный синтез. Таким образом, все еще существует большая потребность в новых непептидных малых молекулах - ингибиторах ренина, которые демонстрируют благоприятные свойства, например, относящиеся к пероральной биодоступности, или имеют не очень сложную молекулярную структуру, и которые легко синтезировать. Настоящее изобретение удовлетворяет этим потребностям, обеспечивая ренин-ингибирующие циклические (аза)индолизинкарбоксамиды формул Ia и Ib.
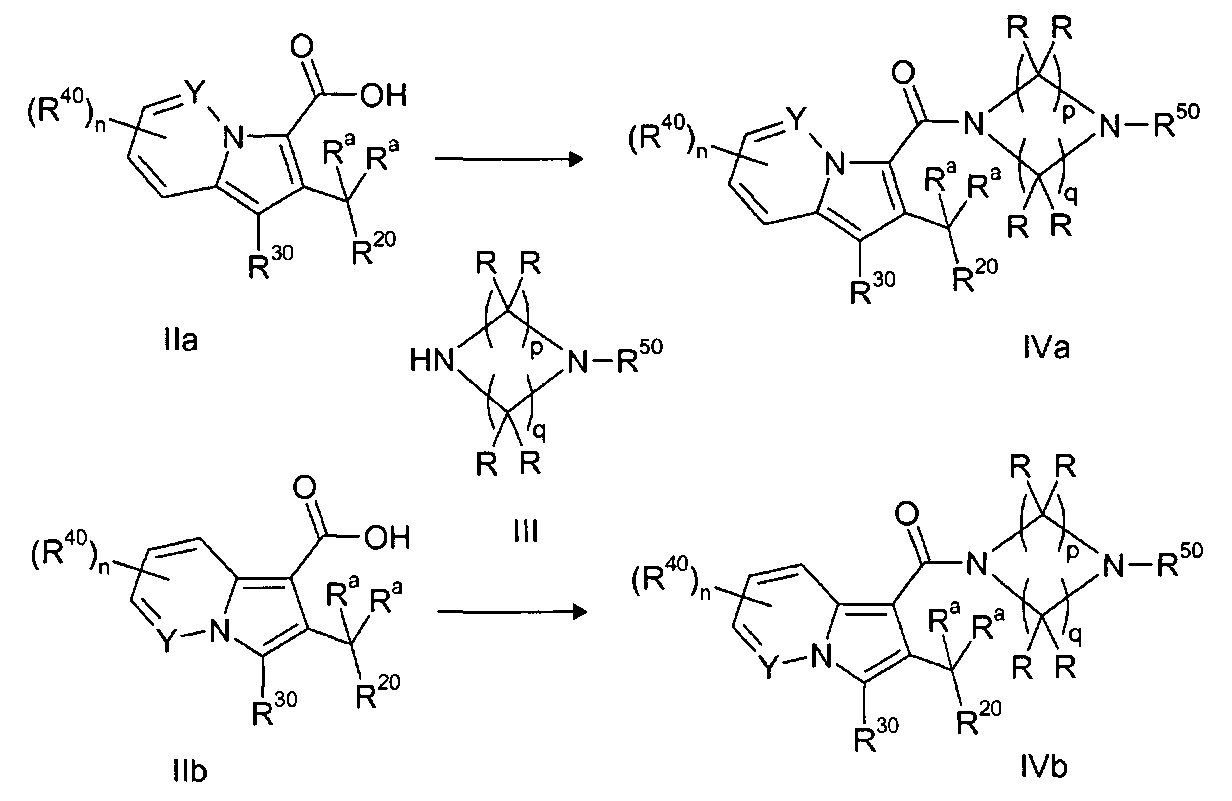
Ранее уже были описаны различные индолизиновые и азаиндолизиновые производные. Например некоторые индолизиновые производные, т.е. соединения, содержащие бициклическую кольцевую систему, которая присутствует в соединениях формул Ia и Ib в случае, когда Y представляет собой атом углерода, описаны в WO 2004/054507, который относится к ингибиторам PDE4, полезным для лечения заболеваний, таких как рак или воспалительные расстройства, или в WO 2006/136859, который относится к лигандам CRTH2 рецептора, полезным для лечения респираторных заболеваний. Некоторые 5-азаиндолизиновые или пирроло[1,2-b]пиридазиновые производные, т.е. соединения, содержащие бициклическую кольцевую систему, которая присутствует в соединениях формул Ia и Ib в случае, когда Y представляет собой атом азота, описаны в EP 1085021, который относится к ингибиторам SPLA2, полезным для лечения заболеваний, таких как септический шок или респираторный дистресс-синдром взрослых, или в WO 2005/030144, который относится к ингибиторам протеинкиназ, полезный для лечения пролиферативных расстройств, таких как рак, и воспалительных расстройств. Индолизинкарбоксамиды и азаиндолизинкарбоксамиды по настоящему изобретению, где атом азота амида представляет собой кольцевой член 1,4- или 1,5-диазациклоалкановой кольцевой системы, один из атомов углерода в 5-членном кольце (аза)индолизиновой кольцевой системы, который является смежным с положением слияния, содержит циклическую группу, и атом углерода в 5-членном кольце (аза)индолизиновой кольцевой системы, который не является смежным с положениями слияния, связан через атом углерода с (гетеро)ароматической группой, до сих пор не были раскрыты.
Таким образом, объектом настоящего изобретения являются соединения формул Ia и Ib, в любой из их стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении и их физиологически приемлемые соли и физиологически приемлемые сольваты любой из таких форм,
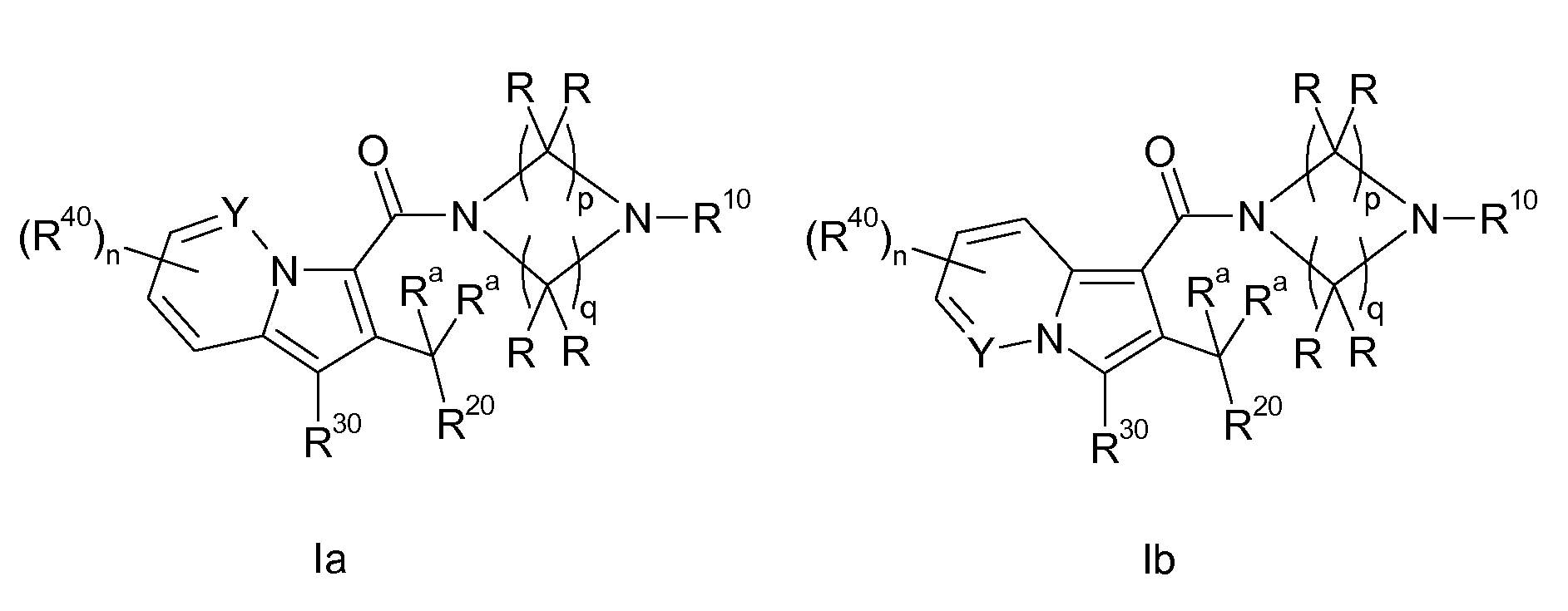
где Ra выбран из водорода, фтора и (C1-C4)-алкил, где две группы Ra являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга или две группы Ra вместе представляют собой двухвалентную (C2-C5)-алкильную группу;
R выбран из водорода, (C1-C6)-алкила, который необязательно замещен одним или несколькими одинаковыми или отличными друг от друга заместителями R1, и (C3-C7)-циклоалкила, где все группы R являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга, или две группы R, связанные с одним и тем же атомом углерода, вместе представляют собой двухвалентную (C2-C5)-алкильную группу;
R1 выбран из (C3-C7)-циклоалкила, фенила, гетероарила, Het1, гидрокси, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)m-, R2-N(R3)-C(O)-, R4-O-C(O)- и циано;
R2 выбран из водорода, (C1-C6)-алкила, который необязательно замещен одним или несколькими одинаковыми или отличными друг от друга заместителями R5, и (C3-C7)-циклоалкила, где все группы R2 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
R3, R4, R6, R7 и R8 выбраны из водорода и (C1-C4)-алкила, где все группы R3, R4, R6, R7 и R8 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
R5 выбран из гидрокси, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)m-, R6-N(R7)-C(O)-, R8-O-C(O)-, циано, (C3-C7)-циклоалкила, фенила, гетероарила и Het1;
R10 выбран из водорода, (C1-C6)-алкил-O-C(O)- и (C3-C7)-циклоалкил- CvH2v-O-C(O)-;
R20 выбран из фенила и гетероарила, которые необязательно замещены одним или несколькими одинаковыми или отличными друг от друга заместителями, выбранными из галогена, (C1-C4)-алкила, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)m- и циано;
R30 выбран из (C5-C7)-циклоалкила, (C5-C7)-циклоалкенил, тетрагидропиранила, фенила и гетероарила, где циклоалкил и циклоалкенил необязательно замещены одним или несколькими одинаковыми или отличными друг от друга заместителями, выбранными из фтора, (C1-C4)-алкила и гидрокси, и фенил и гетероарил необязательно замещены одним или несколькими одинаковыми или отличными друг от друга заместителями, выбранными из галогена, (C1-C4)-алкила, (C1-C4)-алкил-O- и циано;
R40 выбран из галогена, (C1-C4)-алкила, (C3-C7)-циклоалкил-CvH2v-, гидрокси, (C1-C4)-алкил-O, (C1-C4)-алкил-S(O)m-, R41-N(R42)-, Het2, R41-N(R42)-C(O)-, Het2-C(O)-, циано, R41-N(R42)-S(O)2- и Het2-S(O)2-, где все заместители R40 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
R41 выбран из водорода, (C1-C4)-алкила и (C3-C7)-циклоалкил-CvH2v-, где все группы R41 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
R42 выбран из водорода и (C1-C4)-алкила, где все группы R42 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
Y выбран из N, CH и C((C1-C4)-алкил);
гетероарил представляет собой ароматическую моноциклическую, 5-членную или 6-членную гетероциклическую группу, которая включает 1, 2 или 3 одинаковых или отличных друг от друга кольцевых гетероатома, выбранных их N, O и S, где один из кольцевых атомов азота может содержать атом водорода или (C1-C4)-алкильный заместитель и где гетероарильная группа связана через кольцевой атом углерода;
Het1 представляет собой насыщенную моноциклическую 4-членную - 7-членную гетероциклическую группу, которая включает 1 или 2 одинаковых или отличных друг от друга кольцевых гетероатома, выбранных их N, O и S, где группа Het1 связана через кольцевой атом углерода или кольцевой атом азота, где кольцевые атомы азота могут содержать атом водорода или заместитель, выбранный из (C1-C4)-алкила, (C1-C6)-алкил-O-C(O)- и (C3-C7)-циклоалкил-CvH2v-O-C(O)-, где кольцевые атомы серы могут содержать одну или две оксогруппы и где Het1 необязательно замещен по кольцевым атомам углерода одним или несколькими одинаковыми или отличными друг от друга заместителями, выбранными из фтора, (C1-C4)-алкила и оксо;
Het2 представляет собой насыщенную моноциклическую 4-членную - 7-членную гетероциклическую группу, которая включает кольцевой атом азота, через который группа Het2 является связанной, и необязательно дополнительный кольцевой гетероатом, выбранный из N, O и S, где дополнительный кольцевой атом азота содержит атом водорода или заместитель, выбранный из (C1-C4)-алкила, (C1-C6)-алкил-O-C(O)- и (C3-C7)-циклоалкил-CvH2v-O-C(O)-, где кольцевой атом серы может содержать одну или две оксогруппы, и где Het2 необязательно замещен по кольцевым атомам углерода одним или несколькими одинаковыми или отличными друг от друга заместителями, выбранными из фтора, (C1-C4)-алкила и оксо;
m выбран из 0, 1 и 2, где все значения m являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
n выбран из 0, 1, 2 и 3;
p и q, которые являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга, выбраны из 2 и 3;
v выбран из 0, 1 и 2, где все значения v являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
где все алкильные группы независимо друг от друга необязательно замещены одним или несколькими атомами фтора;
где все циклоалкильные группы независимо друг от друга необязательно замещены одним или несколькими одинаковыми или отличными друг от друга заместителями, выбранными из фтора и (C1-C4)-алкила, если не указано иное;
где все фенильные и гетероарильные группы, присутствующие в R1 и R5 независимо друг от друга необязательно замещены одним или несколькими одинаковыми или отличными друг от друга заместителями, выбранными из галогена, (C1-C4)-алкила, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)2- и циано.
Если структурные элементы, такие как группы, заместители или числовые значения встречаются несколько раз в соединениях формул Ia и Ib, они все являются независимыми друг от друга и могут в каждом случае иметь любое из указанных значений и могут в каждом случае иметь значение одинаковое с любым другим таким элементом или отличное от него значение.
Алкильные группы, т.е. насыщенные углеводородные остатки, могут быть прямоцепочечными (линейными) или разветвленными. Это также применимо, когда такие группы являются замещенными или являются частью другой группы, например алкил-O-группы (алкилоксигруппа, алкоксигруппа) или алкил-S(O)m-группы. В зависимости от соответствующего определения, количество атомов углерода в алкильной группе может составлять 1, 2, 3, 4, 5 или 6. Примерами алкила являются метил, этил, пропил, включая н-пропил и изопропил, бутил, включая н-бутил, втор-бутил, изобутил и трет-бутил, пентил, включая н-пентил, 1-метилбутил, изопентил, неопентил и трет-пентил, и гексил, включая н-гексил, 3,3-диметилбутил и изогексил. Примерами группы алкил-O- являются метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, трет-бутокси и н-пентокси. Примерами группы алкил-S(O)m- являются метилсульфанил-(CH3-S-), метансульфинил-(CH3-S(O)-), метансульфонил-(CH3-S(O)2-), этилсульфанил-(CH3-CH2-S-), этансульфинил-(CH3-CH2-S(O)-), этансульфонил-(CH3-CH2-S(O)2-), 1-метилэтилсульфанил-((CH3)2CH-S-), 1-метилэтансульфинил-((CH3)2CH-S(O)-) и 1 -метилэтансульфонил-((CH3)2CH-S(O)2-). В одном варианте воплощения настоящего изобретения число m выбирают из 0 и 2, в другом варианте воплощения оно составляет 0, в другом варианте воплощения оно составляет 2, где все значения m являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга.
Замещенная алкильная группа может быть замещена в любых положениях, при условии что полученное соединение является достаточно стабильным и является подходящим в качестве фармацевтического активного соединения. Условие, чтобы конкретная группа и соединение формулы Ia или Ib были достаточно стабильными и подходящими в качестве фармацевтически активного соединения, в основном применимо ко всем группам в соединениях формул Ia и Ib. Если алкильная группа является необязательно замещенной одним или несколькими атомами фтора, она может быть незамещенной, т.е. не содержать атомы фтора, или замещенной, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 атомами фтора или 1, 2, 3, 4 или 5 атомами фтора или 1, 2 или 3 атомами фтора, которые могут присутствовать в любых положениях. Например, в фтор-замещенной алкильной группе одна или несколько метильных групп могут содержать три атома фтора каждая и могут присутствовать в виде трифторметильных групп, и/или одна или несколько метиленовых групп (CH2) могут содержать два атома фтора каждая, и могут присутствовать в виде дифторметиленовых групп. Объяснения, касающиеся замещения группы фтором, также применимы, когда группа дополнительно содержит другие заместители и/или является частью другой группы, например алкил-O- группы. Примерами фтор-замещенных алкильных групп являются трифторметил, 2-фторэтил, 1,1-дифторэтил, 2,2,2-трифторэтил, пентафторэтил, 3,3,3-трифторпропил, 2,2,3,3,3-пентафторпропил, 4,4,4-трифторбутил и гептафторизопропил. Примерами фтор-замещенных алкил-O-групп являются трифторметокси, 2,2,2-трифторэтокси, пентафторэтокси и 3,3,3-трифторпропокси. Примерами фтор-замещенных алкил-S(O)m-групп являются трифторметилсульфанил-(CF3-S-), трифторметансульфинил-(CF3-S(O)-) и трифторметансульфонил-(CF3-S(O)2-).
Если это является подходящим, представленные выше объяснения, касающиеся алкильных групп, применимы соответственного к двухвалентным алкильным группам (алкандиильным группам), включая двухвалентную алкильную группу CvH2v, которую также можно рассматривать как алкильную часть замещенной алкильной группы. Таким образом, двухвалентные алкильные группы, включая двухвалентную алкильную группу CvH2v, также могут быть линейными или разветвленными, связи со смежными группами могут присутствовать в любых положениях и могут начинаться от одного и того же атома углерода или от разных атомов углерода, и они могут быть замещены фтором. Примерами двухвалентных алкильных групп являются -CH2-, -CH2-CH2-, -CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH2-, -CH(CH3)-, -C(CH3)2-, -CH(CH3)-CH2-, -CH2-CH(CH3)-, -C(CH3)2-CH2- и -CH2-C(CH3)2-. Примерами фтор-замещенных двухвалентных алкильных групп, которые могут содержать 1, 2, 3, 4, 5 или 6 атомов фтора, например являются -CHF-, -CF2-, -CF2-CH2-, -CH2-CF2-, -CF2-CF2-, -CF(CH3)-, -C(CFs)2-, -C(CH3)2-CF2- и -CF2-C(CH3)2-. Если число v в двухвалентной алкильной группе CvH2v равно 0 (ноль), две смежные группы, которые связаны с этой группой, непосредственно связаны друг с другом через простую связь. Например, когда группа R40 представляет собой группу (C3-C7)-циклоалкил-CvH2v-, которая связана с остальной частью молекулы через CvH2v группу, как показано завершающей линией (дефис) на конце CvH2v группы, представляющей свободную связь, и число v в этой группе составляет 0, (C3-C7)-циклоалкильная группа связана непосредственно через простую связь с атомом углерода, который содержит группу R40. В одном варианте воплощения настоящего изобретения число v выбрано из 0 и 1, в другом варианте воплощения оно составляет 0, в другом варианте воплощения оно составляет 1, где все значения v являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга.
Количество кольцевых атомов углерода в циклоалкильной группе может быть 3, 4, 5, 6 или 7. Количество кольцевых атомов углерода в циклоалкенильной группе может составлять 5, 6 или 7. Примерами циклоалкила являются циклопропил, циклобутил, циклопентил, циклогексил и циклогептил, примерами циклоалкенила являются циклопентенил, циклогексенил и циклогептенил. Двойная связь в циклоалкенильной группе может присутствовать в любом положении относительно атома углерода в положении 1, через который группа связана с (аза)индолизиновым кольцом, и циклоалкенил, таким образом, может представлять собой, например, циклопент-1-енил, циклопент-2-енил, циклопент-3-енил, циклогекс-1-енил, циклогекс-2-енил, циклогекс-3-енил, циклогепт-1-енил, циклогепт-2-енил, циклогепт-3-енил, циклогепт-4-енил. В одном варианте воплощения настоящего изобретения циклоалкильная группа, такая как (C3-C7)-циклоалкил, в определении любой группы выбрана из любой одной или нескольких из указанных конкретных циклоалкильных групп, например из циклопропила и циклобутила, или из циклопропила, циклобутила и циклопентила, или из циклопропила, циклопентила и циклогексила, или из циклопентила и циклогексила, или из циклопентила, циклогексила и циклогептила, где все циклоалкильные группы являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга. Подобным образом, в одном варианте воплощения циклоалкенильная группа выбрана из любой одной или нескольких из указанных конкретных циклоалкенильных групп, например из циклопентенила и циклогексенила, или из циклогексенила и циклогептенила, или из циклопент-1-енила, циклопент-2-енила, циклогекс-1-енила, циклогекс-2-енила, циклогепт-1-енила и циклогепт-2-енила, или из циклопент-2-енила, циклопент-3-енила, циклогекс-2-енила, циклогекс-3-енила, циклогепт-2-енила, циклогепт-3-енила и циклогепт-4-енила, или из циклопент-2-енила и циклогекс-2-енила, или из циклопент-2-енила, циклогекс-2-енила и циклогепт-2-енила. В одном варианте воплощения настоящего изобретения атом углерода, через который циклоалкенильная группа, представляющая группу R30, связана с (аза)индолизиновым кольцом, не является частью двойной связи, т.е. циклоалкенильная группа не является циклоалк-1-енильной группой. Циклоалкильные группы и циклоалкенильные группы, как правило, необязательно замещены одним или несколькими (C1-C4)-алкильными заместителями. Т.е. они являются незамещенными и не содержат алкильных заместителей или являются замещенными, например, 1, 2, 3 или 4 одинаковыми или отличными друг от друга (C1-C4)-алкильными заместителями, например метильными группами и/или этильными группами и/или изопропильными группами и/или трет-бутильными группами, в частности метильными группами, при этом такие заместители могут присутствовать в любых положениях. Примерами алкил-замещенных циклоалкильных групп являются 1-метил-циклопропил, 2,2-диметил-циклопропил, 1-метил-циклопентил, 2,3-диметил-циклопентил, 1-метил-циклогексил, 4-метил-циклогексил, 4-изопропил-циклогексил, 4-трет-бутил-циклогексил и 3,3,5,5-тетраметил-циклогексил. Примерами алкил-замещенных циклоалкенильных групп являются 1-метил-циклопент-2-енил, 2-метил-циклопент-2-енил, 3-метил-циклопент-2-енил, 3,4-диметил-циклопент-3-енил, 1-метил-циклогекс-2-енил, 2-метил-циклогекс-2-енил, 3-метил-циклогекс-2-енил, 4-метил-циклогекс-2-енил, 2-метил-циклогекс-3-енил, 3-метил-циклогекс-3-енил, 4-метил-циклогекс-3-енил, 2,3-диметил-циклогекс-2-енил, 4,4-диметил-циклогекс-2-енил, 3,4-диметил-циклогекс-3-енил. Циклоалкильные группы и циклоалкенильные группы, как правило, также необязательно замещены одним или несколькими атомами фтора. Т.е. они являются незамещенными и не содержат атомов фтора или замещены, например 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 атомами фтора или 1, 2, 3, 4, 5 или 6 атомами фтора. Циклоалкильные группы и циклоалкенильные группы также могут быть замещены одновременно фтором и алкилом. Атомы фтора могут присутствовать в любых положениях и также могут присутствовать в алкильном заместителе. Примерами фтор-замещенных циклоалкильных групп являются 1-фтор-циклопропил, 2,2-дифтор-циклопропил, 3,3-дифтор-циклобутил, 1-фтор-циклогексил, 4,4-дифтор-циклогексил и 3,3,4,4,5,5-гексафтор-циклогексил. Примерами фтор-замещенных циклоалкенильных групп являются 1-фтор-циклопент-2-енил, 1-фтор-циклогекс-2-енил, 4-фтор-циклогекс-2-енил, 4,4-дифтор-циклогекс-2-енил. В одном варианте воплощения настоящего изобретения циклоалкильные группы не являются необязательно замещенными заместителями, выбранными из фтора и (C1-C4)-алкила. Когда циклоалкильная группа или циклоалкенильная группа может быть замещена дополнительными заместителями, такими как гидрокси, как в случае циклоалкильной группы или циклоалкенильной группы, представляющими группу R30, она может быть замещена просто одним или несколькими такими дополнительными заместителями, такими как гидрокси, а не заместителями, выбранными из фтора и (C1-C4)-алкила, или одним или несколькими такими дополнительными заместителями и одновременно одним или несколькими заместителями, выбранными из фтора и (C1-C4)-алкила. В одном варианте воплощения количество таких дополнительных заместителей, как гидрокси, которые могут присутствовать в циклоалкильной или циклоалкенильной группах, составляет 1, 2 или 3, в другом варианте воплощения 1 или 2, в другом варианте воплощения 1. В одном варианте воплощения общее количество всех заместителей в циклоалкильной группе или циклоалкенильной группе составляет 1, 2, 3, 4, 5, 6, 7 или 8, в другом варианте воплощения 1, 2, 3, 4 или 5, в другом варианте воплощения 1, 2 или 3. Такие дополнительные заместители, как гидрокси, могут присутствовать в любых положениях, при условии что полученное соединение является достаточно стабильным и является подходящим в качестве подгруппы в фармацевтически активном соединении. В одном варианте воплощения гидрокси заместитель не присутствует в положении 1 циклоалкенильной группы или циклоалкильной группы, представляющей группу R30. В одном варианте воплощения в циклоалкенильной группе гидрокси заместитель не присутствует по атому углерода, который является частью двойной связи. Примерами гидрокси-замещенных циклоалкильных групп являются 3-гидрокси-циклобутил, 2-гидрокси-циклопентил, 3-гидрокси-циклопентил, 3,4-дигидрокси-циклопентил, 2-гидрокси-циклогексил, 3-гидрокси-циклогексил, 4-гидрокси-циклогексил, 2,3-дигидрокси-циклогексил, 2,4-дигидрокси-циклогексил, 3,4-дигидрокси-циклогексил, 3,5-дигидрокси-циклогексил, 3,4,5-тригидрокси-циклогексил, 2-гидрокси-циклогептил, 3-гидрокси-циклогептил, 4-гидрокси-циклогептил. Примерами гидрокси-замещенных циклоалкенильных групп являются 5-гидрокси-циклопент-2-енил, 4-гидрокси-циклогекс-2-енил, 5-гидрокси-циклогекс-2-енил, 6-гидрокси-циклогекс-2-енил, 6-гидрокси-циклогекс-3-енил. Примерами группы циклоалкилалкил-, которая может присутствовать в группе (C3-C7)-циклоалкил-CvH2v-, являются циклопропилметил-, циклобутилметил-, циклопентилметил-, циклогексилметил-, циклогептилметил-, циклопропилдифторметил-, циклобутилдифторметил-, циклопентилдифторметил-, циклогексилдифторметил-, циклогептилдифторметил-, 1-циклопропилэтил-, 2-циклопропилэтил-, 1-циклобутилэтил-, 2-циклобутилэтил-, 1-циклопентилэтил-, 2-циклопентилэтил-, 1-циклогексилэтил-, 2-циклогексилэтил-, 1-циклогептилэтил-, 2-циклогептилэтил-.
Тетрагидропиранильная группа, представляющая группу R30, которая также может быть обозначена как оксанильная группа или тетрагидро-2H-пиранильная группа, может быть связана через любой атом углерода и может представлять собой тетрагидропиран-2-ил, тетрагидропиран-3-ил или тетрагидропиран-4-ил. В одном варианте воплощения настоящего изобретения тетрагидропиранил представляет собой тетрагидропиран-3-ил или тетрагидропиран-4-ил, в другом варианте воплощения тетрагидропиранил представляет собой тетрагидропиран-4-ил.
В замещенных фенильных группах заместители могут присутствовать в любых положениях. В монозамещенных фенильных группах заместитель может присутствовать в 2-положении, 3-положении или 4-положении. В дизамещенных фенильных группах заместители могут присутствовать в 2,3-положении, 2,4-положении, 2,5-положении, 2,6-положении, 3,4-положении или 3,5-положении. В тризамещенных фенильных группах заместители могут присутствовать в 2,3,4-положении, 2,3,5-положении, 2,3,6-положении, 2,4,5-положении, 2,4,6-положении или 3,4,5-положении. Когда фенильная группа содержит четыре заместителя, из которых один, два, три или четыре заместителя могут представлять собой атомы фтора, например незамещенный кольцевой атом углерода может присутствовать в 2-положении, 3-положении или 4-положении. Когда полизамещенная фенильная группа или гетероарильная группа содержит разные заместители, каждый заместитель может присутствовать в любом подходящем положении, и настоящее изобретение включает все позиционные изомеры. Количество заместителей в замещенной фенильной группе может составлять 1, 2, 3, 4 или 5. В одном варианте воплощения замещенная фенильная группа, а также замещенная гетероарильная группа содержит 1, 2 или 3, в другом варианте воплощения 1 или 2, одинаковых или отличных друг от друга заместителей, в другом варианте воплощения 1 заместитель, где все фенильные и гетероарильные группы являются независимыми друг от друга. В одном варианте воплощения настоящего изобретения заместители в замещенных фенильных и гетероарильных группах независимо друг от друга выбраны из любого одного или нескольких заместителей, перечисленнных в соответствующем определении, например заместители, выбранные из галогена, (C1-C4)-алкила, (C1-C4)-алкил-O- и (C1-C4)-алкил-S(O)m-, или из галогена, (C1-C4)-алкила, (C1-C4)-алкил-O- и (C1-C4)-алкил-S(O)2-, или из галогена, (C1-C4)-алкила, (C1-C4)-алкил-O- и циано, или из галогена, (C1-C4)-алкила и (C1-C4)-алкил-O-, или из галогена и (C1-C4)-алкила, при условии что заместители охватываются определением соответствующей фенильной или гетероарильной группы, где все алкильные группы могут быть незамещенными или замещены одним или несколькими атомами фтора, и в качестве примера заместителей, содержащих фтор-замещенный алкил, заместители, включающие группу CF3 (трифторметил), такую как CF3 как таковая, CF3-O- или CF3-S-, могут быть включены в каждый перечень заместителей в дополнение к заместителям, включающим незамещенный алкил.
В гетероарильной группе, которая представляет собой остаток ароматической моноциклической 5-членной или 6-членной гетероциклической кольцевой системы, кольцевые гетероатомы, указанные в определении группы, могут присутствовать в любом сочетании и могут присутствовать в любом подходящем положении, при условии что группа соответствует ее определению, и полученное соединение формулы Ia или Ib является стабильным и подходящим в качестве фармацевтически активного соединения. Один из кольцевых атомов азота, специально указанный в определении группы гетероарил, который может содержать атом водорода или заместитель, такой как алкил, представляет собой кольцевой атом азота в 5-членной кольцевой системе, такой как пиррол, пиразол, имидазол или триазол, с которым связан экзоциклический атом или группа. Примерами кольцевых систем, из которых может происходить гетероарильная группа, являются пиррол, фуран, тиофен, имидазол, пиразол, триазолы, такие как [1,2,3]триазол и [1,2,4]триазол, оксазол ([1,3]оксазол), изоксазол ([1,2]оксазол), тиазол ([1,3]тиазол), изотиазол ([1,2]тиазол), оксадиазолы, такие как [1,2,4]оксадиазол, [1,3,4]оксадиазол и [1,2,5]оксадиазол, тиадиазолы, такие как [1,3,4]тиадиазол, пиридин, пиридазин, пиримидин, пиразин, триазины, такие как [1,2,3]триазин, [1,2,4]триазин и [1,3,5]триазин. В одном варианте воплощения настоящего изобретения гетероарильная группа включает один или два одинаковых или отличных друг от друга кольцевых гетероатома, в другом варианте воплощения настоящего изобретения гетероарил включает один кольцевой гетероатом, которые имеют указанное значение. В другом варианте воплощения гетероарил выбран из тиофенила, тиазолила и пиридинила, в другом варианте воплощения - из тиофенила и пиридинила, в другом варианте воплощения гетероарил представляет собой тиофенил, в другом варианте воплощения гетероарил представляет собой пиридинил. Гетероарильные группы могут быть связаны через любой кольцевой атом углерода. Например, тиофенильная группа (тиенильная группа) может представлять собой тиофен-2-ил (2-тиенил) или тиофен-3-ил (3-тиенил), фуранил может представлять собой фуран-2-ил или фуран-3-ил, пиридинил (пиридил) может представлять собой пиридин-2-ил, пиридин-3-ил или пиридин-4-ил, пиразолил может представлять собой 1H-пиразол-3-ил, 1H-пиразол-4-ил или 2H-пиразол-3-ил, имидазолил может представлять собой 1H-имидазол-2-ил, 1H-имидазол-4-ил или 3H-имидазолил-4-ил, тиазолил может представлять собой тиазол-2-ил, тиазол-4-ил или тиазол-5-ил, [1,2,4]триазолил может представлять собой 1H-[1,2,4]триазол-3-ил, 2H-[1,2,4]триазол-3-ил или 4H-[1,2,4]триазол-3-ил.
В замещенных гетероарильных группах заместители могут присутствовать в любых положениях, например в тиофен-2-ильной группе или фуран-2-ильной группе в 3-положении и/или в 4-положении и/или в 5-положении, в тиофен-3-ильной группе или фуран-3-ильной группе в 2-положении и/или в 4-положении и/или в 5-положении, в пиридин-2-ильной группе в 3-положении и/или в 4-положении и/или в 5-положении и/или в 6-положении, в пиридин-3-ильной группе в 2-положении и/или в 4-положении и/или в 5-положении и/или в 6-положени, в пиридин-4-ильной группе в 2-положении и/или в 3-положении и/или в 5-положении и/или в 6-положении. В одном варианте воплощения замещенная гетероарильная группа замещена одним, двумя или тремя, в другом варианте воплощения одним или двумя одинаковыми или отличными друг от друга заместителями, в другом варианте воплощения - одним заместителем. Когда присутствует кольцевой атом азота, который может содержать атом водорода или заместитель, заместитель по этому атому азота может представлять собой, например метильную группу, этильную группу, пропильную группу или трет-бутильную группу, при этом такие группы необязательно замещены одним или несколькими атомами фтора. Как правило, подходящие кольцевые атомы азота в соединениях формул Ia и Ib, например атом азота в пиридинильной группе или атом азота в [1,2,5]оксадиазолильной группе, также могут содержать оксидо заместитель -O-, и соединение, таким образом, может присутствовать в форме N-оксида.
В одном варианте воплощения настоящего изобретения кольцевые гетероатомы в Het1 выбраны из N и O, в другом варианте воплощения - из O и S, в другом варианте воплощения они представляют собой O атомы, в другом варианте воплощения они представляют собой N атомы. В одном варианте воплощения количество кольцевых гетероатомов в Het1 составляет 1. В одном варианте воплощения два кольцевых атома кислорода в Het1 не могут присутствовать в смежных положениях в кольце, в другом варианте воплощения два кольцевых гетероатома, выбранные из O и S, не могут присутствовать в смежных положениях в кольце, в другом варианте воплощения два кольцевых гетероатома не могут присутствовать в смежных положениях в кольце. Кольцевые атомы азота в Het1, за исключением кольцевого атома азота, через который Het1 является связанным, содержат атом водорода или заместитель, определенный выше. В одном варианте воплощения необязательные заместители по кольцевым атомам азота в Het1 выбраны из (C1-C4)-алкила и (C1-C6)-алкил-O-C(O)-, в другом варианте воплощения - из (C1-C6)-алкил-O-C(O)- и (C3-C7)-циклоалкил-CvH2v-O-C(O)-, в другом варианте воплощения - из (C1-C4)-алкила, в другом варианте воплощения - из (C1-C6)-алкил-O-C(O)-. В одном варианте воплощения необязательные заместители по кольцевым атомам углерода в Het1 выбраны из фтора и (C1-C4)-алкила, в другом варианте воплощения - из (C1-C4)-алкила и оксо, в другом варианте воплощения - из (C1-C4)-алкила. В случае когда Het1 содержит любые оксогруппы в качестве заместителей, в одном варианте воплощения присутствуют не более чем два таких оксо заместителя, и еще в одном варианте воплощения присутствует не более чем один такой оксо заместитель. В одном варианте воплощения количество необязательных заместителей на Het1 составляет 1, 2, 3, 4 или 5, в другом варианте воплощения 1, 2, 3 или 4, в другом варианте воплощения 1, 2 или 3, в другом варианте воплощения 1 или 2, в другом варианте воплощения 1, в другом варианте воплощения Het1 является незамещенным. Het1 может быть связан через любой подходящий кольцевой атом углерода или кольцевой атом азота. В одном варианте воплощения Het1 связан через кольцевой атом углерода. В другом варианте воплощения Het1 связан через кольцевой атом азота. Het1 может быть 4-членным, 5-членным, 6-членным или 7-членным. В одном варианте воплощения Het1 является 4-членным или 5-членным, в другом варианте воплощения - от 5-членного до 7-членного, в другом варианте воплощения - 5-членным или 6-членным, в другом варианте воплощения - 5-членным, в другом варианте воплощения - 6-членным. Примерами Het1, из любого одного или нескольких значений Het1, из которых он выбран в одном варианте воплощения, являются оксетанил, включая оксетан-2-ил и оксетан-3-ил, тетрагидрофуранил, включая тетрагидрофуран-2-ил и тетрагидрофуран-3-ил, тетрагидропиранил, включая тетрагидропиран-2-ил, тетрагидропиран-3-ил и тетрагидропиран-4-ил, оксепанил, включая оксепан-2-ил, оксепан-3-ил и оксепан-4-ил, [1,3]диоксоланил, включая [1,3]диоксолан-2-ил и [1,3]диоксолан-4-ил, [1,4]диоксанил, включая [1,4]диоксан-2-ил, тиетанил, включая тиетан-2-ил и тиетан-3-ил, тетрагидротиофенил, включая тетрагидротиофен-2-ил и тетрагидротиофен-3-ил, тетрагидротиопиранил, включая тетрагидротиопиран-2-ил, тетрагидротиопиран-3-ил и тетрагидротиопиран-4-ил, [1,4]дитианил, включая [1,4]дитиан-2-ил, азетидинил, включая азетидин-1-ил, азетидин-2-ил и азетидин-3-ил, пирролидинил, включая пирролидин-1-ил, пирролидинил-2-ил и пирролидинил-3-ил, пиперидинил, включая пиперидин-1-ил, пиперидинил-2-ил, пиперидинил-3-ил и пиперидинил-4-ил, азепанил, включая азепан-1-ил, азепан-2-ил, азепан-3-ил и азепан-4-ил, имидазолидинил, включая имидазолидин-1-ил, имидазолидин-2-ил и имидазолидин-4-ил, оксазолидинил, включая оксазолидин-2-ил, оксазолидин-3-ил, оксазолидин-4-ил и оксазолидин-5-ил, тиазолидинил, включая тиазолидин-2-ил, тиазолидин-3-ил, тиазолидин-4-ил и тиазолидин-5-ил, пиперазинил, включая пиперазин-1-ил и пиперазин-2-ил, морфолинил, включая морфолин-2-ил, морфолин-3-ил и морфолин-4-ил, тиоморфолинил, включая тиоморфолин-2-ил, тиоморфолин-3-ил и тиоморфолин-4-ил, которые все являются необязательно замещенными, как определено выше в отношении Het1.
В одном варианте воплощения настоящего изобретения дополнительный кольцевой гетероатом, который необязательно присутствует в Het2, помимо кольцевого атома азота, через который Het2 связан, выбран из N и O, в другом варианте воплощения - из O и S, в другом варианте воплощения он представляет собой O атом, в другом варианте воплощения он представляет собой N атом. В одном варианте воплощения никакой дополнительный кольцевой гетероатом не присутствует в Het2, помимо кольцевого атома азота, через который Het2 связан. В одном варианте воплощения два кольцевых гетероатома не могут присутствовать в смежных положениях в кольце Het2. Дополнительный кольцевой атом азота, который присутствует в Het2, помимо кольцевого атома азота, через который Het2 связан, содержит атом водорода или заместитель, определенный выше. В одном варианте воплощения необязательный заместитель по такому дополнительному кольцевому атому азота в Het2 выбран из (C1-C4)-алкила и (C1-C6)-алкил-O-C(O)-, в другом варианте воплощения - из (C1-C6)-алкил-O-C(O)- и (C3-C7)-циклоалкил-CvH2v-O-C(O)-, в другом варианте воплощения - из (C1-C4)-алкила, в другом варианте воплощения - из (C1-C6)-алкил-O-C(O)-. В одном варианте воплощения необязательные заместители по кольцевым атомам углерода в Het2 выбраны из фтора и (C1-C4)-алкила, в другом варианте воплощения - из (C1-C4)-алкила и оксо, в другом варианте воплощения - из (C1-C4)-алкила. В случае когда Het2 содержит любые оксогруппы в качестве заместителей, в одном варианте воплощения присутствуют не более чем два таких оксо заместителя, и еще в одном варианте воплощения присутствует не более чем один такой оксо заместитель. В одном варианте воплощения количество необязательных заместителей по Het2 составляет 1, 2, 3, 4 или 5, в другом варианте воплощения 1, 2, 3 или 4, в другом варианте воплощения 1, 2 или 3, в другом варианте воплощения 1 или 2, в другом варианте воплощения 1, в другом варианте воплощения Het2 является незамещенным. Het2 может быть 4-членным, 5-членным, 6-членным или 7-членным. В одном варианте воплощения Het2 является 4-членным или 5-членным, в другом варианте воплощения - от 5-членного до 7-членного, в другом варианте воплощения является 5-членным или 6-членным, в другом варианте воплощения - 5-членным, в другом варианте воплощения - 6-членным. Примерами Het2, из любого одного или нескольких значений, из которых Het2 выбран в одном варианте воплощения, являются азетидин-1-ил, пирролидин-1-ил, пиперидин-1-ил, азепан-1-ил, имидазолидин-1-ил, оксазолидин-3-ил, тиазолидин-3-ил, пиперазин-1-ил, морфолин-4-ил, тиоморфолин-4-ил, которые все необязательно замещены, как определено выше в отношении Het2.
Галоген представляет собой фтор, хлор, бром или иод. В одном варианте воплощения настоящего изобретения галоген представляет собой фтор, хлор или бром, в другом варианте воплощения фтор или хлор, где все атомы галогена во всех случаях их присутствия в соединениях формул Ia и Ib являются независимыми друг от друга.
Настоящее изобретение включает все стереоизомерные формы соединений формул Ia и Ib, например все возможные энантиомеры и диастереомеры, включая цис/транс изомеры. Настоящее изобретение также включает смеси двух или более стереоизомерных форм, например смеси энантиомеров и/или диастереомеров, включая цис/транс изомеры, во всех отношениях. Асимметрические центры, содержащиеся в соединениях формул Ia и Ib, например, в незамещенных или замещенных алкильных группах или в диазациклоалкановом кольце, представленном в формулах Ia и Ib, все независимо друг от друга могут иметь S конфигурацию или R конфигурацию. Настоящее изобретение относится к энантиомерам, как к левовращающему, так и правовращающему антиподу, в энантиомерно чистой форме и в по существу энантиомерно чистой форме, и в форме рацематов, и в форме смеси двух энантиомеров во всех отношениях. Настоящее изобретение также относится к диастереомерам в форме чистых и по существу чистых диастереомеров, и в форме смеси двух или более диастереомеров во всех отношениях. Настоящее изобретение также включает все цис/транс изомеры соединений формул Ia и Ib в чистой форме и по существу чистой форме, и в форме смеси цис- изомера и транс- изомера во всех отношениях. Например цис/транс изомерия может присутствовать в замещенных циклоалкановых кольцах и в диазациклоалкановом кольце, представленном в формуле Ia и Ib. Получение индивидуальных стереоизомеров, если это желательно, можно осуществить путем разделения смеси в соответствии с общепринятыми способами, например путем хроматографии или кристаллизации или с использованием в синтезе стереохимически однородных исходных соединений или с использованием стереоселективных реакций. Необязательно, перед разделением стереоизомеров можно осуществить дериватизацию. Разделение смеси стереоизомеров можно осуществить на стадии соединения формулы Ia или Ib или на стадии промежуточного соединения в ходе синтеза. Настоящее изобретение также включает все таутомерные формы соединений формул Ia и Ib.
В случае когда соединения формул Ia и Ib содержат одну или несколько кислотных и/или основных групп, т.е. солеобразующих групп, настоящее изобретение также включает их соответствующие физиологически или токсикологически приемлемые соли, т.е. нетоксичные соли, в частности их фармацевтически приемлемые соли. Соли могут содержать неорганические или органические компоненты соли. Соли могут быть образованы, например, из соединений формул Ia и Ib, которые содержат кислотную группу, например карбоновокислотную группу (HO-CO-), и нетоксичные неорганические или органические основания. Подходящими основаниями являются, например, соединения щелочных металлов или соединения щелочноземельных металлов, такие как гидроксид натрия, гидроксид калия, карбонат натрия или гидрокарбонат натрия, или аммиак, органические аминосоединения и гидроксиды четвертичного аммония. Реакции соединений формул Ia и Ib с основаниями для получения солей, как правило, осуществляют в соответствии с общепринятыми процедурами в растворителе или разбавителе. С учетом физиологической и химической стабильности предпочтительные соли кислотных групп во многих случаях представляют собой натриевые, калиевые, магниевые или кальциевые соли или аммониевые соли, которые также могут содержать одну или несколько органических групп по атому азота. Соединения формул Ia и Ib, которые содержат основную, т.е. протонируемую группу, например аминогруппу, диазациклоалкановая группа, представленная в формуле Ia и Ib, в случае когда R10 представляет собой водород, или другой основный гетероцикл, такой как 6-членное кольцо в (аза)индолизиновой группе в случае, когда Y представляет собой атом азота, могут присутствовать в форме их кислотно-аддитивных солей с физиологически приемлемыми кислотами, например в виде соли с хлористоводородной кислотой, бромистоводородной кислотой, фосфорной кислотой, серной кислотой, уксусной кислотой, бензойной кислотой, метансульфоновой кислотой, п-толуолсульфоновой кислотой, которую, как правило, можно получить из соединений формул Ia и Ib путем взаимодействия с кислотой в растворителе или разбавителе в соответствии с общепринятыми процедурами. Как правило, в частности, в случае кислотно-аддитивных солей соединения, содержащего две или более основных группы, в полученной соли отношение компонентов соли может отклоняться в большую или меньшую сторону от стехиометрического отношения, такого как молярное отношение 1:1 или 1:2 в случае кислотно-аддитивной соли соединения формулы Ia или Ib, содержащего одну или две основные группы с одновалентной кислотой, и изменяется в зависимости от применяемых условий. Настоящее изобретение включает также соли, содержащие компоненты в нестехиометрическом отношении, и указание, что кислотно-аддитивная соль соединения формулы Ia или Ib содержит кислоту в 2-молярном количестве, например также допускает меньшее или большее количество кислоты в полученной соли, например около 1,8 или около 2,1 моль кислоты на моль соединения формулы Ia или Ib. Когда соединение формулы Ia или Ib одновременно содержит кислотную и основную группу в молекуле, настоящее изобретение также включает внутренние соли (бетаины, цвиттерионы) в дополнение к указанным солевым формам. Настоящее изобретение также включает все соли соединений формул Ia и Ib, которые из-за низкой физиологической переносимости не являются подходящими непосредственно для применения в качестве фармацевтического средства, но являются подходящими в качестве промежуточных соединений для химических реакций или для получения физиологически приемлемых солей, например, путем анионного обмена или катионного обмена. Объектом настоящего изобретения также являются сольваты соединений формул Ia и Ib и их солей, такие как гидраты, и продукты присоединения со спиртами, такими как (C1-C4)-алканолы, в частности физиологически приемлемые сольваты, а также активные метаболиты соединений формул Ia и Ib и пролекарства соединений формул Ia и Ib, т.е. соединения, которые in vitro необязательно демонстрируют фармакологическую активность, но которые in vivo преобразуются в фармакологически активные соединения формулы Ia или Ib, например соединения, которые преобразуются посредством метаболического гидролиза в соединения формулы Ia или Ib. Примерами таких пролекарств являются соединения, в которых ацилируемый атом азота, например атом азота, содержащий группу R10, в диазациклоалкановой группе, представленной в формуле Ia и Ib, в случае когда R10 представляет собой водород, содержит, например, алкил-O-CO-группу или ацильную группу, такую как алкил-CO-группа и, таким образом, преобразован в карбаматную группу или амидную группу, или соединения, в которых карбоновокислотная группа была этерифицирована.
Когда две группы Ra вместе представляют собой двухвалентную (C2-C5)-алкильную группу, в одном варианте воплощения настоящего изобретения указанная двухвалентная алкильная группа связана с атомом углерода, содержащим группы Ra, через два раздельных атома углерода и образует вместе с атомом углерода, содержащим группы Ra, циклоалкановое кольцо, с которым (аза)индолизиновое кольцо, представленное в формуле Ia и Ib, и группа R20 связаны в одном и том же положении кольца. Указанное циклоалкановое кольцо, такое как циклоалкановое кольцо в соединениях формул Ia и Ib, как правило, может содержать одну или несколько (C1-C4)-алкильные группы, например одну, две, три или четыре метильные группы, и/или одну или несколько, например один, два, три или четыре атомов фтора. Указанное циклоалкановое кольцо может представлять собой циклопропановое, циклобутановое, циклопентановое или циклогексановое кольцо, которые все могут быть незамещенными или замещены алкилом и/или фтором, как указано. В одном варианте воплощения настоящего изобретения указанное циклоалкановое кольцо представляет собой циклопропановое кольцо, которое может быть незамещенным или замещено алкилом и/или фтором, как указано, т.е. в этом варианте воплощения двухвалентная (C2-C5)-алкильная группа представляет собой этан-1,2-диильную группу (1,2-этиленовую группу), которая является незамещенной или замещена алкилом и/или фтором, как указано. В одном варианте воплощения двухвалентная (C2-C5)-алкильная группа представляет собой (C2-C4)-алкильную группу, в другом варианте воплощения (C2-C3)-алкильную группу, в другом варианте воплощения C2-алкильную группу. В одном варианте воплощения настоящего изобретения группы Ra выбраны из водорода и фтора, в другом варианте воплощения - из водорода и (C1-C4)-алкила, где две группы Ra являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга, или во всех этих вариантах воплощения две группы Ra вместе представляют собой двухвалентную (C2-C5)-алкильную группу. В одном варианте воплощения настоящего изобретения группы Ra являются одинаковыми или отличными друг от друга группами, выбранными из водорода и фтора, в другом варианте воплощения они являются одинаковыми или отличными друг от друга группами, выбранными из водорода и (C1-C4)-алкила. В другом варианте воплощения настоящего изобретения группы Ra являются одинаковыми и выбраны из водорода, фтора и (C1-C4)-алкила или две группы Ra вместе представляют собой двухвалентную (C2-C5)-алкильную группу. В другом варианте воплощения настоящего изобретения группы Ra обе представляют собой водород, или две группы Ra вместе представляют собой двухвалентную (C2-C5)-алкильную группу. В другом варианте воплощения настоящего изобретения группы Ra обе представляют собой водород, т.е. группа C(Ra)2 представляет собой группу CH2. В одном варианте воплощения (C1-C4)-алкильная группа, представляющая группу Ra, представляет собой (C1-C2)-алкильную группу, в другом варианте воплощения она представляет собой метильную группу.
В одном варианте воплощения настоящего изобретения одна, две, три или четыре группы R, в другом варианте воплощения одна, две или три группы R, в другом варианте воплощения одна или две группы R, в другом варианте воплощения одна из групп R, которые присутствуют в диазациклоалкановой группе, представленной в формулах Ia и Ib, имеют значения, определенные выше или ниже, и выбраны из всех значений, входящих в соответствующее определение R, включая водород, и все другие группы R представляют собой водород, где все группы R, которые не являются водородом, являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга. В одном варианте воплощения настоящего изобретения все группы R представляют собой водород и диазациклоалкановая группа, представленная в формуле Ia и Ib, представляет собой пиперазиновое кольцо, гомопиперазиновое кольцо или 1,5-диазокановое кольцо, которое содержит группу R10, но не является замещенным какими-либо заместителями по кольцевым атомам углерода. В другом варианте воплощения все группы R представляют собой водород и диазациклоалкановая группа, представленная в формуле Ia и Ib, представляет собой пиперазиновое кольцо, которое содержит группу R10, но не является замещенным какими-либо заместителями по кольцевым атомам углерода. Группы R, которые являются отличными от водорода, могут присутствовать в любых положениях диазациклоалкановой группы. Например, в случае когда присутствует одна группа R, которая являются отличной от водорода, в одном варианте воплощения эта группа R присутствует по кольцевому атому углерода, который является смежным с кольцевым атомом азота, который содержит группу R10, в другом варианте воплощения эта группа R присутствует по кольцевому атому углерода, который является смежным с кольцевым атомом азота, который не содержат группу R10, и еще в одном варианте воплощения, который относится к случаю, когда по меньшей мере одно из значений p и q составляет 3, эта группа R присутствует по атому углерода, который не является смежным с каким-либо кольцевым атомом азота. В случае когда присутствуют две группы R, которые являются отличными от водорода, в одном варианте воплощения эти две группы R присутствуют по одному и тому же кольцевому атому углерода, который является смежным с кольцевым атомом азота, который содержит группу R10, в другом варианте воплощения одна из этих двух групп R присутствует по каждому из двух кольцевых атомов углерода, которые являются смежными с кольцевым атомом азота, который содержит группу R10, в другом варианте воплощения эти две группы R присутствуют по одному и тому же кольцевому атому углерода, который является смежным с кольцевым атомом азота, который не содержит группу R10, в другом варианте воплощения одна из этих двух групп R присутствует по каждому из двух кольцевых атомов углерода, которые являются смежными с кольцевым атомом азота, который не содержит группу R10, в другом варианте воплощения одна из этих двух групп R присутствует по кольцевому атому углерода, который является смежным с кольцевым атомом азота, который содержит группу R10, а другая группа R присутствует по кольцевому атому углерода, смежному с кольцевым атомом азота, который не содержит группу R10, при этом в этом последнем варианте воплощения два кольцевых атома углерода, содержащие указанные группы R, могут присутствовать на одной и той же стороне диазациклоалкановой группы, либо в цепи (C(R)2)P, либо в цепи (C(R)2)q, или на разных сторонах диазациклоалкановой группы, где один присутствует в цепи (C(R)2)P, а другой в цепи (C(R)2)q.
В одном варианте воплощения настоящего изобретения группы R выбраны из водорода, (C1-C6)-алкила, который необязательно замещен одним или несколькими одинаковыми или отличными друг от друга заместителями R1, и (C3-C7)-циклоалкила, где все группы R являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга. В другом варианте воплощения группы R выбраны из водорода и (C1-C6)-алкила, который необязательно замещен одним или несколькими одинаковыми или отличными друг от друга заместителями R1, где все группы R являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга, или две группы R, связанные с одним и тем же атомом углерода, вместе представляют собой двухвалентную (C2-C5)-алкильную группу. В другом варианте воплощения группы R выбраны из водорода и (C1-C6)-алкила, который необязательно замещен одним или несколькими одинаковыми или отличными друг от друга заместителями R1, где все группы R являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга. В одном варианте воплощения настоящего изобретения необязательно замещенная (C1-C6)-алкильная группа, представляющая группу R, представляет собой необязательно замещенную (C1-C4)-алкильную группу, в другом варианте воплощения - необязательно замещенную (C1-C2)-алкильную группу, в другом варианте воплощения - необязательно замещенную метильную группу. Когда две группы R вместе представляют собой двухвалентную (C2-C5)-алкильную группу, в одном варианте воплощения настоящего изобретения указанная двухвалентная алкильная группа связана с атомом углерода, содержащим группы R, через два раздельных атома углерода и образует вместе с атомом углерода, содержащим группы R, спиро-конденсированное циклоалкановое кольцо. Указанное циклоалкановое кольцо, такое как циклоалкановое кольцо в соединениях формул Ia и Ib, как правило, может содержать одну или несколько (C1-C4)-алкильных групп, например одну, две, три или четыре метильные группы, и/или один или несколько, например один, два, три или четыре атома фтора. Указанное циклоалкановое кольцо может представлять собой циклопропановое, циклобутановое, циклопентановое или циклогексановое кольцо, которые все могут быть незамещенными или замещены алкилом и/или фтором, как указано. В одном варианте воплощения настоящего изобретения указанное циклоалкановое кольцо представляет собой циклопропановое кольцо, которое может быть незамещенными или замещено алкилом и/или фтором, как указано, т.е. в этом варианте воплощения двухвалентная (C2-C5)-алкильная группа представляет собой этан-1,2-диильную группу (1,2-этиленовую группу), которая является незамещенной или замещена алкилом и/или фтором, как указано. В одном варианте воплощения двухвалентная (C2-C5)-алкильная группа представляет собой (C2-C4)-алкильную группу, в другом варианте воплощения (C2-C3)-алкильную группу, в другом варианте воплощения C2-алкильную группу.
В одном варианте воплощения настоящего изобретения алкильная группа, представляющая группу R, является необязательно замещенной одним, двумя, тремя или четырьмя одинаковыми или отличными друг от друга заместителями R1, в другом варианте воплощения одним, двумя или тремя одинаковыми или отличными друг от друга заместителями R1, в другом варианте воплощения одним или двумя одинаковыми или отличными друг от друга заместителями R1, в другом варианте воплощения одним заместителем R1 и еще в одном варианте воплощения алкильная группа, представляющая группу R, является незамещенной, где все алкильные группы, представленные как группы R, являются независимыми друг от друга, что касается их картины замещения. В одном варианте воплощения R1 выбран из (C3-C7)-циклоалкила, фенила, гетероарила, гидрокси, R2-N(R3)-C(O)-, R4-O-C(O)- и циано, в другом варианте воплощения - из фенила, гетероарила, гидрокси, R2-N(R3)-C(O)-, R4-O-C(O)- и циано, в другом варианте воплощения - из фенила, гидрокси, R2-N(R3)-C(O)- и R4-O-C(O)-, в другом варианте воплощения - из фенила, гидрокси и R2-N(R3)-C(O)-, в другом варианте воплощения - из гидрокси, R2-N(R3)-C(O)- и R4-O-C(O)-, в другом варианте воплощения - из гидрокси и R2-N(R3)-C(O)-, в другом варианте воплощения - из R2-N(R3)-C(O)- и R4-O-C(O)-, и еще в одном варианте воплощения R1 представляет собой R2-N(R3)-C(O)-.
В одном варианте воплощения настоящего изобретения группы R2 выбраны из водорода и (C1-C6)-алкила, который необязательно замещен одним или несколькими одинаковыми или отличными друг от друга заместителями R5, в другом варианте воплощения группы R2 выбраны из (C1-C6)-алкила, который необязательно замещен одним или несколькими одинаковыми или отличными друг от друга заместителями R5, и (C3-C7)-циклоалкила, и еще в одном варианте воплощения группы R2 представляют собой (C1-C6)-алкил, который необязательно замещен одним или несколькими одинаковыми или отличными друг от друга заместителями R5, где все группы R2 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга. В одном варианте воплощения необязательно замещенная (C1-C6)-алкильная группа, представляющая группу R2, представляет собой необязательно замещенную (C2-C6)-алкильную группу, в другом варианте воплощения - необязательно замещенную (C1-C4)-алкильную группу, в другом варианте воплощения - необязательно замещенную (C2-C4)-алкильную группу. В одном варианте воплощения алкильная группа, представляющая группу R2, является необязательно замещенной одним, двумя, тремя или четырьмя одинаковыми или отличными друг от друга заместителями R5, в другом варианте воплощения - одним, двумя или тремя одинаковыми или отличными друг от друга заместителями R5, в другом варианте воплощения - одним или двумя одинаковыми или отличными друг от друга заместителями R5, в другом варианте воплощения - одним заместителем R5, и еще в одном варианте воплощения алкильная группа, представляющая группу R2, является незамещенной, при этом все алкильные группы, представляющие группу R2, являются независимыми друг от друга, что касается их картины замещения.
В одном варианте воплощения настоящего изобретения R3 выбран из водорода и (C1-C2)-алкила, в другом варианте воплощения - из водорода и метила, в другом варианте воплощения R3 представляет собой (C1-C4)-алкил, в другом варианте воплощения R3 представляет собой водород.
В одном варианте воплощения настоящего изобретения R4 выбран из водорода и (C1-C3)-алкила, в другом варианте воплощения R4 представляет собой (C1-C4)-алкил, в другом варианте воплощения R4 представляет собой (C1-C3)-алкил, в другом варианте воплощения R4 представляет собой водород.
В одном варианте воплощения настоящего изобретения R5 выбран из гидрокси, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)m-, R6-N(R7)-C(O)-, R8-O-C(O)-, (C3-C7)-циклоалкила, гетероарила и Het1, в другом варианте воплощения - из гидрокси, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)m-, R6-N(R7)-C(O)-, (C3-C7)-циклоалкила, гетероарила и Het1, в другом варианте воплощения - из гидрокси, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)m -, R6-N(R7)-C(O)-, (C3-C7)-циклоалкила и Het1, в другом варианте воплощения - из гидрокси, (C1-C4)-алкил-O-, R6-N(R7)-C(O)-, (C3-C7)-циклоалкила и Het1, в другом варианте воплощения - из гидрокси, (C1-C4)-алкил-O-, (C3-C7)-циклоалкила и Het1, в другом варианте воплощения - из гидрокси и (C1-C4)-алкил-O-, в другом варианте воплощения - из (C1-C4)-алкил-O-, (C3-C7)-циклоалкила и Het1, в другом варианте воплощения - из гидрокси, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)m-, R6-N(R7)-C(O)-, R8-O-C(O)-, гетероарила и Het1, в другом варианте воплощения - из гидрокси, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)m-, R6-N(R7)-C(O)-, гетероарила и Het1, в другом варианте воплощения - из гидрокси, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)m-, R6-N(R7)-C(O)- и Het1, в другом варианте воплощения - из гидрокси, (C1-C4)-алкил-O-, R6-N(R7)-C(O)- и Het1, в другом варианте воплощения - из гидрокси, (C1-C4)-алкил-O- и Het1, в другом варианте воплощения - из гидрокси, (C1-C4)-алкил-O- и (C1-C4)-алкил-S(O)m-, и еще в одном варианте воплощения - из (C1-C4)-алкил-O- и Het1, в другом варианте воплощения R5 представляет собой (C1-C4)-алкил-O-, в другом варианте воплощения R5 представляет собой Het1, в другом варианте воплощения R5 представляет собой гидрокси, в другом варианте воплощения R5 представляет собой R6-N(R7)-C(O)-. В одном варианте воплощения группа гетероарил, представляющая группу R5, представляет собой пиридинильную группу. В одном варианте воплощения группа Het1, представляющая группу R5, включает один или два кольцевых гетероатома, один из которых представляет собой атом кислорода, а другой из них, который необязательно присутствует, выбран из кислорода и азота, в другом варианте воплощения эта группа включает один кольцевой гетероатом, который представляет собой атом кислорода, и необязательно один дополнительный кольцевой гетероатом, который представляет собой атом азота, в другом варианте воплощения эта группа включает один кольцевой гетероатом, который представляет собой атом кислорода, и еще в одном варианте воплощения группа Het1, представляющая группу R5, представляет собой тетрагидропиранильную группу.
В одном варианте воплощения настоящего изобретения R6 выбран из водорода и (C1-C2)-алкила, в другом варианте воплощения - из водорода и метила, в другом варианте воплощения R6 представляет собой (C1-C4)-алкил, в другом варианте воплощения R6 представляет собой водород.
В одном варианте воплощения настоящего изобретения R7 выбран из водорода и (C1-C2)-алкила, в другом варианте воплощения - из водорода и метила, в другом варианте воплощения R7 представляет собой (C1-C4)-алкил, в другом варианте воплощения R7 представляет собой водород.
В одном варианте воплощения настоящего изобретения R8 выбран из водорода и (C1-C3)-алкила, в другом варианте воплощения R8 представляет собой (C1-C4)-алкил, в другом варианте воплощения R8 представляет собой (C1-C3)-алкил, в другом варианте воплощения R8 представляет собой водород.
В одном варианте воплощения настоящего изобретения R10 выбран из водорода и (C1-C6)-алкил-O-CO-, в другом варианте воплощения - из водорода и (C1-C4)-алкил-O-CO-, в другом варианте воплощения R10 представляет собой водород.
В одном варианте воплощения настоящего изобретения R20 выбран из фенила и гетероарила, где гетероарил выбран из тиофенила, тиазолила и пиридинила, в другом варианте воплощения - из фенила и гетероарила, где гетероарил выбран из тиофенила и пиридинила, в другом варианте воплощения - из фенила и гетероарила, где гетероарил представляет собой тиофенил, в другом варианте воплощения - из фенила и гетероарила, где гетероарил представляет собой пиридинил, которые все являются необязательно замещенными, как указано. В другом варианте воплощения настоящего изобретения R20 представляет собой фенил, который необязательно замещен, как указано. В одном варианте воплощения количество необязательных заместителей в группе R20 составляет один, два, три или четыре, в другом варианте воплощения - один, два или три, в другом варианте воплощения - один или два, в другом варианте воплощения - один. Заместители в замещенной группе R20 могут присутствовать по атомам углерода в любых положениях, как указано выше в отношении замещения фенильных и гетероарильных групп, в основном. Таким образом, например, в случае монозамещенной фенильной группы, представляющей группу R20, заместитель может присутствовать в 2-положении, 3-положении или 4-положении, и в случае дизамещенной фенильной группы заместители могут присутствовать в положениях 2 и 3, или в положениях 2 и 4, или в положениях 2 и 5, или в положениях 2 и 6, или в положениях 3 и 4, или в положениях 3 и 5. Подобным образом тризамещенная фенильная группа, представляющая группу R20, может содержать заместители в любых положениях и может представлять собой группу, такую как 3-хлор-2,6-диметил-фенил, 3-фтор-2,6-диметил-фенил, 6-хлор-3-фтор-2-метил-фенил или 2-хлор-3-фтор-6-метил-фенил, например, в случае когда фенильная группа является тризамещенной фтором и/или хлором и метилом. В одном варианте воплощения заместители, которые могут присутствовать в группе R20, выбраны из галогена, (C1-C4)-алкила, (C1-C4)-алкил-O- и (C1-C4)-алкил-S(O)m-, в другом варианте воплощения - из галогена, (C1-C4)-алкила и (C1-C4)-алкил-O-, в другом варианте воплощения - из галогена и (C1-C4)-алкила, например из хлора, фтора и метила, при этом в одном варианте воплощения настоящего изобретения алкильные группы в заместителях в группе R20 могут быть незамещенными или замещены одним или несколькими атомами фтора, и в качестве примера заместителей, содержащих фтор-замещенный алкил, заместители, включающие группу трифторметил, например CF3 как таковой, CF3-O- или CF3-S-, могут быть включены в каждый перечень заместителей в дополнение к заместителям, включающим незамещенный алкил, и еще в одном варианте воплощения настоящего изобретения алкильные группы в заместителях в группе R20 не являются замещенными фтором, и в этом последнем варианте воплощения указанный алкил, таким образом, означает незамещенный алкил. Конкретные группы в дополнение к указанным выше конкретным группам, которые могут представлять группу R20, и из которых, из одной или нескольких, R20 выбран в одном варианте воплощения настоящего изобретения, включают, например, фенил, т.е. незамещенный фенил, 2-фтор-фенил, 3-фтор-фенил, 4-фтор-фенил, 2-хлор-фенил, 3-хлор-фенил, 4-хлор-фенил, 2-метил-фенил (о-толил), 3-метил-фенил (м-толил), 4-метил-фенил (п-толил), 2-этил-фенил, 3-этил-фенил, 4-этил-фенил, 2-метокси-фенил, 3-метокси-фенил, 4-метокси-фенил, 2,3-дифтор-фенил, 2,4-дифтор-фенил, 2,5-дифтор-фенил, 2,6-дифтор-фенил, 3,4-дифтор-фенил, 3,5-дифтор-фенил, 2,3-дихлор-фенил, 2,4-дихлор-фенил, 2,5-дихлор-фенил, 2,6-дихлор-фенил, 3,4-дихлор-фенил, 3,5-дихлор-фенил, 2-хлор-3-фтор-фенил, 2-хлор-4-фтор-фенил, 2-хлор-5-фтор-фенил, 2-хлор-6-фтор-фенил, 3-хлор-2-фтор-фенил, 3-хлор-4-фтор-фенил, 3-хлор-5-фтор-фенил, 4-хлор-2-фтор-фенил, 4-хлор-3-фтор-фенил, 5-хлор-2-фтор-фенил, 2,3-диметил-фенил, 2,4-диметил-фенил, 2,5-диметил-фенил, 2,6-диметил-фенил, 3,4-диметил-фенил, 3,5-диметил-фенил, 2-фтор-3-метил-фенил, 2-фтор-4-метил-фенил, 2-фтор-5-метил-фенил, 2-фтор-6-метил-фенил, 3-фтор-2-метил-фенил, 3-фтор-4-метил-фенил, 3-фтор-5-метил-фенил, 4-фтор-2-метил-фенил, 4-фтор-3-метил-фенил, 5-фтор-2-метил-фенил, 2-хлор-3-метил-фенил, 2-хлор-4-метил-фенил, 2-хлор-5-метил-фенил, 2-хлор-6-метил-фенил, 3-хлор-2-метил-фенил, 3-хлор-4-метил-фенил, 3-хлор-5-метил-фенил, 4-хлор-2-метил-фенил, 4-хлор-3-метил-фенил, 5-хлор-2-метил-фенил, 2-метокси-3-метил-фенил, 2-метокси-4-метил-фенил, 2-метокси-5-метил-фенил, 2-метокси-6-метил-фенил, 3-метокси-2-метил-фенил, 3-метокси-4-метил-фенил, 3-метокси-5-метил-фенил, 4-метокси-2-метил-фенил, 4-метокси-3-метил-фенил, 5-метокси-2-метил-фенил.
В одном варианте воплощения настоящего изобретения R30 выбран из (C5-C7)-циклоалкила, (C5-C7)-циклоалкенила, тетрагидропиранила и фенила, в другом варианте воплощения - из (C5-C7)-циклоалкила, тетрагидропиранила и фенила, в другом варианте воплощения - из (C5-C7)-циклоалкила, (C5-C7)-циклоалкенила и фенила, в другом варианте воплощения - из (C5-C7)-циклоалкила, (C5-C7)-циклоалкенила и тетрагидропиранила, в другом варианте воплощения - из (C5-C7)-циклоалкила, (C5-C7)-циклоалкенила, фенила и гетероарила, в другом варианте воплощения - из (C5-C7)-циклоалкила, тетрагидропиранила, фенила и гетероарила, в другом варианте воплощения - из (C5-C7)-циклоалкила, фенила и гетероарила, в другом варианте воплощения - из (C5-C7)-циклоалкила и (C5-C7)-циклоалкенила, в другом варианте воплощения - из (C5-C7)-циклоалкила и фенила, в другом варианте воплощения - из фенила и гетероарила, в другом варианте воплощения R30 представляет собой фенил, при этом циклоалкильные, циклоалкенильные, фенильные и гетероарильные группы все являются необязательно замещенными, как указано. В одном варианте воплощения циклоалкильная группа, представляющая группу R30, представляет собой (C5-C6)-циклоалкил, в другом варианте воплощения - циклогексил. В одном варианте воплощения циклоалкенильная группа, представляющая группу R30, представляет собой (C5-C6)-циклоалкенил, в другом варианте воплощения - циклогексенил. В одном варианте воплощения гетероарильная группа, представляющая группу R30, выбрана из тиофенила и пиридинила, в другом варианте воплощения она представляет собой тиофенил, в другом варианте воплощения она представляет собой пиридинил, при этом все эти группы являются необязательно замещенными, как указано. В одном варианте воплощения количество необязательных заместителей в группе R30 составляет один, два, три или четыре, в другом варианте воплощения - один, два или три, в другом варианте воплощения - один или два, в другом варианте воплощения - один, и еще в одном варианте воплощения группа R30 является незамещенной. Заместители в замещенной группе R30 могут присутствовать по атомам углерода в любых положениях, как указано выше, в основном, в отношении замещенных циклоалкильных, циклоалкенильных, фенильных и гетероарильных групп. Например, в случае монозамещенной фенильной группы, представляющей группу R30, заместитель может присутствовать в 2-положении, 3-положении или 4-положении, и в случае дизамещенной фенильной группы заместители могут присутствовать в положениях 2 и 3, или в положениях 2 и 4, или в положениях 2 и 5, или в положениях 2 и 6, или в положениях 3 и 4, или в положениях 3 и 5. В одном варианте воплощения заместители, которые могут присутствовать в циклоалкильной или циклоалкенильной группе, представляющей группу R30, выбраны из фтора, метила и гидрокси, в другом варианте воплощения - из фтора и метила. В одном варианте воплощения настоящего изобретения заместители в циклоалкильной или циклоалкенильной группе, представляющей группу R30, представляют собой гидрокси. В другом варианте воплощения циклоалкильная или циклоалкенильная группа, представляющая группу R30, является незамещенной. В одном варианте воплощения заместители, которые необязательно присутствуют в фенильной или гетероарильной группе, представляющей группу R30, выбраны из галогена, (C1-C4)-алкила и (C1-C4)-алкил-O-, в другом варианте воплощения - из галогена, (C1-C4)-алкила и циано, в другом варианте воплощения - из галогена и (C1-C4)-алкила, при этом в одном варианте воплощения настоящего изобретения алкильные группы в заместителях в фенильной и гетероарильной группах, представляющих группу R30, могут быть незамещенными или замещены одним или несколькими атомами фтора, и в качестве примера заместителей, содержащих фтор-замещенный алкил, заместители, включающие группу трифторметил, например CF3 как таковой или CF3-O-, могут быть включены в каждый перечень заместителей в дополнение к заместителям, включающим незамещенный алкил, и еще в одном варианте воплощения настоящего изобретения алкильные группы в заместителях в группе R30 не являются замещенными фтором и в этом последнем варианте воплощения указанный алкил, таким образом, означает незамещенный алкил. В одном варианте воплощения настоящего изобретения заместители, которые необязательно присутствуют в фенильной или гетероарильной группе, представляющей группу R30, выбраны из галогена, в другом варианте воплощения - из фтора, хлора и брома, в другом варианте воплощения - из фтора и хлора. Конкретные группы, которые могут присутствовать в качестве группы R30 и из которых, любой одной или нескольких, R30 выбран в одном варианте воплощения настоящего изобретения, включают, например, циклопентил, циклогексил, циклогептил, циклопент-2-енил, циклогекс-2-енил, циклогепт-2-енил, 4-фтор-циклогексил, 4-метил-циклогексил, 2-гидрокси-циклопентил, 3-гидрокси-циклопентил, 2-гидрокси-циклогексил, 3-гидрокси-циклогексил, 4-гидрокси-циклогексил, 2-гидрокси-циклогептил, 3-гидрокси-циклогептил, 4-гидрокси-циклогептил, 4,4-дифтор-циклогексил, 3,3-диметил-циклогексил, 4,4-диметил-циклогексил, тетрагидропиран-3-ил, тетрагидропиран-4-ил, фенил, т.е. незамещенный фенил, 2-фтор-фенил, 3-фтор-фенил, 4-фтор-фенил, 2-хлор-фенил, 3-хлор-фенил, 4-хлор-фенил, 3-бром-фенил, 4-бром-фенил, 2-метил-фенил, 3-метил-фенил, 4-метил-фенил, 2-метокси-фенил, 3-метокси-фенил, 4-метокси-фенил, тиофен-2-ил, тиофен-3-ил, пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, 2-метокси-пиридин-3-ил, 4-метокси-пиридин-3-ил, 5-метокси-пиридин-3-ил, 6-метокси-пиридин-3-ил, 2-метокси-пиридин-4-ил, 3-метокси-пиридин-4-ил.
Заместители R40 могут присутствовать по кольцевым атомам углерода в любом из положений в 6-членном кольце (аза)индолизиновой группы, представленной в формуле Ia и Ib, которое не занято группой Y и не является положением слияния. В случае когда число n заместителей R40 меньше чем 3, все атомы углерода в указанных положениях 6-членного кольца (аза)индолизиновой группы, представленной в формуле Ia и Ib, которые не заняты группой Y или являются положением слияния, которые не содержат заместитель R40, содержат атом водорода, т.е. в соответствующих положениях присутствуют CH группы. В случае когда количество n равно 0, все три из таких кольцевых атомов углерода содержат атомы водорода. В случае соединения формулы Ia или Ib, которое содержит один заместитель R40, в одном варианте воплощения настоящего изобретения заместитель R40 присутствует по кольцевому атому углерода в 6-членном кольце в (аза)индолизиновой группе, представленной в формуле Ia и Ib, который является смежным с группой Y, в другом варианте воплощения заместитель R40 присутствует по кольцевому атому углерода, который отделен от группы Y одним кольцевым атомом углерода, и еще в одном варианте воплощения заместитель R40 присутствует по кольцевому атому углерода, который отделен от группы Y двумя кольцевыми атомами углерода. В случае соединения формулы Ia или Ib, которое содержит два заместителя R40, в одном варианте воплощения заместители R40 присутствуют по кольцевому атому углерода, который является смежным с группой Y и по кольцевому атому углерода, который отделен от группы Y одним кольцевым атомом углерода, в другом варианте воплощения заместители R40 присутствуют по кольцевому атому углерода, который является смежным с группой Y и по кольцевому атому углерода, который отделен от группы Y двумя кольцевыми атомами углерода, и еще в одном варианте воплощения заместители R40 присутствуют по кольцевому атому углерода, который отделен от группы Y одним кольцевым атомом углерода, и по кольцевому атому углерода, который отделен от группы Y двумя кольцевыми атомами углерода. В одном варианте воплощения настоящего изобретения число n заместителей R40 составляет 0, 1 или 2, в другом варианте воплощения оно составляет 0 или 1. В одном варианте воплощения настоящего изобретения число n составляет 1 или 2, в другом варианте воплощения оно составляет 1. В другом варианте воплощения количество n=0, т.е. никакого заместителя R40 нет в соединении формулы Ia или Ib. В одном варианте воплощения настоящего изобретения R40 выбран из галогена, (C1-C4)-алкила, гидрокси, (C1-C4)-алкил-O-, R41-N(R42)-, Het2, R41-N(R42)-C(O)-, Het2-C(O)-, циано, R41-N(R42)-S(O)2- и Het2-S(O)2-, в другом варианте воплощения - из галогена, (C1-C4)-алкила, гидрокси, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)m-, R41-N(R42)-, Het2, R41-N(R42)-C(O)-, Het2-C(O)-, R41-N(R42)-S(O)2- и Het2-S(O)2-, в другом варианте воплощения - из галогена, (C1-C4)-алкила, гидрокси, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)m-, Het2, R41-N(R42)-C(O)-, Het2-C(O)-, R41-N(R42)-S(O)2- и Het2-S(O)2-, в другом варианте воплощения - из галогена, (C1-C4)-алкила, гидрокси, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)m-, R41-N(R42)-C(O)-, Het2-C(O)-, R41-N(R42)-S(O)2- и Het2-S(O)2-, в другом варианте воплощения - из галогена, (C1-C4)-алкила, гидрокси, (C1-C4)-алкил-O-, R41-N(R42)-, Het2, R41-N(R42)-C(O)- и Het2-C(O)-, в другом варианте воплощения - из галогена, (C1-C4)-алкила, гидрокси, (C1-C4)-алкил-O-, R41-N(R42)-C(O)- и Het2-C(O)-, в другом варианте воплощения - из галогена, гидрокси, (C1-C4)-алкил-O-, Het2, R41-N(R42)-C(O)- и Het2-C(O)-, в другом варианте воплощения - из галогена, гидрокси, (С1-C4)-алкил-O-, R41-N(R42)-C(O)- и Het2-C(O)-, в другом варианте воплощения - из галогена, (C1-C4)-алкил-O-, R41-N(R42)-C(O)- и Het2-C(O)-, в другом варианте воплощения - из галогена, (C1-C4)-алкила, R41-N(R42)-, Het2, R41-N(R42)-C(O)- и Het2-C(O)-, в другом варианте воплощения - из галогена, (C1-C4)-алкила, R41-N(R42)-C(O)- и Het2-C(O)-, в другом варианте воплощения - из галогена, Het2, R41-N(R42)-C(O)- и Het2-C(O)-, в другом варианте воплощения - из галогена, R41-N(R42)-C(O)- и Het2-C(O)-, в другом варианте воплощения - из R41-N(R42)-C(O)- и Het2-C(O)-, в другом варианте воплощения - из галогена и R41-N(R42)-C(O)-, в другом варианте воплощения - из галогена и Het2-C(O)-, в другом варианте воплощения - из галогена, гидрокси и (C1-C4)-алкил-O-, в другом варианте воплощения - из галогена и (C1-C4)-алкил-O-, в другом варианте воплощения R40 представляет собой (C1-C4)-алкил-O-, в другом варианте воплощения R40 представляет собой R41-N(R42)-C(O)-, в другом варианте воплощения R40 представляет собой Het2-C(O), где все заместители R40 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга.
В одном варианте воплощения настоящего изобретения R41 выбран из водорода и (C1-C4)-алкила, в другом варианте воплощения - из водорода и (C3-C7)-циклоалкил-CvH2v-, в другом варианте воплощения - из (C1-C4)-алкила и (C3-C7)-циклоалкил-CvH2v-, в другом варианте воплощения R41 представляет собой (C1-C4)-алкил, в другом варианте воплощения R41 представляет собой водород, где все группы R41 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга.
В одном варианте воплощения настоящего изобретения R42 выбран из водорода и метила, в другом варианте воплощения R42 представляет собой (C1-C4)-алкил, в другом варианте воплощения R42 представляет собой водород, где все группы R42 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга.
В одном варианте воплощения настоящего изобретения Y выбран из CH и C((C1-C4)-алкил), в другом варианте воплощения - из N, CH и C(CH3), в другом варианте воплощения - из N и CH, в другом варианте воплощения Y представляет собой CH, и еще в одном варианте воплощения Y представляет собой N. В одном варианте воплощения настоящего изобретения соединение формулы Ia или Ib представляет собой соединение формулы Ia в любой из его стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении, или физиологически приемлемую соль такого соединения или физиологически приемлемый сольват любой из таких форм соединения, в другом варианте воплощения оно представляет собой соединение формулы Ia, в котором группа Y выбрана из CH и C((C1-C4)-алкил), в любой из его стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении, или физиологически приемлемую соль такого соединения или физиологически приемлемый сольват любой из таких форм соединения, т.е. оно представляет собой индолизин-3-карбоксамидное производное, которое может быть представлено формулой Ic, и еще в одном варианте воплощения оно представляет собой соединение формулы Ia, в котором группа Y представляет собой N, в любой из его стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении, или физиологически приемлемую соль такого соединения или физиологически приемлемый сольват любой из таких форм соединения, т.е. оно представляет собой 5-азаиндолизин-3-карбоксамидное производное или пирроло[1,2-b]пиридазин-7-карбоксамидное производное, которое может быть представлено формулой Id.
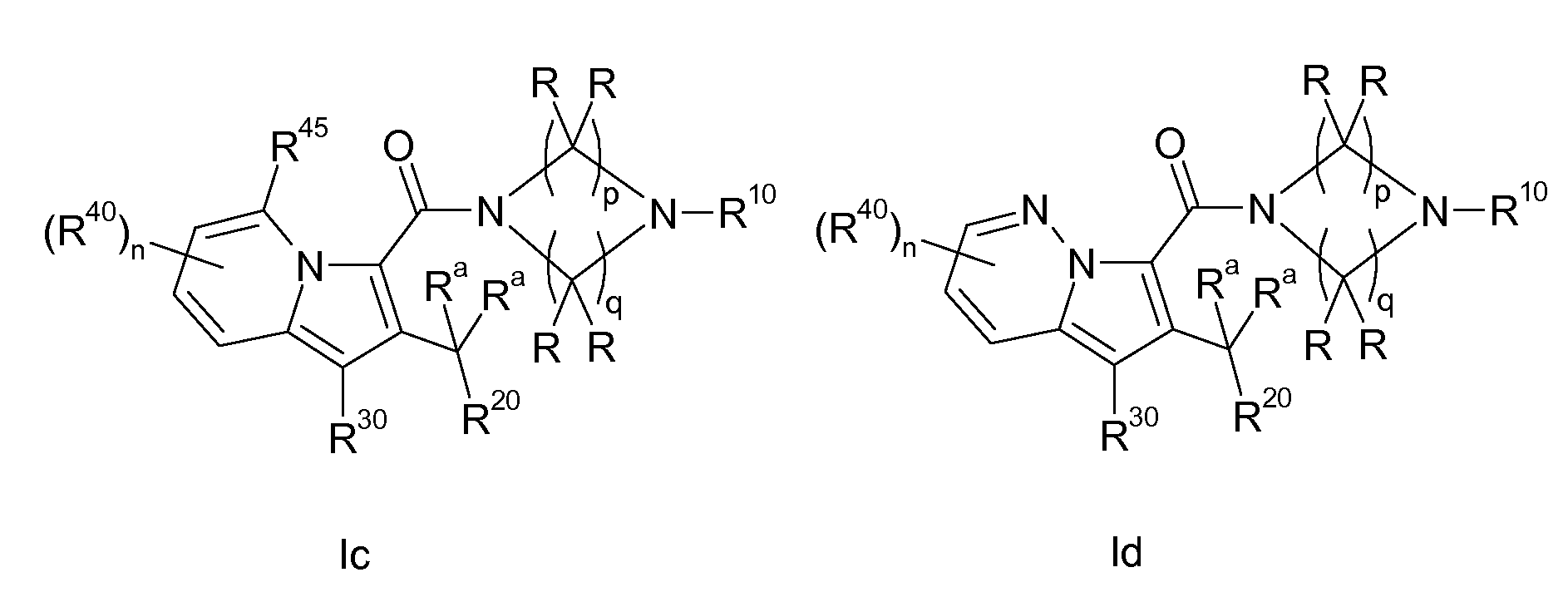
В другом варианте воплощения настоящего изобретения соединение формулы Ia или Ib представляет собой соединение формулы Ib, в любой из его стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении, или физиологически приемлемую соль такого соединения или физиологически приемлемый сольват любой из таких форм соединения, в другом варианте воплощения оно представляет собой соединение формулы Ib, в котором группа Y выбрана из CH и C((C1-C4)-алкил), в любой из его стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении, или физиологически приемлемую соль такого соединения или физиологически приемлемый сольват любой из таких форм соединения, т.е. оно представляет собой индолизин-1-карбоксамидное производное, которое может быть представлено формулой Ie, и еще в одном варианте воплощения оно представляет собой соединение формулы Ib, в котором группа Y представляет собой N, в любой из его стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении, или физиологически приемлемую соль такого соединения или физиологически приемлемый сольват любой из таких форм соединения, т.е. оно представляет собой 5-азаиндолизин-1-карбоксамидное производное или пирроло[1,2-b]пиридазин-5-карбоксамидное производное, которое может быть представлено формулой If.
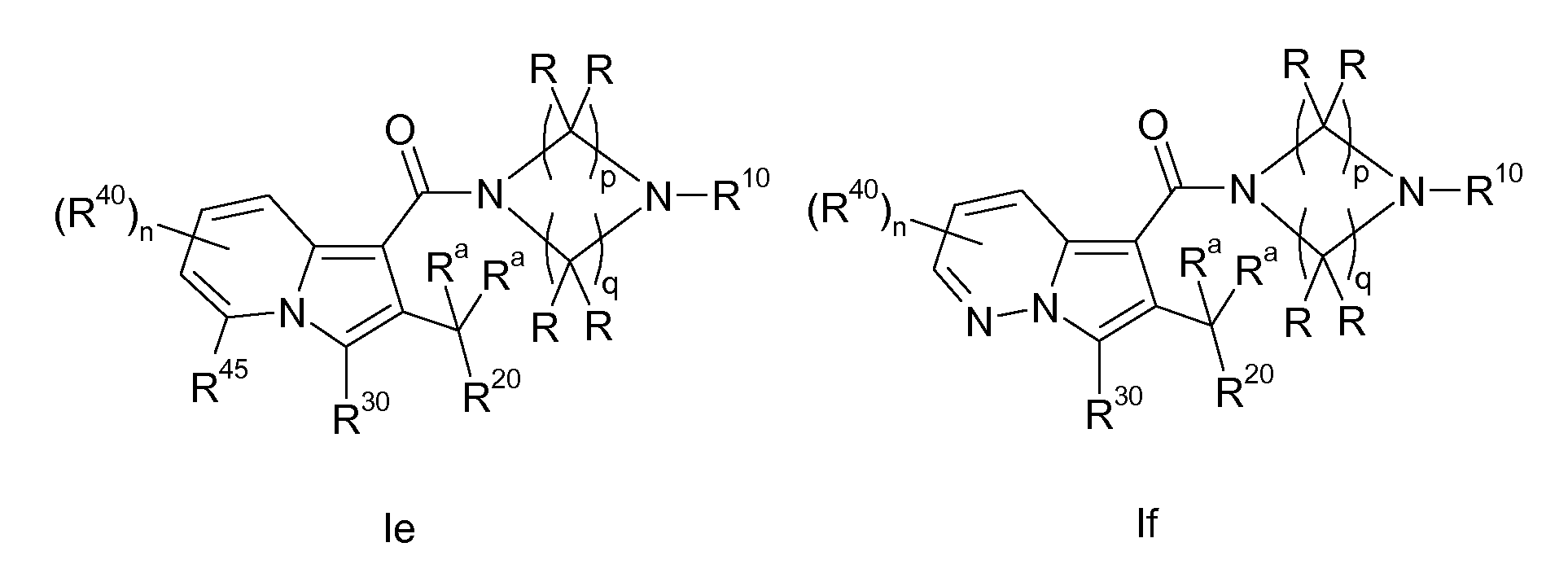
Все указания и объяснения, представленные выше и ниже, в отношении соединений формул Ia и Ib и настоящего изобретения в целом касаются соответственно соединений формул Ic, Id, Ie и If. В частности, R, Ra, R10, R20, R30, R40, n, p и q в соединениях формул Ic, Id, Ie и If имеют значения, указанные в общем определении соединений формул Ia и Ib или в любом варианте воплощения, описанном выше или ниже. Группа R45 в соединениях формул Ic и Ie выбрана из водорода и (C1-C4)-алкила. В одном варианте воплощения R45 выбран из водорода и метила, и еще в одном варианте воплощения R45 представляет собой водород. В одном варианте воплощения настоящего изобретения соединение формулы Ia или Ib представляет собой соединение формулы Ia, в котором группа Y выбрана из N, CH и C((C1-C4)-алкил), или соединение формулы Ib, в котором группа Y выбрана из CH и C((C1-C4)-алкил), в любой из его стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении, или физиологически приемлемую соль такого соединения или физиологически приемлемый сольват любой из таких форм соединения, т.е. в этом варианте воплощения соединения формул Ia и Ib могут быть представлены формулами Ic, Id и Ie.
В одном варианте воплощения настоящего изобретения число p составляет 2 и число q выбрано из 2 и 3. В другом варианте воплощения настоящего изобретения оба p и q равны 2, т.е. диазациклоалкановое кольцо, представленное в формуле Ia и Ib, представляет собой пиперазиновое кольцо, и соединение формулы Ia или Ib представляет собой соединение формулы Ig или Ih в любой из его стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении, или физиологически приемлемую соль такого соединения или физиологически приемлемый сольват любой из таких форм соединения. Все указания и объяснения в отношении соединений формул Ia и Ib и настоящего изобретения в целом касаются соответственно соединений формул Ig и Ih. В частности, R, Ra, R10, R20, R30, R40, Y и n в соединениях формул Ig и Ih имеют значения, указанные в общем определении соединений формул Ia и Ib или в любом варианте воплощения, описанном выше или ниже.
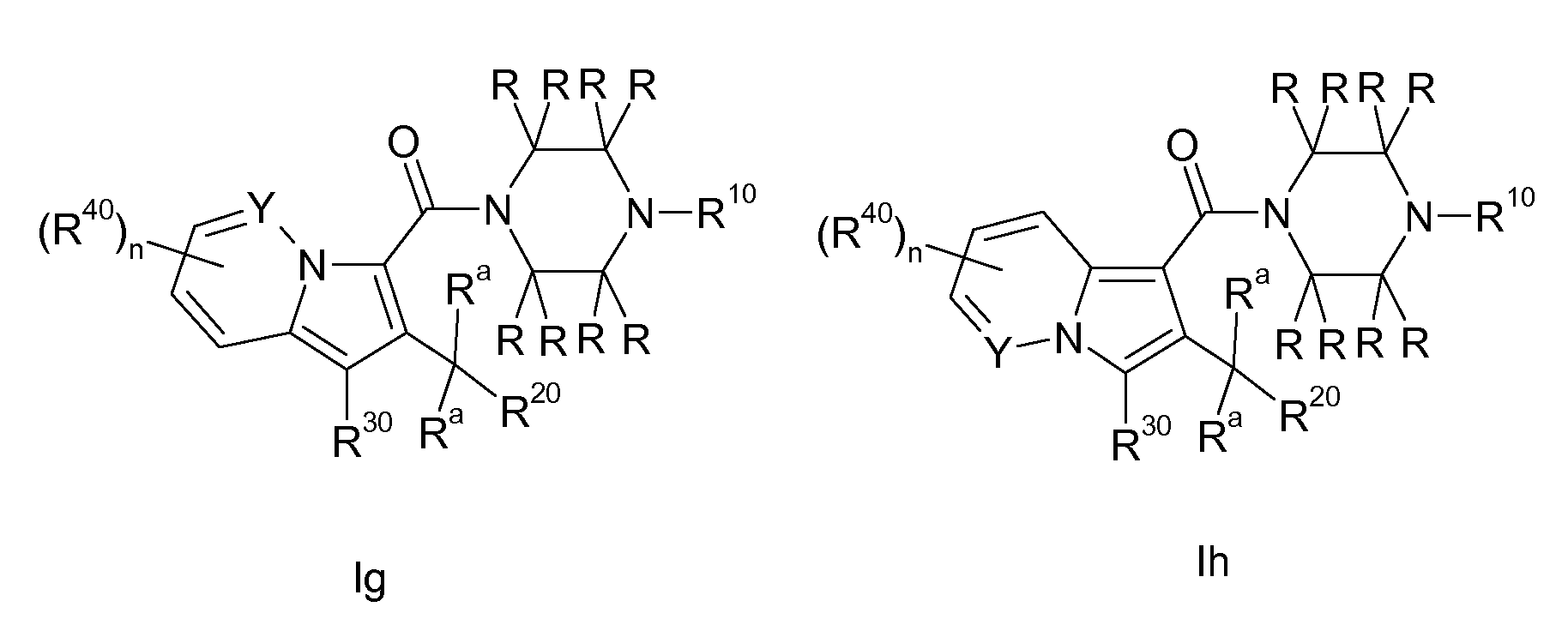
Объектом настоящего изобретения являются все соединения формул Ia и Ib, где любые один или несколько структурных элементов, таких как группы, заместители и количественные значения, определены в любом из описанных вариантов воплощения или определениях элементов или имеют любое одно или несколько из конкретных значений, которые указаны в настоящем описании в качестве примеров элементов, при этом все сочетания одного или нескольких описанных вариантов воплощения и/или определений и/или конкретных значений элементов являются объектом настоящего изобретения, и структурные элементы в соединениях формулы Ia определены независимо от структурных элементов в соединениях формулы Ib и могут быть одинаковыми или отличными друг от друга в соединениях этих двух формул. Также, что касается всех таких соединений формул Ia и Ib, все их стереоизомерные формы и смеси стереоизомерных форм в любом соотношении и их физиологически приемлемые соли и физиологически приемлемые сольваты любой из таких форм являются объектом настоящего изобретения. Подобным образом также в отношении всех конкретных соединений, раскрытых в настоящей заявке, таких как соединения примеров, которые представляют собой варианты воплощения настоящего изобретения, где структурные элементы в общем определении соединений формул Ia и Ib имеют конкретные значения, присутствующие в соответствующем конкретном соединении, подразумевается, что они являются объектом настоящего изобретения в любой из их стереоизомерных форм и или в виде смеси стереоизомерных форм в любом соотношении, и в форме их физиологически приемлемых солей и в виде физиологически приемлемых сольватов любой из таких форм. Независимо от того, раскрыто ли конкретное соединение в настоящей заявке в виде свободного соединения и/или в виде определенной соли, оно является объектом настоящего изобретения как в форме свободного соединения, так и в форме всех его физиологически приемлемых солей и, если раскрывается конкретная соль, также и в форме этой конкретной соли, и в форме физиологически приемлемых сольватов любой из таких форм.
В качестве примера соединений по настоящему изобретению, в которых любой один или несколько структурных элементов имеют значения, определенные в любом из раскрытых вариантов воплощения или определений, можно указать соединения формул Ia и Ib, где p и q оба имеют значение 2, R10 выбран из водорода и (C1-C6)-алкил-O-C(O)-, и группы Ra обе представляют собой водород, т.е. соединения формул Ig и Ih, где R10 выбран из водорода и (C1-C6)-алкил-O-C(O)-, и Ra представляет собой водород. Другим примером являются соединения формул Ia и Ib, где p и q оба имеют значение 2, одна, две или три из групп R независимо друг от друга выбраны из водорода, (C1-C6)-алкила, который необязательно замещен одним, двумя или тремя одинаковыми или отличными друг от друга заместителями R1, и (C3-C7)-циклоалкила, или две из этих групп R, связанные с одним и тем же атомом углерода, вместе представляют собой двухвалентную (C2-C5)-алкильную группу, и все другие группы R представляют собой водород, R10 выбран из водорода и (C1-C6)-алкил-O-C(O)-, и группы Ra обе представляют собой водород. Другим примером являются соединения формул Ia и Ib, где p и q оба имеют значение 2, одна, две или три из групп R независимо друг от друга выбраны из водорода и (C1-C6)-алкила, который необязательно замещен одним, двумя или тремя одинаковыми или отличными друг от друга заместителями R1, и все другие группы R представляют собой водород, R10 представляет собой водород, и группы Ra обе представляют собой водород. Все эти соединения, в которых все другие группы и количественные значения определены в общем определении соединений формул Ia и Ib или в любом из раскрытых вариантов воплощения или определений, являются объектом настоящего изобретения в любой из их стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении и в форме их физиологически приемлемых солей и в виде физиологически приемлемых сольватов любой из таких форм.
Другим таким примером являются соединения формул Ia и Ib, в любой из их стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении, и их физиологически приемлемые соли и физиологически приемлемые сольваты любой из таких форм, где
Ra выбран из водорода и фтора;
R выбран из водорода и (C1-C6)-алкила, который необязательно замещен одним или несколькими одинаковыми или отличными друг от друга заместителями R1, где все группы R являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга, или две группы R, связанные с одним и тем же атомом углерода, вместе представляют собой двухвалентную (C2-C5)-алкильную группу;
R1 выбран из фенила, гидрокси, (C1-C4)-алкил-O-, R2-N(R3)-C(O)-, R4-O-C(O)- и циано;
R2 выбран из водорода и (C1-C6)-алкила, который необязательно замещен одним или несколькими одинаковыми или отличными друг от друга заместителями R5, где все группы R2 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
R3, R4, R6, R7 и R8 выбраны из водорода и (C1-C4)-алкила, где все группы R3, R4, R6, R7 и R8 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
R5 выбран из гидрокси, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)m-, R6-N(R7)-C(O)-, R8-O-C(O)-, циано, (C3-C7)-циклоалкила, фенила, гетероарила и Het1;
R10 выбран из водорода и (C1-C6)-алкил-O-C(O)-;
R20 выбран из фенила и гетероарила, которые необязательно замещены одним или несколькими одинаковыми или отличными друг от друга заместителями, выбранными из галогена, (C1-C4)-алкила, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)m- и циано;
R30 выбран из (C5-C7)-циклоалкила, тетрагидропиранила, фенила и гетероарила, где циклоалкил необязательно замещен одним или несколькими одинаковыми или отличными друг от друга заместителями, выбранными из фтора, (C1-C4)-алкила и гидрокси, и фенил и гетероарил необязательно замещены одним или несколькими одинаковыми или отличными друг от друга заместителями, выбранными из галогена, (C1-C4)-алкила, (C1-C4)-алкил-O- и циано;
R40 выбран из галогена, (C1-C4)-алкила, (C3-C7)-циклоалкил-CvH2v-, гидрокси, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)m-, R41-N(R42)-, Het2, R41-N(R42)-C(O)-, Het2-C(O)-, циано, R41-N(R42)-S(O)2- и Het2-S(O)2-, где все заместители R40 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
R41 выбран из водорода и (C1-C4)-алкила, где все группы R41 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
R42 выбран из водорода и (C1-C4)-алкила, где все группы R42 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
Y выбран из N, CH и C((C1-C4)-алкил);
гетероарил представляет собой ароматическую моноциклическую 5-членную или 6-членную гетероциклическую группу, которая включает 1 или 2 одинаковых или отличных друг от друга кольцевых гетероатома, выбранных их N, O и S, где один из кольцевых атомов азота может содержать атом водорода или (C1-C4)-алкильный заместитель и где гетероарильная группа связана через кольцевой атом углерода;
Het1 представляет собой насыщенную моноциклическую 4-членную - 7-членную гетероциклическую группу, которая включает 1 или 2 одинаковых или отличных друг от друга кольцевых гетероатома, выбранных их N, O и S, где группа Het1 связана через кольцевой атом углерода или кольцевой атом азота, где кольцевые атомы азота могут содержать атом водорода или заместитель, выбранный из (C1-C4)-алкила и (C1-C6)-алкил-O-C(O)-, где кольцевые атомы серы могут содержать одну или две оксогруппы и где Het1 необязательно замещен по кольцевым атомам углерода одним или несколькими одинаковыми или отличными друг от друга заместителями, выбранными из фтора, (C1-C4)-алкила и оксо;
Het2 представляет собой насыщенную моноциклическую 4-членную - 7-членную гетероциклическую группу, которая включает кольцевой атом азота, через который группа Het2 связана, и необязательно дополнительный кольцевой гетероатом, выбранный из N, O и S, где дополнительный кольцевой атом азота содержит атом водорода или заместитель, выбранный из (C1-C4)-алкила и (C1-C6)-алкил-O-C(O)-, где кольцевой атом серы может содержать одну или две оксогруппы, и где Het2 необязательно замещен по кольцевым атомам углерода одним или несколькими одинаковыми или отличными друг от друга заместителями, выбранными из фтора, (C1-C4)-алкила и оксо;
m выбран из 0, 1 и 2, где все значения m являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
n выбран из 0, 1 и 2;
p и q имеют значение 2;
v выбран из 0, 1 и 2, где все значения v являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
где все алкильные группы независимо друг от друга необязательно замещены одним или несколькими атомами фтора;
где все циклоалкильные группы независимо друг от друга необязательно замещены одним или несколькими одинаковыми или отличными друг от друга заместителями, выбранными из фтора и (C1-C4)-алкила, если не указано иное;
где все фенильные и гетероарильные группы, присутствующие в R1 и R5, независимо друг от друга необязательно замещены одним или несколькими одинаковыми или отличными друг от друга заместителями, выбранными из галогена, (C1-C4)-алкила, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)2- и циано.
Другим таким примером являются соединения формул Ia и Ib в любой из их стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении, и физиологически приемлемые соли, и физиологически приемлемые сольваты любой из таких форм, где
Ra представляет собой водород;
одна или две из групп R независимо друг от друга выбраны из водорода и (C1-C6)-алкила, который необязательно замещен одним или двумя одинаковыми или отличными друг от друга заместителями R1, и другие группы R представляют собой водород;
R1 выбран из гидрокси, R2-N(R3)-C(O)- и R4-O-C(O)-;
R2 выбран из водорода и (C1-C6)-алкила, который необязательно замещен одним или двумя одинаковыми или отличными друг от друга заместителями R5, где все группы R2 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
R3, R4, R6, R7 и R8 выбраны из водорода и (C1-C4)-алкила, где все группы R3, R4, R6, R7 и R8 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
R5 выбран из гидрокси, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)m-, R6-N(R7)-C(O)-, R8-O-C(O)-, гетероарила и Het1,
R10 выбран из водорода и (C1-C6)-алкил-O-C(O)-;
R20 представляет собой фенил, который необязательно замещен одним, двумя или тремя одинаковыми или отличными друг от друга заместителями, выбранными из галогена и (C1-C4)-алкила;
R30 представляет собой фенил, который необязательно замещен одним или двумя одинаковыми или отличными друг от друга заместителями, выбранными из галогена и (C1-C4)-алкила;
R40 выбран из галогена, (C1-C4)-алкила, гидрокси, (C1-C4)-алкил-O-, R41-N(R42)-, Het2, R41-N(R42)-C(O)- и Het2-C(O)-, где все заместители R40 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
R41 выбран из водорода и (C1-C4)-алкила, где все группы R41 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
R42 выбран из водорода и (C1-C4)-алкила, где все группы R42 являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
Y выбран из N, CH и C((C1-C4)-алкил);
гетероарил представляет собой ароматическую моноциклическую 5-членную или 6-членную гетероциклическую группу, которая включает 1 или 2 одинаковых или отличных друг от друга кольцевых гетероатома, выбранных их N, O и S, где один из кольцевых атомов азота может содержать атом водорода или (C1-C4)-алкильный заместитель и где гетероарильная группа связана через кольцевой атом углерода;
Het1 представляет собой насыщенную моноциклическую 4-членную - 7-членную гетероциклическую группу, которая включает 1 или 2 одинаковых или отличных друг от друга кольцевых гетероатома, выбранных их N, O и S, где группа Het1 связана через кольцевой атом углерода или кольцевой атом азота, где кольцевые атомы азота могут содержать атом водорода или заместитель, выбранный из (C1-C4)-алкила и (C1-C6)-алкил-O-C(O)-, где кольцевые атомы серы могут содержать одну или две оксогруппы и где Het1 необязательно замещен по кольцевым атомам углерода одним или несколькими одинаковыми или отличными друг от друга заместителями, выбранными из фтора и (C1-C4)-алкила;
Het2 представляет собой насыщенную моноциклическую 4-членную - 7-членную гетероциклическую группу, которая включает кольцевой атом азота, через который группа Het2 связана, и необязательно дополнительный кольцевой гетероатом, выбранный из N, O и S, где дополнительный кольцевой атом азота содержит атом водорода или заместитель, выбранный из (C1-C4)-алкила и (C1-C6)-алкил-O-C(O)-, где кольцевой атом серы может содержать одну или две оксогруппы и где Het2 необязательно замещен по кольцевым атомам углерода одним или несколькими одинаковыми или отличными друг от друга заместителями, выбранными из фтора и (C1-C4)-алкила;
m выбран из 0, 1 и 2, где все значения m являются независимыми друг от друга и могут быть одинаковыми или отличными друг от друга;
n выбран из 0, 1 и 2;
p и q имеют значение 2;
где все алкильные группы независимо друг от друга необязательно замещены одним или несколькими атомами фтора;
где все гетероарильные группы, присутствующие в R5, независимо друг от друга необязательно замещены одним или несколькими одинаковыми или отличными друг от друга заместителями, выбранными из галогена, (C1-C4)-алкила, (C1-C4)-алкил-O-, (C1-C4)-алкил-S(O)2- и циано.
Другим объектом настоящего изобретения являются способы получения соединений формул Ia и Ib, включая их соли и сольваты, которые описаны ниже и с использованием которых можно получить такие соединения. Например, в одном подходе к получению соединения формулы Ia или Ib соединение формулы IIa или IIb или соединение, в котором вместо карбоновокислотной группы, представленной в формуле IIa и IIb, присутствует реакционноспособная группа карбоновокислотного производного, например группа хлорангидрида карбоновой кислоты, подвергают взаимодействию с соединением формулы III с получением соединения формулы IVa или IVb соответственно,
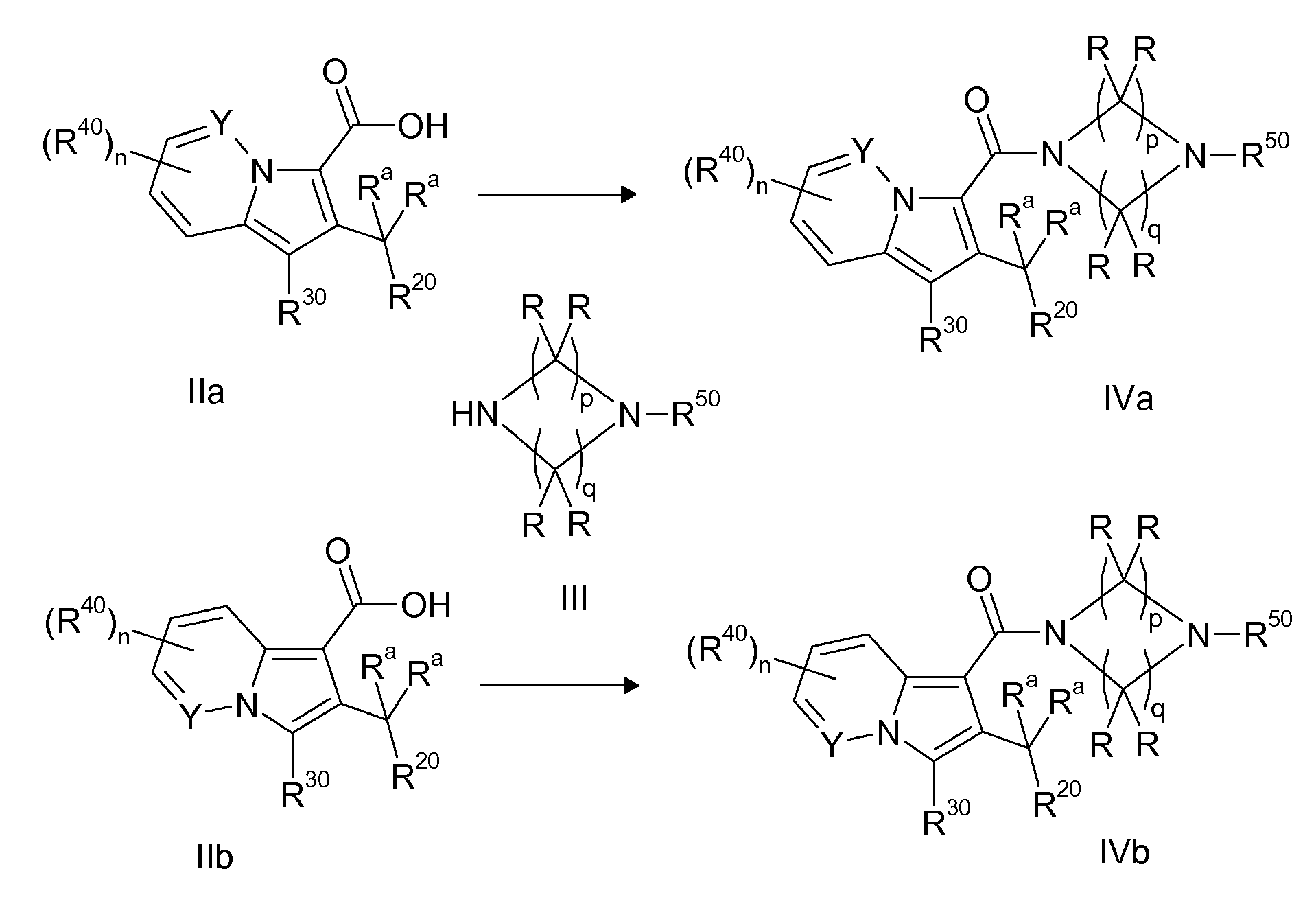
где R, Ra, R20, R30, R40, Y, n, p и q в соединениях формул IIa, IIb, III, IVa и IVb имеют значения, определенные для соединений формул Ia и Ib и, кроме того, функциональные группы могут присутствовать в защищенной форме или в форме группы-предшественника, которую на более поздней стадии преобразуют в конечную группу, и R50 определен как R10 в соединениях формул Ia и Ib за исключением водорода, или R50 представляет собой защитную группу, и осуществляют удаление защитной группы R50 в соединении формулы IVa или IVb в случае получения соединения формулы Ia или Ib, в котором R10 представляет собой водород, и необязательно преобразование любых других защищенных групп или групп-предшественников в конечные группы. Т.е. группа R50 в соединениях формул III, IVa и IVb может представлять собой (C1-C6)-алкил-O-CO- или (C3-C7)-циклоалкил-CvH2v-O-CO-, при этом такие группы защищают атом азота, содержащий R50, против взаимодействия с соединением формулы IIa или IIb, или R50 может представлять собой другую защитную группу, которая препятствует реакции по указанному атому азота и может быть впоследствии удалена с получением конечного соединения формулы Ia или Ib, в котором R10 представляет собой водород. Примерами групп, которые препятствуют реакции по указанному атому азота, помимо таких групп, как трет-бутилоксикарбонильная группа, которые могут быть впоследствии удалены путем обработки кислотой, такой как трифторуксусная кислота или хлористый водород, являются бензилоксикарбонильная группа и бензильная группа, которые могут быть впоследствии удалены путем гидрирования в присутствии катализатора, такого как палладиевый катализатор, или флуорен-9-илоксикарбонильная группа, которая может быть впоследствии удалена путем обработки пиперидином.
Взаимодействие карбоновых кислот формул IIa и IIb или их реакционноспособных производных с диазациклоалканом формулы III с получением соединений формул IVa и IVb включает образование амидной связи, и это можно осуществить в стандартных условиях для таких амидных связываний. Когда в реакции используют карбоновую кислоту формулы IIa или IIb, ее обычно преобразовывают в реакционноспособное производное, которое может быть выделено или получено in situ или активировано in situ с использованием традиционного амидного связывающего реагента. Например, соединение формулы IIa или IIb можно преобразовать в хлорангидрид карбоновой кислоты путем обработки тионилхлоридом, оксалилхлоридом или (1-хлор-2-метил-пропенил)-диметиламином, в реакционноспособный сложный эфир или в смешанный ангидрид путем обработки алкилхлорформиатом, таким как этилхлорформиат или изобутилхлорформиат, или оно может быть активировано реагентом, таким как пропанфосфоновый ангидрид, N,N'-карбонилдиазол, такой как N,N'-карбонилдиимидазол (CDI), карбодиимид, такой как N,N'-диизопропилкарбодиимид (DIC), N,N'-дициклогексилкарбодиимид (DCC) или гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC), карбодиимид вместе с добавкой, такой как 1-гидроксибензотриазол (HOBT) или 1-гидрокси-7-азабензотриазол (HOAT), связывающий реагент на основе урония, такой как тетрафторборат O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TBTU), гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU), гексафторфосфат O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU) или тетрафторборат O-(циано(этоксикарбонил)метиленамино)- N,N,N',N'-тетраметилурония (TOTU), или связывающий реагент на основе фосфония, такой как гексафторфосфат (бензотриазол-1-илокси)трис(диметиламино)фосфония (BOP), гексафторфосфат (бензотриазол-1-илокси)трипирролидинофосфония (PyBOP) или гексафторфосфат бромтрипирролидинофосфония (PyBroP). Активацию соединения формулы IIa или IIb и взаимодействие активированного соединения формулы IIa или IIb или реакционноспособного карбоновокислотного производного с соединением формулы III обычно осуществляют в инертном растворителе, таком как простой эфир, такой как тетрагидрофуран (ТГФ), диоксан или 1,2-диметоксиэтан (DME), или углеводород, такой как толуол, или хлорированный углеводород, такой как дихлорметан или хлороформ, или амид, такой как диметилформамид (DMF) или N-метилпирролидин-2-он (NMP), например, или в смеси растворителей, при температурах от около 0°C до около 60°C в присутствии подходящего основания, такого как третичный амин, такой как триэтиламин, этил-диизопропиламин, N-метилморфолин или пиридин, или основного соединения щелочного металла, такого как карбонат щелочного металла, такой как карбонат натрия, карбонат калия или карбонат цезия, например.
Карбоновые кислоты формулы IIa или соединения, которые вместо карбоновокислотной группы, представленной в формуле IIa, содержат группу производного карбоновой кислоты, например группу хлорангидрида карбоновой кислоты, можно получить из (аза)индолизинов формулы V путем введения непосредственно карбоновокислотной группы или групп производного карбоновой кислоты, или введения сначала альдегидной группы в соединение формулы V с получением соединения формулы VI и затем окисления альдегидной группы до карбоксильной группы.
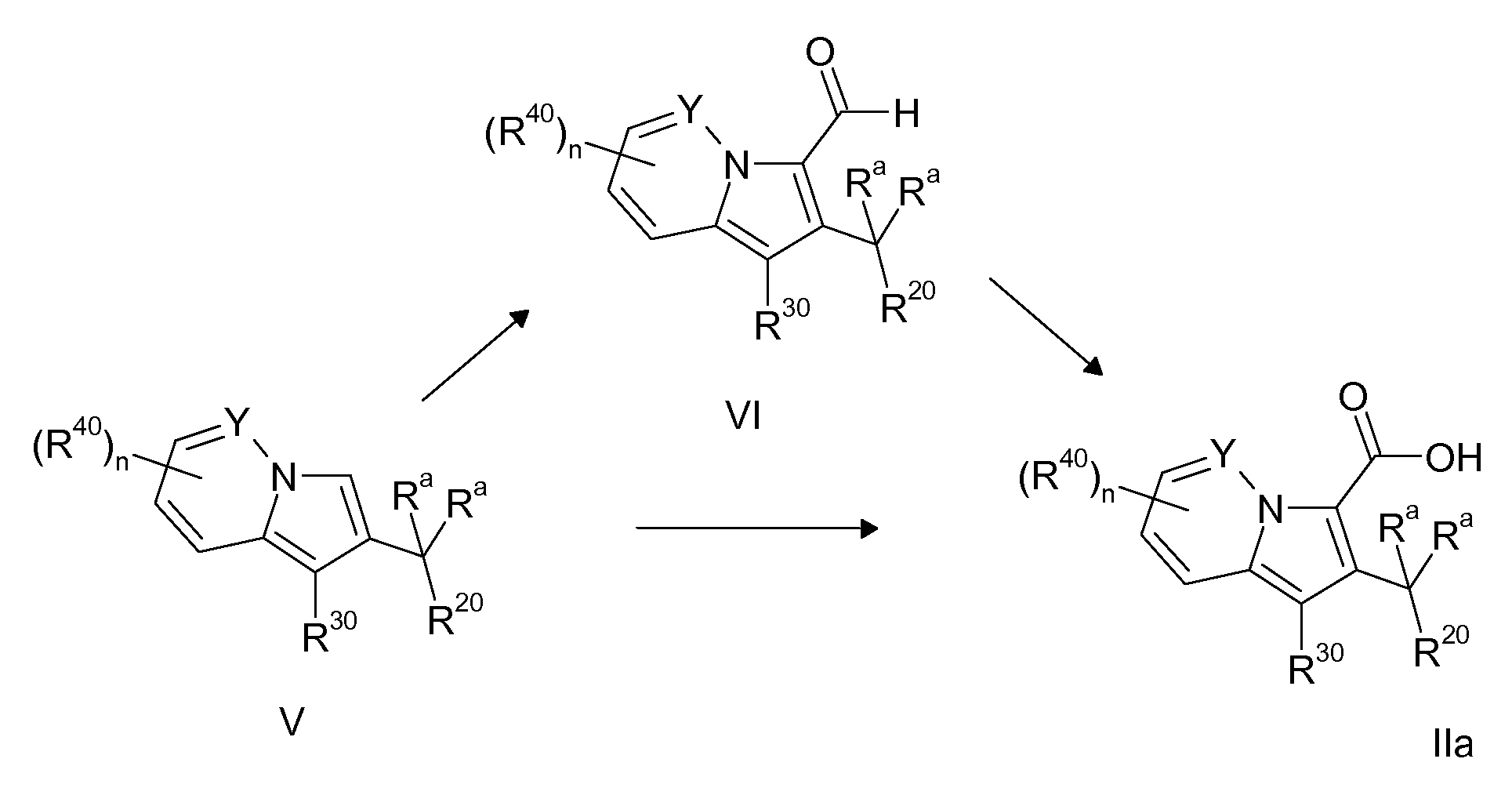
Ra, R20, R30, R40, Y и n в соединениях формул V и VI имеют значения, определенные для соединений формулы Ia и, кроме того, функциональные группы могут присутствовать в защищенной форме или в форме группы-предшественника, которую на более поздней стадии преобразуют в конечную группу.
Непосредственное введение карбоновокислотной группы или группы производного карбоновой кислоты в соединения формулы V удобным образом можно осуществить путем взаимодействия с фосгеном или производным фосгена, таким как трифосген, эта реакция приводит к образованию хлорангидридов кислот соединений формулы IIa, которые затем можно использовать в последующей реакции с соединением формулы III без дополнительной стадии активации и без выделения. Взаимодействие с фосгеном или производным фосгена, таким как трифосген, обычно осуществляют в инертном растворителе, таком как углеводород, такой как толуол или бензол, или хлорированный углеводород, такой как дихлорметан, или в смеси растворителей, при температурах от около 0°C до около 30°C, предпочтительно в присутствии основания, такого как пиридин (см. G. A. M. Giardina et al., Farmaco 54 (1999), 364). Формилирование (аза)индолизинов формулы V до соединений формулы VI удобным образом можно осуществить в условиях реакции Вилсмейера (см. G. Jones, Organic Reactions 49 (1997), 1). Реагент Вилсмейера можно получить in situ из диметилформамида (DMF) и подходящего неорганического или органического хлорида, такого как фосген, оксалилхлорид или оксихлорид фосфора, в инертном апротонном растворителе, таком как углеводород или хлорированный углеводород, такой как бензол, дихлорметан или хлороформ, или простой эфир, такой как DME, или избыточное количество DMF, или их смесь, при температурах от около 0°C до около 10°C. Предпочтительно используют оксихлорид фосфора в избыточном количестве DMF в качестве растворителя. Взаимодействие реагента Вилсмейера с соединением формулы V обычно осуществляют при температурах от около 0°C до около 60°C. Гидролитическая обработка реакционной смеси, которую также как и обработку для всех реакций в получении соединений формул Ia и Ib обычно можно осуществить в стандартных условиях, затем дает альдегид формулы VI. Реагенты для окисления альдегида до карбоновой кислоты формулы IIa представляют собой перманганаты, такие как перманганат калия, который можно использовать в смеси воды и инертного органического растворителя, такого как кетон, такой как ацетон, или простой эфир, такой как ТГФ, при температурах от около 10°C до около 30°C, при значениях pH около нейтральных, или галогеновые окислители, такие как хлориты, такие как хлорит натрия, который можно использовать в присутствии 2-метилбут-2-ена в смеси воды и инертного органического растворителя, такого как спирт, такой как трет-бутанол, или простой эфир, такой как ТГФ, или их смесь, при температурах от около 0°C до около 30°C, при слабо кислотном значении pH, например, в присутствии дигидрофосфата.
Синтетические процедуры, которые можно использовать в получении соединений формулы V, а также (аза)индолизиновых производных, описаны в T. Uchida et al., Synthesis (1976), 209, например. Соединения формулы V, в которых группа Y представляет собой необязательно замещенный атом углерода, т.е. соединения формулы Va, можно синтезировать из пиридиновых производных, содержащих R30-CH2- заместитель в 2-положении, т.е. соединений формулы VII, и 3-замещенных 1-галоген-пропанонов формулы VIII с использованием хорошо известного способа Чичибабина (см. A. E. Tschitschibabin, Ber. Dtsch. Chem. Ges. 60 (1927), 1607; W. Chai et al., Synlett (2003), 2086), например.
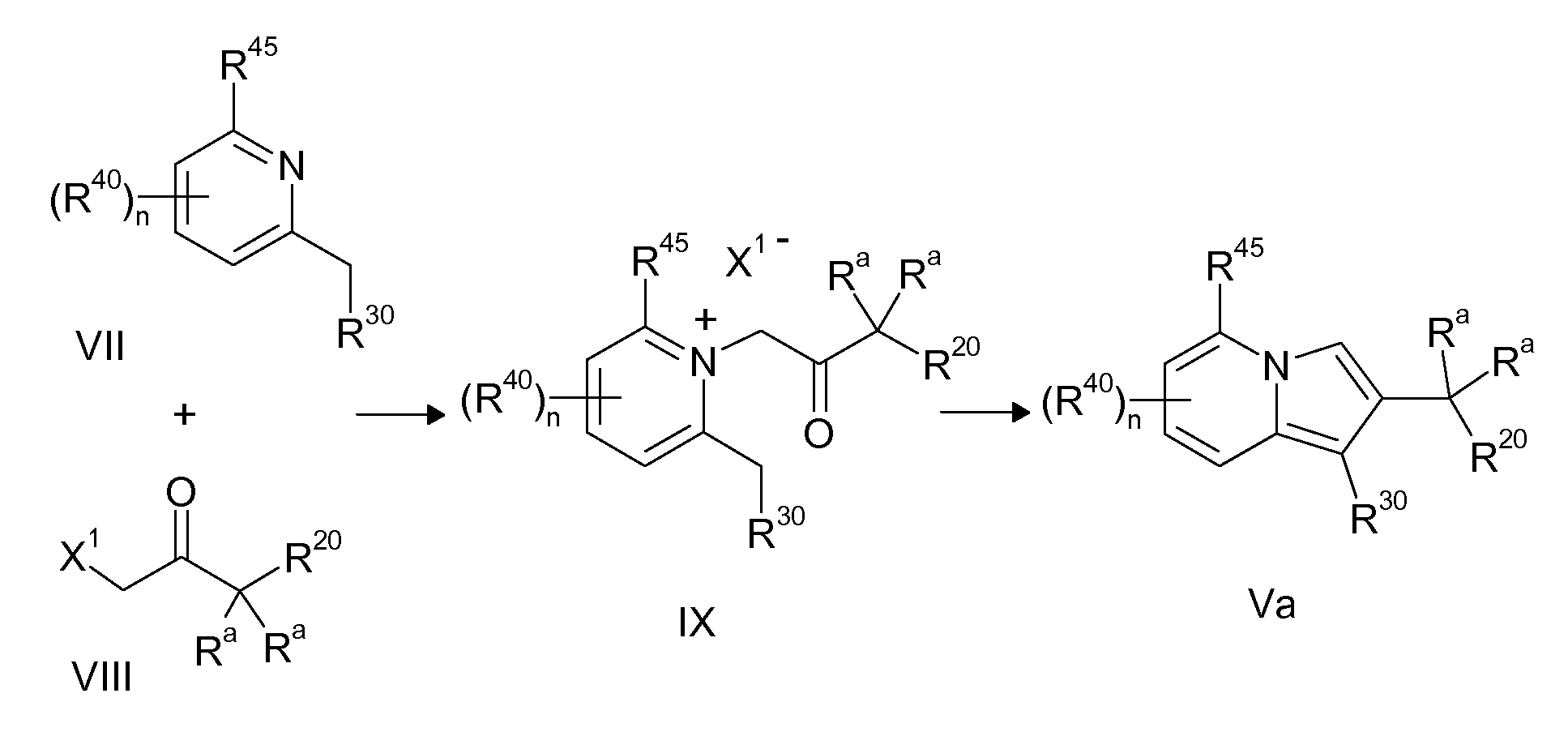
Ra, R20, R30, R40 и n в соединениях формул Va, VII, VIII и IX имеют значения, определенные для соединений формулы Ia, и, кроме того, функциональные группы могут присутствовать в защищенной форме или в форме группы-предшественника, которую на более поздней стадии преобразуют в конечную группу. Группа R45 в соединениях формул Va, VII и IX определена как в соединениях формулы Ic, т.е. R45 выбран из водорода и (C1-C4)-алкила и соответствует атому водорода или алкильной группе, присутствующей в группе Y, в случае когда Y в соединениях формулы Ia представляет собой необязательно замещенный атом углерода. Группа X1 в соединениях формулы VIII предпочтительно представляет собой хлор или бром, и соответственно анион X1- в соединениях формулы IX тогда представляет собой хлоридный ион или бромидный ион, но также может представлять собой другой анион, например, в случае когда осуществляют анионообмен и выделяют соединение формулы IX.
В соответствии со способом Чичибабина для получения индолизиновых производных 2-(R30-CH2)-замещенное пиридиновое производное формулы VII подвергают кватернизации с использованием галоген-пропанона формулы VIII с получением четвертичной соли формулы IX, которую затем подвергают циклизации в присутствии основания с получением соединения формулы Va. Эту процедуру можно осуществить с выделением или без выделения соединения формулы IX. Взаимодействие соединений формул VII и VIII и циклизацию, как правило, осуществляют в растворителе, например, таком как углеводород, такой как толуол, или простой эфир, такой как ТГФ или диоксан, или кетон, такой как ацетон или 2-бутанон, или спирт, такой как метанол, этанол или изопропанол, или вода, или в смеси растворителей, при нагревании, например при температурах от около 50°C до около 110°C. В качестве основания на стадии циклизации можно использовать неорганическое основание, такое как основная соль щелочного металла, например карбонат или гидрокарбонат, такой как карбонат натрия, карбонат калия или гидрокарбонат натрия, или органическое основание, например амин, такой как триэтиламин или 1,8-диазабицикло[5,4,0]ундец-7-ен (DBU). Взаимодействие также можно осуществить с использованием избыточного количества пиридинового производного формулы VII, которое затем действует как основание на стадии циклизации.
Соединения формулы VII являются коммерчески доступными, или их можно получить при помощи различных процедур в стандартных условиях, например, из соответствующего соединения, содержащего атом хлора вместо группы R30-CH2- в 2-положении, путем взаимодействия с соответствующим 9-(R30-CH2)-замещенным 9-борабицикло[3,3,1]нонаном (см. A. Flaherty et al., Org. Lett. 7 (2005), 4975, например), или из соответствующего соединения, содержащего метильную группу вместо R30-CH2- группы в 2-положении, путем металлирования, например, с использованием амида лития или литийорганического соединения, такого как н-бутиллитий, и непосредственного взаимодействия соединения, металлированного по метильной группе, с электрофильным реагентом, вводящим группу R30, например, подходящим реакционноспособным галоген-замещенным или сульфонилокси-замещенным циклоалкановым, циклоалкеновым, тетрагидропирановым, бензольным или гетероареновым производным, или сначала взаимодействия соединения, металированного по метильной группе, с диизопропилкетоном и затем взаимодействия полученного 1,1-диизопропил-2-(пиридин-2-ил)-этанольного производного с таким электрофильным реагентом, в соответствии с процедурой, описанной в T. Niwa et al., Angew. Chem. Int. Ed. 46 (2007), 2643, где такие реакции осуществляют в присутствии палладиевого соединения, такого как тетракис(трифенилфосфин)палладий(0), трис(дибензилиденацетон)дипалладий(0), ацетат палладия(II) или трифторацетат палладия(II), и фосфина, такого как трифенилфосфин, трициклогексилфосфин или 2-дициклогексилфосфино-2',6'-диметокси-бифенил, если это необходнимо. Соединения формулы VIII также являются коммерчески доступными, или их можно получить при помощи различных процедур в стандартных условиях, например, путем взаимодействия соответствующего соединения формулы VIII, содержащего атом водорода вместо группы X1, c бромом в соответствии с процедурой бромирования-дебромирования, описанной в H. Y. Choi et al., Org. Lett. 5 (2003), 411, с получением соединения формулы VIII, в котором X1 представляет собой бром, или путем взаимодействия соответствующего 2-R20-замещенного ацетилхлорида с триметилсилилдиазометаном и обработки промежуточного 3-R20-замещенного 1-диазо-пропан-2-она бромистоводородной кислотой с получением соединения формулы VIII, в котором X1 представляет собой бром (см. N. Desideri, Lett. Org. Chem. 3 (2006), 546), или путем взаимодействия соответствующего соединения формулы R20-M1, в которой R20 определен как в соединениях формулы Ia, и, кроме того, функциональные группы могут присутствовать в защищенной форме или в форме группы-предшественника, и M1 представляет собой магниямоногалогенидную группу, и соединение формулы R20-M1 представляет собой соединение Гриньяра, или M1 представляет собой металл, такой как литий, с хлорметил-оксираном, в частности эпихлоргидрином, предпочтительно в присутствии соединения меди, такого как иодид меди(I), с последующим окислением полученного 3-R20-замещенного 1-хлор-пропан-2-ола до кетона с использованием одного из множества известных агентов для окисления вторичных спиртов, например, с использованием такого реагента как периодинан Dess-Martin, т.е. 1,1,1-триацетокси-1,1-дигидро-1,2-бензиодоксол-3(1H)-он, с получением соединения формулы VIII, в котором X1 представляет собой хлор (см. H.-D. Becker et al., J. Org. Chem. 54 (1989), 3182; K. Okano et al., J. Am. Chem. Soc. 128 (2006), 7136). Если это желательно, соединение формулы VIII, в котором X1 представляет собой хлор, удобным образом можно преобразовать путем обработки бромидом лития в растворителе, таком как ацетон, например, в соответствующее соединение формулы VIII, в котором X1 представляет собой бром.
Соединения формулы V, в которых Y представляет собой атом азота, т.е. соединения формулы Vb, можно синтезировать через пиррольные производные формулы XIV, которые можно получить в соответствии с синтезом пиррола по методу Barton-Zard (см. D.H.R. Barton et al., Tetrahedron 46 (1990), 7587) из изоцианоацетатов формулы XIII и нитроолефинов формулы XII, которые, в свою очередь, можно получить из нитросоединений формулы X и альдегидов формулы XI, путем N-аминирования по пиррольному кольцу с получением соединения формулы XV, взаимодействия с ацеталем эфира малональдегидной кислоты формулы XVI и введения и/или модификации функциональных групп в 6-членном кольце азаиндолизиновой кольцевой системы в соединении формулы XVII.
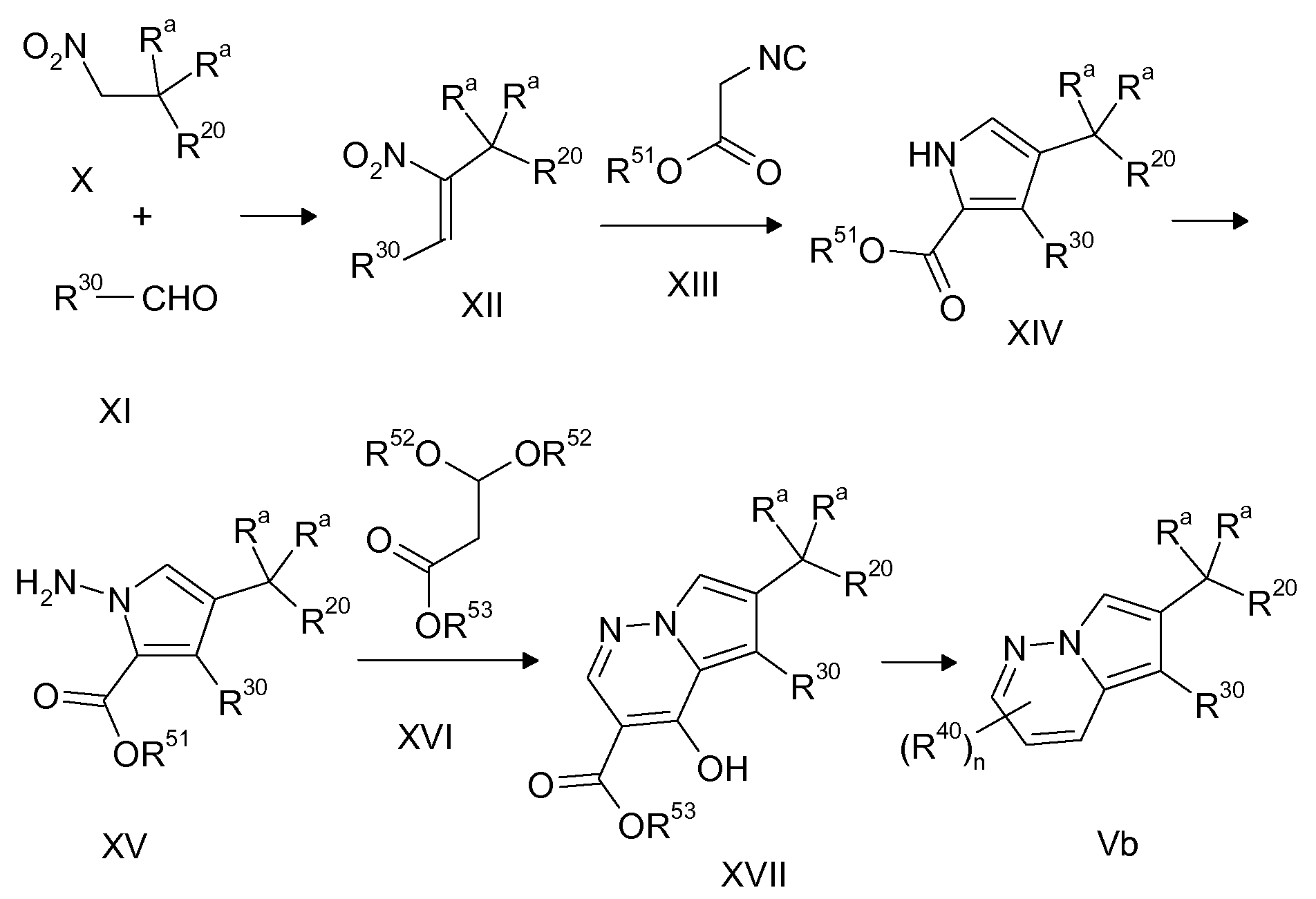
Ra, R20, R30, R40 и n в соединениях формул Vb, X, XI, XII, XIII, XIV, XV, XVI и XVII имеют значения, определенные для соединений формулы Ia, и, кроме того, функциональные группы могут присутствовать в защищенной форме или в форме группы-предшественника, которую на более поздней стадии преобразуют в конечную группу. Группы R51, R52 и R53, которые могут быть одинаковыми или отличными друг от друга, удобным образом представляют собой (C1-C4)-алкильные группы, такие как, например, метил, этил или трет-бутил. Исходные соединения для этого синтеза соединений формулы Vb являются коммерчески доступными, или их можно получить в соответствии со стандартными процедурами, которые описаны в литературе и известны специалистам в данной области, а также схематически описаны ниже.
Реакцию конденсации нитросоединения формулы X с альдегидом формулы XI с получением нитроолефина формулы XII обычно осуществляют путем нагревания компонентов в инертном растворителе, таком как углеводород, такой как толуол или ксилол, например, в условиях удаления воды путем азеотропной перегонки при температуре кипения растворителя и/или при добавлении кислоты, такой как уксусная кислота, или амина, такого как н-бутиламин, или соли аммония, такой как ацетат аммония или ацетат н-бутиламмония, например. С использованием аналогичной реакции конденсации альдегида формулы R20-CHO, где R20 определен как в соединениях формулы Ia, и, кроме того, функциональные группы могут присутствовать в защищенной форме или в форме группы-предшественника и нитрометана, в соответствии с реакцией Кнёвенагеля, например, в уксусной кислоте при температуре кипения растворителя в присутствии ацетата аммония и восстановления полученного нитростирола формулы R20-CH=CH-NO2, где R20 определен как в соединениях формулы Ia, и, кроме того, функциональные группы могут присутствовать в защищенной форме или в форме группы-предшественника, например, при помощи борогидрида натрия в присутствии силикагеля, как описано в A. K. Sinhababu et al., Tetrahedron Lett. 24 (1983), 227, можно получить соединения формулы X, в которых группы Ra представляют собой водород. Процедура получения соединений формулы X, в которых Ra является отличным от водорода, где соответствующее соединение формулы R20-C(Ra)2-NO2, в которой Ra и R20 имеют значения, определенные для соединений формулы Ia, и, кроме того, функциональные группы могут присутствовать в защищенной форме или в форме группы-предшественника, подвергают взаимодействию с нитрометаном в присутствии гидрида натрия в диметилсульфоксиде, описана в N. Kornblum et al., J. Org. Chem. 46 (1981), 1037. Взаимодействие соединения формулы XII с эфиром изоцианоуксусной кислоты формулы XIII с получением пиррольного производного формулы XIV предпочтительно осуществляют в инертном растворителе, таком как простой эфир, такой как ТГФ или диоксан, или спирт, такой как изопропанол, или в смеси растворителей в присутствии основания, например тетраметилгуанидина или DBU (см. D. H. R. Barton et al., Tetarhedron 46 (1990), 7587; J. A. Pfefferkorn et al., Bioorg. Med. Chem. Lett. 17 (2007), 4538).
В качестве реагента для N-аминирования соединения формулы XIV для получения соединения формулы XV можно указать гидроксиламин-O-сульфоновую кислоту/гидроксид калия, аммиак/хлорид аммония/гипохлорит натрия/гидроксид натрия или O-(4-нитробензоил)-гидроксиламин/трет-бутоксид калия. Предпочтительно N-аминирование осуществляют путем обработки соединения формулы XIV в инертном растворителе, таком как амид, такой как DMF, основанием, таким как гидрид натрия, и O-(2,4-динитрофенил)-гидроксиламином в качестве агента аминирования, при температурах от около 0°C до около 30°C (см. C. Legault et al., J. Org. Chem. 68 (2003), 7119; P. H. Boyle et al., ARKIVOC (2003) (vii), 67; K. S. Kim et al., Bioorg. Med. Chem. Lett. 16 (2006), 3937). Конденсацию 1-амино-группы пиррольного производного формулы XV с защищенной альдегидной группой ацеталя эфира малональдегидной кислоты формулы XVI и последующую циклизацию с получением 4-гидрокси-пирроло[1,2-b]пиридазинового производного формулы XVII, которое также может присутствовать в таутомерной форме и может быть указано как 4-оксо-1,4-дигидро-пирроло[1,2-b]пиридазиновое или 1H-пирроло[1,2-b]пиридазин-4-оновое производное, можно осуществить путем взаимодействия компонентов в инертном растворителе, например в амиде, таком как DMF, при нагревании, например, до температур от около 40°C до около 100°C, сначала в кислотных условиях, например в присутствии сульфоновой кислоты, такой как толуол-4-сульфоновая кислота, и затем в щелочных условиях, например в присутствии органического основания, такого как DBU.
В зависимости от желаемых заместителей в соединении формулы Vb или конечного соединения формулы Ia, заместители затем можно ввести в 6-членное кольцо в азаиндолизиновой кольцевой системе в соединении формулы XVII, и/или сложноэфирная группа и/или гидроксигруппа в соединении XVII могут быть модифицированы или удалены. Например, гидроксигруппа может быть алкилирована, или она может быть замещена атомом галогена, например атомом хлора, путем обработки агентом галогенирования, таким как галогенид фосфора, например оксихлорид фосфора. Такое замещение также может происходить одновременно с формилированием по методу Вилсмейера соединения формулы XVII или Vb с использованием DMF и оксихлорида фосфора, например, с получением соединения формулы VI, как показано выше. В соединении формулы XVII, в котором гидроксигруппа замещена атомом хлора, или в соединении, которое было получено из соединения формулы XVII путем реакции формилирования по Вилсмейеру и последующим окислением до карбоновой кислоты формулы IIa и, необязательно, с последующими реакциями, атом хлора в 6-членном кольце азаиндолизиновой кольцевой системы затем может быть замещен другой группой в реакции замещения, или он может быть замещен атомом водорода, например путем гидрирования в присутствии катализатора на основе переходного металла, такого как палладий на активированном угле, и основания, такого как триэтиламин. Сложноэфирная группа подобным образом может быть замещена атомом водорода путем гидролиза до карбоновой кислоты, например путем обработки гидроксидом щелочного металла, таким как гидроксид лития или гидроксид натрия, и декарбоксилирования карбоновой кислоты путем нагревания с медью в хинолине. Указанную карбоновую кислоту также можно преобразовать в карбоксамид, как показано выше в отношении взаимодействия карбоновых кислот формулы IIa с соединениями формулы III. Сложноэфирная группа, или указанная карбоновая кислота, или подходящий полученный из такой группы карбоксамид могут быть непосредственно восстановлены до альдегида, или они могут быть восстановлены до гидроксиметильного соединения, которое может быть окислено до альдегида, и альдегидную группу можно преобразовать в гидроксигруппу в соответствии с методом Байера-Виллигера путем окисления перкислотой и путем гидролиза, где гидроксигруппа затем может быть алкилирована. Первичная карбоксамидная группа, полученная из сложного эфира или указанной карбоновой кислоты, может быть преобразована в нитрильную группу, и можно осуществить другие различные модификации, если это желательно. Эти объяснения, касающиеся введения, модификации и удаления функциональных групп в 6-членном кольце (аза)индолизиновой кольцевой системы в соединениях формул Vb и XVII, применимы соответственно к соединениям формул IIa, IIb, Va, XX и другим соединениям, определенным выше или ниже, в которых подобным образом функциональные группы могут быть введены, модифицированы или удалены. В качестве дополнительных примеров таких реакций этих соединений можно указать введение бром-заместителей, которое удобным образом можно осуществить через последовательность бромирование/дебромирование путем обработки бромом и затем основанием, таким как DBU (см. A. Kakehi et al., Chem. Pharm. Bull. 52 (2004), 279), или получение амино-замещенных соединений через замещение галогенового заместителя, такого как бромный или иодный заместитель, амином в условиях реакции Бухвальда-Хартвига в присутствии палладиевого катализатора, такого как трис(дибензилиденацетон)дипалладий(0), и фосфина, такого как три(o-толил)фосфин, например (см. J. P. Wolfe et al., Acc. Chem. Res. 31 (1998), 8052).
Соединения формулы IIb или соответствующие соединения, которые вместо карбоновокислотной группы, представленной в формуле IIb, содержат группу производного карбоновой кислоты, такую как сложноэфирная группа, т.е. соединения формулы XX, можно синтезировать с использованием процедуры, которая исходит из эфира пиридин-2-ил-уксусной кислоты или эфира пиридазин-3-ил-уксусной кислоты формулы XVIII и 3-замещенного 1-галоген-пропанона формулы VIII и включает хорошо известный метод Чичибабина, такой как синтез соединений формулы Va, описанный выше. Дополнительную информацию, касающуюся этой процедуры, также можно найти, например, в T. Uchida et al., Synthesis (1976), 209.
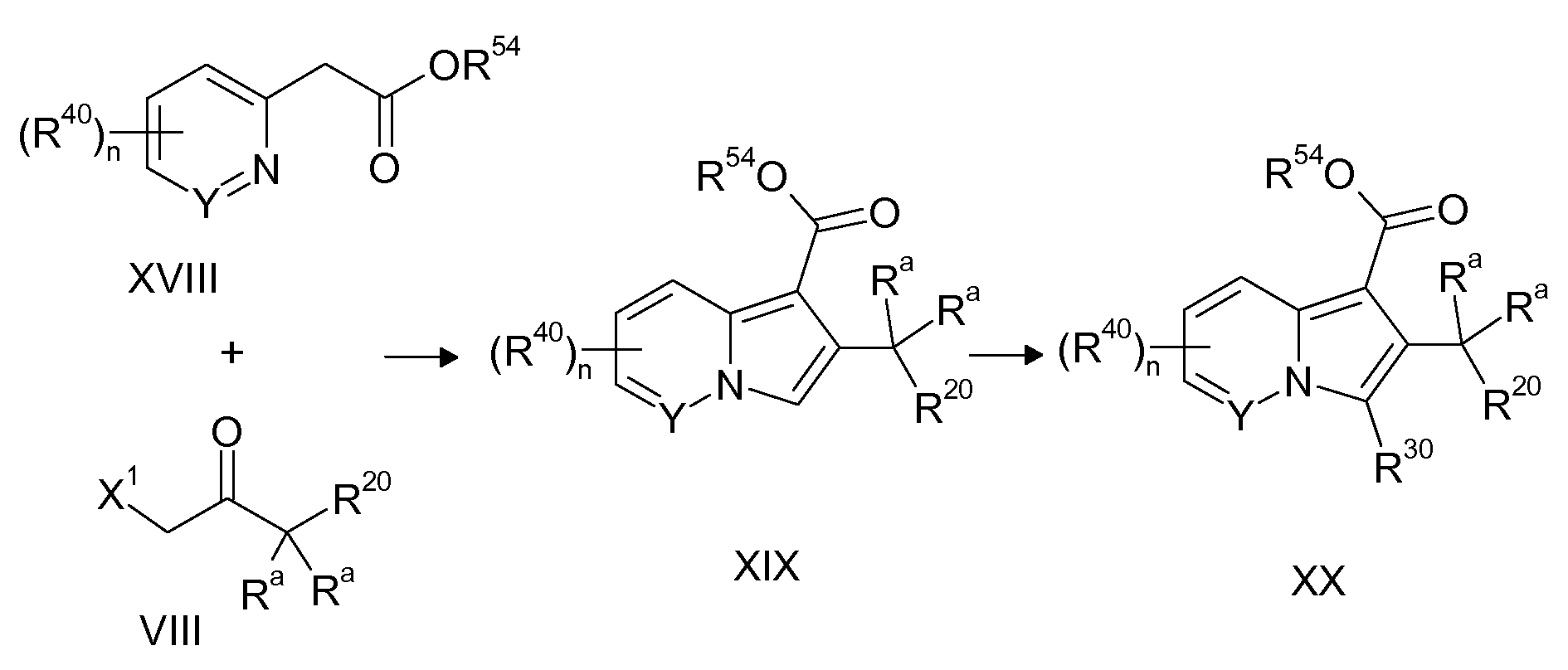
Ra, R20, R30, R40, Y и n в соединениях формул XVIII, XIX и XX имеют значения, определенные для соединений формулы Ib, и, кроме того, функциональные группы могут присутствовать в защищенной форме или в форме группы-предшественника, которую на более поздней стадии преобразуют в конечную группу. Группа R54 в соединениях формул XVIII, XIX и XX может представлять собой (C1-C4)-алкильную группу, такую как метил, этил или трет-бутил, например, но также может представлять собой другую группу, такую как бензил. Соединения формулы XX, которые содержат карбоновокислотную группу COOH вместо группы COOR54, соединения могут быть легко получены из соединений формулы XX, представляют собой соединения формулы IIb, и водород, соответственно, можно считать дополнительным значением R54 в соединениях формулы XX.
Соединения формулы XVIII являются коммерчески доступными, или их можно получить при помощи различных процедур в стандартных условиях, например, из соответствующего гетероарена, содержащего атом хлора вместо группы CH2-COOR54, путем взаимодействия с диалкилмалонатом и гидролизом и декарбоксилирования одной из сложноэфирных групп полученного диалкилгетероарен-малоната, или из соответствующего гетероарена, содержащего метильную группу вместо группы CH2-COOR54, путем металлирования, например, при помощи литиевого соединения, такого как н-бутиллитий или диизопропиламид лития, и взаимодействия с диалкилкарбонатом (см. EP 1958946; A. Ohsawa et al., Chem. Pharm. Bull. 26 (1978), 3633). Взаимодействие соединений формул VIII и XVIII с получением соединения формулы XIX можно осуществить аналогичным образом, как показано выше в отношении взаимодействия соединений формул VII и VIII с получением соединения формулы IX и циклизации этого последнего соединения с получением соединения формулы Va, предпочтительно без выделения промежуточной соли, соответствующей соединению формулы IX, например, путем нагревания компонентов вместе с основанием, таким как гидрокарбонат щелочного металла, такой как гидрокарбонат натрия, в растворителе, таком как кетон, такой как ацетон или 2-бутанон, до температур от около 50°C до около 100°C. Для введения группы R30 с получением соединения формулы XX соединение формулы XIX предпочтительно подвергают взаимодействию с соединением формулы R30-X2, в котором R30 определен, как в соединениях формулы Ib, и, кроме того, функциональные группы могут присутствовать в защищенной форме или в форме группы-предшественника, и X2 представляет собой подходящую удаляемую группу, например галоген, такой как бром или иод, в катализируемой переходным металлом реакции сочетания, например, в присутствии соединения палладия, такого как бис(трифенилфосфин)палладий(II) хлорид или тетракис(трифенилфосфин)палладий(0), и основания, такого как основная соль щелочного металла, такая как ацетат калия, в инертном растворителе, таком как амид, такой как DMF или NMP, при температурах от около 60°C до около 120°C.
Диазациклоалканы формулы III, которые взаимодействуют в реакции амидного связывания с соединениями формул IIa и IIb с получением соединений формул IVa и IVb и после необязательного преобразования группы R50 в группу R10 конечных соединений формул Ia и Ib являются коммерчески доступными, или их можно получить в соответствии или аналогично стандартным процедурам, описанным в литературе (см. WO 96/31501; WO 2005/026177; WO 2005/061510; S. Fustero et al., Org. Lett. 9 (2007), 5283, например), которые также проиллюстрированы в качестве примеров ниже. Хиральные соединения формулы III, в которых p и q оба имеют значение 2, одна из групп R являются отличной от водорода, и все другие группы R представляют собой водород, например, можно получить с использованием процедуры, исходящей из хиральных α-аминокислотных производных формулы XXI и н-бензил-глицинового сложного эфира формулы XXII. В соответствии с этой процедурой, можно получить соединения формулы III, в которых хиральный атом углерода, содержащий группу R, которая является отличной от водорода, присутствует в смежном положении с группой NH в соединении формулы III, например соединения формулы IIIa, и соединения, в которых хиральный атом углерода, содержащий группу R, которая является отличной от водорода, присутствует в смежном положении с группой NR50 в соединении формулы III, например соединения формулы IIIb. Кроме того, в соответствии с этой процедурой, можно получить соединения формулы III, в которых хиральный атом углерода имеет S конфигурацию или имеет R конфигурацию или присутствует в виде рацемической смеси, например, в зависимости от того, что используют: α-аминокислотное производное, имеющее S конфигурацию или R конфигурацию (или L конфигурацию или D конфигурацию) или их рацемическую смесь.
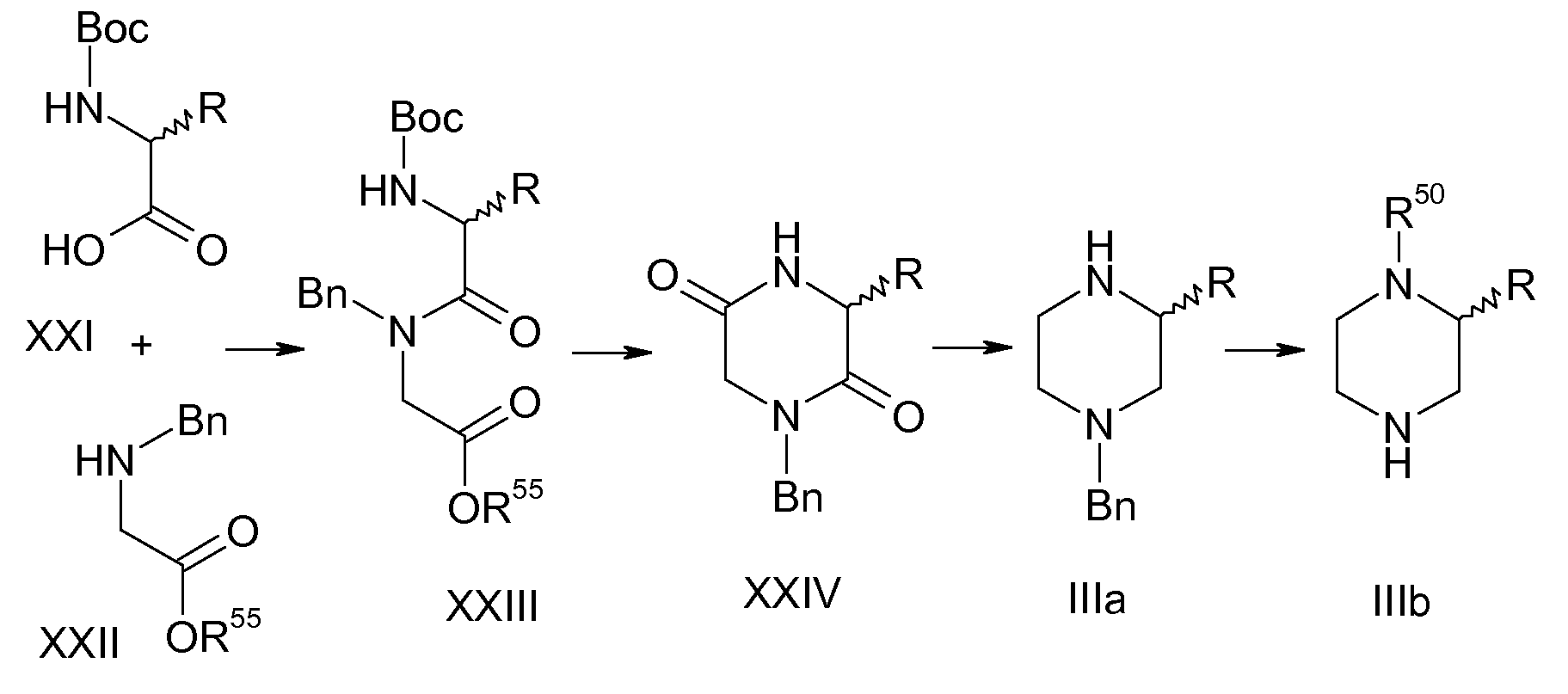
Группы R и R50 в соединениях формул IIIa, IIIb, XXI, XXIII и XXIV имеют значения, определенные для соединений формул Ia и Ib, и, кроме того, функциональные группы могут присутствовать в защищенной форме или в форме группы-предшественника, которую на более поздней стадии преобразуют в конечную группу, т.е. они имеют значения, определенные для соединений формулы III, за исключением того, что такую процедуру нельзя осуществлять в случае, когда R представляет собой водород. Группа R55 удобным образом представляет собой (C1-C4)-алкильную группу, например метил или этил. Группа Bn в соединениях формул IIIa, XXII, XXIII и XXIV представляет собой бензильную группу. Группа Boc в соединениях формул XXI и XXIII представляет собой трет-бутилоксикарбонильную группу. Исходные соединения формул XXI и XXII являются коммерчески доступными, или их можно получить в соответствии со стандартными процедурами из соответствующих аминокислот. Для реакции амидного связывания соединений формулы XXI с соединениями формулы XXII соединение формулы XXI активируют или преобразовывают в реакционноспособное производное и реакцию осуществляют в стандартных условиях, как показано выше в отношении взаимодействия соединений формул IIa и IIb с соединениями формулы III. Подобным образом удаление Boc группы из соединения формулы XXIII, например, путем обработки трифторуксусной кислотой, циклизацию полученного соединения формулы XXIII, в котором Boc группа замещена атомом водорода, с получением дикетопиперазинового производного формулы XXIV, например, путем обработки органическим основанием, таким как амин, такой как триэтиламин, восстановление соединения формулы XXIV с получением соединения формулы IIIa, например, путем обработки металлогидридным восстановителем, таким как литийалюминийгидрид, и, в случае когда нужно получить соединение формулы IIIb, введение группы R50, например, путем обработки хлорформиатом или дикарбонатом, таким как ди-трет-бутилдикарбонат, в случае когда группа R50 в соединении формулы IIIb должна представлять собой сложноэфирную группу, такую как алкил-O-C(O)-, циклоалкил-O-C(O)- или циклоалкилалкил-O-C(O)- группа, например Boc группа, и удаление Bn группы, например, путем гидрирования в присутствии катализатора на основе переходного металла, такого как палладиевый катализатор, такой как гидроксид палладия(II) на активированном угле, можно осуществить в стандартных условиях.
В соединениях формул IIIa и IIIb можно осуществить различные модификации в группе R и/или по кольцевым атомам азота с получением дополнительных соединений формулы III. Например, когда соединение формулы XXI, которое используют в процедуре, описанной выше, представляет собой β алкиловый эфир (S)-N-трет-бутоксикарбонил-аспарагиновой кислоты, такой как β метиловй эфир или β-бензиловый эфир (S)-N-трет-бутоксикарбонил-аспарагиновой кислоты, т.е. группа R представляет собой группу -CH2-C(O)-OCH3 или -CH2-C(O)-O-бензил, например, при восстановлении соединения формулы XXIV, например, с использованием литийалюминийгидрида в ТГФ при температуре около 60°C, одновременно β-эфирную группу можно восстановить до гидроксиметильной группы и, таким образом, можно получить соединение формулы IIIc, т.е. соединение трет-бутилового эфира (S)-2-(2-гидрокси-этил)-пиперазин-1-карбоновой кислоты, в случае когда введенная группа R50 представляет собой Boc группу. В соединении формулы IIIc, в котором гидроксигруппа может быть защищена в виде силилового простого эфира путем обработки трет-бутил-диметил-силилхлоридом, а впоследствии у нее может быть удалена защита путем обработки фторидом, таким как фторид калия, фторид цезия, фторид тетрабутиламмония, например, группа NH в кольце может быть защищена путем введения бензилоксикарбонильной группы при помощи обработки бензилхлорформиатом в присутствии основания, такого как гидрокарбонат натрия, например.
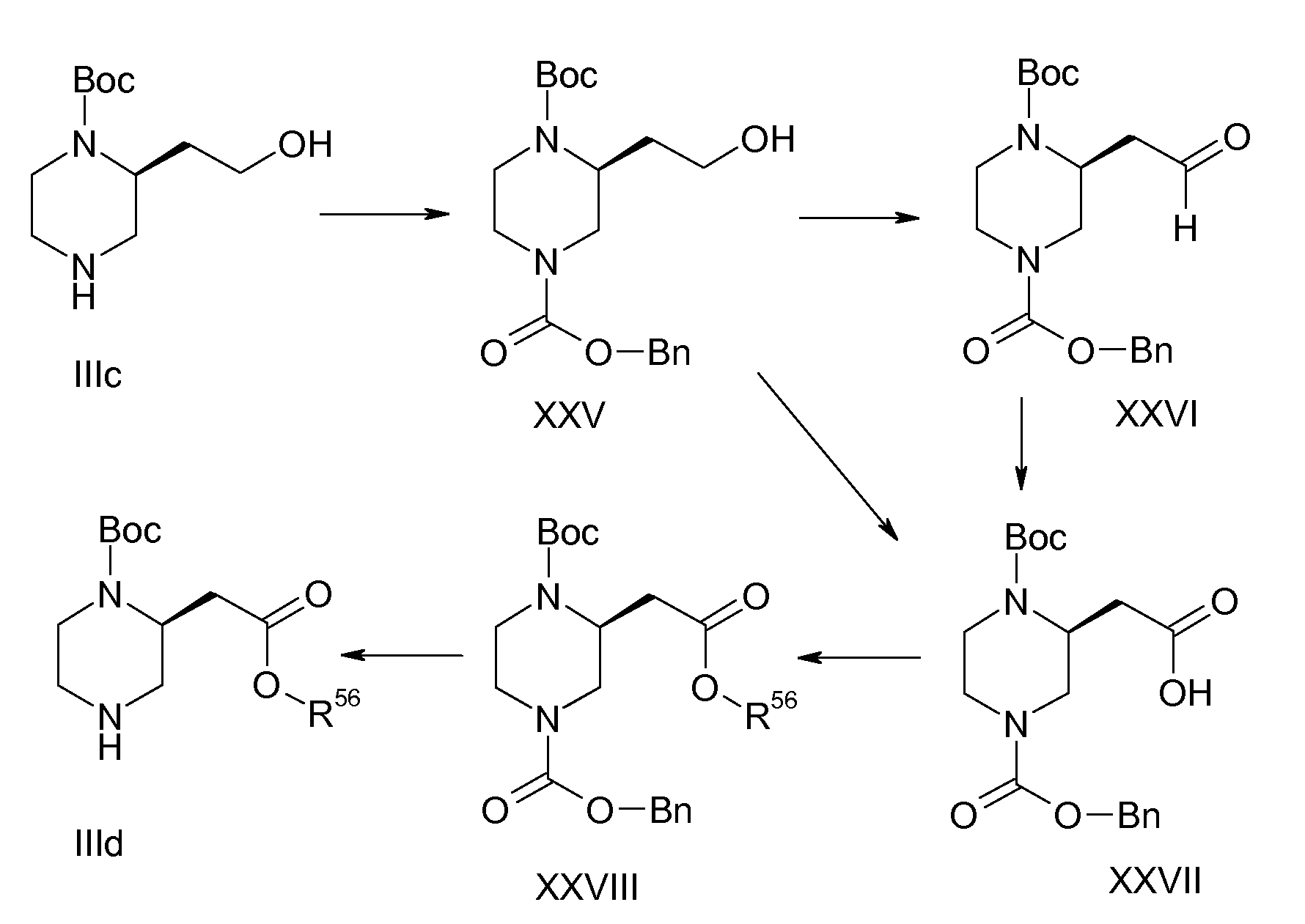
В полученном соединении формулы XXV гидроксигруппа может быть алкилирована с получением алкил-O- группы, или ее можно активировать, например, путем преобразования в метансульфонат, и подвергнуть взаимодействию с алкантиолом или цианидом металла с получением тиоэфира или нитрила, или она может быть окислена с получением альдегида формулы XXVI, например, путем обработки таким реагентом, как периодинан Dess-Martin (см. выше). Метансульфонат соединения формулы XXV и соединения формулы XXVI также можно подвергнуть взаимодействию с другими нуклеофильными соединениями, например аминосоединениями и полученными гетероциклами, и соединение формулы XXVI может быть окислено до карбоновой кислоты формулы XXVII, например, путем обработки хлоритом натрия, как показано выше в отношении окисления альдегидов формулы VI. Соединение формулы XXV также может быть окислено непосредственно до соединения формулы XXVII, например, путем обработки дихроматом пиридиния. Карбоновую кислоту формулы XXVII можно активировать, как показано выше в отношении соединений формул IIa и IIb, и преобразовать в карбоксамиды и гетероциклы или этерифицировать, например, путем обработки галогеналканом в присутствии основания, такого как карбонат калия, в растворителе, таком как кетон, такой как ацетон или бутанон, с получением соединения формулы XXVIII. Группа R56 в соединениях формулы XXVIII, а также в соединениях формулы IIId представляет собой (C1-C4)-алкильную группу, такую как метил или этил, например. В соединениях формулы XXVIII бензилоксикарбонильную группу Bn-O-C(O)- можно удалить путем каталитического гидрирования в присутствии катализатора на основе переходного металла, такого как палладий на активированном угле, с получением соединений формулы IIId, которые затем можно подвергнуть взаимодействию с соединениями формул IIa и IIb с получением соединений формул IVa и IVb. Так же как в соединениях формулы XXVIII, во всех других соединениях, которые можно получить из соединений формулы IIIc, как показано выше, бензилоксикарбонильная группа может быть удалена, и соответствующие соединения, содержащие свободную NH группу подвергают взаимодействию с соединениями формул IIa и IIb с получением соединений формул IVa и IVb. Дополнительные соединения формул IVa и IVb можно получить путем удаления Boc группы вместо бензилоксикарбонильной группы, например, путем обработки трифторуксусной кислотой и взаимодействия полученных соединений с соединениями формул IIa и IIb и в конце удаления бензилоксикарбонильной группы.
Кроме того, в соединениях формулы III или в процессе получения соединений формулы III, как показано выше, также можно осуществить соответствующие модификации функциональных групп, или функциональные группы также могут быть введены после взаимодействия соединений формулы III с соединениями формул IIa и IIb, т.е. в соединениях формул IVa и IVb. Все объяснения, представленные выше, соответственно применимы к такому синтетическому подходу. Например, соединение формулы IIa или IIb можно подвергнуть взаимодействию с соединением формулы IIIc, при этом в такой реакции гидроксигруппа в соединении формулы IIIc, как правило, является защищенной, например, в виде трет-бутил-диметил-силилового эфира, полученного путем обработки трет-бутил-диметил-силилхлоридом в присутствии имидазола, с его последующим отщеплением путем обработки фторидом с получением соединения формулы IVc или IVd. Аналогично процедурам, описанным выше, CH2OH группа, представленная в формулах IVc и IVd, может быть окислена до альдегидной группы C(O)H путем обработки периодинановым реагентом Dess-Martin, и альдегидная группа, в свою очередь, может быть окислена при помощи хлорита натрия с получением карбоновых кислот формул IVe и IVf.
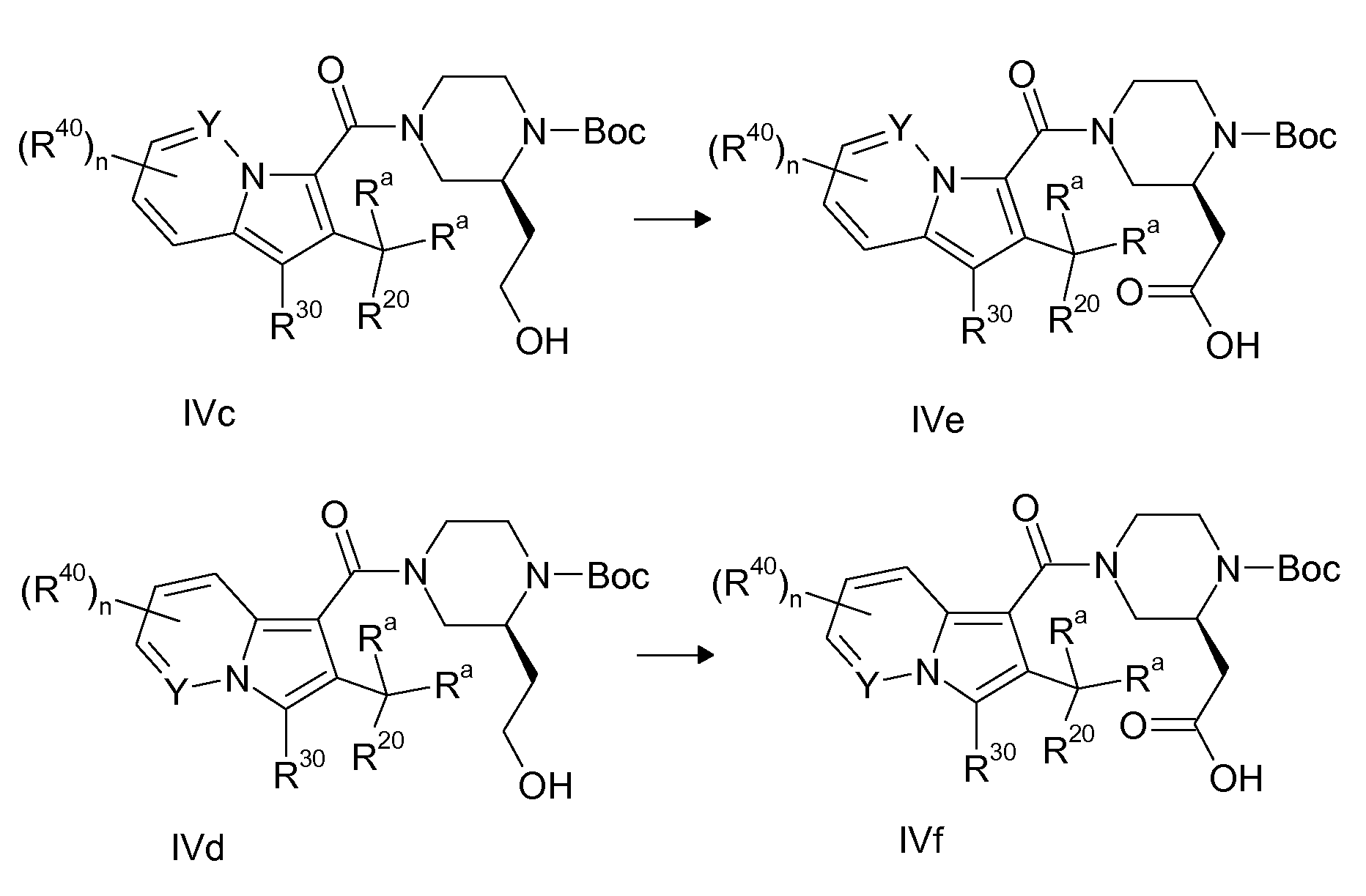
Ra, R20, R30, R40, Y и n в соединениях формул IVc, IVd, IVe и IVf имеют значения, определенные для соединений формул IVa и IVb, и Boc представляет собой трет-бутилоксикарбонильную группу. Соединения формул IVe и IVf также получают путем взаимодействия соединений формулы IIId с соединениями формул IIa и IIb и гидролиза сложноэфирной группы C(O)-OR56, например, путем обработки гидроксидом лития в случае, когда R56 представляет собой метил или этил. C(O)-OH группа, представленная в формуле IVe и IVf, может быть активирована или преобразована в реакционноспособное производное, как показано выше в отношении соединений формул IIa и IIb, и может взаимодействовать с амином формулы R2-N(R3)-H, в котором группы R2 и R3 имеют значения, определенные для соединений формул Ia и Ib, и, кроме того, функциональные группы могут присутствовать в защищенной форме или в форме группы-предшественника, которую на более поздней стадии преобразуют в конечную группу, с получением соответствующих соединений формул IVe и IVf, в которых группа C(O)-OH замещена группой C(O)-N(R3)-R2 и которые можно преобразовать в соединения формул Ia и Ib, в которых R10 представляет собой водород, путем обработки трифторуксусной кислотой или хлористым водородом для удаления Boc группы. В качестве другого примера модификаций функциональных групп, которые можно осуществить в соединениях формул IVc и IVd, можно указать преобразование гидроксигруппы, представленной в формулах IVc и IVd, в алкоксигруппу, которое можно осуществить путем алкилирования соединения формулы IVc или IVd с использованием реакционноспособного галогеналкана, например бромалкана или иодалкана, или взаимодействия алканола с соединением, содержащим удаляемую группу вместо гидроксигруппы, такую как метансульфонилоксигруппа, полученная путем взаимодействия соединения формулы IVc или IVd с метансульфонилхлоридом, например, в присутствии основания, такого как карбонат калия или карбонат цезия, в инертном растворителе, таком как кетон, такой как ацетон или бутанон, или амид, такой как DMF или NMP. Все объяснения, относящиеся к получению соединений, в которых p и q оба имеют значение 2, одна из групп R является отличной от водорода, и все другие группы R представляют собой водород, соответственно применимы к другим соединениям.
Для получения дополнительных соединений формул Ia и Ib можно осуществить различные другие преобразования функциональных групп в соединениях формул Ia и Ib, а также в соединениях, образованных как промежуточные соединения в синтезе соединений формул Ia и Ib. В отношении всех частей молекул применимо, например, следующее: гидроксигруппа может быть этерифицирована в стандартных условиях путем алкилирования при помощи соответствующего галогенового соединения, в частности бромида или иодида, в присутствии основания, такого карбонат щелочного металла, в инертном растворителе, или с использованием соответствующего спирта в условиях реакции Мицунобу в присутствии азодикарбоксилата, такого как диэтилазодикарбоксилат или диизопропилазодикарбоксилат, и фосфина, такого как трифенилфосфин или трибутилфосфин, в инертном апротонном растворителе, таком как простой эфир, такой как ТГФ или диоксан (см. O. Mitsunobu, Synthesis (1981), 1). Аминогруппа может быть модифицирована в стандартных условиях для алкилирования, например, путем взаимодействия с галогеновым соединением или путем восстановительного аминирования карбонильного соединения, или для ацилирования, например, путем взаимодействия с активированной карбоновой кислотой или карбоновокислотным производным, таким как хлорангидрид или ангидрид кислоты. Карбоновокислотная группа может быть активирована или преобразована в реакционноспособное производное, как показано выше, и взаимодействовать со спиртом или амином с получением сложного эфира или амида. Алкил-S- группа может быть окислена пероксидом, таким как перекись водорода или перкислота, с получением алкил-S(O)- или алкил-S(O)2- группы, и у защищенной меркаптогруппы может быть удалена защита, и она может быть окислена с получением сульфоновой кислоты, которую затем можно активировать и подвергнуть взаимодействию с амином в стандартных условиях с получением сульфонамида. Гидроксигруппы, которые были активированы, например, путем преобразования в метансульфонильное или трифторметансульфонильное производное, и реакционноспособные атомы галогена могут быть замещены группами, связанными через атом кислорода, серы, азота или углерода в реакциях нуклеофильного замещения и металл-катализируемых реакциях.
Как уже указывалось выше, в случае когда группа R50 в соединении формул IVa и IVb имеет любое из значений группы R10 в соединениях формул Ia и Ib и все другие группы имеют желаемые значения, охватываемые определением соединений формул Ia и Ib, соединения формул IVa и IVb представляют собой уже конечные соединения формул Ia и Ib. В случае когда R50 представляет собой защитную группу и нужно получить соединение формулы Ia или Ib, в котором R10 представляет собой водород, и/или любые другие группы присутствуют в защищенной форме или в форме группы-предшественника, соединение формулы IVa или IVb в конце может быть преобразовано в желаемое соединение формулы Ia или Ib путем удаления защитных групп и/или преобразования любых других групп. Как уже указывалось выше, для избежания нежелательного пути реакции или побочных реакций на любой одной или нескольких стадиях в синтезе соединений формул Ia и Ib функциональные группы, как правило, может присутствовать в защищенной форме или в форме группы-предшественника. Помимо конечной стадии синтеза соединений формулы Ia или Ib защитные группы могут быть удалены и группы-предшественники могут быть преобразованы также и на других стадиях синтеза. Соответствующие синтетические стратегии и подробности, касающиеся подходящих защитных групп и их введения и удаления, известны специалистам в данной области, и их можно найти в P. G. M. Wuts and T. W. Greene, Greene's Protective Groups in Organic Synthesis, 4. ed. (2007), John Wiley & Sons, например. Примерами защитных групп, которые можно указать, в основном являются бензильные защитные группы, такие как простых в бензиловых эфирах гидроксигрупп и сложных бензиловых эфирах карбоновокислотных групп, из которых бензильную группу можно удалить путем каталитического гидрирования в присутствии палладиевого катализатора, трет-бутильные защитные группы, такие как в сложных трет-бутиловых эфирах карбоновокислотных групп, из которых трет-бутильную группу можно удалить путем обработки трифторуксусной кислотой, ацильные защитные группы, которые могут защищать гидроксигруппы и аминогруппы в форме сложных эфиров и амидов и которые можно расщепить при помощи кислотного или щелочного гидролиза, алкилоксикарбонильные защитные группы, такие как в трет-бутоксикарбонильных производных аминогрупп, включая циклическую аминогруппу, являющуюся частью диазациклоалкановой группы, представленной в формулах Ia и Ib, в случае когда R10 представляет собой водород, которые можно расщепить путем обработки трифторуксусной кислотой, и силильные защитные группы, такие как трет-бутил-диметил-силил и триметилсилил, которые могут защищать гидроксигруппы в форме простых силиловых эфиров и которые можно расщепить путем обработки фторидом. Примерами групп-предшественников, которые можно указать, являются нитрогруппы, которые можно преобразовать в аминогруппы путем каталитического гидрирования или путем восстановления с использованием дитионита натрия, например, и цианогруппы, которые можно преобразовать в карбоксамидные группы и карбоновокислотные группы путем гидролиза.
Реакции, осуществляемые при получении соединений формул Ia и Ib, известны per se, и их можно осуществить способами, известными специалистам в данной области, с использованием процедур, которые описаны в стандартной литературе, или аналогичных процедур, например в Houben-Weyl, Methods of Organic Chemistry, Thieme; Organic Reactions, John Wiley & Sons; или R. C. Larock, Comprehensive Organic Transformations: Guide to Functional Group Prepartions, 2. ed. (1999), John Wiley & Sons, и в цитируемых в этих изданиях ссылочных документах.
Объектом настоящего изобретения также являются новые исходные соединения и промежуточные соединения, образуемые в ходе синтеза соединений формул Ia и Ib, включая соединения формул IIa, IIb, III, IIIa, IIIb, IIId, IVa, IVb, IVc, IVd, IVe, IVf, V, Va, Vb, VI, VII, VIII, IX, X, XI, XII, XIV, XV, XVII, XVIII, XIX, XX, XXI, XXIII, XXIV, XXVI, XXVII, XXVIII, где R, Ra, R20, R30, R40, R45, R50, R51, R53, R54, R55, R56, Bn, Boc, X1, Y, n, p и q имеют значения, определенные выше, в любой из их стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении и их соли и сольваты любой из таких форм и их применение в качестве промежуточных соединений. Общие объяснения, предпочтительные определения групп и числовых значений и варианты воплощения настоящего изобретения, представленные выше в отношении соединений формул Ia и Ib, применимы соответственно к указанным промежуточным соединениям и исходным соединениям. Объектом настоящего изобретения являются, в частности, новые специфические исходные соединения и промежуточные соединения, раскрытые в настоящей заявке. Независимо от того, раскрыты они в форме свободного соединения и/или в виде конкретной соли, они являются объектом настоящего изобретения как в форме свободных соединений, так и в форме их солей, и, когда раскрыта конкретная соль, также и в форме этой конкретной соли, и в форме сольватов любой из таких форм.
Соединения формул Ia и Ib ингибируют фермент ренин, как может быть продемонстрировано в фармакологических испытаниях, описанных ниже, и в других фармакологических испытаниях, которые известны специалистам в данной области, например в in vitro испытаниях, в которых определяют ингибирование человеческого ренина, или в животных моделях, в которых определяют антигипертензивную активность и другие эффекты in vivo. Соединения формул Ia и Ib являются подходящими для лечения гипертензии, включая, например, легочную гипертензию, и других расстройств сердечно-сосудистой системы и заболеваний сердца, таких как паралич сердца, инфаркт миокарда, стенокардия, сердечная недостаточность, сердечное расстройство, гипертрофия сердца, сердечный фиброз, сосудистая гипертрофия, левожелудочковая недостаточность, в частности левожелудочковая недостаточность после инфаркта миокарда, эндотелиальная дисфункция, ишемические и обструктивные расстройства периферического кровообращения и рестеноз, включая рестеноз после ангиопластики, например для лечения почечных заболеваний, таких как почечный фиброз, почечная ишемия, почечная недостаточность и нарушение работы почек, например, и для лечения других заболеваний, например диабетических осложнений, таких как нефропатия и ретинопатия, церебральных нарушений, таких как внутримозговое кровоизлияние, глаукома и конечное поражение органов. Лечение заболеваний следует рассматривать как означающее терапию существующих патологических изменений или нарушений функций организма или существующих симптомов с целью облегчения, уменьшения тяжести или лечения и профилактики или предупреждения патологических изменений или нарушений функций организма или симптомов у человека или животных, которые являются подверженными этому и нуждаются в такой профилактике или предупреждении, с целью предупреждения или подавления их возникновения или ослабления тяжести в случае их возникновения. Например, у пациентов, которые согласно их истории болезни подвержены вентрикулярной дисфункции после инфаркта миокарда, при помощи профилактического или превентивного медицинского лечения возникновение вентрикулярной дисфункции можно предотвратить или уменьшить его развитие и осложнения. Лечение заболеваний можно осуществлять как в острых случаях, так и в хронических случаях.
Соединения формул Ia и Ib и их физиологически приемлемые соли и их физиологически приемлемые сольваты поэтому можно использовать для животных, в частности, для млекопитающих, в частности для человека, в виде фармацевтического или лекарственного средства, включающего только такие соединения, в виде смесей друг с другом или в виде фармацевтических композиций. Объектом настоящего изобретения также являются соединения формул Ia и Ib и их физиологически приемлемые соли, и их физиологически приемлемые сольваты для применения в качестве фармацевтического средства, а также фармацевтические композиции и лекарственные средства, которые включают эффективную дозу по меньшей мере одного соединения формулы Ia или Ib и/или его физиологически приемлемой соли и/или физиологически приемлемого сольвата любой из этих форм в качестве активного ингредиента и фармацевтически приемлемый носитель, т.е. один или несколько фармацевтически безвредных носителей и/или эксципиентов. Объектом настоящего изобретения, кроме того, являются соединения формул Ia и Ib и их физиологически приемлемые соли и их физиологически приемлемые сольваты для использования в лечении заболеваний, указанных выше или ниже, например гипертензии, или для ингибирования ренина, а также применение соединений формул Ia и Ib и их физиологически приемлемых солей, и их физиологически приемлемых сольватов для получения лекарственного средства для лечения заболеваний, указанных выше или ниже, например гипертензии, или для получения лекарственного средства для ингибирования ренина, при этом лечение заболеваний включает их терапию и профилактику. Объектом настоящего изобретения также являются способы лечения заболеваний, указанных выше или ниже, которые включают введение эффективного количества по меньшей мере одного соединения формулы Ia или Ib или физиологически приемлемой соли такого соединения, или физиологически приемлемый сольват любой из таких форм соединения, человеку или животному, нуждающемуся в этом. Соединения формул Ia и Ib и включающие их фармацевтические композиции и лекарственные средства можно вводить энтеральным путем, например путем перорального, буккального, сублингвального или ректального введения, парентерально, например путем внутривенной, внутримышечной или подкожной инъекции или инфузии, или с использованием другого типа введения, такого как местное, чрескожное, путем проникновения через кожу, интратрахеальное, интраназальное или внутриглазное введение.
Фармацевтические композиции и лекарственные средства в соответствии с настоящим изобретением обычно содержат от около 0,5 до около 90 массовых процентов соединений формул Ia и Ib и/или их физиологически приемлемых солей, и/или их физиологически приемлемых сольватов. Количество активного ингредиента соединения формулы Ia или Ib и/или его физиологически приемлемой соли, и/или физиологически приемлемого сольвата любой из таких форм соединения, в фармацевтических композициях и лекарственных средствах, как правило, составляет от около 0,2 мг до около 1000 мг, предпочтительно от около 0,2 мг до около 500 мг, особенно предпочтительно от около 1 мг до около 300 мг в расчете на единицу дозирования. Получение фармацевтических композиций и лекарственных средств можно осуществить способом, известным per se. Для этого соединения формул Ia и Ib, и/или их физиологически приемлемые соли, и/или их физиологически приемлемые сольваты смешивают вместе с одним или несколькими твердыми или жидкими носителями и/или эксципиентами и, если это желательно, также в сочетании с одним или несколькими другими активными ингредиентами, такими как, например, ингибитор ангиотензин-превращающего фермента, антагонист ангиотензинового рецептора, диуретик, антагонист эндотелинового рецептора, ингибитор эндотелин-превращающего фермента, ингибитор нейтральной эндопептидазы, блокатор кальциевых каналов, нитрат, такой как изосорбиддинитрат, блокатор β-рецепторов, антагонист α1-адренорецептора, антагонист каннабиноидного рецептора, модулятор калиевых каналов, ингибитор тромбоксансинтетазы, антисеротонинергическое средство или другое средство, полезное для лечения гипертензии, сердечной недостаточности, сосудистых заболеваний, связанных с диабетом, или почечных заболеваний, таких как острая или хроническая почечная недостаточность, например, и приводят в подходящую форму для дозирования и введения, которую затем можно использовать в медицине для лечения человека или в ветеринарии. Объектом настоящего изобретения также является, в частности, фармацевтическая композиция, которая включает эффективную дозу по меньшей мере одного соединения формулы Ia или Ib и/или его физиологически приемлемой соли, и/или физиологически приемлемого сольвата любой из таких форм соединения, и один или несколько других активных ингредиентов и фармацевтически приемлемый носитель, где другие активные ингредиенты являются полезными для лечения гипертензии, инфаркта миокарда, сердечной недостаточности, сосудистых заболеваний, связанных с диабетом, конечного поражения органов, такого как сердечная недостаточность или почечная недостаточность, почечных заболеваний, таких как острая или хроническая почечная недостаточность, рестеноза или глаукомы, и где в качестве примеров таких других активных ингредиентов могут быть указаны ингибиторы ангиотензин-превращающего фермента, антагонисты ангиотензинового рецептора, диуретики, антагонисты эндотелинового рецептора, ингибиторы эндотелин-превращающего фермента, ингибиторы нейтральной эндопептидазы, блокаторы кальциевых каналов, нитраты, такие как изосорбиддинитрат, блокаторы β-рецепторов, антагонисты α1-адренорецептора, антагонисты каннабиноидного рецептора, модуляторы калиевых каналов, ингибиторы тромбоксансинтетазы и антисеротонинергические средства.
В качестве носителей и эксципиентов, можно использовать подходящие органические и неорганические вещества, которые не вступают в нежелательное взаимодействие с соединениями формул Ia и Ib. Примеры, которые можно указать, включают воду, растительные масла, воски, спирты, такие как этанол, изопропанол, 1,2-пропандиол, бензиловые спирты или глицерин, полиолы, полиэтиленгликоли, полипропиленгликоли, глицерин триацетат, желатин, углеводы, такие как лактоза или крахмал, стеариновую кислоту и ее соли, такие как стеарат магния, тальк, ланолин, вазелин или их смеси, например смеси воды с одним или несколькими органическими растворителями, такие как смеси воды со спиртами. Для перорального и ректального применения можно использовать, в частности, фармацевтические формы, такие как, например, таблетки, таблетки с пленочным покрытием, таблетки с сахарным покрытием, гранулы, твердые и мягкие желатиновые капсулы, суппозитории, растворы, предпочтительно масляные, спиртовые или водные растворы, сиропы, соки или капли, а также суспензии или эмульсии. Для парентерального применения, например, посредством инъекции или инфузии, можно использовать, в частности, фармацевтические формы, такие как растворы, предпочтительно водные растворы. Для местного применения можно использовать, в частности, фармацевтические формы, такие как мази, кремы, пасты, лосьоны, гели, спреи, пены, аэрозоли, растворы или порошки. Другие подходящие фармацевтические формы включают, например, имплантаты и пластыри и формы, приспособленные для ингаляции. Соединения формул Ia и Ib и их физиологически приемлемые соли и физиологически приемлемые сольваты любой из таких форм также могут быть лиофилизированы, и полученные лиофилизаты можно использовать, например, для получения композиций для инъекций. В частности, для местного применения липосомные композиции также являются подходящими. В качестве примеров типов эксципиентов или добавок, которые могут содержаться в фармацевтических композициях и лекарственных средствах, можно указать смазывающие вещества, консерванты, загустители, стабилизаторы, разрыхлители, смачивающие вещества, агенты для достижения депо эффекта, эмульгаторы, соли, например, влияющие на осмотическое давление, буферные вещества, красители и отдушки. Фармацевтические композиции и лекарственные средства также могут содержать один или несколько других активных ингредиентов и/или, например один или несколько витаминов.
Как правило, дозировка соединений формул Ia и Ib зависит от обстоятельств в каждом конкретном случае, и ее регулирует лечащий врач в соответствии с общепринятыми правилами и процедурами. Это зависит, например, от соединения формулы Ia или Ib, которое вводят, и его активности и продолжительности действия, от природы и тяжести конкретного синдрома, от пола, возраста, массы тела и индивидуальной чувствительности человека или животного, которого лечат, от того, является ли лечение неотложным или хроническим или профилактическим, или от того, вводят ли другие фармацевтически активные соединения помимо соединения формулы Ia или Ib. Как правило, в случае введения взрослому с массой тела около 75 кг, доза от около 0,1 мг до около 100 мг на кг в день, предпочтительно от около 1 мг до около 10 мг на кг в день (в каждом случае в мг на кг массы тела) является достаточной. Суточную дозу можно вводить в виде разовой дозы или разделенной на несколько доз, например две, три или четыре раздельные дозы. Введение также можно осуществлять непрерывно, например, при помощи непрерывной инъекции или инфузии. В зависимости от обстоятельств в каждом конкретном случае может быть необходимым отступление от указанных доз в большую или меньшую сторону.
Помимо использования в качестве фармацевтически активного соединения в лечении человека и в ветеринарии соединения формул Ia и Ib также можно использовать в качестве вспомогательного средства в биохимических исследованиях или в качестве инструмента для исследований, или для диагностических целей, например в in vitro диагностике биологических образцов, если предполагается ингибирование ренина. Соединения формул Ia и Ib и их соли также можно использовать в качестве промежуточных соединений, например, для получения дополнительных фармацевтически активных веществ.
Следующие далее примеры иллюстрируют настоящее изобретение.
Когда соединения, полученные в примерах, содержащие основную группу, очищали при помощи препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ) на колонке с обращенной фазой (ОФ) и, как обычно, элюент представлят собой градиентную смесь воды и ацетонитрила (ACN), содержащую трифторуксусную кислоту (TFA), они, как правило, были получены в форме кислотно-аддитивной соли с трифторуксусной кислотой в зависимости от деталей конечной обработки, таких как условия лиофилизации. Такое содержание трифторуксусной кислоты, количество которой может варьировать и может составлять до около двух эквивалентов кислоты в случае соединения, содержащего две основные группы, например, не указано в названиях в заголовках примеров и не отражено в структурных формулах, но указано в описании примеров. Это относится, соответственно, к соединениям, которые были получены в форме другой кислотно-аддитивной соли, такой как кислотно-аддитивная соль с хлористоводородной кислотой, количество которой подобным образом может варьировать и может составлять до около двух эквивалентов кислоты в случае соединения, содержащего две основные группы, например, и это не указано в названиях в заголовках примеров и не отражено в структурных формулах, но указано в описании примеров.
Характеристика соединений
Полученные соединения в основном были охарактеризованы спектроскопическими данными и хроматографическими данными, в частности, при помощи масс-спектров (MS) и время удерживания ВЭЖХ (Rt; в минутах), которые были получены объединенным методом аналитической ВЭЖХ/МС c (ЖХ/МС) и ядерного магнитного резонанса (ЯМР), путем определения температуры плавления или температуры разложения (т.пл., в°C) и/или путем оптического вращения (α, т.е. [α]D 20 в °(градусы) при определенной концентрации c (в г/100 мл)). Если не указано иное, 1H-ЯМР спектры записывали при 400 МГц и в DMSO-D6 в качестве растворителя. В ЯМР данных представлены химический сдвиг δ (в м.д.), количество атомов водорода и мультиплетность (с: синглет, д: дублет, дд: двойной дублет, т: триплет, дт: двойной триплет, кв.: квартет, м: мультиплет; шир.: широкий) пиков. В МС данных, как правило, представлено массовое число (m/z) пика молекулярного иона (M, например, M+) или соответствующего иона, такого как ион M+1 (протонированный молекулярный ион MH+, т.е. M+1+), который был образован в зависимости от используемого способа ионизации. Как правило, способ ионизации представляет собой ионизацию электроспреем (ESI). Подробные характеристики используемых ЖХ/МС способов описаны ниже.
ЖХ/МС Способ LC1
Колонка: Waters Acquity BEH C18, 50×2,1 мм, 1,7 мкм; скорость потока: 1,0 мл/мин; элюент A: вода + 0,05% TFA; элюент B: ACN + 0,035% TFA; градиент: от 98% А + 2% B до 0% А + 100% B в течение 1,6 мин, затем 0% А + 100% B в течение 1,5 мин, затем до 98% А + 2% B в течение 3,0 мин; MS способ ионизации: ESI+
ЖХ/МС Способ LC2
Колонка: Waters XBridge C18, 30×4,6 мм, 3 мкм; скорость потока 1,0 мл/мин; элюент A: вода + 0,1% муравьиной кислоты; элюент B: ACN + 0,01% муравьиной кислоты; градиент: от 95% + 5% B до 0% А + 100% B в течение 5,5 мин, затем 0% А + 100% B в течение 2 мин, затем до 95% А + 5% B в течение 8 мин; MS способ ионизации: ESI+
ЖХ/МС Способ LC3
Колонка: YMC J'sphere ODS H80, 20×2,1 мм, 4 мкм; скорость потока 1 мл/мин; элюент A: вода + 0,05% TFA; элюент B: ACN; градиент: от 96% А + 4% B до 5% А + 95% B в течение 2 мин, затем 5% А + 95% B в течение 0,4 мин, затем до 96% А + 4% B в течение 0,05 мин; MS способ ионизации: ESI+
ЖХ/МС Способ LC4
Колонка: Luna C18, 10×2 мм, 3 мкм; скорость потока 1,1 мл/мин; элюент A: вода + 0,05% TFA; элюент B: ACN + 0,05% TFA; градиент: от 93% А + 7% B до 5% А + 95% B в течение 1,2 мин, затем 5% А + 95% B в течение 0,2 мин, затем до 93% А + 7% B в течение 0,05 мин; MS способ ионизации: ESI+
|
Пример 1
[2-(3-Фтор-2-метил-бензил)-1-фенил-индолизин-3-ил]-пиперазин-1-ил-метанон
Стадия 1: 1-Хлор-3-(3-фтор-2-метил-фенил)-пропан-2-он
0,867 г (35,67 ммоль) магниевых стружек сушили и суспендировали в 17 мл безводного ТГФ в атмосфере аргона. Раствор 1,2-дибромэтан (0,14 мл, 1,62 ммоль) и затем добавляли по каплям 2-бром-6-фтор-толуол (6,74 г, 35,67 ммоль) в 17 мл безводного ТГФ, чтобы поддерживать ровное кипячение с обратным холодильником. После того как магний был израсходован, добавляли иодид меди(I) (0,432 г, 2,27 ммоль) с последующим добавлением раствора эпихлоргидрина (3,00 г, 32,42 ммоль) в DMF (8 мл). Смесь перемешивали в течение 3,5 часов при комнатной температуре и затем гасили насыщенным раствором хлорида аммония (120 мл). Органический слой отделяли и водную фазу экстрагировали два раза при помощи EA. Объединенные органические фазы промывали два раза насыщенным раствором хлорида аммония, сушили над сульфатом натрия, фильтровали и упаривали досуха. Продукт очищали хроматографией на силикагеле (циклогексан/EA, от 100:0 до 90:10) с получением 6,89 г 1-хлор-3-(3-фтор-2-метил-фенил)-пропан-2-ола. 3,92 г (16,23 ммоль) этого спирта растворяли в DCM в атмосфере аргона и добавляли 1,1,1-триацетокси-1,1-дигидро-1,2-бензиодоксол-3(1H)-он (периодинановый реагент Dess-Martin; 7,57 г, 16,23 ммоль). Смесь перемешивали при комнатной температуре в течение ночи и затем добавляли диэтиловый эфир (150 мл). Смесь промывали три раза 1н. раствором хлористоводородной кислоты (70 мл) и два раза насыщенным раствором хлорида натрия и экстрагировали простым эфиром. Экстракты сушили над сульфатом натрия, фильтровали и упаривали досуха. 2,69 г указанного в заголовке соединения получали в виде белого порошка.
Стадия 2: 1-Бром-3-(3-фтор-2-метил-фенил)-пропан-2-он
Соединение со стадии 1 (3,20 г, 15,95 ммоль) растворяли в ацетоне (70 мл) и добавляли бромид лития (11,08 г, 127,59 ммоль). Смесь перемешивали в течение ночи. Растворитель выпаривали, полученное твердое вещество растворяли в EA и раствор промывали два раза водой, затем насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и упаривали досуха. 3,66 г указанного в заголовке соединения получали в виде белого порошка.
Стадия 3: 2-(3-Фтор-2-метил-бензил)-1-фенил-индолизин
Соединение со стадии 2 (1,50 г, 6,12 ммоль) и 2-бензил-пиридин (2,071 г, 12,24 ммоль) растворяли в ацетоне (30 мл) и смесь перемешивали при кипячении с обратным холодильником в течение ночи. Смесь концентрировали досуха и остаток очищали хроматографией на силикагеле (циклогексан) с получением 0,653 г указанного в заголовке соединения.
Стадия 4: [2-(3-Фтор-2-метил-бензил)-1-фенил-индолизин-3-ил]-пиперазин-1-ил-метанон
Соединение со стадии 3 (0,635 г, 2,01 ммоль) растворяли в DCM (5 мл) в атмосфере аргона и охлаждали при 0°C. Добавляли пиридин (0,16 мл, 2,01 ммоль) и трифосген (0,598 г, 2,01 ммоль) и смесь перемешивали при комнатной температуре в течение 80 минут. Смесь затем добавляли по каплям к раствору 1-трет-бутоксикарбонил-пиперазина (1,50 г, 8,05 ммоль) и триэтиламина (1,12 мл, 8,05 ммоль) в DCM (15 мл), охлажденному до 0°C. После перемешивания при комнатной температуре в течение ночи смесь разбавляли 1н.. раствором хлористоводородной кислоты и экстрагировали при помощи DCM. Экстракты промывали насыщенным раствором гидрокарбоната натрия и два раза промывали насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом натрия, фильтровали и упаривали досуха. Остаток очищали хроматографией на силикагеле с DCM/MOH (от 100:0 до 98:2) и затем хроматографией на силикагеле с циклогексаном/EA (от 100:0 до 70:30) с получением 0,815 г трет-бутилового эфира 4-[2-(3-фтор-2-метил-бензил)-1-фенил-индолизин-3-карбонил]-пиперазин-1-карбоновой кислоты в виде светло-розового порошка. Для удаления трет-бутоксикарбонильной группы и преобразования в гидрохлорид 0,689 г полученного продукта растворяли в DCM (10 мл), раствор охлаждали до 0°C и насыщали газообразным хлористым водородом. После перемешивания в течение 1 часов при 0°C смесь упаривали досуха. Остаток растирали в порошок с диэтиловым эфиром, фильтровали, промывали диэтиловым эфиром и сушили при пониженном давлении с получением 0,53 г указанного в заголовке соединения в форме [2-(3-фтор-2-метил-бензил)-1-фенил-индолизин-3-ил]-пиперазин-1-ил-метанон гидрохлорида в виде не совсем белого порошка, имеющего следующие характеристики:
Т.пл.: 263°C
ЖХ/МС (Способ LC 1): m/z=428 [MH+]; Rt=1,10 мин
1H-ЯМР: δ (м.д.) = 2,00 (с, 3H), 2,85 (м, 2H), 3,11 (м, 2H), 3,48 (м, 2H), 3,76 (м, 2H), 4,12 (с, 2H), 6,68 (д, 1H), 6,88 (т, 1H), 6,95 (м, 2H), 7,02 (м, 1H), 7,35 (м, 3H), 7,49 (м, 3H), 8,32 (д, 1H), 9,40 (шир.с, 1H).
Пример 2
[1-Циклогексил-2-(3-фтор-2-метил-бензил)-индолизин-3-ил]-пиперазин-1-ил-метанон
Стадия 1: 2-Циклогексилметил-пиридин
Используя модифицированный вариант процедуры, описанной в J. M. Ontoria et al., Bioorg. Med. Chem. Lett. 16 (2006), 4026, раствор 2-метил-пиридина (0,50 г, 5,37 ммоль) в 10 мл безводного ТГФ охлаждали до -78°C в атмосфере аргона. Добавляли по каплям н-бутиллитий (2,36 мл 2,5 M раствора в гексане, 5,91 ммоль) и раствор перемешивали при -78°C в течение 1 часа. Затем добавляли по каплям 3-бром-циклогексен (0,68 мл, 5,91 ммоль) и температуре давали подняться до температуры окружающей среды в течение 3 часов. После перемешивания в течение ночи смесь гасили путем добавления 20 мл воды и экстрагировали два раза при помощи EA. Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и упаривали досуха с получением 0,436 г 2-(циклогекс-2-ен-1-илметил)-пиридина в виде оранжевого масла. Этот продукт растворяли в 8,4 мл этанола, добавляли 5% палладий на активированном угле (50% в воде; 0,087 г) и смесь гидрировали при давлении водорода 3,2 бар в течение 4 часов при комнатной температуре. Катализатор затем отфильтровывали и фильтрат упаривали досуха при пониженном давлении с получением 0,415 г указанного в заголовке соединения в виде масла.
Стадия 2: 1-Циклогексил-2-(3-фтор-2-метил-бензил)-индолизин
Соединение со стадии 1 (0,415 г, 2,37 ммоль) и соединение со стадии 2 примера 1 (0,58 г, 2,37 ммоль) растворяли в 15 мл ацетона и раствор перемешивали при кипячении с обратным холодильником в течение 36 часов. Раствор упаривали досуха и твердое вещество (0,92 г) растворяли в 10 мл изопропанола. Добавляли карбонат натрия (0,70 г, 6,57 ммоль), смесь перемешивали при кипячении с обратным холодильником в течение 2 часов и затем упаривали досуха при пониженном давлении. Остаток брали для поглощения в DCM и воду и водную фазу экстрагировали два раза при помощи DCM. Объединенные органические фазы сушили над сульфатом натрия, фильтровали и упаривали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (HEP/EA, 100:0, затем 70:30) с получением 0,489 г указанного в заголовке соединения в виде вязкого желтого масла.
Стадия 3: [1-Циклогексил-2-(3-фтор-2-метил-бензил)-индолизин-3-ил]-пиперазин-1-ил-метанон
Соединение со стадии 2 (0,488 г, 1,52 ммоль) растворяли в DCM (15,2 мл) в атмосфере аргона и охлаждали при 0°C. Добавляли пиридин (0,12 мл, 1,52 ммоль) и трифосген (0,45 г, 1,52 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов. Смесь затем охлаждали до 0°C и добавляли триэтиламин (0,85 мл, 6,07 ммоль) и 1-трет-бутоксикарбонил-пиперазин (1,13 г, 6,07 ммоль). Смесь перемешивали при комнатной температуре в течение ночи, затем разбавляли 1н.. раствором хлористоводородной кислоты и экстрагировали при помощи DCM. Органические фазы промывали насыщенным раствором гидрокарбоната натрия и два раза насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и упаривали досуха. Остаток очищали хроматографией на силикагеле (циклогексан/EA, 100:0, затем 50:50) с получением 0,686 г трет-бутилового эфира 4-[1-циклогексил-2-(3-фтор-2-метил-бензил)-индолизин-3-карбонил]-пиперазин-1-карбоновой кислоты в виде бежевого пенистого вещества. Полученный продукт растворяли в 10 мл DCM, раствор охлаждали до 0°C в атмосфере азота и добавляли раствор TFA (1,91 мл, 25,7 ммоль) в 1,91 мл DCM. После перемешивания при комнатной температуре в течение ночи смесь упаривали досуха при пониженном давлении и остаток два раза смешивали с толуолом и упаривали досуха снова. Остаток очищали хроматографией на силикагеле (DCM/MOH, 9:1, содержащий 1% аммиака) с получением 0,600 г [1-циклогексил-2-(3-фтор-2-метил-бензил)-индолизин-3-ил]-пиперазин-1-ил-метанона. Для преобразования в гидрохлорид полученный продукт растворяли в 15 мл DCM и добавляли 4н. раствор хлористого водорода в диоксане (0,69 мл, 2,77 ммоль). Раствор перемешивали в течение 1 часа при комнатной температуре и концентрировали досуха при пониженном давлении. Твердое вещество растирали в порошок с диэтиловым эфиром три раза, фильтровали и сушили в вакууме при 65°C с получением 0,422 г указанного в заголовке соединения в форме [1-циклогексил-2-(3-фтор-2-метил-бензил)-индолизин-3-ил]-пиперазин-1-ил-метанон гидрохлорида в виде не совсем белого порошка, имеющего следующие характеристики:
Т.пл.: 317-318°C
ЖХ/МС (Способ LC2): m/z=434,2 [MH+]; Rt=4,10 мин
1H-ЯМР: δ (м.д.) = 1,0-1,25 (м, 3H), 1,45 (м, 2H), 1,61 (м, 5H), 2,13 (с, 3H), 2,47 (м, 1H), 2,78 (м, 2H), 3,01 (м, 2H), 3,35 (м, 2H), 3,56 (м, 2H), 3,94 (с, 2H), 6,52 (м, 2H), 7,02 (м, 1H), 6,90 (м, 1H), 6,98 (м, 1H), 7,55 (д, 1H), 8,09 (д, 1H), 9,08 (шир.с, 2H).
Пример 3
[2-(2-Хлор-6-фтор-бензил)-1-фенил-индолизин-3-ил]-пиперазин-1-ил-метанон
Стадия 1: 1-Бром-3-(2-хлор-6-фтор-фенил)-2-пропанон
К 2 M раствору триметилсилил-диазометана в гексане (6,54 мл, 13,07 ммоль), охлажденному до 0°C, в атмосфере аргона добавляли по каплям раствор 2-хлор-6-фтор-фенилацетилхлорида (1,23 г, 5,94 ммоль) в 24 мл смеси ТГФ и ACN (1:1). Смесь перемешивали при 0°C в течение 5 часов. Затем добавляли по каплям 48% водный раствор бромистоводородной кислоты (5,91 мл, 52,28 ммоль) и раствор перемешивали при комнатной температуре в течение ночи. Затем добавляли 40 мл воды. Водную фазу экстрагировали два раза при помощи EA и объединенные органические фазы промывали водой, насыщенным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (циклогексан/EA, 100:0, затем 95:5) с получением 1,20 г указанного в заголовке соединения в виде белого порошка, имеющего температуру плавления 47°C.
Стадия 2: 2-(2-Хлор-6-фтор-бензил)-1-фенил-индолизин
Соединение со стадии 1 (1,17 г, 4,41 ммоль) и 2-бензил-пиридин (1,49 г, 8,82 ммоль) растворяли в ацетоне (15 мл) и смесь перемешивали при кипячении с обратным холодильником в течение ночи. Смесь концентрировали досуха и остаток очищали хроматографией на силикагеле (DCM/MOH, 100:0, затем 95:5) с получением 1,13 г указанного в заголовке соединения.
Стадия 3: трет-бутиловый эфир 4-[2-(2-хлор-6-фтор-бензил)-1-фенил-индолизин-3-карбонил]-пиперазин-1-карбоновой кислоты
Соединение со стадии 2 (0,576 г, 1,72 ммоль) растворяли в DCM (8 мл) в атмосфере аргона и охлаждали при 0°C. Добавляли пиридин (0,14 мл, 1,72 ммоль) и трифосген (0,509 г, 1,72 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов. Смесь затем добавляли по каплям к раствору 1-трет-бутоксикарбонил-пиперазина (1,28 г, 6,85 ммоль) и триэтиламина (0,86 мл, 6,85 ммоль) в DCM (8 мл), охлажденному до 0°C. Смесь перемешивали при комнатной температуре в течение ночи, затем разбавляли 1н.. раствором хлористоводородной кислоты и экстрагировали при помощи DCM. Объединенные органические фазы промывали насыщенным раствором гидрокарбоната натрия и два раза насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и упаривали досуха. Остаток очищали хроматографией на силикагеле (циклогексан/EA, 100:0, затем 75:25) с получением 0,895 г указанного в заголовке соединения в виде не совсем белого порошка.
Стадия 4: [2-(2-Хлор-6-фтор-бензил)-1-фенил-индолизин-3-ил]-пиперазин-1-ил-метанон
Соединение со стадии 3 (0,886 г, 1,62 ммоль) растворяли в DCM (6,5 мл). Раствор охлаждали при 0°C и добавляли 4н. раствор хлористого водорода в диоксане (2,02 мл, 8,08 ммоль). После перемешивания в течение ночи при комнатной температуре смесь концентрировали досуха. Остаток растирали в порошок с диэтиловым эфиром несколько раз, фильтровали, промывали диэтиловым эфиром и сушили в вакууме при 65°C с получением 0,70 г указанного в заголовке соединения в форме [2-(2-хлор-6-фтор-бензил)-1-фенил-индолизин-3-ил]-пиперазин-1-ил-метанон гидрохлорида в виде не совсем белого порошка, имеющего следующие характеристики:
Т.пл.: 304°C
ЖХ/МС (способ LC1): m/z=448 [MH+]; Rt=1,05 мин
1H-ЯМР: δ (м.д.) = 3,01 (м, 2H), 3,11 (м, 2H), 3,35 (м, 6H), 3,73 (м, 2H), 4,21 (с, 2H), 6,73 (т, 1H), 6,88 (дд, 1H), 6,98 (т, 1H), 7,10 (д, 1H), 7,18 (кв., 1H), 7,38 (м, 3H), 8,23 (д, 1H), 9,35 (шир.с, 2H).
Пример 4
Метиламид 2-(3-фтор-2-метил-бензил)-1-фенил-3-(пиперазин-1-карбонил)-индолизин-7-карбоновой кислоты
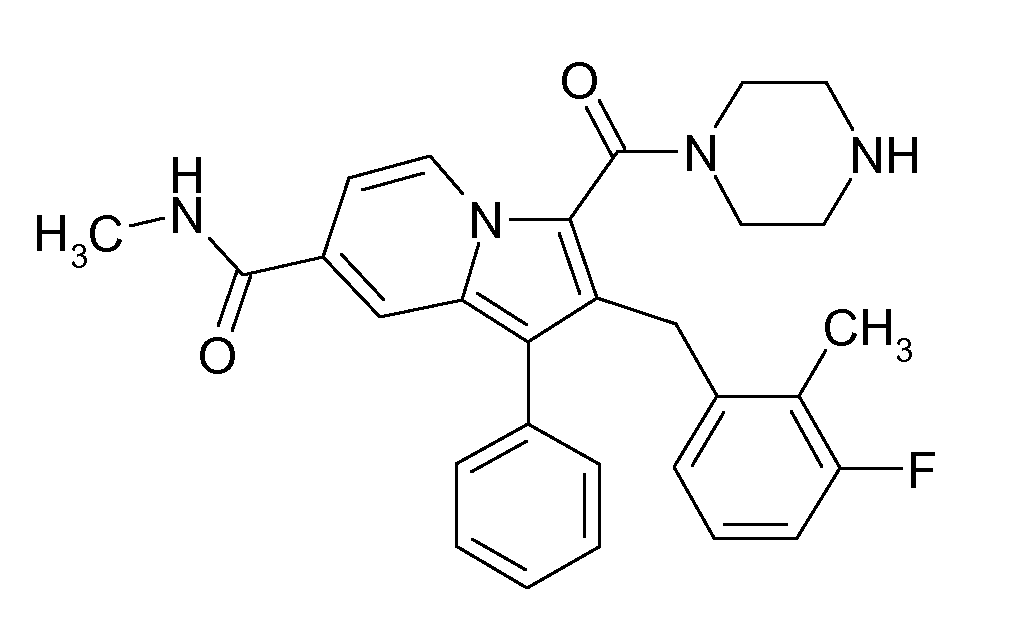
Стадия 1: Метил 2-бензил-пиридин-4-карбоксилат
К 35 мл безводного DMF в атмосфере аргона в герметично закрытой пробирке добавляли трифосфат калия (9,28 г, 43,71 ммоль), 2-дициклогексилфосфино-2',6'-диметокси-бифенил (SPhos, 0,239 г, 0,58 ммоль), ацетат палладия(II) (0,065 г, 0,29 ммоль) и затем метил 2-хлор-пиридин-4-карбоксилат (2,50 г, 14,57 ммоль) и B-бензил-9-борабицикло[3,3,1]нонан (6,80 г, 32,05 ммоль). Смесь нагревали в течение ночи при 60°C. После охлаждения до комнатной температуры смесь разбавляли в 200 мл EA, раствор промывали три раза 100 мл 1н.. раствора гидроксида натрия и два раза 100 мл насыщенного солевого раствора. Органическую фазу сушили над сульфатом натрия, фильтровали и упаривали досуха при пониженном давлении. Остаток затем очищали хроматографией на силикагеле (циклогексан/EA, 100:0, затем 80:20) с получением 2,784 г указанного в заголовке соединения в виде оранжевого масла.
Стадия 2: Метил-2-(3-фтор-2-метил-бензил)-1-фенил-индолизин-7-карбоксилат
Соединение со стадии 1 (1,555 г, 6,84 ммоль) и соединение примера 1 стадия 2 (1,677 г, 6,84 ммоль) растворяли в 28,5 мл ацетона и раствор нагревали до температуры кипения с обратным холодильником в течение ночи. Смесь затем упаривали досуха при пониженном давлении и остаток растворяли в 28,5 мл изопропанола. Добавляли карбонат натрия (2,176 г, 20,53 ммоль) и смесь нагревали при 105°C при перемешивании в течение 2 часов. Твердые вещества отфильтровывали и фильтрат упаривали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (циклогексан/EA, 100:0, затем 95:5) с получением 0,497 г указанного в заголовке соединения в виде желтого твердого вещества, плавящегося при 55°C.
Стадия 3: Метил-2-(3-фтор-2-метил-бензил)-3-формил-1-фенил-индолизин-7-карбоксилат
К оксихлориду фосфора (0,35 мл, 3,82 ммоль), охлажденному при 0°C, в атмосфере аргона добавляли по каплям безводный DMF (0,34 мл, 4,46 ммоль) и смесь перемешивали в течение 5 мин с образованием осадка. Добавляли 1,5 мл DMF и перемешивание продолжали при 0°C в течение 15 минут. К этой смеси добавляли по каплям раствор соединения стадии 2 (0,476 г, 1,27 ммоль) в 5 мл DMF и смесь нагревали при 60°C в течение 1,5 часов и затем перемешивали при комнатной температуре в течение ночи. Добавляли раствор ацетата натрия (0,837 г) в 6,5 мл воды, смесь нагревали при 50°C в течение 1 часа и упаривали досуха при пониженном давлении. Остаток растворяли в EA, раствор промывали насыщенным раствором гидрокарбоната натрия, водой и насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (циклогексан/EA, 100:0, затем 90:10) с получением 0,297 г указанного в заголовке соединения.
Стадия 4: 2-(3-фтор-2-метил-бензил)-7-метоксикарбонил-1-фенил-индолизин-3-карбоновая кислота
Соединение со стадии 3 (0,293 г, 0,73 ммоль) суспендировали в 4 мл трет-бутанола и охлаждали до 0°C. К этой суспензии добавляли раствор дигидрофосфата натрия (0,263 г, 2,19 ммоль) в 1 мл воды, 2 M раствор 2-метил-2-бутена в ТГФ (2,19 мл, 4,38 ммоль) и хлорит натрия (0,124 г, 1,09 ммоль) небольшими порциями. После перемешивания при комнатной температуре в течение 18 часов снова добавляли раствор дигидрофосфата натрия (0,263 г, 2,19 ммоль) в 2 мл воды, 2 M раствор 2-метил-2-бутена в ТГФ (2,19 мл, 4,38 ммоль) и хлорит натрия (0,124 г, 1,09 ммоль) и перемешивание продолжали еще в течение 48 часов. Затем добавляли 30 мл 1:1 смеси насыщенного солевого раствора и EA, органическую фазу отделяли и водную фазу экстрагировали при помощи EA. Объединенные органические фазы промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали досуха при пониженном давлении с получением 0,420 г неочищенного указанного в заголовке соединения в виде желтого порошка, которое непосредственно использовали на следующей стадии.
Стадия 5: метиловый эфир 3-(4-трет-бутоксикарбонил-пиперазин-1-карбонил)-2-(3-фтор-2-метил-бензил)-1-фенил-индолизин-7-карбоновой кислоты
К раствору неочищенного соединения, полученного на стадии 4 (0,420 г, 0,69 ммоль), 1-трет-бутоксикарбонил-пиперазина (0,142 г, 0,76 ммоль) и триэтиламина (0,48 мл, 2,78 ммоль) в 3,5 мл DMF, охлажденному при 0°C, добавляли TBTU (0,490 г, 1,53 ммоль) небольшими порциями и смесь перемешивали при комнатной температуре в течение ночи. Затем добавляли 10 мл EA и 20 мл насыщенного солевого раствора, водную фазу отделяли и экстрагировали два раза при помощи EA. Объединенные органические фазы промывали водой, 1н. раствором хлористоводородной кислоты, водой, насыщенным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (циклогексан/EA, 100:0, затем 70:30) с получением 0,162 г указанного в заголовке соединения в виде бежевого твердого вещества.
Стадия 6: 3-(4-трет-Бутоксикарбонил-пиперазин-1-карбонил)-2-(3-фтор-2-метил-бензил)-1-фенил-индолизин-7-карбоновая кислота
Соединение со стадии 5 (0,159 г, 0,27 ммоль) растворяли в 2 мл диоксана и добавляли раствор гидроксида лития гидрата (0,034 г, 0,82 ммоль) в 0,8 мл воды. Раствор перемешивали при 50°C в течение ночи. Растворители затем выпаривали при пониженном давлении, остаток растворяли в 6 мл воды и подкисляли до pH 1 при помощи 1н. раствора хлористоводородной кислоты. Продукт отфильтровывали, растворяли в EA и раствор промывали насыщенным солевым раствором. Органическую фазу сушили над сульфатом натрия, фильтровали и упаривали с получением 0,139 г указанного в заголовке соединения в виде светло-коричневого порошка.
Стадия 7: трет-бутиловый эфир 4-[2-(3-фтор-2-метил-бензил)-7-метилкарбамоил-1-фенил-индолизин-3-карбонил]-пиперазин-1-карбоновой кислоты
Соединение со стадии 6 (0,139 г, 0,24 ммоль), гидрохлорид метиламина (0,022 г, 0,32 ммоль) и триэтиламин (0,17 мл, 0,97 ммоль) растворяли в 2 мл DMF и охлаждали до 0°C. Добавляли TBTU (0,195 г, 0,61 ммоль) и раствор перемешивали при комнатной температуре в течение ночи. Затем добавляли воду (8 мл) и смесь экстрагировали три раза при помощи EA. Объединенные органические фазы промывали 1н. раствором хлористоводородной кислоты, водой, насыщенным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (DCM/MOH, 100:0, затем 96:4) с получением 0,065 г указанного в заголовке соединения в виде бежевого твердого вещества.
Стадия 8: метиламид 2-(3-фтор-2-метил-бензил)-1-фенил-3-(пиперазин-1-карбонил)-индолизин-7-карбоновой кислоты
Соединение со стадии 7 (0,065 г, 0,11 ммоль) растворяли в 1,1 мл DCM и охлаждали до 0°C и добавляли 4н. раствор хлористого водорода в диоксане (0,54 мл, 2,20 ммоль). Смесь перемешивали при комнатной температуре в течение ночи и затем упаривали досуха при пониженном давлении. Полученное твердое вещество растирали в порошок с диэтиловым эфиром несколько раз и сушили в вакууме при 40°C. 0,053 г указанного в заголовке соединения получали в форме метиламида 2-(3-фтор-2-метил-бензил)-1-фенил-3-(пиперазин-1-карбонил)-индолизин-7-карбоновой кислоты, гидрохлорида в виде светло-желтого твердого вещества, имеющего следующие характеристики:
Т.пл.: 205°C
ЖХ/МС (способ LC1): m/z=485 [MH+]; Rt=0,94 мин
1H-ЯМР: δ (м.д.) = 1,85 (с, 3H), 2,68 (д, 3H), 2,73 (м, 2H), 3,03 (м, 2H), 3,39 (м, 2H), 3,59 (м, 2H), 4,0 (с, 2H), 5,57 (д, 1H), 6,81 (т, 1H), 6,92 (кв., 1H), 7,09 (дд, 1H), 7,30 (м, 3H), 7,39 (м, 2H), 7,89 (д, 1H), 8,08 (дд, 1H), 8,46 (дд, 1H), 9,04 (шир.с, 2H).
Пример 5
[2-(3-Фтор-2-метил-бензил)-1-фенил-индолизин-3-ил]-[(S)-3-(2-гидрокси-этил)-пиперазин-1]-ил-метанон
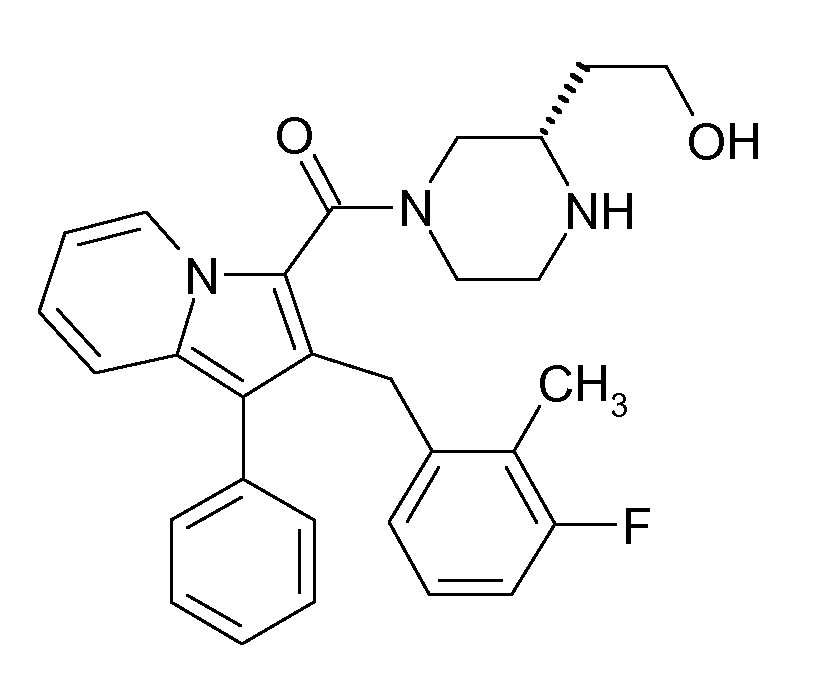
Стадия 1: трет-бутиловый эфир (S)-4-бензил-2-(2-гидрокси-этил)-пиперазин-1-карбоновой кислоты
Ди-трет-бутилдикарбонат (8,737 г, 40,3 ммоль) добавляли к раствору (S)-4-бензил-пиперазин-2-этанола (полученного из метил N-бензил-глицината и β-метилового эфира N-трет-бутоксикарбонил-L-аспарагиновой кислоты в соответствии с WO 2005/026177; 5,88 г, 26,69 ммоль) в 130 мл DCM. Раствор перемешивали при комнатной температуре в течение ночи и затем упаривали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (циклогексан/EA, 100:0, затем 70:30) с получением 6,711 г указанного в заголовке соединения в виде бесцветного масла.
Стадия 2: трет-бутиловый эфир (S)-2-(2-гидрокси-этил)-пиперазин-1-карбоновой кислоты
К раствору соединения стадии 1 (6,675 г, 20,83 ммоль) в 100 мл этанола добавляли 0,293 г 20% гидроксида палладия на активированном угле и раствор гидрировали при давлении водорода 4 бар при комнатной температуре в течение ночи. Катализатор отфильтровывали и фильтрат упаривали досуха с получением 4,636 г указанного в заголовке соединения в виде серого масла.
Стадия 3: трет-бутиловый эфир (S)-2-[2-(трет-бутил-диметил-силилокси)-этил)-пиперазин-1-карбоновой кислоты
Трет-бутил-диметил-силилхлорид (3,62 г, 24,02 ммоль) и имидазол (3,27 г, 48,03 ммоль) добавляли к раствору соединения стадии 2 (4,609 г, 20,01 ммоль) в 75 мл DCM и полученный раствор перемешивали при комнатной температуре в течение 3 часов. Смесь промывали при помощи 50 мл воды и затем 50 мл насыщенного солевого раствора. Водную фазу экстрагировали один раз при помощи DCM. Объединенные органические фазы сушили над сульфатом натрия, фильтровали и упаривали при пониженном давлении с получением 6,90 г указанного в заголовке соединения в виде бледно-желтого масла.
Стадия 4: трет-бутиловый эфир (S)-2-[2-(трет-бутил-диметил-силилокси)-этил]-4-[2-(3-фтор-2-метил-бензил)-1-фенил-индолизин-3-карбонил]-пиперазин-1-карбоновой кислоты
Соединение примера 1, стадия 3 (1,00 г, 3,17 ммоль) растворяли в 15 мл DCM и охлаждали до 0°C. К этому раствору добавляли пиридин (0,26 мл, 3,17 ммоль) и 20% раствор фосгена в толуоле (1,67 мл, 3,17 ммоль) и смесь перемешивали в течение 2,5 часов при комнатной температуре. Этот раствор затем добавляли по каплям к раствору соединения стадии 3 (1,202 г, 3,49 ммоль) в 25 мл DCM, содержащего триэтиламин (0,44 мл, 3,49 ммоль), и смесь перемешивали в течение ночи при комнатной температуре. Добавляли DCM (25 мл) и раствор промывали при помощи 25 мл 0,5н.раствора хлористоводородной кислоты, 25 мл насыщенного раствора гидрокарбоната натрия и 25 мл насыщенного солевого раствора. Органическую фазу сушили над сульфатом натрия, фильтровали и упаривали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (циклогексан/EA, 85:15, затем 80:20) с получением 1,33 г указанного в заголовке соединения в виде не совсем белого порошка, плавящегося при 70°C.
Стадия 5: трет-бутиловый эфир (S)-4-[2-(3-фтор-2-метил-бензил)-1-фенил-индолизин-3-карбонил]-2-(2-гидрокси-этил)-пиперазин-1-карбоновой кислоты
1 M раствор тетрабутиламмонийфторида в ТГФ (2,82 мл, 2,82 ммоль) добавляли к раствору соединения стадии 4 (1,29 г, 1,88 ммоль) в 7,5 мл ТГФ, охлажденному до 0°C, в атмосфере аргона. Смесь перемешивали при комнатной температуре в течение 2 часов и затем добавляли 100 мл насыщенного раствора хлорида аммония. Раствор экстрагировали два раза при помощи EA, каждый раз по 50 мл, и объединенные органические фазы промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (DCM/MOH, 100:0, затем 98:2) с получением 1,069 г указанного в заголовке соединения в виде не совсем белого порошка, плавящегося при 85°C.
Стадия 6: [2-(3-Фтор-2-метил-бензил)-1-фенил-индолизин-3-ил]-[(S)-3-(2-гидрокси-этил)-пиперазин-1]-ил-метанон
К раствору соединения стадии 5 (0,10 г, 0,17 ммоль) в 1,75 мл DCM, охлажденному до 0°C, добавляли 4н. раствор хлористого водорода в диоксане (0,87 мл, 3,50 ммоль). Смесь перемешивали при комнатной температуре в течение 3,5 часов и затем упаривали досуха. Полученное твердое вещество растирали в порошок с диэтиловым эфиром несколько раз и сушили в вакууме при 60°C с получением 0,070 г указанного в заголовке соединения в форме [2-(3-фтор-2-метил-бензил)-1-фенил-индолизин-3-ил]-[(S)-3-(2-гидрокси-этил)-пиперазин-1]-ил-метанон гидрохлорида в виде не совсем белого порошка, имеющего следующие характеристики:
Т.пл.: 202°C
ЖХ/МС (способ LC1): m/z=472 [MH+]; Rt=1,07 мин
1H-ЯМР: δ (м.д.) = 1,68 (м, 2H), 2,0 (д, 3H), 2,95 (м, 1H), 3,21 (м, 3H), 3,50 (м, 3H), 3,85 (м, 1H), 4,10 (м, 3H), 4,86 (шир.с, 1H), 6,64 (м, 1H), 6,80 (дд, 1H), 6,97 (м, 3H), 7,48 (м, 6H), 8,30 (м, 1H), 9,21 (шир.с, 2H).
α = -0,291° (c=4,7 г/100 мл, MOH)
Пример 6
2-{(S)-4-[2-(3-Фтор-2-метил-бензил)-1-фенил-индолизин-3-карбонил]-пиперазин-2-ил}-N-(тетрагидропиран-4-илметил)-ацетамид
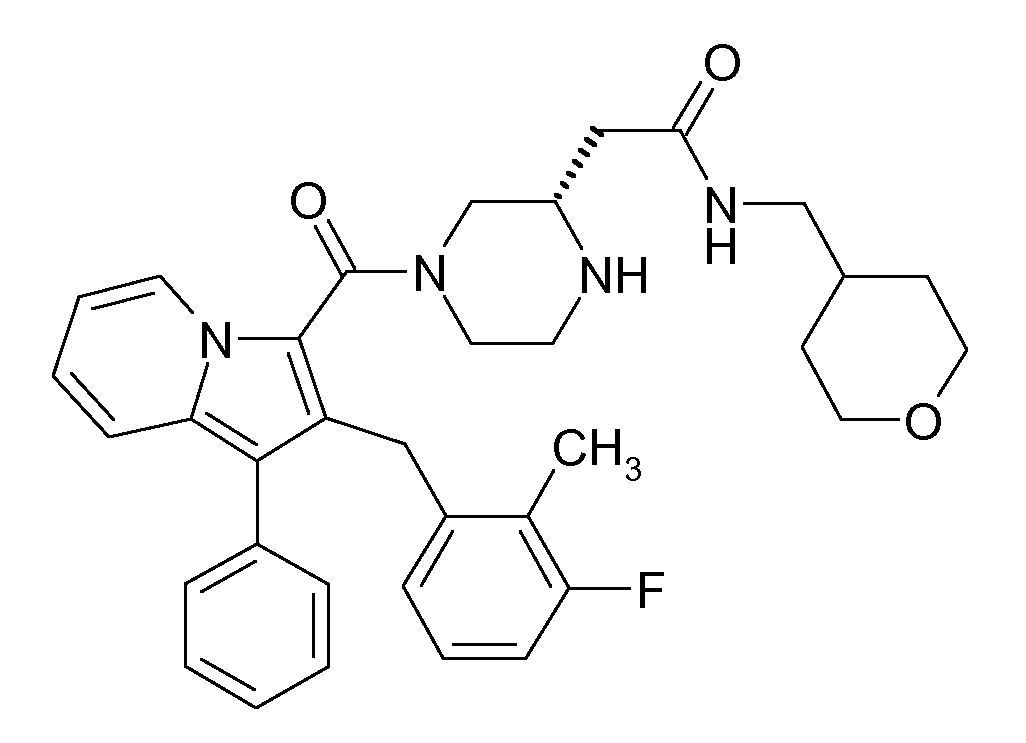
Стадия 1: трет-бутиловый эфир (S)-4-[2-(3-фтор-2-метил-бензил)-1-фенил-индолизин-3-карбонил]-2-(2-оксо-этил)-пиперазин-1-карбоновой кислоты
К раствору соединения примера 5, стадия 5 (0,955 г, 1,67 ммоль) в 10 мл DCM в атмосфере аргона добавляли 1,1,1-триацетокси-1,1-дигидро-1,2-бензиодоксол-3(1H)-он (7,78 г, 1,84 ммоль). Смесь перемешивали при комнатной температуре в течение 3,5 часов и затем разбавляли при помощи 40 мл диэтилового эфира. Раствор промывали три раза 1н. раствором гидроксида натрия (15 мл) и два раза насыщенным солевым раствором (15 мл). Органическую фазу сушили над сульфатом натрия, фильтровали и упаривали досуха при пониженном давлении с получением 0,965 г указанного в заголовке соединения в виде зеленого порошка, которое непосредственно использовали на следующей стадии.
Стадия 2: ((S)-1-трет-Бутоксикарбонил-4-[2-(3-фтор-2-метил-бензил)-1-фенил-индолизин-3-карбонил]-пиперазин-2-ил}-уксусная кислота
Соединение, полученное на стадии 1 (0,960 г, 1,69 ммоль), суспендировали в 9,6 мл трет-бутанола и охлаждали до 0°C. Затем добавляли раствор дигидрофосфата натрия (0,607 г, 5,06 ммоль) в 2,4 мл воды, 2 M раствор 2-метил-бут-2-ена в ТГФ (5,06 мл, 10,11 ммоль) и хлорит натрия (0,286 г, 2,53 ммоль) и смесь перемешивали в течение 3,75 часов. Добавляли насыщенный солевой раствор (30 мл) и смесь экстрагировали три раза при помощи EA. Объединенные органические фазы промывали два раза 1н. раствором хлористоводородной кислоты и один раз насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали досуха. Остаток очищали хроматографией на силикагеле (DCM/MOH, 100:0, затем 96:4) с получением 0,398 г указанного в заголовке соединения.
Стадия 3: трет-бутиловый эфир (S)-4-[2-(3-фтор-2-метил-бензил)-1-фенил-индолизин-3-карбонил]-2-{[(тетрагидропиран-4-илметил)-карбамоил]-метил}-пиперазин-1-карбоновой кислоты
К перемешиваемому охлажденному льдом раствору 4-аминометил-тетрагидропирана (0,047 г, 0,40 ммоль), EDIA (0,19 мл, 1,08 ммоль) и соединения со стадии 2 (0,190 г, 0,27 ммоль) добавляли TBTU (0,259 г, 0,81 ммоль) небольшими порциями. Раствор перемешивали при комнатной температуре в течение 18 часов. Затем добавляли воду (8 мл) и смесь экстрагировали 3 раза при помощи EA. Объединенные органические фазы промывали 1н. раствором хлористоводородной кислоты, водой, насыщенным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (циклогексан/EA, 100:0, затем 50:50) с получением 0,117 г указанного в заголовке соединения в виде оранжевой смолы.
Стадия 4: 2-{(S)-4-[2-(3-Фтор-2-метил-бензил)-1-фенил-индолизин-3-карбонил]-пиперазин-2-ил}-N-(тетрагидропиран-4-илметил)-ацетамид
К раствору соединения стадии 3 (0,113 г, 0,17 ммоль) в 1,65 мл DCM, охлажденному до 0°C, добавляли 4н. раствор хлористого водорода в диоксане (0,41 мл, 1,65 ммоль). Смесь перемешивали в течение 3 часов при комнатной температуре и затем упаривали досуха. Твердое вещество растирали в порошок с диэтиловым эфиром несколько раз и сушили в вакууме при 40°C с получением 0,071 г указанного в заголовке соединения в форме гидрохлорида 2-{(S)-4-[2-(3-фтор-2-метил-бензил)-1-фенил-индолизин-3-карбонил]-пиперазин-2-ил}-N-(тетрагидропиран-4-илметил)-ацетамида, имеющего следующие характеристики:
Т.пл.: 147°C
ЖХ/МС (способ LC1): m/z=583 [MH+]; Rt=1,10 мин
1H-ЯМР: δ (м.д.) = 1,15 (м, 3H), 1,54 (м, 3H), 1,60 (м, 1H), 1,97 и 2,03 (два с, 1H), 2,51 (м, 2H), 2,98 (м, 5H), 3,2 (м, 4H), 3,81 (м, 4H), 4,15 (м, 2H), 6,60 (т, 1H), 6,78 (дд, 1H), 6,92 (м, 4H), 7,40 (м, 6H), 8,18 (м, 2H), 8,35 (м, 1H), 9,13 (шир.с, 2H).
α: -2,69° (c=0,346 г/100 мл, MOH)
Пример 7
3-(2-{(S)-4-[2-(3-Фтор-2-метил-бензил)-1-фенил-индолизин-3-карбонил]-пиперазин-2-ил}-ацетиламино)-2,2-диметил-пропионамид
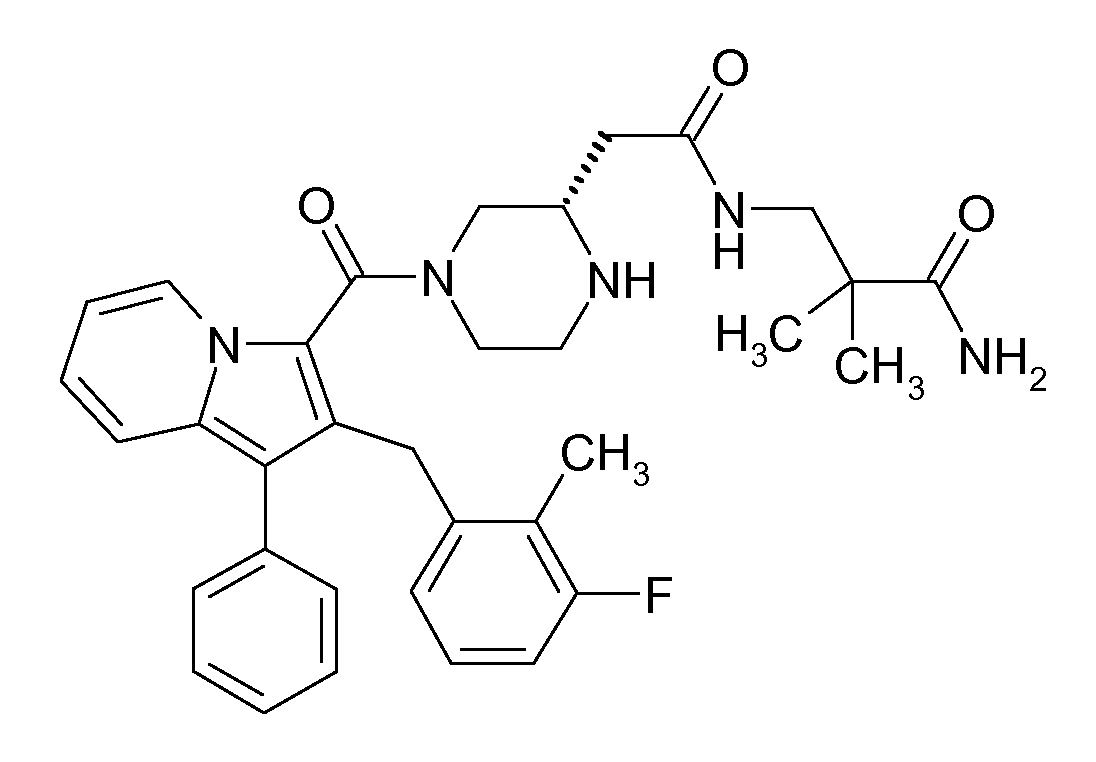
Стадия 1: [(S)-4-Бензилоксикарбонил-1-трет-бутоксикарбонил-пиперазин-2-ил]-уксусная кислота
1-трет-бутиловый эфир 4-бензиловый эфир (S)-2-(2-гидрокси-этил)-пиперазин-1,4-дикарбоновой кислоты (см. WO 96/31501; S. Fustero et al., Org. Lett. 9 (2007), 5283; 2,862 г, 7,85 ммоль) растворяли в 78,5 мл DCM и добавляли дихромат пиридиния (14,772 г, 39,27 ммоль). Смесь перемешивали при комнатной температуре в течение ночи, затем разбавляли насыщенным солевым раствором (330 мл) и экстрагировали три раза при помощи EA (70 мл). Объединенные органические фазы промывали водой (300 мл), фильтровали через диатомовую землю, сушили над сульфатом натрия, фильтровали и упаривали досуха при пониженном давлении. Продукт растворяли в EA и экстрагировали три раза 1н. раствором гидроксида натрия. Объединенные водные фазы подкисляли до pH 1 при помощи 6н. раствора хлористоводородной кислоты, экстрагировали при помощи EA и объединенные экстракты промывали водой и насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали досуха. 2,226 г указанного в заголовке соединения получали в виде вязкого бесцветного масла.
Стадия 2: 1-трет-бутиловый эфир 4-бензиловый эфир (S)-2-Метоксикарбонилметил-пиперазин-1,4-дикарбоновой кислоты
К раствору соединения стадии 1 (2,52 г, 6,66 ммоль) в 45 мл ацетона добавляли карбонат калия (5,522 г, 39,96 ммоль) и иодметан (1,24 мл, 19,98 ммоль) и раствор перемешивали при комнатной температуре в течение ночи. Смесь фильтровали и фильтрат концентрировали досуха. Остаток растворяли в EA, промывали два раза насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали при пониженном давлении. Остаток очищали хроматографией на силикагеле (циклогексан/EA, 100:0, затем 85:15) с получением 2,334 г указанного в заголовке соединения в виде бесцветного масла.
Стадия 3: трет-бутиловый эфир (S)-2-метоксикарбонилметил-пиперазин-1-карбоновой кислоты
К соединению со стадии 2 (2,317 г, 5,90 ммоль) в 40 мл MOH добавляли 0,063 г 10% палладия на активированном угле и смесь гидрировали при давлении водорода 4 бар в течение 45 мин при комнатной температуре. Катализатор отфильтровывали и фильтрат упаривали досуха при пониженном давлении. 1,488 г указанного в заголовке соединения получали в виде бледно-серого масла.
Стадия 4: трет-бутиловый эфир (S)-4-[2-(3-Фтор-2-метил-бензил)-1-фенил-индолизин-3-карбонил]-2-метоксикарбонилметил-пиперазин-1-карбоновой кислоты
К раствору соединения примера 1, стадия 3 (1,32 г, 4,19 ммоль) в 20 мл DCM при 0°C добавляли пиридин (0,34 мл, 4,19 ммоль) и затем 20% раствор фосгена в толуоле (2,20 мл, 4,19 ммоль). Смесь перемешивали при комнатной температуре в течение 1,5 часов и затем добавляли по каплям к охлажденному льдом (0°C) раствору соединения стадии 3 (1,189 г, 4,60 ммоль) и триэтиламина (0,58 мл, 4,60 ммоль) в 32 мл DCM. Смесь перемешивали при комнатной температуре в течение ночи, затем разбавляли при помощи 30 мл DCM и промывали два раза 1н. раствором хлористоводородной кислоты, два раза насыщенным раствором гидрокарбоната натрия и два раза насыщенным солевым раствором. Органическую фазу сушили над сульфатом натрия, фильтровали и упаривали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (циклогексан/EA, 80:20, затем 70:30) с получением 1,44 г указанного в заголовке соединения в виде бледно-желтовато-зеленого порошка.
Стадия 5: {(S)-1-трет-Бутоксикарбонил-4-[2-(3-фтор-2-метил-бензил)-1-фенил-индолизин-3-карбонил]-пиперазин-2-ил}-уксусная кислота
К раствору соединения стадии 4 (1,40 г, 2,33 ммоль) в 15,5 мл диоксана добавляли 3,5 мл 1 M водного раствора гидроксида лития и смесь нагревали при 50°C в течение 1 часа. Растворители выпаривали при пониженном давлении и остаток растворяли в 45 мл воды. Раствор охлаждали до 0°C и подкисляли до pH 2 при помощи 5н. раствора хлористоводородной кислоты. Полученную суспензию экстрагировали при помощи EA и объединенные органические фазы промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали досуха. 1,37 г указанного в заголовке соединения получали в виде зеленого твердого вещества, плавящегося при 103-105°C.
Стадия 6: трет-бутиловый эфир (S)-2-[(2-карбамоил-2-метил-пропилкарбамоил)-метил]-4-[2-(3-фтор-2-метил-бензил)-1-фенил-индолизин-3-карбонил]-пиперазин-1-карбоновой кислоты
Соединение со стадии 5 (0,176 г, 0,30 ммоль) растворяли в 2,5 мл безводного DCM при 0°C. Добавляли 3-амино-2,2-диметил-пропионамид (0,044 г, 0,38 ммоль), EDIA (0,13 мл, 0,75 ммоль) и TBTU (0,120 г, 0,38 ммоль) и раствор перемешивали при комнатной температуре в течение 60 часов. Затем добавляли EA (15 мл) и раствор промывали водой, 1н. раствором хлористоводородной кислоты, насыщенным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органическую фазу сушили над сульфатом магния, фильтровали и упаривали при пониженном давлении. Остаток очищали хроматографией на силикагеле (EA/MOH, 100:0, затем 97:5, затем 95:5) с получением 0,188 г указанного в заголовке соединения в виде зеленовато-коричневого воска.
Стадия 7: 3-(2-{(S)-4-[2-(3-Фтор-2-метил-бензил)-1-фенил-индолизин-3-карбонил]-пиперазин-2-ил}-ацетиламино)-2,2-диметил-пропионамид
4н.раствор хлористого водорода в диоксане (0,68 мл, 2,71 ммоль) добавляли к раствору соединения стадии 6 (0,185 г, 0,27 ммоль) в 2,7 мл безводного DCM и смесь перемешивали при комнатной температуре в течение 2,5 часов. После выпаривания растворителей полученное твердое вещество растирали в порошок с безводным диэтиловым эфиром/DCM (9:1) и сушили в вакууме при 45°C с получением 0,131 г указанного в заголовке соединения в форме гидрохлорида 3-(2-{(S)-4-[2-(3-фтор-2-метил-бензил)-1-фенил-индолизин-3-карбонил]-пиперазин-2-ил}-ацетиламино)-2,2-диметил-пропионамида в виде светло-зеленого порошка, имеющего следующие характеристики:
Т.пл.: 174-176°C
ЖХ/МС (способ LC1) m/z=584 [MH+]; Rt=1,04 мин
1H-ЯМР: δ (м.д.) = 1,02 (с, 6H), 1,96 и 2,03 (два с, 3H), 2,60 (д, 2H), 3,20 (м, 5H), 3,52 (м, 3H), 3,95 (м, 2H), 4,11 (м, 2H), 6,61 (м, 1H), 6,9 (м, 4H), 7,32 (м, 3H), 7,40 (м, 3H), 7,96 (дд, 1H), 8,21 and 8,36 (два д, 1H), 9,30 (шир.с, 1H), 9,55 (шир.с, 1H).
α: -7,53° (c=0,425 г/100 мл, MOH)
Пример 8
Метиламид 6-(3-фтор-2-метил-бензил)-5-фенил-7-(пиперазин-1-карбонил)-пирроло[1,2-b]пиридазин-3-карбоновой кислоты
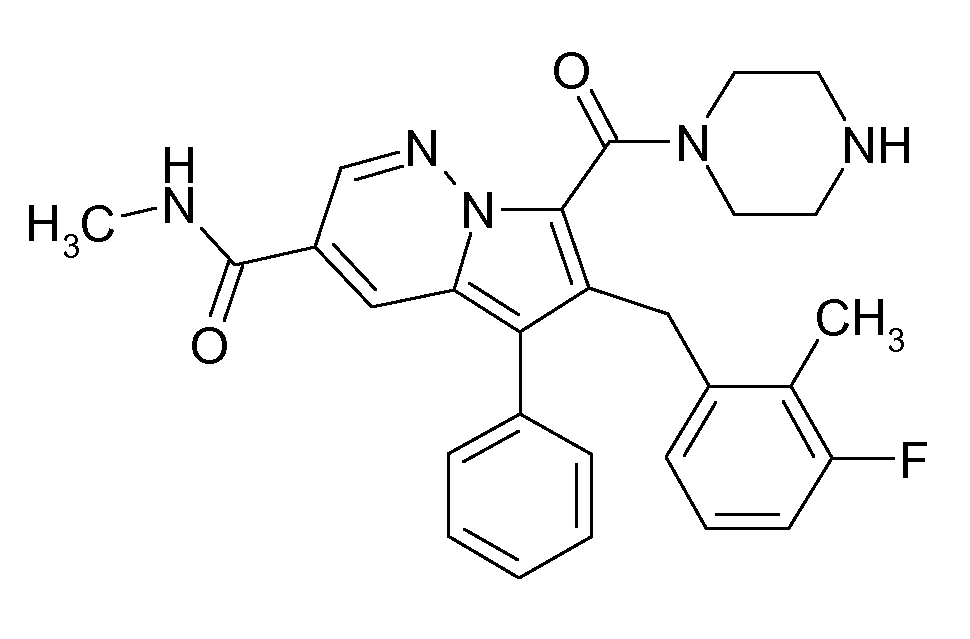
Стадия 1: 1-Фтор-2-метил-3-((E)-2-нитро-этенил)-бензол
Конденсацию по методу Кнёвенагеля осуществляли путем перемешивания 3-фтор-2-метил-бензальдегида (20,721 г, 150 ммоль), нитрометана (48,75 мл, 900 ммоль) и ацетата аммония (34,687 г, 450 ммоль) в 300 мл уксусной кислоты при 115°C в течение 3,5 часов. Смесь упаривали досуха при пониженном давлении и остаток растворяли в 250 мл EA. Раствор промывали водой (250 мл), три раза 1н. раствором гидроксида натрия (125 мл) и насыщенным солевым раствором (125 мл), сушили над сульфатом магния, фильтровали и упаривали досуха. 24,18 г указанного в заголовке соединения получали в виде желтого твердого вещества.
Стадия 2: 1-Фтор-2-метил-3-(2-нитро-этил)-бензол
Аналогично процедуре, описанной в A. K. Sinhababu et al., Tetarhedron Lett. 24 (1983), 227, к раствору соединения стадии 1 (16,85 г, 93,01 ммоль) в изопропаноле (275 мл) и хлороформе (825 мл) добавляли сухой силикагель (110 г) и затем небольшими порциями добавляли борогидрид натрия (7,038 г, 186,02 ммоль). Смесь перемешивали при комнатной температуре в течение 0,5 часа, затем охлаждали до 0°C и гасили путем медленного добавления 10 мл 5н. раствора хлористоводородной кислоты. После перемешивания в течение 10 мин силикагель отфильтровывали и фильтрат концентрировали досуха при пониженном давлении. Остаток растворяли в 150 мл DCM и раствор промывали водой (75 мл) и насыщенным солевым раствором (75 мл), сушили над сульфатом магния, фильтровали и упаривали досуха с получением 15,02 г указанного в заголовке соединения в виде вязкого оранжевого масла.
Стадия 3: 1-Фтор-2-метил-3-(2-нитро-3-фенил-проп-2-ен-1-ил)-бензол
Соединение со стадии 2 (17,951 г, 98 ммоль), бензальдегид (10,43 мл, 102,90 ммоль), н-бутиламин (0,49 мл, 4,90 ммоль) и уксусную кислоту (0,28 мл, 4,90 ммоль) в 49 мл толуола нагревали при 180°C в аппарате Дина-Старка в течение 6 часов. После охлаждения до комнатной температуры смесь упаривали досуха при пониженном давлении. Остаток брали для поглощения в 49 мл толуола, добавляли бензальдегид (10,43 мл, 102,90 ммоль), н-бутиламин (0,49 мл, 4,90 ммоль) и уксусную кислоту (0,28 мл, 4,90 ммоль) и смесь нагревали при 180°C в аппарате Дина-Старка в течение 3 часов. После охлаждения до комнатной температуры смесь упаривали досуха при пониженном давлении. Остаток растирали в порошок с 25 мл диэтилового эфира/пентана (1:1). Твердое вещество отфильтровывали, промывали циклогексаном и растворяли в 75 мл DCM. Раствор сушили при помощи сульфата магния и упаривали досуха с получением 21,57 г указанного в заголовке соединения в виде желтого твердого вещества, плавящегося при 111-112°C.
Стадия 4: этиловый эфир 4-(3-фтор-2-метил-бензил)-3-фенил-1H-пиррол-2-карбоновой кислоты
Соединение со стадии 3 (21,45 г, 79,07 ммоль) и этилизоцианоацетат (10,37 мл, 94,88 ммоль) растворяли в 225 мл безводного ТГФ в атмосфере азота при 5°C и добавляли по каплям DBU (14,16 мл, 94,88 ммоль). Раствор перемешивали при комнатной температуре в течение 18 часов. Затем добавляли 200 мл воды и 200 мл EA. Органическую фазу промывали 1н. раствором хлористоводородной кислоты (200 мл) и насыщенным солевым раствором (150 мл), сушили над сульфатом магния, фильтровали и упаривали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (циклогексан/EA, 90:10, затем 85:15) с получением 16,68 г указанного в заголовке соединения в виде желтого твердого вещества, плавящегося при 120-122°C.
Стадия 5: этиловый эфир 1-амино-4-(3-фтор-2-метил-бензил)-3-фенил-1H-пиррол-2-карбоновой кислоты
К раствору соединения стадии 4 (6,748 г, 20,00 ммоль) в 60 мл безводного DMF в атмосфере азота при 0°C добавляли гидрид натрия (60% в минеральном масле, 0,960 г, 24 ммоль) небольшими порциями. После перемешивания в течение 10 мин при 0°C смеси давали нагреться до комнатной температуры в течение 15 минут. После охлаждения снова до 0°C добавляли небольшими порциями O-(2,4-динитро-фенил)-гидроксиламин (см. C. Legault et al., J. Org. Chem. 68 (2003), 7119; P. Н. Boyle et al., ARKIVOC (2003) (vii), 67; 4,779 г, 24,00 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли воду (250 мл) и EA (250 мл) и органическую фазу промывали два раза, по 125 мл каждый раз, 1н. раствором гидроксида натрия и 125 мл насыщенного солевого раствора, сушили над сульфатом магния, фильтровали и упаривали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле, сначала элюируя смесью циклогексан/DCM (40:60, затем 20:80, затем 0:100), затем смесью DCM/EA (97,5:2,5, затем 95:5) с получением 6,33 г указанного в заголовке соединения в виде бежевого твердого вещества, плавящегося при 87-88°C.
Стадия 6: этиловый эфир 6-(3-фтор-2-метил-бензил)-4-оксо-5-фенил-1,4-дигидро-пирроло[1,2-b]пиридазин-3-карбоновой кислоты
К раствору соединения стадии 5 (6,290 г, 17,85 ммоль) в 180 мл безводного DMF в атмосфере азота добавляли этил 3,3-диэтокси-пропаноат (10,42 мл, 53,55 ммоль) и гидрат п-толуолсульфоновой кислоты (0,509 г, 2,68 ммоль) и раствор нагревали при 90°C в течение 1,5 часов. После охлаждения до 60°C добавляли по каплям DBU (13,32 мл, 89,24 ммоль) и смесь перемешивали в течение 45 мин при 60°C. Раствор затем охлаждали до комнатной температуры, добавляли воду (600 мл) и раствор экстрагировали четыре раза при помощи EA (200 мл). Объединенные органические фазы промывали 0,5н.раствором хлористоводородной кислоты (300 мл) и насыщенным солевым раствором (300 мл), сушили над сульфатом магния, фильтровали и упаривали досуха при пониженном давлении. Остаток растирали в порошок с циклогексаном несколько раз и сушили в вакууме при 50°C. 5,43 г указанного в заголовке соединения получали в виде коричневого твердого вещества, плавящегося при 176-177°C.
Стадия 7: этиловый эфир 4-хлор-6-(3-фтор-2-метил-бензил)-7-формил-5-фенил-пирроло[1,2-b]пиридазин-3-карбоновой кислоты
Оксихлорид фосфора (24,5 мл, 268,00 ммоль) медленно добавляли к соединению со стадии 6 (5,42 г, 13,40 ммоль) с последующим добавлением безводного DMF (5,18 мл, 67 ммоль). Смесь нагревали при 60°C в течение 1 часа и затем концентрировали досуха. Остаток растворяли в DCM (200 мл) и раствор добавляли по каплям при комнатной температуре к насыщенному раствору гидрокарбоната натрия. Смесь перемешивали при комнатной температуре в течение 1 часа, затем добавляли воду (50 мл) и DCM (200 мл), фазы разделяли и водную фазу экстрагировали при помощи DCM (100 мл). Объединенные органические фазы промывали насыщенным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали досуха. Остаток очищали хроматографией на силикагеле (циклогексан/EA, 85:15, затем 80:20) с получением 5,19 г указанного в заголовке соединения в виде желтого твердого вещества, плавящегося при 110-111°C.
Стадия 8: 4-Хлор-3-этоксикарбонил-6-(3-фтор-2-метил-бензил)-5-фенил-пирроло[1,2-b]пиридазин-7-карбоновая кислота
Соединение со стадии 7 (5,15 г, 11,42 ммоль) суспендировали в трет-бутаноле (90 мл) и добавляли 2 M раствор изобутена в ТГФ (34,27 мл, 68,53 ммоль), раствор дигидрофосфата натрия (4,111 г, 34,27 ммоль) в 25 мл воды и хлорит натрия (1,937 г, 17,13 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Затем добавляли насыщенный солевой раствор (200 мл), воду (50 мл), EA (400 мл) и DCM (100 мл) и органическую фазу отделяли, сушили над сульфатом магния, фильтровали и упаривали досуха. Полученное твердое вещество растирали в порошок с циклогексаном несколько раз и сушили в вакууме при 50°C. 5,23 г указанного в заголовке соединения получали в виде желтого твердого вещества, плавящегося при 193-194°C.
Стадия 9: этиловый эфир 7-(4-трет-бутоксикарбонил-пиперазин-1-карбонил)-4-хлор-6-(3-фтор-2-метил-бензил)-5-фенил-пирроло[1,2-b]пиридазин-3-карбоновой кислоты
Соединение со стадии 8 (2,335 г, 5,00 ммоль), 1-трет-бутоксикарбонил-пиперазин (1,024 г, 5,50 ммоль), EDIA (2,18 мл, 12,50 ммоль) и TBTU (1,766 г, 5,50 ммоль) в 50 мл безводного DCM перемешивали при комнатной температуре в течение 1 часа. Раствор затем промывали 0,5н.раствором хлористоводородной кислоты (75 мл) и водную фазу экстрагировали при помощи DCM (25 мл). Объединенные органические фазы промывали насыщенным раствором гидрокарбоната натрия (50 мл) и насыщенным солевым раствором (50 мл), сушили над сульфатом магния, фильтровали и упаривали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (циклогексан/EA, 80:20, затем 75:25) с получением 3,01 г указанного в заголовке соединения в виде желтого твердого вещества, плавящегося при 88-90°C.
Стадия 10: этиловый эфир 7-(4-трет-бутоксикарбонил-пиперазин-1-карбонил)-6-(3-фтор-2-метил-бензил)-5-фенил-пирроло[1,2-b]пиридазин-3-карбоновой кислоты
Соединение со стадии 9 (1,880 г, 2,96 ммоль) в 29,6 мл этанола/ТГФ (1:1) гидрировали при давлении водорода 2 бар в течение 3,5 часов при комнатной температуре в присутствии 0,315 г 10% палладия на активированном угле и триэтиламина (0,62 мл, 4,44 ммоль). Катализатор отфильтровывали и фильтрат промывали насыщенным солевым раствором (50 мл), сушили при помощи сульфата магния, фильтровали и концентрировали досуха при пониженном давлении. 1,67 г указанного в заголовке соединения получали в виде желтого твердого вещества.
Стадия 11: 7-(4-трет-Бутоксикарбонил-пиперазин-1-карбонил)-6-(3-фтор-2-метил-бензил)-5-фенил-пирроло[1,2-b]пиридазин-3-карбоновая кислота
Соединение со стадии 10 (1,680 г, 2,80 ммоль) растворяли в 20 мл диоксана и добавляли 1 M водный раствор гидроксида лития (4,30 мл, 4,30 ммоль). После перемешивания в течение 45 мин при комнатной температуре диоксан выпаривали при пониженном давлении и добавляли 50 мл воды. Смесь подкисляли до pH 2 при помощи 5н. раствора хлористоводородной кислоты. Твердое вещество отфильтровывали, промывали водой и растворяли в EA (100 мл). Раствор промывали водой (50 мл) и насыщенным солевым раствором (50 мл), сушили над сульфатом магния, фильтровали и упаривали досуха при пониженном давлении с получением 1,64 г указанного в заголовке соединения, которое непосредственно использовали на следующей стадии.
Стадия 12: трет-бутиловый эфир 4-[6-(3-фтор-2-метил-бензил)-3-метилкарбамоил-5-фенил-пирроло[1,2-b]пиридазин-7-карбонил]-пиперазин-1-карбоновой кислоты
К раствору соединения, полученного на стадии 11 (0,286 г, 0,50 ммоль), в 5 мл DCM добавляли EDIA (0,26 мл, 1,50 ммоль), гидрохлорид метиламина (0,051 г, 0,75 ммоль), 2 M раствор метиламина в ТГФ (2,5 мл, 0,50 ммоль) и TBTU (0,107 г, 0,57 ммоль). Раствор перемешивали при комнатной температуре в течение 18 часов, затем разбавляли при помощи DCM (15 мл), промывали раствором 0,5 M хлористоводородной кислоты, насыщенным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и упаривали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (циклогексан/EA, 30:70, затем 20:80, затем 10:90) с получением 0,153 г указанного в заголовке соединения в виде желтого твердого вещества, плавящегося при 153-154°C.
Стадия 13: метиламид 6-(3-фтор-2-метил-бензил)-5-фенил-7-(пиперазин-1-карбонил)-пирроло[1,2-b]пиридазин-3-карбоновой кислоты
К раствору соединения стадии 12 (0,150 г, 0,260 ммоль) в 2,6 мл DCM добавляли 4н. раствор хлористого водорода в диоксане (0,64 мл, 2,56 ммоль). Смесь перемешивали при комнатной температуре в течение 5 часов и затем упаривали досуха. Полученное твердое вещество растирали в порошок с диэтиловым эфиром несколько раз и сушили в вакууме при 50°C с получением 0,118 г указанного в заголовке соединения в форме метиламида 6-(3-фтор-2-метил-бензил)-5-фенил-7-(пиперазин-1-карбонил)-пирроло[1,2-b]пиридазин-3-карбоновой кислоты гидрохлорида в виде бледно-оранжевого твердого вещества, имеющего следующие характеристики:
Т.пл.: 208-210°C
ЖХ/МС (способ LC1): m/z=486 [MH+]; Rt=0,93 мин
1H-ЯМР: δ (м.д.) = 1,85 (с, 3H), 2,71 (д, 3H), 2,92 (м, 4H), 3,49 (с, 2H), 3,65 (м, 2H), 4,02 (м, 2H), 6,69 (д, 1H), 6,88 (дд, 1H), 6,98 (дд, 1H), 7,37 (м, 3H), 7,45 (м, 2H), 8,22 (с, 1H), 8,60 (м, 2H), 9,06 (шир.с, 2H).
Пример 9
[6-(3-Фтор-2-метил-бензил)-5-фенил-пирроло[1,2-b]пиридазин-7-ил]-пиперазин-1-ил-метанон
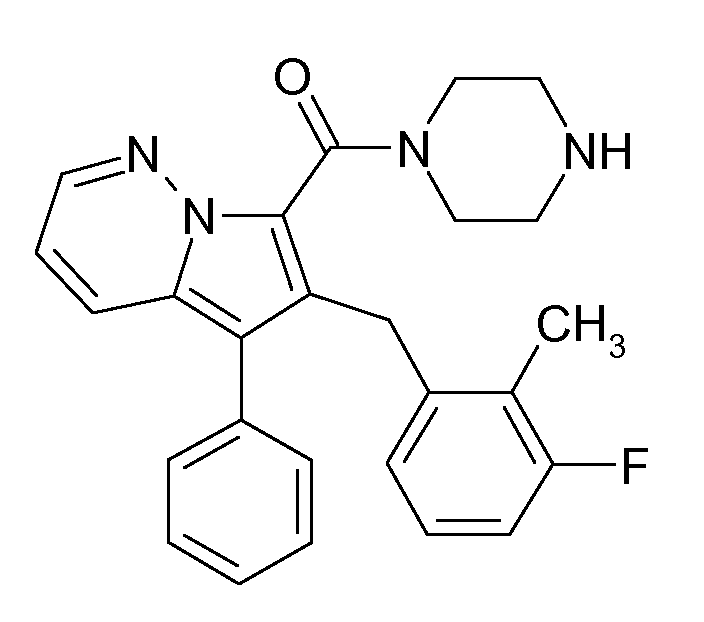
Смесь соединения примера 8, стадия 11 (0,057 г, 0,10 ммоль), медного порошка (0,007 г, 0,10 ммоль) и хинолина (0,40 мл) погружали в масляную баню, предварительно нагретую до 170°C, на 1,25 часа. После охлаждения до комнатной температуры и выпаривания летучих веществ при пониженном давлении остаток растворяли в EA (10 мл) и раствор промывали водой и насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали досуха. Полученное оранжевое масло очищали хроматографией на силикагеле (DCM/MOH, 100:0, затем 90:10). Продукт растворяли в 2 мл DCM и добавляли 4н. раствор хлористого водорода в диоксане (0,25 мл, 0,98 ммоль). После перемешивания при комнатной температуре в течение ночи раствор упаривали досуха. Полученное твердое вещество растирали в порошок с диэтиловым эфиром несколько раз и сушили в вакууме при 50°C с получением 0,016 г указанного в заголовке соединения в форме [6-(3-фтор-2-метил-бензил)-5-фенил-пирроло[1,2-b]пиридазин-7-ил]-пиперазин-1-ил-метанон гидрохлорида в виде оранжевого твердого вещества, имеющего следующие характеристики:
Т.пл.: 140-142°C
ЖХ/МС (способ LC1): m/z=429 [MH+]; Rt=1,25 мин
1H-ЯМР: δ (м.д.) = 1,89 (с, 3H), 2,98 (м, 3H), 3,23 (с, 2H), 3,62 (м, 4H), 4,04 (м, 4H), 6,70 (д, 1H), 6,78 (м, 1H), 6,90 (т, 1H), 6,99 (дд, 1H), 7,32 (м, 3H), 7,41 (м, 2H), 7,89 (дд, 1H), 8,27 (д, 1H), 8,93 (шир.с, 2H).
Пример 10
[6-(3-Фтор-2-метил-бензил)-3-гидрокси-5-фенил-пирроло[1,2-b]пиридазин-7-ил]-пиперазин-1-ил-метанон
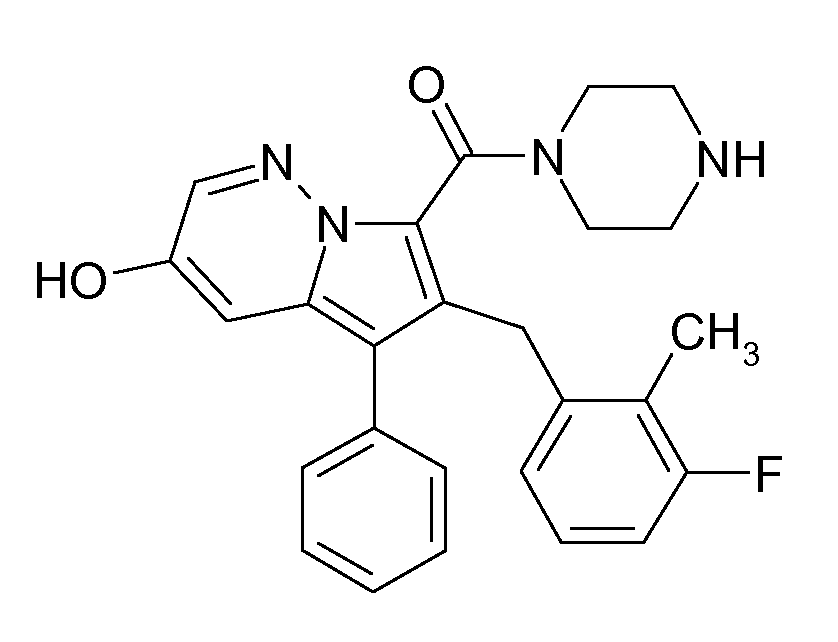
Стадия 1: трет-бутиловый эфир 4-[6-(3-фтор-2-метил-бензил)-3-(N-метокси-N-метил-карбамоил)-5-фенил-пирроло[1,2-b]пиридазин-7-карбонил]-пиперазин-1-карбоновой кислоты
Раствор соединения примера 8, стадия 11 (1,002 г, 1,75 ммоль), гидрохлорида N,O-диметилгидроксиламина (0,213 г, 2,19 ммоль), EDIA (0,76 мл, 4,38 ммоль) и TBTU (0,702 г, 2,19 ммоль) в 15 мл безводного DCM перемешивали при комнатной температуре в течение 4 часов. Затем добавляли DCM (15 мл) и раствор промывали 0,5н.раствором хлористоводородной кислоты (30 мл), насыщенным раствором гидрокарбоната натрия (15 мл) и насыщенным солевым раствором (15 мл), сушили над сульфатом магния, фильтровали и упаривали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (циклогексан/EA, 50:50, затем 40:60, затем 35:65) с получением 0,99 г указанного в заголовке соединения в виде желтого масла.
Стадия 2: трет-бутиловый эфир 4-[6-(3-фтор-2-метил-бензил)-3-формил-5-фенил-пирроло[1,2-b]пиридазин-7-карбонил]-пиперазин-1-карбоновой кислоты
К раствору соединения стадии 1 (0,990 г, 1,61 ммоль) в 11 мл безводного ТГФ, охлажденному до 0°C, в атмосфере азота добавляли 1 M раствор три-трет-бутокси-алюмогидрида лития в ТГФ. Смесь перемешивали при 0-5°C в течение 3,5 часов. Затем добавляли 0,5 M водный раствор гидросульфата калия (20 мл), смесь интенсивно перемешивали в течение 1 минуты и затем экстрагировали два раза при помощи EA (30 мл). Объединенные органические фазы промывали насыщенным раствором гидрокарбоната натрия (20 мл) и насыщенным солевым раствором (40 мл), сушили над сульфатом магния и упаривали досуха. Остаток очищали хроматографией на силикагеле (циклогексан/EA, 70:30, затем 65:35) с получением 0,363 г указанного в заголовке соединения в виде желтого твердого вещества, плавящегося при 208-209°C.
Стадия 3: трет-бутиловый эфир 4-[6-(3-Фтор-2-метил-бензил)-3-гидрокси-5-фенил-пирроло[1,2-b]пиридазин-7-карбонил]-пиперазин-1-карбоновой кислоты
К раствору соединения стадии 2 (0,395 г, 0,71 ммоль) в 7,1 мл DCM добавляли 77% раствор 3-хлор-пербензойной кислоты (0,239 г, 1,06 ммоль) небольшими порциями и раствор перемешивали при комнатной температуре в течение 2,75 часов. Затем добавляли DCM (15 мл) и насыщенный раствор гидрокарбоната натрия (15 мл) и водную фазу отделяли и экстрагировали при помощи DCM (15 мл). Объединенные органические фазы промывали насыщенным солевым раствором (30 мл), сушили над сульфатом магния, фильтровали и упаривали досуха при пониженном давлении. Полученное масло растворяли в 14 мл MOH и перемешивали в присутствии карбоната калия (0,147 г, 1,06 ммоль) при комнатной температуре в течение 15 минут. Затем добавляли воду (15 мл) и смесь подкисляли до pH 5 путем добавления по каплям 1 M водного раствора гидросульфата калия. Раствор затем экстрагировали два раза при помощи EA, по 15 мл каждый раз, и объединенные органические фазы промывали насыщенным солевым раствором (15 мл), сушили над сульфатом магния, фильтровали и упаривали досуха. Остаток очищали хроматографией на силикагеле (DCM/EA, 80:20, затем 60:40, затем 40:60) с получением 0,180 г указанного в заголовке соединения в виде желтого твердого вещества, плавящегося при 165°C.
Стадия 4: [6-(3-Фтор-2-метил-бензил)-3-гидрокси-5-фенил-пирроло[1,2-b]пиридазин-7-ил]-пиперазин-1-ил-метанон
Соединение со стадии 3 (0,109 г, 0,20 ммоль) растворяли в 3 мл безводного DCM и добавляли 4 M раствор хлористого водорода в диоксане (1,0 мл, 4,0 ммоль). После перемешивания при комнатной температуре в течение ночи смесь упаривали досуха при пониженном давлении. Полученное твердое вещество растирали в порошок с диэтиловым эфиром несколько раз и сушили в вакууме при 55°C с получением 0,073 г указанного в заголовке соединения в форме [6-(3-фтор-2-метил-бензил)-3-гидрокси-5-фенил-пирроло[1,2-b]пиридазин-7-ил]-пиперазин-1-ил-метанон гидрохлорида в виде зеленовато-желтого твердого вещества, имеющего следующие характеристики:
Т.пл.: 206-208°C
ЖХ/МС (способ LC1): m/z=445 [MH+]; Rt=0,96 мин
1H-ЯМР: δ (м.д.) = 2,00 (с, 3H), 2,91 (м, 4H), 3,46 (м, 4H), 4,08 (с, 2H), 6,77 (д, 1H), 6,96 (м, 1H), 7,05 (дд, 1H), 7,10 (с, 1H), 7,34 (м, 2H), 7,46 (м, 2H), 8,15 (с, 1H), 9,11 (шир.с, 2H), 10,42 (шир.с, 1H)
Пример 11
[2-(3-Фтор-2-метил-бензил)-3-фенил-индолизин-1-ил]-пиперазин-1-ил-метанон
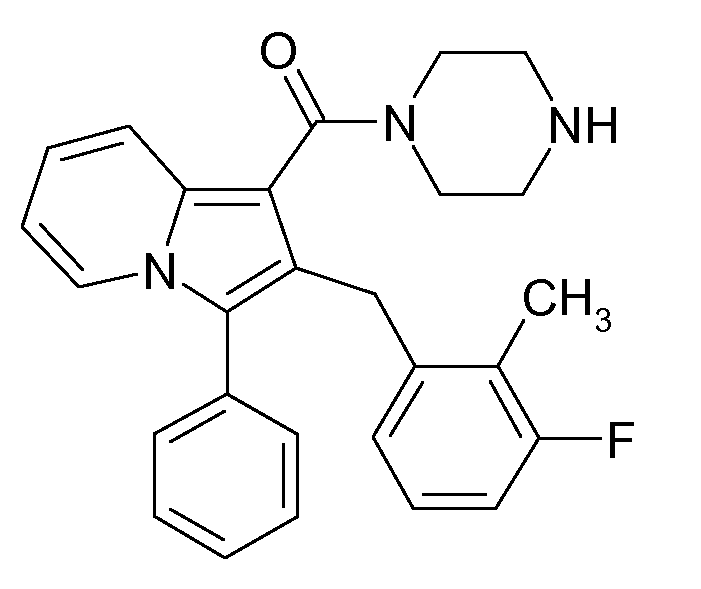
Стадия 1: 1-Бром-3-(3-фтор-2-метил-фенил)-пропан-2-он
Аналогично процедуре, описанной в Н. Y. Choi et al., Org. Lett. 5 (2003), 411, раствор брома (8,46 г, 52,95 ммоль) в уксусной кислоте (12 мл) добавляли при 0°C к раствору 1-(3-фтор-2-метил-фенил)-пропан-2-она (4,00 г, 24,07 ммоль) в уксусной кислоте (4 мл) и 33% раствору бромистого водорода в уксусной кислоте (4 мл). Смесь нагревали до комнатной температуры и перемешивали в течение 12 часов. Затем добавляли ацетон и смесь перемешивали в течение 24 часов. После упаривания при пониженном давлении остаток экстрагировали несколько раз при помощи DCM. Объединенные экстракты сушили над сульфатом натрия и упаривали досуха. Остаток очищали при помощи препаративной ВЭЖХ с получением 4,10 г указанного в заголовке соединения в виде масла.
ЖХ/МС (способ LC3): m/z=245 [M+]
Стадия 2: метиловый эфир 2-(3-фтор-2-метил-бензил)-индолизин-1-карбоновой кислоты
Соединение со стадии 1 (3,89 г, 15,88 ммоль), метиловый эфир пиридин-2-илуксусной кислоты (1,65 г, 10,92 ммоль) и гидрокарбонат натрия (4,59 г, 54,60 ммоль) в бутан-2-оне (43 мл) нагревали при кипячении с обратным холодильником в течение 24 часов. Твердое вещество удаляли фильтрованием и фильтрат концентрировали. Остаток очищали хроматографией на силикагеле (HEP/EA) с получением 1,99 г указанного в заголовке соединения.
ЖХ/МС (способ LC4): m/z=298 [MH+]
Стадия 3: метиловый эфир 2-(3-фтор-2-метил-бензил)-3-фенил-индолизин-1-карбоновой кислоты
Соединение со стадии 2 (1,79 г, 6,02 ммоль), иод-бензол (1,47 г, 7,22 ммоль), ацетат калия (1,18 г, 12,03 ммоль) и бис(трифенилфосфин)палладий(II) хлорид (844 мг, 1,20 ммоль) в NMP нагревали при 100°C в течение 10 минут в атмосфере аргона. Затем добавляли воду (844 мг, 36,10 ммоль) и нагревание продолжали в течение 12 часов. Смесь охлаждали до комнатной температуры, разбавляли при помощи DCM и промывали водой. Органическую фазу сушили над сульфатом натрия и упаривали. Остаток очищали хроматографией на силикагеле (HEP/EA) с получением 729 мг указанного в заголовке соединения. ЖХ/МС (способ LC4): m/z=374 [MH+]
Стадия 4: 2-(3-Фтор-2-метил-бензил)-3-фенил-индолизин-1-карбоновая кислота
Соединение со стадии 3 (250 мг, 0,67 ммоль) растворяли в диоксане (10 мл) и обрабатывали при помощи 10 мл водного 10н.раствора гидроксида натрия. Смесь нагревали до 90°C в течение 12 часов, охлаждали до комнатной температуры и нейтрализовали разбавленной хлористоводородной кислотой. Водную фазу экстрагировали при помощи DCM и объединенные органические фазы сушили над сульфатом натрия и фильтровали. Раствор упаривали с получением 258 мг неочищенного указанного в заголовке соединения, которое использовали на следующей стадии без очистки.
ЖХ/МС (способ LC4): m/z=360 [MH+]
Стадия 5: трет-бутиловый эфир 4-[2-(3-фтор-2-метил-бензил)-3-фенил-индолизин-1-карбонил]-пиперазин-1-карбоновой кислоты
К раствору неочищенного соединения, полученного на стадии 4 (125 мг, 0,35 ммоль), 1-трет-бутоксикарбонил-пиперазин (67,9 мг, 0,37 ммоль), гидрохлорида N-этил-N'-(3-диметиламинопропил)карбодиимида (73,4 мг, 0,38 ммоль) и 1-гидроксибензотриазола (61,3 мг, 0,40 ммоль) в DMF (2 мл) добавляли N-метил-морфолин (0,115 мл, 1,04 ммоль). Смесь перемешивали при комнатной температуре в течение ночи, затем гасили водой и экстрагировали при помощи EA. Органический слой отделяли, сушили над сульфатом натрия, фильтровали и упаривали. Остаток очищали хроматографией на силикагеле (HEP/EA) с получением 158 мг указанного в заголовке соединения. ЖХ/МС (способ LC4): m/z=528 [MH+]
Стадия 6: [2-(3-Фтор-2-метил-бензил)-3-фенил-индолизин-1-ил]-пиперазин-1-ил-метанон
Раствор соединения стадии 5 (158 мг, 299 ммоль) в DCM (8 мл) и TFA (4 мл) перемешивали при комнатной температуре в течение 2 часов. Растворители выпаривали и остаток очищали при помощи препаративной ВЭЖХ. Фракции, содержащие указанное в заголовке соединение, объединяли и лиофилизировали в течение ночи. Полученное твердое вещество растворяли в небольшом количестве MOH, смешивали с 0,1н раствором хлористоводородной кислоты и смесь лиофилизировали в течение ночи с получением 108 мг указанного в заголовке соединения в форме [2-(3-фтор-2-метил-бензил)-3-фенил-индолизин-1-ил]-пиперазин-1-ил-метанон гидрохлорида, имеющего следующие характеристики:
ЖХ/МС (способ LC4): m/z=428,20 [MH+]; Rt=0,82 мин
1H-ЯМР (500 МГц, DMSO-D6): δ (м.д.) = 1,93 (с, 3H), 2,56 (м, 6H), 3,10 (м, 2H), 3,47 (м, 2H), 3,59 (м, 2H), 4,01 (м, 2H), 6,71 (м, 2H), 6,92 (м, 1H), 7,01 (м, 2H), 7,47 (м, 4H), 7,58 (м, 2H), 8,06 (м, 1H), 9,05 (м, 1H), 9,28 (м, 1H).
Пример 12
[7-Бром-2-(3-фтор-2-метил-бензил)-3-фенил-индолизин-1-ил]-пиперазин-1-ил-метанон
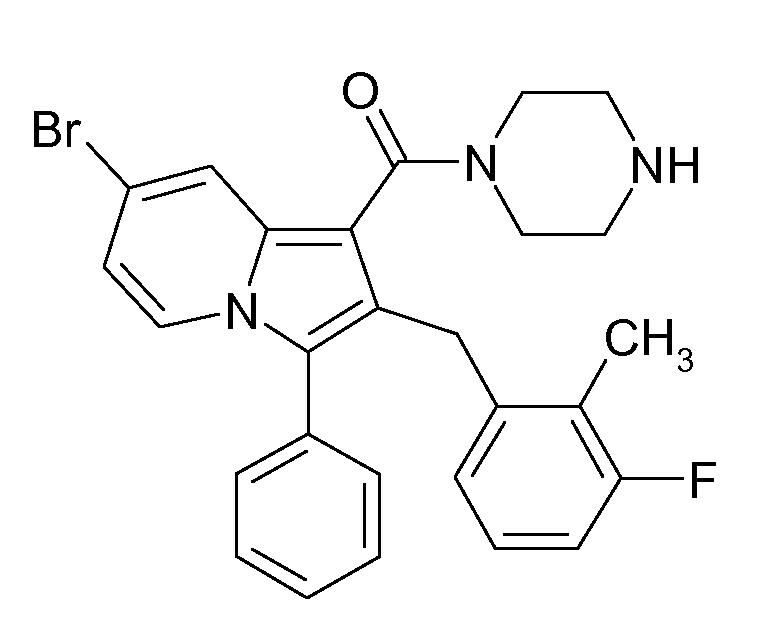
Стадия 1: Метиловый эфир 7-бром-2-(3-фтор-2-метил-бензил)-3-фенил-индолизин-1-карбоновой кислоты
Соединение примера 11, стадия 3, (550 мг, 1,47 ммоль) растворяли в смеси бензола (15 мл) и хлороформа (15 мл) и обрабатывали при комнатной температуре бромом (235 мг, 1,47 ммоль) при перемешивании. Через 2 часа добавляли DBU (224 мг, 1,47 ммоль) и смесь перемешивали в течение 18 часов при комнатной температуре. Растворитель удаляли в вакууме и остаток очищали хроматографией на силикагеле (HEP/EA). Получали 460 мг указанного в заголовке соединения.
ЖХ/МС (способ LC4): m/z=452 [M+]
Стадия 2: 7-Бром-2-(3-фтор-2-метил-бензил)-3-фенил-индолизин-1-карбоновая кислота
Соединение со стадии 1 (450 мг, 0,99 ммоль) растворяли в 1,4-диоксане (10 мл) и обрабатывали при помощи 10 мл водного 10н.раствора гидроксида натрия. Смесь нагревали до 90°C в течение 12 часов, охлаждали до комнатной температуры и нейтрализовали разбавленной хлористоводородной кислотой. Водную фазу экстрагировали при помощи DCM и объединенные органические фазы сушили над сульфатом натрия. Неочищенный указанный в заголовке продукт, полученный после упаривания, использовали без очистки на следующей стадии.
ЖХ/МС (способ LC4): m/z=439 [MH+]
Стадия 3: трет-бутиловый эфир 4-[7-бром-2-(3-фтор-2-метил-бензил)-3-фенил-индолизин-1-карбонил]-пиперазин-1-карбоновой кислоты
К раствору неочищенного соединения, полученного на стадии 2 (219 мг, 0,50 ммоль), 1-трет-бутоксикарбонил-пиперазина (98 мг, 0,55 ммоль), гидрохлорида N-этил-N'-(3-диметиламинопропил)карбодиимида (105 мг, 0,55 ммоль) и 1-гидроксибензотриазола (88 мг, 0,58 ммоль) в DMF (5 мл) добавляли N-метил-морфолин (330 мкл, 3,00 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Смесь гасили водой и экстрагировали при помощи EA. Органический слой отделяли, сушили над сульфатом натрия, фильтровали и упаривали. Остаток очищали хроматографией на силикагеле (HEP/EA). Получали 300 мг указанного в заголовке соединения.
ЖХ/МС (способ LC4): m/z=607 [MH+]
Стадия 4: [7-Бром-2-(3-фтор-2-метил-бензил)-3-фенил-индолизин-1-ил]-пиперазин-1-ил-метанон
Раствор соединения стадии 3 (70 мг, 115 мкмоль) в DCM (4 мл) и TFA (2 мл) перемешивали при комнатной температуре в течение 2 часов. Растворители выпаривали и полученное твердое вещество очищали при помощи препаративной ВЭЖХ. Фракции, содержащие указанное в заголовке соединение, объединяли и лиофилизировали в течение ночи. Полученное твердое вещество растворяли в небольшом количестве MOH, смешивали с 0,1н раствором хлористоводородной кислоты и смесь лиофилизировали в течение ночи с получением 15 мг указанного в заголовке соединения в форме [7-бром-2-(3-фтор-2-метил-бензил)-3-фенил-индолизин-1-ил]-пиперазин-1-ил-метанон гидрохлорида, имеющего следующие характеристики:
ЖХ/МС (способ LC4): m/z=508,2 [MH+]; Rt=0,85 мин
1H-ЯМР (500 МГц, DMSO-D6): δ (м.д.) = 1,92 (с, 3H), 3,13 (м, 2H), 3,58 (м, 2H), 4,01 (м, 2H), 6,71 (м, 1H), 6,79 (м, 1H), 6,93 (м, 1H), 7,01 (м, 1H), 7,46 (м, 3H), 7,58 (м, 2H), 7,74 (м, 1H), 7,97 (м, 1H), 9,01 (м, 2H).
Аналогично получению соединений примеров, описанных выше, были получены соединения примеров 13-46.
Пример 13
метиламид 2-(3-фтор-2-метил-бензил)-1-фенил-3-(пиперазин-1-карбонил)-индолизин-6-карбоновой кислоты
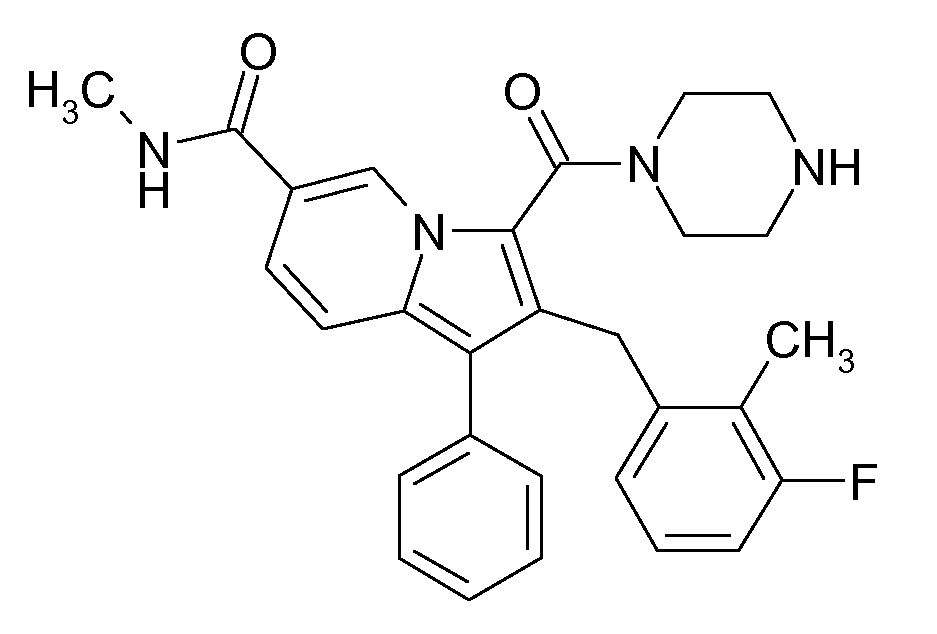
Указанное в заголовке соединение было получено в форме метиламида 2-(3-фтор-2-метил-бензил)-1-фенил-3-(пиперазин-1-карбонил]-индолизин-6-карбоновой кислоты, гидрохлорида.
Т.пл.: 273°C
ЖХ/МС (способ LC1): m/z=485; Rt=0,99 мин
Пример 14
(2-Бензил-3-фенил-индолизин-1-ил)-пиперазин-1-ил-метанон
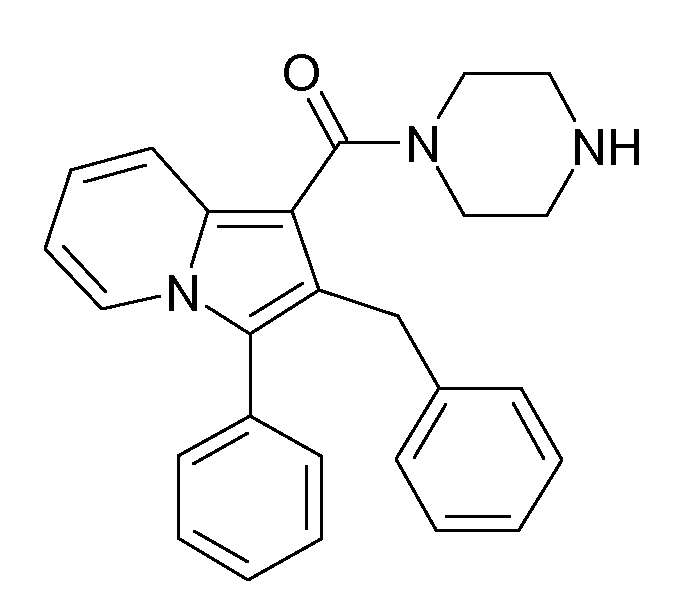
Указанное в заголовке соединение было получено в форме (2-бензил-3-фенил-индолизин-1-ил)-пиперазин-1-ил-метанон гидрохлорида.
ЖХ/МС (способ LC3): m/z=396,20; Rt=1,09 мин
Пример 15
[2-(3-Фтор-2-метил-бензил)-3-фенил-индолизин-1-ил)-((S)-3-метил-пиперазин-1-ил)-метанон
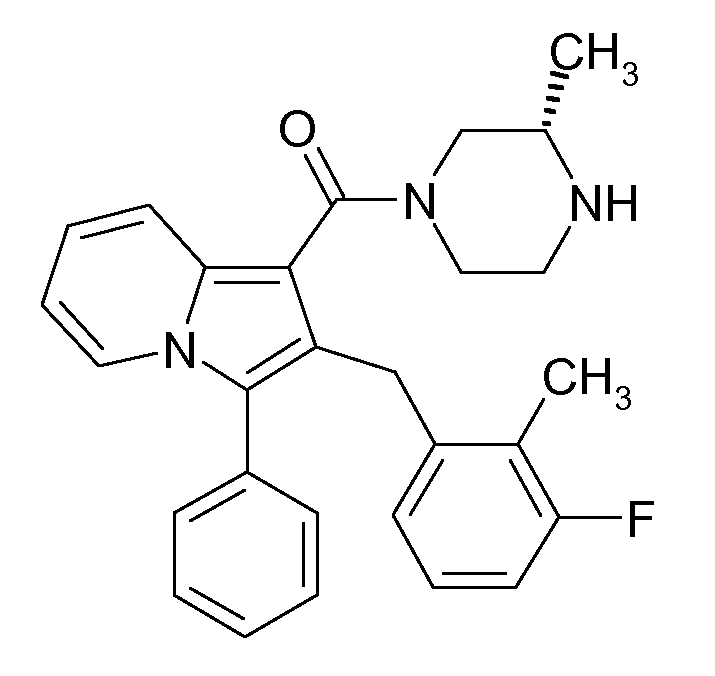
Указанное в заголовке соединение было получено в форме [2-(3-фтор-2-метил-бензил)-3-фенил-индолизин-1-ил)-((S)-3-метил-пиперазин-1-ил)-метанон гидрохлорида.
ЖХ/МС (способ LC4): m/z=442,20; Rt=0,83 мин
Пример 16
[7-Бром-2-(3-фтор-2-метил-бензил)-3-фенил-индолизин-1-ил)-((S)-3-метил-пиперазин-1-ил)-метанон
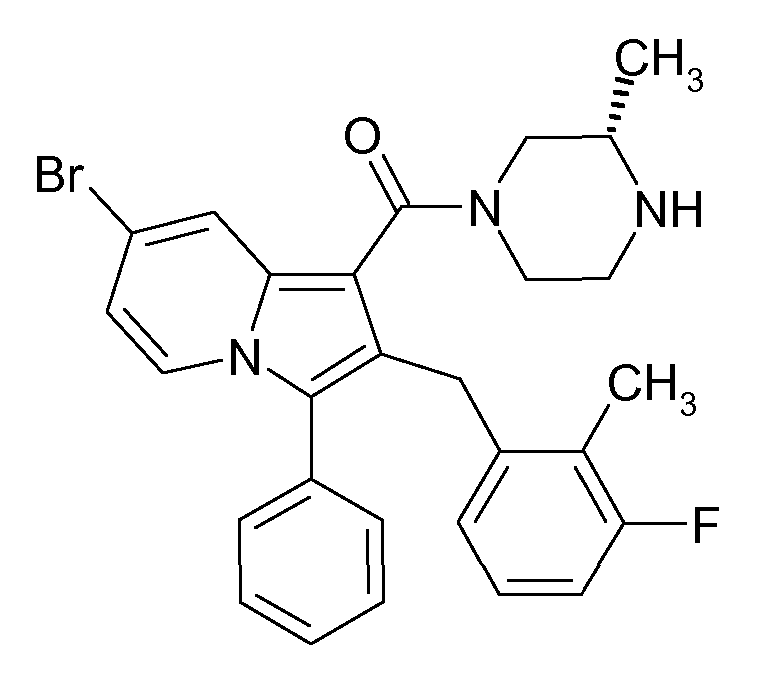
Указанное в заголовке соединение было получено в форме [7-бром-2-(3-фтор-2-метил-бензил)-3-фенил-индолизин-1-ил)-((S)-3-метил-пиперазин-1-ил)-метанон гидрохлорида.
ЖХ/МС (способ LC4): m/z=521; Rt=0,88 мин
Пример 17
[2-(2,6-Диметил-бензил)-1-фенил-индолизин-3-ил)-((R)-3-метил-пиперазин-1-ил)-метанон
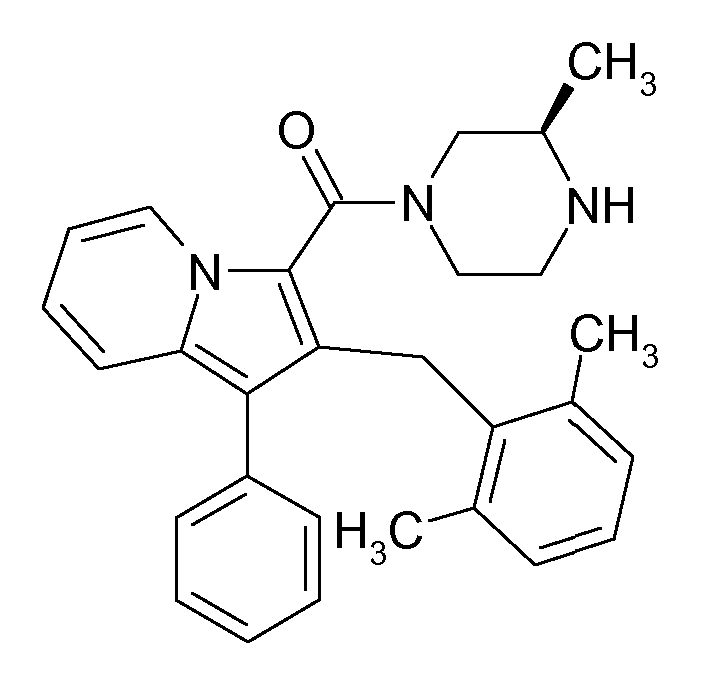
Указанное в заголовке соединение было получено в форме [2-(2,6-диметил-бензил)-1-фенил-индолизин-3-ил)-((R)-3-метил-пиперазин-1-ил)-метанон гидрохлорида.
Т.пл.: 302°C
ЖХ/МС (способ LC1): m/z=438; Rt=4,01 мин
Соединения примеров 18-21, перечисленные в Таблице 1, представляют собой соединения формулы Iv. Они были получены в форме гидрохлорида. Они могут быть названы как [1-(необязательно замещенный фенил)-2-(замещенный бензил)-индолизин-3-ил]-пиперазин-1-ил-метанон, допуская модификации в соответствии с правилами номенклатуры, например, как [2-(3-фтор-2-метил-бензил)-1-(3-фтор-фенил)-индолизин-3-ил]-пиперазин-1-ил-метанона в случае примера 20.

|
Соединения примеров 22-46, перечисленные в Таблице 2, представляют собой соединения формулы Iw. Они были получены в форме гидрохлорида или, в случае примеров 32, 33 и 37, в форме дигидрохлорида. Они могут быть названы как [2-(3-фтор-2-метил-бензил)-(необязательно 7-R40-замещенный)-1-фенил-индолизин-3-ил]-R90-метанон в случае, когда группа Y представляет собой CH, или как [6-(3-фтор-2-метил-бензил)-(необязательно 3- R40-замещенный)-5-фенил-пирроло[1,2-b]пиридазин-7-ил]-R90-метанон в случае, когда группа Y представляет собой N, допуская модификации в соответствии с правилами номенклатуры, например, как [2-(3-фтор-2-метил-бензил)-7-метокси-1-фенил-индолизин-3-ил]-пиперазин-1-ил-метанон в случае примера 35, или как этиламид 6-(3-фтор-2-метил-бензил)-7-{(S)-3-[(2-метокси-этилкарбамоил)-метил]-пиперазин-1-карбонил]-5-фенил-пирроло[1,2-b]пиридазин-3-карбоновой кислоты в случае примера 42.
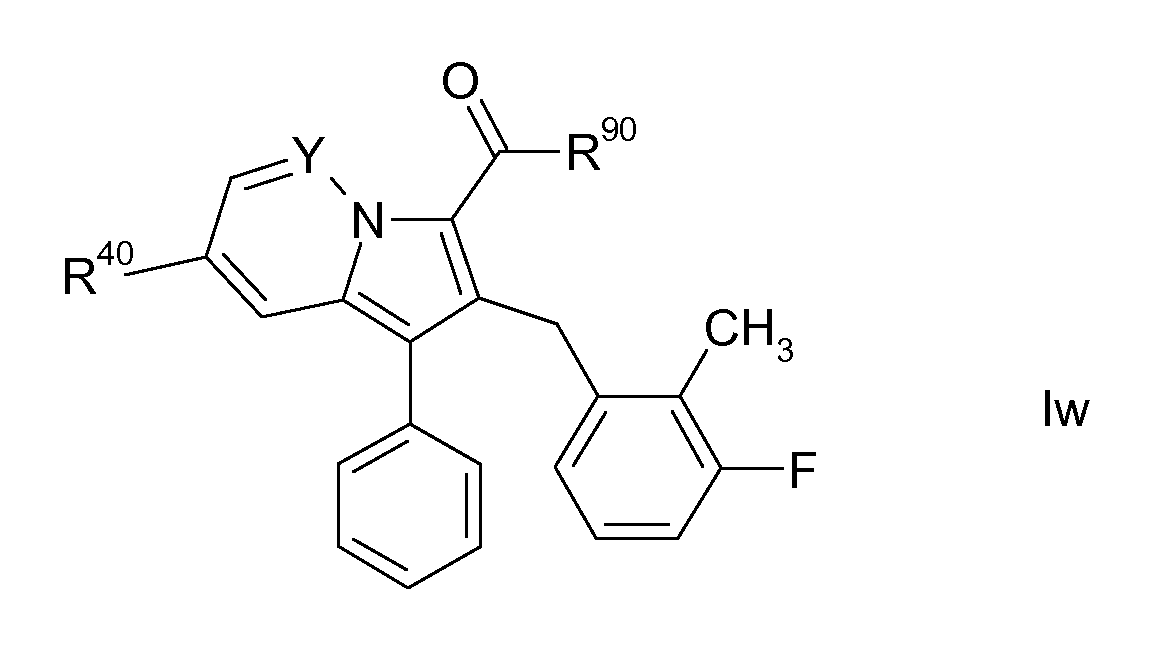
|
Дополнительные соединения формулы Iw, которые можно получить аналогично получению соединений примеров, описанных выше, перечислены в Таблице 3. Они могут быть названы, как указано выше для соединений, перечисленных в Таблице 2.
|
Фармакологические испытания
A) Ингибирование ренина
Ренин-ингибирующая активность соединений по настоящему изобретению была продемонстрирована в in vitro испытании, в котором неэндогенный флуорогенный пептидный субстрат расщепляли ренином, в частности, по Leu-Val связи, которая соответствует сайту расщепления ангиотензиногена.
Рекомбинантный человеческий ренин (Cayman, no. 10006217) при концентрации 5 нМ инкубировали с испытываемыми соединениями при различных концентрациях и синтетическим субстратом Dabcyl-γ-Abu-Ile-His-Pro-Phe-His-Leu-Val-Ile-His-Thr-EDANS (Bachem, no. M-2050; Dabcyl означает 4-(4-диметиламино-фенилазо)-бензоильную группу, и EDANS означает амид с 5-[(2-аминоэтил)амино]-нафталин-1-сульфоновой кислотой) при концентрации 10 мкМ в течение 2 часов при комнатной температуре в 0,05 M Трис буфере (pH 8), содержащем 0,1 M NaCl, 2,5 мМ EDTA и 1,25 мг/мл бычьего сывороточного альбумина. Увеличение флуоресценции в результате передачи резонансной энергии флуоресценции регистрировали при длине волны возбуждения 330 нм и длине волны испускания 485 нм с использованием спектрофлуорометра для микропланшетов. Ингибирующие концентрации ИК50 рассчитывали из процента ингибирования активности ренина как функцию от концентрации испытываемого соединения. В этом испытании соединения примеров, как правило, ингибировали ренин с значением ИК50 меньше чем около 10 микромоль/л (10 мкМ). Репрезентативные ИК50 значения, которые были определены с использованием соединений в форме полученной соли, указанной в примерах выше, представлены в Таблице 4.
|
B) Ингибирование ренина в плазме человека
Ренин-ингибирующая активность соединений по настоящему изобретению была продемонстрирована в in vitro испытании в присутствии человеческой плазмы. Следовали процедуре, описанной в фармакологическом испытании А, за исключением того, что человеческий рекомбинантный ренин при концентрации 30 нМ инкубировали с испытываемыми соединениями при различных концентрациях и флуорогенным субстратом Dabcyl-γ-Abu-Ile-His-Pro-Phe-His-Leu-Val-Ile-His-Thr-EDANS при концентрации 25 мкМ в течение 30 мин при 37°C и 30 мин при комнатной температуре в человеческой плазме (Innovative Research, нормальная человеческая плазма, собранная на EDTA K3 в качестве антикоагулянта, no. IPLA-5).
C) Антигипертензивная активность
In vivo антигипертензивная активность соединений по настоящему изобретению может быть продемонстрирована на дважды трансгенных мышах с гиперэкспрессией генов человеческого ренина и ангиотензиногена (dTghRenhAgt мыши; cf. D. C. Merrill et al., J. Clin. Invest. 97 (1996), 1047; R. L. Davisson et al., J. Clin. Invest. 99 (1997), 1258; J. L. Lavoie et al., Acta Physiol. Scand. 81 (2004), 571; доступные путем селекции штаммов, содержащих трансген человеческого ренина и трансген человеческого ангиотензиногена соответственно). Вкратце, в этом испытании артериальное давление у свободно передвигающихся самцов dTghRenhAgT мышей определяли телеметрическим методом. Для этого катетер радиотрансмиттера (модель TA11 PA-10, DSI) имплантировали в левую сонную артерию dTghRenhAgT мышей под анестезией. Животных выдерживали в условиях 12-часоввого цикла свет/темнота, и они имели свободный доступ к пище и воде. После недельного периода восстановления артериальное давление и частоту сердечных сокращений отслеживали в течение 24 часов для установления базовых значений. Затем животным принудительно вводили пероральным путем суточную дозу испытываемого соединения в носителе (вода, содержащая 0,6% метилцеллюлозы и 0,5% Tween® 80) или, в качестве контроля, только носитель. Гемодинамические параметры непрерывно регистрировали еще в течение 24 часов и определяли максимальный эффект снижения среднего артериального давления и продолжительность антигипертензивной активности (среднее артериальное давление = диастолическое давление + 1/3 (систолическое давление - диастолическое давление)). Соединения скринировали при различных дозах, таких как 3 мг/кг массы тела и 10 мг/кг массы тела в день.