Результат интеллектуальной деятельности: АНТИТЕЛА ПРОТИВ ИНТЕРЛЕЙКИНА 17 (ИЛ-17) ЧЕЛОВЕКА И ИХ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Настоящее изобретение относится к антителам против ИЛ-17А человека (антитело ИЛ-17), способам их получения, фармацевтическим композициям, содержащим указанные антитела, и их применению.
Уровень техники
Интерлейкин 17А человека (CTLA-8, Swiss Prot Q16552, далее обозначаемый «ИЛ-17») является провоспалительным цитокином, вырабатываемым подгруппой Т-клеток памяти (называемых Th17), участвующих в патогенезе рассеянного склероза (PC). ИЛ-17А участвует в индукции других воспалительных цитокинов, хемокинов и молекул адгезии. Лечение животных с помощью антител, нейтрализующих ИЛ-17А, снижает сферу охвата и тяжесть аутоиммунного энцефаломиелита (Komiyama Y. и др., J. Immunol. 177, 2006, cc.566-573). ИЛ-17А сверхэкспрессируется в цереброспинальной жидкости пациентов с рассеянным склерозом (Hellings P.W. и др., Am. J. Resp. Cell Mol. Biol. 28, 2003, cc.42-50; Matusevicius D. и др., Multiple Sclerosis 5, 1999, cc.101-104; WO 2005/051422). Кроме того, антитела, нейтрализующие ИЛ-17А, снижают тяжесть и сферу охвата индуцированного коллагеном артрита в модели ревматоидного артрита (РА) у мышей, и высокие уровни ИЛ-17А могут быть выявлены в синовиальной жидкости воспаленных суставов у пациентов с РА (Ziolkowska М. и др., J. Immunol. 164, 2000, cc.2832-2838; Kotake S. и др., J. Clin. Invest. 103, 1999, cc.345-1352; Hellings P.W. и др., Am. J. Resp. Cell Mol. Biol. 28, 2003, cc.42-50).
WO 96/17939, US 5716623; WO 95/18826; WO 97/15320; WO 99/35276 и WO 00/69436, WO 95/18826, US 6274711, US 6274711, WO 97/15320, US 6063372, WO 2006/013107 и WO200802115 относятся к ИЛ-17А и антителам против ИЛ-17А.
Краткое описание изобретения
Настоящее изобретение включает антитело, связывающееся с ИЛ-17, которое отличается тем, что вариабельный домен тяжелой цепи включает область CDR3 последовательности SEQ ID NO:1, область CDR2 последовательности SEQ ID NO:2 или 9 и область CDR1 последовательности SEQ ID NO:3, а также тем, что вариабельный домен легкой цепи включает область CDR3 последовательности SEQ ID NO:4, область CDR2 последовательности SEQ ID NO:5 и область CDR1 последовательности SEQ ID NO:6. Предпочтительно антитело отличается тем, что вариабельный домен тяжелой цепи включает SEQ ID NO:7 или 10. Предпочтительно антитело отличается тем, что вариабельный домен тяжелой цепи включает SEQ ID NO:7 или 10, а вариабельный домен легкой цепи включает SEQ ID NO:8. Предпочтительно антитело, связывающее ИЛ-17 и отличающееся указанными выше аминокислотными последовательностями и фрагментами аминокислотных последовательностей, является изотипом IgG1 человека, модифицированным в шарнирной области по положению аминокислот 216-240, предпочтительно по положению аминокислот 220-240, между CH1 и CH2 и/или во второй внутридоменной области по положению аминокислот 327-331 между CH2 и CH3. Предпочтительно антитело включает мутации L234A (аланин вместо лейцина по положению аминокислоты 234) и L235A. Предпочтительная константная область тяжелой цепи, включающая мутации L234A и L235A, показана в SEQ ID NO:11.
Предпочтительная линия гибридомных клеток по настоящему изобретению, <hИЛ-17>1А1.3С1 (антитело 3С1) депонирована в коллекции Deutsche Sammlung von Mikroorganismen und Zeilkulturen GmbH (DSMZ), Брауншвейг, Германия.
|
Антитело, получаемое из указанной линии клеток (антитело 3С1), является предпочтительным вариантом осуществления настоящего изобретения. Другой объект по настоящему изобретению является химерным, гуманизированным ил истощенным по эпитопу Т-клеток вариантом антитела 3С1 (DSM ACC2941). Антитело специфически связывается с ИЛ-17 с величиной IC50, равной 1 нМ или меньше. Предпочтительными версиями 3С1 являются Mab 106 и Mab 107.
Настоящее изобретение также относится к антителу, связывающему ИЛ-17 и отличающемуся тем, что связывается с тем же эпитопом ИЛ-17, с которым связывается моноклональное антитело 3С1. Антитело, связывающееся с ИЛ-17 со сродством, составляющим по меньшей мере от 10-8 М-1 до 10-12 М-1, является изотипом IgG1 человека, модифицированным в шарнирной области по положению аминокислот 216-240, предпочтительно по положению аминокислот 220-240, между CH1 и CH2 и/или во второй внутридоменной области по положению аминокислот 327-331 между CH2 и CH3. Предпочтительно антитело является изотипом IgG1 человека, включающим мутации L234A (аланин вместо лейцина по положению аминокислоты 234) и L235A.
Предпочтительно антитело является гуманизированным или антителом человека. Предпочтительно антитело по настоящему изобретению ингибирует в концентрации 100 нг/мл индуцированную ИЛ-17А макаки крабоеда выработку ИЛ-6 и ИЛ-8 в анализе высвобождения цитокина с величиной IC50, равной 1,5 нМ или ниже, используя кожные фибробласты макаки крабоеда.
В другом варианте осуществления настоящего изобретения представлена фармацевтическая композиция антитела по настоящему изобретению. Предпочтительно фармацевтическая композиция включает антитело, отличающееся связыванием с тем же эпитопом ИЛ-17, с которым связывается моноклональное антитело 3С1. Предпочтительно антитело фармацевтической композиции, связывающееся с ИЛ-17 со степенью сродства, составляющей по меньшей мере от 10-8 М-1 до 10-12 М-1, является изотипом IgG1 человека, модифицированным в шарнирной области по положению аминокислот 216-240, предпочтительно по положению аминокислот 220-240, между CH1 и CH2 и/или во второй внутридоменной области по положению аминокислот 327-331 между CH2 и CH3. Предпочтительно антителом является изотип IgG1 человека, включающий мутации L234A (аланин вместо лейцина по положению аминокислоты 234) и L235A.
В другом варианте осуществления настоящего изобретения применяют антитело по настоящему изобретению для получения фармацевтической композиции. Предпочтительно фармацевтическая композиция включает антитело, отличающееся связыванием с тем же эпитопом ИЛ-17, с которым связывается моноклональное антитело 3С1. Предпочтительно антитело фармацевтической композиции, связывающееся с ИЛ-17 со степенью сродства, составляющей по меньшей мере от 10-8 М-1 до 10-12 М-1, является изотипом IgG1 человека, модифицированным в шарнирной области по положению аминокислот 216-240, предпочтительно по положению аминокислот 220-240, между CH1 и CH2 и/или во второй внутридоменной области по положению аминокислот 327-331 между CH2 и CH3. Предпочтительно антитело является изотипом IgG1 человека, включающим мутации L234A (аланин вместо лейцина по положению аминокислоты 234) и L235A.
В другом варианте осуществления настоящего изобретения применяют антитело по настоящему изобретению для лечения рассеянного склероза, ревматоидного артрита, псориаза, болезни Крона, хронического обструктивного заболевания легких (ХОЗЛ), астмы и отторжения трансплантата. В другом варианте осуществления настоящего изобретения предусмотрен способ получения фармацевтической композиции, включающей антитело по настоящему изобретению. Предпочтительно фармацевтическая композиция включает антитело, отличающееся связыванием с тем же эпитопом ИЛ-17, с которым связывается моноклональное антитело 3С1. Предпочтительно антитело фармацевтической композиции, связывающееся с ИЛ-17 со степенью сродства, составляющей по меньшей мере от 10-8 М-1 до 10-12 М-1, является изотипом IgG1 человека, модифицированным в шарнирной области по положению аминокислот 216-240, предпочтительно по положению аминокислот 220-240, между CH1 и CH2 и/или во второй внутридоменной области по положению аминокислот 327-331 между CH2 и CH3. Предпочтительно антитело является изотипом IgG1 человека, включающим мутации L234A (аланин вместо лейцина по положению аминокислоты 234) и L235A.
Другим объектом настоящего изобретения является нуклеиновая кислота, кодирующая тяжелую цепь антитела, связывающегося с ИЛ-17, которое отличается включением области CDR3 тяжелой цепи последовательности SEQ ID NO:1, и предпочтительно мутаций L234A и L235A в константный домен тяжелой цепи IgG1. Предпочтительно антитело включает также область CDR2 последовательности SEQ ID NO:2 или 9 и область CDR1 последовательности SEQ ID NO:3. Другим объектом настоящего изобретения является нуклеиновая кислота, кодирующая легкую цепь антитела, связывающегося с ИЛ-17, которое отличается включением области CDR3 легкой цепи по настоящему изобретению и предпочтительно мутаций L234A и L235A в константный домен тяжелой цепи IgG1. Предпочтительно антитело включает также область CDR2 тяжелой цепи последовательности SEQ ID NO:2 или 9 и область CDR1 последовательности SEQ ID NO:3. Другим объектом настоящего изобретения является нуклеиновая кислота, кодирующая антитело по настоящему изобретению, отличающееся включением вариабельного домена тяжелой цепи последовательности SEQ ID NO:7 или 10 и вариабельного домена легкой цепи последовательности SEQ ID NO:8 и предпочтительно мутаций L234A и L235A в константном домене тяжелой цепи IgG1.
Антитело по настоящему изобретению отличается тем, что константные цепи происходят от человека. Такие константные цепи известны в данной области и, например, описаны Kabat (см., например, Johnson G. и Wu T.T., Nucleic Acids Res. 28, 2000, cc.214-218). Например, полезная константная область тяжелой цепи человека включает аминокислотную последовательность SEQ ID NO:11 с мутациями L234A и L235A. Например, полезная константная область легкой цепи человека включает аминокислотную последовательность константной области каппа-легкой цепи последовательности SEQ ID NO:12. Также предпочтительно, чтобы антитело происходило от мыши и включало основу вариабельной последовательности антитела мыши по Kabat (см., например, Johnson G. и Wu T.T., Nucleic Acids Res. 28, 2000, cc.214-218).
Антитело по настоящему изобретению особенно отличается подавлением выделения интерлейкина-8 (ИЛ-8) из клеток CCD25-SK. Антитело по настоящему изобретению специфически нейтрализует опосредованную ИЛ-17 активацию клеток с величиной IC50, равной 0,5 нМ (16 нг/мл) или менее. Антитело по настоящему изобретению специфически связывается с ИЛ-17 с величиной IC50, равной 1 нМ или менее.
Антитело по настоящему изобретению предпочтительно является изотипом IgG1 человека. Предпочтительные константные области γ1 тяжелой цепи показаны в SEQ ID NO:11 и SEQ ID NO:11 без мутаций L234A и L235A.
Антитело по настоящему изобретению предпочтительно отличается отсутствием связывания фактора C1q комплемента человека и, следовательно, не обладает эффекторной функцией CDC.
Антитело по настоящему изобретению предпочтительно является изотипом IgG1 человека, модифицированным в шарнирной области по положению аминокислот 216-240, предпочтительно по положению аминокислот 220-240, между CH1 и CH2, и/или во второй внутридоменной области по положению аминокислот 327-331 между CH2 и CH3. Антитело по настоящему изобретению предпочтительно отличается принадлежностью к изотипу IgG1 человека, содержащему по меньшей мере одну мутацию L234 (лейцина по положению аминокислот 234), L235, D270, N297, Е318, K320, K322, Р331 и/или Р329 (нумерация по индексу EU). Предпочтительно антитело является изотипом IgG1 человека, включающим мутации L234A (аланин вместо лейцина по положению аминокислоты 234) и L235A.
Настоящее изобретение также предусматривает векторы экспрессии, содержащие нуклеиновую кислоту по настоящему изобретению, способные экспрессировать указанную нуклеиновую кислоту в прокариотических или эукариотических клетках-хозяевах, и клетки-хозяева, содержащие такие векторы, для получения путем рекомбинации такого антитела. Настоящее изобретение также включает прокариотические или эукариотические клетки-хозяева, включающие вектор по настоящему изобретению. Настоящее изобретение также включает способ получения рекомбинантного антитела человека или гуманизированного антитела по настоящему изобретению, отличающийся экспрессией нуклеиновой кислоты по настоящему изобретению в прокариотических или эукариотических клетках-хозяевах, и выделения указанного антитела из указанных клеток или супернатанта культуры клеток. Настоящее изобретение также включает антитело, получаемое таким рекомбинантным методом.
Антитела по настоящему изобретению демонстрируют пользу для пациентов, нуждающихся в ИЛ-17 нацеливающей терапии. Антитела по настоящему изобретению обладают новыми и патентоспособными свойствами, приносящими пользу для пациента со следующими иммунологическими заболеваниями, особенно с рассеянным склерозом, ревматоидным артритом, псориазом, болезнью Крона, хроническим обструктивным заболеванием легких (ХОЗЛ), астмой или отторжением трансплантата. Антитела по настоящему изобретению не вызывают чувствительности к стафилококковой и кишечной бактериальной инфекции у подвергаемых лечению пациентов. Настоящее изобретение дополнительно предусматривает способ лечения пациента с рассеянным склерозом, ревматоидным артритом, псориазом, болезнью Крона, хроническим обструктивным заболеванием легких (ХОЗЛ), астмой или отторжением трансплантата, включающий введение пациенту с установленным указанным заболеванием (и, следовательно, нуждающемуся в такой терапии) эффективного количества антитела, связывающегося с ИЛ-17, по настоящему изобретению. Антитела предпочтительно вводят в фармацевтической композиции. В другом варианте осуществления настоящего изобретения предусмотрен способ лечения пациента с рассеянным склерозом, ревматоидным артритом, псориазом, болезнью Крона, хроническим обструктивным заболеванием легких (ХОЗЛ), астмой или отторжением трансплантата, отличающийся введением пациенту антитела по настоящему изобретению. Настоящее изобретение также включает применение антитела по настоящему изобретению для лечения пациента с рассеянным склерозом, ревматоидным артритом, псориазом, болезнью Крона, хроническим обструктивным заболеванием легких (ХОЗЛ), астмой или отторжением трансплантата и для получения фармацевтической композиции по настоящему изобретению. Кроме того, настоящее изобретение также включает способ получения фармацевтической композиции по настоящему изобретению.
Настоящее изобретение также включает фармацевтическую композицию, включающую антитело по настоящему изобретению, необязательно вместе с буфером и/или адъювантом, для состава антител для фармацевтических целей. Настоящее изобретение также предусматривает фармацевтические композиции, включающие антитело по настоящему изобретению в фармацевтически приемлемом носителе. В одном варианте осуществления настоящего изобретения фармацевтическая композиция может быть включена в изделие или в набор.
Подробное описание изобретения
Понятие «антитело» охватывает разные формы структур антител, включая, но ими не ограничиваясь, целые антитела и фрагменты антител. Антитело по настоящему изобретению предпочтительно является гуманизированным антителом, химерным антителом или другим генетически сконструированным антителом, измененным, но не утратившим специфических свойств по настоящему изобретению. Понятие «фрагменты антитела» включают часть антитела полной длины, предпочтительно его вариабельный домен, или по меньшей мере его сайт связывания антигена. К примерам фрагментов антител относятся двухвалентные антитела, молекулы одноцепочечных антител и полиспецифичных антител, сформированных из фрагментов антител. Антителами scFv являются, например, антитела, описанные в работе Huston J.S., Methods in Enzymol. 203, 1991, cc.46-52. Кроме того, фрагменты антител включают одноцепочечные полипептиды, обладающие свойствами домена VH, т.е. способные соединяться вместе с доменом VL, или с доменом VL, связывающимся с ИЛ-17, т.е. способные соединяться вместе с доменом VH с функциональным антиген-связывающим сайтом и тем самым обеспечивающим свойства антитела по настоящему изобретению. Понятия «моноклональное антитело» или «композиция моноклонального антитела», используемые в настоящем изобретении, относятся к получению молекул антител одной аминокислотной композиции. Понятие «гуманизированное антитело» относится к антителам, у которых каркасный участок и/или «комплементарно детерминируемые области (complementary determining regions - CDR)» модифицированы для включения CDR иммуноглобулина от другого вида по сравнению с CDR исходного иммуноглобулина. В предпочтительном варианте осуществления настоящего изобретения CDR мыши пересаживают в каркасный участок антитела человека для получения «гуманизированного антитела». См., например, Riechmann L. и др., Nature 332, 1988, cc.323-327; и Neuberger M.S. и др., Nature 314, 1985, cc.268-270.
Понятие «связывание с ИЛ-17», используемое в настоящем изобретении, означает связывание антитела с ИЛ-17 человека в анализе связывания ELISA. Связывание устанавливают, если антитело вызывает соотношение С/Ш (сигнал/шум) 7:1 или более при концентрации антитела 1 мкг/мл. Антитело по настоящему изобретению специфически связывается с ИЛ-17А человека с величиной IC50, равной 1 нМ (0,15 мкг/мл) или ниже. Антитело не связывается с ИЛ-17 В, С, D, Е и F (соотношение С/Ш (сигнал/шум) ниже 7:1) и, следовательно, специфически связывается с ИЛ-17А. Связывание с ИЛ-17 А и вариантами проводят методом ELISA, используя иммобилизованный ИЛ-17 или его вариант.
Понятие «эпитоп» означает белковый детерминант, способный специфически связываться с антителом. Эпитопы обычно состоят из химически активных поверхностных группировок молекул, например аминокислот или боковых цепей сахаров, и обычно эпитопы имеют специфические трехмерные пространственные структурные характеристики, а также специфические характеристики заряда. Конформационные и неконформационные эпитопы различаются тем, что связывание с первыми, но не со вторыми, утрачивается в присутствии денатурирующих растворителей. Предпочтительно антитело по настоящему изобретению связывается специфически с нативным, но не денатурированным ИЛ-17. Антитело ИЛ-17 по настоящему изобретению связывается с тем же эпитопом на ИЛ-17, с которым связывается антитело Mab317. Свойство связывать эпитоп антитела ИЛ-17 по настоящему изобретению может быть определено, используя методы, известные в настоящем изобретении. Антитело ИЛ-17 тестируют in vitro с помощью анализа перекрестного блокирующего связывания для определения способности исследуемого антитела препятствовать связыванию антитела Mab317 с ИЛ-17. Если происходит вытеснение исследуемого антитела антителом Mab317 по меньшей мере на 15%, тогда эпитопы находятся в непосредственной близости.
Понятие «вариабельный домен» (вариабельный домен легкой цепи (VL), вариабельный домен тяжелой цепи (VH)) в контексте настоящего изобретения означает каждую из доменов пары легкой и тяжелой цепи, которые непосредственно вовлечены в связывание антитела с антигеном. Вариабельные домены легкой и тяжелой цепей имеют ту же общую структуру, и каждый домен включает четыре области каркасных участков (FR), последовательности которых в высокой степени консервативные, соединенные тремя «гипервариабельными областями» (или комплементарно детерминируемыми областями - CDR). Каркасные участки принимают конфигурацию β-плоскости и CDR могут формировать петли, соединяющие структуру β-плоскости. Области CDR в каждой цепи поддерживаются в присущей им трехмерной структуре каркасными участками и формируют вместе с областями CDR из другой цепи сайт связывания антигена. Области CDR3 легкой цепи антитела играют особенно важную роль в специфическом связывании/сродстве антител по настоящему изобретению и, следовательно, предусматривают другой объект по настоящему изобретению.
Понятие «антиген-связывающая часть антитела», используемое в настоящем изобретении, относится к аминокислотным остатка антитела, ответственным за связывание антигена. Антиген-связывающая часть антитела включает аминокислотные остатки из «комплементарно детерминируемых областей (CDR)». Понятия «каркасный участок (Framework - FR)» или «области FR» относятся к тем вариабельным областям доменов, которые отличаются от остатков гипервариабельных областей, описанных в настоящем изобретении. Таким образом, вариабельные домены легкой и тяжелой цепей антител включают от N- до С-конца домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Особенно CDR3 тяжелой цепи является областью, которая наибольшим образом содействует связыванию антигена и обусловливает свойства антитела. Области CDR и FR определяют по стандартному определению Kabat и др. в кн.: «Sequences of Proteins of Immunological Interest», 1991, 5-е изд., изд. Public Health Service, National Institutes of Health, Bethesda, Мэриленд, и/или по таким остаткам из «гипервариабельной петли».
Понятие «аминокислота», используемое в настоящем изобретении, означает группу природных карбокси-α-аминокислот, включая аланин (по трехбуквенному коду: ala, по однобуквенному коду: А), аргинин (arg, R), аспарагин (asn, N), аспарагиновую кислоту (asp, D), цистеин (cys, С), глутамин (gln, Q), глутаминовую кислоту (glu, Е), глицин (gly, G), гистидин (his, Н), изолейцин (ile, I), лейцин (leu, L), лизин (lys, K), метионин (met, М), фенилаланин (phe, F), пролин (pro, Р), серин (ser, S), треонин (thr, Т), триптофан (trp, W), тирозин (tyr, Y) и валин (val, V).
Понятия «нуклеиновая кислота» или «молекула нуклеиновой кислоты» в контексте настоящего изобретения означают молекулы ДНК и молекулы РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но предпочтительно является двухцепочечной ДНК. Нуклеиновая кислота является «оперативно связанной», если она расположена в функциональной связи с другой нуклеиновой кислотой. Например, ДНК последовательности-предшественника или секреторного лидера оперативно связана с ДНК полипептида, если он экспрессируется в качестве белка-предшественника, который участвует в секреции полипептида; промотор или энхансер оперативно связаны с кодирующей последовательностью, если они воздействуют на транскрипцию последовательности; или сайт связывания рибосомы является оперативно связанным с кодирующей последовательностью, если он расположен таким образом, чтобы способствовать трансляции. Обычно «оперативно связанный» означает, что последовательности ДНК, будучи связанными, являются лежащими на одной прямой и в случае секреторного лидера соприкасаются в рамке считывания. Однако энхансеры не должны соприкасаться. Связывание дополняется лигированием по соответствующим сайтам рестрикции. Если таких сайтов нет, используют синтетические олигонуклеотидные адаптеры или линкеры согласно с обычной практикой. В контексте настоящего изобретения понятия «клетки», «клеточные линии» и «культуры клеток» используют взаимозаменяемо, и все эти обозначения включают последующие генерации. Таким образом, понятия «трансформанты» и «трансформированные клетки» включают клетки главного субъекта и культуры, производные от них, независимо от числа пересевов. Также следует понимать, что все последующие генерации могут быть полностью неидентичными по ДНК из-за спланированных или случайных мутаций. К этим понятиям также относятся варианты последующих генераций, имеющие ту же функцию или то же биологическое действие, что и первоначально трансформированные клетки.
«Часть Fc» антитела не участвует непосредственно в связывании антитела с антигеном, но проявляет различные эффекторные функции. Термин «часть Fc антитела» известен специалистам в данной области и определяется по расщеплению антител папаином. В зависимости от аминокислотной последовательности константной области их тяжелых цепей, антитела или иммуноглобулины делятся на классы: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно поделены на подклассы (изотипы), например IgG1, IgG2, IgG3 и IgG4, IgA1 и IgA2. По константным областям тяжелой цепи разные классы иммуноглобулинов называются α, δ, ε, γ и µ, соответственно. Часть Fc антитела непосредственно включена в ADCC (antibody-dependent cell-mediated cytotoxicity - антитело-обусловленную клеточнозависимую цитотоксичность) и CDC (complement-dependent cytotoxicity - комплемент-зависимую цитотоксичность), основанные на активации комплемента, связывании C1q и связывании рецептора Fc. Активация комплемента (CDC) инициируется связыванием фактора комплемента C1q с частью Fc большинства антител подкласса IgG. Хотя влияние антитела на систему комплемента зависит от определенных условий, связывание с C1q обусловлено определенными сайтами связывания в части Fc. Такие сайты связывания известны в данной области и описаны, например, Boakle R.J. и др., Nature 282, 1979, cc.742-743; Lukas T.J. и др., J. Immunol. 127, 1981, cc.2555-2560; Brunhouse R. и Cebra J.J., Mol. Immunol. 16, 1979, cc.907-917; Burton D.R. и др., Nature 288, 1980, cc.338-344; Thommesen J.E. и др., Mol. Immunol. 37, 2000, cc.995-1004; Idusogie E.E. и др., J. Immunol. 164, 2000, cc.4178-4184; Hezareh M. и др., J. Virology 75, 2001, cc.12161-12168; Morgan А. и др., Immunology 86, 1995, cc.319-324; ЕР 0307434. Такими сайтами связывания являются, например, L234, L235, D270, N297, Е318, K320, K322, Р331 и Р329 (нумерация по индексу EU по Kabat, см. ниже). Антитела подклассов IgG1, IgG2 и IgG3 обычно проявляют активирование комплемента и связывание C1q, хотя IgG4 не активирует систему комплемента и не связывает C1q.
Антитело по настоящему изобретению включает часть Fc, происходящую от человека, которая является частью Fc антитела человека подкласса IgG1. Для части Fc антитела по настоящему изобретению предпочтительно нельзя обнаружить связывания C1q, согласно описанному ниже.
Таким образом, настоящее изобретение включает антитело по настоящему изобретению, отличающееся тем, что указанное антитело связывает ИЛ-17, содержащий часть Fc, происходящую от человека, и не связывает фактор C1q комплемента человека и, следовательно, избегает эффекторной функции CDC.
Предпочтительно антитело по настоящему изобретению связывается с рецептором Fey подкласса IgG1 или IgG2 человека, с мутацией в L234, L235 и/или D265 и/или мутацией PVA236. Предпочтительны мутации L234A, L235A, L235E и/или PVA236 (PVA236 означает, что аминокислотная последовательность ELLG (по однобуквенному коду аминокислот) в положениях аминокислот 233-236 у IgG1 или EFLG у IgG4 замещена на PVA). Таким образом, настоящее изобретение также предусматривает антитело по настоящему изобретению, отличающееся тем, что указанное антитело является антителом подкласса IgG1 человека, включающее по меньшей мере одну мутацию L234, L235, D270, N297, Е318, K320, K322, Р331 и/или Р329. В одном из вариантов осуществления настоящего изобретения антитело является антителом человека. В другом варианте осуществления настоящего изобретения антитело является гуманизированным. В другом варианте осуществления настоящего изобретения предусмотрено антитело по настоящему изобретению, содержащее часть Fc, производную от антитела человека, и отличающееся тем, что указанное антитело является антителом человека подкласса IgG1, содержащим по меньшей мере одну мутацию в L234, L235, D270, N297, Е318, K320, K322, Р331 и указанное антитело связывается с ИЛ-17 с величиной KD менее 10-8 М в анализе BIAcore. В другом варианте осуществления настоящего изобретения диапазон KD составляет от 10-11 до 10-9 М.
Связывание C1q может быть измерено по Idusogie Е.Е. и др., J. Immunol. 164, 2000, cc.4178-4184. Но связывание C1q по настоящему изобретению отличается тем, что в таком анализе, в котором планшет ELISA покрыт разными концентрациями антитела, добавляют C1q человека. Связывание C1q определяют с помощью антитела, направленного против C1q человека, с последующим выявлением конъюгата, меченного пероксидазой, с субстратом для пероксидазы ABTS® (2,2'-азино-ди-[3-этилбензтиазолинсульфонатом]). По настоящему изобретению не установлено связывание C1q, если оптическая плотность (ОП) при 405 нм исследуемого антитела ниже 0,05 при концентрации антитела 10 мкг/мл.
Антитело по настоящему изобретению предпочтительно отличается тем, что константные цепи происходят от человека. Такие константные цепи известны в данной области и описаны, например, Kabat (см., например, Johnson G. и Wu T.T., Nucleic Acids Res. 28, 2000, cc.214-218). Например, полезная константная область тяжелой цепи человека включает SEQ ID NO:23. Например, полезная константная область легкой цепи человека включает аминокислотную последовательность константной области каппа-легкой цепи SEQ ID NO:12.
В другом варианте осуществления настоящего изобретения предусмотрена нуклеиновая кислота, кодирующая тяжелую и легкую цепи антитела по настоящему изобретению.
Настоящее изобретение включает способ лечения пациента, нуждающегося в таком лечении, отличающийся введением пациенту терапевтически эффективного количества антитела по настоящему изобретению. Настоящее изобретение включает применение антитела по настоящему изобретению для лечения. Настоящее изобретение включает применение антитела по настоящему изобретению для получения лекарственного средства для профилактики и лечения воспалительных и тромботических расстройств. Настоящее изобретение включает применение антитела по настоящему изобретению для лечения воспалительных заболеваний, предпочтительно для лечения хронического обструктивного заболевания легких (ХОЗЛ), рассеянного склероза и ревматоидного артрита.
К антителам по настоящему изобретению также относятся такие антитела с «модификациями консервативных последовательностей» (варианты антител), модификациями нуклеотидных и аминокислотных последовательностей, которые не влияют или не изменяют указанные выше характеристики антитела по настоящему изобретению. Модификации могут быть интродуцированы стандартными методами, известными в данной области, например сайт-направленным мутагенезом и ПЦР-опосредованным мутагенезом. К консервативным аминокислотным замещениям относятся те, в которых аминокислотный остаток замещен аминокислотным остатком, имеющим сходную боковую цепь. Семейства аминокислотных остатков, имеющие сходные боковые цепи, определены в настоящей области. К этим семействам относятся аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, прогнозировавшиеся аминокислотные остатки в анти-ИЛ-17 антителе человека могут быть предпочтительно замещены другими аминокислотными остатками из семейства с той же боковой цепью. «Вариантом» анти-ИЛ-17 антитела в контексте настоящего изобретения называется молекула, которая отличается по аминокислотной последовательности от «исходной» аминокислотной последовательности анти-ИЛ-17 антитела десятью, предпочтительно примерно двумя-пятью, добавлениями, делециями и/или замещениями в одной или нескольких вариабельных областях исходного антитела. Аминокислотные замещения могут быть получены мутагенезом, основанным на молекулярном моделировании, описанном Riechmann L. и др., Nature 332, 1988, cc.323-327, и Queen С. и др., Proc. Natl. Acad. Sci. USA 86, 1989, cc.10029-10033.
Другой вариант осуществления настоящего изобретения предусматривает способ получения антитела против ИЛ-17, который не связывает рецептор Fcγ и/или C1q, отличающийся тем, что последовательность нуклеиновой кислоты, кодирующей тяжелую цепь антитела типа IgG1 человека, связывающаяся с ИЛ-17, модифицирована таким образом, что указанное модифицированное антитело не связывается с C1q и/или Fcγ рецептором, указанная модифицированная нуклеиновая кислота и нуклеиновая кислота, кодирующая легкую цепь указанного антитела, инсертированы в вектор экспрессии, указанный вектор инсертирован в эукариотическую клетку-хозяина, кодируемый белок экспрессируется и выделяется из клеток-хозяев или из супернатанта.
Идентичность или гомология последовательностей в настоящем изобретении выражена в виде процента аминокислотных остатков в исследуемой последовательности, идентичной с исходной последовательностью, после выравнивания последовательностей и интродукции гэпов при необходимости для достижения максимального процента идентичности последовательностей. Ни одна из N-концевой, C-концевой или внутренней мутации по типу протяженного отрезка, делеции или инсерции в последовательность антитела не может быть сконструирована в качестве определяющей идентичность или гомологию последовательности. Вариант сохраняет способность связывать ИЛ-17 человека и предпочтительно обладает свойствами, превосходящими свойства исходного антитела. Например, вариант может проявлять пониженные побочные эффекты при лечении.
«Исходное» антитело включает области CDR антитела 3С1 и предпочтительно используется для получения варианта. Предпочтительно исходное антитело содержит каркасный участок и, если имеется, содержит константную область антитела человека или константные домены антитела человека. Например, исходное антитело может быть гуманизированным антителом или антителом человека.
Антитела по настоящему изобретению предпочтительно получают методами рекомбинации. Такие методы хорошо известны в данной области и включают экспрессию белка в прокариотических и эукариотических клетках с последующим выделением полипептида антитела и обычно очисткой до фармацевтически приемлемой чистоты. Для экспрессии белка нуклеиновые кислоты, кодирующие легкую и тяжелую цепи или их фрагменты, инсертируют в векторы экспрессии стандартными методами. Экспрессию проводят в соответствующих прокариотических или эукариотических клетках-хозяевах, например клетках СНО, клетках NS0, клетках SP2/0, клетках HEK293, клетках COS, в дрожжах или клетках Е.coli, и антитело выделяют из клеток (из супернатанта или после лизиса клеток). Рекомбинантное получение антител известно в данной области и описано, например, в обзорных статьях Makrides S.C., Protein Expr. Purif. 17, 1999, cc.183-202; Geisse S. и др., Protein Expr. Purif. 8, 1996, cc.271-282; Kaufman R.J., Mol. Biotechnol. 16, 2000, cc.151-160; Werner R.G., Drug Res. 48, 1998, cc.870-880. Антитела могут присутствовать в целых клетках, в лизатах клеток или в частично очищенной или существенно очищенной форме. Очистку проводят для элиминации других клеточных компонентов или других контаминантов, например других клеточных нуклеиновых кислот или белков, стандартными методами, включая колоночную хроматографию и другие, хорошо известные в данной области. См. кн.: «Current Protocols in Molecular Biology», 1987, под ред. Ausubel F. и др., изд-во Greene Publishing and Wiley Interscience, Нью-Йорк. Экспрессию в клетках NSO описывают, например, Barnes L.M. и др., Cytotechnology 32, 2000, cc.109-123; Barnes L.M. и др., Biotech. Bioeng. 73, 2001, cc.261-270. Кратковременную экспрессию описывают, например, Durocher Y. и др., Nucl. Acids. Res. 30, 2002, с.Е9. Клонирование вариабельных доменов описывают Orlandi R. и др., Proc. Natl. Acad. Sci. USA 86, 1989, cc.3833-3837; Carter Р. и др., Proc. Natl. Acad. Sci. USA 89, 1992, cc.4285-4289; Norderhaug L. и др., J. Immunol. Methods 204, 1997, cc.77-87. Система предпочтительной кратковременной экспрессии (HEK 293) описана Schlaeger E.-J. и Christensen K., Cytotechnology 30, 1999, cc.71-83, и Schlaeger E.-J., J. Immunol. Methods 194, 1996, cc.191-199. Моноклональные антитела соответствующим образом отделяют от культуральной среды обычными методами очистки иммуноглобулина, например хроматографией с применением белка А-Цефарозы, гидроксилапатита, гель-электрофорезом, диализом или аффинной хроматографией. ДНК и РНК, кодирующие моноклональные антитела, легко выделить и секвенировать, используя обычные процедуры. Гибридомные клетки могут служить источником такой ДНК и РНК. После выделения ДНК может быть инсертирована в векторы экспрессии, которые затем трансфецируют в клетки-хозяева, например клетки HEK 293, клетки СНО или клетки миеломы, которые иным образом не вырабатывают белок, для синтеза рекомбинантных моноклональных антител в клетках-хозяевах.
Варианты аминокислотной последовательности антитела ИЛ-17 человека получают путем внедрения соответствующих нуклеотидных изменений в ДНК, кодирующую антитело, или синтезом пептида. Однако такие модификации могут быть осуществлены только в весьма ограниченном диапазоне, например, описанном выше. Например, модификации не изменяют указанных выше свойств антитела, например, изотипа IgG и связывания эпитопа, но могут улучшить выход рекомбинантного продукта, стабильность белка или облегчить очистку. Какой-либо остаток цистеина, не участвующий в поддержании правильной конформации анта-ИЛ-17 антитела, также может быть замещен, обычно серином, для улучшения окислительной стабильности молекулы и для предупреждения нарушенного перекрестного скрещивания. Напротив, цистеиновые связи (связь) могут быть добавлены к антителу для улучшения его стабильности (особенно если антитело является фрагментом антитела, например, фрагментом Fv). Другой тип варианта аминокислоты антитела изменяет первоначальный вариант гликозилирования антитела. Понятие «изменение» означает удаление одной или нескольких углеводородных частей молекул, обнаруженных в антителе, и/или удаление одного или нескольких сайтов гликозилирования, которых нет в антителе. Гликозилирование антител обычно N-связанное. Понятие «N-связанное» относится к присоединению углеводной части молекулы к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-Х-серин и аспарагин-Х-треонин, где Х означает какую-либо кислоту кроме пролина, являются последовательностями распознавания для ферментативного присоединения углеводной части молекулы к боковой цепи аспарагина. Таким образом, наличие какой-либо из этих трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. Добавление сайтов гликозилирования к антителу легко дополняется изменением аминокислотной последовательности таким образом, что оно содержит одну или несколько описанных выше трипептидных последовательностей (для N-связанных сайтов гликозилирования).
Молекулы нуклеиновых кислот, кодирующих варианты аминокислотных последовательностей анти-ИЛ-17 антитела, получают разными методами, известными в данной области. Эти методы включают, но ими не ограничиваются, выделение из природного источника (в случае вариантов природных аминокислотных последовательностей) или получение олигонуклеотид-опосредованным (или сайт-направленным) мутагенезом, ПЦР мутагенезом и кассетным мутагенезом ранее полученных вариантов или невариантной версии гуманизированного анти-ИЛ-17 антитела.
Другой тип ковалентной модификации антитела включает связывание антитела с одним из вариантов небелковых полимеров, например с полиэтиленгликолем, полипропиленгликолем или полиоксиалкиленами, способом, описанным в US 4640835, 4496689, 4301144, 4670417, 4791192, 4179337.
Вариабельные домены тяжелой и легкой цепи по настоящему изобретению комбинируют с последовательностями промотора, инициации трансляции, константной области, 3'-нетранслируемой области, полиаденилирования и терминации транскрипции для формирования конструкций вектора экспрессии. Конструкции экспрессии тяжелой и легкой цепи могут комбинироваться в одном векторе, совместно трансфецироваться, трансфецироваться сериями или по отдельности в клетки-хозяева, которые затем гибридизируют для формирования клеток-хозяев, экспрессирующих обе цепи.
В другом объекте настоящего изобретения предусматривают композицию, например фармацевтическую композицию, включающую одно моноклональное антитело или комбинацию моноклональных антител, или их антиген-связывающую часть, по настоящему изобретению, переработанную вместе с фармацевтически приемлемым носителем. В контексте настоящего изобретения понятие «фармацевтически приемлемый носитель» включает какой-либо или все растворители, дисперсионные среды, покровные материалы, антибактериальные и противогрибковые агенты, изотонические агенты и агенты абсорбции/ресорбции и другие физиологически совместимые. Предпочтительно носитель пригоден для инъекции или инфузии. Композиция по настоящему изобретению может вводиться разными методами, известными в данной области. Специалистам известно, что путь и/или способ введения может варьировать в зависимости от требуемых результатов. К фармацевтически приемлемым носителям относятся стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных инъекционных растворов или дисперсий. Применение таких сред и агентов для фармацевтически действующих веществ известно в данной области. Помимо воды носителем может быть, например, изотонический буферный солевой раствор. Независимо от выбранного пути введения, соединения по настоящему изобретению, которые могут применяться в соответствующей гидратированной форме, и/или фармацевтические композиции по настоящему изобретению перерабатывают в фармацевтически приемлемые дозированные формы путем обычных методов, известных специалистам в данной области. Фактические уровни дозирования действующих ингредиентов в фармацевтических композициях настоящего изобретения могут варьировать таким образом, чтобы получить количество действующего ингредиента, которое эффективно для достижения требуемого терапевтического ответа для определенного пациента, композиции и способа введения, без проявления токсичности для пациента (эффективного количества). Выбранные уровни дозирования могут зависеть от разных фармакокинетических факторов, включая действие определенных применяемых композиций по настоящему изобретению, или их сложных эфиров, солей или амидов, способа введения, времени введения, скорости экскреции определенного применяемого соединения, других лекарственных средств, соединений и/или материалов, используемых в комбинации с определенными применяемыми композициями, возраста, пола, массы тела, состояния, общего состояния здоровья и предшествующей истории болезни пациента, подвергаемого лечению, и от других факторов, известных в медицине.
Настоящее изобретение включает применение антител по настоящему изобретению для лечения пациента с рассеянным склерозом, ревматоидным артритом (РА), псориазом, болезнью Крона, хроническим обструктивным заболеванием легких (ХОЗЛ), астмой или отторжением трансплантата.
В другом варианте осуществления настоящего изобретения предусмотрено применение анти-ИЛ-17 антитела, предпочтительно антитела по настоящему изобретению, для лечения пациента с ревматоидным артритом, который не отвечает умеренно или не отвечает на лечение антагонистами ФНО, анти-CD20 антителом, CTLA4Ig или анти-ИЛ-6 антителом. В другом варианте осуществления настоящего изобретения предусмотрено применение анти-ИЛ-17 антитела, предпочтительно антитела по настоящему изобретению, для получения лекарственного средства для лечения пациента с ревматоидным артритом, который отвечает умеренно или не отвечает на лечение антагонистом ФНО, анти-CD20 антителом, CTLA4Ig или анти-ИЛ-6 антителом. Антагонистами ФНО для лечения ревматоидного артрита являются, например, инфликсимаб (IFX, продукт Remicade®), этанерсепт (ЕТА, продукт Enbrel®) и адалимумаб (ADA, продукт Humira®). Анти-ИЛ-17 антитело предпочтительно вводят пациенту, который отвечает умеренно или не отвечает на лечение антагонистом фактора некроза опухоли (ФНО), анти-CD20 антителом, CTLA4Ig или анти-IL6 антителом в течение по меньшей мере 3 месяцев, предпочтительно в течение 6 месяцев.
Настоящее изобретение также предусматривает способ получения фармацевтической композиции, включающей эффективное количество антитела по настоящему изобретению вместе с фармацевтически приемлемым носителем, и применение антитела по настоящему изобретению для такого способа. Настоящее изобретение также предусматривает применение антитела по настоящему изобретению в эффективном количестве для получения фармацевтического агента, предпочтительно вместе с фармацевтически приемлемым носителем, для лечения пациента с рассеянным склерозом, ревматоидным артритом, псориазом, болезнью Крона, хроническим обструктивным заболеванием легких (ХОЗЛ), астмой или отторжением трансплантата. Настоящее изобретение также предусматривает применение антитела по настоящему изобретению в эффективном количестве для получения фармацевтического агента, предпочтительно вместе с фармацевтически приемлемым носителем, для лечения пациента с рассеянным склерозом, ревматоидным артритом, псориазом, болезнью Крона, хроническим обструктивным заболеванием легких (ХОЗЛ), астмой и отторжением трансплантата.
Описание последовательностей
SEQ ID NO:1 тяжелая цепь CDR3, Mab 106 и Mab 107
SEQ ID NO:2 тяжелая цепь CDR2, Mab 106
SEQ ID NO:3 тяжелая цепь CDR1, Mab 106 и Mab 107
SEQ ID NO:4 легкая цепь CDR3, Mab 106 и Mab 107
SEQ ID NO:5 легкая цепь CDR2, Mab 106 и Mab 107
SEQ ID NO:6 легкая цепь CDR1, Mab 106 и Mab 107
SEQ ID NO:7 вариабельный домен тяжелой цепи, Mab 106
SEQ ID NO:8 вариабельный домен легкой цепи, Mab 106 и Mab 107
SEQ ID NO:9 тяжелая цепь CDR2, Mab 107
SEQ ID NO:10 вариабельный домен тяжелой цепи, Mab 106
SEQ ID NO:11 константная область γ1 тяжелой цепи
SEQ ID NO:12 константная область κ легкой цепи
Примеры
Пример 1. Описание иммунизации
Иммунизацию проводят в течение 20 недель, используя 5 самок мышей линии Balb/c, применяя 250 (1×) и 100 мкг (3×) рекомбинантного ИЛ-17 человека от фирмы Peprotech (http://www.peprotech.com; Cat.Nr.: 200-17, в 1% ФСБ с 1% альбумином) на мышь.
Пример 2. Связывание с ИЛ-17, измеренное методом ELISA
Планшеты NUNC® Maxisorp (96-луночные) покрывают рекомбинантным ИЛ-17 человека (фирмы Peprotech # 200-17, www.peprotech.com) в концентрации 0,5 мкг/мл в ФСБ (100 мл/лунку). Планшеты инкубируют при 37°С на круговой качалке при перемешивании в течение 2 ч. Затем покровный раствор удаляют и добавляют по 100 мкл/лунку ФСБТСЦ (фосфатно-солевой буфер, 0,05% Tween®20, 2% сыворотки цыпленка). Планшеты инкубируют при комнатной температуре в течение 1 ч. Блокирующий раствор удаляют и образцы вносят в планшет (100 мкл/лунку) (контроль: ФСБТСЦ, образцы (10 мкг/мл в ФСБ): антитела против ИЛ-17 человека 3С1 и Mab 106 по настоящему изобретению; Mab 16-7178-85 фирмы eBioscience (www.ebioscience.com); MAB 317 фирмы R&D Systems (www.rndsystems.com), NVP-AIN-497 (WO 2006013107)). Планшеты инкубируют при комнатной температуре с перемешиванием. Образцы удаляют, планшеты промывают трижды 200 мкл/лунку ФСБТ (фосфатно-солевой буфер, 0,05% Tween® 20) и добавляют второе антитело (козье антитело против IgG человека, Fc гамма, конъюгат с ферментом пероксидазой хрена (borseradish peroxidase - HRP); фирма Chemicon AP127P, www.millipore.com) для обнаружения антител мыши или козьего антитела против IgG человека, Fc гамма, конъюгат HRP (фирма Chemicon AP113P) для выявления гуманизированных антител. Второе антитело разводят 1:10000 в ФСБТСЦ и планшеты инкубируют в течение 1 ч комнатной температуре с перемешиванием. Второе антитело удаляют, планшеты промывают трижды 200 мкл/лунку ФСБТ (фосфатно-солевой буфер, 0,05% Tween®20) и добавляют 100 мкл/лунку ABTS® (Roche Diagnostics GmbH). Оптическую плотность измеряют при 405/492 нм относительно связывания с ИЛ-17А (принятого за 100%). Связывание с другими подтипами ИЛ-17 человека (ИЛ-17В, ИЛ-17С, ИЛ-17D, ИЛ-17Е и ИЛ-17F) получают в том же формате исследования. Результаты представлены в табл.1.
|
Пример 3. Получение плазмиды экспрессии для иммуноглобулина класса IgG1
Плазмида 6454 (в дальнейшем обозначаемая «рб454») является плазмидой экспрессии для экспрессии анти-ИЛ-17-антитела (геномно организованной кассеты экспрессии с сохраненной организацией экзон-интрон) в эукариотических клетках. Она включает следующие функциональные элементы:
- репликон, происходящий от вектора pUC18 (источник pUC),
- ген β(бета)-лактамазы, обусловливающий устойчивость к ампициллину у Е.coli (Amp),
- кассету экспрессии для экспрессии гамма 1-тяжелой цепи, включающей следующие элементы:
- главный предранний промотор и энхансер из цитомегаловируса человека (hCMV IE1 промотор),
- синтетическая 5'-концевая нетранслируемая область (5'UTR), включающая последовательность Kozak,
- сигнальная последовательность тяжелой цепи иммуноглобулина грызунов, включающая интрон сигнальной последовательности (L1_интрон_L2),
- кДНК для вариабельной области тяжелой цепи (VH), собранная с сайтом сплайсинга донора по 3'-концу,
- область µ-энхансера иммуноглобулина мыши,
- ген гамма-1 тяжелой цепи иммуноглобулина человека (human immunoglobulin heavy chain gamma 1-gene - IGHG1), включающий экзоны СН1, шарнирную область, СН2 и СН3, интроны и область 3'UTR, несущую сигнальную последовательность полиаденилирования,
- кассета экспрессии для экспрессии каппа-легкой цепи, включающая следующие элементы:
- главный предранний промотор и энхансер из цитомегаловируса человека (hCMV IE1 промотор),
- синтетическая область 5'UTR, включающая последовательность Kozak,
- сигнальная последовательность тяжелой цепи иммуноглобулина грызунов, включающая интрон сигнальной последовательности (L1_интрон_L2),
- кДНК вариабельной области легкой цепи, собранной с сайтом сплайсинга донора, по 3' концу (VL),
- интронная область энхансера Ig-каппа мыши,
- ген иммуноглобулина каппа (human immunoglobulin kappa gene - IGK), включающий экзон IGKC и IGK 3'UTR, несущий сигнальную последовательность полиаденилирования,
- кассета экспрессии для экспрессии дигодрофолатредуктазы грызунов (dihydrofolate reductase - DHFR), применимой для ауксотрофной селекции в эукариотических клетках, включающая:
- укороченную версию раннего промотора и начала репликации SV40,
- кодирующую последовательность DHFR грызунов,
- раннего сигнала полиаденилирования SV40.
Р6454 трансфецируют в клетки СНО-K1, выделяют стабильные линии клеток после селекции с метотрексатом (Methotrexate - МТХ) и проводят скрининг на получение антитела человека методом ELISA для IgG человека.
Пример 4. Исследование активирования системы комплемента (C1q связывание ELISA)
Для изучения связывания C1q антитела по настоящему изобретению используют подход ELISA. C1q является частью адаптивной иммунной системы и при связывании с иммунными комплексами индуцирует последовательное активирование нескольких зимогенов. Ферменты в свою очередь вызывают расщепление молекул С3, что может привести к началу воспалительных реакций, опсонизации чужеродных или аберрантных частиц и лизису клеточных мембран.
Планшет МТР (фирма Nunc) покрывают исследуемыми антителами в ФСБ-буфере в течение ночи при 4°С в 7 концентрациях от 10 мкг/мл до 0,156 мкг/мл, 100 мкл/лунку. Блокирование свободных сайтов связывания проводят с помощью 3% BPLA (фирма Roche) в ФСБ в течение 1 ч при комнатной температуре, 200 мкл/лунку. Планшет МТР инкубируют с 2 мкг/мл C1q (фирма Quiddel) в 3% BPLA в ФСБ, 100 мкг/мл. Планшет МТР промывают трижды при комнатной температуре 0,1% Tween®20 в ФСБ. Связывание выявляют путем добавления поликлонального антитела кролика против C1q (фирма DAKO) в количестве 0,25 мкг/мл в 3% BPLA, 0,1% Tween®20 в ФСБ, 100 мкл/лунку в течение 1 ч при комнатной температуре. Планшет МТР промывают трижды при комнатной температуре 0,1% Tween20 в ФСБ. Второе антитело козы против IgG кролика POD (фирма Jackson Immuno Research) добавляют в количестве 0,1 мкг/мл в 3% Tween 20 в ФСБ в течение 1 ч при комнатной температуре, 100 мкл/лунку. После трехкратной промывки планшета МТР с помощью 0,1% Tween20 в ФСБ при комнатной температуре планшет МТР инкубируют с раствором ABTS (фирма Roche) и измеряют поглощение при длине волны 405 нм с начальной длиной волны 490 нм. Фоновые сигналы определяют в лунках, не покрытых антителами, но обработанных в одинаковой процедуре. Не установлено связывание C1q, если оптическая плотность (ОП) при 405 нм для тестируемого антитела ниже 0,05 при концентрации антитела 10 мкг/мл.
Пример 5. Картирование области эпитопа с помощью экспериментов перекрестного блокирования BIAcore
Все измерения проводят, используя сенсор BIAcore 3000 при 25°С. Используют систему и буфер для образцов HBS-EP (10 мМ HEPES, 150 мМ NaCl, 3,4 мМ EDTA, 0,005 об.% полисорбат 20). Сенсорный чип BIAcore CM5 подвергают предварительной обработке. Последовательно 0,1% SDS, 50 мМ NaOH, 10 мМ HCl и 100 мМ H3PO4 вводят инъекцией в течение 30 сек поверх проточных кассет FC1, FC2, FC3 и FC4. Процедуру присоединения амина проводят по инструкциям производителя, используя программное обеспечение BIAcore 3000 wizard v. 4.1.
Для проведения экспериментов по перекрестному блокированию химерными или гуманизированными антителами после активирования EDC/NHS сенсорной поверхности поликлональное козье антитело против IgG человека (фирма Jackson) иммобилизуют на сенсорных проточных кюветах (FC). 30 мкг/мл поликлонального козьего антитела против IgG человека в 10 мМ NaAc рН 5,0 используют в количестве 10 мкл/мин в течение 7 мин для иммобилизации 10000 RU системы ловушки антител. Поверхность дезактивируют насыщением этаноламином. Сенсор системы ловушки человека обусловливается 5 циклами связывания вещества huIgG (фирма Bayer) в количестве 10 мкл/мин в течение 2 мин и регенерацией с 10 мМ глицином рН 1,7 в количестве 30 мкл/мин в течение 3 мин.
Со скоростью тока 10 мкл/мин первоначальное mAb инъецируют в течение 3 мин в кюветы FC1-FC4. Свободное связывание сенсорной системы ловушки блокируют, используя 3 мин инъекции в кюветы FC1-FC4 в количестве 10 мкл/мин смеси из 50 мкг/мл huIgG (фирма Bayer) в буфере HBS-EP. Впоследствии антиген rhuIL17-A инъецируют в количестве 10 мкл/мин в течение 3 мин в кюветы FC1-FC4 для насыщения связывающей способности основных антител. Вторую инъекцию в кюветы FC1-FC4 в количестве 30 мкл/мин в течение 3 мин проводят до отдельной инъекции вторичных антител в количестве 30 мкл/мин в течение 3 мин в проточные кюветы FC1, FC2, FC3 и FC4. Сенсор регенерируют, используя 10 мМ глицин рН 1,75 в количестве 30 мкл/мин в течение 3 мин.
Сначала инъекцию 0 нМ анализируемого вещества вычитают из всех сенсограмм для коррекции диссоциации первичных антител от поликлональной козьей системы захвата против IgG человека. Показатель выражают по ответному сигналу вторичного антитела и первичного антитела. Показатель называют мольным отношением (МО), которое показывает достижимость области эпитопа.
Величины молярных отношений перечислены в матрице. Комбинации гомологичных mAb выступают в качестве контроля того, успешно ли были проведены процедуры блокирования. Отсечение определяют с помощью комбинаций гомологичных mAb.
Отсечение в экспериментах по перекрестному блокированию устанавливают по формату гомогенного Mab106 анализа (9%). Величины указанных выше молярных отношений (МО)=15% относительно независимых эпитопов.
Результаты картирования эпитопа (см. табл.2) показывают, что Mab K106 и его производное Mab107 связываются с разными областями эпитопа, в отличие от NVP-AIN-497. Кроме того, Mab K106 накрывает другой эпитоп в отличие от eBio64CAP17 и ту же эпитопную область, что и Mab317.
|
Отсечение анализа выражают с помощью комбинаций однородных анализов (106, 9%); (AIN-457, 6%); (eBio64CAP17, 7%); (Mab317, 0%). Отсечение здесь устанавливают по гомогенному Mab106 анализу.
Пример 6. Анализ высвобождения цитокина, ингибирование ИЛ-17А, индуцированное высвобождением hIL-8
Проведение анализа заключается в идентификации выработки чИЛ-8 клетками CCD-25SK после стимуляции с помощью ИЛ-17А и ФНО-альфа с предварительной инкубацией анти-ИЛ-17 антител. Клетки CCD-25SK имеют рецептор ИЛ-17. Растворимый ИЛ-17А связывается с этим рецептором ИЛ-17. Антитела против ИЛ-17А связываются с ИЛ-17А. Механизм работает только в присутствии ФНО-альфа. Посредством связывания ИЛ-17А с рецептором ИЛ-17 клетки вырабатывают чИЛ-8, который можно выявить методом ELISA путем считывания результата. Измеренный чИЛ-8 дает информацию, согласно которой концентрации анти-ИЛ-17 антител ингибируют стимуляцию клеток CCD-25SK за счет ИЛ-17.
Клетки CCD-25SK засевают при плотности 2,5×104 клеток/лунку в 48-луночный планшет (объем 0,45 мл/лунку) и инкубируют в течение 24 ч при 37°С и 5% СО2. После инкубации в течение ночи клетки обрабатывают анти-ИЛ-17 антителами в течение 30 мин с конечными концентрациями 9000, 3000, 1000, 333,3, 111,1, 37,03, 12,34 и 4,11 нг/мл. Серийные разведения каждого антитела производят в среде, 50 мкл/лунку (10× концентрация). Через 30 мин клетки стимулируют смесью 10 нг/мл ИЛ-17А и 50 пг/мл ФНО-альфа. 50 мкл/лунку (10× концентрация) и инкубируют в течение 24 ч при 37°С и 5% СО2. После инкубирования в течение ночи супернатанты переносят в 96-луночные планшеты и замораживают при -20°С в качестве промежуточных продуктов для чИЛ-8 ELISA.
Метод чИЛ-8 ELISA проводят следующим образом. 100 мкл разведенного захваченного антитела добавляют в каждую лунку и инкубируют в течение ночи при 4°С. Делают разведения покровным буфером. Планшеты аспирируют, промывают трижды с помощью 200 мкл/лунку, блокируют с помощью 200 мкл/лунку растворителя и инкубируют в течение 1 ч при комнатной температуре. Планшеты аспирируют и промывают трижды с помощью 200 мкл/лунку. По 100 мкл стандарта и образцов добавляют и инкубируют в течение 2 ч при комнатной температуре. Серии стандартных разведений: 400 пг/мл; 200 пг/мл; 100 пг/мл; 50 пг/мл; 25 пг/мл; 12,5 пг/мл; 6,3 пг/мл и растворитель в качестве отрицательного контроля. Разведение образцов составляет 1:200. Планшеты аспирируют и 4 раза промывают с помощью 250 мкл/лунку. По 100 мкл конъюгата добавляют в каждую лунку. Конъюгат получают при выявлении антитела и ферментного реагента при разведении 1:250 в растворителе. Планшеты аспирируют и промывают с помощью 250 мкл/лунку 6 раз. По 100 мкл субстрата добавляют в каждую лунку и инкубируют в течение 12 мин. После инкубирования реакцию останавливают с помощью 50 мкл/лунку 1М H2SO4. Считывание проводят при 450 нм за 30 мин с λ коррекцией при 570 нм. Результаты представлены в табл.3 (величины IC50 измеряют относительно максимального подавления 80%).
|
Пример 7. Анализ высвобождения синовиоцитного цитокина. Подавление ИЛ-17А индуцированного чИЛ-6 и чИЛ-8
Первичные фибробласты человека типа синовиоцитов (ФЧТВ) образуют чИЛ-6 и чИЛ-8 в ответ на стимуляцию с помощью ИЛ-17А. Анализ проводят для измерения подавления такой простимулированной с помощью ИЛ-17А выработки чИЛ-6 и чИЛ-8 клетками ФЧТВ после предварительной инкубации клеток с анти-ИЛ-17 антителами перед стимуляцией.
Клетки ФЧТВ высевают при плотности клеток 4×105 клеток/мл в объем 0,5 мл в лунки 48-луночного планшета и инкубируют в течение ночи при 37°С и 5% CO2 для адгезии. После инкубации в течение ночи среду замещают на 400 мкл свежей среды и клетки обрабатывают анти-ИЛ-17 антителами в течение 30 мин в диапазоне концентраций антитела (10000, 3000, 1000, 300, 100, 30, 10, 3, 0 нг/мл). Серии разведений каждого антитела получают в среде, используя 50 мкл/лунку (10× концентрация). Через 30 мин клетки стимулируют 100 нг/мл ИЛ-17А (50 мкл 1000 нг/мл 10× концентрация) и инкубируют в течение ночи (18 ч) при 37°С и 5% СО2. После периода инкубирования надосадки переносят в новые пробирки и немедленно анализируют или хранят при -80°С до проведения анализа ELISA. Для анализа чИЛ-6 и чИЛ-8 ELISA в каждую лунку добавляют по 100 мкл разведенного захваченного антитела и инкубируют в течение ночи при 4°С. Разводят в покровном буфере. Планшеты аспирируют, трижды промывают 200 мкл/лунку, блокируют 200 мкл/лунку растворителя и инкубируют в течение 1 ч при комнатной температуре. Планшеты аспирируют и трижды промывают 200 мкл/лунку. Добавляют по 100 мкл стандарта и образцов и инкубируют в течение 2 ч при комнатной температуре по инструкциям производителя. Планшеты аспирируют и промывают по меньшей мере трижды с помощью 250 мкл/лунку. По 100 мкл конъюгата добавляют в каждую лунку. Конъюгат получают при выявлении антитела и ферментного реагента при разведении 1:250 в растворителе. Планшеты аспирируют и по меньшей мере трижды промывают с помощью 250 мкл/лунку. По 100 мкл субстрата добавляют в каждую лунку и инкубируют до тех пор, пока не сформируется окраска, достаточная для прочтения. После инкубирования реакцию останавливают с помощью 50 мкл/лунку 1М H2SO4 и прочитывают на ридере для планшетов при длине волны 450 нм в течение 30 мин. Результаты показаны в табл.4.
|
Пример 8. Перекрестное действие с ИЛ-17А макаки крабоеда (анализ связывания)
Анализ связывания проводят согласно описанию, приведенному в примере 2. Результаты представлены в табл.5.
|
Пример 9. Анализ высвобождения цитокина макаки крабоеда (Массаса Fasicularis), подавление индуцированной ИЛ-17А макаки крабоеда выработки ИЛ-6 и ИЛ-8
Кожные фибробласты макак (КФМ) образуют ИЛ-6 и ИЛ-8 макаки крабоеда в ответ на стимуляцию с помощью ИЛ-17А человека или макаки крабоеда. Анализ проводят для измерения подавления такого простимулированного ИЛ-17А макаки крабоеда образования ИЛ-6 и ИЛ-8 клетками КФМ с последующей предварительной инкубацией клеток с анти-ИЛ-17 антителами, сформированными против ИЛ-17 человека перед стимуляцией.
Клетки CDF высевают с плотностью 2×105 клеток/мл в объем 0,5 мл в лунки 48-луночного планшета и инкубируют в течение ночи при 37°С и 5% СО2 для адгезии. После инкубирования в течение ночи среды замещают 400 мкл свежей среды и клетки обрабатывают анти-ИЛ-17 антителами в течение 30 мин в диапазоне концентраций антитела (10000, 3000, 1000, 300, 100, 30, 10, 3, 0 нг/мл). Серию разведения каждого антитела получают в среде, используя 50 мкл/лунку (10× концентрация). Через 30 мин клетки стимулируют с помощью 100 нг/мл ИЛ-17А (50 мкл 1000 нг/мл с концентрацией 10×) и инкубируют в течение ночи (18 ч) при 37°С и 5% СО2. После периода инкубирования надосадки переносят в новые пробирки и либо сразу анализируют, либо хранят при -80°С до анализа методом ELISA. Показано, что чИЛ-6 и чИЛ-8 ELISA обладают перекрестной реакционной способностью с соответствующими цитокинами макаки крабоеда и используются для подсчета уровней цитокинов. Для метода ELISA 100 мкл разведенного мобилизованного антитела добавляют в каждую лунку и инкубируют в течение ночи при 4°С. Разведения делают в покровном буфере. Планшеты аспирируют, трижды промывают 200 мкл/лунку, блокируют 200 мкл/лунку растворителем и инкубируют в течение 1 ч при комнатной температуре. Планшеты аспирируют и трижды промывают 200 мкл/лунку. По 100 мкл стандарта и образцов добавляют и инкубируют в течение 2 ч при комнатной температуре по инструкциям производителя. Планшеты аспирируют и промывают объемом 250 мкл/лунку по меньшей мере трижды. По 100 мкл конъюгата добавляют в каждую лунку. Конъюгат получают при выявлении антитела и ферментного реагента при разведении 1:250 в растворителе. Планшеты аспирируют и промывают объемом 250 мкл/лунку по меньшей мере трижды. По 100 мкл субстрата добавляют в каждую лунку и инкубируют до развития окраски, достаточной для считывания. После инкубации реакцию останавливают с помощью 50 мкл/лунку 1М H2SO4 и получают результаты на ридере для планшетов при длине волны 450 нм в течение 30 мин. Результаты показаны в табл.6.
|
Пример 10. Анализ ADCC на основе европия
Лимфоциты периферической крови (ЛПК) выделяют с помощью центрифугирования в градиенте Ficoll Paque Plus: обработанные гепарином образцы крови разводят 1:1 в ФСБ. Наслаивают 8 мл разведенной крови на Ficoll и центрифугируют в течение 30 мин при 800g. Клетки (ЛПК) собирают, промывают RPMI 1640/10% ФСТ и ресуспендируют в среде для культивирования клеток. Клетки разводят до 2,5×106 клеток/мл (это может привести к эффекторному/целевому соотношению 25:1, поскольку используют 5×103 клеток-мишеней на лунку).
Клетки-мишени метят с помощью BADTA (2,2':6',2" -терпиридин-6,6"-ацетометиловый эфир дикарбоновой кислоты): клетки собирают добавлением продукта Accutase™ (фирма Millipore), однократно промывают и разводят до 1×106 клеток/мл. Добавляют 2,5 мкл BADTA/1×106 клеток и инкубируют в течение 35 мин при 37°С и 5% СО2. После периода нанесения метки клетки разводят 10 мл культуральной среды, центрифугируют в режиме 200g в течение 10 мин и надосадок аспирируют. Эту стадию повторяют трижды с культуральной средой/2 мМ пробеницидом и образец разводят до 1×105 клеток/мл, центрифугируют в режиме 300g в течение 5 мин, надосадок удаляют и 50 мкл переносят пипеткой в лунки, предназначенные для контролей фона.
Фон: аликвота 50 мкл, разведенная с помощью 100 мкл среды. Спонтанный лизис: 50 мкл суспензии меченых клеток-мишеней; добавляют 100 мкл культуральной среды и инкубируют 2 ч/37°С в качестве остатка образцов. Максимальный лизис: 50 мкл/лунку суспензии меченых клеток-мишеней; добавляют 100 мкл Triton® Х-100 (0,5% в ФСБ) и инкубируют 2 ч/37°С. Контроль лизиса без антител: 50 мкл/лунку суспензии меченых клеток-мишеней; добавляют 50 мкл культуральной среды; добавляют 50 мкл эффекторных клеток, 2 ч при 37°С. Контроль лизиса без эффекторных клеток: 50 мкл/лунку суспензии меченых клеток-мишеней; добавляют 50 мкл культуральной среды, добавляют 50 мл раствора антитела в наивысшей используемой концентрации и инкубируют 2 ч/37°С.
К концу периода инкубирования 96-луночный планшет центрифугируют при 100 об/мин. По 20 мкл каждого надосадка переносят в OptiPlate™ HTRF-96 (фирма Packard), добавляют 200 мл раствора европия и инкубируют в течение 15 мин на качалке. Флуоресценцию измеряют в виде зависящей от времени флуоресценции и спонтанного высвобождения, а специфическое высвобождение рассчитывают по следующей формуле:
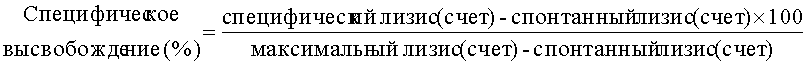
Специфическое высвобождение (ADCC) не удается измерить после добавления антитела 106.
Пример 11. Анализ CDC
Клетки собирают добавлением трипсина, промывают, разводят до 1×105 клеток/мл и добавляют по 100 мкл/лунку в 96-луночный планшет для микротитрования с плоским дном. Антитело добавляют (комплекс антитело-лиганд, соответственно) в 6-кратной конечной концентрации в объеме 25 мкл в среде. После 30 мин инкубирования добавляют 25 мкл свежеразведенного комплемента крольчонка (фирма Cedarlane, продукт CL3441, 1 мл лиофилизированного свежеразведенного в 4 мл бидистиллированной воды) до конечной концентрации 1:24. После периода инкубирования длительностью 20 ч отбирают 50 мкл надосадка и добавляют 100 мкл реагента Cell Titer Glo® (фирма Promega Corp.) к оставшимся 100 мкл надосадка. Планшеты встряхивают в течение 2 мин на круговой качалке, 100 мкл/лунку переносят в черные люминесцентные планшеты для микротитрования (фирма Costar) и измеряют люминесценцию.
Контроли: контроль среды (клетки-мишени + 50 мкл среды), максимальный лизис (клетки-мишени + 50 мкл 0,5% Triton X-100), контроль комплемента (клетки-мишени + 25 мкл среды + 25 мкл комплемента).
Результаты: не выявлено комплемент-зависимой цитотоксичности (complement dependent cytotoxicity - CDC) при использовании анти-IL17 антитела 106.






