Результат интеллектуальной деятельности: ПРОТИВОГРИБКОВЫЕ СОЕДИНЕНИЯ НА ОСНОВЕ ПРОИЗВОДНЫХ 3,5,8-ТРИОКСАБИЦИКЛО[5.1.0]ОКТАНА
Вид РИД
Изобретение
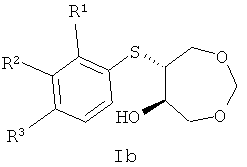
Изобретение относится к синтетическим биологически активным веществам гетероциклического ряда, обладающим высокой противогрибковой активностью, и представляющим собой продукты транс-раскрытия эпоксидного цикла 3,5,8-триоксабицикло[5.1.0]октана, а именно 6-(арилтио)-1,3-диоксепан-5-олы в рацемическом и энантиочистом виде общей формулы Ia и Ib:
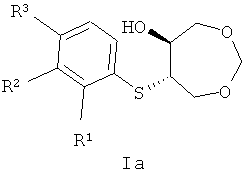
 , где:
, где:
при R1=F, R2=H, R3=H
при R1=Br, R2=H, R3=H
при R1=H, R2=Br, R3=H
при R1=H, R2=H, R3=Br
Соединения формулы Ia и Ib обладают высокой противогрибковой активностью на фоне низкой токсичности и могут найти применение в медицине и ветеринарии.
Микозы - актуальная медицинская проблема. Увеличение популяции иммуноскомпрометированных пациентов с высоким риском развития тяжелых грибковых инфекций обусловлено внедрением в клиническую практику новых медицинских технологий (например, трансплантации органов и тканей, высокодозной иммуносупрессивной терапии, инвазивных диагностических и лечебных процедур и пр.), пандемией ВИЧ-инфекции, а также успехами в лечении бактериальных осложнений. Количество инвазивных микозов прогрессивно увеличивается, при этом связанная с ними летальность остается очень высокой (40-90%). Основным методом лечения микозов на сегодняшний день является химико-терапевтический метод, основанный на использовании различных препаратов, обладающих противогрибковыми свойствами.
Важной особенностью микозов в настоящее время является высокая частота возбудителей, резистентных к применяемым антимикотикам, таких как Fusarium spp., Scedosporium spp., Rhizopus spp., Mucor spp.и др. Кроме того, все чаще встречаются возбудители инвазивного кандидоза, в частности, Candida glabrata и Candida krusei, отличающиеся устойчивостью к триазолам первого поколения и сниженной чувствительностью к амфотерицину В. Отмечено появление Aspergillus spp., резистентных к амфотерицину В и итраконазолу [Климко Н.Н. Инвазивные микозы: новые возможности лечения // Инфекции и антимикробная терапия - 2004. - Т.6, №.2. - С.71-74]. Разработка новых эффективных и безопасных антимикотиков, действующих на ранее неизвестные биомишени, дает новые возможности клиницистам в борьбе с этими тяжелыми заболеваниями [Lee Yu-Ting, Cui Chang-Jun, Chow Eve W.L., Pue Nason, Lonhienne Thierry, Wang Jian-Guo, Fraser James A., Guddat Luke W. Sulfonylureas Have Antifungal Activity and Are Potent Inhibitors of Candida albicans Acetohydroxyacid Synthase // J. Med. Chem. - 2013. - V.56. - P.210-219].
Из исследованного заявителем уровня техники не выявлены аналоги заявленного технического решения со сходной структурной формулой, однако выявлены аналоги по назначению - препараты, обладающие высокой антимикотической активностью.
Наиболее распространенными в клинической практике антибиотиками по назначению являются флуконазол и тербинафин.
Флуконазол проявляет высокую антимикотическую активность и обладает низкой токсичностью [патент US 4404216. Antifungal 1,3-bis-triazolyl-2-propanol derivative I Pfizer. Inc. - Опубл. - 13.09.1983].
Однако, как уже было отмечено, в последнее время количество флуконазол-резистентных штаммов сильно возросло [Vanden Bossche H., Marichal P., Odds F. Molecular mechanisms of drug resistance in fungi // Trends Microbiol - 1994. -V 2. - P.393-400].
Из исследованного уровня техники выявлен не менее значимый антимикотик тербинафин [патент US 5231183. Antifungal 1,3-bis-triazolyl-2-propanol derivative / Banyu Pharmaceutical Co., Ltd. - Опубл. - 27.07.1993]. Следует отметить, что резистентность к данному препарату у микроорганизмов вырабатывается значительно реже, чем к средствам класса триазолов, однако токсичность последних заметно ниже.
Из исследованного уровня техники заявителем выявлены продукты тиолиза тиофенолом дизамещенного при ацетальном атоме углерода 3,5,8-триоксабицикло[5.1.0]октана, а именно 2,2-диметил-3,5,8-триоксабицикло[5.1.0] октана, которые были описаны японскими авторами еще в 1995 году [Yamada О., Ogasawara К. Lipase-mediated preparation of optically pure four-carbon di- and triols from meso-precursor // Synthesis. - 1995. - N.10. - P.1291-1294]. В указанной работе для разделения полученного рацемического спирта на энантиомеры ими была использована липаза PS (Amano). Однако биологические свойства синтезированных энантиомеров не были исследованы в принципе.
Из уровня техники выявлена известность раскрытия тиофенолом другого дизамещенного производного 3,5,8-триоксабицикло[5.1.0]октана, а именно 3,5,8-триоксаспиро[бицикло[5.1.0]октан-4,1-циклогексана], полученная заявителем [Павельев Р.С., Климовицкий Е.Н., Никитина Л.Е. Синтез изомерных гидроксисульфидов (сульфонов) на основе 3,5,8-триоксаспиро[бицикло[5.1.0]октан-4,1′-циклогексана] // Химия в интересах устойчивого развития. - 2010. - Т.18, №.6. - С.775-781].
Таким образом, полученный 3,5,8-триоксаспиро[бицикло[5.1.0]октан-4,1-циклогексан] также не был исследован заявителем на предмет наличия противогрибковой активности.
Кроме указанного, заявителем выявлена также собственная работа по исследованию реакции тиолиза тиофенолом монофенилзамещенных при ацетальном атоме углерода изомерных 3,5,8-триоксабицикло[5.1.0]октанов [Pavelyev R.S., Gnevashev S.G., Vafina R.M., Gnezdilov О.I., Dobrynin А.В., Lisovskaya S.A., Nikitina L.E., Klimovitsckii E.N. Synthesis and Antimycotic Properties of Hydroxy Sulfides Derived from exo- and endo-4-phenyl-3,5,8-trioxabicyclo[5.1.0]octanes // Mendeleev communications. - 2012. - V.12, №. 3. - P.127-128].
Полученные изомерные бета-гидроксисульфиды (в том числе в энантиочистом виде) были исследованы на предмет наличия противогрибковой активности, которая сильно зависела от структуры синтезированных соединений. Однако минимальные ингибирующие концентрации данных соединений были весьма высоки и не представляли практический интерес с точки зрения наличия перспектив при разработке новых антимикотических средств.
Сам 3,5,8-триоксабицикло[5.1.0]октан был подвергнут тиолизу тиофенолом в присутствии поташа реакцией без растворителя, в ходе которой был получен 6-(фенилтио)-1,3-диоксепан-5-ол, отличающийся от заявленных соединений отсутствием атома галогена в ароматическом кольце [Павельев Р.С. Синтез β-гидрокси (ацетокси) сульфидов и сульфонов на основе 3,5,8-триоксабицикло[5.1.0]октанов: Дис. … канд. хим. наук: 02.00.03: защищена 22.04.2011: утв. 08.07.2011 / Павельев Роман Сергеевич. - Казань, 2011. - 142 с. - Библиогр.: с.127-142].
Данный спирт проявил антимикотическую активность, полностью подавляя рост исследуемых грибов (Candida albicans, Aspergillus fumigatus, Epidermophyton floccosum) в концентрации менее 1 мг/мл, но более 0,5 мг/мл.
Также данный рацемический спирт был разделен на энантиомеры с использованием липазы PS (Amano). Противогрибковые свойства энантиомеров исследованы не были.
Следует отметить, что описанные выше соединения в целом, по мнению заявителя, могут рассматриваться в качестве структурных аналогов к заявленному техническому решению вследствие того, что они относятся к одному и тому же классу соединений - 1,3-диоскепанам и не совпадают с заявляемым техническим решением по характеру заместителей в диоскепановом цикле, которые определяют антимикотические свойства заявленного технического решения.
Задача заявленного технического решения состоит в создании новых низкотоксичных биологически активных соединений с высокой противогрибковой активностью в отношении как мицеллиальных, дрожжеподобных, так и дрожжевых грибов.
Поставленная задача решается путем синтеза противогрибковых веществ общей формулы Ia и Ib:

 , где
, где
при R1=F, R2=H, R3=H
при R1=Br, R2=H, R3=H
при R1=H, R2=Br, R3=H
при R1=H, R2=H, R3=Br
В современной медицине не используются антимикотики с похожими структурами.
Заявляемые вещества на фоне низкой токсичности проявили высокую противогрибковую активность в отношении штаммов грибов Candida albicans, Aspergillus fumigatus, Epidermophyton floccosum, Mucor pusilos, Saccharomyces cerevisiae и могут найти применение в медицине и ветеринарии.
Заявителем не выявлены источники, в которых содержались бы сведения о влиянии отличительных признаков изобретения на достигаемый технический результат. Указанное новое свойство объекта обусловливает, по мнению заявителя, соответствие изобретения критерию «изобретательский уровень».
Представленные в заявленном техническом решении соединения формулы Ia и Ib получали согласно нижеприведенной схеме:
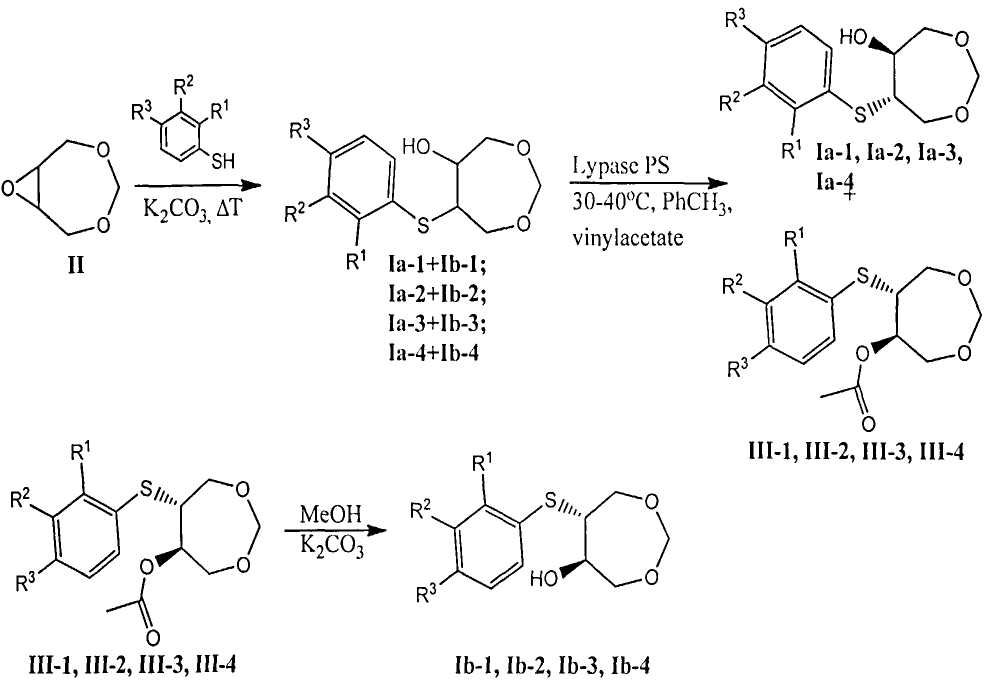
где
|
Характеристики новых соединений приведены в примерах конкретного выполнения. Структуры полученных соединений подтверждены методами масс-спектрометрии, 1H и 13C ЯМР-спектроскопии. Спектры ЯМР регистрировали на приборе Bruker AVANCE-400. Химический сдвиг определялся относительно сигналов остаточных протонов дейтерированных растворителей (1H и 13C). Контроль за ходом реакций и чистотой соединений проводили методом ТСХ на пластинах Sorbfil Plates. Масс-спектры MALDI регистрировались на приборе Ultraflex III компании Bruker, оборудованном твердотельным лазером и время-пролетным анализатором масс. Ускоряющее напряжение 25 кВ. Образцы наносили на мишень Anchor Chip. Запись спектров производили в режиме положительных ионов. Результирующий спектр представлял собой сумму 300 спектров, полученных в разных точках образца. В качестве матриц применяли 2,5-дигидроксибензойную кислоту (DHB) (Acros, 99%) и n-нитроанилин (PNA). Для приготовления матриц использовали хлороформ. Нанесение образцов на мишень проводили методом «высушенных капель».
Углы вращения луча поляризованного света оптически деятельных соединений определяли на поляриметре ADP-440 (B+S) (Британия).
Температуру плавления кристаллических веществ определяли с помощью прибора МРА-100 OptiMelt (Stanford Research Systems).
Для определения энантиомерного избытка (ее) использовали метод ЯМР 1Н-спектроскопии в присутствии шифт-реагента (трис[3-(гептафторпропилгидроксиметилен)-(+)-камфорат] европия (III) фирмы ALDRICH CHEMISTRY), сопоставляя подынтегральную площадь (интенсивность) сигналов атомов водорода при атоме углерода С2 энантиомеров.
Примеры конкретного выполнения заявленного технического решения
Пример 1. Синтез 3,5,8-триоксабицикло[5.1.0]октана (II). К 22.35 г (223 ммоль) 1,3-диоксациклогепт-5-ена и 89 г (1061 ммоль) NaHCO3 в 400 мл пятидесятипроцентного водного ацетона при комнатной температуре добавляли по порциям при перемешивании 178 г (290 ммоль) оксона. Реакционную массу дополнительно перемешивали 1.5 ч. Ход реакции контролировали методом ТСХ. Продукт экстрагировали хлористым метиленом (3×70 мл). Воду насыщали хлоридом натрия и вновь производили экстракцию. Органические фазы объединяли и сушили над сульфатом магния. Растворитель упаривали. Получено 19.18 г бесцветных кристаллов с т.пл. 56-57°C (выход 74%) [лит. Gianni М.Н., Cody R., Asthana M.R. The role of the generalized anomeric effect in the conformational analysis of 1,3-dioxacycloalkanes. Conformational analysis of 3,5-dioxabicyclo[5.1.0]octanes and 3,5,8-trioxabicyclo[5.1.0]octanes // J. Org. Chem. - 1977. - V.42, N.2. - P.365-368].
Пример 2. Синтез рацемического 6-((2-фторфеиил)тио)-1,3-диоксепан-5-ола (Ia-1+Ib-1). Смесь 0.22 г (1.72 ммоль) 2-фтортиофенола, 0.023 г (0.17 ммоль) K2CO3 и 0.2 г (1.72 ммоль) эпоксида II нагревали до появления первых пузырьков, далее нагрев прекращали. Происходило кратковременное (<1 мин) вскипание смеси с резким повышением температуры. Массу охлаждали, продукт очищали методом колоночной хроматографии (элюент - смесь петролейного эфира и этилацетата в соотношении 4:1). Получено 0.38 г бесцветной маслообразной жидкости (выход 90%).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 3.07 уш. с (1H, OH), 3.17 м (1H, H6, 3J(Н6Н5)=5.4 Гц, 3J(H6H7 A)=5.8 Гц, 3J(H6H7 B)=6.3 Гц), 3.65 м (1Н, Н5, 3J(H5H4 A)=2.7 Гц, 3J(H5H4 B)=1.9 Гц), 3.74 м (1H, H4 A, 2J(H4 A, Н4 В)=-12.0 Гц), 3.83 дд (1H, H7 A), 4.04 дд (1H, H7 A, 2J(H7 AH7 B)=-12.4 Гц), 4.09 дд (1H, H4 B), 4.72 д (1H, H2 A, 2J(H2 AH2 B)=-4.4 Гц), 4.73 д (1H, H2 B,), 7.04-7.51 м (4H, 2-FC6H4). ЯМР 13C {H} (100 МГц, CDCl3) δ, м.д.: 54.61 (C6, 4J(FC6)=-1.2 Гц), 65.41 (C7), 66.44 (C4), 71.63 (C5), 94.20 (C2), 116.20 (CAr, 2J=-23.1 Гц), 120.02 (CAr, 2J=-18.0 Гц), 124.75 (CAr, 3J=3.8 Гц), 130.38 (CAr, 3J=8.1 Гц), 135.49 (CAr), 162.59 (CAr, 1J=246.0 Гц). Масс-спектр MALDI: 267 [M+Na]+, 283 [M+K]+.
Пример 3. Синтез рацемического 6-((2-бромфенил)тио)-1,3-диоксепан-5-ола (Ia-2+Ib-2). Синтезируют и очищают аналогично соединению (Ia-1+Ib-1) из 0.2 г (1.72 ммоль) эпоксида II. Получено 0.44 г бесцветной маслообразной жидкости (выход 83%).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 3.01 уш. с (1H, OH), 3.31 м (1H, H6, 3J(H6H5)=5.5 Гц, 3J(H6H7 A)=5.7 Гц, 3J(H6H7 B)=2.7 Гц, 4J(H6H4 A)=-1.2 Гц), 3.72 тд (1H, H5, 3J(H5H4 A)=5.3 Гц, 3J(H5H4 B)=1.5 Гц), 3.78 ддд (1H, H4 A, 2J(H4 A, H4 B)=-12.1 Гц), 3.93 дд (1H, H7 A, 2J(H7 AH7 B)=-12.6 Гц), 4.14 дд (1H, H7 B), 4.14 дд (1H, H4 B), 4.75 д (1H, H2 A, 2J(H2 AH2 B)=-4.6 Гц), 4.76 д (1H, H2 B,), 7.07-7.60 м (4H, 2-BrC6H4). ЯМР 13C {H} (100 МГц, CDCl3) δ, м.д.: 54.17 (C6), 65.21 (C7), 66.51 (C4), 71.51 (C5), 94.42 (C2), 126.70 (CAr), 128.12 (CAr), 128.50 (CAr), 132.03 (CAr), 133.59 (CAr), 135.14 (CAr). Масс-спектр MALDI: 328 [M+Na]+, 344 [M+K]+.
Пример 4. Синтез рацемического 6-((3-бромфенил)тио)-1,3-диоксепан-5-ола (Ia-3+Ib-3). Синтезируют и очищают аналогично соединению (Ia-1+Ib-1) из 0.2 г (1.72 ммоль) эпоксида II. Получено 0.47 г бесцветной маслообразной жидкости (выход 89%).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 2.96 уш. с (1H, OH), 3.24 м (1H, H6, 3J(H6H5)=5.4 Гц, 3J(H6H7 A)=5.8 Гц, 3J(H6H7 B)=2.7 Гц), 3.69 тд (1H, H5,3J(H5H4 A)=5.5 Гц, 3J(H5H4 B)=1.5 Гц), 3.76 дд (1H, H4 A, 2J(H4 AH4 B)=-12.0 Гц), 3.84 дд (1H, H7 A, 3J(H7 AH7 B)=-12.5 Гц), 4.04 дд (1H, H7 B), 4.06 дд (1H, H4 B), 4.73 д (1H, H2 A, 2J(H2 AH2 B)=-4.6 Гц), 4.74 д (1H, H2 B,), 7.13-7.56 м (4H, 3-BrC6H4). ЯМР 13C {H} (100 МГц, CDCl3) δ, м.д.: 54.75 (C6), 65.22 (C7), 66.39 (C4), 71.50 (C5), 94.27 (C2), 122.98 (CAr), 129.86 (CAr), 130.44 (CAr), 130.53 (CAr), 133.86 (CAr). 136.13 (CAr). Масс-спектр MALDI: 328 [M+Na]+, 344 [M+K]+.
Пример 5. Синтез рацемического 6-((4-бромфенил)тио)-1,3-диоксепан-5-ола (Ia-4+Ib-4). Синтезируют и очищают аналогично соединению (Ia-1+Ib-1) из 0.2 г (1.72 ммоль) эпоксида II. Получено 0.48 г бесцветного кристаллического вещества Тпл=58°C (выход 91%).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 3.00 уш. д (1H, OH, 3J(OHH5)=3.5 Гц), 3.20 м (1H, H6, 3J(H6H5)=5.5 Гц, 3J(H6H7 A)=5.9 Гц, 3J(H6H7 B)=2.7 Гц, 4J(H6H4 A)=0.8 Гц), 3.75 уш. м (1H, H5, 3J(H5H4 A)=5.7 Гц), 3.76 м (1H, H4 A, 2J(H4 AH4 B)=-12.1 Гц), 3.83 дд (1H, H7 A, 2J(H7 AH7 B)=-12.5 Гц), 4.05 т (1H, H7 B), 4.06 т (1H, H4 B), 4.73 д (1H, H2 A, 2J(H2 AH2 B)=-4.6 Гц), 4.75 д (1H, H2 B,), 7.27-7.44 м (4H, 4-BrC6H4). ЯМР 13C {H} (100 МГц, CDCl3) δ, м.д.: 54.91 (C6), 65.28 (C7), 66.39 (C4), 71.46 (C5), 94.30 (C2), 121.66 (CAr), 132.36 (CAr), 132.74 (CAr). 133.30 (CAr). Масс-спектр MALDI: 328 [M+Na]+, 344 [M+K]+.
Пример 6. Разделение рацемического 6-((2-фторфенил)тио)-1,3-диоксепан-5-ола (Ia-1+Ib-1) на энантиомеры путем ферментативного ацилирования с использованием липазы PS (Amano).
К раствору 1.00 г (4.09 ммоль) рацемического 6-((2-фторфенил)тио)-1,3-диоксепан-5-ола (Ia-1+Ib-1) в 30 мл тетрагидрофурана или толуола прибавили 0.76 мл (8.19 ммоль) винилацетата и 0.5 г липазы PS, иммобилизованной на диатомите. Смесь перемешивали при 30-40°C в течение двух дней. Липазу отфильтровали, растворитель удалили на вакууме. Продукты разделяли методом колоночной хроматографии (элюент - смесь петролейного эфира и этилацетата в соотношении 7:1).
(5S,6S)-6-((2-фторфенил)тио)-1,3-диоксепан-5-ол (Ia-1).
Получено 0.45 г прозрачного маслообразного вещества (выход 45%) с углом вращения луча поляризованного света [α]24 D=1.2°; ee>99%.
Спектры ЯМР 1H и ЯМР 13C полученного соединения полностью соответствуют рацемическому образцу.
(5R,6R)-6-((2-фторфенил)тио)-1,3-диоксепан-5-ил ацетат (III-1).
Получено 0.54 г бесцветного кристаллического вещества Тпл=51-52°C (выход 46%) с углом вращения луча поляризованного света α=-0.4°; ee>99%.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 2.06 с (3H, CH3); 3.36 м (1H, H6, 3J(H6H5)=5.5 Гц, 3J(H6H7 A)=6.5 Гц, 3J(H6H7 B)=2.1 Гц); 3.87 дд (1H, H7 A, 2J(H7 AH7 B)=-12.3 Гц); 3.89 дд (1H, H4 A, 2J(H4 AH4 B)=-12.7 Гц, 3J(H4 AH5)=5.6 Гц); 4.08 дд (1H, H4 B, 3J(H4 BH5)=2.1 Гц); 4.15 м (1H, H7 B); 4.75 д (1H, H2 A, 2J(H2 AH2 B)=-4.4 Гц); 4.80 д (1H, H2 B); 4.87 тд (1H, H5); 7.08-7.54 м (4H, 2-FC6H4). ЯМР 13C {H} (100 МГц, CDCl3) δ, м.д.: 21.15 (CH3), 51.89 (C6), 65.23 (C7(4)), 65.34 (C4(7)), 73.82 (C5), 94.49 (C2), 116.18 (CAr, 2J=-23.1 Гц), 120.09 (CAr, 2J=-17.8 Гц), 124.76 (CAr, 3J=3.7 Гц), 130.49 (CAr, 3J=8.0 Гц), 135.60 (CAr), 162.69 (CAr, 1J=246.4 Гц), 170.19 (CO). Масс-спектр MALDI: 309 [M+Na]+, 328 [M+K]+.
Пример 7. Синтез (5R,6R)-6-((2-фторфенил)тио)-1,3-диоксепан-5-ола (Ib-1).
К раствору 0.5 г (1.75 ммоль) оптически активного ацетата (III-1) в 20 мл метанола добавили 0.72 г (5.25 ммоль) поташа (K2CO3). Смесь перемешивали 5 часов при комнатной температуре, далее поташ и растворитель удаляли. Продукт очищали методом колоночной хроматографии (элюент - смесь петролейного эфира и этилацетата в соотношении 1:1). Получено 0.40 г прозрачного маслообразного вещества (выход 93%) с углом вращения луча поляризованного света [α]24 D=-1.2°; ее>99%.
Спектры ЯМР 1H и ЯМР 13C полученного соединения полностью соответствуют рацемическому образцу.
Пример 8. Разделение рацемического 6-((2-бромфенил)тио)-1,3-диоксепан-5-ола (Ia-2+Ib-2) на энантиомеры путем ферментативного ацилирования с использованием липазы PS (Amano).
(5S,6S)-6-((2-бромфенил)тио)-1,3-диоксепан-5-ол (Ia-2).
Синтезируют и очищают аналогично соединению (Ia-1) из 1 г (3.28 ммоль) рацемического 6-((2-бромфенил)тио)-1,3-диоксепан-5-ола (Ia-2+Ib-2). Получено 0.41 г прозрачного маслообразного вещества (выход 41%) с углом вращения луча поляризованного света [α]24 D=1.0°; ее>99%.
Спектры ЯМР 1H и ЯМР 13C полученного соединения полностью соответствуют рацемическому образцу.
(5R,6R)-6-((2-бромфенил)тио)-1,3-диоксепан-5-ол ацетат (III-2).
Получено 0.51 г прозрачного маслообразного вещества (выход 45%) с углом вращения луча поляризованного света α=0.2°; ее>99%.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 2.08 с (3H, CH3); 3.46 м (1H, H6, 3J(H6H5)=4.6 Гц, 3J(H6H7 A)=5.3 Гц, 3J(H6H7 B)=2.2 Гц, 4J(H6H4 A)=-1.2 Гц); 3.92 ддд (1H, H4 A, 2J(H4 AH4 B)=-12.8 Гц, 3J(C4 AH5)=4.7 Гц); 3.96 ддд (1H, H7 A, 2J(H7 AH7 B)=-12.3 Гц, 4J(H7 AH5)=-0.8 Гц); 4.13 дд (1H, H4 B, 3J(H4 BH5)=2.0 Гц); 4.18 дд (1H, H7 B); 4.77 д (1H, H2 A, 2J(H2 AH2 B)=-4.4 Гц); 4.82 д (1H, H2 B); 4.92 м (1H, H5); 7.09-7.60 м (4H, 2-BrC6H4). ЯМР 13C {H} (100 МГц, CDCl3) δ, м.д.: 21.13 (CH3), 51.72 (C6), 64.87 (C7(4)), 65.47 (C4(7)), 73.65 (C5), 94.47 (C2), 126.64 (CAr), 128.05 (CAr), 128.55 (CAr), 132.40 (CAr), 133.49 (CAr), 134.97 (CAr), 170.10 (CO). Масс-спектр MALDI: 370 [M+Na]+, 386 [M+K]+.
Пример 9. Синтез (5R,6R)-6-((2-бромфенил)тио)-1,3-диоксепан-5-ола (Ib-2).
Синтезируют и очищают аналогично соединению (Ib-1) из 0.5 г (1.44 ммоль) оптически активного ацетата (III-2). Получено 0.43 г прозрачного маслообразного вещества (выход 98%) с углом вращения луча поляризованного света [α]24 D=-1.0°; ee>99%.
Спектры ЯМР 1H и ЯМР 13C полученного соединения полностью соответствуют рацемическому образцу.
Пример 10. Разделение рацемического 6-((3-бромфенил)тио)-1,3-диоксепан-5-ола (Ia-3+Ib-3) на энантиомеры путем ферментативного ацилирования с использованием липазы PS (Amano).
(5S,6S)-6-((3-бромфенил)тио)-1,3-диоксепан-5-ол (Ia-3).
Синтезируют и очищают аналогично соединению (Ia-1) из 1 г (3.28 ммоль) рацемического 6-((3-бромфенил)тио)-1,3-диоксепан-5-ола (Ia-3+Ib-3). Получено 0.40 г бесцветного кристаллического вещества Тпл=69°C (выход 40%) с углом вращения луча поляризованного света [α]24 D=1.2°; ee>99%.
Спектры ЯМР 1Н и ЯМР 13С полученного соединения полностью соответствуют рацемическому образцу.
(5R,6R)-6-((3-бромфенил)тио)-1,3-диоксепан-5-ол ацетат (III-3).
Получено 0.45 г прозрачного маслообразного вещества (выход 40%) с углом вращения луча поляризованного света α=-0.1°; ee>99%.
Спектр ЯМР 1Н (400 МГц, CDCl3) δ, м.д.: 2.09 с (3H, CH3); 3.45 тд (1H, H6, 3J(H6H5)=5.4 Гц, 3J(H6H7 A)=6.2 Гц, 3J(H6H7 B)=2.3 Гц); 3.84 дд (1H, H7 A, 2J(H7 AH7 B)=-12.3 Гц); 3.87 дд (1H, H4 A, 2J(H4 A H4 B)=-12.3 Гц, 3J(H4 AH5)=5.4 Гц); 4.03 дд (1H, H4 B, 3J(H4 BH5)=2.3 Гц); 4.13 дд (1H, H7 B); 4.74 д (1H, H2 A, 2J(H2 AH2 B)=-4.6 Гц); 4.80 д (1H, H2 B); 4.92 тд (1H, H5); 7.15-7.63 м (4H, 3-BrC6H4). ЯМР 13C {H} (100 МГц, CDCl3) δ, м.д.: 21.07 (CH3), 52.06 (C6), 65.08 (C7(4)), 65.40 (C4(7)). 73.65 (C5), 94.38 (C2), 122.84 (CAr), 129.85 (CAr), 130.37 (CAr), 130.42 (CAr), 133.81 (CAr), 136.07 (CAr), 170.04 (CO). Масс-спектр MALDI: 370 [M+Na]+, 386 [M+K]+.
Пример 11. Синтез (5R,6R)-6-((3-бромфенил)тио)-1,3-диоксепан-5-ола (Ib-3).
Синтезируют и очищают аналогично соединению (Ib-1) из 0.5 г (1.44 ммоль) оптически активного ацетата (III-3). Получено 0.40 г бесцветного кристаллического вещества Тпл=69°C (выход 98%) с углом вращения луча поляризованного света [α]24 D=-1.2°; ee>99%.
Спектры ЯМР 1H и ЯМР 13C полученного соединения полностью соответствуют рацемическому образцу.
Пример 12. Разделение рацемического 6-((4-бромфенил)тио)-1,3-диоксепан-5-ола (Ia-4+Ib-4) на энантиомеры путем ферментативного ацилирования с использованием липазы PS (Amano).
(5S,6S)-6-((4-бромфенил)тио)-1,3-диоксепан-5-ол (IA-4).
Синтезируют и очищают аналогично соединению (Ia-1) из 1 г (3.28 ммоль) рацемического 6-((4-бромфенил)тио)-1,3-диоксепан-5-ола (Ia-4+Ib-4). Получено 0.39 г бесцветного кристаллического вещества Тпл=68°C (выход 39%) с углом вращения луча поляризованного света [α]24 D=1.0°; ee>99%.
Спектры ЯМР 1H и ЯМР 13C полученного соединения полностью соответствуют рацемическому образцу.
(5R,6R)-6-((4-бромфенил)тио)-1,3-диоксепан-5-ол ацетат (III-4).
Получено 0.45 г прозрачного маслообразного вещества (выход 40%) с углом вращения луча поляризованного света α=-0.9°; ee>99%.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 2.09 с (3H, CH3); 3.32 тд (1H, H6, 3J(H6H5)=5.4 Гц, 3J(H6H7 A)=6.1 Гц, 3J(H6H7 B)=2.4 Гц); 3.82 дд (1H, H7 A, 2J(H7 AH7 B)=-12.3 Гц); 3.86 дд (1H, H4 A, 2J(H4 AH4 B)=-12.5 Гц, 3J(H4 AH5)=5.3 Гц); 4.03 дд (1H, H4 B,, 3J(H4 BH5)=2.3 Гц); 4.13 дд (1H, H7 B); 4.73 д (1H, H2 A, 2J(H2 AH2 B)=-4.6 Гц); 4.80 д (1H, H2 B); 4.91 тд (1H, H5); 7.32-7.44 м (4H, 4-BrC6H4). ЯМР 13C {H} (100 МГц, CDCl3) δ, м.д.: 21.13 (CH3), 52.26 (C6), 65.23 (C7(4)), 65.45 (C4(7)), 73.66 (C5), 94.46 (C2), 121.75 (CAr), 132.27 (CAr), 132.68 (CAr), 133.48 (CAr), 170.11 (CO). Масс-спектр MALDI: 370 [M+Na]+, 386 [M+K]+.
Пример 13. Синтез (5R,6R)- 6-((4-бромфенил)тио)-1,3-диоксепан-5-ола (Ib-4).
Синтезируют и очищают аналогично соединению (Ib-1) из 0.5 г (1.44 ммоль) оптически активного ацетата (III-4). Получено 0.37 г бесцветного кристаллического вещества Тпл=68°C (выход 91%) с углом вращения луча поляризованного света [α]24 D=-1.0°; ee>99%.
Спектры ЯМР 1H и ЯМР 13C полученного соединения полностью соответствуют рацемическому образцу.
Методика изучения противогрибковой активности
В связи с разнообразием свойств микроскопических грибов и их различий в адаптивных возможностях, включая существование грибов in vivo, на представителях других царств живых существ, в том числе и на человеке, необходимо использовать тест-штаммы грибов, принадлежащих как к разным классам, так и учитывать их потенциальную способность быть патогенами. Для более полной оценки исследуемых веществ с точки зрения их антимикотических свойств, прогнозирования последствий от их применения и определения областей практического использования нами были предложены наиболее значимые группы грибов с различной физиолого-биохимической активностью, относящиеся к отделам: Zygomycota - низшие грибы (Mucor pusilos), Ascomycota - высшие грибы. Кроме того, поскольку в лабораторных условиях чаще всего выявляют вегетативные формы грибов Ascomycota, для них используют рабочую классификацию, в соответствии с которой эту группу грибов называют дейтеромицеты, которые в свою очередь также делятся на бластомицеты (дрожжи Candida albicans) и на гифомицеты (с септированными гифами - Aspergillus fumigatus, Epidermophyton floccosum). Данные по антимикотической активности по отношению к представленным грибам можно экстраполировать на других представителей соответствующих таксонов ввиду близости их строения и процессов жизнедеятельности.
Исходя из вышеприведенных фактов, исследование противогрибковой активности проводилось на штаммах грибов Candida albicans, Aspergillus fumigatus, Epidermophyton floccosum, Mucor pusilos, которые были выделены из людей, больных микозами. Культивирование грибов осуществляли на жидкой питательной среде Сабуро.
Оценку противогрибковой активности проводили in vitro, методом серийных разведений, основанном на определении величины минимальной ингибирующей концентрации (МИК).
Для изучения фунгицидной активности брали физиологически активные двухсуточные культуры дрожжеподобных грибов и шестисуточные культуры мицелиальных грибов. Далее готовили суспензию грибов в концентрации 1-2 млн./мл. Суспензию вегетативных клеток или споровую суспензию вносили в пробирки со средами, содержащими набор концентраций исследуемых соединений: от 160 мг/мл до 0,1 мг/мл. Инкубировали при температуре 28-30°C в течение 9 суток. В качестве контроля использовали среды в отсутствии препаратов. МИК (минимальную ингибирующую концентрацию) оценивали с помощью фотоэлектрокалориметра при длине волны 530 нм. Показатели сравнивали с показателями поглощения в контрольных пробирках.
Также был использован штамм дрожжей Saccharomyces cerevisiae №Y-830. Клетки дрожжей S. cerevisiae растили на среде YPD до стационарной фазы роста в течение суток при 37°C и 250 об/мин. Определение минимальной ингибирующей концентрации вещества проводили по стандартной методике микроразведений культуры [Wiegand I., Hilpert K., Hancock R.E.W. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances / Nature Protocols. - 2008. - V.3. - pp.163-175]. Культуру разводили до 106 клеток/мл. Стоковая концентрация вещества составляла 90 мг/мл, которая затем разбавлялась в 10 раз и последовательно разводилась двоекратно до 20480 раз от начальной концентрации. Разведения вещества добавлялись в количестве 100 мкл к 100 мкл питательной среды YPD в 96-луночный планшет. В качестве контролей использовалась питательная среда и необработанные клетки. Инкубация происходила при 37°C в течение 24 часов и 250 об/мин. Полученные данные оптической плотности культуры при длине волны 600 нм сопоставляли с контролями и выражали в виде оси ординат на полиномиальном графике, ось абсцисс выражалась в десятичном логарифме концентрации вещества. По графику находили минимальную ингибирующую концентрацию.
В качестве реперных (соединения для сравнения противогрибковой активности) соединений были выбраны известные современные антимикотики - флуконазол и тербинафин.
|
Из представленных в таблице 1 данных следует, что заявленные вещества обладают антимикотическим действием, при этом соединения Ia-3 и Ia-4 ингибируют рост грибов на уровне тербинафииа - одного из самых сильных системных антимикотиков, выявленных заявителем на дату представления заявочных материалов, при этом следует указать на его высокую цитотоксичность.
В таблице 2 приведены данные по шпогоксичности самых активных соединений Ia-2 и Ia-3 на нормальных клетках почки собаки (MDCK) в сравнении с известными антимикотическими препаратами флуконазолом и тербинафином. Эксперимент проводили по следующей методике.
Клетки почки собаки Майдин-Дэрби (линия MDCK) культивировали в полистироловых флаконах в среде DMEM с добавлением 10% эмбриональной сыворотки телят, 2 мМ L-глутамина, 100 мкг/мл стрептомицина и 100 ед./мл пенициллина в CO2-инкубаторе при 37°C, 5% CO2. Клетки выращивали до достижения монослоя и диссоциировали с использованием раствора трипсин-ЭДТА. Плотность клеток в суспензии оценивали на гемоцитометре. Цитотоксичиость определяли с помощью пролиферативного МТТ-теста. Клетки рассеивали в 96-луночный планшет плотностью 1000 клеток в лунке и прекультивировали 12 часов в стандартных условиях. В культуральную среду вносили аликвоту растворов исследуемых веществ в фосфатно-солевом буфере (ФСБ) в разной концентрации и культивировали клетки 3 суток. После инкубации в лунки вносили по 20 мкл реагента МТТ концентрацией 5 мг/мл в DMEM, смесь выдерживали 2 часа, затем культуральную среду заменяли на DMSO и далее измеряли поглощение в лунках при 550 им на планшетном анализаторе Infinite 200 PRO (Tecan). Жизнеспособность клеток, пропорциональную поглощению раствора, выражали в процентах относительно контроля (ФСБ), принимаемого за 100%. Цитотоксичность оценивали по величине концентрации исследуемых веществ, подавляющую рост клеток на 50% (ингибирующая концентрация, IC50).
|
Из представленных в таблице 2 данных следует, что исследуемые вещества в полтора-два раза более токсичны флуконазола и в три-четыре раза менее токсичны тербинафина. Таким образом, синтезированные 6-(арилтио)-1,3-диоксепан-5-олы представляют интерес при разработке новых малотоксичных противогрибковых средств, т.к. заявленное техническое решение обладает более приемлемой терапевтической широтой действия.
Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, т.к. заявленная совокупность выполняемых действий, приводящих к реализации поставленной цели, не выявлена из исследованного уровня техники.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям, т.к. позволяет разрешить не разрешенную до даты подачи настоящих заявочных материалов проблему по созданию эффективных и безопасных антимикотиков.
Заявленное техническое решение соответствует критерию «промышленная применимость», предъявляемому к изобретениям, т.к. выполненные опыты показали возможность промышленного применения для получения в промышленности антимикотических средств, основанных на заявленном техническом решении.
Противогрибковые соединения на основе производных 3,5,8-триоксабицикло[5.1.0]октана, полученные транс-раскрытием его эпоксидного цикла, а именно 6-(арилтио)-1,3-диоксепан-5-олы в рацемическом и энантиочистом виде общей формулы Ia и Ib , гдепри R=F, R=H, R=Hпри R=Br, R=H, R=Hпри R=H, R=Br, R=Hпри R=H, R=H, R=Br![ПРОТИВОГРИБКОВЫЕ СОЕДИНЕНИЯ НА ОСНОВЕ ПРОИЗВОДНЫХ 3,5,8-ТРИОКСАБИЦИКЛО[5.1.0]ОКТАНА](https://fips.edrid.ru/images/rid/22/76/78/06f12c377b29306e153c7b842b068284.png)
![ПРОТИВОГРИБКОВЫЕ СОЕДИНЕНИЯ НА ОСНОВЕ ПРОИЗВОДНЫХ 3,5,8-ТРИОКСАБИЦИКЛО[5.1.0]ОКТАНА](https://fips.edrid.ru/images/rid/22/76/78/1fa11cc71e3183f9e8d7f40a9260055f.png)

