Результат интеллектуальной деятельности: ПРЕПАРАТЫ ИНГИБИТОРЫ ТРОМБООБРАЗОВАНИЯ
Вид РИД
Изобретение
Уведомление об авторском праве
[0001] Часть материалов настоящего патента, раскрывающих данное изобретение, являются объектом авторского права. Собственник авторского права не имеет возражений против воспроизведения информации, раскрытой в изобретении, согласно описанию в заявке на патент в Ведомство по патентам и товарным знакам США, в иных случаях все авторские права защищены.
Уровень техники
Область изобретения
[0002] Данное изобретение относится к препаратам, ингибирующим формирование тромбов.
Описание известного уровня техники
[0003] Такие тромботические заболевания, как инфаркт миокарда и инфаркт головного мозга, лидируют в списке заболеваний по частоте случаев заболеваемости, сложности заболевания и показателям смертности. Стеноз и тромбоз коронарной артерии или мозговой артерии возникают в результате атеросклероза и являются следствием повторных повреждений кровеносных сосудов. Когда кровеносные сосуды страдают от повреждений, тромбоциты, которые прикрепляются к стенке сосуда на месте повреждения, продуцируют аденозиндифосфат (АДФ) и тромбоксан A2 (TpA2), образуемые в результате метаболизма мембранного фосфолипида. Эти два включения активируют тромбоциты, которые циркулируют, и затем активированные тромбоциты агрегируют для формирования тромба с наличием фибриногена. Повреждение кровеносных сосудов также активирует систему коагуляции, и образованный тромбин способствует дальнейшей агрегации тромбоцитов, формируется фибрин, и после включения фибрина стабильность артериального тромба повышается. Препараты антитромбоцитарного действия ингибируют процесс формирования тромбов, препятствуя адгезии, агрегации и высвобождению тромбоцитов, тем самым играя важную роль в профилактике и лечении тромботических заболеваний.
[0004] Трифлузал является антиагрегантным препаратом и обладает высокой эффективностью для профилактики и лечения тромботических заболеваний и осложнений в сравнении с ацетилсалициловой кислотой (аспирин), поскольку трифлузал одновременно оказывает угнетающее действие на циклооксигеназу и цАМФ фосфодиэстеразу и эффективно ингибирует агрегацию тромбоцитов. В то же время, трифлузал в терапевтических дозах оказывает слабое воздействие на биосинтез простациклина, риск кровотечений также минимальный. Проведенные исследования подтверждают отсутствие различий в применении трифлузала и аспирина для профилактики тяжелых сердечно-сосудистых осложнений у больных с облитерирующими заболеваниями периферических артерий, однако частота осложнений при применении трифлузала значительно ниже.
[0005] Клопидогрел широко применяется в качестве антиагрегантного препарата. Механизм антиагрегационного действия препарата обусловлен его способностью вызывать необратимые изменения рецептора АДФ P2Y12 и селективно ингибировать агрегацию тромбоцитов, которая вызывается АДФ, а также агрегацию, вызываемую коллагеном и тромбином. Широко известно, что по сравнению с аспирином клопидогрел является более эффективным. Считается, однако, что клопидогрел не обладает преимуществами, поскольку не представлены их официальные доказательства. Для пациентов с высоким риском коронарных цереброваскулярных событий или заболеваний периферийных артерий, которым противопоказан аспирин в небольших дозах, клопидогрел (75 мг в сутки) является хорошей альтернативой.
Резюме изобретения
[0006] Целью изобретения является создание препаратов ингибиторов тромбообразования.
[0007] Дополнительные преимущества и признаки данного изобретения будут ясны из приведенного ниже описания. Они могут быть осуществлены с использованием средств и комбинаций, которые, в частности, раскрываются в прилагаемой формуле изобретения.
[0008] Поставленная цель достигается тем, что фармацевтическая композиция препаратов содержит в качестве действующего вещества трифлузал и клопидогрел бисульфат, при этом массовое соотношение трифлузала и клопидогрела бисульфата составляет (100-650):(30-150).
[0009] В качестве действующего вещества предлагается трифлузал и клопидогрел бисульфат в массовом соотношении (100-600):(30-100), предпочтительно (100-600):(50-100).
[0010] В качестве действующего вещества предлагается трифлузал и клопидогрел бисульфат в массовом соотношении (100-600):(92-104), предпочтительно (300-600):(92-104).
[0011] В качестве действующего вещества предлагается трифлузал и клопидогрел бисульфат в массовом соотношении (250-650):(50-150).
[0012] Предлагается предпочтительное массовое соотношение трифлузала и клопидогрела (285-315):(95-105).
[0013] Предлагается предпочтительное массовое соотношение трифлузала и клопидогрела (570-630):(95-105).
[0014] В качестве действующего вещества предлагается трифлузал и клопидогрел бисульфат в массовом соотношении (1-20):1, предпочтительно (3-6):1, и более предпочтительно 3:1 или 6:1.
[0015] В качестве действующего вещества предлагается трифлузал и клопидогрел бисульфат в массовом соотношении (300-600): 98±5%, предпочтительно 300:97,875 или 600:97,875.
[0016] Предлагается разовая терапевтическая доза вышеназванных препаратов с содержанием действующего вещества в количестве 130-800 мг, предпочтительно 130-700 мг.
[0017] Предлагается разовая терапевтическая доза вышеназванных препаратов с содержанием 100-600 мг трифлузала и 30-100 мг клопидогрела бисульфата, предпочтительно 100-600 мг трифлузала и 50-100 мг клопидогрела бисульфата.
[0018] Предлагается разовая терапевтическая доза вышеназванных препаратов с содержанием 100-600 мг трифлузала и 92-104 мг клопидогрела бисульфата, предпочтительно 300-600 мг трифлузала и 92-104 мг клопидогрела бисульфата.
[0019] Предлагается разовая терапевтическая доза вышеназванных препаратов с содержанием 285-315 мг трифлузала и 95-105 мг клопидогрела бисульфата, предпочтительно 300 мг трифлузала и 100 мг клопидогрела бисульфата.
[0020] Предлагается разовая терапевтическая доза вышеназванных препаратов с содержанием 570-630 мг трифлузала и 95-105 мг клопидогрела бисульфата, предпочтительно 600 мг трифлузала и 100 мг клопидогрела бисульфата.
[0021] Предлагаются препараты для перорального применения.
[0022] Предлагаемые препараты изготавливаются в форме таблеток, капсул, гранул и сухой суспензии.
[0023] В качестве вспомогательного компонента в препаратах предлагается не менее одного из группы веществ, содержащих микрокристаллическую целлюлозу, натриевый карбоксиметил крахмал, декстрин, лактозу, стеарат магния.
[0024] Препараты применяются в лечении кардиоваскулярных и цереброваскулярных поражений, причиной которых может быть агрегация тромбоцитов. Кардиоваскулярные и цереброваскулярные поражения представляют собой не менее одного заболевания из группы, включающей стенокардию, тромбоз коронарных артерий и церебральную эмболию. [0025] Препараты применяются в качестве средств, ингибирующих агрегацию тромбоцитов и/или тромбообразование.
[0026] Кроме того, предусматриваются другие усовершенствования, которые раскрываются в последующем описании и чертежах.
[0027] Эти и другие цели, признаки и преимущества данного изобретения будут ясны из приведенного ниже подробного описания, приложенных чертежей и формулы изобретения.
Краткое описание чертежей
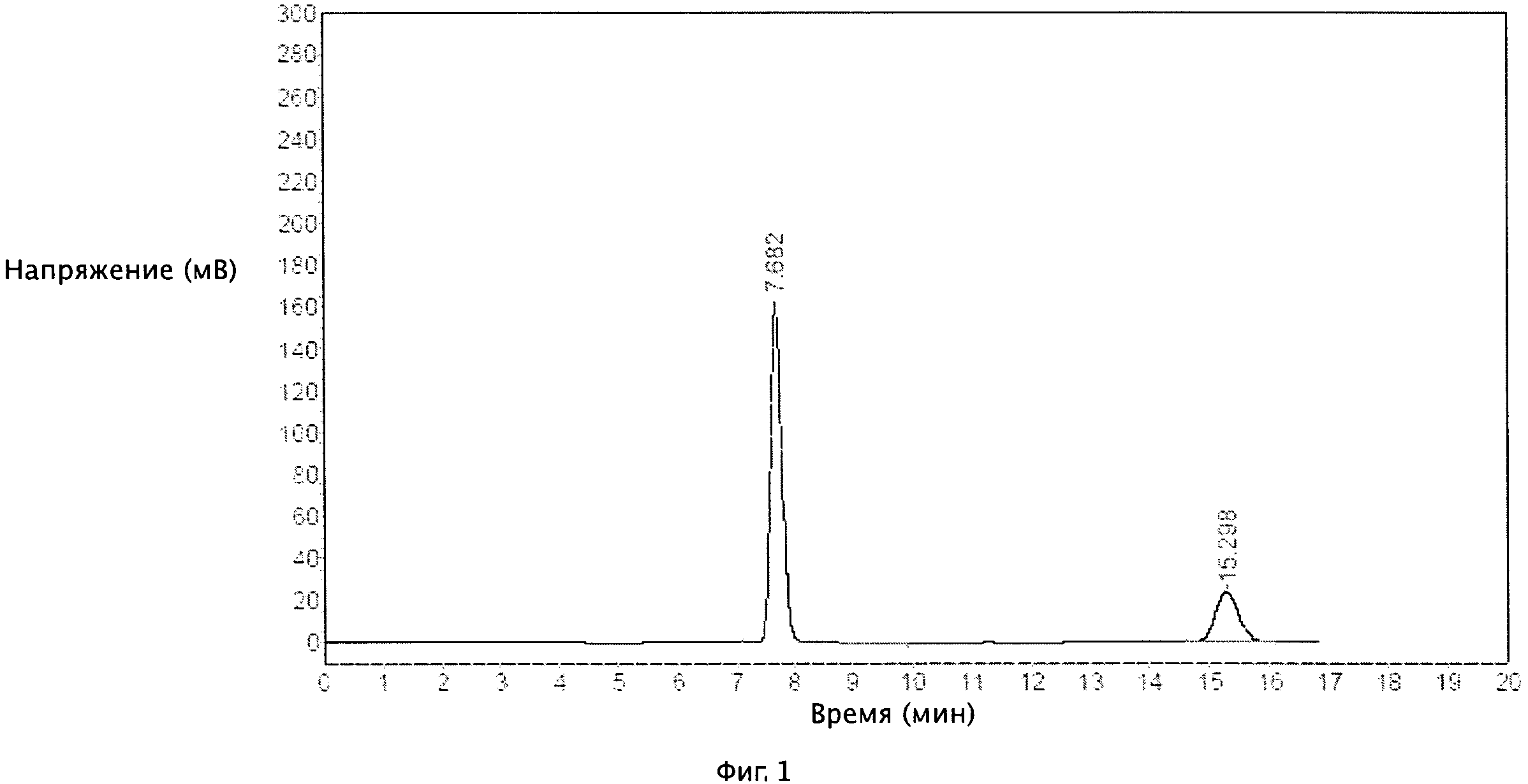
[0028] На Фиг.1 изображена спектральная диаграмма пробного экземпляра II.
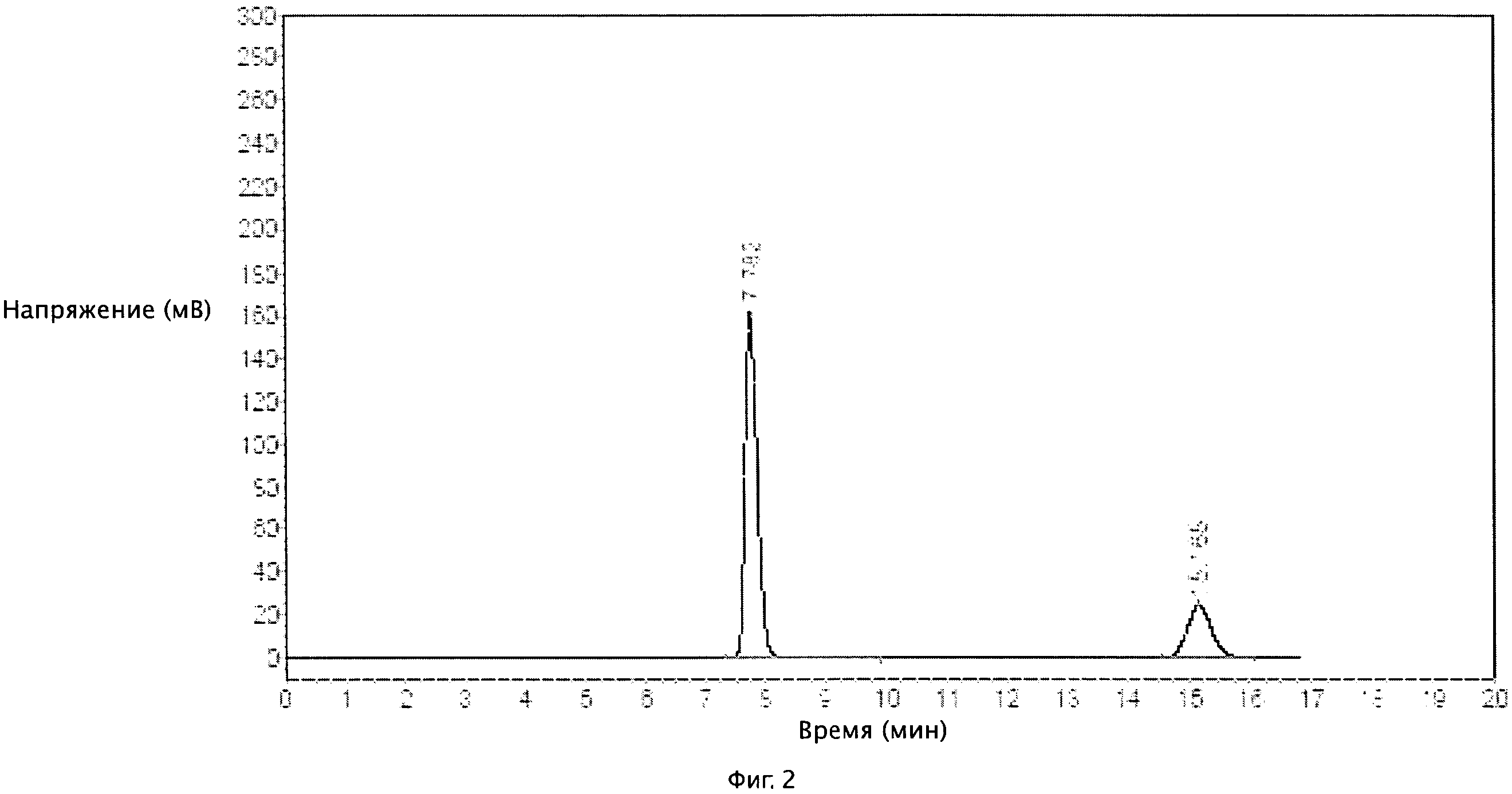
[0029] На Фиг.2 изображена спектральная диаграмма контрольного пробного экземпляра II.
Подробное описание предпочтительного варианта осуществления изобретения
[0030] Из приведенного ниже описания специалистам вполне понятны способы осуществления и применение данного изобретения. Из предлагаемых в следующем ниже описании предпочтительных вариантов осуществления изобретения специалистам ясно, что возможны эти и другие варианты осуществления изобретения. Нижеизложенные общие принципы следует применять к другим вариантам осуществления и применения данного изобретения, его альтернативам, модификациям и эквивалентам в пределах сущности и объема изобретения.
[0031] Приведенные ниже экспериментальные методы, использованные в предлагаемом варианте осуществления изобретения, являются общепринятыми, если не указано иначе. Компоненты препарата приобретаются в торгующих биохимическими реактивами организациях, если не указано иначе. Символ “%” обозначает процентное массовое соотношение, если не указано иначе.
[0032] Трифлузал, клопидогрел и клопидогрел бисульфат получены в центре разработок компании Dalian Tianyu Haibin Pharmaceutial Co., Ltd.
[0033] Вариант осуществления изобретения 1: Ингибирующее действие препаратов данного изобретения на формирование тромбов и агрегацию тромбоцитов.
[0034] Во-первых, ниже приводится описание ингибирующего действия препаратов на тромбообразование у крыс-альбиносов.
[0035] Эксперименты проводились на 130 крысах-альбиносах серии SD, из которых 65 самцов и 65 самок, с массой тела 300-400 г.130 крыс были разделены на 13 групп, по 10 особей в каждой. В Группе 1, которая являлась контрольной, применялся физиологический раствор; в другой контрольной группе, Группе 2, применялся комбинированное средство из трифлузала и клопидогрела в массовом соотношении трифлузал:клопидогрел 1:1; в Группе 3 вводились препараты данного изобретения с массовым соотношением трифлузала и клопидогрела бисульфата 20:1; в Группе 4 применялись препараты данного изобретения с массовым соотношением трифлузал:клопидогрел бисульфат 12:1; в Группе 5 применялись препараты данного изобретения с массовым соотношением трифлузал:клопидогрел бисульфат 6:1; в Группе 6 применялись препараты данного изобретения с массовым соотношением трифлузал:клопидогрел бисульфат 3:1; в Группе 7 применялись препараты данного изобретения с массовым соотношением трифлузал:клопидогрела бисульфата 1:1; в Группе 8 применялся только трифлузал; в Группе 9 только клопидогрел бисульфат; в Группе 10 применялись препараты с массовым соотношением трифлузал:клопидогрел 20:1; в Группе 11 применялись препараты с массовым соотношением трифлузала и клопидогрела 12:1; в Группе 12 применялись препараты с массовым соотношением трифлузала и клопидогрела 6:1; в Группе 13 применялись препараты с массовым соотношением трифлузала и клопидогрела 3:1.
[0036] Методика проведения эксперимента: внутрижелудочное введение, при котором в контрольной Группе 1 вводился физиологический раствор одинаковой массы, а в других группах вводились препараты в соответствии с вышеизложенным. Ввод препаратов осуществлялся в течение пяти дней, один раз в сутки, дозировка составляла 10 мг препарата на 1 кг массы тела крысы (для комбинированных препаратов общая масса всех ингредиентов составляла 10 мг).
[0037] Через час после последнего введения препаратов на пятый день их применения проводилось измерение веса крысы и анестезия инъекцией 3% этаминал-натрия в дозировке 1 мл /кг массы тела. Подопытная крыса находилась в положении на спине, проводился разрез посередине шеи, выделялась трахея, а также сонная артерия и яремная вена. Шелковая нить длиной 6 см заводилась через полиэтиленовый катетер, который затем наполнялся физиологическим раствором с гепарином. Когда один конец полиэтиленового катетера помещался в яремную вену с левой стороны, проводилась инъекция гепарина в яремную вену для антиагрегантного действия. Затем второй конец полиэтиленового катетера помещался в сонную артерию с правой стороны. Кровоостанавливающий зажим «бульдог» открывался, и проводилось артериовенозное шунтирование для прямого соединения артерии с веной. Кровообращение поддерживалось в течение 15 минут, затем шунтирующий катетер удалялся, шелковая нить с тромбом также извлекалась. Шелковая нить с тромбом аккуратно помещалась в маленькую чашку Петри, вес которой был известен. Измерение сырого веса проводилось на аналитических весах. Общий сырой вес за вычетом веса шелковой нити составлял вес тромба. Коэффициент ингибирования тромбообразования (%)=(вес тромба в контрольной группе, в которой применялся физиологический раствор - вес тромба в экспериментальной группе, в которой применялись лекарства или препараты данного изобретения) / вес тромба в контрольной группе, в которой применялся физиологический раствор× 100%.
[0038] Таблица 1 Сравнение веса тромба в экспериментальных группах (χ±s).
|
[0039] Следует отметить, что контрольная группа, в которой применялся физиологический раствор, взята для сравнения, значение ∗∗Р составляет менее 0,01.
[0040] Можно сделать вывод, что трифлузал, клопидогрел и клопидогрел бисульфат могут взаимодействовать друг с другом в соединении и препятствовать формированию тромбов.
При одинаковом соотношении 1:1 результаты в группе 7, в которой вводились трифлузал и клопидогрел бисульфат, были лучше, чем в группе 2, в которой вводились трифлузал и клопидогрел. При других одинаковых соотношениях результаты в группах, в которых вводились трифлузал и клопидогрел бисульфат, были лучше, чем в группах, в которых применялся трифлузал и клопидогрел. Предпочтительное соотношение трифлузал:клопидогрел 6:1 или 3:1. Результаты в группах, в которых вводились трифлузал и клопидогрел бисульфат, были лучше, чем в группах, в которых вводились только трифлузал или только клопидогрел бисульфат.
[0041] Во-вторых, ниже приводится описание антиагрегантного действия препаратов на тромбоциты у крыс-альбиносов (метод нефелометрии).
[0042] Эксперименты проводились на 130 крысах-альбиносах серии SD, из которых 65 самцов и 65 самок, с массой тела 300-400 г.130 крыс были разделены на 13 групп, по 10 особей в каждой. В Группе 1, которая являлась контрольной, применялся физиологический раствор; в другой контрольной группе, Группе 2, применялся комбинированное средство из трифлузала и клопидогрела в массовом соотношении трифлузал:клопидогрел 1:1; в Группе 3 вводились препараты данного изобретения с массовым соотношением трифлузала и клопидогрела бисульфата 20:1; в Группе 4 применялись препараты данного изобретения с массовым соотношением трифлузал:клопидогрел бисульфат 12:1; в Группе 5 применялись препараты данного изобретения с массовым соотношением трифлузал:клопидогрел бисульфат 6:1; в Группе 6 применялись препараты данного изобретения с массовым соотношением трифлузал:клопидогрел бисульфат 3:1; в Группе 7 применялись препараты данного изобретения с массовым соотношением трифлузал:клопидогрел бисульфат 1:1; в Группе 8 применялся только трифлузал; в Группе 9 только клопидогрел бисульфат; в Группе 10 применялись препараты с массовым соотношением трифлузала и клопидогрела 20:1; в Группе 11 применялись препараты с массовым соотношением трифлузала и клопидогрела 12:1; в Группе 12 применялись препараты с массовым соотношением трифлузала и клопидогрела 6:1; в Группе 13 применялись препараты с массовым соотношением трифлузала и клопидогрела 3:1.
[0043] Методика проведения эксперимента: внутрижелудочное введение, при котором в контрольной Группе 1 вводился физиологический раствор одинаковой массы, а другим группам вводились препараты в соответствии с вышеизложенным. Ввод препаратов осуществлялся в течение семи дней, один раз в сутки, дозировка составляла 10 мг препарата на 1 кг массы тела крысы (для комбинированных препаратов общая масса всех ингредиентов составляла 10 мг).
[0044] Через полчаса после последнего введения препаратов на седьмой день их применения осуществлялся забор образца крови из артерии задней камеры глаза крысы. В качестве антикоагулянта в образец добавлялся 0,13% цитрат натрия. Кровь забиралась в силиконовую пробирку, пробирка закрывалась пластмассовой пленкой. Силиконовую пробирку переворачивали 3-4 раза для лучшего перемешивания крови и антикоагулянта. Кровь, осажденная на внутренней поверхности силиконовой пробирки, удалялась с помощью чистой фильтровальной бумаги, после чего пробирка герметично упаковывалась. Кровь в пробирке центрифугировали в течение 10 мин со скоростью 1000 об/мин, поверхностный слой крови аккуратно удалялся, и оставшаяся плазма подвергалась повторному центрифугированию в течение 20 мин со скоростью 2000 об/мин, в результате чего прозрачный раствор на дне был бедной тромбоцитами плазмой БТП. Подсчитывалось количество тромбоцитов в обогащенной тромбоцитами плазме ОТП и доводилось до 200×109/л при помощи бедной тромбоцитами плазмы БТП. 450 мкл бедной тромбоцитами плазмы БТП и обогащенной тромбоцитами плазмы ОТП набирались силиконовой пипеткой и помещались в непрозрачную пробирку соответственно. Перед проведением измерения светопропускание графического регистратора устанавливалось на 100 с помощью образца БТП. Образец ОБП затем помещался в измерительную камеру, и затем светопропускание устанавливалось на 10. Опускалась электромагнитная мешалка, проводился предварительный нагрев в течение 3 мин при 37°С. Открывался графический регистратор, в ОБП добавлялась АДФ (аденозиндифосфат) в качестве индуктора агрегации тромбоцитов. Агрегометр CHROND-Log использовался для расчета максимальной активности агрегации тромбоцитов (%) с помощью кривой агрегации, где Amax=h1/h0×100%. Коэффициент ингибирования агрегации тромбоцитов=[(Amax в группе, где вводился физиологический раствор - Amax в экспериментальной группе, где вводилось лекарственное средство) / Amax в группе, где вводился физиологический раствор] х100%. Результаты показаны в Таблице 2.
[0045] Таблица 2. Влияние на агрегацию тромбоцитов в экспериментальных группах (χ±s).
|
|
[0046] Следует отметить, что контрольная группа, в которой в которой применялся физиологический раствор, взята для сравнения, значение ∗∗Р составляет менее 0,01.
[0047] Результаты в группах, в которых вводились трифлузал и клопидогрел бисульфат, были лучше, чем в группах, в которых применялся только трифлузал или клопидогрел. При одинаковом соотношении результаты в группах, в которых вводились трифлузал и клопидогрел бисульфат, были лучше, чем в группах, в которых вводились трифлузал и клопидогрел.
[0048] В-третьих, изучалась стабильность препаратов данного изобретения.
[0049] Экспериментальные экземпляры готовились в приведенном ниже массовом
соотношении.
[0050] Пробный экземпляр I: массовое соотношение трифлузал:клопидогрел бисульфат 1:1.
[0051] Пробный экземпляр II: массовое соотношение трифлузал:клопидогрел бисульфат 3:1.
[0052] Пробный экземпляр III: массовое соотношение трифлузал:клопидогрел бисульфат 6:1.
[0053] Пробный экземпляр IV: массовое соотношение трифлузал:клопидогрел бисульфат 12:1.
[0054] Пробный экземпляр V: массовое соотношение трифлузал:клопидогрел бисульфат 20:1.
[0055] Контрольный пробный экземпляр I: массовое соотношение трифлузал:клопидогрел 1:1.
[0056] Контрольный пробный экземпляр II: массовое соотношение трифлузал:клопидогрел бисульфат 3:1.
[0057] Контрольный пробный экземпляр III: массовое соотношение трифлузал:клопидогрел бисульфат 6:1.
[0058] Контрольный пробный экземпляр IV: массовое соотношение трифлузал:клопидогрел бисульфат 12:1.
[0059] Контрольный пробный экземпляр V: массовое соотношение трифлузал:клопидогрел бисульфат 20:1.
[0060] 10 г образцов вышеуказанных пробных экземпляров были помещены в медицинский пластиковый контейнер, где хранились в течение шести месяцев при температуре 40°С±2°С и влагоемкости 75%±5%. Осуществлялся контроль внешнего вида и массы действующего вещества в 0-м, 1-м, 3-м и 6-м месяцах эксперимента. Действующее вещество измерялось с помощью метода высокоэффективной жидкостной хроматографии, где колонка содержала сорбент с цианогруппой, подвижной фазой были метанол-вода-триэтиламин (соотношение объемов 500:500:2, рН доводилось до 3,8 с помощью фосфорной кислоты), скорость потока 1 мл/мин, детектирование 235 нм, температура колонки 35°С, объем пробы 20 мкл. При указанных условиях, обе комбинации, клопидогрел бисульфат с трифлузалом и клопидогрел с трифлузалом, могли быть полностью разделены благодаря хорошим сепарационным свойствам. Массовая концентрация клопидогрела бисульфата 12,0~100,0 мг/л соответствовала площади пика, при этом уравнение регрессии составило А=0,176С+0,0474r=0.9995.Массовая концентрация клопидогрела 9,2~75,9 мг/л соответствовала площади пика, при этом уравнение регрессии составило А=0,191С+0,0584r=0,9997. Массовая концентрация трифлузала 38,4~320,0 мг/л соответствовала площади пика, при этом уравнение регрессии составило А=0,2991С+0,9882r=0,9997. Выход клопидогрела бисульфата, клопидогрела и трифлузала составил 99,7±1,80%, 99,2±1.01%, 100,2±0,81% соответственно, и для проведения измерений клопидогрела бисульфата, клопидогрела и трифлузала использовался метод ВЭЖХ. Время удерживания клопидогрела бисульфата, клопидогрела и трифлузала 15,298 мин, 15,65 мин и 7,682 мин соответственно. На Фиг.1 показана спектральная диаграмма пробного экземпляра II, на Фиг.2 показана спектральная диаграмма контрольного пробного экземпляра II. Результаты приведены в Таблице 3 и Таблице 4.
[0061] Таблица 3. Остаточная масса клопидогрела бисульфата и трифлузала в препаратах в разное время (В таблице ниже, А: трифлузал; В: клопидогрел бисульфат; С: клопидогрел).
|
[0062] Таблица 4. Остаточная масса клопидогрела и трифлузала в препаратах в разное время (В таблице ниже, А: трифлузал; В: клопидогрел бисульфат; С: клопидогрел).
|
[0063] Результаты показали, что для каждого массового соотношения при комнатной температуре стабильность комбинированного лекарственного средства из трифлузала и клопидогрела бисульфата была выше, чем комбинированного лекарственного средства из трифлузала и клопидогрела.
[0064] Вариант осуществления изобретения 2: приготовление и применение лекарственных средств (капсула) для лечения кардиоваскулярных и цереброваскулярных поражений.
[0065] (1) Изготовление капсулы с трифлузалом и клопидогрелом бисульфатом.
[0066] 100 г трифлузала и 30 г клопидогрела бисульфата равномерно смешивались, в смесь добавляли 2 г стеарата магния, равномерно смешивали, затем полученной смесью наполняли и изготавливали 1000 капсул.
[0067] (2) Изготовление капсулы с трифлузалом и клопидогрелом бисульфатом. [0068] 600 г трифлузала и 100 г клопидогрела равномерно смешивались, в смесь добавляли нужное количество декстрина, равномерно смешивали, затем полученной смесью наполняли и изготавливали 1000 капсул.
[0069] (3) Изготовление капсулы с трифлузалом и клопидогрелом.
[0070] 300 г трифлузала и 75 г клопидогрела равномерно смешивались, в смесь добавляли 120 г карбоксиметил крахмала и 5 г стеарата магния, равномерно смешивали, затем полученной смесью наполняли и изготавливали 1000 капсул.
[0071] (4) Изготовление капсулы с трифлузалом и клопидогрелом.
[0072] 600 г трифлузала и 75 г клопидогрела равномерно смешивались, в смесь добавляли нужное количество декстрина, равномерно смешивали, затем полученной смесью наполняли и изготавливали 1000 капсул.
[0073] (5) Изготовление капсулы комбинированного лекарственного средства с трифлузалом и клопидогрелом.
[0074] 300 г трифлузала, 97.875 г клопидогрела бисульфата, 100 г карбоксиметил крахмала и 2.1 г стеарата магния равномерно смешивали, затем полученной смесью наполняли и изготавливали 1000 капсул.
[0075] Вариант осуществления изобретения 3: изготовление лекарственных средств (таблетка) для лечения кардиоваскулярных и цереброваскулярных поражений.
[0076] (1) Изготовление таблетки, содержащей 600 мг трифлузала и 97.9 мг клопидогрела бисульфата.
[0077] 97.9 мг клопидогрела бисульфата и 2 мг безводного коллоидного диоксида кремния смешивали, в смесь добавляли 30 мг прежелатинизированного кукурузного крахмала и 20 мг безводной лактозы и равномерно смешивали, в полученную смесь добавляли 600 мг трифлузала и 30 мг микрокристаллической целлюлозы, после чего осуществлялся процесс таблетирования для изготовления конечной таблетированной продукции.
[0078] (2) Изготовление таблетки комбинированного лекарственного средства из трифлузала и клопидогрела бисульфата.
[0079] 300 г трифлузала и 97.875 г клопидогрела бисульфата равномерно смешивались, в смесь добавляли 150 г микрокристаллической целлюлозы и 10 г сетчатого поливинилпирролидона, полученная смесь измельчалась и размягчалась этанолом. Просеивание через сито 60 для гранулирования, сушка при 50°С. Просеивание через сито 60. В полученную смесь добавляли 10 г натриевого карбоксиметил крахмала, 2 г аспартама и 30 г стеарата магния и равномерно смешивали. После процесса таблетирования изготавливали 1000 таблеток.
[0080] (3) Изготовление таблетки комбинированного лекарственного средства из трифлузала и клопидогрела бисульфата.
[0081] 600 г трифлузала, 97,875 г клопидогрела бисульфата, подходящее количество крахмала и небольшое количество стеарата магния равномерно смешивались. Смесь сразу подвергалась таблетированию для изготовления 1000 таблеток.
[0082] Промышленное применение.
[0083] В данном изобретении предлагаются препараты для лечения кардиоваскулярных и цереброваскулярных поражений. Действующим веществом препаратов является трифлузал и клопидогрел бисульфат, которые взаимодействуют в процессе применения. Результаты экспериментов продемонстрировали, что действие трифлузала и клопидогрела бисульфата по ингибированию тромбообразования и агрегации тромбоцитов намного эффективнее, чем трифлузала и клопидогрела (контрольный), а также намного эффективнее, чем при применении только трифлузала или клопидогрела бисульфата. Шестимесячное наблюдение показало, что стабильность комбинированного лекарственного средства из трифлузала и клопидогрел бисульфата была выше, чем комбинированного лекарственного средства из трифлузала и клопидогрела.