Результат интеллектуальной деятельности: СПОСОБ КУЛЬТИВИРОВАНИЯ ДВУСТВОРЧАТЫХ МОЛЛЮСКОВ
Вид РИД
Изобретение
Изобретение относится к марикультуре, в частности к способам культивирования двустворчатых моллюсков с планктонной личинкой.
Многие виды двустворчатых моллюсков имеют большое экономическое значение. Они являются важными промысловыми объектами, имеющими большую ценность в качестве деликатесных пищевых продуктов. Кроме того, двустворчатые моллюски имеют большое экологическое значение. Взрослые особи являются биофильтраторами, и оголение участков дна в результате антропогенных воздействий может приводить к усилению последствий техногенных загрязнений в водных (как пресноводных, так и морских) экосистемах. Личинки двустворчатых моллюсков составляют до 70% зоопланктона, таким образом, являясь важным звеном водных пищевых цепей. Большое значение это имеет для роста молоди и нагула массы промысловых видов рыб, обитающих в прибрежной шельфовой зоне. Очевидно, что продуктивность плантации зависит как от количества особей, так и от скорости их роста. Пополнение молодью литоральных популяций двустворчатых моллюсков крайне нестабильно при сильной зависимости от абиотических и биотических факторов среды. В дополнение к колебаниям температуры и солености нередки вспышки бактериальных и вирусных инфекций, приводящие к массовой гибели моллюсков и наносящие значительный урон экологии и промысловой индустрии. Также среди факторов, влияющих на численность двустворок, можно отметить различные химические загрязняющие вещества. Одним из способов, позволяющих быстро восстанавливать численность популяций двустворчатых моллюсков как в природе, так и на промысловых фермах, является искусственное оплодотворение и культивация моллюсков до момента их выседания.
Известен способ экологического культивирования двустворчатого моллюска Ruditapes philippinarum. Для повышения уровня выживаемости и одновременного ускорения метаморфоза у личинок в воду с культурой добавляют сок чеснока (Заявка КНР, №101347105, A01K61/00; A61K36/8962; A61P43/00, опубл. 21.01.2009).
Недостатками данного способа являются сравнительно небольшой эффект действия сока чеснока на выживаемость личинок, небольшой прирост в скорости метаморфоза, общее время культивирования изменяется не существенно, не обнаруживается личинок особо крупного размера.
Известен способ культивирования моллюсков, включающий размещение моллюсков в ваннах, получение яиц и спермы от родительских животных, помещение оплодотворенных яйцеклеток в ванны, где ведут выращивание личинок. Весь процесс культивирования ведут в морской воде, освобожденной от бактерий (обеззараживание) и взвесей. Для обеззараживания используют последовательность различных антибиотиков. Антибиотики берут из группы, состоящей из polymyxin B, хлорамфеникола, ампициллина, эритомицина, chlortetracycline, неомицина, стрептомицина и gentamycin (п. США, №4532883, A01K61/00, опубл. 06.08.1985).
Недостатком данного способа является необходимость проведения всего процесса культивирования в воде, обеззараженной различными антибиотиками. Процесс культивирования является длительным, сложным, требует последовательного использования большого числа различных антибиотиков. Цель использования антибиотиков - уничтожение бактерий, при этом неизвестно, каким образом используемые антибиотики действуют на личинок моллюсков.
Наиболее близким к заявляемому способу культивирования двустворчатых моллюсков является способ культивирования гребешка, включающий сбор и содержание в искусственных условиях взрослых особей гребешка, стимулирование нереста, оплодотворение яиц, содержание развивающихся яиц до момента выплыва личинок в морской воде с присутствием неомицина, перидический отбор и ресуспендирование личинок по отдельным емкостям, доращивание личинок в морской воде низкой температуры (15оС) с последующей высадкой на субстрат (п. США, №5144907, A01K61/00, опубл. 08.09. 1992).
К недостаткам данного способа следует отнести:
- содержание только оплодотворенных яиц в морской воде с присутствием неомицина не приводит к ускорению развития и уменьшению срока культивирования личинок;
- неомицин, присутствующий в морской воде, используемой только после оплодотворения личинок, выполняет функцию вещества, предотвращающего развитие бактерий и микроорганизмов, и при этом не оказывает никакого влияния на культивируемые организмы;
- длительный срок культивирования личинок, более 30 суток;
- личинок отбирают и периодически ресуспендируют в глубокие емкости, что приводит к травмированию личинок и уменьшению их количества;
- низкая плотность культуры (2 личинки на 1 мл), используемая в способе, в конечном результате делает данный способ неэффективным, поскольку требует больших объемов специально обработанной морской воды и емкостей большого объема;
- необходимость поддержания низкой температуры в течение всего срока культивирования.
Задачей, на решение которой направлено заявляемое изобретение, является повышение эффективности выращивания личинок морских двустворчатых моллюсков в плотной культуре посредством одновременного повышения выживаемости личинок и ускорения процесса их развития за счет воздействия на естественные механизмы физиологической регуляции активности нейронов личинки.
Поставленная задача решается тем, что в известном способе культивирования двустворчатых моллюсков, включающем сбор и содержание в искусственных условиях взрослых моллюсков, стимулирование нереста, оплодотворение яиц, содержание развивающихся яиц до момента выплыва личинок, отбор и рассаживание личинок по отдельным емкостям, доращивание личинок в морской воде, включая стадии бластулы, велигера и педивелигера, и высадку на субстрат, согласно изобретению при доращивании личинок со стадии велигера до стадии педивелигера, т.е. на стадии велигера, в морскую воду добавляют неомицин в количестве 30-50 мкмоль/л.
В качестве двустворчатых моллюсков могут быть использованы виды с планктонной личинкой, в частности разные виды мидий, устриц, морских гребешков. Использование при доращивании личинок на стадии велигера морской воды, содержащей неомицин в количестве 30-50 мкмоль/л, оказывает воздействие на нервные клетки личинки, приводя к увеличению содержания пептида FMRFамида, вследствие чего происходит ускорение развития личинок и увеличение числа выживших личинок. В конечном результате это приводит к снижению продолжительности сроков культивирования и повышению эффективности культивирования двустворчатых моллюсков.
Добавление в морскую воду при культивировании личинок на стадии велигера неомицина в количестве большем 50 мкмоль/л является неэффективным, так как возрастает расход неомицина, а количество выживших личинок и срок их культивирования существенно не меняются.
Культивирование личинок на стадии велигера в морской воде, содержащей неомицин в количестве меньшем 30 мкмоль/л не приводит к существенному изменению содержания пептида FMRFамида в нейронах личинки, не наблюдается сокращения времени развития личинок. В результате снижения продолжительности культивирования не происходит, кроме того, наблюдается высокая смертность личинок при высокой плотности культуры.
С целью дальнейшего увеличения количества выживающих личинок на ранних сроках культивирования, для личинок от стадии бластулы до стадии велигера целесообразно повышать соленость морской воды до 40-42 ‰. В этом случае снижается содержание серотонина в нейронах личинки, что приводит к повышению их выживаемости даже при высокой плотности содержания.
Однако культивирование личинок от стадии бластулы до стадии велигера в морской воде, имеющей соленость более 42‰ недопустимо, так как вызывает повышенную гибель личинок, а снижение солености морской воды менее 40 ‰ неэффективно, так как существенно не влияет на содержание серотонина в нейронах личинки, а, следовательно, не обеспечивает выживаемость личинок со стадии бластулы до стадии велигера в достаточной степени.
Заявленный способ иллюстрируется следующими примерами.
Пример 1
Отбирают в море 30 половозрелых мидий и помещают их в 5 л емкость с морской водой, имеющей температуру 8оС, и аэрируют. Через 8 часов производят стимуляцию выметывания половых продуктов путем замены воды в емкости на подогретую до температуры 25оС морскую воду (термошок). Начало выметывания половых продуктов контролируют визуально в течение 1 часа. После начала выметывания половых продуктов по визуальным признакам определяют пол особей. Точный контроль пола производится путем исследования половых продуктов под микроскопом проходящего света. Самцов и самок распределяют отдельно по одной особи по емкостям со свежей водой объемом 200 мл и температурой 20оС. В течение 30 мин ожидают полного выметывания половых продуктов. Полученную первичную суспензию половых продуктов (отдельно яйцеклетки, отдельно сперматозоиды) процеживают через сито с ячеей 100 мкм. Оплодотворение производят в 10 л емкостях с морской водой нормальной солености (33‰) и высотой столба воды 10 см, при температуре 20оС. На 10 л взвеси яйцеклеток плотностью около 500 яйцеклеток/мл3 добавляют порционно 100 мкл взвеси спермы (приблизительно 15000 сперматозоидов/10 мкл3) при плавном перемешивании. Все дальнейшее развитие проводят при 20оС. Через 12 часов после оплодотворения всплывших личинок собирают с поверхности емкости, аккуратно зачерпывая верхний слой воды стеклянным стаканом (200 мл), и перемещают в 5 л стеклянные стаканы с морской водой, в которых личинок содержат в течение 6 дней (со стадии выплыва до стадии велигера) при плотности около 1000 личинок/10 мл. Перемешивание столба воды осуществляют при помощи механической мешалки (10 об/мин). Смену воды производят каждые третьи сутки, концентрируя личинок с помощью сита с ячеей газа 30 мкм. Кормление личинок начинают на третий день после выплыва добавлением раствора водорослей (Isochrisis) из расчета 100 мкл плотной культуры на 5 л каждый день. Через 6 дней культивирования при очередной смене воды добавляют неомицин до концентрации 50 мкмоль/л. Дальнейшее развитие проводят в воде с неомицином 50 мкмоль/л. Кормление проводят смесью водорослей (Isochrisis и Dunaliella). Смену воды с неомицином производят каждые третьи сутки, концентрируя личинок с помощью сита с ячеей газа 60 мкм. Через 12 дней культивирования, когда большинство личинок достигают стадии педивелигера, перемешивание личинок мешалкой прекращают, личинок собирают и с помощью сита с ячеей газа 60 мкм и высаживают на субстрат.
Количество выживших личинок в 7 раз превышает контроль, средний размер личинок на 20% больше чем в воде без неомицина, личинки достигали стадии педивелигера на 6 дней раньше, чем личинки, культивировавшиеся в воде без неомицина. Относительная яркость нейронов, содержащих серотонин, у личинок при выращивании в воде с неомицином была на 10% ниже, а содержащих FMRFамид на 23% выше, чем у личинок, культивировавшихся в воде без неомицина.
Пример 2
Отбирают в море 30 половозрелых гребешков Свифта и производят стимуляцию выметывания половых продуктов путем инъекции серотонина в мантийную полость (1 мг/мл, 5 мл на 1 кг моллюска). Начало выметывания половых продуктов контролируют визуально в течение 1 часа. После начала выметывания половых продуктов по визуальным признакам определяют пол особей. Точный контроль пола производится путем исследования половых продуктов под микроскопом проходящего света. Самцов и самок распределяют отдельно по одной особи по емкостям со свежей водой объемом 500 мл и температурой 20оС. В течение 30 мин ожидают полного выметывания половых продуктов. Полученную первичную суспензию половых продуктов (отдельно яйцеклетки, отдельно сперматозоиды) процеживают через сито с ячеей 100 мкм. Оплодотворение производят в 10 л емкостях с морской водой нормальной солености (33‰) и высотой столба воды 10 см. На 10 л взвеси яйцеклеток плотностью около 500 яйцеклеток/мл3 добавляют порционно 100 мкл взвеси спермы (приблизительно 15000 сперматозоидов/10 мкл3) при плавном перемешивании. Все дальнейшее развитие проводят при 20оС. Через 12 часов после оплодотворения всплывших личинок собирают с поверхности емкости, аккуратно зачерпывая верхний слой воды стеклянным стаканом (200 мл), и перемещают в 5 л стеклянные стаканы с морской водой с повышенной соленостью 42‰, в которых личинок содержат в течение 6 дней (со стадии выплыва до стадии велигера) при плотности около 1000 личинок/10 мл. Перемешивание столба воды осуществляют при помощи механической мешалки (10 об/мин). Смену воды производят каждые третьи сутки, концентрируя личинок с помощью сита с ячеей газа 30 мкм. Кормление личинок начинают на третий день после выплыва добавлением раствора водорослей (Isochrisis) из расчета 100 мкл плотной культуры на 5 л каждый день. Через 6 дней культивирования при очередной смене воды воду с соленостью 42‰ заменяют на воду с соленостью 33 промилле, в которую добавляют неомицин до концентрации 50 мкмоль/л. Дальнейшее развитие проводят в воде с соленостью 33‰ с неомицином 50 мкмоль/л. Кормление проводят смесью водорослей (Isochrisis и Dunaliella). Смену воды с неомицином производят каждые третьи сутки, концентрируя личинок с помощью сита с ячеей газа 60 мкм. Через 12 дней культивирования, когда большинство личинок достигают стадии педивелигера, перемешивание личинок мешалкой прекращают, личинок собирают и с помощью сита с ячеей газа 60 мкм и высаживают на субстрат.
Количество личинок, выживших при выращивании в воде с соленостью 42‰, а затем в воде соленостью 33‰ с неомицином, в 4 раза больше, их средний размер на 12% больше, личинки достигали стадии педивелигера на 5 дней раньше, чем личинки, культивировавшиеся в воде соленостью 33‰ без неомицина. Относительная яркость нейронов, содержащих серотонин, у личинок при описанном способе выращивания была на 11% ниже, а содержащих FMRFамид на 17% выше, чем у личинок, культивировавшихся в воде без неомицина.
Пример 3
Берут 30 половозрелых устриц и помещают на 8 часов в 5 л морской воды с температурой 8оС и аэрацией. Через 8 часов производят стимуляцию выметывания половых продуктов путем замены воды в емкости на подогретую до температуры 25оС морскую воду (термошок). Начало выметывания половых продуктов контролируют визуально в течение 1 часа. После начала выметывания половых продуктов по визуальным признакам определяют пол особей. Точный контроль пола производится путем исследования половых продуктов под микроскопом проходящего света. Самцов и самок распределяют отдельно по одной особи по емкостям со свежей водой объемом 500 мл и температурой 20оС. В течение 30 мин ожидают полного выметывания половых продуктов. Полученную первичную суспензию половых продуктов (отдельно яйцеклетки, отдельно сперматозоиды) процеживают через сито с ячеей 100 мкм. Оплодотворение производят в 10 л емкостях с морской водой нормальной солености (33 промилле) и высотой столба воды 10 см. На 10 л взвеси яйцеклеток плотностью около 500 яйцеклеток/мл3 добавляют порционно 100 мкл взвеси спермы (приблизительно 15000 сперматозоидов/10 мкл3) при плавном перемешивании. Все дальнейшее развитие проводят при 20оС. Через 12 часов после оплодотворения всплывших личинок собирают с поверхности емкости, аккуратно зачерпывая верхний слой воды стеклянным стаканом (200 мл), и перемещают в 5 л стеклянные стаканы с морской водой с повышенной соленостью 42 ‰, в которых личинок содержат в течение 6 дней (со стадии выплыва до стадии велигера) при плотности около 1000 личинок/10 мл. Перемешивание столба воды осуществляют при помощи механической мешалки (10 об/мин). Смену воды производят каждые третьи сутки, концентрируя личинок с помощью сита с ячеей газа 30 мкм. Кормление личинок начинают на третий день после выплыва добавлением раствора водорослей (Isochrisis) из расчета 100 мкл плотной культуры на 5 л каждый день. Через 6 дней культивирования при очередной смене воды воду с соленостью 42 ‰ заменяют на воду с соленостью 33 ‰, в которую добавляют неомицин до финальной концентрации 30 мкмоль/л. Дальнейшее развитие проводят в воде с соленостью 33 ‰ с неомицином 30 мкмоль/л. Кормление проводят смесью водорослей (Isochrisis и Dunaliella). Смену воды с неомицином производят каждые третьи сутки, концентрируя личинок с помощью сита с ячеей газа 60 мкм. Через 12 дней культивирования, когда большинство личинок достигают стадии педивелигера, перемешивание личинок мешалкой прекращают, личинок собирают и с помощью сита с ячеей газа 60 мкм и высаживают на субстрат. В описанном примере количество личинок, выживших при выращивании в воде с неомицином, было в 3 раза больше, их средний размер был на 12% больше, чем в воде без неомицина, личинки достигали стадии педивелигера на 3 дня раньше, чем личинки, культивировавшиеся в воде без неомицина. Относительная яркость нейронов, содержащих серотонин, у личинок при описанном способе выращивания была на 5% ниже, а содержащих FMRFамид на 10% выше, чем у личинок, культивировавшихся в воде без неомицина.
Пример 4
Берут 30 половозрелых мидий и помещают на 8 часов в 5 л морской воды с температурой 8оС и аэрацией. Через 8 часов производят стимуляцию выметывания половых продуктов путем замены воды в емкости на подогретую до температуры 25оС морскую воду (термошок). Начало выметывания половых продуктов контролируют визуально в течение 1 часа. После начала выметывания половых продуктов по визуальным признакам определяют пол особей. Точный контроль пола производится путем исследования половых продуктов под микроскопом проходящего света. Самцов и самок распределяют отдельно по одной особи по емкостям со свежей водой объемом 200 мл и температурой 20оС. В течение 30 мин ожидают полного выметывания половых продуктов. Полученную первичную суспензию половых продуктов (отдельно яйцеклетки, отдельно сперматозоиды) процеживают через сито с ячеей 100 мкм. Оплодотворение производят в 10 л емкостях с морской водой нормальной солености (33 ‰) и высотой столба воды 10 см при температуре 20оС. На 10 л взвеси яйцеклеток плотностью около 500 яйцеклеток/мл3 добавляют порционно 100 мкл взвеси спермы (приблизительно 15000 сперматозоидов/10 мкл3) при плавном перемешивании. Все дальнейшее развитие проводят при 20оС. Через 12 часов после оплодотворения всплывших личинок собирают с поверхности емкости, аккуратно зачерпывая верхний слой воды стеклянным стаканом (200 мл), и перемещают в 5 л стеклянные стаканы с морской водой с повышенной соленостью 40 ‰, в которых личинок содержат в течение 6 дней (со стадии выплыва до стадии велигера) при плотности около 1000 личинок/10 мл. Перемешивание столба воды осуществляют при помощи механической мешалки (10 об/мин). Смену воды производят каждые третьи сутки, концентрируя личинок с помощью сита с ячеей газа 30 мкм. Кормление личинок начинают на третий день после выплыва, добавлением раствора водорослей (Isochrisis) из расчета 100 мкл плотной культуры на 5 л каждый день. Через 6 дней культивирования при очередной смене воды добавляют неомицин до финальной концентрации 50 мкМ. Дальнейшее развитие проводят в воде с неомицином 50 мкМ. Кормление проводят смесью водорослей (Isochrisis и Dunaliella). Смену воды с неомицином производят каждые третьи сутки, концентрируя личинок с помощью сита с ячеей газа 60 мкм. Через 12 дней культивирования, когда большинство личинок достигают стадии педивелигера, перемешивание личинок мешалкой прекращают, личинок собирают и с помощью сита с ячеей газа 60 мкм и высаживают на субстрат. В описанном примере количество личинок, выживших при выращивании в воде с неомицином, было в 10 раз больше, их средний размер был на 25% больше, чем в воде без неомицина, личинки достигали стадии педивелигера на 7,5 дней раньше, чем личинки, культивировавшиеся в воде без неомицина. Относительная яркость нейронов, содержащих серотонин, у личинок при описанном способе выращивания была на 15% ниже, а содержащих FMRFамид на 25% выше, чем у личинок, культивировавшихся в воде без неомицина.
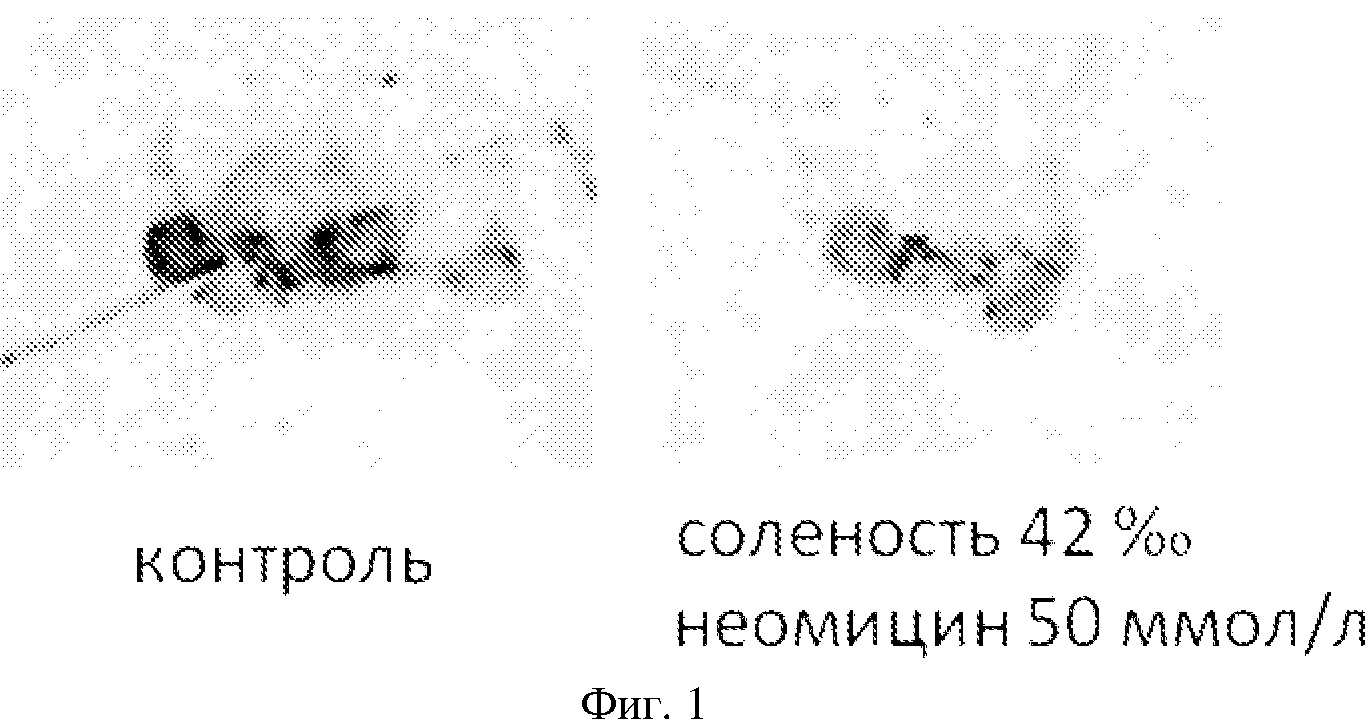
Заявленный технический результат также иллюстрируются чертежами 1-5 и таблицей. На фиг. 1 показаны апикальные нейроны личинки мидии, культивированной по Примеру 4. Нейроны окрашены антителами против серотонина. Видно, что яркость окрашивания, и, следовательно, содержание серотонина существенно ниже у личинок, культивированных в воде соленостью 40‰ с 50 мкмоль/л неомицина.
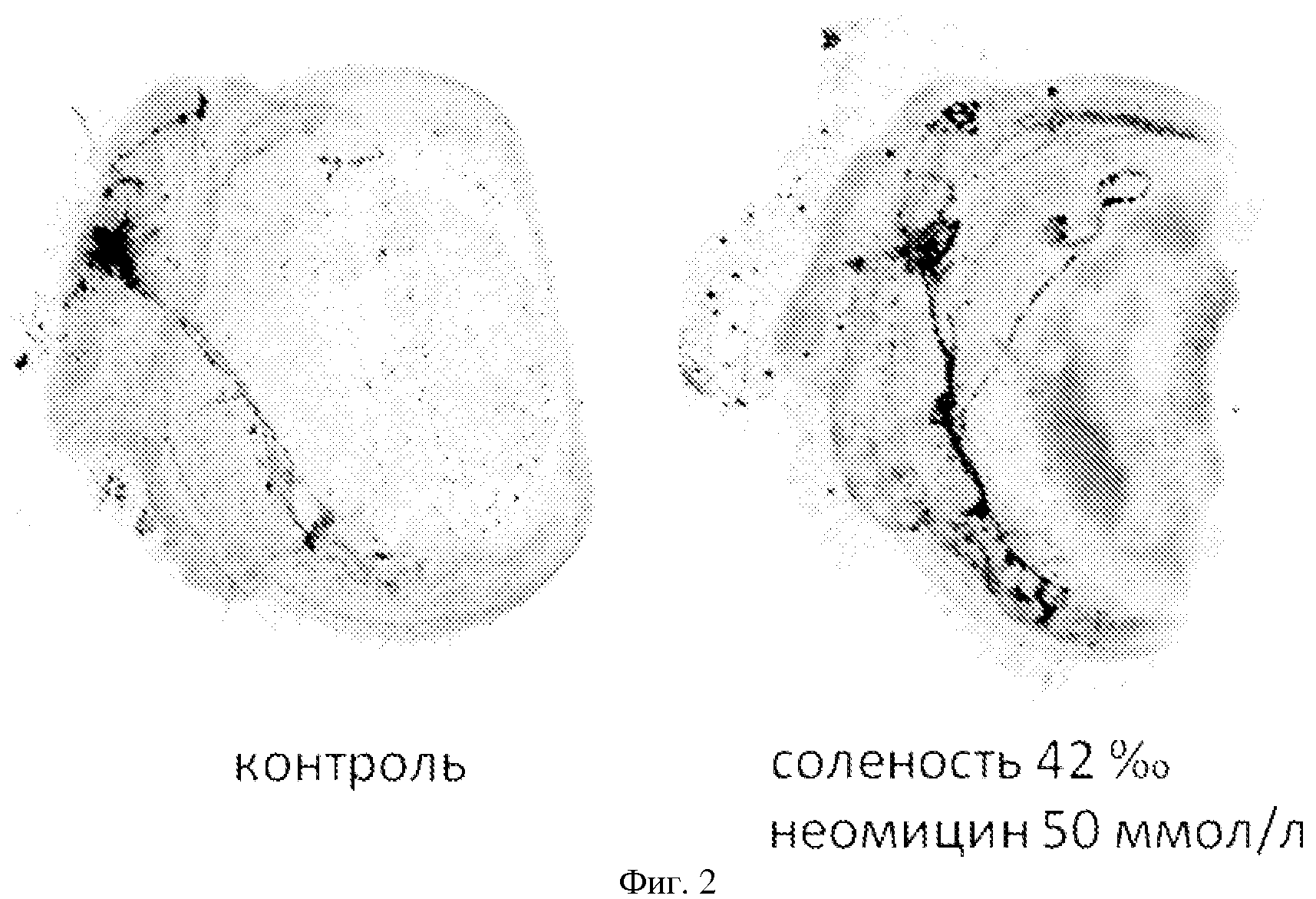
На фиг. 2 показана нервная система личинки мидии, культивированной по Примеру 4. Нейроны окрашены антителами против пептида FMRFамида. Видно, что яркость окрашивания и количество выявленных нервных отростков, и, следовательно, содержание FMRFамида, существенно выше у личинок, культивированных в воде соленостью 40‰ с 50 мкмоль/л неомицина.
На фиг. 3 представлен график выживаемости личинок мидии при культивировании в воде различной солености. Видно, что количество личинок в воде с соленостью 40‰ в 2,5 раза больше, чем в воде с соленостью 33‰.
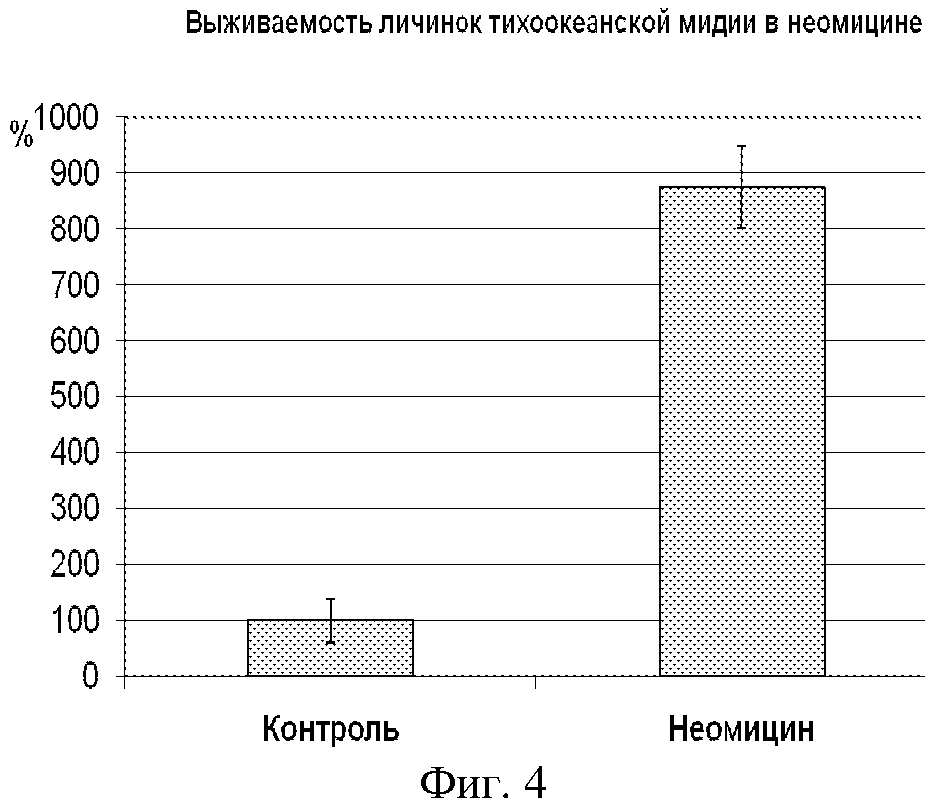
На фиг. 4 представлен график выживаемости личинок мидии при культивировании в воде с 50 мкмоль/л неомицина. Видно, что количество личинок в воде с неомицином в 8,5 раз больше, чем в контроле (без неомицина).
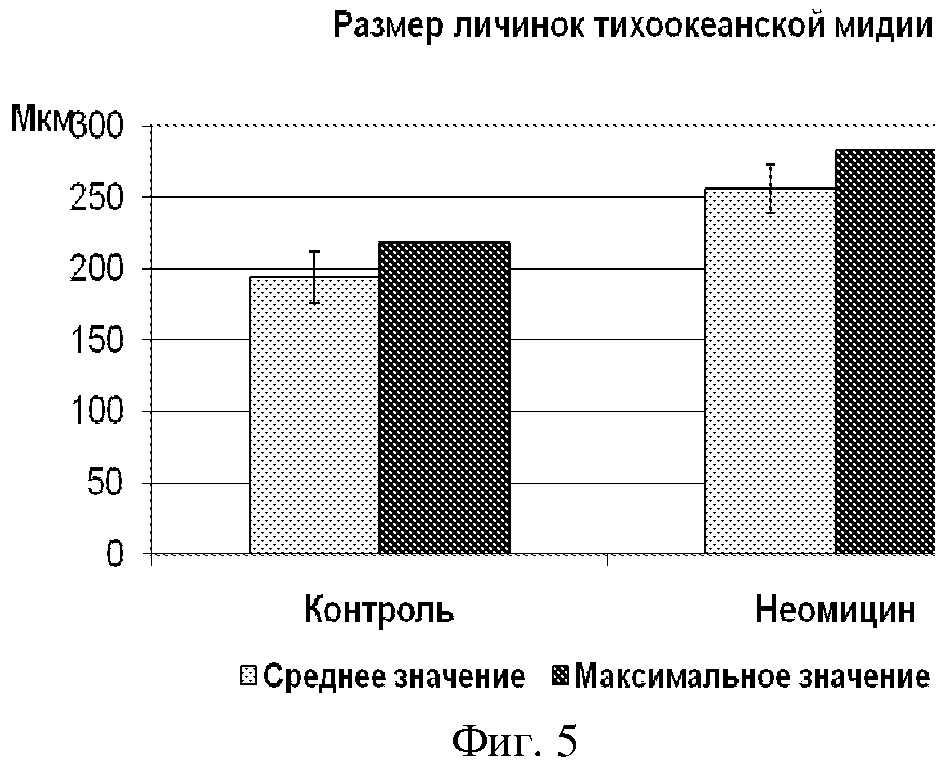
На фиг. 5 представлен график размеров личинок мидии при культивировании в воде с 50 мкмоль/л неомицина. Видно, что средний размер личинок в воде с неомицином на 62 мкм (32%), а максимальный на 89 мкм больше, чем у контрольных (культивировавшихся в воде без неомицина).
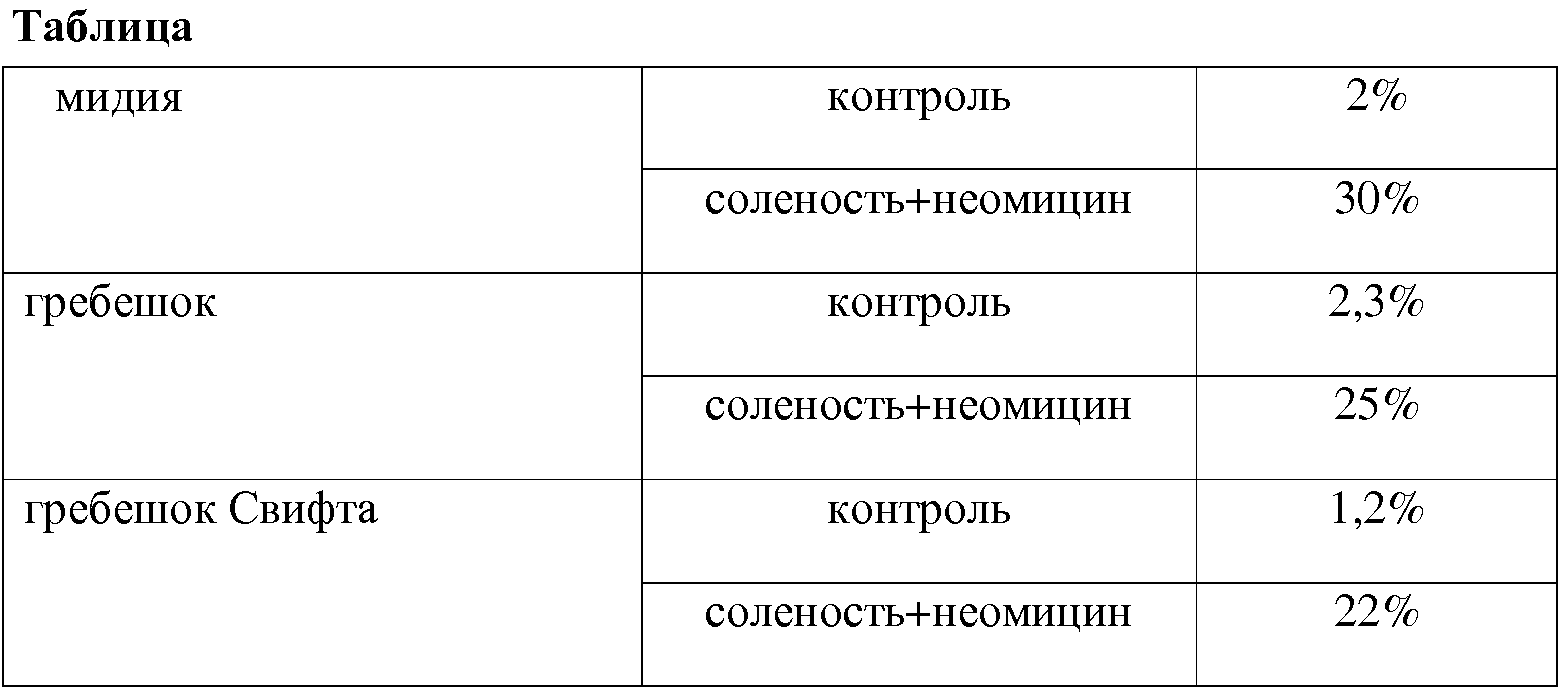
В Таблице показан процент личинок, достигших стадии педивелигера (готовой к оседанию личинки), у различных двустворчатых моллюсков на 17 день развития. Видно, что процент готовых к оседанию личинок у всех трех видов моллюсков в 7-18 раз больше, чем при культивировании в воде нормальной солености без неомицина.
Таким образом, представленные иллюстрации не только подтверждают результаты, полученные в примерах 1-4, но и наглядно демонстрируют, что добавление неомицина в морскую воду при доращивании личинок со стадии велигера до стадии педивелигера, а также дополнительное использование морской воды с повышенной соленостью 40-42‰ со стадии бластулы до стадии велигера, оказывают значительное влияние на содержание медиаторов серотонина и FMRFамида в нейронах личинки, что приводит к увеличению выживаемости и увеличению среднего размера личинок. В конечном результате, повышается продуктивность и уменьшается продолжительность культивирования личинок с момента оплодотворения до момента их высадки на субстрат.