СПОСОБ ИЗУЧЕНИЯ ФЛУОРЕСЦЕНТНЫХ СВОЙСТВ И СПЕКТРАЛЬНЫХ ХАРАКТЕРИСТИК НУКЛЕОТИДНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ДНК С ПОМОЩЬЮ КВАНТОВО-СВЯЗАННОГО СПЕКТРА ИЗЛУЧЕНИЯ КРАСИТЕЛЕЙ СО СВОБОДЫМИ ФЛУОРОФОРНЫМИ ГРУППАМИ
Вид РИД
Изобретение
Область техники
Изобретение относится к сфере молекулярной генетики и квантовой биофизики клетки и предназначено для выявления флуоресцентных свойств последовательностей ДНК в широком диапазоне спектра света, включая ультрафиолетовую, видимую и инфракрасную области. Изобретение может найти применение в фундаментальных исследованиях спектральной природы митогенетического излучения и роли изменений нуклеотидных перестроек концевых областей теломерной ДНК в процессе активации деления клетки. В связи с этим заявленный способ позволяет изучать механизмы спектрального кодирования пролиферативной информации в клетке. Его применение для исследования генных последовательностей позволяет понять механизмы квантового насыщения геноструктур как способа лазерно-оптической записи и спектрального кодирования наследственной информации.
Заявленный способ лежит в основе ДНК-спектрального флуоресцентного анализа - нового направления исследований в биологии и медицине. Он может применяться в диагностике и лечебных целях для получения сведений о влиянии изменений длины и нуклеотидных окончаний теломерных оверхенгов на интенсивность и спектральные характеристики световой энергии, регулирующей деление клетки. Способ может применяться для составления спектральных карт и цветовых маркеров результирующей флуоресценции участков генов, их регуляторных элементов и целых генных последовательностей (генное картирование), участков хромосом, целых хромосом и всего генома в целом (хромосомное и геномное картирование). В указанном смысле изобретение позволяет проводить спектральную диагностику точечных мутаций генов, хромосомных перестроек и любых изменений кариотипа и генома клетки. При этом проникновение в механизмы спектрального кодирования генетической информации предоставляет уникальные возможности для воздействия на него с помощью физических источников света или флуоресцентных молекул.
Уровень техники
Общепринятые сведения о флуоресценции ДНК базируются на представлении о том, что она слабоинтенсивная и располагается в ультрафиолетовой области спектра. Поглощающие свойства ДНК в основном определяются максимумом поглощения азотистых оснований в ближнем ультрафиолете (260 нм). Излучательные свойства ДНК также определяются свойствами входящих в их состав оснований. Основной вклад во флуоресценцию ДНК вносят пурины. В водном растворе максимум флуоресценции ДНК приходится на пик эмиссии гуанина (358 нм). Флуоресценция аденина и тимина в водном растворе намного слабее и соответствует 380 нм. Таким образом, согласно основным представлениям в науке флуоресценция ДНК находится в ультрафиолетовой области спектра. Это так называемая общепринятая флуоресценция ДНК, легко доступная для регистрации прямыми спектрофотометрическими методами.
Спорной до сегодняшнего дня является существование флуоресценции ДНК в видимом диапазоне спектра, изучение которой классическими спектрофотометрическими способами затруднено. Однако в работах исследовательской группы Ф.А. Поппа (Германия) приводятся сведения о регистрации с помощью фотоумножительной техники излучения ДНК и хромосом в широком диапазоне волн света от 300 до 800 нм в виде очень слабых полей (Рорр F.A. Electromagnetic Bioinformation. Munchen-Baltimore. Urban und Schwarzenberg, 1979; Popp F.A., Nagl W., Li K.H., Scholz W., Weingartner O., Wolf R. Biophoton emission. New evidence for coherence and DNA as source. Cell Biophys. 1984; 6(1): 33-52).
Регистрация такого сверхслабого излучения ДНК в диапазоне видимых волн очень трудна для прямого анализа и базируется на использовании высокочувствительных детекторов фотомультиплеров, усиливающих сигнал (Wijk Е.Р., Wijk R.V. Multi-site recording and spectral analysis of spontaneous photon emission from human body. Forsch Komplementarmed Klass Naturheilkd. 2005; 12(2): 96-106) или высокочувствительных счетчиков фотонов (Inaba Н. Super-high sensitivity systems for detection and spectral analysis of ultraweak photon emission from biological cells and tissues. Experientia. 1988; 44(7): 550-559).
На настоящий момент не существует распространенных методов, позволяющих регистрировать флуоресценцию ДНК в видимом спектре прямыми спектрофотометрическими способами с необходимой чувствительностью с целью бесспорного признания ее существования. При этом недостатки чувствительности прямых способов, даже с использованием фотоумножительной техники, не позволили до сегодняшнего дня установить связь между конкретной нуклеотидной последовательностью и излучением в различных областях видимого спектра. Не существует также методик, позволяющих связать основные виды азотистых оснований с излучением в конкретной области видимого спектра.
Трудность изучения флуоресцентных свойств ДНК привела к созданию способов непрямого анализа через исследование связанной с молекулами красителя флуоресценции. Однако следует отметить, что все известные непрямые способы касаются изучения флуоресценции ДНК только в ультрафиолетовой области без рассмотрения волн видимого спектра. Они основываются на том, что некоторые молекулы флуоресцентных красителей спонтанно связываются с ДНК, проявляя в связанном состоянии еще более интенсивную флуоресценцию. Это связано с тем, что спектр возбуждения этих красителей соответствует спектру флуоресценции ДНК в УФ-диапазоне. Таким образом, красители выполняют роль своеобразных молекул-свидетелей, которые за счет увеличения собственной флуоресценции видимого диапазона в структурно-связанном с ДНК состоянии свидетельствуют об изменении ее флуоресцентных свойств в УФ-диапазоне. При этом до текущего момента не раскрывается возможный вклад последовательностей ДНК в увеличение флуоресценции красителей в видимом диапазоне за счет собственной флуоресценции ДНК в видимом спектре той же длины волны.
Наиболее широко используются для проявления УФ-флуоресцентных свойств ДНК следующие вещества: этидиум бромид (EtBr), акридиновый оранжевый и DAPI. Многие красители, в том числе и широко применяемые этидиум бромид и акридиновый оранжевый, связываются с ДНК посредством интеркаляции. При этом происходит вклинивание ароматического кольца молекулы флуорофора между основаниями двух спиралей, то есть происходит структурное взаимодействие. Существенным недостатком применения этих красителей является нарушение целостности ДНК. При этом локальное расплетение и удлинение двойной спирали изменяют ее структуру и свойства, в том числе и флуоресцентные характеристики (Neville D.M. and Davies D.R. The interaction of acridine dyes with DNA: AnX-ray diffraction and optical investigation. J. Mol. Biol. 1966; 17: 57-74).
Флуорофоры другого типа, например 4,6-диамидино-2-фенилиндол (DAPI), связываются с малой бороздкой ДНК и называются внешне связывающимися лигандами. Они имеют преимущества перед интеркалирующими соединениями, так как при взаимодействии не нарушают видимой целостности биополимера. Однако соединение подобных красителей с ДНК, не меняя видимую структуру двойной спирали, приводит к изменению веса и моментов инерции для оснований, что может способствовать распространению конформационных возбуждений нелинейной природы типа солитонов. Подобные возбуждения могут влиять на динамику рассеивания излучения основаниями ДНК и таким образом изменять ее нативную флуоресценцию (Fedyanin V.K. and Yakushevich L.V. Scattering of neutrons and light by DNA solitons. Stud. Biophys. 1984; 103: 171-178). Кроме того, флуорофоры типа DAPI обладают четкой избирательностью связывания в отношении нуклеотидного состава ДНК и подходят для изучения только АТ-богатых участков. Этот факт существенно ограничивает универсальность использования подобных красителей для анализа флуоресцентных свойств гетеронуклеотидных последовательностей.
Таким образом, главным недостатком существующих непрямых способов изучения флуоресцентных свойств ДНК с помощью флуоресцентных красителей является изменение структуры и физических параметров ДНК. Последнее замечание не может не отразиться на ее флуоресцентных характеристиках. В связи с этим все существующие методы с использованием связывающихся лигандных, и особенно интеркалирующих красителей, обладают погрешностью результатов, связанной с изменением нативной флуоресценции ДНК. Поэтому бесспорно актуальным является разработка способа исследования флуоресценции ДНК с использованием флуоресцентных молекул со свободными флуорофорными группами, которые не входят в непосредственный физический контакт с ДНК и не изменяют ее структуру и параметры.
Основной методологической ошибкой исследователей до разработки заявленного способа являлось рассмотрение флуоресцентных свойств ДНК в видимом диапазоне света отдельно без их взаимосвязи с молекулами, флуоресцирующими в том же спектре видимого света. Результатом подобных исследований явилась спорная регистрация с помощью фотоумножительной техники сверхслабых полей в виде одиночных фотонов (работы исследовательской группы Ф.А. Поппа, Германия). Таким образом, в литературе не существует аналога непрямого способа изучения флуоресценции ДНК в видимом диапазоне света с помощью флуоресцентных красителей. Разработка такого способа на основе использования флуоресцентных красителей со свободными флуорофорными группами, не входящими в контакт с внутренней структурой ДНК, явилось целью данного изобретения. Следует отметить, что заявляемый способ впервые позволил установить образование квантово-связанного спектра ДНК и подобных флуоресцентных молекул в видимом диапазоне света. При этом квантовый выход спектра флуорофор-связанной флуоресценции ДНК значительно превосходит таковой для одиночного флуорофора, а тем более для одиночной ДНК. При этом регистрация результатов не требует использования фотоумножительной техники и ее трудно оспорить, как в случае регистрации одиночных фотонов. В указанных свойствах для заявляемого способа на текущий момент не существует ближайших аналогов и прототипов.
Важным для исследования вопросом является зависимость флуоресцентных свойств ДНК от ее нуклеотидной последовательности. В литературе имеются сведения о том, что интенсивность люминесценции DAPI возрастает в наибольшей степени, когда молекула этого красителя связывается с двухцепочечными участками ДНК, имеющими много А-Т нуклеотидов (Tanious F.A., Veal J.M., Buczak Н., Ratmeyer L.S., Wilson W.D. DAPI (4',6-diamidino-2-phenylindole) binds differently to DNA and RNA: minor-groove binding at AT sites and intercalation at AU sites. Biochemistry. 1992; 31(12): 3103-12). В связи с этим использование DAPI позволяет установить связь его флуоресценции только с АТ-составом ДНК, но не с конкретной нуклеотидной последовательностью. При этом речь идет о взаимосвязи флуоресценции красителя и ДНК в ультрафиолете, а не в видимом диапазоне света.
Таким образом, на сегодняшний момент не существует известных способов, позволяющих проследить связь между конкретной нуклеотидной последовательностью и флуоресценцией ДНК в разных областях спектра, включая УФ, видимый и ИК диапазоны. До текущего момента, предшествующего заявленному изобретению, не найдено упоминаний о взаимосвязи основных видов азотистых оснований и поглощением или излучением в конкретном спектре видимого света.
Раскрытие изобретения
Главной технической задачей заявленного изобретения является разработка принципиально нового непрямого способа исследования флуоресцентных свойств ДНК в широком диапазоне волн света, позволяющего исследовать интегративную характеристику ее спектра. Поставленная задача решается с помощью нового подхода к исследованию флуоресцентных свойств ДНК без использования флуоресцентных молекул, которые входят в непосредственный контакт с ДНК и изменяют ее структуру и физические параметры.
В первом варианте осуществления способа флуоресцентные красители являются свободными молекулами, находящимися совместно в одном растворе с исследуемой ДНК (вариант с использованием свободного красителя). Во втором варианте молекула красителя располагается на одном из концов ДНК-последовательности зонда (вариант с использованием меченных по концу зондов) или в виде модифицированных нуклеозидов внутри последовательности (зонды с внутренней меткой). При этом плоскости флуорофорных групп красителя располагаются свободно по отношению к молекуле ДНК без интеркаляции.
В дистанционном бесконтактном варианте осуществления способа краситель в виде свободных молекул или в составе ДНК-зондов находится в отдельной пробирке по отношению к изучаемой последовательности ДНК. Использование флуоресцентных красителей, соответствующих определенным спектрам излучения, позволяет установить соотношение основных цветовых каналов флуоресценции изучаемых последовательностей ДНК.
Основным техническим результатом изобретения является повышение специфичности и чувствительности спектрального анализа флуоресцентных свойств последовательностей ДНК по сравнению с существующими способами. Повышение специфичности анализа заключается в возможности одновременного исследования различных диапазонов волн света, соответствующих спектральным характеристикам флуоресцентных красителей, используемых для анализа. Существующие ранее способы с использованием интеркалирующих флуоресцентных красителей позволяли исследовать только ультрафиолетовую область спектра флуоресценции ДНК.
Особое значение для оценки специфичности заявленного способа анализа спектральных свойств ДНК имеет возможность установления соотношения интенсивности основных цветов флуоресценции ДНК в видимом спектре света применительно к специфике ее нуклеотидной последовательности. Существующие ранее методики с применением интеркалирующих красителей типа DAPI позволяли улавливать связь флуоресценции ДНК в УФ-спектре лишь с ее нуклеотидным составом, а именно с расположением АТ-пар. При этом последовательности, обладающие одинаковым нуклеотидным составом, но различающиеся последовательностью нуклеотидов, не выявляли различий во флуоресценции. В связи с этим главной отличительной особенностью заявляемого изобретения является возможность исследования спектрально-специфичных свойств гетеронуклеотидных последовательностей ДНК, не обусловленных наличием АТ-богатых сайтов. Повышение чувствительности заявляемого способа выражается в возможности регистрации его результатов без использования фотоумножительной техники с применением стандартного флуориметрического оборудования. Это значительно упрощает технику проведения анализа и уменьшает его стоимость.
Повышение специфичности и чувствительности спектрального анализа с помощью заявленного способа позволило установить взаимосвязанную флуоресценцию нуклеотидных последовательностей ДНК и флуоресцентных молекул в определенных областях видимого спектра, выявляющих зоны излучения и поглощения. Этот вид флуоресценции связан с установлением общего квантово-связанного спектра флуоресценции ДНК и флуоресцентных молекул. В связи с этим она была названа флуорофор-связанной флуоресценцией ДНК. Согласно полученным представлениям спектр флуорофор-связанной флуоресценции ДНК функционирует как общепринятая RGB-система кодирования цветовой информации и представлен основными цветами (красным, зеленым и синим) и промежуточными цветами (желтым, оранжевым, голубым, пурпурным, фиолетовым), образующимися в результате их наложения. При этом все цвета спектра взаимосвязаны (интегрированы) и могут выполнять роль каналов излучения или поглощения в зависимости от настройки спектрального кода ДНК. Спектральный код флуорофор-связанной флуоресценции ДНК, как управляющий жизнедеятельностью клетки механизм, подвергается естественным незначительным колебаниям (флуктуациям). Существенная перестройка кода была зарегистрирована во второй половине 2012 года. В связи с этим изучение в примерах осуществления изобретения спектральных свойств ДНК в такой спектрально-нестабильный период является важным моментом для понимания механизмов квантово-оптического регулирования процессов жизнедеятельности клетки. Особую роль эти исследования приобретают в связи с исследованиями теломерной ДНК, а именно ее концевых областей, именуемых G-оверхенгами. Именно в них заложены механизмы существования в клетке последовательностей ДНК, различающихся по нуклеотидному составу и спектральным свойствам за счет изменения положения нуклеотидов в терминальном теломерном повторе. Последний факт имеет большую значимость в свете открытия процесса изменения терминальных нуклеотидов ДНК в ходе активации деления клетки. Заявленный способ впервые позволяет устанавливать соотношение основных каналов флуоресценции теломерных оверхенгов на любом этапе клеточного цикла.
При этом существенным качественным отличием заявляемого способа является то, что он дает представление о соотношении процессов поглощения и излучения световой энергии для каждого цветового канала в рамках формировании результирующего потока флуоресценции изучаемых последовательностей. На основе этого впервые становится возможным изучение квантово-резонансных отношений между отдельными последовательностями ДНК в рамках изучаемых цветовых каналов. Особое значение это обретает в свете изучения взаимодействий теломерных оверхенгов, которые в клетке могут быть представлены разными вариантами основного теломерного повтора и оканчиваться на разные терминальные нуклеотиды. Таким образом, использование заявленного способа открывает новые возможности для изучения ранее неизвестных флуоресцентных свойств и спектральных характеристик ДНК, недоступных для существовавших ранее способов исследования.
Сущность изобретения заключается в новом подходе к исследованию флуоресценции последовательностей ДНК с использованием набора флуоресцентных красителей, соответствующих основным цветам спектра излучения ДНК. При этом красители не являются по отношению к ДНК связывающимися с бороздками лигандами или интеркаляторами между плоскостями оснований. Способ основан на уникальных свойствах последовательностей ДНК по-разному влиять на флуоресценцию красителей в зависимости от собственных излучательных и поглощающих свойств в соответствующем спектре света. При этом установление квантово-связанных отношений между нуклеотидной последовательностью ДНК и используемыми красителями позволяет охарактеризовать флуоресцентные свойства исследуемого образца в широком диапазоне волн видимого света от фиолетового до красного, включая УФ- и ИК-области. Подбирая красители с определенными спектральными характеристиками, исследователь получает возможность избирательно изучать интересующую его область спектра.
Главным существенным отличием заявляемого способа от известных ранее является возможность выявления флуоресцентных свойств ДНК в видимом диапазоне, в то время как общепринятые спектрофотометрические способы выявляют флуоресценцию только в УФ-диапазоне. При этом отличительным свойством данного способа является использование свободных флуоресцентных красителей, которые не вступают в непосредственный контакт с последовательностью ДНК и не влияют на ее свойства. Применение способа впервые позволяет изучать механизм ранее неизвестного способа резонансной миграции энергии на расстояния, превышающие радиус электронных облаков взаимодействующих веществ. Дистанционный характер подобных процессов можно исследовать с помощью бесконтактного варианта осуществления способа, при котором раствор флуоресцентного красителя находится в отдельной пробирке по отношению к исследуемой последовательности ДНК. При этом важным преимуществом заявленного способа является возможность изучения соотношения процессов поглощения и излучения световой энергии в определенном спектре.
Обнаружению описываемых флуоресцентных свойств последовательностей ДНК в видимом спектре предшествовало наблюдение необычного распределения фоновой флуоресценции ДНК-зондов, в состав которых входили вариации теломерного повтора (пример 1). Эти флуоресцентно-меченные зонды содержали комбинацию красителя (FAM) и гасителя (RTQ1) на противоположных концах. Было замечено, что независимо от положения красителя на 5'-конце или на 3'-конце, зонд, содержащий вариант теломерного повтора, оканчивающийся на максимальное количество гуанина (TTAGGG), обладал максимальной фоновой флуоресценцией (фиг.2). Соответственно меньшей флуоресценцией обладали зонды с теломерными повторами GTTAGG, TAGGGT и GGTTAG. Было установлено, что такая градация снижения флуоресценции в зеленом спектре связана с расположением гуанина в нуклеотидной последовательности.
Было сделано предположение о том, что флуоресцентный краситель в составе ДНК-зондов на основе теломерных последовательностей приобретает новые свойства за счет квантово-связанного с ДНК состояния, подобно широко используемым интеркалирующим и лигандным флуорофорам. Однако механизм квантово-связанного состояния совершенно иной, так как флуорофорные группы карбоксифлуоресцеина не входят с ДНК в прямой контакт (не интеркалируют внутрь между основаниями и не связываются с ее бороздкой). В этих условиях предполагается установление особой квантовой связи, которая, как будет показано в примере 3, осуществляется дистанционно. Была установлена подобная связь между расположением нуклеотидов и флуоресценцией других красителей в других диапазонах видимого света. Было показано, что при установлении квантово-связанного спектра флуоресценции краситель может находиться в свободном состоянии в растворе, будучи не связанным с 5'- или 3'-концами ДНК-последовательности. При этом следует учитывать, что пространственное расположение молекулы флуорофора влияет на специфику образующегося спектра за счет установления направления миграции энергии в изучаемой нуклеотидной последовательности.
Описанные наблюдения в общем виде можно сформулировать в виде явления специфического изменения флуоресценции раствора красителя со свободными флуорофорными группами при добавлении к нему последовательностей ДНК. При этом характер изменения флуоресценции красителя в соответствующем ему спектре излучения зависит от нуклеотидной последовательности фрагмента ДНК, а именно от расположения азотистых оснований. Указанное явление легло в основу заявленного способа спектрального анализа флуоресцентных свойств нуклеотидных последовательностей ДНК.
Общая схема проведения спектрального анализа флуоресцентных свойств ДНК с помощью молекул красителей со свободными флуорофорными группами
Первым вариантом осуществления ДНК-спектрального флуоресцентного анализа является использование флуоресцентного красителя в составе нуклеотидных зондов в виде метки, свободно располагающейся на его 5' или 3' конце. При этом плоскость гетероциклов молекулы самого красителя и его флуорофорные группы располагаются свободно в пространстве и не вступают во взаимодействие с основаниями ДНК. Таким образом, сохраняется условие отсутствия интеркаляции и внутримолекулярного взаимодействия. Изготовление подобных зондов осуществляется по общепринятым методикам концевого модифицирования олигонуклеотидов в ходе стандартного фосфорамидитного синтеза. В качестве метки используются любые флуоресцентные красители в зависимости от спектральных характеристик изучаемого спектра ДНК. Использование подобных зондов, содержащих концевой карбоксифлуоресцеин для изучения флуоресцентных свойств теломерных последовательностей в зеленом спектре видимого света, приведено в примерах 1-3. Важным условием является качество включения в зонд флуоресцентной метки и ее гасителя, если он используется. Для адекватного сравнения флуоресцентных свойств последовательностей между собой качество включения метки в них должно быть одинаковым. В противном случае различия во флуоресценции зондов будут связаны с эффективностью включения метки или гасителя, а не определяться свойствами флуоресценции изучаемой последовательности ДНК. В связи с этим при использовании услуг коммерческих фирм, занимающихся синтезом модифицированных олигонуклеотидов, необходимо требовать проведения тщательного контроля на всех этапах их модификации.
Эксперименты показали, что олигонуклеотидные последовательности ДНК, меченные комбинацией флуорофор-гаситель на противоположных концах, могут применяться для спектрального анализа наряду с растворами свободных молекул красителя. Однако существуют некоторые отличия их использования, связанные с близостью расположения флуорофора к 5' или 3' концу, что определяет соответствующее направление миграции энергии и ее величину. В связи с этим результаты ДНК-спектрального анализа при использовании свободного красителя или его концевого расположения в составе зонда могут различаться.
Особой разновидностью осуществления ДНК-спектрального флуоресцентного анализа является бесконтактный вариант, в котором взаимовлияние ДНК-последовательностей в составе зондов осуществляется дистанционно. При этом растворы квантово-взаимодействующих зондов влияют друг на друга на расстоянии нескольких сантиметров, располагаясь в разных пробирках (пример 3).
Следующим вариантом осуществления способа является использование флуоресцентного красителя в качестве водного раствора молекул, полностью свободных по отношению к структуре ДНК. На первом этапе готовятся исходные растворы флуоресцентных красителей, соответствующих основным спектрам флуоресценции ДНК: зеленый канал (FITC, FAM, R110, ТЕТ и аналоги), желто-зеленый (R6G, JOE, HEX, VIC, YakimaYellow и аналоги), желтый (TAMRA, Cy3 и аналоги), оранжево-красный канал (ROX, SuperROX, Cy3.5 и аналоги), красный (Cy5, Cy5.5, TexasRed и аналоги), ближний ИК (Cy7, Cy7.5 и аналоги).
Исследование видимого фиолетового и синего каналов флуоресценции на настоящий момент затруднено из-за отсутствия подходящих красителей. К доступным в этом спектре красителям следует отнести пирен (Pyrene). Однако он не удовлетворяет требованиям свободного расположения флуорофорных групп, так как интеркалирует не только в дуплекс, но и активно связывается с одноцепочечной ДНК. Широко используемый краситель DAPI также не подходит для спектрального анализа, так как, во-первых, тоже взаимодействует со структурой ДНК, а во-вторых, обладает избирательностью в связывании с АТ-областями, что ограничивает его применение для анализа GC-содержащих последовательностей.
Особенностью заявляемого способа является возможность исследования не только видимого спектра флуоресценции, но и полного спектра света, включая ультра-фиолетовую и инфракрасную области, что требует разработки подходящих красителей. Кроме того, изучение УФ- и ИК-диапазонов требует детальной дискретизации спектра по длинам волн возбуждения и излучения.
Существенным преимуществом заявленного способа является возможность использования любого флуоресцентного красителя, который соответствует требованию отсутствия взаимодействия с внутренней структурой ДНК. В перспективе возможно использование любых подходящих по спектру флуорофоров, широко представленных на рынке, в том числе ранее не использовавшихся для молекулярных исследований нуклеиновых кислот и белков. При этом существенно облегчается поиск подходящих красителей для всех цветовых каналов и особенно для фиолетового и синего. Сегодня существует широкий ассортимент флуорофоров, флуоресцирующих различными длинами волн видимого спектра при УФ-облучении. Это может значительно облегчить и удешевить создание детекторов-флуориметров, которые работают лишь на одной длине возбуждения в УФ-области.
Для всех вариантов проведения спектрального анализа необходимо условие определенной степени разведения красителя, что обеспечивает его фоновую флуоресценцию, удобную для регистрации приборным обеспечением. Она подбирается эмпирически так, чтобы на ее фоне легко детектировалось воздействие последовательностей ДНК. При этом следует учитывать доступные верхние и нижние пределы разведения, использование которых определяется прямой зависимостью прироста флуоресценции красителя под воздействием ДНК от его первоначальной концентрации. При добавлении одного и того же количества ДНК к растворам красителя с разной концентрацией прирост флуоресценции красителя изменяется пропорционально изменению его исходного фона. В связи с этим на фоне слишком разбавленной флуоресценции красителя можно не заметить влияние флуоресцентных свойств ДНК. С другой стороны, очень высокая концентрация красителя затруднит детекцию результатов.
Использование гасителя флуоресценции при конструировании зондов обеспечивает необходимое снижение уровня собственной флуоресценции красителя, которое имитирует разбавленные растворы свободного красителя. Диапазон разведения каждого красителя или концентрация меченых зондов подбирается эмпирически так, чтобы обеспечить приблизительно одинаковый квантовый выход флуоресценции за единицу времени для всех используемых красителей для адекватного сравнения интенсивности цветовых каналов. При этом важным условием является соблюдение одинаковой интенсивности (яркости) возбуждающего излучения для всех цветов спектра, соответствующих пику флуоресценции красителей, так как было установлено, что влияние последовательностей ДНК на их флуоресценцию пропорционально зависит от этого фактора. Использование волн возбуждения, не соответствующих пику возбуждения красителя, приводит к снижению прироста флуоресценции раствора под воздействием ДНК пропорционально падению общей интенсивности флуоресценции красителя при этой длине волны.
Описанные закономерности свидетельствует о том, что на фоне установления общего квантово-связанного спектра ДНК обладает зависимыми флуоресцентными свойствами по отношению к количеству красителя и интенсивности возбуждающего излучения. ДНК добавляет или забирает флуоресценцию в исследуемом спектре соответственно своему количеству и пропорционально интенсивности возбуждения и исходному уровню флуоресценции раствора красителя.
Таким образом, на первом этапе ДНК-спектрального флуоресцентного анализа с использованием свободных молекул красителя проводится измерение фоновой флуоресценции его раствора. Измерение осуществляют с помощью общепринятых методов флуоресцентного анализа при помощи специально предназначенных для этих целей приборов (флуориметров, фотометров-флуориметров, флуоресцентных детекторов и подобных им). Действие этих приборов основано на возбуждении флуоресценции с помощью источника света, соответствующего максимуму поглощения используемого красителя и регистрации эмиссии с помощью фильтров, соответствующих максимуму его флуоресценции.
На втором этапе анализа после получения значения фоновой флуоресценции раствора красителя к нему добавляют образец исследуемой ДНК и тщательно перемешивают. Если речь идет о синтетических последовательностях олигонуклеотидной природы, то удобно добавлять непосредственно раствор в очень небольших объемах (не более 1/10), например, 1-2 мкл на 20 мкл исходного раствора красителя. При этом увеличение объема раствора не сказывается на изменении исходной фоновой флуоресценции.
Если исследованию подвергается раствор нативной ДНК, например образец теломерных оверхенгов, то его концентрируют до необходимого объема. В другом варианте осуществления способа заранее определяется фоновая флуоресценция раствора заданной концентрации красителя в исследуемом объеме раствора оверхенгов. При этом предполагается, что все растворы в указанном объеме обладают приблизительно одинаковой флуоресценцией, что требует использования красителей со стабильным квантовым выходом.
Изменение флуоресценции раствора красителя регистрируют сразу после добавления образца ДНК и фиксируют значения в течение первых десяти минут для получения усредненного значения. Следует отметить, что ДНК является квантово-динамической системой в отличие от молекул флуоресцентного красителя, квантовый выход которого во времени изменяется незначительно. Поэтому в течение первых минут после добавления образца ДНК к раствору красителя значения флуоресценции могут меняться. Это связано с установлением сложных квантово-резонансных отношений миграции энергии во времени, возникающих как между азотистыми основаниями внутри самой последовательности ДНК, так и между ними и молекулой красителя.
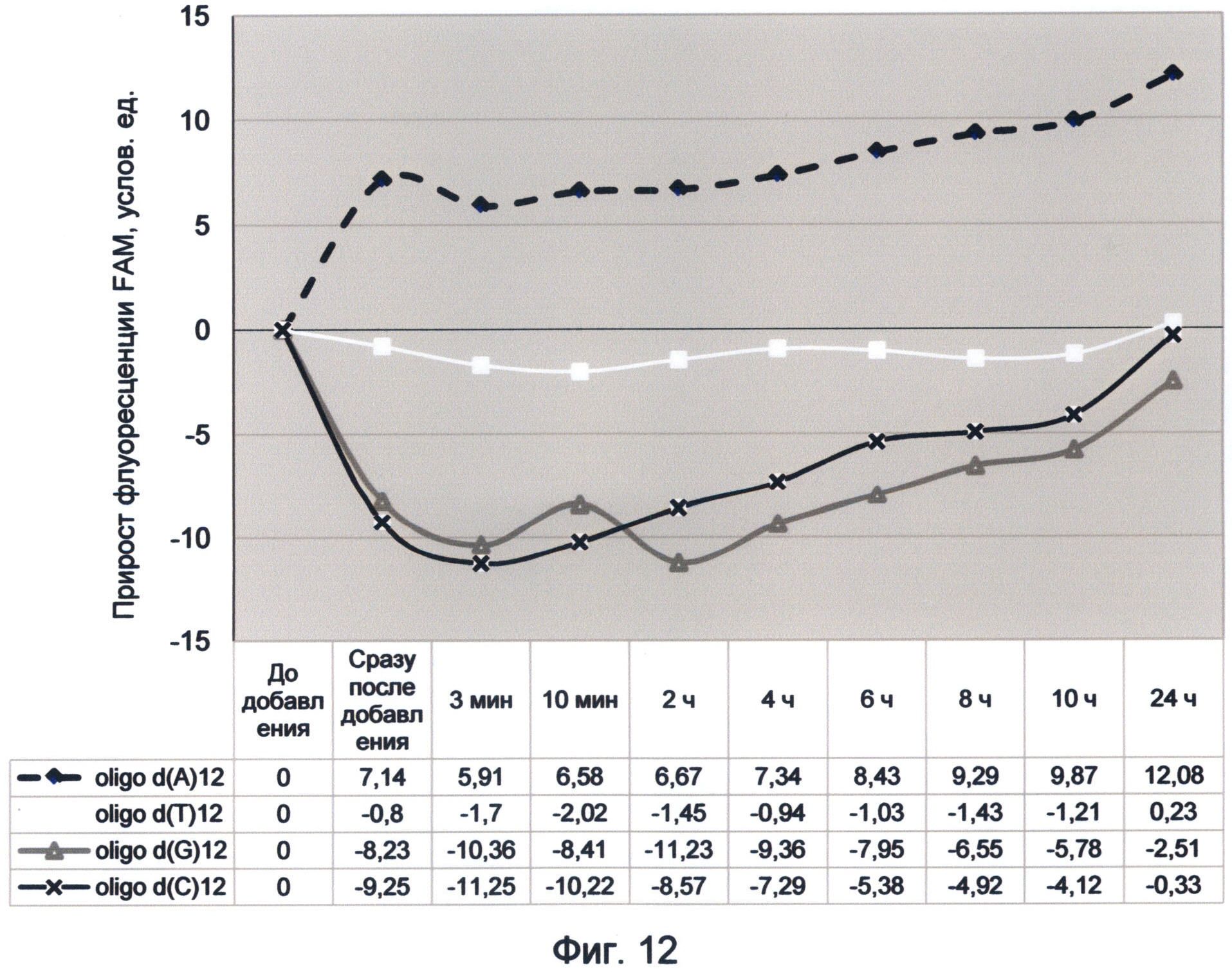
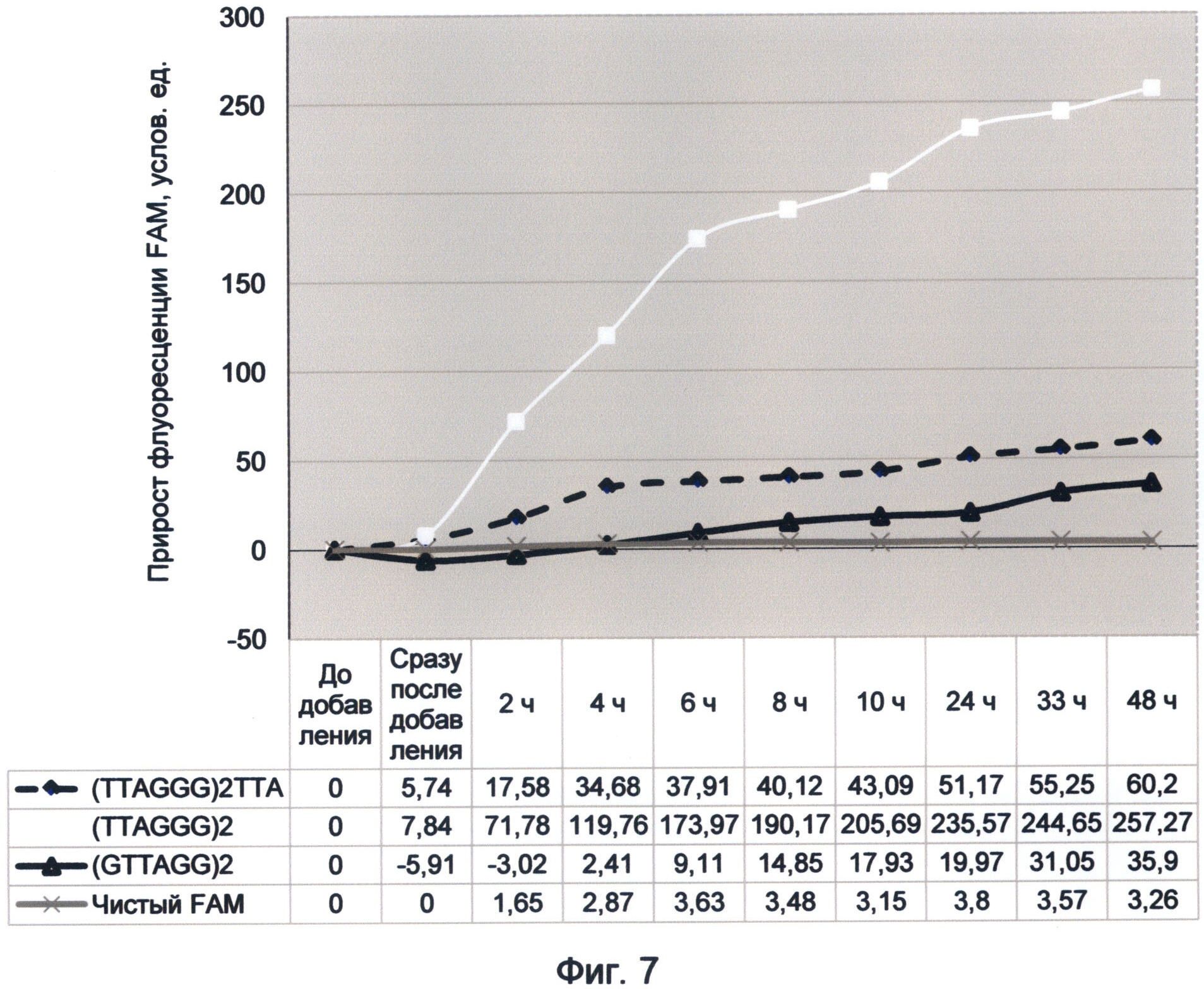
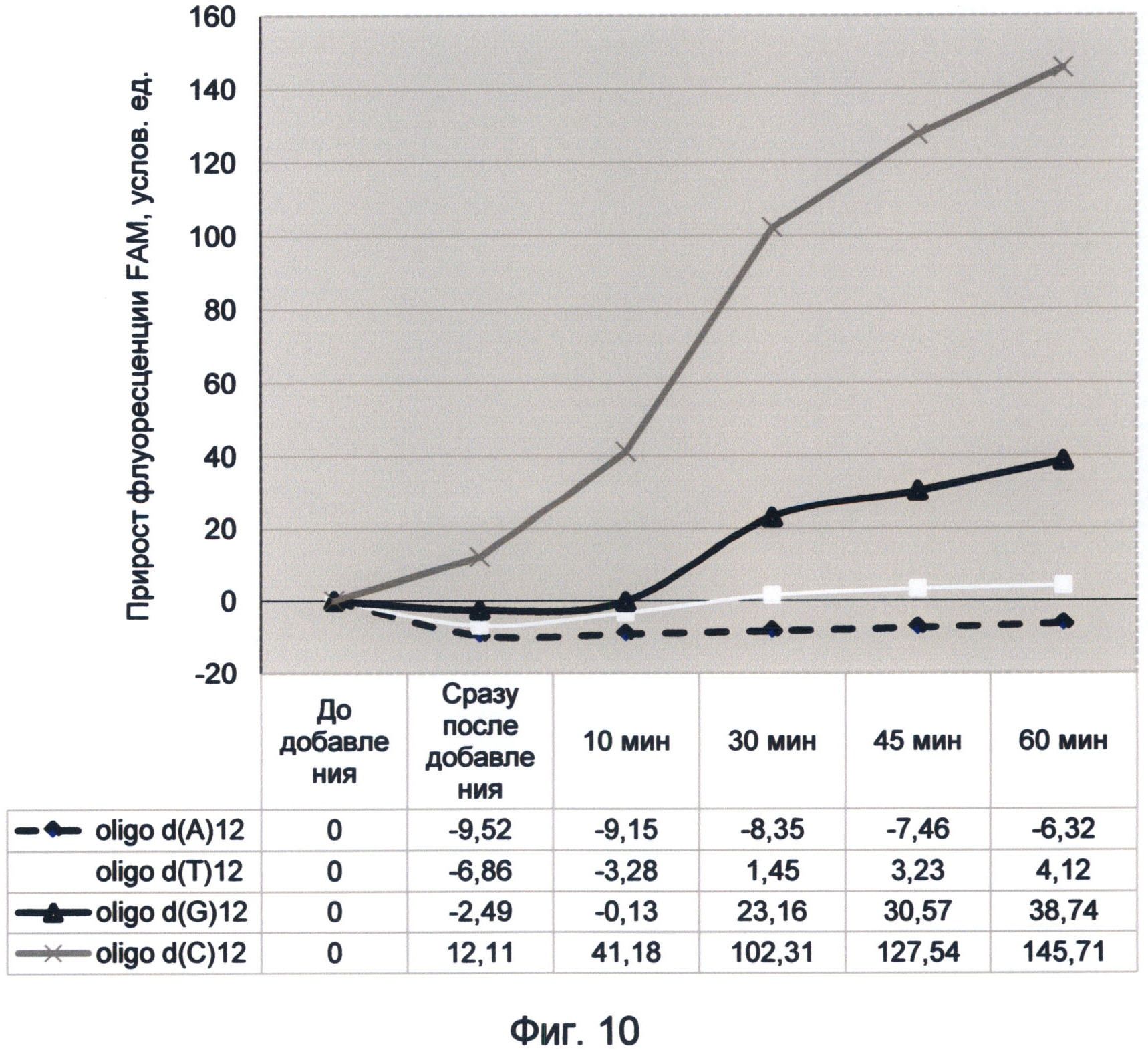
В связи с этим рекомендуется брать усредненное значение за промежутки времени, соответствующие первым трем, пяти и десяти минутам, так как в большинстве случаев этого времени достаточно для установления стабильного квантового выхода связанного спектра ДНК-краситель. Однако в ряде случаев исследование динамики флуоресценции раствора в течение более длительного времени может дать более подробное представление о динамической составляющей спектра ДНК. В связи с этим рекомендуется использовать более длительные промежутки измерения по желанию исследователя. Стабильность результатов в этом случае свидетельствует об установлении энергетического баланса между сопряженными процессами поглощения и испускания квантов света в изучаемом спектре. Если таковой не наступает и изменение флуоресценции продолжается, то это свидетельствует об особом режиме насыщения последовательностей ДНК световой энергией. Такой особый режим насыщения наблюдался во второй половине 2012 года для мононуклеотидных и теломерных последовательностей ДНК (фиг.7 и 10).
Следует отметить, что существенным преимуществом заявляемого способа является использование стандартных флуориметрических приборов, без использования фотоумножительной техники. При этом регистрируемый прирост флуоресценции легко детектируется и может достигать 100% и более от исходного уровня фоновой флуоресценции раствора. При наблюдении эффекта суперфлуоресценции теломерного повтора TTAGGG, происходившей 21 сентября 2012 года, прирост флуоресценции составил 260% в течение 48 часов (фиг.7). При наблюдении подобного эффекта для содержащей цитозин последовательности 19 июня 2012 г. прирост флуоресценции составил 124% за первый час (фиг.10). При этом прирост флуоресценции чистого красителя в контрольном образце был на несколько порядков меньше по сравнению с образцами, содержащими ДНК. Это однозначно свидетельствует об уникальных свойствах ДНК-последовательностей увеличивать квантово-связанную с ней флуоресценцию красителя.
Регистрация такого значительного прироста флуоресценции, в отличие от фиксации единичных фотонов с помощью фотомультиплера, бесспорна и является достоверным результатом. Регистрируемый прирост флуоресценции красителя свидетельствует о большом квантовом вкладе ДНК в общую флуоресценцию их связанного спектра, который легко регистрируется и виден невооруженным глазом (фиг.1). Таким образом, квантовый выход флуоресценции ДНК в общем квантово-связанном спектре, сопоставим с таковым для самого флуоресцентного красителя. Это свидетельствует о выдающихся потенциальных возможностях самой ДНК как источника фотонов видимого спектра.
В качестве прибора, регистрирующего флуоресценцию в примерах использования изобретения, использовался флуоресцентный детектор FDG-001 (совместная разработка автора и института теоретической и экспериментальной биофизики, г. Пущино). Детектор построен по общепринятым принципам флуориметрии с использованием мультицветовой светодиодной подсветки и набора светофильтров, позволяющих детектировать следующие красители (FAM, FITC, R6G, JOE, HEX, TAMRA, ROX) с чувствительностью, не уступающей коммерческим приборам. Интенсивность флуоресценции детектировалась с помощью соответствующего светофильтра на матрице монохромной высокочувствительной камеры и сохранялась в виде графического файла. Графические файлы обрабатывались с помощью специализированной программы обработки изображений LabWorks 4.6. (UVP, England), которая позволяла преобразовать полученные результаты в числовой формат и получать значение значимой флуоресценции в условных единицах. Результаты представлялись в виде столбчатых диаграмм или кривых, отображающих изменение флуоресценции раствора красителя после добавления образца ДНК в условных единицах. Одной из форм представления результатов ДНК-спектрального флуоресцентного анализа являлось составление спектральных карт в исследуемом диапазоне длин волн, а также цветовых маркеров результирующей флуоресценции изучаемых нуклеотидных последовательностей.
Краткое описание чертежей
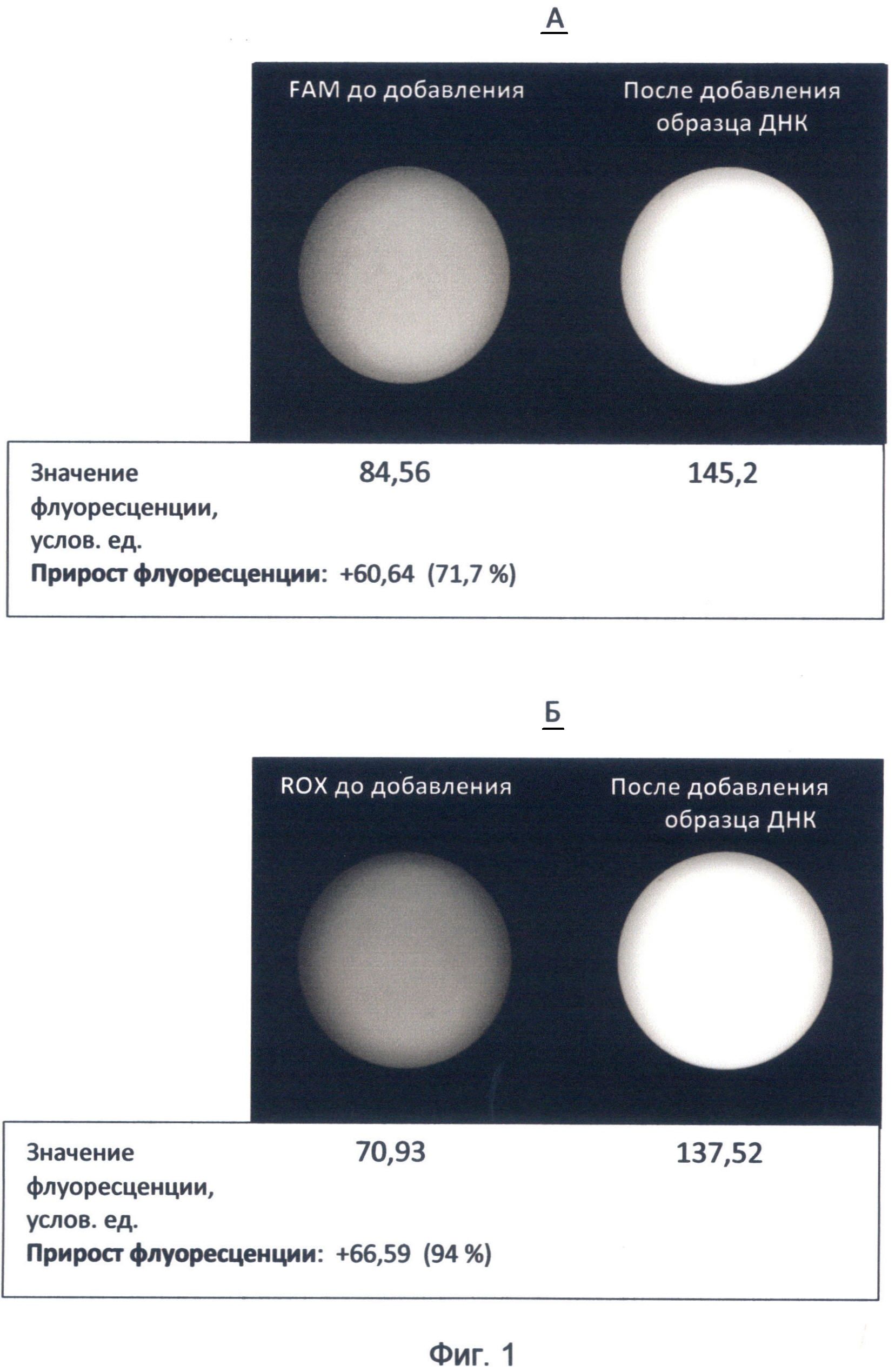
Фигура 1. Изображение флуоресценции красителей FAM и ROX до и после добавления к ним образца ДНК. Изображения получены с помощью высокочувствительной видеокамеры детектора FDG-001 с использованием зеленого (520 нм) и красного (605 нм) каналов детекции. Значения флуоресценции приведены по данным программы LabWorks 4.6. (UVP, England).
А - краситель FAM, к которому добавлялась мононуклеотидная последовательность oligo d(C)12 в условиях спектрального кода флуоресценции ДНК по состоянию на 19 июня 2012 года; изображение демонстрирует явление пролонгированного гипернасыщения изучаемой последовательности зеленой флуоресценцией в течение 20 минут;
Б - краситель ROX, к которому добавлялась последовательность CAGATGGCTGCTCCCACACTTC гена циклина D2 человека в условиях спектрального кода флуоресценции ДНК по состоянию на конец июня 2012 года.
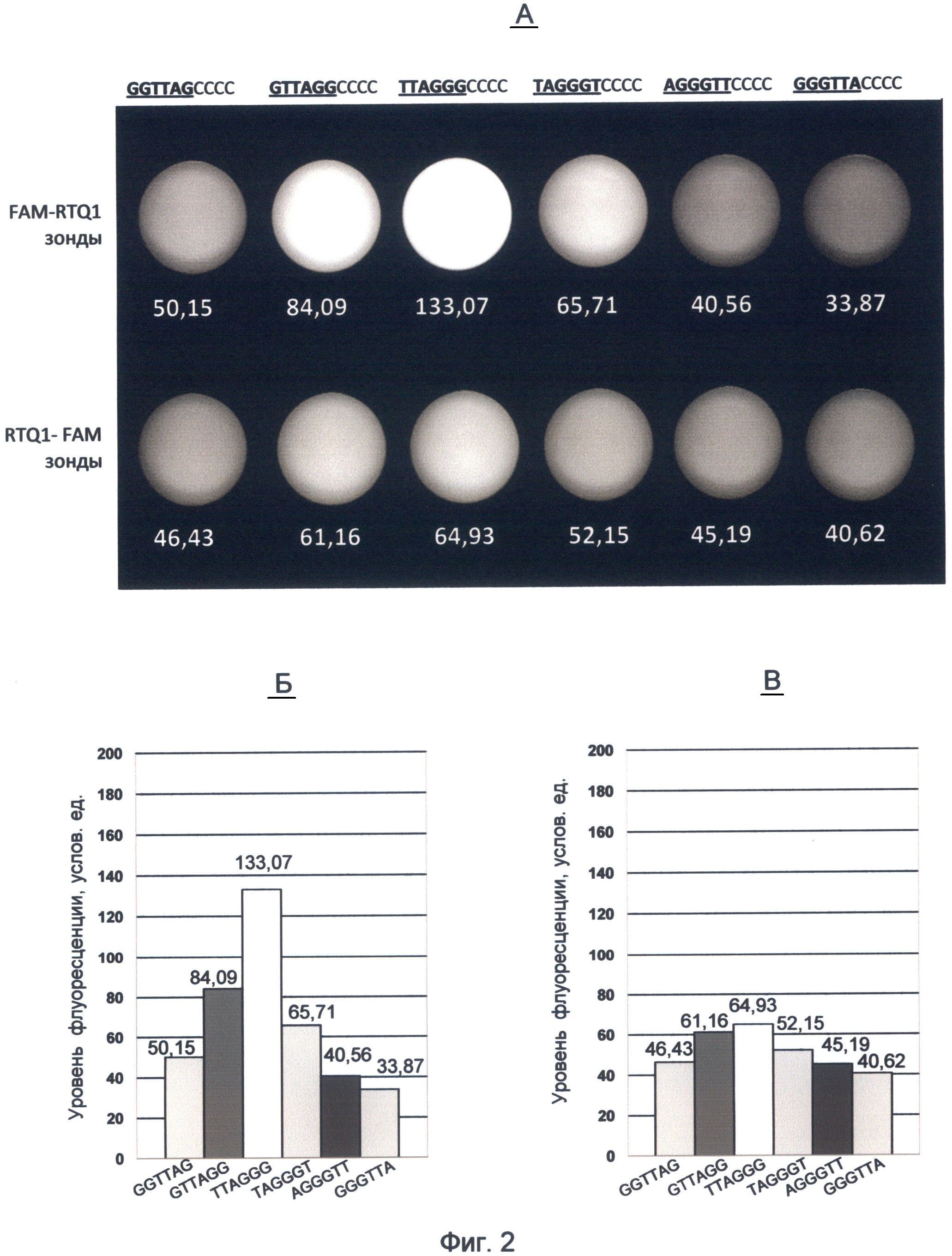
Фигура 2. Флуоресценция ДНК-зондов на основе вариаций теломерного повтора ДНК человека, меченных комбинацией красителя FAM и гасителя RTQ1.
А - изображение флуоресценции зондов, полученное с помощью видеокамеры детектора FDG-001 с использованием зеленого (520 нм) светофильтра. Верхний ряд соответствует зондам FAM-RTQ1, нижний - RTQ1-FAM зондам. Значения флуоресценции для каждого зонда приведены по данным программы LabWorks 4.6. (UVP, England).
Б и В - значения флуоресценции для зондов, содержащих вариации теломерного повтора, представленные в виде столбчатых диаграмм.
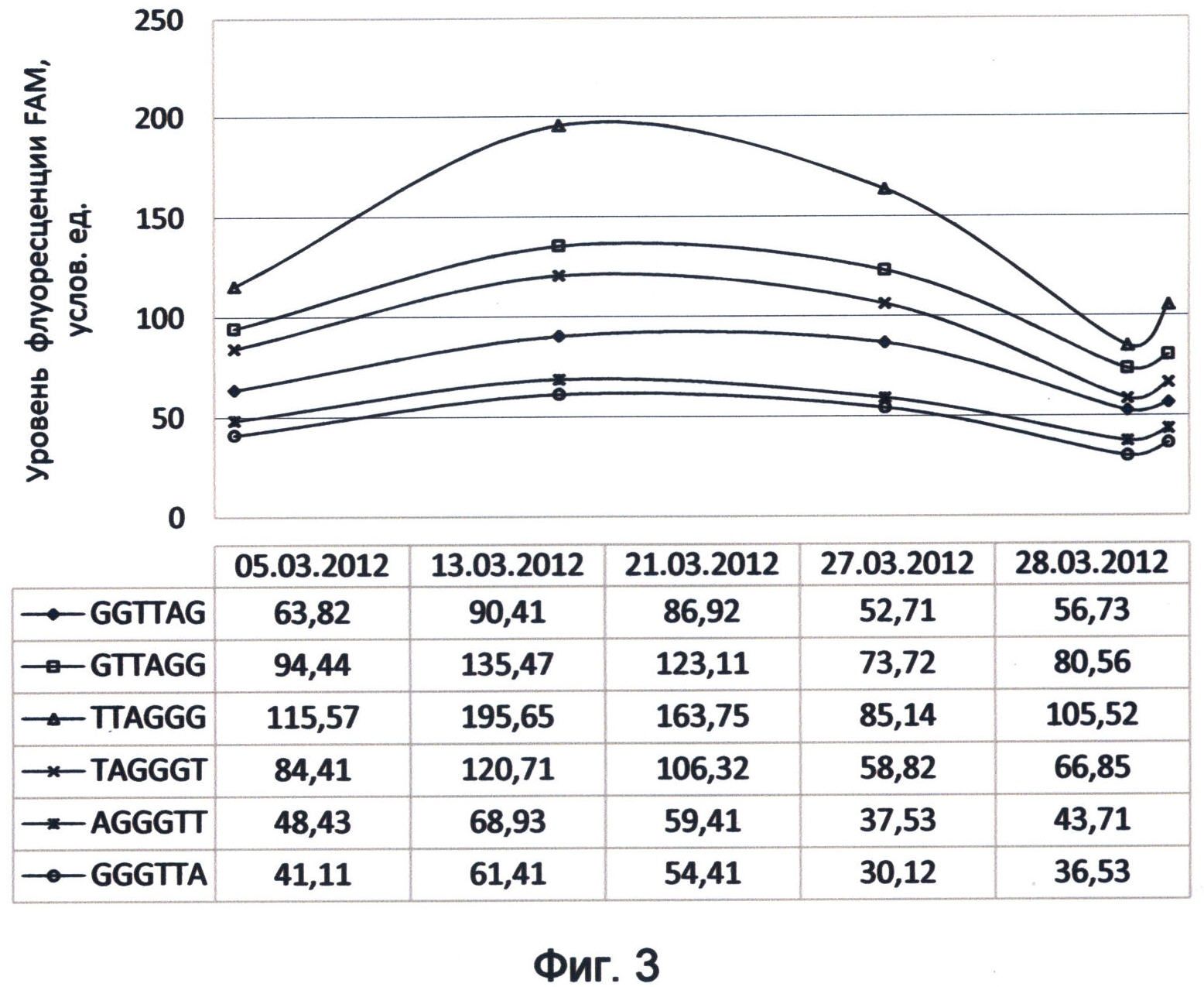
Фигура 3. Динамика зеленого канала флуоресценции теломерных повторов ДНК человека на примере FAM-RTQ1 меченых зондов (характеристика соответствует спектральному коду флуоресценции ДНК на март 2012 года). Отображает флуктуационные изменения уровней насыщения теломерной ДНК зеленой флуоресцентной энергией во времени в рамках существовавшего на момент исследования спектрального кода ДНК.
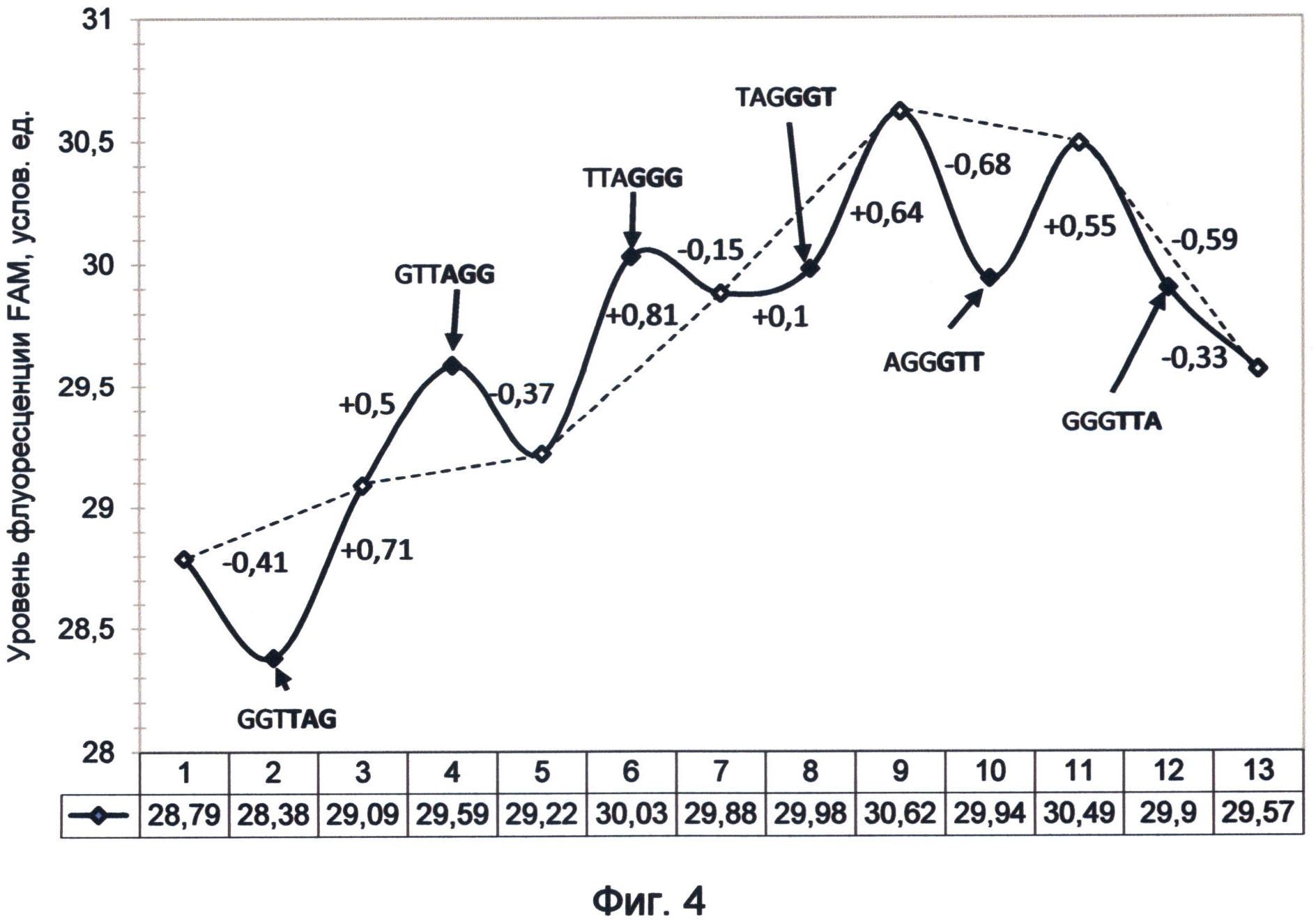
Фигура 4. График изменения FAM-связанной флуоресценции теломерного повтора TTAGGG под влиянием дистанционного воздействия последовательностей других вариантов теломерного повтора ДНК человека. Демонстрирует природу квантово-резонансных отношений миграции энергий, возникающих между различными вариантами последовательности теломерного повтора. Эксперимент проводился в период стабильного существования спектрального кода ДНК на момент исследования (первая половина апреля 2012 года).
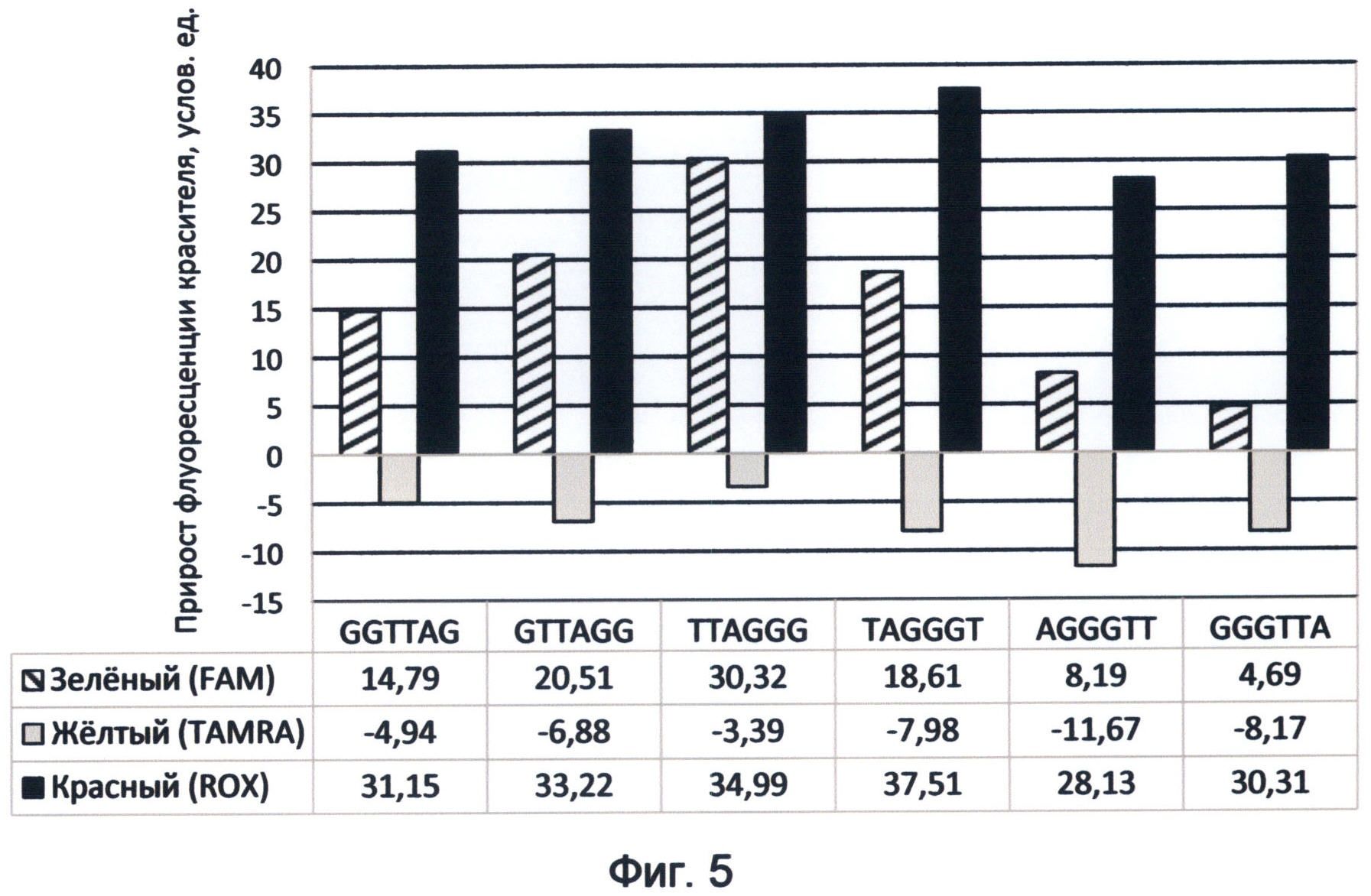
Фигура 5. Диаграмма прироста флуоресценции красителей FAM, TAMRA и ROX в соответствующих цветах видимого спектра под влиянием возможных вариантов теломерного повтора ДНК человека. Демонстрирует спектральные характеристики окончаний теломерных оверхенгов, соответствующие спектральному коду ДНК на конец апреля 2012 года.
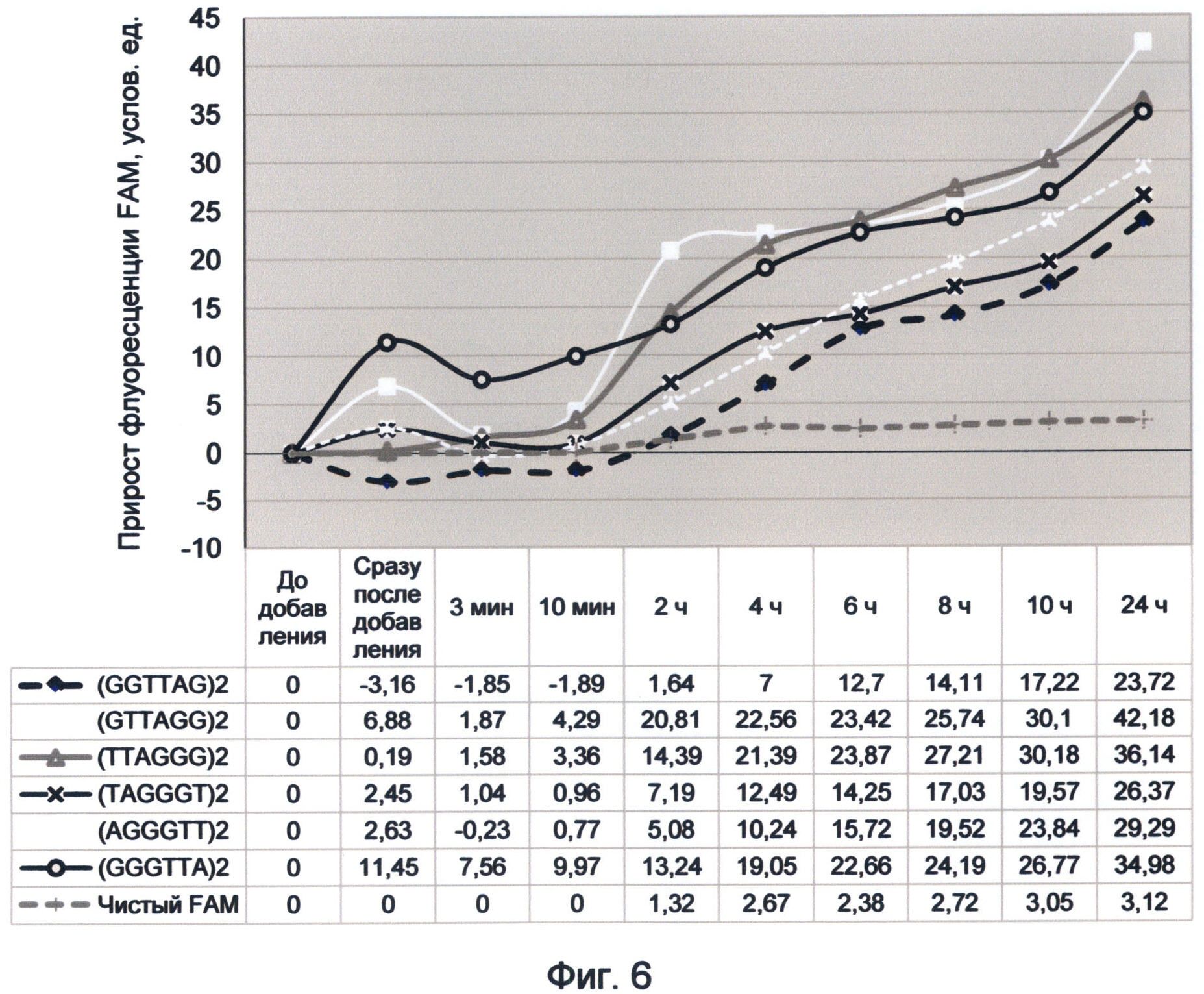
Фигура 6. График прироста флуоресценции красителя FAM под влиянием вариаций теломерного повтора. Отображает динамику медленного насыщения теломерных последовательностей зеленой флуоресценцией в условиях измененного спектрального кода ДНК на конец сентября 2012 года.
Фигура 7. График прироста флуоресценции красителя FAM во времени под влиянием вариаций теломерного повтора. Отображает динамику периодического гипернасыщения теломерных последовательностей на основе повтора TTAGGG зеленой флуоресценцией в условиях измененного спектрального кода ДНК (21 сентября 2012 г.).
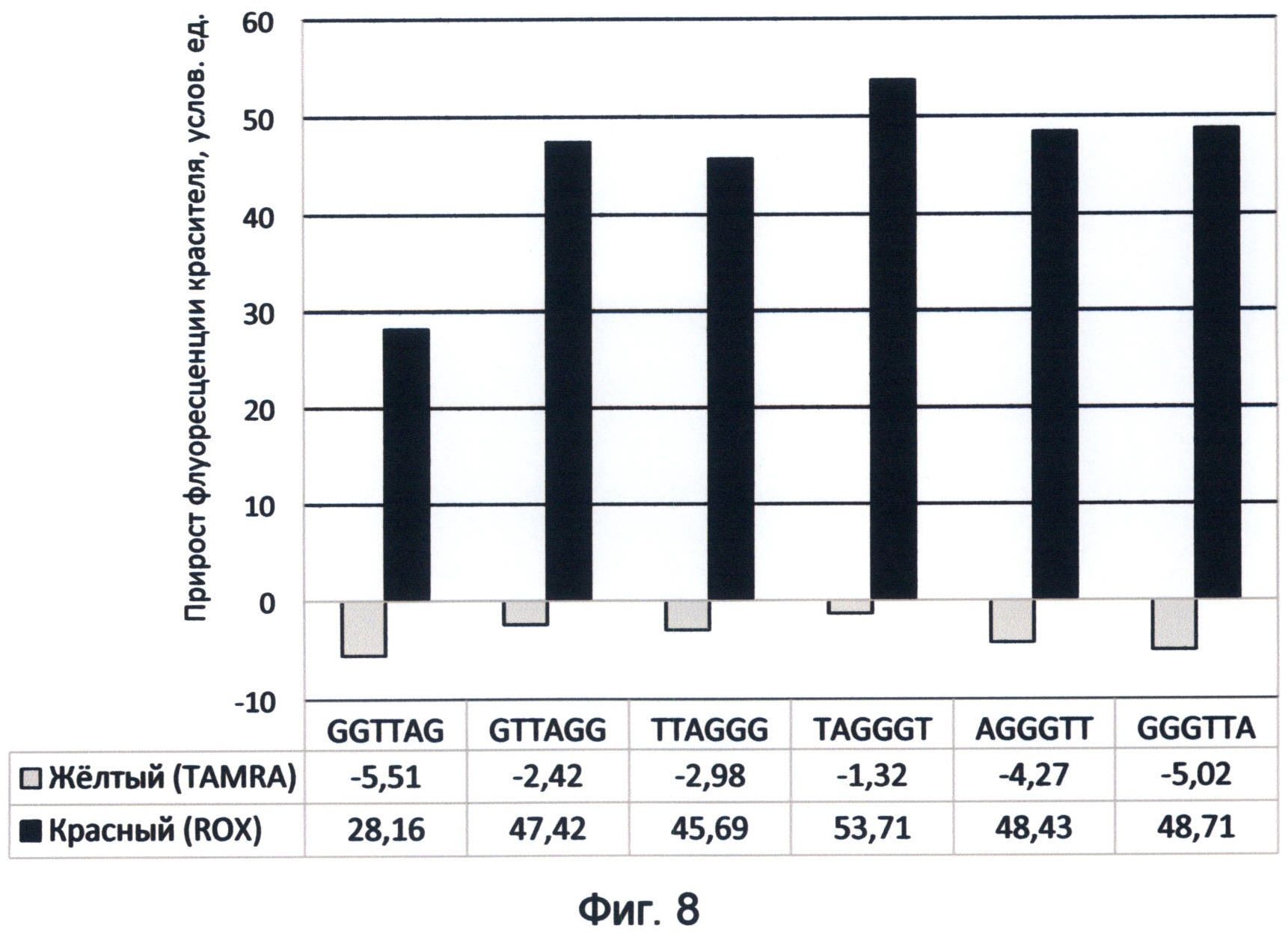
Фигура 8. Диаграмма прироста флуоресценции красителей TAMRA и ROX в соответствующих цветах видимого спектра под влиянием возможных вариантов теломерного повтора ДНК человека. Демонстрирует спектральные характеристики окончаний теломерных оверхенгов в желтом и красном спектрах флуоресценции в условиях измененного спектрального кода ДНК на конец июня 2012 года.
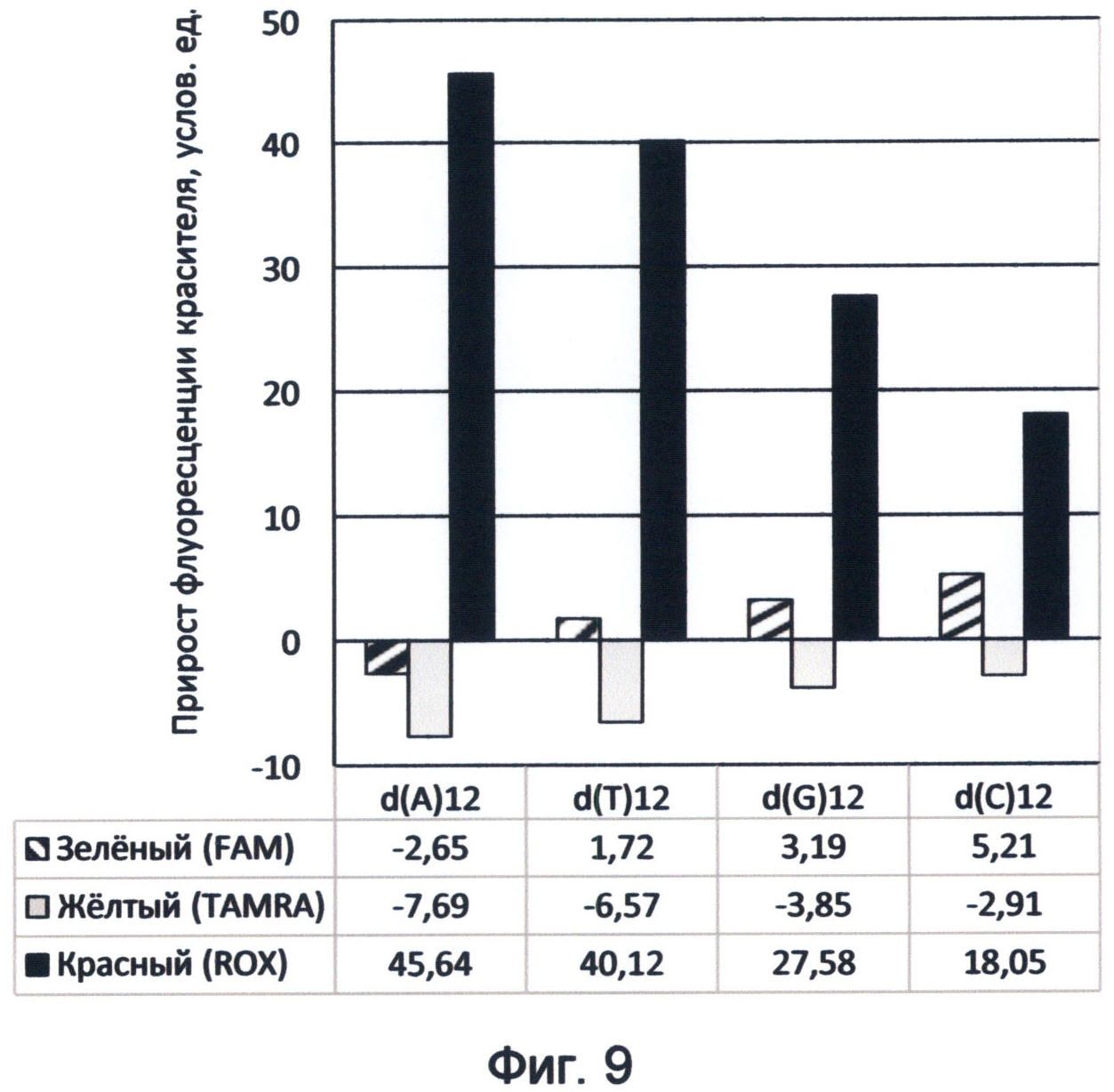
Фигура 9. Диаграмма прироста флуоресценции красителей FAM, TAMRA и ROX в соответствующих цветах видимого спектра под влиянием различных вариантов мононуклеотидных последовательностей ДНК. Демонстрирует спектральные характеристики азотистых оснований, соответствующие спектральному коду ДНК на конец апреля 2012 года.
Фигура 10. График прироста флуоресценции красителя FAM во времени под влиянием мононуклеотидных последовательностей. Отображает динамику периодического гипернасыщения зеленой флуоресценцией последовательности, содержащей цитозин, в условиях измененного спектрального кода ДНК (19 июня 2012 г.).
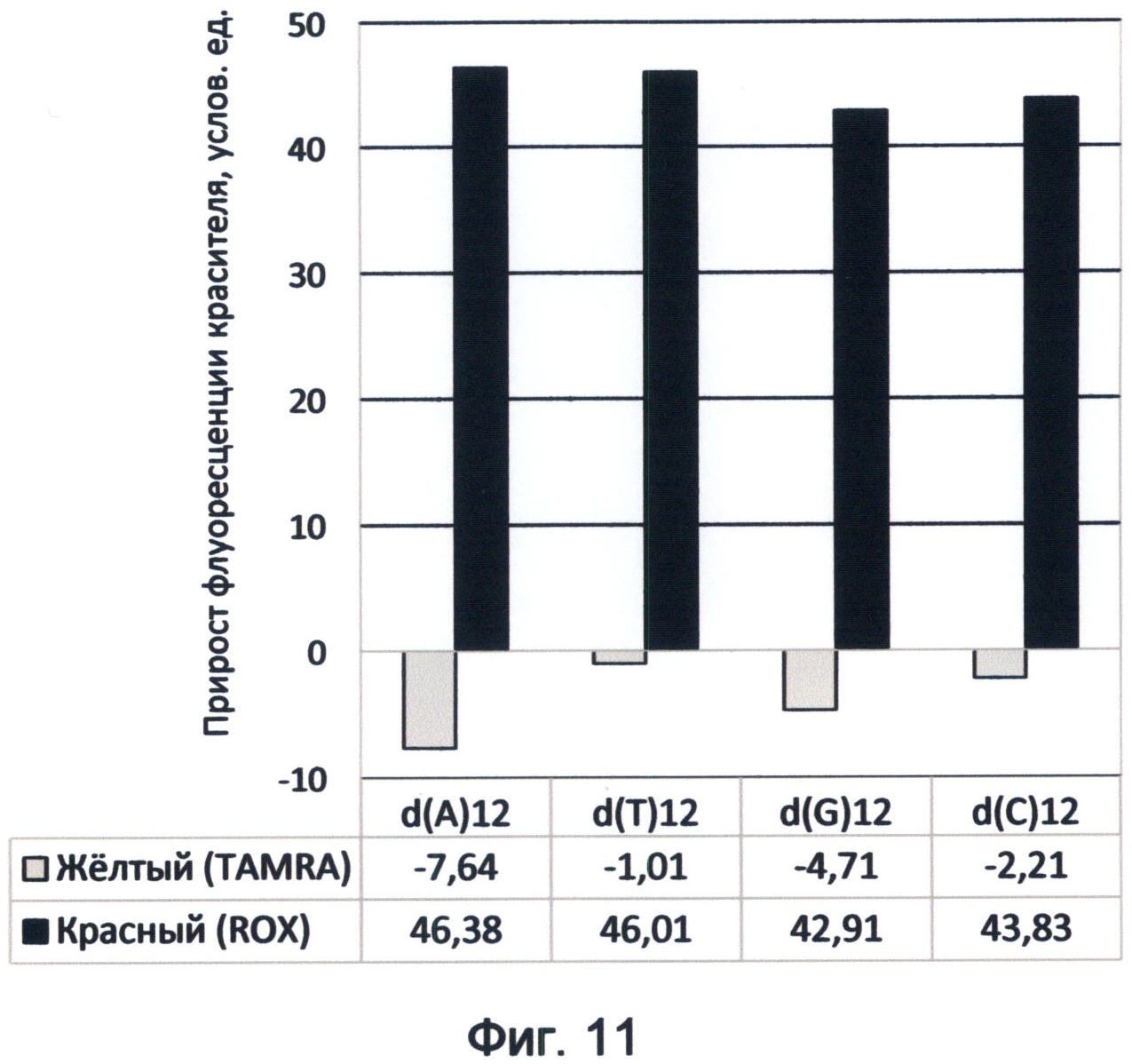
Фигура 11. Диаграмма прироста флуоресценции красителей TAMRA и ROX в соответствующих цветах видимого спектра под влиянием мононуклеотидных последовательностей. Демонстрирует спектральные характеристики азотистых оснований в желтом и красном спектрах флуоресценции в условиях измененного спектрального кода ДНК на конец июня 2012 года.
Фигура 12. График прироста флуоресценции красителя FAM во времени под влиянием мононуклеотидных последовательностей. Отображает динамику медленного насыщения зеленой флуоресценцией азотистых оснований в условиях измененного спектрального кода ДНК (конец октября 2012 г.).
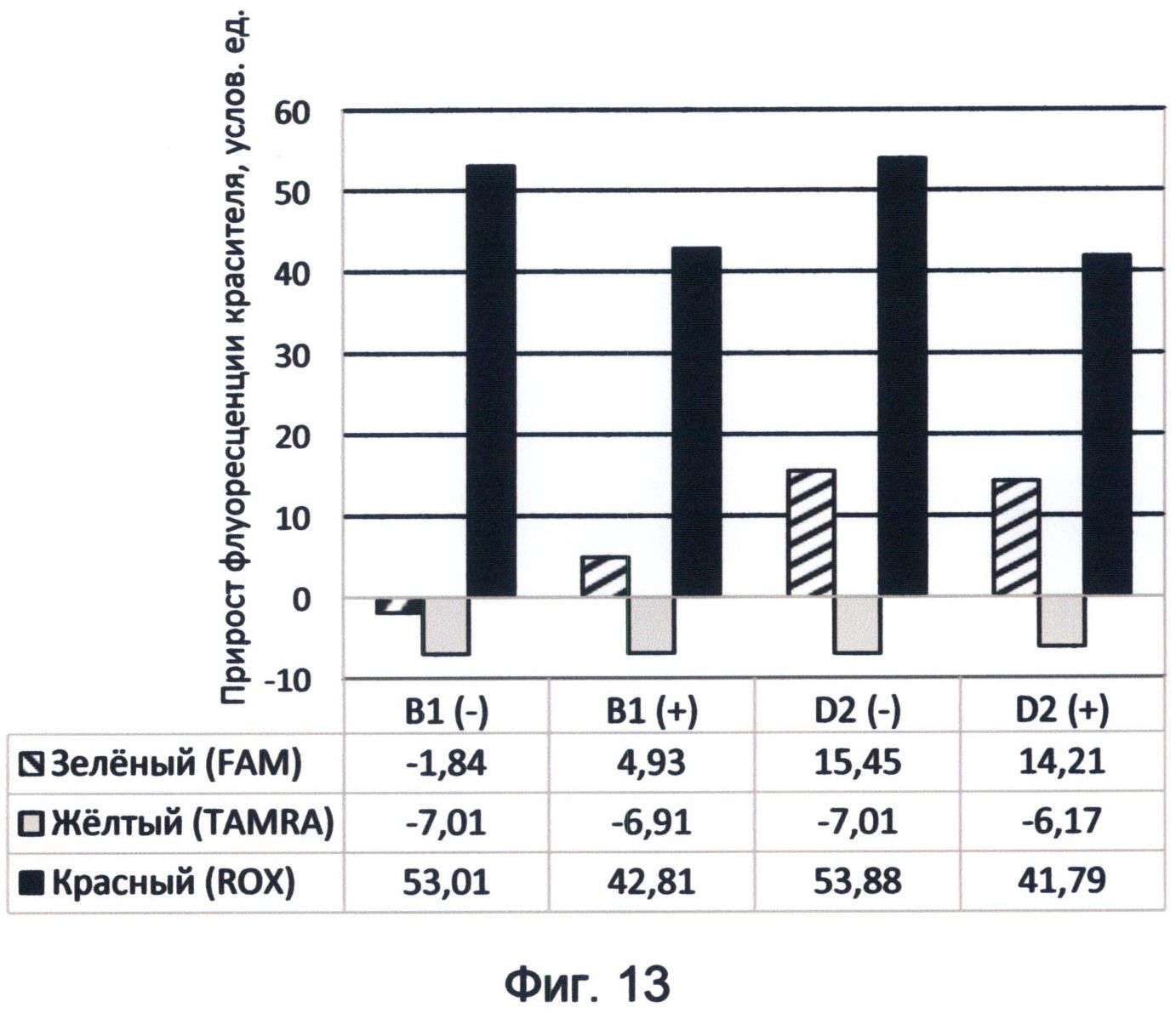
Фигура 13. Диаграмма прироста флуоресценции красителей FAM, TAMRA и ROX в соответствующих цветах видимого спектра под влиянием фрагментов минусовой и плюсовой цепей ДНК генов циклина В1 и D2 человека. Демонстрирует спектральные характеристики флуоресценции указанных генных последовательностей в условиях спектрального кода флуоресценции ДНК на конец апреля 2012 года.
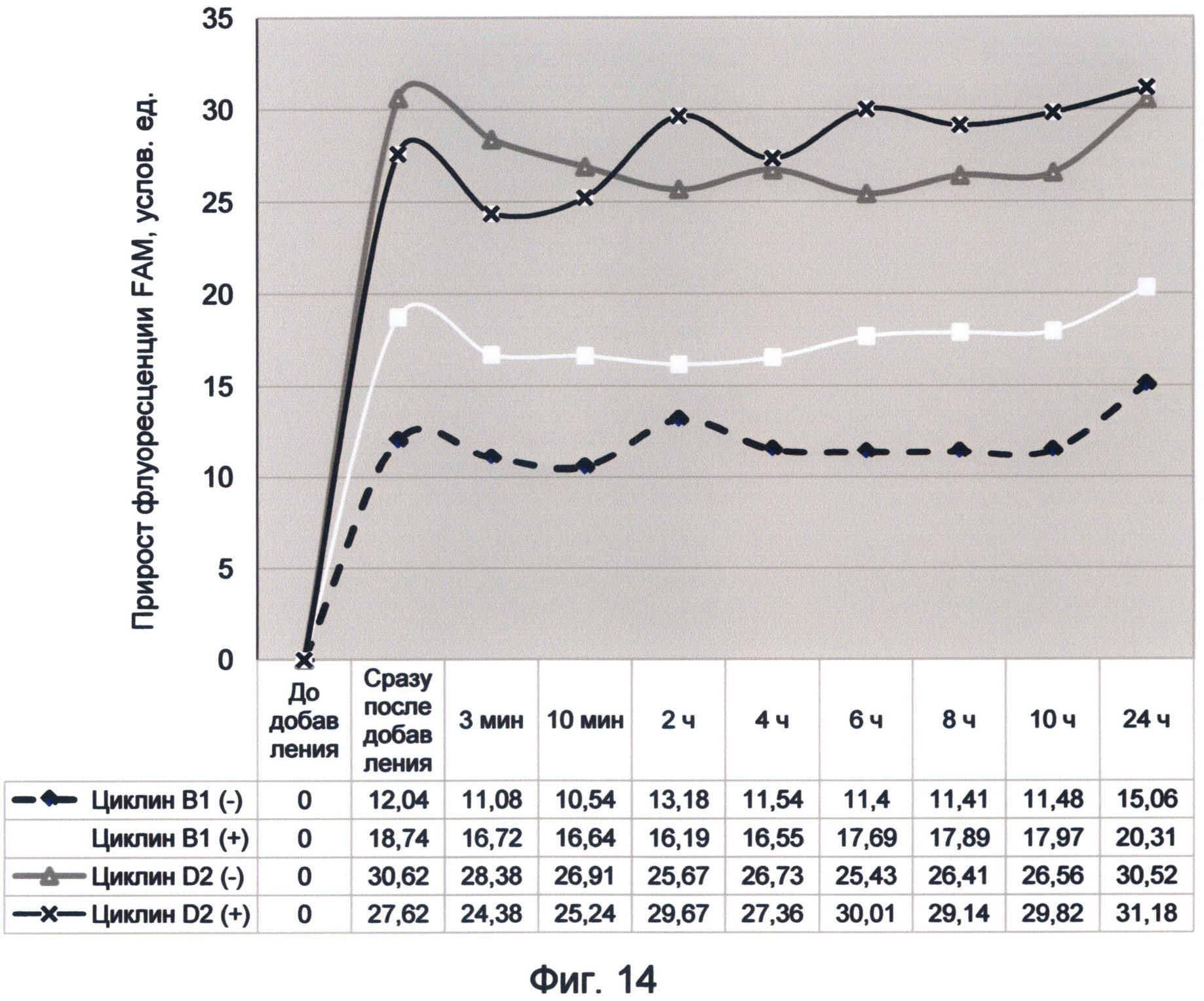
Фигура 14. График прироста флуоресценции красителя FAM во времени под влиянием последовательностей минусовых и плюсовых цепей циклинов В1 и D2 человека. Отображает динамику насыщения зеленой флуоресценцией последовательностей в условиях измененного спектрального кода ДНК (середина октября 2012 г.).
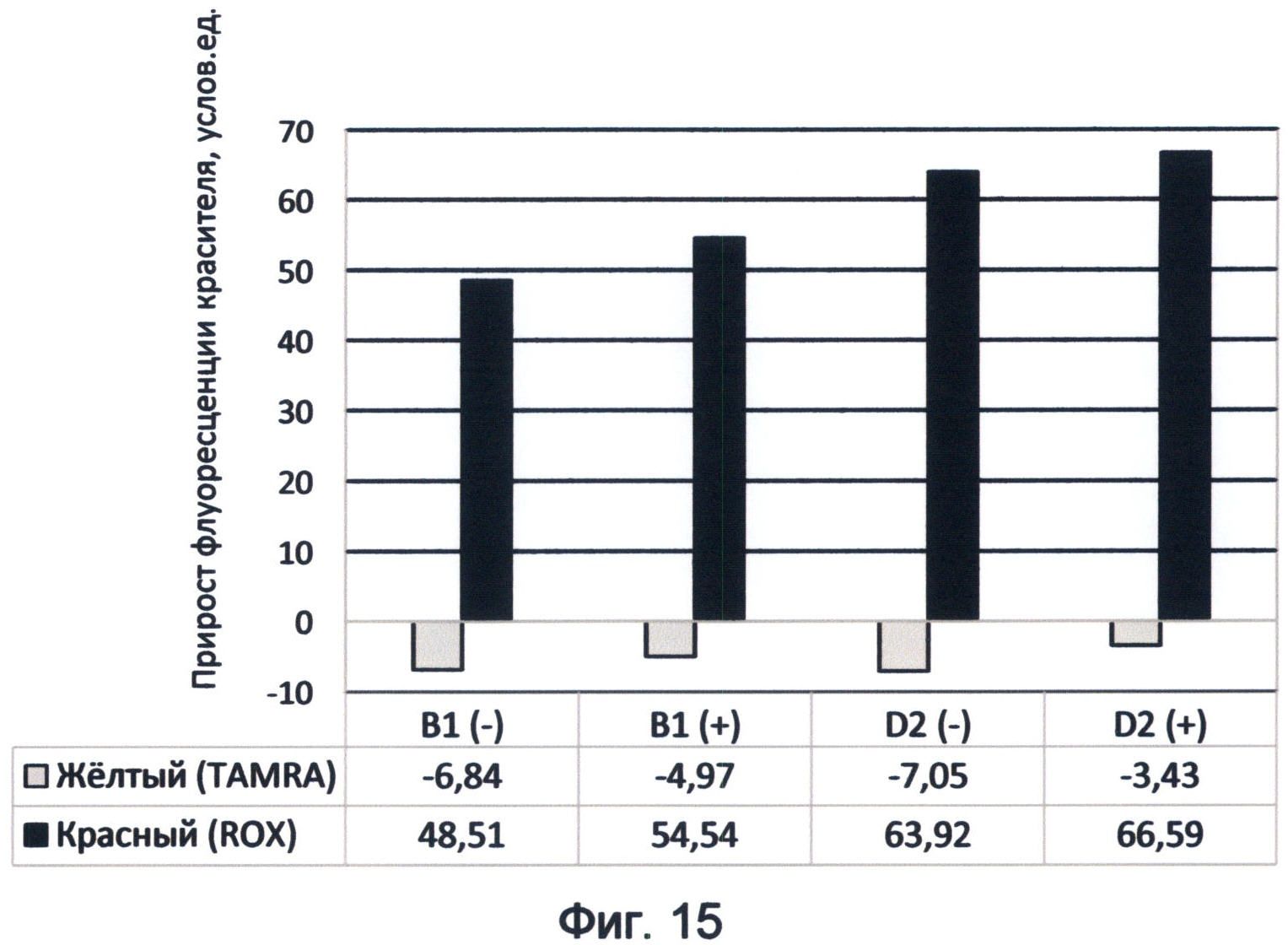
Фигура 15. Диаграмма прироста флуоресценции красителей TAMRA и ROX в соответствующих цветах видимого спектра под влиянием последовательностей минусовых и плюсовых цепей циклинов В1 и D2 человека. Демонстрирует спектральные характеристики генных последовательностей в желтом и красном спектрах флуоресценции в условиях измененного спектрального кода ДНК на конец июня 2012 года.
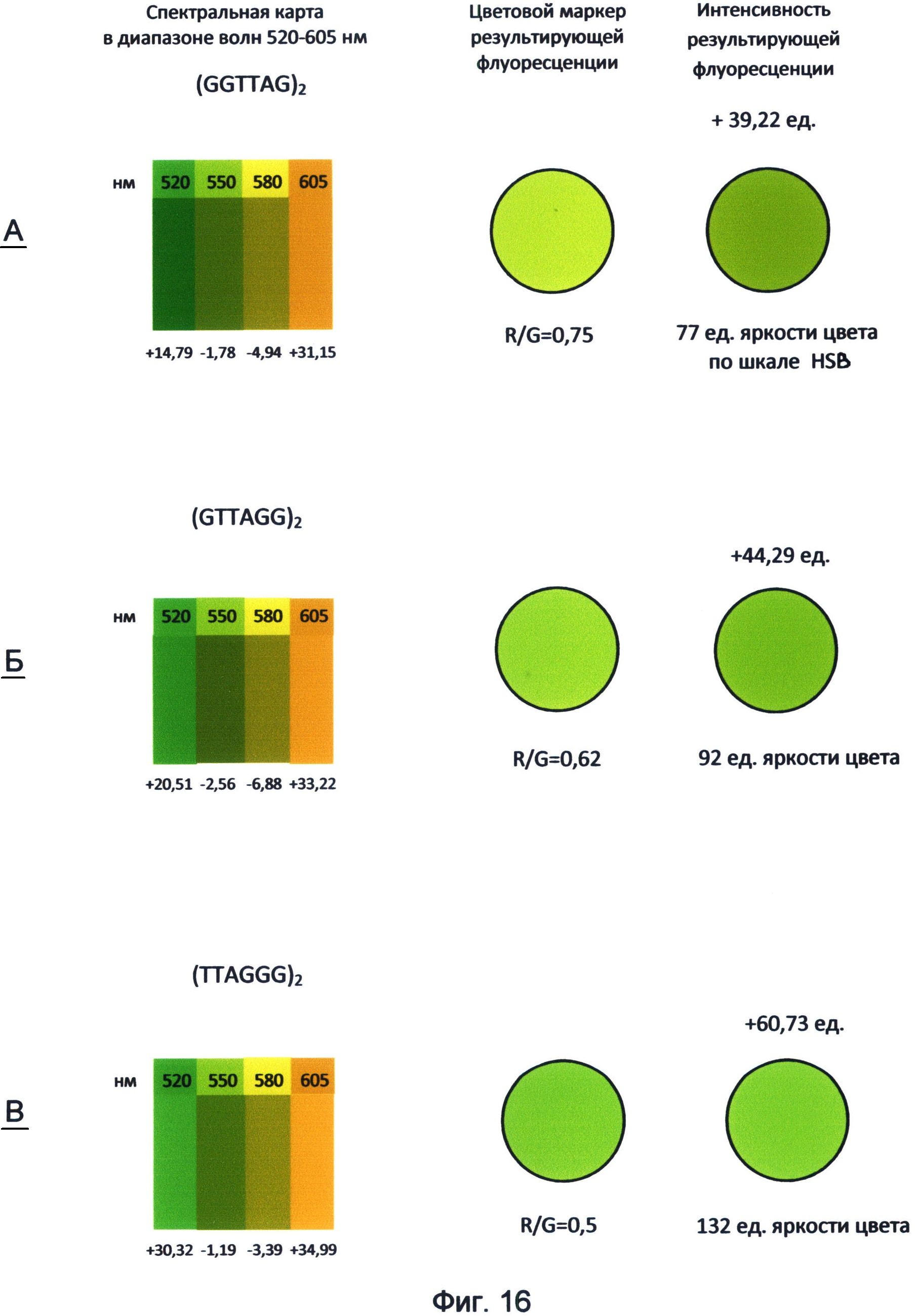
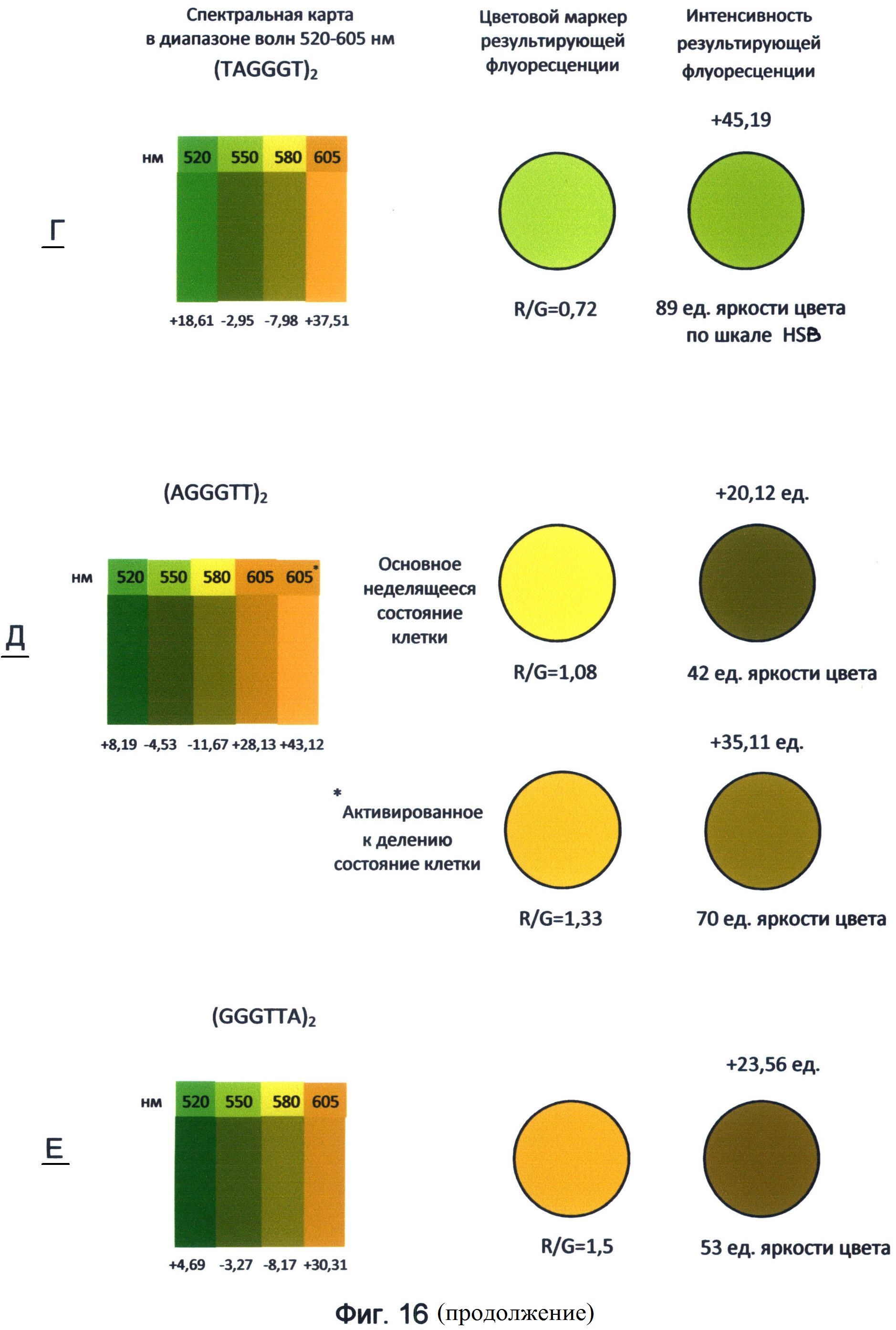
Фигура 16. Пример составления спектральных карт и цветовых маркеров результирующей флуоресценции последовательностей теломерного повтора ДНК человека в диапазоне волн 520-605 нм. Составлены по данным флуоресценции красителей FAM, R6G, TAMRA и ROX по состоянию на апрель-май месяц 2012 года.
Осуществление изобретения
Заявленный способ иллюстрируется несколькими примерами, демонстрирующими его универсальные возможности как метода анализа спектральных свойств генома клетки (спектрального геномного анализа). Главной характеристикой спектральных свойств генома является соотношение уровней флуоресценции основных цветовых каналов нуклеотидных последовательностей, которые изменяются во времени. Исследование спектральных свойств мононуклеотидных последовательностей позволяет выявить собственный вклад каждого вида азотистого основания во флуоресценцию ДНК-последовательности без влияния других видов азотистых оснований, входящих в ее состав, как в случае гетеронуклеотидной последовательности (пример 5).
Изучение гетеронуклеотидных последовательностей различной длины отображает общий спектр их флуоресценции, который возникает при взаимодействии входящих в их состав азотистых оснований. Он складывается из баланса процессов испускания и поглощения флуоресценции в разных цветах спектра.
Особое значение для регуляции деления клетки имеет изучение флуоресцентных свойств последовательностей теломерных оверхенгов, которые определяются нуклеотидным составом их окончаний, представленных вариантами терминального теломерного повтора (примеры 1-4).
Изучение различных генных последовательностей позволяет исследовать механизмы спектрального цветового кодирования генетической информации и квантового насыщения геноструктур с целью создания управляющей лазерно-активной среды генома (пример 6).
Пример 1. ДНК-спектральный анализ флуоресценции теломерных повторов ДНК человека в зеленом диапазоне видимого света с использованием концевого мечения зондов комбинацией карбоксифлуоресцеина и гасителя RTQ1.
В эксперименте использовались водные растворы следующих олигонуклеотидных зондов, содержащих возможные варианты теломерного повтора (подчеркнут):
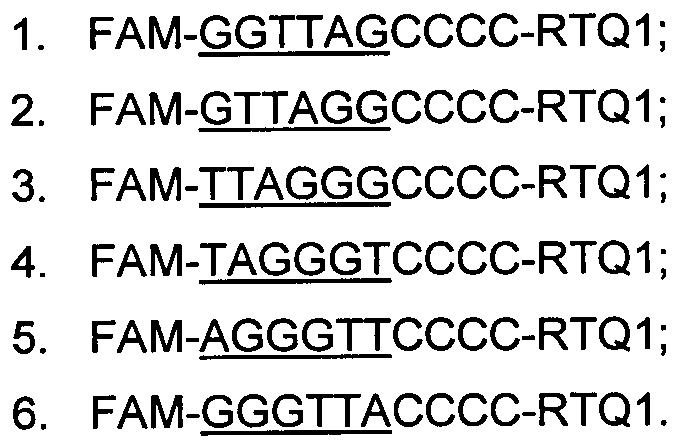
Второй набор зондов, той же нуклеотидной последовательности, содержал комбинацию метки и гасителя на противоположных концах, а именно 5'-RTQ1 и 3'-FAM.
Каждый зонд содержал один из вариантов полноразмерного теломерного повтора и одинаковую для всех последовательность из 4-х остатков цитозина, которая позволила удлинить зонд до оптимальной длины. Нужно отметить, что для проведения аналогичных экспериментов можно использовать последовательности зондов, целиком состоящие из теломерной последовательности без влияния цитозина, не входящего в состав нативной теломерной ДНК человека. Использовавшаяся конструкция зондов, содержащая во всех своих вариантах одинаковую поли(dC)-последовательность, соответствует целям данного исследования, так как позволяет сохранить однозначную дискриминацию влияния последовательности теломерного повтора. При этом присутствие короткой поли(dC)-последовательности способствует установлению более выявленной градации флуоресцентного потенциала разновидностей теломерного повтора в зависимости от нуклеотидной последовательности. Это связано с влиянием флуоресцентных свойств цитозина, обладающего максимальным энергетическим потенциалом в зеленом спектре.
Зонды были синтезированы в компании «Синтол» (Россия) в условиях неизмененного спектрального кода флуоресценции ДНК (FAM-RTQ1 - апрель 2009 года и RTQ1-FAM - январь 2012 года). Последовательности получены стандартным фосфорамидитным способом с высокой степенью включения красителя и гасителя, одинаковой для всех зондов. В связи с этим различия во флуоресценции зондов определялись особенностями флуорофорсвязанной флуоресценции ДНК-последовательностей зондов в зеленом спектре на момент синтеза, а не качеством включения меток.
Для измерения флуоресценции зондов готовились одинаковые 10 мкМ водные растворы в объеме 20 мкл. Для целей исключения влияния внутри- и межзондовых взаимодействий последовательностей с образованием дуплекса GGG/CCC растворы кратковременно нагревались до температуры 70°C с последующим градиентом снижения до 37°C. Измерение флуоресценции осуществляли с помощью флуоресцентного детектора FDG-001 при одинаковых условиях интенсивности возбуждающего излучения и выдержки сигнала детектирующей камеры.
Результаты представлены на фигуре 2, где под графическим изображением каждого зонда (А) приводится величина значимой флуоресценции в условных единицах по данным программы анализа изображений LabWorks 4.6 (UVP, England). Соотношение уровней сигнала каждого зонда для удобства сравнения флуоресцентных потенциалов теломерных повторов проиллюстрировано в виде столбчатой диаграммы (фиг.2Б и В).
Из анализа полученных данных видно, что при обоих вариантах мечения сохранялась характерная градация величины флуоресценции зондов, зависящая от положения гуанина в теломерном повторе. Наибольшей флуоресценцией в обоих вариантах мечения обладает третий зонд, содержащий теломерный повтор TTAGGG, оканчивающийся на максимальное количество гуанина. Меньшую флуоресценцию имел зонд с теломерным повтором GTTAGG, оканчивающимся на два гуанина. Далее по убывающей энергетического потенциала располагались зонды с теломерными повторами TAGGGT и GGTTAG. Самыми наименьшими величинами флуоресценции обладали зонды с теломерными повторами GGGTTA и AGGGTT.
Таким образом, использование концевого карбоксифлуоресцеинового мечения для изучения нуклеотидных последовательностей теломерного повтора человека выявило их специфические спектральные характеристики. Было установлено, что варианты теломерного повтора резко различаются своим флуоресцентным потенциалом в зеленом спектре видимого света. В указанном спектре флуоресценции наблюдается следующая градация энергетического потенциала вариантов теломерного повтора по направлению от максимального к минимальному: 1. TTAGGG; 2. GTTAGG; 3. TAGGGT; 4. GGTTAG; 5. AGGGTT и 6. GGGTTA.
При этом величина энергетического потенциала повторов зависела от расположения молекулы флуорофора. Наибольшей величины различия между повторами наблюдались при 5'-концевом расположении карбоксифлуоресцеина (фиг.2Б). Таким образом, использование различного концевого положения метки в зонде при осуществлении заявляемого способа позволило выявить роль положения флуорофора в формировании квантово-связанного спектра.
В клетке максимальными различиями во флуоресценции могут обладать теломерные оверхенги, оканчивающиеся различными теломерными повторами при расположении флуорофора ближе к 5'-концу. В качестве источников флуоресценции (флуорофоров) могут выступать аминокислоты белков, входящих в соединение с теломерной ДНК. Например, белок РОТ1, обладающий родством к теломерной последовательности оверхенгов, имеет ряд остатков аминокислот тирозина и фенилаланина, ароматические гетероциклы которых вступают в близкий контакт с плоскостями азотистых оснований. В связи с этим теломерные повторы, расположенные за сайтом связывания белка РОТ1 по направлению к 3'-концу ДНК обладают большей флуоресценцией, чем стоящие перед ним. При этом создаются уникальные условия для максимального различия во флуоресценции зеленого спектра для различных вариантов терминальных теломерных повторов. Этот механизм обеспечивает существование в клетке различных фоторежимов, характерных для неделящегося и активированного к делению состояний клетки. Их возникновение напрямую связано с изменениями нуклеотидных окончаний теломерных оверхенгов и существованием сбалансированного равновесного и неравновесного профилей их терминальных нуклеотидов.
В связи с установленными выше особенностями флуоресценции зондов было показано, что зеленый канал флуоресценции является спектрально-специфичным для последовательностей теломерного повтора ДНК человека. Он обеспечивает главный триггерный механизм переключения интенсивности цветовых каналов при активации деления клетки, связанный с перестройками окончаний теломерных оверхенгов в цикле понуклеотидных смещений. Сбалансированный профиль терминальных нуклеотидов, характерный для неделящегося состояния клетки и фаз активированной к делению клетки после триггерного момента запуска деления в ранней G1 фазе, обладает высоким содержанием AGG и TAG терминальных триплетов. Именно эти триплеты в составе терминальных повторов теломерных оверхенгов определяют их высокий уровень флуоресценции в зеленом спектре. Триггерный переход в активированное к делению состояние сопровождается перестройками окончаний теломерных оверхенгов и развитием несбалансированного неравновесного профиля их терминальных нуклеотидов с преобладанием ТТА терминального триплета. Как видно из полученных данных, GGGTTA триплет в составе изученных зондов обладает наименьшей флуоресценцией в зеленом спектре, в несколько раз меньшей, чем таковая для повтора GTTAGG, характерного для равновесного состояния профиля. Таким образом, активация деления клетки сопровождается резким падением интенсивности зеленого канала флуоресценции терминальных теломерных повторов ДНК человека.
В связи с этим исследование динамики изменения зеленого канала флуоресценции теломерных повторов ДНК как разновидности спектрального геномного мониторинга является примером исследования квантово-оптических процессов активации деления клетки.
Следующим аспектом применения концевого мечения ДНК-зондов в ДНК-спектральном анализе флуоресценции видимого диапазона является изучение динамики их фоновой флуоресценции во времени. Примером такого исследования может служить изучение динамики зеленого канала флуоресценции теломерных повторов ДНК в составе ДНК-зондов в период марта месяца 2012 года. Для исследования использовались описанные выше концентрации синтетических зондов, содержащих разновидности теломерного повтора и меченных комбинацией красителя FAM на 5'-конце и гасителя RTQ1 на 3'-конце. Результаты мониторинга представлены в виде графиков, отображающих уровни флуоресценции в зеленом спектре для различных вариантов теломерного повтора человека в указанные даты проведения анализа (фиг.3).
Проведенный с помощью заявленного способа мониторинг демонстрирует динамическую составляющую работы генома в рамках текущего спектрального кода, при которой сохраняется общий вид соотношения энергетического вклада каждого вида теломерного повтора в зеленом спектре, который растет по направлению: 6-й, 5-й, 1-й, 4-й, 2-й и 3-й варианты повтора. При этом сами энергетические уровни варьируют и выявляют периоды подъема (13.03.2012) и спада (5.03.2012 и 27.03.2012). График демонстрирует дальнейшую тенденцию возрастания флуоресценции после последней точки измерения (28.03.2012), что, видимо, свидетельствует о присутствии следующего периода подъема. За данный период мониторинга максимальный предел варьирования значений флуоресценции в зеленом спектре для некоторых вариантов теломерного повтора достигал более 50%. Это демонстрирует активную динамическую составляющую зеленого спектра флуорофорсвязанной флуоресценции теломерной ДНК.
Концепция триггерного механизма переключения цветовых каналов при активации деления клеток, сформулированная автором заявляемого способа, предполагает, что адекватность его функционирования напрямую зависит от баланса интенсивности цветов флуоресценции. Прежде всего, это касается энергетического уровня цветового канала, наиболее спектрально-дискриминирующего основные нуклеотидные переходы окончаний теломерных оверхенгов. Исходя из этого значительное изменение уровня флуоресценции зеленого канала является для генома клетки уязвимым моментом. Это связано с тем, что в этих условиях должна сохраняться адекватность триггерных механизмов переключения каналов и связанных с ними процессов модификации окончаний теломерной ДНК.
В связи с этим возможной причиной возникновения злокачественного перерождения клетки и различных геномных поломок могут являться различные нарушения, происходящие в такие спектрально-нестабильные моменты. Поэтому выявление времени критического изменения уровня основного спектрально-специфичного канала флуоресценции теломерных оверхенгов, а именно зеленого, является важной профилактической задачей спектрального геномного мониторинга, который можно осуществлять с помощью заявленного способа.
Пример 2. Описание процессов излучения и поглощения флуоресцентной энергии в зеленом спектре видимого света последовательностями теломерной ДНК на примере смесей вариантов теломерного повтора, меченных карбоксифлуоресцеином и гасителем RTQ1.
Эксперимент проводился в дни стабильного существования спектрального кода флуорофор-связанной флуоресценции ДНК (вторая половина марта 2012 года).
Полученные данные о том, что нуклеотидный состав зондов влияет на их флуоресцентные и спектральные характеристики позволили предположить, что зонды, несущие разные варианты теломерного повтора, будут влиять на флуоресценцию друг друга. Это утверждение имеет огромное значение для понимания роли совокупности теломерных G-оверхенгов, оканчивающихся на разные теломерные повторы, как системы, различные компоненты которой (отдельные G-оверхенги) влияют друг на друга и на конечный результат их общего взаимодействия. Роль критерия этого взаимодействия может выполнять результирующая флуоресценции оверхенгов в зеленом FAM-связанном спектре.
В данном примере изобретения изучалось взаимное влияние FAM-RTQ1 зондов друг на друга как модели антагонистического взаимовлияния вариантов теломерного повтора в зеленом спектре флуоресценции. Эксперимент заключался в изучении влияния на фоновую флуоресценцию зонда FAM-TTAGGGCCCC-RTQ1 зондов с другими теломерными повторами. Исследования проводились в различные по спектральной стабильности дни марта месяца 2012 года. Для этих дней характерная зависимость уровня зеленой флуоресценции теломерных повторов от количества гуанина в терминальном триплете проявлялась в различной степени. В качестве тестируемого зонда был взят вариант с максимальной фоновой флуоресценцией, содержащий теломерный повтор, оканчивающийся на три остатка гуанина.
Период исследования соответствовал промежутку между первым максимумом флуоресценции (13.03.12) и следующим за ним минимумом (27.03.12), что соответствует динамике флуктуационного изменения флуоресценции в зеленом спектре для теломерных повторов за март 2012 года в предыдущем примере (фиг.3).
Для исследования брались одинаковые количества зондов (по 20 пикомоль) в конечном объеме смеси 20 мкл. Теоретически ожидаемая флуоресценция смеси рассчитывалась как сумма двух усредненных значений фоновой флуоресценции для каждого зонда в этой смеси: Fтеор=F1+F2. Усредненное значение фона для каждого зонда рассчитывалось отдельно по пяти независимым растворам. Как видно из таблицы 1, фактическая флуоресценция смеси зондов оказалась отличной от теоретически ожидаемой и определяла значение разницы ΔF (ΔF=Fфакт-Fтеор).
Эксперимент позволил установить, что варианты теломерного повтора вступают друг с другом в квантово-резонансные отношения. В рамках зеленого канала флуоресценции было показано, что каждый из вариантов теломерного повтора, обладая определенным соотношением излучательных и поглощающих свойств, влияет на свойства других повторов, находящихся с ним вместе в смеси. Вариант теломерного повтора GGGTTA, обладающий максимальными поглощающими свойствами в зеленом спектре излучения в смеси с TTAGGG-повтором, показал самое большое занижение флуоресценции по сравнению с другими смесями. При этом зонды четко разделились на две группы. Первую группу составили зонды с повторами TTAGGG, GTTAGG и TAGGGT, для которых в период максимума характерно преобладание излучательных свойств над поглощающими (положительная ΔF). При падении общей интенсивности флуоресценции в зеленом спектре в промежуточный период и период минимума положительное значение ΔF сохранилось только для TTAGGG-повтора. Это говорит о его особых свойствах как главного донора зеленой флуоресцентной энергии в условиях основного спектрального кода ДНК. В период минимума интенсивности зеленой флуоресценции все остальные варианты зондов показали увеличенное отрицательное значение ΔF, что свидетельствует о его критической роли в насыщении генома зеленой флуоресценцией, см. таблицу.
|
Для зондов второй группы (GGGTTA, AGGGTT, GGTTAG), особенно для теломерного повтора GGGTTA, поглощение зеленой световой энергии всегда преобладало над излучением (отрицательная AF). При этом наблюдалась характерная тенденция увеличения поглощения в периоды минимумов по сравнению с периодами максимумами, что отображает общую тенденцию падения интенсивности флуоресценции в зеленом спектре.
В заключении следует отметить, что независимо от динамической составляющей спектральных свойств теломерных повторов, заключающейся в чередовании периодов максимумов и минимумов флуоресценции, сохраняется следующая градация увеличения их энергетического потенциала в зеленом спектре, зависящая от взаимного положения нуклеотидов в их составе: 1. GGGTTA; 2. AGGGTT; 3. GGTTAG; 4. TAGGGT; 5. GTTAGG; 6. TTAGGG.
Для изучения соотношения свойств излучения и поглощения световой энергии последовательностями ДНК особую роль играет дистанционный бесконтактный вариант осуществления способа, который представлен следующим примером осуществления изобретения.
Пример 3. Бесконтактный дистанционный способ изучения процессов излучения и поглощения флуоресцентной энергии в зеленом спектре видимого света последовательностями теломерной ДНК на примере вариантов теломерного повтора, меченных карбоксифлуоресцеином и гасителем RTQ1. Эксперимент проводился в дни стабильного существования спектрального кода флуорофорсвязанной флуоресценции ДНК (первая половина апреля 2012 года).
В эксперименте использовались те же олигонуклеотидные зонды, что и в примерах 1 и 2. Исходно готовился контрольный 1 мкМ водный раствор зонда FAM-TTAGGGCCCC-RTQ1, относительно которого оценивалось воздействие теломерных повторов других зондов. После разведения из стока с высокой концентрацией раствор подвергался изоляции от дистанционного действия любых последовательностей в течение 2-х часов. В ходе этого времени первоначально высокая флуоресценция контрольного раствора, насыщенного квантами от исходного стока, естественно снижалась до определенного стартового уровня. Такое состояние контрольного раствора называется квантово-ненасыщенным и характеризует его собственный энергетический потенциал, в отличие от первоначально квантово-насыщенного раствора, полученного сразу после разведения из стока с высокой концентрацией.
Стартовое значение флуоресценции в эксперименте составило 28,79 ед. (точка 1 на графике фиг.4). Перед проведением эксперимента изучался разброс погрешности измерений путем пятикратного измерения стартового значения флуоресценции после встряхивания раствора на вортексе. Встряхивание на вортексе позволяло осуществить переориентирование диполей флуорофора и перераспределить квантовое насыщение общей системы. В связи с этим в ходе проведения эксперимента перед каждым измерением флуоресценции мы осуществляли встряхивание и кратковременное центрифугирование раствора.
Разброс значений стартового уровня флуоресценции зонда составил не более 0,05 ед. Такое небольшое значение погрешности, связанное с переориентировкой диполей флуорофора в пространстве, оказалось на порядок меньше полученных нами величин изменения флуоресценции контрольного зонда под влиянием последовательностей других зондов. В связи с этим полученные результаты являются достоверными и адекватно демонстрируют взаимное влияние вариантов теломерного повтора друг на друга.
Растворы зондов, влияние которых изучалось, готовились заранее. Они представляли собой 10 мкМ растворы объемом 20 мкл. Зонды хранились в замороженном виде в другой комнате. Раствор непосредственно перед исследованием доставали из морозильника, оттаивали, нагреванием до 37°C в течение 1 минуты. После встряхивания контрольный и тестируемый образцы помещались в штатив в непосредственной близости друг от друга на расстоянии 1,5 см в течение 5 минут. Затем контрольный образец опять встряхивался и подвергался замеру уровня флуоресценции, при этом пробирка с воздействующим зондом находилась на расстоянии не более 5 см, то есть сохранялось условие квантовой связи между растворами зондов. Значения флуоресценции зондов соответствуют точкам 2, 4, 6, 8, 10 и 12 на графике фиг.4. После замера флуоресценции контрольного раствора тестируемый зонд уносили в другую комнату и помещали в морозильную камеру. Далее контрольный образец подвергался встряхиванию, после чего он находился в течение 5 минут в изоляции без влияния каких-либо последовательностей. После изоляции контрольный раствор опять подвергался встряхиванию и измерению флуоресценции (белые точки на графике 3, 5, 7, 9, 11 и 13). Описанная последовательность действий повторялась для всех тестируемых зондов в указанной на графике последовательности справа налево (фиг.4).
Бесконтактный дистанционный вариант заявляемого способа позволил установить, что последовательности теломерной ДНК, представленные различными вариантами теломерного повтора, обладают уникальным соотношением процессов излучения и поглощения. Было показано, что относительно зеленого канала флуоресценции в рамках шести возможных последовательностей теломерного повтора четко выделяются две группы.
Первую группу составляют повторы TTAGGG, GTTAGG и TAGGGT. Они обладают свойствами испускания зеленой флуоресценции, преимущественными над поглощением. Особую роль играет TTAGGG-вариант теломерного повтора, так как он обладает максимальными свойствами излучения флуоресценции в данном диапазоне, при этом у него отсутствует видимое поглощение. Он является максимальным донором зеленой световой энергии в теломерной ДНК клетки в условиях функционирования ее флуорофор-связанной флуоресценции. Другие варианты теломерного повтора из этой группы обладают этим свойством в меньшей степени в зависимости от нуклеотидной последовательности. Повторы GTTAGG и TAGGGT могут являться как донорами, так и поглотителями энергии, в зависимости от квантового насыщения системы. Дополнительные эксперименты, подобные примеру 6, позволили установить, что если повторы GTTAGG и TAGGGT предшествуют зонду TTAGGG, обладающему максимальной излучательной способностью, то они будут также являться излучателями. После воздействия повтора TTAGGG другие повторы этой группы становятся поглотителями и сдерживают квантовое насыщение системы, как это видно на примере TAGGGT-повтора (точка 8 графика фиг.4). Однако после удаления TAGGGT-повтора система вернулась к своему квантовому насыщению, наступившему благодаря действию TTAGGG-повтора, что явно демонстрирует подъем пунктирной линии, соединяющей точки 7 и 9 на графике.
Во вторую группу входят повторы GGGTTA, AGGGTT и GGTTAG, у которых свойство резонансного поглощения зеленой световой энергии преимущественно преобладает над излучением, что было продемонстрировано и в контактном варианте способа в примере 4. Особое место среди них занимает GGGTTA повтор, который является ярко выраженным антагонистом TTAGGG повтора в зеленом спектре флуоресценции, так как обладает напротив самыми ярко выраженными поглощающими свойствами пролонгированного действия. Падение флуоресценции продолжалось даже после того, как контрольный раствор побывал в уединении (точка 13 графика фиг.4). Выдающиеся свойства поглощения GGGTTA повтора демонстрирует движение вниз пунктирной линии, отображающей квантовое насыщение системы после воздействия зонда и соединяющей светлые точки 11 и 13 графика. Сходные результаты были получены и в контактных экспериментах, в которых также было показано максимальное преобладание поглощающих флуоресцентных свойств над излучательными для повтора GGGTTA. На втором месте по свойству поглощения зеленой флуоресценции находятся AGGGTT и GGTTAG повторы.
В случае использования первично квантово-насыщенных растворов контрольного образца с высокой степенью энергетического насыщения, полученного от исходного стока с высокой концентрацией, все теломерные повторы приводили к снижению флуоресценции в различной степени в зависимости от своего энергетического потенциала, определяемого последовательностью нуклеотидов.
Таким образом, соотношение поглощающих и излучательных свойств теломерных повторов как первой, так и второй группы, подчиняется общему правилу, а именно зависит от соотношения их энергетического потенциала и уровня насыщения общей квантовой системы раствора красителя. Если уровень насыщения общей квантовой системы больше, как, например, в случае первично квантово-насыщенного раствора или после воздействия предшествующего энергетически более богатого повтора, то наблюдается видимое поглощение энергии в виде падения флуоресценции раствора. И, наоборот, если уровень квантового насыщения системы меньше, чем энергетический потенциал повтора, например, после воздействия предшествующего повтора с более низким потенциалом, то наблюдается увеличение флуоресценции раствора и происходит рост общего квантового насыщения системы.
Важным преимуществом бесконтактного способа является то, что он позволяет оценить влияние нескольких теломерных последовательностей в виде непрерывной последовательности одного варианта за другим, что имитирует естественную смену окончаний теломерных оверхенгов в процессе активации деления клетки. При этом изучение процессов излучения и поглощения световой энергии возможно в любом из цветовых каналов благодаря использованию красителей соответствующего спектра флуоресценции.
Таким образом, использование различных вариантов осуществления способа (как контактного, так и бесконтактного) позволило установить, что теломерные оверхенги представляют собой элементы единой квантово-резонансной системы и влияют друг на друга не только будучи в одном растворе, но и находясь в разных пробирках (дистанционно). Проводя аналогию между замкнутыми объемами микропробирок и отдельными клетками, использование заявленного способа приобретает колоссальное значение для понимания механизма дистанционного взаимодействия клеток и существования единого светового поля клетки и организма в целом.
Результатом квантово-резонансного взаимодействия теломерных оверхенгов, различающихся своей длиной и нуклеотидными окончаниями, является поддержание светового потока определенной интенсивности и спектральной характеристики, который является основой митогенетического излучения видимого диапазона, управляющего делением клетки. В связи с этим заявленный способ является уникальным, не имеющим аналога инструментом его исследования, который может найти широкое применение в медицине и фундаментальной биологии.
Пример 4. ДНК-спектральный анализ флуоресценции видимого диапазона синтетических последовательностей G-цепи теломерной ДНК человека, представленных различными вариантами теломерного повтора (вариант осуществления способа с использованием флуоресцентного красителя в виде водного раствора свободных молекул).
В эксперименте использовалась группа последовательностей синтетических олигонуклеотидов длиной 12 н.о., которая состояла из возможных вариантов окончаний теломерных G-оверхенгов, представленных шестью вариантами терминального теломерного повтора. Каждый олигонуклеотид состоял из двух полноразмерных теломерных повторов, отличающихся от предыдущего варианта сдвигом на один нуклеотид.
Все последовательности были синтезированы стандартным фосфорамидитным способом в компании «Евроген» (Россия):
1. GGTTAG GGTTAG;
2. GTTAGG GTTAGG;
3. TTAGGG TTAGGG;
4. TAGGGT TAGGGT;
5. AGGGTT AGGGTT;
6. GGGTTA GGGTTA.
В эксперименте готовились исходные водные растворы красителей (FAM, TAMRA, ROX) объемом 20 мкл в конечной концентрации 0,25-0,5 мкг/мл в зависимости от их квантового выхода так, чтобы полученные разведения обеспечивали приблизительно одинаковую фоновую флуоресценцию в каждом из цветовых каналов детекции с целью их адекватного сравнения.
В качестве красителей использовались коммерческие препараты N-гидроксисукцинимидных эфиров производства фирмы «Синтол» (Россия), которые в отсутствии аминогрупп в условиях экспериментов удовлетворяли требованиям химически свободного красителя и не входили во взаимодействие с исследуемыми последовательностями ДНК. Измерялась фоновая флуоресценция этих растворов в трехкратном повторении для вычисления среднего значения фона и установления максимального разброса естественной флуктуации флуоресценции раствора красителя. Затем к раствору добавлялось одинаковое количество исследуемого олигонуклеотида (40 пмоль в 1 мкл водного раствора), образец тщательно перемешивали и проводили измерение флуоресценции в трехкратном повторе для вычисления среднего значения в течение первых десяти минут после смешивания. Значения уровней флуоресценции, соответствующих трем, пяти и десяти минутам после смешивания усреднялись и являлись критерием достижения квантового равновесия раствора. При отсутствии достижения равновесия и продолжении роста флуоресценции замеры продолжались в установленные промежутки времени.
Все измерения проводили с помощью флуоресцентного детектора FDG-001 с использованием соответствующих каналов детекции, а именно зеленого фильтра (520 нм) для детекции FAM, желто-зеленого фильтра (550 нм) для красителя R6G, желтого фильтра (580 нм) для TAMRA и оранжево-красного фильтра (605 нм) для красителя ROX. Все измерения проводились при одинаковой интенсивности возбуждающего излучения соответствующего спектра и равной длительности выдержки сигнала на матрице детектирующей камеры, что обеспечивало сопоставимые условия накопления светового сигнала и оценки изменения флуоресценции.
По результатам измерений высчитывали, на сколько условных единиц увеличилась или уменьшилась флуоресценция исходного раствора красителя после добавления соответствующего образца олигонуклеотида. Результаты представляли в виде диаграмм и графиков, отображающих уровни флуоресценции красителей. Соотношение полученных значений прироста флуоресценции демонстрирует спектральные характеристики флуоресцентных свойств изучаемых последовательностей теломерного повтора в исследуемых спектрах видимого света.
Исследования проводились с апреля по сентябрь 2012 года, результатом чего стало установление разных спектральных характеристик теломерной ДНК (фиг.5-8), демонстрирующих уникальный процесс изменения режима насыщения теломерной ДНК зеленой световой энергией, зафиксированный в указанный период.
Установление полиморфизма терминальных нуклеотидов теломерных оверхенгов и связанного с ним цикла понуклеотидных смещений их 3'-окончания, позволило выявить присутствие специфического баланса вариантов окончаний теломерных оверхенгов, характерного для основного неделящегося и активированного к делению состояния клетки. В связи с этим изучение спектральных свойств возможных вариантов терминальных повторов, которыми оканчиваются теломерные оверхенги, а именно баланса соотношения основных цветов спектра флуоресценции на разных этапах клеточного цикла, является актуальной задачей. Оно позволяет определить специфические спектральные маркеры активированной к делению клетки, возникающие при основных переходах нуклеотидных окончаний теломерных оверхенгов GTTAGG→GGTTAG→GGGTTA.
При исследовании всех трех цветов видимого спектра флуоресценции в ходе непрерывной смены одного образца за другим был замечен эффект так называемого «остаточного поля ДНК». Он заключается в том, что место сканирования образца в детекторе продолжало нести информацию о его флуоресценции в виде слабого поля даже после его удаления. В связи с этим на флуоресцентные свойства образцов влияли предыдущие ДНК-последовательности. Поэтому особое значение имела последовательность сканирования образцов.
Учитывая обнаруженные эффекты влияния предыдущих образцов на последующие, мы придерживались одинаковой схемы чередования образцов при проведении анализа всех изучаемых последовательностей как теломерных, так и генных или мононуклеотидных. На фиг.5 отображены спектральные характеристики теломерных повторов в указанной последовательности слева направо, с первого по шестой варианты. Указанные значения флуоресценции соответствовали существовавшему на момент исследования состоянию спектрального кода ДНК (конец апреля 2012 г.).
Обнаружение эффекта «остаточного поля ДНК» применительно к последовательностям теломерных оверхенгов имеет большое значение в свете понимания скорости и последовательности изменений их терминальных нуклеотидов в процессе активации деления клетки. В связи с этим мы изучили последовательность образцов, соответствующую основным переходам терминальных триплетов в клетке, происходящих при активации деления клетки: 1.TAG→6.TTA→5.GTT→4.GGT→3.GGG→2.AGG.
Для красного спектра такое изменение последовательности образцов сказалось существенным образом только на флуоресценции теломерного повтора с терминальным триплетом GTT. Все остальные варианты теломерного повтора оверхенгов имели сходные с первой последовательностью образцов значения. Флуоресценция теломерного повтора AGGGTT при втором варианте последовательности образцов составила +43,12, что существенно выше по сравнению с исходной последовательностью образцов (+28,13 на диаграмме 5). Исходя из этого можно сделать вывод о том, что прирост флуоресценции в ближнем красном спектре для GTT-терминального триплета зависит от того, предшествует он по времени гуанин-богатым триплетам (AGG,GGG и GGT) или возникает после них, испытывая при этом их подавляющее влияние. Указанный факт раскрывает энергетическую целесообразность существующего цикла переходов терминальных триплетов теломерных оверхенгов в ходе активации деления клетки. Он заключается в поддержании высокого уровня красного канала флуоресценции на фоне падения зеленого при переходе большинства окончаний в терминальный триплет ТТА. Кроме того, уровень красной флуоресценции при активации деления клетки поддерживается переключением теломерного повтора с терминальным триплетом GTT в состояние повышенной флуоресценции в отсутствии подавляющего влияния повтора AGG (фиг.16Д, активированное состояние клетки*). Напротив, высокое содержание GTT терминального триплета (25-27%) в условиях неделящегося состояния клетки характеризуется его сниженным вариантом флуоресценции, так как он испытывает влияние одновременно присутствующего с ним гуанинсодержащего триплета AGG в равном количестве.
Таким образом, применение заявленного способа в данном исследовании показывает, что каждый вариант теломерного повтора, которым могут оканчиваться теломерные оверхенги, обладает специфическими спектральными свойствами и, прежде всего, уникальным соотношением красной и зеленой флуоресценции. Наиболее наглядно эти свойства демонстрирует спектральная карта, составленная для изученного диапазона волн 520-605 нм с использованием красителей FAM (520 нм), R6G (550 нм), TAMRA (580 нм) и ROX (605 нм) (фиг.16). Преобразование полученных спектральных данных в RGB-систему цветового кодирования информации представлено в виде маркера результирующей флуоресценции для каждого варианта теломерного повтора. Все исследуемые цвета спектра в исследуемом диапазоне длин волн представлены как результирующее соотношение красного и зеленого каналов цветности. В частности, желто-зеленый канал флуоресценции (550 нм) рассматривался как результат преобладания зеленого цвета над красным в отношении 2:1, оранжево-красный канал (605 нм) как результат преобладания красного над зеленым в отношении 1,8:1. Желтый канал флуоресценции (580 нм) представлялся как соотношение красного и зеленого цветов в отношении 1:0,9. Результат взаимодействия указанных цветов представлен в виде цветового маркера, как результирующее соотношение R/G красного и зеленого каналов цветности в исследуемом диапазоне спектра света.
Как видно из рассмотрения фиг.16, маркеры результирующей флуоресценции различаются не только по тону цвета, но и по его интенсивности (яркости) по шкале HSL (HSB). Из этого следует, что различные варианты терминальных повторов теломерных оверхенгов складываются в общую картину результирующей флуоресценции определенной интенсивности, которая составляет цветовой маркер специфической яркости, характерный для клетки на определенном этапе ее клеточного цикла.
Следует отметить, что основные различия в спектральных свойствах теломерных повторов связаны с зеленым каналом флуоресценции, соответствующим красителю FAM с максимумом испускания 520 нм. Аналогичные данные, свидетельствующие о наибольшей спектральной специфичности зеленого спектра для последовательностей теломерного повтора, были получены также при использовании их концевого FAM-мечения (пример 1).
Для ближнего красного спектра с максимумом испускания 605 нм, соответствующего красителю ROX, различия для вариантов теломерного повтора не такие выраженные по сравнению с зеленым спектром. Возможно, использование в рамках заявленного способа других красителей типа Cy5, Cy7 и их аналогов, спектр флуоресценции которых смещен в более дальнюю красную область, включая инфракрасную, позволит лучше выявить спектральные различия теломерных повторов.
Изменения, затрагивающие уровни флуоресценции основных цветовых каналов, могут иметь более глобальные последствия, чем установленные флуктуации энергетического потенциала флуоресцентно-меченных ДНК-зондов в примере 1.
Использование для осуществления заявленного способа растворов красителей в виде свободных молекул позволило установить существенные изменения спектральных свойств ДНК, произошедшие в период между апрелем и сентябрем 2012 года. Характер этих изменений в основном связан с изменением насыщения теломерной ДНК зеленой флуоресценцией, которая играет роль главного триггерного переключателя при активации деления клетки.
Результат изучения зеленого спектра флуоресценции последовательностей теломерного повтора в конце сентября 2012 года изображен на фиг.6. На графике представлена динамика накопления сигнала флуоресценции карбоксифлуоресцеина во времени, которая отображает их медленное пролонгированное насыщение зеленой световой энергией под воздействием различных вариантов теломерного повтора. Характерной особенностью проведения анализа на этом этапе являлось отсутствие наступления энергетического равновесия в квантово-связанной системе ДНК-краситель, то есть флуоресценция продолжала медленно расти на протяжении всего периода исследования.
Из сравнения данных диаграммы фиг.5 и графика фиг.6 видно, что изменение спектрального кода теломерной ДНК связано с резким падением флуоресценции в зеленом спектре. Для апреля 2012 года результаты анализа зеленого спектра флуоресценции теломерных повторов с использованием растворов свободных молекул красителя были сходными с результатами анализа, проведенного с помощью меченых зондов в примере 1, что видно из сравнения диаграмм фиг.2Б и фиг.5. В сентябре месяце 2012 года результаты, полученные с помощью этих двух вариантов осуществления анализа, различны. Скорее всего, это связано с влиянием различного пространственного расположения молекул флуорофора по отношению к последовательности теломерной ДНК, имитирующего различные варианты их естественного фотонного насыщения в клетке.
Таким образом, основные изменения спектральных свойств теломерной ДНК связаны с режимом ее насыщения световой энергией зеленого спектра. Она определяется квантово-связанным спектром флуоресценции свободных флуоресцентных молекул в клетке, не входящих с ней в близкий контакт. При этом режим насыщения теломерной ДНК, определяемый ДНК-связывающимися белками, изменился незначительно. Об этом свидетельствует сохранение в сентябре 2012 года флуоресцентных свойств меченных по концам зондов на основе вариаций теломерного повтора. Возможно, сохранение флуоресцентных свойств зондов связано с особым видом квантовой памяти, которая сохранила их флуоресцентные свойства, характерные для неизмененного спектрального кода ДНК на момент синтеза зондов.
Главной особенностью измененного режима насыщения световой энергией теломерной ДНК в зеленом спектре являлось не только очень медленное насыщение, но и существование периодов практически полного его отсутствия, а также периодов гиперфлуоресценции теломерной ДНК. Примером обнаружения периодической гиперфлуоресценции теломерного повтора TTAGGG является динамика насыщения от 21 сентября 2012 г. (фиг.7). Как видно из анализа графиков, максимальным потенциалом к насыщению обладал теломерный повтор TTAGGG, гораздо меньшим потенциалом обладала вариация этого повтора, оканчивающаяся триплетом ТТА. Вариант теломерного повтора GTTAGG, отличающийся от повтора TTAGGG сдвигом всего лишь на один нуклеотид, выявил наименьшее насыщение.
При исследовании динамики насыщения зеленой флуоресцентной энергией теломерных последовательностей проводилось исследование контрольного образца чистого раствора красителя FAM без добавления ДНК (фиг.6-7). Важно отметить, что подобное исследование контрольного образца, учитывая эффект остаточного поля ДНК, необходимо проводить без влияния образцов, содержащих тестируемые в этот день олигонуклеотиды. Лучше осуществлять его в специально отведенный день, при этом выждать как можно большее количество времени после проведенных до этого исследований ДНК. Наблюдавшееся небольшое увеличение фоновой флуоресценции контрольного образца чистого красителя связано с остаточными полями ДНК в сканирующем отделении флуоресцентного детектора. Подобные фантомные эффекты могут оказывать влияние на флуоресценцию контрольного красителя на протяжении нескольких дней после проведенных ранее исследований ДНК. Тем не менее, прирост флуоресценции чистого красителя, во много раз меньший по сравнению с образцами, содержащими теломерную ДНК, однозначно свидетельствовал о специфических свойствах последней в увеличении квантово-связанной флуоресценции общего с красителем спектра.
Полученные данные свидетельствуют о том, что режим насыщения теломерной ДНК зеленой флуоресценцией, осуществляемый свободными флуоресцентными молекулами в клетке, изменился в сторону общего снижения насыщения с его пролонгированием и одновременным существованием периодов гипернасыщения.
Было показано, что изменения в зеленом спектре флуоресценции, начавшиеся в конце июня 2012 года, сопряжены с небольшим уменьшением поглощения в желтом спектре для некоторых теломерных повторов и одновременным ростом красной флуоресценции (фиг.8). Эти наблюдения свидетельствует в пользу утверждения взаимосвязанности каналов флуоресценции и интегрированности мультицветового спектра излучения ДНК. Наблюдаемые данные коррелируют с изменением свойств мононуклеотидных последовательностей в примере 5, что свидетельствует об общем характере изменений свойств азотистых оснований при изменении спектрального кода ДНК. Уменьшение поглощения в желтом спектре для тимина, которое наблюдалось при изучении мононуклеотидных последовательностей, коррелировало с падением поглощения в этом спектре для вариантов теломерного повтора TAGGGT и AGGGTT, оканчивающихся этим азотистым основанием.
В заключении рассмотрения использования заявляемого способа для исследования теломерных последовательностей следует отметить, что спектральные свойства ДНК динамичны, особенно в условиях второй половины 2012 года. В первую очередь это касается установления квантово-связанного спектра излучения ДНК со свободными флуоресцентными молекулами. Это связано с формированием разнонаправленной миграции энергии в ДНК-последовательности, неориентированной к 5' или 3' концам, как в случае с использованием меченных по концам зондов.
Пример 5. ДНК-спектральный анализ флуоресценции видимого диапазона мононуклеотидных последовательностей ДНК с помощью свободных молекул флуоресцентных красителей.
В эксперименте использовались синтетические мононуклеотидные последовательности длиной 12 н.о. производства фирмы «Евроген» (Россия), полученные стандартным фосфорамидитным способом синтеза.
ДНК-спектральный анализ осуществляли аналогично описанному способу в примере 4.
По результатам измерений высчитывали, на сколько условных единиц увеличилась или уменьшилась флуоресценция исходного раствора красителя после добавления соответствующего образца мононуклеотида. Результаты исследования в условиях неизмененного кода ДНК в апреле 2012 года представлены в виде диаграммы, отображающей уровни флуоресценции красителей, связанной с типами азотистых оснований ДНК (фиг.9). Соотношение полученных значений прироста их флуоресценции демонстрирует спектральные характеристики флуоресцентных свойств изучаемых мононуклеотидных последовательностей в исследуемых спектрах видимого света. На основе полученных данных можно составить представление о спектральных свойствах каждого из четырех видов азотистых оснований в отсутствие их взаимного влияния друг на друга, как в случае гетеронуклеотидной последовательности.
Именно спектральные свойства азотистых оснований составляют основу спектрального кода ДНК как универсальной характеристики ее спектральных свойств, определяющей уникальное соотношение процессов поглощения и испускания флуоресценции в пределах спектра видимого света. Основу спектрального кода ДНК составляет соотношение уровней флуоресценции основных цветовых каналов, которое представляет собой динамическую составляющую и выражается в чередованиях пиков максимумов и минимумов их интенсивности.
Исследования проводились в период с апреля по октябрь 2012 года. Результатом стало построение разных динамических спектров флуоресценции азотистых оснований ДНК (фиг.9-12), демонстрирующих уникальный процесс изменения спектрального кода флуоресценции ДНК, зафиксированный в период исследования.
Использование заявленного способа позволило установить, что для спектрального кода ДНК в апреле 2012 г. была характерна четко выраженная градация квантового выхода флуоресценции азотистых оснований в зеленом спектре, соответствующем красителю FAM. При этом тимин, гуанин и цитозин демонстрировали увеличивающийся положительный прирост, а аденин - отрицательный прирост флуоресценции этого красителя (фиг.9).
Сравнение полученных для теломерных повторов спектров со спектрами флуоресценции мононуклеотидных последовательностей в условиях неизмененного спектрального кода в апреле 2012 года (фиг.5 и 9) показывает, что возникновение зеленой флуоресценции во многом связано с установлением квантово-резонансных взаимодействий между различными азотистыми основаниями в пределах ДНК-последовательностей. Так, мононуклеотидные последовательности, состоящие из одного вида азотистых оснований, показали гораздо меньший прирост флуоресцентной энергии в зеленом спектре по сравнению с гетеронуклеотидными последовательностями, к которым относятся теломерная и генная ДНК. Это указывает на особую квантово-резонансную природу зеленой флуоресценции ДНК-последовательностей, которая показала их наибольшую спектральную специфичность по сравнению с желтым и красным спектрами.
Желтый спектр флуоресценции мононуклеотидных последовательностей, так же как теломерных и генных, характеризовался поглощением для всех типов азотистых оснований, а ближний красный - испусканием. Таким образом, главным отличительным свойством спектрального кода флуорофор-связанной флуоресценции ДНК является наличие ярко выраженных каналов испускания флуоресценции в красном и зеленом спектрах с одновременным поглощением в промежуточном желтом спектре. При этом красный канал флуоресценции более мощный, чем зеленый, но менее спектрально-специфичный для нуклеотидных последовательностей. В связи с этим именно зеленый канал флуоресценции составляет основу спектрального кодирования генетической информации, так как позволяет различать нуклеотидные последовательности ДНК. Соотношение цветовых каналов флуоресценции составляет основу спектрально-оптического регулирования функционирования генома.
Обнаружение эффекта «остаточного поля ДНК» применительно к мононуклеотидным последовательностям имеет большое значение в свете понимания механизмов записи генетической информации в виде чередования азотистых оснований по ходу полинуклеотидной цепи ДНК. Рассмотрение образцов в порядке oligo(dA)12→(dT)12→(dG)12→(dC)12 описывает возможные взаимовлияния видов азотистых оснований по ходу миграции энергии вдоль нуклеотидной последовательности ATGC в ДНК. В таком порядке чередования образцов, как видно из диаграммы на фиг.9, для желтого канала красителя TAMRA максимальным поглощением обладали поли(dA)- и поли(dT)образцы, которые исследовались первыми. Исследования влияния изменения последовательности образцов проводились в условиях неизмененного спектрального кода флуоресценции ДНК (апрель-май 2012 г.). Изменение последовательности образцов, при котором поли(dC)образец изучался первым, а затем следовали поли(dG)-, поли(dA)- и поли(dT)образцы, показали значения флуоресценции красителя TAMRA: -10,53; -3,81; -5,69; -9,03 соответственно. Из этого следует, что для желтого спектра флуоресценции первый по порядку нуклеотид в последовательности ДНК обладает большим поглощением, чем последующие одноименные нуклеотиды (эффект первичного положения). Особенно это свойство выражено для цитозина, так как изменение положения поли(dC)олигонуклеотида в последовательности анализа образцов с первого на четвертое привело к падению поглощения более чем в три раза. Для остальных образцов в желтом спектре изменение порядка сказалось менее значительно.
В красном спектре изменение последовательности образцов на обратную последовательность oligo(dC)12→(dG)12→(dT)12→(dA)12 показало следующие значения прироста флуоресценции красителя ROX: +22,48; +34,03; +25,99 и +37,64 соответственно. В этом спектре эффект положения в основном сказался на свойствах поли(dT) последовательности и связан с ее положением относительно поли(dG) образца в ряду образцов. Если поли(dT)последовательность предшествовала поли(dG)образцу, то прирост флуоресценции красителя увеличился в полтора раза. Менее значительно проявился эффект первичного положения для поли(dA)- и поли(dC)образцов. Их первичное положение в сравнении с последним в ряду образцов несколько увеличило прирост флуоресценции красителя ROX.
В зеленом спектре изменение последовательности анализа образцов на обратное показало следующие значения флуоресценции красителя FAM: dC12 (+15,31); dG12 (+9,96); dT12 (+5,12); dA12 (-2,52). Оно выявило эффект первичного положения для поли(dA)образца. Его поглощающие свойства наиболее ярко выявлялись при первичном положении в ряду образцов, аналогично тому, как увеличивались излучательные свойства поли(dC)образца при его первичном положении (+15,31). Таким образом, поглощающие свойства первичного поли(dA)образца несколько занижали разгорание флуоресценции для последующих образцов при исходном порядке. При смене порядка на обратный высокий энергетический потенциал первичной поли(dC)последовательности повлиял на все последующие образцы и вызвал уменьшение поглощающих свойств последнего в ряду поли(dA)образца (-2,52).
Основные изменения спектрального кода, начавшиеся в июне 2012 года, были связаны с измененем спектральных свойств тимина, гуанина и цитозина в зеленом спектре. Первый этап таких изменений отображен на совмещенном графике динамики насыщения мононуклеотидных последовательностей зеленой флуоресцентной энергией от 19 июня 2012 года (фиг.10). Из сравнения полученного графика с диаграммой фиг.9 видно, что изменения связаны с тем, что в первые десять минут после добавления образцов поли(dT)- и поли(dG)последовательностей к раствору красителя FAM наблюдалось падение флуоресценции раствора. Положительный прирост сохранила только поли(dC)последовательность. При этом изменился сам режим насыщения флуоресцентной энергией, который растянулся во времени. За весь промежуток времени проведения измерений не наступило энергетическое равновесие и постоянно прирастала флуоресцентная энергия. Наблюдавшаяся гиперфлуоресценция поли(dC)последовательности была сходна с гиперфлуоресценцией теломерного повтора TTAGGG, наблюдавшаяся в предыдущем примере (фиг.7). Она также носит периодический характер. При этом гиперфлуоресценция поли(dC)образца значительно превосходила таковую для теломерного повтора. Прирост флуоресценции красителя FAM за первый час измерений составил 124%. Это свидетельствовало о более значительном флуоресцентном потенциале цитозина в зеленом спектре по сравнению с другими азотистыми основаниями. Зафиксированное явление представляло собой первый этап изменения спектральных свойств азотистых оснований, произошедший во второй половине 2012 года. Таким образом, было установлено, что изменение режима насыщения теломерных последовательностей было связано прежде всего с изменениями общих спектральных свойств азотистых оснований.
На первом этапе изменений спектрального кода флуоресценции ДНК в июне 2012 года аденин продемонстрировал спектрально-стабильные свойства в изучаемых спектрах и не выявил каких-либо значительных изменений. На фоне снижения энергетического потенциала тимина в зеленом спектре существенно уменьшилось поглощение в желтом спектре для поли(dT) последовательности (фиг.11). Для остальных последовательностей существенных изменений желтого спектра замечено не было. Изменения в красном спектре в основном свелись к увеличению флуоресценции для гуанина и цитозина с общей тенденцией выравнивания энергетических потенциалов для всех видов азотистых оснований в этом спектре.
Следует отметить, что описанными в июне месяце характеристиками изменение спектрального кода ДНК в 2012 году не завершилось. Они представляют собой лишь этапы перестройки, для изучения которой заявленный способ представляет уникальный, не имеющий аналога инструмент. Были продолжены исследования, которые свидетельствовали о дальнейших спектральных изменениях ДНК в последующие за июнем месяцы 2012 года. Последующая тенденция изменений была связана с дальнейшим падением насыщения ДНК-последовательностей зеленой флуоресценцией за счет измененных свойств гуанина и цитозина с одновременным приростом флуоресценции, связанной с аденином (фиг.12). Если в апреле месяце гуанин и цитозин демонстрировали максимальную флуоресценцию в зеленом спектре, а аденин максимальное поглощение, то в последующие после июня месяцы гуанин и цитозин стали поглощать с медленным положительным приростом (насыщением) флуоресцентной энергии. При этом поли(dA)последовательность сразу после добавления к раствору красителя FAM сменила поглощение на прирост излучения с таким же медленным насыщением. Последствием этого процесса стало наблюдаемое соотношение энергетических потенциалов теломерных повторов в зеленом спектре флуоресценции в сентябре месяце 2012 года (фиг.6). При этом полученные результаты демонстрируют общую тенденцию изменений зеленого канала флуоресценции для мононуклеотидных последовательностей, которая связана с обеспечением спектральных различий между азотистыми основаниями. Это различие закладывает основу спектрального кодирования нуклеотидных последовательностей в условиях измененного состояния спектрального кода ДНК. При этом особое значение, как в условиях измененного, так и неизмененного спектрального кода ДНК, имеют различия между аденином и гуанином. Это связано с тем, что именно эти азотистые основания определяют специфику флуоресценции окончаний теломерных оверхенгов при основном неделящемся и активированном к делению состояниях клетки.
Пример 6. ДНК-спектральный анализ флуоресценции видимого диапазона фрагментов генных последовательностей циклина В1 и D2 человека с помощью свободных молекул флуоресцентных красителей.
В эксперименте использовались синтетические олигонуклеотидные последовательности производства фирмы «Евроген» (Россия) для генов циклина человека:
1. TGCCAGTGCCAGTGTCTGAGCC (ген CNB1, минусовая цепь ДНК хромосомы 5);
2. GGTCTGACTGCTTGCTCTTCCTC (ген CNB1, плюсовая цепь ДНК хромосомы 5);
3. GTGCTGTCTGCATGTTCCTGGC (ген CND2, минусовая цепь ДНК хромосомы 12);
4. CAGATGGCTGCTCCCACACTTC (ген CND2, плюсовая цепь ДНК хромосомы 12).
ДНК-спектральный анализ проводился аналогично исследованиям олигонуклеотидных последовательностей в предыдущих примерах. Результаты представлены в виде столбчатых диаграмм и графиков фигур 13-15.
Диаграмма фиг.13 демонстрирует соотношение каналов флуоресценции в трех основных цветах видимого спектра в апреле 2012 года. Таким образом, условия неизмененного спектрального кода флуоресценции ДНК в этот период демонстрируют ярко выраженные спектральные различия не только мононуклеотидных и теломерных последовательностей, но и генных.
Полученные результаты свидетельствовали о том, что изменения спектрального кода ДНК, произошедшие в конце июня 2012 года, также затронули спектральные свойства генных последовательностей. При этом характер этих изменений существенно отличался от таковых для теломерных последовательностей.
Перестройка спектрального кода ДНК во второй половине 2012 года, связанная с изменениями свойств азотистых оснований, по-разному отразилась на свойствах полинуклеотидных последовательностей ДНК. Эти различия связаны с их нуклеотидным составом, а именно с количеством азотистых оснований гуанина и аденина. Именно эти азотистые основания наиболее изменили свои спектральные свойства при установлении квантово-связанного спектра флуоресценции со свободными молекулами красителя в условиях измененного спектрального кода ДНК. Для последовательности G-цепи теломерной ДНК, содержащей регулярно повторяющуюся последовательность из трех гуанинов, изменения свойств этого азотистого основания привели к резкому падению зеленой флуоресценции. Генные последовательности, более вариабельные по нуклеотидному составу, не только не снизили, но и увеличили свою флуоресценцию в этом спектре. Это доказывает значимость насыщения зеленой флуоресценцией для работы генома клетки. Именно в зеленом спектре флуоресценции были получены наибольшие различия между нуклеотидными последовательностями ДНК, особенно в условиях неизмененного спектрального кода ДНК, существовавшего до июня 2012 года.
В условиях измененного спектрального кода пролонгированное насыщение зеленой флуоресценцией, характерное для теломерных последовательностей, практически не наблюдалось для генных последовательностей (фиг.14). Этот факт указывает на принципиальные различия теломерных последовательностей от генных. Именно теломерные последовательности обладают уникальным механизмом подпитки генома зеленой флуоресценцией, выполняющей основные функции спектрального кодирования наследственной информации.
Изменения в других спектрах для изучаемых генных последовательностей так же, как для мононуклеотидных и генных, были связаны с незначительным падением уровня флуоресценции в желтом спектре и увеличением в красном. В конце июня 2012 г. незначительное снижение поглощения в желтом спектре наблюдалось только для последовательностей плюсовых цепей обоих генов, что возможно связано с концевым положением в них тимина (фиг.15). В красном спектре все изучаемые последовательности выявили увеличение флуоресценции, за исключением минусовой цепи циклина В1. Возможно, это связано со сменой поглощения на испускание в зеленом спектре.
Таким образом, самое спектрально-нестабильное положение занимала последовательность минусовой цепи циклина В1, которая сменила поглощение на испускание в зеленом спектре. В связи с этим обнаружение с помощью заявленного способа подобных спектрально-нестабильных участков генов, наряду со спектрально-стабильными, играет важную роль для понимания функционирования генома.
Использование заявленного способа дает возможность получить представления о существенных различиях генных последовательностей от теломерных. Применение ДНК-спектрального флуоресцентного анализа с использованием свободных красителей позволило установить, что изменение спектрального кода во второй половине 2012 года главным образом отразилось на свойствах теломерных последовательностей. Именно теломерная ДНК характеризовалась наибольшим падением насыщения зеленой флуоресцентной энергией. При этом изменился режим ее насыщения, который в отличие от генных последовательностей стал медленным и растянулся во времени, демонстрируя периодические всплески быстрого гипернасыщения (фиг.6 и 7). Крайне спектрально-неустойчивыми оказались практически все теломерные повторы. Особенно это касалось повторов GGGTTA, GGTTAG и TTAGGG, которые регулируют существование основных квантовых состояний теломерных оверхенгов, характерных для неделящейся и активированной к делению клетки. Возможно, это связано с отсутствием азотистого основания цитозина в составе теломерной ДНК человека, который обладает максимальной, а следовательно, самой стабильной флуоресценцией в зеленом спектре. Последний факт свидетельствует о колоссальной значимости процесса изменения спектральных свойств ДНК и его мониторинга с помощью заявленного способа для регуляции деления клетки и выявления фактора риска малигнизации клеток.
Сравнение спектров, полученных в примерах 4-6, показало, что варианты теломерного повтора выявили не менее выраженные различия в соотношении зеленого и красного каналов флуоресценции, чем генные или мононуклеотидные последовательности. Это подтверждает представление о том, что в рамках нуклеотидного кода теломерной ДНК обеспечивается необходимое существование в геноме терминальных нуклеотидных последовательностей, особо различающихся своими спектральными и флуоресцентными свойствами. Именно за счет них осуществляется регуляция результирующей флуоресценции как части митогенетического излучения, являющегося необходимым условием запуска и осуществления процесса деления клетки.
В связи с этим предложенный метод является универсальным механизмом, с помощью которого можно оценить изменения уровня флуоресценции в клетке, происходящей за счет перестроек окончаний теломерных оверхенгов, как основы митогенетического излучения видимого диапазона, управляющего делением клетки. Таким образом, расширяется понятие самого митогенетического излучения, которое в отличие от классического понимания, заложенного еще А.Г. Гурвичем в первой половине XX века, включает не только УФ-область, но и весь видимый спектр флуоресценции.
Молекулы используемых флуоресцентных красителей являются универсальной моделью, с помощью которой изучается влияние последовательностей теломерной ДНК на флуоресценцию в клетке. В клетке может находиться множество подобных флуоресцирующих молекул, которые могут являться источниками митогенетического излучения в УФ и видимом диапазонах света. Источниками УФ-флуоресценции могут выступать аминокислоты триптофан, тирозин, фенилаланин, цистеин и цистин, входящие в состав белков, максимум флуоресценции которых соответствует 300-350 нм. В зеленой области спектра флуоресцируют окисленные флавопротеиды (510-540 нм). Источниками красной флуоресценции могут выступать некоторые производные порфиринов. Источниками синей флуоресценции являются восстановленные пиридин-нуклеотиды НАДН и НАДФН (440-480 нм), а также соединения типа тиохрома (производной витамина B1). С пищей человек также может потреблять флуоресцирующие вещества. Например, растительный хлорофилл является мощным источником красной флуоресценции, а производные некоторых алкалоидов (растительного хинина) обладают сильной голубой флуоресценцией. Таким образом, многие метаболиты организма человека обладают флуоресцентными свойствами в видимом диапазоне света и могут образовывать с ДНК связанный мультицветовой спектр, составляющий основу квантово-оптического регулирования генома.
Согласно общепринятому мнению собственная флуоресценция ДНК очень слабая и принадлежит УФ-спектру. Однако было показано, что сама ДНК испускает свет в широком диапазоне видимого спектра в виде очень слабых полей (работы Поппа, Германия). В связи с этим описанные свойства ДНК образовывать квантово-связанный спектр и увеличивать флуоресценцию некоторых красителей могут распространяться и на различные флуоресцентные молекулы в клетке, что в результате может стать источником света большей мощности. В этом заключается новое понимание роли ДНК в генерировании единого светового поля клетки, достаточного для формирования лазерно-активной среды генома. Теоретические и экспериментальные наработки по поводу существования в ДНК когерентного излучения фотонов видимого спектра, образующего лазерно-активную среду, приведены в исследованиях группы Поппа (Рорр F.A., Li K.H., Cu G. Recent Advances in Biophoton Reseach and its Application (Kaiserslantern, Word Scientific, 1992) и Гаряева П.П. (Волновой геном. Москва, 1994; Волновой генетический код. Москва, 1997). Несмотря на это, существование сверхслабого лазерного излучения ДНК в диапазоне видимых волн до сих пор остается спорным.
До сегодняшнего дня исследователи не прекращают поиск источников подходящей мощности для существования лазерного поля ДНК как основы квантово-оптической записи наследственной информации. Развитию идеи записи генетической информации посредством лазера способствовал прогресс в оптической электронике, связанный с созданием лазера на флуоресцентных красителях. Было показано, что флуорофоры с высоким квантовым выходом могут применяться в качестве компонентов активных сред лазеров. При этом одним из основных направлений использования подобного лазера была заявлена передача большого объема информации. В связи с этим идея о записи подобным способом огромного объема генетической информации на ДНК напрашивается сама собой. Кроме того, основной характеристикой созданных на основе флуоресцентных красителей лазеров было использование сверхкоротких импульсов света. Это приближает к мысле о ДНК как о подобной среде, когерентные фотоны которой соответствуют сверхкоротким пико- и фемтосекундным импульсам. Остается нерешенным вопрос о необходимой мощности излучения ДНК.
Спорные данные о сверхслабом излучении ДНК мешали прогрессу в этой области. Главной методологической ошибкой исследователей являлось рассмотрение флуоресценции ДНК в отдельности без ее квантовой связи с другими флуоресцирующими молекулами. Открытие флуорофор-связанной флуоресценции ДНК объясняет существование более мощного источника излучения ДНК, чем было принято раньше, достаточного для формирования лазерно-активной среды. Использование заявленного способа позволило установить, что образование квантово-связанного спектра между красителем (флуорофором) и ДНК в общем растворе может приводить к мощному возрастанию исходной флуоресценции раствора красителя, достигающему в ряде случаев 100% и более. Уникальным фактом, обнаруженным с помощью заявляемого способа, является обнаруженная периодическая гиперфлуоресценция последовательностей ДНК. Она описывает механизмы насыщения генома клетки световой энергией за счет неизвестного науке источника. При этом прирост флуоресценции красителя в присутствии ДНК зависит от ее нуклеотидной последовательности и может достигать более 260% в зависимости от продолжительности мониторинга.
Это демонстрирует уникальные флуоресцентные возможности ДНК, напрямую зависящие от флуоресцентного потенциала флуорофора, с которым она образует связанный спектр. Было установлено, что квантовый выход флуорофор-связанной флуоресценции ДНК прямо пропорционально зависит от интенсивности и спектральной характеристики светового возбуждения и сопоставим с таковым для специализированного красителя. Это позволяет предположить возможность существования в клетке лазерной среды на основе квантово-связанного спектра ДНК и флуоресцентных молекул. При этом для формирования возбуждающего излучения существенное значение имеет фоторежим самой клетки, интенсивность и спектральные характеристики которого также определяются количеством и составом входящих в нее флуоресцентных молекул. С одной стороны флуорофор-связанный спектр ДНК определяется флуоресцентными молекулами, образующими с ДНК общий спектр, с другой стороны, сами эти молекулы используют другие подходящие по спектру молекулы для своего возбуждения. Таким образом, контроль состава флуоресцентных молекул организма и спектра их излучения представляет собой уникальный инструмент управления флуоресценцией ДНК как основы лазерно-оптического механизма функционирования генома. Для этих целей применение различных вариантов осуществления заявляемого способа предоставляет широкие возможности.
Естественно, что присутствующие в организме вещества по своему флуоресцентному потенциалу значительно уступают специализированным красителям. Однако мощность фотонного насыщения (светового поля) ДНК в каждом конкретном спектре излучения усиливается флуоресцентными свойствами флуоресцентных молекул, не только находящихся в данной клетке, но и за счет всей совокупности подобных молекул в организме. В совокупности это может составить достаточную фотонную накачку, необходимую для формирования лазерно-активной среды генома. Учитывая сверхкороткие импульсы излучения, она обеспечит достаточный уровень мощности для создания лазерного поля ДНК.
О возможности дистанционного гипернасыщения ДНК фотонами свидетельствует обнаруженное дистанционное действие одних флуоресцентно-меченных последовательностей ДНК на другие, находящиеся в отдельной пробирке на расстоянии нескольких сантиметров (пример 3). В связи с этим открываются возможности объяснения дистанционного фотонасыщения генома организма не только от собственных флуоресцентных молекул, но и от окружающих объектов живой и неживой природы. Использование заявленного способа в виде бесконтактного варианта осуществления открывает перспективы применения дистанционного корректирующего воздействия на биосистемы. Для воздействия на фотопроцессы организма могут использоваться физические источники света или последовательности ДНК, обладающие собственной флуоресценцией, в том числе усиленной флуорофором, а также чистые растворы флуорофоров без последовательностей ДНК. Этот аспект применения заявляемого способа освещен в последнем пункте формулы изобретения.
Все примеры осуществления изобретения, за исключением третьего, относятся к контактному варианту осуществления способа, в котором молекулы изучаемой ДНК-последовательности и красителя (флуорофора) находятся в одном растворе в общей пробирке. Пример 4 наглядно продемонстрировал, что нуклеотидная последовательность теломерной ДНК, а именно последовательность ее теломерного повтора, определяет ее собственные флуоресцентные свойства. Они отражаются на изменении флуоресценции исходного раствора флуоресцентного красителя, к которому добавлялись исследуемые фрагменты теломерной ДНК. Таким образом, контактный способ является вариантом, наиболее близко имитирующим естественные водные условия существования теломерной ДНК в клетках. При этом результирующая флуоресценция красителя определяется воздействием флуоресцентных свойств теломерной последовательности в виде соотношения излучения и поглощения световой энергии в изучаемом спектре.
В изучении последних качеств бесспорное преимущество имеет вариант контактного способа, при котором к раствору красителя добавляется не одна ДНК-последовательность, а используется смесь фрагментов ДНК. Например, исследование смесей синтетических олигонуклеотидных зондов, имитирующих различные варианты теломерных повторов в примере 2. В этом случае использование заявленного способа предоставляет уникальные возможности для описания спектральной характеристики вариаций теломерного повтора, которыми могут оканчиваться теломерные оверхенги в клетке.
Особую актуальность приобретает перспектива исследования нативных фракции теломерных оверхенгов с помощью заявленного способа для выявления их спектральных характеристик, которые могут являться цветовыми маркерами активации деления клетки и прохождения фаз клеточного цикла.
С помощью заявленного способа было показано, что теломерная ДНК обладает уникальными флуоресцентными свойствами и спектральными характеристиками. Последние данные о нуклеотидном полиморфизме окончаний теломерной ДНК привели к новому пониманию канонического гексануклеотидного повтора как шести вариантов возможной последовательности (GGTTAG, GTTAGG, TTAGGG, TAGGGT, AGGGTT и GGGTTA), каждая из которых обладает уникальными флуоресцентными свойствами и спектральными характеристиками. Поэтому обнаруженное явление перестроек терминальных нуклеотидных окончаний теломерной ДНК напрямую связано с явлением флуорофор-связанной флуоресценции ДНК в видимом диапазоне света, открытой с помощью заявленного способа.
В зависимости от вариации нуклеотидного окончания 3' и 5'-концов теломерной ДНК совокупность ее G-оверхенгов представляет собой гетероморфную популяцию, различающуюся по нуклеотидному составу теломерных повторов. В зависимости от 5'-окончания С-цепи теломерной ДНК последовательность каждого однонитевого оверхенга G-цепи представляет собой n-е число одного из шести вариантов полноразмерного повтора. При этом оверхенги могут оканчиваться не полноразмерным повтором. В связи с этим становится понятной роль их терминальных триплетов в определении результирующей флуоресценции.
Было установлено, что активация деления клетки в первые часы воздействия стимула связана с перестройками терминальных нуклеотидов теломерных оверхенгов. При этом показано, что клетка наиболее чувствительна к изменению последовательности последнего теломерного повтора на 3'-конце ДНК. Результатом этого процесса может служить изменение спектральных характеристик результирующей флуоресценции, определяемой 3'-окончаниями теломерных оверхенгов клетки.
Согласно полученным представлениям каналы интегрированной флуоресценции ДНК составляют основу триггерного механизма активации деления клетки за счет переключения двух основных цветов спектра. Один из цветов является красным, а второй, антагонистический цвет, может быть представлен зеленым или синим. Такая схема обеспечивает четкую спектральную дискриминацию оптического сигнала, который воспринимает клетка для начала подготовки к делению.
Было показано, что в соответствии со спектральным кодом флуорофор-связанной флуоресценции ДНК человека для регулирования процессов деления клетки используется зелено-красная кодировка пролиферативной информации. Изменения спектрального кода, произошедшие в июне 2012 года, связаны с существенным изменением режима насыщения теломерной ДНК человека зеленой флуоресценцией. Использование заявляемого способа представляет уникальные возможности для изучения механизма квантового насыщения теломерной ДНК и позволило установить новый режим его функционирования в зеленом спектре (пример 4).
Изучение терминальных нуклеотидов G-цепи теломерной ДНК человека позволило установить существование сбалансированного и несбалансированного профилей терминальных нуклеотидов теломерных оверхенгов. Использование заявляемого способа позволило связать их с существованием разных квантовых состояний клетки, связанных с окончаниями теломерных оверхенгов. Эти состояния характеризуются разным балансом зеленого и красного каналов излучения в зависимости от изменения их нуклеотидных окончаний. Впервые было установлено, что основное неделящееся состояние клетки сопровождается преимущественным окончанием теломерных оверхенгов на гуанин. Активация деления клетки в первые часы воздействия стимула сопровождается резким увеличением содержания окончаний теломерных оверхенгов на аденин. Различие спектральных свойств азотистых оснований, установленное с помощью заявляемого способа, позволяет связать эти нуклеотидные перестройки с изменением флуоресценции теломерных оверхенгов. Неделящееся состояние клетки характеризуется преобладанием испускания флуоресценции теломерных оверхенгов в спектре, соответствующем их окончанию на гуанин. Для условий стабильного существования спектрального кода теломерной ДНК человека таким спектром является зеленый. Именно зеленый спектр оказался наиболее спектрально-специфичным для различных вариантов окончаний теломерных G-оверхенгов.
Было установлено, что активация деления сопровождается увеличением содержания теломерных окончаний на аденин, что напрямую связано с сохранением красного спектра их излучения и резким падением зеленого. В этих условиях, особенно в первые часы активации деления, ядро активированной клетки «краснеет» за счет изменения результирующей флуоресценции окончаний теломерных оверхенгов. Об этом свидетельствует составление спектральной карты и цветового маркера результирующей флуоресценции теломерного повтора GGGTTA в диапазоне волн 520-605 нм (фиг.16Е). Указанный признак может использоваться как диагностический цветовой маркер активированной к делению клетки. В последующие часы дальнейшая прогрессия цикла перестроек терминальных нуклеотидов приводит к постепенному падению красного сигнала. На фоне его снижения снова возрастает зеленый канал флуоресценции вплоть до соотношения, характерного для неделящейся клетки. При этом цветовой маркер результирующей флуоресценции окончаний теломерных оверхенгов вновь приобретает выраженную зеленую составляющую. Главный вклад в этот процесс вносит теломерный повтор GTTAGG, что демонстрирует его спектральная карта и цветовой маркер результирующей флуоресценции (фиг.16Б).
Условия измененного спектрального кода, возникшие во второй половине 2012 года, видимо, связаны с существенным преобразованием описанной выше схемы активации деления. В основном оно связано с замедленным насыщением зеленой флуоресцентной энергией теломерных повторов, которая обеспечивает их спектральную дифференцировку. В зеленом спектре преобладание флуоресценции GTTAGG повтора (основного для неделящегося состояния клетки) над GGGTTA повтором (основным для активированной к делению клетки) стало наблюдаться после двух часов изучения динамики их насыщения (фиг.6).
Таким образом, по соотношению основных каналов кодирования пролиферативной информации, представленных флуоресцентными излучениями теломерных оверхенгов, можно судить об этапах активации деления клеток. Это может составить основу новейшего ДНК-спектрального анализа, который может найти широкое применение в медицине. Любые изменения на этапах перестроек терминальных нуклеотидов могут диагностироваться не только напрямую, но и с помощью заявляемого способа через установление соотношения зеленого и красного каналов флуоресценции теломерных оверхенгов.
В заключение следует отметить, что теломерные оверхенги являются единственным вариабельным генетическим субстратом клетки, способным к быстрым рефлекторным изменениям в ответ на изменения условий окружающей среды. Это обусловлено тем, что геномная ДНК консервативна по своей структуре и поддерживается строгими механизмами репликации и репарации. Существование в клетке механизмов экзонуклеазного воздействия на 5'- и, главным образом, на 3'- концы теломерной ДНК, составляет основу быстрого рефлекторного ответа клетки на воздействие стимула к делению. Происходящие при этом изменения спектральных характеристик флуоресценции теломерных оверхенгов могут служить важным критерием оценки пролиферативных свойств клетки. В связи с этим заявленный способ может составить основу нового направления в молекулярной диагностике - ДНК-спектрального анализа флуоресценции теломерных оверхенгов, который заключается в установлении соотношения основных каналов флуоресценции теломерных оверхенгов в ходе активации деления клетки и прохождения основных этапов клеточного цикла.
Другим направлением применения заявляемого способа является ДНК-спектральный анализ флуоресценции генных последовательностей. В этом случае в качестве исследуемых образцов используют синтетические последовательности генов, нативные фрагменты геномной ДНК, участки хромосом и т.п. ДНК-спектральный анализ представляет собой мощный инструмент исследования генома клетки, особенно в связи с рассмотрением концепции квантово-оптического кодирования наследственной информации. Эта концепция исходит из того, что каждый нуклеотид обладает специфическими спектральными характеристиками и вносит свой вклад в результирующую флуоресценцию последовательности ДНК. При этом каждая последовательность не зависимо от длины может быть представлена характерным спектром флуоресценции как результатом взаимодействия основных цветовых каналов. Примером изучения роли основных типов азотистых оснований в видимом спектре флуоресценции ДНК может служить исследование мононуклеотидных последовательностей в примере 5.
Изучение роли каждого вида азотистого основания и их сочетаний в конкретной нуклеотидной последовательности позволяет заново осмыслить значение однонуклеотидных полиморфизмов и точечных мутаций в геноме клетки. Дальнейшее развитие ДНК-технологий в этом направлении может привести к составлению спектральных цветовых карт участков генов, полноразмерных генных последовательностей или их регуляторных элементов, что поможет понять механизмы их функционирования. В примере 6 показано, что различные участки, представленные плюсовыми и минусовыми цепями ДНК, в пределах последовательности одного гена различаются своими спектральными характеристиками, особенно в условиях стабильного спектрального кода ДНК (апрель 2012 г.).
Спектральное картирование хромосом и их фрагментов позволит по-новому объяснить их вклад в формирование общего светового поля клетки и понять значение хромосомных перестроек в ее геноме.
Перечисленные новые направления исследования генома клетки, которые становятся возможными с применением заявляемого способа, говорят о его бесспорной практической значимости и преимуществе перед существующими методами изучения флуоресценции ДНК. До текущего момента не существовало способов, позволяющих осветить вопрос о соотношении процессов поглощения и излучения квантов света в видимом спектре в зависимости от конкретной нуклеотидной последовательности ДНК. Заявленный способ позволил установить, что для спектрального кода флуорофор-связанной флуоресценции ДНК человека основными флуоресцирующими каналами в видимом диапазоне света являются красный и зеленый, а желтый спектр поглощается. Наблюдавшиеся после середины июня 2012 года изменения спектрального кода флуоресценции ДНК в основном затронули свойства теломерных последовательностей, для которых изменился режим насыщения зеленой флуоресценцией.
Впервые предложенный способ изучения флуоресценции ДНК позволил оценить вклад каждого нуклеотида изучаемой последовательности в формирование результирующего потока излучения как баланса основных цветов видимого спектра. Стало возможным исследование квантово-резонансных взаимоотношений между отдельными последовательностями, основанных на эффектах миграции энергии между нуклеотидами в рамках изучаемых цветовых каналов. При этом использование различных вариантов осуществления способа позволяет изучить влияние конкретного направления миграции энергии, а именно 5'-концевого или 3'-концевого направления, в зависимости от расположения красителя в составе изучаемой последовательности ДНК-зонда. Условия отсутствия предпочтительного направления миграции энергии изучаются при использовании красителя в виде молекул, свободно окружающих изучаемую ДНК-последовательность в растворе. Особую роль использование свободных молекул красителя играет для целей исследования режима насыщения нуклеотидных последовательностей флуоресцентной энергией определенного спектра.
Большое значение это приобретает в рамках комплексного исследования популяции теломерных оверхенгов как молекулярного субстрата управляющего световым потоком, регулирующим деление клетки. Использование патентуемого способа позволяет исследовать квантово-резонансные взаимоотношения между отдельными теломерными оверхенгами, которые заключаются в балансе процессов излучения и поглощения квантов определенного спектра в зависимости от их нуклеотидной последовательности.
С помощью заявленного способа был установлен универсальный дистанционный механизм квантовых взаимодействий, возникающий между нуклеотидами как внутри самих последовательностей, так и между разными последовательностями. Было открыто дистанционное влияние растворов синтетических аналогов оверхенгов на флуоресценцию друг друга, находящихся на расстоянии нескольких сантиметров в разных пробирках. Этот механизм отличается от описанных в литературе механизмов индуктивно-резонансной и обменно-резонансной миграции энергии, при которых необходим тесный контакт или перекрывание электронных облаков между молекулами донора и акцептора. Таким образом, было установлено, что теломерные оверхенги могут влиять друг на друга, не только будучи в одной клетке, но и воздействовать на флуоресценцию оверхенгов окружающих клеток и тканей. Последний факт особенно актуален в целях изучения механизмов формирования единого поля клетки, органа и организма в целом, а также для развития систем дистанционной диагностики и коррекции происходящих в них процессов.