Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ РАДИОИММУННОГО ПРЕПАРАТА ДЛЯ ДИАГНОСТИКИ И ТЕРАПИИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ
Вид РИД
Изобретение
Изобретение относится к технологии получения противоопухолевого препарата для обнаружения и разрушения микрометастаз, в том числе на клеточном уровне, с использованием γ-излучающих радиоизотопов, например Тс-99m и короткоживущих α-излучающих радиоизотопов, например, Bi-212, Bi-213, Pb-212, Ra-223, Ac-225, закрепленных на белковой платформе, обеспечивающей специфическое связывание с опухолевой клеткой-мишенью.
Настоящее изобретение может быть использовано для получения противоопухолевого препарата на основе наноразмерного биосовместимого конъюгата человеческого сывороточного альбумина (ЧСА) и гуманизированных миниантител, специфичных к раковоассоциированному маркеру HER2/neu. Препарат предназначен как для диагностики и локализации, так и для терапии злокачественных новообразований. Использование препарата для диагностики возможно за счет γ-излучающих радиоизотопов, например короткоживущего Тс-99m, присоединенных к белковому конъюгату, обеспечивающему высокоточную доставку. Терапевтический эффект препарата достигается за счет атомов α-излучающих радиоизотопов, например Bi-212, Bi-213, Pb-212, Ra-223 или Ас-225, присоединенных к тому же конъюгату.
Предшествующий уровень техники
Одним из наиболее перспективных методов терапии онкологических заболеваний считается радиоиммунотерапия с помощью короткоживущих α-излучающих радиоизотопов (α-эмиттеров) Bi-213; Bi-212, Pb-212, Ас-225 и др. α-Частицы обладают высокой энергией и коротким пробегом в веществе, поэтому при локализации достаточного количества атомов α-эмиттера в непосредственной близости от опухолевой клетки достигается избирательное уничтожение опухолевой ткани при минимальном повреждении окружающих тканей. Для обеспечения избирательной локализации атомов α-эмиттера чаще всего используются антитела к различным опухолевым антигенам (как нативные, так и в виде фрагментов или модификаций), а также лиганды, способные специфически связываться с определенными рецепторами клеточной поверхности.
Основной радиоизотоп, используемый при диагностике онкологических заболеваний - Тс-99m, обладающий оптимальными периодом полураспада (6 часов) и типом излучения (γ-излучение, энергия 140 кэВ). При использовании препаратов для высокоточной доставки к мишени радиоизотопа Тс-99m возможно существенное снижение его концентрации, что обеспечит снижение дозовой нагрузки на пациента и медицинского персонала.
Одним из наиболее изученных и часто упоминаемых в литературе опухолевых антигенов является поверхностный рецептор HER2/neu. Повышенный уровень экспрессии этого антигена играет ключевую роль в патогенезе злокачественных опухолей груди и ряда других форм злокачественных новообразований. К этому антигену разработан ряд моноклональных антител, пригодных для применения в диагностических и терапевтических целях.
Известны различные методы мечения белковых молекул (в том числе моноклональных антител) радиоизотопами. Наиболее эффективным считается мечение с использованием бифункциональных хелатирующих агентов, которые способны образовывать достаточно прочные координационные связи с большим количеством катионов, в т.ч. катионами переходных элементов и лантаноидов (Co, Cu, Y, In, Ac, Bi и др.).
В качестве хелаторов в основном используются DTPA (Diethylene triamine pentaacetic acid) и DOTA (1,4,7,10-tetraazacyclododecane-N,N′,N″,N″′-tetraacetic acid) и их производные.
Различные варианты синтеза конъюгата «антитело - хелатор - радиоизотоп» описаны в литературе. В качестве примера можно привести публикацию [Blend, M.J., Stastny, J.J., Swanson, S.M. and Breichbel, M.W. Labeling anti-HER2/neu Monoclonal Antibodies with In-111 and Y-90 using a bifunctional DTPA Chelating agent. Cancer Biotherapy & Radiopharmaceuticals, 2003, vol.18, no 3, pp 355-363], в которой преимущественно рассматривается конъюгат антител к HER2/neu с DTPA, но также описан и метод конъюгирования с DOTA (в форме р-SCN-bensyl-DOTA). Такие же данные содержатся в публикации [Lewis M, Kao J, Anderson A-L, Shivley J, Raubitschek A. An improved method for conjugating monoclonal antibodies with N-hydroxysulfosuccinimidyl DOTA. Bioconj. Chem. 2001; 12: 320-324]. Как правило, наряду с нативными молекулами антител упоминается возможность использования любых их фрагментов и модификаций, сохраняющих способность специфически связываться с антигеном.
Методы направленного и контролируемого формирования ковалентных связей между белковыми молекулами, в том числе пригодные для конъюгирования молекул ЧСА и мини-антитела, описаны в работе [Hermanson G.T. 2008. Bioconjugate Techniques, 2nd Edition. Academic Press, Inc., pp.1-1202]. В патенте US 2011/0286920 A1 [Jeong J.M., Lee M.C., Chung K.G. and Lee D.C. Complex of bifunctional chelating agent and mannosyl human serum albumin] описан способ образования комплекса между молекулой модифицированного ЧСА и бифункционального хелатора с целью последующего мечения радиоизотопом. В частности, упомянуто использование хелатора DOTA и радиоизотопа Bi-212. Однако описанный комплекс не включал элемент, обеспечивающий специфическое связывание с опухолеспецифичным антигеном, что делало конструкцию непригодной для направленной доставки противоопухолевого препарата.
В патенте WO 2012/089336 A1 [Caviglioli G., Parodi В., Cafaggi S., et al. A conjugate of human albumin and 2-(4-isothiocyanatobenzyl)-1,4,7,10-tetraazocyclododecane-1,4,7,10-tetraacetic acid useful for the localization of radionuclides for diagnostic and therapeutic purposes] также описан метод получения конъюгата ЧСА с DOTA с целью последующего мечения радиоактивным изотопом (в том числе и изотопами висмута). Однако для синтеза описанного комплекса было использовано бензильное производное DOTA (р-SCN-bensyl-DOTA), в отличие от гидроксисукцинилимидного эфира DOTA. Кроме того, описанный комплекс также не обеспечивал связывания с опухолеспецифичным антигеном.
В патенте WO 2008/045604 [Yang D, Yu D. Efficient synthesis of chelators for nuclear imaging and radiotherapy: compositions and applications] упоминаются и конструкции вида «антитело-хелатор-Тс-99m» (для диагностических целей) и «антитело-хелатор-Bi-213» (для терапевтических целей). Однако в составе конъюгата не была использована молекула ЧСА.
В патенте US 2009/0136421 [Ranson M; Allen BJ and Bunn CL PAI-2 conjugates for the treatment and imaging of cancer] описана конструкция, которую предлагалось метить либо Tc-99m (для диагностических целей), либо Bi-213 (для терапевтических целей). Однако связывание конструкции с опухолевой тканью достигалось не за счет антитела, а за счет молекулы PAI-2 (plasmin activator inhibitor).
В печати опубликована серия работ, в которых описано одновременное мечение молекулы Trastuzumab (гуманизированое моноклональное мышиное антитело к HER2/neu) флуоресцентным красителем и радиоактивным изотопом (гамма-эмиттером In-111 [Sampath L, Kwon S, Ke S, Wang W, Schiff R, Mawad ME, Sevick-Muraca EM. Dual-labeled trastuzumab-based imaging agent for the detection of human epidermal growth factor receptor 2 overexpression in breast cancer. J Nucl Med. 2007 Sep; 48 (9): 1501-10], либо β-эмиттером Cu-64 [Sampath L, Kwon S, Hall MA, Price RE, Sevick-Muraca EM. Detection of Cancer Metastases with a Dual-labeled Near-Infrared/Positron Emission Tomography Imaging Agent. Transl Oncol. 2010 Oct 1; 3 (5): 307-217]). Такой подход позволил улучшить диагностические возможности конструкции, однако возможность ее терапевтического применения не рассматривалась.
В качестве прототипа выбран патент [US 6403771 B1, (ACTINIUM PHARMACEUTICALS, LIMITED (BM), 11.06.2002], описывающий метод получения радиоиммуноконъюгата для использования в терапевтических целях.
Радиоиммуноконъюгат содержит антитело или его фрагмент, обеспечивающие специфическое связывание с опухолеспецифичным антигеном, присоединенные к молекуле-носителю, к которой присоединены несколько атомов α-излучающих изотопов. В качестве α-эмиттеров используются Bi-212 и Bi-213, в качестве молекулы-носителя - ЧСА. В указанном прототипе ЧСА включен в состав конъюгата с целью увеличения числа сайтов для присоединения хелатирующего агента (соответственно, увеличения количества атомов изотопа в расчете на одну молекулу антитела). Следует отметить, что ЧСА упоминался в качестве возможного, но не необходимого элемента радиоиммуноконъюгата. В качестве примера практического воплощения в указанном патенте были описаны молекулы полноразмерных моноклонального антитела, меченные радиоактивным изотопом с применением хелатирующего агента, но без участия молекулы-носителя. При описании синтеза основное внимание уделено выбору радиоизотопа и методическим аспектам мечения конъюгата.
К недостаткам прототипа относится:
- при описании структуры РФП не уделяется внимания решению проблемы быстрого выведения такого РФП из кровотока, и, соответственно, резкого снижения его терапевтического действия, если в его состав входят фрагменты антител с низкой молекулярной массой, такие как мини-антитела, имеющие молекулярную массу 30 кДа.
Раскрытие изобретения
В основу изобретения положена задача получения терапевтического радиоконъюгата, обладающего одновременно набором следующих свойств:
- сниженным риском возникновения конфликта радиоиммуноконъюгата с иммунной системой пациента;
- повышенной специфичностью;
- улучшенными параметрами фармакокинетики;
- повышенным уровнем удельной радиоактивности (терапевтической активности);
- упрощением и удешевлением технологии его получения и обеспечения растущих потребностей в препаратах направленной доставки диагностических и терапевтических агентов для лечения онкологических заболеваний.
Поставленная задача решена тем, что предложен способ получения терапевтического радиоконъюгата, специфически связывающегося вещества с короткоживущим альфа-излучающим радиоизотопом для его доставки в патологические области, при этом осуществляют мечение рекомбинантных гуманизированных мини-антител, специфичных к раковоассоциированному антигену HER2/neu, диагностическим гамма-излучающим радиоизотопом, а именно аквокарбонильным комплексом Тс-99m, проводят конъюгирование мини-антител с человеческим сывороточным альбумином, очищают полученный конъюгат, вводят в состав конъюгата хелатирующий агент DOTA (1,4,7,10 - тетраазициклододекан тетрауксусной кислоты) или DTPA (диэтилен триамин пентауксусной кислоты), проводят мечение полученного конъюгата терапевтическими радиоизотопами, а именно короткоживущими альфа-излучающими радиоизотопами, и очищают полученный препарат.
При этом в качестве терапевтического радиоизотопа используют короткоживущие α-излучающие радиоизотопы: Bi-212, и/или Bi-213, и/или Pb-212, и/или Ra-223, и/или Ас-225.
Связывание диагностического радиоизотопа в конъюгате осуществляется с помощью хелатора олигогистидина.
В качестве рекомбинантного гуманизированного антитела, специфичного к раковоассоциированному антигену HER-2/new, используют гуманизированное мини-антитело scFv 4D5.
Связывание гуманизированного мини-антитела с человеческим сывороточным альбумином в конъюгате осуществляют с помощью хелатора олиголизина.
Кроме того, в качестве рекомбинантных гуманизированных мини-антител, специфичных к раковоассоциированному антигену HER-2/neu, используют гуманизированное мини-антитело с олиголизиновым и олигогистидиновым фрагментами в С-концевой части молекулы, которые предназначены для специфической конъюгации мини-антител с человеческим сывороточным альбумином и диагностическим изотопом соответственно.
В описываемом способе принципиально использование гуманизированных мини-антител. На сегодняшний день в онкологической практике приняты для применения всего два препарата для радиоиммунотерапии опухолей, оба применяют для лечения неходжкинской лимфомы: Bexxar© (GlaxoSmithkline, 2003), представляющий собой IgG2a мыши, конъюгированный с β-эмиттером средней энергии I-131 (радиус проникновения 1 мм) и Zevalin© (Biogen IDEC, 2002) - IgG1 мыши, конъюгированный с β-эмиттером высокой энергии Y-90 (радиус проникновения 11 мм) [Гусаров Д.А. Краткий обзор биофармацевтического рынка препаратов для терапии лимфатического рака. Биофармацевтический журнал. 2010. Т.2. №4. с.8-13]. Мышиное происхождение этих антител часто является причиной возникновения тяжелых осложнений при их использовании, вплоть до анафилактического шока. Гуманизация компонентов препаратов для радиоиммунотерапии существенно сокращает риск возникновения конфликта с иммунной системой пациента, тогда как использование мышиных либо иных ксеногенных антител вызывает иммунную реакцию при первом же введении радиоиммуноконъюгата на их основе в кровоток пациента, с риском анафилактического шока при повторном введении такого радиофармпрепарата. В настоящее время гуманизированные антитела получают с помощью методов генной инженерии, заменяя отдельные фрагменты молекулы антитела на полностью человеческие последовательности.
В отличие от прототипа принципиально использование именно мини-антител и исключается использование полноразмерных антител. Основными преимуществами мини-антител является отсутствие эффекторных функций, присущих Fc-фрагменту полноразмерных антител [Deyev S.M., Lebedenko E.N. Multivalency - the hallmark of antibodies used for optimization of tumor targeting by design. BioEssays. 2008. V.30. P.904-918].
Мини-антитела представляют собой единый полипептид, кодируются одним геном и содержат только один антиген-связывающий участок, состоящий из вариабельных доменов легкой (VL) и тяжелой (VH) цепей, соединенных гибким пептидным линкером. Мини-антитела, в отличие от полноразмерных антител, лишены константной части, которая содержит участки связывания с белком системы комплемента C1q и клеточными рецепторами Fc-фрагментов (FcγR) и опосредует эффекторные (вторичные) функции иммуноглобулинов (способность убивать клетки-мишени, запуская механизмы антителозависимой клеточной цитотоксичности и комплементзависимой цитотоксичности). Отсутствие константной части у мини-антител значительно улучшает их свойства при использовании в качестве нацеливающего компонента в составе радиоиммуноконъюгатов.
Несмотря на то что получение гуманизированных мини-антител более трудоемко, а молекулярная масса значительно ниже, чем у полноразмерных антител, их применение в радиоиммунотерапии имеет ряд существенных преимуществ перед полноразмерными молекулами моноклональных антител. Одним из способов увеличения молекулярной массы радиоиммуноконъюгатов с использованием гуманизированных мини-антител является их конъюгация с молекулой инертного биосовместимого белка-носителя. В описываемой конструкции конъюгация молекул гуманизированных мини-антител обеспечена за счет молекулы ЧСА (в чем заключается принципиальное отличие от прототипа). На поверхности белковой глобулы молекулы ЧСА находится до 40 вторичных аминогрупп [Prasad, Т.S.K. et al. (2009) Human Protein Reference Database - 2009 Update. Nucleic Acids Research. 37, D767-72], за счет которых возможно образование ковалентных связей с молекулами мини-антитела. В указанном прототипе никаким образом не была оговорена роль ЧСА в фармакокинетике полученного иммуноконъюгата. В отличие от прототипа в настоящей заявке оптимизация параметров фармакокинетики послужила одной из причин, по которой ЧСА является необходимым элементом конструкции радиоиммуноконъюгата.
Для достижения терапевтического эффекта молекула радиоиммуноконъюгата должна находиться в кровотоке достаточное время для того, чтобы достичь органа-мишени и связаться с поверхностью опухолевой клетки. Время полувыведения белков через почки коррелирует с их молекулярной массой: порог клубочковой фильтрации оценивается в 60-65 кДа [Trejtnar, F., Laznicek, M. Analysis of renal handling of radiopharmaceuticals. The quarterly journal of nuclear medicine: official publication of the Italian Association of Nuclear Medicine (AIMN) [and] the International Association of Radiopharmacology (IAR) 2002; 46 (3): 181-94]. Молекулярная масса радиоиммуноконъюгата, состоящего только из только мини-антитела, хелатора и изотопа, как правило, не превышает 50 кДа (в среднем около 30 кДа). Период полувыведения таких молекул оценивается в 0.5-2 ч [Covell DG, Barbet J, Holton OD, Black CD, Parker RJ, Weinstein JN. Pharmacokinetics of monoclonal immunoglobulin G1, F(ab′)2, and Fab′ in mice. Cancer Res. 1986 Aug; 46 (8): 3969-3978]. В этом случае значительная часть конъюгата будет выведена почками еще до того, как успеет связаться с клетками-мишенями; при этом вместо опухолевой ткани воздействию радиоактивного излучения будут подвержены ткани почек. Введение ЧСА (молекулярная масса 69 кДа) в состав радиоиммуноконъюгата не только позволяет создать центр наночастицы, вокруг которой происходит конъюгация молекул мини-антител, но и увеличивает общую молекулярную массу комплекса и время его в нахождения в кровотоке, соответственно снижается радиоактивное воздействие на почки. Поскольку ЧСА является естественным белком крови человека, практически отсутствует вероятность возникновения нежелательного иммунного ответа на введение такого конъюгата.
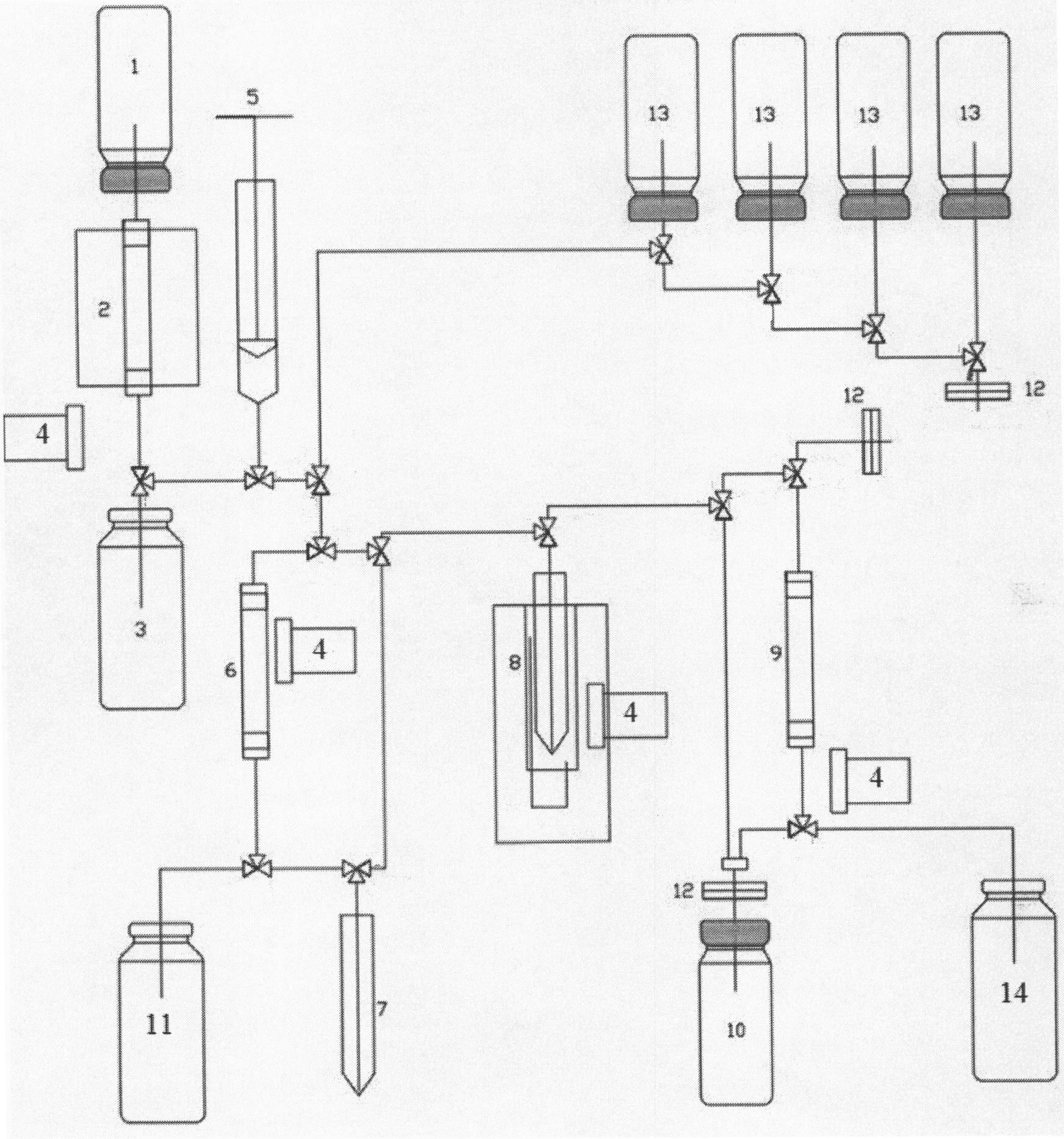
На чертеже дана схема модуля синтеза конъюгата, где 1 - флакон с элюентом; 2 - радиоизотопный генератор; 3, 11, 14 - сборники отходов; 4 - детекторы ионизирующего излучения; 5 - шприцевой насос; 6 - колонка кондиционирования элюата из генератора; 7 - реактор подготовки реакционной смеси; 8 - термореактор для реализации конъюгирования; 9 - гель-фильтрационный картридж; 10 - стерильный флакон для готового продукта; 12 - стерилизующий фильтр; 13 - флаконы для реактивов.
Пример осуществления изобретения
1. Использованные материалы:
Рекомбинантные мини-антитела, специфичные к антигену HER-2, клон 4D5, содержащие олигогистидиновый фрагмент в С-концевой части молекулы (далее МА) (ИБХ РАН), рекомбинантный человеческий сывороточный альбумин (ЧСА, Sigma, кат. № А9731), реагент Траута (Pierce, кат. №26101), Sulfo-SMCC (Pierce, кат. №22322), DMSO (Sigma, кат. № D8418), хелатирующий агент DOTA-NHS (Macrocyclics, кат. № B-280), хелатирующий агент p-SCN-Bn-DTPA (Macrocyclics, кат. № В-305), Chelex 100 (Sigma, кат. № С7901), Triton Х-100 (Sigma, кат. № T9284).
Для приготовления буферных растворов используют соли, кислоты и щелочи фирм Sigma или Merck высокой степени чистоты. Диализ проводят в диализных мешках (Sigma, кат. № D9277) и (Sigma, кат. № D9777) согласно рекомендациям Производителя. В работе используют деионизованную воду с проводимостью 18 МОм. Измерение оптических плотностей производят на спектрофотометре СФ-102 (ООО «НПО Интерфотофизика»).
Элюирование радиоизотопного генератора Bi-212 или Bi-213 проводят хлористоводородной кислотой (TraceSELECT® Ultra, for ultratrace analysis, кат. №96208-250) с концентрацией 0,3 моль/л. Корректировку pH смеси для проведения реакции мечения конъюгата α-излучающими радиоизотопами проводят насыщенным раствором Na2CO3 (кат. № m.1.06392.0500 EMSURE® ISO, для анализа). Комплексообразование ионов Bi-212, Bi-213 проводят 0,1 М раствором H3Cit. (кат. № m.1.00244.0500, для анализа). Для проведения реакции мечения используют 100 мл раствора конъюгатов, приготовленных согласно пп. 2-8 с концентрацией 0,2 мг/мл в буферном растворе №5 [0.02 М MES, 0,15 М NaCl, pH 6.2].
2. Получение рекомбинантных гуманизированных мини-антител, специфичных к раковоассоциированному маркеру HER2/neu (МА)
Свежеприготовленные компетентные клетки штаммов Escherichia coli SB536 трансформируют генетической конструкцией pIG4D5 и высевают на чашки Петри с агаризованной средой LB (1% триптон, 0.5% дрожжевой экстракт, 1% NaCl, 1.5% бактоагар) с 2% глюкозой и ампициллином (конечная концентрация 150 мкг/мл) и инкубируют при 37°C в течение ночи. Выращенные колонии смывают с чашки 10 мл жидкой среды LB (1% триптон, 0.5% дрожжевой экстракт, 1% NaCl) с ампициллином (конечная концентрация 150 мкг/мл) и переносят в 1 л той же культуральной среды. Инкубируют при интенсивном встряхивании при 37°C до оптической плотности А550, равной 0.8-1, затем снижают температуру до 28°C и проводят индукцию целевых генов добавлением ИПТГ до конечной концентрации 0.66 мМ. Инкубируют в течение ночи (14-16 ч) при интенсивном встряхивании при 28°C.
Полученную культуру охлаждают на ледяной бане, затем отделяют клетки от культуральной жидкости центрифугированием 10 мин при 4000-6000g 4°C. Супернатант отбросывают. Клетки ресуспендируют на ледяной бане в лизирующем буфере TBS (30 mM Tris HCl, pH 7.6-7.8; 20 mM KH2PO4; 150 mM NaCl), добавляют лизоцим до концентрации 0.5 мг/мл и выдерживают на льду при постоянном перемешивании в течение 40 мин. Полученный лизат центрифугируют в течение 30 мин при 15000 об/мин; 4°C. Супернатант отбросывают. Осветленный лизат фильтруют через миллипоровый фильтр 0.22 мкм. Для предотвращения гидрофобных взаимодействий между белками к отфильтрованному осветленному лизату добавляют по каплям 7/8 объема глицерина и 1/8 объема 5М хлорида натрия. Для уменьшения неспецифической сорбции белков на аффинном носителе к лизату добавляют имидазол до концентрации 10 мМ и доводят pH до 7.8 при 0-4°C при помощи 1М NaOH.
Подготовленный лизат наносят со скоростью 0.1-0.15 мл/мин на колонку HisTrap FF с Ni-NTA-сефарозой объемом 5 мл (GE Healthcare), уравновешенную буфером LSW (25 мМ Tris, 20 мМ KH2PO4; 0.1 М NaCl; 10% глицерин; pH 7.8). Колонку промывают 3 объемами буфера HSW (25 мМ Tris, 20 мМ KH2PO4; 0.5 М NaCl; 10% глицерин; pH 7.8) и 2 объемами буфера LSW (25 мМ Tris, 20 мМ KH2PO4; 0.1 М NaCl; 10% глицерин; pH 7.8) при скорости 0.1-0.15 мл/мин. Для отмывки неспецифически связанных белков колонку промывают 5 объемами буфера LSW с добавлением 0.05% Tween20 при скорости 0.03-0.04 мл/мин, а затем последовательно 5 объемами буфера LSW при той же скорости.
МА элюируют 10 объемами колонки градиента имидазола (0□0.2 М) в буфере LSW (25 мМ Tris, 20 мМ KH2PO4; 0.1 М NaCl; 10% глицерин; pH 7.8). Полученные фракции, содержащие МА (~0.1 М имидазол), объединяют, разбавляют в 10 раз до концентрации имидазола 0.01 М. Для дополнительной очистки повторяют стадию аффинной хроматографии на колонке HisTrap FF с Ni-NTA-сефарозой объемом 5 мл (GE Healthcare), уравновешенной буфером LSW (25 мМ Tris, 20 мМ KH2PO4; 0.1 М NaCl; 10% глицерин; pH 7.8).
Для смены буфера в растворе МА используют колонки NAP-5, PD-10 (GE Healthcare). Полученные МА содержат олиголизиновый и олигогистидиновый фрагменты на С-конце молекулы.
3. Мечение МА аквакарбонильным комплексом Tc-99m
Для получения аквакарбонильного комплекса Tc-99m смесь 0.004 г (0.038 ммоль) Na2CO3 и 0.005 г (0.13 ммоль) NaBH4 в пробирке объемом 8 мл с завинчивающейся крышкой с резиновой прокладкой насыщают в течение 10 мин CO. Затем шприцом добавляют 3 мл элюата с молибденового генератора, содержащего до 30 GBq.Na[99mTcO4] в 0.9% водном растворе NaCl, и выдерживают при температуре 75°C в течение 30 мин. Охлаждают и добавляют 0.3 мл 1М фосфата Na, pH 7.4.
К 50 мкл МА (концентрация 2 мг/мл) в буфере PBS (7 мМ NaH2PO4, 3 мМ Na2HPO4, 350 мМ NaCl, pH 7.4) добавляют 25 мкл 0.5 М MES pH 6.2 и 25 мкл полученного раствора [99mTc(CO)3(OH2)3]+ (~0.25 GBq) и инкубируют 30 мин при 37°C. Аквакарбонильный комплекс Tc-99m специфически связывается с олигогистидиновым фрагментом МА (удельная активность ~2-2.5 GBq/мг белка). Для очистки МА, меченных аквакарбонильным комплексом Tc-99m, от несвязавшегося радиоизотопа проводят гель-фильтрацию на колонке с Superdex-75 в буфере PBS.
4. Подготовка ЧСА и МА к конъюгированию
Белок ЧСА растворяют в буферном растворе №1: [0.02 М NaHCO3, 0,15 М NaCl, pH 8.0], в концентрации 10 мг/мл.
Раствор мини-антител (МА) в буфере с концентрацией 12 мг/мл диализуют в 5 смен против 1000х избытка буферного раствора №2 [0.02 М NaHCO3, 0,15 М NaCl, 0,3% Chelex-100, pH 8.0], по 12 ч при +4°C при перемешивании на магнитной мешалке. Затем с помощью разведения буферным раствором №1 полученный раствор МА доводят до концентрации 5 мг/мл и используют для конъюгирования.
Для введения SH-групп используют реагент Траута в 10-кратном молярном избытке по отношению к молекулам ЧСА. Реакцию инкубируют 1 ч при комнатной температуре с перемешиванием, после чего обессоливают на колонках Zeba-spin (Pierce, кат. №89894), промытых буферным раствором №1 [0.02 М NaHCO3, 0,15 М NaCl, pH 8.0], согласно рекомендациям производителя с целью удаления избытка непрореагировавшего реагента Траута. Раствор тиолированного белка ЧСА используют для конъюгирования с мини-антителами.
Малеимидные группы в состав мини-антител вводят с помощью 5-кратного молярного избытка sSMCC по отношению к мини-антителам. После инкубирования реакций в течение 1 ч при комнатной температуре растворы обессоливают на колонках Zeba-spin (Pierce, кат. №89890), промытых буфером [0.02 М NaHCO3, 0,15M NaCl, pH 8.0] согласно рекомендациям производителя с целью удалить избыток -sSMCC, а также побочные продукты реакции.
5. Конъюгирование МА с ЧСА
Тиолированный с помощью 10-кратного избытка реагента Траута ЧСА смешивают с активированными 5-кратным избытком sSMCC мини-антителами в молярном соотношении 1:1. Смесь инкубируют в течение 4 ч при комнатной температуре. В реакционной смеси практически отсутствуют мономерные мини-антитела; в то же время остается значительное количество свободных молекул ЧСА. Результаты электрофореза свидетельствует о том, что к одной молекуле ЧСА присоединено несколько молекул мини-антител.
6. Очистка конъюгата МА с ЧСА
Очистку полученных конъюгатов от неконъюгированного белка ЧСА проводят на колонке с Ni-NTA объемом 3 мл (HisPur Ni-NTA Spin Columns, Pierce), уравновешенной буферным раствором [0.02 М NaHCO3, 0.3 М NaCl, 0,02 М имидазола, 0.01% Triton X-100, pH 8.0]. Связавшиеся с колонкой конъюгаты элюируют 3 мл буферного раствора [0.02 М NaHCO3, 0.3 М NaCl, 0.5 М имидазола, 0.01% Triton X-100, pH 8.0].
Для дальнейшей очистки конъюгатов от компонентов с молекулярной массой ниже 150 кДа используют микроконцентраторы с отсечкой по молекулярной массе 150 кДа (89922, Pierce, США) с применением буферного раствора [0.02 М NaHCO3, 0,15 М NaCl pH 8.0], согласно инструкции фирмы-производителя.
7. Включение хелатирующего агента DOTA или DTPA в конъюгаты МА-ЧСА
Для включения в конъюгаты хелатирующего агента используют 40-кратный избыток DOTA-NHS или p-SCN-Bn-DTPA из расчета, что усредненная молекулярная масса полученных конъюгатов составляет 150 кДа.
8. Определение концентрации белка в полученном препарате
Концентрацию белка в получаемых препаратах определяют методом спектрофотометрии на длине волны 280 нм с использованием следующих коэффициентов экстинкции:
ЧСА=0,53
МА=1,27
Конъюгаты МА-ЧСА, MA-ЧСА-DOTA и MA-ЧСА-DTPA=0,93.
9. Электрофорез конъюгатов ЧСА с мини-антителами
Электрофорез белков проводят в градиентном акриламидном геле 4-12% (Life Technologies, кат. № NP 0322BOX) согласно рекомендациям фирмы-производителя. В качестве маркеров молекулярного веса используют маркеры низкомолекулярного диапазона LMW (GE Healthcare, кат: №17-0446-01).
10. Определение количества хелатирующего агента DOTA в составе конъюгатов
Титрование DOTA в составе конъюгата проводили по ранее предложенному методу с небольшими изменениями (Dadachova et al, 1999). Для этого приготавливают следующие растворы:
- раствор Pb(II)-AA(III): 0.15 М ацетат аммония, 10 мкМ Arsenazo III, 4.83 мкМ Pb(CH3CO2)2·3H2O, pH 7.0. При этом соль свинца добавляют в раствор из концентрированного раствора 0.01 М Pb(СН3СO2)2·3Н20 в 10 мМ HCl;
- раствор DOTA для титрования: 0.1 мМ раствор DOTA-NHS в буферном растворе №5 [0.02 М MES, 0,15 М NaCl, pH 6.2].
Раствор DOTA для титрования (0 мкл, 10 мкл, 20 мкл и т.д. до 50 мкл) добавляют к 2 мл раствора Pb(II)-АА(III), перемешивают, выстаивают при комнатной температуре 5 мин и измеряют поглощение света полученными растворами на спектрофотометре СФ-102 при длине волны 656 нм. Строится калибровочная прямая, показывающая зависимость поглощения света при длине волны 656 нм от концентрации добавленного в него раствора DOTA для титрования.
Раствор конъюгатов ЧСА-MA-DOTA, 20 мкл добавляют к 2 мл раствора Pb(II)-AA(III), перемешивают, выстаивают при комнатной температуре 5 мин и измеряют поглощение света полученными растворами при длине волны 656 нм. Все измерения проводят по 3 раза и в качестве значения берут среднее значение.
Концентрация белка в полученных олигомерных конструкциях составляет 1 мг/мл, при добавлении 20 мкл растворов конъюгатов MA-ЧСА-DOTA к 2 мл раствора Pb(II)-АА(III) молярная концентрация белка (усредненный по массе 150 кДа олигомер) в смеси составляет:
Cолигомеров=0.067 (мкМ).
Количество молекул DOTA на молекулу олигомера вычисляют по формуле:
N=CDOTA/Cолигомеров.
Синтез препарата проводится на автоматизированном модуле синтеза, показанном на чертеже.
11. Элюирование короткоживущих α-излучателей с изотопных генераторов (кондиционирование элюата методом фракционирования)
С помощью шприцевого насоса 5 из флакона с элюентом 1 прокачивают 1-2 мл 0,3 М HCl через радиоизотопный генератор 2. Элюат собирают в сборник отходов 3. Затем через радиоизотопный генератор 2 прокачивают 0.5-1.5 элюента. Наличие в элюате радиоизотопов контролируется с помощью датчиков ионизирующего излучения 4. Элюат собирают в реактор подготовки реакционной смеси 7 для кондиционирования раствора перед мечением, в который предварительно вносят 10 мкл 0,1 М раствора комплексообразователя H3Cit.
12. Элюирование короткоживущих α-излучателей с изотопных генераторов (кондиционирование элюата методом концентрирования)
С помощью шприцевого насоса 5 из флакона с элюентом 1 прокачивают 4-6 мл 0,3 М HCl через радиоизотопный генератор 2. Элюат подается на колонку кондиционирования элюата из генератора 6 для концентрирования и очистки элюата, при этом целевой радиоизотоп сорбируется на колонке. Элюат на выходе из колонки собирается в сборник отходов 11.
Через колонку кондиционирования элюата из генератора 6 пропускают 0,5-0,8 мл 0.1 М раствора H3Cit pH=4. Элюат, содержащий целевой радиоизотоп, собирают в реактор подготовки реакционной смеси 7.
13. Мечение короткоживущими α-излучающими радиоизотопами конъюгированных антител
В реактор подготовки реакционной смеси 7 добавляют 0.2-0.4 мл насыщенного раствор Na2CO3, перемешивают в течение 3-4 мин и после окончания реакции нейтрализации полученную смесь перемещают в термореактор для реализации конъюгирования 8. Предварительно в термореактор для реализации конъюгирования 8 помещают 100 мкл буферного раствора конъюгированных антител.
Раствор в термореакторе для реализации конъюгирования 8 нагревают максимум до 40°C и перемешивают в течение 5-15 мин.
14. Формирование кондиционной физико-химической и медико-биологической формы препарата
После окончания реакции мечения раствор отбирают из термореактора для реализации конъюгирования 8 и подают для очистки от несвязанного висмута на гель-фильтрационный картридж 9. На выходе «мертвый» объем элюента собирают в сборник отходов 14. Затем через гель-фильтрационный картридж 9 пропускают буферный раствор и «целевой» элюат собирают в стерильный флакон 10 для продукта. После этого гель-фильтрационный картридж 9 промывают буферным раствором и «хвостовой» элюат собирают в сборник отходов 14.
При необходимости получения стерильного продукта «целевой» элюат из гель-фильтрационного картриджа 9 пропускают через стерилизующий фильтр 12 и собирают в стерильный флакон 10 для лекарственных средств. При необходимости придания определенных свойств готовому продукту в элюат могут добавлять химические компоненты из флаконов для реактивов 13.
Таким образом, предложенный способ позволяет получить противоопухолевый препарат для диагностики и радиоиммунотерапии, отличающийся набором одновременно действующих свойств: низкой иммуногенностью; повышенной специфичностью; улучшенными параметрами фармакокинетики и повышенным уровнем удельной радиоактивности (терапевтической активности). Данный способ имеет потенциальную терапевтическую и коммерческую ценность.