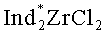Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ЭНАНТИОМЕРНО ОБОГАЩЕННОГО 1-ЭТИЛ-(3S)-ЦИКЛОГЕКСИЛАЛЮМИНАЦИКЛОПЕНТАНА
Вид РИД
Изобретение
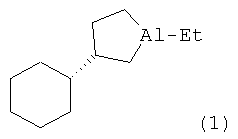
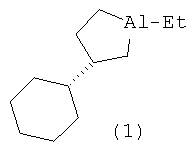
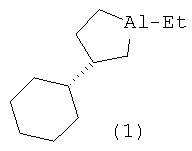
Изобретение относится к области органической химии, конкретно к способу получения нового энантиомерно обогащенного алюминийорганического соединения 1-этил-(35)-циклогексилалюминациклопентана формулы (1):
Указанное соединение может найти применение в реакциях стереорегулярной поли- и олигомеризации непредельных соединений, а также в качестве синтонов тонкого органического и металлорганического синтеза ([1] Толстиков Г.А., Джемилев У.М., Толстиков А.Г. Алюминийорганические соединения в органическом синтезе. Гео, Новосибирск, 2009. 645 с. [2] Одиноков В.Н., Ишмуратов Г.Ю., Ибрагимов А.Г., Яковлева М.П., Золотарев А.П., Джемилев У.М., Толстиков Г.А. // Химия природн. соедин., 1992, 567; [3] Одиноков В.Н., Ишмуратов Г.Ю., Харисов Р.Я., Ибрагимов А.Г., Султанов P.M., Джемилев У.М., Толстиков Г.А. // Химия природ, соединений, 1989, 272).
Известен способ ([4] Khalilov L.M., Parfenova L.V., Pechatkina S.V., Ibragimov A.G., Genet J.P., Dzhemilev U.M., Beletskaya I. P. // J. Organomet. Chem.-2004.-v.689.-No.2.-p.444-453) получения оптически активных алюминациклопентанов (2) взаимодействием триэтилалюминия (AlEt3) с ноненом-1 в присутствии Cp2ZrCl2 и энантиомерно чистых АОС* 4, 5, 6 с выходом продукта циклоалюминирования (2) 19% с энантиомерным избытком 13%ее по схеме:
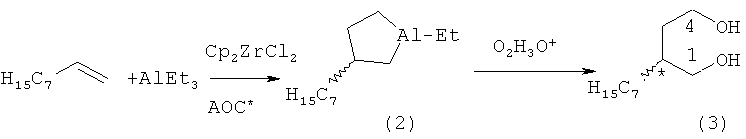
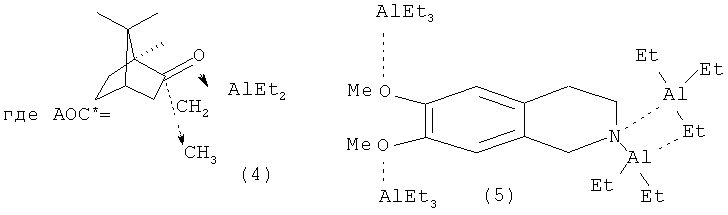
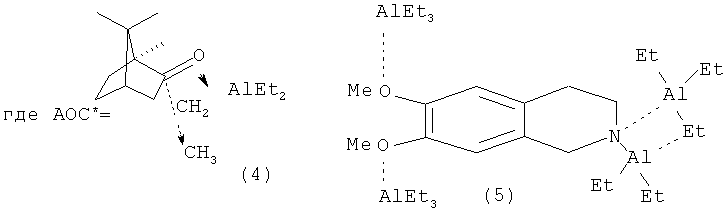
Недостатком данного метода является низкий выход продуктов циклометаллирования и невысокая оптическая чистота получаемых соединений; не установлена абсолютная конфигурация хирального центра полученных алюминациклопентанов.
Известен способ ([5] Millward D.B., Cole А.Р., Waymouth R.M. // Organometallics, 2000, 19, 1870) получения оптически активных алюминациклопентанов (7) при взаимодействии AIE13 с терминальными алкенами, в том числе стиролом и аллилбензолом, в присутствии 5 мол.% (+)-η5-5,η5-1 -инденил(диметилсилил)(R-метилбензил)амидотитан дихлорида (η5-(C5Me4)SiMe2N(But)TiCl2) (9). Выход продуктов окисления и гидролиза 2-бензил- или 2-фенил-1,4-диола (8) составил 47 и 12%, а энантиомерный избыток-28 и 19%ее соответственно.
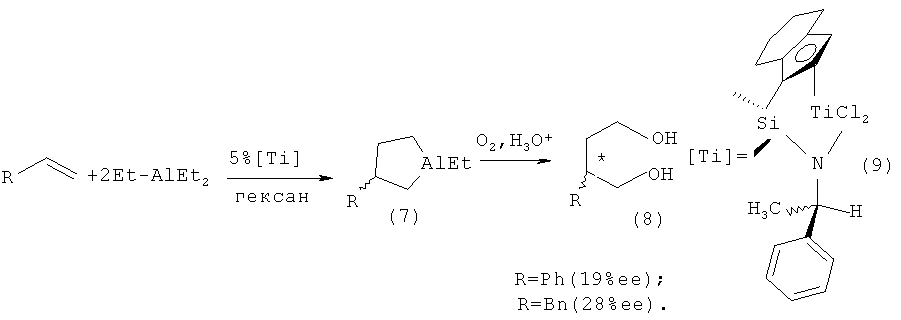
Недостатком данного метода является невысокий энантиомерный избыток получаемых соединений, а также неизвестная конфигурация хирального центра образующихся энантиомерно обогащенных алюминациклопентанов.
Известен способ ([6] Dawson, G., Currant, С.А., Kirk, G.G., Whitby, R.J. // Tetrahedron Letters, 1997, 38, 13, 2335-2338) получения оптически активных алюминациклопентанов (10) реакцией AlEt3 с 4-фенил-1-бутеном или аллилфенилсульфидом в гексане, в присутствии 4 мол.% циклопентадиенил 1-неоментил-4,5,6,7-тетрагидроинденил цирконий дихлорида (CpCp*ZrCl2) (12) в течение семи дней при комнатной температуре. Выход полученного продукта окисления и гидролиза 1,4-диола (11) составил 69%, а энантиомерный избыток - 30%ее.
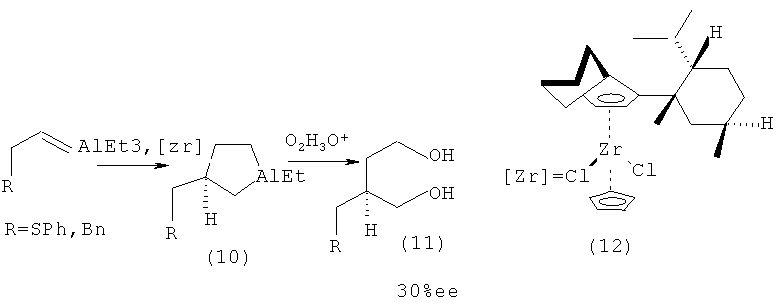
Недостатком данного метода является длительное время проведения реакции.
Известен способ ([7] Патент US6002037A. Negishi E-L, Kondakov D.Y. Chiral Organoalanes and their Organic Derivatives via Zirconium Catalyzed Asymmetric Carboalumination of Terminal Alkenes; [8] Kondakov D.Y., Negishi E-i.// J. Am. Chem. Soc, 1995, V.117, p.10771-10772) получения 1-этил-3-(н-октил)-алюминациклопентана (13) взаимодействием триэтилалюминия с деценом-1 в присутствии 8 мол.% энантимерно чистого катализатора бис(1-неоментилинденил)цирконий дихлорида (Ind* 2ZrCl2), в гексане по схеме:
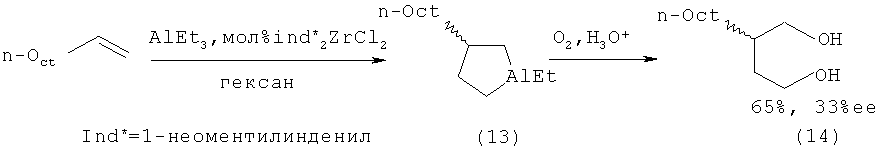
Выход алюминийорганического соединения (13) определялся по продукту последующего окисления и гидролиза 2-н-октил-1,4-бутандиолу (14). Так, выход (14) составил 65%, а энантиомерный избыток 33%ее, однако авторами не была установлена абсолютная конфигурация хирального центра в полученном продукте. В работе также не приведены условия и время проведения реакции (температура, соотношение А1Еt3:олефин). Недостатком данного метода является использование большого количества Zr катализатора.
Известен способ ([9] Parfenova L.V., Berestova T.V., Tyumkina T.V., Kovyazin P.V., Khalilov L.M., Whitby RJ., Dzhemilev U.M. // Tetrahedron: Asymmetry, 21, 2010, p.299-310) получения 1-этил-(35)-(n-бутил)-алюминациклопентана (15) взаимодействием триэтилалюминия с гексеном-1 в присутствии 8 мол.% катализатора бис(1-неоментилинденил)цирконий дихлорида (Ind* 2ZrCl2) в гексане по схеме:
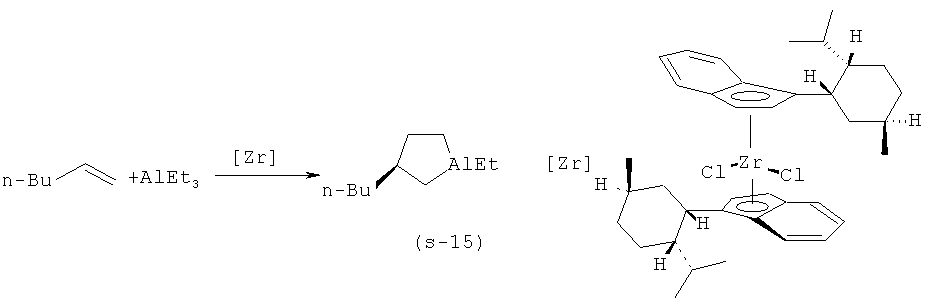
Известный способ позволяет получать преимущественно S-энантиомер 1-этил-3-бутил алюминациклопентана (S-15) с выходом до 80% и энантиомерным избытком 36%ее.
Таким образом, в литературе отсутствуют сведения о способах получения энантиомерно обогащенного 1-этил-(3S)-циклогексилалюминациклопентана.
Предлагается способ получения энантиомерно обогащенного 1-этил-(35)- циклогексилалюминациклопентана формулы (1).
Сущность способа заключается во взаимодействии олефина винилциклогексана с триэтилалюминием (AlEt3) в присутствии хирального катализатора бис(1-неоментилинденил) цирконий дихлорида (Ind* 2ZrCl2), взятых в мольном соотношении винилциклогексан: АlЕt3:[Zr]=25:(29-31):2. Реакцию проводят в атмосфере аргона при комнатной температуре (~22°С) и атмосферном давлении, преимущественно в хлористом метилене. Время реакции 24 часа, выход целевого продукта (1) составляет 35-37%, с энантиомерным избытком 55-51%ее. Реакция проходит по схеме:
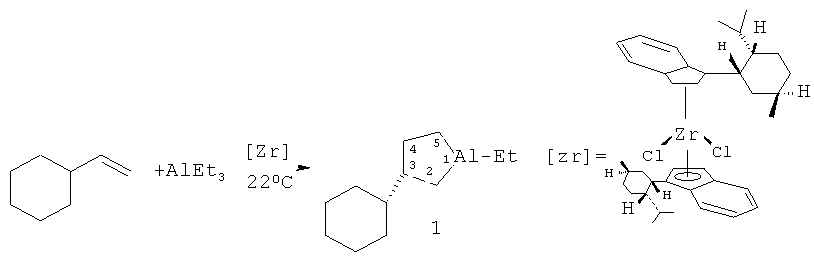
Энантиомерно обогащенный 1-этил-(3S)-винилциклогексилалюминациклопентан (1) образуется с участием винилциклогексана, А1Еt3 и энантиомерно чистого комплекса Ind* 2ZrCl2 в качестве катализатора. В присутствии других алюминийорганических соединений (например, А1Ме3, AlBui 3, Et2AlCl) целевой продукт (1) не образуется. В присутствии других комплексов Zr, например Cp2ZrCl2, (CpMe)2ZrCl2, (CpMe5)2ZrCl2, Ind2ZrCl2, Flu2ZrCl2, не обладающих оптической активностью, образующийся алюминациклопентан (1) представляет собой рацемическую смесь 3R- и 3S-энантиомеров. При использовании другого энантиомерно чистого катализатора - циклопентадиенил 1-неоментилинденил цирконий дихлорида (CpInd*ZrCl2) значительно снижается энантиоселективность реакции (Таблица 1). Использование других алкенов, как гексен-1, гептен-1, октен-1, нонен-1, децен-1, метилпентен-1, позволяет получать соответствующие 1-этил-3-алкилалюминациклопентаны (где Алкил=н-бутил, н-пентил, н-гексил, н-гептил, н-октил, изо-бутил) с энантиомерным избытком, не превышающим 36%ее. Проведение реакции в бензоле или без растворителя также приводит к снижению энантиомерного избытка продукта реакции - алюминациклопентана (1) (Таблица 1).
Реакцию проводили при перемешивании на магнитной мешалке при температуре ~22°С. Повышение температуры выше 40°C приводит к уменьшению конверсии алкена. Понижение температуры снижает скорость образования (1), а также увеличивает время реакции.
Изменение соотношения исходных реагентов в сторону уменьшения исходной концентрации AlEt3 или олефина приводит к снижению скорости реакции и выхода целевого продукта (1). Увеличение исходной концентрации AlEt3 существенно ускоряет побочные реакции. Повышение содержания катализатора по сравнению с другими исходными реагентами существенно уменьшает выход (1).
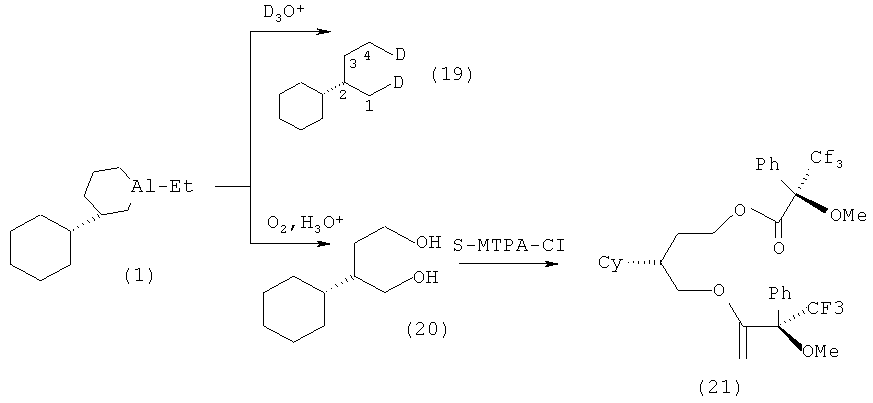
Образование циклического АОС 1 доказывалось путем анализа методами хроматомасс-спектрометрии, ЯМР 1Н и 13С продукта дейтеролиза -1,4-дидейтеро-2-циклогексилбутана (19). Энантиомерный избыток и абсолютную конфигурацию 1-этил-(3S)- циклогексилалюминациклопентана (1) определяли по продукту окисления и гидролиза - (2S)-циклогексил-1,4-бутандиолу (20), который вовлекали в реакцию с реагентом Мошера (а-метокси-а-фенил-а-(трифторометил)хлорангидридом (S-MTPAC1)).
Полученный МТРА эфир (21) анализировали с помощью спектроскопии ЯМР 1Н и 13С.
Существенные отличия предлагаемого способа:
1. В предлагаемом способе получения энантиомерно обогащенного циклогексилзамещенного алюминациклопентана используется винилциклогексан. В известных способах [4-9] описаны лишь методы получения н-алкил-, фенил- и бензилзамещенных алюминациклопентанов.
2. В предлагаемом способе для получения 1-этил-(35)-циклогексилалюминациклопентана используется хлористый метилен в качестве растворителя. В известных способах [4-9] применяются углеводородные растворители.
Предлагаемый способ обладает следующими преимуществами: 1. Способ позволяет получать энантиомерно обогащенный 1-этил-(3S-циклогексилалюминациклопентан (1) с выходом 35-37% и энантиомерным избытком 55-51%ее.
Способ поясняется следующим примером:
Пример 1. В стеклянный реактор объемом 10 мл, установленный на магнитной мешалке, в атмосфере аргона помещают 50 мг (0,08 ммоль) катализатора 1-неометилинденил цирконий дихлорида (Ind* 2ZrCl2), 0,3 мл хлористого метилена, 0.15 мл (1,2 ммоль) AlEt3 и 0,13 мл (1 ммоль) винилциклогексана. Реакцию проводят при температуре 22°C при непрерывном перемешивании в течение 24 ч.
По окончанию реакции часть реакционной массы разлагали 10% DC1, продукты экстрагировали бензолом, органический слой сушили над Na2SO4 и анализировали с помощью ГХ-МС.
Оставшуюся часть окисляли барботированием O2 в течение 2 ч и выдерживали в атмосфере кислорода в течение 24 ч. Продукты разлагали НСl и экстрагировали диэтиловым эфиром, органический слой сушили над Na2SO4, фильтровали и упаривали. Двухатомный спирт (20) в виде маслянистой жидкости выделяли методом колоночной хроматографиии на силикагеле с помощью ацетона. Органические фракции сушили над Na2SO4. Полученный спирт (2R)- винилциклогексил-1,4-бутандиол (20) ([α]D25 -5.3° (с=1.6, СН2Сl2) вовлекали в реакцию с реагентом Мошера (S-MTPAC1). Полученный МТРА эфир 21 анализировали с помощью спектроскопии ЯМР 1H и 13С. Выход 1 составляет 36% и энантиомерным избытком 57%ее, (S).
Другие примеры, подтверждающие способ, приведены в Таблице 1.
Спектральные характеристики (19-21):
1,4-Дидейтеро-2-циклогексилбутан (19). 1Н ЯМР (400.13 МГц, CDCl3) δH 0.77-0.83 (м, 2Н, CRCH2D), 0.82-0.89 (м, 2Н, CH2CH2D), 1.40-1.65 (м, 2Н, СH2СН2D), 1.42-1.47 (1H, м, СHСН2СН2D), 1.63-1.76 (м, 1H, СН2СHСН2), 1.08-1.29, 1.62-1.81 (м, 6Н, С6Н2, С8Н2), 0.98-1.11, 1.55-1.72 (м, 4Н, С7Н2). 13С ЯМР (100.62 МГц, CDCl3) δс 11.6 (С4), 15.4 (C1), 27.0, 26.5 (С7, С8), 30.8 (С3), 33.4, 33.5 (С6), 39.7 (С2), 42.4 (С5).
(25)-Циклогексил-1,4-бутандиол (20). [α]D 25 -5.3° (с=1.6, СН2Сl2). nD 22=1.4910, ИК (КВr, см-1): 3329, 2923, 1449, 1043. 1Н ЯМР (400.13 МГц, CDCl3) δH 0.95-1.12 (м, 2Hax, Су), 1.57-1.72 (м, 2Heq, Су), 1.13-1.31 (м, 2Нax, Су), 1.71-1.80 (м, 2Heq, Су), 1.015-1.2 (м, 1Hax, Су), 1.61-1.71 (м, lHeq, Су), 1.34-1.44 (1Н, м, СHСНСН2ОН), 1.45-1.53 (1H, м, СНСHСН2ОН), 1.54-1.66 (1Н, м, СНСHНСН2ОН), 1.68-1.78 (1Н, м, СНСНHСН2ОН), 3.58 (1Н, дд, 2J=10.6 Гц, 3J=7.8 Гц, СНСНHОН), 3.71 (1Н, ддд, 2J=10.8 Гц, 3J=3.6 Гц, СНСHНОН), 3.64 (1Н, ддд, 2J=10.8 Гц, 3J=8.0 Гц, 3J=4.4 Гц, СН2СНHОН), 3.81 (1Н, ддд, 2J=10.8 Гц, 3J=6.4 Гц, 3J=4.4 Гц, СН2СHНОН). 13С ЯМР (100.62 МГц, CDCI3) δс 26.6, 26.7, 26.8 (С7, С8, С9), 30.1, 30.2 (С6, С10), 33.4 (С3), 40.2 (С5), 45.0 (С2), 61.9 (С4), 64.9 (С1).
(Л)-МТРА эфир 2-циклогексил-1,4-бутандиола (21) 1Н ЯМР (400.13 МГц, C7D8) δН 0.58-0.75 (2Н, м, СHaxНСН (Су)), 1.22-1.39 (2Н, м, СНHeqСН (Су)), 0.89-1.11 (3Н, м, СHaxНСН2 (Су)), 1.48-1.62 1.48-1.62 (ЗН, м, СНHeqСН2 (Су)), 1.00-1.13 (1Н, м, СЯСНСН2ОН), 1.29-1.39 (1Н, м, СHСН2ОН), 1.26-1.36 (1Н, м, СНHСН2ОН), 1.44-1.54 (1Н, м, СHНСН2ОН),, 3.91 (1Н, дд, 2J=11.6 Гц, 3J=5.7 Гц, СН2СНHОН) (SRR), 3.95-4.04 (1Н, м, СН2СНHОН) (RRR), 4.07-4.15 (1Н, м, СН2СHНОН) (SRR, RRR), 3.93-4.15 (2H, м, CHCH2OH), 3.41 (6Н, с, ОСН3), 6.75-7.58 (10Н, Ph). 13С ЯМР (100.62 МГц, C7D8) δС26.16, 26.30, 26.32 (С8, С9, С10, (Су)), 29.3, 29.4 (С6, С7, (Су)), 27.12 (SRR), 27.23 (RRR) (С3), 38.39 (RRR), 38.47 (SRR) (С5), 39.15 (С2), 64.11 (С4), 66.24 (SRR), 66.28 (RRR) (C1), 54.9 (ОСН3), 84.5 (к, J=26.4 Гц, СОСН3), 123.5 (к, JC-F=288 Гц), 127.3-130.2 (Ph), 166.0 (С=O).
|
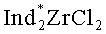
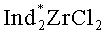
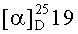 (CH2Cl2)
(CH2Cl2)