Результат интеллектуальной деятельности: СЛИТНЫЙ БЕЛОК, СПЕЦИФИЧЕСКИ УЗНАЮЩИЙ МЕЛАНОМНЫЕ КЛЕТКИ
Вид РИД
Изобретение
Изобретение относится к микробиологической промышленности, медицинской биотехнологии, генной инженерии и представляет собой рекомбинантный слитый белок формулы S-L-R или R-L-S, в том числе SR10, SR13, SR15, SdR10, SdR13 или SdR15, специфически узнающий меланомные клетки и обладающий потенциалом для использования в диагностике и терапии онкологических заболеваний человека, где: S - обозначает мономер стрептавидина; L - линкер, содержащий или не содержащий сайт расщепления энтеропептидазой, обозначаемый как «d», R - обозначает меланома-адресующий олигопептид.
Изобретение охватывает также сконструированные in vitro рекомбинантные плазмидные ДНК, каждая из которых обеспечивает гетерологичную экспрессию одного из вышеупомянутых слитых белков, и бактериальные штаммы Escherichia coli - продуценты данных слитых белков.
В состав заявляемого слитого белка, специфически узнающего меланомные клетки, входит стрептавидин (S) и меланома-адресующий олигопептид (R), выбранный из R10, R13 или R15, соединенные посредством линкера (L), имеющего последовательность а.о., включающую (или не включающую) сайт расщепления энтеропептидазой (Asp-Asp-Asp-Asp-Lys, обозначаемый в дальнейшем как «d».
Из уровня техники известна аминокислотная последовательность стрептавидина; нуклеотидная последовательность, кодирующая данный белок; создан вектор, в состав которого входит вышеупомянутая нуклеотидная последовательность, находящаяся под контролем сильного конститутивного промотора или промотора уридинфосфорилазы Е.coli (Rudp); генно-инженерно модифицированный штамм E.coli, содержащий упомянутый вектор и являющийся продуцентом стрептавидина; а также способ наработки данного полипептида в бактериальных клетках и хроматографической очистки [Патент RU 2153535].
Кроме того, известна аминокислотная последовательность меланома-адресующих олигопептидов R10, R13 и R15 (упоминающихся в литературном источнике как RGD10, RGD13 и RGD15) [Hölig P., Bach M., Völkel Т., Nahde Т., Hoffmaim S., Müller R. and Kontermann R.E. (2004) Protein Eng. Des. Sel., 17, 433-441].
Наконец, подробно описан и охарактеризован RGD-содержащий циклический пептид RGDfV, выпускаемый под торговой маркой Cilengitide компанией Merck KgaA (Германия). [Mas-Moruno С., Rechenmacher F., Kessler H. (2010) Anti-Cancer Agents in Medicinal Chemistry, 10, 753-768].
Для эффективного связывания с интегриновыми рецепторами на поверхности меланомных клеток белок должен содержать трипептид Arg-Gly-Asp (RGD). [Pierschbacher M.D. and Ruoslahti E. (1984) Nature, 309, 30-33]. Однако связывать RGD-мотив способны несколько интегриновых рецепторов (это группа интегринов, содержащие субчастицу αv, а также интегрины α5β1, α8β1 αIIbβ3). Для обеспечения селективности важно окружение RGD-мотива. Варьируя последовательность аминокислотных остатков, окружающих RGD-мотив, была создана панель RGD-содержащих олигопептидов с различной тканевой специфичностью, обусловленной селективным взаимодействием с различными интегриновыми рецепторами. В ряду прочих, были получены RGD-содержащие олигопептиды, обладающие способностью селективно связываться с рецепторами на поверхности меланомных клеток и клеток эндотелия опухолевых сосудов человека и мыши (RGD10, RGD13, RGD15). [Hölig P., Bach M., Völkel Т., Nahde Т., Hoffmann S., Müller R. and Kontermann R.E. (2004) Protein Eng. Des. Sel., 17, 433-441].
Следует отметить, что для эффективного связывания с рецептором трипептид RGD должен принимать изогнутую конформацию, которую стабилизируют либо посредством циклизации пептидной цепочки [Aumailey M., Gurrath M., Müller G., Calvete J., Timple R., Kessler H. (1991) FEBS Lett., 291, 50-54.; Gurrath M., Müller G., Kessler H., Aumailey M. Timple R. (1992) Eur. J. Biochem., 210, 911-921], либо путем образования дисульфидной связи между фланкирующими RGD-мотив остатками цистеина [Pierschbacher M.D. and Ruoslahti E. (1987) J. Biol. Chem., 262, 17924-17928.; Hölig P., Bach M., Völkel Т., Nahde Т., Hoffmann S., Müller R. and Kontermann R.E. (2004) Protein Eng. Des. Sel., 17, 433-441].
Известно, что RGD-содержащие пептиды способны оказывать токсический эффект на клетки - связываясь с интегриновыми рецепторами на поверхности опухолевых клеток, они запускают внутриклеточные сигнальные каскады, приводящие к остановке роста, снижению пролиферации и, впоследствии, гибели клеток. Данный принцип положен в основу действия препарата Cilengitide производства Merck KGaA (Германия), представляющего собой циклический пептид RGDfV (Arg-Gly-Asp-(D-Phe)-Val). [Mas-Moruno С., Rechenmacher F., Kessler H. (2010) Anti-Cancer Agents in Medicinal Chemistry, 10, 753-768]. Тем не менее, использование малых концентраций таких пептидов имеет обратный эффект, обусловленный кластеризацией рецепторов интегрина и активацией другого сигнального пути. Это создает дополнительные сложности при использовании препаратов, в состав которых входят RGD-содержащие пептиды, не несущие токсической части. Для устранения вышеописанного эффекта такие пептиды конъюгируют с токсическими агентами либо располагают на поверхности нагруженных токсическим агентом наноструктур или липосом [Pattillo C.B. et al. (2005) Pharm. Res., 22, 1117-1120.; Dubey P.K. Mishra V., Jain S., Manor S., Vyas S.P. (2004) J. Drug Target, 12, 257-264.], что является достаточно трудоемкой процедурой.
Помимо вышеперечисленных короткие RGD-пептиды имеют и другие недостатки.
Короткие пептиды, как правило, получают методом химического синтеза. Однако при реализации данного способа возможна рацемизация аминокислотных остатков. Замена L-формы аминокислот на D-форму может приводить к образованию нефункциональных пептидов, в данном, случае - со сниженной аффинностью к рецептору. [Han Y., Albericio F., Barany G. (1997), J Org Chem, 62, 4307-4312; Palasek S.A., Cox Z.J., Collins J.M. (2007) J. Peptide Sci., 13, 143-148]
Кроме того, небольшие пептиды, как правило, имеют малое время циркуляции в организме, что, наряду с пониженным сродством к рецептору, может вести к необходимости увеличения как количества применяемого препарата, так и частоты его введения. Эти процессы могут существенно снижать эффективность действия препарата.
Изогнутая конформация трипептида RGD, обусловленная кольцевой структурой химически синтезируемых пептидов, подобных Cilengitide, может также поддерживаться за счет дисульфидной связи, образуемой между фланкирующими RGD-мотив остатками цистеина. [Pierschbacher M.D. and Ruoslahti E. (1987) J. Biol. Chem., 262, 17924-17928.; Hölig P., Bach M., Völkel Т., Nahde Т., Hoffmann S., Müller R. and Kontermann R.E. (2004) Protein Eng. Des. Sel., 17, 433-441]. Это предоставляет возможность для биотехнологического получения пептидов, исключающего саму возможность рацемизации. Тем не менее, основной проблемой, возникающей при наработке белков в клетках микроорганизмов, является деградация коротких молекул, осуществляемая протеолитическими ферментами в цитоплазме клетки. Эта проблема решается путем включения целевого пептида в состав белка-«носителя», обспечивающего его защиту от действия протеиназ и пептидаз.
Заявляемые слитые белки позволяют не только устранить перечисленные недостатки, но также обладают рядом преимуществ по сравнению с короткими RGD-пептидами.
Для решения ряда вышеперечисленных проблем было предложено использовать стрептавидин в качестве «носителя» для меланома-адресующего олигопептида.
Включение олигопептида в состав тетрамеризующегося белка-носителя (стрептавидина) приводит к тому, что рекомбинантный слитый белок будет содержать в своем составе четыре интегрин-адресующих олигопептида. В результате взаимодействия такой структуры с рецептором на поверхности клетки происходит увеличение локальной концентрации RGD-мотивов вблизи данного рецептора, что повышает эффективность связывания. Литературные данные подтверждают повышенную эффективность связывания таких поливалентных структур по сравнению с моновалентными. [RU 2153535]
Помимо этого, стрептавидин способен с высоким сродством связывать остаток d-биотина (Kd=10-15). Учитывая тот факт, что каждая субъединица стрептавидина связывает 1 молекулу биотина, тетрамер способен связать 4 молекулы биотина, что может приводить к амплификации сигнала при использовании биотинилированного диагностического агента или усилению токсического эффекта при использовании биотинилированного терапевтического агента [Xia N., Liu L., Harrington M.G., Zhou F. (2010), Anal. Chem., 82, 10151-10157].
Использование запатентованной экспрессионной системы, позволяющей в препаративных количествах нарабатывать рекомбинантный стрептавидин в периплазме E.coli. [RU 2153535], обеспечивает локализацию химерного белка на основе стрептавидина в периплазматическом пространстве клетки, что позволяет не только ограничить его расщепление протеолитическими ферментами, присутствующими в цитоплазме, но и существенно упростить стадию выделения.
Наличие сайта протеолитического расщепления, располагающегося между стрептавидином и RGD-содержащим олигопептидом, позволяет получать из слитого белка короткий RGD-содержащий олигопептид, который может быть иммобилизован на носителе и использоваться в аналитических целях.
Из анализа уровня техники не выявлено решений, обладающих указанными свойствами, а именно не выявлено слитых со стрептавидином RGD-содержащих меланома-адресующих белков, которые могут быть получены биотехнологически и обеспечивают селективное и эффективное связывание с рецепторами на поверхности меланомных клеток.
Задачей заявляемой группы изобретений является создание рекомбинантных слитых белков, специфически узнающих меланомные клетки и обладающих потенциалом для использования в диагностике и терапии онкологических заболеваний человека, в том числе слитых белков, содержащих сайт протеолиза, для получения в дальнейшем меланома-адресующих олигопептидов, создание рекомбинантных плазмидных ДНК, каждая из которых обеспечивает гетерологичную экспрессию одного из вышеупомянутых слитых белков, а также штаммов-продуцентов вышеупомянутых слитых белков.
Кроме того, в заявляемом изобретении представлены подобранные условия протеолиза рекомбинантных слитых белков, содержащих сайт расщепления энтеропептидазой, и способ очистки отщепленных олигопептидов.
Поставленная задача решается тем, что слитый белок, специфически узнающий меланомные клетки, имеет формулу S-L-R или R-L-S, где:
S - мономер стрептавидина, имеющий аминокислотную последовательность SEQ NO 1;
L - линкер, имеющий аминокислотную последовательность SEQ NO 2, содержащую сайт расщепления энтеропептидазой и обозначаемую как «d», или аминокислотную последовательность SEQ NO 3;
R - меланома-адресующий олигопептид, имеющий аминокислотную последовательность SEQ NO 4 или SEQ NO 5 или SEQ NO 6, где

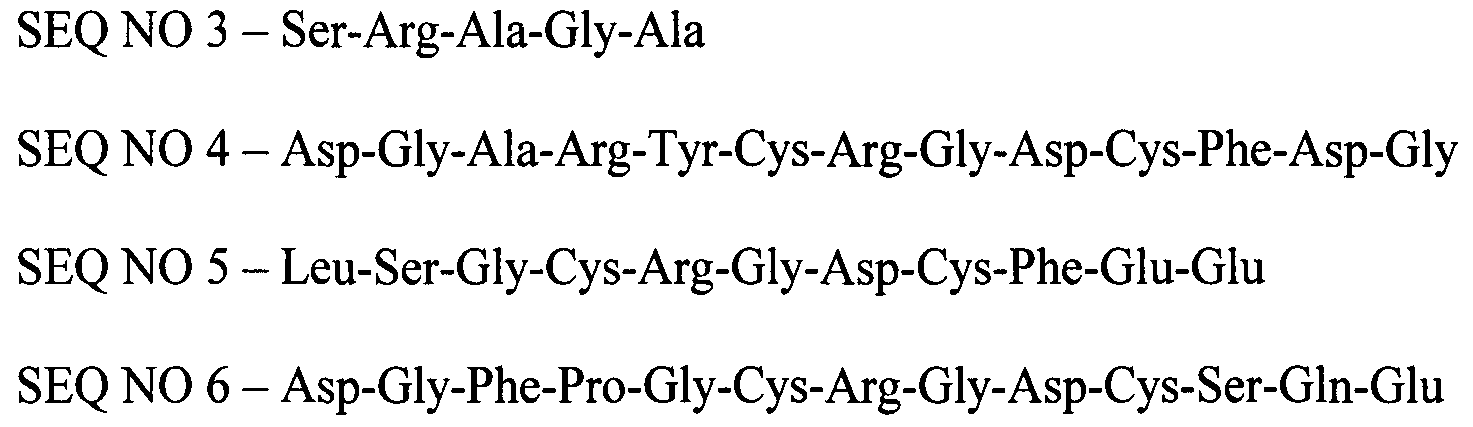
Поставленная задача решается также тем, что рекомбинантная плазмидная ДНК pSR или pSdR на базе вектора pUC18 включает последовательность промотора уридинфосфорилазы E.coli, а также последовательность, кодирующую слитой белок (pSR10 или pSdR10 или pSR13 или pSdR13 или pSR15 или pSdR15).
Поставленная задача решается также тем, что получен бактериальный штамм Escherichia coli MG1655/pSR или MG1655/pSdR, трансформированный указанной плазмидной ДНК, продуцент слитого белка, представленного выше (штамм Escherichia coli MG1655/pSR10 или MG1655/pSdR10 или MG1655/pSR13 или MG1655/pSdR13 или MG1655/pSR15 или MG1655/pSdR15).
Поставленная задача решается также тем, что создан способ получения меланома-адресующего олигопептида R из данного рекомбинантного слитого белка, содержащего сайт расщепления d, включающий расщепление данного белка энтеропептидазой и хроматографическую очистку пептида, при этом очистку осуществляют в два этапа: на первом этапе отщепленный стрептавидин и нерасщепленные белки удаляют из раствора при помощи аффинной хроматографии на 2-иминобиотинагарозе, собирая фракцию несвязавшихся с сорбентом белков, с последующим концентрированием раствора; на втором этапе осуществляют очистку олигопептида при помощи HPLC.
Поставленная задача решается также за счет применения стрептавидина в качестве компонента слитого белка для визуализации активности меланома-адресующего пептида.
Сущность группы изобретений заключается в создании рекомбинантного слитого белка SR10, SR13, SR15 или SdR10, SdR13, SdR15, специфически узнающего меланомные клетки и обладающего потенциалом для использования в диагностике и терапии онкологических заболеваний человека, в состав которого входит стрептавидин (S) и меланома-адресующий олигопептид (R), выбранный из R10, R13, R15, соединенный со стрептавидином посредством пептидного линкера, который содержит (или не содержит сайт расщепления энтеропептидазой быка, обозначаемый как «d»); конструировании 6 рекомбинантных плазмидных ДНК, каждая из которых обеспечивает гетерологичную экспрессию слитого белка SR10, SR13, SR15 или SdR10, SdR13, SdR15, в состав которого входит стрептавидин (S) и меланома-адресующий олигопептид (R), R10, R13 или R15, соединенный со стрептавидином посредством пептидного линкера, который содержит (или не содержит) сайт расщепления энтеропептидазой быка, обозначаемый как «d»; а также получении бактериальных штаммов Escherichia coli - продуцентов слитых белков SR10, SR13, SR15 или SdR10, SdR13, SdR15. Кроме того, описан способ получения коротких RGD-пептидов из слитых белков SdR10, SdR13, SdR15 при помощи расщепления энтеропептидазой, узнающей специфическую аминокислотную последовательность, располагающуюся в линкерной области таких слитых белков.
Для решения задачи получают рекомбинантные плазмидные ДНК pSR (pSR10, pSR13, pSR15) на основе мультикопийного вектора pUC18, включающие ген гибридного белка SR (SR10, SR13 или SR15) и последовательность промотора уридинфосфорилазы Е.coli (Rudp), и рекомбинантные плазмидные ДНК pSdR (pSdR10, pSdR13, pSdR15) на основе из мультикопийного вектора pUC18, включающие ген гибридного белка SdR (SdR10, SdR13, SdR15), и последовательность промотора уридинфосфорилазы Е.coli (Rudp). Ген гибридного белка представляет собой ген предшественника стрептавидина (pro-SAV), слитый с геном меланома-адресующего олигопептида RGD (RGD10, RGD13 или RGD15) или D4KRGD (D4KRGD10, D4KRGD13 или D4KRGD15), соответственно. В последнем между геном, кодирующим стрептавидин, и геном, кодирующим RGD-содержащий олигопептид, располагается последовательность, кодирующая сайт расщепления энтеропептидазой Asp-Asp-Asp-Asp-Lys (D4K). Наличие последовательности D4K обеспечивает эффективное расщепление слитого белка при помощи фермента энтеропептидазы, в результате которого происходит образование свободного стрептавидина и свободного меланома-узнающего олигопептида.
Также для решения поставленной задачи получают штамм E.coli MG1655, трансформированный рекомбинантной плазмидой pSR или pSdR, который за 12-16 часов ферментации в жидкой среде LB (Luria-Bertani) при 32-37°С накапливает не менее 30 мг рекомбинантного слитого белка SR (SR10, SR13 или SR15) или SdR (SdR10, SdR13 или SdR15) на 1 л культуры. Наблюдаемый эффект достигается, во-первых, за счет введения в реципиентную клетку E.coli мультикопийного вектора (200-250 копий клонированного гена на геномный эквивалент), а во-вторых, за счет использования сильного конститутивного промотора, обеспечивающего эффективную транскрипцию клонированного гена.
Заявляемые штаммы E.coli MG1655/pSR10, MG1655/pSR13, MG1655/pSR15, а также MG1655/pSdR10, MG1655/pSdR13, MG1655/pSdR15 хранятся в коллекции НИЛ ВИЭ биологического факультета МГУ.
Заявляемая группа изобретений иллюстрируется фигурами графических изображений фиг.1 - фиг.7.
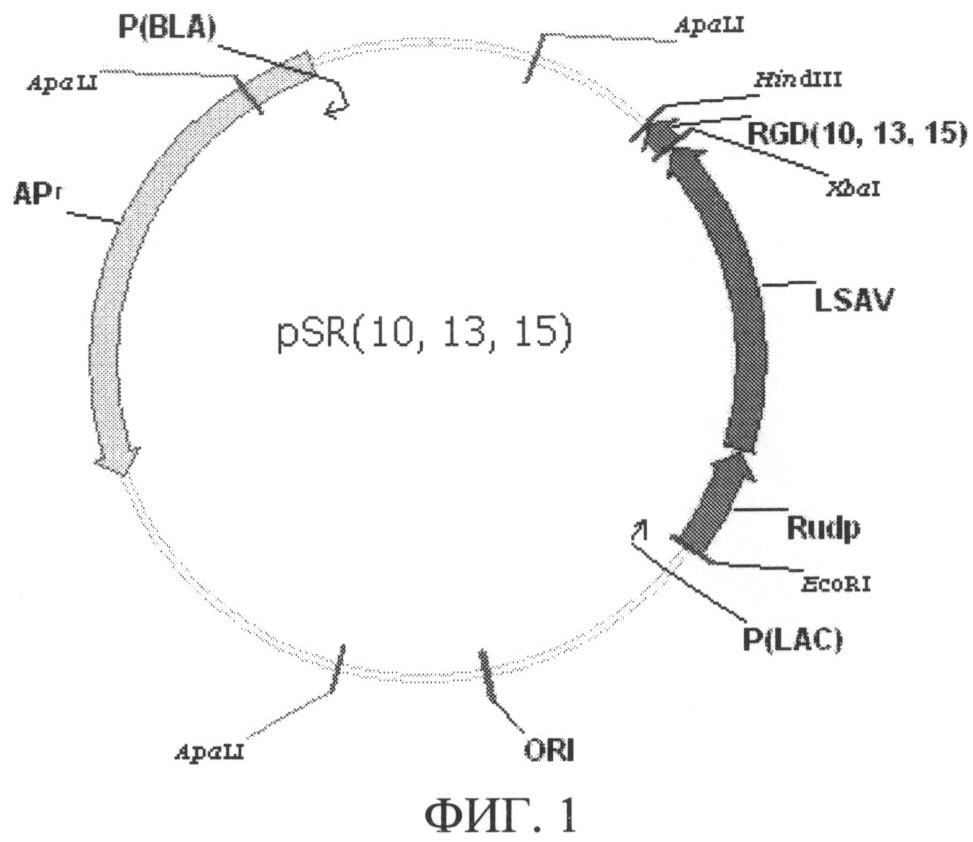
На фиг.1 представлена физико-генетическая карта рекомбинантной плазмиды pSR (10, 13, 15), фиг.2 - физико-генетическая карта рекомбинантной плазмиды pSdR (10, 13, 15), фиг.3 - результат электрофоретического разделения в денатурирующем 12% ПААГ суммарных белков перипламатической фракции Escherichia coli штамма-реципиента MG1655 (дорожка 1) и штамма-продуцента белка SR10 (дорожка 2); дорожка 3 - рекомбинантный стрептавидин; М - белки-маркеры, на фиг.4 представлен профиль хроматографического разделения фракции периплазматических белков штамма-продуцента SR10 E.coli: пик 1 - суммарные белки периплазматической фракции штамма-продуцента, не связавшиеся с сорбентом; пик 2 - связавшийся с сорбентом белок, элюированный при помощи раствора 3, на фиг.5 - результат электрофоретического разделения в денатурирующем 12% ПААГ фракций белков, полученных на различных стадиях хроматографической очистки белка SR10 на 2-иминобиотинагарозе: суммарные белки периплазматической фракции штамма-продуцента (дорожка 1), суммарные белки периплазматической фракции, не связавшиеся с сорбентом (дорожка 2), очищенный рекомбинантный белок SR10; М - белки-маркеры, на фиг.6 - клетки меланомных и немеланомных линий человека и мыши после взаимодействия с FITC-мечеными белками SdR10, SdR13, SdR15 и rSAV, на фиг.7 - результат электрофоретического разделения в 12% ПААГ в денатурирующих условиях продуктов расщепления слитых белков SdR10, SdR13 и SdR15 легкой цепью бычьей энтеропептидазы: дорожка 1 - рекомбинантный стрептавидин, дорожки 2, 4, 7 - нерасщепленные белки SdR10, SdR13, SdR15, соответственно, дорожки 3, 5, 6, 8 - расщепленные белки SdR10, SdR13, SdR13 (с удвоенным количеством энтеропептидазы), SdR15, соответственно.
Конструирование штаммов и технология получения слитых белков SR10, SR13, SR15, SdR10, SdR13 и SdR15 включает нескольких этапов.
Этап 1. Создание генно-инженерными методами генов меланома-узнающих олигопептидов RGD10, RGD13, RGD15, а также генов меланома-узнающих олигопептидов D4K-RGD10, D4K-RGD13 и D4K-RGD15, содержащих последовательность, кодирующую сайт расщепления энтеропептидазой (D4K), и введение в данные гены сайтов для эндонуклеаз рестрикции.
Этап 2. Конструирование рекомбинантных плазмид pSR (pSR10, pSR13 и pSR15) и pSdR (pSdR10, pSdR13 и pSdR15), основными характеристиками которых являются высокая копийность (200-300 копий на геномный эквивалент), удобный селективный маркер (устойчивость к антибиотику ампициллину), сильный конститутивный промотор, обеспечивающий эффективную экспрессию клонированных слитых генов в штаммах E.coli.
Этап 3. Трансформация сконструированными рекомбинантными плазмидами pSR (pSR10, pSR13 и pSR15) и pSdR (pSdR10, pSdR13 и pSdR15) штамма E.coli MG1655, подтверждение соответствия нуклеотидных последовательностей клонированных генов с последовательностями генов меланома-узнающих олигопептидов R10, R13, R15, dR10, dR13 и dR15.
Этап 4. Культивирование полученных штаммов E.coli MG1655/pSR10, MG1655/pSR13, MG1655/pSR15, MG1655/pSdR10, MG1655/pSdR13, MG1655/pSdR15 на среде LB, содержащей 100-150 мг/л ампициллина, при температуре 32-37°С.
Этап 5. Получение из клеточной массы фракции периплазматических белков.
Этап 6. Очистка рекомбинантных слитых белков SR10, SR13, SR15, SdR10, SdR13 и SdR15 на 2-иминобиотин агарозе.
Этап 7. Ультрафильтрация растворов выделенных белков SR10, SR13, SR15, SdR10, SdR13 и SdR15 при помощи мембраны YM-30 (Amicon, США), позволяющей отсекать (cut-off) белки размером свыше 25 кДа.
Этап 8. Получение из слитого белка пептида R10, R13 и R15 путем расщепления энтеропептидазой быка белка SdR10, SdR13 или SdR15, соответственно.
Штамм Escherichia coli K12 MG1655/pSR (или MG1655/pSdR) обладает следующими культурально-морфологическими и физиолого-биохимическими признаками.
1. Морфологические признаки. Клетки - прямые палочки, 1,1-1,5 × 2.0-6,0 мкм, подвижные за счет перитрихиальных жгутиков, грамотрицательные, неспороносные.
2. Культуральные признаки. Клетки штамма хорошо растут на стандартных, описанных для E.coli средах, содержащих до 150 мкг/мл ампициллина. При выращивании на полноценных агаризованных средах (LB-агар) колонии блестящие, гладкие, круглые, с ровными краями. При 32-37°С достаточно 12-16 часов роста. При выращивании в жидких средах в пробирках клетки образуют равномерную муть, достигая оптической плотности 4,0-6,0 при А600 за 12-16 часов роста при 37°С.
3. Физиолого-биохимические признаки. Температурный оптимум для роста клеток 37°С, факультативный анаэроб, оксидазоотрицательные, каталазоположительные, отрицательные по признакам образования H2S, гидролиза мочевины и активности липазы, катаболизируют D-глюкозу и другие углеводы с образованием кислоты и газа, источником азота могут служить минеральные соли в аммонийной форме, а также органические соединения в виде пептона, триптона, дрожжевого экстракта и аминокислот.
4. Генотипические признаки. Основной генотипический признак заявляемых штаммов E.coli (F-lambda - ilvG-rfb-50 rph-1) состоит в наличии гена гибридного белка SR (SR10 (MG1655/pSR10), SR13 (MG1655/pSR13), SR15 (MG1655/pSR15)) или SdR (SdR10 (MG1655/pSdR10), SdR13 (MG1655/pSdR13), SdR15 (MG1655/pSdR15)) под регуляцией промотора уридинфосфорилазы Е.coli (Rudp), интегрированного в состав мультикопийного экспрессионного вектора pUC18, содержащего в качестве селективного маркера ген устойчивости к ампициллину.
5. Устойчивость к антибиотикам. Устойчивость к ампициллину у штаммов не ниже 100 мкг/мл при наращивании в жидких полноценных средах или на твердых агаризованных средах.
6. Стабильность плазмид pSR (pSR10, pSR13, pSR15) и pSdR (pSdR10, pSdR13, pSdR15) в штамме E.coli K12 MG1655. При хранении клеток на агаризованной среде (сроком до 1 месяца), при серии последовательных пересевов (в течение не менее 6 месяцев) и в процессе культивирования в жидкой среде с антибиотиком не происходит потери и перестройки плазмиды pSR (pSR10, pSR13, pSR15) или pSdR (pSdR10, pSdR13, pSdR15).
Процесс биосинтеза рекомбинантных белков SR (SR10, SR13, SR15) и SdR (SdR10, SdR13, SdR15) в штаммах E.coli включает стадии получения посевного материала, основную ферментацию, выделение биомассы и получение фракции периплазматических белков. Выращивание посевного материала и основную ферментацию штаммов E.coli MG1655/pSR10, MG1655/pSR13, MG1655/pSR15, MG1655/pSdR10, MG1655/pSdR13, MG1655/pSdR15 осуществляют в аэробных условиях на среде LB. В питательные среды вносят ампициллин в концентрации 100-150 мг/л. Биомассу выращивают при рН 7-7.4 и температуре 32-37°С до концентрации, определяемой составом питательной среды.
После завершения процесса ферментации бактериальные клетки отделяют от культуральной среды центрифугированием и ресуспендируют в соответствующем буферном растворе, после чего выделяют фракцию периплазматических белков, которую и используют для последующего выделения целевых продуктов. Для этого проводят хроматографическую очистку стрептавидин-содержащих белков на 2-иминобиотин агарозе и ультрафильтрацию очищенных белков.
Рекомбинантная плазмида pSR (10, 13, 15), представленная на фиг.1, состоит из следующих фрагментов ДНК:
1) последовательность с 1 нуклеотида по 404 нуклеотид (н.) включает фрагмент ДНК размером 404 п.о., содержащий фрагмент ДНК плазмиды pUC18 с 1 н. по 404 н.
2) последовательность с 405 н. по:
- 455 н. включает фрагмент ДНК размером 51 п.о., содержащий ген RGD10 в случае pSR10; или
- 449 н. включает фрагмент ДНК размером 45 п.о., содержащий ген RGD13 в случае pSR13; или
- 455 н. включает фрагмент ДНК размером 51 п.о., содержащий ген RGD15 в случае pSR15.
3) последовательность:
- с 456 н. по 461 н. в случае pSR10; или
- с 450 н. по 455 н. в случае pSR13; или
- с 456 н. по 461 н. в случае pSR15 включает синтетический фрагмент ДНК размером 6 п.о., содержащий синтетичекий полилинкер;
4) последовательность:
- с 462 н. по 1010 н. в случае pSR10; или
- с 456 н. по 1004 н. в случае pSR13; или
- с 462 н. по 1010 н. в случае pSR15 включает фрагмент ДНК размером 549 п.о., содержащий ген прострептавидина, SAV (последовательность, кодирующая стоп-кодон, отсутствует);
5) последовательность:
- с 1011 н. по 1017 н. в случае pSR10; или
- с 1005 н. по 1011 н. в случае pSR13; или
- с 1011 н. по 1017 н. в случае pSR15 включает фрагмент ДНК размером 6 п.о., содержащий синтетический полилинкер;
6) последовательность:
- с 1018 н. по 1196 н. в случае pSR10; или
- с 1012 н. по 1190 н. в случае pSR13; или
- с 1018 н. по 1196 н. в случае pSR15 включает фрагмент ДНК размером 180 п.о., содержащий последовательность промотора уридинфосфорилазы Е.coli, Rudp;
7) последовательность:
- с 1197 н. по 3433 н. в случае pSR10; или
- с 1191 н. по 3427 н. в случае pSR13; или
- с 1197 н. по 3433 н. в случае pSR15 включает фрагмент ДНК плазмиды pUC18 с 450 н. по 2686 н. размером 2237 п.о., содержащий промотор гена β-лактамазы (P(BLA)), ген устойчивости к ампициллину (APr), последовательность, ответственную за репликацию плазмиды (ori) и lac промотер (P(LAC)).
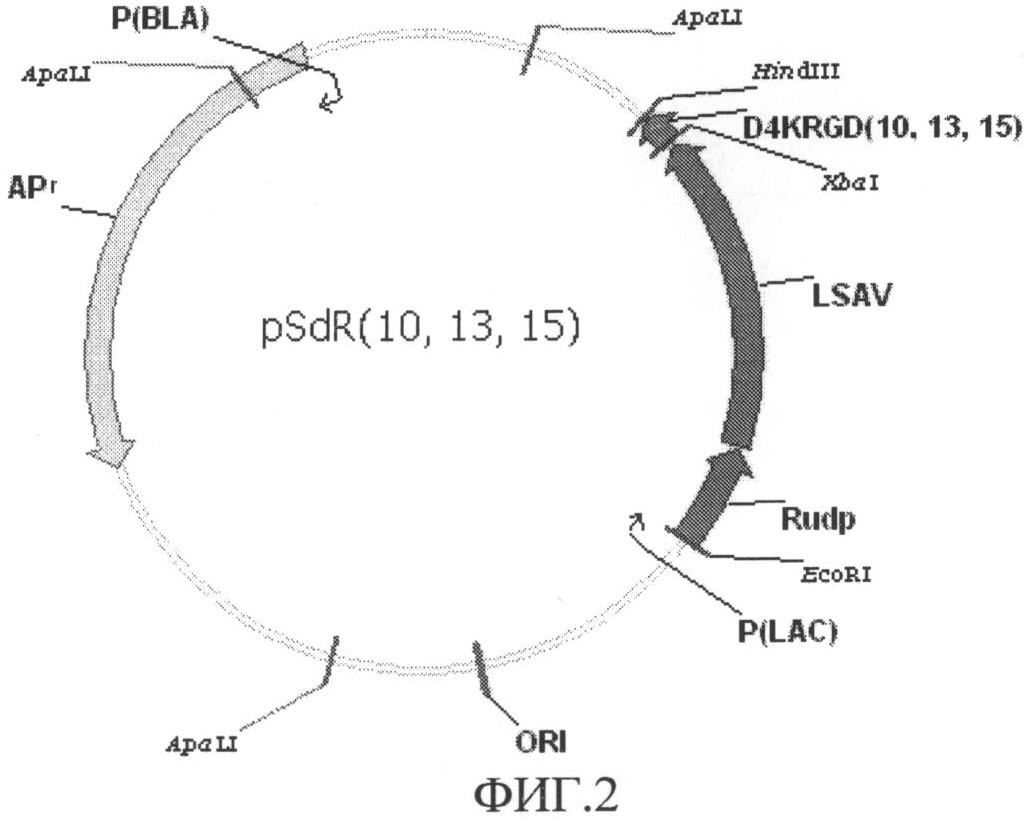
Рекомбинантная плазмида pSdR (10, 13, 15), представленная на фиг.2, состоит из следующих фрагментов ДНК:
1) последовательность с 1 нуклеотида по 404 нуклеотид (н.) включает фрагмент ДНК размером 404 п.о., содержащий фрагмент ДНК плазмиды pUC18 с 1 н. по 404 н.
2) последовательность с 405 н. по:
- 461 н. включает фрагмент ДНК размером 57 п.о., содержащий ген D4KRGD10 с сайтом для энтеропептидазы в случае pSdR10; или
- 455 н. включает фрагмент ДНК размером 51 п.о., содержащий ген D4KRGD13 с сайтом для энтеропептидазы в случае pSdR13; или
- 461 н. включает фрагмент ДНК размером 57 п.о., содержащий ген D4KRGD15 с сайтом для энтеропептидазы в случае pSdR15.
3) последовательность:
- с 462 н. по 467 н. в случае pSdR10; или
- с 456 н. по 461 н. в случае pSdR13; или
- с 462 н. по 467 н. в случае pSdR15 включает синтетический фрагмент ДНК размером 6 п.о., содержащий синтетический полилинкер;
4) последовательность:
- с 468 н. по 1016 н. в случае pSdR10; или
- с 462 н. по 1010 н. в случае pSdR13; или
- с 468 н. по 1016 н. в случае pSdR15 включает фрагмент ДНК размером 549 п.о., содержащий ген прострептавидина, SAV (последовательность, кодирующая стоп-кодон, отсутствует);
5) последовательность:
- с 1017 н. по 1022 н. в случае pSdR10; или
- с 1011 н. по 1016 н. в случае pSdR13; или
- с 1017 н. по 1022 н. в случае pSdR15 включает фрагмент ДНК размером 6 п.о., содержащий синтетический полилинкер;
6) последовательность:
- с 1023 н. по 1202 н. в случае pSdR10; или
- с 1017 н. по 1196 н. в случае pSdR13; или
- с 1023 н. по 1202 н. в случае pSdR15 включает фрагмент ДНК размером 180 п.о., содержащий последовательность промотора уридинфосфорилазы Е.coli, Rudp;
7) последовательность:
- с 1203 н. по 3439 н. в случае pSdR10; или
- с 1197 н. по 3433 н. в случае pSdR13; или
- с 1203 н. по 3439 н. в случае pSdR15 включает фрагмент ДНК плазмиды pUC18 с 450 н. по 2686 н. размером 2237 п.о., содержащий ген бета-лактамазы, определяющий устойчивость трансформированных клеток E.coli к ампициллину (ApR), последовательность, ответственную за репликацию плазмиды (ori) и lac промотер (Plac).
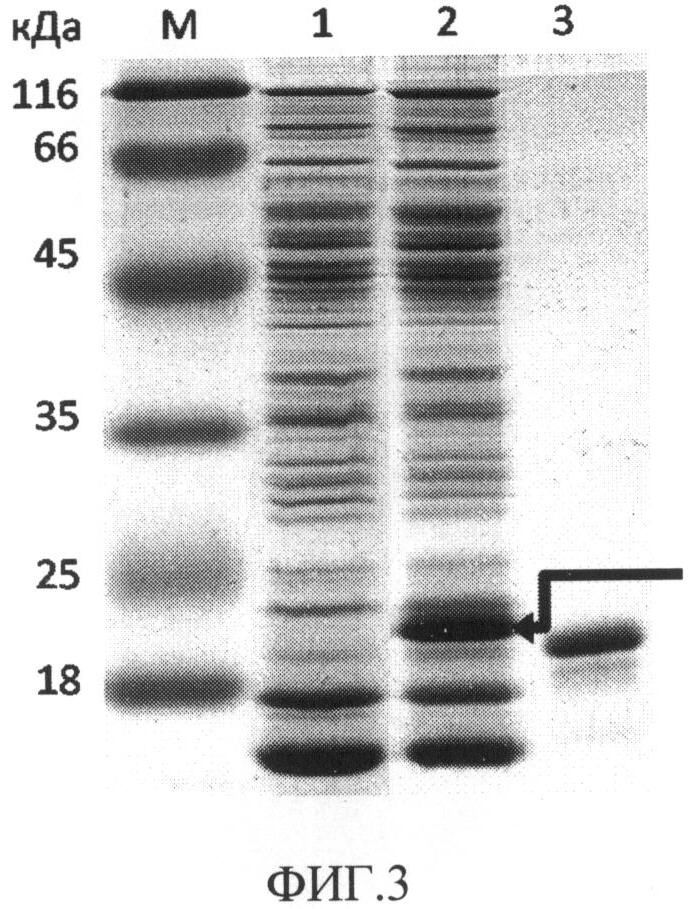
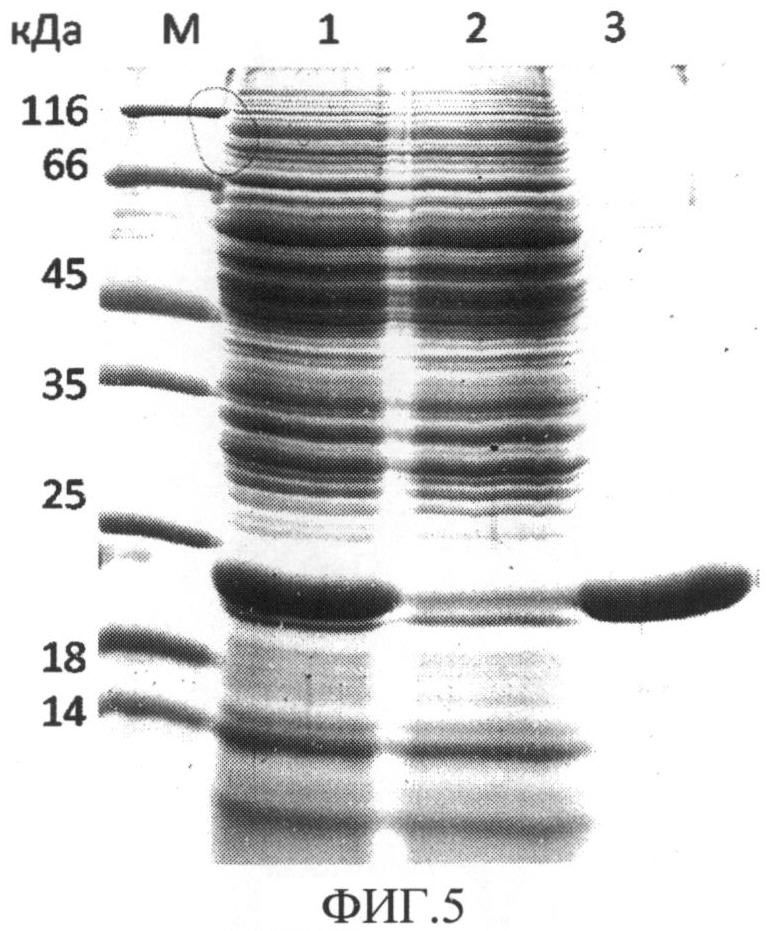
На фиг.3 представлен результат электрофоретического разделения в денатурирующем 12% ПААГ белков перипламатической фракции Escherichia coli, где М - белковые маркеры с известными молекулярными массами; 1 - периплазматическая фракция белков культуры MG1655/pUC18 (штамм-реципиент, трансформированный вектором pUC18, не несущим ген рекомбинантного белка SR или SdR); 2 - периплазматическая фракция белков культуры MG1655/pSR10 (штамм-продуцент слитого белка SR10); 3 - очищенный рекомбинантный стрептавидин rSAV. Стрелка указывает на полосу, соответствующую рекомбинантному белку SR10 (дорожка 2).
Аналогичные иллюстрации были получены для белков SR13, SR15, SdR10, SdR13, SdR15.
В периплазматической фракции белков штамма, трансформированного плазмидой pSR10 (дорожка 2), присутствует продукт с молекулярной массой, соответствующий расчетной молекулярной массе для мономера слитого белка SR10 и составляющей около 20 кДа (соответствующая полоса на электрофореграмме отмечена стрелкой). В то же время, данный продукт отсутствует в периплазматической фракции белков штамма, трансформированного вектором pUC18, что говорит об том, что вышеупомянутый продукт появляется в результате экспрессии слитого гена SAV-RGD10. Учитывая тот факт, что аналогичные иллюстрации были получены для периплазматических фракций белков штаммов, трансформированных плазмидами pSR13, pSR15, pSdR10, pSdR13 и pSdR15, можно говорить о том, что мы также наблюдаем экспрессию сконструированных слитых генов SAV-RGD13, SAV-RGD15, SAV-D4KRGD10, SAV-D4KRGD10, SAV-D4KRGD15. Наконец, меньшая электрофоретическая подвижность рекомбинантного слитого белка по сравнению с электрофоретической подвижностью рекомбинантного стрептавидина и соответствие реальной и расчетной молекулярной массы позволяют сделать вывод о том, что слитый белок помимо стрептавидина содержит также олигопептид.
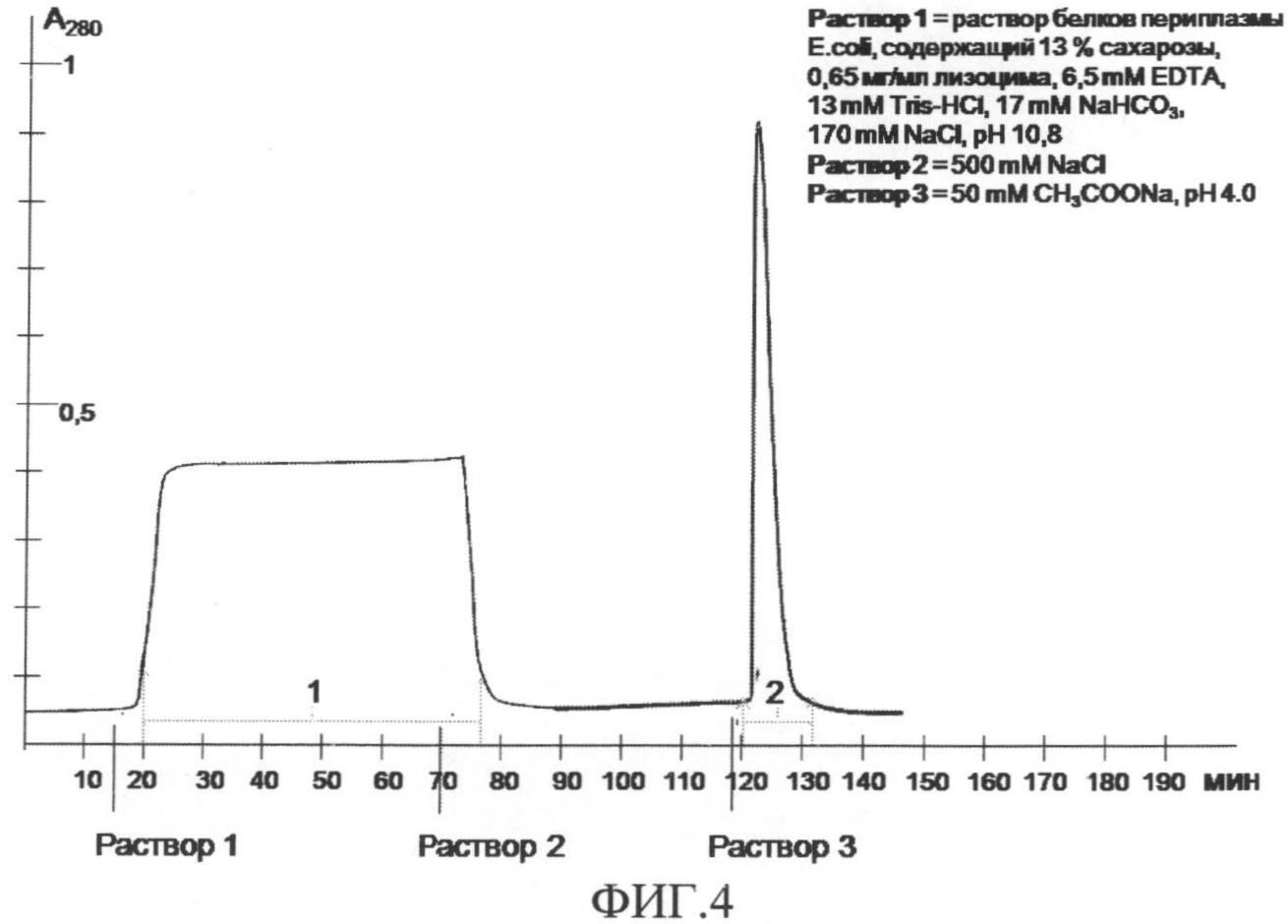
На фиг.4 представлен профиль хроматографического разделения фракции периплазматических белков штамма-продуцента SR10 E.coli, где 1 - фракция белков, не связавшихся с сорбентом, 2 - фракция белков, элюированных с 2-иминобиотин агарозы. В качестве раствора 1 был использован раствор белков периплазмы E.coli, содержащий 13% сахарозы, 0,65 мг/мл лизоцима, 6,5 мM EDTA, 13 мM Tris-HCl, 17 мM NaHCO3, 170 мM NaCl, pH 10,8; в качестве раствора 2 - 500 мM NaCl; раствора 3-50 мM CH3COONa, pH 4,0.
Для хроматографического разделения периплазмы штаммов-продуцентов белков SR13, SR15, SdR10, SdR13 и SdR15 были получены аналогичные профили.
Во время нанесения раствора 1 (раствора периплазматических белков) на колонку происходит связывание стрептавидин-содержащих белков с сорбентом (2-иминобиотинагарозой), в то время как белки, не обладающие аффинностью к 2-иминобиотину и, соответственно, не способные связаться с сорбентом, не задерживаются на колонке и сходят в виде пика 1. После нанесения осуществляют промывку сорбента при помощи раствора 2, чтобы удалить неспецифически связавшиеся белки. После промывки осуществляют элюцию стрептавидин-содержащих белков раствором 3, в результате которой происходит диссоциация молекул сорбента и молекул целевых белков, и стрептавидин-содержащие белки сходят в виде пика 2.
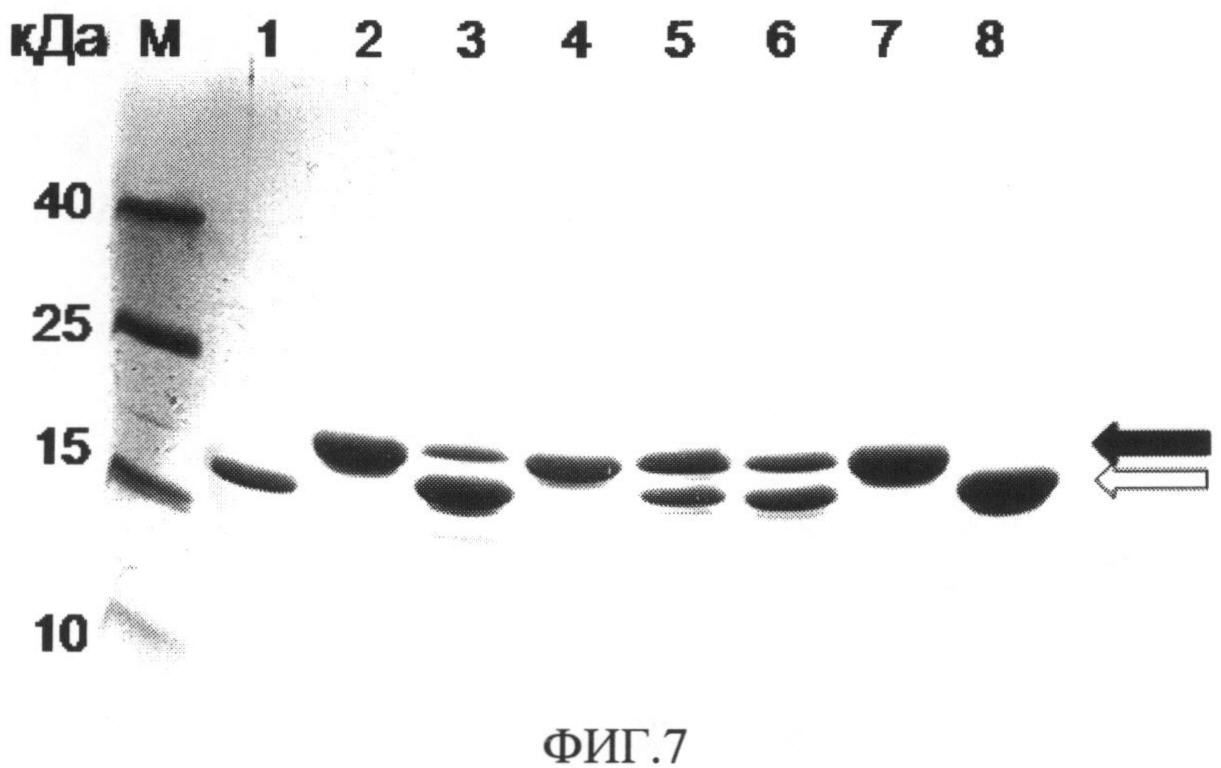
На фиг.5 представлено электрофоретическое разделение в 12% ПААГ фракций белков, полученных в результате хроматографического разделения периплазмы штаммов Е.coli, продуцирующих гибридные белки, на 2-иминобиотин агарозе, где М - белковые маркеры с известными молекулярными массами; 1 - периплазматическая фракция белков культуры MG1655/pSR10 (штамм-продуцент слитого белка SR10); 2 - фракция белков, не связавшихся с сорбентом (2-иминобиотин агарозой); 3 - белок SR10, элюированный с колонки после связывания с сорбентом.
Структуры полученных гибридных белков были подтверждена методом масс-спектрометрии (MALDI-TOF MS).
Сопоставляя фиг.4 и 5, можно заметить, что на электрофореграмме белков из пика 1 (дорожка 2) практически отсутствует полоса, соответствующая слитому белку SR10, который присутствовал в растворе белков, наносимом на колонку (дорожка 1) следовательно, при нанесении целевой белок связался с сорбентом. С другой стороны, на электрофореграмме белков из пика 2 присутствует преимущественно целевой белок (дорожка 3). Отсутствие паразитных полос говорит об отсутствии существенной деградации и достаточной чистоте полученного препарата.
Для белков SR13, SR15, SdR10, SdR13, SdR15 были получены аналогичные иллюстрации. Номера дорожек (1 и 2) соответствуют номерам фракций на профиле хроматографического разделения (Фиг.4).
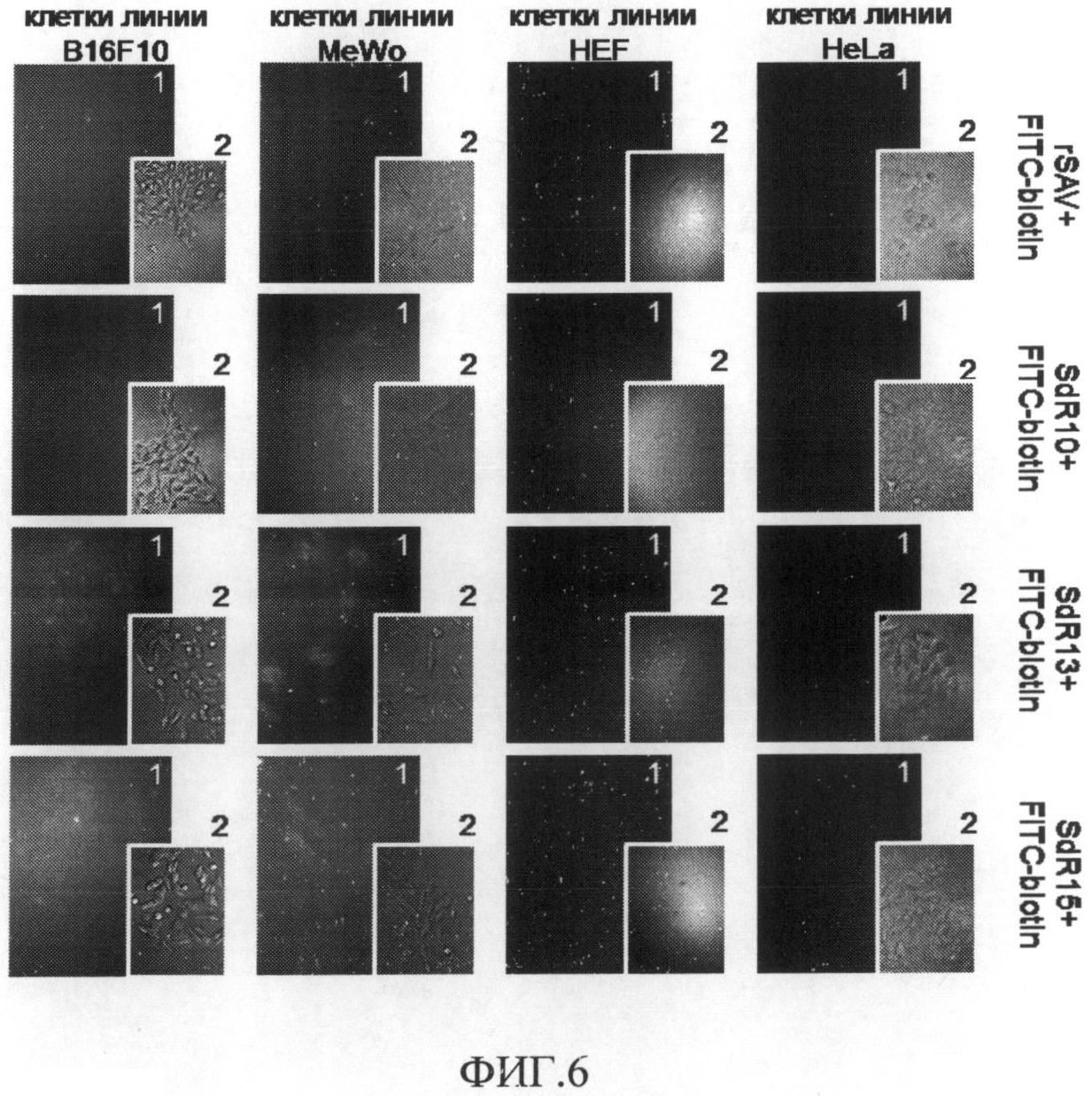
На фиг.6 представлено изображение клеток меланомных и немеланомных линий человека и мыши после взаимодействия с FITC-мечеными белками SdR10, SdR13, SdR15 и rSAV. Снимки выполнены: 1 - при облучении образца возбуждающим светом с длиной волны 495 нм; 2 - в проходящем свете.
Сравнивая изображения, соответствующие контрольным (HeLa, HEF1698) и опытным экспериментальным (MeWo, B16F10) точкам, можно сделать вывод о том, что исследуемые слитые белки действительно связываются с клетками меланомных линий человека (MeWo) и мыши (B16F10), но не связываются с клетками немеланомных линий как первичной (HEF1698), так и трансформированной (HeLa). Это указывает на селективность полученных белков по отношению к клеткам меланомы. Следует отметить отсутствие связывания с клетками стрептавидина, не несущего RGD-содержащий олигопептид, а также свободного FITC-биотина. Следовательно, можно сделать вывод о том, что за связывание меченых флуоресцеином слитых белков с рецепторами на поверхности клеток меланомы отвечает RGD-содержащий олигопептид, входящий в состав слитого белка.
На фиг.7 представлено электрофоретическое разделение в 12% ПААГ в денатурирующих условиях продуктов расщепления слитых белков SdR10, SdR13 и SdR15 легкой цепью бычьей энтеропептидазы. Дорожка 1 - rSAV; дорожки 2, 4, 7 - нерасщепленные белки SdR10, SdR13 и SdR15, соответственно; дорожки 3, 5, 6, 8 - расщепленные белки SdR10, SdR13, SdR13 (реакция с двукратным количеством энтеропептидазы) и SdR15, соответственно. М - белки-маркеры.
Относительная молекулярная масса расщепленных белков (отмечены пустой стрелкой) соответствует относительной молекулярной массе рекомбинантного стрептавидина (дорожка 7) и составляет 18 кДа, в то время как относительная молекулярная масса нерасщепленных белков SdR10, SdR13 и SdR15 составляет 20 кДа (дорожки 1, 3, 5, соответственно). Это свидетельствует в пользу того, что в результате взаимодействия химерных белков SdR с энтеропептидазой происходит отщепление фрагмента с относительной молекулярной массой 2 кДа, что соответствует рассчитанной молекулярной массе RGD-содержащего олигопептида.
Визуальная оценка соотношения количества расщепленного и нерасщепленного белка (пустая и закрашенная стрелки, соответственно) позволяет сделать вывод о том, что эффективность расщепления белков SdR10 и SdR15 составляет не менее 90%, а белка SdR13 - около 50% (причем, увеличение количества фермента в 2 раза не приводит к заметному изменению соотношения количества расщепленного и не расщепленного белка (дорожка 6)).
Для получения белков SdR10, SdR13, SdR15 и rSAV, меченых флуоресцеином, к раствору белка в 1 мМ Tris-HCl-буфере (рН 8.0) добавляли FITC, коньюгированный с биотином (FITC-биотин), растворенный в DMSO, используя молярное соотношение SdR:FITC-биотин (rSAV:FITC-биотин), равное 1:5, и инкубировали в течение 30 минут при комнатной температуре в темноте.
Заявляемая группа изобретений поясняется примерами конкретного выполнения с подробным описанием перечисленных выше этапов.
Пример 1 (описание этапа 1, 2). Конструирование генов SR10, SR13, SR15, SdR10, SdR13, SdR15 и создание плазмид pSR10, pSR13, pSR15, pSdR10, pSdR13, pSdR15.
Для получения слитых генов необходимо получение гена стрептавидина (SAV) и генов RGD-содержащих олигопептидов (RGD10, RGD13, RGD15, D4KRGD10, D4KRGD13, D4KRGD15). Ниже приведены нуклеотидные последовательности кодирующих цепей ДНК:
- гена RGD10:
GCGGGTGCAGATGGCGCACGTTATTGCCGTGGTGATTGCTTCGATGGTTGA
- гена RGD13:
GCGGGTGCACTGAGCGGCTGCCGTGGTGATTGCTTCCAGCAGTGA
- гена RGD15:
GCGGGTGCAGATGGCTTCCCAGGTTGCCGTGGTGATTGCAGTCAGGAATGA
- гена D4KRGD10:
GATGATGATGATAAAGATGGCGCAC-GTTATTGCCGTGGTGATTGCTTCGATGGTTGA
- гена D4KRGD13:
GATGATGATGATAAACTGAGCGGCTGCCGTGGTGATTGCTTCCAGCAGTGA
- гена D4KRGD15:
GATGATGATGATAAAGATGGCTTCCCAGGTTGCCGTGGTGATTGCAGTCAG-GAATGA
Гены RGD-содержащих олигопептидов получали путем отжига и PCR-достройки следующих пар синтетических олигонуклеотидов:
1) RGD10F (5'-GCGATCTAGAGCGGGTGCAGATGGCGCACGTTATTGCCGTGGTGATTG-3') и RGD10R (5'-TGACAAGCTTTCAACCATCGAAGCAATCACCACGGCAATAACGTGCG-3') для получения гена RGD10;
2) RGD13F (5'-GCGATCTAGAGCGGGTGCACTGAGCGGCTGCCGTGGTGATTG-3') и RGD13R (5'-TGACAAGCTTTCACTGCTGGAAGCAATCACCACGGCAGCCG-3') для получения гена RGD13;
3) RGD15F (5'-GCGATCTAGAGCGGGTGCAGATGGCTTCCCAGGTTGCCGTGGTG-3') и RGD15R (5'-TGACAAGCTTTCATTCCTGACTGCAATCACCACGGCAACCTGGGAAG-3') для получения гена RGD15;
4) RGd4k10 (5'-GCGATCTAGAGATGATGATGATAAAGATGGCGCACGTTATTGCC-3') и RGD10R (5'-TGACAAGCTTTCAACCATCGAAGCAATCACCACGGCAATAACGTGCG-3') для получения гена D4KRGD10;
5) RGd4k13F (5'-GCGATCTAGAGATGATGATGATAAACTGAGCGGCTGCCGTGG-3') и RGD13R (5'-TGACAAGCTTTCACTGCTGGAAGCAATCACCACGGCAGCCG-3') для получения гена D4KRGD13;
6) RGd4k15F (5'-GCGATCTAGAGATGATGATGATAAAGATGGCTTCCCAGGTTGCCG-3') и RGD15R (5'-TGACAAGCTTTCATTCCTGACTGCAATCACCACGGCAACCTGGGAAG-3') для получения гена D4KRGD15.
Реакционная смесь имела следующий состав: 10× буфер для ПЦР (конечная концентрация в смеси: 75 мМ Tris-HCl (рН 8.8 at 25°С), 20 мМ (NH4)2SO4, 0.01% (v/v) Tween 20) - 2 мкл, 25 mM MgCl2 (конечная концентрация - 3 мМ) - 3 мкл, 1.25 мМ dNTP (конечная концентрация - 0.125 мМ) - 2 мкл, праймеры - по 10 pmol на реакцию каждого, Taq-полимераза - 5 ед. акт. на реакцию, mQ Н2О - до 20 мкл. Амплификация включала: предварительную денатурацию при 94°С в течение 2 мин, 5 циклов (денатурация 94°С - 10 сек, отжиг праймеров 65°С - 10 сек, элонгация 72°С - 20 секунд), заключительная элонгация 72°С - 2 минуты. Последовательности нуклеотидов, полученные таким образом, содержали сайты расщепления эндонуклеазами рестрикции XbaI и HindIII для лигирования с вектором.
После проведения ПЦР полученные фрагменты ДНК осаждали 3,5 объемами 96% этанола с добавлением 1/10 по объему 3 М ацетата натрия (рН 5,0) в течение 30 минут на -70°С, после чего центрифугировали при 13400 об/мин в течение 10 минут, удаляли супернатант, осадок промывали 70% этанолом, затем центрифугировали еще 5 минут при 13400 об/мин и высушивали на вакуумной сушке.
Для получения слитых генов в составе вектора pUC18 под контролем промотора уридинфосфорилазы E.coli (Rudp) использовали вектор pLSAVdS(H), аналогичной плазмиде pflSAV19 [Гулько Л.Б., Дьяков Н.А., Окорокова Н.А., Вейко В.П., Дебабов В.Г. (1999) Биотехнология, 4, с.3-8]. Данный вектор содержит ген стрептавидина (последовательность, кодирующая стоп-кодон, отсутствует) под контролем промотора уридинфосфорилазы Е.coli (Rudp).
Затем проводили совместное расщепление вектора и фрагмента эндонуклеазами рестрикции XbaI и HindIII. Реакционная смесь рестрикции имела следующий состав: плазмида - 6 мкл (900 нг); фрагмент - 5 мкл (100 нг); 10× буфер Trango Yellow+ (Fermentas (Литва) (конечная концентрация в смеси: 33 мМ Tris-acetate, рН 7,9, 10 мМ Mg-acetate, 66 мМ K-acetate, 0,1 мг/мл BSA) - 2 мкл; рестриктаза XbaI - 1 мкл (10 ед. акт.); рестриктаза HindIII - 1 мкл (10 ед. акт.); mQ H2O - 5 мкл. Молярное соотношение вектор : фрагмент в смеси составило 1:5. Рестрикцию проводили при 37°С в течение 1 часа.
После проведения расщепления ДНК осаждали 3,5 объемами 96% этанола в присутствии 0,3 М ацетата натрия (рН 5,0) в течение 30 минут при -70°С, после чего центрифугировали при 13400 об/мин в течение 10 минут, удаляли супернатант, промывали осадок 70% этанолом и высушивали.
Полученную смесь расщепленных гена и плазмиды лигировали в течение 1 часа при 22°С. Реакционная смесь лигирования имела следующий состав: 10× буфер для лигирования (Fermentas (Литва); конечная концентрация в смеси: 40 мМ Tris-HCl, 10 мМ MgCl2, 10 мМ DTT, 2,5 мМ ATP (рН 7.8 при 25°C)) - 2 мкл, расщепленные по сайтам XbaI и HindIII вектор pLSAVdS(H) и ген RGD10 (или RGD13, или RGD15, или D4KGD10, или D4KRGD13, или D4KRGD15) в молярном соотношении 1:5 - 15 мкл, Т4-лигаза - 2 мкл (10 ед.акт.), mQ H2O - 1 мкл. После проведения лигирования ДНК в составе лигазной смеси осаждали 3,5 объемами 96% этанола в присутствии 0,3 М ацетата натрия (рН 5,0) в течение 30 минут при -70°С, после чего центрифугировали при 13400 об/мин в течение 10 минут, удаляли супернатант, осадок промывали 70% этанолом, осаждали центрифугированием и высушивали.
Далее лигазной смесь трансформировали компетентные клетки штамма E.coli JM110 и рассевали на чашке Петри с агаризованной средой LB, содержащей 100-150 мг/л ампициллина. Переосажденную лигазную смесь добавляли к компетентным клеткам. Количество ДНК, использовавшейся для трансформации, составляло около 300 нг в пересчете на плазмидную ДНК), 40 минут инкубировали на ледяной бане, далее 2 минуты при 42°С, потом добавляли по 1 мл среды LB, 1 час инкубировали при 32-37°С и рассевали клетки по чашке. Чашки инкубировали при 32-37°С в течение ночи.
Скрининг выросших клонов осуществляли с помощью ПЦР с использованием праймеров M13F (5'-TAACTAGTACGCAAGTTCACG-3') и Seq2SAV (5'-AGACCGCTTCTGCGTTCTG-3'). Реакционная смесь имела следующий состав: 10× буфер для ПЦР (конечная концентрация в смеси: 75 мМ Tris-HCl (рН 8.8 при 25°С), 20 мМ (NH4)2SO4, 0.01% (v/v) Tween 20) - 2 мкл, 25 мМ MgCl2 (конечная концентрация - 3 мМ) - 2,4 мкл, 1.25 мМ dNTP (конечная концентрация - 0.125 мМ) - 2 мкл, праймеры - по 5 pmol на реакцию каждого, клетки с колонии, суспендированные в - мкл стерильной воды, - 1 мкл на реакцию, Taq-полимераза - 5 ед. акт. на реакцию, mQ Н2О - до 20 мкл. Амплификация включала: предварительную денатурацию при 94°С в течение 2 мин, 25 циклов (денатурация 94°С - 10 сек, отжиг праймеров 60°С - 10 сек, элонгация 72°С - 10 секунд), заключительная элонгация 72°С - 2 минуты.
После проведения ПЦР реакционную смесь подвергали электрофоретическому разделению в 3% агарозном геле, содержащем этидий бромид. Наличие слитого гена в ДНК бактериальных клеток идентифицировали по наличию светящихся продуктов ПЦР-амплификации требуемого размера (около 150 п.о.).
Колонии, продемонстрировавшие положительный ответ при ПЦР-скрининге, высевали в жидкую среду LB, содержащую 100-150 мг/л ампициллина, и культивировали при 32-37°С в течение ночи при покачивании.
На следующий день клетки осаждали центрифугированием (3-5 минут при 4500-6000 об/мин), и выделяли плазмидные ДНК при помощи набора GeneJET™ Plasmid Miniprep Kit (Fermentas, Литва).
Схематическое изображение плазмид pSR и pSdR представлены на фиг.1 и 2, соответственно.
Пример 2 (описание этапа 3). Получение штаммов E.coli MG1655/pSR10, MG1655/pSR13, MG1655/pSR15, MG1655/pSdR10, MG1655/pSdR13, MG1655/pSdR15 - продуцентов рекомбинантных слитых белков SR10, SR13, SR15, SdR10, SdR13, SdR15, соответственно.
Полученные на предыдущем этапе плазмиды pSR10, pSR13, pSR15, pSdR10, pSdR13, pSdR15 секвенировали на участках, содержащих ген RGD10, RGD13, RGD15, D4KRGD10, D4KRGD13, D4KRGD15, соответственно. Реакцию секвенирования проводили на амплификаторе Eppendorf (Германия) по следующей программе: предварительная денатурация 94°С - 2 мин, 25 циклов (денатурация 94°С - 10 сек, отжиг праймеров 60°С - 10 сек, элонгация 72°С - 20 секунд), заключительная элонгация 72°С - 5 минут. Секвенирование проводили с помощью следующих праймеров: Seq2SAV и M13F. Реакционная смесь имела следующий состав: 10× буфер для секвенирования - 1 мкл, праймер - по 10 pmol на реакцию, плазмида - 200 нг на реакцию, радиоактивная метка (α32P-dATP, активность 250 mkKu) - 1 мкл, дидезоксирибонуклеозидтрифосфаты-терминаторы - 2 мкл (свой в каждую реакцию), Taq-полимераза - 1 мкл (10 ед. акт.), mQ Н2О - до 8 мкл. Остановка реакции осуществлялась добавлением реагента StopSolution. Далее продукты реакции секвенирования прогревали до 95°С и наносили на 5% полиакриламидный гель с мочевиной. Электорофорез проводили в течение 2-3 часов. После этого гель вымачивали 20 минут в 10% уксусной кислоте, переносили на лист 3 мм ватмана и высушивали на гель-драйере. Далее гель закладывали в кассету с рентгеновской пленкой и оставляли на ночь в полной темноте. На следующий день пленку проявляли, последовательность нуклеотидов читали вручную, оценку проводили в программе VectorNTI 8.0 (Invitrogen, США). Плазмидой с выверенной нуклеотидной последовательностью трансформировали штамм E.coli MG1655. Трансформацию проводили химическим методом: плазмиду в количестве 20 нг добавляли в компетентные клетки, смесь 40 минут инкубировали сначала на ледяной бане, затем 2 минуты при 42°С, потом добавляли по 1 мл среды LB, 1 час инкубировали при 32-37°С и рассевали клетки на чашке Петри со средой LB с агаром, содержащей 100-150 мг/л ампициллина. Чашки инкубировали при 37°С в течение ночи.
В результате вышеописанных процедур получали штаммы E.coli MG1655 MG1655/pSR10, MG1655/pSR13, MG1655/pSR15, MG1655/pSdR10, MG1655/pSdR13, MG1655/pSdR15 - продуценты гибридных белков SR10, SR13, SR15, SdR10, SdR13, SdR15, соответственно.
Пример 3 (описание этапов 4-7). Культивирование штаммов E.coli MG1655/pSR10, MG1655/pSR13, MG1655/pSR15, MG1655/pSdR10, MG1655/pSdR13, MG1655/pSdR15 и получение периплазматической фракции, содержащей белок SR10, SR13, SR15, SdR10, SdR13, или SdR15, соответственно.
Для препаративной наработки рекомбинантных белков плазмидосодержащие клетки выращивали на агаризованной среде LB с ампициллином (100-150 мг/л) при 32-37°С в течение 12-16 часов. Выросшими клетками инокулировали 100-200 мл среды LB (150 мг/л ампициллина) в качалочных колбах на 500 мл. Клетки культивировали при 32-37°С в течение 12-14 часов при интенсивном (250 об/мин) перемешивании на качалке. Клетки осаждали центрифугированием на 5000 об/мин при температуре 4°С в течение 10 минут. Полученную биомассу ресуспендировали в буферном растворе (объем буферного раствора составлял 1/20 - 1/10 от объема культуры), содержащем 20% сахарозы, 1 мг/мл лизоцима, 10 мМ EDTA, 25 мМ Tris (pH 8.0), и инкубировали в течение 20-30 минут при помешивании при +4°С. Полученную суспензию центрифугировали в течение 20 минут на 12500 об/мин при +4°С и отбирали супернатант, представляющий собой суммарную фракцию периплазматических белков E.coli (см. фиг.3) [Sambrook J., Fritsch E.F., Maniatis T. (1989) Cold Spring Harbor Laboratory Press.].
Затем к раствору белков периплазматической фракции добавляли буфер для нанесения на колонку, содержащий 50 мМ NaHCO3, 500 мМ NaCl, pH 10.8, получая, таким образом, Раствор 1, содержащий 13% сахарозы, 0,65 мг/мл лизоцима, 6,5 мМ EDTA, 13 мМ Tris-HCl, 17 мМ NaHCO3, 170 мМ NaCl, и переходили к стадии хроматографической очистки.
Колонку с 2-иминобиотин агарозой (объем 1 см × 4,5 см) предварительно промывали буфером для нанесения на колонку, содержащим 50 мМ NaHCO3, 500 мМ NaCl, pH 10.8, после чего осуществляли нанесение Раствора 1 на колонку. Скорость нанесения - 1 мл/мин. После прохождения образца колонку промывали 30 мл Раствора 2 (500 мМ NaCl). Элюцию исследуемых веществ осуществляли при помощи Раствора 3 (50 мМ CH3COONa, pH 4,0). [Hofmarm К., Wood S.W., Brinton C.C, Montibeller J.A., Finn M. (1980) Proc. Natl. Acad. Sci., 77, 4666-4668] (см. фиг.4 и 5)
После проведения хроматографии целевые рекомбинантные белки SR10, SR13, SR15, SdR10, SdR13 или SdR15 в подвергали ультрафильтрации через мембрану YM-30 (Amicon, США), позволяющую фильтровать белки размером свыше 25 кДа, для концентрирования и перевода в Раствор 4 (1 мМ Tris-HCl, pH 7.0).
В результате вышеописанных процедур получали очищенные препараты рекомбинантных белков SR10, SR13, SR15, SdR10, SdR13 и SdR15. Гомогенность рекомбинантных белков подтверждают электрофорезом в денатурирующем полиакриламидном геле.
Пример 4. Селективное связывание полученных слитых белков SdR10, SdR13, SdR15 с клетками меланомы человека и мыши.
Клетки линий MeWo и B16F10, а также клетки двух контрольных линий (HEF1698 и HeLa) высевали на 6-луночные культуральные планшеты и выращивали в течение 13-15 часов. К моменту постановки эксперимента клетки занимали приблизительно 50% площади лунки.
Исследуемые белки SdR10, SdR13 и SdR15 и контрольный белок rSAV растворяли в PBS и стерилизовали фильтрацией через мембрану с диаметром пор 0,22 мкм. Все полученные белки «метили» флуоресцеином. Для этого к раствору каждого белка добавляли раствор FITC-биотина, используя молярное соотношение белок : FITC-биотин, равное 1:5
Из лунок культуральных планшетов удаляли среду, промывали клетки 3 раза однократным PBS, после чего в лунки вносили по 2 мл DMEM без сыворотки и по 50 мкл раствора исследуемых белков, меченых флуоресцеином, в концентраци 1,25 мкМ для SdR13 и SdR15 и 12,5 мкМ для SdR10 (концентрации даны для клеток линии MeWo, для связывания с клетками B16F10, минимальная концентрация белков в растворе составляла 12,5 мкМ). Планшеты инкубировали в течение 1 часа при 37°С в атмосфере 5% CO2. Для удаления несвязавшихся белков лунки промывали 3 раза однократным PBS, после чего вносили по 3 мл DMEM без сыворотки и незамедлительно анализировали полученные препараты с использованием флуоресцентного микроскопа Leica DMI6000 (Германия), оснащенного модулем для прижизненной съемки (37°С, 5% CO2).
Результаты эксперимента по оценке селективности связывания слитых белков SdR10, SdR13 и SdR15 с клетками меланомных и немеланомных линий человека и мыши представлены на фиг.6. Сравнивая изображения, соответствующие контрольным (линии HeLa и HEF1698) и опытным (линии MeWo и B16F10) экспериментальным точкам, можно сделать вывод о том, что исследуемые слитые белки действительно связываются с клетками меланомных линий человека (MeWo) и мыши (B16F10), но не связываются с клетками немеланомных линий как первичной (HEF1698), так и трансформированной (HeLa). Это указывает на селективность полученных белков по отношению к клеткам меланомы. Следует отметить отсутствие связывания с клетками стрептавидина, не несущего RGD-содержащего олигопептида, а также свободного FITC-биотина, т.к. за связывание меченых флуоресцеином слитых белков с рецепторами на поверхности клеток меланомы отвечает RGD-содержащий олигопептид, располагающийся на С-конце слитого белка.
Пример 5. Получение из слитых белков коротких олигопептидов R10, R13 и R15. (описание этапа 8).
Реакцию расщепления слитых белков при помощи энтеропептидазы быка (Sigma-Aldrich, США) проводили при +20-25°С в течение 12-16 часов в 1 мМ Tris-HCl-буфере, рН 8.0. Для расщепления 1 мг белка использовали 0,34 ед. энтеропептидазы.
Электрофореграмма продуктов расщепления в сравнении с нерасщепленными образцами представлена на фиг.7.
Визуальная оценка соотношения количества расщепленного и нерасщепленного белка (пустая и закрашенная стрелки, соответственно) позволяет сделать вывод о том, что эффективность расщепления белков SdR10 и SdR15 составляет не менее 90%, а белка SdR13 - около 50% (причем, увеличение количества фермента в 2 раза не приводит к заметному изменению соотношения количества расщепленного и не расщепленного белка (дорожка 6)). Данная эффективность расщепления (50-90%) позволяет получать короткие RGD-содержащие олигопептиды в препаративных количествах.
Для очистки отщепленных коротких RGD-содержащих олигопептидов проводят двухэтапную хроматографическую очистку: на первом этапе отщепленный стрептавидин и нерасщепленные белки удаляют из раствора при помощи аффинной хроматографии на 2-иминобиотинагарозе, собирая фракцию несвязавшихся с сорбентом белков, с последующим концентрированием раствора; на втором этапе осуществляют очистку олигопептидов при помощи HPLC [Beat Steiner S, Denis Cousot, Arnold Trzeciak, Dieter Gillessen, and Paul Hadvary. Ca2+-dependent Binding of a Synthetic Arg-Gly-Asp (RGD) Peptide to a Single Site on the Purified Platelet Glycoprotein IIb-IIIa Complex. The Journal of Biological Chemistry. Vol.264, No.22, p.13102-13108, 1989].
Таким образом, по итогам проведенных исследований обнаружено, что заявляемые рекомбинантные слитые белки способны к селективному узнаванию меланомных клеток (благодаря наличию RGD-содержащего олигопептида) и обладают потенциалом для прикрепления визуализирующего/токсического агента (за счет входящего в его состав стрептавидина). Данные белки могут быть использованы для получения противомеланомных препаратов и диагностических средств.
Представленные плазмиды, в состав которых входят гены таких белков, и штаммы-продуценты, содержащие данные плазмиды, позволяют получать вышеописанные белки биотехнологически.
Представленный способ позволяет получать RGD-содержащие олигопептиды путем расщепления слитых белков SdR10, SdR13, SdR15 при помощи легкой цепи энтеропептидазы быка. Отщепленные олигопептиды могут быть очищены хроматографически и использоваться для создания диагностических тест-систем. Такие системы, позволяющие отбирать меланомные клетки, обладающие высоким метастатическим потенциалом, могут быть использованы для определения стадии заболевания, идентификации вторичных опухолей меланомного происхождения, а также обнаружения метастаз и микрометастаз меланомы.
Перечень последовательностей
SEQ NO 1 - Met-Arg-Lys-Ile-Val-Val-Ala-Ala-Ile-Ala-Val-Ser-Leu-Thr-Thr-Val-Ser-Ile-Thr-Ala-Ser-Ala-Ser-Ala-Asp-Pro-Ser-Lys-Asp-Ser-Lys-Ala-Gln-Val-Ser-Ala-Ala-Glu-Ala-Gly-Ile-Thr-Gly-Thr-Trp-Tyr-Asn-Gln-Leu-Gly-Ser-Thr-Ile-Ile-Val-Thr-Ala-Gly-Ala-Asp-Gly-Ala-Leu-Thr-Gly-Thr-Tyr-Glu-Ser-Ala-Val-Gly-Asn-Ala-Glu-Ser-Arg-Tyr-Val-Leu-Thr-Gly-Arg-Tyr-Asp-Ser-Ala-Pro-Ala-Thr-Asp-Gly-Ser-Gly-Thr-Ala-Leu-Gly-Trp-Thr-Val-Ala-Trp-Lys-Asn-Asn-Tyr-Arg-Asn-Ala-His-Ser-Ala-Thr-Thr-Trp-Ser-Gly-Gln-Tyr-Val-Gly-Gly-Ala-Glu-Ala-Arg-Ile-Asn-Thr-Gln-Trp-Leu-Leu-Thr-Ser-Gly-Thr-Thr-Glu-Ala-Asn-Ala-Trp-Lys-Ser-Thr-Leu-Val-Gly-His-Asp-Thr-Phe-Thr-Lys-Val-Lys-Pro-Ser-Ala-Ala-Ser-Ile-Asp-Ala-Ala-Lys-Lys-Ala-Gly-Val-Asn-Asn-Gly-Asn-Pro-Leu-Asp-Ala-Val-Gln-Gln
SEQ NO 2 - Ser-Arg-Asp-Asp-Asp-Asp-Lys
SEQ NO 3 - Ser-Arg-Ala-Gly-Ala
SEQ NO 4 - Asp-Gly-Ala-Arg-Tyr-Cys-Arg-Gly-Asp-Cys-Phe-Asp-Gly
SEQ NO 5 - Leu-Ser-Gly-Cys-Arg-Gly-Asp-Cys-Phe-Glu-Glu
SEQ NO 6 - Asp-Gly-Phe-Pro-Gly-Cys-Arg-Gly-Asp-Cys-Ser-Gln-Glu