Результат интеллектуальной деятельности: СПОСОБ МОЛЕКУЛЯРНОЙ ДИАГНОСТИКИ ГЕНЕТИЧЕСКОГО РИСКА РАЗВИТИЯ ОСЛОЖНЕНИЙ УРОГЕНИТАЛЬНОЙ ХЛАМИДИЙНОЙ ИНФЕКЦИИ, ПРИВОДЯЩИХ К НАРУШЕНИЮ РЕПРОДУКТИВНОЙ ФУНКЦИИ, У ЧЕЛОВЕКА
Вид РИД
Изобретение
Область техники настоящего изобретения
Настоящее изобретение относится к области медицины и представляет собой способ молекулярной диагностики индивидуального генетического риска развития осложнений урогенитальной хламидийной инфекции (УГХИ), приводящих к развитию нарушений репродуктивной функции у человека. Изобретение может быть использовано для персонализации тактики ведения пациентов с УГХИ.
Предшествующий уровень техники настоящего изобретения
Урогенитальный хламидиоз является широко распространенной инфекцией, передаваемой половым путем (ИППП). В мире ежегодно наблюдается более 90 млн. новых случаев инфицирования С.trachomatis, из них 4 миллиона приходится на США и около 5,5 миллионов на Европу [Moss T.R. Human genital infections with С.trachomatis / Moss T.R., Darougar R. 2001].
На территории России урогенитальная хламидийная инфекция подлежит обязательной регистрации, начиная с 1994 года. В течение последних десятилетий в Российской Федерации заболеваемость урогенитальной хламидийной инфекцией вышла на первое место среди всех бактериальных инфекций, передаваемых половым путем [Анализ эпидемиологической ситуации по ВИЧ-инфекции и сопутствующим заболеваниям (туберкулез, ИППП, гепатиты): Минздравсоцразвития. 2007] и составила в 2011 году 65,9 случаев на 100 000 населения. На сегодняшний день в России урогенитальный хламидиоз - вторая по распространенности регистрируемая ИППП после трихомоноза.
В группе риска инфицирования хламидийной инфекцией оказываются в основном молодые люди. Согласно современным исследованиям, распространенность заболевания в популяционной группе 18-25 лет на 60% выше в сравнении с другими возрастными группами [Kohl K.S. Developments in the screening for Chlamydia trachomatis: a review / Kohl KS, Markowitz LE, Koumans EH. Obstet Gynecol Clin North Am. 2003; 30(4):637-58.].
С клинической точки зрения, УГХИ подразделяется на неосложненную (в случае развития уретрита у мужчин и уретрита и/или цервицита у женщин) и осложненную (когда диагностируют воспалительные заболевания органов малого таза у женщин и эпидидимоорхит и простатит у мужчин). По данным разных авторов, осложнения в результате инфицирования С.trachomatis могут наблюдаться в 30-50% случаев как у мужчин, так и у женщин.
Заболевание нередко характеризуется малосимптомным и бессимптомным течением. Бессимптомное течение заболевания у мужчин встречается в 40-50% случаев, у женщин - в 70-80%. Согласно результатам современных исследований, урогенитальная хламидийная инфекция выявляется у 29-32% женщин, не имеющих патологических выделений из цервикального канала, у 80-84% - со слизисто-гнойными выделениями, у 79-87% - с наличием гипертрофической эрозии шейки матки [Анри-Сюше Ж. Хламидиозы в гинекологии // Актуальные микробиологические и клинические проблемы хламидийных инфекций. - М., 1990. - С.16-30; Kleimann D., Sarov I., Insler V. The effects of contraceptive hormones on the replication of Clamydia trachomatis in human endometrial cells // Contraception. - 1987.- Vol.35, №6. - P. 533-542.; Ripa K.T. Biological principles of the culture of Clamydia trachomatisin cells monolayers // Acta pathol., microb., immunol. Scand. - 1982. - Suppl. 32. - P. 4-8].
Малосимптомное и бессимптомное течение заболевания, отсутствие своевременного и адекватного лечения может приводить к позднему обращению пациентов к врачу и развитию серьезных осложнений со стороны репродуктивной системы: у женщин - к воспалительным заболеваниям органов малого таза (ВЗОМТ) и, как следствие, к развитию эктопической беременности, трубному бесплодию.
ВЗОМТ представляют собой различные комбинации нозологических форм, характеризующих поражения верхних отделов репродуктивной системы женщин. ВЗОМТ широко распространены во всем мире и наносят обществу значительный экономический и демографический урон. Munday P.E. (1997), Paavonen J. (1996) [Paavonen J. Immunopathogenesis of pelvic inflamantory disease and infertility - what do we know and what shal we do? / J. Paavonen // J. Br. Fert. - 1996. - Soc. - 1. - P. 42-45; Munday PE. Clinical aspects of pelvic inflammatory disease. / PE Munday // Hum Reprod. - 1997. - Nov; 12(11 Suppl):121-6. Review] указывают, что до 60% случаев ВЗОМТ вызваны возбудителями ИППП. Основное значение в инициировании ВЗОМТ имеют хламидийная и гонококковая инфекции, возбудители которых поражают слизистую оболочку цервикального канала, что приводит к снижению ее барьерной функции и возникновению восходящего процесса верхних отделов половой системы.
С.trachomatis является часто выявляемым инфекционным агентом из нижних и верхних отделов полового тракта женщин с хроническими ВЗОМТ (11,1% - 54,0%), у больных с хроническими гнойными ВЗОМТ также установлена высокая инфицированность данными микроорганизмами (до 40% наблюдений) [Канищева Е.Ю. Воспалительные заболевания органов малого таза у женщин и их связь с инфекциями, передаваемыми половым путем. Диагностика, лечение. / Вест, дерматологии и венерологии 2002, 4, 16-23]. Каждый год в Европе эпидемиологи регистрируют около миллиона случаев сальпингитов, из них большая часть, около 600 тыс., хламидийной этиологии. Примерно, в 120 тыс. случаев инфекция заканчивается так называемым механическим бесплодием. При этом каждый новый эпизод обусловленного хламидиями воспаления увеличивает вероятность развития вторичного бесплодия в несколько раз [Domeika М., Mardh P.A. ABC on Chlamydia. Syva a Syntex Company, Berkshire, 1993.].
В патогенезе бесплодия при воспалительных заболеваниях придатков матки ведущую роль играют функциональные нарушения кинетики и обструкция маточных труб. Обструкция маточных труб возникает в результате рубцовых склеротических изменений при разрушении инфекцией трубного эпителия. После однократного эпизода сальпингита обструкция маточных труб выявлена у 11-13% больных, двукратного - у 23-36%, троекратного и более - у 54-75%) пациенток [Эль-Рифаи Набиль Рифаи. Трубное бесплодие: диагностика и методы хирургического лечения. Автореф. дис. … канд. мед. наук. М., 1986].
У мужчин урогенитальная хламидийная инфекция может приводить к развитию орхитов, эпидидимитов, простатитов [Гомберг М.А., Ковалык В.П., 2002; Сафина О.Н., 2003; Валиева С.А. и др., 2005; Mardh P.A. et al., 1978; Ostaszewska-Puchalska I. et al., 2004], что также служит фактором развития бесплодия, вызванного как повреждением мочеполовых путей, так и изменением качества спермы.
Расходы национальных систем здравоохранения на лечение последствий, вызываемых урогенитальной хламидийной инфекцией, в том числе нарушений репродуктивной функции, являются весьма существенными. Исследования экономической эффективности мероприятий по обследованию и лечению больных урогенитальной хламидийной инфекцией в развитых странах показали, что наилучшей стратегией в данном случае является ранняя диагностика и лечение неосложненной инфекции [Kamwendo F, Forslin L, Bodin L, Danielson D. Decreasing incidences of gonorrhea - and chlamydia-associated acute pelvic inflammatory disease: a 25-year study from an urban area of central Sweden. Sex Transmit Dis 1996; 23:384-91].
В основе повреждающего воздействия С.trachomatis на ткани организма лежит внутриклеточная репликация, воспалительные и иммунные реакции организма хозяина.
Урогенитальная хламидийная инфекция запускает специфические и неспецифические иммунологические реакции, в которых участвуют гуморальный и клеточный звенья иммунитета.
Установлено, что важную роль в регуляции воспалительных реакций, межклеточных взаимодействий играет система цитокинов, представленная множеством протеинов или гликопротеидов, вырабатываемых преимущественно активированными лимфоцитами и моноцитарно-макрофагальной системой, а также в меньшей мере фибробластами, эндотелиальными, соматическими клетками.
Считается, что цитокины оказывают влияние на работу не только иммунной системы, но и способны корректировать ключевые функции репродуктивной системы человека. Исследования показывают, что цитокины принимают участие в процессах регуляции выработки мужских и женских половых клеток, оплодотворения и эмбрионального развития [Ingman W.V., Jones R.L. Cytokine knockouts in reproduction: the use of gene ablation to dissect roles of cytokines in reproductive biology. / W.V. Ingman // Human reproduction update. - 2008. - vol. 24, No3, pp.179-192]. При урогенитальной хламидийной инфекции поражаются эпителиальные клетки урогенитального тракта, при разрушении которых происходит выброс молекул цитокинов (IL-1, IL-6, IL-8, фактора некроза опухолей, макрофагального колониестимулирующего фактора, и других), которые взаимодействуют с клетками иммунной системы, инициируя развитие воспалительной реакции различной степени интенсивности.
Различное клиническое течение урогенитального хламидиоза, в том числе сопровождающегося осложнениями и нарушением репродуктивной функции, может быть связано с генетически детерминированными факторами, зависящими от организма человека.
В современной научной литературе имеется большое количество публикаций, свидетельствующих о наличии ассоциаций между полиморфизмами в регуляторных областях генов, кодирующих про- и противовоспалительные цитокины, и предрасположенностью к развития заболеваний, к различному типу клинического течения заболевания и развитию осложнений клинического течения различных заболеваний [Öhman Н., Triitinen A., Halttunen М, et al. IL-10 polymorphism and cell-mediated immune response to Chlamydia trachomatis. / H. Öhman // Genes and Immunity. - 2006. - 7. - P. 243-249; Rasouli M, Kiany S. Association of interferon-gamma and interleukin-4 gene polymorphisms with susceptibility to brucellosis. / M. Rasouli // Cytokine. - 2007. - 38. - P. 49-53; Hvid, M., A. Baczynska, B. Deleuran, J. Fedder, H. Knudsen, G. Christiansen, and S. Birkelund. Interleukin-1 is the initiator of Fallopian tube destruction during Chlamydia trachomatis infection. Cell. Microbiol. 2007; Mamyrova G, Hanlon T.P., Sillers L. et al. Cytokine gene polymorphisms as risk and severity factors for juvenile dermatomyositis./ G. Mamyrova//Arthritis and Rheumatism 2008. - 58(12). - P. 3941-50; Öhman H., Triitinen A., Halttunen M., et al. Cytokine polymotphisms and severity of tubal damage in womaen with Chlamydia-associated infertility. / H. Öhman // The journal of infectious diseases. - 2009. - 199. - P. 1353-9; Kinnunen et al., 2002; Mei В., Luo Q., Du K. et al., Assotiation of MICA gene polymorphisms with Chlamydia trachomatis infection and related tubal pathology in infertile woman / Mei B.// Hum Reprog 2009. - 24912. - P. 3090-5].
Однако проблема прогнозирования клинического течения урогенитальной хламидийной инфекции, сопровождающегося осложнениями и развитием нарушений репродуктивной функции, в том числе бесплодия, на основании изучения полиморфизмов генов, кодирующих про- и противовоспалительные цитокины человека, на данный момент изучена недостаточно. Появление современных лабораторных методов, в частности, технологии секвенирования генов с целью выявления особенностей их индивидуальной молекулярной структуры, диктует необходимость поиска принципиально новых путей предотвращения развития заболевания и его осложнений. Так, прогнозирование течения заболевания на основании генетически детерминированных, индивидуальных особенностей иммунного ответа на агент, становится перспективным путем решения проблемы ранней диагностики и, как следствие, своевременного и адекватного лечения урогенитальной хламидийной инфекции. Определение предикторов развития осложнений заболевания является критерием для дополнительного обследования пациентов с целью ранней диагностики осложнений и назначения терапии в соответствии с установленным диагнозом.
Учитывая высокую социальную значимость развития осложнений урогенитального хламидиоза, приводящих к бесплодию, особую актуальность представляет персонализированный подход к ведению больных. Реализация персонализированного подхода осуществляется в разработке молекулярно-генетических методов, позволяющих прогнозировать характер клинического течения заболевания до назначения лечения, и корригировать назначаемую терапию в зависимости от результатов молекулярно-генетических исследований, что дает возможность своевременно назначать терапию по схемам лечения осложненных форм заболевания.
С целью определения предшествующего уровня техники настоящего изобретения был проведен патентный поиск.
Объектом патентного исследования являлись технологии молекулярной диагностики индивидуального генетического риска развития нарушений репродуктивной функции, ассоциированных с УГХИ у человека. Для обеспечения правовой охраны результатов исследования, определения их патентной чистоты и патентоспособности проведены патентные исследовании в соответствии с ГОСТ P 15011-96.
По результатам исследования сети патентной информации espacenet.com, созданной Европейским патентным ведомством, и базы данных патентной информации www.freepatentsonline.com и www.google.com/patents/ была установлена чистота патентного поля. Поиск производился по комбинациям названий изучаемой патологии, патогенного микроорганизма, ассоциированного с патологией, и группы молекулярных маркеров.
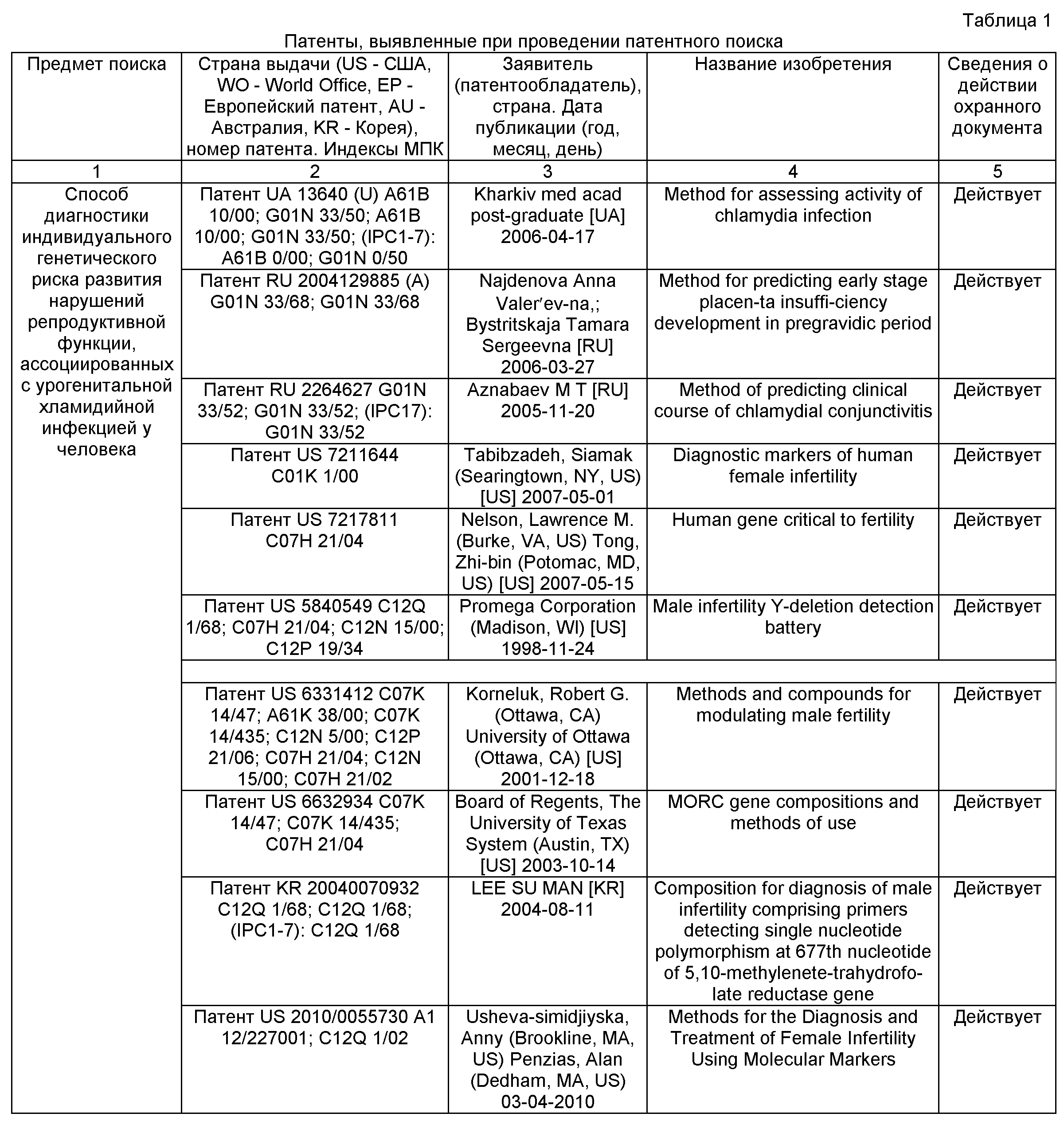
Поиск патентов в кратких аннотациях к документам по базе американских патентов www.freepatentsonline.com, проведенный по ключевому слову «chlamydia», показал только патенты, касающиеся диагностики хламидийной инфекции. Однако в патентной базе esp@cenet, охватывающей также патенты европейской части, при запросе с ключевым словом «chlamydia» было найдено три патента, полученных в России и на Украине, касающихся способов прогнозирования беременности у лиц, перенесших хламидийную инфекцию, прогнозирования течения хламидиоза, а также определения активности хламидии.
Поиск по ключевым словам «infertility» и «polymorphism» в базе www.freepatentsonline.com показал два патента, в которых были представлены гены, связанные с женской фертильностью, способы диагностики фертильности, связанные с определением их активности, а также методы контрацепции, основанные на использовании продуктов этих генов. Также было найдено два патента, касающихся способов диагностики делеций и полиморфизмов, ассоциированных с мужским бесплодием. Кроме того, был найден патент на метод модуляции мужской фертильности на основе белкового ингибитора апоптоза, а также патент на фрагменты ДНК, кодирующие белок, который отвечает за сперматогенез и способы диагностики и лечения мужского бесплодия, основанные на его использовании.
При осуществлении поиска по ключевым словам «chlamydia» и «polymorphism» по всему документу было найдено несколько патентов на белки-иммуномодуляторы, такие как TNF, ICE LAP-7 и иммуногенные комбинации препаратов, а также способы их получения и коммерческого применения.
Поиск по ключевым словам «infertility», «female» и «markers» выявил патент, касающийся диагностики фертильности у женщин, основанный на определении концентрации различных веществ в фолликулярной жидкости (широкий список веществ включает IL-6, IL-10, IFNγ, TNFα). Принципиальным отличием данного патента от предмета разработки настоящей темы НИР является методологический подход: в запатентованном методе проводятся количественные измерения конечных белковых продуктов, а не качественное выявление полиморфизмов генов, кодирующих обозначенные маркеры, ассоциированных с осложненным течением воспалительного заболевания.
Поиск по ключевым словам «infertility» и «polymorphism» в базе esp@cenet выявил один патент, непосредственно относящийся к рассматриваемой теме. Это патент на набор для диагностики полиморфизмов гена, связанного с мужским бесплодием.
Таким образом, патентный поиск показал, что на данный момент зарегистрированы патенты, касающиеся как прогнозирования риска развития нарушений репродуктивной функции при УГХИ, течения болезни и определения степени активности урогенитальной хламидийной инфекции, так и определения активности генов и полиморфизмов в последовательности генов, ассоциированных с бесплодием. Однако патента, непосредственно связанного с оценкой репродуктивного риска, ассоциированного с урогенитальной хламидийной инфекцией, на основе исследования полиморфизмов генов у человека обнаружено не было. Перечень выявленных патентов, относящихся к разрабатываемой теме, приведен в таблице 1.
Раскрытие настоящего изобретения
Задачей изобретения является разработка способа молекулярной диагностики индивидуального генетического риска развития осложнений УГХИ, приводящих к развитию нарушений репродуктивной функции у человека.
Технический результат изобретения заключается в возможности прогнозирования характера клинического течения УГХИ на основании определения молекулярных маркеров в крови больных, что позволяет осуществлять прогнозирование осложненного клинического течения УГХИ, которое приводит нарушениям репродуктивной функции, в том числе бесплодия, на основании определения гомозиготного СС генотипа гена цитокина IL6 человека (у женщин и мужчин) в положении - 174 и гетерозиготного генотипа GC гена TGFb1, в положении - 915 (у женщин) и определять индивидуальную тактику ведения пациентов с предполагаемым неосложненным и осложненным течением УГХИ.
Это достигается за счет того, что у пациентов УГХИ стандартным способом производят забор крови из локтевой вены и осуществляют:
- выделение ДНК;
-амплификацию фрагмента гена IL6 человека, включающего полиморфизм в позиции - 174 и гена TGFb1, включающего полиморфизм в позиции -915;
- детекцию и визуализацию продуктов амплификации фрагмента гена IL6 человека в позиции - 174 и гена TGFb1, в позиции - 915 (оценочный электрофорез);
- секвенирование фрагмента IL6 человека в позиции - 174 и фрагмента гена TGFb1 в позиции - 915;
- анализ полученных результатов, заканчивающийся определением генотипа фрагмента гена IL6 человека в позиции - 174 и фрагмента гена TGFb1 в позиции - 915.
СПОСОБ ОСУЩЕСТВЛЯЕТСЯ СЛЕДУЮЩИМ ОБРАЗОМ
У пациента до начала лечения стандартным способом производят забор крови из локтевой вены.
Выделение ДНК
Выделение ДНК осуществляется с использованием коммерческого набора реагентов Diatom™ DNA Prep 100.
Выделение ДНК проводится в боксе биологической безопасности во избежание загрязнения помещения и последующей контаминации инкубационной смеси чужеродной ДНК при постановке ПНР.
В состав набора реагентов Diatom™ DNA Prep 100 входит лизирующий реагент (Lysis reagent) с гуанидинтиоционатом, в присутствии которого ДНК активно сорбируется на сорбенте NucleoS (суспензия сорбента), затем отмывается от белков и солей спиртовым раствором.
В пробирку типа эппендорф объемом 1.5 мл к полученному лизату добавляется 400 мкл лизирующего реагента, содержимое пробирки перемешивается переворачиванием (5-10 раз). Интенсивное встряхивание смеси не рекомендуется. Далее пробирка со смесью термостатируется при 65°C в течение 1 часа. После термостатирования пробирка со смесью центрифугируется в течение 15 сек при 5000 g (≈12000 об/мин) в том случае, если смесь содержит несолюбилизированный клеточный дебрис или другой нерастворимый остаток. Прозрачный супернатант целиком переносится в чистую пробирку типа эппендорф объемом 1.5 мл, и к нему добавляется 20 мкл суспензии сорбента NucleoS. Перед использованием NucleoS интенсивно встряхивается на вортексе. Пробирка помещается на ротатор, перемешивается в течение 30-40 мин (10-20 об/мин), затем центрифугируется в течение 15 сек при 5000 g. Супернатант удаляется осторожно, не задевая осадок. К осадку добавляется 200 мкл лизирующего реагента, смесь тщательно перемешивается на вортексе до полного гомогенного состояния. Если суспендирование затруднено из-за сильного слипания сорбента, которое может быть обусловлено высоким содержанием ДНК, то сорбент необходимо вначале осторожно суспендировать пипетированием, а затем перемешать на вортексе. Затем в пробирку добавляется 1 мл рабочего раствора солевого буфера (Saline burrer) для отмывки ДНК. Содержимое пробирки перемешивается переворачиванием пробирки 5-10 раз и центрифугируется в течение 15 сек при 5000 g. Супернатант удаляется осторожно, не задевая осадок. К осадку добавляется 1 мл рабочего раствора солевого буфера, содержимое пробирки перемешивается на вортексе и центрифугируется в течение 15 сек при 5000 g. Супернатант удаляется осторожно, не задевая осадок. Процедура отмывки ДНК повторяется еще один раза. Осадок подсушивается при температуре 65°C в течение 4-5 мин. ДНК элюируется из сорбента путем добавления 50-100 мкл ЭкстраГена Е (Extragene Е) (100 мкл добавляется, если выделение проводится из цельной крови или другой пробы, содержащей большое количество ДНК). ЭкстраГен Е отбирается из пробирки при постоянном перемешивании. Далее содержимое пробирки суспендируется на вортексе в течение 5-10 сек до получения гомогенной суспензии, затем термостатируется при 65°C в течение 5-10 мин, еще раз суспендируется на вортексе и центрифугируется в течение 1 мин при 10000 g. Полученный раствор, содержащий ДНК, пригоден для дальнейшего использования. Однако через 2-3 дня рекомендуется центрифугировать данный раствор, содержащий сорбент, в течение 1 мин при 10000 g и перенести супернатант с ДНК в чистую пробирку типа эппендорф объемом 1.5 мл. ДНК хранится при температуре 4°C. При длительном хранении рекомендуется перенести пробирки с ДНК в температуру -20°C.
Амплификация ДНК фрагментов генов IL6 человека в позиции - 174 и гена TGFb1, в положении - 915
Для выделения ДНК гена IL6 человека в позиции - 174 и гена TGFb1, в позиции - 915 использованы праймеры, характеристика которых представлена в таблице 2.
|
Чтобы избежать контаминации, сбор амплификационной смеси проводится в стерильном ламинаре.
Амплификация осуществляется с использованием коммерческого набора регентов "Набор реагентов для проведения ПЦР" (фирма "Синтол", Россия).
Перед проведением реакции подготавливается нужное количество ПЦР пробирок типа эппендорф объемом 0.2 мл. Пробирки маркируются соответствующим образом: положительный (K+), отрицательный (K-) контроли и исследуемые пробы (указывается номер пробы).
Затем приготавливается амплификационная смесь, включающая следующие объемы компонентов в расчете на одну пробирку (Таблица 3).
|
После приготовления смесь компонентов перемешивается и центрифугируется на вортексе.
Затем в каждую пробирку типа эппендорф объемом 0.2 мл вносится по 20 мкл приготовленной амплификационной смеси и по 5 мкл исследуемого образца ДНК или отрицательного контроля. В качестве отрицательного контроля используется dH2O. Общий объем реакционной смеси составляет 25 мкл.
ПЦР проводится в амплификаторе Dyad. На первой стадии образцы подвергаются тепловой денатурации при 96°C в течение 10 минут. Затем следуют 35 циклов, состоящие из стадии денатурации ДНК - 96°C, 30 сек, отжига праймеров - 60°C, 30 сек и синтеза ДНК - 72°C, 60 сек. На последней стадии образцы подвергаются обработке при 72°C в течение 10 минут.
Детекция и визуализация продуктов амплификации ДНК фрагмента гена IL6 человека в позиции - 174 и гена TGFb1, в положении - 915 (оценочный электрофорез)
А) Приготовление 2%-ного агарозного геля. Приготовление геля проводится в соответствии с указаниями Маниатис с соавторами, 1984. Для приготовления 75 мл 2%-ного агарозного геля к 1.5 г агарозы добавляется 7.5 мл 10-кратного трисборатного буфера (10×TBE) и 67.5 мл дистиллированной воды. Приготовленная смесь прогревается в СВЧ-печи 5-7 мин (до полного растворения агарозы), затем в нее добавляется 8-10 мкл бромистого этидия (10 мг/мл) и перемешивается. Расплавленная агароза охлаждается до температуры 50-60°C и заливается в планшет для заливки геля. Для получения в агарозном геле карманов для нанесения образцов на планшет устанавливается одна или две гребенки. В некоторых случаях при установлении гребенок используются зажимы типа «бульдог» (в зависимости от модели камеры для горизонтального электрофореза). Раствор агарозы застывает за 15-30 мин при комнатной температуре.
Б) Разделение продуктов амплификации ДНК фрагмента гена IL6 в позиции - 174 человека и гена TGFb1, в положении - 915 методом горизонтального электрофореза
В камеру для горизонтального электрофореза помещается 1×TBE буфер, приготовленный разбавлением 10×TBE буфера дистиллированной водой.
После застывания агарозы гребенка/гребенки осторожно вынимается/ются из геля. Планшет с агарозным гелем переносится в камеру для проведения электрофореза. 1×TBE буфер должен покрывать агарозный гель на 5-7 мм.
Для электрофоретического анализа продуктов амплификации выбранных генов отбирается одинаковый объем (5 мкл) инкубационной смеси из каждой пробы, полученной в результате амплификации, смешивается с 1-2 мкл раствора, предназначенного для нанесения проб в агарозный гель (содержит бромфеноловый синий), и наносится в карманы геля. Для установления точного размера амплифицируемого продукта в один из карманов агарозного геля вносится маркер молекулярного веса ДНК в растворе, предназначенном для нанесения на гель (100 bp) GeneRuler.
Затем электрофоретическая камера подключается к источнику питания и задается напряжение, соответствующее напряженности электрического поля 10-15 В/см. Электрофоретическое разделение продуктов амплификации осуществляется в направлении от катода (-) к аноду (+).
Контроль над электрофоретическим разделением осуществляется визуально по движению полосы красителя. Полоса красителя должна пройти от старта 1.5-2 см или 6-8 см в зависимости от размера используемого агарозного геля.
В) Визуализация результатов электрофореза продуктов амплификации выбранного гена
После электрофореза агарозный гель фотографируется в трансиллюминаторе в коротковолновом УФ-свете (длина волны 254-310 нм) с выводом данных на экран монитора компьютера.
По полученным данным последовательно оцениваются четыре параметра:
1) отсутствие светящихся полосок в дорожке, в которую был нанесен амплифицированный отрицательный контроль;
2) прошла ли реакция амплификации (наличие/отсутствие светящихся полосок в дорожках агарозного геля, соответствующих положительному контролю и анализируемым образцам);
3) насколько специфично прошла реакция амплификации (наличие одной/нескольких светящихся полосок в дорожках агарозного геля, соответствующих положительному контролю и анализируемым образцам);
4) соответствует ли размер амплификационного продукта ожидаемому (если реакция амплификации прошла специфично, и в дорожках агарозного геля, соответствующих положительному контролю и анализируемым образцам, определяется одна светящаяся полоска, то сравнивается положение данной полоски на геле с положением маркера молекулярных весов ДНК).
Г) Выделение ДНК IL6 и TGFb1 человека из агарозного геля
Если все параметры оценены положительно, а именно в дорожке, в которую был нанесен амплифицированный отрицательный контроль, отсутствует светящаяся полоска, а в дорожках, соответствующих положительному контролю и анализируемым образцам, реакция прошла специфично, и размер амплифицированного продукта соответствует ожидаемому, то данные продукты агарозного электрофореза подходят для дальнейшего исследования.
Выделение ДНК из агарозного геля осуществляется с использованием коммерческого набора реагентов WizardR SV Gel and RCR Clean-Up System.
На первом этапе проводится растворение геля. Для этого выбранные бэнды (светящиеся полоски) вырезаются из агарозного геля, взвешиваются и помещаются в пробирку типа эппендорф объемом 1.5 мл. Затем в пробирку добавляется мембрансвязывающий раствор (Membrane Binding Solution) в соотношении 1 мкл раствора на 1 мг геля. Содержимое пробирки интенсивно перемешивается на вортексе и инкубируется при 50-65°C до полного растворения геля (данный процесс контролируется визуально). На втором этапе проводится связывание ДНК. Для этого колонка (SV Minicolumn) вставляется в пробирку для сбора материала (Collection Tube). Затем в колонку переносится растворенный агарозный гель. Содержимое колонки инкубируется при комнатной температуре в течение 1 мин и центрифугируется при 16000 g в течение 1 мин. Колонка вынимается из пробирки для сбора материала, содержимое данной пробирки сливается, и колонка вновь вставляется в пробирку для сбора материала. На третьем этапе проводится отмывка ДНК. Для этого в колонку добавляется 700 мкл мембранотмывающего раствора (Membrane Wash Solution) и центрифугируется при 16000 g в течение 1 мин. Колонка вынимается из пробирки для сбора материала, содержимое данной пробирки сливается, и колонка вновь вставляется в пробирку для сбора материала. Затем в колонку добавляется 500 мкл мембранотмывающего раствора и центрифугируется при 16000 g в течение 5 мин. Колонка вынимается из пробирки для сбора материала, содержимое данной пробирки сливается, и колонка вновь вставляется в пробирку для сбора материала. Колонка центрифугируется с открытой крышкой при 16000 g в течение 1 мин для полного удаления этанола, содержащегося в мембранотмывающем растворе. На последнем этапе проводится элюция ДНК с колонки. Колонка аккуратно вставляется в чистую пробирку типа эппендорф объемом 1.5 мл. В колонку добавляется 50 мкл горячей дистиллированной водой (Nuclease-Free Water) (≈80°C) и центрифугируется при 16000 g в течение 1 мин. Колонка вынимается из пробирки типа эппендорф объемом 1.5 мл и выбрасывается. ДНК хранится при температуре 4°C. При длительном хранении рекомендуется перенести пробирки с ДНК в температуру -20°C.
Осаждение продуктов амплификации ДНК фрагмента гена IL6 и гена TGFb1
Осаждение продуктов амплификации ДНК проводится для того, чтобы получить чистый препарат ДНК и избавится от компонентов амплификационной смеси, таких как праймеры и dNTP, которые в дальнейшем мешают проведению сиквенсовой реакции.
В настоящее время существует несколько способов осаждения продуктов амплификации.
Осаждение продуктов амплификации ДНК фрагмента гена IL6 и гена TGFb1 7M ацетатом аммония
Подготавливается и подписывается необходимое количество пробирок типа эппендорф объемом 1,5 мл, в каждую пробирку добавляется по 60 мкл охлажденного 96° этилового спирта.
Далее в пробирки типа эппендорф объемом 0.2 мл с реакционной смесью добавляется 10 мкл 7M ацетата аммония. Реакционная смесь с ацетатом аммония переносится в пробирки с этиловым спиртом и аккуратно перемешивается. Пробы инкубируются в морозильной камере при -22°C в течение 1,5 часов, затем центрифугируются в течение 15-20 мин при 14000 об/мин при 4°C (используется центрифуга с функцией охлаждения). Затем надосадочная жидкость удаляется. К осадку добавляется 400 мкл охлажденного 80° этилового спирта и с ним инкубируется при комнатной температуре в течение 3-5 мин. Затем этиловый спирт удаляется, и осадок высушивается при 40°-45°C в настольном термостате до полного высыхания (контролируется визуально). После высушивания к осадку добавляется 5-20 мкл dH2O (в зависимости от интенсивности свечения полосок при оценочном электрофорезе), перемешивается на вортексе и инкубируется 5-10 мин при 41°C или 20-30 мин при комнатной температуре для полного растворения осадка.
Затем повторно проводится оценочный форез №2 для того, чтобы убедиться в том, что на стадии осаждении амплифиционных продуктов не произошли потери ДНК.
Оценочный электрофорез №2 проводится так, как описано в разделе 9.5.2. За исключением того, что в данном случае для анализа отбирается одинаковый объем (2 мкл) из каждой пробы после переосаждения ДНК, смешивается с 1-2 мкл раствора, предназначенного для нанесения проб в агарозный гель (содержит бромфеноловый синий), и наносится в карманы геля (раздел 9.5.2.2).
Если в каждой дорожке агарозного геля видна светящаяся полоска, значит, осаждение прошло успешно, потери ДНК не произошло, и можно переходить к разделу 10.6. Если в каких-то или во всех дорожках геля светящиеся полоски отсутствуют, значит, произошли потери ДНК, и необходимо вернуться к работе с раздела 10.3.
Осаждение продуктов амплификации ДНК фрагмента гена IL6 и гена TGFb1 ферментами
Более современным, надежным, удобным и быстрым методом является осаждение продуктов амплификации ферментами. Для этого используются экзонуклеаза I из E.coli и щелочная фосфатаза. Существует два вида используемых фосфатаз. Одна выделена из кишечника теленка, вторая - креветочная. В данном исследовании используется креветочная щелочная фосфатаза.
Перед проведением реакции подготавливается и маркируется необходимое количество пробирок типа эппендорф объемом 0.2 мл. Затем на льду приготовляется смесь ферментов, включающая следующие объемы компонентов в расчете на одну пробирку: 0.5 мкл экзонуклеазы (20 ед. в мкл) и 1 мкл фосфатазы (1 ед. в мкл). Смесь ферментов готовится с запасом (т.е. на количество реакций, большее на 10%, чем реально необходимое). Ферменты отбираются из пробирок с поверхности, плавным движением.
После приготовления смесь ферментов аккуратно перемешивается и центрифугируется на вортексе.
Затем в каждую пробирку типа эппендорф объемом 0.2 мл вносится по 1.5 мкл приготовленной смеси ферментов и по 5 мкл амплификационного продукта (см. раздел 10.3). Общий объем реакционной смеси составляет 6,5 мкл.
Реакция проводится в амплификаторе Dyad по следующему протоколу: 1) 37°C в течение 20 мин, 2) 90°C в течение 20 мин.
После проведения реакции пробы необходимо разбавить dH2O в зависимости от интенсивности свечения полосок при оценочном электрофорезе (возможно добавление от 6 до 48 мкл dH2O).
Проведение сиквенсовой ПЦР
Проведение сиквенсовой реакции осуществляется с использованием коммерческого набора реагентов для секвенирования ДНК Big Dye Terminator v1.1 или v3.1 Sequencing RR-100.
Перед проведением реакции подготавливается и маркируется необходимое количество пробирок типа эппендорф объемом 0.2 мл.
Затем приготавливается сиквенсовая амплификационная реакционная смесь, включающая следующие объемы компонентов в расчете на одну пробирку (Таблица 4).
|
В качестве праймеров для сиквенсовой реакции используются праймеры, представленные в таблице 1.
После приготовления смесь компонентов перемешивается и центрифугируется на вортексе.
Затем в каждую пробирку типа эппендорф объемом 0.2 мл вносится по 18 мкл приготовленной смеси компонентов и по 2 мкл очищенной (по любой из двух описанных в разделе 10.5 методике) ДНК. Общий объем реакционной смеси составляет 20 мкл.
Сиквенсовая ПЦР проводится в амплификаторе Dyad и состоит из стадии денатурации (96°C, 10 сек), отжига (60°C, 5 сек) и синтеза (60°C, 4 мин). Количество циклов составляет 25.
Осаждение продуктов сиквенсовой ПЦР
Осаждение продуктов сиквенсовой ПЦР проводится для того, чтобы избавится от компонентов сиквенсовой смеси, таких как праймеры и меченые ddNTP, которые в дальнейшем мешают проведению реакции секвенирования на приборе 3130 Genetic Analyzer.
В настоящее время существует несколько способов осаждения сиквенсовых амплификатов ДНК.
Осаждение продуктов сиквенсовой ПЦР 3M ацетатом натрия
Подготавливается и подписывается необходимое количество пробирок типа эппендорф объемом 1.5 мл, в каждую пробирку добавляется по 50 мкл охлажденного 96% этилового спирта. Далее в пробирки типа эппендорф объемом 0,2 мл с реакционной смесью добавляется 2 мкл 0,125M ЭДТА и 2 мкл 3M ацетата натрия. Реакционная смесь с ацетатом натрия из микропробирок переносится в пробирки с этиловым спиртом и перемешивается на вортексе. Пробы инкубируются в морозильной камере при -20°C в течение 45 минут, затем центрифугируются в течение 15-20 мин при 12000 об/мин при 4°C (используется центрифуга с функцией охлаждения). Затем надосадочная жидкость тщательно удаляется (сливается и отстукивается 2-3 раза). К осадку добавляется 70 мкл охлажденного 80% этилового спирта. Пробы центрифугируются в течение 10 мин при 12000 об/мин при 4°C, надосадочная жидкость тщательно удаляется (сливается и промакивается салфеткой). Осадок высушивается при 41°C (не более) в настольном термостате до полного высыхания (контролируется визуально). После высушивания к осадку добавляется 15 мкл формамида, перемешивается на вортексе и инкубируется 5-10 мин при 41°C или 20-30 мин при комнатной температуре для полного растворения осадка. Пробы готовы для последующей процедуры секвенирования или хранятся при минус 20°C.
Осаждение продуктов сиквенсовой ПЦР с использованием коммерческого набора реагентов X-Terminator
Более современным, надежным, удобным и быстрым методом является осаждение сиквенсовых амплификатов ДНК с использованием коммерческого набора реагентов X-Terminator, в который входят два реагента SAM и сам X-Terminator (представляет собой сорбент). Оба реагента перед использованием перемешиваются на вортексе. Перед постановкой реакции для устранения ошибок (перепутывания проб) создается информационная решетка, в соответствии с которой подготовленные пробы переносятся в планшет для проведения реакции. В лунку планшета добавляется 10 мкл реагента X-Terminator (для нанесения носик пластикового наконечника обрезается). В пробирку типа эппендорф объемом 0.2 мл с сиквенсовым амплификатом ДНК добавляется 45 мкл реагента SAM, смесь перемешивается и переносится в соответствующую лунку планшета. Планшет накрывается специальным серым ковриком, застегивается специальной белой крышкой и центрифугируется при 600 об/мин в течение 2 мин. Пробы готовы для последующей процедуры секвенирования.
Проведение реакции секвенирования на приборе 3130 Genetic Analyzer
Секвенатор 3130 Genetic Analyzer должен быть подготовлен к эксплуатации, а именно должны быть установлены капилляры выбранного размера, проведена калибровка прибора под используемый набор реагентов, инсталлировано программное обеспечение (Run 3130 Data Collection v3.0; Sequencing Analysis 5.2; Seqscape v2.5), выбран используемый тип полимера, загружены необходимые протоколы работы.
Пробы, растворенные в 15 мкл формамида, переносятся в лунки планшета для проведения реакции в соответствии с информационной решеткой. Планшет накрывается специальным серым ковриком и подвергается тепловой денатурации, которая проводится в амплификаторе Dyad по следующему протоколу: 1) 95°C в течение 3 мин, 2) 4°C в течение 5 мин. При этом крышка амплификатора не закрывается.
Затем планшет с ковриком вставляются в черный держатель и застегиваются специальной белой крышкой (отверстия в крышке должны четко совпадать с отверстиями лунок и коврика). Данная конструкция вставляется в секвенатор.
Программа Data Collection контролирует сбор данных, полученных при электрофоретическом разделении продуктов секвенирующей реакции.
Анализ полученных результатов
После завершения электрофоретического разделения продуктов секвенирующей реакции предварительные данные, собранные программой Data Collection, подвергаются анализу с помощью специальных программ.
На первом этапе анализа используется программа Sequencing Analysis 5.2, которая позволяет посмотреть первичные данные и оценить ряд параметров, таких как общий уровень сигнала по каждому из четырех нуклеотидов (высота пиков), уровень фонового сигнала, степень достоверности идентификации (расшифровки) каждого нуклеотида в сиквенсе и др.
На втором этапе анализа используется программа Seqscape v2.5, которая позволяет обрабатывать полученные данные, а именно собирать перекрывающиеся фрагменты в один и сравнивать их с референсной последовательностью, которая предварительно вводится в память программы. Референсная последовательность представляет собой сиквенс исследуемого гена, расшифрованный при проведении проекта "Геном человека". В настоящем исследовании в качестве референсного выбран сиквенс фрагмента гена IL6. Данную информацию можно получить на сайте www.ncbi.nlm.nih.gov. В итоге результаты по каждому исследуемому образцу выглядят как расшифрованная последовательность нуклеотидов с указанием замен относительно референсной последовательности.
Результатом проведенного исследования является определение генотипа больного урогенитальным хламидиозом в позиции - 174 фрагмента гена IL6; при этом, при выявлении гомозиготного СС генотипа в позиции - 174 фрагмента гена IL6 прогнозируют высокую вероятность возникновения осложнений урогенитального хламидиоза, приводящих к развитию нарушений репродуктивной функции как у женщин, так и у мужчин, а при выявлении гетерозиготного генотипа GC гена TGFb1 в положении - 915 прогнозируют высокую вероятность возникновения осложнений урогенитального хламидиоза, приводящих к развитию нарушений репродуктивной функции, хламидиоза, у женщин.
Основание для разработки патента
Основанием для разработки патента послужили результаты, полученные в ходе выполнения научно-исследовательской работы «Разработка технологии молекулярной диагностики индивидуального генетического риска развития нарушений репродуктивной функции, ассоциированных с урогенитальной хламидийной инфекцией у человека», выполнявшейся ФГБУ «ГНЦДК» Минздравсоцразвития России в рамках Государственного контракта №02.740.11.0774 от 20.04.2010 г.
Объектом исследования являлись 80 женщин и 40 мужчин, больных урогенитальным хламидиозом. Среди женщин у 20 пациенток регистрировалась УГХИ нижних отделов урогенитального тракта, у 20 - УГХИ органов малого таза (восходящий процесс); 20 пациенток с вторичным (трубным) бесплодием с урогенитальной хламидийной инфекцией в анамнезе составили группу сравнения и 20 практически здоровых женщин составили группу контроля. Среди мужчин у 20 пациентов регистрировались неосложненные формы заболевания (уретрит) и у 20 - осложненные формы урогенитальной хламидийной инфекции; 20 практически здоровых мужчин составили группу контроля.
При проведении исследований до начала лечения у пациентов проводилось изучение молекулярной структуры генов, включающих функционально значимые полиморфизмы, ассоциированные с повышенной восприимчивостью к инфекции, развитием воспаления, фиброзных изменений в органах репродуктивной системы человека и вторичного (трубного) бесплодия, особенностями клинического течения хламидиоза, изменением баланса иммунорегуляторных клеток (T-хелперов I-го и II-го типа) и антительного ответа к белку теплового шока хламидий: TNF A: позиция 308; L10: в позициях 1082, 819 и 592; TGFb, позиции - 915, -869; ген MBL2, позиция - 204; генов, кодирующих цитокины - IFN-γ, позиция - 874, и IL-6, позиция - 174.
В результате проведенных исследований было установлено, что между группами больных с неосложненными формами урогенитального хламидиоза и осложненными формами заболевания, которые могут привести к развитию нарушений репродуктивной функции, существуют достовернее различия в частоте регистрации генотипов:
- в позиции - 174 гена IL-6 (у женщин и мужчин) и гена TGFb1 в позиции - 915 (у женщин).
При этом частота регистрации гомозиготного СС генотипа гена в позиции - 174 у больных осложненными формами урогенитального хламидиоза (как у женщин, так и у мужчин) была достоверно выше (женщины: p=0,002; OR=2,7±0,97; χ=29,52; мужчины: OR - 5.02±1.55; χ2-критерий - 29.066; p<0,001), чем у больных без осложнений. Частота регистрации гетерозиготного GC генотипа гена TGFb1 в позиции - 915 была достоверно выше у женщин больных осложненными формами урогенитального хламидиоза в сравнении с пациентками больными неосложненными формами заболевания (p=0,008; OR=10,23±11,54; χ=25,62).
Таким образом, проведенные исследования позволили установить, что генотипы: СС в позиции - 174 гена IL-6 у женщин и мужчин и GC гена TGFb1 в позиции - 915 у женщин являются предикторами осложненного клинического течения урогенитального хламидиоза, которое приводит к развитию нарушений репродуктивной функции у пациентов, а носители указанных генотипов лицами, обладающими повышенным риском развития осложнений заболевания.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Пример №1.
Пациентка К.А.Н., 22 года. Диагноз: хламидийная инфекция органов малого таза. Жалобы при обращении: выделения из половых путей белые обильные, чувство жжения в уретре, боль внизу живота. Длительность заболевания около 2-х месяцев. ИППП в анамнезе отрицает. Соматические заболевания и хирургические вмешательства отрицает. Гинекологические заболевания в анамнезе отрицает. Беременности 1 (аборт 2009 г.). Не замужем. Начало половой жизни с 17 лет. Половой партнер не обследован. Половая жизнь регулярная, метод контрацепции - презерватив (не регулярно).
Локальный статус: Кожные покровы и видимые слизистые половых органов нормальной окраски, специфических высыпаний не выявлено, Слизистая оболочка наружного отверстия уретры не измененная. Выделения из уретры отсутствуют. Слизистая оболочка вульвы гиперемирована, свободных выделений нет, специфических высыпаний не выявлено. Слизистая оболочка влагалища розовой окраски. Характер выделений в заднем своде влагалища: сливкообразные, скудные, без запаха. Шейка матки цилиндрической формы, наружный зев точечный. Слизистая оболочка экзоцервикса розовой окраски. Вокруг цервикального канала определяется циркулярный очаг эктопии ярко-красного цвета с ровными, четкими краями. Бимануальное исследование: яичники и маточные трубы без патологии, матка не увеличена, умеренная болезненность тракции за шейку матки. Аногенитальная область: не изменена.
Данные лабораторного обследования: микроскопия мазка, окрашенного по Граму: U - 3-5-10 ПМЯЛ в поле зрения, местами в скоплениях слизи до 20, эпителий в умеренном количестве, слизь в значительном количестве; C -30-60 ПМЯЛ в поле зрения, эпителий в значительном количестве, слизь в значительном количестве; V - 5-10-15 в поле зрения, эпителий в умеренном количестве, слизь в скудном количестве. Методом ПЦР; С.trachomatis обнаружена. Методом ИФА: IgM - отрицательный, IgG - положительный, IgA - отрицательный. Данных за другие ИППП выявлено не было.
Заключение ультразвукового исследования органов малого таза: ультразвуковые признаки правостороннего сальпингита.
Результаты определения генотипа гена IL-6 в - 174 положении: выявлен гомозиготный генотип CC - предиктор осложненного течения урогенитального хламидиоза.
Результаты определения генотипа гена TGFb1 в - 915 положении: выявлен гетерозиготный генотип GC - предиктор осложненного течения урогенитального хламидиоза.
Таким образом, в данном случае у пациентки с осложненным клиническим течением урогенитального хламидиоза выявлены молекулярно-генетические предикторы осложненного течения заболевания (гомозиготный генотип CC гена IL-6 в - 174 положении и гетерозиготный генотип GC гена TGFb1 в - 915 положении), которое заключается в развитии воспалительных заболеваний органов малого таза. Это определяет необходимость назначения ей адекватной терапии, по схемам лечения осложненных форм хламидийной инфекции, в целях профилактики развития нарушений репродуктивной функции.
Пример №2
Пациентка Р.Т.С., 20 лет. Диагноз: хламидийная инфекция нижних отделов урогенитального тракта. Жалобы при обращении: не предъявляет. ИППП в анамнезе отрицает. Соматические заболевания и хирургические вмешательства отрицает. Гинекологические заболевания в анамнезе отрицает. Беременности: 0. Не замужем. Начало половой жизни с 16 лет. Половой партнер обследован, выявлена хламидийная инфекция (со слов). Половая жизнь регулярная, метод контрацепции - презерватив (не регулярно).
Локальный статус: Кожные покровы и видимые слизистые половых органов нормальной окраски, специфических высыпаний не выявлено, Слизистая оболочка наружного отверстия уретры не измененная. Выделения из уретры отсутствуют. Слизистая оболочка вульвы бледно-розовая, свободных выделений нет, специфических высыпаний не выявлено. Слизистая оболочка влагалища нормальной розовой окраски. Характер выделений в заднем своде влагалища: белые, однородные, гомогенные. Шейки матки цилиндрической формы, наружный зев точечный. Слизистая оболочка экзоцервикса нормальной розовой окраски. Бимануальное исследование: яичники и маточные трубы без патологии. Матка не увеличена, тракция за шейки матки безболезненна. Аногенитальная область: не изменена.
Данные лабораторного обследования: микроскопия мазка, окрашенного по Граму: U - ПМЯЛ не выявлено, эпителий в умеренном количестве, слизь в умеренном количестве; C - 5-15-25 ПМЯЛ в поле зрения, эпителий в значительном количестве, слизь в значительном количестве, V - 5-15 в поле зрения, эпителий в значительном количестве, слизь в значительном количестве. Методом ПЦР: С.trachomatis обнаружена. Методом ИФА: IgM - отрицательный, IgG - отрицательный, IgA - отрицательный. Данных за другие ИППП выявлено не было.
Заключение ультразвукового исследования органов малого таза: ультразвуковых признаков патологии не выявлено.
Результаты определения генотипа гена IL-6 в - 174 положении: выявлен гетерозиготный генотип CG, который не является предиктором осложненного течения урогенитального хламидиоза
Результаты определения генотипа гена TGFb1 в - 915 положении: выявлен гомозиготный генотип GC, который не является предиктором осложненного течения урогенитального хламидиоза.
Таким образом, в данном случае у пациентки с неосложненным клиническим течением урогенитального хламидиоза не были выявлены молекулярно-генетические предикторы осложненного течения заболевания, которое приводит к развитию нарушений репродуктивной функции у пациентки, что определяет необходимость назначения ей терапии по схемам лечения неосложненной урогенитальной хламидийной инфекции.
Пример №3
Пациентка П.А.С., 25 лет. Диагноз: хламидийная инфекция органов малого таза. Жалобы при обращении: выделения из половых путей белые обильные, чувство жжения, зуд в области наружных половых органов. Длительность заболевания затрудняется уточнить. ИППП в анамнезе отрицает. Соматические заболевания и хирургические вмешательства отрицает. Гинекологические заболевания в анамнезе отрицает. Беременности: 0. Не замужем. Начало половой жизни с 19 лет. Половой партнер не обследован. Половая жизнь регулярная, метод контрацепции - презерватив (не регулярно).
Локальный статус: Кожные покровы и видимые слизистые половых органов нормальной окраски, специфических высыпаний не выявлено. Слизистая оболочка наружного отверстия уретры не измененная. Выделения из уретры отсутствуют. Слизистая оболочка вульвы бледно-розовая, свободных выделений нет, специфических высыпаний не выявлено. Слизистая оболочка влагалища нормальной розовой окраски. Характер выделений в заднем своде влагалища: сливкообразные, белые, умеренные, без запаха. Шейка матки цилиндрической формы, наружный зев точечный. Слизистая оболочка экзоцервикса нормальной розовой окраски. Вокруг цервикального канала определяется циркулярный очаг гиперемии до 1 см в диаметре. Бимануальное исследование: пальпация в проекции яичника и маточных труб справа слегка болезненна, матка не увеличена, умеренная болезненность тракции за шейку матки. Аногенитальная область: не изменена.
Данные лабораторного обследования: микроскопия мазка, окрашенного по Граму: U - 0 ПМЯЛ в поле зрения, эпителий в скудном количестве, слизь в значительном количестве; C - 20-40-60 ПМЯЛ в поле зрения, эпителий в умеренном количестве, слизь в умеренном количестве; V - 2-5-10 в поле зрения, эпителий в значительном количестве, слизь в значительном количестве. Методом ПЦР: С.trachomatis обнаружена. Методом ИФА: IgM - отрицательный, IgG - положительный, IgA - положительный. Данных за другие ИППП выявлено не было.
Заключение ультразвукового исследования органов малого таза: ультразвуковые признаки правостороннего оофорита.
Результаты определения генотипа гена IL-6 в - 174 положении: выявлен гетерозиготный генотип CG, который не является предиктором осложненного течения урогенитального хламидиоза
Результаты определения генотипа гена TGFb1 в - 915 положении: выявлен гетерозиготный генотип GC, который является предиктором осложненного течения урогенитального хламидиоза.
Таким образом, в данном случае у пациентки с осложненным клиническим течением урогенитального хламидиоза выявлен молекулярно-генетический предиктор осложненного течения заболевания (гетерозиготный генотип GC гена TGFb1 в - 915 положении), которое заключается в развитии воспалительных заболеваний органов малого таза. Это определяет необходимость назначения ей адекватной терапии, по схемам лечения осложненных форм хламидийной инфекции, в целях профилактики развития нарушений репродуктивной функции.
Пример №4
Пациент Р.А.Н., 26 лет. Диагноз: хламидийная инфекция нижних отделов урогенитального тракта. Жалобы при обращении: чувство жжения в уретре при мочеиспускании. Длительность заболевания около 2-х недель.
ИППП в анамнезе отрицает. Соматические заболевания и хирургические вмешательства отрицает. Урологические заболевания в анамнезе отрицает. Холост. Начало половой жизни с 18 лет. Половой партнер не обследован. Половая жизнь регулярная, метод контрацепции - презерватив (не регулярно).
Локальный статус: Кожные покровы и видимые слизистые половых органов нормальной окраски, специфических высыпаний не выявлено. Органы мошонки: яички и придатки с обеих сторон безболезненны при пальпации, не увеличены, без анатомических изменений; вены: не расширены; кавернозные тела: не изменены; уретра: слизистая оболочка наружного отверстия уретры слегка гиперемированна, отмечается слипание губок уретры. Стенка уретры при пальпации без уплотнений. Выделения из уретры: слизистые скудные. Половой член: налет на glans et corpus penis отсутствует; аногенитальная область: не изменена. Пальцевое ректальное исследование: предстательная железа при пальпации безболезненна
Данные лабораторного обследования: микроскопия мазка, окрашенного по Граму: 5-10 ПМЯЛ в поле зрения. Методом ПЦР: С.trachomatis обнаружена. Методом ИФА: IgM - отрицательный, IgG - отрицательный, IgA - отрицательный. Данных за другие ИППП выявлено не было.
Исследование секрета простаты: 0-2 ПМЯЛ в поле зрения.
Результаты ультразвукового исследования предстательной железы: ультразвуковых признаков изменений предстательной железы не выявлено.
Результаты определения генотипа гена IL-6 в - 174 положении: выявлен гетерозиготный генотип CG, который не является предиктором осложненного течения урогенитального хламидиоза.
Таким образом, в данном случае у пациента с неосложненным клиническим течением урогенитального хламидиоза не были выявлены молекулярно-генетические предикторы осложненного течения заболевания, которое приводит к развитию нарушений репродуктивной функции, что определяет необходимость назначения ему терапии по схемам лечения неосложненной урогенитальной хламидийной инфекции.
Пример №5
Пациент Х.О.Н., 27 лет. Диагноз: осложненная хламидийная инфекция урогенитального тракта. Жалобы при обращении: чувство жжения в уретре при мочеиспускании, учащенное мочеиспускание. Длительность заболевания около месяца.
ИППП в анамнезе отрицает. Соматические заболевания и хирургические вмешательства отрицает. Урологические заболевания в анамнезе отрицает. Холост. Начало половой жизни с 16 лет. Половой партнер не обследован. Половая жизнь регулярная, метод контрацепции презерватив (не регулярно).
Локальный статус: Кожные покровы и видимые слизистые половых органов нормальной окраски, специфических высыпаний не выявлено. Органы мошонки: яички и придатки с обеих сторон безболезненны при пальпации, не увеличены, без анатомических изменений; вены не расширены; кавернозные тела не изменены; уретра слизистая оболочка наружного отверстия уретры не изменена. Стенка уретры при пальпации без уплотнений. Выделения из уретры: слизистые умеренные. Половой член: налет на glans et corpus penis отсутствует; аногенитальная область: не изменена, пальцевое ректальное исследование: отмечается умеренная болезненность при пальпации предстательной железы.
Данные лабораторного обследования: микроскопия мазка, окрашенного по Граму:
Методом ПЦР: С.trachomatis обнаружена. Методом ИФА: IgM - отрицательный, IgG - положительный, IgA - положительный. Данных за другие ИППП выявлено не было.
Исследование секрета простаты: лейкоциты 5-7, в скоплении слизи до 18 в поле зрения.
Результаты ультразвукового исследования предстательной железы: При ультразвуковом исследовании выявлены признаки увеличения размеров, диффузно-очаговых изменений центральной части предстательной железы. Отмечается некоторое обеднение сосудистого рисунка справа.
Результаты определения генотипа гена IL-6 в - 174 положении: выявлен гомозиготный генотип CC - предиктор осложненного течения урогенитального хламидиоза.
Таким образом, в данном случае у пациента с осложненным клиническим течением урогенитального хламидиоза (простатит) выявлен молекулярно-генетический предиктор осложненного течения заболевания (гомозиготный генотип CC гена IL-6 в - 174 положении), которое приводит к развитию нарушений репродуктивной функции у пациента, что определяет необходимость назначения ему адекватной терапии, по схемам лечения осложненных форм хламидийной инфекции, в целях профилактики развития нарушений репродуктивной функции.
Таким образом, приведенные примеры позволяют заключить, что разработанный Способ молекулярной диагностики генетического риска развития нарушений репродуктивной функции, ассоциированных с урогенитальной хламидийной инфекцией у человека, может быть применен для прогнозирования характера клинического течения урогенитального хламидиоза у мужчин и женщин с целью определения возможности развития у них нарушений репродуктивной функции и решения вопроса о выборе тактики терапии.
Разработанный способ имеет важную медицинскую и социальную значимость. Учитывая высокую социальную значимость развития таких последствий осложнений УГХИ, как развитие нарушений репродуктивной функции, в том числе бесплодия, разработанный способ позволяет принимать обоснованные решения о персонализации терапии конкретного пациента и сэкономить значительные материальные средства госбюджета, затрачиваемые на лечение развившихся осложнений урогенитального хламидиоза и нарушений репродуктивной функции. Кроме этого, способ позволяет предупредить развитие осложнений при лечении больных урогенитальным хламидиозом за счет выбора адекватной тактики лечения больных.
На основе данного способа может быть разработана тест-система для осуществления прогноза характера клинического течения урогенитального хламидиоза у мужчин и решения вопроса о выборе тактики их терапии, выполненная в формате ПЦР в реальном времени.
Способ диагностики генетического риска развития осложненного клинического течения урогенитальной хламидийной инфекции у человека, включающий определение методом ПЦР полиморфных вариантов генов и , и при определении гомозиготного генотипа СС в позиции -174 гена у мужчин и женщин, больных урогенитальным хламидиозом, а также гетерозиготного генотипа GC в позиции -915 гена у женщин прогнозируют высокий риск развития осложненного клинического течения урогенитальной хламидийной инфекции.
