МИКРОКОЛЛОИДНЫЙ РАСТВОР ПРОПОФОЛА ДЛЯ АНЕСТЕЗИИ
Вид РИД
Изобретение
Изобретение относится к области медицины и ветеринарии и может быть использовано для индукции и поддержания анестезии.
Пропофол (2,6-диизопропилфенол) - анестетик кратковременного действия, применяется для индукции и поддержания общей анестезии и седации при местном хирургическом вмешательстве. Препараты пропофола вводят в однократной внутривенной дозе или в повторяющейся дозе в виде болюса, возможно также непрерывное инфузионное введение.
Пропофол впервые получен в исследовательском подразделении корпорации ICI (Великобритания) посредством химического синтеза. В 70-80 годы прошлого века корпорация ICI получила несколько патентов на составы и применение пропофола в качестве анестезирующего средства - US Pat. 4056635 "2,6-Diisopropylphenol as an anaesthetic agent", US Pat. 4452817 "Anesthetic composition containing 2,6-Diisopropylphenol", US Pat. 4798846 "Pharmaceutical compositions". В этих патентах заявлены составы на водно-органической основе, содержащие в качестве солюбилизатора Cremophor EL (полиоксиэтилированное касторовое масло) или другие сходные соединения.
Впоследствии, при широком применении лекарственных средств на основе кремофоров, у большого числа пациентов были отмечены многочисленные анафилактические (аллергические) реакции и данные препараты были изъяты из медицинской практики.
Основное необходимое условие биодоступности и эффективности лекарственной формы пропофола - растворимость в воде. Пропофол - гидрофобное вещество и может смешиваться с водой только в присутствии солюбилизаторов (поверхностно-активных веществ). Однако большинство поверхностно-активных веществ (ПАВ) не совместимо с организмом человека и животных, поэтому разработки проводились только с ПАВами, разрешенными фармакопеями.
Наиболее известный состав лекарственного средства на основе пропофола содержит в качестве эмульгатора/солюбилизатора смесь соевого масла и яичного лецитина и имеет следующий состав:
Пропофол - 1%; Соевое масло очищенное - 10%; Лецитин яичный - 12%; Глицерин - 22,5%; Гидроксид натрия - до рН 8,5; Вода - до 100%. При смешивании этих веществ с водой получается непрозрачная эмульсия белого цвета, весьма чувствительная к перепаду температур.
В 1986 году фирма Astra-Zeneca (Великобритания) внедрила эту рецептуру на медицинский и ветеринарный рынок под коммерческим названием «Диприван», для ветеринарии «Рапиновет». Данный препарат получил широкое распространение в мировой анестезиологической практике, но уже в первые годы использования был выявлен основной недостаток этого препарата - неустойчивость к микробному загрязнению и, как следствие, угроза общего заражения пациента. Причина такой неустойчивости в большой чувствительности эмульсии к присутствию ионных и гидрофобных соединений, так как это нарушает поверхностный заряд микрокапель эмульсии и приводит к расслаиванию раствора. Поэтому разработчики отказались от введения в рецептуру консервантов, антиоксидантов и других веществ, влияющих на физико-химическую стабильность препарата.
В дальнейшем, сотрудники фирмы Astra-Zeneca пытались усовершенствовать данную рецептуру в следующих патентах: Патент РФ №2147432 «Эмульсии типа масло в воде, содержащие пропофол и эдетат» и US Pat. 7125909 «Sterile parenteral nutrition compositions». В этих патентах устойчивость к микробной контаминации была увеличена до 24 часов за счет введения в рецептуру эдетата натрия (ЭДТА), но это также недостаточно в связи с большим расходом препарата и слабым антимикробным действием ЭДТА.
Известны патенты, в которых в качестве солюбилизатора использованы полоксамеры (плюроники): патент РФ №2250101 «Анестезирующие рецептуры», US Pat. 4798846 «Pharmaceutical compositions», US Pat. 6623765 «Microemulsion and micelle systems for solubilizing drugs», US Pat. 7915317 «Aqueous 2,6-diisopropylphenol pharmaceutical compositions», US Pat. 6743436 «Anesthetic composition for intravenous injection comprising propofol», WO/2003/017977 «Anaesthetic formulations of propofol». В этих патентах приведены рецептуры лекарственной формы пропофола следующего состава: пропофол - 0,1-10%; полоксамеры 407/188/237/108/234 (в разных соотношениях) - 5-20%; консервант (ЭДТА) - 0,005-0,1%; вода для инъекций - до 100%. Приведен пример, характерный для всех этих патентов, в US Pat. 6623765 «Microemulsion and micelle systems for solubilizing drugs» добавлены соэмульгаторы (поливинилпирролидон, поливиниловый спирт, полиэтиленгликоли, полиоксиэтилированные эфиры).
Составы, представленные в вышеизложенных патентах, отвечают основным критериям физико-химической стабильности, принятым для лекарственных препаратов. Тем не менее, эти составы обладают заметной вязкостью, что затрудняет их парентеральное введение. К тому же, коллоидный раствор пропофола в водном полоксамере чувствителен к введению дополнительных компонентов - антиоксидантов, консервантов, биологически-активных веществ, влияющих на биодоступность и снижающих токсичность пропофола. Введение этих веществ необходимо для улучшения фармакологических свойств препарата, но приводит к резкому падению физико-химической стабильности лекарственных форм, содержащих полоксамеры.
В патентах US Pat. 7138387 « Clear aqueous composition comprising propofol and hydroxypropyl-beta-cyclodextrin» и ЕР 1928412 «Aqueous anaesthetic compositions comprising propofol» заявлены лекарственные формы на основе комплекса циклодекстринов с пропофолом следующего состава: Пропофол - 1 г; 2-гидроксипропил-бета-циклодекстрин - 30 г; Глицерин - 2,25 г; Эдетат натрия - 0,005 г; Вода до 100 мл.
При практическом воспроизведении данного состава в лаборатории, обнаруживается, что образование комплекса сильно зависит от особенностей синтеза исходной субстанции циклодекстрина (использовались коммерческие субстанции циклодекстрина разных производителей) и содержание пропофола в стабильных лекарственных формах не превышало 0,3%, что недостаточно для эффективной анестезии.
Наиболее близкими к предлагаемому решению являются лекарственные формы, заявляемые в патенте US 7326735 «Formulations for anaesthetic use». В данном патенте приведена рецептура лекарственной формы пропофола следующего состава: пропофол - 0,5-1,5%; растворитель (гликофурол) - 10-30%; сорастворитель (Solutol HS 15 (ПЭГ-660 12-гидроксистеарат), эфиры полиэтиленгликоля и 12-гидроксистеариновой кислоты) - 5-20%; модификатор вязкости (этанол) - 0,5-5%; консерванты (ЭДТА) - 0,005-0,1%; бензиловый спирт - 0,1-10%; вода для инъекций - до 100%.
В предложенной лекарственной форме обязательно присутствие растворителя (гликофурола), что приводит к увеличению себестоимости препарата. Также авторы изобретения не заявили введение в состав биологически-активных веществ, которые улучшают фармакологические свойства и уменьшают токсичность растворителя, при этом авторы патента заявляют, что по фармакологическому действию предлагаемая лекарственная форма аналогична Дипривану (Astra-Zeneca).
Задачей настоящего изобретения является конструирование инъекционного препарата для анестезии на основе пропофола, обладающего низкой токсичностью, высокой эффективностью (биодоступностью) и высокой физико-химической стабильностью при введении биологически-активных веществ, улучшающих вышеназванные параметры.
Техническим результатом является более низкая токсичность лекарственной формы и высокая эффективность по сравнению с известными препаратами.
Поставленная задача решается тем, что водная композиция для анестезии, содержащая пропофол в качестве активно-действующего вещества, ПЭГ-660-12-гидроксистеарат в качестве солюбилизатора, бензиловый спирт, или хлорэтон, или парабены в качестве консерванта, согласно изобретению дополнительно содержит токоферол и аргинин или глицин при следующем содержании компонентов, мас.%:
|
Композиция может дополнительно содержать ГАМК-агонисты, например, аминофенилмаслянная кислота в количестве от 0,01 до 10 мас.%, а также местные анестетики, например, лидокаин в количестве от 0,05 до 5 мас.%. Кроме того, в композицию могут быть добавлены альфа-2-адреномиметики, например, ксилазин в количестве от 0,01 до 10 мас.%.
Поставленная задача решается также тем, что способ осуществления анестезии включает введение пациенту эффективного количества композиции перечисленного выше состава.
Поставленная задача решается тем, что лекарственная форма представляет собой устойчивый (физико-химически стабильный) микроколлоидный раствор пропофола в воде, в качестве солюбилизатора используется ПЭГ660-12-гидроксистеарат, физико-химическая стабильность раствора обеспечивается определенным соотношением пропофол/солюбилизатор/консервант/вода, низкая токсичность и высокая биодоступность достигается благодаря введению в лекарственную форму токоферола и аргинина или глицина.
Ниже приведены фармакологические параметры (токсичность и эффективность седации (анестезии)) наиболее стабильных лекарственных форм пропофола (таблицы 1 и 2). За основу была взята лекарственная форма пропофола с оптимальным соотношением пропофол/солюбилизатор/консервант/вода (базовая ЛФ). Данный состав является наиболее физико-химически стабильным и устойчивым к микробной контаминации. Количества компонентов базовой ЛФ приведены в примере 1.
|
Введение в базовую лекарственную форму пропофола таких компонентов, как токоферол или аминокислоты аргинин/глицин, снижает острую токсичность композиции анестетика (ЛД50) в 1,1 и 1,2 раза соответственно. Одновременное включение в состав базовой лекарственной формы пропофола токоферола с аминокислотами оказывает взаимоусиливающий эффект на уменьшение токсичности композиции анестетика от 1,5 до 1,8 раз (варианты VI, VIII, IX).
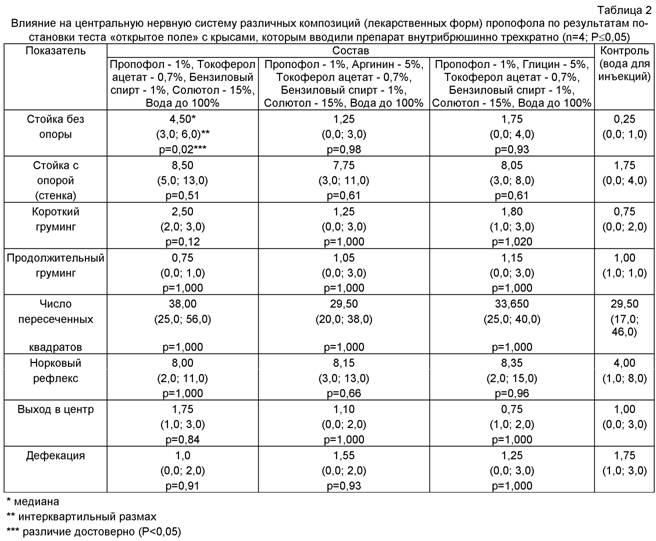
Введение базовой ЛФ пропофола с токоферолом, но без аминокислот приводило к достоверному повышению такого показателя, как стойка без опоры, 4,50 против 1,25 и 1,75 для лекарственных форм пропофола, содержащих аминокислоты аргинин и глицин соответственно. Остальные показатели у крыс группы, получившей ЛФ пропофола без аминокислот, такие как стойка с опорой, короткий груминг, число пересеченных квадратов, выход в центр, недостоверно были выше, чем в группах, которым вводили пропофол в сочетании с аминокислотами. Уровень тревожности в группах животных, которым была введена базовая лекарственная форма пропофола с токоферолом и с токоферолом и аминокислотами (аргнин/глицин), был заметно ниже уровня тревожности в контрольной группе.
Ниже представлена технология приготовления лекарственных форм пропофола и наиболее существенные примеры составов.
Технология приготовления лекарственных форм пропофола следующая.
В подходящую емкость из стекла помещают навеску ПЭГ660-12-гидроксистеарата (солютола), нагревают до расплавления, добавляют навески пропофола и консерванта и перемешивают до получения однородной смеси. Температура смеси +40-50°С.
В отдельную емкость помещают навеску воды для инъекций и добавляют навески остальных компонентов, перемешивают до полного растворения.
Затем добавляют смесь солютол-пропофол-консервант в емкость с водным раствором при постоянном перемешивании. Полученный прозрачный слегка опалесцирующий раствор фильтруют через мембранный фильтр 0,22 мкм и расфасовывают в стерильные стеклянные флаконы.
ПРИМЕР 1
Базовый состав лекарственной формы пропофола и оптимальные количества других необходимых компонентов
|
В таблице 3 приведены примеры, иллюстрирующие пределы физико-химической стабильности составов ЛФ пропофола, а также варианты вспомогательных веществ, которые могут быть использованы в ЛФ.
|
Композиция I. Максимальное содержание аргинина (при применении глицина происходят сходные процессы). Дальнейшее увеличение содержания аргинина или глицина ведет к физико-химической нестабильности системы (расслоению и помутнению раствора).
Композиция II. Увеличение содержания пропофола до 2,0% приводит к увеличению концентрации солюбилизатора, что делает раствор более вязким, особенно при температурах ниже +20°C.
Композиции III и IV. Дальнейшее увеличение содержания пропофола (до 10%) приводит к резкому увеличению вязкости и нестабильности раствора. Для таких ЛФ необходимо введение в состав органического растворителя, что отрицательно сказывается на фармакологических свойствах препарата. Для уменьшения побочных эффектов органического растворителя необходимо повышать концентрацию лидокаина, что приводит к ограничению способов введения данных ЛФ (только внутримышечно или подкожно). Повышение концентрации токоферола ацетата частично нейтрализует побочное действие высоких концентраций лидокаина.
Композиция V. Максимальное содержание глицина. При дальнейшем увеличении содержания глицина происходит расслоение раствора.
Композиция VI. Минимальное содержание солюбилизатора (ПЭГ-660-12-гидроксистеарат). В данной композиции также уменьшено содержание пропофола и токоферола в связи с физико-химической нестабильностью данной ЛФ при повышенных концентрациях вышеназванных компонентов.
Композиции VII, VIII. Максимальные содержания веществ, повышающих эффективность анестезии (ГАМК-агонисты и альфа-2-адреномиметики). При дальнейшем увеличении содержания этих веществ физико-химическая стабильность раствора резко падает (выпадение осадка, расслоение).
Композиция IX. Максимальное содержание консерванта. Увеличение концентрации консерванта приводит к недопустимому повышению токсичности лекарственной формы.

