Результат интеллектуальной деятельности: СПОСОБ ОЦЕНКИ ФАРМАКОЛОГИЧЕСКИХ И ТОКСИКОЛОГИЧЕСКИХ СВОЙСТВ ВЕЩЕСТВ - РАДИО-, ТОКСИКОПРОТЕКТОРОВ И РАДИО-, ТОКСИКОСЕНСИБИЛИЗАТОРОВ
Вид РИД
Изобретение
Воздействие различных видов ионизирующего излучения на человека в повседневной жизни достаточно велико. Такие риски возникают в повседневной жизни многих людей. В частности, для носителей гипоморфных мутаций гомологичных генов у человека опасными могут быть посещения рентгеновского кабинета, долговременные полеты на самолетах, работа на атомных реакторах, длительное нахождение в условиях повышенной концентрации радона (в подвальных помещениях) и т.д. Помимо этого, с увеличением возраста человека вследствие влияния соматического мутагенеза расширяется число людей, для которых уровень опасности ионизирующего облучения повышен.
Настоящее изобретение относится к исследованиям в области биологии и экспериментальной медицины и может использоваться в медико-биологических исследованиях, в частности токсикологических, радиологических, фармакологических, биофизических исследованиях и для лабораторно-экспериментальной оценки и направленного поиска веществ - радио- и токсикопротекторов, обладающих свойствами радио-, токсикопротекции и радио-, токсикосенсибилизации и способствующих адаптивному ответу организма на токсические действия различных видов радиации или экзогенных токсинов. Традиционно для выявления, оценки и направленного поиска фармакологических, токсикологических, фармацевтических свойств веществ - радио- и токсикопротекторов по их способности вызывать метаболический ответ на токсическое воздействие различных видов, в том числе на воздействие ионизирующей радиации, используют различные модельные объекты лабораторных животных - мышей, крыс, кроликов, собак и их клетки, выведенные в культуру. Эволюционно эти объекты близки к человеку, но недостаточно широкий спектр имеющихся генетических методов и высокая стоимость проведения исследований ограничивает возможность их использования.
Наиболее близким к заявляемому способу является техническое решение по патенту KR 20120020820 (A) - SCREENING METHOD OF A TOXIC MATERIAL POLLUTING INTERIOR ATMOSPHERE USING DROSOPHILA MELANOGASTER [1], в котором предложен способ исследования с использованием мутантных линий дрозофилы для определения вредных веществ в воздухе внутренних помещений зданий. В основе предлагаемого патента лежит использование микрочипов, для выявления генов активированных воздействием вдыхаемых мухами газообразных токсинов. Для этого предлагается использовать линии дрозофилы, мутантные по генам, белковые продукты которых задействованы в непосредственный процесс метаболического ответа на действие различного рода токсинов. В списке предлагаемых к использованию мутаций предлагаются гены, кодирующие: белки теплового шока, глютатион-S-трансферазы, цитохром Р450, супероксиддисмутазы, каталазы и ряд других белков, работающих на разных фазах нейтрализации действия различных токсинов. Предлагаемый в [1] метод с высокой чувствительностью позволяет регистрировать присутствие вредных веществ в воздухе внутренних помещений зданий. Однако этот метод не предполагает поиск веществ, способных модифицировать экспрессию генов, регулирующих метаболический ответ на действие вредных веществ в процессе развития in vivo и способных понижать или повышать риск возникновения нарушений процессов развития.
В основу настоящего изобретения положена техническая задача создания эффективного, направленного, достоверного и высокочувствительного способа исследования и оценки фармакологических и токсикологических свойств веществ с предполагаемыми токсикопротекторными, радиопротекторными, токсикосенсибилизирующими и радиосенсибилизирующими свойствами, способных понижать или повышать токсичность действия ионизирующего излучения, для отбора таких веществ и дальнейшего использования при создании фармацевтических средств, способных влиять на токсическое действие радиации и других экзогенных и эндогенных факторов.
Общепринятые требования к оценке действия радиационного облучения на организмы предполагают использование изогенных линий лабораторных животных, не имеющих в своем геноме мутации по генам, вовлеченным в метаболическую регуляцию ответа на действие радиации. К ним в первую очередь следует отнести гены, экспрессия которых направлена на нормализацию уровня супероксидных соединений, повышение которого является одним из следствий ионизирующего облучения. Важным элементом ответа клеток млекопитающих на повышение уровня супероксидных соединений является активизация экспрессии AHR-гена. Его белковым продуктом является арилгидрокарбоновый рецептор (AHR), рецептор для многих токсинов как экзогенного, так и эндогенного происхождения. Одним из эндогенных лигандов AHR является токсичное производное триптофана - формил-индол-карбазол (FICZ). Уровень концентрации FICZ в клетках существенно повышается в ответ на ионизирующее излучение. Это стимулирует повышение активности AHR. Сообщения об участии AHR в реакции на воздействие ионизирующего излучения и вызванных им нарушениях процессов нейрогенеза и памяти дают основания для опасений более сильного действия ионизирующего облучения и других токсических факторов на людей, имеющих в своем геноме гипоморфные мутации AHR-гена [2], [3]. С увеличением возраста соматический мутагенез расширяет число людей, для которых уровень опасности ионизирующего облучения повышен. Такие риски возникают в повседневной жизни многих людей. Несмотря на то что риски обозначены в первую очередь для человека, высокая консервативность структуры и функций AHR-гена и его мишеней позволяет делать первые шаги в оценке веществ, способных усиливать или ослаблять токсическое действие радиации, используя в качестве тест-системы дрозофилу.
У дрозофилы проявление гипоморфной мутации ssa40a в гене spineless, который является гомологом гена AHR, резко усиливается в случае сочетания ее в одном геноме с гипоморфными мутациями других генов, участвующих в формировании памяти, реакции на тепловой шок и поляризации клеток. На примере двойного мутанта, несущего гипоморфную мутацию ssa40a и мутацию гена CG5017, можно продемонстрировать последствия на морфогенез и на адаптивный ответ, вызванные ионизирующим облучением особей, сочетающих две гипоморфные мутации в одном геноме.
Мутации гена spineless в различной степени способны нарушать: морфогенез щетинок; дистальных структур и антенн и конечностей; дендритных структур нейронов и фоторецепторов.
CG5017-ген кодирует нуклеотропный шаперон, относящийся к семейству NAP 1-белков. Мутация CG5017-гена не нарушает морфогенез, но вызывает нарушение формирования долговременной памяти [4]. Учитывая молекулярно-функциональные особенности продуктов ss-, CG5017-генов и высокую степень консерватизма продуктов их экспрессии, можно вполне обоснованно опираться на результаты исследования их взаимодействия для оценки рисков сочетания мутаций гомологов этих генов у человека и возможностей их фармакологической коррекции. Вместе с тем можно предположить, что даже слабые мутации таких генов могут изменить адаптивный ответ организма на действие ионизирующего облучения или других токсических агентов. Так как человеческие популяции в результате созданных социальных условий современного общества обременены множеством гипоморфных мутаций, вероятность встречи в одном геноме одной и более гипоморфной мутации достаточно велика. Их носители могут благополучно существовать, но для них действие радиации и других токсических агентов представляет повышенный риск даже в случаях малых доз воздействия.
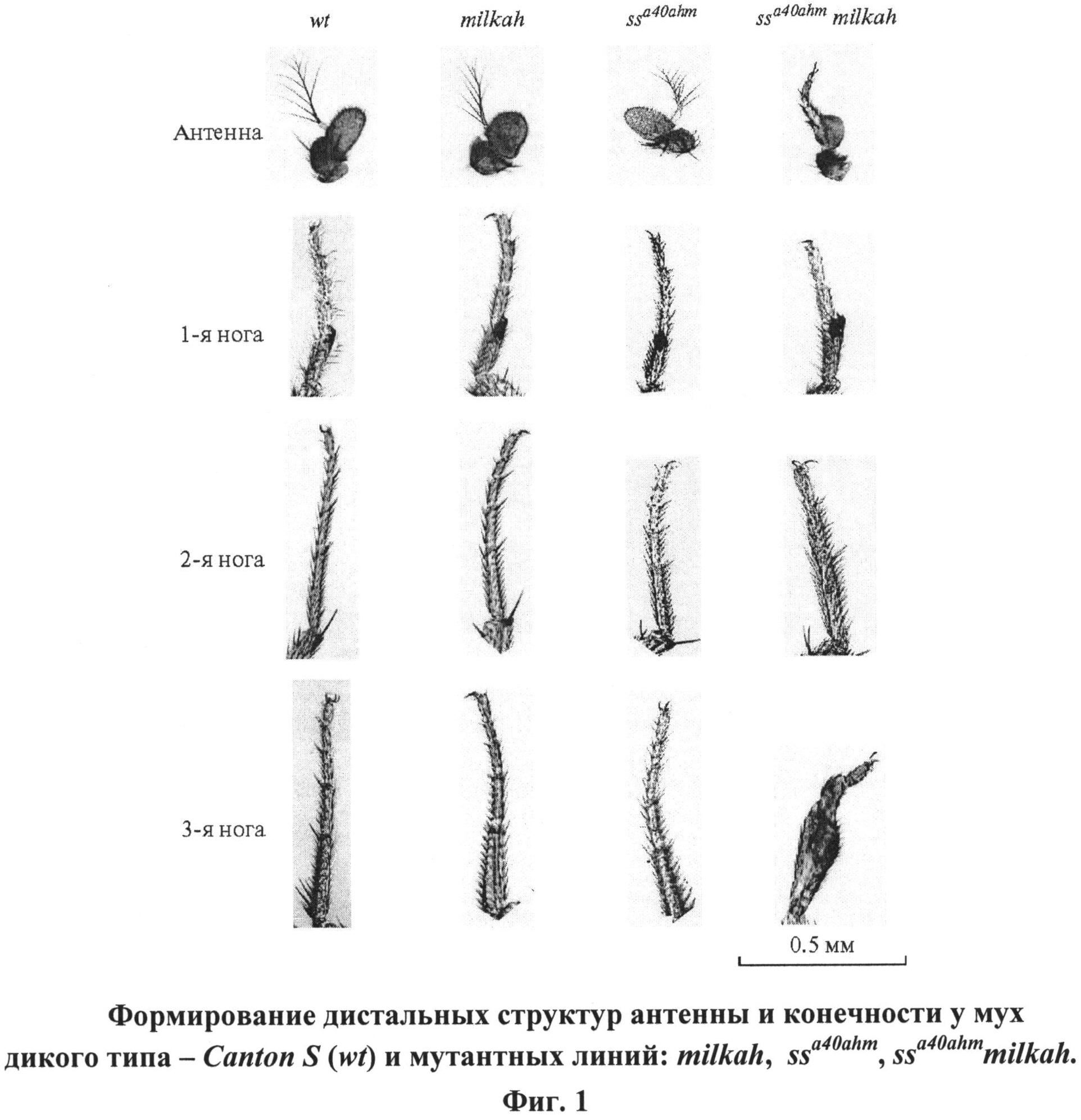
Для усиления демонстрации эффекта взаимодействия гипоморфных мутаций использовали специально отселектированную гипоморфную сублинию мух ssa40ahm, отличающуюся от мух исходной линии ssa40a менее выраженной трансформацией дистальных частей антенны в тарзус и мутантных по локусу CG5017 мух - milkah, не имеющих морфологических нарушений, но отличающихся нарушенной долговременной памятью [4].
Гибридные мухи ssa40ahm CG5017 (milkah) отличаются от ssa40ahm резко усиленным проявлением мутантного ss-фенотипа (фиг.1). На фиг.1 видно усиление мутантного фенотипа у гибридных мух ssa40ahm milkah, проявляющееся в усилении гомеозисной трансформации дистальных структур антенны в тарзус и нарушении сегментации конечности.
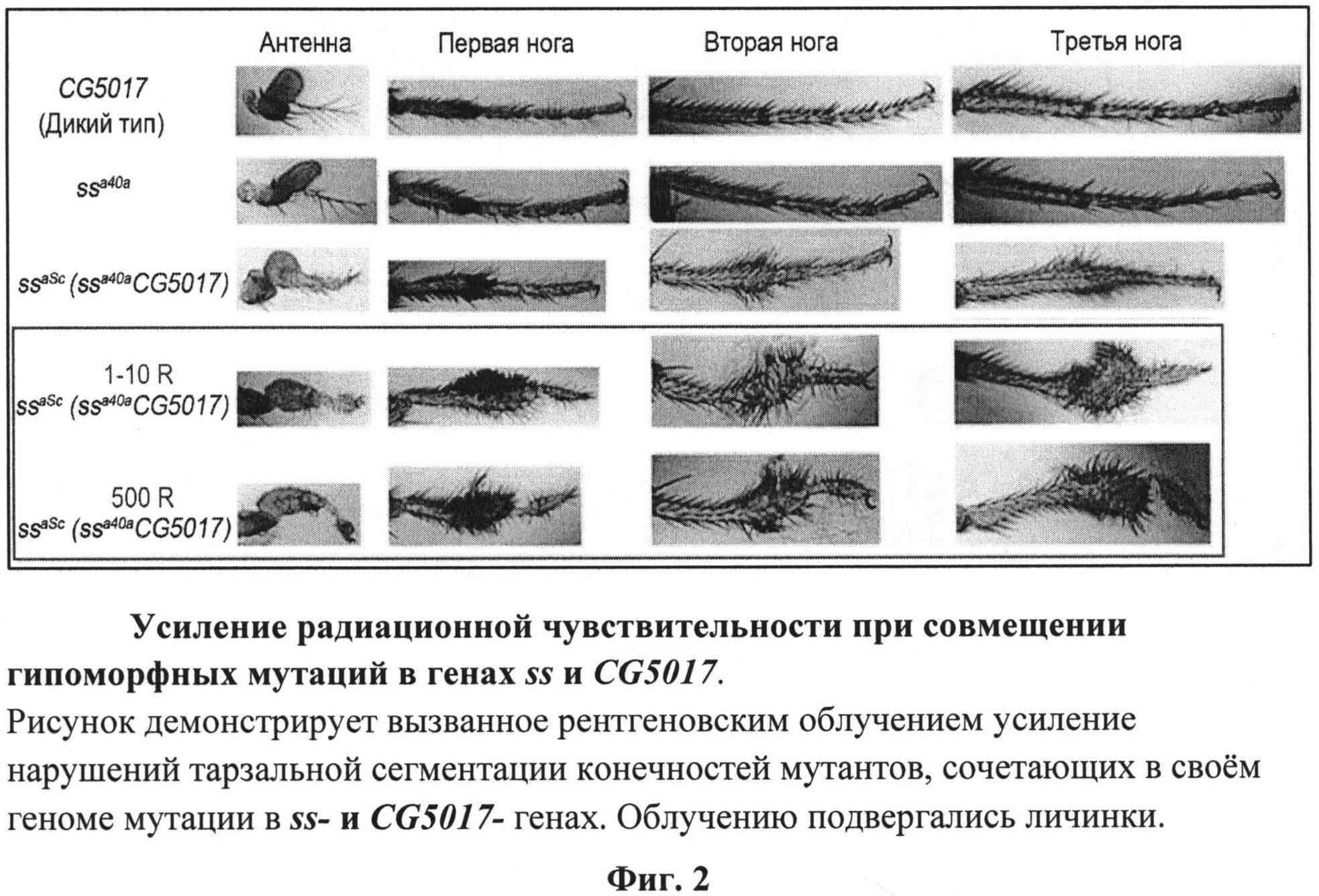
У гибридных мух усиление проявления ss-фенотипа наблюдается не только в антенных структурах, но и в тарзальных сегментах конечностей (Табл.1-2, фиг.2). Их фенотип вполне соответствовал фенотипу мух ssaSc, полученных в независимых экспериментах, в результате скрещивания мух из супермутагенной, дисгенной линии w oc/FM4 с мухами из линии ssa40ahm. Мухи ssaSc, помимо мутации в локусе ss, имеют вставку P-элемента в районе CG5017-гена, что существенно подавляет уровень его экспрессии [5]. Однако проявление мутантного ss-фенотипа у мух, сочетающих мутации в локусах ss- и CG5017-генов, еще более усиливается после облучения личинок третьего возраста развития (табл.1-2, фиг.2).
На фиг.2 и из табл.1-2 видно, что сочетание в геноме сразу двух мутаций в локусах spineless и CG5017 делает организм чувствительным даже к низким дозам радиации 1-10 R, что проявляется в усилении мутантного фенотипа. Важно отметить, что степень мутантного проявления ss-фенотипа зависит также от насыщения питательной среды токсическими продуктами жизнедеятельности личинок дрозофилы. Это означает, что, внося в питательную среду те или иные вещества, можно исследовать их влияние на развитие как в сторону протекции ионизирующего облучения, так и в сторону усиления риска его воздействия. Это влияние можно оценивать по качественным и количественным показателям гомеозисной трансформации антенных структур и нарушению тарзальной сегментации. Представленные результаты и иллюстрирующие их рисунки вместе с обсуждением мы приводим для облегчения использования настоящего технического решения.
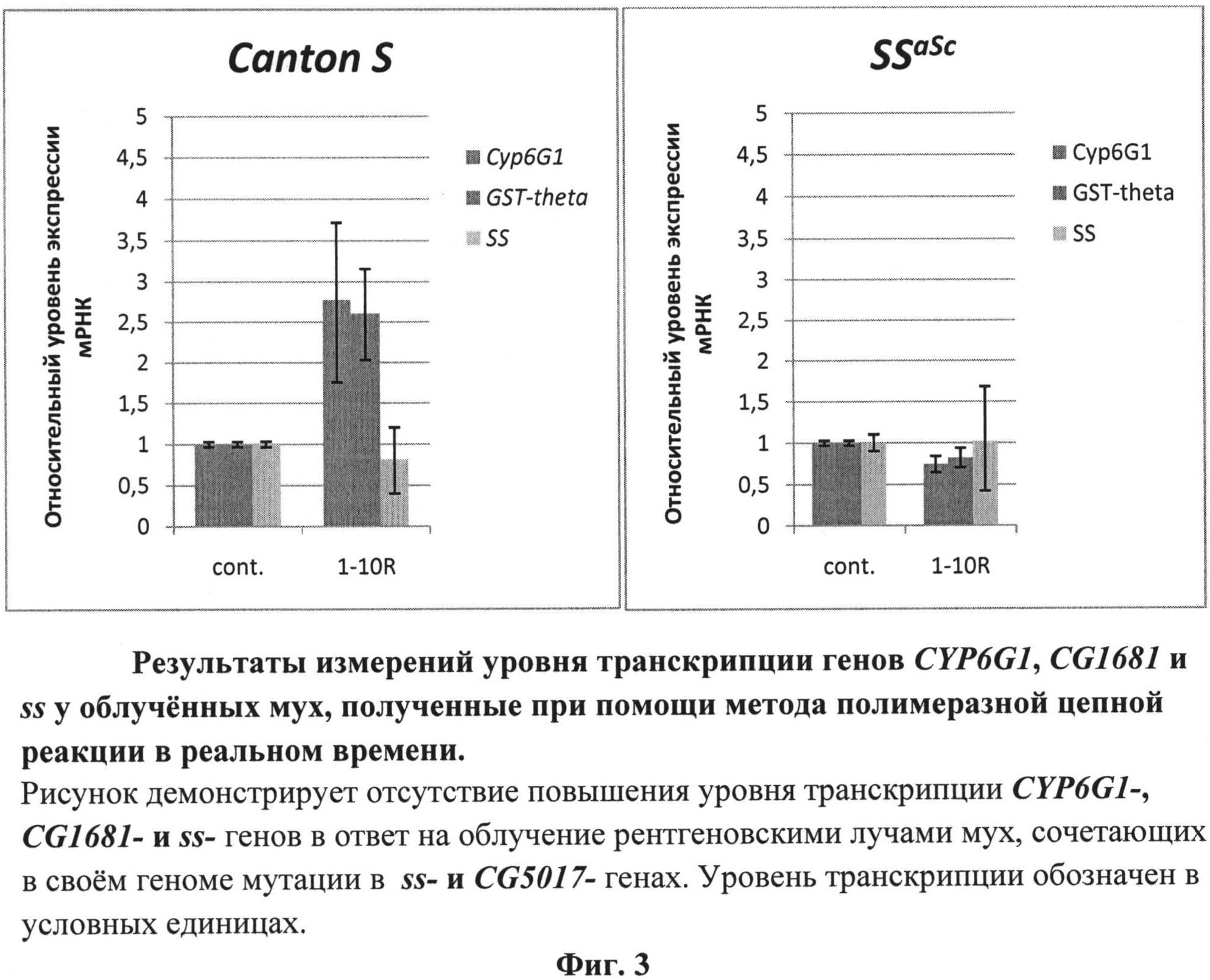
Другим важным показателем влияния фармакологических агентов на AHR может служить оценка их влияния на уровень экспрессии генов CYP (кодируют белки семейства цитохромов Р450) и GST (кодируют белки семейства глютатион S трансфераз). Эти гены участвуют в метаболическом ответе клеток на токсические воздействия супероксидных соединений, резкое повышение уровня которых является основой токсического действия ионизирующего облучения на клетки. Уровень их экспрессии меняется на разных фазах метаболического ответа клеток на токсическое действие супероксидных соединений. Ниже показано изменение уровня экспрессии CG1681 - (относится к семейству GST-генов) и CYP6G1- генов в ответ на рентгеновское облучение у мух нормального генотипа и у мух, сочетающих в своем геноме мутации в локусах ss и CG5017. В структуре обоих генов имеются целевые 8-ми нуклеотидные CRE мотивы узнавания для AHR. Результаты измерений уровня транскрипции CYP6G1 CG1681 и ss у облученных мух, полученные при помощи метода полимеразной цепной реакции, в реальном времени представлены на фиг.3 в виде графиков. Изображенные на фиг.3 графики демонстрируют увеличение уровня транскрипции CG1681- и CYP6G1-генов у мух дикого типа Canton S в ответ на рентгеновское облучение даже в малых дозах в интервале 1-10R. Облучение мух ssaSc, сочетающих в своем геноме мутации в локусах ss и CG5017, приводит к падению уровня транскриптов CYP6G1- и CG1681-генов. Дефицит AHR у этих мух не обеспечивает компенсаторную регуляцию транскрипции CYP6G1- и CG1681-генов, продукты которых востребованы при биодеградации радиотоксинов. Учитывая то обстоятельство, что морфологические нарушения после облучения возникают только у мух ssaSc (табл.1-2, фиг.2), можно сделать вывод, что отсутствие у них компенсаторной регуляции транскрипции CG1681-, CYP6G1- и ss- генов является причиной нарушений морфогенеза конечностей. Отличия в последствиях рентгеновского облучения для мух линии и ssaSc свидетельствуют о повышенном риске реализации сценариев развития патологий у людей, сочетающих в своем геноме различные гипоморфные мутации генов. Использованные линии мух содержат мутации высококонсервативных генов, приводящих к нарушениям развития и метаболизма по сценариям, схожим как у мухи, так и у человека. Поэтому предлагается использование линии мух дрозофилы, сочетающих в своем геноме гипоморфные мутации ss- и CG5017-генов, в качестве чувствительной тест-системы для направленного поиска фармацевтических средств с токсикопротекторными, радиопротекторными, токсикосенсибилизирующими и радиосенсибилизирующими свойствами, способных влиять на токсическое действие радиации и других экзогенных и эндогенных факторов. Найденные с ее помощью фармацевтические агенты с токсикопротекторными, радиопротекторными, токсикосенсибилизирующими и радиосенсибилизирующими свойствами могут оказаться востребованными также в геронтологии, так как с увеличением возраста у человека возрастает риск мозаичного возникновения соматических мутаций.
Далее в примерах приводится описание процедур, необходимых для проведения оценки возможности веществ усиливать или ослаблять действие токсического агента по способности корректировать развитие дистальных структур конечностей и уровень транскрипции CG1681- и CYP6G1-генов у мух дрозофилы сочетающих в своем геноме гипоморфные мутации ss- и CG5017-генов.
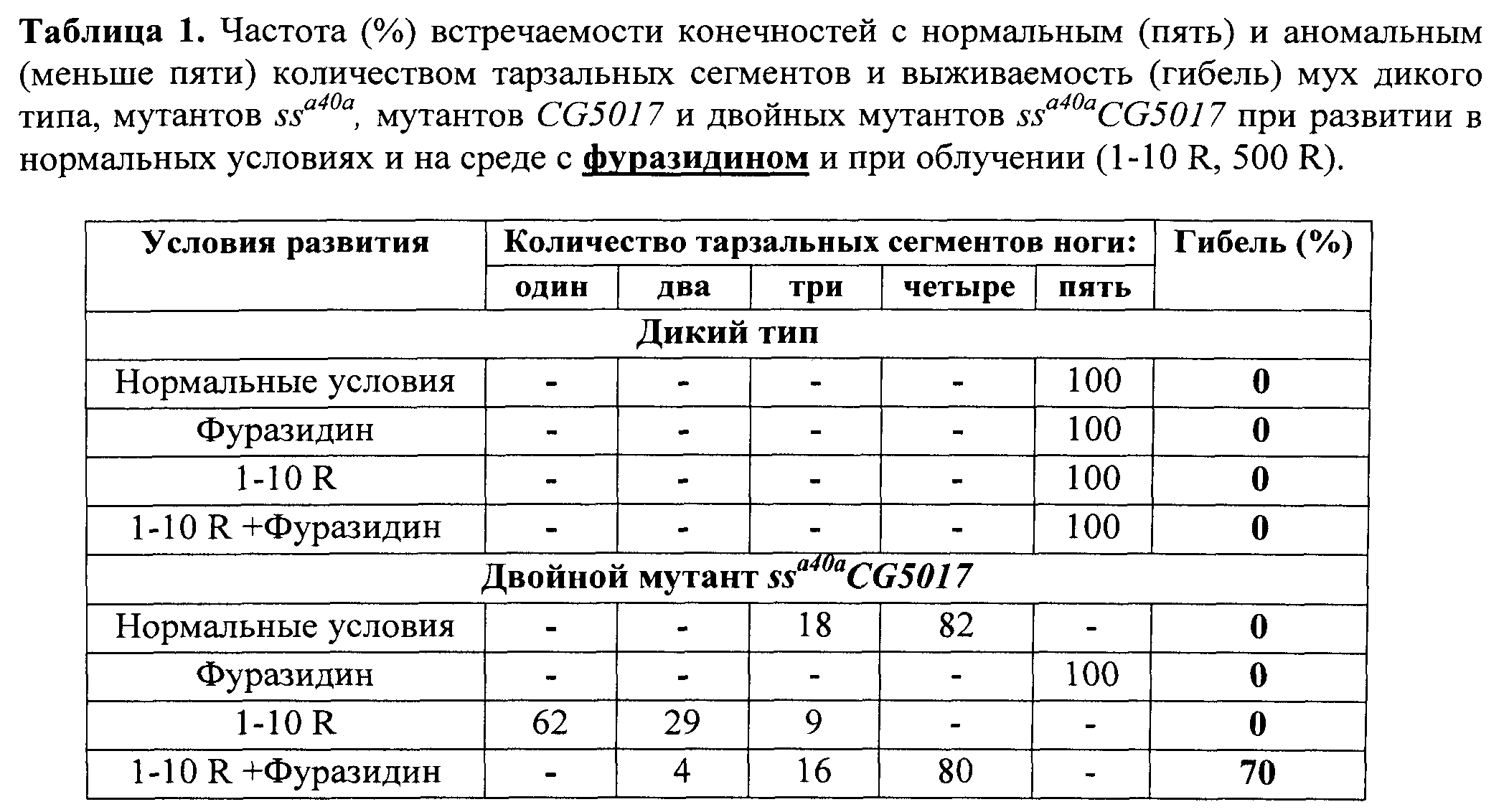
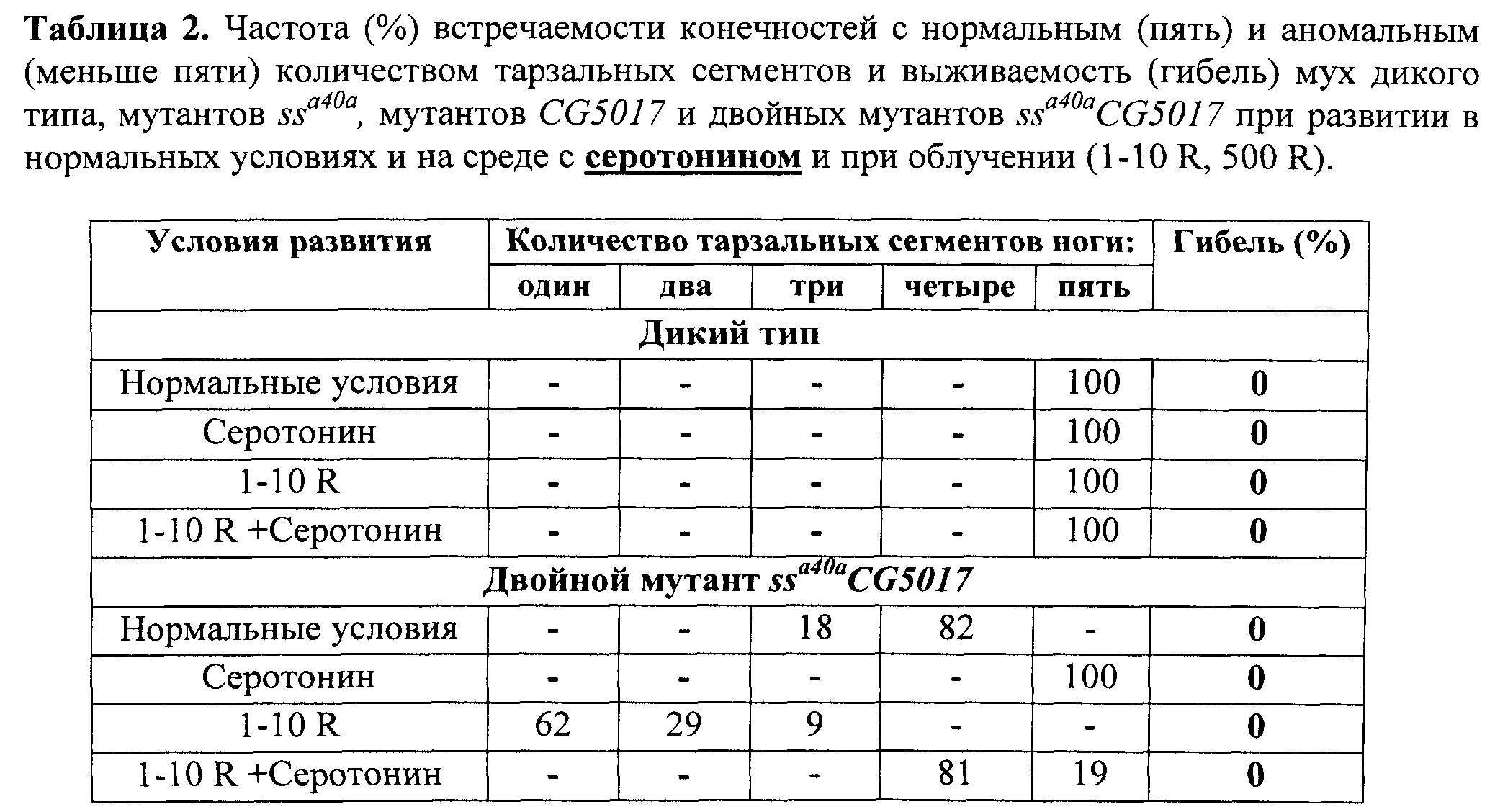
В таблицах 1 и 2 представлена частота встречаемости конечностей с нормальным (пять) и аномальным (меньше пяти) количеством тарзальных сегментов и выживаемость (гибель) мух дикого типа и двойных мутантов ssa40a CG5017 при развитии в нормальных условиях и на среде с фуразидином (табл.1), серотонином (табл.2) и при облучении (1-10 R).
На фиг.1 представлен пример формирования дистальных структур антенны и конечностей у мух дикого типа - Canton S и мутантных линий: ssa40ahm, milkah, ssa40ahmmilkah;
На фиг.2 представлен пример усиления радиационной чувствительности у носителей гипоморфной мутации в гене ss при совмещении ее с мутацией в гене CG5017;
На фиг.3 представлены результаты измерений уровня транскрипции генов CYP6G1, CG1681 и ss у мух до и после облучения.
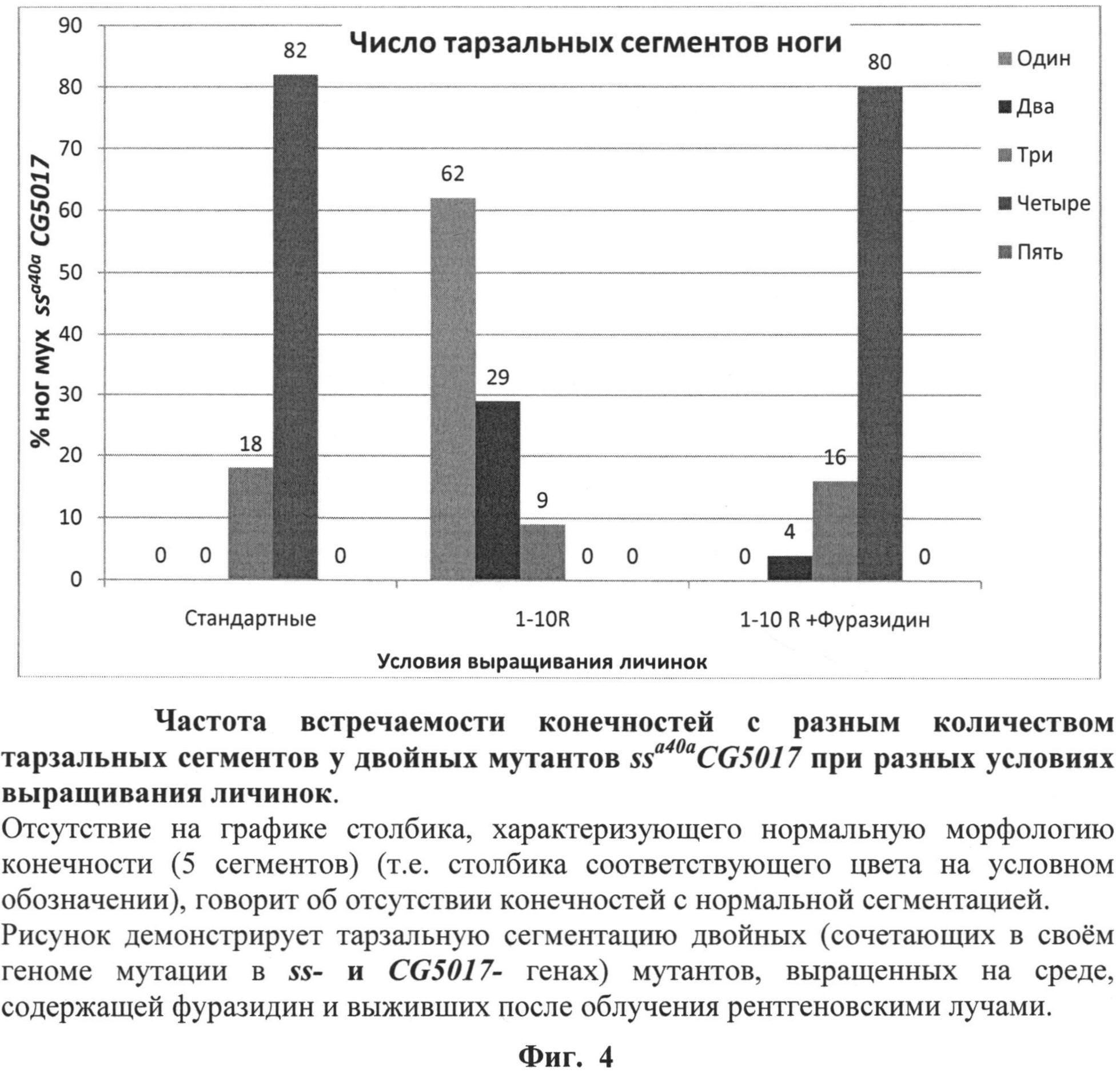
На фиг.4 (см. примеры) представлена частота встречаемости конечностей с разным количеством тарзальных сегментов у двойных мутантов ssa40aCG5017 при выращивании личинок на среде с фуразидином. Зеленый столбик (5 сегментов) характеризует нормальную морфологию конечности.
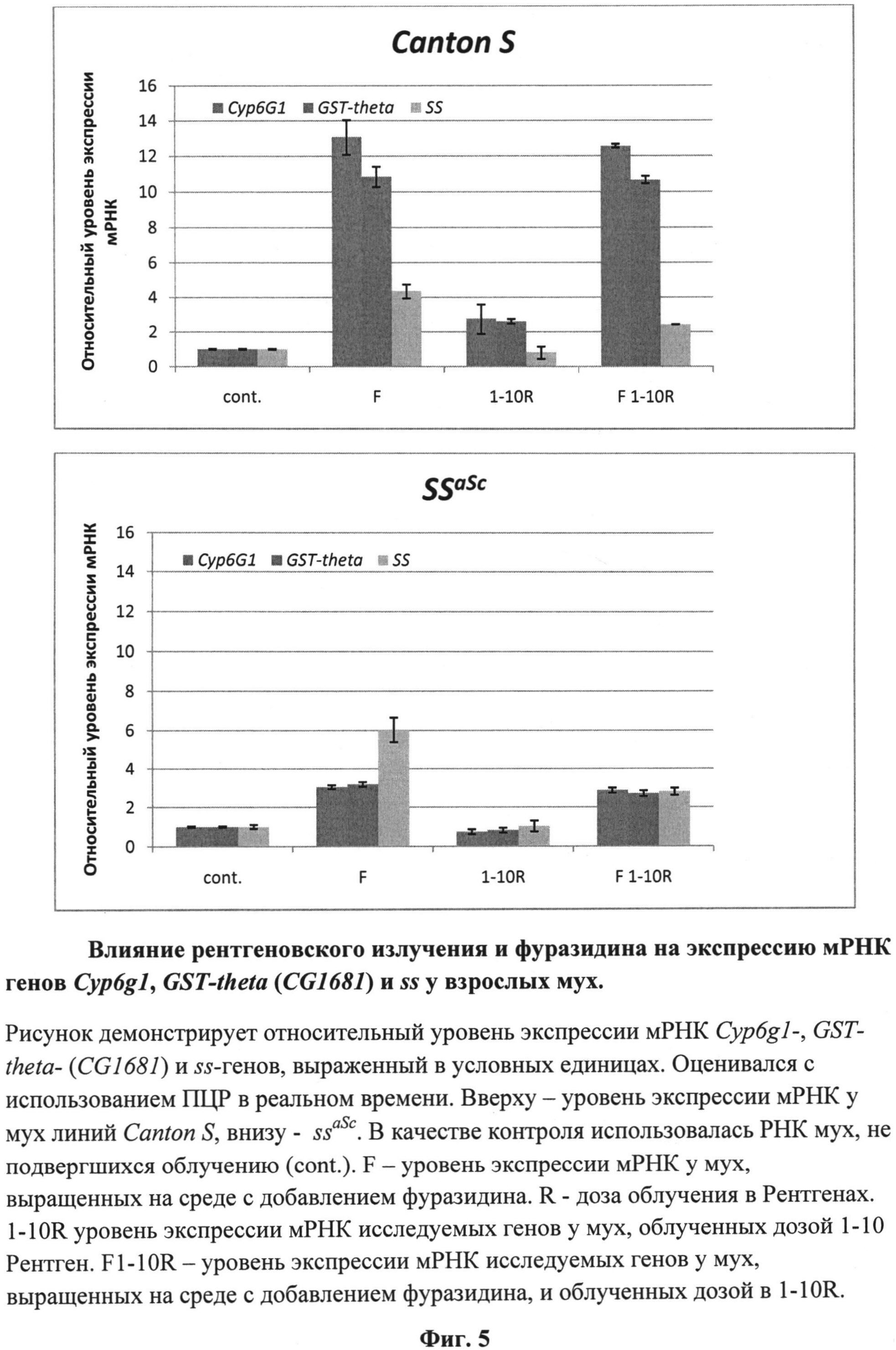
На фиг.5 (см. примеры) представлены результаты измерений уровня транскрипции генов CYP6G1, CG1681 и ss у облученных мух в условиях содержания их личинок на стандартной кормовой среде и среде, содержащей фуразидин.
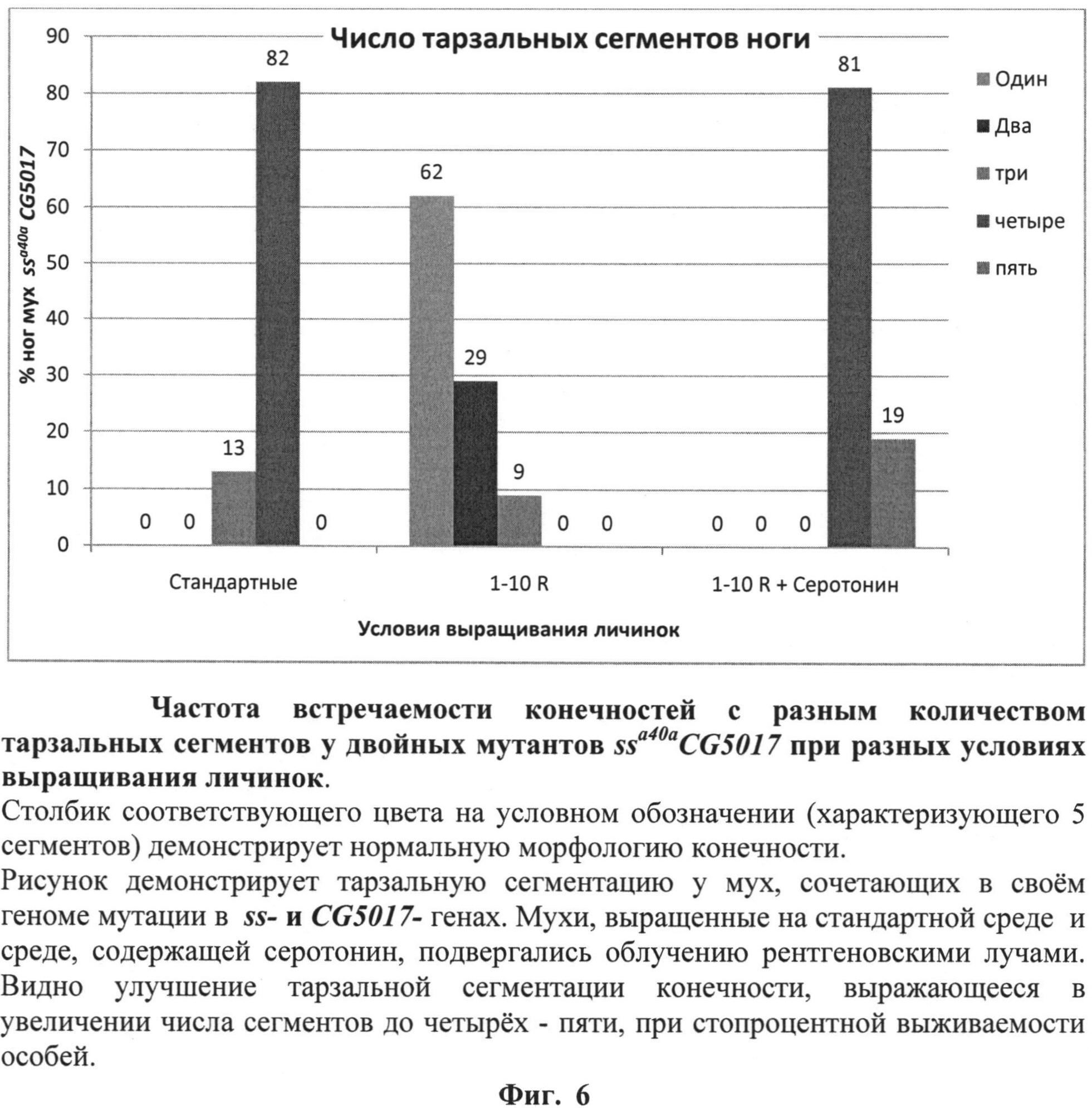
На фиг.6 (см. примеры) представлена частота встречаемости конечностей с разным количеством тарзальных сегментов у двойных мутантов ssa40aCG5017 при выращивании личинок на среде с серотонином. Зеленый столбик (5 сегментов) характеризует нормальную морфологию конечности.
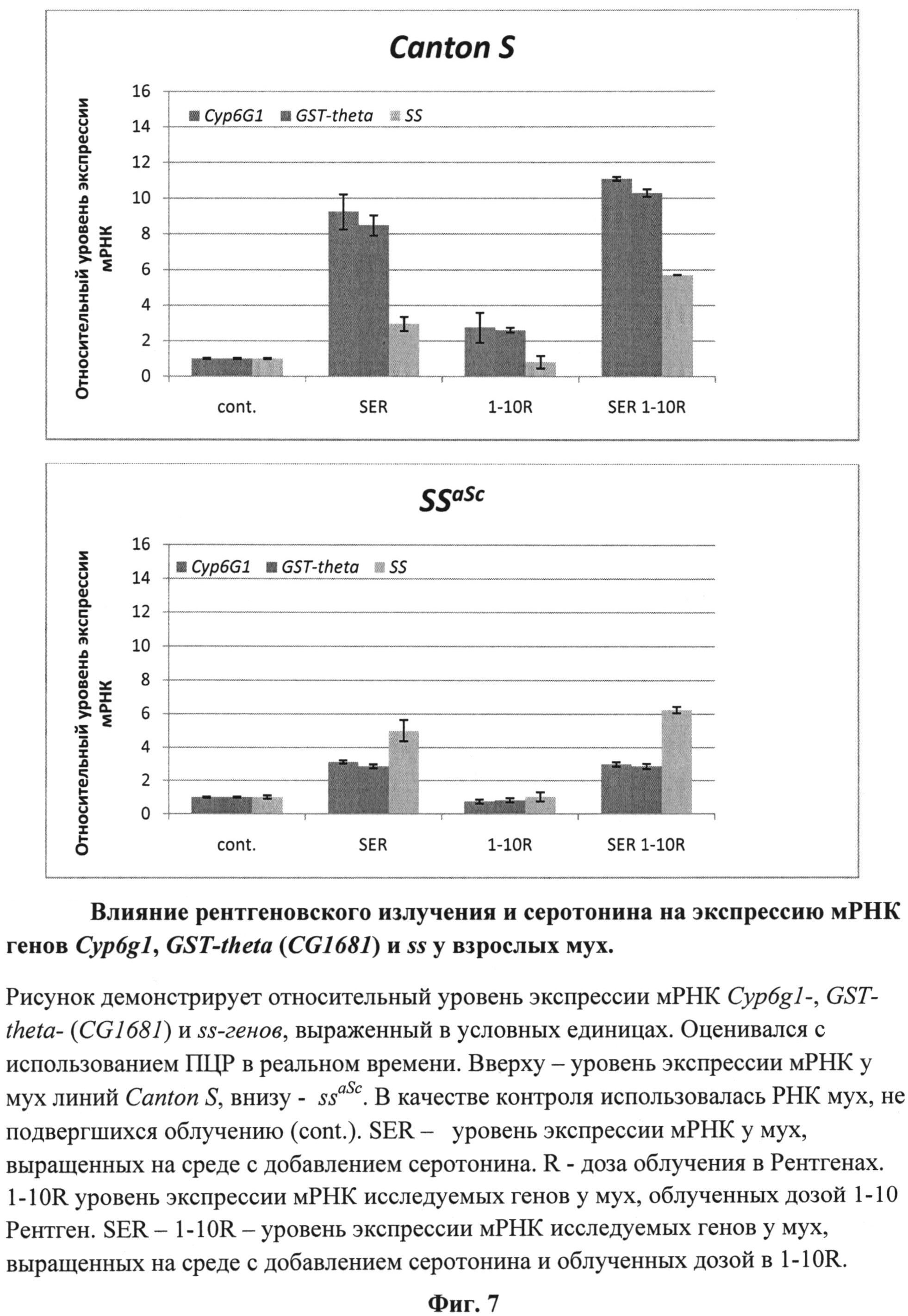
На фиг.7 (см. примеры) представлены результаты измерений уровня транскрипции генов CYP6G1, CG1681 и ss у облученных мух в условиях содержания их личинок на стандартной кормовой среде и среде, содержащей серотонин.
Пример 1. Описание процедур, направленных на оценку свойств фуразидина (Furazidin - производное нитрофурановых соединений) по способности корректировать нарушения развития дистальных структур конечностей имаго и компенсаторной регуляции уровня экспрессии CG1681- (относится к семейству GST-генов) - и CYP6G1-генов в ответ на рентгеновское облучение Drosophila melanogaster.
Для оценки способности фуразидина корректировать последствия действия радиации на развитие структур конечностей и жизнеспособность развивающихся мух отбирали по 600-800 пар самцов и самок линии CS (дикая линия) и ssaSc (сочетающих в своем геноме гипоморфные мутации в локусах ss- и CG5017-генов) Drosophila melanogaster. Отобранных мух каждой линии помещали в отдельную 0,5 литровую бутылку с широким горлом диаметром 30-40 мм (по 150-200 пар мух в одну бутылку). Помимо горлового отверстия, бутылка имела вентиляционное отверстие, закрываемое ватой. В горловое отверстие бутылки вставляли чашку Петри, заполненную стандартной кормовой средой следующего состава: 1% агар, 10% сахароза, 3% сухие дрожжи, 8% кукурузная мука, 28% виноградное вино или сок, 0,002% ингибитор плесени, 50% вода. Через сутки чашку Петри с отложенными яйцами в каждой бутылке меняли на другую со свежей кормовой средой. Поверхность среды с отложенными яйцами освобождали от вылупившихся личинок. Через период времени, составляющий 1-2 часа, вновь вылупившихся личинок отбирали (не менее 200 особей) и переносили по 25-30 личинок в пробирки с 10-ю миллилитрами свежей стандартной питательной среды. Перенесенные в пробирки личинки развивались при температуре 25°C в течение двух суток. Через двое суток прошедших вторую линьку личинок третьего возраста переносили на свежеприготовленную стандартную питательную среду (Carolina Biological Sapply - Formula 4-24) в две пробирки (по 25-30 личинок в каждую) и с дополнительно внесенным фуразидином в концентрации 80 мг/л в две пробирки (по 25-30 личинок в каждую). Еще через сутки половину личинок в каждой группе подвергали облучению рентгеновскими лучами дозой 1-10 R. В качестве источника облучения была использована рентгеновская установка РУМ-17. Таким образом в процессе исследования формировались восемь групп личинок:
1 - группа личинок нормального генотипа (CS), развивавшихся на стандартной среде, не подвергавшихся рентгеновскому облучению;
2 - группа личинок ssaSc, развивавшихся на стандартной среде, не подвергавшихся рентгеновскому облучению.
3 - группа личинок нормального генотипа (CS), развивавшихся на стандартной среде, подвергавшихся рентгеновскому облучению;
4 - группа личинок ssaSc, развивавшихся на стандартной среде, подвергавшихся рентгеновскому облучению;
5 - группа личинок нормального генотипа (CS), развивавшихся на стандартной среде, содержащей фуразидин в концентрации 80 мг/л, не подвергавшихся рентгеновскому облучению.
6 - группа личинок ssaSc, развивавшихся на стандартной среде, содержащей фуразидин в концентрации 80 мг/л, не подвергавшихся рентгеновскому облучению;
7 - группа личинок нормального генотипа (CS), развивавшихся на стандартной среде, содержащей фуразидин в концентрации 80 мг/л, подвергавшихся рентгеновскому облучению;
8 - группа личинок ssaSc, развивавшихся на стандартной среде, содержащей фуразидин в концентрации 80 мг/л, подвергавшихся рентгеновскому облучению.
После завершения процесса личиночного развития и метаморфозы всех имаго собирали, фиксировали в этиловом спирте и анализировали структуры конечностей, оценивая степень трансформации аристы в тарзус и количество тарзальных сегментов конечностей. Оценку свойств фуразидина выполняли, сравнивая структуры 100 конечностей мух каждой из групп - диких и мутантных, выращенных на среде, содержащей фуразидин и выращенных на стандартной питательной среде без добавления фуразидина, облученных и необлученных по количеству тарзальных сегментов конечностей у мух каждой группы. Результаты оценки свойств фуразидина по способности модифицировать действие радиации на развитие конечностей мух линии ssaSc Drosophila melanogaster, сочетающих в своем геноме мутации в локусах ss- и CG5017-генов, представлены в таблице 1 и фиг.4. Представленные результаты свидетельствуют о радиосенсибилизирующих свойствах фуразидина. На это указывает 70%-ная гибель личинок ssaSc, подвергнутых совместному действию радиации и фуразидина. Вместе с тем тарзальная сегментация мух ssaSc, выживших после такого воздействия, существенно нормализуется. У 80% выживших мух тарзусы имели 4 сегмента. Это можно объяснить неполной синхронизацией развития привлеченных в опыт личинок. Для части из них облучение пришлось на наименее радиочувствительный период развития.
Для оценки способности фуразидина корректировать последствия действия радиации, по способности влиять на уровень транскрипции CG1681-, CYP6G1- и ss- генов, собирали по 240 самцов имаго, линии CS и ssaSc Drosophila melanogaster односуточного возраста.
Из отобранных самцов каждой линии формировали по 4 группы по 60 мух в каждой группе.
1-ая группа - линия CS - переносили в пластиковую пробирку с 10 мг свежей питательной среды (Carolina Biological Sapply - Formula 4-24). Через 30 часов мух замораживали и измельчали в жидком азоте.
2-ая группа - линия ssaSc - переносили в пластиковую пробирку с 10 мг свежей питательной среды (Carolina Biological Sapply - Formula 4-24). Через 30 часов мух замораживали и измельчали в жидком азоте.
3-я группа - CS - переносили в пластиковую пробирку с 10 мг свежей питательной среды (Carolina Biological Sapply - Formula 4-24) и через сутки подвергали облучению рентгеновскими лучами. Через 6-7 часов после воздействия облучением мух замораживали и измельчали в жидком азоте.
4-ая группа - ssaSc - переносили в пластиковую пробирку с 10 мг свежей питательной среды (Carolina Biological Sapply - Formula 4-24) и через сутки подвергали облучению рентгеновскими лучами. Через 6-7 часов после воздействия облучением мух замораживали и измельчали в жидком азоте.
5-ая группа - CS - переносили в пластиковую пробирку с 10 мг свежей питательной среды (Carolina Biological Sapply - Formula 4-24), содержащей фуразидин в концентрации 80 мг/л. Через 30 часов мух замораживали и измельчали в жидком азоте.
6-ая группа - ssaSc - переносили в пластиковую пробирку с 10 мг свежей питательной среды (Carolina Biological Sapply - Formula 4-24), содержащей фуразидин в концентрации 80 мг/л. Через 30 часов мух замораживали и измельчали в жидком азоте.
7-ая группа - CS - переносили в пластиковую пробирку с 10 мг свежей питательной среды (Carolina Biological Sapply - Formula 4-24), содержащей фуразидин в концентрации 80 мг/л, и через сутки подвергали облучению рентгеновскими лучами. Через 6-7 часов после воздействия облучением мух замораживали и измельчали в жидком азоте.
8-ая группа - ssaSc - переносили в пластиковую пробирку с 10 мг свежей питательной среды (Carolina Biological Sapply - Formula 4-24), содержащей фуразидин в концентрации 80 мг/л, и через сутки подвергали облучению рентгеновскими лучами. Через 6-7 часов после воздействия облучением мух замораживали и измельчали в жидком азоте.
Из замороженных и измельченных в жидком азоте мух выделяли тотальную РНК с использованием Tri Reagent (Sigma, США) в соответствии с рекомендациями производителя. К измельченным в жидком азоте образцам добавляют Tri Reagent из расчета 1 мл на 100 мг образца. Далее центрифугировали 10 мин при 10000 g. Затем к надосадочной жидкости добавляли хлороформ из расчета 0,2 мл хлороформа на 1 мл TriReagent. Встряхивали на высокой скорости 15 сек. Далее полученную смесь инкубировали 10 мин при комнатной температуре. Затем полученную смесь центрифугировали при 12000 g в течение 15 мин. Отбирали супернатант и проводили фенолхлороформную экстракцию. Далее РНК осаждали в присутствии изопропанола из расчета 0.5 мл изопропанола на 1 мл использованного TriReagent. Полученный осадок РНК промывали 75% этанолом 3 раза. Осадок подсушивали и растворяли в соответствующем объеме стерильной свободной от нуклеаз воды. Все центрифугирования проводили при 4°C. Качество полученной РНК проверяли в 1%-ной агарозе в присутствии бромистого этидия. Для электрофореза РНК смешивали с буфером для нанесения на гель (Formaldehyde loading dye, Ambion, США) из расчета 3 объема буфера на один объем раствора РНК. Затем полученную смесь инкубировали 3 мин при 70°C, после чего полученную смесь инкубировали во льду 5 мин. Затем наносили ее на гель.
Для оценки уровня транскрипции генов ss, CG1681 и CYP6G1 использовали метод ПНР в реальном времени (ПЦР-РВ). При работе над изобретением использовался прибор ABI PRISM® 7500 Sequence Detection System, Applied Biosystems, США. Каждую реакцию повторяли 3 раза в объеме 25 мкл. В работе использован сравнительный, или ddCt, метод, который позволяет оценить изменения уровня мРНК при двойном сравнении: исследуемого гена с контрольным геном между различными образцами. Реакции проводили в режиме относительных измерении (программное обеспечение RQ-relative quantification, Applied Biosystems, США). Для проведения реакций использовали готовые реакционные смеси «Синтол» (Россия). Условия проведения реакции: 10 мин при 95°C («горячий старт» для активации ДНК-полимеразы) и далее - 40 циклов: 15 сек при 95°C (денатурация) и 1 мин при 60°C (отжиг с праймерами и элонгация). Стандартные кривые, т.е. кривые зависимости СТ от десятичного логарифма количества внесенной кДНК (lg C0) для исследованных последовательностей кДНК и вычисление по ним эффективности амплификации для каждой последовательности вычисляли при помощи программного обеспечения ABI Prism 7500 SDS Software Version 2.0.3 (Applied Biosystems, США). Результаты PCR в реальном времени анализировали с помощью программного обеспечения ABI Prism 7500 SDS Software Version 2.0.3 (Applied Biosystems, США) в соответствии с рекомендациями фирмы Applied Biosystems. Для реакций использовали 10 пкМ и 10 пкМ праймеров и линейного разрушаемого зонда (TaqMan®) соответственно. В качестве контрольного гена использовался ген рибосомального белка Rpl32: Для апмлификации использовали следующие пары праймеров и зонды:
для гена Rpl32: праймеры Rpl32dir 5′-CCAGCATACAGGCCCAAGATC-3′, Rpl32rev 5′-ACGCACTCTGTTGTCGATACC-3′, зонд - FAM-CGCACCAAGCACTTCATCCGCCAC-BHQ1;
для гена Cyp6g1: праймеры Cyp6g1f 5′-GCGATCCATTGGGCTATAAT-3′, Cyp6g1r 5′-CCAATCTCCTGCATAAGGGT-3′, зонд - FAM-TCGCACCAAGCTGACTCCCG-BHQ1;
для гена CG1681 (GST-theta): праймеры CG1681f 5′-TTCGCACCCACTCTAGTCAC-3′, CG1681r 5′-GCTCGATTGGTTCAGGAAAT-3′, зонд - FAM-TCAACGAGATGTCGCAGCCACTC-BHQ1;
для гена ss: праймеры SSdir 5′-CGAAGGCGACGCAACGG-3′, SSrev 5′-GATGCCGCTTTGATGGATTGC-3′, зонд - FAM-AGCCTGAAGCCGCCGCCCAAG-BHQ1.
В наших экспериментах зонды были синтезированы в компании «Синтол» (Россия), олигонуклеотидные праймеры - в компании «Литех» (Россия).
Анализ продуктов ПЦР-РВ проводили в 2% агарозном ТАЕ-геле. Все продукты амплификации имели ожидаемый размер.
Результаты анализа уровня транскрипции генов CG1681, CYP6G1 и ss у анализируемых мух представлены на фиг.5.
Комплексная оценка свойств фуразидина позволяет отнести его к токсическим веществам, обладающим токсикосенсибилизирующим и радиосенсибилизирующим действием. Основанием для этого является зарегистрированная нами гибель подавляющего числа личинок линии ssaSc при сочетании действия на них фуразидина и рентгеновского облучения (табл.1). Действие фуразидина вызывает некоторое повышение уровня транскрипции CG1681-, CYP6G1- и ss- генов. Этого достаточно для нормализации тарзальной сегментации у выживших мух, но недостаточно для нейтрализации токсического эффекта.
Пример 2. Описание процедур, направленных на оценку свойств 5-гидрокситриптамина (серотонин) в концентрации 80 мг/л по способности корректировать нарушения развития дистальных структур конечностей имаго и компенсаторной регуляции уровня экспрессии CG1681- (относится к семейству CST-генов) - и CYP6G1-генов в ответ на рентгеновское облучение Drosophila melanogaster.
Для оценки способности свойств 5-гидрокситриптамина корректировать последствия действия радиации на развитие структур конечностей и жизнеспособность развивающихся мух отбирали по 600-800 пар самцов и самок линии CS (дикая линия) и ssaSc (сочетающих в своем геноме гипоморфные мутации в локусах ss- и CG5017-генов) Drosophila melanogaster. Отобранных мух каждой линии помещали в отдельную 0,5 литровую бутылку с широким горлом диаметром 30-40 мм (по 150-200 пар мух в одну бутылку). Помимо горлового отверстия, бутылка имела вентиляционное отверстие, закрываемое ватой. В горловое отверстие бутылки вставляли чашку Петри, заполненную стандартной кормовой средой следующего состава: 1% агара, 10% сахароза, 3% сухие дрожжи, 8% кукурузная мука, 28% виноградное вино или сок, 0,002% ингибитор плесени, 50% вода. Через сутки чашку Петри с отложенными яйцами в каждой бутылке меняли на другую со свежей кормовой средой. Поверхность среды с отложенными яйцами освобождали от вылупившихся личинок. Через период времени, составляющий 1-2 часа, вновь вылупившихся личинок отбирали (не менее 200) и переносили в количестве по 25-30 личинок в пробирки с 10 мг свежей стандартной питательной среды. Перенесенные в пробирки личинки развивались при температуре 25°C в течение двух суток. Через двое суток прошедших вторую линьку личинок третьего возраста переносили на свежеприготовленную стандартную питательную среду (Carolina Biological Sapply - Formula 4-24) в две пробирки (по 25-30 личинок в каждую) и с дополнительно внесенным 5-гидрокситриптамином в концентрации 80 мг/л в две пробирки (по 25-30 личинок в каждую). Еще через сутки половину личинок в каждой группе подвергали облучению рентгеновскими лучами дозой 1-10 R. В качестве источника облучения была использована рентгеновская установка РУМ-17. Таким образом, в процессе исследования формировались восемь групп личинок:
1 - группа личинок нормального генотипа (CS), развивавшихся на стандартной среде, не подвергавшихся рентгеновскому облучению;
2 - группа личинок ssaSc, развивавшихся на стандартной среде, не подвергавшихся рентгеновскому облучению.
3 - группа личинок нормального генотипа (CS), развивавшихся на стандартной среде, подвергавшихся рентгеновскому облучению;
4 - группа личинок ssaSc, развивавшихся на стандартной среде, подвергавшихся рентгеновскому облучению;
5 - группа личинок нормального генотипа (CS), развивавшихся на стандартной среде, содержащей серотонин в концентрации 80 мг/л, не подвергавшихся рентгеновскому облучению;
6 - группа личинок ssaSc, развивавшихся на стандартной среде, содержащей серотонин в концентрации 80 мг/л, не подвергавшихся рентгеновскому облучению;
7 - группа личинок нормального генотипа (CS), развивавшихся на стандартной среде, содержащей серотонин в концентрации 80 мг/л, подвергавшихся рентгеновскому облучению;
8 - группа личинок ssaSc, развивавшихся на стандартной среде, содержащей серотонин в концентрации 80 мг/л, подвергавшихся рентгеновскому облучению;
После завершения процесса личиночного развития и метаморфозы всех имаго собирали, фиксировали в этиловом спирте и анализировали структуры конечностей, оценивая степень трансформации аристы в тарзус и количество тарзальных сегментов конечностей. Оценку свойств серотонина выполняли, сравнивая труктуры 100 конечностей мух каждой из групп - диких и мутантных, выращенных на среде, содержащей серотонин, и выращенных на стандартной питательной среде без добавления 5-гидрокситриптамина, облученных и необлученных по количеству тарзальных сегментов конечностей у мух каждой группы. Результаты оценки свойств серотонина по способности модифицировать действие радиации на развитие конечностей мух линии ssaSc Drosophila melanogaster, сочетающих в своем геноме мутации в локусах ss- и CG5017-генов, представлены в таблице 2 и фиг.6.
Для оценки способности свойств серотонина корректировать последствия действия радиации по способности влиять на уровень транскрипции CG1681-, CYP6G1- и ss-генов, у мух линии ssaSc, Drosophila melanogaster, сочетающих в своем геноме гипоморфные мутации в локусах ss- и CG5017-генов, собирали по 240 самцов имаго линии CS и ssaSc Drosophila melanogaster односуточного возраста.
Отобранных самцов Drosophila melanogaster разделяли на группы по 60 мух.
1-ая группа - CS - переносили в пластиковую пробирку с 10 мг свежей питательной среды (Carolina Biological Sapply - Formula 4-24). Через 30 часов мух замораживали и измельчали в жидком азоте.
2-ая группа - ssaSc - переносили в пластиковую пробирку с 10 мг свежей питательной среды (Carolina Biological Sapply - Formula 4-24). Через 30 часов мух замораживали и измельчали в жидком азоте.
3-я группа - CS - переносили в пластиковую пробирку с 10 мг свежей питательной среды (Carolina Biological Sapply - Formula 4-24) и через сутки подвергали облучению рентгеновскими лучами. Через 6-7 часов после воздействия облучением мух замораживали и измельчали в жидком азоте.
4-ая группа - ssaSc - переносили в пластиковую пробирку с 10 мг свежей питательной среды (Carolina Biological Sapply - Formula 4-24) и через сутки подвергали облучению рентгеновскими лучами. Через 6-7 часов после воздействия облучением мух замораживали и измельчали в жидком азоте.
5-ая группа - CS - переносили в пластиковую пробирку с 10 мг свежей питательной среды (Carolina Biological Sapply - Formula 4-24), содержащей серотонин в концентрации 80 мг/л. Через 30 часов мух замораживали и измельчали в жидком азоте.
6-ая группа - ssaSc - переносили в пластиковую пробирку с 10 мг свежей питательной среды (Carolina Biological Sapply - Formula 4-24), содержащей серотонин в концентрации 80 мг/л. Через 30 часов мух замораживали и измельчали в жидком азоте.
7-ая группа - CS - переносили в пластиковую пробирку с 10 мг свежей питательной среды (Carolina Biological Sapply - Formula 4-24), содержащей серотонин в концентрации 80 мг/л, и через сутки подвергали облучению рентгеновскими лучами. Через 6-7 часов после воздействия облучением мух замораживали и измельчали в жидком азоте.
8-ая группа - ssaSc - переносили в пластиковую пробирку с 10 мг свежей питательной среды (Carolina Biological Sapply - Formula 4-24), содержащей серотонин в концентрации 80 мг/, и через сутки подвергали облучению рентгеновскими лучами. Через 6-7 часов после воздействия облучением мух замораживали и измельчали в жидком азоте.
Из замороженных и измельченных в жидком азоте мух выделяли тотальную РНК с использованием Tri Reagent (Sigma, США) в соответствии с рекомендациями производителя. К измельченным в жидком азоте образцам добавляют Tri Reagent из расчета 1 мл на 100 мг образца. Далее центрифугируют 10 мин при 10000 g. Затем к надосадочной жидкости добавляли хлороформ из расчета 0,2 мл хлороформа на 1 мл TriReagent. Встряхивали на высокой скорости 15 сек. Далее полученную смесь инкубировали 10 мин при комнатной температуре. Затем полученную смесь центрифугировали при 12000 g в течение 15 мин. Отбирали супернатант и проводили фенолхлороформную экстракцию. Далее РНК осаждали в присутствии изопропанола из расчета 0.5 мл изопропанола на 1 мл использованного TriReagent. Полученный осадок РНК промывали 75% этанолом 3 раза. Осадок подсушивали и растворяли в соответствующем объеме стерильной свободной от нуклеаз воды. Все центрифугирования проводили при 4°C. Качество полученной РНК проверяли в 1%-ной агарозе в присутствии бромистого этидия. Для электрофореза РНК смешивали с буфером для нанесения на гель (Formaldehyde loading dye, Ambion, США) из расчета 3 объема буфера на один объем раствора РНК. Затем полученную смесь инкубировали 3 мин при 70°C, после чего полученную смесь инкубировали во льду 5 мин. Затем наносили ее на гель.
Для оценки уровня транскрипции CG1681- и CYP6G1-генов использовали метод ПНР в реальном времени (ПЦР-РВ). При работе над изобретением использовался прибор ABI PRISM® 7500 Sequence Detection System, Applied Biosystems, США. Каждую реакцию повторяли 3 раза в объеме 25 мкл. В работе использован сравнительный, или ddCt, метод, который позволяет оценить изменения уровня мРНК при двойном сравнении: исследуемого гена с контрольным геном между различными образцами. Реакции проводили в режиме относительных измерений (программное обеспечение RQ-relative quantification, Applied Biosystems, США). Для проведения реакций использовали готовые реакционные смеси «Синтол» (Россия). Условия проведения реакции: 10 мин при 95°C («горячий старт» для активации ДНК-полимеразы) и далее - 40 циклов: 15 сек при 95°C (денатурация) и 1 мин при 60°C (отжиг с праймерами и элонгация). Стандартные кривые, т.е. кривые зависимости СТ от десятичного логарифма количества внесенной кДНК (lg C0), для исследованных последовательностей кДНК и вычисление по ним эффективности амплификации для каждой последовательности вычисляли при помощи программного обеспечения ABI Prism 7500 SDS Software Version 2.0.3 (Applied Biosystems, США). Результаты PCR в реальном времени анализировали с помощью программного обеспечения ABI Prism 7500 SDS Software Version 2.0.3 (Applied Biosystems, США) в соответствии с рекомендациями фирмы Applied Biosystems. Для реакций использовали 10 пкМ и 10 пкМ праймеров и линейного разрушаемого зонда (TaqMan®) соответственно. В качестве контрольного гена использовался ген рибосомального белка Rpl32. Для апмлификации использовали следующие пары праймеров и зонды:
для гена Rpl32: праймеры Rpl32dir 5′-CCAGCATACAGGCCCAAGATC-3′, Rpl32rev 5′-ACGCACTCTGTTGTCGATACC-3′, зонд - FAM-CGCACCAAGCACTTCATCCGCCAC-BHQ1;
для гена Cyp6g1: праймеры Cyp6g1f 5′-GCGATCCATTGGGCTATAAT-3′, Cyp6g1r 5′-CCAATCTCCTGCATAAGGGT-3′, зонд - FAM-TCGCACCAAGCTGACTCCCG-BHQ1;
для гена CG1681 (GST-theta): праймеры CG1681f5′-TTCGCACCCACTCTAGTCAC-3′, CG1681r 5′-GCTCGATTGGTTCAGGAAAT-3′, зонд - FAM-TCAACGAGATGTCGCAGCCACTC-BHQ1;
для гена ss: праймеры SSdir 5′-CGAAGGCGACGCAACGG-3′, SSrev 5′-GATGCCGCTTTGATGGATTGC-3′, зонд - FAM-AGCCTGAAGCCGCCGCCCAAG-BHQ1.
В наших экспериментах зонды были синтезированы в компании «Синтол» (Россия), олигонуклеотидные праймеры - в компании «Литех» (Россия). Анализ продуктов ПЦР-РВ проводили в 2% агарозном ТАЕ-геле. Все продукты амплификации имели ожидаемый размер.
Результаты анализа уровня транскрипции CG1681-, CYP6G1- и ss-генов у анализируемых мух представлены на фиг.7.
Комплексная оценка свойств серотонина позволяет отнести его к веществам, обладающим радиопротекторным действием. Основанием для этого является зарегистрированное нами существенное улучшение сегментации тарзальных структур конечностей имаго ssaSc, подвергнутых в личиночный период развития рентгеновскому облучению в сочетании с действием серотонина. Улучшение, выражается в увеличении числа тарзальных сегментов до четырех-пяти при стопроцентной выживаемости. По-видимому, причиной этого является повышение уровня транскрипции ss-гена в 6 раз (фиг.7).
Совокупность признаков изобретения в виде использования мух Drosophila melanogaster, сочетающих в своем геноме гипоморфные мутации ss- и CG5017-генов, для оценки испытуемого вещества по способности корректировать вызванные радиационным излучением нарушения развития конечностей имаго и транскрипции CG1681- и CYP6G1- и ss- генов позволяет обеспечить получение технического результата в виде эффективного быстрого направленного отбора и определения свойств веществ с токсикопротекторными, радиопротекторными, токсикосенсибилизирующими и радиосенсибилизирующими свойствами.
Изобретение предназначено для использования в фармакологических фирмах и научно-исследовательских институтах медицинского и биологического профиля, для лабораторно-экспериментальной оценки фармакологических, токсикологических и фармацевтических свойств веществ с предполагаемыми токсикопротекторными, радиопротекторными, токсикосенсибилизирующими и радиосенсибилизирующими свойствами, при изучении свойств веществ, способных повышать или понижать токсичность действия ионизирующего излучения на биологический объект, с целью вынесения рекомендаций и заключений по их применению. Использованная в изобретении линия мух содержат мутации высококонсервативных генов, приводящих к нарушениям развития и метаболизма по сценариям, схожим как у мухи, так и у человека. Поэтому предлагается использовать их в качестве чувствительной тест-системы поиска фармацевтических средств, способных влиять на токсическое действие радиации и других экзогенных и эндогенных факторов. Найденные при использовании предлагаемого изобретения фармацевтические агенты могут оказаться востребованными также в геронтологии, так как с увеличением возраста у человека возрастает риск мозаичного возникновения соматических мутаций.
Источники
1. (KR 20120020820 (A) - SCREENING METHOD OF A TOXIC MATERIAL POLLUTING INTERIOR ATMOSPHERE USING DROSOPHILA MELANOGASTER).
2. Jux B. et al. 2011 Journal of Investigative Dermatology 131, 203-210.
3. Dranovsky et al. 2011, Neuron 70, 908-923, June 9, 2011.
4. Dubnau et al., 2003, Current Biology, Vol.13, 286-296, February 18.
5. Кузин Б.А. и др. 2010. Онтогенез. 2010. Т.41. №5. С.364-370.