Результат интеллектуальной деятельности: ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Данное изобретение относится к новым соединениям - замещенным [1,2,4]триазоло[4,3-а]пиридинам, проявляющим антагонистическую активность по отношению к аденозиновым А2А рецепторам, и к их применению в качестве лекарственной субстанции, фармацевтических композиций, лекарственных средств и адьювантов. Изобретение относится также к способам лечения нарушений деятельности центральной нервной системы (ЦНС), нейродегенеративных, воспалительных, инфекционных и онкологических заболеваний.
Аденозин регулирует множество физиологических функций, в частности, действует как цитопротектор в нормальных и патофизиологических условиях в ответ на стресс в органах и тканях [Haskó G, Linden J, Cronstein B, Pacher P. Adenosine receptors: therapeutic aspects for inflammatory and immune diseases. Nat Rev Drug Discov. 2008; 7: 759-770]. Этот защитный ответ может проявляться как усиление кровоснабжения (вазодиляция или ангиогенез), ишемическое прекондиционирование [Akaiwa K, Akashi H, Harada H, Sakashita H, Hiromatsu S, Kano Т, Aoyagi S. Moderate cerebral venous congestion induces rapid cerebral protection via adenosine A1 receptor activation. Brain Res. 2006; 1122: 47-55], и/или противовоспалительное действие (активация и инфильтрация воспалительных клеток, продукция цитокинов и свободных радикалов) [Ohta A, Sitkovsky M. Role of G-protein-coupled adenosine receptors in downregulation of inflammation and protection from tissue damage. Nature. 2001; 41: 916-920]. Экстрацеллюлярный аденозин действует на находящиеся на клеточной мембране рецепторы, активируя соответствующие внутриклеточные сигнальные каскады.
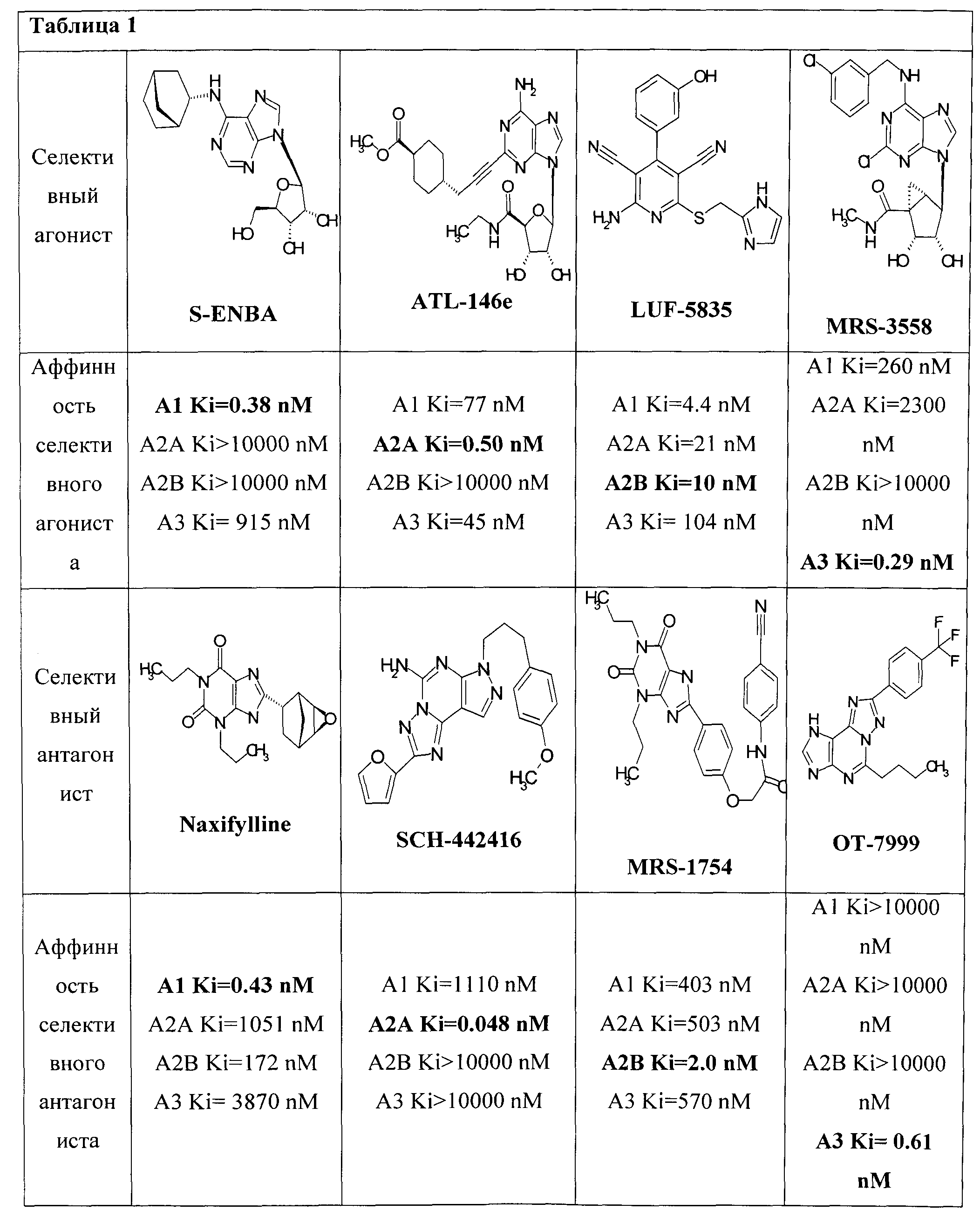
Существуют четыре подтипа аденозиновых рецепторов, обозначаемых как A1, A2A, А2В и A3 (Таблица 1), каждый из которых обладает уникальными фармакологическим профилем, тканевым распределением и связыванием с эффекторными молекулами [Fredholm BB, IJzerman АР, Jacobson KA, Klotz KN, Linden J. International Union of Pharmacology. XXV. Nomenclature and classification of adenosine receptors. Pharmacol Rev. 2001; 53: 527-552]. Все аденозиновые рецепторы относятся к семейству рецепторов, связанных с G-белками (GPCRs), структурно напоминая рецепторы биогенных аминов.
|
|
Активация А1 рецепторов приводит к ингибированию аденилатциклазы посредством связанных с рецепторами А1 Gi/o - белками [Londos С, Cooper DM, Wolff J. Subclasses of external adenosine receptors. PNAS USA. 1980; 77: 2551-2554], а также увеличивает активность фосфолипазы С PLC [Rogel A, Bromberg Y, Sperling О, Zoref-Shani E. Phospholipase С is involved in the adenosine activated signal transduction pathway conferring protection against iodoacetic acid-induced injury in primary rat neuronal cultures. Neurosci Lett. 2005; 373: 218-221]. Рецепторы А1 активируют калиевые каналы, в том числе каналы КАТР, и блокируют Q-, Р- и N-типы кальциевых Са2+ каналов.
Активация А2А рецепторов увеличивает активность аденилатциклазы. В периферической системе основными белками, сопряженными с А2А рецепторами, являются Gs-белки. В стриатуме, где содержание А2А рецепторов максимальное, они сопряжены с белками Golf [Kull В, Svenningsson Р, Fredholm ВВ. Adenosine А2А receptors are colocalized with and activate Golf in rat striatum. Mol Pharmacol. 2000; 58: 771-777], которые подобно Gs-белкам связаны с аденилатциклазой. Рецепторы А2А способны включать PLC-сигнальный каскад, индуцируют синтез инозитолфосфата и увеличивают внутриклеточную концентрацию кальция, а также активируют протеин киназу С.
Рецепторы А2 В позитивно сопряжены с аденилатциклазой и фосфолипазой С. Многие функции рецепторов А2В определяются фосфолипазой С, которая активируется посредством белков Gq [Linden J, Thai T, Figler H, Jin X, Robeva AS. Characterization of human A2B adenosine receptors: radioligand binding, western blotting, and coupling to Gq in human embryonic kidney 293 cells and HMC-1 mast cells. Mol Pharmacol. 1999; 56: 705-713]. Эти рецепторы участвуют также в сигнальном каскаде арахидоновой кислоты [Donoso MV, Lopez R, Miranda R, Briones R, Huidobro-Toro JP. A2B adenosine receptor mediates human chorionic vasoconstriction and signals through the arachidonic acid cascade. Am J Physiol Heart Circ Physiol. 2005; 288: H2439-H2449].
Рецепторы A3 участвуют в классических сигнальных путях, ингибируя аденилатциклазу, стимулируя фосфолипазу С и вызывая мобилизацию ионов кальция [Zhou QY, et al. Molecular cloning and characterization of an adenosine receptor: the A3 adenosine receptor. PNAS USA. 1992; 89: 7432-7436]. Агонисты A3 рецепторов подавляют рост клеток меланомы, участвуя в WNT-сигнальном каскаде [Fishman P, et al. Evidence for involvement of Wnt signaling pathway in IB-MECA mediated suppression of melanoma cells. Oncogene. 2002; 21: 4060-4064].
Малые молекулы - модуляторы аденозиновых рецепторов могут найти широкое применение в фармакологии и медицине. В настоящее время известно большое число веществ, обладающих сродством к рецепторам аденозина, однако большинство из них не являются селективными. Неселективные лиганды аденозиновых рецепторов (например, некоторые аналоги аденина и ксантины) обладают очень сложным фармакологическим профилем, поэтому имеют крайне ограниченное клиническое применение (исключение - неселективный слабо аффинный кофеин). Поэтому поиск селективных аденозиновых лигандов является актуальной задачей. Особое значение имеют селективные антагонисты А2А рецепторов.
Большое количество научных работ и патентов посвящено использованию антагонистов А2А рецепторов в качестве лекарственных кандидатов для лечения заболеваний ЦНС, к которым относятся, в частности:
- болезнь Паркинсона [Pinna A. Novel investigational adenosine А2А receptor antagonists for Parkinson's disease. Expert Opin Invest Drugs. 2009; 18(11): 1619-1631];
- болезнь Альцгеймера и другие когнитивные нарушения [Takahashi RN, Pamlona FA, Prediger RD. Adenosine receptor antagonists for cognitive dysfunction: a review of animal studies. Front Biosci. 2008; 13: 2614-32];
- ишемия мозга и инсульт [Monopoli A, Lozza G, Forlani A, Mattavelli A, Ongini E. Blockade of adenosine A2A receptors by SCH 58261 results in neuroprotective effects in cerebral ischaemia in rats. Neuroreport. 1998; 9(17): 3955-3959];
- психические расстройства [Wardas J. Potential role of adenosine A2A receptors in the treatment of schizophrenia. Front Biosci., 2008; 13: 4071-4096];
- другие нейродегенеративные заболевания и зависимости [Ribeiro JA, Sebastião AM, de Mendonça A. Adenosine receptors in the nervous system: pathophysiological implications. Prog Neurobiol. 2002; 68(6): 377-392].
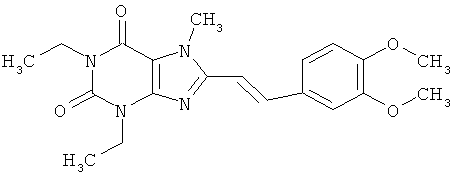
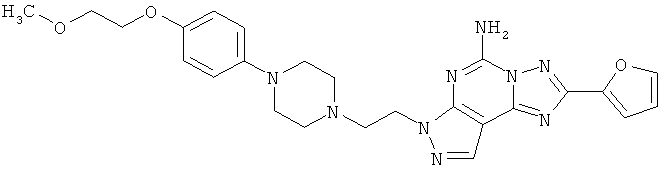
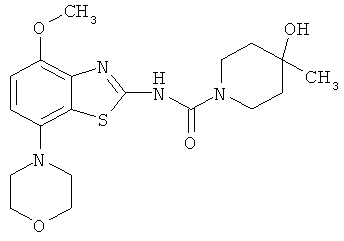
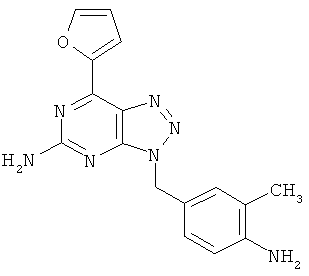
Перспективность поиска селективных аденозиновых А2А-лигандов подтверждается целой серией ЦНС-лекарственных кандидатов, находящихся в настоящее время на разных стадиях клинических испытаний (таблица 2) [http://www.integrity.prous.com]:
|
|
|
|
|
Ранее было показано, что аденозин, который накапливается вблизи опухолевой ткани [BIay J, White TD, Oskin DW. The Extracellular Fluid of Solid Carcinomas Contains immunosuppressive Concentrations of Adenosine. Cancer Research. 1997; 57: 2602-2605], существенно подавляет способность активированных Т-лимфоцитов и натуральных клеток-киллеров связываться с опухолевыми клетками и убивать их [Hoskin DW, Reynolds Т, Blay J. Adenosine as a possible inhibitor of killer T-cell activation in the microenvironment of solid tumours. Int J Cancer. 1994; 59: 854-855]. Гипоксия, развивающаяся в условиях солидных опухолей, приводит к повышению концентрации аденозина вблизи опухолевой ткани. Аденозин, связываясь с аденозиновыми рецепторами типа А2А, находящимися на клеточной мембране лимфоцитов, передает аденозиновый сигнал внутрь клеток, который снижает способность лимфоцитов атаковать опухолевую ткань [Sitkovsky MV, Kjaergaard J, Lukashev D, Ohta A. Hypoxia-Adenosinergic Immunosuppression: Tumor Protection by Т Regulatory Cells and Cancerous Tissue Hypoxia. Clin Cancer Res. 2008; 14(19): 5947-5952]. На этом основании предложен новый подход к усилению эффективности противоопухолевой терапии (в частности, вакцин) с помощью адьюванта, являющегося антагонистом А2А рецепторов [Ohta A, Sitkovsky M. Methods and composition for improving immune responses. WO 2008/147482 04.12.2008].
Исследования показали, что агонисты рецепторов аденозина А2А являются важными регуляторами воспалительных процессов. Было показано, что агонисты А2А обладают противовоспалительными свойствами in vitro и in vivo. Аденозин, вступая во взаимодействие с поверхностными рецепторами А1, А2А, А2В и A3, имеет разное биологическое действие. Из всех четырех рецепторов А2А наиболее распространен и тесно связан с воспалительной реакцией. Проведенные исследования позволили выявить способность А2А ингибировать фосфорилирование тирозинкиназы Zap-70, секрецию эозинофилов и моноцитов, ослаблять перфорин и цитотоксичность лимфокин-активируемых клеток-киллеров Активация рецептора аденозина А2А подавляет систему воспалительного сигнализирования в цитокинах и ускоряет процесс заживления ран. [М.А. Trevethick, S.J. Mantell, E.F. Stuart, A. Barnard, K.N. Wright, M Yeadon, Pfizer Global R&D, «Лечение воспалительных процессов дыхательных путей агонистами рецепторов аденозина А2А», журнал Провизор, 2009 г., выпуск №3, http://www.provisor.com.ua/].
Таким образом, поиск эффективных и селективных антагонистов А2А рецепторов представляется исключительно важной и многообещающей задачей.
С целью разработки новых высокоэффективных А2А лигандов авторами данного изобретения выполнен широкий скрининг разнообразных низкомолекулярных соединений, определяя эффективность их взаимодействия с аденозиновыми рецепторами. Неожиданно были обнаружены соединения-хиты, представляющие собой некоторые производные [1,2,4]триазоло[4,3-а]пиридинов. Затем проводились направленные модификации обнаруженных структур и тестирование новых соединений, при этом установлена взаимосвязь ″структура-активность″ и выбраны наиболее перспективные ряды и соединения-лидеры. В результате синтезированы серии новых производных [1,2,4]триазоло[4,3-а]пиридинов, ранее не описанных в литературе, которые являются оригинальными и высокоэффективными антагонистами А2А-рецепторов.
Цель настоящего изобретения заключается в создании новых селективных антагонистов А2А-рецепторов.
Поставленная цель достигается новыми антагонистами аденозиновых А2А рецепторов, представляющими собой замещенные [1,2,4]триазоло-[4,3-а]пиридины общей формулы I, а также их фармацевтически приемлемые соли.
Предметом настоящего изобретения являются замещенные [1,2,4]триазоло[4,3-а]пиридины общей формулы I, а также их фармацевтически приемлемые соли:
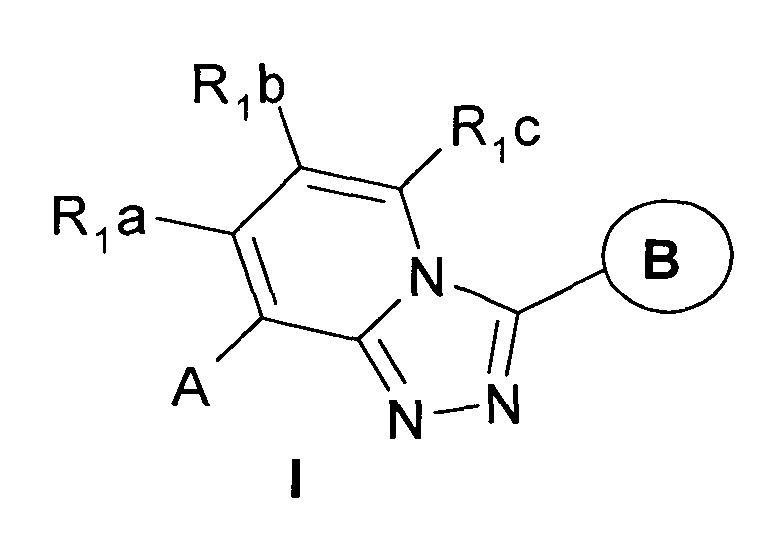
где А представляет собой необязательно замещенную аминокарбонильную группу -N-C(O)-, в которой аминогруппа может быть замещена и заместители могут быть выбраны из
водорода, C1-С5алкила, возможно замещенного C1-С3алкокси, С3-С6циклоалкилом, 5-6-членным гетероарилом, в котором гетероатомы выбраны из кислорода или азота;
арила, выбранного из фенила, возможно замещенного гидрокси, C1-С5алкилом, C1-С5алкокси, галогеном, C1-С5ациламиногруппой, или нафтила;
или аминогруппа выбирается из С3-С7гетероциклила, содержащего 1-2 гетероатома в цикле, выбранного из азота, кислорода или серы, возможно замещенного гидрокси, C1-С5алкилом, бензилом, фенилом, который может быть замещен галогеном, при этом указанный гетероциклил может быть конденсирован с бензольным кольцом;
ациламиногруппу, в которой ацил выбирается из
C1-С6алкилкарбонила, где алкил может быть замещен фенилом, замещенным фенилом, в котором заместители выбраны из C1-С5алкокси; 5-членным гетероарилом с гетероатомом, выбранным из атома кислорода или серы;
бензоила, возможно замещенного C1-С5алкилом, C1-С5алкокси, C1-С5алкилтио или галогеном, метилендиокси;
гетероциклилкарбонила, в котором гетероциклил выбран из 5-6-членного гетероциклила, с 1-2 гетероатомами, выбранными из азота, кислорода или серы, возможно конденсированного с бензольным кольцом и возможно замещенным C1-С5алкилом, галогеном;
или уреидо-группу, в которой один из заместителей концевой амидогруппы представляет собой водород, а второй заместитель выбирается из:
C1-С3алкила, замещенного фенилом, 5-членным насыщенным или ароматическим гетероциклилом, в котором гетероатомы выбраны из кислорода или серы;
С2-С6алкенила;
арила, выбранного из фенила, замещенного C1-С5алкилом, C1-С5алкокси, этилендиокси, метилендиокси, галогеном, C1-С3алкилкарбонилом;
5-членного гетероциклила, в котором гетероатомы выбраны из атома серы или кислорода, и возможно замещенного алкилоксикарбонильной группой;
В представляет собой неароматический циклический заместитель, выбранный из С4-С6циклоалкила;
ароматический циклический заместитель, выбранный из фенила, который может быть замещен галогеном, C1-С3алкокси;
неароматический 5-6-членный гетероциклический заместитель с атомом азота в качестве гетероатома, и возможно N-замещенный C1-С3алкилом;
ароматический 5-6-членный гетероциклический заместитель, в котором гетероатомы выбраны из азота, кислорода или серы, и который может быть замещен C1-С6алкилом;
или ароматический 5-6-членный гетероциклический заместитель, в котором гетероатом выбран из азота, конденсированный с бензольным кольцом;
R1a, R1b и R1c, независимо представляют водород, C1-С3 алкокси;
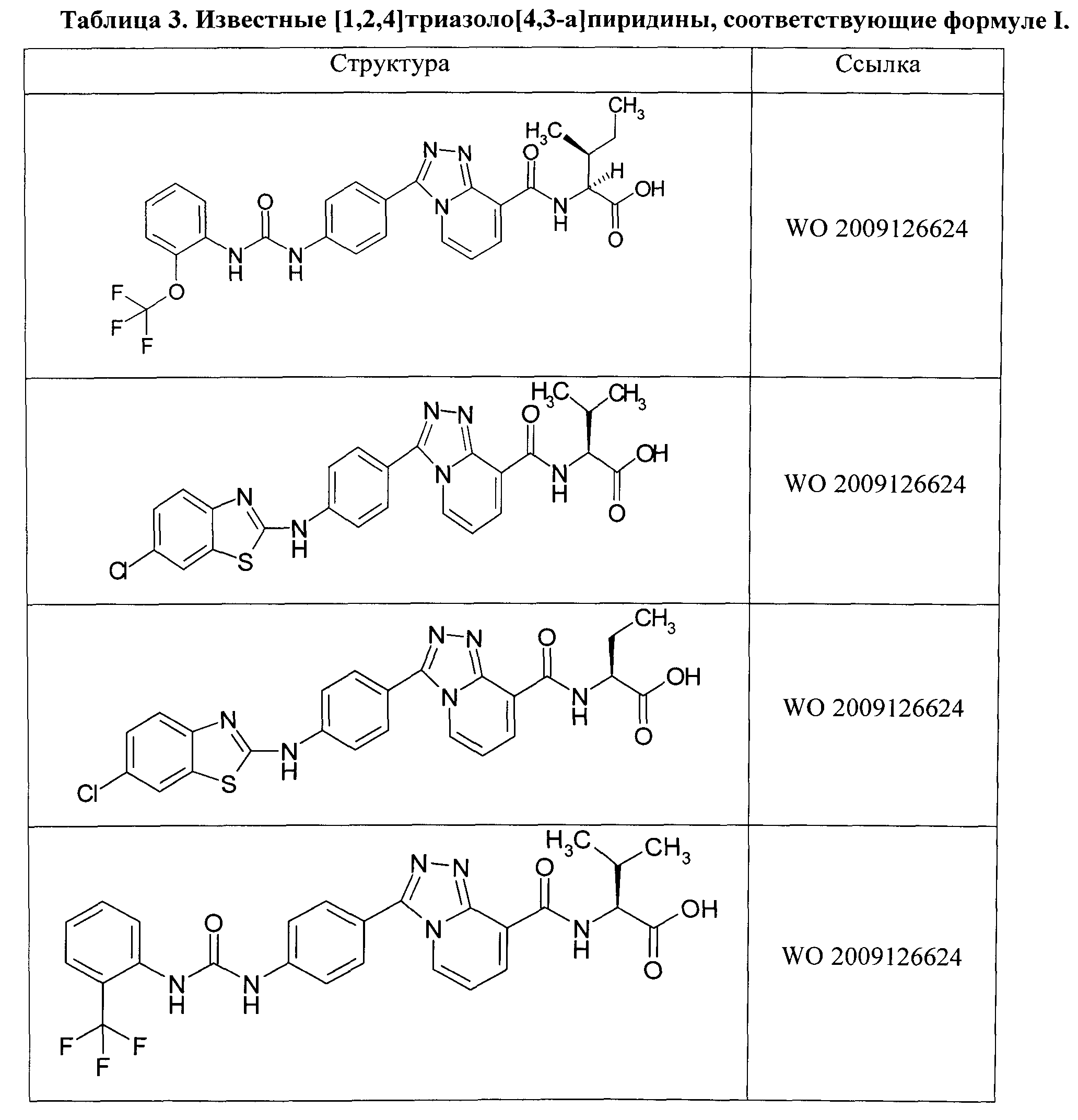
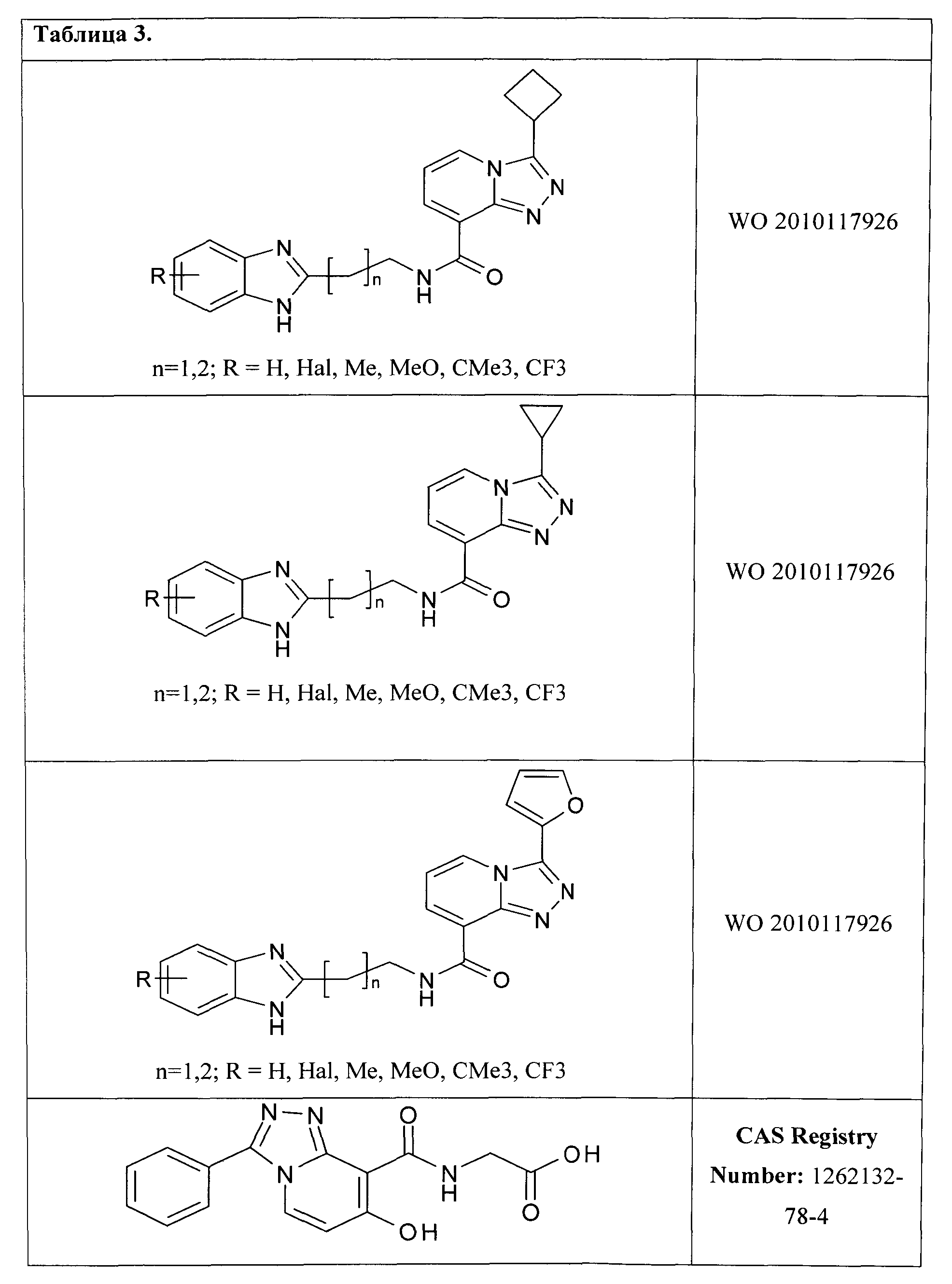
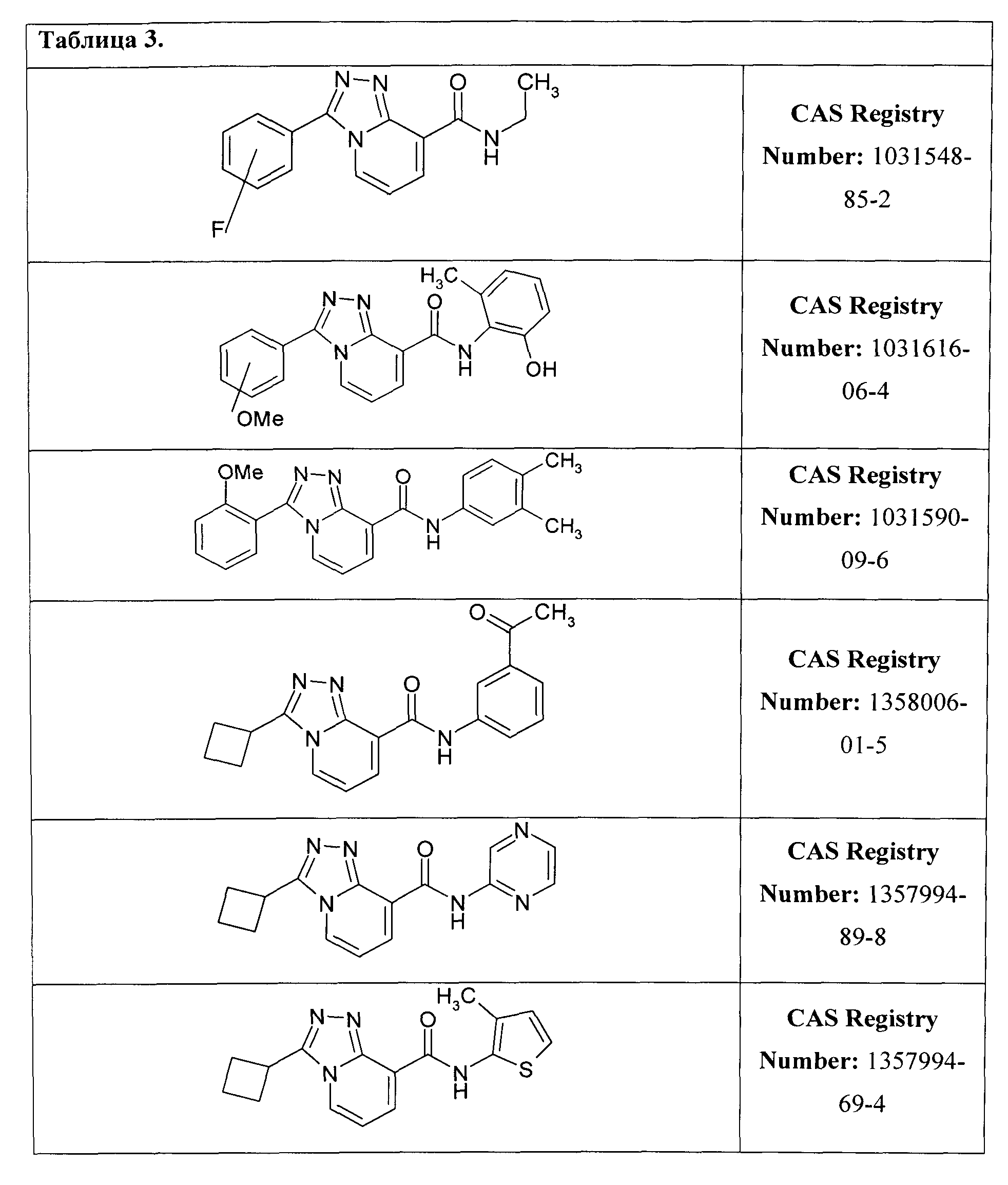
исключая соединения, представленные в Таблице 3.
Ниже приведены определения терминов, которые использованы в описании настоящего изобретения.
″Аминокарбонил″ означает -C(=O)NR2- группу, каждый R независимо друг от друга является водородом, алкилом, алкенилом (см. заместители аминокарбонильной группы см. ″заместитель карбамоильный″). Предпочтительно карбамоил, метиламинокарбонил, этиламинокарбонил, пропиламинокарбонил или бутиламинокарбонил. Аминокарбонил может иметь заместители см. ″заместитель карбамоильный″, определенные в данном разделе.
″Аминотиокарбонил″ означает R-C(=S)NH2, аминотиокарбонил может иметь заместители, см. ″заместитель карбамоильный″, ″замещенная аминотиокарбонильная группа″ определенные в данном разделе.
″Замещенная аминотиокарбонильная группа″ (аминотиокарбонил) означает R′R″N-C(=S)- группу, в которой заместители R′ и R″ могут быть представлены необязательно замещенными алкилом, циклоалкилом, арилом, гетарилом и гетероциклилом, значение которых определено в данном разделе. Предпочтительными аминокарбонильными группами являются необязательно замещенный C1-С5алкил, C1-С5циклоалкил, необязательно замещенный арил (см. заместитель циклической системы), необязательно замещенный гетарил (см. заместитель циклической системы), необязательно замещенный гетероциклил (см. заместитель гетероциклила) или аминогруппой R′R″N.
″Аминогруппа″ означает радикал формулы -NR2, в котором каждый R независимо друг от друга представляет собой водород, алкил, алкенил или циклоалкил, например, -NH2, метиламино, диэтиламино, циклогексиламино, трет-бутиламино или этиламино.
″Азагетероцикл″ означает ароматическую или неароматическую моноциклическую или полициклическую систему, содержащую в цикле, по крайней мере, один атом азота. Предпочтительно пиперидин, пиперазин, пирролидин, морфолин, тиоморфолин, азациклооктан. Азагетероцикл может иметь заместители (см. заместители циклической системы).
″Арил″ означает ароматическую моноциклическую или полициклическую систему, включающую от 6 до 14 атомов углерода, преимуществено от 6 до 10 атомов углерода. Арил может содержать один или более ″заместителей циклической системы″, которые могут быть одинаковыми или разными. Предпочтительно фенил или нафтил.
″Алкенил″ означает линейную или разветвленную углеводородную группу, содержащую от 2 до 7 атомов углерода и включающую, по крайней мере, одну углерод-углеродную двойную связь.
Разветвленная, означает, что к линейной алкенильной цепи присоединены один или несколько низших алкильных групп, таких как метил, этил или пропил. Предпочтительными алкенильными группами являются этенил, пропенил, н-бутенил, изо-бутенил, 3-метилбут-2-енил, н-пентенил, и циклогексилбутенил.
Алкенильная группа может иметь один или несколько заместителей см. ″Заместители алкенильной группы″.
″Заместители алкенильной группы″ могут представлять собой галоген, алкенилокси, циклоалкил, циано, гидрокси, алкокси, карбокси, алкинилокси, аралкокси, арилокси, арилоксикарбонил, алкилтио, гетероаралкилокси, гетероциклил, гетероциклилалкилокси, алкоксикарбонил, аралкоксикарбонил, гетроаралкилоксикарбонил.
″Алкинил″ означает линейную или разветвленную углеводородную группу, содержащую от 2 до 12 атомов углерода и включающую, по крайней мере, одну углерод-углеродную тройную связь.
Разветвленная означает, что к линейной алкинильной цепи присоединены один или несколько низших алкильных групп, таких как метил, этил или пропил. Алкинильная группа может иметь один или несколько заместителей см. ″Заместители алкенильной группы″. Предпочтительными алкинильными группами являются этинил, пропинил, н-бутинил, изо-бутинил, 3-метилбут-2-инил, н-пентинил, бута-1,3-диин и гекса-1,3,5-триин.
″Алкил″ означает алифатическую углеводородную линейную или разветвленную группу с 1-6 атомами углерода в цепи. Разветвленная группа обозначает, что группа C1-С6алкила, такая как метил, этил или пропил, присоединена к линейной цепи алкила. Предпочтительными прямыми или разветвленными алкильными группами являются группы, представляющие собой алкильные группы, имеющие от 1 до 10 атомов углерода. Наиболее предпочтительные группы низшего алкила имеют от 1 до 8 атомов углерода. Предпочтительными алкильными группами являются С1-C6алкил, более предпочтительными являются метил, этил, н-пропил, 2-изо-пропил, н-бутил, изо-бутил, втор-бутил, трет-бутил, циклопропилметил, циклобутилметил, циклопентилметил, н-пентил, 2-пентил, 3-пентил, нео-пентил, н-гексил. Алкил может иметь заместители, см. ″Замещенный алкил″.
″Алкилциклоалкил″ обозначает циклоалкил, замещенный алкилом. Предпочтительно 1-, 2-, 3- или 4-метил или этилциклогексил.
″Алкилциклоалкилалкил″ обозначает алкил, замещенный алкилциклоалкилом. Предпочтительно 2-, 3- или 4-метил- или этилциклогексилметил или 2-, 3- или 4-метил- или этилциклогексилэтил.
″Аралкил″ обозначает алкил, замещенный арилом. Предпочтительные аралкильные группы включают в себя бензил, нафт-1-илметил, нафт-2-илметил и фенетил.
″Алкилокси″ или ″Алкокси″ означает C1-С6АлкилО- группу, в которой алкил определен в данном разделе. Предпочтительными алкоксигруппами являются метокси, этокси, н-пропокси, изо-пропокси, н-бутокси и трет-бутокси.
″Ароматический цикл″ (ароматическая система) означает планарную циклическую систему, в которой все атомы цикла участвуют в образовании единой системы сопряжения, включающей, согласно правилу Хюккеля, (4n+2) π-электронов (n - целое неотрицательное число). Примерами ароматических циклов являются бензол, нафталин, антрацен и т.п. В случае ″гетероароматических циклов″ в системе сопряжения участвуют π-электроны и р-электроны гетероатомов, их суммарное число также равняется (4n+2). Примерами таких циклов являются пиридин, тиофен, пиррол, фуран, тиазол и т.п. Ароматический цикл может иметь один или более ″заместителей циклической системы″ и может быть анелирован с неароматическим циклом, гетероароматической или гетероциклической системой.
″Ацильная группа″ (Ацил) означает R-C(=O)-, (предпочтительно C1-С6ацил), необязательно замещенные C1-С5алкил-С(=O)-, C1-С5циклоалкил-С(=O)-, (предпочтительно циклопропил-С(=O)-, циклобутил-С(=O)-); гетероциклил-С(=O)-, (предпочтительно 2-метилфуран), арил-С(=O)-(ароил), аралкил-С(=O)-, (предпочтительно 3-фенилпентан-С(=O)-), гетероарил-С(=O)-(гетероароил), гетероарилалкил-С(=O)- группы, в которых C1-С6алкил-, C1-С5алкенил-, C1-С6циклоалкил-, гетерциклил-, арил-, аралкил, гетероарил-, гетероарилалкил, метоксигруппа, указанные группы могут иметь заместители, см. ″заместители циклической системы″, ″замещенный алкил″, ″замещенный алкенил″, ″заместители гетероциклической системы″, определенные в данном разделе.
″α-аминоацильная группа″ (α-аминоацил) означает C(=O)CH(R2 k)NR2 k+1R2 k+2,
где R2 k, R2 k+1 и R2 k+2 могут принимать значение водород, С1-С5алкил-, арил, насыщенный или ненасыщенный гетероциклил, или NR2 kR2 k+2 представляет собой 5-6 членный гетероцикл, указанные группы могут иметь заместители, см. ″заместители циклической системы″, ″замещенный алкил″, ″заместители гетероциклической системы″, ″замещенный арил″, определенные в данном разделе.
″Ацилоксигруппа″ означает R(=O)-O группу.
″Гидразинокарбонильная группа″ означает -C(=O)-NH-NH2 группу. Гидразинокарбонильная группа может иметь заместители см. ″заместитель карбамоильный″, определенные в данном разделе.
″Гетероарил″ (гетарил) означает ароматическую моноциклическую или полициклическую систему, включающую от 5 до 14 атомов углерода, предпочтительно от 5 до 10, в которой один или больше атомов углерода замещены гетероатомом или гетероатомами, такими как азот, сера или кислород. Приставка ″аза″, ″окса″ или ″тиа″ перед ″гетероарил″ означает наличие в циклической системе, атома азота, атома кислорода или атома серы, соответственно. Атом азота находящийся в гетероариле может быть окислен до N-оксида. Гетероарил может иметь один или несколько ″заместителей циклической системы″, которые могут быть одинаковыми или разными. Предпочтительно пирролил, фуранил, тиенил, пиридинил. Гетероарил может иметь заместители (см. заместители циклической системы).
″Гетероцикл″ означает ароматическую или неароматическую насыщенную или частично насыщенную моноциклическую или полициклическую систему, включающую от 3 до 10 атомов углерода, преимущественно от 4 до 6 атомов углерода, в которой один или несколько атомов углерода заменены на гетероатом, такой как азот, кислород, сера, фосфор. Приставка ″аза″, ″окса″ или ″тиа″ перед гетероциклилом означает наличие в циклической системе атома азота, атома кислорода или атома серы, соответственно. Гетероциклил может иметь один или несколько заместителей, которые могут быть одинаковыми или разными. Атомы азота и серы, находящиеся в гетероциклиле могут быть окислены до N-оксида, S-оксида или S-диоксида. Представителями гетероциклилов являются пиперидинил, пирролидинил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, 1,4-диоксан-2-ил, тетрагидрофурил, тетрагидротиенил и др. Гетероциклил может иметь заместители. Предпочтительны соединения: пиперидинил, замещенный метилом; пиперидинил, замещенный необязательно замещенной гидроксигруппой; пиперидинил замещенный фенилом; пиперазинил, замещенный С1-С5алкилом.
″Гидроксигруппа″ (Гидроксильная группа) обозначает -ОН группу.
″Галоген″ означает фтор, хлор, бром и йод. Предпочтительными являются фтор, хлор.
″Циклоалкил″ обозначает насыщенную карбоциклическую группу, имеющую одно или более колец, имеющих 3-10 атомов углерода. Предпочтительные циклоалкильные группы включают в себя циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и декагидронафтил.
″Циклоалкилалкил″ обозначает группу алкила, замещенную циклоалкильной группой. Предпочтительные циклоалкилалкилы включают в себя циклопентилметил, циклогексилметил, циклогексилэтил, декагидронафт-1-илметил и декагидронафт-2-илметил.
″Цианогруппа″ обзначает группу -C≡N.
″Замещенный алкил″ замещенный алкил может иметь один или несколько одинаковых или различных заместителей, включая галоген, алкенилокси, циклоалкил, арил, гетероарил, гетероциклил, гидроксигруппу. Предпочтительными алкильными заместителями являются: ацил, ациламино, ацилокси, алкенил, алкокси, алкил, алкинил, амино, арил, арилокси, карбамоил, карбоалкокси, карбокси, карбоксиамидо, карбоксиамино, циано, дизамещенный амино, формил, гуанидино, галоген, гетероарил, гетероциклил, гидрокси, иминоамино, нитро, оксо, фосфонамин, сульфинил, сульфонамин, сульфонил, тио, тиоациламин, тиоуреидо или уреидо.
″Замещенный арил″ обозначает фенил или нафтил, замещенные одним или более заместителями арильной группы, которые могут быть одинаковыми или различными, где ″заместитель арильной группы″ включает в себя алкил, алкенил, алкинил, арил, аралкил, гидроксигруппу, алкоксигруппу, арилоксигруппу, аралкоксигруппу, гидроксиалкил, ацил, формил, карбоксигруппу, алкеноил, ароил, галоген, нитрогруппу, тригалогенметил, цианогруппу, алкоксикарбонил, арилоксикарбонил, аралкоксикарбонил, ациламиногруппу, ароиламиногруппу, карбамоил, алкилкарбамоил, диалкилкарбамоил, арилкарбамоил, аралкилкарбамоил, алкилсульфонил, алкилсульфинил, арилсульфонил, арилсульфинил, аралкилсульфонил, аралкилсульфинил или - NRaRb, где Ra и Rb обозначают независимо водород, алкил, арил или аралкил.
Предпочтительно фенил, замещенный гидроксигруппой; C1-С5алкилом (предпочтительно метилом); галогеном (предпочтительно хлором, фтором); аминокарбонильной группой; сульфогруппой. Предпочтительно нафтил, замещенный C1-С5алкилом. Арил может быть анелирован с неароматической циклической системой или гетероциклом.
″Заместители аминогруппы″ заместители аминогруппы R′ и R″ представляют собой водород, необязательно замещенный C1-С5алкил, необязательно замещенный С3-С5циклоалкил (см. заместитель циклической системы), необязательно замещенный арил (см. заместитель циклической системы), необязательно замещенный гетероарил (см. заместитель циклической системы), необязательно замещенный гетероциклил (см. заместитель циклической системы), алкоксикарбонил замещенный линейным или нелинейным C1-С5алкилом, галогеном, гетероциклилом; алкиламинокарбонил, ариламинокарбонил, гетероариламинокарбонил, гетероциклиламинокарбонил.
″Заместители циклической системы″ могут быть представителями арильных групп предпочтительно фенил или нафтил, замещенный фенил или замещенный нафтил. Предпочтительно фенил, замещенный гидроксигруппой; C1-С5 алкилом; галогеном; аминокарбонильной группой.
Арил может быть аннелирован с неароматической циклической системой или гетероциклом. Предпочтительно земестителями циклической системы являются водород, галогены (хлор, фтор, бром), необязательно замещенный C1-С5алкил, гидроскигруппа, C1-С5алкилоксигруппа (метокси, этокси, пропокси), карбоксигруппа, аминокарбонил (см. ″аминокарбонил″), фениланнелированный с 5-7-членным насыщенным циклом, содержащим 1-3 гетероатома (атомы азота, кислорода и серы предпочтительно).
″Заместитель″ означает химический радикал, который присоединяется к молекулярному остову (скэффолду, фрагменту), например ″заместитель алкильный″, ″заместитель аминогруппы″, ″заместитель карбамоильный″, ″заместитель циклической системы″, значения которых определено в данном разделе.
″Замещенная аминокарбонильная группа″ (аминокарбонил) означает R′R″N-С(=O)- группу, в которой заместители R′ и R″ могут быть представлены необязательно замещенными алкилом, циклоалкилом, арилом, гетарилом и гетероциклилом, значение которых определено в данном разделе. Предпочтительными аминокарбонильными группами являются необязательно замещенный C1-С5алкил, C1-С5циклоалкил, необязательно замещенный арил (см. заместитель циклической системы), необязательно замещенный гетарил (см. заместитель циклической системы), необязательно замещенный гетероциклил (см. заместитель гетероциклила) или аминогруппой R′R″N.
″Заместитель карбамоильный″ означает заместитель, присоединенный к аминокарбонильной группе, значение которой определено в данном разделе. Заместитель карбамоильный представляет собой водород, алкил, циклоалкил, арил, гетероарил, гетероциклил, алкоксикарбонилалкил, аралкоксикарбонилалкил, гетероаралкилоксикарбонилалкил или Rk aRk+1 aN-, Rk aRk+1 aNC(=O)-алкил, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил. Предпочтительными ″заместителями карбамоильными″ являются алкил, циклоалкил, арил, гетероарил, гетероциклил, алкоксикарбонилалкил, аралкоксикарбонилалкил, гетероаралкилокси-карбонилалкил или Rk aRk+1 aN-, Rk aRk+1 aNC(=O)-алкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил.
«Заместители гетероцикла» могут быть представителями арильных групп предпочтительно фенил или нафтил, замещенный фенил или замещенный нафтил. Арил может быть анелирован с неароматической циклической системой или гетероциклом. Предпочтительно земестителями циклической системы являются водород, галогены (хлор, фтор, бром), необязательно замещенный C1-C5алкил, необязательно замещенный цикло C1-C5алкил, C1-C5алкен, гидроскигруппа, С1-С5алкилоксигруппа (метокси, этокси, пропокси, диэфир этиленгликоля, диэфир метандиола), цианогруппа, С1-С5алкилоксикарбонил (метил, этил), алкилтиогруппа (метилтио), карбоксигруппа, аминокарбонил (см. «аминокарбонил»), фениланелированный с 5-7-членным насыщенным циклом, содержащим 1-3 гетероатома (атомы азота, кислорода и серы предпочтительно).
″Лекарственное средство (препарат)″ - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и других готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
″Нитрогруппа″ означает группу -NO2.
″Трифторметил″ означает группу R-CF3;
″Уреидо″ означает группу NH2-СО-NH-.
Более предпочтительными являются замещенные [1,2,4]триазоло[4,3-а]пиридины, представленные общими формулами I-1, I-2, I-3, а также их фармацевтически приемлемые соли:
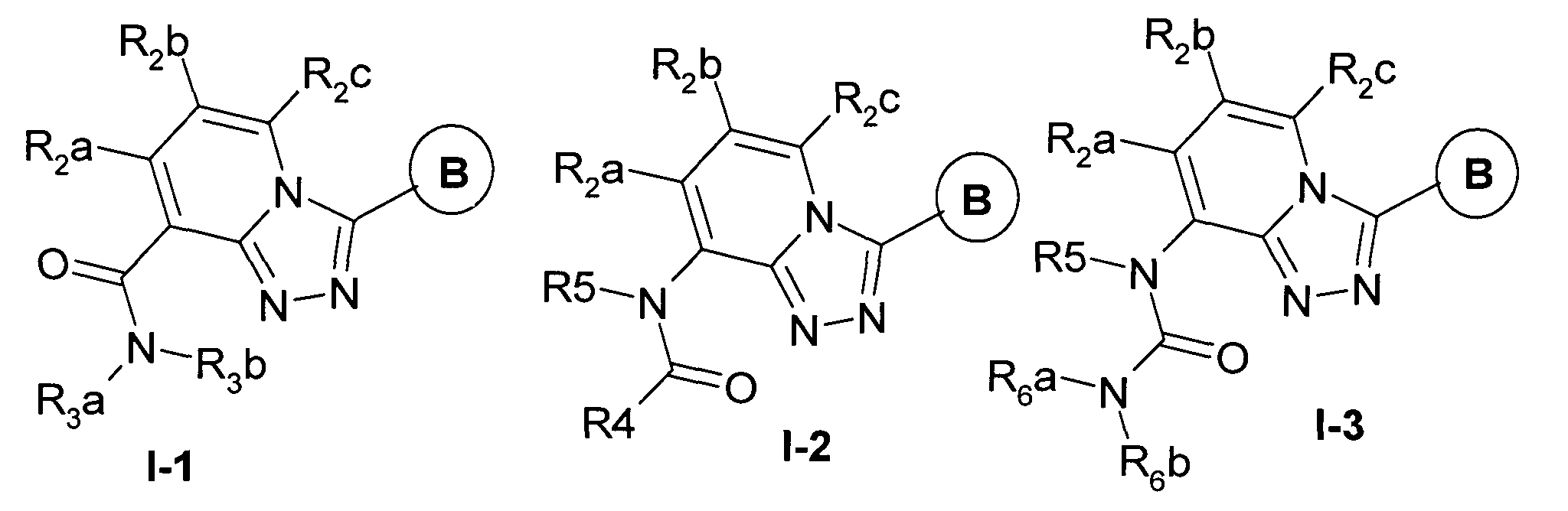
где В имеет значения, определенные выше;
R2a, R2b и R2c, независимо представляют Н, C1-С3алкокси; R3a и R3b независимо представляют водород, C1-C5алкил, возможно замещенный C1-С3алкокси, С3-С6циклоалкилом, 5-6-членным гетероарилом, в котором гетероатомы выбраны из кислорода или азота; арил, выбранный из фенила, возможно замещенного гидрокси, C1-С5алкилом, C1-C5алкокси, галогеном, C1-С5ациламиногруппой, или нафталина;
R3a и R3b могут образовывать совместно циклические заместители, при этом группа R3a-N-R3b представляет С3-С7гетероциклил, содержащий 1-2 гетероатома в цикле, выбранных из азота, кислорода или серы, возможно замещенный гидрокси, C1-С5алкилом, бензилом, фенилом, который может быть замещен галогеном, при этом указанный гетероциклил может быть конденсирован с бензольным кольцом;
R4 представляет C1-С5 алкил, где алкил может быть замещен фенилом, замещенным фенилом, в котором заместители выбраны из C1-С5алкокси; 5-членным гетероарилом с гетероатомом, выбранным из атома кислорода или серы; арил, выбранный из фенила, возможно замещенного C1-С5алкилом, C1-С5алкокси, C1-С5алкилтио или галогеном, метилендиокси; гетероциклил, в котором гетероциклил выбран из 5-6-членного гетероциклила, с 1-2 гетероатомами, выбранными из азота, кислорода или серы, возможно конденсированного с бензольным кольцом и возможно замещенного C1-С5алкилом, галогеном;
R5 представляет водород;
R6a и R6b независимо представляют водород, C1-С3 алкил, замещенный фенилом, 5-членным насыщенным или ароматическим гетероциклилом, в котором гетероатомы выбраны из кислорода или серы; С2-С6алкенил, арил, выбранный из фенила, замещенного C1-С5алкилом, C1-С5алкокси, этилендиокси, метилендиокси, галогеном, C1-С3алкилкарбонилом;
R6a и R6b могут образовывать совместно циклические заместители, при этом группа R6a-N-R6b представляет собой 5-членный гетероцикл, в котором гетероатомы выбраны из атома серы или кислорода, и возможно замещенный алкилоксикарбонильной группой;
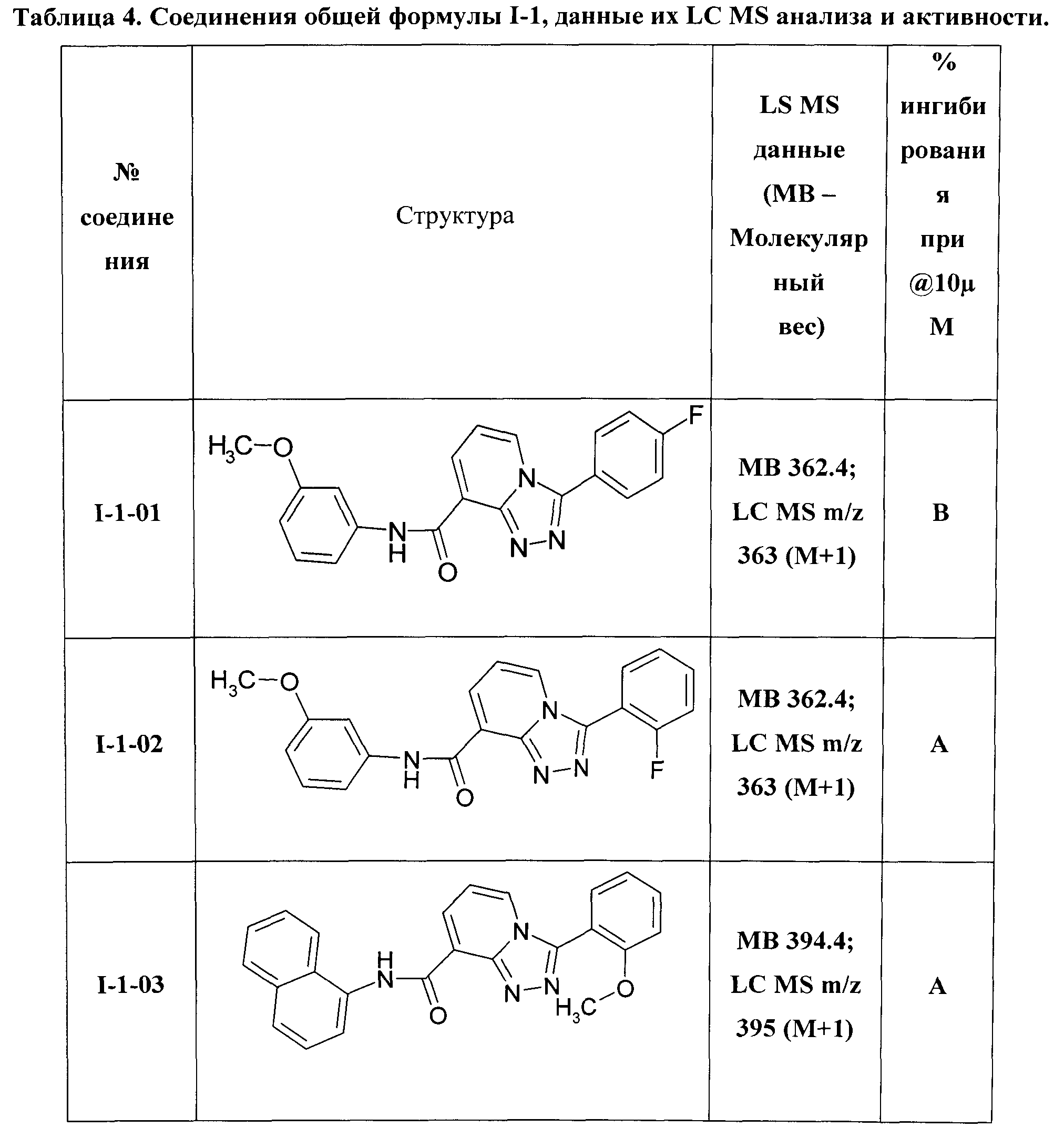
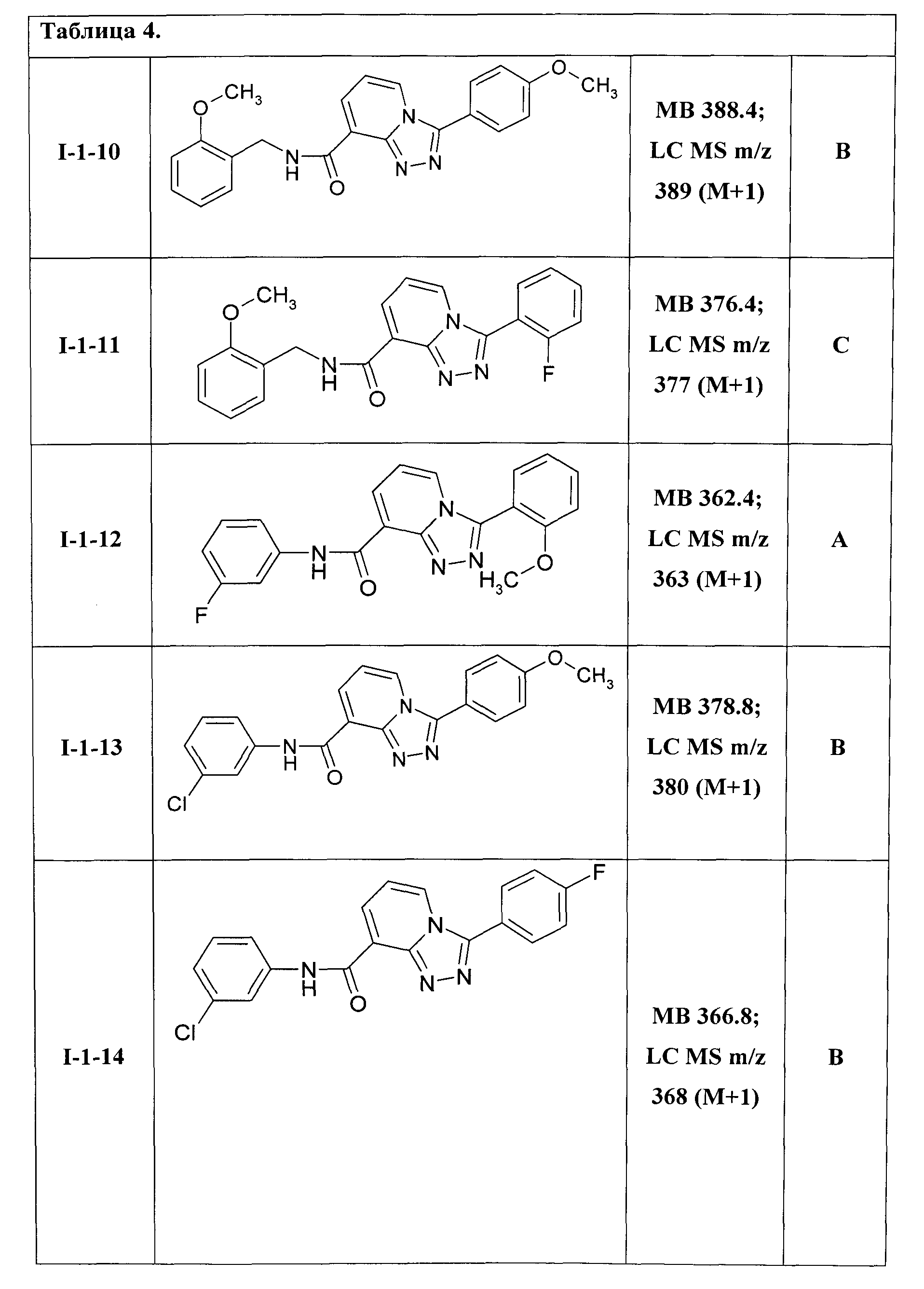
Наиболее предпочтительными производными [1,2,4]триазоло[4,3-а]пиридинов являются:
3-(4-фторфенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 3-метоксифениламид (I-1-01);
3-(2-фторфенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 3-метоксифениламид (I-1-02);
3-(2-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты нафтил-1-амид (I-1-03);
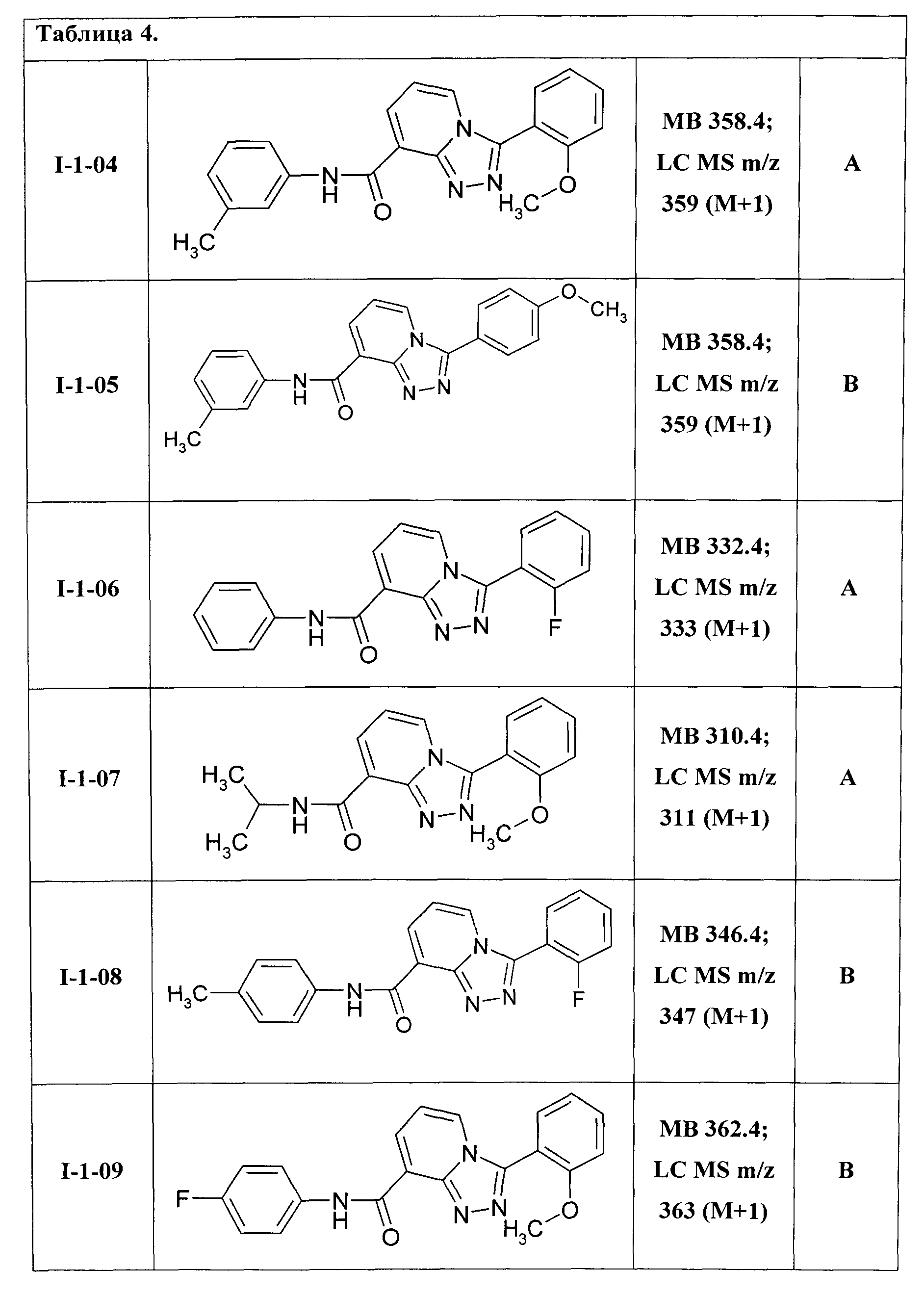
3-(2-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 3-метилфениламид (I-1-04);
3-(4-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 3-метилфениламид (I-1-05);
3-(2-фторфенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты фениламид (I-1-06);
3-(2-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-пропиламид (I-1-07);
3-(2-фторфенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 4-метилфениламид (I-1-08);
3-(2-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 4-фторфениламид (I-1-09);
3-(4-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты (2-метоксифенил)метиламид (I-1-10);
3-(2-фторфенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты (2-метоксифенил)метиламид (I-1-11);
3-(2-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 3-фторфениламид (I-1-12);
3-(4-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 3-хлорфениламид (I-1-13);
3-(4-фторфенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 3-хлорфениламид (I-1-14);
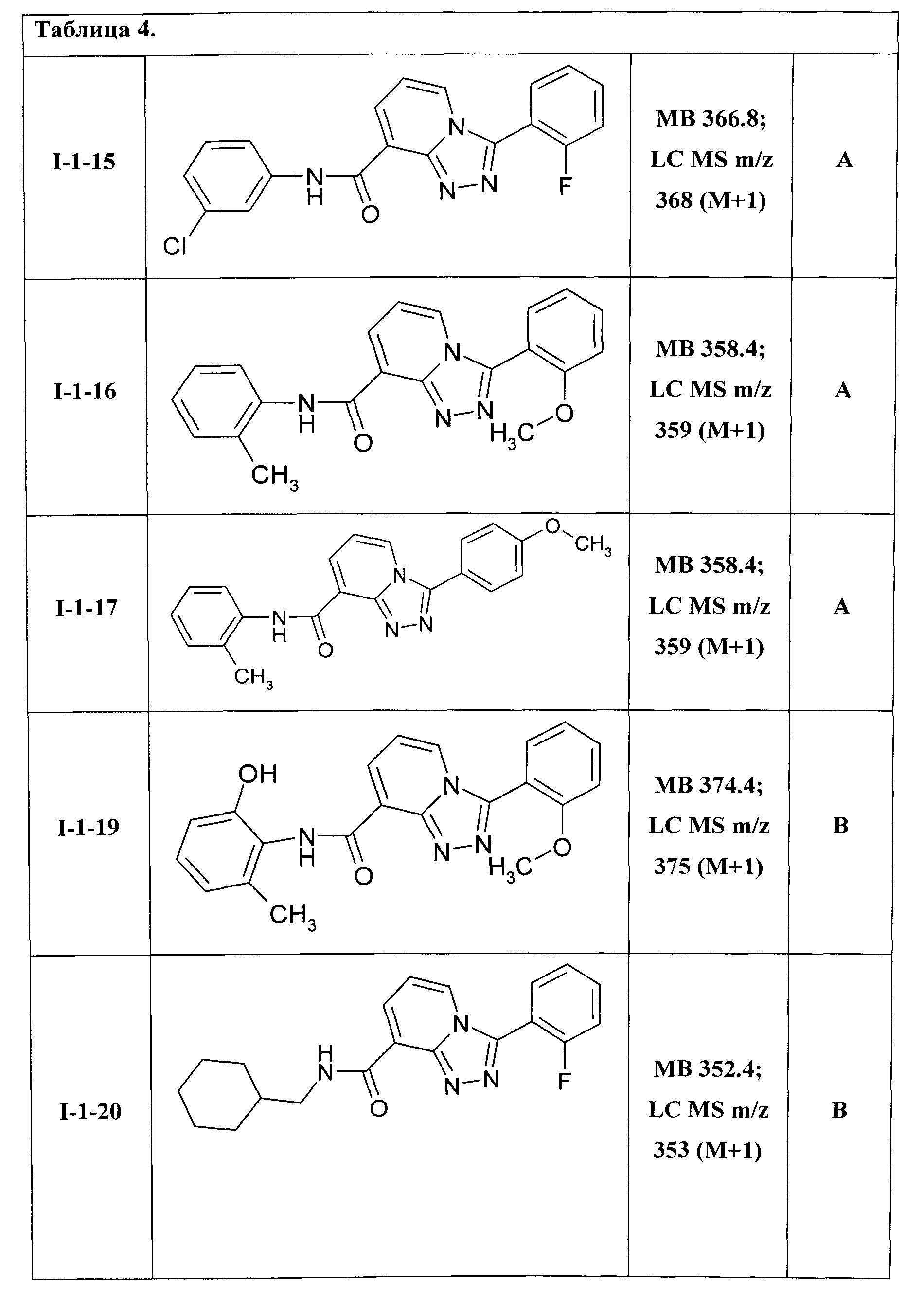
3-(2-фторфенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 3-хлорфениламид (I-1-15);
3-(2-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-метилфениламид (I-1-16);
3-(4-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-метилфениламид (I-1-17);
3-(2-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-гидрокси-6-метилфениламид (I-1-19);
3-(2-фторфенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты (циклогексил)метиламид (I-1-20);
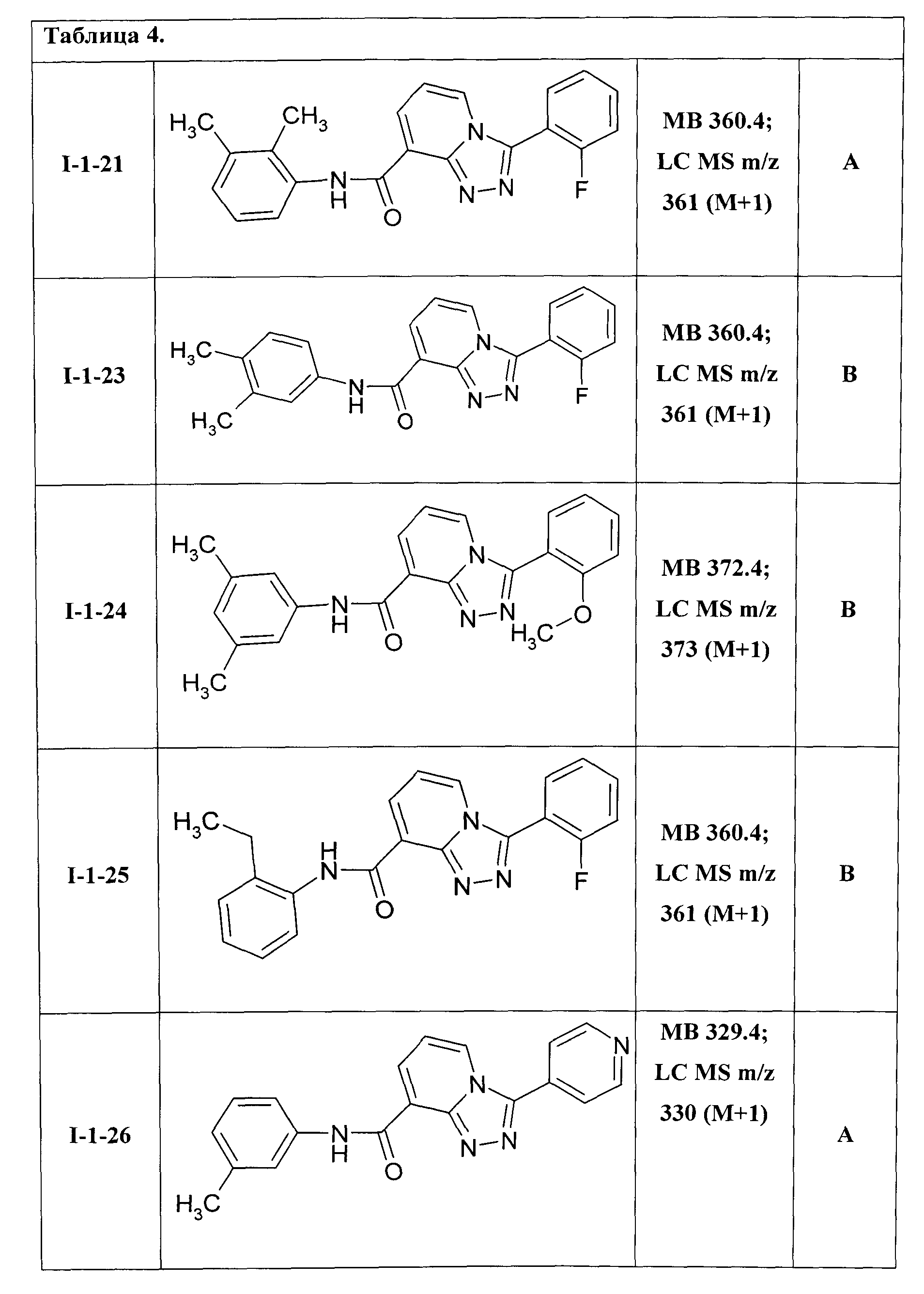
3-(2-фторфенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2,3-диметилфениламид (I-1-21);
3-(2-фторфенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 3,4-диметилфениламид (I-1-23);
3-(2-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 3,5-диметилфениламид (I-1-24);
3-(2-фторфенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-этилфениламид (I-1-25);
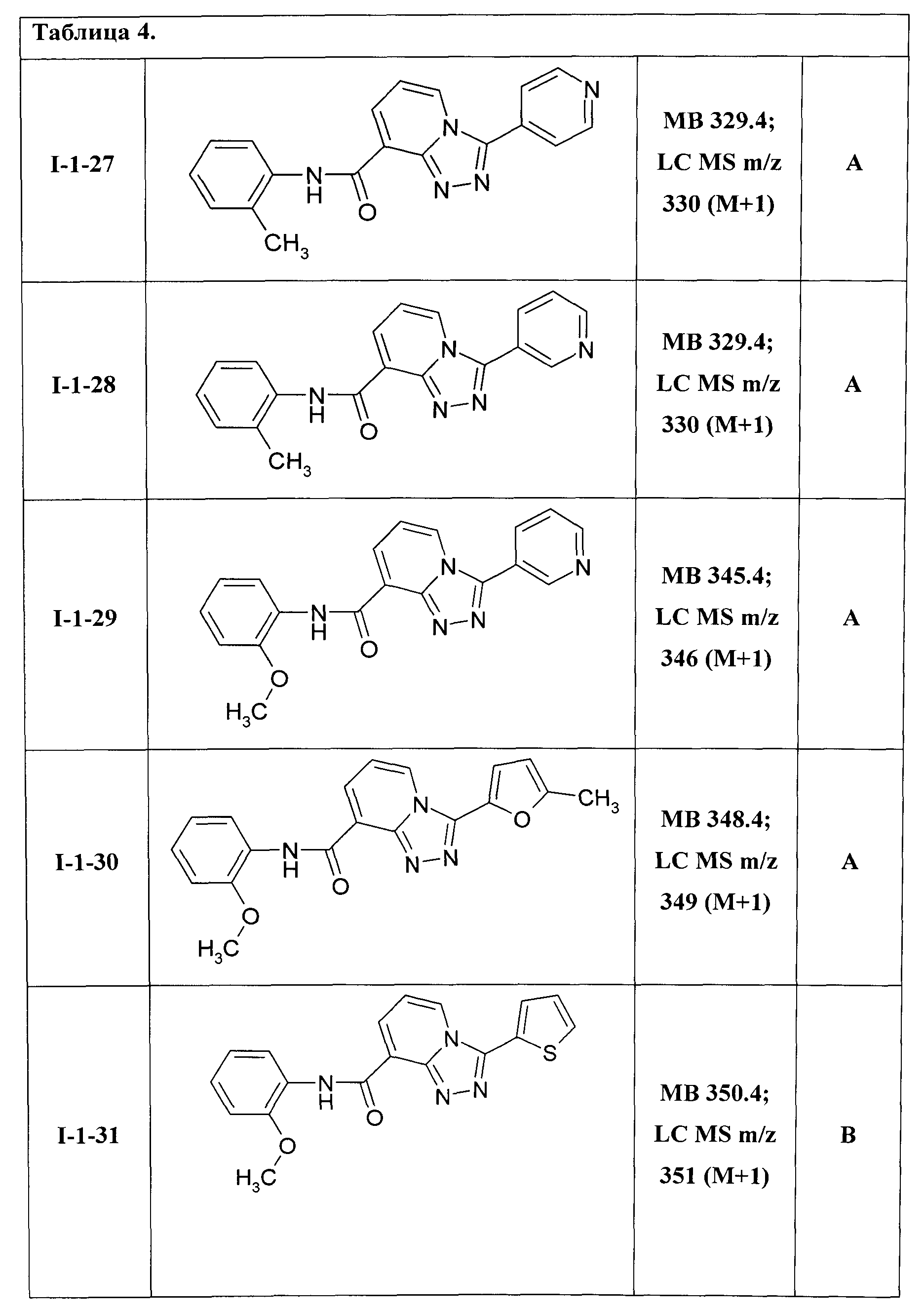
3-(пирид-4-ил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 3-метилфениламид (I-1-26);
3-(пирид-4-ил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-метилфениламид (I-1-27);
3-(пирид-3-ил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-метилфениламид (I-1-28);
3-(пирид-3-ил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-метоксифениламид (I-1-29);
3-(5-метилфурил-2)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-метоксифениламид (I-1-30);
3-(тиенил-2)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-метоксифениламид (I-1-31);
3-(индол-2-ил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-метоксифениламид (I-1-32);
3-(N-метилпиперидин-4-ил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-этилфениламид (I-1-33);
3-(N-метилпиперидин-4-ил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-метоксифениламид (I-1-34);
3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-метоксифениламид (I-1-35);
3-(4-фторфенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты (фуран-2-ил)метиламид (I-1-36);
3-(2-фторфенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты (фуран-2-ил)метиламид (I-1-37);
3-(4-фторфенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты гептаметиленамид (I-1-38);
N-{3-(4-фторфенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбонил}-3,5-диметилпиперидин (I-1-39);
N-{3-(4-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбонил}-4-гидрокси-4-(4-хлорфенил)-пиперидин (I-1-40);
N-{3-(4-фторфенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбонил}-4-бензилпиперидин (I-1-41);
N-{3-(4-фторфенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбонил}-1,2,3,4-тетрагидрохинолин (I-1-42);
N-{3-(4-фторфенил)-[1,2,4]триазоло[4,3-a]пиридин-8-карбонил}-4-гидрокси-4-(4-хлорфенил)-пиперидин (I-1-43);
3-фенил-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-метил4-хлор-фениламид (I-1-44)
3-(4-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-нафтиламид (I-1-47);
3-(4-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-пропиламид (I-1-48);
3-(2-метоксифенил)-5-метокси-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-метилфениламид (I-1-49);
3-(2-метоксифенил)-5-метокси-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-фторфениламид (I-1-50);
3-(2-метоксифенил)-5-метокси-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 3-метилфениламид (I-1-51);
3-(2-фторфенил)-5-метокси-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты (фуран-2-ил)метиламид (I-1-52);
N-{3-(2-метоксифенил)-5-метокси-[1,2,4]триазоло[4,3-а]пиридин-8-карбонил}-пиперазин (I-1-53);
N-{3-(2-метоксифенил)-5-метокси-[1,2,4]триазоло[4,3-а]пиридин-8-карбонил}-N′-метилпиперазин (I-1-54);
N-{3-(2-метоксифенил)-5-метокси-[1,2,4]триазоло[4,3-а]пиридин-8-карбонил}-2-гидроксиэтиламин (I-1-55);
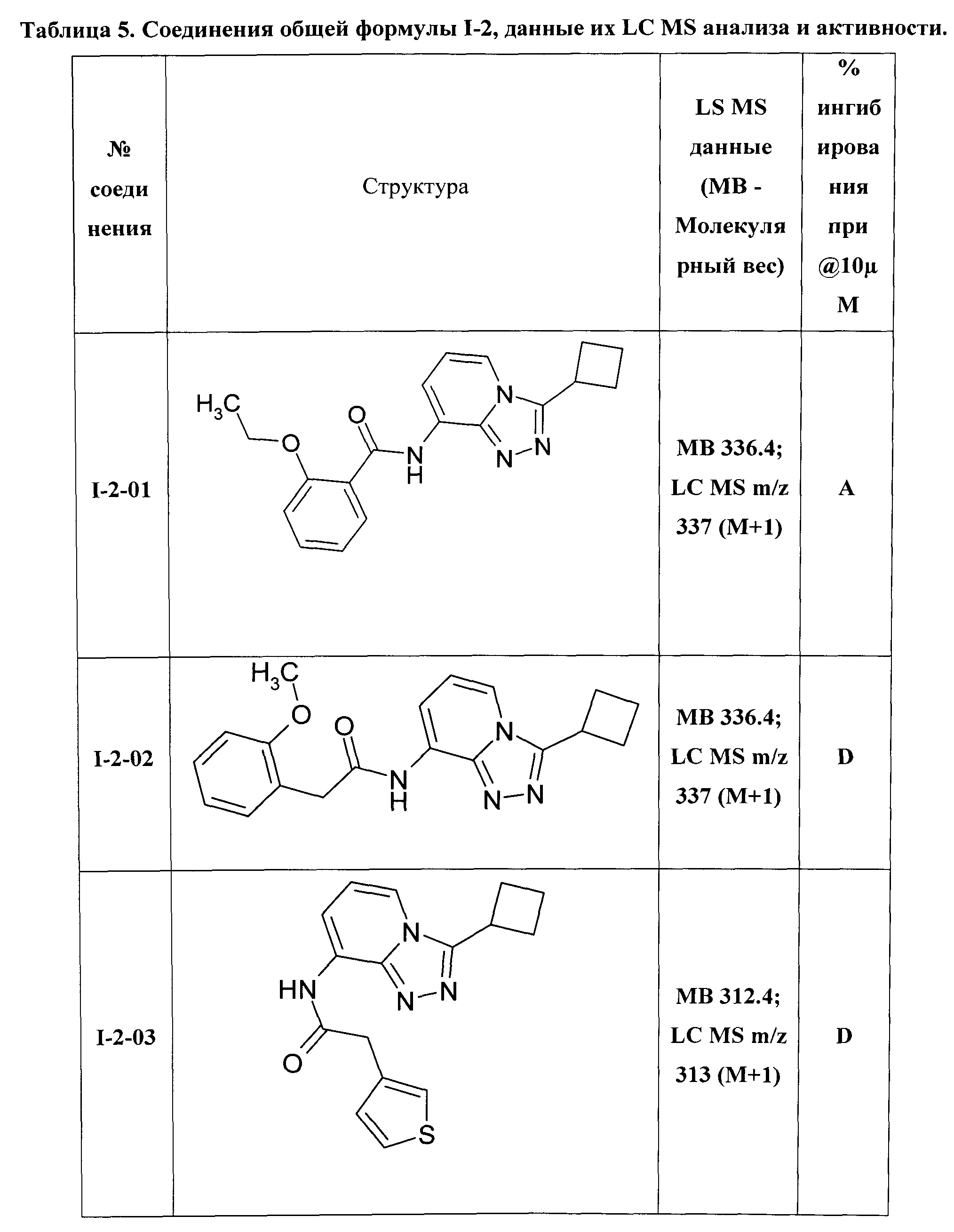
8-[(2-этоксибензоил)амино]-3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин (I-2-01);
8-{[(2-метоксифенил)ацетил]-амино}-3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин (I-2-02);
8-[(тиен-3-ил)ацетиламино]-3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин (I-2-03);
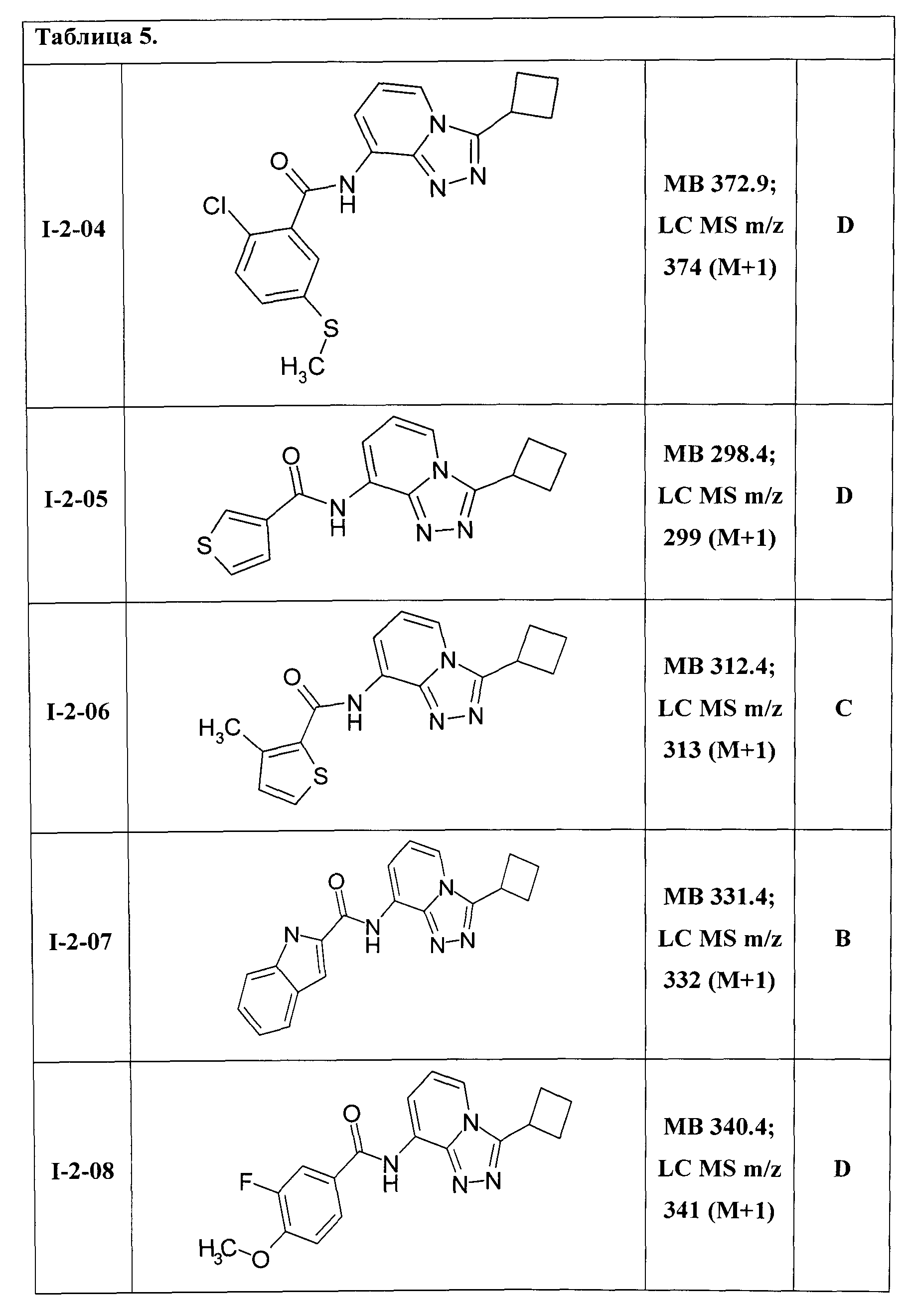
8-[(2-хлор-5-метилтио-бензоил)амино]-3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин (I-2-04);
8-[(тиен-3-ил)карбониламино]-3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин (I-2-05);
8-[(3-метилтиен-2-ил)карбониламино]-3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин (I-2-06);
8-[(индол-2-ил)карбониламино]-3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин (I-2-07);
8-[(3-фтор-4-метокси-бензоил)амино]-3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин (I-2-08);
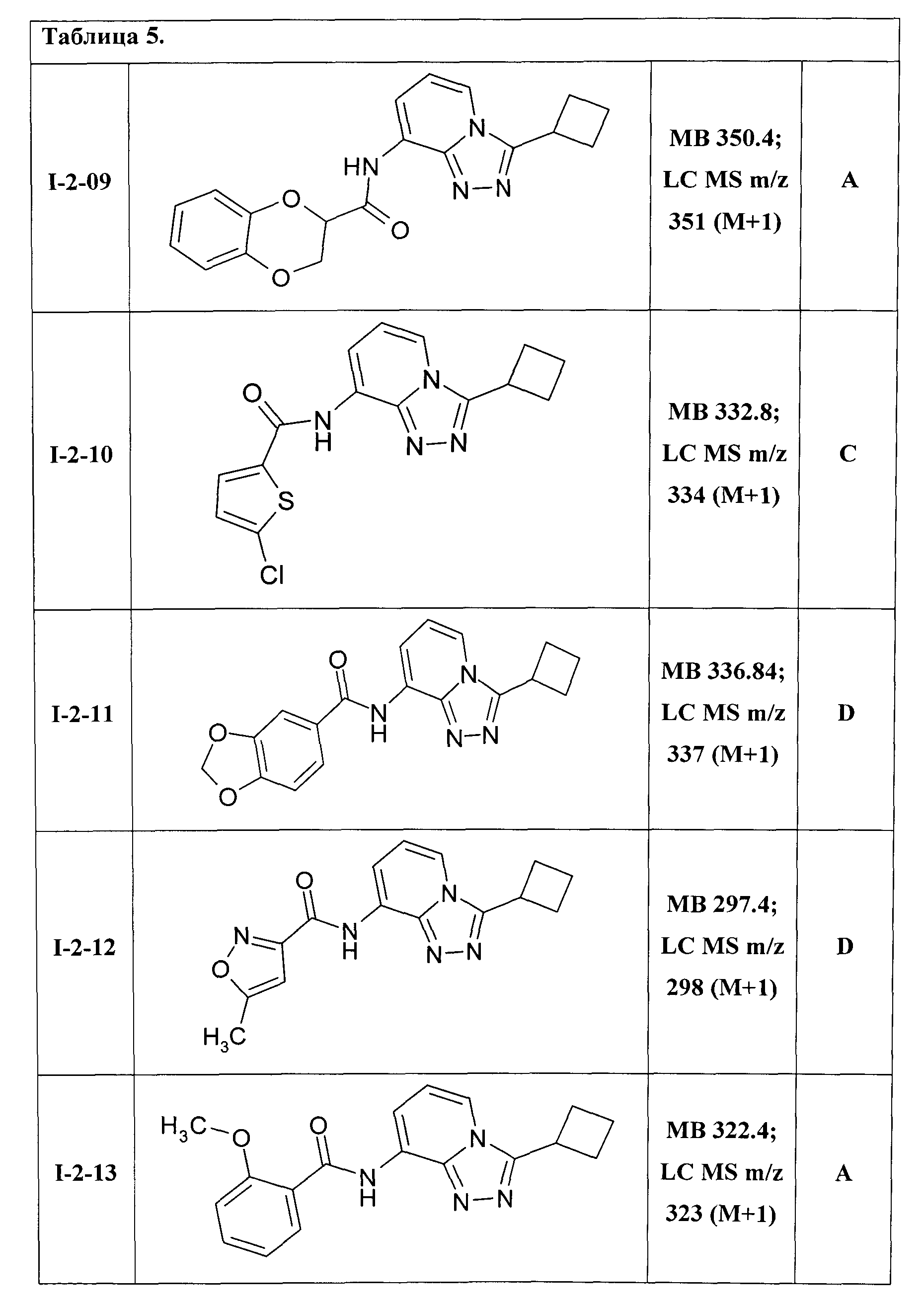
8-[(2,3-дигидробензо[1,4]диоксин-2-ил)карбониламино]-3-циклобутил-[1,2,4]триазоло [4,3-а] пиридин (I-2-09);
8-[(5-хлортиен-2-ил)карбониламино]-3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин (I-2-10);
8-[(3,4-метилендиокси-бензоил)амино]-3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин (I-2-11);
8-[(5-метилизоксазол-3-ил)карбониламино]-3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин (I-2-12);
8-[(2-метоксибензоил)амино]-3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин (I-2-13);
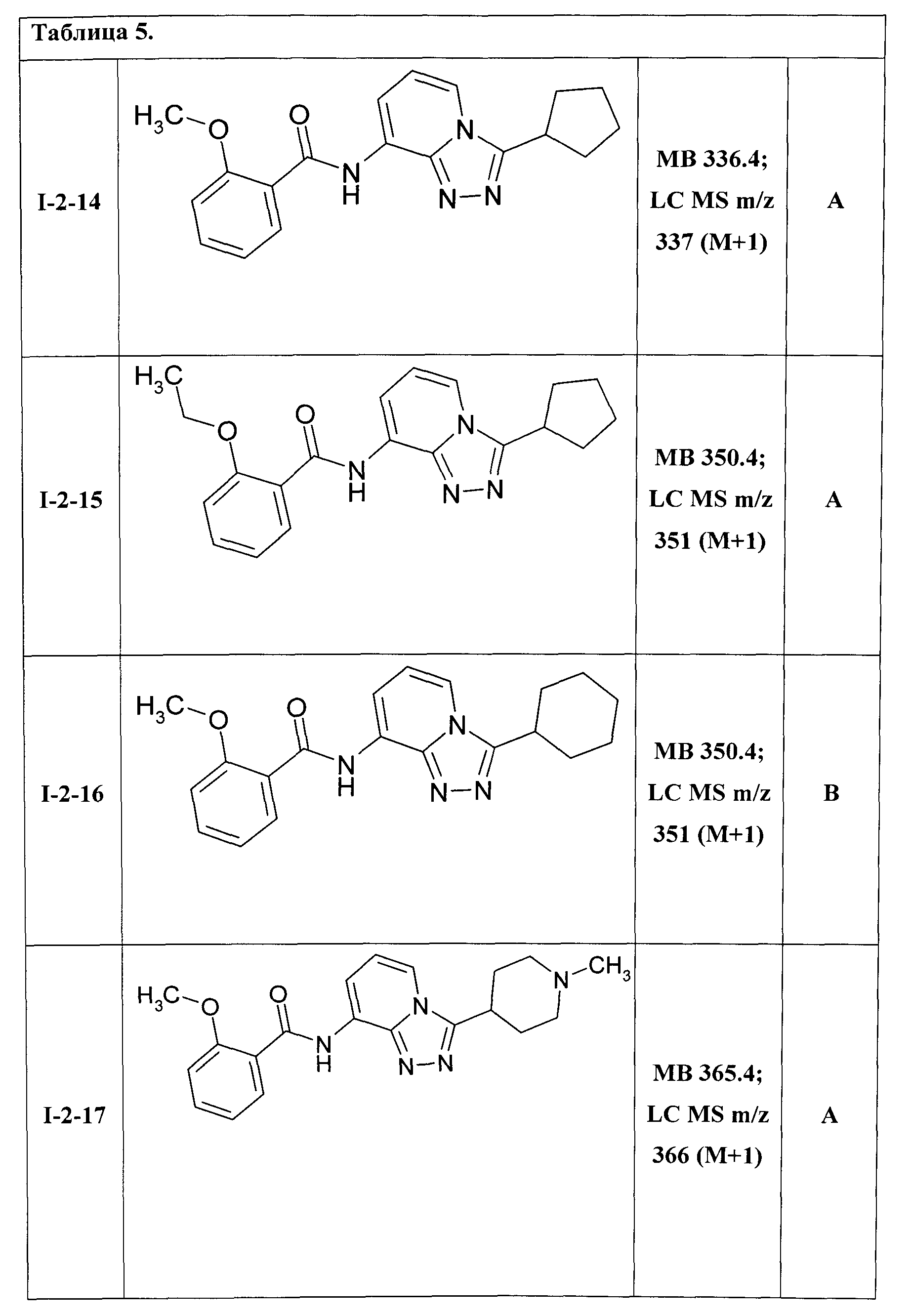
8-[(2-метоксибензоил)амино]-3-циклопентил-[1,2,4]триазоло[4,3-а]пиридин (I-2-14);
8-[(2-этоксибензоил)амино]-3-циклопентил-[1,2,4]триазоло[4,3-а]пиридин (I-2-15);
8-[(2-метоксибензоил)амино]-3-циклогексил-[1,2,4]триазоло[4,3-а]пиридин (I-2-16);
8-[(2-метоксибензоил)амино]-3-(N-метилпиперидин-4-ил)-[1,2,4]триазоло[4,3-а]пиридин (I-2-17);
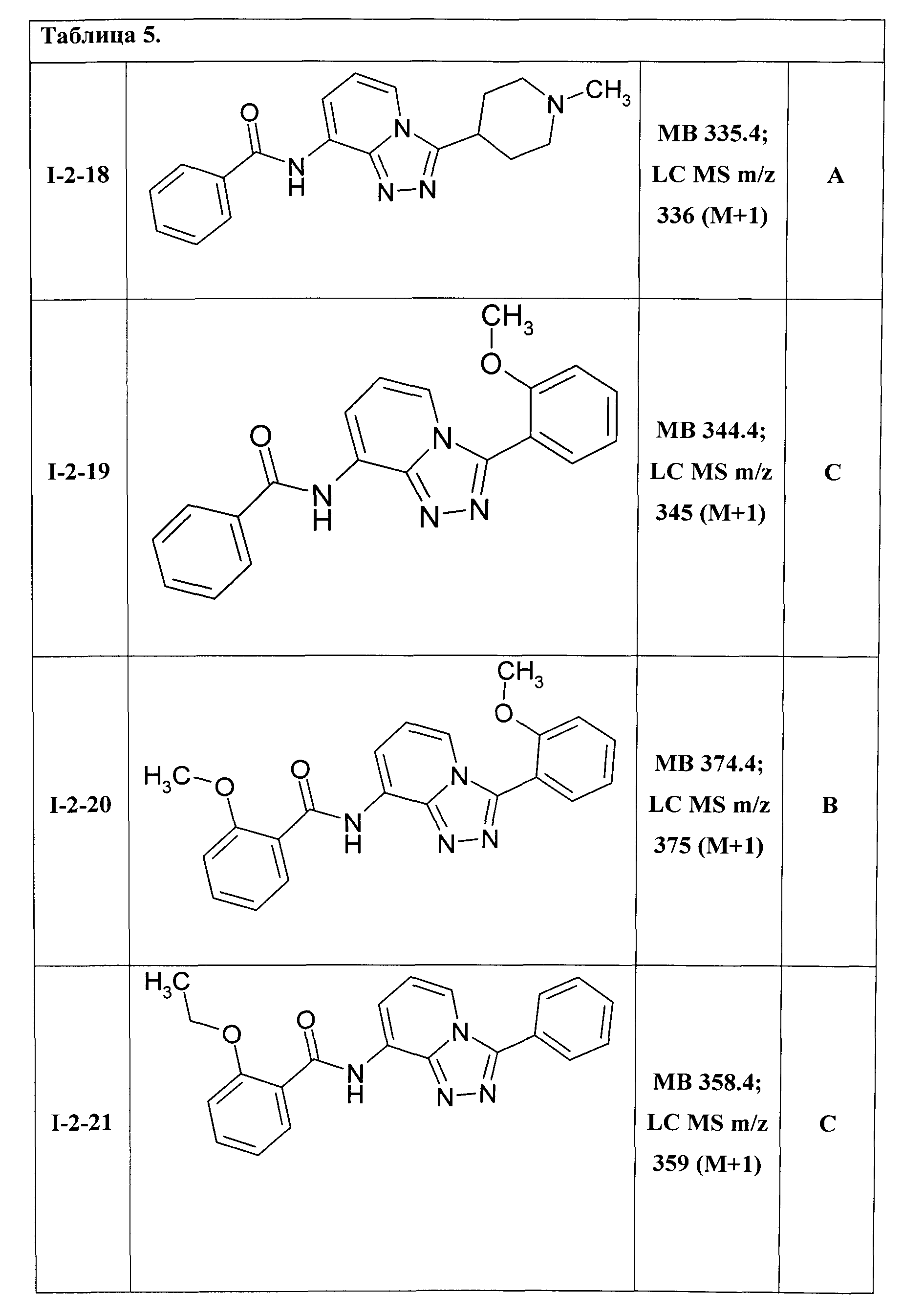
8-(бензоиламино]-3-(N-метилпиперидин-4-ил)-[1,2,4]триазоло[4,3-а]пиридин (I-2-18);
8-(бензоиламино]-3-(2-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин (I-2-19);
8-(2-метоксибензоиламино]-3-(2-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин (I-2-20);
8-(2-этоксибензоиламино]-3-фенил-[1,2,4]триазоло[4,3-а]пиридин (I-2-21);
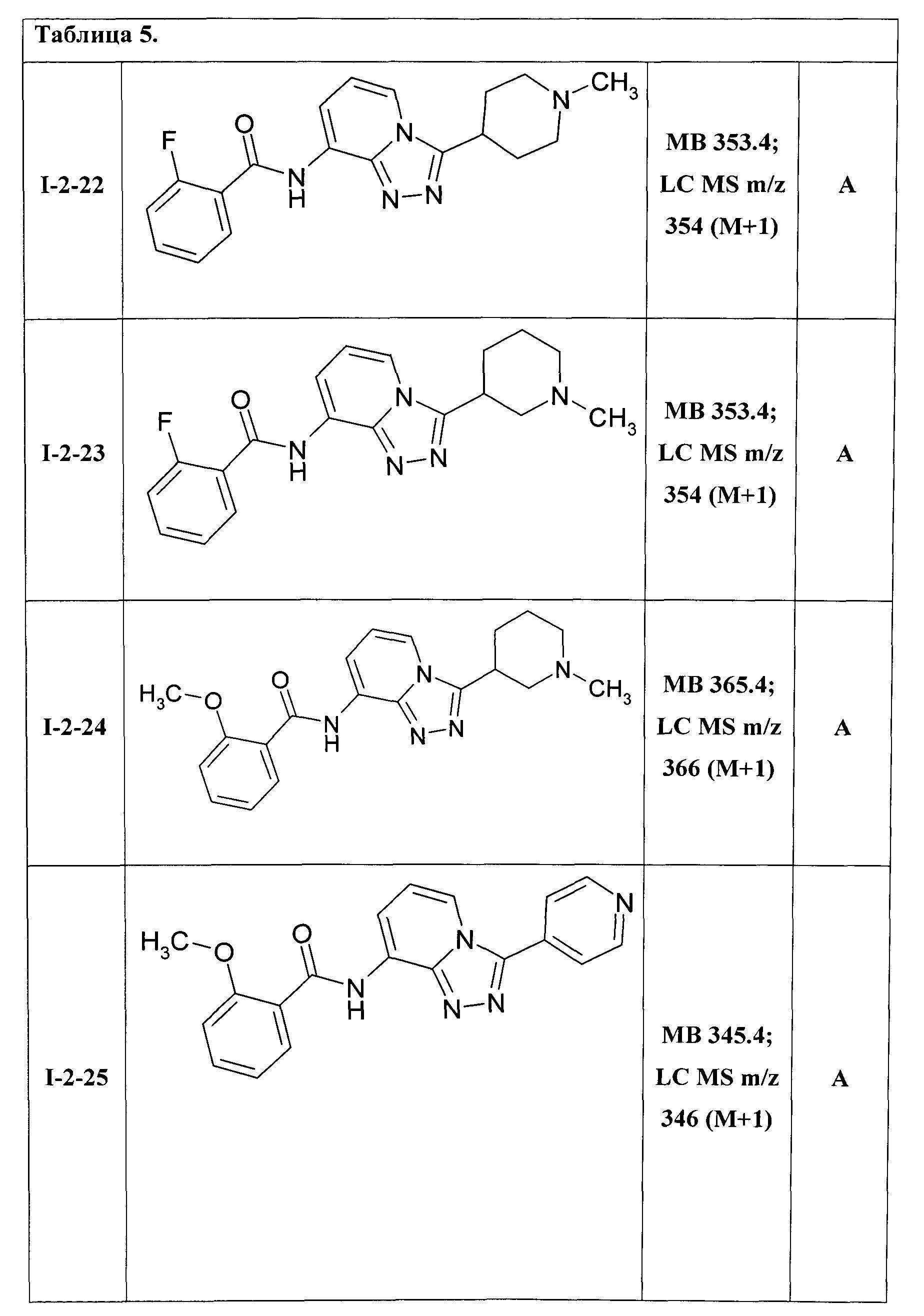
8-[(2-фторбензоил)амино]-3-(N-метилпиперидин-4-ил)-[1,2,4]триазоло[4,3-а]пиридин (I-2-22);
8-[(2-фторбензоил)амино]-3-(N-метилпиперидин-3-ил)-[1,2,4]триазоло[4,3-а]пиридин (I-2-23);
8-[(2-метоксибензоил)амино]-3-(N-метилпиперидин-3-ил)-[1,2,4]триазоло[4,3-а]пиридин (I-2-24);
8-[(2-метоксибензоил)амино]-3-(пиридин-4-ил)-[1,2,4]триазоло[4,3-а]пиридин (I-2-25);
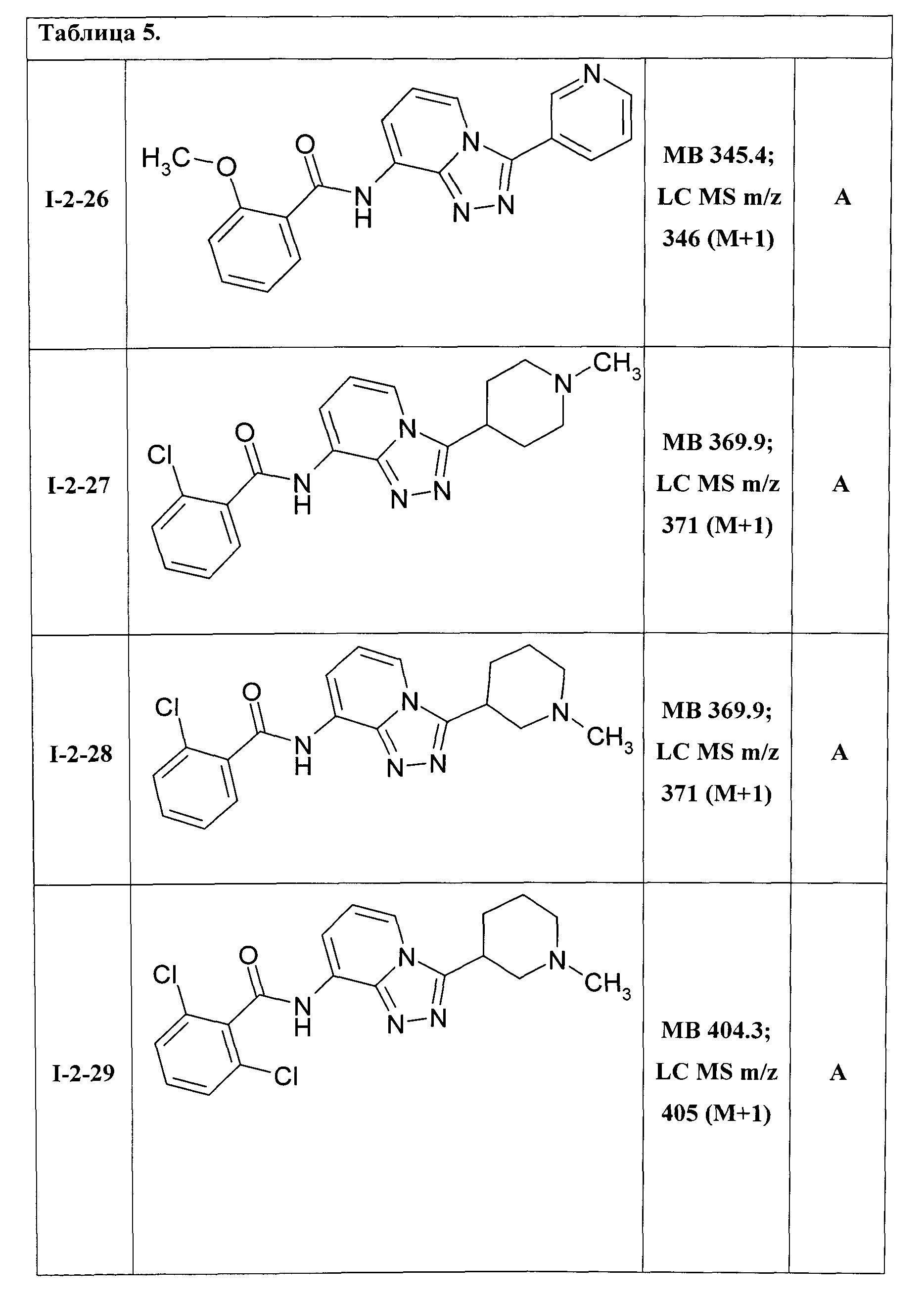
8-[(2-метоксибензоил)амино]-3-(пиридин-3-ил)-[1,2,4]триазоло[4,3-а]пиридин (I-2-26);
8-[(2-хлорбензоил)амино]-3-(N-метилпиперидин-4-ил)-[1,2,4]триазоло[4,3-а]пиридин (I-2-27);
8-[(2-хлорбензоил)амино]-3-(N-метилпиперидин-3-ил)-[1,2,4]триазоло[4,3-а]пиридин (I-2-28);
8-[(2,6-дихлорбензоил)амино]-3-(N-метилпиперидин-3-ил)-[1,2,4]триазоло[4,3-а]пиридин (I-2-29);
8-[(2,6-диметилбензоил)амино]-3-(N-метилпиперидин-3-ил)-[1,2,4]триазоло[4,3-а]пиридин (I-2-30);
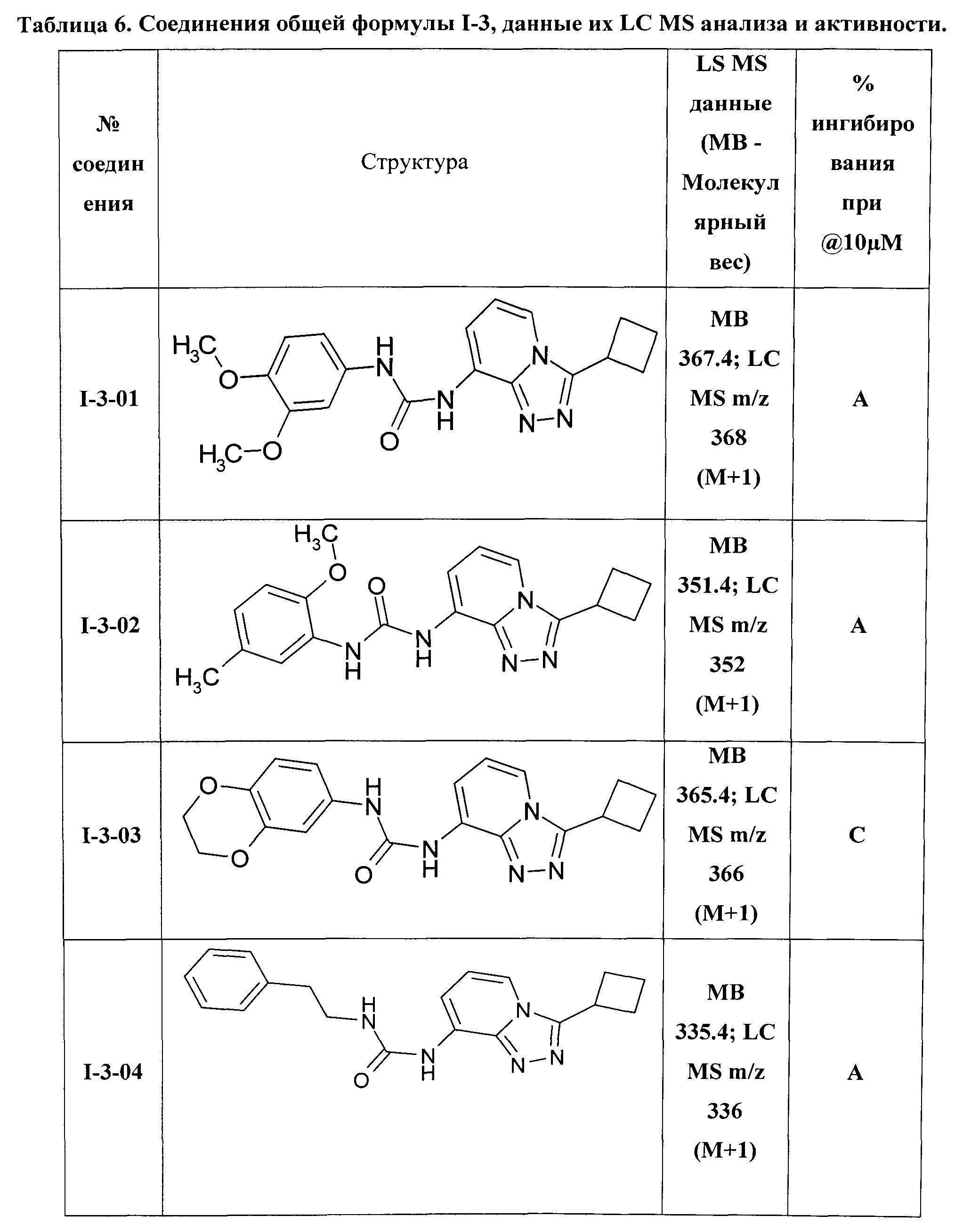
1-(3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин-8-ил)-3-(3,4-диметоксифенил)-мочевина (I-3-01);
1-(3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин-8-ил)-3-(2-метокси-5-метилфенил)-мочевина (I-3-02);
1-(3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин-8-ил)-3-(3,4-этилендиоксифенил)-мочевина (I-3-03);
1-(3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин-8-ил)-3-(2-фенилэтил)-мочевина (I-3-04);
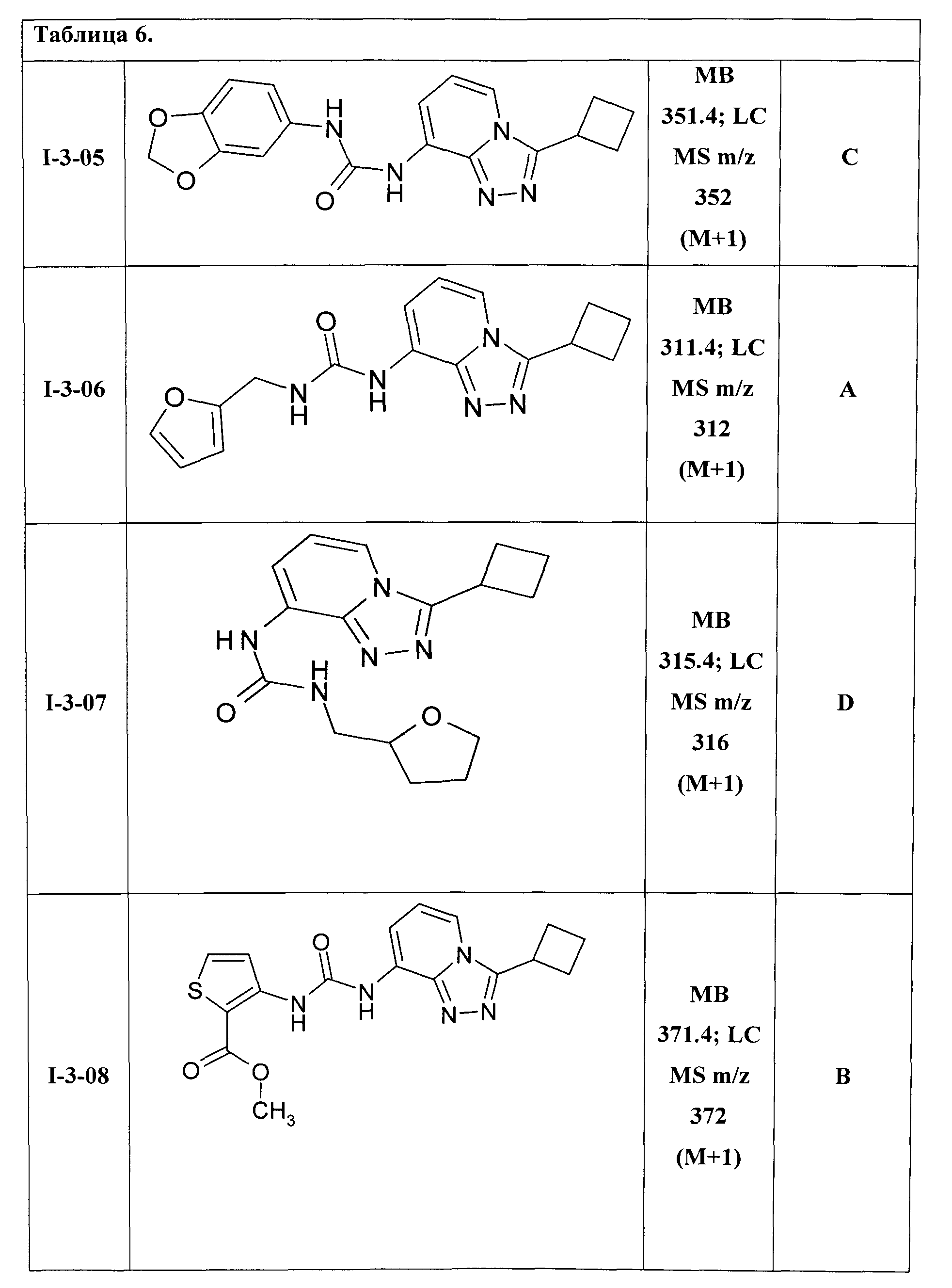
1-(3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин-8-ил)-3-(3,4-метилендиоксифенил)-мочевина (I-3-05);
1-(3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин-8-ил)-3-(фурил-2-метил)-мочевина (I-3-06);
1-(3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин-8-ил)-3-(тетрагидрофурил-2-метил)-мочевина (I-3-07);
1-(3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин-8-ил)-3-(2-метоксикарбонилтиенил-3)-мочевина (I-3-08);
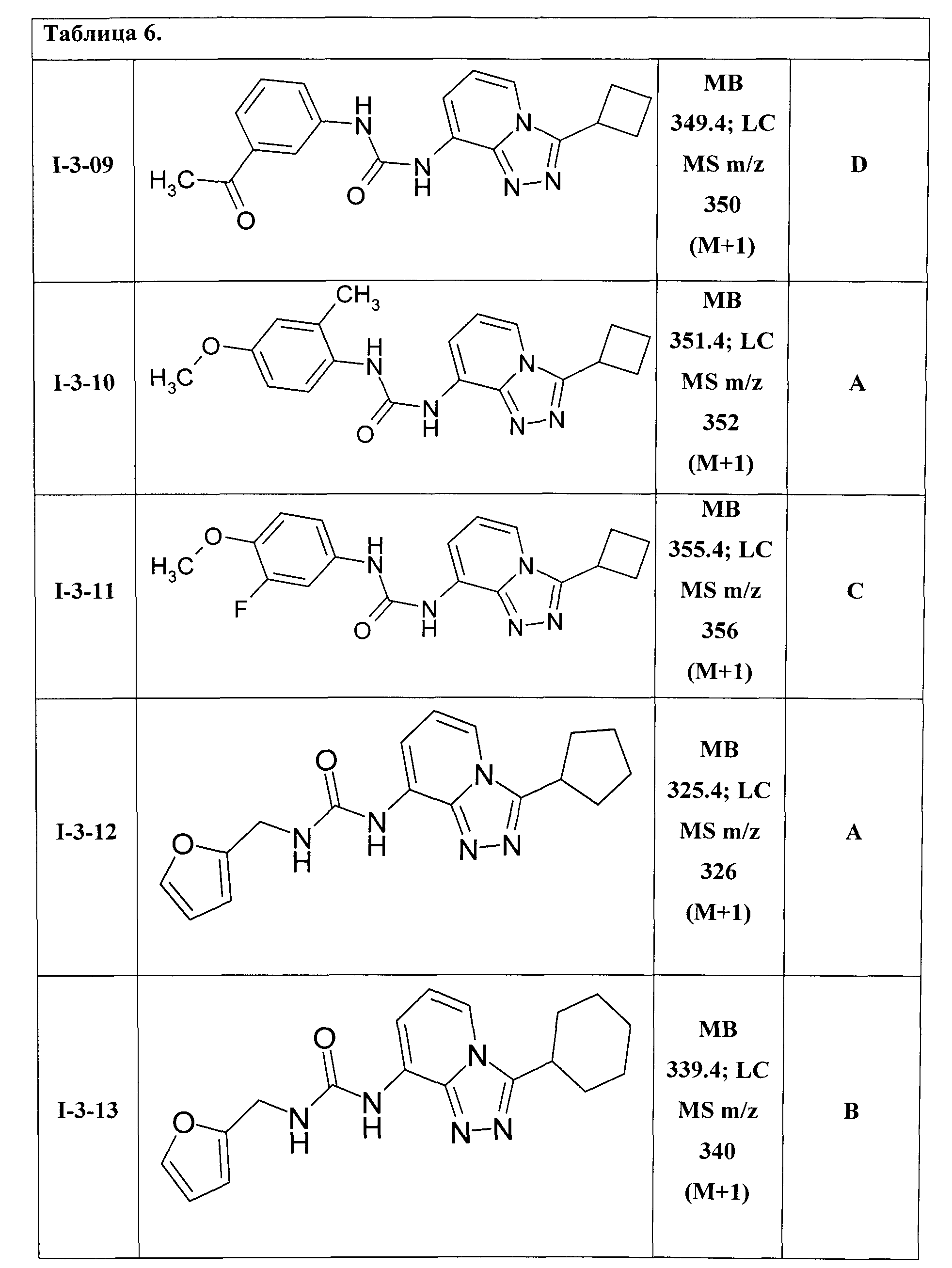
1-(3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин-8-ил)-3-(3-ацетилфенил)-мочевина (I-3-09);
1-(3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин-8-ил)-3-(4-метокси-2-метилфенил)-мочевина (I-3-10);
1-(3-циклобутил-[1,2,4]триазоло[4,3-а]пиридин-8-ил)-3-(4-метокси-3-фторфенил)-мочевина (I-3-11);
1-(3-циклопентил-[1,2,4]триазоло[4,3-а]пиридин-8-ил)-3-(фурил-2-метил)-мочевина (I-3-12);
1-(3-циклогексил-[1,2,4]триазоло[4,3-а]пиридин-8-ил)-3-(фурил-2-метил)-мочевина (I-3-13);
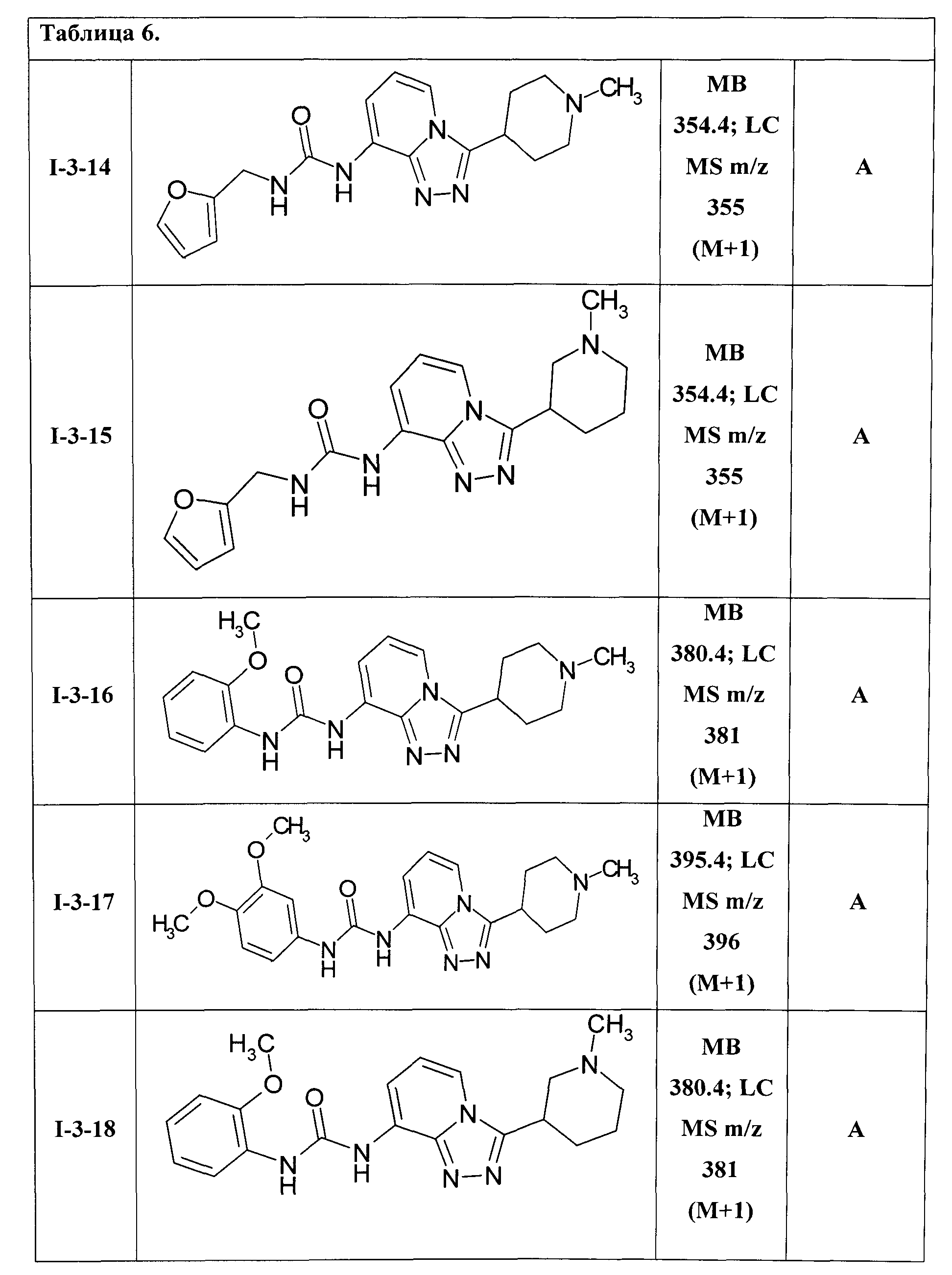
1-{3-N-метилпиперидин-4-ил)[1,2,4]триазоло[4,3-а]пиридин-8-ил}-3-(фурил-2-метил)-мочевина (I-3-14);
1-{3-N-метилпиперидин-3-ил)[1,2,4]триазоло[4,3-а]пиридин-8-ил}-3-(фурил-2-метил)-мочевина (I-3-15);
1-{3-(N-метилпиперидин-4-ил)[1,2,4]триазоло[4,3-а]пиридин-8-ил}-3-(2-метоксифенил)-мочевина (I-3-16);
1-{3-(N-метилпиперидин-4-ил)[1,2,4]триазоло[4,3-а]пиридин-8-ил}-3-(3,4-диметоксифенил)-мочевина (I-3-17);
1-{3-(N-метилпиперидин-3-ил)[1,2,4]триазоло[4,3-а]пиридин-8-ил}-3-(2-метоксифенил)-мочевина (I-3-18);
1-{3-(N-метилпиперидин-3-ил)[1,2,4]триазоло[4,3-а]пиридин-8-ил}-3-(3,4-диметоксифенил)-мочевина (I-3-19);
1-(3-пирид-4-ил-[1,2,4]триазоло[4,3-а]пиридин-8-ил)-3-(фурил-2-метил)-мочевина (I-3-20);
1-(3-пирид-3-ил-[1,2,4]триазоло[4,3-а]пиридин-8-ил)-3-(фурил-2-метил)-мочевина (I-3-21);
1-(3-пирид-4-ил-[1,2,4]триазоло[4,3-а]пиридин-8-ил)-3-(фурил-2-метил)-мочевина (I-3-22);
1-(3-пирид-3-ил-[1,2,4]триазоло[4,3-а]пиридин-8-ил)-3-(фурил-2-метил)-мочевина (I-3-23);
1-{3-(N-метилпиперидин-4-ил)[1,2,4]триазоло[4,3-а]пиридин-8-ил}-3-аллилмочевина (I-3-24);
1-{3-(N-метилпиперидин-3-ил)[1,2,4]триазоло[4,3-а]пиридин-8-ил}-3-аллилмочевина (I-3-25);
Предметом данного изобретения являются фармацевтически приемлемые соли соединений общей формулы I. Часть соединений данного изобретения содержит ионогенные группы (вторичные, третичные амины) и может образовывать соли, которые были получены способами, известными в данной области техники.
Предметом данного изобретения является способ получения производных [1,2,4]триазоло[4,3-а]пиридинов общей формулы I-2 и I-3 (Схема 2):
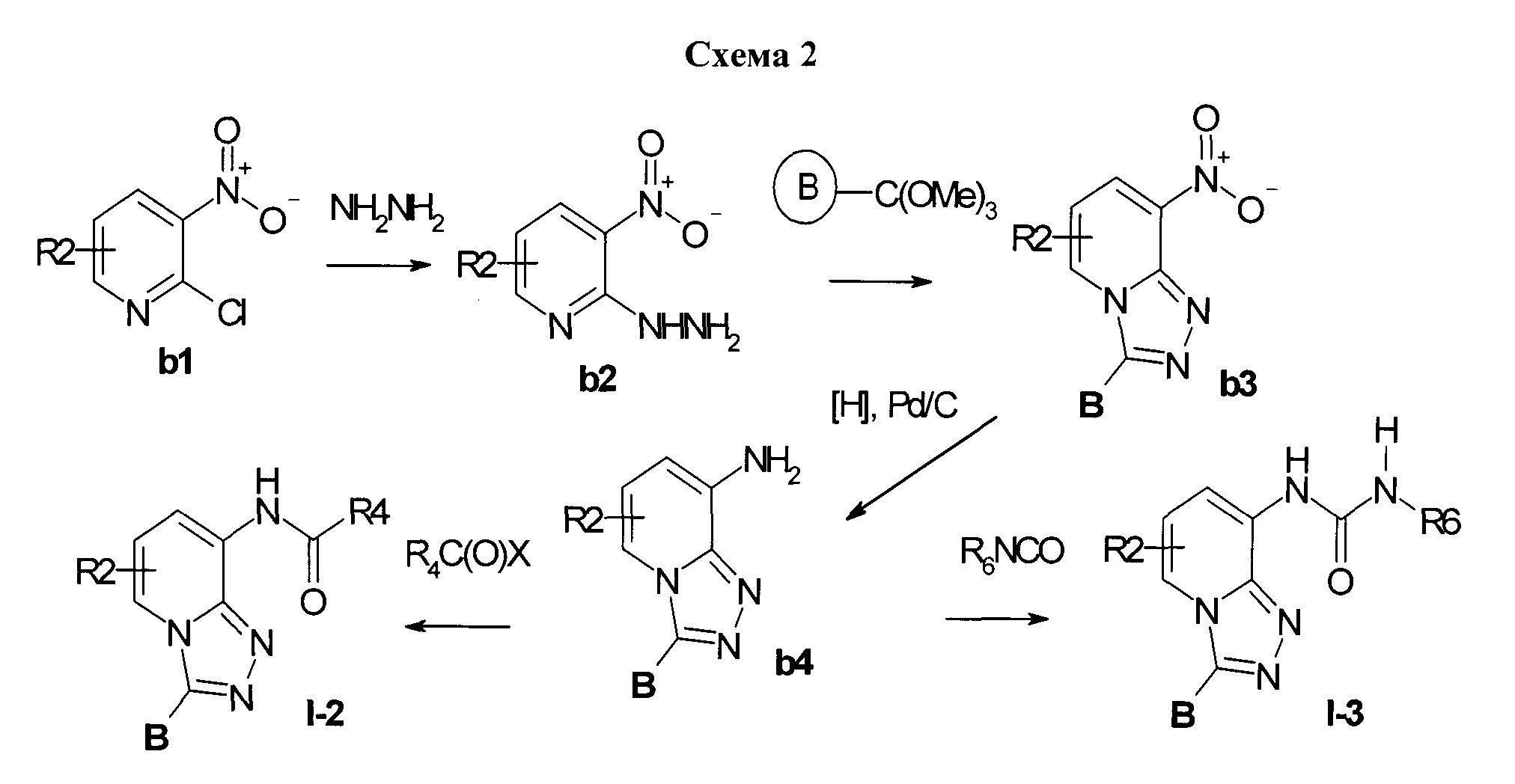
Для этого из 2-хлор-3-нитропиридинов b1 получали соответствующие 2-гидразино-3-нитропиридины b2. Гидразины b2 циклоконденсировали с подходящим ацил-производным, получая [1,2,4]триазоло[4,3-а]пиридины b3. Далее нитропиридины b3 восстанавливали водородом над палладием на угле и получали серию гетероциклических аминов b4. Ацилирование аминов b4 подходящими ацилгалогенидами (ацилхлоридом, ацилфторидом, ацилбромидом) в апротонном нейтральном растворителе (дихлорметан, диоксан, хлороформ и подобные) в присутствии основания (триэтиламин, DABCO, пиридин и подобные) при охлаждении приводило к серии веществ I-2. Взаимодействие аминов b4 с изотиоцианатами в нейтральном растворителе (этанол, дихлорметан, диоксан, хлороформ и подобные) приводило к серии веществ I-3.
Заместители R2, R3a и R3b, R4, R6 и В в Схемах 1 и 2 определены выше, Х=Cl.
Предметом данного изобретения является активный компонент, обладающий свойствами антагониста А2А рецепторов, представляющий собой (субстанцию) для приготовления фармацевтических композиций и готовых лекарственных форм для профилактики и лечения нарушений деятельности ЦНС, нейродегенеративных, воспалительных, инфекционных и онкологических заболеваний и представляющий собой соединения общей формулы I.
Предметом данного изобретения являются новые соединения общей формулы I представляющие собой средство (адьювант) для усиления иммунного ответа или действия лекарственных средств, при комбинированном лечении нарушений деятельности ЦНС, нейродегенеративных, воспалительных, инфекционных и онкологических заболеваний.
Предметом данного изобретения является фармацевтическая композиция, обладающая антагонистической активностью по отношению к аденозиновому А2А рецептору, включающая в качестве активного компонента (субстанции) или средства (адьюванта) соединения общей формулы I или их фармацевтически приемлемые соли в терапевтически эффективном количестве.
Предметом данного изобретения является любая из вышеуказанных фармацевтических композиций в форме таблеток, капсул и инъекций, мазей, гелей и других готовых форм, помещенных в фармацевтически приемлемую упаковку.
Фармацевтические композиции могут включать фармацевтически приемлемые эксципиенты, а именно: применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция наряду с соединением общей формулы I или его фармацевтически приемлемой солью, по настоящему изобретению, может включать и другие активные субстанции при условии, что они не вызывают нежелательных эффектов.
При необходимости использования фармацевтических композиций по настоящему изобретению в клинической практике они могут смешиваться для изготовления различных форм, при этом они могут включать в свой состав традиционные фармацевтические носители; например, пероральные формы (такие, как таблетки, желатиновые капсулы, пилюли, растворы или суспензии); формы для инъекций (такие, как растворы или суспензии для инъекций, или сухой порошок для инъекций, который требует лишь добавления воды для инъекций перед использованием); местные формы (такие, как мази или растворы).
Носители, используемые в фармацевтических композициях по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, в том числе: в пероральных формах используются связующие вещества, смазывающие агенты, дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты, бесцветные агенты, корригенты вкуса; в формах для инъекций используются антисептические агенты, солюбилизаторы, стабилизаторы; в местных формах используются основы, разбавители, смазывающие агенты, антисептические агенты.
Предметом данного изобретения является способ получения фармацевтической композиции смешением с инертным наполнителем, вспомогательным агентом, носителем и/или растворителем, по крайней мере, одного активного компонента (субстанции) общей формулы I или его фармацевтически приемлемой соли в терапевтически эффективном количестве.
Предметом данного изобретения является способ селективного ингибирования активности аденозинового А2А рецептора, заключающийся в действии активного компонента (субстанции) общей формулы I на биологические объекты или образцы, функции которых регулируются А2А аденозиновыми рецепторами.
Предметом данного изобретения является лекарственное средство, обладающее антагонистической активностью по отношению к аденозиновому А2А рецептору, в форме таблеток, капсул иди инъекций, помещенных в фармацевтически приемлемую упаковку, предназначенное для профилактики и лечения нарушений деятельности ЦНС, нейродегенеративных, воспалительных, инфекционных и онкологических заболеваний у людей и теплокровных животных, включающее в свой состав новый активный компонент (субстанцию) общей формулы I или фармацевтическую композицию в терапевтически эффективном количестве.
Лекарственные средства могут вводиться перорально или парентерально (например, внутривенно, подкожно, внутрибрюшинно или местно). Клиническая дозировка средства общей формулы I у пациентов может корректироваться в зависимости от терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их метаболизма и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента. При этом суточная доза у взрослых обычно составляет 10~500 мг, предпочтительно - 50~300 мг. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени (предпочтительно - от одного до шести раз в сутки).
Предметом настоящего изобретения является способ профилактики и лечения нарушений деятельности ЦНС, нейродегенеративных, воспалительных, инфекционных и онкологических заболеваний у животных и людей, который заключается во введении в эффективном количестве пациенту лекарственного средства или фармацевтической композиции, включающих в свой состав новый активный компонент (субстанцию) общей формулы I, в терапевтически эффективном количестве.
Изобретение иллюстрируется, но не ограничивается следующими примерами.
Исходные реагенты и физико-химические методы доказательства строения синтезированных веществ и их чистоты.
Все растворители и реагенты были получены из коммерческих источников, таких как Acros (Бельгия), Sigma-Aldrich (США), Lancaster (Англия) и ChemDiv (США). Растворители и реагенты использовали без дополнительной очистки. 1Н-ЯМР спектры регистрировали на спектрометре фирмы Bruker DPX-400 (400 MHz, 27°C). Химические сдвиги приведены в шкале δ (м.д.), внутренний стандарт тетраметилсилан.
LC-MS характеристики заявляемых соединений (Таблицы 5-7) определяли на установке Shimadzu HPLC, оборудованной колонкой Waters XBridge C18 3.5 mm (4.6 мм × 150 мм), детектором РЕ SCIEX API 150 EX mass detector, или спектрофотометрическим детектором Shimadzu detector (λ, 220 and 254 nm). В соответствии с данными LC-MS все синтезированные соединения имели содержание основного вещества выше 95%.
Аналитическую ТСХ проводили на силикагеле на алюминевых пластинках Silufol UV254 (5 см × 15 см) (Kavalier, Czech Republic) или на стеклянных пластинках с 0.25 мм слоем силикагеля 60 F254 (Merck, Germany). Визуализация осуществлялась с помощью УФ света на длинне волны 254 нм. Для хроматографической очистки использовали силикагель 5-40 µm (Chemapol, Czech Republic) и 63 µm (ЕМ Science, USA).
Методы получения и ЯМР характеристики заявляемых соединений
Пример 1. Синтез этилового эфира 2-гидразинил-никотиновой кислоты а2-1
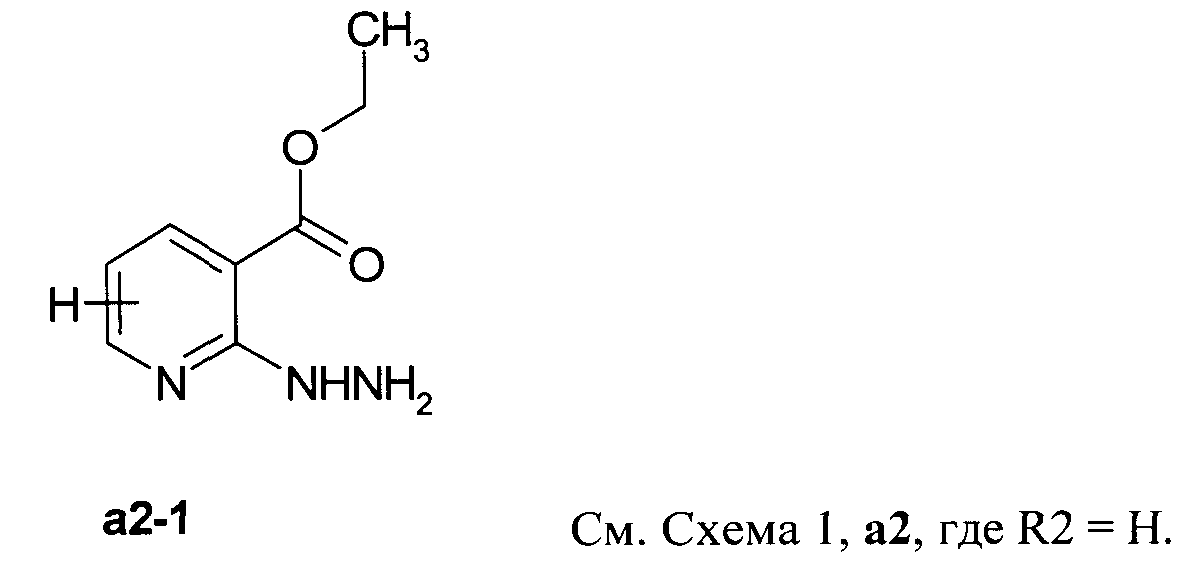
Раствор этил-2-хлорникотината а1-1 (10 г, 53.9 ммоль) и безводного гидразина (4.08 г, 127.6 ммоль) в 200 мл диоксана перемешивали при 60°С 12 часов. Смесь охлаждали, концентрировали в вакууме и растворяли в 35 мл абсолютного метанола, удаляя осадок. Метанол упаривали, продукт а2-1 кристаллизовали под абсолютным эфиром. Выход: 5.4 г (55%). MB 181; LC MS m/z 182 (M+H).
Пример 2. Общий метод синтеза этиловых эфиров 2-[(2-ацил-замещенных)гидразинил]-никотиновых кислот.
Суспензию карбоновой кислоты (45.8 ммоль), гидроксибензотриазола HOBt (6.25 г, 46 ммоль) и N-этил-N′-3-диметиламинопропилкарбодиимида EDC (8.74 г, 46 ммоль) в сухом дихлорметане (200 мл) перемешивали при комнатной температуре 10 минут, затем в смесь добавляли раствор гидразина а2-1 (9.5 г, 52.4 ммоль) в 150 мл дихлорметана. Реакционную смесь перемешивали при комнатной температуре от 2.0 до 16 часов, удаляли осадок, а затем промывали водой (3×100 мл). Органический слой сушили над MgSO4 и упаривали. Полученный твердый остаток использовали далее без дополнительной очистки. Выход: 50-85%.
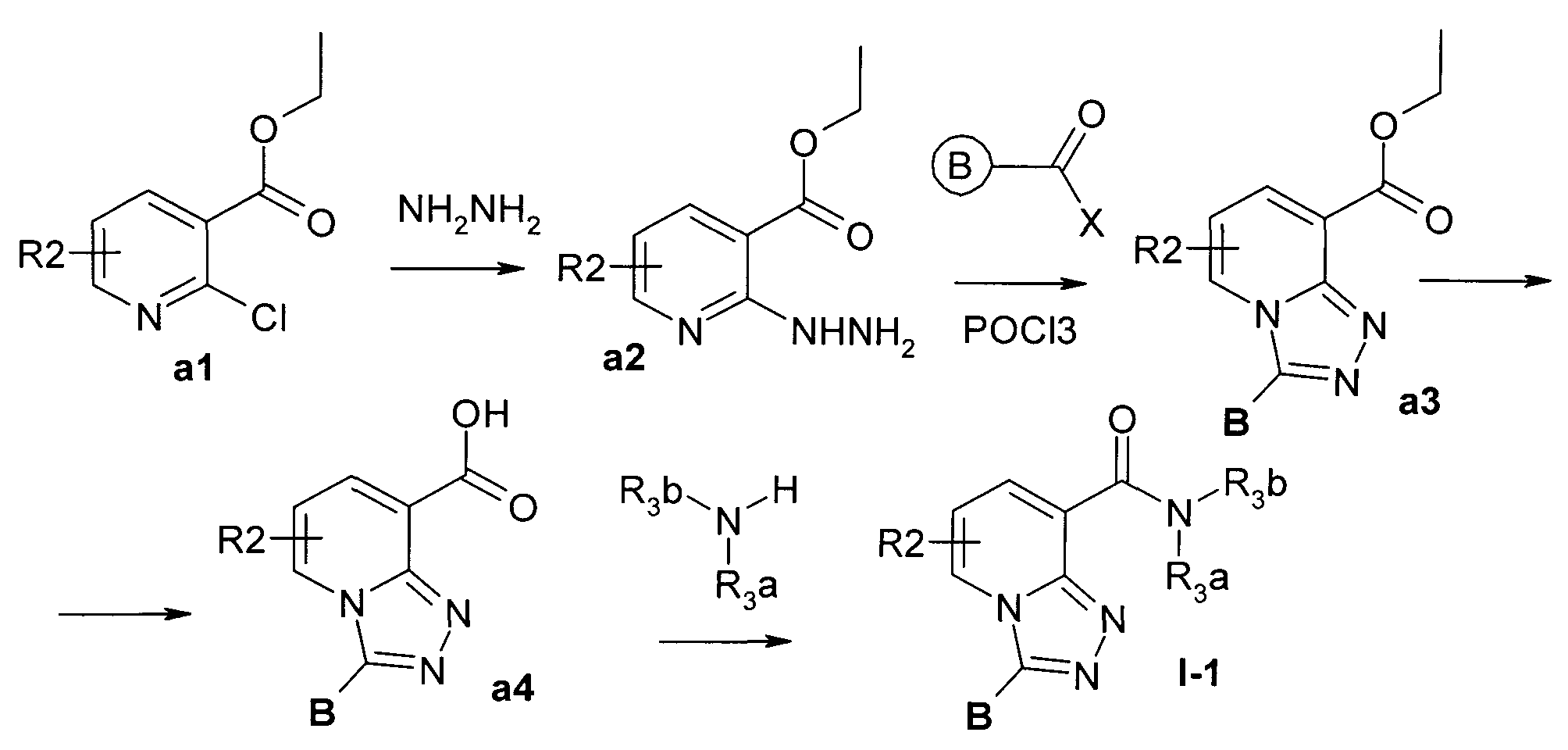
Пример 3. Общий метод синтеза этиловых эфиров 3-замещенных [1,2,4]триазоло[4,3-а]пиридин-8-карбоновых кислот а3 (см. Схема 1).
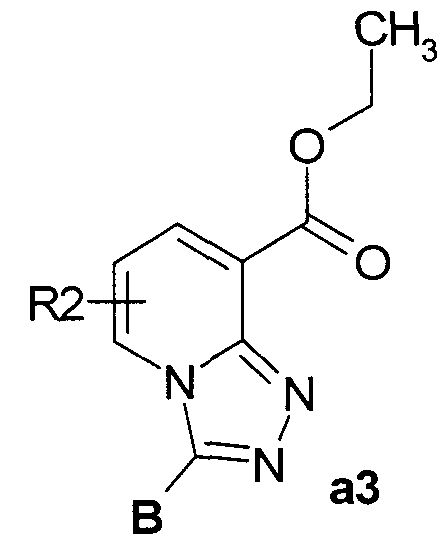 К раствору 3.0 ммоль этилового эфира 2-[(2-ацил-замещенной)гидразинил]-никотиновой кислоты в 150 мл дихлорметана добавляли 15 мл POCI3, затем смесь кипятили 2.5-20 часов, контролируя протекание реакции с помощью ТСХ. Смесь охлаждали и концентрировали в вакууме. Остаток растворяли в 200 мл этилацетата, полученную смесь обрабатывали водным раствором NaHCO3 и сушили над сульфатом магния. После упаривания этилацетата получали гетероциклические эфиры а3 с выходами 70-90%.
К раствору 3.0 ммоль этилового эфира 2-[(2-ацил-замещенной)гидразинил]-никотиновой кислоты в 150 мл дихлорметана добавляли 15 мл POCI3, затем смесь кипятили 2.5-20 часов, контролируя протекание реакции с помощью ТСХ. Смесь охлаждали и концентрировали в вакууме. Остаток растворяли в 200 мл этилацетата, полученную смесь обрабатывали водным раствором NaHCO3 и сушили над сульфатом магния. После упаривания этилацетата получали гетероциклические эфиры а3 с выходами 70-90%.
Схема 1
где R2, R3a и R3b, В имеют вышеуказанные значения, Х=ОН.
Пример 4. Общий метод синтеза 3-замещенных [1,2,4]триазоло[4,3-а]пиридин-8-карбоновых кислот а4 (см. Схема 1).
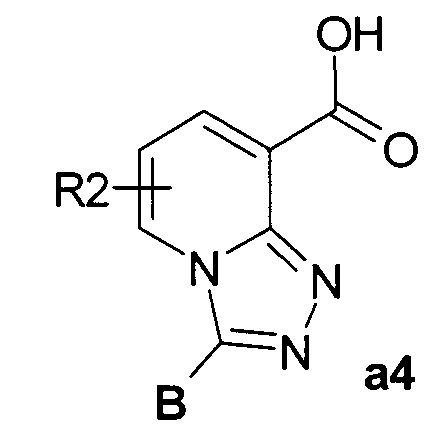 К охлажденному (0°С) раствору 1.5 ммоль эфира а3 в 10 мл этанола добавляли при перемешивании 1.5 мл 2.5 н водного раствора NaOH. Смесь нагревали до комнатной температуры в течение 3 часов, реакцию останавливали, добавляя концентрированную соляную кислоту (до рН=2-3). Смесь упаривали, остаток промывали водой и высушивали. Выход кислот а4: 70-95%.
К охлажденному (0°С) раствору 1.5 ммоль эфира а3 в 10 мл этанола добавляли при перемешивании 1.5 мл 2.5 н водного раствора NaOH. Смесь нагревали до комнатной температуры в течение 3 часов, реакцию останавливали, добавляя концентрированную соляную кислоту (до рН=2-3). Смесь упаривали, остаток промывали водой и высушивали. Выход кислот а4: 70-95%.
Пример 5. Общий метод синтеза амидов 3-замещенных [1,2,4]триазоло[4,3-а]пиридин-8-карбоновых кислот I-1/
Синтез осуществляли в соответствии со Схемой 1.
Смесь кислоты а4 (1.0 ммоль), амина (1.1 ммоль), карбодиимида EDC (1.0 ммоль) и 1-гидроксибензотриазола (1.0 ммоль) в 10 мл ДМФА перемешивали 2-20 часов при комнатной температуре, контролируя протекание реакции с помощью LS-MS. По окончании реакции смесь разбавляли 30 мл воды и экстрагировали хлористым метиленом (3×30 мл). Органический слой сушили над сульфатом магния и упаривали. Продукт очищали хроматографически на силикагеле (элюент CH2Cl2/МеОН 19:1). Выходы амидов I-1 25-85%.
Таким образом были получены соединения общей формулы I-1-01-I-1-55, представленные в Таблице 4.
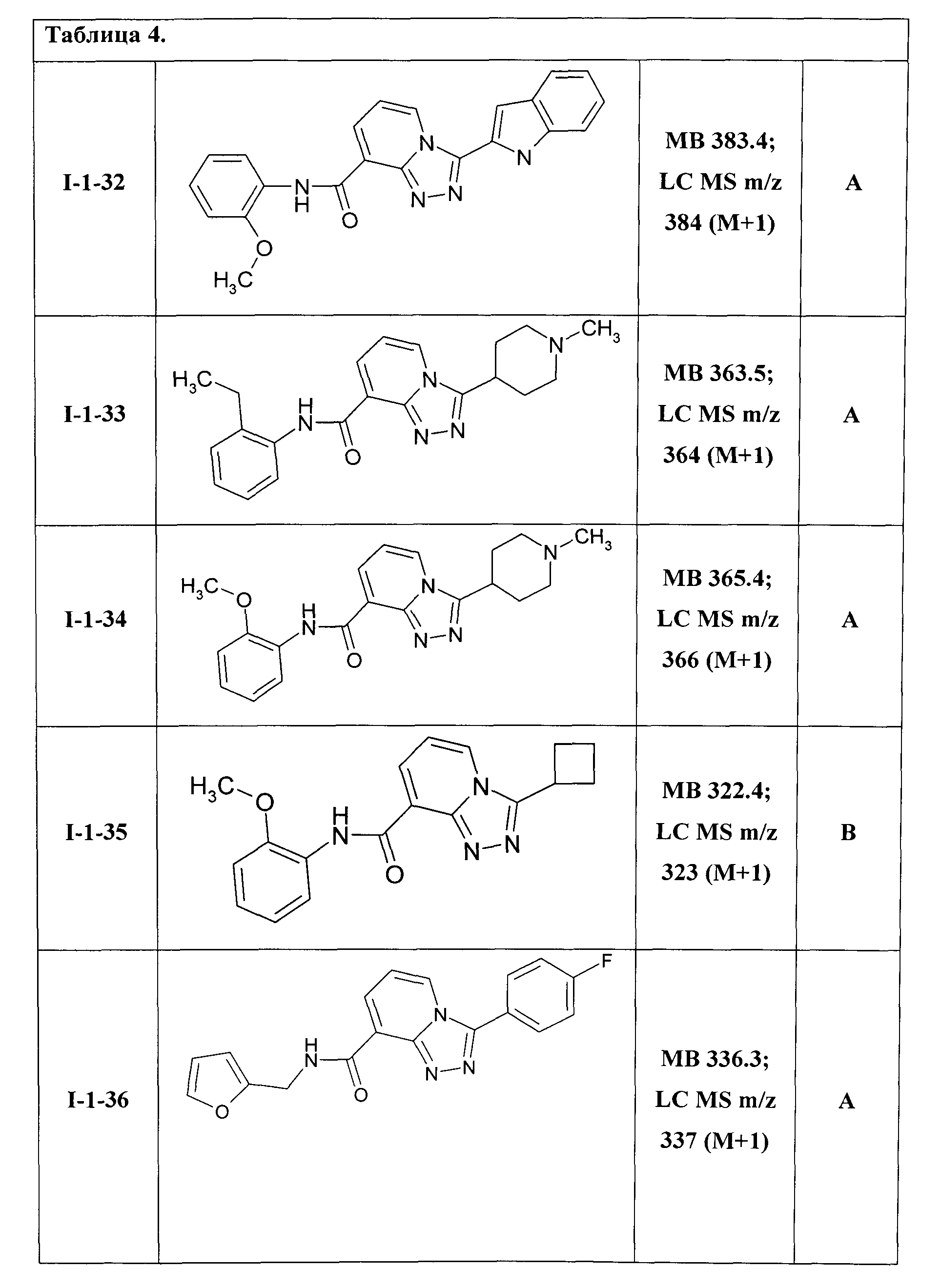
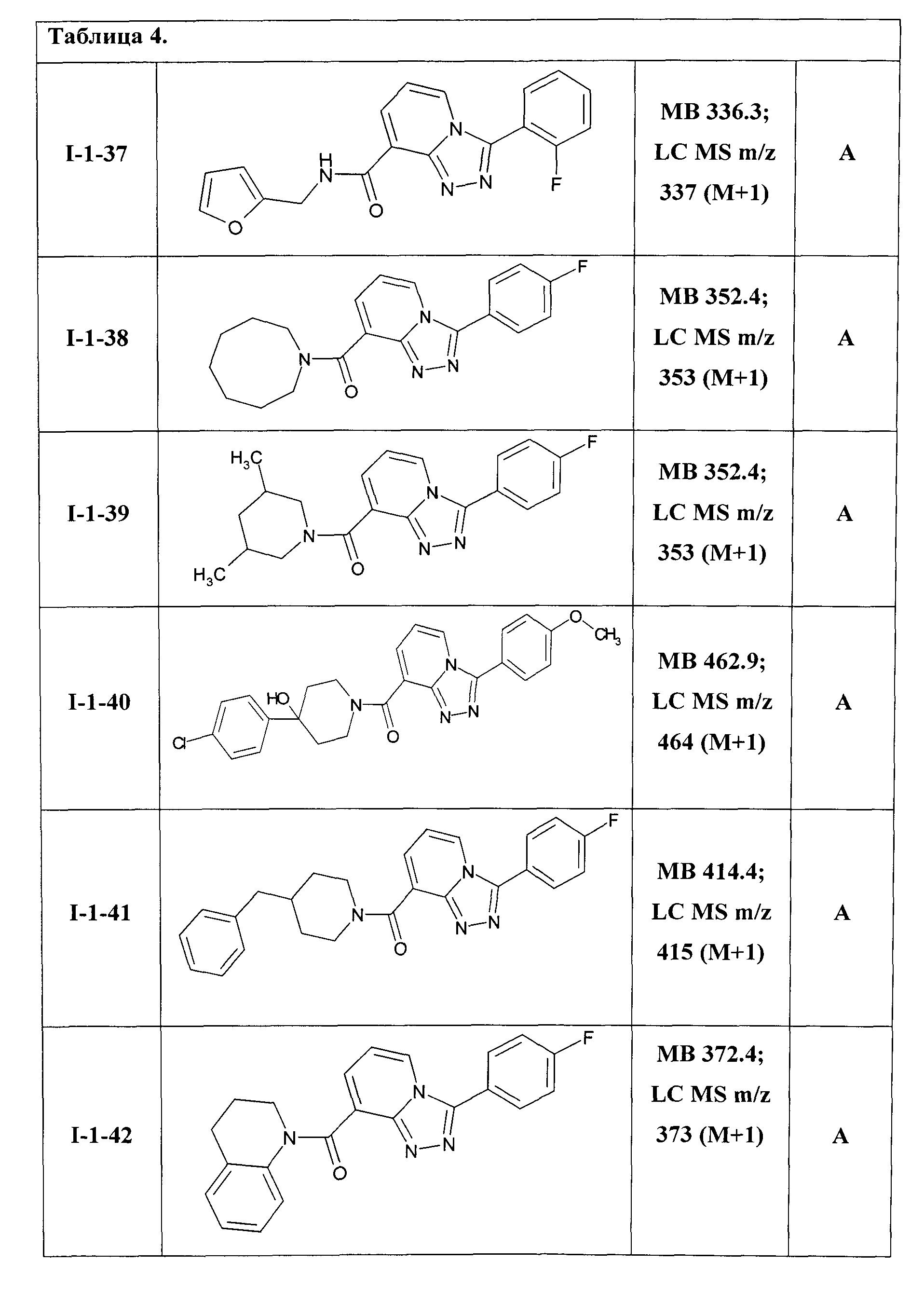
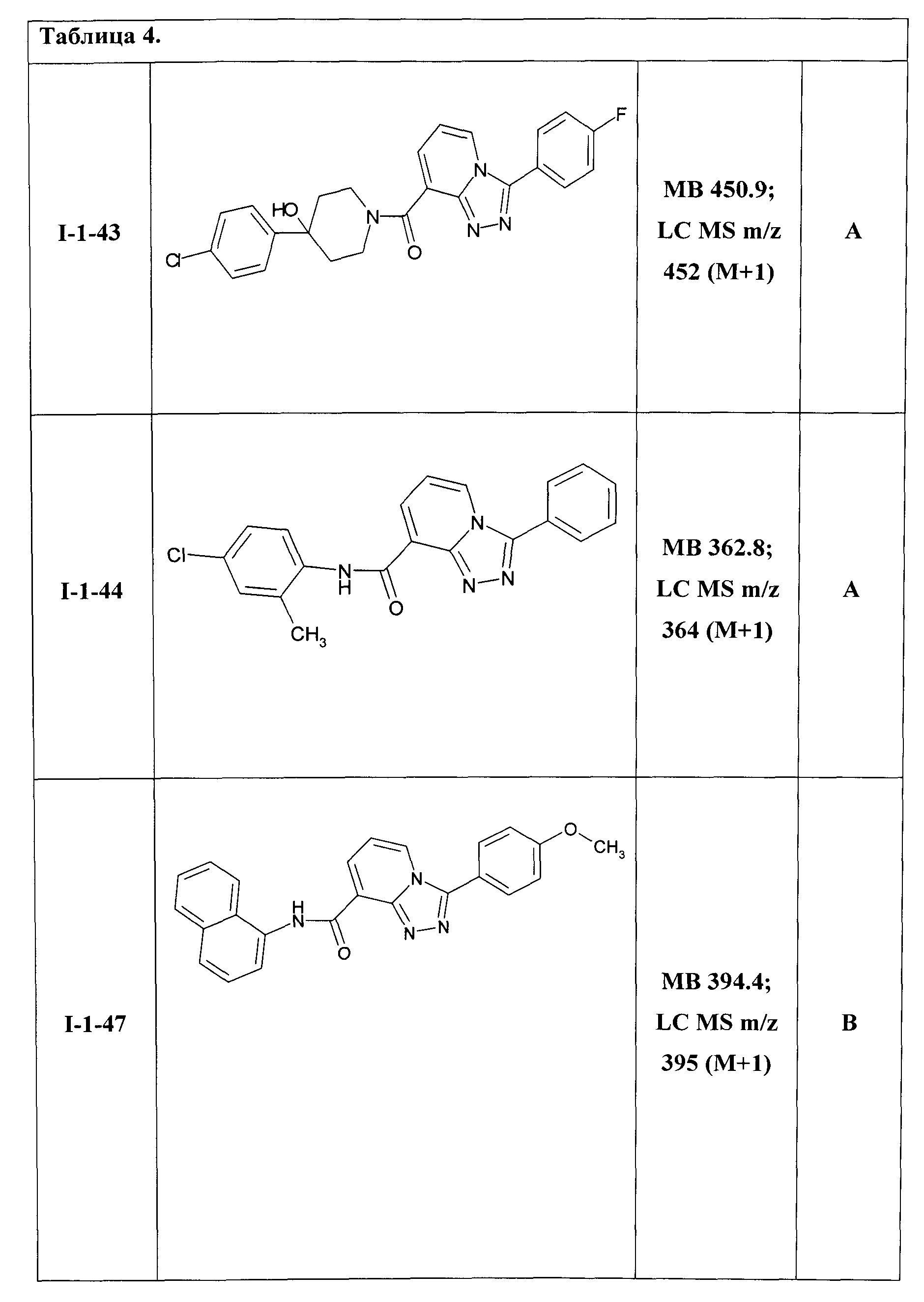
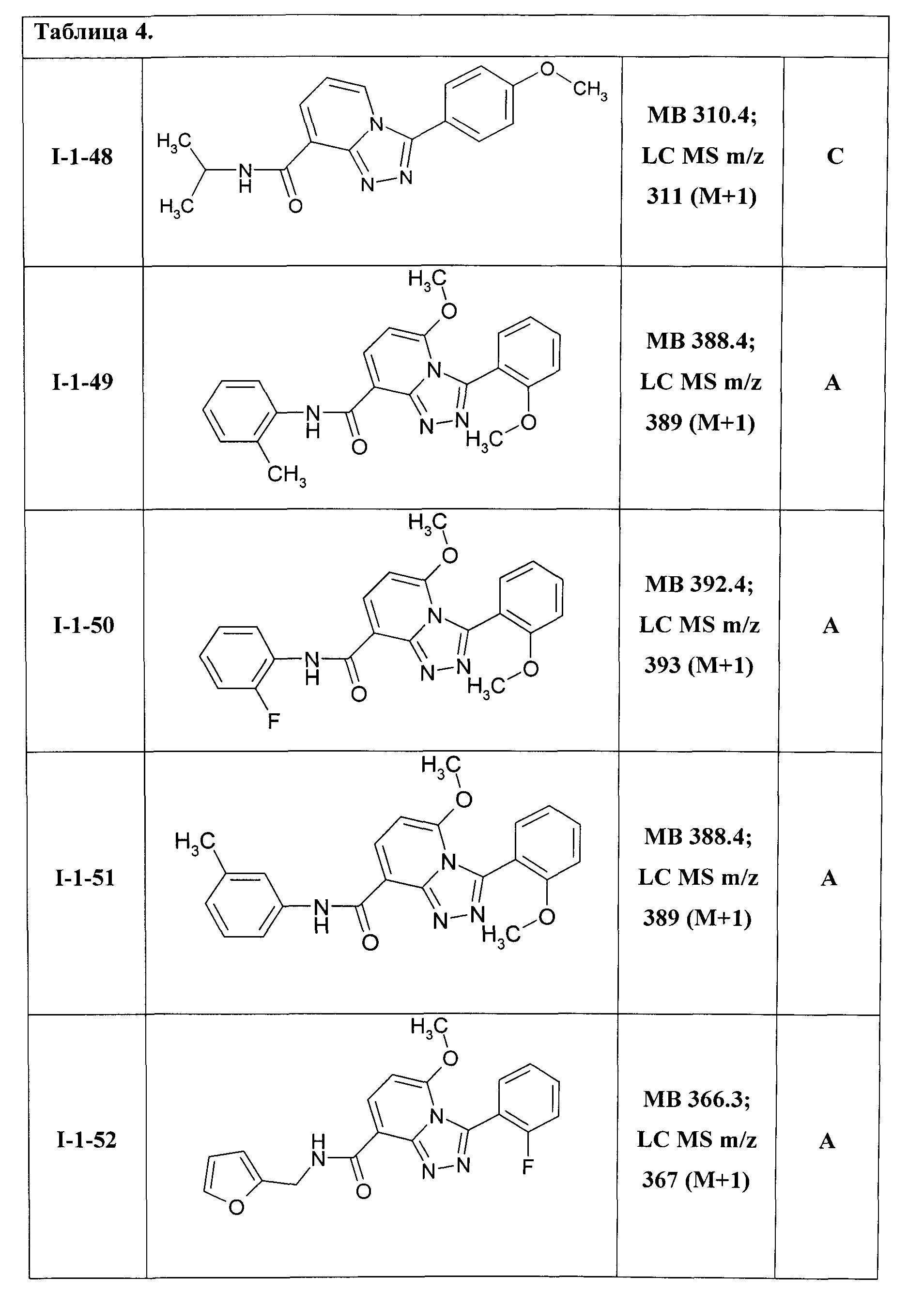
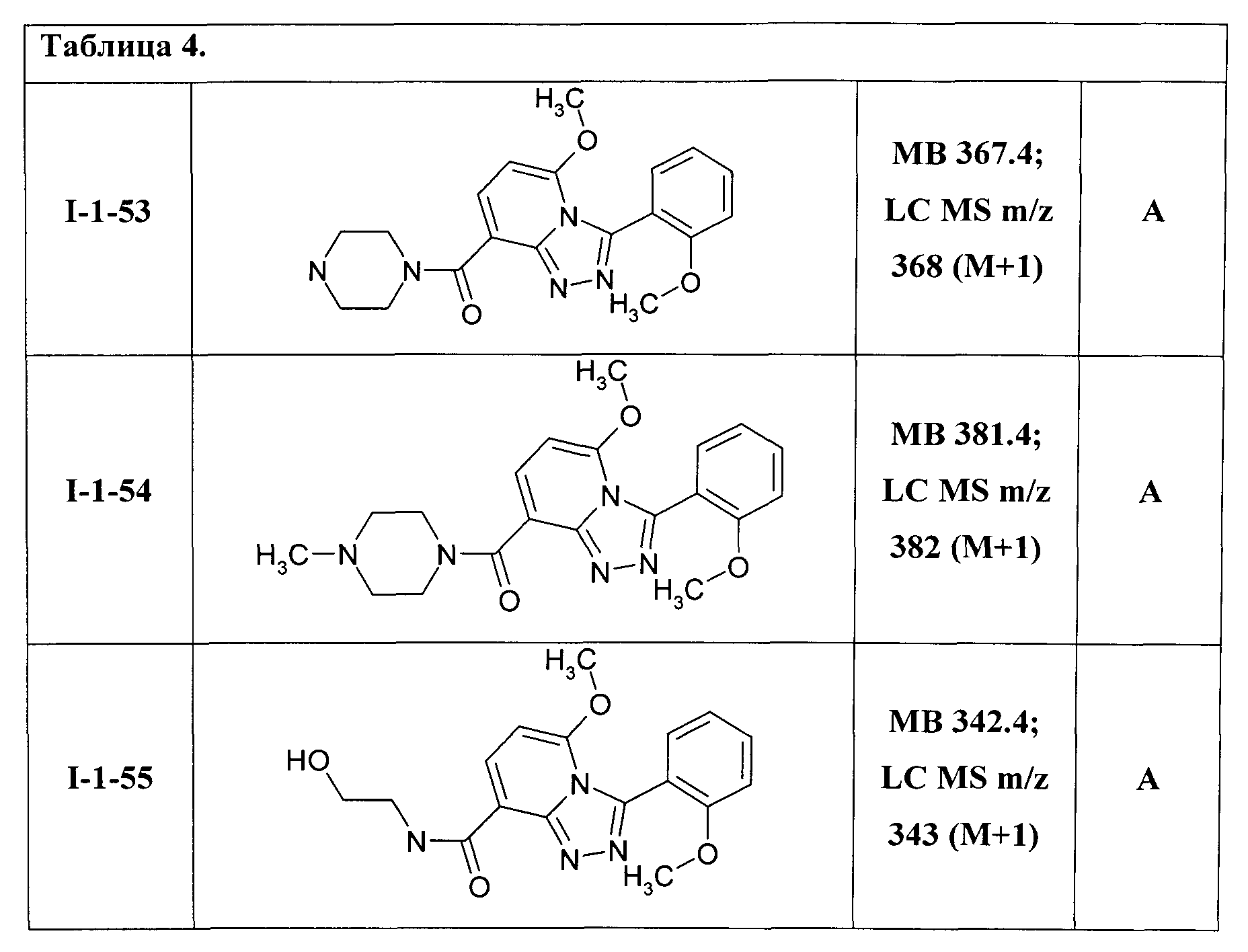
Ниже представлены ЯМР-спектральные данные некоторых полученных амидов соединений общей формулы I-1:
I-1-01. 1Н NMR (400 MHz, DMSO-d6) δ 3.83 (s, 3H), 6.74 (dt, J=7.6, 2.1 Hz, 1H), 7.25-7.36 (m, 3H), 7.47 (t, J=8.8 Hz, 2H), 7.56 (t, J=2.1 Hz, 1H), 8.00 (dd, J=8.8, 5.4 Hz, 2H), 8.27 (d, J=7.0 Hz, 1H), 8.76 (d, J=6.9 Hz, 1H), 11.71 (s, 1H)
I-1-02. 1H NMR (400 MHz, DMSO-d6) δ 3.84 (s, 3H), 6.74 (dt, J=7.1, 2.4 Hz, 1H), 7.30 (m, 3H), 7.51 (m, 2H), 7.57 (m, 1H), 7.75 (m, 1H), 7.84 (td, J=7.4, 2.0 Hz, 1H), 8.31 (d, J=7.0 Hz, 1H), 8.48 (dd, J=7.0,3.1 Hz, 1H), 11.65 (s, 1H)
I-1-03. 1H NMR (400 MHz, DMSO-d6) δ 3.88 (s, 3H), 7.25 (m, 2H), 7.33 (d, J=8.5 Hz, 1H), 7.60 (m, 2H), 7.70 (m, 3H), 7.79 (d, J=8.2 Hz, 1H), 7.99 (d, J=8.1 Hz, 1H), 8.33 (d, J=6.9 Hz, 1H), 8.38 (d, J=7.0 Hz, 1H), 8.50 (d, J=7.5 Hz, 1H), 8.58 (d, J=8.5 Hz, 1H), 12.27 (s, 1H)
I-1-04. 1H NMR (400 MHz, DMSO-d6) δ 2.40 (s, 3H), 3.86 (s, 3H), 6.99 (d, J=7.6 Hz, 1H), 7.21 (m, 2H), 7.30 (m, 2H), 7.65 (m, 4H), 8.27 (m, 2H), 11.68 (s, 1H)
I-1-05. 1Н NMR (400 MHz, DMSO-d6) δ 2.40 (s, 3Н), 3.91 (s, 3H), 6.98 (d, J=7.8 Hz, 1H), 7.19 (d, J=8.7 Hz, 2H), 7.24 (t, J=7.0 Hz, 1H), 7.28 (t, J=7.8 Hz, 1H), 7.63 (bs, 1H), 7.66 (d, J=8.0 Hz, 1H), 7.86 (d, J=8.7 Hz, 2H), 8.25 (d, J=7.0 Hz, 1H), 8.72 (d, J=7.0 Hz, 1H), 11.71 (s, 1H)
I-1-06. 1H NMR (400 MHz, DMSO-d6) δ 7.17 (t, J=7.6 Hz, 1H), 7.30 (t, J=7.0 Hz, 1H), 7.42 (t, J=7.6 Hz, 2H), 7.52 (m, 2H), 7.75 (m, 1H), 7.84 (m, 3H), 8.31 (d, J=7.0 Hz, 1H), 8.48 (dd, J=6.9, 3.1 Hz, 1H), 11.67 (s, 1H)
I-1-07. 1H NMR (400 MHz, DMSO-d6) δ 1.34 (d, J=6.5 Hz, 6H), 4.24 (m, 1H), 7.14 (t, J=7.0 Hz, 1H), 7.19 (t, J=7.5 Hz, 1H), 7.29 (d, J=8.3 Hz, 1H), 7.58 (d, J=7.5 Hz, 1H), 7.64 (t, J=8.3 Hz, 1H), 8.15 (m, 2H), 9.51 (d, J=7.6 Hz, 1H)
I-1-08. 1H NMR (400 MHz, DMSO-d6) δ 2.35 (s, 3H), 7.22 (d, J=8.1 Hz, 2H), 7.29 (t, J=7.0 Hz, 1H), 7.51 (m, 2H), 7.72 (m, 3H), 7.84 (td, J=7.4, 1.7 Hz, 1H), 8.30 (d, J=7.0 Hz, 1H), 8.46 (dd, J=7.0, 3.1 Hz, 1H), 11.59 (s, 1H)
I-1-09. 1H NMR (400 MHz, DMSO-d6) δ 3.86 (s, 3H), 7.21 (m, 4H), 7.31 (d, J=8.5 Hz, 1H), 7.65 (m, 2H), 7.86 (m, 2H), 8.27 (m, 2H), 11.72 (s, 1H)
I-1-10. 1H NMR (400 MHz, DMSO-d6) δ 3.89 (s, 3H), 3.93 (s, 3H), 4.66 (d, J=5.8 Hz, 2H), 6.91 (t, J=7.4 Hz, 1H), 7.00 (d, J=8.1 Hz, 1H), 7.17 (m, 3H), 7.27 (t, J=7.4 Hz, 1H), 7.31 (d, J=7.4 Hz, 1H), 7.81 (d, J=8.6 Hz, 2H), 8.14 (d, J=7.0 Hz, 1H), 8.65 (d, J=7.0 Hz, 1H), 10.04 (t, J=5.8 Hz, 1H)
I-1-11. 1H NMR (400 MHz, DMSO-d6) δ 3.93 (s, 3H), 4.67 (d, J=5.9 Hz, 2H), 6.91 (t, J=7.3 Hz, 1H), 7.01 (d, J=8.1 Hz, 1H), 7.25 (m, 2H), 7.32 (d, J=7.4 Hz, 1H), 7.49 (m, 2H), 7.73 (m, 1H), 7.80 (t, J=7.4 Hz, 1H), 8.20 (d, J=6.9 Hz. 1H), 8.39 (dd, J=7.1, 3.2 Hz, 1H), 9.99 (t, J=5.9 Hz, 1H)
I-1-12. 1H NMR (400 MHz, DMSO-d6) δ 3.86 (s, 3H), 6.95 (m, 1H), 7.21 (m, 2H), 7.31 (d, J=8.4 Hz, 1H), 7.46 (m, 2H), 7.65 (m, 2H), 7.89 (dt, J=11.4,2.2 Hz, 1H), 8.28 (d, J=7.0 Hz, 2H), 11.86 (s, 1H)
I-1-13. 1H NMR (400 MHz, DMSO-d6) δ 3.90 (s, 3H), 7.18 (m, 3H), 7.24 (t, J=7.0 Hz, 1H), 7.43 (t, J=8.1 Hz, 1H), 7.64 (d, J=8.1 Hz, 1H), 7.85 (d, J=8.8 Hz, 2H), 8.06 (t, J=2.1 Hz, 1H), 8.25 (d, J=7.0 Hz, 1H), 8.73 (d, J=7.0 Hz, 1H), 11.85 (s, 1H)
I-1-14. 1H NMR (400 MHz, DMSO-d6) δ 7.19 (dd, J=7.9, 2.1 Hz, 1H), 7.27 (t, J=7.0 Hz, 1H), 7.45 (m, 3H), 7.63 (d, J=8.3 Hz, 1H), 7.99 (dd, J=8.7, 5.3 Hz, 2H), 8.06 (t, J=2.1 Hz, 1H), 8.27 (d, J=7.0 Hz, 1H), 8.77 (d, J=7.0 Hz, 1H), 11.81 (s, 1H)
I-1-15. 1Н NMR (400 MHz, DMSO-d6) δ 7.20 (dd, J=8.0, 2.0 Hz, 1H), 7.30 (t, J=7.0 Hz, 1H), 7.44 (t, J=8.1 Hz, 1H), 7.52 (m, 2H), 7.66 (d, J=8.2 Hz, 0H), 7.75 (m, 1H), 7.84 (t, J=7.4 Hz, 1H), 8.08 (t, J=2.0 Hz, 1H), 8.31 (d, J=7.0 Hz, 1H), 8.49 (dd, J=7.0, 3.1 Hz, 1H), 11.75 (s, 1H)
I-1-16. 1H NMR (400 MHz, DMSO-d6) δ 2.56 (s, 3Н), 3.86 (s, 3Н), 7.10 (t, J=7.4 Hz, 1H), 7.22 (m, 3Н), 7.30 (m, 2H), 7.65 (m, 2H), 8.27 (m, 2H), 8.31 (d, J=7.0 Hz, 1H), 11.54 (s, 1H)
I-1-17. 1H NMR (400 MHz, DMSO-d6) δ 2.56 (s, 3Н), 3.91 (s, 3Н), 7.09 (t, J=7.4 Hz, 1H), 7.19 (d, J=8.7 Hz, 2H), 7.26 (m, 3Н), 7.86 (d, J=8.7 Hz, 2H), 8.29 (d, J=7.5 Hz, 2H), 8.74 (d, J=7.0 Hz, 1H), 11.56 (s, 1H)
I-1-19. 1H NMR (400 MHz, DMSO-d6) δ 2.29 (s, 3Н), 3.87 (s, 3Н), 6.76 (d, J=7.5 Hz, 1H), 6.80 (d, J=7.7 Hz, 1H), 7.04 (t, J=7.8 Hz, 1H), 7.21 (m, 2H), 7.31 (d, J=8.4 Hz, 1H), 7.65 (m, 2H), 8.26 (m, 2H), 9.37 (s, 1H), 10.99 (s, 1H)
I-1-20. 1H NMR (400 MHz, DMSO-d6) δ 1.00-1.35 (m, 5H), 1.57-1.89 (m, 6H), 3.37 (t, J=6.3 Hz, 2H), 7.23 (t, J=7.0 Hz, 1H), 7.49 (m, 2H), 7.72 (m, 1H), 7.80 (t, J=7.4 Hz, 1H), 8.18 (d, J=7.0 Hz, 1H), 8.39 (dd, J=7.0, 3.3 Hz, 1H), 9.59 (t, J=5.9 Hz, 1H)
I-1-21. 1H NMR (400 MHz, DMSO-d6) δ 2.37 (s, 3Н), 2.43 (s, 3Н), 7.03 (d, J=7.4 Hz, 1H), 7.14 (t, J=7.8 Hz, 1H), 7.30 (t, J=7.0 Hz, 1H), 7.51 (m, 2H), 7.75 (m, 1H), 7.85 (t, J=7.3 Hz, 1H), 7.95 (d, J=8.5 Hz, 1H), 8.34 (d, J=7.0 Hz, 1H), 8.48 (dd, J=7.0, 3.3 Hz, 1H), 11.42 (s, 1H)
I-1-23. 1H NMR (400 MHz, DMSO-d6) δ 2.26 (s, 3Н), 2.30 (s, 3Н), 7.15 (d, J=8.0 Hz, 1H), 7.29 (t, J=7.0 Hz, 1H), 7.51 (m, 2H), 7.58 (m, 2H), 7.75 (m, 1H), 7.84 (t, J=7.4 Hz, 1H), 8.29 (d, J=7.0 Hz, 1H), 8.46 (dd, J=7.0, 3.2 Hz, 1H), 11.54 (s, 1H)
I-1-24. 1H NMR (400 MHz, DMSO-d6) δ 2.36 (s, 6H), 3.86 (s, 3Н), 6.81 (s, 1H), 7.21 (m, 2H), 7.31 (d, J=8.4 Hz, 1H), 7.46 (s, 2H), 7.65 (m, 2H), 8.26 (m, 2H), 11.63 (s, 1H)
I-1-25. 1H NMR (400 MHz, DMSO-d6) δ 1.34 (t, J=7.5 Hz, 3Н), 2.94 (q, J=7.5 Hz, 2H), 7.14 (t, J=7.5 Hz, 1H), 7.29 (m, 3Н), 7.52 (m, 2H), 7.75 (m, 1H), 7.86 (t, J=7.4 Hz, 1H), 8.23 (d, J=8.1 Hz, 1H), 8.35 (d, J=7.0 Hz, 1H), 8.49 (dd, J=6.9,3.2 Hz, 1H), 11.53 (s, 1H)
I-1-36. 1Н NMR (400 MHz, DMSO-d6) δ 4.71 (d, J=5.5 Hz, 2H), 6.38 (m, 2H), 7.20 (t, J=6.9 Hz, 1Н), 7.44 (t, J=8.5 Hz, 2H), 7.55 (s, 1Н), 7.95 (dd, J=8.5, 5.3 Hz, 2H), 8.18 (d, J=6.9 Hz, 1Н), 8.69 (d, J=6.9 Hz, 1Н), 9.91 (t, J=5.5 Hz, 1Н)
I-1-37. 1Н NMR (400 MHz, DMSO-d6) δ 4.72 (d, J=5.8 Hz, 2H), 6.39 (m, 2H), 7.23 (t, J=7.0 Hz, 1Н), 7.49 (m, 2H), 7.55 (d, J=1.8 Hz, 1Н), 7.73 (m, 1Н), 7.79 (t, J=7.4 Hz, 1Н), 8.22 (d, J=7.0 Hz, 1Н), 8.41 (dd, J=7.0, 3.2 Hz, 1Н), 9.88 (t, J=5.8 Hz, 1Н)
I-1-38. 1Н NMR (400 MHz, DMSO-d6) δ 1.57 (m, 4H), 1.68 (m, 4H), 1.85 (m, 2H), 3.28 (m, 2H), 3.65 (t, J=6.2 Hz, 2H), 7.07 (t, J=6.8 Hz, 1Н), 7.33 (d, J=6.7 Hz, 1Н), 7.43 (t, J=8.8 Hz, 2H), 7.96 (dd, J=8.8, 5.3 Hz, 2H), 8.55 (d, J=7.1 Hz, 1Н)
I-1-39. 1Н NMR (400 MHz, DMSO-d6) δ 0.74 (d, J=6.5 Hz, 3H), 0.86 (m, 1Н), 0.99 (d, J=6.5 Hz, 3H), 1.42-2.09 (m, 3H), 2.31 (m, 1Н), 2.55-2.91 (m, 1Н), 3.24-3.69 (m, 1Н), 4.59 (m, 1Н), 7.06 (t, J=6.9 Hz, 1Н), 7.36 (d, J=6.8 Hz, 1Н), 7.43 (t, J=8.8 Hz, 2H), 7.97 (m, 2H), 8.56 (d, J=7.1 Hz, 1H)
I-1-40. 1Н NMR (400 MHz, DMSO-d6) δ 1.74 (d, J=13.7 Hz, 2H), 2.32 (m, 2H), 3.30 (m, 4H), 3.89 (s, 3H), 5.43 (s, 1Н), 7.04 (t, J=6.9 Hz, 1Н), 7.15 (d, J=8.4 Hz, 2H), 7.33 (d, J=8.6 Hz, 2H), 7.51 (d, J=8.6 Hz, 2H), 7.79 (d, J=8.4 Hz, 2H), 7.91 (m, 1Н), 8.48 (d, J=6.9 Hz, 1Н), 9.43 (s, 1Н)
I-1.41. 1Н NMR (400 MHz, DMSO-d6) δ 1.31 (m, 2H), 1.52 (m, 1Н), 1.77 (d, J=14.3 Hz, 1Н), 1.84 (m, 1Н), 2.58 (d, J=7.1 Hz, 2H), 2.81 (t, J=12.5 Hz, 1Н), 3.03 (t, J=12.6 Hz, 1Н), 3.42 (d, J=13.1 Hz, 1Н), 4.60 (d, J=12.9 Hz, 1Н), 7.06 (t, J=6.9 Hz, 1Н), 7.16 (m, 3H), 7.25 (m, 2H), 7.36 (d, J=6.7 Hz, 1Н), 7.42 (t, J=8.7 Hz, 2H), 7.95 (dd, J=8.7, 5.5 Hz, 2H), 8.54 (d, J=7.1 Hz, 1Н)
I-1-42. 1Н NMR (400 MHz, DMSO-d6) δ 2.05 (m, 2H), 2.90 (t, J=6.7 Hz, 2H), 3.78 (s, 2H), 7.02 (m, 4H), 7.17 (d, J=8.0 Hz, 1Н), 7.41 (t, J=8.8 Hz, 2H), 7.45 (m, 1Н), 7.94 (dd, J=8.8, 5.4 Hz, 2H), 8.55 (d, J=7.0 Hz, 1H)
I-1-43. 1Н NMR (400 MHz, DMSO-d6) δ 1.50 (d, J=13.0 Hz, 1Н), 1.78 (d, J=13.8 Hz, 1Н), 2.04 (m, 2H), 3.30 (m, 2H), 3.53 (t, J=13.0 Hz, 1Н), 4.58 (d, J=12.7 Hz, 1Н), 5.22 (s, 1Н), 7.08 (t, J=6.9 Hz, 1Н), 7.35 (d, J=8.6 Hz, 2H), 7.43 (m, 3H), 7.53 (d, J=8.6 Hz, 2H), 7.96 (dd, J=8.8, 5.3 Hz, 2H), 8.55 (d, J=7.1 Hz, 1Н)
I-1-44. 1Н NMR (400 MHz, DMSO-d6) δ 2.26 (s, 3Н), 7.01 (t, J=7.0 Hz, 1H), 7.15 (dd, J=8.6, 2.4 Hz, 1H), 7.21 (d, J=2.4 Hz, 1H), 7.60 (m, 3Н), 7.84 (d, J=7.1 Hz, 2H), 7.89 (d, J=6.7 Hz, 1H), 7.97 (d, J=8.6 Hz, 1H), 8.48 (d, J=6.9 Hz, 1H), 9.93 (s, 1H)
Пример 6. Синтез 3-нитропиридил-2-гидразина b2-1 (схема 2, b2, R2=Н).
(см. Схема 2)
В коническую колбу помещали раствор 0,6 моль хлорпиридина b1 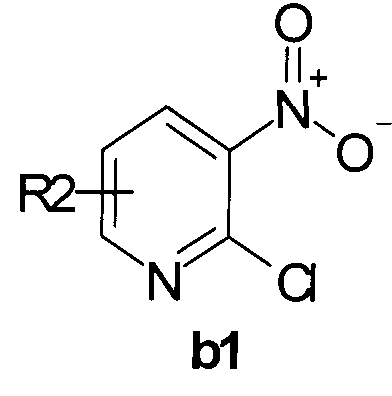 в 2 литрах этанола и прибавляли по порциям 2,5 моля гидразингидрата. Смесь перемешивали при комнатной температуре в течение двух часов. Выпавший осадок отфильтровывали, промывали водой и холодным этанолом, сушили на воздухе. Выход продукта b2-1: 95%.
в 2 литрах этанола и прибавляли по порциям 2,5 моля гидразингидрата. Смесь перемешивали при комнатной температуре в течение двух часов. Выпавший осадок отфильтровывали, промывали водой и холодным этанолом, сушили на воздухе. Выход продукта b2-1: 95%.
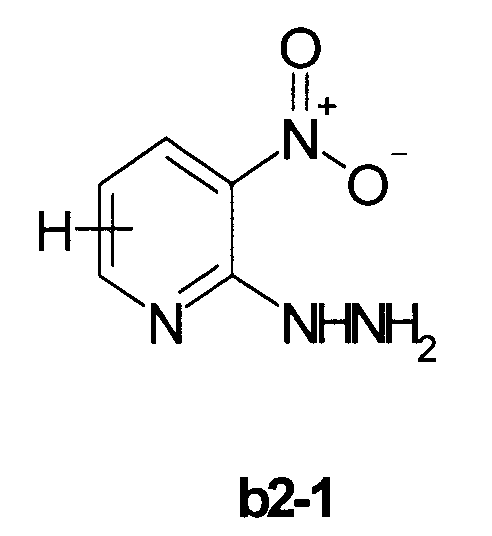
Пример 7. Общий метод синтеза 3-замещенных 8-нитро[1,2,4]триазоло[4,3-а]пиридинов b3 (см. Схему 2)
В суспензию 5 ммоль гидразина b2-1 в 50 мл этанола добаляли 5.5 ммоль соответствующего ортоэфира и кипятили при перемешивании 1-2 часа. Смесь охлаждали, выпавший осадок отфильтровывали, промывали эфиром и сушили. Выход продукта b3: 50-80%.
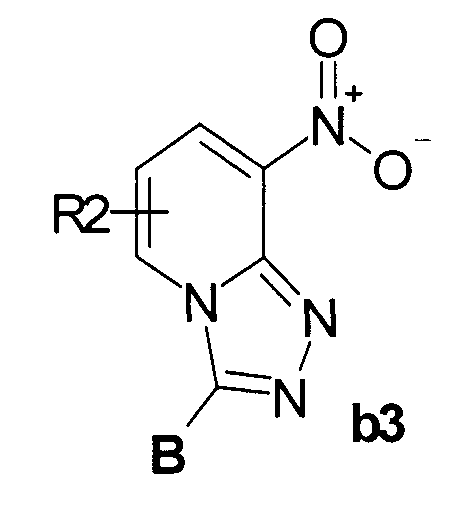
Пример 8. Общий метод синтеза 3-замещенных 8-амино[1,2,4]триазоло[4,3-а]пиридинов b4 (Схема 2)
В 250 мл автоклав помещали 0,05 моль соединения b3 в 100 мл метанола, 1 г 10% Pd/C и гидрировали при комнатной температуре до полного поглощения расчетного количества водорода. Смесь фильтровали, органику упаривали, выпавший осадок промывали ацетонитрилом, сушили. Выход продукта b4: 50-70%.
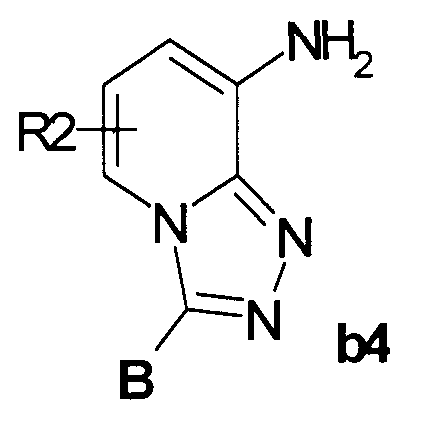
Пример 9. Общий метод синтеза 3-замещенных 8-ациламино[1,2,4]триазоло[4,3-а]пиридинов I-2
Синтез осуществляли в соответствии со Схемой 2.
Амин b4 (0.001 моль) растворяли в 3 мл дихлорметана, добавляли триэтиламин (0.002 моль, 0.202 г) и охлаждали до 0°С. При интенсивном перемешивании осторожно добавляли 0.0012 моль хлорангидрида R4C(O)X и смесь нагревали до комнатной температуры. Через три часа реакционную массу разбавляли дихлорметаном (30 мл), промывали 2.0 н раствором соляной кислоты (2×15 мл), высушивали над сульфатом натрия и хроматографировали смесью CH2Cl2/EtOH (высота колонки 5 см, ширина 1 см). Получали чистые продукты 1-2 с выходами 60-90%.
Таким образом были получены соединения I-2-01-I-2-30, представленные в Таблице 5.

Ниже представлены ЯМР-спектральные данные некоторых полученных амидов I-2:
I-2-04. 1Н NMR (400 MHz, DMSO-d6) δ 1.75 (t, J=7.0 Hz, 3H), 2.06 (m, 1H), 2.19 (m, 1H), 2.54 (m, 4H), 4.02 (p, J=8.5 Hz, 1H), 4.42 (q, J=7.0 Hz, 2H), 6.90 (t, J=7.1 Hz, 1H), 7.13 (t, J=7.4 Hz, 1H), 7.27 (d, J=8.4 Hz, 1H), 7.58 (td, J=7.2, 1.9 Hz, 1H), 7.94 (d, J=7.1 Hz, 1H), 8.13 (dd, J=7.9, 1.9 Hz, 1H), 8.25 (d, J=7.1 Hz, 1H), 11.09 (s, 1H)
I-2-07. 1H NMR (400 MHz, DMSO-d6) δ 2.05 (m, 1H), 2.21 (m, 1H), 2.55 (m, 4H), 4.05 (d, J=8.0 Hz, 1H), 6.94 (t, J=7.1 Hz, 1H), 7.06 (t, J=8.0 Hz, 1H), 7.23 (t, J=8.0 Hz, 1H), 7.48 (m, 2H), 7.67 (d, J=8.1 Hz, 1H), 8.02 (m, 2H), 9.99 (s, 1H), 11.92 (s, 1H)
I-2-10. 1H NMR (400 MHz, DMSO-d6) δ 2.04 (m, 1H), 2.19 (m, 1H), 2.52 (m, 4H), 4.04 (p, J=8.4 Hz, 1H), 6.93 (t, J=7.1 Hz, 1H), 7.18 (m, 1H), 7.83 (d, J=7.1 Hz, 1H), 8.04 (d, J=7.1 Hz, 1H), 8.11 (d, J=4.1 Hz, 1H), 10.43 (s, 1H).
Пример 10. Общий метод синтеза 3-замещенных 8-уреидо[1,2,4]триазоло[4,2-а]пиридинов 1-3
Синтез осуществляли в соответствии со Схемой 2.
Амин b4 (0.001 моль) растворяли в 3 мл дихлорметана, добавляли триэтиламин (0.002 моль, 0.202 г) и охлаждали до 0°С. При интенсивном перемешивании добавляли 0.0012 моль изотиоцианата R6NCO и смесь нагревали до комнатной температуры. Через 1-3 часа реакционную массу разбавляли дихлорметаном (30 мл), промывали 2.0 н раствором соляной кислоты (2×15 мл), высушивали над сульфатом натрия и хроматографировали смесью CH2Cl2/EtOH (высота колонки 5 см, ширина 1 см). Получали чистые продукты 1-3 с выходами 60-90%.
Таким образом были получены соединения I-3-01-I-3-25, представленные в Таблице 6.
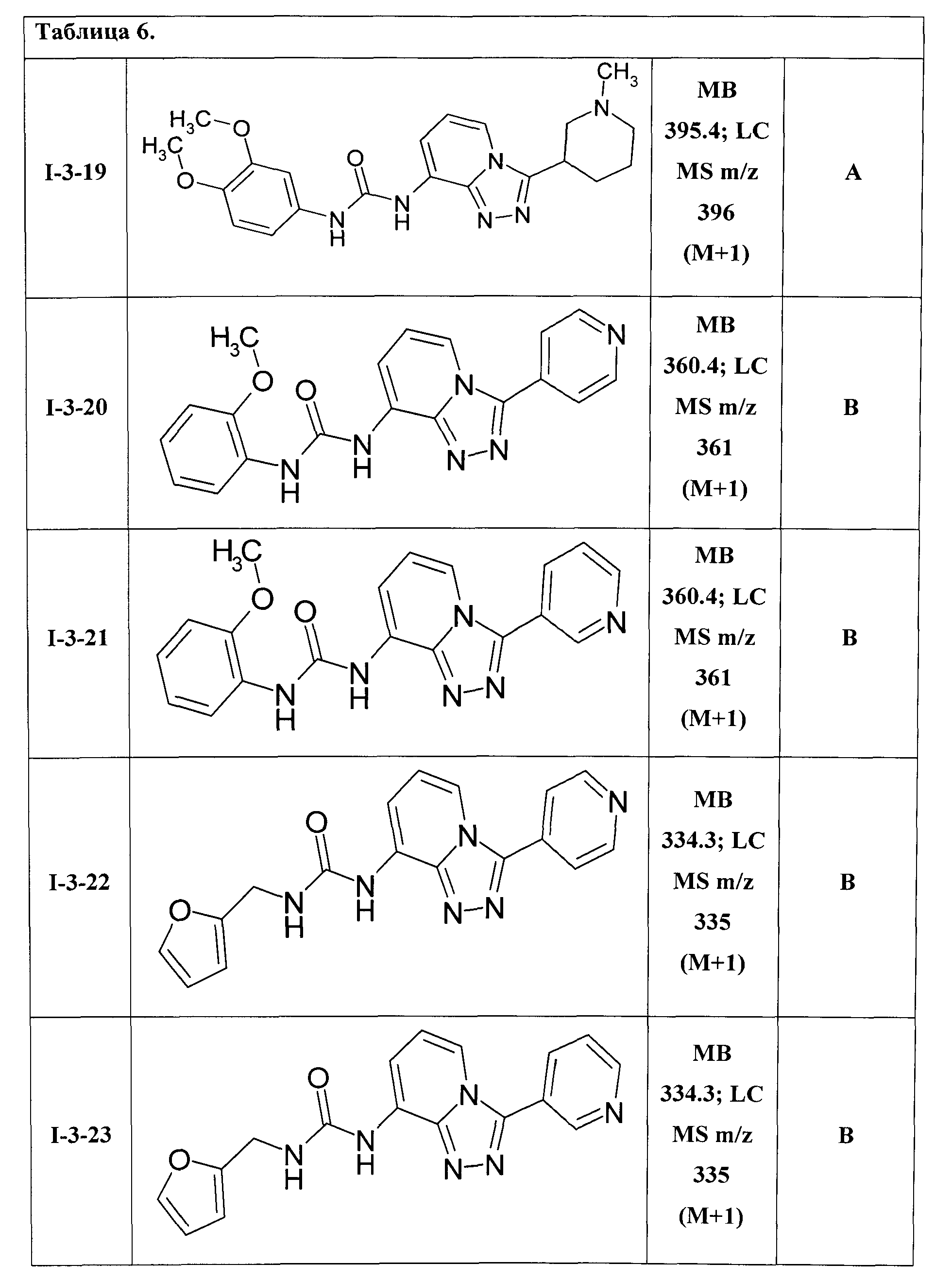
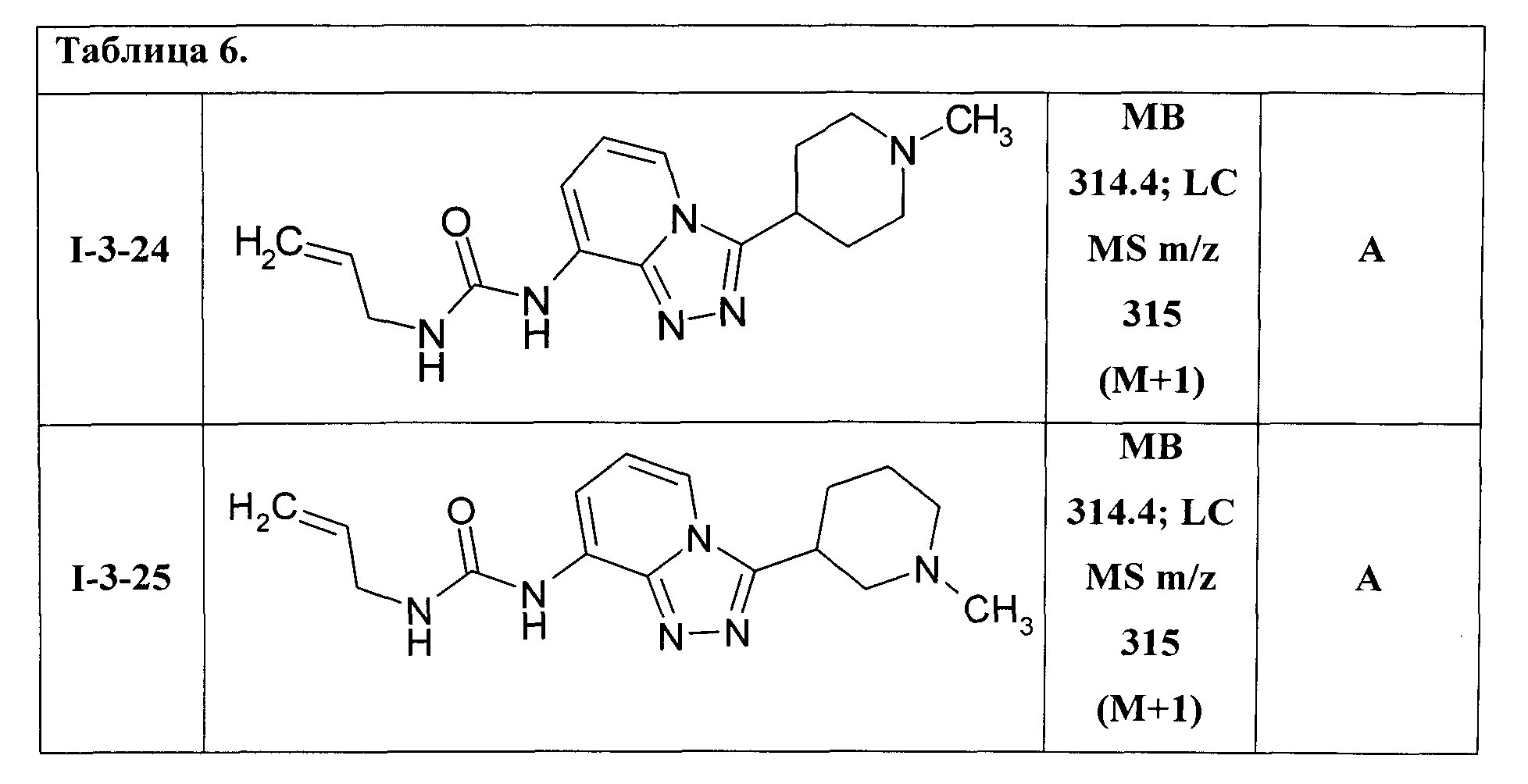
Ниже представлены ЯМР-спектральные данные некоторых полученных мочевин 1-3:
I-3.03. 1Н NMR (400 MHz, DMSO-d6) δ 2.04 (m, 1H), 2.18 (m, 1H), 2.53 (m, 4H), 4.00 (p, J=8.3 Hz, 1H), 4.20 (m, 4H), 6.74 (m, 2H), 6.84 (t, J=7.1 Hz, 1H), 7.10 (d, J=2.4 Hz, 1H), 7.79 (d, J=6.8 Hz, 1H), 7.88 (d, J=7.3 Hz, 1H), 9.13 (s, 1H), 9.26 (s, 1H)
I-3-06. 1H NMR (400 MHz, DMSO-d6) δ 2.03 (m, 1H), 2.17 (m, 1H), 2.50 (m, 4H), 3.98 (p, J=8.4 Hz, 1H), 4.33 (d, J=5.5 Hz, 2H), 6.25 (d, J=3.1 Hz, 1H), 6.36 (dd, J=3.1, 1.8 Hz, 1H), 6.80 (t, J=7.1 Hz, 1H), 7.46 (t, J=5.5 Hz, 1H), 7.51 (d, J=1.8 Hz, 1H), 7.75 (d, J=6.9 Hz, 1H), 7.84 (d, J=7.2 Hz, 1H), 9.07 (s, 1H)
I-3-08. 1H NMR (400 MHz, DMSO-d6) δ 2.05 (m, 1H), 2.18 (m, 1H), 2.54 (m, 4H), 3.86 (s, 3H), 4.01 (p, J=8.2 Hz, 1H), 6.85 (t, J=7.1 Hz, 1H), 7.73 (d, J=5.5 Hz, 1H), 7.84 (d, J=6.9 Hz, 1H), 7.92 (d, J=7.5 Hz, 1H), 7.97 (d, J=5.5 Hz, 1H), 10.11 (s, 1H), 10.74 (s, 1H)
I-3-10. 1H NMR (400 MHz, DMSO-d6) δ 2.04 (m, 1H), 2.19 (m, 1H), 2.24 (s, 3H), 2.51 (m, 4H), 3.74 (s, 3H), 4.00 (p, J=8.4 Hz, 1H), 6.70 (m, 2H), 6.82 (t, J=7.1 Hz, 1H), 7.59 (d, J=8.7 Hz, 1H), 7.78 (d, J=6.8 Hz, 1H), 7.89 (d, J=7.4 Hz, 1H), 8.61 (s, 1H), 9.52 (s, 1H).
Антагонистическую активность новых соединений общей формулы I и их фармацевтически приемлемых солей по отношению к аденозиновому А2А рецептору проводили ex vitro в функциональном тесте на клетках. В эксперименте использовали клетки линии ValiScreen cell line (PerkinElmer, США), экспрессирующей рекомбинантный человеческий аденозиновый рецептор типа А2А.
В Таблицах 4-6 представлены данные по активности некоторых из соединений общей формулы I, подтверждающие их высокую антагонистическую активность по отношению к аденозиновому А2А рецептору: А означает ингибирование А2А рецепторов соединением в концентрации 10 µМ более чем на 75%, В - более 50%, С - более 25%, D - более 10%.
Пример 11. Общий метод синтеза солей соединений общей формулы I.
Часть соединений данного изобретения содержит ионогенные группы (вторичные, третичные амины) и может образовывать соли, которые были получены способами, известными в данной области техники.
Для этого, например, к раствору основания в инертном растворителе (спирт, ацетон, хлороформ, эфир, этилацетат) добавляли раствор эквивалентного количества (иногда избытка) органической или неорганической кислоты в инертном растворителе и добивались осаждения искомой соли. Неорганическая кислота может представлять собой хлороводородную кислоту, фосфорную кислоту, серную кислоту, азотную кислоту, бромоводородную кислоту или йодоводородную кислоту. Органическая кислота может представлять собой метансульфокислоту, п-толуолсульфокислоту, уксусную кислоту, трифторуксусную кислоту, малеиновую кислоту, янтарную кислоту, щавелевую кислоту, бензойную кислоту, винную кислоту, фумаровую кислоту, миндальную кислоту, пропионовую кислоту, лимонную кислоту, молочную кислоту, гликолевую кислоту, глюконовую кислоту, галактуроновую кислоту, глютаминовую кислоту, глутаровую кислоту, глюкуроновую кислоту, аспарагиновую кислоту, аскорбиновую кислоту, карбоновую кислоту или ванилиновую кислоту, но не ограничиваясь ими. В Таблице 7 представлены примеры полученных фармацевтически приемлемых солей и некоторые их свойства.
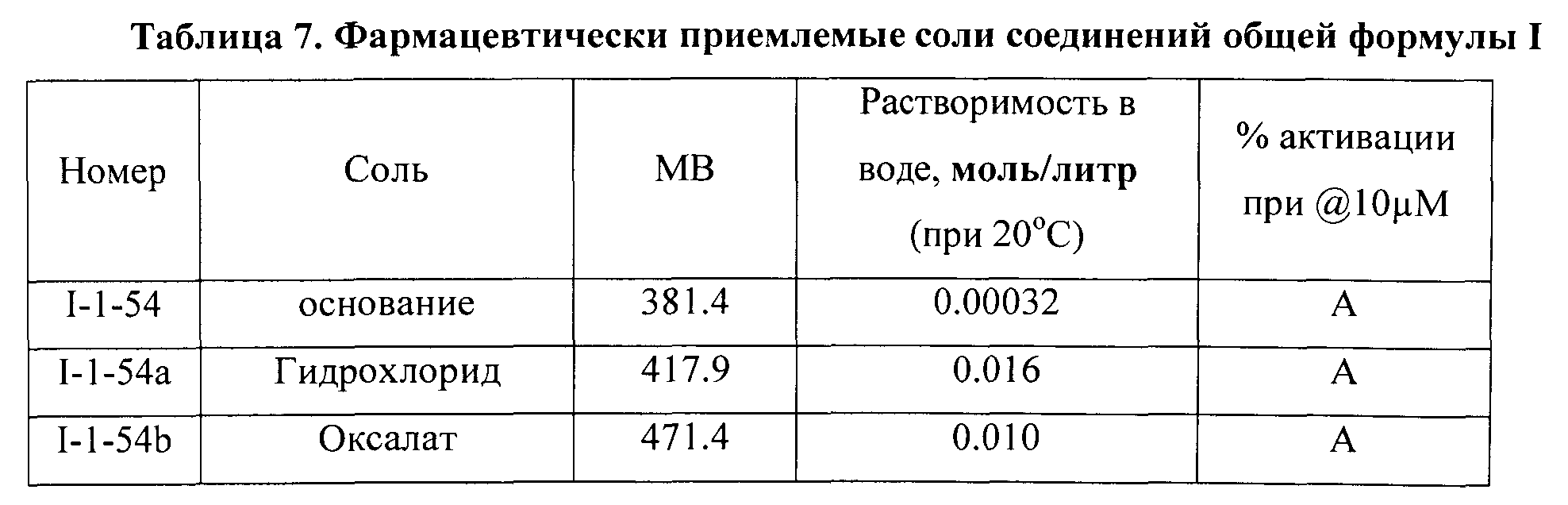
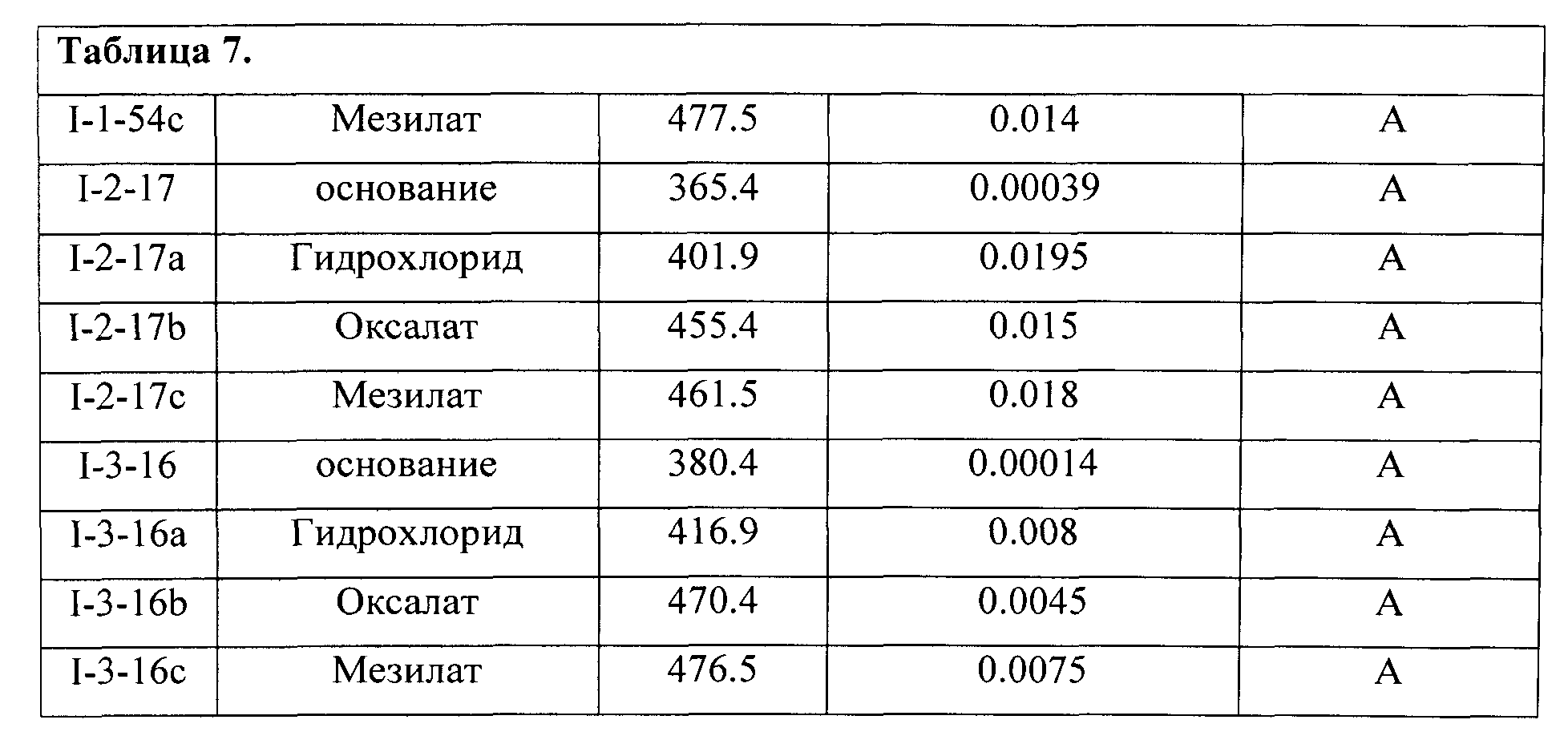
Биологические испытания и активность синтезированных соединений.
Пример 11. Изучение антагонистической активности соединений общей формулы I и их фармацевтически приемлемых солей по отношению к аденозиновому А2А рецептору.
Антагонистическую активность новых соединений общей формулы I и их фармацевтически приемлемых солей по отношению к аденозиновому А2А рецептору проводили ex vitro в функциональном тесте на клетках. В эксперименте использовали клетки линии ValiScreen cell line (PerkinElmer, США), экспрессирующей рекомбинантный человеческий аденозиновый рецептор типа А2А. При стимуляции рецепторов в этих клетках агонистом CGS-21680 (Tocris) активируется аденилатциклаза, что приводит к увеличению синтеза внутриклеточного циклического аденозинмонофосфата (цАМФ или сАМР). Количество цАМФ определялось с помощью технологии LANCE (LANCE Ultra сАМР kit, PerkinElmer). По способности испытуемых соединений снижать количество цАМФ, синтезируемого в присутствии CGS-21680, оценивали их антагонистическую активность. В качестве стандарта (соединения сравнения) использовали описанный в литературе антагонист KW-6002 (Axon Medchem, Netherlands).
Клетки культивировали в среде DMEM (ПанЭко, Россия) с добавками 10% FBS (Biological Industries), смеси пенициллин/стрептомицина (ПанЭко) и G418 (Sigma) при температуре 37°С в атмосфере 5% CO2. Перед экспериментом, клетки снимали с культурального флакона раствором Версена (ПанЭко) и суспендировали в буфере SB2 (среда Хэнкса+5 мМ HEPES (рН 7,4)+0,1% BSA+200 uM Ro-20-1734+2U/mL ADA (adenosine deaminase)) до плотности 0,2 миллиона клеток в миллилитре. К клеточной суспензии добавляли 1:150 (по объему) ULight™-anti-cAMP Antibody (PerkinElmer) и эту смесь разливали в белые 384-луночные планшеты (PerkinElmer) по 5 мкл (1000 клеток) в каждую лунку.
Тестируемые соединения растворяли в ДМСО до концентрации 6.32 мМ и готовили 3.16-кратные серийные разведения в ДМСО. Приготовленные серийные разведения разбавляли в 50 раз буферным раствором SB1 (среда Хэнкса+5 мМ HEPES (рН 7,4)+0,1% BSA). Полученные растворы соединений в SB1 буфере смешивали в пропорции 1:1 с раствором CGS-21680 (12.64 нМ), предварительно приготовленным в буфере SB3 (SB1+0.1% Pluronic F127). Полученные смеси испытуемых соединений с агонистом добавляли (по 5 мкл в дупликатах) в лунки плашки, содержащие по 5 мкл клеток (как описано выше) и плашки инкубировали 30 минут при комнатной температуре. Каждая плашка содержала также по 16 лунок для каждого контороля (МАКС и МИН). МАКС - клетки с 3.16 нМ CGS 21680 (концентрация агониста, соответствующая ЕС90, то есть концентрации, вызывающей 90% актвность клеток); сигнал от этих лунок использовался в расчетах как 100% активность (0% ингибирования). МИН - клетки со смесью 3.16 нМ CGS-21680 и 2 мкМ KW-6002 (концентрация антагониста, соответствующая IC100, то есть концентрации, вызывающей 100% подавление актвности клеток); сигнал от этих лунок использовался в расчетах как 0% активность (100% ингибирования). Кроме этого каждая плашка содержала лунки (в 4-х повторах), где клетки обрабатывались агонистом (CGS-21680) при разных его концентрациях. Конечная концентрация ДМСО во всех лунках равнялась 1%.
Образующийся в клетках цАМФ определяли количественно при помощи набора LANCE Ultra cAMP kit (PerkinElmer, США), в соответствии с методикой, рекомендованной производителем. Флуоресцентный сигнал измеряли на приборе Victor3V (PerkinElmer), снабженном встроенной программой для измерения LANCE High Count.
Кажущееся сродство тестируемых соединений определяли по формуле:
Ki=IC50/(1+L/KD),
где IC50 - концентрация антагониста, при которой активность аденилатциклазы составляет 50% от максимальной, L - концентрация CGS-21680, при которой проводятся измерения (3.16 nM) и KD - кажущаяся константа сродства CGS-21680, количественно соответствующая величине EC50 (концентрация полумаксимальной стимуляции клеток) для CGS-21680 и определенная по кривым стимуляции накопления цАМФ в клетках при разных концентрациях агониста. В таблицах 5-7 представлены данные по активности соединений общей формулы I.
Пример 12. Радиолигандный анализ взаимодействия соединений общей формулы I с аденозиновыми А1, А2А, А2В и A3 рецепторами.
Радиолигандный анализ взаимодействия соединений общей формулы I с аденозиновыми A1, A2A, А2В и A3 рецепторами проводили для определения селективности взаимодействия соединений общей формулы I с аденозиновым A2A рецептором. При определении взаимодействия исследуемых соединений с аденозиновым A2A рецептором использовали мембранные препараты, полученные из эмбриональных клеток почек человека, экспрессирующих рекомбинантный человеческий A2A рецептор. Экспрессия рецептора составляла 7 пмоль/мг белка. В качестве радиолиганда использовали [3H]CGS 21680 при концентрации 0.05 мкМ. Растворы испытуемых соединений готовили так же, как описано в процедуре для функционального теста с тем различием, что вместо среды SB1 использовали буфер следующего состава: 50 mM Tris-HCl, рН 7.4, 10 тМ MgCl2, I mM EDTA, 2 U/mL Adenosine Deaminase. Мембранные препараты инкубировали в присутствии смеси тестируемых соединений и [3H]CGS 21680 в течение 90 мин при 25°С и смеси фильтровали на стекломикроволоконных фильтрах GF (Millipor, USA). Радиоактивность на фильтрах определяли с помощью жидкостинцилляционного счетчика MicroBeta (PerkinElmer, USA). Неспецифическое связывание измеряли в присутствии 50 мкМ NECA, которое составляло не более 15% от общего связывания. Сродство тестируемых соединений определяли по формуле:
Ki=IC50/(1+L/KD),
где IC50 - концентрация антагониста, при которой связывание [3H]CGS-21680 снижается до 50% от максимального, L - концентрация [3H]CGS-21680, при которой проводятся измерения (50 nM) и KD - константа сродства [3H]CGS-21680, количественно соответствующая величине EC50 (концентрация полумаксимального связывания) для [3H]CGS-21680, и определенная по кривым радиоактивного связывания при разных концентрациях [3H]CGS-21680 (KD=64 нМ).
Аналогично исследовали взаимодействия новых соединений общей формулы I с аденозиновыми A1, A2B и A3 рецепторами.
Радиолигандный анализ взаимодействия некоторых соединений общей формулы I с аденозиновыми A1, A2A, A2B и A3 рецепторами показал их высокую селективность по отношению к аденозиновому A2A рецептору (Таблица 8).

Пример 13. Получение фармацевтической композиции.
Фармацевтическая композиция согласно изобретению приготавливается с помощью общепринятых в данной области техники приемов и включает фармакологически эффективное количество лекарственной субстанции, представляющего соединение формулы I или его фармацевтически приемлемую соль, составляющее обычно от 5 до 30 вес.%, в сочетании с одной или более фармацевтически приемлемыми вспомогательными добавками, такими как разбавители, связующие, разрыхляющие агенты, адсорбенты, ароматизирующие вещества, вкусовые агенты. В соответствии с известными методами фармацевтические композиции могут быть представлены различными жидкими или твердыми формами.
Примеры твердых лекарственных форм включают, например, таблетки, пилюли, желатиновые капсулы и др.
Примеры жидких лекарственных форм для инъекций и парентерального введения включают растворы, эмульсии, суспензии и др.
Композиции, как правило, получают с помощью стандартных процедур, предусматривающих смешение активного соединения с жидким или тонко измельченным твердым носителем.
Пример. 100 мг композиции, содержащей 15.0 мг соединения 3-(2-метоксифенил)-[1,2,4]триазоло[4,3-а]пиридин-8-карбоновой кислоты 2-метилфениламид (соединение I-1-16)
|
Согласно изобретению аналогичным образом получают фармацевтические композиции, содержащие в качестве лекарственной субстанции другие соединения общей формулы I.
![ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/6b/df/04/8b2e4091f25ec5eb439e6e71d6c9bbc7.png)
![ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/6b/df/04/fe348657c0fc952a187cd1684280e950.png)
![ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/6b/df/04/a377bcf4e3ff7f349b772d1ea93e153f.png)
![ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/6b/df/04/7e6bef3b7733c2ead09bc55590ece088.png)
![ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/6b/df/04/46782a2a8e55c0a4bb3c71753b60fafe.png)
![ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/6b/df/04/317d419b47fef42c8e0f8f43ba0c69c9.png)
![ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/6b/df/04/6d37e76556e0c2e98e546dc05e6406c6.png)
![ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/6b/df/04/33e247224c2ae9ebbd3e574c80a3f413.png)
![ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/6b/df/04/c488a93b8c2fe5135dcba74f08bbd3eb.png)
![ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/6b/df/04/7b9225266ab0daca24483af4aa14aed3.png)
![ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/6b/df/04/20f7c8fea8d0e3bf829666c8b007b84b.png)
![ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/6b/df/04/725410550c4ce7eb6f350d758bd74c34.png)
![ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/6b/df/04/1ca571095ea306f439fa6adff90ccba6.png)
![ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/6b/df/04/bed7e6618f2e425c6ac6b3c957146e34.png)
![ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/6b/df/04/c59e20d74646ccc70cdc7aeaff718497.png)
![ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/6b/df/04/8b77ca799b360a3db8355c6603e1a96e.png)
![ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ](https://fips.edrid.ru/images/rid/6b/df/04/008ac5391b9cc0148cd2954d7df9e819.png)