Результат интеллектуальной деятельности: СПОСОБ МОДЕЛИРОВАНИЯ ХРОНИЧЕСКИХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ЖЕНСКИХ ПОЛОВЫХ ОРГАНОВ В ЭКСПЕРИМЕНТЕ
Вид РИД
Изобретение
Изобретение относится к экспериментальной медицине и может быть использовано для моделирования хронического воспаления эндометрия с целью создания новых способов лечения. Экспериментальные модели на животных необходимы, поскольку не все особенности воспаления эндометрия могут быть изучены на людях.
Известны способы моделирования хронического воспаления эндометрия на самках самых разных лабораторных и домашних животных путем введения (часто под наркозом) в различные отделы матки и влагалища микробных тел в соответствующих концентрациях (1-3, 13, 16, 18, 20, 22, 23, 29, 30). Так, беспородным крысам-самкам в заднебоковую стенку средней трети влагалища под слизистую вводился Staphylococcus aureus, штамм 25923, в дозе 3·106 микробных тел (1). В других случаях вводили в оба яйцевода флогоген в виде 0,1 мл суточной культуры золотистого стафилококка - штамм 209, содержащий 50 млн. микробных тел при одномоментном точечном десерозировании медицинским скарификатором в 8-10 точках висцеральной брюшины яйцеводов с двух сторон, покровного эпителия яичников медицинским скарификатором с двух сторон, затем распыляли над десерозированными участками медицинский тальк в дозе 0,1 мг/см2 (2). Флогогенные агенты - Staphylococcus aureus и/или Escherichia coli в дозе 3·106 микробных тел вводили крысам в парацервикальную клетчатку в области перешейка матки (3). В некоторых случаях крысам предварительно вводили в полость матки 3% уксусной кислоты, а затем осуществляли бактериальную инокуляцию смешанной культурой патогенов (18). Эти модели использовались для апробации новых препаратов. Мышам для изучения патогенеза трихомониаза и отработки методов лечения интравагинально вводили 100 Trichomonad foetus или 106 Trichomonad vaginalis (13). Методами генетической инженерии мышам осуществляли активацию онкогена K-ras в эпителиальных клетках поверхности яичников. Восемь месяцев спустя у половины животных развивается эндометриоз (16). У коров модель эндометрита создавалась через 10-11 недель после отела и 6-8 дней после овуляции. Специфическое воспаление вызывали внутриматочным введением С.fetus ssp. veneralis животным, иммунизированным этими бактериями подкожно или внутриматочно. Неспецифическое воспаление вызывали введением липополисахарида (ЛПС) в левый маточный рог. Модель применялась для изучения роли иммунитета при эндометрите (20). Самкам крыс линии Sprague-Dawley (неинфицированным, в возрасте 11 недель) вводили культуры микроорганизмов, выделенных из образцов ткани матки людей, страдающих эндометритом. Культуры микроорганизмов Е.coli и В.fragilis, культивировали in vitro, затем 0,05 мл суспензии бактерий, содержащих 1,1×105 Е.coli или 1,3×105 В.fragilis вводили через разрез на передней брюшной стенке в правую половину полости матки. Инфекция развивалась в пределах матки. Модель применялась для исследований терапевтического эффекта антимикробных препаратов (22). Для изучения патогенеза инфекции и иммунного ответа на нее использовали мышиные модели, в т.ч. на «голой» мыши (иммунодефицитной). Мыши получали прогестерон, затем их однократно интравагинально инокулировали 100 (иногда меньше) единицами культуры Chlamydia muridarum. Урогенитальная инфекция сероварами С.trachomatis человека осуществлялась в дозе 1-10 единиц (23). Максимально близкая человеку модель острого сальпингита и восходящей хламидийной инфекции получалась на нечеловекообразных обезьянах (свинохвостые макаки, мартышки, зеленые мартышки) инокуляцией С.trachomatis непосредственно в маточные трубы или в полость матки, с повторными инокуляциями в шейку матки (23). Для оценки эффективности препаратов для лечения трихомониаза у крупного рогатого скота создана модель на мышах линии BALB/c, (возраст 6 недель). Размноженные in vitro культуры Tritrichomonas foetus (простейшего) в объеме 20 мкл (8,6×105 клеток) были введены мышам интравагинально через 2 суток после проведения подкожной инокуляции силиконовых трубочек, содержащих 15 пг 17P-эстрадиола, и вновь в той же дозе на следующий день. У мышей развивались значимые изменения толщины стенки матки, серозная эритема, или пиометра (гнойное воспаление матки). У многих - гистологические изменения маточного эпителия (29). Модель, применимая для изучения патологической анатомии, патогенеза и иммунного ответа на генитальную инфекцию, вызываемую С.trachomatis, создана на неинфицированных специфическими патогенами самках свиней (возраст 13 недель). Культуры С.trachomatis типов Е strain Bour и serovar E genital isolate, полученные из образцов зараженной ими женщины, были размножены in vitro и введены интравагинально свиньям, в количестве 108 клеток. Особенность модели в том, что она основана на применении крупного животного. При этом свинья весьма сходна с человеком по генетическим и физиологическим параметрам (30).
К сожалению, приведенные модели воспалительных заболеваний женских половых органов односторонне освещают воспалительный процесс как локальную иммунную реакцию на микробный агент, в то время как хроническое воспаление всегда сопровождается разной степенью дисфункции системного иммунного ответа (6, 14). Используя в качестве возбудителя моноагент, экспериментаторы воспроизводят классическую специфическую реакцию, тогда как в современной этиологии хронических воспалительных заболеваний половых органов превалирует микст-инфекция (12, 17, 24). Кроме того, воспалительный процесс, вызванный инфекционным агентом, невозможно регулировать по степени выраженности и другим показателям, необходимым для полноценного планирования эксперимента.
Для изучения влияния лечебного препарата на центральное звено иммуногенеза при хронических воспалительных заболеваниях женских половых органов модель эндометрита воспроизводили на беспородных крысах-самках следующим образом. В качестве антигена использовали 2%-ный водно-солевой экстракт ткани матки и яичника. Иммунизацию проводили по схеме: антиген с полным адъювантом Фрейнда (Дикфа) вводили в переднюю брюшную стенку в дозе 5 мг/кг (по белку), через 7 дней - в аналогичной дозе внутрибрюшинно, через 14 дней - внутривенно без стимулятора в дозе 3 мг/кг (4). Для оценки фармакотерапевтической эффективности лекарственного препарата для лечения эндометрита у белых крысах линии Wistar модель создавалась экспериментальным повреждение матки. Это осуществлялось введением 0,1 мл 2% водного раствора формалина внутрь матки. Однако у большинства крыс развивался острый, а не хронический эндометрит (5). В экспериментах на «голых» мышах (SCID mice) проводили двустороннюю оофоректомию (удаление яичников) либо введение антипрогестеронового препарата, затем вводили микроисточник экзогенного эстрогена в ксенографт человеческой нормальной эндометриальной ткани и имплантировали такой ксенографт в брюшную полость мыши. Источники экзогенного эстрогена добавляют мыши и после имплантации ксенографта, который разрастается и имитирует развитие эндометриальной ткани человека. Двусторонняя оофоректомия (удаление яичников) либо введение антипрогестеронового препарата производятся минимум за неделю до имплантации ксенографта. Эта модель применима для изучения молекулярных и иммуногистохимических/иммуногистопатологических профилей эндометриоза человека, биомаркеров заболевания. Может найти применение для оценки потенциальных способов лечения и профилактики эндометриоза: доз препаратов, схем терапии, методов и путей доставки (10).
Данные способы моделирования хронических воспалительных заболеваний женских половых органов не подходят для воспроизведения в эксперименте хронического эндометрита, приближенного к его реальным клинико-морфологическим характеристикам, ввиду сложности постановки и наличия множества побочных моментов.
Известны способы моделирования хронических заболеваний женских половых органов, основанные на трансплантации фрагментов эндометриальной ткани (часто отделенной от миометрия) и подшивании к различным тканям организма с помощью микрохирургической техники (11, 15, 16, 21, 25, 26, 28, 31). На разных этапах развития заболеваний или после введения лекарственных препаратов животных забивают и извлекают трансплантаты для гистологического изучения. Сравнивая полученные результаты с контрольной группой животных, делают выводы о механизмах развития заболевания и оценивают потенциал лекарственных средств. В некоторых случаях сравнение производят на наркотизированных животных после предварительного разреза кожи и обеспечения доступа к имплантату с последующим ушиванием раны. Для оценки эффективности доксициклина в отношении инволюции эндометриальной ткани у взрослых самок крыс линии Wistar Albino (не беременных) вырезали фрагмент (5×5 мм) аутологичной эндометриальной ткани, отделенной от миометрия, и подшивали этот фрагмент на внутреннюю поверхность брюшной полости справа (11). Для изучения действия противовоспалительных и иммуномодулирующих препаратов при эндометриозе у мышей и крыс удаляли матку, нарезали ее на мелкие фрагменты, которые подшивали в брюшную полость. В большинстве случаев эндометрий не отделяли от миометрия и подшивали вместе (16). Для изучения механизмов развития эндометриоза оценки потенциала лекарственных средств у «голых» мышей или иммунодефицитных трансгенных мышей RAG-2/γ(c)KO осуществляли ксенотрансплантацию в брюшную полость или подкожно фрагментов эндометриальной ткани человека, полученной в фазах пролиферации или секреции менструального цикла, либо менструального эндометрия (16). У макак и бабуинов менструальную кровь направляли в брюшную полость путем репозиции шейки матки или ее перевязывания - создается ретроградный ток менструальной крови. Либо подшивали фрагменты аутологичной эндометриальной ткани в брюшную полость, либо «засевали» ее фрагментами эндометриальной ткани (подшивание не производят). Это позволяет изучать роль иммунной системы в появлении и прогрессировании эндометриоза (16). Для исследования экспрессии alpha-TNF в ткани эндометрия и ее динамики под воздействием разных факторов, а также исследования роли воспаления в инволюции эндометрия у взрослых самок крыс линии Wistar Albino фрагмент средней трети левого рога матки размером 5×5 мм и подшивали вблизи кровеносного сосуда на внутреннюю поверхность брюшной полости справа (21). У взрослых самок макак: «свинохвостой» (Масаса nemestrina) и Макаки-резус (Масаса mulatta) в ходе лапаротомии, фрагменты бахромы (каймы) маточных труб нарезали на мелкие фрагменты и аутотрансплантировали под кожу, в карманы, формируемые на передней брюшной стенке. При трансплантации эпителия ампулы и перешейка маточных труб их сепарировали от гладкомышечного слоя, нарезали на фрагменты по 4-6 мм, и проводили аутотрансплантацию аналогично. Овариеэктомию не проводили. Затем в эти «карманы» инокулировали размноженными in vitro культурами С.trachonatis (по 100 тыс. единиц, что соответствует 10 минимальным дозам инфицирования). Эта модель предназначена для изучения иммунопатологии хламидиозной окологенитальной инфекции. Авторы отмечают, что модель применима и в отношении иных патогенов человека (25). Для изучения потенциала лекарственного средства в лечении эндометриоза взрослым самкам крыс линии Sprague-Dawley выполняли имплантацию фрагментов ткани эндометрия разного размера к боковой стенке брюшной полости (28). Коровам и кобылам осуществляли введение в матку человеческого рекомбинантного интерлейкина-8 (rhIL-8; 1,25 микрограмм на кобылу и 5 микрограмм на корову, растворенных в 50 мл фосфатно-солевого буфера). Это простая модель развития эндометрита, основанная на «прямом» подходе: полиморфоядерные нейтрофильные гранулоциты (ПНГ) привлекаются в полость матки введением провоспалительного аттрактанта. Модель предназначена для исследования параметров миграции ПНГ в матку в разных условиях. Предложенная in vivo модель превосходит используемые in vitro модели трансмиграции (31). Кролику проводили трансплантацию фрагментов аутологичного эндометрия в глаз (ксенотрансплантация человеческого эндометрия в данном случае не работает, т.к. отторжение происходит за неделю). Важной особенностью этой модели является то, что модель действует долго (181 день). При этом возможно наблюдение in vivo за морфологией имплантата при помощи глазной лампы, возможен забор водянистой влаги глаза для исследований. Модель хорошо подходит для изучения морфологии (например, васкуляризации) и биохимии эндометрия (26).
Известен способ моделирования хронических воспалительных заболеваний женских половых органов на кроликах, выбранный нами в качестве прототипа (15). Для создания модели осуществляли трансплантацию эндометриальной ткани кролика в его брюшную полость. Изменения имплантата изучали через 12 недель. Только к этому моменту эндометриальные имплантаты имели кистозную структуру. Макроскопический и гистологический вид имплантатов соответствовал эндометриозу. Гормональная терапия не проводилась. Использование микрохирургической техники фиксации имплантов позволяла предотвратить образование спаек между маточными трубами и яичниками. Это позволило использовать данную модель для изучения влияния хронических воспалительных заболеваний женских половых органов на фертильность - способность к зачатию.
Недостатком этого способа моделирования является довольно большой срок создания модели - 3 месяца (15).
Целью нашего изобретения явилось уменьшение времени получения модели хронических воспалительных заболеваний женских половых органов.
Для достижения поставленной цели вначале кролику проводят гормональную терапию (эстрогенизацию) по определенной схеме, затем под наркозом в стерильных условиях проводят аутотрансплантацию участков эндометрия. Для этого после лапаротомии из маточного рога выделяют несколько прямоугольных участков эндометрия размером 2×3 мм и подшивают их к париетальной брюшине различными способами. После ушивания раны животное выхаживают и проводят гормональную терапию, но уже по другой схеме. Если подшивание участков эндометрия проводят микрохирургическими инструментами и атравматическим синтетическим нерассасывающимся монофиламентным шовным материалом 9/0 четырьмя швами по углам участка эндометрия двумя двойными узлами в каждом шве, то через 2 недели у кролика развивается эндометриоз. В случае, если подшивание участков эндометрия осуществляют общехирургическими инструментами и синтетическим нерассасывающимся шовным материалом 4/0 четырьмя швами по углам участка эндометрия тремя узлами в каждом шве, то в имплантате через 2 недели наблюдают все признаки хронического эндометрита. Предоперационную эстрогенизацию проводят внутримышечным (в.м.) введением 0,1% синестрола по 1,0 мл в день, начиная за 7 дней до планируемой операции (в 7-й день, в 5-й день, в 3-й день, в день перед операцией) и в день операции. После операции синестрол вводят в.м. в той же дозе однократно на 2-й, 4-й и 6-й день.
Положительный эффект от внедрения предлагаемого способа состоит в том, что уменьшение времени создания модели приводит к повышению интенсивности научно-исследовательской работы и экономии материальных ресурсов, необходимых для содержания лабораторных животных. В ходе создания модели и последующей работы с ней возможно проведение визуального мониторинга состояния имплантатов эндометрия. Морфологические методы исследования позволяют дать адекватную оценку результатам моделирования. Данная экспериментальная модель пригодна для изучения различных терапевтических воздействий, в том числе клеточного продукта на основе эндометриальных стволовых клеток, на ткань поврежденного эндометрия и оценки эффективности этих воздействий. Кроме этого, разработанная модель обладает характеристиками, обеспечивающими возможность ее использования для апробации современных хирургических технологий, в том числе изучения воздействия различных видов энергии (электрокоагуляции, лазеров, плазменного потока и т.д.) для лечения хронического эндометрита.
На фиг.1 представлена морфологическая картина имплантата через 14 дней после имплантации с использованием микрохирургической техники (модель эндометриоза). Окраска гематоксилином-эозином. Увеличение 360 х.
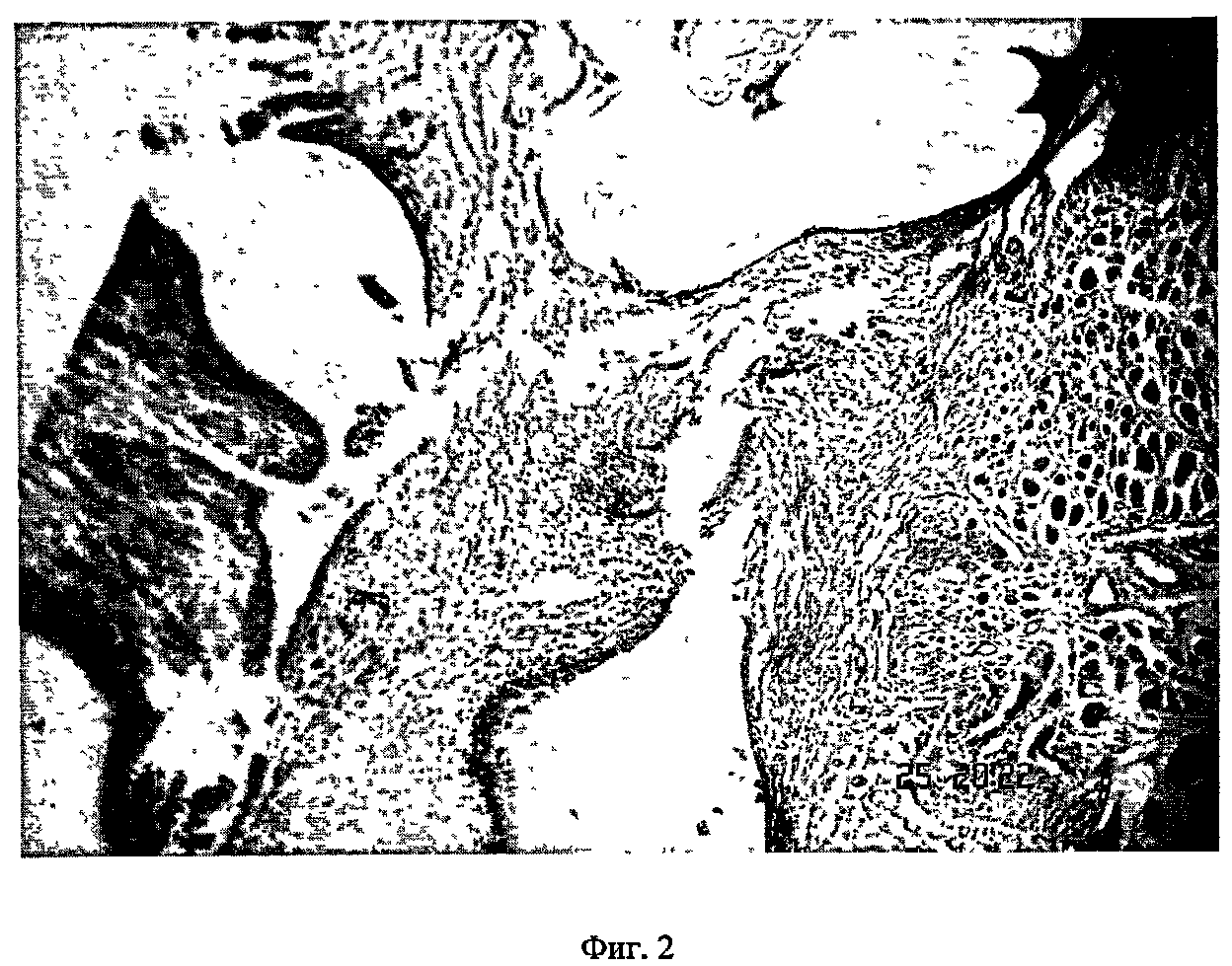
На фиг.2 - морфологическая картина имплантата через 14 дней после имплантации с использованием общехирургической техники (модель хронического эндометрита). Окраска гематоксилином-эозином. Увеличение 120 х.
Способ осуществляется следующим образом. Для моделирования заболеваний эндометрия использовали половозрелых самок кроликов породы Шиншилла массой 2,5-3,5 кг, возраст от 1 года до 2,5 лет. Перед операцией проводили эстрогенизацию животных путем в.м. введения 0,1% синестрола по следующей схеме: введение через день по 1,0 мл внутримышечно в мышцы заднего отдела бедра один раз в день, начиная за 7 дней до планируемой операции (в 7-й день, в 5-й день, в 3-й день, в день перед операцией) и в день операции. После обработки операционного поля под тиопенталовым наркозом (30-40 мг/кг массы тела животного) выполняли нижнесрединную лапаротомию длиной 6 см. Послойно рассекали: кожу, подкожную жировую клетчатку, поверхностную фасцию, белую линию, предбрюшинную клетчатку, брюшину. Отграничение подкожной клетчатки салфетками не проводили. Производили гемостаз - лигирование сосудов. Проводили отграничение петель тонкой кишки влажными салфетками. Правый маточный рог выделяли и резецировали на протяжении 3 см. Резекция выполнялась без использования электрокоагуляции острым путем с помощью ножниц. Гемостаз - лигирование сосудов. Удаленный препарат рассекали продольным разрезом ножниц, вскрывая полость матки. Разрез выполняли на стороне, противоположной прикреплению брыжейки матки. Эндометрий из центра препарата отделяли острым путем при помощи острого лезвия и микрохирургического анатомический пинцета и его фрагменты 2×3 мм подшивали к париетальной брюшине передней брюшной стенки. Местом фиксации был участок интактной брюшины справа и слева от операционной раны на расстоянии 2 см от краев. Фрагменты подшивали на расстоянии 2 см друг от друга с каждой стороны по 2 фрагмента для обеспечения независимого процесса приживления. Для создания модели эндометриоза подшивание фрагментов производили с использованием микрохирургического инструмента (иглодержатель для микрохирургических игл и микрохирургический анатомический пинцет) и атравматического синтетического нерассасывающегося монофиламентного шовного материала 9/0. Для улучшения визуализации использовали бинокулярную лупу (БЛ2-1, Россия). Данная толщина нити была минимальной, позволяющей для микрохирургической техники осуществить надежную фиксацию фрагмента эндометрия к брюшине четырьмя швами по углам участка эндометрия двумя двойными узлами в каждом шве с минимальной травмой пересаживаемого участка и подлежащих тканей. Использование монофиламентного атравматического материала позволило свести к минимуму операционную травму. Для создания модели хронического эндометрита для фиксации эндометрия к брюшине использовали общехирургические инструменты (иглодержатель для атравматических игл) и атравматический синтетический пересасывающийся шовный материал 4/0. Данная толщина нити была минимальной, позволяющей для общехирургической техники осуществить надежную фиксацию фрагмента эндометрия 2×3 мм к брюшине при помощи четырех швов по углам. Швы фиксировали при помощи трех узлов, обеспечивающих надежность шва. После проверки гемостаза и удаления отграничивающих салфеток рану послойно ушивали с наложением на кожу шелковых швов по Донати. В послеоперационном периоде всем модельным животным с целью профилактики послеоперационных осложнений применяли антибиотики (цефтриаксон в дозе 50 мг/кг/сут) в течение 5 суток. Производили повторную (послеоперационную) эстрогенизацию 0,1% раствором синестрола по следующей схеме: введение через день по 1,0 мл внутримышечно в мышцы заднего отдела бедра, начиная со второго дня после операции три раза (однократно на 2-й, 4-й и 6-й день).
Повторное оперативное вмешательство - забор материала и выведение всех модельных животных производили через 14 дней после оперативного вмешательства. После обработки операционного поля под тиопенталовым наркозом (30-40 мг/кг массы тела в.м. в мышцы заднего отдела бедра) выполняли минилапаротомию длиной 2,5 см по средней линии передней брюшной стенки, на 1 см отступя от верхнего конца послеоперационного рубца. Кожу передней брюшной стенки захватывали кожно-бельевыми зажимами по средней линии на уровне нижнего конца послеоперационного рубца и по сосковой линии на уровне середины послеоперационного рубца справа и слева (3 зажима) и поднимали. При этом производили визуальное обследование (макроскопическая оценка) состояния операционного поля, состояния имплантированного эндометрия и забор материала для морфологического исследования. Последовательно осматривали область послеоперационного рубца, брюшину правой и левой половины передней брюшной стенки, петли тонкой и толстой кишки, левый (интактный) маточный рог. Забор гистологического материала для исследования у всех модельных животных выполняли путем эксцизионной биопсии имплантов эндометрия в пределах неизмененных тканей. После выделения левого маточного рога его резецировали ножницами на протяжении не менее 3 см. Удаленный препарат рассекали ножницами продольно, вскрывая полость матки. Разрез выполняли на стороне, противоположной прикреплению широкой связки матки. Эндометрий из центра препарата (интактный участок левого маточного рога) отделяли острым способом при помощи лезвия.
Подготовку препаратов ткани эндометрия для морфологического исследования проводили на основании фиксации в 10% нейтральном формалине не менее 10 суток с последующей проводкой по схеме:
1) спирт в течение 1 часа
2) спирт в течение 1 часа
3) спирт в течение 1 часа
4) спирт в течение 1 часа
5) спирт-касторовое масло (50%-50%) при 37°C в термостате в течение суток
6) хлороформ в течение 30 минут
7) хлороформ в течение 30 минут
8) парафин-хлороформ (50%-50%) при 60°C в термостате в течение часа.
Окраску препаратов осуществляют гематоксилином-эозином и по Ван-Гизон по стандартной методике (8).
Макроскопическая характеристика имплантатов ткани эндометрия в группах животных с использованием микрохирургической техники следующая: объемные импланты ярко-розового цвета в виде четко выраженной полусферы; возвышающиеся над поверхностью брюшины; незначительная гиперемия зоны имплантации по всей площади, включая места наложения швов; отсутствие кровоизлияний в зоне имплантации как в центре, так и по периферии; отсутствие спаечного процесса. При морфологическом анализе тканей имплантов, фиксированных к брюшине с использованием микрохирургической техники было обнаружено: над поверхностью всех имплантов прослеживается брюшинный покров; наличие хорошо выраженных эндометриальных желез с четкими контурами и жизнеспособным неслущенным эпителием; отдельные железы проникают в мышечный слой брюшной стенки, что свидетельствует о прогрессирующем срастании тканей; стромальный компонент хорошо выражен, прослеживаются слабо выраженные признаки отека тканей; отсутствие кровоизлияний; по периферии имплантатов наблюдается умеренно выраженная полиморфноклеточная инфильтрация; отсутствие границы между имплантом и подлежащими тканями, свидетельствующее о срастании тканевых элементов; кистевидное расширение части эндометриальных желез (фиг.1).
В группе животных с использованием общехирургической техники на обзорной лапароскопии на 14 день после моделирования имплантаты характеризовались следующим образом: округлые имплантаты бледно-розового цвета возвышались над поверхностью брюшины в виде уплощенной полусферы; выраженная гиперемия зоны имплантации, максимально интенсивная в местах наложения швов; наличие в некоторых случаях плоскостных спаек длиной 2-3 мм между имплантатом и кишкой, между кишкой и париетальной брюшиной; При морфологическом анализе имплантатов, фиксированных к брюшине с помощью общехирургической техники, выявлены следующие изменения: железистый компонент в виде желез с частично спущенным эпителием; эндометриальная строма в состоянии дистрофии, выраженный отек межклеточных промежутков, проявляющийся ослаблением тинкториальных свойств; кровоизлияния в имплант и подлежащие ткани брюшной стенки, более выраженные в зоне наложения швов; полиморфноклеточная инфильтрация импланта и подлежащей ткани, наиболее интенсивная в зоне наложения швов; прослеживается неравномерный промежуток в виде щели между имплантом и подлежащей брюшиной (фиг.2).
Хронический воспалительный процесс считается воспроизведенным, если в имплантатах эндометрия присутствуют следующие морфотипические признаки: наличие инфильтратов, состоящих преимущественно из лимфоидных элементов в сочетании с лейкоцитами и гистиоцитами, плазматических клеток, отек стромы и ее очаговый фиброз, стаз эритроцитов и склеротические изменения стенок спиральных артерий эндометрия (7). Таким образом, из полученных нами результатов видно, что уже через 2 недели после аутотрансплантации участков эндометрия, выделенных из маточного рога к париетальной брюшине, при дополнительной эстрогенизации животного и в зависимости от способа фиксации в этих аутотрансплантатах, происходят такие изменения эндометриальной ткани, которые характерны для эндометриоза и хронического эндометрита у женщин (9, 19, 27).
Список литературы
1. Патент RU 2142163. Способ моделирования воспалительных заболеваний женских половых органов. Дата подачи заявки: 17.07.1996.
2. Патент RU 2224297. Способ моделирования хронического воспаления придатков матки Дата подачи заявки: 28.06.2002.
3. Патент RU 2279142. Способ моделирования воспалительных заболеваний верхних отделов женских половых органов. Дата подачи заявки: 12.11.2004.
4. Абильдаева А.Ж., С.М.Адекенов. Противовоспалительные и иммуномодулирующие свойства сесквитерпенового лактона арглабин при экспериментальном хроническом эндометрите. Российский биотерапевтический журн. - 2005. - Т.4. - №2. - С.50-53.
5. Ботоева Е.А., И.П.Убеева, С.М.Николаев. Оценка фармакотерапевтической эффективности сухого экстракта ортилии однобокой. Бюллетень ВСНЦ СО РАМП. - 2009. - Т.66. - №2. - С.100-102.
6. Калинина Н.М. и др. Показатели иммунитета у женщин с нарушением репродуктивной функции. Цитокины и воспаление. 2002. - Т.1. - №2. - С.276-277.
7. Кузнецова А.В. Хронический эндометрит. Архив патологии. 2000. - №3. - С.48-52.
8. Меркулов Г.А. Основы патогистологической техники. - М.: Медицина. 1961. - 187 с.
9. Сухих, Г.Т. Хронический эндометрит: руководство. Г.Т.Сухих, А.В.Шуршалина. - М.: ГЭОТАР-Медиа, 2010. - 64 с.
10. Патент US6429353. Endometriosis mouse model. Дата подачи заявки 25.03.1998. Дата публикации 06.08.2002.
11. Akkaya P., Onalan G., Haberal N., Bayraktar N., Mulayim В., Zeyneloglu H. B. Doxycycline causes regression ofendometriotic implants: a rat model. Hum. Reprod. - 2009. - V.24 (8). - P.1900-1908.
12. Brook I. Microbiology and management ofpolymicrobial female genital tract infections in adolescents. J. Pediatr. Adolesc. Gynecol. - 2002. - V.15 (4). - P.217-226.
13. Cobo E.R., Eckmann L., Corbeil L.B. Murine models of vaginal trichomonad infections. Am J. Trop. Med. Hyg. - 2011. - V.85(4). - P.667-673.
14. Disep В., et al. Immunohistochemical characterization ofendometrial leucocytes in endometritis. Histopathology. - 2004. - V.45 (6). - P.625-632.
15. Dunselman, G.A., D.Willebrand, et al. A rabbit model ofendometriosis. Gynecol. Obstet. Invest. - 1989. - V.27 (1). - P.29-33.
16. Grummer, R. Animal models in endometriosis research. Hum Reprod Update. - 2006. - V.12 (5). - P.641-649.
17. Haggerty C.L., et al. Bacterial vaginosis and anaerobic bacteria are associated with endometritis. Clin. Infect. Dis. - 2004. - V.39 (7). - P.990-995.
18. He Chong-Yi.Wu Rui, Li Li, Wang Xiao-Xu, Wang Jian-Fa, Wang Shuang, Liu Wen, Yang Ke-Li. Establishment of a rat model of endometritis and its treatment with a Chinese-Western medicine emulsion. Acta Laboratorium Animalis Scientia Sinica. - 2008. - V.3 (12). - P.842-851.
19. Kitaya K., Т.Yasuo. Immunohistochemistrical and clinicopathological characterization of chronic endometritis. Am J. Reprod. Immunol. - 2011. - Jul 12. - P.4108-4155.
20. Klucinski W., Targowski S.P., Winnicka A., Miernik-Degorska E. Immunological induction ofendometritis-model investigations in cows. Zentralbl Veterinarmed A. - 1990. - V.37 (2). - P.148-153.
21. Kondo W., dal Lago E.A., Noronha L., Olandoski M., Kotze P. G., Amaral V. F. Effect ofanti-TNF-a on peritoneal endometrial implants of rats. Rev. Col. Bras. Cir. -2011. - V.38 (4). - P.266-273.
22. Mikamo H., Kawazoe K., Sato Y., Izumi K., Tamaya T. Therapeutic effects of a new quinolone, DU-6859a, on polymicrobial infections in a newly designed model of rat uterine endometritis. J Antimicrob Chemother. - 1998. - V.41 (1). - P.131-133.
23. Miyairi I., Ramsey K.H., Patton D. L. Duration of untreated chlamydial genital infection and factors associated with clearance: review of animal studies. J Infect Dis. - 2010. - V.201, Suppl. 2. - P.S96.103.
24. Nasraty S. Infections of the female genital tract. Prim. Care. - 2003. - V.30 (1). - P.193-203.
25. Patton D. L., Kuo C.C., Brenner R.M. Chlamydia trachomatis oculogenital infection in the subcutaneous autotransplant model of conjunctiva, salpinx and endometrium. Br. J. Exp. Pathol. - 1989. - V.70 (3). - P.357-367.
26. Rock, J.A., R.A.Prendergast, et al. Intraocular endometrium in the rabbit as a model for endometriosis. Fertil Steril. - 1993. - V.59 (1). - P.232-235.
27. Smith M., et al. Chronic endometritis: a combined histopathologic and clinical review of cases from 2002 to 2007. Int. J. Gynecol. Pathol. - 2010. - V.29 (1). - P.44-50.
28. Tjaden В., D. Galetto D. et al. Time-related effects ofRU486 treatment in experimentally induced endometriosis in the rat. Fertil. Steril. - 1993. - V.59 (2). - 437-440.
29. Van Andel R.A., Franklin C.L., St Claire M.C., Riley L.K., Besch-Williford C.L., Hook R.R. Jr. Lesions of experimental genital Tritrichomonas foetus infections in estrogenized BALB/c mice. Vet. Pathol. - 1996. - V.33 (4). - P.407-411.
30. Vanrompay D., Hoang T.Q., De Vos L., Verminnen K., Harkinezhad Т., Chiers K., Morre S.A., Cox E. Specific-pathogen-free pigs as an animal model for studying Chlamydia trachomatis genital infection. Infect Immun. - 2005. - V.73 (12). - P.8317-8321.
31. Zerbe H., Schuberth H. J., Engeike F., Frank J., Klug E., Leibold W. Development and comparison of in vivo and in vitro models for endometritis in cows and mares. Theriogenology. - 2003. - V.60 (2). - P.209-223.
Способ моделирования заболеваний женских половых органов в эксперименте путем аутотрансплантации участков эндометрия, выделенных из маточного рога, к париетальной брюшине, отличающийся тем, что для моделирования эндометриоза для аутотрансплантациии берут прямоугольные участки эндометрия размером 2×3 мм и подшивают их микрохирургическими инструментами атравматическим синтетическим нерассасывающимся монофиламентным шовным материалом 9/0 четырьмя швами по углам участка эндометрия двумя двойными узлами в каждом шве или для моделирования хронического эндометрита фиксацию участков эндометрия осуществляют общехирургическими инструментами синтетическим нерассасывающимся шовным материалом 4/0 четырьмя швами по углам участка эндометрия тремя узлами в каждом шве; проводят пред- и послеоперационную эстрогенизацию животного по следующей схеме: введение через день по 1,0 мл 0,1% синестрола внутримышечно один раз в день, начиная за 7 дней до аутотрансплантации - в 7-й день, в 5-й день, в 3-й день, в день перед операцией и в день операции, после операции синестрол вводят в той же дозе однократно на 2-й, 4-й и 6-й день.