Результат интеллектуальной деятельности: СПОСОБ ЭЛЕКТРОХИМИЧЕСКОЙ ИДЕНТИФИКАЦИИ ЦЕЛЕВЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ НУКЛЕОТИДОВ
Вид РИД
Изобретение
Настоящее изобретение относится к способу и к комплекту для электрохимической идентификации целевых последовательностей нуклеотидов.
Одна область предполагаемого применения представляет собой, в частности, экспресс-анализ биологических образцов, которые могут содержать бактерии или вирусы, а в общем случае - любую нуклеиновую кислоту.
Известные электрохимические методы обнаружения уже делают возможным демонстрировать целевые последовательности нуклеиновых кислот. Некоторые используют как процессы амплификации нуклеиновых кислот, например ПЦР (полимеразная цепная реакция), так и процессы циклической вольтамперометрии. По одному из этих методов обеспечивают биологический образец, содержащий нуклеиновую кислоту, которая демонстрирует заданную целевую последовательность нуклеотидов, и добавляют к биологическому образцу окислитель, способный к окислению, по меньшей мере, одного из нуклеотидных оснований целевой последовательности. Средства амплификации содержат нуклеотиды типа, включающего окисляемое нуклеотидное основание, и эти нуклеотиды, конечно, предназначены, чтобы быть использованными в ходе реализации процесса амплификации так, чтобы получить копируемые последовательности нуклеиновых кислот. Одновременно или после каждой стадии амплификации на образец воздействуют электрическим полем так, чтобы вызвать реакцию окислителя с окисляемым нуклеотидным основанием, и измеряют электрический ток, который, следовательно, проходит через образец. По этому способу, описанному более подробно в документе PCT/FR2007/000373, определяют присутствие заданной целевой последовательности и начальное ее количество, когда электрический ток уменьшается в ходе амплификации. Это происходит потому, что в течение процесса амплификации число свободных нуклеотидов из средств амплификации уменьшается, так как они встраиваются в синтезируемые нуклеиновые кислоты. Тогда окислитель может вступать в реакцию только со все более и более ограниченным количеством свободных нуклеотидов. Следовательно, все меньше и меньше электронов переносят вследствие прохождения реакции окисления, и электрический ток уменьшается.
Таким образом, такой способ делает возможным быстрое обнаружение и количественное определение присутствия данной нуклеиновой кислоты в любом биологическом образце.
Проблема, которая возникает и которую настоящее изобретение стремится решить, состоит не только в том, чтобы обеспечить другой электрохимический способ обнаружения, который делает возможным обнаруживать присутствие целевой последовательности нуклеотидов в биологическом образце, но также и в том, чтобы дать возможность идентифицировать ее природу и определять ее количество.
С целью решения этой задачи, по первому объекту, настоящее изобретение предлагает способ электрохимической идентификации целевых последовательностей нуклеотидов. Указанный способ представляет собой способ такого типа, по которому обеспечивают биологический образец, который может содержать заданную целевую последовательность нуклеотидов, в то время как активируемые средства амплификации содержат свободные нуклеотиды, чтобы вызывать репликацию указанной заданной целевой последовательности нуклеотидов и формирование копируемых целевых последовательностей нуклеотидов. По этому способу также обеспечивают соединение, способное к окислению-восстановлению, которое может вступать в реакцию с указанными нуклеотидами, и указанное соединение, способное к окислению-восстановлению, приводят в контакт с указанным биологическим образцом. Указанные активируемые средства амплификации затем активируют и воздействуют электрическим полем на указанный образец, чтобы активировать указанное соединение, способное к окислению-восстановлению, и измеряют электрический ток, представляющий электрохимическую активность указанного соединения, способного к окислению-восстановлению, который проходит через указанный образец. Таким образом, определяют присутствие указанной заданной целевой последовательности нуклеотидов, если электрический ток уменьшается. По этому изобретению обеспечивают соединение, способное к окислению-восстановлению, которое может интеркалировать в ходе репликации между нуклеотидами, формирующими указанные копируемые целевые последовательности, причем указанные копируемые целевые последовательности вызывают ингибирование электрохимической активности указанного интеркалируемого соединения, способного к окислению-восстановлению, благодаря которому электрический ток уменьшается.
В дополнение к свободным нуклеотидам, активируемые средства амплификации содержат праймеры, которые представляют собой олигонуклеотидные кислоты, специфические для и комплементарные к целевой последовательности нуклеотидов, подлежащей обнаружению, и полимеразу. Кроме того, как будет объяснено подробно в дальнейшем, на указанный образец воздействуют электрическим полем, приводя электроды в контакт с указанным образцом и применяя разность потенциалов между этими электродами.
Таким образом, один признак изобретения состоит в том, чтобы обеспечивать соединение, способное к окислению-восстановлению, которое не будет окислять нуклеотидные основания свободных нуклеотидов в образце, как это имеет место в указанном выше документе предшествующего уровня техники, но которое будет интеркалировать между нуклеотидами, формирующими копируемые целевые последовательности.
Предпочтительно, указанные активируемые средства амплификации активируются в соответствии с последовательными циклами амплификации, и при каждом цикле амплификации удваивается указанная копируемая целевая последовательность. Соединение, способное к окислению-восстановлению, затем интеркалирует между нуклеотидами, формирующими указанные копируемые целевые последовательности, и теряет свою активность окисления-восстановления в отношении приложенного электрического поля. Следовательно, в течение циклов амплификации уменьшается измеряемый электрический сигнал.
Число циклов амплификации, соответствующих уменьшению электрического тока, затем, предпочтительно, регистрируют, чтобы определить концентрацию указанной целевой последовательности нуклеотидов в указанном образце. Это является причиной уменьшения измеренного сигнала пропорционально количеству копируемой целевой последовательности нуклеотидов. Можно вывести из этой пропорциональности количество заданной целевой последовательности нуклеотидов, первоначально присутствующей в указанном образце. Таким образом, активация указанного активируемого средства амплификации тем самым повторяется в соответствии с определенным числом циклов амплификации, и регистрируют число циклов указанных средств амплификации, когда уменьшается электрический ток, чтобы определить концентрацию указанной целевой последовательности нуклеотидов в образце. В данном случае, чем больше заданных целевых последовательностей нуклеотидов содержит биологический образец, тем ниже число циклов амплификации, необходимых, чтобы интенсивность электрического тока падала. Наоборот, чем меньше образец содержит заданных целевых последовательностей, тем выше число циклов амплификации. Таким способом, как это будет объясняться более подробно в остальной части описания, этот способ также делает возможной количественную оценку концентрации заданной целевой последовательности в биологическом образце.
Далее будет указано, что термин "соединение, способное к окислению-восстановлению (oxide-reducible compound)", описывает не только редокс-соединения, но также и соединения, способные быть окисленными при определенных условиях и быть восстановленными при других условиях.
По одному варианту выполнения изобретения, который является особенно предпочтительным, после того как заданная целевая последовательность нуклеотидов амплифицируется, указанному образцу также сообщают тепловую энергию, чтобы вызвать высвобождение указанного интеркалированного окисляющегося-восстанавливающегося соединение, и электрическое поле прикладывают к указанному образцу, чтобы одновременно регистрировать изменения электрического тока, который проходит через указанный образец. Количество тепловой энергии Q, соответствующее максимальным зарегистрированным изменениям электрического тока, затем определяют, чтобы идентифицировать природу указанной заданной целевой последовательности нуклеотидов. Предпочтительно, указанному образцу сообщают тепловую энергию таким способом, чтобы вызывать постепенное увеличение температуры указанного образца. Таким образом, регистрируют изменения электрического тока как функцию подаваемой тепловой энергии, или, более конкретно, температуры в данном интервале. Природу указанной заданной целевой последовательности нуклеотидов идентифицируют по максимальному изменению электрического тока при данной температуре. Это происходит потому, что в соответствии с природой амплифицированной целевой последовательности максимальное изменение электрического тока при данной температуре является характеристикой указанной копируемой целевой последовательности нуклеотидов.
Таким образом, когда образец и, следовательно, копируемые целевые последовательности нуклеотидов обеспечиваются достаточной тепловой энергией, двойные цепи копируемых целевых последовательностей нуклеотидов имеют тенденцию разделяться на две одиночные цепи и в результате высвобождать интеркалированное соединение, способное к окислению-восстановлению, которому затем возвращают его электрохимическую активность. Двойные цепи копируемых целевых последовательностей нуклеотидов отделяют друг от друга для данного теплового движения, то есть при данной температуре так, что высвобождение соединения, способного к окислению-восстановлению, которое затем измеряют посредством электрического тока, генерируемого на электродах, происходило резко, фактически, в дискретной манере, то есть в узком диапазоне температур, когда образцу придают заданное количество тепловой энергии.
Предпочтительно, указанному образцу сообщают тепловую энергию таким способом, чтобы вызывать постепенное увеличение температуры указанного образца, например, от 40°С до 98°С. В этом диапазоне температур двойные цепи копируемой целевой последовательности нуклеотидов будут постепенно изменяться от спаренного состояния, в котором каждое из нуклеотидных оснований копируемых целевых последовательностей связано комплементарным образом, к диссоциированному состоянию, где каждая копируемая целевая последовательность окажется одноцепочечной. Изменение от двухцепочечного состояния к одноцепочечному состоянию, следовательно, происходит внутри узкого диапазона температур, который характеризуется температурой "диссоциации", обычно указываемой как Тm, характеристикой природы копируемой целевой последовательности нуклеотидов.
Кроме того, электрический ток, представляющий электрохимическую активность указанного соединения, способного к окислению-восстановлению, предпочтительно измеряют при заданной температуре указанного образца, при которой никакая другая молекула, образованная или образуемая в этом процессе, не ингибирует соединение, способное к окислению-восстановлению, например димеры праймеров. Предпочтительно, указанная заданная температура заметно ниже, но, тем не менее, близка к температура указанного образца, соответствующей заданному количеству тепловой энергии Q такому, что при этой высокой температуре все другие молекулы, которые меньше по размерам, чем копируемая целевая последовательность нуклеотидов, не гибридизуются, тогда как копируемые целевые последовательности нуклеотидов остаются интактными. Таким образом, количество тока, получающегося при высвобождении указанного соединения, способного к окислению-восстановлению, различными димерами праймеров, или из любых других меньших молекул, которым уже сообщена тепловая энергия, давая возможность им диссоциировать, исключают из измеренного электрического тока.
Предпочтительно, используют вольтамперометрию, чтобы измерять и регистрировать электрический ток или указанные изменения электрического тока. Этот потенциодинамический метод состоит в приложении между двумя электродами, как это будет объяснено более подробно в остальной части описания, потенциала, который изменяется во времени, и одновременно регистрации изменения тока, который возникает. Предпочтительно, используют квадратно-волновую вольтамперометрию. Конечно, потенциально применимы и другие электрохимические методы, например дифференциальная импульсная вольтамперометрия, или линейная, или циклическая сканирующая вольтамперометрия, или еще дискретно-токовая (sampled current) вольтамперометрия, или переменно-токовая вольтамперометрия.
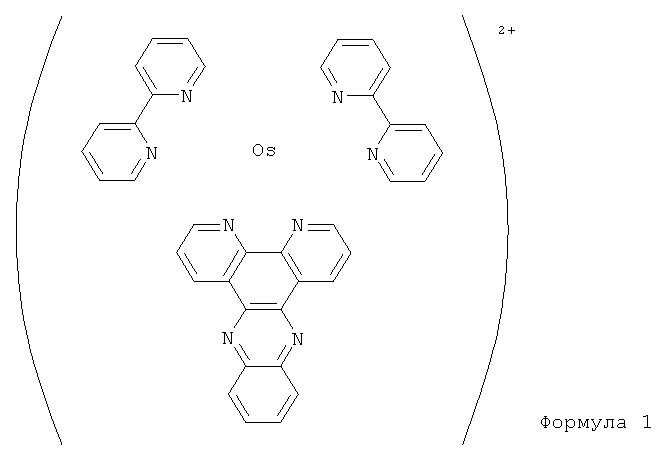
По одному варианту выполнения изобретения, который является особенно предпочтительным, указанное обеспечиваемое соединение, способное к окислению-восстановлению, представляет собой комплекс переходного металла, например металла из колонки VIDA таблицы Менделеева, и более конкретно, осмия. Кроме того, соединение, способное к окислению-восстановлению, предпочтительно, имеет, по меньшей мере, один лиганд, интеркалирующийся в последовательность нуклеиновой кислоты, и, например, дипиридофеназиновый лиганд, который способен к интеркаляции между спаренными цепями, образуемыми копируемыми целевыми последовательностями нуклеотидов.
Кроме того, соединение, способное к окислению-восстановлению, имеет по меньшей мере один бипиридиновый лиганд и, предпочтительно, два лиганда этого типа. Комплекс осмия с сопутствующим дипиридофеназиновым лигандом или двумя сопутствующими бипиридиновыми лигандами будет описан более подробно в описании далее. Кроме того, можно наблюдать, что некоторые полностью органические соединения, способные к окислению-восстановлению, также могут быть предложены для предпочтительное применения, например, это метиленовый голубой.
По одному предпочтительному варианту выполнения изобретения осуществляют репликацию указанной заданной целевой последовательности нуклеотидов и формирование копируемых целевых последовательностей нуклеотидов в форме двойных цепей нуклеиновой кислоты. Таким образом, указанные активируемые средства амплификации имеют тип ПЦР.
По второму объекту настоящее изобретение предлагает комплект для электрохимической идентификации целевых последовательностей нуклеотидов. Указанный комплект содержит средства для получения биологического образца, который может содержать заданную целевую последовательность нуклеотидов, и активируемые средства амплификации, содержащие свободные нуклеотиды, чтобы вызывать репликацию указанной заданной целевой последовательности нуклеотидов и формирование копируемых целевых последовательностей нуклеотидов. Кроме того, этот комплект включает соединение, способное к окислению-восстановлению, которое может вступать в реакцию с указанными нуклеотидами, причем указанное соединение, способное к окислению-восстановлению, приводят в контакт с указанным биологическим образцом.
Средства активации делают возможным активировать указанные активируемые средства амплификации, и средства дают возможность прикладывать электрическое поле к указанному образцу таким способом, чтобы активировать указанное соединение, способное к окислению-восстановлению, и в то же время измерительные средства делают возможным измерять электрический ток, представляющий электрическую активность указанного соединение, способного к окислению-восстановлению, который проходит через указанный образец. Наконец, средства определения делают возможным определение присутствия указанной заданной целевой последовательности нуклеотидов, если электрический ток уменьшается. По этому изобретению указанное соединение, способное к окислению-восстановлению, выбирают из соединений, способных к интеркаляции в ходе репликации между нуклеотидами, формирующими указанные копируемые целевые последовательности, то есть в двойные цепи копируемой целевой последовательности нуклеотидов, причем указанные копируемые целевые последовательности вызывают ингибирование электрохимической активности указанного интеркалированного соединения, способного к окислению-восстановлению, благодаря чему электрический ток уменьшается.
В дополнение и по одному предпочтительному варианту выполнения изобретения комплект для идентификации также содержит средства сообщения указанному образцу тепловой энергии таким способом, чтобы вызывать высвобождение указанного интеркалированного соединения, способного к окислению-восстановлению, и средства для приложения электрического поля к указанному образцу посредством электродов, приводимых в контакт с образцом, таким способом, чтобы одновременно регистрировать, как функцию температуры, изменения электрического тока, который проходит через указанный образец, а также средства определения количества тепловой энергии, соответствующей максимальным изменениям электрического тока, которые зарегистрированы, чтобы проверять присутствие указанной заданной целевой последовательности нуклеотидов. Эти средства определяют на основе максимального изменения зарегистрированного электрического тока температуру диссоциации (Тm), характеризующую присутствие целевой последовательности нуклеотидов, подлежащей обнаружению.
Указанный выше комплект для электрохимической идентификации, который делает возможным осуществление способа по изобретению, будет раскрыт более подробно в дальнейшем описании. В частности, будут описаны средства активации, которые, предпочтительно, способны к активации указанного активируемого средства амплификации в соответствии с последовательными циклами амплификации, чтобы удвоить указанную копируемую целевую последовательность в каждом цикле амплификации. Кроме того, комплект для идентификации по изобретению содержит средства регистрации числа циклов амплификации, соответствующего уменьшению электрического тока, таким образом, чтобы определять концентрацию указанной целевой последовательности нуклеотидов в указанном образце.
Кроме того, другие особенности и преимущества изобретения будут видны из чтения описания, приведенного в дальнейшем, специфического варианта выполнения изобретения, данного посредством неограничивающего указания со ссылкой на приложенные чертежи, в которых:
- Фиг.1 представляет собой схематическое изображение комплекта для электрохимической идентификации по изобретению;
- Фиг.2А-2С представляют собой схематические изображения элемента комплекта для идентификации, представленного на Фиг.1, по одному варианту выполнения изобретения;
- Фиг.3А и 3В представляют собой диаграммы интенсивности/потенциала, полученные посредством комплекта для идентификации, представленного на Фиг.1;
- Фиг.3С представляет собой вид диаграммы, полученной вычитанием диаграмм, представленных на Фиг.3А и 3В;
- Фиг.4 представляет собой вид диаграммы типа, аналогичного таковому на Фиг.3С;
- Фиг.5А иллюстрирует диаграмму интенсивности/температуры, полученную посредством комплекта для идентификации, представленного на Фиг.1 и в первой стадии
- Фиг.5В иллюстрирует диаграмму, полученную во второй стадии перегруппировкой диаграммы, показанной в фигуре 5А;
- Фиг.6 иллюстрирует диаграмму типа, представленного на Фиг.5В, в специфическом приложении.
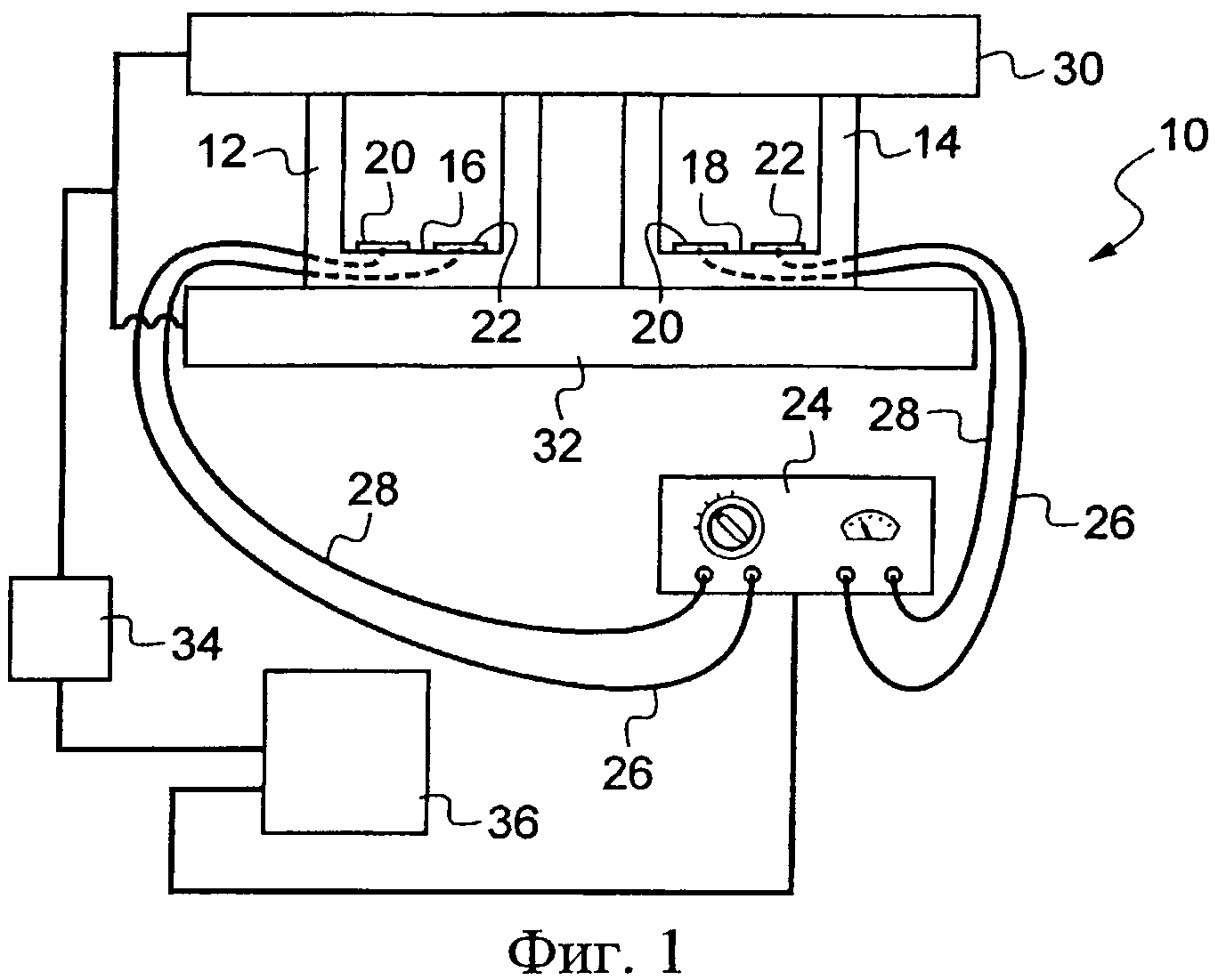
Способ электрохимической идентификации по изобретению требует использования комплекта для электрохимической идентификации, содержащего, с одной стороны, средства контроля и измерения, которые будут описаны сначала, а, с другой стороны, специфические биологические и химические компоненты. Таким образом, аппарат для электрохимической идентификации 10 по изобретению был представлен схематически на Фиг.1. Фиг.1 показывает две микрокюветы 12, 14, пригодные для помещения внутри них биологического образца, характеристики которого будут определены в дальнейшем. Эти микрокюветы 12, 14, уже известные согласно предшествующему уровню техники, имеют, соответственно, дно 16, 18, на котором находится электрод 20, противоэлектрод 22 и не представленный контрольный электрод, полученный, например, трафаретной печатью и, соответственно, связанный со стабилизатором напряжения 24, а два первых - посредством проводов 26, 28. Кроме того, они вставлены между модулем на основе эффекта Пельтье 32, который поддерживает их, и нагревающей крышкой 30, которые связаны с генератором 34. Как будет объяснено в дальнейшем, модуль на основе эффекта Пельтье 32 делает возможным давать заданное количество тепловой энергии содержимому микрокювет 12, 14. Кроме того, генератор 34 и стабилизатор напряжения 24 управляются микрокомпьютером 36, который содержит компьютерную программу и средства регистрации.
Таким образом, эти микрокюветы 12, 14 составляют средства приема, способные принимать биологический образец, причем этот биологический образец может включать последовательность нуклеиновых кислот, в частности ДНК, которая содержит заданную целевую последовательность нуклеотидов, подлежащую обнаружению. Кроме того, модуль на основе эффекта Пельтье 32 и генератор 34, способные контролироваться посредством микрокомпьютера 36, составляя первую часть активируемых средств амплификации, причем вторая часть состоит из биологического материала и химических соединений.
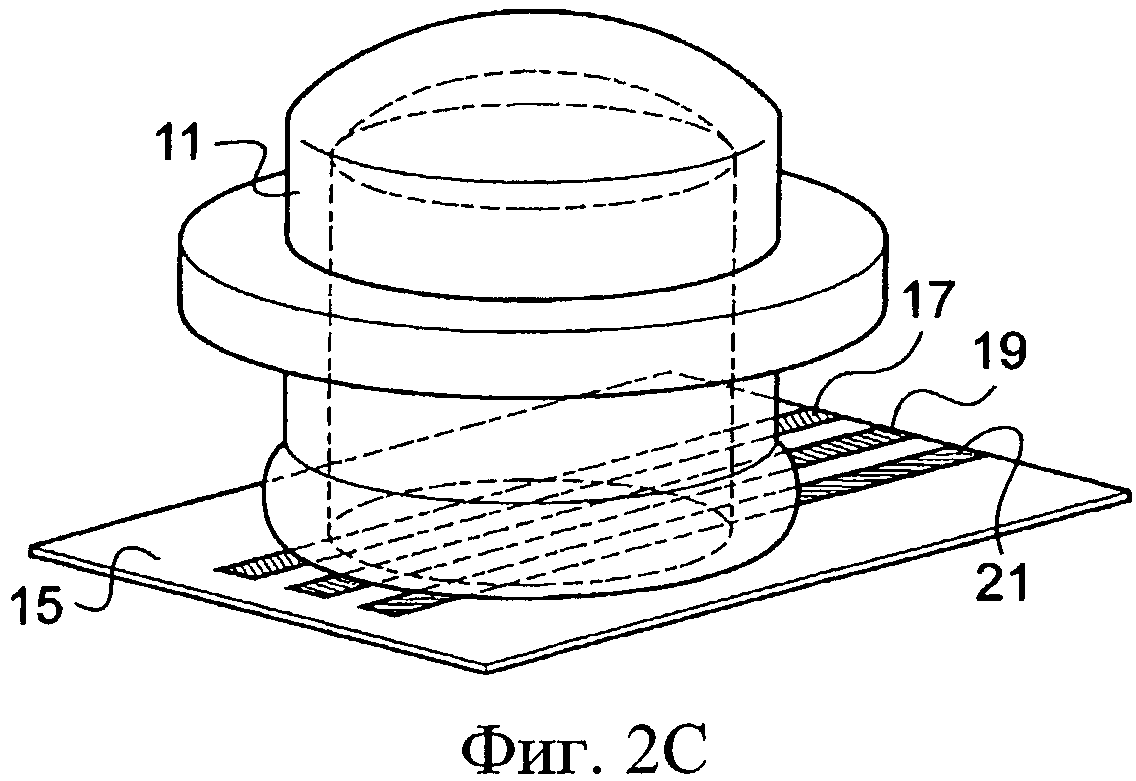
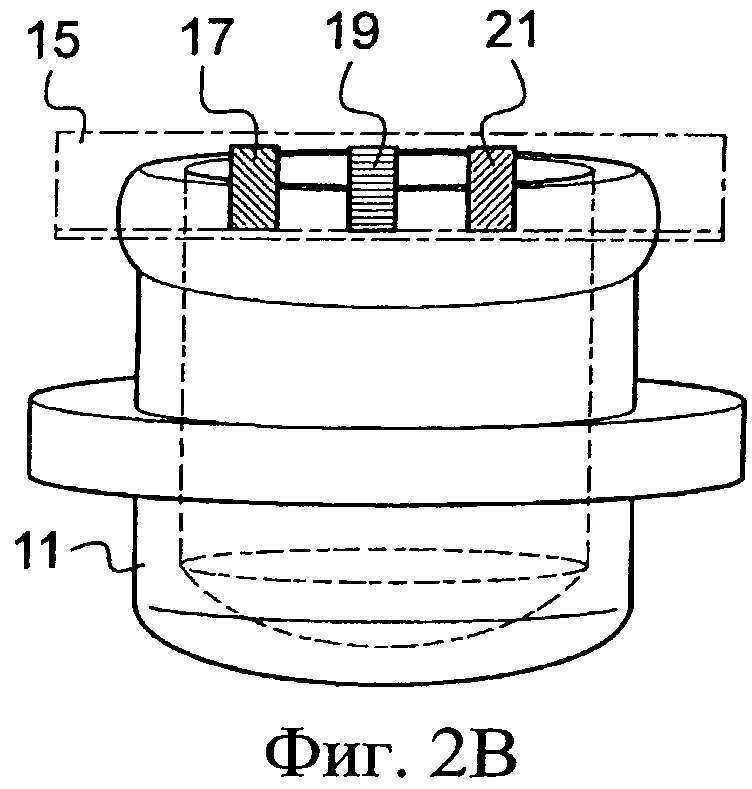
Конечно, другие известные принимающие средства, которые не представлены, содержат пробирку, в основании которой помещают биологический образец. Эту пробирку затем оборудуют электродами, способными к погружению в этот биологический образец и присоединенными к стабилизатору напряжения. Далее эта трубка предназначена, чтобы быть установленной в термоциклическое устройство, чтобы привести биологические образцы к заданным температурам и в соответствие с заранее установленными продолжительностями циклов. Еще другие принимающие средства, показанные на Фиг. 2А-2С, дают возможность помещать биологические образцы. Они содержат емкость 11 небольших размеров, например крышку пробирки, представленную на Фиг.2А, которая может содержать, например, от 1 мкл до 1 мл и верхняя часть 13 которой открыта. Она способна к приему реакционной смеси. Затем ее герметично закрывают посредством пленки 15, на которую методом трафаретной печати нанесены три несвязанных электрода 17, 19, 21. Эти электроды 17, 19, 21 ориентированы по направлению к внутренней части емкости 11, и они выходят оттуда в месте соединения между краем емкости и пленкой 15. Далее емкость 11, снабженную пленкой 15, затем переворачивают так, чтобы к ней плотно прилегал модуль на основе эффекта Пельтье и, следовательно, реакционная смесь, изначально находившаяся на дне емкости 11, входит в контакт с электродами 17, 19, 21, которые погружаются в указанную смесь.
Способ амплификации, использованный здесь, представляет собой способ "ПЦР". Таким образом, посредством модуля на основе эффекта Пельтье 32 внутренняя часть микрокювет 12, 14 может быть приведена к заданным температурам за периоды времени, которые также заданы, и по следующему протоколу: протокол начинается с первой стадии с 1 по 15 минуту согласно типу полимеразы, в котором внутреннюю часть микрокювет 12, 14 приводят к температуре 94-95°С; затем, некоторое число последовательных циклов температуры в соответствии с амплификацией, требуемой для обнаружения копируемой целевой последовательности нуклеотидов, обычно между 10 и 50 циклами, применяют к микрокюветам 12, 14, по четыре последовательные стадии на цикл, первая стадия "денатурации" обычно от 1 до 60 секунд при температуре 94-95°С; вторая стадия "отжига праймера", обычно от 1 до 60 секунд при температуре между 40°С и 72°С, характерная для праймеров, специфических для заданной целевой последовательности нуклеотидов; третья стадия "элонгации", обычно от 1 до 60 секунд при 72°С, и заключительная стадия в несколько секунд при температуре между 40°С и 95°С, определяемая временем, требуемым для электрохимического измерения. Условия для выполнения этой первой части средств амплификации будут описаны в дальнейшем, после описания второй части, содержащей, в частности, биологический материал и химические соединения.
Так как одна из задач изобретения состоит в увеличении количества последовательности нуклеиновых кислот путем репликации и в том, чтобы электрохимически измерять ее присутствие в среде в ходе процесса амплификации, желательно, прежде всего, иметь биологический материал, позволяющий эту амплификацию. Чтобы проводить методику ПЦР, желательно приводить в контакт с нуклеиновой кислотой, подлежащей амплификации, фермент полимеразу, пару праймеров и четырех свободных нуклеотида: дГТФ, дАТФ, дТТФ и дЦТФ, которые составляют ДНК, соответственно, дезоксигуанозинтрифосфат, дезоксиаденозинтрифосфат, дезокситимидинтрифосфат и дезоксицитозинтрифосфат. Аналоги оснований дезоксирибонуклеотидтрифосфатного типа, такие как дезоксидеазагуанозинтрифосфат, также могут быть использованы.
Таким образом, по первому примеру применения, в добавление к биологическому образцу, подвергаемому испытанию, и фактически, экстракту ДНК цитомегаловируса, содержащего целевую последовательность нуклеиновых кислот из 283 пар оснований, полимеразу ДНК, то есть фермент, праймеры и четыре типа нуклеотидов вводят в одну из микрокювет 12, полностью формируя реакционную смесь, которая является, конечно, жидкой и буферизированной. Кроме того, чтобы дать возможность измерять интенсивность электрического сигнала, добавляют к реакционной смеси соединение, способное к окислению-восстановлению, причем указанное соединение, способное к окислению-восстановлению, является, в данном случае, комплексом осмия: бис(2,2'-бипиридин)дипиридо[3,2-а:2',3'-с]феназин осмия (II), номер CAS которого может быть 3555395-37-8, которое в нашем случае обозначается [OsII(bpy)2DPPZ]2+и имеет формулу I:
Могут быть предложены другие соединения, способные к окислению-восстановлению, и, в частности, с рутением вместо осмия. Также могут быть использованы другие лиганды. Преимущество дипиридофеназинового лиганда заключается в его способности интеркалироваться между нуклеотидами, формирующими целевые последовательности нуклеиновой кислоты. В качестве других лигандов, которые могут быть предложены, можно упомянуть, например, полученные из ДПФ: 7,8-(диметил)дипиридо[3,2-а:2,3-с]феназин; PTDB: 3-(пиридин-2-ил)-5,6-дифенил-аз-триазин; или DPT: 3-(пиразин-2-ил)-аз-триазино[5,6-f]фенантрен; или еще лиганды, которые имеют хиноновую функцию, такие как ФХИ; фенантренхинондиимин.
ДНК-интеркалирующие и органические соединения, способные к окислению-восстановлению, также могут быть использованы в способе, который является предметом изобретения. Упоминание будет сделано, например, на бромид этидия, акридин и их производные, производные акридона или другие производные феназина.
Для целей эксперимента и контроля идентичные элементы, указанные выше, за исключением биологического образца, подлежащего проверке, вводят в другую микрокювету 14. По одному типичному варианту выполнения изобретения концентрации различных элементов, вводимых в микрокюветы 12, 14, перечислены в таблице 1 ниже.
|
Таким образом, реакционную смесь, содержащуюся в этих двух микрокюветах 12, 14, посредством модуля на основе эффекта Пельтье 32, управляемого микрокомпьютером 36, доводят до различных температур в течение заданных периодов времени. После предварительной стадии, в которой реакционную смесь доводят один раз до температуры 95°С в течение 15 минут, реакционную смесь доводят на первой стадии до температуры 94°С в течение 30 секунд так, чтобы дегибридизовать целевые последовательности нуклеиновой кислоты, то есть диссоциировать две комплементарные цепи целевых последовательностей нуклеиновой кислоты; затем ее доводят на второй стадии до 53°С в течение 60 секунд для того, чтобы гибридизовать соответствующие праймеры к диссоциированным цепям ДНК; затем ее доводят на третьей стадии до 72°С в течение 60 секунд, чтобы позволить полимеразам синтезировать комплементарную цепь и таким образом сформировать ампликон и копируемую целевую последовательность, которую он включает. Наконец, на четвертой стадии реакционную смесь доводят до температуры 85°С в течение 10 секунд, в ходе которой применение стабилизатора напряжения 24 управляется посредством микрокомпьютера 36.
По первому примеру применения, определенного выше, на заданной четвертой стадии и в течение периода 10 секунд регистрируют методом квадратно-волновой вольтамперометрии кривую интенсивность/потенциал в области потенциала, ограниченного стандартным потенциалом соединения, способного к окислению-восстановлению, посредством стабилизатора напряжения 24. Разность потенциалов, таким образом, прикладывают между электродом 20 и противоэлектродом 22, и эту разность потенциалов изменяют по профилю прямоугольного импульса. Параллельно измеряют электрический ток, который проходит через эти электроды, и получают кривую интенсивность/потенциал в форме пика, в котором максимальная величина тока, после вычитания базовой линии, представляет собой концентрацию неинтеркалированного соединения, способного к окислению-восстановлению, присутствующего в растворе.
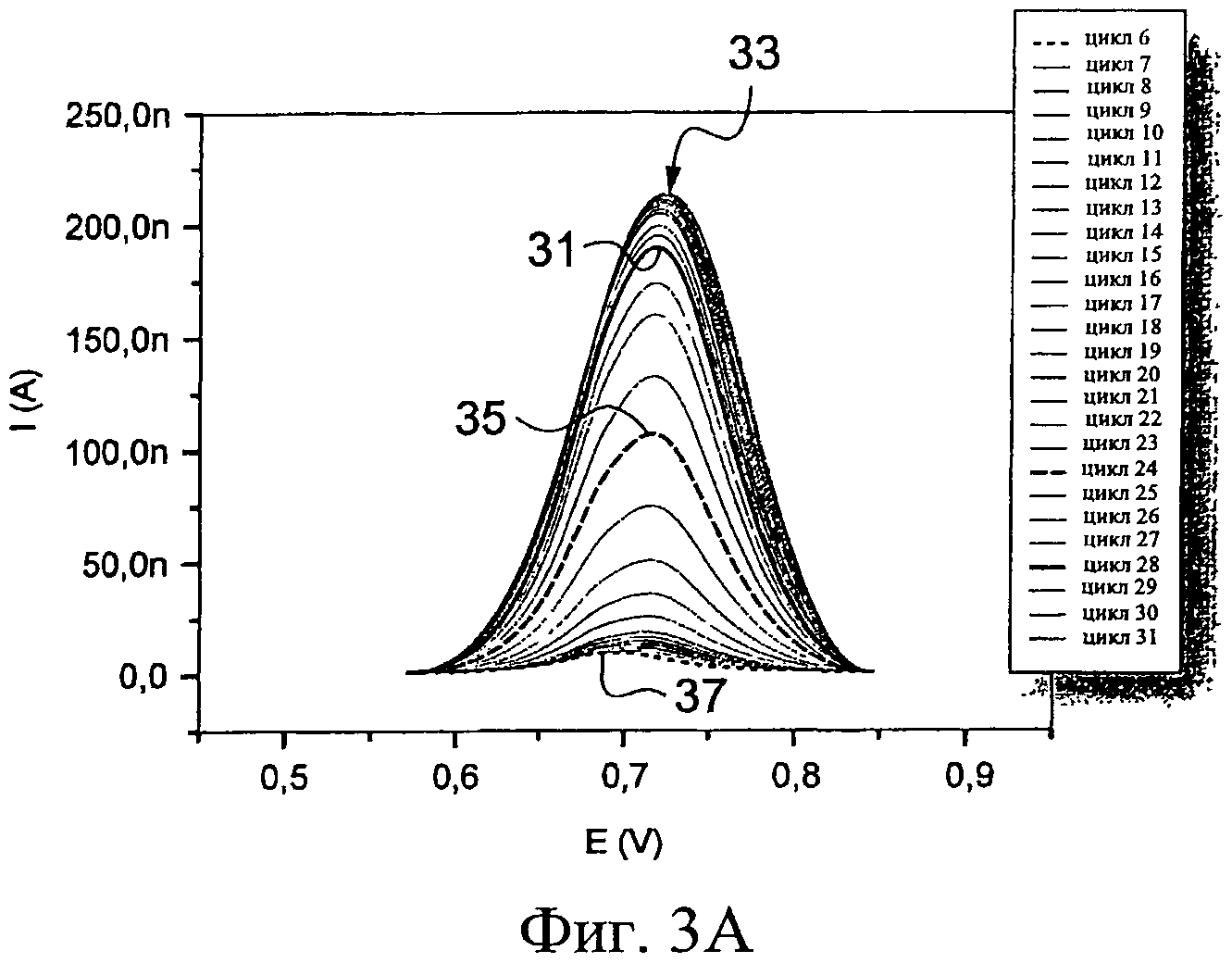
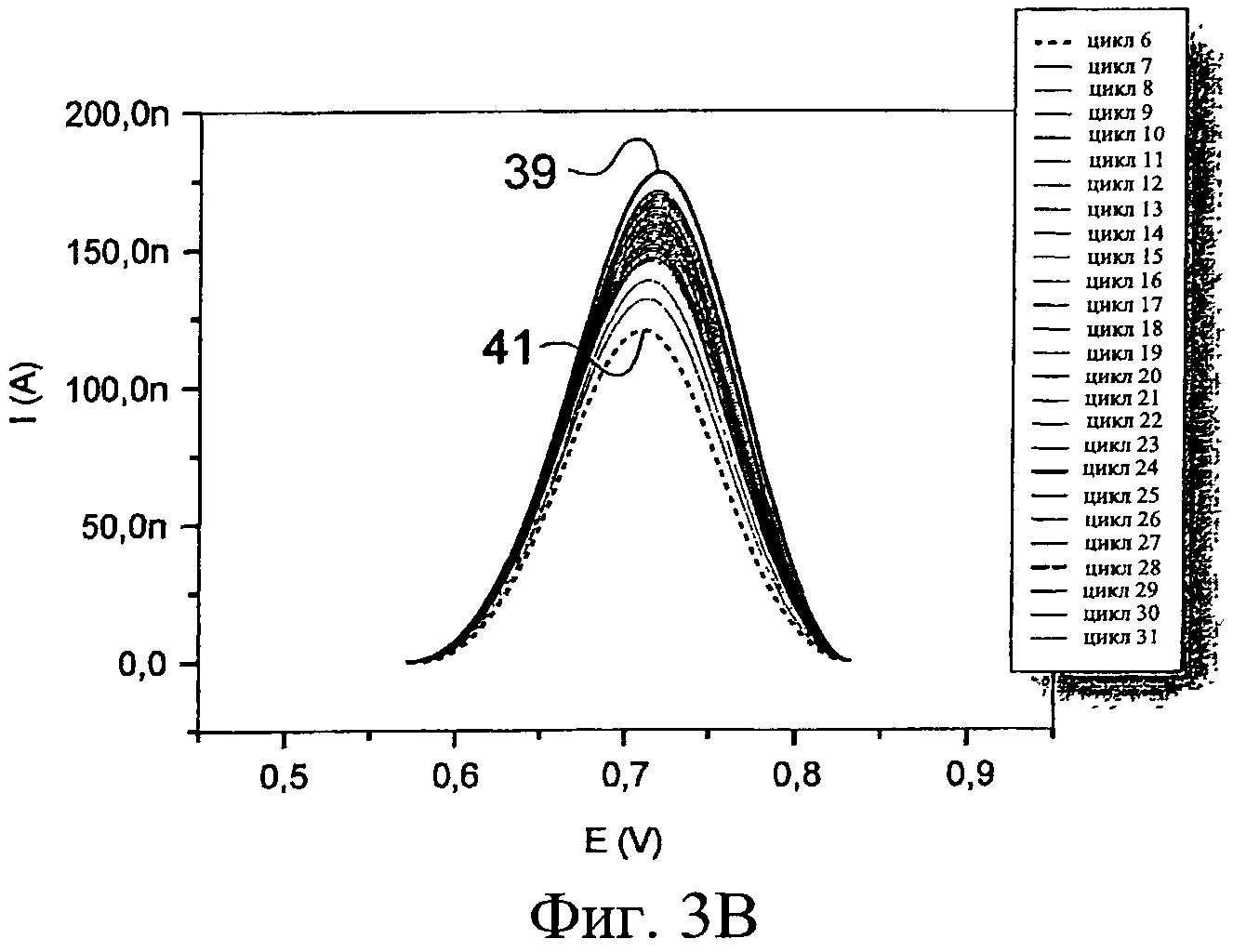
Теперь будет сделана ссылка, прежде всего, на Фиг.3А-3В и затем на фигуру 3С. В частности, 31 циклов репликации применяли к биологическим образцам, содержащимся в микрокюветах 12, 14. Фиг.3А иллюстрирует изменение в кривых интенсивность/потенциал как функцию циклов для биологических образцов, включающих целевую искомую последовательность нуклеотидов, в то время как Фиг.3В представляет изменение в кривых интенсивность/потенциал как функцию циклов для реакционной смеси, не имеющей целевой последовательности. На Фиг.3А вершина 33 кривой значительно уменьшается, то есть потребление соединения, способного к окислению-восстановлению, заметен, начиная с 18-го цикла 31, и достигает средней высоты 35 в 22-м цикле. В 31-м цикле кривая 37 становится фактически плоской, и ее вершина достигает величины интенсивности, которая на 5% меньше, чем таковая первых циклов. Таким образом, соединение, способное к окислению-восстановлению, было встроено в сформированные двухцепочечные молекулы ДНК. Это подразумевает, что искомая целевая последовательность нуклеотидов действительно присутствовала в биологических образцах.
Наоборот, на Фиг.3В экстремум 39 кривой остается при, по существу, постоянном значении до 31-го цикла по сравнению с предыдущей кривой, так как в этих образцах искомая целевая последовательность нуклеотидов не присутствует. Тем не менее, он слегка уменьшается, в частности, вследствие формирования димеров праймеров в реакционной смеси.
Таким образом, присутствие искомой целевой последовательности нуклеотидов быстро обнаруживается в любом биологическом образце посредством способа, описанного выше.
Может наблюдаться, что значение максимального тока стандартизировано делением его на среднюю величину, корректирующую дрейф максимальных токов, полученных в ходе первых циклов амплификации, то есть когда количество копируемой целевой последовательности нуклеотидов еще не достаточно, чтобы вызывать значительное падение измеренного максимального тока, например в 5-м цикле.
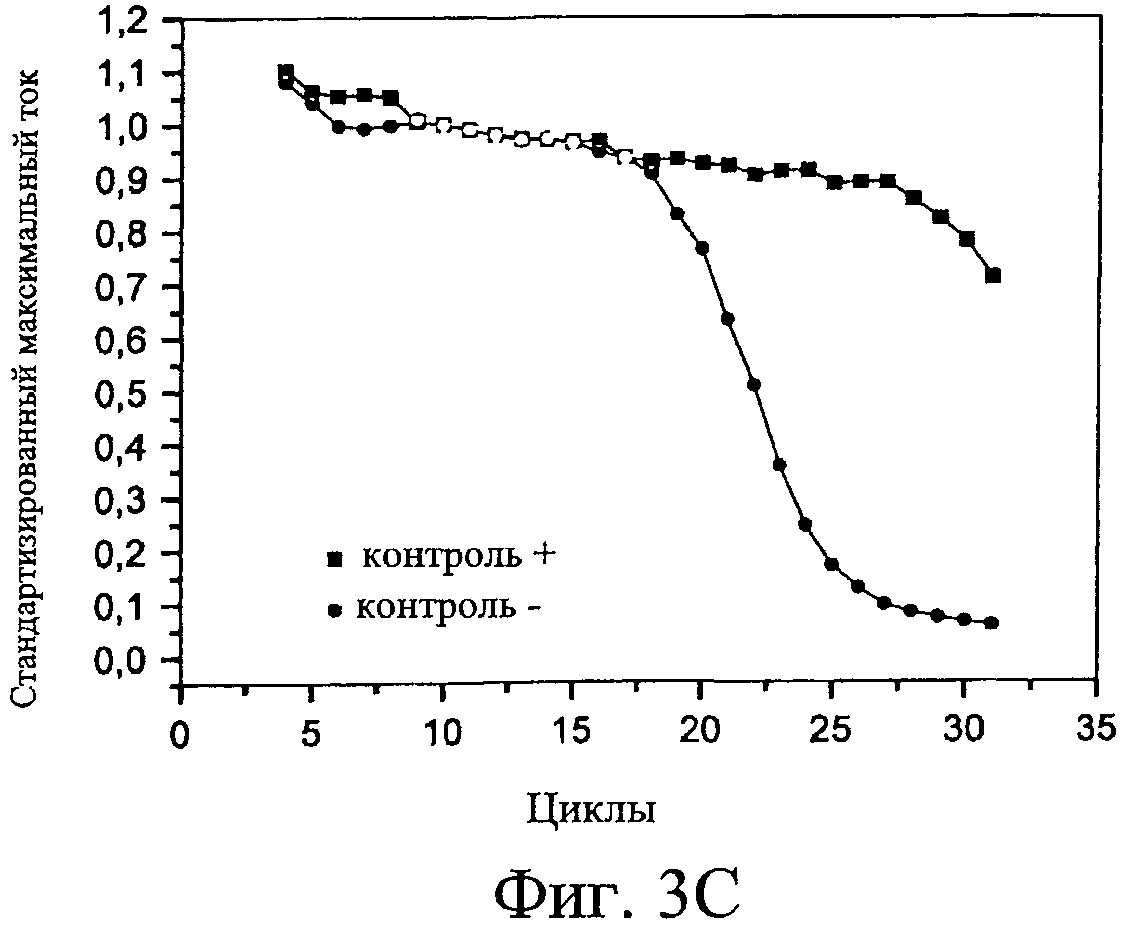
Будет сделана ссылка на фигуру 3С, иллюстрирующую кривые, взятые из двух серий кривых, указанных выше, и показывающую величину максимального тока, стандартизированного как функция числа проведенных циклов для этих двух микрокювет 12, 14, содержащих, соответственно, испытуемый биологический образец и биологический материал, предназначенный для репликации, а также соединение, способное к окислению-восстановлению, и, в другом случае, только биологический материал с соединением, способным к окислению-восстановлению.
Таким образом, обнаружено, что до 25-го цикла величина тока, который проходит через реакционные смеси этих двух микрокювет 12, 14, приблизительно параллельна и относительно постоянна. С другой стороны, между 25-м циклом и до 30-го цикла наблюдается, что величина электрического тока, который проходит через микрокювету 12, которая включает испытуемый биологический образец, резко падает по сравнению с электрическим током, который проходит через другую микрокювету 14, которая не содержит заданной целевой последовательности нуклеиновой кислоты. Это резкое и экспоненциальное падение электрического тока согласно функции εc, причем с представляет собой число циклов, а ε - интенсивность амплификации, близкая к 2, подтверждает амплификацию заданной целевой последовательности нуклеотидов, для которой праймеры были специфическими, и конечное получение копируемых целевых последовательностей. В частности, получение молекул копируемых целевых последовательностей нуклеиновой кислоты затем вызывает инактивацию указанного выше соединения, способного к окислению-востановлению, через интеркаляцию указанного соединения в образованную двойную цепь копируемой последовательности нуклеиновой кислоты. Соединение, способное к окислению-восстановлению, которое таким образом инактивируется, больше не может изменять заряды поверхности электродов 20, 22 и, следовательно, больше не может быть обнаружено электрохимически. Это приводит к падению электрического сигнала, что затем показывает образование заданной целевой последовательности нуклеотидов посредством специфических праймеров в исследуемом биологическом образце.
Ток регистрируют при температуре выше температуры "диссоциации" димеров затравок и/или других последовательностей ДНК, в данном случае не амплифицируемых. Выбор температуры, при которой проводят измерение, представляет собой существенный параметр для различия между фальшиво-положительным и истинно-положительным образцами.
Кроме того, ссылка будет теперь сделана на график, показанный на Фиг.4, чтобы описать, в соответствии со вторым примером применения, принцип количественного анализа заданной целевой последовательности нуклеотидов в данном образце.
По оси x 51 графика указано число циклов репликации средств амплификации, а по оси y 53 указаны стандартизированные величины максимального тока, регистрируемого при каждом цикле по варианту выполнения изобретения, показанному на Фиг.3А.
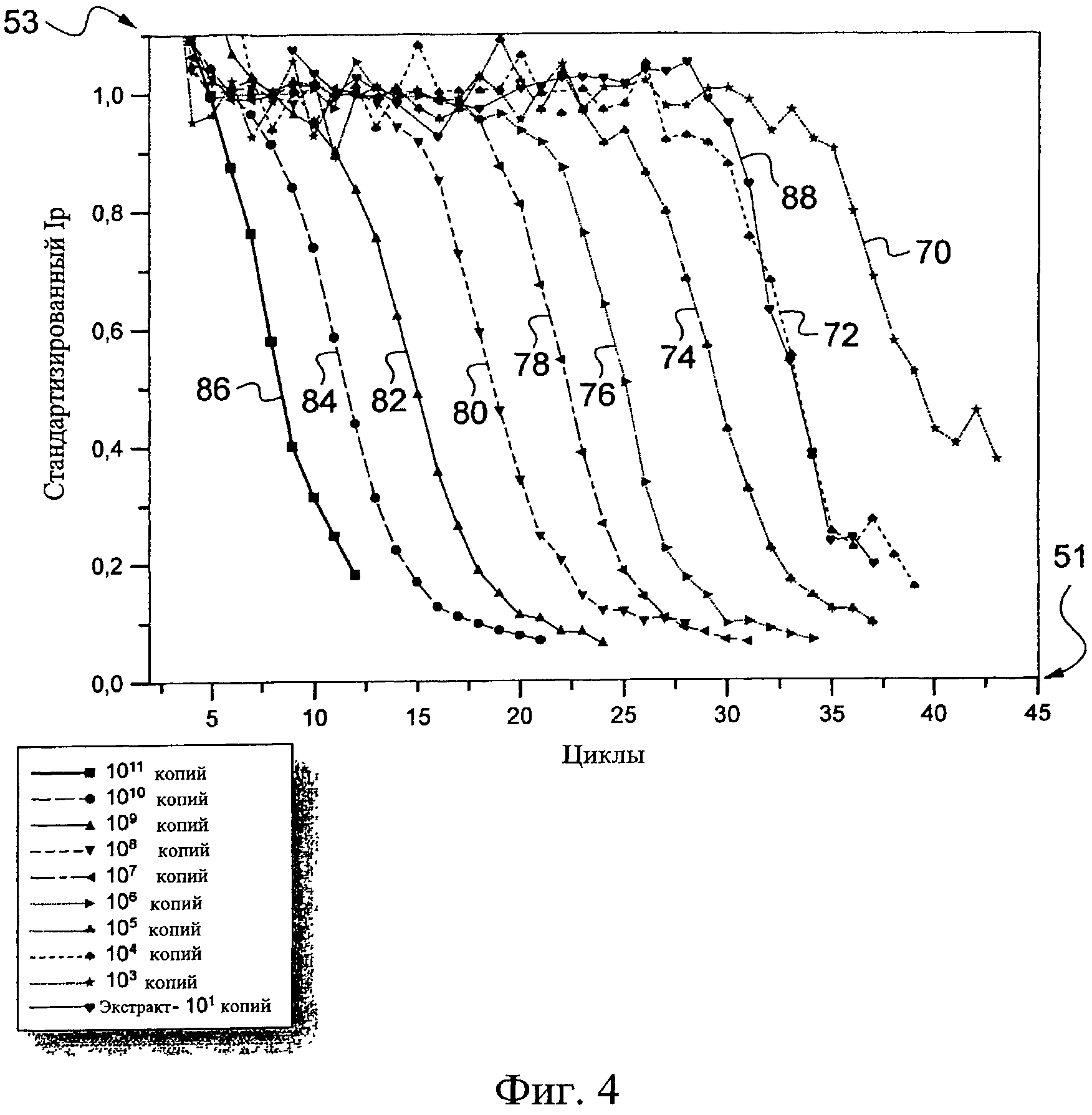
На этом графике Фиг.4 девять калибровочных кривых представлены справа налево, 70, 72, 74,76, 78, 80, 82, 84 и 86, и они показывают промежуточные части, которые, приблизительно, параллельны друг другу в направлении, близком к вертикали. Эти кривые соответствуют, соответственно, различным графикам, полученным, начиная с биологического образца, содержащего 103 копий целевой последовательности, содержащейся в геноме цитомегаловируса, для первой из девяти кривых, которая представляет собой кривую 70, и 1011 для девятой кривой, которая представляет собой кривую 86. С первой кривой 70 до последней кривой 86 число копий для каждой последующей кривой умножается на десять.
Таким образом отмечают, что, чем больше количество заданной целевой последовательности нуклеотидов, содержащейся в биологическом образце, тем раньше электрический ток, который проходит через электроды, уменьшается, как функция числа циклов. Это происходит потому, что, чем больше нуклеиновых кислот, включающих заданную целевую последовательность, содержит образец на старте, тем меньше число циклов, необходимых для получения путем репликации того же количества заданных целевых последовательностей нуклеотидов, и, следовательно, тем более раннее снижение тока из-за интеркаляции соединения, способного к окислению-восстановлению, в двойные цепи копируемых целевых последовательностей нуклеотидов. Таким образом понятно, что возможно измерять количество нуклеиновых кислот, включающих целевую последовательность, определением числа циклов, начиная с которых ток, который проходит через образец, падает. Кроме того, первая кривая 70 на Фиг.4 показывает, что присутствие целевой последовательности все еще обнаруживаемо, когда только 1000 копий указанной целевой последовательности первоначально присутствует в образце.
Таким образом, первоначально был испытан экстракт с концентрацией заданной целевой последовательности нуклеиновой кислоты, и его кривая 88 показана как пунктирная линия вдоль второй калибровочной кривой 72, соответствующей 104 копий целевой последовательности.
Таким образом, способ, согласно изобретению применимый к биологическому образцу, который может содержать заданную целевую последовательность нуклеотидов, делает возможным не только посредством осуществления метода амплификации и электрохимического измерения агента, способного к окислению-восстановлению, интеркалирующего в двухцепочечную ДНК, обнаружение присутствия или отсутствия заданной целевой последовательности нуклеотидов, но также и определение ее количество по амплитуде сигнала, воспроизводимость и чувствительность которого улучшены по сравнению с другими электрохимическими методами по предшествующим технологиям. Этот способ имеет преимущество свойств окисления-восстановления агента, который интеркалируется в последовательности нуклеиновой кислоты, образующие двойную цепь, что никоим образом не используют в обычных методах амплификации для обнаружения присутствия целевой последовательности нуклеиновой кислоты.
С целью усовершенствования этого способа обнаружения, в особенности, в отношении специфичности идентификации амплифицированной целевой последовательности, проводят постепенную дегибридизацию всех копируемых целевых последовательностей в конце амплификации посредством постепенного повышения температуры образца, чтобы высвободить интеркалированное соединение, способное к окислению-восстановлению. Так как это соединение, способное к окислению-восстановлению, затем снова становится электрохимически обнаруживаемым, оно вновь способно подавать электрический сигнал электродам, представляющий количество высвобожденного соединения, способного к окислению-восстановлению и, следовательно, природу и таким образом длину заданной целевой последовательности нуклеотидов.
Эту дегибридизацию проводят, постепенно приводя, согласно подходящему наклону температуры, молекулы ДНК от температуры, где все двойные цепи спарены, то есть около 40°С, к температуре, где все двойные цепи диссоциированы, то есть около 98°С, и указанный выше модуль на основе эффекта Пельтье 32 является предпочтительным средством для этого. Последний фактически делает возможным обеспечение реакционной смеси, содержащейся в этих двух микрокюветах 12, 14, представленных на Фиг.1, с такой тепловой энергией, чтобы вызывать дегибридизацию копируемых целевых последовательностей нуклеотидов и, следовательно, высвобождение указанного интеркалируемого соединения, способного к окислению-восстановлению. Кроме того, благодаря стабилизатору напряжения 24 и посредством микрокомпьютера 36 разность потенциалов затем прикладывают между электродом 20 и противоэлектродом 22, и эту разность потенциалов изменяют по указанному выше профилю прямоугольного импульса. Измеряют электрический ток, который проходит через эти электроды, и этим способом определяют максимальный ток.
Таким образом, благодаря модулю на основе эффекта Пельтье 32 температуру реакционных смесей увеличивают, например, по одному градусу от 70°С до 95°С. Параллельно, как только температура реакционных смесей увеличивается на 1°С, прикладывают разность потенциалов между электродами 20, 22 и измеряют ток, который проходит через них, в соответствии с указанным выше методом вольтамперометрии.
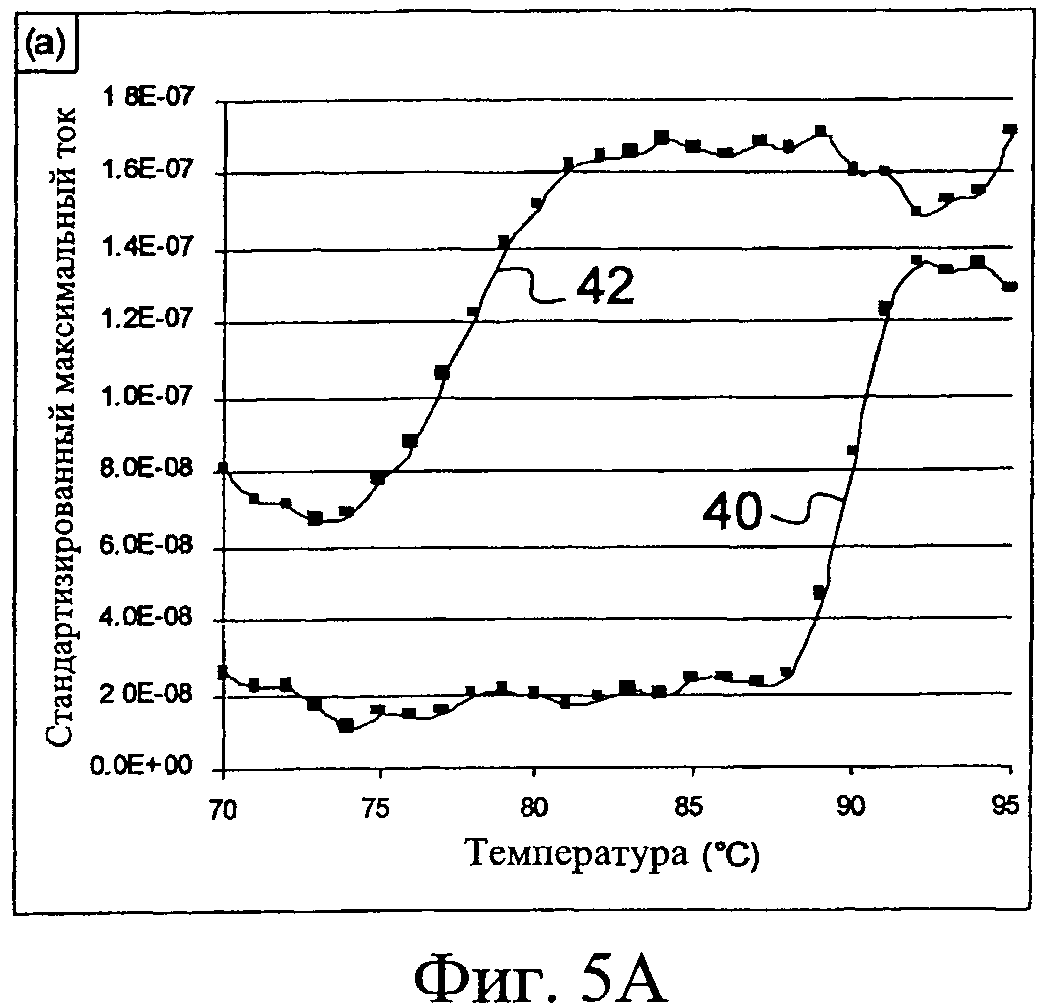
Ссылка будет теперь сделана на Фиг.5А, демонстрирующую согласно третьему примеру применения, диаграмму максимального тока, полученную в таком случае как функцию температуры, для этих двух микрокювет 12, 14, причем одна включает реакционную смесь с искомой целевой последовательностью нуклеотидов, а другая - реакционную смесь без этой целевой последовательности.
Полученная таким образом нижняя кривая 40 соответствует реакционной смеси, включающей целевую последовательность нуклеотидов, и, следовательно, множество копируемых целевых последовательностей нуклеотидов. Таким образом, наблюдают, что увеличение температуры реакционной смеси между 70°С и 88°С не производит никакого эффекта на молекулы ДНК, которые включают целевые последовательности нуклеотидов. С другой стороны, между 88°С и 92°С максимальный ток увеличивается в семь раз. Этот максимальный ток тогда прямо пропорционален количеству высвобожденного соединения, способного к окислению-восстановлению, и, следовательно, природе и таким образом длине заданной целевой последовательности нуклеиновой кислоты, которая в этом случае составляет 283 пар оснований.
Как может быть обнаружено в соответствии с верхней кривой 42, соответствующей реакционной смеси, не содержащей заданной целевой последовательности нуклеиновой кислоты, измеренный электрический сигнал удваивается между 70°С и 85°С. Это представляет собой результат интеркаляции в димеры праймеров и другие двойные цепи, синтезированные неспецифически и которые меньше, чем заданная целевая последовательность нуклеиновой кислоты.
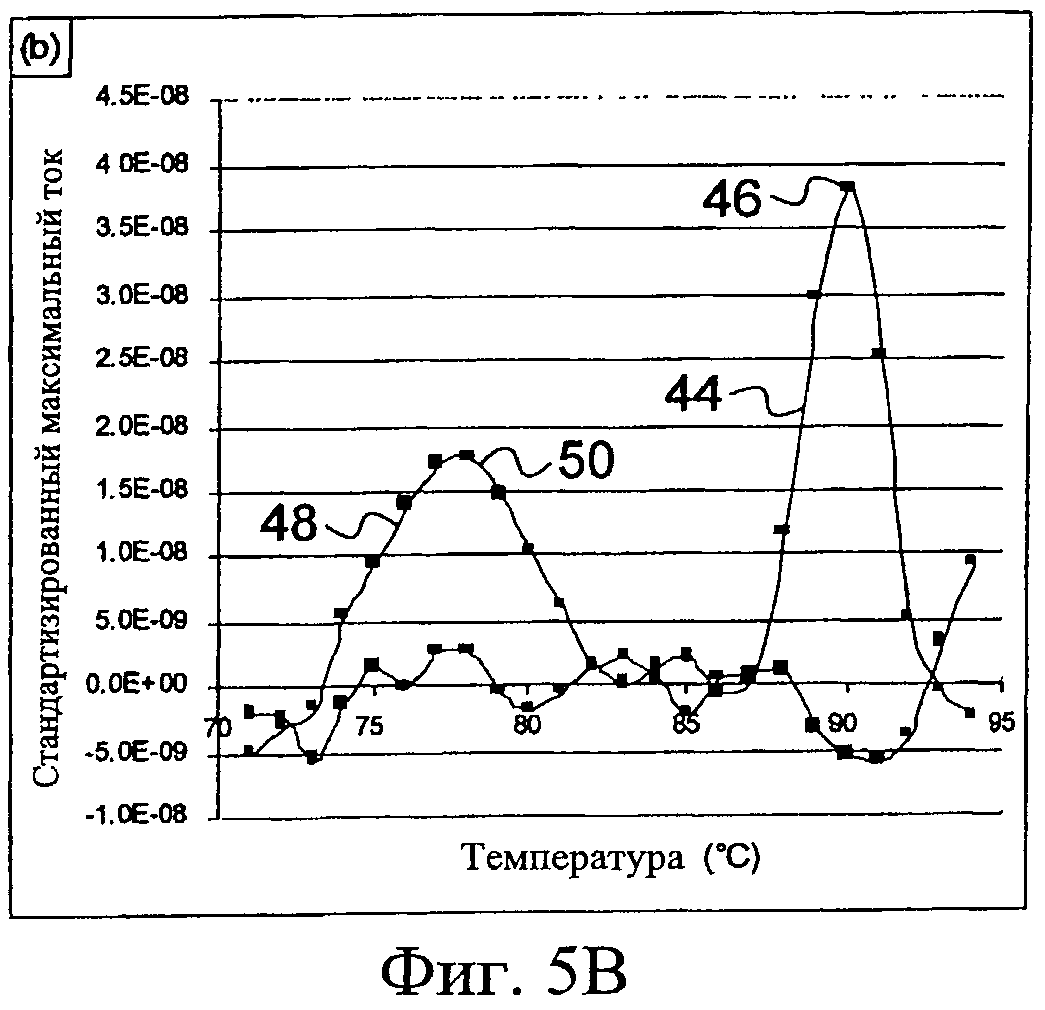
Выявление искомой целевой последовательности нуклеотидов является в таком случае более доказательным, если каждую точку кривых, представленных на Фиг.5А, транспонируют в значение производной в этой точке. Таким образом получают кривые плавления, представленные на Фиг.5В.
Таким образом, нижнюю кривую 40, соответствующую реакционной смеси, включающей целевую последовательность, преобразуют в типичную кривую 44, имеющую значительный пик 46 при температуре 90°С. Конечно, этот значительный пик 46 соответствует резкому изменению максимального тока, наблюдаемому на Фиг.5А для нижней кривой 40. Этот значительный пик 46 характерен для природы и, следовательно, длины заданной целевой последовательности на протяжении температуры, при которой он появляется. В частности, чем искомая целевая последовательность является главным образом более длинной, тем больше количество соединения, способного к окислению-восстановлению, включенного в ампликоны, что вполне очевидно для эквивалентного количества ампликонов. Таким образом, чтобы высвобождать молекулы соединения, способного к окислению-восстановлению, необходимо будет обеспечивать большее количество тепловой энергии, чтобы дегибридизовать двойную цепь, образуемую заданной целевой последовательностью. Следовательно, температура, при которой будет происходить эта дегибридизация, будет все выше. Кроме того, так как количество молекул соединения, способного к окислению-восстановлению, включенного в ампликоны, больше, как только оно высвобождается, регистрируемый электрический сигнал также будет, соответственно, больше.
Следовательно, чем главным образом более длинной является искомая целевая последовательность нуклеотидов в природе, тем выше значительный пик 46 и тем больше он сдвигается в область высоких температур.
С другой стороны, что касается верхней кривой 42, представленной на Фиг.5А, ее трансформация в производную кривую 48, представленную на Фиг.5В, выявляет широкий пик 50 при температуре между 75°С и 80°С. Этот широкий пик 50 соответствует в действительности просто дегибридизации димеров праймеров и других двойных цепей, синтезированных неспецифически и меньших, чем заданная целевая последовательность нуклеиновой кислоты, которая затем вызывает высвобождение соединения, способного к окислению-восстановлению. Будет наблюдаться, что этот широкий пик 50 появляется в диапазоне температур ниже, чем значительный пик 46, и что он является более размытым.
В соответствии с четвертым примером применения показано, что можно обнаружить присутствие, по меньшей мере, двух различных целевых последовательности нуклеотидов в одном и том же биологическом образце посредством метода идентификации по этому изобретению.
Чтобы это делать, комплект для идентификации, представленный на Фиг.1, применяется вполне очевидным образом, и проводят три серии измерений в соответствии с примерами применения, описанными выше. В данном случае это всего лишь вопрос демонстрации, возможно ли идентифицировать в одном и том же биологическом образце присутствие бактерии, Achromobacter xylosoxidans, размер целевой последовательности нуклеотидов которой составляет 100 пар оснований, и человеческий цитомегаловирус, использованный ранее, размер целевой последовательности нуклеотидов которого составляет 283 пары оснований. Первая серия измерений отвечает человеческому цитомегаловирусу и ее проводят при тех же условиях, которые описаны выше. Вторая серия измерений точно соответствует бактерии Achromobacter xylosoxidans, и, следовательно, материал амплификации включает праймеры, специфические для соответствующей целевой последовательности. Кроме того, третья серия измерений соответствует смеси человеческого цитомегаловируса и бактерии Achromobacter xylosoxidans, и, следовательно, материал амплификации в этом случае включает два соответствующих специфических праймера в смеси.
Кривые плавления для трех серий измерений затем получали в соответствии с третьим примером применения.
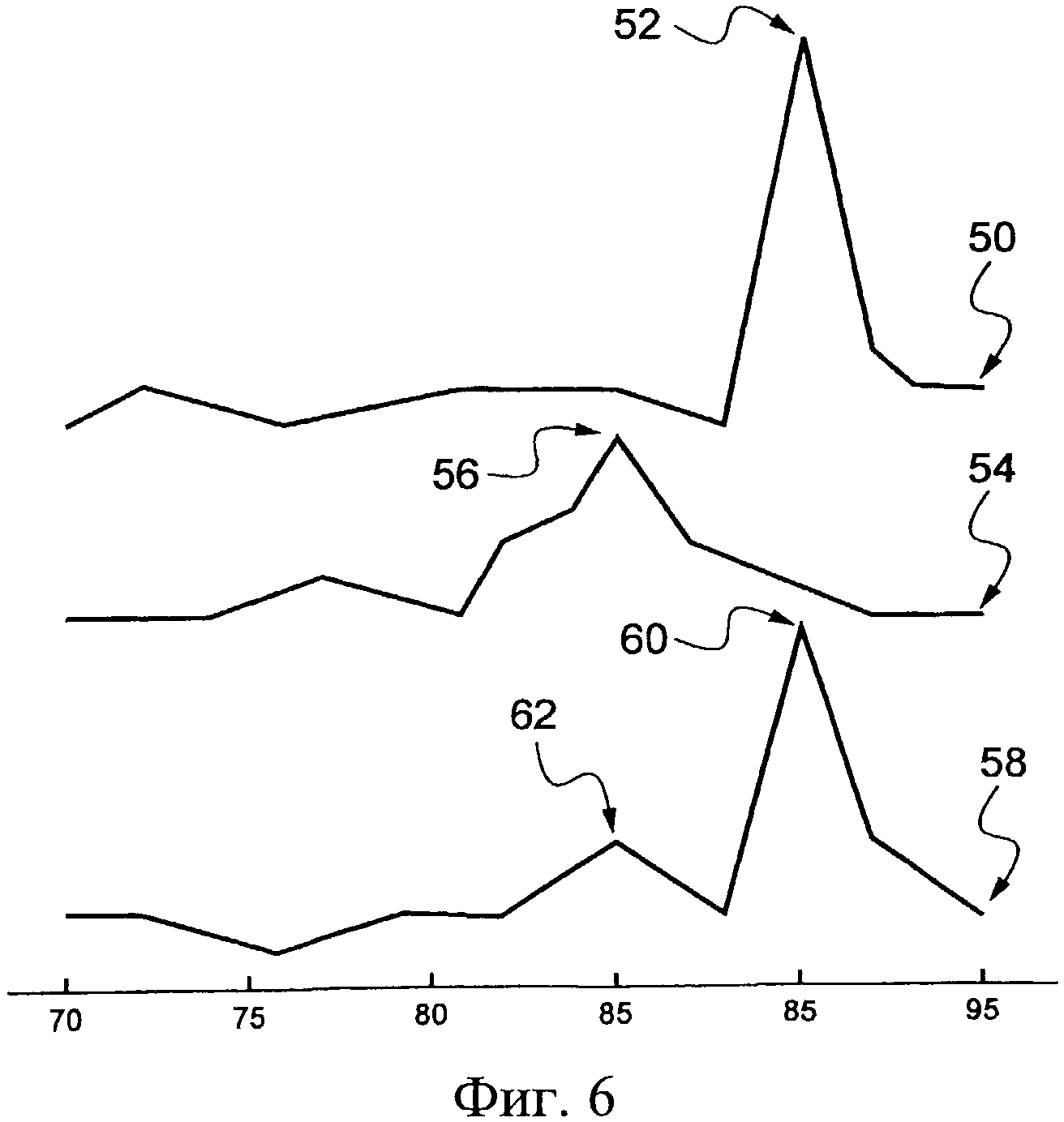
Полученные таким образом три кривые представлены на Фиг.6 и, для большей ясности, они были сдвинуты относительно друг друга по оси у. Таким образом, первая кривая 50, относящаяся к человеческому цитомегаловирусу и которая соответствует типичной кривой 44, показанной на Фиг.5В, находится на этой Фиг.6. Значительный первый пик 52 таким образом обнаруживается для значения температуры, эквивалентного 90°С. Кроме того, что касается бактерии Achromobacter xylosoxidans, кривая плавления 54, соответствующая второй серии измерений, характеризуется вторым значительным пиком 56 для значения температуры около 85°С.
Кроме того, наконец, третья серия измерений приводит к третьей кривой 58, демонстрирующей третий значительный пик 60 и четвертый значительный пик 62 для значений температуры, эквивалентных 90°С и 85°С, соответственно. Эти значения точно соответствуют только бактерии и только человеческому цитомегаловирусу.
Возможность обнаружения множества целевых последовательностей нуклеотидов в одном и том биологическом образце посредством способа идентификации по изобретению, таким образом, показана посредством этого четвертого примера применения.
По одному варианту выполнения изобретения, который является особенно предпочтительным и не представлен здесь, но находится в соответствии с изобретением, предусматривается, что можно амплифицировать целевую последовательность, возможно, имеющую некоторые отличия в своей последовательности, и идентифицировать присутствие или отсутствие этих отличий посредством кривой плавления, как определено выше.