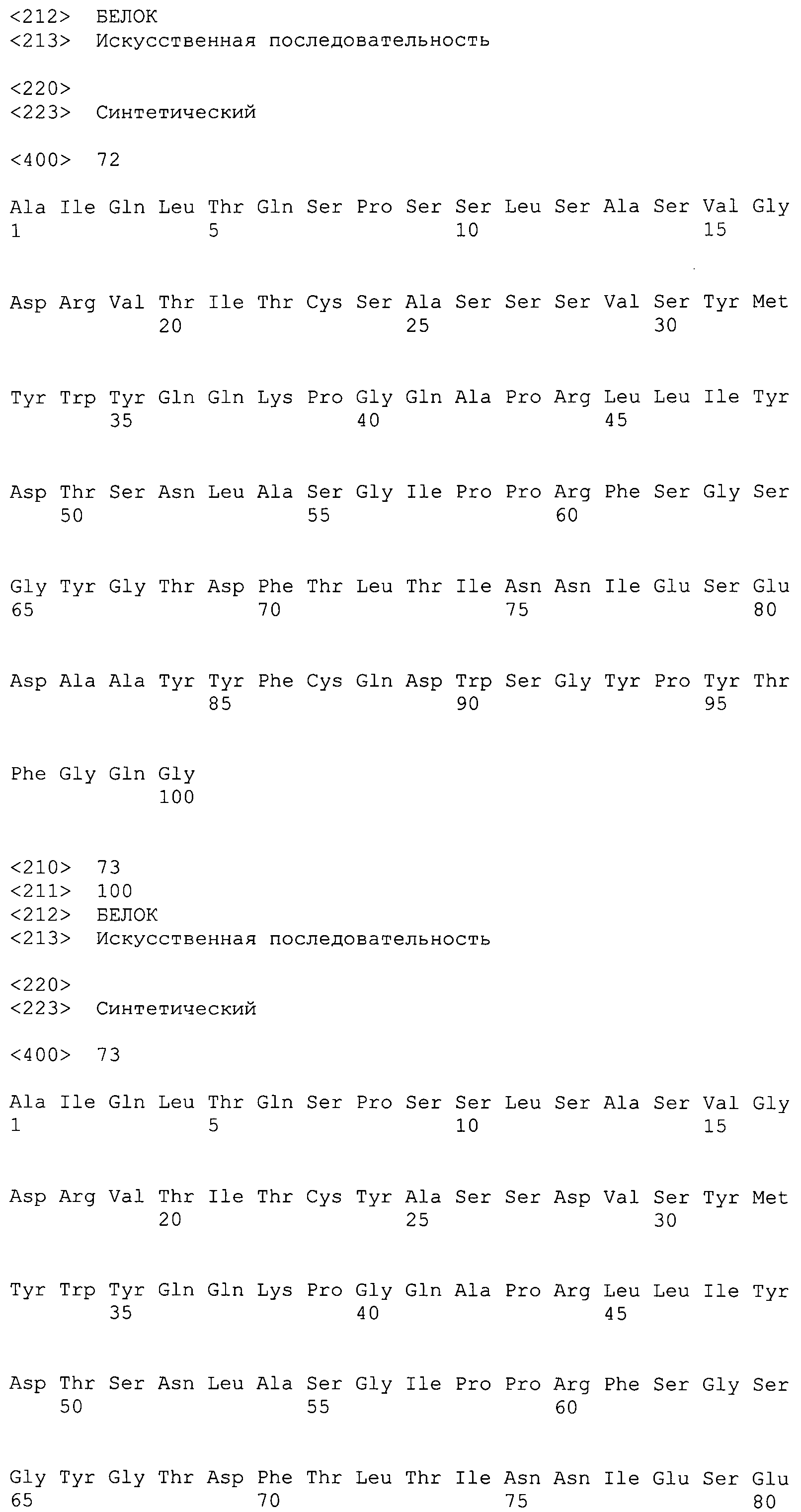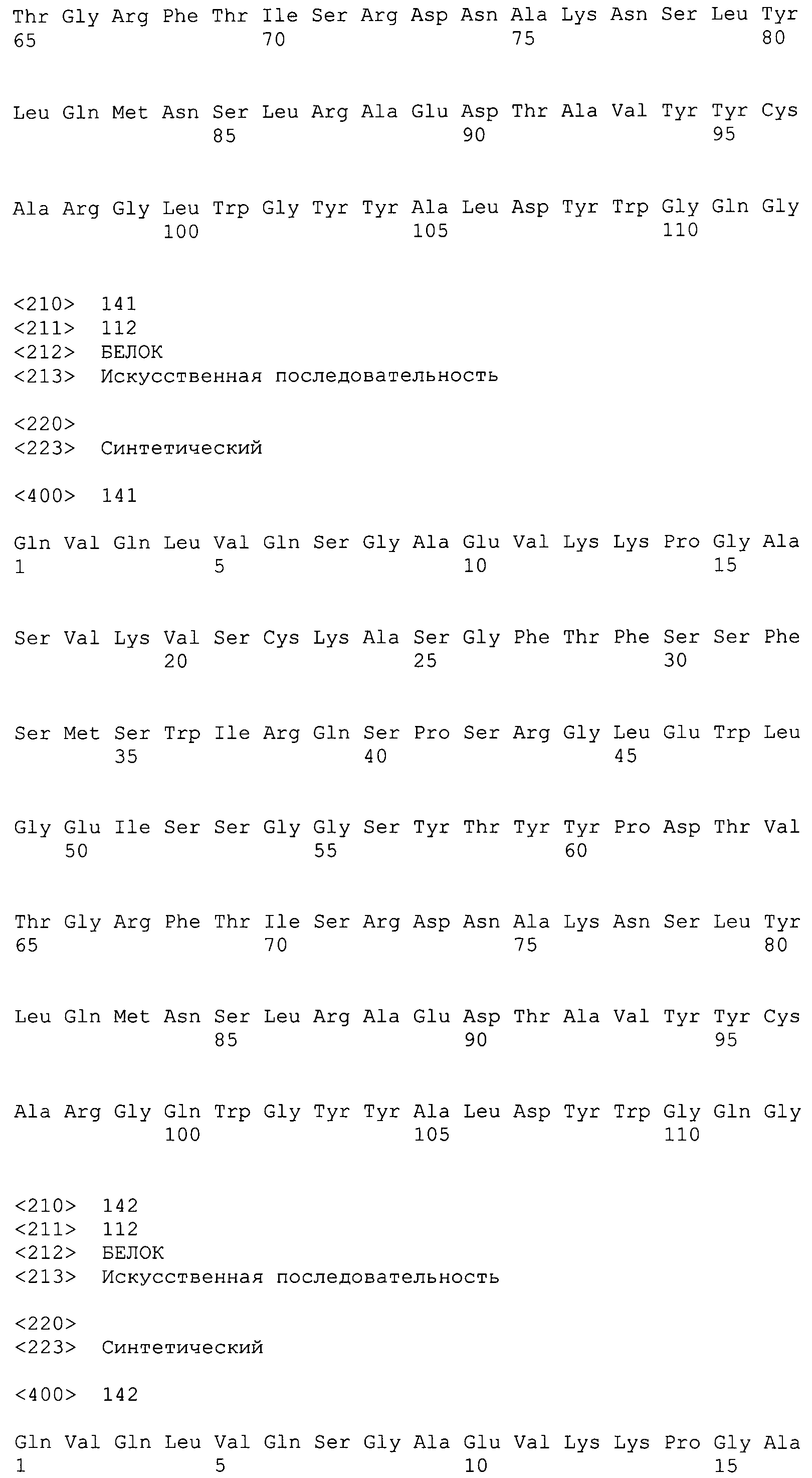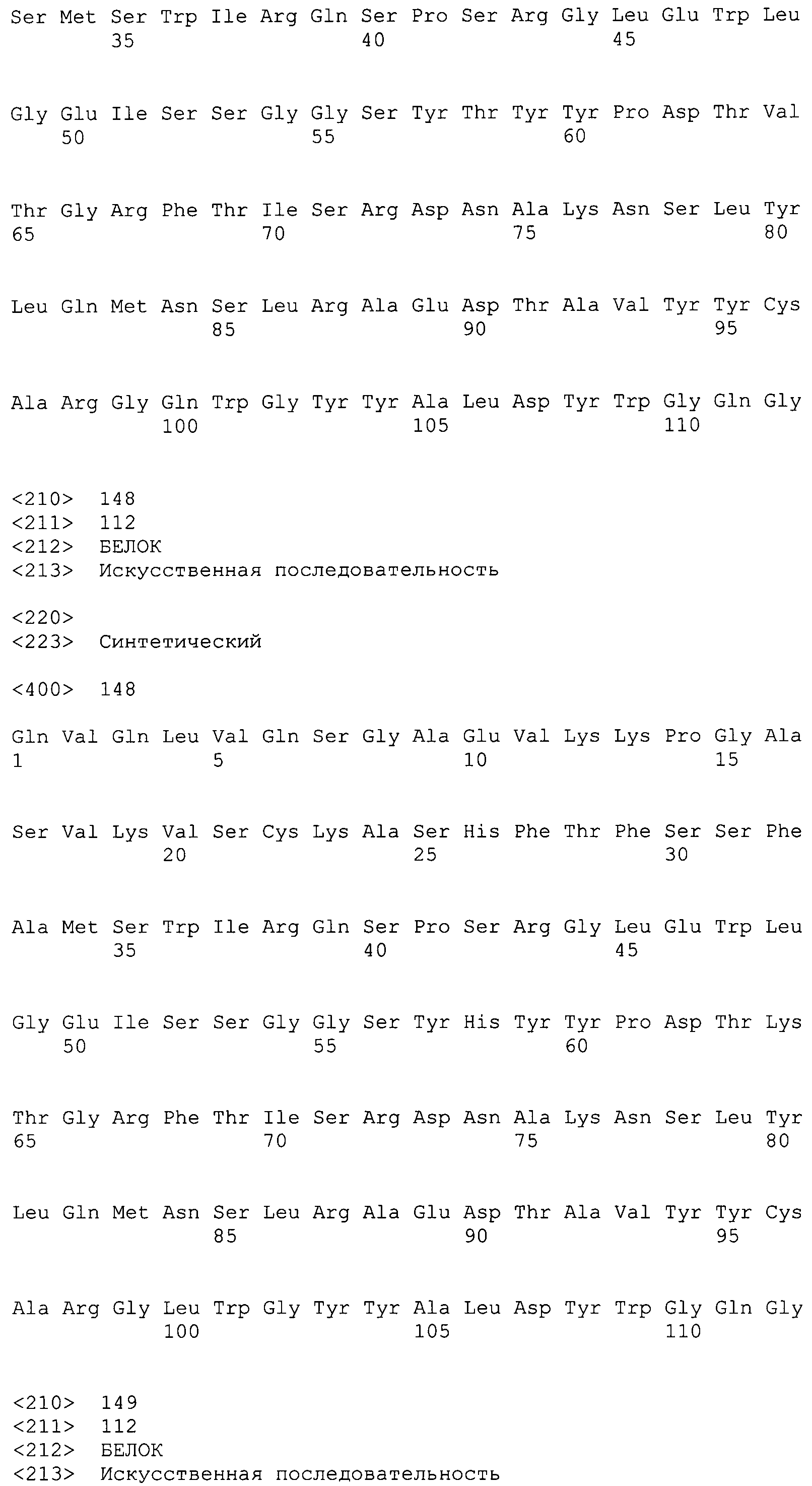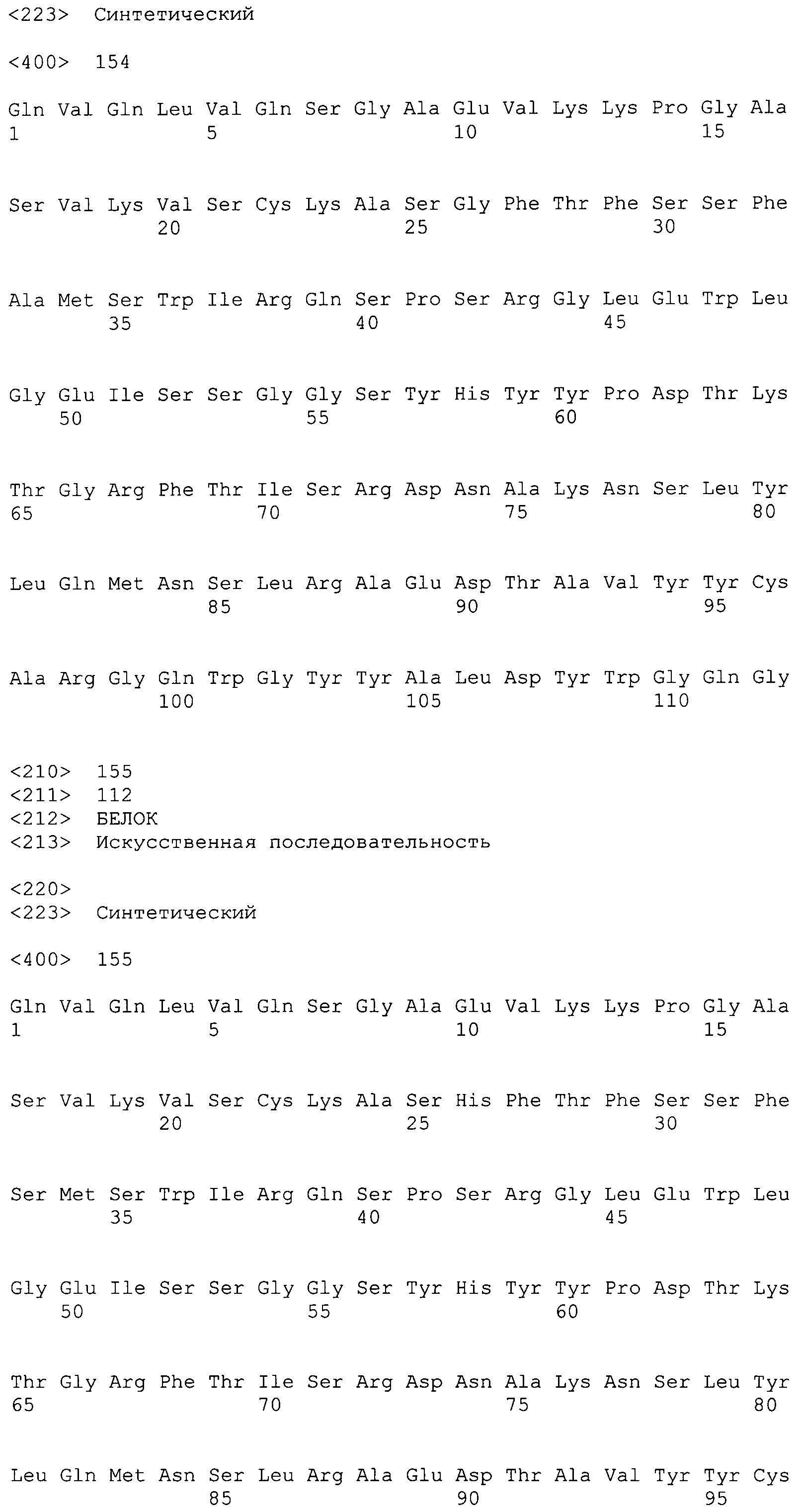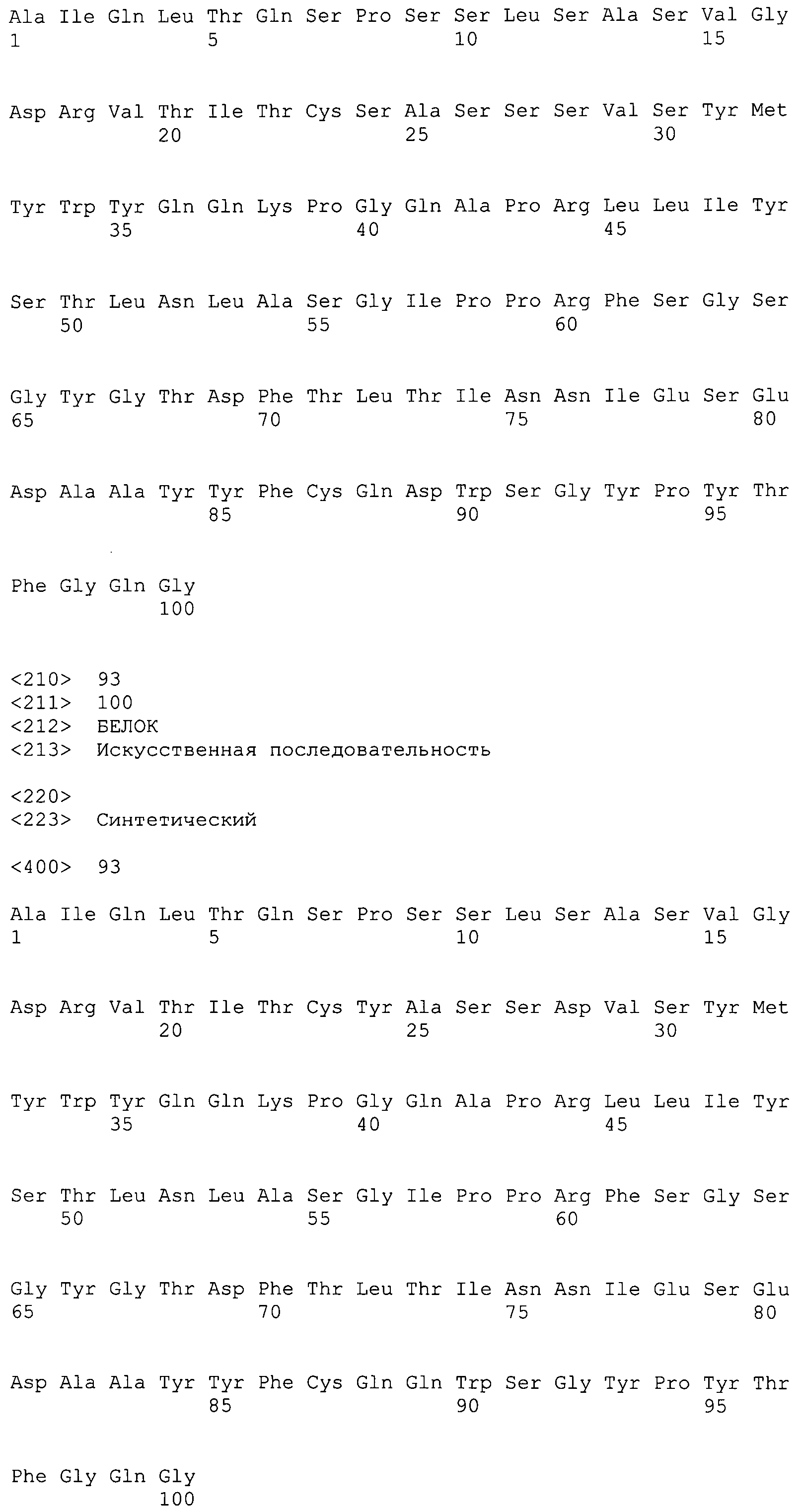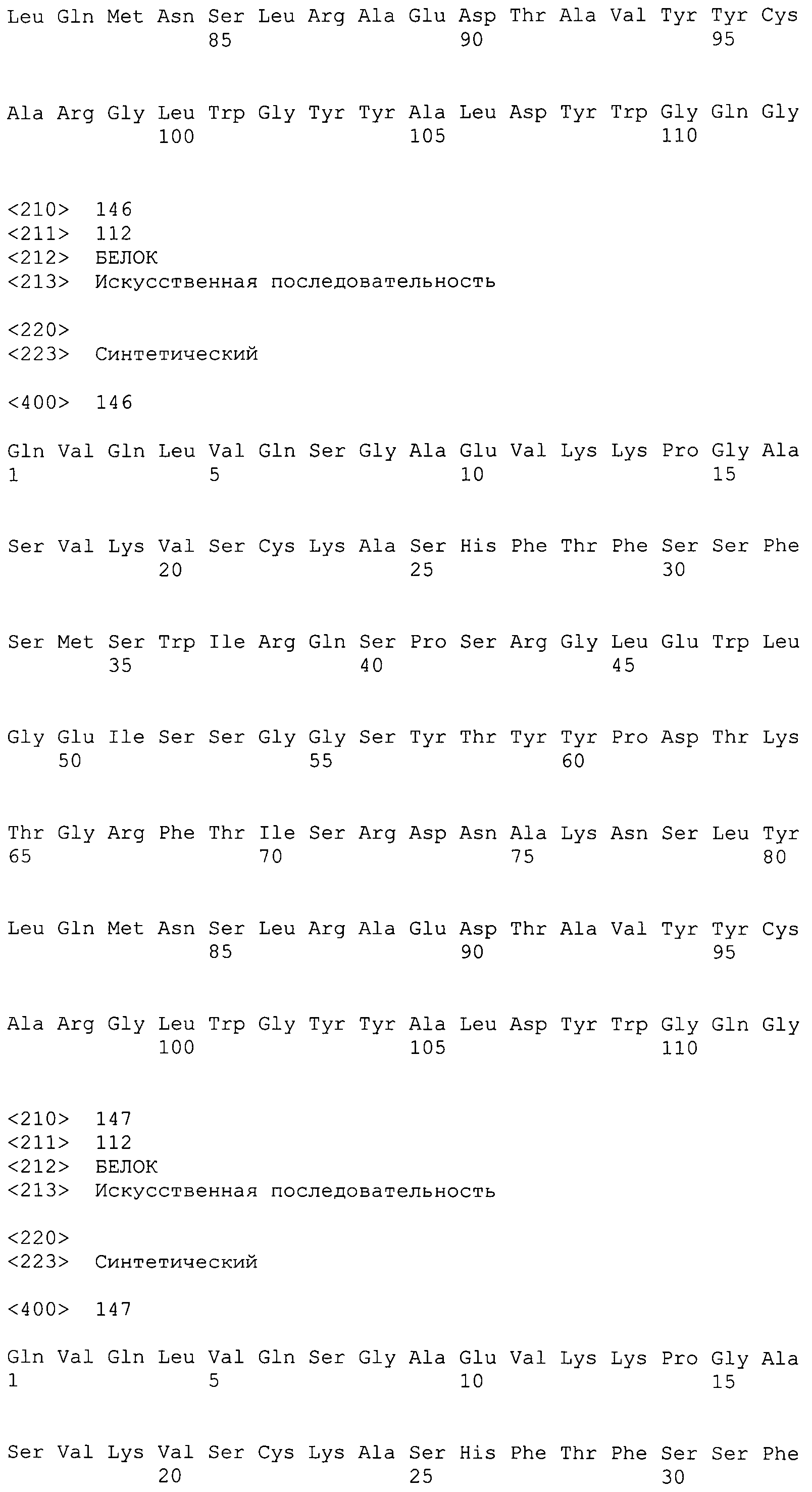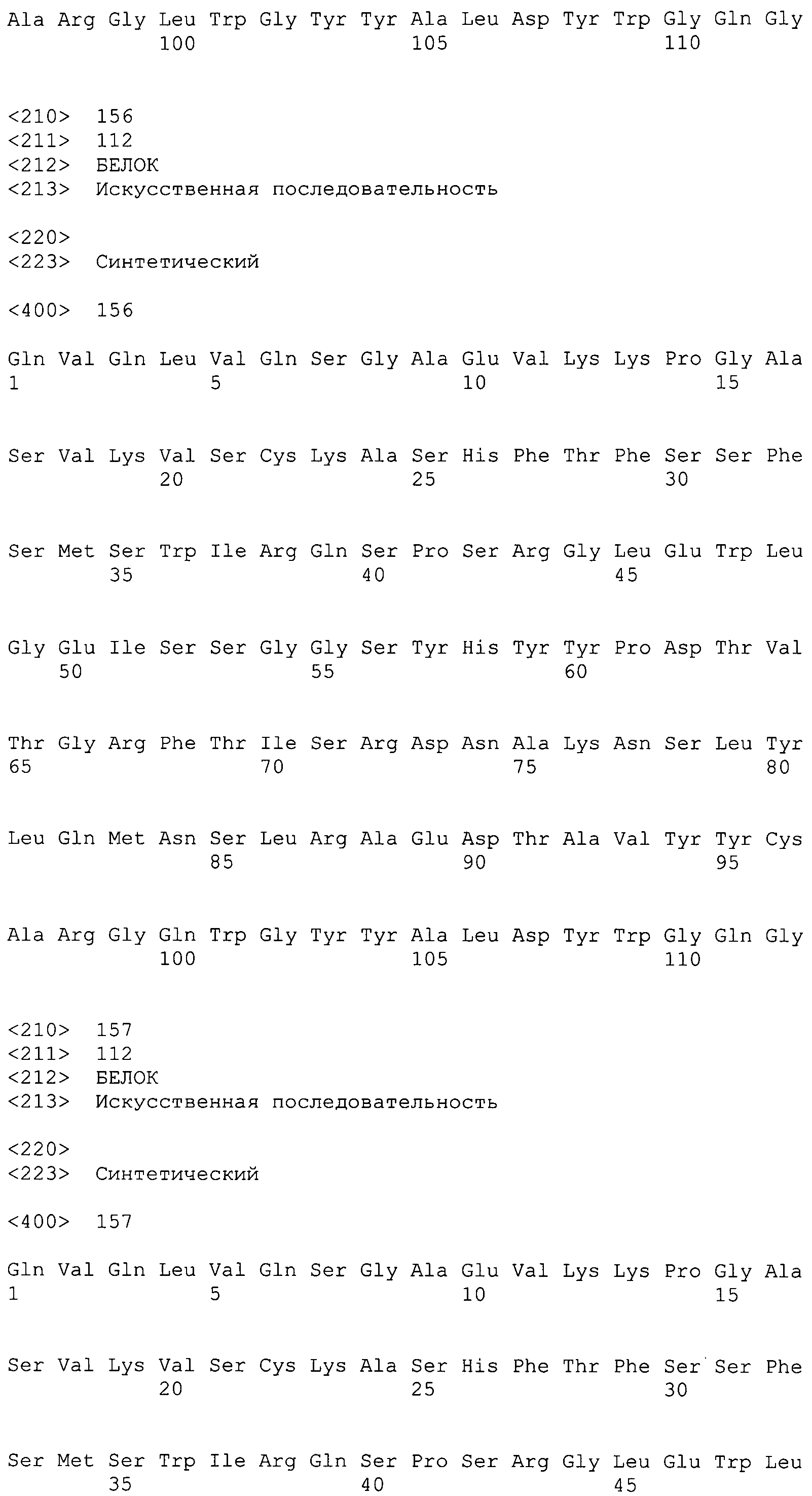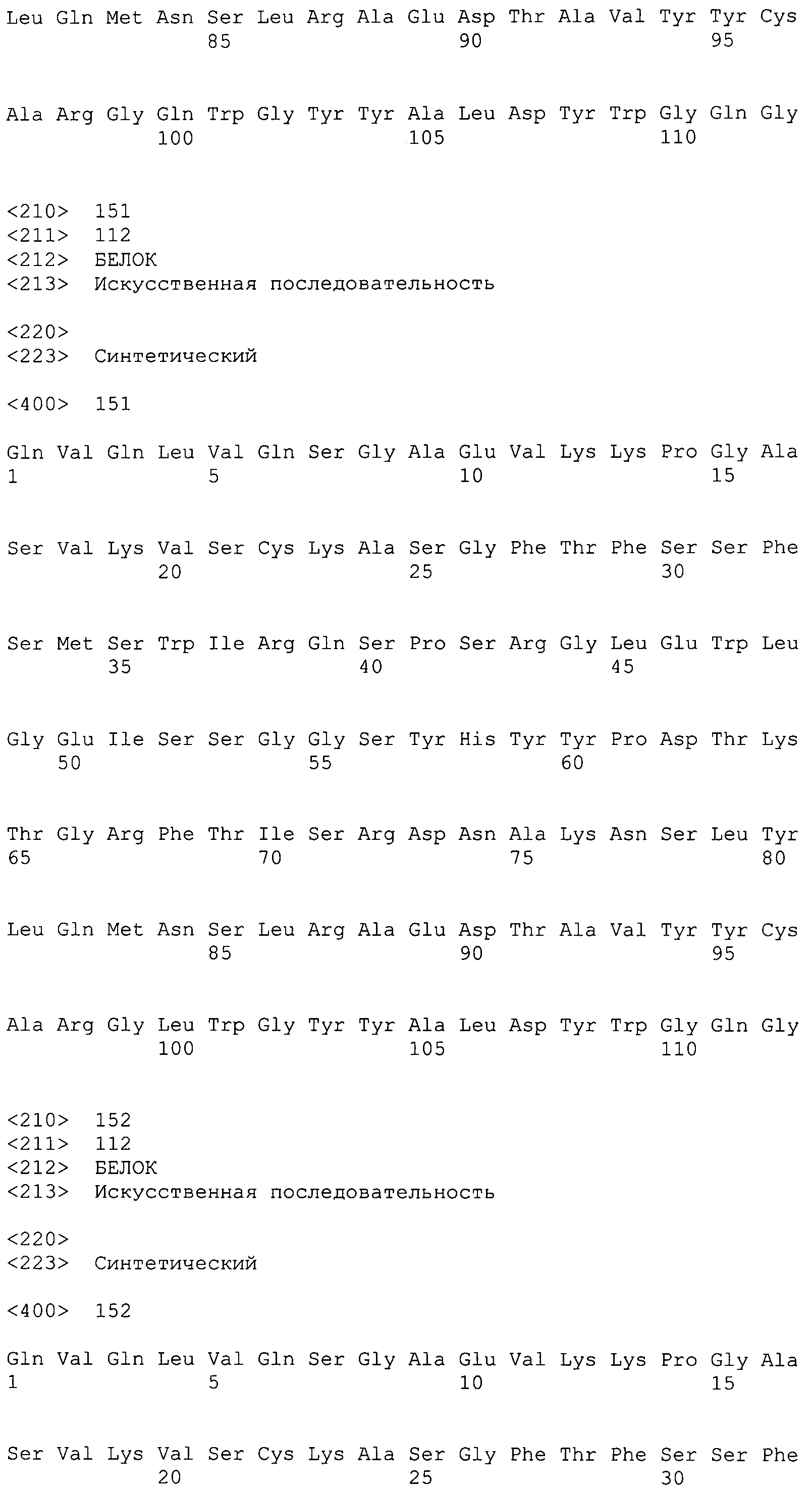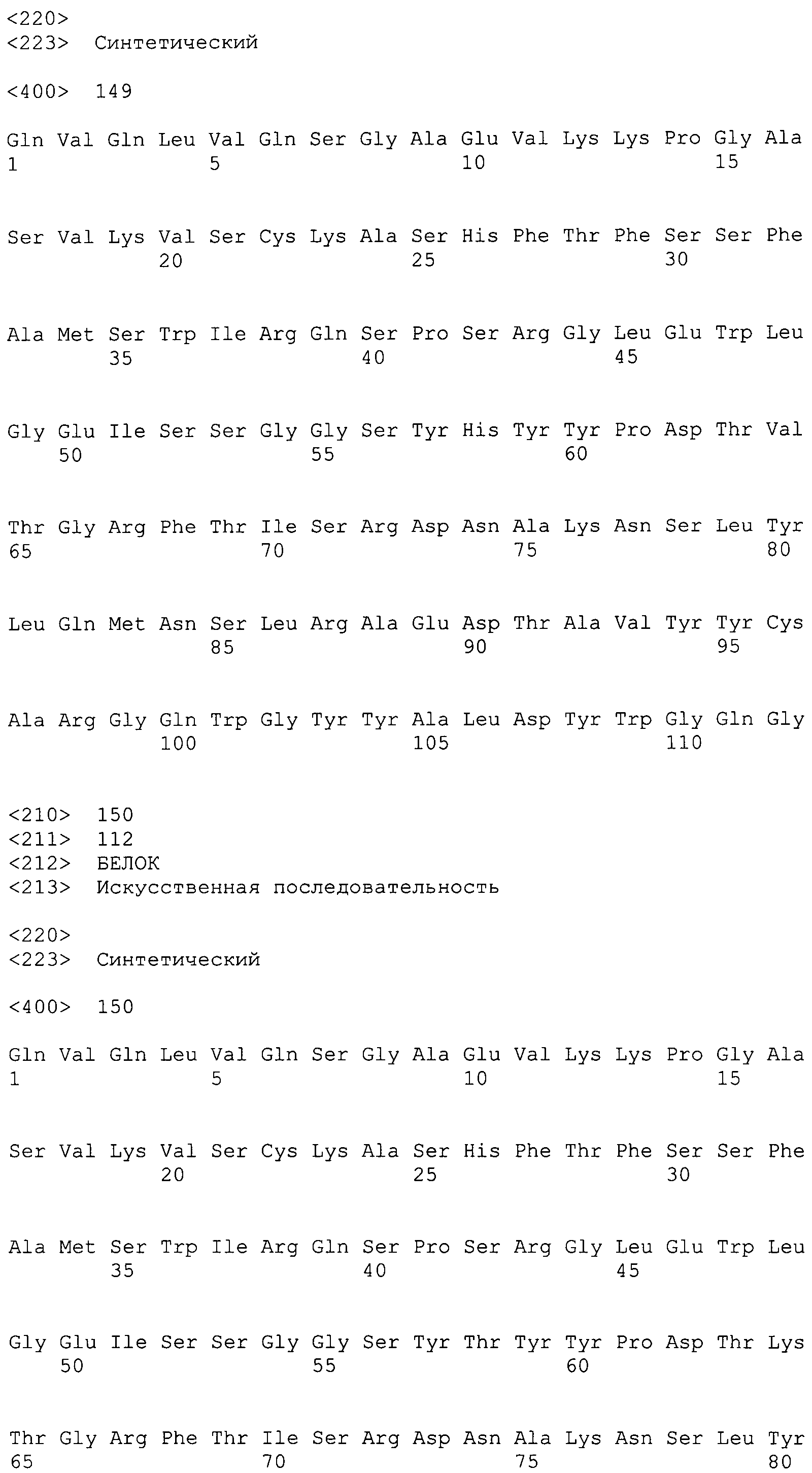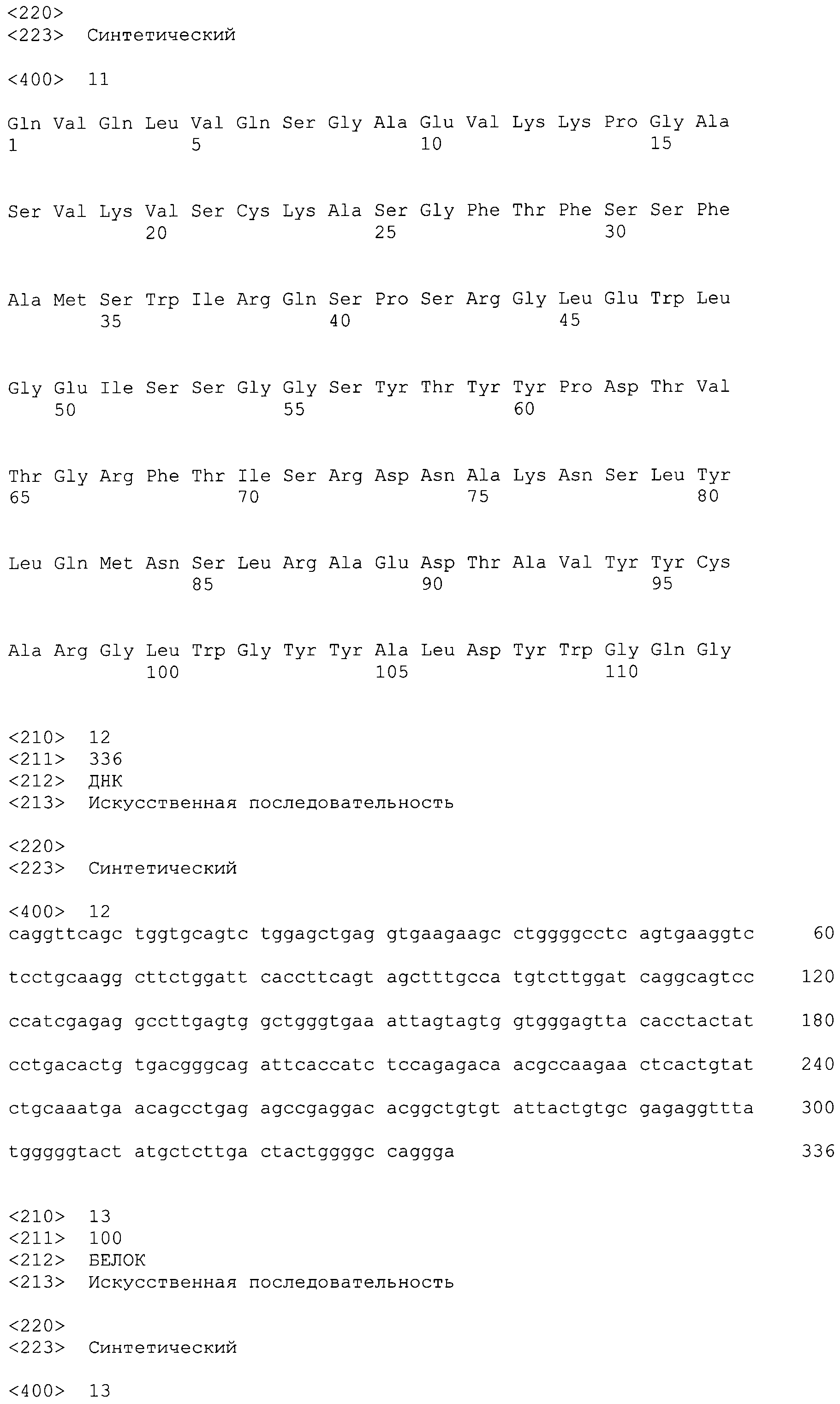ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА ПРОТИВ IL-6
Вид РИД
Изобретение
Информация о родственных заявках
Настоящая заявка подана 13 ноября 2009 года в качестве международной заявки на патент согласно РСТ на имя Фемта Фармасьютикалз, Инк., национальной корпорации США, которая является заявителем, указываемым во всех странах, кроме США, Герхарда Фрея, гражданина Германии, Хвай Вен Чанга, гражданина США, и Джей Шорт, гражданки США, которые являются заявителями, указываемыми только в США, и притязает на приоритет предварительной заявки на патент США № 61/114295, поданной 13 ноября 2008 года.
Предпосылки создания изобретения
1. Область техники, к которой относится изобретение
Настоящее изобретение относится к антителам, в том числе к определенным частям или вариантам антител, которые специфичны по меньшей мере к одному белку интерлейкина 6 (IL-6, известному также как β2-интерферон) или его фрагменту, а также к нуклеиновым кислотам, кодирующим такие антитела против IL-6, комплементарным нуклеиновым кислотам, векторам, клеткам-хозяевам и способам их получения и применения, к терапевтическим препаратам, способам введения и устройствам.
2. Уровень техники
Интерлейкин 6 (IL-6) является провоспалительным цитокином, продуцируемым многими клетками разных типов. Стимулированные моноциты, фибробласты и эндотелиальные клетки являются основными источниками IL-6 in vivo. Другие клетки, такие как макрофаги, Т- и В-лимфоциты, гранулоциты, кератиноциты, мастоциты, остеобласты, хондроциты, глиальные клетки и гладкомышечные клетки, также продуцируют IL-6 после стимуляции. Некоторые опухолевые клетки также продуцируют IL-6, поэтому IL-6 считается прогностическим фактором прогрессирования рака предстательной железы. Продуцирование IL-6 может регулироваться самим IL-6 и зависит от типа клеток, при этом IL-6 может стимулировать или ингибировать собственный синтез.
IL-6 может связываться с рецептором IL-6, экспрессированным на митогенактивируемых В-клетках, Т-клетках, периферических моноцитах и определенных опухолях. Рецептор IL-6 имеет по меньшей мере два разных компонента и состоит из альфа-цепи, именуемой gp80, которая отвечает за связывание с IL-6, и бета-цепи, именуемой gp130, которая необходима для трансдукции сигнала. Все члены семейства цитокинов, в которое входят IL-6, LIF, онкостатин М, IL-11, CNTF и СТ-1, передают сигналы по цепи gp130 после связывания с родственными рецепторами. Кроме того, все члены семейства цитокинов IL-6 могут индуцировать экспрессию в печени белков острой стадии.
IL-6 выполняет по меньшей мере две основные биологические функции: опосредует образование белков острой стадии и действует в качестве фактора дифференцировки и активации. Как известно, белки острой стадии регулируют иммунные реакции, опосредуют воспаление и играют определенную роль в изменении ткани. В качестве фактора дифференцировки и активации, IL-6 индуцирует дифференцировку В-клеток и секрецию антитела, дифференцировку Т-клеток в цитотоксические Т-клетки, активирует факторы передачи сигналов клеток и стимулирует гемопоэз. IL-6 участвует во многих важных функциях и процессах организма. Поэтому такие физиологические процессы, как костный метаболизм, малигнизация, иммунные и воспалительные реакции, могут быть усилены, подавлены или предотвращены путем манипуляции биологической активностью IL-6 in vivo при помощи антитела.
Существует потребность в высокоаффинных, нейтрализующих химерных или человеческих антителах к IL-6 или их фрагментам, предназначенных для предотвращения, лечения, ослабления или диагностики состояний, определяемых IL-6.
Сущность изобретения
Настоящее изобретение относится к выделенным гуманизированным антителам против IL-6, имеющим по меньшей мере одну антигенсвязывающую область, выдленную из высокоаффинных антител против IL-6 ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890 или ВА939, а также к композициям антител против IL-6, кодирующим или комплементарным нуклеиновым кислотам, векторам, клеткам-хозяевам, композициям, препаратам, устройствам, трансгенным животным, трансгенным растениям, а также к способам их получения и применения, рассмотренным в настоящем описании изобретения, в комбинации с достижениями, известными в данной области. Антитело по настоящему изобретению специфически нейтрализует IL-6 человека с высокой степенью сродства.
Настоящее изобретение относится по меньшей мере к одному выделенному гуманизированному антителу против IL-6, рассмотренному в настоящем описании изобретения. Антитело по настоящему изобретению включает любое антитело ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890 или ВА939, любую молекулу белка или пептида, включающую по меньшей мере одну область, определяющую комплементарность (CDR) тяжелой или легкой цепи или ее лигандсвязывающую часть, выделенную из любого антитела ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890 или ВА939, в комбинации с константной областью тяжелой или легкой цепи, каркасной областью или любой ее частью, которая может быть введена в антитело по настоящему изобрерению. Один вариант осуществления изобретения относится к антителу против IL-6, включающему легкую цепь и тяжелую цепь, каждая из которых содержит по меньшей мере часть константной области человека и по меньшей мере часть вариабельной области (v), происходящей из одного или более антител ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890 или ВА939, каждое из которых является специфичным к IL-6 человека, при этом указанное антитело связывается с высокой степенью сродства с ингибирующим и/или нейтрализующим эпитопом IL-6 человека. В объем настоящего изобретения также входят фрагменты или производное такого антитела, в частности, одна или более частей цепи антитела, такие как константные, соединительные, дивергирующие или вариабельные области тяжелой цепи или константные, соединительные или вариабельные области легкой цепи.
Антитело может включать по меньшей мере одну определенную часть по меньшей мере одной области, определяющей комплементарность (CDR) (например, CDR1, CDR2 или CDR3 вариабельной области тяжелой или легкой цепи), выделенную из антитела против IL-6 (в соответствии с термином, используемым в настоящем описании изобретения), и/или по меньшей мере одну каркасную область константной или вариабельной области или любую ее часть. Аминокислотная последовательность антитела может далее необязательно включать по меньшей мере одну определенную замену, инсерцию или делецию, рассмотренную в настоящем описании изобретения или известную в данной области.
Предпочтительные антитела по настоящему изобретению включают ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890, ВА939, ВА399-01, ВА399-02, ВА399-03, ВА399-04, ВА399-05, ВА399-06, ВА399-07, ВА399-08, ВА399-09 и ВА399-10, а также их фрагменты и области.
Один вариант осуществления изобретения относится к выделенному антителу или фрагменту антитела, связывающемуся с IL-6 человека, которые включают вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO:3, 7, 11, 15, 19, 23, 27, 31, 134, 140, 141, 144, 147, 149, 152, 153 или 156; вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO:1, 5, 9, 13, 17, 21, 25, 29, 68, 71, 72, 75, 76, 80 или 88; и константную область, происходящую из одного или более человеческих антител. Одним объектом настоящего изобретения является выделенное антитело или фрагмент антитела, связывающиеся с IL-6, которые включают области, определяющие комплементарность (CDR) тяжелой и легкой цепей, выделенные из вариабельных областей одного или более антител ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890 или ВА939, и константную область, происходящую из одного или более человеческих антител. Другим объектом настоящего изобретения является антитело или его фрагмент по п.1, которые конкурентно ингибируют in vivo связывание с IL-6 человека мышиного антитела против IL-6.
Предпочтительными антителами по настоящему изобретению являются антитела, связывающиеся с IL-6 человека и блокирующие его связывание с рецептором, которые включают эпитопы, описанные в публикации Brackenhoff et al. (смотрите выше). Предпочтительные методы определения специфичности и сродства моноклональных антител путем конкурентного ингибирования рассмотрены в публикации Harlow, et al., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1988), которая включена в настоящее описание изобретения в качестве ссылки. По меньшей мере одно антитело по настоящему изобрерению связывается по меньшей мере с одним определенным эпитопом, специфичным к белку, субъединице, фрагменту, части или любой их комбинации IL-6 человека, описанным, например, в публикации Brackenhoff et al. (смотрите выше). Такой эпитоп может включать по меньшей мере одну область связывания антитела, при этом указанный эпитоп предпочтительно состоит по меньшей мере из 1-5 аминокислот или по меньшей мере одной их части, которая включает, не ограничиваясь ими, по меньшей мере один функциональный, внеклеточный, растворимый, гидрофильный, внешний или цитоплазматический домен белка IL-6 человека или любую его часть.
Одним объектом настоящего изобретения является по меньшей мере одно выделенное антитело против IL-6 млекопитающего, включающее по меньшей мере одну вариабельную область из любого антитела ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890, ВА939, ВА399-01, ВА399-02, ВА399-03, ВА399-04, ВА399-05, ВА399-06, ВА399-07, ВА399-08, ВА399-09 и ВА399-10 и кодирующие их последовательности нуклеиновых кислот.
Другим объектом настоящего изобретения является по меньшей мере одно выделенное антитело против IL-6 млекопитающего, включающее (i) аминокислотные последовательности всех областей, определяющих комплементарность (CDR) тяжелой цепи, выделенные из ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890, ВА939, ВА399-01, ВА399-02, ВА399-03, ВА399-04, ВА399-05, ВА399-06, ВА399-07, ВА399-08, ВА399-09 и ВА399-10, и кодирующие их последовательности нуклеиновых кислот; или (ii) аминокислотные последовательности всех CDR-областей легкой цепи, выделенные из ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890, ВА939, ВА399-01, ВА399-02, ВА399-03, ВА399-04, ВА399-05, ВА399-06, ВА399-07, ВА399-08, ВА399-09 и ВА399-10, и кодирующие их последовательности нуклеиновых кислот.
Другим объектом настоящего изобретения является по меньшей мере одно выделенное антитело против IL-6 человека, включающее по меньшей мере одну CDR тяжелой цепи или легкой цепи, имеющую аминокислотную последовательность, выделенную из ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890, ВА939, ВА399-01, ВА399-02, ВА399-03, ВА399-04, ВА399-05, ВА399-06, ВА399-07, ВА399-08, ВА399-09 и ВА399-10, и кодирующие их последовательности нуклеиновых кислот.
Другим объектом настоящего изобретения является по меньшей мере одно выделенное химерное, гуманизированное или CDR-привитое антитело против IL-6 млекопитающего, включающее по меньшей мере одну CDR человека, которое специфически связывается по меньшей мере с одним эпитопом, включающим по меньшей мере 1-3 аминокислоты эпитопа IL-6 человека.
По меньшей мере одно антитело может далее необязательно связываться с IL-6 со степенью сродства (Kd), равной по меньшей мере 10-9 М, предпочтительной по меньшей мере 10-10 М, и/или по существу нейтрализовать по меньшей мере одну активность по меньшей мере одного белка IL-6. В предпочтительном варианте осуществления изобретения антитело связывается с IL-6 со степенью сродства (Kds), равной по меньшей мере 5×10-10 М, предпочтительно 5×10-11, более предпочтительно 5×10-12, и нейтрализует IL-6 человека.
Одним объектом настоящего изобретения являются молекулы выделенных нуклеиновых кислот, включающих, комплементарных или гибридизирующих с полинуклеотидом, кодирующим вышеуказанные специфические антитела против IL-6, которые включают по меньшей мере одну определенную последовательность, домен, его часть или вариант. Настоящее изобретение далее относится к рекомбинантным векторам, включающим указанные молекулы нуклеиновых кислот антитела против IL-6, клеткам-хозяевам, содержащим такие нуклеиновые кислоты и/или рекомблинантные векторы, а также к способам получения и/или применения таких нуклеиновых кислот антитела, векторов и/или клеток-хозяев. Таким образом, настоящее изобретение включает выделенную нуклеиновую кислоту, кодирующую по меньшей мере одно выделенное антитело против IL-6 человека; вектор, включающий выделенную нуклеиновую кислоту, и/или прокариотическую или эукариотическую клетку-хозяина, включающую выделенную нуклеиновую кислоту. Клетка-хозяин может необязательно быть по меньшей мере одной клеткой, выбранной из COS-1, COS-7, HEK293, BHK21, CHO, BSC-1, HepG2, 653, SP2/0, 293, HeLa, PER.C6®, клеток миеломы или лимфомы либо любых производных, иммортализованных или трансформированных клеток. Настоящее изобретение относится также к способу получения по меньшей мере одного антитела против IL-6, который включает трансляцию нуклеиновой кислоты, кодирующей антитело, в условиях in vitro, in vivo или in situ, позволяющих экспрессировать антитело против IL-6 в обнаруживаемых или выделяемых количествах.
Настоящее изобретение относится также по меньшей мере к одному способу экспрессии по меньшей мере одного вышеуказанного антитела против IL-6 в клетке-хозяине, который включает культивирование клетки-хозяина по настоящему изобретению в условиях, в которых по меньшей мере одно антитело против IL-6 может быть экспрессировано в обнаруживаемых и/или выделяемых количествах.
Настоящее изобретение относится также по меньшей мере к одной композиции, включающей (а) выделенную нуклеиновую кислоту, кодирующую антитело против IL-6, и/или антитело по настоящему изобретению; (b) приемлемый носитель или разбавитель. Носитель или разбавитель необязательно может быть фармацевтически приемлемым известным носителем или разбавителем. Композиция может далее необязательно включать по меньшей мере одно дополнительное соединение, белок или композицию.
Настоящее изобретение далее относится по меньшей мере к одному антителу против IL-6 или композиции и способу их применения, предназначенному для введения терапевтически эффективного количества с целью модуляции или лечения по меньшей мере одного IL-6-определяемого состояния в клетке, ткани, органе, организме животного или субъекта до, после или в процессе развития состояния, известного в данной области и/или рассмотренного в настоящем описании изобретения. Таким образом, настоящее изобретение относится к способу диагностики или лечения IL-6-определяемого состояния в клетке, ткани, органе или организме животного, который включает осуществление контактирования или введение композиции, включающей эффективное количество по меньшей мере одного выделенного антитела против IL-6 по настоящему изобретению в клетку, ткань, орган или животному. Указанный способ может далее необязательно включать введение эффективного количества, равного 0,001-50 мг/кг антитела против IL-6 по настоящему изобретению, в клетки, ткань, орган или организм животного. Указанный способ может далее необязательно включать осуществление контактирования или введение при помощи по меньшей мере одного способа введения, выбираемого из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, внутриабдоминального, внутрикапсульного, внутрихрящевого, внутриполостного, внутрибрюшинного, внутрипупочного, интрацеребровентрикулярного, внутрикишечного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интраперикардиального, интраперитонеального, интраплеврального, внутрипростатического, внутрилегочного, интраректального, интраренального, интраретинального, интраспинального, внутрисуставного, внутригрудного, внутриматочного, внутрипузырного, вагинального, ректального, трансбуккального, сублингвального, назального или чрескожного. Указанный способ может далее необязательно включать введение до, одновременно или после контактирования с антителом или введения по меньшей мере одной композиции, включающей эффективное количество по меньшей мере одного соединения или белка, выбираемого по меньшей мере из одной детектируемой метки или репортера, антагониста TNF, противоревматического средства, миорелаксанта, наркотического лекарственного средства, нестероидного противовоспалительного средства (NSAID), анальгетика, анестезирующего средства, седативного средства, местного анестетика, нервно-мышечного блокатора, антимикробного средства, антипсориазного средства, кортикостероида, анаболического стероида, эритропоэтина, иммунизирующего вещества, иммуноглобулина, иммуносупрессора, гормона роста, гормонозамещающего средства, радиофармацевтического средства, антидепрессанта, антипсихотического средства, стимулятора, лекарственного средства от астмы, бета-агониста, ингалируемого стероида, эпинефрина или его аналога, цитотоксического или другого противоракового средства, антиметаболита, такого как метотрексат, антипролиферативного средства, цитокина, антагониста цитокина и моноклонального антитела против TNFα или IL-12/IL-23.
Настоящее изобретение далее относится по меньшей мере к одному способу применения антитела против IL-6 для диагностики по меньшей мере одного IL-6-определяемого состояния в клетке, ткани, органе, организме животного или субъекта до, после или в процессе развития состояния, известного в данной области и/или рассмотренного в настоящем описании изобретения.
Настоящее изобретение относится также по меньшей мере к одной композиции, устройству и/или способу применения для диагности по меньшей мере одного антитела против IL-6 по настоящему изобретению.
Настоящее изобретение относится также к композиции, включающей по меньшей мере одно выделенного гуманизированное антитело против IL-6 и по меньшей мере один фармацевтически приемлемый носитель или разбавитель. Композиция может далее необязательно включать эффективное количество по меньшей мере одного соединения или белка, выбираемого по меньшей мере из одной детектируемой метки или репортера, цитотоксического или другого противоракового средства, антиметаболита, такого как метотрексат, антипролиферативного средства, цитокина или антагониста цитокина, антагониста TNF, антиревматического средства, миорелаксанта, наркотического лекарственного средства, нестероидного противовоспалительного средства (NSAID), анальгетика, анестезирующего средства, седативного средства, местного анестетика, нервно-мышечного блокатора, антимикробного средства, антипсориазного средства, кортикостероида, анаболического стероида, эритропоэтина, иммунизирующего вещества, иммуноглобулина, иммуносупрессора, гормона роста, гормонозамещающего средства, радиофармацевтического средства, антидепрессанта, антипсихотического средства, стимулятора, лекарственного средства от астмы, бета-агониста, ингалируемого стероида, эпинефрина или его аналога.
Настоящее изобретение относится также к медицинскому устройству, включающему по меньшей мере одно выделенное антитело против IL-6 млекопитающего, которое предназначено для осуществления контактирования или введения по меньшей мере одного антитела против IL-6 при помощи по меньшей мере одного способа введения, выбираемого из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, внутриабдоминального, внутрикапсульного, внутрихрящевого, внутриполостного, внутрибрюшного, внутрипупочного, интрацеребровентрикулярного, внутрикишечного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интраперикардиального, интраперитонеального, интраплеврального, внутрипростатического, внутрилегочного, интраректального, интраренального, интраретинального, интраспинального, внутрисуставного, внутригрудного, внутриматочного, внутрипузырного, вагинального, ректального, трансбуккального, сублингвального, назального или чрескожного.
Другим объектом настоящего изобретения является набор, включающий первую емкость, содержащую по меньшей мере одно антитело против IL-6 или его фрагмент в лиофилизованном виде, и необязательно вторую емкость, содержащую стерильную воду, стерильную воду с буфером или по меньшей мере один консервант, выбираемый из группы, состоящей из фенола, м-крезола, п-крезола, о-крезола, хлоркрезола, бензилового спирта, фенилмеркурнитрита, феноксиэтанола, формальдегида, хлорбутанола, хлорида магния, алкилпарабена, хлорида бензалкония, хлорида бензетония, дегидроацетата натрия и тимерозала или их смесей в водном разбавителе. В соответствии с одним объектом изобретения антитело против IL-6, его определенную часть или вариант в первой емкости набора восстанавливают до концентрации от примерно 0,1 мг/мл до примерно 500 мг/мл содержимым второй емкости. В соответствии с другим объектом изобретения во второй емкости далее находится регулятор изотоничности раствора. В соответствии с другим объектом изобретения во второй емкости далее находится физиологически приемлемый буфер. Одним объектом изобретения является способ лечения по меньшей мере одного IL-6-опосредованного состояния, который включает введение нуждающемуся субъекту препарата, находящегося в наборе и восстанавливемого перед введением.
Настоящее изобретение относится также к изделию для фармацевтического или диагностического применения, которое включает упаковочный материал и емкость, содержащую по меньшей мере одно выделенное антитело против IL-6 млекопитающего по настоящему изобретению в растворе или лиофилизованном виде. Указанное изделие может необязательно включать емкость в качестве компонента устройства или системы для парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, внутриабдоминального, внутрикапсульного, внутрихрящевого, внутриполостного, внутрибрюшного, внутрипупочного, интрацеребровентрикулярного, внутрикишечного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интраперикардиального, интраперитонеального, интраплеврального, внутрипростатического, внутрилегочного, интраректального, интраренального, интраретинального, интраспинального, внутрисуставного, внутригрудного, внутриматочного, внутрипузырного, вагинального, ректального, трансбуккального, сублингвального, назального или чрескожного введения.
Настоящее изобретение далее относится к любому изобретению, представленному в настоящем описании изобретения.
Краткое описание чертежей
На фиг.1 показаны соответственно аминокислотные последовательности и последовательности нуклеиновых кислот для вариабельной области легкой цепи (SEQ ID NO:1, 2) и тяжелой цепи (SEQ ID NO:3, 4) антитела против IL-6 ВА399.
На фиг.2 показаны соответственно аминокислотные последовательности и последовательности нуклеиновых кислот для вариабельной области легкой цепи (SEQ ID NO:5, 6) и тяжелой цепи (SEQ ID NO:7, 8) антитела против IL-6 ВА436.
На фиг.3 показаны соответственно аминокислотные последовательности и последовательности нуклеиновых кислот для вариабельной области легкой цепи (SEQ ID NO:9, 10) и тяжелой цепи (SEQ ID NO:11, 12) антитела против IL-6 ВА802.
На фиг.4 показаны соответственно аминокислотные последовательности и последовательности нуклеиновых кислот для вариабельной области легкой цепи (SEQ ID NO:13, 14) и тяжелой цепи (SEQ ID NO:15, 16) антитела против IL-6 ВА808.
На фиг.5 показаны соответственно аминокислотные последовательности и последовательности нуклеиновых кислот для вариабельной области легкой цепи (SEQ ID NO:17, 18) и тяжелой цепи (SEQ ID NO:19, 20) антитела против IL-6 ВА840.
На фиг.6 показаны соответственно аминокислотные последовательности и последовательности нуклеиновых кислот для вариабельной области легкой цепи (SEQ ID NO:21, 22) и тяжелой цепи (SEQ ID NO:23, 24) антитела против IL-6 ВА848.
На фиг.7 показаны соответственно аминокислотные последовательности и последовательности нуклеиновых кислот для вариабельной области легкой цепи (SEQ ID NO:25, 26) и тяжелой цепи (SEQ ID NO:27, 28) антитела против IL-6 ВА890.
На фиг.8 показаны соответственно аминокислотные последовательности и последовательности нуклеиновых кислот для вариабельной области легкой цепи (SEQ ID NO:29, 30) и тяжелой цепи (SEQ ID NO:31, 32) антитела против IL-6 ВА939.
На фиг.9 показаны соответственно аминокислотные последовательности и последовательности нуклеиновых кислот для вариабельной области легкой цепи (SEQ ID NO:33, 34) и тяжелой цепи (SEQ ID NO:35, 36) антитела против IL-6 ВА001.
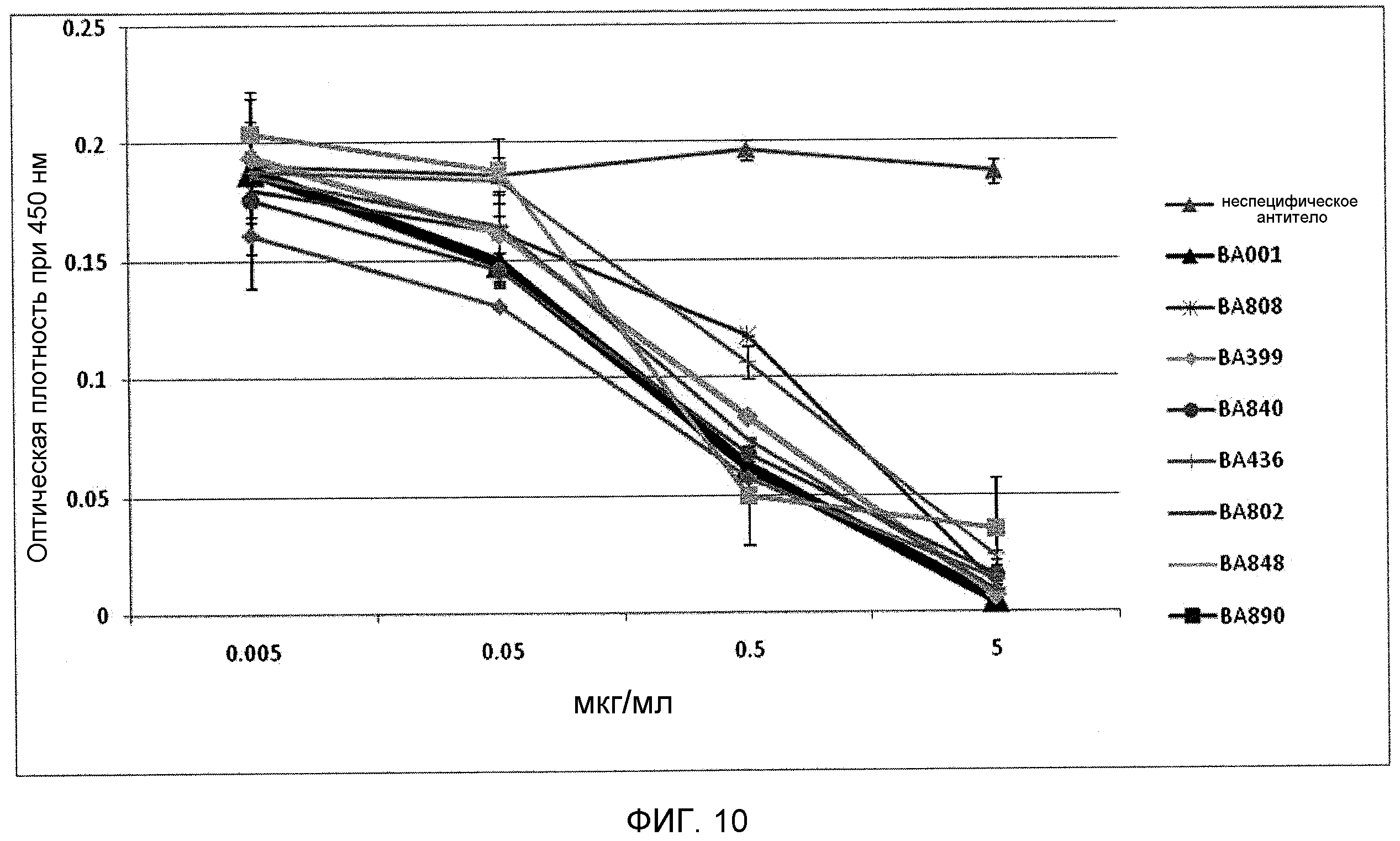
На фиг.10 показан конкурентный анализ ELISA антитела ВА001 и антитела против IL-6 по настоящему изобретению.
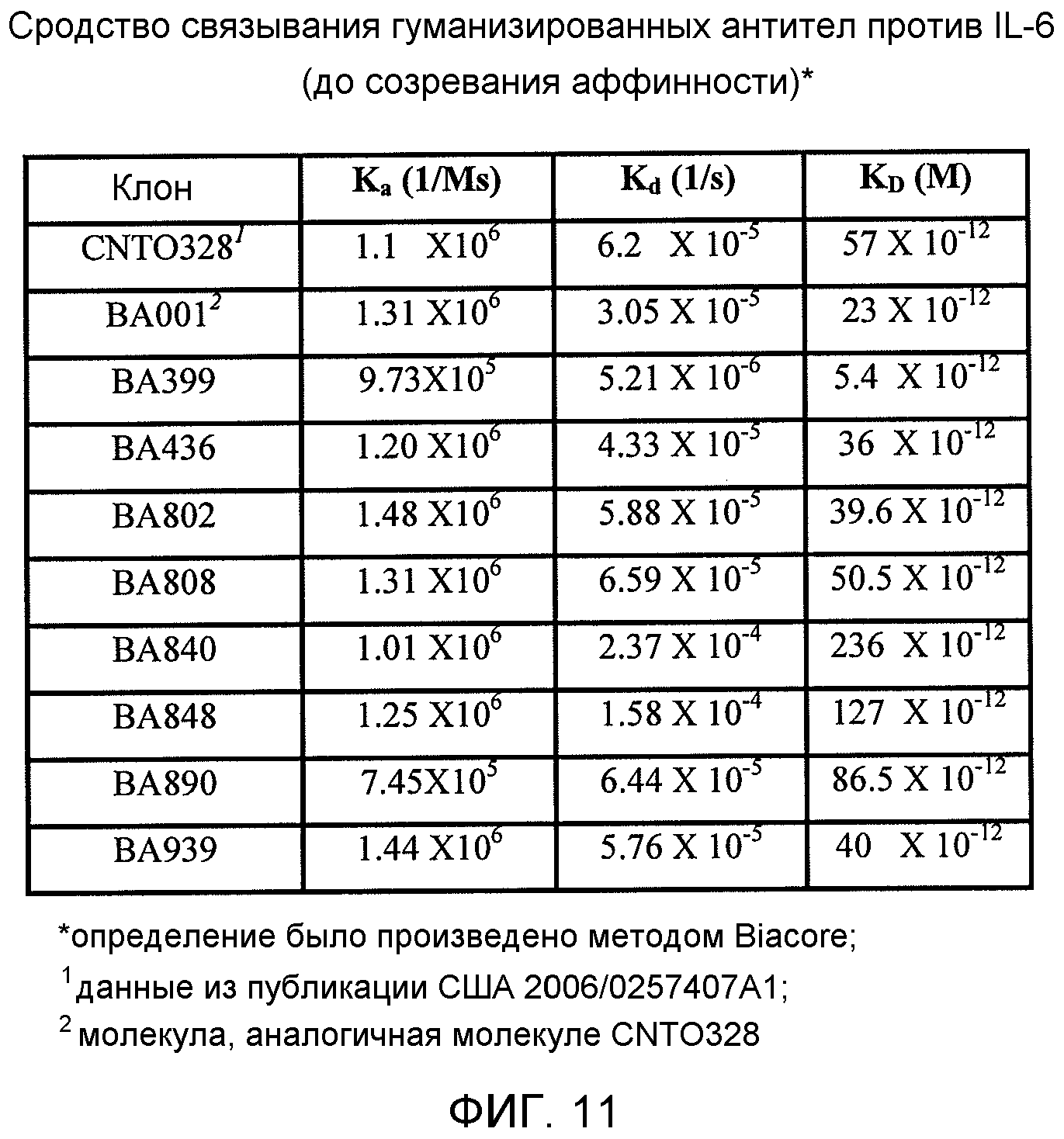
На фиг.11 показан анализ BiaCore и ELISA антитела ВА001 и антитела против IL-6 по настоящему изобретению.
На фиг.12 показаны последовательности нуклеиновых кислот для вариабельной области легкой цепи ВА399 CPS от LC01_DNA до LC06_DNA антитела против IL-6 ВА399 (соответственно SEQ ID NO:2, 37, 38, 39, 40 и 41).
На фиг.13 показаны последовательности нуклеиновых кислот для вариабельной области легкой цепи ВА399 CPS от LC07_DNA до LC12_DNA антитела против IL-6 ВА399 (соответственно SEQ ID NO:42, 43, 44, 45, 46 и 47).
На фиг.14 показаны последовательности нуклеиновых кислот для вариабельной области легкой цепи ВА399 CPS от LC13_DNA до LC18_DNA антитела против IL-6 ВА399 (соответственно SEQ ID NO:48, 49, 50, 51, 52 и 53).
На фиг.15 показаны последовательности нуклеиновых кислот для вариабельной области легкой цепи ВА399 CPS от LC19_DNA до LC24_DNA антитела против IL-6 ВА399 (соответственно SEQ ID NO:54, 55, 56, 57, 58 и 59).
На фиг.16 показаны последовательности нуклеиновых кислот для вариабельной области легкой цепи ВА399 CPS от LC25_DNA до LC30_DNA антитела против IL-6 ВА399 (соответственно SEQ ID NO:60, 61, 62, 63, 64 и 65).
На фиг.17 показаны последовательности нуклеиновых кислот для вариабельной области легкой цепи ВА399 CPS LC31_DNA и LC32_DNA антитела против IL-6 ВА399 (соответственно SEQ ID NO:66 и 67); и аминокислотные последовательности для вариабельной области легкой цепи от LC01_PRO до LC08_PRO антитела против IL-6 ВА399 (соответственно SEQ ID NO:1, 68, 69, 70, 71, 72, 73 и 74).
На фиг.18 показаны аминокислотные последовательности для вариабельной области легкой цепи ВА399 CPS от LC09_PRO до LC20_PRO антитела против IL-6 ВА399 (соответственно SEQ ID NO:75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85 и 86).
На фиг.19 показаны аминокислотные последовательности для вариабельной области легкой цепи ВА399 CPS от LC21_PRO до LC32_PRO антитела против IL-6 ВА399 (соответственно SEQ ID NO:87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97 и 98).
На фиг.20 показаны последовательности нуклеиновых кислот для вариабельной области тяжелой цепи ВА399 CPS от НС01_DNA до НС06_DNA антитела против IL-6 ВА399 (соответственно SEQ ID NO:4, 99, 100, 101, 102 и 103).
На фиг.21 показаны последовательности нуклеиновых кислот для вариабельной области тяжелой цепи ВА399 CPS от НС07_DNA до НС12_DNA антитела против IL-6 ВА399 (соответственно SEQ ID NO:104, 105, 106, 107, 108 и 109).
На фиг.22 показаны последовательности нуклеиновых кислот для вариабельной области тяжелой цепи ВА399 CPS от НС13_DNA до НС18_DNA антитела против IL-6 ВА399 (соответственно SEQ ID NO:110, 111, 112, 113, 114 и 115).
На фиг.23 показаны последовательности нуклеиновых кислот для вариабельной области тяжелой цепи ВА399 CPS от НС19_DNA до НС24_DNA антитела против IL-6 ВА399 (соответственно SEQ ID NO:116, 117, 118, 119, 120 и 121).
На фиг.24 показаны последовательности нуклеиновых кислот для вариабельной области тяжелой цепи ВА399 CPS от НС25_DNA до НС30_DNA антитела против IL-6 ВА399 (соответственно SEQ ID NO:122, 123, 124, 125, 126 и 127).
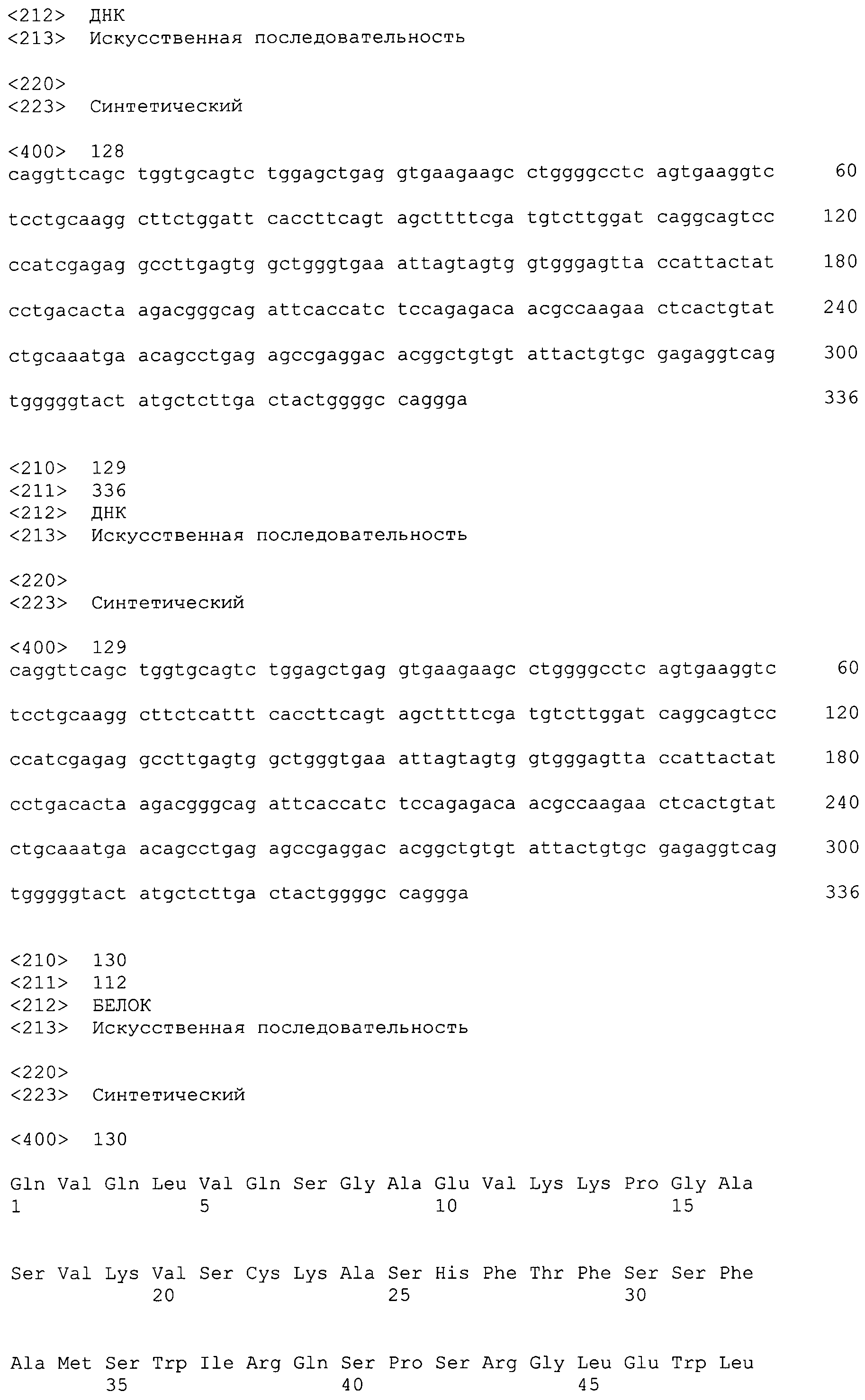
На фиг.25 показаны последовательности нуклеиновых кислот для вариабельной области тяжелой цепи ВА399 CPS НС31_DNA и НС32_DNA антитела против IL-6 ВА399 (соответственно SEQ ID NO:128 и 129); и аминокислотные последовательности для вариабельной области тяжелой цепи от НС01_PRO до НС06_PRO антитела против IL-6 ВА399 (соответственно SEQ ID NO:3, 130, 131, 132, 133 и 134).
На фиг.26 показаны аминокислотные последовательности для вариабельной области тяжелой цепи ВА399 CPS от НС07_PRO до НС15_PRO антитела против IL-6 ВА399 (соответственно SEQ ID NO:135, 136, 137, 138, 139, 140, 141, 142 и 143).
На фиг.27 показаны аминокислотные последовательности для вариабельной области тяжелой цепи ВА399 CPS от НС16_PRO до НС25_PRO антитела против IL-6 ВА399 (соответственно SEQ ID NO:144, 145, 146, 147, 148, 149, 150, 151, 152 и 153).
На фиг.28 показаны аминокислотные последовательности для вариабельной области тяжелой цепи ВА399 CPS от НС26_PRO до НС32_PRO антитела против IL-6 ВА399 (соответственно SEQ ID NO:154, 155, 156, 157, 158, 159 и 160).
На фиг.29 показана относительная удельная активность 10 лучших клонов, полученных в результате созревания аффинности ВА399 методом широкой позиционной эволюции (СРЕ). Относительная удельная активность для каждого клона нормализована в соответствии с относительной удельной активностью антитела против IL-6 ВА399, показанной в виде черной горизонтальной линии.
На фиг.30 показано сравнение аминокислотных последовательностей от 399CPS_LC01 до 399CPS_LC32 (соответственно SEQ ID NO:1, 68, 69, 70 ... 98), полученных в результате созревания аффинности методом комбинаторного синтеза белка (CPS) вариабельной области легкой цепи антитела против IL-6 ВА399. Непроцессированные последовательности и соответствующие SEQ ID NO показаны на фиг.17-19.
На фиг.31 показано сравнение аминокислотных последовательностей от 399CPS_НС01 до 399CPS_НС32 (соответственно SEQ ID NO:3, 130, 131, 132 ... 160), полученных в результате созревания аффинности методом комбинаторного синтеза белков (CPS) вариабельной области тяжелой цепи антитела против IL-6 ВА399. Непроцессированные последовательности и соответствующие SEQ ID NO показаны на фиг.25-28.
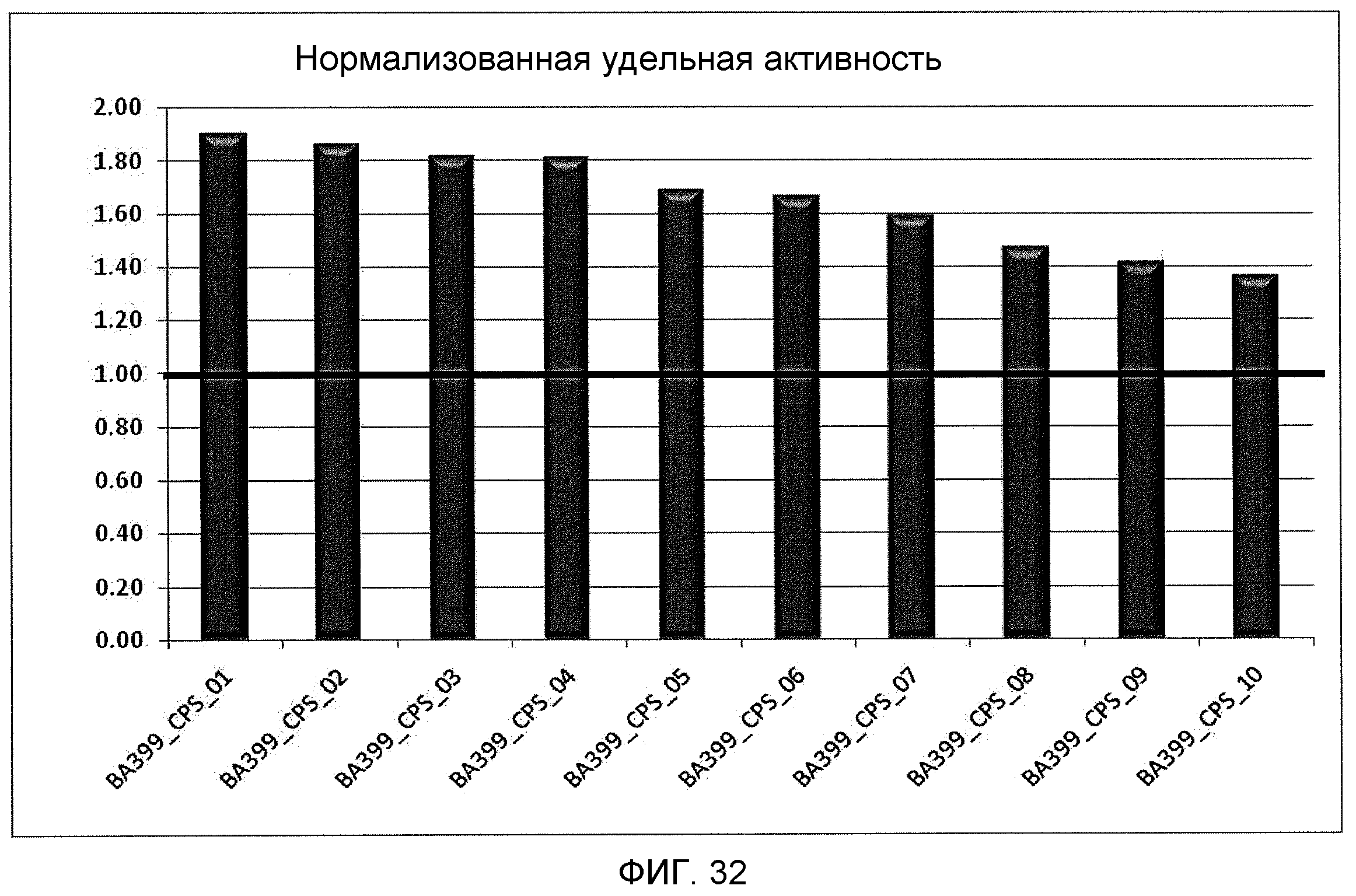
На фиг.32 показана нормализованная удельная активность 10 лучших клонов, полученных в результате созревании аффинности ВА399 методом комбинаторного синтеза белков (CPS). Относительная удельная активность для каждого клона нормализована в соответствии с относительной удельной активностью антитела против IL-6 ВА399, показанной в виде горизонтальной черной линии.
На фиг.33 показана таблица, в которой представлены константы диссоциации (Kd), полученные в результате выполнения кинетического анализа методом исключения Sapidyne KinExA® клона моноклонального антитела против IL-6 ВА003(CNTO136), от ВА001 клон 1 до ВА001 клон 10, которые были получены в результате созревании аффинности антитела против IL-6 ВА399.
На фиг.34 показана таблица, в которой представлены данные связывания, полученные при выполнении анализа BiaCore клонов антител против IL-6 ВА399-2, ВА399-5, ВА399-9 и ВА399-10 в результате созревания аффинности антитела против IL-6 ВА399.
На фиг.35 показано ингибирование IL-6/sIL6R-индуцированного фосфорилирования Stat3 в клетках ТНР-1 в результате увеличения концентрации моноклонального антитела против IL-6. Данные нормализованы методом вестерн-блоттинга для всего Stat3.
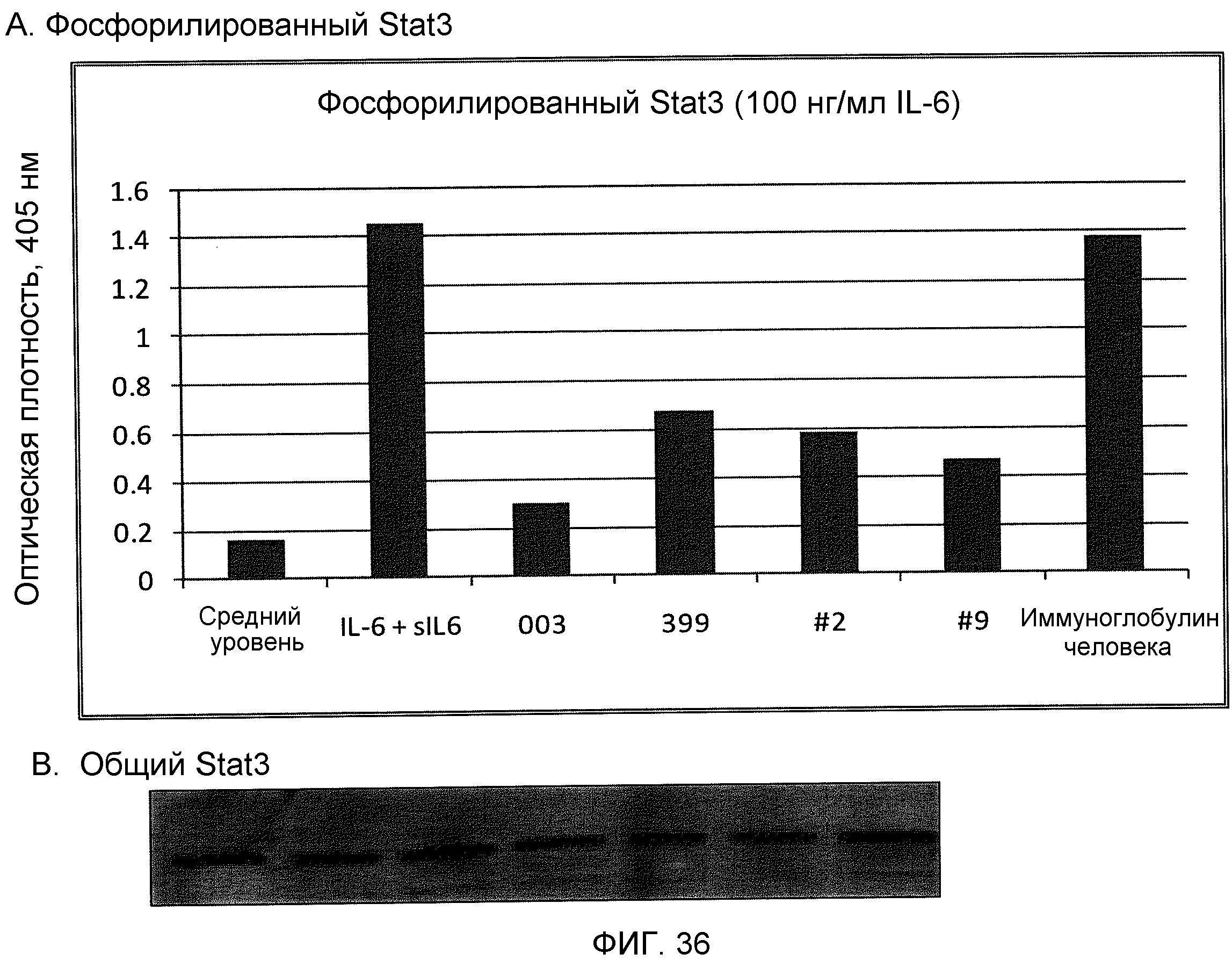
На фиг.36 показано ингибирование фосфорилирования Stat3 в клетках ТНР-1, стимулированного IL-6/sIL-6R, разными моноклональными антителами против IL-6, включающими 003, ВА399, ВА399-2 и ВА399-9, показанными на фиг.(А), при использовании 100 нг/мл IL-6. Вестерн-блоттинг всего Stat3 для каждого состояния показан на фиг.(В).
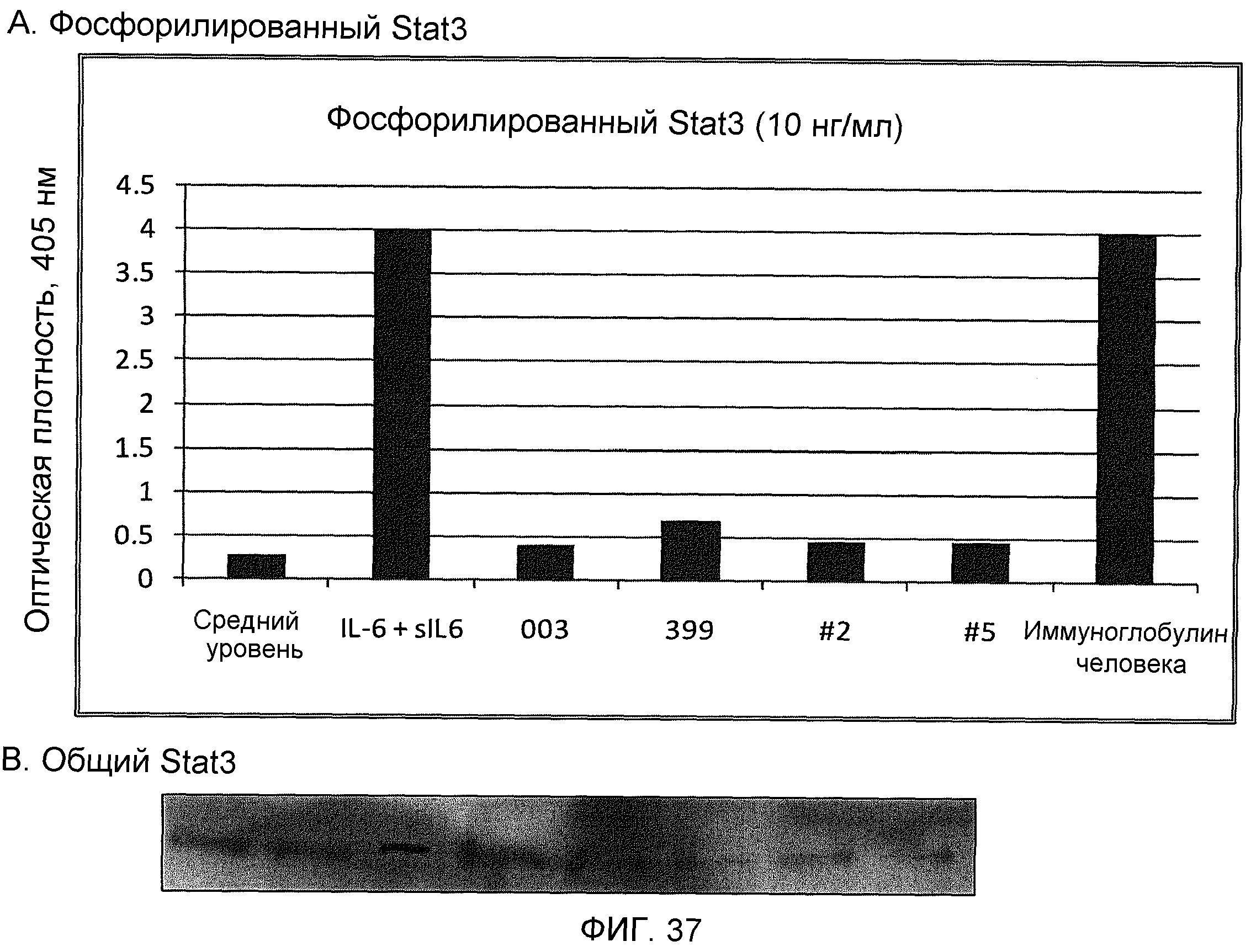
На фиг.37 показано ингибирование фосфорилирования Stat3 в клетках ТНР-1, стимулированного IL-6/sIL-6R, разными моноклональными антителами против IL-6, включающими 003, ВА399, ВА399-2 и ВА399-5, показанными на фиг.(А), при использовании 10 нг/мл IL-6. Вестерн-блоттинг всего Stat3 для каждого состояния показан на фиг.(В).
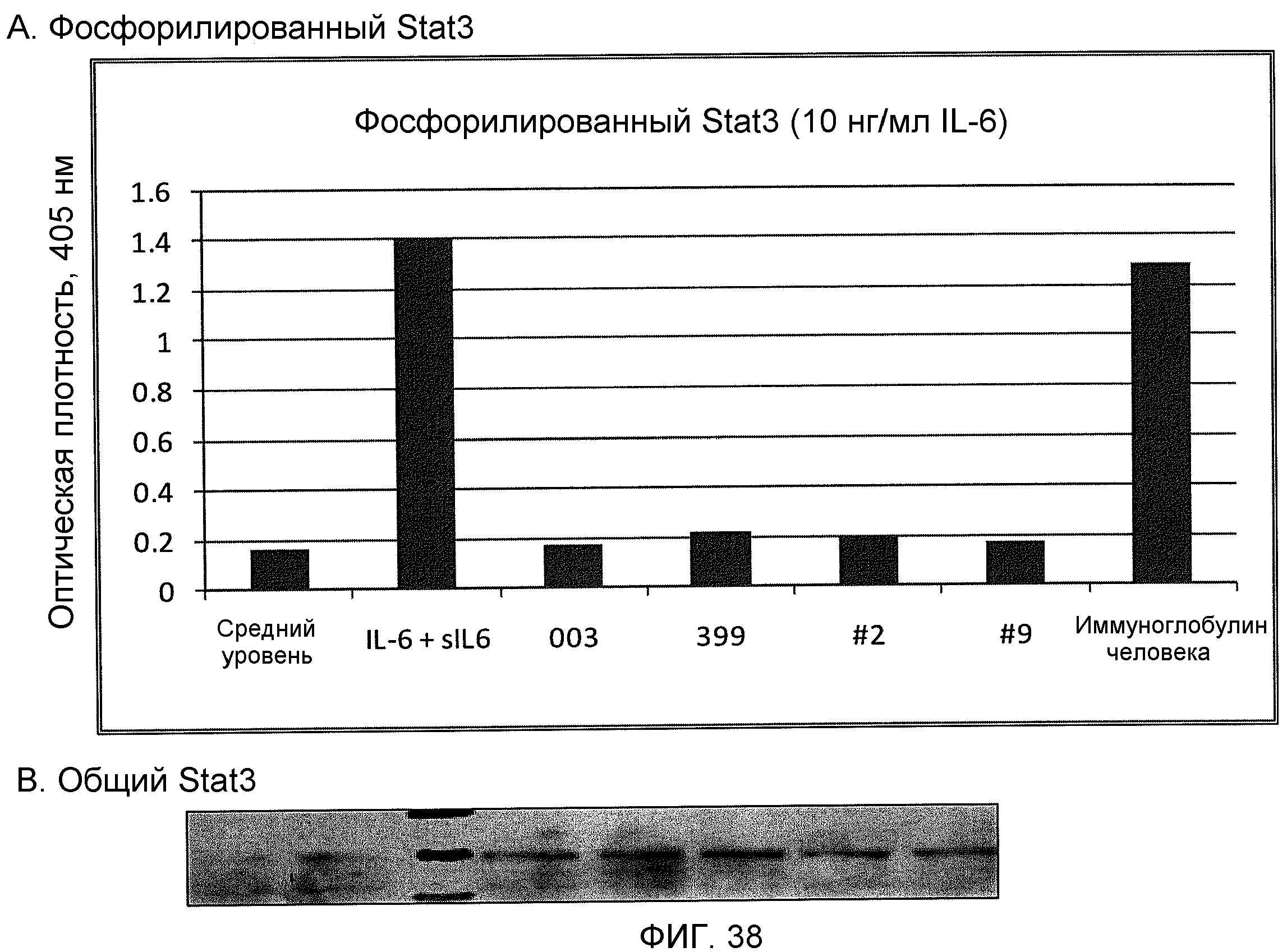
На фиг.38 показано ингибирование фосфорилирования Stat3 в клетках ТНР-1, стимулированного IL-6/sIL-6R, разными моноклональными антителами против IL-6, включающими ВА003, ВА399, ВА399-2 и ВА399-9, показанными на фиг.(А), при использовании 10 нг/мл IL-6. Вестерн-блоттинг всего Stat3 для каждого состояния показан на фиг.(В).
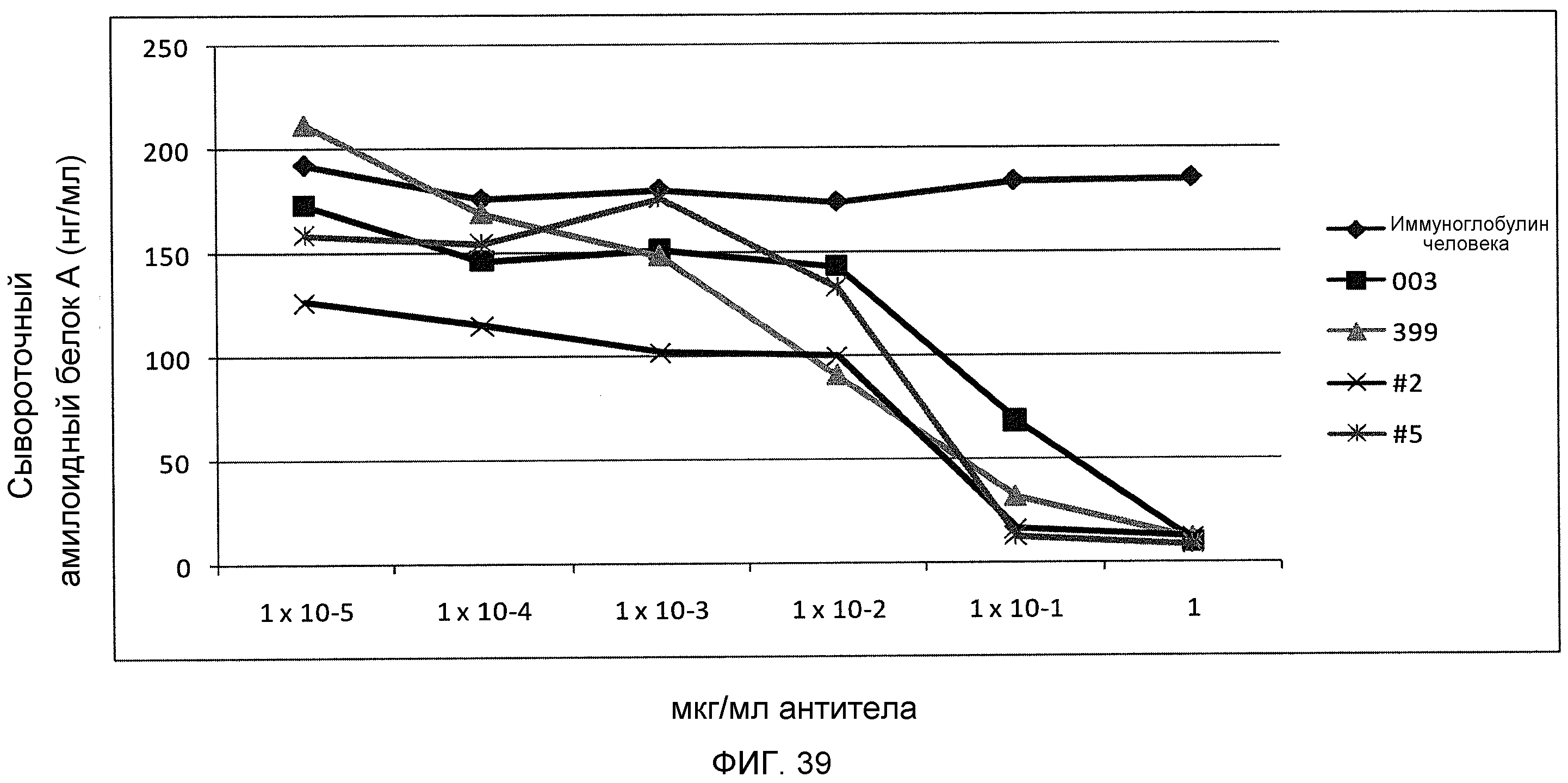
На фиг.39 показано ингибирование продуцирования сывороточного амилоидного белка А клетками HepG2, стимулированного IL-6, sIL-6R и IL-1b человека, путем серийных разведений моноклональных антител против IL-6 CNTO136, ВА399, ВА399-2, ВА399-9 через 24 часа.
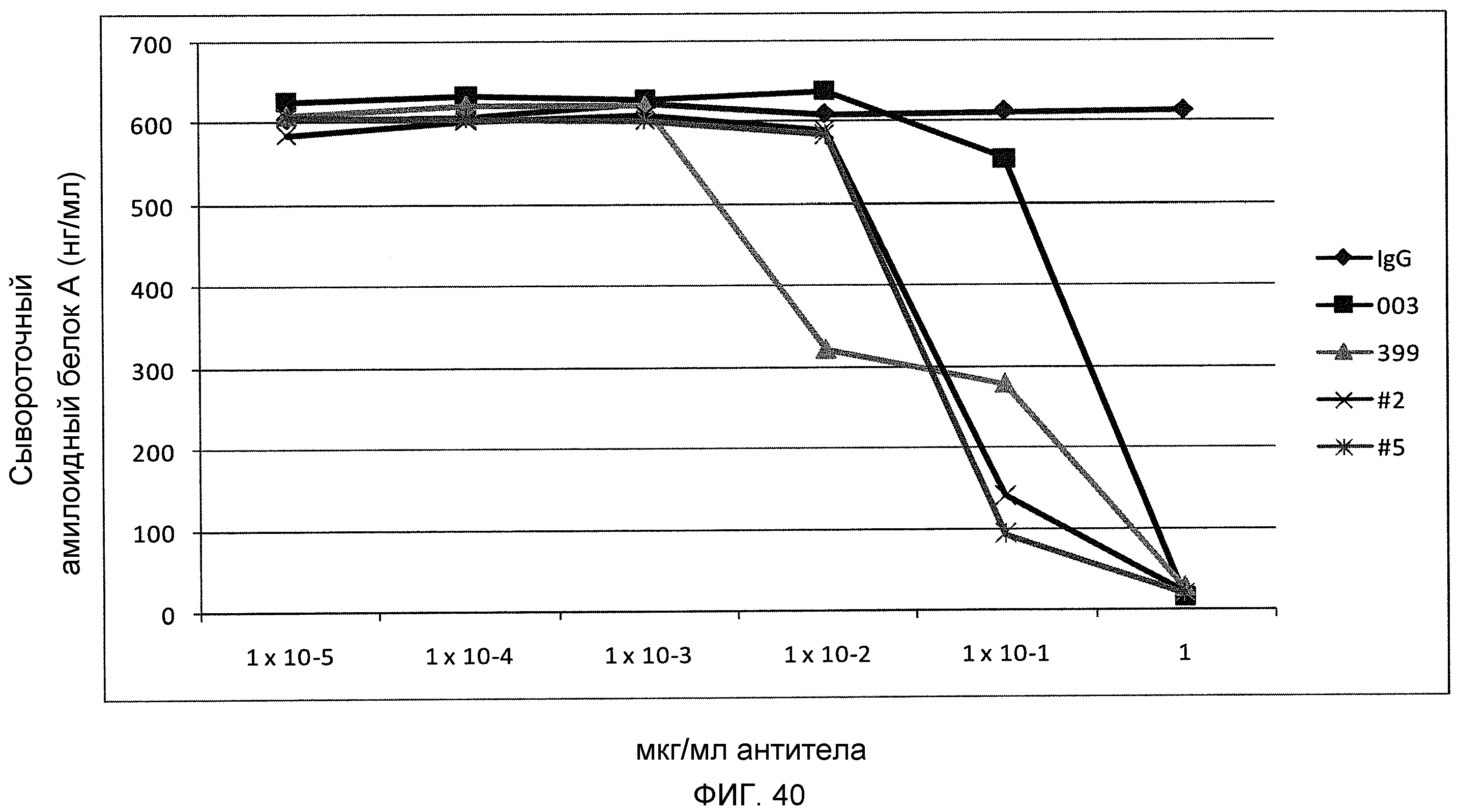
На фиг.40 показано ингибирование продуцирования сывороточного амилоидного белка А клетками HepG2, стимулированного IL-6, sIL-6R и IL-1b человека, путем серийных разведений моноклональных антител против IL-6 CNTO136, ВА399, ВА399-2, ВА399-9 через 48 часов.
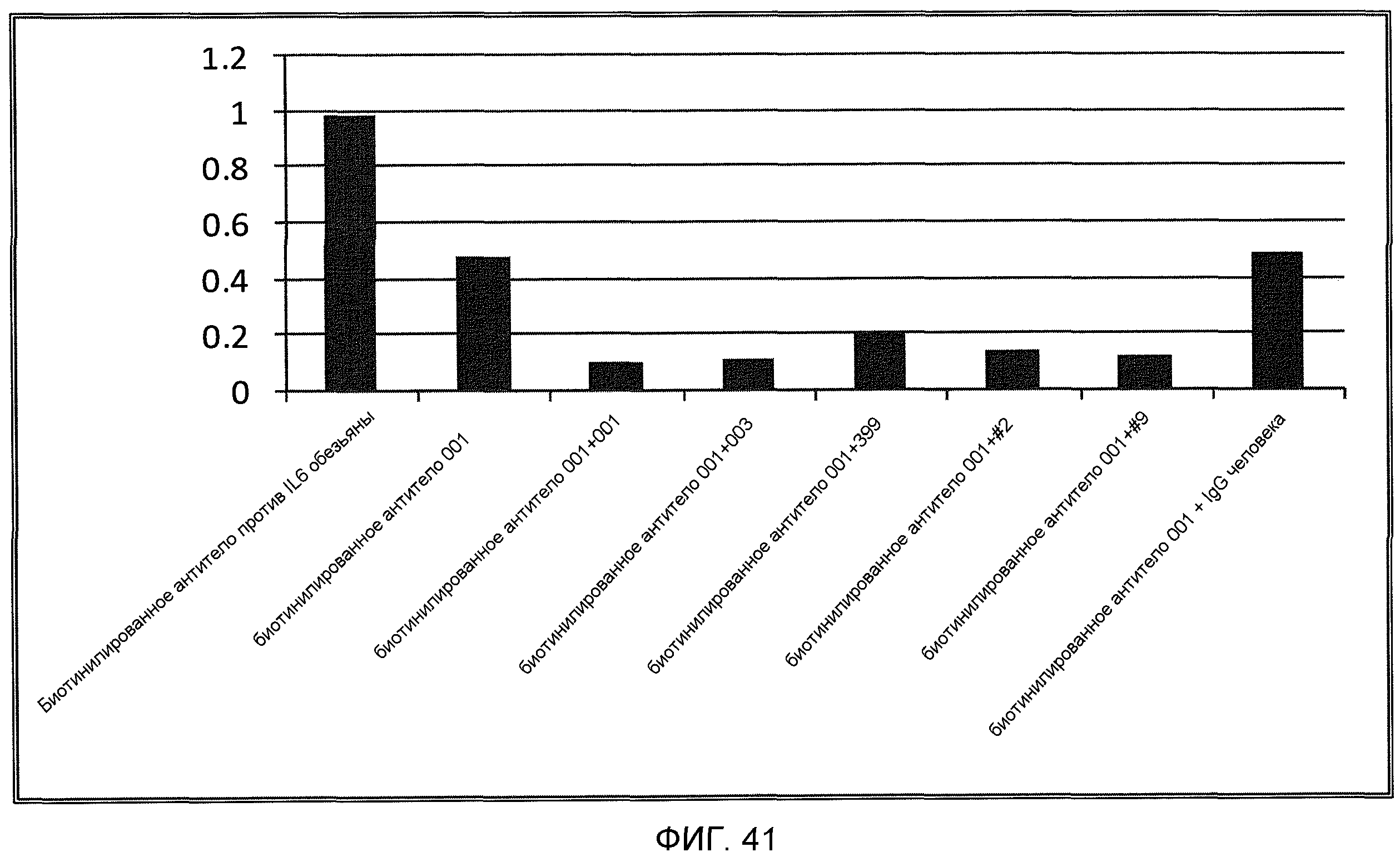
На фиг.41 показана перекрестная реактивность в отношении IL-6 обезьяны биотинилированного моноклонального антитела против IL-6 001 и способность небиотинилированных гуманизированных моноклональных антител против IL-6 ВА001, ВА003, ВА399, ВА399-2 и ВА399-9 блокировать связывание биотинилированного антитела ВА001 с IL-6 обезьяны. В качестве неспецифического антитела использован IgG человека.
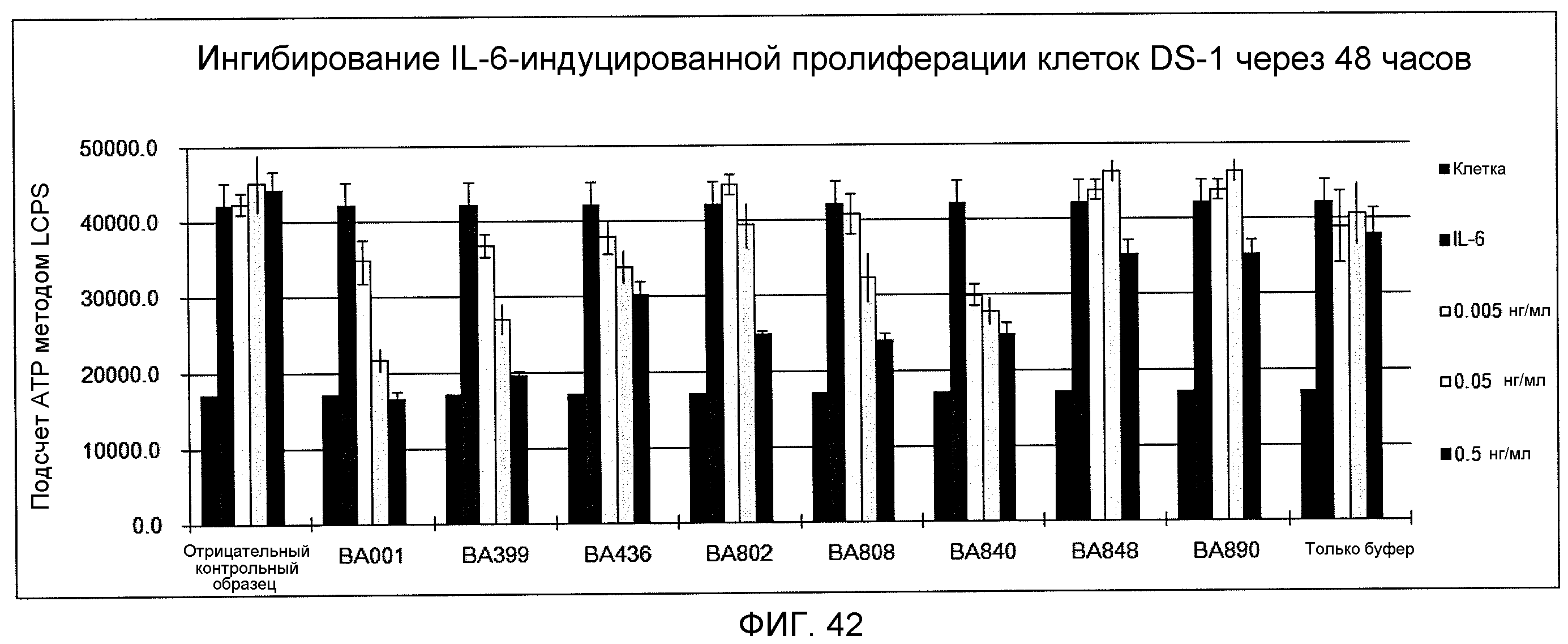
На фиг.42 показано ингибирование IL-6-индуцированной пролиферации клеток DS-1 через 48 часов моноклональными антителами против IL-6 ВА001, ВА399, ВА436, ВА802, ВА808, ВА840, ВА848 и ВА890.
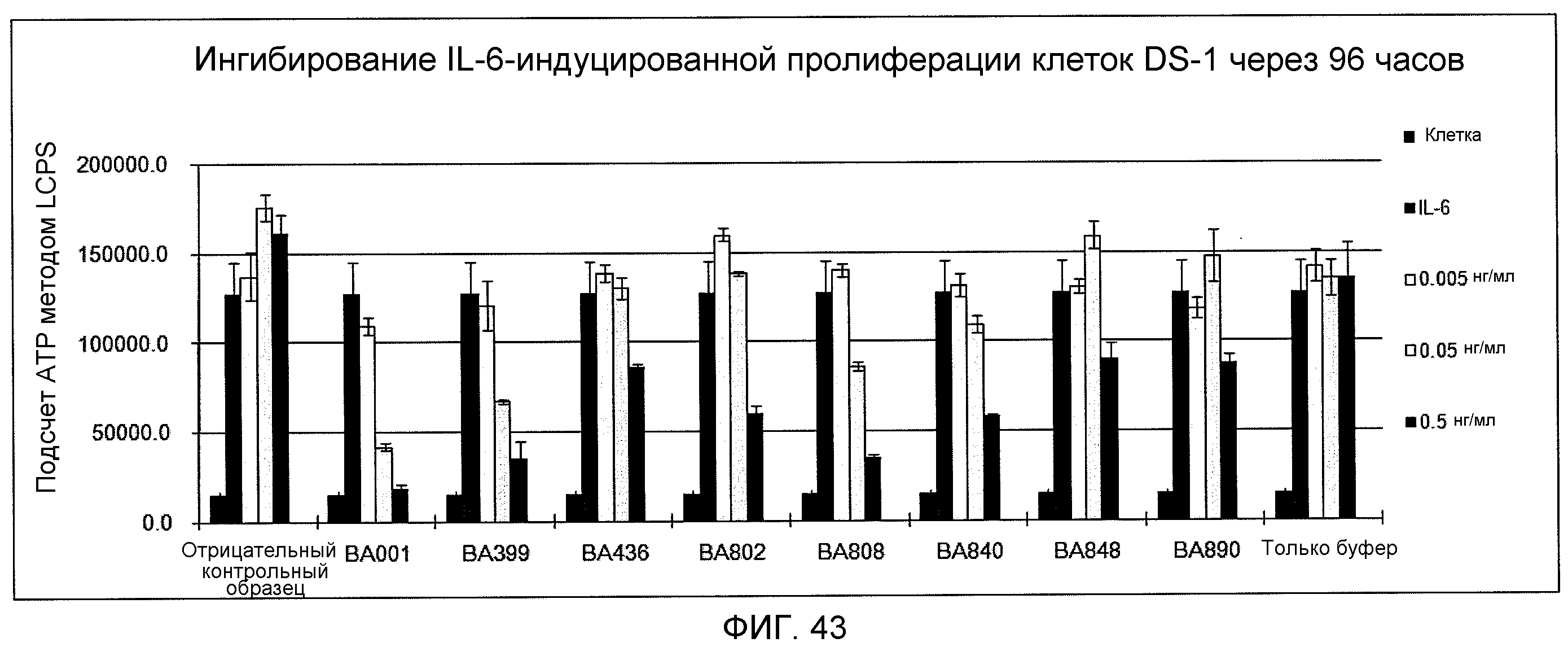
На фиг.43 показано ингибирование IL-6-индуцированной пролиферации клеток DS-1 через 96 часов моноклональными антителами против IL-6 ВА001, ВА399, ВА436, ВА802, ВА808, ВА840, ВА848 и ВА890.
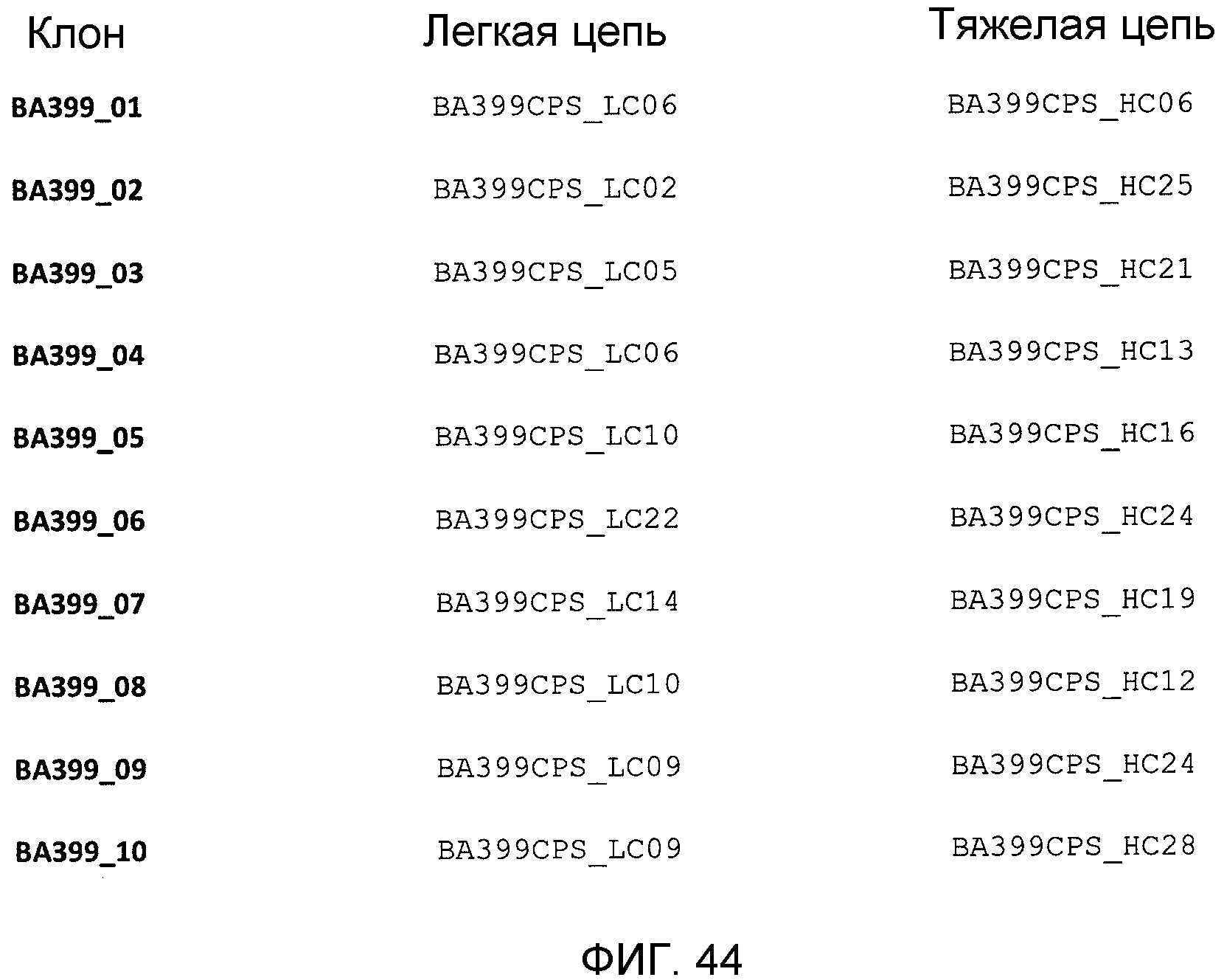
На фиг.44 показаны комбинации легких цепей и тяжелых цепей, используемые в 10 лучших клонах, полученных в результате созревании аффинности методом CPS моноклонального антитела против IL-6 ВА399. Соответствующие аминокислотные последовательности и SEQ ID NO для легких цепей и тяжелых цепей показаны соответственно на фиг.17-19 и фиг.25-28.
Подробное описание изобретения
Ссылки
Все публикации или патенты, приведенные при описании изобретения, полностью включены в настоящее описание изобретения в качестве ссылки, так как они показывают уровень техники на момент создания настоящего изобретения и/или описывают и определяют возможности настоящего изобретения. Публикации представляют собой любые научные публикации или публикации патентов, а также любую другую информацию, доступную в любых средствах информации, включая все записанные, электронные или печатные формы. Следующие материалы полностью включены в настоящее описание изобретения в качестве ссылки: Ausubel, et al., ed., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., NY, N.Y. (1987-2001); Sambrook, et al., Molecular Cloning: A Laboratory Manual, 2.sup.nd Edition, Cold Spring Harbor, N.Y. (1989); Harlow and Lane, Antibodies, a Laboratory Manual, Cold Spring Harbor, N.Y. (1989); Colligan, et al., eds., Current 20 Protocols in Immunology, John Wiley & Sons, Inc., NY (1994-2001); Colligan et al., Current Protocols in Protein Science, John Wiley & Sons, NY, N.Y., (1997-2001).
Коды аминокислот
Аминокислоты, образующие антитела против IL-6 по настоящему изобретению, часто имеют сокращенные обозначения. Аминокислоты могут быть определены однобуквенным кодом, трехбуквенным кодом, названием или кодоном из трех нуклеотидов, и такие обозначения хорошо известны в данной области (смотрите публикацию Alberts, B., et al., Molecular Biology of The Cell, Third Ed., Garland Publishing, Inc., New York, 1994).
Определения терминов
В используемом здесь значении термины “антитело против интерлейкина 6", “антитело против IL-6", “часть антитела против IL-6" или “фрагмент антитела против IL-6" и/или “вариант антитела против IL-6" и подобные термины означают любую молекулу, содержащую белок или пептид, которая включает по меньшей мере часть молекулы иммуноглобулина, содержащую по меньшей мере одну область, определяющую комплементарность (CDR) тяжелой или легкой цепи или ее лигандсвязывающую часть, выделенную по меньшей мере из одного гуманизированного моноклонального антитела ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890 или ВА939, в комбинации с вариабельной областью тяжелой или легкой цепи, константной областью тяжелой или легкой цепи, каркасной областью или любой их частью, полученными предпочтительно у человека, а не у мыши, которые могут быть введены в антитело по настоящему изобретению. Альтернативно термин "антитело против IL-6" означает вместе или отдельно гуманизированные моноклональные антитела ВА399, ВА436, ВА802, ВА840, ВА848, ВА890 и ВА939. Такое антитело может модулировать, уменьшать, оказывать антагонистическое воздействие, смягчать, ослаблять, блокировать, ингибировать, подавлять и/или препятствовать по меньшей мере одной активности или связыванию IL-6 либо активности или связыванию рецептора IL-6 in vitro, in situ и/или in vivo. В качестве неограничивающего примера можно отметить, что соответствующее антитело против IL-6, его определенная часть или вариант по настоящему изобретению может связываться с высоким сродством с ингибирующим и/или нейтрализующим эпитопом IL-6 человека, узнаваемым по меньшей мере одним моноклональным антителом ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890 или ВА939. Соответствующее антитело против IL-6, его определенная часть или вариант также может воздействовать по меньшей мере на одну активность или функцию IL-6, которые включают, не ограничиваясь ими, синтез РНК, ДНК или белка, высвобождение IL-6, передачу сигнала рецептору IL-6, расщепление мембраны IL-6, активность IL-6, продуцирование и/или синтез IL-6.
В определение термина "антитело" входят антитела, их отщепленные фрагменты, определенные части и варианты, в том числе миметики антител или части антител, имитирующие структуру и/или функцию антитела, его определенного фрагмента или части, включая одноцепочечные антитела и их фрагменты, содержащие по меньшей мере одну CDR-область, выделенную из антитела против IL-6. Функциональные фрагменты включают антигенсвязывающие фрагменты, которые связываются с IL-6 млекопитающего. Например, в объем настоящего изобретения входят фрагменты антител, способные связываться с IL-6 или его частями, которые включают, не ограничиваясь ими, фрагменты Fab (например, получаемый в результате расщепления папаином), Fab' (например, получаемый в результате расщепления пепсином и частичного восстановления) и F(ab')2 (например, получаемый в результате расщепления пепсином), facb (например, получаемый в результате расщепления плазмином), pFc' (например, получаемый в результате расщепления пепсином или плазмином), Fd (например, получаемый в результате расщепления пепсином, частичного восстановления и повторной агрегации), Fv или scFv (например, получаемый методами молекулярной биологии) (смотрите, например, публикацию Colligan, Immunology, выше).
Фрагменты антител могут быть получены путем ферментативного расщепления, методами синтеза или рекомбинантных ДНК, известными в данной области и/или рассмотренными в настоящем описании изобретения. Антитела могут быть также получены в разных усеченных формах при использовании генов антител, в которых один или более терминирующих кодонов введены вверху от природного сайта терминации. Например, может быть создан комбинированный ген, кодирующий часть тяжелой цепи F(ab')2, который включает последовательности ДНК, кодирующие СН1-домен и/или шарнирную область тяжелой цепи. Разные части антител могут быть соединены стандартными химическими методами или могут быть получены в виде смежного белка при помощи методов генетической инженерии.
В используемом здесь значении термины "химерные" антитела, "гуманизированные" антитела или "CDR-привитые" антитела означают любую комбинацию антител против IL-6 по настоящему изобретению или любую CDR, выделенную из таких антител и объединенную с одним или более белками или пептидами, выделенными предпочтительно из человеческого антитела, а не мышиного антитела. В соответствии с настоящим изобретением химерные или гуманизированные антитела включают такие антитела, в которых CDR-области выделены из одного или более антител против IL-6 по настоящему изобретению, и по меньшей мере часть или остальная часть антитела выделена из одного или более человеческих антител. Таким образом, человеческая часть антитела может включать каркасную область, CL, CH домены (например, СН1, СН2, СН3), шарнирную область, (VL, VH) области, которые по существу не являются иммуногенными у человека. Области антитела, выделяемые из человеческих антител, необязательно должны быть на 100% идентичны человеческим антителам. В предпочтительном варианте осуществления изобретения может быть оставлено как можно больше аминокислотных остатков человека для максимального уменьшения иммуногенности, но человеческие остатки при необходимости могут быть модифицированы для сохранения антигенсвязывающего центра, образованного CDR-областью, при одновременной максимальной гуманизации антитела. Такие изменения или вариации необязательно и предпочтительно сохраняют или уменьшают иммуногенность в организме человека или других видах по сравнению с немодифицированными антителами. Следует отметить, что гуманизированное антитело может быть продуцировано животным, отличным от человека, прокариотической или эукариотической клеткой, способной функционально экспрессировать реаранжированные гены иммуноглобулина человека (например, тяжелой цепи и/или легкой цепи). Кроме того, антитело, являющееся одноцепочечным антителом, может включать линкерный пептид, отсутствующий в нативных человеческих антителах. Например, Fv может включать линкернный пептид, состоящий из примерно двух - примерно восьми остатков глицина или других аминокислот, который соединяет вариабельную область тяжелой цепи и вариабельную область легкой цепи. Такие линкерные пептиды должны быть получены у человека.
Антитело может быть гуманизировано путем синтеза комбинаторной библиотеки, включающей шесть CDR-областей моноклонального антитела-мишени, отличного от человеческого, гибридизированного в рамке считывания с несколькими отдельными человеческими остовами. Может быть использована библиотека человеческих остовов, содержащая гены, типичные для всех известных зародышевых генов тяжелой и легкой цепей человека. Полученные комбинаторные библиотеки затем могут быть исследованы на связывание с представляющими интерес антигенами. Данный подход позволяет выбрать наиболее благоприятные комбинации полностью человеческих остовов с точки зрения сохранения активности связывания с исходным антителом. Гуманизированные антитела затем могут быть оптимизированы разными методами.
Гуманизация антитела может быть использована для превращения мышиных антител или других антител, отличных от человеческих, в "полностью человеческие" антитела. Полученное антитело содержит только человеческую последовательность при отсутствии последовательности мышиного антитела или антитела, отличного от человеческого, сохраняя при этом сродство связывания и специфичность, присущие исходному антителу.
Термин "широкая позиционная эволюция" (СРЕ™) использован для описания метода эволюционирования антитела, который может быть использован для объединения методов широкого мутагенеза, перестановки экзонов и синтеза с целью усиления одного или более свойств и характеристик связывания антитела. Метод СРЕ обеспечивает широкое картирование эффектов in vivo, вызываемых изменением отдельных кодонов в белке для всех 63 возможных изменений кодонов в каждом положении белка. Указанный метод широкого мутагенеза позволяет быстро создать варианты антитела путем исследовангия замен аминокислот в каждом положении последовательности вариабельного домена антитела.
Термин "комбинаторный синтез белков" (CPS™) использован для описания методов комбинаторного синтеза белков, которые могут быть использованы для оптимизации требуемых характеристик антител путем объединения их лучших свойств в новом высокоактивном антителе. Метод CPS™ может быть использован после выполнения СРЕ™ с целью последующего создания и отбора in vivo всех перестановок улучшенных кодонов для идентификации оптимальной комбинации или совокупности изменений кодонов в белке или антителе. Комбинация указанных методов может значительнго расширить совокупность исследуемых вариантов антител и значительно увеличить вероятность обнаружения антител с одной или более улучшенными характеристиками, такими как сродство связывания, специфичность, термостойкость, уровень экспрессии, эффекторная функция, гликозилирование и растворимость.
Иммуноглобулиновые гены для непроцессированных молекул антител могут быть получены из геномной ДНК или мРНК линий клеток гибридомы. Тяжелые и легкие цепи антитела могут быть клонированы в системе векторов млекопитающих. Сборку подтверждают, выполняя анализ двухцепочечной последовательности. Конструкция антитела может быть экспрессирована в других линиях клеток-хозяев человека или млекопитающих. Указанная конструкция затем может быть подтверждена методом временной трансфекции и вестерн-блоттинга экспрессированного антитела, представляющего интерес. Устойчивые линии клеток, обладающие наибольшей продуктивностью, могут быть выделены и исследованы при помощи экспресс-анализов.
Термин "созревание аффинности" означает увеличение среднего уровня сродства антитела по мере формирования иммунной реакции в отношении антигена. В природе созревание аффинности может происходить после неоднократного воздействия антигена. Особенно предпочтительный тип замещенного варианта включает замену одного или более остатков гипервариабельного участка исходного антитела (например, человеческого антитела). Полученные варианты, отобранные для дальнейшей разработки, должны обладать лучшими биологическими свойствами по сравнению с исходным антителом, из которого они были получены. Общепринятый способ создания таких замещенных вариантов включает созревание аффинности при помощи методов, рассмотренных в настоящем описании изобретения, или других методов, известных специалисту в данной области, таких как, например, отображение на фаге (Schier R., J. Mol. Biol., 263:551-67, 1996). Указанные варианты затем исследуют в отношении биологической активности (например, сродства связывания), например, при помощи анализа Biacore, рассмотренного в настоящем описании изобретения. Для идентификации остатков гипервариабельного участка, которые могут быть хорошими кандидатами для модификации, может быть выполнен мутагенез путем сканирования аланином, который позволяет идентифицировать остатки гипервариабельного участка, в значительной степени способствующие связыванию с антигеном. Антитела, демонстрирующие лучшие свойства при выполнении одного или более соответствующих анализов, могут быть использованы для дальнейшей разработки.
Термин "эффективное количество" означает количество антитела против IL-6 или его фрагмента, которое позволяет эффективно лечить или предотвратить нарушение в живом организме при введении в течение определенного периода времени, например, оказывает терапевтический эффект в течение предписанного времени введения лекарственного средства.
Термин "лечение" означает: (1) предотвращение или задержку возникновения клинических симптомов нарушения или состояния у животного, которое может быть предрасположено к возникновению такого нарушения или состояния, но еще не испытывает клинических или субклинических симптомов указанного нарушения или состояния; (2) ингибирование нарушения или состояния (то есть подавление, уменьшение или замедление развития заболевания или рецидива в случае поддерживающего лечения по меньшей мере одного клинического или субклинического симптома); и/или (3) ослабление нарушения (то есть регресс нарушения или состояния либо по меньшей мере одного из клинических или субклинических симптомов). Благоприятное воздействие, оказываемое на подвергаемого лечению субъекта, может быть статистически значимым или по меньшей мере заметным для субъекта или лечащего врача.
Используемый в настоящем описании изобретения в связи с измеренным количеством термин "примерно" означает нормальное отклонение измеренного количества, ожидаемое квалифицированным специалистом, производящим измерение с необходимой тщательностью, соответствующей цели измерения и точности используемого измерительного устройства. За исключением особо оговоренных случаев термин "примерно" означает отклонение полученного значения на ±10%.
Антитела по настоящему изобретению
В соответствии с настоящим изобретением антитела против IL-6 включают любые антитела ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890 или ВА939 или антитело, в котором вариабельная область или CDR-области выделены из любого антитела ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890 или ВА939 и остов и константные области антитела происходят из одного или более человеческих антител. Вариабельная область или CDR-области, выделенные из антитела, предпочтительно от примерно 90% до примерно 100% идентичны вариабельной области или CDR-областям любого антитела ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890 или ВА939, несмотря на наличие любых и всех модификаций, включающих замены, инсерции и делеции, если химерное антитело сохраняет способность связываться и ингибировать IL-6. Области химерных, гуманизированных или CDR-привитых антител, выделенные из человеческих антител, не обязательно должны быть на 100% идентичны человеческим антителам. В предпочтительном варианте осуществления изобретения сохранено как можно больше аминокислотных остатков человека, чтобы свести к минимуму иммуногенность, но человеческие остатки, в частности, остатки каркасной области, заменены в соответствии с требованиями и положениями настоящего изобретения. Такие модификации необходимы для сохранения антигенсвязывающего центра, образованного CDR-областями, при одновременной максимальной гуманизации антитела.
Последовательности нуклеиновых кислот и выделенные аминокислотные последовательности вариабельных областей (легкая и тяжелая цепь) антител против IL-6 по настоящему изобретению показаны на фиг.1-8. Последовательности вариабельных областей легкой и тяжелой цепей антитела ВА001 показаны на фиг.9. Последовательности нуклеиновых кислот и аминокислотные последовательности вариабельных областей легкой и тяжелой цепей, полученные в результате созревания аффинности антитела ВА399, показаны на фиг.12-28. Сравнительные анализы последовательностей вариабельных областей легкой и тяжелой цепей показаны соответственно на фиг.30 и 31. Все вариабельные области тяжелой и легкой цепей содержат три CDR-области, которые совместно образуют антигенсвязывающий центр. Три CDR-области окружены четырьмя каркасными областями, которые в основном поддерживают CDR-области. Последовательности CDR-областей в последовательностях вариабельных областей тяжелой и легкой цепей можно идентифицировать при помощи сравнительного анализа, выполняемого с использованием компьютера, по методу Кабата и др., описанному в публикации Kabat et al. (1987) in Sequences of Proteins of Immunological Interest, 4th ed., United States Department of Health and Human Services, U.S. Government Printing Office, Washington, D.C. или путем молекулярного моделирования вариабельных областей, например, с использованием программы ENCAD, описанной в публикации Levitt (1983) J. Mol. Biol. 168:595.
В предпочтительном варианте осуществления изобретения CDR-области выделяют из любого антитела ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890 или ВА939. Специалисту в данной области должны быть известны методы определения CDR-областей тяжелой цепи и легкой цепи. Смотрите, например, сайт http://www.bioinf.org.uk/abs/.
Последовательности CDR-областей антитела против IL-6 могут быть модифицированы при помощи инсерций, замен и делеций с сохранением способности CDR-привитого антитела связываться и ингибировать IL-6 человека. Квалифицированный специалист может убедиться в сохранении данной активности в результате выполнения функциональных анализов, рассмотренных ниже в настоящем описании изобретения.
Альтернативно вся вариабельная область тяжелой цепи и вариабельная область легкой цепи любого антитела ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890 или ВА939 может быть объединена с константной и каркасной областями человека с образованием химерного антитела по настоящему изобретению. Аминокислотные последовательности вариабельной области легкой и тяжелой цепей, соответствующие одному объекту настоящего изобретения, которые были использованы в десяти лучших клонах моноклонального антитела против IL-6 ВА399, полученных в результате созревания аффинности, показаны на фиг.44. Клон ВА399-01 включает легкую цепь BA399CPS-LC06 (SEQ ID NO:72) и тяжелую цепь BA399CPS-HC06 (SEQ ID NO:134). Клон ВА399-02 включает легкую цепь BA399CPS-LC02 (SEQ ID NO:68) и тяжелую цепь BA399CPS-HC25 (SEQ ID NO:153). Клон ВА399-03 включает легкую цепь BA399CPS-LC05 (SEQ ID NO:71) и тяжелую цепь BA399CPS-HC21 (SEQ ID NO:149). Клон ВА399-04 включает легкую цепь BA399CPS-LC06 (SEQ ID NO:72) и тяжелую цепь BA399CPS-HC13 (SEQ ID NO:141). Клон ВА399-05 включает легкую цепь BA399CPS-LC10 (SEQ ID NO:76) и тяжелую цепь BA399CPS-HC16 (SEQ ID NO:144). Клон ВА399-06 включает легкую цепь BA399CPS-LC22 (SEQ ID NO:88) и тяжелую цепь BA399CPS-HC24 (SEQ ID NO:152). Клон ВА399-07 включает легкую цепь BA399CPS-LC14 (SEQ ID NO:80) и тяжелую цепь BA399CPS-HC19 (SEQ ID NO:147). Клон ВА399-08 включает легкую цепь BA399CPS-LC10 (SEQ ID NO:76) и тяжелую цепь BA399CPS-HC12 (SEQ ID NO:140). Клон ВА399-09 включает легкую цепь BA399CPS-LC09 (SEQ ID NO:75) и тяжелую цепь BA399CPS-HC24 (SEQ ID NO:152). Клон ВА399-10 включает легкую цепь BA399CPS-LC09 (SEQ ID NO:75) и тяжелую цепь BA399CPS-HC28 (SEQ ID NO:156).
Человеческие гены, кодирующие константные (С) области гуманизированных антител, их фрагментов и областей по настоящему изобретению, могут быть выделены из библиотеки плодной печени человека известными методами. Гены С-области человека могут быть выделены из любой человеческой клетки, включая клетки, экспрессирующие и продуцирующие иммуноглобулины человека. СН-область человека может быть выделена из тяжелых цепей человека любых известных классов или изотипов, включая γ, μ, α, δ, ε и их подтипы, такие как G1, G2, G3 и G4. Так как изотип тяжелой цепи отвечает за разные эффекторные функции антитела, выбор СН-области должен определяться требуемыми эффекторными функциями, такими как фиксация комплемента или активность в антителозависимой клеточно-опосредованной цитотоксичности (ADCC). СН-область предпочтительно выделяют из иммуноглобулина гамма 1 (IgG1).
CL-область человека может быть выделена из легкой цепи человека изотипа каппа или лямбда, предпочтительно каппа.
Гены, кодирующие С-области иммуноглобулина человека, получают из человеческих клеток стандартными методами клонирования (Sambrook, et al. (Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor Press, Cold Spring Harbor, N.Y. (1989) and Ausubel et al., eds. Current Protocols in Molecular Biology (1987-1993)). Гены С-области человека могут быть легко получены из известных клонов, содержащих гены, представляющие два класса легких цепей, пять классов тяжелых цепей и их подклассы. Фрагменты химерного антитела, такие как F(ab')2 и Fab, могут быть получены путем создания химерного гена тяжелой цепи, усеченного соответствующим образом. Например, химерный ген, кодирующий часть тяжелой цепи F(ab')2-фрагмента, должен включать последовательности ДНК, кодирующие СН1 домен и шарнирную область тяжелой цепи, и последующий кодон терминации трансляции с образованием усеченной молекулы.
Гуманизированные антитела, их фрагменты и области по настоящему изобретению обычно получают путем клонирования сегментов ДНК, кодирующих антигенсвязывающие области тяжелой и легкой цепей специфического антитела против IL-6, и соединения указанных сегментов ДНК с сегментами ДНК, включающими соответственно СН и CL области, с образованием непроцессированных химерных генов, кодирующих иммуноглобулин.
Последовательности вариабельных областей антитела могут быть модифицированы путем инсерций, замен и делеций с сохранением способности химерного антитела связываться и ингибировать IL-6 человека. Квалифицированный специалист может убедиться в сохранении данной активности в результате выполнения функциональных анализов, рассмотренных ниже в настоящем описании изобретения. Вариабельные области могут быть от примерно 50% до примерно 100% гомологичны вариабельным областям SEQ ID NO:1-32. В предпочтительном варианте осуществления изобретения вариабельные области антитела от примерно 80% до примерно 100% гомологичны вариабельным областям SEQ ID NO:1-32 и 37-160. В более предпочтительном варианте осуществления изобретения вариабельные области от примерно 90% до примерно 100% гомологичны вариабельным областям SEQ ID NO:1-32 и 37-160.
В одном конкретном объекте изобретения предпочтительные моноклональные антитела против IL-6 по настоящему изобретению включают вариабельные области легкой цепи, аминокислотные последовательности которых на 95%, 96%, 97%, 98% или 99% гомологичны SEQ ID NO:1, и далее включают вариабельные области тяжелой цепи, аминокислотные последовательности которых на 95%, 96%, 97%, 98% или 99% гомологичны SEQ ID NO:3.
В одном конкретном объекте изобретения предпочтительные моноклональные антитела против IL-6 по настоящему изобретению включают вариабельную область легкой цепи, выбираемую из SEQ ID NO:68-98. В другом конкретном объекте изобретения предпочтительные моноклональные антитела против IL-6 по настоящему изобретению включают вариабельную область легкой цепи, выбираемую из SEQ ID NO:68, 71, 72, 75, 76, 80 и 88.
В другом конкретном объекте изобретения предпочтительные моноклональные антитела против IL-6 по настоящему изобретению включают вариабельную область тяжелой цепи, выбираемую из SEQ ID NO:130-160. В другом конкретном объекте изобретения предпочтительные моноклональные антитела против IL-6 по настоящему изобретению включают вариабельную область тяжелой цепи, выбираемую из SEQ ID NO:134, 140, 141, 144, 147, 149, 152, 153 и 156.
Методы создания или гуманизации антител, отличных от человеческих, или человеческих антител хорошо известны в данной области. Гуманизированное или искусственно созданное антитело содержит один или более аминокислотных остатков, полученных из источника, отличного от человека, который включает, не ограничиваясь ими, мышь, крысу, кролика, примата кроме человека или другого млекопитающего. Такие аминокислотные остатки человека часто определяются как "импортные" остатки, которые обычно получают из "импортного" вариабельного, константного или другого домена известной последовательности человека. Известные последовательности Ig человека представлены, например, на сайтах http://www.ncbi.nlm.nih.gov/entrez/query.fcgi; http://www.atcc.org/phage/hdb.html; http://www.sciquest.com/; http://www.abcam.com/; http://www.antibodyresource.com/onlinecomp.html; http://www.public.iastate.edu/.about.pedro/researchtools.html; www.mgen.uni-http://heidelberg.de/SD/IT/IT.html; www.whfreeman.com/immunology/CH05/kuby05.htm; www.library.thinkquest.org/12429/Immune/Antibody.html; www.hhmi.org/grants/lectures/1996/vlab/; ; ; . www.immunologylink.com/; pathbox.wustl.edu/.abouthcenter/index.html;
http://www.biotech.ufl.edu/.about.hcl/; http://www.pebio.com/pa/340913/340913.html; http://www.nal.usda.gov/awic/pubs/antibody/; http://www.m.ehime-u.ac.jp/.about.yasuhito/Elisa.html; http://www.biodesign.com/table.asp; http://www.icnet.uk/axp/facs/davies/links.html; http://www.biotech.ufl.edu/.about.fccl/protocol.html; www.http://isac-net.org/sites_geo.html; aximt1.imt.uni-marburg.de/.about.rek/AEPStart.html; baserv.uci.kun.nl/.about.jraats/linksl.html; http://www.recab.uni- http://hd.de/immuno.bme.nwvu.edu/; http://www.mrc-cpe.cam.ac.uk/imt- doc/public/INTRO.html; http://www.ibt.unam.mx/vir/V_mice.html; imgt.cnusc.fr:8104/; http://www.biochem.ucl.ac.uk/.about.martin/abs/index.html; http://antibody.bath.ac.uk/; http://abgen.cvm.tamu.edu/lab/wwwabgen.hrml; http://www.unizh.ch/.about.honegger/AHOseminar/SlideOl.html; http://www.cryst.bbk.ac.uk/.about.ubcg07s/; http://www.nimr.mrc.ac.uk/CC/ccaewg/ccaewg.htm; www.path.cam.http://ac.uk/.about.mrc7/humanisation/TAHHP.html; http://www.ibt.unam.mx/vir/structure/stat_aim.html; http://www.biosci.missouri.edu/smithgp/index.html; http://www.cryst.bioc.cam.ac.uk/.about.fmolina/Web-pages/Pept/spottech.html; http://www.jerini.de/fr_products.htm; www.patents.ibm.con/ibm.html. Kabat et al. Sequences of Proteins of Immunological Interest, U.S. Dept. Health (1983), которые полностью включены в настоящее описание изобретения в качестве ссылки.
Такие импортированные последовательности могут быть использованы для уменьшения иммуногенности или ослабления, усиления или модификации связывания, сродства, активности, авидности, специфичности, времени полужизни или любых других требуемых характеристик, известных в данной области. Обычно сохраняют часть или все отличные от человеческих или человеческие последовательности CDR, в то время как отличные от человеческих последовательности вариабельной и константной областей заменяют человеческими или другими аминокислотами. Антитела могут быть также необязательно гуманизированы с сохранением высокого сродства к антигену и других благоприятных биологических свойств. Для достижения указанной цели гуманизированные антитела могут быть необязательно получены в результате выполнения анализа исходных последовательностей и разных концептуальных гуманизированных продуктов при использовании трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулина являются общедоступными и известны специалистам в данной области. Существуют компьютерные программы, которые иллюстрируют и отображают вероятные трехмерные конформационные структуры выбранных последовательностей иммуноглобулина-кандидата. Такие изображения позволяют анализировать вероятную роль остатков в функционировании последовательности иммуноглобулина-кандидата, то есть произвести анализ остатков, влияющих на способность иммуноглобулина-кандидата связываться с его антигеном. Таким образом могут быть выбраны и объединены остатки каркасной области, выделенные из консенсусных и импортных последовательностей, с достижением требуемой характеристики антитела, такой как более высокое сродство к антигену-мишени. Остатки CDR обычно непосредственно и существенно влияют на связывание с антигеном. Антитела по настоящему изобретению могут быть гуманизированы или созданы любыми известными методами, которые включают, не ограничиваясь ими, методы, описанные в публикациях Winter (Jones et al., Nature 321:522 (1986); Riechmann et al., Nature 332:323 (1988); Veihoeyen et al., Science 239:1534 (1988)), Sims et al., J. Immunol. 151: 2296 (1993); Chothia and Lesk, J. Mol. Biol. 196:901 (1987), Carter et al., Proc. Natl. Acad. Sei. U.S.A. 89:4285 (1992); Presta et al., J. Immunol. 151:2623 (1993), патенты США №№ 5723323, 5976862, 5824514, 5817483, 5814476, 5763192, 5723323, 5766886, 5714352, 6204023, 6180370, 5693762, 5530101, 5585089, 5225539, 4816567, PCT/: US98/16280, US96/18978, US91/09630, US91/05939, US94/01234, GB89/01334, GB91/01134, GB92/01755; WO90/14443, WO90/14424, WO90/14430, EP 229246, которые полностью включены в настоящее описание изобретения в качестве ссылки.
Константная область человека гуманизированного антитела по настоящему изобретению может относиться к любому классу (IgG, IgA, IgM, IgE, IgD и т.д.) или изотипу и может включать легкую каппа- или лямбда-цепь. В одном варианте осуществления изобретения константная область человека включает тяжелую цепь IgG или определенный фрагмент, например, по меньшей мере один из изотипов IgG1, IgG2, IgG3 или IgG4. В другом варианте осуществления изобретения человеческое антитело против IL-6 человека включает тяжелую цепь IgG1 и легкую каппа-цепь IgG1. Выделенные антитела против IL-6 по настоящему изобретению включают также аминокислотные последовательности антитела по настоящему изобретению, кодированные любым приемлемым полинуклеотидом. Антитело или антигенсвязывающий фрагмент предпочтительно связывается с IL-6 человека и частично или существенно нейтрализует по меньшей мере одну биологическую активность белка. Антитело, его определенная часть или вариант частично или предпочтительно существенно нейтрализует по меньшей мере одну биологическую активность по меньшей мере одного белка IL-6 или его фрагмента и, таким образом, ингибирует активности, опосредуемые связыванием IL-6 с рецептором IL-6 или другими IL-6-зависимыми механизмами. В используемом здесь значении теромин "нейтрализующее антитело" означает антитело, которое может ингибировать IL-6-зависимую активность на примерно 20-120%, предпочтительно по меньшей мере на примерно 10, 20, 30, 40, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100% или более в зависимости от выполняемого анализа. Способность антитела против IL-6 ингибировать IL-6-зависимую активность предпочтительно определяют при помощи по меньшей мере одного приемлемого анализа белка или рецептора IL-6, рассмотренного в настоящем описании изобретения и/или известного в данной области.
По меньшей мере одно антитело по настоящему изобретению связывается по меньшей мере с одним определенным эпитопом, специфичным по меньшей мере к одному белку IL-6, его субъединице, фрагменту, части или любой комбинации. По меньшей мере один эпитоп может включать по меньшей мере одну область связывания с антителом, которая включает по меньшей мере одну часть белка, эпитоп которого предпочтительно состоит по меньшей мере из одной внеклеточной, растворимой, гидрофильной, внешней или цитоплазматической части белка. Человеческое антитело или его антигенсвязывающий фрагмент по настоящему изобретению содержит антигенсвязывающую область, которая включает по меньшей мере одну определяющую комплементарность область человека (CDR1, CDR2 и CDR3) или вариант по меньшей мере одной вариабельной области тяжелой цепи и по меньшей мере одну определяющую комплементарность область человека (CDR4, CDR5 и CDR6) или вариант по меньшей мере одной вариабельной области легкой цепи, выделенную из антитела против IL-6 по настоящему изобретению. В одном конкретном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может содержать антигенсвязывающую область, включающую по меньшей мере часть по меньшей мере одной CDR тяжелой цепи (то есть CDR1, CDR2 и/или CDR3), которая имеет аминокислотную последовательность соответствующих CDR-областей 1, 2 и/или 3. В другом конкретном варианте осуществления изобретения антитело, его антигенсвязывающая часть или вариант может содержать антигенсвязывающую область, включающую по меньшей мере часть по меньшей мере одной CDR-области легкой цепи (то есть CDR4, CDR5 и/или CDR6), которая имеет аминокислотную последовательность соответствующих CDR 4, 5 и/или 6. В предпочтительном варианте осуществления изобретения три CDR-области тяжелой цепи и три CDR-области легкой цепи антитела или его антигенсвязывающего фрагмента имеют аминокислотную последовательность соответствующей CDR-области по меньшей мере одного антитела ВА399, ВА436, ВА802, ВА808, ВА840, ВА848, ВА890 или ВА939. Такие антитела могут быть получены путем химического связывания разных частей (например, CDR-областей, каркасной области) антитела при помощи стандартных методов, в результате чего получают и экспрессируют (то есть одну или более) молекулу нуклеиновой кислоты, кодирующую указанное антитело, при помощи стандартных методов рекомбинантных ДНК или любого другого приемлемого метода с использованием любых возможных избыточных кодонов, в результате чего достигается экспрессия полипептида по настоящему изобретению.
При помощи синтеза в жидкой фазе могут быть получены комбинаторные гуманизированные библиотеки вариабельных доменов для легкой цепи и тяжелой цепи. Гуманизированная библиотека вариабельных доменов легкой цепи (LC), например, содержит каркасные области (FW) легкой цепи человека и определяющие комплементарность области, отличные от человеческих (CDR). Библиотеку собирают, выполняя поэтапное лигирование в жидкой фазе фрагментов ДНК каркасной области и CDR. Библиотеки собирают, выполняя поэтапное лигирование в жидкой фазе фрагментов ДНК каркасной области и CDR в следующем порядке FW1-CDR1-FW2-CDR2-FW3-CDR3, при помощи методов, известных специалисту в данной области. Например, при помощи методов, описанных в одной или более нижеследующих публикациях, которые включены в настоящее описание изобретения в качестве ссылки. Lo, B.K., 2003, Antibody humanization by CDR grafting. Antibody Engineering, Methods and protocols. Edit by Benny K. C. Lo, Methods in Molecular Biology, 248, 135-159; Kashmiri et al., 2003, Developing a minimally immunogenic humanized antibody by SDR grafting. Antibody Engineering, Methods and protocols. Edit by Benny K. C. Lo, Methods in Molecular Biology, 248, 361-376; Bassette, P. H., et al., 2003, Construction of Designed Protein Libraries Using Gene Assembly Mutagenesis. Directed Evolution Library Creation, Methods and protocols. Edit. Arnold and Georgiou, Methods in Molecular Biology, 231, 29-37; Chames, P., et al., 2001, Selections on Biotinylated antigens. Antibody Engineering, Edit by R. Kontermann and S. Dubel, Springer Lab Manual, 149-166; O'Brien S., and Jones, T., 2001, Humanising antibodies by CDR grafting. Antibody Engineering, Edit by R. Kontermann and S. Dubel, Springer Lab Manual, 567-590.
Антитела, которые связываются с IL-6 человека и включают опеределенную вариабельную облать тяжелой или легкой цепи или CDR-области, могут быть получены приемлемыми методами, такими как отображение на фаге (Katsube, Y., et al., Int. J. Mol. Med., 1(5):863-868 (1998)), или методами с использованием трансгенных животных, известных в данной области или рассмотренных в настоящем описании ихобретения. Например, антитело, его определенная часть или вариант могут быть экспрессированы при помощи кодирующей нуклеиновой кислоты или ее чати в приемлемой клетке-хозяине.
Как было указано, настоящее изобретение относится также к антителам, антигенсвязывающим фрагментам, иммуноглобулиновым цепям и CDR-областям, включающим аминокислоты в последовательности, которая по существу идентична аминокислотной последовательности по настоящему изобретению. Такие антитела против IL-6 могут включать замены, делеции или добавления одной или более аминокислот, являющиеся следствием естественных мутаций или манипуляций человека, рассмотренных в настоящем описании изобретения. Такие антитела или антигенсвязывающие фрагменты и антитела, включающие такие цепи или CDR-области, могут предпочтительно связываться с IL-6 человека с высокой степенью сродства (например, KD меньше или равно примерно 10-9 М). Аминокислотные последовательности, которые по существу идентичны последовательностям по настоящему изобретению, включают последовательности, содержащие консервативные замены аминокислот, а также делеции и/или инсерции аминокислот. Консервативная замена аминокислот является заменой первой аминокислоты второй аминокислотой, химические и/или физические свойства которой (например, заряд, структура, полярность, гидрофобность/гидрофильность) аналогичны свойствам первой аминокислоты. Консервативные замены включают замену одной аминокислоты другой аминокислотой из следующих групп: лизин (К), аргинин (R) и гистидин (Н); аспартат (D) и глутамат (Е); аспарагин (N), глутамин (Q), серин (S), треонин (Т), тирозин (Y), K, R, H, D и Е; аланин (А), валин (V), лейцин (L), изолейцин (I), пролин (Р), фенилаланин (F), триптофан (W), метионин (М), цистеин (С) и глицин (G); F, W и Y; C, S и Т.
Число замен аминокислот, производимых квалифицированным специалистом, зависит от многих факторов, включая вышеописанные факторы. Число замен, инсерций или делеций аминокислот для любого данного антитела против IL-6, его фрагмента или варианта не должно превышать 40, 30, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1, например, 1-30, или может включать любой интервал значений или любое число в интервале, указанном в настоящем описании изобретения.
Аминокислоты в антителе против IL-6 по настоящему изобретению, которые имеют важное значение для функционирования антитела, могут быть идентифицированы методами, известными в данной области, такими как сайтнаправленный мутагенез или мутагенез со сканированием аланином (смотрите, например, публикации Ausubel, выше, Chapters 8, 15; Cunningham and Wells, Science 244:1081-1085 (1989)). Указанный последним метод предполагает введение единичных мутаций аланина в положение каждого остатка в молекуле. Полученные мутантные молекулы затем исследуют в отношении биологической активности, которая включает, не ограничиваясь ею, по меньшей мере одну активность, нейтрализующую IL-6. Сайты, имеющие важное значение для связывания антитела, могут быть также идентифицированы при помощи структурного анализа, такого как кристаллизация, спектроскопия ядерного магнитного резонанса или фотоаффинное мечение (Smith, et al., J. Mol. Biol. 224:899-904 (1992), и de Vos, et al., Science 255:306-312 (1992)).
Антитела против IL-6 по настоящему изобретению могут включать, не ограничиваясь ими, по меньшей мере одну часть, последовательность или комбинацию, включающую от 5 до всех смежных аминокислот по меньшей мере одной из CDR-областей, выделенных из SEQ ID NO:1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159 или 160.
Антитело против IL-6 может далее необязательно включать полипептид, состоящий по меньшей мере из 70-100% смежных аминокислот CDR-областей, выделенных по меньшей мере из одной SEQ ID NO:1, 3, 5, ... 31. В одном конкретном объекте настоящего изобретения антитело против IL-6 включает полипептид, последовательность которого на 95-99% гомологична SEQ ID NO:1; предпочтительно CDR, включающую одну из SEQ ID NO:68-98. В другом конкретном объекте настоящего изобретения антитело против IL-6 включает полипептид, последовательность которого на 95-99% гомологична SEQ ID NO:3; предпочтительно CDR, включающую одну из SEQ ID NO:130-160.
В одном варианте осуществления изобретения аминокислотная последовательность иммуноглобулиновой цепи или ее части (например, вариабельная область, CDR) на примерно 70-100% идентична (например, на 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100% или любой интервал указанных значений или любое число в данном интервале) аминокислотной последовательности по меньшей мере одной из SEQ ID NO:1, 3, 5, ... 31. Например, аминокислотную последовательность вариабельной области легкой цепи можно сравнить с последовательностью SEQ ID NO:1, 5, 9, 13, 17, 21, 25, 29. Используя приемлемый компьютерный алгоритм, известный в данной области, можно определить аминокислоту, идентичную на 70-100% (например, на 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100% или любой интервал указанных значений или любое число в данном интервале). В одном конкретном объекте настоящего изобретения антитело против IL-6 включает полипептид, последовательность которого на 95-99% гомологична SEQ ID NO:1; предпочтительно вариабельную область, включающую одну из SEQ ID NO:68-98. В другом конкретном объекте настоящего изобретения антитело против IL-6 включает полипептид, последовательность которого на 95-99% гомологична SEQ ID NO:3; предпочтительно вариабельную область, включающую одну из SEQ ID NO:130-160.
Типичные последовательности вариабельных областей тяжелой цепи и легкой цепи представлены в SEQ ID NO:1, 3, 5, ... 31, 68-98 или 130-160. Антитела по настоящему изобретению или их определенные варианты могут включать любое число смежных аминокислотных остатков из антитела по настоящему изобретению, которое выбирают из группы целых чисел, состоящей из 10-100% смежных остатков в антителе против IL-6. Указанная последовательность смежных аминокислот состоит по меньшей мере примерно из 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250 или большего числа аминокислот или включает любой интервал указанных значений или любое число в данном интервале. Число таких последователностей может быть равно любому целому числу, выбираемому из группы, состоящей из 1-20, например, по меньшей мере из 2, 3, 4 или 5.
Как должно быть понятно специалисту в данной области, в объем настоящего изобретения входит по меньшей мере одно биологически активное антитело по настоящему изобретению. Биологически активные антитела обладают удельной активностью, равной по меньшей мере 20%, 30% или 40%, предпочтительно по меньшей мере 50%, 60% или 70% и наиболее предпочтительно по меньшей мере 80%, 90% или 95%-100% активности нативного (несинтезированного), эндогенного или родственного и известного антитела. Специалистам в данной области хорошо известны методы анализа и количественного определения ферментативной активности и субстратной специфичности.
Другим объектом настоящего изобретения являются человеческие антитела и антигенсвязывающие фрагменты по настоящему изобретению, модифицированные органической частью, присоединенной при помощи ковалентной связи. В результате такой модификации может быть получено антитело или антигенсвязывающий фрагмент с улучшенными фармакокинетическими свойствами (например, лучшим временем полужизни в кровяном русле in vivo). Органическая часть может быть гидрофильной полимерной группой с линейной или разветвленной цепью, группой жирной кислоты или группой сложного эфира жирной кислоты. В конкретных вариантах осуществления изобретения гидрофильная полимерная группа может иметь молекулярную массу от примерно 800 до примерно 120000 Дальтон и может представлять собой полиалкангликоль (например, полиэтиленгликоль (PEG), полипропиленгликоль (PPG), углеводный полимер, аминокислотный полимер или поливинилпирролидон, при этом группа жирной кислоты или сложного эфира жирной кислоты может включать от примерно восьми до примерно сорока атомов углерода.
Модифицированные антитела и антигенсвязывающие фрагменты по настоящему изобретению могут включать одну или более органических частей, ковалентно связанных с антителом при помощи прямой или непрямой связи. Каждая органическая часть, связанная с антителом или антигенсвязывающим фрагментом по настоящему изобретению, может независимо представлять собой гидрофильную полимерную группу, группу жирной кислоты или группу сложного эфира жирной кислоты. В используемом здесь значении термин “жирная кислота" означает монокарбоновые кислоты и дикарбоновые кислоты. Термин "гидрофильная полимерная группа" в используемом здесь значении означает органический полимер, который лучше растворяется в воде, чем в октане. Например, полилизин лучше растворяется в воде, чем в октане. Таким образом, в объем настоящего изобретения входит антитело, модифицированное полилизином, присоединенным при помощи ковалентной связи. Гидрофильные полимеры, пригодные для модификации антител по настоящему изобретению, могут быть линейными или разветвленными и включают, например, полиалкангликоли (например, PEG, монометоксиполиэтиленгликоль (mPEG), PPG и тому подобные), углеводы (например, декстран, целлюлозу, олигосахариды, полисахариды и тому подобные), полимеры гидрофильных аминокислот (например, полилизин, полиаргинин, полиаспартат и тому подобные), полиалканоксиды (например, полиэтиленоксид, полипропиленоксид и тому подобные) и поливинилпиролидон. Гидрофильный полимер, модифицирующий антитело по настоящему изобретению, предпочтительно имеет молекулярную массу от примерно 800 до примерно 150000 Дальтон в виде отдельной молекулярной частицы. Например, может быть использован PEG5000 и PEG20000, где подстрочный индекс означает среднюю молекулярную массу полимера в Дальтонах. Гидрофильная полимерная группа может быть замещена примерно одной-шестью алкильными группами, группами жирной кислоты или эфира жирной кислоты. Гидрофильные полимеры, замещенные группой жирной кислоты или сложного эфира жирной кислоты, могут быть получены приемлемыми методами. Например, полимер, содержащий аминогруппу, может быть связан с карбоксилатом жирной кислоты или сложного эфира жирной кислоты, и активированный карбоксилат (например, активированный N,N-каронилдиимидазолом) жирной кислоты или сложного эфира жирной кислоты может быть связан с гидроксильной группой полимера.
Жирные кислоты и сложные эфиры жирных кислоты, пригодные для модификации антител по настоящему изобретению, могут быть насыщенными соединениями и могут содержать одну или более единиц ненасыщенности. Жирные кислоты, пригодные для модификации антител по настоящему изобретению, включают, например, н-додеканоат (С12, лаурат), н-тетрадеканоат (С14, миристат), н-октадеканоат (С18, стеарат), н-эйкозаноат (С20, арахидат), н-докозаноат (С22, бехенат), н-триаконтаноат (С30), н-тетраконтаноат (С40), цис-δ-9-октадеканоат (С18, олеат), цис-δ-5,8,11,14-эйкозатетраэноат (С20, арахидонат), октандиовую кислоту, тетрадекандиовую кислоту, октадекандиовую кислоту, докозандиовую кислоту и тому подобные. Приемлемые сложные эфиры жирных кислот включают сложные моноэфиры дикарбоновых кислот, содержащие низшую алкильную группу с линейной или разветвленной цепью. Низшая алкильная группа может содержать от одного до примерно двенадцати, предпочтительно от одного до примерно шести атомов углерода.
Модифицированные человеческие антитела и антигенсвязывающие фрагменты могут быть получены приемлемыми методами, такими как осуществление взаимодействия с одним или более модифицирующими агентами. Термин "модифицирующий агент" в используемом здесь значении означает приемлемую органическую группу (например, гидрофильный полимер, жирную кислоту, сложный эфир жирной кислоты), включающую активирующую группу. Термин "активирующая группа" означает химическую часть или функциональную группу, которая в соответствующих условиях может взаимодействовать со второй химической группой с образованием ковалентной связи между модифицирующим агентом и второй химической группой. Например, взаимодействующие с амином активирующие группы включают, электрофильные группы, такие как тозилат, мезилат, галоген (хлор, бром, фтор, йод), N-гидроксисукцинимидиловые сложные эфиры (NHS) и тому подобные. Активирующие группы, которые могут взаимодействовать с тиолами, включают, например, имид малеиновой кислоты, иодоацетил, акрилолил, пиридилдисульфиды, тиол 5-тиол-2-нитробензойной кислоты (TNB-тиол) и тому подобные. Альдегидная функциональная группа может быть связана с амин- или гидразид-содержащими молекулами, и азидная группа может взаимодействовать с трехвалентной фосфорной группой с образованием фосфорамидатных или фосфоримидных связей. В данной области известны приемлемые методы введения активирующих групп в молекулы (смотрите, например, публикацию Hermanson, G.T., Bioconjugate Techniques, Academic Press: San Diego, Calif. (1996)). Активирующая группа может быть связана непосредственно с органической группой (например, гидрофильный полимер, жирная кислота, сложный эфир жирной кислоты) или при помощи линкера, например, двухвалентной С1-С12 группы, в которой один или более атомов углерода могут быть заменены гетероатомом, таким как атом кислорода, азота или серы. Приемлемые линкеры включают, например, тетраэтиленгликоль, -(СН2)3-, -NH-(CH2)6-NH-, -(CH2)2-NH- и -СН2-О-СН2-СН2-О-СН2-СН2-О-СН-NH-. Модифицирующие агенты, включающие линкер, могут быть получены, например, в результате осуществления взаимодействия моно-Вос-алкилдиамина (например, моно-Вос-этилендиамина, моно-Вос-диаминогексана) с жирной кислотой в присутствии 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) с образованием амидной связи между свободным амином и карбоксилатом жирной кислоты. Вос-защитная группа может быть удалена из продукта путем обработки трифторуксусной кислотой (ТФУ), в результате чего выделяется первичный амин, который может быть связан с другим описанным карбоксилатом или может быть подвергнут взаимодействию с малеиновым ангидридом, и полученный продукт может быть циклизован с образованием активированного производного жирной кислоты, являющегося имидом малеиновой кислоты (смотрите, например, публикацию, Thompson, et al., WO 92/16221, которая полностью включена в настоящее описание изобретения в качестве ссылки).
Модифицированные антитела по настоящему изобретению могут быть получены в результате осуществления взаимодействия человеческого антитела или антигенсвязывающего фрагмента с модифицирующим агентом. Например, органические части могут быть связаны с антителом несайтспецифическим образом при использовании взаимодействующего с амином модифицирующего агента, например, гидроксисукцинимидилового эфира (NHS) полиэтиленгликоля (PEG). Модифицированные человеческие антитела или антигенсвязывающие фрагменты могут быть также получены путем восстановоления дисульфидных связей (например, внутрицепных дисульфидных связей) антитела или антигенсвязывающего фрагмента. Восстановленное антитело или антигенсвязывающий фрагмент затем могут быть подвергнуты взаимодействию с реагирующим с тиолом модифицирующим агентом с образованием модифицированного антитела по настоящему изобретению. Модифицированные человеческие антитела и антигенсвязывающие фрагменты, включающие органическую часть, связанную с определенными сайтами антитела по настоящему изобретению, могут быть получены приемлемыми методами, такими как обратный протеолиз (Fisch et al., Bioconjugate Chem., 3:147-153 (1992); Werlen et al., Bioconjugate Chem., 5:411-417 (1994); Kumaran et al., Protein Sci. 6(10):2233-2241 (1997); Itoh et al., Bioorg. Chem., 24(1):59-68 (1996); Capellas et al., Biotechnol. Bioeng., 56(4):456-463 (1997)), и методами, описанными в публикации Hermanson, G.T., Bioconjugate Techniques, Academic Press: San Diego, Calif. (1996).
Антитела по настоящему изобретению могут связываться с IL-6 человека в широком диапазоне сродства (KD). В предпочтительном варианте осуществления изобретения по меньшей мере одно человеческое моноклональное антитело по настоящему изобретению может необязательно связываться с IL-6 человека с высокой степенью сродства. Например, моноклональное антитело может связываться с IL-6 человека со значением KD, равным или меньше примерно 10-7 М, которое может быть равно, не ограничиваясь ими, 0,1-9,9 (или любому интервалу указанных значений или любому числу в данном интервале)×10-7, 10-8, 10-9, 10-10, 10-11, 10-12, 10-13 или любому интервалу указанных значений или любому числу в данном интервале.
Сродство или авидность антитела в отношении антигена можно определить экспериментально любым приемлемым методом (смотрите, например, публикации Berzofsky, et al., "Antibody-Antigen Interactions," In Fundamental Immunology, Paul, W.E., Ed., Raven Press: New York, N.Y. (1984); Kuby, Janis Immunology, W.H. Freeman and Company; New York, N.Y. (1992) и описанные в них методы). Измеренное значение сродства при определенном взаимодействии антиген-антитело может быть различным при измерении в разных условиях (например, концентрация соли, рН). Таким образом, сродство и другие параметры связывания с антигеном (например, KD, Ka, Kd) предпочтительно измеряют при использовании стандартизированных растворов антитела и антигена и стандартизированного буфера, такого как буфер, представленный в настоящем описании изобретения.
Антитела против IL-6, используемые в способах и композициях по настоящему изобретению, характеризуются высоким сродством связывания с IL-6 и необязательно и предпочтительно обладают низкой токсичностью. В частности, в настоящем изобретении может быть использовано антитело, его определенный фрагмент или вариант по настоящему изобретению, в которых отдельные элементы, такие как вариабельная область, константная область и каркасная область, отдельно и/или вместе, необязательно и предпочтительно обладают низкой иммуногенностью. Антитела, которые могут быть использованы в настоящем изобретении, необязательно характеризуются способностью воздействовать на субъектов в течение длительных периодов времени с достижением измеряемого ослабления симптомов при низкой и/или приемлемой токсичности. Низкая или приемлемая иммуногенность и/или высокое сродство, а также другие пригодные свойства могут способствовать достижению терапевтических результатов. Термин "низкая иммуногенность" в используемом здесь значении означает повышение реакций НАНА, НАСА или НАМА менее, чем на примерно 75% или предпочтительно менее, чем на примерно 50% и/или увеличение низких титров у подвергаемых лечению субъектов (менее, чем на примерно 300, предпочтительно менее, чем на примерно 100 при измерении при помощи иммуноферментного анализа антигена с двойным усилением) (публикация Elliott et al., Lancet 344:1125-1127 (1994), которая полностью включена в настоящее описание изобретения в качестве свсылки).
Могут быть также использованы биспецифические, гетероспецифические, гетероконъюгированные или подобные антитела, которые являются моноклональными гуманизированными антителами, обладающими специфичностью связывания в отношении по меньшей мере двух разных антигенов. В данном случае одна специфичность связывания относится по меньшей мере к одному белку IL-6 и другая специфичность связывания относится к любому другому антигену. В данной области известны методы получения биспецифических антител. Получение биспецифических антител методами рекомбинантных ДНК традиционно основано на коэкспрессии двух пар тяжелой цепи-легкой цепи иммуноглобулина, где две тяжелые цепи обладают разной специфичностью (Milstein and Cuello, Nature 305:537 (1983)). Вследствие произвольного выбора тяжелых и легких цепей иммуноглобулина указанные гибридомы (квадромы) образуют потенциальную смесь из 10 разных молекул антитела, из которых только одна молекула имеет правильную биспецифическую структуру. Очистка правильной молекулы, которую обычно выполняют при помощи аффинной хроматогорафии, представляет собой сложный процесс, при этом выход продукта является низким. Аналогоичные методы описаны, например, в публикациях WO 93/08829, патентах США №№ 6210668, 6193967, 6132992, 6106833, 6060285, 6037453, 6010902, 5989530, 5959084, 5959083, 5932448, 5833985, 5821333, 5807706, 5643759, 5601819, 5582996, 5496549, 4676980, WO 91/00360, WO 92/00373, европейском патенте № 03089, публикациях Traunecker et al., EMBO J. 10:3655 (1991), Suresh et al., Methods in Enzymology 121:210 (1986), которые полностью включены в настоящее описание изобретения в качестве ссылки.
Молекулы нуклеиновых кислот
Используя информацию, приведенную в настоящем описании изобретения, которая относится к нуклеотидным последовательностям, кодирующим по меньшей мере 70-100% смежных аминокислот по меньшей мере одной из SEQ ID NO:1, 3, 5, ... 31, 68-98 или 130-160, их определенных фрагментов, вариантов или консенсусных последовательностей, или к депонированному вектору, включающему по меньшей мере одну из указанных последовательностей, можно получить молекулу нуклеиновой кислоты по настоящему изобретению, кодирующую по меньшей мере одно антитело против IL-6, при помощи методов, рассмотренных в настоящем описании изобретения или известных в данной области.
Молекулы нуклеиновых кислот по настоящему изобретению могут быть в форме РНК, такой как мРНК, чнРНК, тРНК, или любой другой форме или в форме ДНК, которая включает, не ограничиваясь ими, кДНК и геномную ДНК, полученную путем клонирования или синтеза, или любых их комбинаций. ДНК может быть трехцепочечной, двухцепочечной или одноцепочечной или может включать любую комбинацию указанных цепей. Любая часть по меньшей мере одной цепи ДНК или РНК может быть кодирующей цепью, известной также как смысловая цепь, или может быть некодирующей цепью, определяемой также как антисмысловая цепь.
Выделенные молекулы нуклеиновых кислот по настоящему изобретению могут включать молекулы нуклеиновых кислот, имеющие открытую рамку считывания (ORF), необязательно с одним или более интронами, например, не ограничиваясь ими, по меньшей мере одну определенную часть по меньшей мере одной CDR, в частности, CDR1, CDR2 и/или CDR3, по меньшей мере одной тяжелой цепи (например, SEQ ID NO:4, 8, 12, 16, 20, 24, 28, 32 или 99-129) или легкой цепи (например, SEQ ID NO:2, 6, 10, 14, 18, 22, 26, 30 или 37-67); молекулы нуклеиновых кислот, содержащие кодирующую последовательность для антитела против IL-6 или вариабельной области (например, SEQ ID NO:2, 4, 6, ... 32, 37-67 или 99-129); и молекулы нуклеиновых кислот, имеющие нуклеотидную последовательность, которая существенно отличается от вышеописанных последовательностей, но вследствие вырожденности генетического кода по-прежнему кодирует по меньшей мере одно антитело против IL-6, рассмотренное в настоящем описании изобретения и/или известное в данной области. Генетический код хорошо известен в данной области. Таким образом, специалисту в данной области не составит труда создать такие вырожденные варианты нуклеиновых кислот, кодирующих специфические антитела против IL-6 по настоящему изобретению. Смотрите, например, публикацию Ausubel, et al., выше, и такие варианты нуклеиновых кислот входят в объем настоящего изобретения. Неограничивающие примеры молекул выделенных нуклеиновых кислот по настоящему изобретению включают SEQ ID NO:2, 4, 6, ... 32, 37-67 или 99-129, которые соответствуют неограничивающим примерам нуклеиновой кислоты, кодирующей соответственно CDR1 тяжелой цепи, CDR2 тяжелой цепи, CDR3 тяжелой цепи, CDR1 легкой цепи, CDR2 легкой цепи, CDR3 легкой цепи, вариабельную область тяжелой цепи и вариабельную область легкой цепи.
Как указано в настоящем описании изобретения, молекулы нуклеиновых кислот по настоящему изобретению, содержащие нуклеиновую кислоту, кодирующую антитело против IL-6, могут включать, не ограничиваясь ими, нуклкеиновые кислоты, кодирующие аминокислотную последовательность фрагмента антитела, кодирующую последовательность для всего антитела или его части, кодирующую последовательность для антитела, его фрагмента или части, а также дополнительные последовательности, такие как кодирующая последовательность по меньшей мере одного сигнального лидерного или слитого пептида, при наличии или отсутствии вышеуказанных дополнительных кодирующих последовательностей, таких как по меньшей мере один интрон, наряду с дополнительными некодирующими последовательностями, которые включают, не ограничиваясь ими, некодирующие 5'- и 3'-концевые последовательности, такие как транскрибированные, нетранслированные последовательности, которые играют определенную роль в транскрипции, процессинге мРНК, включая сигналы сплайсинга и полиаденилирования (например, связывание рибосомы и устойчивосьь мРНК); дополнительную кодирующую последовательность, которая кодирует дополнительные аминокислоты, сообщающие дополнительную функциональность. Таким образом, последовательность, кодирующая антитело, может быть гибридизирована с маркерной последовательностью, такой как последовательность, кодирующая пептид, который облегчает очистку гибридизированного антитела, включая фрагмент или часть антитела.
Полинуклеотиды, избирательно гибридизирующие с полинуклеотидом по настоящему изобретению
Настоящее изобретение относится к выделенным нуклеиновым кислотам, которые гибридизируют в условиях избирательной гибридизации с полинуклеотидом по настоящему изобретению. Таким образом, полинуклеотиды, относящиеся к данному варианту осуществления изобретения, могут быть использованы для выделения, обнаружения и/или количественного определения нуклеиновых кислот, включающих такие полинуклеотиды. Например, полинуклеотиды по настоящему изобретению могут быть использованы для идентификации, выделения или амплификации неполных или непроцессированных клонов в депонированной библиотеке. В некоторых вариантах осуществления изобретения полинуклеотиды являются последовательностями геномной или кДНК либо комплементарными кДНК из библиотеки нуклеиновых кислот человека или млекопитающего.
Библиотека кДНК предпочтительно включает по меньшей мере 80% непроцессированных последовательностей, предпочтительно по меньшей мере 85% или 90% непроцессированных последовательностей и более предпочтительно по меньшей мере 95% непроцессированных последовательностей. Библиотеки кДНК могут быть нормализованы для увеличения представления редких последовательностей. Последовательности с меньшей степенью идентичности по отношению к комплементарным последовательностям, обычно, но не обязательно, гибридизируют в условиях пониженной или умеренной жесткости. Последовательности с большей степенью идентичности могут быть гибридизированы в умеренных или строгих условиях. Гибридизация с условиях пониженной жесткости позволяет избирательно гибридизировать последовательности, характеризующиеся примерно 70% идентичностью последовательностей и может быть использована для идентификации ортологичных или паралогичных последовательностей.
Полинуклеотиды по настоящему изобретению могут необязательно кодировать по меньшей мере часть антитела, кодированного полинуклеотидами по настоящему изобретению. Полинуклеотиды по настоящему изобретению включают последовательности нуклеиновых кислот, которые могут быть использованы для избирательной гибридизации с полинуклеотидом, кодирующим антитело по настоящему изобретению. Смотрите, например, публикации Ausubel, выше; Colligan, выше, которые полностью включены в настоящее описание изобретения в качестве ссылки.
Создание нуклеиновых кислот
Выделенные нуклеиновые кислоты по настоящему изобретению могут быть получены (а) методами рекомбинантных ДНК, (b) методами синтеза, (с) методами очистки или их комбинациями, хорошо известными в данной области.
Нуклеиновые кислоты могут включать последовательности помимо полинуклеотида по настоящему изобретению. Например, в нуклеиновую кислоту может быть введен сайт поликлонирования, включающий один или более сайтов рестрикции эндонуклеизы, который способствует выделению полинуклеотида. Кроме того, могут быть введены транслируемые последовательности, которые способствуют выделению транслированного полинуклеотида по настоящему изобретению. Например, использование маркерной последовательности гексагистидина является удобным способом очистки белков по настоящему изобретению. Нуклеиновая кислота по настоящему изобретению, исключая кодирующую последовательность, необязательно является вектором, адаптером или линкером для клонирования и/или экспрессии полинуклеотида по настоящему изобретению.
В такие клонирующие и/или экспрессирующие последовательности могут быть введены дополнительные последовательности для оптимизации их функции в отношении клонирования и/или экспрессии, для лучшего выделения полинуклеотида или для более эффективного введения полинуклеотида в клетку. Использование клонирующих векторов, экспрессирующих векторов, адаптеров и линкеров хорошо известно в данной области (смотрите, например, публикации Ausubel, выше, или Sambrook, выше).
Методы рекомбинантных ДНК, используемые для создания нуклеиновых кислот
Выделенные нуклеиновые кислоты по настоящему изобретению, такие как РНК, кДНК, геномная ДНК или любая их комбинация, могут быть получены из биологических источников при помощи разных методов клонирования, известных специалистам в данной области. В некоторых вариантах осуществления изобретения для идентификации требуемой последовательности в библиотеке кДНК или геномных ДНК используют олигонуклеотидные зонды, которые избирательно гибридизируют в строгих условиях с полинуклеотидами по настоящему изобретению. Выделение РНК и создание библиотек кДНК и геномных ДНК хорошо известно специалисту в данной области (смотрите, например, публикации Ausubel, выше, или Sambrook, выше).
Методы скрининга и выделения нуклеиновых кислот
Библиотеку кДНК или геномных ДНК можно исследовать, используя зонд, созданный на основе последовательности полинуклеотида по настоящему изобретению. Зонды могут быть использованы для гибридизации с последовательностями геномных ДНК или кДНК с целью выделения гомологичных генов в одинаковых или разных организмах. Специалистам в данной области должно быть известно, что при выполнении данного анализа гибридизация может быть осуществлена в условиях разной степени строгости, при этом строгими могут быть гибридизирующая или промывочная среда. При более строгих условиях гибридизации необходима более высокая степень комплементарности между зондом и мишенью для образования дуплекса. Степень строгости можно контролировать, изменяя температуру, ионную силу, рН и количество частично денатурирующего растворителя, такого как формамид. Например, строгость гибридизации обычно изменяется при изменении полярности реакционного раствора, например, в результате изменения концентрации формамида в пределах от 0% до 50%. Степень комплементарности (идентичности последовательностей), необходимая для обеспечения детектируемого связывания, изменяется в соответствии со строгостью гибридизирующей и/или промывочной среды. Степень комплементарности оптимально равна 100%, 70-100% или любому интервалу указанных значений или любому числу в данном интервале. Однако следует отметить, что незначительные изменения последовательности в зондах и затравках могут быть компенсированы путем уменьшения строгости гибридизирующей и/или промывочной среды.
Методы амплификации РНК или ДНК хорошо известны в данной области и могут быть использованы в настоящем изобретении без ненужного экспериментирования на основании информации и указаний, приведенных в настоящем описании изобретения.
Известные методы амплификации ДНК или РНК включают, не ограничиваясь ими, полимеразную цепную реакцию (ПЦР) и соответствующие методы амплификации (смотрите, например, патенты США №№ 4683195, 4683202, 4800159, 4965188, принадлежащие Муллису и др; 4795699 и 4921794, принадлежащие Табору и др; 5142033, принадлежащий Иннису; 5122464, принадлежащий Вильсону и др.; 5091310, принадлежащий Иннису; 5066584, принадлежащий Гилленстену и др.; 4889818, принадлежащий Гелфанду и др.; 4994370, принадлежащий Силверу и др.; 4766067, принадлежащий Бисвасу; 4656134, принадлежащий Ринголду) и РНК-опосредованнцую амплификацию, в которых использована антисмысловая РНК для последовательности-мишени в качестве матрицы для синтеза двухцепочечной ДНК (патент США № 5130238, принадлежащий Малеку и др., с товарным знаком NASBA); все вышеуказанные публикации полностью включены в настоящее описание изобретения в качестве ссылки (смотрите, например, публикации Ausubel, выше, или Sambrook, выше).
Полимеразная цепная реакция (ПЦР), например, может быть использована для амплификации последовательностей полинуклеотидов по настоящему изобретению и родственных генов непосредственно из библиотек геномных ДНК или кДНК. ПЦР и другие методы амплификации in vitro могут быть также использованы, например, для клонирования последовательностей нуклеиновых кислот, кодирующих экспрессируемые белки, для создания нуклеиновых кислот, используемых в качестве зондов для обнаружения требуемой мРНК в образцах, для секвенирования нуклеиновой кислоты или для других целей. Примеры методов амплификации in vitro представлены в публикациях Berger, выше, Sambrook, выше, и Ausubel, выше, а также в патенте США № 4683202 (1987), принадлежащем Муллису и др., и публикации Innis, et al., PCR Protocols: A Guide to Methods and Applications, Eds., Academic Press Inc., San Diego, Calif. (1990). В данной области известны коммерчески доступные наборы для амплификации геномной ДНК методом ПЦР. Смотрите, например, набор для ПЦР геномной ДНК Advantage-GC (Clontech). Кроме того, для увеличения выхода длинноцепных продуктов ПЦР может быть использован белок Т4 гена 32 (Boehringer Mannheim).
Методы синтеза нуклеиновых кислот
Выделенные нуклеиновые кислоты по настоящему изобретению могут быть также получены известными методами прямого химического синтеза (смотрите, например, публикацию Ausubel, et al., выше). В результате химического синтеза обычно получают одноцепочечный олигонуклеотид, который можно превратить в двухцепочечную ДНК путем гибридизации с комплементарной последовательностью или полимеризации с ДНК-полимеразой с использованием одной цепи в качестве матрицы. Специалисту в данной области должно быть известно, что, хотя химический синтез ДНК может быть ограничен последовательностями длиной примерно 100 или более оснований, более длинные последовательности могут быть получены путем лигирования более коротких последовательностей.
Рекомбинантные экспрессирующие кластеры
Настоящее изобретение далее относится к рекомбинантным экспрессирующим кластерам, включающим нуклеиновую кислоту по настоящему изобретению. Последовательность нуклеиновой кислоты по настоящему изобретению, например, последовательность кДНК или геномной ДНК, кодирующая антитело по настоящему изобретению, может быть использована для создания рекомбинантного экспрессирующего кластера, который может быть введен по меньшей мере в одну требуемую клетку-хозяина. Рекомбинантный экспрессирующий кластер обычно включает полинуклеотид по настоящему изобретению, функционально связанный с регуляторными последовательностями, инициирующими транскрипцию, которые управляют транскрипцией полинуклеотида в выбранной клетке-хозяине. Для прямой экспрессии нуклеиновых кислот по настоящему изобретению могут быть использованы гетерологичные и нетегорологичные (то есть эндогенные) промоторы.
В некоторых вариантах осуществления изобретения выделенные нуклеиновые кислоты, служащие в качестве промотора, энхансера или других элементов, могут быть введены в соответствующее положение (верхней области, нижней области или в интрон) негетерологичного полинуклеотида по настоящему изобретению с целью повышения или уменьшения экспрессии полинуклоеотида по настоящему изобретению. Например, эндогенные промоторы могут быть изменены in vivo или in vitro путем мутации, делеции и/или замены.
Векторы и клетки-хозяева
Настоящее изобретение также относится к векторам, включающим молекулы выделенных нуклеиновых кислот по настоящему изобретению, к клеткам-хозяевам, генетически созданным с помощью рекомбинантных векторов, и к получению по меньшей мере одного антитела против IL-6 методами рекомбинантных ДНК, хорошо известными в данной области. Смотрите, например, публикации Sambrook, et al., выше; Ausubel, et al., выше, которые полностью включены в настоящее описание изобретения в качестве ссылки.
Полинуклеотиды могут быть необязательно связаны с вектором, содержащим селектируемый маркер, для размножения в хозяине. Плазмидный вектор обычно вводят в преципитате, таком как преципитат фосфата кальция, или в комплексе с заряженным липидом. Вектор, являющийся вирусом, может быть упакован in vitro при помощи соответствующей линии упаковочных клеток и затем введен в клетки-хозяева.
ДНК-вставка должна быть функционально связана с соответствующим промотором. Экспрессирующие конструкции далее содержат сайты для инициации и терминации транскрипции, а также сайт связывания рибосомы для трансляции в транскрибированной области. Кодирующая часть зрелых транскриптов, экспрессированных указанными конструкциями, предпочтительно включает кодон инициации трансляции в начале и кодон терминации трансляции (например, UAA, UGA или UAG) в конце транслируемой мРНК, при этом UAA и UAG являются предпочтительными для экспрессии в клетках млекопитающих или эукариотических клетках.
Экспрессирующие векторы предпочтительно, но не обязательно, включают по меньшей мере один селектируемый маркер. Такие маркеры, например, включают, не ограничиваясь ими, гены устойчивости к метотрексату (МТХ), дигидрофолат-редуктазе (DHFR, патенты США №№ 4399216, 4634665, 4656134, 4956288, 5149636, 5179017), ампициллину, неомицину (G418), микофеноловой кислоте или глутаминсинтетазе (GS, патенты США №№ 5122464, 5770359, 5827739) для культуры эукариотических клеток и гены устойчивости к тетрациклину или ампициллину для культивирования в E. coli или других бактериях или прокариотических клетках (вышеуказанные патенты полностью включены в настоящее описание изобретения в качестве ссылки). В данной области известны соответствующие культуральные среды и условия культивирования вышеуказанных клеток-хозяев. Специалисту в данной области должны быть известны приемлемые векторы. Векторная конструкция может быть введена в клетку-хозяина путем трансфекции фосфатом кальция, трансфекции, опосредованной DEAE-декстраном, трансфекции, опосредованной катионным липидом, электропорации, трансдукции, инфицирования или другими известными методами. Такие методы описаны в данной области, например, в публикации Sambrook, смотрите выше, главы 1-4 и 16-18; Ausubel, смотрите выше, главы 1, 9, 13, 15, 16.
По меньшей мере одно антитело по настоящему изобретению может быть экспрессировано в модифицированной форме, такой как слитый белок, и может включать не только сигналы секреции, но также дополнительные гетерологичные функциональные области. Например, к N-концу антитела может быть добавлена область дополнительных аминокислот, в частности, заряженных аминокислот, для повышения устойчивости и выживания в клетке-хозяине, в процессе очистки или во время последующей обработки и хранения. Кроме того, к антителу по настоящему изобретению могут быть добавлены пептидные части для облегчения очистки. Такие области могут быть удалены до окончательного получения антитела или по меньшей мере одного его фрагмента. Такие методы описаны во многих стандартных лабораторных руководствах, таких как публликация Sambrook, смотрите выше, главы 17.29-17.42 и 18.1-18.74; Ausubel, смотрите выше, главы 16, 17 и 18.
Специалистам в данной области должны быть известны многие экспрессирующие системы, предназначенные для экспрессии нуклеиновой кислоты, кодирующей белок по настоящему изобретению.
Альтернативно нуклеиновые кислоты по настоящему изобретению могут быть экспрессированы в клетке-хозяине путем выполнения определенных манипуляций в клетке-хозяине, содержащей эндогенную ДНК, кодирующую антитело по настоящему изобретению. Такие методы хорошо известны в данной области, например, описаны в патентах США №№ 5580734, 5641670, 5733746 и 5733761, которые полностью включены в настоящее описание изобретения в качестве ссылки.
В качестве примера культур клеток, пригодных для продуцирования антител, их определенных частей или вариантов, можно привести клетки млекопитающих. Системы клеток млекопитающих часто представляют собой монослои, хотя также могут быть использованы взвеси клеток млекопитающих или биореакторы. В данной области был получен ряд приемлемых линий клеток-хозяев, способных экспрессировать интактные гликозилированные белки, которые включают линии клеток COS-1 (например, CRL 1650 в АТСС), COS-7 (например, CRL-1651 в АТСС), НЕК293, ВНК21 (например, CRL-10 в АТСС), СНО (например, CRL 1610 в АТСС) и BSC-1 (например, CRL-26 в АТСС), клетки Cos-7, клетки СНО, клетки hepG2, клетки P3X63Ag8.653, SP2/0-Ag14, клетки 293, клетки HeLa и тому подобные, которые могут быть легко приобретены, например, в Американской коллеции типовых культур, Manassas, Va. (http://www.atcc.org). Предпочтительными клетками-хозяевами являются лимфоидные клетки, такие как миеломные и лимфомные клетки. Особенно предпочтительными клетками-хозяевами являются клетки P3X63Ag8.653 (номер доступа CRL-1580 в АТСС) и SP2/0-Ag14 (номер доступа CRL-1851 в АТСС). В особенно предпочтительном варианте осуществления изобретения рекомбинантная клетка является клеткой P3X63Ab8.653 или клеткой SP2/0-Ag14.
Экспрессирующие векторы для указанных клеток могут включать одну или более следующих последовательностей, контролирующих экспрессию, которые включают, не ограничиваясь ими, ориджин репликации; промотор (например, поздние или ранние промоторы SV40, промотор CMV (патенты США №№ 5168062, 5385839), tk промотор HSV, pgk (фосфоглицераткиназный) промотор, альфа-промотор EF-1 (патент США № 5266491), по меньшей мере один промотор человеческого иммуноглобулина; энхансер и/или сайты обработки информации, такие как сайты связыания рибосом, сайты сплайсинга РНК, сайты полиаденилирования (например, большой дополнительный поли(А)-сайт Т Ag SV40) и последовательности терминации транскрипции. Смотрите, например, публикации Ausubel et al., выше; Sambrook, et al., выше. В данной области известны другие клетки, пригодные для продуцирования нуклеиновых кислот или белков по настоящему изобретению, которые представлены, например, в каталоге линий клеток и гибридом Американской коллекции типовых культур (http://www.atcc.org) или в других известных или коммерческих источниках.
При использовании эукариотических клеток-хозяев в вектор обычно вводят последовательности полиаденилирования или терминации транскрипции. Примером терминирующей последовательности является последовательность полиаденилирования из бычьего гена гормона роста. В вектор также могут быть введены последовательности для точного сплайсинга транскрипта. Примером сплайсирующей последовательности является интрон VP1 из SV40 (Sprague, et al., J. Virol. 45:773-781 (1983)). Кроме того, в вектор могут быть введены последовательности генов, контролирующие репликацию, которые известны в данной области.
Продуцирование антитела
По меньшей мере одно антитело против IL-6 по настоящему изобретению может быть необязательно продуцировано линией клеток, линией смешанных клеток, иммортализованной клеткой или клональной популяцией иммортализованных клеток, которые хорошо известны в данной области. Смотрите, например, публикации Ausubel, et al., ed., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., NY, N.Y. (1987-2001); Sambrook, et al., Molecular Cloning: A Laboratory Manual, 2.sup.nd Edition, Cold Spring Haibor, N.Y. (1989); Harlow and Lane, antibodies, a Laboratory Manual, Cold Spring Haibor, N.Y. (1989). Colligan, et al., eds., Current Protocols in Immunology, John Wiley & Sons, Inc., NY (1994-2001); Colligan et al., Current Protocols in Protein Science, John Wiley & Sons, NY, N.Y., (1997-2001), которые полностью включены в настоящее описание изобретения в качестве ссылки.
В соответствии с одним методом гибридому продуцируют путем гибридизации приемлемой линии иммортализованных клеток (например, линии миеломных клеток, которые включают, не ограничиваясь ими, Sp2/0, Sp2/0-AG14, NSO, NS1, NS2, AE-1, L.5, >243, P3X63Ag8.653, Sp2 SA3, Sp2 MAI, Sp2 SS1, Sp2 SA5, U937, MLA 144, ACT IV, MOLT4, DA-1, JURKAT, WEHI, K-562, COS, RAJI, NIH 3T3, HL-60, MLA 144, NAMAIWA, NEURO 2A) или подобных клеток, либо гетеромиеломных клеток, продуктов их гибридизации, любой выделенной из них клетки или гибридизированной клетки, или любой другой приемлемой линии клеток, известной в данной области (смотрите, например, http://www.atcc.org, http://www.lifetech.com и тому подобные), с антителопродуцирующими клетками, которые включают, не ограничиваясь ими, выделенные или клонированные клетки селезенки, периферической крови, лимфы, миндалины, другие иммунокомпетентные клетки или В-клетки, любые другие клетки, экспрессирующие последовательности константных, вариабельных, каркасных или CDR-областей тяжелой или легкой цепи в виде эндогенной или гетерологичной нуклеиновой кислоты, рекомбинантной или эндогенной геномной ДНК, кДНК, рДНК, митохондриальной ДНК или РНК, ДНК или РНК хлоропластов, чяРНК, мРНК, тРНК, являющихся одноцепочечными, двухцепочечными или трехцепочечными, гибридизированными и тому подобными, или любой их комбинации, которые получают из вирусов, бактерий, водорослей, прокариотов, амфибий, насекомых, рептилий, рыб, млекопитающих, грызунов, лошадей, коз, овец, приматов, эукариотов. Смотрите, например, публикации Ausubel, выше, и Colligan, Immunology, выше, глава 2, которые полностью включены в настоящее описание изобретения в качестве ссылки.
Любая другая приемлемая клетка-хозяин также может быть использована для экспрессии гетерологичной или эндогенной нуклеиновой кислоты, кодирующей антитело, его определенный фрагмент или вариант по настоящему изобретению. Гибридизированные клетки (гибридомы) или рекомбинантные клетки могут быть выделены в результате культивировании в избирательных условиях или при помощи других приемлемых известных методов и клонированы путем ограничивающего разведения, сортировки клеток или другими известными методами. Клетки, продуцирующие антитела с требуемой специфичностью, могут быть отобраны в результате выполнения соответствующего анализа (например, ELISA).
Антитела по настоящему изобретению могут быть также получены при использовании по меньшей мере одной нуклеиновой кислоты, кодирующей антитело против IL-6, для создания трансгенных животных или млекопитающих, таких как козы, коровы, лошади, овцы и тому подобные, которые продуцируют такие антитела в своем молоке. Такие животные могут быть получены известными методами. Смотрите, например, патенты США №№ 5827690, 5849992, 4873316, 5849992, 5994616, 5565362, 5304489 и тому подобные, не ограничиваясь ими, которые полностью включены в настоящее описание изобретения в качестве ссылки.
Антитела по настоящему изобретению могут быть дополнительно получены при использовании по меньшей мере одной нуклеиновой кислоты, кодирующей антитело против IL-6, для создания трансгенных растений и культивируемых растительных клеток (которые, например, включают, не ограничиваясь ими, табак и кукурузу), которые продуцируют такие антитела, их определенные части или варианты в частях растений или в культивируемых клетках таких растений. В качестве неограничивающего примера можно привести листья трансгенного табака, экспрессирующие рекомбинантные белки, которые успешно используют для получения рекомбинантных белков в больших количествах, например, при помощи индуцибельного промотора. Смотрите, например, публикацию Cramer et al., Curr. Top. Microbiol. Immunol. 240:95-118 (1999) и приведенные в ней ссылки. Трансгенную кукурузу также используют для экспрессии белков млекопитающих на производственном уровне, при этом биологическая активность указанных белков соответствует аналогичному показателю белков, продуцированных в других рекомбинантных системах или выделенных из природных источников. Смотрите, например, публикацию Hood et al., Adv. Exp. Med. Biol. 464:127-147 (1999) и приведенные в ней ссылки. Антитела могут быть получены в больших количествах из семян трансгенных растений, включая фрагменты антител, такие как одноцепочечные антитела (scFv), в частности, из семян табака и клубней картофеля. Смотрите, например, публикацию Conrad et al., Plant Mol. Biol. 38:101-109 (1998) и приведенные в ней ссылки. Таким образом, антитела по настоящему изобретению могут быть также продуцированы трансгенными растениями при помощи известных методов. Смотрите, например, также публикации Fischer et al., Biotechnol. Appl. Biochem. 30: 99-108 (October, 1999), Ma et al., Trends Biotechnol. 13:522-7 (1995); Ma et al., Plant Physiol. 109:341-6 (1995); Whitelam et al., Biochem. Soc. Trans. 22:940-944 (1994) и приведенные в них ссылки. Все вышеуказанные публикации полностью включены в настоящее описание изобретения в качестве ссылки.
Очистка антитела
Антитело против IL-6 может быть выделено и очищено от культур рекомбинантных клеток хорошо известными методами, которые включают, не ограничиваясь ими, очистку белком А, очистку белком G, преципитацию сульфатом аммония или этанолом, кислотную экстракцию, анионообменную или катионообменную хроматографию, хроматографию на фосфоцеллюлозе, гидрофобную хроматографию, аффинную хроматографию, хроматографию на гидроксиапатите и хроматографию на лектине. Высокоэффективная жидкостная хроматография (ВЭЖХ) также может быть использована для очистки. Смотрите, например, публикации Colligan, Current Protocols in Immunology, or Current Protocols in Protein Science, John Wiley & Sons, NY, N.Y., (1997-2001), например, главы 1, 4, 6, 8, 9 и 10, которые полностью включены в настоящее описание изобретения в качестве ссылки.
Антитела по настоящему изобретению включают продукты, выделенные естественным путем, продукты химического синтеза и продукты, полученные методами рекомбинантных ДНК из эукариотического хозяина, включающего, например, клетки дрожжей, высших растений, насекомых и млекопитающих. В зависимости от хозяина, используемого при выполнении метода рекомбинантных ДНК, антитело по настоящему изобретению может быть гликозилированным или негликозилированным, причем гликозилированное антитело является более предпочтительным. Такие методы описаны во многих стандартных лабораторных руководствах, таких как публикации Sambrook, смотрите выше, разделы 17.37-17.42; Ausubel, смотрите выше, главы 10, 12, 13, 16, 18 и 20, Colligan, Protein Science, смотрите выше, главы 12-14, которые полностью включены в настоящее описание изобретения в качестве ссылки.
Очищенные антитела могут быть исследованы, например, при помощи анализа ELISA, ELISPOT, проточной цитометрии, иммуноцитологии, анализа Biacore®, кинетического анализа исключения Sapidyne KinExA™, SDS-PAGE и вестерн-блоттинга или ВЭЖХ и ряда других функциональных анализов, рассмотренных в настоящем описании изобретения.
Клонирование и экспрессия антитела против IL-6 в клетках млекопитающих
Типичные экспрессирующий вектор млекопитающего содержит по меньшей мере один промотор, который опосредует инициацию транскрипции мРНК, последовательность, кодирующую антитело, и сигналы, необходимые для терминации транскрипции и полиаденилирования транскрипта. Дополнительные элементы включают энхансеры, последовательности Козака и препятствующие последовательности, фланкированные донорскими и акцепторными сайтами для сплайсинга РНК. Высокоэффективная транскрипция может быть достигнута при помощи ранних и поздних промоторов из SV40, длинных концевых повторов (LTRS) из ретровирусов, например, RSV, HTLV1, HIVI, и раннего промотора цитомегаловируса (CMV). Однако также могут быть использованы элементы клетки (например, промотор человеческого актина). Экспрессирующие векторы, пригодные для осуществления настоящего изобретения, включают, например, такие векторы как pIRES1neo, pRetro-Off, pRetro-On, PLXSN или pLNCX (Clonetech Labs, Palo Alto, Calif.), pcDNA3.1 (+/-), pcDNA/Zeo (+/-) или pcDNA3.1/Hygro (+/-) (Invitrogen), PSVL и PMSG (Pharmacia, Uppsala, Sweden), pRSVcat (ATCC 37152), pSV2dhfr (ATCC 37146) и pBC12MI (ATCC 67109). Клетки-хозяева млекопитающих, которые могут быть использованы в настоящем изобретении, включают человеческие клетки Hela 293, H9 и клетки Джурката, мышиные клетки NIH3T3 и С127, Cos 1, Cos 7 и CV 1, перепелиные клетки QC1-3, мышиные клетки L и клетки яичника китайского хомячка (СНО).
Альтернативно ген может быть экспрессирован в устойчивых линиях клеток, содержащих ген, встроенный в хромосому. Котрансфекция селектируемым маркером, таким как dhfr, gpt, неомицин или гигромицин, позволяет идентифицировать и выделить трансфецированные клетки.
Трансфецированный ген может быть также амплифицирован для экспрессии кодированного антитела в больших количествах. Маркер DHFR (дигидрофолат-редуктаза) может быть использован для создания линий клеток, несущих несколько сот или даже несколько тысяч копий представляющего интерес гена. Другим приемлемым селектируемым маркером является фермент глутаминсинтаза (GS) (Murphy, et al., Biochem. J. 227:277-279 (1991); Bebbington, et al., Bio/Technology 10:169-175 (1992)). При использовании указанных маркеров клетки млекопитающих выращивают в элективной среде и отбирают клетки с наибольшей устойчивостью. Указанные линии клеток содержат амплифицированный ген, встроенный в хромосому. Для продуцирования антител часто используют клетки яичника китайского хомячка (СНО) и клетки NSO.
Клонирование и экспрессия в клетках СНО
Выделенную ДНК, кодирующую вариабельную и константную области, и дефосфорилированный вектор лигируют с ДНК-лигазой Т4. Клетки E. coli HB101 или XL-1 Blue затем трансформируют и при помощи рестрикционного анализа идентифицируют бактерии, содержащие фрагмент, вставленный в плазмиду рС4.
Для трансфекции используют клетки яичника китайского хомячка (СНО), в которых отсутствует активный ген DHFR. 5 мкг экспрессирующей плазмиды рС4 котрансфецируют 0,5 мкг плазмиды pSV2-neo, используя липофектин. Плазмида pSV2-neo содержит доминантный селектируемый маркеро, neo ген из Tn5, кодирующего фермент, который сообщает устойчивость к группе антибиотиков, включающей G418. Клетки высевают в среду альфа минус МЕМ, содержащую 1 мкг/мл G418. Через 2 дня клетки обрабатывают трипсином и высевают на планшеты для клонирования гибридом (Greiner, Germany) в среде альфа минус МЕМ, содержащей 10, 25 или 50 нг/мл метотрексата с 1 мкг/мл G418. Примерно через 10-14 дней отдельные клоны обрабатывают трипсином и затем высевают на 6-луночные чашки Петри или в 10 мл колбы, используя метотрексат в разных концентрациях (50 нМ, 100 нМ, 200 нМ, 400 нМ, 800 нМ). Клоны, выращиваемые при самых высоких концентрациях метотрексата, затем переносят на новые 6-луночные чашки Петри, содержащие еще более высокие концентрации метотрексата (1 мМ, 2 мМ, 5 мМ, 10 мМ, 20 мМ). Указанную процедуру повторяют до получения клонов, растущих при концентрации 100-200 мМ. Экспрессию требуемого генного продукта анализируют, например, при помощи SDS-PAGE и вестерн-блоттинга, ELISA или ВЭЖХ с обращенной фазой.
Композиции антител против IL-6
Настоящее изобретение относится также по меньшей мере к одной композиции антител против IL-6, включающей по меньшей мере одно, по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть или более антител против IL-6, рассмотренных в настоящем описании изобретения и/или известных в данной области, которые находятся в неприродной композиции, смеси или форме. Такие композиции представляют собой неприродные композиции, включающие по меньшей мере один или два непроцессированных варианта с удаленным С- и/или N-концом, домены, фрагменты или определенные варианты аминокислотной последовательности антитела против IL-6, выбираемой из группы, состоящей из 70-100% смежных аминокислот CDR-областей антител по настоящему изобретению или их определенных фрагментов или вариантов. Предпочтительные композиции антител против IL-6 включают по меньшей мере один или два непроцессированных фрагмента, домена или варианта в качестве по меньшей мере одной CDR или LBR-содержащей части последовательностей антитела против IL-6 по настоящему изобретению. Предпочтительные композиции далее включают 40-99% по меньшей мере одной из 70-100% CDR-области антитела против IL-6 по настоящему изобретению. Процентные значения такой композиции являются процентами по массе, объему, концентрации, молярности или мольности в виде жидких или сухих растворов, смесей, суспензий, эмульсий или коллоидных растворов, известных в данной области или рассмотренных в настоящем описании изобретения.
Композиции антител против IL-6 по настоящему изобретению могут далее включать по меньшей мере любое приемлемое и эффективное количество другой композиции или фармацевтической композиции, содержащей по меньшей мере одно антитело против IL-6 для клетки, ткани, органа, животного или субъекта, нуждающегося в такой модификации или лечении, выбираемой по меньшей мере из одного антагониста TNF (который, например, включает, не ограничиваясь ими, антитело против TNF или его фрагмент, растворимый рецептор TNF или его фрагмаент, слитые белки или низкомолекулярный антагонист TNF), противоревматического средства (такого как, например, метотрексат, ауранофин, ауротиоглюкоза, азатиоприн, этанерцепт, золото-тиомалат натрия, сульфат гидроксихлорохина, лефлуномид, сульфасалазин), миорелаксанта, наркотического лекарственного средства, нестероидного противовоспалительного средства (NSAID), анальгетика, анестезирующего средства, седативного средства, местного анестетика, нервно-мышечного блокатора, антимикробного средства (такого как, например, аминогликозид, противогрибковое средство, антипаразитарное средство, антивирусное средство, карбапенем, цефалоспорин, фторхинолон, макролид, пенициллин, сульфонамид, тетрациклин, другое антимикробное средство), антипсориазного средства, кортикостероида, анаболического стероида, средства от диабета, минерала, питательного вещества, средства для лечения щитовидной железы, витамина, кальциевого гормона, антидиарейного средства, противокашлевого средства, противорвотного средства, противоязвенного средства, слабительного средства, антикоагулянта, эритропоэтина (такого как, например, альфа-эритропоэтин), филграстима (такого как, например, G-CSF, неупоген), сарграмостима (GM-CSF, лейкин), иммунизирующего вещества, иммуноглобулина, иммуносупрессора (такого как, например, басиликсимаб, циклоспорин, даклизумаб), гормона роста, гормонозамещающего средства, модулятора рецептора эстрогена, мидриатического средства, средства от циклоплегии, алкилирующего агента, антиметаболита, ингибитора митоза, радиофармацевтического средства, антидепрессанта, антиманиакального средства, антипсихотического средства, анксиолитика, снотворного средства, симпатомиметического средства, стимулятора, донепезила, такрина, лекарственного средства от астмы, бета-агониста, ингалируемого стероида, ингибитора лейкотриена, метилксантина, кромолина, эпинефрина или его аналога, альфа-дорназы (пульмозим), цитокина или антагониста цитокина. Неограничивающие примеры таких цитокинов включают, не ограничиваясь ими, любые интерлейкины от IL-1 до IL-34. Приемлемые дозы хорошо известны в данной области. Смотрите, например, публикации Wells et al., eds., Pharmacotherapy Handbook, 2.sup.nd Edition, Appleton and Lange, Stamford, Conn. (2000); PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia 2000, Deluxe Edition, Tarascon Publishing, Loma Linda, Calif. (2000), которые полностью включены в настоящее описание изобретения в качестве ссылки.
Такие противораковые или антиинфекционные средства могут также включать молекулы токсинов, которые объединяют, связывают, совместно получают или совместно вводят по меньшей мере с одним антителом по настоящему изобретению. Токсин может необязательно избирательно уничтожать патогенные клетки или ткани. Патогенная клетка может быть раковой или другой клеткой. Такие токсины могут включать, не ограничиваясь ими, очищенные или рекомбинантные токсины или фрагменты токсинов, имеющие по меньшей мере один функциональный цитотоксический домен токсина, например, выбираемый по меньшей мере из рицина, дифтерийного токсина, токсического яда или бактериального токсина. Термин "токсин" означает также эндотоксины и экзотоксины, продуцируемые любыми природными мутантными или рекомбинантными бактериями или вирусами, которые могут вызывать любое патологическое состояние у человека и других млекопитающих, включая токсиновый шок, который может стать причиной смерти. Такие токсины могут включать, не ограничиваясь ими, термонеустойчивый энтеротоксин (LT) энтеротоксигенного E. coli, термостойкий энтеротоксин (ST), цитотоксин Shigella, энтеротоксины Aeromonas, токсин-1 синдрома токсического шока (TSST-1), стафилококковый энтеротоксин А (SEA), В (SEB) или С (SEC), стрептококковые энтеротоксины и тому подобные. Такие бактерии включают, не ограничиваясь ими, штаммы вида энтеротоксигенного E. coli (ETEC), энтерогеморрагического E. coli (например, штаммы серотипа 0157:Н7), вида Staphylococcus (например, Staphylococcus aureus, Staphylococcus pyogenes), вида Shigella (например, Shigella dysenteriae, Shigella flexneri, Shigella boydii и Shigella sonnei), вида Salmonella (например, Salmonella typhi, Salmonella cholerasuis, Salmonella entetitidis), вида Clostridium (например, Clostridium perfringens, Clostridium dificile, Clostridium botulinum), вида Camphlobacter (например, Camphlobacter jejuni, Camphlobacter fetus), вида Heliobacter (например, Heliobacter pylori), вида Aeromonas (например, Aeromonas sobria, Aeromonas hydrophila, Aeromonas caviae), Pleisomonas shigelloides, Yersina enterocolitica, вида Vibrios (например, Vibrios cholerae, Vibrios parahemolyticus), вида Klebsiella, Pseudomonas aeruginosa и Streptococci. Смотрите, например, публикации Stein, ed., INTERNAL MEDICINE, 3rd ed., pp 1-13, Little, Brown and Co., Boston, (1990); Evans et al., eds., Bacterial Infections of Humans: Epidemiology and Control, 2d. Ed., pp 239-254, Plenum Medical Book Co., New York (1991); Mandell et al, Principles and Practice of Infectious Diseases, 3d. Ed., Churchill Livingstone, N.Y. (1990); Berkow et al, eds., The Merck Manual, 16th edition, Merck and Co., Rahway, N.J., 1992; Wood et al, FEMS Microbiology Immunology, 76:121-134 (1991); Marrack et al, Science, 248:705-711 (1990), которые полностью включены в настоящее описание изобретения в качестве ссылки.
Соединения, композиции или комбинации антител против IL-6 далее содержат по меньшей мере одно вспомогательное вещество, которое включает, не ограничиваясь ими, разбавитель, связывающее вещество, стабилизатор, буферы, соли, липофильные растворители, консервант, адъювант или тому подобные. Фармацевтически приемлемые вспомогательные вещества являются более предпочтительными. Неограничивающие примеры таких стерильных растворов и способов их получения хорошо известны в данной области и, в частности, описаны в публикации Gennaro, Ed., Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co. (Easton, Pa.) 1990. Фармацевтически приемлемые носители могут быть выбраны с учетом их пригодности для определенного способа введения, растворимости и/или устойчивости антитела против IL-6, его фрагмента или варианта, и такие носители хорошо известны в данной области или рассмотрены в настоящем описании изобретения.
Фармацевтические наполнители и добавки, пригодные для использования в композиции по настоящему изобретению, включают, не ограничиваясь ими, белки, пептиды, аминокислоты, липиды и углеводы (например, сахара, включающие моносахариды, ди-, три-, тетра- и олигосахариды; производные сахара, такие как альдиты, альдоновые кислоты, этерифицированные сахара и тому подобные; и полисахариды или полисахара), которые могут присутствовать отдельно или в комбинации в количестве 1-99,99 масс.% или об.%. Типичные белковые наполнители включают сывороточный альбумин, такой как сывороточный альбумин человека (HSA), рекомбинантный альбумин человека (rHA), желатин, казеин и тому подобные. Типичные аминокислоты/антитела, которые также могут выполнять буферную функцию, включают аланин, глицин, аргинин, бетаин, гистидин, глутаминовую кислоту, аспарагиновую кислоту, цистеин, лизин, лейцин, изолейцин, валин, метионин, фенилаланин, аспартам и тому подобные. Одной предпочтительной аминокислотой является глицин.
Углеводные наполнители, пригодные для использования в настоящем изобретении, включают, например, моносахариды, такие как фруктоза, мальтоза, галактоза, глюкоза, D-манноза, сорбоза и тому подобные; дисахариды, такие как лактоза, сахароза, трегалоза, целлобиоза и тому подобные; полисахариды, такие как раффиноза, мелезитоза, мальтодекстрины, декстраны, крахмалы и тому подобные; и альдиты, такие как маннит, ксилит, мальтит, лактит, ксилит-сорбит (глюцит), миоинозит и тому подобные. Предпочтительными углеводными наполнителями, пригодными для использования в настоящем изобретении, являются маннит, трегалоза и раффиноза.
Композиции антител против IL-6 могут также включать буфер или регулятор рН; буфер обычно является солью, полученной из органической кислоты или основания. Типичные буферы включают соли органических кислот, такие как соли лимонной кислоты, аскорбиновой кислоты, глюконовой кислоты, угольной кислоты, винной кислоты, янтарной кислоты, уксусной кислоты или фталевой кислоты; трис-буфер, трометамин-гидрохлоридный или фосфатный буфер. Предпочтительными буферами, пригодными для использования в настоящем изобретении, являются соли органических кислот, такие как цитрат.
Кроме того, композиции антител против IL-6 по настоящему изобретению могут включать полимерные наполнители/добавки, такие как поливинилпирролидоны, фиколлы (полимерный сахар), декстраты (например, циклодекстрины, такие как 2-гидроксипропил-бета-циклодекстрин), полиэтиленгликоли, ароматизаторы, антимикробные средства, подсластители, антиоксиданты, антистатики, поверхностно-активные вещества (например, полисорбаты, такие как "твин 20" и "твин 80"), липиды (например, фосфолипиды, жирные кислоты), стероиды (например, холестерин) и хелатообразователи (например, ЭДТА).
В данной области известны вышеуказанные и дополнительные фармацевтические наполнители и/или добавки, пригодные для использования в композициях антител против IL-6, их частей или вариантов, например, описанные в публикациях "Remington: The Science & Practice of Pharmacy", 19.sup.th ed., Williams & Williams, (1995) и “Physician's Desk Reference", 52nd ed. Medical Eonomics, Montvale, N.J. (1998), которые полностью включены в настоящее описание изобретения в качестве ссылки. Предпочтительными носителями или наполнителями являются углеводы (например, сахариды и альдиты) и буферы (например, цитрат) или полимерные агенты.
Препараты
Как указано выше, настоящее изобретение относится к устойчивым препаратам, которые предпочтительно содержат фосфатный буфер с физиологическим раствором или выбранную соль, к консервированным растворам и препаратам, содержащим консервант, а также к многоцелевым консервированным препарат, пригодным для применения в фармакологии или ветеринарии, которые включают по меньшей мере одно антитело против IL-6 в фармацевтически приемлемом препарате. Консервированные препараты содержат по меньшей мере один известный консервант или необязательно выбираемый из группы, состоящей по меньшей мере из фенола, м-крезола, п-крезола, о-крезола, хлоркрезола, бензилового сирта, фенилмеркурнитрита, феноксиэтанола, формальдегида, хлорбутанола, хлорида магния (напримео, гексагидрата), алкилпарабена (метил, этил, пропил, бутил и тому подобный), хлорида бензалкония, хлорида бензетония, дегидроацетата натрия и тимерозала или их смесей в водной разбавителе. Может быть использована любая известная в данной области приемлемая концентрация или смесь, например, равная 0,001-5%, любому интервалу указанных значений или любому числу в указанном интервале, и включающая, не ограничиваясь ими, 0,001, 0,003, 0,005, 0,009, 0,01, 0,02, 0,03, 0,05, 0,09, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,3, 4,5, 4,6, 4,7, 4,8, 4,9%, любой интервал указанных значений или любое число в указанном интервале. Неограничивающие примеры включают при отсутствии консерванты 0,1-2% м-крезола (например, 0,2, 0,3, 0,4, 0,5, 0,9, 1,0%), 0,1-3% бензилового спирта (например, 0,5, 0,9, 1,1, 1,5, 1,9, 2,0, 2,5%), 0,001-0,5% тимерозала (например, 0,005, 0,01), 0,001-2,0% фенола (например, 0,05, 0,25, 0,28, 0,5, 0,9, 1,0%), 0,0005-1,0% алкилпарабена (например, 0,00075, 0,0009, 0,001, 0,002, 0,005, 0,0075, 0,009, 0,01, 0,02, 0,05, 0,075, 0,09, 0,1, 0,2, 0,3, 0,5, 0,75, 0,9, 1,0%) и тому подобные.
Как указано выше, настоящее изобретение относится к изделию, включающему упаковочный материал и по меньшей мере один сосуд, содержащий раствор по меньшей мере одного антитела против IL-6 с соответствующими буферами и/или консервантами необязательно в водном разбавителе, при этом указанный упаковочный материал имеет этикетку, указывающую, что такой раствор можно хранить в течение 1, 2, 3, 4, 5, 6, 9, 12, 18, 20, 24, 30, 36, 40, 48, 54, 60, 66, 72 часов или больше. Настоящее изобретение далее относится к изделию, включающему упаковочный материал, первый сосуд, содержащий по меньшей мере одно лиофилизованное антитело против IL-6, и второй сосуд, содержащую водный разбавитель соответствующего буфера или консерванты, при этом указанный упаковочный материал имеет этикетку, инструктирующую субъекта о необходимости восстановить по меньшей мере одно антитело против IL-6 в водном разбавителе с образованием раствора, который можно хранить в течение двадцати четырех часов или дольше.
По меньшей мере одно антитело против IL-6, используемое в соответствии с настоящим изобретением, может быть получено методами рекомбинантных ДНК из клетки млекопитающего или трансгенных препаратов или может быть выделено из других биологических источников, рассмотренных в настоящем описании изобретения или известных в данной области.
Продукт по настоящему изобретению содержит по меньшей мере одно антитело против IL-6 в количестве, получаемом после восстановления в мокрой/сухой системе, которое составляет от примерно 1,0 мкг/мл до примерно 1000 мг/мл, хотя могут быть использованы более низкие и более высокие концентрации в зависимости от предполагаемого носителя, например, концентрация в препаратах в виде растворов будет отличаться от концентрации в чрескожном пластыре и препаратах, предназначенных для введения в легкое, через слизистую оболочку или при использовании осмотического насоса или микронасоса.
Водный разбавитель предпочтительно, но не обязательно далее включает фармацевтически приемлемый консервант. Предпочтительные консерванты выбирают из группы, состоящей из фенола, м-крезола, п-крезола, о-крезола, хлоркрезола, бензилового спирта, алкилпарабена (метил, этил, пропил, бутил и тому подобный), хлорида бензалкония, хлорида бензетония, дигидроацетата натрия и тимерозала или их смесей. Концентрация консерванты, используемого в препарате, должна быть достаточной для обеспечения антимикробного действия. Такие концентрации зависят от выбранного консерванта и могут быть легко определены специалистом в данной области.
В разбавитель могут быть необязательно, но предпочтительно добавлены другие наполнители, например, регуляторы изотоничности раствора, буферы, антиоксиданты, усилители консервантов. Регулятор изотоничности раствора, такой как глицерин, обычно используют в известных концентрациях. Физиологически приемлемый буфер предпочтительно добавляют для лучшего регулирования рН. Препараты могут охватывать широкий диапазон значений рН, например, от примерно рН 4 до примерно рН 10, при этом предпочтительные диапазоны охватывают от примерно рН 5 до примерно рН 9, и наиболее предпочтительный диапазон включает от примерно 6,0 до примерно 8,0. Препараты по настоящему изобретению предпочтительно имеют значение рН от примерно 6,8 до примерно 7,8. Предпочтительными буферами являются фосфатные буферы, наиболее предпочтительно натрий-фосфатные буферы, в частности, физиологический раствор с фосфатным буфером (PBS).
Для уменьшения агрегации в препараты или композиции могут быть введены другие добавки, такие как фармацевтически приемлемые растворители, в частности, твин 20 (полиоксиэтилен(20)сорбитанмонолаурат), твин 40 (полиоксиэтилен(20)сорбитанмонопальмитат), твин 80 (полиоксиэтилен(20)сорбитанмоноолеат), плюроник F68 (полиоксиэтилен-полиоксипропиленовый блоксополимер) и PEG (полиэтиленгликоль), или неионогенные поверхностно-активные вещества, такие как полисорбат 20 или 80 или полоксамер 184 или 188, Pluronic.RTM.polyls, другие блоксополимеры и хелатообразователи, такие как ЭДТА и EGTA. Указанные добавки являются особенно полезными, если для введения препарата используется насос или пластиковая емкость. Присутствие фармацевтически приемлемого поверхностно-активного вещества уменьшает агрегацию белка.
Препараты по настоящему изобретению могут быть получены способом, который включает смешивание по меньшей мере одного антитела против IL-6 и консерванта, выбираемого из группы, состоящей из фенола, м-крезола, п-крезола, о-крезола, хлоркрезола, бензилового спирта, алкилпарабена (метил, этил, пропил, бутил и тому подобный), хлорида бензалкония, хлорида бензетония, дигидроацетата натрия и тимерозала или их смесей, в водной разбавителе. Смешивание по меньшей мере одного антитела против IL-6 и консерванта в водном разбавителе выполняют стандартными методами растворения и смешивания. Для получения необходимого препарата измеренное количество по меньшей мере одного антитела против IL-6 в буферном растворе объединяют с желаемым консервантом в буферном растворе в количестве, достаточном для получения белка и консерванта в требуемых концентрациях. Специалисту в данной области должны быть известны варианты указанного метода. Например, порядок добавления компонентов при использовании дополнительных добавок, температура и значение рН, при которых получают препарат, являются факторами, которые могут быть оптимизированы в соответствии с используемой концентрацией и предполагаемым способом введения.
Препараты по настоящему изобретению могут быть предоставлены субъектам в виде прозрачных растворов или в двух сосудах, в одном из которых находится по меньшей мере одно лиофилизованное антитело против IL-6, восстанавливаемое содержимым второго сосуда, содержащего воду, консервант и/или наполнители, предпочтительно фосфатный буфер и/или физиологический раствор и выбранную соль, в водном разбавителе. Один сосуд с раствором или два сосуда, содержимое одного из которых требует восстановления, могут быть использованы несколько раз, причем их содержимого достаточно для одного или более циклов лечения субъекта, что делает схему лечения более удобной по сравнению с применяемыми в настоящее время.
Изделия по настоящему изобретению пригодны для введения в течение двадцати четырех часов или больше. Таким образом, изделия по настоящему изобретению являются весьма удобными для субъекта. Препараты по настоящему изобретению можно безопасно хранить при температурах от примерно 2°С до примерно 40°С при сохранении биологической активности белка в течение длительных периодов времени, благодаря чему на этикетке упаковки может быть указано, что раствор можно хранить и/или использовать в течение 6, 12, 18, 24, 36, 48, 72 или 96 часов или больше. При использовании консервированного разбавителя срок использования, указанный на этикетке, может быть равен 1-12 месяцам, полугоду, полутора годам и/или двум годам.
Растворы по меньшей мере одного антитела против IL-6 по настоящему изобретению могут быть получены способом, который включает смешивание по меньшей мере одного антитела в водном разбавителе. Смешивание выполняют стандартными методами растворения и смешивания. Для получения приемлемого разбавителя измеренное количество по меньшей мере одного антитела в воде или буфере объединяют в количествах, достаточных для получения белка и необязательно консерванта или буфера в требуемых концентрациях. Специалисту в данной области должны быть известны варианты указанного метода. Например, порядок добавления компонентов при использовании дополнительных добавок, температура и значение рН, при которых получают препарат, являются факторами, которые могут быть оптимизированы в соответствии с используемой концентрацией и предполагаемым способом введения.
Продукты по настоящему изобретению могут быть предоставлены субъектам в виде прозрачных растворов или в двух сосудах, в одном из которых находится по меньшей мере одно лиофилизованное антитело против IL-6, восстанавливаемое водным разбавителем из второго сосуда. Один сосуд с раствором или два сосуда, содержимое одного из которых требует восстановления, могут быть использованы несколько раз, причем их содержимого достаточно для одного или более циклов лечения субъекта, что делает схему лечения более удобной по сравнению с применяемыми в настоящее время.
Продукты по настоящему изобретению могут быть предоставлены субъектам опосредованно через аптеки, клиники или другие подобные учреждения в виде прозрачных растворов или в двух сосудах, в одном из которых находится по меньшей мере одно лиофилизованное антитело против IL-6, восстанавливаемое водным разбавителем. В данном случае прозрачный раствор в объеме одного литра или более может находиться в большой емкости, из которой меньшие порции раствора по меньшей мере одного антитела один или более раз переносят в меньшие сосуды и через аптеку или клинику предоставляют потребителям и/или субъектам.
Известными устройствами, включающими указанные системы с одним сосудом, являются устройства для инъекций в виде ручки, предназначенные для введения раствора, такие как BD Pens, BD Autojector.RTM., Humaject.RTM., NovoPen.RTM., B-D.RTM.Pen, AutoPen.RTM., OptiPen.RTM., GenotropinPen.RTM., GenotronormPen.RTM, HumatroPen.RTM, Reco-Pen.RTM., Roferon Pen.RTM., Biojector.RTM., iject.RTM., J-tip Needle-Free Injector.RTM., Intraject.RTM., Medi-Ject.RTM., например, производимые компанией Bector Dickensen (Franklin Lakes, N.J., http://www.bectondickenson.com), Disetronic (Burgdorf, Switzerland, http://www.disetronic.com; Bioject, Portland, Oreg. (http://www.bioject.com); National Medical Products, Weston Medical (Peterborough, UK, http://www.weston-medical.com), MediJect Corp. (Minneapolis, Minn, http://www.mediject.com). Известные устройства, представляющий собой систему с двумя сосудами, включают системы для инъекций в виде ручки, предназначенные для восстановления лиофилизованного лекарственного средства в картридже для доставки восстановленного раствора, такие как HumatroPen.RTM.
Продукты по настоящему изобретению включают упаковочный материал. Помимо информации, требуемой контролирующими органами, упаковочный материал обеспечивает условия, в которых указанный продукт может быть использован. Упаковочный материал по настоящему изобретению предоставляет субъекту инструкции по восстановлению по меньшей мере одного антитела против IL-6 в водном разбавителе с образованием раствора и информацию о необходимости использовать раствор в течение 2-24 часов или более для мокрого/сухого продукта, находящегося в двух сосудах. В случае одного сосуда, содержащего раствор продукта, на этикетке должно быть указано, что такой раствор может быть использован в течение 2-24 часов или больше. Продукты по настоящему изобретению пригодны для использования в качестве фармацевтических продуктов для человека.
Препараты по настоящему изобретению могут быть получены способом, который включает смешивание по меньшей мере одного антитела против IL-6 и выбранного буфера, предпочтительно фосфатного буфера, содержащего физиологический раствор и выбранную соль. Смешивание по меньшей мере одного антитела и буфера в водном разбавителе выполняют стандартными методами растворения и смешивания. Для получения требуемого препарата измеренное количество по меньшей мере одного антитела в воде или буфере объединяют с желаемым буфером в воде в количествах, достаточных для получения белка и буфера в требуемых концентрациях. Специалисту в данной области должны быть известны варианты указанного метода. Например, порядок добавления компонентов при использовании дополнительных добавок, температура и значение рН, при которых получают препарат, являются факторами, которые могут быть оптимизированы в соответствии с используемой концентрацией и предполагаемым способом введения.
Устойчивые или консервированные препараты по настоящему изобретению могут быть предоставлены субъектам в виде прозрачных ратворов или в двух сосудах, в одном из которых находится по меньшей мере одно лиофилизованное антитело против IL-6, восстанавливаемое содержимым второго сосуда, содержащего консервант или буфер и наполнители в водном разбавителе. Один сосуд с раствором или два сосуда, содержимое одного из которых требует восстановления, могут быть использованы несколько раз, причем их содержимого достаточно для одного или более циклов лечения субъекта, что делает схему лечения более удобной по сравнению с применяемыми в настоящее время.
По меньшей мере одно антитело против IL-6, входящее в состав устойчивых или консервированных препаратов или растворов, рассмотренных в настоящем описании изобретения, может быть введено субъекту разными способами, включающими подкожную или внутримышечную инъекцию, с помощью чрескожного пластыря, в легкое, через слизистую оболочку, в виде имплантата, при использовании осмотического насоса, картриджа, микронасоса или другими способами, известными специалисту в данной области.
Терапевтические применения
В одном варианте осуществления настоящего изобретения фармацевтические композиции, включающие антитело против IL-6 по настоящему изобретению, облегчают введение гуманизированных антител в организм, предпочтительно животному, более предпочтительно млекопитающему. Конкретные млекопитающие включают, крупный рогатый скот, собак, лошадей, кошек, овец и свиней, приматов кроме человека и человека. Человек является особенно предпочтительным.
IL-6, благодаря своей плейотропной активности, имеет отношение к патологии разных заболеваний. Поэтому высокоаффинное, нейтрализующее химерное или человеческое антитело к IL-6 желательно использовать при лечении IL-6-опосредованных заболеваний, таких как рак, кахексия, SLE, ревматоидный артрит, остеопороз, черепно-мозговая травма, отек мозга, депрессия и CHF. В одном предпочтительном объекте настоящего изобретения антитело против IL-6 по настоящему изобретению может быть использовано для лечения ревматоидного артрита. Антитела против IL-6 или любые производные указанных моноклональных антител, включая химерные или гуманизированные антитела, или их фрагменты могут быть использованы для ослабления болей в костях, подавления роста опухолей, таких как меланома, рак почки, предстательной железы, молочной железы, легкого, ободочной кишки, лечения множественной миеломы, лимфопролиферативных нарушений и других заболеваний, опосредованных IL-6. Указанные антитела могут быть использованы отдельно или в комбинации с другими терапевтическими средствами. Кроме того, указанные моноклональные антитела могут быть использованы в качестве вещества, чуствительного к химиотерапевтическим препаратам, что позволяет повысить терапевтическую эффективность цитотоксических средств. Указанные антитела могут быть использованы в качестве радиочувствительного вещества, что позволяет повысить эффективность лучевой терапии. Указанные антитела могут быть также использованы в комбинации с другими иммуномодулирующими средствами, такими как IL-2, IL-12 и/или IFNальфа. Кроме того, антитела против IL-6 могут быть использованы в комбинации с другими моноклональными антителами, такими как антитела против TNF-α, IL-12/IL-23, IL-2, рецептора GpIIb/IIIa, CD52, CD20, белков RSV, рецептора HER2/neu, и тому подобными, а также с коммерчески доступными антителами, включающими ритуксан, герцептин, милотарг, кампат, зевалин, бексар, эрбитукс, авастин и вектибикс.
Таким образом, настоящее изобретение относится также к модуляции или лечению по меньшей мере одного IL-6-опосредованного заболевания в клетке, ткани, органе, у животного или субъекта, известного в данной области или рассмотренного в настоящем описании изобретения, при использовании по меньшей мере одного антитела против IL-6 по настоящему изобретению.
Известно, что IL-6 усиливает пролиферацию, дифференцировку и выживание злокачественных плазматических клеток в случае множественной миеломы (ММ) в соответствии с аутокринным или паракринным механизмом, который включает ингибирование апоптоза злокачественных клеток. Множественная миелома является неизлечимым злокачественным нарушением плазматических клеток, на которое эффективно воздействует блокирование IL-6 (Anderson et al., Multiple Myeloma: New Insights and Therapeutic Approaches. Hematology: 147-165, 2000). IL-6 также оказывает онкогенное воздействие в случае базально-клеточного рака, в котором IL-6-трансфецированные клетки характеризуются более высокой скоростью роста опухоли в результате подавления апоптоза и активной стимуляции (Jee et al., Overexpression of interleukin-6 in human basal cell carcinoma cell lines increases anti-apoptotic activity and tumorigenic potency. Oncogene, Vol. 20, No. 2. pp. 198-208, 2001). IL-6 может также стимулировать устойчивость раковых клеток молочной железы к химиотерапии, индуцируя экспрессию mdr1 гена (mdr1 и пути металлотионеина) (Conze et al., Autocrine Production of Interleukin 6 Causes Multidrug Resistance in Breast Cancer Cells. Cancer Res. 61: 8851-8858, 2001).
Способность IL-6 опосредовать выживание опухолевых клеток и развитие заболевания была подтверждена ингибирующим воздействием моноклонального антитела против IL-6 на рост опухоли in vitro и in vivo. В научной литературе сообщалось, что блокада IL-6 может ингибировать рост опухолей головного мозга человека (глиобластома) in vitro (Goswami et al., interleukin-6-mediated autocrine growth promotion in human glioblastoma multiforme cell line U87MG. J. Neurochem. 71:1837-1845, 1998). При использовании аналогичного метода было продедмонстрировано, что инъекция мышиного антитела против IL-6 CLB8 продлевает жизнь мышей, несущих человеческие опухоли (Mauray et al., Epstein-Barr virus-dependent lymphoproliferative disease; critical role of IL-6. Eur. J. Immunol.; 30(7):2065-73, 2000). В научной литературе также сообщалось, что антитело против IL-6 mCLB8 вызывает регресс роста злокачественных опухолей почки человека и уменьшает концентрации кальция в сыворотке голых мышей (Weisglass et al., The role of interleukine-6 in the induction of hypercalcemia in renal cell carcinoma transplanted into nude mice. Endocrinology 138(5):1879-8, 1995). Антитело CLB-8 также вызывает регресс не восприимчивых к гормонам человека ксенотрансплантатов опухоли предстательной железы у мышей (Smith et al., 2001). Моноклональное антитело против интерлейкина 6 вызывает регресс ксенотрансплантатов рака предстательной железы человека у голых мышей (Smith and Keller, Prostate; 48(1):47-53).
IL-6 также может быть прогностическим фактором и маркером злокачественных новообразований. В случае почечно-клеточного рака (RCC) высокие уровни IL-6 свидетельствуют о метастазировании опухоли и в конечном счете о плохом прогнозе и непродолжительной жизни (Jean-Yves Blay et al., 1992). Кроме того, в случае RCC повышенная концентрация IL-6 в сыворотке указывает на плохую восприимчивость к лечению IL-2 (Fumagalli et al., 1999. Pretreatment serum markers and lymphocyte response ro interleukin-2 therapy. Br. J. Cancer 80(3-4):407-11) и соответствует степени IL-2-ассоциированной токсичности (Capuron et al., 2001. Association between immune activation and early depressive symptoms in cancer patients treated with interleukin-2-based therapy. Psychoneuroendocrinology; 26(8):797-808).
Повышенные уровни IL-6 также свидетельствуют о плохом прогнозе и наличии метастазов в случае рака молочной железы (Kurebayashi 2000 and Benoy 2002. Regulation of interleukin-6 secretion from breast cancer cells and its clinical implications. Breast Cancer; 7(2):124-9. Serum interleukin 6, plasma VEGF, serum VEGF, and VEGF platelet load in breast cancer patients. Clin. Breast Cancer; 2(4):311-5).
Гипотетически IL-6 является этиологическим фактором опосредованной раком заболеваемости такими болезнями как астения/кахексия и резорбция кости. Установлено, что вызванная опухолью кахексия (Cahlin et al., 2000) и резорбция кости (последующая гиперкальциемия) (Sandhu et al., 1999) уменьшается у мышей с отсутствием IL-6. Вызванная раком депрессия и отек головного мозга, являющийся вторичным по отношению к опухолям головного мозга, также были связаны с высокими уровнями IL-6 (Musselman et al., 2001). Антитела против IL-6 по настоящему изобретению также могут ингибировать кахексию у голых мышей, вызванную меланомой и раком предстательной железы человека.
Настоящее изобретение относится к способу модуляции или лечения по меньшей мере одного злокачественного заболевания в клетке, ткани, органе, у животного или субъекта, которое включает, не ограничиваясь ими, множественную миелому, лейкоз, острый лейкоз, острый лимфобластный лейкоз (ALL), В-клеточный, Т-клеточный или FAB ALL, острый миелоидный лейкоз (AML), хронический миелолейкоз (CML), хронический лимфолейкоз (CLL), волосатоклеточный лейкоз, миелодипластический синдром (MDS), лимфому, болезнь Ходжкина, злокачественную лимфому, неходжскинскую лимфому, лимфому Беркитта, множественную миелому, саркому Капоши, колоректальный рак, почечно-клеточный рак, рак поджелудочной железы, рак предстательной железы, носоглоточный рак, злокачественный гистиоцитоз, паранеопластический синдром/гиперкальциемию злокачественного заболевания, солидные опухоли, аденокарциномы, саркомы, злокачественную меланому, гемангиому, метастазирующее заболевание, резорбцию кости, обусловленная раком, боли в кости, обусловленные раком; супрессию раковых метастазов; ослабление раковой кахексии; лечение воспалительных заболеваний, таких как пролиферативный гломерулонефрит и тому подобные. Такой способ может быть необязательно использован в комбинации с лучевой терапией, средством, препятствующим образованию кровеносных сосудов, химиотерапевтическим средством, ингибитором фарнезилтрансферазы или тому подобными лечебными мероприятиями, выполняемыми до, одновременно или после введения антитела против IL-6.
Настоящее изобретение относится также к способу модуляции или лечения по меньшей мере одного IL-6-опосредованного иммунного заболевания в клетке, ткани, органе, у животного или субъекта, которое включает, не ограничиваясь ими, ревматоидный артрит, юношеский ревматоидный артрит, системный юношеский ревматоидный артрит, псориатический артрит, анкилозирующий спондилоартрит, язву желудка, сероотрицательную артропатию, остеоартрит, воспалительное заболевание кишечника, неспецифический язвенный колит, системую красную волчанку, антифосфолипидный синдром, иридоциклит/увеит/ретробульбарный неврит, идиопатический пневмофиброз, системный васкулит/гранулематоз Вегенера, саркоидоз, орхитомию/вазэктомию, аллергические/атопические заболевания, астму, аллергический ринит, экзему, аллергический контактный дерматит, аллергический конъюнктивит, аллергический пневмонит, трансплантаты, отторжение трансплантата, реакцию "трансплантат против хозяина", системное воспалительное заболевание, сепсис, сепсис, вызванный грамположительными бактериями, сепсис, вызванный грамотрицательными бактериями, сепсис, вызванный культурой с отсутствием роста, микозный сепсис, агранулоцитарную лихорадку, уросепсис, менингококкемию, травму/кровотечение, ожоги, воздействие ионизирующего облучения, острый панкреатит, респираторный дистресс-синдром взрослых, ревматоидный артрит, алкогольный гепатит, хронические воспалительные патологии, саркоидоз, патологию Крона, серповидно-клеточную анемию, диабет, нефроз, атопические заболевания, аллергические реакции, аллергический ринит, сенную лихорадку, конъюнктивит, эндометриоз, астму, крапивницу, системный анафалаксис, дерматит, анемию, гемолитическую болезнь, тромбоцитопению, отторжение трансплантата любого органа или ткани, отторжение трансплантата почки, отторжение трансплантата сердца, отторжение трансплантата печени, отторжение трансплантата поджелудочной железы, отторжение трансплантата легкого, отторжение трансплантата костного мозга (ВМТ), отторжение кожного аллотрансплантата, отторжение хрящевого трансплантата, отторжение костного трансплантата, отторжение трансплантата тонкой кишки, отторжение имплантата вилочковой железы плода, отторжение трансплантата паращитовидной железы, отторжение трансплантата любого органа или ткани, отторжение аллотрансплантата, аллергические реакции на рецептор, болезнь Грейвса, болезнь Рейно, инсулиноустойчивый диабет типа В, астму, миастению, антителоопосредованную цитотоксичность, аллергические реакции типа III, системную красную волчанку, синдром POEMS (полиневропатия, органомегалия, эндокринопатия, моноклональная гаммапатия и синдром изменения кожи), полиневропатию, органомегалию, эндокринопатию, моноклональную гаммапатию, синдром изменения кожи, антифосфолипидный синдром, пемфигус, склеродерму, смешанную болезнь соединительной ткани, идиопатическую болезнь Аддисона, сахарный диабет, хронический активный гепатит, первичный билиарный церроз печени, витилиго, васкулит, посткардиотомный синдром, аллергию IV типа, контактный дерматит, аллергическую пневмонию, отторжение аллотрансплантата, гранулемы, вызванные внутриклеточными организмами, чувствительность к лекарственному средству, болезнь обмена веществ/идиопатическое заболевание, болезнь Вильсона, гемахроматоз, недостаточность альфа-1-антитрипсина, диабетическую ретинопатию, тиреоидит Хашимото, остеопороз, систему гипоталамус-гипофиз-надпочечник, первичный билиарный цирроз печени, тиреоидит, энцефаломиелит, кахексию, муковисцидоз, хроническое заболевание легких новорожденного, хроническое обструктивное заболевание легких (COPD), семейный гематофагоцитарный лимфогистоцитоз, дерматологические заболевания, псориаз, алопецию, нефротический синдром, нефрит, гломерулонефрит, острую почечную недостаточность, гемодиализ, уремию, токсичность, преэклампсию, okt3 терапию, анти-cd3 терапию, цитокиновую терапию, химиотерапию, лучевую терапию (которая, например, включает, не ограничиваясь ими, астению, анемию, кахексию и тому подобные), хроническую интоксикацию салицилатом, приступы апноэ во сне, ожирение, сердечную недостаточность, синусит, воспалительное заболевание кишечника и тому подобные. Смотрите, например, публикации, the Merck Manual, 12th-17th Editions, Merck & Company, Rahway, N.J. (1972, 1977, 1982, 1987, 1992, 1999), Pharmacotherapy Handbook, Wells et al., eds., Second Edition, Appleton and Lange, Stamford, Conn. (1998, 2000), которые полностью включены в настоящее описание изобретения в качестве ссылки.
Настоящее изобретение относится также к способу модуляции или лечения по меньшей мере одного инфекционного заболевания в клетке, ткани, органе, у животного или субъекта, которое включает, не ограничиваясь ими, острую или хроническую бактериальную инфекцию, острые и хронические паразитарные или инфекционные процессы, включая бактериальные, вирусные и грибковые инфекции, ВИЧ-инфекцию/ВИЧ-невропатию, менингит, гепатит (А, В, С или тому подобный), септический артрит, перитонит, пневмонию, эпиглоттит, E. coli 0157:h7, гемолитико-уремический синдром/тромболитическую тромботическую пурпуру, маларию, геморрагическую лихорадку денге, лейшманиоз, лепру, синдром токсического шока, стрептококковый миозит, газовую гангрену, микобактериальный туберкулез, микобактериальный эндотоксин, пневмоцистоз, воспалительное заболевание таза, орхит/эпидидимит, болезнь "легионеров", болезнь Лайма, грипп, вирус Эпштейна-Барра, гемафагоцитарный синдром, энцефалит с высоким риском смертельного исхода/асептический менингит и тому подобные.
Любые указанные способы могут необязательно включать введение эффективного количества по меньшей мере одной композиции или фармацевтической композиции, содержащей по меньшей мере одно антитело против IL-6, в клетку, ткань, орган, животному или субъекту, нуждающемуся в такой модуляции или лечении. Показания для терапии антителом против IL-6 указаны в нижеследующих публикациях, которые включены в настоящее описание изобретения в качестве ссылки: Van Snick, "Interleukin-6: An Overview," Ann. Rev. Immunol., 8:253-278 (1990); Campbell et al., "Essential Role for Interferon-gamma. And Interleukin-6 in Autoimmune Insulin-Dependent Diabetes in NOD/Wehi Mice," J. Clin. Invest, 87:739-742 (1991); Heinrich et al., "Interleukin-6 Monoclonal Antibody Therapy for a Patient with Plasma Cell Leukemia," Blood, 78(5): 1198-1204 (1991); Starnes et al., "Anti-IL-6 Monoclonal Antibodies Protect Against Lethal Escherichia coli Infection and Lethal Tumor Necrosis Factor-alpha. Challenge in Mice," J. Immunol., 145(12):4185-4191 (1990); Strassman et al., "Evidence for the Involvement of interleukin 6 in Experimental Cancer Cachexia," J. Clin. Invest., 89:1681-1684 (1992).
Любой способ по настоящему изобретению может включать введение эффективного количества композиции или фармацевтической композиции, содержащей по меньшей мере одно антитело против IL-6, в клетку, ткань, орган, животному или субъекту, нуждающемуся в такой модуляции или лечении. Такой способ может далее необязательно включать совместное введение или комбинированную терапию, применяемую для лечения таких иммунных или злокачественных заболеваний, при этом по меньшей мере одно указанное антитело против IL-6, его определенную часть или вариант вводят до, одновременно и/или после введения по меньшей мере одного лекарственного средства, выбираемого из антагониста TNF (который, например, включает, не ограничиваясь ими, антитело против TNF или его фрагмент, растворимый рецептор TNF или его фрагмент, слитые белки или низкомолекулярный антагонист TNF), антитела против IL-18 или его фрагмента, низкомолекулярного антагониста IL-18 или белка, связывающегося с рецептором IL-18, антитела против IL-1 (включая альфа-IL-1 и бета-IL-1) или его фрагмента, антагониста растворимого рецептора IL-1, антиревматического средства (например, метотрексат, ауранофин, ауротиоглюкозу, азатиоприн, этанерцепт, золото-тиомалат натрия, сульфат гидроксихлорохина, лефлуномид, сульфасалазин), лучевой терапии, средства, препятствующего образованию кровеносных сосудов, химиотерапевтического средства, миорелаксанта талидомидея, наркотического лекарственного средства, нестероидного противовоспалительного средства (NSAID), анальгетика, анестезирующего средства, седативного средства, местного анестетика, нервно-мышечного блокатора, антимикробного средства (например, аминогликозида, противогрибкового средства, антипаразитарного средства, антивирусного средства, карбапенема, цефалоспорина, фторхинолона, макролида, пенициллина, сульфонамида, тетрациклина, другого антимикробного средства), антипсориазного средства, кортикостероида, анаболического стероида, средства от диабета, минерала, питательного вещества, средства для лечения щитовидной железы, витамина, кальциевого гормона, эритропоэтина (например, альфа-эритропоэтин), филграстима (такого как, например, G-CSF, неупоген), сарграмостима (GM-CSF, лейкин), иммунизирующего вещества, иммуноглобулина, иммуносупрессора (например, базиликсимаб, циклоспорин, даклизумаб), гормона роста, гормонозамещающего средства, модулятора рецептора эстрогена, мидриатического средства, средства от циклоплегии, алкилирующего агента, антиметаболита, ингибитора митоза, радиофармацевтического средства, антидепрессанта, антиманиакального средства, антипсихотического средства, анксиолитика, снотворного средства, симпатомиметического средства, стимулятора, донепезила, такрина, лекарственного средства от астмы, бета-агониста, ингалируемого стероида, ингибитора лейкотриена, метилксантина, кромолина, эпинефрина или его аналога, альфа-дорназы (пульмозим), цитокина или антагониста цитокина. В данной области хорошо известны приемлемые дозы. Смотрите, например, публикации Wells et al., eds., Pharmacotherapy Handbook, 2nd Edition, Appleton and Lange, Stamford, Conn. (2000); PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia 2000, Deluxe Edition, Tarascon Publishing, Loma Linda, Calif. (2000), которые полностью включены в настоящее описание изобретения в качестве ссылки.
Антагонисты TNF, пригодные для использования в композициях, комбинированной терапии, для совместного введения, в устройствах и/или способах по настоящему изобретению (далее включающие по меньшей мере одно антитело, его определенную часть и вариант по настоящему изобретению), включают, не ограничиваяь ими, антитела против TNF, их антигенсвязывающие фрагменты и молекулы рецепторов, которые специфически связываются с TNF; соединения, которые предотвращают и/или ингибируют синтез TNF, высвобождение TNF или его воздействие на клетки-мишени, такие как талидомид, тенидап, ингибиторы фосфодиэстеразы (например, пентоксифиллин и ролипрам), агонисты рецептора аденозина A2b и усилители рецептора аденозина A2b; соединения, предотвращающие и/или ингибирующие передачу сигнала рецептора TNF, такие как ингибиторы митогенактивированной протеинкиназы (МАР); соединения, блокирующие и/или ингибирующие отщепление TNF от мембраны, такие как ингибиторы металлопротеиназы; соединения, блокирующие и/или ингибирующие активность TNF, такие как ингибиторы ангиотензинпревращающего фермента (АСЕ) (например, каптоприл); и соединения, блокирующие и/или ингибирующие продуцирование и/или синтез TNF, такие как ингибиторы МАР-киназы.
Терапия
Любой способ по настоящему изобретению может быть способом лечения IL-6-опосредованного нарушения, который включает введение эффективного количества композиции или фармацевтической композиции, содержащей по меньшей мере одно антитело против IL-6, в клетку, ткань, орган, животному или субъекту, нуждающемуся в такой модуляции или лечении. Такой способ может далее необязательно включать совместное введение или комбинированную терапию для лечения таких иммунный заболеваний, в соответствии с которыми по меньшей мере одно указанное антитело против IL-6, его определенную часть или вариант вводят до, одновременно и/или после введения по меньшей мере одного вышеописанного средства.
В процессе лечения патологических состояний обычно вводят эффективное количество по меньшей мере одной композиции антитела против IL-6, которое в среднем составляет по меньшей мере от примерно 0,01 до 500 миллиграммов по меньшей мере одного антитела против IL-6 на килограмм массы тела субъекта в одной дозе и предпочтительно по меньшей мере от примерно 0,1 до 100 миллиграммов антитела/килограмм массы тела субъекта в одной или более дозах в зависимости от удельной активности композиции. Альтернативно эффективная концентрация в сыворотке может быть равна 0,1-5000 мкг/мл сыворотки в одной или более дозах. Лечащим врачам известны приемлемые дозы, которые зависят от тяжести заболевания, удельной активности вводимой композиции и в некоторых случаях от состояния конкретного субъекта, подвергаемого лечению; для определения требуемого терапевтического количества может быть необходимо произвести повторное введение, то есть повторно ввести субъекту определенную контролируемую или измеренную дозу и повторять введение до тех пор, пока не будет установлена требуемая суточная доза или достигнут желаемый эффект.
Предпочтительные дозы могут необязательно включать 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 и/или 100-500 мкг/кг/введение, а также любой интервал, значение или его часть в указанном интервале или обеспечивать достижение концентрации в сыворотке, равной 0,1, 0,5, 0,9, 1,0, 1,1, 1,2, 1,5, 1,9, 2,0, 2,5, 2,9, 3,0, 3,5, 3,9, 4,0, 4,5, 4,9, 5,0, 5,5, 5,9, 6,0, 6,5, 6,9, 7,0, 7,5, 7,9, 8,0, 8,5, 8,9, 9,0, 9,5, 9,9, 10, 10,5, 10,9, 11, 11,5, 11,9, 12, 12,5, 12,9, 13,0, 13,5, 13,9, 14,0, 14,5, 4,9, 5,0, 5,5, 5,9, 6,0, 6,5, 6,9, 7,0, 7,5, 7,9, 8,0, 8,5, 8,9, 9,0, 9,5, 9,9, 10, 10,5, 10,9, 11, 11,5, 11,9, 12, 12,5, 12,9, 13,0, 13,5, 13,9, 14, 14,5, 15, 15,5, 15,9, 16, 16,5, 16,9, 17, 17,5, 17,9, 18, 18,5, 18,9, 19, 19,5, 19,9, 20, 20,5, 20,9, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 96, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500 и/или 5000 мкг/мл сыворотки в одной или более дозах, а также любому интервалу, значению или его части в указанном интервале.
Альтернативно вводимая доза может изменяться в зависимости от известных факторов, таких как фармакодинамические характеристики определенного средства, способа и схемы введения; возраста, состояния здоровья и массы тела реципиента; характера и тяжести симптомов, вида одновременно проводимого лечения, частоты повторения лечения и желаемого эффекта. Доза активного ингредиента обычно может составлять от примерно 0,1 до 100 миллиграммов на килограмм массы тела. Для достижения желаемых результатов эффективной является доза от 0,1 до 50, предпочтительно от 0,1 до 10 миллиграммов на килограмм массы тела в виде одной дозы или лекарственной формы пролонгированного действия.
Неограничивающим примером лечения человека или животных может быть введение однократной или многократной дозы по меньшей мере одного антитела по настоящему изобретению, равной 0,1-100 мг/кг, такой как 0,5, 0,9, 1,0, 1,1, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 40, 45, 50, 60, 70, 80, 90 или 100 мг/кг в сутки по меньшей мере один раз в день в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 дней, альтернативно или дополнительно по меньшей мере один раз в неделю в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51 или 52 недель, альтернативно или дополнительно по меньшей мере один раз в год в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 лет или в любой комбинации указанных периодов в виде однократной дозы, вливания или многократных доз.
Лекарственные формы (композиции), предназначенные для введения внутрь, обычно содержат от примерно 0,1 миллиграмма до примерно 500 миллиграммов активного ингредиента в стандартной дозе или емкости. В указанных фармацевтических композициях активный ингредиент обычно присутствует в количестве, равном примерно 0,5-99,999 масс.% в расчете на общую массу композиции.
Препараты для парентерального введения и способы их введения
Антитело, предназначенное для парентерального введения, может быть получено в виде раствора, суспензии, эмульсии или лиофилизованного порошка вместе или отдельно с фармацевтически приемлемым наполнителем для парентерального введения. Примерами таких наполнителей являются вода, физиологический раствор, раствор Рингера, раствор декстрозы и 1-10% сывороточный альбумин человека. Также могут быть использованы липосомы и неводные наполнители, такие как нелетучие масла. Наполнитель или лиофилизованный порошок может содержать добавки, сохраняющие изотоничность раствора (например, хлорид натрия, маннит) и химическую стойкость (например, буферы и консерванты). Препарат стерилизуют известными или приемлемыми методами.
Приемлемые фармацевтические носители описаны в последнем издании публикации Remington's Pharmaceutical Sciences, A. Osol, которая является стандартным справочником в данной области.
Препараты для парентерального введения могут содержать в качестве обычных наполнителей стерильную воду или физиологический раствор, полиалкиленгликоли, такие как полиэтиленгликоль, растительные масла, гидрированные нафталины и тому подобные. Водные или масляные суспензии для инъекций могут быть получены при использовании соответствующего эмульгатора, увлажнителя или суспендирующего агента известными методами. Вещества, используемые для инъекций, могут быть нетоксичных разбавителем, не предназначенным для перорального введения, таким как водный раствор, стерильный инъецируемый раствор или суспензия в растворителе. В качестве приемлемого наполнители или растворителя может быть использована вода, раствор Рингера, изотонический физиологический раствор и т.д.; в качестве обычного растворителя или суспендирующего растворителя может быть использовано стерильное нелетучее масло. Для указанных целей может быть использовано любое нелетучее масло и жирная кислота, в том числе природные, синтетические или полусинтетические жирные масла или жирные кислоты; природные, синтетические или полусинтетические моно-, ди- или триглицериды. В данной области известны способы парентерального введения, которые включают, не ограничиваясь ими, обычные устройства для инъекций, пневматическое безыгольное устройство для инъекций, опиСанное в патенте США № 5851198, и лазерное перфорирующее устройство, описанное в патенте США № 5839446, которые полностью включены в настоящее описание изобретения в качестве ссылки.
Альтернативные способы введения
Настоящее изобретение далее относится к введению по меньшей мере одного антитела против IL-6 парентеральным, подкожным, внутримышечным, внутривенным, внутрисуставным, внутрибронхиальным, внутрибрюшинным, внутрикапсульным, внутрихрящевым, внутриполостным, внутричревным, внутрипупочным, церебровентрикулярным, внутрикишечным, интрацервикальным, внутрижелудочным, внутрипеченочным, интрамиокардиальным, внутрикостным, внутритазовым, интраперикардиальным, внутрибрюшинным, интраплевральным, внутрипростатическим, внутрилегочным, интраректальным, интраретинальным, интраспинальным, внутрисуставным, внутригрудным, внутриматочным, внутрипузырным, внутривлагалищным, вагинальным, ректальным, трансбуккальным, сублингвальным, назальным или чрескожным способом. По меньшей мере одна композиция антитела против IL-6 может быть получена в форме жидких растворов или суспензий для парентерального введения (подкожного, внутримышечного или внутривенного) или любого другого способа введения; в полутвердых формах, которые включают, не ограничиваясь ими, кремы и суппозитории, для вагинального или ректального введения; в форме таблеток или капсул, не ограничиваясь ими, для трансбуккального или сублингвального введения; или в форме порошков, назальных капель, аэрозолей или определенных агентов, не ограничиваясь ими, для назального введения; или в форме геля, мази, лосьона, суспензии или системы доставки в виде пластыря, не ограничиваясь ими, для чрескожного введения, при этом могут быть использованы химические усилители, такие как диметилсульфоксид, позволяющие модифицировать структуру кожи или увеличивать концентрацию лекарственного средства в чрескожном пластыре (публикация Junginger, et al., In “Drug Permeation Enhancement"; Hsieh, D.S., Eds., pp. 59-90, Marcel Dekker, Inc. New York 1994, которая полностью включена в настоящее описание изобретения в качестве ссылки), окислители, позволяющие наносить на кожу препараты, содержащие белки и пептиды (WO 98/53847), электрические поля, образующие временные пути переноса, такие как электропорация, или увеличивающие подвижность заряженных лекарственных средств при прохождении через кожу, такие как лекарстенный электрофорез, или воздействие электрозвуком, такое как ультразвуковой электрофорез (патенты США №№ 4309989 и 4767402) (вышеуказанные публикации и патенты полностью включены в настоящее описание изобретения в качестве ссылки).
Внутрилегочное/назальное введение
По меньшей мере одну композицию для внутрилегочного введения антитела поротив IL-6 вводят в виде частиц, размер которых позволяет достигать нижних отделов дыхательных путей легкого или синуса легочного ствола. В соответствии с настоящим изобретением по меньшей мере одно антитело против IL-6 может быть доставлено при помощи разных устройств для ингаляции и введения в нос, известных в данной области для введения терапевтического средства путем ингаляции. Указанные устройства, способные доставлять препараты в виде аэрозолей в полость синуса или альвеолы субъекта, включают дозирующие ингаляторы, распылители, генераторы сухого порошка, пульверизаторы и тому подобные. В данной области также известны другие устройства, пригодные для внутрилегочного или назального введения антител. Во всех таких устройствах могут быть использованы препараты, предназначенные для введения антитела в аэрозоле. Такие аэрозоли могут включать растворы (как водные, так и неводные) или твердые частицы. В дозирующих ингаляторах, таких как дозирующий ингалятор Ventolin.RTM, обычно использован газообразный пропеллент, и такие устройства необходимо привести в действие во время вдоха (смотрите, например, публикации WO 94/16970, WO 98/35888). Ингаляторы сухого порошка, такие как Turbuhaler.TM. (Astra), Rotahaler.RTM (Glaxo), Diskus.RTM (Glaxo), Spiros.TM (Dura), поставляемые на рынок сбыта компанией Inhale Therapeutics, и ингалятор порошка Spinhaler.RTM (Fisons), приводятся в действие путем возбуждения смешанного порошка дыханием (патент США № 4668218, Astra, европейский патент № 237507, Astra, WO 97/25086, Glaxo, WO 94/08552, Dura, патент США № 5458135, Inhale, WO 94/06498, Fisons, полностью включены в настоящее описание изобретения в качестве ссылки). Такие распылители как AERx.TM Aradigm, распылитель Ultravent.RTM (Mallinckrodt) и распылитель Acorn II.RTM (Marquest Medical Products) (патент США № 5404871, Aradigm, и WO 97/22376 полностью включены в настоящее описание изобретения в качестве ссылки) образуют аэрозоли из растворов, в то время как дозирующие ингаляторы, ингаляторы сухого порошка и т.д. образуют аэрозоли в виде мелких частиц. Приведенные примеры коммерчески доступных ингаляторов дают представление о конкретных устройствах, пригодных для осуществления настоящего изобретению, и не ограничивают объем настоящего изобретения. Композицию, включающую по меньшей мере одно антитело против IL-6, предпочтительно доставляют при помощи ингалятора сухого порошка или распылителя. Ингалирующее устройство, предназначенное для введения по меньшей мере одного антитела по настоящему изобретению, должно обладать несколькими желательными свойствами. Например, ингалирующее устройство должно обеспечивать надежную, воспроизводимую и точную доставку лекарственного средства. Ингалирующее устройство может необязательно доставлять мелкие сухие частицы, например, менее примерно 10 мкм, предпочтительно примерно 1-5 мкм, для хорошего вдыхания.
Введение композиций антитела против IL-6 в виде распыляемого раствора
Распыляемый раствор, содержащий белок композиции антитела против IL-6, может быть получен в результате нагнетания под давлением суспензии или раствора по меньшей мере одного антитела против IL-6 через сопло. Размер сопла и его конфигурация, создаваемое давление и скорость подачи жидкости могут быть выбраны с учетом достижения требуемого выхода и размера частиц. Электрораспыление может быть произведено, например, при помощи электрического поля, соединенного с капиллярным устройством подачи или соплом. Частицы белка композиции антитела против IL-6, доставляемые с помощью распылителя, имеют размер частиц меньше примерно 10 мкм, предпочтительно от примерно 1 мкм до примерно 5 мкм и особенно предпочтительно от примерно 2 мкм до примерно 3 мкм.
Препараты, содержащие белок композиции по меньшей мере одного антитела против IL-6, предназначенные для использования в распыляющем устройстве, обычно включают белок композиции антитела в водном растворе в концентрации от примерно 0,1 мг до примерно 100 мг белка композиции по меньшей мере одного антитела против IL-6 на мл раствора или мг/гм, в любом интервале указанных значений или при любом значении данного интервала, которые включают, не ограничиваясь ими, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 40, 45, 50, 60, 70, 80, 90 или 100 мг/мл или мг/гм. Препарат может включать такие вещества как наполнитель, буфер, регулятор изотоничности, консервант, поверхностно-активное вещество и предпочтительно цинк. Препарат может также включать наполнитель или стабилизатор белка композиции антитела, такой как буфер, восстановитель, белок-наполнитель или углевод. Белки-наполнители, пригодные для получения белков композиций антител, включают, альбумин, протамин и тому подобные. Типичные углеводы, используемые при создании белков композиций антител, включают сахарозу, маннит, лактозу, трегалозу, глюкозу и тому подобные. Препарат белка композиции антитела может также включать поверхностно-активное вещество, которые может уменьшать или предотвращать поверхностную агрегацию белка композиции антитела, вызываемую распылением раствора при образовании аэрозоля. Могут быть использованы разные известные поверхностно-активные вещества, такие как полиоксиэтиленовые сложные эфиры жирных кислот, спирты и сложные эфиры жирных кислот полиоксиэтиленсорбита. Указанные вещества используют в количестве от 0,001 до 14 масс.% от общей массы препарата. Особенно предпочтительными поверхностно-активными вещества в соответствии с целями настоящего изобретения являются моноолеат полиоксиэтиленсорбита, полисорбат 80, полисорбат 20 и тому подобные. В препарат могут быть также введены дополнительные вещества, известные в данной области, для получения белка, такого как белок антитела против IL-6, его определенные части или варианты.
Введение композиций антитела против IL-6 с помощью распылителя
Белок композиции антитела может быть введен при помощи распылителя, такого как струйный распылитель или ультразвуковой распылитель. В струйном распылителе обычно использован источник сжатого воздуха, образующий струю воздуха, проходящую с высокой скоростью через отверстие. На выходе газа из сопла возникает область низкого давления, которая проталкивает раствор белка композиции антитела через капиллярную трубку, соединенную с резервуаром, в котором находится жидкость. Поток жидкости из капиллярной трубки распадается на неустойчивые нити и капли на выходе из трубки, образуя аэрозоль. Для достижения требуемых рабочих характеристик данного струйного распылителя могут быть использованы разные конфигурации устройства, скорости потока и типов перегородок. В ультразвуковом распылителе использована высокочастотная электрическая энергия для создания колебательной механической энергии обычно с помощью пьезоэлектрического преобразователя. Указанная энергия направляется к белку композиции антитела или прямо, или через связующую жидкость, в результате чего обтразуется аэрозоль, включающий белок композиции антитела. Частицы белка композиции антитела, распыляемые распылителем, имеют размер менее примерно 10 мкм, предпочтительно в интервале от примерно 1 мкм до примерно 5 мкм и наиболее предпочтительно от примерно 2 мкм до примерно 3 мкм.
Препараты, содержащие по меньшей мере одно антитело против IL-6 и пригодные для использования в струйном или ультразвуковом распылителе, обычно имеют концентрацию от примерно 0,1 мг до примерно 100 мг по меньшей мере одного белка антитела против IL-6 на мл раствора. Препарат может включать такие вещества как наполнитель, буфер, регулятор изотоничности, консервант, поверхностно-активное вещество и предпочтительно цинк. Указанный препарат может также включать наполнитель или стабилизатор белка композиции по меньшей мере одного антитела против IL-6, такой как буфер, восстановитель, белок-наполнитель или углевод. Белки-наполнители, используемые для образования белков композиции по меньшей мере одного антитела против IL-6, включают альбумин, протамин или тому подобные. Типичные углеводы, используемые для получения по меньшей мере одного антитела против IL-6, включают сахарозу, маннит, лактозу, трегалозу, глюкозу или тому подобные. Препарат, содержащий по меньшей мере одно антитело против IL-6, может также включать поверхностно-активное вещество, которое может уменьшать или предотвращать поверхностную агрегацию по меньшей мере одного антитела против IL-6, вызываемую распылением раствора с образованием аэрозоля. Могут быть использованы разные известные поверхностно-активные вещества, такие как полиоксиэтиленовые сложные эфиры жирных кислот, спирты и сложные эфиры жирных кислот полиоксиэтиленсорбита. Указанные вещества используют в количестве от 0,001 до 4 масс.% от общей массы препарата. Особенно предпочтительными поверхностно-активными вещества в соответствии с целями настоящего изобретения являются моноолеат полиоксиэтиленсорбита, полисорбат 80, полисорбат 20 и тому подобные. В препарат могут быть также введены дополнительные вещества, известные в данной области, для получения белка, такого как белок антитела.
Введение композиций антитела против IL-6 при помощи дозирующего ингалятора
В дозирующем ингаляторе (MDI) пропеллент, по меньшей мере одно антитело против IL-6 и любые наполнители или другие добавки находятся в баллоне в виде смеси, включающей сжиженный сжатый газ. При приведении в действие дозирующего клапана происходит высвобождение смеси в виде аэрозоля, предпочтительно имеющего частицы размером менее примерно 10 мкм, предпочтительно от примерно 1 мкм до примерно 5 мкм и наиболее предпочтительно от примерно 2 мкм до примерно 3 мкм. Частицы аэрозоля требуемого размера могут быть получены при использовании препарата, содержащего белок композиции антитела, полученного разными методами, известными специалистам в данной области, включающими струйное измельчение, сушку распылением, конденсацию до критической точки или тому подобные. Предпочтительными дозирующими ингаляторами являются ингаляторы, производимые компаниями 3М или Glaxo, в которых использован гидрофторуглеродный пропеллент.
Препараты, содержащие по меньшей мере одно антитело против IL-6, предназначенные для испольозования в дозирующем ингаляторе, обычно представляют собой тонкоизмельченный порошок, содержащий по меньшей мере одно антитело против IL-6 в виде суспензии в неводной среде, например, суспендирование в пропелленте с помощью поверхностно-активного вещества. Пропеллент может быть любым известным веществом, используемым для указанной цели, таким как хлорфторуглерод, гидрохлорфторуглерод, гидрофторуглерод или углеводород, включающий трихлорфторметан, дихлордифторметан, дихлортетрафторэтанол и 1,1,1,2-тетрафторэтан, HFA-134a (гидрофторалкан-134а), HFA-227 (гидрофторалкан-227) или тому подобные. Пропеллент предпочтительно является гидрофторуглеродом. Поверхностно-активное вещество может быть использовано для стабилизации по меньшей мере одного антитела против IL-6, находящегося в виде суспензии в пропелленте, для защиты активного агента от химического разложения или тому подобного. Приемлемые поверхностно-активные вещества включают триолеат сорбита, лецитин сои, олеиновую кислоту или тому подобные. В некоторых случаях аэрозоли в виде раствора предпочтительно получают с использованием растворителей, таких как этанол. В препарат могут быть введены дополнительные агенты, известные в области получения препаратов, содержащих белок.
Специалисту в данной области должно быть известно, что способы по настоящему изобретению могут быть осуществлены путем введения в легкое композиций по меньшей мере одного антитела против IL-6 с помощью устройств, не рассмотренных в настоящем описании изобретения.
Препараты для перорального введения и способы их введения
Препараты для перорального введения используют вместе с совместно вводимыми адъювантами (такими как, например, резорцины и неионогенные поверхностно-активные вещества, такие как полиоксиэтиленолеиловый эфир и н-гексадецилполиэтиленовый эфир) для искусственного увеличения проницаемости стенок кишечника, а также вместе с совместно вводимыми ингибиторами ферментов (такими как, например, ингибиторы трипсина поджелудочной железы, диизопропилфторфосфат (DFF) и тразилол) для ингибирования ферментативного расщепления. Активное соединение твердой лекарственной формы для перорального введения может быть смешано по меньшей мере с одной добавкой, включающей сахарозу, лактозу, целлюлозу, маннит, трегалозу, раффинозу, мальтит, декстран, крахмалы, агар, аргинаты, хитины, хитозаны, пектины, трагант, аравийскую камедь, желатин, коллаген, казеин, альбумин, синтетический или полусинтетический полимер и глицерид. Указанные лекарственные формы могут также содержать добавки других типов, например, инертный разбавитель, смазку, такую как стеарат магния, парабен, корнсервант, такой как сорбиновая кислота, аскорбиновая кислота, альфа-токоферол, антиоксидант, такой как цистеин, дезинтегратор, связывающее вещество, загуститель, буфер, подсластитель, ароматизатор, парфюмерное вещество и т.д.
На таблетки и пилюли может быть нанесено энтеросолюбильное покрытие. Жидкие препараты для перорального введения включают эмульсию, сироп, эликсир, суспензию и раствор, пригодные для применения в медицине. Указанные препараты могут содержать инертные разбавители, обычно используемые в данной области, например, воду. Липосомы также описаны в качестве системы для доставки лекарственного средства, такого как инсулин и гепарин (патент США № 4239754). Для доставки фармацевтических препаратов недавно были использованы микросферы искусственных полимеров смешанных аминокислот (протеиноиды) (патент США № 4925673). Кроме того, в данной области известны носители, описанные в патентах США №№ 5879681 и 5871753, которые предназначены для пероральной доставки биологически активных веществ.
Препараты для введения через слизистую оболочку и способы их введения
Композиции по меньшей мере одного антитела против IL-6, предназначенные для абсорбции через поверхности слизистой оболочки, представляют собой эмульсию, включающую множесто частиц в субмикронном диапазоне, макромолекулу, обеспечивающую сцепление со слизистой оболочкой, биоактивный пептид и водную непрерывную фазу, которая стимулирует абсорбцию через поверхности слизистой оболочки, обеспечивая сцепление частиц эмульсии со слизистой оболочкой (патент США № 5514670). Для нанесения эмульсий по настоящему изобретению на слизистые поверхности могут быть использованы роговичный, конъюнктивальный, трансбуккальный, сублингвальный, назальный, вагинальный, легочный, желудочный, кишечный и ректальный способы введения. Препараты для вагинального или ректального введения, например, суппозитории, могут содержать в качестве наполнителей, например, полиалкиленгликоли, вазелин, масло какао и тому подобные. Препараты для назального введения могут быть твердыми и могут содержать в качестве наполнителей, например, лактозу, или могут быть водными или масляными растворами капель в нос. Наполнители для трансбуккального введения включают сахара, стеарат кальция, стеарат магния, прежелатинированный крахмал и тому подобные (патент США № 5849695).
Препараты для чрескожного введения и способы их введения
В препаратах для чрескожного введения по меньшей мере одно антитело против IL-6 инкапсулировано в доставляющем устройстве, таком как липосома или полимерная наночастица, микрочастица, микрокапсула или микросфера (совместно определяемые как микрочастицы за исключением особо оговоренных случаев). Известен ряд приемлемых устройств, включающих микрочастицы, полученные из синтетических полимеров, таких как полиоксикислоты, включающие полимер молочной кислоты, полигликолевую кислоту и их сополимеры, полиортоэфиры, полиангидриды, полифосфазены и природные полимеры, такие как коллаген, полиаминокислоты, альбумин и другие белки, альгинат и другие полисахариды и их комбинации (патент США № 5814599).
Препараты пролонгированного действия и способы их введения
В некоторых случаях может быть желательно доставлять субъекту соединения по настоящему изобретению в течение длительных периодов времени, например, от одной недели до одного года при однократном введении. Могут быть использованы разные лекарственные формы с медленным высвобождением, пролонгированным действием или в виде имплантатов. Например, лекарственная форма может содержать фармацевтически приемлемую нетоксичную соль соединений с низкой степенью растворимости в биологических жидкостях, например, (а) кислотно-аддитивную соль с полиосновной кислотой, такой как фосфорная кислота, серная кислота, лимонная кислота, винная кислота, дубильная кислота, памовая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинмоно- или дисульфоновые кислоты, полигалактуроновая кислота и тому подобные; (b) соль с катионом многовалентного металла, такого как цинк, кальций, висмут, барий, магний, алюминий, медь, кобальт, никель, кадмий и тому подобные, или с органическим катионом, образованным, например, из N,N'-дибензилэтилендиамина или этилендиамина; или (с) комбинации (а) и (b), например, таннат цинка. Кроме того, соединения по настоящему изобретению или предпочтительно относительно нерастворимые соли, аналогичные вышеописанным солям, могут быть получены в геле, например, в геле моностеарата алюминия, например, с использованием кунжутного масла, пригодного для инъекций. Особенно предпочтительными солями являются соли цинка, таннат цинка, памоаты и тому подобные. Препарат пролонгированного действия для инъекций должен содержать соединение или соль, диспергированную для инкапсулирования в медленно разлагающемся, нетоксичном, неантигенном полимере, таком как полимер молочной кислоты/полимер полигликолевой кислоты, описанный в патенте США № 3773919. Соединения или предпочтительно относительно нерастворимые соли, аналогичные вышеописанным солям, могут быть также получены в гранулах из силастика с холестериновой матрицей, особенно для введения животным. В научной литературе описаны дополнительные препараты с медленным высвобождением, пролонгированным действием или в виде имплантата, например, газообразные или жидкие липосомы (патент США № 5770222 и публикация "Sustained and Controlled Release Drug Delivery Systems", J.R. Robinson ed., Marcel Dekker, Inc., N.Y., 1978).
Аббревиатуры
BSA - бычий сывороточный альбумин
EIA - иммуноферментный анализ
FBS - фетальная телячья сыворотка
Н2О2 - пероксид водорода
HRP - пероксидаза хрена
Ig - иммуноглобулин
IL-6 - интерлейкин 6
IP - внутрибрюшинный
IV - внутривенный
Mab - моноклональное антитело
OD - оптическая плотность
OPD - дигидрохлорид о-фенилендиамина
PEG - полиэтиленгликоль
PSA - пенициллин, стрептомицин, амфотерицин
RT - комнатная температура
SQ - подкожный
об./об. - в объемном отношеним
масс./об. - в отношении массы к объему
ПРИМЕР 1. Аффинный и количественный анализы ELISA
Аффинный анализ ELISA с использованием IL-6
96-луночные планшеты Nunc-Immuno MaxiSorp сенсибилизировали 100 мкл 2 мкг/мл, 0,2 мкг/мл, 0,02 мкг/мл или 0,002 мкг/мл IL-6 в сенсибилизирующем растворе; закрывали с помощью приспособления для заклеивания планшетов и инкубировали при 4°С в течение ночи. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 200 мкл промывочного раствора (0,05% твина-20 в PBS) и встряхивали со скоростью 200 оборотов/мин в течение 5 минут при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 200 мкл блокирующего раствора (2% гвоздичного молока в PBS) и встряхивали со скоростью 200 оборотов/мин в течение одного часа при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Для выполнения анализа ELISA использовали 100 мкл разведенных образцов. Образцы встряхивали со скоростью 200 оборотов/мин в течение одного часа при комнатной температуре; содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 200 мкл промывочного раствора (0,05% твина-20 в PBS), встряхивали со скоростью 200 оборотов/мин в течение 5 минут при комнатной температуре; содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Указанную процедуру повторяли три раза. Для образцов 001 добавляли 100 мкл антитела против IgG человека, конъюгированного с HRP, которое было разведено в отношении 1:2500 в блокирующем растворе (2% гвоздичного молока в PBS). Для контрольного антитела добавляли 100 мкл антитела против IgG кролика, конъюгированного с HRP, которое было разведено в отношении 1:2500 в блокирующей растворе (2% гвоздичного молока в PBS). Планшеты встряхивали со скоростью 200 оборотов/мин в течение одного часа при комнатной температуре, содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 200 мкл промывочного раствора (0,05% твина-20 в PBS), встряхивали со скоростью 200 оборотов/мин в течение 5 минут при комнатной температуре; содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Указанную процедуру повторяли три раза. Добавляли 100 мкл раствора субстрата ТМВ и инкубировали при комнатной температуре. Взаимодействие прекращали, добавляя 1 н. раствор HCl, и считывали планшеты при 450 нм.
Аффинный анализ ELISA с использованием биотинилированного IL-6
96-луночные планшеты Nunc-Immuno MaxiSorp сенсибилизировали 100 мкл 10 мкг/мл Fc-специфического антитела козы против IgG человека, очищенного аффинной хроматографией, в сенсибилизирующем растворе. Планшеты закрывали с помощью приспособления для заклеивания планшетов и инкубировали при 4°С в течение ночи. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 200 мкл промывочного раствора (0,05% твина-20 в PBS). Планшеты встряхивали со скоростью 200 оборотов/мин в течение 5 минут при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 200 мкл блокирующего раствора (2% гвоздичного молока в PBS). Планшеты встряхивали со скоростью 200 оборотов/мин в течение одного часа при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Для выполнения анализа ELISA использовали 100 мкл разведенного образца. Планшеты встряхивали со скоростью 200 оборотов/мин в течение одного часа при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 200 мкл промывочного раствора (0,05% твина-20 в PBS). Планшеты встряхивали со скоростью 200 оборотов/мин в течение 5 минут при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Указанную процедуру повторяли три раза. Добавляли 100 мкл 2 мкг/мл, 0,2 мкг/мл, 0,02 мкг/мл или 0,002 мкг/мл биотинилированного IL-6, разведенного в PBS. Планшеты встряхивали со скоростьью 200 оборотов/мин в течение одного часа при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 200 мкл промывочного раствора (0,05% твина-20 в PBS). Планшеты встряхивали по скоростью 200 оборотов/мин в течение 5 минут при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Указанную процедуру повторяли три раза. Добавляли 100 мкл антибиотинового антитела, конъюгированного с HRP, которое было разведено в отношении 1:2000 в блокирующем растворе (2% гвоздичного молока в PBS). Планшеты встряхивали со скоростьью 200 оборотов/мин в течение одного часа при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 100 мкл раствора субстрата ТМВ. Инкубировали при комнатной температуре. Взаимодействие прекращали, добавляя 1 н. раствор HCl. Планшеты считывали при 450 нм.
Количественный анализ ELISA
Указанный анализ ELISA выполняли для определения уровня экспрессии антител в супернатанте культуры клеток. 96-луночные планшеты Nunc-Immuno MaxiSorp (Nalge Nunc) сенсибилизировали 100 мкл 10 мкг/мл Fc-специфического антитела козы против IgG человека, очищенного аффинной хроматографией, в сенсибилизирующем растворе. Планшеты закрывали с помощью приспособления для заклеивания планшетов и инкубировали при 4°С в течение ночи. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 200 мкл промывочного раствора (0,05% твина-20 в PBS). Планшеты встряхивали со скоростью 200 оборотов/мин в течение 5 минут при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 200 мкл блокирующего раствора (2% гвоздичного молока в PBS). Планшеты встряхивали со скоростью 200 оборотов/мин в течение одного часа при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Использовали 100 мкл разведенного образца для анализа ELISA. Для эталонов использовали 20 нг/мл IgG человека, который затем разводили в отношении 1:2. Супернатант, полученный после трансфекции клеток, (50 нг - 200 нг/мл) использовали при выполнении анализа как неразведенным, так и разведенным до 1:10. Планшеты встряхивали со скоростью 200 оборотов/мин в течение одного часа при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 200 мкл промывочного раствора (0,05% твина-20 в PBS). Планшеты встряхивали со скоростью 200 оборотов/мин в течение 5 минут при комнатной температуре. Содержимое планшетов удаляли и остаточную жикдость промокали бумажными салфетками. Указанную процедуру повторяли три раза. Добавляли 100 мкл антитела козы против IgG человека, конъюгированного с HRP, которое было разведено в отношении 1:2500 или 1:5000 в блокирующем растворе (2% гвоздичного молока в PBS). Планшеты встряхивали со скоростью 200 оборотов/мин в течение одного часа при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 100 мкл раствора субстрата ТМВ (Sigma). Инкубировали при комнатной температуре. Взаимодействие прекращали, добавляя 1 н. раствор HCl. Планшеты считывали при 450 нм.
Удельная активность
Удельную активность при выполнении анализа ELISA вычисляют для каждого моноклонального антитела против IL-6 в виде значения аффинного анализа ELISA, деленного на значение количественного анализа ELISA. На фиг.29 показана нормализованная удельная активность для 10 лучших клонов СРЕ, полученных в результате созревания аффинности. На фиг.32 показана нормализованная удельная активность для 10 лучших клонов CPS. Значение удельной активности клонов, полученное при выполнении анализа ELISA, разделено на значение удельной активности клона ВА399. Нормализованная удельная активность ВА399 равна 1 (горизонтальная черная линия).
Функциональный анализ ELISA антитела 001
Указанный анализ ELISA выполняли для сравнения сродства антител в супернатанте культуры клеток. 96-луночные планшеты Nunc-Immuno MaxiSorp сенсибилизировали 100 мкл 2 мкг/мл антигена IL-6 001 и инкубировали в течение ночи при 4°С. Содержимое планшетов сливали, планшеты промывали (0,05% твина-20 в PBS) и блокировали в течение 1 часа при комнатной температуре 2% обезжиренного гвоздичного молока в PBS. В качестве эталонов использовали 20 нг/мл контрольного антитела против 001, которое затем разводили в отношении 1:2. Дубликаты 100 мкл супернатанта, полученные после трансфекции клеток, использовали при выполнении анализов как неразведенными, так и разведенными до 1:50 (50 нг - 200 нг/мл) и помещали на планшеты на 1 час при комнатной температуре. Содержимое планшетов сливали и промывали 3 раза. В каждую лунку добавляли 100 мкл антитела козы против IgG человека, конъюгированного с HRP, которое было разведено в отношении 1:5000 в блокирующем растворе (2% гвоздичного молока в PBS), и планшеты встряхивали со скоростью 200 оборотов/мин в течение одного часа при комнатной температуре. Содержимое планшетов сливали и планшеты промывали. Добавляли 100 мкл раствора субстрата ТМВ (Sigma) и инкубировали при комнатной температуре, контролируя через каждые 2-5 минут. Взаимодействие прекращали, добавляя 1 н. раствор HCl. Планшеты считывали при 450 нм.
ПРИМЕР 2. Конкурентный анализ ELISA, выполняемый для подтверждения перекрывания эпитопов антитела ВА001 и антитела против IL-6 по настоящему изобретению
96-луночные планшеты Nunc-Immuno MaxiSorp сенсибилизировали 100 мкл 0,2 мкг/мл IL-6 в сенсибилизирующем растворе (было получено достаточное число лунок для данного эксперимента). Планшеты закрывали с помощью приспособления для заклеивания планшетов и инкубировали при 4°С в течение ночи. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 200 мкл промывочного раствора (0,05% твина-20 в PBS). Планшеты встряхивали со скоростью 200 оборотов/мин в течение 5 минут при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 200 мкл блокирующего раствора (2% гвоздичного молока в PBS). Планшеты встряхивали со скоростью 200 оборотов/мин в течение одного часа при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 100 мкл 0,05 мкг/мл биотинилированного 001, разведенного в PBS, с 0 мкг/мл, 0,005 мкг/мл, 0,05 мкг/мл, 0,5 мкг/мл, 5 мкг/мл очищенного антитела 001 (были получены две реакционные смеси для каждого количества очищенного антитела 001). Также добавляли 100 мкл 0,05 мкг/мл биотинилированного 001, разведенного в PBS, с 0 мкг/мл, 0,005 мкг/мл, 0,05 мкг/мл, 0,5 мкг/мл, 5 мкг/мл антитела, не являющегося антителом против IL-6 (любое антитело против IgG мыши или другое отрицательное контрольное антитело) (были получены две реакционные смеси для каждого количества очищенного антитела 001). Планшеты встряхивали со скоростью 200 оборотов/мин в течение одного часа при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 200 мкл промывочного раствора (0,05% твина-20 в PBS). Планшеты встряхивали со скоростью 200 оборотов/мин в течение 5 минут при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Указанную процедуру повторяли три раза. Добавляли 100 мкл антибиотинового антитела, конъюгированного с HRP, которое было разведено в отношении 1:2000 в блокирующем растворе (2% гвоздичного молока в PBS). Планшеты встряхивали со скоростью 200 оборотов/мин в течение одного часа при комнатной температуре. Содержимое планшетов удаляли и остаточную жидкость промокали бумажными салфетками. Добавляли 100 мкл раствора субстрата ТМВ. Инкубировали при комнатной температуре. Взаимодействие прекращали, добавляя 1 н. раствор HCl. Планшеты считывали при 450 нм. Результаты приведены на фиг.10. Как показано, все антитела против IL-6 по настоящему изобретению уменьшают связывание антитела ВА001 с IL-6 человека. Полученный результат свидетельствует о том, что новые гуманизированные антитела связываются с той же областью, что и антитело ВА001.
ПРИМЕР 3. Трансфекция клеток СНО-S
За одну неделю до трансфекции клетки СНО-S (Invitrogen) переносили в монослойную культуру в модифицированной по способу Дульбекко сывороточной среде Игла (DMEM) (Invitrogen). За один день до трансфекции клетки выращивали в количестве 0,4×105 клеток в 100 мкл сывороточной среды DMEM на один трансфецируемый образец на 96-луночном планшете. Для каждого трансфецируемого образца были получены комплексы ДНК-липофектамина. 0,25 мкг ДНК разводили в 25 мкл восстановленной сывороточной среды Opti-MEM, осторожно смешивали и инкубировали при комнатной температуре в течение 5 минут. 0,5 мкл липофектамина 2000 (Invitrogen) разводили в 25 мкл восстановленной сывороточной среды Opti-MEM. Осторожно смешивали и инкуировали при комнатной температуре в течение 5 минут. Разведенную ДНК объединяли с разведенным липофектамином. Осторожно смешивали и инкубировали в течение 20 минут при комнатной температуре. В каждую лунку, содержащую клетки и среду, добавляли 50 мкл комплексов ДНК-липофектамина. Осторожно смешивали, покачивая планшет. Клетки инкубировали при 37°С в 5% СО2-инкубаторе в течение ночи. Из каждой лунки отсасывали среду. В каждую лунку добавляли 100 мкл сывороточной среды DMEM. Собирали супернатант для выполнения анализа ELISA и клеточный лизат для выполнения анализа с использованием бета-галактозидазы.
ПРИМЕР 4. Очистка антитела от супернатанта культуры клеток
Стандартным методом были получены следующие буферы. Связывающий буфер: 10 мМ Na2HPO4/NaH2PO4, рН 7,0. Элюирующий буфер: 12,5 мМ лимонной кислоты, рН 2,7 (использован цитрат Na3). Нейтрализующий буфер: 0,5 М Na2HPO4/NaH2PO4, рН 8,0. 20% этанола и вода. Все буферы фильтровали перед использованием (0,45 мкм). Супернатанты очищали с помощью системы ÄKTA™ FPLC™, оснащенной колонкой HiTrap™ с протеин G-сефарозой НР (объем 1 мл). Трубки для введения образца промывали этанолом (20 мл, 5 мл/мин) и затем связывающим буфером (20 мл, 5 мл/мин). Колонку с протеином G присоединяют к системе и промывают связывающим буфером (10 мл, 1 мл/мин). Образец вводят со скоростью 1 мл/мин или медленнее (в течение ночи). После введения образца колонку отсоединяют и подводящие трубки промывают водой (20 мл, 5 мл/мин) и затем 20% этанолом (20 мл, 5 мл/мин). Для очистки антитела систему АКТА промывали (насос А и все трубки) связывающим буфером. В каждую собирающую трубку добавляли 50 мкл нейтрализующего буфера в процессе подготовки к сбору фракций. Колонку с протеином G присоединяли к системе. Скорость потока была задана равной 1 мл/мин и поддерживалась до достижения постоянной нулевой линии. Клапан колонки был установлен в положение 3. Колонку промывали связывающим буфером (минимум 10 мл) до достижения нулевой линии. Насос выключали, промывали водой и затем элюирующим буфером. Скорость потока была задана равной 1 мл/мин и поддерживалась до достижения постоянной нулевой линии. Клапан колонки был установлен в положение 3, после чего был включен коллектор фракций (фракции 0,5 мл). Фракции собирали до достижения нулевой линии, после чего систему выключали. Профиль элюирования копировали в буфер обмена и документ WORD. Насос промывали водой и затем связывающим буфером. Колонку с протеином G промывали связывающим буфером (10 мл). Насос промывали 20% этанолом. Колонку промывали 20% этанолом (20 мл) и хранили в холодном помещении.
ПРИМЕР 5. Анализ Sapidyne
Константы равновесия и скорости разных антител определяли с помощью автоматической системы для иммуноанализа (Sapidyne Instruments, Inc., Boise, ID), предназначенной для выполнения кинетического анализа исключения Sapidyne (KinExA™), в соответствии с инструкциями производителя. Кинетический анализ исключения (KinExA) является методом измерения истинного равновесного сродства связывания и кинетики немодифицированных молекул в фазе раствора. Смотрите, например, публикацию Darling et al., Kinetic Exclusion Assay Technology: Characterization of Molecular Interactions, ASSAY and Drug Dev. Technol. 2(6): 2004, которая включена в настоящее описание изобретения в качестве ссылки. Система KinExA™ состоит из проточного элемента капиллярного типа с возможностью наблюдения (внутренний диаметр 1,6 мм), оснащенного микропористым ситом, через которое разные растворы проходят при отрицательном давлении. Одинаковые частицы, которые больше среднего размера пор сита (53 мм), предварительно покрыты антигеном и расположены поверх сита в уплотненном слое. Смеси отдельных растворов антигена и антитела, находящиеся в равновесии или приближающиеся к равновесию, пропускают через уплотненный слой частиц. Только антитела в каждой смеси с незанятыми сайтами связывания могут связываться с антигеном, нанесенным на твердую фазу. Количественное определение первичного антитела, захваченного таким образом, производят, подвергая частицы кратковременному воздействию меченного флуоресцентным красителем вторичного антитела и измеряя флуоресценцию частиц после удаления избытка несвязанных реагентов.
Антитела восстанавливали в стерильном однократном буфере PBS, рН 7,4, 0,02% азида натрия, 10 мг/мл BSA. Антиген IL-6 (21000 кДа), находившийся в четырех отдельных пробирках в количестве 0,5 мг, 1 мг, 0,5 мг и 0,5 мг, разводили стерильным однократным буфером PBS, рН 7,4, 0,02% азида натрия, до 375 мкг/мл, 1 мг/мл, 500 мкг/мл и 500 мкг/мл. Метка, являющаяся Су5-конъюгированным антителом козы против IgG человека (H+L) AffiniPure, Су5, 1,5 мкг/мл, была приобретена в компании Jackson ImmunoResearch (West Grove, PA). Указанную метку восстанавливали в стерильном однократном буфере PBS, рН 7,4, 0,02% азида натрия, и разводили до 0,500 мг/мл. Рабочий буфер представлял собой однократный буфер PBS, рН 7,4, 0,02% азида натрия. Буфер для образца представлял собой однократный буфер PBS, рН 7,4, 0,02% азида натрия, 1 мг/мл бычьего сывороточного альбумина (BSA). Гранулы РММА (№ изделия 440197/партия 3257) были предоставлены компанией Sapidyne Instruments, Inc. (Boise, ID) и покрыты улавливающим реагентом следующим образом. Гранулы, разделенные на 200-мг порции, помещали в 1 мл сенсибилизирующего раствора (30 мкг/мл ВАР001 в рабочем буфере) и покачивали в течение 2 часов. Затем гранулы покачивали в течение 1 часа в блокирующем растворе (10 мг/мл BSA в рабочем буфере) и хранили при 4°С.
При выполнении анализа равновесия гранулы РММА, покрытые IL-6, использовали для улавливания части свободного рецептора из уравновешенного образца рецептора (антитело против IL-6) и лиганда (антиген; IL-6). Для получения каждой точки данных в проточный элемент вводили свежую колонку гранул, покрытых лигандом. Уравновешенный образец быстро пропускали через колонку, чтобы уменьшить до минимума время контактирования с иммобилизованным лигандом. Это гарантировало, что контактирование с иммобилизованным лигандом не приведет к нарушению равновесия образца. Таким образом, иммобилизованный лиганд действовал в качестве зонда, улавливающего свободный рецептор в растворе. Захваченные антитела обнаруживали при помощи меченного флуоресцентным красителем вторичного антитела против антитела человека. Несвязанные реагенты вымывались, оставляя сигнал, пропорциональный свободному рецептору в уравновешенном образце. Флуоресценцию преобразовывали в напряжение, которое было прямо пропорционально количеству свободного рецептора (антитела) в уравновешенном образце. Эксперименты выполняли при высокой и низкой концентрации рецептора и затем использовали вместе при выполнении анализа n-кривой для получения оптимальных результатов. При выполнении кинетического анализа прямым методом использовали тот же иммобилизованный лиганд (гранулы РММА, покрытые IL-6), что и при выполнении экспериментов по определению константы равновесия. Количество свободного рецептора (антитела) в образце определяли до установления равновесия, в результате чего были получены точки данных, позволяющие контролировать уменьшение свободного рецептора (антитела) с течением времени по мере достижения образцом равновесия. На фиг.33 приведена таблица с данными анализа Sapidyne 10 лучших клонов для антител против IL-6 от ВАР001 клон 1 до ВАР001 клон 10 по сравнению с ВА003 (CNTO136).
ПРИМЕР 6. Измерение сродства антитела ВА001 и его гуманизированных производных методом Biacore (резонанс поверхностных плазмонов)
Для определения кривых связывания и кинетических параметров использовали систему BIAcore 3000, GE Healthcare. Антитело против Fc человека (1,8 мг/мл) разводили до концентрации 50 мкг/мл в буфере NaOAc (10 мМ, рН 4,8) и связывали с матрицей из карбоксиметилированного декстрана сенсорного чипа СМ-5 методом химического связывания амином, описанным в руководстве производителя по использованию систем BIAcore. Используя способность поверхности связывать 10000 ед. антитела, карбоксильные группы на поверхностях сенсорного чипа сначала активировали NHS/EDC и затем добавляли антитело против Fc человека. Остальные активированные группы блокировали путем введения 1 М раствора этаноламина. Все проточные ячейки соединяли отдельно. В указанных условиях были получены четыре поверхности проточных ячеек, содержащие 7554-9571 ед. антитела против Fc человека. При выполнении предварительных экспериментов было установлено, что три впрыскивания (15 мкл со скоростью 30 мкл/мин) 100 мМ Н3РО4/0,05% CHAPS позволяют эффективно удалить связанный иммуноглобулин и сохранить способность связывания иммобилизованного антитела против Fc человека.
Эксперименты выполняли в системе BIAcore 3000 при 25°С и скорости потока 30 мкл/мин. Антитело-кандидат растворяли в HBS (10 мМ HEPES с 0,15 М NaCl, 3,4 мМ ЭДТА и 0,05% поверхностно-активного вещества Р20 при рН 7,4) в количестве 5 мкг/мл. Анализируемое вещество, IL-6, растворяли в HBS в количестве 0,25, 0,125, 0,062, 0,031 и 0,015 мкг/мл. 3×30 мкл 5 мкг/мл антитела ВА001 пропускали через соответствующую проточную ячейку, после чего вводили 240 мкл IL-6 в каждой из указанных концентраций со скоростью 30 мкл/мин (фаза ассоциации) и подавали непрерывный поток буфера в течение 1200 секунд (фаза диссоциации). Поверхность чипа регенерировали тремя последующими впрыскиваниями 15 мкл 100 мМ Н3РО4/0,05% CHAPS. Впрыскивания HBS служат в качестве эталона (контрольная сенсограмма) для вычитания показателей преломления основной массы при выполнении анализа. Используя модель 1:1 в программе BIAevaluation 4.1, производили локальный и глобальный подбор для диссоциации (kd, [с-1]) и ассоциации (ka, [M-1с-1]) и вычисляли константу диссоциации (KD, [M]) (kd/ka).
Анализ выполняли при помощи программы BIAevaluation, версия 3.0. Константы скорости реакции выводили с учетом данных сенсограммы, подбирая экспериментальные кривые для уравнений скорости реакции, полученных на основании моделей механизмов взаимодействия. Выполняли глобальный анализ, используя модель связывания 1:1 с локальным подбором RUmax, и определяли ka, kd и KD.
Были использованы следующие уравнения:
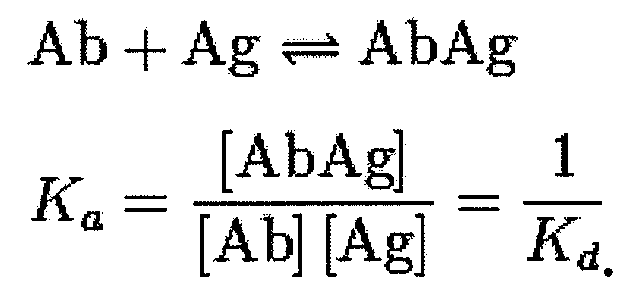
Данные Biacore для гуманизированных моноклональных антител против IL-6 до созревания аффинности приведены на фиг.11. После созревания аффинности ВА399, выполненного в отношении моноклонального антитела против IL-6 ВА399, отобранные клоны исследовали при помощи анализа Biacore. На фиг.34 показаны данные Biacore соответственно для клонов ВА399-2, ВА399-5, ВА399-9 и ВА399-10.
ПРИМЕР 7. Ингибирование фосфорилирования Stat3 в клетках ТНР-1
Фактор транскрипции Stat3 является важной молекулой передачи сигнала в клетке для многих цитокинов и рецепторов факторов роста (Heim. The Jak-STAT pathway: cytokine signaling from the receptor to the nucleus. J. Recept. Signal Transduct. Res. 1999. 19(1-4):75-120). Stat3 конститутивно активирован в ряде опухолей человека и обладает онкогенным потенциалом (Bromberg et al., Stat3 as an oncogene. Cell 1999, 98(3):295-303) и активностью, препятствующей апоптозу. Stat3 активируется фосфорилированием в положении Tyr705, которое вызывает димеризацию, транслокацию ядра и связывание ДНК (Ihle, Cytokine receptor signaling. Nature 1995, 377(6550):591-4). Активация транскрипции, по-видимому, регулируется фосфорилированием в положении Ser727 по путям MAPK или mTOR (Yokogami et al., Serine phosphorylation and maximal activation of Stat3 during CNTF signaling is mediated by rapamycin target mTOR. 2000 Curr Biol. 10(1):47-50).
Ингибирование фосфорилирования Stat3 измеряли в клетках ТНР-1. Клетки ТНР-1 (АТСС) использовали в соответствии со стандартными методами. При выполнении каждого исследования 2×106 клеток выращивали в бессывороточной среде. Положительные контрольные образцы, состоящие из клеток ТНР-1, стимулировали IL-6 человека (100, 50, 10 нг/мл) с sIL-6R (200 нг/мл). Отрицательные контрольные образцы состояли только из среды. Исследуемые образцы включали 10 мг/мл CNTO 136, № 399, клон ВА399 № 2 или клон ВА399 № 9, с IL-6 человека (100, 50, 10 нг/мл) и sIL-6R (200 нг/мл). IL-6, sIL-6R и антитела инкубировали при 37°С в течение 15 минут. Затем реакционную смесь добавляли к клеткам ТНР-1. Клетки инкубировали при 37°С в течение 15 минут, промывали холодным PBS и сразу же анализировали. Уровень фосфорилирования Stat3 измерили, используя набор для сэндвич-анализа ELISA передачи сигнала в клетке Phosphot-Stat3, в соответствии с инструкциями производителя (например, набор № 7300 для сэндвич-анализа ELISA Phospho-Stat3 (Tyr705) PathScan®, Cell Signaling Technology, Inc.). Уровень экспрессии общего Stat3 измеряли при помощи поликлонального антитела кролика Santa Cruz против Stat3 челвека (аминокислоты 50-240) (Santa Cruz Biotechnology, Inc.). Данные фосфорилирования ТНР-1 приведены на фиг.35-38. На всех фигурах данные нормализованы на основании вестерн-блоттинга для общего Stat3.
Как показано на фиг.35, все моноклональные антитела против IL-6 ВА003 (CNTO 136), ВА399, ВА399-2 и ВА399-9 вызывают в зависимости от концентрации уменьшение фосфорилирования Stat-3 в IL6/sILR-стимулированных клетках ТНР-1 по сравнению с положительным контрольным образцом.
На фиг.36 показаны относительные уровни фосфорилирования при стимулировании клеток ТНР-1 100 нг/мл IL-6 и sIL-6R в разных условиях, показаны на фиг.(А). Общие уровни Stat3, установленные методом вестерн-блоттинга, показаны на фиг.(В). Все моноклональные антитела против IL-6 ВА003 (CNTO 136), ВА399, ВА399-2 и ВА399-9 вызывают значительное уменьшение фосфорилирования Stat3 в IL-6/sILR-стимулированных клетках ТНР-1 по сравнению с положительным контрольным образцом.
На фиг.37 показаны относительные уровни фосфорилирования при стимулировании клеток ТНР-1 10 нг/мл IL-6 и sIL-6R в разных условиях, показаны на фиг.(А). Общие уровни Stat3, установленные методом вестерн-блоттинга, показаны на фиг.(В). Все моноклональные антитела против IL-6 ВА003 (CNTO 136), ВА399, ВА399-2 и ВА399-5 вызывают значительное уменьшение фосфорилирования Stat3 в IL-6/sILR-стимулированных клетках ТНР-1 по сравнению с положительным контрольным образцом.
На фиг.38 показаны относительные уровни фосфорилирования при стимулировании клеток ТНР-1 10 нг/мл IL-6 и sIL-6R в разных условиях, показаны на фиг.(А). Общие уровни Stat3, установленные методом вестерн-блоттинга, показаны на фиг.(В). Все моноклональные антитела против IL-6 ВА003 (CNTO 136), ВА399, ВА399-2 и ВА399-9 вызывают значительное уменьшение фосфорилирования Stat3 в IL-6/sILR-стимулированных клетках ТНР-1 по сравнению с положительным контрольным образцом.
ПРИМЕР 8. Ингибирование продуцирования сывороточного амилоидного белка А клетками HepG2
Сывороточный амилоидный белок А (SAA) является белком острой стадии, продуцирование которого индуцирует IL-6. Цитокины, такие как IL-6, IL-1 и TNF, считаются медиаторами синтеза белка SAA. Указанные цитокины стимулируют гепатоциты продуцировать и высвобождать SAA в кровоток. Высокие уровни SAA имеют место у субъектов с острым и хроническим воспалением. Вторичный амилоидоз может возникнуть в результате продолжительных или повторяющихся воспалений, в которых сохраняются повышенные уровни SAA. Такое прогрессирующее заболевание со смертельным исходом характеризуется утратой функции органа. Воспалительные нарушения, такие как ревматоидный артрит, юношеский артрит, анкилозирующий спондилоартрит, семейный желтушный лептоспироз, прогрессирующий склероз, а также хронические инфекционные заболевания, такие как туберкулез и остеомиелит предрасположены к развитию амилоидоза (Reinhoff et al., Molecular and cellular biology of serum amyloid A. 1990 Mol. Bio. Med. 7:287-298).
Способность моноклональных антител против IL-6 блокировать продуцирование сывороточного амилоидного белка А в клетках HepG2, стимулированных IL-6/sIL6R с IL-1b, исследовали следующим образом. Клетки HepG2 высевали в количестве 2,25×105 клеток/лунку на 24-луночные планшеты. Использовали дублированные лунки для каждого заболевания. Положительные контрольные образцы состояли из IL-6 человека (100 нг/мл)+sIL-6R (200 нг/мл)+IL-1b (25 нг/мл). Один отрицательный образец состоял только из среды. Другой отрицательный контрольный образец состоял из IL-6 человека (100 нг/мл)+sIL-6R (200 нг/мл). Все моноклональные антитела против IL-6 CNTO 136, ВА399, ВА399-2, ВА399-9 (10-5, 10-4, 10-3, 10-2, 10-1, 1 мг/мл) последовательно разводили IL-6 человека (100 нг/мл) с sIL-6R (200 нг/мл) и IL-1b (25 нг/мл). IL-6, sIL-6R и моноклональные антитела инкубировали при комнатной температуре в течение 30 минут. IL-1b добавляли в смесь IL-6/антитело. Полную реакционную смесь добавляли к клеткам HepG2. Уровни экспрессии сывороточного амилоидного белка А (SAA) измеряли при помощи набора для иммуноанализа SAA человека в соответствии с инструкциями производителя, через 24 часа и 48 часов после добавления реакционной смеси. Данные приведены на фиг.39 и 40.
На фиг.39 показано ингибирование продуцирования сывороточного амилоидного белка А клетками HepG2, стимулированными IL-6/sIL-6R и IL-1b, моноклональными антителами против IL-6 через 24 часа. Все моноклональные антитела против IL-6 003 (CNTO 136), ВА399, ВА399-2 и ВА399-5 ингибировали продуцирование SAA в зависимости от дозы. IgG человека является отрицательным контрольным образцом.
На фиг.40 показано ингибирование продуцирования сывороточного амилоидного белка А клетками HepG2, стимулированными IL-6/sIL-6R и IL-1b, моноклональными антителами против IL-6 через 48 часов. Все моноклональные антитела против IL-6 003 (CNTO 136), ВА399, ВА399-2 и ВА399-5 ингибировали продуцирование SAA в зависимости от дозы. IgG человека является отрицательным контрольным образцом.
ПРИМЕР 9. Перекрестная реактивность с IL-6 обезьяны
Планшеты для анализа ELISA сенсибилизировали антителом против IL-6 обезьяны. Добавляли 300 пг/мл IL-6 обезьяны. Положительный контрольный образец состоял из биотинилированного антитела против IL-6 обезьяны. Отрицательный контрольный образец состоял только из буфера. Исследуемые образцы включали 0,1 мг/мл биотинилированного антитела 001 с 5 мг/мл антител 001, 003, ВА399, ВА399-2 и ВА399-9 вместе с неспецифическим IgG человека. Анализ ELISA выполняли с использованием стрептавидина-HRP. Данные приведены на фиг.41. Биотинилированное моноклональное антитело против IL-6 характеризовалось некоторой перекрестной реактивностью с IL-6 обезьяны, которая была частично блокирована гуманзированными моноклональными антителами против IL-6 в отличие от неспецифического IgG человека.
ПРИМЕР 10. Ингибирование IL-6-индуцированной пролиферации клеток DS-1
Клетки DS-1 представляют собой линию В-клеток, выделенную у субъекта с иммунодефицитом, страдающего лимфангиектазией кишечника и лимфомой. Пролиферация клеток увеличивается под воздействием IL-6 человека в отличие от IL-6 мыши. Несмотря на продуцирование конститутивного IL-6 рост клеток DS-1 in vitro зависит от экзогенного IL-6. (Bock et al., Characterization of a new IL-6 dependent human B-lymphoma cell line in a long term culture. Cytokine 5(5):480-489 (1993).
800 клеток высевали на 96-луночный планшет для каждого исследования. Использовали 10 ед/мл IL-6 человека и 0, 0,005, 0,05 и 0,5 микроорганизма/мл CNTO136, ВА399 и разные моноклональные антитела против IL-6. Пролиферацию клеток измеряли при помощи анализа Promega CellTiter-Glo® (Promega Corp., Madison, WI) через 0, 2 и 4 дня после добавления антител. Ингибирование IL-6-индуцированной пролиферации клеток DS-1 через 48 часов и 96 часов показано соответственно на фиг.42 и 43. Несколько моноклональных антител против IL-6 уменьшали пролиферацию клеток DS-1 через 48 и 96 часов в зависимости от дозы, такие антитела включают ВА001, ВА399, ВА436, ВА802, ВА808 и ВА840.
Очевидно, что настоящее изобретение может быть осуществлено другими способами помимо конкретных способов, рассмотренных в приведенном выше описании изобретения и примерах.
В свете вышеизложенного возможны многочисленные модификации и варианты настоящего изобретения, которые входят в объем прилагаемой формулы изобретения.