Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ НАСЛЕДСТВЕННОЙ ПРЕДРАСПОЛОЖЕННОСТИ К РАЗВИТИЮ ПРИВЫЧНОГО НЕВЫНАШИВАНИЯ БЕРЕМЕННОСТИ
Вид РИД
Изобретение
Настоящее изобретение относится к области молекулярной биологии и генетики и может быть использовано в медицине при прогнозировании риска развития привычного невынашивания беременности (ПНБ). Предлагается способ определения наследственной предрасположенности к развитию ПНБ, предусматривающий анализ ДНК субъекта, выявление аллельных вариантов генов FVII и FXIII свертывания крови, GpIIIa, AGT и eNOS с последующей оценкой группы риска формирования ПНБ на основании предложенной шкалы баллов.
Привычное невынашивание беременности (ПНБ) представляет собой полиэтиологический симптомокомплекс, в основе развития которого наиболее часто лежат структурные изменения эндометрия, инфекционные, эндокринные, иммунологические и генетические факторы в различных сочетаниях (Baek К.Н. et al., 2007). Важное место среди других факторов риска формирования ПНБ занимает генетическая предрасположенность, при которой носительство тех или иных аллелей определенных генов может видоизменять течение биохимических процессов в организме матери и способствовать формированию ПНБ (Патрушев Л.И., 2002). При этом большой интерес представляет изучение полиморфизма генов, принимающих участие в процессах имплантации и плацентации, к которым относятся гены белков системы гемостаза, тромбоцитарных рецепторов, белков, вовлеченных в патогенез эндотелиальной дисфункции, и белков, принимающих участие в регуляции артериального давления (АД).
Поскольку наличие тех или иных аллельных вариантов генов играет роль своеобразного преморбидного фона, в рамках которого могут развиться различные гестационные осложнения, включая ПНБ, оценка генетического статуса женщины до беременности позволила бы прогнозировать это тяжелое осложнение, осуществлять полноценную предгравидарную подготовку, должный мониторинг течения такой беременности и проводить своевременную коррекцию выявленных нарушений.
В связи с этим совершенно очевидна необходимость дальнейших исследований, которые помогут расширить представления о роли генетического полиморфизма в патогенезе ПНБ, что, в свою очередь, обеспечит новый подход к диагностике данного заболевания, а также более продуктивную предгравидарную подготовку и ведение беременности у женщин с ПНБ.
Уровень техники.
В последние годы изучению генетических факторов риска развития ПНБ уделяется большое внимание. Наблюдается стремительный рост объема информации об участии тех или иных генов в формировании предрасположенности к ПНБ, что, с одной стороны, расширяет возможности при проведении ДНК-тестирования, а с другой - затрудняет диагностику данной патологии из-за отсутствия четких алгоритмов проведения генетического анализа.
Однако следует отметить, что существует ряд положений, необходимость учета которых при прогнозировании генетического риска развития заболевания, в том числе и ПНБ, поддерживается в настоящее время большинством исследователей. К их числу, прежде всего, следует отнести то, что при определении генетического статуса пациентки важно оценивать не только наличие или отсутствие определенной мутантной аллели, но и учитывать, в каком сочетании находится данная аллель с аллелями других генов, имеющих отношение к развитию исследуемого заболевания. Это связано с тем, что индивидуальный вклад каждой отдельной генетической вариации в риск развития заболевания, как правило, невелик, поэтому генотипирование пациентов только по одному полиморфизму имеет обычно низкую предсказательную силу. В связи с этим, очевидно, что повысить достоверность результатов и предсказательную способность анализа можно путем исследования комбинации аллельных вариантов нескольких генов, связанных с развитием заболевания. Вторым важным моментом, который приобретает особое значение именно при исследовании комбинации полиморфизмов, является то, что каждый из них может иметь разную патогенетическую значимость, как в плане ее «направленности», так и в плане эффективности. Соответственно, способ оценки риска развития заболевания должен учитывать функциональную значимость (направление действия, степень его проявления) каждой из аллелей исследуемых генов. Эффективность подобного подхода подтверждается рядом исследований (Choi YS et al 2011; A. Dossenbach-Glaninger et al.,,2008; M. Jeddi-Tehrani et al., 2011), в том числе и работами, проведенными в нашей лаборатории ранее (см. RU 2330071 С1,27.07.2008).
Способ оценки наследственной предрасположенности к развитию ПНБ, раскрытый в патенте RU 2330071 С1, может рассматриваться в качестве ближайшего аналога настоящего изобретения. Этот способ включает проведение ДНК-диагностики на наличие полиморфизма С647Т гена MTHFR и полиморфизма R353Q гена фактора VII свертывания крови и составление заключения о риске развития ПНБ на основании предложенной авторами таблицы, в которой применен полуколичественный метод оценки, вводящий определение (по результатам частоты встречаемости у пациенток с ПНБ) оказываемого каждой аллелью влияния как (+ или ++), (о) или (- или --), суммарный результат для каждого вида генотипа (по двум генам) и основанный на нем прогноз, выражаемый как «благоприятный», «сомнительный», «неблагоприятный» или «крайне неблагоприятный». Несмотря на то, что предложенный ранее способ обладает хорошей предсказательной способностью, получение новых данных о механизмах, задействованных в развитии ПНБ, и выявление новых генов-кандидатов на участие в этом процессе, позволяет усовершенствовать известный метод в плане повышения его точности и достоверности, которые достигаются за счет увеличения числа исследуемых полиморфизмов, предварительно определенных как функционально значимые для развития ПНБ, и за счет использования более точного математического метода для оценки экспериментальных результатов.
Таким образом, основной задачей настоящего изобретения было создание основанной на исследовании комбинации взаимосвязанных полиморфизмов надежной предсказательной модели формирования ПНБ.
Раскрытие изобретения.
Предлагаемый способ прогнозирования развития ПНБ включает ДНК-тестирование полиморфизма 5 генов, для которых предварительно было показано отношение к развитию данного заболевания, а именно 34V/L гена FXIII, 235М/Т гена AGT, 4а/b гена eNOS, PLA1/A2 гена GpIIIa и R353Q гена FVII; определение «вклада» каждого из них с последующим выражением в виде соответствующего балла (коэффициента значимости); подсчет суммы баллов для установленного (по 5 генам) генотипа с использованием предложенной формулы (I) и определение группы риска ПНБ в соответствии с полученным при этом результатом.
Перечисленные выше аллельные варианты были отобраны в исследуемую группу по результатам анализа литературных данных с учетом их патогенетического вклада в формирование ПНБ (первый этап исследования).
Фактор XIII активируется последним в гемокоагуляционном каскаде и отвечает за стабилизацию фибринового тромба на заключительной стадии свертывания крови. Аллельный вариант гена 34L цепи А фактора XIII влияет на структуру и формирование тромба, в результате чего тромб становится прочнее, с меньшей пористостью и состоит из более тонких и коротких волокон (Kobbervig С.et al., 2004). Образование более стабильных тромбов способствует развитию тромботических осложнений, а также может приводить к нарушению фибрин-опосредованной имплантации оплодотворенной яйцеклетки в децидуальную ткань (Inbal A., Dardik R., 2006). Таким образом, генотип LL с высокой степенью вероятности может играть роль в развитии ПНБ, что подтверждается рядом экспериментальных данных (Dossenbach-Glaninger A. et al.,2006 и Yenicesu G.I. et al., 2010).
Как и FXIII, FVII принимает активное участие в процессах свертывания крови. Однако действие полиморфизма R353Q (замена аргинина на глутамин в 353 положении вследствие точечной замены G на А) связывают, прежде всего, с его влиянием на уровень каталитической активности FVII в плазме крови и 20-30% снижением секреции фермента (Lane D.A., Grant P.J., 2000). Низкий уровень FVIIa ведет к меньшей активности тромбообразования (Lindman A.S. et al., 2004). Полиморфизм R353Q мало обсуждается в литературе в связи с осложнениями беременности. По данным Seremak-Mrozikiewicz A. et al. (2009), носительство мутантной аллели оказывает протективный эффект в отношении развития ПНБ.
В механизме свертывания крови принимают не только плазменные, но и клеточные факторы, в частности большая роль в процессе коагуляции принадлежит рецепторам тромбоцитов. Гликопротеин Ша (GpIIIa) представляет собой β3-интегрин. β3-субъединица входит в состав рецептора фибриногена на тромбоцитах и непосредственно участвует в образовании тромба. β3-интегрины играют важную роль в тромбообразовании, процессах миграции и пролиферации гладкомышечных клеток, а также принимают значимое участие в регуляции процессов оплодотворения, имплантации и формирования плаценты (James J.L. et al., 2012).
Данные, касающиеся роли мутантной аллели PLA2 в формировании предрасположенности к развитию осложнений беременности, противоречивы. I. Lambrinoudaki et al. (2010) показана взаимосвязь между носительством аллели PLA2 и спонтанными выкидышами на ранних сроках. Существуют работы, в которых описана негативная роль носительства данной аллели по отношению к развитию ПНБ в I и II триместрах (Ivanov P. et al., 2010; Jeddi-Tehrani М. et al., 2011). Однако B.E. Радзинским и соавт.(2003) показано, что повышенный риск развития гестоза и задержки роста плода ассоциирован с носительством генотипа PLA1/A1.
К образованию тромбов в маточно-плацентарном кровотоке может иметь значение не только патология системы свертывания крови, но и дисфункция эндотелия, вызывающая повреждение сосудистой стенки, на фоне которого формируются тромбы. Поэтому в рамках патогенеза ПНБ изучаются гены, ассоциированные с развитием оксидантного стресса и дисфункцией эндотелия, в частности ген эндотелиальной синтазы оксида азота (Su М.Т. et al., 2011). В рамках проблемы ПНБ наиболее активно изучается полиморфизм 4ab гена eNOS. Носительство аллели 4а ассоциировано с нарушением работы фермента и, как следствие, со снижением концентрации NO в плазме (Hefler L.A. et al, 2002). Ассоциация данного полиморфизма с ПНБ продемонстрирована в работе W. Fan et al. (2007).
Кроме того, много исследований посвящено генам, участвующим в регуляции артериального давления, поскольку ангиопатия, вызванная повышенным АД, является одним из факторов, нарушающих нормальное формирование сосудов маточно-плацентарного кровотока и, следовательно, рост и развитие эмбриона. Наиболее изученным в рамках ПНБ является ген ангиотензиногена (аллельный вариант М235Т). Носительство мутантной аллели 235Т ассоциировано с нарушением ремоделирования маточных спиральных артерий (В. Miskovic et al., 2008). Поэтому вклад полиморфизма М23Т в формирование ПНБ, возможно, обусловлен не столько его эффектами, связанными с регуляцией АД, сколько его негативным влиянием на процессы ангиогенеза и ремоделирование маточных артерий. Тем не менее, существует ряд работ, в которых не подтверждается связь данного полиморфизма с ПНБ (Hefler L.A. et al., 2002).
Вторым этапом исследования была оценка взаимосвязи ПНБ и носительства полиморфных аллелей выбранных генов, вовлеченных в формирование данного заболевания непосредственно у женщин российской популяции.
При разработке предлагаемого способа определения генетической предрасположенности к ПНБ нами был проведен анализ ДНК у 128 пациенток с ПНБ I триместра (2 и более самопроизвольные потери беременности подряд в сроке до 12 недель беременности). Для оценки распространенности вышеуказанных полиморфизмов в российской популяции была сформирована контрольная группа из 130 женщин с реализованной репродуктивной функцией (группа контроля).
Результаты проведенных исследований показали, что у женщин с ПНБ, в отличие от женщин с реализованной репродуктивной функцией, отмечается:
а) достоверное увеличение частоты встречаемости мутантных аллелей 34L гена FXIII (31,3% и 22,3%, р=0,022), 4а гена eNOS (26,6% и 16,5%, р=0,007) и генотипа 235МТ гена AGT (57,0% и 43,1%, р=0,034), что указывает на значимую роль носительства этих полиморфных маркеров в формировании предрасположенности к ПНБ;
б) достоверное снижение частоты встречаемости мутантных аллелей 353Q гена FVII (5,9% и 11,5%, р=0,022) и PLA2 гена GpIIIa (10,9% и 20,4%, р=0,003), что отражает их протективный эффект на гестационный процесс.
Третьим этапом исследования было выявление вклада каждого из аллельных вариантов генов в формирование ПНБ, а также определение и выражение суммарного результата. Для этого была проведена углубленная статистическая обработка полученных на втором этапе экспериментальных данных с использованием многофакторного анализа, в результате которой вклад отдельных вариантов был выражен в виде числового значения (коэффициента значимости).
По результатам анализа (см. табл.1-5) наиболее весомый вклад в формирование предрасположенности к ПНБ принадлежал носительству полиморфизма V34L гена FXIII, на фоне которого маскировалось протективное влияние полиморфизма R353Q гена FVII. В то же время аллельные варианты V34L гена FXIII и PLA1/A2 гена GpIIIa оказывали независимое, существенное и разнонаправленное действие на формирование предрасположенности к ПНБ. Негативный вклад аллельного варианта 4а/b гена eNOS был несколько ниже, чем у V34L гена FXIII. В то время как по результатам многофакторного анализа аллельный вариант М235Т не принимал участия в развитии данного заболевания. Однако при одновременном включении в модель регрессионного анализа всех вышеописанных вариантов влияние на формирование предрасположенности к ПНБ отмечалось для каждого из них, что подтверждает необходимость оценки комбинации генов для выявления предрасположенности к ПНБ. Примечательно, что три из этих пяти аллельных вариантов были ассоциированы с нарушениями в системе гемостаза, указывая на важную роль именно этого этиологического фактора в развитии ПНБ. Дополнительную роль в развитии ПНБ, по всей вероятности, играют генетически опосредованные нарушения нормальной функции эндотелия и нарушения ангиогенеза, обусловленные изменениями белков ренин-ангиотензин-альдостероновой системы.
Для каждого из пяти вышеперечисленных полиморфизмов были определены следующие коэффициенты значимости: 0,19 для аллели 34L гена FXIII; 0,16 для аллели 235Т гена AGT; 0,13 для аллели 4а гена eNOS; (-0,15) для аллели PLA2 гена GpIIIa и (-0,05) для аллели 353Q гена FVII) и создана шкала оценки риска формирования ПНБ на основании подсчета суммы баллов по пяти генотипам.
Суммарный балл по пяти генам рассчитывался по формуле I:
Σ=0,19*(AmutFXIII)+0,16*(AmutAGT)+0,13*(AmuteNOS)-0,15*(AmutGpIIIa)-0,05*(AmutFVII),
где Amut может принимать значения от 0 до 2 в зависимости от количества в генотипе пациентки мутантных аллелей,
0 - отсутствие мутантных аллелей 34L гена FXIII, 235T гена AGT, 4а гена eNOS, PLA2 гена GpIIIa и 353Q гена FVII соответственно (дикий генотип),
1 - наличие 1 мутантной аллели (гетерозиготный генотип),
2 - наличие 2 мутантных аллелей (мутантный генотип),
значения 0,19; 0,16; 0,13; -0,15 и -0,05 являются коэффициентами.
При сравнении полученного для каждой женщины, включенной в исследование, суммарного балла и имеющихся клинических данных был сделан вывод, что по результатам диагностики пациентки могут быть отнесены к одной из трех групп: низкого, среднего и высокого риска формирования предрасположенности к заболеванию. К группе низкого риска могут быть отнесены женщины с суммарным баллом <0,16 (этот балл был выявлен у 52,5% женщин группы контроля и 23,5% женщин с ПНБ (р=0,004, ОШ=0,27); к группе среднего риска - с суммарным баллом 0,16-0,40 (35,6% и 49,4% соотв., р=0,124, ОШ=1,76), к группе высокого риска - с суммарным баллом >0,40 (11,6% и 27,1% соотв., р=0,036, ОШ=2,83).
Балльный подход для оценки риска развития заболеваний (в том числе осложнений беременности) на основании данных генодиагностического исследования предложен многими исследователями (Глотов А.С. и соавт., 2007; Зайнуллина М.С. и соавт., 2009; Чайка В.К. и соавт., 2011), однако присвоение баллов тем или иным аллельным вариантам генов в данных работах осуществлен преимущественно эмпирическим путем. В основе разработанной нами шкалы лежит использование коэффициентов с учетом уровня значимости каждого из включенных в анализ генов. Более того, в отличие от предыдущих работ, предложенная модель включает аллельные варианты с разнонаправленным действием (не только негативным, но и протективным), что позволяет более точно оценить вклад генетической предрасположенности в развитие ПНБ у каждой конкретной пациентки.
Таким образом, поставленная задача разработки предсказательной модели развития ПНБ была решена за счет использования в такой модели комбинации достаточно большого числа полиморфизмов, отобранных по данным литературы и экспериментальной проверки ДНК-тестированием, и применения нового метода обработки экспериментальных данных. Способ по изобретению включает а) получение образца геномной ДНК обследуемого лица, б) анализ данного образца на полиморфизмы 34V/L гена FXIII, M235T гена AGT, 4a/b гена eNOS, PLA1/A2 гена GpIIIa и 353R/Q гена FVII; в) определение суммарного влияния 5 установленных генотипов путем подсчета суммарного балла в соответствии в формулой I; г) составление заключения с отнесением обследуемого лица к одной из трех групп риска формирования ПНБ, где показатель <0,16 баллов считается основанием для отнесения обследуемого лица к группе с низким риском, показатель от 0,16 до 0,40 баллов - к группе со средним риском, а показатель >0,40 баллов - к группе с высоким риском развития заболевания.
Предлагаемый способ достаточно прост в исполнении, характеризуется высокой чувствительностью и обладает значительной предсказательной силой.
Краткое описание фигур.
Фиг.1. Электрофорез в агарозном геле. Генотип VV - два фрагмента: 253 и 701 п.о., генотип VL- три фрагмента: 253. 455 и 701 п.о., генотип LL - два фрагмента: 455 и 701 п.о.
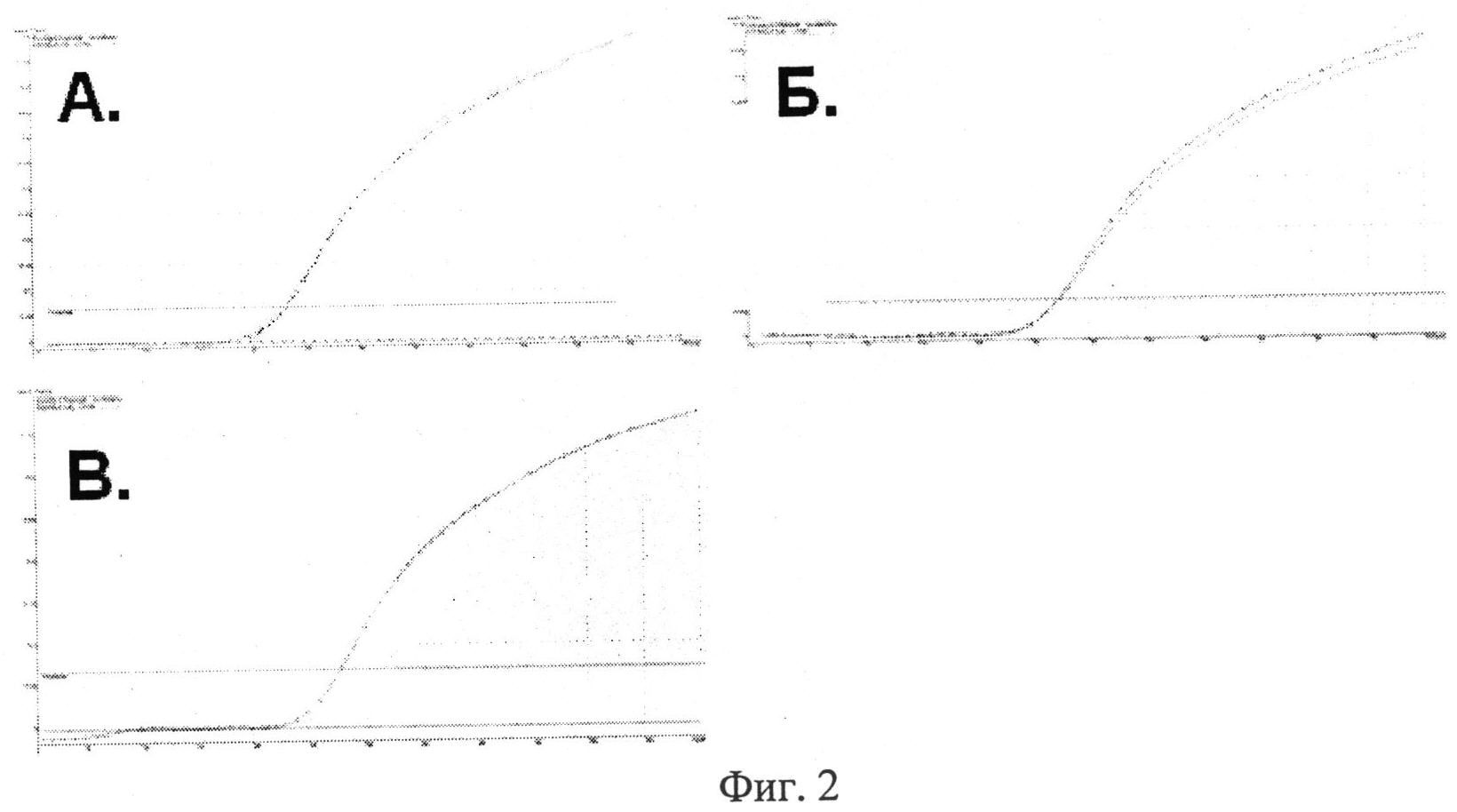
Фиг.2. Вид окон программы при отображении кривых флюоресценции образцов с различными генотипами: генотип ММ - рост кривых амплификации наблюдается только в канале FAM; генотип МТ - визуализация кривых амплификации в обоих каналах FAM/JOE; генотип ТТ - рост кривых амплификации наблюдается только в канале JOE.
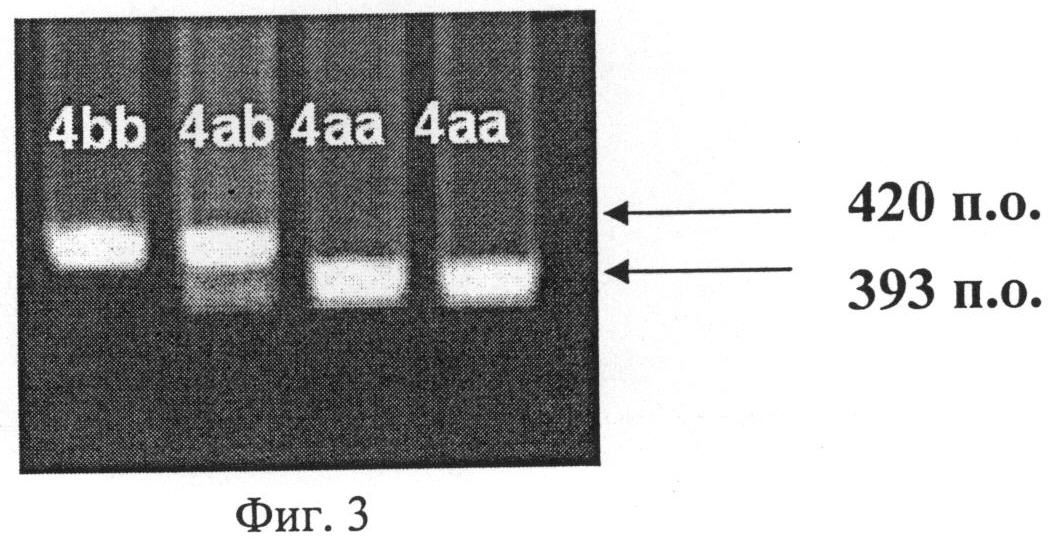
Фиг.3. Электрофорез в агарозном геле. Генотип 4bb - один фрагмент 420 и.о., генотип 4ab -два фрагмента: 393 и 420 п.о., генотип 4аа -один фрагмент 393 п.о.
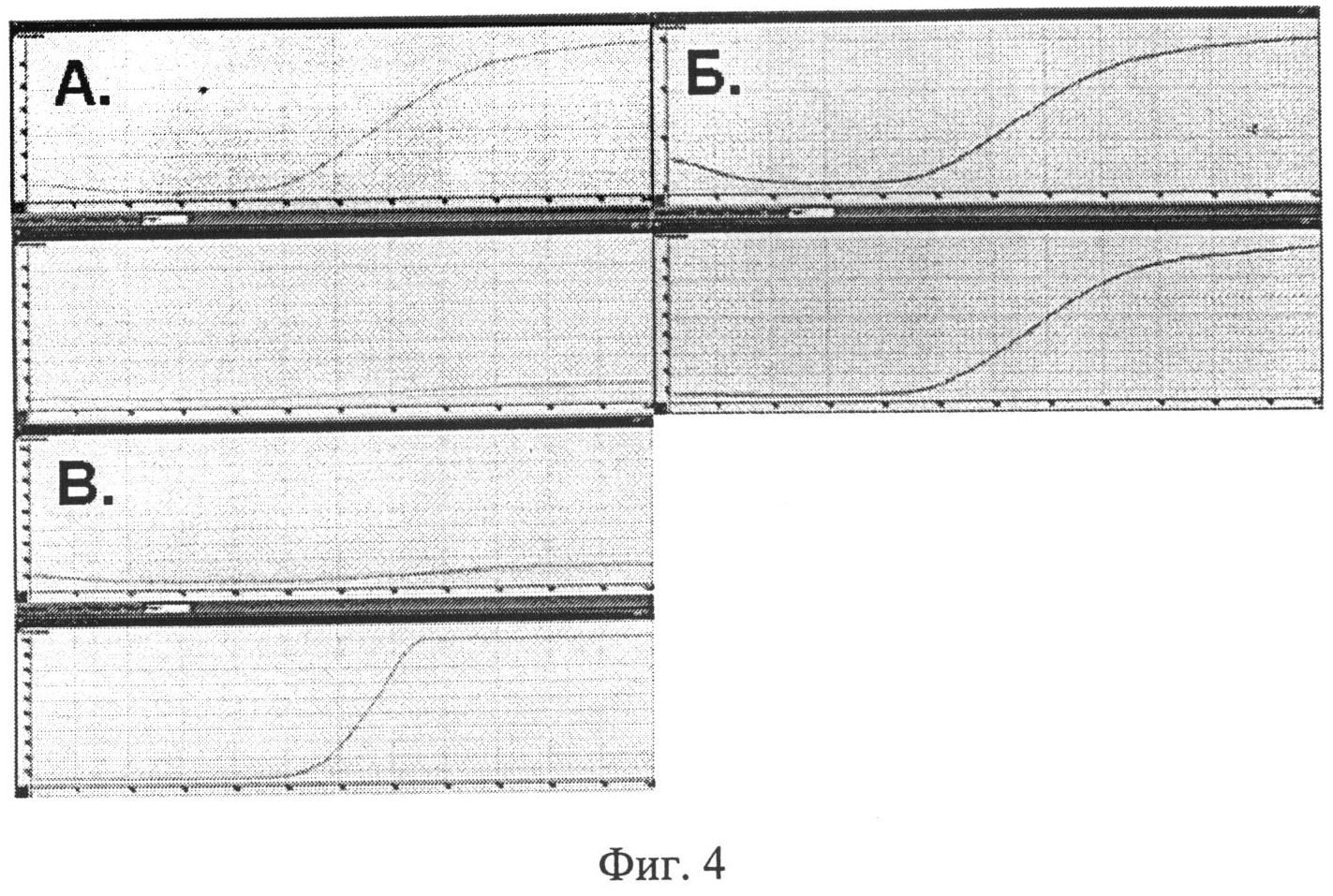
Фиг.4. Вид окон программы при отображении кривых флюоресценции образцов с различными генотипами: генотип RR - рост кривых амплификации наблюдается только в канале FAM; генотип RQ - визуализация кривых амплификации в обоих каналах FAM/JOE; генотип QQ - рост кривых амплификации наблюдается только в канале JOE.
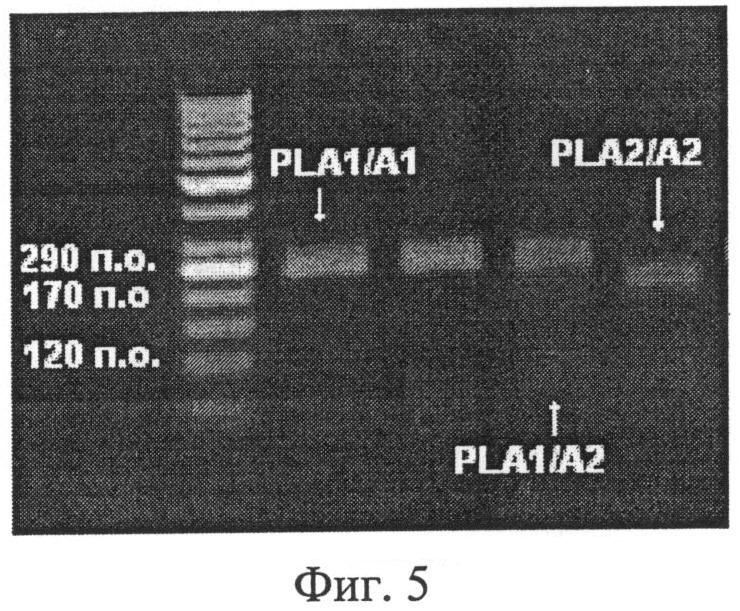
Фиг.5. Электрофорез в агарозном геле после обработки рестриктазой MspI. Генотип PLA1/A1 - один фрагмент 290 п.о., генотип PLA1/A2 - три фрагмента: 120, 170 и 290 п.о., генотип PLA2/A2 - два фрагмента: 120 и 170 п.о.
Осуществление изобретения.
Материалы и методы.
1. Критерии отбора больных для проведения анализа.
В исследование было включено 258 женщин в возрасте от 27 до 37 лет. Основную группу составили 128 пациенток с ПНБ I триместра неясной этиологии. В контрольную группу вошли 130 женщин с реализованной репродуктивной функцией, имевшие в анамнезе 1 и более своевременные роды здоровыми детьми.
Критериями включения в группу с ПНБ стали: детородный возраст, диагноз «ПНБ I триместра неясной этиологии», который устанавливали на основании наличия в анамнезе двух и более самопроизвольных прерываний беременностей подряд в I триместре в отсутствие явных этиологических факторов, а также отсутствие в анамнезе родов живым доношенным плодом.
Критериями исключения для обеих групп являлись анатомические аномалии репродуктивных органов; наличие системных аутоиммунных, эндокринных заболеваний (включая заболевания щитовидной железы, сахарный диабет), острых и хронических инфекционных процессов; антифосфолипидный синдром; Rh-конфликт; наличие хромосомной патологии; наличие тяжелых соматических заболеваний (стойкая артериальная гипертензия, почечная недостаточность, анемия 2-3 степени, ожирение 2-3 степени).
2. Выделение ДНК.
Выделение геномной ДНК из образца крови проводили с помощью модифицированного метода с протеиназой К и экстракцией фенол-хлороформом. Для этого в 1,5 мл пробирку (Eppendorf) вносили 700 мкл анализируемого образца крови и 700 мкл ТЕ-буфера (10 мМ Трис-HCl, рН 8,0, 1 мМ ЭДТА) для гемолиза эритроцитов.
Процедуру повторяли 2 раза, а затем к клеточному осадку добавляли 400 мкл буфера для протеиназы К, содержащего 200 мкг/мл протеиназы К, после чего инкубировали 4 часа при 60°С на термошейкере с постоянным перемешиванием (850 об/мин). Далее проводили фенол-хлороформную экстрацию ДНК с последующим осаждением 96% этанолом и центрифугированием в течение 10 мин при 10000 об/мин. После серии промывок ДНК элюировали ТЕ буфером (200 мкл). Концентрация выделенной ДНК составляла от 30 до 50 нг/мкл.
3. ПЦР-амплификация и анализ ПЦР-продуктов.
Для определения полиморфизмов в исследуемых генах применялись методы ПЦР, ПДРФ (полиморфизма длины рестрикционных фрагментов) и ПЦР в режиме реального времени. ПЦР проводили в термоциклере Master Cycler (Eppendorf). При этом использовали пробу следующего состава: 100 мМ Tris-HCl, рН 8,3 (25°С), 50 мМ КС1, MgCl2 (концентрация подбиралась индивидуально для каждой пары праймеров), четыре дезоксинуклеозидтрифосфата (по 200 мкМ каждого), Taq-полимераза (0,5 ед./реакцию) и 1-2 мкг геномной ДНК и праймеры (4-8 пмоль/реакцию). Конечный объем реакционной смеси составлял 25 мкл. При постановке ПЦР использовался прием «горячего старта» (Hebert В. et al., 1993).
Условия проведения реакции несколько различались в зависимости от определяемой аллели (см. примеры 2-6).
Рестрикционный анализ продуктов ПЦР проводился с помощью соответствующей рестриктазы в течение 6 часов. Продукты рестрикции анализировали с помощью электрофореза в агарозном геле, концентрация которого подбиралась в зависимости от длины рестрикционных фрагментов.
ПЦР в режиме реального времени проводили на амплификаторе Rotor-Gene-3000 (Corbett Research). В состав реакционной смеси помимо соответствующих праймеров (1 пмоль каждого в реакцию) и зондов (0,5 пкмоль каждого в реакцию) входили по 250 мкМ каждого dNTP; Taq-полимераза 3 ед. (0,6 мкл раствора с содержанием 5 ед. полимеразы в 1 мкл); 5 мл 5-кратного буфера для Taq-полимеразы, 1 мкл раствора ДНК (50нг/мкл) и деионизированная вода до 25 мкл.
4. Статистическая обработка результатов
Статистическая обработка данных проводилась при помощи пакета Statistica 8.0 с использованием t-критерия Стьюдента (для количественных признаков) и двустороннего точного критерия χ2 Фишера (для качественных признаков). Многофакторный анализ проводился с использованием модели множественной логистической регрессии. Подбор коэффициентов для создания балльной шкалы осуществлялся при помощи линейного регрессионного анализа. Уровень значимости был принят как р<0,05 (Xie С, 2011).
Примеры.
Пример 1. Характеристика группы пациентов, отобранных для ДНК-тестирования.
В соответствии с указанными выше критериями было отобрано 128 пациенток с ПНБ I триместра неясной этиологии и 130 женщин группы контроля. Средний возраст женщин с ПНБ и женщин контрольной группы существенно не различался (30±4,5 года и 31±4,8 года соотв., р>0,05). Спектр выявленных соматических заболеваний был представлен заболеваниями сердечно-сосудистой (20,3% и 20,7% соотв.), дыхательной (6,3% и 4,5% соотв.), пищеварительной (26,1% и 27,6% соотв.) и мочевыделительной систем (11,7% и 13% соотв.), а также заболеваниями ЛОР-органов (34,3% и 33,8% соотв.) и эндокринными нарушениями (11,7% и 14,5% соотв.).
Средний возраст менархе у женщин с ПНБ и женщин контрольной группы (12,6±1,0 и 13,1±1,6 лет соотв.), длительность менструального цикла (28,6±2,9 и 29,5±2,6 дней) и продолжительность менструаций (4,5±1,2 и 4,5±0,7 дней) были сопоставимы и соответствовали физиологическим параметрам.
Анализ гинекологической заболеваемости не выявил существенных различий среди женщин с ПНБ и группой контроля. ВЗОМТ встречались в 15,6% и 11,5% случаев соотв., кисты яичников - у 19,3% и 15,3% соотв. В группе контроля в отличие от женщин с ПНБ чаще наблюдался наружный (16,6% и 8,6% соотв.) и внутренний эндометриоз (9,2% и 4,6% соотв.), миома матки (26,9% и 17,9% соотв.) и ЗППП (45,4% и 38,2% соотв.), однако эти различия не достигали статистической значимости.
Акушерский анамнез в группе женщин с ПНБ I триместра был отягощен повторными потерями беременности: у 73,4% пациенток в анамнезе было два самопроизвольных прерывания беременности, у 26,6% - три и более. В группе контроля акушерский анамнез был отягощен артифициальными абортами (42,3%), спорадическими потерями беременности в I триместре (16,2%), преждевременными родами (5,3%). У большинства женщин контрольной группы в анамнезе было 2 родов (74,6%).
Пример 2. Определение полиморфизма V34L гена FXIII.
Геномную ДНК, выделенную из каждого образца крови, подвергали ПЦР-амплификации, как описано в разделе «Материалы и методы».
После горячего старта и первой денатурации (95°С, 5 мин) проводили амплификацию из 30 циклов, каждый из которых включал денатурацию при 95°С, в течение 10 сек, отжиг праймеров при 65°С в течение 20 сек и элонгацию при 72°С в течение 60 сек. При этом использовали праймеры 5'-CCACAGTGGAGCTTCAGGGCG-3', 5'-CCTGGGACAAGGCTCTGGGTCTT-3', 5'-TGGGGGAATCTGGGTCTCCAAA-3', 5'-CCTGGGACAAGGCTCTGGGTC TT-3'. В качестве контрольного фрагмента во всех реакциях амплифицировался фрагмент размером 701 п.о. Наличие дополнительного продукта размером 304 п.о. свидетельствовало об амплификации L-аллели и соответствовало гомозиготному генотипу LL. Наличие дополнительного продукта размером 401 п.о. свидетельствовало об амплификации V-аллели и соответствовало гомозиготному генотипу VV. При наличии гетерозиготного генотипа VL на электрофореграмме помимо контрольного продукта длиной 701 п.о. также визуализировались фрагменты длиной 304 и 401 п.о. (фиг.1). После анализа всех образцов рассчитывали частоту встречаемости генотипов в анализируемых группах. Полученные результаты представлены в табл.1.
|
Из приведенных данных видно, что риск развития ПНБ коррелирует с носительством мутантной аллели 34L, а также гетерозиготного генотипа VL. Среди пациенток с ПНБ частота встречаемости мутантной аллели 34L была в 1,4 раза выше, чем в контрольной группе, а риск формирования данного заболевания (ОШ) составил 1,58 раза. Носительство гетерозиготного генотипа VL увеличивало риск развития ПНБ до 3,05 раз, в то время как при наличии дикого генотипа VV эта вероятность снижалась до 0,33 раз. Частота встречаемости мутантного генотипа LL существенно не различалась и была практически одинакова среди женщин обеих групп.
Пример 3. Определение полиморфизма М235Т гена AGT
Геномную ДНК, выделенную из каждого образца крови, подвергали ПЦР-амплификации, как описано в разделе «Материалы и методы».
После денатурации (95°С, 5 мин) проводили амплификацию из 60 циклов, каждый из которых включал: денатурацию (95°С, 15 сек), отжиг праймеров и элонгацию (62°С, 60 сек). При наличии только М аллели (что соответствовало гомозиготному генотипу ММ) рост кривых амплификации наблюдался только в канале FAM. При наличии только Т аллели (что соответствовало гомозиготному генотипу ТТ) рост кривых амплификации наблюдался только в канале JOE. Визуализация кривых амплификации в обоих каналах FAM/JOE свидетельствовала о наличии как М, так и Т аллели и соответствовала гетерозиготному генотипу МТ. Вид окон программы при отображении исходных кривых флюоресценции образцов с различными генотипами изображен на фиг.2. После анализа всех образцов рассчитывали частоту встречаемости генотипов в анализируемых группах. Полученные результаты представлены в табл.2.
|
Из приведенных данных видно, что риск развития ПНБ коррелирует с носительством гетерозиготного генотипа МТ. Частота встречаемости мутантной аллели 23 5Т среди пациенток с ПНБ была выше, чем в контрольной группе, однако эти различия не были статистически достоверными. Носительство гетерозиготного генотипа МТ увеличивало риск развития ПНБ до 1,73 раза, в то время как при наличии дикого генотипа ММ эта вероятность снижалась до 0,56 раз. Частота встречаемости мутантного генотипа ТТ существенно не различалась и была практически одинакова среди женщин обеих групп.
Пример 4. Определение полиморфизма 4а/b гена eNOS
Геномную ДНК, выделенную из каждого образца крови, подвергали ПЦР-амплификации, как описано в разделе «Материалы и методы».
После горячего старта и первой денатурации (94°С, 5 мин) проводили амплификацию из 30 циклов, каждый из которых включал денатурацию при 95°С, в течение 30 сек, отжиг праймеров при 58,8°С в течение 30 сек и элонгацию при 72°С в течение 30 сек. При этом использовали праймеры 5'-AGG ССС TAT GGT AGT GCC ТТ-3' и 5'-ТСТ СТТ AGT GCT GTG GTC АС-3. ПЦР-продукты визуализировали в агарозном геле методом электрофореза. При наличии 4а аллели амплифицировался фрагмент длиной 393 п.о., а при наличии 4b аллели - 420 п.о. Визуализация двух фрагментов - 393 и 420 п.о. свидетельствовала о наличии гетерозиготного генотипа 4ab (фиг.3). После анализа всех образцов рассчитывали частоту встречаемости генотипов в анализируемых группах. Полученные результаты представлены в табл.3.
|
Из приведенных данных видно, что риск развития ПНБ коррелирует с носительством мутантной аллели 4а. Частота встречаемости мутантной аллели 4а в группе пациенток с ПНБ была достоверно выше, чем в группе контроля, при этом риск развития ПНБ составил 1,83 раза. Носительство дикого генотипа bb, напротив, снижало данную вероятность до 0,51 раза. Достоверных различий по частоте встречаемости других генотипов выявлено не было.
Пример 5. Определение полиморфизма R353Q гена FVII
Геномную ДНК, выделенную из каждого образца крови, подвергали ГЩР-амплификации, как описано в разделе «Материалы и методы».
Для амплификации использовали следующие последовательности праймеров и зондов 5' GTACATGTTCTGTGCCGGCTACT-31; 5'-TGACGATGCCCGTCAGGT-35'-FAM АС ССА СТА CCG GGG САС GTG-BHQ1-3'; 5*-JOE-AC ССА СТА CCA GGG САС GTG GT-BHQ2-3'.
После денатурации (95°С, 5 мин) проводили амплификацию из 60 циклов, каждый из которых включал: денатурацию (95°С, 15 сек), отжиг праймеров и элонгацию (60°С, 60 сек). При наличии только R аллели (что соответствовало гомозиготному генотипу RR) рост кривых амплификации наблюдался только в канале FAM. При наличии только Q аллели (что соответствовало гомозиготному генотипу QQ) рост кривых амплификации наблюдался только в канале JOE. Визуализация кривых амплификации в обоих каналах FAM/JOE свидетельствовала о наличии как R, так и Q аллели и соответствовала гетерозиготному генотипу RQ. Вид окон программы при отображении исходных кривых флюоресценции образцов с различными генотипами изображен на фиг.4.
После анализа всех образцов рассчитывали частоту встречаемости генотипов в анализируемых группах. Полученные результаты представлены в табл.4.
|
|
Из приведенных данных видно, что риск развития ПНБ коррелирует с носительством мутантной аллели 353Q. Среди пациенток с ПНБ частота встречаемости мутантной аллели 353Q была почти в 2 раза ниже, чем среди женщин контрольной группы, показатель ОШ составил 0,48, тем самым указывая на протективный эффект носительства мутантной аллели Q. Гетерозиготный генотип RQ среди пациенток с ПНБ обнаруживался в 2,8 раза реже по сравнению с пациентками контрольной группы, а шанс развития ПНБ при носительстве данного генотипа составил 0,67, что указывает на протективную роль данного генотипа по отношению к нормализации течения гестационного процесса. Носительство дикого генотипа RR, напротив, увеличивало вероятность развития ПНБ до 1,87 раза.
Пример 6. Определение полиморфизма PLA1/A2 гена GpIIIa.
Геномную ДНК, выделенную из каждого образца крови, подвергали ГЩР-амплификации, как описано в разделе «Материалы и методы».
После горячего старта и первой денатурации (95°С, 5 мин) проводили амплификацию из 30 циклов, каждый из которых включал денатурацию при 95°С, в течение 15 сек, отжиг праймеров при 60°С в течение 15 сек и элонгацию при 72°С в течение 15 сек. При этом использовали праймеры 5'-ТТС TGA TTG CTG GAC ТТС ТСТ Т-3'и 5'-ТСТ СТС ССС ATG GCA AAG AGT-3'. Для выявления полиморфных вариантов гена GpIIIa, полученные ПЦР-продукты обрабатывали эндонуклеазой рестрикции Msp I («Fermentas»). Для этого реакционную смесь объемом 10 мкл, содержащую 8,5 мкл ПЦР-продукта, 1 мкл буфера Tango для рестрикции («Fermentas») и 0,5 мкл Msp I (5 ед.), инкубировали в течение 6 часов при температуре 37°С, после чего продукты рестрикции визуализировали в агарозном геле методом электрофореза.
При наличии PLA1 аллели на электрофореграмме определялся один фрагмент длиной 290 п.о. При наличии PLA2 аллели на электрофореграмме визуализировалось три фрагмента длиной 170 и 120 п.о. Гетерозиготный генотип характеризовался одновременным наличием трех фрагментов - 290, 170 и 120 п.о. (фиг.5). После анализа всех образцов рассчитывали частоту встречаемости генотипов в анализируемых группах. Полученные результаты представлены в табл.5.
|
Из приведенных данных видно, что риск развития ПНБ коррелирует с носительством мутантной аллели PLA2. Частота встречаемости мутантной аллели PLA2 среди пациенток с ПНБ была в 1,87 раза ниже, чем в контрольной группе (ОШ=0,47). Частота встречаемости генотипа А1/А1 была выше среди пациенток с ПНБ, чем в группе контроля (79,7% и 62,3% соотв., р=0,003, ОШ=2,32). Гетерозиготный генотип А1/А2 достоверно реже обнаруживался среди пациенток с ПНБ - в 18,8% случаев в отличие от 34,6% среди женщин контрольной группы. При этом риск развития ПНБ (ОШ) составил 0,49 (р=0,005), что свидетельствует о протективной роли данного полиморфизма по отношению к нормализации течения гестационного процесса. Частота встречаемости мутантного генотипа ТТ также была ниже среди женщин с ПНБ, однако эти различия не достигали статистической значимости.
Пример 7. Оценка вклада исследуемых полиморфизмов в формирование ПНБ и разработка балльной шкалы риска развития ПНБ.
Для оценки вклада каждого из исследуемых генов был проведен многофакторный анализ исследуемых генов с применением модели множественной логистической регрессии. Самый выраженный негативный эффект отмечался для полиморфизма V34L гена FXIII, а самый слабый негативный эффект - для полиморфизма 4а/b гена eNOS (табл.6). Протективный эффект был наиболее выражен у полиморфизма PLA1/A2, в то время как протективное действие полиморфизма R353Q было выражено значительно слабее.

Поэтому по степени вклада в формирование ПНБ исследуемые полиморфизмы можно расположить следующим образом:
V34L гена FXIII>М235Т гена AGT>PLA1/A2 гена GpIIIa>4a/b гена eNOS>R353Q гена FVII
С учетом полученных данных, нами были введены коэффициенты значимости для каждого из полиморфизмов. Коэффициент отражал не только вклад, но и направленность действия полиморфного варианта. Чем выраженнее был эффект носительства мутантной аллели, тем больше было значение коэффициента. Коэффициент мутантных аллелей с негативным эффектом был положительным, а с протективным - отрицательным (т.к. носительство протективных аллелей уменьшает отрицательный вклад носительства негативных аллелей).
Для присвоения коэффициентов мы использовали модель линейной логистической регрессии. Выбор модели был обусловлен тем, что в использованную на первом этапе многофакторного анализа множественную модель логистической регрессии в качестве независимой переменной включаются бинарные признаки, т.е. каждый ген рассматривается как бинарная переменная, где 0 - дикий тип, 1 - носительство хотя бы одной мутантной аллели. Однако данная модель достаточно сложна для практического применения. Поэтому мы рассмотрели каждый ген не как бинарную переменную, а как переменную, принимающую три значения (0 - отсутствие мутантной аллели, 1 - наличие только 1 мутантной аллели, 2 - наличие 2 мутантных аллелей), но при этом упростили модель, использовав линейную логистическую регрессию. Полученные для каждой из аллелей коэффициенты представлены в табл.7.
|
Суммарный балл по пяти генам для каждой из пациенток высчитывался по формуле I:
X=0,19*(Amut FXIII)+0,16*(Amut AGT)+0,13*(Amut eNOS) - 0,15*(Amut GpIIIa) -0,05*(AmutFVII),
где Amut может принимать значения от 0 до 2 в зависимости от количества в генотипе пациентки мутантных аллелей:
0 - отсутствие мутантных аллелей (дикий генотип),
1 - наличие 1 мутантной аллели (гетерозиготный генотип),
2 - наличие 2 мутантных аллелей (мутантный генотип).
Согласно присвоенным баллам была подсчитана сумма баллов для всех комбинаций генотипов по пяти полиморфизмам. Далее было предпринято разделение пациенток на три группы - низкого, среднего и высокого риска формирования предрасположенности к ПНБ с учетом распределения данных по процентилям (табл.8).
|
Чтобы разделить пациенток на три равномерные группы, можно было выделить группы: 1) низкого риска с суммарным баллом <0,16, 2) среднего риска с суммарным баллом 0,16-0,32 и 3) высокого риска с суммарным баллом >0,32. Однако, для того, чтобы максимально отделить пациенток, попадающих в группу высокого риска, от других женщин, мы искусственно завысили нижнюю границу группы высокого риска формирования предрасположенности к ПНБ до 0,40.
В результате были выделены три группы: суммарный балл <0,16, суммарный балл 0,16-0,40, суммарный балл >0,40. При таком разделении распределение женщин по группам риска существенно различалось среди пациенток с ПНБ и группы контроля (р=0,001, χ2=13,67). При сравнении пациенток обеих групп в рамках каждого из отобранных балльных интервалов оказалось, что суммарный балл<0,16 достоверно чаще встречается в группе контроля в отличие от женщин с ПНБ, в то время как суммарный балл более 0,4 достоверно чаще выявляется в группе женщин с ПНБ (табл.9).
|
Сумма баллов, равная 0,16 и менее, соответствует комбинациям, при которых у пациентки отсутствуют мутантные аллели по трем негативным генам (FXIII, AGT, eNOS) либо имеется гетерозиготное носительство одной или двух негативных аллелей, но при обязательном наличии гетеро- или гомозиготного носительства протективных аллелей генов GpIIIa и/или FVII. Подобная сумма баллов встречалась более чем у половины пациенток группы контроля (52,5%) и лишь у четверти женщин с ПНБ (23,5%) (р=0,004). При этом риск формирования предрасположенности к ПНБ (ОШ) составил всего 0,28. Это свидетельствует о том, что женщины с такой суммой баллов действительно попадают в группу низкого риска развития ПНБ.
Сумма баллов, равная 0,40 и более, соответствует комбинациям, при которых у пациентки имеется гомо- или гетерозиготное носительство одновременно двух или трех негативных аллелей (FXIII, AGT, eNOS) на фоне полного отсутствия протективных аллелей либо наличия протективной аллели только одного гена (GpIIIa или FVII). Такой суммарный балл>0,40 был выявлен у трети пациенток с ПНБ (27,1%) и только у 11,6% женщин группы контроля (р=0,036). Риск формирования предрасположенности к ПНБ у женщин с подобными комбинациями увеличивался почти в три раза (0111=2,83). Это свидетельствует о том, что женщины с такой суммой баллов действительно попадают в группу высокого риска развития ПНБ.
Сумма баллов, равная больше 0,16, но меньше 0,40, соответствует комбинациям, при которых у пациентки имеется носительство одновременно и негативных и протективных аллелей. Подобный суммарный балл отмечался почти у половины пациенток с ПНБ (49,4%) и у трети женщин группы контроля (35,6%). Эти различия не были достоверны (р=0,124), а риск формирования предрасположенности к ПНБ составил 1,76. Таким образом, можно сделать вывод о том, что в формировании ПНБ у данной категории женщин играют роль не только генетические факторы (наличие полиморфизма тех или иных генов), но и негенетические причины, а потому таких женщин можно отнести в группу среднего риска формирования предрасположенности к ПНБ.
С учетом полученных результатов можно утверждать, что наиболее значимым в формировании предрасположенности к ПНБ оказывается носительство полиморфных аллелей генов FXIII (V34L), AGT (М235Т), eNOS (4a/b), GpIIIa (PLA1/A2) и FVII (R353Q), на основании комбинаций которых можно отнести пациентку к группе высокого, среднего или низкого риска предрасположенности к ПНБ.
Таким образом, предлагаемый способ определения риска развития ПНБ, основанный на анализе комбинаций аллельных вариантов генов FXIII, FVII, AGT, eNOS и GpIIIa с подсчетом суммы баллов, позволяет выделить группы женщин низкого, среднего и высокого риска развития ПНБ, что в свою очередь дает возможность проведения своевременной и полноценной коррекции выявленных нарушений.
Список литературы
1. Глотов А.С., Иващенко Т.Э., Образцова Г.И., Т.В.Наседкина, В.С.Баранов. Зависимость между возникновением стабильной артериальной гипертензии у детей и полиморфизма генов ренин-ангиотензиновой и кинин-брадикининовой системы // Мол. Биол. - 2007. - Т. 4, №1. - С.18-25.
2. Тромбофилия в акушерской практике: учебно-методическое пособие / М.С.Зайнулина, Е.А.Корнюшина, М.Л.Степанян, Е.В.Мозговая, Л.А.Александрова / под ред. Э.К.Айламазяна, Н.Н.Петрищева - СПб.: Изд-во Н-Л, 2005. - 46 с.
3. Патрушев, Л.И.Генетические механизмы наследственных нарушений гемостаза. // Биохимия. - 2002. - Т. 67, №1. - С.40-55.
4. Радзинский, В.Е., А.В.Иткес, Т.В.Галина. Прогнозирование гестоза и задержки развития плода по генотипам матери и плода. // Акушерство и гинекология. - 2003. - №4. -С.23-26.
5. В.К.Чайка, Е.М.Носенко, М.Бешир, Е.В.Зоркова. Балльная оценка риска развития преэклампсии у беременных юго-восточного региона Украины с генетически обусловленными формами тромбофилии с использованием технологии гелевых биочипов // Медико-социальные проблемы семьи. - 2011. - Т. 16, №3. - С.16-22.
6. Baek, К.Н., E.J.Lee, Y.S.Kim Recurrent pregnancy loss: the key potential mechanisms // Trends. Mol. Med. - 2007. - Vol.13, N. 7. -P. 310-7.
7. Benedetto C, Marozio L, Ciccone G, Chieppa G, Quaglia M, Matullo G, Bertola L, Guarrera S, Carturan S, Stratta P. Synergistic effect of renin-angiotensin system and nitric oxide synthase genes polymorphisms in pre-eclampsia // Acta Obstet. Gynecol. Scand. - 2007. - Vol.86,N. 6.-P. 678-82.
8. Choi YS, Kwon H, Kim J, Shin JE, Choi Y, Yoon TK, Choi DH, Kim NK. Haplotype-based association of ACE I/D, AT1R 1166A>C, and AGT M235T polymorphisms in renin-angiotensin-aldosterone system genes in Korean women with idiopathic recurrent spontaneous abortions // Eur. J. Obstet. Gynecol. Reprod. Biol. - 2011. - Vol.158, N. 2. - P. 225-8.
9. Dossenbach-Glaninger A, van Trotsenburg M, Dossenbach M, Oberkanins C, Moritz A, Krugluger W, Huber J, Hopmeier P. Plasminogen activator inhibitor 1 4G/5G polymorphism and coagulation factor XIII Val34Leu polymorphism: impaired fibrinolysis and early pregnancy loss // Clin. Chem. - 2003. - Vol.49, N. 7. - P. 1081 -6.
10. Fan W, Li SW, Wang Y. Association of genetic polymorphisms in endothelial nitric oxide synthase 3 gene with recurrent early spontaneous abortion // Zhonghua. Yi. Xue. Yi. Chuan. Xue. Za. Zhi. - 2007. - Vol.24, N. 1. - P. 23-6.
11. Hebert B, Bergeron J, Potworowski EF, Tijssen P. Increased PCR sensitivity by using paraffin wax as a reaction mix overlay // Mol Cell Probes. - 1993. - Vol.7, N.3. - P. 249-52.
12. Hefler LA, Tempfer CB, Bashford MT, Unfried G, Zeillinger R, Schneeberger C, Koelbl H, Nagele F, Huber JC. Polymorphisms of the angiotensinogen gene, the endothelial nitric oxide synthase gene, and the interleukin-lbeta gene promoter in women with idiopathic recurrent miscarriage // Mol. Hum. Reprod. - 2002. - Vol.8, N. 1. - P. 95-100.
13. James JL, Cartwright JE, Whitley GS, Greenhill DR, Hoppe A. The regulation of trophoblast migration across endothelial cells by low shear stress: consequences for vascular remodelling in pregnancy // Cardiovasc. Res. - 2012. - Vol.93, N. 1. - P. 152-61.
14. Jeddi-Tehrani M, Torabi R, Zarnani AH, Mohammadzadeh A, Arefi S, Zeraati H, Akhondi MM, Chamani-Tabriz L, Idali F, Emami S, Zarei S. Analysis of plasminogen activator inhibitor-1, integrin beta3, Beta fibrinogen, and methylenetetrahydrofolate reductase polymorphisms in Iranian women with recurrent pregnancy loss // Am. J. Reprod. Immunol. -2011.-Vol.66, N. 2.-P. 149-56.
15. Inbal A, Dardik R. Role of coagulation factor XIII (FXIII) in angiogenesis and tissue repair // Pathophysiol. Haemost. Thromb. - 2006. - Vol.35, N. 1-2. - P. 162-5.
16. Ivanov P, Komsa-Penkova R, Ivanov I, Konova E, Kovacheva K, Simeonova M, Tanchev S. Plasminogen activator inhibitor type 1 activity in women with unexplained very early recurrent pregnancy loss // Akush. Ginekol. (Sofiia). - 2010. - Vol.49, N. 5. -P. 3-8.
17. Kobbervig C, Williams E. FXIII polymorphisms, fibrin clot structure and thrombotic risk // Biophys. Chem. - 2004. - Vol.112. - P. 223-228.
18. Lambrinoudaki I, Armeni E, Kaparos GJ, Christodoulakos GE, Sergentanis TN, Alexandrou A, Creatsa M, Kouskouni E. The frequency of early, spontaneous miscarriage associated with the leu33pro polymorphism of Glycoprotein Ilia: a pilot study // Aust N. Z. J. Obstet. Gynaecol. - 2010. - Vol.50, N. 5. -P. 485-90.
19. Lane DA, Grant PJ. Role of hemostatic gene polymorphisms in venous and arterial thrombotic disease. // Blood. - 2000. - Vol.95, N 5. - P. 517-532.
20. Lindman AS, Pedersen JI, Arnesen H, Hjerkinn EM, Veiered MB, Prydz H, Seljeflot I. Coagulation factor VII, R353Q polymorphism, and serum choline-containing phospholipids in males at high risk for coronary heart disease // Thromb. Res. - 2004. - Vol.113, N. 1. -P. 57-65.
21. Miskovic В., Sertic J., Stavljenic-Rukavina A., Stipoljev F. Association of angiotensin-converting enzyme insertion-deletion polymorphism with preeclampsia // Coll. Antropol. - 2008. - Vol.32, N. 2. - P. 339-43.
22. Seremak-Mrozikiewicz A., Drews K., Kurzawinska G., Barlik M, Mrozikiewicz PM. The connection between Arg353Gln polymorphism of coagulation factor VII and recurrent miscarriages // Ginekol Pol. - 2009. - Vol.80, N. 1. - P. 8-13.
23. Su MT, Lin SH, Chen YC. Genetic association studies of angiogenesis- and vasoconstriction-related genes in women with recurrent pregnancy loss: a systematic review and meta-analysis // Hum Reprod Update. - 2011. - Vol.17, N. 6. - P. 803-12.
24. C. Xie. A Gene Score Test for Disease Association with Multiple Genes // Open Journal of Statistics. - 2011. - Vol.1, N. 1. - P. 15-18.
25. Yenicesu GI, Cetin M, Ozdemir O, Cetin A, Ozen F, Yenicesu C, Yildiz C, Kocak N. A prospective case-control study analyzes 12 thrombophilic gene mutations in Turkish couples with recurrent pregnancy loss // Am J Reprod Immunol. - 2010. - Vol.63, N. 2. -P. 126-135.
Способ определения генетической предрасположенности к привычному невынашиванию беременности (ПНБ), предусматривающий получение образца геномной ДНК обследуемого лица, анализ данного образца на полиморфизм генов, для которых предварительно установлена связь с развитием данного заболевания, определение генотипа по всем включенным в исследование генам и составление заключения на основании обработки полученных экспериментальных данных, отличающийся тем, что в образце ДНК исследуют полиморфизмы 34V/L гена FXIII, М235Т гена AGT, 4a/b гена eNOS, PLA1/A2 гена GpIIIa и 353R/Q гена FVII; после установления генотипа по всем 5 генам определяют суммарное влияние выявленных аллелей путем подсчета суммарного балла в соответствии с формулой:Σ=0,19*(Amut FXIII)+0,16*(Amut AGT)+0,13*(Amut eNOS)-0,15*(Amut GpIIIa)-0,05*(Amut FVII),где Amut принимает значения от 0 до 2:0 - отсутствие мутантных аллелей 34L гена FXIII, 235Т гена AGT, 4а гена eNOS, PLA2 гена GpIIIa и 353Q гена FVII соответственно (дикий генотип),1 - наличие 1 мутантной аллели (гетерозиготный генотип),2 - наличие 2 мутантных аллелей (мутантный генотип),значения 0,19; 0,16; 0,13; -0,15 и -0,05 являются коэффициентами,и при составлении заключения считают значение суммарного балла <0,16 баллов основанием для отнесения обследуемого лица к группе с низким риском, значение от 0,16 до 0,40 баллов - к группе со средним риском, а значение >0,40 баллов - к группе с высоким риском формирования ПНБ.