СПОСОБЫ ИДЕНТИФИКАЦИИ МИКРООРГАНИЗМОВ С ПОМОЩЬЮ СПЕКТРОСКОПИИ (ВАРИАНТЫ)
Вид РИД
Изобретение
Перекрестная ссылка на родственную заявку
Данная заявка претендует на приоритет в отношении предварительной заявки на патент США №61/110187, озаглавленной ″Method and System for Detection and/or Characterization of a Biological Particle in a Sample″, поданной 31 октября 2008, которая включена в данную заявку.
Область изобретения
Настоящее изобретение относится к способам и системам для обнаружения, изоляции и/или идентификации микроорганизмов в образце. В частности, настоящее изобретение направлено на способ быстрой характеристики и/или идентификации микроорганизма с помощью спектроскопических методов.
Предшествующий уровень техники
Обнаружение патогенных микроорганизмов в биологических жидкостях следует осуществлять в кратчайшее по возможности время, в частности, в случае септицемии, для которой смертность остается высокой, несмотря на широкий спектр антибиотиков, доступных врачам. Присутствие биологически активных агентов, таких как микроорганизмы, в жидкости организма пациента, в частности в крови, обычно определяют, используя флаконы гемокультуры. Инфекции системы кровообращения связаны с высокой заболеваемостью и смертностью, кроме того, осуществление современных способов диагностики, культивирования с последующей биохимической идентификацией и тестирования на чувствительность к антибиотикам может занять несколько суток. Обычно начинают эмпирическую терапию на основании клинических симптомов и результаты тестов влияют на клинические решения только тогда, когда первоначальная терапия неудачна. Способность охарактеризовать инфекции кровообращения в пределах первых нескольких часов, предпочтительно в пределах часа, после положительного результата гемокультуры значительно усилило бы клиническую релевантность предоставленной диагностической информации. Для восполнения данной потребности предложены способы молекулярной амплификации, но при данном подходе остаются серьезные проблемы. Сама среда положительной гемокультуры представляет собой естественно амплифицированную популяцию микроорганизмов с потенциалом использования быстрых тестов идентификации (ID).
Традиционные автоматические фенотипические ID тесты, такие как системы Vitek®, Phoenix™ и Microscan®, или ручные фенотипические тесты, такие как API, требуют, чтобы микроорганизмы находились в соответствующей фазе роста и были свободны от мешающих сред и продуктов крови с целью получения надежных результатов. Эти системы используют колонии, выращенные из положительной культуры в течение 18-24 часов на средах в чашках Петри. Однако при стремлении получить более быстрые результаты некоторые лаборатории сообщили об использовании этих систем с микроорганизмами, выделенными из флаконов с положительными гемокультурами. Эти тесты ″непосредственно из флакона″ пригодны не для всех микроорганизмов (например, непригодны для грамположительных кокков), не подтверждены изготовителями тестов и, как правило, занимают 3-8 часов для получения результатов. Более быстрые и более широко специфичные тесты крайне необходимы в целях обеспечения врача клинически релевантными результатами в пределах первых нескольких часов, предпочтительно в пределах часа, после положительного результата культуры.
Способы оптической спектроскопии, такие как собственная флуоресценция (IF), инфракрасная спектроскопия (FTIR) или рамановская спектроскопия, и способы масс-спектрометрии, такие как MALDI-TOF (времяпролетная ионизация лазерной десорбцией с использованием матрицы), обладают потенциалом, предоставляющим возможность идентификации микроорганизмов очень быстро, но они могут столкнуться с интерференцией от множества высокофлуоресцентных и поглощающих соединений, присутствующих в жидких микробиологических культуральных средах и в клинических образцах, таких как кровь, или в их сочетании. Чаще всего используемые способы выделения микроорганизмов непосредственно из положительной гемокультуры представляют собой двухступенчатое дифференциальное центрифугирование и центрифугирование в пробирке для отделения сыворотки.
Другие описанные способы разделения, характеристики и/или идентификации микроорганизмов включают:
В патенте США №4847198 раскрыт способ идентификации микроорганизмов с помощью рамановской спектроскопии с УФ-возбуждением. В соответствии с патентом ′198 бактериальную суспензию приводят в контакт с одной длиной волны в ультрафиолетовом диапазоне. Часть использованной световой энергии поглощается, а часть световой энергии испускается. Испускаемую световую энергию, усиленное резонансом рамановское светорассеяние, измеряют как обратнорассеянную энергию. Эту энергию обрабатывают с получением спектров, которые являются характеристическими для бактерий.
Патент США №5938617 автора Vo-Dinh направлен на систему, которая идентифицирует биологические патогены в образце путем возбуждения образца светом при нескольких длинах волн и синхронного снятия интенсивностей испускания. Эта система включает механизмы для воздействия на образец возбуждающим излучением и образования в результате этого испускаемого излучения. Биологические патогены могут представлять собой вирусы и бактерии.
В патенте США №6177266 раскрыт способ хемотаксономической классификации бактерий биомаркерами, специфичными для рода, вида и штамма, созданными с помощью анализа масс-спектрометрии времяпролетной ионизации лазерной десорбцией с использованием матрицы (MALDI-TOF-MS) либо клеточных белковых экстрактов, либо целых клеток.
В патенте США №7070739 представлен способ экстракции, разделения и очистки микроорганизмов, включая вирусы, путем двумерного ультрацентрифугирования непосредственно из жидкостей организма или из гомогенизированной ткани. На первой стадии центрифугирования удаляют все частицы, имеющие более высокую скорость седиментации, чем те из микроорганизмов, которые нужно идентифицировать. На второй стадии ультрацентрифугирования используют зональное центрифугирование в градиенте плотности в жидкостях, заполненных с образованием градиента плотности широкого диапазона, используя специальные рифленые центрифужные пробирки. В соответствии с этим патентом этот метод разделения можно использовать для определения сгруппированных частиц с помощью светорассеяния или флуоресценции, используя красители, специфичные для нуклеиновых кислот, и для выделения сгруппированных частиц в очень малых объемах для характеристики с помощью масс-спектрометрии субъединиц вирусных белков и интактных вирусных частиц, а также с помощью флуоресцентного проточного цитометрического определения как массы нуклеиновых кислот, так и масс фрагментов, образуемых ферментами рестрикции.
В опубликованной заявке на патент США №2007/0037135 раскрыта система для идентификации и количественного определения биологического образца, суспендированного в жидкости. Эта система включает модуль возбуждения флуоресценции по меньшей мере с одним возбуждающим источником света; модуль интерфейса образца, оптически соединенный с модулем возбуждения флуоресценции для расположения биологического образца таким образом, чтобы он получал возбуждающий свет по меньшей мере от одного источника возбуждающего света; модуль испускания флуоресценции, оптически соединенный с модулем интерфейса образца и включающий по меньшей мере одно устройство обнаружения для определения матриц возбуждения-испускания флуоресценции биологического образца; и компьютерный модуль, оперативно соединенный с модулем испускания флуоресценции. Компьютерный модуль осуществляет многофакторный анализ на матрицах возбуждения-испускания флуоресценции биологического образца, чтобы идентифицировать и количественно определить биологический образец. Однако в заявке ′135 не обсуждена идентификация и количественное определение микроорганизмов из комплексных биологических образцов, таких как кровь.
В опубликованной заявке на патент США №2007/0175278 описано использование жидкой культуральной среды для культивирования интересующего образца, включающего, например, кровь, мочу, фекалии, внутривенные катетеры и т.д., линии промышленного производства, водные системы, пищевой продукт, косметическое изделие, фармацевтический препарат и криминалистический образец. Следовательно, микроорганизмы могут быть собраны из жидкой среды способами, известными в данной области техники, например, центрифугированием. Затем концентрированные микроорганизмы можно переносить на материал-носитель, необязательно после высушивания, для получения вибрационного спектра. В заявке на патент обсуждены различные способы идентификации и классификации микроорганизмов, включая вибрационную спектроскопию, такую как рамановская спектроскопия.
Однако эти способы имеют несколько недостатков при попытке разделить и охарактеризовать микроорганизмы из комплексных образцов, таких как культуральные среды, содержащие кровь. Полученные в результате препараты микроорганизмов часто содержат загрязняющие эритроциты, тромбоциты, липидные частицы, плазматические ферменты и клеточный детрит, что может вызвать плохие результаты. Эти способы также являются очень трудоемкими и небезопасными за счет стадий, которые могут привести в результате к аэрозольному воздействию потенциально опасных патогенов на пользователя. Необходимы простые, безопасные и надежные способы выделения микроорганизмов из клинических образцов (например, гемокультуры) и других комплексных образцов, которые свободны от этих интерферирующих материалов и совместимы с технологиями быстрой идентификации.
Краткое изложение сущности изобретения
В настоящем изобретении предложены способы разделения, характеристики и/или идентификации микроорганизмов в образце. Эти способы дают возможность характеристики и/или идентификации микроорганизмов быстрее, чем методы предшествующего уровня техники, приводя в результате к более быстрым диагнозам (например, у субъекта, страдающего или подозреваемого на септицемию) и идентификации зараженных материалов (например, пищевых продуктов и фармацевтических препаратов). Стадии, включенные в способы по изобретению, от получения образца для характеристики и/или идентификации микроорганизмов до получения клинически релевантной информации, дающей основания для действий, можно осуществлять в очень короткой временной рамке, например, менее чем примерно за 120 минут. Кроме того, способы по изобретению могут быть полностью автоматизированы, уменьшая за счет этого риск обращения с инфекционными материалами и/или зараженными образцами.
В одном аспекте настоящее изобретение направлено на способ характеристики и/или идентификации микроорганизма из тестируемого образца, включающий:
(a) получение тестируемого образца, о котором известно, что он содержит или может содержать микроорганизмы;
(b) селективный лизис клеток не микроорганизмов в тестируемом образце с получением лизированного образца;
(c) разделение микроорганизмов и других компонентов лизированного образца с образованием изолированного образца микроорганизмов;
(d) спектроскопическое исследование изолированных микроорганизмов с получением спектроскопических измерений данного микроорганизма; и
(e) характеристику и/или идентификацию данного микроорганизма в изолированном образце путем сравнения спектроскопических измерений со снятыми спектроскопическими измерениями или предсказанными спектроскопическими свойствами известных микроорганизмов.
В одном аспекте настоящее изобретение направлено на способ характеристики и/или идентификации микроорганизма из гемокультуры, включающий:
(а) получение образца из гемокультуры, о которой известно, что она содержит или может содержать микроорганизмы;
(b) селективный лизис клеток не микроорганизмов в образце с получением лизированного образца;
(c) наслаивание лизированного образца на плотностный буфер в герметичном контейнере;
(d) центрифугирование контейнера для разделения микроорганизмов от других компонентов образца и образования осадка микроорганизмов;
(e) спектроскопическое исследование изолированных микроорганизмов с получением спектроскопических измерений данного микроорганизма; и
(f) характеристику и/или идентификацию данного микроорганизма в изолированном образце путем сравнения спектроскопических измерений со снятыми спектроскопическими измерениями или предсказанными спектроскопическими свойствами известных микроорганизмов.
В другом аспекте настоящее изобретение направлено на способ характеристики и/или идентификации микроорганизма, включающий:
(a) получение тестируемого образца, о котором известно, что он содержит или может содержать микроорганизмы;
(b) помещение тестируемого образца в герметичный контейнер;
(c) разделение in situ микроорганизмов от других компонентов тестируемого образца с образованием изолированного образца микроорганизмов из микроорганизмов в герметичном контейнере;
(d) спектроскопическое исследование изолированных микроорганизмов in situ с получением спектроскопических измерений данного микроорганизма; и
(e) характеристику и/или идентификацию данного микроорганизма в изолированном образце путем сравнения спектроскопических измерений со снятыми спектроскопическими измерениями или предсказанными спектроскопическими свойствами известных микроорганизмов.
В одной форме осуществления разделение осуществляют путем наслаивания тестируемого образца на плотностный буфер в герметичном контейнере (например, герметично закрытом контейнере) и центрифугирование контейнера для осаждения микроорганизмов, в то время как среда тестируемого образца остается сверху плотностного буфера. В другой форме осуществления контейнер имеет оптическое окно на дне и/или на стенках, так что осадок микроорганизмов может быть исследован спектроскопическим путем. Микроорганизмы можно идентифицировать путем сравнения спектра осадка со спектром или спектрами или предсказанными спектроскопическими свойствами известных микроорганизмов. Способность идентифицировать микроорганизмы непосредственно в осадке без дополнительных манипуляций значительно улучшает показатель безопасности данного способа идентификации микроорганизмов.
В одной форме осуществления спектроскопическое исследование основано на собственных характеристиках микроорганизмов (например, собственной флуоресценции). В других формах осуществления спектроскопическое исследование основано отчасти на сигналах, полученных от дополнительных агентов, которые добавляют в процессе способов по изобретению и которые взаимодействуют со специфичными микроорганизмами или группами микроорганизмов.
В другой форме осуществления способы дополнительно включают стадию выделения осадка микроорганизма, ресуспендирования микроорганизма и проведения дополнительных тестов идентификации или характеристики (например, лекарственной устойчивости, факторов вирулентности, антибиограммы).
Настоящее изобретение более подробно объяснено в графических материалах данной заявки и в приведенном ниже описании.
Краткое описание графических материалов
На ФИГ.1 показаны фотографии разделительных контейнеров после осуществления стадии лизиса, разделения по настоящему изобретению на культуре S. pneumoniae и отрицательной культуральной среде.
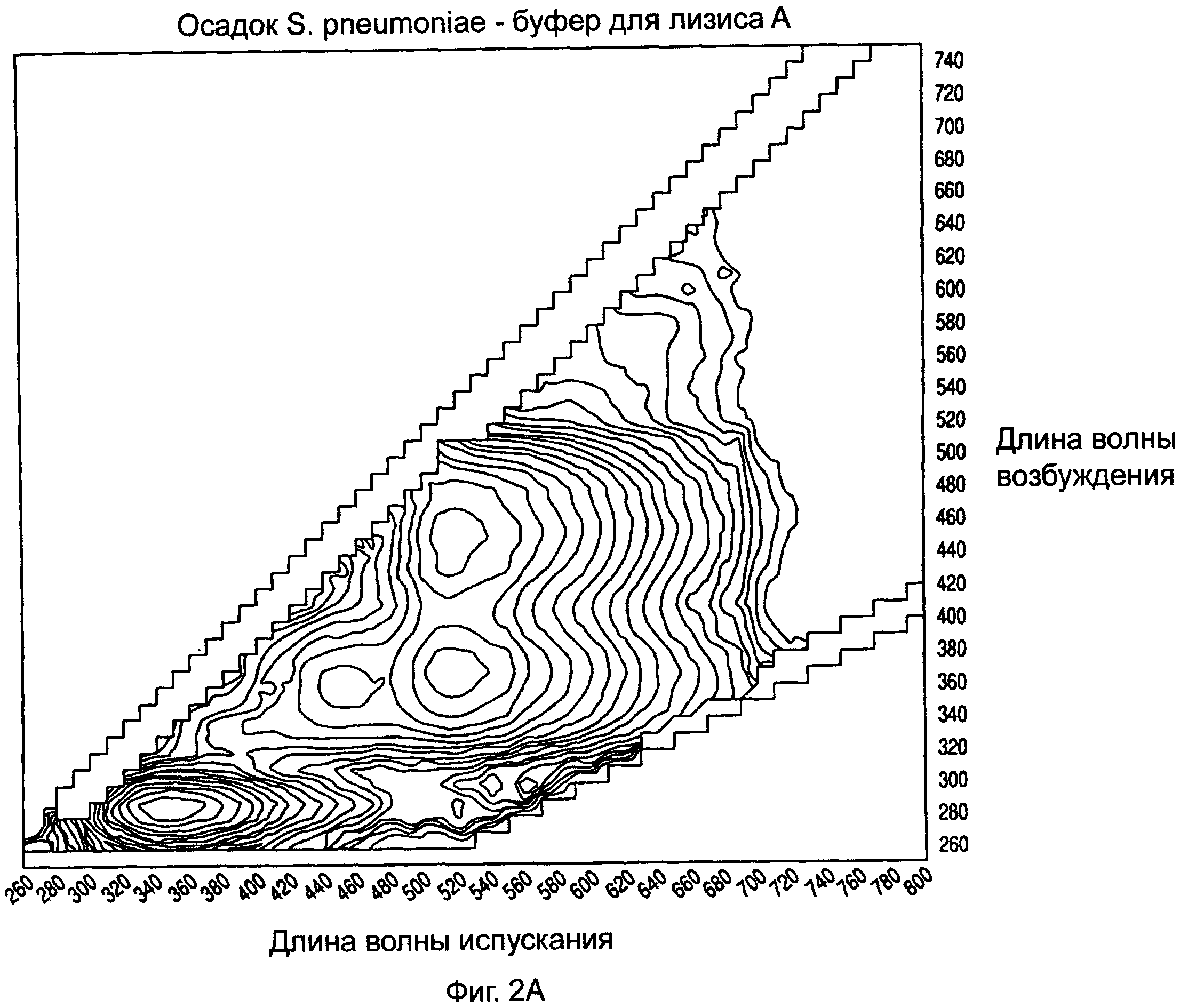
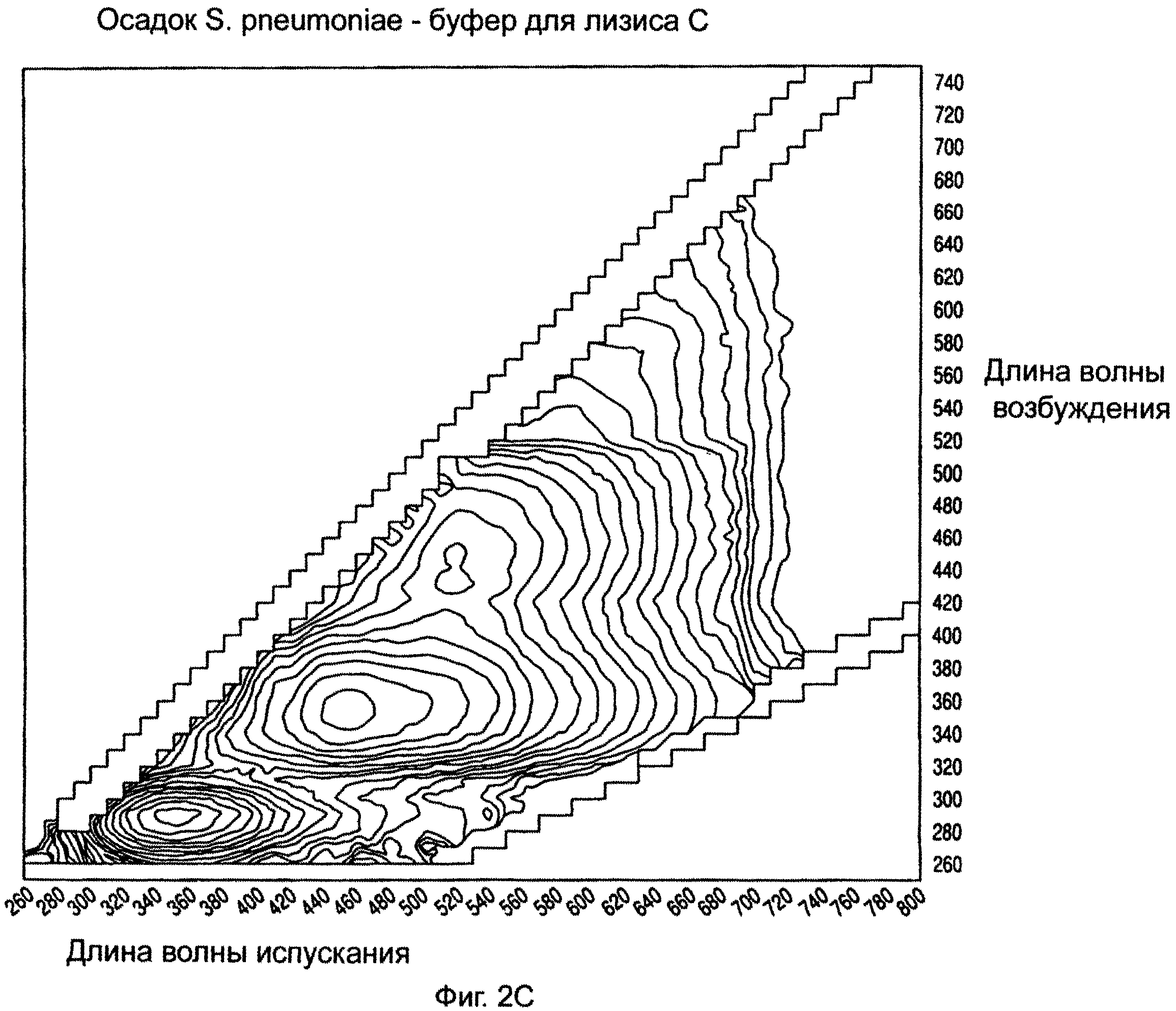
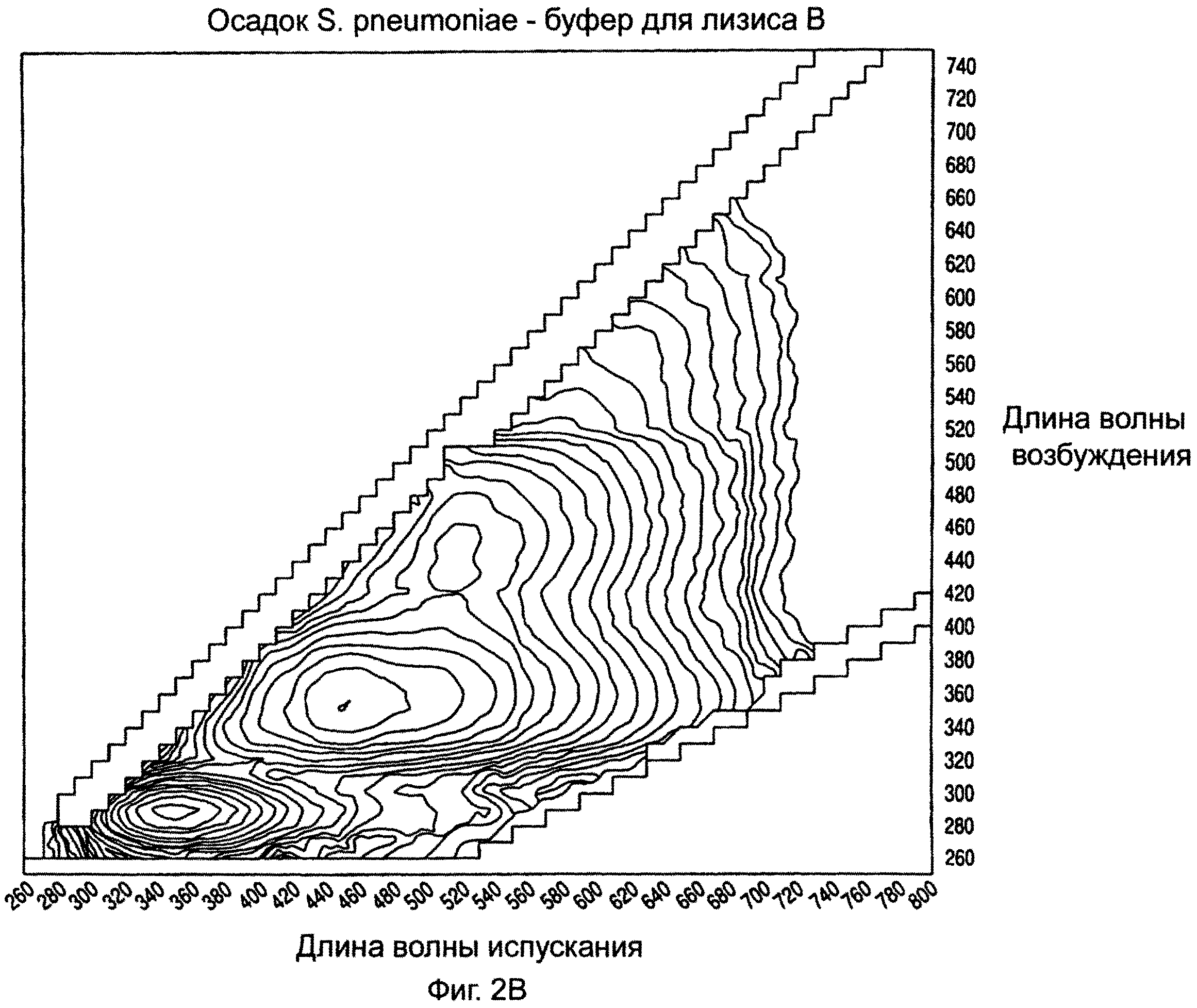
На ФИГ.2А-2С показаны примерные спектры возбуждения/испускания изолированных микроорганизмов с использованием буферов для лизиса А, В и С на стадии лизиса, предшествующей исследованию.
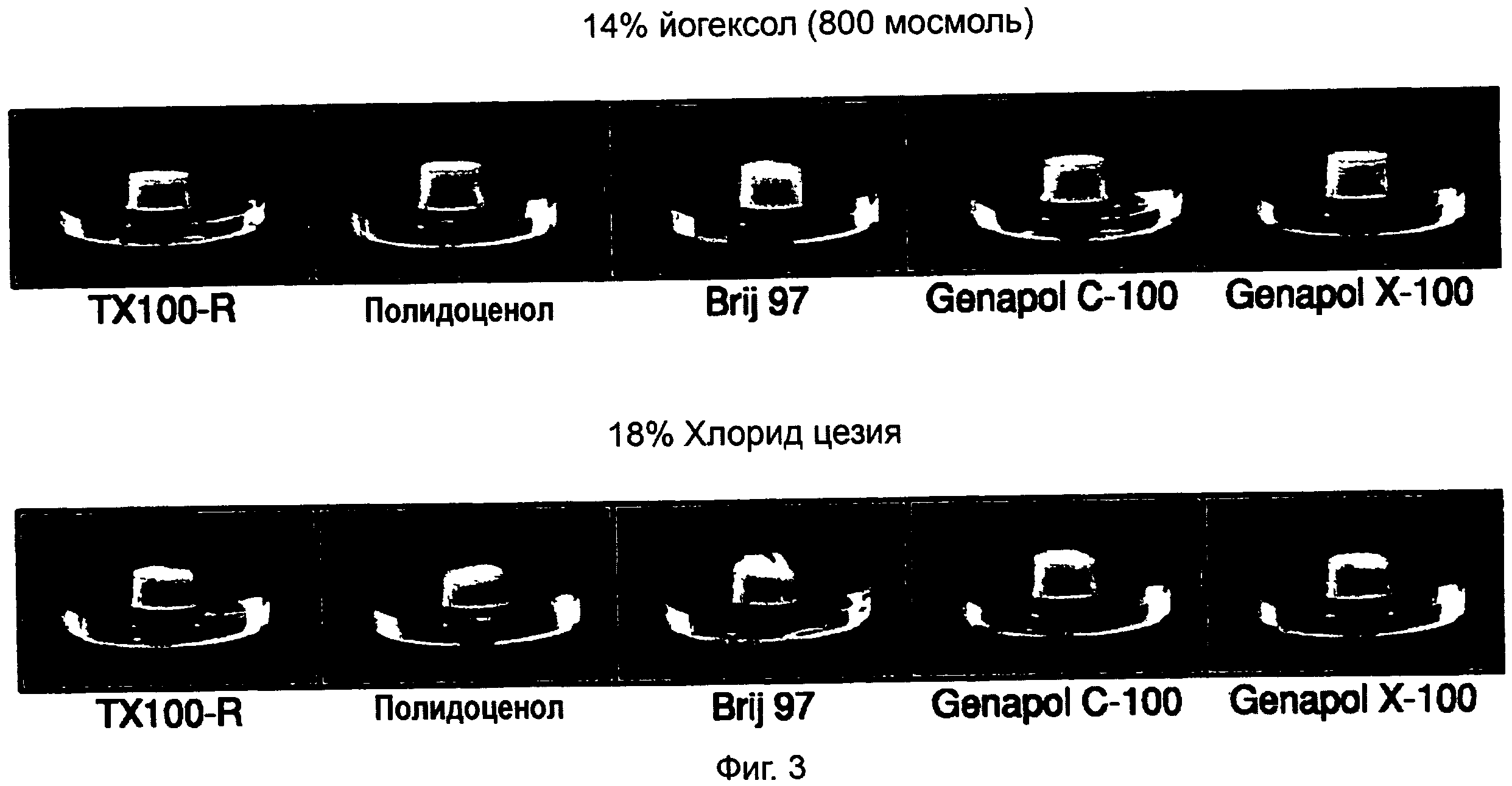
На ФИГ.3 показаны фотографии разделительных контейнеров после осуществления стадии лизиса, разделения по настоящему изобретению с использованием пяти различных буферов для лизиса и двух плотностных буферов.
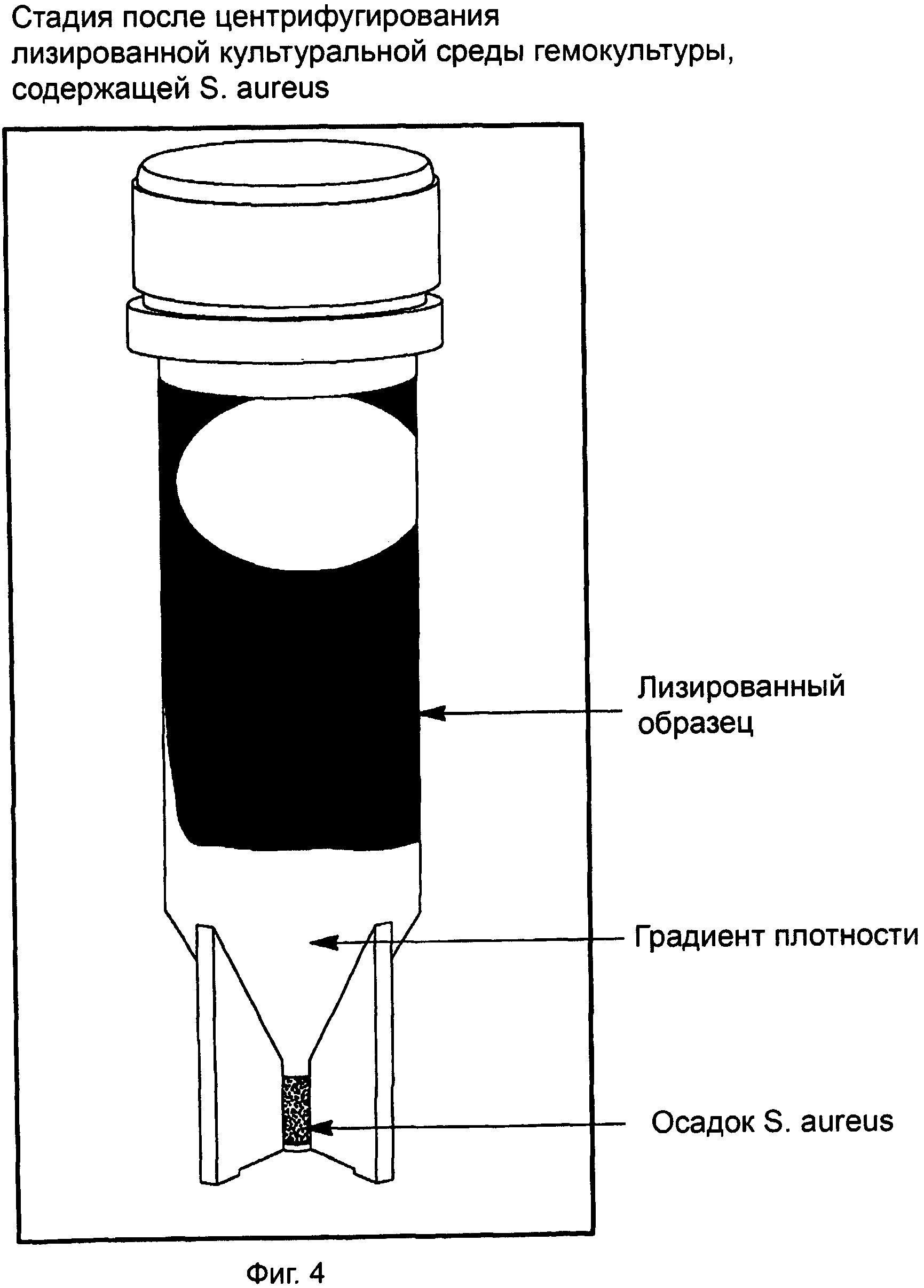
ФИГ.4 представляет собой фотографию сепаратора, показанного после центрифугирования гемокультуры, содержащей лизированную культуру микроорганизма. На фотографии четко видна лизированная культура крови, плотностный буфер и осадок микроорганизма.
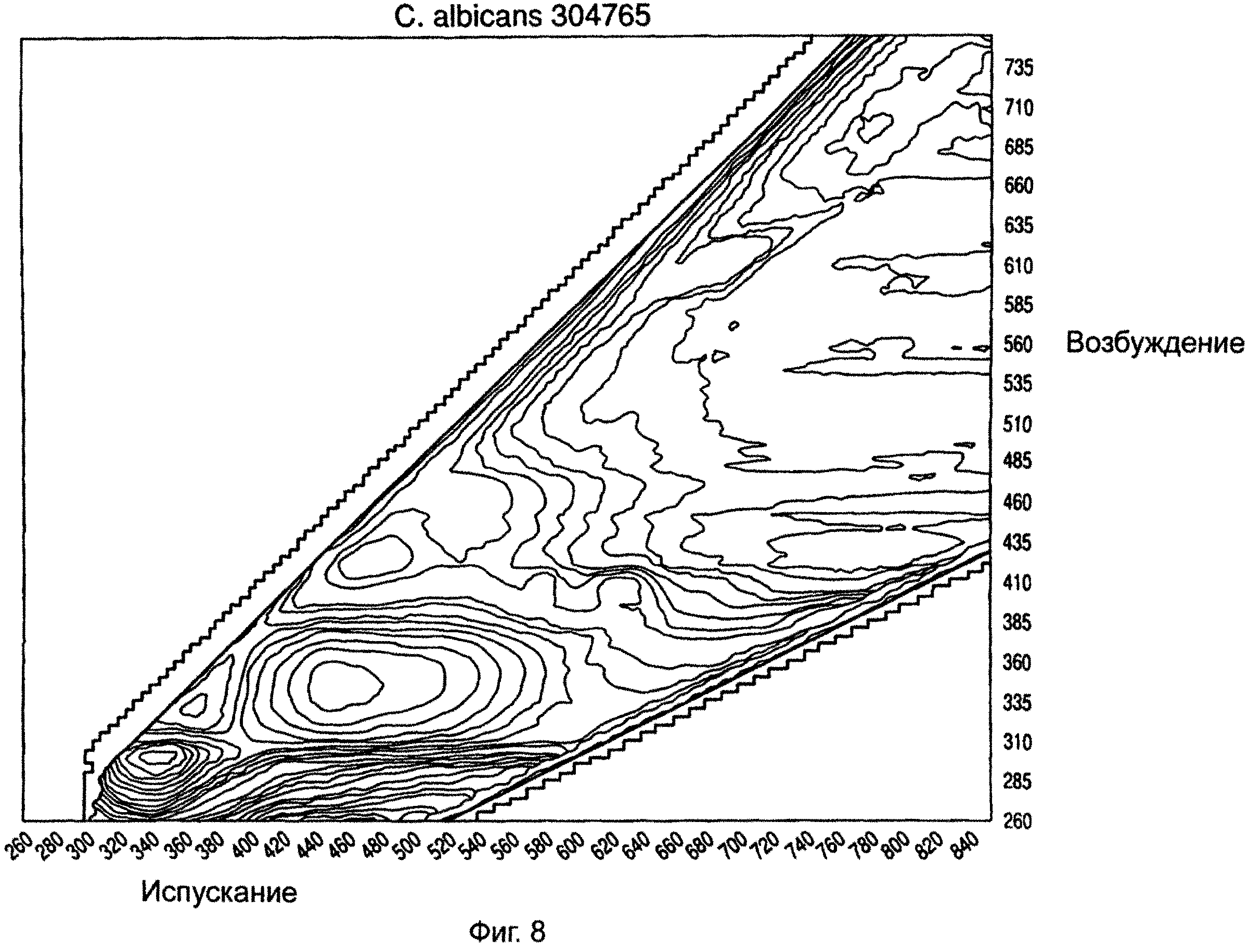
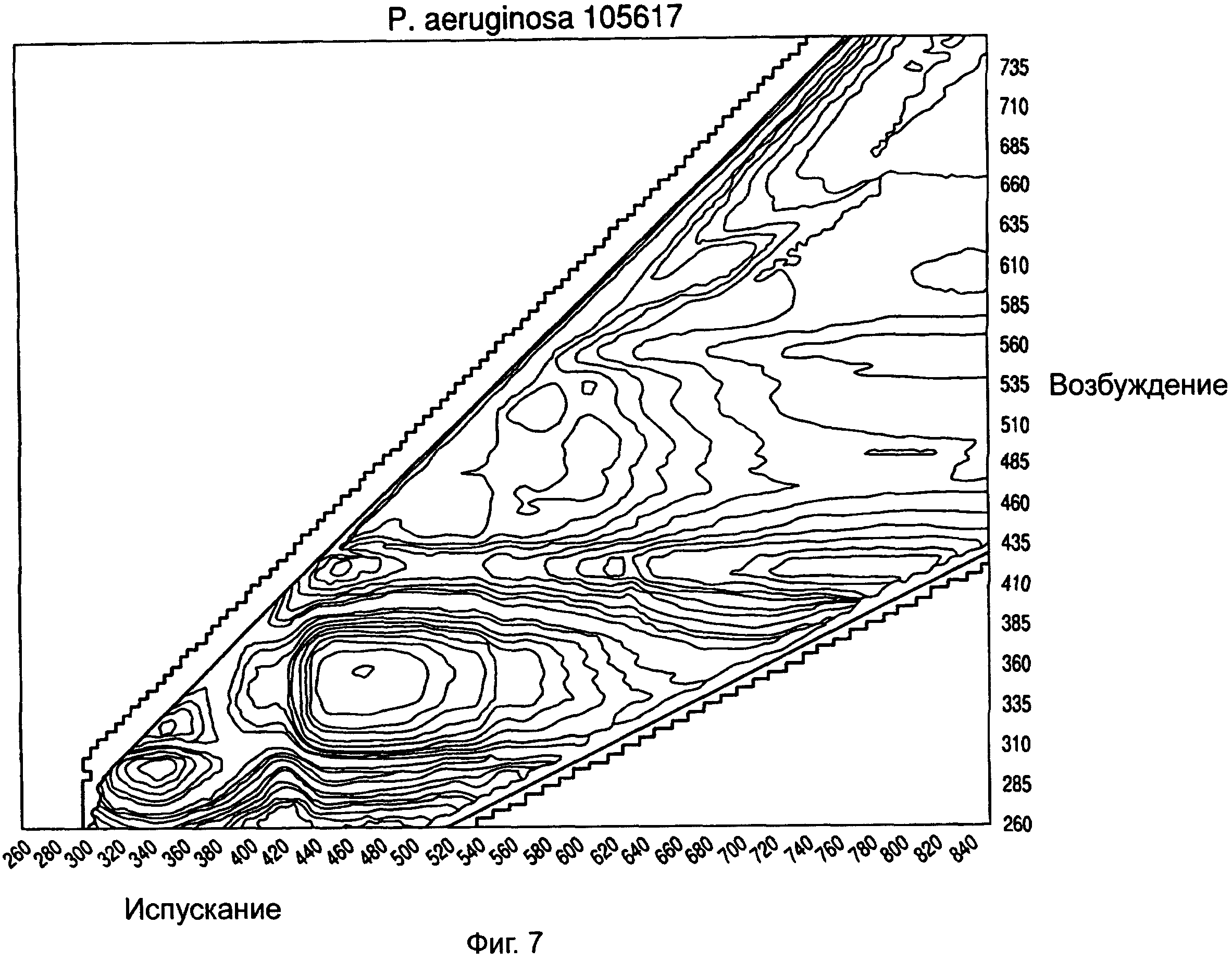
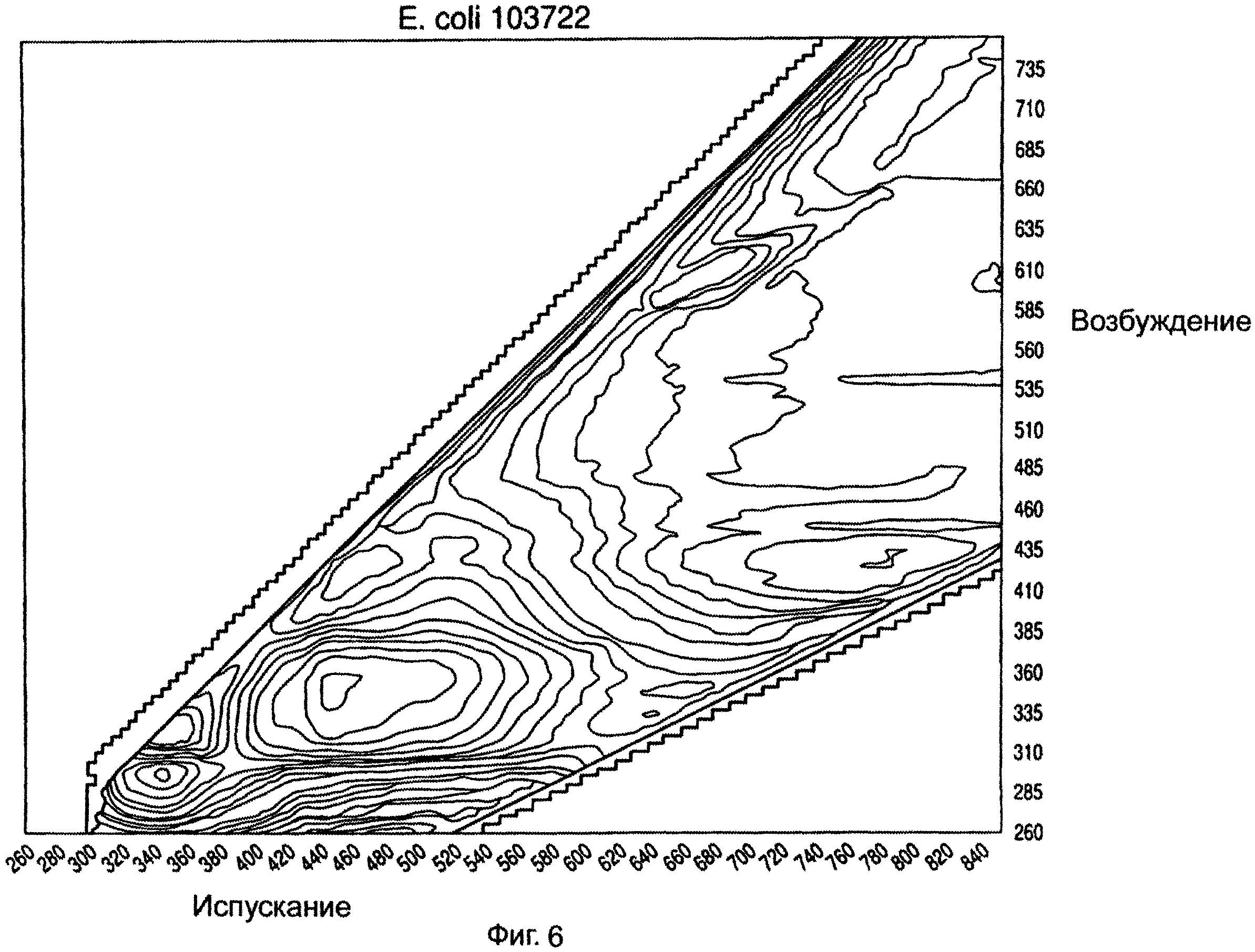
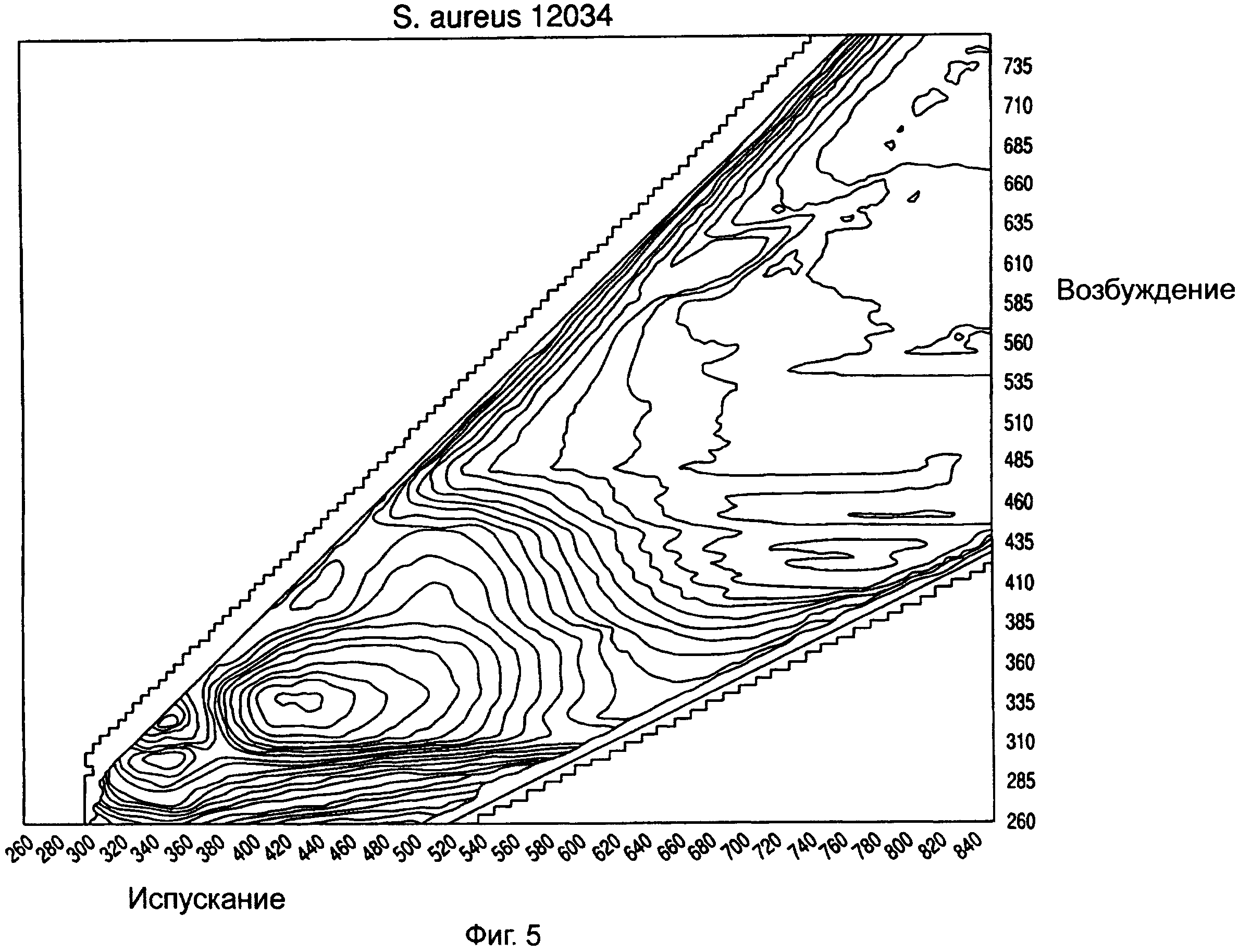
На ФИГ.5-8 показаны примеры спектров возбуждения/испускания для различных микроорганизмов, снятых в герметичном разделительном контейнере.
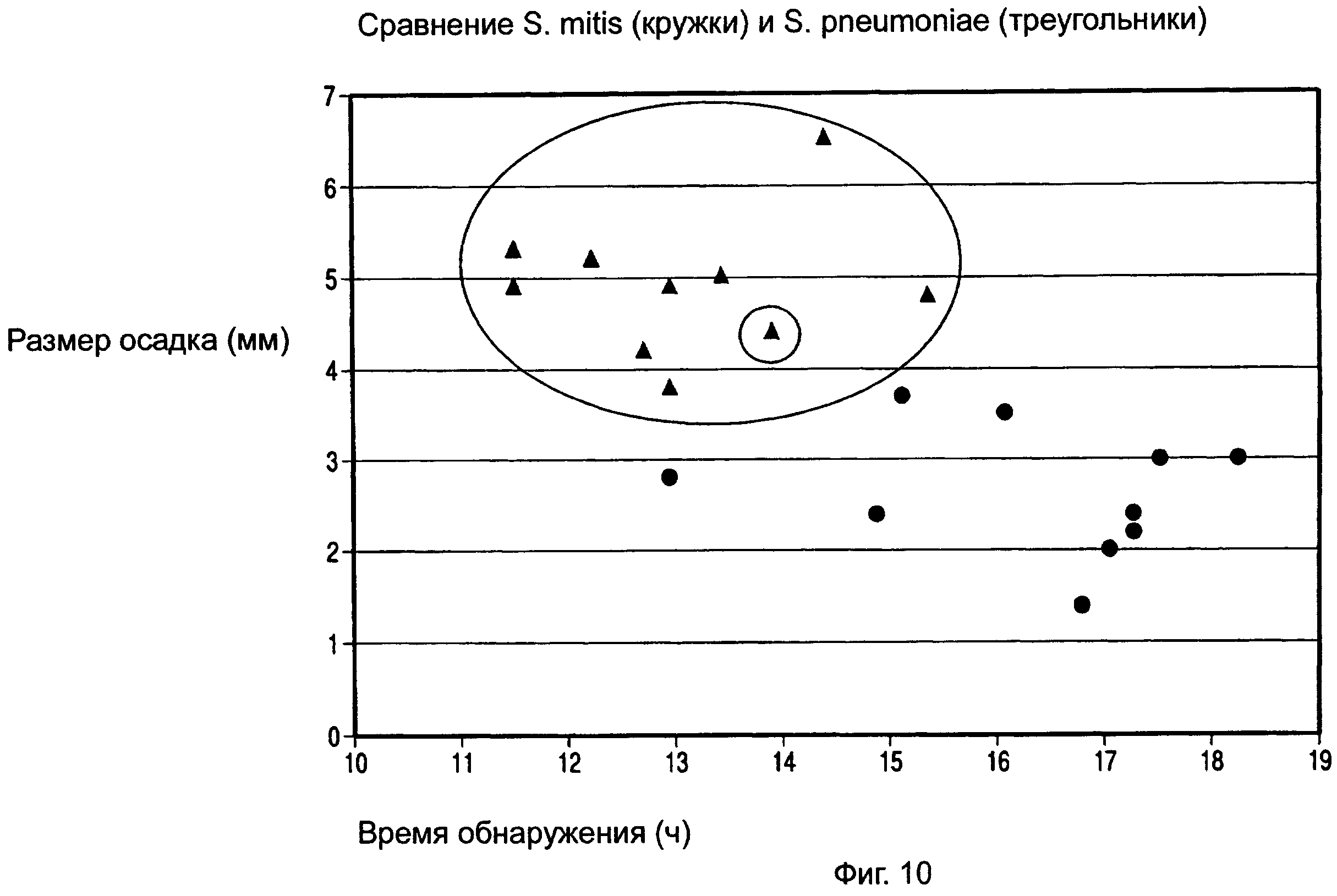
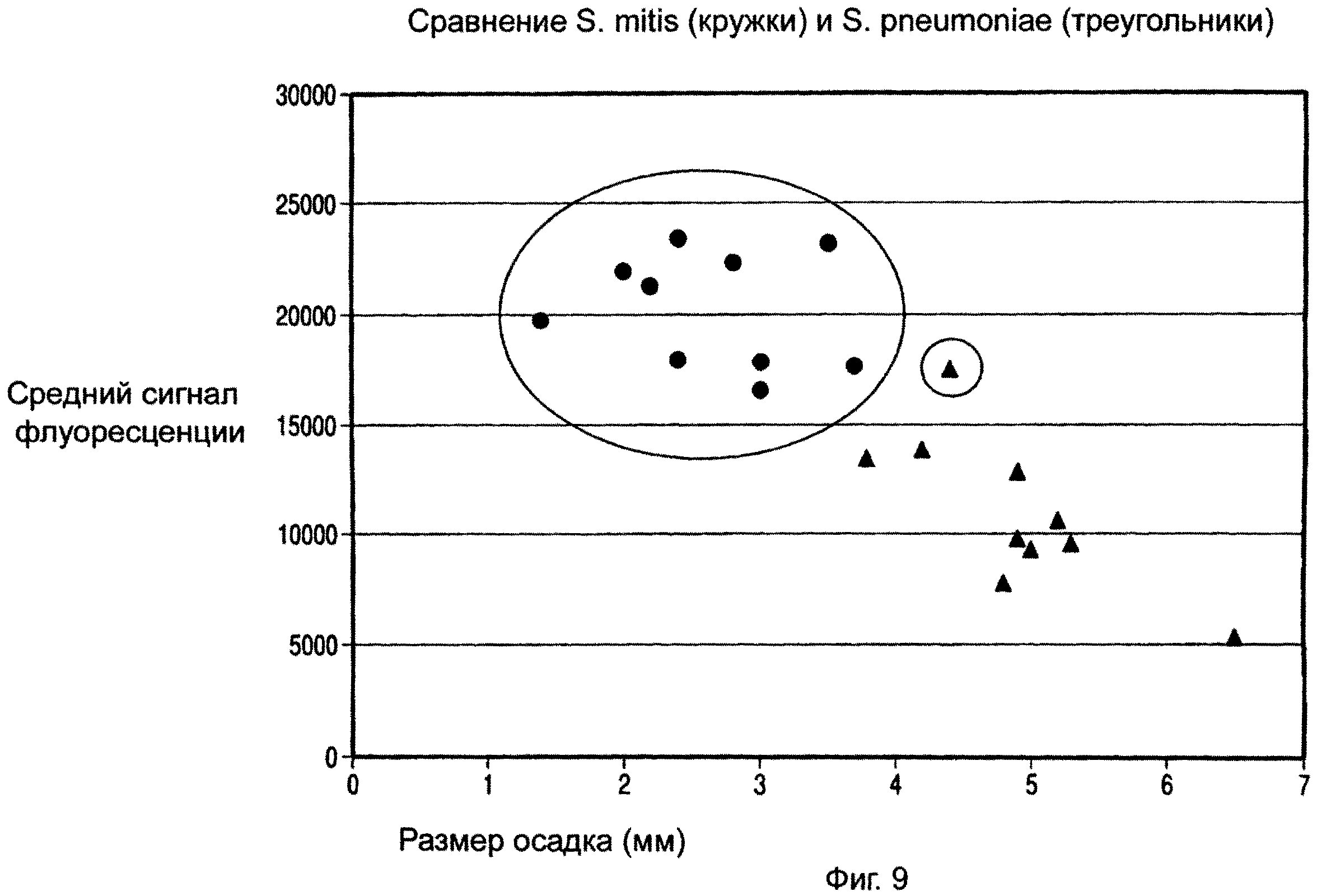
ФИГ.9 представляет собой график, показывающий средний сигнал собственной флуоресценции осадков, полученных от десяти культур S. mitis (кружки) и десяти культур S. pneumoniae (треугольники).
ФИГ.10 представляет собой график, показывающий средний размер осадка для осадков, полученных от десяти культур S. mitis (кружки) и десяти культур S. pneumoniae (треугольники).
Подробное описание изобретения
Настоящее изобретение может быть осуществлено в различных формах и не должно рассматриваться как ограниченное формами осуществления, изложенными в данной заявке. Вероятнее, эти формы осуществления представлены, чтобы данное описание было более тщательным и полным и полностью передавало объем изобретения специалистам в данной области техники. Например, признаки, проиллюстрированные в отношении одной формы осуществления, могут быть включены в другие формы осуществления, а признаки, проиллюстрированные в отношении конкретной формы осуществления, могут быть удалены из этой формы осуществления. Кроме того, различные изменения и дополнения к предложенным здесь формам осуществления, которые не отклоняются от настоящего изобретения, будут очевидны специалистам в данной области техники в свете настоящего описания.
Если не определено иное, все технические и научные термины, используемые в данной заявке, имеют то же значение, которое общепринято понимают обычные специалисты в области техники, к которой принадлежит данное изобретение. Терминология, используемая в описании изобретения в данной заявке, предназначена только для целей описания конкретных форм осуществления и не предназначена для ограничения изобретения.
Определения
Как используют в данной заявке, единственное число может означать одно или более чем одно. Например, ″клетка″ может означать единственную клетку или множество клеток.
Как используют в данной заявке, ″и/или″ также относится к любой или ко всем возможным комбинациям одного или более чем одного из сопутствующих перечисленных пунктов и включает их, а также отсутствие комбинаций при интерпретации в альтернативе (″или″).
Кроме того, термин ″примерно″, как используют в данной заявке по отношению к измеримому значению, такому как количество соединения или агента по данному изобретению, доза, время, температура и тому подобное, подразумевают как охватывающий вариации ±20%, ±10%, ±5%, ±1%, ±0,5% или даже ±0,1% указанного количества.
Как используют в данной заявке, термин ″микроорганизм″ предназначен для включения организмов, которые являются в целом одноклеточными, которые можно размножать и держать в лаборатории, включающие, но не ограниченные ими, грамположительные или грамотрицательные бактерии, дрожжи, плесневые грибы, паразиты и молликуты. Не ограничивающие примеры грамотрицательных бактерий по данному изобретению включают бактерии следующих родов:
Pseudomonas, Escherichia, Salmonella, Shigella, Enterobacter, Klebsiella, Serratia, Proteus, Campylobacter, Haemophilus, Morganella, Vibrio, Yersinia, Acinetobacter, Stenotrophomonas, Brevundimonas, Ralstonia, Achromobacter, Fusobacterium, Prevotella, Branhamella, Neisseria, Burkholderia, Citrobacter, Hafhia, Edwardsiella, Aeromonas, Moraxella, Brucella, Pasteurella, Providencia и Legionella. He ограничивающие примеры грамположительных бактерий по данному изобретению включают бактерии следующих родов: Enterococcus, Streptococcus, Staphylococcus, Bacillus, Paenibacillus, Lactobacillus, Listeria, Peptostreptococcus, Propionibacterium, Clostridium, Bacteroides, Gardnerella, Kocuria, Lactococcus, Leuconostoc, Micrococcus, Mycobacteria и Corynebacteria.
He ограничивающие примеры дрожжей и плесневых грибов по данному изобретению включают дрожжи и плесневые грибы из следующих родов: Candida, Cryptococcus, Nocardia, Penicillium, Alternaria, Rhodotorula, Aspergillus, Fusarium, Saccharomyces и Trichosporon. He ограничивающие примеры паразитов по данному изобретению включают паразиты из следующих родов: Trypanosoma, Babesia, Leishmania, Plasmodium, Wucheria, Brugia, Onchocerca и Naegleria. He ограничивающие примеры молликутов по данному изобретению включают молликуты из следующих родов: Mycoplasma и Ureaplasma.
В одной форме осуществления, как более подробно описано здесь, микроорганизмы из образца или из ростовой среды можно разделить и исследовать, чтобы охарактеризовать и/или идентифицировать микроорганизм, присутствующий в образце. Как используют в данной заявке, термин ″разделить″ подразумевают как включающий любой образец микроорганизмов, который извлечен, сконцентрирован или иначе удален из его исходного состояния или из ростовой или культуральной среды. Например, в соответствии с данным изобретением микроорганизмы могут быть отделены (например, в виде выделенного образца) от не микроорганизмов или компонентов не микроорганизмов, которые иначе могут мешать характеристике и/или идентификации. Этот термин может включать слой микроорганизмов, проложенный между двумя другими слоями, например микроорганизмы, собранные наверху градиента высокой плотности после центрифугирования, или слой микроорганизмов, собранный на твердой поверхности (например, на мембране фильтра). Этот термин может также включать коллекцию микроорганизмов, которая частично прошла через слой (например, плотностный буфер). Как таковой, выделенный образец микроорганизмов может включать любую коллекцию или слой микроорганизмов и/или их компонентов, которые являются более концентрированными, либо иначе отделенными от исходного образца, и могут находиться в диапазоне от тесно упакованного плотного комка микроорганизмов до диффузного слоя микроорганизмов. Компоненты микроорганизмов, которые могут содержаться в выделенной форме или в образце, включают без ограничения пили, флагеллы, фимбрии и капсулы в любой комбинации. Компоненты не микроорганизмов, которые отделяют от микроорганизмов, могут включать клетки не микроорганизмов (например, клетки крови и/или клетки другой ткани) и/или любые их компоненты.
Еще в одной другой форме осуществления, как более подробно описано здесь, микроорганизмы из образца или из ростовой среды могут быть изолированы и исследованы, чтобы охарактеризовать и/или идентифицировать микроорганизм, присутствующий в образце. Как используют в данной заявке, термин ″изолированный″ предназначен для включения любого образца микроорганизмов, который по меньшей мере частично очищен от его исходного состояния или от ростовой или культуральной среды и любых не микроорганизмов или компонентов не микроорганизмов, содержащихся в ней. Например, в соответствии с данным изобретением микроорганизмы могут быть изолированы (например, в виде изолированного образца) от не микроорганизмов или компонентов не микроорганизмов, которые иначе могут мешать характеристике и/или идентификации. Компоненты не микроорганизмов, которые отделяют от микроорганизмов, могут включать клетки не микроорганизмов (например, клетки крови и/или клетки другой ткани) и/или любые их компоненты.
Еще в одной другой форме осуществления, как более подробно описано здесь, микроорганизмы из образца или из ростовой среды могут быть осаждены и исследованы, чтобы охарактеризовать и/или идентифицировать микроорганизм, присутствующий в образце. Как используют в данной заявке, термин ″осадок″ предназначен для включения любого образца микроорганизмов, который спрессован или депонирован в массе микроорганизмов. Например, микроорганизмы из образца можно спрессовать или депонировать в массе на дне пробирки центрифугированием или другими способами, известными в данной области техники. Этот термин включает коллекцию микроорганизмов (и/или их компонентов) на дне и/или стенках контейнера после центрифугирования. Компоненты микроорганизмов, которые могут содержаться в осадке, включают без ограничения пили, флагеллы, фимбрии и капсулы в любой комбинации. В соответствии с данным изобретением микроорганизмы могут быть осаждены (например, в виде по существу очищенного осадка микроорганизмов) из не микроорганизмов или компонентов не микроорганизмов, которые иначе могут мешать характеристике и/или идентификации. Компоненты не микроорганизмов, которые отделяют от микроорганизмов, могут включать клетки не микроорганизмов (например, клетки крови и/или клетки другой ткани) и/или любые их компоненты.
Как используют в данной заявке, термин ″плотностный буфер″ относится к раствору, имеющему однородную плотность по всему раствору.
В настоящем изобретении предложены способы выделения, характеристики и/или идентификации микроорганизмов в образце. Кроме того, этот способ может быть, в частности, полезен для разделения, характеристики и/или идентификации микроорганизмов из комплексных образцов, таких как культуральная среда, содержащая кровь. Быстрые способы также дают возможность для характеристики и/или идентификации микроорганизмов быстрее, чем методы предшествующего уровня техники, что приводит в результате к более быстрым диагнозам (например, у субъекта, страдающего или подозреваемого на септицемию) и характеристике/идентификации зараженных материалов (например, пищевых продуктов и фармацевтических препаратов). Стадии, вовлеченные в способы по изобретению, от получения образца до характеристики/идентификации микроорганизмов, можно осуществлять в очень короткой временной рамке с получением клинически релевантной информации, дающей основания для действий. В некоторых формах осуществления способы по изобретению можно осуществлять менее чем примерно за 120 минут, например, менее чем примерно за 110, 100, 90, 80, 70, 60, 50, 40, 30, 20, 15, 10, 5, 4, 3, 2 или 1 минуту. Огромная скорость способов по изобретению представляет усовершенствование по сравнению со способами предшествующего уровня техники. Эти способы можно применять для характеристики и/или идентификации любого микроорганизма, как описано в данной заявке. В одной форме осуществления микроорганизм представляет собой бактерию. В другой форме осуществления микроорганизм представляет собой дрожжи. В другой форме осуществления микроорганизм представляет собой плесневый гриб. В следующей форме осуществления микроорганизм представляет собой паразит. В другой форме осуществления микроорганизм представляет собой молликут. Кроме того, способы по изобретению могут быть полностью автоматизированы, уменьшая за счет этого риск обращения с инфекционными материалами и/или зараженными образцами.
В одном аспекте настоящее изобретение направлено на способ характеристики и/или идентификации микроорганизма из тестируемого образца, включающий:
(a) получение тестируемого образца, известного как содержащий, или который может содержать микроорганизмы;
(b) селективный лизис клеток не микроорганизмов в тестируемом образце с получением лизированного образца;
(c) разделение микроорганизмов и других компонентов тестируемого образца с образованием изолированного образца микроорганизмов;
(d) спектроскопическое исследование изолированных микроорганизмов с получением спектроскопических измерений данного микроорганизма; и
(e) характеристику и/или идентификацию данного микроорганизма в изолированном образце путем сравнения спектроскопических измерений со снятыми спектроскопическими измерениями или предсказанными спектроскопическими свойствами известных микроорганизмов.
В одном аспекте настоящее изобретение направлено на способ характеристики и/или идентификации микроорганизма из гемокультуры, включающий:
(a) получение образца из гемокультуры, известного как содержащий, или который может содержать микроорганизмы;
(b) селективный лизис клеток не микроорганизмов в образце с получением лизированного образца;
(c) наслаивание лизированного образца на плотностный буфер в герметичном контейнере;
(d) центрифугирование контейнера для отделения микроорганизмов от других компонентов образца и образования осадка микроорганизмов;
(e) спектроскопическое исследование изолированных микроорганизмов с получением спектроскопических измерений данного микроорганизма; и
(f) характеристику и/или идентификацию данного микроорганизма в изолированном образце путем сравнения спектроскопических измерений со снятыми спектроскопическими измерениями или предсказанными спектроскопическими свойствами известных микроорганизмов.
Еще в одном другом аспекте настоящее изобретение направлено на способ характеристики и/или идентификации микроорганизма, включающий:
(a) получение тестируемого образца, известного как содержащий, или который может содержать микроорганизмы;
(b) помещение тестируемого образца в герметичный контейнер (например, герметично закрытый контейнер);
(c) разделение in situ микроорганизмов и других компонентов тестируемого образца с образованием изолированного образца микроорганизмов из микроорганизмов в герметичном контейнере;
(d) спектроскопическое исследование изолированных микроорганизмов in situ с получением спектроскопических измерений данного микроорганизма; и
(e) характеристику и/или идентификацию данного микроорганизма в изолированном образце путем сравнения спектроскопических измерений со снятыми спектроскопическими измерениями или предсказанными спектроскопическими свойствами известных микроорганизмов.
В другой форме осуществления изобретения способы включают выделение осадка микроорганизмов, образованного во время стадии отделения, или их части из разделительного контейнера перед исследованием микроорганизмов. Например, после образования осадка жидкости можно отсосать от осадка, а осадок ресуспендировать в подходящей среде (например, в среде, в которой микроорганизмы жизнеспособны). Ресуспендированные микроорганизмы можно извлечь из разделительного контейнера. Затем микроорганизмы можно исследовать для характеристики и/или идентификации, например, в суспензии или после того, как они повторно осаждены. В других формах осуществления ресуспендированные микроорганизмы можно исследовать в разделительном контейнере, например, в суспензии или после того, как они повторно осаждены. В следующей форме осуществления микроорганизмы, выделенные из осадка, можно использовать непосредственно для дальнейшего исследования (например, рамановской спектроскопией, масс-спектроскопией) без ресуспендирования.
Образцы
Образцы, которые можно тестировать (то есть тестируемый образец) способами по изобретению, включают как клинические, так и неклинические образцы, в которых присутствие и/или рост микроорганизма существует, либо его можно подозревать, а также образцы материалов, которые обычно или время от времени тестируют на присутствие микроорганизмов. Количество используемого образца может значительно варьировать в зависимости от универсальности и/или чувствительности способа. Получение образца можно осуществить с помощью любого набора методик, известных специалистам в данной области техники, хотя одно из преимуществ настоящего изобретения состоит в том, что комплексные типы образцов, такие как, например, кровь, жидкости организма и/или другие непрозрачные вещества, можно тестировать непосредственно, используя систему небольшой обработки или без обширной обработки. В одной форме осуществления образец берут из культуры. В другой форме осуществления образец берут из микробиологической культуры (например, гемокультуры). В другой форме осуществления образец подозревают на наличие в нем микроорганизмов, либо оно известно.
Клинические образцы, которые можно тестировать, включают любой тип образца, типично тестируемого в клинических или исследовательских лабораториях, включая, но не ограничиваясь ими, кровь, сыворотку, плазму, фракции крови, суставную жидкость, мочу, семенную жидкость, слюну, фекалии, цереброспинальную жидкость, содержимое желудка, вагинальные секреции, гомогенаты тканей, пунктаты костного мозга, костные гомогенаты, мокроту, пунктаты, мазки и промывные воды мазков, другие жидкости организма и тому подобное. В другой форме осуществления клинический образец можно культивировать и использовать образец культуры.
Настоящее изобретение находит применение как в исследованиях, так и в ветеринарных и медицинских областях применения. Подходящими субъектами, от которых могут быть получены клинические образцы, обычно являются субъекты млекопитающих, но может быть и любое животное. Термин ″млекопитающее″, как используют в данной заявке, включает, но не ограничен ими, людей, приматов, не являющихся человеком, крупный рогатый скот, овец, коз, свиней, лошадей, кошек, собак, кроликов, грызунов (например, крыс или мышей) и т.д. Субъекты-люди включают новорожденных, детей, подростков, взрослых и пожилых субъектов. Субъекты, от которых могут быть получены образцы, включают без ограничения млекопитающих, птиц, рептилий, амфибий и рыб.
Неклинические образцы, которые можно тестировать, также включают вещества, охватывающие, но не ограниченные ими, пищевые продукты, напитки, фармацевтические препараты, косметические изделия, воду (например, питьевую воду, не питьевую воду и сточные воды), балласты морской воды, воздух, почву, бытовые стоки, растительный материал (например, семена, листья, стебли, корни, цветы, плоды), препараты крови (например, тромбоциты, сыворотку, плазму, фракции лейкоцитов и т.д.,), образцы донорских органов или тканей, образцы биологического оружия и тому подобное. Способ также особенно хорошо пригоден для тестирования в реальном времени для мониторинга уровней заражения, контроля процесса, контроля качества и тому подобного в промышленных условиях. В другой форме осуществления неклинический образец можно культивировать и использовать образец культуры.
В одной форме осуществления изобретения образцы получают от субъекта (например, пациента), страдающего или подозреваемого на инфекцию микроорганизмов. В одной форме осуществления субъект страдает или подозреваем на септицемию, например, бактериемию или фунгемию. Образец может представлять собой образец крови непосредственно от субъекта. Образец может быть взят из гемокультуры, выращенной из образца крови пациента, например, гемокультуры BacT/ALERT®. Образец гемокультуры может быть взят из положительной гемокультуры, например, гемокультуры, которая показывает присутствие микроорганизма. В некоторых формах осуществления образец берут из положительной гемокультуры в пределах короткого времени после того, как она оказывается положительной, например, в пределах примерно 6 часов, например, в пределах примерно 5, 4, 3 или 2 часов или в пределах примерно 60 минут, например, примерно 55, 50, 45, 40, 35, 30, 25, 20, 15, 10, 5, 4, 3, 2 или 1 минуты. В одной форме осуществления образец берут из культуры, в которой микроорганизмы находятся в log фазе роста. В другой форме осуществления образец берут из культуры, в которой микроорганизмы находятся в стационарной фазе.
Настоящее изобретение обеспечивает высокую чувствительность обнаружения, характеристики и/или идентификации микроорганизмов. Это дает возможность обнаружения, характеристики и/или идентификации без первоначальной необходимости в прохождении стадий изоляции микроорганизмов путем выращивания их на твердой или полутвердой среде и отбора выросших колоний. Таким образом, в одной форме осуществления изобретения образец не является образцом из колонии микроорганизма (например, бактерии, дрожжей или плесневого гриба), выращенной на твердой или полутвердой поверхности.
Объем образца должен быть достаточно большим, чтобы получить изолированный образец микроорганизмов или осадок микроорганизмов, который можно исследовать после осуществления стадии отделения/изоляции способов по изобретению. Соответствующие объемы будут зависеть от источника образца и предполагаемого уровня микроорганизмов в образце. Например, положительная гемокультура будет содержать более высокий уровень микроорганизмов на объем, чем образец питьевой воды, подлежащий тестированию на заражение, поэтому меньший объем среды гемокультуры может быть необходим по сравнению с образцом питьевой воды. Как правило, размер образца может составлять менее чем примерно 50 мл, например, менее чем примерно 40, 30, 20, 15, 10, 5, 4, 3 или 2 мл. В некоторых формах осуществления размер образца может составлять примерно 1 мл, например, примерно 0,75, 0,5 или 0,25 мл. В некоторых формах осуществления, в которых разделение осуществляют в микромасштабе, размер образца может составлять менее чем примерно 200 мкл, например, менее чем примерно 150, 100, 50, 25, 20, 15, 10 или 5 мкл. В некоторых формах осуществления (например, когда ожидают, что образец содержит малое число микроорганизмов), размер образца может составлять примерно 100 мл или более, например, примерно 250, 500, 750 или 1000 мл или более.
Необязательная стадия лизиса
В некоторых формах осуществления после получения образца следующая стадия в способе по настоящему изобретению состоит в селективном лизисе нежелательных клеток, которые могут присутствовать в образце, например, клеток крови и/или клеток ткани. Клетки можно подвергать лизису, чтобы дать возможность отделить микроорганизмы от других компонентов образца. Отделение микроорганизмов от других компонентов предотвращает препятствия во время стадии исследования. Если не ожидают, что клетки не микроорганизмов присутствуют в образце, или не ожидают, что они препятствуют стадии исследования, нет необходимости проводить стадию лизиса. В одной форме осуществления клетками, подлежащими лизису, являются клетки не микроорганизмов, которые присутствуют в образце, но клетки микроорганизмов, которые могут присутствовать в образце, не подвергаются лизису. Однако в некоторых формах осуществления селективный лизис определенных классов микроорганизмов может быть желателен и, следовательно, его можно осуществлять в соответствии со способами, как описанными в данной заявке, так и хорошо известными в данной области техники. Например, класс нежелательных микроорганизмов можно подвергать селективному лизису, например дрожжи подвергаются лизису, тогда как бактерии не подвергаются, или наоборот. В другой форме осуществления желательные микроорганизмы подвергают лизису с целью отделения конкретного субклеточного компонента микроорганизмов, например клеточных мембран или органелл. В одной форме осуществления все клетки не микроорганизмов подвергают лизису. В других формах осуществления часть клеток не микроорганизмов подвергают лизису, например, достаточное количество клеток, чтобы предотвратить препятствие стадии исследования, лизис клеток можно осуществлять любым способом, известным в данной области техники как эффективный для селективного лизиса клеток без лизиса или с лизисом микроорганизмов, включающим без ограничения добавление раствора для лизиса, разрушение ультразвуком, осмотический шок, химическую обработку и/или их комбинацию.
Раствор для лизиса является таким, чтобы обладать способностью к лизису клеток, например клеток не микроорганизмов (например, путем солюбилизации мембран эукариотических клеток) и/или клеток микроорганизмов. В одной форме осуществления раствор для лизиса может содержать один или более чем один детергент, один или более чем один фермент или комбинацию одного или более чем одного детергента и одного или более чем одного фермента и может, кроме того, включать дополнительные агенты. В одной форме осуществления детергент может представлять собой не денатурирующий литический детергент, такой как Тритон® Х-100, Тритон® X-100-R, Тритон® Х-114, NP-40, Genapol® C-100, Genapol® Х-100, Igepal® СА 630, Arlasolve™200, Brij® 96/97, CHAPS (3-[(3-холанидопропил)диметиламмоний]-1-пропансульфонат), октил-пара-D-глюкопиранозид, сапонин и нонаэтиленгликоля монододециловый эфир (С12Е9, полидоценол). Необязательно можно включать денатурирующие литические реагенты, такие как додецилсульфат натрия, N-лаурилсаркозин, деоксихолат натрия, желчные соли, гексадецилтриметиламмония бромид, SB3-10, SB3-12, амидосульфобетаин-14 и C7BzO. Необязательно можно также включать солюбилизаторы, такие как Brij® 98, Brij® 58, Brij® 35, Твин® 80, Твин® 20, Pluronic® L64, Pluronic® P84, не детергентные сульфобетаины (NDSB 201), амфиполы (PMAL-C8) и метил-β-циклодекстрин. Типично не денатурирующие детергенты и солюбилизаторы используют при концентрациях выше их критической концентрации мицеллообразования (ККМ), тогда как денатурирующие детергенты можно добавлять при концентрациях ниже их ККМ. Например, не денатурирующие литические детергенты можно использовать при концентрации от примерно 0,010% до примерно 10%, например, от примерно 0,015% до примерно 1,0%, например, от примерно 0,05% до примерно 0,5%, например, от примерно 0,10% до примерно 0,30% (конечная концентрация после разведения образцом). В другой форме осуществления могут быть предпочтительны детергенты, представляющие собой полиоксиэтиленовый детергент. Полиоксиэтиленовый детергент может содержать структуру C12-18/E9-10, где C12-18 обозначает длину углеродной цепи от 12 до 18 атомов углерода, а Е9-10 означает от 9 до 10 оксиэтиленовых гидрофильных концевых групп. Например, полиоксиэтиленовый детергент может быть выбран из группы, состоящей из Brij 97, Bnj 96V, Genapol® C-100, Genapol® X-100, нонаэтиленгликоля монододецилового эфира (полидоценола)или их комбинации.
Ферменты, которые можно использовать в растворах для лизиса, включают без ограничения ферменты, которые расщепляют нуклеиновые кислоты и другие вещества, загрязняющие мембрану (например, протеиназу XXIII, ДНКазу, нейраминидазу, полисахаридазу, Glucanex® и Pectinex®). Другие добавки, которые можно использовать, включают без ограничения восстанавливающие агенты, такие как 2-меркаптоэтанол (2-Ме) или дитиотрейтол (DTT), и стабилизирующие агенты, такие как магний, пируват, а также увлажнители. Раствор для лизиса может быть забуферен при любом рН, который пригоден для лизиса желаемых клеток и зависит от множества факторов, включающих без ограничения тип образца, клетки, подлежащие лизису, и используемый детергент. В некоторых формах осуществления рН может находиться в диапазоне от примерно 2 до примерно 13, например, от примерно 6 до примерно 13, например, от примерно 8 до примерно 13, например, от примерно 10 до примерно 13. Буферы с подходящим рН включают любой буфер, способный к поддержанию рН в желаемом диапазоне, например, от примерно 0,05 М до примерно 1,0 М CAPS.
В одной форме осуществления образец и раствор для лизиса смешивают, а затем инкубируют в течение достаточного времени для того, чтобы произошла солюбилизация клеточных мембран, например, в течение 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 40, 50 или 60 секунд или примерно 2, 3, 4, 5, 6, 7, 8, 9, 10, 15 или 20 минут или дольше, например, от примерно 1 секунды до примерно 20 минут, от примерно 1 секунды до примерно 5 минут или от примерно 1 секунды до примерно 2 минут. Время инкубации зависит от силы раствора для лизиса, например, от концентрации детергента и/или ферментов. Как правило, более мягкие буферы для лизиса потребуют больше времени и большего разведения образца, чтобы полностью солюбилизировать клетки не микроорганизмов. Сила раствора для лизиса может быть выбрана на основе микроорганизмов, известных или подозреваемых на нахождение в образце. Для микроорганизмов, которые более чувствительны к лизису, можно использовать мягкий раствор для лизиса. Лизис может происходить при температуре от примерно 2°С до примерно 45°С, например, от примерно 15°С до примерно 40°С, например, от примерно 30°С до примерно 40°С. В одной форме осуществления раствор для лизиса можно набрать в шприц, а затем образец можно засасывать в шприц, так чтобы смешивание и инкубация происходили в шприце.
В некоторых формах осуществления как условия лизиса (например, раствор или время инкубации), так и стадии разделения и/или исследования могут быть достаточны для уничтожения некоторых или всех микроорганизмов в образце. Способы по настоящему изобретению в высокой степени универсальны и не требуют, чтобы все микроорганизмы были живыми, чтобы происходило выделение и идентификация. В некоторых формах осуществления некоторые или все микроорганизмы могут быть мертвыми, где их гибель произошла до, во время и/или после осуществления стадий способов.
Стадия разделения
Следующей стадией в способе по настоящему изобретению (например, стадией после того, как образец лизирован, если проводят стадию лизиса) является стадия разделения. Стадию разделения можно осуществлять, чтобы разделить микроорганизмы и другие компоненты образца (например, не микроорганизмы или их компоненты) и сконцентрировать микроорганизмы в осадке, который можно исследовать в целях идентификации и характеристики. Разделение не обязательно должно быть полным, то есть не требуется, чтобы произошло 100% разделение. Требуется только то, чтобы разделение микроорганизмов и других компонентов образца было достаточным, чтобы дать возможность исследовать микроорганизмы без значительного препятствия со стороны других компонентов. Например, разделение может привести в результате к осадку микроорганизмов, который является чистым по меньшей мере на 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 96, 97, 98 или 99% или выше.
В одной форме осуществления разделение можно осуществлять посредством стадии центрифугирования, на которой образец (например, лизированный образец) помещают сверху на плотностный буфер в разделительном контейнере, и контейнер центрифугируют в условиях, которые дают возможность изолировать микроорганизмы (например, микроорганизмы могут образовать осадок на дне и/или на стенках контейнера). В соответствии с данной формой осуществления другие компоненты образца (например, не микроорганизмы или их компоненты, которые могут присутствовать в среде образца) остаются сверху на плотностном буфере или внутри верхней части плотностного буфера. Обычно для стадии разделения можно использовать любой известный контейнер. В одной форме осуществления разделительный контейнер представляет собой сепаратор. Данная стадия разделения изолирует микроорганизмы от материалов в образце, таких как среда, клеточный детрит и/или другие компоненты, которые могли бы интерферировать при исследовании микроорганизмов (например, за счет собственной флуоресценции). В одной форме осуществления плотностный буфер также служит для разделения живых микроорганизмов и мертвых микроорганизмов (которые не проходят через плотностный буфер). В другой форме осуществления плотностный буфер не содержит плотностного градиента ни до, ни после центрифугирования. Иными словами, разделительный контейнер не центрифугируют в течение достаточного количества времени и/или с достаточным ускорением для материала, образующего плотностный буфер, чтобы создать плотностной градиент.
Плотность буфера выбрана таким образом, чтобы микроорганизмы в образце проходили через этот буфер, тогда как другие компоненты образца (например, культуральная среда гемокультуры, клеточный детрит) оставались сверху на плотностном буфере или не проходили весь путь через плотностный буфер. Плотностный буфер может быть также выбран таким образом, чтобы разделить живые микроорганизмы (которые проходят через буфер) и мертвые микроорганизмы (которые не проходят через буфер). Подходящие плотности будут зависеть от материала, используемого в плотностном буфере, и от образца, подлежащего разделению. В одной форме осуществления плотность буфера находится в интервале от примерно 1,025 до примерно 1,120 г/мл, например, от примерно 1,030 до примерно 1,070 г/мл, от примерно 1,040 до примерно 1,060 г/мл или в любом интервале от примерно 1,025 до примерно 1,120 г/мл. В другой форме осуществления плотность градиента составляет примерно 1,025, 1,030, 1,035, 1,040, 1,045, 1,050, 1,055, 1,060, 1,065, 1,070, 1,075, 1,080, 1,085, 1,090, 1,095, 1,100, 1,105, 1,110, 1,115 или 1,120 г/мл.
Материал для плотностного буфера может представлять собой любой материал, который имеет соответствующий диапазон плотности для способов по данному изобретению. В одной форме осуществления этот материал представляет собой коллоидный кремнезем. Коллоидный кремнезем может быть без покрытия (например, Ludox® (W.R. Grace, CT)) или с покрытием, например силаном (например, PureSperm® (Nidacon Int′l, Швеция) или Isolate® (Irvine Scientific, Santa Ana, CA)) или поливинилпирролидоном (например, Percoll™, Percoll Plus™ (Sigma- Aldrich, St. Louis, МО)). В одной форме осуществления выбран коллоидный кремнезем, проявляющий наименьшую интерференцию при спектроскопическом исследовании, например, материал с самой низкой собственной флуоресценцией. Коллоидный кремнезем может быть разведен в любой подходящей среде с образованием соответствующей плотности, например, в сбалансированных солевых растворах, в физиологическом растворе и/или в 0,25 М сахарозе. Соответствующие плотности могут быть получены с коллоидным кремнеземом при концентрации от примерно 15% до примерно 80% об/об, например, от примерно 20% до примерно 65% об/об. Другим подходящим материалом для плотностных буферов является йодированный контрастный агент, например йогексол (Omnipaque™, NycoPrep™ или Nycodenz®) и йодиксанол (Visipaque™ или OptiPrep™). Соответствующие плотности могут быть получены с йогексолом или йодиксанолом при концентрации от примерно 10% до примерно 25% масс/об, например, от примерно 14% до примерно 18% масс/об, для образцов гемокультуры. Сахарозу можно использовать в качестве плотностного буфера при концентрации от примерно 10% до примерно 30% масс/об, например, от примерно 15% до примерно 20% масс/об, для образцов гемокультуры. Другие подходящие материалы, которые можно использовать для получения плотностного буфера, включают масла низкой вязкости, высокой плотности, такие как иммерсионное масло для микроскопа (например, Type DF; Cargille Labs, Нью-Йорк), минеральное масло (например, Drakeol®5, Draketex 50, Peneteck®; Penreco Co., Пенсильвания), силиконовое масло (полидиметилсилоксан), фторсиликоновое масло, силиконовый гель, метризоат-Фиколл® (LymphoPrep™), например, при концентрации от примерно 75% до примерно 100% для образцов гемокультуры, диатризоат-декстран (PolymorphoPrep™), например, при концентрации от примерно 25% до примерно 50% для образцов гемокультуры, карбоксиметилцеллюлозу, гидроксипропилметилцеллюлозу, полиэтиленоксид (высокой молекулярной массы), Pluronic® F127, Pluronic® F68, смеси соединений Pluronic®, полиакриловую кислоту, сшитый поливиниловый спирт, сшитый поливинилпирролидин, сополимер ПЭГ метилового эфира и метакрилата, пектин, агарозу, ксантан, геллан, Phytagel®, сорбит, Фиколл® (например, Фиколл® 400 при концентрации от примерно 10% до примерно 15% для образцов гемокультуры), глицерин, декстран (например, при концентрации от примерно 10% до примерно 15% для образцов гемокультуры), гликоген, хлорид цезия (например, при концентрации от примерно 15% до примерно 25% для образцов гемокультуры), перфторуглеродные жидкости (например, перфтор-н-октан), гидрофторуглеродные жидкости (например, Vertrel XF) и тому подобное, которые хорошо известны в данной области техники. В одной форме осуществления плотностный буфер выбран из одного или более чем одного из коллоидного кремнезема, йодиксанола, йогексола, хлорида цезия, метризоат-Фиколла®, диатризоат-декстрана, сахарозы, Фиколла® 400 и/или декстрана в любой комбинации. Плотностный буфер может также состоять из комбинации материалов, например, комбинации коллоидного кремнезема и масла. Некоторые комбинации вышеописанных соединений могут быть полезны для стадий разделения и считывания по настоящему изобретению, например, комбинации соединений с различными свойствами гашения УФ-света, такие как хлорид цезия и йогексол.
Объем/высота плотностного буфера должна быть достаточна, чтобы достичь разделения микроорганизмов от других компонентов образца. Объем будет зависеть от размера и формы разделительного контейнера. Как правило, можно использовать объем от примерно 0,1 до примерно 5 мл, например, от примерно 0,2 до примерно 1 мл, например, от примерно 0,2 мл до примерно 0,5 мл. Если разделение осуществляют в микромасштабе, объем плотностного буфера может составлять от примерно 1 мкл до примерно 100 мкл, например, от примерно 5 мкл до примерно 50 мкл. Объем образца, нанесенного или наслоенного сверху на плотностный буфер, должен быть достаточным, чтобы обеспечить достаточное количество микроорганизмов для получения осадка, пригодного для исследования. Обычно можно использовать любой объем, который входит в контейнер. Например, можно использовать объем от примерно 0,1 мл до примерно 5 мл, например, от примерно 0,2 мл до примерно 1 мл, например, от примерно 0,2 мл до примерно 0,5 мл. Если разделение осуществляют в микромасштабе, объем образца может составлять от примерно 1 мкл до примерно 100 мкл, например, от примерно 5 мкл до примерно 50 мкл. Доступное пространство в контейнере для образца будет зависеть от размера и формы контейнера. В некоторых формах осуществления сверху на плотностный буфер можно поместить промежуточный слой (жидкости или твердого вещества) перед тем, как наносить или наслаивать образец сверху, чтобы предотвратить какое-либо смешивание плотностного буфера и образца. В одной форме осуществления промежуточный слой может представлять собой полиэтиленовые гранулы. В другой форме осуществления маленький пузырек воздуха можно расположить между плотностным буфером и образцом, чтобы предотвратить смешивание. В следующей форме осуществления плотностный буфер можно наслаивать сверху на материал высокой плотности (например, перфторуглеродную жидкость), так чтобы микроорганизмы проходили через плотностный буфер во время разделения и собирались на границе между плотностным буфером и материалом высокой плотности.
В одной форме осуществления изобретения разделительный контейнер центрифугируют в колебательном роторе, так что микроорганизмы образуют осадок непосредственно на дне контейнера. Контейнер центрифугируют при достаточном ускорении и в течение достаточного времени, чтобы разделить микроорганизмы (например, образовавшийся осадок) от других компонентов образца. Ускорение центрифугирования может составлять от примерно 1000 × g до примерно 20000 × g, например, от примерно 2500 × g до примерно 15000 × g, например, от примерно 7500 × g до примерно 12500 × g и т.д. Время центрифугирования может составлять от примерно 30 секунд до примерно 30 минут, например, от примерно 1 минуты до примерно 15 минут, например, от примерно 1 минуты до примерно 5 минут. Центрифугирование можно осуществлять при температуре от примерно 2°С до примерно 45°С, например, от примерно 15°С до примерно 40°С, например, от примерно 20°С до примерно 30°С.
В одной форме осуществления разделительный контейнер содержит крышку и крышку накладывают на контейнер с образованием герметичного закрытия перед центрифугированием. Наличие крышки уменьшает риск в результате обращения с микроорганизмами, которые являются или могут быть инфекционными и/или опасными, а также риск контаминации образца. Одним из преимуществ способов по изобретению является способность осуществлять одну или более чем одну из стадий этих способов (например, лизис, разделение, исследование и/или идентификацию) с микроорганизмами в герметичном контейнере (например, в герметично закрытом контейнере). Настоящие способы, включающие использование автоматизированных систем, позволяют избежать риска для здоровья и безопасности, связанного с обращением с высоковирулентными микроорганизмами, который встречается при выделении микроорганизмов из образцов для непосредственного тестирования. В одной форме осуществления контейнер не центрифугируют в течение достаточного времени и/или не подвергают достаточному ускорению, чтобы градиент плотности образовался внутри плотностного буфера. Настоящее изобретение не включает ультрацентрифугирование образцов, например, центрифугирование при ускорениях выше, чем примерно 100000 × g. Кроме того, настоящее изобретение не включает изопикническую (равновесную) седиментацию или бэндинг.
Разделительный контейнер может представлять собой любой контейнер достаточного объема, чтобы удерживать плотностный буфер и образец. Как отмечено в данной заявке, сепаратор можно использовать в практике данного изобретения. В одной форме осуществления контейнер приспособлен или может быть приспособлен к центрифужному ротору. Объем контейнера может составлять от примерно 0,1 мл до примерно 25 мл, например, от примерно 1 мл до примерно 10 мл, например, от примерно 2 мл до примерно 8 мл. Если разделение осуществляют в микромасштабе, объем контейнера может составлять от примерно 2 мкл до примерно 100 мкл, например, от примерно 5 мкл до примерно 50 мкл.
В одной форме осуществления контейнер имеет широкий внутренний диаметр в верхней части для удержания образца и основной части плотностного буфера и более узкий внутренний диаметр в нижней части, где собирается осадок микроорганизмов. Узкая часть может иметь внутренний диаметр от примерно 0,04 (1,02 мм) до примерно 0,12 (3,05 мм) дюймов, например, от примерно 0,06 (1,52) до примерно 0,10 (2,54 мм) дюймов, например, примерно 0,08 (2,03 мм) дюймов. Широкая часть может иметь внутренний диаметр от примерно 0,32 (8,13 мм) до примерно 0,40 (10,16 мм) дюймов, например, от примерно 0,34 (8,64 мм) до примерно 0,38 (9,65 мм) дюймов, например, примерно 0,36 (9,14 мм) дюймов. Для разделений в микромасштабе внутренние диаметры могут быть даже меньше. Например, внутренний диаметр узкой части может составлять от примерно 0,001 (0,03 мм) до примерно 0,04 (1,02 мм) дюймов, например, от примерно 0,002 (0,05 мм) до примерно 0,01 (0,254 мм) дюймов. Коническая часть внутреннего диаметра может соединять верхнюю и нижнюю часть. Коническая часть может иметь угол от примерно 20 до примерно 70 градусов, например, от примерно 30 до примерно 60 градусов.
В одной форме осуществления нижняя узкая часть составляет менее половины от общей высоты контейнера, например, менее чем примерно 40%, 30%, 20% или 10% от общей высоты контейнера. Контейнер может иметь устройство для закрывания, которое присоединено или может быть снабжено резьбой для присоединения устройства для закрывания (например, крышки), так что контейнер может быть герметично закрыт во время центрифугирования. В некоторых формах осуществления контейнер сконструирован так, чтобы образец или осадок микроорганизмов можно было легко выделить, либо иначе получить или извлечь из контейнера после разделения, либо вручную, либо автоматизированным способом (так, чтобы лаборанты не подвергались воздействию содержимого контейнера). Например, контейнер может содержать отъемную часть или отделяемую часть, которая содержит осадок и которая может быть отделена от остальной части контейнера. В другой форме осуществления контейнер содержит средства для доступа к осадку после разделения, такие как одно или более чем одно отверстие или одна или более чем одна проницаемая поверхность для вставки шприца или другого дозатора или для вытягивания осадка. В одной форме осуществления контейнер может представлять собой пробирку, например центрифужную пробирку. В другой форме осуществления контейнер может представлять собой чип или плату. В одной форме осуществления контейнер представляет собой отдельно стоящий контейнер, то есть устройство для разделения одного образца. В других формах осуществления контейнер является частью устройства, которое включает два или более чем два разделительных контейнера, так что множественные образцы можно разделять одновременно. В одной форме осуществления устройство включает 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 15, 20, 25, 30, 36, 42, 48, 60, 72, 84, 96 или большее число разделительных контейнеров.
Контейнер может содержать оптическое окно, через которое можно осуществлять исследование. Оптическое окно может находиться на дне, сверху и/или на стенках контейнера. Это окно может состоять из любого материала, который является прозрачным для света (например, по меньшей мере части ближнего инфракрасного (БИК; 700 нм - 1400 нм), ультрафиолетового (УФ; 190 нм - 400 нм) и/или видимого (ВИД; 400 нм - 700 нм) светового спектра. Примеры подходящих материалов включают без ограничения акриловую смолу, метакрилат, кремнезем, кварцевое стекло, сапфир и/или циклический олефиновый сополимер (СОС). В одной форме осуществления целый контейнер изготовлен из материала оптического окна. В другой форме осуществления контейнер может быть изготовлен (например, отлит) из двух или более чем двух отдельных частей, таких как оптический УФ-ВИД-БИК прозрачный компонент для оптического окна и другой материал (например, стандартная формованная пластмасса низкой стоимости) для изготовления остальной части контейнера. В одной форме осуществления оптическое окно является достаточно тонким, чтобы давать возможность спектроскопического исследования, которое будет зависеть от материала окна. В другой форме осуществления является тонким насколько возможно, чтобы уменьшить интерференцию при спектроскопическом исследовании. Например, окно может иметь толщину менее чем примерно 0,20 (5,08 мм) дюймов, например, менее чем примерно 0,15 (3,8 мм), 0,10 (2,54 мм) или 0,05 (1,27 мм) дюймов.
В другой форме осуществления разделение осуществляют посредством стадии фильтрования, на которой образец (например, лизированный образец) помещают в устройство, оборудованное селективным фильтром или набором фильтров с размерами пор, которые задерживают микроорганизмы. Задержанные микроорганизмы можно вымыть путем осторожного пропускания подходящего буфера через фильтр. Затем вымытые микроорганизмы можно исследовать непосредственно на фильтре и/или выделить для исследования путем прямого отбора образца с поверхности фильтра или путем обратной промывки фильтра подходящим водным буфером.
Стадия исследования
Как только микроорганизмы отделены, изолированы и/или осаждены, отделенный образец, изолированный образец или осадок можно исследовать, чтобы идентифицировать и/или охарактеризовать микроорганизмы в образце или в осадке. В одной форме осуществления исследование проводят неинвазивным способом, то есть осадок исследуют, в то время как он остается в разделительном контейнере. В другой форме осуществления разделительный контейнер остается герметичным на протяжении исследования. Способность идентифицировать микроорганизмы неинвазивным способом, необязательно в сочетании с содержанием контейнера герметичным на протяжении всего процесса разделения и идентификации/характеристики, и полная или частичная автоматизация метода позволяют избежать постоянного обращения с зараженными и/или инфекционными образцами и значительно повышает безопасность всего процесса. Кроме того, способность характеризовать и/или идентифицировать микроорганизмы путем прямого исследования без дополнительной обработки образца или осадка (например, ресуспендирования, высева на чашки и выращивания колоний) значительно увеличивает скорость, с которой можно осуществить идентификацию/характеристику. В одной форме осуществления образец или осадок выделяют и/или ресуспендируют и необязательно извлекают из разделительного контейнера перед исследованием. В другой форме осуществления образец или осадок выделяют и/или ресуспендируют после исследования in situ, а затем проводят дополнительное исследование. Например, методики, такие как реакции латекс-агглютинации или автоматизированные тесты фенотипической идентификации, которые можно применять к изолированным микроорганизмам, но не к осадку микроорганизмов, можно осуществлять на выделенных и/или ресуспендированных микроорганизмах.
В некоторых формах осуществления изолированный образец или осадок можно исследовать спектроскопическим путем. В одной форме осуществления методы оптической спектроскопии можно использовать для анализа одного или более чем одного внутреннего свойства микроорганизмов, например свойства, присутствующего внутри микроорганизма, в отсутствие дополнительных агентов, таких как красители, контрастные вещества, связывающие агенты и т.д. В других формах осуществления методы оптической спектроскопии можно использовать для анализа одного или более чем одного внешнего свойства микроорганизмов, например свойства, которое может быть обнаружено только с помощью дополнительных агентов. Исследование можно проводить, используя, например, флуоресцентную спектроскопию, спектроскопию диффузного отражения, инфракрасную спектроскопию, терагерцевую спектроскопию, абсорбционную и трансмиссионную спектроскопию, рамановскую спектроскопию, включая рамановскую спектроскопию, усиленную поверхностью (SERS), рамановскую спектроскопию с пространственным смещением (SORS), рамановскую спектроскопию пропускания и/или резонансную рамановскую спектроскопию. Для усиления рамановского (SERS) и флуоресцентного сигналов микроорганизмы могут быть покрыты наночастицами золота и/или серебра перед центрифугированием, и/или внутренняя оптическая поверхность может быть предварительно покрыта коллоидами металлов определенного размера и формы (ссылки: Lakowicz, Anal. Biochem. 537:171 (2005) для флуоресценции; Efrima et al, J. Phys. Chem. B. (Letter) 102/5947 (1998) для SERS). В другой форме осуществления наночастицы присутствуют в плотностном буфере перед центрифугированием и связываются с микроорганизмами, когда микроорганизмы проходят через плотностный буфер. В других формах осуществления микроорганизмы в осадке можно исследовать, используя методы масс-спектрометрии, такие как масс-спектрометрия MALDI-TOF, масс-спектрометрия электрораспылительной ионизацией с десорбцией (DESI), газовая хромато-масс-спектрометрия, жидкостная хромато-масс-спектрометрия, масс-спектрометрия электрораспылительной ионизацией (ESI) и спектрометрия в трубке селективного потока ионов (SIFT).
В одной форме осуществления изолированный образец или осадок исследуют, когда он остается в разделительном контейнере. Контейнер можно исследовать через оптическое окно в этом контейнере. Оптическое окно может находиться на дне и/или на любой стенке или стенках и/или наверху контейнера. В одной форме осуществления разделительный контейнер подобран или может быть подобран к держателю в спектрометре в подходящем положении для исследования. Спектроскопическое исследование можно осуществлять любым методом, известным специалистам в данной области техники, который должен быть эффективен для определения и/или идентификации одного или более чем одного внутреннего или внешнего свойства микроорганизмов. Например, для идентификации микроорганизмов в осадках можно использовать флуоресценцию с фронтальной установкой (где возбуждающий и испускаемый свет входит и выходит из одной и той же оптической поверхности, и, если образец в целом является оптически толстым, возбуждающий свет проникает в образец на очень короткое расстояние (см., например, Eisinger, J., and J. Flores, ″Front-face fluorometry of liquid samples,″ Anal. Biochem. 94:15 (1983)).
В настоящем изобретении можно также использовать другие формы измерения, такие как эпифлуоресценция, измерения отражения, поглощения и/или рассеяния. В другой форме осуществления, как описано в данной заявке, изолированный образец или осадок можно извлечь для исследования (например, изолированный образец или осадок можно извлечь и подготовить для исследования с помощью масс-спектрометрии, как хорошо известно в данной области техники). В следующих формах осуществления изолированный образец или осадок можно исследовать с использованием более чем одного способа. Например, изолированный образец или осадок можно исследовать с использованием флуоресцентной спектроскопии и рамановской спектроскопии. В соответствии с данной формой осуществления эти стадии исследования можно проводить последовательно или одновременно.
Источник освещения образца или источник возбуждения может быть выбран из любого числа подходящих источников света, как известно специалистам в данной области техники. Можно использовать любую часть электромагнитного спектра, которая дает применимые данные. Источники света, способные к испусканию в ультрафиолетовом, видимом и/или ближнем инфракрасном спектре, а также в других частях электромагнитного спектра, могут быть использованы и известны специалистам в данной области техники. Например, источники света могут представлять собой континуальные лампы, такие как дейтериевая или ксеноновая дуговая лампа для генерирования ультрафиолетового света и/или галогенная лампа накаливания с вольфрамовой нитью для генерирования видимого/ближнего инфракрасного возбуждения. Эти источники света дают широкий диапазон испускания, и ширина спектральной полосы для конкретных длин волн может быть уменьшена с использованием поляризационно-интерференционных светофильтров, призм и/или оптических решеток, как хорошо известно в данной области техники.
Альтернативно множество узкополосных источников света, таких как светодиоды и/или лазеры, могут быть мультиплексированы в пространстве и/или во времени, чтобы обеспечить мультиволновой источник возбуждения. Например, доступны светодиоды от 240 нм до более 900 нм, и эти источники имеют ширину спектральной полосы 20-40 нм (полная ширина при половине максимума). Лазеры доступны в дискретных длинах волн от ультрафиолетовых до ближних инфракрасных и могут быть использованы с помощью способов мультиплексирования, хорошо известных специалистам в данной области техники.
Спектральную селективность любого из источников света можно улучшить путем использования средств спектрального выделения, таких как монохроматор со сканированием. Можно использовать другие способы выделения, которые известны специалистам в данной области техники, такие как акустико-оптический настраиваемый фильтр, жидкокристаллический настраиваемый фильтр, ряд поляризационно-интерференционных светофильтров, спектрограф с призмой и т.д., а также в любой комбинации. Соображения при выборе спектрального дискриминатора учитывают как диапазон регулируемости, так и уровень селективности. Для иллюстрации, например, дискриминатор может использовать диапазон длин волн 300-800 нм с селективностью 10 нм. Эти параметры, как правило, определяют оптимальный метод, необходимый для достижения диапазона регулируемости, а также селективности.
Типично источник света приводит в результате к возбуждению образца с последующим измерением испускания флуоресценции образца в предопределенные моменты времени или непрерывно. Подобным образом, отраженный свет от взаимодействия источника возбуждения с образцом можно измерить для получения требуемых данных для определения и/или характеристики.
Испускание от образца можно измерить любыми подходящими средствами спектральной дискриминации, наиболее предпочтительно используя спектрометр. Спектрометр может представлять собой монохроматор со сканированием, который определяет специфичные длины волн испускания, где выход монохроматора определяется фотоэлектронным умножителем, и/или спектрометр может иметь конфигурацию в виде спектрографа визуализации, где выход определяется матрицей детекторов визуализации, такой как матрица детекторов с зарядовой связью (ПЗС-матрица). В одной форме осуществления дискриминатор дает возможность наблюдения сигнала флуоресценции и/или рассеяния с помощью средств фотодетектирования (таких как фотоэлектронный умножитель, лавинный фотодиод, ПЗС-матрица детекторов и/или электронная умножительная матрица детекторов с зарядовой связью (ЭУПЗС)).
Спектроскопический метод используют для получения измерений, которые предпочтительно получают в виде матрицы измерений возбуждения-испускания (МВИ). Как используют в данной заявке, МВИ определяют как интенсивность люминесцентного спектрального испускания флуоресцентных веществ в зависимости от длины волны как возбуждения, так и испускания, и она включает полный спектр или его подгруппу, где подгруппа может содержать единственную или множественные пары возбуждения/испускания. Кроме того, поперечный срез МВИ с фиксированной длиной волны возбуждения можно использовать, чтобы показать спектры испускания для конкретной длины волны возбуждения, а поперечный срез МВИ с фиксированной длиной волны испускания можно использовать, чтобы показать спектры возбуждения для образца. В одной форме осуществления множественные МВИ измеряют более чем при одной специфичной паре длин волн возбуждения-испускания, например, по меньшей мере при 2, 3, 4, 5, 6, 7, 8, 9, 10 или при большем числе специфичных пар длин волн возбуждения-испускания.
В соответствии с одной формой осуществления изобретения обнаружено, что флуоресцентная спектроскопия с фронтальной установкой обеспечивает преимущество при измерении свойств флуоресценции и/или отражения высоко рассеивающих и высоко гасящих образцов. В одной форме осуществления способ с фронтальной установкой может быть особенно полезным. Например, флуоресценция с фронтальной установкой может быть особенно полезной в высоко поглощающих образцах, поскольку нет необходимости в прохождении пучка возбуждения и испускания через массу образца, и, таким образом, он может подвергаться меньшему влиянию со стороны интерферирующих компонентов, которые могут содержаться в нем (например, клеток крови и микробиологических культуральных сред). Оптическая поверхность контейнера может быть освещена под таким углом, чтобы обеспечить приемлемые результаты, как известно специалистам в данной области техники (например, Eisinger, J., and J. Flores, ″Front-face fluorometry of liquid samples,″ Anal. Biochem. 94:15-21 (1983)). В одной форме осуществления эта система сконструирована таким образом, что спектроскопическая система измеряет диффузно отраженный свет минимум при одном фиксированном угле в дополнение к измерению испускаемой флуоресценции минимум при одном фиксированном угле.
В соответствии с изобретением контрольные измерения снимают с известных микроорганизмов, что, таким образом, дает возможность корреляции измеренных тестируемых данных с характеристикой интересующих микроорганизмов, используя различные математические методы, известные специалистам в данной области техники. Например, данные от образцов можно сравнивать с базовым уровнем или с контрольными измерениями, используя системы программного обеспечения, известные специалистам в данной области техники. Более конкретно данные можно анализировать с помощью ряда методов многовариантного анализа, такого как, например, общий дискриминационный анализ (GDA), частичный дискриминационный анализ наименьших квадратов (PLSDA), частичная регрессия наименьших квадратов, анализ главных компонентов (РСА), параллельный факторный анализ (PARAFAC), анализ нейронных сетей (NNA) и/или метод опорных векторов (SVM). Эти методы можно использовать, чтобы классифицировать неизвестные, представляющие интерес микроорганизмы на релевантные группы на основе существующей номенклатуры и/или на встречающиеся в природе группы на основе метаболизма, патогенности и/или вирулентности организма, при разработке системы мониторинга, определения и/или характеристики организма, как описано выше.
Еще в одной другой форме осуществления не спектроскопические измерения системой определения, такие как периоды времени определения и скорости роста, можно использовать, чтобы способствовать характеристике и/или идентификации микроорганизмов из изолированного образца или осадка. Кроме того, измерения, снятые с фотографического изображения нижней части сепаратора, могут обеспечить ценную информацию по идентичности изолята, такую как размер, форма, цвет и плотность осадка.
В некоторых формах осуществления изобретения характеристика и/или идентификация микроорганизмов в изолированном образце или осадке необязательно включает идентификацию точного вида. Характеристика охватывает как широкую категоризацию или классификацию биологических частиц, так и действительную идентификацию отдельного вида. Классификация микроорганизма из изолированного образца или осадка может включать определение фенотипических и/или морфологических характеристик микроорганизма. Например, характеристика биологических частиц может быть выполнена на основании наблюдаемых различий, таких как состав, форма, размер, кластеризация и/или метаболизм. В некоторых формах осуществления классификация интересующих биологических частиц может не требовать предшествующих знаний характеристик данной биологической частицы, но требует только соответствующих корреляций с эмпирическими измерениями, что, таким образом, делает этот способ более универсальным и легко приспосабливаемым, чем способы, основанные на событиях специфичного связывания или метаболических реакциях. Как используют в данной заявке, ″идентификация″ означает определение, к какому семейству, роду, виду и/или штамму принадлежит ранее неизвестный микроорганизм, например, идентификацию ранее неизвестного микроорганизма на уровне семейства, рода, вида и/или штамма.
В некоторых случаях характеристика охватывает модели классификации, которые обеспечивают достаточно полезную информацию для действия, которое нужно предпринять. Как используют в данной заявке, предпочтительные модели классификации включают группировку в одно или более чем одно из приведенного ниже: (1) группы по Граму; (2) клинические группы по Граму; (3) терапевтические группы; (4) функциональные группы и (5) группы собственной естественной флуоресценции.
(1) Группы по Граму: В пределах классификации групп по Граму микроорганизмы могут быть помещены в одну из трех широких категорий классификации на основе их реакции окрашивания по Граму и общего размера, где эти группы выбраны из одной или более чем одной из приведенных ниже: (а) грамположительные микроорганизмы, которые окрашиваются в темно-синий цвет при окрашивании по Граму; (б) грамотрицательные микроорганизмы, которые окрашиваются в красный цвет при окрашивании по Граму; и (в) дрожжевые клетки, которые окрашиваются в темно-синий цвет при окрашивании по Граму, но представляют собой очень большие округлые клетки, которые отличаются от бактерий по их морфологическим характеристикам и размеру.
(2) Клинические группы по Граму: Группы по Граму можно дополнительно разделить на несколько подкатегорий, представляющих различающиеся морфологические признаки. Эти подкатегории включают всю релевантную клиническую информацию, сообщаемую квалифицированным клиническим лаборантом, и, таким образом, дают более высокий уровень идентификации, чем положительная или отрицательная реакция по Граму. Эта конкретная классификация очень полезна, поскольку она исключает проблемы, основанные на качестве штамма по Граму и/или на уровне квалификации лаборанта, исследующего мазок, за счет предоставления эквивалентной клинически релевантной информации автоматизированной системой. Более конкретно подкатегории микроорганизмов, основанные на этой модели классификации, могут быть выбраны из одной или более чем одной из приведенных ниже: (а) кокки, которые представляют собой маленькие округлые клетки; (б) диплококки, которые представляют собой две маленькие округлые клетки, соединенные вместе; (в) палочки, которые имеют прямоугольную форму; и (г) бациллы, которые имеют палочковидную форму. Примеры этих подкатегорий, которые могут быть подтверждены дополнительной морфологической информацией, включают: (i) грамположительные кокки; (ii) грамположительные кокки в цепочках; (iii) грамположительные кокки в кластерах (то есть кластеров в форме ″виноградной грозди″); (iv) грамположительные диплококки; (v) грамположительные палочки; (vi) грамположительные палочки с эндоспорами; (vii) грамотрицательные палочки; (viii) грамотрицательные коккобациллы; (ix) грамотрицательные диплококки; (х) дрожжи и (xi) мицелиальные грибы.
(3) Терапевтические группы: терапевтические группы включают множество видов микроорганизмов, которые при выделении из конкретных типов образцов лечат одним и тем же классом антибиотиков или смесью антибиотиков (например, как описано в ″Sanford Guide to Antimicrobial Therapy 2008″). Во многих случаях идентичность на видовом уровне не требуется врачу, чтобы обеспечить переход от первоначальной эмпирической терапии к более направленной терапии, поскольку более чем один вид можно лечить одним и тем же антибиотиком(ами) выбора. Этот уровень классификации корректно помещает эти микроорганизмы ″одного и того же лечения″ в единые терапевтические категории. Примеры данного уровня характеристики включают способность отличать высоко резистентные виды Enterobacteriacae (ЕВ) от чувствительных видов ЕВ (Enterobacter spp. от Е. coli) или резистентные к флуконазолу виды Candida (С. glabrata и С. kruzei) от чувствительных видов Candida (С. albicans и С. parapsilosis) и т.д.
(4) Функциональные группы: В соответствии с изобретением микроорганизмы могут быть также помещены в несколько групп на основе сочетания метаболических, вирулентных и/или фенотипических характеристик. Не ферментативные организмы можно четко отличить от ферментативных. Кроме того, виды микроорганизмов, которые продуцируют гемолизины, можно группировать отдельно от не гемолитических видов. В некоторых случаях эти группы представляют более широкие категории, чем уровень рода (например, бактерии группы кишечной палочки, грамотрицательные не ферментативные палочки), в некоторых случаях на уровне рода (например, Enterococcus, Candida) и в некоторых случаях ближе к дискриминации видового уровня (например, коагулаза-отрицательные стафилококки, альфа-гемолитические стрептококки, бета-гемолитические стрептококки, коагулаза-положительные стафилококки, то есть S. aureus).
(5) Группы собственной естественной Флуоресценции (″IF″): Микроорганизмы могут быть также помещены в категории на основе тенденции к их естественной группировки вместе на основе характеристик их собственной и/или внутренней флуоресценции. Некоторые из этих групп могут быть общими с категориями терапевтических и функциональных групп. Эти группировки могут включать дополнительные виды, такие как Е. faecalis, S. pyogenes или Р. aeruginosa, которые обладают характеристическими IF признаками и/или могут содержать небольшие группы организмов с относительно консервативными IF признаками, такие как группы К. pneumoniae-K. oxytoca или E. aerogenes-E. cloacae.
В дополнение к измерению внутренних свойств микроорганизмов (таких как собственная флуоресценция) в целях идентификации способы по настоящему изобретению могут дополнительно включать использование дополнительных идентифицирующих агентов, чтобы способствовать процессу разделения и/или идентификации. Агенты, которые связываются со специфичными микроорганизмами, такие как аффинные лиганды, можно использовать для разделения микроорганизмов, для идентификации класса или вида микроорганизма (например, посредством связывания с уникальным поверхностным белком или рецептором) и/или для идентификации характеристики микроорганизма (например, устойчивости к антибиотикам). Полезные идентифицирующие агенты включают без ограничения моноклональные и поликлональные антитела и их фрагменты (например, анти-Еар для идентификации S. aureus), нуклеиново-кислотные зонды, антибиотики (например, пенициллин, ванкомицин, полимиксин В), аптамеры, пептидные миметики, связывающие белки фагового происхождения, пектины, биомаркеры врожденного иммунитета хозяина (белки острой фазы, LPS-связывающий белок, CD 14, маннозосвязывающий лектин, Toll-подобные рецепторы), белки иммунной защиты (например, дефензины, кателицидины, протеогрины, магаинины), бактериоцины (например, лантибиотики, такие как низин, мерсацидин, эпидермин, галлидермин и плантарицин С, и пептиды класса II), бактериофаги и красители, избирательные для нуклеиновых кислот, липидов, углеводов, полисахаридов, капсул/слизи или белков, или любую их комбинацию. Если сам агент не дает обнаружимого сигнала, этот агент может быть меченым, чтобы давать обнаружимый сигнал, например, путем конъюгации агента с маркером (например, видимым или флуоресцентным). Маркеры включают без ограничения флуоресцентные, люминесцентные, фосфоресцирующие, радиоактивные и/или колориметрические соединения. Агент можно добавлять к микроорганизмам на любой стадии в способах по изобретению, например, когда получают образец, во время лизиса и/или во время разделения. В некоторых формах осуществления присутствие агента в осадке можно определить во время исследования осадка. Другие полезные идентифицирующие агенты включают субстраты для ферментов микроорганизмов, хелатирующие агенты, фотосенсибилизирующий агент, гасящий агент, восстанавливающий агент, окисляющий агент, буфер, кислоту, основание, растворитель, фиксатор, детергенты, сурфактанты, дезинфицирующие агенты (например, спирты, гипохлорит натрия, пероксид водорода) и токсичные соединения (например, азид натрия, цианид калия) и ингибиторы метаболизма, такие как циклогексамид и т.д. Подобным образом, многие флуоресцентные соединения для измерения жизнеспособности клеток микроорганизмов, метаболизма и/или мембранного потенциала можно использовать в качестве идентифицирующего агента в настоящем изобретении. Как должно быть легко понятно специалистам в данной области техники, чувствительность конкретного микроорганизма к какому-либо соединению, влияющему на его физическое состояние или метаболизм, такому как антибиотик, можно легко выявить путем добавления этого соединения в образец, буфер для лизиса, плотностный буфер или любую их смесь.
В одном аспекте изобретения способ может дополнительно включать стадию выделения осадка микроорганизмов и проведения дополнительных тестов. В одной форме осуществления осадок можно выделить путем отсасывания среды образца и плотностного буфера. В другой форме осуществления осадок можно выделить путем вставки шприца в контейнер и отсасывания осадка, в то время как среда образца и плотностный буфер остаются интактными. Затем выделенный осадок можно ресуспендировать в подходящей среде, например в физиологическом растворе. Как только микроорганизмы ресуспендированы, их можно подвергать любым дополнительным тестам, которые желательны, как должно быть известно специалистам в данной области техники и как описано выше. В частности, можно проводить любой тест, для которого требуются чистые образцы микроорганизмов, с ресуспендированными микроорганизмами. В некоторых формах осуществления можно проводить дополнительные тесты идентификации. Примеры тестов идентификации включают Vitek® 2, тесты амплифицированных и не амплифицированных нуклеиновых кислот (NAT), хромогенные анализы и реакции латекс-агглютинации, иммунологические анализы (например, использование меченых антител и/или других лигандов), масс-спектрометрию (например, MALDI-TOF масс-спектрометрию) и/или другие оптические методы, такие как инфракрасная спектроскопия (FTIR) или рамановская спектроскопия. Можно также проводить дополнительные тесты характеристики, такие как устойчивость к антибиотикам и/или другим лекарствам. Дополнительная характеристика может составлять часть теста, который был начат во время первоначальных стадий разделения и идентификации способа. Например, определение устойчивого к метициллину S. aureus можно начать путем добавления к образцу пенициллина, меченного флуоресцентной меткой, перед разделением микроорганизмов. Как только осадок выделен и ресуспендирован, можно определить уровень связанного пенициллина.
В одном аспекте изобретения некоторые или все стадии способа могут быть автоматизированными. Автоматизация стадий способов дает возможность более эффективно протестировать большее число образцов и снижает риск ошибок человека при обращении с образцами, которые могут содержать вредные и/или инфекционные микроорганизмы. Огромную важность составляет, однако, то, что автоматизация может давать критически значимые результаты в любое время дня или ночи без промедления. Несколько исследований показало, что более быстрая идентификация организмов, вызывающих сепсис, коррелирует с лучшим лечением пациента, более коротким периодом пребывания в больнице и более низким общим затратам.
В некоторых формах осуществления изобретения эти способы можно также использовать для определения присутствия микроорганизмов в образце. В этих формах осуществления способы включают стадии:
(1) получение образца;
(2) необязательно лизис клеток в этом образце с получением лизированного образца; и
(3) разделение микроорганизмов и других компонентов образца с образованием осадка микроорганизмов;
где присутствие осадка указывает на то, что микроорганизмы присутствуют в образце. В одной форме осуществления осадок определяют невооруженным глазом. В других формах осуществления осадок определяют путем исследования, например, спектроскопического.
В некоторых формах осуществления способы определения можно использовать для мониторинга образцов на заражение микроорганизмами, например, пищевых продуктов, фармацевтических препаратов, питьевой воды и т.д. В одной форме осуществления эти способы можно осуществлять с повторением для постоянного мониторинга на заражение, например, раз в месяц, раз в неделю, раз в сутки, раз в час или по любой другой схеме периодичности. В другой форме осуществления образцы можно тестировать по необходимости, например, когда заражение подозревают. В следующих формах осуществления способы определения можно использовать, чтобы посмотреть присутствие микроорганизмов в клинических образцах, например, в гемокультурах. Например, образец можно отбирать из гемокультуры в определенные моменты времени и осуществлять способ определения на образце, чтобы определить, является ли эта гемокультура положительной. В одной форме осуществления образец может быть отобран в установленный момент времени после инокуляции культуры, например, через 24 часа после инокуляции, чтобы определить, является ли эта гемокультура положительной. В другой форме осуществления образцы можно отбирать из гемокультуры регулярно, например, каждые 12, 6, 4 или 2 часа или каждые 60, 50, 40, 30, 20, 15, 10 или 5 минут, чтобы идентифицировать положительные гемокультуры в пределах короткого промежутка времени как обнаружимо положительные. В некоторых формах осуществления способов определения за стадией определения могут необязательно следовать способы идентификации, которые описаны в данной заявке. В других формах осуществления способы определения частично или полностью автоматизированы, в частности, для форм осуществления, включающих повторяющийся мониторинг образцов.
Настоящее изобретение описано более подробно в приведенных ниже примерах, которые предложены в качестве иллюстрации и никоим образом не предназначены для ограничения изобретения. Используют стандартные методы, хорошо известные в данной области техники, или методы, специально описанные ниже.
ПРИМЕРЫ
ПРИМЕР 1. Быстрый способ разделения и идентификации микроорганизмов А. Метод разделения лизиса-центрифугирования
Суспензию коллоидного кремнезема (0,2-0,5 мл; плотность 1,040-1,050 г/мл) добавляли в несколько конических микроцентрифужных пробирок. Лизированные образцы культуральной среды положительной гемокультуры BacT/ALERT SA (0,5-1,0 мл) наслаивали сверху на суспензию коллоидного кремнезема. Альтернативно раствор коллоидного кремнезема можно добавлять под лизированную культуральную среду гемокультуры, используя иглу или канюлю.
Тестировали положительную среду от культур, содержащих приведенные ниже микроорганизмы:
> E. coli, АТСС 25922
> Е faecalis, АТСС 29212
> S. aureus, ATCC 12600
> P. aeruginosa, ATCC 10145
Пробирки закрывали крышками, а затем центрифугировали в микроцентрифуге в течение 2 мин примерно при 10000 g при комнатной температуре (20-25°С). Надосадочные жидкости отсасывали, затем очищенные осадки микроорганизмов ресуспендировали в 0,45% масс/об NaCl до оптической плотности @ 660 нм 0,40.
Одну часть каждой суспензии переносили в спектрофотометр (Fluorolog® 3 (HORIBA Jobin Yvon Inc., New Jersey)) для измерения собственной флуоресценции микроорганизмов (MIF).
Вторую часть наносили на карты Vitek® 2 ID/AST (bioMerieux Inc., Missouri). ″Прямые″ результаты Vitek® 2 сравнивали с результатами от суспензий колоний, выращенных в течение ночи, субкультивированных из положительной среды (традиционный способ). Все 4 вида дали отличные уровни достоверности идентификации как с прямой культурой непосредственно из крови, так и стандартных методов Vitek®, что демонстрирует, что способ разделения на основе плотности обеспечивает микроорганизмы, по существу свободные от крови и/или частиц и белков культуральной среды.
В. Быстрый метод идентификации in situ с помощью собственной флуоресценции
Флаконы положительных гемокультур извлекали из системы обнаружения микроорганизмов BacT/ALERT Microbial Detection System (bioMerieux Inc., Missouri). в пределах 1 часа положительного мечения, предпочтительно в пределах 10 минут положительного мечения. Образец 2,0 мл среды положительной гемокультуры добавляли к 0,5 мл раствора для лизиса (0,75% Тритон® Х-100-восстановленный (Rohm and Haas, Pennsylvania)+0,375% протеиназа XXIII) в стерильной пробирке с завинчивающейся крышкой. Пробирку кратковременно перемешивали на вортексе для смешивания и инкубировали в течение 5 минут при комнатной температуре. Лизированный образец культуральной среды (0,5 мл) добавляли в изготовленную на заказ микроцентрифужную пробирку (имеющую кварцевое оптическое окно 0,5 мм толщины у основания), содержащую разделительный раствор (коллоидный кремнезем Isolate® 30% об/об в 0,15 М NaCl) плотности 1,045 мг/мл. Пробирку центрифугировали в микроцентрифуге Eppendorf® 5417R, оборудованной колебательным ротором А-8-11 (Eppendorf, New York), в течение 2 минут примерно при 10000 об/мин при комнатной температуре (20-25°С). Пробирку извлекали из центрифуги и переносили в изготовленный на заказ фронтальный адаптер для спектрофотометра Fluorolog® 3 (HORIBA Jobin Yvon Inc., New Jersey). Флуоресценцию осажденных микроорганизмов на дне пробирки сразу регистрировали снизу. Данные передавали на программное обеспечение Excel и Statistica для многофакторного анализа.
ПРИМЕР 2. Оценка быстрого способа очистки и идентификации микроорганизмов
Для оценки потенциала принципа быстрой идентификации, описанного в примере 1, двадцатичетырехчасовые изоляты (6 штаммов 4 видов, включающих С. albicans, E. coli, S. aureus и S. epidermidis), выделенные из положительных гемокультур, тестировали этим способом.
SPS-антикоагулированную кровь собирали от трех доноров и объединяли. Десять мл свежей крови человека добавляли во флаконы для гемокультуры BacT/ALERT® (BTA) SA (bioMerieux Inc., Missouri). Суспензии каждого из изолятов готовили в триптическом соевом бульоне (ТСБ). Каждый флакон инокулировали 0,4 мл 103/мл суспензии и флаконы инкубировали при 36°С в боксе BTA. Четыре флакона BacT/ALERT® SA, содержащих 10 мл крови, но не содержащих организмы, включали в качестве отрицательных контролей.
Положительные флаконы извлекали из бокса BTA в пределах 3 часов положительного мечения. Отрицательный контрольный флакон извлекали с каждой группой положительных флаконов (по видам). Из бокса BTA в один момент времени извлекали один флакон в том порядке, когда они становились положительными. Образец 2,0 мл среды положительной гемокультуры извлекали, используя шприц на 3 мл и иглу 18G, и сразу добавляли к 0,5 мл буфера для лизиса (0,75% масс/об Тритон Х-100-восстановленный (Fluka)) в стерильной стеклянной пробирке с завинчивающейся крышкой. Пробирку кратковременно перемешивали на вортексе для смешивания и инкубировали в течение 5 минут при комнатной температуре. Часть 0,5 мл лизированного образца культуральной среды добавляли в изготовленную на заказ капиллярную микроцентрифужную пробирку (содержащую кварцевое оптическое окно 0,5 мл у основания капиллярного отдела), предварительно заполненную 55 мкл разделительного раствора (30% об/об Isolate® в 0,15 М NaCl). Микроцентрифужную пробирку центрифугировали в микроцентрифуге Eppendorf® 5417R, оборудованной колебательным ротором А-8-11 (Eppendorf, New York), в течение 2 минут при 10000 об/мин при 22°С. Пробирку извлекали из центрифуги и переносили в изготовленный на заказ 30-градусный фронтальный адаптер для спектрофотометра Fluorolog® 3 (HORIBA Jobin Yvon Inc., New Jersey). Флуоресценцию осажденных очищенных микроорганизмов на дне пробирки сразу регистрировали, используя изготовленную на заказ 5-минутную программу. Данные передавали на Excel и Statistica для хемометрического анализа и классификации изолята.
Оптимизацию модели классификации осуществляли на основании данных с нормализацией и без нормализации и методом исключения по одному. Результаты представлены в таблице 1. В таблице ″# стадий″ относится к числу стадий дискриминационного анализа, которое привело в результате к самой высокой чувствительности с использованием подхода к оценке методом ″исключения по одному″. В отсутствие нормализации данных процент правильно идентифицированных штаммов составлял 82,6%. Лучшие результаты (примерно 96% правильной идентификации) были получены, когда данные были нормализованы по точке рассеяния Рэлея, области коллагена или пику пиридоксамина, хотя улучшенные результаты были также получены путем нормализации по пикам НАД-Н, триптофана и флавина.
|
ПРИМЕР 3. Оценка буферов для лизиса
Проводили эксперименты для оценки эффективности разделения и профилей собственной флуоресценции микроорганизмов (MIF) свежей положительной культуральной среды гемокультуры S. pneumoniae WM-43, обработанной жестким и мягким буферами для лизиса. Были протестированы следующие композиции буферов для лизиса: (А) 2,0% TX100-R в 0,5 М CAPS, pH 11,7 (жесткий = LB-A); (В) 0,75% TX100-R в 0,5 М CAPS, pH 11,7 (мягкий = LB-B); и (С) 0,45% TX100-R в 0,3 М CAPS, pH 11,7 (мягкий = LB-C). 1,0 мл буферов для лизиса А и В и 2,0 мл буфера для лизиса С помещали в пробирки с завинчивающимися крышками и пробирки помещали в штатив в водяной бане на 37°С. Образцы культуральной среды (4,0 мл) извлекали из флакона культуры S. pneumoniae WМ43-положительной BacT/ALERT SA, используя 5 мл шприц и иглу 18G, в пределах 5 минут положительного мечения в системе ВТА. Среду быстро распределяли в каждую пробирку, содержащую буфер для лизиса, и пробирки закрывали крышками и перемешивали на вортексе в течение примерно 5 секунд. Также брали образец контрольной среды из переполненных (15 мл крови) флаконов отрицательного контроля BacT/ALERT® SA, чтобы определить эффективность стадий лизиса и разделения. Пробирки возвращали в водяную баню на 37°С на 1 минуту. Пробирки извлекали из водяной бани и 0,5 мл лизата наслаивали в предварительно заполненную разделительную пробирку, содержащую 200 мкл плотностного буфера 14% масс/об йогексола. Пробирки центрифугировали в течение 2 мин при 10000 об/мин (примерно 10000 × g) при 25°С в микроцентрифуге Eppendorf® 5417R, оборудованной колебательным ротором А-8-11 (Eppendorf, New York). Фотографии нижних областей разделительных пробирок с использованием LB-B представлены на фиг.1. Можно отметить отсутствие какого-либо осадка, когда обрабатывали переполненную (15 мл крови) отрицательную контрольную среду. Сразу после завершения центрифугирования пробирки считывали в спектрофотометре Fluorolog® 3 (HORIBA Jobin Yvon Inc., New Jersey), используя адаптер в виде двойной 30-градусной трубки, ФЭУ детектор и файл сканирования ″Full EEM″ (сканирование 20,8 мин). Примеры EEM спектров от индивидуальных образцов показаны на ФИГ.2А-2С.
Профили EEM собственной флуоресценции осадков S. pneumoniae, показанные на фиг.2А-2С, хорошо коррелируют с результатами жизнеспособности клеток. Обработка положительной среды 0,40% ТХ100-содержащим (конечная концентрация) буфером для лизиса (LB-A; жесткий буфер) привела в результате к 30-кратному падению жизнеспособности пневмококков и 5-кратному снижению пика флуоресценции НАД-Н по сравнению с обработкой обоими мягкими буферами, содержащими 0,15% ТХ100 (конечная концентрация), несмотря на сходные сигналы триптофана во всех трех осадках. Другим изменением, связанным со сниженной жизнеспособностью микроорганизмов, было увеличение пика флуоресценции флавина (Таблица 2). Сниженная флуоресценция НАД-Н и повышенная флуоресценция флавина четко видны на фиг.2А.
|
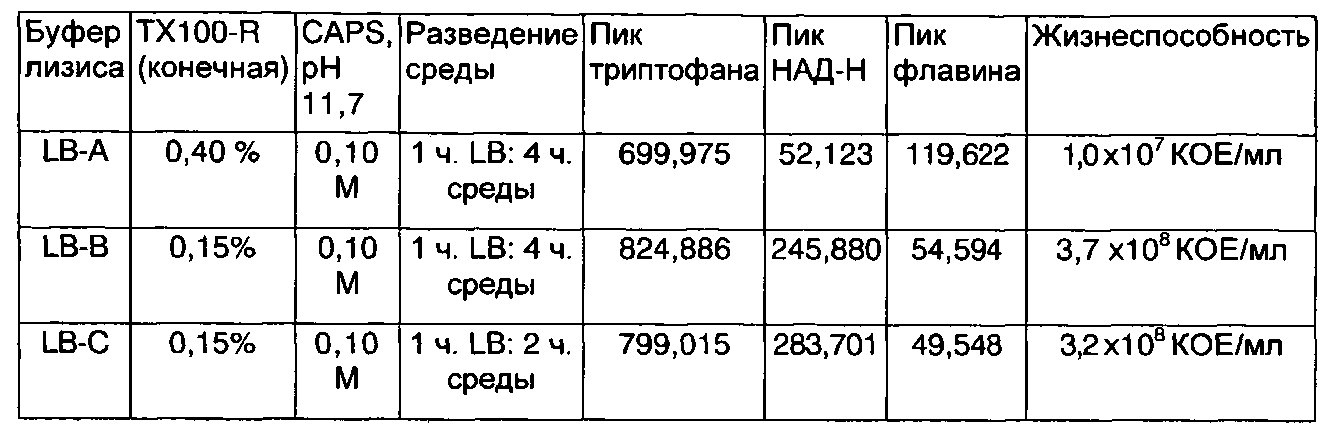
ПРИМЕР 4. Усовершенствованные устройства и способы для идентификации in situ очищенного осадка микроорганизмов
Чтобы дополнительно исследовать потенциал быстрого способа разделения и идентификации in situ, описанного в примере 2, несколько запатентованных устройств было разработано и отлито из пластмассы, пропускающей УФ-свет. Эти устройства имели несколько общих признаков, включая крышку, резервуар для образца и коническую нижнюю область оптического качества для обеспечения спектроскопического исследования седиментированного осадка микроорганизмов снизу и/или на стенке, и признаков, которые облегчают соединение этого устройства со спектрофотометром. Эти устройства также должны быть способны выдерживать относительно высокие g-силы во время стадии разделения. Было сконструировано несколько итераций этой пробирки, чтобы улучшить выделение микроорганизмов, воспроизводимость флуоресценции, а также снизить контаминацию случайно рассеиваемым светом. Пробирка была также сконструирована как герметично закрытая.
Оптическое исследование седиментированного осадка микроорганизмов было достигнуто либо путем вставки сепаратора в изготовленный по заказу адаптер, помещенный внутри отделения для образца спектрофотометра, либо путем прямого соединения сепаратора с разветвленным шестижильным 300-400-микронным оптоволоконным кабелем (Ocean Optics, Florida), присоединенным к спектрофотометру (Fluorolog® 3 (HORIBA Jobin Yvon Inc., New Jersey)). Трехзеркальный оптоволоконный адаптер был сконструирован так, чтобы обеспечить использование обеих систем детекторов (ФЭУ и ПЗС). Спектры полной матрицы возбуждения-испускания (ЕЕМ) снимали на каждом осадке микроорганизмов (диапазон сканирования: возбуждение 260-800 нм; испускание 260-1100 нм; инкременты 5 нм).
Исследования воспроизводимости и надежности калибровки проводили на одноразовой конфигурации устройства оптоволоконного кабеля, используя растворы очищенного триптофана и рибофлавина. Целевые CV<2,5% были получены для обоих флуорофоров, что подтверждает качество одноразового устройства и исследовательскую платформу.
ПРИМЕР 5. Идентификация микроорганизмов с использованием измерений осадков микроорганизмов и сравнение с суспензиями микроорганизмов
Несколькими исследователями ранее описано использование измерений флуоресценции под прямым углом разведенных суспензий микроорганизмов с целью их идентификации. Авторы изобретения сравнили эффективность этого традиционного способа с их новым подходом фронтального измерения седиментированного осадка микроорганизмов на основе патентованного сепаратора, пропускающего УФ-свет, или оптической пробирки. Кроме того, авторы изобретения сравнили эффективность двух детекторов для фронтальных измерений: детектора на основе фотоэлектронного умножителя (ФЭУ), соединенного со спектрометром с двойной дифракционной решеткой, и детектора с зарядовой связью (ПЗС), соединенного со спектрометром с одинарной дифракционной решеткой. Эти эксперименты проводили, используя конструкцию сепаратора из двух частей и колонии микроорганизмов, выросшие на чашках с агаром. Панель из 42 штаммов, представляющих 7 видов (S. aureus, S. epidermidis, Е. coli, К. oxytoca, С. albicans, С. tropicalis и E. faecalis), были протестированы в каждой из приведенных ниже трех оптических конфигураций:
1. Суспензию 0,40 OD при 660 нм каждого микроорганизма готовили в 0,45% NaCl, добавляли в кювету, пропускающую УФ-свет, и снимали полные спектры ЕЕМ под прямым углом, используя ФЭУ детектор (традиционный способ)
2. Осадок микроорганизмов толщиной 2-3 мм готовили в изготовленном на заказ сепараторе путем центрифугирования суспензии. Полные спектры ЕЕМ полученного в результате осадка снимали во фронтальном режиме, используя ФЭУ детектор.
3. Осадок микроорганизмов толщиной 2-3 мм готовили в изготовленном на заказ сепараторе путем центрифугирования суспензии. Полные спектры ЕЕМ полученного в результате осадка снимали во фронтальном режиме, используя ПЗС детектор.
Данные собственной флуоресценции в ЕЕМ анализировали с использованием имеющегося в продаже программного обеспечения многофакторного анализа (General Discriminant Analysis; Statistica). Результаты анализов изображены в таблице 3.
|
Удивительно, что сканирование осадков микроорганизмов во фронтальном режиме значительно улучшало способность к их идентификации, используя известные способы многофакторного анализа. Дальнейший анализ данных ЕЕМ флуоресценции выявил, что основная дискриминационная область для традиционной конфигурации суспензии в кювете находилась в пределах триптофановой области спектра. Напротив, фронтальные измерения осадков микроорганизмов привели в результате к нескольким дополнительным областям спектра ЕЕМ, которые обеспечивали сильную дискриминационную способность, в частности, в пределах 360-440 нм длин волн возбуждения. Данный эксперимент также продемонстрировал функциональную эквивалентность ФЭУ и ПЗС детекторов.
Дополнительная спектральная информация собственной флуоресценции, предоставленная фронтальным исследованием осадка микроорганизмов, является как неожиданным, так и преимущественным результатом.
ПРИМЕР 6. Разработка селективных буферов для лизиса
Авторы изобретения предприняли разработку селективных буферов для лизиса, способных к растворению компонентов крови человека в пределах секунд, но оставляющих большую часть микроорганизмов, вызывающих сепсис, интактными и метаболически активными. Наиболее распространенным образцом, используемым для этих исследований, была культуральная среда BacT/ALERT® SA, содержащая кровь человека. Флаконы засевали 10-15 мл крови человека с небольшим инокулумом или без инокулума тестируемого микроорганизма, затем загружали в систему обнаружения микроорганизмов BacT/ALERT®. Положительные и отрицательные к данному моменту флаконы извлекали и образец культуральной среды обрабатывали, как описано ниже.
Самые ранние растворы для лизиса, используемые в настоящем изобретении, были не забуференными (примеры 1-2) и их использовали, в основном, в сочетании с плотностными буферами коллоидного кремнезема. Одним из интересных свойств коллоидного кремнезема является его способность к разделению не полностью солюбилизированных компонентов крови человека, которые собираются сверху на этом плотностном буфере, и интактных микроорганизмов, которые проходят через буфер и образуют осадок. Поскольку искали более широко применяемые плотностные буферы (ссылка на пример 7), многие были неспособны предотвращать седиментацию этого не микробного детрита, поэтому были необходимы усовершенствованные препараты буферов для лизиса. Авторы изобретения определили, что не микробный детрит быстро растворялся гидроксидом калия, но не кислотой, поэтому ряд буферов щелочного рН протестировали в присутствии ряда детергентов. Во время этих исследований авторы изобретения открыли, что смесь детергента Тритон X100-R и буфера CAPS при рН 11,7 приводила в результате к полной солюбилизации компонентов клеток крови из образца среды стерильной гемокультуры.
Предварительная оценка эффекта концентрации детергента Тритон X100-R и условий лизиса при высоком рН на жизнеспособность S. pneumoniae штамма WM-43 описана в примере 3. Условия, приводящие в результате к низкой жизнеспособности микроорганизмов, вызывали значительное снижение флуоресценции НАД-Н при сопутствующем увеличении флуоресценции флавина (см. таблицу 2; LB-A).
Серию анионных, нейтральных и цвиттерионных детергентов подвергали скринингу на включение в селективный буфер для лизиса. Было обнаружено, что анионные и цвиттерионные детергенты являются слишком денатурирующими для белков крови, поэтому авторы изобретения сосредоточились на не денатурирующих нейтральных детергентах, таких как выбор, приведенный в таблице 4. Детергенты с самой сильной активностью лизиса клеток крови при щелочном рН протестированы и перечислены как #1-6. Эти детергенты полностью солюбилизировали клетки крови в среде отрицательной контрольной гемокультуры в течение 20 секунд, о чем судили по увеличению % пропускания при 660 нм. Вторая группа детергентов (#7-10) демонстрировала более медленный, более контролируемый лизис клеток крови, дающий максимальную солюбилизацию за 30-40 секунд. Для третьей группы (#11-12) полный лизис занимал 8-10 минут при сравнимых концентрациях детергента.
Готовили буферы для лизиса, содержащие детергенты различной структуры и литической активности в базовом буферном препарате 0,3 М CAPS, pH 11,7. Концентрации детергентов приведены в таблице 4. Эти буферы для лизиса оценивали функционально, используя среду положительной гемокультуры, содержащей клинический штамм микроорганизма, известный как чувствительный к детергентам и к щелочным условиям pH, Streptococcus pneumoniae, штамм WM-43. Оцениваемыми параметрами были уровни собственной флуоресценции микроорганизмов (спектры матрицы возбуждения-испускания), эффективность разделения, внешний вид изолированного осадка микроорганизмов и характеристики штамма по Граму, а также жизнеспособность микроорганизмов, выделенных из осадка под плотностным буфером.
Этот метод осуществляли, как описано ниже:
Смешивают 2 части положительной культуральной среды с 1 частью тестируемого буфера для лизиса, инкубируют в водяной бане при 37°С в течение 1 минуты, чтобы лизировать клетки крови, затем наслаивают 0,5 мл лизата на 0,2 мл плотностного буфера (14% масс/об йогексол+1,93% масс/об NaCl+10 мМ ГЭПЭС, pH 7,4), распределенного в оптическую разделительную пробирку из двух частей, которую затем герметично закрывают завинчивающейся крышкой. После центрифугирования пробирки в микроцентрифуге Eppendorf® 5417R, оборудованной колебательным ротором А-8-11 (Eppendorf, New York), в течение 2 минут при 10000 об/мин пробирку помещали в адаптер, изготовленный по заказу, который прямо соединял основание пробирки с 400-микронным оптоволоконным датчиком, соединенным со спектрофотометром (Fluorolog® 3 (HORIBA Jobin Yvon Inc., New Jersey), и снимали полное сканирование ЕЕМ (Ex 260-850 нм; Em 260-1100 нм; каждые 5 нм). После сканирования надосадочную жидкость удаляли и осадок микроорганизмов ресуспендировали в 0,5 мл триптического соевого бульона (TSB). Мазки суспензий готовили для окрашивания по Граму, и 20 микролитров разведения 1:100 высевали на чашки с овечьим кровяным агаром для оценки жизнеспособности по шкале от NG (нет роста) до 4+(максимальный рост).
Результаты этого эксперимента продемонстрировали, что в желательных условиях лизиса, описанных выше, тестируемые детергенты попадали в три категории, широко соответствующие их литическим свойствам:
1. Быстрые литические детергенты (#1-6) обладают некоторым эффектом на реакцию Грама данного изолята S. pneumoniae. Два последних детергента в этой группе (Genapol X-080 (Hoechst AG, Frankfurt, Germany) и полидоценол) обладают относительно малым эффектом, тогда как первые три полностью изменяли реактивность по Граму и снижали жизнеспособность.
2. Группа более мягких литических детергентов (#7-10), которые эффективно солюбилизировали клетки крови в течение 60-секундного периода лизиса и не изменяли реактивность по Граму или жизнеспособность изолята S. pneumoniae.
3. Группа детергентов (#11-12), которые также не изменяли реактивность по Граму или жизнеспособность изолята S. pneumoniae, но обладали более медленной литической активностью.
|
Эффект тестируемых детергентов на уровень собственных флуорофоров, присутствующих в клеточном осадке S. pneumoniae, представлен в таблице 5. Как известно из результатов, представленных в примере 3, отношение флуоресценции флавина к НАД-Н является отличным индикатором состояния здоровья этого чувствительного микроорганизма. Низкие отношения связаны с пониженной жизнеспособностью этого организма, такие как наблюдали с н-октилгликозидом и детергентами CHAPS. Четыре группы, представленные в таблице 5, попадают в категории, которые прямо коррелируют с изменениями, наблюдаемыми в реактивности по Граму клеток S. pneumoniae, выделенных из осадка (таблица 4). Эти данные демонстрируют, что детергенты 7, 8, 9, 10 и 12 проявляют значительное улучшение суррогатного маркера жизнеспособности флавин/НАД-Н.
Интересно, что эти пять детергентов относятся к классу полиоксиэтиленов. Удивительно, что все четыре более мягких детергента, которые легко солюбилизируют клетки крови (#7-10), которые обладают оптимальными уровнями собственных флуорофоров, предположительные для неизмененной жизнеспособности и обладающие оптимальной реактивностью по Граму, имеют общую химическую природу. Каждый имеет полиоксиэтиленовую гидрофильную концевую группу со средней длиной цепи 10 (Е) и средние длины углеводородной цепи в интервале 12-18 (С).
Авторы изобретения предполагают, что данная конкретная группа детергентов представляет собой отличные кандидаты для включения в буферы для лизиса, предназначенные для селективной солюбилизации клеток крови млекопитающих при сохранении жизнеспособности близкорасположенных микроорганизмов.
|
Была разработана модель скрининга, чтобы обеспечить тестирование чувствительности большого числа микробных изолятов к нескольким детергентам. Кратко, суспензии тестируемых микроорганизмов со сложными питательными потребностями вводили в культуральные среды BacT/ALERT SA, содержащие кровь человека, при 103-105 КОЕ/мл. Образцы обрабатывали тестируемыми буферами для лизиса в течение 1-5 минут при 37°С, затем при необходимости разводили 1:100 в TSB и высевали для подсчетов жизнеспособности.
Суммирование подсчетов колоний, приведенное в таблице 6, показывает, что Brij 97 проявляет минимальную токсичность, однако, щелочные условия одного буфера CAPS быстро уничтожают N. meningitidis, H. influenzae и А. actinomycetemcomitans. Genapol C-100 обладал активностью, подобной Brij® 97, но был несколько менее токсичен в отношении H. parainfluenzae и С. hominis в данной модели. В последующем эксперименте жизнеспособность S. pneumoniae, S. pyogenes, S. agalactiae, S. mitis, P. mirabilis, K. pneumoniae и E. coli′ оставалась не подвергнутой влиянию после 5-минутного времени контакта как с Brij® 97, так и с Genapol® C-100 (данные не представлены).
|
Многие буферы для лизиса, в частности, используемые для молекулярных методов, содержат хелатирующие агенты, такие как этилендиаминтетрауксусная кислота (ЭДТА), чтобы способствовать на стадии солюбилизации. Авторы изобретения оценили воздействие добавления ЭДТА в основной буфер для лизиса TX100-CAPS, используя панель грамотрицательных и грамположительных микроорганизмов. В таблице 7 показан быстрый токсический эффект ЭДТА на Р. aeruginosa и A. baumanii, но не на две другие грамотрицательные палочки, B. cepacia и К. pneumoniae, или на грамположительный S. aureus. Отметим, что, хотя ЭДТА обладает ингибиторным действием на Р. aeruginosa и A. baumanii, изменения в основных собственных флуорофорах весьма различались между этими двумя видами. Р. aeruginosa был единственным из протестированных микроорганизмов, который проявлял значительное падение флуоресценции как НАД-Н, так и триптофана после обработки ЭДТА.
Эти эксперименты представляют собой хороший пример того, как определенные соединения или идентификаторы могут быть добавлены в буфер для лизиса, чтобы быстро изменить базовый профиль собственной микробной флуоресценции конкретного микроорганизма, и представляют возможности улучшенной идентификации и дополнительной характеристики изолята. Как должно быть легко понятно специалисту в данной области техники, чувствительность конкретного микроорганизма к любому соединению, воздействующему на его физическое состояние или метаболизм, может быть быстро подтверждена путем добавления этого соединения в образец, буфер для лизиса, плотностный буфер или любую их смесь. Подобным образом, изменения в условиях лизиса или композиции селективного буфера для лизиса (например, рН буфера, тип детергента и его концентрация) может обеспечить характеристические изменения в собственной микробной флуоресценции, пример чего приведен на фиг.2A и 2B.

ПРИМЕР 7. Разработка буферов для разделения на основе плотности
Целью буферов для разделения, также известных как градиенты плотности, является надежное разделение и распределение метаболически активных микроорганизмов от лизированных компонентов крови и культуральной среды за несколько минут. Материал градиента был выбран таким образом, чтобы он имел плотность между плотностью интактных микроорганизмов и лизированного образца культуральной среды положительной гемокультуры. Разделение осуществляли посредством центрифужных сил.
Авторы изобретения первоначально определили (примеры 1-2), что коллоидный кремнезем обладает удовлетворительными свойствами для быстрой изоляции микроорганизмов от высоко флуоресцентных компонентов крови и среды, находящихся в культуральной среде положительной гемокультуры. Однако некоторые виды микроорганизмов, такие как S.pneumoniae, не обладали удовлетворительной седиментацией через коллоидный кремнезем при плотности, требующейся для создания эффективного фазового барьера между седиментированными микроорганизмами и загрязняющими компонентами крови и среды. Поэтому был проведен поиск дополнительных градиентов плотности с более широкой эффективностью.
Серию соединений подвергали скринингу на включение в буфер для разделения. Предпочтительные соединения для плотностного буфера обладают приведенными ниже характеристиками:
1. Низкая вязкость, чтобы обеспечить быструю седиментацию микроорганизмов через градиент
2. Низкая флуоресценция, чтобы свести к минимуму интерференцию с собственной флуоресценцией микробного происхождения
3. Предпочтительно оптическая прозрачность для всех длин волн исследуемого света
4. Являются нетоксичными для микроорганизмов
5. Являются недорогими и легко доступными
6. Широко применимы для широкого ряда бактерий и образцов
|
Потенциальные соединения плотностного буфера подвергали скринингу, используя культуральные среды положительных гемокультур, содержащих S. pneumoniae (капсулированный микроорганизм низкой плотности), Е. coli (микроорганизм средней плотности) и S. aureus (микроорганизм высокой плотности). Образцы культуральной среды подвергали лизису в условиях, описанных в примере 6, путем смешивания одной части буфера для лизиса (0,45% Тритон X100-R+0,3 М CAPS, pH 11,7) с двумя частями образца и инкубации в течение 1 минуты в водяной бане на 37°С. Затем 0,7 мл лизата осторожно наслаивали на 0,5 мл тестируемого плотностного буфера в стандартной 1,5 мл микроцентрифужной пробирке. Пробирки центрифугировали в течение 2 минут примерно при 10000 g и регистрировали результаты разделения. Отличное разделение отмечали, когда присутствовал твердый осадок микроорганизмов, седиментированных в основании двух раздельных слоев жидкости без видимого загрязнения гемоглобином, присутствующим в нижнем слое.
Отличные результаты разделения были получены при использовании коллоидного кремнезема, йогексола, хлорида цезия, LymphoPrep® и PolymorphoPrep® в качестве плотностного буфера. Удовлетворительные результаты были получены с декстрозой Т70, фиколлом 400, сахарозой и поливиниловым спиртом. Ожидают, что йодиксанол обладает свойствами, подобными йогексолу. Авторы изобретения также открыли, что приготовление градиентов плотности гиперосмотическими, например, путем добавления хлорида натрия, улучшало седиментацию микроорганизмов низкой плотности, таких как S. pneumoniae и К. pneumoniae.
Дальнейшее тестирование проводили с йогексолом 14% масс/об, хлоридом цезия 18% масс/об и 30% PolymorphoPrep® от исходного раствора в комбинации с буферами для лизиса, приготовленными с Тритоном X100-R, полидоценолом, Brij® 97, Genapol® С-100 и Genapol® X-100, используя положительную культуральную среду, содержащую чувствительный штамм S. pneumoniae WM43. Комбинация пяти буферов для лизиса и четырех градиентов плотности дала ожидаемое отличное разделение. Результаты для градиентов плотности йогексола и хлорида цезия приведены на фиг.3. Как более подробно обсуждено в примере 6, жизнеспособность выделенных клеток S. pneumoniae была не настолько высокой с буферами, содержащими Тритон X100-R и полидоценол, независимо от состава плотностного буфера.
ПРИМЕР 8. Оценка нескольких буферов для лизиса и градиентов плотности
Чтобы определить широкую применимость концепции настоящего изобретения, авторы изобретения сравнивали эффективность двух селективных буферов для лизиса и двух композиций плотностного буфера, используя исследование засеянной гемокультуры для разработки мини-модели классификации.
Микроорганизмами, используемыми в модели, были К. pneumoniae, К. oxytoca, S. aureus, S. epidermidis, C. tropicalis и S. pneumoniae (6 штаммов каждого). Тестировали приведенные ниже комбинации буферов для лизиса и градиентов плотности:
Серия А=буфер для лизиса Brij®-97+градиент 24% CsCl, содержащий Pluronic F-108
Серия В=буфер для лизиса Genapol® С-100+градиент 24% CsCl, содержащий Pluronic F-108
Серия С=буфер для лизиса Brij®-97+градиент 14% йогексола, содержащий Pluronic F-108
Серия D=буфер для лизиса Brij®-97+градиент 24% CsCl (без Pluronic F-108)
Образцы положительной культуральной среды обрабатывали при каждом из четырех условий, описанных выше, следующим образом:
1. 2,0 мл образец положительной культуральной среды смешивали с 1,0 мл селективного буфера для лизиса, затем помещали в водяную баню на 37°С на 1 минуту.
2. 1,0 мл образец лизата наслаивали на 0,5 мл плотностного буфера, содержащегося в изготовленной на заказ оптической разделительной пробирке. Полипропиленовый шарик присутствовал на поверхности плотностного буфера, чтобы облегчить наслаивание, не нарушая две водные фазы.
3. Оптическую разделительную пробирку герметично закрывали завинчивающейся крышкой и центрифугировали в течение 2 минут при 10000 об/мин (микроцентрифуга Eppendorf® 5417R, оборудованная колебательным ротором А-8-11 (Eppendorf, New York); фиг.4).
4. Затем герметично закрытую пробирку переносили в изготовленный на заказ адаптер, который прямо соединял основание пробирки с 300-микронным оптоволоконным датчиком, соединенным со спектрофотометром (Fluorolog® 3 от HORIBA Jobin Yvon Inc., New Jersey).
5. Полное сканирование ЕЕМ снимали, используя детектор ПЗС конфигурации (Ех 260-850 нм, каждые 5 нм; Еm 260-1100 нм).
6. Данные ЕЕМ передавали в Excel и строили мини-модель классификации для каждой серии реагентов, используя общий дискриминационный анализ (Statistica).
Результаты разделения были эквивалентными для всех четырех серий реагентов за одним исключением. Серия D, которая не содержала мягкий сурфактант Pluronic F-108 в плотностном буфере, имела значительно сниженную биомассу нескольких штаммов С. tropicalis вследствие сильного прилипания этих микроорганизмов к боковым стенкам разделительной пробирки. Это явление также встречалось, когда использовали градиент йогексола (данные не представлены). Последующий анализ данных показал, что, хотя присутствие мягкого сурфактанта в плотностном буфере предпочтительно, оно не является существенным. Действительно, результаты ОДА всех четырех комбинаций реагентов выявили удовлетворительное качество классификации (таблица 9). Какие-либо различия между четырьмя сериями реагентов были относительно малы. Наиболее распространенные ошибки классификации встречались между двумя близкородственными видами на панели, К. pneumoniae и К. oxytoca.
|
Одним из потенциальных недостатков йогексолсодержащих градиентов плотности по сравнению с плотностным буфером, содержащим хлорид цезия, являются сильные адсорбирующие свойства йогексола, применяемого в медицине контрастного агента, которые приводят в результате к значительному гашению флуоресценции при длинах волн возбуждения ниже примерно 380 нм. Однако неожиданным открытием было, что аналитическая дифференциация К. pneumoniae и К. oxytoca была улучшена при использовании градиента йогексола, что позволяет предположить, что частичное гашение более выраженных флуорофоров, таких как НАД-Н и триптофан, может не перекрывать различия ниже уровня клеточных флуорофоров с различными свойствами гашения.
Буферы для лизиса, содержащие Brij® 97 и Genapol® C-100, давали сходные результаты классификации для данной ограниченной панели микроорганизмов. Градиенты плотности хлорида цезия и йогексола также обладали сходными характеристиками. Интересным открытием было то, что йогексол можно использовать, чтобы избирательно способствовать дифференциации некоторых видов микроорганизмов.
ПРИМЕР 9. Усовершенствованный способ быстрой идентификации изолятов гемокультуры по собственной флуоресценции
Кульминация усовершенствований, сделанных в разработке и оценке оптических разделительных пробирок и соответствующей оптической платформы, улучшенной классификационной способности фронтального исследования осадков микроорганизмов и оптимизации буферов для быстрого селективного лизиса и стадии разделения на основе плотности, привела в результате к новому способу с потенциалом идентификации микроорганизмов в пределах минут из комплексных образцов, таких как культуральная среда гемокультуры.
Этот способ обладает преимуществами по простоте и безопасности, поскольку стадии разделения и считывания протекают в герметично закрытом устройстве. Чтобы дополнительно подтвердить применимость этого способа, авторы изобретения сконструировали базу данных 373 штаммов микроорганизмов, представляющих 29 наиболее превалирующих видов, известных как вызывающие сепсис. Эти микроорганизмы ″засевали″ при низком инокулуме во флаконы BacT/ALERT® SA, содержащие 10 мл крови человека. Образцы культуральной среды гемокультуры отбирали из флаконов в пределах нескольких минут после появления положительного мечения системой обнаружения микроорганизмов BacT/ALERT® 3D. Образцы обрабатывали, как описано ниже:
1. 2,0 мл образец положительной культуральной среды смешивали с 1,0 мл селективного буфера для лизиса (0,45% масс/об Brij® 97+0,3 М CAPS, pH 11,7), затем помещали в водяную баню на 37°С на 1 минуту.
2. 1,0 мл образец лизата наслаивали на 0,5 мл плотностного буфера (24% масс/об хлорид цезия в 10 мМ ГЭПЭС pH 7,4+0,005% Pluronic F-108), содержащегося в изготовленной на заказ оптической разделительной пробирке. Полипропиленовый шарик присутствовал на поверхности плотностного буфера, чтобы облегчить наслаивание, не нарушая две водные фазы.
3. Оптическую разделительную пробирку герметично закрывали завинчивающейся крышкой и центрифугировали в течение 2 минут при 10000 об/мин (микроцентрифуга Eppendorf® 5417R, оборудованная колебательным ротором А-8-11 (Eppendorf, New York); фиг.4).
4. Затем герметично закрытую пробирку переносили в изготовленный на заказ адаптер, который прямо соединял основание пробирки с 300-микронным оптоволоконным датчиком, соединенным со спектрофотометром (Fluorolog® 3 от HORIBA Jobin Yvon Inc., New Jersey).
5. Полное сканирование ЕЕМ снимали, используя детектор ПЗС конфигурации (Ех 260-850 нм, каждые 5 нм; Еm 260-1100 нм).
6. Данные ЕЕМ передавали в Excel.
7. Весь процесс, который занимал менее 20 минут с момента положительного мечения флакона, повторяли, используя положительную культуральную среду, которая хранилась при 2-8°С в течение 4-5 часов.
Сохраненную культуру подогревали в течение 5 минут перед обработкой.
Некоторые репрезентативные примеры спектров ЕЕМ осадков микроорганизмов, изолированных из культуральной среды положительной гемокультуры, представлены на фиг.5-8. Различия видны визуально между представленными видами как по величине, так и по форме спектров различных присутствующих клеточных флуорофоров.
Данные анализировали разнообразными способами многофакторного анализа с целью построения базы данных классификации микроорганизмов. Каждый файл сканирования содержал более 9000 индивидуальных считываний флуоресценции, поэтому использовали ряд подходов, чтобы минимизировать и нормализовать данные перед анализом. В качестве примера в таблице 10 показаны некоторые предварительные результаты с использованием способа общего дискриминационного анализа (Statistica). Дополнительные введенные переменные, такие как время до обнаружения и скорости роста, полученные от системы обнаружения микроорганизмов BacT/ALERT®, и количество биомассы, присутствующей в клеточном осадке, можно использовать, чтобы способствовать идентификации и/или характеристике изолята, вызывающего сепсис (см. пример 10).
Хотя данные в таблице 10 представляют результаты идентификации на видовом уровне, может быть получен любой уровень группировки, который дает лечащему врачу клинически релевантную информацию, дающую основание для действий. Примером этого могли бы быть ″терапевтические″ группы, где виды микроорганизмов сгруппированы в соответствии с антибиотиками, используемыми при их лечении.
Способ, описанный в настоящем изобретении, удовлетворяет острую потребность в идентификации микроорганизмов из флакона положительной гемокультуры безопасным и надежным способом. Результаты, приведенные в качестве примера в таблице 10, конкурируют с другими способами идентификации, которые основаны на ростовых или молекулярных характеристиках микроорганизма, но без задержки по времени или затрат. Кроме того, способ может быть полностью автоматизирован, поэтому результат ID может быть отправлен непосредственно врачу посредством электронного устройства в любое время дня и ночи.
Способ по настоящему изобретению также совместим с множеством диагностических методов за счет встроенных секций разделения и считывания одноразового устройства, изготовленного на заказ, с интактными микроорганизмами, представляющими ″твердую фазу″ (фиг.4). Примеры дополнительных тестов, которые разрабатывают с использованием концепции настоящего изобретения, включают, но не ограничены ими, измерение ферментов микроорганизмов, маркеров клеточной поверхности, нуклеиново-кислотных зондов и ингибиторов метаболизма микроорганизмов. Способ пригоден для автоматизации и миниатюризации.
|
ПРИМЕР 10. Не спектроскопические измерения, способствующие при характеристике и/или идентификации микроорганизмов
Не спектроскопические измерения, такие как время обнаружения и скорости роста микроорганизмов, полученные на основании алгоритмов системы обнаружения, а также размер, форму, цвет и плотность изолированного осадка микроорганизмов можно использовать в качестве дополнительных переменных для характеристики и/или идентификации микроорганизма.
Примеры, приведенные на фиг.9 и 10, демонстрируют, что измерение размера осадка, времени обнаружения и средней собственной флуоресценции можно использовать, чтобы способствовать идентификации или подтверждению идентификации двух близкородственных видов, S. pneumoniae и S. mitis. Каждый символ представляет отдельный клинический изолят, выделенный из культуральной среды положительной гемокультуры способом по настоящему изобретению. Изолят S. pneumoniae, обозначенный кружком на фиг.9 и 10, является неверно идентифицированным как S. mitis в предварительных результатах, представленных в таблице 10 (пример 9).
Вышеописанное является иллюстративным для настоящего изобретения и не должно быть истолковано как ограничивающее его. Изобретение определено приведенной ниже формулой изобретения, где эквиваленты формулы изобретения должны быть включены в нее. Все публикации, заявки на патенты, патенты, патентные публикации и любые другие ссылки, цитируемые в данной заявке, включены полностью посредством ссылки на информацию, релевантную для предложения и/или параграфа, в котором представлена ссылка.