Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ ХИНОЛИНА, В ЧАСТНОСТИ 6,7-ЗАМЕЩЕННЫЕ 1-(2-ХЛОРХИНОЛИН-3-ИЛ)-4-ДИМЕТИЛАМИНО-2-(НАФТАЛИН-1-ИЛ)-1-ФЕНИЛБУТАН-2-ОЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ МИКОБАКТЕРИАЛЬНОЙ ПРИРОДЫ, В ЧАСТНОСТИ ТУБЕРКУЛЕЗА
Вид РИД
Изобретение
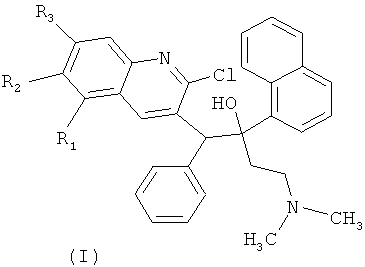
Изобретение относится к биологически активным веществам, в частности к производным замещенных хинолинов, обладающих цитостатической и цитотоксической активностью в отношении микобактерий, а именно к замещенным производным 1-(2-хлорхинолин-3-ил)-4-диметиламино-2-(нафталин-1-ил)-1-фенилбутан-2-олов общей формулы (I), к способу их получения, а также к применению их в качестве антимикобактериальных агентов, в частности субстанций лекарственных препаратов (средств) с целью лечения туберкулеза и других инфекционных заболеваний микобактериальной природы.
По данным ВОЗ, ежегодно более 8-9 млн. человек заболевают туберкулезом, возбудителем которого является бактериальная палочка Micobacterium Tuberculosis. При этом смертность от резистентных и нерезистентных форм колеблется от 20 до 30% (2-3 млн. человек). Используемые в настоящее время подходы к лечению данного заболевания основаны на комбинированной терапии рядом лекарственных препаратов, таких как этамбутол, изониазид, рифампицин, пиразинамид, циклосерин и др. Принимая во внимание возрастающую во всем мире заболеваемость резистентными формами туберкулеза, а также относительно высокую токсичность вышеназванных препаратов и достаточно продолжительный их прием, поиск новых химических веществ, обладающих высокой противомикобактериальной активностью, является актуальной задачей современной медицины и фармакологии.
В последнее время синтезирован и исследован на активность в отношении микобактерий ряд производных диарилхинолинового ряда общей формулы (II) [WO 2004/011436, 05.02.2004, WO 2008068270, 12.06.2008, WO 2006/125769, 30.11.2006], структура которых является родственной используемому с начала 17 века для лечения инфекционных заболеваний хинину
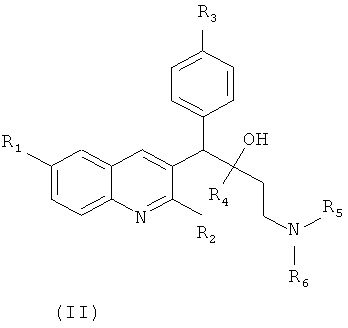
где R1-Н, галоген, галоалкил, циано-, гидрокси-, арил, гетарил, алкил, алкилокси-, алкилтио-, алкилоксиалкил, алкилтиоалкил, арилалкил;
R2 - Н, гидрокси, тио-, алкилокси-, алкилоксиалкилокси-, алкилтио-, моно- и диалкиламино-;
R3 - водород, галоген, алкил;
R4 - нафтил, галонафтил, фенил, галоидарил, арилалкил, пиридинил, алкил, тиенил;
R5, R6 - алкил, Н, бензил, имидазолил, гетарил, алкилтио-, пиримидил.
Из RU 2404971, 27.11.2010 известны производные хинолина общей формулы (III)
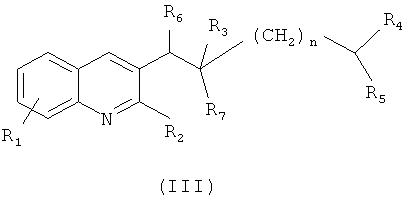
где R1 означает галоген, R2 означает галоген, R3 означает гидрокси, R4, R5 означают C1-C3-алкил, R6 означает арил, R7 означает арил, n=1 или 2, а также их фармацевтически приемлемые соли с кислотами, обладающие активностью в отношении микобактерий.
В указанных патентах описан способ получения этих производных, заключающийся во взаимодействии 2-арилметилхинолинов и соответствующих ацетофенонов и ацетилнафталинов под действием металлирующих агентов, в частности диизопропиламида лития.
Соединения общей формулы (III), исходя из патента №2404971, 27.11.2010, могут быть получены из полупродуктов (VI) и (IV) с использованием металлирующего реагента, например дизопропиламида лития, в частности, получаемого in situ из бутиллития и дизопропиламина в подходящем растворителе, предпочтительно эфирного типа, например, таких как тетрагидрофуран (ТГФ), диэтиловый эфир, диизопропиловый эфир, метилтретбутиловый эфир и их смеси, а также смеси с другими растворителями или сорастворителями (Схема 1). Все радикалы имеют определения, как в формуле (III). Реакция может быть легко проведена в интервале температур от -70 до +20°С, предпочтительно от -70 до -20°С.
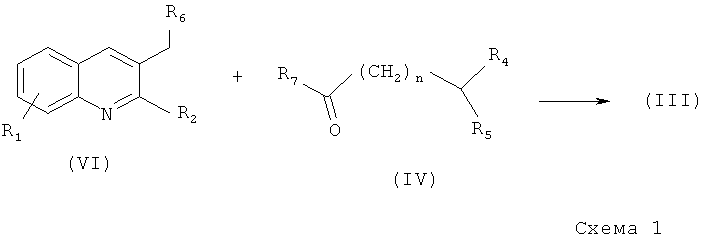
Образовавшаяся в ходе реакции смесь диастереомеров может быть разделена с использованием известных методов, таких как хроматография или кристаллизация диастереомерных солей.
Наличие в положении R2 атома хлора при прочих равных не критично сказывается на цитостатической активности полученных соединений в отношении микобактерий, в то время как их химический синтез упрощается на одну стадию, что сказывается на практическом выходе целевых продуктов.
В то же время наличие двух галоидных заместителей в хинолином ядре является причиной низкой растворимости соответствующих арилхинолинов в ряду растворителей, применяемых в металлоорганической химии (таких как ТГФ, диэтиловый эфир), результатом чего является слабая воспроизводимость условий процесса литирования при масштабировании реакции, сопровождаемая, как правило, низкими выходами конечных соединений.
Задача настоящего изобретения заключается во введении в хинолиновое ядро арилхинолина вместо атома галогена, электронодонорных заместителей с целью увеличения растворимости полупродуктов общей формулы (VI) в ТГФ при температурах ниже -50°С, а также получении новых соединений формулы (I) с повышенным воспроизводимым практическим выходом, а также с улучшенной противобактериальной активностью.
Итак, технической задачей изобретения является получение новых соединений - производных хинолина [общей формулы (I)] с воспроизводимым практическим выходом, обладающих повышенной противобактериальной активностью, а также их фармацевтически приемлемых солей с кислотами, что выражается в расширении арсенала средств для лечения туберкулеза и других инфекционных заболеваний микобактериальной природы.
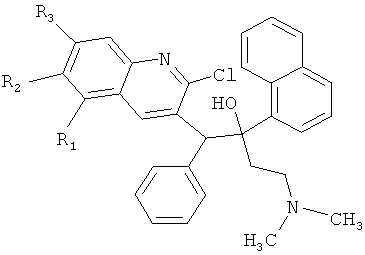
Технический результат достигается получением замещенных производных 1-(2-хлорхинолин-3-ил)-4-диметиламино-2-(нафталин-1-ил)-1-фенилбутан-2-олов, обладающих антимикобактериальной активностью, а именно таких производных хинолина, как 5,6,7-защищенные 1-(2-хлорхинолин-3-ил)-4-диметиламино-2-(нафталин-1-ил)-1-фенилбутан-2-олы общей формулы (I)
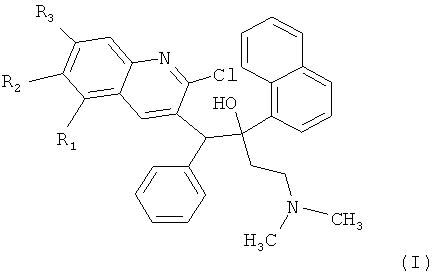
где R1 означает Н,
R2+R3 означает -O-(СН2)n-O-, где n=1-2, что образует
дополнительные диоксановый и 1,3-диоксолановый циклы, а также их формацевтически приемлемые соли с кислотами.
Конкретными примерами, отвечающими общей формуле (I), являются соединения, приведенные ниже:
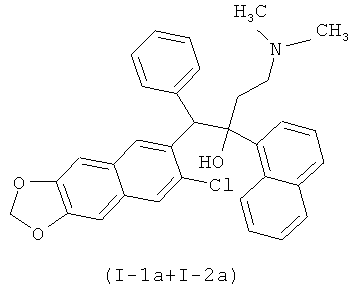
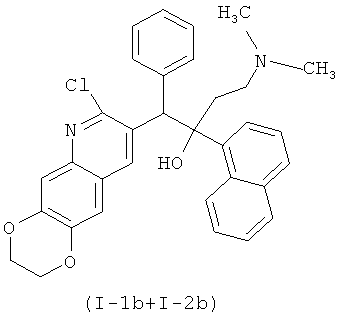
Изобретение также относится к способу получения указанных новых замещенных производных 1-(2-хлорхинолин-3-ил)-4-диметиламино-2-(нафталин-1-ил)-1-фенилбутан-2-олов, обладающих антимикобактериальной активностью, путем взаимодействия замещенных 2-арилметилхинолинов, например, общей формулы (VI)
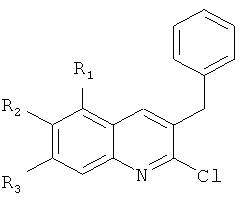
где R1-R3 означают указанные выше значения;
и 2-(N,N)-диметиламиноэтил-1-нафтилкетона (IV)
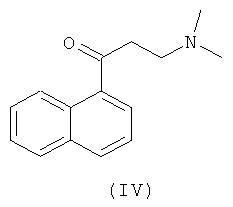
в среде органического растворителя под действием металлирующих агентов в виде органических амидов металлов при температурах в диапазоне от -70 до +20°С в течение 1-3 часов. В способе получения указанных замещенных хинолинов общей формулы (I) по изобретению в качестве металлирующих агентов могут быть использованы органические амиды металлов, такие как диизопропиламид лития, диэтиламид лития, 2,2,6,6-тетраметилпиперидид лития и.т.д.
Фармацевтически приемлемые соли с кислотами указанных замещенных производных хинолинов общей формулы (I) характеризуются тем, что содержат терапевтически активные нетоксичные солевые формы, образуемые соединениями формулы (I), с кислотами. Указанные соли с кислотами могут быть получены обработкой веществ в виде свободных оснований, представленных формулой (I), подходящими неорганическими и органическими кислотами.
Такими кислотами являются, например, хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, уксусная кислота, пропионовая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфокислота, п-толуолсульфоновая кислота, цикламовая кислота, салициловая кислота, п-аминосалициловая кислота.
Было обнаружено, что соединения по изобретению имеют антимикобактериальную активность, в связи с чем могут быть использованы для лечения инфекционных заболеваний, вызываемых Mycobacterium tuberculosis, в частности, могут быть применены в качестве биологически активного компонента (действующего начала) при получении лекарственных препаратов (средств) для лечения туберкулеза, то есть для получения противотуберкулезных лекарственных средств.
Общее описание синтеза
Соединения по изобретению формулы (I) могут быть получены из промежуточного соединений формулы (VI) и промежуточного соединения формулы (IV) с использованием металлирующего реагента, такого как диэтиламид лития, в частности получаемого in situ из н-бутиллития и диэтиламина в подходящем растворителе, таком как ТГФ, диэтиловый эфир, диизопропиловый эфир, метилтретбутиловый эфир и их смесях, а также в смесях с другими растворителями и сорастворителями (Схема 2). Все радикалы имеют определения, как в формуле (I). Реакцию проводят в диапазоне температур от -70 до +20°С, предпочтительно при -70°С в течение 1 -3 часов.

Образованная в результате реакции смесь диастереомеров (I-1+I-2) может быть разделена с использованием известных методов, таких как хроматография или кристаллизация диастереомерных солей.
Исходные соединения и промежуточные продукты формул (VI) и (IV) являются соединениями, которые либо коммерчески доступны, либо могут быть получены обычными методами, известными в литературе [D.Mabire, et al., Med. Chem., 2005, 48, 2134-2153].
Например, промежуточные соединения формулы (I) могут быть получены по схеме 3:

где R1 означает Н,
R2+R3 означает -O-(СН2)n-O-, где n=1-2, что образует дополнительные диоксановый и 1,3-диоксолановый циклы.
Синтез по представленной схеме включает стадию (а), в которой замещенный ариламин подвергают взаимодействию с 3-фенилпропионовой кислотой в присутствии подходящих катализатора (сильная кислота Льюиса) и инертного растворителя, такого как бензол или толуол. Процесс проводят в интервале температур от 20 до 110°С, предпочительно при кипении реакционной массы.
На следующей стадии (b) продукт присоединения, полученный на стадии (а), подвергают взаимодействию с хлорокисью фосфора (POCl3) в присутствии N,N-диметилформамида (формилирование по Вильсмейеру-Хааку с последующей циклизацией). Реакция может быть осуществлена в интервале температур от 20 до 80°С, предпочтительно при 75°С.
Продукты реакций (а) и (b) могут быть выделены в индивидуальном виде и очищены при помощи экстракции, кристаллизации или хроматографии. Продукты реакции (I), существующие в виде диастереомеров, могут быть очищены методом хиральной препаративной высокоэффективной жидкостной хроматографии.
Нижеследующие примеры поясняют данное изобретение без его ограничения.
А. Получение промежуточных соединений (общий метод)
Пример 1
Получение промежуточного соединения (Va).

К смеси 123 г (0,9 моль) 3,4-(метилендиокси)анилина и 135 г (0,9 моль) 3-фенилпропановой кислоты добавляют 200 мл бензола, 7,01 г (0,05 моль) эфирата трехфтористого бора или 5 г (0,08 моль) борной кислоты и кипятят при перемешивании в течение 5 часов. Полученный продукт охлаждают, отфильтровывают, промывают толуолом, ректифицированным спиртом и водой. Сушат до постоянной массы. Практический выход промежуточного соединения (Va) - 224 г (92,5%).
Пример 1'
Получение соединения (VIa)
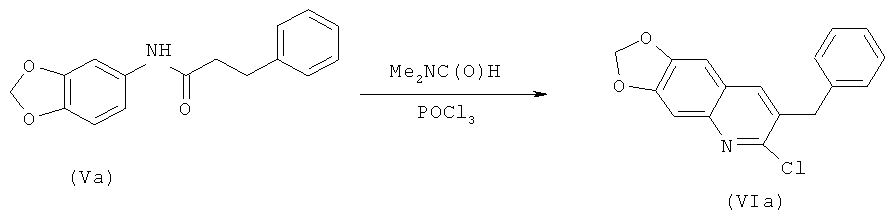
К охлажденной до 10°С смеси 79 г (1,08 моль) диметилформамида и 160 г (0,59 моль) промежуточного соединения (Va) в 600 мл хлороформа добавляют по каплям 274 мл (451,6 г, 2,95 моль) хлорокиси фосфора, после чего полученный раствор кипятят в течение ночи. Охладив до комнатной температуры, реакционную массу затем выливают в смесь воды со льдом, органический слой промывают водным раствором Na2CO3, дистиллированной водой, сушат над MgSO4, фильтруют и растворитель отгоняют в вакууме. Остаток кристаллизуют из метанола. Практический выход промежуточного соединения (VIa) - 93 г (53%).
Пример 2
Получение соединения (IV)
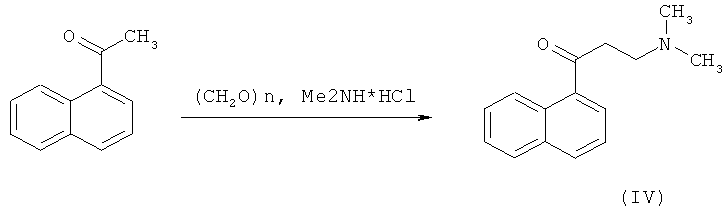
Смесь 340 г (2 моль) 1-ацетилнафталина, 56 г (1,86 моль) параформа и 200 г (2,07 моль) гидрохлорида диметиламина в 700 мл дихлорэтана кипятят 1,5 часа, охлаждают до комнатной температуры, отфильтровывают выпавший осадок, обрабатывают его водным аммиаком и диэтиловым эфиром. Органический слой промывают водой, сушат над MgSO4, фильтруют и растворитель отгоняют досуха. Выход промежуточного соединения (IV) - 335 г (79%).
Б. Получение соединений по изобретению
Пример 3. 1-(6,7-(метилендиокси)-2-хлор-хинолин-3-ил)-4-диметиламино-2-(1-нафтил-ил)-1-фенил-бутан-2-ол (I-1a+I-2а).
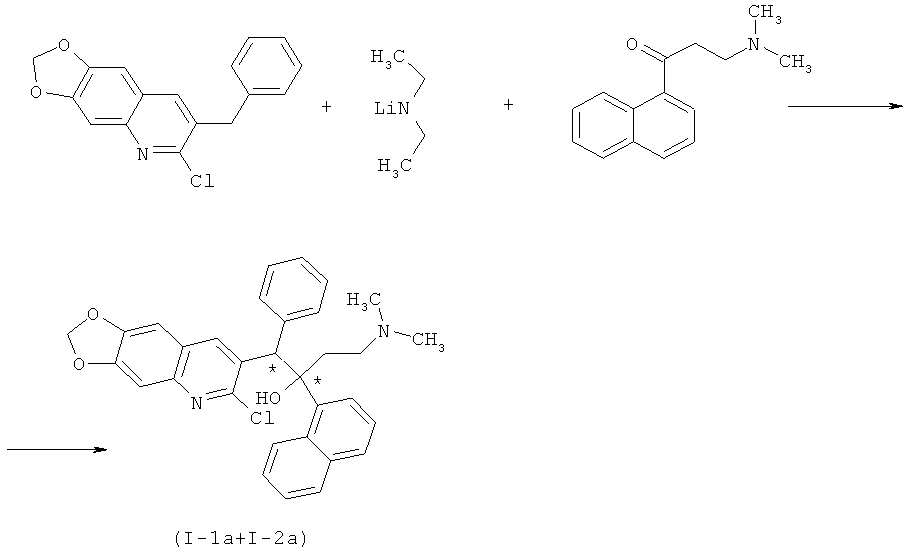
К охлажденному до -30°С раствору 180 г (0,79 моль) промежуточного нафтилкетона (IV) в 2 л абсолютированного ТГФ в токе аргона присыпают 51,3 г (0,65 моль) диэтиламида лития. Смесь перемешивают 1 час, охлаждают до -70°С и прикапывают 129 г (0,43 моль) промежуточного арилхинолина (VIa) в 500 мл ТГФ. Смесь выдерживают 30 минут, далее отогревают до 20°С, после чего добавляют 120 мл ледяной уксусной кислоты. Отогретую до комнатной температуры реакционную массу упаривают досуха, растворяют в хлороформе, промывают несколько раз водой. Органический слой сушат над MgSO4, а растворитель отгоняют. Целевые продукты (I-1а и I-2а) в виде отдельных диастереоизомерных пар выделяют при помощи препаративной высокоэффективной жидкостной хроматографии. Практический выход смеси ацетатов диастереомерных пар (I-1a+I-2а) в соотношении 1:1 составил 74,2 г (29,5%).
Полученные соединения в виде диастереомерных пар на отдельные энантиомеры на разделяли. При этом арабское обозначение "1" соединения характеризует диастереомерную пару с минимальным временем удерживания на хроматографической системе (RRSS-конфигурация диастереомерного центра), в то время как обозначение "2" характеризует диастереомерную пару с RSSR-конфигурацией, и, соответственно, максимальным временем удерживания.
Соединения (I-1b+I-2b) были получены путем, аналогичным описанному для (I-1a+I-2а). Практические выходы синтезированных веществ, а также их масс-спектральные характеристики приведены в нижеследующей табл.1:
|
Описание методики определения антибактериальной активности полученных соединений
Антимикобактериальное действие приведенных в табл.1 соединений изучали по динамике роста штамма М.tuberculosis H37Rv в обогащенной жидкой среде Middlebrook 7H9 в присутствии различных концентраций (0,312 мкг/мл, 0,625 мкг/мл, 1,25 мкг/мл, 2,5 мкг/мл, 5 мкг/мл, 10 мкг/мл, 20 мкг/мл, 40 мкг/мл) по сравнению с ростом этих штаммов на среде, не содержащей соединений, и среде, содержащей препарат 1-го ряда рифампицин в тех же концентрациях.
Микобактериальная суспензия засевалась в количестве 105 КОЕ/мл. Каждую из концентраций, включая контрольные пробирки без соединения и пробирки с рифампицином, исследовали в трипликатах.
Детекцию роста культуры микобактерий проводили с помощью автоматизированной системы учета роста культур Bactec MGIT 960 (Becton Dickenson, USA) в специальных пробирках MGIT, содержащих связанный флюорофор под полупроницаемой мембраной на дне пробирки. Детекция роста микобактериальных культур проводилась каждый час с помощью программного обеспечения Epicenter (Becton Dickenson, USA). Динамика деления микобактериальных клеток выражалась в относительных единицах флюоресценции (ОЕФ).
Время проведения эксперимента составило 42 дня, согласно протоколу Becton Dickinson. После этого все выросшие культуры были подвергнуты контролю на видовую специфичность (принадлежность к микобактериям туберкулеза).
Бактериостатическую активность соединения оценивали:
1) по задержке начала роста культуры по сравнению с контролем без препаратов;
2) по продолжительности фазы активного деления.
Результаты исследования вышеназванных соединений на антимикобактериальную активность, выраженные в единице MIC100, приведены в табл.2:
|
Из приведенных в табл.2 результатов видно, что соединения (I-2а) и (I-2b) проявили достаточно высокую противотуберкулезную активность в отношении штамма микобактерии H37Rv, сравнимую (одного порядка) с таковой при использовании рифампицина (1 мкг/мл). Полученные результаты является основанием для дальнейших испытаний выделенных веществ на зараженных животных с последующим их применением в качестве действующего начала новых и перспективных противотуберкулезных препаратов.