Результат интеллектуальной деятельности: ДИАМИДЫ 2,2'-БИПИРИДИЛ-6,6'-ДИКАРБОНОВЫХ КИСЛОТ И СПОСОБ ИХ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к способу синтеза диамидов 4,4′-дизамещенных 2,2′-бипиридил-6,6′-дикарбоновых кислот в качестве компонента экстракционных смесей для выделения актинидов из жидких радиоактивных отходов. Эти соединения получены впервые и их синтез осуществлен с высокими выходами.
Предпосылки создания изобретения
На фоне быстрого роста энергопотребления и истощения запасов всех видов ископаемого топлива в последние десятилетия атомная энергетика становится доминирующей энерготехнологией мира. Но на ее пути стоит ряд серьезных препятствий. Прежде всего это техногенные риски, возникающие при авариях на АЭС, ярким подтверждением чему являются последние события на АЭС Фукусима-1 в Японии. Однако, по мнению ведущих экспертов, в долговременной перспективе более значимыми являются угрозы, связанные с накоплением большого количества радиоактивных отходов (РАО), возникающих при переработке отработавшего ядерного топлива. В связи с этим создание новых технологий безопасной для окружающей среды переработки, утилизации и долговременного захоронения РАО стало главной задачей ядерной энергетики во всех ведущих странах мира.
При переработке радиоактивного топлива образуется значительное количество жидких радиоактивных отходов (ЖРО), которые наряду с ураном и трансурановыми элементами содержат продукты деления и ряд стабильных изотопов. В растворах ЖРО присутствуют различные нерадиоактивные продукты распада, такие как молибден и редкоземельные элементы (лантан, церий, празеодим, европий, самарий и гадолиний). Выделение некоторых из них представляет интерес для дальнейшего их использования в медицине и научных исследованиях. Утилизация высокоактивных отходов, захоронение в виде устойчивых матриц или трансмутация в ядерном реакторе также предполагает предварительное глубокое разделение радионуклидов. Промышленно используемые методы разделения включают экстракцию жидких радиоактивных отходов, большая часть которых представляют собой азотнокислые растворы, поэтому актуальной задачей является создание соединений, обладающих как высокой селективностью, так и устойчивостью к действию агрессивных химических сред и излучений. К числу таких структур относятся амиды 2,2-бипиридил-6,6-дикарбоновых кислот.
Наиболее близким к данному изобретению является синтез амида 2,2-бипиридил-6,6-дикарбоновой кислоты с N-этиланилином, описанный Alyapyshev, М.; Babain, V.; Borisova, N.; Eliseev, I.; Kirsanov, D.; Kostin, A.; Legin, A.; Reshetova, M.; Smirnova, Z., 2,2′-Dipyridyl-6,6′-dicarboxylic acid diamides: Synthesis, complexation and extraction properties. Polyhedron 2010, 29 (8), 1998-2005 и Alyapyshev, M.Y.; Babain, V.A.; Borisova, N.E.; Kiseleva, R.N.; Safronov, D.V.; Reshetova, M.D., New systems based on 2,2′-dipyridyl-6,6′-dicarboxylic acid diamides for Am-Eu separation. Mendeleev Communications 2008, 18 (6), 336-337. Однако описанный в данных статьях синтез не позволил получать амиды 2,2-бипиридил-6,6-дикарбоновой кислоты, содержащие заместители как в пиридиновых кольцах, так и содержащих заместители в фенильных кольцах амидных групп.
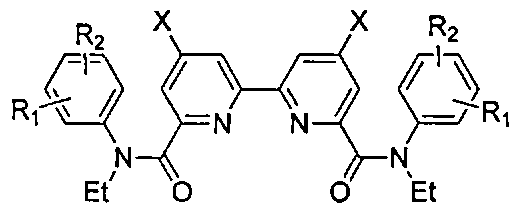
Целью изобретения является способ синтеза нескольких замещенных амидов 2,2-бипиридил-6,6-дикарбоновой кислоты общей формулы:
для выделения актинидов из жидких радиоактивных отходов и синтез 4,4′-дизамещенных 2,2′-бипиридил-6,6′-дикарбоновых кислот.
Сущность изобретения
Поставленная цель достигается настоящим изобретением.
Настоящее изобретение представляет собой способ получения
N,N′-диэтил-N,N′-дифенил-2,2′-бипиридин-6,6′-дикарбоксамида формулы C28H26N4O2 и структуры:

N,N′-диэтил-N,N′-дифенил-4,4′-дибром-2,2′-бипиридин-6,6′-дикарбоксамида формулы C28H24Br2N4O2 и структуры:

N,N′-диэтил-N,N′-бис(4-н-гексилфенил)-2,2′-бипиридин-6,6′-дикарбоксамида формулы C40H48Br2N4O2 и структуры:

N,N′-диэтил-N,N′-бис(4-н-гексилфенил)-4,4′-дибром-2,2′-бипиридин-6,6′-дикарбоксамида формулы C40H48Br2N4O2 и структуры:

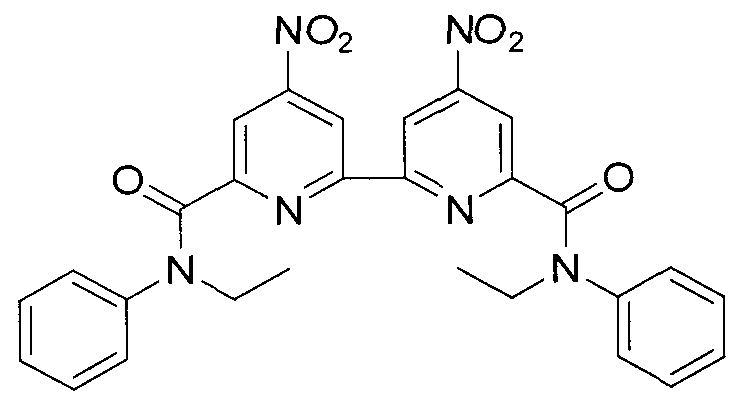
N,N′-диэтил-N,N′-дифенил-4,4′-динитро-2,2′-бипиридин-6,6′-дикарбоксамида формулы C28H24N6O6 и структуры:
N,N′-диэтил-N,N′-биc(4-изoпpoпилфeнил)-2,2′-бипиpидин-6,6′-дикapбoкcaмида формулы C34H38N4O2 и структуры:

N,N′-диэтил-N,N′-бис(4-этилфенил)-2,2′-бипиридин-6,6′-дикарбоксамида формулы С32Н34N4O2 и структуры:

N,N′-диэтил-N,N′-бис(4-этоксифенил)-2,2′-бипиридин-6,6′-дикарбоксамида формулы C32H34N4O4 и структуры:

N,N′-диэтил-N,N′-бис(2,4-диметилфенил)-2,2′-бипиридин-6,6′-дикарбоксамида формулы C32H34N4O2 и структуры:

N,N′-диэтил-N,N′-бис(2,5-диметилфенил)-2,2′-бипиридин-6,6′-дикарбоксамида формулы C32H34N4O2 и структуры:

N,N′-диэтил-N,N′-биc(3,4-димeтилфeнил)-2,2′-бипиpидин-6,6′-дикapбoкcaмида формулы C32H34N4O2 и структуры:

N,N′-диэтил-N,N′-биc(3-фтopфeнил)-2,2′-бипиpидин-6,6′-дикapбoкcaмида формулы C28H24F2N4O2 и структуры:

N,N′-диэтил-N,N′-биc(4-фтopфeнил)-2,2′-бипиpидин-6,6′-дикapбoкcaмида формулы C28H24F2N4O2 и структуры:

N,N′-диэтил-N,N′-бис(2-фторфенил)-2,2′-бипиридин-6,6′-дикарбоксамида формулы C28H24F2N4O2 и структуры:

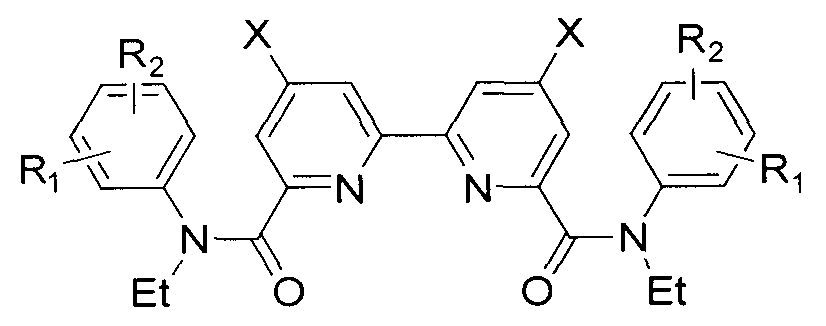
В способе получения амидов 2,2′-бипиридил-6,6′-дикарбоновых кислот, согласно изобретению, 6,6′-диметил-2,2′-бипиридилы обрабатывают хромовым ангидридом в серной кислоте и получают 4,4′-дизамещенные 2,2′-бипиридил-6,6′-дикарбоновые кислоты, которые смешивают с хлористым тионилом, а затем с аминами и получают целевые продукты.
Для синтеза амидов 2,2′-бипиридил-6,6′-дикарбоновых кислот предложена следующая схема:
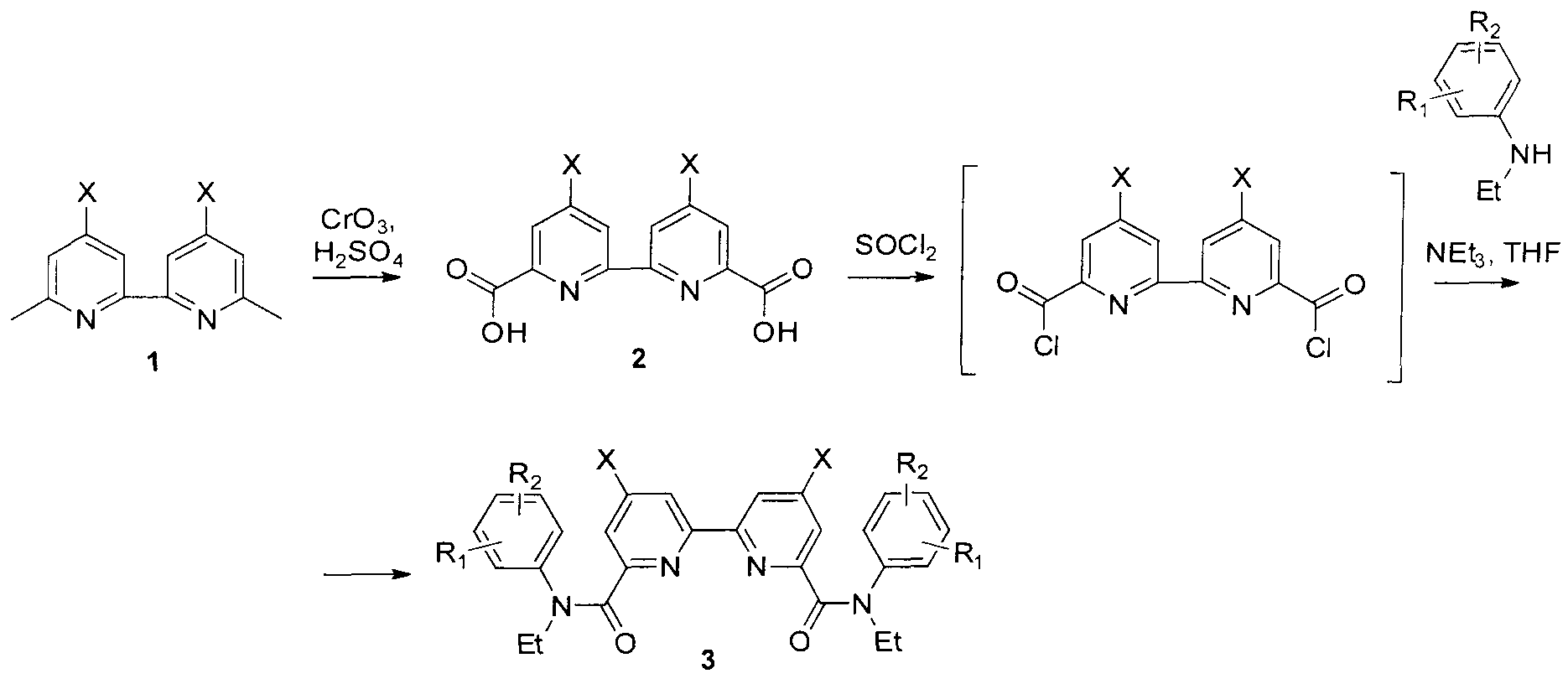
Окислением хромовым ангидридом в серной кислоте 6,6′-диметил-2,2′-бипиридилов 1 получены кислоты 2. На их основе обработкой хлористым тионилом при кипячении в присутствии каталитических количеств диметилформамида получены хлорангидриды 2,2′-бипиридил-6,6′-дикарбоновых кислот, которые были непосредственно введены в реакцию с замещенными анилинами в тетрагидрофуране в присутствии триэтиламина, приводящую к ранее не описанным амидам 2,2′-бипиридил-6,6′-дикарбоновых кислот. Постадийный метод синтеза амидов 2,2′-бипиридил-6,6′-дикарбоновых кислот описан ниже.
Синтез 2,2′-бипиридил-6,6′-дикарбоновой кислоты (2 X=H). Исходный 6,6′-диметил-2,2′-бипиридил (13.8 г, 0.075 моль) растворяли при 50°C в 150 мл концентрированной серной кислоты и порциями вносили 37.5 г (0.375 моль) хромового ангидгида, следя за тем, чтобы температура не поднималась выше 75°C. Полученный раствор перемешивали 2 ч при 70°C и выливали в 300 мл льда. Выпавший осадок отфильтровывали, промывали на фильтре водой, этанолом и диэтиловым эфиром, после чего высушивали на воздухе. Получали 4.8 г (80%) целевой дикислоты (81%) в виде белого порошка. Тпл 274-275°C (с разл.). Спектр ЯМР 1H (DMSO-d6, δ, м.д, J/Гц): 8.91 (уш.с, 2Н); 8.29 (уш.с, 2Н).
Синтез 4,4′-дибром-2,2′-бипиридил-6,6′-дикарбоновой кислоты (2 X=Br). Исходный 4,4′-дибром-6,6′-диметил-2,2′-бипиридил (5 г, 0.015 моль) растворяли при 50°C в 70 мл концентрированной серной кислоты и порциями вносили 7.5 г (0.075 моль) хромового ангидрида, следя за тем, чтобы температура не поднималась выше 75°C. Полученный раствор перемешивали 2 ч при 70°C и выливали в 300 мл льда. Выпавший осадок отфильтровывали, промывали на фильтре водой, этанолом и диэтиловым эфиром, после чего высушивали на воздухе. Получали 14.64 г (80%) целевой дикислоты в виде белого порошка. Тпл 274-275°C (с разл.). Спектр ЯМР 1Н (DMSO-d6, δ, м.д, J/Гц): 8.85 (уш.д, 2Н, 9.30); 8.17 (м, 4Н).
Синтез 2,2′-бипиридил-4,4′-динитро-6,6′-дикарбоновой кислоты (2 X=NO2). В стакан емкостью 250 мл вносили 3,7 г (0.0135 моль) 4,4′-динитро-6,6′-диметил-2,2′-бипиридила, 50 мл концентрированной серной кислоты, при перемешивании и охлаждении в ледяной бане малыми порциями добавляли 6 г (0.06 моль) оксида хрома (VI). Полученную смесь перемешивали при 70°C в течение 3 часов и выливали в лед. Образовавшийся осадок отфильтровывали, многократно промывали водой и высушивали на воздухе. Получали 3.4 г (0.010 моль, 74%) светло-серого твердого вещества. Спектр ЯМР 1H (DMSO-D6, δ, м.д.): δ 9,26 (с, 2Н); 8,66 (с, 2Н). Спектр ЯМР 13С (DMSO-D6 δ, м.д.): 164,27; 155,89; 151,20; 149,48; 118,61; 116,96.
Синтез N,N′-диэтил-N,N′-дифенилдиамида 2,2′-бипиридил-6,6′-дикарбоновой кислоты (3 X=R1=R2=H). Исходную 2,2′-бипиридил-6,6′-дикарбоновую кислоту (1.5 г, 0.006 моль) кипятили в 10 мл хлористого тионила с добавлением 0.5 мл диметилформамида в течение 2.5 ч. Хлористый тионил удаляли отгонкой, оставшийся хлорангидрид высушивали в вакууме водоструйного насоса и растворяли в 15 мл абсолютного тетрагидрофурана. Полученный раствор при перемешивании порциями добавляли к смеси 1.82 г (0.015 моль) N-этиланилина и 3 мл триэтиламина в 15 мл абсолютного тетрагидрофурана. По окончании прибавления полученную смесь защищали от влаги воздуха хлоркальциевой трубкой, перемешивали в течение 5 ч при 50°C и оставляли на ночь. К реакционной массе добавляли 20 мл воды и отделяли органический слой. Водную фракцию экстрагировали диэтиловым эфиром (3×15 мл). Объединенные органические фракции промывали водой и высушивали над безводным сульфатом натрия. После упаривания растворителей к полученному темному маслу добавляли 2 мл этилацетата. Выпавший осадок отфильтровывали, промывали 3 мл холодного этилацетата, 2×3 мл гексана и высушивали на воздухе. Получали 2.13 г (0.0047 моль, 79%) белого вещества. Спектр ЯМР 1Н (CDCl3, δ, м.д, J/Гц): 7,62 (т, 3Н, 7.32); 7,12 (уш.м, 5Н); 4.02 (кв, 2Н, 6.97); 1,24 (т, 3Н, 6.97). Спектр ЯМР 13С (CDCl3, δ, м.д.): 168,68; 154.67; 153.57; 143.43; 136.88; 128.77; 127.55; 126.44; 124.21; 121.53; 45,51; 12.77. ИК-спектр (в.м.): 1639 (C=O), 1576 (C=N). Найдено, %: С 75.01, Н 6.12, N 12.58. Для C28H26N4O2 вычислено, %: С.74.65, Н 5.82, N 12.44.
Синтез N,N′-диэтил-N,N′-ди(4-гексилфенил)диамида 2,2′-бипиридил-6,6′-дикарбоновой кислоты (3 X=R1=H, R2=4-C6H13). Исходную 2,2′-бипиридил-6,6′-дикарбоновую кислоту (1.5 г, 0.006 моль) кипятили в 10 мл хлористого тионила с добавлением 0.5 мл диметилформамида в течение 2.5 ч. Хлористый тионил удаляли отгонкой, оставшийся хлорангидрид высушивали в вакууме водоструйного насоса и растворяли в 15 мл абсолютного тетрагидрофурана. Полученный раствор при перемешивании порциями добавляли к смеси 3.08 г (0.015 моль) 4-гексил-N-этиланилина и 4 мл триэтиламина в 15 мл абсолютного тетрагидрофурана. По окончании прибавления полученную смесь защищали от влаги воздуха хлоркальциевой трубкой, перемешивали в течение 5 ч при 40°C и оставляли на ночь. К реакционной массе добавляли 20 мл воды и отделяли органический слой. Водную фракцию экстрагировали диэтиловым эфиром (3×15 мл). Объединенные органические фракции промывали водой и высушивали над безводным сульфатом натрия. После упаривания растворителей к полученному темному маслу добавляли 2 мл этилацетата. Выпавший осадок отфильтровывали, промывали 3 мл холодного этилацетата, 2×3 мл гексана и высушивали на воздухе. Получали 2.67 г (0.0043 моль, 72%) белого порошка. Спектр ЯМР 1Н (CDCl3, δ, м.д, J/Гц): 7,61 (м, 6Н); 6.98 (уш.м, 8Н); 3.99 (кв, 4Н, 7.05); 2.47 (т, 4Н, 7.83); 1.47 (т.т, 4Н, 6.93, 7.09); 1.27 (м, 18Н); 0.97 (т, 6Н, 6.97). Спектр ЯМР 13С (CDCl3, δ, м.д.): 167.13; 153.31; 151.68; 140.95; 136.25; 135.21; 128.18; 127.00; 123.592; 121.06; 45.07; 34.82; 31.04; 30.57, 28.29; 21.93, 13.34; 12.41. ИК-спектр (в.м.): 1641. (C=O), 1570 (C=N). Найдено, %: С 77.58, Н 8.24, N 9.19. Для C40H50N4O2 вычислено,%: С 77.67, Н 8.14, N. 9.05.
Синтез N,N′-диэтил-N,N′-ди(4-этилфенил)диамида 2,2′-бипиридил-6,6′-дикарбоновой кислоты (3 X=R1=H, R2=Et). Исходную 2,2′-бипиридил-6,6′-дикарбоновую кислоту (1.5 г, 0.006 моль) кипятили в 10 мл хлористого тионила с добавлением 0.5 мл диметилформамида в течение 2.5 ч. Хлористый тионил удаляли отгонкой, оставшийся хлорангидрид высушивали в вакууме водоструйного насоса и растворяли в 15 мл абсолютного тетрагидрофурана. Полученный раствор при перемешивании порциями добавляли к смеси 2.24 г (0.015 моль) 4-этил-N-этиланилина и 3.5 мл триэтиламина в 15 мл абсолютного тетрагидрофурана. По окончании прибавления полученную смесь защищали от влаги воздуха хлоркальциевой трубкой, перемешивали в течение 5 ч при 40°C и оставляли на ночь. К реакционной массе добавляли 20 мл воды и отделяли органический слой. Водную фракцию экстрагировали диэтиловым эфиром (3×15 мл). Объединенные органические фракции промывали водой и высушивали над безводным сульфатом натрия. После упаривания растворителей к полученному темному маслу добавляли 2 мл этилацетата. Выпавший осадок отфильтровывали, промывали 3 мл холодного этилацетата, 2×3 мл гексана и высушивали на воздухе. Получали 2.16 г (0.0043 моль, 71%) белого вещества. Спектр ЯМР 1Н (CDCl3, δ, м.д, J/Гц): 7,62 (ушир. м, 6Н); 7.00 (ушир. м, 8Н); 4.01 (кв, 4Н, CH2, 6.68); 2.51 (кв, 4Н, CH2, 6.67).; 1.27 (тр, 6Н, CH3, 6.68); 1.09 (тр, 6Н, CH3, 6.67). Спектр ЯМР 13С (CDCl3, δ, м.д.): 167.16; 153.38; 152.88; 142.19; 136.18; 135.84; 127.66; 127.12; 123.62; 121.03; 45.08; 27.74; 14.65; 12.44. ИК-спектр (в.м.): 1642 (С=O), 1575 (C=N). Найдено, %: С 76.00; Н 6.60; N 11.21. Для С32Н34Н4O2 вычислено, %: С 75.86, Н 6.76, N 11.06.
Синтез N,N′-диэтил-N,N′-ди(4-изoпpoпилфeнил)диaмидa 2,2′-бипиридил-6,6′-дикарбоновой кислоты (3 X=R1=H, R2=iPr). Исходную 2,2′-бипиридил-6,6′-дикарбоновую кислоту (1.5 г, 0.006 моль) кипятили в 10 мл хлористого тионила с добавлением 0.5 мл диметилформамида в течение 2.5 ч. Хлористый тионил удаляли отгонкой, оставшийся хлорангидрид высушивали в вакууме водоструйного насоса и растворяли в 15 мл абсолютного тетрагидрофурана. Полученный раствор при перемешивании порциями добавляли к смеси 2.45 г (0.015 моль) 4-изопропил-N-этиланилина и 3.5 мл триэтиламина в 15 мл абсолютного тетрагидрофурана. По окончании прибавления полученную смесь защищали от влаги воздуха хлоркальциевой трубкой, перемешивали в течение 4 ч при 50°C и оставляли на ночь. К реакционной массе добавляли 20 мл воды и отделяли органический слой. Водную фракцию экстрагировали диэтиловым эфиром (3×15 мл). Объединенные органические фракции промывали водой и высушивали над безводным сульфатом натрия. После упаривания растворителей к полученному темному маслу добавляли 2 мл этилацетата. Выпавший осадок отфильтровывали, промывали 3 мл холодного этилацетата, 2×3 мл гексана и высушивали на воздухе. Получали 2.05 г (0.0038 моль, 64%) белого вещества. Спектр ЯМР 1H (CDCl3, δ, м.д, J/Гц): 7,60 (ушир. д, 2Н); 7.55 (ушир. кв, 2Н); 7,42 (ушир. д, 2Н); 6.95 (ушир. м, 8Н);3.98 (кв, 4Н, CH2, 6.97); 2.71 (м, 2Н, CH, 5.28).; 1.23 (тр, 6Н, СН3, 6.97); 1.04 (д, 12Н, CH3, 5.28). Спектр ЯМР 13С (CDCl3, 6, м.д.): 170.43; 156.28; 150.09; 144.06; 139.57; 130.27; 129.52; 127.03;123.63; 121.88; 48.40; 36.40; 26.81; 11.04. ИК-спектр (в.м.): 1640 (C=O), 1576 (C=N). Найдено, %: С 76.49; Н 6.98; N 10.51. Для С34H38Н4O2 вычислено, %: С 76.37, Н 7.16, N 10.48.
Синтез N,N′-диэтил-N,N′-ди(2,4-диметилфенил)диамида 2,2′-бипиридил-6,6′-дикарбоновой кислоты (3 Х=Н, R1=R2=2,4-Me2). Исходную 2,2′-бипиридил-6,6′-дикарбоновую кислоту (1.5 г, 0.006 моль) кипятили в 10 мл хлористого тионила с добавлением 0.5 мл диметилформамида в течение 2.5 ч. Хлористый тионил удаляли отгонкой, оставшийся хлорангидрид высушивали в вакууме водоструйного насоса и растворяли в 15 мл абсолютного тетрагидрофурана. Полученный раствор при перемешивании порциями добавляли к смеси 2.24 г (0.015 моль) 2,4-диметил-N-этиланилина и 3.5 мл триэтиламина в 15 мл абсолютного тетрагидрофурана. По окончании прибавления полученную смесь защищали от влаги воздуха хлоркальциевой трубкой, перемешивали в течение 5 ч при 40°C и оставляли на ночь. К реакционной массе добавляли 20 мл воды и отделяли органический слой. Водную фракцию экстрагировали диэтиловым эфиром (3×15 мл). Объединенные органические фракции промывали водой и высушивали над безводным сульфатом натрия. После упаривания растворителей к полученному темному маслу добавляли 2 мл этилацетата. Выпавший осадок отфильтровывали, промывали 3 мл холодного этилацетата, 2×3 мл гексана и высушивали на воздухе. Получали 2.10 г (0.0041 моль, 69%) белого вещества. Спектр ЯМР 1Н (CDCl3, δ, м.д, J/Гц): 7,64 (м, 2Н); 7,60 (т, 2Н, 8.16); 7.53 (т, 2Н, 7.93); 6.91 (т., 2Н, 8.02), 6.87 (с. 2Н); 6.83 (д, 2Н, 7.06); 4.21 (д.д., 2Н, CH2, -13.59, 6.87); 3.54 (д.д., 2Н, CH2, -13.76, 6.79); 2.18 (с., 6Н, CH3); 2.16 (с., 6Н, CH3); 1,24 (м, 6Н, CH3. 7.11). Спектр ЯМР 13С (CDCl3, δ, м.д.): 167.06; 153.38; 152.93; 139.21; 136.44; 135.83; 134.68; 131.05; 128.52; 126.40; 123.18; 121.06; 45.41; 19.59; 19.17; 11,89. ИК-спектр (в.м.): 1645 (С=O), 1573 (C=N). Найдено, %: С 75.92, Н 6.83, N 11.26. Для С32Н34N4O2 вычислено, %: С 75.86, Н 6.76, N 11.06.
Синтез N,N′-диэтил-N,N′-ди(2,5-диметилфенил)диамида 2,2′-бипиридил-6,6′-дикарбоновой кислоты (3 X=H, R1=R2=2,5-Me2). Исходную 2,2′-бипиридил-6,6′-дикарбоновую кислоту (1.5 г, 0.006 моль) кипятили в 10 мл хлористого тионила с добавлением 0.5 мл диметилформамида в течение 2.5 ч. Хлористый тионил удаляли отгонкой, оставшийся хлорангидрид высушивали в вакууме водоструйного насоса и растворяли в 15 мл абсолютного тетрагидрофурана. Полученный раствор при перемешивании порциями добавляли к смеси 2.24 г (0.015 моль) 2,5-диметил-N-этиланилина и 3.5 мл триэтиламина в 15 мл абсолютного тетрагидрофурана. По окончании прибавления полученную смесь защищали от влаги воздуха хлоркальциевой трубкой, перемешивали в течение 5 ч при 40°C и оставляли на ночь. К реакционной массе добавляли 20 мл воды и отделяли органический слой. Водную фракцию экстрагировали диэтиловым эфиром (3×15 мл). Объединенные органические фракции промывали водой и высушивали над безводным сульфатом натрия. После упаривания растворителей к полученному темному маслу добавляли 2 мл этилацетата. Выпавший осадок отфильтровывали, промывали 3 мл холодного этилацетата, 2×3 мл гексана и высушивали на воздухе. Получали 2.16 г (0.0043 моль, 71%) белого вещества. Спектр ЯМР 1Н (CDCl3, δ, м.д, J/Гц): 7,68 (д, 2Н, 7.61); 7,60 (т, 2Н, 7.79); 7.51 (д, 2Н, 7.70); 6.91 (м, 4Н); 6.82 (д, 2Н, 7.61); 4.17 (д.т., 2Н, CH2, -13.71, 7.11); 3.63 (д.т., 2Н, CH2, -13.71, 7.11); 2.20 (уш.с, 3Н, CH3); 2.19 (уш.с, 3Н, CH3); 2.12 (с, 3Н, CH3); 2.10 (с, 3Н, CH3); 1,27 (т., 6Н, CH3, 7.11). Спектр ЯМР 13С (CDCl3, δ, м.д.): 169.91; 156.53; 150.86; 143.43; 138.77; 135.01; 132.62; 131,73; 125.48; 123.00; 120.96; 120.98; 48.88; 20.21; 18.28; 11.92. ИК-спектр (в.м.): 1643 (C=O), 1574 (C=N). Найдено: С, Н, N. Для C32H34N4O2 вычислено, %: С 75.86, Н 6.76, N 11.06.
Синтез N,N′-диэтил-N,N′-ди(3,4-диметилфенил)диамида 2,2′-бипиридил-6,6′-дикарбоновой кислоты (3 Х=Н, R1=R2=3,4-Me2). Исходную 2,2′-бипиридил-6,6′-дикарбоновую кислоту (1.5 г, 0.006 моль) кипятили в 10 мл хлористого тионила с добавлением 0.5 мл диметилформамида в течение 2.5 ч. Хлористый тионил удаляли отгонкой, оставшийся хлорангидрид высушивали в вакууме водоструйного насоса и растворяли в 15 мл абсолютного тетрагидрофурана. Полученный раствор при перемешивании порциями добавляли к смеси 2.24 г (0.015 моль) 3,4-диметил-N-этиланилина и 3.5 мл триэтиламина в 15 мл абсолютного тетрагидрофурана. По окончании прибавления полученную смесь защищали от влаги воздуха хлоркальциевой трубкой, перемешивали в течение 5 ч при 40°C и оставляли на ночь. К реакционной массе добавляли 20 мл воды и отделяли органический слой. Водную фракцию экстрагировали диэтиловым эфиром (3×15 мл). Объединенные органические фракции промывали водой и высушивали над безводным сульфатом натрия. После упаривания растворителей к полученному темному маслу добавляли 2 мл этилацетата. Выпавший осадок отфильтровывали, промывали 3 мл холодного этилацетата, 2×3 мл гексана и высушивали на воздухе. Получали 2.25 г (0.0044 моль, 74%) белого вещества. Спектр ЯМР 1Н (CDCl3, δ, м.д, J/Гц): 7.58 (м, 4Н); 7.53 (м, 2Н); 6.93 (с., 2Н); 6.85 (д, 2Н, 8.07); 6.70 (д, 2Н, 8.07); 3.99 (кв, 4Н, CH2, 7.39); 211 (c., 6H, CH3); 2.08 (с., 6Н, CH3); 1.24 (тр, 6Н, CH3, 7.39). Спектр ЯМР 13С (CDCl3, δ, м.д.): 167.60; 153.67; 153.15; 140.93; 137.11; 136.70; 135.84; 129.77; 128.71, 125; 124.03; 121.29; 44.34; 20,17; 17.39, 12.79 (CH2-CH3). ИК-спектр (в.м.): (C=N). Найдено, %: С 76.06, Н 6.62, N 11.37. Для С32Н34N4O2 вычислено, %: С 75.86, Н 6.76, N 11.06
Синтез N,N′-диэтил-N,N′-ди(4-этоксифенил)диамида 2,2′-бипиридил-6,6′-дикарбоновой кислоты (3 X=R1=H, R2=4-OEt). Исходную 2,2′-бипиридил-6,6′-дикарбоновую кислоту (1.5 г, 0.006 моль) кипятили в 10 мл хлористого тионила с добавлением 0.5 мл диметилформамида в течение 2.5 ч. Хлористый тионил удаляли отгонкой, оставшийся хлорангидрид высушивали в вакууме водоструйного насоса и растворяли в 15 мл абсолютного тетрагидрофурана. Полученный раствор при перемешивании порциями добавляли к смеси 2.48 г (0.015 моль) 4-этокси-N-этиланилина и 3.5 мл триэтиламина в 15 мл абсолютного тетрагидрофурана. По окончании прибавления полученную смесь защищали от влаги воздуха хлоркальциевой трубкой, перемешивали в течение 4 ч при 50°C и оставляли на ночь. К реакционной массе добавляли 20 мл воды и отделяли органический слой. Водную фракцию экстрагировали диэтиловым эфиром (3×15 мл). Объединенные органические фракции промывали водой и высушивали над безводным сульфатом натрия. После упаривания растворителей к полученному темному маслу добавляли 2 мл этилацетата. Выпавший осадок отфильтровывали, промывали 3 мл холодного этилацетата, 2×3 мл гексана и высушивали на воздухе. Получали 2.13 г (0.0039 моль, 66%) белого вещества. Спектр ЯМР 1Н (CDCl3, δ, м.д, J/Гц): 76.59 (м, 6Н); 6.96, 6.67 (2 уш.м, 8Н); 3.94 (кв, 4Н, 6.62); 3.84 (кв, 4Н, 5.94); 1.28 (т, 6Н, 6.62); 1.23 (т, 6Н, 5.94). Спектр ЯМР 13С (CDCl3, δ, м.д.): 167.35; 157.14; 153.47; 153.10; 136.93; 136.22; 128.43; 123.40; 120.87; 114.33; 63.21; 44.93; 14.13; 12.31.
Синтез N,N′-диэтил-N,N′-дифенилдиамида 4,4′-дибром-2,2′-бипиридил-6,6′-дикарбоновой кислоты (3 X=Br, R1=R2=H). Исходную 4,4′-дибром-2,2′-бипиридил-6,6′-дикарбоновую кислоту (2.5 г, 0.006 моль) кипятили в 15 мл хлористого тионила с добавлением 0.5 мл диметилформамида в течение 2.5 ч. Хлористый тионил удаляли отгонкой, оставшийся хлорангидрид высушивали в вакууме водоструйного насоса и растворяли в 15 мл абсолютного тетрагидрофурана. Полученный раствор при перемешивании порциями добавляли к смеси 1.82 г (0.015 моль) N-этиланилина и 3 мл триэтиламина в 15 мл абсолютного тетрагидрофурана. По окончании прибавления полученную смесь защищали от влаги воздуха хлоркальциевой трубкой, перемешивали в течение 5 ч при 50°C и оставляли на ночь. К реакционной массе добавляли 20 мл воды и отделяли органический слой. Водную фракцию экстрагировали диэтиловым эфиром (3×15 мл). Объединенные органические фракции промывали водой и высушивали над безводным сульфатом натрия. После упаривания растворителей к полученному темному маслу добавляли 2 мл этилацетата. Выпавший осадок отфильтровывали, промывали 3 мл холодного этилацетата, 2×3 мл гексана и высушивали на воздухе. Получали 2.37 г (0.039 моль, 65%) белого вещества. Спектр ЯМР 1Н (CDCl3, δ, м.д, J/Гц): 7,97 (д, 2Н, 3.02); 7,41 (д, 2Н, 3.02); 7,26 (уш.м, 3Н); 7.14 (уш.м, 1Н); 7.06 (уш.м, 2Н); 4.02 (к, 2Н, 6.85); 1,26 (т, 3Н, 6.85). Спектр ЯМР 13С (CDCl3, δ, м.д.): 165.12; 159.65; 148.54; 142.89; 134.29; 133.71128.81; 128.06; 126.99; 124.54; 45.61; 12.26. ИК-спектр (в.м.): 1642 (C=O), 1574 (C=N). Найдено, %: С 54.99, Н 4.15, N 9.52. Для C28H24Br2N4O2 вычислено, %: С 55.28, Н 3.98, N 9.21.
Синтез N,N′-диэтил-N,N′-ди(4-гексилфенил)диамида 4,4′-дибром-2,2′-бипиридил-6,6′-дикарбоновой кислоты (3 X=Br, R1=H, R2=4-C6H13). Исходную 4,4′-дибром-2,2′-бипиридил-6,6′-дикарбоновую кислоту (2.5 г, 0.006 моль) кипятили в 15 мл хлористого тионила с добавлением 0.5 мл диметилформамида в течение 2.5 ч. Хлористый тионил удаляли отгонкой, оставшийся хлорангидрид высушивали в вакууме водоструйного насоса и растворяли в 15 мл абсолютного тетрагидрофурана. Полученный раствор при перемешивании порциями добавляли к смеси 1.82 г (0.015 моль) N-этиланилина и 3 мл триэтиламина в 15 мл абсолютного тетрагидрофурана. По окончании прибавления полученную смесь защищали от влаги воздуха хлоркальциевой трубкой, перемешивали в течение 5 ч при 50°C и оставляли на ночь. К реакционной массе добавляли 20 мл воды и отделяли органический слой. Водную фракцию экстрагировали диэтиловым эфиром (3×15 мл). Объединенные органические фракции промывали водой и высушивали над безводным сульфатом натрия. После упаривания растворителей к полученному темному маслу добавляли 2 мл этилацетата. Выпавший осадок отфильтровывали, промывали 3 мл холодного этилацетата, 2×3 мл гексана и высушивали на воздухе. Получали 3.4 г (0.0044 моль, 73%) белого вещества. Спектр ЯМР 1Н (CDCl3, δ, м.д, J/Гц): 7,73 (д, 1Н, 1.84); 7.35 (д, 1Н, 1.84); 6.94 и 7.02 (AA′BB′, 4Н, 7.77, 7.42); 3.97 (кв, 2Н, 6.71); 2.41 (т, 2Н, 7.42); 1.41 (т.т, 2Н, 6.36, 5.65); 1.21 (м, 9Н); 0.84 (т, 3Н, 6.36). Спектр ЯМР 13С (CDCl3, δ, м.д.): 165.40; 160.52; 150.37; 143.69; 137.73; 132.04; 131.87; 130.20; 128.02; 126.76; 45.43; 34.9; 31.14; 30.62; 28.39; 22.08; 13.68; 12.27. ИК-спектр (в.м.): 1645 (C=O), 1577 (C=N). Найдено, %: С 62.03, Н 6.09, N 7.01. Для C40H48Br2N4O2 вычислено, %: С 61.86, Н 6.23, N 7.21.
Синтез N,N′-диэтил-N,N′-ди(2-фторфенил)амида 2,2′-бипиридил-6,6′-дикарбоновой кислоты (3 X=R1=H, R2=2-F). В круглодонную колбу объемом 100 мл, снабженную магнитной мешалкой и обратным холодильником с хлоркальциевой трубкой, вносили 2.0 г (0.0082 моль) 2,2′-бипиридил-6,6′-дикарбоновой кислоты, 20 мл хлористого тионила и 0.1 мл диметилформамида. Реакционную смесь кипятили в течение 3 часов. Упаривали избыток хлористого тионила на водяной бане при уменьшенном давлении. Сухой остаток растворяли в 30 мл абсолютного тетрагидрофурана, полученный раствор вносили при интенсивном перемешивании в предварительно приготовленную смесь из 3 г (0.021 моль) N-этил-2-фторанилина, 4 г (0.040 моль) триэтиламина и 50 мл тетрагидрофурана. При этом наблюдалось выделение серо-коричневого осадка. Колбу с реакционной массой нагревали с обратным холодильником при перемешивании в течение часа на водяной бане при температуре 50-60°C. После охлаждения к содержимому колбы добавляли 30 мл воды, отделяли органический слой, водную фазу экстрагировали диэтиловым эфиром (3×20 мл). Объединенные вытяжки высушивали над безводным сульфатом натрия, растворитель удаляли в вакууме. Из образовавшейся густой массы в течение получаса выкристаллизовывался продукт. Выпавший осадок отфильтровывали, промывали 3 мл холодного этилацетата, 2×3 мл гексана и высушивали на воздухе. Получали 2,6 г (0.00534 моль, 65%) мелкокристаллического вещества белого цвета. Спектр ЯМР 1Н (CDCl3, δ, м.д, J/Гц): 8,28-8,45 (м, 2Н); 7,24-7,47 (м, 12Н); 3,90 (кв, 4Н, НСН2, 7,21); 1,23 (тр, 6Н, СН3, 7,21). Спектр ЯМР 13С (СDСl3, δ, м.д.): 167.72; 156.56-159.04 (д, J=248,82 Гц); 153.09; 152.25; 137.05; 129,65; 128,50; 128,43; 124,12; 121,66; 121,66; 115.94; 45.09; 12.53. Спектр ЯМР 19F (CDCl3): 121,26 (с).
Синтез N,N′-диэтил-N,N'-ди(3-фторфенил)амида 2,2′-бипиридил-6,6′-дикарбоновой кислоты (3 X=R1=H, R2=3-F). В круглодонную колбу объемом 100 мл, снабженную магнитной мешалкой и обратным холодильником с хлоркальциевой трубкой, вносили 2.0 г (0.0082 моль) 2,2′-бипиридил-6,6′-дикарбоновой кислоты, 20 мл хлористого тионила и 0.1 мл диметилформамида. Реакционную смесь кипятили в течение 3 часов. Упаривали избыток хлористого тионила на водяной бане при уменьшенном давлении. Сухой остаток растворяли в 30 мл абсолютного тетрагидрофурана, полученный раствор вносили при интенсивном перемешивании в предварительно приготовленную смесь из 3 г (0.021 моль) N-этил-3-фторанилина, 4 г (0.040 моль) триэтиламина и 50 мл тетрагидрофурана. Колбу с реакционной массой нагревали с обратным холодильником при перемешивании в течение часа на водяной бане при температуре 50-60°C. После охлаждения к содержимому колбы добавляли 30 мл воды, отделяли органический слой, водную фазу экстрагировали диэтиловым эфиром (3×20 мл). Объединенные вытяжки высушивали над безводным сульфатом натрия, растворитель удаляли в вакууме. Из образовавшейся густой массы в течение получаса выкристаллизовывался продукт. Выпавший осадок отфильтровывали, промывали 3 мл холодного этилацетата, 2×3 мл гексана и высушивали на воздухе. Получали 3,1 г (0.0064 моль, 78%) мелкокристаллического вещества белого цвета. Спектр ЯМР 1Н (CDCl2, δ, м.д, J/Гц): 7,68 (м, 6Н); 7.12 (м, 2Н); 6,77-6,90 (м, 6Н); 4.01 (кв, 4Н, CH2, 6,97); 1,26 (тр, 6Н, CH3, 7.09). Спектр ЯМР 13С (CDCl3, δ, м.д.): 165.03; 161,52-163,92 (д, J=241,15 Гц); 153,37; 145.01; 137,25; 129,76; 124,50; 123,43; 119,39; 114,64; 111,20; 45,99; 12,85.
Синтез N,N′-диэтил-N,N′-ди(4-фторфенил)амида 2,2′-бипиридил-6,6′-дикарбоновой кислоты (3 X=R1=H, R2=4-F). В круглодонную колбу объемом 100 мл, снабженную магнитной мешалкой и обратным холодильником с хлоркальциевой трубкой, вносили 2.0 г (0.0082 моль) 2,2′-бипиридил-6,6′-дикарбоновой кислоты, 20 мл хлористого тионила и 0.1 мл диметилформамида. Реакционную смесь кипятили в течение 3 часов. Упаривали избыток хлористого тионила на водяной бане при уменьшенном давлении. Сухой остаток растворяли в 30 мл абсолютного тетрагидрофурана, полученный раствор вносили при интенсивном перемешивании в предварительно приготовленную смесь из 3 г (0.021 моль) N-этил-3-фторанилина, 4 г (0.040 моль) триэтиламина и 50 мл тетрагидрофурана. Колбу с реакционной массой нагревали с обратным холодильником при перемешивании в течение часа на водяной бане при температуре 50-60°C. После охлаждения к содержимому колбы добавляли 30 мл воды, отделяли органический слой, водную фазу экстрагировали диэтиловым эфиром (3×20 мл). Объединенные вытяжки высушивали над безводным сульфатом натрия, растворитель удаляли в вакууме. Из образовавшейся густой массы в течение получаса выкристаллизовывался продукт. Выпавший осадок отфильтровывали, промывали 3 мл холодного этилацетата, 2×3 мл гексана и высушивали на воздухе. Получали 2,65 г (0.00545 моль, 67%) мелкокристаллического вещества белого цвета. Спектр ЯМР 1Н (CDCl3, δ, м.д, J/Гц): 7,58-7,74 (м, 6Н); 7.07 (м, 4Н); 6,83-6,93 (м, 4Н); 3,98 (ушир. кв, 4H, CH2); 1,26 (тр, 6Н, CH3, 6,36). Спектр ЯМР 13С (CDCl3, δ, м.д.): 167,60; 159,94-162,40 (д, J=247,67 Гц); 153,74; 153,18; 139,54; 137.01; 129,48; 124,30; 121,43; 115,55; 45,68; 12,87. Спектр ЯМР 19F (CDCl3): 115,14 (с).
Синтез N,N′-диэтил-N,N′-дифениламида 2,2′-бипиридил-4,4′-динитро-6,6′-дикарбоновой кислоты (3 X=NO2, R1=R2=H). В круглодонную колбу объемом 100 мл, снабженную магнитной мешалкой и обратным холодильником с хлоркальциевой трубкой, вносили 2,7 г (0.0081 моль) 2,2′-бипиридил-4,4′-динитро-6,6′-дикарбоновой кислоты и 0.1 мл диметилформамида. Реакционную смесь кипятили в течение 3 часов. Упаривали избыток хлористого тионила на водяной бане при уменьшенном давлении. Сухой остаток растворяли в 30 мл абсолютного тетрагидрофурана, полученный раствор вносили при интенсивном перемешивании в предварительно приготовленную смесь из 2,5 г (0.021 моль) N-этиланилина, 4 г (0.040 моль) триэтиламина и 50 мл тетрагидрофурана. Колбу с реакционной массой нагревали с обратным холодильником при перемешивании в течение часа на водяной бане при температуре 50-60°C. После охлаждения к содержимому колбы добавляли 30 мл воды, отделяли органический слой, водную фазу экстрагировали диэтиловым эфиром (3×20 мл). Объединенные вытяжки высушивали над безводным сульфатом натрия, растворитель удаляли в вакууме. Из образовавшейся густой массы в течение получаса выкристаллизовывался продукт. Выпавший осадок отфильтровывали, промывали 3 мл холодного этилацетата, 2×3 мл гексана и высушивали на воздухе. Получали 2,75 г (0.00508 моль, 62%) мелкокристаллического вещества светло-серого цвета. Спектр ЯМР 1Н (CDCl3, δ, м.д, J/Гц): 8.52 (ушир. д, 2Н); 8.12 (ушир. д, 2Н); 7.26 (м, 6Н); 7.09 (м, 4Н); 4.06 (кв, 4Н, CH2); 1.29 (тр, 6Н, CH3, 7.09).