Результат интеллектуальной деятельности: КОЖА КОСМЕТИЧЕСКАЯ
Вид РИД
Изобретение
Область техники
Изобретение относится к медицине, а именно к пластической хирургии и косметологии, и может найти применение в качестве биопластического материала для регенерации поверхностных кожных слоев после инвазивных косметологических процедур и хирургической пластики.
Уровень техники
Разработка и изучение новых биодеградируемых пластических материалов с целью высокоэстетического восстановления клеточных кожных слоев является актуальной проблемой современной пластической хирургии и косметологии.
Современные эффективные методы косметологии и пластической хирургии являются инвазивными и основаны на ятрогенном повреждении определенных слоев эпидермиса и/или дермы. В ответ на повреждение происходит выброс огромного количества провоспалительных медиаторов, факторов роста, биологически активных веществ, что приводит к активизации защитных регенераторных механизмов, повышению метаболической и митотической активности базальных кератиноцитов, фибробластов. Ожидаемые эффекты от таких инвазивных процедур (улучшение микро- и макрорельефа, усиление синтеза эпидермальных липидов и внеклеточных структур дермального матрикса, повышение тургора, утолщение дермы) зависят в большей степени от глубины повреждения кожи и меньшей - от метода [29]. При этом важное значение имеет выбор оптимального средства для восстановления клеточных кожных слоев, чтобы достичь идеального эстетического результата [7].
В настоящее время после инвазивных косметологических процедур и пластических операций в зависимости от реакции кожи, от выраженности эритемы, шелушения, отека назначается специальный реабилитационный уход: нахождение в стационаре от 7 до 20 дней, назначение препаратов, содержащих антиоксиданты, репаранты (витамины A, E, F, Se, фитоэстрогены, биофлавоноиды, пантенол и пр.); увлажняющих средств (гиалуроновую кислоту, NMF); средств, смягчающих и восстанавливающих структуру эпидермального барьера (масло ши и др. растительные и минеральные масла) [20].
Период реабилитации является самым ответственным и важным этапом для достижения желаемого эстетического результата, поскольку даже самая блестяще проведенная пластическая операция может в итоге оказаться неудачной при появлении осложнений и плохом заживлении. На этапе реабилитации наблюдается следующее:
- Отечность кожи, ощущение натянутости - больше у представителей тонкой, ослабленной кожи:
- Потемнение кожи - ожидаемое изменение после пилинга;
- Раздражение и зуд, повышенная чувствительность;
- Выделения с поверхности кожи в зоне пилинга, гнойнички;
- Герпетические высыпания (покраснение, сильный зуд, пузырьки).
В подобных случаях срочно назначается противовоспалительная, противовирусная и общая терапия, иногда с госпитализацией в медицинские учреждения и клиники.
В последнее время активно идут исследования по разработке новых биопластических материалов, способных временно на период реабилитации выполнять роль поверхностного слоя кожи (защищать подлежащие слои от проникновения инфекции, высыхания; осуществлять газообмен и стимулировать регенеративные процессы по типу формирования биологического струпа).
Для восстановления целостности покровных тканей в мире применяются следующие современные биопластические материалы [4-19, 21-37].
- Apligraf (graftskin). Это пластический биоматериал, созданный компанией Organogenesis (США) на основе губчатой структуру коллагеновых волокон с дополнительным содержанием матричных белков и цитокинов. Данные компоненты ускоряют регенерацию тканей, но введенные дополнительные вещества становятся объектом иммунно-воспалительной реакции.
- Dermagraft. Данный биоматериал считается фибробластовым заменителем кожи. Управление по контролю за пищевыми продуктами и лекарственными препаратами (FDA), одобрившее маркировку Dermagraft, рекомендует использовать данный продукт в сочетании со стандартным режимом ведения раны. Dermagraft противопоказан в случае инфицирования язвы и наличия язвы со свищевым ходом.
- «OrCel - matrix», производимая Ortec International Inc. В данном биополимере используется принцип объемного построения на основе коллагеновых волокон. Фибриллы коллагена ориентированы в губчатом порядке, имеющем ячеистое строение. В ячейках предполагается размещение клеточных элементов. Подобная фиброархитектоника данного материала обеспечивает благоприятную окружающую среду для перемещения трансплантированных клеточных элементов. «OrCel - matrix» эффективно решает задачи клеточной миграции, но не поддерживает их митотическую активность и не является биорезорбируемым.
- Integra Dermal Regeneration Template, Integra Bilayer Wound Matrix и Integra Meshed Bilayer Wound Matrix компании Integra Life Sciences Holdings Corporation. «Integra» состоит из двух слоев: внутренний, представленный коллагеновым матриксом, и внешний, покрытый слоем хондроитин-6-сульфата. Коллагеновые фибриллы закреплены таким образом на поверхности полимерной основы хондроитина. Данная архитектоника является своего рода примитивным подобием базальной мембраны покровных тканей. Именно внутренняя сторона является биологически активной поверхностью для эффективной миграции клеточных элементов. Биоконструкция данного пластического материала является оптимальной для механической защиты раны и первичной клеточной миграции при ее заживлении. Однако материал не решает задачи естественной биорезорбции и развития иммунного ответа на внешний синтетический слой. Данный биоматериал показан для лечения пациентов с глубокими и обширными ожогами, имеющих ограниченное количество собственной кожи для аутотрансплантации либо не позволяющих создания новых кожных участков для трансплантации ввиду серьезности болезни.
- Alloderm. Alloderm и Alloderm-RTU (бесклеточный дермальный матрикс) показан для реконструктивной хирургии груди. Для всех других показаний Alloderm и Alloderm-RTU считаются экспериментальными и на стадии исследования (например, грыжесечения, снижения случаев развития синдрома Фрея после паротидэктомии и для использования в реконструкции верхних конечностей).
- Artiss. Это фибриновый наполнитель, необходимый для лечения пациентов с тяжелыми ожогами.
- Graftjacket Regenerative Tissue Matrix (матрикс регенеративной ткани). Данный биоматериал необходим для лечения глубоких диабетических язв стопы (продолжительность болезни более 3 недель), распространившихся на дерму, но не затронувших сухожилия, мышцы, суставную капсулу или кости.
По мнению большинства исследователей, самой успешной разработкой в мире является биополимер на основе химически модифицированной гиалуроновой кислоты - «HYAFF». «HYAFF» синтезирован в университете Padova (Италия) благодаря поддержке европейского консорциума с участием ученых из Италии, Бельгии, Германии, Великобритании и производится медико-биотехнологическим концерном Tissue Tech. Разработанный биополимер является уникальным носителем трансплантируемых клеточных элементов, так как благодаря содержанию гиалуроновой кислоты клетки в его структуре не только сохраняют жизнеспособность, но и способны проявлять митотическую активность. «HYAFF» создает оптимальные условия для миграции эпителиальных клеток.
Вышеперечисленные биопластические материалы имеют показания для восстановления дефектов глубоких повреждений кожи (ожоги, травмы, трофические язвы, раны), сообщений об использовании таких биоматериалов в период реабилитации после инвазивных косметологических процедур не отмечено.
Поэтому разработка новых биопластических материалов, по структуре максимально приближенных к строению поверхностного кожно-клеточного слоя и способных выполнять защитные свойства кожи, является актуальной в современной биоинженерии и медицине.
В литературе отмечено использование биопластического материала Hyamatrix в период реабилитации после механической шлифовки [1].
Прототипом данного изобретения является микронаноструктурированный биопластический материал (Патент РФ №2481127 от 21.02.2012 г.). Данный материал имеет торговое название «ГИАМАТРИКС®».
В основе технологии получения данного биопластического материала лежит методика фотохимического наноструктурирования смеси гиалуроновой кислоты и коллагена. В результате чего образуется микронанокаркасная конструкция, имеющая ячеистое строение. Подобная структурная организация макромолекул гиалуроновой кислоты и коллагена придает биоматериалу эластичность, повышенную адгезию, дренажные качества, прозрачность.
Однако полученная таким образом макромолекулярная структура биопластического материала в клинических условиях является недостаточно эффективной и является причиной для развития осложнений в периоде реабилитации после инвазивных процедур и пластических операций:
1. По структуре данный материал является монофазным, вследствие чего в условиях раневого процесса он образует однородное покрытие, превращаясь, таким образом, в сухой струп [2].
По отзывам клиницистов, однородный сухой биологический струп требует ежедневных перевязок с обязательным увлажнением струпа, поскольку сухой струп прочно спаивается с подлежащими тканями, данная процедура является травматичной для раны и болезненной для пациента. Данный факт в итоге приводит к затягиванию сроков реабилитации и уменьшению выраженности эстетического эффекта.
2. Сложная микронаноструктурная организация биоматериала обуславливает формирование объемной губчато-ячеистой структуры, которая значительно отличается от ламинарного построения кожно-клеточных слоев. В итоге фиброархитектоника материала Гиаматрикс значительно отличается от гистологического строения кожи. В связи с этим данный биоматериал не способен полноценно замещать кожу после инвазивных косметологических процедур и пластических операций.
3. Монофазная микронаноструктурная организация биоматериала не обеспечивает эффективного дренирования раневого отделяемого и приводит к скоплению жидкости под биоматериалом, из-за чего необходимо при перевязках дополнительно материал перфорировать скальпелем и формировать в нем дренажные окна [3]. Подобные манипуляции «тревожат» рану в периоде реабилитации.
4. При клиническом применении Гиаматрикса установлено, что при формировании сухого монофазного струпа материал перестает быть газопроницаемым, в результате чего в подлежащих слоях кожи нарушается газохимическая среда, что приводит к нарушению полноценной эпителизации и снижению эстетического результата операции.
Таким образом, микронаноструктурирование биопластического материала Гиаматрикс обуславливает формирование оптимальных биоинженерных свойств (адгезия, прозрачность), но не обеспечивает благоприятного течения периода реабилитации после инвазивных косметологических процедур и пластических операций и может стать причиной осложнений.
Краткое описание изобретения
Указанные недостатки возможно устранить путем разработки новой рецептуры получения биоматериала и изменения ключевых физико-химических параметров, обеспечивающих формирования структуры биоматериала, сходной с фиброархитектоникой наружных клеточных слоев кожи.
Указанный технический результат достигается новой рецептурной смесью гидроколлоида гиалуроновой кислоты и использованием оригинальной технологии точечного макромолекулярного фотопринтирования.
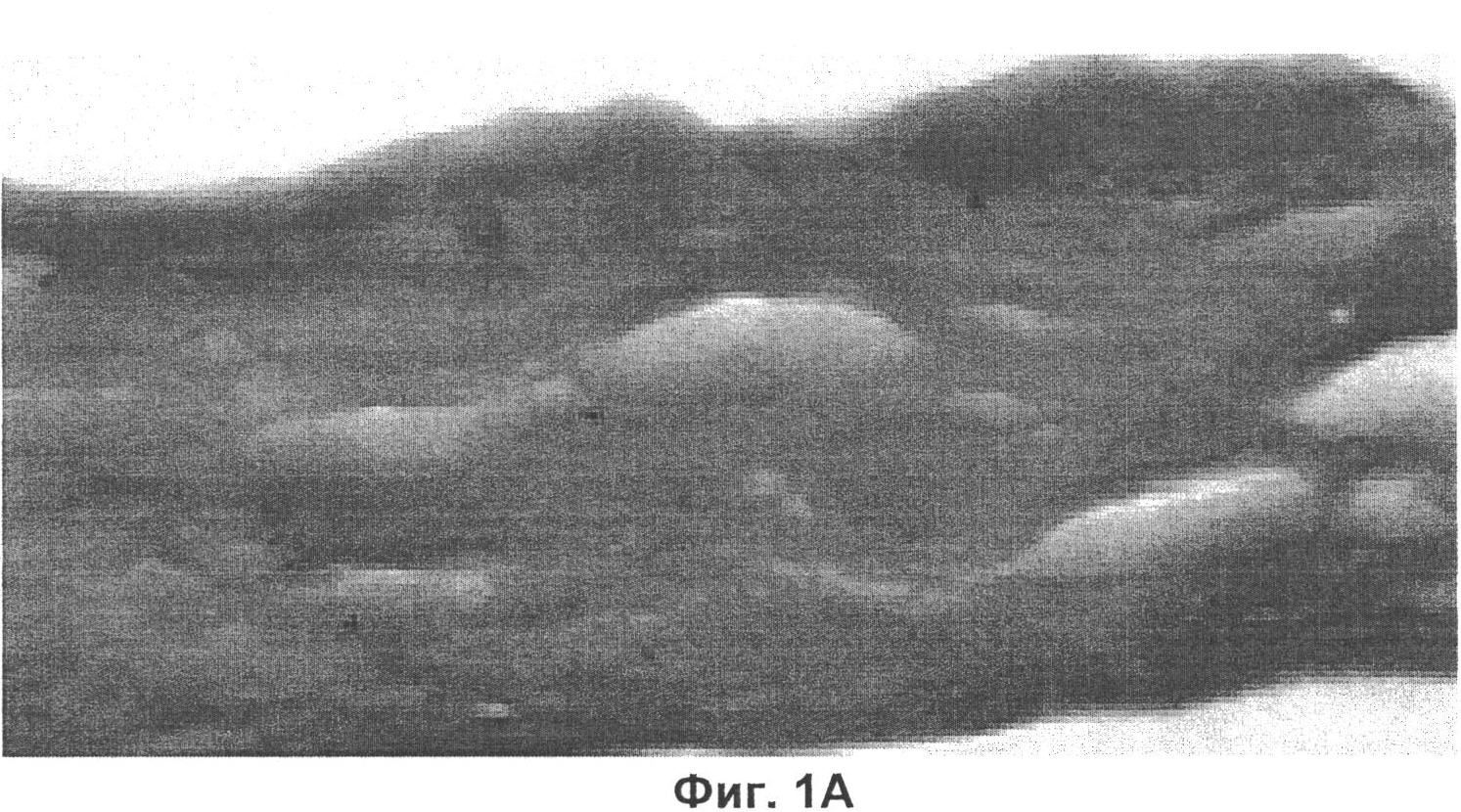
Разработанный биопластический материал для периода реабилитации после инвазивных косметологических процедур и пластических операций авторами изобретения обозначен термином «Косметическое средство "Кожа косметическая"». Данное наименование обусловлено максимальным структурным сходством гистологической картины продольного среза «кожи косметической» и наружных слоев кожи (фиг.1А, 1Б).
Настоящее изобретение относится к косметическому средству для ухода за кожей в период реабилитации после инвазивных косметологических процедур и пластических операций, включающему в себя гиалуроновую кислоту, отличающемуся тем, что косметическое средство «кожа косметическая» содержит смесь аминокислот (гидроксипролин, гидроксилизин, цистеин), позволяющую в процессе точечного макромолекулярного фотопринтирования сформировать устойчивую послойную пластинчатую структуру толщиной менее 50 мкм с адгезионными свойствами при следующем соотношении компонентов, (мас.%:
|
смесь аминокислот 1:1:1
|
Описание фигур
На фиг.1А представлен микропрепарат «кожи косметической».
На фиг.1Б представлен микропрепарат кожи естественной.
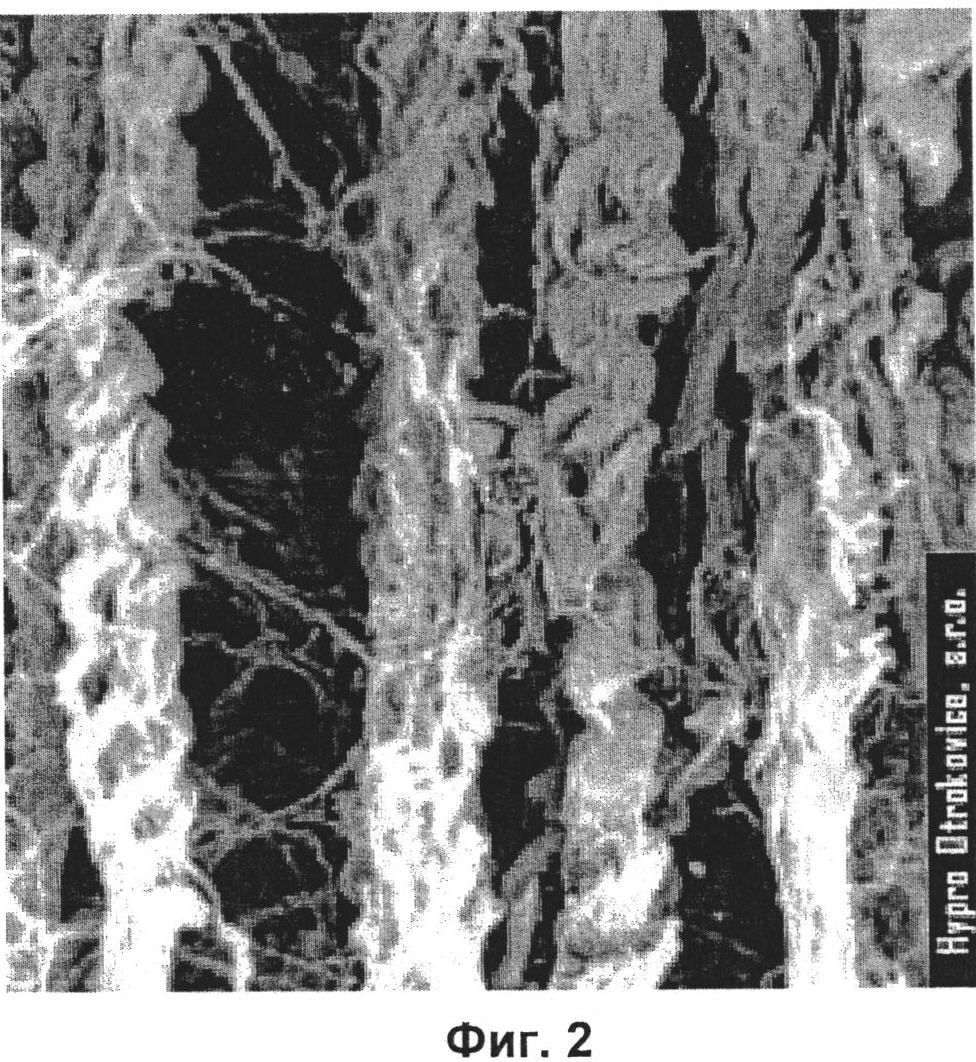
На фиг.2 изображена вторичная и третичная структура коллагеновых фибрилл.
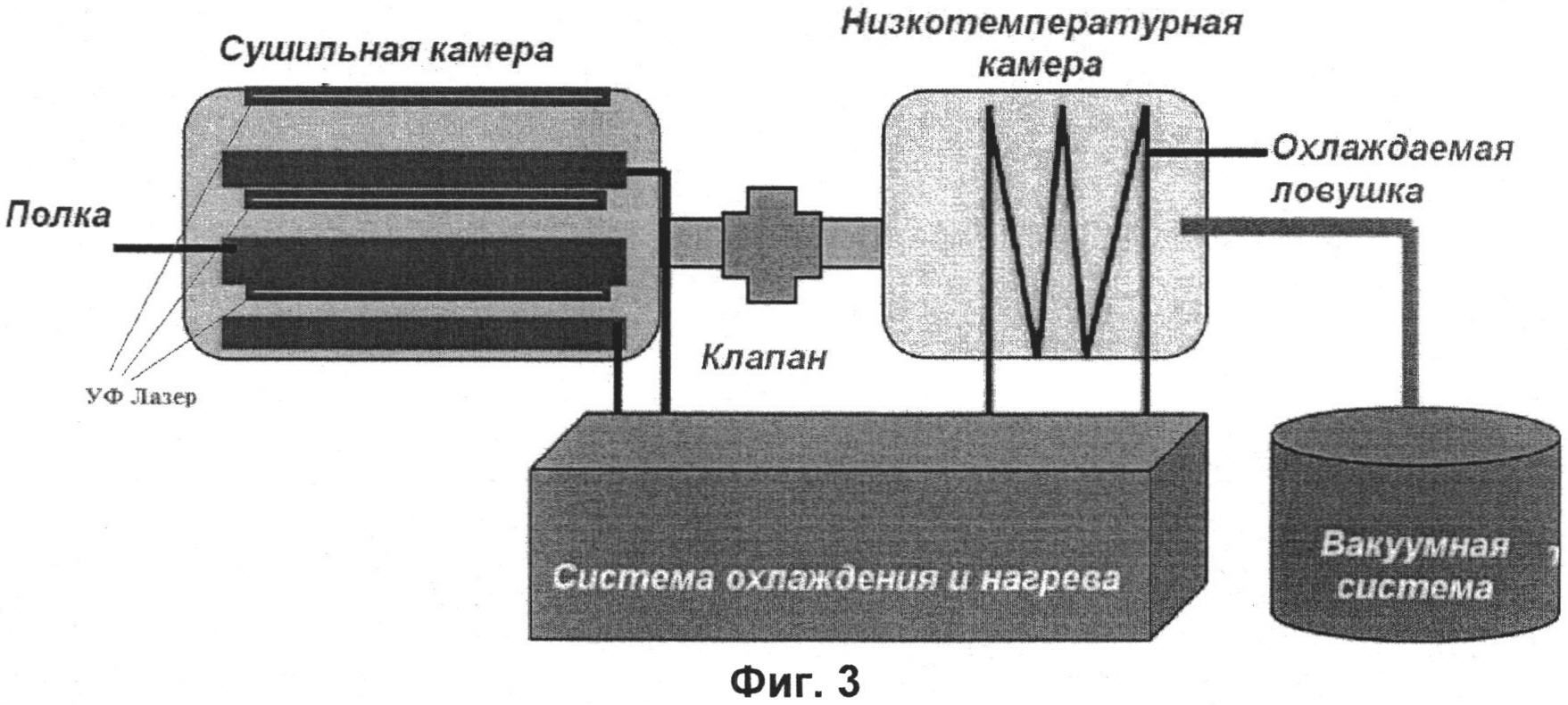
На фиг.3 представлена схема вакуумной лиофильной установки с лазером УФ диапазона.
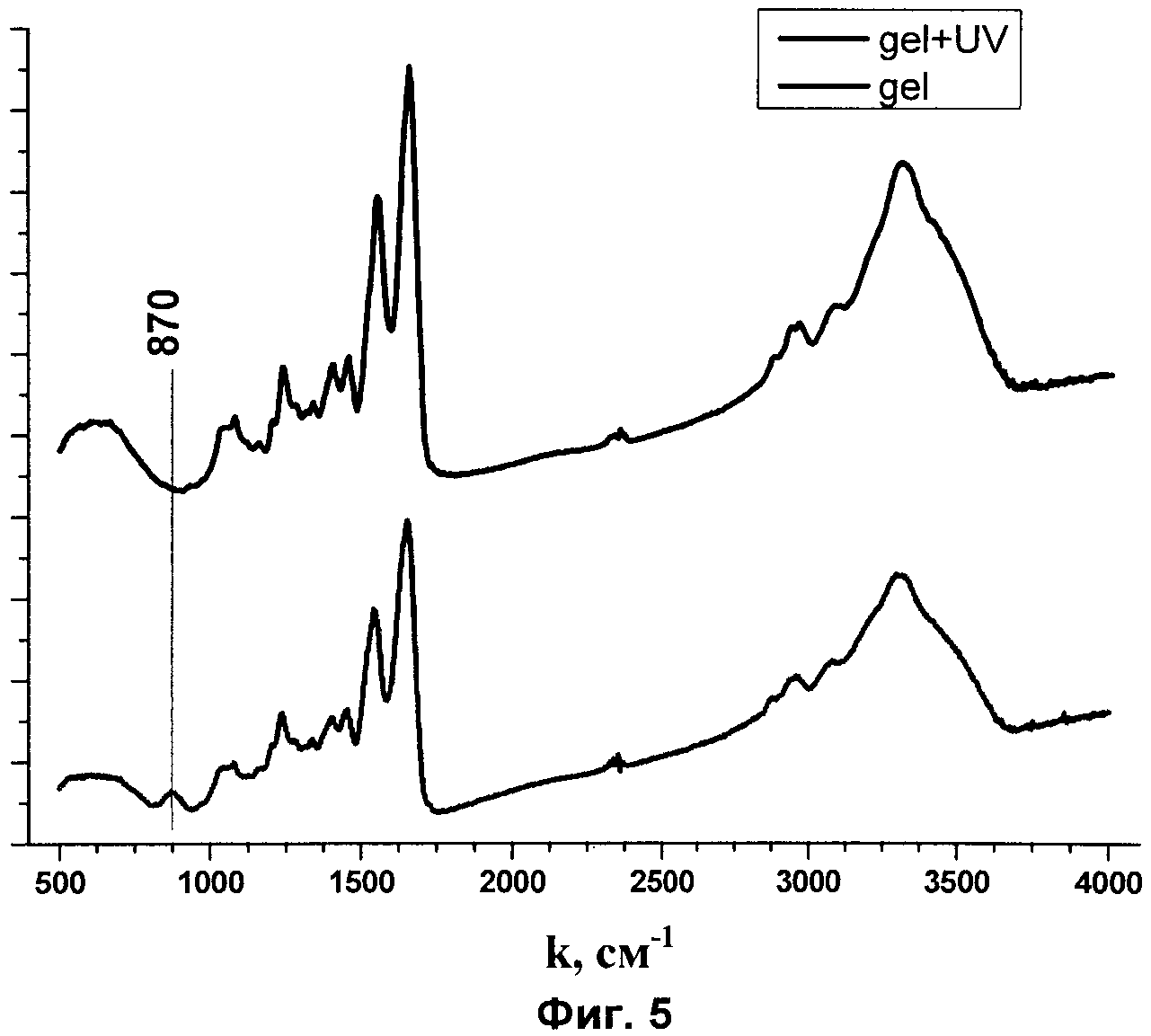
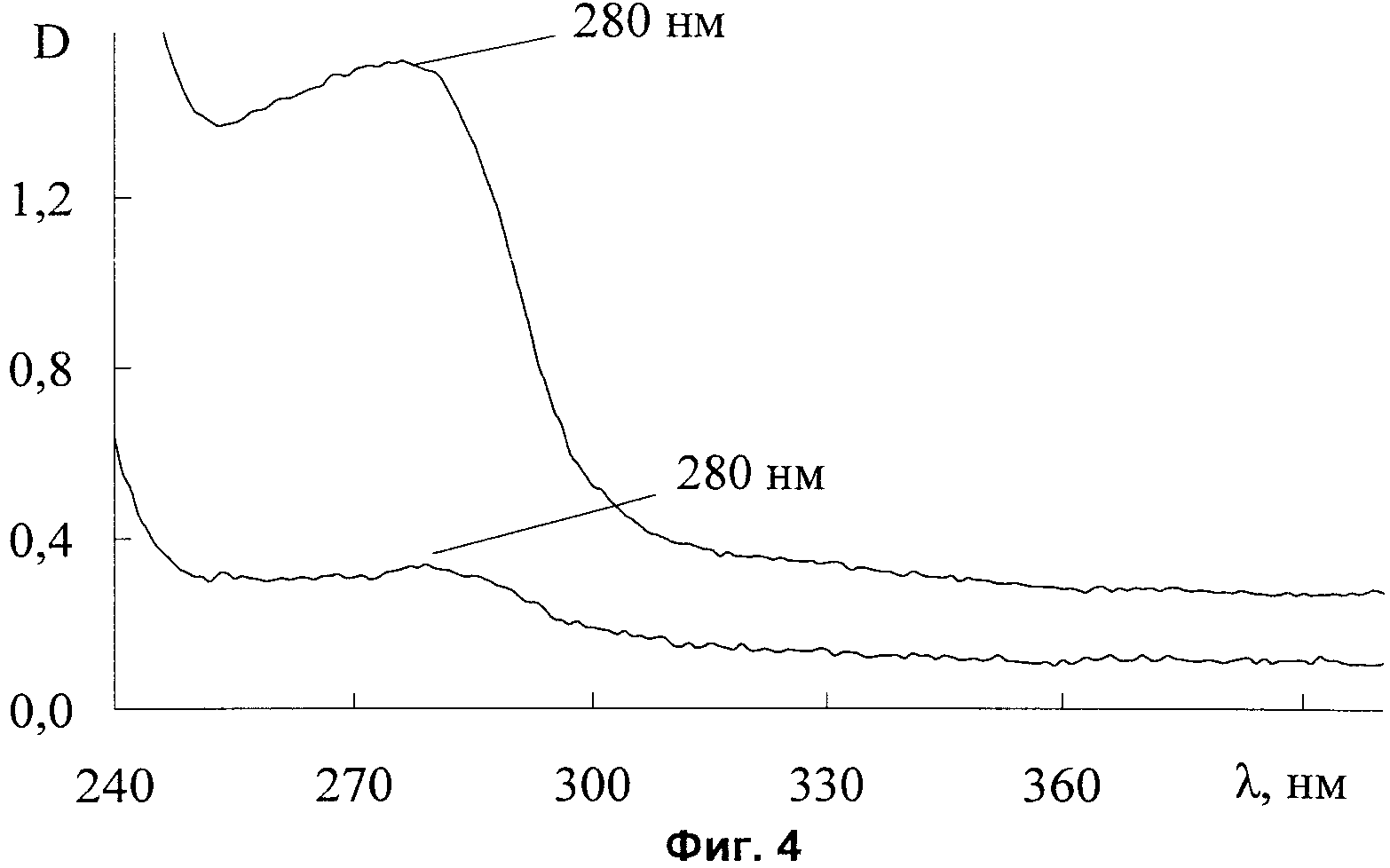
На фиг.4 представлены спектры поглощения «кожи косметической».
На фиг.5 представлены ИК-спектры облученного и необлученного образцов «кожи косметической».
Подробное описание изобретения
«Кожа косметическая» изготовлена на основе гидроколлоида гиалуроновой кислоты и смеси аминокислот гидроксипролина, гидроксилизина, цистеина.
Выбор именно данной смеси аминокислот обусловлен их способностью, вступая во взаимодействие с пептидными связями, формировать макромолекулярные комплексы. Например, благодаря данному феномену образуется вторичная и третичная структуры коллагеновых фибрилл (фиг.2) При этом аминокислота цистеин стабилизирует коллагеновую структуру ковалентной дисульфидной связью [38].
В предлагаемой рецептуре получения «кожи косметической» авторами изобретения впервые использовано сочетание гиалуроновой кислоты и смеси аминокислот гидроксипролина, гидроксилизина, цистеина, позволяющее формировать послойную структуру «кожи косметической».Для биосинтеза «кожи косметической» авторы изобретения разработали технологию точечного макромолекулярного фотопринтирования.
Суть данной технологии заключается в следующем.
Рецептурное количество гидроколлоида гиалуроновой кислоты и смеси аминокислот (в диапазоне соотношений 1:5-1:7) заливается на кварцевую подложку в расчете 1 мл на 1 см2, которая помещается в лиофильную камеру. Здесь расположен УФ-твердотельный лазер на основе церия (Ce+3:LiCAF), в камере создается вакуум (схема установки показана на фиг.3). Осуществляется импульсное лазерное УФ-излучение с длительностью импульса 7 нс. УФ-излучение приводит к активации функциональных групп, приводящих к разрыву и формированию новых химических связей. Дальнейшее исследование ИК-спектров подтвердило данное предположением (ИК-график показан на фиг.5).
Выбор диапазона лазерного излучения обусловлен данными электронного спектра поглощения. Именно в данном диапазоне отмечается пик поглощения гидроколлоида гиалуроновой кислоты, что обеспечивает более эффективную активацию функциональных химических групп с разрывом прежних и образованием новых химических связей.
На фиг.4 приведен электронный спектр поглощения «кожи косметической». Максимум полосы поглощения в УФ-области находится на длине волны 280 нм.
Гидроколлоид гиалуроновой кислоты представляет собой смесь гиалуроновой кислоты и аминокислот. ИК-спектр образца отображает все функциональные группы, входящие в состав исходного геля (табл.1).
|
|
Вид спектральной кривой «кожи косметической» демонстрирует появление новых химических связей в области 870 см-1 (фиг.4). Таким образом, использование точечного макромолекулярного фотопринтирования приводит к образованию новых связей между функциональными группами молекул гидрогеля и смеси аминокислот. Это связано с разрывом отдельных связей, в результате чего образуются активные молекулы со свободными валентными электронами, способными образовать новую химическую связь.
Известно, что на частотах 870 см-1 могут проявлять себя валентные С-С колебания, симметричные и асимметричные C-O-C, ковалентно-связанные N=O, деформационные C-H колебания (табл.2).
|
Появление новых связей между функциональными группами компонентов гидрогеля (гиалуроновая кислота и смеси аминокислот) вследствие применения технологии точечного макромолекулярного фотопринтирования обуславливает формирование устойчивой пластинчатой структуры «кожи косметической», имеющей послойную структуру, сходную с фиброархитектоникой наружных клеточных слоев кожи.
Разработанная средство «кожа косметическая» в периоде постпилинговой реабилитации применяется следующим образом.
Шаг 1. По форме поверхности кожи моделируется маска кожи косметической «G-derm».
Шаг 2. Гладкой стороной кожа косметическая укладывается на обработанную поверхность кожи. Если подлежащая поверхность влажная за счет тканевой жидкости, то кожа косметическая впитывает жидкость и приобретает вид эластичной мембраны, легко прилипающей к постпилинговому участку. При недостаточном содержании влаги или наличию сухой подлежащей поверхности кожи пациента, маску косметической кожи прикладывают в сухом виде, а затем стерильным смоченным в дистиллированной воде тампоном материал увлажняется и расправляется на участке кожи.
Критерием правильного наложения кожи косметической считается отсутствие воздушных карманов и затеков с полным повторением рельефа обработанного участка.
Шаг 3. В течение 15-20 мин кожа косметическая должна плотно прилипнуть к обработанной поверхности и в последующем периоде реабилитации сформировать нежную заживляющую прозрачную «корочку» золотисто-коричневого цвета (полноценный биологический струп).
Шаг 4. Наблюдают постипилинговую область и проводят ежедневное вечернее измерение температуры тела. В большинстве случаев кожа косметическая остается на обработанной поверхности до полной эпителизации, критерием которой станет полное отшелушивание раневой «корочки».
Очень редко наблюдается частичное или полное рассасывание кожи косметической, в этом случае либо докладываются лоскуты кожи косметической, либо целую новую маску в соответствие с шагами 1-3.
Шаг 5. На протяжении всего периода постпилинговой реабилитации в домашних условиях на поверхность нежной корочки кожи косметической наносится ежедневно 2 мл водного раствора 1,5%-ный гиалуроновой кислоты (один день на ночь) и водного раствора 5%-ного пептидного комплекса (второй день на ночь) в течение 14 дней.
Шаг 6. После полного отшелушивания кожи косметической на нежную молодую кожи постпилинговой области в течение 30 дней наносится мусс вечернего применения с маслом ши. Мусс вечернего применения с маслом ши «G-derm» разработан специально на основе уникальной текстуры «нежно тающей» мусс-основы.
Соблюдение вышеуказанной методики постпилингового ухода биопластической регенерации на основе кожи косметической «G-derm» позволит получить максимально яркий эстетический результат обновления кожи после процедур пилинга.
Литература
1. Бурлуцкая О., Рахматуллин Р., Колесова Н., Бурцева Т. ПРИМЕНЕНИЕ БИОМАТЕРИАЛА «ГИАМАТРИКС®» ПОСЛЕ ИНВАЗИВНЫХ ПРОЦЕДУР В ПЛАСТИЧЕСКОЙ ХИРУРГИИ И КОСМЕТОЛОГИИ, //Журнал Врач, 11, 2011, С.22-24.
2. Рахматуллин P.P. Биопластический материал на основе гиалуроновой кислоты: биофизические аспекты фармакологических свойств. // Фармация. - 2011. - №4. - С.37-39.
3. Рахматуллин P.P., Бурлуцкая О.И., Адельшина Л.Р., Бурцева Т.И. Эффективность нового метода восстановления дефекта кожи у больного с врожденным буллезным эпидермолизом: клиническое наблюдение. // Вопросы современной педиатрии. - 2011. - Том. 10 №2. - С.190-192
4. Adams E. Bibliography: Collagen-based Dressings for Chronic Wound Management. Boston, MA: Veterans Health Administration Technology Assessment Program (VATAP): January 2003.
5. Agency for Healthcare Research and Quality (AHRQ). Overview of wound care technologies. Technology Assessment. Rockville, MD: AHRQ; 2003.
6. Barber С, Watt A, Pham C, et al. Bioengineered skin substitutes for the management of wounds: A systematic review. ASERNIP-S Report No. 52. Stepney, Australia: Australian Safety and Efficacy Register of New Interventional Procedures - Surgical (ASERNIP-S); August 2006. Available at:
7. Bradley M, Cullum N, Nelson EA, et al. Systematic reviews of wound care management: (2) dressings and topical agents used in the healing of chronic wounds. Health Tech Assess. 1999; (17 Pt2): 1-35.
8. Canadian Agency for Drugs and Technologies in Health. Non-adherent versus traditional dressings for wound care: Comparative effectiveness, safety, and guidelines. Ottawa, ON: Canadian Agency for Drugs and Technologies in Health (CADTH); 2011.
9. Chaby G, Senet P, Vaneau M, et al. Dressings for acute and chronic wounds: A systematic review. Arch Dermatol. 2007; 143 (10): 1297-1304.
10. Cheng A, Saint-Cyr M. Comparison of different ADM materials in breast surgery. Clin Plast Surg. 2012; 39 (2):167-175.
11. Cullum N, Petherick E. Pressure ulcers. In: BMJ Clinical Evidence. London, UK: BMJ Publishing Group; February 2006.
12. Dumville JC, Deshpande S, O'Meara S, Speak K. Foam dressings for healing diabetic foot ulcers. Cochrane Database Syst Rev. 2011; (9): CD009111.
13. Dumville JC, Deshpande S, O'Meara S, Speak K. Hydrocolloid dressings for healing diabetic foot ulcers. Cochrane Database Syst Rev. 2012; (2): CD009099.
14. Dumville JC, O'Meara S, Deshpande S, Speak K. Alginate dressings for healing diabetic foot ulcers. Cochrane Database Syst Rev. 2012; (2): CD009100.
15. Dumville JC, O'Meara S, Deshpande S, Speak K. Hydrogel dressings for healing diabetic foot ulcers. Cochrane Database Syst Rev. 2011; (9): CD009101.
16. Dumville JC, Walter CJ, Sharp CA, Page T. Dressings for the prevention of surgical site infection. Cochrane Database Syst Rev. 2011; (7): CD003091.
17. Ehrenreich M, Ruszczak Z. Update on tissue-engineered biological dressings. Tissue Eng. 2006; 12 (9): 2407-2424.
18. Ho C, Tran K, Hux M, et al. Artificial skin grafts in chronic wound care: A meta-analysis of clinical efficacy and a review of cost-effectiveness. Technology Report No 52. Ottawa, ON: Canadian Coordinating Office for Health Technology Assessment (CCOHTA); 2005. Available at: http://www.cadth.ca/media/pdf/252_artificial_skin_grafts_tr_e.pdf. Accessed March 9, 2007.
19. http://www.surgeons.org/AM/Template.cfm?Section=ASERNIP_S_Publications&Template=/TaggedPage/
20. http://pf-k.ru/index.php?act=attach&type=post&id=766
21. Hunt D. Foot ulcers and amputations in diabetes. In: BMJ Clinical Evidence. London, UK: BMJ Publishing Group; September 2006.
22. Jones JE, Nelson EA. Skin grafting for venous leg ulcers. Cochrane Database Syst Rev. 2007; (2): CD001737.
23. Kranke P, Bennett MH, Martyn-St James M, et al. Hyperbaric oxygen therapy for chronic wounds. Cochrane Database Syst Rev. 2012; (4): CD004123.
24. National Institute for Clinical Excellence (NICE). Guidance on the use of debriding agents and specialist wound care clinics for difficult to heal surgical wounds. Technology Appraisal Guidance No. 24. London, UK: NICE; April 2001.
25. Nelson EA, Bradley MD. Dressings and topical agents for arterial leg ulcers. Cochrane Database Syst Rev. 2007; (1): CD001836.
26. Nelson EA, Jones JI. Venous leg ulcers. In: BMJ Clinical Evidence. London, UK: BMJ Publishing Group; July 2006.
27. Nicolau I, Xie X, McGregor M, Dendukuri N. Evaluation of acellular dermal matrix for breast reconstruction: An update. Report No. 59. Montreal, QC: Technology Assessment Unit of the McGilI University Health Centre (MUHC); 2012.
28. Palfreyman SJ, Nelson EA, Lochiel R, Michaels JA. Dressings for healing venous leg ulcers. Cochrane Database Syst Rev. 2006; (3): CD001103.
29. Pham СТ. Bioengineered skin substitutes for the management of burns: A systematic review. ASERNIP-S Report No. 46. Stepney, Australia: Australian Safety and Efficacy Register of New Interventional Procedures - Surgical (ASERNIP-S); July 2006. Available at: http://www.surgeons.org/AM/Template.cfm?Section=ASERNIP_S_Publications&Tem plate=/TaggedPage/
30. Rubin M.K. Manual of chemical peels superficial and medium depth. Philadelphia: J.B. Lippicott, 1995. - 176 p.).
31. Snyder DL, Sullivan N, Schoelles KM. Skin substitutes for treating chronic wounds. Technology Assessment Report. Prepared by the ECRI Institute Evidence-based Practice Center (EPC) under contract to the Agency for Healthcare Research and Quality (AHRQ), Contract No. HHSA 290-2007-10063. Project ID: HCPR0610. Rockville, MD: AHRQ; December 18, 2012.
32. Sonnad SS, Goldsack J, Mohr P, Whicher D. Methodological recommendations for comparative effectiveness research on the treatment of chronic wounds. Effectiveness Guidance Document. Version 2.0 Final. Baltimore, MD: Center for Medical Technology Policy (CMTP); October 12, 2012.
33. Tagged Page Display. cfm&TPLID=17&ContentlD=3297. Accessed March 9, 2007.
34. Technology Assessment Unit, Office of Patient Care Services, U.S. Department of Veterans Affairs (VATAP). Collagen-based wound care products: Summary of INAHTA reviews. Boston, MA:VATAP; 2003.
35. Vermeulen H, Ubbink D, Goossens A, et al. Dressings and topical agents for surgical wounds healing by secondary intention. Cochrane Database Syst Rev. 2004; (1): CD003554.
36. Wang C, Lau J. Hyperbaric oxygen therapy in treatment of hypoxic wounds - systematic review. Prepared by the New England Medical Center Evidence-based Practice Center (EPC) for the Agency for Healthcare Research and Quality (AHRQ) under contract no. 270-97-0019. Rockville, MD: Agency for Healthcare Research and Quality (AHRQ); November 2, 2001.
37. Wasiak J, Cleland H. Burns (minor thermal). In: BMJ Clinical Evidence. London, UK: BMJ Publishing Group; January 2006.
38. http://www.hypro.cz/hyRubrln.aspx?intRubrKis=1251&intLang=3.
Косметическое средство для ухода за кожей в период реабилитации после инвазивных косметологических процедур и пластических операций, включающее в себя гиалуроновую кислоту, отличающееся тем, что косметическое средство «кожа косметическая» содержит смесь аминокислот (гидроксипролин, гидроксилизин, цистеин), позволяющую в процессе точечного макромолекулярного фотопринтирования сформировать устойчивую послойную пластинчатую структуру толщиной менее 50 мкм с адгезионными свойствами при следующем соотношении компонентов, мас.%: смесь аминокислот 1:1:1