Результат интеллектуальной деятельности: СПОСОБ ИЗГОТОВЛЕНИЯ КОСТНЫХ ИМПЛАНТОВ
Вид РИД
Изобретение
Изобретение относится к биологии и медицине и может быть использовано в травматологии, ортопедии при изготовлении биологических минерализованных имплантатов и их глубокой стерилизации при заготовке, консервации и последующем хранении. Также изобретение может быть использовано в работе "тканевых банков" для обеспечения костно-пластическим материалом учреждений здравоохранения.
Для получения костно-пластического материала, эквивалентного по качеству аутокости, наиболее эффективным является физическое и(или) физико-химическое воздействие на аллогенный пластический материал, в результате чего добиваются снижения антигенной активности имплантатов и уменьшения риска тканевой несовместимости за счет полного удаления из них костного мозга и клеток.
Одним из наиболее распространенных материалов для костной пластики является деминерализованный костный матрикс благодаря биосовместимости, хорошим остеоиндуктивным и остеокондуктивным свойствам. Для достижения наилучшего клинического результата в деминерализованном костном матриксе необходимо сохранить активность костных морфогенетических белков.
В зависимости от способа получения деминерализованный костный матрикс может обладать разными свойствами. Но при этом важно добиться высокой стерильности продукта, которая влияет на продолжительность и условия его хранения.
Таким образом, применяемый в клинической практике деминерализованный костный имплантат должен иметь определенные стандартизуемые параметры. Для сохранения активности костных морфогенетических белков при хранении препарата его влажность не должна превышать 3-5%, а уровень pH должен находиться в диапазоне от 4,5 до 7,5, суммарное содержание костных морфогенетических белков ВМР-2 и ВМР-7 250-350 мг/г продукта. Для снижения риска иммунного ответа на введение материала, а также для максимального высвобождения белковых факторов роста кости уровень липидов не должен превышать 2%.
Высокая степень стерильности необходима в биоимплантологии, в частности, на завершающих стадиях изготовления костного имплантата в тканевых банках. При их использовании должна быть исключена возможность инфицирования реципиентов бактериальными, грибковыми и вирусными инфекциями. Поэтому технологический процесс изготовления любых имплантатов биологической природы должен завершаться надежной и адекватной стерилизацией с максимально возможным сохранением пластических свойств ткани. Отбор донорского материала, выбор технологии изготовления биологических имплантатов в мировой практике регулируется соответствующими стандартами и контролируется серологическими анализами. Параллельно с решением отмеченных вопросов существуют и другие, которые касаются способов стерилизации биологических тканей. К ним относятся воздействие различных факторов (температура, химическое, радиационное воздействие и т.д.) на эндо- и экзопатогенную флору, присутствующую в донорских тканях, что может привести к денатурации их белковых структур и свести комплекс пластических свойств имплантатов к минимуму или полному исчезновению.
В настоящее время для целей дезинфекции и стерилизации медицинских инструментов, лабораторного оборудования, сред и биологических объектов используют высокотемпературные технологии, химически активные препараты, ионизирующее и ультрафиолетовое (УФ) излучение (Шкарин В.В., Шафеев М.Ш. Дезинфектология: Руководство для студентов медицинских вузов и врачей. Нижний Новгород, 2003. 368 с.).
1. Высокотемпературные технологии. Дезинфекция и стерилизация осуществляется с помощью паровых, воздушных и газовых стерилизаторов. Стерилизующими агентами газовых стерилизаторов являются: смесь окиси этилена и бромида метила, формальдегид, этиленоксид в смеси с инертными газами. Высокотемпературные технологии характеризуются процессом нагрева и охлаждения и не позволяют провести дезинфекцию температурно-чувствительных (особенно биологических) материалов.
2. Химические реагенты. Степень эффективности обеззараживания химически активными веществами различна и зависит как от химической активности дезинфектантов, так и от свойств обрабатываемых образцов. Спектр обеззараживаемых химическими реагентами биологических материалов значительно уже, к тому же все дезинфицирующие вещества чрезвычайно токсичны.
3. Излучения. Достаточным эффективным обеззараживающим действием характеризуется радиационное воздействие. Однако крупным недостатком способа является значительное влияние радиации на остеоиндуктивные свойства имплантатов, а также высокая стоимость используемого оборудования, наличие специально оборудованных радиационно-безопасных помещений. Данные установки требуют высококвалифицированного обслуживающего персонала.
Известны различные технологии изготовления костных имплантатов в зависимости от поставленных задач.
Так, известен способ изготовления аллотрансплантата, включающий механическую обработку полученной от донора заготовки из костной ткани, промывку ее холодной водой, деминерализацию в 1,2-3,6 н. растворе соляной кислоты, промывку деминерализованной заготовки в дистилляте и в физиологическом растворе, стерилизацию и консервацию заготовки путем помещения и выдерживания ее в соответствующей герметичной таре (упаковке), залитой раствором формальдегида с добавкой антибиотика (Савельев В.И. (Деминерализованная кость как особая разновидность костно-пластического материала. Сборник научных трудов ЛНИИТО им P.P. Вредена. Заготовка и пересадка деминерализованной костной ткани в эксперименте и клинике. Л.: НИИТО, 1983, с.3-12). Данный способ позволяет за счет деминерализации костной ткани получать аллотрансплантаты с высокой остеоиндуктивностью, которой практически не обладают замороженные недеминерализованные трансплантаты, и низкой антигенностью. Однако существенным недостатком полученных по этому способу аллотрансплантатов является использование формальдегида в качестве консерванта и стерилизатора, что влечет за собой ряд проблем, обусловленных ограничением времени хранения трансплантата (не более 6 месяцев), необходимостью отмывки приготовленного трансплантата перед клиническим использованием, токсичностью формальдегида, а также неудобством хранения и транспортировки трансплантата, погруженного в раствор формальдегида.
Известен способ изготовления имплантатов из губчатой костной ткани (пат. РФ №2172104), включающий измельчение кости, промывку водой, стерилизацию и консервацию. При этом костные фрагменты погружают в 6%-ный раствор перекиси водорода на 48 часов при соотношении один объем костных фрагментов на четыре объема раствора перекиси водорода со сменой раствора 4 раза через каждые 12 часов, костные фрагменты подвергают центрифугированию, затем погружают их в смесь этанола с хлороформом в соотношении 1:1 на 48 часов при соотношении один объем костных фрагментов на четыре объема раствора перекиси водорода со сменой раствора 4 раза через каждые 12 часов, повторно центрифугируют костные фрагменты, проветривают на воздухе 24 часа, после чего фрагменты замораживают при температуре -70°C в течение 24 часов, по истечении этого времени их подвергают лиофилизации в течение 48 часов с достижением остаточной влажности 5%, а после этого упаковывают в стандартный двойной пакет и стерилизуют потоком быстрых электронов дозой 18±5 кГр на ускорителе ЛУЭ-8-5М. Недостатками данного способа являются его значительная продолжительность, трудоемкость, возможность разрушения костных морфогенетических белков в получаемом имплантате в процессе длительной обработки его перекисью водорода, что не исключает потерю остеоиндуктивных свойств.
Известен способ изготовления костного имплантата (пат. РФ №2147800), который заключается в последовательно проводимых механической обработке и промывке заготовки из костного вещества, выполнении в заготовке сквозных отверстий, деминерализации в растворе соляной кислоты, нейтрализации остатков кислоты, консервации деминерализованной заготовки посредством лиофилизации, стерилизации после окончания сушки, осуществляемой путем облучения заготовки, помещаемой в герметичную упаковку, пучком ускоренных электронов дозой 15-18 кГр в течение 16-20 с. Однако существенным недостатком полученных по данному способу имплантатов является длительный цикл получения трансплантатов. Кроме того, использование в качестве стерилизующего средства радиационного воздействия, отличающегося минимальной продолжительностью обработки значительного по объему, упакованного материала, вместе с тем имеет недостатки, связанные со снижением остеоиндуктивных свойств деминерализованной кости при дозе гамма-лучей 10 кГр и утрате остеоиндуктивных способностей при дозе 25 кГр. При этом минимально необходимая для полного уничтожения бактерий доза равна 20 кГр, а для спор и вирусов - 20-40 кГр.
Известен способ получения костного трансплантата (пат. РФ 2223104) путем очистки и промывки костной ткани, депротеинизации фрагментов вначале в 0,01%-ном растворе химопсина, затем в 10%-ном растворе перекиси водорода в течение 48 часов, обработки жидким эфиром в течение 6 часов, высушивания и обработки 10%-ным раствором хлористого лития в течение 16 часов с последующей стерилизацией целевого продукта. Аллогенные или ксеногенные фрагменты длинных трубчатых костей депротеинизируют в растворе химопсина в течение 96 часов, а при обработке 10%-ным раствором перекиси водорода их помещают в переменное магнитное поле при 45°C. Депротеинизацию фрагмента костного фрагмента размером 5-6 см проводят дважды, а размером более 6 см - трижды. Недостатком данного способа является длительное химическое воздействие, отсутствие указаний на сохранение остеоиндуктивных свойств имплантата, а также сведений о контроле степени деорганификации на различных этапах обработки.
В настоящее время широко применяется способ обработки губчатой костной ткани, включающий в себя отмывку от крови и миелоидно-жирового костного мозга водой, стерилизацию формальдегидом и консервацию замораживанием (Заготовка и консервация губчатого и трубчатого костного матрикса. Метод. рек. - Ереван, 1984 г.). К недостаткам данного способа могут быть отнесены следующие:
- формальдегид, применяемый для стерилизации в виде концентрированных паров, обладает цитотоксическим действием;
- продолжительность непрерывной отмывки от формальдегида не менее суток;
- срок хранения в замороженном состоянии ограничен (1 год);
- хранение требует холодильников с соответствующим режимом работы и постоянного контроля над процессом хранения;
- возникают определенные технические трудности при транспортировке пластического материала, находящегося в стеклянных колбах.
Известен способ получения деминерализованного костного матрикса в виде крошки (пат. РФ 2456003), включающий измельчение кости, обработку фрагментов кости раствором детергента, удаление детергента, обработку смесью спирт-хлороформ (1:1), отмывку водой, лиофилизацию, стерилизацию. Кость распиливают поперечно на фрагменты, проводят обработку фрагментов кости 2%-ным раствором Tween-80 в течение 12-24 часов дважды, далее обрабатывают смесью изопропанол-хлороформ (1:1) в течение 24-48 часов в ультразвуковой ванне, отмывают водой, обрабатывают раствором 0,6 М HCl в течение 30-90 мин, далее крошку промывают дистиллированной водой, помещают в фосфатный буфер, отмывают дистиллированной водой, полученные фрагменты заливают этиловым спиртом, крошку высушивают, измельчают. Стерилизация производится радиационным способом на установке ГУ-200 (ФГУП «НИИП», Лыткарино). Значение поглощенной дозы 15 кГр. Вместе с тем, указанная длительная химическая, а также радиационная обработка могут оказывать негативное влияние на остеоиндуктивные свойства получаемого материала.
Известен способ плазменной стерилизации мелких фрагментов лиофилизированной губчатой кости [Shimizu К., Yano H., Nakamura E., Kaku N. Lipid extracted freeze-dried bank bone sterilized with low temperature plasma. // Ann. Transplant. - 2001. - Vol.6, N 1. - P.26-31]. Авторы способа не обнаружили различий в эволюции трансплантатов, стерилизованных плазмой и газообразной окисью этилена, взятой в качестве контроля. К сожалению, авторы не представили гистологической эволюции таких трансплантатов и сведений об их остеоиндуктивной активности. Кроме того, известно, что лиофилизированная кость по своей биологической ценности значительно уступает костной ткани, консервированной замораживанием.
Известен способ, в котором приведены экспериментальные данные, характеризующие остеоиндуктивные свойства деминерализованных костных трансплантатов, стерилизованных низкотемпературной плазмой пероксида водорода [Ferreira S.D., Dernell W.S., Powers B.E. et al. Effect of gas-plasma sterilization on the osteoinductive capacity of demineralized bone matrix. // din. Orthop. - 2001. - N 388. - Р.233-239]. Низкотемпературная плазма в данном случае лишила деминерализованные трансплантаты их полезных остеоиндуктивных свойств.
Известен способ получения биоматериала (пат. РФ №2472516) для замещения дефектов кости на основе натурального коралла, очищенного от коралловой пыли и микроорганизмов проточной водой с последующей стерилизацией. Коралл, дополнительно очищенный 3%-ным раствором гипохлорита натрия и ультразвуковым воздействием частотой 40 кГц в течение 3-5 мин, высушивают и стерилизуют гамма-облучением при суммарной дозе 25 кГр.
Известен способ камерной стерилизации биологических трансплантатов (пат. РФ 2317109) низкотемпературной плазмой пероксида водорода, заключающийся в воздействии на пероксид водорода магнитным излучением частотой 13,576 МГц при температуре 46±4°C. Непосредственно перед стерилизацией трансплантаты обрабатывают в течение 2-3 ч при комнатной температуре в растворе, состоящем, г: сульфосалициловая кислота (1,0), пропандиасахароль (10,0), спирт этиловый абсолютный (90,0), после чего высушивают в термостате при 37°C. Применение низкотемпературной плазмы пероксида водорода для стерилизации деминерализованных костных трансплантатов, подвергнутых дегидратации, не нарушает их остеоиндуктивных свойств. Кроме этого, как показал эксперимент, стерилизованные низкотемпературной плазмой пероксида водорода сухожильные имплантаты не вызывают в окружающих тканях морфологических изменений, которые могли бы служить противопоказанием для их клинического использования. Указанные дегидратирующие воздействия, имеющие место при нагреве, а также при использовании спиртового раствора, могут ухудшать исходные свойства имплантатов и снижать их регенераторный потенциал.
Наиболее близким прототипом к заявляемому техническому решению является способ по пат. РФ №2268060 изготовления костного имплантата, включающий механическую обработку гидродинамической струей костной ткани и промывку заготовки из костного материала, деминерализацию заготовки в 0,7-1,1 н. растворе ортофосфорной кислоты, нейтрализацию остатков кислоты, стерилизацию и консервацию заготовки. По завершении деминерализации костных фрагментов, которая может быть полной (тотальной), частичной (поверхностной) и сегментарной (избирательной), образцы подвергаются промывке для нейтрализации кислот в течение 1,5 часов в 5% растворе питьевой соды и 1 часа в физиологическом растворе. Для консервации, последующей стерилизации и хранения используется 0,1%-ный раствор формальдегида с добавлением гентомицина из расчета 0,5 г на литр. Ортофосфорную кислоту отмывают из заготовки раствором гипохлорита натрия, троекратно погружая ее в раствор на 35 мин. В таком виде имплантат готов к использованию в пластической операции и может храниться при температуре 18-20°C до 5 лет. Недостатки стерилизации и консервации - невозможность получения 100% степени стерилизации от бактериальных, грибковых и вирусных инфекций, а также деорганифицирующее действие гипохлорита натрия.
Технический результат изобретения состоит в 100-% стерилизации костных имплантатов при сохранении остеоиндуктивных свойств образца, что приводит к морфологической и биопластической сохранности стерилизуемых объектов, возможности использования для массовой заготовки имплантатов из губчатой костной ткани, сокращение времени подготовки имплантатов к клиническому использованию костных образцов.
Достижение технического результата возможно при использовании способа изготовления костного имплантата, включающего механическую обработку гидродинамической струей фрагмента костной ткани, деминерализацию заготовки в растворе неорганической кислоты, нейтрализацию остатков кислоты, промывку заготовки из костного материала, ее стерилизацию и консервацию, при этом осуществляют стерилизацию имплантата озоно-воздушной смесью с концентрацией озона 5-50 мг/м3 в течение 7-10 мин перед механической обработкой и аналогичную окончательную стерилизацию после завершения технологического процесса изготовления имплантата.
Предложенные согласно заявленному изобретению усовершенствования способа изготовления костных имплантатов являются результатом обобщения экспериментальных исследований по созданию и практическому использованию трансплантатов (образцов), изготовленных с использованием вышеуказанных усовершенствований, новых по отношению к способу-прототипу действий, условий и параметров режимов их выполнения. Полученные результаты лабораторных испытаний подтверждают возможность решения поставленной в заявленном изобретении задачи.
Озон О3 - прекрасный современный дезинфектор - для этой цели может быть получен простейшим недорогим способом, например, продувкой струи атмосферного воздуха через факельный разряд электрического тока напряжением 220 В с промышленной частотой 50 Гц, т.е. без применения специальных генераторов, высокочастотных преобразователей электрического тока, кислородных обогатителей и т.д. Следует также отметить, что предложенный способ облегчает соблюдение техники безопасности за счет того, что озон О3 создают в непосредственной близости от обрабатываемого объекта и практически здесь же полностью разлагают его на О* и 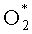 , поэтому он не попадает в атмосферу, не скапливается в нижних слоях в недопустимом количестве, а полученные химически активные О* и
, поэтому он не попадает в атмосферу, не скапливается в нижних слоях в недопустимом количестве, а полученные химически активные О* и 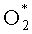 имеют продолжительность "жизни" десятые и сотые доли секунды и исчезают или используются также в непосредственной близости от обрабатываемого объекта. Преимущества стерилизации озоном - низкотемпературный режим, короткая экспозиция, глубокое проникновение в материал, возможность стерилизации термонеустойчивых изделий, возможный большой объем стерилизационной камеры, отсутствие токсичности, а также безопасность для окружающей среды. Согласно многочисленным исследованиям озон обладает сильно выраженными фунгицидными, бактерицидными, вироцидными свойствами («Клинические аспекты озонотерапии» под ред. А.В. Змызговой и В.А. Максимова, М.: НПЦ Озонотерапии, 2003, 288 с.). Озон способен эффективно уничтожать все виды бактерий, вирусов, грибов и простейших. В проведенных экспериментах показано, например, полное подавление роста колоний протеев, кишечной и синегнойной палочки, клебсиеллы, стафилококка при 103-104 КОЕ/мл при обработке озонированной дистиллированной водой с концентрацией озона 4 мг/л в условиях in vitro, a также антивирусный эффект озона на культуре лимфоцитов, зараженной ВИЧ-1 с инактивацией вируса как экстракорпорально, так и внутри клеток, и подавлением сопровождающих ВИЧ инфекций, устойчивых к антибиотикам (А.В. Густов, К.Н. Конторщикова, Ю.П. Потехин. Озонотерапия в неврологии. - Нижний Новгород, Издательство Нижегородской гос. Медицинской академии, 2012. - 192 с.).
имеют продолжительность "жизни" десятые и сотые доли секунды и исчезают или используются также в непосредственной близости от обрабатываемого объекта. Преимущества стерилизации озоном - низкотемпературный режим, короткая экспозиция, глубокое проникновение в материал, возможность стерилизации термонеустойчивых изделий, возможный большой объем стерилизационной камеры, отсутствие токсичности, а также безопасность для окружающей среды. Согласно многочисленным исследованиям озон обладает сильно выраженными фунгицидными, бактерицидными, вироцидными свойствами («Клинические аспекты озонотерапии» под ред. А.В. Змызговой и В.А. Максимова, М.: НПЦ Озонотерапии, 2003, 288 с.). Озон способен эффективно уничтожать все виды бактерий, вирусов, грибов и простейших. В проведенных экспериментах показано, например, полное подавление роста колоний протеев, кишечной и синегнойной палочки, клебсиеллы, стафилококка при 103-104 КОЕ/мл при обработке озонированной дистиллированной водой с концентрацией озона 4 мг/л в условиях in vitro, a также антивирусный эффект озона на культуре лимфоцитов, зараженной ВИЧ-1 с инактивацией вируса как экстракорпорально, так и внутри клеток, и подавлением сопровождающих ВИЧ инфекций, устойчивых к антибиотикам (А.В. Густов, К.Н. Конторщикова, Ю.П. Потехин. Озонотерапия в неврологии. - Нижний Новгород, Издательство Нижегородской гос. Медицинской академии, 2012. - 192 с.).
Пример 1 осуществления способа по прототипу.
Из полученного от донора фрагмента бедренной кости (кортикальная кость диафиза бедра) проводят механическую обработку гидродинамической струей, при этом получают заготовку длиной 25 см, шириной 2 см и толщиной 0,5 мм. Проводят удаление мягких тканей и миелоидно-жирового костного мозга. Затем помещают заготовку в 3%-ный раствор перекиси водорода на 1 час для удаления компонентов крови из компактного слоя. Далее заготовку помещают в 1,1 н. раствор ортофосфорной кислоты при 18-20°C. Степень деминерализации, контролируемая рентгенологическим и морфометрическим методами, составляет по окончании процесса 50%. Ортофосфорную кислоту отмывают из заготовки раствором гипохлорита натрия, троекратно погружая ее в раствор на 35 мин. Для консервации и последующей стерилизации и хранения используется 0,1%-ный раствор формальдегида с добавлением гентомицина из расчета 0,5 г на литр. На 3-4 сутки инкубации в термостате при 37°C на поверхности образцов, погруженных в бульон, появлялись пузырьки газа и помутнение. На следующие сутки помутнение распространялось равномерно по всей питательной среде. При встряхивании отмечали интенсивное газообразование. Стерилизация производилась в течении 7 суток. Обнаружено содержание анаэробных бактерий Clostridium spp. Контроль полноты удаления из костного образца костного мозга и покрывающих кость клеток осуществляли морфологически по результатам изучения структуры образцов методом сканирующей микроскопии. Срок хранения образца один месяц. После чего увеличилось содержание анаэробных бактерий Clostridium spp. на 17% от исходного содержания.
Пример 2 осуществления заявляемого способа.
В нагнетаемом в озонатор атмосферном воздухе, который проходит через факельный электрический разряд напряжением 220 В с промышленной частотой 50 Гц, образуется озон. Далее озоно-воздушную смесь подают в камеру стерилизации, в которую помещен исходный образец из примера 1. Оптимальный рабочий диапазон концентраций озона 5-50 мг/м3. Обдув объекта производят непрерывно в течение 7-10 мин. Затем проводят механическую обработку гидродинамической струей, при этом получают заготовку длиной 25 см, шириной 2 см и толщиной 0,5 мм. Проводят удаление мягких тканей и миелоидно-жирового костного мозга. Затем помещают заготовку в 3%-ный раствор перекиси водорода на 1 час для удаления компонентов крови из компактного слоя. Далее заготовку помещают в 1,1 н. раствор ортофосфорной кислоты при 18-20°C. Степень деминерализации, контролируемая рентгенологическим и морфометрическим методами, составляет по окончании процесса 50%. Ортофосфорную кислоту отмывают из заготовки раствором гипохлорита натрия, троекратно погружая ее в раствор на 35 мин. Для консервации и последующей стерилизации и хранения образец снова обдувают струей озоно-воздушной смесью концентрацией озона 5-50 мг/м3 в течение 7-10 мин. Контроль полноты удаления из костного образца костного мозга и покрывающих кость клеток осуществляли морфологически по результатам изучения структуры образцов методом сканирующей микроскопии. В результате чего установлена полная инактивация аэробных и анаэробных бактерий. Особенно это относится к анаэробным бактериям Clostridium spp. Методом акустической микроскопии установлено, что структура и физико-механические свойства полученных деминерализованных образцов не изменилась.
Предлагаемый способ обеспечивает 100% стерилизацию костных имплантатов при сохранении остеоиндуктивных свойств образца.
Озоновую обработку на этапе подготовки исходного костного фрагмента проводят для обеспечения безопасности персонала, непосредственно контактирующего с исходным материалом на всех стадиях изготовления имплантата.
Испытания подтвердили состоятельность предложенного способа по практическому использованию в медицине для стерилизации костных имплантатов.
Способ изготовления костного имплантата, включающий механическую обработку гидродинамической струей фрагмента костной ткани, деминерализацию заготовки в растворе неорганической кислоты, нейтрализацию остатков кислоты, промывку заготовки из костного материала, ее стерилизацию и консервацию, отличающийся тем, что осуществляют стерилизацию имплантата озоно-воздушной смесью с концентрацией озона 5-50 мг/м в течение 7-10 мин перед механической обработкой и аналогичную окончательную стерилизацию после завершения технологического процесса изготовления имплантата.
