Результат интеллектуальной деятельности: СПОСОБЫ, ОТНОСЯЩИЕСЯ К МОДИФИЦИРОВАННЫМ ГЛИКАНАМ
Вид РИД
Изобретение
По данной заявке испрашивается приоритет предварительной заявки на патент США № 61/139224, поданной 19 декабря 2008, полное раскрытие которой включено сюда с помощью ссылки.
Предпосылки изобретения
Модификации на гликоконъюгате (например, гликопротеине) до гликанов часто значительно воздействуют на функцию гликоконъюгата. Например, гликановые модификации могут воздействовать на способность гликопротеина правильно сворачиваться, на стабильность (например, устойчивость к протеолитическому и/или другому распаду), каталитическую активность, фармакодинамические и/или фармакокинетические свойства и/или взаимодействие с другими молекулами. Гликановые модификации гликопротеина могут воздействовать на транспорт и направленность гликопротеина. Например, гликановые модификации гликопротеина могут воздействовать на то, остается ли гликопротеин внутриклеточным (включая, например, правильную направленность гликопротеина в правильный субклеточный компартмент или компартменты), будет ли гликопротеин мембраносвязанным и/или будет ли гликопротеин секретироваться клеткой.
Краткое описание изобретения
Гликаны зачастую модифицируют с помощью сиалирования, то есть путем присоединения сиаловой кислоты. Необычные модификации до гликанов, такие как сульфатация, фосфорилирование и полиацетилированное сиалирование (например, диацетилированное сиалирование), часто не выявляют при анализе гликопротеинов. Такие модификации могут быть не выявлены, по меньшей мере, частично из-за сложности их анализа и нестабильности таких модификаций. Данное раскрытие включает подтверждение того, что необычные модификации являются, тем не менее, биологически значимыми и что способы их определения и количественной оценки являются необходимыми.
Среди прочего, данное раскрытие обеспечивает способы обогащения, определения, обнаружения и/или количественной оценки необычно модифицированных гликанов. Во многих вариантах осуществления способы включают обеспечение препарата гликана, из которого были выделены сиаловые кислоты (например, обработанный сиалидазой препарат гликана). Этот препарат включает гликаны (т.е., устойчивые к сиалидазе гликаны), которые не отщепились под действием обработки, выделяющей сиаловые кислоты. Предложенные способы типично включают подвергание предоставленного препарата гликана методу разделения, который отделяет гликаны, имеющие первый заряд, от незаряженных гликанов и/или гликанов, имеющих второй заряд, и/или который отделяет гликаны на основании их отношения заряда к массе; и необязательно количественную оценку разделенных гликанов. Во многих вариантах осуществления количественная оценка включает применение, по меньшей мере, одного стандарта количественной оценки.
Краткое описание графических материалов
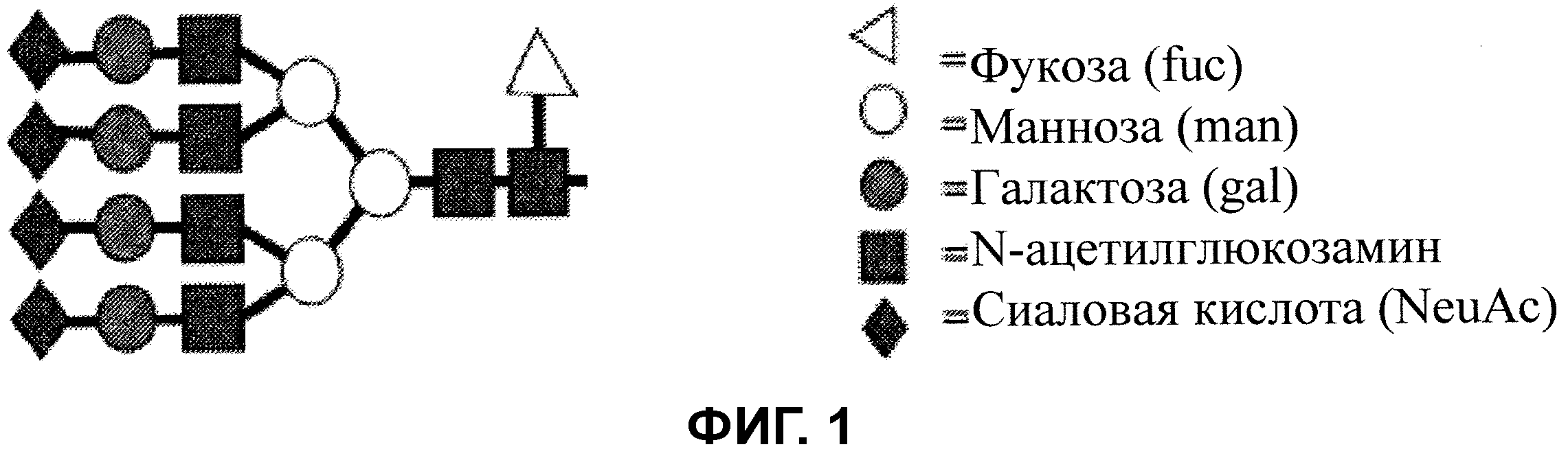
Фигура 1 показывает структуру иллюстративного N-связанного гликана.
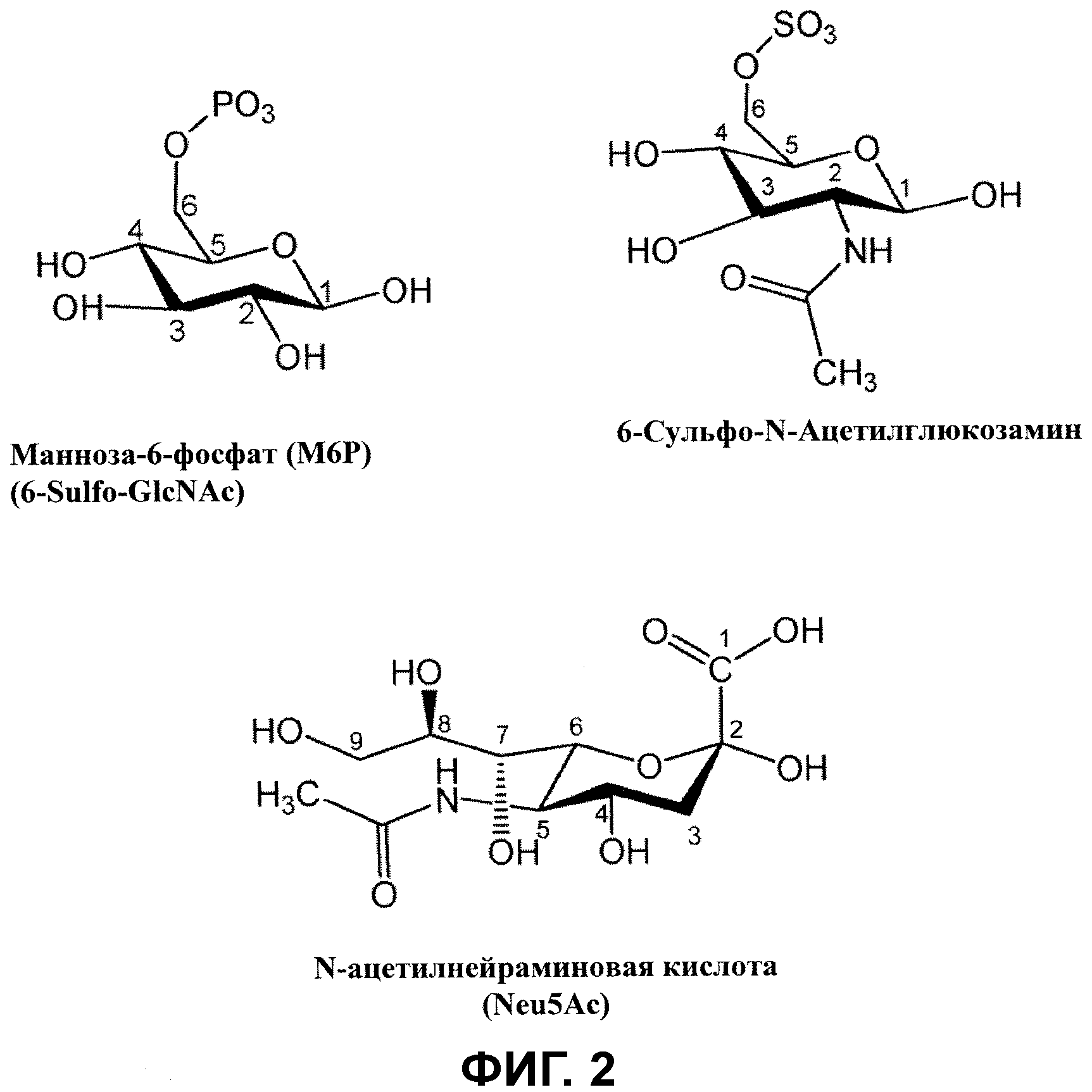
Фигура 2 показывает неограничивающие примеры модифицированных остатков в гликанах: манноза-6-фосфат (M6P) и 6-сульфо-N-ацетилглюкозамин (6-сульфо-GlcNAc). Структура обычной сиаловой кислоты, N-ацетилнейраминовой кислоты (Neu5Ac), показана без дополнительных модификаций для ясности. Ацетилирование обычно присутствует в 5 положении (показано); дополнительное ацетилирование может иметь место в положениях 7, 8 и 9. Как используется здесь, “полиацетилированная” по отношению к сиаловой кислоте касается дополнительного ацетилирования в двух или более из 7, 8 и 9 положений. “Диацетилированная” используется по отношению к сиаловой кислоте для обозначения дополнительного ацетилирования в двух из 7, 8 и 9 положений.
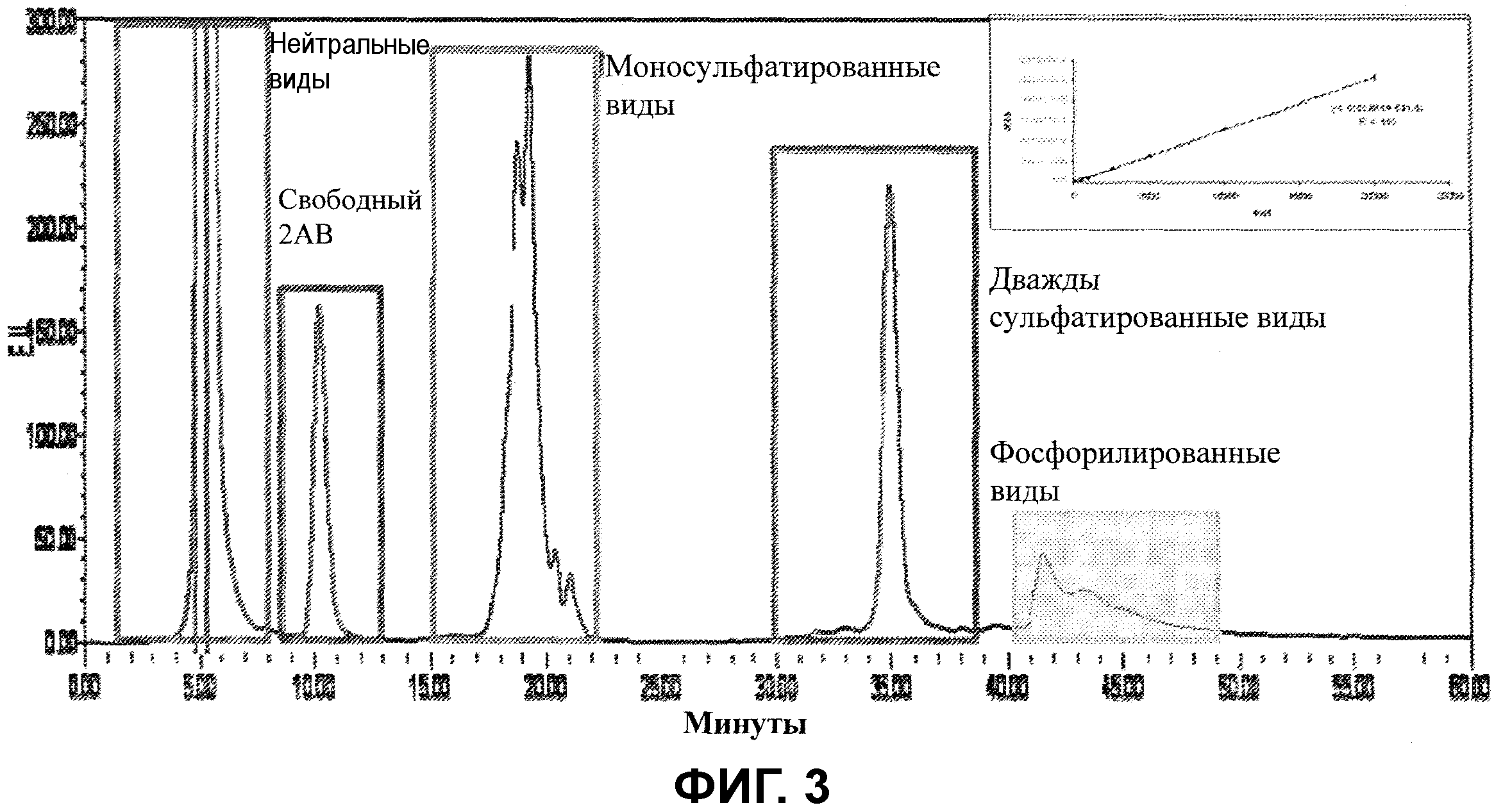
Фигура 3 показывает профиль анионообменной хроматографии-высокоэффективной жидкостной хроматографии (AEX-HPLC) необычно модифицированных видов, полученных из терапевтического гликопротеина эритропоэтина с биологической активностью, полученного из Китайского научного центра, после обработки сиалидазой. Вставка показывает калибровочную кривую с использованием 2-аминобензамид-хитобиозы в качестве внешнего стандарта. Пики, определенные здесь как необычно модифицированные виды, были дополнительно определены как фосфорилированные N-гликаны и сульфатированные гликаны.
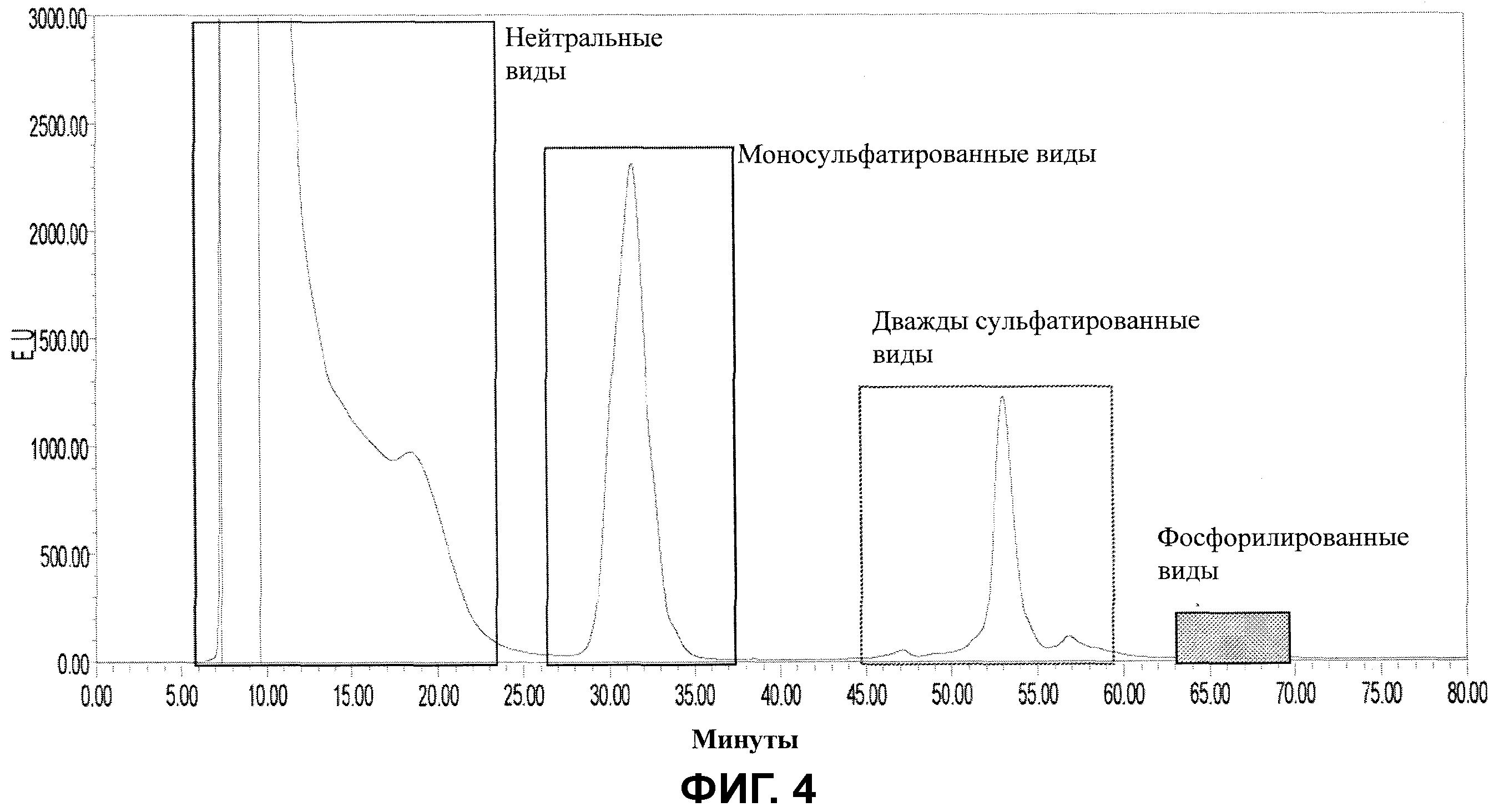
Фигура 4 показывает профиль анионообменной хроматографии-высокоэффективной жидкостной хроматографии (AEX-HPLC) необычно модифицированных видов, полученных из второго гликопротеина, представляющего интерес, с биологической активностью, с 97% идентичностью аминокислотной последовательности с терапевтическим гликопротеином эритропоэтина, описанным на Фигуре 3, после обработки сиалидазой. Пики, определенные здесь как необычно модифицированные виды, были дополнительно определены как фосфорилированные N-гликаны и сульфатированные гликаны.
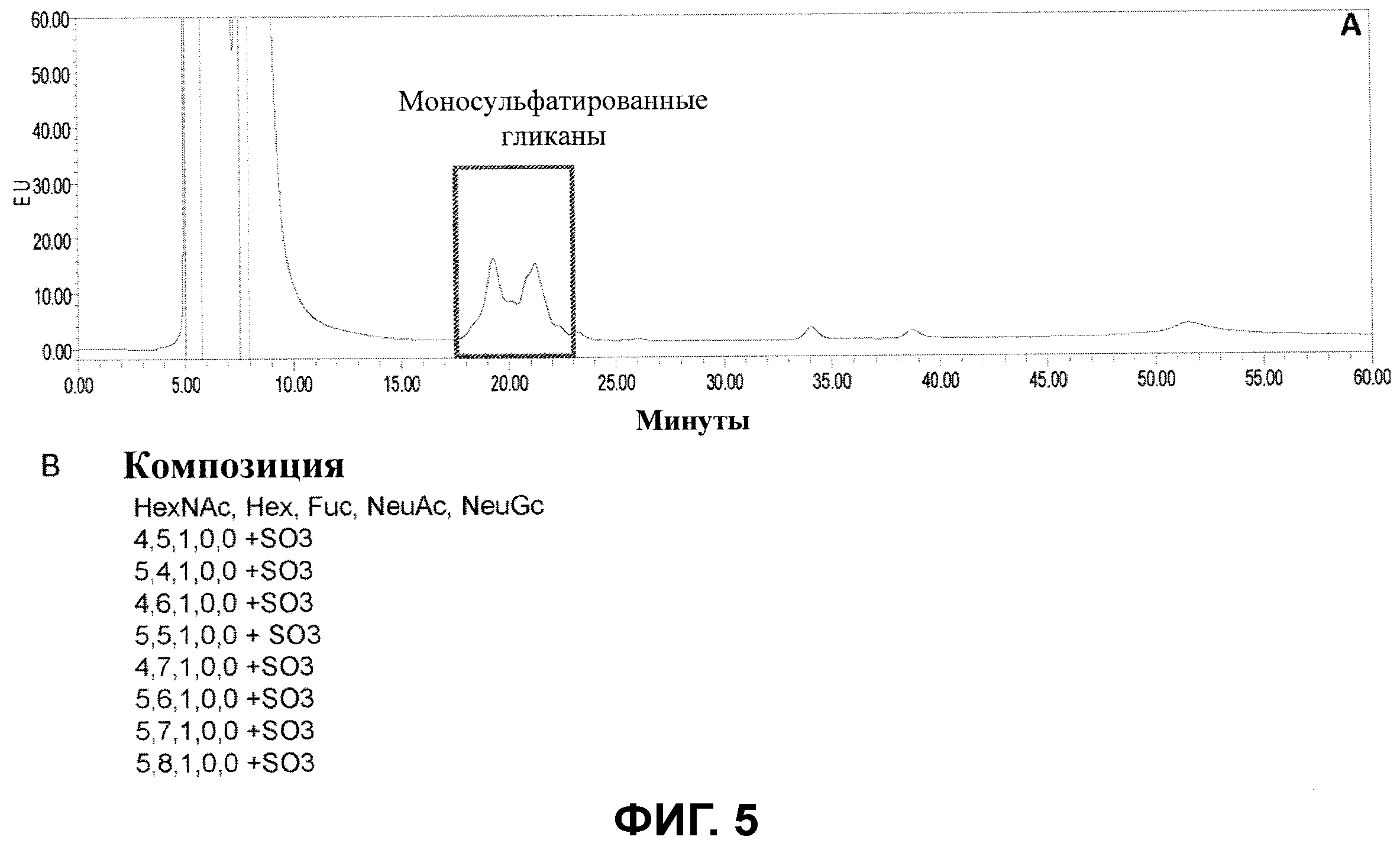
Фигура 5 показывает результаты хроматографического анализа сульфатированных гликанов, полученных из моноклонального анти-EGFR (рецептор эпидермального фактора роста) антитела, полученного у мыши. Композицию гликанов в пределах пика определяли с помощью масс-спектрометрии. В условных обозначениях, используемых на панели B, например, “5,4,1,0,0+SO3” соответствует HexNAc5, Hex4, Fuc1, NeuAc0, NeuGc0 + один сульфату.
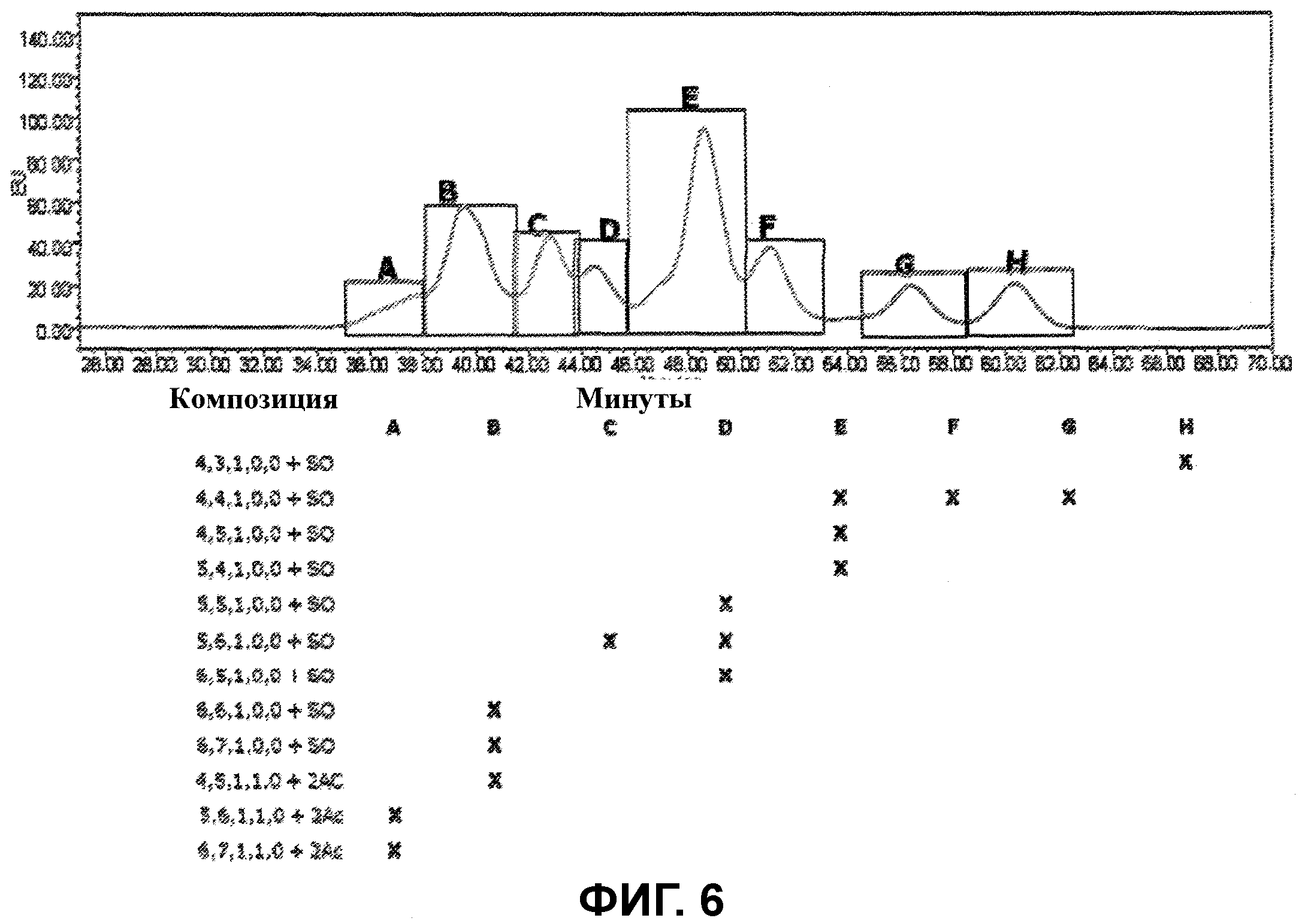
Фигура 6 показывает результаты хроматографического анализа сульфатированных и диацетилированных сиалированных гликанов, полученных из CTLA4-IgG из одного клона (клон 1). Композицию гликанов в пределах пика определяли с помощью масс-спектрометрии.
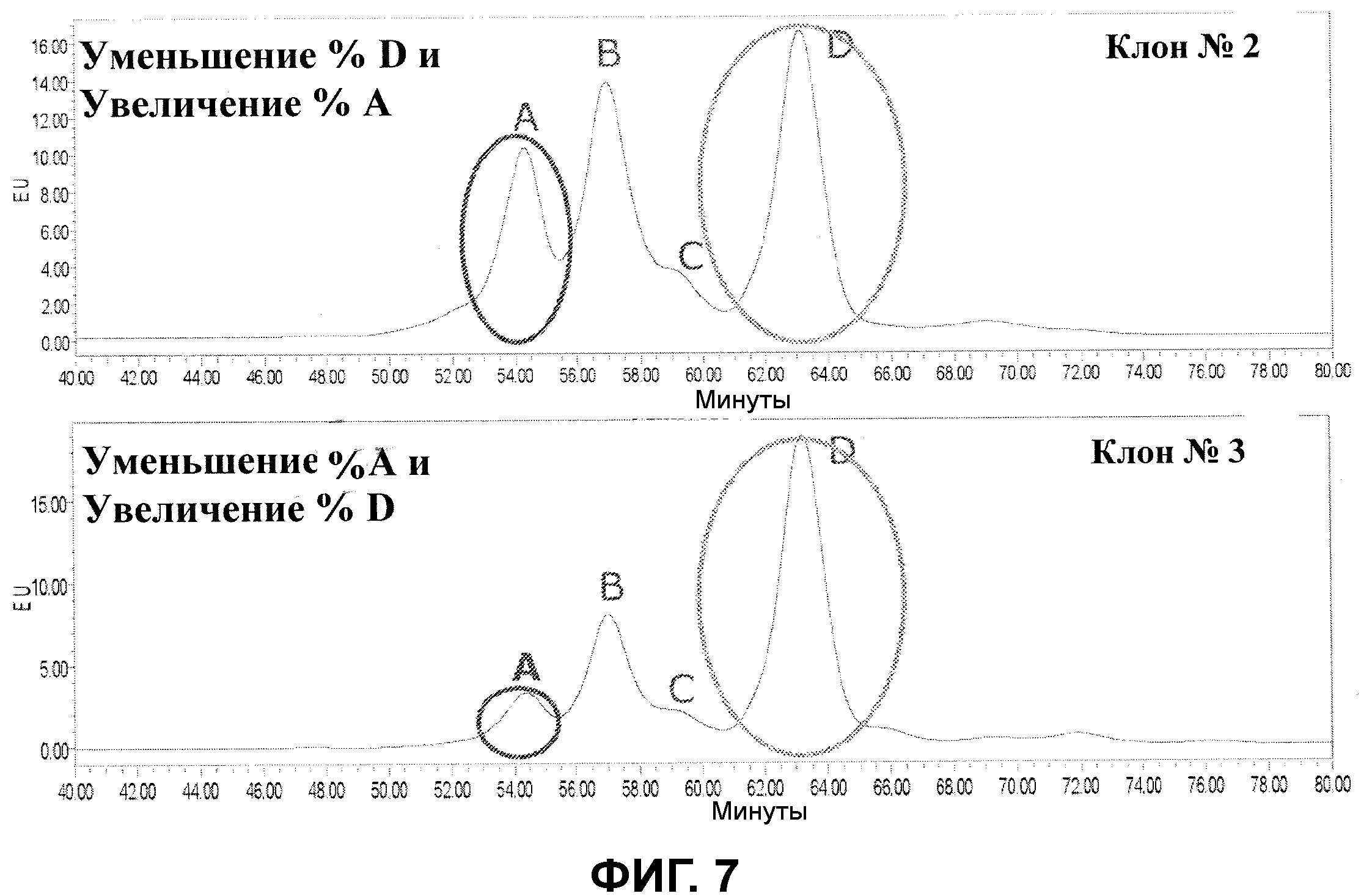
Фигура 7 показывает результаты хроматографического анализа сульфатированных и диацетилированных сиалированных гликанов, полученных из CTLA4-IgG из двух различных отдельных клонов (клон 2, верхняя панель; клон 3, нижняя панель).
Определения
Ацетил: Как используется здесь, термин “ацетил” (также известный как “этаноил” и часто обозначается как “Ac”) используется здесь для обозначения функциональной группы с химической формулой -COCH3.
Ацетилированный: Как используется здесь, термин “ацетилированный” означает модифицированный с помощью ковалентного присоединения ацетильной группы. Например, ацетилированный гликан - это гликан, который модифицирован путем ковалентного присоединения одной или более ацетильных групп. Ацетилированный гликан может иметь или не иметь дополнительных модификаций.
Ацетилирование: Как используется здесь, термин “ацетилирование” (также известное в IUPAC номенклатуре как “этаноилирование”) относится к процессу ковалентного присоединения одной или более ацетильных групп к молекуле (например, к гликану).
Приблизительно, около, приближенно: Как используется здесь, термины “приблизительно”, “около” или “приближенно”, как применяется к одному или более значениям, представляющим интерес, относятся к значению, которое сходно с установленным эталонным значением. В определенных вариантах осуществления термины “приблизительно”, “около” или “приближенно” относятся к диапазону значений, который попадает в пределы 25%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или менее установленного эталонного значения.
Биологический образец: Термин “биологический образец”, как используется здесь, относится к любому твердому или жидкому образцу, полученному из экскретируемому или из секретируемому любой живой клеткой или организмом, включая, но не ограничиваясь следующим: тканевая культура, образец из биореактора, ткань человека или животного, растения, фрукты, овощи, одноклеточные микроорганизмы (такие как бактерии и дрожжи) и многоклеточные организмы. Например, биологический образец может быть биологической жидкостью, полученной из, например, крови, плазмы, сыворотки, мочи, желчи, семенной жидкости, цереброспинальной жидкости, водянистой влаги или стекловидного тела, или любого секрета тела, транссудата, экссудата (например, жидкости, полученной из места абсцесса или любого другого места инфекции или воспаления), или жидкости, полученной из сустава (например, нормального сустава или сустава, пораженного заболеванием, таким как ревматоидный артрит, остеоартрит, подагра или септический артрит). Биологический образец может также быть, например, образцом, полученным из любого органа или ткани (включая препарат для биопсии или аутопсии), может содержать клетки (либо первичные клетки, либо культивированные клетки), среду, кондиционированную любой клеткой, тканью или органом, клеточную культуру.
Гликопротеин клеточной поверхности: Как используется здесь, термин “гликопротеин клеточной поверхности” относится к гликопротеину, по меньшей мере, часть которого присутствует на внешней поверхности клетки. В некоторых вариантах осуществления гликопротеин клеточной поверхности представляет собой белок, который расположен на клеточной поверхности так, чтобы, по меньшей мере, одна из гликановых структур присутствовала на внешней поверхности клетки.
Гликан клеточной поверхности: “Гликан клеточной поверхности” представляет собой гликан, который присутствует на внешней поверхности клетки. Во многих вариантах осуществления данного раскрытия гликан клеточной поверхности ковалентно связан с полипептидом как часть гликопротеина клеточной поверхности. Гликан клеточной поверхности может также быть связанным с липидом клеточной мембраны.
Нахождение в соответствии: Термин “нахождение в соответствии”, как используется здесь, относится к установлению предсказуемой взаимосвязи между двумя вещами. В вариантах осуществления, описанных здесь, паттерн гликозилирования (или его характеристика) на поверхности клетки коррелирует с паттерном гликозилирования (или его характеристикой) целевого гликоконъюгата (например, гликопротеина), продуцируемого клеткой. Нет необходимости, чтобы коррелированные паттерны (или характеристики) были идентичными друг другу, поскольку один может быть предсказан из другого. Как только корреляция установлена, она может быть записана, например, в письменном протоколе или может быть другим образом зафиксирована на носителе или источнике с памятью (например, машиночитаемом носителе или компьютерном банке памяти или диске). Обнаружение коррелированного паттерна гликозилирования (или его характеристики) может затем включать ссылку на письменную или зафиксированную запись, или на эксперимент сравнения, подтверждающий корреляцию и т.д. Такой эксперимент сравнения может быть проведен одновременно с оценкой паттерна гликозилирования (или его характеристики), или может быть предыдущим или последующим экспериментом.
Диацетилирование: Как используется здесь, термин “диацетилирование” относится к ацетилированию в двух положениях на молекуле, где ацетилирование обычно не обнаруживают. При использовании в отношении модификаций молекул сиаловой кислоты “диацетилирование” относится к ацетилированию в двух положениях в дополнение к ацетилированию в положении 5, которое является типично ацетилированным в сиаловых кислотах. В некоторых вариантах осуществления диацетилирование молекул сиаловой кислоты включает ацетилирование двух из положений 7, 8 и 9 (см. Фигуру 2.)
Гликан: Как известно из уровня техники и используется здесь, “гликаны” представляют собой сахара. Гликаны могут быть мономерами или полимерами остатков сахара, но типично содержат, по меньшей мере, три сахара, и могут быть линейными или разветвленными. Гликан может включать остатки природных сахаров (например, глюкозы, N-ацетилглюкозамина, N-ацетилнейраминовой кислоты, галактозы, маннозы, фукозы, гексозы, арабинозы, рибозы, ксилозы и т.д.) и/или модифицированных сахаров (например, 2'-фторрибозы, 2'-дезоксирибозы, фосфоманнозы, 6'-сульфо-N-ацетилглюкозамина и т.д.). Термин “гликан” включает гомо- и гетерополимеры остатков сахара. Термин “гликан” также включает гликановый компонент гликоконъюгата (например, гликопротеина, гликолипида, протеогликана и т.д.). Термин также включает свободные гликаны, включая гликаны, которые были отщеплены или выделены другим образом из гликоконъюгата.
Препарат гликана: Термин “препарат гликана”, как используется здесь, относится к набору гликанов, полученных согласно конкретному способу получения. В некоторых вариантах осуществления “препарат гликана” относится к набору гликанов, полученных из препарата гликопротеина (см. определение препарата гликопротеина ниже). В определенных вариантах осуществления препараты гликана содержат устойчивые к сиалидазе гликаны.
Гликоконъюгат: Термин “гликоконъюгат”, как используется здесь, включает все молекулы, в которых, по меньшей мере, одна часть сахара ковалентно связана, по меньшей мере, с одной другой частью. Термин особенно включает все биомолекулы с ковалентно присоединенными частями сахара, включая, например, N-связанные гликопротеины, O-связанные гликопротеины, гликолипиды, протеогликаны и т.д.
Гликоформа: Термин “гликоформа” используется здесь для обозначения конкретной формы гликоконъюгата. То есть, когда одинаковая часть скелета (например, полипептид, липид и т.д.), которая является частью гликоконъюгата, имеет возможность быть связанной с различными гликанами или набором гликанов, то каждый отличающийся вариант гликоконъюгата (т.е., где скелет связан с конкретным набором гликанов) называют “гликоформа”.
Гликолипид: Термин “гликолипид”, как используется здесь, относится к липиду, который содержит одну или более ковалентно связанных частей сахара (т.е. гликанов). Часть(и) сахара может быть в форме моносахаридов, дисахаридов, олигосахаридов и/или полисахаридов. Часть(и) сахара может содержать одну неразветвленную цепь остатков сахара или может состоять из одной или более разветвленных цепей. В определенных вариантах осуществления части сахара могут включать сульфатные и/или фосфатные группы. В определенных вариантах осуществления гликопротеины содержат O-связанные части сахара; в определенных вариантах осуществления гликопротеины содержат N-связанные части сахара.
Гликопротеин: Как используется здесь, термин “гликопротеин” относится к белку, который содержит пептидный скелет, ковалентно связанный с одной или более частями сахара (т.е., гликанами). Как понятно специалистам в данной области техники, пептидный скелет типично содержит линейную цепь аминокислотных остатков. В определенных вариантах осуществления пептидный скелет пересекает клеточную мембрану так, что он содержит трансмембранную часть и внеклеточную часть. В определенных вариантах осуществления пептидный скелет гликопротеина, который пересекает клеточную мембрану, содержит внутриклеточную часть, трансмембранную часть и внеклеточную часть. В определенных вариантах осуществления способы данного раскрытия содержат отщепление гликопротеина клеточной поверхности с помощью протеазы для выделения внеклеточной части гликопротеина или ее части, где такое воздействие по существу не разрушает клеточную мембрану. Часть(и) сахара может быть в форме моносахаридов, дисахаридов, олигосахаридов и/или полисахаридов. Часть(и) сахара может содержать одну неразветвленную цепь остатков сахара или может содержать одну или более разветвленных цепей. В определенных вариантах осуществления части сахара могут включать сульфатные и/или фосфатные группы. Альтернативно или дополнительно, части сахара могут включать ацетил-, гликолил-, пропил- или другие алкил-модификации. Альтернативно или дополнительно, части сахара могут быть модифицированы диацетилированием. В определенных вариантах осуществления гликопротеины содержат O-связанные части сахара; в определенных вариантах осуществления гликопротеины содержат N-связанные части сахара. В определенных вариантах осуществления способы, раскрытые здесь, содержат стадию анализа любого или всех гликопротеинов клеточной поверхности, выделенных фрагментов (например, гликопептидов) гликопротеинов клеточной поверхности, гликанов клеточной поверхности, присоединенных к гликопротеинам клеточной поверхности, пептидных скелетов гликопротеинов клеточной поверхности, фрагментов таких гликопротеинов, гликанов и/или пептидных скелетов и их комбинаций.
Препарат гликопротеина: “Препарат гликопротеина”, как этот термин используется здесь, относится к набору отдельных молекул гликопротеина, который содержит полипептид, имеющий конкретную аминокислотную последовательность (где аминокислотная последовательность включает, по меньшей мере, один сайт гликозилирования) и, по меньшей мере, один гликан, ковалентно присоединенный к, по меньшей мере, одному сайту гликозилирования. Отдельные молекулы конкретного гликопротеина в препарате гликопротеина типично имеют идентичные аминокислотные последовательности, но могут отличаться по занятости, по меньшей мере, одного из сайтов гликозилирования и/или в идентичности гликанов, связанных с, по меньшей мере, одним из сайтов гликозилирования. То есть, препарат гликопротеина может содержать только одну гликоформу конкретного гликопротеина, но более типично содержит множество гликоформ. Различные препараты одного гликопротеина могут отличаться по идентичности присутствующих гликоформ (например, гликоформа, которая присутствует в одном препарате, может отсутствовать в другом) и/или по относительным количествам различных гликоформ. В некоторых вариантах осуществления данное изобретение обеспечивает способы и реагенты для анализа различных препаратов одного гликопротеина (т.е. имеющих идентичную аминокислотную последовательность). В некоторых вариантах осуществления данное изобретение обеспечивает способы и реагенты для анализа препаратов двух (или более) гликопротеинов, чьи аминокислотные последовательности показывают, по меньшей мере, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичности или больше.
Гликозидаза: Термин “гликозидаза”, как используется здесь, относится к средству, которое расщепляет ковалентную связь между последовательными сахарами в гликане или между сахаром и частью скелета (например, между сахаром и пептидным скелетом гликопротеина). В некоторых вариантах осуществления гликозидаза представляет собой фермент. В определенных вариантах осуществления гликозидаза представляет собой белок (например, белковый фермент), содержащий одну или более полипептидных цепей. В определенных вариантах осуществления гликозидаза представляет собой химическое средство отщепления.
Паттерн гликозилирования: Как используется здесь, термин “паттерн гликозилирования” относится к набору гликановых структур, присутствующих на конкретном образце. Например, конкретный гликоконъюгат (например, гликопротеин) или набор гликоконъюгатов (например, набор гликопротеинов) будет иметь паттерн гликозилирования. В некоторых вариантах осуществления говорят о паттерне гликозилирования гликанов клеточной поверхности, или “поверхностном паттерне гликозилирования.” Как используется здесь, “поверхностный паттерн гликозилирования” может относиться к паттерну гликанов (или “паттерну гликозилирования”), который существует на внеклеточном домене одного гликопротеина клеточной поверхности и/или гликолипида клеточной поверхности, представляющих интерес. Дополнительно или альтернативно, “поверхностный паттерн гликозилирования” может относиться к паттерну гликанов (или “паттерну гликозилирования”), который существует на внеклеточном домене множества гликопротеинов клеточной поверхности и/или гликолипидов клеточной поверхности. В определенных вариантах осуществления “поверхностный паттерн гликозилирования” описывает паттерн гликанов (или “паттерн гликозилирования”), который существует на полном комплементе гликопротеинов клеточной поверхности и/или гликолипидов клеточной поверхности. Основываясь на контексте, специалисты в данной области техники смогут без труда понять, относится ли “поверхностный паттерн гликозилирования” к паттерну гликозилирования множества гликопротеинов клеточной поверхности и/или гликолипидов клеточной поверхности. Паттерн гликозилирования может характеризоваться, например, идентичностями гликанов, количествами (абсолютными или относительными) отдельных гликанов или гликанов конкретных типов, степенью занятости сайтов гликозилирования, модификациями гликанов (например, сиалирование, полиацетилированное сиалирование, фосфорилирование, сульфатация, и т.д.) и т.д., или комбинациями таких параметров.
Полиацетилирование: Как используется здесь, термин “полиацетилирование” относится к ацетилированию в двух или более положениях на молекуле, где ацетилирование обычно не обнаруживают. При использовании в отношении модификаций молекул сиаловой кислоты “полиацетилирование” относится к ацетилированию в двух или более положениях в дополнение к ацетилированию в положении 5, которое является типично ацетилированным в сиаловых кислотах. В некоторых вариантах осуществления полиацетилирование молекул сиаловой кислоты включает ацетилирование двух или более из положений 7, 8 и 9 (см. Фигуру 2.)
N-гликан: Термин “N-гликан”, как используется здесь, относится к полимеру сахаров, который был выделен из гликоконъюгата, но ранее был связан с гликоконъюгатом посредством азотного мостика (см. определение N-связанного гликана ниже).
N-связанный гликан: Термин “N-связанный гликан”, как используется здесь, относится к гликану, который связан с гликоконъюгатом посредством азотного мостика. Существует разнообразный набор N-связанных гликанов, но типично он основан на общем коровом пентасахариде (Man)3(GlcNAc)(GlcNAc).
O-гликан: Термин “O-гликан”, как используется здесь, относится к полимеру сахаров, который был выделен из гликоконъюгата, но ранее был связан с гликоконъюгатом посредством кислородного мостика (см. определение O-связанного гликана ниже).
O-связанный гликан: Термин “O-связанные гликаны”, как используется здесь, относится к гликану, который связан с гликоконъюгатом посредством кислородного мостика. O-связанные гликаны типично присоединены к гликопротеинам посредством N-ацетил-D-галактозамина (GalNAc) или посредством N-ацетил-D-глюкозамина (GlcNAc) к гидроксильной группе L-серина (Ser) или L-треонина (Thr). Некоторые O-связанные гликаны также имеют модификации, такие как ацетилирование и сульфатация. В некоторых случаях O-связанные гликаны присоединены к гликопротеинам посредством фукозы или маннозы к гидроксильной группе L-серина (Ser) или L-треонина (Thr).
Фосфат: Как используется здесь, термин “фосфат” используется здесь для обозначения PO4 - группы (в свободном растворе) или PO3 группы (как часть соединения). В виде части химического названия термин “фосфат” относится к химическому соединению, модифицированному путем добавления фосфатной группы.
Фосфорилированный: Как используется здесь, термин “фосфорилированный” означает модифицированный с помощью ковалентного присоединения фосфатной группы. Например, фосфорилированный гликан - это гликан, который модифицирован путем ковалентного присоединения одной или более фосфорилированных групп. Фосфорилированный гликан может иметь или может не иметь дополнительные модификации.
Фосфорилирование: Как используется здесь, термин “фосфорилирование” относится к способу ковалентного добавления одной или более фосфатных групп к молекуле (например, к гликану).
Протеаза: Термин “протеаза”, как используется здесь, относится к средству, которое расщепляет пептидную связь между последовательными аминокислотами в полипептидной цепи. В некоторых вариантах осуществления протеаза представляет собой фермент (т.е., протеолитический фермент). В определенных вариантах осуществления протеаза представляет собой белок (например, белковый фермент), содержащий одну или более полипептидных цепей. В определенных вариантах осуществления протеаза представляет собой химическое средство отщепления.
Белок: В общем, “белок” представляет собой полипептид (т.е., нить, по меньшей мере, из двух аминокислот, связанных друг с другом пептидными связями). Белки могут включать части, отличные от аминокислот (например, могут быть гликопротеинами) и/или могут быть обработаны или модифицированы другим образом. Специалистам в данной области техники понятно, что “белок” может быть полной полипептидной цепью, такой, которая продуцируется клеткой (с или без сигнальной последовательности), или может быть ее функциональной частью. Специалистам в данной области техники также понятно, что белок может иногда включать более одной полипептидной цепи, например, связанной одной или более дисульфидными связями или ассоциированными другими способами.
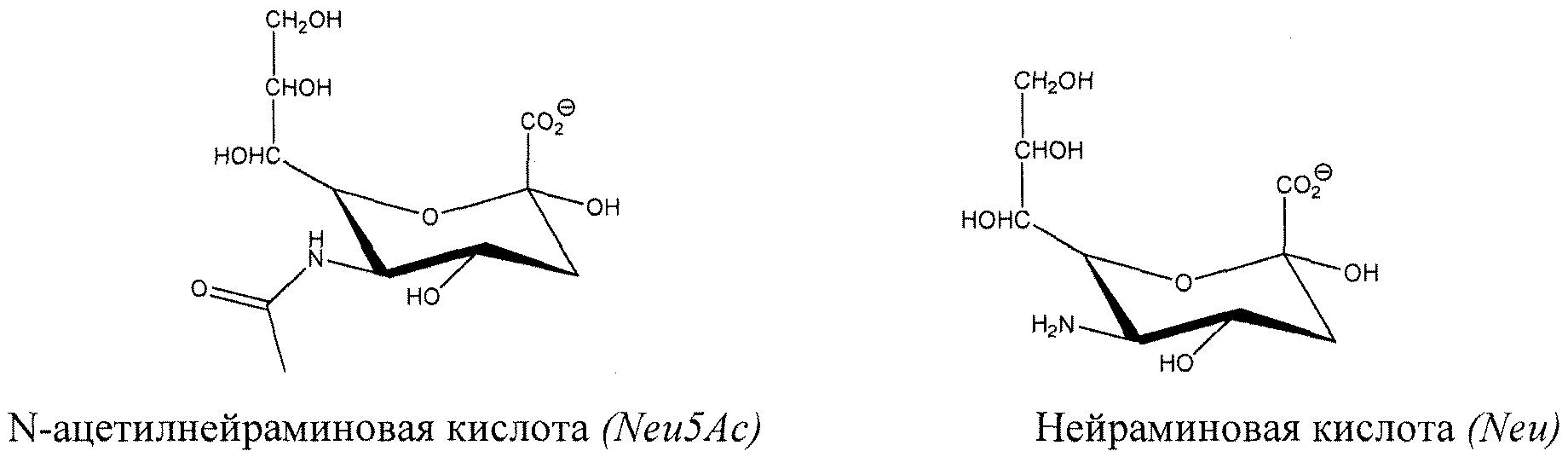
Сиаловая кислота: Термин “сиаловая кислота”, как используется здесь, представляет собой общий термин для N- или O-замещенных производных нейраминовой кислоты, девятиуглеводного моносахарида. Аминогруппа нейраминовой кислоты типично несет либо группу ацетила, либо группу гликолила в сиаловой кислоте. Гидроксильные заместители, присутствующие на сиаловой кислоте, могут быть модифицированы с помощью ацетилирования, метилирования, сульфатации и фосфорилирования. Преобладающая сиаловая кислота представляет собой N-ацетилнейраминовую кислоту (Neu5Ac). Сиаловые кислоты придают отрицательный заряд гликанам, так как карбоксильная группа имеет тенденцию диссоциировать протон при физиологическом pH. Иллюстративные депротонированные сиаловые кислоты представлены ниже:
Сиалидаза: Как используется здесь, термин “сиалидаза” относится к средству, которое отщепляет остатки сиаловой кислоты от гликанов. В некоторых вариантах осуществления сиалидаза представляет собой фермент. В определенных вариантах осуществления сиалидаза представляет собой белок (например, белковый фермент), содержащий одну или более полипептидных цепей. В определенных вариантах осуществления сиалидаза представляет собой химическое средство отщепления; в некоторых таких вариантах осуществления сиалидаза представляет собой слабую кислоту.
Устойчивый к сиалидазе: Как используется здесь, термин “устойчивый к сиалидазе”, при использовании в отношении гликанов, описывает характеристику, по существу, устойчивости к отщеплению с помощью обработки сиалидазой, как определено здесь. Например, гликаны, которые являются устойчивыми к сиалидазе, могут не содержать сиалидазных модификаций. Дополнительно или альтернативно, устойчивые к сиалидазе гликаны могут содержать модификации, которые не могут быть, по существу, отщеплены с помощью обработки сиалидазой. Примеры таких модификаций включают сульфатацию, фосфорилирование и/или полиацетилированное сиалирование. Как используется здесь, “устойчивые к сиалидазе” гликаны включают гликаны, которые содержат как модификации сиаловой кислоты, так и другие модификации, которые не могут быть, по существу, отщеплены с помощью обработки сиалидазой. Например, молекула гликана как с модификациями сиаловой кислоты, так и фосфорилированием, является устойчивой к сиалидазе.
Обработка сиалидазой: Как используется здесь, “обработка сиалидазой” относится к обработке средством при приемлемых условиях, чтобы обеспечить расщепление существенной части связей остатков сиаловой кислоты. В некоторых вариантах осуществления обработка сиалидазой приводит к выделению сиаловых кислот из молекул, таких как гликаны. В некоторых вариантах осуществления средство представляет собой полипептид фермента, такой как полипептид сиалидаза. В некоторых вариантах осуществления средство представляет собой химическое средство, такое как слабая кислота или комбинация слабых кислот. В некоторых вариантах осуществления комбинация средств, которые имеют сиалидазную активность, используется в обработке сиалидазой. Соответственно, “обработанный сиалидазой” образец, такой как, например, обработанный сиалидазой препарат гликана, подвергался обработке средством при таких условиях, чтобы обеспечить расщепление существенной части связей остатков сиаловой кислоты.
По существу: Как используется здесь, термин “по существу” относится к качественному условию проявления полной или почти полной величины или степени характеристики или свойства, представляющего интерес. Специалист в биологической области техники поймет, что биологические и химические явления редко, если вообще, идут до завершения и/или продолжаются до завершенности или достигают или избегают абсолютного результата. Термин “по существу”, таким образом, используется здесь для отражения потенциального отсутствия завершенности, присущей многим биологическим и химическим явлениям. Чтобы предоставить один конкретный пример, когда говорят, что обработка “по существу” не разрушила клеточные мембраны, то это означает, что все или почти все клеточные мембраны остались интактными в ходе и после обработки, например, так что внутриклеточные гликопротеины или гликопептиды, таким образом, не высвободились из клеток. В определенных вариантах осуществления термин “по существу”, как применяется к неразрушенным клеточным мембранам, относится к условию, где 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или менее клеток, подвергшихся конкретной обработке, демонстрируют заметно разрушенные клеточные мембраны. В определенных вариантах осуществления термин “по существу”, как применяется к не разрушенным клеточным мембранам, относится к условию, где ни одна из клеток, подвергшихся конкретной обработке, не демонстрирует заметно разрушенные клеточные мембраны.
Сульфат: Как используется здесь, термин “сульфат” используется здесь для обозначения SO4 - группы (в свободном растворе) или SO3 группы (как часть соединения). Как часть химического названия термин “сульфат” относится к химическому соединению, модифицированному путем добавления сульфатной группы.
Сульфатированный: Как используется здесь, термин “сульфатированный” означает модифицированный с помощью ковалентного присоединения сульфатной группы. Например, сульфатированный гликан представляет собой гликан, который модифицирован путем ковалентного присоединения одной или более сульфатных групп. Сульфатированный гликан может иметь или не иметь дополнительные модификации.
Сульфатация: Как используется здесь, термин “сульфатация” относится к способу ковалентного добавления одной или более сульфатных групп к молекуле (например, к гликану).
Необычные модификации: Как используется здесь, термин “необычные модификации”, когда используются в отношении модификаций гликанов, относятся к модификациям, отличным от сиалирования без модификаций сиаловых кислот, отличным от ацетилирования в 5 положении. Неограничивающие примеры необычных модификаций включают фосфорилирование, сульфатацию и полиацетилированное сиалирование. Например, остатки маннозы могут быть фосфорилированы в C-6 положении, остатки N-ацетилглюкозамина могут быть сульфатированы в C-6 положении, остатки сиаловой кислоты могу быть ацетилированы в двух из 7, 8 и 9 положений в дополнение к тому, что они ацетилированы в обычном 5 положении и т.д.
Подробное описание определенных предпочтительных вариантов осуществления
Как описывается здесь, данное раскрытие относится к способам обогащения, определения, обнаружения и/или количественной оценки необычно модифицированных гликанов в смеси. В общем, необычно модифицированные гликаны содержат модификации, отличные от сиалирования, которые обеспечивают заряд на гликанах. В некоторых вариантах осуществления заряд представляет собой отрицательный заряд. Примеры необычных модификаций включают фосфорилирование, сульфатацию, полиацетилированное сиалирование или их комбинацию. Во многих вариантах осуществления способы содержат стадии, на которых обеспечивают препарат гликана, из которого были выделены сиаловые кислоты; подвергают препарат гликана методу разделения, который разделяет гликаны на основе отношения заряда к массе; и проводят количественную оценку, по меньшей мере, одного разделенного гликана. Во многих вариантах осуществления такая количественная оценка включает использование, по меньшей мере, одного стандарта количественной оценки.
I. Препараты гликана, из которых были выделены сиаловые кислоты
В общем, препараты гликана обеспечивают путем получения материала из источника гликанов и обработки материала. Термин “препарат гликана”, как используется здесь, типично относится к материалу, содержащему гликаны после того, как материал подвергся обработке для выделения гликанов. Во многих вариантах осуществления препараты гликана также подвергаются обработке и/или способу для выделения сиаловых кислот из препарата. В некоторых вариантах осуществления обработка для выделения сиаловых кислот содержит обработку сиалидазой, как описывается здесь. Препараты гликана, которые также подверглись обработке сиалидазой, здесь называют “обработанные сиалидазой препараты гликана”. Термин “обработанный сиалидазой препарат гликана”, как используется здесь, включает материал, который подвергся обработке в дополнение к описанной обработке.
Гликаны могут быть получены из различных источников, как обсуждается ниже. Для того чтобы облегчить лучшее понимание предложенных способов, предлагается описание гликанов и гликоконъюгатов.
A. Гликаны и гликоконъюгаты
В общем, гликан относится к углеводной части, которая в некоторых вариантах осуществления ковалентно прикреплена к гликопротеину. Углеводные части (например, олигосахаридные цепи) связаны с гликопротеинами в эндоплазматическом ретикулуме и аппарате Гольджи посредством либо N-мостиков, либо O-мостиков. Данное раскрытие включает распознавание, которое является благоприятным для определения необычных модификаций (таких, как фосфорилирование) гликанов (например, гликанов, которые конъюгированы с полипептидами в гликопротеинах). Способы, описанные здесь, могут быть использованы для анализа необычных модификаций (например, количества в препарате гликана, химической природы модификации и т.д.) любого гликана. Способы могут альтернативно или дополнительно быть использованы для обогащения необычно модифицированными видами гликанов.
1. N-связанные гликаны
Типично, N-связанные олигосахаридные цепи присоединяются к гликопротеинам в просвете эндоплазматического ретикулума (см. Alberts et al., Molecular Biology of the Cell, 1994, включенную сюда с помощью ссылки). Углеводные части присоединяются к аминогруппе на боковой цепи аспарагинового остатка, который содержится в целевой консенсусной последовательности Asn-X-Ser/Thr, где X может быть любой аминокислотой, кроме пролина. Начальная олигосахаридная цепь обычно обрезается специфическими ферментами гликозидазами в эндоплазматическом ретикулуме, давая в результате короткий, разветвленный коровый олигосахарид, состоящий из двух остатков N-ацетилглюкозамина и трех остатков маннозы.
N-связанные гликаны и N-гликаны могут быть подразделены на три отдельные группы, имеющие названия “тип с высоким содержанием маннозы”, “гибридный тип” и “сложный тип” с общим пентасахаридным кором (Manp(α1,6)-(Manp(α1,3))-Manp(β1,4)-GlcpNAc(β1,4)- GlcpNAc(β1,N)-Asn), наблюдающимся во всех трех группах. Модификации кора включают, например, дополнительное гликозилирование, обеспечивающее деление пополам GlcNAc, прикрепление фукозильного остатка к наиболее глубокому GlcNAc и кэппирование остатками сиаловой кислоты (Neu). Иллюстративная структура N-связанного гликана изображена на Фигуре 1. Как показано на Фигуре 1, структурный вариант N-связанных гликанов главным образом находится относительно (до) 4 антенн на левой стороне N-связанных гликанов, изображенных на Фигуре 1. N-связанные гликаны, главным образом, обнаруживают как компоненты пептидов (т.е., гликопептида) и белков (т.е., гликопротеина).
После начального процессинга в эндоплазматическом ретикулуме гликопротеины затем транспортируются на аппарат Гольджи, где может иметь место дополнительный процессинг. Обрезанные N-связанные олигосахаридные цепи могут быть модифицированы путем присоединения нескольких остатков маннозы, давая в результате “олигосахарид с высоким содержанием маннозы”. Альтернативно или дополнительно, одна или более моносахаридных единиц N-ацетилглюкозамина могут быть присоединены к коровым субъединицам маннозы для образования “сложных олигосахаридов”. Галактоза может быть присоединена к субъединицам N-ацетилглюкозамина, и субъединицы сиаловой кислоты могут быть присоединены к субъединицам галактозы, давая в результате цепи, которые заканчиваются любым остатком сиаловой кислоты, галактозы или N-ацетилглюкозамина. Остаток фукозы может быть присоединен к остатку N-ацетилглюкозамина корового олигосахарида. Каждое из этих присоединений катализируется специфическими гликозилтрансферазами.
'Гибридные гликаны' включают характеристики как гликанов с высоким содержанием маннозы, так и сложных гликанов. Например, одна часть гибридного гликана может включать преимущественно или исключительно остатки маннозы, тогда как другая часть может содержать сахара: N-ацетилглюкозамин, сиаловую кислоту, галактозу и/или фукозу.
N-связанные гликаны вовлечены в разнообразие клеточных процессов. Например, N-связанные гликаны вносят свой вклад в правильное сворачивание белка в эукариотических клетках. Белки шапероны в эндоплазматическом ретикулуме (например, калнексин и калретикулин) связываются с тремя остатками глюкозы, присутствующими на коре N-связанного гликана. Белки шапероны типично содействуют сворачиванию белка, к которому присоединяется гликан. После правильного сворачивания три остатка глюкозы удаляются, и N-связанный гликан может переходить на дальнейшие реакции процессинга. Если белок свернут неправильно, то три остатка глюкозы присоединяются заново, позволяя белку заново ассоциировать с шаперонами. Этот цикл может повторяться несколько раз, пока белок не достигнет своей правильной конформации. Если белок многократно сворачивается неправильно, он обычно экскретируется из эндоплазматического ретикулума и разрушается цитоплазматическими протеазами.
Альтернативно или дополнительно, N-связанные гликаны вносят свой вклад в сворачивание белка с помощью стерических эффектов. Например, остатки цистеина в пептиде могут быть временно заблокированы от образования дисульфидных связей с другими остатками цистеина, из-за размера соседнего гликана. Присутствие N-связанного гликана, таким образом, может позволить клетке контролировать то, какие остатки цистеина будут образовывать дисульфидные связи.
N-связанные гликаны могут быть вовлечены во взаимодействия по типу клетка-клетка. Например, опухолевые клетки часто продуцируют аномальные структуры N-связанного гликана, которые могут быть распознаны CD337 рецептором на клетках натуральных киллерах как признак того, что рассматриваемая клетка является злокачественной.
N-связанные гликаны могут быть вовлечены в направление деструктивных лизосомальных ферментов на лизосому. Модификация N-связанного гликана с остатком манноза-6-фосфата может служить сигналом того, что белок, к которому этот гликан присоединен, должен быть нацелен на лизосому.
2. O-связанные гликаны
O-связанные олигосахаридные цепи присоединяются к специфическим остаткам серина или треонина в полипептидных цепях. Перенос первого остатка сахара, который во многих случаях является N-ацетилгалактозамином, типично начинается в эндоплазматическом ретикулуме и завершается в аппарате Гольджи. Остатки O-связанного олигосахарида присоединяют поочередно, и присоединение с каждого остатка катализируется специфическим ферментом. В отличие от N-связанного гликозилирования, консенсусная аминокислотная последовательность для O-связанного гликозилирования является менее отчетливо определенной.
3. Гликоконъюгаты
Методы данного раскрытия могут быть применены для оценки и/или обогащения необычно модифицированными гликанами на любом гликоконъюгате, представляющем интерес (здесь далее “целевой гликоконъюгат”). Ссылка на “гликоконъюгат, представляющий интерес”, “гликопротеин, представляющий интерес”, “целевой гликоконъюгат”, “целевой гликопротеин” и т.д. не подразумевает, что существует всегда один конкретный гликоконъюгат, чьи гликаны необходимо оценить. Конечно, в определенных вариантах осуществления предложенные способы используются для оценки гликанов из гликоконъюгатов, присутствующих в исходном материале, без нацеленности на конкретный гликоконъюгат.
В определенных вариантах осуществления оценивают гликаны на конкретном гликоконъюгате, представляющем интерес. В некоторых вариантах осуществления гликоконъюгат, представляющий интерес, является гликопротеином (здесь далее “целевой гликопротеин”).
В некоторых вариантах осуществления целевой гликоконъюгат продуцируется естественно клеткой. В некоторых вариантах осуществления целевой гликоконъюгат естественно не производится клеткой; скорее клетку конструируют для его продукции. В некоторых вариантах осуществления целевой гликоконъюгат естественно продуцируется клеткой, но клетку конструируют для того, чтобы продуцировать его на повышенном уровне и/или при определенных заранее условиях (например, в присутствии стимулирующего средства и т.д.).
Во многих вариантах осуществления целевой гликоконъюгат имеет терапевтическую активность при введении животным (например, млекопитающим, таким как люди). Например, эритропоэтины, интерфероны, факторы свертываемости крови, колониестимулирующие факторы, разнообразие антител и определенные ферменты, среди множества прочих, представляют собой все гликопротеины, которые в данное время продуцируются в сконструированных клеточных линиях как биофармацевтические средства. В некоторых вариантах осуществления гликаны на биофармацевтических средствах (такие как, например, те, что были упомянуты ранее) анализируют, как описывается здесь. Специалист в данной области техники будет осведомлен о других коммерчески значимых гликоконъюгатах, которые могут быть экспрессированы в промышленных масштабах (например, в биореакторах для их продукции) для терапевтических и других целей. Данное раскрытие обеспечивает способы оценки гликанов таких коммерчески значимых гликоконъюгатов (например, гликопротеинов).
Репрезентативные коммерчески доступные гликопротеиновые продукты включают, например, те, что перечислены в Таблице 1.
|
|
Как понятно специалистам в данной области техники, паттерны гликозилирования (включая модификации, такие как, например, те, что описаны здесь) таких терапевтических гликопротеинов могут потенциально воздействовать на их терапевтические свойства. В некоторых вариантах осуществления гликаны терапевтических гликопротеинов оценивают как гликопротеины, которые продуцируются, т.е. на различных стадиях получения. Такие оценки могут облегчить контроль качества.
Специалистам в данной области техники будет понятно, что данное раскрытие не ограничивается оценкой гликанов на вышеперечисленных гликоконъюгатах, или обязательно на терапевтических гликоконъюгатах, или на гликоконъюгатах, чья экспрессия (и/или степень или временное регулирование экспрессии) была сконструирована в клетке. Они представляют определенные конкретные варианты осуществления данного раскрытия; специалистам в данной области техники будет понятно, тем не менее, что принципы раскрытия применяются к любому целевому гликоконъюгату.
B. Источники гликанов и/или гликоконъюгатов
Материал, который может быть обработан для получения препарата гликана, в общем, содержит гликоконъюгаты (такие как гликопротеины), чьи гликаны подлежат анализу и/или обогащению. Материалы могут быть получены из разнообразия источников, включая, но не ограничиваясь следующим: терапевтические составы (например, эритропоэтин, инсулин, гормон роста человека и т.д.), коммерческие биологические продукты (например, те, что представлены в Таблице 1), биореакторы и биологические образцы. Материалы могут быть получены из одного источника или объединены из многочисленных источников. Как используется здесь, термин “биологический образец” относится к любому твердому или жидкому образцу (например, жидкостям организма), полученному из экскретируемому или секретируемому любой живой клеткой или организмом, включая, но не ограничиваясь следующим: тканевая культура, ткань человека или животного, растения, фрукты, овощи, одноклеточные микроорганизмы (такие, как бактерии и дрожжи), многоклеточные организмы и их комбинации. Например, биологический образец может быть биологической жидкостью, полученной из, например, крови, плазмы, сыворотки, мочи, желчи, семенной жидкости, цереброспинальной жидкости, водянистой влаги или стекловидного тела или любого другого секрета тела, транссудата, экссудата (например, жидкости, полученной из места абсцесса или любого другого места инфекции или воспаления), или жидкости, полученной из сустава (например, нормального сустава или сустава, пораженного заболеванием, таким как ревматоидный артрит, остеоартрит, подагра или септический артрит). Биологический образец может также быть, например, образцом, полученным из любого органа или ткани (включая препарат для биопсии или аутопсии), может содержать клетки (либо первичные клетки, либо культивированные клетки), среду, кондиционированную любой клеткой, тканью или органом, клеточную культуру.
Исходные материалы, которые могут быть обработаны для получения препарата гликана, могут быть получены с помощью любой машины, человека или организации. В некоторых вариантах осуществления исходные материалы могут быть получены с помощью машины, которая может затем провести один или более испытаний, процессов или обработок препарата гликопротеина. В некоторых вариантах осуществления исходные материалы могут быть получены человеком. В некоторых вариантах осуществления исходные материалы могут быть получены из посторонней организации. В некоторых вариантах осуществления исходные материалы могут быть получены человеком или фирмой, обеспечивающими услуги определения характеристик для второго лица или компании. Например, фирма может работать таким образом, что получает исходные материалы (которые содержат гликаны, подлежащие определению характеристик) из других фирм или лабораторий. Исходные материалы, которые подходят для обработки для получения препарата гликана, могут быть предварительно обработаны любым способом. Например, исходные материалы могут быть предварительно обработаны для выделения одной или более гликоформ.
В определенных вариантах осуществления исходные материалы содержат гликоконъюгаты (например, гликопротеины), которые продуцируются клетками. Гликопротеины могут быть получены в любом из разнообразия клеток и/или клеточных линий. Конечно, любая клетка, которая гликозилирует, по меньшей мере, несколько из ее белков, может быть использована и выращена при любых условиях, которые позволяют произойти такому гликозилированию. Пригодные клетки включают, но не ограничиваются следующим: клетки млекопитающих, клетки птиц, клетки рыб, клетки насекомых, клетки растений, клетки грибов, клетки бактерий и гибридные клетки. В некоторых вариантах осуществления клетки были сконструированы (например, генетически и/или химически), чтобы иметь одну или более характеристик гликозилирования, более сходных с клетками человека.
Иллюстративные клетки млекопитающих, которые могут быть использованы согласно данному раскрытию, включают, но не ограничиваются следующим: клетки яичника китайского хомяка (CHO), HeLa клетки, Клетки почек собак Мадин-Дарби (MDCK), клетки почки новорожденного хомяка (BHK клетки), NS0 клетки, MCF-7 клетки, MDA-MB-438 клетки, U87 клетки, A172 клетки, HL60 клетки, A549 клетки, SP10 клетки, DOX клетки, DG44 клетки, HEK 293 клетки, SHSY5Y, Jurkat клетки, BCP-1 клетки, COS клетки, Vero клетки, GH3 клетки, 9L клетки, 3T3 клетки, MC3T3 клетки, C3H-10T1/2 клетки, NIH-3T3 клетки и C6/36 клетки.
Иллюстративные клеточные линии рыб, которые могут быть использованы согласно данному раскрытию, включают, но не ограничиваются следующим: ZF4 клетки, AB9 клетки, GAKS клетки, OLF-136 клетки, CAEP клетки, CAF клетки, OLHE-131 клетки, OLME-104 клетки, ULF-23 клетки, BRF41 клетки, Hepa-E1 клетки, Hepa-T1 клетки, GEM-81 клетки, GEM-199 клетки, GEM-218 клетки, GAKS клетки, D-11 клетки, R1 клетки, RTG-2 клетки, RTO клетки, и TPS клетки. Более полный перечень можно найти у Fryer and Lannan, 2005, “Three decades of fish cell culture: a current listing of cell lines derived from fishes,” J. Tissue Culture Methods, 16:87-94.
Иллюстративные клеточные линии насекомых, которые могут быть использованы согласно данному раскрытию, включают, но не ограничиваются следующим: SFM клетки, Sf21 клетки, Sf9 клетки, Schneider клетки, S2 клетки, T.ni клетки, SES-MaBr-1 клетки, SES-MaBr-3 клетки, NIAS-MB-25 клетки, NIAS-MaBr-92 клетки, FRI-SpIm-1229 клетки, SES-MaBr-4 клетки, NIAS-LeSe-11 клетки, TUAT-SpLi-221 клетки, NIAS-PX-64 клетки, NIAS-MB-32 клетки, NIAS-MaBr-93 клетки, SES-MaBr-5 клетки, BM-N клетки, NIAS-PX-58 клетки, MBHL-2 клетки и MBHL-3 клетки.
Специалистам в данной области техники будет понятно, что это иллюстративный, но не исчерпывающий перечень различных клеток, которые могут быть использованы согласно данному раскрытию. Другие клетки могут быть успешно использованы для получения целевого гликопротеина. Такие клетки могут быть в культуре или в пределах ткани, органа или организма.
Специалистам в данной области техники также будет понятно, что разнообразие систем экспрессии и векторов может быть использовано для экспрессии белка, представляющего интерес, в клетках или клеточных линиях, используемых согласно данному раскрытию (например, см. Molecular cloning: A Laboratory Manual, Ed. by Sambrook, CSHL Press, 2002).
Также любая из разнообразия сред для выращивания культур клеток, включая сложные среды и/или бессывороточные среды для выращивания культур, которые способны поддерживать рост одного или более клеточных типов или клеточных линий, может быть использована согласно данному раскрытию. Типично среда для выращивания культуры клеток содержит буфер, соли, источник энергии, аминокислоты (например, природные аминокислоты, неприродные аминокислоты и т.д.), витамины и/или микроэлементы. Среды для выращивания культур клеток могут необязательно содержать разнообразие других ингредиентов, включая, но не ограничиваясь следующим: источники углерода (например, натуральные сахара, ненатуральные сахара и т.д.), кофакторы, липиды, сахара, нуклеозиды, компоненты животного происхождения, гидролизаты, гормоны/факторы роста, поверхностно-активные вещества, индикаторы, минералы, активаторы/ингибиторы специфических ферментов и органические вещества (например, бутират, который индуцирует апоптоз, который выделяет гликозилазы, чаще снижает скорость роста клетки, что изменяет уровни гликозилтрансферазы, что может привести к более зрелому гликозилированию; и приводит к изменению энергии клетки; хлорохин, который воздействует на внутриклеточный pH; бетаин, осмопротектор; аммиак, который изменяет уровни внутриклеточного pH и который может изменить эффективность гликозилтрансферазы и т.д.), и/или малые молекулярные метаболиты (например, CMP-сиаловая кислота, глюкозамин, производные ненатурального сахара и т.д.). Среды для выращивания культур клеток, пригодные для использования согласно данному раскрытию, являются коммерчески доступными из различных источников, например, ATCC (Manassas, Va).
В определенных вариантах осуществления одна или более из следующих сред используются для выращивания клеток: RPMI-1640 среда, среда Игла, модифицированная по способу Дюльбекко, минимальная эссенциальная среда Игла, F-12K среда, среда Дюльбекко, модифицированная по способу Исков. Как будет понятно специалистам в данной области техники, при использовании определенной среды, которая является не содержащей сыворотку и/или не содержащей пептон, среда является типично обогащенной аминокислотами и микроэлементами (см., например, Патент США № 5122469 Mather et al. и Патент США № 5633162 Keen et al.).
Различные среды для выращивания культур клеток могут воздействовать на паттерн гликозилирования гликопротеинов, экспрессируемых в средах. Например, данная среда для выращивания культуры клеток может приводить к получению гликопротеинов с увеличенным паттерном гликозилирования, уменьшенным паттерном гликозилирования или измененным гликозилированием (например, представляющим увеличение определенных гликанов и уменьшением других). Специалист в данной области техники будет осведомлен и будет способен выбрать одну или более подходящих сред для выращивания культур клеток для использования в выращивании клеток, чьи гликаны подлежат анализу с использованием определенных способов данного раскрытия.
В некоторых вариантах осуществления клетки культивируют в порционной культуре, культуре с подпиткой, проточной культуре, статичной суспензии (например, роллерных флаконах, T колбах, микроносителях, T150 и т.д.), и/или на шейкерах.
Клетки, которые продуцируют, по меньшей мере, один гликопротеин (т.е., целевой гликопротеин) согласно данному раскрытию, могут быть выращены при любом из разнообразия условий выращивания культуры клеток.
В некоторых вариантах осуществления клетки культивируют при таких условиях, чтобы целевой гликопротеин, как предполагают, проявлял необходимый паттерн гликозилирования. В некоторых вариантах осуществления одно или более условий выращивания культуры клеток контролируют и/или модифицируют для того, чтобы получить целевой гликопротеин с более желательными паттернами гликозилирования. Такие условия выращивания культуры клеток, которые могут быть контролируемыми или модифицированными, включают, но не ограничиваются следующим: pH, CO2 уровни, уровни кислорода, скорость перемешивания культуры, окислительно-восстановительные условия, температура культуры, плотность клеток, плотность посева культуры, длительность культивирования, устройство реактора, скорость барботирования и/или осмолярность.
Любой из разнообразия способов может быть использован для выделения клеток из среды для выращивания культуры клеток, при необходимости. В определенных вариантах осуществления клетки выращивают в суспензионной культуре. В таких вариантах осуществления клетки могут быть очищены от среды для выращивания культуры клеток с помощью одного или более циклов центрифугирования и отмывки (например, с помощью физиологически приемлемых растворов для отмывки, таких как фосфатно-солевой буфер).
В определенных вариантах осуществления клетки выращивают в адгезионной культуре. В таких вариантах осуществления клетки могут быть очищены от среды для выращивания культуры клеток с помощью первого выделения их из монослоя культуры. Например, клетки могут быть выделены из монослоя культуры путем обработки их EDTA (этилендиаминтетрауксусная кислота). Специалисты в данной области техники будут знать о других приемлемых средствах, которые можно использовать для выделения прикрепленных клеток из монослоя культуры. После выделения клетки могут быть очищены с помощью одного или более циклов центрифугирования и отмывки (например, с помощью физиологически приемлемых растворов для отмывки, таких как фосфатно-солевой буфер). Как и с клетками, выращенными в суспензионной культуре, следует проследить, чтобы не центрифугировать клетки при очень большой скорости, чтобы избежать нежелательного разрушения клеток.
C. Обработка
Исходные материалы, содержащие гликоконъюгаты, затем подвергают двойной обработке, как описано ниже. “Препараты гликана, из которых выделены сиаловые кислоты”, как используется здесь, относится к полученному препарату после двойной обработки и необязательной дополнительной переработки (такой как, например, дополнительные обработки, хранение, фракционирование, замораживание, оттаивание и т.д.).
Двойные обработки, используемые в получении препаратов гликана, в общем, содержат следующее: (1) обработка для выделения гликанов из гликоконъюгатов и (2) обработка для выделения сиаловых кислот. Обработки могут быть проведены в любой последовательности относительно друг друга, включая одновременную и/или перекрывающуюся обработки. Например, гликаны могут быть выделены из гликоконъюгатов и затем обработаны для выделения сиаловых кислот (например, с помощью сиалидазы). В некоторых вариантах осуществления гликоконъюгаты обрабатывают для выделения сиаловых кислот (например, с помощью сиалидазы), затем гликаны выделяют из гликоконъюгатов. В некоторых вариантах осуществления гликоконъюгаты подвергают обеим обработкам в одно время в течение, по меньшей мере, части общей длительности двойных обработок.
1. Выделение гликанов
Гликаны выделяют из гликоконъюгатов, используя любой из разнообразия способов, таких как способы, описанные здесь.
В определенных вариантах осуществления одну или более гликановых структур отщепляют от гликоконъюгатов после того, как гликоконъюгаты были высвобождены из клетки (например, посредством обработки протеазами, как описано более детально ниже). В определенных вариантах осуществления одну или более гликановых структур отщепляют от гликоконъюгатов (таких как гликоконъюгаты на клеточной поверхности), которые были высвобождены из клетки.
В определенных вариантах осуществления одну или более гликановых структур выделяют посредством использования фермента или множества ферментов, которые распознают и отщепляют гликановые структуры. Любой из разнообразия гликозидных и других ферментов, которые отщепляют гликановые структуры от гликоконъюгатов, могут быть использованы согласно данному раскрытию. Некоторые примеры таких ферментов представлены в обзоре в R.A. O'Neill, Enzymatic release of oligosaccharides from glycoproteins for chromatographic and electrophoretic analysis, J. Chromatogr. A 720, 201-215. 1996; и S. Prime, et al., Oligosaccharide sequencing based on exo- and endo-glycosidase digestion and liquid chromatographic analysis of the products, J. Chromatogr. A 720, 263-274, 1996, каждый из которых включен сюда посредством ссылки в своей полноте. В определенных вариантах осуществления фермент PNGаза F (Пептид N-Гликозидаза F) используется для удаления гликанов из гликопептида или гликопротеина. PNGаза F представляет собой амидазу, которая расщепляет амидную связь между наиболее глубоким GlcNAc и аспарагиновыми остатками олигосахаридов с высоким содержанием маннозы, гибридных и сложных олигосахаридов из N-связанных гликопротеинов. Дополнительно или альтернативно, в определенных вариантах осуществления ферменты PNGаза A, O-гликаназа и/или Endo-H используются для удаления гликанов.
Для улучшения доступности сайта гликозилирования в гликопротеине для фермента отщепления некоторые гликопротеины могут подвергаться стадии денатурации белка. Типично денатурацию белка осуществляют путем использования детергентов (например, SDS (додецилсульфат натрия)) и/или дисульфид-редуцирующие средства (например, бета-меркаптоэтанол), хотя способы денатурации гликопротеина для использования согласно данному раскрытию не ограничиваются использованием таких средств. Например, воздействие высокой температуры может быть достаточным для денатурации гликопротеина, так чтобы приемлемый фермент для отщепления гликановых структур был способен подойти к сайту отщепления. В определенных вариантах осуществления гликопротеин денатурируют путем инкубации гликопротеина при температуре от около 80, около 81, около 82, около 83, около 84, около 85, около 86, около 87, около 88, около 89, около 90, около 91, около 92, около 93, около 94, около 95, около 96, около 97, около 98, около 99, около 100°С или выше в течение периода времени, достаточного для денатурации гликопротеина.
В определенных вариантах осуществления комбинация детергентов, дисульфид-редуцирующих средств, высокой температуры и/или других средств или условий реакции применяется для денатурации гликопротеина. Специалисты в данной области техники будут осведомлены о приемлемых условиях, времени инкубации и т.д., которые будут достаточными для денатурации гликопротеина. Отмечено, что олигосахариды, расположенные на консервативных Fc сайтах в иммуноглобулине G (IgG), отщепляются более легко с помощью PNGазы F. Таким образом, стадия денатурации белка типично не является необходимым для IgG молекул, когда используется этот фермент. PNGаза F также способна удалять олигосахариды в разведенном растворе гидроксида аммония, является стабильной в 2,5 M мочевины при 37°C в течение 24 часов и все еще обладает 40% ее активности в 5M мочевины. Таким образом, PNGаза F имеет преимущество в том, что она способна отщеплять гликаны от гликопротеинов при определенных условиях денатурации.
Другие приемлемые ферменты, которые могут быть использованы для отщепления гликановых структур от гликоконъюгатов согласно данному раскрытию, включают, но не ограничиваются следующим: PNGаза A, O-гликаназа и/или Endo-H. Специалисты в данной области техники будут осведомлены о других приемлемых ферментах для отщепления гликанов от гликоконъюгатов. В некоторых вариантах осуществления множество ферментов используется для отщепления гликановых структур от гликоконъюгата. В некоторых вариантах осуществления такое множество ферментов отщепления вводят одновременно. В некоторых вариантах осуществления такое множество ферментов отщепления вводят последовательно.
В некоторых вариантах осуществления одну или более гликановых структур отщепляют от гликоконъюгатов посредством использования средства, отличного от фермента. В некоторых вариантах осуществления химическое средство или множество химических средств (например, воздействие таким средством, как гидразин, борогидрид натрия, эндогликозидазы, трифторметасенульфоновая кислота (TFMS) и/или бета-элиминирование и т.д.) могут быть использованы для отщепления гликановых структур от гликоконъюгатов. Например, использование химического гидразина было успешно применено для отщепления гликановых структур. В качестве другого не ограничивающего примера предположили, что смесь аммиак-карбонат аммония может быть использована для щелочного выделения как N-, так и O-связанных олигосахаридов в их нативной форме (см. Y. Huang, et al., Microscale nonreductive release of O-linked glycans for subsequent analysis through MALDI mass spectrometry and capillary electrophoresis, Anal. Chem. 73, 6063-60, 2001, включенный сюда посредством ссылки в своей полноте). Специалисты в данной области техники будут осведомлены о других приемлемых химических средствах, которые могут быть использованы согласно данному раскрытию. В некоторых случаях применение химического средства для отщепления гликановых структур от гликопротеина приводит к разрушению белка, наряду с отщеплением. Тем не менее, после отщепления гликановую структуру часто очищают от белкового компонента гликопротеина до анализа и/или снятия характеристик. В таких ситуациях разрушение белкового компонента после обработки химическим средством не является неблагоприятным для осуществления на практике данного раскрытия. В некоторых случаях разрушение белкового компонента может даже способствовать процессу очищения отщепленной гликановой структуры(структур).
2. Выделение сиаловых кислот
Обеспечение препарата гликана, из которого были выделены сиаловые кислоты, в общем, содержит воздействие на композицию, содержащую гликаны (выделенные или в контексте гликоконъюгатов или обоих), одним или более средствами, которые отщепляют остатки сиаловой кислоты, при условиях, которые позволяют отщепить остатки сиаловой кислоты. Любое из разнообразия средств, которые отщепляют остатки сиаловой кислоты от гликанов, может быть использовано согласно предложенным способам.
В некоторых вариантах осуществления выделение сиаловых кислот из препарата гликана содержит обработку сиалидазой. Обработка сиалидазой может быть осуществлена, например, с использованием фермента полипептида с сиалидазной активностью, химических соединений (например, слабых кислот и т.д.) или их комбинации.
В некоторых вариантах осуществления обработку сиалидазой осуществляют, используя один или более ферментных полипептидов, способных расщепить связи сиаловых кислот (например, способные гидролизировать гликозидные связи сиаловых кислот, способные эндогидролизировать (2→8)-α-сиалозильные связи в олиго- или поли(сиаловых) кислотах и/или способные элиминировать α-сиалильные группы в гликозидах N-ацетилнейраминовой кислоты). Такие ферменты типично известны как сиалидазы и/или нейраминидазы. Типично, конкретный фермент сиалидазы предпочтительно отщепляет конкретный тип связи сиаловой кислоты.
Ферментные полипептиды, которые могут быть пригодны для использования, включают, но не ограничиваются следующим: экзо-α-сиалидазы (также известные как ацетилнейраминилгидролаза, α-нейраминидаза или ацетилнейраминидаза; включая ферментные полипептиды, которые классифицируют под номером E.C. (Комиссия по ферментам) 3.2.1.18), эндо-α-сиалидазы (также известные как полисиалозид 2,8-α-сиалозилгидролаза, эндо-N-ацилнейраминидаза, эндонейраминидаза, эндо-N-ацетилнейраминидаза, поли(α-2,8-сиалозил) эндо-N-ацетилнейраминидаза, поли(α-2,8-сиалозид) α-2,8-сиалозилгидролаза или эндосиалидаза; включая ферментные полипептиды, классифицированные под номером E.C. 3.2.1.129, и ангидросиалидаза (также известная как ангидронейраминидаза, сиалгликоконъюгат N-ацилнейраминилгидролаза (2,7-циклическая), или сиалидаза L).
Неограничивающие специфические примеры ферментов сиалидаз включают следующее: сиалидаза 1 (также известная как лизосомальная сиалидаза, NEU1, или нейраминидаза 1), сиалидаза 2 (также известная как цитозольная сиалидаза, NEU2, или нейраминидаза 2), сиалидаза 3 (также известная как мембранная сиалидаза, NEU3, или нейраминидаза 3), сиалидаза 4 (также известная как NEU4 или нейраминидаза 4), G9 сиалидаза, ганглиозидная сиалидаза, ганглиозид-специфическая сиалидаза, белок гемагглютинин-нейраминидаза, сиалидаза скелетных мышц мышей, N-ацетилнейраминозил гликогидролаза, N-ацилнейраминат гликогидролаза, SA85-1,1 белок, SA85-1,2 белок, SA85-1,3 белок, сиалидаза A, сиалидаза C, сиалидаза S и транс-сиалидаза.
Ферментные полипептиды, приемлемые для использования в обработке сиалидазой, могут быть получены из разнообразия источников, включая, но не ограничиваясь следующим: существующие в природе источники, рекомбинантно сконструированные виды и т.д. Могут быть использованы варианты известных и/или существующих в природе ферментов сиалидаз. Разнообразие видов (включая, но не ограничиваясь следующим: Arthrobacter nicotianae, Arthrobacter sp., Arthrobacter ureafaciens, бактериофаг E, бактериофаг K1E, бактериофаг K1F, бактериофаг PK1A, бактериофаг PK1F, Clostridium perfringens, Clostridum chauvoei, Clostridum sordellii, Corynebacterium diphtheriae, Corynebacterium ulcerans, Crassostrea virginica, Cricetulus griseus, Entamoeba histolytica, Erysipelothrix rhusiophatiae, Homo sapiens, вирус гриппа A, вирус гриппа B, Macrobdella decora, Micromonas viridifaciens, вирус свинки, mus musculus, вирус псевдочумы птиц, Pasteurella multocida, Streptococcus sp., Trichomonas vaginalis, Pasteurella multocida, Streptococcus sp., Sus scrofa, Trichomonas vaginalis, Trypanosoma cruzi и Vibrio cholerae) производят ферменты сиалидазы, которые могут быть получены и/или использованы согласно предложенным способам.
Как известно из уровня техники, ферменты, которые не известны и/или не перечислены в базах данных ферментов (такие как, например, ферменты, которые еще не охарактеризованы), но, тем не менее, отщепляют связи остатков сиаловой кислоты, могут быть приемлемыми для использования согласно предлагаемым способам и системам.
Приемлемые условия для обработки ферментами полипептидами могут изменяться в зависимости от конкретного фермента полипептида. Типично, образец, содержащий гликан, инкубируют при или близкой к оптимальной температуре для фермента полипептида в присутствии концентрации фермента полипептида, достаточной, чтобы катализировать необходимое количество отщепления в течение определенного промежутка времени. Например, некоторые инкубации могут быть проведены при около 37°C. Периоды инкубации могут продолжаться около 5 минут, 10 минут, 20 минут, 25 минут, 30 минут, 35 минут, 40 минут, 45 минут, 50 минут, 55 минут, 1 час, 1 час 10 минут, 1 час 20 минут, 1 час 30 минут, 1 час 40 минут, 1 час 50 минут, 2 часа, 2,5 часа, 3 часа, 3,5 часа, 4 часа, 4,5 часа, 5 часов, 5,5 часов, 6 часов, или больше. В некоторых вариантах осуществления образцы, содержащие гликан, могут инкубировать с ферментами полипептидами в течение ночи.
Любая комбинация ферментов сиалидаз, как упоминается здесь и/или их вариантов, может быть использована для обработки сиалидазой. Обработка с использованием более чем одного фермента может быть последовательной (т.е., инкубация с одним ферментом полипептидом следует за другой, необязательно разделенные инактивацией одного фермента) и/или одновременной (т.е., более чем один фермент полипептид используется в одно время).
В некоторых вариантах осуществления обработку сиалидазой осуществляют, используя один или более химических соединений. Например, гидролиз слабой кислотой остатков сиаловой кислоты может быть проведен, используя любой из разнообразия способов, известных из уровня техники. В общем, гидролиз слабой кислотой содержит инкубацию образца с разведенной кислотой в течение короткого периода времени, необязательно с нагреванием. Неограничивающие примеры кислот, которые используются в гидролизе слабой кислотой, включают следующее: серная кислота (H2SO4), хлористоводородная кислота (HCl), муравьиная кислота (CH2O2) и т.д. Уровни pH кислых растворов, используемых в гидролизе слабой кислотой, типично находятся в диапазоне от около pH 1,4 до около pH 6,9, например, около pH 6,9, pH 6,8, pH 6,7, pH 6,6, pH 6,5, pH 6,4, pH 6,3, pH 6,2, pH 6,1, pH 6,0, pH 5,9, pH 5,8, pH 5,7, pH 5,6, pH 5,5, pH 5,4, pH 5,3, pH 5,2, pH 5,1, pH 5,0, pH 4,9, pH 4,8, pH 4,7, pH 4,6, pH 4,5, pH 4,4, pH 4,3, pH 4,2, pH 4,1, pH 4,0, pH 3,9, pH 3,8, pH 3,7, pH 3,6, pH 3,5, pH 3,4, pH 3,3, pH 3,2, pH 3,1, pH 3,0, pH 2,9, pH 2,8, pH 2,7, pH 2,6, pH 2,5, pH 2,4, pH 2,3, pH 2,2, pH 2,1, pH 2,0, pH 1,9, pH 1,8, pH 1,7, pH 1,6, pH 1,5 или pH 1,4. Более низкие pH условия могут быть использованы в некоторых вариантах осуществления. Концентрации кислот, используемых в обработках с помощью гидролиза слабой кислотой, могут быть, например, около 0,70 M, 0,65 M, 0,60 M, 0,55 M, 0,50 M, 0,45 M, 0,40 M, 0,35 M, 0,30 M, 0,25 M, 0,20 M, 0,15 M, 0,10 M, 0,05 M, 0,025 M, 0,020 M, 0,015 M, 0,010 M, 0,005 M или меньше. Более высокие концентрации кислот могут быть использованы в некоторых вариантах осуществления. Инкубация в слабой кислоте может быть проведена в течение периода времени, такого как меньше чем около 10,0 часов, 9,5 часа, 9,0 часов, 8,5 часа, 8,0 часов, 7,5 часа, 7,0 часов, 6,5 часа, 6,0 часов, 5,5 часа, 5,0 часов, 4,5 часа, 4,0 часа, 3,5 часа, 3,0 часа, 2,5 часа, 2,0 часа, 1,5 часа, 1,0 час, 50 минут, 45 минут, 40 минут, 35 минут, 30 минут, 25 минут, 20 минут, 15 минут, 10 минут, 5 минут, 1 минуты или меньше. Образцы, содержащие гликан, могут инкубировать в течение более длительного периода времени в некоторых вариантах осуществления.
В некоторых вариантах осуществления, в которых используется гидролиз слабой кислотой, образцы, содержащие гликан, нагревают в процессе обработки слабой кислотой. Образцы могут быть нагреты до температур, таких как, например, около 30ºC, 35ºC, 40ºC, 45ºC, 50ºC, 55ºC, 60ºC, 65ºC, 70ºC, 75ºC, 80ºC, 85ºC, 90ºC, 95ºC, 100ºC или больше.
В некоторых вариантах осуществления обработка для выделения сиаловых кислот приводит к существенному десиалированию гликанов. Как понимают в уровне техники, не все остатки сиаловой кислоты могут быть выделены из молекулы гликана, которая подвергалась обработке для выделения сиаловых кислот. В некоторых вариантах осуществления обработка для выделения сиаловых кислот составляет до около 25%, 24%, 23%, 22%, 21%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или менее остатков сиаловой кислоты, присутствующих в препарате гликана до обработки для выделения сиаловых кислот. В некоторых вариантах осуществления такие остаточные остатки сиаловой кислоты не препятствуют последующей обработке и/или анализам. В некоторых вариантах осуществления дополнительная обработка(и) используется для снижения процентного соотношения остаточных сиаловых кислот до последующей обработки и/или анализов; в некоторых таких вариантах осуществления дополнительная обработка(и) содержит одну или более дополнительных обработок для выделения сиаловых кислот.
В некоторых вариантах осуществления композиции, содержащие гликаны, включают сиаловые кислоты, которые являются модифицированными таким образом, чтобы обеспечить им устойчивость к обработке для выделения сиаловых кислот; в некоторых таких вариантах осуществления модификации сообщают сиаловым кислотам устойчивость к отщеплению с помощью сиалидаз. Пример такой модификации представляет собой ацетилирование в двух или более положениях в дополнение к 5 положению (которое является типично ацетилированным), которое называется “полиацетилированное сиалирование”, как описано дополнительно ниже. Когда композиция, содержащая гликаны, содержит такие модифицированные сиаловые кислоты, то остаточное процентное соотношение остатков сиаловой кислоты может быть выше.
3. Выделение гликоконъюгатов из клеток
В определенных вариантах осуществления, таких как те, что включают использование гликоконъюгатов, продуцируемых клетками, способы дополнительно содержат выделение гликоконъюгатов из клеток. В некоторых таких вариантах осуществления гликаны выделяют из гликоконъюгатов после того, как гликоконъюгаты выделяют из клеток.
В некоторых вариантах осуществления выделяют гликоконъюгаты, которые присутствуют в клетках.
В некоторых вариантах осуществления гликаны выделяют из гликоконъюгатов, которые присутствуют на поверхностях клеток. В некоторых таких вариантах осуществления препараты гликана получают из гликоконъюгатов, которые преимущественно выделяют из поверхности клетки. Среди некоторых преимуществ, предоставляемых такими вариантами осуществления, существует факт того, что высоко очищенная популяция гликанов клеточной поверхности может быть получена без существенного загрязнения гликанами, которые преимущественно обнаруживают внутри клетки. Например, используя определенные способы данного раскрытия, лизиса клеток, по существу, избегают, когда гликаны клеточной поверхности высвобождают из клетки. Дополнительно или альтернативно, определенные способы, раскрытые здесь, предоставляют существенные уменьшения числа и/или сложности стадий манипуляции по сравнению с доступными в настоящее время способами.
В определенных вариантах осуществления гликоконъюгаты выделяют из клеток, подвергая клетки действию одной или более протеаз. Протеазы расщепляют амидные связи внутри полипептидной цепи. Существует несколько классов протеаз, включая как химические, так и ферментативные средства. Протеолитические ферменты включают, например, сериновые протеазы, треониновые протеазы, цистеиновые протеазы, протеазы аспарагиновой кислоты, металлопротеазы и протеазы глютаминовой кислоты. Не ограничивающие примеры специфических протеолитических ферментов, которые могут быть использованы согласно данному раскрытию, включают следующее: трипсин, химотрипсин, эластаза, субтилизин, протеиназа K, пепсин, фицин, бромелин, плазмепсин, ренин, химозин, папаин, катепсин (например, катепсин K), каспаза (например, CASP3, CASP6, CASP7, CASP14), кальпаин 1, кальпаин 2, гермолизин, карбоксипептидаза A или B, матриксная металлопротеиназа, протеаза глютаминовой кислоты и/или их комбинации. Специалисты в данной области техники будут осведомлены о ряде других протеаз, которые могут быть использованы согласно данному раскрытию для выделения гликопротеина из поверхности клетки.
В некоторых вариантах осуществления гликоконъюгаты клеточной поверхности выделяют из мембран. В некоторых таких вариантах осуществления один или более агрессивных детергентов используют, чтобы экстрагировать мембраносвязанные гликоконъюгаты, после чего свободные сахара подвергают диализу до обработки для выделения гликанов из гликоконъюгатов. В некоторых вариантах осуществления, в которых гликоконъюгаты выделяют из мембран, обработку детергентом минимизируют или избегают вообще для минимизации разрушения клеточных мембран. Например, в некоторых вариантах осуществления, по меньшей мере, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или более из клеточных мембран остаются интактными (например, как контролируется путем включения трипанового синего). Такие способы могут быть использованы, чтобы сделать возможным уменьшение или устранение загрязнения из незрелых гликопротеинов с высоким содержанием маннозы, которые присутствуют в клетке.
В некоторых вариантах осуществления клетки подвергают действию одной или более протеаз при условиях, которые минимизируют разрушение клеточной мембраны. В некоторых вариантах осуществления клетки подвергают действию одной или более протеаз в течение ограниченного периода времени для того, чтобы избежать существенного лизиса клеточной мембраны.
Например, клетку могут подвергнуть действию одной или более протеаз в течение периода времени, который меньше чем около 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 минута(ы). В некоторых вариантах осуществления клетку подвергают действию одной или более протеаз в течение периода времени, который более чем 15 минут, поскольку существенный лизис клеточной мембраны не происходит. Например, достаточно низкая концентрация протеазы(протеаз), достаточно низкая температура и/или любой из разнообразия других факторов или условий может применяться так, чтобы общая протеазная активность снижалась до точки, где существенный лизис клеточной мембраны не происходит. Специалисты в данной области техники будут осведомлены и будут способны применять факторы или условия, которые обеспечивают то, что существенный лизис клеточной мембраны не происходит.
В некоторых вариантах осуществления, по меньшей мере, около 50%, 60%, 70%, 80%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гликоконъюгатов выделяют из клеток, например, с помощью обработки протеазой.
В определенных вариантах осуществления выделяют гликоконъюгаты, подвергая клетку действию одной или более протеаз (например, протеолитических ферментов) в концентрации, по меньшей мере, около 0,1 мг/мл. В определенных вариантах осуществления гликоконъюгаты выделяют, подвергая клетку действию одной или более протеаз (например, протеолитических ферментов) в концентрации меньше чем около 2,0 мг/мл. В определенных вариантах осуществления гликаны клеточной поверхности выделяют, подвергая клетку действию одной или более протеаз (например, протеолитических ферментов) в концентрации от около 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,5, 3,0, 3,5, 4,0, 5,0, 6,0, 7,0, 8,0, 9,0, 10,0 мг/мл или выше.
В определенных вариантах осуществления гликоконъюгаты выделяют, подвергая клетку действию множества протеаз. Например, клетку могут подвергать действию 2, 3, 4, 5, 6, 7, 8, 9, 10 или более протеаз для выделения гликоконъюгатов. Такое множество протеаз может быть введено в клетку одновременно и/или последовательно. В определенных вариантах осуществления гликоконъюгаты выделяют, подвергая клетку действию множества протеаз одновременно, после чего выделенные гликоконъюгаты очищают от клетки.
В определенных вариантах осуществления гликоконъюгаты выделяют, подвергая клетку действию первой протеазы (или множеству первых протеаз) в течение первого периода времени, после чего клетку подвергают действию второй протеазы (или множеству вторых протеаз) в течение второго периода времени. До обработки второй протеазой первую протеазу могут необязательно удалять и/или инактивировать. Для примера, первую протеазу могут инактивировать, инкубируя протеазу при температуре в течение времени, достаточного для ее инактивации. Дополнительно или альтернативно, первую протеазу могут инактивировать путем инкубации ее с ингибитором, который является специфическим к протеазе (например, антитело или другая молекула, которая специфически связывает первую протеазу и ингибирует ее каталитическую активность). Другие способы инактивации первой протеазы будут известны специалистам в данной области техники. В случае, когда первую протеазу инактивируют путем инкубации ее со специфическим ингибитором, следует понимать, что ингибитор, по существу, не должен ингибировать активность второй протеазы.
В некоторых вариантах осуществления протеазу(ы) удаляют и/или инактивируют до выделения гликанов. Для примера, протеазу могут инактивировать путем инкубации протеазы при температуре в течение периода времени, достаточного для ее инактивации. Альтернативно или дополнительно, протеазу могут инактивировать путем инкубации с ингибитором или антителом или другой молекулой, которая специфически связывается с протеазой и ингибирует ее каталитическую активность.
4. Дополнительная обработка экзогликозидазой
В некоторых вариантах осуществления гликаны обрабатывают одной или более экзогликозидазами в дополнение к прохождению обработки для выделения гликанов и обработки для выделения сиаловых кислот, как упоминалось выше. В некоторых таких вариантах осуществления продукты обработки таких дополнительных обработок экзогликозидазой анализируют согласно предлагаемым способам.
Как упоминалось выше, сиалидазы типично классифицируют как экзогликозидазы. Необязательные дополнительные обработки экзогликозидазой, в общем, содержат обработку, по меньшей мере, одной экзогликозидазы, отличной от сиалидазы. В некоторых вариантах осуществления одну или более сиалидаз используют в комбинации с одной или более других экзогликозидаз, которые не являются сиалидазами.
В некоторых вариантах осуществления дополнительную обработку экзогликозидазой проводят одновременно с или перекрываясь с обработкой для выделения гликана и/или обработкой для выделения сиаловых кислот. В некоторых вариантах осуществления дополнительную обработку экзогликозидазой проводят до обработки сиалидазой. В некоторых вариантах осуществления дополнительную обработку экзогликозидазой проводят после обработки сиалидазой.
Экзогликозидазы представляют собой ферменты, которые отщепляют концевые гликозидные связи от нередуцирующего конца гликанов. Они типично являются высоко специфическими к конкретным моносахаридным связям и аномерности (α/β). В некоторых вариантах осуществления соседние паттерны разветвления могут влиять на экзогликозидазную специфичность. Экзогликозидазная обработка обычно приводит к гликанам стандартных антенных связей, расщепленных вниз к пентасахаридному кору (M3N2), содержащему 3 маннозных и 2 glcNAc остатка. Тем не менее, определенные виды гликанов (например, фукозилированные на антеннах виды, с высоким содержанием маннозы и гибридные гликаны, гликаны с вытянутым лактозамином, фосфорилированные гликаны, сульфатированные гликаны, полиацетилированные сиалированные гликаны и т.д.) могут быть устойчивыми к обработке экзогликозидазой и могут быть хроматографически выделены и количественно оценены относительно M3N2 пентасахарида, как обсуждается здесь.
В некоторых вариантах осуществления экзогликозидазы, используемые согласно данному раскрытию, распознают и отщепляют только один конкретный тип гликозидной связи. В некоторых вариантах осуществления экзогликозидазы, используемые согласно данному раскрытию, распознают и отщепляют более чем один конкретный тип гликозидной связи. Иллюстративные экзогликозидазы, которые могут быть использованы согласно данному раскрытию, включают, но не ограничиваются следующим: сиалидаза, галактозидаза, гексозаминидаза, фукозидаза и маннозидаза. Экзогликозидазы могут быть получены из любого источника, включая коммерческие источники (например, от QA-Bio, ProZyme, Roche, Sigma, NEB, EMD, Glyko и т.д.). Альтернативно или дополнительно, экзогликозидазы могут быть выделены и/или очищены от клеточного источника (например, бактерий, дрожжей, растений и т.д.).
Экзогликозидазы (например, сиалидазы, галактозидазы, гексозаминидазы, фукозидазы и маннозидазы) могут быть разделены на множество категорий или “подклассов”. В некоторых вариантах осуществления различные подклассы проявляют разные способности к отщеплению различных типов связей. Таблица 2 представляет некоторые иллюстративные экзогликозидазы, их специфичности к связям и организм, из которых каждая была получена. Специалисту в данной области будет понятно, что это иллюстративный, не исчерпывающий перечень экзогликозидазов и что любая экзогликозидаза, имеющая специфичность к любой связи, может быть использована согласно данному раскрытию.
|
Согласно данному раскрытию гликаны (такие как, например, те, что были выделены из гликопротеина и/или клеточной поверхности) могут быть обработаны любой экзогликозидазой. В определенных вариантах осуществления гликаны обрабатывают, подвергая популяцию гликанов действию множества экзогликозидаз. Например, популяцию гликанов могут подвергнуть действию 2, 3, 4, 5, 6, 7, 8, 9, 10 или более экзогликозидаз. В некоторых вариантах осуществления множество экзогликозидаз вводят одновременно. В некоторых вариантах осуществления множество экзогликозидаз вводят последовательно. В некоторых вариантах осуществления изменение наименования экзогликозидаз, которые вводят, предоставляет информацию о структуре и/или составе гликана. В некоторых вариантах осуществления изменение последовательности, в которой вводят множество экзогликозидаз, предоставляет информацию о структуре и/или составе гликана.
В некоторых вариантах осуществления последовательная обработка множеством экзогликозидаз предоставляет информацию о структуре и/или составе гликана, которая отличается от информации, предоставляемой одновременной обработкой тем же набором экзогликозидаз. В некоторых вариантах осуществления последовательная обработка множеством экзогликозидаз предоставляет информацию о структуре и/или составе гликана, которая является такой же, как и информация, предоставляемая одновременной обработкой тем же набором экзогликозидаз. Для более полного обсуждения использования обработки экзогликозидазами в анализе структуры гликанов, смотри одновременно рассматриваемую международную заявку № PCT/US08/60343, поданную 15 апреля 2008, Parsons et al., имеющую название “Характеристика N-гликанов с использованием эндогликозидаз”, полное содержание которой включено сюда посредством ссылки.
D. Препараты гликана, из которых были выделены сиаловые кислоты
После двойной обработки (обработки для выделения гликанов и обработки для выделения сиаловых кислот), обсуждаемой выше, препараты гликана, из которых были выделены сиаловые кислоты, могут быть использованы в предлагаемых способах.
В определенных вариантах осуществления препараты гликана, из которых были выделены сиаловые кислоты, содержат гликаны, которые не являются сиалированными.
В определенных вариантах осуществления препараты гликана, из которых были выделены сиаловые кислоты, содержат устойчивые к сиалидазе гликаны.
В определенных вариантах осуществления препараты гликана, из которых были выделены сиаловые кислоты, содержат необычно модифицированные гликаны. В общем, необычно модифицированные гликаны содержат модификации, отличные от сиалирования. Во многих вариантах осуществления необычные модификации обеспечивают заряд на гликанах; в некоторых таких вариантах осуществления заряд представляет собой отрицательный заряд.
В некоторых вариантах осуществления необычно модифицированные гликаны содержат фосфорилированные гликаны. Неограничивающий пример фосфорилированного остатка в гликанах представляет собой манноза-6-фосфат (Man-6-P).
В некоторых вариантах осуществления необычно модифицированные гликаны содержат сульфатированные гликаны. Сульфатация на гликанах может происходить в любом из разнообразия положений. Гликаны могут быть одиночно и/или многократно сульфатированными (т.е., сульфатированными в многочисленных положениях на данной молекуле гликана). Неограничивающие примеры положений, подлежащие, как известно, сульфатированию в некоторых видах гликанов, включают C-3 терминальной Gal и C-6 GlcNAc остатка терминальной единицы N-ацетиллактозамина. Сульфатированные гликаны включают сульфатированные гликозаминогликаны, такие как гепаран сульфат, декстран сульфат, кератан сульфат и хондроитин сульфат.
В некоторых вариантах осуществления необычно модифицированные гликаны содержат сиалированные гликаны, которые имеют дополнительные модификации, которые делают остатки сиаловой кислоты устойчивыми к отщеплению сиалидазами. Например, препараты гликана могут содержать полиацетилированные сиалированные гликаны. Остатки сиаловых кислот являются типично ацетилированными в 5 положении (см. Фигуру 2); такие 5-ацетилированные сиаловые кислоты являются типично чувствительными к обработке сиалидазой. Заявители открыли, что сиаловые кислоты, которые являются ацетилированными в двух или более дополнительных положениях (полиацетилированная сиаловая кислота) являются, в общем, устойчивыми к обработке сиалидазой. В некоторых вариантах осуществления полиацетилированные сиаловые кислоты являются ацетилированными в двух или более из 7, 8 и 9 положений (см. Фигуру 2).
В некоторых вариантах осуществления препараты гликана, из которых были выделены сиаловые кислоты, содержат гликаны, которые не имеют модификаций (будь то сиалирование и/или необычные модификации, обсуждаемые здесь).
В некоторых вариантах осуществления необычно модифицированные гликаны являются малораспространенными гликанами. Например, в некоторых вариантах осуществления необычно модифицированные гликаны содержат меньше чем около 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1%, 0,08%, 0,05% или меньше препарата гликана. В некоторых вариантах осуществления устойчивые к сиалидазе гликаны содержат около 0,01% гликанов. В некоторых вариантах осуществления необычно модифицированные гликаны содержат меньше чем около 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1%, 0,08%, 0,05% или меньше общей популяции гликанов в исходном препарате (и/или в первичном исходном материале). В некоторых вариантах осуществления необычно модифицированные гликаны содержат около 0,01% общей популяции гликанов в исходном препарате и/или материале.
II. Анализ препаратов гликана
Согласно предлагаемым способам препараты гликана, из которых были выделены сиаловые кислоты (например, обработанные сиалидазой препараты гликана), содержат гликаны, не выделенные такой обработкой (например, устойчивые к сиалидазе гликаны), и подвергаются одному или более методов разделения, которые разделяют гликаны, имеющие первый заряд от незаряженных гликанов и/или гликанов, имеющих второй заряд и/или которые разделяют гликаны на основании отношения заряда к массе. В некоторых вариантах осуществления, по меньшей мере, один разделенный гликан (например, гликаны, имеющие первый заряд или имеющие первое отношение заряда к массе) количественно оценивают, используя, по меньшей мере, один стандарт количественной оценки. В определенных вариантах осуществления дополнительные анализы проводят на разделенных гликанах (например, на гликанах, имеющих первый заряд и/или имеющих первое отношение заряда к массе) до и/или после количественной оценки. В некоторых вариантах осуществления определяют разделенные гликаны, используя информацию, полученную в ходе стадии(й) разделения, необязательного стадии(й) анализа или их комбинации. В некоторых вариантах осуществления стадий разделения, анализа и/или количественного определения видов разделенных гликанов (таких как, например, необычно модифицированные виды гликанов) в образце повторяют, и данные из таких повторов вводят в базу данных, например, как описано ниже. В некоторых вариантах осуществления определение видов гликанов (такие как необычно модифицированные гликаны) может основываться полностью или частично на информации в базе данных.
A. Разделение заряженных гликанов
Из уровня техники известно разнообразие способов для отделения заряженной молекулы от незаряженных и/или противоположно заряженных молекул в образце и/или от других молекул с различными отношениями заряда к массе. Любой из этих способов и их варианты могут быть использованы, чтобы разделить гликаны согласно данному раскрытию. В некоторых вариантах осуществления гликаны, имеющие первый заряд и/или имеющие первое отношение заряда к массе, выделяют из остальной части препарата гликана.
В некоторых вариантах осуществления гликаны, имеющие конкретное первое отношение заряда к массе, отделяют от гликанов, имеющих более низкое первое отношение заряда к массе. В некоторых вариантах осуществления гликаны, имеющие конкретный первый отношение заряда к массе отделяют от гликанов, имеющих более высокое первое отношение заряда к массе.
В некоторых вариантах осуществления первое отношение заряда к массе имеет абсолютное значение в диапазоне от около 0 до около 0,0014, и гликаны, имеющие такое первое отношение заряда к массе, отделяют от других гликанов, чьи отношения заряда к массе имеют абсолютное значение в диапазоне от около 0 до около 0,003.
В некоторых вариантах осуществления гликаны, имеющие первый заряд, выделяют из остальной части препарата гликана.
В определенных вариантах осуществления первый заряд представляет собой отрицательный заряд, а второй заряд представляет собой положительный заряд. В таких вариантах осуществления выделенные гликаны содержат отрицательно заряженные гликаны, которые отделяют от нейтральных гликанов и/или положительно заряженных гликанов. В некоторых таких вариантах осуществления отрицательно заряженные гликаны содержат фосфорилированные гликаны, сульфатированные гликаны, полиацетилированные сиалированные гликаны или их комбинацию.
Во многих вариантах осуществления разделение заряженных гликанов осуществляют, используя метод хроматографии. Например, препараты гликана, из которых были выделены сиаловые кислоты (например, обработанные сиалидазой препараты гликана), могут быть разделены с использованием заряженной колонки, такой как в ионообменной хроматографии. Чтобы отделить отрицательно заряженные гликаны от других гликанов, например, может быть использована анионообменная колонка, как в анионообменной хроматографии (AEC/AEX). Смолы, которые типично используются в анионообменной хроматографии, включают, но не ограничиваются следующим: Q-смола (четвертичный амин) и DEAE смола (диэтиламиноэтан). Заряженные смолы для использования в анионообменной хроматографии являются коммерчески доступными от таких поставщиков, как BioRad (Hercules, Канада) и Amersham Biosciences (Chalfont St. Giles, Великобритания).
Конкретные условия для экспериментов по хроматографии могут зависеть от конкретных видов гликана, которые необходимо разделить, композиции препарата гликана и т.д.
В некоторых вариантах осуществления одни или более дополнительных стадий разделения проводят, используя любой способ, приемлемый для разделения молекул, включая, но не ограничиваясь следующим: способы, которые позволяют провести разделение на основании размера, гидрофобности, заряда, отношения заряда к массе или их комбинации и т.д. Дополнительные стадии разделения могут быть проведены непосредственно после предыдущей стадии разделения и/или после другого процесса, такого как, например, необязательные анализы, как обсуждается ниже. В качестве неограничивающего примера, после стадии разделения на анионообменной колонке может быть использована вторая стадия хроматографии, такая как хроматография с нормальной амидной фазой. Информация от одной или обеих стадий разделения может быть использована для определения видов гликана.
B. Анализ разделенных гликанов
В определенных вариантах осуществления предлагаемые способы включают анализ структурных характеристик разделенных и/или выделенных гликанов (например, гликанов, имеющих первый заряд и/или первое отношение заряда к массе). В некоторых вариантах осуществления анализы могут обеспечивать определение заряженных гликанов. Разделенные и/или выделенные гликаны могут необязательно быть собраны от более чем одного препарата гликана и/или образца.
Гликаны могут быть проанализированы с помощью любого метода, включая, например, связывание лиганда, масс-спектрометрию, ядерно-магнитный резонанс и/или другие методики. Разнообразие способов для анализа гликанов известно из уровня техники. Например, см. Anumula, Anal. Biochem, 350(1):1-23, 2006; Klein et al. Anal. Biochem., 179:162-66, 1989; и Townsend, R. R., Carbohydrate Analysis: High Performance Liquid Chromatography and Capillary Electrophoresis, ed. Z. El Rassi, pp. 181-209, 1995, Yuan et al., J. Chromatography A (2005) 1067:145-152, содержание каждого из которых включено сюда посредством ссылки в их полноте.
В некоторых вариантах осуществления анализ гликанов, как описывается здесь, может включать, например, нацеливание гликанов на выделение определенных компонентов сахаридов (например, моносахаридов). Например, в некоторых вариантах осуществления гликаны обрабатывают одной или более обработками эндогликозидазой.
Гликаны могут быть проанализированы с помощью одного или более из разнообразия способов. В качестве неограничивающих примеров, гликаны могут быть охарактеризованы с помощью способов, таких как ядерно-магнитный резонанс (ЯМР), масс-спектрометрия, жидкостная хроматография, 2-мерная хроматография, SDS-PAGE (электрофорез в палиакриламидном геле с использованием додецилсульфата натрия), окрашивание антителами, окрашивание лектином, количественная оценка моносахаридов, капиллярный электрофорез, электрофорез углеводородов с помощью флюорофора (FACE), мицеллярная электрокинетическая хроматография (MEKC), обработки экзогликозидазой и/или эндогликозидазой и их комбинации. Специалисты в данной области техники будут осведомлены о других способах, которые могут быть использованы, чтобы охарактеризовать гликаны.
В некоторых вариантах осуществления структуру гликана и/или состав (например, моносахаридный состав) анализируют с помощью хроматографических способов, таких как, например, жидкостная хроматография (LC), высокоэффективная жидкостная хроматография (HPLC), сверхэффективная жидкостная хроматография (UPLC), тонкослойная хроматография (TLC) и их комбинации.
В некоторых вариантах осуществления структуру гликана и/или состав (например, моносахаридный состав) анализируют с помощью масс-спектрометрии (MS) и связанных способов, таких как, например, тандемная масс-спектрометрия, жидкостная хроматография с масс-спектрометрией (LC-MS), жидкостная хроматография с тандемной масс-спектрометрией (LC-MS/MS), масс-спектрометрия с использованием лазерной десорбции и ионизации в присутствии матрицы (MALDI-MS), масс-спектрометрия с Фурье-преобразованием (FTMS), разделение ионной подвижности с масс-спектрометрией (IMS-MS), диссоциация с переносом электрона (ETD-MS) и их комбинации.
В некоторых вариантах осуществления структуру гликана и/или состав (например, моносахаридный состав) анализируют с помощью электрофоретических способов, таких как, например, капиллярный электрофорез (CE), CE-MS (капиллярный электрофорез с масс-спектрометрией), электрофорез в геле, электрофорез в агарозном геле, электрофорез в акриламидном геле, электрофорез в полиакриламидном геле с использованием додецил сульфата натрия (SDS-PAGE) с последующим вестерн-блоттингом, используя антитела, которые распознают специфические гликановые структуры, и их комбинации.
В некоторых вариантах осуществления структуру гликана и/или состав (например, моносахаридный состав) анализируют с помощью ядерно-магнитного резонанса (ЯМР) и родственных способов, включая, но не ограничиваясь следующим: одномерный ЯМР (1D-NMR), двумерный ЯМР (2D-NMR), ЯМР при вращении под магическим углом с корреляционной спектроскопией (COSY-NMR), ЯМР с полной корреляционной спектроскопией (TOCSY-NMR), ЯМР с гетероядерной одноквантовой корреляцией (HSQC-NMR), ЯМР с гетероядерной многоквантовой корреляцией (HMQC-NMR), ЯМР с вращательной спектроскопией ядерного эффекта Оверхаузера ЯМР (ROESY-NMR), ЯМР со спектроскопией ядерного эффекта Оверхаузера (NOESY- NMR) и их комбинации.
В определенных вариантах осуществления гликоконъюгаты и/или гликановые структуры метят до определения характеристик. Как известно специалистам в данной области техники, такое мечение может увеличивать сигнал и/или уменьшать шум фона в ходе определения характеристик. Любая из разнообразия меток может быть использована согласно данному раскрытию, включая, но не ограничиваясь следующим: флюоресцентные метки, радиоактивные метки и/или хемилюминесцентные метки. В определенных вариантах осуществления гликановые структуры метят флюоресцентным 2-аминобензамидом (“2-AB”). Специалисты в данной области техники будут осведомлены о других приемлемых метках, которые могут быть использованы согласно данному раскрытию.
В некоторых вариантах осуществления более чем один метод анализа может быть использован и/или проводят дополнительные стадии анализов. Дополнительные стадии могут непосредственно следовать за предыдущей стадией анализа и/или другой стадией (например, разделения гликанов, имеющих первый заряд и/или имеющих конкретное отношение заряда к массе и т.д.).
C. Количественная оценка
В некоторых вариантах осуществления способы включают количественное определение, по меньшей мере, одного разделенного гликана, используя, по меньшей мере, один стандарт количественной оценки, то есть известное количество молекулы, которые может быть проанализировано параллельно и/или вместе с разделенными гликанами. Например, в способе, таком как хроматография, высоты и/или площади под пиком(ами), представляющие разделенные гликаны в хроматограмме, могут быть экстраполированы на калибровочную кривую, созданную с использованием стандарта(ов) количественной оценки, для получения аппроксимации количества разделенных гликанов в образце.
В некоторых вариантах осуществления количественная оценка является относительной, т.е. количества конкретных видов гликанов определяют относительно других видов. Например, количества необычно модифицированных видов гликана могут быть определены относительно других видов гликана. Альтернативно или дополнительно, количества типов необычно модифицированных видов гликана (например, фосфорилированные гликаны, сульфатированные гликаны и/или полиацетилированные сиалированные гликаны) могут быть определены относительно друг друга.
В некоторых вариантах осуществления количественная оценка является абсолютной. Например, определяют абсолютное количество разделенных видов гликана (таких как, например, необычно модифицированные виды гликана). Абсолютная количественная оценка может быть определена с использованием, например, стандартной кривой (или “калибровочной кривой”) значений, полученных с использованием стандартов количественной оценки.
Стандарт может быть “внешним” (то есть, проанализированным отдельно от препаратов гликана, например, в параллели) и/или “внутренним” (то есть, проанализированным вместе с препаратами гликана, также известный как “пичковый”). Будь-то внутренним или внешним, стандарт может быть помечен. В некоторых вариантах осуществления как гликаны в препарате гликана, так и стандарт являются мечеными. В некоторых таких вариантах осуществления как гликаны, так и стандарт являются меченными одинаковым типом метки. Как внутренний, так и внешний стандарты могут быть помечены таким же типом метки, как и гликаны. В вариантах осуществления с использованием внутреннего стандарта с такой же меткой внутренний стандарт будет типично отделимым и/или отличимым от меченых гликанов на основании отличия, такого как размер. Например, стандарт может быть намного меньше по молекулярной массе, чем большинство гликанов в данном препарате, так что стандарт будет элюировать, как предполагают, в другой момент времени, нежели гликаны в препарате.
Молекулы, которые могут служить в качестве приемлемых стандартов количественной оценки, включают, но не ограничиваются следующим: более маленькие варианты молекул гликана, растительные углеводороды и т.д. В некоторых вариантах осуществления 2-аминобензамид-хитобиоза используется как стандарт количественной оценки. В некоторых вариантах осуществления стандарты количественной оценки получают путем отщепления гликоконъюгатов и/или гликанов, так чтобы образовались фрагменты гликанов, мечения полученных фрагментов и получением характеристик фрагментов, так чтобы были известны их размеры, что определяют на соответствующих техниках разделения и/или анализа.
III. Применения
Следует понимать, что способы, раскрытые здесь, могут быть использованы в любом из разнообразия применений. В общем, предлагаемые способы используются в любом применении, которое включает структурную характеристику гликанов (например, применения, в которых желательно охарактеризовать гликаны, связанные с целевым гликоконъюгатом (например, гликопротеином) и/или выделить определенные виды гликана (например, необычно модифицированные гликаны).
Способы, как описывается здесь, могут быть использованы, например, для определения характера изменения свойств конкретных необычно модифицированных гликанов (и/или гликоконъюгатов, содержащих их). Как только характер изменения свойств определен, может использоваться применение методов для определения конкретных таких гликанов в препарате гликана или гликоконъюгата. Альтернативно или дополнительно, методы, описанные здесь могут использоваться самостоятельно или в комбинации с другими методами (например, как описывается здесь), чтобы выделить и/или охарактеризовать один или более гликоконъюгатов (например, содержащих необычно модифицированные гликаны) или гликанов (например, необычно модифицированных гликанов). Сходным образом, независимо от того, известна ли структура необычно модифицированных гликанов, присутствующих в обнаруженных пиках или полосах, профили пиков/полос могут сравниваться друг с другом для оценки отличающихся уровней/количеств необычно модифицированных гликанов в различных препаратах гликоконъюгата или гликана.
Как упоминалось ранее, предлагаемые способы могут применяться к препаратам гликана, полученным из широкого разнообразия источников, включая, но не ограничиваясь следующим: терапевтические составы и биологические образцы (например, образцы, содержащие клетки). Такой препарат гликана может подвергаться одной или более стадиям анализа и/или очищения до или после того, как его проанализируют согласно данному раскрытию. Например, в некоторых вариантах осуществления гликаны в препарате гликана метят одной или более обнаруживаемыми метками или другими средствами, которые могу облегчить анализ с помощью методов, таких как, например, масс-спектрометрия или ЯМР. Любой из разнообразия стадий разделения и/или выделения может применяться к препарату гликана согласно данному раскрытию.
В некоторых вариантах осуществления предлагаемые способы используются, чтобы охарактеризовать и/или контролировать или сравнивать качество терапевтических продуктов. Гликозилирование может часто влиять на активность, биодоступность или другие характеристики терапевтического белкового продукта. Предлагаемые способы могут быть использованы, например, для оценки паттернов гликозилирования (таких, как композиция и/или тип необычных модификаций) в клетках, продуцирующих терапевтический белковый продукт. В некоторых вариантах осуществления анализ осуществляют без выделения продуктов. Среди прочего, предлагаемые способы могут облегчать анализ в реальном времени паттернов гликозилирования в системах продукции для терапевтических белков.
Предлагаемые способы могут быть использованы в одной или более стадиях разработки производственного процесса для продукции терапевтического или другого коммерчески значимого гликопротеина, представляющего интерес. Неограничивающие примеры таких стадий разработки производственного процесса, которые могут использовать способы данного раскрытия, включают селекцию клеток, селекцию клонов, оптимизацию сред, условия культивирования, условия процесса и/или процедуру очищения. Специалисты в данной области техники будут осведомлены о других стадиях разработки производственного процесса.
Предлагаемые способы могут быть использованы, чтобы контролировать степень и/или тип гликозилирования (включая тип(ы) необычных модификаций, если они есть), имеющего место в конкретной клеточной культуре и/или при конкретных условиях выращивания, тем самым обеспечивая регулирование или возможного завершения культивирования для того, чтобы, например, получить конкретный необходимый паттерн гликозилирования или чтобы избежать развития конкретного нежелательного паттерна гликозилирования.
Предлагаемые способы могут быть использованы для оценки характеристик гликозилирования клеток или клеточных линий, которые предусматриваются для продукции конкретного необходимого гликопротеина (например, даже до того, как клетки или клеточные линии были сконструированы для продукции гликопротеина, или для продукции гликопротеина на коммерчески значимом уровне).
В некоторых вариантах осуществления предлагаемые способы используются для контроля паттерна гликозилирования в ходе культивирования клеток, которые продуцируют гликопротеин. Например, продукция гликопротеина (например, коммерческая продукция) может включать стадии: (1) культивирования клеток, которые продуцируют гликопротеин; (2) получения образцов через равные или неравные промежутки времени в ходе процесса культивирования клеток; (3) получения препаратов гликана из образцов и (4) анализ паттерна гликозилирования (в частности, композиции и типа необычных модификаций) на гликанах в препаратах. В некоторых вариантах осуществления анализируют паттерн гликозилирования на гликоконъюгатах клеточной поверхности; в некоторых таких вариантах осуществления способы дополнительно содержат стадию сравнения паттернов гликозилирования клеточной поверхности различных образцов друг с другом и/или с паттернами гликозилирования одного или более гликопротеинов не клеточной поверхности, продуцируемых соответствующей клеткой(ами). В некоторых вариантах осуществления способы дополнительно содержат стадию сравнения паттернов гликозилирования для одного или более полученных образцов с паттерном гликозилирования эталонного образца.
В некоторых вариантах осуществления известен необходимый паттерн гликозилирования для конкретного целевого гликопротеина, и технология, описанная здесь, позволяет контролировать культивируемые образцы для оценки прогресса продукции по пути, известному для продукции необходимого паттерна гликозилирования. Например, где целевой гликопротеин представляет собой терапевтический гликопротеин, например, подвергающийся регулярному тестированию в одной или более странах, зачастую будет желательным проконтролировать культуры для оценки вероятности того, что они будут образовывать продукт с паттерном гликозилирования настолько близким к установленному паттерну гликозилирования фармацевтического продукта, насколько это возможно, вне зависимости от того, производится ли он точно таким же путем. Как используется здесь, “близкий” в отношении паттерна гликозилирования в сравнении с таковым у продукта относится к паттерну гликозилирования, имеющему, по меньшей мере, около 75%, 80%, 85%, 90%, 95%, 98% или 99% корреляции с установленным паттерном гликозилирования фармацевтического продукта. В таких вариантах осуществления образцы продуктивной культуры типично берут в многие моменты времени и сравнивают с установленным стандартом или с контрольной культурой для того, чтобы оценить относительное гликозилирование.
В некоторых вариантах осуществления необходимый паттерн гликозилирования будет включать низкий уровень (например, меньше чем около 20%, около 15%, около 10%, около 5%, около 1% или меньше) или высокий уровень (например, больше чем около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95%, около 98%, около 99% или больше) необычно модифицированных гликанов.
В некоторых вариантах осуществления необходимый паттерн гликозилирования будет включать низкий уровень (например, меньше чем около 20%, около 15%, около 10%, около 5%, около 1% или меньше) или высокий уровень (например, больше чем около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95%, около 98%, около 99% или больше) фосфорилированного гликана.
В некоторых вариантах осуществления необходимый паттерн гликозилирования будет включать низкий уровень (например, меньше чем около 20%, около 15%, около 10%, около 5%, около 1% или меньше) или высокий уровень (например, больше чем около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95%, около 98%, около 99% или больше) сульфатированного гликана.
В некоторых вариантах осуществления необходимый паттерн гликозилирования будет включать низкий уровень (например, меньше чем около 20%, около 15%, около 10%, около 5%, около 1% или меньше) или высокий уровень (например, больше чем около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95%, около 98%, около 99% или больше) ацетилированного гликана.
В некоторых вариантах осуществления необходимый паттерн гликозилирования будет включать низкий уровень (например, меньше чем около 20%, около 15%, около 10%, около 5%, около 1% или меньше) или высокий уровень (например, больше чем около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95%, около 98%, около 99% или больше) полиацетилированных сиалированных гликанов (например, диацетилированных гликанов), или конкретного полиацетилированного гликана.
В некоторых вариантах осуществления необходимый паттерн гликозилирования будет иметь другие конкретные признаки в дополнение к признаку, относящемуся к необычным модификациям. Например, в некоторых вариантах осуществления необходимый паттерн гликозилирования будет включать низкий уровень (например, меньше чем около 20%, около 15%, около 10%, около 5%, около 1% или меньше) или высокий уровень (например, больше чем около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95%, около 98%, около 99% или больше) корового фукозилирования.
В некоторых вариантах осуществления необходимый паттерн гликозилирования будет включать низкий уровень (например, меньше чем около 20%, около 15%, около 10%, около 5%, около 1% или меньше) или высокий уровень (например, больше чем около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95%, около 98%, около 99% или больше) сиаловой кислоты, связанной с N-ацетилглюкозамином.
В некоторых вариантах осуществления необходимый паттерн гликозилирования (например, паттерн гликозилирования клеточной поверхности и/или паттерны гликозилирования, наблюдающиеся с продуцируемым гликопротеином неклеточной поверхности), будет более обширным. Например, в некоторых вариантах осуществления необходимый паттерн гликозилирования показывает высокую степень занятости (например, больше чем около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95%, около 98%, около 99% или больше) сайтов гликозилирования; в некоторых вариантах осуществления необходимый паттерн гликозилирования показывает высокую степень разветвления (например, больше чем около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95%, около 98%, около 99% или более имеют три- или тетра-антенные структуры).
В некоторых вариантах осуществления необходимый паттерн гликозилирования может быть менее обширным. Например, в некоторых вариантах осуществления необходимый паттерн гликозилирования клеточной поверхности показывает низкую степень занятости (например, меньше чем около 50%, около 45%, около 40%, около 35%, около 30%, около 25%, около 20%, около 15%, около 15%, около 5%, около 1% или меньше) сайтов гликозилирования; и/или низкую степень разветвления (например, меньше чем около 20%, около 15%, около 10%, около 5%, около 1% или меньше имеют три- или тетра-антенные структуры).
В некоторых вариантах осуществления необходимый паттерн гликозилирования будет более обширным в некоторых аспектах и менее обширным в других. Например, может быть желательно использовать клеточную линию, которая имеет тенденцию продуцировать гликопротеины с длинными, неразветвленными олигосахаридными цепями. Альтернативно, может быть желательным использовать клеточную линию, которая имеет тенденцию продуцировать гликопротеины с короткими, высоко разветвленными олигосахаридными цепями.
В некоторых вариантах осуществления необходимый паттерн гликозилирования будет обогащен конкретным типом гликановой структуры. Например, в некоторых вариантах осуществления необходимый паттерн гликозилирования будет иметь низкие уровни (например, меньше чем около 20%, около 15%, около 10%, около 5%, около 1% или меньше) структур с высоким содержанием маннозы или гибридных структур, высокие уровни (например, больше чем около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95%, около 98%, около 99% или больше) структур с высоким содержанием маннозы, высокие уровни (например, больше чем около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95%, около 98%, около 99% или больше; например, по меньшей мере, на один гликопротеин) фосфорилированных с высоким содержанием маннозы или низкие уровни (например, меньше чем около 20%, около 15%, около 10%, около 5%, около 1% или меньше) фосфорилированных с высоким содержанием маннозы.
В некоторых вариантах осуществления необходимый паттерн гликозилирования будет включать, по меньшей мере, около одной сиаловой кислоты. В некоторых вариантах осуществления необходимый паттерн гликозилирования будет включать высокий уровень (например, больше чем около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95%, около 98%, около 99% или больше) концов, которые являются сиалированными. В некоторых вариантах осуществления необходимый паттерн гликозилирования, который включает сиалирование, будет показывать, по меньшей мере, около 85%, около 90%, около 95%, около 98%, около 99% или более N-ацетилнейраминовой кислоты и/или меньше чем около 20%, около 15%, около 10%, около 5%, около 1% или меньше N-гликолилнейраминовой кислоты.
В некоторых вариантах осуществления необходимый паттерн гликозилирования показывает специфичность удлинения ответвлений (например, больше чем около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95%, около 98%, около 99% или более удлинения имеет место на ответвлениях α1,6-маннозы; или больше чем около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95%, около 98%, около 99% или более удлинения имеет место на ответвлениях α1,3-маннозы).
Репрезентативные терапевтические гликопротеиновые продукты, чья продукция и/или качество может контролироваться согласно данному раскрытию, включают, например, любое из разнообразия гематологических средств (включая, например, эритропоэтин, факторы свертываемости крови и т.д.), интерфероны, колониестимулирующие факторы, антитела, ферменты, гормоны и т.д.
В некоторых вариантах осуществления предложены способы, в которых гликаны из различных источников или образцов сравнивают друг с другом. В некоторых таких примерах множественные образцы из одного источника получают в динамике во времени, так чтобы отследить изменения в паттернах гликозилирования (и в особенности в композиции и/или типе(ах) необычных модификаций). В некоторых вариантах осуществления образцы, содержащие гликан, удаляют с равными интервалами. В некоторых вариантах осуществления образцы, содержащие гликан, удаляют с интервалами в около 30 секунд, около 1 минуты, около 2 минут, около 5 минут, около 10 минут, около 30 минут, около 1 часа, около 2 часов, около 3 часов, около 4 часов, около 5 часов, около 10 часов, около 12 часов или около 18 часов или с даже более длинными интервалами. В некоторых вариантах осуществления образцы, содержащие гликан, удаляют с неравными интервалами. В некоторых вариантах осуществления образцы, содержащие гликан, удаляют с 5-часовыми интервалами.
В некоторых вариантах осуществления один из образцов представляет собой предыдущий образец, и/или запись предыдущего образца используют для сравнения (например, как в испытании при выпуске серий фармацевтических продуктов). В некоторых вариантах осуществления один из образцов является эталонным образцом.
В определенных вариантах осуществления изменения в паттерне гликозилирования гликопротеина, представляющего интерес, выращенного при одном или более различных параметрах выращивания, испытывали для определения одного или более необходимых параметров выращивания или комбинаций параметров, для продукции гликопротеина. В некоторых вариантах осуществления различия в паттернах гликозилирования определяют путем наблюдения и/или измерения характеристики паттерна гликозилирования, такой как, без ограничения: состав и/или тип(ы) необычно модифицированных гликанов, занятость сайта гликозилирования, идентичность связанных гликанов, относительные количества связанных гликанов, полный или частичный состав связанных гликанов и/или относительные количества связанных гликанов. Альтернативно или дополнительно, другие характеристики паттерна гликозилирования, известные специалистам в данной области техники, могут быть измерены.
В некоторых вариантах осуществления способы, предложенные здесь, используют для контроля за степенью и/или типом модификаций гликана, имеющим место в различных образцах (например, в различных клеточных культурах).
В некоторых вариантах осуществления гликаны из различных образцов клеточных культур, полученных при условиях, которые отличаются по одному или более выбранным параметрам (например, тип клеток, тип культуры [например, непрерывное питание в отличие от порционного питания и т.д.], условия культивирования [например, тип сред, присутствие или концентрация конкретного компонента конкретной среды(сред), осмолярность, pH, температура, регулирование времени или степень сдвига по одному или более компонентам, таким как осмолярность, pH, температура и т.д.), время культивирования, стадии выделения и т.д.), но в остальном идентичные, сравнивают, так чтобы определить эффекты выбранного параметра(ов) на модификации гликана и/или другие характеристики паттернов гликозилирования. В определенных вариантах осуществления гликаны из различных образцов клеточных культур, полученные при условиях, которые отличаются по одному выбранному параметру, сравнивают, так чтобы определить эффект одного выбранного параметра на модификации гликана и/или другие характеристики паттернов гликозилирования. Среди прочих применений, следовательно, данные методы могут способствовать определению эффектов конкретных параметров на паттерны гликозилирования в клетках.
В некоторых вариантах осуществления сравнивают гликаны из различных партий клеток, которые продуцируют гликопротеин, представляющий интерес (например, терапевтический гликопротеин), вне зависимости от того, получены ли они одинаковым способом или различными способами, и получены ли они одновременно или раздельно. В таких вариантах осуществления данное раскрытие способствует контролю качества препарата гликопротеина (т.е., препарата целевого препарата гликопротеина). В некоторых вариантах осуществления способы способствуют контролю за развитием конкретной культуры, продуцирующей гликопротеин, представляющий интерес (например, когда образцы удаляют из культуры в различные моменты времени и анализируют и сравнивают друг с другом). В любом из этих вариантов осуществления показатели анализа гликана могут записывать, например, в протокол контроля качества. Как отмечено выше, в некоторых вариантах осуществления сравнение проводят с предыдущей записью предыдущей или стандартной партии гликопротеина и/или со стандартным образцом.
В определенных вариантах осуществления данное раскрытие может быть использовано в исследованиях для модификации характеристик гликозилирования клетки, например, для установления клеточной линии и/или условий культивирования с одной или более необходимыми необычными модификациями. Такая клеточная линия и/или условия культивирования могут затем использоваться, при необходимости, для продукции конкретного целевого гликоконъюгата (например, гликопротеина), для которого такая характеристика(и) гликозилирования, как предполагают, является(ются) благоприятной(ыми).
Согласно данному раскрытию методы, описанные здесь, могут быть использованы для обнаружения необходимых или нежелательных гликанов, например, чтобы обнаружить или количественно оценить присутствие одной или более примесей в продукте, или чтобы обнаружить или количественно оценить присутствие одного или более активных или необходимых видов.
В различных вариантах осуществления способы могут быть использованы для оценки гликозилирования одного или более биомаркеров, определяющих, например, болезненное состояние до появления симптомов, и/или развитие болезненного состояния до неизлечимого или менее поддающегося лечению состояния, путем обнаружения одного или более специфических гликанов, чье присутствие или уровень (будь-то абсолютный или относительный) могут быть соотнесены с конкретным болезненным состоянием (включая предрасположенность к конкретному заболеванию) и/или изменением в концентрации таких гликанов с течением времени. Например, в некоторых вариантах осуществления раскрытия целевой гликоконъюгат является биомаркером.
В определенных вариантах осуществления предлагаемые способы используют для выделения конкретных гликанов, например, конкретных видов гликана или набора видов гликана. Например, предлагаемые способы могут быть использованы для выделения необычно модифицированных гликанов, таких как, например, фосфорилированные гликаны, сульфатированные гликаны, полиацетилированные сиалированные гликаны или их комбинация.
В определенных вариантах осуществления способы, описанные здесь, способствуют обнаружению и/или выделению конкретных гликанов (например, необычно модифицированных гликанов), которые присутствуют в очень низких уровнях в источнике (например, биологическом образце). В таких вариантах осуществления возможно обнаружить и/или необязательно количественно оценить уровни гликанов, которые присутствуют на уровнях, меньших чем около 10%, 5%, 4%, 3%, 2%, 1,5%, 1%, 0,75%, 0,5%, 0,25%, 0,1%, 0,075%, 0,05%, 0,025% или 0,01% в популяции гликанов в источнике. В некоторых вариантах осуществления можно обнаружить и/или необязательно количественно оценить уровни гликанов, включающие от 0,1% до 5%, например, от 0,1% до 2%, например, от 0,1% до 1% препарата гликана. В определенных вариантах осуществления можно обнаружить и/или необязательно количественно оценить уровни гликанов от около 0,1 фемтомоль до около 1 ммоль.
В некоторых вариантах осуществления техники, описанные здесь, могут быть комбинированы с одной или более другими технологиями для обнаружения, анализа и/или выделения гликанов или гликоконъюгатов.
IV. Базы данных
В некоторых вариантах осуществления выделенные гликаны сравнивают с ранее определенными разделенными гликанами. Такие сравнения могут обеспечить анализ разделенных гликанов. В некоторых вариантах осуществления характеристики ранее определенных гликанов сохраняют в базе данных. Анализ разделенных гликанов может, например, содержать использование информации в базе данных.
Предлагаемые способы могут также включать создание списка свойств гликанов, таких как, например, характер изменения свойств конкретных необычно модифицированных гликанов при воздействии одной или более различных аналитических техник. Также предложены способы создания списка свойств конкретных гликанов и/или препаратов гликоконъюгатов. Такие типичные свойства включают, например, присутствие или количество конкретного необычно модифицированного гликана в препарате, степень занятости одного или более конкретных сайтов гликозилирования (например, необычно модифицированными гликанами), типы гликанов (например, присутствующих необычно модифицированных гликанов), относительные количества различных гликанов (например, необычно модифицированных гликанов) и т.д. В некоторых вариантах осуществления список содержит число одного или более типов моносахаридов, присутствующих в препарате гликана или гликоконъюгата. Список может также или альтернативно включать общую массу гликана или гликоконъюгата, массу несахаридной части гликоконъюгата, массу одного и/или более необычно модифицированных гликанов и т.д.
Один пример такого способа включает измерение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более свойств конкретного гликана, препарата гликана или препарата гликоконъюгата и запись значения для одного или более свойств для создания списка свойств гликана. Такие способы могут также или альтернативно содержать создание списка свойств гликоконъюгата.
В некоторых вариантах осуществления список представляет собой структуру данных, материально воплощенную в считываемом компьютером носителе, таком как компьютерный жесткий диск, гибкий магнитный диск, CD-ROM и т.д. Например, структура данных может иметь множество вводов, где каждый ввод кодирует значение свойства. Вводы могут кодироваться любым видом значения, например, как однобитные значения, одноразрядные шестнадцатеричные значения, десятичные значения и т.д.
Также предложены базы данных, материально воплощенные в одном или более считываемых компьютером носителях, где базы данных сохраняют описательную информацию для одного или более гликанов, препаратов гликана и/или препаратов гликоконъюгата (такую как информация о составе и/или типе необычных модификаций). Предложенные базы данных содержат блоки данных, которые соответствуют гликану и/или гликоконъюгату. Блоки данных включают идентификатор, который включает одно или более полей, где каждое поле сохраняет значение, соответствующее одному или более свойствам гликанов и/или гликоконъюгатов. В некоторых вариантах осуществления идентификатор включает 2, 3, 4, 5, 6, 7, 8, 9, 10 или более полей. База данных, например, может быть базой данных всех возможных гликоконъюгатов и/или гликанов или может быть базой данных значений, представляющих гликомный профиль или паттерн для одного или более образцов.
Предложены улучшенные способы для анализа образцов, содержащих гликаны (например, необычно модифицированные гликаны), где комбинированная аналитически вычислительная платформа используется для получения полного определения характеристик гликанов. Любой из способов, описанных здесь, может быть объединен с вычислительными способами. Разнообразная информация, собранная от различных экспериментальных методов, может быть использована для создания ограничений. Создание ограничений может быть выполнено в комбинации с набором биоинформационных средств на основе протеомики и глиомики и баз данных для эффективного определения характеристик (необычных модификаций, занятости сайта гликозилирования, количественной оценки, структуры гликана и т.д.) смеси гликана/гликоконъюгата, представляющей интерес. Базы данных могут быть известными в области техники или могут быть созданы с помощью предлагаемых способов. В качестве примера, способ анализа гликанов с помощью комбинированных аналитических и вычислительных методов может включать проведение эксперимента на образце, содержащем гликаны, анализ результатов эксперимента, создание ограничений и разрешение их. Ограничения могут быть созданы и/или разрешены с помощью данных, полученных из экспериментальных результатов, а также другой известной информации, например, информации из баз данных, которые содержат информацию о гликанах или гликоконъюгатах, и с помощью других средств, которые анализируют свойства гликанов, гликоконъюгатов или их несахаридных частей, такие как масса и активность ферментов.
Ограничения могут быть созданы с использованием, например, того, что известно о биосинтетическом пути синтеза гликана.
V. Наборы
Реагенты, пригодные для осуществления одного или более предлагаемых способов, могут, по желанию, обеспечиваться вместе, объединенными в набор. В определенных вариантах осуществления наборы данного раскрытия включают один или более реагентов, пригодных для выделения гликопротеинов из клеток (например, одна или более протеаз, гликозидаз и/или других средств), одну или более сиалидаз, и/или дополнительных компонентов, таких как буферы, кофакторы и т.д. В определенных вариантах осуществления наборы данного раскрытия включают один или более реагентов, пригодных для очищения и/или анализа препаратов гликана.
В некоторых вариантах осуществления предлагаемые наборы включают один или более реагентов, пригодных для отщепления гликановых структур от гликопротеина или гликопептида (например, ферменты, такие как PNGаза F, PNGаза A, O-гликаназа и/или Endo-H). В некоторых вариантах осуществления наборы данного раскрытия включают один или более реагентов, пригодных для очищения отщепленных гликановых структур от белкового компонента гликопротеинов или гликопептидов (например, одна или более гликозидаз).
В некоторых вариантах осуществления наборы включают один или более реагентов для мечения гликановых структур. Например, наборы данного раскрытия могут включать флюоресцентные метки, радиоактивные метки и/или хемилюминесцентные метки. В определенных вариантах осуществления наборы данного раскрытия включают флюоресцентный 2-аминобензамид (“2-AB”).
В определенных вариантах осуществления предлагаемые наборы включают один или более реагентов для культивирования клеток (например, среды для выращивания культур клеток, буферы, компоненты сред и т.д.) и/или очищения клеток после того, как клетки были культивированы.
Примеры
Пример 1: Определение и количественная оценка необычно модифицированных видов гликанов
В данном примере представлены результаты с использованием предлагаемого способа для определения и количественной оценки необычно модифицированных видов гликана.
Гликаны вначале выделяют из гликопротеина, представляющего интерес, с помощью ферментативных или химических способов (например, используя PNGазу F, гидразинолиз и т.д.). Выделенные гликаны затем метят, используя 2-аминобензамидную флюоресцентную метку. Образец флюоресцентно-меченной смеси N-гликанов затем обрабатывают ферментом сиалидазой и инкубируют в течение ночи при 37°C. После инкубации образец вводят инъекцией на анионообменную колонку и задержанные виды (которые содержат отрицательно заряженные виды) собирают и анализируют с помощью масс-спектрометрии.
Отдельно создают калибровочную кривую, используя внешний стандарт, содержащий такую же флюоресцентную метку, как и метки гликанов в смеси. Необычно модифицированные гликаны затем оценивают количественно с помощью экстраполирования их высот/площадей пиков на калибровочную кривую. Альтернативно, необычно модифицированные гликаны (например, фосфорилированные гликаны, сульфатированные гликаны и/или полиацетилированные сиалированные гликаны) могут быть проанализированы на второй стадии хроматографии (такой как нормальная амидная фаза) и идентичность видов может быть определена из времен удерживания в обоих хроматографических разделениях в сравнении с ранее определенными видами гликанов.
Как показано на Фигурах 3 и 4, необычно модифицированные гликаны элюируются позже, чем нейтральные (десиалированные) гликаны. Этот протокол может затем применяться к смесям гликанов для отделения необычно модифицированных видов от других гликанов в смеси. Количества необычно модифицированных гликанов могут быть определены, используя калибровочную кривую, показанную во вставке Фигуры 3. Подобные результаты были получены из количественного анализа необычно модифицированных гликанов, определенных на Фигуре 4 (данные не показаны).
Как описывается здесь, Фигура 3 показывает AEX-HPLC профиль необычно модифицированных видов гликанов, полученных из терапевтического гликопротеина эритропоэтина с биологической активностью, полученного из Китайского научного центра. Фигура 4 показывает AEX-HPLC профиль необычно модифицированных видов гликанов, полученных из второго терапевтического гликопротеина, представляющего интерес, с 97% аминокислотной идентичностью с гликопротеином эритропоэтином, описанным на Фигуре 3. Профиль необычно модифицированных гликанов от каждого терапевтического гликопротеинового образца отличался друг от друга. Эти данные подтверждают, что предлагаемые способы различают препараты гликопротеинов с высокой степенью подобия (например, в терминах компонентов гликана). Подобные данные были получены также для препаратов гликопротеинов антител (см. Фигуры 5-7).
Как показано на Фигурах 5, 6 и 7, высокочувствительная хроматография позволяет разделить виды с одинаковым заряженным состоянием, такие как моносульфатированные гликаны, и поддающиеся количественному определению при установленных условиях разделения. Фигура 5 показывает хроматографический анализ сульфатированных гликанов, полученных из моноклонального анти-EGFR антитела, продуцируемого у мыши. Фигуры 6 и 7 показывают хроматографический анализ необычно модифицированных гликанов, полученных из отдельных клонов анти-CTLA4-IgG моноклонального антитела. Эти данные подтверждают, что предлагаемые способы различают гликопротеины, продуцируемые различными клеточными линиями (например, различными клонами).
Эквиваленты
Специалисты в данной области техники обнаружат или смогут установить, используя не более чем рутинное экспериментирование, многие эквиваленты к специфическим вариантам осуществления раскрытия, описанным здесь. Другие варианты осуществления будут очевидны для специалистов в данной области техники из рассмотрения описания или практического осуществления изобретения, раскрытого здесь. Подразумевается, что описание изобретения и примеры, рассматриваемые исключительно как иллюстративные, в пределах действительного объема изобретения, подлежащего определению с помощью нижеследующей формулы изобретения.
В формуле изобретения формы единственного числа могут означать один или более чем один, если только не указано обратное или иное неочевидно из контекста. Формула изобретения и описания, которые включают “или” между одним или более членами группы рассматриваются выполненными, если один, более чем один или все члены группы присутствуют в, используются в или иным образом относится к данному продукту или процессу, если только не указано обратное или иное неочевидно из контекста. Раскрытие включает варианты осуществления, в которых точно один член из группы присутствует в, используется в или иным образом относятся к данному продукту или процессу. Раскрытие включает варианты осуществления, в которых более чем один или все из членов группы присутствуют в, используются в или иным образом относятся к данному продукту или процессу.
Более того, следует понимать, что раскрытие включает все изменения, комбинации и перестановки, в которых один или более ограничений, элементов, части, описательных выражений и т.д., из одного или более перечисленных пунктов формулы изобретения включены в другой пункт формулы изобретения. Например, любой пункт формулы, который является зависимым от другого пункта формулы, может быть модифицирован, чтобы включать одно или более ограничений, обнаруженных в любом другом пункте формулы, который является зависимым от того же основного пункта формулы. Более того, когда пункты формулы описывают композицию, следует понимать, что включены способы применения композиция для любой из целей, раскрытых здесь, и включены способы получения композиции согласно любому из способов получения, раскрытых здесь или других способов, известных из уровня техники, если только не указано обратное или если только специалисту в данной области техники не будет очевидно, что будет возникать противоречие или несоответствие.
Если элементы представлены в виде списка, например, в формате группы Маркуша, следует понимать, что каждая подгруппа элементов также раскрыта, и любой элемент(ы) может быть удален из группы. Следует понимать, что, в общем, там, где раскрытие или аспекты раскрытия рассматривается(ются) как содержащее конкретные элементы, признаки и т.д., то определенные варианты осуществления раскрытия или аспектов раскрытия содержит или содержит, по сути, такие элементы, признаки и т.д. Для целей простоты такие варианты осуществления не были специфически представлены in haec verba здесь. Следует отметить, что подразумевается, что термин “содержащий” является открытым и позволяет включение дополнительных элементов или стадий.
Когда дают диапазоны, то границы являются включенными. Более того, следует понимать, что если только не указано обратное или обратное неочевидно из контекста и понятно специалисту в данной области техники, значения, которые выражены как диапазоны, могут принимать любое специфическое значение или поддиапазон в пределах установленного диапазона в различных вариантах осуществления раскрытия, до десятых значений нижней границы диапазона, если только контекстом ясно не предусмотрено обратное.
Кроме того, следует понимать, что любой конкретный вариант осуществления данного раскрытия, который попадает в известный уровень техники, может быть однозначно исключен из любого одного или более пунктов формулы изобретения. Как только такие варианты осуществления посчитаются известными специалисту в данной области техники, они могут быть исключены, даже если исключение не установлено здесь однозначно. Любой конкретный вариант осуществления композиций раскрытия (например, любая экзогликозидаза, любая гликозидная связь, любое условие реакции, любой способ очищения, любой способ анализа продукта и т.д.) может быть исключен из любого одного или более пунктов формулы изобретения, по любой причине, связанной или нет с существованием известного уровня техники.
Публикации, обсуждаемые выше и где-либо в тексте предложены исключительно для их раскрытия до даты подачи данной заявки. В данном документе нет того, что рассматривается как признание, что изобретатели не имеют право датировать задним числом такое раскрытие по предыдущему раскрытию.