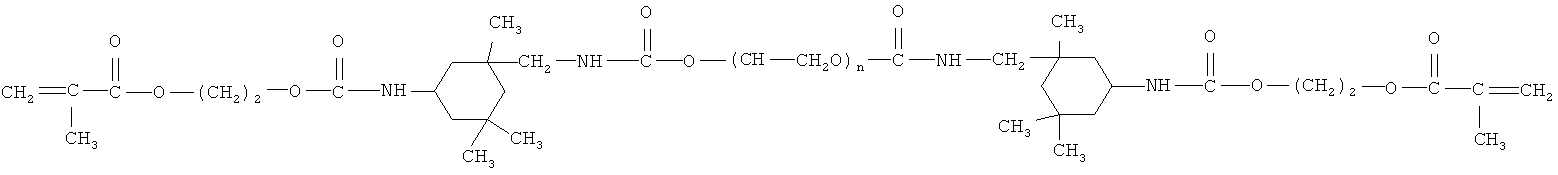Результат интеллектуальной деятельности: МАТРИЦА ДЛЯ РЕГЕНЕРАЦИИ МЯГКИХ ТКАНЕЙ
Вид РИД
Изобретение
Изобретение относится к медицине и может быть использовано в реконструктивной хирургии дефектов слизистой оболочки полости рта с целью восстановления мягких тканей, для послеоперационной защиты слизистой ткани, для защиты швов от внешних воздействий со стороны полости рта, иммобилизации трансплантационного и/или имплантационного материала, слизисто-надкостничных лоскутов в новом положении, а также в качестве материала для замещения дефектов покровных тканей и стимуляции их регенерации.
Применение хирургического этапа ставит перед хирургами сложную задачу восстановления дефектов, образующихся в ходе устранения первичного очага. Для закрытия послеоперационных ран в области полости рта (мягких тканей щеки, неба, нижней и/или верхней губы, угла рта, боковой стенки ротоглотки) известны материалы биологического (аутогенного, аллогенного, ксеногенного) происхождения в расчете на их биоинтеграцию. Для этих целей используют васкуляризированные слизистые лоскуты из щечных областей (М.Hatoko, М.Kuwahara, A.Tanaka, 2002); свободно перемещенные аутотрансплантаты слизистой оболочки (Necek, 1982; Hopkins, 1977; Wenstrom, 1996; L. Butler, 2003), кожи (M.B.Мухина, 1963; Ю.И.Вернадский, 1973 и др.). Каждая из этих методик имеет не только преимущества, но и существенные недостатки. У пациентов с рубцовыми деформациями слизистой оболочки полости рта при пластике аутотрансплантатом кожи и слизистой оболочки требуется проведение дополнительной операции в донорской области, что соответственно увеличивает объем хирургических вмешательств, а также приводит к повреждению здоровых тканей донорской зоны, а пересаженный лоскут, несмотря на сложную реабилитацию, может подвергаться полному или частичному некротизированию и практически в 90% случаев деформируется за счет усадки трансплантата. Внедрению аллогенных материалов (например, Dura Mater) препятствуют этические и технологические проблемы. До конца не решена проблема их антигенной совместимости (М.Bhola, D.Newell, 2003).
Имеются единичные сообщения о применении в полости рта так называемой искусственной кожи (силикон со слоем коллагена) (S.Omura et al., 1997), разработанной для лечения ожогов. Однако сложный процесс изготовления комбинированной мембраны определяет ее высокую стоимость. Кроме того, также возможна антигенная несовместимость некоторых типов коллагена с тканями реципиента. Возникает вопрос о необходимости комбинировать силикон с биологическим материалом для решения хирургических задач в полости рта.
Поиск искусственных материалов с необходимыми характеристиками увенчался наибольшим успехом при разработке методики «направленной регенерации тканей» (тефлоновые мембраны Gore Tex® и др.). Но данная технология связана с оптимизацией регенерации костной ткани и не влияет на мягкотканый компонент, сохранение и восстановление которого, несомненно, является одной из важных задач челюстно-лицевой хирургии для позитивного решения проблем в пластической хирургии полости рта. Кроме того, значительная стоимость не позволяет использовать данные мембраны для закрытия обширных раневых поверхностей в полости рта.
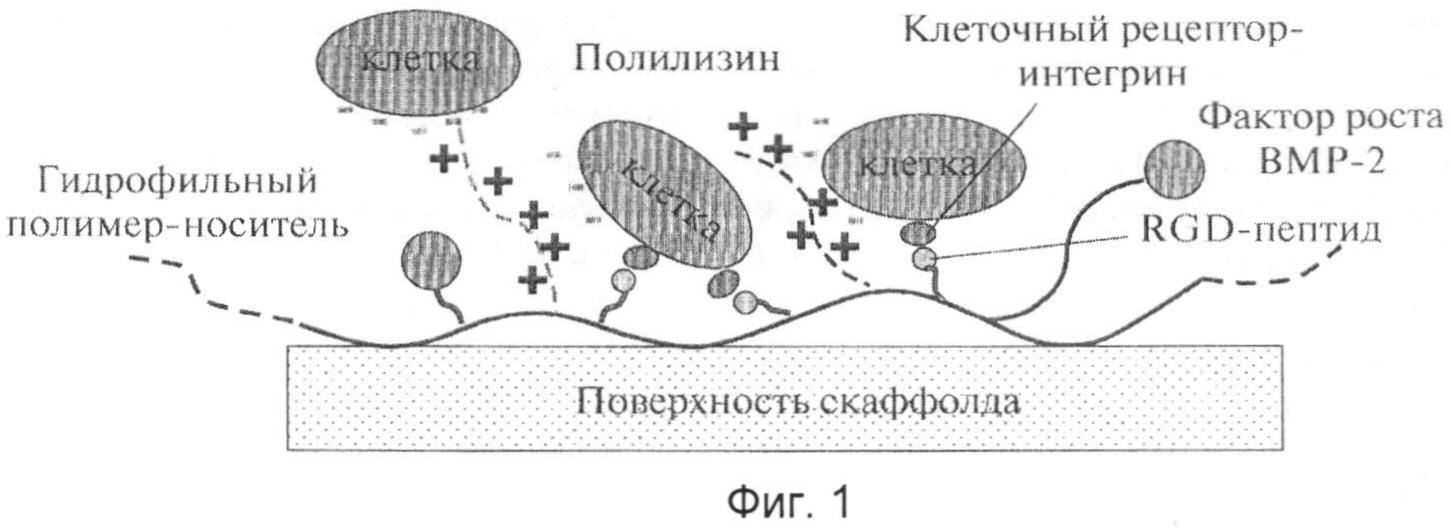
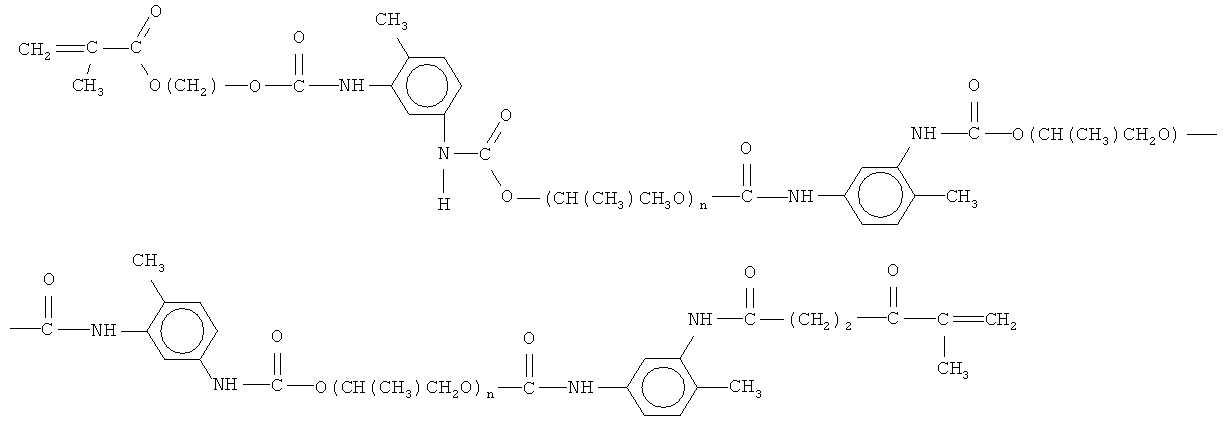
В последнее время появились сообщения о разработке «умных биологически функциональных полимерных структур, способных управлять поведением клеток тканей (Коржиков В.А., Влах Е.Г., Тенникова Т.Б. Полимеры в ортопедической хирургии и тканевой инженерии: от конструкционных материалов к «умной» биофункционализации поверхности // Высокомолек. соед. Серия A, 2012, Т. 54, №8, с.1203-1221). И хотя эти разработки касаются создания материалов для регенерации в основном костных тканей, они отражают общий, превалирующий в мире, подход к решению проблемы создания полимерных материалов/матриц для регенерации: модификация поверхности за счет введения, например, специфических пептидов - факторов роста клеток и перфораций для объемной интеграции тканей в матрицу (скаффолд). Принцип «умной» бифункционализации поверхности скаффолда изображен на фиг.1. Однако на сегодняшний день успехи в этом направлении достигнуты весьма скромные при очень больших затратах на синтез модификаторов поверхности (RGD-пептид) и изготовление самих изделий.
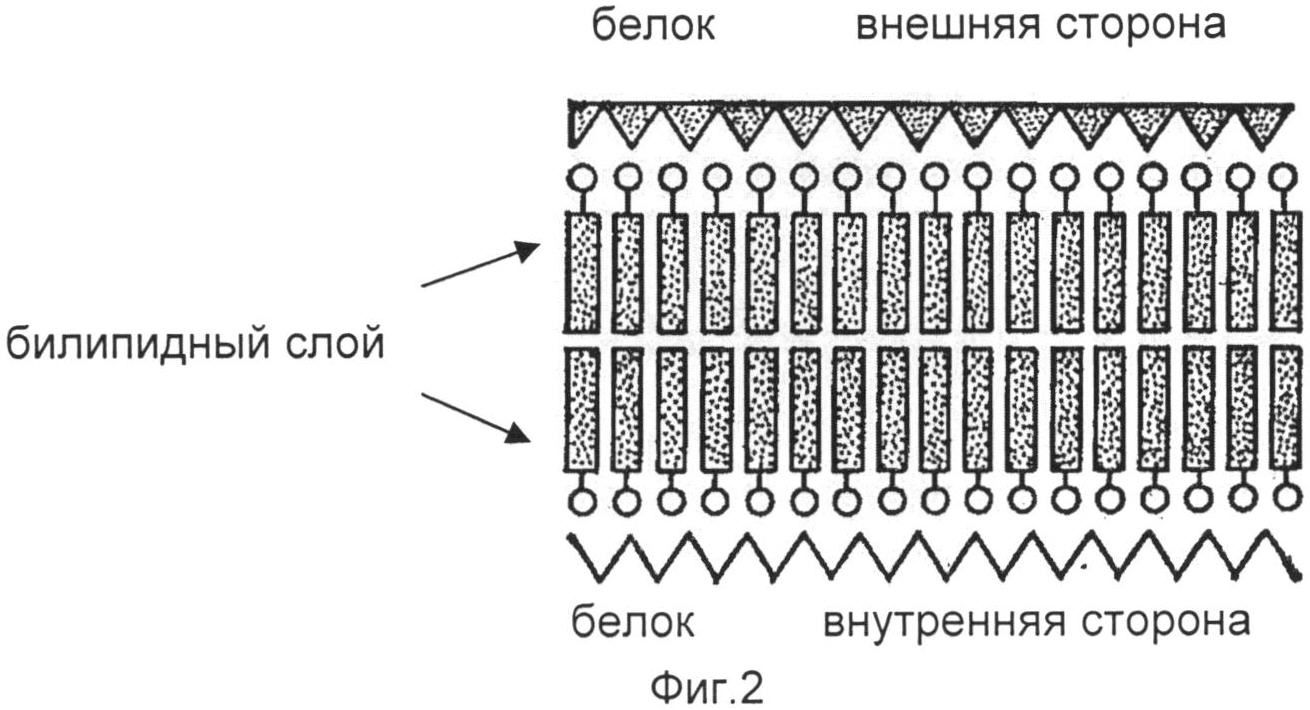
В мире создано огромное количество полимерных материалов, которые не являются токсичными и могут быть использованы в медицине. Тем не менее взаимодействие полимерных материалов с клетками и тканями протекает далеко не всегда предсказуемо и ограничивает или делает невозможным их клиническое применение. Создание полимерных материалов, способствующих улучшению заданных природой регенеративных функций организма человека должно базироваться на технологиях, обеспечивающих биологическую инертность полимерных материалов. Такие технологии описаны в патентах RU №2129846, RU №2198630, RU №2234417, USA 5,725,576, USA 5,833,890, 5,725,576, USA 6,201,036. Кроме того, необходимо, чтобы молекулярный состав и структура полимерной матрицы способствовали естественному функционированию клеточных мембран как периферийной части клеток, поэтому при создании матриц (скаффолдов) для регенерации тканей необходимо учитывать особенности строения мембран клеток. Основу мембраны клеток составляет билипидный слой, на внутренней и внешней сторонах которого адсорбированы молекулы белка, внутри мембраны находятся также белки, но в виде глобул. Модель биологической мембраны изображена на фиг.2.
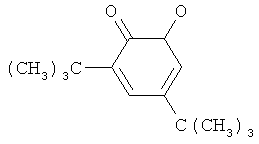
Липиды являются сложными эфирами жирных кислот. Липиды, образованные в результате реакции, например, с аденозином (фрагментом, используемым при синтезе АТФ, АДФ и АМФ) обычно называют фосфолипидами. Структурная формула одного из таких фосфолипидов может выглядеть, например, так
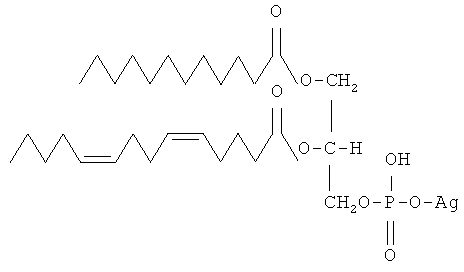
где Ag - фрагмент аденозина, но может быть и другим фрагментом от какой-то иной «биологической» молекулы. Самое главное свойство фосфолипидов в том, что их молекулы содержат две части - гидрофильную часть (наличие групп OH, COOH, NH2 и других), совместимую с полярными растворителями, например, водой, и гидрофобную, состоящую из углеводородных цепей (фрагментов жирных кислот), совместимую с неполярными растворителями. Структура фосфолипидов приспособлена для создания поверхностей раздела, позволяющих отделить цитоплазму клетки от внешней среды. Гидрофобные части молекул фосфолипидов направлены друг к другу и составляют сердцевину мембраны. Взаимодействие между гидрофобными частями фосфолипидов слабое, гораздо меньше, чем между гидрофильными частями и водой. Такое устройство мембран характерно и энергетически выгодно только для тех случаев, когда фосфолипиды находятся в водной среде. В неполярных средах ориентация фосфолипидов меняется - гидрофильные части молекул фосфолипидов находятся в центре мембраны, направленные друг к другу, а гидрофобные - на периферии мембраны. В результате травмы или хирургического вмешательства, когда нарушается целостность мембран клеток необходимо создать условия, при которых гидрофобные концы липидов будут иметь возможность адсорбироваться на подобной гидрофобной поверхности. Поверхность матрицы должна быть такова, что на ее поверхность выходят гидрофобные концы жирных предельных углеводородов, имитируя мембрану, разрезанную пополам, вдоль плоскости стыка гидрофобных концов фосфолипидов. Гидрофильные концы липидов в свою очередь абсорбируют на себя белки, содержащиеся в окружающей среде. Таким образом, воспроизводится поверхность, подобная поверхности клеточной мембраны. Это исключает воспалительные процессы и предотвращает образование рубцовой ткани, поскольку поверхность матрицы неотличима от поверхности окружающих клеток.
Однако матрица, например, по патенту 2436596, который принимаем за прототип, изготовлена из материала, непригодного для подшивания (прокалывания иглой), поскольку в месте прокола возникает дефектная область, которая разрастается при натяжении шва и приводит к разрыву матрицы, то есть материал матрицы по прототипу имеет высокую текучесть и недостаточную прочность. Как правило, из-за этого прототип используют только в случае бесшовной хирургии. Для сохранения целостности матрицы в соответствии с назначением необходимо повысить ее прочность и изменить конструкцию, чтобы избежать ее разрушения при нагрузке (подшивании).
Недостатками матрицы по прототипу является также то, что вероятность выхода гидрофобных концов полимера на поверхность матрицы снижена из-за отсутствия в составе полимера гидрофильного мономера. Поскольку гидрофобные молекулы не поляризованы и неспособны образовывать водородные связи, гидрофильный мономер отталкивает такие молекулы, предпочитая образовывать связи внутри себя. В количественном отношении содержание гидрофильного мономера должно быть значительно ниже гидрофобного общей формулы CH2=C(CH3)-C(O)-O-(CH2)k-CH3, где к от 7 до 17, чтобы не произошло излишней гидрофилизации матрицы.
Таким образом, существуют нерешенные вопросы хирургического лечения для оптимизации заживления послеоперационных ран мягких тканей. Для их решения необходима разработка пленочных материалов с более универсальными возможностями и прогнозируемым результатом с улучшенными функциональными характеристиками защитной пленки.
Задачей предлагаемого изобретения является создание матрицы, которая обладает адсорбирующей способностью, способствует регенерации тканей, изолирует операционную рану со стороны полости рта, имеет эластичность и формоустойчивость при длительной экспозиции (более 10 суток) на раневой поверхности при возможности визуального контроля состояния раны и возможность удаления из постоперационной области без разрушения регенерированных тканей, из биосовместимого, нерассасывающегося пространственно-сшитого гидрофобного полимера с гидрофильными группами, полученного путем экспонирования светом с длиной волны 320-380 нм фотополимеризующейся композиции, содержащей олигомеры метакрилового ряда, выполненной в виде эластичной прозрачной для света двухслойной пленки, сплошной слой которой, имеющий шероховатость от 10 до 20 нм, выполнен из фотополимеризующейся композиции, дополнительно содержащей бензилметакрилат строения CH2=C(CH3)-C(O)OPh и метакриловую кислоту строения CH2=C(CH3)-C(O)OH, при этом компоненты взяты в следующем соотношении, масс.%:
- олигоуретанметакрилат строения:
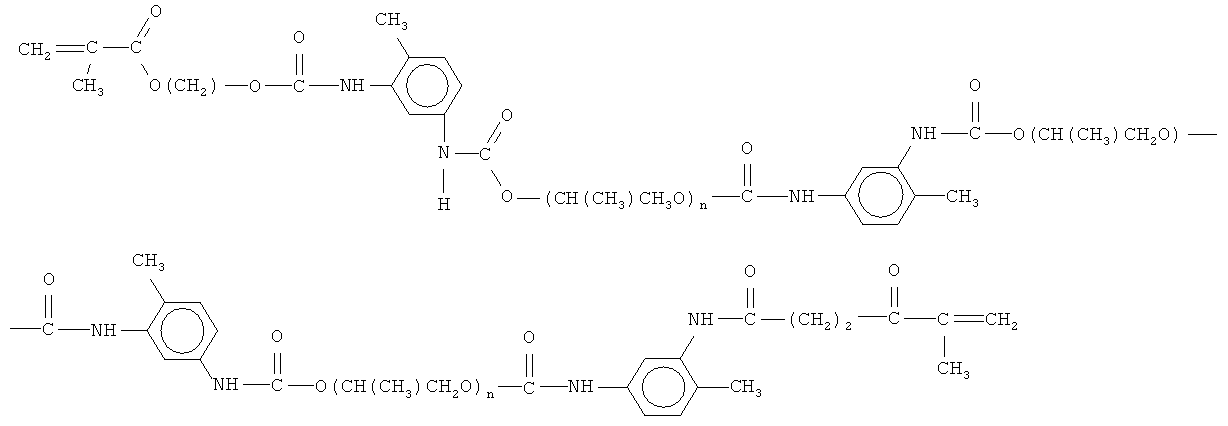
где n порядка 35, - 15-57;
- мономер метакрилового ряда с длиной цепочки от 8 до 18 атомов углерода строения:
CH3-(CH2)k-O-C(O)-C(CH3)=CH2, где k от 7 до 17, - 39-81;
- бензилметакрилат строения:
CH2=C(CH3)-C(O)OPh - 1,0-10,0;
- метакриловая кислота строения:
CH2=C(CH3)-C(O)OH - 2,0-5,0;
- 2,2-диметокси-2-фенилацетофенон строения:
Ph-C(O)-C(CH3)2-Ph - 0,4-3,0;
- 2,4-дитретбутилортохинон строения:
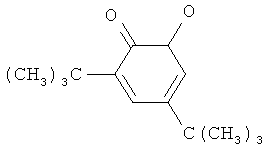 - 0,01-0,06,
- 0,01-0,06,
а другой слой в виде рельефного рисунка, занимающего от 10 до 90% площади матрицы, выполнен высотой, равной половине толщины матрицы, с образующим элементом в форме кольца с внутренним диаметром от 0,7 до 2,0 мм и шириной от 0,2 мм до 1 мм и не имеющим общей стороны с соседствующими элементами, расстояние между которыми от 0,1 до 10 мм, получен путем экспонирования светом с длиной волны 320-380 нм фотополимеризующейся композиции на основе олигомеров метакрилового ряда, содержащей, масс.%:
- олигоуретанакрилат строения:
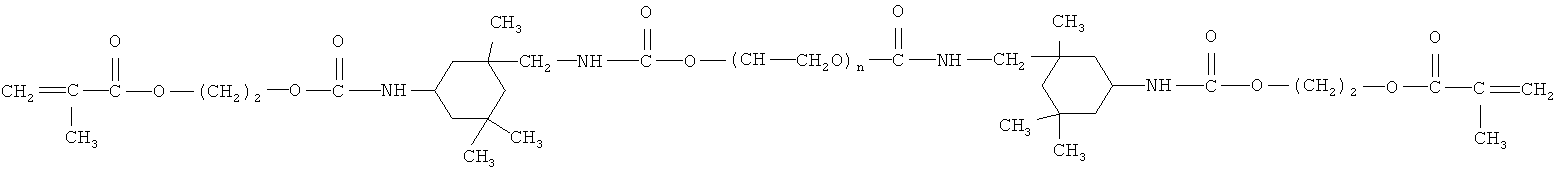
где n порядка 7, - 17-60;
- 2-феноксиметакрилат строения:
CH2=C(CH3)-C(O)-O-(CH2)2-O-Ph - 20-40;
- олигокарбонатметакрилат строения:
CH2=C(CH3)-CO-O-(CH2)2O-[O-CO-O(CH2)2O-CO-O(CH2)2]-O-CO-C(CH3)=CH2 - 10-30;
- метакриловая кислота строения:
CH2=C(CH3)-C(O)OH - 5-10;
- 2,2-диметокси-2-фенилацетофенон строения:
Ph-C(O)-C(CH3)2-Ph - 0,4-3,0;
- 2,4-дитретбутилортохинон строения:
 - 0,01-0,06.
- 0,01-0,06.
Рельефный рисунок матрицы также может быть выполнен из фотополимеризующейся композиции на основе олигомеров метакрилового ряда, дополнительно содержащей пигмент Ультрамарин 463(Р,В.29) - 0,02-0,06 масс.%. Матрица может быть использована целиком или смоделирована по размеру раневой поверхности, при этом обеспечивается одинаковый технический результат.
Указанный технический результат достигается тем, что матрица для регенерации мягких тканей обладает адсорбирующей способностью, способствует регенерации тканей, изолирует операционную рану со стороны полости рта, имеет эластичность и формоустойчивость при длительной экспозиции (более 10 суток) на раневой поверхности при возможности визуального контроля состояния раны и возможность удаления из постоперационной области без разрушения регенерированных тканей, выполнена из биосовместимого, нерассасывающегося пространственно-сшитого гидрофобного полимера с гидрофильными группами, полученного путем экспонирования светом с длиной волны 320-380 нм фотополимеризующейся композиции, содержащей олигомеры метакрилового ряда, в виде эластичной прозрачной для света двухслойной пленки, сплошной слой которой, имеющий шероховатость от 10 до 20 нм, выполнен из фотополимеризующейся композиции, дополнительно содержащей бензилметакрилат строения CH2=C(CH3)-C(O)OPh и метакриловую кислоту строения CH2=C(CH3)-C(O)OH, при этом компоненты взяты в следующем соотношении, мас.%:
- олигоуретанметакрилат строения:

где n порядка 35, - 15-57;
- мономер метакрилового ряда с длиной цепочки от 8 до 18 атомов углерода строения:
CH3-(CH2)k-O-C(O)-C(CH3)=CH2, где k от 7 до 17, - 39-81;
- бензилметакрилат строения:
CH2=C(CH3)-C(O)OPh - 1,0-10,0;
- метакриловая кислота строения:
CH2=C(CH3)-C(O)OH - 2,0-5,0;
- 2,2-диметокси-2-фенилацетофенон строения:
Ph-C(O)-C(CH3)2-Ph - 0,4-3,0;
- 2,4-дитретбутилортохинон строения:
 - 0,01-0,06,
- 0,01-0,06,
а другой слой в виде рельефного рисунка, занимающего от 10 до 90% площади матрицы, выполнен высотой, равной половине толщины матрицы, с образующим элементом в форме кольца с внутренним диаметром от 0,7 до 2,0 мм и шириной от 0,2 мм до 1 мм и не имеющим общей стороны с соседствующими элементами, расстояние между которыми от 0,1 до 10 мм, получен путем экспонирования светом с длиной волны 320-380 нм фотополимеризующейся композиции на основе олигомеров метакрилового ряда, содержащей, масс.%:
- олигоуретанакрилат строения:
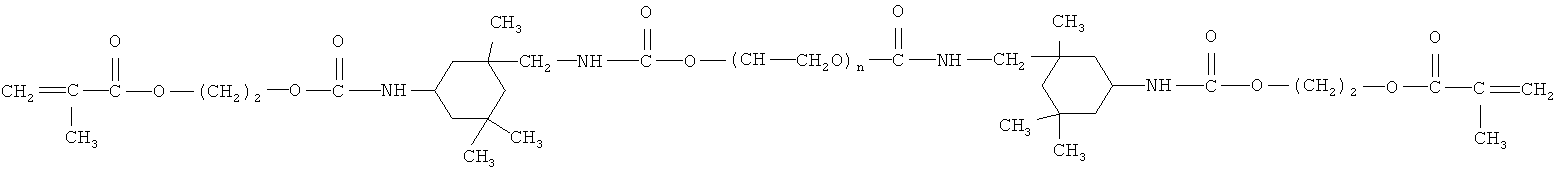
где n порядка 7, - 17-60;
- 2-феноксиметакрилат строения:
CH2=C(CH3)-C(O)-O-(CH2)2-O-Ph - 20-40;
- олигокарбонатметакрилат строения:
CH2=C(CH3)-CO-O-(CH2)2O-[O-CO-O(CH2)2O-CO-O(CH2)2]-O-CO-C(CH3)=CH2 - 10-30;
- метакриловая кислота строения:
CH2=C(CH3)-C(O)OH - 5-10;
- 2,2-диметокси-2-фенилацетофенон строения:
Ph-C(O)-C(CH3)2-Ph - 0,4-3,0;
- 2,4-дитретбутилортохинон строения:
 - 0,01-0,06.
- 0,01-0,06.
Рельефный рисунок матрицы также может быть выполнен из фотополимеризующейся композиции на основе олигомеров метакрилового ряда, дополнительно содержащей пигмент Ультрамарин 463(Р.В.29) - 0,02-0,06 масс.%. Матрица может быть использована целиком или смоделирована по размеру раневой поверхности, при этом обеспечивается одинаковый технический результат.
Матрица выполнена из пространственно-сшитого полимера, полученного путем фотополимеризации светочувствительных композиций, состоящих из олигомеров метакрилового ряда. Процесс формирования матрицы исключает какое-либо механическое воздействие на имплантат, которое провоцирует образование свободных радикалов, что впоследствии приводит к деструкции полимера и нежелательным токсическим реакциям. Используемые в изобретении светочувствительные композиции для формирования двухслойной матрицы с рельефным рисунком отличаются в количественном и качественном соотношении олигомерами и мономерами метакрилового ряда; в качестве фотоинициатора используется 2,2-диметокси-2-фенилацетофенон, в качестве ингибитора используется 2,4-дитретбутилортохинон. Благодаря комбинированному использованию материалов матрица обладает достаточной эластичностью для того, чтобы она могла принимать заданную форму (например, форму части ротовой полости) без образования каких-либо складок и прочностью при фиксации подшиванием для надежного удерживания.
Материал сплошного слоя матрицы, прилегающий к раневой поверхности, имеет на поверхности слой из предельных углеводородов, имитируя мембрану, разрезанную пополам, вдоль плоскости стыка гидрофобных концов фосфолипидов. Гидрофильные концы липидов в свою очередь абсорбируют на себя белки, содержащиеся в окружающей среде. Таким образом, воспроизводится поверхность, подобная поверхности клеточной мембраны. Это исключает воспалительные процессы и предотвращает образование рубцовой ткани, способствует регенерации тканей при непосредственном наложении матрицы на раневые поверхности, поскольку поверхность матрицы неотличима от поверхности окружающих клеток. Эпителизация раневой поверхности происходит без деформаций общего объема тканей и без изменения особенностей их строения. Матрица является биологически инертной, не вызывает воспалительных реакций и капиллярных разрастаний в смежных тканях или реакции отторжения. Введение в состав светочувствительной композиции бензилметакрилата позволяет увеличить прочность сплошного слоя матрицы и адгезию к нему рельефного рисунка, выполненного из светочувствительной композиции по изобретению. Введение в состав светочувствительной композиции для изготовления сплошного слоя метакриловой кислоты повышает гидрофильность полимера внутри матрицы, и происходит как бы выталкивание всех гидрофобных концов молекул на поверхность матрицы, тем самым повышая гидрофобные свойства только ее поверхности.
Матрица обладает прозрачностью для света, позволяющей осуществить визуальный контроль над процессом заживления раневой поверхности. Пространственно-сшитая структура полимера обеспечивает «память формы» матрицы, при этом формоустойчивость сохраняется при длительной экспозиции (более 10 суток) на раневой поверхности.
Матрица представляет собой двухслойную пленку, у которой сплошной слой имеет шероховатость поверхности от 10 до 20 нм, что обеспечивает плотное прилегание матрицы к раневой поверхности. Другой слой, сформированный в виде рельефного рисунка, обеспечивает прочность при подшивании и натяжении швов. При этом слои изготовлены из разных по составу полимеров, но подобраны таким образом, что в ходе дальнейшей эксплуатации матрицы усадка материалов будет происходить синхронно, что повышает надежность их соединения. Светочувствительная композиция для изготовления рельефного рисунка содержит олигокарбонатметакрилат, который придает ему необходимую прочность и устойчивость от прорезания шовным материалом. Полимерный материал рельефного рисунка обладает устойчивостью к различного рода отложениям, на его поверхности не происходит абсорбции белков и каких-либо веществ содержащихся, например, в слюне.
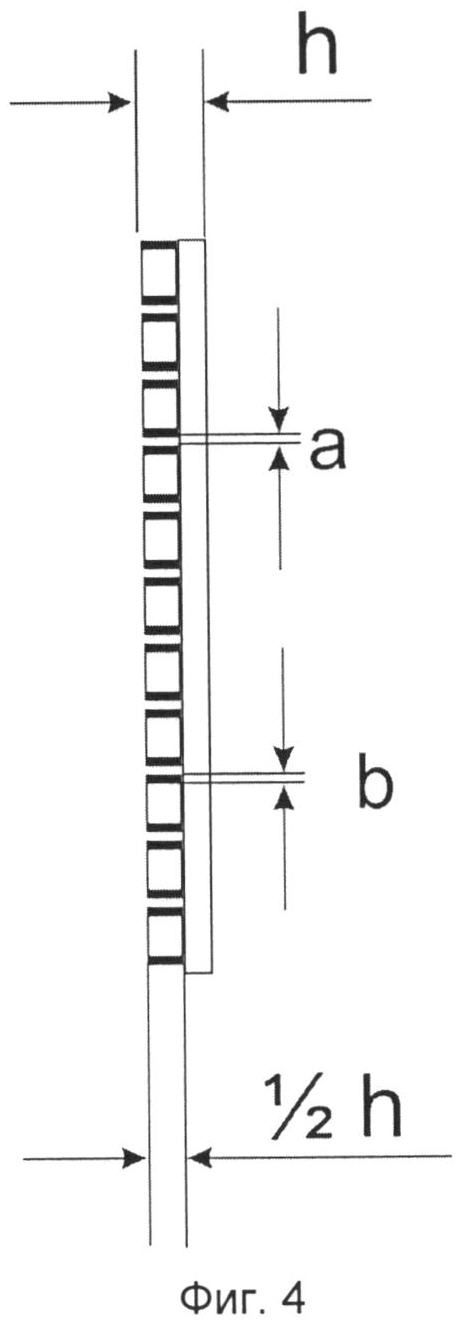
Образующий элемент рельефного рисунка матрицы в форме кольца с внутренним диаметром от 0,7 до 2,0 мм мультиплицирован на 10-90% площади матрицы таким образом, что каждая сторона образующего элемента не является общей стороной с соседствующим элементом, то есть элементы расположены на расстоянии друг от друга от 0,1 до 10 мм. Это позволяет моделировать матрицу по размеру раневой поверхности очень легко при помощи ножниц. Высота рельефного рисунка составляет половину толщины матрицы. Ширина выступающей части рельефного рисунка от 0,2 мм до 1 мм. Самой важной функцией образованного рельефного рисунка является то, что в ходе операции прокалывание матрицы производят только внутри образующего рельефный рисунок элемента, то есть размер иглы с нитью не превышает размер элемента рельефного рисунка, тем самым обеспечивается локализация прокола и целостность имплантата даже при натяжении шва. Размер элемента рельефного рисунка подобран в соответствии с размером шовного материала, используемого в ходе операций на слизистых оболочках:
|
Элементы рельефного рисунка расположены таким образом, что и при использовании матрицы целиком, и после ее моделирования они находятся по периферии, что удобно для подшивания матрицы и обеспечивает ее надежную фиксацию, исключает ее разрыв и смещение даже при длительной экспозиции (более 10 суток) на раневой поверхности.
Выполненная без перфораций матрица изолирует операционную рану со стороны полости рта и дает хирургу возможность удаления ее из постоперационной области без разрушения регенерированных тканей.
Элементы рельефного рисунка расположены так, что матрица является достаточно прозрачной для контроля эффективности заживления раневой поверхности.
Матрица имеет форму круга диаметром от 15 до 40 мм и может быть использована целиком или смоделирована по размеру раневой поверхности (хирург может ножницами разрезать матрицу между элементами рельефного рисунка), при этом обеспечивается одинаковый технический результат
Изобретение матрица для регенерации мягких тканей поясняется следующим графическим материалом.
Фиг.1 - принцип «умной» бифункционализации поверхности скаффолда,
Фиг.2 - модель биологической мембраны,
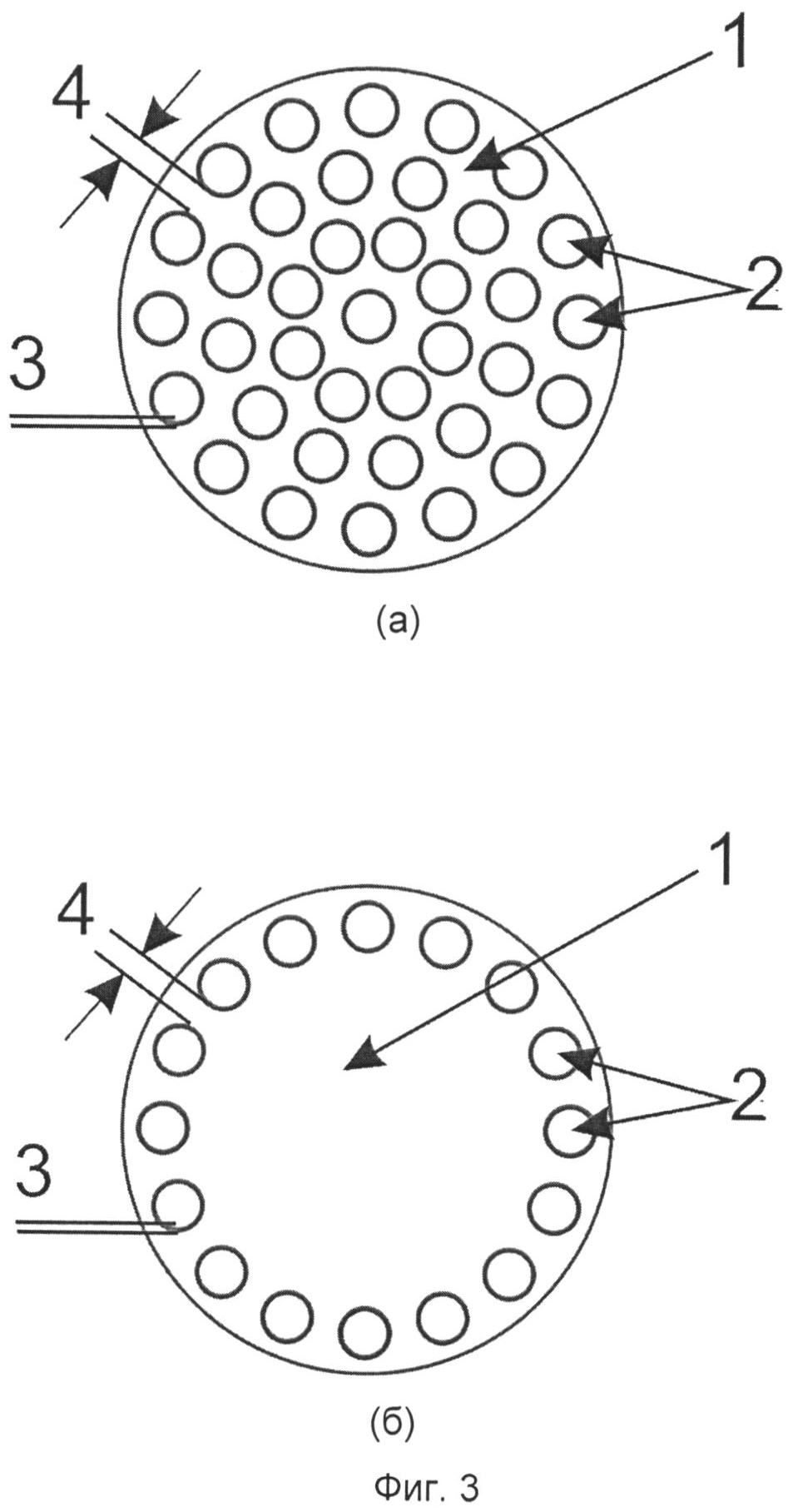
Фиг.3 - матрица для регенерации мягких тканей, представляющая собой двухслойную пленку диаметром от 15 до 40 мм:
(1) - сплошной слой с шероховатостью поверхности от 10 до 20 нм,
(2) - рельефный рисунок, образующие элементы которого имеют форму кольца с внутренним диаметром от 0,7 до 2,0 мм, мультиплицированные на 10-90% площади матрицы (а или б),
(3) - ширина выступающей части рельефного рисунка от 0,2 мм до 1 мм,
(4) - расстояние между образующими элементами рельефного рисунка от 0.1 до 10 мм;
Фиг.4 - профиль матрицы для регенерации мягких тканей общей толщиной (h) и высотой рельефного рисунка, равной половине толщины (1/2h) матрицы.
Данное изобретение поясняется следующими примерами:
Пример 1:
Готовят фотополимеризующуюся композицию №1. В реакционную колбу, снабженную мешалкой, последовательно вводят компоненты в следующем соотношении, % масс.:
|
Полученную смесь перемешивают при комнатной температуре в течение 40 мин до полного растворения. После перемешивания композицию №1 отфильтровывают и откачивают с помощью вакуумного насоса при давлении 0,5-1 мм рт.ст. до полного прекращения газовыделения.
Готовят фотополимеризующуюся композицию №2. В реакционную колбу, снабженную мешалкой, последовательно вводят компоненты в следующем соотношении, % масс.:
|
Полученную смесь перемешивают при комнатной температуре в течение 40 мин до полного растворения. После перемешивания композицию №2 отфильтровывают и откачивают с помощью вакуумного насоса при давлении 0,5-1 мм рт.ст. до полного прекращения газовыделения.
Сначала изготавливают сплошной слой матрицы для регенерации мягких тканей с шероховатостью поверхности от 10 до 20 нм следующим образом. На подложку с шероховатостью поверхности от 10 до 20 нм, с установленной по краю прокладкой из полимерного материала (тефлона, силикона, лавсана), формирующей половину толщины матрицы (hпрокладки=½ hматрицы), наливают композицию №1 по изобретению. Затем накрывают фотошаблоном, прозрачный рисунок на непрозрачном для УФ-света фоне (прозрачные участки соответствуют форме матрицы и имеют размер от 15 до 40 мм) и плотно сжимают. Полученную конструкцию облучают УФ-светом с длиной волны 320-380 нм со стороны фотошаблона в течение времени, оптимального для воспроизведения заданной геометрии. После облучения фотошаблон и подложку разъединяют. Сформированный сплошной слой матрицы остается на подложке. Затем меняют прокладку на другую, имеющую толщину, равную общей толщине матрицы (hпрокладки=hматрицы) из полимерного материала (тефлона, силикона, лавсана), и располагают ее вокруг сформированного сплошного слоя матрицы так, чтобы между ними оставался зазор 1-5 мм, заполняют ограниченный прокладкой объем поверх сформированного сплошного слоя светочувствительной композицией №2 и накрывают вторым фотошаблоном, содержащим прозрачный рисунок на непрозрачном для УФ-света фоне (прозрачные участки соответствуют форме рельефного рисунка, образующие элементы которого имеют форму кольца с внутренним диаметром от 0,7 до 2,0 мм, мультиплицированные на 10-90% площади матрицы, шириной от 0,2 мм до 1 мм и расстоянием между ними от 0,1 до 10 мм), плотно сжимают. Полученную конструкцию облучают УФ-светом с длиной волны 320-380 нм со стороны фотошаблона в течение времени, оптимального для воспроизведения заданной геометрии. После облучения фотошаблон и подложку разъединяют. Полученную матрицу промывают в подходящем растворителе от остатков неотвержденной композиции и сушат до полного удаления растворителя. Благодаря используемой фотохимической технологии по данным ЭПР, свободные радикалы отсутствуют, материал устойчив в биологически активных средах.
Пример 2:
Композицию №1 готовят, как в примере 1, при следующем соотношении компонентов:
|
Композицию №2 готовят, как в примере 1, при следующем соотношении компонентов:
|
Изготавливают матрицу для регенерации мягких тканей, как в примере 1. Характеристики приведены в табл.1.
Пример 3:
Композицию №1 готовят, как в примере 1, при следующем соотношении компонентов:
|
Композицию №2 готовят, как в примере 1, при следующем соотношении компонентов:
|
Изготавливают матрицу для регенерации мягких тканей, как в примере 1. Характеристики приведены в табл.1.
Пример 4:
Композицию №1 готовят, как в примере 1, при следующем соотношении компонентов:
|
Композицию №2 готовят, как в примере 1, при следующем соотношении компонентов:
|
Изготавливают матрицу для регенерации мягких тканей, как в примере 1. Характеристики приведены в табл.1.
Пример 5:
Композицию №1 готовят как в примере 1, при следующем соотношении компонентов:
|
Композицию №2 готовят, как в примере 1, при следующем соотношении компонентов:
|
Изготавливают матрицу для регенерации мягких тканей как в примере 1. Характеристики приведены в табл.1.
|
Из таблицы 1 следует, что в примерах 1, 2, 3, в которых ингредиенты взяты в количестве, соответствующем формуле изобретения, матрица для регенерации мягких тканей обладает достаточной прочностью, хорошей адсорбирующей поверхностью, конгруэнтно укрывает рану без образования полостей и складок, эпителизация проходит без деформаций общего объема тканей и особенностей их строения. Отклонения от способа, соответствующего формуле изобретения (примеры 4, 5), приводят к получению матрицы с низкими указанными характеристиками.
Внедрение заявленной матрицы для регенерации мягких тканей представляет большой интерес для восстановительно-реконструктивной хирургии, облегчает и сокращает период реабилитации пациентов.
Клинические примеры использования матрицы для регенерации мягких тканей
Пример 1: Больная П., 64 лет, оперирована в отделении челюстно-лицевой хирургии ГБУЗ НОКБ им Н.А. Семашко по поводу новообразования твердого неба слева (история болезни 10228). При поступлении на слизистой оболочке твердого неба слева на уровне 2.4-2.5 зубов ближе к срединному шву определяется округлое опухолевидное новообразование плотной консистенции 1,5 см в диаметре. Пальпация умеренно болезненная. Слизистая над ним не изменена. После предоперационной подготовки больная оперирована с использованием матрицы по предлагаемому изобретению. Произведен разрез в пределах здоровых тканей на слизистой оболочке твердого неба слева. Новообразование удалено целым препаратом. Гемостаз. Образовавшийся дефект размером 2 см в диаметре закрыт матрицей для регенерации тканей, которая фиксирована швами викрил 4-0. На швы - повязка с йодоформом. Послеоперационный период протекал без осложнений, рана зажила под матрицей для регенерации тканей, эпителизировалась без деформаций общего объема тканей и особенностей строения слизистой в данном разделе полости рта. Больная выписана в удовлетворительном состоянии. При осмотре через 1, 3, 6 месяцев осложнений не выявлено.
Пример 2: Больная П., 74 лет, оперирована в отделении челюстно-лицевой хирургии по поводу плоскоклеточного Cr слизистой оболочки правой щеки (история болезни №38308). При поступлении на слизистой оболочке правой щечной области имеется изъязвленное новообразование, 3,5 см в диаметре, распространяющееся от переходной складки верхней челюсти до переходной складки нижней челюсти, поверхность мелкозернистая, дно и края плотные, болезненные. После предоперационной подготовки, больная оперирована с использованием матрицы по предлагаемому изобретению. Произведено широкое иссечение опухоли. Новообразование удалено целым препаратом. Гемостаз. Образовавшийся дефект размером 5 см в диаметре закрыт матрицей для регенерации тканей, которая фиксирована швами викрил 4-0. На швы - повязка с йодоформом. Послеоперационный период протекал без осложнений, рана зажила под матрицей для регенерации тканей, эпителизировалась, швы сняты на 10-е сутки. Больная выписана в удовлетворительном состоянии. При осмотре через 1, 3, 6 месяцев деформаций слизистой оболочки полости рта в постоперационной области не выявлено.
Практическое использование в лечебной практике заявляемой матрицы для регенерации мягких тканей показало, что укрытие раны происходит конгруэнтно ее поверхности без полых участков, наложение указанной матрицы предоставляет возможность длительного (до 10 дней) бесконтактного визуального контроля за течением раневого процесса до полного заживления, а самое главное, препятствует рубцеванию и деформированию постоперационной области, чего не удается добиться при использовании других методов.