Результат интеллектуальной деятельности: АНТИБАКТЕРИАЛЬНЫЕ СОЕДИНЕНИЯ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение имеет отношение к соединениям, которые находят применение при лечении бактериальных болезней и инфекций, к композициям, содержащим такие соединения, и к способам лечения бактериальных болезней и инфекций с помощью данных соединений. В частности, соединения настоящего изобретения применяются для лечения инфекции и болезней, вызванных Clostridium difficile.
Уровень техники
(а) Антибактериальные лекарственные средства и Clostridium difficile
Развитие антибактериальных лекарственных средств является одним из самых важных достижений медицины XX века. Ранее неизлечимые болезни теперь можно легко контролировать, и стало понятно, что многие болезни могут быть ликвидированы с помощью этих новых необычайно эффективных лекарственных средств. Несмотря на эти значительные достижения в лечении, инфекционные болезни являются третьей основной причиной смертности в США (Clin. Infect. Dis., 2004, 38, 1279-1286) и остаются одной из самых важных проблем здравоохранения в мире. В целом резко возрастают уровни резистентности (устойчивости) основных бактерий, причем особенно важное значение имеет возрастающее число и тяжесть внутрибольничных инфекций (Infectious Disease Society of America, 2004, Bad Bugs, No Drugs). Появление патогенов с множественной лекарственной устойчивостью делает многие современные лекарственные средства передней линии полностью неэффективными для контролирования многих заболеваний.
Отдельной представляющей интерес субпопуляцией бактериальных болезнетворных организмов является субпопуляция, которая относится к спорообразующим бактериям. Бактериальные споры (эндоспоры) представляют собой находящиеся в состоянии покоя нерепродуктивные структуры, образуемые бактериями в ответ на стресс под влиянием факторов среды. Как только условия окружающей среды становятся благоприятными, споры прорастают, и бактерия размножается. В случае болезнетворных бактерий прорастание в человеке-хозяине может привести к болезни.
Бактериальные споры являются чрезвычайно устойчивыми по отношению ко многим факторам и условиям окружающей среды, включая радиацию, высушивание, температуру, голод и химические вещества. Эта природная устойчивость к химическим веществам дает возможность спорам сохраняться в течение многих месяцев в ключевой окружающей обстановке, такой как госпитали, другие центры здравоохранения и комбинаты питания, где стандартные моющие средства, бактерицидные средства и процессы стерилизации не уничтожают бактерии. В случае производства пищевых продуктов присутствие спор может иметь существенные последствия от простой порчи продуктов питания вплоть до распространения пищевых патогенов и пищевого отравления. Совсем недавно внимание было привлечено к рискам, связанным со спорами Bacillus anthracis, возбудителя сибирской язвы. Эти споры легко можно получить в виде сухого порошка, который может быть рассеян многочисленными способами и может использоваться как средство биотерроризма. Сибирская язва считается отдельным средством биотерроризма, вызывающим наибольшее беспокойство (CDC Emerg. Infect. Dis., 2004, 5 (4), 552-555). Можно напомнить о «почтовых атаках» сибирской язвой в Соединенных Штатах Америки в 2001 г. При этом имели место 22 случая хронической инфекции, которые привели к 5 случаям со смертельным исходом, причем стоимость наведения порядка и дезинфекции после атак оценили в 1 миллиард долларов.
Важными спорообразующими бактериями являются грамположительные эндоспорообразующие бактерии родов Bacillus и Clostridium. Примеры рода Bacillus, представляющие интерес для здоровья людей, включают, но не ограничиваются этим, В. anthracis и В. cereus. Bacillus anthracis имеет особо важное значение как возбудитель сибирской язвы. Заражение сибирской язвой может происходить при проглатывании, вдыхании или кожном контакте со спорами Bacillus anthracis, что приводит к трем разным клиническим формам. Кожная инфекция составляет около 95% всех случаев инфекции и в большинстве случаев хорошо контролируется с помощью подходящих антибиотиков. Около 20% нелеченых случаев кожной сибирской язвы будет приводить к смертельному исходу. Кишечная инфекция характеризуется острым воспалением кишечного тракта, которое приводит к тошноте, потере аппетита, рвоте, лихорадке, боли в животе, рвоте с кровью и тяжелой диарее. Кишечная форма сибирской язвы приводит к смерти в 25-60% случаев. Самой тяжелой формой болезни является легочная сибирская язва, которая часто является смертельной даже при интенсивном и своевременном введении антибиотиков. Возможность легко распространить споры сибирской язвы через воздух и в пределах обширного пространства, чтобы вызвать легочную сибирскую язву, делает сибирскую язву первостепенным по значению средством биотерроризма.
Представители рода Clostridium являются грамположительными, спорообразующими, облигатными анаэробами. Примеры видов, которые вызывают болезни человека, включают, но не ограничиваются этим, С. perfringens, С. tetani, С. botulinium, C. sordellii и С. difficile. Клостридии связаны с разными болезнями человека, включая столбняк, газовую гангрену, ботулизм и псевдомембранозный колит, и могут являться фактором пищевого отравления.
Особенно важное значение имеют болезни, вызываемые Clostridium difficile. Clostridium difficile вызывает болезни, связанные с Clostridium difficile (CDAD), причем в течение последних 10 лет наблюдалось десятикратное увеличение числа случаев со сверхвирулентными и устойчивыми к лекарственным средствам штаммами, теперь ставшими эндемичными. Последние цифры Агентства по охране здоровья показывают, что наблюдалось 55681 случаев инфекции С. difficile у пациентов в возрасте 65 лет и старше в Англии в 2006 г. (увеличение 8% относительно предыдущего года). Наверное, вызывающими самое большое беспокойство являются случаи CDAD без лежащего в основе применения антибиотиков, о которых теперь стало известно.
Clostridium difficile является симбиотической кишечной бактерией, уровни которой сдерживаются нормальной кишечной флорой. Однако установлено, что данная бактерия является возбудителем С. Difficile-ассоциированной диареи (CDAD) и является основной причиной самого серьезного проявления CDAD, псевдомембранозного колита. CDAD связана с разнообразными симптомами от умеренной диареи до псевдомембранозного колита, токсического мегаколона и смерти. Важнейшим фактором риска для развития CDAD является применение антибиотиков, нарушающих нормальную кишечную бактериальную флору, что является причиной чрезмерно быстрого роста Clostridium difficile. Хотя клиндамицин является основным антибиотиком, связанным с CDAD, в настоящее время болезнь связана почти со всеми антибиотиками, включая представителей классов фторхинолонов, цефалоспоринов, макролидов, β-лактамов и многих других классов.
Прежде всего, CDAD имеет значение в больничных условиях и имеет очень важное значение среди пожилых пациентов, где процент смертности является особенно высоким. В последние годы значительно увеличилось количество зарегистрированных случаев CDAD: наблюдалось свыше 55000 случаев в Великобритании в 2006 г. (Health Protection Agency Surveillance of Healthcare Associated Infections Report 2007).
Уровень смертности в США вырос с 5,7 на миллион населения в 1999 г. до 23,7 на миллион в 2004 г. Уровни колонизации С. difficile в общей популяции составляют до 3%, хотя госпитализация значительно увеличивает уровень колонизации до 25%. Особенно важным является появление новых эндемичных штаммов. В частности, подходящим примером является сверхвирулентный штамм BI/NAP1 (также известный как риботип 027), который демонстрирует повышенную выработку токсинов А и В, а также выработку дополнительных новых бинарных токсинов.
Решающим фактором, связанным с клостридиями, является высокий процент бактериальных спор, присутствующих в условиях стационара. Недавно было показано, что многие из стандартных моющих средств, используемых в клиниках, являются неэффективными при уничтожении спор клостридий в окружающей обстановке, что приводит к неэффективной борьбе с болезнью (Infect Cont. Hosp. Epidemiol., 2007, 28, 920-5). Свойство повышенного спорообразования штаммов, как, например, BI/NAP1, значительно способствует такому результату.
Хотя первичными факторами риска, связанными с CDAD, являются лежащие в основе применение антибиотиков и возраст (CMAJ, 2008, 179 (8), 767-772; J. Antimicrob. Chem., 2003, 51, 1339-1350), существуют многочисленные другие связанные с этим факторы, включая например, применение ингибиторов протонной помпы, применение антагонистов Н2 рецепторов, применение диуретиков, длительность стационарного лечения, использование зондов для искусственного кормления, искусственная вентиляция легких и основные сопутствующие заболевания.
Кислотность желудочного сока является частью природного защитного механизма от проглоченных патогенных микроорганизмов, и любое снижение кислотности желудка может привести к колонизации стерильных в норме верхних отделов желудочно-кишечного тракта, что приводит к нарушению нормальной кишечной микрофлоры. По существу, применение средств, подавляющих кислотность желудочного сока, таких как ингибиторы протонной помпы (PPI) и антагонисты рецептора гистамина 2 - (H2RA), связано с повышенным риском колонизации С. difficile и последующим развитием CDAD. Применение PPI и H2RA раньше связывали с другими кишечными инфекциями, такими как диарея путешественников, сальмонеллез и холера. Dial et al. сообщили, что риск CDAD увеличивается при использовании средств, подавляющих кислотность желудочного сока, и среди населения в целом (JAMA, 2005, 294(23), 2989-2995) и в больничных условиях (CMAJ, 2004, 171(1). 33-38).
PPI включают, но не ограничиваются этим, омепразол (лосек, прилосек, зегерид), лансопразол (превацид, зотон, ингибитол), эзомепразол (нексиум), пантопразол (протоникс, сомак, пантолок, пантозол, зуркал, Pan) и рабепразол (рабецид, ацифекс, париет, рабелок).
H2RA включают, но не ограничиваются этим, циметидин (тагамет), ранитидин (зинетак, зантак), фамотидин, (пепцидин, пепцид), роксатидин (роксит) и низатидин (тазак, аксид).
Тройная терапия с PPI или H2RA вместе с комбинацией из двух антибиотиков является признанным способом лечения для уничтожения инфекций Helicobacter pylori (Aliment. Pharmacol. Ther., 2001, 15(5), 613-624; Helicobacter., 2005, 10(3), 157-171). Однако есть несколько сообщений о том, что этот режим тройной терапии может приводить к побочным эффектам (Am. J. Gastroenterol., 1998, 93(7), 1175-1176; J. Int. Med., 1998, 243(3), 251-253; Aliment. Pharm. Ther., 2001, 15(9), 1445-1452; Med. Sci. Monit, 2001, 7(4), 751-754). Типичные антибактериальные средства, используемые для лечения инфекций Helicobacter pylori, представляют собой комбинацию средств, выбранных, но не ограничиваясь этим, из метронидазола, амоксициллина, левофлоксацина и кларитромицина, многие из которых прочно связаны с развитием CDAD.
Современные методы лечения являются крайне ограниченными, особенно принимая во внимание то, что почти все классы антибиотиков связаны с возникновением болезни. Единственным одобренным FDA лекарственным средством для лечения CDAD является ванкомицин, хотя метронидазол также широко используется. Повсеместное использование ванкомицина для лечения CDAD вызывает беспокойство вследствие его бактериостатического действия в отношении клостридий, относительно высокой стоимости и возможного отбора (селекции) резистентных штаммов С. Difficile, а также других бактерий (в частности Enterococcus spp.). Ключевым вопросом при использовании и метронидазола и ванкомицина является высокая частота рецидивов, по меньшей мере, 20% пациентов испытывают, по меньшей мере, один повторный случай. Предположительно рецидив происходит из-за невозможности уничтожить споры клостридия во время лечения, что приводит к последующему перерастанию в патогенное состояние. Эта невозможность контролировать образование спор создает возможность для непрерывного заражения больничной среды. По существу, средства, способные уничтожить вегетативные клетки и контролировать эндоспоры, имели бы значительное преимущество.
Выбором первичной терапии для лечения CDAD является прекращение любого текущего антибактериального лечения, а затем соответствующее использование или ванкомицина или метронидазола. Обычно оба средства вводят перорально, хотя метронидазол также можно вводить внутривенно, а в тяжелых случаях ванкомицин также может быть введен с помощью многочисленных других способов, включая введение внутрь толстой кишки, через назально-желудочный зонд или как ванкомицин-удерживающая клизма. Дополнительные антибиотики, которые, как сообщалось, могут использоваться при лечении CDAD, включают фусидовую кислоту, рифамицин и его аналоги, тейкопланин и бацитрацин, хотя ни один не показал индивидуальную эффективность выше ванкомицина или метронидазола. В дополнение к прекращению любого нарушающего нормальную работу антибактериального лечения следует избегать применения антиперистальтических средств, опиатов или лоперамида, так как они могут уменьшать клиренс токсинов С. difficile и осложнять повреждение толстой кишки, обусловленное токсинами. Также такие средства могут провоцировать кишечную непроходимость и вызывать токсическое расширение толстой кишки (J. Med. Microbiol., 2005, 54, 101-111; JAMA, 1993,269, 71-5; Postgrad. Med. J., 1990,66 (777), 582).
Альтернативные методы лечения, используемые как стандартные отдельные средства или в сочетании с антибактериальными средствами, предназначаются или для попытки восстановить естественную кишечную популяцию микроорганизмов, снижая уровни токсинов С. difficile, или для стимулирования иммунной системы (см. обзоры Antibiotic Treatment for Clostridium difficile-Associsited Diarrhea in Adults, Cochrane Database of Systematic Reviews 2007, Issue 3. Art. No.: CD004610.; Clin. Inf. Dis., 2008, 46(S1), S32-S42; Clin. Inf. Dis., 2007, 45(S2), S122-S128; J. Med. Microbiol., 2005, 54, 101-111 и ссылки в них). Таким образом, альтернативные способы лечения CDAD включают предоставление Saccharomyces boulardii или Lactobacillus acidophilus совместно с антибиотиками, фекальную трансплантацию и в тяжелых случаях, когда все другие виды лечения потерпели неудачу, хирургическое вмешательство. Хотя процент колэктомии является низким (до 3% случаев), он связан с высоким уровнем смертности (до 60%).
В связи с этим существует настоятельная необходимость в новых и эффективных средствах для лечения болезней, связанных со спорообразующими бактериями, в частности, тех болезней, которые вызывают представители родов Clostridium и Bacillus и особенно болезни, связанной с инфекцией Clostridium difficile. Эта необходимость представляется особенно острой в свете устойчивости Clostridium difficile ко многим антибиотикам широкого спектра действия (включая β-лактамовые и хинолоновые антибиотики) и частоты, с которой появляется устойчивость (Antimicrob. Agents Chemother, 1985,28(6): 842-844).
(b) Известный уровень техники
WO 2007056330, WO 2003105846 и WO 2002060879 раскрывают различные 2-амино-бензимидазолы как антибактериальные средства.
WO 2007148093 раскрывает различные 2-амино-бензотиазолы как антибактериальные средства.
WO 2006076009, WO 2004041209 и Bowser et al. (Bioorg. Med. Chem. Lett., 2007, 17, 5652-5655) раскрывают различные замещенные бензимидазольные соединения, пригодные в качестве антисептических средств, которые уменьшают устойчивость, вирулентность или рост микробов. Указанные соединения не проявляют свойственную им антибактериальную активность in vitro.
Патент США 5824698 раскрывает различные дибензимидазолы в качестве антибиотиков широкого спектра действия, показывая активность против и грамотрицательных и грамположительных бактерий, включая Staphylococcus spp. и Enterococcus spp. Однако этот документ не раскрывает активность против анаэробных спорообразующих бактерий и, в частности, не раскрывает активность в отношении какого-либо Clostridium spp. (включая С. difficile).
Патент США 2007/0112048 А1 раскрывает различные би- и триарилимидазолидины и би- и триариламидины как антибиотики широкого спектра действия, показывая активность по отношению к грамотрицательным и грамположительным бактериям, включая Staphylococcus spp., Enterococcus spp. и Clostridium spp. Однако этот документ не раскрывает соединения общей формулы (I), как описано здесь.
Chaudhuri et al. (J.Org. Chem., 2007, 72, 1912-1923) раскрывает различные бис-2-(пиридил)-1Н-бензимидазолы (включая соединения формулы I, как описано здесь) как ДНК-связывающие агенты. Этот документ умалчивает о потенциальной антибактериальной активности.
Раскрытие изобретения
Следовательно, в первом аспекте настоящего изобретения предоставляется соединение общей формулы (I):
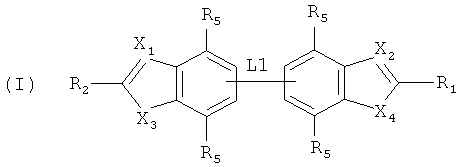
где:
L1 представляет собой непосредственную связь или линкерную группу;
R1 и R2 являются каждый независимо выбранным из Н и необязательно замещенного C1-6 алкила, арила, гетероарила, карбоциклила и гетероциклила, необязательно замещенные одним или более заместителями, выбранными из галогена, CN, NO2, R6, OR6, N(R6)2, COR6, CO2R6, SO2R6, NR7COR6, NR7CO2R6, NR7SO2R6, NR7CONR6R7, CONR6R7 и SO2NR6R7, при условии, что по меньшей мере один из R1 и R2 является циклическим.
Каждый R независимо выбирают из Н, галогена, C1-6 алкила, OR7, N(R7)2, CN и NO2;
X1 и X2 каждый независимо выбирают из N и CR3;
X3 выбирают из NR4, О и S;
X4 представляет собой NH; и
R3 выбирают из Н, галогена и C1-6 алкила; R4 выбирают из Н и C1-6 алкила; R6 выбирают из Н, C1-С6 алкила, С2-С6 алкенила, С2-С6 алкинила, C4-C7 карбоциклила, C4-C7 гетероциклила и 5- или 6-членного арила или гетероарила, любой из которых может быть необязательно замещен одним или более атомами галогена; и R7 выбирают из водорода и C1-C4 алкила, любой из которых является необязательно замещенным одним или более атомами галогена;
или его фармацевтически приемлемый N-оксид, соль, гидрат, сольват, комплекс, биоизостер, метаболит или пролекарство, необязательно для лечения инфекции или болезни, вызванной бактерией.
Некоторые из соединений общей формулы (I) являются новыми. Таким образом, согласно изобретению мы также предоставляем такие соединения общей формулы (I), которые являются новыми, вместе со способом их получения, композициями, содержащими их, а также их применение в качестве фармацевтических препаратов.
Таким образом, в другом аспекте предоставляется соединение общей формулы (I)

где:
L1 является непосредственной связью или линкерным атомом или группой;
R1 и R2 каждый независимо выбирают из Н и необязательно замещенного C1-6 алкила, арила, гетероарила, карбоциклила и гетероциклила, необязательное замещение происходит одним или более заместителями, выбранными из галогена, CN, NO2, R6, OR6, N(R6)2, COR6, CO2R6, SO2R6, NR7COR6, NR7CO2R6, NR7SO2R6, NR7CONR6R7, CONR6R7 и SO2NR6R7, при условии, что по меньшей мере один из R1 и R2 является циклическим.
Каждый R5 является независимо выбранным из Н, галогена, C1-6 алкила, OR7, N(R7)2, CN и NO2;
X1 и X2 каждый независимо выбирают из N и CR3;
X3 выбирают из NR4, О и S;
Х4 представляет собой NH; и
R3 выбирают из Н, галогена и С1-6 алкила; R4 выбирают из Н и C1-6 алкила; R6 выбирают из Н, C1-С6 алкила, С2-С6 алкенила, С2-С6 алкинила, C4-C7 карбоциклила, C4-C7 гетероциклила и 5- или 6-членного арила или гетероарила, любой из которых может быть необязательно замещенным одним или более атомами галогена; и R7 выбирают из водорода и C1-C4 алкила, любой из которых является необязательно замещенным одним или более атомами галогена;
или его фармацевтически приемлемый N-оксид, соль, гидрат, сольват, комплекс, биоизостер, метаболит или пролекарство.
L1 необязательно может быть выбран из О, S, SO2, NR7, C(R7)2 и С=O.
Соединение, определенное выше, может предназначаться для терапии или профилактики, например, при лечении бактериальной инфекции или болезни.
В другом аспекте предоставляется способ лечения бактериальной инфекции или бактериальной болезни у субъекта, включающий введение эффективного количества соединения, определенного выше, указанному субъекту.
В другом аспекте предоставляется способ уничтожения бактерии или ингибирования, уменьшения или предотвращения ее роста, включающий контактирование указанной бактерии с соединением, как определено выше.
Также рассматриваются комбинации, содержащие соединение изобретения, как определено выше, с различными дополнительными веществами, определение дано ниже.
Другие аспекты изобретения определяются в пунктах формулы изобретения, представленных ниже.
Осуществление изобретения
Все публикации, патенты, патентные заявки и другие ссылки, упомянутые в описании, полностью включаются путем отсылки во всех отношениях, как если бы было указано, что каждая отдельная публикация, патент или патентная заявка специально и по отдельности включена путем отсылки и ее содержание изложено полностью.
I. Определения и основные предпочтения
При использовании в описании и, если специально не указано иначе, следующие термины имеют следующие значения в дополнение к любым более широким (или более узким) значениям, которые термины могут иметь в данной области техники.
Если иначе не указывает контекст, использование в описании единственного числа следует считать как включающее множественное число и наоборот. По существу, термины "один или более" и "по меньшей мере один" используются в описании, заменяя друг друга.
При использовании в описании термина "содержать" или его вариантов, таких как "содержит" или "содержащий", его следует считать указывающим на включение любого перечисленного целого (например, признака, элемента, характеристики, свойства, этапа метода/процесса или ограничения) или группы целых (например, признаков, элементов, характеристик, свойств, стадий метода/процесса или ограничений), а не на исключение любого другого целого или группы целых. Таким образом, термин "содержащий", при использовании в описании, является включающим или неограниченным и не исключает дополнительных неперечисленных целых или этапов метода/процесса.
Фраза "состоящий в основном из" используется в описании, чтобы подразумевать указанное целое(ые) или этапы, а также те, которые не оказывают существенного влияния на характер или функцию заявленного изобретения.
При использовании в описании термина "состоящий" он используется, чтобы указать наличие перечисленного целого (например, признака, элемента, характеристики, свойства, этапа метода/процесса или ограничения) или группы целых (например, признаков, элементов, характеристик, свойств, стадий метода/процесса или ограничений) отдельно.
При использовании в описании термина "болезнь" он используется, чтобы определить ненормальное состояние, которое ухудшает физиологическую функцию и связано со специфическими симптомами. Термин используется широко, чтобы включать любое расстройство, заболевание, нарушение, аномалию, патологию, недомогание, состояние или синдром, при котором физиологическая функция является ослабленной независимо от природы этиологии (или действительно ли установлена этиологическая основа болезни). Поэтому термин включает состояния, вызванные травмой, повреждением, оперативным вмешательством, радиологической абляцией, отравлением или дефицитом питательных веществ.
При использовании в описании термина "бактериальная болезнь" он относится к любой болезни, которая затрагивает (например, вызвана, обострена, связана с или характеризуется присутствием) бактерию, живущую и/или воспроизводящуюся в организме и/или клетках субъекта. Поэтому термин включает болезни, вызванные или обостренные бактериальными токсинами (которые также могут называться в описании "бактериальной интоксикацией").
При использовании в описании термина «болезнь, связанная с Clostridium difficile» (CDAD), он используется, чтобы определить любую болезнь, которая вовлекает (например, вызвана, обострена, связана с или характеризуется присутствием) Clostridium difficile, живущую и/или воспроизводящуюся в организме и/или клетках субъекта. Таким образом, термин покрывает любую болезнь, расстройство, патологию, симптом, клиническое состояние или синдром, при котором бактерии вида Clostridium difficile действуют как этиологический агент, или когда инфекция одним или более штаммами Clostridium difficile вовлекается, обнаруживается или предполагается. Следовательно, термин включает различные формы колита, псевдомембранозного колита, диареи и болезни, связанной с антибиотиками.
При использовании в описании термина "бактериальная инфекция" он используется, чтобы определить состояние, при котором субъект инфицирован бактерией. Инфекция может быть симптоматической или бессимптомной. В последнем случае может быть установлено, что субъект инфицирован, на основе различных тестов, включая, например, биохимические тесты, серологические тесты, микробиологическую культуру и/или микроскопию.
Термины бактериостатический и бактерицидный являются терминами данной области техники, используемыми для определения способности предотвращать (или снижать скорость) бактериальный рост и опосредовать (прямо или косвенно) клеточное разрушение бактериальных клеток, соответственно. Термины не являются взаимоисключающими, и многие средства проявляют и бактериостатические и бактерицидные эффекты (в некоторых случаях дозоспецифическим или мишень-специфическим образом). В общем, бактерицидные средства дают лучшие терапевтические результаты и являются предпочтительными.
При использовании в описании термина "антибиотик широкого спектра действия" он определяет средство, которое является бактерицидным и/или бактериостатическим для ряда бактерий, включая и грамположительные и грамотрицательные бактерии.
Термин "множественная лекарственная устойчивость" (MDR) применяется в описании к бактериям, чтобы определить бактерию, которая является устойчивой к двум или более классам антибиотиков, включая, но не ограничиваясь этим антибиотики, выбранные из числа пенициллина, метициллина, хинолона, макролида и/или ванкомицина.
При использовании в описании термина "лечение", он относится к воздействию (например, введению средства субъекту), которое вылечивает, облегчает или уменьшает симптомы болезни или устраняет (или уменьшает влияние) ее причину(ы) (например, бактерию, вызывающую болезнь). В этом случае термин используется синонимично с термином "терапия". Таким образом, лечение инфекции согласно изобретению может быть охарактеризовано (прямым или косвенным) бактериостатическим и/или бактерицидным действием соединений изобретения.
Кроме того, термин "лечение" относится к воздействию (например, введению средства субъекту), которое предотвращает или задерживает начало или прогрессирование болезни или уменьшает (или устраняет) ее распространение внутри леченой популяции. В этом случае термин «лечение» используется синонимично с термином "профилактика".
Термин "субъект" (который включает "индидивидуум", "животное", "пациент" или "млекопитающее", где позволяет контекст) определяет какой-либо субъект, в частности млекопитающее, которому предписано лечение. Субъекты-млекопитающие включают, но не ограничиваются этим, людей, домашних животных, сельскохозяйственных животных, животных в зоопарках, спортивных животных, комнатных животных, таких как собаки, кошки, морские свинки, кролики, крысы, мыши, лошади, крупный рогатый скот; приматов, таких как обезьяны, орангутанги и шимпанзе; собачьих, таких как собаки и волки; кошачьих, таких как кошки, львы и тигры; непарнокопытных, таких как лошади, ослы и зебры; мясомолочный скот, например коров, свиней и овец; копытных, например, оленей и жирафов; грызунов, например, мышей, крыс, хомяков и морских свинок; и т.д. В предпочтительных вариантах осуществления субъект является человеком, например, ребенком.
Термин грамположительная бактерия представляет собой термин области техники, определяющий отдельный класс бактерий, которые сгруппированы вместе исходя из некоторых характеристик окрашивания клеточной стенки.
Термин грамположительная бактерия бедная G+C представляет собой термин области техники, определяющий конкретный подкласс класса бактерий, эволюционно родственных с грамположительными исходя из сравнения оснований в ДНК. Данный подкласс включает Streptococcus spp., Staphylococcus spp., Listeria spp., Bacillus spp., Clostrfdium spp., Enterococcus spp. и Lactobacillus spp.
Термин "минимальная ингибирующая концентрация" или "MIC" определяет самую низкую концентрацию испытываемого соединения, которая нужна для ингибирования роста бактериального изолята in vitro. Обычным способом определения MIC антибиотика является способ приготовления нескольких пробирок, содержащих серийные разведения испытываемого соединения, затем пробирки засевают интересующим бактериальным изолятом. После инкубации в соответствующей атмосфере и температуре можно определить MIC антибиотика, исходя из пробирки с самой низкой концентрацией, где не наблюдалось помутнение.
При использовании в описании термина "комбинация" применительно к двум или более соединениям и/или средствам (которые также называются в описании компонентами) он предназначается для описания материала, в котором два или более соединений/средств являются соединенными. Термины "комбинированный" и "комбинирование" в этом контексте следует интерпретировать соответственно.
Соединение двух или более соединений/средств в комбинации может быть физическим или не физическим. Примеры физически соединенных комбинированных соединений/средств включают:
- композиции (например, единые композиции), содержащие два или более соединений/средств в смеси (например, в одной и той же стандартной дозе);
- композиции, содержащие материал, в котором два или более соединений/средств являются химически/физико-химически соединенными (например, путем образования перекрестных связей (сшивания), молекулярной агломерации или путем связывания с общим фрагментом носителя);
- композиции, содержащие материал, в котором два или более соединений/средств являются химически/физико-химически совместно «упакованными» (например, расположены на или в жидких везикулах, частицах (например, микро- или наночастицы) или капельках эмульсии);
- фармацевтические наборы, фармацевтические упаковки или упаковки для пациентов, в которых два или более соединений/средств совместно упакованы или совместно представлены (например, как часть комплекта стандартных доз).
Примеры не физически соединенных комбинированных соединений/средств включают:
- материал (например, не единая композиция), содержащий по меньшей мере одно из двух или более соединений/средств вместе с инструкциями для непредвиденного соединения по меньшей мере одного соединения/средства с целью образовать физическую связь двух или более соединений/средств;
- материал (например, не единая композиция), содержащий по меньшей мере одно из двух или более соединений/средств вместе с инструкциями для комбинированной терапии двумя или более соединениями/средствами;
- материал (например, не единая композиция), содержащий по меньшей мере одно из двух или более соединений/средств вместе с инструкциями для введения популяции пациентов, в которой другое(ие) из двух или более соединений/средств были введены (или вводятся);
- материал, содержащий по меньшей мере одно из двух или более соединений/средств в количестве или в форме, которая специально приспособлена для применения в комбинации с другим(ими) из двух или более соединений/средств.
При использовании в описании термина "комбинированная терапия", он имеет целью определить методы лечения, которые включают применение комбинации из двух или более соединений/средств (как определено выше). Таким образом, ссылки на "комбинированную терапию", "комбинации" и применение соединений/средств "в комбинации" в данной заявке могут относиться к соединениям/средствам, которые вводятся как часть того же самого общего режима лечения. В этой связи позология каждого из двух или более соединений/средств может различаться: каждое может быть введено в одно и то же время или в разное время. Следовательно, следует принять во внимание, что соединения/средства комбинации могут быть введены последовательно (например, до или после) или одновременно, или в одной и той же композиции (т.е. вместе) или в разных фармацевтических композициях (т.е. отдельно). Одновременно в одной композиции означает в единой (цельной) композиции, тогда как одновременно в разных фармацевтических композициях означает не в единой. Позология каждого из двух или более соединений/средств в комбинированной терапии также может различаться в отношении способа введения.
При использовании в описании термина "фармацевтический набор" он определяет комплект из одной или более стандартных доз фармацевтической композиции вместе со средствами дозирования (например, измеряющим устройством) и/или средствами доставки (например, ингалятор или шприц), причем необязательно все содержится в общей наружной упаковке. В фармацевтическом наборе, содержащем комбинацию из двух или более соединений/средств, отдельные соединения/средства могут быть едиными или не едиными композициями. Стандартная доза(ы) может содержаться в блистерной упаковке. Фармацевтический набор может необязательно дополнительно содержать инструкции по применению.
При использовании в описании термина "фармацевтическая упаковка" он определяет комплект из одной или более стандартных доз фармацевтической композиции, необязательно содержащихся в общей наружной упаковке. В фармацевтических упаковках, содержащих комбинацию из двух или более соединений/средств, отдельные соединения/средства могут быть едиными или не едиными композициями. Стандартная доза(ы) может содержаться в блистерной упаковке. Фармацевтическая упаковка может необязательно дополнительно содержать инструкции по применению.
При использовании в описании термина "упаковка для пациента" он определяет упаковку, предназначенную для пациента, которая содержит фармацевтические композиции для полного курса лечения. Упаковки для пациента обычно содержат одну или более блистерную упаковку(и). Упаковки для пациента имеют преимущество по сравнению с традиционными назначениями (когда фармацевт отделяет часть фармацевтического препарата для пациента от крупной поставки), заключающееся в том, что пациент всегда имеет доступ к вкладышу, содержащемуся в упаковке для пациента и обычно отсутствующему при назначениях. Показано, что добавление вкладыша в упаковку улучшает согласие пациента с инструкциями врача.
Комбинации изобретения могут давать более терапевтически эффективный результат относительно терапевтического действия отдельных соединений/средств при введении отдельно.
При использовании в описании термина эффективное количество или терапевтически эффективное количество соединения, он определяет количество, которое может быть введено субъекту без чрезмерной токсичности, раздражения, аллергического ответа или другой проблемы или осложнения в соответствии с рациональным соотношением польза/риск, но количество, которое является достаточным для обеспечения желательного эффекта, например, лечения или профилактики, который проявляется как постоянное или временное улучшение в состоянии субъекта. Количество будет изменяться от субъекта к субъекту в зависимости от возраста и общего состояния индивидуума, способа введения и других факторов. Таким образом, когда невозможно установить точное эффективное количество, специалисты в данной области техники будут способны определить подходящее "эффективное" количество в любом индивидуальном случае, используя обычное экспериментирование и дополнительные общедоступные сведения. Терапевтический результат в этом контексте включает подавление или уменьшение симптомов, уменьшенную боль или дискомфорт, продленную выживаемость, улучшенную подвижность и другие маркеры клинического улучшения. Терапевтический результат может и не быть полным излечением.
При использовании в описании термина "профилактически эффективное количество", он относится к количеству эффективному, в дозах и в течение необходимых периодов времени, для достижения желательного профилактического результата. Обычно, поскольку профилактическая доза используется субъектами до болезни или на ранней стадии болезни, профилактически эффективное количество может быть меньше, чем терапевтически эффективное количество.
Термин "эффективный" включает полезные эффекты, такие как аддитивность, синергизм, уменьшенные побочные эффекты, пониженную токсичность или улучшенное действие или активность. Преимущественно, эффективное действие может давать возможность использования более низких доз каждого или любого компонента, который нужно ввести пациенту, тем самым снижая токсичность и в то же время производя и/или поддерживая одинаковый терапевтический эффект. Синергический эффект в настоящем контексте относится к терапевтическому эффекту, производимому комбинацией, который больше, чем сумма терапевтических эффектов компонентов комбинации, когда они используются по отдельности. Аддитивный эффект в настоящем контексте относится к терапевтическому эффекту, даваемому комбинацией, который больше чем терапевтический эффект любого из компонентов композиции, когда они используются по отдельности.
Термин "вспомогательное соединение" (или "вспомогательное средство") при использовании в описании предназначается для того, чтобы определять любое соединение, которое дает эффективную комбинацию (как определяется в описании), когда его комбинируют с соединением изобретения. Следовательно, вспомогательное соединение может служить дополнением к соединению изобретения или может иным способом способствовать эффективности комбинации (например, путем получения синергического или аддитивного эффекта или путем усиления действия соединения изобретения).
Термин "дополнительное" применительно к применению соединений и комбинаций изобретения при терапии или профилактике определяет применение, при котором материалы вводятся вместе с одним или более другими лекарственными средствами, воздействиями, режимами или способами лечения (например, хирургическим вмешательством и/или облучением). Такие дополнительные лечебные мероприятия могут включать одновременное, раздельное или последовательное введение/применение материалов изобретения и других методов обработки. Таким образом, в некоторых вариантах осуществления дополнительное применение материалов изобретения отражается на составе фармацевтических композиций изобретения. Например, дополнительное применение может отразиться на конкретной единице дозирования или на композициях, в которых соединение изобретения присутствует в смеси с другим лекарственным средством(ами), вместе с которым оно должно использоваться (или еще физически связывается с другим лекарственным средством(ами) в единой стандартной дозе). В других вариантах осуществления дополнительное использование соединений или композиций изобретения может отражаться на составе фармацевтических наборов изобретения, в которых соединение изобретения совместно упаковано (например, как часть комплекта стандартных доз) с другим лекарственным средством(ами), с которым его дополнительно следует использовать. В других вариантах осуществления дополнительное использование соединений изобретения может быть отражено в содержании информации и/или инструкциях, совместно упакованных вместе с соединением, которые относятся к составу и/или позологии.
Термин фармацевтически приемлемое производное применительно к соединениям изобретения определяет соединения, которые получают (или получаемые) путем химического получения производных исходных соединений изобретения. Фармацевтически приемлемыми производными, следовательно, являются подходящие для введения или для контакта с тканями млекопитающих без чрезмерной токсичности, раздражения или аллергической реакции (т.е. соразмерно соотношению польза/риск). Предпочтительными производными являются производные, которые получают (или получаемые) алкилированием, этерификацией или ацилированием исходных соединений изобретения. Производные могут быть активными сами по себе или могут быть неактивными до тех пор, пока не подвергнутся обработке in vivo. В последнем случае производные изобретения действуют как пролекарства. Особенно предпочтительными пролекарствами являются производные сложных эфиров, которые являются этерифицированными по одному или более свободным гидроксилам и которые активируются при гидролизе in vivo. Другими предпочтительными пролекарствами являются ковалентно связанные соединения, которые высвобождают активное исходное лекарственное средство согласно общей формуле (I) после разрыва ковалентной связи(ей) in vivo.
Фармацевтически приемлемые производные изобретения сохраняют некоторую или полную активность исходного соединения. В некоторых случаях активность увеличивается при получении производных. Получение производных также может увеличить другие виды биологической активности соединения, например, биодоступность.
Термин фармацевтически приемлемая соль применительно к соединениям изобретения определяет какую-либо нетоксичную органическую или неорганическую кислотно-аддитивную соль свободного основания соединения, которая пригодна для применения в контакте с тканями млекопитающих без чрезмерной токсичности, раздражения или аллергического ответа, которые являются сопоставимыми с приемлемым соотношением польза/риск. Подходящие фармацевтически приемлемые соли хорошо известны в данной области техники. Примерами являются соли, образованные с неорганическими кислотами (например, соляной, бромистоводородной, серной и фосфорной кислотами), органическими карбоновыми кислотами (например, уксусной, пропионовой, гликолевой, молочной, пировиноградной, малоновой, янтарной, фумаровой, яблочной, винной, лимонной, аскорбиновой, малеиновой, гидроксималеиновой, дигидроксималеиновой, бензойной, фенилуксусной, 4-аминобензойной, 4-гидроксибензойной, аминобензойной, коричной, салициловой, 2-феноксибензойной, 2-ацетоксибензойной и миндальной кислотами) и органическими сульфоновыми кислотами (например, метансульфоновой кислотой и р-толуолсульфоновой кислотой). Соединения изобретения также могут быть превращены в соли при помощи реакции с галогенидами щелочных металлов, например, хлоридом натрия, иодидом натрия или иодидом лития. Предпочтительно соединения изобретения превращают в соли путем реакции со стехиометрическим количеством хлорида натрия в присутствии растворителя, такого как ацетон.
Такие соли и свободные основания соединения могут находиться или в гидратированной, или в основном безводной форме. Кристаллические формы соединений изобретения также рассматриваются, и, как правило, кислотно-аддитивные соли соединений изобретения представляют собой кристаллические вещества, которые являются растворимыми в воде и различных гидрофильных органических растворителях и которые по сравнению с их формами свободного основания демонстрируют более высокие температуры плавления и повышенную растворимость.
Термин фармацевтически приемлемые сольваты применительно к соединениям изобретения определяет любую фармацевтически приемлемую сольватную форму конкретного соединения, которая сохраняет биологическую эффективность такого соединения. Примеры сольватов включают соединения изобретения в комбинации с водой (гидраты), изопропанолом, этанолом, метанолом, диметилсульфоксидом, этилацетатом, уксусной кислотой, этаноламином или ацетоном. Также включаются смешивающиеся составы смесей сольватов, например, соединение изобретения в комбинации со смесью ацетона и этанола. В предпочтительном варианте осуществления сольваты включают соединение изобретения в комбинации примерно с 20% этанола и примерно 80% ацетона. Таким образом, структурные формулы включают соединения, имеющие указанную структуру, включая гидратированные и негидратированные формы.
Термин фармацевтически приемлемое пролекарство применительно к соединениям изобретения определяет любое фармацевтически приемлемое соединение, которое может превращаться при физиологических условиях или при расщеплении ионами растворителя в определенное соединение в фармацевтически приемлемую соль такого соединения или в соединение, которое обладает, по меньшей мере, некоторой антибактериальной активностью конкретного соединения (например, проявляет активность против Clostridium difficile).
Термин фармацевтически приемлемый метаболит применительно к соединениям изобретения определяет любой фармацевтически активный продукт, полученный в результате метаболизма в организме конкретного соединения или его соли.
Пролекарства и активные метаболиты соединений изобретения могут быть идентифицированы при помощи обычных методов, известных в данной области техники (см. например, Bertolini et al., J. Med. Chem., 1997, 40, 2011-2016).
Термин фармацевтически приемлемый комплекс применительно к соединениям изобретения определяет соединения или композиции, в которых соединение изобретения является составной частью. Таким образом, комплексы изобретения включают производные, в которых соединение изобретения является физически связанным (например, путем ковалентного или нековалентного связывания) с другим фрагментом или фрагментами. Следовательно, термин включает мультимерные формы соединений изобретения. Такие мультимеры могут образовываться путем соединения или расположения нескольких копий соединения изобретения в непосредственной близости друг к другу (например, посредством образования мостика или через фрагмент носителя).
Термин биоизостер (или просто изостер) представляет собой термин области техники, используемый для определения аналогов лекарственного средства, в которых один или более атомов (или групп атомов) замещены атомами (или группами атомов), имеющими сходные стерические и/или электронные свойства с теми атомами, которые они замещают. Замещение атома водорода или гидроксильной группы атомом фтора представляет собой обычно используемое биоизостерическое замещение. Кремнийзамещение (C/Si-обмен) представляет собой относительно новый метод получения изостеров. Данный подход касается замещения в соединении одного или более определенных атомов углерода кремнием (обзоры смотри в статье Tacke and Zilch in Endeavour, New Series, 1986, 10, 191-197). Кремнийзамещенные изостеры (кремниевые изостеры) могут демонстрировать улучшенные фармакологические свойства, и, например, могут быть лучше переносимыми, могут иметь более длинный период полувыведения или могут демонстрировать повышенную эффективность (смотри, например, статью Englebienne in Med. Chem., 2005, 1(3), 215-226). В своем самом широком аспекте настоящее изобретение рассматривает все биоизостеры (и, в частности, все кремниевые биоизостеры) соединений изобретения.
В своем самом широком аспекте настоящее изобретение рассматривает все оптические изомеры, рацемические формы и диастереоизомеры соединений, описанных здесь. Специалистам в данной области техники будет понятно, что вследствие того, что в соединениях изобретения присутствуют асимметрично замещенные атомы углерода, соединения могут быть получены в оптически активной и рацемической формах. Если хиральный центр или другая форма изомерного центра присутствует в соединении настоящего изобретения, все формы такого изомера или изомеров, включая энантиомеры и диастереоизомеры, охватываются данным описанием. Соединения изобретения, содержащие хиральный центр (или множество хиральных центров), могут использоваться как рацемическая смесь, смесь, обогащенная энантиомерами, или рацемическую смесь можно разделить с помощью хорошо известных методов и можно использовать отдельно отдельные энантиомеры. Таким образом, ссылки на соединения настоящего изобретения включают продукты в виде смеси диастереоизомеров, в виде отдельных диастереоизомеров, в виде смеси энантиомеров, а также в виде отдельных энантиомеров.
Следовательно, настоящее изобретение рассматривает все оптические изомеры и их рацемические формы соединений изобретения, и, если не указано иначе (например, путем использования структурных формул в виде тире и клиньев), соединения, показанные в описании, имеют целью включать все возможные оптические изомеры соединений, изображенные таким образом. В случаях, где стереохимическая форма соединения является важной для фармацевтической пользы, изобретение рассматривает применение отдельных эутомеров.
В настоящем описании термин "алкил" определяет прямую или разветвленную насыщенную углеводородную цепь. Термин "C1-С6 алкил" относится к прямой или разветвленной насыщенной углеводородной цепи, имеющей от одного до шести атомов углерода. Примеры включают метил, этил, н-пропил, изопропил, т-бутил, н-гексил. Термин "C1-C9 алкил" относится к прямой или разветвленной насыщенной углеводородной цепи, имеющей от одного до девяти атомов углерода. Термин "C1-C15 алкил" относится к прямой или разветвленной насыщенной углеводородной цепи, имеющей от одного до пятнадцати атомов углерода. Алкильные группы изобретения необязательно могут быть замещенными одним или более атомами галогена.
Термин "C1-C4 алкил" имеет сходное значение, за исключением того, что он содержит от одного до четырех атомов углерода.
Термин "С3-С6 алкенил" относится к прямой или разветвленной углеводородной цепи, имеющей от двух до шести атомов углерода и содержащей, по меньшей мере, одну углерод-углеродную двойную связь. Примеры включают этенил, 2-пропенил и 3-гексенил.
Термин "C1-С6 галоалкил" относится к C1-6 алкильной группе, как определено выше, замещенной одним или более атомами галогена.
В настоящем описании термин "алкенил" относится к прямой или разветвленной углеводородной цепи, содержащей, по меньшей мере, одну углерод-углеродную двойную связь. Термин "C1-С6 алкенил" относится к прямой или разветвленной ненасыщенной углеводородной цепи, имеющей от одного до шести атомов углерода. Термин "C1-C9 алкенил" к прямой или разветвленной ненасыщенной углеводородной цепи, имеющей от одного до девяти атомов углерода. Термин "C1-C15 алкенил" относится к прямой или разветвленной ненасыщенной углеводородной цепи, имеющей от одного до пятнадцати атомов углерода. Предпочтительным является C1-С6 алкенил. Примеры включают этенил, 2-пропенил и 3-гексенил. Алкенильные группы изобретения необязательно могут быть замещенными одним или более атомами галогена.
В настоящем описании термин "алкинил" относится к прямой или разветвленной углеводородной цепи, содержащей, по меньшей мере, одну углерод-углеродную тройную связь. Термин "С1-С6 алкинил" относится к прямой или разветвленной ненасыщенной углеводородной цепи, имеющей от одного до шести атомов углерода. Термин "C1-C9 алкинил" относится к прямой или разветвленной ненасыщенной углеводородной цепи, имеющей от одного до девяти атомов углерода. Термин "C1-C15 алкинил" относится к прямой или разветвленной ненасыщенной углеводородной цепи, имеющей от одного до пятнадцати атомов углерода. Предпочтительным является C1-С6 алкинил. Примеры включают этинил, 2-пропинил и 3-гексинил. Алкинильные группы изобретения могут быть замещенными одним или более атомами галогена.
Термин "гетероциклил" определяет насыщенную или частично насыщенную 3-14-членную систему колец (за исключением случаев, когда точно указано альтернативное число атомов в кольце), сходную с циклоалкилом, но в которой, по меньшей мере, один из атомов углерода замещен N, О, S, SO или SO2. Примеры включают пиперидин, пиперазин, морфолин, тетрагидрофуран и пирролидин.
При использовании в описании термин "карбоциклил" означает моно- или полициклический остаток, содержащий 3 или более (например, 3-14, 3-10 или 3-8) атомов углерода. Карбоциклильные остатки изобретения необязательно могут быть замещенными одним или более атомами галогена. Моно- и бициклические карбоциклильные остатки являются предпочтительными. Карбоциклильные остатки могут быть насыщенными или частично ненасыщенными и включают конденсированные бициклические или трициклические системы. Примеры таких групп включают циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил и также соединенные мостиковой связью системы, такие как норборнил и адамантил.
Насыщенные карбоциклильные остатки являются предпочтительными и упоминаются в описании как "циклоалкилы", а термин "циклоалкил" используется в описании, чтобы определить насыщенное 3-14-членное карбоциклическое кольцо включая конденсированные бициклические или трициклические системы. Примеры таких групп включают циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, а также соединенные мостиковой связью системы, такие как норборнил и адамантил.
Циклоалкильные остатки изобретения необязательно могут быть замещенными одним или более атомами галогена.
В настоящем описании термин "арил" определяет 5-14- (например, 5-10) членную ароматическую моно-, би- или трициклическую группу, по меньшей мере, одно кольцо которой является ароматическим. Таким образом, бициклические арильные группы могут содержать только одно ароматическое кольцо. Примерами ароматических остатков являются бензол, нафталин, имидазол и пиридин. Термин также включает бициклические или трициклические системы, в которых одно или более колец имеет ароматический характер. Индан является примером системы этого типа.
При использовании в описании термин "гетероарил" представляет собой арильный остаток, как определено выше, который содержит гетероатомы (например, азот, серу и/или кислород). Термин также включает системы, в которых кольцо, имеющее ароматический характер, является конденсированным с насыщенным или частично насыщенным кольцом. Примеры включают пиридиновые, пиримидиновые, фурановые, тиофеновые, индольные, изоиндольные, индолиновые, бензофурановые, бензимидазольные, бензимидазолиновые, хинолиновые, изохинолиновые, тетрагидроизохинолиновые, хиназолиновые, тиазольные, бензтиазольные, бензоксазольные, индазольные и имидазольные кольцевые системы. Если не указано иначе, термин "арил" следует интерпретировать как включающий гетероарильные группы, как определено выше.
Арильные и гетероарильные группы изобретения необязательно могут быть замещенными одним или более атомами галогена.
В настоящем описании "гало", "галоген" относится к фтору, хлору, брому или йоду.
В общих формулах настоящего изобретения (и, в частности, в общей формуле (I), как описано ниже) порядки связи указанных колец могут изменяться, когда различные возможные гетероатом(ы) обеспечивают специальные требования, для того чтобы насытить ароматичность, предотвратить антиароматичность и стабилизировать таутомерные формы с учетом локализации. В таких случаях соответствующие порядки связи кольцевых структур в структурных формулах настоящего изобретения предусматриваются в описании.
Термин "симметричный" применительно к соединениям формулы (I) может определять соединения, в которых заместители R1 и R2 одинаковые.
Термин "несимметричный" применительно к соединениям формулы (I) может определять соединения, в которых заместители R1 и R2 разные.
II. Соединения согласно изобретению
(а) Рассмотрение структуры
Соединения изобретения имеют общую формулу (I):
 ,
,
где заместители представляют собой, как определено выше, или могут быть фармацевтически приемлемым N-оксидом, солью, гидратом, сольватом, комплексом, биоизостером, метаболитом или пролекарством.
Особенно предпочтительные соединения общей формулы (I) перечисляются в таблице 1 (ниже).
|
В каждом случае изобретение рассматривает фармацевтически приемлемые соли, гидраты, сольваты, комплексы, биоизостеры, метаболиты или пролекарства каждого из перечисленных соединений.
Ссылки на номер конкретного соединения в описании относятся к номерам в таблице 1.
Некоторые из соединений общей формулы (I) являются новыми. Соответственно, согласно изобретению, изобретение рассматривает такие соединения общей формулы (I), которые являются новыми как соединения по существу (per se), вместе со способом их получения, композициями, содержащими их, а также их применение как фармацевтических средств.
Таким образом, изобретение рассматривает соединение, выбранное из:
4,4'-(3'-метил-1Н,3'Н-5,5'-бибензо[d]имидазол-2,2'-диил)дианилина
4,4'-(1-метил-1Н,1'Н-5,5'-бибензо[d]имидазол-2,2'-диил)дианилина
4,4'-(1Н,1'Н-5,5'-бибензо[d]имидазол-2,2'-диил)бис(N-метиланилина)
4-(1Н,1'Н-5,5'-бибензо[d]имидазол-2-ил)анилина 4-(2'-фенил-1Н,1'Н-5,5'-бибензо[d]имидазол-2-ил)анилина
2'-(4-метоксифенил)-2-фенил-1Н,3'Н-5,5'-бибензо[d]имидазола
5,5'-(1Н,1'Н-5,5'-бибензо[d]имидазол-2,2'-диил)дипиридин-2-амина
или его фармацевтически приемлемый N-оксид, соль, гидрат, сольват, комплекс, биоизостер, метаболит или его пролекарство, а также композиции (например, фармацевтические композиции), содержащие указанные соединения.
Соединения общей формулы (I) можно получить путем определенного изменения методов, описанных в патенте США 5824698 (содержание которого включено в описание путем отсылки) и как описано в примере 1 (ниже).
(b) Рассмотрение функциональности
(i) Действие и селективность по отношению к штаммам Clostridium difficile
Предпочтительные соединения изобретения представляют собой селективные Clostridium difficile средства.
Термин "селективное Clostridium difficile средство" используется в описании, чтобы определить соединения, которые проявляют бактериостатическую и/или бактерицидную активность против одного или более штаммов С. Difficile, но которые не проявляют бактериостатическую и/или бактерицидную активность против одного представителя или более представителей нормальной кишечной флоры, выбранных из: (а) Escherichia spp. (например, Escherichia соli); (b) Bacteroides spp. (например, В. fragilis); (с) Fusobacterium spp.; (d) Eubacterium spp. (e) Ruminococcus spp. (f) Peptococcus spp.; (g) Peptostreptococcus spp.; (h) Bifidobacterium spp; и (i) Lactobacillus spp.
Особенно предпочтительные селективные Clostridium difficile средства проявляют бактериостатическую и/или бактерицидную активность против одного или более штаммов С. difficile, но не проявляют бактериостатическую и/или бактерицидную активность (MIC >64 мкг/мл) против B.fragilis ATCC25285.
Еще более предпочтительные селективные Clostridium difficile средства проявляют бактериостатическую и/или бактерицидную активность против одного или более штаммов С. difficile, но не проявляют бактериостатическую и/или бактерицидную активность (MIC>64 мкг/мл) по отношению и к Bacteroides fragilis ATCC25285 и к Escherichia coli АТСС25922.
Следовательно, предпочтительные соединения изобретения, которые являются селективными Clostridium difficile средствами, могут использоваться для лечения CDAD без нарушения существующей кишечной флоры до клинически значимой степени. Таким образом, соединения могут использоваться как антибактериальные средства без порождения болезни, связанной с антибиотиками (как определено в описании).
Соединения изобретения, которые действуют как селективные Clostridium difficile средства, могут быть установлены путем определения относительных значений антибактериальной активности соединения в отношении Clostridium difficile и одного или более организмов-индикаторов из представителей нормальной кишечной флоры. Подходящие для этой цели организмы-индикаторы включают Escherichia coli и/или различные Bacteroides spp. (например, Bacteroides fragilis)
Альтернативно, или в дополнение, соединения изобретения, которые действуют как селективные Clostridium difficile средства, могут быть точно установлены путем проведения количественных копрокультур на серийных образцах кала, полученных от субъектов, леченных дозами испытываемого соединения. Вариант этого подхода in vitro основывается на определении, вызывает ли испытываемое соединение существенные сдвиги флоры при инкубировании с разбавленными и профильтрованными фекальными образцами in vitro. В этом случае сдвиги флоры могут быть обнаружены путем определения действия испытываемого соединения на относительное число бактерий, представляющих два или более из следующих родов: Bacteroides spp.; (с) Fusо bacterium spp.; (d) Eubacterium spp. (e) Ruminococcus spp. (f) Peptococcus spp.; (g) Peptostreptococcus spp.; (h) Bifidobacterium spp и (i) Lactobacillus spp.
(ii) Действие на развитие спор
Соединения изобретения могут ингибировать или предотвращать развитие спор.
Соединения, которые ингибируют развитие спор, могут быть установлены с помощью определения in vitro изменений в показателе преломления эндоспор, устойчивости к температуре и окрашивании: развивающиеся эндоспоры становятся фазово-контрастными (phase dark), чувствительными к нагреванию и окрашиваются определенными красителями.
(iii) Действие на прорастание спор
Соединения изобретения могут ингибировать или предотвращать прорастание спор.
Соединения, которые ингибируют прорастание спор, могут быть установлены с помощью микроскопического исследования спор, подвергнутых воздействию веществ, вызывающих прорастание, in vitro.
(iv) Бактерицидное и/или бактериостатическое действие
Соединения изобретения могут быть бактерицидными и/или бактериостатическими.
Предпочтительными являются бактерицидные соединения, как определено выше. Такие бактерицидные соединения также могут быть бактериостатическими (например, в зависимости от бактерии-мишени и концентрации).
III. Медицинское применение
Соединения изобретения находят применение при лечении широкого спектра болезней. Таким образом, изобретение рассматривает соединения формулы (I), как описано выше, для применения в медицине (например, для применения при лечении или профилактике), способы терапевтического лечения или профилактики, включающие введение соединений формулы (I), как описано здесь, а также фармацевтические композиции, содержащие соединения формулы (I), как описано здесь.
Соединения изобретения, нашедшие конкретное медицинское применение, описаны более подробно ниже:
(а) Лечение бактериальной болезни и инфекции
Изобретение находит широкое применение при лечении грамположительной бактериальной инфекции или болезни.
Особенно предпочтительным является лечение болезни или инфекции, вызванной или связанной с анаэробной грамположительной бактерией. В таких вариантах осуществления анаэробная бактерия может быть факультативным анаэробом или облигатным анаэробом.
Особенно предпочтительным является лечение болезни или инфекции, вызванной или связанной с образующей эндоспоры грамположительной бактерией. В таких вариантах осуществления образующая эндоспоры грамположительная бактерия может быть анаэробом (например, факультативным анаэробом или облигатным анаэробом).
Особенно предпочтительным является лечение болезни или инфекции, вызванной или связанной с бактерией, выбранной из: (a) Clostridium spp.; (b) Staphylococcus spp.; (с) Enterococcus spp. и (d) комбинаций (а) - (с). В таких вариантах осуществления особенно предпочтительным является лечение болезни или инфекции, вызванной или связанной с бактерией, выбранной из: (a) Clostridium difficile (например, штамм BI/NAP1); (b) Clostridium perfringens; (с) Staphylococcus aureus; и (d) их комбинаций.
Бактериальная болезнь может представлять собой CDAD, колит, псевдомембранозный колит, диарею или болезнь, связанную с антибиотиком (включая диарею, связанную с антибиотиком, и колит, связанный с антибиотиком).
(b) Лечение бактериальной интоксикации
Бактериальная болезнь или инфекция может приводить к интоксикации одним или более бактериальными токсинами, включая, например, эндотоксины, экзотоксины и/или токсичные ферменты.
Таким образом, соединения изобретения находят применение при лечении бактериальной интоксикации. В таких вариантах осуществления предпочтительным является лечение интоксикации бактериальными эндотоксинами, экзотоксинами и/или токсичными ферментами, например, эндотоксинами, экзотоксинами и/или токсичными ферментами, которые продуцируют бактерии, описанные в предыдущих параграфах, включая, в частности, бактерии, выбранные из: (a) Clostridium spp.; (b) Staphylococcus spp.; (с) Enterococcus spp.; и (d) комбинаций (а) - (с).
Особенно предпочтительным является лечение интоксикации экзотоксинами клостридий, включая токсин A (TcdA), токсин В (TcdB) и/или бинарный токсин CDT Clostridium difficile. Таким образом, соединения изобретения находят применение при лечении болезни, вызванной (или обостренной) присутствием токсинов А (TcdA), В (TcdB) и/или бинарного токсина CDT Clostridium difficile.
(c) Лечение болезни, связанной с Clostridium difficile (CDAD)
Clostridium difficile-ассоциированная болезнь (CDAD) определяет набор симптомов (симптомокомплекс) и болезни, связанные с инфекцией и/или интоксикацией С. difficile. CDAD включает диарею, вздутие живота, гриппоподобные симптомы, лихорадку, потерю аппетита, боль в животе, тошноту, обезвоживание и воспаление кишечника (колит). Самым серьезным проявлением CDAD является псевдомембранозный колит (РМС), который гистологически проявляется в виде колита с язвами слизистой оболочки, а клинически в виде тяжелой диареи, коликах в животе и общей токсичности.
Соединения изобретения находят применение при лечении всех форм CDAD, включая диарею, вздутие живота, гриппоподобные симптомы, лихорадку, потерю аппетита, боль в животе, тошноту, обезвоживание, колит и псевдомембранозный колит.
(d) Лечение болезни, связанной с антибиотиками
Антибиотик-ассоциированная болезнь определяет состояния, возникающие в результате изменений в относительных количествах микроорганизмов, составляющих нормальную кишечную флору, вызванных (частично) уничтожением флоры введением антибиотиков. Такие болезни появляются в том случае, когда введение антибиотиков (в частности, антибиотиков широкого спектра действия) допускает рост патогенных организмов (или при разрастании эндогенных популяций, обычно контролируемых нормальной кишечной флорой, или при оппортунистической колонизации мест, освобожденных от нормальной кишечной флоры антибиотиком).
Антибиотик-ассоциированная болезнь обычно проявляется диареей (и связанным с этим обезвоживанием), коликами в животе, позывами и лихорадкой. Она также может привести к разным формам колита, включая псевдомембранозный колит (РМС). Таким образом, антибиотик-ассоциированная болезнь включает диарею, связанную с антибиотиками (AAD) и колит, связанный с антибиотиками (ААС).
Антибиотик-ассоциированную болезнь часто вызывают вырабатывающие токсины штаммы Clostridium difficile, Staphylococcus aureus (включая метициллинустойчивый S. aureus) и Clostridium perfringens, Clostridium difficile представляет собой наиболее частую причину внутрибольничной AAD и служит причиной большинства случаев ААС. Бактерия размножается в кишечнике пациентов, которым назначаются антибиотики широкого спектра действия или химиотерапия при раке.
Следовательно, соединения изобретения находят применение при лечении антибиотик-ассоциированной болезни, включая AAD и ААС. Особенно предпочтительным является лечение AAD или ААС, вызванной бактерией, выбранной из Clostridium difficile, Staphylococcus aureus и Clostridium perfringens, наиболее предпочтительно AAD или ААС, вызванной Clostridium difficile.
В частности, предпочтительными для такого применения являются соединения изобретения, которые являются селективными (как определено выше), так как такие соединения в основном щадят нормальную кишечную флору.
В частности, соединения изобретения находят применение в профилактике антибиотик-ассоциированной болезни, включая AAD и ААС. При таком применении соединения изобретения могут быть введены совместно с другими антибиотиками или методами лечения, которые могут вызвать изменения в относительных количествах микроорганизмов, составляющих нормальную кишечную микрофлору.
Таким образом, соединения изобретения можно применять для лечения субъектов, обработанных (или подвергнутых воздействию) антибиотиками широкого спектра действия.
(е) Лечение колита, псевдомембранозного колита и диареи
Как объяснялось выше, бактерии, выбранные из Clostridium difficile, Staphylococcus aureus и Clostridium perfringens, связаны с колитом, псевдомембранозным колитом (РМС) и диареей.
Соответственно, соединения изобретения находят применение при лечении колита, псевдомембранозного колита (РМС) или диареи.
Особенно предпочтительным является лечение псевдомембранозного колита.
IV. Дополнительные средства для применения в комбинациях изобретения
(а) Общие сведения
В дополнение к соединению изобретения изобретение также рассматривает использование одного или более из следующих дополнительных средств в качестве дополнительных компонентов изобретения.
Таким образом, изобретение предоставляет композиции, содержащие соединение изобретения в комбинации с одним или более дополнительными средствами, выбранными из тех, которые описаны ниже.
(b) Противовирусные дополнительные средства
Предпочтительно комбинации дополнительно содержат одно или более вспомогательных противовирусных средств. Такие дополнительные противовирусные средства могут быть выбраны из одного или более из числа: (а) ингибиторов вирусных ферментов (например, выбранных из (i) ингибиторов протеазы, (ii) ингибиторов геликазы и (iii) ингибиторов полимеразы); (b) нуклеозидных/нуклеотидных ингибиторов обратной транскриптазы; (с) ненуклеозидных ингибиторов обратной транскриптазы; (d) ингибиторов интегразы; (е) ингибиторов созревания; (f) цитокинов или цитокин-стимулирующих факторов; (g) ингибиторов «входа» (попадания) вирусов, например, выбранных из: (i) ингибитора прикрепления, (ii) ингибитора корецепторного связывания и (hi) ингибитора слияния мембран.
(с) Антибактериальные дополнительные средства
Соединения изобретения можно использовать в комбинации с различными антибактериальными средствами, включая, но, не ограничиваясь одним или более антибиотиком(ами), выбранными из нижеследующих:
Аминогликозиды (например, амикацин, гентамицин, канамицин, неомицин, нетилмицин, стрептомицин, тобрамицин и паромомицин).
Ансамицины (например, гелданамицин и гербимицин).
Карбацефемы (например, лорацарбеф).
Карбапенемы (например, эртапенем, дорипенем, имипенем/циластатин и меропенем).
Цефалоспорины (первое поколение), включая, например, цефадроксил, цефазолин, цефалотин и цефалексин).
Цефалоспорины (второе поколение), включая, например, цефаклор, цефамандол, цефокситин, цефпрозил и цефуроксим.
Цефалоспорины (третье поколение), включая, например, цефиксим, цефдинир, цефдиторен, цефоперазон, цефотаксим, цефподоксим, цефтазадим, цефтибутен, цефтизоксим, цефтриаксон и цефдинир.
Цефалоспорины (четвертое поколение), включая, например, цефепим.
Гликопептиды (например, ванкомицин и тейкопланин).
Макролиды (например, азитромицин, кларитромицин, диритромицин, эритромицин, рокситромицин, тролеандомицин, телитромицин и спектиномицин).
Монобактамы (например, азтеонам).
Пенициллины (например, амоксициллин, ампициллин, азлоциллин, карбенициллин, клоксациллин, диклоксациллин, флуклоксациллин, мезлоциллин, нафциллин, пенициллин, пиперациллин и тикарциллин).
Полипептиды (например, бацитрацин, поликсимин В и колистин).
Хинолоны (например, ципрофлоксацин, эноксацин, гатифлоксацин, левофлоксацин, ломефлоксацин, моксифлоксацин, норфлоксацин, офлоксацин и тровафлоксацин).
Сульфаниламиды (например, мафенид, пронтосил, сульфацетамид, сульфаметизол, сульфанилимид, сульфазалазин, сульфизоксазол, триметоприм, триметоприм-сульфаметоксазол (котримоксазол, TMP-SMX)).
Тетрациклины (например, демеклоциклин, доксициклин, миноциклин, окситетрациклин и тетрациклин).
Аминокумарины (например, новобиоцин, албамицин, коумермицин и хлорбиоцин).
Оксазолидиноны (например, линезолид и AZD2563).
Липопептиды (например, даптомицин).
Стрептограмины (например, квинупристин/далфопристин).
Глицилциклины (например, тигециклин).
Лантибиотики (например, лантибиотики Типа А (такие как нисин, субтилин, эпидермин, мутации II, мутации I и III) и лантибиотики Типа В (такие как мерсацидин, актагардин и циннамицин).
Другие подходящие антибиотики, пригодные в качестве вспомогательных средств, включают один или более антибиотик(ов), выбранных из следующих: арсфенамин, хлорамфеникол, клиндамицин, линкоамицин, этамбутол, фосфомицин, фусидовая кислота, фуразолидон, изониазид, линезолид, метронидазол, мупироцин, нитрофурантоин, платенсимицин, пиразинамид, квинупристин/далфопристин, рифампин/рифампицин и тинидазол.
Таким образом, соединения изобретения можно использовать в комбинации с одним или более антибиотиками, выбранными из пенициллина, клоксациллина, диклоксациллина, метициллина, нафциллина, оксациллина, ампициллина, амоксициллина, бакампициллина, капреомицина, циклосерина, азлоциллина, карбенициллина, мезлоциллина, пиперациллина, тикарциллина, азитромицина, кларитромицина, клиндамицина, эритромицина, линкомицина, демеклоциллина, доксициклина, этамбутола, этионамида, миноциклина, окситетрациклина, тетрациклина, хонолона, циноксацина, налидиксовой кислоты, фторхинолонов (например, левофлоксацина, моксафлоксацина и гатифлоксацина, ципрофлоксацина, эноксацина, грепафлоксацина), канамицина, левофлоксацина, ломефлоксацина, норфлоксацина, офлоксацина, р-аминосалициловой кислоты, спарфлоксацина, тровафлоксацина, бацитрацина, колистина, полимиксина В, сульфонамида, триметоприм-сульфаметоксазола, коамоксиклава, цефалотина, цефуроксима, цефтриаксона, ванкомицина, гентамицина, амикацина, метронидазола, хлорамфеникола, стрептомицина, нитрофупантоина, котримоксазола, рифамицина и их производных (например, рифампицина, рифабутина и рифапентина), изониазида, пиразинамида, кирромицина, тиострептона, микрококцина, фусидовой кислоты, тиолактомицина и фосмидомицина.
Другие подходящие антибактериальные вспомогательные средства можно выбрать из тех, которые перечислены в таблице ниже:
|
(d) Противогрибковые дополнительные средства
Соединения изобретения можно использовать в комбинации с различными противогрибковыми средствами (антимикотиками).
(e) Антипротозойные дополнительные средства
Соединения изобретения могут использоваться в комбинации с различными антипротозойными средствами, включая, но не ограничиваясь этим, хлороквин, доксициклин, мефлоквин, метронидазол, эплорнитин, фуразолидон, гидроксихлороквин, иодохинол, пентамидин, мебендазол, пиперазин, галофантрин, примаквин, пириметамин, сульфадоксин, доксициклин, клиндамицин, хинина сульфат, хинидина глюконат, хинина дигидрохлорид, гидроксихлороквина сульфат, прогуанил, хинин, клиндамицин, атоваквон, азитромицин, сурамин, меларсопрол, эфлорнитин, нифуртимокс, амфотерицин В, натрий стибоглюконат, пентамидин изетионат, триметопримсульфаметоксазол, пириметамин и сульфадиазин.
(f) Другие дополнительные средства
Соединения изобретения могут быть введены совместно с рядом других котерапевтических средств, которые лечат или предотвращают побочные явления, являющиеся результатом неэффективного лечения и/или представляющие собой последствия инфекции. Дополнительные средства этого типа могут обладать или могут не обладать противоинфекционной активностью и включают, например, PPI и H2RA (как описано выше).
Таким образом, соединения изобретения можно использовать дополнительно с PPI, включая, но не ограничиваясь этим, омепразол (лосек, прилосек, зегерид), лансопразол (превацид, зотон, ингибитол), эзомепразол (нексиум), пантопразол (протоникс, сомак, пантолок, пантозол, зуркал. Pan) и рабепразол (рабецид, ацифекс, париет, рабелок).
Соединения изобретения можно использовать дополнительно с H2RA, включая, но не ограничиваясь этим, циметидин (тагамет), ранитидин (зинетак, зантак), фамотидин, (пецидин, пепцид), роксатидин (роксит) и низатидин (тазак, аксид).
Соединения изобретения можно использовать дополнительно с тройной терапией, состоящей из PPI или H2RA вместе с комбинацией из двух антибиотиков (включая, но не ограничиваясь этим, антибиотики, выбранные из метронидазола, амоксициллина, левофлоксацина и кларитромицина).
Как дополнительные средства могут использоваться различные пробиотики, включая, например, клетки Saccharomyces boulardii или Lactobacillus acidophilus. Пробиотики представляют собой монокультуры или смешанные культуры живых микроорганизмов, которые предназначаются для того, чтобы помогать восстановлению естественной кишечной микрофлоры пациента, которая была нарушена антибактериальным препаратом, который вызвал CDAD, или даже средством, которое использовалось для лечения CDAD. Кроме того, такие микроорганизмы могут действовать так, чтобы стимулировать иммунную систему пациента и вызвать выработку ферментов, которые разрушают токсины, связанные с С. difficile. В частности, микроогранизмами, представляющими интерес, являются, но не ограничиваясь этим Saccharomyces spp. (например, Saccharomyces boulardii и Saccharomyces cerevisiae) и Lactobacillus spp. (например, Lactobacillus rhamnosus, Lactobacillus casei, Lactobaccillus acidophilus, Lactobacillus bulgaris vl Lactobacillus plantarum). Также может рассматриваться любая другая обычная пробиотическая композиция или микроорганизм, который является нормальным представителем кишечного тракта человека.
Пребиотики - факторы, нацеленные на стимулирование роста кишечной флоры, -также могут использоваться в качестве дополнительных средств. Например, показано, что использование олигофруктозы увеличивает уровни Bifidobacterium spp. и впоследствии уменьшает частоту рецидивов у пациентов. По существу, любое антибактериальное средство с узким диапазоном активности, нацеленное на Clostridium species, могло бы иметь значительное преимущество при приеме в комбинации с методами лечения, нацеленными на восстановление нормальной кишечной популяции микроорганизмов.
Другие подходы, нацеленные на восстановление нормальной кишечной флоры, включают фекальную биотерапию и фекальные клизмы из стула здоровых индивидуумов, которые содержат нормальные микроорганизмы кишечника. Следовательно, фекальная бактериотерапия также может дополнительно использоваться с соединениями изобретения.
Для того чтобы изолировать токсины, вырабатываемые С. difficile, в качестве дополнительных средств могут использоваться абсорбенты, которые связывают и блокируют бактериотоксины разных типов. Ионообменные смолы, такие как секвестранты желчных кислот холестирамин или колестипол, связывают цитотоксины С. difficile и, таким образом, направлены на снижение выраженности проблемы токсичности в кишечнике. Однако известно, что ионообменные смолы связывают такие вещества, как ванкомицин, и поэтому могут приводить к субоптимальным уровням антибактериального средства в месте инфекции. Другие абсорбенты, которые дополнительно можно использовать с соединениями изобретения, включают полимеры, такие как Synsorb 90 и толевамер.
Хотя и предполагают, что терапия пробиотиками повышает ответ иммунной системы у пациентов с CDAD, для лечения пациентов с CDAD также можно использовать, например, внутривенное введение иммуноглобулина (J. Antimicrob. Chem., 2004, 53, 882-884), в частности, при периодически повторяющихся случаях, при которых любое дополнительное антибактериальное лечение могло бы дополнительно осложнить нарушение кишечной флоры. Таким образом, соединения изобретения дополнительно могут использоваться с различными иммуноглобулинами.
Хотя в большинстве случаев избегают применения средств, нацеленных на уменьшение диареи, у пациентов с CDAD в отдельных случаях можно рассматривать их применение, когда использование таких средств совместно с антибактериальным средством может принести пользу при попытке увеличить уровни антибактериального средства в месте инфекции и/или при попытке увеличить продолжительность времени, в течение которого антибактериальное средство контактирует с кишечным патогеном. Такие средства могут включать, но не ограничиваясь этим, лоперамид (лопекс, имодиум, димор, Pepto) дифеноксилат (ломотил, кофенотроп) дифеноксин (мотофен) и рацекадотрил. Таким образом, соединения изобретения дополнительно могут использоваться с различными антидиарейными средствами, включая любые из перечисленных выше.
Котерапевтические средства, которые лечат или предотвращают любое из следующих побочных явлений, могут использоваться как часть того же самого режима лечения, как и соединения изобретения: (а) липодистрофия и истощение; (b) лицевая липодистрофия; (с) гиперлипидемия; (d) утомляемость; (е) анемия; (f) периферическая нейропатия; (g) тошнота; (h) диарея; (i) гепатотоксичность; остеопения (j); (k) обезвоживание и (l) остеопороз.
Лечение или профилактика может включать введение соединений, как определено в описании, в качестве дополнительных к одному или более из следующих методов лечения или воздействий:
(a) Лечение рака;
(b) Лечение AIDS (синдрома приобретенного иммунодефицита);
(c) Иммуносупрессивные воздействия;
(d) Посттрансплантационное лечение после пересадки/имплантации;
(e) Ногтевая хирургия или обработка раны онихомикотиком;
(f) Местное противогрибковое лечение (например, противогрибковым средством, выбранным из азолей, аллиламинов (например, тербинафин) или морфолина (например, аморолфин);
(g) Системное противогрибковое лечение;
(h) Антибактериальная терапия;
(i) Противовирусное лечение;
(j) Противовоспалительная терапия (например, стероидами);
(k) Введение анальгетиков;
(l) Введение противозудных средств;
(m) Введение пробиотиков;
(n) Фекальная бактериотерапия; или
(о) Пересадка кожи.
Таким образом, изобретение может включать лечение или профилактику популяции пацентов, в которой один или более способов лечения или воздействий (а)-(о) проводится или проводился.
(g) Дополнительные способы лечения
Лечение или профилактика может включать введение соединений, как определено выше, в качестве дополнительных к одному или более из следующих методов лечения или воздействий:
1. Лечение рака;
2. Иммуносупрессивные воздействия;
3. Иммуностимулирующие воздействия;
4. Посттрансплантационное лечение после пересадки/имплантации;
5. Ногтевая хирургия или обработка раны онихомикотиком;
6. Противовоспалительная терапия (например, стероидами);
7. Введение анальгетиков;
8. Введение противозудных средств;
9. Хирургия;
10. Абляция (удаление) клеток или тканей;
11. Радиотерапия;
12. Криотерапия;
13. Фекальная трансплантационная терапия (фекальная бактериотерапия);
14. Лечение пробиотиками; или
15. Пересадка кожи.
Таким образом, изобретение может включать лечение или профилактику популяции пацентов, в которой один или более способов лечения или воздействий (1)-(15) проводится или проводился.
(V) Позология
Соединения настоящего изобретения могут быть введены пероральным и парентеральным способами, включая внутривенное, внутримышечное, внутрибрюшинное, подкожное, чрескожное введение, введение через дыхательные пути (аэрозоль), ректальное, вагинальное и местное (включая защечное и подъязычное) введение.
Количество введенного соединения может широко варьировать в соответствии с конкретной применяемой единицей дозирования, периодом лечения, возрастом и полом пациента, которого лечат, природой и степенью расстройства, которое подвергается лечению, и конкретным выбранным соединением.
В общем, эффективное количество введенного соединения, как правило, находится в пределах примерно от 0,01 мг/кг до 10000 мг/кг ежедневно. Единица дозирования может содержать от 0,05 до 500 мг соединения и ее можно принимать один или более раз в день. Соединение может быть введено вместе с фармацевтическим носителем с использованием удобных стандартных лекарственных форм орально, парентерально или местно, как описано ниже.
Предпочтительным способом введения является пероральное введение. В большинстве случаев подходящая доза составляет в пределах от 0,01 до 500 мг на килограмм массы тела реципиента в день, предпочтительно в пределах от 0,1 до 1000 мг на килограмм массы тела в день и наиболее предпочтительно в пределах от 1 до 5 мг на килограмм массы тела в день.
Предпочтительно, необходимая доза является однократной дозой для ежедневного введения. Однако также можно использовать две, три, четыре, пять или шесть субдоз, которые вводят с соответствующими интервалами на всем протяжении дня. Эти субдозы могут быть введены в стандартных лекарственных формах, например, содержащих от 0,001 до 100 мг; предпочтительно от 0,01 до 10 мг; и наиболее предпочтительно от 0,5 до 1,0 мг активного ингредиента на стандартную лекарственную форму.
При определении эффективного количества или дозы лечащим врачом рассматривается ряд факторов, включая, но не ограничиваясь этим, эффективность и продолжительность действия используемых соединений, природа и тяжесть заболевания, которое нужно лечить, а также пол, возраст, массу, общее состояние здоровья и индивидуальная восприимчивость пациента, которого лечат, и другие существенные обстоятельства. Специалистам в данной области техники понятно, что дозировки также могут быть определены с помощью руководства Goodman & Goldman's The Pharmacological Basis of Therapeutics, Ninth Edition (1996), Appendix II, pp.1707-1711.
Количество соединения, которое можно объединить (скомбинировать) с материалами-носителями для получения единой лекарственной формы, варьирует в зависимости от субъекта, которого лечат, и конкретного способа введения. Например, композиция, предназначенная для перорального введения людям, может содержать примерно от 0,5 мг до 7 г активного вещества, необязательно смешанного с подходящим и удобным количеством материала-носителя, которое может варьировать примерно от 5 до 95 процентов всей композиции. Как правило, стандартные лекарственные формы для соединений изобретения содержат примерно от 1 мг до 500 мг активного ингредиента, например, 5 мг; 10 мг; 20 мг; 25 мг; 50 мг; 100 мг; 200 мг; 300 мг; 400 мг; 500 мг; 600 мг; 800 мг или 1000 мг.
Эффективность отдельной дозировки соединения изобретения можно определить, проводя мониторинг влияния данной дозировки на прогрессирование болезни или его предотвращение.
(VI) Лекарственная форма
Соединение изобретения может принимать любую форму. Соединение может быть синтетическим, очищенным или выделенным из природного источника с помощью методов, описанных в данной области техники.
Примерами фармацевтически приемлемых солей являются соли, полученные из муравьиной, уксусной, пропионовой, янтарной, гликолевой, глюконовой, молочной, яблочной, винной, лимонной, аскорбиновой, глюкуроновой, малеиновой, фумаровой, пировиноградной, аспарагиновой, глутаминовой, бензойной, антраниловой, мезиловой, стеариновой, салициловой, р-гидроксибензойной, фенилуксусной, миндальной, эмбоновой (памовой), метансульфоновой, этансульфоновой, бензолсульфоновой, пантотеновой, толуолсульфоновой, 2-гидроксиэтансульфоновой, сульфаниловой, циклогексиламиносульфоновой, альгиновой, b-гидроксимасляной, галактаровой и галактуроновой кислот.
Подходящие фармацевтически приемлемые основно-аддитивные соли включают соли с ионами металлов и соли с органическими ионами. Соли с ионами металлов включают, но не ограничиваются этим, соли подходящих щелочных металлов (группа Iа), соли щелочноземельных металлов (группа IIа) и другими физиологически приемлемыми ионами металлов. Такие соли могут быть получены из ионов алюминия, кальция, лития, магния, калия, натрия и цинка. Органические соли можно получить из третичных аминов и четвертичных аммониевых солей, включая отчасти триметиламин, диэтиламин, N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглюмин (N-метилглюкамин) и прокаин. Все вышеперечисленные соли могут быть получены специалистами в данной области техники из соответствующего соединения с помощью обычных способов.
Фармацевтические композиции могут включать стабилизаторы, антиоксиданты, красители и разбавители. Фармацевтически приемлемые носители и добавки выбирают так, чтобы побочные явления от фармацевтического соединения были уменьшены до минимума, а действие соединения не было скомпрометировано до такой степени, что лечение было бы неэффективным.
Фармацевтические композиции могут быть введены энтерально и/или парентерально. Пероральный (внутрижелудочный) путь является типичным способом введения. Фармацевтически приемлемые носители могут быть в твердых лекарственных формах, включая таблетки, капсулы, пилюли и гранулы, которые можно изготовить с покрытиями и оболочками, например, энтеросолюбильными покрытиями и другими покрытиями, хорошо известными в данной области техники. Жидкие лекарственные формы для перорального применения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры.
Парентеральное введение включает подкожное, внутримышечное, внутрикожное, внутривенное и другие способы введения, известные в данной области техники. Энтеральное введение включает растворы, таблетки, капсулы с замедленным высвобождением, капсулы с энтеросолюбильным покрытием и сиропы.
При введении фармацевтические композиции могут иметь температуру тела или около того.
Композиции, предназначенные для перорального применения, могут быть приготовлены любым способом, известным в данной области техники, для получения фармацевтических композиций, причем такие композиции могут содержать одно или более средств, выбранных из группы, состоящей из подсластителей, вкусовых веществ, красящих веществ и консервирующих веществ, для того чтобы обеспечить фармацевтически элегантные и приятные препараты. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми эксципиентами (вспомогательными средствами), которые подходят для производства таблеток. Эти эксципиенты могут быть, например, инертными разбавителями, такими как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия, гранулирующими или дезинтегрирующими веществами, например, кукурузным крахмалом или альгиновой кислотой, связующими веществами, например, крахмалом, желатином или гуммиарабиком, и смазывающими веществами, например, стеаратом магния, стеариновой кислотой или тальком. Таблетки могут быть непокрытыми или они могут быть покрыты с помощью известных методов, например, чтобы задержать разрушение и абсорбцию в желудочно-кишечном тракте и тем самым обеспечить непрерывное действие в течение более длинного периода. Например, можно использовать материал, дающий задержку по времени, такой как моностеарат или глицерилдистеарат.
Лекарственные формы для пероального применения также могут быть представлены в виде твердых желатиновых капсул, в которых активные ингредиенты смешаны с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активные ингредиенты присутствуют как таковые или смешиваются с водной или масляной средой, например, арахисовым маслом, жидким парафином или оливковым маслом.
Могут быть получены водные суспензии, которые содержат активные вещества в смеси с эксципиентами, подходящими для производства водных суспензий. Такие эксципиенты включают суспендирующие вещества, например, натрий карбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую камедь и гуммиарабик; диспергирующие или смачивающие вещества могут быть фосфатидами природного происхождения, например, лецитином или продуктами конденсации алкиленоксида с жирными кислотами, например, полиоксиэтиленстеарат, или продуктами конденсации этиленоксида с длинноцепочными алифатическими спиртами, например, гептадекаэтиленоксицетанол, или продуктами конденсации этиленоксида с неполными эфирами, полученными из жирных кислот и гексита, такими как полиоксиэтилен сорбитол моноолеат, или продуктами конденсации этиленоксида с неполными эфирами, полученными из жирных кислот и ангидридов гексита, например, полиоксиэтилен сорбитан моноолеат.
Водные суспензии также могут содержать один или более консервантов, например, этил- или н-пропил р-гидроксибензоат, одно или более красящих веществ, одно или более вкусовых веществ или один или более подсластителей, таких как сахароза или сахарин.
Масляные суспензии могут быть приготовлены путем суспендирования активных ингредиентов в омега-3 жирной кислоте, растительном масле, например, арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, например, воск, твердый парафин или цетиловый спирт.
Подсластители, такие как изложенные выше, и вкусовые вещества могут быть добавлены, чтобы обеспечить вкусные пероральные препараты. Эти композиции можно сохранить путем добавления антиоксиданта, такого как аскорбиновая кислота.
Диспергируемые порошки и гранулы, подходящие для приготовления водной суспензии добавлением воды, предоставляют активный ингредиент в смеси с диспергирующим или увлажняющим веществом, суспендирующим средством и одним или более консервантами. Примерами подходящих диспергирующих или увлажняющих веществ и суспендирующих веществ являются уже упомянутые выше. Также могут присутствовать дополнительные эксципиенты, например, подсластители, вкусовые вещества и красители.
Сиропы и эликсиры, содержащие соединение изобретения, могут быть заключены в состав с подсластителями, например, глицеролом, сорбитолом или сахарозой. Такие композиции также могут содержать успокоительное средство, консервант, вкусовое вещество и краситель.
Соединение изобретения может быть введено парентерально, например, подкожно, внутривенно или внутримышечно, или методом вливания, в форме стерильных инъецируемых водных или масляных суспензий. Такие суспензии могут быть созданы согласно известному уровню техники с использованием подходящих диспергирующих или увлажняющих веществ, таких как упомянутые выше или других приемлемых веществ. Стерильные инъецируемые препараты могут быть стерильными инъецируемыми растворами или суспензиями в нетоксичном парентерально приемлемом разбавителе или растворителе, например, раствор в 1,3-бутандиоле. В число приемлемых носителей и растворителей, которые можно использовать, входят вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильное жирное масло. Для этой цели может быть использовано любое мягкое жирное масло, включая синтетические моно- или диглицериды. Кроме того, при приготовлении инъецируемых препаратов могут находить применение омега-3 полиненасыщенные жирные кислоты.
Введение также может осуществляться с помощью ингаляции в форме аэрозолей или растворов для распылителей, или ректально, в форме суппозиториев, приготовленных смешиванием лекарственного средства с подходящим нераздражающим эксципиентом, который является твердым при комнатной температуре, но жидким при ректальной температуре и, следовательно, будет плавиться в прямой кишке и высвобождать лекарственное средство. Такими материалами являются масло какао и полиэтиленгликоли.
Настоящее изобретение также рассматривает защечное и подъязычное введение, включая введение в форме таблеток, пастилок или жевательной камеди, содержащей соединения, изложенные в описании. Соединения могут быть помещены в ароматизированную основу, обычно сахарозу, и гуммиарабик или трагакант.
Другие способы введения соединений изобретения включают кожные пластыри, которые высвобождают лекарственные препараты непосредственно в и/или через кожу субъекта.
Местные системы доставки также рассматриваются настоящим изобретением и включают мази, порошки, спреи, кремы, желе, глазные капли или суспензии.
Композиции настоящего изобретения необязательно могут быть дополнены добавочными веществами, такими как, например, усилители вязкости, консерванты, поверхностно-активные вещества и вещества, способствующие проникновению. Например, вещества, придающие вязкость, включают, поливиниловый спирт, поливинил пирролидон, метилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу или другие средства, известные специалистам в данной области техники. Такие вещества обычно применяются в пределах примерно от 0,01% до 2% по массе фармацевтической композиции.
Для предотвращения роста микробов до или во время использования необязательно используются консервирующие вещества. Подходящие консерванты включают поликватерниум-1, бензалкония хлорид, тимеросал, хлорбутанол, метилпарабен, пропилпарабен, фенилэтиловый спирт, динатрия эдетан, сорбиновую кислоту или другие средства, известные специалистам в данной области техники. Обычно такие консерванты используются в пределах примерно от 0,001% до 1,0% по массе фармацевтической композиции.
Растворимость компонентов настоящих композиций может быть усилена с помощью поверхностно-активного вещества или другого подходящего сорастворителя в композиции. Такие сорастворители включают полисорбаты 20, 60 и 80, полиоксиэтилен/полиоксипропиленовые поверхностно-активные вещества (например, Плюроники F-68, F-84 и Р-103), циклодекстрины или другие вещества, известные специалистам в данной области техники. Обычно такие сорастворители используются в пределах примерно от 0,01% до 2% по массе фармацевтической композиции.
Фармацевтически приемлемые эксципиенты и носители включают все вышеупомянутые и тому подобные. Вышеприведенные рассуждения, касающиеся эффективных композиций и способов введения, хорошо известны в данной области техники и описаны в стандартных руководствах. См., например, Remington: The Science и Practice of Pharmacy, 20th Edition (Lippincott, Williams и Wilkins), 2000; Lieberman et al., ed., Pharmaceutical Dosage Forms, Marcel Decker, New York, N. Y. (1980) и Kibbe et al., ed., Handbook of Pharmaceutical Excipients (3rd Edition), American Pharmaceutical Association, Washington (1999).
Таким образом, в вариантах осуществления, где соединение изобретения заключается в состав вместе с фармацевтически приемлемым эксципиентом, может использоваться любой подходящий эксципиент, включая, например, инертные разбавители, дезинтегрирующие вещества, связывающие вещества, смазывающие вещества, подсластители, вкусовые вещества, красители и консерванты. Подходящие инертные разбавители включают карбонат натрия и кальция, фосфат натрия и кальция и лактозу, тогда как подходящими дезинтегрирующими веществами являются кукурузный крахмал и альгиновая кислота. Связывающие вещества могут включать крахмал и желатин, тогда как смазывающее вещество, если оно присутствует, в большинстве случаев будет представлять собой стеарат магния, стеариновую кислоту или тальк.
Фармацевтические композиции могут принимать любую подходящую форму и включают, например, таблетки, эликсиры, капсулы, растворы, суспензии, порошки, гранулы, лак для ногтей, блеск и защитное покрытие, кожные пластыри и аэрозоли.
Фармацевтические композиции могут представлять собой набор из частей, причем набор может содержать композицию изобретения вместе с инструкциями для применения и/или множество различных компонентов в стандартной лекарственной форме.
Для перорального введения соединение изобретения может быть заключено в состав твердых или жидких препаратов, таких как капсулы, пилюли, таблетки, пастилки, лепешки, порошки, гранулы, растворы, суспензии, дисперсии или эмульсии (причем растворы, суспензии, дисперсии или эмульсии могут быть водными или неводными). Твердая стандартная лекарственная форма может представлять собой капсулу, которая обычно может быть твердой или мягкой желатиновой капсулой, содержащей, например, поверхностно-активные вещества, смазывающие вещества, и инертные наполнители, такие как лактоза, сахароза, фосфат кальция и кукурузный крахмал. Таблетки для перорального применения могут включать соединение изобретения, или отдельно или вместе с фармацевтически приемлемыми эксципиентами, такими как инертные разбавители, диспергирующие вещества, связывающие вещества, смазывающие вещества, подсластители, вкусовые вещества, красители и консерванты. Подходящие инертные разбавители включают карбонат натрия и кальция, фосфат натрия и кальция и лактозу, тогда как кукурузный крахмал и альгиновая кислота являются подходящими дезинтегрирующими веществами. Связывающие вещества могут включать крахмал и желатин, тогда как смазывающее вещество, если оно присутствует, в большинстве случаев будет представлять собой стеарат магния, стеариновую кислоту или тальк. При необходимости таблетки можно покрыть таким материалом, как глицерилмоностеарат или глицерилдистеарат, чтобы задержать абсорбцию в желудочно-кишечном тракте. Капсулы для перорального применения включают твердые желатиновые капсулы, в которых соединение изобретения смешивается с твердым разбавителем, и мягкие желатиновые капсулы, в которых активный ингредиент смешивается с водой или маслом, например, арахисовым маслом, жидким парафином или оливковым маслом.
Лекарственные формы для ректального введения могут быть представлены в виде суппозитория с подходящей основой, содержащей, например, масло какао или салицилат. Композиции, подходящие для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пен или спреев, содержащих в дополнение к активному ингредиенту такие носители, которые, как известно в данной области техники, являются подходящими.
Для внутримышечного, внутрибрюшинного, подкожного и внутривенного применения соединения изобретения в основном предоставляются в стерильных водных растворах или суспензиях, забуференных до соответствующего значения рН и изотоничности.
Подходящие водные разбавители включают раствор Рингера и изотонический хлорид натрия. Водные суспензии согласно изобретению могут содержать суспендирующие вещества, такие как производные целлюлозы, альгинат натрия, поливинилпирролидон и трагакантовая камедь, и увлажняющее вещество, например лецитин. Подходящие консерванты для водных суспензий включают этил- и н-пропил р-гидроксибензоат.
Соединения изобретения также могут быть представлены в виде липосомальных лекарственных форм.
В другом варианте осуществления соединения изобретения таблетируют с общепринятыми основами для таблеток, такими как лактоза, сахароза и кукурузный крахмал в комбинации со связывающими веществами, такими как гуммиарабик, кукурузный крахмал или желатин, дезинтегрирующими веществами, предназначенными для того, чтобы способствовать распадению и растворению таблетки после введения, такими как, картофельный крахмал, альгиновая кислота, кукурузный крахмал и гуаровая камедь, смазывающими веществами, предназначенными для того, чтобы улучшить движение неровностей таблетки и предотвратить прилипание материала таблетки к поверхностям штампов и пуансонов, например, тальк, стеариновая кислота или стеарат магния, кальция или цинка, красящими веществами, красителями и вкусовыми веществами, предназначенными для увеличения эстетических качеств таблеток, что делает таблетки более приемлемыми для пациента.
Подходящие эксципиенты для применения в пероральных жидких лекарственных формах включают растворители, такие как вода и спирты, например, этанол, бензиловый спирт и полиэтиленовые спирты, с добавлением или без добавления фармацевтически приемлемого поверхностно-активного вещества, суспендирующего вещества или эмульгатора.
Соединения изобретения также можно вводить парентерально, то есть подкожно, внутривенно, внутримышечно или внутрибрюшинно. В таких вариантах осуществления соединение предоставляется как инъецируемые дозировки в физиологически приемлемом разбавителе вместе с фармацевтическим носителем (который может быть стерильной жидкостью или смесью жидкостей). Подходящие жидкости включают воду, физраствор, водную декстрозу и растворы родственных соединений, спирт (такой как этанол, изопропанол или гексадециловый спирт), гликоли (такие как пропиленгликоль или полиэтиленгликоль), кетали глицеринов (такие как 2,2-диметил-1,3-диоксолан-4-метанол), эфиры (такие как поли(этиленгликоль) 400), масло, жирную кислоту, эфир жирной кислоты или глицерид, или ацилированный глицерид жирной кислоты с добавлением или без добавления фармацевтически приемлемого поверхностно-активного вещества (такого как мыло или детергент), суспендирующее вещество (такое как пектин, карбомеры, метилцеллюлоза, гидроксипропилметилцеллюлоза или карбоксиметилцеллюлоза) или эмульгирующее вещество и другие фармацевтические адъюванты (вспомогательные вещества). Подходящими маслами, которые можно использовать в парентеральных композициях этого изобретения, являются масла из нефти, масла животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло, кунжутное масло, хлопковое масло, кукурузное масло, оливковое масло, вазелин и минеральное масло.
Подходящие жирные кислоты включают олеиновую кислоту, стеариновую кислоту и изостеариновую кислоту. Подходящими сложными эфирами жирных кислот являются этилолеат и изопропилмиристат. Подходящие мыла включают жирные соли щелочных металлов, аммония и триэтаноламина, а подходящие детергенты включают катионные детергенты, например, диметилдиалкил галиды аммония, алкил пиридиниум галиды, и алкиламинацетаты; анионные детергенты, например, алкил, арил и олефин сульфонаты, алкил, олефин, эфир и моноглицерид сульфаты, и сульфосукцинаты; неионные детергенты, например, жирные аминоксиды, алканоламиды жирных кислот и полиоксиэтиленполипропиленовые сополимеры; и амфотерные детергенты, например, алкил-бета-аминопропионаты и 2-алкилимидазолиновые соли четвертичного аммония, а также их смеси.
Парентеральные композиции этого изобретения обычно содержат примерно от 0,5 до 25% по массе соединения изобретения в растворе. Также могут использоваться консерванты и буферы. Для того чтобы свести к минимуму или устранить раздражение в месте инъекции, такие композиции могут содержать неионные поверхностно-активные вещества, имеющие гидрофильно-липофильный баланс (HLB) примерно от 12 до 17. Количество поверхностно-активного вещества в таких композициях составляет примерно" от 5 до 15% по массе. Поверхностно-активное вещество может быть одним компонентом, имеющим вышеупомянутый HLB, или может быть смесью из двух или более компонентов, имеющей желательный HLB. Примерами поверхностно-активных веществ, используемых в парентеральных композициях, является класс эфиров жирной кислоты и полиэтилен сорбитана, например, сорбитан моноолеат и высокомолекулярные аддукты этиленоксида с гидрофобным основанием, образованные путем конденсации пропиленоксида с пропиленгликолем.
Соединения изобретения также можно вводить местно, и когда так делается, носитель может соответственно содержать основу в виде раствора, мази или геля. Например, основа может содержать одно или более из следующего: вазелин, ланолин, полиэтиленгликоли, пчелиный воск, минеральное масло, растворители, такие как вода и спирт, и эмульгаторы и стабилизирующие вещества. Местные композиции могут содержать концентрацию соединения примерно от 0,1 до 10% масс/об (масса на единицу объема).
При дополнительном применении соединения изобретения могут быть разработаны для применения с одним или более другими лекарственными средствами. В частности, соединения изобретения могут использоваться в комбинации с анальгетиками, противовоспалительными средствами (например, стероидами), иммуномодулирующими средствами и противоспазматическими средствами.
Таким образом, дополнительное применение может отражаться на конкретной единице дозировки, предназначенной для того, чтобы быть совместимой (или синергичной) с другим лекарственным средством(ами) или находиться в композициях, в которых соединение смешивается с одним или более противовоспалительными средствами, цитокинами или иммуносупрессивными средствами (или еще физически быть связанным с другим лекарственным средством(и) в единой стандартной дозе). Дополнительные способы применения также могут отражаться на составе фармацевтических наборов изобретения, в которых соединение изобретения является совместно упакованным (например, как часть комплекта стандартных доз) с антибактериальными средствами и/или противовоспалительными средствами. Дополнительное использование также может быть отражено в информации и/или инстукциях, имеющих отношение к совместному введению соединения с антибактериальными средствами и/или противовоспалительными средствами.
(VII) Иллюстративный пример
Теперь изобретение будет описано с помощью ссылки на конкретные примеры. Эти примеры являются типичными и предназначаются только для иллюстрации: они не предназначаются для ограничения каким-либо образом рамок заявленной монополии или описанного изобретения. Эти примеры представляют лучший вариант осуществления на практике изобретения, рассматриваемый сейчас.
(а) Пример 1: получение соединений общей формулы (I)
(i) Основной эксперимент
HPLC-UV-MS проводили на приборе Gilson 321 HPLC, детектирование осуществляли с помощью Gilson 170 DAD и масс-спектрометра Firmigan AQA, использующего принцип электрораспыления с ионизацией. Использовали HPLC-колонку Phenomenex Gemini C18 150×4,6 мм или Phenomenex Gemini C18 50×4.6 мм 3µ. Препаративную HPLC проводили на Gilson 321, детектирование осуществляли с помощью Gilson 170 DAD. Фракции собирали, используя коллектор фракций Gilson 215. Использовали Препаративную HPLC-колонку Phenomenex Gemini C18 150×10 мм, мобильная фаза была ацетонитрил/вода.
1H ЯМР спектры регистрировали на приборе Bruker, действующем при 300 MHz. Спектры ЯМР были получены как CDCl3 или DMSO-d6 растворы (представленные в ррт), с использованием в качестве эталона хлороформа (7,26 ppm) или DMSO-d6 (2,50 ppm). Для мультиплетности сигналов использовали следующие сокращения s (синглет), d (дублет), t (триплет), m (мультиплет), br (уширенный), dd (дублет дублетов), dt (дублет триплетов), td (триплет дублетов), obsc. (скрытый), арр. (видимый). Константы взаимодействия, если даются, сообщаются в герцах (Hz).
Колоночную хроматографию осуществляли при помощи флэш-хроматографии (40-65 мкм силикагель) или с использованием автоматизированной системы очистки (SP1™ Purification System от Biotage® или CombiFlash Companion от ISCO). Реакции в микроволновой области проводили на приборе Initiator 8™ (Biotage) или на приборе Explorer 48 (СЕМ).
Использовали следующие сокращения: DMSO (диметилсульфоксид), DMF (диметилформамид), IMS (промышленный денатурированный спирт), TLC (тонкослойная хроматография). Вос(трет-бутилоксикарбонил), RT (время удерживания), DCM (дихлорметан), TFA (трифторуксусная кислота), LCMS (жидкостная хромато-масс-спектрометрия), ЯМР (ядерный магнитный резонанс), DME (1,2-диметоксиэтан).
Данные MIC определяли методом микроразведений согласно CLSI протоколам, описанным в Methods for Antimicrobial Susceptibility Testing of Anaerobic Bacteria; Approved Standard-Seventh Edition [M11-A7, Vol.27, No2, Jan 2007] и Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically; Approved Standard-Seventh Edition [M7-A7, Vol.26, No2, Jan 2006].
(ii) Коммерческие соединения
Все нижеперечисленные соединения были закуплены у компании ChemDiv:
3,3'-(1Н,1'Н-5,5'-Бибензо[d]имидазол-2,2'-диил)дианилин (соединение 2).
(iii) Бензимидазолы
Способ 1
4,4'-(1Н,3'Н-5,5'-Бибензо[d]имидазол-2,2'-диил)дианилин (соединение 1)
Гомогенную смесь бифенил-3,3',4,4'-тетраамина (500 мг; 2,34 ммоль) и 4-аминобензойной кислоты (640 мг; 4,67 ммоль) порциями добавили к перемешанному РРА (20 мл) при 200°С. Смесь перемешивали при 200°С в течение 2,5 час. Смесь охладили (до <100°С) и влили в воду. Полученную смесь перемешивали до тех пор, пока не образовался однородный осадок. Твердое вещество отфильтровали, промыли водным К2СО3 и водой, затем высушили под вакуумом. Сырой продукт очистили с помощью колоночной хроматографии (99:1 EtOAc-NEt3 до 89:10:1 EtOAc-MeOH-NEt3) с получением желтого твердого вещества. Его растворили в МеОН и 1М НСl и затем концентрировали в вакууме. Затем вещество измельчили до мелкодисперсного порошка и перемешали в водном NaHCO3. Твердое вещество профильтровали, промыли водой и высушили (в вакуумной печи) с получением продукта в виде твердого желтого вещества (475 мг; 49%).
LCMS КТ=3.28 мин, МH+ 417.3; 1H ЯМР (DMSO+D2O): 7.90-7.84 (6 Н, m), 7.74-7.65 (4 Н, m) и 6.79-6.73 (4 Н, m).
Следующие соединения были получены аналогично, очистку проводили с помощью кристаллизации или колоночной хроматографии, где было необходимо:
4,4'-(1H,1'H-5,5'-Бибeнзo[d]имидaзoл-2,2'-диил)биc(N-мeтилaнилин) (соединение 6)
LCMS КТ=1.46 мин, MH+ 445.2; 1H ЯМР (DMSO): 12.52 (2 Н, br s), 7.98-7.90 (4 Н, m), 7.72 (2 Н, br s), 7.60-7.52 (2 Н, m), 7.48-7.43 (2 Н, m), 6.66 (4 Н, d, J 8.8), 6.24-6.17 (2 Н, m)H2.76(6H,d,J4.8).
5,5'-(1Н,1'Н-5,5'-Бибензо[d]имидазол-2,2'-диил)дипиридин-2-амин (соединение 11)
LCMS RT=1.36 мин, MIT 419.2; 1H ЯМР (DMSO): 12.82 (2 Н, br s), 8.75 (2 Н, d, J 2.4). 8.13 (2 Н, dd, JS.9 и 2.4), 7.76 (2 Н, br s), 7.64-7.57 (2 Н, m), 7.53-7.47 (2 Н, m) и 6.61-6.52 (6 Н, m).
Способ 2
4,4'-(1Н,1'Н-5,5'-Бибензо[d]имидазол-2,2'-диил)дифенол (соединение 3)
Смесь бифенил-3,3',4,4'-тетраамина (214 мг; 2,00 ммоль), 4-гидроксибензальдегида (489 мг; 4,00 ммоль) и Na2S2O5 (380 мг; 2,00 ммоль) в IMS-H2O (3:1, 20 мл) нагревали под микроволновым излучением при 160°С в течение 10 мин, затем 180°С в течение 10 мин. Смесь профильтровали и промыли IMS. К фильтрату добавили Н2О, а полученный белый осадок профильтровали и промыли водой и Et2O. Колоночная хроматография сырого твердого (EtOAc to 95:5 EtOAc-MeOH) дала продукт в виде твердого желтого вещества (50 мг; 6%).
LCMS КТ=10.36 мин [Dionex], MH+ 419.1; 1Н ЯМР (DMSO): 12.75-12.66 (2 Н, m), 10.00-9.96 (2 Н, m), 8.06-7.99 (4 Н, m), 7.86 (1 Н, br s), 7.72-7.63 (2 Н, m), 7.58-7.45 (3 Н, m) и 6.96-6.89 (4 Н, m).
Способ 3
трет-Бутил-4,4'-(1-метил-1Н,1'Н-5,5'-бибензо[d]имидазол-2,2'-диил)бис(4,1-фенилен)дикарбамат (промежуточное соединение 8)
N4-Метилбифенил-3,3',4,4'-тетраамин (150 мг; 0,66 ммоль) растворили в DMF (10 мл). Добавили Охоnе® (810 мг; 1,32 ммоль), а затем раствор N-Boc-4-аминобензальдегида (полученного согласно J. Med. Chem., 1992,15, 4150 и J. Med. Chem., 2004, 47, 2411) 320 мг; 1,45 ммоль) в DMF (5 мл). Смесь перемешивали при комнатной температуре в течение 5 часов. Добавили водный К2СО3, полученный осадок профильтровали и промыли водой (3×100 мл). Этот сырой материал высушили под вакуумом и очистили с помощью колоночной хроматографии (75:25 EtOAc-petrol до 100% EtOAc). Вещество было дополнительно очищено перекристаллизацией из МеОН с получением продукта в виде твердого белого вещества (83 мг; 20%).
1H ЯМР (DMSO): 12.81 (1 Н, br s), 9.67 (2 Н, d, J6.1), 8.15-8.05 (2 Н, m), 7.96-7.89 (1.5 Н, m), 7.86-7.77 (2.5 Н, m), 7.73-7.49 (8 Н, m), 3.91 (3 Н, s) и 1.51 (18 Н, s).
Следующие соединения были получены аналогично, очистку проводили с помощью кристаллизации или колоночной хроматографии, где было необходимо:
2,2'-бис(4-метоксифенил)-1Н,1'Н-5,5'-бибензо[d]имидазол (соединение 7)
LCMS КТ=1.52 мин, MH+ 447.5; 1Н ЯМР (DMSO): 12.84-12.77 (2 Н, m), 8.19-8.10 (4 Н, m), 7.90 (1 Н, br s), 7.75-7.66 (2 Н, m), 7.61-7.48 (3 Н, m), 7.17-7.09 (4 Н, m) и 3.85 (6 H,s).
2,2'-Ди(пиридин-4-ил)-1Н,1'Н-5,5'-бибензо[d]имидазол (соединение 12)
LCMS RT=1.46 мин, MH+ 389.1; 1Н ЯМР (DMSO+D2O): 8.79-8.74 (4 Н, m), 8.12-8.08 (4 Н, m), 8.00-7.89 (2 Н, br m), 7.81-7.73 (2 Н, m) и 7.70-7.63 (2 Н, br m).
(iv) N-Алкилированные соединения
3'-Фтор-3,4'-динитробифенил-4-амин (промежуточное соединение 1)
4-Бром-2-фтор-1 -нитробензол (500 мг; 2,27 ммоль), 2-нитро-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин (660 мг; 2,50 ммоль) и K2CO2 (940 мг; 6,81 ммоль) суспендировали в DME-H2O (4:1, 15 мл) и продули азотом. Раствор дегазировали обработкой ультразвуком перед тем, как был добавлен Pd(dppf)Cl2 (185 мг; 10 мол%). Смесь нагрели до 130°С в течение 10 мин под микроволновым излучением. Охлажденную смесь разделили на части между ЕtOАс и Н2O. Водный слой экстрагировали с EtOAc (2×50 мл). Объединенные органические экстракты промыли рассолом, высушили (MgSO4), профильтровали и концентрировали. Полученное черное твердое вещество адсорбировали на диоксиде кремния и очистили с помощью колоночной хроматографии (4:1 до 1:1 бензин-ЕtOАс) с получением продукта в виде оранжевого твердого вещества (285 мг; 45%).
1Н ЯМР (DMSO): 8.43 (1 Н, d,.72.3), 8.19 (1 H, t, J8.5), 7.96 (1 H, dd,J4.S и 2.1), 7.92 (1 H, d,./2.0), 7.79-7.73 (3 Н, т) и 7.15 (1 H, d, J8.8).
N3-Метил-3',4-динитробифенил-3,4'-диамин(промежуточное соединение 2)
3'-Фтор-3,4'-динитробифенил-4-амин (285 мг; 1,03 ммоль) суспендировали в DCM (10 мл). Добавили К2СО3 (284 мг; 2,06 ммоль), а затем MeNH2 (40% в Н2O, 10 мл). Смесь перемешивали при комнатной температуре в течение 72 час. Затем раствор промыли Н2O и рассолом. Органический слой высушили (MgSO4), профильтровали и концентрировали под вакуумом с получением продукта в виде красного твердого вещества (296 мг; 100%).
1H ЯМР (DMSO): 8.34 (1 Н, d, J 2.2), 8.33-8.26 (1 H, m), 8.11(1 H, d, J 9.0), 7.91 (1 H, dd, J 8.8 и 2.1), 7.71 (2 H, br s), 7.15 (1 H, d, J9.Q), 7.11-7.08 (1 H, m), 6.97 (1 H, dd, J9.0 и 1.8)и 3.05 (3H, d, J5.0).
N3-Метилбифенил-3,3',4,4'-тетраамин (промежуточное соединение 3)
N3-Метил-3',4-динитробифенил-3,4'-диамин (290 мг; 1,01 ммоль) суспендировали в IMS (25 мл) и продули азотом. Добавили Pd (10% на углероде, 30 мг; 10 мол%) и смесь поместили в атмосферу H2 (5 × вакуум/баллон циклов). Смесь перемешивали при комнатной температуре в течение 18 час, к этому времени не оставалось исходного материала TLC (ЕtOАс). Смесь профильтровали через целит, промывая МеОН. Фильтрат концентрировали под вакуумом до получения коричневого масла. Сырой продукт очистили с помощью колоночной хроматографии (ЕtOАс до 97:3 ЕtOАс-МеОН) с получением продукта в виде розовой пены (158 мг; 69%).
1H ЯМР (DMSO): 6.74 (1 Н, d,.7 2.0), 6.61-6.47 (5 H, m), 4.62-4.53 (1 H, m), 4.46-4.31 (6 H, m) и 2.75 (3 H, d, 72.8).
трет-Бутил-4,4'-(3'-метил-1Н,1'Н-5,5'-бибензо[d]имидазол-2,2'-диил)бис(4,1-фенилен)дикарбамат (промежуточное соединение 4)
Получено способом 3, как описано выше.
1H ЯМР (DMSO): 12.81 (1 H, d, J 8.3), 9.69-9.75 (2 H, m), 8.12-8.06 (2 H, m), 8.01-7.99 (0.5 H, m), 7.93-7.89 (1 H, m), 7.83-7.76 (2.5 H, m), 7.74-7.55 (8 H, m), 3.95 (3 H, s) и 1.51 (18H, s).
4,4'-(3'-Метил-1Н,3'Н-5,5'-бибензо[d]имидазол-2,2'-диил)дианилин (соединение 4)
трет-Бутил-4,4'-(3'-метил-1Н,3'Н-5,5'-бибензо[d]имидазол-2,2'-диил)бис(4,1-фенилен)дикарбамат (63 мг; 0,10 ммоль) перемешивали в TFA (3 мл) в течение 30 мин. Растворитель удалили под вакуумом и добавили к остатку водный К2СО3. Полученный осадок профильтровали и промыли водой, затем высушили под вакуумом до получения продукта в виде бледно-желтого твердого вещества (36 мг; 86%).
LCMS КТ=10.28 мин [Dionex], МН+ 431.2; 1Н ЯМР (DMSO): 12.48 (1 H, br s), 7.91-7.79 (4 H, m), 7.67-7.49 (6 H, m), 6.75-6.63 (4 H, m), 5.64-5.59 (4 H, br m) и 3.92 (3 H, s).
4-Бром-N-метил-2-нитроанилин (промежуточное соединение 5)
4-Бром-1-фтор-2-нитробензол (1,50 г; 6,82 ммоль) и К2СО3 (1,88 г; 13,6 ммоль) суспендировали в DCM (7 мл). Медленно добавили MeNH2 (40% в Н2О, 7 мл) и смесь перемешивали при комнатной температуре в течение 4 час. Смесь развели Н2О и экстрагировали с помощью DCM (3×40 мл). Объединенные DCM слои промыли рассолом, высушили (MgSO4), профильтровали и концентрировали до получения продукта в виде оранжевого твердого вещества (1,47 г; 93%).
1Н ЯМР (CDCl3): 8.32 (1 H, d, 72.4), 8.03 (1 H, br s), 7.52 (1 H, dd, 79.2 и 2.5), 6.76 (1 H, d, 79.2) и 3.02 (3 H, d, 74.2).
N4-Метил-3,3'-динитробифенил-4,4'-диамин(промежуточное соединение 6)
4-Бром-N-метил-2-нитроанилин (100 мг; 0.43 ммоль), 2-нитро-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин (115 мг; 0.43 ммоль), бифенил-2-илдициклогексилфосфин (30 мг; 20 мол%) и К3РO4 (275 мг; 1.3 ммоль) суспендировали в DME-H2O (4:1, 5 мл). Смесь продули азотом, затем дегазировали ультразвуком. Добавили Pd(OAc)2 (5 мг; 5 мол%) и нагрели смесь до 130°С в течение 10 мин под микроволновым излучением. Охлажденную смесь разбавили EtOAc и Н2O. Органические вещества отделили, а водный слой экстрагировали с EtOAc (3×50 мл). Объединенные органические экстракты промыли рассолом, высушили (MgSO4), профильтровали и концентрировали под вакуумом до получения сырого продукта в виде темно-коричневого твердого вещества (210 мг). Сырой материал был взят без дополнительной очистки.
1H ЯМР (DMSO): 8.29-8.14 (3 Н, m), 7.90 (1 H, dd, J9.1 и 2.3), 7.77 (1 H, td, J8.5 и 2.3), 7.54 (2 H, br s), 7.15-7.05 (2 H, m) и 3.00 (3 H, d,.75.0).
N4-Метилбифенил-3,3',4,4'-тетраамин (промежуточное соединение 7)
N4-Метил-3,3'-динитробифенил-4,4'-диамин (сырой, 150 мг) суспендировали в IMS (10 мл). Систему продули азотом до того, как был добавлен Pd (10% на углероде, 15 мг; 10 мол%). Смесь поместили в атмосферу Н2 (3 × вакуум/баллон циклов) и перемешивали при комнатной температуре в течение 2,5 час. Смесь профильтровали через целит, промывая МеОН. Фильтрат концентрировали в вакууме. Сырой продукт очистили с помощью колоночной хроматографии (EtOAc to 95:5 EtOAc-MeOH) с получением продукта в виде светло-коричневого масла (65 мг; 66% over 2 этапа).
1H ЯМР (DMSO): 6.73-6.63 (3 H, m), 6.56-6.45 (2 H, m), 6.37 (1 H, d, J 8.1), 4.42 (7 H, brs) и 2.71 (3H,s).
трет-Бутил-4,4'-(1-метил-1Н,1'Н-5,5'-бибензо[d]имидазол-2,2'-диил)бис(4,1-фенилен)дикарбамат (промежуточное соединение 8)
Получено способом 3, как описано выше.
1H ЯМР (DMSO): 12.81 (1 H, br s), 9.67 (2 H, d, J6.1), 8.15-8.05 (2 H, m), 7.96-7.89 (1.5 H, m), 7.86-7.77 (2.5 H, m), 7.73-7.49 (8 H, m), 3.91 (3 H, s) и 1.51 (18 H, s).
4,4'-(1-Метил-1Н,1'Н-5,5'-бибензо[d]имидазол-2,2'-диил)дианилин (соединение 5)
трет-Бутил-4,4'-(1-метил-1Н,1'Н-5,5'-бибензо[d]имидазол-2,2'-диил)бис(4,1-фенилен)дикарбамат (83 мг; 0,13 ммоль) перемешивали в TFA (4 мл) в течение 30 мин. Растворитель удалили под вакуумом и к осадку добавили водный К2СО3. Полученный осадок профильтровали и промыли водой, затем высушили (в вакуумной печи) с получением продукта в виде белого твердого вещества (46 мг; 81%).
LCMS КТ=1.44 мин, МН+ 431.2; 1Н ЯМР (DMSO): 12.49 (1 H, br s), 7.89-7.83 (3 H, m), 7.72 (1 H, br s), 7.63-7.42 (6 H, m), 6.74-6.64 (6 H, m), 5.62 (4 H, m) и 3.88 (3 H, s).
(v) Несимметричные бис-соединения
4-(2-(4-аминофенил)-1Н-бензо[d]имидазол-6-ил)бензол-1,2-диамин (Промежуточное соединение 9)
Получено способом 1, используя соотношение 1:1 бифенил-3,3',4,4'-тетраамина к 4-аминобензойной кислоте и время реакции 2 часа.
1Н ЯМР (DMSO): 12.33 (1 H, br s), 7.86-7.80 (2 H, m), 7.45 (2 H, br m), 7.25 (1 H, dd, J 8.4 и 1.7), 6.86 (1 H, d,./2.1), 6.72 (1 H, dd, 77.9 и 2.1), 6.69-6.63 (2 H, m), 6.57 (1 H, d, J 7.9) и 5.80-4.40 (6 H, br s).
4-(1Н,1'Н-5,5'-Бибензо[d]имидазол-2-ил)анилин (соединение 8)
4-(2-(4-аминофенил)-1Н-бензо[d]имидазол-6-ил)бензол-1,2-диамин (200 мг; 0,64 ммоль) и муравьиную кислоту (0,24 мл; 6,35 ммоль) растворили в Н2O (2 мл) и смесь нагрели до 160°С в течение 20 мин под микроволновым излучением. При охлаждении образовался осадок, который отфильтровали и промыли водой. Фильтрат ощелачивали с помощью К2СО3 и перемешивали в течение 30 мин, к этому времени образовался осадок. Смесь профильтровали, осадок промыли водой и высушили под вакуумом. Сырой продукт очистили с помощью колоночной хроматографии (EtOAc до 85:15 EtOAc-MeOH) с получением продукта в виде белого твердого вещества (12 мг; 6%).
LCMS КТ=1.35 мин, МН+ 326.3; 1Н ЯМР (DMSO): 12.48 (2 Н, br s), 8.23 (1 H, br s), 7.91-7.68 (4 H, m), 7.65-7.41 (4 H, m), 6.70-6.64 (2 Н, m) и 5.62 (2 H, br s).
4-(2'-Фенил-1Н,1'Н-5,5'-бибензо[d]имидазол-2-ил)анилин (соединение 9)
Получено способом 1, используя только 1 эквивалент бензойной кислоты и время реакции 2 часа.
LCMS КТ=1.48 мин, МН+ 402.0; 1H ЯМР (DMSO): 12.97 (1 Н, br s), 12.50 (1 Н, br s), 8.24-8,18 (2 H, m), 7.96-7.80 (3.5 H, m), 7.76-7.70 (1.5 H, m), 7.68-7.43 (8 H, m), 6.67 (2 H, d,J8.7) и 5.63 (2H, brs).
4-(2-(4-Метоксифенил)-1Н-бензо[d]имидазол-6-ил)бензол-1,2-диамин (Промежуточное соединение 10)
Получено способом 2, используя соотношение 1:1 бифенил-3,3',4,4'-тетраамина к 4-метоксибензальдегиду и нагревая до 180°С в течение 10 минут.
1H ЯМР (DMSO): 12.68-12.62 (1 Н, br m), 8.14-8.07 (2 Н, m), 7.66-7.54 (1 H, m), 7.51-7.43 (1 H, m), 7.35-7.27 (1 H, m), 7.16-7.08 (2 H, m), 6.88 (1 H, d,.72.1), 6.76-6.71 (1 H, m), 6.61-6.56 (1 H, m), 4.55 (4 H, br s) и 3.84 (3 H, s).
2'-(4-Метоксифенил)-2-фенил-1Н,3'Н-5,5'-бибензо[d]имидазол (соединение 10)
Получено способом 2, используя только 1 эквивалент бензальдегида и нагревая до 180°С в течение 10 минут.
LCMS КТ=1.52 мин, MH+ 417.0; 1H ЯМР (DMSO): 12.99 (1 Н, br s), 12.82 (1 Н, br s), 8.24-8.19 (2 H, m), 8.18-8.12 (2 H, m), 7.97-7.96 (1 H, br m), 7.80-7.66 (2 H, br m), 7.63-7.47 (4 H, m), 7.17-7.10 (2 H, m) и 3.85 (3 H, s).
(b) Пример 2: активность соединений изобретения против С. difficile
Список предпочтительных соединений общей формулы (I) вместе с их минимальной ингибирующей концентрацией (MIC) по отношению к Clostridium difficile АТСС700057 и клиническому изоляту Clostridium difficile (CI) приведен в таблице 2 (ниже):
|
В вышеприведенной таблице были использованы следующие символы, чтобы показать значения MIC:
+++ = <1 мкг/мл
++ = 1-16 мкг/мл
+ = 17-64 мкг/мл
- = >64 мкг/мл
(с) Пример 3; активность соединений изобретения против С. perfringens
Список соединений вместе с их минимальной ингибирующей концентрацией (MIC) против Clostridium perfringens АТСС13124 и клинического изолята Clostridium perfringens (CI) приведен в таблице 3 (ниже). Чтобы показать значения MIC, использовали символы, как в таблице 2 (выше).
|
(d) Пример 4: активность соединений изобретения против S. pneumoniae
Список соединений вместе с их минимальной ингибирующей концентрацией (MIC) против Streptococcus pneumoniae ATCC49619 и MDR-штамма Streptococcus pneumoniae (MDR) приведен в таблице 4 (ниже). Чтобы показать значения MIC, использовали символы, как в таблице 2 (выше).
|
(е) Пример 5: активность соединений изобретения против S. aureus
Список соединений вместе с их минимальной ингибирующей концентрацией (MIC) против Staphylococcus aureus ATCC29213 и MDR-штамма Staphylococcus aureus (MDR) приведен в таблице 5 (ниже). Чтобы показать значения MIC, использовали символы, как в таблице 2 (выше).
|
(f) Пример 6: активность соединений изобретения против Е. faecium
Список соединений вместе с их минимальной ингибирующей концентрацией (MIC) против Enterococcus faecium и MDR-штамма Enterococcus faecium (MDR) суммирован в таблице 6 (ниже). Чтобы показать значения MIC, использовали символы, как в таблице 2 (выше).
|
(g) Пример 7: активность соединений изобретения против Е. faecalis
Список соединений вместе с их минимальной ингибирующей концентрацией (MIC) против ванкомицинустойчивого штамма Enterococcus faecalis ATCC51299 (VR) суммирован в таблице 7 (ниже). Чтобы показать значения MIC, использовали символы, как в таблице 2 (выше).
|
(h) Пример 8: специфичность соединений изобретения
Ни одно из соединений, перечисленных выше, не показало значительной активности (MIC>64 мкг/мл) против грамотрицательных факультативно анаэробных бактерий Escherichia coli (ATCC25922). Только соединения 7 и 10 показали некоторую активность против грамотрицательного облигатного анаэроба Bacteroides fragilis (были проверены и АТСС25285 и клинический изолят).
E.coli и Bacteroides fragilis являются представителями нормальной кишечной флоры и, следовательно, действуют как заменители нормальной кишечной флоры.
Данные, изложенные в примерах 2-7, показывают, что соединение 12 является высокоселективным для Clostridium difficile по сравнению с С. perfringens, Staphylococcus aureus, Enterococcus faecium и Enterococcus faecalis. Это соединение также не показало значительной антибактериальной активности против Bacillus subtilis или Bacteroides fragilis.
Таким образом, данные показывают, что соединения изобретения могут найти применение при лечении CDAD, не вызывая патологического нарушения нормальной кишечной флоры.
(VIII) Эквиваленты
Предшествующее описание раскрывает предпочтительные варианты осуществления настоящего изобретения. Ожидается, что после рассмотрения этого описания специалисты в данной области техники осуществят на практике его многочисленные модификации и изменения. Такие модификации и изменения включаются в формулу изобретения, прилагаемую к этому документу.

