ПИТАТЕЛЬНАЯ КОМПОЗИЦИЯ ДЛЯ УЛУЧШЕНИЯ ИММУННОЙ СИСТЕМЫ МЛЕКОПИТАЮЩИХ
Вид РИД
Изобретение
Настоящее изобретение касается композиции, включающей белковое вещество, которое включает лейцин, ω3-полиненасыщенную жирную кислоту и иммуномодулятор.
Настоящее изобретение также касается применения композиции, пригодной для улучшения иммунной функции млекопитающих.
Основной функцией иммунной системы у млекопитающих является защита организма от патогенных инфекций и уничтожение (пре-)злокачественных клеток. Иммунная функция является многоуровневой и в эту функцию вовлечено много разных типов клеток. Физические и химические барьеры составляют первый уровень защиты от патогенов, и в этом аспекте особенно важная роль принадлежит эпителию слизистых оболочек, таких как выстилка желудочно-кишечного тракта. Помимо собственно иммунных клеток на этом первом уровне защиты важную роль играют и неиммунные клетки, такие как клетки эпителия. Врожденная иммунная система, состоящая, главным образом, из естественных клеток-киллеров (NK-клеток), способных к фагоцитозу лейкоцитов, таких как гранулоциты и макрофаги, и антиген-презентирующих клеток, таких как дендритные клетки, обеспечивает быстродействующий неадаптивный второй уровень защиты от патогенов. Во взаимодействии с врожденными клетками, Т и В клетки образуют адаптивную иммунную систему, которая представляет собой третий уровень защиты. Это обеспечивает адаптивные высокоспецифичные клеточные или гуморальные иммунные ответы, и это приводит к формированию иммунологической памяти.
Сниженная иммунная функция сказывается на способности индивидуума защищаться против инфекционных агентов. Сниженная иммунная функция характеризуется уменьшением количества иммунных клеток или изменением в функционировании иммунных клеток, что приводит к снижению их эффективности в защите против патогенов. Тяжелые болезненные состояния, связанные с раком, ростом опухолей, диабетом, хроническим обструктивным заболеванием легких (chronic obstructive pulmonary disease, COPD), ВИЧ-инфекциями (то есть, серопозитивными состояниями), СПИДом, заболеваниями почек, почечной недостаточностью, сердечной недостаточностью, и болезненные состояния, характеризующиеся высоким уровнем провоспалительных цитокинов в плазме и/или сыворотке крови, могут стать причиной сниженной иммунной функции пациента.
В частности, у людей, страдающих от таких болезней или от лекарственного привыкания, сниженная иммунная функция может стать причиной более плохих прогнозов в отношении шансов на выживание или продолжительность жизни. Во многих случаях было показано, что, скорее, чем болезнь или лекарственное средство сами по себе, причиной смерти является дополнительная инфекция. Кроме того, сниженная иммунная функция может пагубно влиять на качество жизни. В дополнение к этому, наличие инфекционного осложнения может приводить к изменению предписанного лечения пациента (например, хирургическое вмешательство или терапия с применением лекарств (например, химиотерапия) могут быть отложены).
Предметом настоящего изобретения является обеспечение композиции, пригодной для улучшения иммунной функции. В частности, предметом изобретения является предоставление питательной композиции для такой цели. Улучшенная иммунная функция, в частности, понимается здесь как повышенная способность к ответу на острый патогенный стимул, приводящая к усиленному защитному иммунному ответу на экзогенный патоген или на аутологический триггер, такой как неопластические клетки. В соответствии с этим, улучшенная иммунная функция, в частности улучшенная острая иммунная функция, может представлять собой улучшенную опосредованную клетками иммунную функцию, улучшенный гуморальный иммунитет или их комбинацию.
Улучшенная опосредованная клетками иммунная функция может быть измерена разными способами:
- как усиленная in vivo гиперчувствительность замедленного типа (включая контактную гиперчувствительность) в ответ на повторные антигены или на антигены, к которым организм был предварительно сенсибилизирован или вакцинирован.
- как усиленная клеточная пролиферация, продукция цитокинов, окислительный взрыв или фагоцитирующая активность в ответ на связанные с патогенами, имитирующие патогены, митогенные стимулы или антигены, к которым организм был предварительно сенсибилизирован или вакцинирован.
Улучшенный гуморальный иммунитет может быть определен, например, путем измерения уровней антител и/или уровней одного или более других маркеров (например, продукции белка комплемента) в сыворотке крови. Увеличение продукции антител в ответ на патогенные стимулы или вакцинацию является признаком улучшенного гуморального иммунитета.
Было установлено, что иммунная функция, в частности острая иммунная функция, может быть улучшена путем введения субъекту, особенно субъекту с ослабленной иммунной функцией или находящемуся в состоянии риска развития ослабленной иммунной функции, определенной композиции, включающей белковый материал.
В соответствии с этим настоящее изобретение касается питательной композиции, включающей:
а) по меньшей мере, 18 эн.% белкового материала;
б) по меньшей мере, 12 масс.% лейцина по отношению к общей массе белкового материала;
в) липидную фракцию, включающую, по меньшей мере, одну ω-3 полиненасыщенную жирную кислоту, выбранную из группы, включающей эйкозапентаеновую кислоту, докозагексаеновую кислоту, эйкозатетраеновую кислоту и докозапентаеновую кислоту;
г) иммуномодулятор.
Энергетическая ценность соединения (эн.%) основывается на количестве энергии, предоставляемой перевариваемой частью (в частности, у человека) данного соединения. В частности, энергетическая ценность основывается на вкладе белкового материала, липидов и перевариваемых углеводов, с применением для расчетов следующих коэффициентов: 4 ккал/г для перевариваемых углеводов и белкового материала и 9 ккал/г для липидов.
Настоящая композиция, в частности, применима для улучшения иммунной функции у млекопитающих. Когда говорится о применении композиции, включающей указанные компоненты а), б), в) и г), с определенной целью, это, в частности, означает, что указанные компоненты а), б), в) и г) предназначены для применения с этой целью в виде их комбинации. В соответствии с этим, каждый из указанных компонентов предназначается для выполнения определенной роли для достижения этой цели. Таким образом, настоящее изобретение, в частности, касается композиции, в которой комбинация указанных компонентов а), б), в) и г) предназначена для улучшения иммунной функции у млекопитающего.
В частности, композиция настоящего изобретения может применяться для улучшения иммунной функции, при которой усиливается способность к ответу на острый патогенный стимул. Кроме того, в частности, настоящее изобретение обеспечивает композицию для усиления защитного иммунного ответа на экзогенный патоген или на аутологический триггер, такой как неопластические клетки. В соответствии с этим, композиция настоящего изобретения, в частности, может применяться в профилактических целях, например, для предотвращения инфекции или снижения тяжести инфекции или другого связанного с иммунитетом заболевания.
В определенном воплощении, композиция согласно настоящему изобретению применяется для лечения нейтропении (агранулоцитоза), в частности, нейтропении, являющейся следствием химиотерапии.
Композиции, включающие белковый материал и иммуномодулятор, известны в данной области техники per se. Например, WO 2007/145520 касается противовоспалительной композиции, включающей глицин (в качестве иммуномодулятора) и белок трансферрин. Композиция не обязательно включает противовоспалительную полиненасыщенную жирную кислоту. Упоминается применение таких композиций для лечения воспалений, но не упоминается их конкретное применение для улучшения иммунной функции. Данная композиция не обязательно включает лейцин. Предназначалась данная композиция для борьбы с потерей мышечной массы.
Предпочтительно органолептические свойства настоящей композиции являются такими, что ее употребление обычно воспринимается как приятное.
Предпочтительно настоящая композиция легко проходит через желудок.
Предпочтительно перевариваемые компоненты настоящей композиции становятся легко доступными при употреблении данного продукта.
Композиция согласно настоящему изобретению может, в частности, применяться для улучшения иммунного ответа, опосредуемого Т-хелперами 1 (Th1), у млекопитающих.
Известно, что улучшение Th1-опосредуемого иммунного ответа может включать улучшение клеточных ответов при вакцинации; увеличение Th1-индуцируемой продукции антител подкласса IgG при острых ответах против патогенов или при противоопухолевых иммунных ответах (например, IgG1 у человека, IgG2a у мышей); снижение антиген-специфичных или общих антител IgE в сыворотке крови; улучшение клеточных иммунных ответов на вирусные или бактериальные патогены или имитирующие патогены вещества; увеличение продукции IL-2, IFN-гамма или IL-12 при острых иммунных ответах против патогенов, имитирующих патогены веществ, или при локальных противоопухолевых иммунных ответах.
Композиция согласно настоящему изобретению может также применяться для достижения эффекта, который может выбираться из группы, включающей увеличение активности или количества клеток - натуральных киллеров (NK); увеличение продукции патоген-специфических или опухоль-специфических антител классов IgA, IgG или IgM; увеличение концентраций IgA, IgG или IgM до нормальных значений в крови млекопитающих от субнормальных уровней указанных антител; увеличение общего числа лейкоцитов у млекопитающих при индуцированном лечением или индуцированном болезнью снижении числа лейкоцитов; увеличение числа или активности фагоцитирующих клеток у млекопитающих при индуцированном лечением или индуцированном болезнью снижении числа фагоцитирующих клеток; улучшение опосредуемых клетками цитотоксических ответов против патогенов, патоген-инфицированных клеток или опухолевых клеток; улучшение барьерной функции эпителия слизистых оболочек за счет увеличения секреции sIgA; увеличение продукции слизи в кишечнике; снижение проницаемости эпителия или снижение проникновения бактерий через эпителий за исключением неинфекционного переноса микробов локальными иммунными клетками; улучшение состава кишечной микробиоты за счет увеличения числа или активности полезных бактерий, таких как бифидобактерии или лактобациллы, за счет улучшения колонизационной устойчивости кишечной микробиоты, за счет снижения числа потенциальных патогенных организмов в кишечной микробиоте или за счет снижения значения рН содержимого кишечника.
В одном воплощении композиция настоящего изобретения может применяться для профилактики или лечения пониженной иммунной функции, которая связана или является результатом старения, заболевания, расстройства или травмы, предпочтительно заболевания, расстройства или травмы.
Сниженная иммунная функция может, в частности, проявляться в виде симптома, выбираемого из группы, включающей инфекции, воспаления, сосудистые нарушения, плохое заживление ран, воспаление слизистых оболочек и стоматит.
Непреднамеренная потеря веса и саркопения (потеря мышечной массы) могут дополнительно ухудшать иммунную функцию у млекопитающего.
Композиция настоящего изобретения может, в частности, применяться для лечения млекопитающего, страдающего от заболевания или расстройства, выбираемого из группы, состоящей из рака, роста опухолей, диабета, хронического обструктивного заболевания легких, ВИЧ-инфекций, заболевания почек, почечной недостаточности, сердечной недостаточности и болезненного состояния, характеризующегося высоким уровнем в плазме и/или сыворотке крови провоспалительных цитокинов. Наиболее предпочтительно заболевание представляет собой рак.
В одном воплощении, где композиция согласно настоящему изобретению применяется для лечения травмы, травма может, в частности, выбираться из группы, включающей травмы в результате хирургического вмешательства, применения лекарств, химиотерапии и радиотерапии.
На основании экспериментов, в которых композиции согласно настоящему изобретению скармливались мышам, имеющим опухоли, как показано в примере ниже, авторами настоящего изобретения было обнаружено, что композиция настоящего изобретения является эффективной в улучшении иммунной системы у млекопитающего. В экспериментах было показано, что, по меньшей мере, один из нескольких физиологических и иммунных параметров, связанных с пониженной иммунной функцией, изменился в положительном направлении, указывая на более хороший иммунный ответ млекопитающего. В частности, может быть улучшен ответ гиперчувствительности (клеточный иммунный ответ in vivo). Кроме того, на основании экспериментальных результатов было установлено, что может быть улучшена одна или более иммунных функций, связанных с функционированием тимуса (например, созревание Т-лимфоцитов, продукция тимусом зрелых нативных Т-лимфоцитов или улучшенная защита от аутоиммунных реакций). Увеличение веса тимуса у опытных животных, получавших композицию согласно настоящему изобретению, по сравнению с контрольной группой может рассматриваться как указание на такую улучшенную иммунную функцию.
Было также установлено, что композиция настоящего изобретения может применяться для достижения более хорошего прогноза в плане увеличения продолжительности жизни и/или более хорошего качества жизни. Факторами, улучшающими качество жизни, в частности, являются меньшая утомляемость, большая выносливость, меньшее количество осложнений, таких как вирусные и/или бактериальные инфекции (в частности, во рту, глотке, кишечнике, в ранах и в легких), уменьшенная потеря способности видеть и/или слышать, более хорошее общее состояние и меньшие периоды ощущения депрессии.
Также было обнаружено, что композиция настоящего изобретения может снижать потерю резервов жира и липидов. В соответствии с этим авторы настоящего изобретения установили, что композиция настоящего изобретения может, в частности, применяться для лечения млекопитающего, страдающего от нежелательной потери массы тела (более 5% за 3 месяца), или млекопитающего, имеющего серьезный риск подвергнуться такой потере массы тела.
Композиция, в частности, является пригодной для увеличения эффективности иммунотерапии у млекопитающих, получающих противораковую иммунотерапию, или у которых планируется начало противораковой иммунотерапии в течение ближайших двух месяцев.
Иммуномодулятор
Под «иммуномодулятором» понимается агент, способный модифицировать функцию иммунной системы.
В предпочтительном воплощении, иммуномодулятор выбирается из группы, включающей модулирующие иммунную систему неперевариваемые углеводы, лактоферрин, глицин, модулирующие иммунную систему лекарства и модулирующие иммунную систему бактерии или их фрагменты.
Иммуномодулятор обычно присутствует в эффективном количестве, которое зависит от конкретного иммуномодулятора или иммуномодуляторов, присутствующих в композиции.
В частности, в композиции настоящего изобретения присутствует один или более модулирующих иммунную систему неперевариваемых углеводов.
В предпочтительном воплощении модулирующие иммунную систему неперевариваемые углеводы выбираются из группы, включающей галактоолигосахариды (GOS) и фруктоолигосахариды (FOS).
В частности, галактоолигосахарид выбирается из группы короткоцепочечных галактоолигосахаридов, длинноцепочечных галактоолигосахаридов или любой их комбинации.
В частности, фруктоолигосахарид выбирается из группы короткоцепочечных фруктоолигосахаридов, длинноцепочечных фруктоолигосахаридов или любой их комбинации.
Предпочтительная композиция включает галактоолигосахарид и фруктоолигосахарид.
Предпочтительно молярное отношение галактоолигосахарида к фруктоолигосахариду составляет, по меньшей мере, 1:1, более предпочтительно, по меньшей мере, 5:1. Предпочтительно молярное отношение галактоолигосахарида к фруктоолигосахариду составляет 20:1 или меньше, более предпочтительно от 12:1 или меньше. В предпочтительном воплощении молярное отношение галактоолигосахарида к фруктоолигосахариду находится в диапазоне от 1:1 до 20:1, предпочтительно от 5:1 до 12:1. В особенно предпочтительном воплощении молярное отношение галактоолигосахарида к фруктоолигосахариду составляет примерно 9:1.
Под олигосахаридом понимается цепь, включающая от 2 до 25 сахаридных остатков.
Под длинноцепочечным олигосахаридом понимается олигосахаридная цепь, включающая 10-25 сахаридных остатков. Под короткоцепочечным олигосахаридом понимается олигосахаридная цепь, включающая 2-9 сахаридных остатков, например, 2-5 остатков или 6-9 остатков.
Неперевариваемые углеводы представляют собой углеводы, которые остаются в основном не переваренными в кишечнике человека. В частности, углевод считается неперевариваемым в том случае, когда меньше чем 10% сахаров высвобождается из него в период от 20 до 120 минут в условиях анализа с применением стандартных пищеварительных ферментов, как это можно определить по методу Энквиста.
В определенном воплощении неперевариваемый углевод выбирается из группы, включающей галактоманнаны, имеющие степень полимеризации (DP) между 2 и 50, ксиланы со значением DP от 2 до 60, олигомеры, содержащие более чем 30 масс.% остатков галактуроновой кислоты или глюкуроновой кислоты, имеющие молекулярную массу 520-2200 Дальтон и любые их комбинации.
В одном воплощении содержание неперевариваемого углевода составляет, по меньшей мере, 1 масс.%, по меньшей мере, 2 масс.% или, по меньшей мере, 3 масс.% по отношению к общей массе сухих веществ. В одном воплощении содержание неперевариваемого углевода составляет 15 масс.% или меньше, предпочтительно 12 масс.% или меньше, более предпочтительно 10 масс.% или меньше по отношению к общей массе сухих веществ. В конкретном воплощении содержание неперевариваемого углевода находится в диапазоне от 1 до 15 масс.%, предпочтительно от 2 до 12 масс.%, более предпочтительно от 3 до 10 масс.% по отношению к общей массе сухих веществ.
В одном воплощении композиция настоящего изобретения включает один или более иммуномодуляторов, выбранных из группы, включающей факторы роста для профилактики или лечения нейтропении (гранулоцитопении) и фактор роста для связанной с лечением дисфункции иммунной системы у раковых пациентов. В частности, такие факторы выбираются из группы, включающей 1) колониестимулирующий фактор гранулоцитов (G-CSF) и его производные, такие как Filgrastim, Neupogen, Pegfilgrastim и Neulasta, 2) колониестимулирующий фактор гранулоцитов и макрофагов (GM-CSF), такой как Sargramostim, Leukine, Molgramostim, и 3) фактор стволовых клеток (CSF), такой как Ancestim и StemGem.
В одном воплощении композиция настоящего изобретения включает один или более иммуномодуляторов, выбираемых из группы антибиотиков, пригодных для профилактики или лечения инфекций у раковых пациентов с нейтропенией или получающих противораковое лечение, которое делает их восприимчивыми к инфекциям.
В одном воплощении композиция настоящего изобретения включает один или более иммуномодуляторов, выбранных из группы модулирующих иммунную систему бактерий или их производных, выбираемых из группы пробиотических бактерий, фрагментов бактерий, CpG олигонуклеотидов и белков теплового шока.
Примером лечения, которое включает применение иммуномодулятора, является противораковое иммунотерапевтическое вмешательство. Целью такого вмешательства является стимуляция иммунной системы млекопитающего для усиления эффективных иммунных ответов против раковых клеток либо в качестве первичного лечения, либо в качестве вспомогательного лечения для уничтожения оставшихся раковых клеток.
В конкретном воплощении настоящего изобретения композиция согласно настоящему изобретению включает смесь нейтральных и кислых олигосахаридов, раскрываемых в публикации WO 2005/039597 (N.V. Nutricia), который включается в настоящее изобретение путем отсылки во всей своей полноте. Более конкретно, кислый олигосахарид имеет степень полимеризации (DP) от 1 до 5000, предпочтительно от 1 до 1000, более предпочтительно от 2 до 250, еще более предпочтительно от 2 до 50, наиболее предпочтительно от 2 до 10. Если применяется смесь кислых олигосахаридов с разными степенями полимеризации, среднее значение DP смеси кислых олигосахаридов предпочтительно составляет от 2 до 1000, более предпочтительно от 3 до 250, еще более предпочтительно от 3 до 50. Кислым олигосахаридом может быть гомогенный или гетерогенный углевод. Кислые олигосахариды могут быть получены из пектина, пектата, альгината, хондроитина, гиалуроновых кислот, гепарина, гепарана, бактериальных углеводов, сиалогликанов, фукоидана, фукоолигосахаридов или каррагинана, и предпочтительно получаются из пектина или альгината. Кислые олигосахариды могут быть получены по методам, описанным в публикации WO 01/60378, которая включается в настоящее изобретение путем отсылки во всей своей полноте. Кислый олигосахарид предпочтительно получают из высокометоксилированного пектина, который характеризуется степенью метоксилирования выше 50%. В используемом здесь значении термин «степень метоксилирования» (также обозначаемая как DE или «степень этерификации») предназначен для обозначения степени, в которой свободные карбоксильные группы, присутствующие в цепи полигалактуроновой кислоты, являются этерифицированными (например, метилированными). Кислый олигосахарид предпочтительно характеризуется степенью метоксилирования выше 20%, предпочтительно выше 50%, еще более предпочтительно выше 70%. Предпочтительно кислые олигосахариды имеют степень метилирования выше 20%, предпочтительно выше 50%, еще более предпочтительно выше 70%. Кислый олигосахарид предпочтительно вводится в количестве от 10 мг до 100 граммов в день, предпочтительно от 100 мг до 50 граммов в день, еще более предпочтительно от 0,5 до 20 граммов в день.
Термин «нейтральные олигосахариды» в применяемом в настоящем изобретении значении относится к сахаридам, которые имеют степень полимеризации моносахаридных единиц, превышающую 2, более предпочтительно превышающую 3, еще более предпочтительно превышающую 4, наиболее предпочтительно превышающую 10, которые не перевариваются или только частично перевариваются в кишечнике под действием кислот или пищеварительных ферментов, присутствующих в верхней части пищеварительного тракта человека (тонкий кишечник и желудок), но которые сбраживаются кишечной флорой человека и предпочтительно не содержат кислых групп. Нейтральный олигосахарид структурно (химически) отличается от кислого олигосахарида. Термин «нейтральные олигосахариды» в применяемом в настоящем изобретении значении предпочтительно относится к сахаридам, которые имеют степень полимеризации олигосахарида менее 60 моносахаридных единиц, предпочтительно менее 40, еще более предпочтительно менее 20, наиболее предпочтительно менее 10. Термин «моносахаридная единица» относится к единице, имеющей замкнутую кольцевую структуру, предпочтительно к гексозе, например, в пиранозной или фуранозной формах. Нейтральный олигосахарид предпочтительно включает, по меньшей мере, 90%, более предпочтительно, по меньшей мере, 95% моносахаридных единиц, выбираемых из группы, состоящей из маннозы, арабинозы, фруктозы, фукозы, рамнозы, галактозы, α-D-галактопиранозы, рибозы, глюкозы, ксилозы и их производных, в расчете на общее число содержащихся в нем моносахаридных единиц. Пригодные нейтральные олигосахариды предпочтительно сбраживаются кишечной флорой. Олигосахарид предпочтительно выбирается из группы, состоящей из: целлобиозы (4-O-β-D-глюкопиранозил-D-глюкоза), целлодекстринов ((4-O-β-D-глюкопиранозил)n-D-глюкоза), В-циклодекстринов (циклические молекулы α-1-4-связанной D-глюкозы; α-циклодекстрин-гексамер, β-циклодекстрин-гептамер и γ-циклодекстрин-октамер), неперевариваемого декстрина, гентиоолигосахаридов (смесь р-1-6-связанных остатков глюкозы с некоторым количеством 1-4 связей), глюкоолигосахаридов (смесь α-D-глюкозы), изомальтоолигосахаридов (линейные α-1-6-связанные остатки глюкозы с некоторым количеством 1-4 связей), изомальтозы (6-О-α-D-глюкопиранозил-D-глюкоза); изомалтриозы (6-O-α-D-глюкопиранозил-(1-6)-α-D-глюкопиранозил-D-глюкоза), панозы (6-O-α-O-глюкопиранозил-(1-6)-α-D-глюкопиранозил-(1-4)-D-глюкозы), лейкрозы (5-O-α-О-глюкопиранозил-О-фруктопиранозид), палатинозы или изомальтулозы (6-O-α-D-глюкопиранозил-D-фруктоза), теандерозы (O-α-В-глюкопиранозил-(1-6)-O-α-D-глюкопиранозил-(1-2)-В-O-фруктофуранозид), D-агатозы, D-lyxo-гексулозы, лактосахарозы (O-β-D-галактопиранозил-(1-4)-O-α-D-глюкопиранозил-(1-2)-β-D-фруктофуранозид), α-галактоолигосахаридов, включая раффинозу, стахиозу и другие олигосахариды сои (O-α-D-галактопиранозил-(1-6)-α-D-глюкопиранозил-β-D-фруктофуранозид), β-галактоолигосахаридов или трансгалакто-олигосахаридов (p-D-галактопиранозил-(1-6)-[β-D-глюкопиранозил]n-(1-4) α-D глюкоза), лактулозы (4-O-β-D-галактопиранозил-D-фруктоза), 4'-галактосиллактозы (0-D- галактопиранозил-(1-4)-O-β-D-глюкопиранозил-(1-4)-D-глюкопираноза), синтетического галактоолигосахарида (неогалактобиоза, изогалактобиоза, галсахароза, изолактоза I, II и III), фруктанов типа Левана (β-D-(2→б)-фруктофуранозил)n α-D-глюкопиранозид), фруктанов типа Инулина (β-D-((2→1)-фруктофуранозил)n α-D-глюкопиранозид), 1 f-β-фруктофуранозилнистозы (β-((2→1)-фруктофуранозил)n B-D-фруктофуранозид), ксилоолигосахаридов (B-D-((1→4)-ксилоза)n, лафинозы, лактосахарозы и арабиноолигосахаридов.
Согласно еще одному предпочтительному воплощению нейтральный олигосахарид выбирается из группы, состоящей из фруктанов, фруктоолигосахаридов, неперевариваемых декстринов, галактоолигосахаридов (включая трансгалактоолигосахариды), ксилоолигосахаридов, арабиноолигосахаридов, глюкоолигосахаридов, манноолигосахаридов, фукоолигосахаридов и их смесей. Наиболее предпочтительно нейтральный олигосахарид выбирается из группы, состоящей из фруктоолигосахаридов, галактоолигосахаридов и трансгалактоолигосахаридов.
Пригодные олигосахариды и способы их получения более подробно описаны в работе Laere K.J.M. (Laere, K.J.M., Degradation of structurally different non-digestible oligosaccharides by intestinal bacteria: glycosylhydrolases of Bi. adolescentis. PhD-thesis (2000), Wageningen Agricultural University, Wageningen, The Netherlands), которая включается в настоящее изобретение путем отсылки во всей своей полноте. Трансгалактоолигосахариды (TOS), например, продаются под торговой маркой Vivinal™ (Borculo Domo Ingredients, Netherlands). Неперевариваемый декстрин, который может быть получен путем пиролиза кукурузного крахмала, включает α(1→4) и α(1→6) гликозидные связи, которые присутствуют в нативном крахмале, и содержит 1→2 и 1→3 связи и левоглюкозан. Благодаря этим структурным особенностям, неперевариваемый декстрин содержит хорошо развитые разветвленные частички, которые частично гидролизуются пищеварительными ферментами человека. Специалистам в данной области техники известны другие многочисленные коммерчески легкодоступные источники неперевариваемых олигосахаридов. Например, трансгалактоолигосахарид доступен от фирмы Yakult Honsha Co., Tokyo, Japan. Олигосахарид соевых бобов доступен от фирмы Calpis Corporation и распространяется фирмой Ajinomoto U.S.A. Inc., Teaneck, N.J.
В еще одном предпочтительном воплощении композиция согласно настоящему изобретению включает кислый олигосахарид со значением DP от 2 до 250, полученный из пектина, альгината и их смесей, и нейтральный олигосахарид, выбираемый из группы, включающей фруктаны, фруктоолигосахариды, неперевариваемые декстрины, галактоолигосахариды, включая трансгалактоолигосахариды, ксилоолигосахариды, арабиноолигосахариды, глюкоолигосахариды, манноолигосахариды, фукоолигосахариды и их смеси.
В еще одном предпочтительном воплощении композиция согласно настоящему изобретению включает два химически различающихся нейтральных олигосахарида. Было обнаружено, что введение кислых олигосахаридов в комбинации с двумя химически различающимися нейтральными олигосахаридами обеспечивает оптимальный синергетический иммуностимулирующий эффект.
Предпочтительно композиция согласно настоящему изобретению включает:
- кислый олигосахарид, как определено выше;
- нейтральный олигосахарид на основе галактозы (в котором больше чем 50% моносахаридных единиц представляют собой единицы галактозы), предпочтительно выбираемый из группы, состоящей из галактоолигосахарида и трансгалактоолигосахарида; и
- нейтральный олигосахарид на основе фруктозы и/или глюкозы (в котором больше чем 50% моносахаридных единиц представляют собой единицы фруктозы и/или глюкозы, предпочтительно фруктозы), предпочтительно инулин, фруктан, и/или фруктоолигосахарид, наиболее предпочтительно длинноцепочечный фруктоолигосахарид (со средним значением DP от 10 до 60).
Смесь кислых и нейтральных олигосахаридов предпочтительно вводится в количестве от 10 мг до 100 граммов в день, предпочтительно от 100 мг до 25 граммов в день, еще более предпочтительно от 0,5 до 20 граммов в день.
Белковый материал
Белковый материал состоит из компонентов, образованных из аминокислот. Термин «аминокислоты» в используемом здесь значении включает аминокислотные остатки (например, в составе пептидов). В частности, термин «белковый материал» включает свободные аминокислоты, соли аминокислот, эфиры аминокислот, аминокислотные остатки, связанные с конъюгированными молекулами и пептидами, включая белки. Аналогичным образом, когда делается ссылка на конкретную аминокислоту, например, лейцин, имеется в виду, что это включает конкретную аминокислоту (остаток), присутствующую в виде соли, в связанной форме, а также в виде конкретной свободной аминокислоты.
Под пептидом понимается комбинация из двух или более аминокислот, соединенных одной или большим числом пептидных связей. Входящие в состав пептидов аминокислоты называются аминокислотными остатками. Пептиды включают в себя олигопептиды и полипептиды, включая белки.
Под полипептидом понимается пептидная цепь, включающая 14 или более аминокислотных остатков. Под олигопептидом понимается пептидная цепь, включающая от 2 до 13 аминокислотных остатков.
Хиральные аминокислоты, присутствующие в композиции настоящего изобретения, могут находиться в L-форме или в D-форме. Как правило, хиральные аминокислоты, присутствующие в композиции настоящего изобретения, находятся в L-форме.
В одном воплощении жидкая композиция согласно настоящему изобретению включает, по меньшей мере, 7 г/100 мл белкового материала, предпочтительно, по меньшей мере, 8 г/100 мл, предпочтительно, по меньшей мере, 9 г/100 мл, наиболее предпочтительно, по меньшей мере, 10 г/100 мл.
Белковый материал в композиции настоящего изобретения обеспечивает, по меньшей мере, 18 эн.%, предпочтительно, по меньшей мере, 20 эн.%, более предпочтительно, по меньшей мере, 22 эн.% всей композиции. Белковый материал в композиции настоящего изобретения обычно обеспечивает 50 эн.% или меньше, предпочтительно 40 эн.% или меньше, или более предпочтительно 32 эн.% или меньше от всей композиции.
Белковый материал предпочтительно включает в себя, по меньшей мере, один источник белка, выбираемый из группы, включающей белок сыворотки, казеин, казеинат, соевый белок и белок пшеницы, предпочтительно из группы, включающей белок сыворотки и казеин. Указанный источник белка или его часть могут быть модифицированы, в частности, путем (частичного) гидролиза.
Под белками сыворотки понимаются глобулярные белки, которые могут быть выделены из молочной сыворотки. В частности, глобулярные белки сыворотки могут выбираться из бета-лактоглобулина, альфа-лактальбумина и сывороточного альбумина, включая их смеси. Примерами смесей, которые включают белки сыворотки, являются изолят сыворотки и концентрат сыворотки.
В одном воплощении белковый материал включает сыворотку, в частности, по меньшей мере, 10 масс.% от общей массы белкового материала, предпочтительно, по меньшей мере, 15 масс.% от общей массы белкового материала. Как правило, фракция сыворотки составляет 50 масс.% или меньше от общей массы белкового материала, в частности, 40 масс.% или меньше от общей массы белкового материала.
В случае жидкой композиции, в частности, концентрация денатурированной сыворотки предпочтительно не превышает 35 масс.% от общей массы белкового материала. Это является выгодным с точки зрения устранения риска желирования в процессе хранения.
Присутствие сыворотки может обеспечивать несколько преимуществ. Сыворотка демонстрирует выгодное поведение в плане высвобождения аминокислот, как с точки зрения скорости высвобождения аминокислот, так и с точки зрения тенденции делать аминокислоты доступными для поглощения организмом, практически одновременно.
Выгодное поведение в плане высвобождения аминокислот может быть дополнительно усилено путем (незначительного) гидролиза, по меньшей мере, части сыворотки, как правило, до степени, когда до 20% белка гидролизуется до свободных аминокислот, предпочтительно до степени, когда до 10% белка гидролизуется до свободных аминокислот.
Для указанного усиливающего эффекта, как правило, 50 масс.% сыворотки или меньше (незначительно) гидролизуется, в частности, 10-50 масс.%.
Если это является желательным, свободная аминокислота или часть свободной аминокислоты может быть удалена из гидролизата. Пригодные для этого методы хорошо известны, например, фильтрация, хроматография или абсорбция.
В качестве источника белков сыворотки предпочтительно выбирается фракция сыворотки, включающая меньше чем 20 масс.% гликомакропептида казеина (GMP), более предпочтительно меньше чем 10 масс.%.
Содержание бета-лактоглобулина предпочтительно составляет больше, чем 40 масс.%, более предпочтительно 46-80 масс.%. Это является выгодным, поскольку бета-лактоглобулин имеет относительно высокое содержание лейцина.
При применении в качестве интактного белка, казеин предпочтительно включает высокую концентрацию бета-казеина, в частности, больше чем 36 г/100 г казеина, более конкретно, 38-70 г/100 г казеина.
В одном воплощении, по меньшей мере, часть белкового материала присутствует в форме свободных аминокислот, их солей, или в виде конъюгата с конъюгирующей молекулой, отличающейся от белка или пептида, где указанный конъюгат способен расщепляться до свободной аминокислоты (или ее соли) и конъюгирующего соединения под влиянием компонентов желчи и/или секрета поджелудочной железы в двенадцатиперстной кишке и/или подвздошной кишке. В одном воплощении количество аминокислоты в такой форме, в частности, в форме соли или в свободной форме, составляет до 15 масс.% от общей массы белкового материала, предпочтительно 0,5-14 масс.%.
Содержание пептидов (олигопептида, полипептида, белка) по отношению к белковому материалу, как правило, составляет, по меньшей мере, 50 масс.%, по меньшей мере, 60 масс.% или, по меньшей мере, 75 масс.%. Процент (по массе) пептида по отношению к белковому материалу, как правило, составляет до 99 масс.%, предпочтительно до 94 масс.%, более предпочтительно 89 масс.%.
Преимуществом композиции, в которой содержание пептида является высоким (>50 масс.%), является то, что по своим вкусовым или другим органолептическим свойствам такая композиция обычно лучше воспринимается при (пероральном) употреблении. Кроме того, поглощение аминокислот организмом может быть более постепенным.
В конкретном воплощении композиция настоящего изобретения включает лейцин в форме свободной аминокислоты, соли, дипептида или конъюгата с конъюгирующим соединением, не являющимся аминокислотой, белком или пептидом, где указанный конъюгат способен расщепляться до свободной аминокислоты (или ее соли) предпочтительно в кишечнике или желудке или после поглощения клетками эпителия кишечника или печени.
Предпочтительно, по меньшей мере, 35 масс.%, более предпочтительно, по меньшей мере, 40 масс.% лейцина, по отношению к общему содержанию лейцина в белковом материале, присутствует в форме пептида (олигопептида, полипептида, белка), предпочтительно в форме полипептидов и/или (интактных) белков.
До 100 масс.%, предпочтительно до 80 масс.% лейцина, по отношению к общему содержанию лейцина в белковом материале, присутствует в форме пептида (олигопептида, полипептида, белка), более предпочтительно в форме одного или более полипептидов и/или одного или более (интактных) белков.
Содержание лейцина в композиции настоящего изобретения составляет, по меньшей мере, 12 масс.%, по меньшей мере, 13 масс.%, по меньшей мере, 16 масс.% или, по меньшей мере, 19 масс.% по отношению к общей массе белкового материала. Как правило, содержание лейцина составляет 50 масс.% или меньше, в частности, может составлять 30 масс.% или меньше, 25 масс.% или меньше или 23 масс.% или меньше по отношению к общей массе белкового материала. В одном воплощении содержание лейцина составляет от 12 до 23 масс.% по отношению к общей массе белкового материала.
Преимущественно композиция настоящего изобретения может включать глутамин.
В случае его присутствия, содержание глутамина составляет, по меньшей мере, 4 масс.%, предпочтительно, по меньшей мере, 5 масс.% по отношению к общей массе белкового материала. В одном воплощении содержание глутамина составляет от 4 до 20 масс.%, предпочтительно от 5 до 10 масс.% по отношению к общей массе белкового материала.
Преимущественно композиция настоящего изобретения может включать одну или более аминокислот из группы цистина, цистеина и эквивалентов цистеина, таких как N-ацетилцистеин, предпочтительно в количестве, по меньшей мере, 0,8 масс.% по отношению к общей массе белкового материала. Как правило, содержание цистина, цистеина и эквивалентов цистеина составляет 11 масс.% или меньше, в частности, составляет 8 масс.% или меньше по отношению к общей массе белкового материала. В одном воплощении содержание цистина, цистеина и эквивалентов цистеина составляет от 0,8 до 8 масс.% по отношению к общей массе белкового материала.
Гомеостаз глутатиона в лейкоцитах играет важную роль в функционировании иммунной системы. В экспериментах с мышами, имеющими опухоли, авторы настоящего изобретения обнаружили, что уровни глутатиона в печени были значительно понижены. Неожиданно дальнейшие эксперименты авторов настоящего изобретения показали, что под влиянием глутамина и/или цистеина, который присутствует в композиции настоящего изобретения, происходит, по меньшей мере, частичная нормализация уровня глутатиона в клетках печени. Особенно хорошие результаты были получены, когда в композиции присутствовали обе указанные аминокислоты.
На основании этих экспериментов авторами настоящего изобретения было обнаружено, что композиция настоящего изобретения, включающая глутамин или цистеин, предпочтительно в указанной выше концентрации, является особенно эффективной для улучшения состояния иммунной системы у млекопитающего. Кроме того, было обнаружено, что совместное присутствие глутамина и цистеина в композиции настоящего изобретения является даже более эффективным для улучшения состояния иммунной системы у млекопитающего.
В одном воплощении положительный эффект глутамина и/или цистеина на состояние иммунной системы млекопитающего был получен с применением композиции настоящего изобретения, включающей белок сыворотки и казеин.
В композиции согласно настоящему изобретению весовое отношение лейцин/(валин + изолейцин), как правило, равно 1,0 или больше, предпочтительно 1,05 или больше.
В общем продукте содержание незаменимых аминокислот, как правило, составляет, по меньшей мере, 49 масс.%; предпочтительно 49-80 масс.%, более предпочтительно 52-70 масс.% от белкового материала сформировано незаменимыми аминокислотами.
Содержание лизина, как правило, составляет 7,0-15 г/100 г белкового материала, предпочтительно от 7,5 до 14 г/100 г белкового материала.
Липидная фракция
В композиции настоящего изобретения липидная фракция, как правило, обеспечивает, по меньшей мере, 10 эн.%, предпочтительно, по меньшей мере, 25 эн.% или более предпочтительно, по меньшей мере, 25% эн.% от всей композиции. Липидная фракция в композиции настоящего изобретения, как правило, обеспечивает 50 эн.% или меньше, предпочтительно 40 эн.% или меньше, или более предпочтительно 35 эн.% или меньше от всей композиции.
Под термином «липидная фракция» понимается фракция, включающая один или более липидов, включая жирные кислоты, производные жирных кислот (включая три-, ди- и моноглицериды и фосфолипиды) и стеринсодержащие метаболиты, такие как холестерин.
Как указывалось выше, композиция настоящего изобретения включает, по меньшей мере, одну ω-3 полиненасыщенную жирную кислоту, выбираемую из группы, состоящей из эйкозапентаеновой кислоты (ЕРА), докозагексаеновой кислоты (DHA), эйкозатетраеновой кислоты (ЕТА) и докозапентаеновой кислоты (DPA).
Композиция настоящего изобретения может дополнительно включать ω-3 и/или ω-6 полиненасыщенные жирные кислоты, в частности, таковые, содержащие от 18 до 26 атомов углерода, например, линоленовую кислоту (LA), альфа-линоленовую кислоту (ALA), гамма-линоленовую кислоту (GLA), дигомо-гамма-линоленовую кислоту (DGLA) и арахидоновую кислоту (АА).
Для получения положительного эффекта на иммунную функцию содержание ω-3 ненасыщенной жирной кислоты, как правило, составляет, по меньшей мере, 10 масс.%, предпочтительно, по меньшей мере, 15 масс.% от общего содержания липидов.
В еще одном воплощении композиция настоящего изобретения включает стеаридоновую кислоту (SDA). Сообщается, что пищевые масла, содержащие SDA, являются пищевым источником ω-3 жирных кислот, которые могут быть более эффективными в увеличении концентраций ЕРА и DPA в тканях, чем широко употребляемые ALA-содержащие масла. Предпочтительно липидная фракция в композиции настоящего изобретения включает больше чем 0,5 масс.% SDA, более предпочтительно больше, чем 0,6 масс.% SDA, все еще более предпочтительно больше, чем 1,2 масс.% SDA по отношению к общим липидам. Максимальное количество более или менее ограничивается конкретным используемым источником (типом жира морских рыб), но жиры морских рыб с количеством SDA от 2 масс.% до примерно 5 масс.% (по отношению к общему содержанию липидов в данном жире) являются коммерчески доступными. Предпочтительно количество SDA в липидной фракции находится в диапазоне от 0,5 до 5 масс.% по отношению к общим липидам. Предпочтительно, чтобы количество SDA было относительно высоким по сравнению таковым докозагексаеновой кислоты (DHA) и/или линолевой кислоты (LA). Это обеспечивает высокую эффективность и получение вкусных продуктов, содержащих малые количества окисленных продуктов. Таким образом, в эффективных воплощениях продукта согласно настоящему изобретению весовое отношение SDA к DHA составляет, по меньшей мере, 0,22, предпочтительно, по меньшей мере, 0,25, более предпочтительно, по меньшей мере, 0,30.
Композиция настоящего изобретения может, в частности, представлять собой композицию, в которой, по меньшей мере, 55 масс.% липидной фракции, предпочтительно триглицеридные масла, включают, по меньшей мере, 4 масс.% одной или более из эйкозапентаеновой кислоты и докозагексаеновой кислоты.
В композиции настоящего изобретения липидная фракция включает меньше, чем 30 масс.% насыщенной жирной кислоты, предпочтительно меньше, чем 22 масс.% по отношению к общему содержанию липидов.
Отношение ω-3 к ω-6 полиненасыщенным жирным кислотам может быть выбрано в широком диапазоне, например, от 0,2 до 10 или от 0,4 до 3,0. В частности, отношение ω-3 к ω-6 полиненасыщенным жирным кислотам составляет меньше, чем 1,0, предпочтительно 0,97 или меньше, более предпочтительно 0,95 или меньше. Это отношение предпочтительно больше чем 0,5 или больше, более предпочтительно, 0,6 или больше. В частности, предпочтительно это отношение составляет от 0,5 до 0,97, более предпочтительно от 0,6 до 0,95.
Углеводная фракция
В одном воплощении композиция настоящего изобретения включает перевариваемую углеводную фракцию, обеспечивающую, по меньшей мере, 20 эн.%, предпочтительно, по меньшей мере, 30 эн.% или более предпочтительно, по меньшей мере, 38 эн.% от всей композиции.
Фракция перевариваемых углеводов в композиции настоящего изобретения, как правило, обеспечивает 70 эн.% или меньше, предпочтительно 60 эн.% или меньше, более предпочтительно 48 эн.% от всей композиции.
Под термином фракция «перевариваемых углеводов» понимается фракция, включающая один или более перевариваемых углеводов.
Перевариваемые углеводы включают мальтодекстрозу, мальтозу и глюкозу. В частности, углевод считается перевариваемым в том случае, когда более чем 90% быстрых углеводов переваривается в течение 20 минут в соответствии с методом Энквиста.
Состав углеводной фракции, главным образом, может быть подобран для достижения желаемого потребления углеводов и в соответствии с желаемой продукцией инсулина после употребления композиции. В соответствии с этим, в частности, композиция должна отвечать одному или более из следующих критериев в отношении содержания углеводов, которое рассматривается как желательное.
В одном воплощении меньше чем 75 масс.% углеводов должно приходиться на суммарное содержание сахарозы и мальтодекстрина.
В одном воплощении, по меньшей мере, 40 масс.% от общего содержания углеводов приходится на медленно перевариваемые углеводы, то есть, в частности, на углеводы, которые перевариваются медленнее, чем мальтодекстроза, мальтоза и глюкоза.
В одном воплощении композиция согласно настоящему изобретению включает меньше чем 60 масс.%, предпочтительно 20-50 масс.% от общего содержания углеводов, быстро перевариваемые углеводы, в частности, мальтодекстрозу, мальтозу, глюкозу и другие углеводы, которые перевариваются, по меньшей мере, так же быстро.
В одном воплощении больше чем 20 масс.% от общего содержания углеводов приходится, по меньшей мере, на один дисахарид, предпочтительно 22-60 масс.%. В частности, в таком воплощении дисахарид предпочтительно выбирается из группы, состоящей из сахарозы, трегалозы, палатинозы, лактозы и других низкогликемических дисахаридов, более предпочтительно из трегалозы и палатинозы.
В одном воплощении в композиции присутствует, по меньшей мере, один моносахарид, не являющийся глюкозой. Предпочтительно указанный моносахарид выбирается из группы, состоящей из галактозы, маннозы и рибозы. Предпочтительно общее количество указанного моносахарида(ов) составляет 0,5-30 масс.%, более предпочтительно 5-25 масс.% по отношению к общему содержанию углеводов.
В частности, присутствие рибозы является выгодным, предпочтительно в комбинации с (эндогенной) фолиевой кислотой, для увеличения синтеза белка. Было обнаружено, что комбинация этих двух соединений обеспечивает увеличение продукции гуанозинтрифосфата у млекопитающего, что приводит к увеличению синтеза белка через стимуляцию эукариотического фактора инициации 2 В, особенно у истощенных пациентов. Фолиевая кислота может быть предоставлена в одной или более из следующих форм: свободная фолиевая кислота, фолиновая кислота, формилированная фолиевая кислота, метилированная фолиевая кислота, предпочтительно в восстановленной форме или в виде моно- или полиглутаматного конъюгированного производного. В случае ее присутствия в композиции, содержание фолиевой кислоты, как правило, составляет, по меньшей мере, 95 мкг на 100 ккал углеводов, предпочтительно 110-400 мкг на 100 ккал углеводов, более предпочтительно 125-300 мкг на 100 ккал углеводов.
Было обнаружено, что в отношении улучшения иммунной функции, в особенности клеточной иммунной функции, является выгодным, чтобы композиция имела относительно низкий гликемический индекс. Композиция, имеющая низкий гликемический индекс, является выгодной также и с той точки зрения, что она может иметь более высокую эффективность в отношении предотвращения или, по меньшей мере, уменьшения числа и снижения тяжести инфекций, или предотвращения или, по меньшей мере, уменьшения осложнений, связанных с инфекциями (например, воспаления, являющегося результатом инфекции). Кроме того, было обнаружено, что низкий гликемический индекс композиции согласно настоящему изобретению может вносить свой вклад в предотвращение воспалительных реакций или снижение их тяжести. В частности, не будучи связанным теорией, можно думать, что появление высоких пиковых концентраций глюкозы в крови после употребления (обычной) композиции, имеющей высокий гликемический индекс, может вносить свой вклад в начало хронического воспаления или может делать имеющееся хроническое воспаление более тяжелым. Это в свою очередь усиливает подавление (клеточного) иммунитета. Поскольку введение композиции с низким гликемическим индексом субъекту обычно приводит к более медленному высвобождению глюкозы в кровь, можно думать, что композиция с относительно низким гликемическим индексом может обладать улучшенной эффективностью по сравнению с продуктом, имеющим относительно высокий гликемический индекс, по меньшей мере, в конкретных воплощениях.
В соответствии с этим, в конкретном воплощении композиция представляет собой питательную композицию с низким гликемическим индексом. В частности, считается предпочтительным, чтобы гликемический индекс композиции был ниже 55, в частности, ниже 50, предпочтительно ниже 45. На практике гликемический индекс (композиции, включающей перевариваемые углеводы) будет выше 0 и обычно будет равен, по меньшей мере, 1, в частности, по меньшей мере, 5. Детали определения гликемического индекса композиции представлены в приведенных ниже Примерах.
Квалифицированный специалист сможет составить композицию с относительно низким гликемическим индексом, основываясь на приведенной в настоящем изобретении информации и обычных знаниях. В частности, путем увеличения процента углевода, который переваривается более медленно, чем глюкоза, или путем увеличения процента углеводов, которые предоставляют меньше остатков глюкозы на единицу массы, чем сама глюкоза, гликемический индекс композиции (при прочих равных условиях) может быть снижен. Предпочтительными примерами углеводов, которые перевариваются более медленно, чем глюкоза, являются изомальтулоза, фруктоза, галактоза, лактоза, трегалоза. Помимо этого, добавление жиров и волокон может замедлять освобождение кишечника. Более того, волокна могут формировать в кишечнике физический барьер, снижающий скорость всасывания. Аминокислоты, образующиеся из белка, могут увеличивать секрецию инсулина (особенно лейцин) и, таким образом, увеличивать поглощение глюкозы клетками. Все эти механизмы могут вносить свой вклад в снижение гликемического индекса.
Питательная композиция
Под питательной композицией понимается композиция, которая включает натуральные компоненты, которые предпочтительно можно найти в продуктовых магазинах, которые имеются в свободной продаже в качестве питательных добавок, функциональных продуктов питания или пищевых ингредиентов, то есть продаются без рецепта врача или ветеринара. Питательная композиция может также представлять собой диетическую пищу, предназначенную для диетической коррекции болезни или состояния организма млекопитающего под контролем врача или ветеринара.
Композиция согласно настоящему изобретению может быть в форме жидкости, например, напитка, в полужидкой форме, например, йогурта или крема, в форме геля, например, желейного кекса, или в твердой форме, например, сладкого батончика или мороженого.
В одном воплощении жидкая композиция готовится из концентрата, например, из жидкости (например, с вязкостью меньше, чем примерно 80 мП), из полужидкого концентрата (например, с вязкостью больше, чем примерно 80 мП и меньше, чем примерно 400 мП), из геля или из твердого вещества. Для такого приготовления для разбавления концентрата может применяться вода. В частности, такое приготовление производится непосредственно перед приемом композиции, например, на манер быстрорастворимого продукта.
Одно конкретное воплощение настоящего изобретения представляет собой питательную композицию, включающую белковый материал, липид и перевариваемый углевод, в которой:
а) содержание белкового материала обеспечивает от 18 до 50 эн.%, предпочтительно от 20 до 40 эн.%, более предпочтительно от 22 до 32 эн.% от всей композиции;
б) содержание липида обеспечивает от 10 до 50 эн.%, предпочтительно от 20 до 40 эн.%, более предпочтительно от 25 до 35 эн.% от всей композиции;
в) содержание перевариваемого углевода обеспечивает от 20 до 70 эн.% предпочтительно от 30 до 60 эн.%, более предпочтительно от 38 до 48 эн.% от всей композиции.
Общая энергетическая ценность жидкой композиции согласно настоящему изобретению может выбираться в широких пределах, например, от 0,2 до 4 ккал/мл. Как правило, она составляет, по меньшей мере, 0,3 ккал/мл, в частности, по меньшей мере, 0,8 ккал/мл, более предпочтительно, по меньшей мере, 1,2 ккал/мл. Как правило, она составляет 3,0 ккал/мл или меньше, в частности, 2,6 ккал/мл или меньше, более предпочтительно 2,4 ккал/мл или меньше. В конкретном воплощении жидкая композиция согласно настоящему изобретению имеет энергетическую ценность в диапазоне от 0,3 до 3 ккал/мл, предпочтительно от 0,8 до 2,6 ккал/мл, более предпочтительно от 1,2 до 2,4 ккал/мл.
В другом конкретном воплощении жидкая композиция согласно настоящему изобретению имеет энергетическую ценность в диапазоне от 0,2 до 1,0 ккал/мл, предпочтительно от 0,4 до 0,9 ккал/мл.
Факторы, которые играют роль в определении желательной энергетической ценности, включают легкость достижения более высокого эн.% белкового материала, с одной стороны, и быстрое освобождение желудка (увеличенный анаболический ответ), с другой стороны.
Общая энергетическая ценность полужидкой, гелеобразной или твердой композиции согласно настоящему изобретению может выбираться в широких пределах, например, от 1 до 15 ккал/г. Как правило, она составляет, по меньшей мере, 2 ккал/г, предпочтительно, по меньшей мере, 2,8 ккал/г, еще более предпочтительно, по меньшей мере, 3,2 ккал/г. Как правило, она составляет 12 ккал/г или меньше, предпочтительно 10 ккал/г или меньше, еще более предпочтительно 8,0 ккал/г или меньше. В конкретном воплощении полужидкая, гелеобразная или твердая композиция согласно настоящему изобретению имеет энергетическую ценность в диапазоне от 3,2 до 8,0 ккал/г.
Дополнительные компоненты
В одном воплощении композиция может включать один или более других дополнительных компонентов, таких, как, по меньшей мере, один компонент, выбираемый из группы, состоящей из минеральных веществ, микроэлементов и витаминов, предпочтительно, выбираемых из группы, состоящей из натрия, калия, хлорида, фторида, йодида, кальция, фосфора, магния, витамина А, витамина D3, витамина Е, витамина К, витамина В1, витамина В2, витамина В3, витамина В5, витамина В6, фолиевой кислоты, витамина В12, биотина витамина С, липоевой кислоты, цинка, железа, меди, марганца, молибдена, селена и хрома.
Такие компоненты могут присутствовать в концентрации до рекомендуемой дневной дозы в дневной порции композиции.
Цинк предпочтительно присутствует в концентрации, по меньшей мере, 2,8 мг на 100 ккал углеводов, более предпочтительно 5,6-20 мг на 100 ккал углеводов, еще более предпочтительно 6-15 мг на 100 ккал углеводов.
Препарат с замедленным высвобождением
В предпочтительном воплощении композиция согласно настоящему изобретению дополнительно включает препарат с замедленным высвобождением, который эффективно обеспечивает высвобождение аминокислот в двенадцатиперстной кишке и/или подвздошной кишке, указанный препарат включает, по меньшей мере, один компонент, выбираемый из группы, состоящей из аминокислот в форме свободных аминокислот, аминокислот в форме солей и аминокислот в форме конъюгата с конъюгирующим соединением, не являющимся белком, где данный конъюгат способен расщепляться до свободной аминокислоты (или ее соли) и конъюгирующего соединения под воздействием компонентов желчи и/или секрета поджелудочной железы в двенадцатиперстной кишке и/или подвздошной кишке.
Аминокислота в форме замедленного высвобождения предпочтительно суспендируется в жидком, полужидком или твердом продукте.
Препарат с замедленным высвобождением может быть приготовлен с применением обычных методов. Аминокислота(ы) может быть покрыта рН-чувствительным материалом, который растворяется при значения рН в двенадцатиперстной кишке/подвздошной кишке (около рН 7,0), но не в желудке (сильно кислая среда). Такие покрытия хорошо известны в данной области техники. Примерами конъюгирующих молекул являются молекулы, образующие определенные пептиды с аминокислотой, не расщепляемые пепсином или, по меньшей мере, не эффективно расщепляемые в физиологических условиях. Примерами являются холин, бетаин, диметилглицин и саркозин. Другие подходящие конъюгирующие молекулы включают фосфолипиды, лизофосфолипиды и глицерин.
Аминокислоты, которые предпочтительно присутствуют в препарате с замедленным высвобождением, предпочтительно выбираются из лейцина и других незаменимых аминокислот, в частности, метионина, аргинина, триптофана, фенилаланина и лизина, среди которых наиболее предпочтительным является лейцин.
В предпочтительном воплощении композиция согласно настоящему изобретению вводится в режиме лекарства. В частности, композиция может применяться как адъювант лекарства, такого как выбранного из группы, состоящей из противораковых лекарств, антиретровирусных лекарств, противогипертензивных лекарств, противотромбозных лекарств, антидепрессантов и противодиабетических лекарств. В частности, полезно принимать данный продукт с метформином или другим противодиабетическим лекарством. В частности, учитывается, что эти лекарства стабильны в композиции согласно настоящему изобретению и очень эффективны. Указанное лекарство может входить в состав композиции согласно настоящему изобретению или может приниматься отдельно.
Настоящее изобретение также касается способа улучшения иммунной системы млекопитающего, включая введение питательной композиции, включающей, по меньшей мере, 18 эн.% белкового материала с содержанием лейцина, по меньшей мере, 9,5 масс.% от общей массы белкового материала, липидную фракцию, включающую, по меньшей мере, одну ω-3-полиненасыщенную жирную кислоту, выбираемую из группы эйкозапентаеновой кислоты (ЕРА), докозагексаеновой кислоты (DHA), эйкозатетраеновой кислоты (ЕТА) и докозапентаеновой кислоты (DPA), и иммуномодулятор.
Композиции настоящего изобретения могут приниматься под контролем специалиста-медика или могут приниматься самостоятельно.
Композиции могут вводиться в кишечник или приниматься перорально.
Млекопитающее предпочтительно представляет собой человека.
Настоящее изобретение будет далее проиллюстрировано с помощью следующих Примеров.
Примеры
ПРИМЕР 1
Материалы и методы
Животные и Диета. Сингенные самцы мышей линии CD2F1 (BALB/c×DBA/2) возрастом шесть-семь недель были получены от Harlan Nederland (Horst, The Netherlands). Все экспериментальные процедуры были одобрены Комитетом по Экспериментальным Животным и выполнялись в соответствии с правилами обращения с лабораторными животными. Животных содержали в индивидуальных клетках в кондиционируемом виварии при постоянной комнатной температуре и влажности. Все животные имели свободный доступ к корму и питьевой воде. После получения животные акклиматизировались в течение одной недели, после чего разделялись на группы случайным образом на основании веса тела. Эксперименты были разделены на: А-эксперименты, предназначенные для оценки эффекта индивидуальных ингредиентов, и В-эксперименты, предназначенные для оценки эффекта полной смеси ингредиентов, которая представляет собой композицию согласно настоящему изобретению. Как в А-, так и в В-экспериментах мышей разделяли на контрольную группу (С), получающую контрольную диету, контрольную группу с опухолью (ТВ), получающую контрольную диету, и экспериментальную группу с опухолью (ТВ-питательной ингредиент). Представленные данные получены в результате нескольких экспериментов на животных с идентичными характеристиками при идентичной постановке экспериментов (если не указано иначе).
Группа с опухолью в А-экспериментах получала диету на основе AIN93-M (Research Diet Services, Wijk bij Duurstede, the Netherlands) с добавлением либо рыбьего жира, включающего ω-3 полиненасыщенные жирные кислоты, выбираемые из группы эйкозапентаеновой кислоты, докозагексаеновой кислоты, эйкозатетраеновой кислоты и докозапентаеновой кислоты (TB-FO), определенной смеси олигосахаридов в качестве иммунного модулятора (TB-SOM), или корма с высоким содержанием белка, обогащенного лейцином (TB-HPrleu) в виде кормовых гранул, а в В-экспериментах получала диету с комбинацией рыбьего жира, определенной смеси олигосахаридов и богатого белком/лейцином корма (TB-SNC). Последняя диета отличалась по составу пищевых макрокомпонентов от корма AIN93-M в целях получения более гуманизированной диеты и предоставлялась в виде густой массы в связи с техническими особенностями ее производства.
Контрольная диета в А-экспериментах содержала на 1 кг корма: 126 г белка (100 масс.% казеин), 727 г углеводов и 40 г жира (100 масс.% соевое масло). Экспериментальные диеты в А-экспериментах были адаптированы путем добавления 22,1 г рыбьего жира (обеспечивает 6,9 г ЕРА и 3,1 г DHA) на 1 кг корма (TB-FO), 18 г короткоцепочечных галактоолигосахаридов (Vivinal GOS, Friesland Domo Foods, Zwolle, The Netherlands) и 2 г короткоцепочечных фруктоолигосахаридов (Beneo p95, Orafti, Wijchen, The Netherlands) на 1 кг корма (TB-SOM) или 151 г казеина/кг и 16 г лейцина/кг корма (TB-HPrleu).
Контрольная диета в В-эксперименте содержала больше жира и больше смеси жиров Западного типа, хотя диета была изокалорийной и имела тот же состав питательных компонентов, что и контрольная диета в А-экспериментах, на 1 кг корма: 126 г белка (100 масс.% казеин), 699 г углеводов и 52,6 г жира (100 масс.% кукурузное масло). Эта контрольная диета не оказывала никакого влияния на иммунные параметры в используемой модели на животных (данные не показаны). Экспериментальная диета в В-эксперименте содержала на 1 кг корма: 210 г белка (189 г интактного белка, из которого 68 масс.% составлял казеин и 32 масс.% составляли белки сыворотки, и 21 г свободного лейцина), 561 г углеводов, 52,5 г жиров (20,2 г кукурузное масло, 10,2 г рапсовое масло и 22,1 г рыбий жир (обеспечивает 6,9 г БРА и 3,1 г DHA), 18 г короткоцепочечных галактоолигосахаридов и 2 г короткоцепочечных фруктоолигосахаридов.
Методика Эксперимента. Для индукции кахексии (общего истощения) у мышей применялись клетки аденокарциномы толстой кишки - 26 мышей. Коротко: в день 0 мышам CD2F1 в группах с опухолью под общей анестезией (изофлуран/H2/O2) были инокулированы опухолевые клетки (5×105 клеток в 0,2 мл) подкожно в паховую область с правой стороны. Животным в контрольной группе вводили в качестве симуляции 0,2 мл HBSS. Три раза в неделю измеряли вес тела (BW), потребление корма и размер опухоли (длина и ширина). Для оценки влияния на иммунную систему в качестве модели in vivo клеточного (Th1-зависимого) иммунитета была определена контактная гиперчувствительность (CHS) к оксазолону. Коротко: в день 8 все животные были сенсибилизированы с помощью 150 мкл 3% раствора оксазолона (4-этоксиметилен-2-фенил-2-оксазолин-5-он, Sigma-Aldrich Chemie, Zwijndrecht, The Netherlands, 300 мг в 7,5 мл 96% этанола и 2,5 мл ацетона), который наносили животным на выбритые грудь и брюхо. После этого в день 13 под общей анестезией была измерена толщина ушной раковины и все животные были подвержены действию гаптена (провокационная проба) путем местного нанесения на ушную раковину 25 мкл 0,8% раствора оксазолона (32 мг в 3 мл 96% этанола и 1 мл ацетона). В день 14 после инокуляции опухоли (через 24 часа после провокационной пробы) под общей анестезией измеряли опухание ушной раковины для определения Th1-иммунного ответа.
В день 20 с помощью пункции сердца была взята кровь, которую помещали в пробирки с гепарином. После умерщвления животных извлекали селезенку, взвешивали ее и помещали в холодную культуральную среду (RPMI-1640, содержащая 25 мМ HEPES и 2 мМ L-глутамин, Life-Technologies, Merelbeke, Belgium, обогащенная 100 Ед/мл пенициллина/стрептомицина) с 10% инактивированной нагреванием фетальной сыворотки теленка (FCShi) для иммунологического анализа. Скелетные мышцы (передняя большеберцовая мышца (m. Tibialis Anterior, mTA), длинный разгибатель пальцев (т.Extensor Digitorum Longus, mEDL), камбаловидная мышца (т.Soleus, mS) и икроножная мышца (т.Gastrocnemius, mG)), опухоль, жир с придатка яичка и тимус были вырезаны, взвешены и заморожены при -80°С (скелетные мышцы).
Результаты
Физиологическая кахексия и иммунные параметры
В день 20 после инокуляции опухоли мыши умерщвлялись, после чего измерялись кахексия и иммунные параметры. Данные, полученные в разных экспериментах с индивидуальными пищевыми ингредиентами или их комбинациями (А-эксперименты), были объединены и представлены в Таблице 1, а данные экспериментов по оценке эффективности полной смеси FO, SOM и богатого белком/лейцином корма (В-эксперимент) представлены в Таблице 2. В экспериментах А вес тела (BW) и вес тушки (CW=BW минус вес опухоли (TW)) достоверно уменьшались (оба) с 24,4 граммов в контрольной группе (С) до 22,8 и 20,7 граммов соответственно в контрольной группе с опухолью (ТВ), тогда как в эксперименте В наблюдаемое уменьшение составило с 25,7 граммов (оба) в контрольной группе С до 20,1 и 18,0 граммов соответственно в группе ТВ. Такое снижение веса может быть вызвано достоверной потерей веса жира и скелетных мышц в группе ТВ. Потребление пищи контролировалось и не изменялось в обоих экспериментах А и В (неопубликованные данные).
Добавление одного из индивидуальных пищевых ингредиентов в диету не приводило к какому-либо достоверному эффекту на BW или CW по сравнению с животными из группы ТВ. Однако диета, содержащая полную смесь FO, SOM и богатого белком/лейцином корма, достоверно увеличивала и BW, и CW с 20,1 и 18,0 граммов соответственно в группе ТВ до 21,9 и 20,3 граммов соответственно в группе TB-SNC (Таблица 2), что указывает на менее кахектическое состояние мышей. Это подтверждается положительным эффектом на другие кахектические проявления, такие как достоверное ингибирование потери веса жира придатка яичка и скелетных мышц, которое отсутствовало после применения диеты с индивидуальными пищевыми ингредиентами. Однако потеря веса как жира придатка яичка, так и скелетной мышцы mTA уже достоверно снижалась после добавления в пищу комбинации FO и богатого белком/лейцином корма (неопубликованные данные).
Как в эксперименте А, так и в эксперименте В вес тимуса достоверно снижался после инокуляции опухоли на 47,9% и 61,7% соответственно, тогда как вес селезенки был больше чем вдвое выше в группе ТВ по сравнению с группой С. После добавления в пищу FO или полной смеси FO, SOM и богатого белком/лейцином корма наблюдалось достоверное ингибирование потери веса тимуса, тогда как ни один из индивидуальных пищевых ингредиентов не влиял на вес селезенки (Таблица 2).
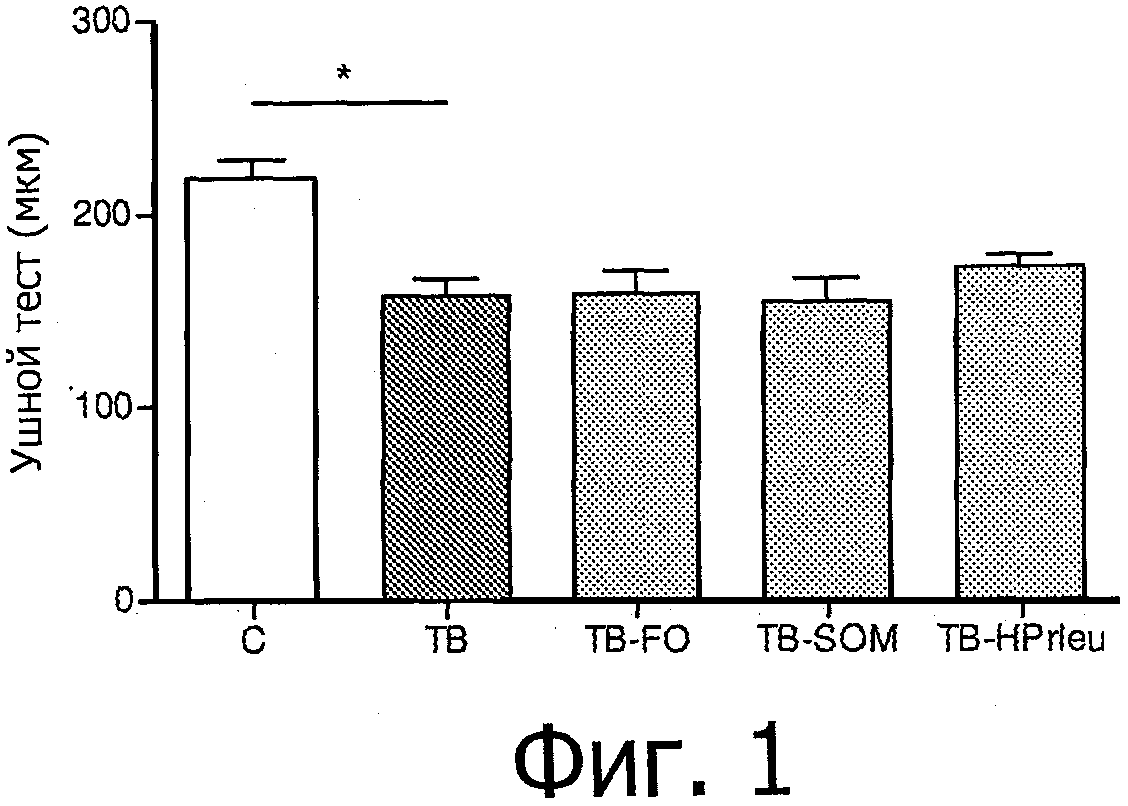
Таблица 1 показывает влияние перорального введения рыбьего жира, смеси определенных олигосахаридов или богатого белком/лейцином корма на параметры физиологической кахексии и иммунные параметры у мышей с опухолью. Данные из разных экспериментов были объединены и представлены в виде средних значений ±SEM для контрольной группы (С, n=40), контрольной группы с опухолью (ТВ, n=40), и групп с опухолью после добавления рыбьего жира (TB-FO, n=10), смеси определенных олигосахаридов (TB-SOM, n=10) или богатого белком/лейцином корма ((TB-HPrleu, n-10). * Достоверно отличается (р<0,0125) от контрольной группы с опухолью (ТВ).
Таблица 2 показывает влияние перорального введения полной смеси рыбьего жира, смеси определенных олигосахаридов и богатого белком/лейцином корма на параметры физиологической кахексии и иммунные параметры у мышей с опухолью.
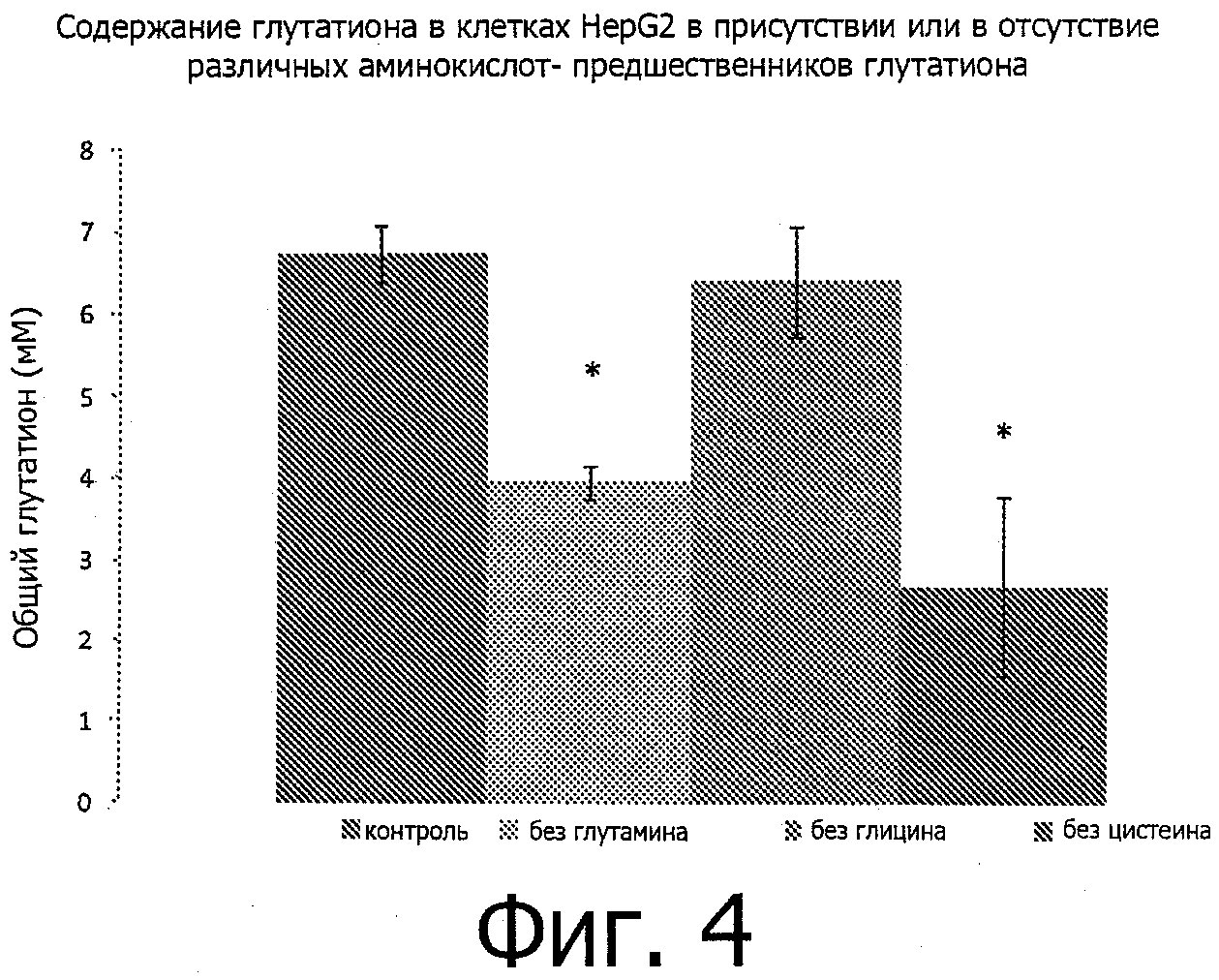
Данные представляют собой средние значения ±SEM для контрольной группы (С, n=10), контрольной группы с опухолью (ТВ, n=19) и для группы с опухолью после перорального введения определенной питательной композиции (TB-SNC) (n=20).
* Достоверно отличается (р<0,025) от контрольной группы с опухолью (ТВ). а определены как клетки GR-1high, b определены на основании профиля прямого и углового светорассеяния, F4/80dull и GR-1low to dull, c определены как клетки F4/80high.
|
|
|
Контактная гиперчувствительность
Контактная гиперчувствительность (CHS) проверялась на 13/14 день для определения in vivo иммунной функции до начала потери веса. Ответы CHS достоверно снижались в группе ТВ по сравнению с группой С в экспериментах А (28,1%, Фигура 1) и В (31,0%, Фигура 2), что указывает на нарушенный Th1-иммунный ответ у мышей с опухолью. После добавления одного из индивидуальных пищевых ингредиентов в диету мышей с опухолью не наблюдалось никакого влияния на этот иммунный биомаркер (Фигура 1). Однако после введения полной смеси FO, SOM и богатого белком/лейцином корма мышам с опухолью (TB-SNC) иммунная реактивность достоверно увеличивалась на 20,7% по сравнению с мышами ТВ, что указывает на более хороший Th1-опосредованный иммунный ответ (Фигура 2).
Фигура 1 показывает влияние перорального введения рыбьего жира, определенной смеси олигосахаридов или богатого белком/лейцином корма на контактную гиперчувствительность у мышей с опухолью. Данные представляют собой средние значения (мкм)±SEM для контрольной группы (С, n=20), контрольной группы с опухолью (ТВ, n=20) и группы с опухолью после добавления рыбьего жира (TB-FO, n=10), определенной смеси олигосахаридов (TB-SOM, n=10) или богатого белком/лейцином корма (TB-HPrleu, n=10).
* Достоверно отличается (р<0,0125) от контрольной группы с опухолью (ТВ).
Фигура 2 показывает влияние перорального введения полной смеси рыбьего жира, определенной смеси олигосахаридов и богатого белком/лейцином корма на контактную гиперчувствительность.
Данные представляют собой средние значения ±SEM для контрольной группы (С, n=10), контрольной группы с опухолью (ТВ, n=19) и для группы с опухолью после перорального введения определенной питательной композиции (TB-SNC) (n=20).
* Достоверно отличается (р<0,025) от контрольной группы с опухолью (ТВ).
ПРИМЕР 2
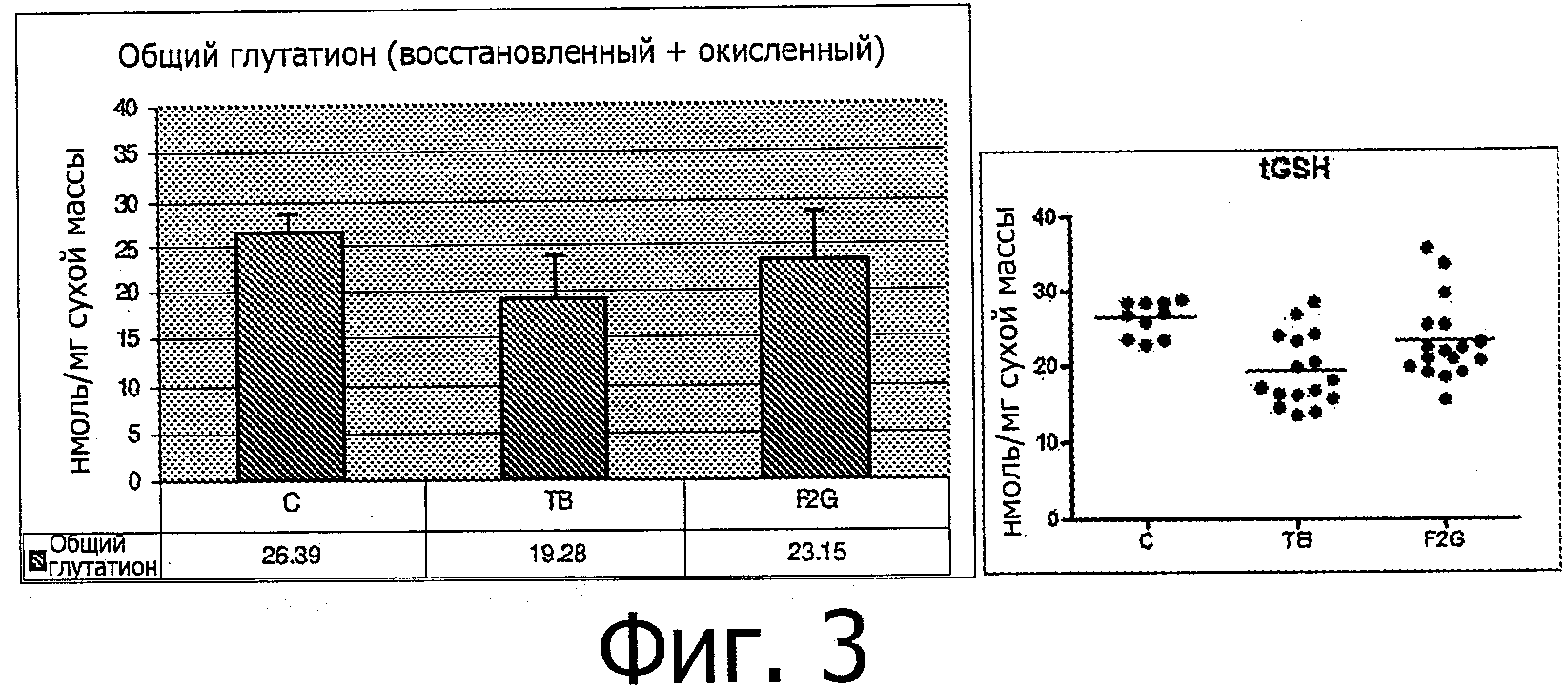
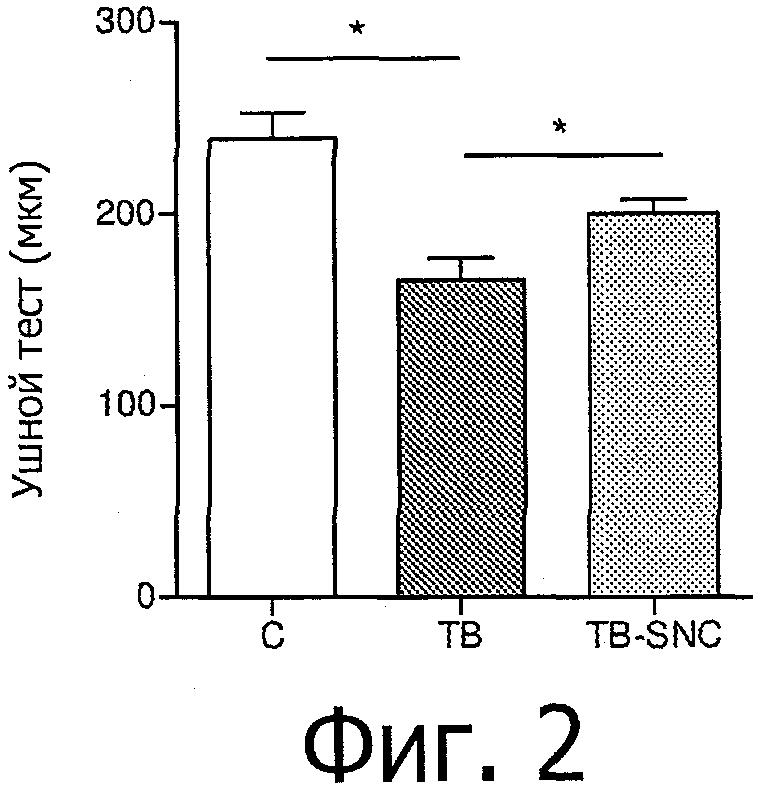
Было показано, что у раковых кахектических мышей были снижены уровни глутатиона в печени (Фигура 3). Фигура 3 показывает общий уровень GSH в печени у контрольной группы (С), группы с опухолью (ТВ) и группы с комбинацией пищевых продуктов (F2G), которая получала диету с той же самой композицией, что и группа TB-SNC в Примере 1. В левой части Фигуры результаты представлены в виде среднего значения + стандартное отклонение (нмоль/мг сухой массы), а в правой части Фигуры - в виде точек. Для группы с опухолью (ТВ) против контрольной группы значение р=0,001. Для группы с комбинацией пищевых продуктов (F2G) против группы с опухолью значение р=0,042. Статистический анализ проводился по методу Манна-Уитни. В экспериментах с применением in vitro модели нормальной печени было показано, что глутамин и цистеин оказывают положительное влияние на гомеостаз глутатиона в клетках печени HepG2 (Фигура 4). Кроме того, было показано, что питательная композиция, обогащенная глутамином и цистеином, содержащая сыворотку (богата цистеином) и казеин (богат глутамином), рыбий жир и лейцин, при введении мышам с опухолью приводит к частичной нормализации содержания глутатиона в печени (Фигура 4).
ПРИМЕР 3
В этом эксперименте было исследовано влияние перорального введения комбинации пищевых ингредиентов на инфекцию Pseudomonas aeruginosa у мышей С3Н/HeN, получающих химиотерапию.
Материалы и методы
Самки мышей С3Н/HeN (Charles River, the Netherlands) в начале эксперимента были 7-8 недельного возраста. Животные содержались в индивидуальных вентилируемых клетках (Р/С) и все действия с животными производились в ламинарном шкафу с протоком воздуха. Условия содержания включали 12:12 цикл день: ночь при постоянной комнатной температуре 21±2°С и влажности 50±5%. Животные после получения акклиматизировались в течение одной недели.
Животные получали диеты С и FC-2G с таким же составом, как контрольная диета (С; n=18) и дополненная диета TB-SNC (FC-2G; n=18) в эксперименте В из Примера 1. Кроме того, группа животных получала диету С, но не получала химиотерапию (группа СТ-С; n=8), для демонстрации того, что без химиотерапии инфекция не возникает.
Штамм Pseudomonas aeruginosa РАО-1 (АТТС ВАА-47) был субкультивирован на Питательном Агаре и был инокулирован в Трипсинизированный Соевый Бульон (500 мл). Ночную культуру промывали, концентрировали и разводили до концентрации примерно 1×109 КОА/мл в буфере PBS (D-PBS, Invitrogen)+3% бикарбоната (для нейтрализации кислоты в желудке) по данным спектрофотометрии (OD600≈1×109 КОА/мл). Количество бактерий подтверждали высеиванием на чашках Петри разведении (в PBS) на Pseudomonas C-N-селективном агаре с добавками (Oxoid CM0559+SR0102E).
Организация эксперимента и временные рамки
Стадия 1: Перед инфицированием РАО1 мыши предварительно обрабатывались антибиотиком широкого спектра действия Ампициллином (внутрибрюшинная инъекция, 200 мг/кг, растворенный в 0,2 мл физиологического раствора, Sigma) в течение трех последовательных дней для получения селективной дезинфекции пищеварительного тракта (дни -2, -1 и 0).
Стадия 2: Мышей инфицировали 0,2 мл устойчивого к ампициллину Pseudomonas aeruginosa (РАО-1 штамм АТТС ВАА-47: 109 КОЕ/мл в PBS+3% бикарбонат), который вводили перорально через зонд (инфицирование в день 0).
Стадия 3: В день шесть мышей распределяли по разным группам по уровню колонизации РАО1 согласно результатам измерений в свежих фекалиях и на основании веса их тела так, чтобы в начале применения диеты каждая группа имела одинаковое распределение по весу и по колонизации РАО1. После распределения животных по группам начинали применение диеты. Контрольные группы С и СТ-С получали диету С, группа FC-2G получала обогащенную диету FC-2G.
Стадия 4: Через 3 недели после начала применения диеты (День 28) вводился химиотерапевтический агент, что приводило к нейтропении и снижению иммунной функции. В день 28 и в день 30 мышам внутрибрюшинно вводили 100 мг циклофосфамида на 1 килограмм веса тела. Контрольной группе на действие химиотерапии (СТ-С; n=10) в те же дни внутрибрюшинно инъецировали физиологический раствор.
Стадия 5: Мышей умерщвляли через 5 дней после начала применения химиотерапии. Асептически извлекали печень для определения бактериальной транслокации, параметра, характеризующего системную бактериальную инфекцию РАО1.
Асептически удаленную печень помещали в 0,5 мл М BPW, взвешивали, помещали на лед и гомогенизировали с помощью гомогенизатора Ultra-Turrax (IKA, автоклавируемый одноразовый диспергатор). Были сделаны серии десятикратных разведений в буфере PBS, которые высевали на чашки Петри с Питательным Агаром и агаром C-N. После инкубации в течение ночи при 37°С подсчитывали количество специфических колоний Pseudomonas aeruginosa.
Статистическую достоверность различий между группами С и FC-2G определяли с помощью Т-критерия Стьюдента для количества транслоцированных бактерий и с помощью Хи-квадрат теста Пирсона для степени транслокации.
Результаты
Данные представлены в Таблице 3. У мышей, не получавших химиотерапию, не было обнаружено никакой транслокации РАО1 в печень (группа СТ-С). У мышей, которые получали химиотерапию, степень измеряемой транслокации РАО1 и среднее количество транслоцированных бактерий на 1 мышь были достоверно ниже в группе, которая получала обогащенную диету (группа FC-2G) по сравнению с группой, получавшей контрольную диету (группа С). Эти данные показывают, что применение обогащенной диеты FC-2G снижает индуцируемую химиотерапией бактериальную инфекцию.
Таким образом, в одном воплощении настоящего изобретения композиция согласно настоящему изобретению является пригодной для лечения нейтропении, в частности, нейтропении, индуцированной химиотерапией.
ПРИМЕР 4
Следующая композиция (Таблица 4) была приготовлена согласно стандартным способам и является пригодной для применения согласно настоящему изобретению предпочтительно в виде жидкой питательной добавки.
|
|
ПРИМЕР 5
Цель
Исследовать влияние кратковременного приема питательной добавки на стимулируемую липополисахаридами (LPS) продукцию цитокинов и простагландинов в цельной крови здоровых волонтеров.
Дизайн исследования
В данном исследовании применялся несравнительный открытый (без контроля плацебо) дизайн эксперимента. В исследование после подписания письменного согласия было вовлечено двенадцать здоровых волонтеров. В утро визита 1 субъекты употребляли основную жидкую питательную добавку (200 мл) для стандартизации исходных значений. В течение одной недели субъекты ежедневно употребляли 2×200 мл Тестируемой жидкой питательной композиции. Композиция содержала 27 эн.% белкового материала, 19 масс.% общего лейцина, 890 мг на 100 мл EPA+DHA и GOS+FOS в качестве иммуномодулирующих олигосахаридов (полный состав композиции представлен в Таблице 5). Для измерения продукции ex vivo провоспалительных цитокинов и Простагландина E2 (PGE2) в стимулированной липополисахаридами (LPS) цельной крови; образцы крови брали в дни 1, 2, 3, 5 и 8.
Композиция
Состав тестируемой жидкой питательной композиции был таким, как показано в Таблице 5.
|
|
|
|
Результаты
В исследовании участвовало двенадцать субъектов (среднее значение ±SD для возраста: 62,0±4,8 лет и для Индекса Массы Тела (BMI) 25,6±3,2 кг/м). Через одну неделю приема обогащенной питательной композиции ex vivo продукция цитокинов IL-1R, IL-6, IL-8, IFN-γ и TNF-α в LPS-стимулированной цельной крови увеличивалась, как показано в Таблице 6.
|
|
Заключение
Продукция ex vivo цитокинов IL-1β, IL-6 IL-8, IFN-y и TNF-α в LPS-стимулированной цельной крови во время применения композиции увеличивалась, что указывает на улучшенный иммунный ответ против экзогенных, связанных с патогенами стимулов через одну неделю приема обогащенной композиции здоровыми волонтерами.
ПРИМЕР 6
Определение
Гликемический индекс (GI) углевода представляет собой меру его способности увеличивать концентрации глюкозы после приема пищи. Продукты с высоким GI обеспечивают более высокие уровни глюкозы в крови после приема пищи, чем таковые с низким GI. Значение GI углевода также позволяет предсказать ответ инсулина на такую пищу.
Значение GI углевода рассчитывается путем сравнения двухчасового гликемического ответа после приема 25 г данного углевода с таковым после приема 25 г стандартного углевода глюкозы.
GI равен «Пошагово растущей площади под кривой уровня глюкозы в крови для исследуемого продукта, содержащего 25 г углевода», разделенной на «Соответствующую площадь после приема эквивалентного количества углевода в виде глюкозы».
Способ расчета Гликемического Индекса
Доступный углевод для целей измерения GI определяется как: Общие углеводы минус неперевариеваемые углеводы (растворимые и нерастворимые), которые с физиологической точки зрения представляют собой пищевые волокна (например, инулин, FOS, устойчивый крахмал 3 типа).
Представляемые образцы должны являться продуктами, которые доступны покупателю в обычном магазине.
Все продукты, предназначаемые для исследования, тестируются in vivo, то есть, на 10 субъектах, которые употребляют количества продукта, содержащие эквивалент 25 г доступного углевода. Эти субъекты должны быть здоровыми людьми без хронических болезней, диабета или непереносимости глюкозы. Субъекты имеют индекс массы тела (BMI) между 18,5 и 27 кг/м2.
Продукт для сравнения: Продукт для сравнения представляет собой 25 г порошка глюкозы, растворенного в 250 мл воды. Каждый субъект тестирует продукт для сравнения, по меньшей мере, дважды.
Тестируемые продукты: Тестируемые продукты готовятся в соответствии с инструкциями производителя и представляют собой обычно употребляемый продукт. Тестируемые продукты употребляются однократно в каждом отдельном случае в количестве, обеспечивающем 25 г доступного углевода, определение которого дано выше.
Протокол работы с испытуемыми: Субъекты тестируются утром после 10-12 часового голодания в течение ночи. На голодный желудок берутся два образца крови с интервалом в 5 минут (-5 & 0), после чего субъекты употребляют тестируемый продукт или продукт сравнения в спокойном режиме в течение 15 минут. После этого образцы крови берутся через 15, 30, 45, 60, 90 и 120 минут после начала употребления пищи. Тестируемый продукт и продукт сравнения должны употребляться с 250 мл выпиваемой воды. Это должно соблюдаться для каждого из тестов в сериях тестов.
За 24 часа перед измерением GI: В день перед каждой сессией субъекты воздерживаются от алкоголя и избегают необычных уровней физической нагрузки и употребления пищи. На ужин субъекты должны употреблять пищу на основе богатых углеводами продуктов, таких как рис, макароны, хлеб, картофель, и не употреблять много жира. Эта пища не должна включать фасоли, бобов и других бобовых (чтобы избежать повторного влияния пищи на следующее утро). Также важно, чтобы они в этот день обедали и не голодали больше 18 часов. Субъектов просят находиться в одном и том же состоянии каждый раз, когда они приходят на сессию. После ужина субъекты должны воздерживаться от пищи ночью в течение, по меньшей мере, 10 часов перед началом их тестовой сессии на следующее утро. Во время воздержания от приема пищи они могут только пить воду.
Взятие крови: Взятие крови производится путем прокалывания пальца.
Кровь берется без применения ингибиторов свертывания (гепарин, ЭДТА).
Измерение глюкозы: Цельная капиллярная кровь измеряется с помощью автоматического анализатора глюкозы. В данном конкретном случае применялся анализатор глюкозы Hemocue.
Обработка данных: Пошагово растущая площадь под кривой уровня глюкозы в крови (iAUC), исключая площадь ниже базовой линии, рассчитывается геометрически следующим образом:
Для времен t0, t1, …tn концентрации глюкозы в крови составляют G0, G1, …Gn, соответственно:
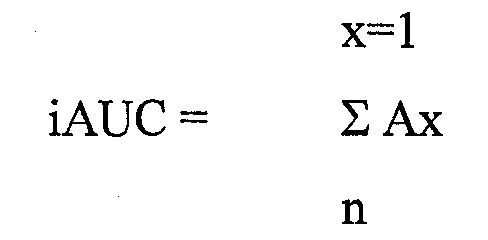
где Ax=AUC для интервала времени xth (то есть, между точками tx-1 и tx).
Для первого временного интервала (то есть, для х=1): если G1>G0, Al=(G1-G0)×(t1-t0)/2
в ином случае, A1=0
Для других интервалов времени (то есть, для х>1)
если Gx≥G0 и Gx-1≥G0, Ax={[(Gx-G0)/2]+(Gx-1-G0)/2}×(tx-tx-1)
если Gx>G0 и Gx-1<G0, Ax=[(Gx-G0)2/(Gx-Gx-1)]×(tx-tx-1)/2
если Gx<G0 и Gx-1>G0, Ax=[(Gx-l-G0)2/(Gx-1-Gx)]×(tx-tx-1)/2
если Gx≤G0 и Gx-1≤G0, Ax=0
Расчет GI: Для каждого индивидуального субъекта значение GI представляет собой iAUC для каждого продукта, выраженную в процентах от среднего значения iAUC для двух образцов продукта сравнения (глюкозы). Значение GI тестируемого продукта представляет собой среднее значение GI±SEM для 10 субъектов.
Из общего набора данных может быть исключено до двух выпадающих значений (выпадающим считается индивидуум, значение GI у которого отличается от среднего значения больше чем на два значения SD). Величина SEM должна находиться в пределах 20% от среднего значения.