ИМПЛАНТИРУЕМЫЕ ПРОДУКТЫ, СОДЕРЖАЩИЕ НАНОЧАСТИЦЫ
Вид РИД
Изобретение
Настоящее изобретение относится к имплантируемым продуктам, содержащим наночастицы, и к их применению в медицине, в частности, для последующего термотерапевтического лечения после хирургического удаления опухолей и раковых язв.
После хирургического удаления опухолевой ткани, почти всегда возникают проблемы, связанные с тем, что в организме все еще сохраняются опухолевые клетки (неполная резекция). После закрытия раны, эти опухолевые клетки снова смогут расти и образовывать более крупные опухоли и/или метастазы. По этой причине осуществляют последующее химиотерапевтическое лечение, которое является для пациента серьезным стрессом. При этом нужно удалить минимальное количество здоровой ткани, и оперирующий хирург должен идти на компромисс между, предпочтительно, полной резекцией опухоли и удалением минимального количества здоровой ткани.
Цель настоящего изобретения состоит в том, чтобы предоставить продукты и способы для более эффективного последующего лечения после операции на раковой опухоли.
Цель достигается с помощью независимых пунктов формулы изобретения. Дополнительные предпочтительные варианты осуществления следуют из независимых пунктов формулы изобретения, примеров и описания.
К удивлению, было обнаружено, что имплантируемые медицинские продукты, содержащие наночастицы, нагревающиеся в переменном магнитном поле, обладают способностью к значительному улучшению последующего лечения после операции на раковой опухоли по сравнению с химиотерапией, если эти медицинские продукты имплантированы или помещены в операционную область.
Поэтому настоящее изобретение относится к твердым или гелеобразным медицинским продуктам, нагревающимся в переменном магнитном поле, в котором медицинский продукт присутствует в форме физиологически приемлемой ткани, губки, пленки или геля, где магнитные частицы, содержащиеся в медицинском продукте, образуют тепло, когда возбуждаются переменным магнитным полем и, таким образом, нагревают медицинский продукт.
Для патентоспособного медицинского продукта принципиально важно, чтобы эти частицы, т.е. частицы, возбуждаемые переменным магнитным полем, были стационарно внедрены в медицинский продукт или приклеены к нему.
Водные растворы магнитных частиц обычно получают или для того, чтобы направить частицы, нагруженные фармакологическими лекарственными средствами в определенное целевое местоположение с помощью статического магнитного поля, или водные растворы частиц, возбуждаемых в переменном магнитном поле, инъецируют непосредственно в опухоль для того, чтобы частицы накапливались в опухолевых клетках и разрушали опухолевые клетки при помощи образуемого тепла. В первую очередь тепло образуется за счет рассеивания энергии гистерезисного нагрева частиц.
Патентоспособные медицинские продукты не являются водными или физиологическими водными растворами или суспензиями магнитных частиц, а представляют собой твердые или гелеобразные носители, такие как ткань или пленка, в которую стационарно внедрены частицы. При условии, что это не относится к биоразрушаемым медицинским продуктам, частицы будут постоянно оставаться внутри медицинского продукта, а медицинский продукт будет постоянно оставаться в имплантированном месте, подобно зубному имплантату или искусственному коленному суставу.
Поскольку частицы, постоянно остающиеся в медицинском продукте, не будут вымываться за счет диффузии, а только будут высвобождаться за счет процесса деградации в случае с биоразрушаемыми медицинскими продуктами, то область, в которую помещен имплантированный медицинский продукт, все еще сможет нагреваться после желаемого периода времени, т.е. через одну неделю после имплантации, через один месяц после имплантации, через один год после имплантации, а также через десять лет после имплантации.
Предпочтительные варианты осуществления настоящего изобретения относятся к биоразрушаемым медицинским продуктам, которые разрушаются организмами человека и животных с различными скоростями в зависимости от показаний. Однако частицы высвобождаются из этого медицинского продукта не посредством диффузии, а лишь в рамках биологического разрушения. Таким образом, этот биорассасывающийся медицинский продукт будет подвергаться растворению, при котором остающиеся фрагменты медицинского продукта, подвергающегося растворению, могут и далее нагреваться под действием переменного магнитного поля.
Однако для патентоспособных медицинских продуктов принципиально важно, чтобы они были гибкими или деформируемыми и обладали способностью повторять контуры поверхности ткани или органа или операционной области после хирургического удаления опухоли. Таким образом, патентоспособные медицинские продукты представлены в форме тканей, которые можно помещать на ткани или органы или в операционную область и которые будут повторять неровные поверхности без труда, или в форме геля, пленкообразующей композиции или пленкообразующего спрея, свойства которых позволяют наносить их на любые неровные поверхности.
В настоящем документе операционная область относится к области, которая ограничена самыми внешними краями хирургической раны. Другими словами, операционная область представляет собой переходную область или граничную область между опухолью и здоровой тканью. Последующее лечение этой области играет очень важную роль в предотвращении образования рецидивов.
Медицинские продукты, описываемые в настоящем документе, накладываются, наносятся в виде покрытия на операционную область и, в случае спрея, распыляются на операционную область и, таким образом, предоставляются для последующего лечения хирургической раны после операции на опухоли.
Таким образом, патентоспособные медицинские продукты первоначально не предназначены для системного применения, а для имплантации в операционную область. Поскольку патентоспособные медицинские продукты будут оставаться в операционной области, предпочтительно на протяжении последующей химиотерапии, патентоспособные медицинские продукты являются биоразрушаемыми в соответствии с временными рамками запланированных сеансов терапии и подвергаются биологическому рассасыванию в течение более длительного периода времени или не являются разрушаемыми.
Важно, чтобы патентоспособные медицинские продукты, предпочтительно биоразрушаемые или медленно биоразрушаемые медицинские продукты, были представлены не в негнущейся форме, а могли эластично принимать форму поверхности операционной области, которая должна быть накрыта.
Таким образом, предпочтительны, в частности, гибкие, высокоэластичные, легко принимающие другие формы или бесформенные медицинские продукты или носители для нагревающихся частиц.
Таким образом, все медицинские продукты по изобретению представляют собой эластичные и неметаллические носители, которые принимают заданную форму поверхности и максимально покрывают ее, и, кроме того, пригодны для введения магнитных частиц, в частности, суперпарамагнитных наночастиц. Предпочтительными биоразрушаемыми патентоспособными медицинскими продуктами являются медицинская целлюлоза, перевязочный материал, помещаемые в раны приспособления, хирургический шовный материал, компрессы, губки, медицинские ткани, мази, гели или пленкообразующие спреи.
Медицинская целлюлоза и медицинские ткани предпочтительно образуют двухмерные структуры с низкой плотностью, которые импрегнированны частицами. Магнитные частицы прикрепляют к волокнистой структуре этого медицинского продукта, который после операции помещают внутрь раны в операционную область в сухом или предварительно увлажненном виде.
Губки или биоразрушаемые пористые трехмерные структуры, которые, в основном, могут содержать магнитные частицы на поверхности и в полостях внутри пористой структуры, а также в самом губчатом материале, представляют собой другой вид патентоспособных медицинских продуктов. После операции эти губки помещают внутрь раны, где они будут заполнять операционную область полностью или только частично. Магнитные частицы могут высвобождаться из этих губчатых структур, в которых эти частицы также могут присутствовать в прочно связанной форме. Может происходить высвобождение только слабо связанных частиц посредством диффузии из полостей пористой структуры, а также посредством биоразрушения губчатой структуры, если частицы встроены или внедрены в сам материал с губчатой структурой.
Патентоспособные медицинские продукты предназначены для имплантации в организм человека и животного и должны быть физиологически приемлемыми. Важно, чтобы патентоспособные медицинские продукты присутствовали не в жидкой форме в виде раствора или суспензии, а в виде вязкого или плотного или пленкообразующего или твердого состава, так чтобы после имплантации медицинский продукт обязательно оставался в желаемом положении.
Также важно, чтобы медицинский продукт подходил для любых поверхностей, т.е. чтобы он повторял контуры поверхности.
В настоящем документе, носитель магнитных частиц обозначается как «медицинский продукт», а ткани, целлюлозы, гели, пленкообразующие композиции и т.д., подробно описываемые в настоящем документе, служат в качестве «носителей», которые могут быть биоразрушаемыми или биостабильными и не обладают магнитными свойствами и, таким образом, без магнитных частиц не нагреваются в переменном магнитном поле. Носители, выполненные из неживого вещества, могут содержать рентгеновские метки или контрастные среды и связывать частицы, предпочтительно за счет склеивания и/или ковалентных связей. Однако главным образом частицы, не являющиеся биоразрушаемыми, будут рассеивать тепло посредством возбуждения в переменном магнитном поле и, таким образом, будут не только нагревать сами себя, но также носитель, то есть, иными словами весь медицинский продукт целиком, а также окружающую ткань. Кроме того, фармакологические лекарственные средства, например, цитостатики, могут быть внедрены в медицинский продукт, как описано ниже, и высвобождаться под действием диффузии и/или биоразрушения носителя и/или образования тепла и/или переменного магнитного поля, чтобы прежде всего бороться с опухолевыми клетками.
В настоящем документе, любая используемая в медицинских целях ткань или целлюлоза обозначается как «ткань», из которой изготавливают перевязочный материал, помещаемые в раны приспособления, бинты или другую медицинскую ткань или материю.
Фраза «биоразрушаемый медицинский продукт» в явной форме относится только к матрице для магнитных частиц, но не к самим магнитным частицам, которые обычно не являются биоразрушаемыми. Следовательно, биоразрушаемыми являются медицинская целлюлоза, перевязочный материал, помещаемые в раны приспособления, хирургический шовный материал, компрессы, губки, медицинские ткани, мази, гели или пленкообразующие спреи, в которые встраивают или на которые наносят магнитные частицы. Таким образом, матрица для магнитных частиц разрушаемого медицинского продукта с магнитными частицами, т.е. медицинский продукт без магнитных частиц, является биоразрушаемой, а магнитные частицы обычно будут оставаться или аккумулироваться в опухолевой ткани или злокачественных клетках, соответственно, и они почти не будут подвергаться биологическому разрушению или их покрытие будет подвергаться биологическому разрушению частично, а магнитное ядро обычно не будет подвергаться биологическому разрушению.
Область, в которой присутствовала удаленная опухоль или удаленная раковая ткань, обозначают как операционную область.
Другие предпочтительные альтернативные варианты патентоспособных медицинских продуктов представляют собой жидкие или гелеобразные составы в форме мазей, кремов, гелей и спреев, в частности, пленкообразующих спреев. Эти составы содержат магнитные частицы и должны наноситься или распыляться на операционную область после удаления опухоли.
За исключением магнитных частиц, патентоспособные медицинские продукты предпочтительно являются биоразрушаемыми и, следовательно, будут полностью растворяться предпочтительно в течение от одного до двенадцати месяцев, более предпочтительно от одного до шести месяцев, при этом содержащиеся магнитные частицы также будут высвобождаться.
Принцип функционирования патентоспособных медицинских продуктов состоит в том, что они должны покрывать операционную область в максимально возможной степени для того, чтобы магнитные частицы оказались настолько близко к сохранившимся злокачественным клеткам или сохранившейся раковой ткани, насколько это возможно. Магнитные частицы и, предпочтительно, суперпарамагнитные частицы могут нагреваться в переменном магнитном поле, и при этом еще сохранившиеся злокачественные клетки будут уничтожены посредством термотерапии. В настоящем документе магнитные частицы, содержащиеся в патентоспособном медицинском продукте, будут нагревать медицинский продукт целиком, а магнитные частицы, диффундирующие за пределы медицинского продукта, будут нагревать злокачественные клетки, к которым они будут прилипать или в которые они будут проникать.
Кроме того, термотерапевтическое лечение может дополнять обычную химиотерапию или лучевую терапию, поскольку термотерапевтическое лечение ведет к сравнительно небольшим неблагоприятным воздействиям и может осуществляться одновременно с химеотерапевтическим лечением. Поскольку патентоспособные медицинские продукты должны покрывать операционную область или должны заполнять операционную область в максимально возможной степени, то, соответственно, патентоспособные медицинские продукты предпочтительно находятся в непосредственном контакте со все еще сохранившимися злокачественными клетками и все еще сохранившейся раковой тканью, которые могут быть убиты особенно эффективным способом при непосредственной близости магнитных частиц. Следовательно, термотерапевтическое лечение патентоспособными медицинскими продуктами является значительно более избирательным и щадящим, чем химиотерапия и лучевая терапия.
В одном из предпочтительных вариантов осуществления настоящего изобретения по меньшей мере одно фармакологически активное соединение, предпочтительно противораковое лекарственное средство, связано с указанными магнитными частицами. Примеры подходящих противораковых лекарственных средств включают: актиномицин, аминоглютетимид, амсакрин, анастрозол, антагонисты пуриновых или пиримидиновых оснований, антрациклин, ингибиторы ароматазы, аспарагиназы, антиэстрогены, бексаротен, блеомицин, бусерелин, бусульфан, производные камптотецина, капецитабин, карбоплатин, кармустин, хлорамбуцил, цисплатин, кладрибин, циклофосфамид, цитарабин (цитозинарабинозид), алкилирующие цитостатики, дакарбазин, дактиномицин, даунорубицин, доцетаксел, доксорубицин (адриамицин), эпирубицин, эстрамустин, этопозид, эксеместан, флударабин, фторурацил, антагонисты фолиевой кислоты, форместан, гемцитабин, глюкокортикоиды, гозерелин, гормоны и антагонисты гормонов, гикамтин, гидроксимочевина, идарубицин, ифосфамид, иматиниб, иринотекан, летрозол, лейпрорелин, ломустин, мелфалан, меркапто-пурин, метотрексат, милтефозин, митомицин, ингибиторы митоза, митоксантрон, нимустин, оксалиплатин, паклитаксел, пентостатин, прокарбазин, тамоксифен, темозоломид, тенипозид, тестолактон, тиотепа, тиогуанин, ингибиторы топоизомеразы, топотекан, треосульфан, третиноин, трипторелин, трофосфамид, винбластин, винкристин, виндезин, винорелбин, антибиотики с цитостатической активностью.
Отделение по меньшей мере одного терапевтически активного лекарственного средства от частиц дополнительно может быть достигнуто или инициировано с помощью переменного магнитного поля. Таким образом, можно добиться, чтобы термотерапевтическое лечение дополнялось антипролиферативным лекарственным средством непосредственно в операционной области, что снова будет увеличивать эффективность. Конечно, в настоящем документе также возможно проводить дополнительную химиотерапию или лучевую терапию параллельно или раздельно во времени.
По меньшей мере одно фармакологическое лекарственное средство не должно быть обязательно привязано к частицам, предпочтительно наночастицам. Оно может дополнительно содержаться в патентоспособном медицинском продукте или наноситься на его поверхность без привязывания к частицам.
Связывание лекарственного средства с частицами имеет преимущество, которое заключается в том, что будет происходить предпочтительное, нацеленное на мишень высвобождение, поскольку лекарственное средство вместе с частицами может проникать в злокачественные клетки или может присоединяться к злокачественным клеткам, а высвобождение может быть индуцировано магнитным полем.
В этом контексте, «вызванный» или «индуцированный магнитным полем» обозначает, что в отношении некоторого объекта переменное магнитное поле или импульс вызывает непосредственно высвобождение или отделение, или что отделение лекарственного средства происходит опосредовано, например, под действием ферментов или образующегося тепла.
Таким образом, содержащие наночастицы медицинские продукты в форме медицинской целлюлозы, перевязочного материала, помещаемых в раны приспособлений, хирургического шовного материала, компрессов, медицинских губок, медицинских тканей, мазей, гелей или пленкообразующих спреев могут дополнительно содержать по меньшей мере одно фармакологическое лекарственное средство, предпочтительно противораковое вещество. Подходящие лекарственные средства, а также связывание с частицами, подробно описано ниже.
Указанные имплантаты и имплантируемые медицинские продукты нагреваются в переменном магнитном поле посредством приложения внешнего переменного магнитного поля после применения медицинских продуктов или биоразрушаемых медицинских продуктов в операционной области.
Нагревание частиц происходит в переменном магнитном поле, при этом напряженность переменного магнитного поля предпочтительно находится в диапазоне от 1 до 25 кА/м, более предпочтительно в диапазоне от 2 до 18 кА/м, а частота находится предпочтительно в диапазоне от 5 до 5000 кГц, более предпочтительно в диапазоне от 10 до 1000 кГц.
Под действием тепла высвобождаются магнитные частицы, предпочтительно суперпарамагнитные наночастицы, а также необязательно присутствующие лекарственные средства, которые затем будут присоединяться к злокачественным клеткам и убивать их. Указанная щадящая терапия, включающая термотерапию, применима, в частности, в сочетании с другими лечебными процедурами, такими как лучевая терапия и/или химиотерапия.
Магнитные частицы
По изобретению, любые магнитные частицы могут быть использованы при условии, что они нагреваются под действием переменного магнитного поля.
Таким образом, предпочтительны микрочастицы и, в частности, наночастицы, и суперпарамагнитные микрочастицы и, в частности, наночастицы.
Указанные наночастицы предпочтительно отличаются наличием магнитного, более предпочтительно суперпарамагнитного, ядра. Предпочтительными материалами являются маггемит, магнетит, железоникелевые сплавы, никелемедные сплавы или кобальтникелевые сплавы, такие как FeNi или CoNi.
Для улучшения магнитных характеристик, в магнитном ядре также может использоваться второй слой. Это будет вести к более сильному результирующему коэрцитивному полю по сравнению с наночастицами с однослойным ядром. Первый слой ядра может быть выполнен из суперпарамагнитного вещества, а второй слой ядра может быть выполнен из вещества, которое отличается от вещества первого слоя ядра. На это ядро могут быть нанесены дополнительные слои, которые, например, будут нести лекарственные средства. Многослойные частицы для инфильтрирования опухолевых клеток конъюгатами частиц и лекарственных средств описаны в заявке WO 98/58673 A.
Ядро или ядра сами по себе состоят из магнитного вещества, предпочтительно из ферромагнитного, антиферромагнитного, ферримагнитного, антиферримагнитного или суперпарамагнитного вещества, более предпочтительно выполнены из оксида железа, в частности суперпарамагнитного оксида железа или из чистого железа, предоставленного с оксидной пленкой. Такие наночастицы могут нагреваться под действием переменного магнитного поля, предпочтительно при напряженности магнитного поля в диапазоне от 2 до 25 кА/м и при частоте, которая предпочтительно находится в диапазоне от 5 до 5000 кГц. С помощью этого способа возможно нагревание ткани, содержащей наночастицы, более чем до 50°C. Таких высоких температур можно добиться, если опухолевой клеткой будет абсорбировано вплоть до 800 пг железа в форме наночастиц или более. Следовательно, наночастицы не могут покидать целевую область в течение более длительного периода времени, и, таким образом, нагревание может быть приложено к опухоли, к тому же неоднократно, с высокой точностью и без взаимодействия с внешней средой. Нагревание основано на выделении тепла при поступательном и вращательном движении в результате процесса магнитной релаксации, а также потерь гистерезисного тепла.
Наночастицы предпочтительно состоят из оксида железа и, в частности, из магнетита (Fe3O4), маггемита (γ-Fe2O3) или из смесей обоих оксидов. В основном, предпочтительные наночастицы можно определить с помощью формулы FeOx, где x обозначает рациональное число от 1 до 2. Наночастицы характеризуются диаметром предпочтительно менее 500 нм. Наночастицы предпочтительно имеют средний диаметр 15 нм или предпочтительно их диаметр находится в диапазоне от 1 до 200 нм и, в частности, предпочтительно в диапазоне от 5 до 30 нм.
Получение наночастиц без лекарственного средства, а также без покрытия, подробно описано в DE 4428851 A.
По изобретению, помимо магнитных веществ с формулой FeOx, где x представляет собой рациональное число в диапазоне от 1,0 до 2,0, можно использовать вещества с общей формулой MFe2O4, где M = Co, Ni, Mn, Zn, Cd, Ba, или другие ферриты.
Также возможна конфигурация наночастиц с другим металлическим ядром вместо оксида железа. В настоящем документе следует назвать такие металлы, как золото, серебро, платина, медь, кобальт, никель, железо, марганец, самарий, неодимий, иридий, осмий, рутений, родий, палладий или сплавы вышеперечисленных металлов.
Однако также можно получать наночастицы из немагнитного вещества, такого как диоксид кремния (SiO2). Более того, также пригодны частицы из диоксида кремния или полимера, в который внедрены и/или к которому присоединены магнитные вещества, такие как вышеупомянутые магнитные вещества.
Кроме того, можно получать магнитные частицы, на поверхности которых присутствуют химические структуры, такие как антитела, нуклеиновые кислоты, пептиды, аптамеры или другие молекулы, которые обладают способностью к избирательному связыванию с мишенью, что будет увеличивать аффинность частиц к выродившимся клеткам. Такие модификации поверхности увеличивают аффинность к злокачественным клеткам за счет распознавания специфических поверхностных структур на выродившихся клетках. Предпочтительные химические структуры, которые обеспечивают магнитным частицам способность к избирательному связыванию с мишенью, представляют собой, например, поликлональные антитела, моноклональные антитела, гуманизированные антитела, антитела человека, химерные антитела, рекомбинантные антитела, биспецифические антитела, фрагменты антител, аптамеры, Fab-фрагменты, Fc-фрагменты, пептиды, пептидомиметики, олигомеры с пропусками, рибозимы, CpG-олигомеры, дезоксирибозимы, РНК-переключатели, а также липиды.
В предпочтительном варианте осуществления настоящего изобретения между наночастицами и терапевтически активными веществами необязательно могут быть образованы связи. Может иметь место образование связи с лекарственным средством за счет ковалентных или преимущественно ковалентных связей и/или достаточно сильных ионных связей, соединения включения или образования комплексных связей, так что неконтролируемое высвобождение лекарственного средства будет в значительной степени предотвращено. Высвобождение лекарственного средства не под влиянием переменного магнитного поля рассматривается как неконтролируемое высвобождение.
В качестве терапевтически активных веществ могут быть выбраны антипролиферативные, противомиграционные, антиангиогенные, антитромбические, противовоспалительные, антифлогистивные, цитостатические, цитотоксические, противосвертывающие, антибактериальные, противовирусные и/или противогрибковые лекарственные средства, где предпочтительными являются антипролиферативные, противомиграционные, антиангиогенные, цитостатические и/или цитотоксические лекарственные средства, а также нуклеиновые кислоты, аминокислоты, пептиды, белки, углеводы, липиды, гликопротеины, гликаны или липопротеины с антипролиферативными, противомиграционными, антиангиогенными, антитромбическими, противовоспалительными, антифлогистивными, цитостатическими, цитотоксическими, противосвертывающими, антибактериальными, противовирусными и/или противогрибковыми свойствами. Кроме того, эти вещества могут представлять собой радиосенсибилизирующие средства или сенсибилизирующие средства или усиливающие средства для других, также комбинированных, обычных способов лечения злокачественных опухолей, или содержат такие сенсибилизирующие средства.
Алкилирующие средства, антибиотики с цитостатическими свойствами, антиметаболиты, ингибиторы микротрубочек и ингибиторы топоизомеразы, содержащие платину соединения и другие цитостатические средства, такие как аспарагиназа, третиноин, алкалоиды, токсины подофила, таксаны и Милтефозин®, гормоны, иммуномодуляторы, моноклональные антитела, трансдукторы сигналов (молекулы сигнальной трансдукции) и цитокины среди прочих можно использовать в качестве цитотоксических и/или цитостатических соединений, т.е. химических соединений с цитотоксическими и/или цитостатическими свойствами.
В качестве примеров алкилирующих средств среди прочего можно назвать хлорэтамин, циклофосфамид, трофосфамид, ифосфамид, мелфалан, хлорамбуцил, бусульфан, тиотепа, кармустин, ломустин, дакарбазин, прокарбазин, темозоломид, треосульфан, эстрамустин и нимустин.
Примерами антибиотиков с цитостатическими свойствами являются даунорубицин, доксорубицин (адриамицин), дактиномицин, митомицин C, блеомицин, эпирубицин (4-эпи-адриамицин), идарубицин, митоксантрон и амсакрин.
Метотрексат, 5-фторурацил, 6-тиогуанин, 6-меркаптопурин, флударабин, кладрибин, пентостатин, гемцитабин, азатиоприн, ралтитрексед, капецитабин, цитозин-арабинозид, тиогуанин и меркаптопурин могут быть названы в качестве примеров антиметаболитов (антиметаболические лекарственные средства).
Винкристин, винбластин, виндезин, этопозид, а также тенипозид среди прочих принадлежат к классу алкалоидов и токсинов подофила. Кроме того, по изобретению можно использовать содержащие платину соединения. Например, в качестве содержащих платину соединений отмечались цисплатин, карбоплатин и оксаплатин. Например, такие алкалоиды, как алкалоиды барвинка (винкристин, винбластин, виндезин, винорелбин) и таксаны (паклитаксел/Таксол®, паклитаксел и доцетаксел), а также производные паклитаксела принадлежат к ингибиторам микротрубочек. Токсины подофила (этопозид, тенипозид) и алкалоиды камптотеки (камптотецин, топотекан и иринотекан) могут быть приведены в качестве ингибиторов топоизомеразы.
Например, гидрокарбамиды (гидроксимочевина), иматиниб, Милтефозин®, амсакрин, пентостатин, бексаротен, третиноин и аспарагиназа можно рассматривать в качестве других цитостатических лекарственных средств (другие цитостатические средства). Представителями класса моноклональных антител являются трастузумаб (также известен как Герцептин®), алемтузумаб (также известен как Мабкампат®) и ритуксимаб (также известен как Мабтера®).
По изобретению, также такие гормоны, как глюкокортикоиды (преднизон), эстрогены (фосфэстрол, эстрамустин), LHRH (бусерелин, гозерелин, лейпрорелин, трипторелин), флутамид, ципротеронацетат, тамоксифен, торемифен, аминоглютетимид, форместан, эксеместан, летрозол и анастрозол можно использовать. Интерлейкин-2, интерферон-α, интерферон-γ, эритропоэтин, G-CSF, трастузумаб (Герцептин®), ритуксимаб (Мабтера®), гефитиниб (Иресса®), ибритумомаб (Зевалин®), левамизол, а также ретиноиды принадлежат к классам иммуномодуляторов, цитокинов, антител и трансдукторов сигналов.
Вышеупомянутые лекарственные средства могут содержаться вместе с магнитными частицами в патентоспособном медицинском продукте или наноситься на его поверхность. В том случае, когда лекарственное средство за счет ковалентных или ионных связей соединено с магнитными частицами или медицинским продуктом или биоразрушаемым медицинским продуктом, связывание лекарственного средства происходит, например, с участием гидроксигрупп, аминогрупп, карбонильных групп, тиоловых групп, или карбоксильных групп, в зависимости от того, какие функциональные группы несет соответствующее лекарственное средство.
С участием гидроксигрупп предпочтительно образуются сложные эфиры, ацетали или кетали, с участием тиоловых групп предпочтительно образуются тиоловые эфиры, тиоловые ацетали или тиоловые кетали, с участием аминогрупп предпочтительно образуются амиды и отчасти имины (шиффовы основания), с участием карбоксильных групп предпочтительно образуются сложные эфиры или амиды, а с участием карбонильных групп предпочтительно образуются кетали.
Кроме того, предпочтительно, чтобы лекарственное средство или лекарственные средства были связаны с наночастицами или с медицинским продуктом или биоразрушаемым медицинским продуктом не напрямую, а в иммобилизованном виде с помощью линкерной молекулы. Кроме того, известны способы функционализации поверхности наночастицы, так что аминогруппы, гидроксигруппы, карбоксильные группы или карбонильные группы могут быть образованы на поверхности наночастиц известными способами.
Терапевтически активные вещества связаны с наночастицами и/или с медицинским продуктом или с биоразрушаемым медицинским продуктом непосредственно или через линкерную молекулу, предпочтительно через амидную связь или эфирную связь.
Предпочтительны линкеры, которые содержат pH-расщепляемый ацеталь, эфир, гидразоновые или иминовые группы и могут быть расщеплены посредством реакции в кислой среде или ферментативной реакции.
Амидная группа должна быть названа в качестве ферментативно расщепляемой группы в линкерной молекуле или около нее. Группы, расщепляемые под действием температуры или кислоты, содержат, например, фосфатные группы, тиофосфатные группы, сульфатные группы, фосфамидные группы, карбаматные группы или иминогруппы.
Нет необходимости в том, чтобы лекарственное средство было ковалентно связано с линкером или с биоразрушаемым медицинским продуктом, оно может быть связано с помощью ионных или водородных связей или может присутствовать в интеркалированной или координатной форме.
Как описано выше, в патентоспособных медицинских продуктах можно использовать любые магнитные частицы. Примеры таких магнитных частиц описаны в WO 2005 070471 А2, WO 02/43708 A2, US 5411730 A1, WO 2005 042142 A2, WO 03/026618 A1, WO 2005 065282 A2, WO 2006 108405 A2 и WO 2007 019845 A2.
Биоразрушаемые медицинские продукты
После операции на раковой опухоли хирург оставляет внутри организма пациента патентоспособные биоразрушаемые медицинские продукты в форме имплантатов, гелей, тканей, материи, покрытий для ран или пленкообразующих препаратов, а затем закрывает рану.
Патентоспособные биоразрушаемые медицинские продукты служат, в частности, для последующего лечения операционной области с помощью тепла, образующегося при термотерапии, чтобы уничтожить оставшиеся опухолевые клетки и чтобы предотвратить рецидивирование.
Таким образом, патентоспособные биоразрушаемые медицинские продукты состоят из физиологически приемлемых материалов и/или расщепляются на физиологически приемлемые продукты распада и компоненты.
Материалы для патентоспособных медицинских продуктов выбраны из группы, содержащей или состоящей из: полиакриловая кислота, полиакрилат, полиметилметакрилат, полибутилметакрилат, полиизобутилметакрилат, полиакриламид, полиакрилонитрил, полиамид, полиэфирамид, полиэтиленамин, полиимид, поликарбонат, поликарбоуретан, поливинилкетон, поливинилгалогенид, поливинилиденгалогенид, простой поливиниловый эфир, поливиниловые ароматические соединения, сложный поливиниловый эфир, поливинилпирролидон, полиоксиметилен, полиэтилен, полипропилен, политетрафторэтилен, полиуретан, полиолефиновый эластомер, полиизобутилен, EPDM смолы, фторсиликон, карбоксиметилхитозан, полиэтилентерефталат, поливалерат, карбоксиметилцеллюлоза, целлюлоза, вискоза триацетат, вискозы, нитрат целлюлозы, ацетат целлюлозы, гидроксиэтилцеллюлоза, бутират целлюлозы, ацетат-бутират целлюлозы, этилвинилацетатный сополимер, полисульфон, полиэфирсульфон, эпоксидная смола, ABS смолы, EPDM смолы, силиконовый предполимер, силикон, полисилоксан, поливинилгалоген, простой эфир целлюлозы, целлюлозы триацетат, хитозан, производные хитозана, полимеризуемые масла, поливалеролактоны, поли-ε-декалактон, полилактид, полигликолид, сополимеры полилактида и полигликолида, поли-ε-капролактон, полигидроксимасляная кислота, полигидроксибутират, полигидроксивалерат, полигидроксибутират-со-валерат, поли(1,4-диоксан-2,3-дион), поли(1,3-диоксан-2-он), поли-пара-диоксанон, полиангидрид, ангидрид полималеиновой кислоты, полигидроксиметакрилат, полицианоакрилат, поликапролактондиметилакрилат, поли-β-малеиновая кислота, поликапролактонбутилакрилат, многоблочные сополимеры, полученные из олигокапролактондиола и олигодиоксанондиола, полиэфирэфирные многоблочные сополимеры, полученные из ПЭГ и поли(бутилентерефталата), полипивотолактон, триметилкарбонат полигликолевой кислоты, поликапролактон-гликолид, поли(γ-этилглутамат), поли(DTH-иминокарбонат), поли(DTE-со-DT-карбонат), поли(бисфенол A-иминокарбонат), полиортоэфир, триметилкарбонат полигликолевой кислоты, политриметилкарбонат, полииминокарбонат, поливиниловые спирты, полиэфирамиды, гликолидизированные полиэфиры, полифосфоэфиры, полифосфазены, поли[p-карбоксифенокси)пропан], полигидроксивалериановая кислота, полиэтиленоксид-пропиленоксид, мягкие полиуретаны, полиуретаны с остатками аминокислот в остове, полиэфирэфиры, полиэтиленоксид, полиалкеноксалаты, полиортоэфиры, каррагинаны, крахмал, коллаген, полимеры на белковой основе, полиаминокислоты, синтетические полиаминокислоты, цеин, модифицированный цеин, полигидроксиалканоаты, пектиновая кислота, актиновая кислота, фибрин, модифицированный фибрин, казеин, модифицированный казеин, карбоксиметилсульфат, альбумин, гиалуроновая кислота, гепарансульфат, гепарин, хондроитина сульфат, декстран, циклодекстрин, сополимеры, полученные из ПЭГ и полипропиленгликоля, аравийская камедь, гуаровая или другие камеде-смолы, желатин, коллаген, коллаген-N-гидроксисукцинимид, липиды, липоиды, полимеризуемые масла и их модификации, сополимеры и смеси выше указанных веществ.
Вышеуказанные полимеры являются биоразрушаемыми и их можно получать с такими степенью полимеризации и с поперечными связями, которые поддаются биоразрушению.
Под термином «биоразрушаемый» или «биорассасывающийся» понимают, что эти материалы разрушились или будут разрушены на 90 процентов по массе в течение периода от 1 месяца до 12 месяцев, предпочтительно до 6 месяцев, при физиологических условиях.
Предпочтительными биоразрушаемыми полимерами являются полилактиды, полигликолиды, сополимеры полилактидов и полигликолидов, полигидроксибутират, полигидроксиметакрилат, полиортоэфиры, гликолированные полиэфиры, поливиниловые спирты, поливинилпирролидон, сополимеры акриламида и акриловой кислоты, гиалуроновая кислота, гепарансульфат, гепарин, хондроитин сульфаты, декстран, β-циклодекстрины, гидрофильно сшитые декстрины, альгинаты, фосфолипиды, карбомеры, сшитые пептиды и белки, силиконы, полиэтиленгликоль (ПЭГ), полипропиленгликоль (ППГ), сополимеры ПЭГ и ППГ, коллаген, полимеризуемые масла и воски и их смеси и сополимеры.
Кроме того, предпочтительными являются полиэфиры, полилактиды, а также сополимеры диолов и сложных эфиров или диолов и лактидов. Например, в качестве диолов используют в этан-1,2-диол, пропан-1,3-диол или бутан-1,4-диол.
По изобретению, в частности, полиэфиры используются для полимерного слоя. Предпочтительными являются такие полимеры из группы полиэфиров, которые отличаются наличием следующих мономеров:
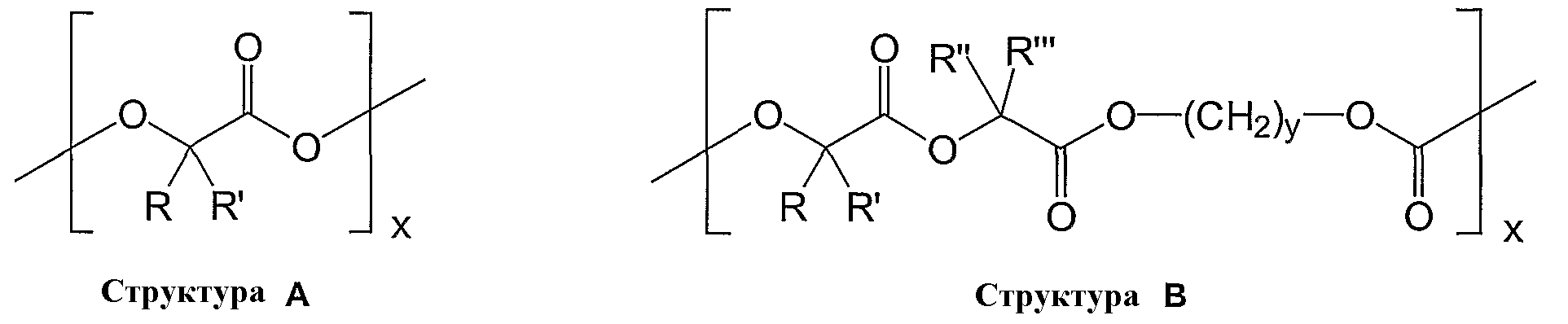
В изображенных мономерах R, R', R'' и R''' обозначают алкильные группы, содержащие от 1 до 5 углеродных атомов, в частности, метил, этил, пропил, изопропил, н-бутил, с-бутил, трет-бутил, изобутил, н-пентил, или циклопентил, и предпочтительно метил или этил. Y представляет собой целое число от 1 до 9, а x обозначает степень полимеризации. В частности, предпочтительными являются следующие полимеры из приведенных представительных мономеров:
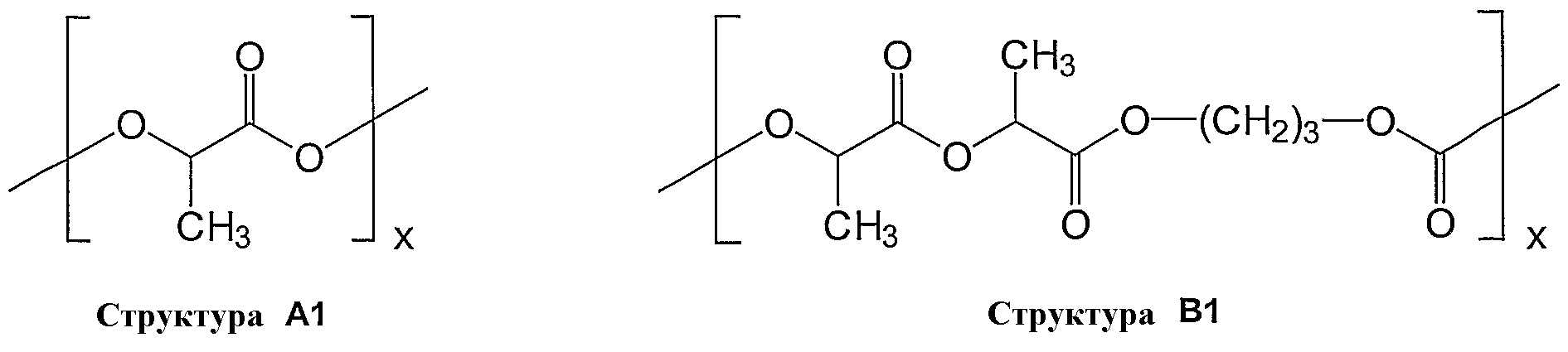
В качестве дополнительных представителей рассасывающихся полимеров следует назвать Resomer®, поли(L-лактиды) с общей формулой -(С6Н8О4)n-, например, L 210, L 210 S, L 207 S, L 209 S, поли(L-лактид-ко-D,L-лактид)ы с общей формулой -(С6Н8О4)n-, например, LR 706, LR 708, L 214 S, LR 704, поли(L-лактид-ко-триметилкарбонат)ы с общей формулой -[(С6Н8О4)x-(С4Н6О3)y]n-, например, LT 706, поли(L-лактид-ко-гликолид)ы с общей формулой -[(С6Н8О4)x-(С4Н4О4)y]n-, например, LG 824, LG 857, поли(L-лактид-ко-ε-капролактон)ы с общей формулой -[(C6H8O4)x-(C6H10O2)y]n-, например, LC 703, поли(D,L-лактид-ко-гликолид)ы с общей формулой -[(C6H8O4)x-(C4H4O4)y]n-, например, RG 509 S, RG 502 H, RG 503 H, RG 504 H, RG 502, RG 503, RG 504, поли(D,L-лактид)ы с общей формулой -[(C6H8O4)n-, например, R 202 S, R 202 H, R 203 S и R 203 H. В настоящем документе Resomer® 203 S представляет собой альтернативу для особенно предпочтительного полимера, Resomer® R 203. Название Resomer® обозначает высокотехнологичный продукт компании Boehringer Ingelheim.
В основном, в настоящем изобретении использование абсорбируемых полимеров является особенно предпочтительными. Кроме того, предпочтительными являются гомополимеры молочной кислоты (полилактиды), а также полимеры, которые получают из молочной и гликолевой кислот.
Биостабильные медицинские продукты
Патентоспособные биостабильные или не поддающиеся биоразрушению медицинские продукты в форме гелей, губок и, в частности, пленкообразующих композиций, пленкообразующих спреев или материи, тканей, целлюлозы, покрытий для ран и т.п. получают из не поддающихся биоразрушению или плохо биоразрушающихся материалов.
Материалы для патентоспособных биостабильных медицинских продуктов выбраны из группы, содержащей или состоящей из: полиакриловая кислота и полиакрилат, например, полиметилметакрилат, полибутилметакрилат, полиакриламид, полиакрилонитрилы, полиамиды, полиэфирамиды, полиэтиленамин, полиимиды, поликарбонаты, поликарбоуретаны, поливинилкетоны, поли(винилгалогенид)ы, поли(винилиденгалогенид)ы, простые поливиниловые эфиры, поливиниловые ароматические соединения, сложные поливиниловые эфиры, поливинилпирролидоны, полиоксиметилены, полиэтилен, полипропилен, политетрафторэтилен, полиуретаны, полиолефиновые эластомеры, полиизобутилен, EPDM смолы, фторсиликоны, карбоксиметил хитозан, полиэтилентерефталат, поливалерат, карбоксиметилцеллюлоза, целлюлоза, вискоза, триацетаты вискозы, нитрат целлюлозы, ацетат целлюлозы, гидроксиэтилцеллюлоза, бутират целлюлозы, ацетат-бутират целлюлозы, этилвиниловые ацетатные сополимеры, полисульфоны, эпоксидные смолы, ABS смолы, EPDM смолы, силиконы, такие как полисилоксаны, поливиниловые галогены и сополимеры, простой эфир целлюлозы, триацетат целлюлозы, хитозан и их сополимеры и/или смеси.
Предпочтительные биостабильные полимеры, которые используются в медицинской инженерии и для биостабильных имплантатов, представляют собой полиэфирсульфон, замещенный полиэфирсульфон, полифенилсульфон, замещенный полифенилсульфон, блок-сополимеры полисульфона, блок-сополимеры перфторированного полисульфона, блок-сополимеры полуфторированного полисульфона, блок-сополимеры замещенного полисульфона и/или смеси вышеуказанных полимеров.
Гели
Патентоспособные наночастицы могут быть внедрены в гели или гидрогели, или могут являться компонентами пленкообразующих спреев, которые предпочтительно также поддаются биоразрушению. Для улучшения стабилизации гелей или пленкообразующих спреев, патентоспособные наночастицы, описываемые в настоящем документе, могут комбинироваться с гелеобразующими или пленкообразующими средствами.
Подходящие гелеобразующие или пленкообразующие средства предпочтительно представляют собой материалы на основе целлюлозы, такие как нитрат целлюлозы или этилцеллюлоза или их физиологически приемлемые полимеры, поливинилацетат, частично омыленный поливинилацетат, полимерные смеси винилацетата и акриловой кислоты или кротоновой кислоты или моноалкилового эфира малеиновой кислоты, трехкомпонентные полимерные смеси винилацетата и кротоновой кислоты и винилнеодеканоата, или кротоновой кислоты и винилпропионата, полимерные смеси метилвинилового эфира и моноалкилового эфира малеиновой кислоты, в частности, в виде монобутилового эфира малеиновой кислоты, полимерные смеси винилового эфира жирной кислоты и акриловой кислоты или метакриловой кислоты, полимерные смеси N-винилпирролидона, метакриловой кислоты и алкилового эфира метакриловой кислоты, полимерные смеси акриловой кислоты и метакриловой кислоты или алкилового эфира акриловой кислоты или алкилового эфира метакриловой кислоты, в частности, с содержанием групп четвертичного аммония, или полимеры, сополимеры или смеси, содержащие этилакрилат, метилметакрилат или триметиламмоний этилметакрилатхлорид, или поливинилацетали и поливинилбутирали, алкил-замещенные поли-N-винилпирролидоны, алкиловый эфир полимерных смесей олефинов и ангидрида малеиновой кислоты, продукты реакции канифоли с акриловой кислотой и стираксовыми смолами, хитозан, Luvimer 100®, стеарат алюминия, карбомеры, кокамид МЭА, карбоксиметилдекстран, карбоксиметил гидроксипропил гуар или каррагинаны красных водорослей.
Алкильные радикалы вышеуказанных сложных эфиров обычно имеют короткие цепи и, по большей части, не содержат более четырех углеродных. Такие соединения обозначаются в настоящем документе как полимерообразующие или гелеобразующие средства.
Кроме того, водорастворимые полимеры, например, ионные полиамиды, полиуретаны и полиэфиры, а также гомо- и сополимеры этиленовых ненасыщенных мономеров принадлежат к гелеобразующим и пленкообразующим средствам, соответственно. Такие соединения, например, поставляются под марками Acronal®, Acudyne®, Amerhold®, Amphome®, Eastman AQ®, Ladival®, Lovocryl®, Luviflex VBM®, Luvimer®, Luviset P. U. R. ®, Luviskol®, Luviskol Plus®, Stepanhold®, Ultrahold®, Ultrahold Strong® или Versatyl®. Luvimer® представляет собой полиакрилат.
Дополнительными компонентами патентоспособных гелей может быть большинство натуральных полимеров. Среди них присутствуют альбумин, коллаген, гиалуронан, хитозан и хитин. Сополимер или блок-сополимер полиэтиленоксида с концевыми α-гидроксикислотами или поли-α-гидроксикислотами представляет собой особенно предпочтительный неприродный полимер.
Кроме того, гликозаминогликаны, такие как аггрекан, декорин, бигликан и фибромодулин представляют собой обычные компоненты биоабсорбируемых гелей или пленкообразующих растворов или спреев.
Также в гелях, растворах и спреях можно использовать растворы солей, такие как физиологический раствор (0,9 процента), PBS (фосфатно-солевой буфер, т.е. раствор фосфатно-солевого буфера), DMEM (модифицированная Дульбекко среда Игла).
При использовании суперпарамагнитных частиц с ядром из оксида железа, предпочтительным является содержание оксида железа 3-30 процентов по массе в 200 мг геля, более предпочтительным является содержание оксида железа 5-25 процентов по массе в 200 мг геля, и наиболее предпочтительным является содержание оксида железа 10-20 процентов по массе в 200 мг геля.
Полимерные носители
Магнитные частицы могут быть добавлены уже в процессе получения полимеров и затем будут внедрены в биорассасывающуюся полимерную структуру.
Примеры для биоразрушаемых медицинских продуктов по изобретению представляют собой полимерные бусины, содержащие магнитные частицы. Полимерные бусины предпочтительно состоят из полигидроксибутирата, полилактида, полигликолида или сополимеров полилактид-ко-гликолида. Альгинат, а также Eudragit®, являются другими особенно предпочтительными материалами. Содержание магнитных частицы в этих полимерных бусинах составляет вплоть до 20 процентов по массе.
Полимерные бусины можно использовать сами по себе или их можно встраивать в гели или пасты, а также их можно иммобилизовать на медицинской целлюлозе.
Полимерные бусины можно нагревать вплоть до температуры 50°C в переменном магнитном поле.
Медицинская целлюлоза
Покрытые медицинские имплантируемые продукты, на которые можно наносить наночастицы, предпочтительно являются биорассасывающимися. То есть они могут полностью растворяться в организме или по меньшей мере могут быть физиологически хорошо переносимыми.
Медицинскими имплантатами, содержащими наночастицы, среди прочего, являются медицинская целлюлоза, перевязочный материал, помещаемые в раны приспособления, хирургическая нить, компрессы и медицинская ткань.
Полигидроксибутират и производные целлюлозы, производные хитозана, а также коллаген, полиэтиленгликоль, полиэтиленоксид и полилактиды являются предпочтительными материалами для медицинской целлюлозы и материи. Продукты из альгината кальция с вотканной карбоксиметилцеллюлозой натрия предпочтительно используют, если альгинаты используют в качестве покрытия для ран. В качестве примера нужно привести SeaSorb Soft из компании Coloplast.
Если наночастицы наносят на перевязочный материал и/или помещаемые в раны приспособления, то следует отметить, в частности, продукты Tabotamp® и Spongostan® компании Johnson & Johnson. Эти продукты получают из регенерированной целлюлозы путем контролируемого окисления.
Если хирургическая нить должна быть импрегнирована наночастицами, то используют хирургическую нить, которая состоит из полигликолевой кислоты, поликапролактон-ко-гликолид или поли-p-диоксанон. Примерами являются продукты Marlin®, PCL и Marisorb® компании Catgut GmbH.
Если компрессы должны быть импрегнированы наночастицами, то в настоящем документе, в частности, нужно использовать стерильные марлевые компрессы из 100% хлопка. Примерами являются линии продуктов Stericomp® и Askina®.
Если используется медицинская целлюлоза, то предпочтительно, чтобы содержание целлюлозы в ней составляло более 90%.
Если используются медицинские ткани, то продукты Trevira® являются предпочтительными.
На медицинские ткани и целлюлозу распыляют раствор магнитных частиц в воде, этаноле или смеси воды и этанола или наносят покрытие окунанием в раствор. Процесс нанесения покрытия окунанием или распылением можно повторять несколько раз после высушивания медицинского продукта.
На один см2 поверхности медицинского продукта наносят от 10 мк до 100 мг магнитных частиц.
На каждый грамм медицинского продукта наносят от 100 мкг до 2 г покрытия из магнитных частиц.
Губки
Медицинские губки представляют собой биорассасывающиеся имплантаты с губчатой пористой структурой.
Предпочтительными материалами для медицинских губок являются коллаген, окисленная целлюлоза, хитозан, тромбин, фибрин, хитин, альгинат, гиалуроновая кислота, PLGA, PGA, PLA, полисахариды и глобин.
Если используются медицинские губки, то предпочтительно, чтобы в них содержание коллагена составляло более 90%.
На каждый грамм медицинского продукта наносят от 100 мкг до 2 г магнитных частиц.
Мази и пасты
Если наночастицы внедряют в мази, то следует использовать основу для мази, которая содержит очищенную воду в количестве предпочтительно 5-50 процентов по массе, более предпочтительно 10-40 процентов по массе и наиболее предпочтительно 20-30 процентов по массе. Кроме того, мазь также содержит вазелиновое масло в количестве предпочтительно 40-90 процентов по массе, более предпочтительно 50-80 процентов по массе и наиболее предпочтительно 20-60 процентов по массе. Кроме того, мазь может содержать вязкий парафин в количестве предпочтительно 5-50 процентов по массе, более предпочтительно 10-40 процентов по массе и наиболее предпочтительно 20-30 процентов по массе.
Кроме того, можно использовать гелеобразующие и/или пленкообразующие средства, которые описаны в настоящем документе, которые можно добавлять в количестве вплоть до 30 процентов по массе. Кроме того, полимеры, такие как целлюлоза, хитозан, тромбин, фибриноген, хитин, альгинаты, альбумин, гиалуроновая кислота, гиалуронан, полисахариды, глобин, полилактид, полигликолид, полилактид-ко-гликолид, полигидроксибутираты, производные целлюлозы, производные хитозана, полиэтиленгликоль и полиэтиленоксид в количествах вплоть до 30 процентов по массе.
Пленкообразующие спреи
Наночастицы по изобретению могут быть внедрены в распыляемые растворы или могут являться компонентами пленкообразующих спреев. Магнитные частицы или наночастицы, содержащие лекарственное средство, которые описываются в настоящем документе, можно использовать в сочетании с гелеобразующими или пленкообразующими средствами для лучшей стабилизации пленкообразующих спреев. Пленкообразующие спреи содержат по меньшей мере один или несколько пленкообразующих средств.
Подходящие пленкообразующие средства предпочтительно представляют собой соединения на основе целлюлозы, такие как нитрат целлюлозы или этилцеллюлоза или их физиологически приемлемые полимеры, поливинилацетат, частично омыленный поливинилацетат, полимерные смеси винилацетата и акриловой кислоты или кротоновой кислоты или моноалкилового эфира малеиновой кислоты, трехкомпонентные полимерные смеси винилацетата и кротоновой кислоты и винилнеодеканоата, или кротоновой кислоты и винилпропионата, полимерные смеси метилвинилового эфира и моноалкилового эфира малеиновой кислоты, в частности в виде монобутилового эфира малеиновой кислоты, полимерные смеси винилового эфира жирной кислоты и акриловой кислоты или метакриловой кислоты, полимерные смеси N-винилпирролидона, метакриловой кислоты и алкилового эфира метакриловой кислоты, полимерные смеси акриловой кислоты и метакриловой кислоты или алкилового эфира акриловой кислоты или алкилового эфира метакриловой кислоты, в частности, с содержанием групп четвертичного аммония, или полимеры, сополимеры или смеси, содержащие этилакрилат, метилметакрилат или триметиламмоний этилметакрилат хлорид, или поливиниловые ацетали и поливинилбутирали, алкил-замещенные поли-N-винилпирролидоны, алкиловый эфир полимерных смесей олефинов и ангидрида малеиновой кислоты, продукты реакции канифоли с акриловой кислотой и стираксовыми смолами, хитозан, Luvimer 100®, стеарат алюминия, карбомеры, кокамид МЭА, карбоксиметилдекстран, карбоксиметил гидроксипропил гуар или каррагинаны красных водорослей.
Алкильные радикалы вышеуказанных эфиров обычно обладают короткими цепями и главным образом не содержат более четырех углеродных атомов.
Кроме того, водорастворимые полимеры, такие как ионные полиамиды, полиуретаны и полиэфиры, а также гомо- и сополимеры этиленовых ненасыщенных мономеров относятся к гелеобразующим и пленкообразующим средствам, соответственно. Такие соединения доступны, например, под марками Acronal®, Acudyne®, Amerhold®, Amphome®, Eastman AQ®, Ladival®, Lovocryl®, Luviflex VBM®, Luvimer®, Luviset P. U. R. ®, Luviskol®, Luviskol Plus®, Stepanhold®, Ultrahold®, Ultrahold Strong® или Versatyl®. Luvimer® представляет собой полиакрилаты, которые разрабатывались в качестве полимера для укладки волос компанией BASF AG.
Предпочтительными растворителями является вода, этанол или смеси воды и этанола.
Для использования суперпарамагнитных частиц с ядром из оксида железа, предпочтительным является содержание оксида железа 3-30 процентов по массе в 200 мг геля, более предпочтительным является содержание оксида железа 5-25 процентов по массе в 200 мг геля, и наиболее предпочтительным является содержание оксида железа 10-20 процентов по массе в 200 мг геля.
На каждый грамм медицинского продукта наносят от 100 мкг до 2 г магнитных частиц.
Производство имплантатов, содержащих наночастицы, происходит с помощью процесса окунания или распыления. В настоящем документе, продукты, подлежащие имплантации, окунают в содержащий наночастицы раствор или суспензию или на них распыляют содержащий наночастицы раствор. После этого продукты сушат и помещают в асептическую упаковку. Гели, мази, растворы и спреи получают путем получения желаемого фармацевтического препарата в соответствии со стандартными процедурами, а желаемое количество магнитных частиц добавляют предпочтительно на последней стадии.
Полученные патентоспособные биоразрушаемые медицинские продукты используются для лечения и профилактики опухолей, карцином и раков, а также они служат, в частности, для последующего лечения операционной области после операции на раковой опухоли и, в частности, после удаления солидной опухоли.
Примеры рака и опухолей, для которых можно использовать патентоспособные медицинские продукты, представляют собой: аденокарциномы, хориоидальная меланома, острый лейкоз, невринома слухового нерва, ампулярная карцинома, анальная карцинома, астроцитомы, базалиома, панкреатическая карцинома, опухоль соединительной ткани, рак мочевого пузыря, бронхиальная карцинома, немелкоклеточная бронхиальная карцинома, рак молочной железы, лимфома Беркитта, карцинома тела матки, карцинома с неизвестной локализацией первичной опухоли, рак толстого кишечника, рак тонкой кишки, опухоли тонкой кишки, рак яичников, карцинома эндометрия, эпендимома, эпителиальные раки, Саркома Юинга, опухоли желудочно-кишечного тракта, рак желчного пузыря, билиарные карциномы, рак матки, рак шейки матки, глиобластомы, гинекологические опухоли, оториноларингологические опухоли, опухоли кроветворной системы, рак мочеиспускательного канала, рак кожи, опухоли мозга (глиомы), метастазы в мозге, рак яичка, гипофизарная опухоль, карциноиды, саркома Капоши, рак гортани, герминома, рак кости, колоректальная карцинома, опухоли головы и шеи (опухоли в области шеи, носа и глаз), карцинома толстой кишки, краниофарингиомы, рак области рта и губ, рак печени, метастазы в печени, опухоль века, рак легких, рак лимфатических узлов (ходжкиновский/неходжкиновский), лимфомы, рак желудка, злокачественная меланома, злокачественная неоплазия, малигномы желудочно-кишечного тракта, карцинома молочной железы, рак прямой кишки, медуллобластомы, меланома, менингиомы, болезнь Ходжкина, грибовидный микоз, рак носа, невринома, нейробластома, рак почки, почечноклеточная карцинома, Неходжкинские лимфомы, олигодендроглиома, карцинома пищевода, остеолитическая карцинома и остеопластическая карцинома, остеосаркома, карцинома яичника, панкреатическая карцинома, рак полового члена, плоскоклеточные карциномы головы и шеи, рак предстательной железы, рак глотки, карцинома прямой кишки, ретинобластома, рак влагалища, рак щитовидной железы, болезнь Шнебергера, рак пищевода, спиналиома, T-клеточная лимфома (грибовидный микоз), тимома, трубная карцинома, опухоли глаза, рак мочеиспускательного канала, урологические опухоли, уротелиальная карцинома, рак вульвы, поражение сосцевидного отростка, опухоли мягких тканей, саркома мягких тканей, опухоль Вильмса, цервикальная карцинома и рак языка.
В частности, предпочтительными являются солидные опухоли. Кроме того, предпочтительными являются карцинома простаты, опухоли мозга, саркомы, цервикальные карциномы, карциномы яичника, карциномы молочной железы, бронхиальные карциномы, меланомы, опухоли головы и шеи, карциномы пищевода, карциномы прямой кишки, панкреатические карциномы, карциномы мочевого пузыря, карциномы почек, метастазы в печени, мозге и лимфатических узлах.
Кроме того, использование и применение патентоспособных биорассасывающихся медицинских продуктов является особенно предпочтительным в области медицины, предпочтительно, в сочетании с лучевой терапией и/или вместе с обычной химиотерапией.
Этот щадящий способ термотерапии включает локально ограниченное применение противораковых лекарственных средств и, таким образом, снижает лекарственную нагрузку и неблагоприятные воздействия на пациента. Кроме того, вероятность рецидива метастазов будет значительно снижена, поскольку борьба с опухолевыми клетками, оставшимися после неполной резекции, происходит локально и избирательно. Кроме того, лекарственные средства, необязательно расположенные на патентоспособном имплантате или медицинском продукте, могут высвобождаться из наночастиц под действием переменного магнитного поля, приложенного извне, и будут обладать более сильным избирательным действием в области действия. Это делает возможным более точное дозирование лекарственного средства, поскольку лекарственное средство не будет теряться в процессе доставки через организм в силу местного характера способа лечения. Также вышеописанный способ можно эффективно осуществлять против злокачественных клеток с использованием наночастиц без присоединенного лекарственного средства. В настоящем документе, наночастицы присоединяются к злокачественным клеткам или проникают в злокачественные клетки и разрушают злокачественные клетки под действием приложенного извне магнитного поля, которое нагревает магнитные частицы.
Дополнительно, молекулы со способностью к избирательному связыванию, например, моноклональные антитела и/или аптамеры, можно соединять с поверхностью наночастиц или наружным слоем или оболочкой наночастиц для дополнительного увеличения аффинности к конкретным типам клеток.
В предпочтительном варианте осуществления настоящего изобретения ядро магнитной наночастицы состоит из магнетита (Fe3O4), маггемит (γ-Fe2O3) или смесей обоих оксидов и предпочтительно является суперпарамагнитным. Кроме того, ядра стабилизируют с помощью коллоидных защитных оболочек, которые делают возможным присоединение терапевтически эффективных средств.
ПРИМЕРЫ
Пример 1A:
Общие указания относительно получения суспензии/раствора наночастиц для импрегнирования или нанесения на носитель распылением или окунанием
Раствор 0,23 моль FeCl2 и 0,46 моль FeCl3 в 1 л воды дегазировали азотом. После этого добавляли столько 5 М NaOH в течение 20 минут, чтобы достичь значения pH 11,5. Полученный осадок нагревали до 65°C в течение десяти минут и затем охлаждали до комнатной температуры в течение пяти минут. После этого осадок суспендировали в деионизированной и дегазированной воде до тех пор, пока значение pH раствора для промывания не составило 9. Осадок суспендировали в воде и значение pH суспензии довели до 6 с использованием ледяной уксусной кислоты. В полученную суспензию добавили 10 процентов по объему 30-процентного по массе водного раствора, которую затем перемешивали до тех пор, пока не закончилось выделение газа. После этого суспензию разводили водой до концентрации твердого оксида железа 5 процентов по массе.
Пример 1B (без окисления/при газировании воздухом):
Чтобы получить наночастицы оксида железа в этиленгликоле, в 900 мл этиленгликоля растворяли 0,1 моль FeCl3 Ч 6Н2О и 0,2 моль FeCl3 (безводный), 50 г ацетата натрия и 195 г диаминогексана и нагревали при 60°C в течение 1 часа. Затем раствор нагревали до температуры кипения в течение 30 минут. Температуру кипения поддерживали в течение шести часов. Полученную дисперсию медленно охлаждали до комнатной температуры.
Частицы промывали три раза смесью этанола и воды.
После этого частицы ресуспендировали в 900 мл этиленгликоля и газировали атмосферным кислородом. Суспензию нагревали до температуры кипения этиленгликоля и поддерживали эту температуру в течение 24 часов.
После охлаждения частицы промывали водой/этанолом и суспендировали в воде.
Эти частицы покрывали способом, аналогичным приведенному в примере 1G.
Пример 1С (при окислении/при газировании воздухом):
Чтобы получить наночастицы оксида железа в этиленгликоле, в 900 мл этиленгликоля растворяли 0,1 моль FeCl3 Ч 6Н2О и 0,2 моль FeCl3 (безводный), 50 г ацетата натрия и 195 г диаминогексана и нагревали при 60°C в течение 1 часа. Затем раствор нагревали до температуры кипения в течение 30 минут. Температуру кипения поддерживали в течение шести часов. Полученную дисперсию медленно охлаждали до комнатной температуры.
Частицы промывали три раза смесью этанола и воды.
После этого частицы ресуспендировали в 900 мл этиленгликоля и газировали атмосферным кислородом. Суспензию нагревали до температуры кипения этиленгликоля и поддерживали эту температуру в течение 24 часов.
После охлаждения частицы промывали водой/этанолом и суспендировали в 900 мл 1 M HNO3. Затем добавляли 450 мл 0,7 M раствора нитрата железа (Fe(NO3)3 Ч 9H2O) и кипятили с обратным холодильником в течение одного часа (100°C). Частицы промывали три раза, каждый раз в 500 мл воды.
Эти частицы покрывали способом, аналогичным приведенному в примере 1G.
Пример 1D (без окисления/без газирования воздухом):
Чтобы получить наночастицы оксида железа в этиленгликоле, в 900 мл этиленгликоля растворяли 0,1 моль FeCl3 Ч 6Н2О и 0,2 моль FeCl3 (безводный), 50 г ацетата натрия и 195 г диаминогексана и нагревали при 60°C в течение 1 часа.
Затем раствор нагревали до температуры кипения в течение 30 минут. Температуру кипения поддерживали в течение шести часов. Полученную дисперсию медленно охлаждали до комнатной температуры.
Частицы промывали три раза смесью этанола и воды.
После этого частицы ресуспендировали в 900 мл этиленгликоля.
Суспензию нагревали до температуры кипения этиленгликоля и поддерживали эту температуру в течение 24 часов.
После охлаждения частицы промывали водой/этанолом и суспендировали в воде.
Эти частицы покрывали способом, аналогичным приведенному в примере 1G.
Пример 1E (при окислении/без газирования воздухом):
Чтобы получить наночастицы оксида железа в этиленгликоле, в 900 мл этиленгликоля растворяли 0,1 моль FeCl3 Ч 6Н2О и 0,2 моль FeCl3 (безводный), 50 г ацетата натрия и 195 г диаминогексана и нагревали при 60°C в течение 1 часа.
Затем раствор нагревали до температуры кипения в течение 30 минут. Температуру кипения поддерживали в течение шести часов. Полученную дисперсию медленно охлаждали до комнатной температуры.
Частицы промывали три раза смесью этанола и воды.
После этого частицы ресуспендировали в 900 мл этиленгликоля. Суспензию нагревали до температуры кипения этиленгликоля и поддерживали эту температуру в течение 24 часов.
После охлаждения частицы промывали водой/этанолом и суспендировали в 900 мл 1 M HNO3. Затем добавляли 450 мл 0,7 M раствора нитрата железа (Fe(NO3)3 Ч 9H2O) и кипятили с обратным холодильником в течение одного часа (100°C). Частицы промывали три раза, каждый раз в 500 мл воды.
Эти частицы покрывали способом, аналогичным приведенному в примере 1G.
Пример 1F:
Чтобы получить наночастицы оксида железа, раствор 96 г гидроксида натрия и 680 мл масляной кислоты 2000 мл метанола добавляли в раствор 216 г шестиводного оксида железа (III) в 500 мл метанола. Полученное твердое вещество промывали метанолом и растворяли в диэтиловом эфире. Затем его несколько раз экстрагировали водой. Твердое вещество осаждали ацетоном, промывали и сушили под вакуумом.
75 г этого твердого вещества растворяли в 250 мл триоктиламина и нагревали при 120°C в течение одного часа.
Затем раствор нагревали до 380°C в течение 30 минут в автоклаве. Эту температуру поддерживали в течение 4 часов. Полученную дисперсию медленно охлаждали до комнатной температуры.
Частицы промывали три раза смесью этанола и воды.
После этого частицы суспендировали в 300 мл дибутилового эфира диэтиленгликоля и газировали атмосферным кислородом. Суспензию нагревали при 300°C в автоклаве и поддерживали эту температуру в течение 24 часов.
Эти частицы окисляли, как в примере 1С, и затем покрывали способом, аналогичным приведенному в примере 1G.
Пример 1G:
Частицы из примеров 1B-1F собирали центрифугированием при высокой центробежной силе и промывали этанолом. 500 мг промытого продукта взвешивали в экстракционном патроне (603 г, Whatman) и помещали в аппарат Сокслета. 200 мл этанола помещали в перегонный куб аппарата Сокслета в качестве экстрагента. Экстрагент нагревали до кипения. Непрерывное экстрагирование осуществляли в течение 8 часов, которое включало приблизительно 16 циклов экстракции. В ходе этого процесса этаноловый раствор приобретал желтоватую окраску. Экстракционный патрон после окончания удаляли, а порошок переносили в аппарат Шленка и сушили под вакуумом в течение 1 часа.
0,5 г порошка наночастицы из примера 4 суспендировали в 20 мл 0,01 M HCl для того, чтобы диспергировать частицы после экстракции. Затем наночастицы обрабатывали ультразвуком в течение 30 минут. После этого добавляли 0,5 г твердого олеата натрия.
3,3 мл дисперсии частиц согласно примеру 5 (0,97 моль/л Fe) и 2,14 мл тетраэтоксисилана добавляли в 120 мл смеси воды/этанола (3:1) и 1,5 процента по массе аммония. В процессе добавления дисперсию перемешивали, а после этого обрабатывали ультразвуком в течение шести часов. Дисперсию очищали центрифугированием и повторным диспергированием в воде.
Пример 2: Губка
Помещаемое в рану приспособление, импрегнированное наночастицами
Коммерчески доступную губку Tabotamp® окунали в суспензию наночастиц, полученную в соответствии с примером 1, на 6 минут. Процесс окунания повторяли дважды после высыхания. Альтернативно, суспензию можно было наносить пипеткой. Этот процесс можно повторять несколько раз до тех пор, пока не будет достигнута желаемая степень загрузки губки.
Пример 3: Медицинская целлюлоза
Медицинская целлюлоза, покрытая наночастицами
На кусок покрытия для раны, шириной 3 см и длиной 6 см, например, SeaSorb из компании Coloplast, состоящий из альгината кальция и карбоксиметилцеллюлозы натрия, пять раз распыляли приблизительно 1 мл суспензии наночастиц согласно примеру 1 и сушили на воздухе приблизительно в течение 20 минут после каждого цикла распыления.
Альтернативно, суспензию можно наносить пипеткой. Этот процесс можно повторять несколько раз до тех пор, пока не будет достигнута желаемая степень загрузки покрытия для раны.
Пример 4: Медицинская целлюлоза с лекарственным средством
Медицинская целлюлоза, импрегнированная наночастицами и цитостатиком
Коммерчески доступную медицинскую целлюлозу, выполненную из карбоксиметилцеллюлозы натрия, поли-N-винилпирролидона и полиэтиленоксида (5 см2), на пять минут окунали в суспензию наночастиц, полученную согласно примеру 1, которая содержала раствор паклитаксела 0,3 мг/мл. Медицинский продукт готов к использованию после высушивания и стерилизации.
Пример 5: гель
Получение геля по изобретению
4 г смеси коллагена I типа и коллагена II типа растворяли в литре 50 мМ раствора уксусной кислоты. Раствор коллагена центрифугировали при скорости 9500 оборотов в минуту и температуре 4°C в течение 45 минут. Супернатант декантировали, помещали в диализную трубку и диализовали против 25 литров 1 M раствора уксусной кислоты в течение двух дней, а затем диализовали против воды в течение дополнительных четырех дней.
После этого раствор коллагена концентрировали в диализной трубке до концентрации 20 мг/мл (2% масс./об.).
Для получения геля, 10 мл раствора коллаген инкубировали с 0,1 мл 1 Н раствора NaOH и 1 мл DMEM (модифицированная Дульбекко среда Игла 10Ч) при температуре 37°C в течение одного часа.
После этого добавляли 1,5 г лиофилизированных наночастиц с распределением по размерам 1-100 нм.
Гель наносили на операционную область в максимально возможной степени после хирургического удаления солидной опухоли тонкой кишки.
Успешное лечение с помощью термотерапии в переменном магнитном поле было показано при нагревании операционной области до 53°C.
Пример 6: Гель с лекарственным средством
0,1 г цитостатического средства, темозоломида, добавляли в 10 г геля, полученного согласно примеру 5, и затем хорошо перемешивали.
Нанесение геля осуществляли как описано в примере 5.
Пример 7: Губка
2 г порошка глобина получали как описано в US 2007031474 A.
Губчатый имплантат получали посредством лиофилизации 1% водной суспензии окисленной целлюлозы в 1,5-процентном по массе порошке глобина при значении pH 7,2. Окисленную целлюлозу можно использовать как в форме волокон, так и в форме двух- или трехмерной структуры.
Полученная губчатая структура состояла приблизительно из 100 мг окисленной целлюлозы и 40-200 мг глобина и имела объем приблизительно 10 см3 и толщину приблизительно 3 мм.
Губчатую структуру стерилизовали этиленоксидом и упаковывали.
Пример 8A: Частицы с лекарственным средством
Получение наночастиц с присоединенным митомицином
Прежде всего, синтезировали конъюгат митомицина и функционализированного альдегидными группами алкоксисилана (например, триэтоксисилилбутилальдегид) для того, чтобы соединить цитостатическое средство митомицин с наночастицами оксида железа, стабилизированными аминосиланом. Таким образом, лекарственное средство присоединяли с помощью образования иминовой связи. При перемешивании этот конъюгат добавляли в водную дисперсию частиц, стабилизированных аминосиланом, например, из WO 97/38058 A. В смесь добавляли этиленгликоль, а воду удаляли дистилляцией. В результате конъюгат лекарственного средства и силана присоединяли (конденсировали) к уже присутствующей оболочке на основе аминосилана. Очистку осуществляли посредством диализа против воды сверхвысокой чистоты. Подробное описание реакции включено в WO 2006108405 A2.
Пример 8B:
Получение наночастиц, связанных с доксорубицином через авидиновый мостик, осуществляли как описано в WO 2006108405 A2.
Пример 8C:
Получение наночастиц, связанных с доксорубицин через нуклеотидную последовательность, осуществляли как описано в WO 2006108405 A2.
Пример 9: Губка
Губчатую структуру получали как описано в примере 7, где вместо окисленной целлюлозы использовали смесь коллагена I типа, коллагена II типа и хитозана (25:25:50 процентов по массе).
После этого полученную губку пропитывали водной суспензией наночастиц, соединенных с доксорубицином согласно примеру 8B или 8C, и сушили.
Вместо последующего пропитывания, суспензию согласно примеру 7 также можно добавить в суспензию наночастиц согласно примерам 8A, 8B или 8C и лиофилизировать вместе с другим компонентами.
Пример 10: Медицинская целлюлоза
Медицинскую целлюлозу на основе хитозана, уроновой кислоты и карбоксиметилдекстрана (4 см2, приблизительно 20 мг) раскладывали слоем в чашке для культивирования и по каплям наносили на нее водную суспензию, содержавшую наночастицы с митомицином, присоединенным согласно примеру 8A, до тех пор, пока загрузка целлюлозы не достигла 50 мг наночастиц.
Пример 11: Гель с наночастицами
23,5 процента по массе негидратированного лецитина, 20,0 процента по массе пропиленгликоля, 10,0 процента по массе этанола, 2,5 процента по массе сорбита, 0,05 M фосфатный буфер (до 100,0%) перемешивали при комнатной температуре в течение 16 часов.
Полученный таким образом гель перемешивали вместе с суспензией наночастиц из примера 1 в течение 4 часов для того, чтобы получить гель с наночастицами.
Пример 12: Пленкообразующий спрей с наночастицами
172 г диэтилового эфира малеиновой кислоты (впуск 1), 98 г ангидрида малеиновой кислоты (впуск 2, в нагревающейся делительной воронке), 200 г винилизобутилового эфира (впуск 3) и 12 г трет-бутил пернеодеканоата (впуск 4) помещали в соответствующие мерные сосуды. Сначала 111 мл из впуска 1, 10 мл из впуска 3 и 3 мл из впуска 4 подавали в 2 л смесительный сосуд, оснащенный перемешивателем, нагревом, обратным холодильником и подготовленными дозаторами, а также впускным отверстием и выпускным отверстием для газа, и нагревали до 60°C. Остаток из впуска 1, остаток из впуска 3 и впуска 2 аддитивно прибавляли в течение 3 часов, а остаток из впуска 4 в течение 4 часов при этой температуре. Затем перемешивали в течение еще 1 часа при 80°C. Получили бесцветный расплав с высокой вязкостью, которые смешивали с 18 г воды при этой температуре и перемешивали в течение 1 часа. После охлаждения до 75°C, 480 г этанола аддитивно добавляли в течение 15 минут и перемешивали в течение 1 часа при этой температуре. После охлаждения до 25°C получили прозрачный вязкий раствор полимера с содержанием твердого вещества 48,1 процентов по массе.
Полученный таким образом вязкий раствор полимера перемешивали с суспензией наночастиц из примера 1 в течение 2 часов для того, чтобы получить пленкообразующий спрей с наночастицами.
Пример 13: Пленкообразующий спрей с наночастицами и лекарственным средством
10 мл раствора полимера, который получали согласно примеру 12, смешивали с 100 мг карбоплатина и 1000 мг лиофилизированных наночастиц согласно примеру 1.
Пример 14: Лечение опухолей шейки матки, грудной стенки, уха, горла и носа
Материал-носитель, пропитанный раствором наночастиц согласно примеру 1A (2 М и 3 М), применяли к кости. Кость помещали в терапевтическое устройство и подвергали воздействию переменного магнитного поля. Увеличение температуры, измеряемой на верхней части кости, определяли при постоянной температуре окружающей среды, насколько это было возможно. Эта постановка эксперимента показывает, что опухоли шейки матки, грудной стенки, уха, горла и носа можно лечить в переменном магнитном поле при помощи покрытых наночастицами носителей, которые применяют на кости или поблизости от кости.
Материалы
Оборудование:
- Терапевтическое устройство MFH-12TS,
- Рециркуляционный охладитель (Julabo; FC600S) с трубным соединением,
- Фиксатор (для крыс) с трубным соединением,
- Polytec Luxtron (модель: LAB. KIT) с двумя датчиками измерения температуры,
- Устройство для измерения напряженности поля (с датчиком),
- Водяные бани (37°C),
- Калибровочный датчик (откалиброван до 11/09)
Материал:
- 2 M или 3 M суспензия наночастиц согласно примеру 1A: каждую обрабатывали ультразвуком в течение 15 минут
- Материал носителя:
1: порошок SPONGOSTAN (1 г, рассасывающийся желатиновый порошок, кровоостанавливающий; Johnson & Johnson)
2: SPONGOSTAN Special (7Ч5Ч0,1 см, рассасывающаяся кровоостанавливающая желатиновая губка; Johnson & Johnson)
3: тампон Gelita (1Ч1Ч1 см, губчатый, выполнен из затвердевшего желатина, полученный из свиньи, биоразрушаемое антигеморрагическое средство; B. Braun Melsungen AG)
4: Lyostypt® (3Ч5 см, влагостойкий компресс из природного коллагена, полученного из коровы, для локализованной остановки кровотечения, рассасывающийся; B. Braun Melsungen AG)
- Кости («свиные ребрышки»),
- Пинцет,
- Пластилиновая масса,
- Медицинский пластырь, (Durapore™; 3 M; 2,5 см Ч 9,14 м)
- Холодный/теплый компресс (Pharma-Depot GmbH; 13Ч14 см)
- Шприц для инъекций туберкулина (Omnifix®-F; Braun; 0,01 мл/1 мл),
- одноразовая игла для инъекций (Sterican®; Braun; 27GЧ11/2”, 0,40Ч40 мм),
- Штангенциркуль с нониусом (DialMax. Откалиброван до 08/09; MS150-4/Atl),
- Скальпель (лезвие № 11),
- Стаканы,
- Камера,
Реактивы:
- Перекись водорода (H2O2; 30%),
- Альгинат (натриевая соль альгиновой кислоты),
Постановка эксперимента
Подходящий фиксатор доводили до 55°C с помощью рециркуляционного охладителя. Проводили испытания на герметичность.
1. Фиксатор располагали в отверстие в терапевтическом устройстве.
2. Предварительно нагретый (37°C) холодный/теплый компресс помещали в «область головы» фиксатора (уменьшался объем воздуха в устройстве и слегка «сглаживались» колебания температуры).
3. Кость:
- кость отделяли от свиных ребрышек и на скорую руку освобождали от мяса,
- помещали в стакан с H2O2,
- затем кость «очищали» скальпелем,
- кость делили с помощью пилы на удобные для эксперимента части.
4. Напряженность поля:
- измерение было направлено на измерение напряженности поля,
- измерительную головку для изменения напряженности поля помещали в то положение в фиксаторе, в котором позднее проводили измерения, пластилин выполнял функцию вспомогательных меток,
- анализировали следующие 3 напряженности поля (уместные для клинического применения): 3,0 кА/м, 3,5 кА/м, 4,0 кА/м,
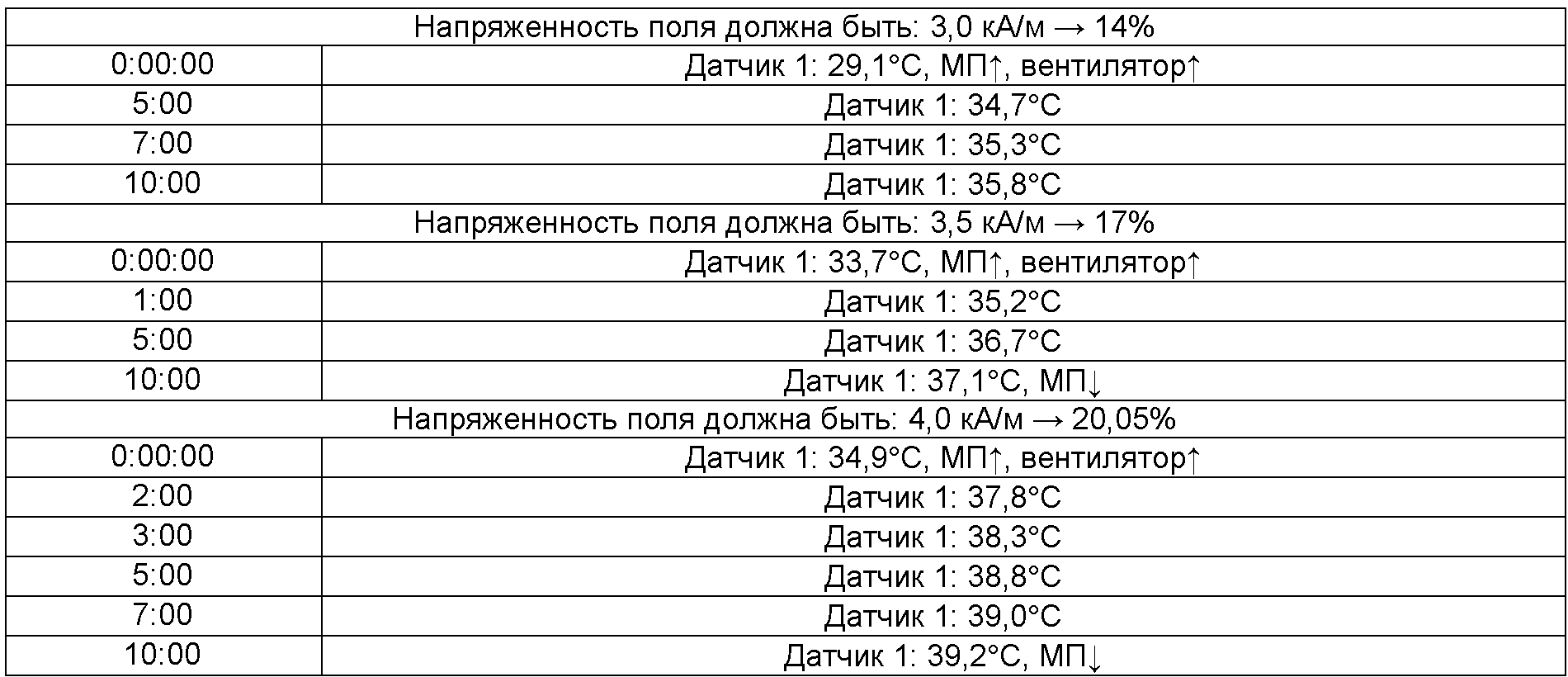
- при этих измерениях получены следующие значения:
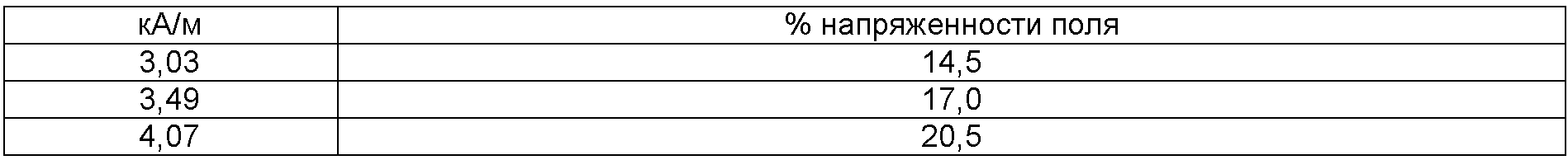
% напряженности поля представляет собой настройку устройства, которая соответствует заданной напряженности поля в кА/м.
5. Температура воздуха во внутреннем пространстве и температуру нижней части аппликатора определяли в фиксаторе.
Пример 14A: Lyostypt®
Частицы: Суспензия наночастиц согласно примеру 1A (0,5 мл, 2 М).
Носитель: Lyostypt®, размер: (19,95Ч14,9Ч3,4) мм.
Кость: размер: (44,4Ч13,2Ч10,9) мм.
Проводили измерения фрагмента кости [линейные размеры: (44,4Ч13,2Ч10,9) мм] и отрезали часть носителя размером [линейные размеры: (19,95Ч14,9Ч3,4) мм]. Носитель помещали на кость и пропитывали частицами (0,5 мл, 2 М согласно примеру 1A). Загруженную кость помещали в аппликатор [датчик 1 (красный): перпендикулярно сверху на пропитанный носитель; датчик 2 (синий): исходное значение («пустая» кость)], и определяли значения для носителя:
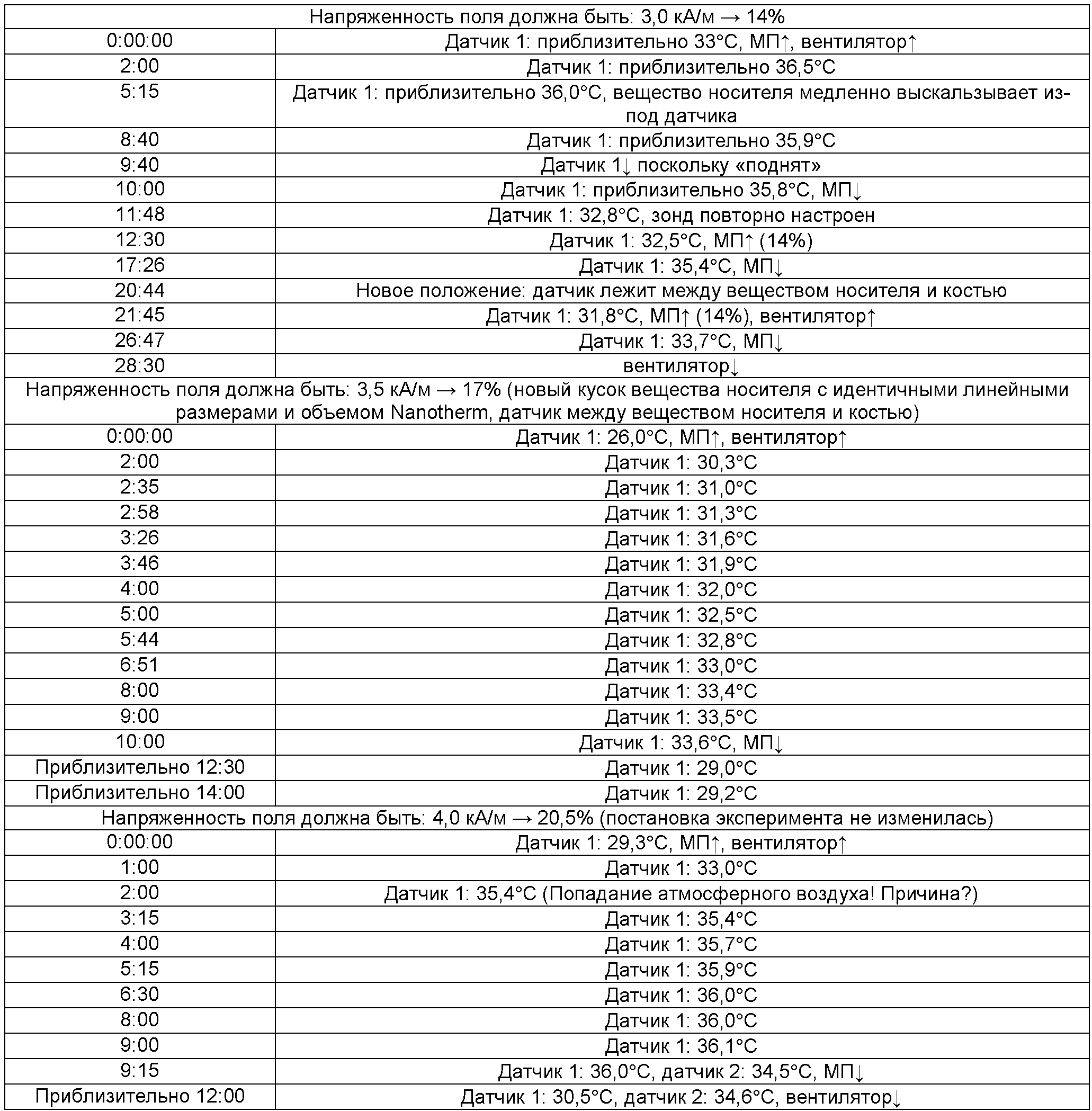
Датчик постоянно располагался между носителем и костью.
МП↑: Переменное магнитное поле включено.
МП↓: Переменное магнитное поле выключено.
Вентилятор↑: Вентилятор включен.
Вентилятор↓: Вентилятор выключен.
Датчик 1↓: Датчик не функционирует.
Пример 14B: SPONGOSTAN
Частицы: Суспензия наночастиц согласно примеру 1A (1,5 мл, 2 М).
Носитель: порошок Spongostan, масса: 0,3 г.
Кость: размер: (44,4Ч13,2Ч10,9) мм.
1,08 г порошка (носитель) пропитывали в 1,5 мл частиц (2 М согласно примеру 1A) и хорошо перемешивали, и часть количества m=0,46 г пропитанного носителя наносили на кость.
Измерительную головку для измерения напряженности поля помещали в то положение в фиксаторе, в котором позже проводили измерения; пластилин выполнял функцию вспомогательных меток. Анализировали следующие 3 напряженности поля (уместные для клинического применения): 3,0 кА/м, 3,5 кА/м, 4,0 кА/м.
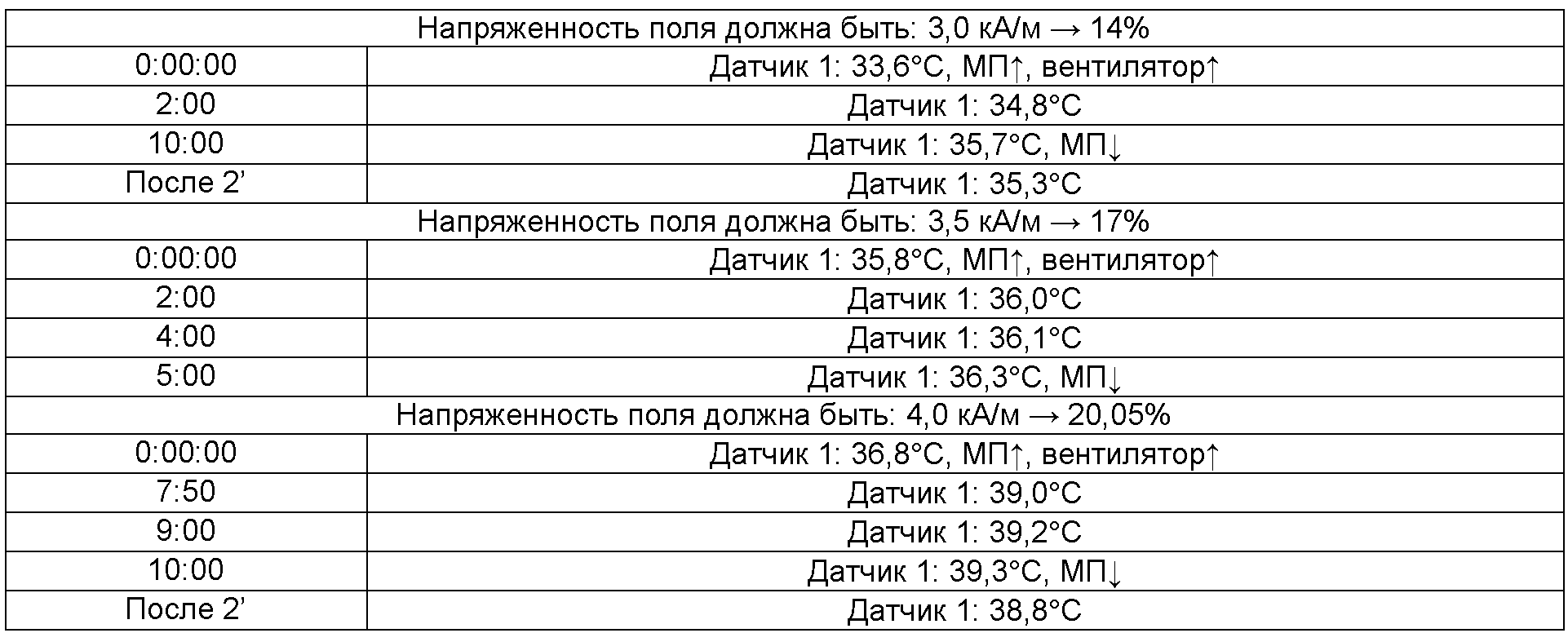
Пример 14C: SPONGOSTAN
Частицы: Суспензия наночастиц согласно примеру 1A (1,6 мл, 2 М)
Носитель: Носитель, пропитанный согласно примеру 14B, масса: приблизительно 0,8 г.
Кость: размер: (44,4Ч13,2Ч10,9) мм.
Оставшееся количество приблизительно 0,8 грамма пропитанного носителя из примера 14B смешивали с 1,6 мл частиц (2 М согласно примеру 1A) и применяли к кости, очищенной согласно примеру 14. Датчик снова помещали между костью и носителем. Снова измеряли следующие 3 напряженности поля: 3,0 кА/м, 3,5 кА/м, 4,0 кА/м.

Пример 14D: SPONGOSTAN Special
Частицы: Суспензия наночастиц согласно примеру 1A (1,0 мл, 2 М)
Носитель: Носитель, пропитанный согласно примеру 14B, размер: (10,0Ч10,0Ч2,0) мм.
Кость: размер: (44,4Ч13,2Ч10,9) мм.
Носитель должен быть пропитан суспензией частицам (15 минут) для того, чтобы носитель абсорбировал частицы (1,0 мл, 2 М согласно примеру 1A). 1 мл суспензии частиц впрыскивали в носитель внутрь упаковки [m=0,00]; ashlar абсорбирует максимум и наносится на кость.
Измерения осуществляли как описано в примере 14A.

Пример 14E: тампон Gelita
Частицы: Суспензия наночастиц согласно примеру 1A (1,0 мл, 2 М).
Носитель: тампон Gelita, размер: (1Ч1Ч1) см.
Кость: размер: (44,4Ч13,2Ч10,9) мм.
Носитель должен быть пропитан суспензией частиц (15 минут) для того, чтобы носитель абсорбировал суспензию наночастиц (1,0 мл, 2 М согласно примеру 1a). 1 мл суспензии частиц впрыскивали в упаковку носителя тампона Gelita; куб абсорбирует максимум (тампон Gelita [m=0,00] суспензия наночастиц: m=0,45 г) и помещается на кость.