Результат интеллектуальной деятельности: СПОСОБ ДИАГНОСТИКИ РАННЕЙ СТАДИИ РЕВМАТОИДНОГО АРТРИТА
Вид РИД
Изобретение
Изобретение относится к области предиктивной (предсказательной) медицины и может быть использовано при диагностике ревматоидного артрита на ранней стадии заболевания.
Ревматические заболевания в последние годы привлекают все большее внимание ученых в силу своей высокой распространенности и социальной значимости. Среди ревматических заболеваний особое теоретическое и медико-социальное значение имеет ревматоидный артрит (РА). Распространенность РА в популяции составляет 0,5-1,5% [1]. Поражая преимущественно лиц трудоспособного возраста, РА приводит к ранней инвалидизации, около 50% больных теряют трудоспособность в течение первых 5 лет заболевания, продолжительность жизни пациентов сокращается на 8-10 лет. Согласно статистике, в России в 2002 году было зарегистрировано 280000 пациентов с РА, среди которых более 26000 человек заболевших впервые. Ежегодно в РФ регистрируется около 300000 больных [2].
РА в развернутой стадии характеризуется прогрессирующим течением с формированием деформаций суставов, развитием тяжелых функциональных нарушений и поражений внутренних органов. По данным эпидемиологических исследований, частота сердечно-сосудистых событий у пациентов с ревматоидным артритом в 3,96 раза выше, чем в популяции и на 30-60% выше, чем у больных с другой патологией суставов. Обзор исследований показал, что прямая стоимость РА составляла к 2000 г. около 6000 евро в год. Ухудшение функции суставов приносит обществу наибольшие финансовые потери, поскольку расходы на заболевание пропорциональны нарастанию функциональной недостаточности (ФН). Показано, что общие затраты возрастают с 5000 евро на пациента с минимальной ФН и до 20000 евро на пациента с тяжелой ФН. Общая стоимость РА в странах западной и восточной Европы на 2006 год составляет от 42 млрд. до 3,4 млрд. евро в год, соответственно [1].
В настоящее время разработаны диагностические критерии РА, включающие: суставной синдром, рентгенологические изменения. К лабораторным маркерам данного заболевания относят аутоантитела иммуноглобулинов класса М, реагирующих с Fc-фрагментом иммуноглобулина класса G, или ревматоидный фактор (РФ) - иммуноглобулин класса М и антитела к циклическому цитрулированному пептиду (анти-ЦЦП антитела).
К сожалению, ни один из разработанных в настоящее время критериев РА не является строго специфичными для данного заболевания. Более того, используя имеющиеся критерии очень сложно диагностировать РА на очень ранней и ранней стадиях заболевания. Например, у «условно» здоровых людей, в последующем заболевших РА, обнаруживают различные иммунологические нарушения, характерные для РА (увеличение уровня РФ, анти-ЦЦП антител, С - реактивного белка), задолго до появления первых клинических симптомов заболевания. У 2/3 пациентов структурные изменения (эрозии) суставов возникают очень быстро, уже в течение первых двух лет с момента начала болезни.
Установлено, что предотвращение структурных повреждений в дебюте РА способствует сохранению функциональной активности пациентов в долговременной перспективе. Однако промежуток времени, когда активная терапия базисными противовоспалительными препаратами может эффективно затормозить прогрессирование поражения суставов (так называемое «окно возможности») весьма короткий и иногда составляет всего несколько месяцев от начала болезни.
Очевидно, что РА - это заболевание, при котором отдаленный прогноз напрямую зависит от того, насколько рано был установлен диагноз и начата фармакотерапия [3]. Таким образом, разработка новых способов диагностики РА на ранней стадии заболевания является перспективным направлением предиктивной (предсказательной) медицины.
Известен способ доклинической диагностики ювенильного ревматоидного артрита (см. патент РФ 2195856, МПК А61В 3/10, дата публикации 10.01.2003) путем проведения биомикроскопии роговицы и радужной оболочки глаз с использованием щелевой лампы, согласно которому, потенциальный юношеский ревматоидный артрит выставляют при выявлении кератопатии, симптома Аксенфельда, светлой радужной оболочки, сужении или звездчатой формы зрачкового пояса, слабой дифференцировки линии Краузе, гипоплазии или дисплазии переднего листка, лакун в области наружных сегментов, «эмбрионального» типа радужки, «фестончатости» периферических отделов цилиарного пояса.
Недостаток этого изобретения заключается в низкой эффективности и узкой области применения из-за возрастных ограничений пациентов.
В качестве ближайшего аналога взят способ тестирования на наличие ревматического заболевания (см. патент РФ 2173462, МПК G01N 33/48, G01N 33/68, дата публикации 10.09.2001), включающий исследование элементов сустава, анализ результатов исследования и диагностику ревматического заболевания по результатам исследования.
Недостатком ближайшего аналога является повышенная трудоемкость процесса и низкая эффективность анализа из-за субъективности морфологической оценки форм кристаллов, а также отсутствия количественной оценки диагностических показателей и их параметров.
Технической задачей заявляемого изобретения является разработка эффективного способа диагностики, позволяющего определить ревматоидный артрит на ранней стадии заболевания.
Технический результат, достигаемый при решении поставленной задачи, выражается в расширении области применения благодаря возможности диагностирования заболевания на его ранней стадии, а также повышении эффективности диагностики за счет следующих факторов:
- дополнительное исследование образцов костного мозга позволяет повысить информативность и достоверность способа;
- проведение иммуногистохимического и иммуноцитохимического исследований позволяет определить количество и локализацию клеток, синтезирующих белок Mdm2;
- выявление антиапоптотического белка, а именно Mdm2, позволяет установить диагностический показатель, специфичный для ревматоидного артрита на ранних стадиях.
Поставленная задача решается тем, что в способе диагностики ранней стадии ревматоидного артрита, включающем исследование элементов сустава, анализ результатов исследования и диагностику ревматического заболевания по результатам исследования, производят забор у пациента одновременно образцов костного мозга и синовиальной оболочки, из которых готовят препараты для иммуногистохимического и иммуноцитохимического исследований, после чего определяют долю клеток, синтезирующих белок Mdm2, по формуле:
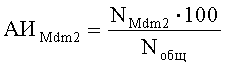 ,
,
где АИMdm2 - доля клеток, синтезирующих белок Mdm2, %;
NMdm2 - количество клеток, синтезирующих белок Mdm2;
Noбщ - общее число клеток в поле зрения;
причем в случае, когда в образцах синовиальной оболочки АИMdm2=81,6-88,8%, а в образцах костного мозга АИMdm2=85,0-89,2%, у пациента диагностируют раннюю стадию ревматоидного артрита.
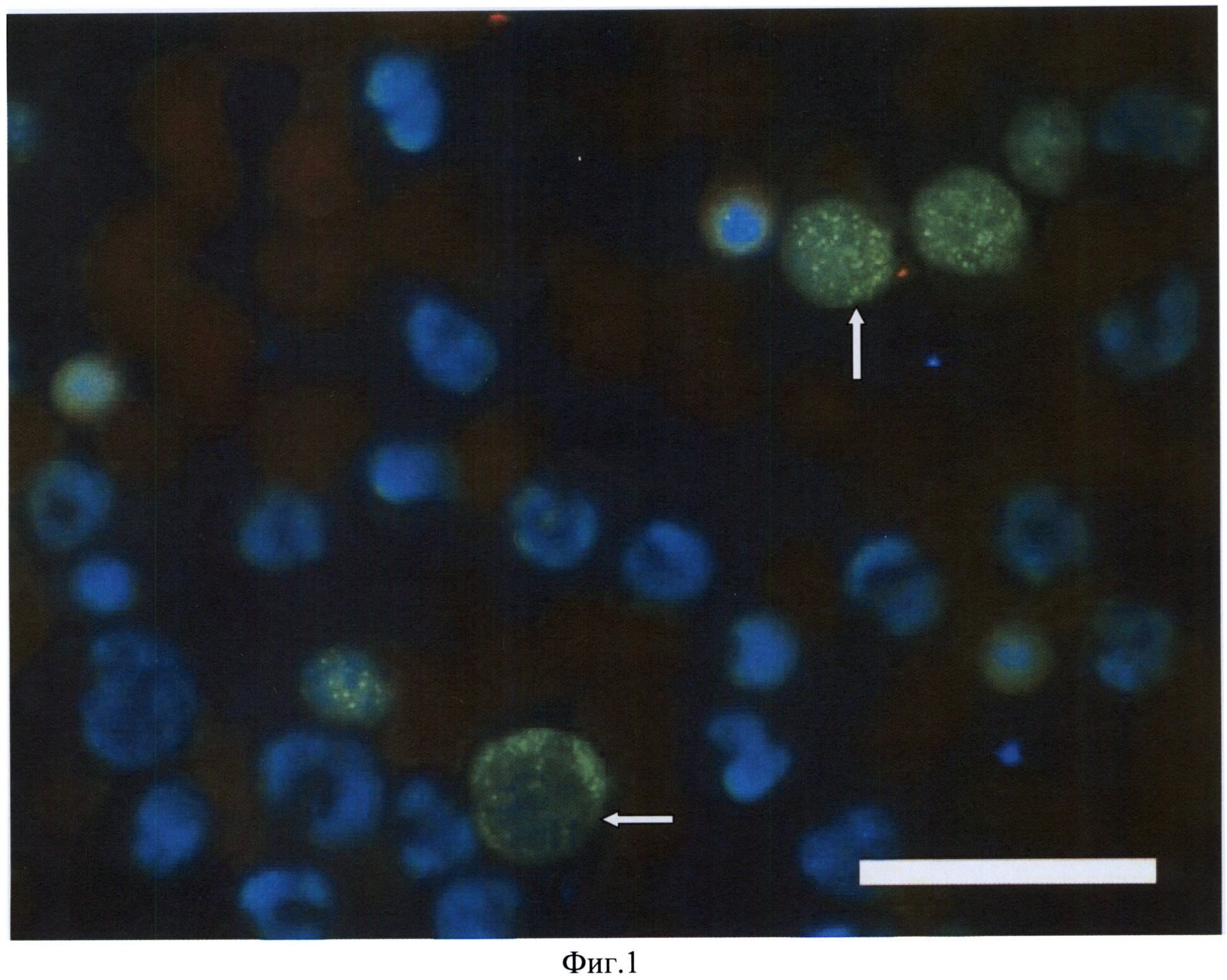
На фиг.1 изображены клетки костного мозга пациента с ранней стадией ревматоидного артрита, синтезирующие белок Mdm2.
Мазок костного мозга окрашен иммуногистохимическим методом антителами к белку Mdm2 (зеленая иммунофлуоресценция) (показано стрелкой). Масштабная линейка соответствует 20 мкм.
Морфологически РА характеризуется гиперплазией синовиальной ткани и ее инвазией в хрящ и кость с последующей их деструкцией [4, 5]. Данные изменения являются следствием дисбаланса между размножением внутреннего слоя синовиальной оболочки путем деления, в частности, синовиальных макрофагов и фибробластов с одной стороны и программированной клеточной смертью (апоптозом) этих клеток с другой стороны [5]. Ключевым моментом в блокировании клеточного цикла и стимуляции апоптоза в клетках является синтез Р53-белка, отвечающего за синтез другого клеточного белка, а именно Р21. Белок Р21 тормозит G1-фазу клеточного цикла, а также влияет на синтез белка Mdm 2, отвечающего за блокирование апоптоза и белка PUMA, отвечающего за запуск апоптоза с участием митохондрий. [6]. Опухолеподобный рост синовиоцитов играет существенную роль в прогрессировании РА, а неадекватный апоптоз синовиальных фибробластов вносит весомый вклад в данные процессы. Таким образом, анти- и проапоптотические белки могут выступать диагностическими маркерами РА на разных стадиях.
При углубленном изучении роли апоптоза в патогенезе РА и зависимости активности программированной клеточной смерти от стадии РА рядом исследователей были получены следующие результаты. Оказалось, что распространенность апоптоза коррелирует с длительностью и выраженностью воспалительной инфильтрации синовиальной оболочки. На ранних стадиях РА зарегистрирована низкая интенсивность апоптоза. На поздней стадии выявлена значительная активизация апоптоза [1]. Соответственно определение антиапоптотического белка, а именно Mdm2, является достоверным способом диагностики РА на ранней стадии.
Способ осуществляют следующим образом.
На первоначальном этапе у пациента с РА производят забор биологического материала. Забор образцов костного мозга (КМ) проводят путем проведения стернальной пункции под местной анестезией; параллельно, в момент проведения артроскопии, производят забор образцов синовиальной оболочки (СО).
На втором этапе готовят препараты для дальнейших исследований.
Для этого подготавливают мазки костного мозга и подсушивают их при комнатной температуре в течение 10 минут. Затем мазки костного мозга фиксируют в 4% параформе в течение 5 минут, после чего высушивают.
Также готовят замороженные срезы из образцов синовиальной оболочки. Предварительно образцы синовиальной оболочки фиксируют в 4% растворе параформа в течение 1 часа, а затем промывают в растворе фосфатно-солевого буфера. Далее фиксированный образец синовиальной оболочки помещают в 15% раствор сахарозы на фосфатно-солевом буфере на 24 часа, а затем помещают в среду Neg 50 (Thermo Scientific, USA) и замораживают на замораживающем столике. Из замороженных образцов синовиальной оболочки готовят срезы толщиной 10-15 мкм на криостате (Thermo Scientific, USA).
Затем кипятят мазки костного мозга и замороженные срезы синовиальной оболочки в цитратном буфере (рН 6,0) в течение 20 минут. Затем остывшие мазки костного мозга и срезы синовиальной оболочки трехкратно промывают в дистиллированной воде в течение 5 минут.
На третьем этапе проводят исследования.
Иммуногистохимическое исследование проводят путем окрашивания фиксированных мазков костного мозга и замороженных срезов синовиальной оболочки, которые предварительно отмывают в фосфатно-солевом буфере первичными антителами в разведении PUMA - 1:100, Р53 - 1:100, Mdm2 - 1:30, P21 - 1:30. После чего промывают трехкратно мазки костного мозга и замороженные срезы синовиальной оболочки, окрашенные первичными антителами PUMA, Р53, Mdm2 и P21 фосфатно-солевым буфером. Затем мазки, окрашенные первичными антителами обрабатывали вторичными антителами (анти-кроличьи или анти-мышиные в зависимости от первичных) меченные Alexa (488, 546, 594). Затем мазки, окрашенные первичными антителами, обрабатывают вторичными антителами (антикроличьи или антимышиные в зависимости от первичных) меченными Alexa (488, 546, 594).
Для проведения иммуногистохимического исследования мазков костного мозга и замороженных срезов синовиальной оболочки применялся биологический микроскоп биологический «Axio Imager Z2» (Carl Zeiss, Германия, 2009), который снабжен системой DIC, галогеновым осветителем 100 Вт, флуоресцентным осветителем с НХР лампой, а также высокочувствительными цифровыми камерами Axio Cam MRM и Axio Cam HRC. Объективы А-Plan: 10х/0.25, 40х/0.65, 100х/1.25 Oil, окуляры E-PL 10х/20.
Также проводят иммуноцитохимическое исследование мазков костного мозга и замороженных срезов синовиальной оболочки с применением трансмиссионного электронного микроскопа Libra 120 (Carl Zeiss, Германия, 2005) со следующими характеристиками: трансмиссионная электронная микроскопия, разгонное напряжение 120 кВ, макс. увеличение 630000, разрешение 3.2 А.
На заключительном этапе проводят анализ полученных результатов.
В процессе количественного анализа определяют долю клеток, синтезирующих белки, по формулам:
 ,
,
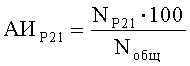 ,
,
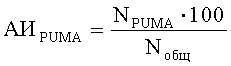 ,
,
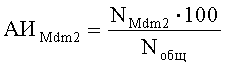 ,
,
где АИP53, АИP21, АИPUMA, АИMdm2 - доля клеток, синтезирующих соответственно белок Р53, Р21, PUMA и Mdm2, %;
NP53, NP21, NPUMA, NMdm2 - количество клеток, синтезирующих соответственно белок Р53, Р21, PUMA и Mdm2;
Nобщ - общее число клеток в поле зрения.
При этом количество клеток, синтезирующих изучаемые белки (NP53, NP21, NPUMA, NMdm2), определяют по свечению (флюоресценции) зеленым цветом. Полученные в результате исследований данные обрабатывают методом вариационной статистики с определением t-критерия достоверности по Стьюденту (Р<0,05).
В случае, когда в образцах синовиальной оболочки АИMdm2=81,6-88,8%, а в образцах костного мозга АИMdm2=85,0-89,2%, у пациента диагностируют раннюю стадию ревматоидного артрита.
Во Владивостокском государственном медицинском университете в течение трех лет проводились специальные научные исследования для разработки заявляемого способа.
Для исследований было сформировано 2 группы пациентов.
В контрольную группу вошло 20 женщин с диагностированным остеоартрозом (ОА), средний возраст которых составил 55,75 (38-70 лет). У 25% (5 человек) обследуемых стадия ОА соответствовала ранней стадии, у 75% (15 человек) поздней стадии ОА.
Авторами заявляемого способа обследовано 30 женщин, средний возраст которых составил 60,52 года (35-76 лет) с достоверным диагнозом РА (согласно диагностическим критериям ACR/EULAR 2010). У 35% обследуемых больных стадия РА соответствовала очень ранней и ранней стадиям, у 22% - развернутой и у 43% - поздней стадии РА.
У всех обследованных больных, независимо от стадии РА и степени активности заболевания, было выявлено присутствие в клетках изучаемых образцов ткани синовиальной оболочки ставов и мазков красного костного мозга белков Р53, Р21, PUMA и Mdm2 (таблица 1).
|
На ранней стадии РА определялось максимальное количество белка Mdm2 (достоверное различие с группой контроля), которое снижалось на поздней стадии РА (достоверное различие с группой раннего РА). В то же время число клеток, содержащих молекулы белков Р53 и PUMA, было низким на ранней стадии РА (не отличалось от контроля) и резко увеличивалось к поздней стадии РА, достоверно отличаясь от группы контроля и от группы раннего РА. Наличие в клетках изучаемых белков у пациентов из группы контроля не превышало 10%, что соответствует литературным данным [7].
В настоящее время феномен апоптоза рассматривается как одно из ведущих звеньев патогенеза аутоиммунных заболеваний, в частности РА. Проанализировав результаты данного исследования, можно утверждать, что количество клеток, экспрессирующих молекулу Mdm2 в клетках костного мозга и синовиальной оболочки (синовиоциты), превышает нормальные значения, а именно более 10% от общего количества клеток в препарате на ранней стадии РА.
Пример 1. Пациентка Н., 45 лет. Обратилась к ревматологу по поводу болей и припухания в суставах кистей, утренней скованности до двух часов. Вышеуказанные жалобы беспокоят пациентку около 6 месяцев. При объективном осмотре выявлено: болезненность 6 суставов, припухлость 4 суставов. При обследовании:
- клинический анализ крови: эритроциты 4,5·1012, гемоглобин 130 г/л, лейкоциты 8,7·109, тромбоциты 380·109, СОЭ 40 мм/час;
- ревматоидный фактор иммуноглобулин М=204,9 (RU/ml);
- антитела к ЦЦП=50,9 (RU/ml);
- рентгенография кистей и стоп: признаки околосуставного остеопороза.
По результатам клинико-лабораторных данных пациентке был выставлен предварительный диагноз: ревматоидный артрит, ранняя стадия, высокой степени активности, неэрозивный вариант, R I ст., серопозитивный по и РФ Ig М и антителам к ЦЦП, ФК-3 ст.
У пациентки был произведен забор костного мозга с целью проведения иммуногистохимического и иммуноцитохимического исследования и последующим определением количества клеток, синтезирующих белок Mdm2.
В результате проведенного анализа мазков костного мозга было обнаружено 87,4% клеток, синтезирующих белок Mdm2, от общего количества клеток в изучаемых мазках. Полученный результат позволяет выставить окончательный диагноз - ревматоидный артрит на ранней стадии заболевания и, соответственно, назначить адекватную базисную терапию для лечения и замедления прогрессирования ревматоидного артрита.
Пример 2. Пациентка П., 36 лет. Обратилась к ревматологу по поводу болей и припухания в коленных суставах, утренней скованности до одного часа. Вышеуказанные жалобы беспокоят пациентку около 4 месяцев. При объективном осмотре выявлено: болезненность и припухание обоих коленных суставов. При обследовании:
- клинический анализ крови: эритроциты 3,6·1012, гемоглобин 110 г/л, лейкоциты 10,4·109, тромбоциты 280,3·109, СОЭ 45 мм/час;
- ревматоидный фактор иммуноглобулин М=520,4 (RU/ml);
- антитела к ЦЦП=100,6 (RU/ml);
- рентгенография кистей и стоп: признаки околосуставного остеопороза;
- рентгенография коленных суставов: признаки синовита коленных суставов.
По результатам клинико-лабораторных данных пациентке был выставлен предварительный диагноз: ревматоидный артрит, ранняя стадия, высокой степени активности, неэрозивный вариант, R I ст., серопозитивный по и РФ Ig М и антителам к ЦЦП, ФК-3 ст.
У пациентки был произведен забор костного мозга и синовиальной оболочки при проведении артроскопии с целью проведения иммуногистохимического и иммуноцитохимического исследования и последующим определением количества клеток, синтезирующих белок Mdm2.
В результате проведенного анализа было обнаружено 87,4% клеток костного мозга и 82,9% клеток синовиальной оболочки, синтезирующих белок Mdm2, от общего количества клеток в изучаемых мазках. Полученный результат позволяет выставить окончательный диагноз - ревматоидный артрит на ранней стадии заболевания и, соответственно, назначить адекватную базисную терапию для лечения и замедления прогрессирования ревматоидного артрита.
Пример 3. Пациентка В., 54 года. Обратилась к ревматологу по поводу болей и припухания в суставах кистей, утренней скованности до четырех часов, слабости и повышения температуры тела до 37,8°С. Вышеуказанные жалобы беспокоят пациентку около 7 месяцев. При объективном осмотре выявлено: болезненность 10 суставов, припухлость 6 суставов. При обследовании:
- клинический анализ крови: эритроциты 3,8·1012, гемоглобин 98 г/л, лейкоциты 10,6·109, тромбоциты 306·109, СОЭ 35 мм/час;
- ревматоидный фактор иммуноглобулин М=102,5 (RU/ml);
- антитела к ЦЦП=3 0,4 (RU/ml);
- рентгенография кистей и стоп: признаки эрозивного артрита.
По результатам клинико-лабораторных данных пациентке был выставлен предварительный диагноз: ревматоидный артрит, ранняя стадия, высокой степени активности, эрозивный вариант, R I ст., серопозитивный по и РФ Ig М и антителам к ЦЦП, ФК-3 ст.
У пациентки был произведен забор костного мозга с целью проведения иммуногистохимического и иммуноцитохимического исследования и последующим определением количества клеток, синтезирующих белок Mdm2.
В результате проведенного анализа мазков костного мозга было обнаружено 88,9% клеток, синтезирующих белок Mdm2, от общего количества клеток в изучаемых мазках. Полученный результат позволяет выставить окончательный диагноз - ревматоидный артрит на ранней стадии заболевания и, соответственно, назначить адекватную базисную терапию для лечения и замедления прогрессирования ревматоидного артрита.
Таким образом, заявляемое изобретение отличается широкой областью применения и повышенной эффективностью диагностики.
Список литературы
1. Дубиков А.И. Ревматоидный артрит, апоптоз, оксид азота: новые аспекты патогенеза: Монография. - Владивосток: - Изд-во Дальневост. Ун-та, 2004.
2. Чичасова Н.В., Владимиров С.А., Иголкина Е.В., Имаметдинова Г.Р. Бремя ревматоидного артрита: медицинские и социальные проблемы. Научно-практическая ревматология 2009; 1: 105-108.
3. Ревматология: национальное руководство / под ред. Е.Л. Насонова, В.А. Насоновой. - М.: ГОЭТАР-Медиа, 2008. - 720 с.
4. You X., Boyle D.L., Hammaker D., Firestein G.S. PUMA-mediated apoptosis in fibroblast-like synoviocytes does not require p53. Arthritis Research & Therapy 2006: Vol.8 No 6: 1-7.
5. Cha H.S., Bae Е.К., Ahn J.K., Lee J., Ahn K.S., Koh Е.М. Slug suppression induces apoptosis via Puma transactivation in rheumatoid arthritis fibroblast-like synoviocytes treated with hydrogen peroxide. Experimental and molecular medicine 2010; Vol.42, No. 6: 428-436.
6. Castedo М., Perfettini J. Z., Roumier Т., Andreau K., Medema R., Kroemer G. Cell death by mitotic catastrophe: a molecular definition. Oncogene 2004: 23: 2825-2837.
7. Tu Y., Xue H., Xia Z., Cai М., Liu X., Ma Т., Zhang C. Effect of different concentrations of dexamethasone on apoptosis and expression of Fas/FasL in human osteoarthritis chondrocytes. Zhongguo Xiu Fu Chong Jian Wai Ke ZaZhi. 2012 May; 26 (5): 536-41.
Способ диагностики ранней стадии ревматоидного артрита, включающий исследование элементов сустава, анализ результатов исследования и диагностику ревматического заболевания по результатам исследования, отличающийся тем, что производят забор у пациента одновременно образцов костного мозга и синовиальной оболочки, из которых готовят препараты для иммуногистохимического и иммуноцитохимического исследований, после чего определяют долю клеток, синтезирующих белок Mdm2, по формуле: ,где АИ - доля клеток, синтезирующих белок Mdm2, %;N - количество клеток, синтезирующих белок Mdm2;N - общее число клеток в поле зрения;причем в случае, когда в образцах синовиальной оболочки АИ=81,6-88,8%, а в образцах костного мозга АИ=85,0-89,2%, у пациента диагностируют раннюю стадию ревматоидного артрита.