Результат интеллектуальной деятельности: НОВЫЕ ПРОИЗВОДНЫЕ ИНСУЛИНА С ЧРЕЗВЫЧАЙНО ЗАМЕДЛЕННЫМ ПРОФИЛЕМ ВРЕМЯ/ДЕЙСТВИЕ
Вид РИД
Изобретение
Изобретение относится к новым аналогам инсулина с базальным профилем время/действие, к их получению и применению.
В последние годы число заболеваний диабетом возросло прямо-таки до масштаба эпидемии. Из-за этой болезни может произойти существенное сокращения ожидаемой продолжительности жизни. Люди с диабетом должны часто вводить инсулин в тело извне. Имеет смысл оптимизировать лечение инсулином. Между тем существуют разные инсулины с особыми фармакологическими свойствами для лечения. На практике разные инсулины в зависимости от длительности их действия различаются на инсулины короткого действия, быстродействующие инсулины, инсулины медленного действия и смешанные инсулины. Синонимами для обозначения инсулинов медленного действия являются инсулин замедленного высвобождения, депо-инсулин, а также базальный инсулин. Активными веществами многих этих инсулиновых препаратов являются так называемые аналоги инсулина, которые были выведены из человеческого инсулина путем замещения, удаления и/или присоединения одной или нескольких аминокислот. Понятия "аналоги инсулина" и "инсулины" используются здесь как синонимы.
Концепция интенсифицированной инсулиновой терапии пытается уменьшить риск для здоровья, стремясь к стабильному контролю уровня сахара в крови путем раннего введения базальных инсулинов. Примером общеупотребительного базального инсулина является лекарство Lantus® (активное вещество: инсулин кларгин = Gly (A21), Arg (B31), Arg (B32) - человеческий инсулин). Обычно при разработке новых улучшенных базальных инсулинов необходимо минимизировать число гипогликемических событий. При этом идеальный базальный инсулин с надежностью действует у каждого пациента по меньшей мере 24 часа. В идеале действие инсулина происходит замедленно и по возможности с плоским профилем время/действие, так что опасность кратковременного недостатка сахара в крови заметно минимизируется и введение можно проводить даже без предварительного приема пищи. Хорошее снабжение базальным инсулином имеется тогда, когда активность инсулина сохраняется постоянной как можно дольше, т.е. тело снабжается постоянным количеством инсулина. Тем самым до минимума снижается опасность гипогликемических событий и обусловленная пациентом и временем суток вариабельность. Таким образом, фармакокинетический профиль идеального базального инсулина должен отличаться замедленным наступлением действия и пролонгированным, т.е. равномерным и долго сохраняющимся действием.
Однако, несмотря на уже достигнутые терапевтические преимущества, ни один из описанных до настоящего времени инсулинов замедленного действия не имеет фармакокинетических свойств идеального базального инсулина. Желательны инсулины, которые имеют такой плоский и долго длящийся профиль время/действие, что опасность гипогликемических событий и зависимая от времени изменчивость у пациентов еще больше снижается, а длительность действия еще больше продлевается, так что при известных условиях инсулин больше не нужно будет принимать ежедневно. Это способствовало бы упрощению лечения диабетиков, в частности пожилых и нуждающихся в уходе диабетиков, которые больше не могут сами вкалывать себе инсулин, и тем самым имело бы большой народнохозяйственный эффект. Кроме того, такие базальные инсулины были бы полезны на ранней фазе диабета типа 2. Врачи-клиницисты сообщают, что имеющаяся у многих людей фобия перед уколами отпугивает их от своевременного начала лечения инсулином. Как следствие получается плохое регулирование уровеня сахара в крови, что тянет за собой поздние осложнения диабета. Базальный инсулин, который снижает число вводимых инъекциями доз инсулина, мог бы способствовать тому, что пациенты будут легче воспринимать инсулиновую терапию.
Kohn и др. (Peptides 28 (2007) 935-948) описывает, что оптимизации фармакодинамики инсулина можно достичь, получив аналоги инсулина, у которых изоэлектрическая точка (pl) сдвинута присоединением лизина или аргинина к B-концу цепи или N-концу цепей A и B в направлении щелочной области, сравнимой с изоэлектрической точкой человеческого инсулина (pl=5,6), так что растворимость в физиологических условиях понижается, и получается пролонгированный профиль время/действие. При этом соединение 18 из работы Kohn и др. (Arg (A0), Gly (A21), Arg (B31), Arg (B32) - человеческий инсулин (экспериментально определенная pl=7,3; расчетная pl=7,58) представлено как наилучшее соединение в духе этой концепции. Основную цель при разработке новых аналогов инсулина Kohn и др. усматривают поэтому в присоединении положительно заряженных аминокислот к последовательности аминокислот человеческого инсулина с целью повышения изоэлектрической точки pl=5,6 в нейтральную область.
Этой цели при создании новых аналогов инсулина препятствует замещение нейтральных аминокислот в человеческом инсулине кислыми аминокислотами и/или присоединение кислых аминокислот, так как такое замещение и/или присоединение по меньшей мере частично отменяет эффект введения положительно заряженных аминокислот. Однако теперь неожиданно было обнаружено, что к описанному желательному базальному профилю время/действие ведут такие аналоги инсулина, которые отличаются теми признаками, что:
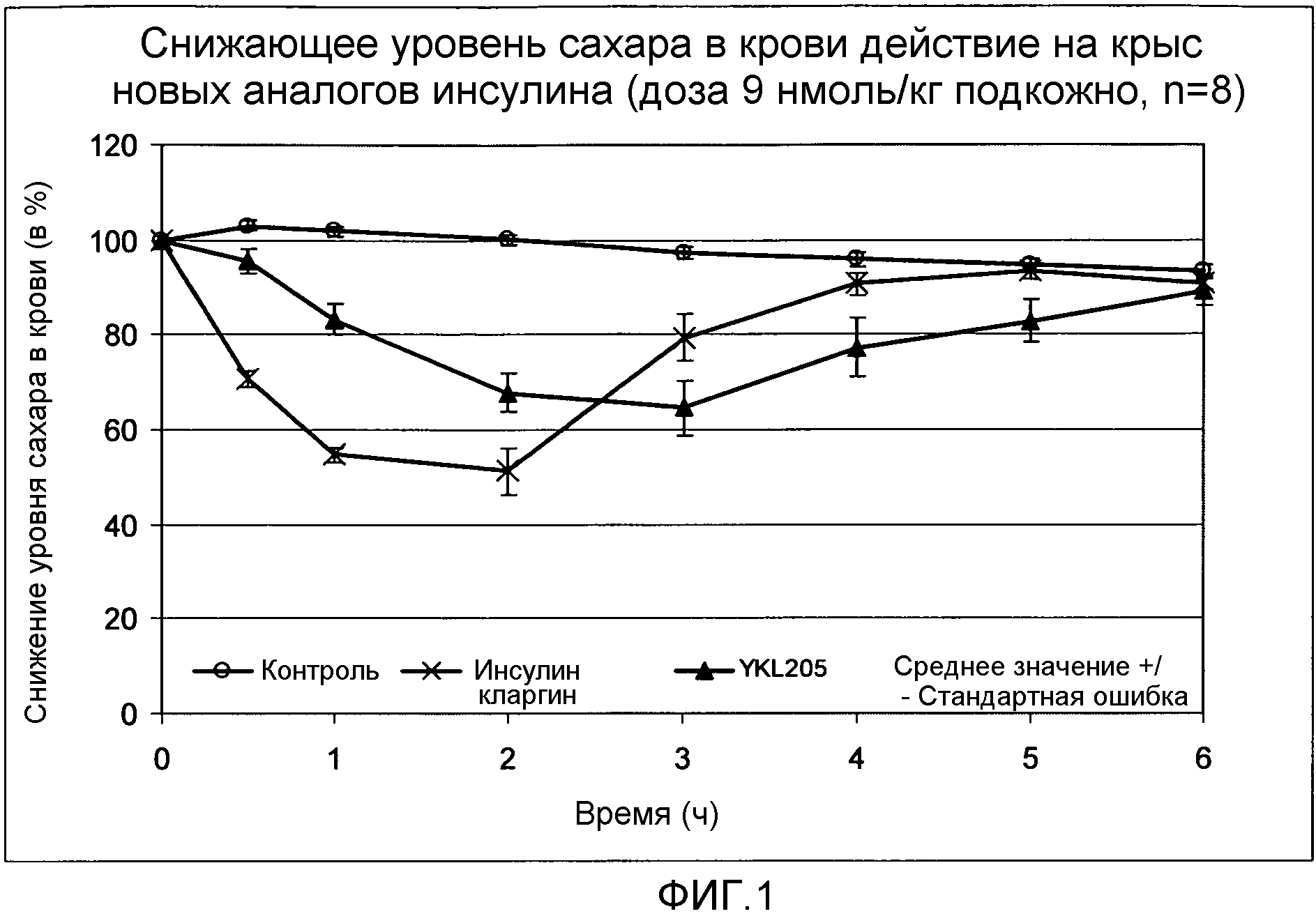
- конец B-цепи состоит из амидированного основного аминокислотного остатка, такого, как лизин- или аргининамид, т.е. у амидированного основного аминокислотного остатка на конце B-цепи карбоксильная группа концевой аминокислоты находится в ее амидированной форме, и
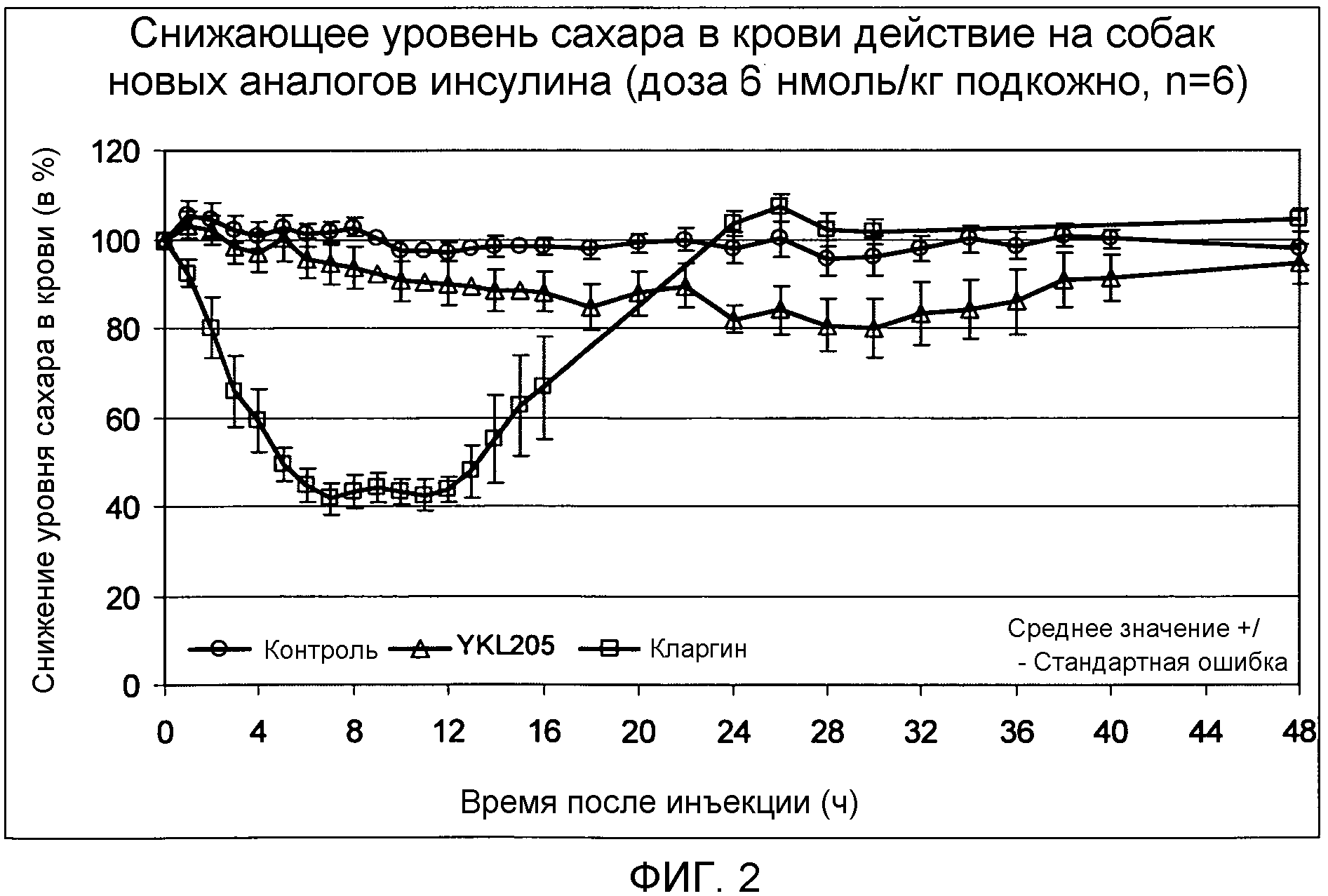
- N-терминальный аминокислотный остаток цепи A инсулина является лизиновым или аргининовым остатком, и
- позиция аминокислоты A8 занята гистидиновым остатком, и
- позиция аминокислоты A21 занята глициновым остатком, и
- два замещения нейтральных аминокислот кислыми аминокислотами, два присоединения отрицательно заряженных аминокислотных остатков или по одному такому замещению и такому присоединению происходит в позициях A5, A15, A18, B-1, B0, B1, B2, B3 и B4.
Тогда как первые три указанных признака в результате введения положительных зарядов или устранения отрицательных зарядов имеют тенденцию способствовать повышению значений pl соответствующего аналога инсулина, упомянутые последними замещения и/или присоединения отрицательно заряженных аминокислотных остатков имеют обратный эффект и способствуют снижению значений pl. Неожиданно оказалось, что именно описанные выше аналоги инсулина имеют желательные выгодные профили время/действие. Значения pl у этих соединений ниже, чем у соединения 18 из работы Kohn и др. (Arg (A0), Gly (A21), Arg (B31), Arg (B32) - человеческий инсулин), но при этом они имеют тем не менее замедленное начало действия и более пролонгированное действие, т.е. предельно плоский и длительный равномерный ход воздействия. Тем самым заметно снижается опасность гипогликемических событий. Замедление настолько заметно, что этот эффект, к удивлению, можно обнаружить даже в модельных опытах на крысах, хотя, в отличие от этого, замедленное действие инсулина кларгина на крыс нельзя наблюдать однозначно. На фигуре 1 представлен гипогликемический эффект соединения YKL205 (согласно изобретению) в сравнении с инсулином кларгином. Похожие результаты получены на собаках (см. фигуру 2). Таким образом, были разработаны новые базальные инсулины, которые нужно вводить заметно реже. Помимо этих описанных фармакокинетических достоинств, аналоги согласно изобретению имеют заметно лучшие свойства в сравнении с инсулином кларгином с точки зрения фармакологии, как, например, специфичность рецепторов и митогенность in vitro. Кроме того, патентуемые инсулины имеют преимущества также с физико-химической точки зрения.
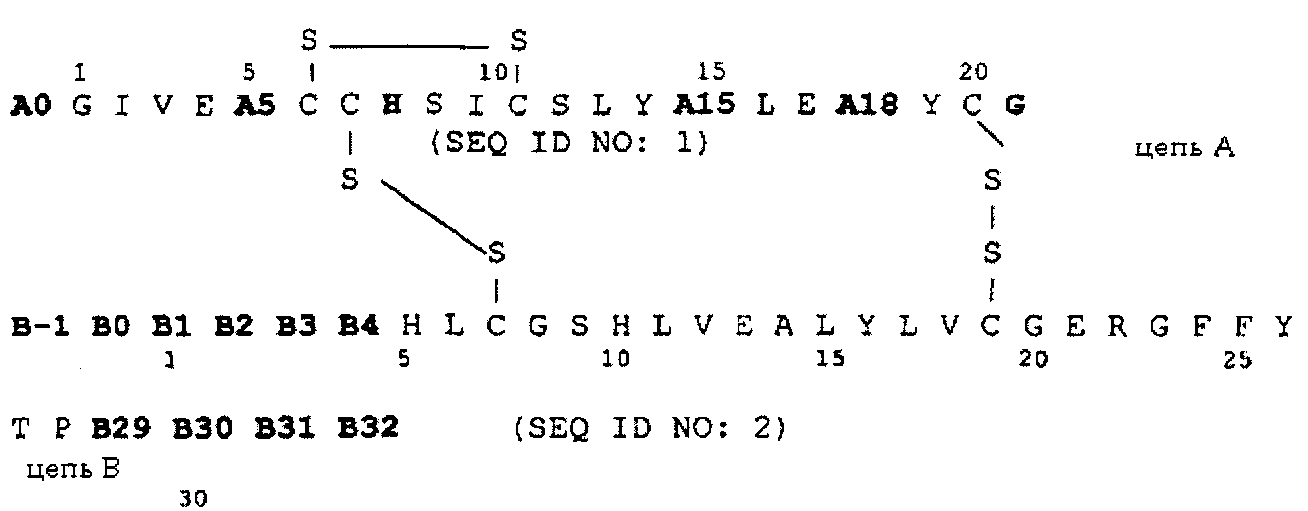
Таким образом, объектом изобретения является аналог инсулина формулы I:
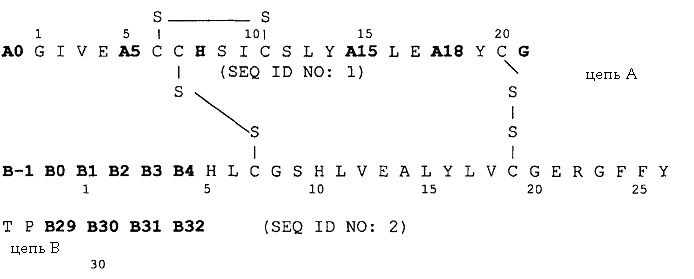
причем имеются следующие соответствия:
A0 Lys или Arg;
A5 Asp, Gln или Glu;
A15 Asp, Glu или Gln;
A18 Asp, Glu или Asn;
B-1 Asp, Glu или аминогруппа;
B0 Asp, Glu или химическая связь;
B1 Asp, Glu или Phe;
B2 Asp, Glu или Val;
B3 Asp, Glu или Asn;
B4 Asp, Glu или Gln;
B29 Lys или химическая связь;
B30 Thr или химическая связь;
B31 Arg, Lys или химическая связь;
B32 Arg-амид, Lys-амид или аминогруппа,
причем два аминокислотных остатка группы, содержащей A5, A15, A18, B-1, B0, B1, B2, B3 и B4, одновременно и независимо друг от друга означают Asp или Glu.
В частности, объектами изобретения являются аналоги инсулина, какие указаны выше, у которых независимо друг от друга A0 соответствует Arg, или в которых A5 соответствует Glu, или в которых A15 соответствует Glu, или в которых A18 соответствует Asp, или в которых B-1 соответствует аминогруппе, или в которых B0 соответствует Glu, или в которых B1 соответствует Asp, или в которых B2 соответствует Val, или в которых B3 соответствует Asp, или в которых B4 соответствует Glu, или в которых B29 соответствует Lys, или в которых B30 соответствует Thr, или в которых B31 соответствует Arg или Lys.
Особенно предпочтительным объектом изобретения является аналог инсулина, выбранный из группы, содержащей:
Arg (A0), His (A8), Glu (A5), Asp (A18), Gly (A21), Arg (B31), Arg (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A5), Asp (A18), Gly (A21), Arg (B31), Lys (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A15), Asp (A18), Gly (A21), Arg (B31), Arg (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A15), Asp (A18), Gly (A21), Arg (B31), Lys (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A5), Glu (A15), Gly (A21), Arg (B31), Arg (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A5), Glu (A15), Gly (A21), Arg (B31), Lys (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A5), Gly (A21), Asp (B3), Arg (B31), Arg (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A5), Gly (A21), Asp (B3), Arg (B31), Lys (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A15), Gly (A21), Asp (B3), Arg (B31), Arg (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A15), Gly (A21), Asp (B3), Arg (B31), Lys (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Asp (A18), Gly (A21), Asp (B3), Arg (B31), Arg (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Asp (A18), Gly (A21), Asp (B3), Arg (B31), Lys (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Gly (A21), Asp (B3), Glu (B4), Arg (B31), Arg (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Gly (A21), Asp (B3), Glu (B4), Arg (B31), Lys (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A5), Gly (A21), Glu (B4), Arg (B31), Arg (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A5), Gly (A21), Glu (B4), Arg (B31), Lys (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A15), Gly (A21), Glu (B4), Arg (B31), Arg (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A15), Gly (A21), Glu (B4), Arg (B31), Lys (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Asp (A18), Gly (A21), Glu (B4), Arg (B31), Arg (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Asp (A18), Gly (A21), Glu (B4), Arg (B31), Lys (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A5), Gly (A21), Glu (B0), Arg (B31), Arg (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A5), Gly (A21), Glu (B0), Arg (B31), Lys (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A15), Gly (A21), Glu (B0), Arg (B31), Arg (B32) -NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A15), Gly (A21), Glu (B0), Arg (B31), Lys (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Asp (A18), Gly (A21), Glu (B0), Arg (B31), Arg (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Asp (A18), Gly (A21), Glu (B0), Arg (B31), Lys (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A5), Gly (A21), Asp (B1), Arg (B31), Arg (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A5), Gly (A21), Asp (B1), Arg (B31), Lys (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A15), Gly (A21), Asp (B1), Arg (B31), Arg (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Glu (A15), Gly (A21), Asp (B1), Arg (B31), Lys (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Asp (A18), Gly (A21), Asp (B1), Arg (B31), Arg (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Asp (A18), Gly (A21), Asp (B1), Arg (B31), Lys (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Gly (A21), Glu (B0), Asp (B1), Arg (B31), Arg (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Gly (A21), Glu (B0), Asp (B1), Arg (B31), Lys (B32) - NH2 человеческий инсулин,
Arg (A0), His (A8), Asp (A18), Gly (A21), Asp (B3), Arg (B30), Arg (B31) - NH2 человеческий инсулин,
Arg (A0), His (A8), Asp (A18), Gly (A21), Asp (B3), Arg (B30), Lys (B31) - NH2 человеческий инсулин.
При наличии выражения "человеческий инсулин" в обозначениях названных аналогов инсулина имеется ввиду последовательность аминокислот в цепи A и B человеческого инсулина, а все отклонения от него (присоединения, замещения, удаления) указываются в приведенном обозначении аналога инсулина.
Следующим объектом изобретения является способ получения аналога инсулина, какой указан выше, в котором, в частности, рекомбинантно получают предшественник аналог инсулина, предшественник ферментативно обрабатывают с получением двухцепочечного инсулина, и сочетание с аргининамидом проводят в присутствии фермента с трипсиновой активностью, и аналог инсулина выделяют.
Следующим объектом изобретения является применение аналога инсулина, какой описан выше, для получения лекарственного средства для лечения диабета, в частности диабета типа I или типа II. Объектом изобретения является также применение аналога инсулина, какой описан выше, для получения лекарственного средства для поддержки регенерации бета-клеток.
Следующим объектом изобретения является лекарственное средство, содержащее аналог инсулина, какой описан выше, и/или его физиологически приемлемые соли.
Следующим объектом изобретения является композиция с аналогом инсулина, какой описан выше, причем композиция находится в водной форме, содержащей растворенный аналог инсулина.
Следующим объектом изобретения является композиция с аналогом инсулина, какой описан выше, причем композиция находится в виде порошка.
Следующим объектом изобретения является композиция, какая описана выше, причем аналог инсулина, какой описан выше, находится в кристаллической и/или аморфной форме.
Следующим объектом изобретения является композиция с аналогом инсулина, какой описан выше, причем композиция находится в форме суспензии.
Следующим объектом изобретения является композиция с аналогом инсулина, какой описан выше, причем композиция дополнительно содержит химический шаперон.
Следующим объектом изобретения является ДНК, кодирующая предшественник аналога инсулина, какой описан выше, или A-цепь или B-цепь аналога инсулина, какой описан выше.
Следующим объектом изобретения является вектор, содержащий ДНК, какая описана выше.
Следующим объектом изобретения является организм-хозяин, содержащий ДНК, какая описана выше, или вектор, какой описан выше.
Следующим объектом изобретения является аналог препроинсулина, отличающийся тем, что C-пептид на своем N-конце содержит аминокислотный остаток аргинин, а на своем C-конце два аргининовых остатка или один аргининовый остаток и один лизиновый остаток, причем в последнем случае лизиновый остаток образует собственно C-конец.
Следующим объектом изобретения является композиция, какая описана выше, в которой дополнительно содержатся глюкагоноподобные пептиды-1 (GLP1) или их аналог или производное, или эксендин-3 или -4 или его аналог или производное, предпочтительно эксендин-4.
Следующим объектом изобретения является композиция, какая описана выше, в которой аналог эксендина-4 выбран из группы, содержащей:
H-desPro36-Exendin-4-Lys6-NH2,
H-des(Pro36,37)-Exendin-4-Lys4-NH2 и
H-des(Pro36,37)-Exendin-4-Lys5-NH2,
или его фармакологически приемлемую соль.
Следующим объектом изобретения является композиция, какая описана выше, в которой аналог эксендина-4 выбран из группы, содержащей:
desPro36[Asp28]Exendin-4(1-39),
desPro36[IsoAsp28]Exendin-4(1-39),
desPro36[Met(O)14,Asp28]Exendin-4(1-39),
desPro36[Met(O)14,IsoAsp28]Exendin-4(1-39),
desPro36[Trp(O2)25,Asp28]Exendin-2(1-39),
desPro36[Trp(O2)25,IsoAsp28]Exendin-2(1-39),
desPro36[Met(O)14Trp(O2)25,Asp28]Exendin-4(1-39) и
desPro36[Met(O)14Trp(O2)25,IsoAsp28]Exendin-4(1-39),
или его фармакологически приемлемую соль.
Следующим объектом изобретения является композиция, какая описана в предыдущем абзаце, в которой к C-концам аналогов эксендина-4 присоединен пептид -Lys6-NH2.
Следующим объектом изобретения является композиция, какая описана выше, в которой аналог эксендина-4 выбран из группы, содержащей:
H-(Lys)6-desPro36[Asp28]Exendin-4(1-39)-Lys6-NH2,
desAsp28Pro36,Pro37,Pro38Exendin-4(1-39)-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Asp28]Exendin-4(1-39)-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Asp28]Exendin-4(1-39)-NH2,
desPro36,Pro37,Pro38[Asp28]Exendin-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Asp28]Exendin-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Asp28]Exendin-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36[Trp(O2)25,Asp28]Exendin-4(1-39)-Lys6-NH2,
H-desAsp28Pro36,Pro37,Pro38[Trp(O2)25]Exendin-4(1-39)-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Trp(O2)25,Asp28]Exendin-4(1-39)-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Trp(O2)25,Asp28]Exendin-4(1-39)-NH2,
desPro36,Pro37,Pro38[Trp(O2)25,Asp28]Exendin-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Trp(O2)25,Asp28]Exendin-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Trp(O2)25,Asp28]Exendin-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36[Met(O)14,Asp28]Exendin-4(1-39)-Lys6-NH2,
desMet(O)14Asp28Pro36,Pro37,Pro38 Exendin-4(1-39)-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Met(O)14,Asp28]Exendin-4(1-39)-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Met(O)14,Asp28]Exendin-4(1-39)-NH2,
desPro36,Pro37,Pro38[Met(O)14,Asp28]Exendin-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Met(O)14,Asp28]Exendin-4(1-39)-Lys6-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Met(O)14,Asp28]Exendin-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36[Met(O)14,Trp(O2)25,Asp28]Exendin-4(1-39)-Lys6-NH2,
desAsp28Pro36,Pro37,Pro38[Met(O)14,Trp(O2)25]Exendin-4(1-39)-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Met(O)14,Trp(O2)25,Asp28]Exendin-4(1-39)-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Met(O)14,Asp28]Exendin-4(1-39)-NH2,
desPro36,Pro37,Pro38[Met(O)14,Trp(O2)25,Asp28]Exendin-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Met(O)14,Trp(O2)25,Asp28]Exendin-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Met(O)14,Trp(O2)25,Asp28] Exendin-4(1-39)-(Lys)6-NH2,
или его фармакологически приемлемую соль.
Следующим объектом изобретения является композиция, какая описана выше, в которой дополнительно содержится Arg34,Lys26(Nε(γ-глутамил(Nα-гексадеканоил)))GLP-1(7-37) [лираглютид] или его фармакологически приемлемая соль.
При этом специалисту ясно, что инсулины согласно изобретению могут быть предметом фармацевтической композиции, которая после приема действует благоприятным образом. При этом исходят из водных растворов. Соответственно, другие компоненты должны быть смешиваемыми. Опасность загрязнения животными вирусами минимизируется тем, что препарат не должен содержать никаких компонентов, которые происходят из животных источников. Кроме того, предпочтительно предотвращать микробное загрязнение добавлением консервантов. Добавлением изотонирующих агентов можно компенсировать возможное негативное влияние композиции на физиологию клеток ткани в месте введения. Стабилизирующее действие может оказывать добавление протамина, так что можно получить по существу не содержащий соли препарат инсулина, если в композицию добавить протамин. Добавление фенольного компонента может привести к стабилизации структуры применяющегося аналога инсулина и, таким образом, дополнительно вызывать кроме прочего дополнительный эффект замедления при наступлении действия. В композицию могут также добавляться вещества, которые стабилизируют пространственную структуру инсулинов замедленного действия согласно изобретению и ведут к лучшей термической стабильности. Такие химические шапероны могут, например, содержать короткие синтетические пептиды, которые могут также включать аналоги аминокислот или, например, пептидные последовательности, выведенные из C-пептида инсулина.
Для разработки депо-форм можно инсулины согласно изобретению связывать на наночастицах. Допустимы также так называемые "slow-release" композиции, в которых инсулин замедленного действия согласно изобретению находится обратимо связанным на полимерном носителе.
Инсулины согласно изобретению могут приниматься параллельно с быстродействующим инсулином, как Apidra®, NovoRapid®, Humalog®, или с находящимися в стадии разработки дериватами инсулина или композициями с соответствующим профилем время/действие, или с инсулином, вводимым путем ингаляции, или с инсулинами, вводимыми через нос или рот, которые находятся в разработке. При этом специалисту ясно, что кроме этого могут применяться также соответствующие смеси быстродействующего инсулина и инсулина замедленного действия согласно изобретению. Кроме того, аналоги инсулина согласно изобретению можно использовать в фармацевтических препаратах, которые содержат пептиды, характеризующиеся активностью, сравнимой с активностью GLP-1 (глюкагоноподобные пептиды-1), или эксендина-4, или эксендина-3. Примерами таких пептидов являются GLP-1 (7-37), эксенатид (Byetta®) или пептиды, получение которых описано в патентных заявках WO 2006/058620, WO 2001/04156, WO 2004/005342 и WO 98/08871. При этом особенно выгодны композиции, которые содержат депо-рецептуру этих пептидов. Выгодны, особенно в начальной фазе заболевания диабетом типа II, формы лечения, которые параллельно с приемом лекарственных средств согласно изобретению предусматривают прием лекарств, которые усиливают действие инсулина, как, например, метформин. Возможна также комбинированная терапия с ингибиторами дипептидилпептидазы-4, которые повышают уровень внутренней секреции, например комбинации с сульфонилмочевинами, которые повышают распределение инсулина в поджелудочной железе. Особенно предпочтительно можно назначать инсулины замедленного действия согласно изобретению тогда, когда в результате применения дифференцирующих факторов регенерация бета-клеток поджелудочной железы начинается из соответствующих стволовых клеток. Все эти приложения указаны как пример для лечения диабета и также являются объектом изобретения. Следующим объектом изобретения является тем самым применение инсулинов согласно изобретению в комбинации с другими активными веществами для лечения диабета, в частности диабета типа I или типа II.
Следующим объектом изобретения является лекарственное средство, содержащее аналог инсулина согласно изобретению, которое представляет собой, в частности, водную композицию или порошок.
Лекарственное средство является фармацевтическим препаратом, который предпочтительно представляет собой раствор или суспензию для инъекций; оно отличается наличием по меньшей мере одного аналога инсулина согласно изобретению и/или по меньшей мере одной его физиологически приемлемой соли в растворенной, аморфной и/или кристаллической форме, предпочтительно в растворенной.
Готовая форма предпочтительно имеет pH примерно от 2,5 до 8,5, в частности примерно от 4,0 до 8,5, предпочтительно содержит подходящий изотонирующий агент, подходящий консервант и при необходимости подходящий буфер, а также, предпочтительно, определенную концентрацию ионов цинка, в стерильном водном растворе. Совокупность компонентов препарата, кроме активного вещества, образует носитель формы. Подходящими изотонирующими агентами являются, например, глицерин, глюкоза, маннит, NaCl, соединения кальция или магния, как CaCl2, и т.д. Выбором изотонирующего агента и/или консерванта воздействуют на растворимость инсулинов согласно изобретению или из физиологически приемлемых солей при слабокислотных значениях pH.
Подходящими консервантами являются, например, фенол, м-крезол, бензиловый спирт и/или сложный эфир п-гидроксибензойной кислоты.
В качестве буферных веществ, в частности для установки значения pH примерно от 4,0 до 8,5, можно использовать, например, ацетат натрия, цитрат натрия, фосфат натрия и т.д. Впрочем, для регулирования pH подходят также физиологически безопасные разбавленные кислоты (типично HCl) или щелочи (типично NaOH).
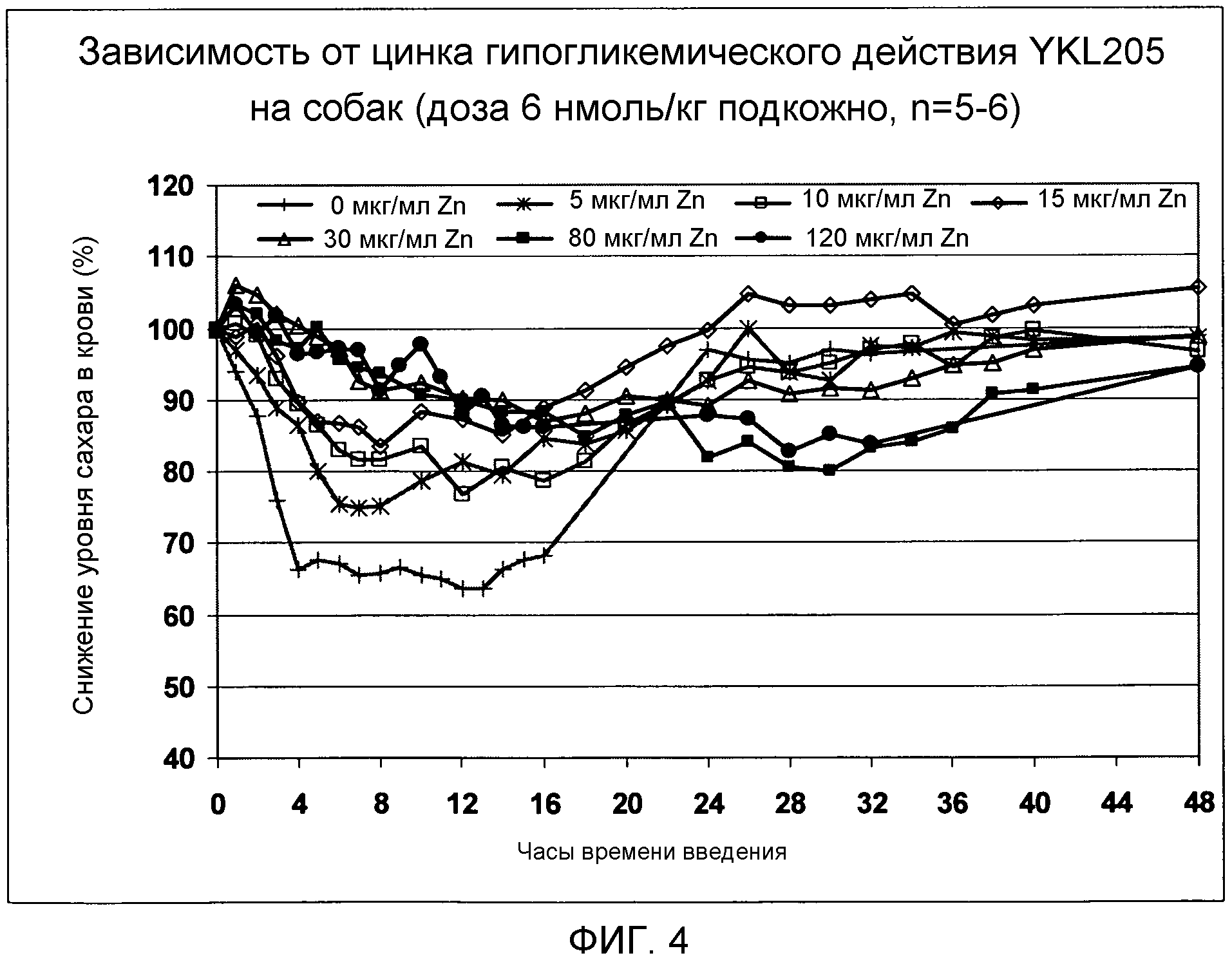
Если препарат содержит цинк, то предпочтительно содержание цинка от 1 до 2 мг/мл, в частности, от 1 мкг/мл до 200 мкг/мл. Неожиданно оказалось, что добавкой Zn можно хорошо влиять на профиль активности аналогов инсулина согласно изобретению. Это позволяет получить препараты, которые различаются по полной продолжительности действия, скорости наступления действия и кривой профиля действия и, таким образом, позволяют индивидуальную подстройку под конкретного пациента. Другая возможность получается в результате использования "двухкамерного инсулинового устройства", которое позволяет вводить композицию с быстрым началом действия и/или с медленным плавным началом действия в зависимости от жизненной ситуации.
С целью изменения профиля активного вещества в препарате согласно изобретению можно также добавлять в него немодифицированный инсулин, предпочтительно бычий, свиной или человеческий инсулин, в частности человеческий инсулин, или аналоги инсулина и его дериваты. Можно также добавлять один или несколько производных эксендина-4 или пептиды, которые отличаются активностью, сравнимой с активностью GLP-1 (глюкагоноподобный пептид-1), или прямо соответствует GLP-1. Такие лекарственные средства (препараты) также являются объектом изобретения.
Предпочтительными концентрациями активного вещества являются концентрации, соответствующие примерно 1-1500, более предпочтительно, примерно 5-1000 и, в частности, примерно 40-400 международных единиц/мл.
Аналоги инсулина согласно изобретению сначала получают биотехнологическими методами как предшественники, которые еще не содержат амида. Специалисту известно, что имеется множество возможностей для получения инсулинов. При этом в качестве клеточной системы-хозяина используются бактерии, дрожжи и растения или растительные клетки, культивированные ферментативно. Если анализ затрат это позволяет, возможны также экспрессирующие системы, которые в качестве системы-хозяина используют животные клетки. Однако необходимым условием для этого является надежное отсутствие животных вирусов. Таким образом, ясно, что описанные как примеры экспрессирующие системы представляют собой лишь малую часть систем-хозяев/векторных систем, разработанных для рекомбинантного получения белков. В заявке не описываются, например, биотехнологические способы, которые имеют в основе дрожжевые или растительные системы, как мхи, водоросли или высшие растения, такие, как табак, горох, бодяк, ячмень, кукуруза или рапс. Тем не менее системы хозяин/вектор, а также кодирующие ДНК-последовательности, которые позволяют получение желаемых пептидов в соответствующих биотехнологических экспрессирующих системах, также являются составной частью изобретения. Организмы-хозяева могут также быть выбраны, в частности, из растительного мира из организмов первого типа Schizophyta, содержащего шизомицеты, бактерии или сине-зеленые водоросли, организмов 2-го типа Phycophyta V-го класса Chlorophyceae, организмов 2-го типа Phycophyta VII-го класса Rhodophyceae, организмов 3-го типа Mycophyta, организмов 5-го типа Bryophyta и организмов 2-го типа Spermatophyta.
В европейской патентной заявке EP-A 1222207 описана плазмида plNT358d, которая кодирует препроинсулин, содержащий измененный C-пептид. С помощью полимеразной цепной реакции (ПЦР) теперь можно целенаправленно изменять кодирующую проинсулин последовательность таким образом, чтобы можно было экспрессировать препроинсулины, которые могут служить предшественниками для инсулинов согласно изобретению. Соответствующие слитые белки не обязательно должны получаться внутриклеточно. Специалисту ясно, что такие белки можно также получить бактериальной экспрессией с последующей секрецией в периплазме и/или в избытке культуры. Это описано, например, в европейской патентной заявке EP-A 1364029. Предшественники проинсулина, которые ведут к аналогам согласно изобретению, также являются объектом изобретения.
Полученные таким путем проинсулины можно в принципе преобразовать в предшественники аналогов инсулина, которые в позиции A0 содержат лизин или аргинин, а на C-терминальном конце цепи B несут лизин или аргинин.
Если проинсулины согласно изобретению после внутриклеточной экспрессии в бактериях присутствуют как тельца-включения или растворены, то эти предшественники нужно путем сворачивания in vitro свернуть в правильную конформацию, прежде чем можно будет провести обработку и биохимическую модификацию. При этом описанный слитый белок позволяет прямое сворачивание после денатурации мочевиной или гидрохлоридом гуанидина, при этом промежуточные продукты сворачивания также являются объектом изобретения.
Для обогащения отдельных промежуточных соединений применяются биохимические методы, в частности процессы разделения, причем лежащие в их основе принципы опубликованы и даже являются предметом учебников. Специалисту ясно, что такие принципы могут комбинироваться по следованию и что, таким образом, можно осуществить способы, которые по своей последовательности ранее не публиковались. Тем самым способ, который ведет к очистке аналогов согласно изобретению, также является объектом изобретения.
Следующим объектом изобретения является способ получения аналогов инсулина по изобретению, причем предшественник аналога инсулина получают рекомбинантно и ферментативно превращают в двухцепочечный предшественник инсулина, который на N-конце аминокислоты 1 А-цепи несет аргинин или лизин, а на C-конце конца B-цепи содержит лизиновый или аргининовый остаток, который аргининамидом или лизинамидом в присутствии фермента с трипсиновой активностью переводится в амид и, таким образом, в инсулин замедленного действия согласно изобретению, который после процесса биохимической очистки будет высокочистым.
Белки, которые отличаются от соответствующего, в остальном идентичного белка натурального происхождения замещением по меньшей мере одного натурального аминокислотного остатка другими аминокислотными остатками, и/или присоединением, и/или удалением по меньшей мере одного аминокислотного остатка, будут называться "аналогами" белков. При этом под добавленными и/или замещенными аминокислотными остатками речь может идти о таких остатках, которые в природе не встречаются.
Белки, которые получены химической модификацией определенных аминокислотных остатков исходных белков, обозначаются как "производные" белков. Химическая модификация может состоять например, в присоединении одной или нескольких определенных химических групп к одной или нескольким аминокислотам.
Подписи к фигурам:
Фиг. 1: Снижающее уровень сахара в крови действие на крыс новых аналогов инсулина;
Фиг. 2: Снижающее уровень сахара в крови действие на собак новых аналогов инсулина;
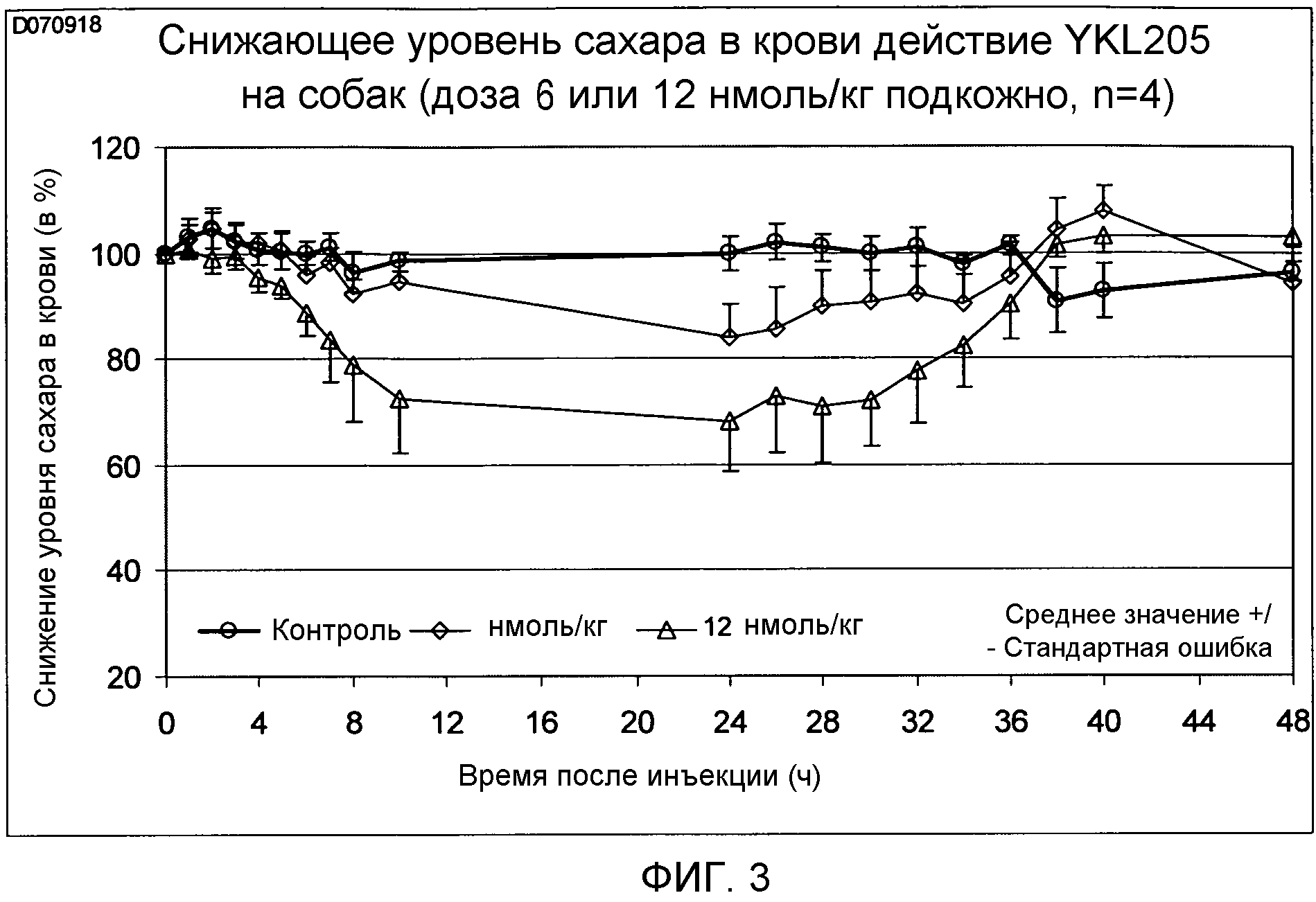
Фиг. 3: Снижающее уровень сахара в крови действие на собак YKL205;
Фиг. 4: Зависимость от цинка гипогликемического действия YKL205 на собак.
Следующие примеры должны проиллюстрировать идеи изобретения, при этом не ограничивая его.
Пример 1: Получение векторного производного plNT3580, который кодирует Gly (A21)-инсулин и модифицированный C-пептид, несущий на границе цепи C/A Arg Arg.
Европейская патентная заявка EP-A 1222207 описывает плазмиды plNT358d, plNT91d и последовательность праймера Tir. ДНК этих продуктов применяется для конструирования плазмиды plNT3580. При этом плазмида plNT358d характеризуется генной последовательностью, которая кодирует модифицированный C-пептид с особыми свойствами. Синтезированы три последовательности праймеров:
pint3580_glya21rev
5'-CAAAGGTCGACTATTA GCC GCAGTAGTTCTCCAGCTGG-3' (SEQ ID NO: 3)
Этот праймер служит для того, чтобы после обработки ввести в позицию 21 A-цепи кодируемой plNT358d последовательности проинсулина глицин (жирный шрифт, подчеркнуто) вместо аспарагина.
arg_cjuncf
5'-GTCCCTGCAGCGTCGCGGCATCGTGGAGCAG-3' (SEQ ID NO: 4)
Этот праймер служит, подобно праймеру arg_cjunc_rev, для введения аргинина вместо лизина на границе цепи A/B инсулина.
arg_cjunc_rev
5'-CCACGAT GCCGCGACGCTGC AGGGACCCCT CCAGCG-3' (SEQ ID NO: 5)
Кодон для вводимого аргинина в обоих праймерах выделен жирным. ПЦР проводится в соответствии с европейской патентной заявкой EP-A 1222207 с ДНК плазмиды plNT358d как матрицей и с парой праймеров Tir/arg_cjunc_rev и arg_cjuncf/pint3580_glya21rev. Аликвоты продуктов двух реакций соединяют и вместе с парой праймеров Tir/pint3580_glya21rev вводят в третью ПЦР. Продукт этой реакции очищают после гель-электрофоретического разделения реакционной смеси и вместе с рестриктивным ферментом Sal1/Nco1, согласно указаниям производителя, используют в одной и той же реакции, реакционную смесь разделяют гель-электрофорезом и выделяют фрагмент ДНК, кодирующий проинсулиновую последовательность. Затем фрагмент через реакцию ДНК-лигазы внедряют в открытый посредством Nco1/Sal1 plNT91d вектор ДНК.
Сшивающей смесью трансформируют подходящие клетки бактерий E. coli. Преобразованную смесь распределяют на высеивающем диске, который содержит 25 мг/л ампициллина. Плазмиду ДНК выделяют из колоний и характеризуют анализом последовательности ДНК. Правильные плазмиды получают обозначение plNT3580.
Пример 2: Конструирование плазмиды plNT3581, кодирующей His (A8), Gly (A21) - препроинсулин
Конструирование проводится, как описано в примере 1, путем 3 полимеразных цепных реакций. Продукт третьей реакции после отщепления Nco1/Sal1 внедряется в открытый посредством Nco1/Sal1 plNT91d вектор ДНК. Используются праймеры Tir и pint3580_glya21rev. Синтезированы два следующих праймера:
pint3580_Ha8f
5'-AGCAGTGCTGCCACAGCATCTGCTCCCTCTAC-3' (SEQ ID NO: 6)
pint3580_Ha8rev
5'-GAG CAGATGCT GTG GCAGCACTG CTCCACGATG-3' (SEQ ID NO: 7)
Кодон, который кодирует гистидин в позиции 8 цепи A, каждый раз выделен жирным. Конструирование проводится, как описано в примере 1. Матрицей для ПЦР 1 и 2 является ДНК плазмиды plNT3580. ПЦР 1 проводится с парой праймеров Tir/pint3580_Ha8rev, а ПЦР 2 с парой праймеров pint3580_Ha8f/pint3580_glya21rev. В ПЦР 3 используется пара праймеров Tir/pint3580_glya21rev. При этом матрицей является смесь продуктов реакции ПЦР 1 и ПЦР 2. Правильные плазмиды получают обозначение plNT3581.
Пример 3: Конструирование плазмиды plNT3582, кодирующей His (A8), Glu (A5), Gly (A21) - препроинсулин
Конструирование проводится, как описано в примерах 1 и 2, путем 3 полимеразных цепных реакций. Продукт третьей реакции после отщепления Nco1/Sal1 внедряется в открытый посредством Nco1/Sal1 plNT91d вектор ДНК. Используются праймеры Tir и pint3580_glya21rev. Синтезированы два следующих праймера:
pint3581_Ea5f
5'-GCATCGTGGAGGAGTGCTGCCACAGCATCTG-3' (SEQ ID NO: 8)
pint3581_Ea5rev
5'-CTGT GGCAGCACTC CTCCACGATG CCGCGACG-3' (SEQ ID NO: 9)
Кодон, который кодирует глутаминовую кислоту в позиции 5 цепи A, каждый раз выделен жирным. Конструирование проводится, как описано в примере 1. Матрицей является ДНК плазмиды plNT3581. Правильные плазмиды получают обозначение plNT3582.
Пример 4: Конструирование плазмиды plNT3583, кодирующей His (A8), Asp (A18), Gly (A21) - препроинсулин
Конструирование проводится, в отличие от примера 1, только с одной полимеразной цепной реакцией. Продукт этой реакции после отщепления Nco1/Sal1 внедряется в открытый посредством Nco1/Sal1 plNT91d вектор ДНК. Используется праймер Tir. Синтезирован следующий праймер:
pint3580_Da18rev
5'-CAAAGGTCGACTATTAGCCGCAGTAGTCCTCCAGCTGGTAGAGGGAG-3' (SEQ ID NO: 10)
Кодон, который кодирует аспарагиновую кислоту в позиции 18 цепи A, выделен жирным. Матрицей является ДНК плазмиды plNT3581. Правильные плазмиды получают обозначение plNT3583.
Пример 5: Конструирование плазмиды plNT3584, кодирующей His (A8), Glu (A5), Asp (A18), Gly (A21) - препроинсулин
Конструирование проводится, в отличие от примера 1, всего с одной полимеразной цепной реакцией. Продукт третьей реакции после отщепления Nco1/Sal1 внедряется в открытый посредством Nco1/Sal1 plNT91d вектор ДНК. Используется праймер Tir pint3580_Da18rev (пр.4). Матрицей является ДНК плазмиды plNT3582. Правильные плазмиды получают обозначение plNT3584. Кодированный плазмидой препроинсулин является предшественником соединения YKL205-1, которое образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), Glu (A5), His (A8), Asp (A18), Gly (A21), Arg (B31), Arg (B32) - NH2 - человеческий инсулин
Соответствующее амидирования лизинамидом приводит к соединению YKL205-1b:
Arg (A0), Glu (A5), His (A8), Asp (A18), Gly (A21), Arg (B31), Lys (B32) - NH2 - человеческий инсулин
Пример 6: Конструирование плазмиды plNT3585, кодирующей His (A8), Glu (A15), Gly (A21) - препроинсулин
Конструирование проводится, в отличие от примера 1, всего с одной полимеразной цепной реакцией. Продукт этой реакции после отщепления Nco1/Sal1 внедряется в открытый plNT91d вектор ДНК. Используется праймер Tir. Синтезирован следующий праймер:
pint3580_Ea15rev
5'-CAAAGGTCGA CTATTAGCCG CAGTAGTTCTCCAGCTCGTA GAGGGAGCAGATGCTG-3' (SEQ ID NO: 11)
Кодон, который кодирует глутаминовую кислоту в позиции 15 цепи А, выделен жирным. Матрицей является ДНК плазмиды plNT3581. Правильные плазмиды получают обозначение plNT3585.
Пример 7: Конструирование плазмиды plNT3586, кодирующей His (A8), Glu (A15), Asp (A18), Gly (A21) - препроинсулин
Конструирование проводится, в отличие от примера 1, всего с одной полимеразной цепной реакцией. Продукт этой реакции после отщепления Nco1/Sal1 внедряется в открытый посредством Nco1/Sal1 plNT91d вектор ДНК. Используется праймер Tir. Синтезирован следующий праймер:
pint3585_Ea15_Da18rev
5'-CAAAGGTCGACTATTAGCCGCAGTAGTCCTCCAGCTCGTAGAGGGAGCAGATGCTG-3' (SEQ ID NO: 12)
Кодон, кодирующий глутаминовую кислоту в позиции 15 цепи А и аспарагиновую кислоту в позиции A18 цепи А, каждый раз выделен жирным. Матрицей является ДНК плазмиды plNT3581. Правильные плазмиды получают обозначение plNT3586. Кодируемый плазмидой препроинсулин является предшественником соединения YKL205, которое образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), His (A8), Glu (A15), Asp (A18), Gly (A21), Arg (B31), Arg (B32) - NH2 - человеческий инсулин
Кодируемый плазмидой препроинсулин является предшественником соединения YKL205b, которое получается после амидирования лизинамидом и описывается следующей структурой:
Arg (A0), His (A8), Glu (A15), Asp (A18), Gly (A21), Arg (B31), Lys (B32) - NH2 - человеческий инсулин
Пример 8: Конструирование плазмиды plNT3587, кодирующей Glu (A5), His (A8), Glu (A15), Gly (A21) - препроинсулин
Конструирование проводится, в отличие от примера 1, всего с одной полимеразной цепной реакцией. Продукт этой реакции после отщепления Nco1/Sal1 внедряется в открытый посредством Nco1/Sal1 plNT91d вектор ДНК. Используются праймеры Tir и pint3580_Ea15rev согласно примеру 6. Матрицей является ДНК плазмиды plNT3582. Правильные плазмиды получают обозначение plNT3587. Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-2, которое образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), Glu (A5), His (A8), Glu (A15), Gly (A21), Arg (B31), Arg (B32) - NH2 - человеческий инсулин
Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-2b, которое получается после амидирования лизинамидом и описывается следующей структурой:
Arg (A0), Glu (A5), His (A8), Glu (A15), Gly (A21), Arg (B31), Lys (B32) - NH2 - человеческий инсулин
Пример 9: Конструирование плазмиды plNT3588, кодирующей His (A8), Gly (A21), Asp (B3) - препроинсулин
Конструирование проводится, как описано в примерах 1 и 2, с 3 полимеразными цепными реакциями. Продукт третьей реакции после отщепления Nco1/Sal1 внедряется в открытый посредством Nco1/Sal1 plNT91d вектор ДНК. Используются праймеры Tir и pint3580_glya21rev. Синтезированы два следующих праймера:
pint3581_Db3f
5'-GCACGATTTGTGGACCAGCACCTGTGCGGC-3' (SEQ ID NO: 13)
pint3581_Db3rev
5'-CACAGG TGCTGGTCCA CAAATCGTGC CGAATTTC-3' (SEQ ID NO: 14)
Кодон, который кодирует аспарагиновую кислоту в позиции 3 инсулина цепи B, каждый раз выделен жирным. Конструирование проводится, как описано в примере 1. Матрицей является ДНК плазмиды plNT3581. Правильные плазмиды получают обозначение plNT3588.
Пример 10: Конструирование плазмиды plNT3589, кодирующей Glu (A5), His (A8), Gly (A21), Asp (B3) - препроинсулин
Если проводить реакции, как описано в примере 9, но в ПЦР1 и ПЦР2 в качестве матрицы использовать ДНК плазмиды plNT3582, то получат плазмиду plNT3589.
Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-3, которое образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), Glu (A5), His (A8), Gly (A21), Asp (B3), Arg (B31), Arg (B32) - NH2 - человеческий инсулин
Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-3b, которое получается после амидирования лизинамидом и описывается следующей структурой:
Arg (A0), Glu (A5), His (A8), Gly (A21), Asp (B3), Arg (B31), Lys (B32) - NH2-человеческий инсулин
Пример 11: конструирование плазмиды plNT3590, кодирующей His (A8), Glu (A15), Gly (A21), Asp (B3) - препроинсулин
Если проводить реакции, как описано в примере 9, но в ПЦР1 и ПЦР2 в качестве матрицы использовать ДНК плазмиды plNT3585, то получится плазмида plNT3590. Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-4, которое образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), His (A8), Glu (A15), Gly (A21), Asp (B3), Arg (B31), Arg (B32) - NH2 - человеческий инсулин
Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-4b, которое получается после амидирования лизинамидом и описывается следующей структурой:
Arg (A0), His (A8), Glu (A15), Gly (A21), Asp (B3), Arg (B31), Lys (B32) - NH2 - человеческий инсулин
Пример 12: Конструирование плазмиды plNT3591, кодирующей His (A8), Asp (A18), Gly (A21), Asp (B3) - препроинсулин
Если проводить реакции, как описано в примере 9, но в ПЦР1 и ПЦР2 в качестве матрицы использовать ДНК плазмиды plNT3586, то получится плазмида plNT3591. Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-5, который образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), His (A8), Asp (A18), Gly (A21), Asp (B3), Arg (B31), Arg (B32) - NH2 - человеческий инсулин
Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-5b, которое получается после амидирования лизинамидом и описывается следующей структурой:
Arg (A0), His (A8), Asp (A18), Gly (A21), Asp (B3), Arg (B31), Lys (B32) - NH2 - человеческий инсулин
Пример 13: Конструирование плазмиды plNT3592, кодирующей His (A8), Gly (A21), Asp (B3), Glu (B4) - препроинсулин
Конструирование проводится, как описано в примерах 1 и 2, путем 3 полимеразных цепных реакций. Продукт третьей реакции после отщепления Nco1/Sal1 внедряется в открытый посредством Nco1/Sal1 plNT91d вектор ДНК. Используются праймеры Tir и pint3580_glya21rev. Синтезированы два следующих праймера:
pint3581_Db3_Eb4f
5-GCACGATTTGTGGACGAGCACCTGTGCGGCTC-3' (SEQ ID NO: 15)
pint3581_Db3_Eb4rev
5'-CGCACAGG TGCTCGTCCA CAAATCGTGC CGAATTTC-3' (SEQ ID NO: 16)
Кодон, который кодирует аспарагиновую кислоту в позиции 3 и глутаминовую кислоту в позиции 4 B-цепи инсулина, каждый раз выделен жирным. Конструирование проводится, как описано в примере 1. Матрицей является ДНК плазмиды plNT3581. Правильные плазмиды получают обозначение plNT3592. Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-6, которое образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), His (A8), Gly (A21), Asp (B3), Glu (B4), Arg (B31), Arg (B32) - NH2 - человеческий инсулин
Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-6b, которое получается после амидирования лизинамидом и описывается следующей структурой:
Arg (A0), His (A8), Gly (A21), Asp (B3), Glu (B4), Arg (B31), Lys (B32) - NH2 - человеческий инсулин
Пример 14: Конструирование плазмиды plNT3593, кодирующей His (A8), Gly (A21), Glu (B4) - препроинсулин
Конструирование проводится, как описано в примерах 1 и 2, путем 3 полимеразных цепных реакций. Продукт третьей реакции после отщепления Nco1/Sal1 внедряется в открытый посредством Nco1/Sal1 plNT91d вектор ДНК. Используются праймеры Tir и pint3580_glya21rev. Синтезированы два следующих праймера:
pint3581_Eb4f
5'-ACGATTTGTGAACGAGCACCTGTGCGGCTC-3' (SEQ ID NO: 17)
pint3581_Eb4rev
5'-CGCACAGG TGCTCGTTCA CAAATCGTGC CGAATTTC-3' (SEQ ID NO: 18)
Кодон, кодирующий глутаминовую кислоту в позиции 4 B-цепи инсулина, выделен жирным. Конструирование проводится, как описано в примере 1. Матрицей является ДНК плазмиды plNT3581. Правильные плазмиды получают обозначение plNT3593.
Пример 15: Конструирование плазмиды plNT3594, кодирующей Glu (A5), His (A8), Gly (A21), Glu (B4) - препроинсулин.
Если проводить реакции, как описано в примере 9, но в ПЦР1 и ПЦР2 в качестве матрицы использовать ДНК плазмиды plNT3582, то получится плазмида plNT3594.
Проинсулин является предшественником соединения YKL205-7, которое образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), Glu (A5), His (A8), Gly (A21), Glu (B4), Arg (B31), Arg (B32) - NH2 - человеческий инсулин.
Проинсулин является предшественником соединения YKL205-7b, которое получается после амидирования лизинамидом и описывается следующей структурой:
Arg (A0), Glu (A5), His (A8), Gly (A21), Glu (B4), Arg (B31), Lys (B32) - NH2 - человеческий инсулин
Пример 16: Конструирование плазмиды plNT3595, кодирующей His (A8), Glu (A15), Gly (A21), Glu (B4)-препроинсулин.
Если проводить реакции, как описано в примере 9, но в ПЦР1 и ПЦР2 в качестве матрицы использовать ДНК плазмиды plNT3585, то получится плазмида plNT3595. Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-8, которое образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), His (A8), Glu (A15), Gly (A21), Glu (B4), Arg (B31), Arg (B32) - NH2 - человеческий инсулин
Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-8b, которое получается после амидирования лизинамидом и описывается следующей структурой:
Arg (A0), His (A8), Glu (A15), Gly (A21), Glu (B4), Arg (B31), Lys (B32) - NH2 - человеческий инсулин
Пример 17: Конструирование плазмиды plNT3596, кодирующей His (A8), Asp (A18), Gly (A21), Glu (B4) - препроинсулин
Если проводить реакции, как описано в примере 9, но в ПЦР1 и ПЦР2 в качестве матрицы использовать ДНК плазмиды plNT3586, то получится плазмида plNT3596. Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-9, которое образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), His (A8), Asp (A18), Gly (A21), Glu (B4), Arg (B31), Arg (B32) - NH2 - человеческий инсулин
Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-9b, которое получается после амидирования лизинамидом и описывается следующей структурой:
Arg (A0), His (A8), Asp (A18), Gly (A21), Glu (B4), Arg (B31), Lys (B32) - NH2 - человеческий инсулин
Пример 18: Конструирование плазмиды plNT3597, кодирующей His (A8), Gly (A21), Glu (B0) - препроинсулин
Конструирование проводится двумя полимеразными цепными реакциями. Используется праймер pint3580_glya21rev. Синтезированы два следующих праймера:
pint3581_Eb0f1
5'-CAACAGGAA ATTCGGCACG AGAGTTTGTG AACCAGCACCGTG-3' (SEQ ID NO: 19)
pint3581_Eb01f2
5'-TATCGA CCAT GG CAACAACA TCAACAGGAA ATTCGGCACG AGAG-3' (SEQ ID NO: 20)
При этом оба праймера частично перекрываются. Pint3581_Eb0f2 содержит последовательность распознавания Ncol. Это показано подчеркиванием. Кодон, который кодирует глутаминовую кислоту в позиции 0 в начале цепи B, каждый раз выделен жирным. Матрицей для ПЦР1 является ДНК плазмиды plNT3581.
ПЦР1 проводится с парой праймеров pint3581_Eb-1f2/pint3580_glya21rev. Матрицей для ПЦР2 является продукт реакции ПЦР1. ПЦР2 проводится с парой праймеров pint3581_Eb-1f2/pint3580_glya21rev. Продукт ПЦР2 покрывает полную последовательность препроинсулина. Продукт второй реакции после отщепления Nco1/Sal1 внедряется в открытый посредством Nco1/Sal1 plNT91d вектор ДНК. Правильные плазмиды получают обозначение plNT3597. Если заменить кодон для глутаминовой кислоты в позиции B0 кодоном для аспарагиновой кислоты и следовать примеру, то получатся плазмиды, которые в позиции B0 вместо глутаминовой кислоты несут аспарагиновую кислоту.
Пример 19: Конструирование плазмиды plNT3598, кодирующей Glu (A5), His (A8), Gly (A21), Glu (B0) - препроинсулин
Если вести реакции, как описано в примере 18, но на стадии ПЦР1 в качестве матрицы использовать ДНК плазмиды plNT3582, то получится плазмида plNT3598. Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-10, которое образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), Glu (A5), His (A8), Gly (A21), Glu (B0), Arg (B31), Arg (B32) - NH2 - человеческий инсулин
Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-10b, которое получается после амидирования лизинамидом и описывается следующей структурой:
Arg (A0), Glu (A5), His (A8), Gly (A21), Glu (B0), Arg (B31), Lys (B32) - NH2 - человеческий инсулин
Пример 20: Конструирование плазмиды plNT3599, кодирующей His(A8),Glu(A15),Gly(A21),Glu(B0) - препроинсулин
Если вести реакции, как описано в примере 18, но на стадии ПЦР1 в качестве матрицы использовать ДНК плазмиды plNT3585, то получится плазмида plNT3599. Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-11, которое образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), His (A8), Glu (A15), Gly (A21), Glu (B0), Arg (B31), Arg (B32) - NH2 - человеческий инсулин
Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-11b, которое получается после амидирования лизинамидом и описывается следующей структурой:
Arg (A0), His (A8), Glu (A15), Gly (A21), Glu (B0), Arg (B31), Lys (B32) - NH2 - человеческий инсулин
Пример 21: Конструирование плазмиды plNT3600, кодирующей His (A8), Asp (A18), Gly (A21), Glu (B0) - препроинсулин
Если вести реакции, как описано в примере 18, но на стадии ПЦР1 в качестве матрицы использовать ДНК плазмиды plNT3586, то получится плазмида plNT3600. Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-12, которое образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), His (A8), Asp (A18), Gly (A21), Glu (B0), Arg (B31), Arg (B32) - NH2 - человеческий инсулин
Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-12b, которое получается после амидирования лизинамидом и описывается следующей структурой:
Arg (A0), His (A8), Asp (A18), Gly (A21), Glu (B0)1 Arg (B31), Lys (B32) - NH2 - человеческий инсулин
Пример 22: Конструирование плазмиды plNT3601, кодирующей His (A8), Gly (A21), Asp (B1) - препроинсулин
Конструирование проводится через две полимеразные цепные реакции. Используется праймер pint3580_glya21rev. Синтезированы два следующих праймера:
pint3581_Db1f1
5'-CAACAGGAA ATTCGGCACG AGACGTG AACCAGCACC TGTGCG-3' (SEQ ID NO: 21)
pint3581_Db1f2
5'-TATCGA CCAT GG CAACAACA TCAACAGGAA ATTCGGCACG AGAC-3' (SEQ ID NO: 22)
При этом оба праймера частично перекрываются. Pint3581_Db-1f2 содержит последовательность распознавания Ncol. Это показано подчеркиванием. Кодон, который кодирует аспарагиновую кислоту в позиции 1 цепи B, каждый раз выделен жирным. Матрицей для ПЦР1 является ДНК плазмиды plNT3581. ПЦР1 проводится с парой праймеров pint3581_Db1f1/pint3580_glya21rev. Матрицей для ПЦР2 является продукт реакции ПЦР1. ПЦР2 проводится с парой праймеров pint3581_Db1f2/pint3580_glya21rev. Продукт ПЦР2 покрывает полную последовательность препроинсулина. Продукт второй реакции после отщепления Nco1/Sal1 внедряется в открытый посредством Nco1/Sal1 plNT91d вектор ДНК. Правильные плазмиды получают обозначение plNT3601.
Пример 23: Конструирование плазмиды plNT3602, кодирующей Glu (A5), His (A8), Gly (A21), Asp (B1) - препроинсулин
Если вести реакции, как описано в примере 22, но на стадии ПЦР1 в качестве матрицы использовать ДНК плазмиды plNT3582, то получится плазмида plNT3602. Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-13, которое образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), Glu (A5), His (A8), Gly (A21), Asp (B1), Arg (B31), Arg (B32) - NH2 - человеческий инсулин
Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-13b, которое получается после амидирования лизинамидом и описывается следующей структурой:
Arg (A0), Glu (A5), His (A8), Gly (A21), Asp (B1), Arg (B31), Lys (B32) - NH2 - человеческий инсулин
Пример 24: Конструирование плазмиды plNT3603, кодирующей His (A8), Glu (A15), Gly (A21), Asp (B1) - препроинсулин
Если вести реакции, как описано в примере 22, но на стадии ПЦР1 в качестве матрицы использовать ДНК плазмиды plNT3585, то получится плазмида plNT3603. Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-14, которое образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), His (A8), Glu (A15), Gly (A21), Asp (B1), Arg (B31), Arg (B32) - NH2 - человеческий инсулин
Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-14b, которое получается после амидирования лизинамидом и описывается следующей структурой:
Arg (A0), His (A8), Glu (A15), Gly (A21), Asp (B1), Arg (B31), Lys (B32) - NH2 - человеческий инсулин
Пример 25: Конструирование плазмиды plNT3604, кодирующей His (A8), Asp (A18), Gly (A21), Asp (B1) - препроинсулин
Если вести реакции, как описано в примере 22, но на стадии ПЦР1 в качестве матрицы использовать ДНК плазмиды plNT3586, то получится плазмида plNT3604. Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-15, которое образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), His (A8), Asp (A18), Gly (A21), Asp (B1), Arg (B31), Arg (B32) - NH2 - человеческий инсулин
Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-15b, которое получается после амидирования лизинамидом и описывается следующей структурой:
Arg (A0), His (A8), Asp (A18), Gly (A21), Asp (B1), Arg (B31), Lys (B32) - NH2 - человеческий инсулин
Пример 26: Конструирование плазмиды plNT3605, кодирующей His (A8), Gly (A21), Glu (B0), Asp (B1) - препроинсулин
Конструирование проводится двумя полимеразными цепными реакциями. Используется праймер pint3580_glya21rev и описанный в примере 18 праймер pint3581_EbO1f2. Синтезирован праймер pint3597_Db1f:
5'-CAACAGGAA ATTCGGCACG AGAGGACGTG AACCAGCACC TGTGC-3' (SEQ ID NO: 23)
Кодон, который кодирует глутаминовую кислоту в позиции 0 и аспарагиновую кислоту соответственно в начале B-цепи, каждый раз выделен жирным. Матрицей для ПЦР1 является ДНК плазмиды plNT3597. ПЦР1 проводится с парой праймеров pint3597_Db1f/pint3580_glya21rev. Матрицей для ПЦР2 является продукт реакции ПЦР1. ПЦР2 проводится с парой праймеров pint3581_Eb1f2/pint3580_glya21rev. Продукт ПЦР2 покрывает полную последовательность препроинсулина. Продукт второй реакции после отщепления Nco1/Sal1 внедряется в открытый посредством Nco1/Sal1 plNT91d вектор ДНК. Правильные плазмиды получают обозначение plNT3605. Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-16, которое образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), His (A8), Gly (A21), Glu (B0), Asp (B1), Arg (B31), Arg (B32) - NH2 - человеческий инсулин
Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-16b, которое получается после амидирования лизинамидом и описывается следующей структурой:
Arg (A0), His (A8), Gly (A21), Glu (B0), Asp (B1), Arg (B31), Lys (B32) - NH2 - человеческий инсулин
Пример 27: Конструирование плазмиды plNT3606, кодирующей His (A8), Glu (A15), Asp (A18), Gly (A21), desThr (B30) - препроинсулин
Конструирование проводится, как описано в примерах 1 и 2, через 3 полимеразные цепные реакции. Используются праймеры Tir и pint3580_glya21rev. Синтезированы два следующих праймера:
desB30f
5′-TTCTACACACCCAAGCGCGATGTTCCTCAGGTGG-3′ (SEQ ID NO: 24)
desB30rev
5′-AGGAACATCGCGCTTGGGTGTGTAGAAGAAGC-3′ (SEQ ID NO: 25)
Матрицей для ПЦР1 и ПЦР2 является ДНК плазмиды plNT3586. ПЦР1 проводится с парой праймеров desB30f/pint3580_glya21rev, а ПЦР2 с парой праймеров Tir/desB30rev. В качестве матрицы для ПЦР3 используется эквимолярная смесь продуктов ПЦР1 и ПЦР2. Реакция проводится с парой праймеров Tir/pint3580_glya21rev. Продукт ПЦР3 покрывает полную последовательность препроинсулина. Продукт этой реакции после отщепления Nco1/Sal1 внедряется в открытый посредством Nco1/Sal1 plNT91d вектор ДНК. Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-17, которое образуется после амидирования аргининамидом и описывается следующей структурой:
Arg (A0), His (A8), Glu (A15), Asp (A18), Gly (A21), Arg (B30), Arg (B31) - NH2 - человеческий инсулин
Кодируемый плазмидой препроинсулин является предшественником соединения YKL205-17b, которое получается после амидирования лизинамидом и описывается следующей структурой:
Arg (A0), His (A8), Glu (A15), Asp (A18), Gly (A21), Arg (B30), Lys (B31) - NH2 - человеческий инсулин
Пример 28: Экспрессия деривата проинсулина
Экспрессия осуществляется в соответствии с примером 1 европейской патентной заявки ЕР-А 1222207.
Для экспрессирования дериватов проинсулина векторы экспресии plNT3580-plNT3606, сконструированные в Примерах 1-27 настоящей заявки, трансформируются в клетки E.coli W3110, как описывается в Примере 4, подпункт (i), европейской патентной заявки ЕР-B1-0489780. Протокол экспресии следующий:
(i) Ферментация: из E.coli W3110 получают культуру с использованием перемешивания в среде LB и трансформируют с помощью любого из векторов plNT3580-plNT3606. Пятнадцать микролитров этой культуры, у которой OD=2, затем переносят в среду 15,7 I TP и ферментируют суспензию в течение 16 часов при 37°C. Культуру, у которой к тому времени OD=13, доводят до 20 µг/мл IAA и, вплоть до конца ферментации, после еще пяти часов, непрерывно подается 50% (масс./об.) мальтозный раствор со скоростью 100 мл./час. В этом процессе достигается OD=17,5. В конце, бактерии собирают центрифугированием.
(ii) Разрыв клеток: клетки ресуспендировали в 400 мл/дезинтегрирующего буфера (10 мМ Трис с pH 8,0, 5 мМ EDTA) и разрушали во французском прессе. Затем, слитый белок, содержащий инсулин, концентрировали в течение 30 минут с помощью центрифугирования при 23500 g и промывали с помощью дезинтегрирующего буфера. Это приводило к 134 г осадка (влажное вещество).
(iii) Сульфитолизис: 12,5 г осадка (влажное вещество), полученного на стадии (ii), перемешивали в 125 мл в растворе мочевины 8М при 35°C. После перемешивания, в течение тридцати минут, раствор доводили до pH 9,5 с помощью раствора гидроксида натрия и подвергали взаимодействию с 1 г сульфита натрия. После дополнительных тридцати минут перемешивания при 350°C, добавляли 0,25 г тетратионата натрия и смесь снова перемешивали в течение тридцати минут при 35°C.
(iv) DEAE-анионообменная хроматография: полученное на стадии (iii) разбавляли с помощью 250 мл буфера A (50 мМ глицина, pH=9,0) и помещали в хроматографическую колонку, которая содержала Fractogel® TSK DEAE-650 (объем колонки 130 мл, диаметр колонки 2 6 мм), выравненную буфером A. После промывки буфером A, слитый белок-S-сульфонат элюировали с помощью солевого градиента, состоящего из 250 мл каждого из буфера A и буфера B (50 мМ глицина с pH 9,0, 3М мочевины и 1М NaCl) при скорости потока 3 мл/мин. Затем, фракции, содержащие слитый белок-S-сульфонат, объединяют.
После очистки дериватов проинсулина с помощью DEAE-анионообменной хроматографии, дериваты проинсулина сворачивают.
Пример 29: Сворачивание дериватов проинсулина
Сворачивание проводится в основном согласно способу, описанному в ЕР-А 0668282.
Пример 30: Ферментативная обработка свернутого препроинсулина в 2-цепочечный предшественник Arg (А0) - инсулина, у которого С-конец на конце В-цепи характеризуется лизином или аргинином.
Ферментативная обработка свернутого предшественника препроинсулина проводится, например, как описано в примере 4 документа WO 91/03550. Особенно предпочтительным при этом оказалось применение описанных в WO 2007/031187 A1 вариантов с трипсином.
Пример 31: Получение Arg (A0), His (A8), Gly (A21), Arg (B31), Arg (B32) - NH2 - человеческого инсулина
Независимо от позиционирования дополнительных кислых аминокислот, стандартная реакция проводится следующим образом: 100 мг Arg (A0), Gly (A21), Arg (B31) - аналога инсулина растворяют в 0,95 мл раствора аргининамида (446 г/л), добавляют 0,13 мл натрийацетатного буфера 1М (pH 5,8) и 2 мл ДМФ. Реакционную смесь охлаждают до 12°C, реакцию запускают добавлением 0,094 мл трипсина (0,075 мг, Roche Diagnostics). Через 8 ч реакцию останавливают добавлением TFA до pH 2,5 и анализируют методом ВЭЖХ. Образуется более >60% Arg (A0), Gly (A21), Arg (B31), Arg (B32) - NH2 - человеческого инсулина. После добавления раствора, ингибирующего трипсин, проводится очистка амидированного аналога по аналогии с документом US 5656722.
Получение соответствующего лизинамидного соединения проводится аналогично. Разумеется, исходят из концентрированного водного раствора лизинамида, который содержит 366 г/л лизинамида.
Пример 32: Композиция с амидированными дериватами инсулина
Чтобы дериваты инсулина согласно изобретению проверить на их биологические, фармакологические и физико-химические свойства, из соединений получали раствор следующим образом: дериват инсулина согласно изобретению растворяли в целевой концентрации 240±5 мкМ в 1 мМ соляной кислоте с 80 мкг/мл цинка (в виде хлорида цинка).
В качестве растворяющей среды использовали следующие составы:
a) 1 мМ соляной кислоты;
b) 1 мМ соляной кислоты, 5 мкг/мл цинка (добавленные как хлорид цинка и соляная кислота);
c) 1 мМ соляной кислоты, 10 мкг/мл цинка (добавленные как хлорид цинка и соляная кислота);
d) 1 мМ соляной кислоты, 15 мкг/мл цинка (добавленные как хлорид цинка и соляная кислота);
e) 1 мМ соляной кислоты, 30 мкг/мл цинка (добавленные как хлорид цинка и соляная кислота);
f) 1 мМ соляной кислоты, 80 мкг/мл цинка (добавленные как хлорид цинка и соляная кислота);
g) 1 мМ соляной кислоты, 120 мкг/мл цинка (добавленные как хлорид цинка и соляная кислота).
Для этого сначала отвешивают примерно на 30% более высокое количество высушенного сублимацией материала, чем требуется на основании молекулярного веса и желаемой концентрация. Затем фактическую концентрацию определяют с помощью аналитической ВЭЖХ и затем раствор дополняют требующимся для достижения целевой концентрации объемом соляной кислоты 5 мМ с 80 мкг/мл цинка. При необходимости значение pH при этом дополнительно корректируют на 3,5±0,1. После окончательного ВЭЖХ-анализа для обеспечения целевой концентрации 240±5 мкМ готовый раствор шприцем с фильтровальной насадкой 0,2 мкм переводят в стерильную бутыль, закрытую перегородкой и фланцевой крышкой. Для краткосрочного однократного тестирования дериватов инсулина согласно изобретению не проводилось никакой оптимизации составов, например, в отношении добавок изотонирующих агентов, консервантов или буферных веществ.
Пример 33: Оценка на крысах снижающего уровень сахара в крови действия новых аналогов инсулина
Снижающее уровень сахара в крови действие выбранных новых аналогов инсулина проверялось на здоровых нормогликемических самцах крыс Wistar. Самцам крыс подкожно вводили дозу 9 нмоль/кг аналога инсулина. Непосредственно перед инъекцией аналога инсулина и через равные промежутки времени вплоть до восьми часов после инъекции у животных брали кровь для анализа и определяли содержание сахара в крови. Эксперимент ясно показал (ср. фиг. 1), что использующийся аналог инсулина по изобретению ведет к явно замедленному началу действия и к более продолжительной равномерной длительности действия.
Пример 34: Оценка на собаках снижающего уровень сахара в крови действия новых аналогов инсулина
Снижающее уровень сахара в крови действие выбранных новых аналогов инсулина проверялось на здоровых нормогликемических самцах собак породы бигль. Самцам животных подкожно вводили дозу 6 нмоль/кг аналога инсулина. Непосредственно перед инъекцией аналога инсулина и через равные промежутки времени вплоть до сорока восьми часов после инъекции у животных брали кровь для анализа и определяли содержание сахара в крови. Эксперимент ясно показал (ср. фиг. 2), что использующийся аналог инсулина по изобретению ведет к явно замедленному началу действия и к более продолжительной равномерной длительности действия.
Пример 35: Оценка на собаках снижающего уровень сахара в крови действия при двукратно повышенной дозе
Снижающее уровень сахара в крови действие выбранных новых аналогов инсулина проверялось на здоровых нормогликемических самцах собак породы бигль. Самцам животных подкожно вводили дозу 6 нмоль/кг и 12 нмоль/кг аналога инсулина. Непосредственно перед инъекцией аналога инсулина и через равные промежутки времени вплоть до сорока восьми часов после инъекции у животных брали кровь для анализа и определяли содержание сахара в крови. Эксперимент ясно показал (ср. фиг. 3), что использующийся аналог инсулина по изобретению действует в зависимости от дозы, но что, несмотря на удвоенную дозу, действие протекает плавно, т.е. не наблюдается выраженной низшей точки (надира). Из этого можно заключить, что инсулины по изобретению в сравнении с известными инсулинами замедленного действия ведут к значительно более низкому числу гипогликемических событий.
Пример 36: Оценка на собаках снижающего уровень сахара в крови действия при разных концентрациях цинка в композиции
Эксперименты проводились, как описано в примере 35. Результат показан на фигуре 4. В соответствии с ней, на кривые время/действие аналога инсулина согласно изобретению при равной концентрации инсулина можно воздействовать содержанием ионов цинка в композиции, так что при нулевом или низком содержании цинка наблюдается быстрое наступление действия, и действие сохраняется более 24 часов, тогда как при более высоком содержании цинка наблюдается более плавное начало действия, и действие инсулина продолжается заметно больше 24 часов.
Пример 37: Дополнительные эксперименты, подтверждающие достижение в настоящем изобретении неожиданного эффекта, возникающего в результате изменения в положении В32.
Заявитель получил аналоги инсулина YKL254, YKL508 и YKL511 и изучил фармакокинетические свойства этих соединений.
Arg (А0), His (А8), Glu (А5), Gly (А21), Asp (B1), Arg (B31), Arg (B32) - NH2 человеческий инсулин, (YKL254)
Arg (A0), His (A8), Gly (A21), Glu (BO), Asp (B1), Arg (B31), Arg (B32) - NH2 человеческий инсулин, (YKL508)
Arg (A0), His (A8), Glu (B1), Asp (BO), Gly (A21), Arg (B31), Lys (B32) - NH2 человеческий инсулин, (YKL511)
Результаты суммированы в следующей таблице:
|
|
Среднее время действия было в диапазоне от 2,66 до 2,75 ч для аналогов инсулина YKL508, YKL511 и YKL254.
Следовательно, по сравнению со средним значением времени действия гларгина (2,11 часа), аналоги инсулина по настоящей заявке, имели значительно увеличенное среднее время воздействия. Это увеличение еще более впечатляющее, т.к. среднее время действия гларгина (МТА: 2,11 часа) уже на 1 час больше, чем таковое у человеческого инсулина (МТА: 1,17 часа).